Область, к которой относится изобретение
Настоящее изобретение относится к новым экспрессионным кластерам, которые могут быть использованы для увеличения выхода продукта представляющего интерес белка. Экспрессионные кластеры содержат элементы регуляции экспрессии кластеров человеческого гена глобина, а в частности, промотор человеческого глобина Aγ и регуляторную область локуса кластера гена β-глобина или α-глобина. Настоящее изобретение, в частности, относится к экспрессионному кластеру, содержащему такие элементы регуляции экспрессии глобина.
Предшествующий уровень техники
Продуцирование рекомбинантных белков является главным аспектом современной биотехнологической промышленности. Оно приобретает все большее значение в ряде применений, требующих увеличения поступления на рынок больших количеств высококачественных белков. Пищевая промышленность, а особенно фармакология, представляют собой две главные области, где спрос на рекомбинантные белки постоянно растет. Для разработки коммерчески продуктивного способа необходима более высокая эффективность продуцирования, а следовательно, более низкая стоимость конечного продукта.
Однако, в настоящее время, важным фактором является высокое качество продукта и его пригодность для введения человеку. В настоящее время появляется все больше и больше областей применения, где требуется рекомбинантное продуцирование белков в эукариотических клетках, а в частности, в высших эукариотических клетках. В частности, белки, несущие посттрансляционные модификации, такие как гликозилирование (гликопротеинов), значительно отличаются в зависимости от того были ли они экспрессированы в прокариотических клеточных системах, таких как E. coli, или в эукариотических клеточных системах, таких как, человеческие клеточные линии. Во многих случаях, эти различия значительно влияют на биологическую активность, а также на иммуногенность продуцируемых белков. Однако, многие экспрессионные системы, в которых используются высшие эукариотические клеточные линии, имеют довольно низкий уровень экспрессии нужного белка, что снижает выход и увеличивает стоимость рекомбинантного белка.
Поэтому, необходимо разработать новые средства и способы увеличения выхода продуцирования рекомбинантного белка, а особенно, при использовании эукариотических экспрессионных клеточных линий.
Описание сущности изобретения
Как было продемонстрировано в настоящем изобретении, некоторые элементы кластеров человеческого гена глобина могут быть объединены с получением экспрессионного кластера, позволяющего достигать стабильный и высокий уровень экспрессии представляющих интерес полипептидов в эукариотических клетках. В частности, комбинация специфических частей регуляторной области локуса кластера гена β-глобина или кластера гена α-глобина вместе с промотором Aγ-глобина, а также, но необязательно, с 3'-энхансером Aγ-глобина способствует образованию экспрессионного кластера с неожиданно высоким и стабильным уровнем экспрессии.
Поэтому, в своем первом аспекте, настоящее изобретение относится к способу рекомбинантного продуцирования представляющего интерес полипептида, где указанный способ включает стадии:
(a) получения клетки-хозяина, содержащей экспрессионный кластер, включающий, функционально присоединенные друг к другу:
(i) регуляторную область локуса, содержащую по меньшей мере функциональную часть регуляторной области локуса кластера человеческого гена β-глобина или кластера человеческого гена α-глобина;
(ii) промоторную область, содержащую по меньшей мере функциональную часть промотора человеческого гена Aγ-глобина; и
(iii) кодирующую область, содержащую последовательность нуклеиновой кислоты, кодирующую представляющий интерес полипептид;
(b) культивирования клетки-хозяина в условиях, при которых клетка-хозяин экспрессирует представляющий интерес полипептид; и
(c) выделения представляющего интерес полипептида.
Во втором своем аспекте, настоящее изобретение относится к экспрессионному кластеру, содержащему функционально присоединенные друг к другу:
(i) регуляторную область локуса, содержащую по меньшей мере функциональную часть регуляторной области локуса кластера человеческого гена β-глобина или кластера человеческого гена α-глобина;
(ii) промоторную область, содержащую по меньшей мере функциональную часть промотора человеческого гена Aγ-глобина;
(iii) необязательно кодирующую область;
(iv) область терминации транскрипции; и
(v) энхансерную область, содержащую по меньшей мере функциональную часть 3'-энхансера человеческого гена Aγ-глобина;
где экспрессионный кластер не содержит последовательности нуклеиновой кислоты, кодирующей полноразмерный человеческий Aγ-глобин.
В своих третьих аспектах, настоящее изобретение относится к вектору, содержащему экспрессионный кластер согласно второму аспекту изобретения, и к клетке-хозяину, содержащей указанный экспрессионный кластер или указанный вектор.
Другие цели, признаки, преимущества и аспекты настоящего изобретения будут очевидны для специалиста из нижеследующего описания и прилагаемой формулы изобретения. Однако, следует отметить, что нижеследующее описание, прилагаемая формула изобретения и конкретные примеры, в которых описаны предпочтительные варианты применения, приводятся лишь в целях иллюстрации. Различные изменения и модификации, составляющие сущность и объем описанного изобретения, будут очевидны для специалиста из нижеследующего описания.
Определения
Используемые здесь нижеследующие общие термины имеют предпочтительно, значения, указанные ниже, если это не противоречит контексту описания, и если это не оговорено особо.
Используемый здесь термин «содержит», помимо его буквального смысла, также включает и, в частности, означает «состоит, по существу, из..» и «состоит из..». Таким образом, термин «содержит» относится к вариантам, где предмет изобретения, который «включает» конкретно перечисленные элементы и не содержит других элементов, а также к вариантам, где предмет изобретения, который «включает» конкретно перечисленные элементы, может содержать и/или действительно содержит другие элементы. Аналогичным образом, слово «имеет» следует понимать как слово «содержит», которое также подразумевает и, в частности, означает «состоит, по существу, из..» и «состоит из..».
Используемый здесь термин «нуклеиновая кислота» означает рибонуклеотидный или дезоксирибонуклеотидный полимер. Нуклеиновой кислотой может быть РНК или ДНК. Она может состоять из одной полимерной цепи, либо она может быть двухцепочечной. Нуклеиновая кислота может быть природной, рекомбинантной или синтетической. В предпочтительных вариантах осуществления изобретения, нуклеиновой кислотой является двухцепочечная ДНК.
«Экспрессионный кластер» представляет собой полученную или синтезированную конструкцию нуклеиновой кислоты с элементами нуклеиновой кислоты, способными осуществлять экспрессию структурного гена у хозяев, которые являются совместимыми с такими последовательностями. Экспрессионные кластеры включают по меньшей мере промотор и, необязательно, сигналы терминации транскрипции. Экспрессионный кластер обычно включает транскрибируемую нуклеиновую кислоту и промотор. Могут быть также использованы и дополнительные факторы, стимулирующие экспрессию, как описано в настоящей заявке. Так, например, экспрессионный кластер может также включать нуклеотидные последовательности, кодирующие сигнальную последовательность, которая направляет секрецию экспрессируемого белка из клетки-хозяина. Экспрессионный кластер предпочтительно является частью экспрессионного вектора. Клетки-хозяева, используемые для экспрессии транскрибируемой нуклеиновой кислоты, трансформируют или трансфецируют экспрессионным вектором. Для отбора трансформированных клеток, содержащих эти конструкции, в экспрессионные векторы может быть соответствующим образом включен селективный маркерный ген. Специалисту в данной области известно, что этот векторный компонент может быть модифицирован без какого-либо значительного влияния на его функцию.
Термин «функционально присоединенный» означает, что два или более элементов экспрессионного кластера присоединены друг к другу так, что это приводит к координации их функций и к экспрессии кодирующей последовательности (например, кодирующей области). Так, например, промотор, функционально присоединенный к кодирующей последовательности, гарантированно обеспечивает экспрессию указанной кодирующей последовательности. Конструирование экспрессионного кластера согласно изобретению и сборка его различных элементов могут быть осуществлены методами, хорошо известными специалистам, а в частности, методами, описанными в руководстве Sambrook et al. (1989, Molecular Cloning: A Laboratory Manual, Nolan C. ed., New York: Cold Spring Harbor Laboratory Press).
Используемые здесь термины «вышерасположенный» и «нижерасположенный» относятся к положению элемента или последовательности нуклеиновой кислоты на молекуле нуклеиновой кислоты по отношению к другому элементу или к другой последовательности нуклеиновой кислоты на указанной молекуле нуклеиновой кислоты. Термин «вышерасположенный» относится к положению, расположенному ближе к 5'-концу молекулы нуклеиновой кислоты, а термин «нижерасположенный» относится к положению, расположенному ближе к 3'-концу молекулы нуклеиновой кислоты. В случае двухцепочечных нуклеиновых кислот, а в частности, ДНК, цепь нуклеиновой кислоты, которая используется в качестве матрицы для транскрипции РНК, такой как мРНК, то есть, смысловой цепи, применяется для определения 5'-конца и 3'-конца нуклеиновой кислоты. Следовательно, «вышерасположенный» указывает на направление к 5'-концу смысловой цепи, а «нижерасположенный» указывает на направление к 3'-концу смысловой цепи.
«Гомология» последовательности нуклеиновой кислоты-мишени или аминокислотной последовательности-мишени означает, что указанные последовательности по меньшей мере на 75%, а более предпочтительно, по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90%, по меньшей мере на 93%, по меньшей мере на 95%, по меньшей мере на 96%, по меньшей мере на 97%, по меньшей мере на 98% или по меньшей мере на 99% гомологичны или идентичны указанной последовательности нуклеиновой кислоты-мишени или аминокислотной последовательности-мишени. «Гомологию» или «идентичность» аминокислотной последовательности или нуклеотидной последовательности определяют предпочтительно в соответствии с настоящим изобретением по всей длине последовательности-мишени или по всей длине указанной части последовательности-мишени. Настоящее изобретение, если оно относится к конкретной последовательности нуклеиновой кислоты или аминокислотной последовательности, также, в основном, охватывает гомологи указанной последовательности нуклеиновой кислоты или аминокислотной последовательности, соответственно. Гомолог последовательности нуклеиновой кислоты-мишени или аминокислотной последовательности-мишени, в частности, представляет собой функциональный гомолог, который имеет такие же или, в основном, такие же функции и активности последовательности нуклеиновой кислоты-мишени или аминокислотной последовательности-мишени, от которых они происходят.
«Промотор» представляет собой последовательность нуклеиновой кислоты, которая осуществляет и регулирует транскрипцию последовательности нуклеиновой кислоты, функционально присоединенной к этой последовательности, а в частности, к кодирующей последовательности. Промотор содержит последовательность распознавания связывания РНК-полимеразы и включает последовательность или представляет собой последовательность, функционально присоединенную к сайту инициации транскрипции. Промотором может быть индуцибельный промотор, обладающий активностью только в присутствии (или в отсутствии) специфического сигнала, либо таким промотором может быть конститутивно активный промотор. Активность промотора может также регулироваться регуляторными элементами, такими как регуляторные области локуса и энхансерные элементы.
«Кодирующая последовательность» представляет собой последовательность нуклеиновой кислоты, кодирующую генный продукт, такой как полипептид или РНК.
«Часть» элемента нуклеиновой кислоты, в частности, содержит по меньшей мере 5 нуклеиновых кислот, а предпочтительно, по меньшей мере 10, по меньшей мере 15, по меньшей мере 20, по меньшей мере 30 или по меньшей мере 50 нуклеиновых кислот указанного элемента нуклеиновой кислоты. «Часть» элемента нуклеиновой кислоты, в частности, содержит по меньшей мере 5 смежных нуклеотидов, а предпочтительно, по меньшей мере 10, по меньшей мере 15, по меньшей мере 20, по меньшей мере 30 или по меньшей мере 50 смежных нуклеотидов указанного элемента нуклеиновой кислоты. В частности, эта часть содержит по меньшей мере 1%, а предпочтительно, по меньшей мере 2%, по меньшей мере 3%, по меньшей мере 5%, по меньшей мере 7,5%, по меньшей мере 10%, по меньшей мере 15%, по меньшей мере 20% или по меньшей мере 25% указанного элемента нуклеиновой кислоты. «Функциональная часть» элемента нуклеиновой кислоты представляет собой часть указанного элемента, способную осуществлять нужную функцию элемента. Так, например, функциональная часть регуляторной области локуса, промотора или 3'-энхансера способна модулировать, а в частности, повышать уровень экспрессии кодирующей области, к которой она функционально присоединена. Часть элемента нуклеиновой кислоты, в частности, означает функциональную часть указанного элемента нуклеиновой кислоты.
Используемые здесь термины «пептид» или «полипептид» означают полипептидную цепь, содержащую по меньшей мере 5 аминокислот. Пептид или полипептид, предпочтительно, содержит по меньшей мере 10, по меньшей мере 15, по меньшей мере 20, по меньшей мере 25, по меньшей мере 30 или по меньшей мере 35 аминокислот. Используемые здесь термины «пептид» или «полипептид» также означают белки, включая пептиды, полипептиды и белки, которые были посттрансляционно модифицированны. В частности, термин пептид или полипептид включает гликозилированные пептиды и гликопротеины. Используемые здесь термины «пептид» или «полипептид» являются синонимами.
Часть пептида, полипептида или белка предпочтительно включает по меньшей мере 3 смежных аминокислот указанного пептида, полипептида или белка, а предпочтительно, по меньшей мере 5, по меньшей мере 10, по меньшей мере 15 или по меньшей мере 20 смежных аминокислот указанного белка.
Термин «фармацевтическая композиция» и аналогичные термины, в частности, означают композицию, подходящую для введения человеку, то есть, композицию, содержащую компоненты, которые являются фармацевтически приемлемыми. Фармацевтическая композиция, предпочтительно, содержит активное соединение или его соль или пролекарство вместе с носителем, разбавителем или фармацевтическим наполнителем, таким как буфер, консервант и модификатор тоничности.
Подробное описание изобретения
Настоящее изобретение относится к экспрессионному кластеру, содержащему по меньшей мере часть регуляторной области локуса кластера человеческого гена глобина и промотора человеческого Aγ-глобина.
Гемоглобин представляет собой металлопротеин, присутствующий в крови человека и животных и осуществляющий транспорт кислорода и диоксида углерода. Гемоглобин представляет собой мультисубъединичный глобулярный белок, состоящий из четырех субъединиц (глобинов), каждая из которых состоит из полипептидной цепи, тесно связанной с гемом, то есть, с группой, которая несет ион железа. Существует несколько различных типов субъединиц глобина, и состав субъединиц гемоглобина изменяется на протяжении всей жизни. Так, например, плод человека имеет гемоглобин F, состоящий из двух α-глобинов и двух γ-глобинов (α2γ2), а у взрослого человека преобладает гемоглобин А с двумя α-глобинами и двумя β-глобинами (α2β2). Различные полипептиды глобина экспрессируются кластерами человеческого гена глобина, ответственными за экспрессию различных субъединиц на различных стадиях развития человека. Кластер человеческого гена β-глобина содержит регуляторную область локуса и пять различных генов глобина, то есть, ген ε-, Gγ-, Aγ-, δ- и β-глобина. Аналогичным образом, кластер гена α-глобина также содержит регуляторную область локуса и гены ζ-, α2-, α1- и θ-глобина. На фигуре 1 представлена структура кластеров человеческого гена α- и β-глобина. Каждый отдельный ген глобина в генном кластере имеет свои собственные специфические промоторные и энхансерные последовательности, которые регулируют экспрессию кодирующией последовательности соответствующей субъединицы глобина. Однако, эти промоторы сами регулируются регуляторной областью локуса. В частности, регуляторная область локуса способна активировать или инактивировать промоторы, и этот паттерн активации изменяется на протяжении всей жизни. Обе регуляторные области локуса (одна в кластере гена α-глобина и одна в кластере гена β-глобина) регулируют экспрессию различных генов глобина в процессе развития организма, что позволяет получить специфический состав субъединиц различных белков гемоглобина.
Регуляторные области локуса содержат несколько сайтов гиперчувствительности к ДНКазе I (HS), ответственных за активацию и инактивацию промоторов. Было обнаружено, что, например, HS2 кластера гена β-глобина регулирует активность промотора Aγ-глобина. HS2 кластера гена β-глобина может быть дополнительно подразделен на коровую область и модуляторные субдомены. Коровой областью является часть HS2, которая, главным образом, ответственна за активацию промотора глобина. Модуляторные субдомены M1-M5 позитивно или негативно модулируют эффект корового домена. Коровая область расположена между модуляторными субдоменами M1 и M2, а за ними следуют M1-M5. В частности, M1 и M2 также усиливают активирующий эффект коровой области на промоторе Aγ-глобина.
В настоящее время известно, что использование экспрессионных элементов кластеров человеческого гена глобина позволяет достичь стабильного и высокого уровня экспрессии целевого продукта, такого как представляющий интерес полипептид в эукариотических клетках, а в частности, в клетках крови человека или в клетках, происходящих от этих клеток. Настоящее изобретение относится к экспрессионному кластеру, содержащему по меньшей мере функциональную часть промотора человеческого Aγ-глобина и по меньшей мере функциональную часть регуляторной области локуса кластера человеческого гена α-глобина или β-глобина. Экспрессионный кластер также содержит кодирующую область, которая включает последовательность нуклеиновой кислоты, кодирующую представляющий интерес полипептид и/или сайт клонирования для введения такой кодирующей области. Экспрессионный кластер может также включать энхансерную область, содержащую по меньшей мере функциональную часть 3'-энхансера человеческого гена Aγ-глобина. Регуляторная область локуса, промотор и 3'-энхансер расположены в экспрессионном кластере так, что они могут модулировать, а в частности, осуществлять и усиливать экспрессию кодирующей области. Экспрессионный кластер может также включать область терминации транскрипции, где осуществляется терминация транскрипции кодирующей области. Элементы экспрессионного кластера, в частности, функционально присоединены друг к другу.
Конкретные примеры экспрессионного кластера включают последовательность нуклеиновой кислоты любой из SEQ ID NN: 1-5 или состоят из этой последовательности. Соответствующие экспрессионные элементы также представлены на фигуре 2, где показаны различные элементы экспрессионных кластеров. В частности, HS4, HS3, HS2 и HS40 представляют собой части регуляторной области локуса кластера человеческого α-глобина или β-глобина. За этой регуляторной областью локуса показана функциональная часть промотора человеческого Aγ-глобина (Aγ-Prom). За этой областью расположена кодирующая последовательность или сайт клонирования для введения кодирующей последовательности (CS) и область терминации транскрипции, включая сигнал полиаденилирования (γpA). На конце экспрессионного кластера расположена функциональная часть 3'-энхансера человеческого гена Aγ-глобина (Aγ-Enh).
В некоторых вариантах осуществления изобретения, экспрессионный кластер не содержит интрона 2 β-глобина, а в частности, любого интрона гена β-глобина или любого другого гена глобина.
Промотор человеческого Aγ-глобина
В экспрессионном кластере используется функциональная часть промотора человеческого Aγ-глобина для осущетвления и регуляции экспрессии кодирующей области, а в частности, представляющего интерес полипептида. Функциональная часть промотора человеческого Aγ-глобина, в частности, расположена выше кодирующей области. Она функционально присоединена к кодирующей области и обеспечивает транскрипцию и регуляцию транскрипции. В некоторых вариантах осуществления изобретения, функциональная часть промотора человеческого Aγ-глобина включает сайт инициации транскрипции, где происходит инициация транскрипции пре-мРНК. Кроме того, функциональная часть промотора человеческого Aγ-глобина может также включать по меньшей мере часть 5'-нетранслируемой области (5'-UTR), а в частности, по меньшей мере часть 5'-UTR человеческого гена Aγ-глобина. В конкретных вариантах осуществления изобретения, функциональная часть промотора человеческого Aγ-глобина включат по меньшей мере часть человеческого гена Aγ-глобина, которая осуществляет транскрипцию мРНК человеческого Aγ-глобина. В некоторых вариантах осуществления изобретения, функциональная часть промотора человеческого Aγ-глобина содержит CCAAT-бокс. В частности, функциональная часть промотора человеческого Aγ-глобина включает, или состоит из них, нуклеотиды (-299)-(-26), а в частности, нуклеотиды (-299)-(+36), нуклеотид (-384)-(-26) или нуклеотиды (-384)-(+36) по отношению к сайту инициации транскрипции человеческого гена Aγ-глобина. В частности, функциональная часть промотора человеческого Aγ-глобина включает последовательность нуклеиновой кислоты в положениях 1123-1542 SEQ ID NO: 1 и, по существу, состоит из нее. Можно также использовать более короткие фрагменты промотора человеческого Aγ-глобина, которые являются еще функциональными. Специалист в данной области может самостоятельно определить подходящие функциональные части промотора человеческого Aγ-глобина. В частности, методы определения активности промоторной последовательности известны специалистам и описаны ниже в примерах.
Альтернативно, гомолог указанной функциональной части промотора человеческого Aγ-глобина может быть использован в соответствии с настоящим изобретением. Указанный гомолог, предпочтительно, по меньшей мере на 85%, а более предпочтительно, по меньшей мере на 90%, по меньшей мере на 95%, по меньшей мере на 97%, по меньшей мере на 98% или по меньшей мере на 99% идентичен одной из последовательностей нуклеиновой кислоты, определенной выше, по всей ее длине. В некоторых вариантах осуществления изобретения, гомолог имеет такую же функцию и/или активность или, по существу, такую же функцию и/или активность, как и функциональная часть промотора Aγ-глобина, от которого она происходит, и в частности, обеспечивает уровнь экспрессии кодирующей области, составляющий по меньшей мере 75%, а предпочтительно, по меньшей мере 80%, по меньшей мере 85% или по меньшей мере 90% от уровня экспрессии, достигаемого с использованием функциональной части промотора Aγ-глобина, от которой она происходит, в одних и тех же условиях.
Регуляторная область локуса
Регуляторная область локуса функционально присоединена к промоторной области и способна модулировать, а в частности, усиливать активность функциональной части промотора человеческого Aγ-глобина. Регуляторная область локуса, в частности, расположена выше промотороной области.
В некоторых предпочтительных вариантах осуществления изобретения используется регуляторная область локуса или функциональная часть кластера человеческого гена β-глобина. Как известно специалистам, регуляторная область локуса человеческого гена β-глобина включает четыре эритроид-специфических сайтов гиперчувствительности к ДНКазе I, обозначаемых HS1-HS4 и расположенных на 6-20 т.п.н. выше первого гена глобина этого генного кластера, то есть, гена ε-глобина. В частности, HS2 отвественнен за регуляцию экспрессии генов глобина, и считается, что он включает главный функциональный компонент регуляторной области локуса. HS2 регуляторной области локуса человеческого β-глобина подразделяется на коровый элемент и дополнительные модуляторные субдомены, где коровый элемент расположен между модуляторными субдоменами M1 и M2. Коровый элемент представляет собой минимальную область регуляторной области локуса β-глобина, которая способна усиливать промоторную активность промотора человеческого Aγ-глобина.
В предпочтительном варианте осуществления изобретения, регуляторная область локуса включает коровый элемент сайта гиперчувствительности к ДНКазе I 2 (HS2) кластера человеческого гена β-глобина. В частности, коровый элемент HS2 кластера человеческого гена β-глобина имеет последовательность нуклеиновой кислоты в положениях 906-939 SEQ ID NO: 1. В некоторых вариантах осуществления изобретения, регуляторная область локуса включает или состоит из них, коровый элемент HS2 и два смежных модуляторных субдомена M1 и M2, то есть, элемент M1-кор-M2 HS2 кластера человеческого гена β-глобина. Указанный элемент M1-кор-M2 может иметь последовательность нуклеиновой кислоты в положениях 742-995 SEQ ID NO: 1. Следовательно, он включает коровую область HS2, имеющую последовательность нуклеиновой кислоты в положениях 906-939 SEQ ID NO: 1.
В другом варианте осуществления изобретения, регуляторная область локуса включает по меньшей мере функциональную часть сайта гиперчувствительности 2 (HS2) кластера человеческого гена β-глобина, который содержит последовательность нуклеиновой кислоты в положениях 741-1109 SEQ ID NO: 1. Эта функциональная часть HS2 включает элемент M1-кор-M2 и дополнительную последовательность нуклеиновой кислоты, расположенную непосредственно ниже.
В некоторых вариантах осуществления изобретения, регуляторная область локуса, которая включает по меньшей мере функциональную часть HS2 кластера человеческого гена β-глобина, также содержит по меньшей мере часть сайта гиперчувствительности 3 (HS3) кластера человеческого гена β-глобина. В частности, HS3 или его часть расположены выше HS2 или его части в регуляторной области локуса экспрессионного кластера. HS3 или его часть, в частности, содержат последовательность нуклеиновой кислоты в положениях 310-735 SEQ ID NO: 1 или состоят из нее. Кроме того, регуляторная область локуса может также включать сайт гиперчувствительности 4 (HS4) или его часть в кластере человеческого гена β-глобина, которые, в частности, расположены выше HS2 и HS3, если они присутствуют. В некоторых вариантах осуществления изобретения, HS4 или его часть включают последовательность нуклеиновой кислоты в положениях 13-294 SEQ ID NO: 1 или состоят из нее. Следовательно, регуляторная область локуса экспрессионного кластера согласно изобретению может включать, в направлении к 3'-концу, но необязательно, по меньшей мере часть HS4, необязательно, по меньшей мере часть HS3, и по меньшей мере функциональную часть HS2 кластера человеческого гена β-глобина. В альтернативных вариантах осуществления изобретения, регуляторная область локуса не содержит сайта гиперчувствительности 3 (HS3) кластера человеческого гена β-глобина.
В конкретных вариантах осуществления изобретения, регуляторная область локуса имеет последовательность нуклеиновой кислоты, выбранную из группы, состоящей из последовательностей в положениях 13-1109 SEQ ID NO: 1, в положениях 20-819 SEQ ID NO: 2, в положениях 18-386 SEQ ID NO: 3 и в положениях 13-266 SEQ ID NO: 4.
В другом варианте осуществления изобретения, регуляторная область локуса содержит по меньшей мере функциональную часть сайта гиперчувствительности 40 (HS40) кластера человеческого гена α-глобина. Часть HS40, в частности, включает или состоит из него, коровый элемент HS40, который может иметь последовательность нуклеиновой кислоты в положениях 24-278 SEQ ID NO: 5. В частности, HS40 или его часть включают последовательность нуклеиновой кислоты в положениях 7-372 SEQ ID NO: 5 или состоит из нее.
Кроме того, в некоторых вариантах осуществления изобретения может быть использована регуляторная область локуса, включающая последовательность нуклеиновой кислоты или состоящая из последовательности нуклеиновой кислоты, которая гомологична одной из последовательностей вышеуказанных регуляторных областей локуса. В частности, указанный гомолог имеет последовательность, которая по меньшей мере 90%, а предпочтительно, по меньшей мере на 95%, по меньшей мере на 97%, по меньшей мере на 98% или по меньшей мере на 99% идентична одной из вышеуказанных последовательностей регуляторных областей локуса по всей длине и/или имеет такую же или почти такую же функцию, как и регуляторная область локуса, от которой она происходит. В предпочтительных вариантах осуществления изобретения, регуляторная область локуса гомолога обеспечивает уровень экспрессии кодирующей области, который составляет по меньшей мере 75%, а предпочтительно, по меньшей мере 80%, по меньшей мере 85% или по меньшей мере 90% от уровня экспрессии, достигаемого с использованием регуляторной области локуса, от которой она происходит, в одних и тех же условиях.
Кодирующая область
Кодирующая область экспрессионного кластера включает последовательности нуклеиновой кислоты, кодирующие представляющий интерес продукт, а в частности, представляющий интерес полипептид, который экспрессируется в экспрессионном кластере. Экспрессия последовательностей нуклеиновой кислоты кодирующей области регулируется промоторной областью и, следовательно, функционально присоединена к этой области. При введении экспрессионного кластера, необязательно присутствующего в векторе, в подходящую клетку-хозяина, указанная клетка-хозяин продуцирует продукт, а в частности, полипептид, кодируемый последовательностями нуклеиновой кислоты кодирующей области.
Кодирующая область экспрессионного кластера, в частности, содержит последовательность нуклеиновой кислоты, кодирующую представляющий интерес полипептид, или состоит из этой последовательности.
Представляющим интерес полипептидом может быть любой полипептид, включая белки. Такой полипептид может иметь любое происхождение, включая полипептиды млекопитающих и человеческие полипептиды, а также искусственные полипептиды. В некоторых вариантах осуществления изобретения, полипептид включает один или более сайтов гликозилирования и, в частности, представляет собой гликозилированный полипептид, такой как гликопротеин или его часть; антитела или их производные или части; пептидные гормоны; гонадотропины, такие как FSH (фолликуло-стимулирующий гормон), CG (хорионический гонадотропин), LH (лютеинизирующий гормон) и TSH (тиреотропный гормон), включая все их изоформы и варианты; эритропоэтин; факторы свертывания крови, такие как фактор VII, VIII, IX или фактор фон Виллебранда; лизосомные ферменты и цитокины. Кроме того, представляющий интерес полипептид может быть выбран из группы, состоящей из любых белковых молекул группы цитокинов и их рецепторов, например, факторов некроза опухоли TNF-альфа и TNF-бета; ренина; человеческого гормона роста и бычьего гормона роста; рилизинг-фактора гомона роста; паратиреоидного гормона; стереотропного гормона; липопротеинов; альфа-1-антитрипсина; A-цепи и B-цепи инсулина; гонадотропинов, например, фолликулостимулирующего гормона (FSH), лютеинизирующего гормона (LH), тиротропина и человеческого хорионического гонадотропина (hCG); кальцитонина; глюкагона; факторов свертывания крови, таких как фактор VIIIC, фактор IX, фактор VII, тканевый фактор и фактор фон Виллебранда; факторов, препятствующих свертыванию крови, таких как белок C; натрийуретического фактора предсердий; поверхностно-активного вещества легких: активаторов плазминогена, таких как урокиназа, человеческий активатор плазминогена мочи и активатор плазминогена тканевого типа; бомбезина; тромбина; гемопоэтического фактора роста; энкефаллиназы; воспалительного белка человеческих макрофагов; сыворотчного альбумина, такого как альбумин человеческой сыворотки; мюллеровского ингибирующего фактора; А-цепи и В-цепи релаксина; прорелаксина; пептида, ассоциированного с мышиным гонадотропином; васкулярного эндотелиального фактора роста; рецепторов гормонов или факторов роста; интегрина; белка A и D; ревматоидных факторв; нейротропных факторов, таких как нейротропный фактор кости, нейротропин -3, -4, -5, -6 и фактор-бета роста нервных тканей; тромбоцитарного фактора роста; фактора роста фибробластов; эпидермального фактора роста; трансформирующего фактора роста, такого как TGF-альфа и TGF-бета; инсулинподобного фактора роста -l и -II; белков, связывающихся с инсулинподобным фактором роста; белков CD, таких как CD-3, CD-4, CD-8 и CD-19; эритропоэтина (EPO); остеогенных факторов; иммунотоксинов; белка морфогенеза кости; интерферона, такого как интерферон-альфа, -бета и -гамма; колониестимулирующих факторов (CSF), например, M-CSF, GM-CSF и G-CSF; интерлейкинов (IL), например, IL-1 - IL-12; супероксид-дисмутазы; Т-клеточных рецепторов; поверхностных мембранных белков; фактора, ускоряющего разложение; антител и иммуноадгезинов; гликофорина A; и белков-муцинов, таких как MUC1.
В некоторых вариантах осуществления изобретения, представляющий интерес полипептид представляет собой антитело или его часть или производное. В частности, представляющим интерес полипептидом может быть тяжелая цепь или легкая цепь антитела или его части. Кроме того, представляющим интерес полипептидом может быть часть или производное антитела, выбранные из группы, состоящей из (i) Fab-фрагментов, одновалентных фрагментов, состоящих из вариабельной области и первого константного домена каждой тяжелой и легкой цепи; (ii) F(ab)2-фрагментов, двухвалентных фрагментов, содержащих два Fab-фрагмента, связанных дисульфидным мостиком в шарнирной области; (iii) Fd-фрагментов, состоящих из вариабельной области первого константного домена CH1 тяжелой цепи; (iv) Fv-фрагментов, состоящих из вариабельной области тяжелой цепи и легкой цепи одной ветви антитела; (v) scFv-фрагментов, Fv-фрагментов, состоящих из одной полипептидой цепи; (vi) (Fv)2-фрагментов, состоящих из двух Fv-фрагментов, ковалентно связанных друг с другом; (vii) вариабельного домена тяжелой цепи и (viii) мультиантител, состоящих из вариабельной области тяжелой цепи и вариабельной области легкой цепи, ковалентно связанных друг с другом так, чтобы ассоциация вариабельных областей тяжелой цепи и легкой цепи могла быть только межмолекулярной, но не внутримолекулярной. В тех вариантах, где экспрессионный кластер включает кодирующую область, кодирующую антитело или его часть или производное, регуляторная область локуса, в частности, содержит по меньшей мере часть HS2 кластера человеческого гена β-глобина, предпочтительно, по меньшей мере часть HS2 и по меньшей мере HS3 кластера человеческого гена β-глобина, или по меньшей мере часть HS2 и по меньшей мере часть HS4 кластера человеческого гена β-глобина, а в частности, по меньшей мере часть HS2 и по меньшей мере часть HS3 и по меньшей мере часть HS4 кластера человеческого гена β-глобина.
В некоторых вариантах осуществления изобретения, кодирующая область кодирует более, чем один полипептид, а в частности, два полипептида. В этих вариантах осуществления изобретения, кодирующая область может содержать две или более отдельных последовательностей нуклеиновой кислоты, которые транскрибируются в отдельные мРНК, каждая из которых имеет свой собственный сайт инициации транскрипции, сайт терминации транскрипции и сигнал полиаденилирования. Альтернативно, кодирующая область может содержать последовательность нуклеиновой кислоты, которая транскрибируется в мРНК, включающую две или более отдельных кодирующих последовательностей нуклеиновой кислоты, каждая из которых кодирует отдельный полипептид. В этих вариантах осуществления изобретения, кодирующая область может включать один или более внутренних сайтов связывания с рибосомой, каждый из которых кодирует каждую последовательность нуклеиновой кислоты. Эти внутренние сайты связывания с рибосомой осуществляют трансляцию более, чем одного полипептида из одного транскрипта. В некоторых вариантах осуществления изобретения, кодирующая область кодирует два полипептида, а в частности, тяжелую цепь и легкую цепь антитела.
В некоторых вариантах осуществления изобретения, кодирующая область содержит последовательность нуклеиновой кислоты, кодирующую сигнальный пептид, который, в частности, включает внеклеточный сигнал локализации. Последовательность нуклеиновой кислоты, кодирующая сигнальный пептид, может представлять собой лишь кодирующую последовательность кодирующей области, либо она может присутствовать помимо других кодирующих последовательностей, таких как последовательности нуклеиновой кислоты, кодирующие описанный выше полипептид. Сигнальный пептид, в частности, индуцирует секреторную экспрессию представляющего интерес полипептида, кодируемого кодирующей областью. Сигнальный пептид может отщепляться от остального полипептида в процессе экспрессии. Сигнальный пептид, в частности, расположен выше других кодирующих последовательностей нуклеиновой кислоты, содержащихся в кодирующей области, или выше сайта клонирования, в частности, в начале кодирующей области. Кроме того, последовательность нуклеиновой кислоты, кодирующая сигнальный пептид, расположена в одной рамке считывания с другими кодирующими последовательностями нуклеиновой кислоты, содержащимися в кодирующей области.
В конкретных вариантах осуществления изобретения, кодирующая область включает последовательность нуклеиновой кислоты, кодирующую представляющий интерес полипептид.
В некоторых вариантах осуществления изобретения, кодирующая область не содержит репортерного гена или селективного маркерного гена. В других вариантах осуществления изобретения, кодирующая область не содержит последовательности нуклеиновой кислоты, кодирующей белок глобин или его часть, включающие по меньшей мере 20 смежных аминокислот белка глобина.
Сайт клонирования
В некоторых вариантах осуществления изобретения, экспрессионный кластер включает сайт клонирования для интеграции последовательности нуклеиновой кислоты. Сайт клонирования может присутствовать в экспрессионном кластере вместо кодирующей области и может служить для введения указанной последовательности нуклеиновой кислоты в экспрессионный кластер. Кроме того, сайт клонирования может присутствовать в экспрессионном кластере помимо кодирующей области, а в частности, в тех вариантах осуществления изобретения, где кодирующая область содержит только последовательность нуклеиновой кислоты, кодирующую сигнальный пептид.
Сайт клонирования, присутствующий в экспрессионном кластере, является подходящим для введения кодирующей области, а в частности, нуклеиновой кислоты, кодирующей представляющий интерес полипептид, в экспрессионный кластер. Подходящие сайты клонирования и методы введения фрагментов нуклеиновой кислоты в другие молекулы нуклеиновой кислоты, такие как экспрессионные кластеры или векторы, хорошо известны специалистам. В некоторых вариантах осуществления изобретения, сайт клонирования содержит по меньшей мере одну, а в частности, по меньшей мере две, по меньшей мере три, по меньшей мере четыре или по меньшей мере пять последовательностей распознавания рестриктирующих ферментов. Подходящие рестриктирующие ферменты и распознающие их последовательности известны специалистам. Репрезентативными рестриктирующими ферментами являются EcoRI, EcoRV, HindIII, BamHI, XbaI, PvuI, KpnI, BstXI, XmaI, SmaI, NotI, XhoI и ClaI. Репрезентативная последовательность нуклеиновой кислоты множественного сайта клонирования представлена последовательностью нуклеиновой кислоты в положениях 1559-1664 SEQ ID NO: 1.
Область терминации транскрипции
В некоторых вариантах осуществления изобретения, экспрессионный кластер включает область терминации транскрипции. Область терминации транскрипции функционально присоединена к промоторной области и осуществляет терминацию транскрипции кодирующей области. Эта область расположена ниже кодирующей области и/или сайта клонирования.
В конкретных вариантах осуществления изобретения, область терминации транскрипции содержит сайт терминации транскрипции и/или сигнал полиаденилирования. Сигналом полиаденилирования может быть любой сигнал полиаденилирования, способный индуцировать полиаденилирование пре-мРНК в эукариотических клетках, а в частности, в человеческих клетках. Он может содержать последовательность нуклеиновой кислоты или состоять из последовательности нуклеиновой кислоты в положениях 1725-1730 SEQ ID NO: 1 или ее гомолога.
Энхансерная область
В некоторых вариантах осуществления изобретения, экспрессионный кластер содержит энхансерную область, а в частности, 3'-энхансерную область. 3'-энхансерная область расположена ниже кодирующей области и/или сайта клонирования и ниже области терминации транскрипции, если она присутствует. Эта область функционально присоединена к промоторной области и усиливает экспрессию кодирующей области. Энхансерная область, в частности, содержит по меньшей мере функциональную часть 3'-энхансера человеческого гена Aγ-глобина или состоит из нее. В некоторых вариантах осуществления изобретения, энхансерная область содержит последовательность нуклеиновой кислоты или состоит из последовательности нуклеиновой кислоты в положениях 2136-2881 SEQ ID NO: 1 или ее гомолога. В некоторых вариантах осуществления изобретения, энхансерная область гомолога обеспечивает уровень экспрессии кодирующей области, который составляет по меньшей мере 75%, а предпочтительно, по меньшей мере 80%, по меньшей мере 85% или по меньшей мере 90% от уровня экспрессии, достигаемого с использованием энхансерной области, от которой она происходит, в одних и тех же условиях.
Вектор, содержащий экспрессионный кластер
В одном из своих аспектов настоящее изобретение относится к к вектору, содержащему экспрессионный кластер согласно изобретению. Таким вектором может быть любой вектор, подходящий для переноса экспрессионного кластера в клетку-хозяина. Подходящие векторы известны специалистам. В частности, данный вектор адаптирован для переноса в эукариотические клетки, такие как клетки млекопитающих, а в частности, человеческие клетки.
Помимо экспрессионного кластера, вектор может включать и другие элементы. Так, например, вектор может включать один или более селективных маркеров. В некоторых вариантах осуществления изобретения, по меньшей мере один из селективных маркеров является подходящим для отбора клеток-хозяев, содержащих данный вектор, в частности, эукариотических клеток-хозяев, таких как клетки-хозяева млекопитающих, а в частности, человеческие клетки-хозяева, от клеток-хозяев, не содержащих этого вектора. Подходящими примерами селективных маркеров являются гены, которые сообщают резистентность к соединению-антибиотику. Кроме того, вектор может содержать элементы, подходящие для его амплификации в прокариотических клетках-хозяевах, таких как клетки E. coli. Такими элементами являются, например, ориджин репликации, такой как Col E1 Ori и, прокариотический селективный маркер, такой как ген, сообщающий резистентность к бактерициду, например, к ампициллину.
В некоторых вариантах осуществления изобретения, вектор представляет собой кольцевую или линейную двухцепочечную ДНК, а в частности, кольцевую двухцепочечную ДНК.
В некоторых вариантах осуществления изобретения, вектор включает экспрессионный кластер с кодирующей областью, содержащей последовательность нуклеиновой кислоты, кодирующую представляющий интерес полипептид.
Селективный маркерный ген
В некоторых вариантах осуществления изобретения, вектор также содержит селективный маркерный ген. Селективный маркерный ген необязательно должен быть функционально присоединен к элементам экспрессионного кластера. Селективный маркерный ген позволяет осуществлять отбор клеток-хозяев, которые содержат данный вектор. Клетки, содержащие данный вектор, предпочтительно, культивируют в присутствии соответствующего селективного агента, который подавляет или ингибирует пролиферацию клеток, не содержащих селективного маркерного гена.
В конкретных вариантах осуществления изобретения, селективный маркерный ген представляет собой амплифицированный селективный маркерный ген, который позволяет осуществлять амплификацию маркерного гена и ко-амплификацию экспрессионного кластера, присутствующего в этом же векторе. При использовании амплифицированного селективного маркерного гена, амплификация селективного маркера, в частности, в трансфицированных клетках, в частности, достигается путем поэтапного культивирования клеток в присутствии возрастающих концентраций селективного агента. В некоторых вариантах осуществления изобретения, селективный маркерный ген кодирует дигидрофолат-редуктазу (DHFR), такую как антифолат-резистентный вариант DHFR, а соответствующим селективным агентом является антифолат, такой как метотрексат.
Другими примерами подходящих амплифицируемых селективных маркерных генов и их соответствующих селективных агентов являются ген резистентности к неомицину (например, аминогликозид-фосфотрансфераза) и генетицин (G418); пуромицин-N-ацетилтрансфераза и пуромицин; металлотионеин и кадмий; CAD (карбомоил-фосфатсинтетаза: аспартат-транскарбамилаза: дигидрооротаза) и N-фосфоацетил-L-аспартат; аденозин-дезаминаза и Xyl-A- или аденозин, 2'-дезоксикоформицин; AMP (аденилат)-дезаминаза и аденин, азасерин, коформицин; UMP-синтаза и 6-азауридин, пиразофуран; IMP 5'-дегидрогеназа и микофеноловая кислота; ксантин-гуанин-фосфорибозилтрансфераза и микофеноловая кислота с ограниченным количеством ксантина; мутантная HGPRTаза или мутантная тимидинкиназа и гипоксантин, аминоптерин и тимидин (HAT); тимидилат-синтетаза и 5-фтордезоксиуридин;; P-гликопротеин 170 (MDR1) и адриамицин, винкристин, колхицин; рибонуклеотид-редуктаза и афидиколин; глутамин-синтетаза и метионин-сульфоксимин (MSX); аспарагин-синтетаза и β-аспартилгидроксамат, альбизин, 5'-азацитидин; аргининосукцинат-синтетаза и канаванин; орнитин-декарбоксилаза и α-дифторметилорнитин; HMG-CoA-редуктаза и компактин; N-ацетилглюкозаминил-трансфераза и туникамицин; треонил-тРНК-синтетаза и боррелидин; и Na+K+-АТФаза и убаин.
Клетка-хозяин, содержащая экспрессионный кластер или вектор
В другом своем аспекте, настоящее изобретение относится к клетке-хозяину, содержащей экспрессионный кластер согласно изобретению или вектор согласно изобретению. Клеткой-хозяином может быть любая клетка, подходящая для трансфекции экспрессионным кластером или вектором, а в частности, подходящая для продуцирования представляющего интерес полипептида. В некоторых вариантах осуществления изобретения, клетка-хозяин происходит от клеточной линии со стабильной экспрессией. Клеткой-хозяином, в частности, является эукариотическая клетка, такая как клетка млекопитающего, а в частности, клетка человека или происходящая от нее клетка. В частности, клеткой-хозяином является клетка крови, такая как лейкоцит, клетка-предшественник крови или клетка лейкоза или клетка, происходящая от этих клеток. В некоторых вариантах осуществления изобретения, клеткой-хозяином является клетка лейкоцитарного происхождения.
В конкретных вариантах осуществления изобретения, клетка-хозяин происходит от клеток человеческого миелоидного лейкоза. Конкретными примерами клеток-хозяев являются K562, NM-F9, NM-D4, NM-H9D8, NM-H9D8-E6, NM-H9D8-E6Q12, GT-2X, GT-5s и клетки, происходящие от любой из указанных клеток-хозяев. K562 представляет собой клеточную линию человеческого миелоидного лейкоза, имеющуюся в Американской коллекции типовых культур (ATCC CCL-243). Остальные клеточные линии происходят от клеток K562 и были отобраны на специфические признаки гликозилирования. Клеточные линии, происходящие от K562, могут быть культивированы и могут поддерживаться в хорошо известных условиях, подходящих для K562. Все эти клеточные линии, за исключением клеток K562, были депонированы в соответствии с Будапештским договором. Информацию о депонировании можно найти в конце описания.
Репрезентативные клетки-хозяева также описаны, например, в WO 2008/028686. В некоторых вариантах осуществления изобретения, клетку-хозяина оптимизируют по экспрессии гликопротеинов, имеющих специфический паттерн гликозилирования. В частности, встречаемость кодонов в кодирующей области и/или в промоторе и в других элементах экспрессионного кластера или вектора является совместимой с типом используемых клеток-хозяев, а в частности, оптимизирована по этому типу.
В некоторых вариантах осуществления изобретения, клеткой-хозяином является выделенная клетка-хозяин. В конкретных вариантах осуществления изобретения, клетка-хозяин не присутствует в организме человека или животного.
Клетка-хозяин может быть транзиентно или стабильно трансфецирована экспрессионным кластером или вектором согласно изобретению. Стабильную трансфекцию предпочтительно осуществляют в частности, путем интеграции экспрессионного кластера в геном клетки-хозяина. Методы трансфекции для стабильной или транзиентной трансфекции хорошо известны специалистам. В некоторых вариантах осуществления изобретения, клетку-хозяина трансфецируют вектором, который содержит экспрессионный кластер с кодирующей областью, включающей последовательность нуклеиновой кислоты, кодирующую представляющий интерес полипептид.
Способ продуцирования
В другом своем аспекте, настоящее изобретение относится к способу рекомбинантного продуцирования представляющего интерес полипептида, где указанный способ включает стадии:
(a) получения клетки-хозяина, содержащей экспрессионный кластер, включающий, функционально присоединенные друг к другу:
(i) регуляторную область локуса, содержащую по меньшей мере функциональную часть регуляторной области локуса кластера человеческого гена β-глобина или кластера человеческого гена α-глобина;
(ii) промоторную область, содержащую по меньшей мере функциональную часть промотора человеческого гена Aγ-глобина; и
(iii) кодирующую область, содержащую последовательность нуклеиновой кислоты, кодирующую представляющий интерес полипептид;
(b) культивирования клетки-хозяина в условиях, при которых клетка-хозяин экспрессирует представляющий интерес полипептид; и
(c) выделения представляющего интерес полипептида.
Клетка-хозяин, в частности, содержит экспрессионный кластер, определенный в настоящей заявке и имеющий один или более определенных здесь элементов.
Условия, подходящие для культивирования клеток-хозяев и экспрессии представляющего интерес полипептида, зависят от конкретной клетки-хозяина, вектора и экспрессионного кластера, используемых в этом способе. Специалист в данной области может легко определить подходящие условия, и условия для множества клеток-хозяев уже описаны в литературе. В некоторых вариантах осуществления изобретения, клетку-хозяина трансфецируют вектором, содержащим экспрессионный кластер, а также селективный маркерный ген. В этих вариантах осуществления изобретения, условия культивирования в стадии (b) могут включать присутствие соответствующего селективного агента в клеточной культуральной среде.
Выделение представляющего интерес полипептида, в частности, означает отделение представляющего интерес полипептида от остальных компонентов клеточной культуры. В некоторых вариантах осуществления изобретения, кодирующая область экспрессионного кластера также включает последовательность нуклеиновой кислоты, кодирующую сигнальный пептид для секреторной экспрессии, а в стадии (b), представляющий интерес полипептид секретируется клеткой-хозяином. В этих вариантах осуществления изобретения, стадия (c), в частности, включает отделение клеточной культуральной среды, содержащей представляющий интерес полипептид, от клеток-хозяев, например, путем центрифугирования, и отделение представляющего интерес полипептида от некоторых или большинства компонентов клеточной культуральной среды, например, хроматографическими методами. Подходящие методы и средства для выделения представляющего интерес полипептида известны специалистам и могут быть легко выбраны самим специалистом.
В некоторых вариантах осуществления изобретения, способ продуцирования представляющего интерес полипептида, после проведения стадии (c), также включает стадию
(d) приготовления представляющего интерес полипептида в виде фармацевтической композиции.
Приготовление представляющего интерес полипептида в виде фармацевтической композиции, в частности, включает обмен буферного раствора или компонентов буферного раствора композиции, содержащей представляющий интерес полипептид. Кроме того, стадия приготовления может включать лиофилизацию представляющего интерес полипептида. В частности, представляющий интерес полипептид переносят в композицию, содержащую только фармацевтически приемлемые ингредиенты.
Указанные здесь числовые интервалы являются инклюзивными в пределах определенного интервала. Указанные здесь заголовки не рассматриваются как ограничения различных аспектов или вариантов осуществления изобретения, которые могут быть представлены со ссылкой на описание как единое целое. В соответствии с одним из вариантов осуществления изобретения, описанный здесь предмет изобретения, включающий некоторые стадии, если он относится к способам, и некоторые ингредиенты, если он относится к композициям, означает предмет изобретения, состоящий из соответствующих стадий или ингредиентов. При этом предпочтительно выбрать и объединить конкретно описанные здесь аспекты и варианты и конкретный предмет изобретения, относящийся к соответствующей комбинации конкретных вариантов изобретения, также являющихся частью настоящего описания.
Чертежи
На фигуре 1 представлена структура кластеров человеческого гена глобина, включающих регуляторную область локуса (LCR) с различными сайтами гиперчувствительности к ДНКазе (HS) и с различными генами глобина. A: кластер человеческого гена β-глобина на хромосоме 11; B: кластер человеческого гена α-глобина на хромосоме 16.
На фигуре 2 представлены элементы репрезентативных экспрессионных кластеров, используемых в векторах pHBG1A-E. HS: сайт гиперчувствительности к ДНКазе; Aγ-Prom: промотор гена Aγ-глобина; CS: кодирующая последовательность/сайт клонирования; γpA: сигнал полиаденилирования гена Aγ-глобина; Aγ-ENh: 3'-энхансер гена Aγ-глобина.
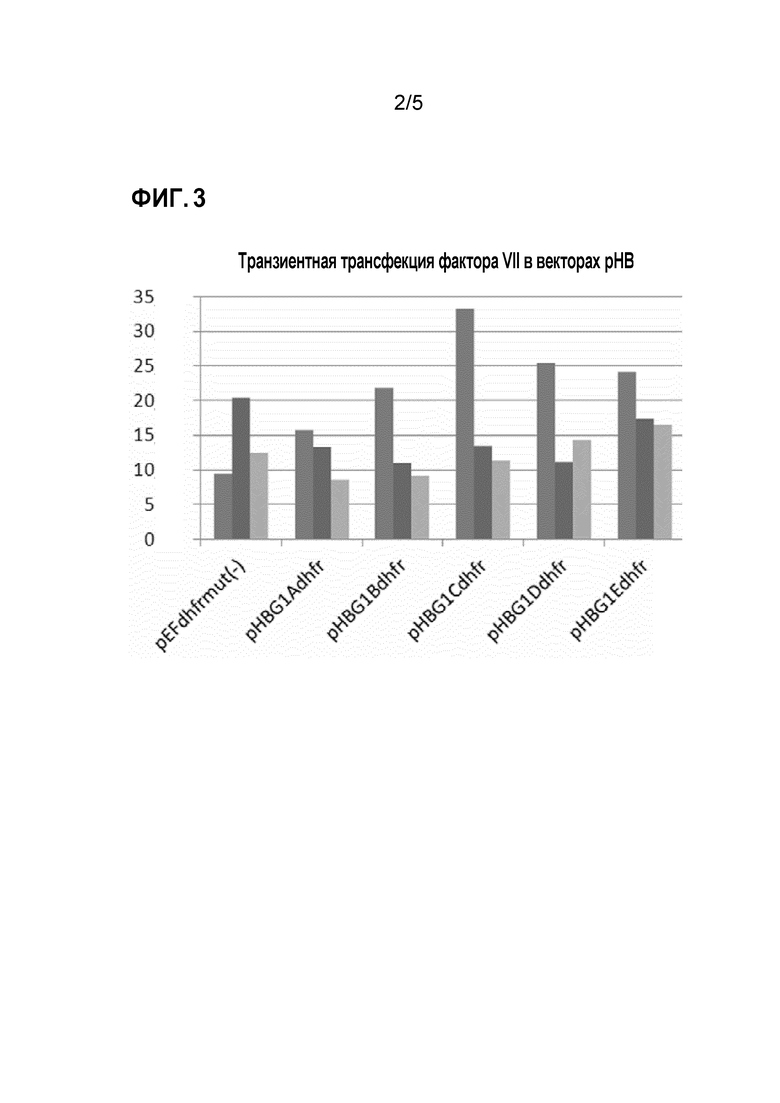
На фигуре 3 указан выход белка фактора VII, полученный после транзиентной трансфекции различными векторами, содержащими кодирующую последовательность фактора VII. Векторы, содержащие экспрессионные кластеры, представленные на фигуре 2 вместе с кодирующей последовательностью фактора VII, введенной в сайт клонирования, и с геном, кодирующим DHFR как амплифицируемый селективный маркер, были транзиентно перенесены в клетки NM-H9D8. Общий выход фактора VII был определен после культивирования. pEFdhfrmut(-): контрольный вектор с кодирующей последовательностью фактора VII. Представлены результаты трех независимых экспериментов.
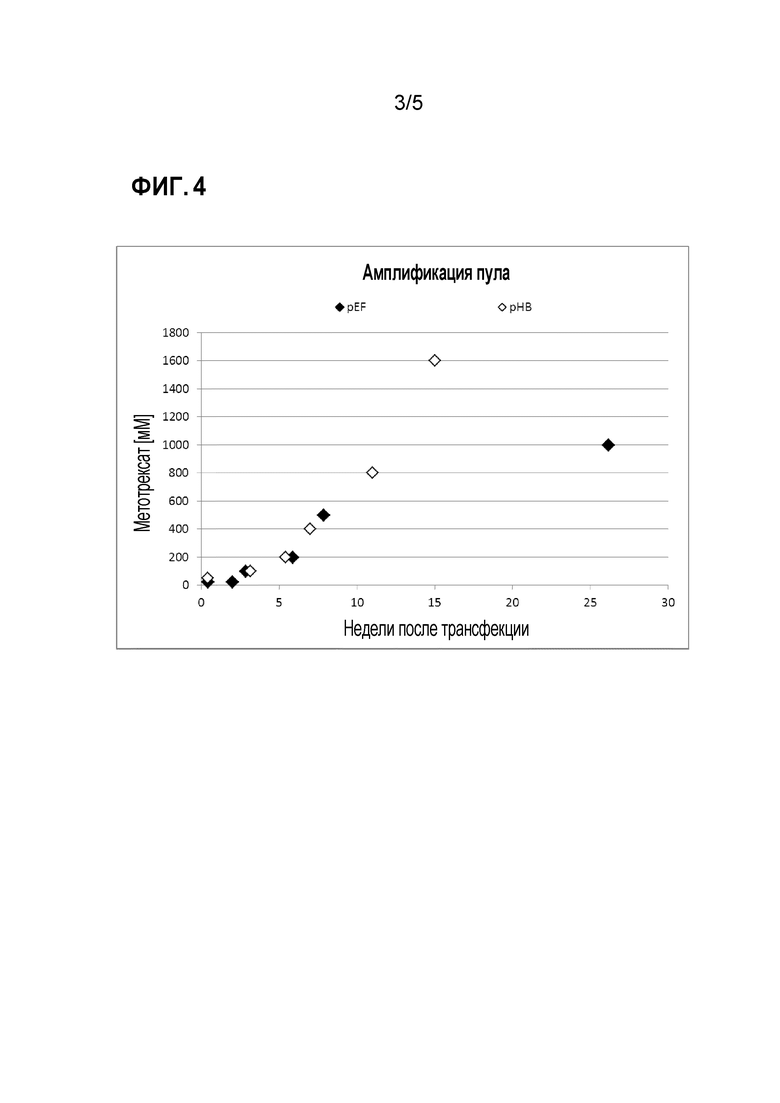
На фигуре 4 проиллюстрировано сравнение стабильной трансфекции вектора согласно изобретению и контрольного вектора, кодирующего антитело. Клетки NM-H9D8-E6Q12 были стабильно трансфецированы контрольным вектором pEF или вектором pHB согласно изобретению. Оба вектора содержат последовательность, кодирующую антитело и ген, кодирующий DHFR как амплифицируемый селективный маркер. Для амплификации вектора в клетках, давление отбора, то есть, концентрацию селективного агента метотрексата в культуральной среде постадийно увеличивали. На графике проиллюстровано максимальное давление отбора, которое было возможным для соответствующего вектора по прошествии определенного времени культивирования. Более высокое возможное давление отбора (концентрация метотрексата) указывает на более высокую степень амплификации вектора в трансфецированных клетках, что будет приводить к повышению уровня продуцирования представляющего интерес белка.
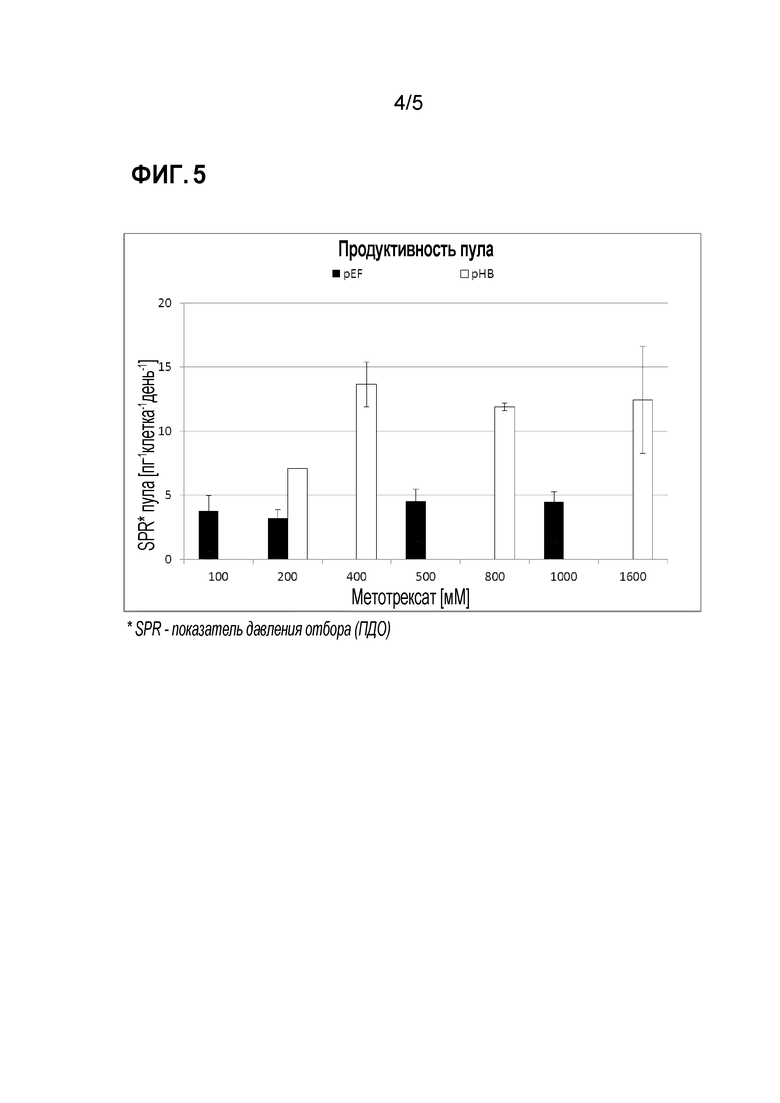
На фигуре 5 проиллюстрирована продуктивность пула стабильно трансфецированных клеток, представленных на фигуре 4. Продуцирование антитела в пикограммах на клетку в день представлено для различных давлений отбора вектора согласно изобретению и контрольного вектора.
На фигуре 6 проиллюстрировано повышение продуктивности стабильно трансфецированных клеток, представленных на фигуре 4, путем амплификации вектора благодаря давлению отбора. Продуцирование антитела в пикограммах на клетку в день представлено для различных давлений отбора исходного клеточного пула, клеточного пула после амплификации и одиночных клеточных клонов после амплификации. A: контрольный вектор pEF; B: вектор pHB согласно изобретению.
Примеры
Пример 1: Конструирование векторов, содержащих промотор человеческого Aγ-глобина и элементов регуляторных областей локуса кластеров человеческого гена глобина
Для конструирования векторов глобина, энхансерные и промоторные области родительского вектора (например, pEF, имеющего ген резистентности к пуромицину или неомицину или ген dhfr в качестве селективного маркера) удаляли. Промотор человеческого Aγ-глобина, сигнал полиаденилирования и 3'-энхансерные области и различные конструкции регуляторных областей локуса кластеров человеческого гена глобина синтезировали и клонировали в вектор в соответствующих сайтах. На фиг. 2 представлены репрезентативные конструкции экспрессионных кластеров сконструированных векторов. Затем последовательность нуклеиновой кислоты, кодирующую представляющий интерес полипептид, вводили в сайт клонирования.
Пример 2: Транзиентная трансфекция векторов глобина
Транзиентную трансфекцию осуществляли с использованием липофектамина® LTX и реагента Plus™ в соответствии с инструкциями производителей. Вкратце, 2 × 105 клеток высевали в 6-луночные планшеты во время их логарифмической фазы роста. Плазмидную ДНК разводили в редуцированной сывороточной среде Opti-MEM I и в Plus™-реагенте. По истечении времени инкубирования (15 минут) к раствору добавляли липофектамин® LTX. После дополнительного инкубирования (30 минут), смесь погружали в клеточную суспензию. Экспрессию анализировали через 72 часа с помощью ELISA. Более высокие титры белка были достигнуты с использованием векторов pHBG1Cdhfr, pHBG1Ddhfr и pHBG1Edhfr, но не вектора pEFdhfrmut(-) (фиг. 3).
Пример 3: Стабильная трансфекция векторов глобина
Трансфекцию клеточной линии NM-H9D8 осуществляли путем нуклеофекции (Nucleofector™ Technology, Amaxa) с использованием плазмидной ДНК двух экспрессионных плазмид, кодирующих тяжелую и легкую цепь антитела, соответственно (обе плазмиды были линеаризованы), согласно инструкциям производителей. Для отбора и амплификации антитело-продуцирующих пулов, метотрексат и пуромицин добавляли в возрастающих концентрациях, и пулы скринировали на секрецию активных молекул антитела.
Пулы, трансфецированные плазмидами pHB, могут быть амплифицированы за более короткий период времени (фиг. 4) и дают более высокие уровни белка (фиг. 5), что может подтверждать наличие отдельных клеточных клонов, соответственно (фиг. 6).
Идентификация депонированного биологического материала
Клеточные линии DSM ACC 2606 и DSM ACC 2605 были депонированы в DSMZ - Немецкой коллекции микроорганизмов и клеточных культур GmbH, Mascheroder Weg 1b, 38124 Braunschweig (DE), Nemod Biotherapeutics GmbH & Co. KG, Robert-Rössle-Str. 10, 13125 Berlin (DE) 14 августа, 2003. Эти биологические материалы указаны под названием «гликотоп», поскольку они были в свое время переуступлены компанией Nemod Biotherapeutics GmbH & Co. KG компании Glycotope GmbH.
Клеточные линии DSM ACC 2806, DSM ACC 2807, DSM ACC 2856, DSM ACC 2858 и DSM ACC 3078 были депонированы в DSMZ - Немецкой коллекции микроорганизмов и клеточных культур GmbH, Inhoffenstraße 7B, 38124 Braunschweig (DE), Glycotope GmbH, Robert-Rössle-Str. 10, 13125 Berlin (DE) на даты, указанные в нижеследующей таблице.
| название | год | авторы | номер документа |
|---|---|---|---|
| КОМПОЗИЦИИ И СПОСОБЫ ЛЕЧЕНИЯ ГЕМОГЛОБИНОПАТИИ | 2013 |
|
RU2650811C2 |
| СПОСОБЫ И КОМПОЗИЦИИ ДЛЯ МОДИФИКАЦИИ ЦЕЛЕВОГО ЛОКУСА | 2015 |
|
RU2704283C2 |
| ФУНКЦИОНАЛЬНЫЕ ЛОКУСЫ FAD2 И СООТВЕТСТВУЮЩИЕ СПЕЦИФИЧНЫЕ ДЛЯ САЙТА-МИШЕНИ СВЯЗЫВАЮЩИЕСЯ БЕЛКИ, СПОСОБНЫЕ ИНДУЦИРОВАТЬ НАПРАВЛЕННЫЕ РАЗРЫВЫ | 2013 |
|
RU2656158C2 |
| СИСТЕМА ИНДИКАЦИИ НА ОСНОВЕ ПОЛНОРАЗМЕРНОГО АНТИТЕЛА ДЛЯ ЭУКАРИОТИЧЕСКИХ КЛЕТОК И ЕЕ ПРИМЕНЕНИЕ | 2012 |
|
RU2625033C2 |
| ДИСПЛЕЙ НА ПОВЕРХНОСТИ КЛЕТОК ПОЛИПЕПТИДНЫХ ИЗОФОРМ НА ОСНОВЕ ПРОЧИТЫВАНИЯ ТЕРМИНИРУЮЩЕГО КОДОНА | 2009 |
|
RU2528858C2 |
| СИНТЕТИЧЕСКИЕ 5 UTR (НЕТРАНСЛИРУЕМЫЕ ОБЛАСТИ), ЭКСПРЕССИОННЫЕ ВЕКТОРЫ И СПОСОБ ПОВЫШЕНИЯ ТРАНСГЕННОЙ ЭКСПРЕССИИ | 2008 |
|
RU2524431C2 |
| ПОЛУЧЕНИЕ УЛУЧШЕННОЙ ЧЕЛОВЕЧЕСКОЙ PAH ДЛЯ ЛЕЧЕНИЯ ТЯЖЕЛОЙ PKU С ПОМОЩЬЮ ГЕННОЙ ЗАМЕСТИТЕЛЬНОЙ ТЕРАПИИ, НАПРАВЛЕННОЙ НА ПЕЧЕНЬ | 2019 |
|
RU2839587C2 |
| СПОСОБЫ И КОМПОЗИЦИИ ДЛЯ НАПРАВЛЕННОЙ МОДИФИКАЦИИ ГЕНОМА | 2014 |
|
RU2725520C2 |
| ТЕРАПЕВТИЧЕСКИЕ СОЕДИНЕНИЯ ДЛЯ ЛЕЧЕНИЯ БОЛЕЗНИ ХАНТИНГТОНА | 2015 |
|
RU2711147C2 |
| СПОСОБЫ И КОМПОЗИЦИИ ДЛЯ НАПРАВЛЕННОЙ МОДИФИКАЦИИ ГЕНОМА | 2014 |
|
RU2685914C1 |


Изобретение относится к области биотехнологии, конкретно к экспрессионным кластерам, содержащим коровый элемент сайта гиперчувствительности к ДНКазе I 2 (HS2) кластера человеческого гена β-глобина или сайт гиперчувствительности 40 (HS40) кластера человеческого гена α-глобина и часть промотора человеческого гена Aγ-глобина. Полученные кластеры обеспечивают повышенный уровень экспрессии представляющих интерес белков или полипептидов при их рекомбинантном продуцировании в клетках-хозяевах млекопитающих. 4 н. и 28 з.п. ф-лы, 6 ил., 1 табл., 3 пр.
1. Способ рекомбинантного продуцирования представляющего интерес полипептида, где указанный способ включает стадии:
(a) получения клетки-хозяина млекопитающего, которая не является клеткой эмбриона человека и клеткой зародышевой линии и содержит экспрессионный кластер, который для возможности экспрессии последовательности нуклеиновой кислоты, кодирующей полипептид, представляющий интерес, включает по направлению транскрипции функционально присоединенные друг к другу:
(i) регуляторную область локуса, содержащую по меньшей мере функциональную часть регуляторной области локуса кластера человеческого гена β-глобина или кластера человеческого гена α-глобина, где регуляторная область локуса или его функциональная часть содержит коровый элемент сайта гиперчувствительности к ДНКазе I 2 (HS2) кластера человеческого гена β-глобина, имеющий последовательность нуклеиновой кислоты в положениях 906-939 последовательности SEQ ID NO: 1, или где регуляторная область локуса или его функциональная часть содержит сайт гиперчувствительности 40 (HS40) кластера человеческого гена α-глобина, имеющего последовательность нуклеиновой кислоты в положениях 24-278 последовательности SEQ ID NO: 5;
(ii) промоторную область, содержащую по меньшей мере функциональную часть промотора человеческого гена Aγ-глобина или его гомолога, где промоторная область или ее функциональная часть содержит последовательность нуклеиновой кислоты в положениях 1123-1542 последовательности SEQ ID NO: 1; и
(iii) кодирующую область, содержащую последовательность нуклеиновой кислоты, кодирующую представляющий интерес полипептид;
(b) культивирования клетки-хозяина в условиях, при которых клетка-хозяин экспрессирует представляющий интерес полипептид; и
(c) выделения представляющего интерес полипептида.
2. Способ по п. 1, где кодирующая область экспрессионного кластера также включает последовательность нуклеиновой кислоты, кодирующую сигнальный пептид для секреторной экспрессии, и где в стадии (b) представляющий интерес полипептид секретируется клеткой-хозяином.
3. Способ по п. 1, где регуляторная область локуса экспрессионного кластера включает элемент M1-кор-M2 сайта гиперчувствительности к ДНКазе I 2 (HS2) кластера человеческого гена β-глобина, предпочтительно имеющий последовательность нуклеиновой кислоты в положениях 742-995 SEQ ID NO: 1.
4. Способ по п. 3, где регуляторная область локуса экспрессионного кластера включает по меньшей мере часть сайта гиперчувствительности 2 (HS2) кластера человеческого гена β-глобина, содержащий последовательность нуклеиновой кислоты в положениях 741-1109 SEQ ID NO: 1.
5. Способ по п. 1, где регуляторная область локуса экспрессионного кластера также включает сайт гиперчувствительности 3 (HS3) или его часть в кластере человеческого гена β-глобина, предпочтительно имеющие последовательность нуклеиновой кислоты в положениях 310-735 SEQ ID NO: 1, и/или сайт гиперчувствительности 4 (HS4) или его часть в кластере человеческого гена β-глобина, предпочтительно имеющие последовательность нуклеиновой кислоты в положениях 13-294 SEQ ID NO: 1.
6. Способ по п. 1, где промоторная область экспрессионного кластера содержит сайт инициации транскрипции и, необязательно, по меньшей мере часть 5'-нетранслируемой области человеческого гена Aγ-глобина.
7. Способ по п. 1, где экспрессионный кластер также включает область терминации транскрипции.
8. Способ по п. 7, где область терминации транскрипции включает сигнал полиаденилирования, предпочтительно содержащий последовательность нуклеиновой кислоты в положениях 1725-1730 SEQ ID NO: 1 и сайт терминации транскрипции.
9. Способ по п. 1, где экспрессионный кластер также включает энхансерную область, содержащую по меньшей мере функциональную часть 3'-энхансера человеческого гена Aγ-глобина, функционально присоединенную к другим элементам экспрессионного кластера.
10. Способ по п. 9, где энхансерная область экспрессионного кластера содержит последовательность нуклеиновой кислоты в положениях 2136-2881 SEQ ID NO: 1.
11. Способ по п. 1, где представляющим интерес полипептидом является гликопротеин или его часть.
12. Способ по п. 1, где представляющий интерес полипептид выбран из группы, состоящей из антител или их производных или частей, включающих тяжелую цепь или легкую цепь антитела; гонадотропинов, таких как FSH (фолликуло-стимулирующий гормон), CG (хорионический гонадотропин), LH (лютеинизирующий гормон) и TSH (тиреотропный гормон); эритропоэтина; и факторов свертывания крови, таких как фактор VII, VIII, IX или фактор фон Виллебранда.
13. Способ по п. 1, где экспрессионный кластер стабильно трансфецирован в клетку-хозяина.
14. Способ по п. 1, где клетка-хозяин была трансфецирована вектором, содержащим экспрессионный кластер и селективный маркерный ген, а предпочтительно амплифицируемый селективный маркерный ген, и где условия культивирования в стадии (b) включают присутствие соответствующего селективного агента в клеточной культуральной среде.
15. Способ по п. 14, где селективный маркерный ген кодирует дигидрофолат-редуктазу (DHFR), предпочтительно антифолат-резистентный вариант DHFR, а соответствующим селективным агентом является антифолат, предпочтительно метотрексат.
16. Способ по п. 1, где клеткой-хозяином является клетка крови, предпочтительно лейкоцит, предшественник клетки крови или клетка лейкоза или происходящая от них клетка.
17. Экспрессионный кластер, который для возможности экспрессии последовательности нуклеиновой кислоты, кодирующей полипептид, представляющий интерес, содержит по направлению транскрипции функционально присоединенные друг к другу:
(i) регуляторную область локуса, содержащую по меньшей мере функциональную часть регуляторной области локуса кластера человеческого гена β-глобина или кластера человеческого гена α-глобина, где регуляторная область локуса или его функциональная часть содержит коровый элемент сайта гиперчувствительности к ДНКазе I 2 (HS2) кластера человеческого гена β-глобина, имеющий последовательность нуклеиновой кислоты в положениях 906-939 последовательности SEQ ID NO: 1, или где регуляторная область локуса или его функциональная часть содержит сайт гиперчувствительности 40 (HS40) кластера человеческого гена α-глобина, имеющего последовательность нуклеиновой кислоты в положениях 24-278 последовательности SEQ ID NO: 5;
(ii) промоторную область, содержащую по меньшей мере функциональную часть промотора человеческого гена Aγ-глобина, где промоторная область или ее функциональная часть содержит последовательность нуклеиновой кислоты в положениях 1123-1542 последовательности SEQ ID NO: 1;
(iii) необязательно, кодирующую область;
(iv) область терминации транскрипции, содержащаую последовательность нуклеиновой кислоты в положениях 1725-1730 последовательности SEQ ID NO:1; и
(v) энхансерную область, содержащую по меньшей мере функциональную часть 3'-энхансера человеческого гена Aγ-глобина, где энхансерная область или ее функциональная часть содержит последовательность нуклеиновой кислоты в положениях 2136-2881 последовательности SEQ ID NO: 1;
где экспрессионный кластер не содержит последовательности нуклеиновой кислоты, кодирующей полноразмерный человеческий Aγ-глобин.
18. Экспрессионный кластер по п. 17, где регуляторная область локуса включает элемент M1-кор-M2 сайта гиперчувствительности к ДНКазе I 2 (HS2) кластера человеческого гена β-глобина, предпочтительно имеющий последовательность нуклеиновой кислоты в положениях 742-995 SEQ ID NO: 1.
19. Экспрессионный кластер по п. 18, где регуляторная область локуса включает по меньшей мере часть сайта гиперчувствительности 2 (HS2) кластера человеческого гена β-глобина, содержащий последовательность нуклеиновой кислоты в положениях 741-1109 SEQ ID NO: 1.
20. Экспрессионный кластер по п. 17, где регуляторная область локуса также включает сайт гиперчувствительности 3 (HS3) или его часть в кластере человеческого гена β-глобина, предпочтительно имеющие последовательность нуклеиновой кислоты в положениях 310-735 SEQ ID NO: 1, и/или сайт гиперчувствительности 4 (HS4) или его часть в кластере человеческого гена β-глобина, предпочтительно имеющие последовательность нуклеиновой кислоты в положениях 13-294 SEQ ID NO: 1.
21. Экспрессионный кластер по п. 17, где промоторная область содержит сайт инициации транскрипции и, необязательно, по меньшей мере часть 5'-нетранслируемой области человеческого гена Aγ-глобина.
22. Экспрессионный кластер по п. 17, где область терминации транскрипции включает сигнал полиаденилирования и сайт терминации транскрипции.
23. Экспрессионный кластер по п. 17, также включающий сайт клонирования, который содержит по меньшей мере одну последовательность распознавания рестриктирующего фермента.
24. Экспрессионный кластер по п. 17, где кодирующая область включает последовательность нуклеиновой кислоты, кодирующую представляющий интерес полипептид.
25. Экспрессионный кластер по п. 24, где представляющим интерес полипептидом является гликопротеин или его часть.
26. Экспрессионный кластер по п. 24, где представляющим интерес полипептидом является антитело, тяжелая цепь или легкая цепь антитела или его часть.
27. Экспрессионный кластер по п. 17, где кодирующая область включает последовательность нуклеиновой кислоты, кодирующую сигнальный пептид для секреторной экспрессии.
28. Вектор для введения экспрессионного кластера в клетку-хозяина, содержащий экспрессионный кластер по п. 17.
29. Вектор по п. 28, также содержащий один или более селективных маркерных генов.
30. Вектор по п. 28, адаптированный для стабильной трансфекции эукариотической клетки.
31. Клетка-хозяин млекопитающего, не являющаяся клеткой эмбриона человека и клеткой зародышевой линии, для получения белка, представляющего интерес, содержащая экспрессионный кластер по п. 17.
32. Клетка-хозяин по п. 31, представляющая собой клетку крови, предпочтительно лейкоцит, предшественник клетки крови или клетку лейкоза или происходящую от них клетку.
| US 6524851, 25.02.2003 | |||
| WO 2010046493, 01.07.2010 | |||
| HANAWA H | |||
| et al | |||
| Extended β-globin locus control region elements promote consistent therapeutic expression of a γ-globin lentiviral vector in murine β-thalassemia, Blood, 2004, V | |||
| Счетная таблица | 1919 |
|
SU104A1 |
| Топка с несколькими решетками для твердого топлива | 1918 |
|
SU8A1 |
| CHUNG J | |||
| H | |||
| et al | |||
| Кипятильник для воды | 1921 |
|
SU5A1 |
Авторы
Даты
2020-03-17—Публикация
2016-03-30—Подача