Область техники, к которой относится изобретение
Группа изобретений относится к области наноматериалов, а именно к ультрастабильным наночастицам золота, содержащим карбеновые лиганды, способу их получения, их конъюгатам с биомолекулами, содержащими данные наночастицы, а также к применению таких наночастиц или таких конъюгатов в биологии и медицине, например, в качестве средств доставки лекарств, контрастных веществ и маркеров для иммунохроматографических тестов.
Уровень техники
В настоящее время наночастицы золота (НЧЗ) используются во многих областях техники, от создания сенсоров и катализаторов до их применения в качестве средств доставки лекарств и диагностических агентов. НЧЗ были тщательно исследованы благодаря их уникальным физическим свойствам. Например, четко определенный поверхностный плазмонный резонанс (ППР) этих частиц применяется в качестве аналитического сигнала во множестве сенсоров, отслеживающих изменения ППР во время эксперимента. Благодаря использованию этой колориметрической стратегии возможна не только детекция малых молекул и ионов, но также и более сложных систем, таких как, белки.
Несмотря на потенциал НЧЗ в качестве сенсорной платформы и инструмента для биодоставки различных биоактивных молекул, использование этого материала в реальных условиях ограничено отсутствием долгосрочной коллоидной стабильности в водных растворах при воздействии различных физических и химических факторов (например, контакт с биожидкостями, лиофилизация и градиент ионной силы). Стабильность НЧЗ является важной предпосылкой для использования их в условиях in vitro и in vivo, и поэтому проблема деградации коллоидных растворов НЧЗ усложняет или делает невозможным их использование в биологических средах.
Для решения данной проблемы было исследовано несколько подходов. На сегодняшний день одним из успешных подходов является использование неионогенного полиэтиленгликоля (ПЭГ) для функционализации НЧЗ (Guodong Zhang, et. al. (2009) Influence of anchoring ligands and particle size on the colloidal stability and in vivo biodistribution of polyethylene glycol-coated gold nanoparticles in tumor-xenografted mice, Biomaterials, 30, 10, 1928-1936. DOI: 10.1016/j.biomaterials.2008.12.038; Yanli Liu, et. al. (2007) Synthesis, Stability, and Cellular Internalization of Gold Nanoparticles Containing Mixed Peptide-Poly(ethylene glycol) Monolayers, Anal. Chem., 79, 6, 2221-2229. DOI: 10.1021/ac061578f). Данный способ способен придать некоторую степень стабильности НЧЗ. Однако отсутствие центров для химической модификации в ПЭГ в сочетании с ее амфифильной природой препятствует химической функционализации ПЭГ-стабилизированных НЧЗ.
Использование цвиттер-ионных лигандов на основе тиола и олигоэтиленгликоля придает высокую коллоидную стабильность НЧЗ (Akash Gupta, et. al. (2016) Ultrastable and Biofunctionalizable Gold Nanoparticles, ACS Applied Materials & Interfaces, 8, 22, 14096-14101. DOI: 10.1021/acsami.6b02548). Такие наночастицы устойчивы в водных растворах, проявляют стабильность к лиофилизации/ресуспендированию, градиенту ионной силы, а также стабильны в сыворотке крови в течение 24 ч. Однако отсутствие возможности дальнейшей модификации НЧЗ ограничивает их применение. Исследования устойчивости наночастиц, стабилизированных цвиттер-ионными лигандами, к различным факторам среды, как устойчивость на воздухе, диапазон pH и нагревание, проведены не были.
Другим подходом к стабилизации наночастиц является использование гетероциклических карбеновых лигадов (ГКЛ) в качестве поверхностных лигандов. С момента получения и выделения стабильных карбенов Бертрандом (Alain Igau, et. al. (1988) Analogous .Alpha.,.Alpha.’-Bis-Carbenoid, Triply Bonded Species: Synthesis of a Stable .Lambda.3-Phosphino Carbene-.Lambda.5-Phosphaacetylene, J. Am. Chem. Soc., 110, 19, 6463-6466. DOI: 10.1021/ja00227a028) и Ардуенго (Anthony J. Arduengo, et. al. (1991) A Stable Crystalline Carbene, J. Am. Chem. Soc., 113, 1, 361-363. DOI: 10.1021/ja00001a054) к этим соединениям (Hopkinson, M. N., et. al. (2014) An Overview of N-Heterocyclic Carbenes. Nature, 510, 7506, 485-496. DOI: 10.1038/nature13384) обращено большое внимание как к лигандам для различных комплексов металлов (Nesterov, V., et. al. (2018) NHCs in Main Group Chemistry. Chem. Rev., 118, 19, 9678-9842. DOI: 10.1021/acs.chemrev.8b00079; Doddi, A., et. al. (2019) N-Heterocyclic Carbene Adducts of Main Group Elements and Their Use as Ligands in Transition Metal Chemistry. Chem. Rev., 119, 12, 6994-7112. DOI: 10.1021/acs.chemrev.8b00791), а также для стабилизации и функционализации поверхности металлических наночастиц. ГКЛ обеспечивают стабильность наночастиц за счет комбинации стерических и электронных свойств. В 2009 году впервые были синтезированы ГКЛ-стабилизированные НЧЗ (Hurst, E. C., et. al. (2009) N-Heterocyclic Carbene Coated Metal Nanoparticles, New J. Chem., 33, 9, 1837-1840. DOI: 10.1039/B905559B), однако данные наночастицы не были достаточно устойчивы и разлагались на карбеновые комплексы золота.
В 2017 году следом за ПЭГ-илированными ГКЛ-стабилизированными НЧЗ (Michelle J. MacLeod and Jeremiah A. Johnson. (2015) PEGylated N-Heterocyclic Carbene Anchors Designed To Stabilize Gold Nanoparticles in Biologically Relevant Media, J. Am. Chem. Soc., 137, 25, 7974-7977. DOI: 10.1021/jacs.5b02452) была опубликована статья о водорастворимых ГКЛ-стабилизированных наночастицах золота (Kirsi Salorinne, et. al. (2017) Water-Soluble N-Heterocyclic Carbene-Protected Gold Nanoparticles: Size-Controlled Synthesis, Stability, and Optical Properties, Angew. Chem. Int. Ed., 56, 22, 6198-6202. DOI: 10.1002/anie.201701605). Лиганды представляли собой монодентатные карбены, функционализированные карбоксильной группой. Однако, как отмечали авторы лигандов, проблема стабильности по отношению к внешним нуклеофилам (тиолам) продолжала оставаться нерешенной. У данных НЧЗ не наблюдается выраженного пика плазмонного резонанса, а также полученные НЧЗ устойчивы только в щелочных растворах. К достоинствам НЧЗ можно отнести растворимость в воде и возможность ресуспендирования после лиофилизации. Информация об устойчивости указанных частиц при высушивании на воздухе отсутствует.
Чуть позже та же группа ученых сообщила о получении ультрастабильных наночастиц золота, модифицированных бидентатными ГКЛ (Renee W. Y. Man, et. al. (2018) Ultrastable Gold Nanoparticles Modified by Bidentate N-Heterocyclic Carbene Ligands, Journal of the American Chemical Society, 140, 5, 1576-1579. DOI: 10.1021/jacs.7b08516). Два карбеновых лиганда, без заместителя и замещенные длинным гидрофобным хвостом, соединены через углеводородные мостики с числом метиленовых звеньев 6 и 12. НЧЗ были получены с помощью двух подходов: «top-down» (замещение тиольного лиганда на карбеновый в уже предварительно готовых НЧЗ) и «bottom-up» (синтез НЧЗ путем восстановления комплекса карбена с золотом). Авторы отмечают зависимость стабильности НЧЗ от длины линкера, соединяющего два карбена, а также синтетического подхода. Более стабильные к нагреванию и замещению тиолами стабилизированные карбенами НЧЗ получаются при использовании подхода «top-down», который необходимо проводить в инертной атмосфере и с использованием органических растворителей, к тому же необходимо дополнительно использовать покрытые додецилсульфидом частицы (синтез которых тоже довольно осложнен), что требует введения еще одной стадии в синтез данных наночастиц. Получаемые стабилизированные частицы хоть и проявляли некоторую стабильность по отношению к тиолам, через 48 часов демонстрировали заметное разложение, также они нерастворимы в воде и имеют малый размер, что ограничивает их биологическое и медицинское применение. Данные об устойчивости частиц при высушивании на воздухе, в различных диапазонах pH, ионной силы, устойчивости к автоклавированию и замораживанию в водном растворе отсутствуют.
В статье (Joseph F. DeJesus, et. al. (2020) A Benchtop Method for Appending Protic Functional Groups to N-Heterocyclic Carbene Protected Gold Nanoparticles, Angew. Chem. Int. Ed., 59, 19, 7585-7590. DOI: 10.1002/anie.202001440) описан метод получения наночастиц золота из бискарбеновых комплексов, без заместителя и нитрозамещенных, и коммерчески доступных золотых наночастиц, покрытых цитратом, в смешанной водной/органической среде. Нитро-группа может быть восстановлена до амино-группы и далее введена в стадию амидного каплинга с карбоновой кислотой, что говорит о возможности функционализации НЧЗ. Недостатком вышеописанного подхода является использование предварительно готовых НЧЗ и органических растворителей. Исследования устойчивости наночастиц к различным факторам среды, таким как устойчивость на воздухе, к различным pH и ионной силе, устойчивость к замораживанию и автоклавированию проведены не были.
Что касается устойчивости золотых наночастиц в биологических средах следует отметить работу Michelle J. MacLeod and Jeremiah A. Johnson. (2015) PEGylated N-Heterocyclic Carbene Anchors Designed To Stabilize Gold Nanoparticles in Biologically Relevant Media, J. Am. Chem. Soc., 137, 25, 7974-7977. DOI: 10.1021/jacs.5b02452, в которой наночастицы 1-Au-NP подвергались воздействию среды для культивирования клеток с фетальной бычьей сывороткой в течение 26 ч при комнатной температуре и 37 °C, при этом не наблюдалось значительного изменения положения полосы ППР. В другой работе M.J. MacLeod, et. al. (2019) Robust gold nanorods stabilized by bidentate N-heterocyclic-carbene-thiolate ligands, Nat. Chem, 11, 57-63. DOI:10.1038/s41557-018-0159-8 были проведены in vitro анализы жизнеспособности клеток аденокарциномы молочной железы человека MCF7 для оценки потенциала наночастиц NHC@Au-I для фототермической терапии in vitro. Лазерное облучение клеток, подвергшихся воздействию NHC@Au-I (золотые наностержни), приводило к значительному уничтожению клеток. Группа под руководством Крадден разработала сверхчувствительную и не содержащую меток систему обнаружения вирусов с использованием золотого электрода с самоорганизующимся монослоем на основе N-содержащих гетероциклических карбенов (Ab-SAM) (R.M. Mayall, et. al. (2020) Ultrasensitive and Label-Free Detection of the Measles Virus Using an N-Heterocyclic Carbene-Based Electrochemical Biosensor, ACS Sensors, 5, 9, 2747-2752. DOI:10.1021/acssensors.0c01250).
Применение наночастиц золота, покрытых ГКЛ, для фотоакустической визуализации описано в работе K. Salorinne, et. al. (2017) Water-Soluble N-Heterocyclic Carbene-Protected Gold Nanoparticles: Size-Controlled Synthesis, Stability, and Optical Properties, Angew. Chemie Int. Ed., 56, 22, 6198-6202. DOI: 10.1002/anie.201701605. Облучение водного раствора наночастиц импульсным лазерным лучом привело к воспроизводимому звуковому волновому сигналу, поэтому авторы приходят к выводу, что такие наночастицы могут стать ценными фотоакустическими зондами.
В связи с вышеописанным можно сделать вывод, что разработка водорастворимых стабильных наночастиц и их конъюгатов с функциональными молекулами является актуальной задачей, это позволит расширить их применение в качестве средств доставки лекарств, контрастных веществ, маркеров для иммунохимических тестов, в области биосенсорики и молекулярной экспресс-диагностики.
Технической задачей, на решение которой направлено настоящее изобретение, является решение как минимум одной из вышеуказанных в уровне техники проблем.
Раскрытие изобретения
Одной из задач заявленной группы изобретений является создание максимально устойчивых к внешним физическим и химическим воздействиям водорастворимых наночастиц золота для биологических и медицинских применений, что включает в себя устранение недостатков вышеописанных аналогов, связанных с недостаточной коллоидной стабильностью при высушивании и заморозке, а также упрощение способа получения наночастиц. Одним из возможных технических результатов является повышение устойчивости водорастворимых наночастиц золота к внешним физическим и химическим воздействиям, облегчение процесса хранения и транспортировки НЧЗ, стабилизированных ГКЛ, обеспечение возможности применения заявленных НЧЗ в молекулярных экспресс-тест системах без дополнительных ПАВ и стабилизаторов, а также сокращение стадийности синтеза НЧЗ относительно известных аналогов и его экологичность.
Указанный пример технического результата может проявляться в том, что заявленные НЧЗ после по крайней мере трех циклов воздушного (или лиофильного) высушивания-ресуспендирования и/или замораживания-размораживания раствора сохраняют коллоидную стабильность, то есть устойчивость к агрегированию, что подтверждается отсутствием смещения пика плазмонного резонанса и устойчивостью к осаждению. Преимущества предлагаемого способа могут заключаться в использовании экологичных растворителей, а также комплекса гетероциклического карбена с золотом вместо уже готовой наночастицы со стабилизирующим лигандом.
Заявленное изобретение (группа изобретений) может быть использовано в персонифицированной медицине, молекулярной диагностике, биоимиджинге, и в целом для терапии большого количества различных заболеваний и нарушений.
Новизна и преимущество настоящего изобретения (группы изобретений) перед аналогами может заключаться в том, что заявленные наночастицы золота, стабилизированные ГКЛ, одновременно проявляют устойчивость и к градиенту ионной силы, и в широком диапазоне pH, и в присутствии глутатиона, и к автоклавированию, также они не теряют коллоидной стабильности при ряде циклов высушивания-ресуспендирования и замораживания-размораживания в широком диапазоне условий (в том числе высушивание на воздухе из водного раствора при комнатной температуре без добавления каких-либо дополнительных ПАВов и т.п.). Более того, наличие карбоксильной группы позволяет проводить функционализацию наночастиц, например, амино-содержащими биомолекулами (белки, антитела и т.д.). Заявленный способ получения наночастиц не требует инертной атмосферы и специфического оборудования, также его можно отнести к области «зеленой химии», так как он проводится без использования хлорсодержащих растворителей, в водно-спиртовой среде в присутствии щелочи, то есть является экологичным. Синтез не требует использования тиольных или цитратных наночастиц, то есть предварительно сформированных наночастиц, а сами наночастицы образуются в ходе реакции из комплекса гетероциклического карбена с золотом, к тому же без использования восстановителей в отличие от описанных аналогов.
В рамках данного документа термины «лиганд» и «карбеновое соединение» могут быть взаимозаменяемыми, при этом не ограничивая объем прав на данное изобретение.
В рамках данного изобретения предложен лиганд (карбеновое соединение) общей формулы I и его прекурсор общей формулы II:

 ,
,
где
R1 и R2 независимо выбраны из группы, включающей COOR5 и CONHR6.
R3 и R4 независимо выбраны из группы, включающей H, C1-С6 алкил, необязательно замещенный одним или несколькими заместителями, выбранными из группы, состоящей из C1-С6 алкила, C3-С7 циклоалкила, C1-С6 алкилокси и галогена; и арил, необязательно замещенный одним или несколькими заместителями, выбранными из группы, состоящей из C1-С6 алкила, C3-С7 циклоалкила, C1-С6 алкилокси и галогена.
R5 и R6 представляют собой независимо H, C1-С6 алкил, C3-С7 циклоалкил или C1-С6 алкилокси.
X- представляет собой анион, включающий: галогенид, нитрат, тозилат, трифлат, ацетат, гексахлорфосфат, тетрафторборат или гексахлороплатинат;
Под галогенидом в контексте настоящего описания имеются в виду анионы фтора, хлора, брома или йода.
n может принимать значения от 3 до 12.
В одном варианте заместители R1 и R2 представляют собой карбоксильные группы.
В еще одном варианте заместители R3 и R4 представляют собой изопропильные группы.
В другом варианте X представляет собой галогенид, а именно бромид.
Кроме того, предложена наночастица золота, содержащая на поверхности соединение общей формулы I.
Форма наночастиц может быть сферической, околосферической, полигональной, плоской, формой стержня и т.п.
В одном варианте наночастица имеет околосферическую форму.
В другом варианте осуществления наночастица имеет размер от примерно 5 до примерно 200 нм.
В другом варианте осуществления наночастица золота может иметь средний размер от 5 до 7 нм, от 7 до 9 нм, от 9 до 11 нм, от 5 до 10 нм, от 11 до 13 нм, от 13 до 16 нм, от 10 до 15 нм или от 15 до 20 нм.
В другом варианте осуществления суспензия упомянутой наночастицы может иметь гидродинамические размеры в диапазоне от 5 до 40 нм, от 5 до 30 нм, от 5 до 25 нм, от 5 до 20 нм, от 5 до 15 нм, от 5 до 10 нм, от 20 до 40 нм или от 40 до 60 нм или может обладать узкой дисперсностью от 6 до 9 нм, от 13 до 18 нм или от 9 до 13 нм.
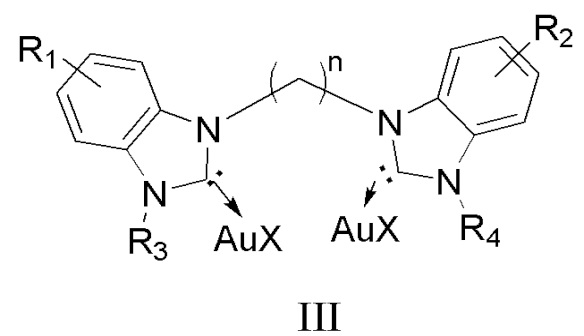
В другом аспекте настоящее изобретение также относится к способу получения наночастицы золота, содержащей на поверхности соединение общей формулы I, заключающийся во взаимодействии соединения формулы III:
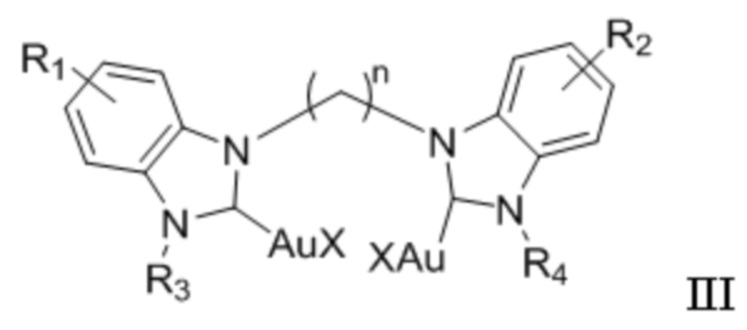
и основания в полярном протонном растворителе при нагревании в течение примерно от 2 до 8 часов.
В другом варианте основание выбрано из группы, включающей гидроксиды, карбонаты и гидрокарбонаты калия, натрия, лития или цезия.
В другом варианте основание представляет собой гидроксид калия.
В другом варианте растворитель выбирают из группы, включающей воду, этанол, метанол, изопропанол и их смеси.
В другом варианте растворитель представляет собой водно-этанольную смесь. Специалисту в данной области техники понятно, что растворителем можем быть вода и любой соответствующий органический растворитель.
В еще одном варианте нагревание производят в диапазоне температур от 50 до 100°С. В другом варианте нагревание производят в диапазоне температур от 78 до 100°С. Диапазон температур определяется для каждого конкретного случая применения способа получения наночастиц золота.
В другом аспекте настоящее изобретение относится к конъюгату, образованному наночастицей золота, содержащей на поверхности соединение общей формулы I, и по меньшей мере одной функциональной молекулой. Термин «функциональная молекула» обозначает молекулярную конструкцию, которая может определяться своим функционалом или своей природой. Функциональная молекула, определённая функционалом может, например, быть нацеливающим рецептором (антителом, аптамером, фолиевой кислотой и т.п.), быть терапевтической молекулой (токсином, химиотерапевтической субстанцией, генотерапевтической конструкцией и т.п.), быть визуализирующей или сигнализирующей системой (флуоресцентным, люминесцентным, фосфоресцентным молекулярным красителем или наночастицей-маркером), быть диагностическим агентом (контрастное вещество для МРТ, КТ исследований) и т.п. Функциональная молекула, которая определена своей природой может быть, например, ионом, малой молекулой, белком, антителом, углеводом, липидом, ДНК, в том числе фрагментом и целые молекулы ДНК, а также транспортные, матричные, рибосомальные, микро РНК; синтетические аналоги нуклеиновых кислот (НК), такие как пептидные НК, морфолиновые, закрытые, гликолевые и треозо-НК; а также, за счет использования особенных распознающих олигонуклеотидов (например, аптамеров), РНК, синтетический полимер, углеродный органический каркас или металл-органический каркас, радиоактивные элементы и соединения, лекарства, вакцины, фотосенсибилизаторы, иммунологические агенты и т. д. и / или их комбинации; при этом указанная наночастица может быть связана с функциональной молекулой непосредственно или с помощью линкера, имеющего общую формулу СONH(CH2)mY, где Y=COOH, NH2, SH, CONH2, OH, CHO, CO-ПЭГ-OH или CO-ПЭИ-NH2, m может принимать значения от 3 до 12.
В другом варианте функциональная молекула может быть надмолекулярной конструкцией, например, включающей несколько молекул. Специалисту данной области понятно, что в случае наличия нескольких функциональных молекул, одна функциональная молекула может быть определена своим функционалом, другая функциональная молекула может быть определена своей природой, и так далее, включая любые комбинации из вышеобозначенных вариантов. Специалисту понятно, что функциональные молекулы могут быть определены одним и тем же критерием, например, две функциональные молекулу, определённые своей природой. Также функциональная молекула может быть одна и она может быть определена как своей природой, так и своим функционалом.
В одном варианте осуществления конъюгат образован наночастицей золота, содержащей на поверхности соединение общей формулы I, и связанным с ней антителом.
В другом варианте антителом является противоопухолевое антитело, например, Трастузумаб (Герцептин).
В другом варианте антителом является антитело, выбранное из следующих Абциксимаб, Адалимумаб, Адуканумаб, Алемтузумаб, Алирокумаб, Амивантамаб, Ансувимаб, Бамланивимаб, Базиликсимаб, Казиривимаб, Катумаксомаб, Деносумаб, Натализумаб, Толицизумаб, Канакинумаб, Инфликсимаб, Сарилумаб, Секукинумаб, Ритуксимаб, Голимумаб или Устекинумаб.
В другом варианте осуществления наночастица золота, содержащая на поверхности соединение общей формулы I, может быть связана с функциональной молекулой через электростатические, ковалентные и водородные взаимодействия.
В другом варианте связь между наночастицей золота, содержащей на поверхности соединение общей формулы I, и функциональной молекулой является ковалентной.
Кроме того, настоящее изобретение относится к способу применения наночастицы золота, содержащей на поверхности соединение общей формулы I, в SPR-анализе, спектрофотометрическом анализе, электрохимическом анализе, биосенсорике, иммуноферментном анализе, для доставки функциональных молекул в живые клетки и организмы, в качестве катализаторов, контраста для компьютерной томографии (КТ), в качестве агента для фотоакустической терапии, агента для радиотерапии или при проведении иммунохроматографии для детекции целевых молекул (аналитов, антигенов, маркеров заболеваний или состояний организма и т.п.). В таком способе доставки функциональных молекул, молекулярной нагрузкой является функциональная молекула в отношении к наночастицы золота по настоящему изобретению.
В случае применения наночастицы золота, содержащей на поверхности соединение общей формулы I к детекции целевых молекул, под целевыми молекулами в контексте настоящего описания подразумеваются одни функциональные молекулы, которые отличаются от других функциональных молекул, входящих в состав конъюгата.
Также настоящее изобретение относится к способу применения конъюгата наночастицы золота, содержащей на поверхности соединение общей формулы I, в SPR-анализе, спектрофотометрическом анализе, электрохимическом анализе, биосенсорике, иммуноферментном анализе, для доставки функциональных молекул и целевых молекул в живые клетки и организмы, в качестве катализаторов, контраста для КТ, в качестве агента для фотоакустической терапии, агента для радиотерапии или при проведении иммунохроматографии для детекции целевых молекул.
В другом аспекте настоящее изобретение относится к способу детекции аналита в образце для диагностики или экспресс-диагностики заболеваний или состояний организма. Упомянутым аналитом могут быть известные маркеры заболеваний - малые молекулы, белки, нуклеиновые кислоты. Упомянутый образец может представлять собой образец крови, слюны, мочи, кала, биопсийный материал и иной образец.
В другом аспекте настоящее изобретение относится к способу детекции целевой молекулы, выбранной из группы, содержащей малые молекулы, белки, антитела, углеводы, липиды, ДНК и РНК, включающий применение наночастицы по п. 2.
В другом аспекте настоящее изобретение относится к способу детекции целевой молекулы, выбранной из группы, содержащей малые молекулы, белки, антитела, углеводы, липиды, ДНК и РНК, включающий применение конъюгата по п. 12.
В другом аспекте настоящее изобретение относится к способу адресной доставки в клетки терапевтических препаратов, с помощью конъюгата по п. 12, образованному наночастицей золота и нацеливающим рецептором, выбранным из группы, включающей малые молекулы, белки, антитела, углеводы, липиды, ДНК и РНК.
Настоящее изобретение также относится к тест-набору, включающему:
- тестовую кассету, содержащую на мембране наночастицу золота, содержащую на поверхности соединение общей формулы I, (в индивидуальной упаковке из фольги в комплекте с осушителем).
Настоящее изобретение также относится к тест-набору, включающему дополнительно:
- пробирку с буфером для разведения биологического образца;
- насадку с капельницей;
- инструкцию к медицинскому изделию.
В одном варианте изобретения, упомянутые наночастицы золота включают (или создают на их основе) терапевтические/диагностические/фармацевтические препараты, субстанции, композиции, дозированные лекарственные формы.
Упомянутые НЧЗ или конъюгаты НЧЗ могут вводиться любыми способами, известными в области медицины, а также новыми способами. Например, композиции могут включать введение субъекту внутривенно, внутрикожно, внутриартериально, внутрибрюшинно, внутричерепно, внутрисуставно, интрапростатически, интратрахеально, интраназально, интравитреально, интравагинально, внутриректально, местно, внутримышечно, внутримышечно, интратекально, подкожно, субконъюнктивально, внутрипузырно, слизистой, внутричерепной, внутрибрюшной, внутриглазной, орально, локально, путем ингаляции, путем инъекции, путем инфузии, путем непрерывной инфузии, путем локализованной перфузии, через катетер, через промывание, в креме или в липидной композиции. Администрация может быть локальной, например, на участке заболевания (например, опухоль в случае рака) или системной. Можно использовать несколько путей введения (например, внутримышечный, оральный, трансдермальный).
Краткое описание чертежей
Изобретение иллюстрируются следующими графическими материалами:
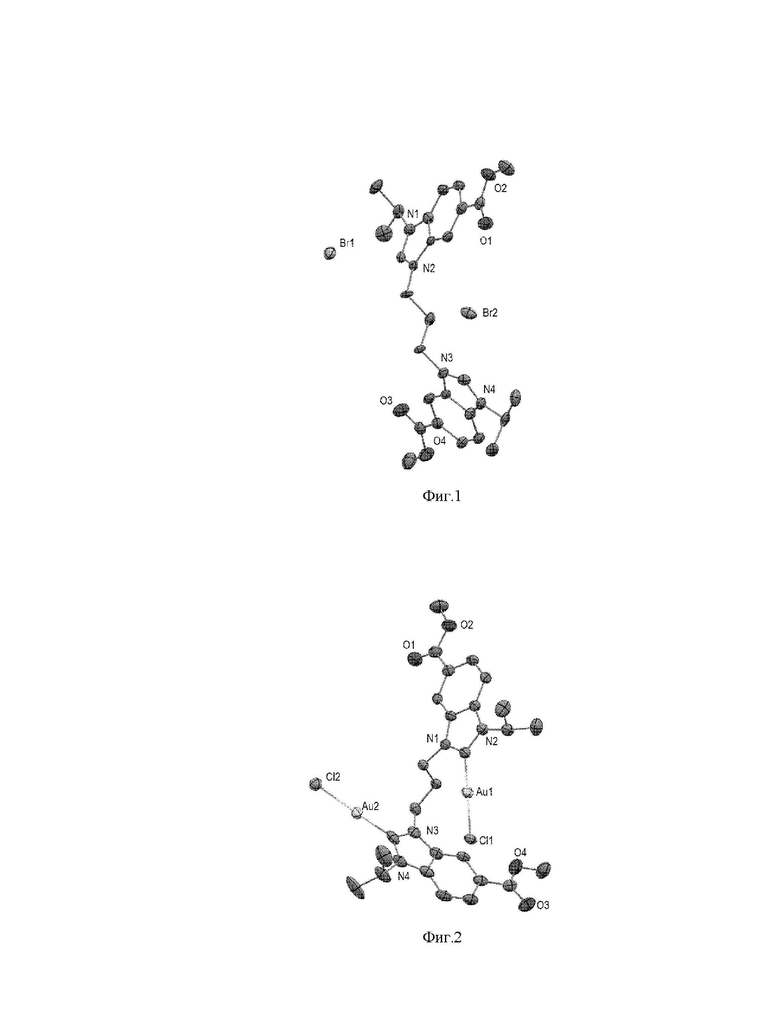
На фиг. 1 представлена молекулярная структура прекурсора для синтеза НЧЗ (1-Me)(HBr)2 на основе данных рентгеноструктурного анализа (РСА).
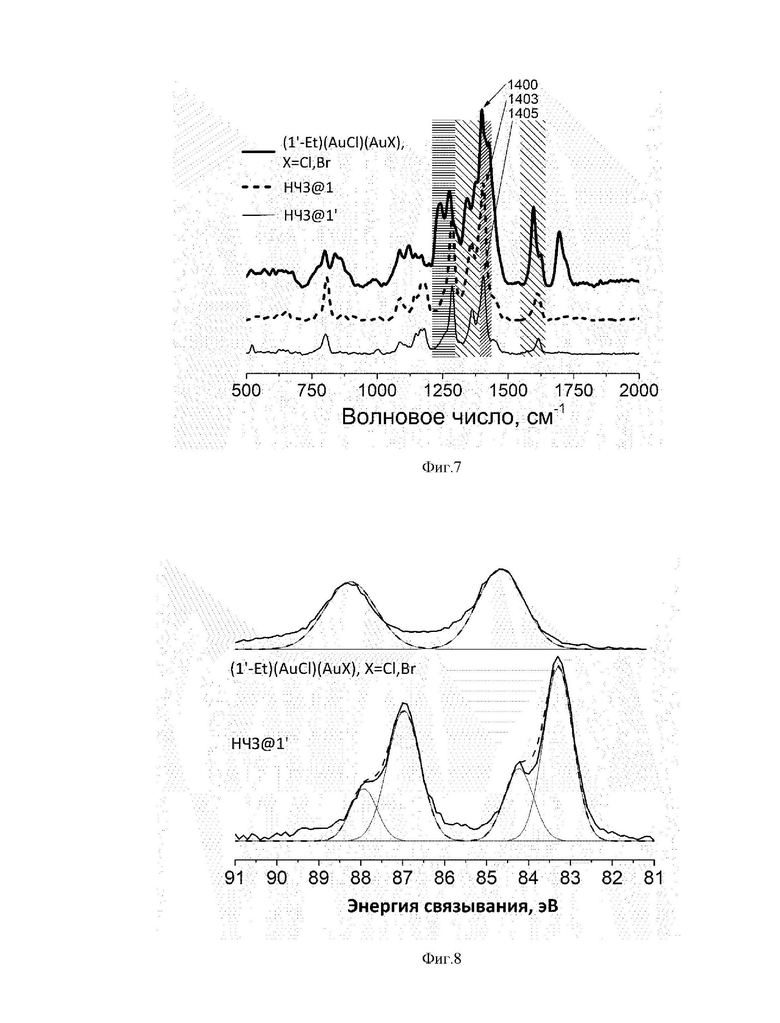
На фиг. 2 представлена молекулярная структура прекурсора для синтеза (1-Me)(AuCl)2 на основе данных рентгеноструктурного анализа (РСА).
На фиг. 3 представлено ПЭМ-изображение НЧЗ@1.
На фиг. 4 представлено ПЭМ-изображение НЧЗ@1’.
На фиг. 5 приведена гистограмма распределения НЧЗ@1 по размеру по данным ПЭМ.
На фиг. 6 приведена гистограмма распределения НЧЗ@1’ по размеру по данным ПЭМ.
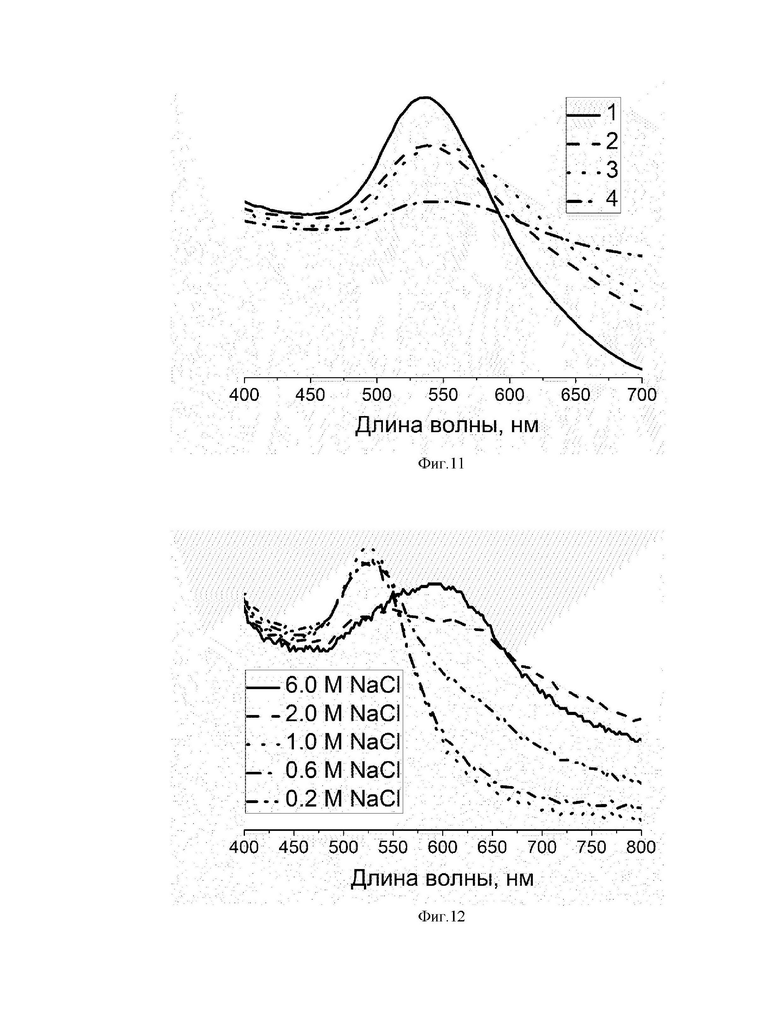
На фиг. 7 представлен Рамановский спектр (1’-Et)(AuCl)(AuX), где X=Cl, Br (жирная черная линия), SERS-спектр НЧЗ@1’(пунктирная линия) и НЧЗ@1 (тонкая черная линия).
На фиг. 8 приведены XPS-спектры (1’-Et)(AuCl)(AuX), где X=Cl, Br и НЧЗ@1’: XPS-сигналы Au 4f для (1’-Et)(AuCl)(AuX) и HЧЗ@1’.
На фиг. 9 приведены XPS-спектры C 1s для НЧЗ@1’.
На фиг. 10 приведены УФ спектры растворов НЧЗ@1’ в различных условиях: НЧЗ@1’ в готовом виде (кривая 1); после 2-ух циклов высушивания/ресуспендирования (кривая 2); после 3-ех циклов высушивания/ресуспендирования (кривая 3); после 3-ех циклов высушивания/ресуспендирования и добавления раствора NaHCO3 (кривая 4); после 3-ех циклов высушивания/ресуспендирования и добавления раствора NaHCO3 и NaOAc (кривая 5).
На фиг. 11 приведены УФ спектры растворов НЧЗ@1 в различных условиях: НЧЗ@1 в готовом виде (кривая 1); после 2-ух циклов высушивания/ресуспендирования (кривая 2); после 3-ех циклов высушивания/ресуспендирования (кривая 3); после 3-ех циклов высушивания/ресуспендирования и добавления раствора NaHCO3 и NaOAc (кривая 4).
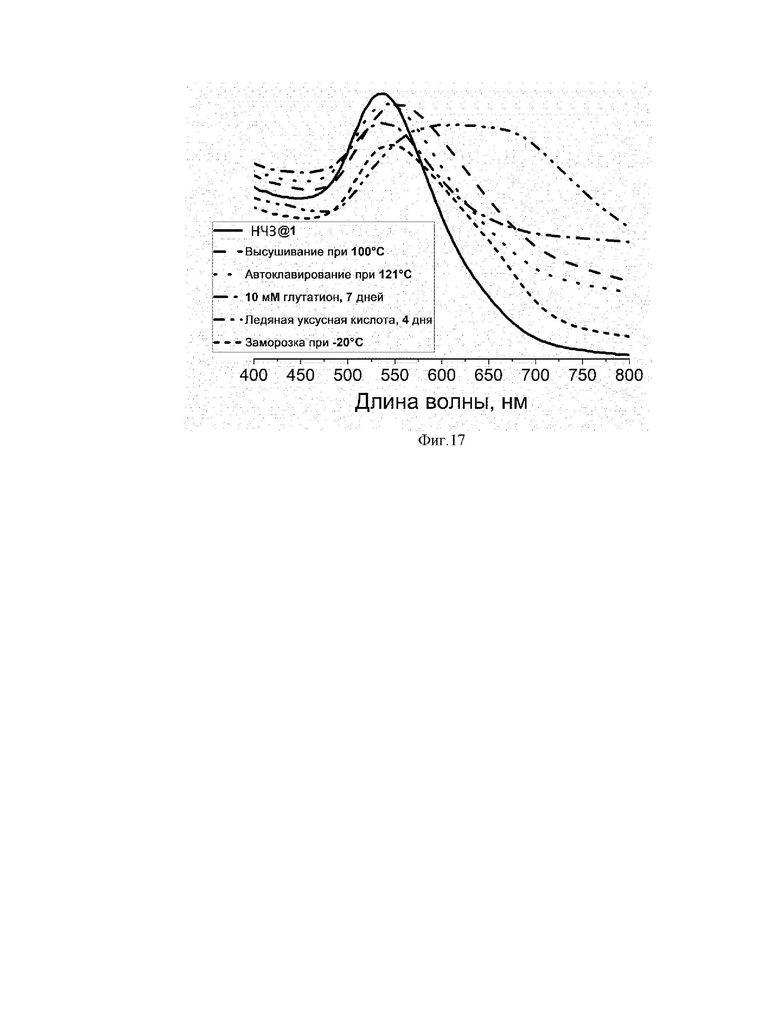
На фиг. 12 приведена стабильность НЧЗ@1’ в растворах NaCl различной концентрации.
На фиг. 13 приведена стабильность НЧЗ@1 в растворах NaCl различной концентрации.
На фиг. 14 приведена стабильность НЧЗ@1’ при различных pH.
На фиг. 15 приведена стабильность НЧЗ@1 при различных pH.
На фиг. 16 приведена реакция НЧЗ@1’ на циклы изменения pH.
На фиг. 17 приведена реакция НЧЗ@1 на различные условия.
На фиг. 18 показаны предварительные результаты МТТ-теста.
Осуществление изобретения
Если не указано иначе, предполагается, что все термины и обозначения, используемые в данной заявке, имеют значения, которые обычно понимают специалисты в области, к которой относится настоящее изобретение.
Сокращения, используемые в настоящем описании, включая приведенные в иллюстративных схемах и последующих примерах, хорошо известны среднему специалисту. Некоторые из сокращений используют как следующие:
ПТСА- п-толуолсульфокислота
MW- микроволновое излучение
MES- 2-(N-морфолино)этансульфоновая кислота
EDC- N-(3-диметиламинопропил)-N'-этилкарбодиимид гидрохлорид
сульфо-NHS- N-гидроксисульфосукцинимид натриевая соль
SERS- поверхностно-усиленная рамановская спектроскопия
XPS- рентгеновская фотоэлектронная спектроскопия (РФЭС)
БСА- Бычий сывороточный альбумин
PBS- фосфатно-солевой буферный раствор
ДМСО- диметилсульфоксид
ИПС- изопропанол
ПЭГ- полиэтиленгликоль
ПЭИ- полиэтиленимин
SPR- поверхностный плазмонный резонанс (ППР)
ПАВ- поверхностно-активное вещество
РСА- рентгеноструктурный анализ
ПЭМ- просвечивающая эмиссионная спектроскопия
ИХА- иммунохроматографический анализ
ХЕПЕС- 4-(2-гидроксиэтил)-1-пиперазинэтансульфоновая кислота (HEPES)
Среда DMEM- среда ДМЕМ; модифицированная по способу Дульбекко среда Игла (Dulbecco's modified Eagles medium)
КТ- компьютерная томография
Бидентатный лиганд (1-Me)(HBr)2, являющийся прекурсором комплекса с золотом и наночастиц, был синтезирован в 4 стадии (Схема 1). Взаимодействие метил 4-хлор-3-нитробензоата с изопропиламином, последующие восстановление гидразин гидратом нитро-группы до амино-группы и циклизация с триэтилортоформиатом приводят к получению бензимидазола 4. Последний алкилируют 0,5 экв дибромпропана и получают соль заявленного бидентатного лиганда (1-Me)(HBr)2, структура которого была подтверждена спектром 1H ЯМР (наличие синглета на 10,33 мд, характерного для азолиевого протона), масс-спектрометрией высокого разрешения (m/z 239,1290 ([M-2Br]2+; расчетное 239,1285), а также РСА (фиг. 1).
Схема 1.

Комплекс лиганда с золотом (1-Me)(AuCl)(AuX), где X=Cl, Br получали через in situ образование комплекса с серебром (1-Me)(AgBr)2 и последующим трансметаллированием. Когда в качестве источника серебра использовали оксид серебра (I), реакция протекала очень медленно, и при этом происходило частичное разложение образующегося комплекса. Замена его на карбонат серебра значительно ускорила реакцию. После полного растворения карбоната серебра, в реакционную смесь добавляли (Me2S)AuCl. Структура комплекса (1-Me)(AuCl)(AuX), где X=Cl, Br была подтверждена спектроскопией 13С ЯМР за счет появления слегка смещенного в область сильного поля сигнала на 180,46 мд, масс-спектроскопии высокого разрешения (m/z 905,1439 ([(1-Me)Au2Cl]+; расчетное 905,1439) и 949,0930 ([(1-Me)Au2Br]+; расчетное 949,0933)) и РСА (фиг. 2).
Схема 2.
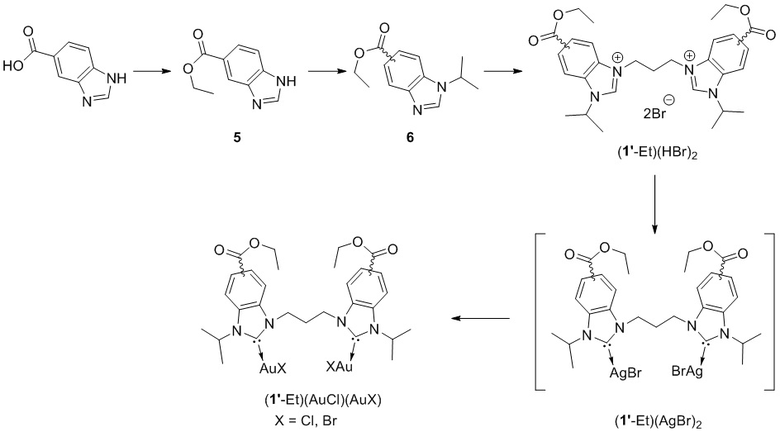
Поскольку положение карбоксильной группы в бензимидазоле не влияет на стабилизацию НЧЗ, исходное соединение (1’-Et)(HBr)2 было получено и использовалось в следующих стадиях в виде смеси трех изомеров (Схема 2). Соль бидентатного лиганда (1’-Et)(HBr)2 была получена из коммерчески доступной бензимидазол-5-карбоновой кислоты. Следуя известной методике, из вышеупомянутой кислоты был получен этиловый эфир 5, который далее алкилировали изопропилбромидом. Соединение 6 использовали для получения соответствующей бензимидазолиевой соли, а также комплексов с серебром и золотом в соответствии с вышеописанными методиками для метилового эфира. Их строение было подтверждено спектроскопией ЯМР, а также масс-спектроскопией высокого разрешения.
Схема 3.

Гидролиз комплексов (1’-Et)(AuCl)(AuX) и (1-Me)(AuCl)(AuX), где X= Cl или Br гидроксидом калия в водно-этанольной смеси без добавления восстановителей при мягком кипении приводит к образованию темно-красного раствора (Схема 3). Образующиеся наночастицы выделяли высаживанием изопропанолом. Побочные продукты реакции (1’2Au2)Cl2 и (12Au2)Cl2, содержащиеся в супернатанте, были также выделены и охарактеризованы.
Полученные наночастицы были проанализированы при помощи просвечивающей электронной микроскопии (ПЭМ) (фиг.3-4) с использованием прибора JEOL JEM-2100 (200 кВ, JEOL, Япония). Можно сделать вывод, что были получены наночастицы золота НЧЗ@1’ и НЧЗ@1 околосферической формы с высокой степенью кристалличности. НЧЗ@1’ характеризуются достаточно узким распределением по размеру 7,4±0,4 нм (фиг.4), размеры НЧЗ@1 находятся в более широком диапазоне 16,7±4,4 нм (фиг. 3).
Стоит отметить, что размер наночастицы сильно зависит от времени упаривания реакционной смеси в условиях мягкого кипения. Так, при выдерживании реакционной смеси в течение 8 ч получаются частицы большего размера (со средним размером 16 нм) (фиг. 5), в то время как за 2 ч - частицы со средним размером 8 нм (фиг. 6).
Присутствие ГКЛ на поверхности НЧЗ было подтверждено SERS-спектрами на приборе Confotec MR 350 (Sol instruments, Беларусь). Сигналы бензимидазолиевых колец наблюдаются при 1400-1405 см-1 (фиг.7): выделены следующие характерные колебания (υ - валентное колебание, δ - деформационное колебание): 1320-1210 см-1 - υ С-О (горизонтальная штриховка), 1440-1395 - δ OH группы COOH (плотная штриховка с наклоном вправо), 1400-1300 - υсимм. С-О и 1650-1550 - υасимм. С-О карбоксилат-аниона соответственно (штриховка с наклоном влево).
С помощью XPS-спектров, полученных на приборе Axis Ultra DLD (Kratos Analytical Limited, Великобритания, источник изучения: Al монохроматор (Kα =1486,6 эВ), область анализа для каждого образца составляла 300×700 мк2. Глубина анализа поверхности - до 3 нм), были изучены состав и электронная структура поверхности наночастиц.
На фиг. 8 показаны сигналы XPS орбитали Au 4f для (1’-Et)(AuCl)(AuX) (верхний) и НЧЗ@1’ (нижний), соответственно. Для комплекса (1’-Et)(AuCl)(AuX) имеется сигнал XPS Au 4f, который состоит из двух пиков при 84,7 и 88,3 эВ в соответствии со спин-орбитальной связью (Au 4f7/2 и Au 4f5/2, соответственно) (N. Bridonneau, et. al (2018) N-Heterocyclic carbene-stabilized gold nanoparticles with tunable sizes, Dalton Trans, 47, 6850-6859. DOI:10.1039/c8dt00416a). Точное положение Au 4f7/2 (84,7 эВ) типично для комплексов Au (I) (R. Ye, et. al. (2018) Supported Au Nanoparticles with N -Heterocyclic Carbene Ligands as Active and Stable Heterogeneous Catalysts for Lactonization, J. Am. Chem. Soc, 140, 11, 4144-4149. DOI:10.1021/jacs.8b01017). Образование наночастицы (НЧЗ@1’) также четко подтверждается XPS-сигналом Au 4f. Энергия связи Au 4f7/2 для НЧЗ@1 ’ составляла 83,3 эВ, что согласуется с наночастицами Au (0) (R. Ye, et. al. (2018) Supported Au Nanoparticles with N -Heterocyclic Carbene Ligands as Active and Stable Heterogeneous Catalysts for Lactonization, J. Am. Chem. Soc, 140, 11, 4144-4149. DOI:10.1021/jacs.8b01017; N. Kruse, S. Chenakin. (2011) XPS characterization of Au/TiO2 catalysts: Binding energy assessment and irradiation effects, Appl. Catal. A Gen, 391, 1-2, 367-376. DOI: 10.1016/j.apcata.2010.05.039). С другой стороны, линии Au 4f для НЧЗ@1’ в спектре XPS разделены на две линии каждая, что указывает на два возможных состояния золота на поверхности наночастиц. Известно, что распределение степеней окисления Au на поверхности НЧЗ можно регулировать с помощью различных ГКЛ (R. Ye, et. al. (2018) Supported Au Nanoparticles with N -Heterocyclic Carbene Ligands as Active and Stable Heterogeneous Catalysts for Lactonization, J. Am. Chem. Soc, 140, 11, 4144-4149. DOI:10.1021/jacs.8b01017) или режимов координации (A. Bakker, et. al. (2018) Elucidating the Binding Modes of N-Heterocyclic Carbenes on a Gold Surface, J. Am. Chem. Soc, 140, 38, 11889-11892. DOI:10.1021/jacs.8b06180; C.R. Larrea, et. al. (2017) N-Heterocyclic Carbene Self-assembled Monolayers on Copper and Gold: Dramatic Effect of Wingtip Groups on Binding, Orientation and Assembly, ChemPhysChem, 18, 24, 3536-3539. DOI:10.1002/cphc.201701045; L. Jiang, et. al. (2017) N-Heterocyclic carbenes on close-packed coinage metal surfaces: Bis-carbene metal adatom bonding scheme of monolayer films on Au, Ag and Cu, Chem. Sci, 8, 8301-8308. DOI: 10.1039/c7sc03777e). Можно предположить, что дублет линий меньшей интенсивности, скорее всего, проявляется либо за счет образования комплексов бискарбена с адатомами на поверхности наночастиц, либо в случае, когда бидентатный карбеновый лиганд содержит одну связь C-Au, которая представляет собой атом золота на поверхности наночастиц, и одна связь C-Au, оставшаяся в комплексе ГКЛ-Au (I). Сигнал C 1s НЧЗ@1’, который показан на фиг.9, указывает на образование связи C-Au. Обратим внимание на пятый компонент сигнала C 1s, расположенный с высокой энергией связи (288,50 эВ). Следует сказать, что это можно отнести к переходу π→π*, который характерен для пика встряски (сателлитного пика), возникающего в результате фотоэлектронного возбуждения гетероциклического кольца (F. Petraki, et. al. (2007) The electronic structure of Ni-phthalocyanine/metal interfaces studied by X-ray and ultraviolet photoelectron spectroscopy, Org. Electron, 8, 5, 522-528. DOI: 10.1016/j.orgel.2007.03.006). Таким образом, достоверно установлено, что полученные в данной работе наночастицы золота покрыты ГКЛ.
Данные SERS и XPS-спектров согласуются с литературными данными (J.F. DeJesus, et.al. (2020) A Benchtop Method for Appending Protic Functional Groups to N-Heterocyclic Carbene Protected Gold Nanoparticles, Angew. Chemie - Int. Ed., 59, 19, 7585-7590. DOI: 10.1002/anie.202001440; J.F. Dejesus, et. al. (2018) N-Heterocyclic Carbenes as a Robust Platform for Surface-Enhanced Raman Spectroscopy, J. Am. Chem. Soc, 140, 4, 1247-1250. DOI: 10.1021/jacs.7b12779; M.J. Trujillo, et.al. (2018) Using SERS to understand the binding of n-heterocyclic carbenes to gold surfaces, J. Phys. Chem. Lett. 9, 23, 6779-6785. DOI: 10.1021/acs.jpclett.8b02764), что подтверждает наличие лигандов на поверхности наночастиц.
Стабильность частиц НЧЗ@1’, НЧЗ@1 была подтверждена в широком диапазоне pH (1-12) (фиг. 14-15), градиенте ионной силы (фиг. 12-13) и в нескольких циклах высушивания/ресуспендирования в различных условиях (фиг. 10-11), что определяется отсутствием смещения в УФ/вид. спектре пика ППР, положение которого строго зависит от степени агрегирования наночастиц.
Частицы показали удивительную способность к ресуспендированию в воде, в буферных водных растворах с сохранением коллоидной стабильности даже после воздушной сушки при комнатной (в интервале 15-26°С) или повышенной (в интервале 80-100°С) и пониженной температуре, вакуумной сушке, лиофильной сушке, высушивание проводили до сухого порошка или до тонкой пленки на различных твердых фазах (стекло, пластик, полимерное покрытие, металл, бумага, нитроцеллюлоза, керамика, дерево) непосредственно из водного раствора без добавления каких-либо дополнительных ПАВов и стабилизаторов. Высушивание на воздухе проводили следующим образом: в определённую тару (виала, пробирки типа эппендорф, пробирка стеклянная, пробирка пластиковая) или на определенную поверхность (стекло, пластик, полимерное покрытие, металл, бумага, нитроцеллюлоза, керамика, дерево) помещали определённый объем раствора, содержащего НЧЗ@1’, НЧЗ@1 и инкубировали на воздухе при определенной температуре до полного высыхания (испарения воды из раствора). Ресуспендирование (смывание частиц НЧЗ@1’, НЧЗ@1 с поверхности) проводили путем добавления к сухим частицам воды или водного буферного раствора, например, PBS, MES, HEPES, ацетатного буфера.
Так, например, частичная агрегация наблюдалась только после третьего цикла высушивания/ресуспендирования, но добавление NaHCO3 или раствора NaHCO3 и NaOAc приводило к ее исчезновению. Можно предположить, что причиной агрегации является образование водородных связей между карбоксильными группами лигандов, находящихся на поверхности наночастиц (фиг. 10), а не удалением лиганда с поверхности НЧЗ.
НЧЗ@1’ показали превосходную стабильность при 0,6 М NaCl при том, что физиологическая концентрация составляет 0,15 М (фиг.12).
Частицы НЧЗ@1’ высаживали из нейтрального pH добавлением кислоты (при pH≤3), затем ресуспендировали добавлением раствора щелочи, фиксировали положение пика ППР, снимая спектр поглощения, и повторяли описанную процедуру несколько раз. Данный эксперимент позволяет сделать вывод об обратимом агрегировании частиц при pH меньше 3 (фиг. 16).
Проверка термической стабильности (при 100 и 120°С), а также устойчивость к различным жестким условиям (выдерживание в присутствии глутатиона, ледяной уксусной кислоты и замораживание до -20°С) была проведена на НЧЗ со средним размером 16 нм (фиг. 17). Частицы НЧЗ@1 показали повышенную стабильность во всех вариантах, за исключением выдерживания в ледяной уксусной кислоте в течение нескольких дней.
Полученные данные позволяют сделать вывод о схожей, а в некоторых случаях и превосходящей стабильности заявленных наночастиц золота по сравнению с известными аналогами. Значительным плюсом предложенных частиц является возможность их конъюгации с биомолекулами за счет наличия карбоксильной группы на поверхности.
Представленное изобретение предполагает возможность связывания наночастиц с функциональными молекулами, в частности посредством ковалентной конъюгации с карбоксильной группой. Полученные конъюгаты в том числе, могут нести в себе различные молекулы: малые молекулы (родамин, флуоресцеин, цианиновые красители, производные BODIPY и т.п.), цитостатики и цитотоксические вещества (доксорубицин, даунорубицин, паклитаксел, темозоломид и другие), фотосенсибилизаторы (порфирины, фталоцианины и др.). Ковалентная конъюгация функциональных молекул с поверхностью частиц является одним из вариантов воплощения.
Для разработки тестов иммунохроматографического анализа (ИХА) НЧЗ@1’ ковалентно модифицировали с помощью природных антиген-специфических белков-антител. Для этого наночастицы конъюгируют с антителом, например, карбодиимидным методом с анти-человеческим IgG (НЧЗ@1’@анти-человеческий IgG), герцептином (трастузумабом - НЧЗ@1’@герцептин) или антителами против хлорамфеникола, флуоресцеина или тропонина. Анализ показал, что наночастицы НЧЗ@1’@анти-человеческий IgG, НЧЗ@1’@герцептин специфическим образом взаимодействуют только с антигеном-мишенью. Более того, указанные наночастицы не взаимодействуют с типичными белками сыворотки крови - альбумином и иммуноглобулинами. Эти белки играют важную роль в опсонизации и ускоряют выведение из кровотока. Такой результат позволил нам сделать вывод, что НЧЗ@1’ являются многообещающими агентами для приложений in vivo. Кроме того, наночастицы НЧЗ@1’@анти-человеческий IgG, НЧЗ@1’@герцептин, которые подвергались сушке и ресуспендированию, сохранили сродство к антигену, что упрощает способ хранения и транспортировки тестов ИХА. Кроме того, частицы функционализированные антителами против хлормафеникола, флуоресцеина или человеческих иммуноглобулинов показали чувствительную регистрацию соответствующих аналитов в различных образцах - молока, сыворотки и плазме крови, а также цельной крови.
Чтобы продемонстрировать возможность использования разработанных наночастиц для специфического таргетинга клеток, НЧЗ@1' были сконъюгированы с одним из наиболее клинически успешных моноклональных антител - Трастузумабом, который связывается с рецептором эпидермального фактора роста человека (HER2/neu), который гиперэкспрессируется на поверхности опухолевых клеток примерно в 30% случаев рака груди и 20% рака яичников (P. Yousefpour, et. al. (2011) Targeted delivery of doxorubicin-utilizing chitosan nanoparticles surface-functionalized with anti-Her2 trastuzumab., Int. J. Nanomedicine, 6, 1977-1990. DOI: 10.2147/ijn.s21523). Полученные функционализированные наночастицы НЧЗ@1’@анти-HER2/neu инкубировали с клеточными линиями SK-BR-3 (суперэкспрессия HER2/neu) и CHO (HER2/neu-отрицательная). Затем образцы были проанализированы на проточном цитометре Amnis ImageStream X Mark II (Luminex Corporation, США, увеличение 40X, 488 нм лазер (200 мВ) для возбуждения флуоресценции и 785 нм лазер (0,5 мВ) для измерения бокового рассеяния. Программное обеспечение Amnis INSPIRE). Поскольку наночастицы имеют значительный сигнал в канале бокового светорассеяния (БС), была исследована зависимость средней интенсивности БС от концентрации частиц, чтобы оценить эффективность связывания частиц с клетками. Результаты показали, что частицы связываются с раковыми клетками SK-BR-3, в то время как связывание с клетками CHO практически не наблюдается. Более того, для клеток SK-BR-3 чем выше концентрация частиц, тем выше эффективность связывания. Изображения, полученные как в канале светлого поля, так и в канале БС, также подтверждают специфичность связывания частиц.
Настоящее изобретение позволяет доставлять in vitro и in vivo различные средства (вещества), включающие, например, терапевтические (например, противораковые), питательные вещества (например, минералы, витамины и т. д.), профилактические субстанции (например, вакцины), диагностические (например, радионуклиды и флуоресцентные, люминесцентные, контрастные и магнитные вещества), и/или могут быть доставлены агентами по данному изобретению. В некоторых вариантах использования изобретения агент, который должен быть доставлен, полезен для лечения рака (например, рака молочной железы).
Примеры фармакологически активных соединений, которые могут быть доставлены к клеточным мишеням с помощью настоящего изобретения, включают липофильные, плохо или совсем не растворимые в воде соединения, перечисленные в разделе «Индекс терапевтических категорий и биологической активности» индекса Merck (12th Ed'n, 1996).
Предварительные результаты МТТ-теста (фиг.18) показывают очень низкую цитотоксичность НЧЗ@1’ со средним размером 8 нм. Выживаемость клеток в данном случае сопоставима с результатами контрольного теста.
Описание оборудования, использованного в экспериментальной части:
Реакции под действием микроволнового излучения проводились в микроволновом реакторе CEM Discover® (CEM Corporation, Мэтьюз, США).
Спектры ЯМР были измерены на приборе Varian Unity Inova 500 M WB (Agilent, США, 500 МГц).
Масс-спектры были получены на приборе NexION 2000 (PerkinElmer, США).
Элементный анализ синтезированных соединений был проведен с помощью элементного анализатора Vario micro cube (Elementar, Германия).
Данные рентгеноструктурного анализа были получены на дифрактометре высокого разрешения SMART APEX II (Германия, Bruker) при температуре 120 К (графитовый монохроматор, CCD детектор APEX II, MoKα-излучение, λ 0,71073 Å, ω-сканирование). Определение параметров ячейки и измерение интенсивности дифракционных отражений произведено с использованием пакета программ SHELXTL PLUS.
Контроль за ходом реакций производили методом ТСХ на SiO2 (Merk TLC Silica gel 60 F254) по исчезновению исходных соединений.
Тест-полоска для ИХА представляет собой изделие из специального пористого материала, состоящего из природных полимеров, например, целлюлозы и материалов на ее основе (например, волокнистые полимеры - фильтровальная бумага, бумага для хроматографии и пр.); минеральных гранул, например, сульфата алюминия, солей магния, кремния; синтетических или модифицированных природных полимеров, таких как поливинилхлорид, полиакрилаты, декстран различных степеней сшивки, нитроцеллюлоза, ацетилцеллюлоза, полиакриламиды и др.; стекло; керамические материалы; и подобные материалы. Тест-полоска ИХА имеет зону нанесения образца и зону связывания, как указано выше.
Для использования описываемого изобретения одним их возможных материалов является нитроцеллюлоза.
Иммобилизация целевых молекул с поверхностью мембраны полоски ИХА может проводится по известным методикам (Immobilized Enzymes, Inchiro Chibata, Halsted Press, New York (1978) и Cuatrecasas, J. Bio. Chem., 1970, 245:3059).
Первым шагом ИХА является иммобилизация целевой молекулы на тест-полоску, вторым действием является помещение тест-полоски в специальный буферный раствор со значениями pH в интервале 4-11, для настоящего изобретения может осуществляться, например, в интервале 5-9. Возможные варианты буферных систем перечислены ниже: боратный, диэтилбарбитуровый, фосфатный, карбонатный, Tris, ацетатный, HEPES, MES и др.
Проводить ИХА с использованием данного изобретения может осуществляться, например, при температуре близкой к комнатной 16-26°C, но также возможно в интервале температур 11-40°C.
Сущность и промышленная применимость заявленной группы изобретений поясняются следующими примерами.
Пример 1. Получение карбоната серебра (Ag2CO3).
Раствор нитрата серебра (1,70 г, 10,0 ммоль) в 20 мл воды Milli-Q смешали с раствором карбоната натрия (0,530 г, 5,0 ммоль) в 20 мл воды Milli-Q. Образовавшийся осадок центрифугировали в течение 10 мин при 2,300 g, промывали три раза водой Milli-Q, затем снова центрифугировали и высушивали на воздухе при минимальном освещении. Выход: 1,365 г (99%).
Пример 2. Получение хлор(диметилсульфид)золота (I) (Me2SAuCl).
Золото (0,890 г, 4,5 ммоль) растворили в 16 мл царской водки (смесь концентрированных азотной и соляной кислот, взятых в соотношении 1:3 по объёму), затем полученный раствор концентрировали до объема 5 мл, добавили 10 мл концентрированной соляной кислоты и снова концентрировали до объема 5 мл. Процедуру повторяли, пока не прекратилось выделение коричневого газа. Далее смесь охлаждали до комнатной температуры и разбавляли 20 мл метанола. К полученному метанольному раствору добавляли по каплям Me2S (1 мл, 13,5 ммоль) и интенсивно перемешивали до исчезновения красного цвета. Полученную суспензию перемешивали в течение 1 ч в темноте, отфильтровывали белый осадок и сушили в вакууме. Выход: 1,20 г (91%).
Пример 3. Общая методика А получения (1-Me)(HBr)2 и (1’-Et)(HBr)2.
К раствору соединения 4 или 6 (10 ммоль) в 20 мл ацетонитрила добавили 1,3-дибромпропан (0,51 мл, 50,0 ммоль). После нагревания в микроволновом реакторе при 100 в течение 6 ч реакционную смесь охладили до комнатной температуры, растворитель отогнали в вакууме. Продукт использовали в следующей стадии без дополнительной очистки.
Пример 4. Общая методика Б получения (1-Me)(AuCl)(AuX) и (1’-Et)(AuCl)(AuX), где Х=Cl, Br.
К раствору (1-Me)(HBr)2 или (1’-Et)(HBr)2 (0.375 ммоль) в 15 мл дихлорметана добавили Ag2CO3 (103 мг, 0,375 ммоль) и подвергли воздействию ультразвука до полного растворения (3 мин). К полученному раствору добавили Me2SAuCl (220 мг, 0,750 ммоль) и обработали ультразвуком (2 мин) при минимальном воздействии света, полученную суспензию центрифугировали в течение 5 мин при 2300 g, супернатант концентрировали в вакууме при комнатной температуре. Продукт получали в виде белых кристаллов.
Пример 5. Общая методика В получения ГКЛ стабилизированных НЧЗ со средним размером 8 нм.
К суспензии (1-Me)(AuCl)(AuX) или (1’-Et)(AuCl)(AuX), где Х=Cl, Br (75 мг, 0,080 ммоль) в 5 мл этанола добавили 5 мл воды Milli-Q и 1М KOH (302 мкл). Полученную смесь подвергли воздействию ультразвука в течение 30 сек и концентрировали при кипении и перемешивании в течение 2 ч до итогового объема реакционной смеси 5 мл. Полученную темно-красную смесь смешали с 5 мл ИПС, образовавшийся осадок центрифугировали в течение 10 мин на 10,000 g, промывали 2 раза ИПС, снова центрифугировали. Чистые наночастицы растворяли в воде Milli-Q.
Супернатант подкислили соляной кислотой до pH 4 и промыли сначала дихлорметаном (1x5 мл), затем смесью дихлорметан-этанол (4:1) (2x5 мл). Объединенный органический слой сушили безводным Na2SO4 и сконцентрировали в вакууме. Продукт (12Au2)Сl2 использовали без дополнительной очистки.
Пример 6. Общая методика Г получения ГКЛ стабилизированных НЧЗ со средним размером 16 нм.
К суспензии (1-Me)(AuCl)(AuX) или (1’-Et)(AuCl)(AuX), где Х=Cl, Br (75 мг, 0,080 ммоль) в 5 мл этанола добавили 5 мл воды Milli-Q и 1М KOH (302 мкл). Полученную смесь подвергали воздействию ультразвука (30 сек) и концентрировали при кипении и перемешивании в течение 8 ч до итогового объема реакционной смеси 1 мл. Полученную темно-красную смесь смешали с 5 мл ИПС, образовавшийся осадок центрифугировали в течение 10 мин на 10,000 g, промывали 2 раза ИПС, снова центрифугировали. Чистые наночастицы растворяли в воде Milli-Q.
Супернатант подкислили соляной кислотой до pH 4 и промыли сначала дихлорметаном (1×5 мл), затем смесью дихлорметан-этанол (4:1) (2×5 мл). Объединенный органический слой сушили безводным Na2SO4 и сконцентрировали в вакууме. Продукт (12Au2)Cl2 использовали без дополнительной очистки.
Пример 7. Получение соединения (1-Me)(AuCl)(AuX), где Х=Cl, Br.

Стадия 1. Получение метил-4-(изопропиламино)-3-нитробензоата (2).
Раствор метил 4-хлор-3-нитробензоата (2,16 г, 10,0 ммоль) в 16 мл ацетонитрила смешали с изопропиламином (1,23 мл, 15,0 ммоль) и раствором NaOAc (1,64 г, 20,0 ммоль) в 5,4 мл воды Milli-Q. После нагревания при 120 в течение 2 ч в микроволновом реакторе реакционную смесь охладили до комнатной температуры и влили в 200 мл ледяной воды, выпавший осадок отфильтровали, высушивали на воздухе. Продукт 2 выделили в виде светло-жёлтых кристаллов после перекристаллизации из гексана. Выход 1,71 г (79%). 1H ЯМР (500 МГц, CDCl3) δ, мд: 8,88 (д, 4J = 1,9 Гц, 1H, Ar-H), 8,30 (уш.с, 1H, NH), 8,03 (д, J = 9,1 Гц, 1H, Ar-H), 6,88 (д, 3J =9,1 Гц, 1H, Ar-H), 3,92-3,90 (м, 4H, (CH3)2CH-+COOCH3), 1,36 (д, J =6,4 Гц, 6H, (CH3)2CH-).
Стадия 2. Получение метил 3-амино-4-(изопропиламино)бензоата (3).
N2H4·H2O (2.0 мл, 2.25 ммоль) и Fe(AcAc)3 (0.200 г, 0.6 ммоль) добавили к раствору соединения 2 (4,47 г, 18,8 ммоль) в 20 мл этанола. После нагревания в микроволновом реакторе при 150 в течение 8 мин реакционную смесь охладили до комнатной температуры и отфильтровали через слой силикагеля. Фильтрат концентрировали досуха. Продукт использовали в следующей стадии без дополнительной очистки. Выход: 3,99 г (98%). 1H ЯМР (500 MГц, CDCl3) δ, мд: 7,58 (дд, 3J= 8,4 Гц, 4J= 2,0 Гц, 1H, Ar-H), 7,40 (д, 4J= 1,9 Гц, 1H, Ar-H), 6,59 (д, 3J= 8,4 Гц, 1H, Ar-H), 3,90-3,78 (м, 5H, NH2+COOCH3), 3,69 (дт, 3J= 12,5, 6,3 Гц, 1H, (CH3)2CH-), 1,26 (д, 3J= 6,3 Гц, 1H, (CH3)2CH-).
Стадия 3. Получение метил 1-изопропил-1H-бенз[d]имидазол-5-карбоксилата (4).
ПТСА (0,200 г, 1,2 ммоль) добавили при перемешивании к раствору соединения 3 (3,99 г, 19,2 ммоль) в триэтилортоформиате (20 мл). После нагревания в микроволновом реакторе при 150 в течение 1 ч реакционную смесь охладили до комнатной температуры, отогнали растворитель досуха. Полученный остаток растворили в смеси 100 мл дихлорметана и 50 мл насыщенного раствора NaHCO3. Слои отделили, органический слой промыли рассолом, сушили безводным Na2SO4 и концентрировали в вакууме. Продукт 4 выделили при помощи колоночной хроматографии на силикагеле, элюент дихлорметан-метанол (100:1). Выход: 4,19 г (88%). 1H ЯМР (500 МГц, CDCl3) δ, мд: 8,54 (с, 1H, N=CH-N), 8,18 (с, 1H, Ar-H), 8,05 (дд, 3J = 8,3 Гц, 4J = 1,5 Гц, 1H, Ar-H), 7,47 (д, 3J = 8,3 Гц, 1H, Ar-H), 4,69 (сеп, J = 6,7 Гц, 1H, (CH3)2CH-), 3,69 (с, 3H, COOCH3), 1,66 (д, 3J = 6,8 Гц, 1H, (CH3)2CH-).
Стадия 4. Получение 3-изопропил-1-(3-(1-изопропил-5-(метоксикарбонил-1H-бенз[d]имидазол-3-иум-3-ил)пропил)-6-(метоксикарбонил)-1H-бенз[d]имидазол-3-иум бромида ((1-Me)(HBr)2).
Соединение (1-Me)(HBr)2 в виде белого порошка получили по методике А (пример 3), используя соединение 4. Выход: 3,83 г (60%).1H ЯМР (500 МГц, DMSO-d6), мд: 10,33 (с, 2H, N=CH-N), 8,66 (с, 2H, Ar-H), 8,31 (д, 3J= 8,8 Гц, 2H, Ar-H), 8,23 (дд, J= 8,8 Гц, 4J= 1,5 Гц, 2H, Ar-H), 5,13 (сеп, 3J=6,4 Гц, 2H, (CH3)2CH-), 4,80 (т, 3J=7,1 Гц, 4H, CH2-CH2-CH2), 3,94 (с, 6H, COOCH3), 2,76 (квин, 3J= 7,3 Гц, 2H, CH2-CH2-CH2), 1,66 (д, J=6,9 Гц, 12H, (CH3)2CH-).13C NMR (100 МГц, DMSO-d6мд:) 165,14 (COOCH3), 143,31 (N=CH-N, определено с помощью спектра HMBC), 133,29 (Ar), 131,37 (Ar), 127,82 (Ar), 126,71 (Ar), 115,11 (Ar), 114,38 (Ar), 52,52 (COOCH3), 51,07 (CH3)2CH-), 43,98 (CH2-CH2-CH2), 28,08 (CH2-CH2-CH2), 21,39 ((CH3)2CH-). ICP-MS: m/z расчетное для [C27H34N4O4]2+ 239,1285, найденное 239,1290.
Стадия 5. Получение (1-Me)(AuCl)(AuX), где Х=Cl, Br.
Продукт (1-Me)(AuCl)(AuX), где Х=Cl, Br был получен в виде смеси (1-Me)(AuCl)2 и 26 мол-% (1-Me)(AuCl)(AuBr) по методике Б (пример 4), используя соединение (1-Me)(HBr)2. Выход: 363 мг (99%). 1H ЯМР (500 МГц, CDCl3) мд 8,10 ̶ 8,22 (м, 4H, Ar-H), 7,72 (д, 3J=8,3 Гц, 2H, Ar-H), 5,44 (сеп, 3J=6,4 Гц, 2H, (CH3)2CH-), 4,74 (т, 3J=6,9 Гц, 6H, CH2-CH2-CH2), 4,00 (с, 6H, COOCH3), 2,73 (квин, 3J=6,4 Гц, 2H, CH2-CH2-CH2), 1,78 (д, J=6,9 Гц, 12H, (CH3)2CH-). 13C NMR (100 МГц, CDCl3) мд: 183,5 (N2C-Au-Br), 180,46 (N2C-Au-Cl), 165,91 (COOMe), 135,04 (Ar), 133,18 (Ar), 127,10 (Ar), 125,94 (Ar), 113,05 (Ar), 112,96 (Ar), 54,54 ((CH3)2CH-), 52,59 (COOCH3), 46,23 (CH2-CH2-CH2), 29,75 (CH2-CH2-CH2), 22,02 ((CH3)2CH-). ICP-MS: m/z расчётное для [C27H32Au2ClN4O4]+ 905,1448, найденное 905,1439; расчетное для [C27H32Au279BrN4O4] 949,0933, найденное 949,0930; расчетное для [C27H32Au281BrN4O4] 951,0913, найденное 951,0915.
Пример 8. Получение соединения (1’-Et)(AuCl)(AuX), где Х=Cl, Br.
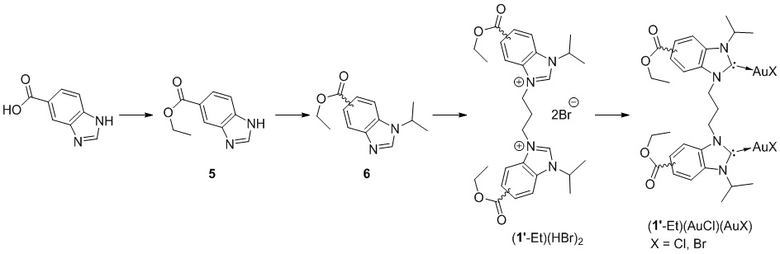
Стадия 1. Получение этил 1H-бенз[d]имидазол-5-карбоксилата (5).
Этил 1H-бенз[d]имидазол-5-карбоксилат был получен из бензимидазол-5-карбоновой кислоты по методике, описанной в (Dr. Kirsi Salorinne, et. al. (2017) Water-Soluble N-Heterocyclic Carbene-Protected Gold Nanoparticles: Size-Controlled Synthesis, Stability, and Optical Properties, 56, 22, 6198-6202. DOI: 10.1002/anie.201701605).
Стадия 2. Получение смеси этил 1-изопропил-1H-бенз[d]имидазол-5-карбоксилата и этил 1-изопропил-1H-бенз[d]имидазол-4-карбоксилата (6).
Cs2CO3 (2,80 г, 8,6 ммоль) добавили к раствору соединения 5 (1,0 г, 5,3 ммоль) и 2-бромпропана (0,50 мл, 5,3 ммоль) в 15 мл ацетонитрила. После нагревания в микроволновом реакторе при 100 в течение 6 ч реакционную смесь охладили до комнатной температуры и профильтровали через слой целита. Фильтрат концентрировали досуха. Смесь двух изомеров в соотношении 1:1 была выделена при помощи колоночной хроматографии на силикагеле, элюент дихлорметан-метанол (95:5). Выход: 1,10 г (90%). 1H ЯМР (500 МГц, CDCl3), мд: 8,54 (д, 4J=0,7 Гц, 1H, N=CH-N), 8,20 (д, 4J=1,0 Гц, 1H, N=CH-N), 8,14 (с, 1H, Ar-H), 8,09 (с, 1H, Ar-H), 8,04 (дд, 3J=8,6, 4J=1,5 Гц, 1 H, Ar-H), 8,00 (дд, 3J=8,6, 4J=1,5 Гц, 1H, Ar-H), 7,82 (дд, 3J=8,6 Гц, 4J=0,5 Гц, 1H, Ar-H), 7,44 (д, 3J=8,3 Гц, 1H, Ar-H), 4,63-4,78 (м, 2H, (CH3)2CH-), 4,39-4,45 (м, 4H, CO2CH2CH3), 1,65 (2д, 3J = 6,8 Гц, 12H, (CH3)2CH-), 1,42-1,44 (м, 6H, CO2CH2CH3).
Стадия 3. Получение смеси 3-изопропил-1-(3-(1-изопропил-5-(метоксикарбонил-1H-бенз[d]имидазол-3-иум-3-ил)пропил)-6-(метоксикарбонил)-1H-бенз[d]имидазол-3-иум бромида ((1’-Et)(HBr)2).
Смесь изомеров (1’-Et)(HBr)2 в виде белого порошка была получена по методике А (пример 3), используя соединение 6. Выход: 4,92 г (74%). 1H ЯМР (500 МГц, DMSO-d6), мд: 10,48 (с, 1H, N=CH-N), 10,45 (с, 1 H, N=CH-N), 8,61 8,68 (м, 2H, N=CH-N, Ar-H), 8,37 (дд, 3J=16,1, 8,8 Гц, 1H, Ar-H), 8,31 (д, J=8,8 Гц, 1H, Ar-H), 8,17-8,24 (м, 2H, Ar-H), 5,25 (дт, J=13,2, 6,6 Гц, 1H, (CH3)2CH-), 5,13 (дт, J=13,2, 6,6 Гц, 1 H, (CH3)2CH-), 4,78-4,88 (м, 4H, CH2-CH2-CH2), 4,36-4,44 (м, 4H, CH2-CH2-CH2), 2,78-2,80 (м, 2H, CH2-CH2-CH2), 1,66 (т, J=6,1 Гц, 12H, (CH3)2CH-), 1,26-1,47 (м, 6H, (CH3)2CH-). 13C ЯМР (100 МГц, DMSO-d6), мд: 164,68, 164,65, 143,29, 143,24, 134,17, 133,23, 131,39, 131,33, 130,45, 130,43, 128,11, 128,06, 126,71, 126,69, 126,63, 115,20, 115,06, 115,04, 114,37, 114,36, 114,17, 114,12, 61,33, 61,32, 51,08, 50,73, 44,21, 44,00, 40,01, 39,84, 39,68, 39,34, 39,18, 39,01, 28,02, 27,99, 21,65, 21,41, 14,00, 13,98. ICP-MS: m/z расчетное для [C29H38N4O4]2+ 253,1441, найденное 253,1447; m/z расчетное для [C29H38BrN4O4]+ 585,2071, найденное 585,2072.
Стадия 4. Получение соединения (1’-Et)(AuCl)(AuX), где Х= Cl, Br.
Продукт (1’-Et)(AuCl)(AuX), где Х=Cl, Br был получен в виде смеси (1’-Et)(AuCl)2 и 26 мол-% (1’-Et)(AuCl)(AuBr) по методике Б (пример 4) из соединения (1’-Et)(HBr)2 и использовался далее без дополнительной очистки. Выход: 365 мг (97%). Элементный анализ: расчетное для C29H36N4Au2Cl1.48Br0.52 (%) C 35,05, H 3,63, N 5,64, найденное (%) C 35,5, H 3,84, N 5,64. ICP-MS: m/z расчетное для [C29H36Au279BrN4O4]+ 977,1248, найденное 977,1245; m/z расчетное для [C29H36Au2ClN4O4]+ 933,1751, найденное 933,1753.
Пример 9. Получение НЧЗ@1’.

НЧЗ@1’ была получена по методике В (пример 5), используя (1’-Et)(AuCl)(AuX), где Х=Cl, Br. Выход: 15 мг.
Выход 1’2Au2Сl2: 30 мг (55%). 1H ЯМР (500 МГц, DMSO-d6), мд: 13,41 (уш.с, 2H, COOH) 8,76 (с, 2H, Ar-H), 8,05-8,13 (м, 4H, Ar-H) 5,19 (сеп, 3J=7,0 Гц, 2H, (CH3)2CH-), 4,85 (т, 3J=6,4 Гц, 4H, CH2-CH2-CH2) 2,77 (квин, 3J=6,9 Гц, 2H, CH2-CH2-CH2) 1,44 (д, J=6,9 Гц, 12H, (CH3)2CH-). 13C ЯМР (100 МГц, DMSO-d6), мд: 189,88 (N2C-Au), 166,71 (COOH), 134,44 (Ar), 133,26 (Ar), 128,40 (Ar), 125,67 (Ar), 113,79 (Ar), 112,65 (Ar), 51,65 ((CH3)2CH-), 46,25 (CH2-CH2-CH2), 32,60 (CH2-CH2-CH2), 22,33 ((CH3)2CH-), ICP-MS: m/z расчетное для [C50H56Au2N8O8]2+ 645,1778, найденное 645,1771.
Пример 10. Получение НЧЗ@1.
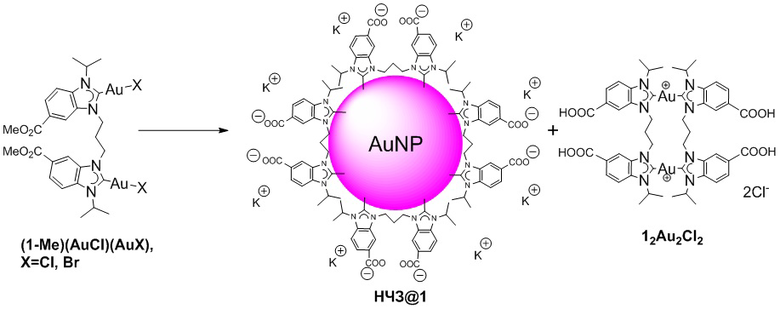
НЧЗ@1 были получены по методике Г (пример 6), используя (1-Me)(AuCl)(AuX), где Х=Cl, Br. Выход: 19 мг. Выход (12Au2)Сl2: 23 мг (42%).
Пример 11. Конъюгация наночастиц с белками.
0,5 мг НЧЗ@1’ в 1 мл буфера PBS (pH 7,8) смешивали с 200 мкл буфера PBS с 0,5 мг EDC и 0,5 мг сульфо-NHS. НЧЗ@1’ инкубировали в течение 30 мин при комнатной температуре, а затем дважды промывали (15000 g, 10 мин) 200 мкл воды PBS. Суспензию смешивали с одним из следующих белков в боратном буфере (pH 8,5), фосфатном буфере (рН 7,8), или ХЕПЕС-буфере (рН 6,0):
1) анти-человеческий-IgG (объем раствора белка в буфере -100 мкл, концентрация белка в буфере -1 г/л),
2) человеческий-IgG (100 мкл, 1 г/л),
3) герцептин (100 мкл, 0,4 г/л),
4) БСА-биотин (100 мкл, 3 г/л),
5) БСА-хлорамфеникол (100 мкл, 3 г/л),
6) антитела на хлорамфеникол (100 мкл, 3 г/л),
7) стрептавидин (100 мкл, 1 г/л),
8) лектин WGA (100 мкл, 1 г/л),
9) лектин ConA (100 мкл, 1 г/л).
10) антитела на С-реактивный белок (100 мкл, 1 г/л)
11) С-реактивный белок (100 мкл, 1 г/л)
12) антитела на тропонин (100 мкл 1г/л)
Конечную смесь в течение короткого времени обрабатывали ультразвуком и инкубировали в течение ночи при комнатной температуре. НЧЗ@1’@белок трижды промывали PBS и хранили в 100 мкл PBS перед использованием.
Пример 12. Подготовка тест-полосок для ИХА-теста.
В одном из вариантов белковые растворы (1 г/л) наносили на нитроцеллюлозные мембраны длиной 300 мм (каталожный номер HF075MC100, EMD Millipore Corporation, Берлингтон, Массачусетс, США) с помощью адсорбирующей прокладки (каталожный номер CFSP203000, EMD Millipore Corporation, Берлингтон, Массачусетс, США) со скоростью впрыска 4 мкл/см с использованием дозирующей системы XYZ3060 (BioDot, Ирвин, Калифорния, США) для формирования тестовой линии. Мембраны сушили при комнатной температуре не менее 24 часов. Тест-полоски (шириной 2,0 мм) нарезали автоматическим резаком CM4000 (BioDot, Irvine CA, USA) и хранили при комнатной температуре в темноте перед экспериментом.
Пример 13. Определение специфичности конъюгатов НЧЗ методом ИХА.
2 мкл наночастиц НЧЗ@1’@антитело (0,5 г/л) в PBS смешивали с 19 мкл 1% раствора БСА в PBS. Смесь помещали в пробирку на 0,6 мл, инкубировали в течение нескольких минут при комнатной температуре. Полоску, с предварительно нанесенным антигеном, помещали в пробирку после быстрой обработки ультразвуком. Все полоски сушили не менее 24 часов перед сканированием с помощью сканера Perfection V800 Photo (Epson, Suwa, Japan). Для проведения эксперимента с высушенными наночастицами растворы наночастиц сушили на воздухе и ресуспендировали с использованием воды MilliQ того же объема, что и исходный.
Наблюдали появление окрашенной тест-полоски в области нанесения антигена.
Для проведения эксперимента с высушенными наночастицами растворы наночастиц сушили на воздухе и ресуспендировали с использованием воды MilliQ того же объема, что и исходный.
Пример 14. Проведение ИХА теста с использованием конъюгатов НЧЗ для детекции антибиотика хлорамфеникола (CAP) в образце.
В образец (молоко, кровь, сыворотка, плазма крови мыши) добавляли антибиотик хлорамфеникол, чтобы итоговая концентрация была в диапазоне от 1 нг/мл до 1 мг/мл. 2 мкл наночастиц НЧЗ@1’@антитела на хлорамфеникол (0,5 г/л) в PBS смешивали с 5 мкл образца (или разбавленного миграционным буфером образца) с 19 мкл миграционного буфера - 1% раствора БСА в PBS. Смесь помещали в пробирку на 0,6 мл, инкубировали в течение нескольких минут при комнатной температуре. Полоску для ИХА с нанесенным 1 мкл конъюгата БСА-хлорамфеникол помещали в пробирку после быстрой обработки ультразвуком. Все полоски сушили не менее 24 часов перед сканированием с помощью сканера Perfection V800 Photo (Epson, Suwa, Japan). Для проведения эксперимента с высушенными наночастицами растворы наночастиц сушили на воздухе и ресуспендировали с использованием воды MilliQ того же объема, что и исходный.
Наблюдали снижение яркости тест-линии при повышении концентрации хлорамфеникола в образце как результат конкурентного анализа. Затем вычисляли концентрацию хлорамфеникола в образце с неизвестной концентрацией на основе калибровочной кривой (по известным образцам).
Пример 15. Проведение ИХА теста с использованием конъюгатов НЧЗ для детекции флуоресцеина в образце.
В образец (молоко, кровь, сыворотка, плазма крови мыши) добавляли антибиотик хлорамфеникол, чтобы итоговая концентрация была в диапазоне 1 нг/мл до 1 мг/мл. 2 мкл наночастиц НЧЗ@1’@антитела на флуоресцеин (0,5 г/л) в PBS смешивали с 5 мкл образца (или разбавленного миграционным буфером образца) с 19 мкл миграционного буфера - 1% раствора БСА в PBS. Смесь помещали в пробирку на 0,6 мл, инкубировали в течение нескольких минут при комнатной температуре. Полоску для ИХА с нанесенным 1 мкл конъюгата БСА-флуоресцеин изотиоцианат помещали в пробирку после быстрой обработки ультразвуком. Все полоски сушили не менее 24 часов перед сканированием с помощью сканера Perfection V800 Photo (Epson, Suwa, Japan). Для проведения эксперимента с высушенными наночастицами растворы наночастиц сушили на воздухе и ресуспендировали с использованием воды MilliQ того же объема, что и исходный.
Наблюдали снижение яркости тест-линии при повышении концентрации флуоресцеина в образце как результат конкурентного анализа. Затем вычисляли концентрацию хлорамфеникола в образце с неизвестной концентрацией на основе калибровочной кривой (по известным образцам).
Пример 16. Проведение ИХА теста с использованием конъюгатов НЧЗ@1’@антитело против тропонина для детекции тропонина белка в образце.
В образец крови мыши или человека добавляли тропонин, чтобы итоговая концентрация была в диапазоне 0.1 нг/мл - 1 мг/мл. 2 мкл наночастиц НЧЗ@1’@антитела против тропонина (0,5 г/л) в PBS смешивали с 5 мкл образца и 19 мкл миграционного буфера - 1% раствора БСА в PBS с 0.01% Tween 20, 0.05% Trinton X-100. Смесь помещали в пробирку на 0,6 мл, инкубировали в течение нескольких минут при комнатной температуре. Полоску для ИХА с нанесенными 1 мкл антител против тропонина (1 г/л) помещали в пробирку после быстрой обработки ультразвуком. Все полоски сушили не менее 24 часов перед сканированием с помощью сканера Perfection V800 Photo (Epson, Suwa, Japan). Для проведения эксперимента с высушенными наночастицами растворы наночастиц сушили на воздухе и ресуспендировали с использованием воды MilliQ того же объема, что и исходный.
Наблюдали повышение яркости тест-линии при повышении концентрации тропонина в образце как результат сэндвич-анализа. Затем вычисляли концентрацию тропонина в образце с неизвестной концентрацией на основе калибровочной кривой (по известным образцам).
Пример 17. Измерение биосовместимости НЧЗ@1’ с помощью MТТ-теста.
Клетки HEK293 были культивированы в питательной среде DMEM/F12 в течение 24 часов. Затем среду удалили и добавили раствор частиц в соответствующей концентрации и МТТ (5 мг/мл) (бромид 3-(4,5-диметилтиазол-2-ил)-2,5-дифенилтетразолия) в питательной среде DMEM/F12. Полученную систему инкубировали в течение 24 часов. Затем удалили среду и добавили ДМСО. Оптическую плотность полученного раствора измеряли при 550 нм на мультимодальном ридере CLARIOstar (BMG Labtech, Германия).
Выживаемость клеток, обработанных НЧЗ@1’, сопоставима с контрольным образцом, то есть частицы не проявляют острой цитотоксичности in vitro.
Пример 18. Специфическая доставка конъюгатов НЧЗ в клетки.
Конъюгат НЧЗ@1’@Трастозумаб икубировали с клеточными линиями SK-BR-3 (суперэкспрессия HER2/neu, 0,25 миллионов клеток) и CHO (HER2/neu-отрицательная, 0,25 миллионов клеток) 25 мкл 1% BSA в PBS при различных концентрациях в течение 15 мин. и промывали 1% BSA в PBS. Затем клетки немедленно обрабатывали с помощью проточного цитометра ImageStream X Mark II (Luminex Corporation, США) с использованием 40-кратного объектива и лазера 785 нм для измерения бокового рассеяния (0,25 мВт). Сфокусированные популяции одиночных клеток регистрировались во время сбора данных в программе Amnis INSPIRE по среднеквадратичному градиенту светлого поля (35-100) и площади светлого поля (200-900) по отношению к соотношению сторон (0,75-1,00). Для каждого образца было собрано 3000 стробированных событий.
Результаты показали, что частицы специфически связываются с раковыми клетками SK-BR-3, в то время как связывание с клетками CHO практически не наблюдается. Более того, для клеток SK-BR-3 чем выше концентрация частиц, тем выше эффективность связывания.
Пример 19. Использование НЧЗ в радиотерапии.
Конъюгат Au@1’@Трастозумаб инкубировали с клеточными линиями SK-BR-3 (суперэкспрессия HER2/neu, 0,25 миллионов клеток) 25 мкл 1% BSA в PBS при различных концентрациях конъюгата в течение 15 мин и промывали 1% BSA в PBS. Далее клетки с доставленными НЧЗ облучали рентгеновским излучением и наблюдали сокращение количества опухолевых клеток SK-BR-3 в образце как минимум на 20% в сравнении с контрольными образцами.
Пример 20. Применение НЧЗ@1’ в КТ in vitro.
НЧЗ@1’ или конюгаты НЧЗ@1’ инкубировали с клеточными линиями SK-BR-3 (суперэкспрессия HER2/neu, 0,25 миллионов клеток) 25 мкл 1% BSA в PBS при различных концентрациях НЧЗ@1’ или конюгата НЧЗ@1’ в течение 15 мин и промывали 1% BSA в PBS. Полученные образцы клеток с частицами помещали в микротомограф MARS-CT (MARS Bioimaging Ltd., США) и наблюдали появление контраста в сравнении с контрольными образцами. Сканирование проводилось при напряжении на рентгеновской трубке (SB-120-350) от 60 до 120 кВ. Изображения реконструировались из полученных срезов (размер вокселя 30 мкм) с полем зрения 100 мм (Field of View, FoV).
Пример 21. Применение НЧЗ@1’ в КТ in vivo.
НЧЗ@1’ вводили мышам подкожно в дозах 0,17, 0,85 и 4,26 мг/кг. Через 30 минут, 7 часов и 24 часа после инъекции мыши были гуманно умерщвлены и помещены в микротомограф MARS-CT, наблюдали появление контраста в местах введения НЧЗ@1’ в сравнении с контрольными образцами. Сканирование проводилось при напряжении на рентгеновской трубке (SB-120-350) от 60 до 120 кВ. Изображения реконструировались из полученных срезов (размер вокселя 30 мкм) с полем зрения 100 мм (Field of View, FoV).
Пример 22. Применение НЧЗ в флуоресцентном биоимиджинге in vivo.
НЧЗ, конъюгированные с БСА-Су7 или БСА-Су5, вводили мышам внутривенно в дозах 50-1000 мкг на мышь. Через 30 минут, 7 часов и 24 часа после инъекции распределение наночастиц в мыши было визуализировано в оптическом томографе Abisense LumoTrace FLUO. Затем биовизуализация была проведена в экстрагированных органах ex vivo. Локализация флуоресцентного сигнала наблюдалась преимущественно в печени, селезенке и легких.
Пример 23. Применение НЧЗ для доставки в опухоль.
НЧЗ, конъюгированные с БСА-Су7, вводили мышам с привитыми опухолями CT26 внутривенно в дозах 50-1000 мкг на мышь. Через 30 минут, 7 часов и 24 часа после инъекции регистрировали накопление частиц в опухоли с помощью оптического томографа Abisense LumoTrace FLUO.
Пример 24. Применение НЧЗ@1’ в гипертермии клеток.
Агенты на основе НЧЗ, конъюгированные с Трастузумабом, инкубировали с клетками SK-BR-3 или СНО (как описано в Примерах 16-17). Затем отмывали не связавшиеся частицы и облучали клетки светом на длине волны 530 нм или 810 нм, 1-2 Вт/см^2. Затем через 12-24 часа клетки изучали с помощью проточной цитометрии с окрашиванием пропидий йодидом/ФИТЦ-аннексином V. Тест показал, что процент мертвых клеток и клеток в апоптозе (суммарно) SK-BR-3 в присутствии наночастиц был не менее чем в 4 раза выше, чем для СНО клеток.
Все публикации, патенты и заявки на патенты включены в настоящий документ посредством ссылки. Хотя в вышеприведенном описании это изобретение было описано в отношении некоторых предпочтительных вариантов его осуществления, и многие детали были изложены в целях иллюстрации, для специалистов в данной области техники будет очевидно, что изобретение допускает дополнительные варианты осуществления и что некоторые детали, описанные в данном документе, могут значительно изменяться без отклонения от сущности изобретения.
Использование терминов в единственном числе в контексте описания изобретения должно толковаться как охватывающее как единственное, так и множественное число, если иное не указано в данном документе или явно не противоречит контексту. Термины «состоящий из», «имеющий», «включающий» и «содержащий» следует толковать как неограничивающие термины, т.е. означающие «включая, но не ограничиваясь», если не указано иное. Перечисление диапазонов значений в данном документе просто предназначено для использования в качестве сокращенного способа индивидуальной ссылки на каждое отдельное значение, попадающее в этот диапазон, если здесь не указано иное, и каждое отдельное значение включено в спецификацию, как если бы оно было отдельно изложено в данном документе. Все способы, описанные в данном документе, могут выполняться в любом подходящем порядке, если иное не указано в данном документе или иным образом явно не противоречит контексту. Использование любых и всех примеров или иллюстративного языка (например, «такой как»), представленных в данном документе, предназначено просто для лучшего описания изобретения и не налагает ограничения на объем изобретения, если иное не заявлено. Никакие формулировки в описании не следует истолковывать как указывающие на какой-либо не заявленный элемент как существенный для практического применения изобретения.
Здесь описаны варианты осуществления этого изобретения, включая лучший из известных изобретателям способа осуществления изобретения. Разновидности этих вариантов осуществления могут стать очевидными для специалистов в данной области техники после прочтения предшествующего описания. Авторы ожидают, что квалифицированные специалисты будут использовать такие варианты в зависимости от обстоятельств, и авторы предполагают, что изобретение будет реализовано на практике иначе, чем конкретно описано в данном документе. Соответственно, это изобретение включает в себя все модификации и эквиваленты признаков, изложенных в прилагаемой формуле изобретения, как это разрешено действующим законодательством. Более того, любая комбинация вышеописанных признаков во всех их возможных вариациях охватывается изобретением, если иное не указано в данном документе или иным образом явно не противоречит контексту.
| название | год | авторы | номер документа |
|---|---|---|---|
| Наночастица состава золото-магнетит, способ получения наночастицы (варианты), конъюгат на ее основе (варианты), способ получения конъюгата и тест-набор | 2023 |
|
RU2814660C1 |
| Конъюгат наночастицы состава золото-магнетит с функциональной молекулой (варианты) и способ применения (варианты) | 2023 |
|
RU2811020C1 |
| Способ получения 5-арил-4-тиоксо-3,4,5,6-тетрагидро-2H-пиридо[3,2-e][1,3]тиазин-7(8H)-онов | 2024 |
|
RU2831154C1 |
| Способ получения 4-гетарил-3,6-диоксо-2,3,4,5,6,7-гексагидроизотиазоло[5,4-b]пиридин-5-карбонитрилов | 2023 |
|
RU2812610C1 |
| СОЕДИНЕНИЯ, СОДЕРЖАЩИЕ РАСЩЕПЛЯЕМЫЙ ЛИНКЕР, И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2018 |
|
RU2795168C2 |
| ЗАМЕЩЁННЫЕ ИЗОКСАЗОЛЫ, ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ НА ИХ ОСНОВЕ, ОБЛАДАЮЩИЕ ПРОТИВОВИРУСНОЙ АКТИВНОСТЬЮ, И СПОСОБ ИХ ПРИМЕНЕНИЯ | 2018 |
|
RU2733945C2 |
| ОПОСРЕДОВАННАЯ НАНОЧАСТИЦАМИ ДОСТАВКА СИКВЕНС-СПЕЦИФИЧНЫХ НУКЛЕАЗ | 2017 |
|
RU2664865C2 |
| ОПОСРЕДОВАННАЯ НАНОЧАСТИЦАМИ ДОСТАВКА СИКВЕНС-СПЕЦИФИЧНЫХ НУКЛЕАЗ | 2010 |
|
RU2612156C2 |
| ОПОСРЕДОВАННАЯ НАНОЧАСТИЦАМИ ДОСТАВКА СИКВЕНС-СПЕЦИФИЧНЫХ НУКЛЕАЗ | 2010 |
|
RU2556376C2 |
| 1H-ПИРРОЛО[3,4-b]ХИНОЛИН-3,9(2H,4H)-ДИОНЫ, ОБЛАДАЮЩИЕ ПРОТИВОТУБЕРКУЛЕЗНОЙ АКТИВНОСТЬЮ, И СПОСОБ ИХ ПОЛУЧЕНИЯ | 2009 |
|
RU2457208C2 |






Изобретение относится к области наноматериалов, а именно к соединению общей формулы II, где R1 и R2 независимо выбраны из группы, включающей COOR5; R3 и R4 независимо выбраны из группы, включающей H; C1-С6 алкил, необязательно замещенный одним или несколькими заместителями, выбранными из группы, состоящей из C1-С6 алкила, C3-С7 циклоалкила, C1-С6 алкилокси и галогена; арил, необязательно замещенный одним или несколькими заместителями, выбранными из группы, состоящей из C1-С6 алкила, C3-С7 циклоалкила, C1-С6 алкилокси и галогена; R5 выбирают из группы, включающей H; C1-С6 алкил; C3-С7 циклоалкил; C1-С6 алкилокси и галоген; X– представляет собой анион, выбранный из группы, включающей галогенид, нитрат, тозилат, трифлат, ацетат, гексахлорфосфат, тетрафторборат и гексахлороплатинат; n принимает значение от 3 до 12. Также предложены наночастица золота, полученная взаимодействием соединения формулы III и основания в полярном протонном растворителе при нагревании от 50 до 100°С от 2 до 8 часов, конъюгат с биомолекулами, образованный данной наночастицей, и применение наночастиц и конъюгатов в биологии и медицине, в частности, в качестве средств доставки лекарств, контрастных веществ и маркеров для иммунохимических тестов. Технический результат заключается в повышении устойчивости водорастворимых наночастиц золота к внешним физическим и химическим воздействиям, облегчении хранения и транспортировки наночастиц золота, обеспечении возможности применения наночастиц золота в молекулярных экспресс-тест системах без дополнительных ПАВ и стабилизаторов, а также в сокращении стадийности синтеза наночастиц золота. 7 н. и 11 з.п. ф-лы, 18 ил., 24 пр.

1. Соединение общей формулы II
 II,
II,
где R1 и R2 независимо выбраны из группы, включающей COOR5;
R3 и R4 независимо выбраны из группы, включающей H; C1-С6 алкил, необязательно замещенный одним или несколькими заместителями, выбранными из группы, состоящей из C1-С6 алкила, C3-С7 циклоалкила, C1-С6 алкилокси и галогена; арил, необязательно замещенный одним или несколькими заместителями, выбранными из группы, состоящей из C1-С6 алкила, C3-С7 циклоалкила, C1-С6 алкилокси и галогена;
R5 выбирают из группы, включающей H; C1-С6 алкил; C3-С7 циклоалкил; C1-С6 алкилокси и галоген;
X– представляет собой анион, выбранный из группы, включающей галогенид, нитрат, тозилат, трифлат, ацетат, гексахлорфосфат, тетрафторборат и гексахлороплатинат;
n принимает значение от 3 до 12.
2. Наночастица золота для биологических и медицинских применений, полученная
взаимодействием соединения формулы III
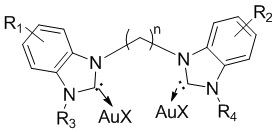 III,
III,
где R1, R2, R3, R4, Х, n такие, как определены в п.1,
и основания в полярном протонном растворителе при нагревании от 50 до 100°С от 2 до 8 часов.
3. Наночастица по п.2, характеризующаяся тем, что ее размеры составляют от примерно 5 до примерно 200 нм.
4. Наночастица по п.3, характеризующаяся тем, что ее средний размер составляет от 7 до 9 нм.
5. Наночастица по п.3, характеризующаяся тем, что ее средний размер составляет от 15 до 18 нм.
6. Способ получения наночастицы золота по п.2, включающий взаимодействие соединения формулы III
 III
III
и основания в полярном протонном растворителе при нагревании от 50 до 100°С от 2 до 8 часов.
7. Способ по п.6, в котором основание выбирают из группы, включающей гидроксид, карбонат и гидрокарбонат калия, натрия, лития или цезия.
8. Способ по п.7, в котором в качестве основания используют гидроксид калия.
9. Способ по п.6, в котором растворитель выбирают из группы, включающей воду, этанол, метанол, изопропанол и их смеси.
10. Способ по п.9, в котором в качестве растворителя используют водно-этанольную смесь.
11. Способ по п.6, в котором нагревание осуществляют при температуре от 78 до 100°С.
12. Конъюгат, образованный наночастицей золота по п.2 и по меньшей мере одной функциональной молекулой, при этом указанная наночастица может быть связана с функциональной молекулой непосредственно или с помощью линкера, имеющего общую формулу СONH(CH2)mY, где Y представляет собой COOH, NH2, SH, CONH2, OH, CHO, CO-ПЭГ-OH или CO-ПЭИ-NH2, а m принимает значение от 3 до 12.
13. Конъюгат по п.12, в котором функциональная молекула представляет собой антитело.
14. Конъюгат по п.12, в котором антитело представляет собой любое из следующих: Абциксимаб, Адалимумаб, Адуканумаб, Алемтузумаб, Алирокумаб, Амивантамаб, Ансувимаб, Бамланивимаб, Базиликсимаб, Казиривимаб, Катумаксомаб, Деносумаб, Натализумаб, Толицизумаб, Канакинумаб, Инфликсимаб, Сарилумаб, Секукинумаб, Ритуксимаб, Голимумаб, Трастузумаб или Устекинумаб.
15. Применение наночастицы по п.2 в анализе, выбранном из группы, содержащей спектрофотометрический анализ, электрохимический анализ, иммуноферментный анализ, иммунохроматографический анализ, анализ с помощью компьютерной томографии, для детекции целевых молекул.
16. Способ детекции целевой молекулы, выбранной из группы, содержащей малые молекулы, белки, антитела, углеводы, липиды, ДНК и РНК, включающий применение наночастицы по п.2.
17. Способ детекции целевой молекулы, выбранной из группы, содержащей малые молекулы, белки, антитела, углеводы, липиды, ДНК и РНК, включающий применение конъюгата по п.12.
18. Способ адресной доставки в клетки животного или человека терапевтических препаратов с помощью конъюгата по п.12, образованного наночастицей золота и функциональной молекулой, представляющей собой нацеливающий рецептор, выбранный из группы, включающей малые молекулы, белки, антитела, углеводы, липиды, ДНК и РНК.
| MAN R.W.Y | |||
| et al | |||
| Ultra Stable Gold Nanoparticles Modified by Bidentate N-Heterocyclic Carbene Ligands, Journal of the American Chemical Society, 2018, v | |||
| Способ закалки пил | 1915 |
|
SU140A1 |
| Кипятильник для воды | 1921 |
|
SU5A1 |
| Цоколь для электрической лампы с нарезкой Эдисона, препятствующей вывинчиванию лампы | 1924 |
|
SU1576A1 |
| MAYALL R.M | |||
| et al | |||
| Ultrasensitive and Label-Free Detection of the Measles Virus Using an N-Heterocyclic Carbene-Based Electrochemical Biosensor, ACS Sens., 2020, v | |||
| Кипятильник для воды | 1921 |
|
SU5A1 |
Авторы
Даты
2023-03-22—Публикация
2021-12-23—Подача