Изобретение относится к области биотехнологии, в частности к культивированию клеток растения мачка желтого и может быть использовано в фармацевтической и косметической промышленности для получения ценных биологически активных соединений.
Растение мачек желтый (глауциум желтый), (Glaucium flavum Grantz.) - относится к семейству Маковые (Papaveraceae). Является двулетним растением, которое может вырастать до 1 метра. Корень оранжево-коричневый, стержневого типа. Одиночные, верхушечные желтые цветки достигают в диаметре до 5 сантиметров. Розетку составляют крупные сизые, густо опушенные, перисторассеченные листья. Плодом является стручковидная линейная коробочка длиной 15-25 см. Семена почковидные, коричневые или почти черного цвета. Все части растения содержат млечный сок. Местами произрастания являются дренированные песчаные почвы, галечники, реже скалистые и щебнистые склоны. Мачек желтый произрастает в европейской части СНГ вдоль побережья Черного моря - в Крыму, на Кавказе. Растение занесено в Красную книгу СССР и России. Культивируется в Краснодарском крае, Крыму, Молдове, на юге Украины и в Южном Казахстане. Заготовки сырья мачка желтого в природных зарослях экономически нецелесообразно, так как встречается рассеяно. Как сырье используется трава культивируемого мачка желтого первого и второго года жизни, собранная в период стеблевания, бутонизации, начала цветения.
Надземная часть растения содержит алкалоиды изохинолинового ряда (до 3-4%), среди которых наибольший интерес представляет глауцин (около 1,8-2%), обладающий противокашлевым и бронхолитическим действием и, в отличие от кодеина, не обладает наркотическим действием, не оказывает угнетающего действия на дыхательный центр, не оказывает тормозящего влияния на моторику кишечника, не вызывает привыкания, пристрастия, как это выражено у кодеина.
Помимо противокашлевого эффекта, глауцин обладает противовоспалительным, анальгетическим, гипотензивным, спазмолитическим, адренолитическим эффектом. У него широкий диапазон применения в медицине: при инфекционно-воспалительных заболеваниях верхних отделов дыхательных путей, бронхов и легких, плеврите, коклюше, бронхиальной астме, туберкулезе, раке легких. Все эти свойства подтверждены экспериментальными и клиническими данными в научных работах специалистов, занимающихся исследованием глауцина. Было также показано, что глауцин обладает бронходилатирующей активностью. Он действует как антагонист кальциевых каналов в бронхах и ингибитор фосфодиэстеразы в гранулоцитах [Scholar, Eric Glaucine / Eric Scholar // The Comprehensive Pharmacology Reference. - 2007. - №3. - C. 1-4.].
Известен способ получения каллусной культуры мачка желтого [Получение каллусных культур Glaucium flavum Crantz (Papaveraceae) / E.A. Гумерова, A.B. Плотникова, K.P. Шкильменская, Р.Г. Тухбатуллина, Н.И. Румянцева // Биотехнология и общество в XXI ВЕКЕ. -2015. - №1. - С. 26-31], включающий стерилизацию семян спиртом и белизной, отличающиеся комбинациями, но время экспозиции в белизне составляет во всех вариантах 15 минут.Получение каллусной культуры осуществляли из семян сразу после стерилизации и из части полученных растений, выращенных в возрасте двух недель и одного месяца в условиях in vitro. Для получения каллуса использовали различные варианты гормональных агаризованных сред Гамборга и Мурасиге Скуга с различным содержанием гидролизата казеина (ГК) в количестве 1,2 г/л. Отличительной особенностью всех эксплантов из семян было образование только гетерогенного каллуса с проэмбриональным клеточным комплексом (ПЭКК). При получении каллуса из настоящих листьев первичный каллус формировался лучше на вторых листьях.
Недостатком примененного способа получения каллусной культуры является стерилизация семян с использованием агрессивных соединений (спиртом и белизной), требующих защиты дыхательных путей персонала при выполнении экспериментальных работ из-за раздражающего действия белизны и опьяняющего действия этанола на организм человека. Для индукции каллуса предпочтительной средой оказалась среда Гамборга(RX)ГК1 - это среда с добавлением гидролизата казеина. Недостатком является то, что ГК - это соединение дорогостоящее.
Индукция соматического эмбриогенеза в Glaucium flavum Grantz описана в научной литературе (Iva Doycheva, Somatic embryogenesis induction in Glaucium flavum Grantz (Papaveraceae)/ Iva Doycheva, Elina Yankova-Tsvetkova, Marina Stanilova // Comptes rendus de l'Acad'emie bulgare des Sciences, Tome 70, №4, 2017.). Для достижения стерильности семян их подвергали поверхностной стерилизации замачиванием в 70% - ном этаноле в течение 1-2 мин, затем 10 мин в разбавленном коммерческом отбеливателе (хлор <2,5%), а затем 3 раза промывали стерильным раствором дистиллированной воды. Проростки получали на базальной среде В5, содержащая двойное количество макросолей, которую дополняли 20 г/л сахарозы и отверждали 6,5 г/л растительного агара. Также получение каллуса осуществляли с использованием среды Мурасиге Скуга (MS) с добавлением регуляторов роста растений-ауксинов и цитокинов в различных комбинациях и добавляли активированный уголь. Использовали температуру 10±2° и 23±2°.
Недостатком данного способа также является то, что используются агрессивные компоненты, обладающие раздражающим действием на организм человека, в частности, коммерческого отбеливателя с содержанием хлора <2,5%. В зависимости от применения экзогенных химических соединений зависела индукция соматического эмбриогенеза в большей степени, чем рост растений и каллусных культур in vitro. Непрямой соматический эмбриогенез был достигнут на среде MS с добавлением 1,0 мг/л 2,4 Д (2,4-Дихлорфеноксиуксусная кислота), 0,5 мг/л ТДЗ (Тидиазурон) и 0,2 мг/л БАП (бензил аминопурин).
В другой научной статье описан способ стерилизации семян мачка желтого, состоящий из следующих операций: выдерживание семян в 70%-ном этиловом спирте в течение 1 минуты, а затем встряхивание в 50%-ном коммерческом растворе гипохлорита и 2 каплями раствора Твина-20 в течение 20 мин с последующей промывкой семян стерильной дистиллированной водой [М.Е. Mohamed, Plant germination and production of callus from the yellow hornpoppy (Glaucium flavum): the first stage of micropropagation / M.E. Mohamed, A.M. Arafa, S.S. Soliman, S.I. Eldahmy // Pharmazie 69. - 2014 - 715-720.]. Здесь также использованы для стерилизации семян агрессивные компоненты спирт и коммерческий раствор гипохлорита, обладающего раздражающим действием на дыхательные пути человека. В статье описывается способ получения каллуса из проросших семян при температуре 15°С с использованием 50 мг/л GA3 (гиббереллиновая кислота) для нарушения покоя семян. Наилучшими условиями для индукции каллуса было использование MS-среды (Мурасиге-Скуга) при 15°С и использование NAA (нафталинуксусной кислоты) и БАП (бензиламинопурин) (1:0,5 мг/л) или БАП (бензиламинопурин), 2,4-Д (2,4-дихлорфеноксиуксусная кислота) и ТДЗ (тидиазурон) (0,1:1:0,5 мг/л) и К (кинетина) в качестве комбинаций фитогормонов, с добавлением аскорбиновой кислоты (15 мг/л) для удаления потемнения каллусной культуры.
Известен способ получения глауцина гидрохлорида (варианты) (Патент RU №2259829, МПК А61К 31/4738, C07D 235/06, А61Р 11/14 - 10.09.2005, Бюл. №25), включающий экстракцию надземной части мачка желтого (Glaucium flavum Crantz) органическим растворителем, последующей фильтрации, подщелачивания водно-кислотного раствора, экстракции алкалоидов органическим растворителем, удаления органического растворителя в вакууме, обработки полученного основания глауцина хлористоводородной кислотой и очистки продукта.
Недостатком данного способа является то, что глауцин здесь добывается из лекарственного растительного сырья. В настоящее время мачок желтый не образует зарослей, занесен в Красную книгу и введен в культуру. Культивирование зависит от времени года, площадей, техники, ручного труда, что не позволяет получать сырье круглогодично, в отличие от биотехнологического способа, предлагаемого авторами.
Задачей настоящего изобретения является получение каллусной культуры клеток мачка желтого (Glaucium flavum Grantz) в условиях in vitro для дальнейшего использования в получении суспензионной культуры и выделения глауцина как сырья биологически активных веществ для дальнейшего производства лекарственных средств, содержащих глауцин, в фармацевтической и косметической промышленности.
Техническим результатом заявленного изобретения является получение каллусной культуры мачка желтого (Glaucium flavum Grantz).
Технический результат заявленного изобретения достигается за счет того, что для получения каллусной культуры мачка желтого (Glaucium flavum Grantz) в условиях in vitro, включающий стерилизацию семян мачка желтого, раствором антибактериального мыла при перемешивании магнитной мешалкой в течение 10-15 минут, трехкратное ополаскивание в стерильной дистиллированной воде, помещение стерильных семян на твердую питательную среду без гормонов следующего состава, в мг/л: вода - 1000 мл, агар-агар - 6500, появление у семян трещин на 4 день, на 7 день появление всходов, на 12-15 день появление зеленых ростков, далее, проростки культивировались на питательной среде следующего состава, мг/л: вода - 1000 мл, NH4NO3 - 825, KNO3 - 950, CaCl2 x 2H2O - 220, MgSO4 х 7H2O -185, KH2PO4 - 85, KI - 0,415, Н3ВО3 - 3,1, MnSO4 х 4H2O - 11,15, ZnSO4 х 7H2O - 4,3, Na2MoO4 х 2H2O - 0,125, CuSO4 х 5H2O - 0,0125, CoCl2 х 6H2O - 0,0125, FeSO4 х 7H2O - 13,9, Na-ЭДТА - 18,65, мезоинозит - 100, тиамин - 0,5, пиридоксин - 0,5, никотиновая кислота - 0,5, сахароза - 15000, агар - 6500, при температуре 24±1°С с фотопериодом 16/8 часов (свет/темнота), до третьего-пятого настоящих листьев в течение трех недель до получения листовых эксплантов, которые разрезались на мелкие кусочки и помещались в питательную среду следующего состава, мг/л.: вода - 1000 мл, NH4NO3 - 1650, KNO3 - 1900, CaCl2 х 2H2O - 440, MgSO4 х 7H2O - 370, KH2PO4 - 170, KI - 0,83, Н3ВО3 - 6,2, MnSO4 х 4H2O - 22,3, ZnSO4 х 7H2O - 8,6, Na2MoO4 х 2H2O - 0,25, CuSO4 х 5H2O - 0,025, CoCl2 х 6H2O - 0,025, FeSO4 х 7H2O - 27,8, Na-ЭДТА (трилон Б) - 37,3, мезоинозит - 100, тиамин - 0,5, пиридоксин - 0,5, никотиновая кислота - 0,5, сахароза - 30000, НУК - 1, БАП - 0,5, агар - 6500; культивирование каллусной культуры проводили в темноте, при температуре 24±1°С, влажности камеры 70±5%, цикл субкультивирования составляет 5 недель, начало формирования каллуса наблюдалось на 14-18 день с момента посадки экспланта, значительный рост каллуса наблюдался на 27 день с момента высадки листовых эксплантов на перечисленные гормональные питательные среды до истечения срока субкультивирования.
Совокупность существенных признаков обеспечивает решение заявленной технической задачи, а именно, получение каллусной культуры мачка желтого (Glaucium flavum Grantz) in vitro.
Детали, признаки, а также преимущества настоящего изобретения следуют из нижеследующего описания реализации заявленного технического решения с использованием чертежей, на которых показано:
Фиг. 1 - культивирование семян на питательной среде;
Фиг. 2 - культивирование семян на питательной среде с появлением зеленых проростков;
Фиг. 3 - каллусообразование на питательной среде;
Фиг. 4 - каллусообразование на питательной среде;
Фиг. 5 - каллусообразование на питательной среде.
Осуществление изобретения.
Предлагаемое решение получения каллусной культуры состоит в том, что за основу взяты стерильные свежие проростки, полученные культивированием в контролируемых условиях климатической камеры из семян интактного растения, выращенного в ботаническом саду КГМУ на территории Республики Татарстан в фенофазах «конец цветения, начало плодоношения».
При этом отобранные семена стерилизовали раствором антибактериального мыла (жидкое мыло «Защитное» с антибактериальным эффектом, изготовитель - ООО «Русская косметика») следующего состава: Вода, Лаурилсульфат натрия, Хлорид натрия, Кокамидопропилбетаин, Глицерет-2 Кокоат, Триклозан, Масло чайного дерева, Декспантенол, Глицерин, Динатриевая соль этилендиаминтетрауксусной кислоты, Лимонная кислота, Метилхлоризотиазолинон, Метилизотиазолинон, парфюм, Гексилкоричный альдегид, Краситель «Бриллиантовый синий» (Е113, CI42090) (раствор в соотношении 3:30, 4:30, 3:40 и 4:40 мл) с использованием магнитной мешалки при перемешивании при оборотах 300 об/мин с магнитным мешальником размером 3×10 мм в течении 10-15 минут, с последующей промывкой семян стерильной дистиллированной водой не менее 3-х раз и ополаскиванием семян стерильной дистиллированной водой с использованием магнитной мешалки в течение 5 минут.
Затем вначале стерильные семена помещали в твердую питательную среду без гормонов следующего состава для прорастания и формирования проростка растения, мг/л.: вода - 1000 мл, агар-агар - 6500.
Семена начали давать трещины на 4 день, на 7 день появились всходы (Фиг. 1). На 12-15 день появились зеленые ростки (Фиг. 2). Всходы появились у 80-83% всех посаженных семян.
Полученные проростки в дальнейшем культивировались на питательной среде следующего состава, мг/л: вода - 1000 мл, NH4NO3 - 825, KNO3 - 950, CaCl2 х 2H2O - 220, MgSO4 х 7H2O - 185, KH2PO4 - 85, KI - 0,415, H3BO3 - 3,1, MnSO4 x 4H2O - 11,15, ZnSO4 х 7H2O - 4,3, Na2MoO4 х 2H2O - 0,125, CuSO4 х 5H2O - 0,0125, CoCl2 х 6H2O - 0,0125, FeSO4 x 7H2O - 13,9, Na-ЭДТА (трилон Б) - 18,65, мезоинозит - 100, тиамин - 0,5, пиридоксин - 0,5, никотиновая кислота - 0,5, сахароза - 15000, агар - 6500.
Проростки культивировались при температуре 24±1°С с фотопериодом 16/8 часов (свет/темнота). Культивирование проростков проводилось до третьего-пятого настоящих листьев в течение трех недель.
Из полученных проростков получали листовые экспланты, которые разрезались на мелкие кусочки и помещались в питательную среду с добавлением альфа-нафтилуксусной кислоты (НУК), 6-бензиламинопурина (БАП).
На среде с содержанием фитогормонов с содержанием 1,0 мг/л НУК и 0,5 мг/л БАП наблюдалось наиболее интенсивное каллусообразование: вода - 1000 мл, NH4NO3 - 1650, KNO3 - 1900, CaCl2 х 2H2O - 440, MgSO4 х 7H2O - 370, KH2PO4 - 170, KI - 0,83, H3BO3 - 6,2, MnSO4 х 4H2O - 22,3, ZnSO4 х 7H2O - 8,6, Na2MoО4 х 2H2O - 0,25, CuSO4 х 5H2O - 0,025, CoCl2 х 6H2O - 0,025, FeSO4 х 7H2O - 27,8, Na-ЭДТА (трилон Б) - 37,3, мезоинозит - 100, тиамин - 0,5, пиридоксин - 0,5, никотиновая кислота - 0,5, сахароза - 30000, НУК - 1, БАП - 0,5, агар - 6500.
Формирование каллуса было заметным на 14-18 день с момента посадки экспланта - разрезанного растения. Значительный рост каллуса был заметным на 27 день с момента высадки листовых эксплантов на перечисленные гормональные питательные среды до истечения срока субкультивирования (5 недель) (Фиг. 3).
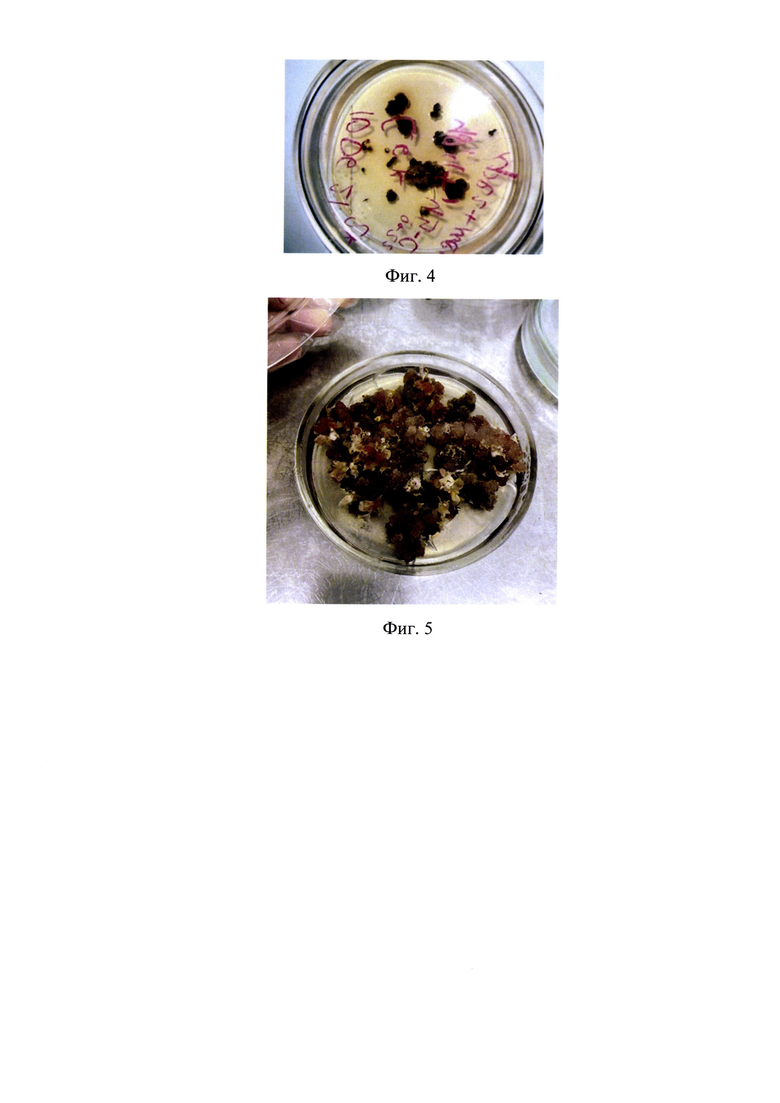
Листовые экспланты в количестве 33 единиц помещались на 3 чашки Петри с данной средой. Каллус был индуцирован у 21 экспланта, что составляет 63,6% (Фиг. 4). В дальнейшем образовавшийся каллус 5 раз подвергался последовательному субкультивированию путем разрезания на мелкие части в количестве 21 единиц. В результате из 21 эксплантов, пересаженных на среду этого же состава, был получен 21 каллус, что составляет 100%. В процессе субкультивирования в течение 5 недель появились экземпляры каллуса (Фиг. 5). Таким образом, эксперименты показали, что более качественный каллус образовывался в процессе многократного субкультивирования и имел тенденцию к увеличению своей массы.
Культивирование каллуса проводили в темноте, при 24±1°С, влажности климатостата 70±5%, на чашках Петри с диаметром 90 мм, цикл субкультивирования составляет 5 недель. Полученный вначале каллус характеризовался следующими признаками. Культуральные признаки: каллусные культуры плотные, оформленные, имеют темную, коричнево-серую окраску. После субкультивирования каллусы имели разнообразную окраску и рыхлую структуру (Фиг. 5).
Таким образом, предложен способ получения каллусных культур мачка желтого (Glaucium flavum Grantz) из листовых эксплантов - проростков, полученных in vitro в климатостате.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ получения стерильных проростков семян мачка желтого | 2021 |
|
RU2773121C1 |
| Способ получения каллусной культуры Hedysarum alpinum L. | 2022 |
|
RU2787746C1 |
| Способ получения каллусной культуры змееголовника дланевидного (Dracocephalum palmatum Steph.) в условиях in vitro | 2019 |
|
RU2718253C1 |
| Способ выращивания каллусных тканей Mertensia maritima (L.) S.F.Gray | 2024 |
|
RU2830878C1 |
| СПОСОБ ПОЛУЧЕНИЯ КАЛЛУСНОЙ КУЛЬТУРЫ БОЛИГОЛОВА ПЯТНИСТОГО (Conium maculatum L) | 2015 |
|
RU2590586C1 |
| Способ получения каллусной культуры борца бородатого (Aconitum barbatum Patr. ex Pers.) | 2016 |
|
RU2631927C1 |
| Способ получения микрорастений лекарственного растения Stephania glabra (Roxb.) Miers | 2021 |
|
RU2757318C1 |
| Способ культивирования каллусной культуры полыни обыкновенной (Artemisia vulgaris L.) | 2019 |
|
RU2718254C1 |
| СПОСОБ РАЗМНОЖЕНИЯ ГРЕЧИХИ IN VITRO | 2013 |
|
RU2538167C1 |
| СПОСОБ КУЛЬТИВИРОВАНИЯ IN VITRO КЛЕТОЧНОЙ КУЛЬТУРЫ ТРАНСГЕННОГО ТАБАКА NICOTIANA TABACUM L., СОДЕРЖАЩЕГО ГЕН ИНТЕРЛЕЙКИНА-18 ЧЕЛОВЕКА | 2007 |
|
RU2354692C2 |

Изобретение относится к области биотехнологии. Изобретение представляет собой способ получения каллусной культуры мачка желтого (Glaucium flavum Grantz) в условиях in vitro, включающий стерилизацию семян мачка желтого раствором антибактериального мыла при перемешивании магнитной мешалкой в течение 10-15 минут, трехкратное ополаскивание в стерильной дистиллированной воде, помещение стерильных семян на твердую питательную среду без гормонов следующего состава, в мг/л: вода - 1000 мл, агар-агар - 6500, далее проростки культивируют на питательной среде следующего состава, мг/л: вода - 1000 мл, NH4NO3 - 825, KNO3 - 950, CaCl2 х 2H2O - 220, MgSO4 х 7H2O -185, KH2PO4 - 85, KI - 0,415, H3BO3 - 3,1, MnSO4 х 4H2O - 11,15, ZnSO4 х 7H2O - 4,3, Na2MoO4 х 2H2O - 0,125, CuSO4 х 5H2O - 0,0125, CoCl2 х 6H2O - 0,0125, FeSO4 х 7H2O - 13,9, Na-ЭДТА - 18,65, мезоинозит - 100, тиамин - 0,5, пиридоксин - 0,5, никотиновая кислота - 0,5, сахароза - 15000, агар - 6500, при температуре 24±1°С с фотопериодом 16/8 часов (свет/темнота) до третьего-пятого настоящих листьев в течение трех недель до получения листовых эксплантов, которые разрезают на мелкие кусочки и помещают в питательную среду следующего состава, мг/л: вода - 1000 мл, NH4NO3 - 1650, KNO3 - 1900, CaCl2 х 2H2O - 440, MgSO4 х 7H2O - 370, KH2PO4 - 170, KI - 0,83, H3BO3 - 6,2, MnSO4 х 4H2O - 22,3, ZnSO4 х 7H2O - 8,6, Na2MoO4 х 2H2O - 0,25, CuSO4 х 5H2O - 0,025, CoCl2 х 6H2O - 0,025, FeSO4 х 7H2O - 27,8, Na-ЭДТА (трилон Б) - 37,3, мезоинозит - 100, тиамин - 0,5, пиридоксин - 0,5, никотиновая кислота - 0,5, сахароза - 30000, НУК - 1, БАП - 0,5, агар - 6500; культивирование каллусной культуры проводят в темноте, при температуре 24±1°С, влажности камеры 70±5%, цикл субкультивирования составляет 5 недель. Изобретение позволяет получить каллусную культуру мачка желтого (Glaucium flavum Grantz). Таким образом, разработан способ получения каллусных культур мачка желтого из эксплантов проростков, полученных с использованием климатостата. 5 ил.
Способ получения каллусной культуры мачка желтого (Glaucium flavum Grantz) в условиях in vitro, включающий стерилизацию семян мачка желтого раствором антибактериального мыла при перемешивании магнитной мешалкой в течение 10-15 минут, трехкратное ополаскивание в стерильной дистиллированной воде, помещение стерильных семян на твердую питательную среду без гормонов следующего состава, в мг/л: вода - 1000 мл, агар-агар - 6500, далее проростки культивируют на питательной среде следующего состава, мг/л: вода - 1000 мл, NH4NO3 - 825, KNO3 - 950, CaCl2 х 2H2O - 220, MgSO4 х 7H2O - 185, KH2PO4 - 85, KI - 0,415, H3BO3 - 3,1, MnSO4 х 4H2O - 11,15, ZnSO4 х 7H2O - 4,3, Na2MoO4 х 2H2O - 0,125, CuSO4 х 5H2O - 0,0125, CoCl2 х 6H2O - 0,0125, FeSO4 х 7H2O - 13,9, Na-ЭДТА - 18,65, мезоинозит - 100, тиамин - 0,5, пиридоксин - 0,5, никотиновая кислота - 0,5, сахароза - 15000, агар - 6500, при температуре 24±1°С с фотопериодом 16/8 часов (свет/темнота) до третьего-пятого настоящих листьев в течение трех недель до получения листовых эксплантов, которые разрезают на мелкие кусочки и помещают в питательную среду следующего состава, мг/л: вода - 1000 мл, NH4NO3 - 1650, KNO3 - 1900, CaCl2 х 2H2O - 440, MgSO4 х 7H2O - 370, KH2PO4 - 170, KI - 0,83, H3BO3 - 6,2, MnSO4 х 4H2O - 22,3, ZnSO4 х 7H2O - 8,6, Na2MoO4 х 2H2O - 0,25, CuSO4 х 5H2O - 0,025, CoCl2 х 6H2O - 0,025, FeSO4 х 7H2O - 27,8, Na-ЭДТА (трилон Б) - 37,3, мезоинозит - 100, тиамин - 0,5, пиридоксин - 0,5, никотиновая кислота - 0,5, сахароза - 30000, НУК - 1, БАП - 0,5, агар - 6500; культивирование каллусной культуры проводят в темноте, при температуре 24±1°С, влажности камеры 70±5%, цикл субкультивирования составляет 5 недель.
| ГУМЕРОВА Е.А., Получение каллусных культур Glaucium flavum Crantz (Papaveraceae), Биотехнология и общество в XXI ВЕКЕ, 2015, N 1., c | |||
| Прибор для получения стереоскопических впечатлений от двух изображений различного масштаба | 1917 |
|
SU26A1 |
| SCHOLAR ERIC, GlaucineThe Comprehensive Pharmacology Reference., 2007, N 3, c | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| IVA DOYCHEVA, et al., Somatic embryogenesis induction in Glaucium flavum Grantz (Papaveraceae), Comptes rendus de | |||
Авторы
Даты
2023-03-24—Публикация
2022-02-04—Подача