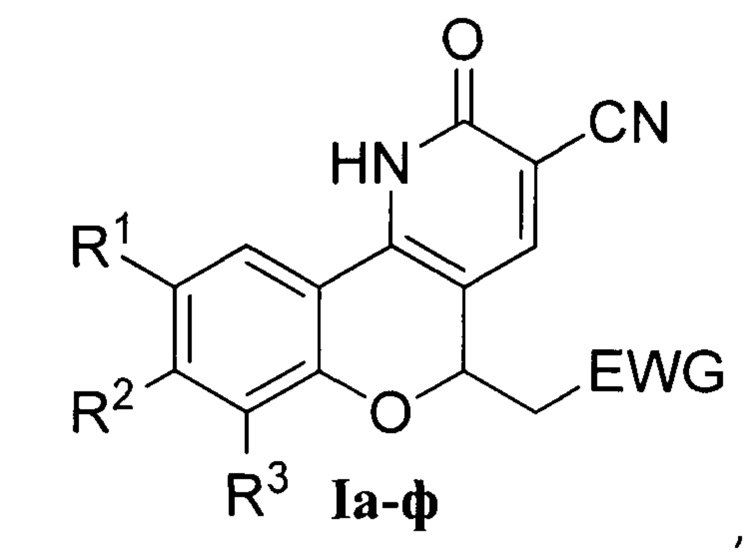
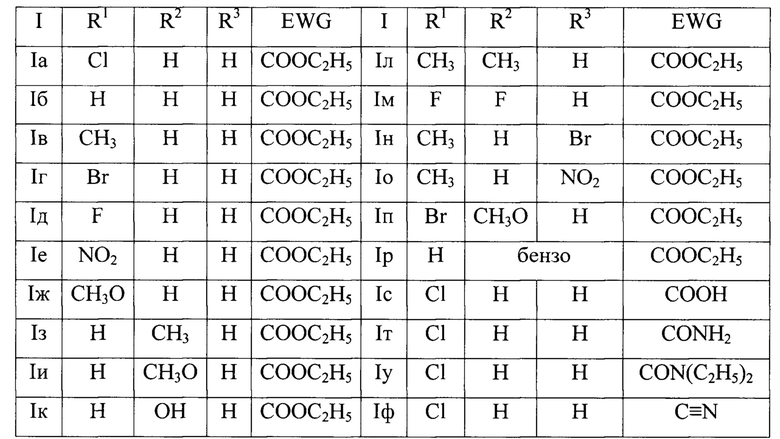
Группа изобретений относится к области органической химии и химии красителей, а именно к новым полициклическим гетероциклическим соединениям - производным 2-(хромено[4,3-b]пиридин-5-ил)уксусной кислоты Ia-ф, которые могут быть использованы в органическом синтезе и в биохимических исследованиях в качестве флуоресцентных красителей и зондов, а также способу их получения.
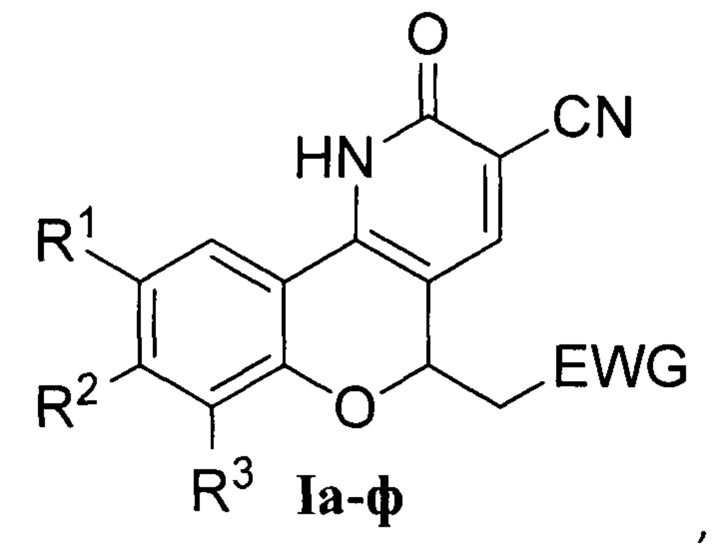 где:
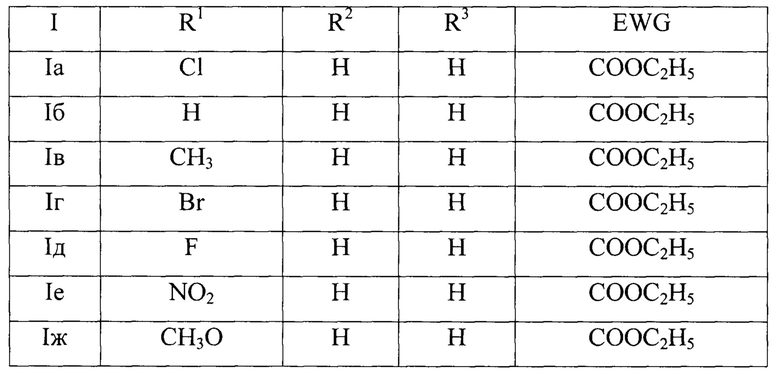
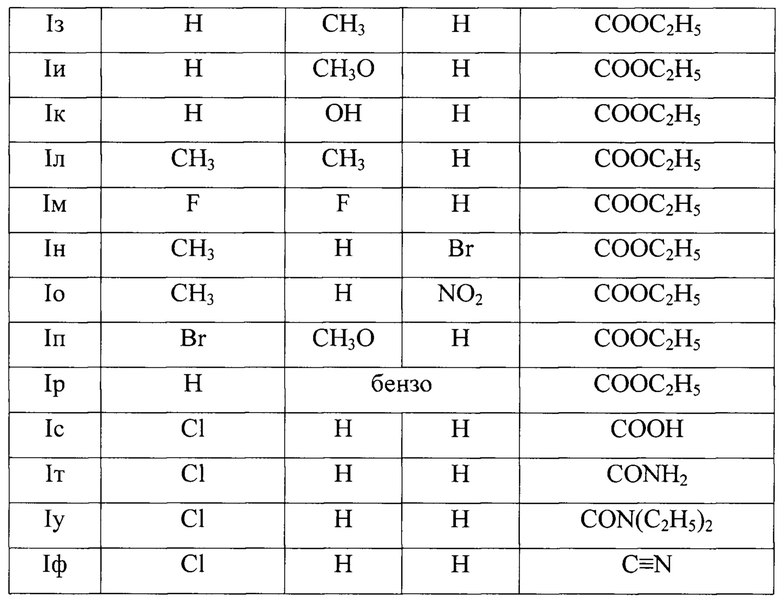
где:
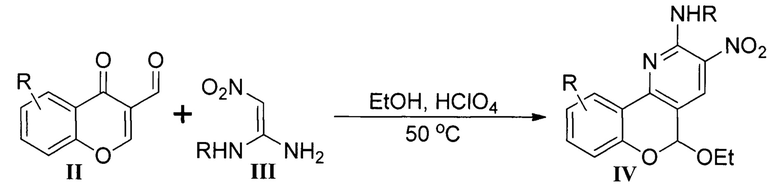
В научно-технической литературе представлено несколько способов синтеза хромено[4,3-b]пиридинов, преимущественно построенных на взаимодействии хромонов с 1,3-N,С-бинуклеофильными реагентами. Так, реакция 3-формилхромонов II с 2-нитроэтилен-1,1-диаминами III в этаноле при катализе хлорной кислотой приводит к образованию хромено[4,3-b]пиридинов IV с выходами 74-91% [Zhang, С.-Н. Three-component site-selective synthesis of highly substituted 5H-chromeno[4,3-b]pyridines / C.-H. Zhang, R. Huang, X.-M. Hu, J. Lin, S.-J. Yan // Journal of Organic Chemistry. - 2018. - Vol. 83. - P. 4981-4989].
Другим подходом, представленным единичным примером, является использование 3-(6-метил-4-оксо-4Н-хромен-3-ил)акрилонитрила V с цианацетамидом VI в спирте при катализе пиперидином [Ibrahim, М.А. Domino reactions between 3-(6-methylchromonyl)acrylonitrile and nucleophilic reagents / M.A. Ibrahim, N.M. El-Gohary // Tetrahedron. - 2018. - Vol. 74. - P. 512-518]. Выход хромено[4,3-b]пиридина VII составил 61%.
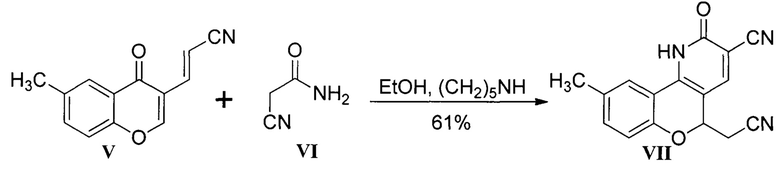
Недостатком существующего метода является невысокий выход продукта и отсутствие данных о применении его для широкого круга возможных субстратов.
Таким образом, задачей предполагаемой группы изобретений является создание ряда неописанных в литературе хромено[4,3-b]пиридинов формулы Iа-ф.
Техническими результатами, на решение которых направлена группа изобретений, являются получение ряда новых полифункциональных гетероциклических соединений (Ia-ф), обладающих флуоресцентными свойствами; простой и эффективный способ их получения из электронодефицитных 3-винилхромонов VIIIa-ф и 1,3-N,N-бинуклеофильного реагента - цианацетамида VI.
Согласно разработанному способу получения взаимодействие 3-винилхромонов VIIIa-ф и цианацетамида VI протекает в этаноле при температуре 80°С при катализе сильными ненуклеофильными основаниями - 1,8-диазабицикло[5.4.0]ундец-7-еном (DBU) или тетраметилгуанидином (TMG), применяемыми в количестве 1,5 эквивалента.
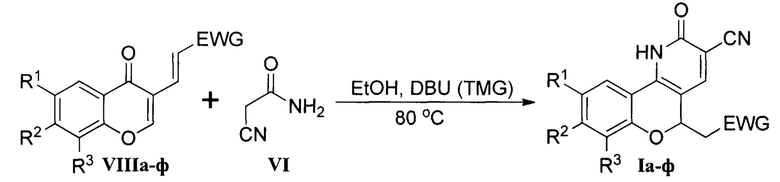
По завершении реакции выделение хромено[4,3-b]пиридинов Iа-ф выполняется путем закисления реакционной массы подходящей неорганической (серной, соляной) или органической (уксусной) кислотами. Выход продуктов Ia-ф составляет 8-88%, преимущественно 75-85%.
Высокий выход большей части целевых продуктов Ia-ф и, как следствие, эффективности синтеза связано с использованием сильных ненуклеофильных оснований (DBU или TMG). Последние в отличие от вторичных аминов несклонны к присоединению по кратной связи 3-винилхромонов VIIIa-ф и, как следствие, не приводят к побочным реакциям.
Разработанный способ получения хромено[4,3-b]пиридинов Iа-ф изучен и проверен в лабораторных условиях. Структура и чистота полученных продуктов установлены методами спектроскопии ЯМР 1Н, 13С и масс-спектрометрии высокого разрешения (HRMS-ESI). Изучение фотофизических свойств производных 2-(хромено[4,3-b]пиридин-5-ил)уксусной кислоты Ia-ф показало их способность к флуоресценции в сине-зеленой области спектра (455-500 нм).
Предлагаемая группа изобретений проиллюстрирована примерами практического осуществления.
Пример 1. Получение этил-2-(2-оксо-9-хлор-3-циан-2,5-дигидро-1H-хромено[4,3-b]пиридин-5-ил)ацетата (Iа).
Смесь этил-3-(6-хлор-4-оксо-4H-хромен-3-ил)акрилата VIIIa (556 мг, 2 ммоль), цианацетамида VI (252 мг, 3 ммоль) и DBU (456 мг, 3 ммоль) в 10 мл этанола перемешивают при 80°С в течение получаса. Затем реакционную массу подкисляют ледяной уксусной кислотой (0,5 мл), отфильтровывают выпавший осадок продукта, промывают этанолом и сушат на воздухе. Получают 605 мг (выход 88%) соединения Iа в виде желтоватого порошка с Тпл. 275-276°С. Спектр ЯМР 1Н (400 МГц, ДМСО-d6): δH (м.д.) 1.17 (t, J=7.0 Hz, 3Н, СН3СН2), 2.82 (dd, J=9.3, 15.6 Hz, 1H, H-2'a), 2.91 (dd, J=4.3, 15.6 Hz, 1H, H-2'b), 4.06-4.12 (m, 2H, CH3CH2), 5.67 (dd, J=4.3, 9.3 Hz, 1H, H-5), 6.98 (d, J=8.8 Hz, 1H, H-7), 7.47 (dd, J=2.5, 8.8 Hz, 1H, H-8), 8.15 (s, 1H, H-4), 8.16 (d, J=2.5 Hz, 1H, H-10), 12.80 (br. s, 1H, NH). Спектр ЯМР 13C (100 МГц, ДМСО-d6 - CD3CO2D, 9:1): δC (м.д.) 14.28 (CH2CH3), 40.22 (С-2'), 60.74 (СН2СН3), 72.92 (С-5), 100.60 (С-3), 112.82 (С-4а), 116.58 (CN), 118.11 (С-10а), 120.17 (С-7), 124.76 (С-10), 126.83 (С-9), 133.54 (С-8), 142.19 (С-10b), 145.23 (С-4), 153.37 (С-6а), 161.48 (С-2), 169.56 (С-1'). Масс-спектр HRMS-ESI: m/z [M+Na]+ вычислено для C17H13ClN2O4: 367.0456; найдено: 367.0447.
Пример 2. Получение этил-2-(2-оксо-3-циан-2,5-дигидро-1H-хромено[4,3-b]пиридин-5-ил)ацетата (Iб).
Смесь этил-3-(4-оксо-4H-хромен-3-ил)акрилата VIIIб (488 мг, 2 ммоль), цианацетамида VI (252 мг, 3 ммоль) и DBU (456 мг, 3 ммоль) в 10 мл этанола перемешивают при 80°С в течение получаса. Затем реакционную массу подкисляют концентрированной соляной кислотой (0,5 мл), отфильтровывают выпавший осадок продукта, промывают этанолом и сушат на воздухе. Получают 520 мг (выход 84%) соединения Iб в виде желтоватого порошка с Тпл. 251-253°С. Спектр ЯМР 1Н (400 МГц, CD3CO2D): δH (м.д.) 1.28 (t, J=7.0 Hz, 3Н, СН3СН2), 2.90 (dd, J=5.0, 15.6 Hz, 1H, H-2'a), 3.00 (dd, J=9.0, 15.6 Hz, 1H, H-2'b), 4.21-4.24 (m, 2H, CH3CH2, 5.75 (dd, J=5.0, 9.0 Hz, 1H, H-5), 7.06 (dd, J=0.9, 8.3 Hz, 1H, H-7), 7.23 (m, 1H, H-9), 7.54 (m, 1H, H-8), 8.00 (dd, J=1.4, 8.0 Hz, 1H, H-10), 8.06 (s, 1H, H-4). Спектр ЯМР 13C (100 МГц, CD3CO2D): δC (м.д.) 13.30, 39.06, 61.26, 72.27, 101.76, 112.41, 114.67, 114.80, 118.56, 122.93, 123.94, 134.64, 141.46, 146.20, 154.76, 162.96, 170.50. Масс-спектр HRMS-ESI: m/z [M+Na]+ вычислено для C17H14N2O4: 333.0846; найдено: 333.0839.
Пример 3. Получение этил-2-(9-метил-2-метил-3-циан-2,5-дигидро-1H-хромено[4,3-b]пиридин-5-ил)ацетата (Iв).
Смесь этил-3-(6-метил-4-оксо-4H-хромен-3-ил)акрилата VIIIв (516 мг, 2 ммоль), цианацетамида VI (252 мг, 3 ммоль) и DBU (456 мг, 3 ммоль) в 10 мл этанола перемешивают при 80°С в течение получаса. Затем реакционную массу подкисляют серной кислотой (0,5 мл), отфильтровывают выпавший осадок продукта, промывают этанолом и сушат на воздухе. Получают 545 мг (выход 83%) соединения Iв в виде желтоватого порошка с Тпл 295-296°С. Спектр ЯМР 1Н (400 МГц, ДМСО-d6 - CD3CO2D, 9:1): δH (м.д.) 1.17 (t, J=7.0 Hz, 3Н, СН3СН2), 2.28 (s, 3Н, СН3), 2.77 (dd, J=9.2, 15.4 Hz, 1Н, H-2'a), 2.85 (dd, J=4.4, 15.4 Hz, 1H, H-2'b), 4.05-4.11 (m, 2H, СН3СН2), 5.57 (dd, J=4.4, 9.2 Hz, 1H, H-5), 6.85 (d, J=8.3 Hz, 1H, H-7), 7.26 (dd, J=1.0, 8.3 Hz, 1H, H-8), 7.94 (d, J=1.0 Hz, 1H, H-10), 8.09 (s, 1H, H-4). Спектр ЯМР 13C (100 МГц, ДМСО-d6 - CD3CO2D, 9:1): δC (м.д.) 14.41, 20.02, 39.11, 60.69, 72.52, 100.02, 111.99, 115.89, 116.91, 118.17, 125.25, 131.93, 134.99, 143.10, 145.65, 152.57, 161.36, 169.68. Масс-спектр HRMS-ESI: m/z [M+Na]+ вычислено для C18H16N2O4: 347.1002; найдено: 347.0991.
Пример 4. Получение этил-2-(9-бром-2-оксо-3-циан-2,5-дигидро-1H-хромено[4,3-b]пиридин-5-ил)ацетата (Iг).
Смесь этил-3-(6-бром-4-оксо-4H-хромен-3-ил)акрилата VIIIг (646 мг, 2 ммоль), цианацетамида VI (252 мг, 3 ммоль) и TMG (345 мг, 3 ммоль) в 10 мл этанола перемешивают при 80°С в течение получаса. Затем реакционную массу подкисляют ледяной уксусной кислотой (0,5 мл), отфильтровывают выпавший осадок продукта, промывают этанолом и сушат на воздухе. Получают 665 мг (выход 86%) соединения Iг в виде желтоватого порошка с Тпл. 282-284°С. Спектр ЯМР 1Н (400 МГц, ДМСО-d6 - CD3CO2D, 9:1): δн (м.д.) 1.16 (t, J=7.1 Hz, 3Н, СН3СН2), 2.80 (dd, J=9.0, 15.6 Hz, 1H, H-2'a), 2.88 (dd, J=4.5, 15.6 Hz, 1H, H-2'b), 4.03-4.11 (m, 2H, CH3CH2), 5.65 (dd, J=4.5, 9.0 Hz, 1H, H-5), 6.88 (d, J=8.8 Hz, 1H, H-7), 7.55 (dd, J=2.1, 8.8 Hz, 1H, H-8), 8.09 (s, 1H, H-4), 8.28 (d, J=2.1 Hz, 1H, H-10). Спектр ЯМР 13C (100 МГц, ДМСО-d6 - CD3CO2D, 9:1): δC (м.д.) 14.35, 40.03, 60.76, 72.92, 100.34, 112.98, 114.37, 116.58, 118.70, 120.48, 127.64, 136.36, 142.30, 145.13, 153.82, 161.60, 169.56. Масс-спектр HRMS-ESI: m/z [M+Na]+ вычислено для C17H13BrN2O4: 410.9951; найдено: 410.9960.
Пример 5. Получение этил-2-(2-оксо-9-фтор-3-циан-2,5-дигидро-1H-хромено[4,3-b]пиридин-5-ил)ацетата (Iд).
Смесь этил-3-(6-фтор-4-оксо-4H-хромен-3-ил)акрилата VIIIд (524 мг, 2 ммоль), цианацетамида VI (252 мг, 3 ммоль) и TMG (345 мг, 3 ммоль) в 10 мл этанола перемешивают при 80°С в течение получаса. Затем реакционную массу подкисляют соляной кислотой (0,5 мл), отфильтровывают выпавший осадок продукта, промывают этанолом и сушат на воздухе. Получают 570 мг (выход 87%) соединения Iд в виде желтоватого порошка с Тпл. 227-230°С. Спектр ЯМР 1Н (400 МГц, ДМСО-d6 - CD3CO2D, 9:1): δH (м.д.) 1.08 (t, J=7.0 Hz, 3Н, СН3СН2), 2.70 (dd, J=5.1, 15.6 Hz, 1H, H-2'a), 2.75 (dd, J=8.5, 15.6 Hz, 1H, H-2'b), 3.96-4.04 (m, 2H, CH3CH2), 5.52 (dd, J=5.1, 8.5 Hz, 1H, H-5), 6.87 (dd, J=9.0 Hz, JHF=4.6 Hz, 1H, H-7), 7.12 (pseudotd, J=2.7, 8.5 Hz, JHF=8.5 Hz, 1H, H-8), 7.76 (dd, J=2.7 Hz, JHF=9.2 Hz, 1H, H-10), 7.90 (s, 1H, H-4). Спектр ЯМР 13C (100 МГц, ДМСО-d6 - CD3CO2D, 9:1): δC (м.д.) 13.79, 38.93, 60.68, 72.51, 101.39, 110.94 (d, 2JCF=23.8 Hz), 112.53, 116.01, 116.74 (d, 3JCF=8.8 Hz), 119.80 (d, 3JCf=8.1 Hz), 120.73 (d, 2JCF=24.0 Hz), 141.62, 145.34, 150.69, 157.53 (d, 1JCF=239.7 Hz), 161.59, 169.49. Масс-спектр HRMS-ESI: m/z [M+Na]+ вычислено для C17H13FN2O4: 351.0752; найдено: 351.0754.
Пример 6. Получение этил-2-(9-нитро-2-оксо-3-циан-2,5-дигидро-1H-хромено[4,3-b]пиридин-5-ил)ацетата (Iе).
Смесь этил-3-(6-нитро-4-оксо-4H-хромен-3-ил)акрилата VIIIe (578 мг, 2 ммоль), цианацетамида VI (252 мг, 3 ммоль) и TMG (345 мг, 3 ммоль) в 10 мл этанола перемешивают при 80°С в течение получаса. Затем реакционную массу подкисляют ледяной уксусной кислотой (0,5 мл), отфильтровывают выпавший осадок. Далее его 2 часа кипятят в 10 мл этанола, содержащего триэтиламин (303 мг, 3 ммоль). После этого раствор охлаждают и закисляют ледяной уксусной кислотой (0,5 мл). Выпавший осадок продукта отфильтровывают, промывают этанолом и сушат на воздухе. Получают 530 мг (выход 75%) соединения Iе в виде желтоватого порошка с Тпл. 230-232°С. Спектр ЯМР 1Н (400 МГц, ДМСО-d6 - CD3CO2D, 9:1): δH (м.д.) 1.16 (t, J=7.0 Hz, 3Н, СН3СН2), 2.89 (dd, J=8.8, 15.8 Hz, 1H, H-2'a), 2.97 (dd, J=4.1, 15.8 Hz, 1H, H-2'b), 4.05-4.11 (m, 2H, СН3СН2), 5.85 (dd, J=4.1, 8.8 Hz, 1H, H-5), 7.12 (d, J=9.0 Hz, 1H, H-7), 8.16 (s, 1H, H-4), 8.24 (dd, J=2.8, 9.0 Hz, 1H, H-8), 9.03 (d, J=2.8 Hz, 1H, H-10). Спектр ЯМР 13C (100 МГц, ДМСО-d6 - CD3CO2D, 9:1): δC (м.д.) 14.23, 40.09, 60.82, 74.03, 99.72, 114.32, 116.27, 117.87, 119.21, 121.47, 128.70, 142.63, 142.91, 144.37, 159.71, 162.26, 169.40. Масс-спектр HRMS-ESI: m/z [M+Na]+ вычислено для C17H13N3O6: 378.0697; найдено: 378.0705.
Пример 7. Получение этил-2-(9-метокси-2-оксо-3-циан-2,5-дигидро-1H-хромено[4,3-b]пиридин-5-ил)ацетата (Iж).
Смесь этил-3-(6-метокси-4-оксо-4H-хромен-3-ил)акрилата VIIIж (548 мг, 2 ммоль), цианацетамида VI (252 мг, 3 ммоль) и TMG (345 мг, 3 ммоль) в 10 мл этанола перемешивают при 80°С в течение получаса. Затем реакционную массу подкисляют серной кислотой (0,5 мл), отфильтровывают выпавший осадок продукта, промывают этанолом и сушат на воздухе. Получают 515 мг (выход 76%) соединения Iд в виде желтого порошка с Тпл. 294-296°С. Спектр ЯМР 1Н (400 МГц, ДМСО-d6 - CD3CO2D, 9:1): δн (м.д.) 1.16 (t, J=7.0 Hz, 3Н, СН3СН2), 2.76 (dd, J=8.8, 15.6 Hz, 1H, H-2'a), 2.83 (dd, J=4.6, 15.6 Hz, 1H, H-2'b), 3.77 (s, 3H, CH3O), 4.04-4.10 (m, 2H, CH3CH2), 5.53 (dd, J=4.6, 8.8 Hz, 1H, H-5), 6.86 (d, J=8.9 Hz, 1H, H-7), 7.00 (dd, J=2.9, 8.9 Hz, 1H, H-8), 7.65 (d, J=2.9 Hz, 1H, H-10), 8.06 (s, 1H, H-4). Спектр ЯМР 13C (100 МГц, ДМСО-d6 - CD3CO2D, 9:1): δC (м.д.) 14.37, 39.12, 56.06, 60.69, 72.46, 100.48, 108.19, 111.82, 116.26, 116.91, 119.44, 121.62, 142.84, 145.65, 148.54, 154.85, 161.36, 169.70. Масс-спектр HRMS-ESI: m/z [M+Na]+ вычислено для C18H16N2O5: 363.0951; найдено: 363.0943.
Пример 8. Получение этил-2-(8-метил-2-оксо-3-циан-2,5-дигидро-1H-хромено[4,3-b]пиридин-5-ил)ацетата (Iз).
Смесь этил-3-(7-метил-4-оксо-4H-хромен-3-ил)акрилата VIIIз (516 мг, 2 ммоль), цианацетамида VI (252 мг, 3 ммоль) и TMG (345 мг, 3 ммоль) в 10 мл этанола перемешивают при 80°С в течение получаса. Затем реакционную массу подкисляют ледяной уксусной кислотой (0,5 мл), отфильтровывают выпавший осадок продукта, промывают этанолом и сушат на воздухе. Получают 525 мг (выход 81%) соединения Iз в виде желтоватого порошка с Тпл. 290-292°С. Спектр ЯМР 1Н (400 МГц, ДМСО-d6 - CD3CO2D, 9:1): δH (м.д.) 1.14 (t, J=7.0 Hz, 3Н, СН3СН2), 2.27 (s, 3Н, СН3), 2.74 (dd, J=8.5, 15.6 Hz, 1Н, H-2'a), 2.80 (dd, J=5.0, 15.6 Hz, 1H, H-2'b), 4.01-4.10 (m, 2H, CH3CH2), 5.55 (dd, J=5.0, 8.5 Hz, 1H, H-5), 6.74 (s, 1H, H-7), 6.89 (d, J=8.0 Hz, 1H, H-9), 7.94 (d, J=8.0 Hz, 1H, H-10), 7.98 (s, 1H, H-4). Спектр ЯМР 13C (100 МГц, ДМСО-d6 - CD3CO2D, 9:1): δC (м.д.) 14.17, 21.28, 39.83, 60.65, 72.50, 99.92, 110.99, 113.28, 116.86, 118.50, 118.60, 123.75, 124.99, 142.84, 145.39, 154.67, 161.29, 169.60. Масс-спектр HRMS-ESI: m/z [M+Na]+ вычислено для C18H16N2O4: 347.1002; найдено: 347.1015.
Пример 9. Получение этил-2-(8-метокси-2-оксо-3-циан-2,5-дигидро-1H-хромено[4,3-b]пиридин-5-ил)ацетата (Iи).
Смесь этил-3-(7-метокси-4-оксо-4H-хромен-3-ил)акрилата VIIIк (548 мг, 2 ммоль), цианацетамида VI (252 мг, 3 ммоль) и TMG (345 мг, 3 ммоль) в 10 мл этанола перемешивают при 80°С в течение получаса. Затем реакционную массу подкисляют ледяной уксусной кислотой (0,5 мл), отфильтровывают выпавший осадок продукта, промывают этанолом и сушат на воздухе. Получают 400 мг (выход 59%) соединения Iк в виде желтого порошка с Тпл. 285-286°С. Спектр ЯМР 1Н (400 МГц, ДМСО-d6 - CD3CO2D, 9:1): δH (м.д.) 1.17 (t, J=7.2 Hz, 3Н, СН3СН2), 2.78 (dd, J=8.8, 15.6 Hz, 1H, H-2'а), 2.86 (dd, J=4.4, 15.6 Hz, 1Н, H-2'b), 3.79 (s, 3 H, CH3O), 4.06-4.12 (m, 2H, CH3CH2), 5.58 (dd, J=4.4, 8.8 Hz, 1H, H-5), 6.49 (d, J=2.5 Hz, 1H, H-7), 6.70 (dd, J=2.5, 8.8 Hz, 1H, H-9), 8.03 (m, 2H, H-4, H-10). Спектр ЯМР 13C (100 МГц, ДМСО-d6 - CD3CO2D, 9:1): δC (м.д.) 14.41, 40.34, 56.15, 60.72, 72.88, 98.69, 103.13, 108.73, 109.89, 109.97, 117.19, 126.73, 143.11, 145.53, 156.71, 161.36, 164.53, 169.67. Масс-спектр HRMS-ESI: m/z [M+Na]+ вычислено для C18H16N2O5: 363.0951; найдено: 363.0955.
Пример 10. Получение этил-2-(8-гидрокси-2-оксо-3-циан-2,5-дигидро-1H-хромено[4,3-b]пиридин-5-ил)ацетата (Iк).
Смесь этил-3-(7-гидрокси-4-оксо-4H-хромен-3-ил)акрилата VIIIк (520 мг, 2 ммоль), цианацетамида VI (252 мг, 3 ммоль) и TMG (345 мг, 3 ммоль) в 10 мл этанола перемешивают при 80°С в течение получаса. Затем реакционную массу подкисляют соляной кислотой (0,5 мл) и отфильтровывают выпавший оранжевый осадок побочно образовавшегося пиранохромена. Фильтрат разбавляют 100 мл воды, отфильтровывают выпавший осадок продукта, перекристаллизовывают его из этанола и сушат на воздухе. Получают 50 мг (выход 8%) соединения Iк в виде желтого порошка с Тпл. 295-297°С. Спектр ЯМР 1Н (400 МГц, ДМСО-d6 - CD3CO2D, 9:1): δH (м.д.) 1.17 (t, J=7.1 Hz, 3Н, СН3СН2), 2.75 (dd, J=8.9, 15.4 Hz, 1Н, Н-2'а), 2.82 (dd, J=4.8, 15.4 Hz, 1Н, H-2'b), 4.03-4.12 (m, 2H, CH3CH2), 5.53 (dd, J=4.8, 8.9 Hz, 1Н, H-5), 6.32 (d, J=2.3 Hz, 1H, H-7), 6.53 (dd, J=2.3, 8.8 Hz, 1H, H-9), 7.94 (d, J=8.8 Hz, 1H, H-10), 7.98 (s, 1H, H-4). Спектр ЯМР 13C (100 МГц, ДМСО-d6 - CD3CO2D, 9:1): δC (м.д.) 14.34, 40.16, 60.68, 72.74, 98.20, 104.46, 107.29, 109.29, 111.07, 117.28, 126.93, 143.28, 145.49, 156.72, 161.31, 163.37, 169.69. Масс-спектр HRMS-ESI: m/z [M+Na]+ вычислено для C17H14N2O5: 349.0795; найдено: 349.0808.
Пример 11. Получение этил-2-(8,9-диметил-2-оксо-3-циан-2,5-дигидро-1H-хромено[4,3-b]пиридин-5-ил)ацетата (Iл).
Смесь этил-3-(6,7-диметил-4-оксо-4H-хромен-3-ил)акрилата VIIIл (544 мг, 2 ммоль), цианацетамида VI (252 мг, 3 ммоль) и TMG (345 мг, 3 ммоль) в 10 мл этанола перемешивают при 80°С в течение получаса. Затем реакционную массу подкисляют ледяной уксусной кислотой (0,5 мл), отфильтровывают выпавший осадок продукта, промывают этанолом и сушат на воздухе. Получают 530 мг (выход 78%) соединения Iл в виде желтоватого порошка с Тпл. 271-273°С. Спектр ЯМР 1Н (400 МГц, ДМСО-d6 - CD3CO2D, 9:1): δн (м.д.) 1.14 (t, J=7.0 Hz, 3Н, СН3СН2), 2.16 (s, 3Н, СН3), 2.18 (s, 3Н, СН3), 2.74 (m, 2Н, Н-2), 4.01-4.09 (m, 2Н, СН3СН2), 5.52 (dd, J=5.7, 7.8 Hz, 1Н, H-5), 6.72 (s, 1H, H-7), 7.85 (s, 1H, H-10), 7.95 (s, 1H, H-4). Спектр ЯМР 13C (100 МГц, ДМСО-d6 - CD3CO2D, 9:1): δC (м.д.) 14.15, 18.70, 18.77, 39.77, 60.62, 72.44, 99.72, 110.92, 113.16, 116.91, 118.90, 125.35, 131.02, 142.92, 144.22, 145.44, 152.77, 161.26, 169.63. Масс-спектр HRMS-ESI: m/z [M+Na]+ вычислено для C19H18N2O4: 361.1159; найдено: 361.1160.
Пример 12. Получение этил-2-(2-оксо-8,9-дифтор-3-циан-2,5-дигидро-1H-хромено[4,3-b]пиридин-5-ил)ацетата (Iм).
Смесь этил-3-(6,7-дифтор-4-оксо-4H-хромен-3-ил)акрилата VIIIм (560 мг, 2 ммоль), цианацетамида VI (252 мг, 3 ммоль) и TMG (345 мг, 3 ммоль) в 10 мл этанола перемешивают при 80°С в течение получаса. Затем реакционную массу подкисляют ледяной уксусной кислотой (0,5 мл), отфильтровывают выпавший осадок продукта, промывают этанолом и сушат на воздухе. Получают 555 мг (выход 80%) соединения Iм в виде желтоватого порошка с Тпл. 252-253°С. Спектр ЯМР 1Н (400 МГц, CD3CO2D): δн (м.д.) 1.28 (t, J=7.0 Hz, 3Н, СН3СН2), 2.93 (dd, J=5.0, 15.6 Hz, 1H, H-2'a), 3.03 (dd, J=8.5, 15.6 Hz, 1H, H-2'b), 4.20-4.26 (m, 2H, СН3СН2), 5.78 (dd, J=5.0, 8.5 Hz, 1H, H-5), 7.00 (dd, JHF=6.8, 10.8 Hz, 1H, H-7), 7.99 (dd, JHF=8.5, 10.8 Hz, 1H, H-10), 8.08 (s, 1H, H-4). Спектр ЯМР 13C (100 МГц, CD3CO2D): δC (м.д.) 13.29, 38.87, 61.38, 72.87, 102.29, 107.93 (d, JCF=20.9 Hz), 111.28 (d, JCF=5.7 Hz), 112.07, 112.57 (d, JCF=20.9 Hz), 114.59, 140.13, 146.16, 146.35 (dd, JCF=13.5, 243.0 Hz), 151.85 (d, JCF=9.4 Hz), 153.75 (dd, JCF=14.1, 255.8 Hz), 162.84, 170.28. Масс-спектр HRMS-ESI: m/z [M+Na]+ вычислено для C7H12F2N2O4: 369.0657; найдено: 369.0652.
Пример 13. Получение этил-2-(7-бром-9-метил-2-оксо-3-циан-2,5-дигидро-1H-хромено[4,3-b]пиридин-5-ил)ацетата (Iн).
Смесь этил-3-(8-бром-6-метил-4-оксо-4H-хромен-3-ил)акрилата VIIIн (674 мг, 2 ммоль), цианацетамида VI (252 мг, 3 ммоль) и TMG (345 мг, 3 ммоль) в 10 мл этанола перемешивают при 80°С в течение получаса. Затем реакционную массу подкисляют ледяной уксусной кислотой (0,5 мл), отфильтровывают выпавший осадок продукта, промывают этанолом и сушат на воздухе. Получают 690 мг (выход 86%) соединения Iн в виде желтоватого порошка с Тпл. 310-312°С. Спектр ЯМР 1Н (400 МГц, ДМСО-d6 - CD3CO2D, 9:1): δН (м.д.) 1.19 (t, J=7.0 Hz, 3Н, СН3СН2), 2.28 (s, 3Н, СН3), 2.74 (dd, J=10.2, 15.4 Hz, 1H, H-2'a), 2.88 (dd, J=3.8, 15.4 Hz, 1H, H-2'b), 4.07-4.13 (q, J=7.0 Hz, 2H, CH3CH2), 5.73 (dd, J=3.8, 10.2 Hz, 1H, H-5), 7.57 (s, 1H, H-8), 7.93 (s, 1H, H-10), 8.14 (s, 1H, H-4). Спектр ЯМР 13C (100 МГц, ДМСО-d6 - CD3CO2D, 9:1): δC (м.д.) 14.44, 20.02, 39.10, 60.92, 73.57, 100.32, 111.46, 112.88, 116.68, 117.94, 124.99, 133.37, 137.24, 142.83, 145.29, 148.92, 161.60, 169.41. Масс-спектр HRMS-ESI: m/z [M+Na]+ вычислено для C18H15BrN2O4: 425.0107; найдено: 425.0101.
Пример 14. Получение этил-2-(9-метил-7-нитро-2-оксо-3-циан-2,5-дигидро-1H-хромено[4,3-b]пиридин-5-ил)ацетата (Iо).
Смесь этил-3-(6-метил-8-нитро-4-оксо-4H-хромен-3-ил)акрилата VIIIo (606 мг, 2 ммоль), цианацетамида VI (252 мг, 3 ммоль) и TMG (345 мг, 3 ммоль) в 10 мл этанола перемешивают при 80°С в течение получаса. Затем реакционную массу подкисляют ледяной уксусной кислотой (0,5 мл), отфильтровывают выпавший осадок. Далее его 2 часа кипятят в 10 мл этанола, содержащего триэтиламин (303 мг, 3 ммоль). После этого раствор охлаждают и закисляют ледяной уксусной кислотой (0,5 мл). Выпавший осадок продукта отфильтровывают, промывают этанолом и сушат на воздухе. Получают 530 мг (выход 72%) соединения Iо в виде желтоватого порошка с Тпл. 268-270°С. Спектр ЯМР 1Н (400 МГц, ДМСО-d6 - CD3CO2D, 9:1): δH (м.д.) 1.15 (t, J=7.0 Hz, 3Н, СН3СН2), 2.35 (s, 3Н, СН3), 2.78 (dd, J=10.0, 15.6 Hz, 1Н, H-2'a), 2.90 (dd, J=3.6, 15.6 Hz, 1H, H-2'b), 4.03-4.08 (m, 2H, CH3CH2), 5.78 (dd, J=3.6, 10.0 Hz, 1H, H-5), 7.86 (s, 1H, H-8), 8.15 (s, 1H, H-4), 8.19 (s, 1H, H-10). Спектр ЯМР 13C (100 МГц, ДМСО-d6 - CD3CO2D, 9:1): δC (м.д.) 14.21, 20.26, 39.04, 60.88, 74.04, 100.30, 113.73, 116.42, 119.48, 128.71, 130.28, 132.21, 139.79, 142.30, 144.86, 145.57, 161.88, 169.23. Масс-спектр HRMS-ESI: m/z [M+Na]+ вычислено для C18H15N3O6: 392.0853; найдено: 392.0846.
Пример 15. Получение этил-2-(9-бром-8-метокси-2-оксо-3-циан-2,5-дигидро-1H-хромено[4,3-b]пиридин-5-ил)ацетата (Iп).
Смесь этил-3-(6-бром-6-метокси-4-оксо-4H-хромен-3-ил)акрилата VIIIп (674 мг, 2 ммоль), цианацетамида VI (252 мг, 3 ммоль) и TMG (345 мг, 3 ммоль) в 10 мл этанола перемешивают при 80°С в течение получаса. Затем реакционную массу подкисляют ледяной уксусной кислотой (0,5 мл), отфильтровывают выпавший осадок продукта, промывают этанолом и сушат на воздухе. Получают 700 мг (выход 84%) соединения Iп в виде желтоватого порошка с Тпл. 279-282°С. Спектр ЯМР 1Н (400 МГц, ДМСО-d6 - CD3CO2D, 9:1): δH (м.д.) 1.15 (t, J=7.0 Hz, 3Н, СН3СН2), 2.83 (m, 2Н, Н-2), 3.84 (s, 3Н, CH3O), 4.04-4.10 (m, 2Н, СН3СН2), 5.61 (pseudo t, J=7.0 Hz, 1Н, H-5), 6.63 (s, 1H, H-7), 7.96 (s, 1H, H-10), 8.34 (s, 1H, H-4). Спектр ЯМР 13C (100 МГц, ДМСО-d6 - CD3CO2D, 9:1): δC (м.д.) 14.19, 39.83, 57.01, 60.71, 73.15, 99.19, 102.40, 104.43, 109.99, 110.29, 116.84, 129.10, 142.27, 145.13, 156.16, 159.97, 161.35, 169.56. Масс-спектр HRMS-ESI: m/z [M+Na]+ вычислено для C18H15BrN2O5: 441.0056; найдено: 441.0053.
Пример 16. Получение этил-2-(3-оксо-2-циан-4,12-дигидро-3H-бензо[7,8]хромено[4,3-b]пиридин-12-ил)ацетата (Iр).
Смесь этил-3-(4-оксо-4H-бензо[h]хромен-3-ил)акрилата VIIIp (589 мг, 2 ммоль), цианацетамида VI (252 мг, 3 ммоль) и TMG (345 мг, 3 ммоль) в 10 мл этанола перемешивают при 80°С в течение получаса. Затем реакционную массу подкисляют ледяной уксусной кислотой (0,5 мл), отфильтровывают выпавший осадок продукта, промывают этанолом и сушат на воздухе. Получают 700 мг (выход 84%) соединения Iр в виде желтого порошка с Тпл 296-298°С. Спектр ЯМР 1H (400 МГц, ДМСО-d6 - CD3CO2D, 9:1): δH (м.д.) 1.08 (t, J=7.0 Hz, 3Н, СН3СН2), 2.85 (dd, J=9.5, 15.4 Hz, 1H, H-2'a), 2.93 (dd, J=43, 15.4 Hz, 1H, H-2'b), 4.04-4.10 (m, 2H, CH3CH2), 5.84 (dd, J=4.3, 9.5 Hz, 1H, H-12), 7.52-7.63 (m, 3Н, H-6, H-8, H-9), 7.88 (d, J=8.0 Hz, 1H, H-7), 8.01 (d, J=8.0 Hz, 1H, H-10), 8.09 (s, 1H, H-1), 8.11 (d, J=8.8 Hz, 1H, H-5). Спектр ЯМР 13C (100 МГц, ДМСО-d6 - CD3CO2D, 9:1): δC (м.д.) 14.35, 39.09, 60.78, 73.46, 99.03, 110.99, 111.24, 117.07, 120.70, 122.19, 122.72, 124.71, 127.07, 128.26, 129.38, 136.09, 143.92, 144.92, 151.76, 161.79, 169.67. Масс-спектр HRMS-ESI: m/z [M+Na]+ вычислено для C21H16N2O4: 383.1002; найдено: 383.0994.
Пример 17. Получение 2-(2-оксо-9-хлор-3-циан-2,5-дигидро-1H-хромено[4,3-5]пиридин-5-ил)уксусной кислоты (Iс).
Смесь 3-(6-хлор-4-оксо-4H-хромен-3-ил)акриловой кислоты VIIIc (501 мг, 2 ммоль), цианацетамида VI (252 мг, 3 ммоль) и TMG (345 мг, 3 ммоль) в 10 мл этанола перемешивают при 80°С в течение получаса. Затем реакционную массу подкисляют ледяной уксусной кислотой (0,5 мл), отфильтровывают выпавший осадок продукта, промывают этанолом и сушат на воздухе. Получают 290 мг (выход 46%) соединения Iс в виде желтоватого порошка с Тпл. 320-322°С. Спектр ЯМР 1Н (400 МГц, ДМСО-d6 - CD3CO2D, 9:1): δH (м.д.) 2.75 (dd, J=8.8, 15.8 Hz, 1H, H-2'a), 2.82 (dd, J=4.6, 15.8 Hz, 1H, H-2'b), 5.62 (dd, J=4.6, 8.8 Hz, 1H, H-5), 6.97 (d, J=8.8 Hz, 1H, H-7), 7.44 (dd, J=2.5, 8.8 Hz, 1H, H-8), 8.09 (s, 1H, H-4), 8.16 (d, J=2.5 Hz, 1H, H-10). Спектр ЯМР 13C (100 МГц, ДМСО-d6 - CD3CO2D, 9:1): δC (м.д.) 40.27, 73.05, 100.41, 113.16, 116.63, 118.22, 120.20, 124.73, 126.74, 133.55, 142.33, 145.24, 153.54, 161.54, 171.07. Масс-спектр HRMS-ESI: m/z [M+Na]+ вычислено для C15H9ClN2O4: 339.0143; найдено: 339.0149.
Пример 18. Получение 2-(2-оксо-9-хлор-3-циан-2,5-дигидро-1H-хромено[4,3-b]пиридин-5-ил)ацетамида (Iт).
Смесь 3-(6-хлор-4-оксо-4H-хромен-3-ил)акриламида VIIIт (500 мг, 2 ммоль), цианацетамида VI (252 мг, 3 ммоль) и TMG (345 мг, 3 ммоль) в 10 мл этанола перемешивают при 80°С в течение получаса. Затем реакционную массу подкисляют ледяной уксусной кислотой (0,5 мл), отфильтровывают выпавший осадок продукта, промывают этанолом и сушат на воздухе. Получают 420 мг (выход 67%) соединения Iт в виде желтоватого порошка с Тпл. 343-345°С. Спектр ЯМР 1Н (400 МГц, ДМСО-d6 - CD3CO2D, 9:1): δн (м.д.) 2.56 (dd, J=5.3, 14.7 Hz, 1H, H-2'a), 2.65 (dd, J=8.0, 14.8 Hz, 1H, H-2'b), 5.62 (dd, J=5.3, 8.0 Hz, 1H, H-5), 6.96-6.98 (m, 2H, H-7, NH), 7.38 (br. s, 1H, NH), 7.43 (dd, J=2.0, 8.7 Hz, 1H, H-8), 7.99 (s, 1H, H-4), 8.15 (d, J=2.0 Hz, 1H, H-10). Спектр ЯМР 13C (100 МГц, ДМСО-d6 - CD3CO2D, 9:1): δC (м.д.) 40.48, 73.46, 100.41, 113.55, 116.65, 118.19, 120.32, 124.67, 126.64, 133.52, 142.16, 145.15, 153.71, 161.58, 170.60. Масс-спектр HRMS-ESI: m/z [M+Na]+ вычислено для C15H10ClN3O3: 338.0303; найдено: 338.0311.
Пример 19. Получение N,N-диэтил-2-(2-оксо-9-хлор-3-циан-2,5-дигидро-1H-хромено[4,3-6]пиридин-5-ил)ацетамида (Iу).
Смесь N,N-диэтил-3-(6-хлор-4-оксо-4H-хромен-3-ил)акриламида VIIIy (612 мг, 2 ммоль), цианацетамида VI (252 мг, 3 ммоль) и TMG (345 мг, 3 ммоль) в 10 мл этанола перемешивают при 80°С в течение получаса. Затем реакционную массу подкисляют ледяной уксусной кислотой (0,5 мл), отфильтровывают выпавший осадок продукта, промывают этанолом и сушат на воздухе. Получают 540 мг (выход 73%) соединения Iу в виде желтоватого порошка с Тпл. 128-130°С. Спектр ЯМР 1Н (400 МГц, ДМСО-d6 - CD3CO2D, 9:1): δн (м.д.) 0.93 (t, J=7.1 Hz, 3Н, СН3СН2), 0.99 (t, J=7.1 Hz, 3Н, СН3СН2), 2.75 (dd, J=5.0, 15.7 Hz, 1H, H-2'a), 2.93 (dd, J=8.0, 15.7 Hz, 1H, H-2'b), 3.08-3.32 (m, 4H, CH3CH2), 5.72 (dd, J=5.0, 8.0 Hz, 1H, H-5), 6.95 (d, J=8.8 Hz, 1H, H-7), 7.44 (dd, J=2.4, 8.8 Hz, 1H, H-8), 8.07 (s, 1H, H-4), 8.17 (d, J=2.4 Hz, 1H, H-10). Спектр ЯМР 13C (100 МГц, ДМСО-d6 - CD3CO2D, 9:1): δC (м.д.) 13.31, 14.54, 37.50, 41.86, 73.54, 100.36, 113.61, 116.66, 118.20, 120.11, 124.77, 126.57, 133.48, 142.22, 145.53, 153.83, 161.49, 167.57. Масс-спектр HRMS-ESI: m/z [M+Na]+ вычислено для C19H18ClN3O3: 394.0929; найдено: 394.0932.
Пример 20. Получение 2-оксо-9-хлор-5-(цианметил)-2,5-дигидро-1H-хромено[4,3-6]пиридин-3-карбонитрила (Iф).
Смесь 3-(6-хлор-4-оксо-4H-хромен-3-ил)акрилонитрила VIIIф (463 мг, 2 ммоль), цианацетамида VI (252 мг, 3 ммоль) и TMG (345 мг, 3 ммоль) в 10 мл этанола перемешивают при 80°С в течение получаса. Затем реакционную массу подкисляют ледяной уксусной кислотой (0,5 мл), отфильтровывают выпавший осадок продукта, промывают этанолом и сушат на воздухе. Получают 420 мг (выход 82%) соединения Iф в виде желтоватого порошка с Тпл. 312-314°С. Спектр ЯМР 1Н (400 МГц, ДМСО-d6 - CD3CO2D, 9:1): δн (м.д.) 3.14 (dd, J=4.5, 17.3 Hz, 1Н, H-2'a), 3.22 (dd, J=7.3, 17.3 Hz, 1H, H-2'b), 5.65 (dd, J=4.5, 7.3 Hz, 1H, H-5), 7.08 (d, J=8.8 Hz, 1H, H-7), 7.47 (dd, J=2.5, 8.8 Hz, 1H, H-8), 8.12 (s, 1H, H-4), 8.17 (d, J=2.5 Hz, 1H, H-10). Спектр ЯМР 13C (100 МГц, ДМСО-d6): δC (м.д.) 23.44, 71.75, 100.38, 111.75, 116.52, 117.67, 118.19, 120.13, 124.76, 127.21, 133.75, 142.82, 144.88, 152.99, 161.82. Масс-спектр HRMS-ESI: m/z [M+Na]+ вычислено для C15H8ClN3O2: 320.0197; найдено: 320.0210.
Пример 21. Флуоресцентные свойства производных 2-(хромено[4,3-b]пиридин-5-ил)уксусной кислоты (Iа-ф).
Спектры флуоресценции растворов исследуемых соединений Iа-ф зарегистрированы на спектрофлуориметре BMG Labtech CLARIOstar. Растворы веществ Ia-ф были приготовлены в этаноле в концентрации 10-4 моль/л. Длины волн максимумов поглощения (λabs) и эмиссии (λem) представлены в таблице 1. Сдвиг Стокса (Δλ) рассчитан по формуле (1):

Из полученных данных следует, что синтезированные хромено[4,3-b]пиридины Ia-ф флуоресцируют в сине-зеленой области спектра (455-500 нм) со стоксовым сдвигом 54-94 нм, что делает данные соединения пригодными для применения в качестве флуоресцентных красителей и/или зондов в биохимических исследованиях.
| название | год | авторы | номер документа |
|---|---|---|---|
| Производные 2-(пирано[3,2-c]хромен-5-ил)уксусной кислоты и способ их получения | 2021 |
|
RU2775546C1 |
| Производные 2-(хромено[4,3-d]пиримидин-5-ил)уксусной кислоты и способ их получения | 2019 |
|
RU2716597C1 |
| Этил-2-(9-аминохромено[4,3-d]пиримидин-5-ил)ацетаты и способ их получения | 2020 |
|
RU2746879C1 |
| СОЕДИНЕНИЯ, ПРИГОДНЫЕ В КАЧЕСТВЕ МОДУЛЯТОРОВ TRPM8 | 2011 |
|
RU2608109C2 |
| БИЦИКЛИЧЕСКИЕ ЛАКТАМЫ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2016 |
|
RU2716136C2 |
| ПРОИЗВОДНЫЕ ХИНОЛИН- ИЛИ НАФТИРИДИНКАРБОНОВОЙ КИСЛОТЫ И СПОСОБЫ ИХ ПОЛУЧЕНИЯ | 1995 |
|
RU2120940C1 |
| СПОСОБ ПОЛУЧЕНИЯ 2-ОКСО-4-ЦИАНО-1,2-ДИГИДРОПИРИДИН-3-КАРБОКСАМИДОВ | 2011 |
|
RU2475480C1 |
| НОВЫЕ ГЕТЕРОЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ КАК ИНГИБИТОРЫ BRD4 | 2016 |
|
RU2721120C2 |
| ПРОИЗВОДНЫЕ АЗАИНДАЗОЛА ИЛИ ДИАЗАИНДАЗОЛА В КАЧЕСТВЕ МЕДИКАМЕНТА | 2012 |
|
RU2600976C2 |
| 3-ОКСО-3,9-ДИГИДРО-1Н-ХРОМЕНО[2,3-c]ПИРРОЛЫ В КАЧЕСТВЕ АКТИВАТОРОВ ГЛЮКОКИНАЗЫ | 2011 |
|
RU2603191C2 |
Группа изобретений относится к области органической химии и химии красителей, а именно к новым полициклическим гетероциклическим соединениям - производным 2-(хромено[4,3-b]пиридин-5-ил)уксусной кислоты Ia-ф
 где:
где:
Изобретение относится также к способу получения производных 2-(хромено[4,3-b]пиридин-5-ил)уксусной кислоты из электронодефицитных 3-винилхромонов и 1,3-N,N-бинуклеофильного реагента - цианацетамида. Технический результат – получены новые соединения, которые могут быть использованы в органическом синтезе и в биохимических исследованиях в качестве флуоресцентных красителей и зондов. 2 н.п. ф-лы, 1 табл., 21 пр.
1. Производные 2-(хромено[4,3-b]пиридин-5-ил)уксусной кислоты общей формулы I
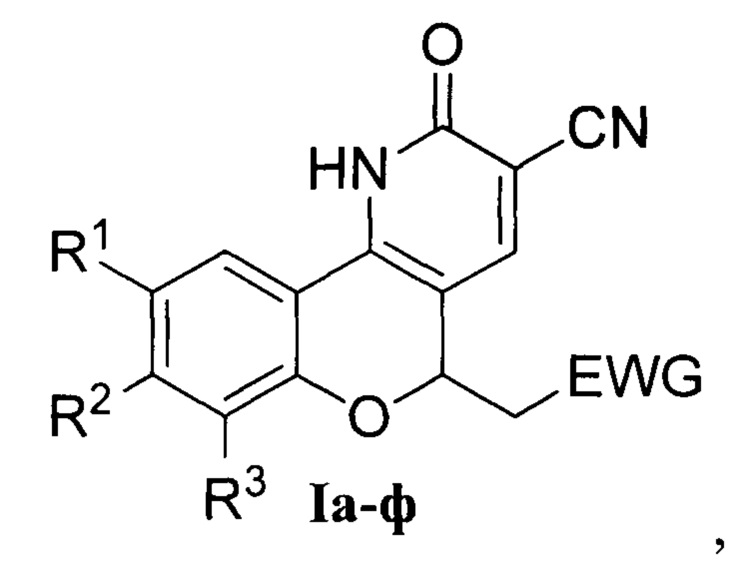 где
где
R1=Cl, R2=H, R3=H, EWG=COOC2H5; Ia - этил-2-(2-оксо-9-хлор-3-циан-2,5-дигидро-1H-хромено[4,3-b]пиридин-5-ил)ацетат;
R1=H, R2=H, R3=H, EWG=COOC2H5; Iб - этил-2-(2-оксо-3-циан-2,5-дигидро-1H-хромено[4,3-b]пиридин-5-ил)ацетат;
R1=CH3, R2=H, R3=H, EWG=COOC2H5; Iв - этил-2-(9-метил-2-метил-3-циан-2,5-дигидро-1H-хромено[4,3-b]пиридин-5-ил)ацетат;
R1=Br, R2=H, R3=H, EWG=COOC2H5; Iг - этил-2-(9-бром-2-оксо-3-циан-2,5-дигидро-1H-хромено[4,3-b]пиридин-5-ил)ацетат;
R1=F, R2=H, R3=H, EWG=COOC2H5; Iд - этил-2-(2-оксо-9-фтор-3-циан-2,5-дигидро-1H-хромено[4,3-b]пиридин-5-ил)ацетат;
R1=NO2, R2=H, R3=H, EWG=COOC2H5; Ie - этил-2-(9-нитро-2-оксо-3-циан-2,5-дигидро-1H-хромено[4,3-b]пиридин-5-ил)ацетат;
R1=CH3O, R2=H, R3=H, EWG=COOC2H5; Iж - этил-2-(9-метокси-2-оксо-3-циан-2,5-дигидро-1H-хромено[4,3-b]пиридин-5-ил)ацетат;
R1=H, R2=CH3, R3=H, EWG=COOC2H5; Iз - этил-2-(8-метил-2-оксо-3-циан-2,5-дигидро-1H-хромено[4,3-b]пиридин-5-ил)ацетат;
R1=H, R2=CH3O, R3=H, EWG=COOC2H5; Iи - этил-2-(8-метокси-2-оксо-3-циан-2,5-дигидро-1H-хромено[4,3-b]пиридин-5-ил)ацетат;
R1=H, R2=OH, R3=H, EWG=COOC2H5; Iк - этил-2-(8-гидрокси-2-оксо-3-циан-2,5-дигидро-1H-хромено[4,3-b]пиридин-5-ил)ацетат;
R1=CH3, R2=CH3, R3=H, EWG=COOC2H5; Iл - этил-2-(8,9-диметил-2-оксо-3-циан-2,5-дигидро-1H-хромено[4,3-b]пиридин-5-ил)ацетат;
R1=F, R2=F, R3=H, EWG=COOC2H5; Iм - этил-2-(2-оксо-8,9-дифтор-3-циан-2,5-дигидро-1H-хромено[4,3-b]пиридин-5-ил)ацетат;
R1=CH3, R2=H, R3=Br, EWG=COOC2H5; Iн - этил-2-(7-бром-9-метил-2-оксо-3-циан-2,5-дигидро-1H-хромено[4,3-b]пиридин-5-ил)ацетат;
R1=CH3, R2=H, R3=NO2, EWG=COOC2H5; Iо - этил-2-(9-метил-7-нитро-2-оксо-3-циан-2,5-дигидро-1H-хромено[4,3-b]пиридин-5-ил)ацетат;
R1=Br, R2=CH3O, R3=H, EWG=COOC2H5; Iп - этил-2-(9-бром-8-метокси-2-оксо-3-циан-2,5-дигидро-1H-хромено[4,3-b]пиридин-5-ил)ацетата;
R1=H, R2+R3=бензо, EWG=COOC2H5; Ip - этил-2-(3-оксо-2-циан-4,12-дигидро-3H-бензо[7,8]хромено[4,3-b]пиридин-12-ил)ацетат;
R1=Cl, R2=H, R3=H, EWG=COOH; Iс - 2-(2-оксо-9-хлор-3-циан-2,5-дигидро-1H-хромено[4,3-b]пиридин-5-ил)уксусной кислоты;
R1=Cl, R2=H, R3=H, EWG=CONH2; Iт - 2-(2-оксо-9-хлор-3-циан-2,5-дигидро-1H-хромено[4,3-b]пиридин-5-ил)ацетамид;
R1=Cl, R2=H, R3=H, EWG=CON(C2H5)2; Iу - N,N-диэтил-2-(2-оксо-9-хлор-3-циан-2,5-дигидро-1H-хромено[4,3-b]пиридин-5-ил)ацетамид;
R1=Cl, R2=H, R3=H, EWG=C≡N; Iф - 2-оксо-9-хлор-5-(цианметил)-2,5-дигидро-1H-хромено[4,3-b]пиридин-3-карбонитрил.
2. Способ получения производных 2-(хромено[4,3-b]пиридин-5-ил)уксусной кислоты общей формулы I по п. 1, включающий взаимодействие выбранных из группы: этил-3-(6-хлор-4-оксо-4H-хромен-3-ил)акрилата, этил-3-(4-оксо-4H-хромен-3-ил)акрилата, этил-3-(6-метил-4-оксо-4H-хромен-3-ил)акрилата, этил-3-(6-бром-4-оксо-4H-хромен-3-ил)акрилата, этил-3-(6-фтор-4-оксо-4H-хромен-3-ил)акрилата, этил-3-(6-нитро-4-оксо-4H-хромен-3-ил)акрилата, этил-3-(6-метокси-4-оксо-4H-хромен-3-ил)акрилата, этил-3-(7-метил-4-оксо-4H-хромен-3-ил)акрилата, этил-3-(7-метокси-4-оксо-4H-хромен-3-ил)акрилата, этил-3-(7-гидрокси-4-оксо-4H-хромен-3-ил)акрилата, этил-3-(6,7-диметил-4-оксо-4H-хромен-3-ил)акрилата, этил-3-(6,7-дифтор-4-оксо-4H-хромен-3-ил)акрилата, этил-3-(8-бром-6-метил-4-оксо-4H-хромен-3-ил)акрилата, этил-3-(6-метил-8-нитро-4-оксо-4H-хромен-3-ил)акрилата, этил-3-(6-бром-6-метокси-4-оксо-4H-хромен-3-ил)акрилата, этил-3-(4-оксо-4H-бензо[h]хромен-3-ил)акрилата, 3-(6-хлор-4-оксо-4H-хромен-3-ил)акриловой кислоты, 3-(6-хлор-4-оксо-4H-хромен-3-ил)акриламида, N,N-диэтил-3-(6-хлор-4-оксо-4H-хромен-3-ил)акриламида, 3-(6-хлор-4-оксо-4H-хромен-3-ил)акрилонитрила, - соответствующих 3-винилхромонов и цианацетамида при катализе сильными ненуклеофильными основаниями - 1,8-диазабицикло[5.4.0]ундец-7-еном (DBU) или тетраметилгуанидином (TMG), взятыми в мольном соотношении 1:1,5:1,5 соответственно, в этаноле при температуре 80°С, а выделение производных хромено[4,3-b]пиридинов выполняют путем закисления реакционной массы неорганической (серной, соляной) или органической (уксусной) кислотами.
| Производные 2-(хромено[4,3-d]пиримидин-5-ил)уксусной кислоты и способ их получения | 2019 |
|
RU2716597C1 |
| Этил-2-(9-аминохромено[4,3-d]пиримидин-5-ил)ацетаты и способ их получения | 2020 |
|
RU2746879C1 |
| WO 2012095803 A1, 19.07.2012 | |||
| MAGDY A | |||
| IBRAHIM ET AL, Tetrahedron, 74(4), 2018, pp | |||
| СПОСОБ ПОЛУЧЕНИЯ ТВЕРДЫХ ПРОДУКТОВ УПЛОТНЕНИЯ ФОРМАЛЬДЕГИДА С ФЕНОЛАМИ И ДРУГИМИ ВЕЩЕСТВАМИ | 1925 |
|
SU512A1 |
| CONG-HAI ZHANG ET AL, The Journal of Organic Chemistry, 83(9), 2018, pp | |||
| ДВЕРНОЙ ИЛИ НАСТОЛЬНЫЙ ЗВОНОК | 1926 |
|
SU4981A1 |
Авторы
Даты
2023-03-29—Публикация
2021-11-08—Подача