Группа изобретений относится к области органической химии и химии красителей, а именно: к полифункциональным гетероциклическим соединениям - этил-2-(9-аминохромено[4,3-d]пиримидин-5-ил)ацетатам Iа-д, а также к способу их получения. Соединения могут быть использованы в органическом синтезе и в биохимических исследованиях в качестве флуоресцентных красителей и зондов.
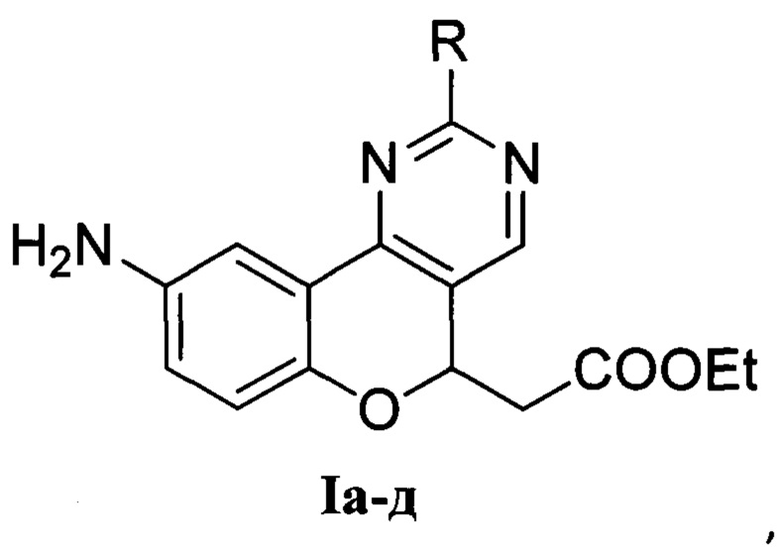 где
где
R=Me (Ia) - этил-2-(9-амино-2-метил-5H-хромено[4,3-d]пиримидин-5-ил)ацетат;
R=Ph (Iб) - этил-2-(9-амино-2-фенил-5H-хромено[4,3-d]пиримидин-5-ил)ацетат;
R=NH2 (Iв) - этил-2-(2,9-диамино-5H-хромено[4,3-d]пиримидин-5-ил)ацетат;
R=MeS (Iг) - этил-2-(9-амино-2-метилтио-5H-хромено[4,3-d]пиримидин-5-ил)ацетат;
R=PhCH2S (Iд) - этил-2-(9-амино-2-бензилтио-5H-хромено[4,3-d]пиримидин-5-ил)ацетат.
В научно-технической литературе представлен способ получения производных 2-(хромено[4,3-d]пиримидин-5-ил)уксусных кислот IV путем взаимодействия 3-винилхромонов II, содержащих электроноакцепторную группу EWG (EWG=СООН, COOEt, CONH2, CN), с 1,3-N,N-бинуклеофильными реагентами III [Chernov, N.M. Convenient synthesis of fluorescent chromeno[4,3-d]pyrimidines from electron-deficient 3-vinylchromones / N.M. Chernov, R.V. Shutov, A.E. Potapova, I.P. Yakovlev // Synthesis. - 2020. - Vol. 52. - P. 40-50]. Реакция протекает в спирте в щелочных условиях.
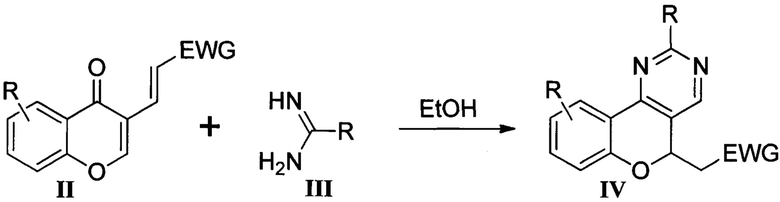
Существенным недостатком данного метода является то, что при получении 9-гидрокси- и 9-аминопроизводных промежуточно образующиеся фрагменты 4-гидрокси- или 4-аминофенола соответственно окисляются кислородом воздуха [Haist, G.M. Modern Photographic Processing / G.M. Haist. - New York, Chichester, Brisbane, Toronto: John Whiley and sons, 1979. - Vol. 1. - 358 р.]. В то же время введение сильных электронодонорных групп (ОН или NH2) позволит сместить максимум флуоресценции соединений в более длинноволновую область и увеличить их стоксов сдвиг, расширяя таким образом область применения хромено[4,3-d]пиримидинов в качестве флуоресцентных красителей.
Исходя из этого, задачей предполагаемой группы изобретений является создание неописанных в литературе этил-2-(9-аминохромено[4,3-d]пиримидин-5-ил)ацетатов формулы Ia-д, что позволит расширить ассортимент флуоресцентных красителей, находящих применение в биохимических исследованиях, и улучшить их потребительские свойства.
Техническими результатами, на решение которых направлена группа изобретений, являются получение ряда новых полифункциональных гетероциклических соединений Ia-д, обладающих флуоресцентными свойствами; простой и эффективный способ их получения из этил-3-(6-нитро-4-оксо-4H-хромен-3-ил)акрилата V и 1,3-N,N-бинуклеофильных реагентов IIIа-д.
Согласно разработанному способу получения взаимодействие хромона V и бинуклеофильных реагентов IIIа-д протекает в этаноле при температуре 15-25°С по следующей схеме:
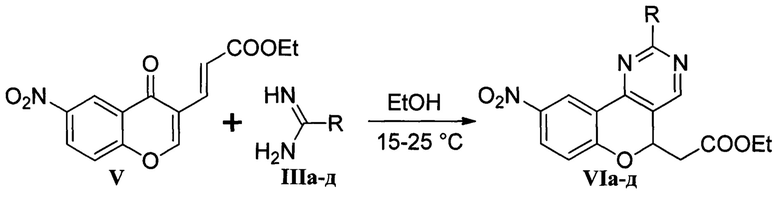
Бинуклеофильный реагент IIIа-д генерируется непосредственно в реакционной массе из коммерчески доступной соли (хлорида или сульфата) под действием сильного основания (этилат натрия, гидроксид натрия, 1,8-диазабицикло[5.4.0]ундец-7-ен). По завершении реакции выделение полупродуктов VIa-д выполняется путем выливания реакционной смеси в 1М соляную кислоту или воду. Последующее восстановление полупродуктов VIa-д дихлоридом олова в кипящем этаноле приводит к целевым 9-аминохромено[4,3-d]пиримидинам Ia-д.
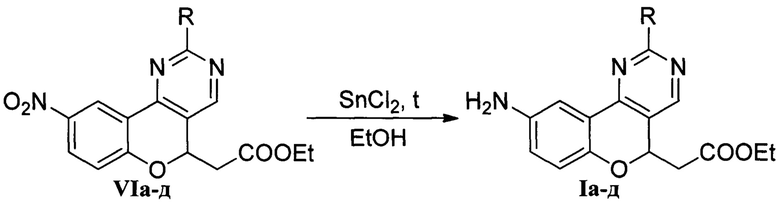
Предложенный метод позволяет получать соединения формулы Ia-д с общим выходом по двум стадиям 61-84%, считая на хромон V. Разработанный способ получения этил-2-(9-аминохромено[4,3-d]пиримидин-5-ил)ацетатов Ia-д изучен и проверен в лабораторных условиях. Структура и чистота полученных продуктов установлены методами спектроскопии ЯМР 1Н, 13С и масс-спектрометрии высокого разрешения (HRMS-ESI).
Изучение фотофизических свойств 9-аминохромено[4,3-d]пиримидинов Ia-д показало их способность к флуоресценции в желто-зеленой области спектра (530-580 нм), в то время как хромено[4,3-d]пиримидины, не содержащие аминогруппы, имеют максимум флуоресценции в более коротковолновом диапазоне (390-440 нм) [Chernov, N.M. Convenient synthesis of fluorescent chromeno[4,3-d]pyrimidines from electron-deficient 3-vinylchromones / N.M. Chernov, R.V. Shutov, A.E. Potapova, I.P. Yakovlev // Synthesis. - 2020. - Vol. 52. - P. 40-50].
Предлагаемая группа изобретений проиллюстрирована примерами практического осуществления.
Пример 1. Получение этил-2-(9-амино-2-метил-5H-хромено[4,3-d]пиримидин-5-ил)ацетата (Ia).
Смесь этил-3-(6-нитро-4-оксо-4H-хромен-3-ил)акрилата V (578 мг, 2 ммоль), гидрохлорида ацетамидина IIIа (227 мг, 2.4 ммоль) и этилата натрия (163 мг, 2.4 ммоль) в 10 мл этанола перемешивают при 15-25°С в течение 12-24 часов. Конец реакции определяют по ТСХ (этилацетат/гексан = 3/7, проявление в УФ свете). Затем реакционную массу выливают в 100 мл 1М соляной кислоты, отфильтровывают выпавший осадок полупродукта VIa и сушат на воздухе.
Полупродукт VIa и 2.26 г (10 ммоль) дигидрата дихлорида олова кипятят в 10 мл этанола в течение 1-2 часов. Конец реакции определяют по ТСХ (этилацетат/гексан = 3/7, проявление в УФ свете). Затем реакционную массу разлагают 100 мл воды и экстрагируют двумя порциями по 25 мл дихлорметана. Экстракт сушат безводным сульфатом магния и упаривают досуха под вакуумом. Остаток кристаллизуют смесью хлороформ/гексан = 1/10, отфильтровывают продукт и сушат на воздухе. Получают 430 мг (выход 72%, считая на хромон V) соединения Ia в виде желтого порошка с Тпл. 157-158°С. Спектр ЯМР 1Н (400 МГц, ДМСО-d6): δH (м.д.) 1.19 (т, J=7.3 Гц, 3Н, СН3СН2), 2.63 (с, 3Н, СН3), 2.88 (дд, J=8.8, 15.6 Гц, 1Н, H-2'a), 2.95 (дд, J=4.5, 15.6 Гц, 1Н, H-2'b), 4.10 (м, 2Н, СН3СН2), 5.04 (уш.с, 2Н, NH2), 5.65 (дд, J=4.5, 8.8 Гц, 1H, Н-5), 6.68 (д, J=8.5 Гц, 1Н, Н-7), 6.72 (дд, J=2.5, 8.5 Гц, 1Н, Н-8), 7.38 (д, J=2.5 Гц, 1Н, Н-10), 8.55 (с, 1Н, Н-4). Спектр ЯМР 13С (100 МГц, ДМСО-d6): δС (м.д.) 14.53, 26.16, 39.09, 60.73, 71.53, 108.78, 118.46, 120.41, 120.68, 122.42, 144.46, 146.60, 153.67, 154.69, 167.53, 169.88. Масс-спектр HRMS-ESI: m/z [М+Н]+ вычислено для C16H18N3O3: 300.1343; найдено: 300.1330.
Пример 2. Получение этил-2-(9-амино-2-фенил-5H-хромено[4,3-d]пиримидин-5-ил)ацетата (Iб).
Смесь этил-3-(6-нитро-4-оксо-4H-хромен-3-ил)акрилата V (578 мг, 2 ммоль), гидрохлорида бензамидина IIIб (313 мг, 2.4 ммоль) и гидроксида натрия (96 мг, 2.4 ммоль) в 10 мл этанола перемешивают при 15-25°С в течение 12-24 часов. Конец реакции определяют по ТСХ (этилацетат/гексан = 3/7, проявление в УФ свете). Затем реакционную массу выливают в 100 мл 1М соляной кислоты, отфильтровывают выпавший осадок полупродукта VIб и сушат на воздухе.
Полупродукт VIб и 2.26 г (10 ммоль) дигидрата дихлорида олова кипятят в 10 мл этанола в течение 1-2 часов. Конец реакции определяют по ТСХ (этилацетат/гексан = 3/7, проявление в УФ свете). Затем реакционную массу разлагают 100 мл воды и экстрагируют двумя порциями по 25 мл дихлорметана. Экстракт сушат безводным сульфатом магния и упаривают досуха под вакуумом. Остаток кристаллизуют смесью хлороформ/гексан = 1/10, отфильтровывают продукт и сушат на воздухе. Получают 560 мг (выход 78%, считая на хромон V) соединения Iб в виде желтого порошка с Тпл. 142-144°С. Спектр ЯМР 1Н (400 МГц, ДМСО-d6): δH (м.д.) 1.20 (т, J=7.3 Гц, 3Н, СН3СН2), 2.95 (дд, J=8.8, 15.6 Гц, 1Н, H-2'a), 3.03 (дд, J=4.5, 15.6 Гц, 1Н, Н-2'b), 4.12 (м, 2Н, CH3CH2), 5.17 (уш.с, 2Н, NH2), 5.75 (дд, J=4.5, 8.8 Гц, 1Н, Н-5), 6.73 (д, J=8.8 Гц, 1Н, Н-7), 6.77 (дд, J=2.5, 8.8 Гц, 1Н, Н-8), 7.58 (м, 4Н, Н-10, Ph), 8.50 (м, 2Н, Ph), 8.78 (с, 1Н, Н-4). Спектр ЯМР 13С (100 МГц, ДМСО-d6): δС (м.д.) 14.55, 39.08, 60.77, 71.67, 108.96, 118.53, 120.76 (2С), 123.57, 128.14 (2С), 129.16 (2С), 131.38, 137.65, 144.37, 146.87, 154.24, 155.12, 163.40, 169.90. Масс-спектр HRMS-ESI: m/z [М+Н]+ вычислено для C21H20N3O3: 362.1499; найдено: 363.1417.
Пример 3. Получение этил-2-(2,9-диамино-5H-хромено[4,3-d]пиримидин-5-ил)ацетата (Iв).
Смесь этил-3-(6-нитро-4-оксо-4H-хромен-3-ил)акрилата V (578 мг, 2 ммоль), гидрохлорида гуанидина IIIв (229 мг, 2.4 ммоль) и этилата натрия (163 мг, 2.4 ммоль) в 10 мл этанола перемешивают при 15-25°С в течение 12-24 часов. Конец реакции определяют по ТСХ (этилацетат/гексан = 3/7, проявление в УФ свете). Затем реакционную массу выливают в 100 мл воды, отфильтровывают выпавший осадок полупродукта VIв и сушат на воздухе.
Полупродукт VIв и 2.26 г (10 ммоль) дигидрата дихлорида олова кипятят в 10 мл этанола в течение 1-2 часов. Конец реакции определяют по ТСХ (этилацетат/гексан = 3/7, проявление в УФ свете). Затем реакционную массу разлагают 100 мл воды и экстрагируют двумя порциями по 25 мл дихлорметана. Экстракт сушат безводным сульфатом магния и упаривают досуха под вакуумом. Остаток кристаллизуют смесью хлороформ/гексан = 1/10, отфильтровывают продукт и сушат на воздухе. Получают 365 мг (выход 61%, считая на хромон V) соединения Iв в виде желтого порошка с Тпл. 127-129°С. Спектр ЯМР 1Н (400 МГц, ДМСО-d6): δH (м.д.) 1.19 (т, J=7.3 Гц, 3Н, СН3СН2), 2.77 (дд, J=8.8, 15.3 Гц, 1H, H-2'a), 2.85 (дд, J=4.8, 15.3 Гц, 1Н, Н-2'b), 4.10 (м, 2Н, СН3СН2), 4.93 (уш.с, 2Н, NH2), 5.46 (дд, J=4.8, 8.8 Гц, 1Н, Н-5), 6.65 (м, 4Н, Н-7, Н-8, NH2), 7.23 (д, J=2.5 Гц, 1H, Н-10), 8.12 (с, 1Н, Н-4). Спектр ЯМР 13С (100 МГц, ДМСО-d6): δС (м.д.) 14.55, 39.16, 60.60, 71.83, 109.06, 114.56, 118.30, 119.94, 121.35, 143.63, 146.84, 154.77, 155.40, 163.95, 170.08. Масс-спектр HRMS-ESI: m/z [М+Н]+ вычислено для C15H17N4O3: 301.1295; найдено: 301.1292.
Пример 4. Получение этил-2-(9-амино-2-метилтио-5H-хромено[4,3-d]пиримидин-5-ил)ацетата (Iг).
Смесь этил-3-(6-нитро-4-оксо-4H-хромен-3-ил)акрилата V (578 мг, 2 ммоль), гемисульфата S-метилизотиомочевины IIIг (334 мг, 2.4 ммоль) и 1,8-диазабицикло[5.4.0]ундец-7-ена (DBU, 365 мг, 2.4 ммоль) в 10 мл этанола перемешивают при 15-25°С в течение 12-24 часов. Конец реакции определяют по ТСХ (этилацетат/гексан = 3/7, проявление в УФ свете). Затем реакционную массу выливают в 100 мл 1М соляной кислоты, отфильтровывают выпавший осадок полупродукта VIг и сушат на воздухе.
Полупродукт VIг и 2.26 г (10 ммоль) дигидрата дихлорида олова кипятят в 10 мл этанола в течение 1-2 часов. Конец реакции определяют по ТСХ (этилацетат/гексан = 3/7, проявление в УФ свете). Затем реакционную массу разлагают 100 мл воды и экстрагируют двумя порциями по 25 мл дихлорметана. Экстракт сушат безводным сульфатом магния и упаривают досуха под вакуумом. Остаток кристаллизуют смесью хлороформ/гексан = 1/10, отфильтровывают продукт и сушат на воздухе. Получают 535 мг (выход 81%, считая на хромон V) соединения Iг в виде желтого порошка с Тпл. 167-168°С. Спектр ЯМР 1H (400 МГц, ДМСО-d6): δH (м.д.) 1.19 (т, J=7.0 Гц, 3Н, СН3СН2), 2.58 (с, 3Н, СН3), 2.90 (дд, J=9.0, 15.6 Гц, 1Н, H-2'a), 2.98 (дд, J=4.5, 15.6 Гц, 1Н, Н-2'b), 4.11 (м, 2Н, СН3СН2), 5.11 (уш.с, 2H, NH2), 5.71 (дд, J=4.5, 9.0 Гц, 1H, Н-5), 6.80 (д, J=8.5 Гц, 1Н, Н-7), 6.92 (дд, J=2.8, 8.5 Гц, 1Н, Н-8), 7.53 (д, J=2.8 Гц, 1Н, Н-10), 8.54 (с, 1Н, Н-4). Спектр ЯМР 13С (100 МГц, ДМСО-d6): δC (м.д.) 14.08, 14.53, 39.20, 60.76, 71.61, 110.58, 118.72, 120.23, 120.83, 122.33, 141.45, 148.28, 154.23, 154.86, 169.81, 171.55. Масс-спектр HRMS-ESI: m/z [М+Н]+ вычислено для C16H18N3O3S: 332.1063; найдено: 332.1056.
Пример 5. Получение этил-2-(9-амино-2-бензилтио-5H-хромено[4,3-d]пиримидин-5-ил)ацетата (Iд).
Смесь этил-3-(6-нитро-4-оксо-4H-хромен-3-ил)акрилата V (578 мг, 2 ммоль), гидрохлорида S-бензилизотиомочевины IIIд (486 мг, 2.4 ммоль) и этилата натрия (163 мг, 2.4 ммоль) в 10 мл этанола перемешивают при 15-25°С в течение 12-24 часов. Конец реакции определяют по ТСХ (этилацетат/гексан = 3/7, проявление в УФ свете). Затем реакционную массу выливают в 100 мл 1М соляной кислоты, отфильтровывают выпавший осадок полупродукта VIд и сушат на воздухе.
Полупродукт VIд и 2.26 г (10 ммоль) дигидрата дихлорида олова кипятят в 10 мл этанола в течение 1-2 часов. Конец реакции определяют по ТСХ (этилацетат/гексан = 3/7, проявление в УФ свете). Затем реакционную массу разлагают 100 мл воды и экстрагируют двумя порциями по 25 мл дихлорметана. Экстракт сушат безводным сульфатом магния и упаривают досуха под вакуумом. Остаток кристаллизуют смесью хлороформ/гексан = 1/10, отфильтровывают продукт и сушат на воздухе. Получают 680 мг (выход 84%, считая на хромон V) соединения Iд в виде желтого порошка с Тпл. 178-180°С. Спектр ЯМР 1Н (400 МГц, ДМСО-d6): δH (м.д.) 1.18 (т, J=7.3 Гц, 3Н, СН3СН2), 2.95 (дд, J=8.8, 15.6 Гц, 1Н, H-2'a), 3.06 (дд, J=4.3, 15.6 Гц, 1H, Н-2'b), 4.11 (м, 2Н, СН3СН2), 4.51 (с, 2Н, СН2), 5.17 (уш.с, 2Н, NH2), 5.85 (дд, J=4.3, 8.8 Гц, 1Н, Н-5), 7.00 (д, J=8.5 Гц, 1Н, Н-7), 7.27 (м, 2Н, Н-8, Ph), 7.33 (м, 2Н, Ph), 7.49 (м, 2Н, Ph), 7.95 (д, J=1.8 Гц, 1Н, Н-10), 8.62 (с, 1Н, Н-4). Спектр ЯМР 13С (100 МГц, ДМСО-d6): δС (м.д.) 14.52, 34.74, 39.37, 60.82, 71.98, 115.29, 119.20, 120.36, 120.95, 125.90, 127.65, 128.97 (2С), 129.41 (3С), 138.23, 151.88, 154.26, 154.79, 169.72, 170.89. Масс-спектр HRMS-ESI: m/z [М+Н]+ вычислено для C22H22N3O3S: 408.1376; найдено: 408.1370.
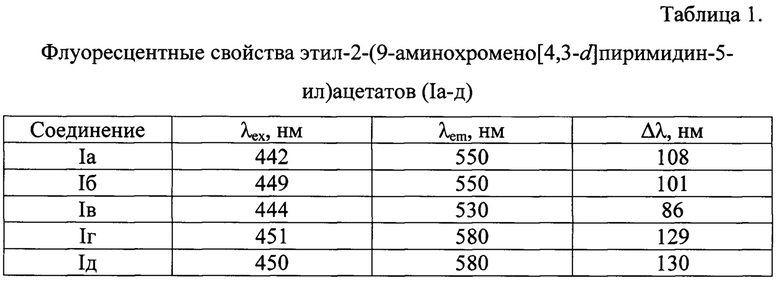
Пример 6. Флуоресцентные свойства этил-2-(9-аминохромено[4,3-d]пиримидин-5-ил)ацетатов (Ia-д).
Спектры экстинкции и эмиссии растворов исследуемых соединений Ia-д зарегистрированы на спектрофлуориметре BMGLabtechCLARIOstar. Растворы веществ Ia-д были приготовлены в диметилсульфоксиде в концентрации 10-4 моль/л. Длины волн максимумов поглощения (λex) и флуоресценции (λem) представлены в таблице 1. Сдвиг Стокса (Δλ) рассчитан по формуле (1):

Из полученных данных следует, что синтезированные 9-аминохромено[4,3-d]пиримидины Ia-д обладают флуоресценцией в желто-зеленой области спектра (530-580 нм) со стоксовым сдвигом 86-130 нм, что делает данные соединения пригодными для применения в качестве флуоресцентных красителей и/или зондов в биохимических исследованиях.
| название | год | авторы | номер документа |
|---|---|---|---|
| Производные 2-(хромено[4,3-d]пиримидин-5-ил)уксусной кислоты и способ их получения | 2019 |
|
RU2716597C1 |
| Производные 2-(хромено[4,3-b]пиридин-5-ил)уксусной кислоты и способ их получения | 2021 |
|
RU2793186C1 |
| Производные 2-(пирано[3,2-c]хромен-5-ил)уксусной кислоты и способ их получения | 2021 |
|
RU2775546C1 |
| Способ получения замещенных O-алкилированных гексагидро-2H-хромено[4,3-d]пиримидин-2,5(1H)-дионов | 2022 |
|
RU2796532C1 |
| N-Арил-4-(5-нитрофуран-2-ил)-пиримидин-5-амины, проявляющие антибактериальную активность, и способ их получения | 2017 |
|
RU2642428C1 |
| Способ получения замещенных (4R*,5S*,6R*)-2-тиогексагидропиримидин-5-карбогидразидов | 2021 |
|
RU2776954C1 |
| АНТАГОНИСТЫ ХЕМОКИНОВЫХ РЕЦЕПТОРОВ | 2013 |
|
RU2646762C2 |
| БИЦИКЛИЧЕСКИЕ ГЕТЕРОЦИКЛИЛЬНЫЕ СОЕДИНЕНИЯ И ИХ ПРИМЕНЕНИЯ | 2020 |
|
RU2811612C2 |
| ПРОИЗВОДНЫЕ ПИРИДОПИРИМИДИНОНА И ИХ ИСПОЛЬЗОВАНИЕ В КАЧЕСТВЕ МОДУЛЯТОРОВ РЕЦЕПТОРА АРОМАТИЧЕСКИХ УГЛЕВОДОРОДОВ | 2021 |
|
RU2818954C1 |
| Соединения формул (I) и (A), фармацевтическая композиция, лекарственное средство, применение и способ получения соединения формулы (I) | 2018 |
|
RU2822758C2 |
Настоящее изобретение относится к области органической химии, а именно к этил-2-(9-аминохромено[4,3-d]пиримидин-5-ил)ацетату общей формулы I
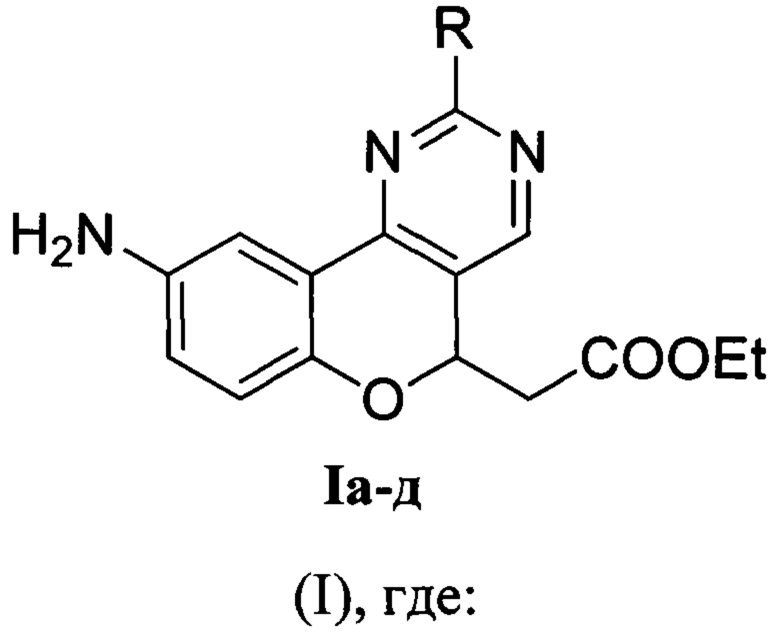
R=Me (Ia) - этил-2-(9-амино-2-метил-5H-хромено[4,3-d]пиримидин-5-ил)ацетат; R=Ph (Iб) - этил-2-(9-амино-2-фенил-5H-хромено[4,3-d]пиримидин-5-ил)ацетат; R=NH2 (Iв) - этил-2-(2,9-диамино-5H-хромено[4,3-d]пиримидин-5-ил)ацетат; R=MeS (Iг) - этил-2-(9-амино-2-метилтио-5H-хромено[4,3-d]пиримидин-5-ил)ацетат; R=PhCH2S (Iд) - этил-2-(9-амино-2-бензилтио-5H-хромено[4,3-d]пиримидин-5-ил)ацетат. Также предложен способ получения этил-2-(9-аминохромено[4,3-d]пиримидин-5-ил)ацетатов общей формулы I. Технический результат: предложены новые соединения, которые могут быть использованы в качестве флуоресцентных красителей и зондов. 2 н.п. ф-лы, 1 табл., 6 пр.
1. Этил-2-(9-аминохромено[4,3-d]пиримидин-5-ил)ацетаты общей формулы I
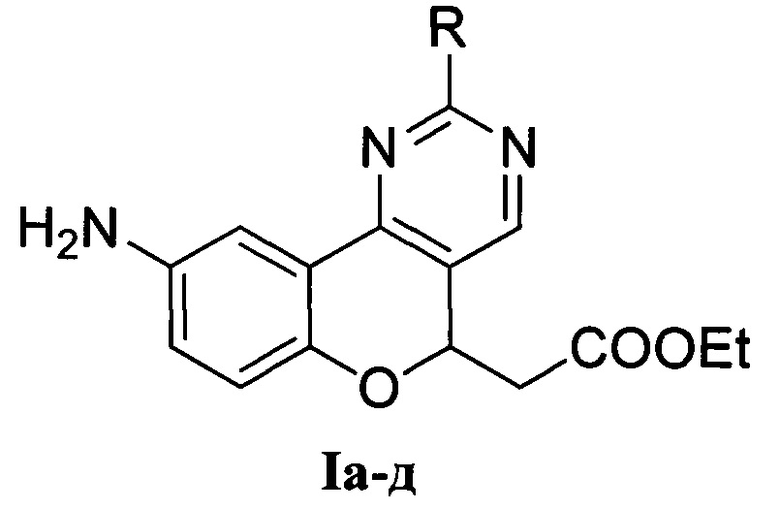
(I), где:
R = Me (Ia) - этил-2-(9-амино-2-метил-5H-хромено[4,3-d]пиримидин-5-ил)ацетат;
R = Ph (Iб) - этил-2-(9-амино-2-фенил-5H-хромено[4,3-d]пиримидин-5-ил)ацетат;
R = NH2 (Iв) - этил-2-(2,9-диамино-5H-хромено[4,3-d]пиримидин-5-ил)ацетат;
R = MeS (Iг) - этил-2-(9-амино-2-метилтио-5H-хромено[4,3-d]пиримидин-5-ил)ацетат;
R = PhCH2S (Iд) - этил-2-(9-амино-2-бензилтио-5H-хромено[4,3-d]пиримидин-5-ил)ацетат.
2. Способ получения этил-2-(9-аминохромено[4,3-d]пиримидин-5-ил)ацетатов общей формулы I
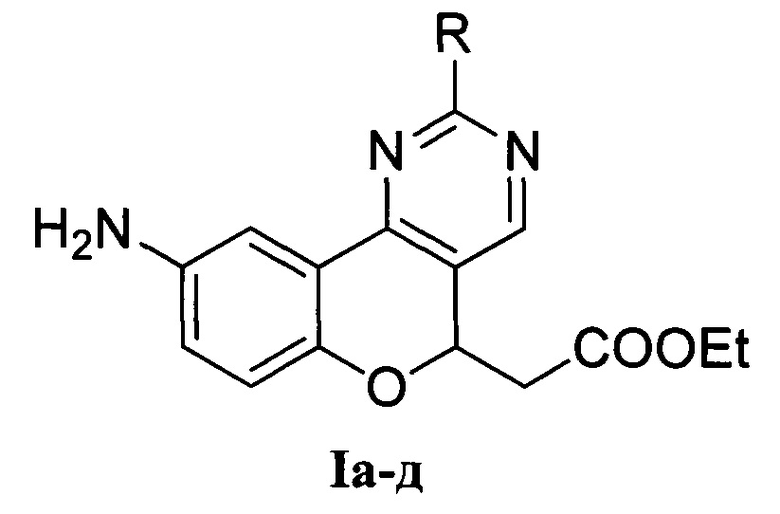
(I), где:
R = Me (Ia) - этил-2-(9-амино-2-метил-5H-хромено[4,3-d]пиримидин-5-ил)ацетат;
R = Ph (Iб) - этил-2-(9-амино-2-фенил-5H-хромено[4,3-d]пиримидин-5-ил)ацетат;
R = NH2 (Iв) - этил-2-(2,9-диамино-5H-хромено[4,3-d]пиримидин-5-ил)ацетат;
R = MeS (Iг) - этил-2-(9-амино-2-метилтио-5H-хромено[4,3-d]пиримидин-5-ил)ацетат;
R = PhCH2S (Iд) - этил-2-(9-амино-2-бензилтио-5H-хромено[4,3-d]пиримидин-5-ил)ацетат,
путем взаимодействия этил-3-(6-нитро-4-оксо-4H-хромен-3-ил)акрилата и бинуклеофильного реагента, выбранного из группы: ацетамидина, бензамидина, гуанидина, S-метилизотиомочевины, S-бензилизотиомочевины, в этаноле при температуре 15-25°С, причем бинуклеофильный реагент генерируется непосредственно в реакционной массе из соли бинуклеофильного реагента, выбранного из хлорида или сульфата, под действием сильного основания, выбранного из этилата натрия, гидроксида натрия, 1,8-диазабицикло[5.4.0]ундец-7-ена, по завершении реакции выделяют полупродукт путем выливания реакционной смеси в 1М соляную кислоту, в случае, когда в соединении формулы I R=Me, Ph, MeS, PhCH2S, или в воду, в случае, когда в соединении I R=NH2, а целевой продукт получают восстановлением полупродукта дихлоридом олова в кипящем этаноле.
| CHERNOV N.M | |||
| et al | |||
| Очаг для массовой варки пищи, выпечки хлеба и кипячения воды | 1921 |
|
SU4A1 |
| Устройство для устранения мешающего действия зажигательной электрической системы двигателей внутреннего сгорания на радиоприем | 1922 |
|
SU52A1 |
| Приспособление с иглой для прочистки кухонь типа "Примус" | 1923 |
|
SU40A1 |
| HAIST G.M | |||
| Modern Photographic Processing, New York, Chichester, Brisbane, Toronto: John Whiley and sons, 1979, Vol | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| BRUNO O | |||
| et al | |||
| Progress in | |||
Авторы
Даты
2021-04-21—Публикация
2020-10-06—Подача