Область изобретения
Настоящее изобретение относится к области медицины человека и ветеринарной медицины, и косметологии. В частности изобретение относится к амидным производным 2-гидрокси-2-метил-4-(3,5,6-триметил-1,4-бензохинон-2-ил)бутановой кислоты для лечения состояний, при которых ингибирование активности и/или экспрессии фермента mPGES-1 может быть полезным, таких как воспалительные заболевания, ноцицептивная боль, аутоиммунные заболевания, нарушения дыхания, лихорадка, злокачественная опухоль, обусловленная воспалением анорексия, болезнь Альцгеймера и сердечно-сосудистое заболевание.
Уровень техники
Простагландины (PG) являются важными липидными медиаторами, поддерживающими физиологическую и гомеостатическую функцию, а также индуцирующими патологический ответ, такой как воспалительный и ноцицептивный ответы (Miller, 2006). Простагландины синтезируются из арахидоновой кислоты (AA), которая высвобождается из клеточной мембраны под действием фосфолипазы A2 (PLA2). Изоформы 1 и 2 ферментов циклооксигеназ (COX-1 и COX-2) метаболизируют AA в простагландин G2 (PGG2), а затем в простагландин H2 (PGH2) посредством реакции бис-оксигенации и перокисления, соответственно. PGH2 является общим предшественником четырех основных биологически активных простагландинов: PGD2, PGI2, PGE2 и PGF2α и простаноида тромбоксана A2 (TXA2), которые синтезируются специфическими для клеток и тканей синтазами и изомеразами (фиг.1). Простагландины играют ключевую роль в индукции воспалительного ответа (Ricciotti and FitzGerald, 2011). Их биосинтез значительно возрастает в воспаленной ткани и может приводить к развитию главных симптомов острого воспаления. Среди простаноидов, PGE2 имеет наибольшее влияние на обработку воспалительных болевых сигналов (Nakanishi and Rosenberg, 2013). PGE2 синтезируется тремя различными синтазами PGE2, которые являются либо мембранными ферментами (mPGES-1, mPGES-2), либо цитозольными (cPGES) (Hara et al., 2010). Среди этих синтаз PGE, cPGES и mPGES-2 конститутивно экспрессируются в различных органах и тканях, в то время как уровень mPGES-1, такого как COX-2, повышается в ответ на различные воспалительные стимулы (Ikeda-Matsuo et al., 2005; Riendeau et al., 2005; Smith et al., 2011). После воспаления или ноцицептивных пусковых факторов происходит индукция mPGES-1 и COX-2 в периферической (ПНС) и центральной нервной системе (ЦНС), где они могут вносить вклад в образование PGE2 и развитие хронической боли (Zeilhofer, 2007). Современные нестероидные противовоспалительные лекарственные средства (NSAID) нацелены на вышерасположенные ферменты синтеза простагландинов COX. Неселективные ингибиторы COX-1/2 или селективные ингибиторы COX-2 (Coxib) являются наиболее часто назначаемыми лекарственными средствами при показаниях, связанных с воспалительной болью. Оба класса NSAID ассоциированы с серьезными сердечно-сосудистыми и желудочно-кишечными неблагоприятными явлениями (Norberg et al., 2013a). Фермент COX-1 конститутивно экспрессируется в большинстве тканей и обладает гастропротективным действием; таким образом, ингибиторы COX-1 могут индуцировать повреждение желудка. Несмотря на экспрессию в основном в воспаленных тканях, селективные ингибиторы COX-2 связаны с сердечно-сосудистыми неблагоприятными явлениями и гипертензией. Исследования показали, что эти эффекты связаны с подавлением опосредуемого COX-2 синтеза простациклинов (PGI2) (Catella-Lawson et al.; Mcadam et al., 1999; Hui et al., 2010). Действительно, PGI2 играет важную роль в расширении кровеносных сосудов, ингибировании агрегации тромбоцитов, а также является кардиопротектором. Уровень mPGES-1 значительно повышается посредством воспалительных стимулов, что приводит к продуцированию провоспалительного, проноцицептивного и проангиогенного PGE2. Нацеливание на нижерасположенный фермент mPGES-1 недавно появилось в качестве более безопасной альтернативы, чем современные классы NSAID или Coxib (Samuelsson et al., 2007; Koeberle and Werz, 2009, 2015a; Chen et al., 2015). Действительно, в противоположность его вышерасположенным ферментам COX-1 и COX-2, ингибирование mPGES-1 селективно блокирует индуцируемый воспалением PGE2 без снижения синтеза и функции других простагландинов. Таким образом, нацеливание на mPGES-1 может снизить неблагоприятные эффекты, приписываемые неселективному ингибированию синтеза простагландинов посредством NSAID или ингибированию самой COX-1 (Norberg et al., 2013b; Koeberle and Werz, 2015b). mPGES-1 слабо экспрессируется в нормальных тканях и активируется в воспаленных тканях, таким образом, она является менее склонной к специфическим неблагоприятным эффектам. Модифицированные способами инженерии мыши, лишенные mPGES-1, являются жизнеспособными и не имеют какого-либо аномального фенотипа. Было показано, что они имеют сниженные симптомы, ассоциированные с воспалением, такие как опухание, анорексия или лихорадка, и также сниженную чувствительность к боли (Kamei et al., 2004; Hara et al., 2010). Эти данные подтверждают применимость mPGES-1 в качестве мишени для лекарственного средства при связанном с воспалением заболевании. Кроме того, было описано, что его экспрессия повышена в воспаленных тканях пациентов, страдающих, но не ограничиваясь этим, артритом, подагрой, заболеванием кишечника и периодонтитом, и пациентов с нейровоспалением, таким как болезнь Альцгеймера, боковой амиотрофический склероз, болезнь Паркинсона, ишемия головного мозга, эпилепсия, злокачественная опухоль головного мозга и рассеянный склероз (Fahmi, 2004; Westman et al., 2004; Kojima et al., 2005; Chaudhry et al., 2008; Miyagishi et al., 2012; Akitake et al., 2013; Kats et al., 2013; Takeuchi et al., 2013; Ikeda-Matsuo, 2017). mPGES-1 также сверхэкспрессируется в многочисленных злокачественных опухолях, и описано, что ее ингибирование является эффективным способом лечения злокачественной опухоли в различных доклинических моделях (Larsson et al.; Seo et al.; Yoshimatsu et al.; Hanaka et al., 2009; Beales and Ogunwobi, 2010; Nakanishi et al., 2010; Larsson and Jakobsson, 2015; Sasaki et al., 2015; Kim et al., 2016; Ramanan and Doble, 2017). В целом, PGE2, продуцируемому с помощью mPGES-1 и mPGES-1, приписывают роль в патологических механизмах большого набора заболеваний и состояний, воспалительных заболеваний, ноцицептивной боли, аутоиммунных заболеваний, нарушений дыхания, лихорадки, злокачественной опухоли, связанной с воспалением анорексии, болезни Альцгеймера и сердечно-сосудистом заболевании. Таким образом, ингибиторы mPGES-1 являются эффективной возможностью лечения всех из упомянутых выше заболеваний и состояний.
В WO 2006/063466, WO 2007/059610, WO 2008/058514, WO 2008/071173, WO 2009/130242, WO 2009/146696, WO 2010/034796, WO 2010/100249, WO 2010/127152, WO 2011/023812 WO 2012/055995, WO 2012/076672, WO 2012/110860, WO 2013/038308 WO 2013/072825, WO 2013/118071, WO 2013/153535 и WO 2015/158204 описаны многочисленные соединения, которые, как утверждается, являются ингибиторами mPGES-1.
В WO2014/011047 и WO2017/060432 описаны амидные производные 2-гидрокси-2-метил-4-(3,5,6-триметил-1,4-бензохинон-2-ил)бутановой кислоты для лечения или предупреждения митохондриальных нарушений и/или состояний, ассоциированных с митохондриальной дисфункцией.
Однако, в данной области остается необходимость в дополнительных ингибирующих mPGES-1 соединениях, которые имеют улучшенные профили безопасности, эффективности и/или (пероральной) биодоступности. Настоящее изобретение относится к таким дополнительным соединениям, которые действуют в качестве ингибиторов mPGES-1 и, таким образом, являются пригодными для лечения состояний, при которых ингибирование активности и/или экспрессии фермента mPGES-1 может быть полезным, включая, например, предупреждение или подавление воспаления или боли при различных заболеваниях или состояниях.
Сущность изобретения
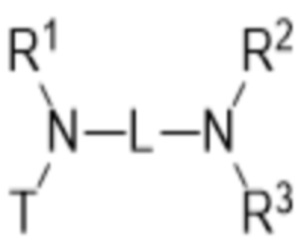
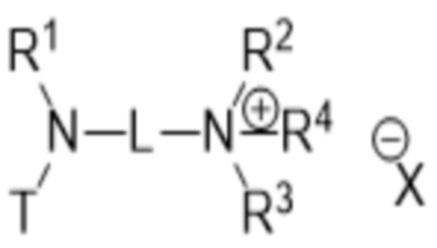
В первом аспекте изобретение относится к соединению, соответствующему общей структуре (I):
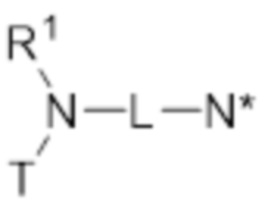
(I)
где
- T представляет собой растворимое в воде производное витамина E, имеющее центральный каркас хроманила или хроманилхинона и часть в виде карбоновой кислоты, замещенную в положении 2, где T связан с азотом через часть в виде карбоновой кислоты, по существу формируя амидную часть;
- L представляет собой линкер между атомом азота амида и дистальным атомом азота, содержащий 1-10 необязательно замещенных атомов основной цепи, выбранных из углерода, азота и кислорода;
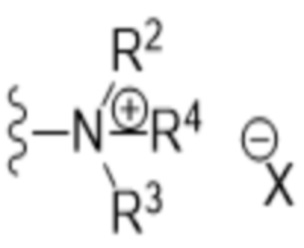
- N* соответствует структуре (IIa) или (IIb)
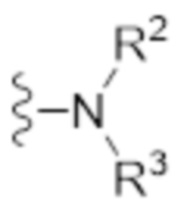
(IIa)
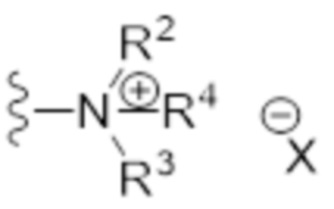
(IIb)
- каждый из R1 и R2 независимо выбран из водорода (H), C1-C6 алкила или C1-C6 алкенила, или R1 и R2 соединены вместе и, таким образом, образуют второй линкер между атомом азота амида и дистальным атомом азота, или R1 соединен с атомом остова линкера L в циклическую структуру и/или R2 соединен с атомом остова линкера L в циклическую структуру;
- R3 выбран из водорода (H), C1-C6 алкила или C1-C6 алкенила, где алкильная или алкенильная часть может быть замещена одним или несколькими атомами галогена, гидроксильными частями или (галоген)алкоксичастями, или R3 отсутствует, когда дистальный атом азота является частью иминочасти; и
- R4 выбран из водорода (H) или C1-C6 алкила, где алкильная часть может быть замещена одним или несколькими атомами галогена или (галоген)алкоксичастями;
- X представляет собой анион, предпочтительно фармацевтически приемлемый анион,
для применения для лечения, предупреждения или подавления симптомов, опосредуемых усиленной экспрессией или активностью mPGES-1.
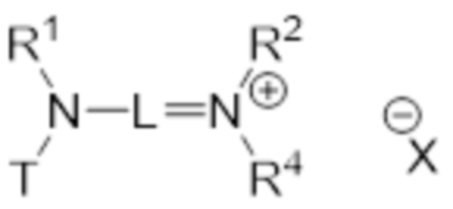
В конкретных вариантах осуществления этого аспекта изобретение относится к соединению для применения в соответствии с изобретением, где соединение соответствует структуре (VI):
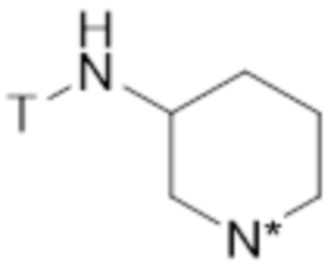
(VI)
где N* представляет собой -NR3 или -N+R3R4 X-, где T, X, R3 и R4 являются такими, как определено выше.
В предпочтительных вариантах осуществления этого аспекта изобретение относится к соединению для применения в соответствии с изобретением, где T соответствует структуре (IIIa) или (IIIb):
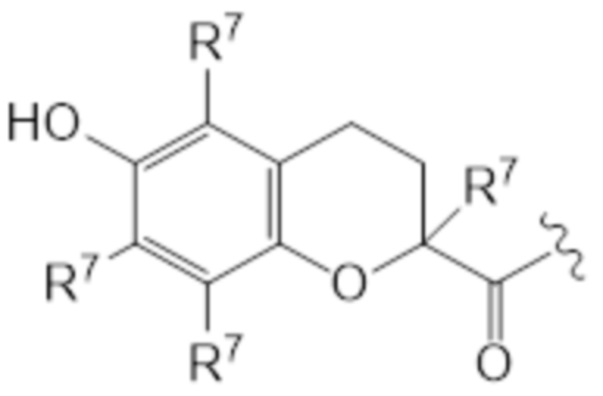
(IIIa)
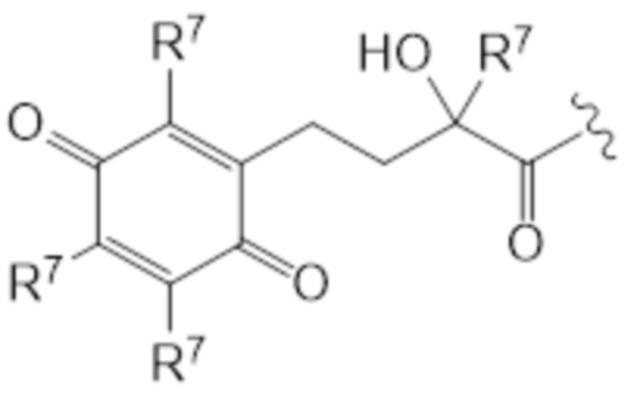
(IIIb)
где каждый R7 индивидуально представляет собой C1-C6 алкильную часть, предпочтительно каждый R7 представляет собой метил.
В предпочтительных вариантах осуществления этого аспекта изобретение относится к соединению для применения в соответствии с изобретением, где соединение соответствует структуре (VIIb):
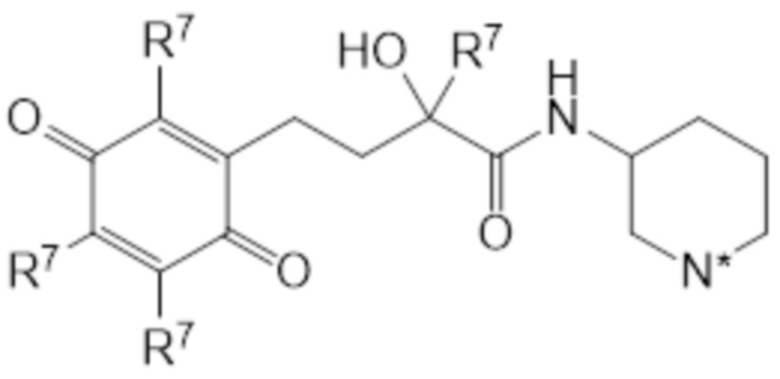
(VIIb)
где
каждый R7 представляет собой метил;
N* представляет собой -NR3 или -N+R3R4 X-;
X является таким, как определено выше, и предпочтительно представляет собой Cl-;
R3 является таким, как определено выше, и предпочтительно представляет собой водород; и
R4 является таким, как определено выше, и предпочтительно представляет собой водород.
В предпочтительных вариантах осуществления этого аспекта изобретение относится к соединению для применения в соответствии с изобретением, где симптомы, опосредуемые усиленной экспрессией или активностью mPGES-1, включают по меньшей мере одно или несколько из воспаления, боли, опухания, лихорадки, ангиогенеза и анорексии. Предпочтительно, соединение используют для предупреждения или подавления симптомов, опосредуемых усиленной экспрессией или активностью mPGES-1, для лечения заболевания или состояния, выбранного из группы, состоящей из:
a) острого и хронического воспаления; заболеваний кожи, таких как дерматит, экзема, псориаз, ожоги, обыкновенные угри, гнойный гидраденит и травма ткани; висцеральных заболеваний, таких как воспалительное заболевание кишечника, болезнь Крона, язвенный колит, дивертикулит, синдром раздраженного кишечника (IBS), пептические язвы, цистит, (хронический) простатит, панкреатит или нефрит; заболевания уха, носа, полости рта и горла, такого как грипп, ринит, фарингит, тонзиллит, конъюнктивит, ирит, склерит, отит и увеит; вирусных и бактериальных инфекций; связанной с воспалением анорексии; аллергии; воспалительного заболевания таза; реперфузионного повреждения; отторжения трансплантата; тендинита, васкулита и флебита;
b) острой боли, хронической боли, невропатической боли, ноцицептивной боли, гипералгезии, боли, связанной с центральной сенсибилизацией, воспалительной боли по типу аллодинии, висцеральной боли, боли при злокачественной опухоли, боли при травме, зубной или хирургической боли, послеоперационной боли, боли при родах, болезненности при деторождении, персистирующей боли, периферически-опосредуемой боли, центрально-опосредуемой боли, хронической головной боли, мигрени, синусовых головных болей, тензионных головных болей, фантомных болей конечностей, боли при химиотерапии, обусловленной повреждением периферических нервов, и боли при злокачественной опухоли;
c) аутоиммунного заболевания, такого как артрит, остеоартрит, ювенильный артрит, ревматоидный артрит, анкилозирующий спондилит, подагра, ревматическая атака, бурсит, системная красная волчанка (SLE) и рассеянный склероз;
d) нарушений дыхания или заболеваний легких, таких как астма, хроническое обструктивное заболевание легких (COPD), саркоидоз и фиброз легких;
e) злокачественной опухоли, такой как рак головного мозга, рак предстательной железы, рак почки, рак печени, рак поджелудочной железы, рак желудка, рак молочной железы, рак легкого, рак головы и шеи, рак щитовидной железы, глиобластома, меланома, лимфома, лейкоз, T-клеточная лимфома кожи и B-клеточная лимфома кожи;
f) осложнений диабета, включающих диабетическую васкулопатию, диабетическую невропатию и диабетическую ретинопатию;
g) нейродегенеративного нарушения, такого как болезнь Альцгеймера, болезнь Паркинсона, болезнь Гентингтона и боковой амиотрофический склероз; и
h) сердечно-сосудистого заболевания, такого как атеросклероз, тромбоз, инсульт и коронарная болезнь сердца.
В предпочтительных вариантах осуществления этого аспекта изобретение относится к соединению для применения в соответствии с изобретением, где общая суточная доза, которую вводят, находится в диапазоне приблизительно от 5 до 2000 мг, предпочтительно приблизительно от 20 до 800 мг, более предпочтительно общая суточная доза находится в диапазоне приблизительно от 30 до 400 мг и наиболее предпочтительно общая суточная доза находится в диапазоне приблизительно от 150 до 250 мг. Предпочтительно соединение вводят перорально. Предпочтительно, соединение вводят в твердой форме или в жидкой форме, где предпочтительно соединение смешивают с водным раствором перед введением, где более предпочтительно водный раствор представляет собой изотонический водный раствор и где еще более предпочтительно изотонический водный раствор представляет собой солевой раствор. Предпочтительно, соединение вводят по меньшей мере два раза в сутки, предпочтительно где соединение вводят два раза в сутки, где более предпочтительно соединение вводят два раза в сутки в двух сходных или равных дозах. Предпочтительно, интервал между двумя введениями составляет по меньшей мере приблизительно 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11 или 12 часов. Предпочтительно, индивидуумом, подвергаемым лечению, является примат, где более предпочтительно индивидуумом является человек.
Во втором аспекте изобретение относится к способу лечения заболевания или состояния, опосредуемого или ассоциированного с усиленной экспрессией или активностью mPGES-1, где способ включает стадию введения индивидууму, страдающему от заболевания или состояния, эффективного количества соединения, как определено выше.
В предпочтительных вариантах осуществления этого аспекта изобретение относится к способу, как описано выше, где заболевание или состояние, опосредуемое или ассоциированное с усиленной экспрессией или активностью mPGES-1, предпочтительно выбрано из группы, состоящей из a) острого и хронического воспаления; заболеваний кожи, таких как дерматит, экзема, ожоги, обыкновенные угри, гнойный гидраденит и травма ткани; висцеральных заболеваний, таких как язвенный колит, дивертикулит, синдром раздраженного кишечника (IBS), пептические язвы, цистит, (хронический) простатит или нефрит; заболевания уха, носа, полости рта и горла, такого как грипп, ринит, фарингит, тонзиллит, конъюнктивит, ирит, склерит, отит и увеит; вирусных и бактериальных инфекций; связанной с воспалением анорексии; аллергии; воспалительного заболевания таза; реперфузионного повреждения; отторжения трансплантата; тендинита, васкулита и флебита; b) острой боли, хронической боли, невропатической боли, ноцицептивной боли, гипералгезии, боли, связанной с центральной сенсибилизацией, воспалительной боли по типу аллодинии, висцеральной боли, боли при злокачественной опухоли, боли при травме, зубной или хирургической боли, послеоперационной боли, боли при родах, болезненности при деторождении, персистирующей боли, периферически-опосредуемой боли, центрально-опосредуемой боли, хронической головной боли, мигрени, синусовых головных болей, тензионных головных болей, фантомных болей конечностей, боли при химиотерапии, обусловленной повреждением периферических нервов, и боли при злокачественной опухоли; c) анкилозирующего спондилита, подагры, ревматической атаки, бурсита; и d) осложнений диабета, включая диабетическую васкулопатию, диабетическую невропатию и диабетическую ретинопатию.
Описание изобретения
Настоящее изобретение относится к открытию того, что соединения по изобретению, такие как амидные производные 2-гидрокси-2-метил-4-(3,5,6-триметил-1,4-бензохинон-2-ил)-бутановой кислоты, способны эффективно и селективно снижать уровень индуцируемого mPGES-1 PGE2 без влияния на уровень других простагландинов посредством блокирования экспрессии mPGES-1 и его ферментативной активности. Таким образом, соединения являются пригодными в способах лечения для предупреждения или подавления симптомов, опосредуемых усиленной экспрессией или активностью mPGES-1 и/или опосредуемых (конечными) увеличенными уровнями PGE2.
В первом аспекте изобретение, таким образом, относится к способу лечения, предупреждения или подавления симптомов, опосредуемых усиленной экспрессией или активностью mPGES-1, причем способ включает введение индивидууму, нуждающемуся в этом, эффективного количества одного или нескольких соединений по изобретению, как определено в настоящем описании ниже. Эффективное количество предпочтительно представляет собой количество, как определено в настоящем описании ниже.
Альтернативно изобретение относится к соединению по изобретению, как определено ниже, для применения для лечения, предупреждения или подавления симптомов, опосредуемых усиленной экспрессией или активностью mPGES-1, предпочтительно путем введения эффективной дозы соединения, как определено в настоящем описании ниже.
Медицинское применение, описанное в настоящем описании, формулируется как соединение, как определено в настоящем описании, для применения в качестве лекарственного средства для лечения указанного состояния(ий) (например, путем введения эффективного количества соединения), однако оно также может быть сформулировано как i) способ лечения указанного состояния(й) с использованием соединения, как определено в настоящем описании, включающий стадию введения индивидууму эффективного количества соединения, ii) соединение, как определено в настоящем описании, для применения для производства лекарственного средства для лечения указанного состояния(й), где предпочтительно соединение предназначено для введения в эффективном количестве, и iii) применение соединения, как определено в настоящем описании, для лечения указанного состояния(й), предпочтительно путем введения эффективного количества. Все такие медицинские применения охватываются настоящим изобретением.
Соединение по изобретению может быть идентифицировано с помощью общей структуры (I):
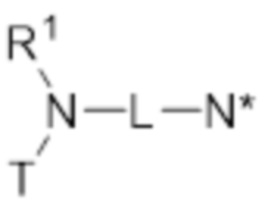
(I)
здесь
- T представляет собой растворимое в воде производное витамина E, имеющее центральный каркас хроманила или хроманилхинона и часть в виде карбоновой кислоты, замещенную в положении 2, где T связан с азотом через часть в виде карбоновой кислоты, по существу формируя амидную часть;
- L представляет собой линкер между атомом азота амида и дистальным атомом азота, содержащий 1-10 необязательно замещенных атомов основной цепи, выбранных из углерода, азота и кислорода;
- N* соответствует структуре (IIa) или (IIb)

(IIa)
(IIb)
- каждый из R1 и R2 независимо выбран из водорода (H), C1-C6 алкила или C1-C6 алкенила, или R1 и R2 соединены вместе и, таким образом, образуют второй линкер между атомом азота амида и дистальным атомом азота, или R1 соединен с атомом остова линкера L в циклическую структуру и/или R2 соединен с атомом остова линкера L в циклическую структуру;
- R3 выбран из водорода (H), C1-C6 алкила или C1-C6 алкенила, где алкильная или алкенильная часть может быть замещена одним или несколькими атомами галогена, гидроксильными частями или (галоген)алкоксичастями, или R3 отсутствует, когда дистальный атом азота является частью иминочасти; и
- R4 выбран из водорода (H) или C1-C6 алкила, где алкильная часть может быть замещена одним или несколькими атомами галогена или (галоген)алкоксичастями;
- X представляет собой анион, предпочтительно фармацевтически приемлемый анион.
Соединение в соответствии со структурой (I) содержит по меньшей мере два атома азота: атом азота, с которым соединен T, который также называют "атомом азота амида", и атом азота части N*, который также называют "дистальным атомом азота". N* может представлять собой аминочасть, когда ковалентная связь между дистальным атомом азота и соседним атомом остова представляет собой одинарную связь, или часть иминочасти, когда ковалентная связь между дистальным атомом азота и соседним атомом остова представляет собой двойную связь. Дистальный атом азота может быть нейтральным или катионным. В случае, когда N* является нейтральным, соединение по изобретению также может быть указано посредством общей структуры (Ia). В случае, когда N* является катионным, соединение по изобретению может быть указано посредством общей структуры (Ib).
(Ia)
(Ib)
T представляет собой растворимое в воде производное витамина E, где каркас хроманила или хроманилхинона замещен карбоновой кислотой во 2 положении. Вариант 2-карбокси витамина E также известен как Trolox™ (6-гидрокси-2,5,7,8-тетраметилхроман-2-карбоновая кислота). Растворимые в воде производные витамина E известны в данной области и включают 6-гидрокси-2,5,7,8-тетраалкил-2-карбоксихроманил (общая структура (IIIa), также указываемый как "закрытая форма") и его окисленную форму 2-(3-гидрокси-3-алкил-4-оксобутил)-3,5,6-триалкилциклогекса-2,5-диен-1,4-дион (общая структура (IIIb), также указываемая как "открытая форма"). Авторы изобретения обнаружили, что открытая форма согласно общей структуре (IIIb) встречается в качестве метаболита закрытой формы в соответствии с общей структурой (IIIa), когда последнюю вводят. После обработки в течение 24 ч клеточной линии P4 соединением I-IVa-X (соединение общей структуры (I), где T представляет собой общую структуру (IVa), в конфигурации S, R, и где в отношении соединения X применимо следующее: L=L19; R1=H; R2-R2’ = L3; R3=H), приблизительно 48% (±10%) закрытого соединения конвертировалось в открытую форму. Приблизительно 15% (±3%) конвертировалось в ходе того же периода при инкубации только со средой. Такое конвертирование также описано в Beyrath et al., DOI: 10.1038/s41598-018-24900-3, и в Koene et al., DOI: 10.1186/s13023-017-0715-0. Предпочтительным каркасом хроманила является каркас 6-гидроксихромана. Предпочтительным каркасом хроманила является 2-(3-гидроксиалкил)-циклогекса-2,5-диен-1,4-дион, где предпочтительно 3-гидроксиалкил представляет собой 3-гидроксибутил, более предпочтительно 4-оксо-3-гидроксибутил, содержащийся в общей структуре (IIIb).
2 положение закрытой формы представляет собой положение в кольце оксана, имеющее карбоновую кислоту (или амид, как в случае молекулы по изобретению) и часть R7, которое представляет собой 2 положение в соответствии с соглашениями по наименованию, известными в данной области, такими ка номенклатура IUPAC. Для открытой формы тот же атом углерода подразумевается для 2 положения, так что указывается атом углерода, имеющий гидроксильную часть и часть R7. Как показано для общей структуры (IIIb) ниже. Это положение также может считаться 3 положением алкильной части, которое замещено хиноном. Таким образом, T представляет собой растворимое в воде производное витамина E, где каркас хроманила замещен карбоновой кислотой во 2 положении или где каркас хроманилхинона замещен карбоновой кислотой в 3 положении 3-гидроксиалкильной части, которое в свою очередь заменяется на 2’ положение циклогекса-2,5-диен-1,4-диона.
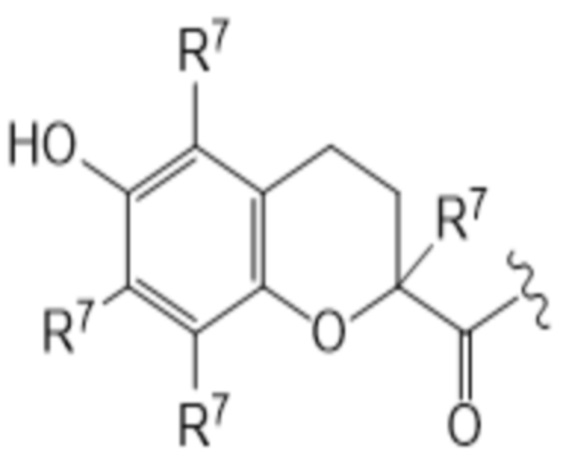
(IIIa)
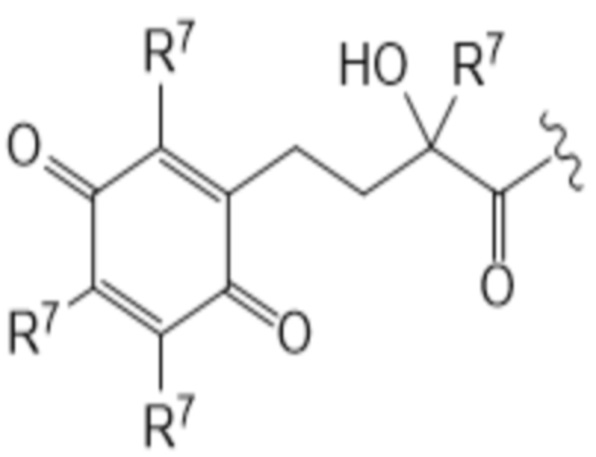
(IIIb)
Здесь R7 в каждом случае индивидуально выбран из галогена, алкила, амино, нитро или -NHCO-алкила. Предпочтительными вариантами для R7 являются галоген и алкил, наиболее предпочтительно алкил. В контексте R7, галоген предпочтительно представляет собой фтор или хлор, наиболее предпочтительно хлор. В этом контексте алкил предпочтительно представляет собой C1-C6 алкильную часть, предпочтительно C1-C6 алкильную часть, наиболее предпочтительно метил. В контексте R7 амино предпочтительно представляет собой -NH2. В контексте R7 -NHCO-алкил предпочтительно представляет собой -NHCOMe. Предпочтительно, каждый R7 представляет собой один и тот же заместитель. Наиболее предпочтительно, R7 представляет собой метил. В предпочтительном варианте осуществления T соответствует структуре (IVa) или (IVb). Иными словами, структура (IVa) является предпочтительным вариантом осуществления структуры (IIIa), и структура (IVb) является предпочтительным вариантом осуществления структуры (IIIb).
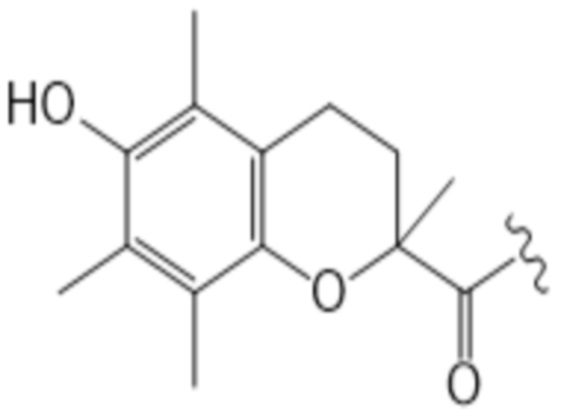
(IVa)
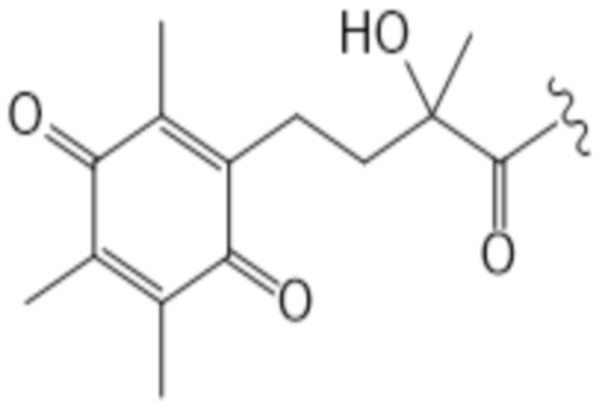
(IVb)
В предпочтительном варианте осуществления T соответствует структуре IIIa или IIIb, предпочтительно структуре IVa или IVb. В более предпочтительном варианте осуществления T соответствует структуре (IIIa), предпочтительно структуре (IVa). В еще более предпочтительном варианте осуществления T соответствует структуре (IIIb), предпочтительно структуре (IVb).
Соединение, идентифицируемое общей структурой (I), содержит по меньшей мере один хиральный атом углерода (стереоцентр), т.е. атом во 2 положении T (например, кольца оксана структуры (IIIa) или части в виде бутановой кислоты структуры (IIIa)). Как соединение, имеющее S-конфигурацию, так и соединение, имеющее R-конфигурацию атома углерода во 2 положении, охватываются настоящим изобретением, также как и смеси различных стереоизомеров. Такая смесь может иметь одну из конфигураций в энантиомерном избытке или может быть рацемической. Когда один или несколько дополнительных стереоцентров присутствуют в соединении по изобретению, например, в линкере L, каждый из них может индивидуально существовать в S-конфигурации, в R-конфигурации, или в качестве смеси обеих конфигураций. Такая смесь может иметь только одну из конфигураций в энантиомерном избытке или может быть рацемической. В случае, когда присутствуют дополнительные стереоцентры, настоящее изобретение охватывает все диастереомеры соединения, имеющего общую структуру (I), в каждом возможном соотношении.
В предпочтительном варианте осуществления растворимость соединения по изобретению в воде, выражаемая в качестве log(Pow), составляет от 2,0 до 5,0, предпочтительно от 2,5 до 4,5, более предпочтительно от 3,0 до 4,0. Log(Pow), логарифм коэффициента распределения между 1-октанолом и водой, является хорошо известной мерой растворимости в воде. Соединения, имеющие величину log(Pow) между 3 и 4, являются идеально сбалансированными между достаточной растворимостью в воде для получения водных растворов или суспензий и достаточной липофильностью для обеспечения эффективного транспорта соединения через клеточную мембрану. Квалифицированному специалисту будет понятно, как определить, какие комбинации L, R1, R2, R3, R4 и X, как определено в настоящем описании, обеспечивают соединение, имеющее величину log(Pow) между 3 и 4. Подходящие тесты для определения величины log(Pow) соединения хорошо известны специалисту в данной области и включают, но не ограничиваются ими, способ вращающегося флакона, ITIES, капельный способ или способ с использованием ВЭЖХ. Log(Pow) соединения также можно спрогнозировать с использованием алгоритмов QSPR.
Каждый из R1 и R2 независимо выбран из водорода (H), C1-C6 алкила или C1-C6 алкенила, или один или оба из R1 и R2 заключены в циклическую структуру, как описано в настоящем описании ниже. Предпочтительно, R1 представляет собой H или C1-C2 алкил или R1 и R2 соединены вместе и, таким образом, образуют второй линкер между атомом азота амида и дистальным атомом азота, или R1 соединен с атомом остова линкера L в циклическую структуру, более предпочтительно R1 представляет собой H или C1-C2 алкил, еще более предпочтительно R1 представляет собой H или метил (Me), наиболее предпочтительно R1 представляет собой H. Предпочтительно, R2 представляет собой H или C1-C2 алкил или R1 и R2 соединены вместе и, таким образом, образуют второй линкер между атомом азота амида и дистальным атомом азота, или R2 соединен с атомом остова линкера L в циклическую структуру, более предпочтительно R2 представляет собой H, C1-C2 алкил или соединен с атомом остова линкера L в циклическую структуру, еще более предпочтительно R2 представляет собой H, метил (Me), или соединен с атомом остова линкера L в циклическую структуру. В одном варианте осуществления R2 представляет собой H, метил (Me), предпочтительно R2 представляет собой H. В особенно предпочтительном варианте осуществления R2 соединен с атомом остова линкера L в циклическую структуру, как дополнительно определено ниже, предпочтительно в насыщенную циклическую структуру, наиболее предпочтительно в кольцо пиперидина.
В одном варианте осуществления атом азота амида соединен с дистальным атомом азота через второй линкер. Этот второй линкер определяется соединением вместе R1 на атоме азота амида и R2 на дистальном атоме азота. Таким образом, атом азота амида, дистальный атом азота, первый линкер и второй линкер вместе образуют циклическую структуру, предпочтительно 4-10-членную циклическую структуру, более предпочтительно 5-8-членную циклическую структуру, наиболее предпочтительно 6-членную циклическую структуру. В предпочтительном варианте осуществления второй линкер представляет собой мостик -CH2-CH2- или -CH2-CH2-CH2-, наиболее предпочтительно мостик -CH2-CH2-, где два или три, предпочтительно два, атома углерода присутствуют между атомом азота амида и дистальным атомом азота.
В другом варианте осуществления атом азота амида соединен с атомом остова линкера через второй линкер, тем самым образуя циклическую структуру, предпочтительно 4-10-членную циклическую структуру, более предпочтительно 5-8-членную циклическую структуру, наиболее предпочтительно 6-членную циклическую структуру. В этом отношении, атом остова линкера, с котором соединен атом азота, имеет заместитель R1’, который присоединен вместе с R1 к атому азота амида. Таким образом, атом азота амида, часть первого линкера, находящаяся между атомом азота амида и атомом, несущим R1’, атом остова, имеющий R1’, и второй линкер вместе образуют циклическую структуру. В этом варианте осуществления дистальный атом азота не включен в циклическую структуру, а вместо этого включена только часть остова линкера. В предпочтительном варианте осуществления это соединение между атомом азота амида и атомом остова линкера представляет собой мостик -CH2-CH2- или -CH2-CH2-CH2-, наиболее предпочтительно мостик -CH2-CH2-, где два или три, предпочтительно два, атома углерода присутствует между атомом азота амида и атомом остова линкера. Наиболее предпочтительно, циклическая структура, содержащая атом азота амида, представляет собой полностью насыщенное кольцо, предпочтительно выбранное из кольца пиперидина, кольца пирролидина, кольца пиперазина, кольца имидазолидина, кольца пиразолидина и кольца азепана, более предпочтительно кольца пиперазина, кольца пиперидина или кольца пирролидина, наиболее предпочтительно кольца пиперидина.
В другом варианте осуществления дистальный атом азота соединен с атомом остова линкера через второй линкер, тем самым образуя циклическую структуру, предпочтительно 4-10-членную циклическую структуру, более предпочтительно 5-8-членную циклическую структуру, наиболее предпочтительно 6-членную циклическую структуру. В этом отношении, атом остова линкера, с которым соединен атом азота, имеет заместитель R2’, который соединен с R2 на дистальном атоме азота. Таким образом, дистальный атом азота, часть первого линкера, находящаяся между дистальным атомом азота и атомом, несущим R2’, атом остова, имеющий R2’, и второй линкер вместе образуют циклическую структуру. В этом варианте осуществления атом азота амида не включен в эту циклическую структуру, а вместо этого включена только часть остова линкера. В предпочтительном варианте осуществления это соединение между дистальным атомом азота и атомом остова линкера представляет собой мостик -CH2-CH2- или -CH2-CH2-CH2-, наиболее предпочтительно мостик -CH2-CH2-, где два или более, предпочтительно два, атома углерода присутствуют между дистальным атомом азота и атомом остова линкера. Наиболее предпочтительно, циклическая структура, содержащая дистальный атом азота, представляет собой полностью насыщенное кольцо, предпочтительно выбранное из кольца пиперидина, кольца пирролидина, кольца пиперазина, кольца имидазолидина, кольца пиразолидина и кольца азепана, более предпочтительно, кольца пиперидина или кольца пирролидина, наиболее предпочтительно кольца пиперидина. Также является возможным, что существует связь между R1 на атоме азота амида и заместителем R1’ на линкере и между R2 на дистальном атоме азота и заместителем R2’ на линкере.
В другом варианте осуществления дистальный атом азота соединен с атомом остова линкера через второй и третий линкер, тем самым образуя бициклическую структуру, предпочтительно 6-12-членную циклическую структуру, более предпочтительно 6-9-членную циклическую структуру, такую как структура, подобная бициклооктану, наиболее предпочтительно структура, подобная [2.2.2]бициклооктану. В этом отношении атом остова линкера, с которым соединен атом азота, имеет заместители R2’ и R3’, которые соединены вместе с R2 и R3, соответственно, на дистальном атоме азота. Таким образом, дистальный атом азота, часть первого линкера, находящаяся между дистальным атомом азота и атомом, несущим R2’, атом остова, несущий R2’, и второй линкер вместе образуют один цикл бициклической структуры, и часть первого линкера, находящаяся между дистальным атомом азота и атомом, несущим R3’, и третий линкер образуют второй цикл бициклической структуры. В этом варианте осуществления атом азота амида не включен в эту бициклическую структуру, а вместо этого включена только часть остова линкера. В предпочтительном варианте осуществления эта связь между дистальным атомом азота и атомом остова линкера представляет собой мостик -CH2-, -CH2-CH2- или -CH2-CH2-CH2-, наиболее предпочтительно мостик -CH2-CH2-, где два или более, предпочтительно два, атома углерода присутствуют между дистальным атомом азота и атомом остова линкера. Наиболее предпочтительно, циклическая структура, содержащая дистальный атом азота, является полностью насыщенной структурой.
Среди упомянутых выше возможностей для R2 наиболее предпочтительно, чтобы дистальный атом азота был соединен с атомом остова линкера через второй линкер, где R2 соединен с R2’, как дополнительно определено в настоящем описании выше.
Когда дистальный атом азота является частью иминочасти, линкер L содержит по меньшей мере одну двойную связь, находящуюся между дистальным атомом азота и соседним атомом остова линкера, или R2 содержит по меньшей одну двойную связь, находящуюся между дистальным атомом азота и соседним атомом R2 (т.е. R2=C1-C6 алкенил). В таких случаях R3 отсутствует. В случае когда дистальный атом азота являются частью иминочасти, где двойная связь находится между дистальным атомом азота и соседним атомом остова линкера, соединение по изобретению может быть указано посредством структуры (Ic).
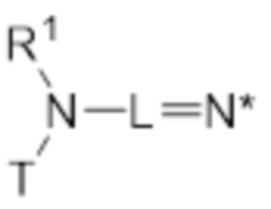
(Ic)
Когда дистальный атом азота является частью иминочасти в структуре (Ic), он может быть либо катионным, либо нейтральным. Для N*, как определяется структурами (IIa) и (IIb), где R3 отсутствует, применимы те же возможности. В случае когда дистальный атом азота является нейтральным и составляет часть иминочасти, где двойная связь находится между дистальным атомом азота и соседним атомом остова линкера, соединение согласно изобретению также может быть указано посредством общей структуры (Id). В случае когда дистальный атом азота является катионным и составляет часть иминочасти, где двойная связь находится между дистальным атомом азота и соседним атомом остова линкера, соединение согласно изобретению также может быть указано посредством общей структуры (Ie).
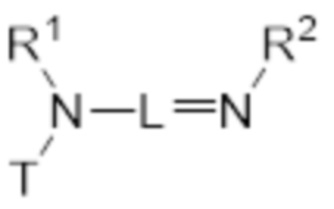
(Id)
(Ie)
В контексте настоящего изобретения дистальный азот, являющийся частью иминочасти, включает случаи, когда дистальный атом азота является частью гетероароматического кольца, в частности, кольца пиррола, кольца пиридина или кольца имидазола, и в этих случаях двойная связь формально присутствует между дистальным атомом азота и соседним атомом углерода, либо в линкере, либо в R2. Предпочтительные части, содержащие иминочасть, включают гуанидин, амидин и пиридин. Для гуанидина и амидина один из атомов азота замещен с образованием связи с атомом азота амида через линкер L. Для пиридина замещен один из атомов углерода. Когда дистальный атом азота является частью аминочасти, он соединен с линкером и R2 через две одинарных связи, и R3 присутствует. Предпочтительно, чтобы дистальный атом азота был частью аминочасти, т.е. имел три или четыре одинарных связи с каждым из R1, R2, R3 и необязательно R4.
В случае когда R3 присутствует, R3 выбран из водорода (H), C1-C6 алкила или C1-C6 алкенила, где часть алкила или алкенила может быть замещена одним или несколькими атомами галогена, гидроксильными группами или (галоген)алкоксичастями, предпочтительно R3 представляет собой H, C1-C6 алкил, более предпочтительно R3 представляет собой H или C1-C4 алкил, еще более предпочтительно R3 представляет собой H или C1-C2 алкил, где алкильная часть может быть замещена одним или несколькими атомами галогена, гидроксильными группами или (галоген)алкоксичастями. Атомы галогена включают фтор (F), хлор (Cl), бром (Br), йод (I) и астат (At), предпочтительно атом галогена представляет собой фтор (F). Предпочтительные алкоксичасти включают метокси и этокси. В галогеналкоксичастях по меньшей мере один атом водорода алкоксичасти заменен атомом галогена, предпочтительно F. Предпочтительными заместителями для алкильных частей являются атомы галогена и алкоксичасти. Подходящие части для R3 включают, предпочтительно ограничиваются ими, H, метил (Me), трифторметил (-CF3), этил (Et), изопропил (iPr), циклопропил (-cPr), метиленциклопропил (-CH2cPr), н-пропил (n-Pr), 2,2,2-трифторэтил (-CH2CF3), 2-гидроксиэтил (-CH2CH2OH) и метоксиметил (-CH2OCH3), более предпочтительно R3 представляет собой H или метил (Me), наиболее предпочтительно R3 представляет собой H. Альтернативно R3 предпочтительно представляет собой C1-C4 алкил, где алкильная часть может быть замещена одним или несколькими атомами галогена или (галоген)алкоксичастями, более предпочтительно R3 представляет собой C1-C2 алкил, где алкильная часть может быть замещена одним или несколькими атомами галогена или (галоген)алкоксичастями.
В случае когда дистальный атом азота находится в катионной форме, она формально образуется в результате протонирования или алкилирования, предпочтительно протонирования или метилирования, трехвалентного атома азота. Трехвалентный атом азота предпочтительно представляет собой аминочасть, либо первичную, либо вторичную, либо третичную, или иминочасть, либо первичную, либо вторичную. Противоион (X) катионного дистального атома азота представляет собой отрицательно заряженный ион, предпочтительно одновалентный отрицательно заряженный ион, более предпочтительно анион, как указано в настоящем описании ниже. Синтез соединений по изобретению не обязательно охватывает протонирование или алкилирование атома азота амина или имина. Катионный дистальный атом азота также может быть образован другим путем. По существу, катионный дистальный атом азота только "формально" образуется посредством протонирования или алкилирования атома азота амина или имина.
R4 представляет собой заместитель на катионном дистальном атоме азота, который образуется путем формального протонирования или алкилирования аминочасти или иминочасти. Таким образом, соединение согласно этому варианту осуществления ввиду присутствия катионного атома азота и X представляет собой соль, предпочтительно фармацевтически приемлемую соль. Фармацевтически приемлемые соли представляют собой соли, которые пригодны для введения в качестве лекарственных средств или фармацевтических средств человеку и/или животным. Фармацевтически приемлемые соли аминочасти или иминочасти соединения согласно изобретению известны специалистам в данной области и образуются посредством формальной обработки соединения кислотой (протонирующий агент) или алкилирующим средством. Подходящие кислоты включают органические кислоты или неорганические кислоты. Примеры неорганических кислот включают, но не ограничиваются ими, хлористоводородную кислоту (HCl), бромистоводородную кислоту (HBr), йодистоводородную кислоту (HI), серную кислоту (H2SO4), азотную кислоту (HNO3), трифторуксусную кислоту (TFAH или CF3CO2H) и фосфорную кислоту (H3PO4). Примеры органических кислот включают, но не ограничиваются ими, муравьиную кислоту, уксусную кислоту, пропионовую кислоту, гликолевую кислоту, пировиноградную кислоту, щавелевую кислоту, малеиновую кислоту, малоновую кислоту, янтарную кислоту, фумаровую кислоту, виннокаменную кислоту, лимонную кислоту, бензойную кислоту, коричную кислоту, миндальную кислоту, сульфоновые кислоты и салициловую кислоту. Когда кислоту, проиллюстрированную в настоящем описании, используют для формального получения соли, R4 представляет собой водород, и тип кислоты определяет противоион X. Альтернативно соль может быть получена посредством формальной обработки алкилирующим средством. Подходящие алкилирующие средства включают, но не ограничиваются ими, C1-C6 алкилгалогениды (такие как метилйодид, этилйодид, пропилйодид, бутилхлорид, бутилфторид, бутилбромид), диметилсульфат, диметилкарбонат, метилтрифлат, метилфторсульфонат, метилхлорсульфонат, метилметансульфонат и метилбензолсульфонат. Соль может быть получена посредством фактической обработки соединения не в форме соли кислотой или алкилирующим средством, как указано выше, или другими способами, известными в данной области и/или дополнительно проиллюстрированными ниже.
R4 выбран из водорода (H) или C1-C6 алкила, где алкильная часть может быть замещена одним или несколькими атомами галогена или (галоген)алкоксичастями, предпочтительно R4 представляет собой H или C1-C4 алкил, где алкильная часть может быть замещена одним или несколькими атомами галогена или (галоген)алкоксичастями, более предпочтительно R4 представляет собой H или C1-C2 алкил, где алкильная часть может быть замещена одним или несколькими атомами галогена или (галоген)алкоксичастями. Атомы галогена включают фтор (F), хлор (Cl), бром (Br), йод (I) и астат (At), предпочтительно атом галогена представляет собой фтор (F). Предпочтительные алкоксичасти включают метокси и этокси. В галогеналкоксичастях по меньшей мере один атом водорода алкоксичасти заменен атомом галогена, предпочтительно F. Подходящие части для R4 включают, предпочтительно ограничиваются ими, H, метил (Me), трифторметил (-CF3), этил (Et), изопропил (iPr), циклопропил (-cPr), метиленциклопропил (-CH2cPr), н-пропил (n-Pr), 2,2,2-трифторэтил (-CH2CF3), метоксиметил (-CH2OCH3). Еще более предпочтительно R4 представляет собой H или метил (Me), наиболее предпочтительно R4 представляет собой H.
X может представлять собой любой анион, предпочтительно физиологически или фармацевтически приемлемый анион, более предпочтительно одновалентный анион. X предпочтительно выбран из F, Cl, Br, I, HSO4, NO3, TFA (CF3CO2), формиата, ацетата, пропионата, гликолята, пирувата, оксалата, малеата, малоната, сукцината, фумарата, тартрата, цитрата, бензоата, циннамата, манделата, сульфоната и салицилата. Предпочтительно X представляет собой Cl, I, TFA или формиат, более предпочтительно Cl, I, TFA или формиат, еще более предпочтительно X представляет собой Cl или формиат, наиболее предпочтительно X представляет собой Cl. Когда катионный атом азота образован путем формального протонирования, это протонирование предпочтительно проводят с использованием хлористоводородной кислоты (HCl), трифторуксусной кислоты (TFAH или CF3CO2H) или муравьиной кислоты (HCOOH), более предпочтительно с использованием HCl или муравьиной кислоты. Формальное метилирование предпочтительно проводят с использованием метилйодида (MeI). Таким образом, в предпочтительном варианте осуществления R4=Me, когда X=I-, и R4=H, когда X=Cl-, TFA- или формиат.
Подходящие линкеры L для соединения атома азота амида с дистальным атомом азота представляют собой линкеры, предпочтительно содержащие 1-10 необязательно замещенных атомов остова, более предпочтительно содержащие 1-8 необязательно замещенных атомов остова. Таким образом, L может содержать 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 необязательно замещенных атомов остова. Предпочтительно, чтобы линкер L содержал 1-10 необязательно замещенных атомов остова, выбранных из углерода, азота и кислорода. В рамках настоящего изобретения атомы остова представляют собой атомы, которые составляют наиболее короткую цепь между атомом азота амида и дистальным атомом азота. Остов может представлять собой линейную структуру, однако остов (часть) также может быть частью циклической структуры. Когда остов является частью циклической структуры, остов определяют как наиболее короткую цепь между атомом азота амида и дистальным атомом азота. В одном варианте осуществления один из атомов азота содержит заместитель R5, и один из атомов остова содержит заместитель R5’, предпочтительно два различных атома остова содержат заместители R5 и R5’, где R5 и R5’ соединены в образованием циклической структуры, предпочтительно 4-10-членной циклической структуры, более предпочтительно 5-8-членной циклической структуры, наиболее предпочтительно 6-членной циклической структуры. В этом варианте осуществления атом азота амида и дистальный атом азота не включены в циклическую структуру, а вместо этого включена только часть остова линкера. В предпочтительном варианте осуществления эта соединение между атомом(ами) линкера, имеющего заместители R5 и R5’, представляет собой мостик -(CH2)n-, где n=1-6, предпочтительно мостик -CH2-CH2- или -CH2-CH2-CH2-, где между замещенными атомами остова линкера присутствуют атомы углерода.
В предпочтительном варианте осуществления атомы остова выбраны из углерода, азота и кислорода, предпочтительно из углерода и азота. Такой остов согласно этому предпочтительному варианту осуществления может быть идентифицирован как Cn-mNm, где n обозначает общее количество атомов в остове, и m представляет собой количество атомов азота в остове. Каждый из n и m представляет собой неотрицательное целое число. Подходящие линкеры имеют n=1-10 и m=0-4, предпочтительно n=2-7 и m=0-3, более предпочтительно n=4-7 и m=0-2. Особенно предпочтительные линкеры имеют остов, обозначаемый как Cn-mNm, где n=2 и m=0 (C2); n=5 и m=1 (C4N); n=3 и m=0 (C3); n=4 и m=1 (C3N); n=7 и m=2 (C5N2); n=4 и m=0 (C4); n=6 и m=1 (C5N); или n=5 и m=0 (C5). Наиболее предпочтительно, все атомы остова представляют собой атомы углерода (m=0).
Для соблюдения требований валентности атомы углерода и атомы азота остова линкера могут иметь атомы водорода, могут быть замещены, или между соседними атомами остова могут присутствовать двойные или тройные связи, как будет понятно специалисту в данной области. В контексте изобретения водород не считается заместителем. Когда в качестве атома остова линкера присутствует кислород, специалисту в данной области будет понятно, что кислород атом остова не имеет атомов водорода, заместителей или двойных или тройных связей. Между двумя атомами углерода остова могут присутствовать тройные связи. Атомы остова вместе с атомами водорода и/или заместителями составляют линкер. В контексте настоящего изобретения, "необязательно замещенный" используют для указания на то, что атом (остова) может иметь один или несколько заместителей, или может не иметь заместителей, и вместо этого может присутствовать достаточное количество атомов водорода, чтобы соблюдались требования валентности для указанного атома (остова).
Подходящие заместители включают, но не ограничиваются ими, галоген, NH2, NHR6, N(R6)2, NHNH2, N3, NHC(=O)R6, NHC(=O)NHR6, NHC(=O)NH2, NHC(=O)OR6, OH, OR6, OC(=O)R6, R6 (например, алкил, циклоалкил), аралкил, алкенил, алкинил, арил, гетероарил, OC(=O)OR6, OC(=O)NHR6, O(SO2)R6, O(SO2)OH, O(PO2)OH, SH, SR6, C(=O)R6, алкил-NH2, алкил-OH, алкил-SH, C(=O)CF3, C(=O)OR6, C(=O)OH, C(=O)H, C(=O)OR6, C(=O)NH2, C(=O)NMe2, C(=O)N(R6)2, C(=S)NH2 C(=S)SH, CN, NC, CNO, ONC, OCN, SCN, SNC, CNS, S(=O)R6, S(=O)2R6, S(=O)2(OH), P(=O)(OH)2 или P(=O)(OH)(OR6). Атомы, имеющие две или более остаточных валентностей, такие как атомы углерода остова, могут иметь заместитель, присоединенный через двойную связь, такой как оксо (=O), имино (=NH или =NR6), тиоксо (=S), алкилиден (=CH2 или =CHR6 или =C(R6)2). В настоящем описании каждый R6 независимо представляет собой алкильную часть, предпочтительно C1-C6 алкильную часть, более предпочтительно C1-C2 алкильную часть. В R6 каждая из одной или нескольких частей CH2 может быть независимо заменена на O, S или NH, и/или одна или несколько частей CH могут быть заменены на N. Кроме того, два заместителя на одном атоме или на различных атомах могут быть соединены с образованием циклических структур. Если два заместителя на одном атоме остова соединены в циклическую структуру, эту циклическую структуру можно считать соединенной через спиро-соединение с остовом. Если два заместителя на различных атомах остова соединены в циклическую структуру, часть этой циклической структуры представляет собой (часть) остова, и остов считается наиболее короткой цепью атомов между атомом азота амида и дистальным атомом азота. Образовавшиеся циклические структуры по сути могут быть полностью углеродными или могут содержать 0-3 гетероатома (например, N, O, S и/или P) и могут содержать 0-3 двойных связи. Все этомы в этих циклических структурах необязательно могут быть замещенными. Примерами подходящих циклических структур являются необязательно замещенный циклоалкил, необязательно замещенный циклогетероалкил, необязательно замещенный арил или необязательно замещенный гетероарил. Как дополнительно указано ниже, циклическая структура также может быть образована путем соединения одного заместителя на атоме остова с R1 на атоме азота амида или с R2 на дистальном атоме азота.
В контексте настоящего изобретения, термин "алкил" относится к насыщенным алифатическим группам, включающим прямые, разветвленные, циклические группы и их комбинации, имеющие указанное количество атомов углерода, или, если количество не указано, предпочтительно имеющие вплоть до 12 атомов углерода. "Прямая алкильная" или "линейная алкильная" группа относится к алкильным группам, которые не являются ни циклическими, ни разветвленными, часто обозначаемым как "н-алкильные" группы. Одной подгруппой алкильных групп является C1-C6 алкил, который включает группы, такие как метил, этил, н-пропил, изопропил, бутил, н-бутил, изобутил, втор-бутил, трет-бутил, пентил, н-пентил, гексил, циклопропил, циклобутил, циклопентил, циклогексил и любую другую алкильную группу, содержащую от одного до шести атомов углерода, где C1-C6 алкильные группы могут быть присоединены через любую валентность на C1-C6 алкильных группах.
В одном варианте осуществления атомы остова необязательно замещены одним или несколькими заместителями, выбранными из группы, состоящей из R6, карбокси, оксо и первичного амино, или атом остова может быть соединен с R1 с образованием 4-10-членной циклической структуры и/или атом остова может быть соединен с R2 с образованием 4-10-членной циклической структуры, или два атома остова могут быть соединены с образованием циклической структуры, где R6 является таким, как определено выше, предпочтительно R6 представляет собой C1-C6 алкил, более предпочтительно C1-C2 алкил. Предпочтительными заместителями атомов остова являются алкил, такой как метил (Me или -CH3), карбоксил (-C(=O)OH), оксо (=O) и первичный амино (-NH2).
Предпочтительные линкеры L идентифицированы в настоящем описании ниже как L1-L28. Более предпочтительными являются L1-L26:

-(CH2)2-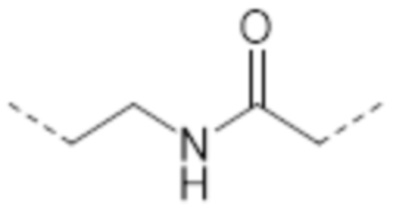
-(CH2)2NHC(O)CH2-
-(CH2)3-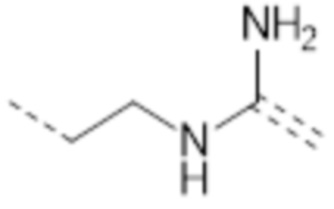
-(CH2)2NHC(NH2)=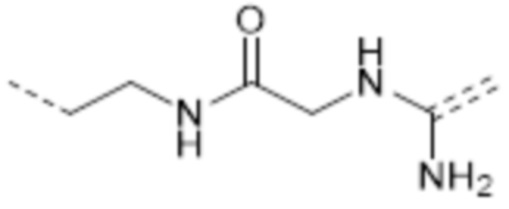
-(CH2)2NHC(O)CH2NHC(NH2)=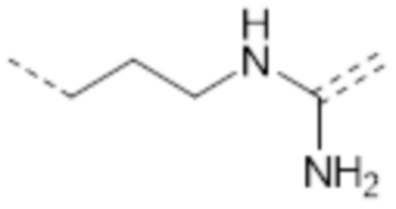
-(CH2)3NHC(NH2)=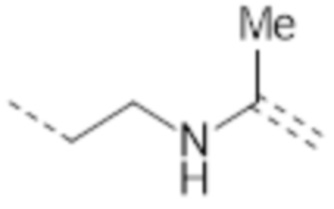
-(CH2)2NHC(Me)=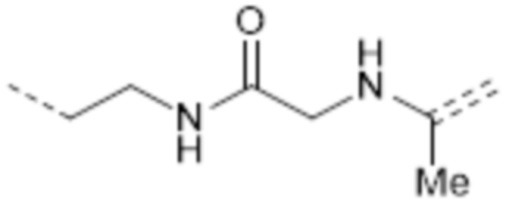
-(CH2)2NHC(O)CH2NHC(Me)=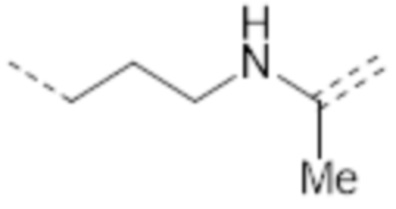
-(CH2)3NHC(Me)=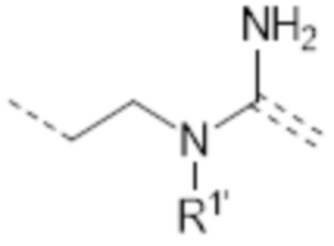
-(CH2)2NR1’C(NH2)=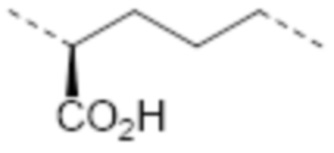
-C(CO2H)(CH2)3-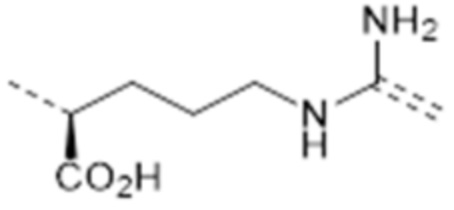
-C(CO2H)(CH2)3NHC(NH2)=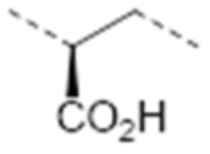
-C(CO2H)CH2-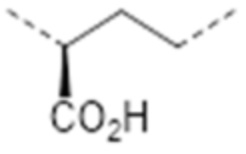
-C(CO2H)(CH2)2-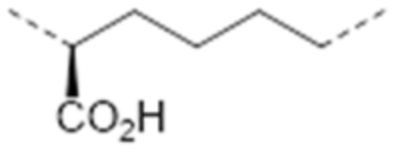
-C(CO2H)(CH2)4-
-(CH2)4-
-(CH2)5-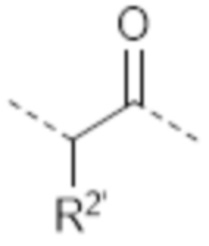
-CHR2’C(O)-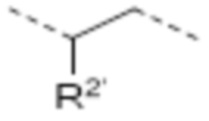
-CHR2’CH2-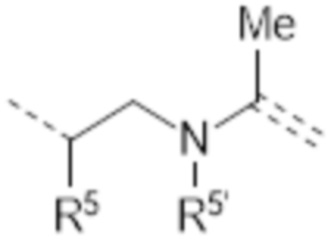
-CHR5CH2NR5’C(Me)=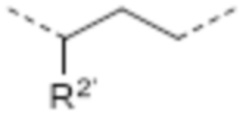
-CHR2’(CH2)2-
-(CH2)2CHR1’-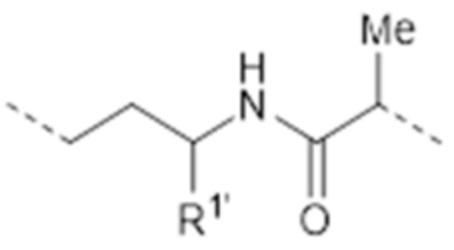
-(CH2)2CHR1’NHC(O)C(Me)-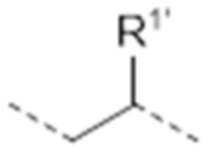
-CH2CHR1’-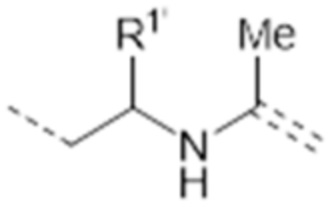
-CH2CHR1’NHC(Me)=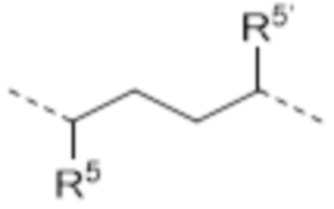
-CHR5(CH2)2CHR5’-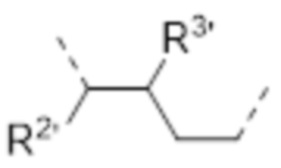
-CHR2’CHR3’(CH2)2-
В рамках настоящего изобретения пунктирная связь с левой стороны каждой из структур L1-L28 предпочтительно указывает на связь между линкером и атомом азота амида, и пунктирная связь с правой стороны каждой из структур L1-L28 предпочтительно указывает на связь между линкером и дистальным атомом азота.
R1’ в каждом случае представляет собой соединение между вторым линкером и атомом азота амида, где R1’ соединен с R1 через второй линкер, таким образом образуя 4-10-членную циклическую структуру, предпочтительно 5-8-членную циклическую структуру, наиболее предпочтительно 6-членную циклическую структуру, которая состоит из атома азота амида, 1-4 атомов остова линкера и 1-4 атомов, которые составляют мостик, соединяющий R1 и R1’. Аналогично R2’ в каждом случае представляет собой соединение между вторым линкером и катионным атомом азота, где R2’ соединен с R2 через второй линкер, таким образом образуя 4-10-членную циклическую структуру, предпочтительно 5-8-членную циклическую структуру, наиболее предпочтительно 6-членную циклическую структуру, которая построена из катионного атома азота, 1-4 атомов остова линкера и 1-4 атомов, которые составляют мостик, соединяющий R2 и R2’. Аналогично, R5 и R5’ в каждом случае представляют собой соединение во втором линкере между одним атомом остова линкера, имеющим R5, и другим атомом остова линкера, имеющим R5’, где R5’ соединен с R5 через второй линкер, таким образом образуя 4-10-членную циклическую структуру, предпочтительно 5-8-членную циклическую структуру, наиболее предпочтительно 6-членную циклическую структуру, которая построена из 2-5 атомов остова линкера, и 1-5 атомов, которые составляют мостик, соединяющий R5 и R5’. Таким образом, в линкерах L10, L22, L23, L24 и L25, R1’ соединен с R1 через второй линкер, предпочтительно мостик -CH2-CH2- или -CH2-CH2-CH2-, более предпочтительно мостик -CH2-CH2-. Таким образом, в соединении, содержащем линкер L10, где R1’ и R1 соединены через мостик -CH2-CH2-, атом азота амида включен в шестичленную циклическую структуру, которая построена из атома азота амида, двух атомов углерода и одного атома азота линкера, и еще двух атомов углерода, которые составляют мостик из R1 и R1’. Этот мостик -CH2-CH2- между атомом азота амида и центральным атомом азота в остове линкера L10 может быть представлен как L1. Аналогично, в линкерах L18, L19 и L21, R2’ соединен с R2 через второй линкер, предпочтительно мостик -CH2-CH2- или -CH2-CH2-CH2-, более предпочтительно мостик -CH2-CH2-CH2-. Аналогично, в линкере L20 и L26, R5’ соединен с R5 через второй линкер, предпочтительно мостик -CH2-CH2- или -CH2-CH2-CH2-, более предпочтительно мостик -CH2-CH2-.
Линкер L26 содержит двухзамещенную циклоалкильную часть, предпочтительно двухзамещенную циклогексильную часть, и, таким образом, может встречаться либо в цис-форме, либо в транс-форме, предпочтительно в транс-форме.
Линкер L27 содержит бициклическую циклоалкильную часть, предпочтительно бициклическую циклооктильную часть. Когда L=L27, в высокой степени предпочтительно, чтобы L, R2 и R3 вместе содержали 7, 8, 9, 10, 11 или 12 атомов углерода. Наиболее предпочтительно L27 находится на азабициклооктане, таком как азабицикло[2.2.2]октан.
Линкеры L11, L12, L13, L14, L15, L18 (при условии, что R2-R2’ не является -C(O)-), L19 (при условии, что R2-R2’ не является -CH2-), L20 (при условии, что R5-R5’ не является -CH2-), L21 (при условии, что R2-R2’ не является -CH2-CH2-), L22 (при условии, что R1-R1’ не является -CH2-CH2-), L23 (при условии, что R1-R1’ не является -CH2-CH2-), L24 (при условии, что R1-R1’ не является -CH2-) и L25 (при условии, что R1-R1’ не является -CH2-) содержат дополнительный стереоцентр. Стереоизомер, когда он указан в структурах этих линкеров, выше, является иллюстративным, а не ограничивающим. Как дополнительно указано выше, каждый стереоцентр, присутствующий в соединениях по изобретению, может индивидуально присутствовать в каждой из его стереоизомерных форм, либо S, либо R, или в качестве смеси обоих изомеров в любом соотношении. С учетом того, что стереоцентр уже присутствует во 2 положении T, соединения, имеющие линкеры, могут представлять собой (R, R); (S, R); (R, S) или (S, S). На протяжении описания первый символ (R или S) конфигурации приведен для 2 положения T, и второй его символ определяет конфигурацию дополнительного стереоцентра, который может присутствовать в соединении по изобретению. Для L23 метильная группа, как указано посредством "Me" в таблице выше, предпочтительно является (S).
В предпочтительных вариантах осуществления особенно предпочтительными линкерами являются L5, L8, L11, L12, L16, L17, L19, L21, L26, L27 и L28. Особенно предпочтительными линкерами являются L5, L8, L11, L12, L16, L17, L19, L21 и L26. Еще более предпочтительными линкерами являются L11, L16, L19 и L26, и наиболее предпочтительно линкер представляет собой L19. Предпочтительно, L19 скомбинирован с R2-R2’ = L1 или L3, наиболее предпочтительно с R2-R2’ = L3. Предпочтительно, L21 скомбинирован с R2-R2’ = L1 или L3, наиболее предпочтительно с R2-R2’ = L1. Предпочтительно, L26 скомбинирован с R5-R5’ = L1 или L3, более предпочтительно с R5-R5’ = L1, наиболее предпочтительно, где циклогексил является транс-1,4-двухзамещенным. Особенно предпочтительной является комбинация линкера L19 с R2-R2’ = L3 и R3=H, Me, Et, iPr, CH2OCH3 или CH2CF3, более предпочтительно R3=Me, Et, iPr или CH2CF3, наиболее предпочтительно R3=H.
В случае когда N* соответствует структуре (IIa), предпочтительно, чтобы линкер L содержал 1-5 необязательно замещенных атомов остова и/или чтобы линкер содержал по меньшей мере один атом остова, отличный от углерода. В случае когда N* соответствует структуре (IIa), особенно предпочтительно, чтобы дистальный атом азота был соединен с атомом атом остова линкера через второй линкер, где R2 соединен с R2’, более предпочтительно, где циклическая структура, образованная таким образом, представляет собой кольцо пиперидина, кольцо пирролидина, кольцо имидазолидина, кольцо пиразолидина или кольцо азепана, наиболее предпочтительно кольцо пиперидина, и/или по меньшей мере один из атомов остова замещен частью в виде карбоновой кислоты. В случае когда N* соответствует структуре (IIa), предпочтительно, чтобы L представлял собой любой из L2, L4- L21, L23, L25, L26, L27 и L28, особенно предпочтительно, чтобы L представлял собой любой из L2, L4- L21, L23, L25 и L26, более предпочтительно любой из L5, L8, L11, L12, L16, L17, L19, L21 и L26. В случае когда N* соответствует структуре (IIb), предпочтительно, чтобы R4 представлял собой H или Me, более предпочтительно R4 представляет собой H, и X представляет собой Cl, I, TFA или формиат, еще более предпочтительно X представляет собой Cl или формиат, наиболее предпочтительно X представляет собой Cl. В случае когда N* соответствует структуре (IIb), предпочтительно, чтобы линкер L содержал 3-10 атомов остова, или 2 атома остова, один из которых соединен с дистальным атомом азота через второй линкер. В случае когда N* соответствует структуре (IIb), предпочтительно, чтобы L представлял собой любой из L2-L28, особенно предпочтительно, чтобы L представлял собой любой из L2-L26, более предпочтительно один из L5, L8, L11, L12, L16, L17, L19, L21 и L26.
В одном варианте осуществления линкер L представляет собой L1, и R1 и R2 соединены вместе в циклическую структуру через второй линкер L1, таким образом, образуя шестичленное кольцо пиперазина, включающее всего четыре атома углерода из двух линкеров, атом азота амида и дистальный атом азота. В одном варианте осуществления линкер L представляет собой L19, и R2 и R2’ соединены в циклическую структуру через второй линкер L3, таким образом образуя шестичленное кольцо пиперидина, включающее всего пять атомов углерода из ликеров и дистальный атом азота.
В предпочтительном варианте осуществления соединение соответствует общей структуре (I), где:
- L представляет собой линкер между атомом азота амида и дистальным атомом азота;
- N* соответствует структуре (IIa);
- T соответствует структуре (IIIa) или (IIIb), где R7 представляет собой C1-C6 алкильную часть;
- R1 выбран из водорода (H), C1-C6 алкила или C1-C6 алкенила, или R1 соединен с атомом остова линкера L в циклическую структуру;
- R2 соединен с атомом остова линкера L с образованием циклической структуры, выбранной из кольца пиперидина, кольца пирролидина, кольца имидазолидина, кольца пиразолидина или кольца азепана; и
- R3 выбран из водорода (H), C1-C6 алкила или C1-C6 алкенила, где алкильная или алкенильная часть может быть замещена одним или несколькими атомами галогена, гидроксильными частями или (галоген)алкоксичастями, или R3 отсутствует, когда дистальный атом азота является частью иминочасти.
В альтернативном предпочтительном варианте осуществления соединение согласно изобретению соответствует общей структуре (I), где
- L представляет собой линкер между атомом азота амида и дистальным атомом азота, содержащий 3-10 атомов остова, или 2 атомов остова, один из которых соединен с дистальным атомом азота через второй линкер;
- N* соответствует структуре (IIb);
- T соответствует структуре (IIIa) или (IIIb), где R7 представляет собой C1-C6 алкильную часть;
- каждый из R1 и R2 независимо выбран из водорода (H), C1-C6 алкила или C1-C6 алкенила, или R1 и R2 соединены вместе и, таким образом, образуют второй линкер между атомом азота амида и дистальным атомом азота, или R1 соединен с атомом остова линкера L в циклическую структуру и/или R2 соединен с атомом остова линкера L в циклическую структуру;
- R3 выбран из водорода (H), C1-C6 алкила или C1-C6 алкенила, где алкильная или алкенильная часть может быть замещена одним или несколькими атомами галогена, гидроксильными частями или (галоген)алкоксичастями, или R3 отсутствует, когда дистальный атом азота является частью иминочасти;
- R4 выбран из водорода (H) или C1-C6 алкила, где алкильная часть может быть замещена одним или несколькими атомами галогена или (галоген)алкоксичастями; и
- X представляет собой анион, предпочтительно фармацевтически приемлемый анион.
Особенно предпочтительные соединения в контексте настоящего изобретения указаны в настоящем описании ниже как структуры (VI)-(IX). Таким образом, в предпочтительном варианте осуществления соединение общей структуры (I) соответствует структуре (VI):

(VI)
В рамках настоящего изобретения R2 соединен с атомом остова через второй линкер, образующий циклическую структуру, таким образом, N* представляет собой -NR3 или -N+R3R4 X-. В рамках настоящего изобретения, R3, R4, X и T являются такими, как определено выше. Предпочтительно, T соответствует структуре (IIIa) или (IIIb), более предпочтительно соответствует структуре (IVa) или (IVb), наиболее предпочтительно соответствует структуре (IIIb) или (IVb). В соединении согласно структуре (VI), атом углерода во 2 положении T может быть в R-конфигурации или в S-конфигурации, предпочтительно он находится в S-конфигурации. Аналогично, атом углерода во 2 положении кольца пиперидина может быть в R-конфигурации или в S-конфигурации, предпочтительно, он находится в R-конфигурации. Таким образом, конфигурация соединений согласно структуре (VI) может представлять собой (R, R); (S, R); (R, S) или (S, S), предпочтительно она представляет собой (S, R).
В предпочтительном варианте осуществления соединение общей структуры (I) соответствует структуре (VIIa) или (VIIb):
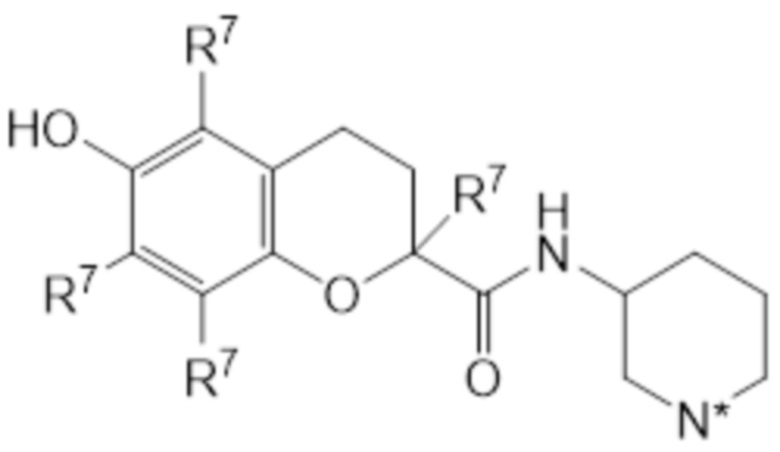
(VIIa)

(VIIb)
В рамках настоящего изобретения R2 соединен с атомом остова через второй линкер, образующий циклическую структуру, таким образом N* представляет собой -NR3 или -N+R3R4 X-. В рамках настоящего изобретения, R3, R4, X и R7 являются такими, как определено выше. В соединении согласно структуре (VIIa) или (VIIb), R7 предпочтительно представляет собой метил. В соединении согласно структуре (VIIa) или (VIIb), атом углерода во 2 положении T может быть в R-конфигурации или в S-конфигурации, предпочтительно он находится в S-конфигурации. Аналогично, атом углерода во 2 положении кольца пиперидина может быть в R-конфигурации или в S-конфигурации, предпочтительно он находится в R-конфигурации. Таким образом, конфигурация соединения согласно структуре (VIIa) или (VIIb) может представлять собой (R, R); (S, R); (R, S) или (S, S), предпочтительно она представляет собой (S, R). В одном варианте осуществления соединение общей структуры (I) соответствует структуре (VIIa). В альтернативном варианте осуществления соединение общей структуры (I) соответствует структуре (VIIb). В высокой степени предпочтительных вариантах осуществления изобретение относится к соединению для применения, как описано выше, где соединение соответствует структуре (VIIb), где каждый R7 представляет собой метил; N* представляет собой -NR3 или -N+R3R4 X-; X является таким, как определено выше и предпочтительно представляет собой Cl-; R3 является таким, как определено выше, и предпочтительно представляет собой водород; и R4 является таким, как определено выше, и предпочтительно представляет собой водород. В еще более предпочтительном варианте осуществления соединение находится в S, R-конфигурации.
В предпочтительном варианте осуществления соединение общей структуры (I) соответствует структуре (VIIIa) или (VIIIb):
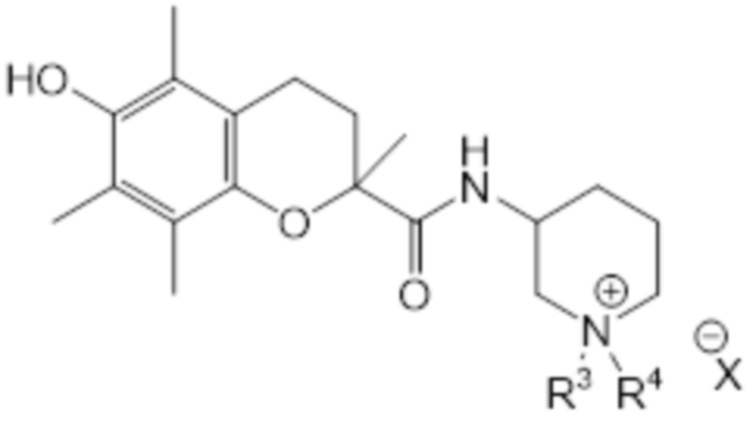
(VIIIa)
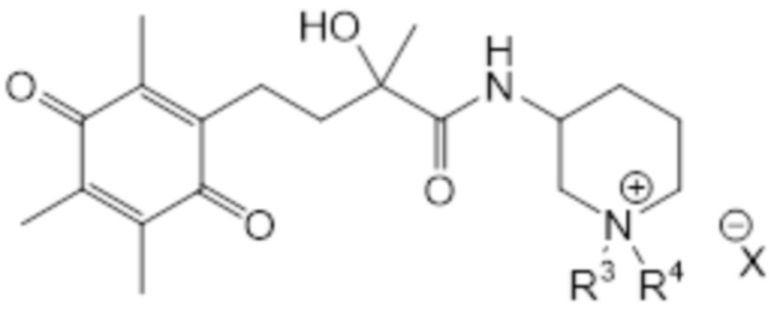
(VIIIb)
В рамках настоящего изобретения R2 соединен с атомом остова через второй линкер, образующий циклическую структуру, и N* представляет собой -N+R3R4 X-. В рамках настоящего изобретения R3, R4 и X являются такими, как определено выше. В соединении согласно структуре (VIIIa) или (VIIIb) R3 предпочтительно представляет собой H или C1-C2 алкил, наиболее предпочтительно R3 представляет собой H. В соединении согласно структуре (VIIIa) или (VIIIb) R4 предпочтительно представляет собой H или C1-C2 алкил, наиболее предпочтительно R4 представляет собой H. В соединении согласно структуре (VIIIa) или (VIIIb) X предпочтительно представляет собой Cl, I, TFA или формиат, наиболее предпочтительно X представляет собой Cl. В соединении согласно структуре (VIIIa) или (VIIIb) атом углерода во 2 положении T может быть в R-конфигурации или в S-конфигурации, предпочтительно он находится в S-конфигурации. Аналогично, атом углерода во 2 положении кольца пиперидина может быть в R-конфигурации или в S-конфигурации, предпочтительно он находится в R-конфигурации. Таким образом, конфигурация соединений согласно структуре (VIIIa) или (VIIIb) может представлять собой (R, R); (S, R); (R, S) или (S, S), предпочтительно она представляет собой (S, R). В одном варианте осуществления соединение общей структуры (I) соответствует структуре (VIIIa). В альтернативном варианте осуществления соединение общей структуры (I) соответствует структуре (VIIIb).
В предпочтительном варианте осуществления соединение общей структуры (I) соответствует структуре (IXa) или (IXb):
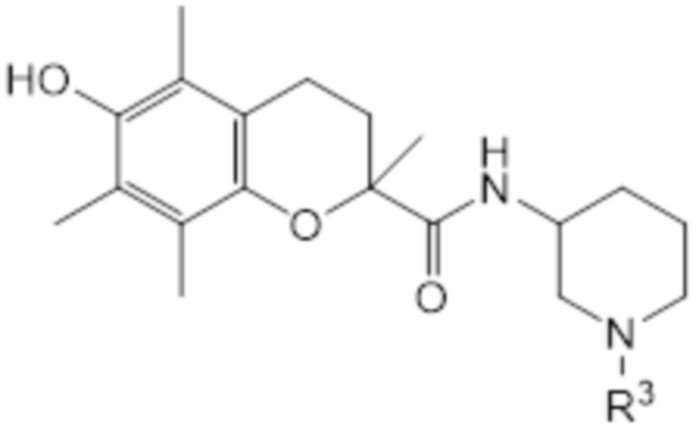
(IXa)
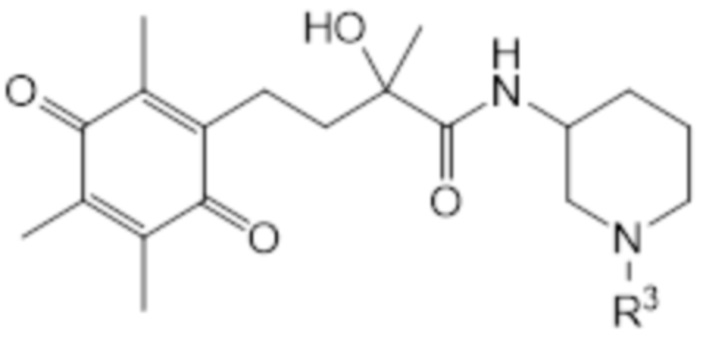
(IXb)
В рамках настоящего изобретения R2 соединен с атомом остова через второй линкер, образующий циклическую структуру, и N* представляет собой -NR3. В рамках настоящего изобретения R3 является таким, как определено выше. В соединении согласно структуре (VIIIa) или (VIIIb) R3 предпочтительно представляет собой H или C1-C2 алкил, наиболее предпочтительно R3 представляет собой H. В соединении согласно структуре (IXa) или (IXb) атом углерода во 2 положении T может быть в R-конфигурации или в S-конфигурации, предпочтительно он находится в S-конфигурации. Аналогично, атом углерода во 2 положении кольца пиперидина может быть в R-конфигурации или в S-конфигурации, предпочтительно он находится в R-конфигурации. Таким образом, конфигурация соединения согласно структуре (IXa) или (IXb) может представлять собой (R, R); (S, R); (R, S) или (S, S), предпочтительно она представляет собой (S, R). В одном варианте осуществления соединение общей структуры (I) соответствует структуре (IXa). В альтернативном варианте осуществления соединение общей структуры (I) соответствует структуре (IXb).
В предпочтительном варианте осуществления соединение соответствует общей структуре (I), где T соответствует структуре (IVa) или (IVb), N* соответствует структуре (IIa) или структуре (IIb) где R4=H и X=Cl, и где:
(A) L=L1, R1-R2=L1, R3=H;
(B) L=L1, R1=H, R2=H, R3=H;
(C) L=L2, R1=H, R2=H, R3=H;
(D) L=L3, R1=H, R2=H, R3=H;
(E) L=L4, R1=H, R2=H, R3=отсутствует;
(F) L=L5, R1=H, R2=H, R3=отсутствует;
(G) L=L6, R1=H, R2=H, R3=отсутствует;
(H) L=L3, R1=H, R2=Me, R3=Me;
(I) L=L1, R1=H, R2=Me, R3=Me;
(J) L=L7, R1=H, R2=H, R3=отсутствует;
(K) L=L8, R1=H, R2=H, R3=отсутствует;
(L) L=L9, R1=H, R2=H, R3=отсутствует;
(M) L=L10, R1-R1’ = L1, R2=H, R3=отсутствует;
(N) L=L11, R1=H, R2=H, R3=H;
(O) L=L12, R1=H, R2=H, R3=отсутствует;
(P) L=L13, R1=H, R2=H, R3=H;
(Q) L=L14, R1=H, R2=H, R3=H;
(R) L=L15, R1=H, R2=H, R3=H;
(S) L=L11, R1=H, R2=Me, R3=Me
(T) L=L16, R1=H, R2=H, R3=H;
(U) L=L17, R1=H, R2=H, R3=H;
(V) L=L16, R1=H, R2=Me, R3=Me;
(W) L=L18, R1=H, R2-R2’ = L3, R3=H;
(X) L=L19, R1=H, R2-R2’ = L3, R3=H;
(Y) L=L20, R1=H, R2=H, R5-R5’ = L3, R3=отсутствует;
(Z) L=L21, R1=H, R2-R2’ = L1, R3=H;
(AA) L=L22, R1-R1’ = L1, R2=H, R3=H;
(AB) L=L23, R1-R1’ = L1, R2=H, R3=H;
(AC) L=L24, R1-R1’ = L3, R2=H, R3=H;
(AD) L=L25, R1-R1’ = L3, R2=H, R3=отсутствует;
(AE) L=L26, R1=H, R2=H, R5-R5’ = L1, R3=H.
(AF) L=L19, R1=H, R2-R2’ = L3, R3=Me;
(AG) L=L19, R1=H, R2-R2’ = L1, R3=H;
(AH) L=L21, R1=H, R2-R2’ = L1, R3=Me;
(AI) L=L27, R1=H, R2-R2’ = -CH2-, R3-R3’ = L1, R4=H, X=Cl;
(AJ) L=L28, R1=H, R2=H, R3=H, R4=H, X=Cl.
Таким образом соединение согласно структуре (I) предпочтительно выбрано из соединений A-AJ, определенных выше, более предпочтительно из соединений A-AH, определенных выше, еще более предпочтительно оно выбрано из соединений A - AJ, исходя из общей структуры (IVb), наиболее предпочтительно оно выбрано из соединений A - AH на основе общей структуры (IVb). Особенно предпочтительные соединения выбраны из F, K, N, O, U, V, T, X, Z, AE, AF, AG, AH, AI и AJ, более предпочтительные соединения выбраны из F, K, N, O, U, V, T, X, Z, AE, AF, AG и AH, еще более предпочтительно N, T, X и AE, наиболее предпочтительно X. В рамках настоящего изобретения, N* предпочтительно соответствует структуре (IIb), где R4=H и X=Cl, и соединение предпочтительно имеет общую структуру (IVb).
Соединение F может иметь R-конфигурацию, S-конфигурацию или их смесь, предпочтительно соединение F представляет собой смесь R- и S-энантиомеров, более предпочтительно рацемическую смесь. Соединение K может иметь R-конфигурацию, S-конфигурацию или их смесь, предпочтительно соединение K представляет собой смесь R- и S-энантиомеров, более предпочтительно рацемическую смесь. Соединение N может иметь R, R-конфигурацию, R, S-конфигурацию, S, R-конфигурацию, S, S-конфигурацию или любую их смесь, предпочтительно соединение N имеет R, R-конфигурацию или S, R-конфигурацию, наиболее предпочтительно R, R-конфигурацию. Соединение O может иметь R, R-конфигурацию, R, S-конфигурацию, S, R-конфигурацию, S, S-конфигурацию или любую их смесь, предпочтительно соединение O представляет собой смесь R, S- и S, S-диастереомеров, более предпочтительно смесь приблизительно 1/1 (моль/моль). Соединение U может иметь R-конфигурацию, S-конфигурацию или их смесь, предпочтительно соединение U имеет R-конфигурацию или S-конфигурацию. Соединение V может иметь R-конфигурацию, S-конфигурацию или их смесь, предпочтительно соединение V имеет R-конфигурацию. Соединение T может иметь R-конфигурацию, S-конфигурацию или их смесь, предпочтительно соединение T имеет R-конфигурацию или S-конфигурацию, наиболее предпочтительно R-конфигурацию. Соединение X может иметь R, R-конфигурацию, R, S-конфигурацию, S, R-конфигурацию, S, S-конфигурацию или любую их смесь, предпочтительно соединение X имеет R, S-конфигурацию или S, R-конфигурацию, наиболее предпочтительно S, R-конфигурацию. Соединение Z может иметь R-конфигурацию, S-конфигурацию или их смесь, предпочтительно соединение Z представляет собой смесь R- и S-энантиомеров, более предпочтительно рацемическую смесь. Соединение AE может иметь R,транс-конфигурацию, R,цис-конфигурацию, S,транс-конфигурацию, S,цис-конфигурацию или любую их смесь, предпочтительно соединение AE имеет R,транс-конфигурацию или S,транс-конфигурацию, наиболее предпочтительно R,транс-конфигурацию. Соединение AF может иметь R, R-конфигурацию, R, S-конфигурацию, S, R-конфигурацию, S, S-конфигурацию или любую их смесь, предпочтительно соединение AF имеет S, R-конфигурацию. Соединение AG может иметь R, R-конфигурацию, R, S-конфигурацию, S, R-конфигурацию, S, S-конфигурацию или любую их смесь, предпочтительно соединение AG имеет S, S-конфигурацию или S, R-конфигурацию. Соединение AH может иметь R-конфигурацию, S-конфигурацию или их смесь, предпочтительно соединение AH имеет S-конфигурацию. В рамках настоящего изобретения, первый символ (R или S) конфигурации относится ко 2 положению T, и в случае, когда в соединении по изобретению присутствует дополнительный стереоцентр, его конфигурацию определяет второй символ. Соединение AJ может иметь R, R-конфигурацию, R, S-конфигурацию, S, R-конфигурацию, S, S-конфигурацию, или их смесь, предпочтительно соединение AJ имеет S, R-конфигурацию или R, R-конфигурацию или их смесь, наиболее предпочтительно соединение AJ имеет R, R-конфигурацию.
В высокой степени предпочтительные соединения включают соединение N в R, R-конфигурации (R, R-N), соединение T в R-конфигурации (R-T), соединение AE в R,транс-конфигурации (R,транс-AE), соединение AJ в R-конфигурации (R-AJ), и соединение X в любой конфигурации. Наиболее предпочтительные соединения включают соединение N в R, R-конфигурации (R, R-N), соединение T в R-конфигурации (R-T), соединение AE в R,транс-конфигурации (R,транс-AE) и соединение X в любой конфигурации, наиболее предпочтительно соединение согласно изобретению представляет собой соединение X в S, R-конфигурации (S, R-X). В одном варианте осуществления эти наиболее предпочтительные соединения согласно изобретению представляют собой соединение N в R, R-конфигурации (R, R-N), соединение T в R-конфигурации (R-T), соединение AE в R,транс-конфигурации (R,транс-AE) и соединение X в любой конфигурации, и необязательно соединение AJ предпочтительно в качестве R, R-AJ, где N* соответствует структуре (IIb), где R4=H и X=Cl, более предпочтительно соединение по изобретению представляет собой соединение X в S, R-конфигурации (S, R-X), где N* соответствует структуре (IIb), где R4=H и X=Cl. В одном варианте осуществления эти наиболее предпочтительные соединения по изобретению представляют собой соединение N в R, R-конфигурации (R, R-N), соединение T в R-конфигурации (R-T), соединение AE в R,транс-конфигурации (R,транс-AE) и соединение X в любой конфигурации, и необязательно соединение AJ предпочтительно в качестве R, R-AJ, где N* соответствует структуре (IIa), наиболее предпочтительно соединение по изобретению представляет собой соединение X в S, R-конфигурации (S, R-X), где N* соответствует структуре (IIa).
В одном варианте осуществления эти наиболее предпочтительные соединения по изобретению представляют собой соединение N в R, R-конфигурации (R, R-N), соединение T в R-конфигурации (R-T), соединение AE в R,транс-конфигурации (R,транс-AE) и соединение X в любой конфигурации, и необязательно соединение AJ предпочтительно в качестве R, R-AJ, где соединение имеет структуру (IIIa), наиболее предпочтительно соединение по изобретению представляет собой соединение X в S, R-конфигурации (S, R-X), где соединение имеет структуру (IIIa).
В одном варианте осуществления эти наиболее предпочтительные соединения по изобретению представляют собой соединение N в R, R-конфигурации (R, R-N), соединение T в R-конфигурации (R-T), соединение AE в R,транс-конфигурации (R,транс-AE) и соединение X в любой конфигурации, и необязательно соединение AJ предпочтительно в качестве R, R-AJ, где соединение имеет структуру (IIIa), где N* соответствует структуре (IIb), где R4=H и X=Cl, наиболее предпочтительно соединение по изобретению представляет собой соединение X в S, R-конфигурации (S, R-X), где соединение имеет структуру (IIIa) и где N* соответствует структуре (IIb), где R4=H и X=Cl.
В одном варианте осуществления эти наиболее предпочтительные соединения по изобретению представляют собой соединение N в R, R-конфигурации (R, R-N), соединение T в R-конфигурации (R-T), соединение AE в R,транс-конфигурации (R,транс-AE) и соединение X в любой конфигурации, и необязательно соединение AJ предпочтительно в качестве R, R-AJ, где соединение имеет структуру (IIIa), где N* соответствует структуре (IIa), наиболее предпочтительно соединение по изобретению представляет собой соединение X в S, R-конфигурации (S, R-X), где соединение имеет структуру (IIIa) и где N* соответствует структуре (IIa).
В одном предпочтительном варианте осуществления эти наиболее предпочтительные соединения по изобретению представляют собой соединение N в R, R-конфигурации (R, R-N), соединение T в R-конфигурации (R-T), соединение AE в R,транс-конфигурации (R,транс-AE) и соединение X в любой конфигурации, и необязательно соединение AJ предпочтительно в качестве R, R-AJ, где соединение имеет структуру (IIIb), наиболее предпочтительно соединение по изобретению представляет собой соединение X в S, R-конфигурации (S, R-X), где соединение имеет структуру (IIIb).
В одном в высокой степени предпочтительном варианте осуществления эти наиболее предпочтительные соединения по изобретению представляют собой соединение N в R, R-конфигурации (R, R-N), соединение T в R-конфигурации (R-T), соединение AE в R,транс-конфигурации (R,транс-AE) и соединение X в любой конфигурации, и необязательно соединение AJ предпочтительно в качестве R, R-AJ, где соединение имеет структуру (IIIb), где N* соответствует структуре (IIb), где R4=H и X=Cl, наиболее предпочтительно соединение по изобретению представляет собой соединение X в S, R-конфигурации (S, R-X), где соединение имеет структуру (IIb) и где N* соответствует структуре (IIb), где R4=H и X=Cl.
В другом в высокой степени предпочтительном варианте осуществления эти наиболее предпочтительные соединения по изобретению представляют собой соединение N в R, R-конфигурации (R, R-N), соединение T в R-конфигурации (R-T), соединение AE в R,транс-конфигурации (R,транс-AE) и соединение X в любой конфигурации, и необязательно соединение AJ предпочтительно в качестве R, R-AJ, где соединение имеет структуру (IIIb), где N* соответствует структуре (IIa), наиболее предпочтительно соединение по изобретению представляет собой соединение X в S, R-конфигурации (S, R-X), где соединение имеет структуру (IIIb) и где N* соответствует структуре (IIa).
Было обнаружено, что соединения с открытыми конфигурациями (содержащие каркас хроманилхинона, предпочтительно общей структуры (IIIb)) являются более мощными ингибиторами mPGES-1, чем соединения с закрытыми конфигурациями (содержащие каркас хроманила, предпочтительно общей структуры (IIIa)). Однако было показано, что соединения с закрытыми конфигурациями имеют более высокую пероральную биодоступность, чем соединения с открытыми конфигурациями.
Также изобретение относится ко всем стереоизомерам и геометрическим изомерам соединений, включая диастереомеры, энантиомеры и цис/транс (E/Z)-изомеры. Также изобретение включает смеси стереоизомеров и/или геометрических изомеров в любом соотношении, включая, но не ограничиваясь ими, рацемические смеси.
Соединения по изобретению являются селективными ингибиторами mPGES-1 и могут быть использованы как есть. Термин "селективный ингибитор mPGES-1", как используют в рамках изобретения, относится к веществу, которое способно ингибировать или подавлять (усиленную) экспрессию и/или функциональную активность mPGES-1 в клетках или у индивидуумов, но не имеют какого-либо или значительного ингибиторного эффекта на экспрессию циклооксигеназы, в частности, COX-2. Таким образом, соединения по изобретению способны селективно снижать уровень PGE2 без влияния на уровни других простагландинов, например, таких как PGD2, 6-кето PGF1a и PGI2. Авторы изобретения полагают, что, поскольку селективные ингибиторы mPGES-1 по изобретению не имеют значительного или не имеют эффекта на экспрессию/активность циклооксигеназ, гомеостаз простагландинов в клетках или у индивидуумов может поддерживаться на относительно стабильном уровне, тем самым облегчая заболевания или симптомы, ассоциированные со сверхэкспрессией mPGES-1, и в то же время со снижением риска неблагоприятных явлений, индуцированных ингибированием COX-1/2, таких как сердечно-сосудистые явления и повреждение желудка.
Таким образом, соединения по изобретению можно использовать в способах лечения или предупреждения усиленной экспрессии или активности mPGES-1, и/или лечения, предупреждения и/или подавления симптомов, ассоциированных с усиленной экспрессией или активностью mPGES-1. Такая усиленная или увеличенная активность mPGES-1 обычно является результатом индуцированной экспрессии фермента mPGES-1, т.е. сверхэкспрессии mPGES-1, и обеспечивает повышенные уровни PGE2. Таким образом, в рамках настоящего изобретения подразумевают, что усиленная активность mPGES-1, сверхэкспрессия mPGES-1 и увеличенные уровни PGE2 являются более высокими, чем в соответствующих нормальных, например, без воспаления, условиях, индивидуумах, органах, тканях или клетках.
В контексте настоящего изобретения активность фермента предпочтительно относится к количеству реакций, которое он катализирует за единицу времени. В контексте настоящего изобретения, величина экспрессии фермента предпочтительно относится к количеству молекул фермента, которые присутствуют в данный момент или которые продуцируются, предпочтительно в клетке, на единицу времени.
Ожидается, что соединения по изобретению будут полезными для лечения воспаления. Под термином "воспаление" специалисты в данной области подразумевают любое состояние, характеризующееся локализованным или системным защитным ответом, который может индуцироваться физической травмой, инфекцией, хроническими заболеваниями, такими как заболевания, упоминаемые в настоящем описании далее, и/или химические и/или физиологические реакции на внешние стимулы (например, в качестве части аллергического ответа). Любой такой ответ, который может служить для разрушения, разбавления или изолирования как повреждающего агента, так и поврежденной ткани, может проявляться симптомами, опосредуемыми усиленной экспрессией или активностью mPGES-1, например, нагреванием, опуханием, болью, покраснением, расширением кровеносных сосудов и/или увеличенным кровотоком.
Под термином "воспаление" также подразумевают любое воспалительное заболевание, нарушение или состояние само по себе, любое состояние, которое имеет воспалительный компонент, ассоциированный с ним, и/или любое состояние, характеризующееся воспалением в качестве симптома, включая, среди прочих, острое, хроническое, язвенное, специфическое, аллергическое, инфекцию патогенами, иммунные реакции вследствие гиперчувствительности, попадание чужеродных тел, физическое повреждение и некротическое воспаление, и другие формы воспаления, известные специалистам в данной области. Таким образом, для целей настоящего изобретения термин также включает воспалительную боль, боль в общем и/или лихорадку.
В предпочтительном варианте осуществления соединения по изобретению используют в способах лечения, предупреждения или подавления симптомов, ассоциированных с усиленной экспрессией или активностью mPGES-1, которые включают по меньшей мере одно или несколько из воспаления, боли, опухания, лихорадки, ангиогенеза и анорексии.
Предпочтительно, соединения по изобретению используют в способах лечения, предупреждения или подавления симптомов заболеваний или состояний, которые вовлекают (усиленную экспрессию и/или активность) PGES-1, которые ассоциированы с mPGES-1, и заболеваний или состояний, при которых ожидается эффективность соединений, исходя из болеутоляющего, противовоспалительного, антиангиогенного, цитостатического и/или жаропонижающего действия ингибирования mPGES-1.
Таким образом, соединения по изобретению предпочтительно используют для предупреждения или подавления симптомов, опосредуемых усиленной экспрессией или активностью mPGES-1, для лечения заболевания или состояния, выбранного из группы, состоящей из: a) острого и хронического воспаления; заболеваний кожи, таких как дерматит, экзема, псориаз, ожоги, обыкновенные угри, гнойный гидраденит и травма ткани; висцеральных заболеваний, таких как воспалительное заболевание кишечника, болезнь Крона, язвенный колит, дивертикулит, синдром раздраженного кишечника (IBS), пептические язвы, цистит, (хронический) простатит, панкреатит или нефрит; заболевания уха, носа, полости рта и горла, такого как грипп, ринит, фарингит, тонзиллит, конъюнктивит, ирит, склерит, отит и увеит; вирусных и бактериальных инфекций; связанной с воспалением анорексии; аллергии; воспалительного заболевания таза; реперфузионного повреждения; отторжения трансплантата; тендинита, васкулита и флебита; b) острой боли, хронической боли, невропатической боли, ноцицептивной боли, гипералгезии, боли, связанной с центральной сенсибилизацией, воспалительной боли по типу аллодинии, висцеральной боли, боли при злокачественной опухоли, боли при травме, зубной или хирургической боли, послеоперационной боли, боли при родах, болезненности при деторождении, персистирующей боли, периферически-опосредуемой боли, центрально-опосредуемой боли, хронической головной боли, мигрени, синусовых головных болей, тензионных головных болей, фантомных болей конечностей, боли при химиотерапии, обусловленной повреждением периферических нервов, и боли при злокачественной опухоли; c) аутоиммунного заболевания, такого как артрит, остеоартрит, ювенильный артрит, ревматоидный артрит, анкилозирующий спондилит, подагра, ревматическая атака, бурсит, системная красная волчанка (SLE) и рассеянный склероз; d) нарушений дыхания или заболеваний легких, таких как астма, хроническое обструктивное заболевание легких (COPD), саркоидоз и фиброз легких; e) злокачественной опухоли, такой как рак головного мозга, рак предстательной железы, рак почки, рак печени, рак поджелудочной железы, рак желудка, рак молочной железы, рак легкого, рак головы и шеи, рак щитовидной железы, глиобластома, меланома, лимфома, лейкоз, T-клеточная лимфома кожи и B-клеточная лимфома кожи; f) осложнений диабета, включающих диабетическую васкулопатию, диабетическую невропатию и диабетическую ретинопатию; g) нейродегенеративного нарушения, такого как болезнь Альцгеймера, болезнь Паркинсона, болезнь Гентингтона и боковой амиотрофический склероз; и h) сердечно-сосудистого заболевания, такого как атеросклероз, тромбоз, инсульт и коронарная болезнь сердца.
В другом варианте осуществления изобретение относится к способу лечения заболевания или состояния, опосредуемого или ассоциированного с усиленной экспрессией или активностью mPGES-1, где способ включает стадию введения индивидууму, страдающему от заболевания или состояния, эффективного количества соединения по изобретению. Заболевание или состояние, опосредуемое или ассоциированное с усиленной экспрессией или активностью mPGES-1, предпочтительно выбрано из группы, состоящей из a) острого и хронического воспаления; заболеваний кожи, таких как дерматит, экзема, псориаз, ожоги, обыкновенные угри, гнойный гидраденит и травма ткани; висцеральных заболеваний, таких как воспалительное заболевание кишечника, болезнь Крона, язвенный колит, дивертикулит, синдром раздраженного кишечника (IBS), пептические язвы, цистит, (хронический) простатит, панкреатит или нефрит; заболевания уха, носа, полости рта и горла, такого как грипп, ринит, фарингит, тонзиллит, конъюнктивит, ирит, склерит, отит и увеит; вирусных и бактериальных инфекций; связанной с воспалением анорексии; аллергии; воспалительного заболевания таза; реперфузионного повреждения; отторжения трансплантата; тендинита, васкулита и флебита; b) острой боли, хронической боли, невропатической боли, ноцицептивной боли, гипералгезии, боли, связанной с центральной сенсибилизацией, воспалительной боли по типу аллодинии, висцеральной боли, боли при злокачественной опухоли, боли при травме, зубной или хирургической боли, послеоперационной боли, боли при родах, болезненности при деторождении, персистирующей боли, периферически-опосредуемой боли, центрально-опосредуемой боли, хронической головной боли, мигрени, синусовых головных болей, тензионных головных болей, фантомных болей конечностей, боли при химиотерапии, обусловленной повреждением периферических нервов, и боли при злокачественной опухоли; c) анкилозирующего спондилита, подагры, ревматической атаки, бурсита; и d) осложнений диабета, включая диабетическую васкулопатию, диабетическую невропатию и диабетическую ретинопатию.
"Эффективное количество" соединения представляет собой количество соединения, которое при введении индивидууму является достаточным для снижения или устранения любого одного или нескольких симптомов заболевания или для замедления прогрессирования одного или нескольких симптомов заболевания, или для снижения тяжести одного или нескольких симптомов заболевания, или для подавления проявления заболевания, или для подавления проявления неблагоприятных симптомов заболевания. Эффективное количество может быть введено за одно или несколько введений.
"Эффективное количество", которое можно комбинировать с материалами носителя для получения единичной дозированной формы, варьируется в зависимости от хозяина, которому вводят активный ингредиент, и конкретного пути введения. Выбранную дозировку обычно изготавливают и вводят для обеспечения желаемой конечной концентрации соединения в крови.
Эффективное количество (т.е. эффективную суточную дозу), предпочтительно для взрослых, определяют в настоящем описании как общую суточную дозу приблизительно от 5 до 2000 мг, или приблизительно от 10 до 1000 мг, или приблизительно от 20 до 800 мг, или приблизительно от 30 до 800 мг или приблизительно от 30 до 700 мг, или приблизительно от 20 до 700 мг или приблизительно от 20 до 600 мг, или приблизительно от 30 до 600 мг, или приблизительно от 30 до 500 мг, приблизительно от 30 до 450 мг или приблизительно от 30 до 400 мг, или приблизительно от 30 до 350 мг или приблизительно от 30 до 300 мг или приблизительно от 50 до 600 мг, или приблизительно от 50 до 500 мг, или приблизительно от 50 до 450 мг, или приблизительно от 50 до 400 мг или приблизительно от 50 до 300 мг, или приблизительно от 50 до 250 мг, или приблизительно от 100 до 250 мг или приблизительно от 150 до 250 мг. В наиболее предпочтительном варианте осуществления эффективное количество составляет приблизительно от 200 мг.
Альтернативно эффективное количество соединения, предпочтительно для взрослых, предпочтительно вводят на кг массы тела. Таким образом, общая суточная доза, предпочтительно для взрослых, составляет от приблизительно 0,05 до приблизительно 40 мг/кг, от приблизительно 0,1 до приблизительно 20 мг/кг, от приблизительно 0,2 мг/кг до приблизительно 15 мг/кг, или от приблизительно 0,3 мг/кг до приблизительно 15 мг/кг или от приблизительно 0,4 мг/кг до приблизительно 15 мг/кг или от приблизительно 0,5 мг/кг до приблизительно 14 мг/кг или от приблизительно 0,3 мг/кг до приблизительно 14 мг/кг или от приблизительно 0,3 мг/кг до приблизительно 13 мг/кг или от приблизительно 0,5 мг/кг до приблизительно 13 мг/кг или от приблизительно 0,5 мг/кг до приблизительно 11 мг/кг.
Общая суточная доза для детей предпочтительно составляет не более 200 мг. Более предпочтительно общая суточная доза составляет приблизительно от 5 до 200 мг, приблизительно от 10 до 200 мг, приблизительно от 20 до 200 мг приблизительно от 30 до 200 мг приблизительно от 40 до 200 мг, или приблизительно от 50 до 200 мг. Предпочтительно, общая суточная доза для детей составляет приблизительно от 5 до 150 мг, приблизительно от 10 до 150 мг, приблизительно от 20 до 150 мг приблизительно от 30 до 150 мг приблизительно от 40 до 150 мг, или приблизительно от 50 до 150 мг. Более предпочтительно, общая суточная доза составляет приблизительно от 5 до 100 мг, приблизительно от 10 до 100 мг, приблизительно от 20 до 100 мг приблизительно от 30 до 100 мг приблизительно от 40 до 100 мг, или приблизительно от 50 до 100 мг. Еще предпочтительно, общая суточная доза составляет приблизительно от 5 до 75 мг, приблизительно от 10 до 75 мг, приблизительно от 20 до 75 мг приблизительно от 30 до 75 мг приблизительно от 40 до 75 мг, или приблизительно от 50 до 75 мг.
Альтернативные примеры дозировок, которые можно использовать, представляют собой эффективное количество соединений по изобретению, находящееся в диапазоне дозировок от приблизительно 0,1 мкг/кг до приблизительно от 300 мг/кг, или в диапазоне от приблизительно 1,0 мкг/кг до приблизительно 40 мг/кг массы тела, или в диапазоне от приблизительно 1,0 мкг/кг до приблизительно 20 мг/кг массы тела, или в диапазоне от приблизительно 1,0 мкг/кг до приблизительно 10 мг/кг массы тела, или в диапазоне от приблизительно 10,0 мкг/кг до приблизительно 10 мг/кг массы тела, или в диапазоне от приблизительно 100 мкг/кг до приблизительно 10 мг/кг массы тела, или в диапазоне от приблизительно 1,0 мг/кг до приблизительно 10 мг/кг массы тела, или в диапазоне от приблизительно 10 мг/кг до приблизительно 100 мг/кг массы тела, или в диапазоне от приблизительно 50 мг/кг до приблизительно 150 мг/кг массы тела, или в диапазоне от приблизительно 100 мг/кг до приблизительно 200 мг/кг массы тела, или в диапазоне от приблизительно 150 мг/кг до приблизительно 250 мг/кг массы тела, или в диапазоне от приблизительно 200 мг/кг до приблизительно 300 мг/кг массы тела, или в диапазоне от приблизительно 250 мг/кг до приблизительно 300 мг/кг массы тела. Другие дозировки, которые можно использовать, составляют приблизительно 0,01 мг/кг массы тела, приблизительно 0,1 мг/кг массы тела, приблизительно 1 мг/кг массы тела, приблизительно 10 мг/кг массы тела, приблизительно 20 мг/кг массы тела, приблизительно 30 мг/кг массы тела, приблизительно 40 мг/кг массы тела, приблизительно 50 мг/кг массы тела, приблизительно 75 мг/кг массы тела, приблизительно 100 мг/кг массы тела, приблизительно 125 мг/кг массы тела, приблизительно 150 мг/кг массы тела, приблизительно 175 мг/кг массы тела, приблизительно 200 мг/кг массы тела, приблизительно 225 мг/кг массы тела, приблизительно 250 мг/кг массы тела, приблизительно 275 мг/кг массы тела или приблизительно 300 мг/кг массы тела.
Соединения по настоящему изобретению можно вводить в однократной суточной дозе, или общую суточную дозировку можно вводить разделенными дозами два, три или четыре раза в сутки.
В предпочтительном варианте осуществления изобретения под "субъектом", "индивидуумом" или "пациентом" подразумевают индивидуальный организм, предпочтительно позвоночное, более предпочтительно млекопитающее, еще более предпочтительно примата и наиболее предпочтительно человека.
Доза, как определяют в настоящем описании, предпочтительно пригодна для введения человеку. Таким образом, в предпочтительном варианте осуществления изобретение относится к соединению, как определено в настоящем описании выше, для применения для лечения, предупреждения или подавления симптомов, ассоциированных с усиленной экспрессией или активностью mPGES-1, посредством введения эффективной дозы, как определено в настоящем описании, где индивидуумом, подлежащим лечению, является примат, где предпочтительно индивидуум является человек.
В следующем предпочтительном варианте осуществления изобретения человек является взрослым, например, человеком в возрасте 18 лет или старше. Кроме того, в рамках настоящего изобретения подразумевается, что средний вес взрослого человека составляет 62 кг, хотя известно, что средний вес варьируется между странами. В другом варианте осуществления изобретения средний вес взрослого человека, таким образом, составляет приблизительно 50-90 кг. В рамках настоящего изобретения подразумевается, что эффективная доза, как определено в настоящем описании, не ограничивается индивидуумами, имеющими средний вес. Предпочтительно, индивидуум имеет ИМТ (индекс массы тела) от 18,0 до 40,0 кг/м2, и более предпочтительно ИМТ от 18,0 до 30,0 кг/м2.
Альтернативно индивидуумом, подвергаемым лечению, является ребенок, например, человек в возрасте 17 лет или младше. Кроме того, индивидуумом, подвергаемым лечению, может быть человек от рождения до пубертатного периода или от пубертатного периода до зрелого возраста. В рамках настоящей заявки подразумевается, что пубертатный период начинается для девочек в возрасте 10-11 лет для мальчиков в возрасте 11-12 лет. Более того, индивидуум, подвергаемый лечению, может быть новорожденным (первые 28 суток после рождения), младенцем (0-1 год), ребенком преддошкольного возраста (1-3 года), ребенком дошкольного возраста (3-5 лет); ребенком школьного возраста (5-12 лет) или подростком (13-18 лет).
Соединение для применения, как определено в настоящем описании (т.е. для применения для лечения, предупреждения или подавления симптомов, опосредуемых или ассоциированных с усиленной экспрессией или активностью mPGES-1, посредством введения эффективной общей суточной дозы) можно вводить в качестве композиции.
Композиции, содержащие соединения, как описано выше, можно получать в качестве медицинского или косметического препарата или в различных других носителях, таких как продукты питания для человека или животных, включая продукты лечебного питания и пищевые добавки. "Продуктом лечебного питания" является продукт, который предназначен для специального контроля заболевания или состояния посредством диетотерапии, для которого существуют особые требования к питанию. В качестве неограничивающего примера, продукты лечебного питания могут включать витаминные и минеральные составы, вводимые через питательную трубку (посредством так называемого энтерального введения). "Биологически активная добавка" означает продукт, предназначенный для дополнения рациона человека и, как правило, ее предоставляют в форме пилюли, капсулы и таблетки, или сходного состава. В качестве неограничивающего примера, пищевая добавка может включать один или несколько из следующих ингредиентов: витамины, минералы, травы, средства фитотерапии; аминокислоты, питательных веществ, предназначенных для дополнения рациона путем увеличения общего пищевого рациона, и концентраты, метаболиты, компоненты, экстракты или комбинации любых из вышеуказанных. Биологически активные добавки также могут быть включены в продукты питания, включая, но не ограничиваясь ими, питательные батончики, напитки, порошки, злаки, готовые продукты, пищевые добавки и сладости; или другие функциональные продукты питания, предназначенные для улучшения здоровья головного мозга или для предупреждения или остановки прогрессирования нейродегенеративного заболевания, ассоциированного с усиленной экспрессией или активностью mPGES-1.
Таким образом, композиции по настоящему изобретению можно составлять с другими физиологически приемлемыми материалами, которые могут быть проглочены, включая, но не ограничиваясь этим, продукты питания. Дополнительно или альтернативно, композиции для применения, как описано в настоящем описании, можно вводить перорально в комбинации с употреблением (по отдельности) пищи.
Композиции можно вводить отдельно или в комбинации с другими фармацевтическими или косметическими средствами, и их можно комбинировать с их физиологически приемлемым носителем. В частности, соединения, описанные в настоящем описании, можно составлять в качестве фармацевтических или косметических композиций путем составления с добавками, такими как фармацевтически или физиологически приемлемые эксципиенты, носители и наполнители. Подходящие фармацевтически или физиологически приемлемые эксципиенты, носители и наполнители включают технологические добавки и модификаторы и усилители доставки лекарственных средств, например, такие как фосфат кальция, стеарат магния, тальк, моносахариды, дисахариды, крахмал, желатин, целлюлоза, метилцеллюлоза, натрий карбоксиметилцеллюлоза, декстроза, гидроксипропил-P-циклодекстрин, поливинилпирролидинон, низкоплавкие воски, ионообменные смолы и т.п., а также комбинации любых двух или более из них. Другие подходящие фармацевтически приемлемые эксципиенты описаны в "Remington's Pharmaceutical Sciences", Mack Pub. Co., New Jersey (1991), и "Remington: The Science and Practice of Pharmacy", Lippincott Williams & Wilkins, Philadelphia, 20th edition (2003), 21st edition (2005) and 22nd edition (2012), включенные в настоящее описание в качестве ссылок.
Фармацевтические или косметические композиции, содержащие соединения для применения в соответствии с изобретением, могут быть в любой форме, пригодной для предполагаемого способа введения, включая, например, раствор, суспензию или эмульсию. В предпочтительном варианте осуществления соединение вводят в твердой форме или в жидкой форме.
Твердые дозированные формы для перорального введения могут включать капсулы, таблетки, пилюли, порошки и гранулы. В таких твердых дозированных формах активное соединение может быть смешано по меньшей мере с одним инертным разбавителем, таким как сахароза, лактоза или крахмал. Такие дозированные формы также могут включать дополнительные вещества, отличные от инертных разбавителей, например, смазывающие вещества, такие как стеарат магния. В случае капсул, таблеток и пилюль, дозированные формы также могут содержать буферные средства. Кроме того, таблетки и пилюли можно получать с кишечнорастворимыми покрытиями.
Жидкие дозированные формы для перорального введения могут включать фармацевтически приемлемые эмульсии, растворы, суспензии, сиропы и эликсиры, содержащие инертные разбавители, обычно используемые в данной области, такие как вода или солевой раствор. Такие композиции также могут содержать адъюванты, такие как смачивающие вещества, эмульгирующие и суспендирующие вещества, циклодекстрины и подсластители, вкусовые добавки и отдушки.
Жидкие носители обычно используют для получения растворов, суспензий и эмульсий. В предпочтительном варианте осуществления жидкие носители/жидкие дозированные формы, предусматриваемые для применения настоящего изобретения на практике, включают, например, воду, солевой раствор, фармацевтически приемлемый органический растворитель(и), фармацевтически приемлемые масла или жиры и т.п, а также смеси двух или более из них. В предпочтительном варианте осуществления соединение для применения, как определено в настоящем описании, смешивают с водным раствором перед введением. Водный раствор должен быть пригодным для введения, и такие водные растворы хорошо известны в данной области. Кроме того, в данной области известно, что пригодность водного раствора для введения может зависеть от пути введения.
В предпочтительном варианте осуществления водный раствор представляет собой изотонический водный раствор. Изотонический водный раствор предпочтительно является практически (или полностью) изотоничным с плазмой крови. В еще более предпочтительном варианте осуществления изотонический водный раствор представляет собой солевой раствор.
Жидкий носитель может содержать другие подходящие фармацевтически приемлемые добавки, такие как солюбилизаторы, эмульгаторы, пищевые добавки, буферы, консерванты, суспендирующие вещества, загустители, регуляторы вязкости, стабилизаторы, вкусовые добавки и т.п. Предпочтительными вкусовыми добавками являются подсластители, такие как моносахариды и/или дисахариды. Подходящие органические растворители включают, например, одноатомные спирты, такие как этанол, и многоатомные спирты, такие как гликоли. Подходящие масла включают, например, соевое масло, кокосовое масло, оливковое масло, сафлоровое масло, хлопковое масло и т.п.
Для парентерального введения носитель также может представлять собой жирный сложный эфир, такой как этилолеат, изопропилмиристат и т.п. Композиции для применения в рамках настоящего изобретения также могут иметь форму микрочастиц, микрокапсул, инкапсулированных в липосомы средств и т.п., а также комбинаций любых двух или более из них.
Можно использовать системы доставки с модифицированным во времени высвобождением, замедленным высвобождением или контролируемым высвобождением, такие как матриксная система с контролируемой диффузией или эродируемая система, как описано, например, в: Lee, "Diffusion-Controlled Matrix Systems", pp. 155-198 и Ron and Langer, "Erodible Systems", pp. 199-224, "Treatise on Controlled Drug Delivery", A. Kydonieus Ed., Marcel Dekker, Inc., New York 1992. Матрикс может представлять собой, например, биодеградируемый материал, который может деградировать самопроизвольно in situ и in vivo, пример, посредством гидролиза или ферментативного расщепления, например, протеазами. Система доставки может представлять собой, например, встречающийся в природе или синтетический полимер или сополимер, например, в форме гидрогеля. Иллюстративные полимеры с поддающимися расщеплению связями включают простые полиэфиры, сложные полиортоэфиры, полиангидриды, полисахариды, сложные полифосфоэфиры, полиамиды, полиуретаны, поли(имидокарбонаты) и поли(фосфазены).
Соединения по настоящему изобретению также можно вводить в форме липосом. Как известно в данной области, липосомы, как правило, получают из фосфолипидов или других липидных веществ. Липосомы образованы однослойными или многослойными гидратированными жидкими кристаллами, которые диспергированы в водной среде. Можно использовать любой нетоксичный, физиологически приемлемый и метаболизируемый липид, способный образовывать липосомы. Композиции по настоящему изобретению в форме липосом могут содержать, в дополнение к соединению, как определено в рамках настоящего изобретения, стабилизаторы, консерванты, эксципиенты и т.п. Предпочтительными липидами являются фосфолипиды и фосфатидилхолины (лецитины), как природные, так и синтетические. Способы формирования липосом известны в данной области. См., например, Prescott, Ed., Methods in Cell Biology, Volume XIV, Academic Press, New York, N. Y., p. 33 et seq (1976).
Фармацевтическая или косметическая композиция может содержать состав единичной дозы, где единичная доза представляет собой дозу, достаточную для терапевтического или супрессивного эффекта на нарушение или состояние, как определено в настоящем описании. Единичная доза может быть достаточной в качестве однократной дозы для терапевтического или супрессивного эффекта на нарушение или состояние, как определено в настоящем описании. Альтернативно, единичная доза может представлять собой дозу, вводимую периодически в ходе лечения или подавления нарушения или состояния, как определено в настоящем описании. В ходе лечения можно проводить мониторинг концентрации композиций по изобретению, чтобы обеспечить поддержание желаемого уровня соединения по изобретению.
В предпочтительном варианте осуществления изобретение относится к соединению, как определено в настоящем описании, для применения для лечения, предупреждения или подавления симптомов, опосредуемых или ассоциированных с усиленной экспрессией или активностью mPGES-1, путем введения эффективной общей суточной дозы, и где предпочтительно соединение достигает стационарного уровня в крови в течение 5 суток. Более предпочтительно стационарные уровни достигаются в течение 4 суток, еще более предпочтительно в течение 3 суток и наиболее предпочтительно стационарные уровни достигаются в течение 2 суток после первого введения.
Под стационарным состоянием подразумевают в настоящем описании, что общее поступление соединения, как определено выше (приблизительно) находится в динамическом равновесии с его выведением. В стационарном состоянии уровни соединения в плазме предпочтительно сохраняются в эффективном терапевтическом диапазоне. Иными словами, уровни соединения в крови поддерживаются между минимальной терапевтически эффективной концентрацией и максимальной терапевтически эффективной концентрацией. При концентрации ниже минимальной соединение не имеет достаточного терапевтического эффекта, чтобы считать его эффективным. При концентрации выше максимальной побочные эффекты возрастают, что в конечном итоге приводит к токсичности.
Для поддержания эффективного терапевтического диапазона в ходе лечения средние концентрации в плазме (Cav) соединения, как определено в настоящем описании, поддерживают на уровне от приблизительно 10 нг/мл до приблизительно 20000 нг/мл, или от приблизительно 20 нг/мл до приблизительно 10000 нг/мл, или от приблизительно 30 нг/мл до приблизительно 5000 нг/мл, или от приблизительно 30 нг/мл до приблизительно 4000 нг/мл, или от приблизительно 30 нг/мл до приблизительно 3000 нг/мл, или от приблизительно 30 нг/мл до приблизительно 2000 нг/мл, или от приблизительно 30 нг/мл до приблизительно 1000 нг/мл, или от приблизительно 50 нг/мл до приблизительно 5000 нг/мл, или от приблизительно 100 нг/мл до приблизительно 5000 нг/мл, или от приблизительно 50 нг/мл до приблизительно 4000 нг/мл, или от приблизительно 50 нг/мл до приблизительно 3000 нг/мл, или от приблизительно 50 нг/мл до приблизительно 2000 нг/мл, или от приблизительно 50 нг/мл до приблизительно 1000 нг/мл. В более предпочтительном варианте осуществления поддерживают среднюю концентрацию соединения в плазме приблизительно 50 нг/мл-500 нг/мл или 100 нг/мл-500 нг/мл.
Средние концентрации в плазме можно определять с использованием любого общепринятого способа, известного в данной области. Однако в предпочтительном варианте осуществления концентрации в плазме определяют путем экстракции соединения, как определено в настоящем описании, из плазмы человека посредством преципитации с белком, с последующей жидкостной хроматографией - тандемной масс спектрометрией (LC-MS/MS). Затем можно определять концентрацию соединения с использованием калибровочных стандартов.
Соединение, как определено в настоящем описании, может метаболизироваться и вместо или в дополнение к не метаболизированному соединению в ходе лечения можно поддерживать эффективный терапевтический диапазон метаболизированного соединения. В предпочтительном варианте осуществления изобретения средние концентрации в плазме (Cav) метаболизированного соединения поддерживают на уровне от приблизительно 5 нг/мл до приблизительно 5000 нг/мл, или от приблизительно 10 нг/мл до приблизительно 2000 нг/мл, или от приблизительно 20 нг/мл до приблизительно 1000 нг/мл, или от приблизительно 20 нг/мл до приблизительно 800 нг/мл, или от приблизительно 20 нг/мл до приблизительно 600 нг/мл, или от приблизительно 20 нг/мл до приблизительно 400 нг/мл, или от приблизительно 20 нг/мл до приблизительно 200 нг/мл, или от приблизительно 30 нг/мл до приблизительно 1000 нг/мл, или от приблизительно 50 нг/мл до приблизительно 1000 нг/мл, или от приблизительно 30 нг/мл до приблизительно 800 нг/мл, или от приблизительно 30 нг/мл до приблизительно 600 нг/мл, или от приблизительно 30 нг/мл до приблизительно 400 нг/мл, или от приблизительно 30 нг/мл до приблизительно 200 нг/мл. В более предпочтительном варианте осуществления поддерживают среднюю концентрацию соединения в плазме приблизительно 40 нг/мл-500 нг/мл или 50 нг/мл-200 нг/мл.
В ходе или после введения соединения, как определено в рамках настоящего изобретения, максимальные концентрации в плазме (Cmax) остаются на уровне ниже приблизительно 20000 нг/мл, или ниже 10000 нг/мл, или ниже 5000 нг/мл, или ниже приблизительно 4000 нг/мл, или ниже приблизительно 3000 нг/мл, или ниже приблизительно 2000 нг/мл или ниже приблизительно 1000 нг/мл. В наиболее предпочтительном варианте осуществления максимальные концентрации в плазме остаются на уровне ниже 500 нг/мл.
Аналогично, максимальные концентрации в плазме метаболизированного соединения остаются на уровне ниже приблизительно 5000 нг/мл, или 2000 нг/мл, или 1000 нг/мл, или ниже приблизительно 800 нг/мл, или ниже приблизительно 600 нг/мл, или ниже приблизительно 400 нг/мл. В наиболее предпочтительном варианте осуществления максимальные концентрации метаболизированного соединения в плазме остаются на уровне ниже приблизительно 250 нг/мл.
Для поддержания эффективного диапазона в ходе лечения соединение можно вводить один раз в сутки, или один раз в двое, трое, четверо или пятеро суток. Однако предпочтительно соединение можно вводить по меньшей мере один раз в сутки. Таким образом, в предпочтительном варианте осуществления изобретение относится к соединению, как определено в настоящем описании выше, для применения для лечения, предупреждения или подавления симптомов, опосредуемых или ассоциированных с усиленной экспрессией или активностью mPGES-1, посредством введения эффективной общей суточной дозы, где эффективная доза определена в настоящем описании выше. Общую суточную дозу можно вводить в качестве однократной суточной дозы. Альтернативно соединение вводят по меньшей мере два раза в сутки. Таким образом, соединение, как определено в настоящем описании, можно вводить один раз, два раза, три раза, четыре раза или пять раз в сутки. По сути, общая суточная доза может быть разделена на несколько доз (единиц), которые обеспечивают введение общей суточной дозы, как определено в настоящем описании. В предпочтительном варианте осуществления соединение вводят два раза в сутки. Кроме того, понятно, что термины "два раза в сутки", "bid" и "bis in die" могут использоваться в настоящем описании взаимозаменяемо.
В предпочтительном варианте осуществления общая суточная доза разделена на несколько доз в сутки. Эти отдельные дозы могут различаться количеством. Например, для каждой общей суточной дозы первая доза может иметь большее количество соединения, чем вторая доза, или наоборот. Однако предпочтительно соединение вводят в сходных или равных дозах. Таким образом, в наиболее предпочтительном вариант осуществления соединение вводят два раза в сутки в двух сходных или равных дозах.
В следующем предпочтительном варианте осуществления изобретения общую суточную дозу соединения, как определено в настоящем описании выше, вводят по меньшей мере в двух отдельных дозах. Интервал между введением по меньшей мере двух отдельных доз составляет по меньшей мере приблизительно 0,5, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11 или 12 часов, предпочтительно интервал между по меньшей мере двумя отдельными дозами составляет по меньшей мере приблизительно 4, 5, 6, 7, 8, 9, 10, 11 или 12 часов и более предпочтительно интервал между по меньшей мере двумя отдельными дозами составляет по меньшей мере приблизительно 8, 9, 10, 11 или 12 часов.
Композицию можно вводить в эффективной суточной дозе, как определено в рамках настоящего изобретения, в качестве либо профилактики, либо лечения, пациенту любым из ряда способов. В частности, способ введения может варьироваться в зависимости от конкретного индивидуума, состояния или стадии заболевания и других факторов, известных специалисту в данной области.
Соединения для применения, как определено в настоящем описании, можно вводить энтеральным путем, перорально, парентерально, сублингвально, посредством ингаляции (например, в качестве аэрозолей или спреев), ректально или местным путем в единичных дозированных составах, содержащих общепринятые нетоксичные фармацевтически или физиологически приемлемые носители, адъюванты и наполнители, если желательно. Например, подходящие способы введения включают пероральный, подкожный, трансдермальный, трансмукозальный, ионофоретический, внутривенный, внутриартериальный, внутримышечный, внутрибрюшинный, интраназальный (например, через слизистую оболочку носа), субдуральный, ректальный, желудочно-кишечный и т.п., и прямо в конкретный или пораженный орган или ткань. Для доставки в центральную нервную систему можно использовать спинномозговое или эпидуральное введение или введение в желудочки головного мозга. Местное введение также может вовлекать использование трансдермального введения, такого как трансдермальные пластыри или устройства для ионофореза. Термин "парентеральный", как используют в рамках изобретения, включает подкожные инъекции, внутривенные, внутримышечные, внутригрудинные инъекции или способы инфузии.
Соединения смешивают с фармацевтически приемлемыми носителями, адъювантами и наполнителями, пригодными для требуемого пути введения. Предпочтительным путем введения является пероральное введение, и предпочтительными составами являются составы, пригодные для перорального введения. Альтернативно соединения можно вводить путем подпитки через желудочные или подкожные трубки.
Таким образом, в предпочтительном варианте осуществления изобретение относится к соединению, как определено в настоящем описании выше, для применения для лечения, предупреждения или подавления симптомов, опосредуемых или ассоциированных с усиленной экспрессией или активностью mPGES-1, посредством введения эффективной общей суточной дозы, где соединение вводят перорально.
Пероральный путь является предпочтительным способом введения и (по меньшей мере для взрослых) предпочтительно используемая дозированная форма представляет собой твердую пероральную дозированную форму. Класс твердых пероральных дозированных форм состоит в основном из таблеток и капсул, хотя другие формы известны в данной области и могут быть в равной степени пригодными. При использовании в качестве твердой пероральной дозированной формы, соединение, как определено в настоящем описании, можно вводить, например, в форме таблетки немедленного высвобождения (или капсулы и т.п.) или таблетки замедленного высвобождения (или капсулы и т.п.). В контексте изобретения можно использовать любые подходящие твердые дозированные формы немедленного высвобождения или замедленного высвобождения, как будет понятно специалисту в данной области.
Соединения, описанные для применения, как описано в настоящем описании, можно вводить в твердой форме, в жидкой форме, в форме аэрозоля или в форме таблеток, пилюль, порошковых смесей, капсул, гранул, инъекционных форм, кремов, растворов, суппозиториев, клизм, кишечных орошений, эмульсий, дисперсий, пищевых готовых смесей и в других подходящих формах. Соединения также можно вводить в липосомальных составах. Соединения также можно вводить в качестве пролекарств, где пролекарство претерпевает трансформацию у подвергаемого лечению индивидуума в форму, которая является терапевтически эффективной. Дополнительные способы введения известны в данной области.
Инъекционные препараты, например, стерильные инъекционные водные или масляные суспензии, можно составлять известными способами с использованием подходящих диспергирующих или смачивающих веществ и суспендирующих веществ. Стерильный инъекционный препарат также может представлять собой стерильный инъекционный раствор или суспензию в нетоксичном парентерально приемлемом разбавителе или растворителе, например, в качестве раствора в пропиленгликоле. Приемлемыми носителями и растворителями, которые могут использоваться, являются вода, раствор Рингера и изотонический раствор хлорида натрия. Кроме того, в качестве растворителя или суспендирующей среды обычно используют стерильные жирные масла. Для этой цели можно использовать любое легкое жирное масло, включая синтетические моно- или диглицериды. Кроме того, для получения инъекционных составов применимы жирные кислоты, такие как олеиновая кислота.
Суппозитории для ректального введения лекарственного средства можно получать путем смешения лекарственного средства с подходящим не вызывающим раздражения эксципиентом, таким как масло какао и полиэтиленгликоль, который является твердым при комнатной температуре, но жидким при ректальной температуре и, таким образом, плавится в прямой кишке и высвобождает лекарственное средство.
В то время как соединения для применения, как описано в настоящем описании, можно вводить в качестве единственного фармацевтического (или косметического) средства, их также можно использовать в комбинации с одним или несколькими другими средствами, используемыми для лечения или подавления нарушений.
Когда в комбинации с соединениями по настоящему изобретению используют дополнительные активные вещества, дополнительные активные вещества можно, главным образом, использовать в терапевтических количествах, указанных в Physicians' Desk Reference (PDR) 53rd Edition (1999), которая включена в настоящее описание в качестве ссылки, или в таких терапевтически полезных количествах, которые известны специалисту в данной области. Соединения по изобретению и другие терапевтически активные вещества можно вводить в рекомендованной максимальной клинической дозе или в более низких дозах. Дозировки активных соединений в композициях по изобретению могут варьироваться для достижения желаемого терапевтического ответа в зависимости от пути введения, тяжести заболевания и ответа пациента. При введении в комбинации с другими терапевтическими средствами, терапевтические средства можно составлять в качестве отдельных композиций, которые вводят в то же время или в другое время, или терапевтические средства можно вводить в качестве единой композиции.
В этом документе и его формуле изобретения глагол "содержать" и его спряжения используют в его неограничивающем значении для обозначения того, что приведенные далее положения включены, однако положения, конкретно не упомянутые, не исключены. Кроме того, указание на элемент в форме единственного числа не исключает возможности, что присутствует более одного элемента, если контекст явно не требует, чтобы был один и только один из элементов. Таким образом, форма единственного числа обычно означает "по меньшей мере один".
Слово "приблизительно" или "примерно", когда оно используется совместно с числовой величиной (например, приблизительно 10), предпочтительно означает, что эта величина может представлять собой данную величину (10) и величину, которая больше или меньше этой величины в пределах 0,1%.
Все патенты и источники литературы, цитированные в настоящем описании, включены в настоящее описание в качестве ссылок в полном объеме.
Настоящее изобретение далее описано с использованием следующих примеров, которые не следует считать ограничивающими объем изобретения.
Описание чертежей
Фиг.1. Пути синтеза простагландинов и стратегии нацеливания.
Фиг.2. (A-C) Уровни простагландинов (PG) PGE2 (A), PGD2 (B) и 6-кето PGF1a (C) в супернатанте макрофагов мыши RAW 264.7, подвергнутых воздействию в течение 24 часов носителя или 1 мкг/мл липополисахарида (LPS), приведенные к носителю.
(D-F) Уровни PGE2, PGD2 и 6-кето PGF1a в супернатанте макрофагов мыши RAW 264.7, подвергнутых воздействию в течение 24 часов носителю или 1 мкг/мл LPS, отдельно (принято за 100%) или в комбинации с возрастающими концентрациями соединения I-IVb-X (соединение общей структуры (I), где T представляет собой общую структуру (IVb), в S, R-конфигурации, и где для соединения X применимо следующее: L=L19; R1=H; R2-R2’ = L3; R3=H; указано как KH) (D), неселективного ингибитора COX индометацина (E) или ингибитора COX-2 целекоксиба (F).
Фиг.3. (A-B) Уровни PGE2 (A) и PGD2 (B) в супернатанте первичных фибробластов кожи человека, подвергнутых воздействию в течение 24 часов носителя, 1 мкг/мл LPS или 1 мкг/мл интерлейкина-1β (IL-1β), приведенные к носителю.
(C-D) Уровни PGE2 и PGD2 в супернатанте первичных фибробластов кожи человека, подвергнутых воздействию в течение 24 часов 1 мкг/мл LPS (C) или 1 мкг/мл IL-1β (D) отдельно (принято за 100%) или в комбинации с возрастающими концентрациями соединения I-IVb-X (указано как KH).
Фиг.4. (A) Анализ с использованием вестерн-блоттинга ферментов mPGES-1, COX-2, cPGES, mPGES-2 и COX-1 в макрофагах мыши RAW 264.7, подвернутых воздействию в течение 24 часов носителя или 1 мкг/мл LPS, отдельно или в комбинации с возрастающими концентрациями соединения I-IVb-X (указано как KH). (B-F) Количественное определение уровней ферментов mPGES-1 (B), COX-2 (C), mPGES-2 (D), cPGES (E) и COX-1 (F) как в (A) с актином в качестве эталона нагрузки и приведенных к клеткам, обработанных носителем.
Фиг.5. Количественное определение посредством кПЦР уровней РНК ферментов mPGES-1 (A), COX-2 (B), cPGES (C), mPGES-2 (D) и COX-1 (E) в макрофагах мыши RAW 264.7, подвергнутых воздействию в течение 24 часов носителя, 1 мкг/мл LPS отдельно или в комбинации с возрастающими концентрациями соединения I-IVb-X (указано как KH).
Фиг.6. Активность mPGES-1 анализировали в качестве конвертирования PGH2 в PGE2 с использованием микросомальных фракций клеток RAW 264.7, подвергнутых обработке в течение 24 часов LPS 1 мкг/мл для повышения экспрессии mPGES-1. Микросомальную фракцию подвергали воздействию возрастающих концентраций соединения, подлежащего тестированию, или 3 мкМ известных ингибиторов mPGES-1 MK866 или PF9184 в качестве положительных контролей. Уровень PGE2 приводили к обработанным носителям образцам микросом (100%). (A) Соединение I-IVb-X; (B) соединение I-IVb-AE; (C) соединение I-IVb-A-HCl; (D) соединение I-IVb-I.
Примеры
Пример 1
Способы и материалы
Химические реактивы и антитела
Антитела, направленные против cPGES, mPGES-1 и mPGES-2, приобретали от Cayman chemicals. Антитела, направленные против COX-1, COX-2 и актина, приобретали от R&D systems, Thermo Fisher Scientific and Sigma-Aldrich, соответственно. Ингибиторы COX, целекоксиб и индометацин, и липополисахарид приобретали от Sigma-Aldrich. Ингибиторы mPGES-1, MK866 и PF9184, и PGH2 приобретали от Cayman Chemicals. IL-1β приобретали от Cell Signaling Technologies.
Соединения для применения в соответствии с изобретением получали, как описано в WO2014/011047 или в WO2017/060432.
Культура клеток Raw 264.7
Клетки RAW264.7 (Sigma-Aldrich, St-Louis) поддерживали в DMEM (Thermo Fisher Scientific), содержавшей 10% FBS (Greiner Bio-one) и антибиотики (100 Е/мл пенициллина, 100 мкг/мл стрептомицина) в увлажненной атмосфере с 5% CO2 при 37°C. Клетки выращивали до 80% смыкания монослоя, соскребали, а затем культивировали либо в 96-луночных планшетах (2×104 клеток/лунка) или шестиячеечных планшетов (4×105 клеток/лунка) в течение 6-24 часов перед экспериментом.
Культура первичных фибробластов кожи человека
Клетки поддерживали в M199, HEPES (Thermo Fischer Scientific), содержавшей 10% FBS (#758093, Greiner Bio-one), 100 МЕ/мл пенициллина и 100 мкг/мл стрептомицина (#30-002-CI, Corning) в увлажненной атмосфере с 5% CO2 при 37°C. Клетки пассировали посредством трипсинизации каждые 4-5 суток до достижения ими количества пассажей 20, а затем выбрасывали. Клетки выращивали до 80% смыкания монослоя, трипсинизировали, а затем культивировали в 96-луночных планшетах (4×103 клеток/лунка) за 24 часа до эксперимента.
Количественное определение простогландинов
Концентрацию PGE2, PGD2 и 6-кето-PGF1α в культуральной среде определяли посредством твердофазного иммуноферментного анализа (ELISA) с использованием, соответственно, набора для высокоселективного EIA на PGE2 (Enzo Life Science), набора для ELISA на простагландин D2-MOX (Cayman Chemicals) и набора для ELISA на 6-кето простагландин F1α Kit (Cayman Chemicals), в соответствии с инструкциями изготовителя. Образцы (100 мкл) культуральной среды из каждой лунки собирали и разбавляли буфером для анализа. Уровни каждого простаноида вычисляли с использованием стандартной кривой и приводили, как указано на легендах к чертежам.
Анализ с использованием вестерн-блоттинга
После обработки клетки собирали соскабливанием и лизировали в буфере для анализа с использованием радиоиммунопреципитации (50 мМ Tris-HCl, pH8,0, 150 мМ NaCl, 0,2% Triton, 1× ингибитор протеаз, и 0,1 мг/мл ДНК-азы). Концентрацию белка в образцах определяли с использованием анализа Брэдфорда. Равные количества белков в каждых образцах разделяли SDS-полиакриламидным гель-электрофорезом (SDS-PAGE) и подвергали электропереносу на мембрану из PVDF. Мембраны блокировали в течение 1 ч при комнатной температуре в блокирующем буфере Odyssey (Li-Cor), а затем инкубировали с первичным антителом против mPGES-1 (разведение 1:200), mPGES-2 (разведение 1:200), cPGES (разведение 1:200), COX-1 (разведение 1: 250), COX-2 (разведение 1:500) или β-актином (разведение 1:10000) в TBST при 4°C в течение ночи. После промывания мембран три раза посредством TBST добавляли вторичное антитело (вторичное антитело козы против IgG кролика (H+L), Alexa Fluor 488, или вторичное антитело козы против антител IgG мыши (H+L), Alexa Fluor 647, Thermo Fisher scientific) добавляли в разведении 1:10000 в течение 1 часа при комнатной температуре. Сканирование флуоресценции блотов проводили с использованием инфракрасной системы сканирования Odyssey (Li-Cor).
Активность PGES в микросомах
Активность PGES количественно определяли посредством оценки конвертирования PGH2 в PGE2. В кратком изложении, после инкубации в течение 24 часов с 1 мкг/мл LPS клетки собирали и лизировали обработкой ультразвуком (три раза по 10 секунд с интервалами 1 мин) в 300 мкл 1 M Tris-HCl (pH 8,0). После центрифугирования лизата при 12000 g в течение 10 мин при 4°C, супернатант собирали и далее центрифугировали при 100000 g в течение 1 ч при 4°C. Осадок (микросомальные мембраны) ресуспендировали в 100 мкл 0,1 M Tris-HCl, pH 8,0, содержавшем ингибиторы протеаз) и подвергали определению активности PGES в микросомах. Для определения активности PGES аликвоту каждого образца, эквивалентную 50 мкг белка, инкубировали с 2 мкг PGH2 в течение 60 с при 24°C В 0,1 мл 1 M Tris-HCl, содержавшего 2 мМ глутатион (Sigma-Aldrich) и 14 мкМ индометацин, в отсутствии или в присутствии исследуемых соединений. Реакцию останавливали добавлением 100 мМ FeCl2, и реакционную смесь далее инкубировали при 20-25°C в течение 15 мин. После центрифугирования реакционной смеси определяли концентрацию PGE2 в супернатанте с использованием высокочувствительного набора для EIA на PGE2 (Enzo Life Science) в соответствии с инструкциями изготовителя.
Количественное определение РНК посредством кОТ-ПЦР
После обработки в течение 6 ч посредством 1 мкг/мл LPS в отсутствии или в присутствии тестируемых соединений тотальную РНК выделяли из клеток с использованием реагента Trizol (Thermo Fisher Scientific). Проводили транскрипцию РНК в кДНК с использованием набора для синтеза первой цепи кДНК (Thermo Fisher Scientific). кДНК подвергали денатурации в течение 10 мин при 95°C. Специфические фрагменты ДНК COX-1, COX-2, mPGES-1, mPGES-2, cPGES и PPIA амплифицировали способом ПЦР с использованием устройства управления циклами SYBR Green (Roche Life Science) в течение 40 циклов с 15 с при 95°C, 60 с при 60°C. Олигонуклеотидные праймеры, использованные для COX1, представляли собой 5’-GATTGTACTCGCACGGGCTAC-3’ (прямой) и 5’-GGATAAGGTTGGACCGCACT-3’ (обратный), для COX2 они представляли собой 5’-AGGACTCTGCTCACGAAGGA-3’ (прямой) и 5’-TGACATGGATTGGAACAGCA-3’ (обратный), для mPGES-1 они представляли собой 5’-AGCACACTGCTGGTCATCAA-3’ (прямой) и 5’-CTCCACATCTGGGTCACTCC-3’ (обратный), для mPGES-2 они представляли собой 5’-GCTGGGGCTGTACCACAC-3’ (прямой) и 5’-GATTCACCTCCACCACCTGA-3’ (обратный), для cPGES они представляли собой 5’-GGTAGAGACCGCCGGAGT-3’ (прямой) и 5’-TCGTACCACTTTGCAGAAGCA-3’ (обратный), для PPIA они представляли собой 5’-AGGGTGGTGACTTTACACGC-3’ (прямой) и 5’-GATGCCAGGACCTGTATGCT-3’ (обратный). Амплификацию с использованием ПЦР также проводили в образцах без кДНК в качестве отрицательного контроля. Относительную экспрессию генов COX-1, COX-2, mPGES-1, mPGES-2 и cPGES определяли способом ΔΔCT, сравнивающим экспрессию в группах носителя и обработки. В качестве эталонного гена использовали PPIA.
Результаты
Соединение I-IVb-X селективно снижает уровень PGE2.
Макрофаги RAW 264.7 обрабатывали воспалительным стимулом LPS отдельно или в комбинации с возрастающими концентрациями соединения I-IVb-X (соединение общей структуры (I), где T представляет собой общую структуру (IVb), в S, R-конфигурации, и где в отношении соединения X применимо следующее: L=L19; R1=H; R2-R2’ = L3; R3=H), NSAID индометацином или Coxib целекоксибом. После инкубации в течение 24 часов уровни PGE2, PGD2 и 6-кето PGF1a количественно определяли в супернатантах клеток посредством ELISA. Как и ожидалось, LPS эффективно индуцировал продуцирование трех простагландинов (фиг.2A-C) (Ikeda-Matsuo et al., 2005), которое во всех случаях могло снижаться зависимым от дозы образом посредством ингибиторов COX индометацина и целекоксиба (фиг.2E-F). Неожиданно, хотя соединение I-IVb-X могло зависимым от дозы образом снижать уровень PGE2, оно не имеет эффекта на два других простагландина PGD2 и 6-кето PGF1a, стабильный метаболит PGI2, часто определяемый вместо PGI2 (фиг.2D). Сходные результаты были получены для соединения I-IVb-X в первичных фибробластах кожи человека. После инкубации фибробластов в течение 24 часов с воспалительным стимулом либо LPS, либо с IL-1β, уровни PGE2 и PGD2 в супернатанте значительно возрастали (фиг.3A и B). Соединение I-IVb-X могло эффективно снижать уровень PGE2, но не PGD2, в супернатанте клеток, обработанных либо LPS (фиг.3C), либо IL-1β (фиг.3D).
Соединение I-IVb-X селективно снижает экспрессию фермента mPGES-1.
Макрофаги RAW 264.7 обрабатывали воспалительным стимулом LPS отдельно или в комбинации с возрастающими концентрациями соединения I-IVb-X. После инкубации в течение 24 часов уровни белков mPGES-1, mPGES-2, cPGES, COX-1 и COX-2 количественно определяли в супернатантах клеток посредством вестерн-блоттинга или кПЦР, соответственно. Как и ожидалось, LPS эффективно индуцировал продуцирование двух индуцибельных ферментов mPGES-1 и COX-2 на уровнях белка (фиг.4 A-C)) и РНК (фиг.5A и B), в то время как не имел эффекта на конститутивно экспрессируемые ферменты mPGES-2, cPGES и COX-1 на уровнях белка (фиг.4A, D-F) и РНК (фиг.5 C-E). В то время как соединение I-IVb-X могло зависимым от дозы образом снижать индуцируемую LPS экспрессию белка mPGES-1 (фиг.4B) и РНК (фиг.5A), оно не имело эффекта на экспрессию COX-2 (фиг.4C и 5B). Соединение I-IVb-X не имело эффекта на три других конститутивных фермента mPGES-2, cPGES и COX-1 (фиг.4 D-F и фиг.5 C-E). Эти результаты показывают, что соединение I-IVb-X может селективно ингибировать экспрессию фермента mPGES-1, индуцированную воспалительным стимулом LPS, что объясняет его селективность в отношении снижения уровня только PGE2, но не других простагландинов.
Соединение I-IVb-X ингибирует ферментативную активность mPGES-1.
Макрофаги RAW 264.7 обрабатывали воспалительным стимулом LPS для повышения экспрессии mPGES-1. После инкубации в течение 24 часов микросомы выделяли и подвергали воздействию возрастающих концентраций соединения I-IVb-X или однократной концентрации ранее описанных ингибиторов mPGES-1 MK866 и PF9184 в течение 30 минут. Затем анализировали активность mPGES-1 в микросомальной фракции в качестве конвертирования PGH2 в PGE2. Результаты показывают, что активность mPGES-1 в очищенных микросомах, обработанных соединением I-IVb-X или двумя положительными контролями MK866 и PF9184, снижалась (фиг.6A).
Пример 2 - Ингибирование ферментативной активности mPGES-1
С использованием способов, как описано в примере 1, тестировали дополнительные соединения. В таблице 1 представлен обзор соединений, которые были протестированы, вместе с соответствующими величинами IC50. На фиг.6B, 6C и 6D представлены соответствующие кривые ингибирования для I-IVb-AE, I-IVb-A-HCl и I-IVb-I, соответственно.
Таблица 1 - Иллюстративные соединения, которые ингибируют ферментативную активность mPGES-1
(×10-6)
L=L11, R1=H,
R2=H, R3=H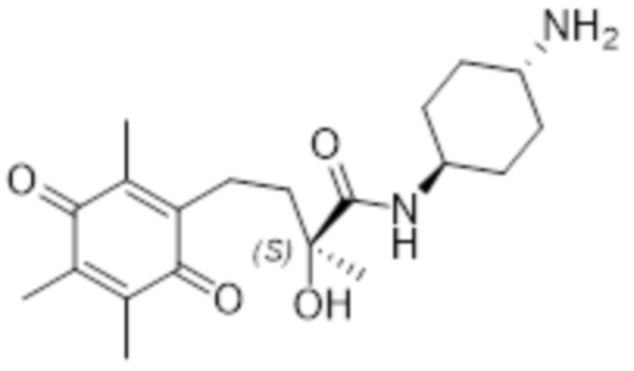
L=L26, R1=H,
R2=H,
R5-R5’ = L1,
R3=H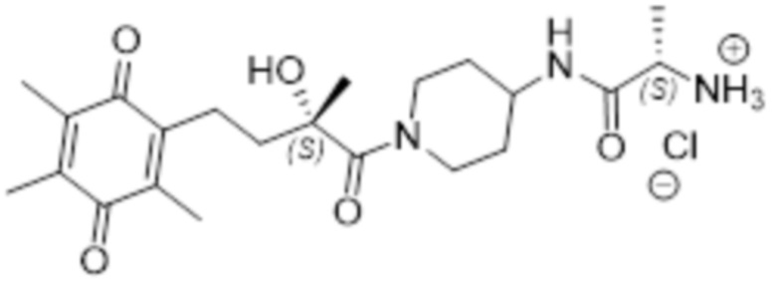
L=L23,
R1-R1’ = L1,
R2=H, R3=H
R4=H, X=Cl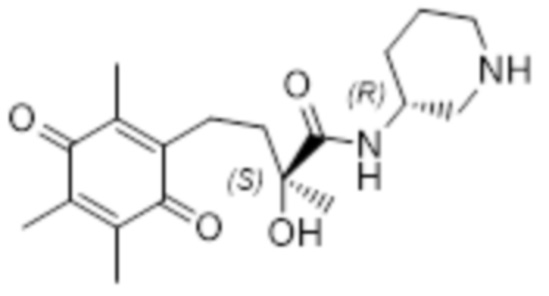
L=L19, R1=H, R2-R2’ = L3,
R3=H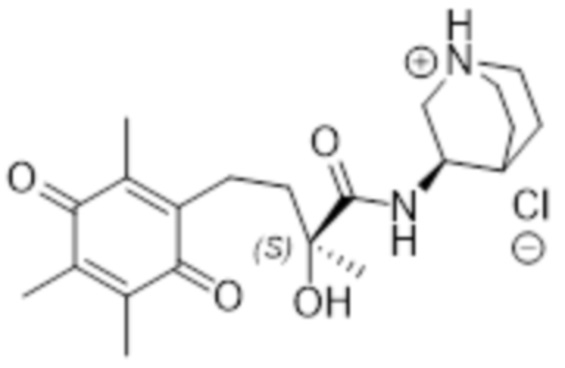
L=L27, R1=H,
R2-R2’ = -CH2-, R3-R3’ = L1, R4=H, X=Cl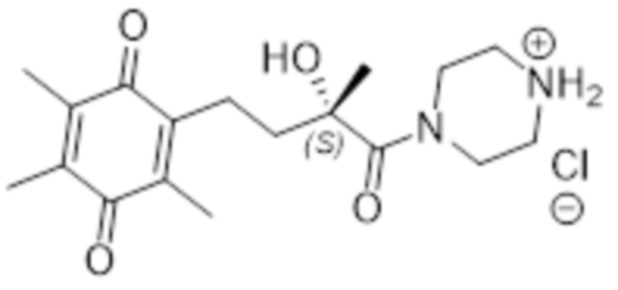
L=L1, R1-R2=L1, R3=H, R4=H,
X=Cl
L=L28, R1=H, R2=H, R3=H, R4=H, X=Cl
L=L1, R1=H,
R2=Me, R3=Me
Ссылки
Akitake, Y., Nakatani, Y., Kamei, D., Hosokawa, M., Akatsu, H., Uematsu, S., et al. (2013). Microsomal prostaglandin E synthase-1 is induced in alzheimer’s disease and its deletion mitigates alzheimer’s disease-like pathology in a mouse model. J. Neurosci. Res. 91: 909-919.
Beales, I.L.P., and Ogunwobi, O.O. (2010). Microsomal prostaglandin E synthase-1 inhibition blocks proliferation and enhances apoptosis in oesophageal adenocarcinoma cells without affecting endothelial prostacyclin production. Int. J. Cancer 126: 2247-55.
Catella-Lawson, F., Mcadam, B., Morrison, B.W., Kapoor, S., Kujubu, D., Antes, L., et al. Effects of Specific Inhibition of Cyclooxygenase-2 on Sodium Balance, Hemodynamics, and Vasoactive Eicosanoids 1.
Chaudhry, U.A., Zhuang, H., Crain, B.J., and Doré, S. (2008). Elevated microsomal prostaglandin-E synthase-1 in Alzheimer’s disease. Alzheimer’s Dement. 4: 6-13.
Chen, Y., Liu, H., Xu, S., Wang, T., and Li, W. (2015). Targeting microsomal prostaglandin E 2 synthase-1 (mPGES-1): the development of inhibitors as an alternative to non-steroidal anti-inflammatory drugs (NSAIDs). Med. Chem. Commun. 6: 2081-2123.
Fahmi, H. (2004). mPGES-1 as a novel target for arthritis. Curr. Opin. Rheumatol. 16: 623-627.
Hanaka, H., Pawelzik, S.-C., Johnsen, J.I., Rakonjac, M., Terawaki, K., Rasmuson, A., et al. (2009). Microsomal prostaglandin E synthase 1 determines tumor growth in vivo of prostate and lung cancer cells. Proc. Natl. Acad. Sci. U. S. A. 106: 18757-62.
Hara, S., Kamei, D., Sasaki, Y., Tanemoto, A., and Nakatani, Y. (2010). Prostaglandin E synthases: Understanding their pathophysiological roles through mouse genetic models. Biochimie 92: 651-659.
Hui, Y., Ricciotti, E., Crichton, I., Yu, Z., Wang, D., Stubbe, J., et al. (2010). Targeted Deletions of Cyclooxygenase-2 and Atherogenesis in Mice. Circulation 121:.
Ikeda-Matsuo, Y. (2017). The Role of mPGES-1 in Inflammatory Brain Diseases. Biol. Pharm. Bull 40: 557-563.
Ikeda-Matsuo, Y., Ikegaya, Y., Matsuki, N., Uematsu, S., Akira, S., and Sasaki, Y. (2005). Microglia-specific expression of microsomal prostaglandin E2 synthase-1 contributes to lipopolysaccharide-induced prostaglandin E2 production. J. Neurochem. 94: 1546-1558.
Kamei, D., Yamakawa, K., Takegoshi, Y., Mikami-Nakanishi, M., Nakatani, Y., Oh-Ishi, S., et al. (2004). Reduced pain hypersensitivity and inflammation in mice lacking microsomal prostaglandin e synthase-1. J. Biol. Chem. 279: 33684-95.
 Quezada, H.C., Gustafsson, A., et al. (2013). Inhibition of microsomal prostaglandin E synthase-1 by aminothiazoles decreases prostaglandin E2 synthesis in vitro and ameliorates experimental periodontitis in vivo. FASEB J. 27: 2328-41.
Quezada, H.C., Gustafsson, A., et al. (2013). Inhibition of microsomal prostaglandin E synthase-1 by aminothiazoles decreases prostaglandin E2 synthesis in vitro and ameliorates experimental periodontitis in vivo. FASEB J. 27: 2328-41.
Kim, S.-H., Hashimoto, Y., Cho, S.-N., Roszik, J., Milton, D.R., Dal, F., et al. (2016). Microsomal PGE2 synthase-1 regulates melanoma cell survival and associates with melanoma disease progression. Pigment Cell Melanoma Res. 29: 297-308.
Koeberle, A., and Werz, O. (2009). Inhibitors of the microsomal prostaglandin E(2) synthase-1 as alternative to non steroidal anti-inflammatory drugs (NSAIDs)--a critical review. Curr. Med. Chem. 16: 4274-96.
Koeberle, A., and Werz, O. (2015a). Perspective of microsomal prostaglandin E2 synthase-1 as drug target in inflammation-related disorders. Biochem. Pharmacol. 98: 1-15.
Koeberle, A., and Werz, O. (2015b). Perspective of microsomal prostaglandin E 2 synthase-1 as drug target in inflammation-related disorders.
Kojima, F., Kato, S., and Kawai, S. (2005). Prostaglandin E synthase in the pathophysiology of arthritis. Fundam. Clin. Pharmacol. 19: 255-261.
Larsson, K., and Jakobsson, J. (2015). Inhibition of microsomal prostaglandin E synthase-1 as targeted therapy in cancer treatment. Prostaglandins Other Lipid Mediat. 120: 161-165.
Larsson, K., Kock, A., Idborg, H., Arsenian Henriksson, M., Martinsson, T., Johnsen, J.I., et al. COX/mPGES-1/PGE 2 pathway depicts an inflammatory- dependent high-risk neuroblastoma subset.
Mcadam, B.F., Catella-Lawson, F., Mardini, I.A., Kapoor, S., Lawson, J.A., and Fitzgerald, G.A. (1999). Systemic biosynthesis of prostacyclin by cyclooxygenase (COX)-2: The human pharmacology of a selective inhibitor of COX-2 (prostaglandins platelets monocytes ibuprofen celecoxib). Pharmacology 96: 272-277.
Miller, S.B. (2006). Prostaglandins in Health and Disease: An Overview. Semin. Arthritis Rheum. 36: 37-49.
Miyagishi, H., Kosuge, Y., Ishige, K., and Ito, Y. (2012). Expression of microsomal prostaglandin E synthase-1 in the spinal cord in a transgenic mouse model of amyotrophic lateral sclerosis. J. Pharmacol. Sci. 118: 225-36.
Nakanishi, M., Gokhale, V., Meuillet, E.J., and Rosenberg, D.W. (2010). mPGES-1 as a target for cancer suppression: A comprehensive invited review "Phospholipase A2 and lipid mediators". Biochimie 92: 660-4.
Nakanishi, M., and Rosenberg, D.W. (2013). Multifaceted roles of PGE2 in inflammation and cancer. Semin. Immunopathol. 35: 123-137.
Norberg, J.K., Sells, E., Chang, H.-H., Alla, S.R., Zhang, S., and Meuillet, E.J. (2013a). Targeting inflammation: multiple innovative ways to reduce prostaglandin E2. Pharm. Pat. Anal. 2: 265-88.
Norberg, J.K., Sells, E., Chang, H., Alla, S.R., Zhang, S., and Meuillet, E.J. (2013b). Targeting inflammation: multiple innovative ways to reduce prostaglandin E2. Pharm. Pat. Anal. 2: 265-88.
Ramanan, M., and Doble, M. (2017). Transcriptional Regulation of mPGES1 in Cancer: An Alternative Approach to Drug Discovery? Curr. Drug Targets 18: 119-131.
Ricciotti, E., and FitzGerald, G.A. (2011). Prostaglandins and inflammation. Arterioscler. Thromb. Vasc. Biol. 31: 986-1000.
Riendeau, D., Aspiotis, R., Ethier, D., Gareau, Y., Grimm, E.L., Guay, J., et al. (2005). Inhibitors of the inducible microsomal prostaglandin E2 synthase (mPGES-1) derived from MK-886. Bioorg. Med. Chem. Lett. 15: 3352-3355.
Samuelsson, B., Morgenstern, R., and Jakobsson, P.-J. (2007). Membrane Prostaglandin E Synthase-1: A Novel Therapeutic Target. Pharmacol. Rev. Pharmacol Rev 59: 207-224.
Sasaki, Y., Nakatani, Y., and Hara, S. (2015). Role of microsomal prostaglandin E synthase-1 (mPGES-1)-derived prostaglandin E 2 in colon carcinogenesis. Prostaglandins Other Lipid Mediat. 121: 42-45.
Seo, T., Tatsuguchi, A., Shinji, S., Yonezawa, M., Mitsui, K., Tanaka, S., et al. Microsomal prostaglandin E synthase protein levels correlate with prognosis in colorectal cancer patients.
Smith, W.L., Urade, Y., and Jakobsson, P.-J. (2011). Enzymes of the Cyclooxygenase Pathways of Prostanoid Biosynthesis. 111: 5821-5865.
Takeuchi, C., Matsumoto, Y., Kohyama, K., Uematsu, S., Akira, S., Yamagata, K., et al. (2013). Microsomal prostaglandin E synthase-1 aggravates inflammation and demyelination in a mouse model of multiple sclerosis. Neurochem. Int. 62: 271-80.
Westman, M., Korotkova, M., Klint, E. af, Stark, A., Audoly, L.P., Klareskog, L., et al. (2004). Expression of microsomal prostaglandin E synthase 1 in rheumatoid arthritis synovium. Arthritis Rheum. 50: 1774-1780.
Yoshimatsu, K., Altorki, N.K., Golijanin, D., Zhang, F., Jakobsson, J., Dannenberg, A.J., et al. Inducible Prostaglandin E Synthase Is Overexpressed in Non-Small Cell Lung Cancer.
Zeilhofer, H.U. (2007). Prostanoids in nociception and pain. Biochem. Pharmacol. 73: 165-174.
--->
СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ:
<110> Khondrion IP B.V.
<120> НОВЫЕ СОЕДИНЕНИЯ В КАЧЕСТВЕ ИНГИБИТОРОВ mPGES-1
<130> P6071600PCT
<150> EP17203033.0
<151> 2017-11-22
<160> 12
<170> PatentIn version 3.5
<210> 1
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Праймер
<400> 1
gattgtactc gcacgggcta c 21
<210> 2
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Праймер
<400> 2
ggataaggtt ggaccgcact 20
<210> 3
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Праймер
<400> 3
aggactctgc tcacgaagga 20
<210> 4
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Праймер
<400> 4
tgacatggat tggaacagca 20
<210> 5
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Праймер
<400> 5
agcacactgc tggtcatcaa 20
<210> 6
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Праймер
<400> 6
ctccacatct gggtcactcc 20
<210> 7
<211> 18
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Праймер
<400> 7
gctggggctg taccacac 18
<210> 8
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Праймер
<400> 8
gattcacctc caccacctga 20
<210> 9
<211> 18
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Праймер
<400> 9
ggtagagacc gccggagt 18
<210> 10
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Праймер
<400> 10
tcgtaccact ttgcagaagc a 21
<210> 11
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Праймер
<400> 11
agggtggtga ctttacacgc 20
<210> 12
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Праймер
<400> 12
gatgccagga cctgtatgct 20
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| НОВЫЕ СОЕДИНЕНИЯ ДЛЯ ПРИМЕНЕНИЯ ДЛЯ ЛЕЧЕНИЯ ДЕПРЕССИИ И МИГРЕНИ | 2018 |
|
RU2795169C2 |
| СПОСОБЫ ПОЛУЧЕНИЯ КОНЪЮГАТОВ | 2012 |
|
RU2621035C2 |
| АМИНОКИСЛОТЫ-ЛИПИДЫ | 2013 |
|
RU2670618C2 |
| ПРОЛЕКАРСТВО, СОДЕРЖАЩЕЕ САМОРАСЩЕПЛЯЕМЫЙ ЛИНКЕР | 2014 |
|
RU2676324C2 |
| VEGF-НЕЙТРАЛИЗУЮЩИЕ ПРОЛЕКАРСТВА ДЛЯ ЛЕЧЕНИЯ ОФТАЛЬМОЛОГИЧЕСКИХ ЗАБОЛЕВАНИЙ | 2013 |
|
RU2673881C2 |
| ПРОЛЕКАРСТВО, СОДЕРЖАЩЕЕ САМОРАСЩЕПЛЯЕМЫЙ ЛИНКЕР | 2018 |
|
RU2798085C2 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ БЛОК-СОПОЛИМЕР, ВКЛЮЧАЮЩИЙ СОЕДИНЕНИЕ БОРОНОВОЙ КИСЛОТЫ | 2012 |
|
RU2569847C2 |
| КОМПЛЕКСНОЕ СОЕДИНЕНИЕ, СОДЕРЖАЩЕЕ МАКРОЦИКЛИЧЕСКИЙ ТЕТРАДЕНТАТНЫЙ ЛИГАНД, ХЕЛАТНЫЙ КОМПЛЕКС И ПРОМЕЖУТОЧНОЕ СОЕДИНЕНИЕ ДЛЯ ПОЛУЧЕНИЯ МАКРОЦИКЛИЧЕСКИХ ТЕТРАДЕНТАТНЫХ СОЕДИНЕНИЙ | 1997 |
|
RU2173322C2 |
| БЕТА-КАРБОЛИНОВЫЕ СОЕДИНЕНИЯ, ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ НА ИХ ОСНОВЕ И СПОСОБЫ СВЯЗЫВАНИЯ, ДОСТИЖЕНИЯ АГОНИСТИЧЕСКОГО/АНТАГОНИСТИЧЕСКОГО ЭФФЕКТА | 1999 |
|
RU2233841C2 |
| РЕАКЦИИ МАКРОЦИКЛИЗАЦИИ И ПРОМЕЖУТОЧНОЕ СОЕДИНЕНИЕ И ДРУГИЕ ФРАГМЕНТЫ, ПОЛЕЗНЫЕ В СИНТЕЗЕ МАКРОЛИДОВ ГАЛИХОНДРИНОВ | 2016 |
|
RU2739034C2 |
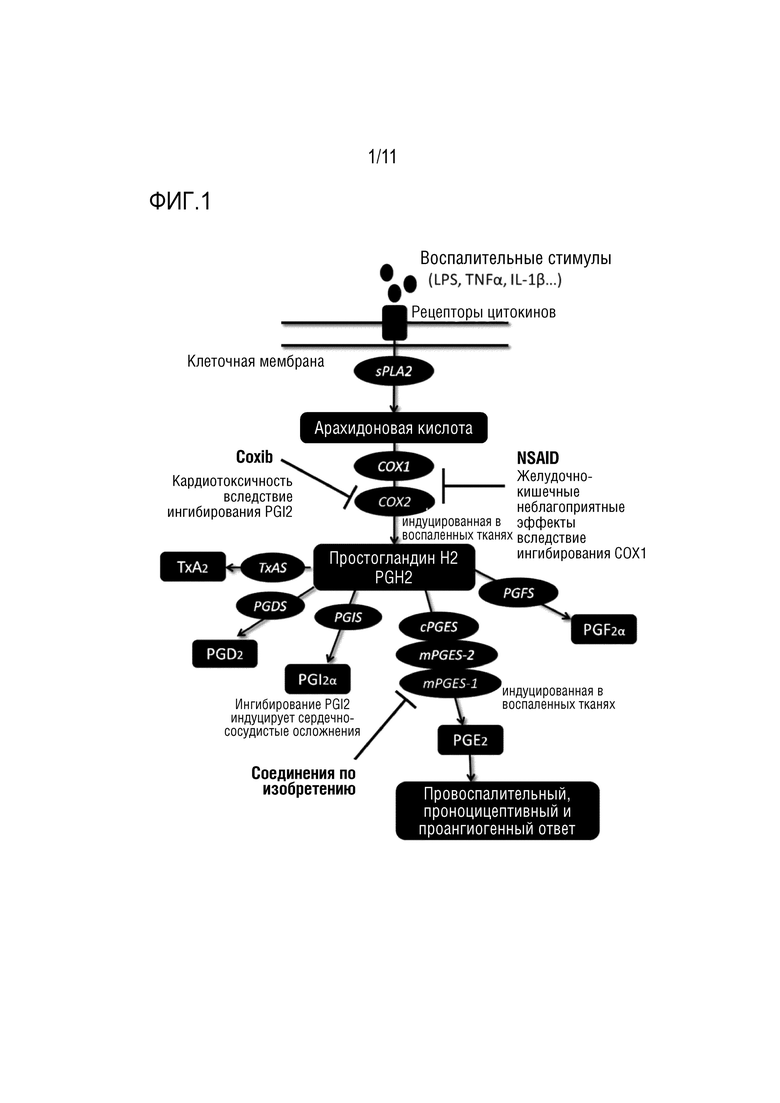
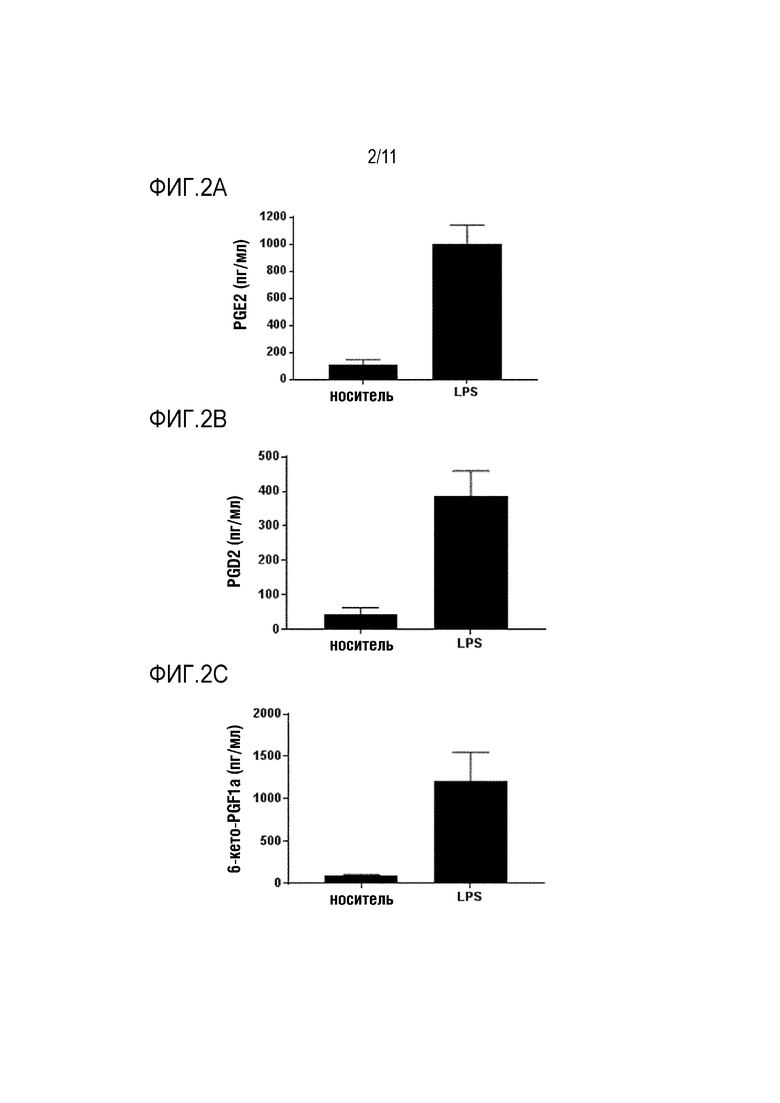
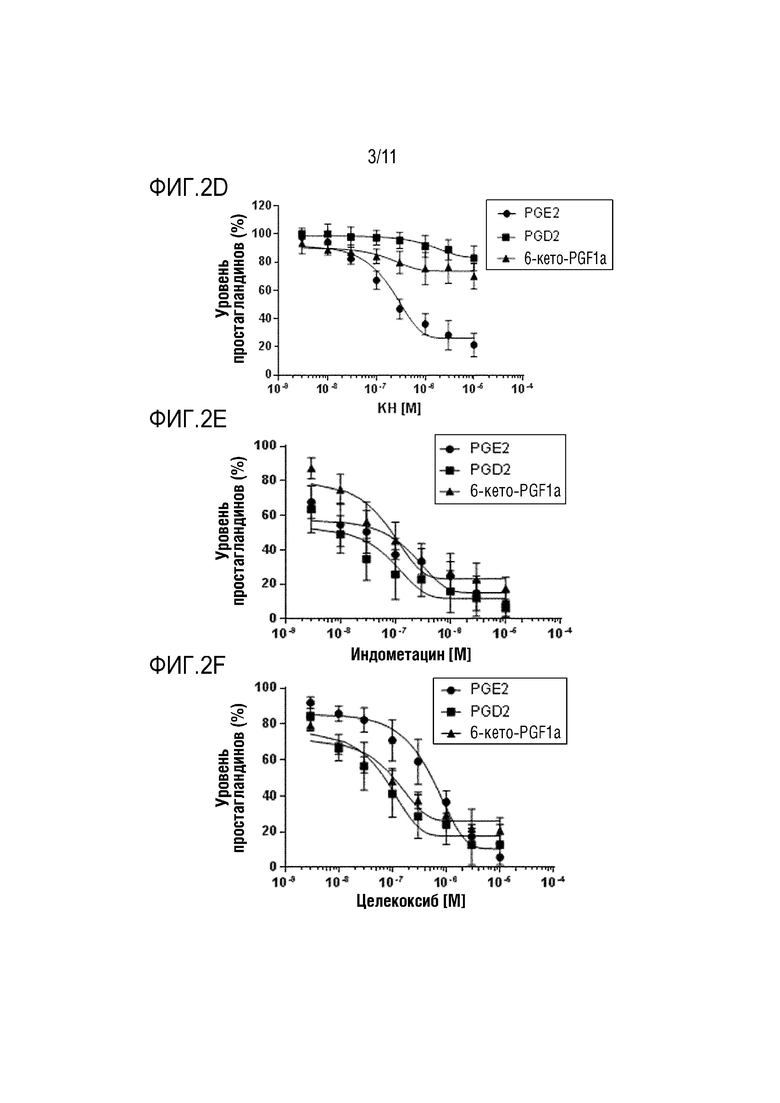
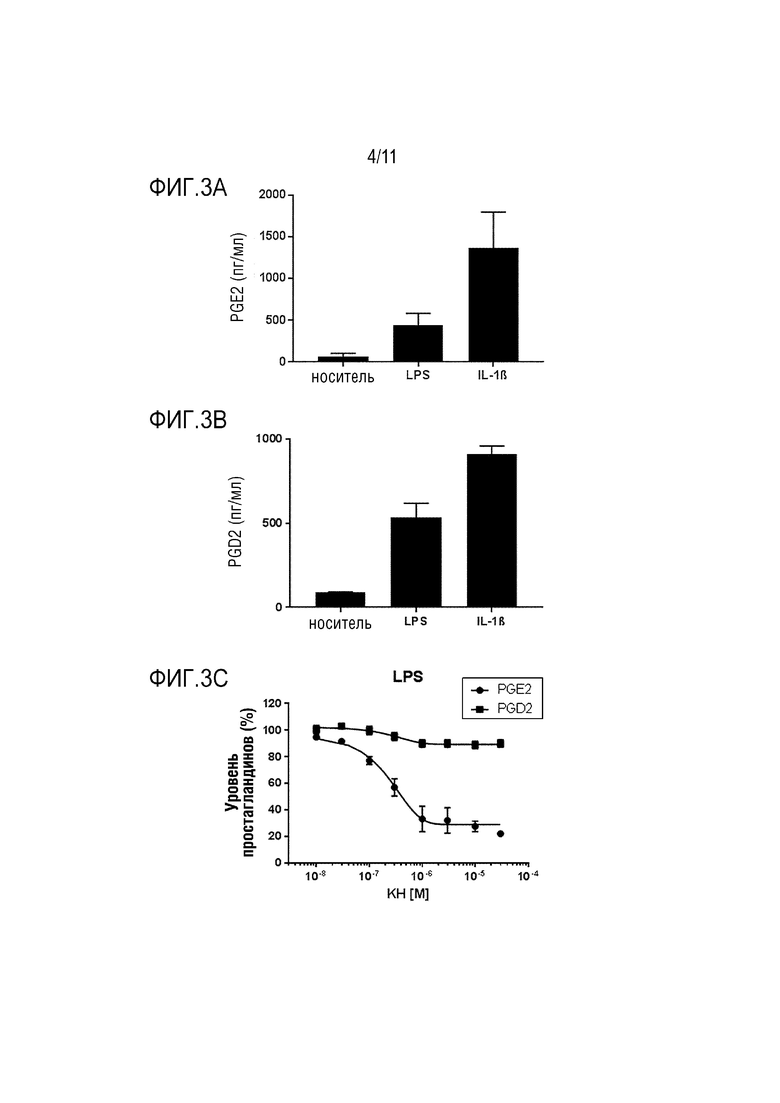
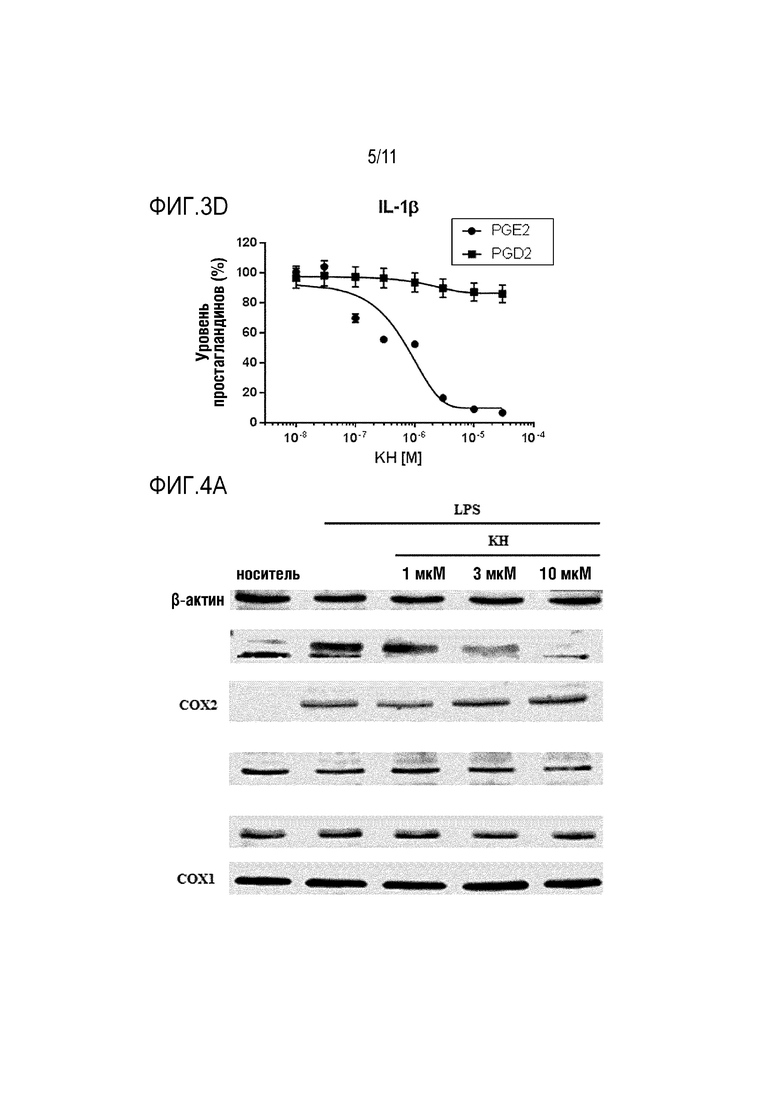
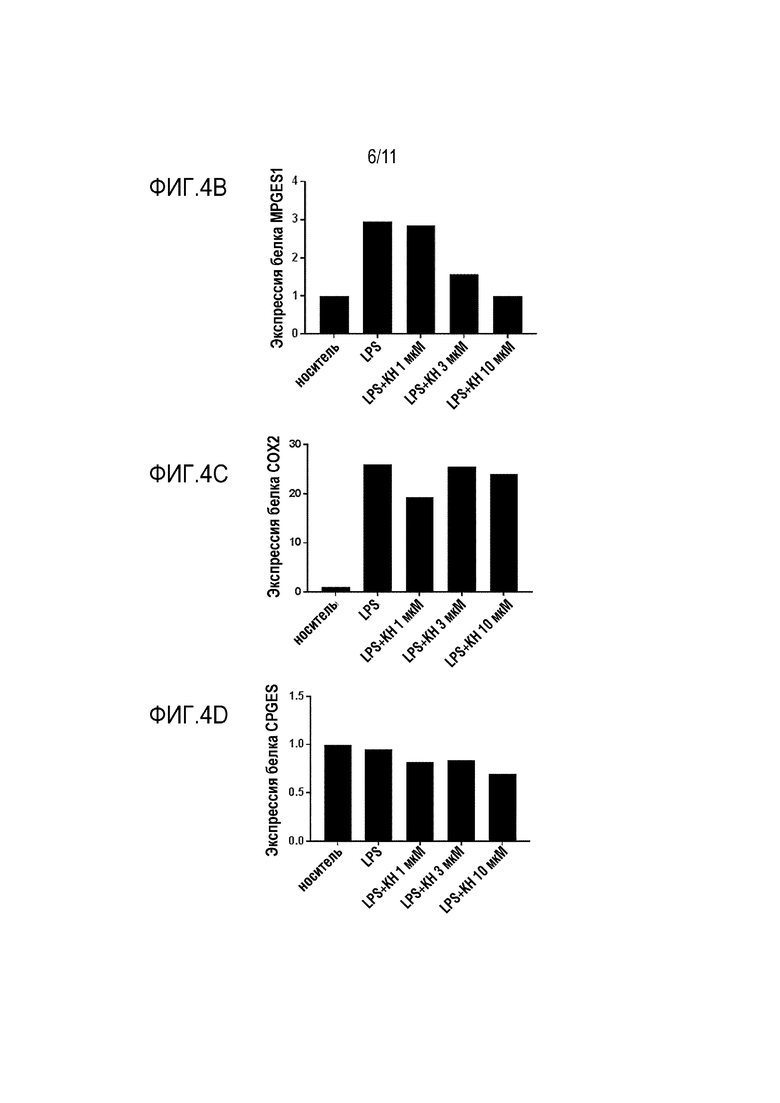
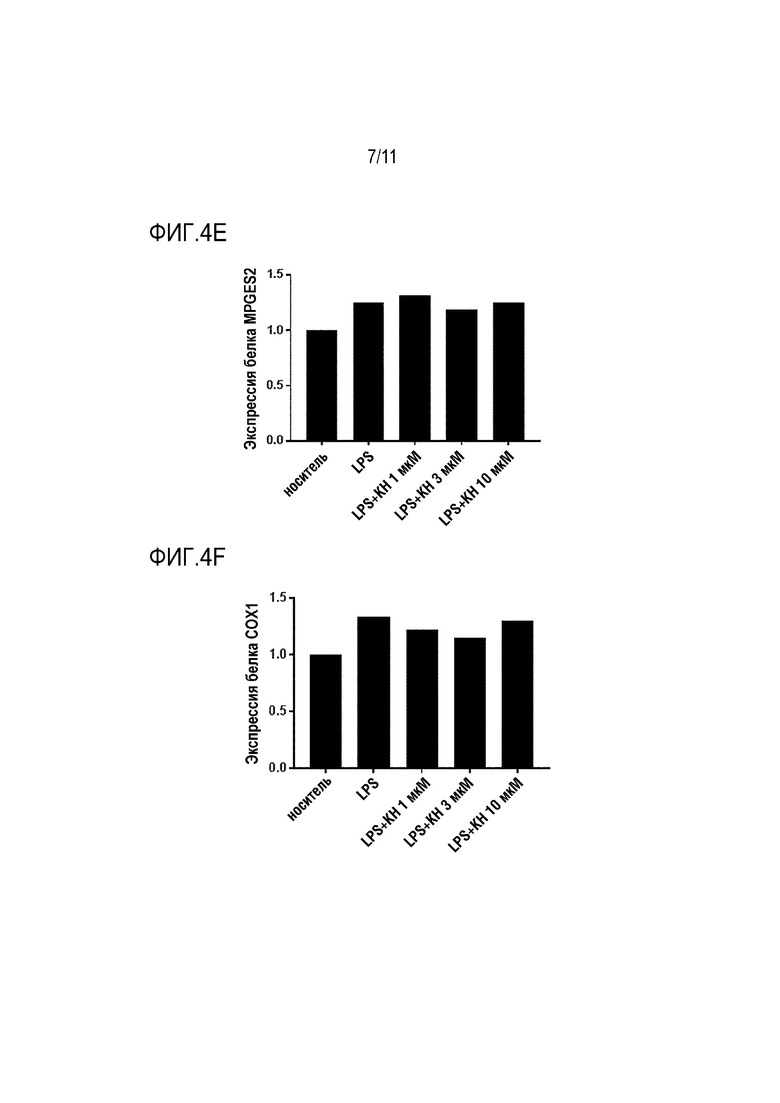
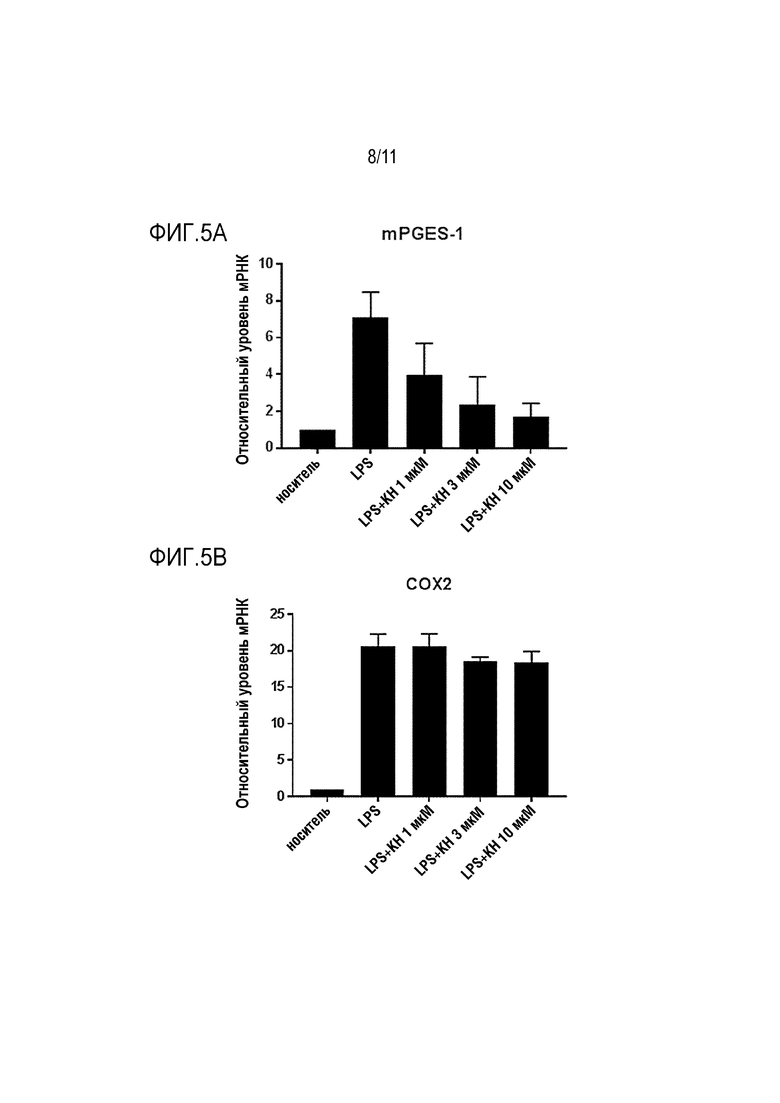
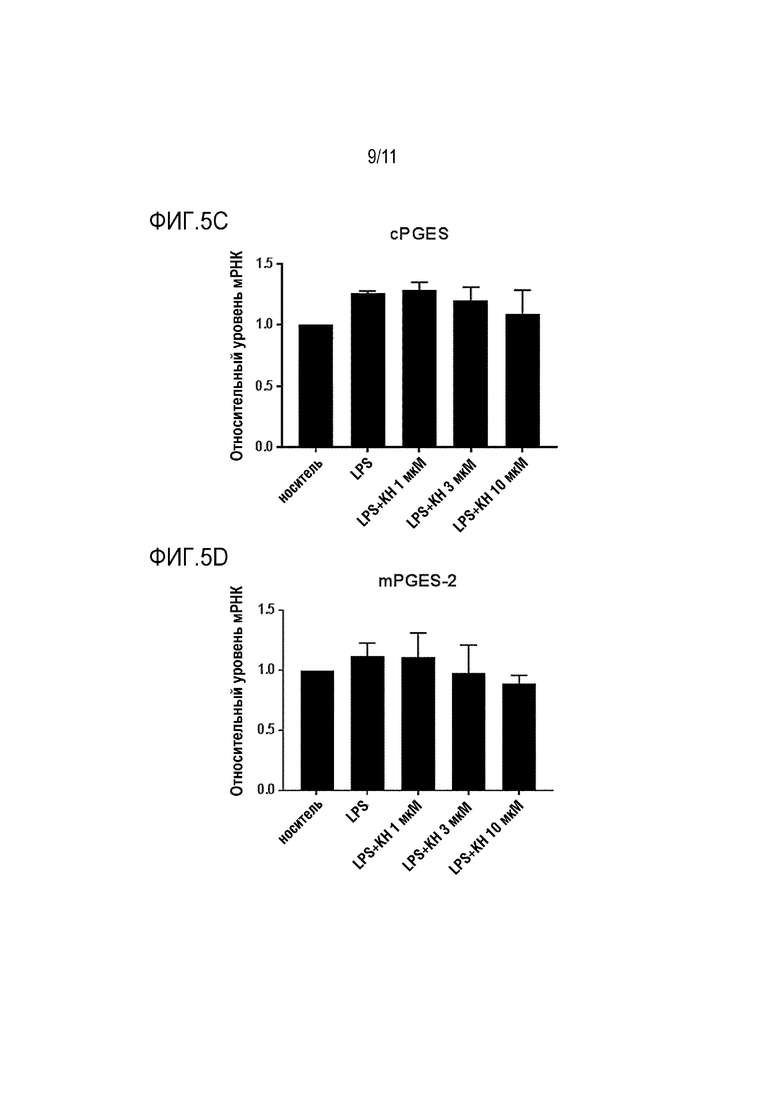
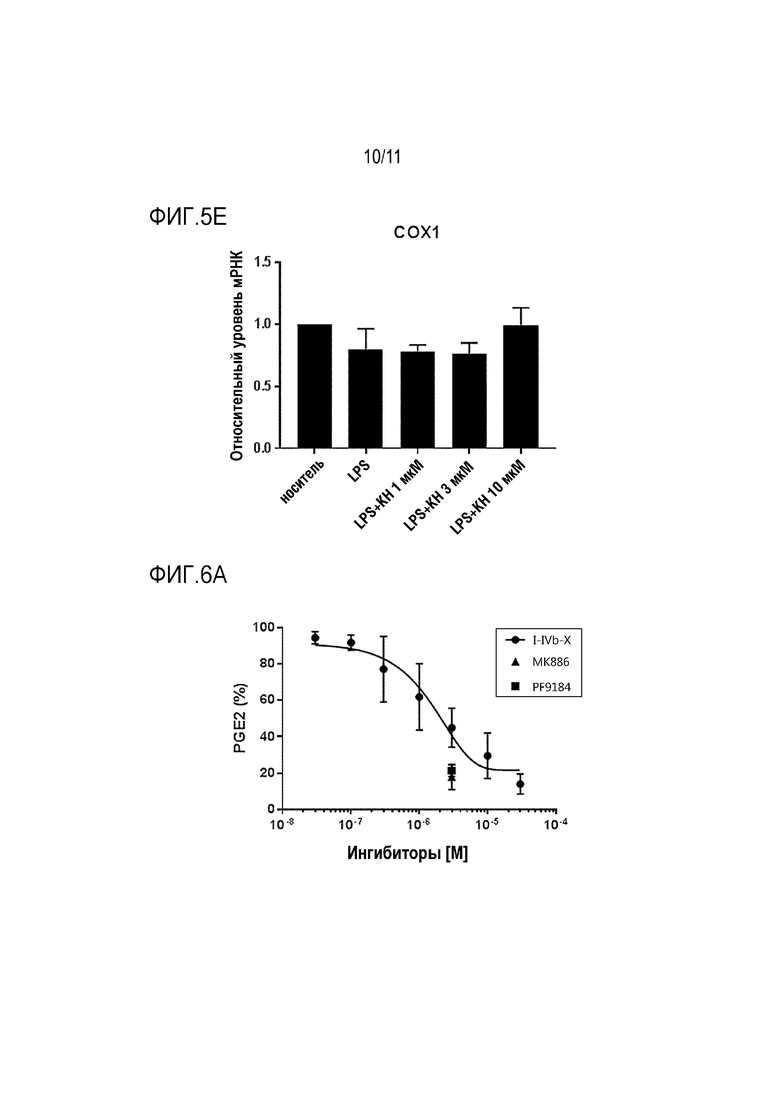
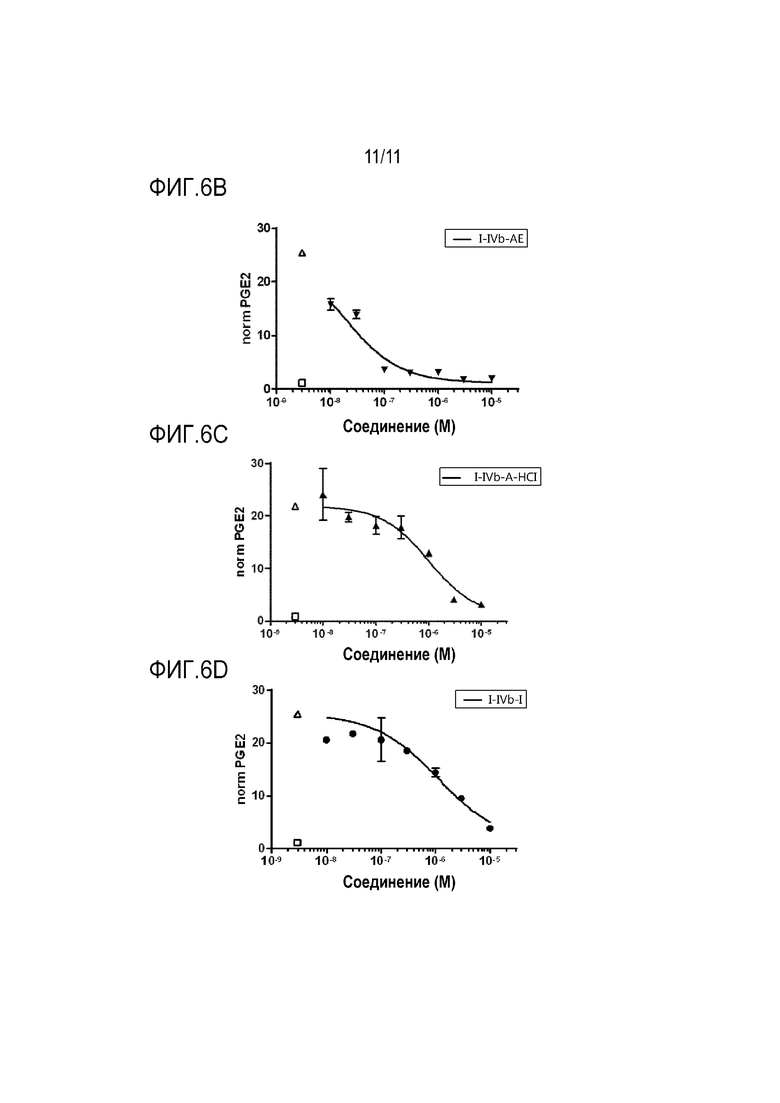
Изобретение относится к применению соединения, соответствующего общей структуре (I), где T соответствует структуре (IIIa) или (IIIb), где каждый R7 индивидуально представляет собой C1-C6 алкильную часть; L представляет собой линкер между атомом азота амида и дистальным атомом азота, где линкер представляет собой насыщенную алифатическую группу, которая может включать прямые цепи, разветвленные цепи и циклические группы, содержащие 1-10 необязательно замещенных атомов остова, выбранных из углерода, азота и кислорода, где между соседними атомами остова могут присутствовать двойные связи, и при этом необязательные заместители выбраны из группы, состоящей из R6, карбокси, оксо, первичного амино и карбоксильной группы, или атом остова может быть соединен с R1 с образованием 5-8-членной циклической структуры и/или атом остова может быть соединен с R2 с образованием 5-8-членной циклической структуры, или два атома остова могут быть соединены с образованием 5-8-членной циклической структуры, где R6 представляет собой C1-C6 алкил; N* соответствует структуре (IIa) или (IIb), каждый из R1 и R2 независимо выбран из водорода (H), C1-C6 алкила или C1-C6 алкенила, или R1 и R2 соединены вместе и, таким образом, образуют второй линкер между атомом азота амида и дистальным атомом азота, или R1 соединен с атомом остова линкера L в 5-8-членную циклическую структуру и/или R2 соединен с атомом остова линкера L в 5-8-членную циклическую структуру; R3 выбран из водорода (H), C1-C6 алкила или C1-C6 алкенила, где алкильная или алкенильная часть может быть замещена одним или несколькими атомами галогена, гидроксильными частями или (галоген)алкоксичастями, или R3 отсутствует, когда дистальный атом азота является частью иминочасти, или R3 необязательно соединен с атомом остова линкера в 5-8-членную циклическую структуру; и R4 выбран из водорода (H) или C1-C6 алкила, где алкильная часть может быть замещена одним или несколькими атомами галогена или (галоген)алкоксичастями; X представляет собой фармацевтически приемлемый анион, для лечения, предупреждения или подавления симптомов, опосредуемых усиленной экспрессией или активностью mPGES-1. Технический результат - амидные производные 2-гидрокси-2-метил-4-(3,5,6-триметил-1,4-бензохинон-2-ил)бутановой кислоты для лечения состояний, при которых ингибирование активности и/или экспрессии фермента mPGES-1. 2 н. и 12 з.п.ф-лы, 1 табл., 6 ил., 2 пр.
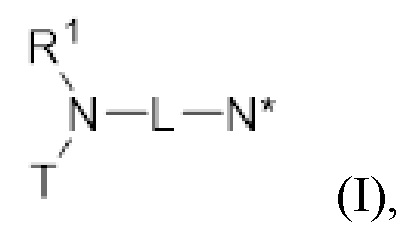
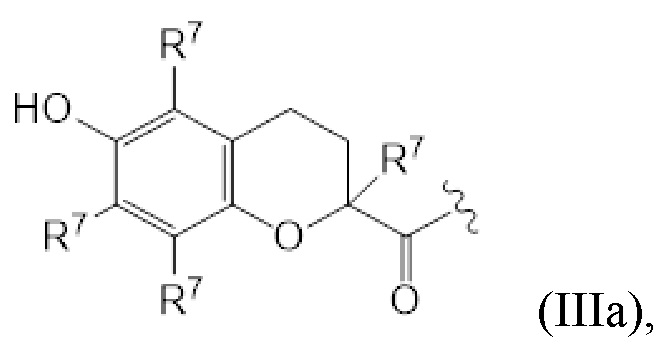
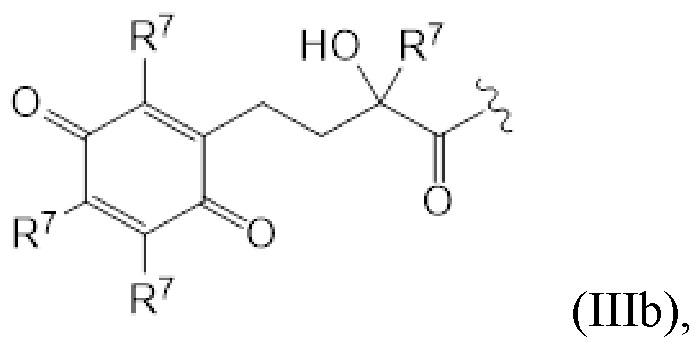
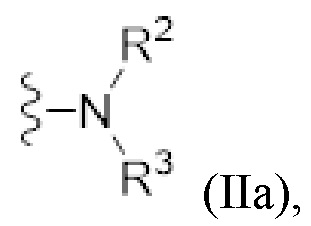
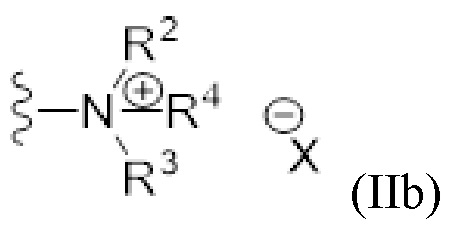
1. Применение соединения, соответствующего общей структуре (I):
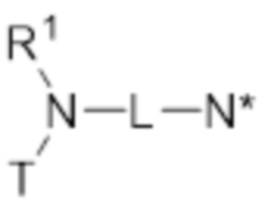
(I)
где
- T соответствует структуре (IIIa) или (IIIb):
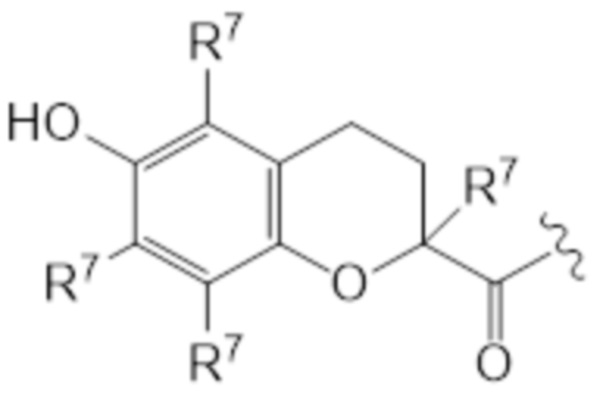
(IIIa)
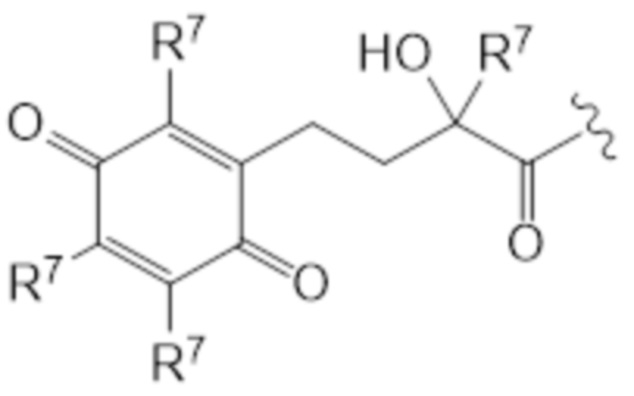
(IIIb)
где каждый R7 индивидуально представляет собой C1-C6 алкильную часть;
- L представляет собой линкер между атомом азота амида и дистальным атомом азота, где линкер представляет собой насыщенную алифатическую группу, которая может включать прямые цепи, разветвленные цепи и циклические группы, содержащие 1-10 необязательно замещенных атомов остова, выбранных из углерода, азота и кислорода, где между соседними атомами остова могут присутствовать двойные связи, и при этом необязательные заместители выбраны из группы, состоящей из R6, карбокси, оксо, первичного амино и карбоксильной группы, или атом остова может быть соединен с R1 с образованием 5-8-членной циклической структуры и/или атом остова может быть соединен с R2 с образованием 5-8-членной циклической структуры, или два атома остова могут быть соединены с образованием 5-8-членной циклической структуры, где R6 представляет собой C1-C6 алкил;
- N* соответствует структуре (IIa) или (IIb)
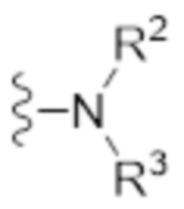
(IIa)
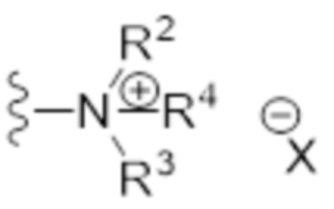
(IIb)
- каждый из R1 и R2 независимо выбран из водорода (H), C1-C6 алкила или C1-C6 алкенила, или R1 и R2 соединены вместе и, таким образом, образуют второй линкер между атомом азота амида и дистальным атомом азота, или R1 соединен с атомом остова линкера L в 5-8-членную циклическую структуру и/или R2 соединен с атомом остова линкера L в 5-8-членную циклическую структуру;
- R3 выбран из водорода (H), C1-C6 алкила или C1-C6 алкенила, где алкильная или алкенильная часть может быть замещена одним или несколькими атомами галогена, гидроксильными частями или (галоген)алкоксичастями, или R3 отсутствует, когда дистальный атом азота является частью иминочасти, или R3 необязательно соединен с атомом остова линкера в 5-8-членную циклическую структуру; и
- R4 выбран из водорода (H) или C1-C6 алкила, где алкильная часть может быть замещена одним или несколькими атомами галогена или (галоген)алкоксичастями;
- X представляет собой фармацевтически приемлемый анион,
для лечения, предупреждения или подавления симптомов, опосредуемых усиленной экспрессией или активностью mPGES-1.
2. Применение по п.1, где соединение соответствует структуре (VI):
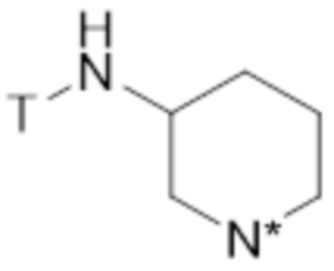
(VI)
где N* представляет собой -NR3 или -N+R3R4 X-, где T, X, R3 и R4 являются такими, как определено в п.1.
3. Применение по п.1 или 2, где каждый R7 представляет собой метил.
4. Применение по п.3, где соединение соответствует структуре (VIIb):
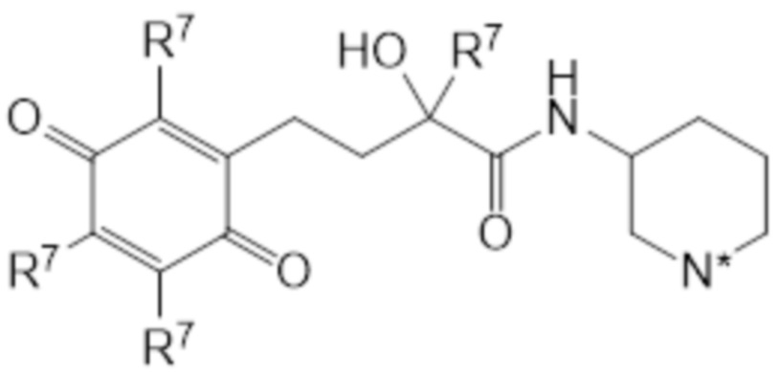
(VIIb)
где
каждый R7 представляет собой метил;
N* представляет собой -NR3 или -N+R3R4 X-;
X является таким, как определено в п.1, и предпочтительно представляет собой Cl-;
R3 является таким, как определено в п.1, и предпочтительно представляет собой водород; и
R4 является таким, как определено в п.1, и предпочтительно представляет собой водород.
5. Применение по любому из пп.1-4, где симптомы, опосредуемые усиленной экспрессией или активностью mPGES-1, включают по меньшей мере одно или несколько из воспаления, боли, опухания, лихорадки, ангиогенеза и анорексии.
6. Применение по любому из пп.1-5, где соединение используют для предупреждения или подавления симптомов, опосредуемых усиленной экспрессией или активностью mPGES-1, при лечении заболевания или состояния, выбранного из группы, состоящей из:
a) острого и хронического воспаления; заболеваний кожи, таких как дерматит, экзема, псориаз, ожоги, обыкновенные угри, гнойный гидраденит и травма ткани; висцеральных заболеваний, таких как воспалительное заболевание кишечника, болезнь Крона, язвенный колит, дивертикулит, синдром раздраженного кишечника (IBS), пептические язвы, цистит, (хронический) простатит, панкреатит или нефрит; заболевания уха, носа, полости рта и горла, такого как грипп, ринит, фарингит, тонзиллит, конъюнктивит, ирит, склерит, отит и увеит; вирусных и бактериальных инфекций; связанной с воспалением анорексии; аллергии; воспалительного заболевания таза; реперфузионного повреждения; отторжения трансплантата; тендинита, васкулита и флебита;
b) острой боли, хронической боли, невропатической боли, ноцицептивной боли, гипералгезии, боли, связанной с центральной сенсибилизацией, воспалительной боли по типу аллодинии, висцеральной боли, боли при злокачественной опухоли, боли при травме, зубной или хирургической боли, послеоперационной боли, боли при родах, болезненности при деторождении, персистирующей боли, периферически-опосредуемой боли, центрально-опосредуемой боли, хронической головной боли, мигрени, синусовых головных болей, тензионных головных болей, фантомных болей конечностей, боли при химиотерапии, обусловленной повреждением периферических нервов, и боли при злокачественной опухоли;
c) аутоиммунного заболевания, такого как артрит, остеоартрит, ювенильный артрит, ревматоидный артрит, анкилозирующий спондилит, подагра, ревматическая атака, бурсит, системная красная волчанка (SLE) и рассеянный склероз;
d) нарушений дыхания или заболеваний легких, таких как астма, хроническое обструктивное заболевание легких (COPD), саркоидоз и фиброз легких;
e) злокачественной опухоли, такой как рак головного мозга, рак предстательной железы, рак почки, рак печени, рак поджелудочной железы, рак желудка, рак молочной железы, рак легкого, рак головы и шеи, рак щитовидной железы, глиобластома, меланома, лимфома, лейкоз, T-клеточная лимфома кожи и B-клеточная лимфома кожи;
f) осложнений диабета, включающих диабетическую васкулопатию, диабетическую невропатию и диабетическую ретинопатию;
g) нейродегенеративного нарушения, такого как болезнь Альцгеймера, болезнь Паркинсона, болезнь Гентингтона и боковой амиотрофический склероз; и
h) сердечно-сосудистого заболевания, такого как атеросклероз, тромбоз, инсульт и коронарная болезнь сердца.
7. Применение по любому из пп.1-6, где общая суточная доза, которую вводят, находится в диапазоне приблизительно от 5 до 2000 мг, предпочтительно приблизительно от 20 до 800 мг, более предпочтительно общая суточная доза находится в диапазоне приблизительно от 30 до 400 мг и наиболее предпочтительно общая суточная доза находится в диапазоне приблизительно от 150 до 250 мг.
8. Применение по любому из пп.1-7, где соединение вводят перорально.
9. Применение по любому из пп.1-8, где соединение вводят в твердой форме или в жидкой форме, где предпочтительно соединение смешивают с водным раствором перед введением, где более предпочтительно водный раствор представляет собой изотонический водный раствор и где еще более предпочтительно изотонический водный раствор представляет собой солевой раствор.
10. Применение по любому из пп.1-9, где соединение вводят по меньшей мере два раза в сутки, предпочтительно где соединение вводят два раза в сутки, где более предпочтительно соединение вводят два раза в стуки в двух сходных или равных дозах.
11. Применение по п.10, где интервал между двумя введениями составляет по меньшей мере приблизительно 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11 или 12 часов.
12. Применение по любому из пп.1-11, где индивидуумом, подвергаемым лечению, является примат, где предпочтительно индивидуумом является человек.
13. Применение соединения, соответствующего общей структуре (I):
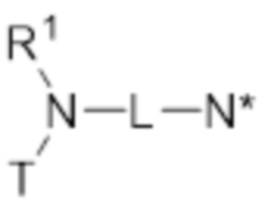
(I)
где
- T соответствует структуре (IIIa) или (IIIb):

(IIIa)

(IIIb)
где каждый R7 индивидуально представляет собой C1-C6 алкильную часть;
- L представляет собой линкер между атомом азота амида и дистальным атомом азота, где линкер представляет собой насыщенную алифатическую группу, которая может включать прямые цепи, разветвленные цепи и циклические группы, содержащие 1-10 необязательно замещенных атомов остова, выбранных из углерода, азота и кислорода, где между соседними атомами остова могут присутствовать двойные связи, и при этом необязательные заместители выбраны из группы, состоящей из R6, карбокси, оксо, первичного амино и карбоксильной группы, или атом остова может быть соединен с R1 с образованием 5-8-членной циклической структуры и/или атом остова может быть соединен с R2 с образованием 5-8-членной циклической структуры, или два атома остова могут быть соединены с образованием 5-8-членной циклической структуры, где R6 представляет собой C1-C6 алкил;
- N* соответствует структуре (IIa) или (IIb)

(IIa)

(IIb)
- каждый из R1 и R2 независимо выбран из водорода (H), C1-C6 алкила или C1-C6 алкенила, или R1 и R2 соединены вместе и, таким образом, образуют второй линкер между атомом азота амида и дистальным атомом азота, или R1 соединен с атомом остова линкера L в 5-8-членную циклическую структуру и/или R2 соединен с атомом остова линкера L в 5-8-членную циклическую структуру;
- R3 выбран из водорода (H), C1-C6 алкила или C1-C6 алкенила, где алкильная или алкенильная часть может быть замещена одним или несколькими атомами галогена, гидроксильными частями или (галоген)алкоксичастями, или R3 отсутствует, когда дистальный атом азота является частью иминочасти, или R3 необязательно соединен с атомом остова линкера в 5-8-членную циклическую структуру; и
- R4 выбран из водорода (H) или C1-C6 алкила, где алкильная часть может быть замещена одним или несколькими атомами галогена или (галоген)алкоксичастями;
- X представляет собой фармацевтически приемлемый анион,
при лечении заболевания или состояния для предотвращения или подавления симптомов, опосредованных усиленной экспрессией или активностью mPGES-1.
14. Применение по п.13, где заболевание или состояние предпочтительно выбрано из группы, состоящей из a) острого и хронического воспаления; заболеваний кожи, таких как дерматит, экзема, ожоги, обыкновенные угри, гнойный гидраденит и травма ткани; висцеральных заболеваний, таких как язвенный колит, дивертикулит, синдром раздраженного кишечника (IBS), пептические язвы, цистит, (хронический) простатит или нефрит; заболевания уха, носа, полости рта и горла, такого как грипп, ринит, фарингит, тонзиллит, конъюнктивит, ирит, склерит, отит и увеит; вирусных и бактериальных инфекций; связанной с воспалением анорексии; аллергии; воспалительного заболевания таза; отторжения трансплантата; тендинита, васкулита и флебита; b) острой боли, хронической боли, невропатической боли, ноцицептивной боли, гипералгезии, боли, связанной с центральной сенсибилизацией, воспалительной боли по типу аллодинии, висцеральной боли, боли при злокачественной опухоли, боли при травме, зубной или хирургической боли, послеоперационной боли, боли при родах, болезненности при деторождении, персистирующей боли, периферически-опосредуемой боли, центрально-опосредуемой боли, хронической головной боли, мигрени, синусовых головных болей, тензионных головных болей, фантомных болей конечностей, боли при химиотерапии, обусловленной повреждением периферических нервов, и боли при злокачественной опухоли; c) анкилозирующего спондилита, подагры, ревматической атаки, бурсита; и d) осложнений диабета, включая диабетическую васкулопатию, диабетическую невропатию и диабетическую ретинопатию.
| Автомобиль-сани, движущиеся на полозьях посредством устанавливающихся по высоте колес с шинами | 1924 |
|
SU2017A1 |
| Способ защиты переносных электрических установок от опасностей, связанных с заземлением одной из фаз | 1924 |
|
SU2014A1 |
| ЕА 201000756 А1, 30.12.2010 | |||
| Ingold, Mariana; Dapueto, Rosina; et al.: " A green multicomponent synthesis of tocopherol analogues with antiproliferative activities", European Journal of Medicinal Chemistry, 2017 (03.11.2017), vol.143, p.1888-1902 (doi:10.1016/j.ejmech.2017.11.003) | |||
Авторы
Даты
2023-03-31—Публикация
2018-11-22—Подача