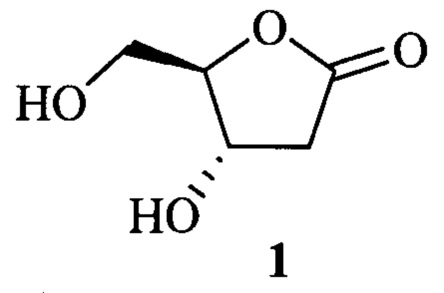
Изобретение относится к органической химии, конкретно к способу получения 2-дезокси-D-риболактона [синонимы: 2-дезокси-D-рибо-1,4-лактон, (4S,5R)-4-гидрокси-5-(гидроксиметил)-дигидрофуран-2(3H)-он, (4S,5R)-4-гидрокси-5-(гидроксиметил)-4-бутанолид, (4S,5R)-3,4,5-тригидроксипентановой кислоты 1,4-лактон] (1).
Результаты изобретения могут быть использованы в химии, биологии и медицине.
2-Дезокси-D-риболактон 1, соединение углеводного происхождения, обладает разносторонней биологической активностью и, несмотря на свою труднодоступность, широко используется для синтеза различных природных объектов.
2-Дезокси-D-риболактон 1 проявляет антиоксидантную, антимикробную активность против Escherichia coli, Micrococcus luteus, Pseudomonas agarici и Staphylococcus warneri, а также способность к ингибированию ацетилхолинэстеразы [F. Kaaniche, A. Hamed, A.S. Abdel-Razek, D. Wibberg, N. Abdissa, I.Z. El Euch, N. Allouche, L. Mellouli, M. Shaaban, N. Sewald. Bioactive secondary metabolites from new endophytic fungus Curvularia. sp isolated from Rauwolfia macrophylla II PLoS ONE, 2019, v. 14, Art. No: E0217627]. 2-Дезокси-D-риболактон 1 в клетках конкурирует с PGE2 в связывании с ЕР рецепторами [P.O. Miranda, F. Estevez, J. Quintana, C.I. Garcia, I. Brouard, J.I. Padron, J.P. Pivel, J. Bermejo. Enantioselective synthesis and biological activity of (3S,4R)- and (3S,4S)-3-hydroxy-4-hydroxymethyl-4-butanolides in relation to PGE2 // J. Med. Chem., 2004, v.47, р. 292]. Он ингибирует образование супероксидных анионов и высвобождение эластазы нейтрофилов [M.L. Yang, Р.С. Kuo, T.L. Hwang, T.S. Wu. Anti-inflammatory principles from Cordyceps sinensis II J. Nat. Prod., 2011, v.74, p. 1996].
Наиболее широко 2-дезокси-D-риболактон 1 используется в качестве исходного или промежуточного соединения в синтезе практически важных соединений. Например, в связи с тем, что в гликозидной части нуклеиновых кислот содержится 2-дезокси-D-рибоза, 2-дезокси-D-риболактон 1 нашел применение в синтезе противовирусных и противораковых нуклеозидов [(1) US 0175648 А1, 25.06.2015; (2) WO 164812 A1, 29.10.2015; (3) WO 041877 A1, 24.03.2016; (4) WO 069975 A1, 06.05.2016; (5) WO 140615 A1, 09.09.2016; (6) J. H. Rothman. Direct and facile syntheses of heterocyclic vinyl-C-nucleosides for recognition of inverted base pairs by DNA triple helix formation: First report by direct wittig route // J. Org. Chem., 2007, v. 72, p. 3945; (7) S. Zhou, S. Mahmoud, P. Liu, L. Zhou, M. Ehteshami, L. Bassit, S. Tao, R.A. Domaoal, O. Sari, C. De Schutter, S. Amiralaei, A. Khalil, O.O. Russell, T. McBrayer, T. Whitaker, N. Abou-Taleb, F. Amblard, S.J. Coats, R.F. Schinaz. 2'-Chloro,2'-fluoro ribonucleotide prodrugs with potent pan-genotypic activity against hepatitis С virus replication in culture // J. Med. Chem., 2017, v. 60, р. 5424]. На основе 2-дезокси-D-риболактона 1 осуществлены синтезы различных биологически активных лактонов синтетического и природного происхождения [(1) US 0220251 A1, 04.11.2004; (2) ЕР 0460413 A1, 11.12.1991; (3) J.C. Briggs, A.P. Dawson, I. Gibson, A.H. Haines, J. Hook, R.J.K. Taylora. The synthesis of conformationally-restricted diacyl glycerol analogues // Bioorg. Med. Chem. Lett., 1992, v.2, 131], алкалоидов [P. Cao, Z.J. Li, W.W. Sun, S. Malhotra, Y.L. Ma, B. Wu, V.S. Parmar. Cascade N-alkylation/hemiacetalization for facile construction of the spiroketal skeleton of acortatarin alkaloids with therapeutic potentiality in diabetic nephropathy // Nat. Prod. Bioprospect., 2015, v. 5 р. 3] и циклических а-амино кислот [D. Scarpi, L. Bartali, A. Casini, E.G. Occhiato. Complementary and stereodivergent approaches to the synthesis of 5-hydroxy- and 4,5-dihydroxypipecolic acids from enantiopure hydroxylated lactams // Eur. J. Org. Chem., 2013, р. 1306].
2-Дезокси-D-риболактон 1 все больше привлекает внимание синтетиков для решения своих задач, поэтому необходимы эффективные методы его получения.
2-Дезокси-D-риболактон 1 встречается в различных природных объектах. Он может быть выделен из надземной части растения Mentha haplocalyx Briq [L. Su, Y. Wang, K. Zhong, G. Tu, Y. Jiang, B.Liu. Chemical constituents of mentha haplocalyx II Chem. Nat. Compd., 2019, v.55, p.351, из корней и корневищ растений Clematis hexapetala Pall и Clematis mandshurica Rupr. [(1) C.X. Dong, S.P. Shi, K.S. Wu, P.F. Tu Chemical constituents from the roots and rhizomes of Clematis hexapetala Pall. // Z. Naturforsch., B: J. Chem. Sci., 2007, v. 62, p. 854; (2) S.P. Shi, D. Jiang, C.X. Dong, P.F. Tu. New phenolic glycosides from Clematis mandshurica II Helv. Chim. Acta., 2006, v. 89, p. 1023], из плодов растений: Pimpinella anisum L [E. Fujimatu, T. Ishikawa, J. Kitajima. Aromatic compound glucosides, alkyl glucoside and glucide from the fruit of anise // Phytochemistry, 2003, v. 63, p. 609], Anethum graveolens L. [T. Ishikawa, M. Kudo, J. Kitajima. Water-soluble constituents of dill // Chem. Pharm. Bull., 2002, v. 50, p. 501], Cnidium monnieri [J. Kitajima, T. Ishikawa, Y. Aoki. Glucides of Cnidium monnieri fruit // Phytochemistry, 2001, v. 58, p. 641], Carum ajowan (Umbelliferae) [T. Ishikawa, Y. Sega, J. Kitajima. Water-soluble constituents of ajowan // Chem. Pharm. Bull., 2001, v. 49, p. 840], Foeniculum vulgare Miller (Umbelliferae) [J. Kitajima, T. Ishikawa, Y. Tanaka, Y. Ida. Water-soluble constituents of fennel. IX. Glucides and Nucleosides // Chem. Pharm. Bull., 1999, v. 47, p. 988]. 2-Дезокси-D-риболактон 1 может быть выделен из экстракта эндофитного гриба Curvularia sp., обитающего на Rauwolfia macrophylla [F. Kaaniche, A. Hamed, A.S. Abdel-Razek, D. Wibberg, N. Abdissa, I.Z. El Euch, N. Allouche, L. Mellouli, M. Shaaban, N. Sewald. Bioactive secondary metabolites from new endophytic fungus Curvularia. sp isolated from Rauwolfia macrophylla II PLoS ONE, 2019, v. 14, Art. No: E0217627], из мицелия гриба Cordyceps sinensis [M.L Yang, P.C. Kuo, T.L. Hwang, T.S. Wu. Anti-inflammatory principles from Cordyceps sinensis II J. Nat. Prod., 2011, v. 74, p. 1996]. Однако выделение 2-дезокси-D-риболактона 1 из природных объектов малоэффективно из-за низкого его содержания.
Известно несколько способов получения 2-дезокси-D-риболактона 1. Наиболее доступным методом получения 2-дезокси-D-риболактона 1 является окисление 2-дезокси-D-рибозы в 1,4-лактон в воде с помощью брома. Окисление 2-дезокси-D-рибозы протекает от 2 до 5 дней с выходом продукта до 73% [(1) J.C. Briggs, А.Р. Dawson, I. Gibson, А. Н. Haines, J. Hook, R.J.K. Taylora. The synthesis of conformationally-restricted diacyl glycerol analogues // Bioorg. Med. Chem. Lett., 1992, v. 2, p. 131; (2) R.E. Deriaz, W.G. Overend, M. Stacey, E.G. Teece, L.F. Wiggins, Deoxy-sugars. Part V. A reinvestigation of the glycal method for the synthesis of 2-deoxy-D- and -L-ribose.// J. Chem. Soc, 1949, p. 1879-1883].
Известен способ получения 2-дезокси-D-риболактона 1 в одну стадию через дезоксигенирование D-арабино- и D-риболактона с применением системы SmI2-THF/H2O, где выход продукта составил 56 и 44% соответственно [S. Hanessian, С.Girard. One step α-deoxygenation of unprotected aldonolactones using samarium diiodide-THF/H2O system - A new synthesis of 2-deoxy-D-ribose // Synlett, 1994, p. 861-862]. Дезоксигенирование D-арабинопиранозы до 2-дезокси-D-риболактона 1 может быть реализовано через сульфонаты в присутствии гидроксида свинца [Р.А. Гахокидзе, Н.Н. Сидамонидзе. Удобный метод получения 2-дезоксиэритропетозы// Журнал общей химии, 1987, т. 57, с. 2399]. 2-Дезокси-D-риболактон 1 может быть получен из 2,3-O-изопропилиден-D-глицеральдегида [(1) K. Mikami, M.Terada, Т. Nakai. Lanthanide (III) catalyzed aldol reactions of glyceraldehyde acetonide with ketene silyl acetals: catalytic asymmetric route to monosaccharides // Tetrahedron: Asymmetry, 1991, v. 2, p. 993; (2) Y, Kita, O. Tamura, F. Itoh, H. Yasuda, H. Kishino, Y.Y. Ke, Y. Tamura. Chemistry of O-silylated ketene acetals: stereocontrolled synthesis of 2-deoxy- and 2-deoxy-2-C-alkyl-erythro-pentoses // J. Org. Chem., 1988, v. 53, p. 554], но недостатком этих способов синтеза является их многостадийность. Кроме того, все представленные выше способы синтеза сходны в том, что для получения 2-дезокси-D-риболактона 1 используются близкие углеводные предшественники, которые сами по себе могут быть крайне редкими соединениями либо необходимо применение дорогих реагентов.
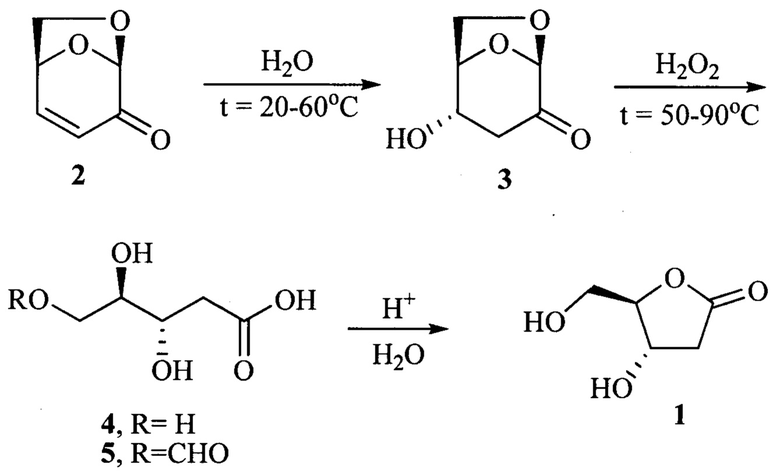
Наиболее близким способом получения 2-дезокси-D-риболактона 1 по отношению к предлагаемому способу его получения является использование левоглюкозенона [(1S,5R)-6,8-диоксабицикло[3.2.1]окт-2-ен-4-он] 2. Этот способ включает несколько стадий синтеза. Первый этап заключается в гидратации левоглюкозенона 2 в воде в присутствии триэтиламина до кетоспирта [(1R,2S,5R)-2-гидрокси-6,8-диоксабицикло[3.2.1]октан-4-он] 3 и выделение его из реакционной массы. Далее осуществляется окисление кетоспирта 3 надуксусной кислотой в уксусной кислоте по реакции Байера-Виллигера. Заключительный этап состоит в гидролизе формирующихся в результате окисления промежуточных формиатов соляной кислотой в метаноле с получением 2-дезокси-D-риболактона 1 с общим выходом 64.3%. [K. Matsumoto, T. Ebata, K. Koseki, K. Okano, Н. Kawakami, H. Matsushita. Short synthesis of (3S,4R)- and (3R,4R)-3-hydroxy-4-hydroxymethyl-4-butanolides, two lactones from levoglucosenone // Bull. Chem. Soc. Jpn., 1995, v. 68, р. 670]. Недостатками данного способа являются необходимость выделения промежуточного соединения, а именно продукта гидратации левоглюкозенона кетоспирта 3, использование в реакции Байера-Виллигера надуксусной кислоты, что усложняет процесс окисления, а также необходимость замены растворителей на каждом этапе синтеза.
Задача, на решение которой направлено заявленное изобретение, заключается в упрощении и удешевлении процесса получения 2-дезокси-D-риболактона 1.
В заявленном способе получения 2-дезокси-D-риболактона 1 в качестве исходного соединения используется левоглюкозенон 2. На первой стадии левоглюкозенон 2 подвергается гидратации путем выдерживания в воде в течение 2-6 дней при температуре 20-60°С. Данный интервал температур для гидратации левоглюкозенона 2 является оптимальным, так как в этих условиях он количественно гидратируется до кетоспирта 3. Полученный кетоспирт 3 окисляют перекисью водорода при температуре 50-90°С. Окисление проводят при любом мольном соотношении Н2О2 по отношению к кетоспирту 3. В результате окисления кетоспирта 3 перекисью водорода формируется смесь промежуточных кислот 4 [2-дезокси-D-рибоновая кислота] и 5 [2-дезокси-5-O-формил-D-рибоновая кислота], которые, в случае избытка Н2О2, лактонизируются путем кислотной обработки в целевой 2-дезокси-D-риболактон 1 с общим выходом 92%. При этом остаточные количества H2O2 могут быть нейтрализованы любым доступным способом. При использование 1 эквивалента H2O2 по отношению к кетоспирту 3, образующиеся после окисления кетоспирта 3 промежуточные кислоты 4 и 5 безопасно лактонизируются в целевой продукт путем кипячения полученной смеси с выходом 86%. Использование 1 эквивалента Н2О2 по отношению к кетоспирту 3 является наиболее эффективным в практическом плане, так как отпадает необходимость удаления избытка перекиси из реакционной массы. Следует отметить, что все стадии предлагаемого способа получения 2-дезокси-D-риболактона 1 проводятся в одном реакторе в водной среде, промежуточные продукты не выделяются из реакционной массы и все необходимые реагенты добавляются по мере необходимости.
Таким образом, предложен высокоэффективный способ получения 2-дезокси-D-риболактона 1 с общим выходом более 86%, принципиальной особенностью которого является проведение всех стадий синтеза в одном реакторе в водной среде. Кроме этого предложенный способ максимально приближен к принципам зеленой химии, практичность и эффективность синтеза достигается за счет использования недорогих и нетоксичных реагентов, и отсутствия необходимости выделения промежуточных продуктов.
Сущность изобретения подтверждается следующими примерами:
Пример 1. Синтез 2-дезокси-D-риболактона с использованием избытка H2O2 при комнатной температуре. Раствор 10.0 г (0.079 моль) левоглюкозенона 2 в 100 мл воды выдержали при комнатной температуре 6 дней. Далее к раствору медленно добавили 16.1 мл (0.158 моль) 30%-ной H2O2 и реакционную массу перемешивали при 50°С в течение 1 ч. Раствор охладили до комнатной температуры, добавили 6 мл Me2S и перемешивали 1 ч. Реакционную массу упарили при пониженном давлении. Полученную густую массу растворили в 25 мл MeCN, добавили 1 мл конц. HCl и раствор перемешивали в течение 24 ч. После раствор упарили, остаток хроматографировали на SiO2. Выход 9.6 г (92%) 2-дезокси-D-риболактона 1, прозрачная густая жидкость, [α]D22 +21.5° (с 1.0, H2O); после 2 дней выдерживания 2-дезокси-D-риболактона 1 в воде [α]D22 +18.0° (с 1.0, H2O). [Tetrahedron, 1993, v. 49, р. 349: [α]D22 +19.9° (с 0.71, H2O)]. Rf 0.4 (EtOAc). ИК спектр, ν, см-1: 3336, 1766, 1192, 1056. Спектр ЯМР 1Н (500 МГц, CDCl3) δ, м. д. (J, Гц): 2.38 (1Н, д.д, J=18.0, J=2.4, Н-2), 2.92 (1H, д.д, J=18.0, J=6.7, Н-2), 3.68 (1Н, д.д, J=12.5, J=3.7, CH2OH), 3.76 (1Н, д.д, J=12.5, J=3.3, CH2OH), 4.35-4.40 (1Н, м, H-4), 4.38 (1Н, д. т, J=6.7, J=2.4, Н-3), 4.70-4.90 (2Н, м, ОН). Спектр ЯМР 13С (125 МГц, CDCl3) δ, м.д.: 37.79 (С-2), 61.17 (СН2ОН), 68.33 (С-3), 88.78 (С-4), 177.41 (С-1). Масс-спектр, m/z: 174.1 [M+MeCN+H]+. Найдено, %: С 45.73; Н 6.01. C5H8O4. Вычислено, %: С 45.46; Н 6.10.
Пример 2. Синтез 2-дезокси-D-риболактона с использованием избытка H2O2 при 50°С. Раствор 10 г (0.079 моль) левоглюкозенона 2 в 100 мл воды выдержали при 50°С в течение 48 ч. Далее к раствору медленно добавили 16.1 мл (0.158 моль) 30%-ной H2O2 и реакционную массу перемешивали при 50°С в течение 1 ч. Для нейтрализации избытка перекиси водорода раствор охладили до комнатной температуры, добавили 6 мл Me2S и перемешивали 1 ч. Реакционную массу упарили при пониженном давлении. Для лактонизации полученную густую массу растворили в 25 мл MeCN, добавили 1 мл конц. HCl и раствор перемешивали в течение 24 ч. После раствор упарили, остаток хроматографировали на SiO2. Выход 8.7 г (83%) 2-дезокси-D-риболактона 1.
Пример 3. Синтез 2-дезокси-D-риболактона с использованием 1 эквивалента H2O2. Раствор 10.0 г (0.079 моль) левоглюкозенона 2 в 100 мл воды выдержали при комнатной температуре 6 дней. Далее к раствору медленно добавили 8.1 мл (0.079 моль) 30%-ной H2O2. Реакционную массу перемешивали при 50°С в течение 1 ч, затем кипятили 2 ч. Для удаления примесей из реакционной массы раствор охладили до комнатной температуры, экстрагировали 1 раз 50 мл CH2Cl2. Водную фазу упарили, полученную густую массу выдержали 2 часа при 90°С при давлении 1-2 мм рт.ст. Выход 10.5 г (100%) 2-дезокси-D-риболактона 1, прозрачная или слегка желтоватая густая жидкость, чистота продукта 86%.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ КЕТООЗОНИДОВ | 2013 |
|
RU2523014C1 |
| СПОСОБ ПОЛУЧЕНИЯ КЕТОТЕТРАОКСАНОВ | 2013 |
|
RU2537318C1 |
| СПОСОБ ПОЛУЧЕНИЯ (4S,5S)-4,5-О-ИЗОПРОПИЛИДЕНЦИКЛОПЕНТ-2-ЕН-1-ОНА | 2009 |
|
RU2400478C1 |
| Способ получения N-замещенных мостиковых 1,2,4-диоксазолидинов | 2023 |
|
RU2804396C1 |
| Гидройодная соль 7-метил-2'-дезоксигуанозина в качестве субстрата для получения 2'-дезоксинуклеозидов методом ферментативного трансгликозилирования | 2017 |
|
RU2664472C1 |
| Замещенные трициклические органические монопероксиды и способ их получения | 2020 |
|
RU2752760C1 |
| Кумарины с бициклическими монотерпеновыми заместителями | 2019 |
|
RU2707103C1 |
| Способ получения хиральных монотерпеновых сульфинамидов | 2017 |
|
RU2650681C1 |
| Способ получения цис-миртановой кислоты | 2021 |
|
RU2756658C1 |
| СПОСОБ ПОЛУЧЕНИЯ (+)- И (-)-3-ОКСАБИЦИКЛО[3.3.0]ОКТ-6-ЕН-2-ОНОВ | 2008 |
|
RU2381221C2 |
Изобретение относится к области органической химии, в частности к способу получения 2-дезокси-D-риболактона, применяемого в химии, биологии и медицине. Раскрывается способ получения 2-дезокси-D-риболактона, включающий гидратацию [(1S,5R)-6,8-диоксабицикло[3.2.1]окт-2-ен-4-он] левоглюкозенона в воде, окисление полученного [(1R,2S,5R)-2-гидрокси-6,8-диоксабицикло[3.2.1]-октан-4-он] кетоспирта и лактонизацию образующихся промежуточных продуктов окисления кетоспирта в целевой продукт путем кислотной обработки, отличающийся тем, что гидратацию левоглюкозенона в воде проводят при температуре 20-60°С в течение 2-6 дней, окисление кетоспирта приводят перекисью водорода при температуре 50-90°С. Изобретение обеспечивает упрощение и удешевление процесса получения 2-дезокси-D-риболактона 1. 3 з.п. ф-лы, 3 пр.
1. Способ получения 2-дезокси-D-риболактона, включающий гидратацию [(1S,5R)-6,8-диоксабицикло[3.2.1]окт-2-ен-4-он] левоглюкозенона в воде, окисление полученного [(1R,2S,5R)-2-гидрокси-6,8-диоксабицикло[3.2.1]-октан-4-он] кетоспирта и лактонизацию образующихся промежуточных продуктов окисления кетоспирта в целевой продукт путем кислотной обработки, отличающийся тем, что гидратацию левоглюкозенона в воде проводят при температуре 20-60°С в течение 2-6 дней, окисление кетоспирта приводят перекисью водорода при температуре 50-90°С.
2. Способ по п. 1, отличающийся тем, что образующуюся после окисления кетоспирта смесь промежуточных кислот [2-дезокси-D-рибоновая кислота и 2-дезокси-5-O-формил-D-рибоновая кислота] не выделяют из реакционной массы.
3. Способ по п. 1, отличающийся тем, что при использовании 1 эквивалента перекиси водорода по отношению к кетоспирту образующуюся смесь промежуточных кислот лактонизируют в целевой продукт путем кипячения реакционной массы.
4. Способ по п. 1, отличающийся тем, что все стадии синтеза 2-дезокси-D-риболактона проводят в одном реакторе.
| K | |||
| MATSUMOTO et al | |||
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
| Bull | |||
| Chem | |||
| Soc | |||
| Jpn., 1995, v | |||
| Способ получения смеси хлоргидратов опийных алкалоидов (пантопона) из опийных вытяжек с любым содержанием морфия | 1921 |
|
SU68A1 |
| YUSUKE MASUDA et al | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Angewandte Chemie International Edition, 2019, vol | |||
Авторы
Даты
2023-04-04—Публикация
2021-05-25—Подача