Настоящее изобретение относится к области химии органических пероксидов, производных кетонов, а именно, к новому способу получения неописанных ранее кетоозонидов общей формулы:

где R=Н, Cl или Br, которые могут представить интерес в качестве инициаторов радикальной полимеризации полимеров, а также в медицине и фармакологии в качестве антипаразитарных средств.
Химия органических пероксидов насчитывает уже более ста лет (Baeyer, A; Villiger, V. Einwirkung des Caro'schen Reagens auf Ketone. Chemische Berichte,. 1899, 32, 3625-3633; Baeyer, A; Villiger, V. Ueber die Einwirkung des Caro'schen Reagens auf Ketone. Chemische Berichte,. 1900, 33, 858-864). На протяжении этого периода времени кетоны являются ключевыми реагентами в синтезе пероксидов благодаря своей доступности и легкости протекания реакции между углеродным атомом карбонильной группы и атомом кислорода ООН группы (например, в H2O2). Пероксиды, полученные из кетонов, производятся в количестве тысяч тонн и широко используются как инициаторы радикальной полимеризации непредельных мономеров (Патент РФ №2352587, 20.04.2009; Патент РФ №2393173, 27.06.2010; Ullman's Encyclopedia of Industrial Chemistry, Elvers, В., Hawkins, S., and Russey, W., Eds., VCH: New York, 1995, 5th ed.).
С периода 1980 годов к химии органических пероксидов, в особенности циклического строения, растет интерес со стороны медицины и фармакологии, вследствие обнаружения у них высокой антималярийной (Dong, Y. Synthesis and Antimalarial Activity of 1,2,4,5-Tetraoxanes. Mini-Reviews in Med.Chem. 2002, 2, 113-123) и антигельминтной активности (Ingram, К.; Yaremenko, I.A.; Krylov, I.B.; Hofer, L.; Terent'ev, A.O.; Keiser, J. Identification of antischistosomal leads by evaluating peroxides of β-dicarbonyl compounds and their heteroanalogs: bridged 1,2,4,5-tetraoxanes and alphaperoxides, and β,δ-triketones: tricyclic monoperoxides. // J. Med. Chem. 2012, 55 (20), 8700-8711). Интерес к получению инициаторов радикальной полимеризации и лекарственных препаратов стимулирует развитие методов синтеза пероксидов, в которых карбонильные соединения и H2O2 играют ведущую роль.
Анализ научно-технической и патентной литературы за последние сто лет демонстрирует, что количество публикаций, связанных с получением пероксидов в реакции Н2О2 с монокетонами исчисляется тысячами (Zmitek, К.; Zupan, M.; Iskra, J. α-Substituted organic peroxides: synthetic strategies for a biologically important class of gem-dihydroperoxide and perketal derivatives. Org. Biomol. Chem. 2007, 5, 3895-3908; Terent'ev A.O., Platonov M.M., Ogibin Yu.N., Nikishin G.I. Convenient synthesis of geminal bishydroperoxides by the reaction of ketones with hydrogen peroxide. // Synth. Commun., 2007, 37(8), 1281-1287). Так, например, известны моноциклические дипероксидные соединения, содержащие в молекуле два пероксидных O-O фрагмента и/или моноциклический трипероксид, содержащий в молекуле три пероксидных O-O фрагмента, которые получают взаимодействием монокетонов с H2O2 (Kharasch, M.; Sosnovsky, G. Structure of Peroxides Derived from Cyclohexanone and Hydrogen Peroxide. J. Org. Chem. 1958, 23, 1322-1324) и трипероксиды (Story, P.; Lee, В.; Bishop, С.; Denson, D.; Busch, P. Macrocyclic synthesis. II. Cyclohexanone peroxides. J. Org. Chem. 1970, 35, 3059-3061) по следующей схеме (I):

Публикаций, связанных с получением пероксидов в реакции H2O2 с дикетонами, насчитывается несколько. Например, известны бициклические органические дипероксиды, содержащие в своей молекуле два пероксидных O-O фрагмента, которые получают взаимодействием дикетона с Н2О2 в присутствии кислот (Terent'ev, A.O.; Borisov, D.A.; Chemyshev, V.V.; Nikishin. G.I. Facile and Selective Procedure for the Synthesis of Bridged 1,2,4,5-Tetraoxanes; Strong Acids As Cosolvents and Catalysts for Addition of Hydrogen Peroxide to P-Diketones. J.Org.Chem. 2009, 74, 3335-3340; Terent'ev, A.O.; Yaremenko, I.A.; Vil', V.A.; Moiseev, I.K.; Kon'kov, S.A.; Dembitsky, V.M.; Levitsky, D.O.; Nikishin, G.I. Phosphomolybdic and phosphotungstic acids as efficient catalysts for the synthesis of bridged 1,2,4,5-tetraoxanes from β-diketones and hydrogen peroxide. // Org. Biomol. Chem., 2013, DOI: 10.1039/C3OB27239G; Патент РФ №2472799, 20.01.2013) по следующей схеме (2):

Известны также трициклические монопероксиды и способ их получения (патент РФ №2466133, 10.11.2012), в котором было показано, что фундаментальные органические соединения - β,δ-трикетоны могут реагировать с Н2О2; в результате происходит селективная сборка трициклических пероксидов, содержащих в своем составе один O-O фрагмент. Полученные трициклы содержат один ацетальный и два монопероксиацетальных фрагмента. Процесс протекает по следующей схеме:

Для полученных из β,δ-трикетонов и Н2О2 трициклических монопероксидов была показана высокая антипаразитарная активность. В литературе описан способ получения кетоозонидов общей формулы
 , где R=алкил,
, где R=алкил,
основанный на совместном озонолизе алкинов и кетонов в CH2Cl2 при -75°С; кетоозониды получаются с выходом от 12 до 79% в зависимости от строения исходных органических соединений [Griesbaum, К.; Dong, Y.; McCullough, K.J. Ozonolyses of Acetylenes: Trapping of a-Oxo Carbonyl Oxides by Carbonyl Compounds and Stabilization of a-Oxo Ozonides by Derivatizations. J. Org. Chem. 1997, 62, 6129-6136].
Также известен способ получения кетоозонида формулы 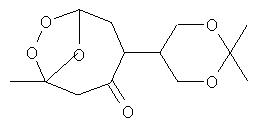 под действием озона на соединение с циклогексеноновым фрагментом в CH2Cl2 при -78°С, в результате получается бициклический кетоозонид с выходом 92% [Wang, С.; Liu, J.; Ji, Y.; Zhao, J.; Li, L.; Zhang, H. Total Synthesis of (±)-Paeonilide. Org. Lett., 2006, 8, 2479-2481].
под действием озона на соединение с циклогексеноновым фрагментом в CH2Cl2 при -78°С, в результате получается бициклический кетоозонид с выходом 92% [Wang, С.; Liu, J.; Ji, Y.; Zhao, J.; Li, L.; Zhang, H. Total Synthesis of (±)-Paeonilide. Org. Lett., 2006, 8, 2479-2481].
Известен способ получения кетоозонидов, в котором они образуются как промежуточные интермедиаты общей формулы,  основанный на действии синглетного кислорода на ацилзамещенные фураны. Синтез проводят в растворе ацетонитрила при облучении кварцевой галогеновой лампой при 0°С в течение 5 минут, пробулькивая через раствор воздух; для превращения кислорода воздуха в синглетный кислород используют медиатор возбуждения - Розовый бенгальский. Однако в чистом виде кетоозонид выделен не был [Onitsuka, S.; Nishino, H.; Kurosawa, K. Photooxygenation of 3-acetyl-5-aryl-2-methylfurans via endoperoxide intermediate and the following reactions. Tetrahedron 2001, 57, 6003-6009].
основанный на действии синглетного кислорода на ацилзамещенные фураны. Синтез проводят в растворе ацетонитрила при облучении кварцевой галогеновой лампой при 0°С в течение 5 минут, пробулькивая через раствор воздух; для превращения кислорода воздуха в синглетный кислород используют медиатор возбуждения - Розовый бенгальский. Однако в чистом виде кетоозонид выделен не был [Onitsuka, S.; Nishino, H.; Kurosawa, K. Photooxygenation of 3-acetyl-5-aryl-2-methylfurans via endoperoxide intermediate and the following reactions. Tetrahedron 2001, 57, 6003-6009].
Известен также способ получения кетоозонида формулы  совместным озонолизом трикетона - индантриона с тетраметилэтиленом при - 20°С, в результате получается дикетоозонид, выход которого не определен; отмечается, что он устойчив при температуре около 0°С, при повышении которой кетоозонид разлагается [Kopecky, K.R. Luminescent Products from Ozonolysis Reactions. Quimica Nova, 1993, 16, 321-324].
совместным озонолизом трикетона - индантриона с тетраметилэтиленом при - 20°С, в результате получается дикетоозонид, выход которого не определен; отмечается, что он устойчив при температуре около 0°С, при повышении которой кетоозонид разлагается [Kopecky, K.R. Luminescent Products from Ozonolysis Reactions. Quimica Nova, 1993, 16, 321-324].
Известные способы как правило основаны на использовании дорогостоящего и токсичного озона, процесс проводят при низких температурах. Кроме того, озон является химически очень активным соединением и легко при избыточном применении может образовывать продукты более глубокого окисления - взрывчатые озониды.
Задачей настоящего изобретения является разработка удобного, безопасного и простого в исполнении способа получения неописанных ранее кетоозонидов.
Поставленная задача достигается предлагаемым новым способом получения кетоозонидов общей формулы (I):

где R=Н, Cl или Br, заключающимся во взаимодействии β,δ-трикетонов общей формулы (II):
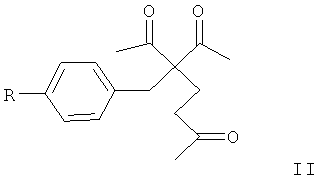
где R имеет вышеуказанные значения, с пероксидом водорода в присутствии фосфорномолибденовой кислоты в качестве катализатора в среде ацетонитрила.
Процесс получения кетоозонидов (I) проводят при комнатной температуре (20-25°С) в течение 6-10 часов и мольном соотношении β,δ-трикетон II:фосфорномолибденовая кислота (ФМК):пероксид водорода=1:(0,1-0,2):(1,5-2,0).
Процесс протекает по следующей схеме:

В результате реакции образуются кетоозониды формулы I, содержащие в своем составе озонидный цикл и кетогруппу.
Выход целевого продукта составляет от 30 до 42%.
Предлагаемый способ получения кетоозонидов является новым, так как до настоящего времени не было известно из уровня техники о получении кетоозонидов из трикетонов под действием пероксида водорода. Известно было, что в реакции β,δ-трикетонов с H2O2 образуются трициклические монопероксиды и все три карбонильные группы β,δ-трикетонов участвуют в реакции (патент РФ №2466133, 10.11.2012).
В настоящем изобретении удалось показать, что фундаментальный класс органических соединений - β,δ-трикетоны в определенных условиях (ацетонитрил как растворитель, фосфорномолибденовая кислота как катализатор, комнатная температура и соотношение исходных реагентов) могут реагировать с H2O2 с образованием кетоозонидов, а не трициклических монопероксидов, как следовало ожидать на основании уровня техники по пероксидированию β,δ-трикетонов, где все три карбонильные группы β,δ-трикетонов участвуют в реакции.
В предлагаемом изобретении один из Р-углеродных атомов (карбонильной группы) остается не затронутым, а другая карбонильная группа, находящаяся в β-положении, и карбонильная группа, находящаяся в δ-положении, реагируют с пероксидом водорода с образованием озонидного цикла, в котором углеродные атомы карбонильных групп соединены через пероксидный фрагмент -O-O- и через атом кислорода -O-. До настоящего времени на основании результатов работы [Terent'ev, A.O.; Borisov, D.A.; Chemyshev, V.V.; Nikishin. G.I. Facile and Selective Procedure for the Synthesis of Bridged 1,2,4,5-Tetraoxanes; Strong Acids As Cosolvents and Catalysts for Addition of Hydrogen Peroxide to P-Diketones. J.Org.Chem. 2009, 74, 3335-3340] ожидалось, что карбонильные группы, находящиеся в β-положениях друг относительно друга в реакции с пероксидом водорода, превратятся в тетраоксан, через пероксидирование пероксидом водорода, что не наблюдалось в данном случае. Необычно, что в реакции с пероксидом водорода вместо получения соединений исключительно с фрагментом -O-O-, углеродные атомы оказываются связанными через кислородный атом -O-. До начала исследования нельзя было предвидеть, что озонидный цикл будет образовываться с участием β,δ-карбонильных групп, а не β,β-карбонильных групп. Необычным является также факт мономолекулярной, а не межмолекулярной реакции кетонов с пероксидом водорода.
Полученные соединения и способ их получения могут быть использованы для производства веществ с высокой антипаразитарной активностью. Известно, что озониды, как класс соединений, обладают выраженной антипаразитарной активностью, на их основе ведется активный поиск антипаразитарных препаратов [Zhao, Q.; Vargas, M.; Dong, Y.; Zhou, L.; Wang, X.; Sriraghavan, K.; Keiser, J.; Vennerstrom, J.L. Structure-Activity Relationship of an Ozonide Carboxylic Acid (OZ78) against Fasciola hepatica. J. Med. Chem. 2010, 53, 4223-4233; Tang, Y.; Dong, Y.; Wittlin, S.; Charman, S. A.; Chollet J.; Chiu, F.C.K.; Charman, W.N.; Matile, H.; Urwyler, H.; Dom, A.; et al. Weak base dispiro-l,2,4-trioxolanes: Potent antimalarial ozonides. Bioorg. Med. Chem. Lett. 2007, 17(5), 1260-1265; Vennerstrom, J.L.; Arbe-Bames, S.; Brun, R.; Charman, S.A.; Chiu, F.C.K.; Chollet, J.; Dong, Y.; Dom, A. et al. Identification of an antimalarial synthetic trioxolane drug development candidate. Nature 2004, 430, 900-904].
Соединение с озонидным циклом (Артеролан) формулы:  находится на клинических испытаниях для лечения малярии. Полученные кетоозониды интересны в плане поиска антипаразитарных средств еще и тем, что кето-группа легко модифицируется с использованием широкого ряда химических превращений, что позволит получать на основе кетоозонидов широкие ряды озонидов с другими заместителями.
находится на клинических испытаниях для лечения малярии. Полученные кетоозониды интересны в плане поиска антипаразитарных средств еще и тем, что кето-группа легко модифицируется с использованием широкого ряда химических превращений, что позволит получать на основе кетоозонидов широкие ряды озонидов с другими заместителями.
Технический результат - разработан удобный, безопасный и простой в техническом исполнении новый способ получения неописанных ранее кетоозонидов формулы I из β,δ-трикетонов и доступного недорогого и нетоксичного пероксида водорода (H2O2) - реагента «Зеленой химии», который не обладает столь высоким окислительным потенциалом как озон, а следовательно, не приводит к непредвиденному образованию взрывчатых соединений. Процесс проводят при комнатной температуре. Предлагаемые соединения могут представить интерес в качестве инициаторов радикальной полимеризации мономеров, а также в медицине и фармакологии в качестве антипаразитарных средств.
Пример 1. Получение 1-(2-бензил-1,5-диметил-6,7,8-триоксабицкло[3.2.1]окт-2-ил)этанона (1а)
К раствору 3-ацетил-3-бензилгептан-2,6-диона (II) (0,1 г, 0,38 ммоль) в CH2CN (2 мл) при перемешивании и комнатной температуре последовательно добавляли эфирный раствор Н2О2 (0,57 ммоль; мольное соотношение β,δ-трикетон II:пероксид водорода 1:1,5) и фосфорномолибденовую кислоту (ФМК) (0,089 г; мольное соотношение β,δ-трикетон II:фосфорномолибденовая кислота 1:0,1). Перемешивали при 20-25°С в течение 6 ч. Далее добавляли CH2CCl2 (10 мл), органический слой промывали водой (10 мл), 5% водным раствором NaHCO3 и снова водой (10 мл). Сушили над Na2SO4, фильтровали, удаляли растворитель в вакууме водоструйного насоса. Продукт 1-(2-бензил-1,5-диметил-6,7,8-триоксабицкло[3.2.1]окт-2-ил)этанон (1а) выделяли хроматографией на SiO2. Выход 30% (31,5 мг).
1Н ЯМР (300.13 МГц CDCl3, δ, м.д.): 1.48 (с), 1.50 (с), 1.53-2.03 (м), 2.07 (с), 2.15 (с), 2.18-2.33 (м), 2.57-2.71 (м), 2.89 (д), 3.54 (д),3.55 (д), 7.01-7.10 (м), 7.15-7.29 (м).
Элементный анализ. Вычислено. (%): С, 69.54; Н, 7.30. Найдено (%): С, 69.49; Н, 7.39. C16H20O5.
Пример 2. Получение 1-[2-(4-хлорбензил)-1,5-диметил-6,7,8-триоксабицкло[3.2.1]окт-2-ил этанона (16).
К раствору 3-ацетил-3-хлорбензилгептан-2,6-диона (II) (0,1 г, 0,34 ммоль) в CH3CN (2 мл) при перемешивании и комнатной температуре последовательно добавляли эфирный раствор H2O2 (0,58 ммоль; мольное соотношение β,δ-трикетон II:пероксид водорода 1:1,7) и фосфорномолибденовую кислоту (ФМК) (0,140 г; мольное соотношение β,δ-трикетон II:фосфорномолибденовая кислота 1:0,18). Перемешивали при 20-25°С в течение 6 ч. Далее добавляли CH2Cl2 (10 мл), органический слой промывали водой (10 мл), 5% водным раствором NaHCO3 и снова водой (10 мл). Сушили над Na2SO4, фильтровали, удаляли растворитель в вакууме водоструйного насоса. Продукт 1-(2-хлорбензил-1,5-диметил-6,7,8-триоксабицкло[3.2.1]окт-2-ил)этанон (Iб) выделяли хроматографией на SiO2. Выход 35% (37,0 мг).
1Н ЯМР (300.13 МГц, CDCl3), δ: 1.44 (с), 1.48-1.74 (м), 1.76-2.00 (м), 2.08-2.31 (м), 2.54 (д), 2.58-2.73 (м), 2.85 (д), 3.35 (д), 3.51 (д), 6.99 (д), 7.01 (д), 7.19 (д), 7.20 (д).
Элементный анализ. Вычислено (%): С, 61.84; Н, 6.16; Cl, 11.41. Найдено (%): С, 61.80; Н, 6.11; Cl, 11.50; C16H19ClO4
Пример 3. Получение 1-[2-(4-бромбензил)-1,5-диметил-6,7,8-триоксабицкло[3.2.1]окт-2-ил этанона (Iв).
К раствору 3-ацетил-3-бромбензилгептан-2,6-диона (II) (0,1 г, 0,29 ммоль) в CH3CN (2 мл) при перемешивании и комнатной температуре последовательно добавляли эфирный раствор H2O2 (0,58 ммоль; мольное соотношение β,δ-трикетон II:пероксид водорода 1:2,0) и фосфорномолибденовую кислоту (ФМК) (0,136 г; мольное соотношение β,δ-трикетон II:фосфорномолибденовая кислота 1:0,2). Перемешивали при 20-25°С в течение 6 ч. Далее добавляли CH2Cl2 (10 мл), органический слой промывали водой (10 мл), 5% водным раствором NaHCO3 и снова водой (10 мл). Сушили над Na2SO4, фильтровали, удаляли растворитель в вакууме водоструйного насоса. Продукт 1-(2-бромбензил-1,5-диметил-6,7,8-триоксабицкло[3.2.1]окт-2-ил)этанон (Iв) выделяли хроматографией на SiO2. Выход 42% (43,2 мг)
1Н ЯМР (300.13 МГц, CDCl3), δ: 1.39-1.70 (м, 1Н), 1.76-2.00 (м), 2.11 (с), 2.13-2.28 (м), 2.52 (д), 2.59-2.74 (м), 2.84 (д), 3.33 (д), 3.50 (д), 6.93 (д), 6.96 (д), 7.35 (д).
Элементный анализ. Вычислено (%): С, 54.10; Н, 5.39; Вг, 22.49. Найдено (%): С, 54.15; Н, 5.45; Br, 22.55; C16H19BrO4
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ КЕТОТЕТРАОКСАНОВ | 2013 |
|
RU2537318C1 |
| Замещенные трициклические органические монопероксиды и способ их получения | 2020 |
|
RU2752760C1 |
| ТРИЦИКЛИЧЕСКИЕ ОРГАНИЧЕСКИЕ МОНОПЕРОКСИДЫ И СПОСОБ ИХ ПОЛУЧЕНИЯ | 2011 |
|
RU2466133C1 |
| Способ получения трициклических органических дипероксидов | 2020 |
|
RU2752957C1 |
| СПОСОБ ПОЛУЧЕНИЯ ЗАМЕЩЕННЫХ 2,3,5,6-ТЕТРАОКСАБИЦИКЛО-[2.2.1]ГЕПТАНОВ | 2012 |
|
RU2472799C1 |
| Способ получения замещенных 5-гидроперокси-5-алкил-1,2-диоксолан-3-онов | 2020 |
|
RU2752940C1 |
| СПОСОБ ПОЛУЧЕНИЯ 5-ГИДРОПЕРОКСИ-3,5-ДИМЕТИЛ-1,2-ДИОКСОЛАН-3-ОЛА | 2012 |
|
RU2473548C1 |
| СПОСОБ ПОЛУЧЕНИЯ ЗАМЕЩЕННЫХ 2,3,5,6-ТЕТРАОКСАБИЦИКЛО[2.2.1]ГЕПТАНОВ | 2012 |
|
RU2494102C1 |
| Способ получения N-замещенных мостиковых 1,2,4-диоксазолидинов | 2023 |
|
RU2804396C1 |
| СПОСОБ ПРИГОТОВЛЕНИЯ КАТАЛИЗАТОРА ДЛЯ ПОЛУЧЕНИЯ 3-АЦЕТИЛГЕПТАН-2,6-ДИОНА И СПОСОБ ПОЛУЧЕНИЯ 3-АЦЕТИЛГЕПТАН-2,6-ДИОНА С ИСПОЛЬЗОВАНИЕМ ПОЛУЧЕННОГО КАТАЛИЗАТОРА | 2012 |
|
RU2494810C1 |
Изобретение относится к области химии органических пероксидов, производных кетонов, а именно к новому способу получения неописанных ранее кетоозонидов общей формулы:

где R=Н, Cl или Br, заключающемуся во взаимодействии β,δ-трикетонов общей формулы II:

где R имеет вышеуказанные значения, с пероксидом водорода в присутствии фосфорномолибденовой кислоты в качестве катализатора в среде ацетонитрила при комнатной температуре и мольном соотношении β,δ-трикетон II:фосфорномолибденовая кислота:пероксид водорода 1:(0,1-0,2):(1,5-2,0). Полученные соединения могут представить интерес в качестве инициаторов радикальной полимеризации полимеров, а также в медицине и фармакологии в качестве антипаразитарных средств. 3 пр.
Способ получения кетоозонидов общей формулы I:

где R=Н, Cl или Br,
заключающийся во взаимодействии β,δ-трикетонов общей формулы II:

где R имеет вышеуказанные значения, с пероксидом водорода в присутствии фосфорномолибденовой кислоты в качестве катализатора в среде ацетонитрила при комнатной температуре и мольном соотношении β,δ-трикетон II: фосфорномолибденовая кислота:пероксид водорода 1:(0,1-0,2):(1,5-2,0).
| Bunnell H | |||
| Et al, JACS, 1989, 111(19),p.7612-13 | |||
| 0 |
|
SU242799A1 | |
| ТРИЦИКЛИЧЕСКИЕ ОРГАНИЧЕСКИЕ МОНОПЕРОКСИДЫ И СПОСОБ ИХ ПОЛУЧЕНИЯ | 2011 |
|
RU2466133C1 |
| Способ получения 1,4-бис-замещенных 2,6,7-триоксабицикло (2,2,2)октанов | 1985 |
|
SU1792417A3 |
Авторы
Даты
2014-07-20—Публикация
2013-03-19—Подача