Изобретение относится к кумаринам, а именно к гидроксикумаринам с изоборнильным или изокамфильным заместителем в бензопирановом кольце.
Гидроксикумарины и их производные представляют интерес в качестве фармакологически активных соединений, поскольку проявляют противовирусные, противовоспалительные и противоопухолевые свойства [M.Z. Hassan, Н. Osman, М.А. Ali, M.J. Ahsan. Therapeutic potential of coumarins as antiviral agents // Eur. J. Med. Chem. 2016, 123, 236-255; M.A.I. Salem, M.I. Marzouk, A.M. Et-Kazak. Synthesis and characterization of some new coumarins with in vitro antitumor and antioxidant activity and high protective effects against DNA damage // Molecules. 2016, 21, 249; Vijaya Bhargavi, M.; Shashikala, P.; Sumakanth, M. Coumarins and chromones: a remarkable scaffolds for anti-inflammatory activity // J. Pharm. Sci. & Res. 2017, Vol. 9(9), 1483-1489; Carrico-Moniz, D. Coumarin derivatives for cancer therapy // Patent US 9388155 (2016); Ma, J.; Huang, K.; Ni, X.; Chen, R.; Yu, C.; Yan, Q.; Chen, S.; Hou, X. Coumarin derivative and its application in preparing drug for treating or preventing cancer and other proliferative disease // Patent CN 109232498. 18.06.2019]. Кроме того, гидроксикумарины могут выступать как промежуточные соединения в синтезе новых биологически активных производных, в том числе галогенсодержащих, аминов, амидов, сложных эфиров, бензоксазинов и так далее [Sun М., Hu J., Song X., Wu D., Kong L., Sun Y., Wang D., Wang Y., Chen N., Liu G. Coumarin derivatives protect against ischemic brain injury in rats // Eur. J. Med. Chem. 2013, 67, 39-53; Chen Y., Cheng M., Liu F.Q., Xia P., Qian K., Yu D., Xia Y., Yang Z.Y., Chen C.H., Morris-Natschke S.L., Lee K.H. Anti-AIDS agents 86. Synthesis and anti-HIV evaluation of 20,30-seco-30-nor DCP and DCK analogues // Eur. J. Med. Chem. 2011, 46, 4924-4936; Guo X.-Y., Liu G. Scaffold-hopping strategy toward calanolides with nitrogen-containing heterocycles // Chinese Chemical Letters. 2013, 24, 295-298; Zhang M.-Z., Zhang R.-R., Yin W.-Z., Yu X., Zhang Y.-L., Liu P., Gu Y.-C., Zhang W.-H. Microwave-assisted Synthesis and antifungal activity of coumarin[8,7-e][1,3]oxazine derivatives // Mol. Divers. 2016, 20:611-618].
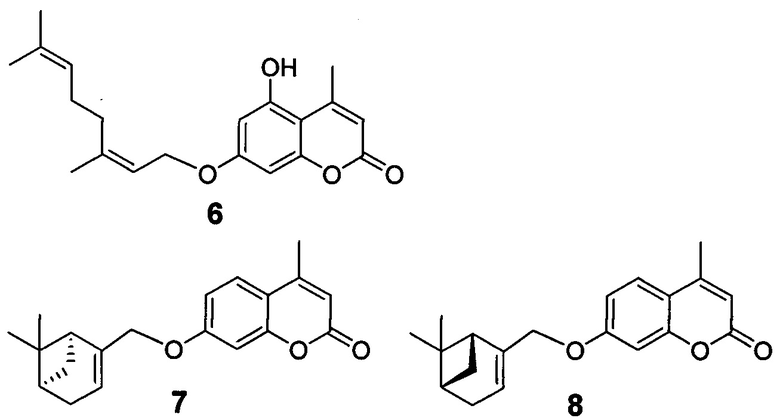
Ближайшими аналогами заявляемых соединений можно считать 4-метил-5-гидрокси-(Z)-аураптен (6) [Si, J.; Li, G.; Cao, L. Application of terpenoid coumarin compounds to treating gastric cancer // Patent CN 109223772. 18.06.2019], оказывающий хороший эффект против пролиферации раковых клеток желудка; 7-(((1R,5S)-6,6-диметилбицикло[3.1.1]гепт-2-ен-2-ил)метокси)-4-метил-2Н-хромен-2-он (7) и 7-(((1S,5R)-6,6-диметилбицикло[3.1.1]гепт-2-ен-2-ил)метокси)-4-метил-2Н-хромен-2-он (8), демонстрирующие ингибирующий эффект против вируса гриппа A/California/07/09 (H1N1)pdm09 [Т.М. Khomenko, V.V. Zarubaev, I.R. Orshanskaya, R.A. Kadyrova, V.A. Sannikova, D.V. Korchagina, K.P. Volcho, N.F. Salakhutdinov, Anti-influenza activity of monoterpene-containing substituted coumarins // Bioorg. Med. Chem. Lett. 2017, 27, 2920-2925].
Описания заявляемых соединений и их свойств в источниках информации не обнаружено.
Задачей изобретения является получение новых гидроксикумаринов с терпеновыми заместителями формулы I.
Технический результат состоит в расширении арсенала кумаринов, а именно гидроксикумаринов с изоборнильным или изокамфильным заместителем в бензопирановом кольце, которые могут найти применение в медицине, в частности для получения препаратов, обладающих антиоксидантной и мембранопротекторной активностью.
Технический результат достигается тем, что кумарины с бициклическими монотерпеновыми заместителями (изоборнильным или изокамфильным) имеют общую формулу структуры (I) Группа соединений, представлена общей формулой (I):
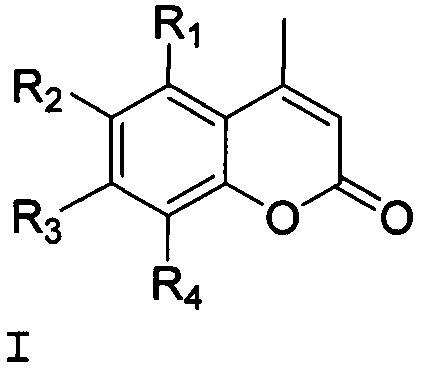
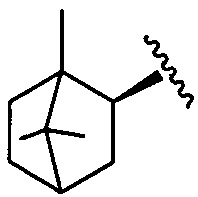 1,7,7-триметилбицикло[2.2.1]гепт-экзо-2-ил
1,7,7-триметилбицикло[2.2.1]гепт-экзо-2-ил
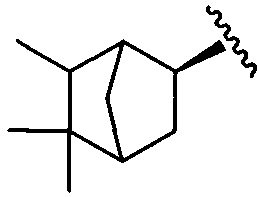 2,2,3-триметилбицикло[2.2.1]гепт-экзо-5-ил
2,2,3-триметилбицикло[2.2.1]гепт-экзо-5-ил
где R1=R4=H, R3=OH, R2=(1,7,7-триметилбицикло[2.2.1]гепт-экзо-2-ил) (1);
R1=R4=H, R2=OH, R3=(1,7,7-триметилбицикло[2.2.1]гепт-экзо-2-ил) (2);
R2=R4=(1,7,7-триметилбицикло[2.2.1]гепт-экзо-2-ил), R1=OH, R3=Н (3);
R1=R4=H, R3=OH, R2=(2,2,3-триметилбицикло[2.2.1]гепт-экзо-5-ил) (4);
R1=R4=H, R2=OH, R3=(2,2,3-триметилбицикло[2.2.1]гепт-экзо-5-ил) (5).
Полученные кумарины обладают антиоксидантной и мембранопротекторной активностью.
Синтез заявляемых соединений осуществлен методом конденсации Пехмана [P. Srivastava; V.K. Vyas; В. Variya; P. Patel; G. Qureshi; M. Ghate. Synthesis, anti-inflammatory, analgesic, 5-lipoxygenase (5-LOX) inhibition activities, and molecular docking study of 7-substituted coumarin derivatives. Bioorganic Chemistry, 2016, 67, 130-138] при взаимодействии соответствующих терпенофенолов с ацетоуксусным эфиром в среде концентрированной H2SO4.
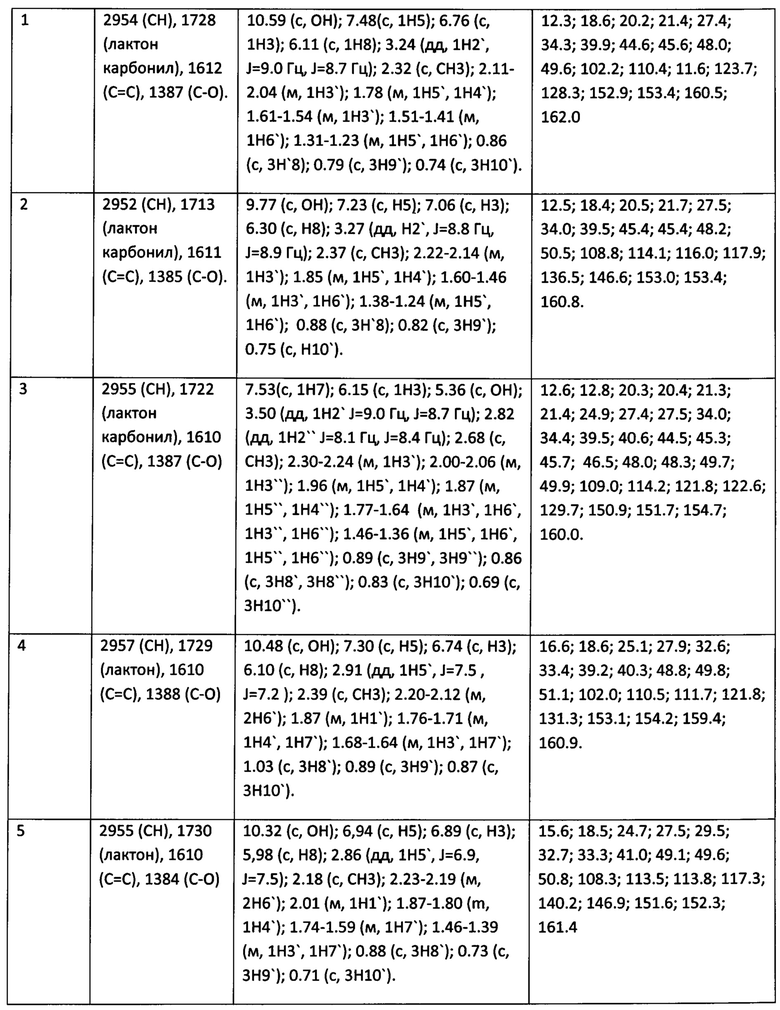
Соединения (1-5) представляют собой белые мелкокристаллические порошки, растворимые в хлороформе (умеренно), диметилсульфоксиде, бензоле, диэтиловом эфире, ацетоне, этаноле, нерастворимые в воде. Структуры соединений (1-5) подтверждены методами ИК и ЯМР спектроскопии, а так же масс-спектрометрии (ESI-MS). ИК-спектры регистрировали на ИК-Фурье-спектрометре Shimadzu IR Prestige 21 (Япония) в таблетках с KBr. Спектры ЯМР 1Н и 13С записывали на спектрометре Bruker Avance II 300 (Германия) при рабочей частоте прибора 300 и 75.5 МГц соответственно в DMSO или CDCl3. Масс-спектры записывали на масс-спектрометре Thermo Finnigan LCQ Fleet.
Сущность предлагаемого решения и возможность его осуществления подтверждается примером и результатами физико-химических исследований.
Пример 1. 7-Гидрокси-6-(1,7,7-триметилбицикло[2.2.1]гепт-экзо-2-ил)-4-метил-2Н-хромен-2-он (1) получен при взаимодействии смеси 4-(1,7,7-триметилбицикло[2.2.1]гепт-экзо-2-ил)бенз-1,3-диола (1 г, 4 ммоль) и ацетоуксусного эфира (0.8 г, 6 ммоль) при охлаждении (0-5°С), к которой по каплям добавили избыток концентрированной H2SO4 (2 мл) и перемешивали 4 ч при охлаждении, а затем еще ночь при комнатной температуре. Реакционную смесь вылили в лед. Образовавшийся осадок отфильтровали, промыли холодной водой и высушили. Полученный кумарин перекристаллизовали из этанола. Выход 1.1 г (93%), т. пл. 273°С с разложением. ESI-MS (70 eV) m/z: 313.19 [М+Н] Спектральные характеристики соединения (1) приведены в таблице 1.
Пример 2. 6-Гидрокси-7-(1,7,7-триметилбицикло[2.2.1]гепт-экзо-2-ил)-4-метил-2Н-хромен-2-он (2) получен аналогично примеру 1, исходя из 2-(1,7,7-триметилбицикло[2.2.1]гепт-экзо-2-ил)бенз-1,4-диола (1 г, 4 ммоль). Выход 1.0 г (86%), т. пл. 287°С с разложением. ESI-MS (70 eV) m/z: 313.21 [М+Н]. Спектральные характеристики соединения (2) приведены в таблице 1.
Пример 3. 5-Гидрокси-6,8-ди-(1,7,7-триметилбицикло[2.2.1]гепт-экзо-2-ил)-4-метил-2Н-хромен-2-он (3) получен аналогично примеру 1, исходя из 4,6-ди-(1,7,7-триметилбицикло[2.2.1]гепт-экзо-2-ил)бенз-1,3-диола (1.5 г, 4 ммоль). Продукт выделяли колоночной хроматографией на SiO2 (элюент - хлороформ). Выход 0.9 г (52%), т. пл. 284°С с разложением. ESI-MS (70 eV) m/z: 449.34 [М+Н]. Спектральные характеристики соединения (3) приведены в таблице 1.
Пример 4. 7-Гидрокси-6-(2,2,3-триметилбицикло[2.2.1]гепт-экзо-5-ил)-4-метил-2Н-хромен-2-он (4) получен аналогично примеру 1, исходя из 4-(2,2,3-триметилбицикло[2.2.1]гепт-экзо-5-ил)бенз-1,3-диола. Выход 91%, т. пл. 256°С с разложением. ESI-MS (70 eV) m/z: 313.47 [М+Н]. Спектральные характеристики соединения (4) приведены в таблице 1.
Пример 5. 6-Гидрокси-7-(2,2,3-триметилбицикло[2.2.1]гепт-экзо-5-ил)-4-метил-2Н-хромен-2-он (5) получен аналогично примеру 1, исходя из 2-(2,2,3-триметилбицикло[2.2.1]гепт-экзо-5-ил)бенз-1,4-диола. Выход 83%, т. пл. 256°С с разложением. ESI-MS (70 eV) m/z: 313.32 [М+Н]. Спектральные характеристики соединения (5) приведены в таблице 1.

Поиск наиболее активных и относительно малотоксичных биологически активных веществ для использования их на практике обуславливает необходимость проведения их первичного отбора на модельных биологических системах. Для впервые синтезированных соединений нами будут проведены сравнительные исследования мембранопротекторной активности на модели H2O2-индуцированного гемолиза эритроцитов и антиоксидантные свойства по эффективности ингибирования накопления вторичных продуктов перекисного окисления липидов. Известно, что биологическая активность большинства соединений зависит от их способности влиять на регуляцию процессов окисления липидов, а также воздействовать на структурное состояние клеточных мембран [Burlakova Е.В. Chemical and Biological Kinetics: New Horizons. V. 2. Biological Kinetics. 2005]. Удобной клеточной моделью исследования механизмов развития окислительных повреждений являются эритроциты крови, чувствительные к оксидативным повреждениям вследствие значительного содержания полиненасыщенных жирных кислот в липидах мембран и наличия гемоглобина, являющегося потенциальным промотором окислительных процессов [О.Г. Шевченко, Л.Н. Шишкина. Успехи современной биологии. 2014. 134. 133-148].
Пример 6. Для оценки токсичности, антиоксидантной и мембранопротекторной активности соединений использовали 0.5% (v/v) суспензию эритроцитов лабораторных мышей в фосфатно-солевом буфере (PBS, рН 7.4). Исследуемые вещества предварительно растворяли в ацетоне. Токсичность (гемолитическую активность) оценивали по степени гемолиза эритроцитов через 1-5 ч после внесения растворов исследуемых соединений в концентрации 1 мкМ. Сравнительную оценку биологической активности кумаринов с бициклическими терпеновыми заместителями (изоборнильным или изокамфильным) проводили при концентрации 1 мкМ, поскольку для соединения (4) в концентрации 10 мкМ была выявлена цитотоксичность. Мембранопротекторную и антиоксидантную активность определяли по степени ингибирования H2O2-индуцированного гемолиза, торможения накопления вторичных продуктов ПОЛ и окисления оксигемоглобина в эритроцитах [Takebayashi J., Chen J., Tai A. // Advanced Protocols in Oxidative Stress II, Methods in Molecular Biology / Ed. Armstrong D. New York; Dordrecht; Heidelberg; London: Humana Press, 2010. V. 594. P. 287-296; Van den Berg J.J.M., Op den Kamp J.A.F., Lubin B.H., Roelofsen В., Kuypers F.A. // Free Radical Biol. Med. 1992. V. 12. P. 487-498]. 7-Гидрокси-4-метилкумарин в этой концентрации не изучали, поскольку в предварительных экспериментах было установлено отсутствие у них значимой мембранопротекторной активности даже при 10 мкМ.
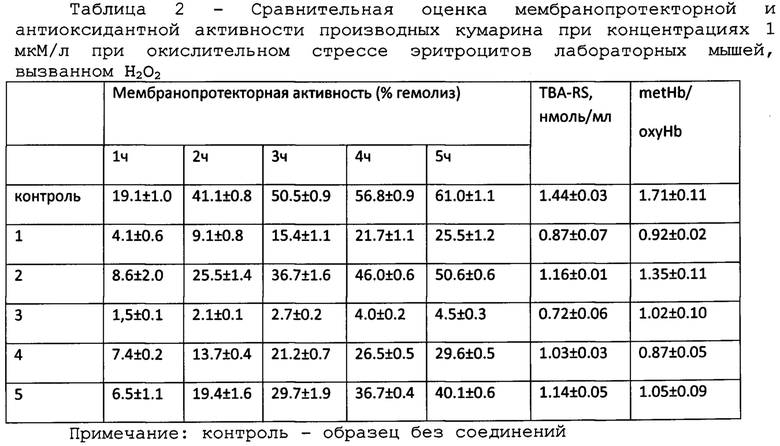
Оценка антиоксидантной и мембранопротекторной активности заявляемых соединений показала высокий потенциал соединений как антиоксидантов.
По мембранопротекторной активности наиболее эффективным является кумарин 3, содержащий в составе два изоборнильных заместителя, действие которого существенно превышает незамещенный 7-гидрокси-4-метилкумарин.
| название | год | авторы | номер документа |
|---|---|---|---|
| НОВЫЕ ПРОИЗВОДНЫЕ 2,6-ДИИЗОБОРНИЛФЕНОЛА И СПОСОБ ИХ ПОЛУЧЕНИЯ | 2012 |
|
RU2516699C2 |
| Гибридные терпенофенолы с изоборнильным и 1-фенилэтильным или 1-фенилпропильным заместителями и их применение в качестве средства, обладающего антирадикальной, антиоксидантной и мембранопротекторной активностью | 2016 |
|
RU2642062C2 |
| ПРОИЗВОДНЫЕ 2,6-ДИИЗОБОРНИЛФЕНОЛА | 2011 |
|
RU2575294C2 |
| 2,6-ДИИЗОБОРНИЛФЕНОЛЫ | 2011 |
|
RU2502719C2 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ 4-АРИЛ-2-ОКСО-2Н-ХРОМЕН-3-КАРБОНИТРИЛОВ | 2015 |
|
RU2577524C1 |
| ТЕТРА-(МЕЗО-АРИЛ)-ПОРФИРИН С ДИИЗОБОРНИЛФЕНОЛЬНЫМИ ЗАМЕСТИТЕЛЯМИ В МАКРОЦИКЛЕ | 2012 |
|
RU2496761C1 |
| ПИРАЗОЛЫ | 2006 |
|
RU2381217C2 |
| СРЕДСТВО, ОБЛАДАЮЩЕЕ НЕЙРОПРОТЕКТОРНОЙ АКТИВНОСТЬЮ | 2018 |
|
RU2701739C1 |
| РЕЗИНОВАЯ СМЕСЬ НА ОСНОВЕ БУТАДИЕН-МЕТИЛСТИРОЛЬНОГО КАУЧУКА | 2012 |
|
RU2516644C1 |
| РЕЗИНОВАЯ СМЕСЬ НА ОСНОВЕ БУТАДИЕН-МЕТИЛСТИРОЛЬНОГО КАУЧУКА | 2012 |
|
RU2507225C1 |
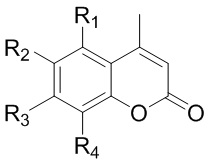
Изобретение относится к кумаринам общей формулы (I)
 ,
,
I
где R1=R4=H, R3=OH, R2= (1,7,7-триметилбицикло[2.2.1]гепт-экзо-2-ил) (1);
R1=R4=H, R2=OH, R3= (1,7,7-триметилбицикло[2.2.1]гепт-экзо-2-ил) (2);
R2=R4= (1,7,7-триметилбицикло[2.2.1]гепт-экзо-2-ил), R1=OH, R3= H (3).
R1=R4=H, R3=OH, R2= (2,2,3-триметилбицикло[2.2.1]гепт-экзо-5-ил) (4);
R1=R4=H, R2=OH, R3= (2,2,3-триметилбицикло[2.2.1]гепт-экзо-5-ил) (5).
Полученные кумарины могут быть использованы в качестве средства, обладающего антиоксидантной и мембранопротекторной активностью. 1 з.п. ф-лы, 2 табл. 6 пр.
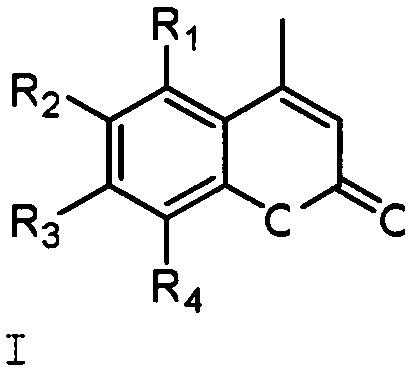
1 Кумарины с бициклическими монотерпеновыми заместителями (изоборнильным или изокамфильным) общей формулы (I)
 ,
,
где R1=R4=H, R3=OH, R2=(1,7,7-триметилбицикло[2.2.1]гепт-экзо-2-ил) (1);
R1=R4=H, R2=OH, R3=(1,7,7-триметилбицикло[2.2.1]гепт-зкзо-2-ил) (2);
R2=R4=(1,7,7-триметилбицикло[2.2.1]гепт-экзо-2-ил), R1=OH, R3=Н (3);
R1=R4=H, R3=OH, R2=(2,2,3-триметилбицикло[2.2.1]гепт-экзо-5-ил) (4);
R1=R4=H, R2=OH, R3=(2,2,3-триметилбицикло[2.2.1]гепт-экзо-5-ил) (5).
2 Кумарины по п. 1, обладающие антиоксидантной и мембранопротекторной активностью.
| CN 109223772 A, 18.01.2019 | |||
| Khomenko, T | |||
| M., Zarubaev, V | |||
| V., Orshanskaya, I | |||
| R., Kadyrova, R | |||
| A., Sannikova, V | |||
| A., Korchagina, D | |||
| V | |||
| Salakhutdinov, N | |||
| F | |||
| Автомобиль-сани, движущиеся на полозьях посредством устанавливающихся по высоте колес с шинами | 1924 |
|
SU2017A1 |
| Anti-influenza activity of monoterpene-containing substituted coumarins | |||
| Bioorganic & Medicinal Chemistry Letters, 27(13), 2920-2925.doi:10.1016/j.bmcl.2017.04.091 | |||
| 4-ГИДРОКСИБЕНЗОПИРАН-2-ОН ИЛИ 4-ГИДРОКСИЦИКЛОАЛКИЛ/В/-БЕНЗОПИРАН-2-ОН И СПОСОБ ПОЛУЧЕНИЯ N-/3-/ЦИКЛОПРОПИЛ(5,6,7,8,9,10-ГЕКСАГИДРО-4-ГИДРОКСИ-2-ОКСО-2H-ЦИКЛООКТА/В /- ПИРАН-3-ИЛ)МЕТИЛ/ФЕНИЛ/БЕНЗОЛСУЛЬФОНА | 1994 |
|
RU2125999C1 |
Авторы
Даты
2019-11-22—Публикация
2019-06-15—Подача