1. Область техники, к которой относится изобретение
Изобретение относится к медицине и биологии, предназначено для профилактики или лечения респираторных вирусных инфекций, включая коронавирусные инфекции, в частности, Сovid-19, путем применения препарата «ТРИАВИР ОВИД®».
2. Уровень техники
В конце 2019 года в Китайской Народной Республике (КНР) произошла вспышка новой коронавирусной инфекции с эпицентром в городе Ухань (провинция Хубэй). Всемирная организация здравоохранения (ВОЗ) 11 февраля 2020 г. присвоила официальное название инфекции, вызванной новым коронавирусом, – COVID 19 («Coronavirus disease 2019»). Международный комитет по таксономии вирусов 11 февраля 2020 г. присвоил официальное название возбудителю инфекции – SARS CoV 2.
Появление COVID 19 поставило перед специалистами здравоохранения задачи, связанные с быстрой диагностикой и оказанием медицинской помощи больным. В настоящее время сведения об эпидемиологии, клинических особенностях, профилактике и лечении этого заболевания ограничены.
Коронавирусы (Coronaviridae) – это большое семейство РНК содержащих вирусов, способных инфицировать как животных (их естественных хозяев), так и человека.
В настоящее время известно о циркуляции среди населения четырех коронавирусов (HCoV 229E, OC43, NL63 и HKU1), которые круглогодично присутствуют в структуре ОРВИ, и, как правило, вызывают поражение верхних дыхательных путей легкой и средней степени тяжести.
До 2002 г. коронавирусы рассматривались в качестве агентов, вызывающих нетяжелые заболевания верхних дыхательных путей (с крайне редкими летальными исходами). В период с 2002 по 2004 гг. коронавирус SARS-CoV из рода Betacoronavirus (резервуар – летучие мыши, промежуточные хозяева – верблюды) впервые стал причиной развития эпидемии так называемой атипичной пневмонии – тяжелого острого респираторного синдрома (SARS) и подтвержденной причиной смерти 774 человек в 37 странах мира. Очередная эпидемия, вызванная коронавирусом MERS-CoV (резервуар – одногорбые верблюды), также из рода Betacoronavirus ближневосточный коронавирусный синдром, началась в 2012 г. на Аравийским полуострове (82% случаев в Саудовской Аравии). До 2020 г. зарегистрировано 866 летальных исходов от MERS. В настоящий момент MERS-CoV продолжает циркулировать и вызывать новые случаи заболевания.
SARS-CoV-2 представляет собой одноцепочечный РНК содержащий вирус, относящийся к семейству Coronaviridae, роду Betacoronavirus. Учитывая высокую патогенность вирусов SARS-CoV, SARS-CoV-2 и MERS-CoV отнесены ко II группе патогенности. Генетическая последовательность SARS-CoV 2 сходна с последовательностью SARS-CoV по меньшей мере на 79%.
Основными входными воротами вируса SARS-CoV-2 является эпителий различных отделов верхних дыхательных путей. При этом основной и быстро достижимой мишенью SARS-CoV-2 являются альвеолярные клетки II типа (AT2) легких, что определяет развитие диффузного альвеолярного повреждения.
Установлено, что при манифестации заболевания отмечается значительная и быстро нарастающая виремия с диссеминацией SARS-CoV-2.
Исходя из анализа клинической симптоматики, можно предполагать тропность вируса к эпителию гортани, мерцательному эпителию дыхательных путей на всем протяжении, альвеолоцитам I и II типов. Судя по всему, вирусные поражения у таких пациентов не приводят к развитию выраженного экссудативного воспаления и соответственно катаральных явлений.
Вирус SARS-CoV-2 выявляется при иммуногистохимическом, ПЦР, ультраструктурном исследованиях в реснитчатых клетках бронхов, эпителии бронхиол, в альвеолоцитах и макрофагах, а также в эндотелии сосудов. В части наблюдений выявлены изменения и в других органах, которые можно предположительно связать с генерализацией коронавирусной инфекции: в лимфатических узлах, кишечнике, мягкой мозговой оболочке, сердце, поджелудочной железе, почках, селезенке. Отмечены тяжелые поражения микроциркуляторного русла с развитием синдрома диссеминированного внутрисосудистого свертывания (ДВС), которые оказались наиболее выраженными в легких и почках. Описаны типичные для COVID-19 кожные проявления – от геморрагического синдрома до высыпаний различного вида, патогенез которых неясен.
Таким образом, как и при других коронавирусных инфекциях, а также гриппе А/H1N1, основным морфологическим субстратом COVID-19 является диффузное альвеолярное повреждение. Термин вирусной интерстициальной пневмонии, широко используемый в клинике, по сути своей отражает именно его развитие.
С начала 2020 года отмечалось волнообразное течение, которая протекала на фоне массовой вакцинации населения и появлением новых мутаций вируса SARS-CоV2, а именно: «штамма Дельта» (B.1.617), «Дельта Плюс» (B.1.617.2.1), «Омикрон» (B.1.1.529) и его новой разновидности Омикрон Стелс (BA.2), обладающей еще большей скоростью распространения.
Появление этих штаммов привело к значительному изменению эпидемиологических свойств и клинического течения COVID-19, а именно:
Существенному уменьшению эффективности вакцинации;
Значительному в 5-10 раз повышению заразности вируса.
Более короткому инкубационному периоду заболевания и более длительному периоду развития вирусной пневмонии.
Кроме того, новый штамм коронавируса, недавно обнаруженный в ЮАР (NEOCoV), очевидно будет обладать существенно более высокой летальностью, характерной для вируса MERS (возбудителя ближневосточного респираторного синдрома, характеризующегося, стремительным течением заболевания и очень высокой летальностью – более 30%), с еще более высокой скоростью распространения при еще большей устойчивости к профилактическому действию векторных вакцин.
В связи со всеми этими факторами объективно возникла необходимость поиска иных дополнительных способов профилактики или лечению коронавирусной инфекции.
Кроме того, существует острая неудовлетворенная потребность в оптимальном лечении как коронавирусной инфекции, так и универсальных противовирусных средств, включая специфическую противовирусную терапию. На данный момент зарегистрировано более 160 рандомизированных и неслучайных исследований. Для лечения COVID-19 используют различные средства, включая кортикостероиды, различные комбинации рибавирина, лопинавира/ритонавира, хлорохина, гидроксихлорохина, интерферонов и других агентов. Проводится РКИ с использованием ремдесивира при тяжелом течении COVID-19 (NCT04257656). [15].
В уровне техники описаны следующие подходы к лечению коронавирусной инфекции.
Остановка копирования вирусного генома.
Если ферменту, синтезирующему РНК, к обычным рибонуклеотидам добавить какую-нибудь молекулу-аналог, похожую на рибонуклеотид, то синтез РНК испортится: фермент остановится, не закончит начатую нить РНК или же продолжит её синтезировать, но теперь в РНК будут часто попадаться неправильные буквы, которые будут вступать в разные химические реакции и тем самым провоцировать многочисленные мутации.
Коронавирусы и другие РНК-вирусы используют для синтеза особый фермент — РНК-зависимую РНК-полимеразу. В самой клетке такого фермента нет, клетка не занимается синтезом молекул РНК на шаблоне РНК, поэтому можно попробовать подействовать на вирусную полимеразу, не мешая клетке. Молекулы-аналоги рибонуклеотидов синтезируют давно, и некоторые из них создавали как раз для борьбы с вирусами. Например, лекарство ремдесивир разрабатывали против вирусов Эбола, но впоследствии оказалось, что ремдесивир подавляет размножение MERS-CoV и SARS-CoV. Известно, что ремдесивир блокирует инфекцию SARS-CoV-2 в культуре клеток человека и обезьяны. Клинические испытания с больными людьми проходят в Китае и США, и как минимум один пациент, принимавший ремдесивир, уже выздоровел — правда, пока непонятно, насколько он своим выздоровлением обязан именно этому препарату.
Другой аналог рибонуклеотидов под названием EIDD-2801 разрабатывали против вируса гриппа, — и он, как говорится в недавней статье в «Science Translational Medicine», также подавляет инфекцию SARS-CoV и MERS-CoV у мышей и размножение нового SARS-CoV-2 в клетках лёгких человека. EIDD-2801 провоцирует много мутаций в вирусной РНК, при этом клеточная РНК не повреждается. Осталось дождаться результатов клинических исследований.
Можно попробовать выключить саму вирусную РНК-полимеразу. Хлорохин используют против малярийного паразита, иногда — против патогенных амёб. Как оказалось, он ещё и подавляет активность вирусной полимеразы: хлорохин сильно повышает в клетке уровень ионов цинка, которые как раз мешают работать ферменту. Кроме того, хлорохин не даёт вторгающемуся в клетку вирусу высвободить свой геном в клеточную цитоплазму. Однако у хлорохина есть серьёзный минус — из-за него возникают аномалии в сердечном ритме, и, чем выше доза лекарства, тем выше риск сердечных аномалий. А пока нельзя сказать, могут ли небольшие дозы хлорохина остановить инфекцию SARS-CoV-2.
Другой путь – это помешать проникнуть вирусу в клетку. Вне клетки вирус не может размножаться, а те вирусные частицы, что остались в межклеточном пространстве и в крови будут уничтожены клетками иммунной системы. S-белок играет роль отмычки, взламывающей клетку: чтобы вирус вошёл в клетку, его S-белок взаимодействует с белком ACE2, который сидит на поверхности клеточной мембраны.
Вирусному S-белку можно предоставить обманку, похожую на ACE2, чтобы он отвлёкся от клеток. Например, сам ACE2, только свободно плавающий вокруг вируса, а не сидящий на клетке. Так, в апрельской статье в журнале «Cell» говорится про человеческий модифицированный ACE2, выращенный в бактериальных клетках. Его действие проверяли на органоидах — крохотных моделях почки и кровеносных сосудов, выращенных из стволовых клеток человека, и такой белок действительно не позволял вирусу проникать в человеческие клетки [19].
Амантадин был синтезирован в 1967 г. в качестве противовирусного средства. Амантадин представляет собой трициклический амин, относящийся к классу аминоадамантанов. Амантадин имеет уникальный двойной фармакологический профиль (дофаминергический и недофаминергический). На сегодняшний день можно говорить о следующих доказанных механизмах действия амантадинов:
— стимуляция выброса дофамина из пресинаптических окончаний;
— увеличение синтеза дофамина;
— уменьшение обратного захвата дофамина; — повышение чувствительности к нему дофаминовых рецепторов;
— блокада глутаматных NMDA-рецепторов;
— мягкое антихолинергическое действие (за счет блокады высвобождения ацетилхолина, опосредованного NMDA-рецепторами;
— противовирусное действие, связанное со способностью блокировать проникновение вируса гриппа типа А в клетки).
Амантадин используется в качестве антивирусного препарата при лечении гриппа типа А, так как он, предположительно, блокирует репликацию вируса на ранних стадиях. В 1976 г. FDA одобрило применение амантадина для симптоматического и/или профилактического лечения гриппа типа А у взрослых.
На сегодняшний день опубликовано несколько наблюдений, свидетельствующих о возможном защитном эффекте амантадина в отношении COVID-19.
Подобные наблюдения позволили ряду авторов рекомендовать амантадин для профилактики COVID-19 в дозе 100 мг 2 раза в сутки на протяжении 14 дней после контакта с заболевшим или получении положительного анализа на COVID-19. Безусловно, для подтверждения защитного эффекта амантадинов требуются клинические исследования. Будет полезно и ретроспективное обобщение результатов на большей когорте больных БП [2].
Ремдесивир (в клинических исследованиях ещё известен как GS-5734) относится к классу противовирусных препаратов, которые ингибируют РНК-зависимую РНК-полимеразу, фермент, необходимый для репликации ряда РНК-вирусов.
Поскольку ингибирование фермента препятствует репликации вируса в инфицированных клетках, он проявляет антивирусную активность против ряда одноцепочечных РНК-содержащих вирусов, таких как вирус Эбола, вирус Марбург, респираторно-синцитиальный вирус человека, вирус лихорадки Ласса, и коронавирусы (включая вирусы MERS и SARS). Обосновано его применение для лечения людей, заболевших COVID-19, и, исходя из ранее принятой схемы лечения болезни, вызванной вирусом Эбола, предложен 10-дневный режим лечения ремдесивиром: в 1-й день 200 мг, а затем поддерживающие дозы 100 мг 1 р/д на протяжении 9 дней.
1 мая 2020 г. Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) выдало «разрешение для экстренного использования» ремдесивира для лечения COVID-19 в США. Предварительные результаты исследования NCT04280705 показали, что пациенты, получавшие ремдесивир, выздоравливали на 31 % быстрее, чем пациенты, получавшие плацебо. В частности, среднее время выздоровления составляло 11 дней у пациентов, получавших ремдесивир (95 % доверительный интервал [ДИ] от 9 до 12), по сравнению с 15 днями (95 % ДИ от 13 до 19) у пациентов, получавших плацебо (р<0,001). Оценки шкал Каплана—Мейера для смертности через 14 дней значимо не различались для ремдесивира по сравнению с плацебо (7,1 против 11,9 %; отношение рисков: 0,70; 95 % ДИ от 0,47 до 1,04). Показатели смертности на 28-й день не представлены, поскольку значительная часть пациентов ещё не завершила исследование. Показатели вирусной нагрузки не измерялись. Серьёзные побочные эффекты были зарегистрированы у 21,1 % в группе ремдесивира и у 27,0 % в группе плацебо. Однако некоторые исследователи критикуют предварительные выводы данного КИ, в частности, отсутствие в качестве первичной конечной точки объективных показателей (смертность, выживаемость) пациентов. В рандомизированном открытом исследовании (NCT04292899) III фазы сравнивалось 14-дневное клиническое улучшение у 397 пациентов с тяжёлой формой COVID-19. Первая группа пациентов получала лечение ремдесивиром в течение 5 дней, вторая — 10 дней. Исследование было открытым, рандомизированным, но без контрольной группы, получающей плацебо. Пациенты в группе 10-дневного лечения имели исходно более тяжёлое клиническое состояние, чем пациенты в группе 5-дневного лечения. Через 14 дней в группе, получавшей ремдесивир в течение 10 дней, показано улучшение клинического состояния в 64 % случаев по сравнению с 54 % в группе, получавшей ремдесивир 5 дней. Результаты после корректировки по исходному клиническому статусу не позволяют сделать вывод о наличии различий между двумя группами. Кроме того, в отсутствие группы, получающей плацебо, не ясно, изменил ли ремдесивир естественное развитие болезни и исходы. В РФ в реестре разрешений на проведение клинических исследований на 09.07.2020 года, зарегистрировано 2 исследования ремдесивира. Первое (WA42511) — по оценке эффективности и безопасности комбинированной терапии «ремдесивир плюс тоцилизумаб» в сравнении с комбинацией «ремдесивир плюс плацебо» у госпитализированных пациентов с тяжёлой пневмонией, вызванной коронавирусной инфекцией СOVID-19. Второе (№ REMVR-2020/I) — изучение безопасности и эффективности применения препарата Ремдеформ (МНН — ремдесивир), лиофилизат для приготовления раствора для внутривенного введения 100 мг.
In vitro ремдесивир является субстратом изоферментов CYP3A4, CYP2C8, что говорит о возможном взаимодействии с ингибиторами и индукторами этих изоферментов. В ряде протоколов препарат не рекомендован при СКФ 5 верхних норм. В исследовании Wang M с соавт. доля пациентов, у которых развилось какое-либо неблагоприятное событие, была одинаковой в группах ремдесивира и плацебо, но доля пациентов с серьёзными неблагоприятными событиями была выше в группе плацебо, чем в группе ремдесивира (26 против 18 %, соответственно). Доля пациентов, у которых наблюдались нежелательные явления, приводящие к прекращению лечения, была выше при применении ремдесивира, чем при применении плацебо (12 против 5 %, соответственно). Наиболее частыми нежелательными явлениями при применении ремдесивира были: запор (14 %), гипоальбуминемия (13 %), анемия (13 %), гипокалиемия (12 %), анемия (12 %), тромбоцитопения (10 %) и гипербилирубинемия (10 %). Наиболее частыми серьёзными побочными явлениями оказались дыхательная недостаточность или острый респираторный дистресс-синдром (10 % — на ремдесивире и 8 % — на плацебо) и сердечно-лёгочная недостаточность (5 % — на ремдесивире и 9 % — на плацебо). Описан как минимум один случай развития печёночной недостаточности у пациента 64 лет через пять дней после начала приёма ремдесивира. После отмены препарата показатели функции печени нормализовались.
ВОЗ не рекомендует применение ремдесивира для лечения или профилактики COVID-19 вне клинических испытаний. Необходимо принимать во внимание ограничения применения ремдесивира, указанные в разъяснении, выпущенном FDA, а именно, ремдесивир: не следует использовать профилактически; не следует использовать на амбулаторном этапе; показан только пациентам с сатурацией менее 94 % или имеющим потребность в какой-либо форме респираторной поддержки.
Предварительные результаты нескольких рандомизированных клинических исследований эффективности ремдесивира — противоречивы [3].
Лопинавир представляет собой комбинированный антиретровирусный препарат с фиксированной дозой для лечения и профилактики СПИДа. Действующие вещества — ингибиторы протеазы лопинавир и (в низкой дозе) ритонавир. Его можно использовать для профилактики после укола иглой или воздействия другого потенциального источника заражения ВИЧ. Его принимают внутрь в виде таблеток, капсул или раствора. Общие побочные эффекты включают диарею, рвоту, чувство усталости, головные боли и боли в мышцах. Серьёзные побочные эффекты могут включать панкреатит, проблемы с печенью и высокий уровень сахара в крови. Может применяться во время беременности. Обе компоненты препарата являются ингибиторами протеазы ВИЧ. Ритонавир замедляет распад лопинавира. В 2020 году неслепое рандомизированное исследование показало, что лопинавир/ритонавир не эффективен для лечения тяжёлой формы COVID-19 [4].
В методических рекомендациях лечения коронавируса говорится: "Лопинавир/ритонавир. Применялся у взрослых пациентов с COVID-19 в КНР, Иране, США. Доказательная база эффективности и безопасности у детей отсутствует. В настоящее время препарат не рекомендован ни детям, ни взрослым".
Однако также имеются исследования указывающие на безопасность ремдесивира, лопинавира/ритонавира, при отсутствии снижения госпитальной летальности у пациентов с COVID-19 [5].
Таким образом, в уровне техники отсутствуют данные указывающие на то, что любой из препаратов: амантадин, ремдесивир и лопинавир, действительно являются эффективными и безопасными в лечении коронавирусной инфекции. разные исследования показывают противоречащие друг другу результаты по эффективности использования указанных препаратов [6].
Рекомбинантный интерферон альфа-2b — водорастворимый белок, содержащий 165 аминокислот, с молекулярной массой примерно 19300 Да, полученный с использованием штамма Escherichia coli SG-20050/pIF 16, содержащего генно-инженерный плазмидный гибрид, кодирующий ген интерферона альфа-2b лейкоцитов человека. Идентичен по характеристикам и свойствам человеческому лейкоцитарному интерферону альфа-2b.
В 2020 году было проведено исследование, целью которого было оценить профилактическую эффективность рекомбинантного интерферона α-2b (Виферон) в условиях пандемии COVID-19 у медицинских работников.
Была выявлена выраженная профилактическая эффективность применения интереферона α-2b в различных схемах как для местного применения в виде геля (заболели 3 из 15), так и в комбинации ректальной и топической форм интерферона α-2b (1 из 60) по сравнению с группой медицинских работников без профилактической терапии (11 из 34). Такие результаты ожидаемы, совпадают с полученными ранее данными по эффективности интерферона α-2b при ОРВИ. Предполагается, что профилактическое интраназальное введение или ингаляция рекомбинантных интерферонов позволяют ограничивать репликацию вируса в верхних дыхательных путях. Таким образом в статье [7] делается вывод, что применение рекомбинантного интерферона для профилактики COVID-19 в условиях пандемии является перспективным направлением дальнейших исследований.
Поскольку теоретические данные говорят о возможном положительном эффекте применения указанных выше средств для лечения коронавирусной инфекции, то исследователи предприняли попытки использования данных препаратов в комбинированной терапии.
Так в [8] раскрыт способ лечения, профилактики, улучшения состояния, замедления течения, уменьшения тяжести или профилактики коронавирусной инфекции, или инфекции COVID-19, или инфекции, вызванной вирусом подсемейства Orthocoronavirinae или вирусом семейства Coronaviridae или вируса порядка Nidovirales, включающий введение нуждающемуся в этом лицу терапевтической комбинации лекарственных средств или лекарственного средства, фармацевтической лекарственной формы, устройством для доставки лекарственного средства или продукта производства, содержащего: (а) хлорохин, хлорохина фосфат, хлорохина дифосфат или гидроксихлорохин; (b) макролидный антибиотик или макролидный препарат; (c) лекарственное средство, выбранное из группы, состоящей из ремдесивира, осельтамивира, занамивира и их комбинации; а также г) цинк, а также комбинацию лопинавира и ритонавира и интерферона-бета-1b или интерферона альфа -2b; или амантадин, интерферон типа II и/или интерферон типа III), ремдесивир, лопинавир.
В [9] раскрыт способ профилактики или лечения индуцированного вирусом повреждения или недостаточности органов у индивидуума, включающий введение индивидууму эффективного количества димера IL-22 и дополнительно комбинацию ремдесивира, лопинавира, IFN-α, амантадина. При этом вызванное вирусом повреждение или недостаточность органов индуцируется SARS-CoV-2.
В уровне техники широко представлено использование комбинации лопинавир, ремдесивир и амантадин в качестве дополнительного компонента композиции для лечения коронавирусной инфекции [10-15] в том, числе в виде ингаляции.
Недостатками приведенных выше способов является то, что интерферон, лопинавир, ремдесивир и/или амантадин, используются в составе комбинированной терапии, а не в составе единого средства в виде монотерапии.
Как известно, недостатком комбинированной терапии служит то, что иногда больным приходится принимать лекарство, в котором нет необходимости. Кроме того, подобная терапия приводит к заметному удорожанию стоимости лечения. Именно экономический аспект, который сегодня приобретает существенное, а иногда и решающее значение, во многих случаях являлся поводом для отказа от комбинированной терапии. При этом схемы приёма за частую являются сложными, а необходимость контроля за выполнением таких схем приводит к дополнительной нагрузке на персонал лечебных учреждений или ложится дополнительной ношей на больного. В таком случае не исключены ошибки и нарушения оптимальной схемы приёма.
Таким образом, использование единого комбинированного препарата, является предпочтительным в сравнении с комбинированной терапий несколькими отдельными препаратами.
Интерес к созданию комбинированных лекарственных препаратов (фиксированных комбинаций), содержащих два или более действующих веществ в одной лекарственной форме, в последние годы растет. Однако разработка таких препаратов является сложной, в том числе и с методологической точки зрения, так как отсутствует единая программа предрегистрационных клинических исследований комбинированных лекарственных препаратов. С другой стороны для каждого комбинированного лекарственного препарата программа предрегистрационного клинического изучения должна разрабатываться индивидуально. Выбор оптимальной стратегии клинических исследований позволяет получить достаточную информацию об эффективности и безопасности комбинированного лекарственного препарата для его последующей регистрации. Только определение оптимальной стратегии клинических исследований каждый раз является сложной задачей для разработчиков комбинированного лекарственного средства.
Комбинированные лекарственные препараты (фиксированные комбинации) — лекарственных средств содержат два или более действующих веществ в одной лекарственной форме. Ожидаемыми преимуществами комбинированных препаратов по сравнению с монокомпонентными является большая эффективность, ускоренное наступление эффекта, большая безопасность и лучшая переносимость при сопоставимой эффективности, что возможно за счет применения более низких доз одного или нескольких компонентов комбинации, а также удобством применения: уменьшением количества одновременно принимаемых таблеток, упрощением схемы приема. Кроме того, применение комбинированного препарата в ряде случаев позволяет уменьшить частоту возникновения нежелательных реакций на один из компонентов комбинации или же осуществлять терапию одновременно существующих (сопутствующих) заболеваний с различным патогенезом [17].
За ближайший аналог может быть принята следующая публикация. Из [18] известна терапевтическая комбинация лекарственных средств или лекарственное средство, фармацевтическая лекарственная форма, устройство для доставки лекарственного средства или продукт производства, включающие: комбинацию интерферон типа II, лопинавир, амантадин и ремдесивир. При этом указанное средство используется для лечения Covid-19. Средство для доставки может являться ингалятором.
В ближайшем аналоге указанные лекарственные средства используются в составе комбинированной терапии, в не как единый препарат для монотерапии, что делает актуальным все недостатки, присущие такому типу лечения. В данном источнике не была поставлена задача получения одного лекарственного средства на основе интерферона, лопинавира, ремдесивира и амантадина. Таким образом, остается открытым вопрос доз и схем введения. Кроме того, в ближайшем аналоге был использован интерфером типа II, а не типа I, как предлагается в настоящем решении. Использование ИНФ 2-го типа для лечения или профилактики вирусный заболеваний, а в частности коронавирусных инфекций, уступает использованию ИНФ 1-го типа, что будет продемонстрировано в дальнейшем.
Техническим результатом заявляемого технического решения является упрощение схемы лечения или профилактики вирусных инфекций, снижение лекарственной нагрузки на организм пациента, с одновременным получением эффективного результата профилактики или лечения. Кроме того, еще одним эффектом является простота использования препарата при его применении. Эффективность выражается в ингибировании репликации вируса, со снижением инфекционного титра вируса на 5,25 lgТЦИД50. Техническим результатом, достигаемым при реализации заявляемого решения, также является эффективная профилактика или лечение пациентов с вирусной инфекцией, в том числе с коронавирусной инфекцией.
Инновационными решениями при разработке препарата явилось использование ингаляционного пути введения комбинации противовирусных препаратов с различными механизмами противовирусного действия, направленными на различные клеточные и молекулярные мишени.
При этом два компонента композиции- интерферон альфа и амантадин обладают выраженной противовирусной активностью против широкого спектра острых респираторных инфекций, включая грипп, что подтверждается данными литературы [1,16,20].
3. Сущность изобретения
Препарат «ТРИАВИР ОВИД®» является комбинированным ингаляционным лекарственным средством, для профилактики или лечения в составе комплексной терапии «Коронавирусной инфекции CОVID-19» а также других острых респираторных инфекций, включая грипп.
Рецептура препарата «ТРИАВИР ОВИД®».
Дозы, используемые в рецептуре могут быть выбраны из следующего диапазона: интерферон альфа 50000 - 1000000 МЕ /100 мл, лопинавир 0,1-100 мг/100 мл, ремдесивир - 0,1- 200 мг/100 мл, амантадин 0,1-200 мг/100 мл.
Целесообразность объединения четырех компонентов в одном препарате, подтверждающее специфическую активность композиции основывается на следующих соображениях.
Соединение четырех разных фармакологических агентов, возможно эффективных против вируса SARS-CoV-2, с разными молекулярными мишенями в одной лекарственной форме должно обеспечить суммационный эффект воздействия композиции на репликацию вируса и его проникновение в эпителиальные клетки дыхательного эпителия.
Применение с использованием ингаляционного метода введения, должно обеспечить быстрый доступ препаратов к патологическому очагу и блокаду репликации вируса во всех отделах верхних дыхательных путей при высокой безопасности воздействия. Это является важным, особенно при COVID-19, где поражаются преимущественно нижние отделы дыхательной системы.
Как показали наши исследования, ингаляционное воздействие in situ приводит к существенному потенцированию противовирусного эффекта, предположительно в связи со значительным повышением активной концентрации вещества при его непосредственном воздействии на вирус. Очень важным доводом в пользу этого является существенно более высокая безопасность такого способа введения по сравнению с пероральным. Это связано с тем, что максимальная дозировка, которая применяется при пероральном введении лопинавира оставляет 100 мг два раза в день, при этом средняя максимальная концентрация в плазме (Cmax) составляет 9,8±3,7 мкг/мл и достигается примерно через 4 ч после приема. Очевидно, что ингаляционное введение препарата в дозе 100 мкг/5мл, т.е., в 2000- 4000 раз меньшей, практически безопасно (в отношении системного и местно-раздражающего действия) и при этом воздействует на SARS 3C-подобную протеазу вируса в среднем в 10-20 раз более эффективной дозой в плане её блокирующего воздействия на инфицирование вирусом.
В уровне техники уже изучалось воздействие лопинавира/ритонавира на новую короновирусную инфекцию, но результаты применения лопинавира/ритонавира были неудовлетворительными. Обычно специалист ожидает повысить эффект препарата изменив путь введения на внутривенный или по меньшей мере внутримышечный. Следовательно, специалист не мог бы предполагать, что при изменении пути введения будет достигнут необходимый уровень лечебного эффекта. Следовательно, средний специалист не мог бы предположить, что ингаляционное введение будет эффективным в сравнении с пероральным.
Эффективные терапевтические дозировки ИФН при ингаляционном пути введения в тысячи раз ниже возможных токсических, и составляют для взрослого человека при дозированном ингаляционном введении 125-500 пг/мл (31250-125000МЕ/мл). При этом терапевтические дозы интерферонов, из-за их низкой концентрации практически не обладают каким-либо местно-раздражающим действием и могут применяться по нескольку раз в день в течение длительного времени (до нескольких месяцев).
Показаниями к применению являются: контакт с вирусной инфекции, особенно инфекцией, вызываемой РНК-вирусами, в частности, коронавирусной инфекций, включая CОVID-19, для профилактики инфицирования, в инкубационном периоде заболевания, а также как терапия на всех этапах течения заболевания.
Способ применения и дозы. Из флакона 100 мл отбирается 5,0 мл раствора для ингаляций, которые помещаются в кювету ингалятора. После этого в течение 10 минут или до использования всего раствора проводится непрерывная ингаляция с использованием маски, прилагаемой в комплекте прибора. Раствор для ингаляций, можно применять, используя любое современное оборудование для ингаляций, например, небулайзер или любой другой холодный, компрессионный ингалятор. Использование ультразвуковых и горячих паровых ингаляторов запрещено, поскольку это приводит к разрушению интерферонов во время ингаляций.
Препарат возможно применять для профилактики инфицирования РНК-вирусом в течение всего периода эпидемии. Длительность применения препарата не ограничена.
Для профилактики после посещения людных мест достаточно делать 2 ингаляции в день. При этом отсутствует необходимость строго соблюдения интервалов между ингаляциями. Желательно проводить ингаляцию перед посещением возможного очага инфекции и после.
В случае установленного контакта с лицами, возможно инфицированными РНК-вирусами, или при установлении диагноза необходимо принимать препарат по 4-6 ингаляций в сутки с равномерными промежутками. Такой курс следует проводить в течение от 1 до 14 суток. При появлении симптомов также следует использовать данную схему до полного исчезновения симптомов.
Действие одной ингаляции продолжается 3-4 часа, после этого риск заражения возобновляется.
Не смотря на то, что далее будет приведен конкретный пример использования препарата «ТРИАВИР ОВИД®» на вирусе SARS-CoV-2, специалисту понятно, что действие препарата будет столь же эффективно в отношении любого представителя семейства coronaviridae, так как все они являются РНК-вирусами, а кроме того, препарат является эффективным для профилактики и раннего лечения любой инфекции дыхательных путей, вызванной РНК-вирусом. Это понятно специалисту, так как с одной стороны препарат содержит интерферон, который является фактором неспецифической защиты от любых вирусных инфекций. При этом в препарате использован интерферон первого типа (ИФН-α), которому присущи антивирусный и антипролиферативный эффекты, в меньшей степени - иммуномодулирующий. Он вырабатывается непосредственно после встречи с патогеном, его действие направлено на локализацию возбудителя и предотвращение его распространения в организме. Этот интерферон осуществляет раннюю и неспецифическую защиту организма от инфекционного агента. С другой стороны препарат содержит лопинавир, который является ингибитором SARS 3C-подобной протеазы, и активно изучался на возбудителях SARS и MERS in vitro, продемонстрировав определенные результаты в плане ингибирования репликации этих вирусов. При этом сравнительный генетический анализ показал практически полную идентичность структуры SARS 3C-подобной протеазы у вируса SARS-CoV-2, по сравнению с таковыми у SARS и MERS. Таким образом, если лопинавир оказывает действие на SARS и MERS, то нет оснований полагать, что он не будет работать на других видах коронавирусов. Следующим компонентом препарата является ремдесивир, который представляет собой аденозиновое нуклеотидное пролекарство, которое метаболизируется в клетках организма с образованием фармакологически активного метаболита нуклеозидтрифосфата. Ремдесивира трифосфат выступает в качестве аналога аденозинтрифосфата (АТФ) и конкурирует с природным АТФ-субстратом за включение в формирующиеся РНК-цепи с помощью РНК-зависимой РНК-полимиразы вируса, что приводит к задержанному обрыву цепи во время репликации вирусной РНК. Точно также как ремдесивир проявлял противовирусную активность in vitro в отношении клинического изолята вируса SARS-CoV-2 в первичных эпителиальных клетках дыхательных путей человека с полумаксимальной эффективной концентрацией вещества (ЕС50) 9,9 нМ через 48 часов с момента начала лечения, так он проявляет противовирусную активность в отношении любого РНК-вируса, так как строение молекулы РНК у всех организмов одинаково. Значения ЕС50 ремдесивира в отношении SARS-CoV-2 в клетках Vero составляли 137 нМ через 24 часа и 750 нМ через 48 часов с момента начала лечения.
Еще одним компонентом препарата является амантадин, который также действует непосредственно на вирус в низких концентрациях, что определяет целесообразность его ингаляционного применения. Основной механизм его действие, ингибирование репликации респираторных вирусов, в первую очередь, Гриппа А путем взаимодействовия с белком М2, который ответственен за образование в липидной оболочке ионных каналов, предположительно обеспечивающих транспорт протонов внутрь вириона и его раздевание. Кроме того, препарат может действовать и на этапе сборки вируса.
Примеры
Способ применения и дозы
Из флакона 100 мл отбирается 4,0 мл исследуемого раствора для ингаляций, препарата «Триавир Овид®», которые помещаются в кювету ингалятора. После этого в течение 10 минут (до использования всего раствора) проводится непрерывная ингаляция с использованием маски, прилагаемой в комплекте прибора. После этого съёмные части тщательно промываются горячей водой с добавлением безопасных антисептических растворов.
Раствор для ингаляций, можно применять, используя любое современное оборудование для ингаляций, например, небулайзер или любой другой холодный, компрессионный ингалятор. Использование ультразвуковых и горячих паровых ингаляторов запрещено, поскольку это приводит к разрушению интерферонов во время ингаляций.
Ингаляции проводятся 3-6 раз в день через равные промежутки времени.
Пример 1
Получение препарата «ТРИАВИР ОВИД®».
Для приготовления раствора для ингаляций растворяют Твин 80 и хлорид натрия в этиловом спирте, из расчета 2,0 мл спирта этилового, 900 мг хлорида натрия и 200 мг Твин 80.
Далее в полученную смесь добавляют интерферон α2b рекомбинантный, лопинавир, ремдесивир и амантадин, из расчета интерферон 50000 - 1000000 МЕ /100 мл, лопинавир 0,1-100 мг/100 мл, ремдесивир - 0,1- 200 мг/100 мл, амантадин 0,1-200 мг/100 мл.
Смешивание проводят стандартными методами, используемыми в фармацевтической промышленности на стандартном оборудовании, соблюдая стандартные технические условия, предъявляемые к приготовлению лекарственных средств.
Пример 2
Анализ жизнеспособности клеток с препаратом без вируса проводили по ряду «G», в который были внесены разведения препараты, но не были внесены разведения вирусной суспензии. Жизнеспособность клеток была оценена визуально по целостности клеточного монослоя, а также по морфологической структуре клеток.
Определение противовирусной эффективности тестируемого препарата «ТРИАВИР ОВИД®» по лечебно-профилактической схеме (введение ЛС за 1 час до инфицирования).
Оценку противовирусной активности препарата учитывали по снижению инфекционного титра вируса в культуре клеток Vero E6 по цитопатическому действию. Полученные результаты представлены в Таблице 1.
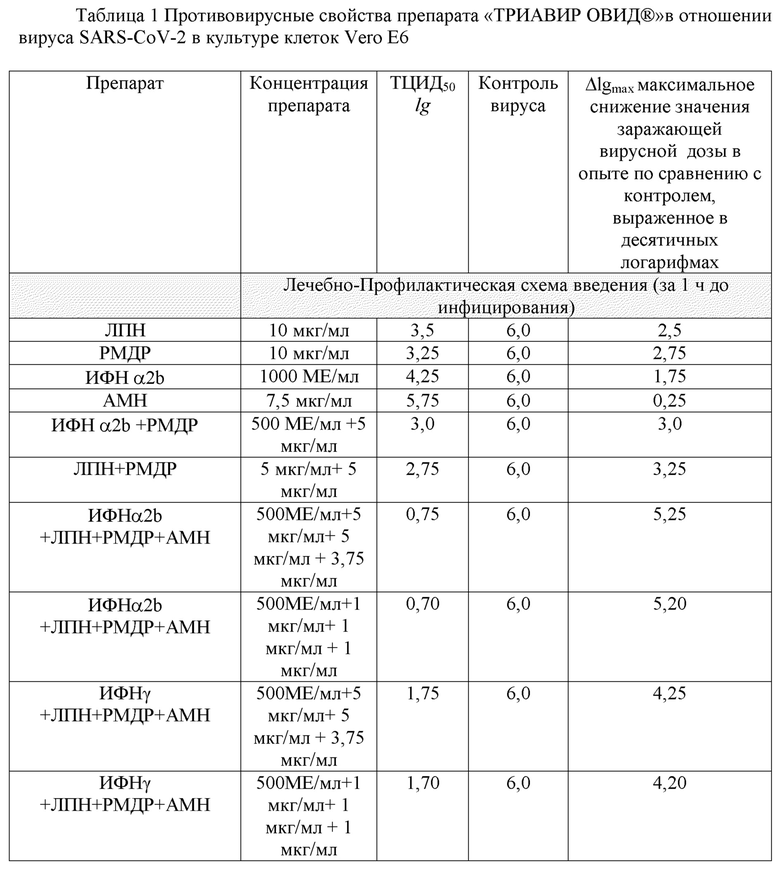
Как видно, амантодин практически не оказал противовирусного действия и снижения lgТЦИД50 практически не отмечалось.
В результате исследования противовирусной активности указанных выше субстанций в опытах in vitro в отношении штамма коронавируса SARS-CoV-2 по лечебно-профилактической схеме добавления препарата к культуре клеток Vero E6 установлено, что исследуемый препарат «ТРИАВИР ОВИД®» ингибировал репликацию вируса SARS-CoV-2 в культуре клеток Vero E6 снижая инфекционный титр вируса на 5,25 lgТЦИД50. Что является самым высоким показателем для исследуемых субстанций. При этом данный показатель существенно выше, чем показатель для совместного использования ИНФ и ремдесивира, что является неожиданным, так как на основании уровня техники именно для каждого из данных препаратов выявлен наибольший лечебный эффект. Кроме того, неожиданно было выявлено, что использование ИНФ α2b в сравнении с ИНФ γ ощутимо повышает эффективность комбинации ИНФ+ЛПН+РМДР+АМН, что не мог ожидать специалист, в частности, до 5,25 lgТЦИД50 с 4.25.
Для оценки противовирусной эффективности комбинации по отношению к каждому из входящих компонентов была использована формула отношения ЭКАВ и ЭΣ (А + [В+С]), где:
Противовирусный эффект комбинации (ЭК):
A- Противовирусный эффект Интерферона α2b
[В+C] - противовирусный эффект лопинавира+ ремдесивира
А+[В+C] = 5,0 lgТЦИД50. ЭКАБ =5.25 lgТЦИД50
ЭКАВ> ЭΣ (А + В), то есть композиция обладает потенцирующим эффектом. [Потенцирующий эффект — ЭК больше суммарного эффекта комбинантов: ЭКАВ> ЭΣ (А + В)].
Таким образом, согласно критериям области применения данной композиции, в качестве лекарственного препарата для лечения COVID-19, она обладает потенцирующим противовирусным эффектом по отношению к составляющим комбинантам и может быть использована для профилактики и лечения данного заболевания.
Пример 3
В соответствии с Постановлением Правительства РФ от 3 апреля 2020 г. № 441 «Об особенностях обращения лекарственных препаратов для медицинского применения, которые предназначены для применения в условиях угрозы возникновения и ликвидации чрезвычайной ситуации», а также Приказа Министерства Здравоохранения и Социального Развития РФ от 9 августа 2005 г. N 494 «О порядке применения лекарственных средств у больных по жизненным показаниям» нами были проведены малоинтервенционные клинические исследования.
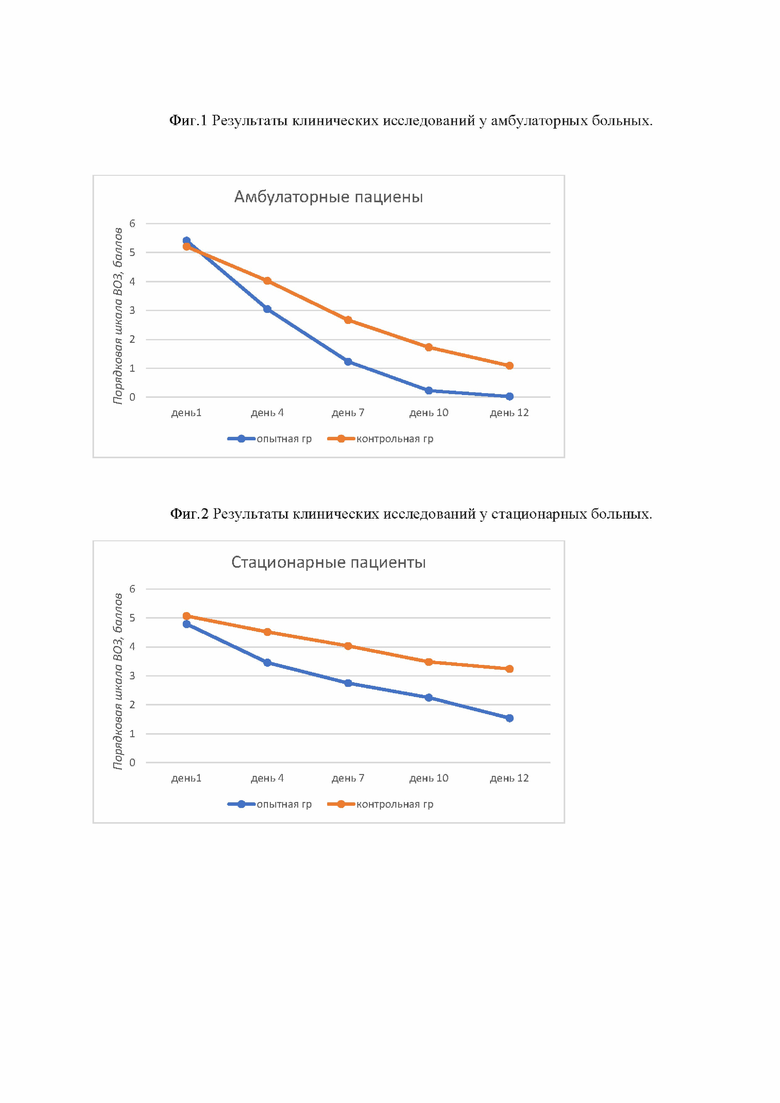
В ходе клинического исследования, проведенного с участием 286 (198 пациентов получали «Триавир Овид®», и 88 пациентов вошли в группу сравнения, которая получала лечение в соответствии с «Временными Методическими Рекомендациями Профилактика, Диагностика, и Лечение Новой Коронавирусной Инфекции (COVID-19)» Минздрава РФ, Версии 7- 9). Всем пациентам был подтвержден диагноз: «Новая коронавирусная инфекция с COVID-19 среднетяжёлого течения, которые наблюдались амбулаторно, было установлено, что «Триавир Овид®» позволяет сократить медиану времени до наступления клинического улучшения (по Порядковой шкале клинического улучшения Всемирной организации здравоохранения (ВОЗ). В группе «Триавир Овид®» клиническое улучшение наступало на 4 (±1,1) день, а в группе стандартной терапии на 7,4 (±5,0) день (р<0,05). Таким образом, применение «Триавира®» позволяет в среднем сократить период до наступления клинического улучшения на 3,4 дня. Важно отметить, что на 10-й день в группе «Триавир Овид®» у всех пациентов наступало практически полное выздоровление, тогда как в группе сравнения, в которой использовалась стандартная терапия, оно наступало лишь на 14 день (фиг.1).
Было также проведено малоинтервенционное исследование с участием 70 пациентов с COVID-19 среднетяжелого течения, находящихся на стационарном лечении. Исследование проводилось со следующим дизайном: «Пилотное рандомизированное контролируемое в параллельных группах, малоинтервенционное, одноцентровое терапевтическое исследование комбинированной ингаляционной смеси препарата «Триавир Овид®» для профилактики и лечения COVID-19: у пациентов 18-65 лет». В результате клинического исследования было установлено, что улучшение (по Порядковой шкале клинического улучшения Всемирной организации здравоохранения (ВОЗ), соответствующее положительной динамике или разрешению клинической симптоматики, в группе «Триавир Овид®» наступало на 6,2 (±1,4) день, а в группе стандартной терапии (согласно схеме лечения в амбулаторных условиях в соответствии с «Временными Методическими Рекомендациями Профилактика, Диагностика, и Лечение Новой Коронавирусной Инфекции (COVID-19)» Минздрава РФ, Версии 7- 9) на 12,4 (±5,0) день (р<0,005). Таким образом, применение «Триавира®» позволяет в среднем сократить период до наступления клинического улучшения на 6,2 дня (фиг.2).
Необходимо отметить, что на фоне приёма «Триавир Овид®» в ходе клинических исследований не было зарегистрировано ни одного случая, при котором бы был рекомендован перевод в ОРИТ, тогда как в группе сравнения, не получавшей соответствующую терапию препаратом, 3 пациента (8.6%) были переведены в ОРИТ в связи с нарастанием тяжести течения заболевания.
Не менее важным результатом стало подтверждение благоприятного профиля безопасности «Триавир Овид®». Так, общая частота нежелательных явлений в группе пациентов, получавшей проходившую испытания терапию, сопоставима с аналогичными показателями на фоне стандартной терапии. Никаких специфических побочных действий, вязанных с приемом препарата «Триавир Овид®», отмечено не было.
Малоинтервенционное клиническое исследование было проведено с участием 298 добровольцев, находящихся в контакте с лицами, инфицированными COVID-19, которые наблюдались амбулаторно.
Таблица 1 демонстрирует оптимальный потенцирующий эффект композиции ИФН+ЛПН+РМДР+АМН. Это согласуется со следующими дозировками препарата Триавир Овид:
ИФН 500 МЕ/мл соответствует ингаляционной дозе – 4 мл раствора концентрации 200000 МЕ/100 мл
ЛПН – 2 мг/100 мл
РМДР – 2 мг/100 мл
АМН – 1,5 мг/100 мл
Соотношение 100 000/1/1/0.75
В указанной дозировке – 100 000/5/5/5.
При этом само по себе соотношение компонентов не имеет значения, важны лишь оптимальные концентрации действующих веществ.
При необходимости можно скорректировать дозы.
Таблица 2 сравнение in vitro решения по настоящему изобретению с известным из уровня техники решением.
lg
Список литературы:
1. Н. Д. Ющук, О. С. Хадарцев, Использование интерферонов в профилактике и лечении респираторных вирусных инфекций у взрослых и детей. Лечащий врач №03, 2018
2. Катунина Е.А. Амантадины в лечении болезни Паркинсона. Новые возможности в условиях COVID-19. Журнал неврологии и психиатрии им. С.С. Корсакова. 2021;121(4):101-106.
Katunina EA. Amantadine in the treatment of Parkinson’s disease. New opportunities in the context of COVID-19. Zhurnal Nevrologii i Psikhiatrii imeni S.S. Korsakova. 2021;121(4):101-106. (In Russ.).
https://doi.org/10.17116/jnevro2021121041101
3. Цветов В.М., Мирзаев К.Б., Сычёв Д.А. Возможность и перспективы применения препарата ремдесивир у пациентов с COVID-19 // Качественная клиническая практика. — 2020. — №S4. — С.99-102. DOI: 10.37489/2588-0519-2020-S4- 99-102
4. Cao, B. A Trial of Lopinavir-Ritonavir in Adults Hospitalized with Severe Covid-19 : [англ.] / B. Cao, Y. Wang, D. Wen … [et al.] // New England Journal of Medicine. — 2020. — Vol. 382, no. 19. — P. 1787–1799. — doi:10.1056/NEJMoa2001282. — PMID 32187464. — PMC 7121492
5. Федеральное государственное бюджетное учреждение НАЦИОНАЛЬНЫЙ МЕДИЦИНСКИЙ
ИССЛЕДОВАТЕЛЬСКИЙ ЦЕНТР КАРДИОЛОГИИ ИМЕНИ АКАДЕМИКА Е.И. ЧАЗОВА Министерства здравоохранения Российской Федерации, 20 октября 2020, https://cardioweb.ru/news/item/2429-remdesivir-gidroksikhlorokhin-lopinavir-ritonavir-interferon-beta1-a-ne-snizhayut-gospitalnuyu-letalnost-u-patsientov-s-covid-19-promezhutochnye-rezultaty-naibolee-krupnogo-na-segodnya-randomizirovannogo-issledovaniya-solidarity
6. A. Vitiello, F. Ferrara и др., Remdesivir versus ritonavir/lopinavir in COVID-19 patients, Irish Journal of Medical Science, Published 18 November 2020, https://www.semanticscholar.org/paper/Remdesivir-versus-ritonavir%2Flopinavir-in-COVID-19-Vitiello-Ferrara/363935556c18f2406494c6ae5599d93916eaa5e9
7. Понежева Ж. Б., Гришаева А. А., Маннанова И. В., Купченко А. Н., Яцышина С. Б., Краснова С. В., Малиновская В. В., Акимкин В. Г. Профилактическая эффективность рекомбинантного интерферона α-2b в условиях пандемии COVID-19 // Лечащий Врач. 2020; 12 (23): 56-60. DOI: 10.26295/OS.2020.29.66.011
8. US 20210330663 28.10.2021 A1
9. WO 2021160163 19.08.2021 A1
10. WO 2021203100 07.10.2021 A9
11. WO 2021248008 09.12.2021 A1
12. US 20210393536 23.12.2021 A1
13. WO 2021223894 11.11.2021 A1
14. US 0010925889 23.02.2021 B2
15. WO 2021226479 11.11.2021 A1
16. C Wang, K Takeuchi, L H Pinto, and R A Lamb,Ion channel activity of influenza A virus M2 protein: characterization of the amantadine block.J Virol. 1993 Sep; 67(9): 5585–5594.
17. Добровольский АВ. Подходы к клинической разработке комбинированных лекарственных препаратов в Российской Федерации и Евразийском экономическом союзе с учетом требований действующего законодательства. Ведомости Научного центра экспертизы средств медицинского применения. 2019;9(1):14–27. https://doi. org/10.30895/1991-2919-2019-9-1-14-27
18. WO 2021155443 12.08.2021 A1
19. К. Стасевич, Как лечить коноравирус, Наука и жизнь, №5, 2020, стр.2-6.
20. Binod Kumar, 1 Kumari Asha,1 Madhu Khanna,2 Larance Ronsard,3 Clement Adebajo Meseko,4 and Melvin Sanicas The emerging influenza virus threat: status and new prospects for its therapy and control. Arch Virol. 2018; 163(4): 831–844.
| название | год | авторы | номер документа |
|---|---|---|---|
| МЕФЛОХИН И ЕГО КОМБИНАЦИИ ДЛЯ ЛЕЧЕНИЯ И ПРОФИЛАКТИКИ КОРОНАВИРУСНОЙ ИНФЕКЦИИ | 2020 |
|
RU2763024C1 |
| Способ лечения очаговых и полостных изменений легких постковидной этиологии. | 2023 |
|
RU2809304C1 |
| Противо-SARS-CoV-2 вирусное средство Антипровир | 2020 |
|
RU2738885C1 |
| СПОСОБ ЗАЩИТЫ ОТ КОРОНАВИРУСНОЙ ИНФЕКЦИИ | 2020 |
|
RU2747467C1 |
| СПОСОБ ЛЕЧЕНИЯ COVID-19 ПНЕВМОНИИ | 2020 |
|
RU2745535C1 |
| Применение дигидрохлорида N,N'-бис-(2,3-бутадиенил)-1,4-диаминобутана (MDL72.527) для подавления репродукции вируса SARS-CoV-2 | 2020 |
|
RU2761565C1 |
| Средство для снижения риска и облегчения симптомов заражения бета-коронавирусной инфекцией | 2021 |
|
RU2747890C1 |
| 2-(ИМИДАЗОЛ-4-ИЛ)-ЭТАНАМИД ПЕНТАНДИОВОЙ-1,5 КИСЛОТЫ ИЛИ ЕГО ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМАЯ СОЛЬ ДЛЯ ЛЕЧЕНИЯ COVID-19 И ЕЕ СИМПТОМОВ | 2021 |
|
RU2824607C2 |
| СПОСОБЫ ЛЕЧЕНИЯ ИНФЕКЦИОННЫХ ЗАБОЛЕВАНИЙ, ВЫЗВАННЫХ КОРОНАВИРУСОМ | 2021 |
|
RU2772701C1 |
| СПОСОБЫ ЛЕЧЕНИЯ КОРОНАВИРУСНЫХ ИНФЕКЦИЙ | 2021 |
|
RU2825648C1 |
Группа изобретений относится к области медицины, а именно к терапии и инфектологии, и предназначена для профилактики или лечения респираторных вирусных инфекций. Комбинированный препарат для профилактики или лечения РНК-вирусных инфекций выполнен в виде раствора для ингаляций и содержит интерферон α2b рекомбинантный, лопинавир, ремдесивир, амантадин, натрия хлорид, спирт этиловый и твин 80. Компоненты используются в заявленных количествах. В другом воплощении представлен способ профилактики или лечения РНК-вирусной инфекции, включает использование указанного препарата в виде ингаляций, которые проводят 5 мл раствора в течение 10 мин от 2 до 6 раз в день в течение 1-14 дней. Использование группы изобретений обеспечивает эффективное лечение или профилактику респираторных вирусных инфекций с одновременным снижением лекарственной нагрузки на организм пациента. 2 н. и 2 з.п. ф-лы, 2 ил., 3 табл., 3 пр.
1. Комбинированный препарат для профилактики или лечения РНК-вирусных инфекций, выполненный в виде раствора для ингаляций, содержащий следующие компоненты из расчета на 100 мл:
2. Способ профилактики или лечения РНК-вирусной инфекции, включающий использование препарата по п. 1 в виде ингаляций, где ингаляции проводят 5 мл раствора в течение 10 мин от 2 до 6 раз в день в течение 1-14 дней.
3. Способ по п. 2, где РНК-вирусная инфекция является коронавирусной инфекций, в том числе представляет собой COVID-19.
4. Способ по п. 2, где ингаляции проводят через небулайзер.
| US 2021330663 A1, 28.10.2021 | |||
| WO 2021253008 A1, 16.12.2021 | |||
| CN 112891327 A, 04.06.2021 | |||
| WO 2021159050 A1, 12.08.2021 | |||
| CN 111297838 A, 19.06.2020. |
Авторы
Даты
2023-04-14—Публикация
2022-07-28—Подача