ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится к самоэмульгирующейся композиции лекарственного средства на основе полифенола флавоноидного ряда, способу ее получения, фармацевтической композиции на ее основе и ее применению, которые относятся к области лекарственных препаратов.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
В настоящее время соединения флавоноидного полифенола обычно делятся на три категории: (1) низкомолекулярные фенольные кислоты, такие как салициловая кислота, коричная кислота, п-гидроксикоричная кислота, кофейная кислота, феруловая кислота и хлорогеновая кислота; (2) таннины, которые представляют собой полифенольные полимеры и разделены на конденсированные таннины и гидролитические таннины, где конденсированные таннины представляют собой полифенолы, образованные путем связывания флаванолов через связи C4-C6 или C4-C8, и имеющие разные степени полимеризации, и также называемые проантоцианидином, и гидролитические таннины образуются путем образования сложного эфира галловой кислоты или эллаговой кислоты с гидроксильными группами на сахарах, таких как глюкоза; (3) полигидроксифлавоноиды, где одним типом полигидроксифлавоноидов являются антоцианы (гликозиды антоцианидинов), которые являются одним из растительных пигментов, и другим типом полигидроксифлавоноидов являются флавоноиды в узком смысле и их гликозиды, где агликоны включают флавоны, флавонолы, дигидрофлавоны, дигидрофлавонолы, изофлавоны, дигидроизофлавоны, халкон, оранжевый кетон, флаван, антоцианидины, бисфлавоны и флавоноиды (справочный документ 1: Advances in intestinal biotransformation of polyphenol constituents [C]. Eighth Academic Annual Meeting of Chinese Medicine Chemistry Branch of Chinese Traditional Medicine Society, 2013).
Исследования показывают, что лекарственные средства на основе полифенола флавоноидного ряда обладают многими фармакологическими эффектами в различных аспектах, таких как положительные эффекты в аспектах против опухолей, против коагуляции, против бактерий, гормонального регулирования, против окисления, против старения, против атеросклероза, против инфекций, против остеопороза, против вирусов, против микроорганизмов, регулирования содержания жира в крови и снижения уровня сахара в крови.
Ограниченные физическими и химическими свойствами, пероральные препараты лекарственных средств на основе полифенола флавоноидного ряда имеют низкую биодоступность, что приводит к плохому эффекту перорального лечения. Следовательно, клинически важно увеличить максимальные концентрации в плазме (Cmax) и воздействие в крови (площадь под кривой, AUC) при пероральном введении посредством фармацевтических методов.
Самоэмульгирующаяся система доставки лекарственных средств (SEDDS) представляет собой гомогенную смесь масляных фаз, эмульгатора и соэмульгатора и может использоваться как содержащая лекарственное средство и средство для доставки такового. После перорального приема SEDDS может быстро и спонтанно эмульгироваться с образованием капель эмульсии масло-в-воде в среде перистальтики желудочно-кишечного тракта и жидкой среде желудочно-кишечного тракта.
Zhiqin WANG et al. сообщили, что самоэмульгирующаяся микроэмульсия, инкапсулирующая проантоцианидины, была получена с триглицеридом каприловой/каприновой кислоты в качестве масляной фазы, касторовым маслом полиоксиэтиленом 40 в качестве эмульгатора и 1,2-пропандиолом в качестве соэмульгатора. Быстрое эмульгирование достигается, когда три компонента имеют массовое соотношение 1:3:1 с нагрузкой лекарственного средства 10%. Полиоксиэтилен 40, касторовое масло, 1,2-пропандиол и триглицерид каприловой/каприновой кислоты взвешивали при массовом соотношении и равномерно перемешивали на водяной бане при 37°C, затем в составе смешивали и растворяли некоторое количество проантоцианидинов и смесь уравновешивали при 37°C в течение 1 ч с получением самоэмульгирующейся микроэмульсии, инкапсулирующей проантоцианидины, которая имеет средний размер частиц 63,6 ± 0,7 нм после 100-кратного разбавления водой (справочный документ 2: Chinese Patent Drug, 2013, 35 (12): 2749-2752).
Weiling ZHANG et al. сообщают, что избыточный ингредиент кверцетина подвергали магнитному перемешиванию с полиэтиленгликольглицерилолеатом в качестве масляной фазы, касторовым маслом в виде полиоксиэтилена 35 в качестве эмульгатора и моноэтиловым эфиром диэтиленгликоля в качестве соэмульгатора, которые имеют соотношение 27,0:55,6:17,4 (вес:вес:вес) на водяной бане с постоянной температурой 60°C с получением перенасыщенного раствора кверцетина. Смесь перемешивали в течение 24 ч. при комнатной температуре, уравновешивали и центрифугировали при 4000 об/мин в течение 10 мин, после чего отбирали супернатант с получением самоэмульгирующейся микроэмульсии, инкапсулирующей ингредиент кверцетина. Самоэмульгирующаяся микроэмульсия имеет максимальную нагрузку лекарственного средства 67,87 мг/г и средний размер частиц 25,26 нм после 50-кратного разбавления водой (справочный документ 3: Journal of Shandong University, 2016, 54 (3): 41-49).
Zemin LI et al. сообщили, что избыток ингредиента куркумина смешивали до однородности с жирной кислотой со средней длиной цепи (триглицерид со средней длиной цепи (MCT)) в качестве масляной фазы, полиоксиэтиленовым гидрогенизированным касторовым маслом (Cremophor RH40) в качестве эмульгатора и полиэтиленгликолем-400 (PEG-400) в качестве соэмульгатора, которые имеют соотношение 2:6:2 (вес./вес.), перемешивали на вортексе в течение 5 мин и встряхивали в течение 48 ч при 37°C с исключением светового излучения. Образец отбирали и центрифугировали в течение 10 мин при 12000 об/мин, и супернатант точно так же отбирали с получением самоэмульгирующейся микроэмульсии, инкапсулирующей ингредиент куркумина, которая имеет значительно улучшенную растворимость. Самоэмульгирующаяся микроэмульсия имеет максимальную нагрузку лекарственного средства 55,30 мг/г и средний размер частиц 11,8 нм после 100-кратного разбавления водой (справочный документ 4: Journal of Chengdu Medical College, 2017, 12 (2): 155-59).
Lu CAO et al. сообщили, что триацетат глицерина использовался в качестве масляной фазы, Cremophor EL и Cremophor RH40 использовались в качестве эмульгаторов и изопропанол использовался в качестве соэмульгатора, где соотношение триацетат глицерина:Cremophor EL:Cremophor RH40:изопропанол составляло 22:27:13,5:37,8 (вес./вес.). Их смешивали до однородности посредством магнитной мешалки на водяной бане при 37°C с получением чистой самоэмульгирующейся микроэмульсии. Соответствующее количество ресвератрола добавляли к чистой самоэмульгирующейся микроэмульсии и растворяли с помощью ультразвуковых волн с получением самоэмульгирующейся микроэмульсии ресвератрола. Самоэмульгирующаяся микроэмульсия ресвератрола характеризуется нагрузкой лекарственного средства 45 мг/г и средним размером частиц 15 нм после 100-кратного разбавления водой (справочный документ 5: Lu CAO, Formulation and Studies of Resveratrol-SMEDDS [D]. Hebei: Hebei Medical University, 2014).
Самоэмульгирующиеся микроэмульсии проантоцианидинов, кверцетина, куркумина и ресвератрола получали в соответствии со способами, приведенными в справочных документах 2-5 соответственно. Эти самоэмульгирующиеся микроэмульсии хранили при 4°C и комнатной температуре в течение 5 дней, одного месяца и двух месяцев по отдельности. Наблюдались изменения внешнего вида и физической стабильности самоэмульгирующихся микроэмульсий. Результаты показывают, что самоэмульгирующиеся микроэмульсии лекарственного средства на основе полифенола флавоноидного ряда, полученные в соответствии с рецептурами в справочных документах 2-5, имеют очевидные дефекты стабильности: полутвердые вещества или осадки легко образуются после помещения их при 4°C, и лекарственные средства осаждаются после помещения при комнатной температуре на некоторый период времени.
Кроме того, Xue KE et al. сообщают, что чистую самоэмульгирующейся систему доставки микроэмульсии лекарственного средства (SMEDDS) получали в соответствии с составом с Migly-col812/Maisine35-1 (1:1) в качестве масляных фаз, Cremphor EL35/лабразолом (2:1) в качестве эмульгаторов и транскутолом P в качестве соэмульгатора, добавляли избыточное количество байкалеина, перемешивали и растворяли на водяной бане при 37°C, извлекали через 24 ч и центрифугировали при высокой скорости, составляющей 12000 об/мин-1, в течение 15 мин, и отбирали супернатант с получением самоэмульгирующейся микроэмульсии, инкапсулирующей ингредиент байкалеина, которая имеет максимальную нагрузку лекарственного средства 18,1 ± 1,11 мг/г и образует стабильную и однородную микроэмульсию в течение 3 минут после 100-кратного разбавления очищенной водой. Образовавшаяся микроэмульсия имеет размер частиц 27,2 ± 0,56 нм. По сравнению с ингредиентом байкалеина (желудочный зонд), самоэмульгирующаяся микроэмульсия байкалеина при пероральном введении крысам увеличивает Cmax в 3,1 раза и относительную биодоступность (AUC) в 3,77 раза (справочный документ 6: Chinese Journal of New Drugs, 2010, 19 (5): 371-395).
Wenli LIU et al. сообщили, что с триглицеридом каприловой/каприновой кислоты (ODO, 25%) в качестве масляной фазы, Cremophor RH40 (53,57%) в качестве эмульгатора и транскутолом P (21,43%) в качестве соэмульгатора избыточный ингредиент байкалеина и масляную фазу, эмульгатор и соэмульгатор перемешивали при 37°C в течение 48 ч, смесь центрифугировали при 12000 об/мин в течение 20 мин и отбирали супернатант с получением самоэмульгирующейся микроэмульсии, инкапсулирующей ингредиент байкалеина, которая имеет максимальную нагрузку лекарственного средства 32,02 мг/г и размер частиц 27,54 нм после эмульгирования с водой. По сравнению с суспензией ингредиента байкалеина (диспергированной в растворе 0,5% натрийкарбоксиметилцеллюлозы), самоэмульгирующаяся микроэмульсия байкалеина при пероральном введении крысам увеличивает Cmax в 1,6 раза и относительную биодоступность (AUC) в 2,01 раза (справочный документ 7: Fitoterapia, 2012, 83: 1532-1539).
Самоэмульгирующиеся микроэмульсии, полученные в справочных документах 6 и 7, значительно улучшают пероральную биодоступность байкалеина. Однако подтверждающие эксперименты показывают, что самоэмульгирующиеся микроэмульсии все еще имеют указанные ниже дефекты.
(1) Полученные самоэмульгирующиеся микроэмульсии байкалеина легко образуют полутвердые вещества или выпадают в осадок после помещения их при 4°C, и лекарственные средства осаждаются после помещения при комнатной температуре в течение одного месяца.
(2) При заданных условиях масляной фазы, эмульгатора и соэмульгатора нагрузку лекарственного средства байкалеина трудно дополнительно увеличить, что не может удовлетворить требования по нагрузке лекарственного средства в дозировке для клинического лечения.
(3) По сравнению с ингредиентом байкалеина, самоэмульгирующиеся микроэмульсии увеличивают Cmax и AUC в ограниченных степенях.
Кроме того, Changshun LIU et al. сравнили фармакокинетику байкалина (BG), комплекса байкалин-фосфолипид (BGPC), SMEDDS, содержащих байкалин (BG-SMEDDS), и SMEDDS с комплексом байкалин-фосфолипид в качестве промежуточного соединения (BGPC-SMEDDS) у крыс. Результаты показывают, что по сравнению с BG, BGPC, BG-SMEDDS и BGPC-SMEDDS имеют повышенные концентрации в плазме крови, и Cmax в 3,89, 11,01 и 6,70 раз больше, чем в BG, и AUC0→24 ч в 2,46, 2,86 и 2,38 раза выше этих значений в BG. То есть для Cmax самоэмульгирующаяся микроэмульсия байкалина > самоэмульгирующейся микроэмульсии комплекса байкалин-фосфолипид > комплекса байкалин-фосфолипид; и для AUC0→24 ч самоэмульгирующаяся микроэмульсия байкалина > комплекса байкалин-фосфолипид > самоэмульгирующейся микроэмульсии комплекса байкалин-фосфолипид.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Идеальная самоэмульгирующаяся композиция, содержащая лекарственное средство, должна удовлетворять следующим условиям: (1) при хранении в течение длительного времени в холодильнике или при комнатной температуре самоэмульгирующаяся композиция должна представлять собой светлую и прозрачную жидкость с однородным внешним видом и не быть слоистой; (2) при хранении в течение длительного времени в холодильнике или при комнатной температуре самоэмульгирующаяся композиция должна представлять собой светлую и прозрачную жидкость с однородным внешним видом и не должна затвердевать или осаждаться, чтобы избежать процесса «нагревания и плавления смеси лекарственного средства» перед применением и уменьшить разложение лекарственного средства; (3) должна быть высокая эффективность самоэмульгирования и должны образовываться наноразмерные капли эмульсии в результате быстрого и самопроизвольного эмульгирования после разбавления определенным количеством воды в моделируемой желудочно-кишечной среде; (4) капли эмульсии, образующиеся в результате спонтанного эмульгирования самоэмульгирующейся смеси в желудочно-кишечном тракте после непосредственного перорального приема, должны быть наноразмерными (1-1000 нм), а не микронных размеров (>1 мкм).
Для SEDDS, содержащих лекарственное средство, разные лекарственные средства имеют разные содержания лекарственного средства и стабильность из-за разных физических и химических свойств. Кроме того, изменения масляной фазы, эмульгатора, соэмульгатора и соотношения будут влиять на нагрузку лекарственного средства и эффективность самоэмульгирования, влияя тем самым на проницаемость слизистой оболочки и биодоступность SEDDS, которые, как правило, не следуют законам.
В ходе интенсивных исследований фармацевтических препаратов лекарственного средства на основе полифенола флавоноидного ряда авторы данного изобретения обнаружили, что самоэмульгирующаяся система, полученная с использованием комплекса лекарственного средства на основе полифенола флавоноидного ряда и фосфолипидов в качестве промежуточного соединения, которое состоит из фосфолипидов и лекарственного средства на основе полифенола флавоноидного ряда, выбранных из байкалеина, проантоцианидина, кверцетина, куркумина и ресвератрола имеют положительные эффекты в виде хорошей стабильности, высокой нагрузки лекарственного средства, высокой биодоступности и т.п.
Ввиду этого в одном аспекте настоящее изобретение обеспечивает самоэмульгирующуюся композицию лекарственного средства на основе полифенола флавоноидного ряда. Самоэмульгирующаяся композиция лекарственного средства на основе полифенола флавоноидного ряда включает комплекс лекарственного средства на основе полифенола флавоноидного ряда и фосфолипида, масляную фазу, эмульгатор и соэмульгатор, где лекарственное средство на основе полифенола флавоноидного ряда включает одно или более, выбранных из группы, состоящей из байкалеина, проантоцианидина, кверцетина, куркумина и ресвератрола.
Необязательно, лекарственное средство на основе полифенола флавоноидного ряда может дополнительно включать другие лекарственные средства на основе полифенола флавоноидного ряда в дополнение к байкалеину, проантоцианидину, кверцетину, куркумину и ресвератролу, где другие лекарственные средства на основе полифенола флавоноидного ряда представляют собой одно или более, выбранных из группы, состоящей из вогонина, феруловой кислоты, катехина, магнолола, хонокиола, апигенина, гесперетина, ротенона, изобавахалкона, ауреузидина, дельфинидина и гинкгетина.
Предпочтительно, лекарственное средство на основе полифенола флавоноидного ряда представляет собой байкалеин, проантоцианидин, кверцетин, куркумин или ресвератрол. Необязательно, самоэмульгирующаяся композиция лекарственного средства на основе полифенола флавоноидного ряда характеризуется нагрузкой лекарственного средства, составляющей 10-110 мг/г, предпочтительно 10-100 мг/г. Необязательно, самоэмульгирующаяся композиция лекарственного средства на основе полифенола флавоноидного ряда имеет размер частиц 10-1000 нм.
Необязательно, в комплексе лекарственного средства на основе полифенола флавоноидного ряда и фосфолипида массовое соотношение лекарственного средства на основе полифенола флавоноидного ряда и фосфолипида составляет 1:1-1:15, необязательно 1:1-1:8.
Комплекс лекарственного средства на основе полифенола флавоноидного ряда и фосфолипида состоит из лекарственного средства на основе полифенола флавоноидного ряда и фосфолипидного материала. Необязательно, комплекс лекарственного средства на основе полифенола флавоноидного ряда и фосфолипида имеет степень смешения лекарственного средства, превышающую или равную 80%.
Необязательно, лекарственное средство на основе полифенола флавоноидного ряда представляет собой экстракты лекарственного средства на основе полифенола флавоноидного ряда, экстрагированные из лекарственного препарата традиционной китайской медицины, и/или химически синтезированное лекарственное средство на основе полифенола флавоноидного ряда.
Необязательно, байкалеин может являться искусственно синтезированным байкалеином, эффективным компонентом, экстрагированным из растения и характеризующимся содержанием байкалеина более чем 50%, или продуктом, полученным из растительного экстракта посредством трансформации или перекристаллизации.
Необязательно, фосфолипид представляет собой один или более, выбранных из группы, состоящей из природных фосфолипидов и синтетических фосфолипидов.
Необязательно, природные фосфолипиды включают один или более, выбранных из группы, состоящей из фосфолипида соевых бобов и фосфолипида яичного желтка.
Необязательно, синтетические фосфолипиды включают одно или более, выбранных из группы, состоящей из фосфоглицерида, сфингомиелина, фосфатидилхолина, фосфатидилэтаноламина, фосфатидилсерина, фосфатидилинозитола, фосфатидилсеринглицерина, глицерофосфатидной кислоты, дистеарилфосфатидилхолина, дипальмитоилфосфатидилхолина, дипальмитоилфосфатидилэтаноламина и димиристоилфосфатидилхолина. Предпочтительно, синтетические фосфолипиды представляют собой одно или более, выбранных из группы, состоящей из фосфатидилхолина, фосфатидилэтаноламина, фосфатидилглицерина и глицерофосфатидной кислоты.
Необязательно, масляная фаза представляет собой одно или более, выбранных из группы, состоящей из растительных масел и производных растительных масел.
Необязательно, растительные масла включают одно или более, выбранных из группы, состоящей из соевого масла, кукурузного масла, оливкового масла, кокосового масла, арахисового масла, масла камелии и касторового масла;
необязательно производные растительного масла включают одно или более, выбранных из группы, состоящей из сорбитанолеата, глицерилолеата, глицериллинолеата, полиэтиленгликольглицерилолеата (Labrafil®1944cs), глицерилмонолинолеата (Maisine 35-1), этилолеата, этиллинолеата, моноглицерида C8/С10, диглицерида C8/C10 кокосового масла, триглицерида C8/C10 кокосового масла, триглицерида каприловой кислоты, диглицерида каприловой кислоты, моноглицерида каприловой кислоты, моноглицерида каприновой кислоты, диглицерида каприновой кислоты, триглицерида каприновой кислоты, моноглицерида каприловой/каприновой кислоты, глицерида каприловой/каприновой кислоты, триглицерида каприловой/каприновой кислоты, изопропилмиристата, полиэтиленгликольглицериллинолеата (Labrafil®M2125CS), полиэтиленгликольглицериллаурата (Gelucire) и пропиленгликольмонокаприлата (Capryol 90).
Предпочтительно, масляная фаза представляет собой одну или более фаз, выбранных из группы, состоящей из соевого масла, касторового масла, этилолеата, изопропилмиристата и глицерида каприловой/каприновой кислоты.
Необязательно, эмульгатор представляет собой одно или более, выбранных из группы, состоящей из полиэтиленгликольглицерида каприловой/каприновой кислоты (лабразола или лабраозола), полиэтиленгликоля (включая PEG-200, PEG-400, PEG-600, PEG-800 (число после PEG означает среднюю молекулярную массу)), Tween (включая Tween 20, Tween 21, Tween 40, Tween 60, Tween 61, Tween 80, Tween 81 и Tween 85, предпочтительно Tween 80, Tween 60, Tween 20), Span 80, полиэтиленгликольглицерилолеата (Labrafil®1944cs), полиэтиленгликольглицериллинолеата (Labrafil®M2125CS), фосфолипидов и октилфенилполиоксиэтиленового эфира (X-100). Предпочтительно, эмульгатор представляет собой одно или более из следующих компонентов: полиэтиленгликольглицерид каприловой/каприновой кислоты (лабразол или лабраозол), Tween 80, Tween 85, Triton X-100 и Labrafil®1944cs.
Необязательно, соэмульгатор представляет собой один или более соэмульгаторов, выбранных из группы, состоящей из этанола, пропиленгликоля, пропиленкарбоната, моноэтилового эфира этиленгликоля, фурфурола глицерина, диметилизосорбида, монокаприлата пропиленгликоля (Capryol 90), моноэтилового эфира диэтиленгликоля (транскутола HP или транскутола P), полиэтиленгликоля (включая PEG-200, PEG-400, PEG-600 и PEG-800 (число после PEG обозначает среднюю молекулярную массу)), глицерина, полиэтиленгликольглицерида каприловой/каприновой кислоты (лабраозола) и бензилового спирта. Предпочтительно, соэмульгатор представляет собой одно или более из моноэтилового эфира диэтиленгликоля (транскутол HP или транскутол P), полиэтиленгликоля 400 (PEG-400), этанола и монокаприлата пропиленгликоля (Capryol 90).
Необязательно, в пересчете на общую массовую долю масляной фазы, эмульгатора и соэмульгатора, составляющую 100%, масляная фаза составляет 10-50% (предпочтительно 20-40%), эмульгатор составляет 30-60% (предпочтительно 40-60%), и соэмульгатор составляет 20-60% (предпочтительно 30-50%).
В другом аспекте настоящее изобретение предусматривает способ получения предыдущей самоэмульгирующейся композиции лекарственного средства на основе полифенола флавоноидного ряда. Способ включает следующие стадии получения.
(1) Получают комплекс лекарственного средства на основе полифенола флавоноидного ряда и фосфолипида: лекарственное средство на основе полифенола флавоноидного ряда и фосфолипиды растворяют в органическом растворителе, обеспечивают реакцию сочетания и высушивают с удалением органического растворителя с получением комплекса лекарственного средства на основе полифенола флавоноидного ряда и фосфолипида.
Необязательно, органический растворитель представляет собой одно или более, выбранных из группы, состоящей из этилацетата, тетрагидрофурана, метанола, ацетона, этанола, абсолютного этанола, н-пропанола, изопропанола, н-бутанола, изобутанола, трет-бутанола, диэтилового эфира, метилэтилового эфира, диоксана, бутанона, петролейного эфира, гексана, циклогексана, дихлорметана, хлороформа, тетрахлорида углерода, DMSO и DMF, предпочтительно одно или более из этилацетата, тетрагидрофурана, метанола, этанола, циклогексана, DMSO и DMF.
(2) Получают самоэмульгирующуюся композицию лекарственного средства на основе полифенола флавоноидного ряда: комплекс лекарственного средства на основе полифенола флавоноидного ряда и фосфолипида, полученный на стадии (1), полностью смешивают с масляной фазой, эмульгатором и соэмульгатором в любой последовательности.
Например, комплекс лекарственного средства на основе полифенола флавоноидного ряда и фосфолипида, полученный на стадии (1), может быть полностью смешан непосредственно с масляной фазой, эмульгатором и соэмульгатором.
Альтернативно, масляную фазу, эмульгатор и соэмульгатор смешивают до однородности с получением чистого самоэмульгирующегося концентрата, а затем комплекс лекарственного средства на основе полифенола флавоноидного ряда и фосфолипида, полученный на стадии (1), добавляют к полученному чистому самоэмульгирующемуся концентрату и полностью смешивают с ним.
Альтернативно, комплекс лекарственного средства на основе полифенола флавоноидного ряда и фосфолипида, полученный на стадии (1), растворяют в любом из масляной фазы, эмульгатора или соэмульгатора, а затем добавляют два других из масляной фазы, эмульгатора или соэмульгатора и полностью смешивают.
В другом аспекте настоящее изобретение предусматривает фармацевтическую композицию. Фармацевтическая композиция включает предыдущую самоэмульгирующуюся композицию лекарственного средства на основе полифенола флавоноидного ряда и необязательное фармацевтически приемлемое вспомогательное вещество.
Необязательно, лекарственная форма фармацевтической композиции включает препарат для перорального введения, препарат для инъекции, препарат для трансдермального введения, препарат для введения через слизистые оболочки, препарат для введения посредством ингаляции в легкие или препарат для энтерального введения. Необязательно, лекарственная форма фармацевтической композиции предусматривает капли, жидкости для перорального введения, таблетки, капсулы (включая мягкие капсулы и твердые капсулы), гранулы, инфузионные гранулы, пленки, гель, порошки, эмульсии, микропилюли, суппозитории, аэрозоли, спреи, порошковые аэрозоли, пластыри, лейкопластыри, растворы, мази или крем.
Фармацевтически приемлемое вспомогательное вещество может представлять собой любое общепринятое вспомогательное вещество в области фармацевтических препаратов. Конкретное вспомогательное вещество выбирается в зависимости от способа введения для лечения конкретного пациента или типа и состояния заболевания конкретного пациента. Например, фармацевтически приемлемое вспомогательное вещество включает общепринятые разбавители, носители, наполнители, связующие вещества, смачивающие средства, разрыхлители, стимуляторы абсорбции, поверхностно-активные вещества, поглощающие среды-носители и смазывающие вещества в фармацевтической области. При необходимости, в фармацевтическую композицию также могут быть добавлены ароматизаторы, консерванты и подсластители.
В другом аспекте настоящее изобретение предусматривает применение предыдущей самоэмульгирующейся композиции лекарственного средства на основе полифенола флавоноидного ряда или предыдущей фармацевтической композиции для получения лекарственных средств против бактерий, против вирусов, противовоспалительных средств, средств для подавления аллергии, средств для регуляции иммунитета, противоопухолевых средств, антиоксидантов, омолаживающих средств, средств против ультрафиолетового излучения, средств для лечения недостатка гормонов, средств против гипертонии, средств для снижения содержания жиров в крови, средств против атеросклероза, средств против сенильной деменции, средств для лечения энтеровирусного везикулярного стоматита, средств против остеопороза или средств для защиты печени.
Положительные эффекты
Самоэмульгирующаяся композиция лекарственного средства на основе полифенола флавоноидного ряда по настоящему изобретению характеризуется положительными эффектами в виде хорошей стабильности, высокой нагрузки лекарственного средства и высокой биодоступности.
Самоэмульгирующаяся композиция лекарственного средства на основе полифенола флавоноидного ряда по настоящему изобретению представляет собой однородную жидкость по внешнему виду и характеризуется нагрузкой лекарственного средства, которое может достигать более чем 100 мг/г (вес лекарственного средства на основе полифенола флавоноидного ряда/вес композиции).
Самоэмульгирующаяся композиция лекарственного средства на основе полифенола флавоноидного ряда по настоящему изобретению характеризуется хорошей способностью к самоэмульгированию. После разбавления водой в 10-1000 раз самоэмульгирующаяся композиция лекарственного средства на основе полифенола флавоноидного ряда может быстро эмульгироваться с образованием капель с размером частиц 10-1000 нм.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
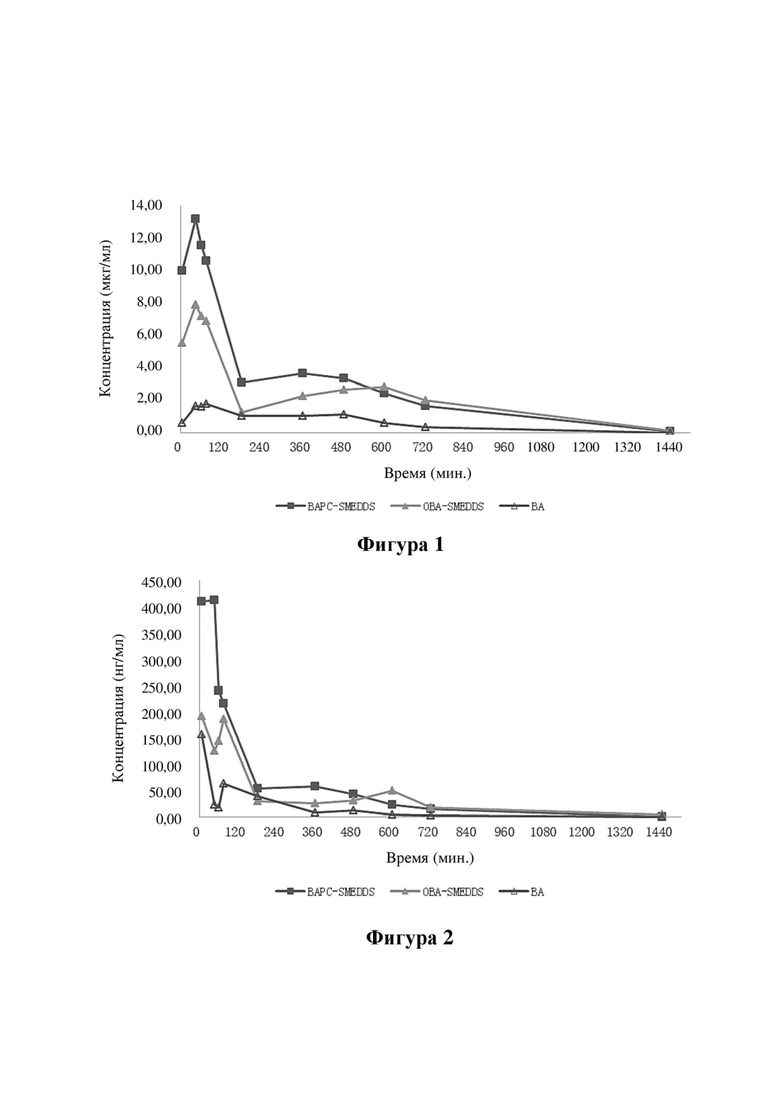
На ФИГ. 1 продемонстрирован график, показывающий кривую «концентрация-время» байкалина в плазме крови крыс в тестовых группах A, B и C в тестовом примере 2.
На ФИГ. 2 продемонстрирован график, показывающий кривую «концентрация-время» байкалина в плазме крови крыс в тестовых группах A, B и C в тестовом примере 2.
ПОДРОБНОЕ ОПИСАНИЕ
Конкретные варианты осуществления настоящего изобретения подробно описаны ниже. Необходимо понимать, что варианты осуществления, описанные в данном документе, предназначены для иллюстрации и не предназначены для ограничения настоящего изобретения.
В следующих примерах 1-5 скорость смешивания лекарственного средства на основе полифенола флавоноидного ряда и фосфолипидов в комплексе лекарственного средства на основе полифенола флавоноидного ряда и фосфолипида измеряется с помощью высокоэффективной жидкостной хроматографии (HPLC).
Условия HPLC
Хроматографическая колонка: колонка Agilent ZORBAX SB C18 (250 мм × 4,6 мм, 5 мкм);
подвижная фаза: 0,05% фосфорная кислота-метанол (35:65, об./об.);
скорость потока: 1,0 мл/мин;
температура колонки: 25°C (нормальная температура);
объем инъекции: 10 мкл;
длина волны выявления: 275 нм.
Способ определения: точно взвешивают 24 мг лекарственного средства на основе полифенола флавоноидного ряда для сравнения, помещают в мерную колбу объемом 10 мл, добавляют абсолютный этанол до растворения и разбавляют до объема. Аккуратно переносят 1 мл в мерную колбу объемом 100 мл и добавляют абсолютный этанол для разбавления к раствору с концентрацией 24 мкг/мл в качестве раствора сравнения. Точно взвешивают 135 мг комплекса лекарственного средства на основе полифенола флавоноидного ряда и фосфолипида, помещают в мерную колбу объемом 50 мл, растворяют в абсолютном этаноле, разбавляют до метки и равномерно встряхивают. Аккуратно переносят 1 мл в мерную колбу объемом 25 мл, добавляют абсолютный этанол до растворения, разбавляют до метки и равномерно встряхивают как тестовый раствор А. Точно взвешивают 135 мг комплекса лекарственного средства на основе полифенола флавоноидного ряда и фосфолипида, помещают в мерную колбу объемом 50 мл, добавляют н-гексан для растворения, разбавляют до объема, равномерно встряхивают и фильтруют через 0,45 мкм органическую мембрану. Аккуратно переносят 1 мл фильтрата в мерную колбу объемом 25 мл, продувают азотом для удаления растворителя, добавляют абсолютный этанол до растворения, разбавляют до метки и равномерно встряхивают как тестовый раствор В. Контрольный раствор, тестовый раствор A и тестовый раствор B точно отмеряют по 10 мкл каждого и определяют в соответствии с предыдущим способом HPLC. Записывают хроматограмму и рассчитывают содержание комплекса лекарственного средства на основе полифенола флавоноидного ряда и фосфолипида с помощью способа внешнего стандарта в соответствии с площадью пика, которые записываются как Wsum и Wcom отдельно.
Скорость смешивания рассчитывается по следующей формуле:
скорость смешивания % = (Wcom/Wsum)*100%.
Пример 1. Комплексы байкалеин-фосфолипид, полученные при различных соотношениях лекарственное средство-липид (массовое соотношение ингредиента байкалеина и фосфолипидов сои)
Ингредиент байкалеина и фосфолипиды сои точно взвешивали в соответствии с соотношением лекарственное средство-липид в таблице 1, помещали в роторную испарительную колбу объемом 1000 мл, добавляли соответствующее количество тетрагидрофурана, смешивали с ним и равномерно встряхивали. После того как ингредиент байкалеин и фосфолипиды полностью растворялись и раствор соединения становился прозрачным, – роторную испарительную колбу ставили неподвижно в течение 15-30 мин и помещали на роторный испаритель так, чтобы растворитель выпаривался при 40°C. После того как вещество в роторной испарительной колбе вспенивалось и принимало форму сот, непрерывное роторное испарение осуществляли в течение 1-2 часов. После получения комплекса байкалеин-фосфолипид роторную испарительную колбу помещали в сушильный шкаф для высушивания в течение 3 дней, а затем твердые вещества, комплексы байкалеин-фосфолипид, осторожно соскребали и помещали в сушильный шкаф для хранения для дальнейшего использования.
Таблица 1. Составы комплексов байкалеин-фосфолипид с различными соотношениями лекарственное средство-липид и степенями их смешивания
Пример 2. Комплексы байкалеин-фосфолипид, полученные с использованием различных органических растворителей
Использовали тот же способ, что и в примере 1, за исключением того, что ингредиент байкалеин и фосфолипиды сои подавались в массовом соотношении 1:3,5 (вес./вес.) и этилацетат, метанол, ацетон, этанол, абсолютный этанол, н-пропанол, изопропанол, н-бутанол, изобутанол, трет-бутанол, диэтиловый эфир, метилэтиловый эфир, диоксан, бутанон, петролейный эфир, гексан, циклогексан, дихлорметан, хлороформ, тетрахлорид углерода, DMSO и DMF использовали в качестве растворителей для получения комплексов байкалеин-фосфолипид. Определяли коэффициенты смешивания.
Результаты показывают, что когда использовали предыдущие органические растворители, – все полученные комплексы байкалеин-фосфолипид имели степень смешивания более чем 80%.
Пример 3. Комплексы байкалеин-фосфолипид, полученные с использованием различных фосфолипидов
Использовали тот же способ, что и в примере 1, за исключением того, что байкалеин и фосфолипиды подавали в массовом соотношении 1:3,5 (вес./вес.) и природные фосфолипиды, такие как фосфолипид яичного желтка или фосфолипид соевых бобов, или синтетические фосфолипиды, такие как фосфоглицерид, сфингомиелин, фосфатидилхолин, фосфатидилэтаноламин, фосфатидилсерин, фосфатидилинозитол, фосфатидилглицерин, глицерофосфатидная кислота, дистеарилфосфатидилхолин, дипальмитоилфосфатидилхолин, дипальмитоилфосфатидилэтаноламин или димиристоилфосфатидилхолин использовали в качестве липидных материалов для получения комплексов байкалеин-фосфолипид. Определяли коэффициенты смешивания.
Результаты показывают, что все комплексы байкалеин-фосфолипид, полученные с использованием предыдущих фосфолипидов, имеют степень смешивания более чем 80%.
Пример 4. Комплексы байкалеин-фосфолипид, полученные с использованием ингредиента байкалеина из разных источников
Использовали тот же способ, что и в примере 1, за исключением того, что ингредиент байкалеина и фосфолипиды сои подавали в массовом соотношении 1:3,5 (вес./вес.), и полученные химически синтезированные байкалеин или экстракты байкалеина (с содержанием байкалеина большим или равным 50%) из лекарственного препарата традиционной китайской медицины использовали для получения серий комплексов байкалеин-фосфолипид. Определяли коэффициенты смешивания.
Синтезированный байкалеин, используемый в данном примере, был приобретен у Nanjing Zelang Biotechnology Co., Ltd.
Экстракт байкалеина, используемый в данном примере, получали следующим способом: порошок Scutellaria baicalensis просеивали через сито 20 меш, к порошку Scutellaria baicalensis добавляли пятикратный объем воды, ферментативно гидролизовали при 38°C в течение 24 ч, высушивали до постоянного веса с получением ферментативно гидролизованного порошка Scutellaria baicalensis; затем к порошку по отдельности добавляли в 10-кратном объеме этанол с различными концентрациями (10%, 30%, 50%, 70%, 100%), экстрагировали три раза при мощности ультразвука 70%, каждый раз по 20 минут, и фильтровали. Фильтрат перегоняли при пониженном давлении и высушивали до постоянного веса с тем, чтобы получить экстракты байкалеина с различными содержаниями.
В результате все комплексы байкалеин-фосфолипид имели степень смешивания более чем 80%.
Пример 5. Получение различных комплексов лекарственного средства на основе полифенола флавоноидного ряда и фосфолипида
Использовали тот же способ, что и в примере 1, за исключением того, что проантоцианидин, кверцетин, куркумин или ресвератрол и фосфолипиды сои подавали в массовом соотношении 1:3,5 (вес./вес.) для получения серии комплексов лекарственного средства на основе полифенола флавоноидного ряда и фосфолипида. Результаты показывают, что степень смешивания лекарственного средства составляла более чем 90%, см. таблицу 2.
Таблица 2. Коэффициенты смешивания различных комплексов лекарственного средства на основе полифенола флавоноидного ряда и фосфолипида
В следующих примерах представлены сравнительные примеры и тестовые примеры:
1. Размер частиц самоэмульгирующейся композиции лекарственного средства на основе полифенола флавоноидного ряда после эмульгирования определяли с помощью следующего способа:
200 мкл самоэмульгирующейся композиции лекарственного средства на основе полифенола флавоноидного ряда переносили с помощью пипетки и медленно добавляли к 20 мл дистиллированной воды (водяная баня 37°C, медленное перемешивание). Регистрировали время эмульгирования самоэмульгирующейся композиции лекарственного средства на основе полифенола флавоноидного ряда и эмульгированный раствор непосредственно измеряли с помощью лазерного анализатора размера частиц для определения размера его частиц.
2. Нагрузку лекарственного средства в самоэмульгирующейся композиции лекарственного средства на основе полифенола флавоноидного ряда определяли следующим способом:
0,5 г самоэмульгирующейся композиции лекарственного средства на основе полифенола флавоноидного ряда точно взвешивали, помещали в мерную колбу объемом 10 мл, растворяли в абсолютном этаноле, разбавляли до метки и равномерно встряхивали. Аккуратно переносили 1 мл в мерную колбу объемом 50 мл, добавляли 95% этанол (содержащий 0,02% VC) до растворения, разбавляли до метки и равномерно встряхивали как тестовый раствор. Точно взвешивали 30 мг ингредиента лекарственного средства на основе полифенола флавоноидного ряда, помещали в мерную колбу объемом 25 мл, добавляли абсолютный этанол до растворения и разбавляли до объема. Аккуратно переносили 1 мл в мерную колбу объемом 50 мл и добавляли 95% этанол (содержащий 0,02% VC) для разбавления к раствору с концентрацией 24 мкг/мл в качестве контрольного раствора. Тестовый раствор и контрольный раствор точно отмеряли по 10 мкл каждого и вводили в жидкостный хроматограф для разделения и анализа. Хроматографическая колонка представляла собой колонку Agilent ZORBAX SB C18 (250 мм × 4,6 мм, 5 мкм), подвижная фаза 0,05% фосфорная кислота-метанол (35:65 об./об.), скорость потока 1,0 мл/мин, температура колонки составляла 25°C и длина волны выявления составляла 275 нм. Регистрировали хроматограмму и рассчитывали нагрузку лекарственного средства в самоэмульгирующейся композиции лекарственного средства на основе полифенола флавоноидного ряда с помощью способа внешнего стандарта в соответствии с площадью пика.
Пример 6. Скрининг масляной фазы, эмульгатора, соэмульгатора, используемых в самоэмульгирующейся композиции лекарственного средства на основе полифенола флавоноидного ряда, и их соотношения
(а) Предварительное получение самоэмульгирующейся композиции байкалеина
(1) Байкалеин и фосфолипиды соевых бобов подавали в массовом соотношении 1:3,5 (вес./вес.), обеспечивали реакцию сочетания с тетрагидрофураном в качестве растворителя, затем удаляли органический растворитель и высушивали с получением комплекса байкалеин-фосфолипид.
(2) С этилолеатом в качестве масляной фазы, полиэтиленгликольглицеридом каприловой/каприновой кислоты (лабраозолом) в качестве эмульгатора и транскутолом HP в качестве соэмульгатора, масляную фазу, эмульгатор и соэмульгатор точно взвешивали в соотношении 2:5:3, помещали в соответствующий контейнер и смешивали до однородности с получением чистого самоэмульгирующегося концентрата.
(3) Соответствующее количество (30% от веса чистого самоэмульгирующегося концентрата) комплекса байкалеин-фосфолипид на стадии (1) взвешивали, помещали в чистый самоэмульгирующийся концентрат на стадии (2) и помещали в осциллятор на воздушной бане при температуре 25°C и скорости вращения 210 об/мин. После полного растворения комплекса байкалеин-фосфолипид получали самоэмульгирующуюся композицию байкалеина.
Результаты продемонстрировали, что полученная самоэмульгирующаяся композиция байкалеина, представляющая собой однородный раствор, может полностью эмульгироваться в течение 2 мин и имеет размер частиц 10-1000 нм.
(b) Самоэмульгирующиеся композиции байкалеина, полученные с использованием различных эмульгаторов
Самоэмульгирующуюся композицию байкалеина получали тем же способом, что и в (а), за исключением того, что лабразол заменяли одним из PEG-400, Tween 80, Tween 60, Tween 20, Tween 85, Span 80, полиэтиленгликольглицерилолеата (Labrafil®1944cs), полиэтиленгликольглицериллинолеата (Labrafil®M2125CS), эфира фосфолипидов и октилфенилполиоксиэтилена (Triton X-100), комбинации полиэтиленгликольглицерида каприловой/каприновой кислоты и Tween 80, комбинации полиэтиленгликольглицерида каприловой/каприновой кислоты и PEG-400, комбинации полиэтиленгликольглицерида каприловой/каприновой кислоты и октилфенилполиоксиэтиленового эфира, комбинации полиэтиленгликольглицерида каприловой/каприновой кислоты и фосфолипидов, комбинации Tween 80 и PEG-400, комбинации Tween 80 и октилфенилполиоксиэтиленового эфира или комбинации Tween 80 и фосфолипидов в качестве эмульгатора для получения самоэмульгирующейся композиции байкалеина.
Результаты продемонстрировали, что полученная самоэмульгирующаяся композиция байкалеина, представляющая собой однородный раствор, может полностью эмульгироваться в течение 2 мин и имеет размер частиц 10-1000 нм.
(c) Самоэмульгирующиеся композиции байкалеина, полученные с использованием различных соэмульгаторов
Самоэмульгирующуюся композицию байкалеина получали тем же способом, что и в (а), за исключением того, что транскутол HP заменяли одним из этанола, пропиленгликоля, полиэтиленгликоля, пропиленкарбоната, моноэтилового эфира этиленгликоля, фурфуролглицерина, диметилизосорбида, транскутола P, PEG 400, глицерина, лабраозола и бензилового спирта, комбинации транскутола HP и этанола, комбинации транскутола HP и пропиленгликоля, комбинации транскутола HP и PEG 400, комбинации транскутола HP и глицерина, комбинации транскутола HP и моноэтилового эфира этиленгликоля, комбинации лабраозола и этанола, комбинации лабраозола и пропиленгликоля, комбинации лабраозола и PEG 400 или комбинации лабраозола и глицерина в качестве соэмульгатора, и Tween 80 использовали в качестве эмульгатора для получения самоэмульгирующейся композиции байкалеина.
Результаты продемонстрировали, что полученная самоэмульгирующаяся композиция байкалеина, представляющая собой однородный раствор, может полностью эмульгироваться в течение 2 мин и имеет размер частиц 10-1000 нм.
(d) Самоэмульгирующиеся композиции байкалеина, полученные с использованием различных масляных фаз
Самоэмульгирующуюся композицию байкалеина получали тем же способом, что и в (а), за исключением того, что этилолеат заменяли одним из соевого масла, кукурузного масла, оливкового масла, кокосового масла, арахисового масла, масла камелии, касторового масла, сорбитанолеата, глицерилолеата, глицериллинолеата, полиэтиленгликольглицерилолеата (Labrafil®1944cs), Maisine 35-1, этиллинолеата, моноглицерида C8/C10, диглицерида C8/C10 кокосового масла, триглицерида C8/C10 кокосового масла, триглицерида каприловой кислоты, триглицерида каприловой кислоты, моноглицерида каприловой кислоты, моноглицерида каприновой кислоты, диглицерида каприновой кислоты, триглицерида каприновой кислоты, моноглицерида каприловой кислоты, глицерида каприловой/каприновой кислоты, триглицерида каприловой/каприновой кислоты, изопропилмиристата, полиэтиленгликольглицериллинолеата (Labrafil Capry®M2125CS), Gelucire и Capryol 90, комбинации этилолеата и глицерида каприловой/каприновой кислоты, комбинации этилолеата и изопропилмиристата, комбинации этилолеата и соевого масла, комбинация полиэтиленгликольглицериллинолеата и этиллинолеата, комбинации полиэтиленгликольглицериллинолеата и оливкового масла, комбинации полиэтиленгликольглицериллинолеата и моноглицерида каприловой кислоты в качестве масляной фазы, и Tween 80 использовали в качестве эмульгатора для получения самоэмульгирующейся композиции байкалеина.
Результаты продемонстрировали, что полученная самоэмульгирующаяся композиция байкалеина, представляющая собой однородный раствор, может полностью эмульгироваться в течение 2 мин и имеет размер частиц 10-1000 нм.
(e) Самоэмульгирующиеся композиции байкалеина, полученные с использованием различных соотношений масляной фазы, эмульгатора и соэмульгатора
(1) Байкалеин и фосфолипиды соевых бобов подавали в массовом соотношении 1:3,5 (вес./вес.), обеспечивали реакцию сочетания с тетрагидрофураном в качестве растворителя, затем удаляли органический растворитель и высушивали с получением комплекса байкалеин-фосфолипид.
(2) Масляную фазу, эмульгатор и соэмульгатор с этилолеатом в качестве масляной фазы, Tween 80 в качестве эмульгатора и транскутолом HP в качестве соэмульгатора точно взвешивали в соотношении 10%:60%:30%, 20%:50%:30% или 20%:40%:40%, в пересчете на общую массовую долю трех компонентов, составляющую 100%, помещали в соответствующий контейнер и смешивали до однородности с получением чистого самоэмульгирующегося концентрата.
(3) Соответствующее количество (30% от веса чистого самоэмульгирующегося концентрата) комплекса байкалеин-фосфолипид на стадии (1) взвешивали, помещали в чистый самоэмульгирующийся концентрат на стадии (2) и помещали в осциллятор на воздушной бане при температуре 25°C и скорости вращения 210 об/мин. После полного растворения комплекса байкалеин-фосфолипид получали самоэмульгирующуюся композицию байкалеина.
Результаты продемонстрировали, что полученная самоэмульгирующаяся композиция байкалеина, представляющая собой однородный раствор, может полностью эмульгироваться в течение 2 мин и имеет размер частиц 10-1000 нм.
Пример 7. Исследование нагрузки лекарственного средства в самоэмульгирующейся композиции лекарственного средства на основе полифенола флавоноидного ряда
(1) Лекарственное средство на основе полифенола флавоноидного ряда (байкалеин, проантоцианидин, кверцетин, куркумин и ресвератрол) и фосфолипиды сои подавали в массовом соотношении 1:3,5 (вес./вес.), обеспечивали реакцию сочетания с тетрагидрофураном в качестве растворителя, затем удаляли органический растворитель и высушивали с получением комплекса байкалеин-фосфолипид, комплекса проантоцианидин-фосфолипид, комплекса кверцетин-фосфолипид, комплекса куркумин-фосфолипид и комплекса ресвератрол-фосфолипид соответственно.
(2) С этилолеатом в качестве масляной фазы, лабраозолом в качестве эмульгатора и транскутолом HP в качестве соэмульгатора, масляную фазу, эмульгатор и соэмульгатор точно взвешивали в соотношении 2:5:3, помещали в соответствующий контейнер и смешивали до однородности с получением чистого самоэмульгирующегося концентрата.
(3) Соответствующее количество комплекса байкалеин-фосфолипид, комплекса проантоцианидин-фосфолипид, комплекса кверцетин-фосфолипид, комплекса куркумин-фосфолипид или комплекса ресвератрол-фосфолипид на стадии (1) взвешивали, помещали в 5 г масляной фазы (этилолеат) или чистого самоэмульгирующегося концентрата на стадии (2), нагревали до 37°C и перемешивали или сдвигали так, чтобы каждый фосфолипидный комплекс был полностью перемешан и растворен. Их помещали при комнатной температуре на 24 часа, чтобы наблюдать, выпало ли лекарственное средство в осадок. Если лекарственное средство не осаждалось, то добавляли соответствующее количество каждого фосфолипидного комплекса и действовали таким же образом до тех пор, пока лекарственное средство не осаждалось. Супернатант отбирали и центрифугировали при 12000 об/мин в течение 20 мин. Затем отбирали супернатант и определяли насыщенную растворимость каждого комплекса лекарственного средства на основе полифенола флавоноидного ряда и фосфолипида в масляной фазе и чистом самоэмульгирующемся концентрате с помощью предыдущего способа HPLC.
Результаты испытаний показывают, что комплекс байкалеин-фосфолипид может увеличивать растворимость в насыщенном состоянии байкалеина в масле с 0,3 мг/г до более чем 60 мг/г и повышать растворимость в насыщенном состоянии байкалеина в чистом самоэмульгирующемся концентрате (содержание лекарственного средства в самоэмульгирующейся композиции байкалеина) от 20 мг/г до более чем 100 мг/г.
Фосфолипидные комплексы проантоцианидина, кверцетина, куркумина и ресвератрола могут повышать растворимость в насыщенном состоянии их соответствующего активного фармацевтического ингредиента в масле до более чем 60 мг/г и повышать растворимость в насыщенном состоянии в чистом самоэмульгирующемся концентрате до более чем 100 мг/г.
Вышеупомянутые тесты показывают, что самоэмульгирующаяся композиция лекарственного средства на основе полифенола флавоноидного ряда по настоящему изобретению характеризуется высокой нагрузкой лекарственного средства.
Пример 8. Самоэмульгирующиеся композиции байкалеина, полученные с использованием различных масляных фаз с комплексом байкалеин-фосфолипид в качестве промежуточного соединения
(1) Байкалеин и фосфолипиды соевых бобов подавали в массовом соотношении 1:3,5 (вес./вес.), обеспечивали реакцию сочетания с тетрагидрофураном в качестве растворителя, затем удаляли органический растворитель и высушивали с получением комплекса байкалеин-фосфолипид.
(2) С лаброзолом в качестве эмульгатора и транскутолом HP в качестве соэмульгатора и с использованием различных масляных фаз, показанных в таблице 3, масляную фазу, эмульгатор и соэмульгатор точно взвешивали в соотношении 2:5:3, помещали в подходящий контейнер и смешивали до однородности с получением самоэмульгирующегося концентрата.
(3) Соответствующее количество комплекса байкалеин-фосфолипид на стадии (1) (подаваемого в соответствии с нагрузкой лекарственного средства 50 мг/г) взвешивали, помещали в чистый самоэмульгирующийся концентрат на стадии (2) и помещали в осциллятор на воздушной бане с температурой 25°C и скоростью вращения 210 об/мин. После полного растворения комплекса байкалеин-фосфолипид получали самоэмульгирующуюся композицию байкалеина. Определяли нагрузку лекарственного средства и размер частиц после эмульгирования. Результаты показаны в таблице 3.
Таблица 3. Самоэмульгирующиеся композиции байкалеина, полученные с использованием различных масляных фаз
Пример 9. Самоэмульгирующиеся композиции байкалеина, полученные с использованием различных эмульгаторов с комплексом байкалеин-фосфолипид в качестве промежуточного соединения
(1) Байкалеин и фосфолипиды соевых бобов подавали в массовом соотношении 1:3,5 (вес./вес.), обеспечивали реакцию сочетания с тетрагидрофураном в качестве растворителя, затем удаляли органический растворитель и высушивали с получением комплекса байкалеин-фосфолипид.
(2) С этилолеатом в качестве масляной фазы и транскутолом HP в качестве соэмульгатора и с использованием различных эмульгаторов, показанных в таблице 4, масляную фазу, эмульгатор и соэмульгатор точно взвешивали в соотношении 2:5:3, помещали в подходящий контейнер и смешивали до однородности с получением самоэмульгирующегося концентрата.
(3) Соответствующее количество комплекса байкалеин-фосфолипид на стадии (1) (подаваемого в соответствии с нагрузкой лекарственного средства 50 мг/г) взвешивали, помещали в чистый самоэмульгирующийся концентрат на стадии (2) и помещали в осциллятор на воздушной бане с температурой 25°C и скоростью вращения 210 об/мин. После полного растворения комплекса байкалеин-фосфолипид получали самоэмульгирующуюся композицию байкалеина. Определяли нагрузку лекарственного средства и размер частиц после эмульгирования. Результаты показаны в таблице 4.
Таблица 4. Самоэмульгирующиеся композиции байкалеина, полученные с использованием различных эмульгаторов
Пример 10. Самоэмульгирующиеся композиции байкалеина, полученные с использованием различных соэмульгаторов с комплексом байкалеин-фосфолипид в качестве промежуточного соединения
(1) Байкалеин и фосфолипиды соевых бобов подавали в массовом соотношении 1:3,5 (вес./вес.), обеспечивали реакцию сочетания с тетрагидрофураном в качестве растворителя, затем удаляли органический растворитель и высушивали с получением комплекса байкалеин-фосфолипид.
(2) С этилолеатом в качестве масляной фазы и лаброзолом в качестве эмульгатора и с использованием различных соэмульгаторов, показанных в таблице 5, масляную фазу, эмульгатор и соэмульгатор точно взвешивали в соотношении 2:5:3, помещали в подходящий контейнер и смешивали до однородности с получением самоэмульгирующегося концентрата.
(3) Соответствующее количество комплекса байкалеин-фосфолипид на стадии (1) (подаваемого в соответствии с содержанием лекарственного средства 50 мг/г) взвешивали, помещали в чистый самоэмульгирующийся концентрат на стадии (2) и помещали в осциллятор на воздушной бане с температурой 25°C и скоростью вращения 210 об/мин. После полного растворения комплекса байкалеин-фосфолипид получали самоэмульгирующуюся композицию байкалеина. Определяли нагрузку лекарственного средства и размер частиц после эмульгирования. Результаты показаны в таблице 5.
Таблица 5. Самоэмульгирующиеся композиции байкалеина, полученные с использованием различных соэмульгаторов
Пример 11. Самоэмульгирующиеся композиции байкалеина, полученные при различных соотношениях масляной фазы, эмульгатора и соэмульгатора с комплексом байкалеин-фосфолипид в качестве промежуточного соединения
(1) Байкалеин и фосфолипиды соевых бобов подавали в массовом соотношении 1:3,5 (вес./вес.), обеспечивали реакцию сочетания с тетрагидрофураном в качестве растворителя, затем удаляли органический растворитель и высушивали с получением комплекса байкалеин-фосфолипид.
(2) С этилолеатом в качестве масляной фазы, лаброзолом в качестве эмульгатора и транскутолом HP в качестве соэмульгатора масляная фаза, эмульгатор и соэмульгатор точно взвешивали при различных соотношениях масляной фазы, эмульгатора и соэмульгатора в таблице 6, помещали в соответствующий контейнер и смешивали до однородности с получением чистого самоэмульгирующегося концентрата.
(3) Соответствующее количество комплекса байкалеин-фосфолипид на стадии (1) (подаваемого в соответствии с нагрузкой лекарственного средства 50 мг/г) взвешивали, помещали в чистый самоэмульгирующийся концентрат на стадии (2) и помещали в осциллятор на воздушной бане с температурой 25°C и скоростью вращения 210 об/мин. После полного растворения комплекса байкалеин-фосфолипид получали самоэмульгирующуюся композицию байкалеина. Определяли нагрузку лекарственного средства и размер частиц после эмульгирования. Результаты показаны в таблице 6.
Таблица 6. Самоэмульгирующиеся композиции байкалеина, полученные при различных соотношениях масляной фазы, эмульгатора и соэмульгатора
Пример 12. Самоэмульгирующиеся композиции байкалеина с различными содержаниями лекарственного средства, полученные с комплексом байкалеин-фосфолипид в качестве промежуточного соединения
(1) Байкалеин и фосфолипиды соевых бобов подавали в массовом соотношении 1:3,5 (вес./вес.), обеспечивали реакцию сочетания с тетрагидрофураном в качестве растворителя, затем удаляли органический растворитель и высушивали с получением комплекса байкалеин-фосфолипид.
(2) С этилолеатом в качестве масляной фазы, лаброзолом в качестве эмульгатора и транскутолом HP в качестве соэмульгатора, масляную фазу, эмульгатор и соэмульгатор точно взвешивали в соотношении 2:5:3, помещали в соответствующий контейнер и смешивали до однородности с получением чистого самоэмульгирующегося концентрата.
(3) Различные количества комплекса байкалеин-фосфолипид на стадии (1) взвешивали, помещали в чистый самоэмульгирующийся концентрат на стадии (2) и помещали в осциллятор на воздушной бане с температурой 25°C и скоростью вращения 210 об/мин. После полного растворения комплекса байкалеин-фосфолипид получали самоэмульгирующиеся композиции байкалеина с различными содержаниями лекарственного средства. Определяли содержание лекарственного средства и размер частиц после эмульгирования. Результаты показаны в таблице 7.
Таблица 7. Самоэмульгирующиеся композиции байкалеина с различной нагрузкой лекарственного средства
Пример 13. Самоэмульгирующиеся композиции байкалеина, полученные с комплексами байкалеин-фосфолипид с различными соотношениями лекарственное средство-липид в качестве промежуточных соединений
(1) С этилолеатом в качестве масляной фазы, лаброзолом в качестве эмульгатора и транскутолом HP в качестве соэмульгатора, масляную фазу, эмульгатор и соэмульгатор точно взвешивали в соотношении 2:5:3, помещали в соответствующий контейнер и смешивали до однородности с получением чистого самоэмульгирующегося концентрата.
(2) Серию комплексов байкалеин-фосфолипид в примере 1 (подаваемых в соответствии с нагрузкой лекарственного средства 100 мг/г) взвешивали, помещали в чистый самоэмульгирующийся концентрат на стадии (1) и помещали в осциллятор с воздушной баней при температуре 25°C и скорости вращения 210 об/мин. После полного растворения комплекса байкалеин-фосфолипид получали самоэмульгирующуюся композицию байкалеина. Определяли нагрузку лекарственного средства и размер частиц после эмульгирования. Результаты показаны в таблице 8.
Таблица 8. Самоэмульгирующиеся композиции байкалеина, полученные с использованием комплексов байкалеин-фосфолипид с различными соотношениями лекарственное средство-липид
Пример 14. получение различных самоэмульгирующихся композиций лекарственного средства на основе полифенола флавоноидного ряда
(1) С этилолеатом в качестве масляной фазы, лаброзолом в качестве эмульгатора и транскутолом HP в качестве соэмульгатора, масляную фазу, эмульгатор и соэмульгатор точно взвешивали в соотношении 2:5:3, помещали в соответствующий контейнер и смешивали до однородности с получением чистого самоэмульгирующегося концентрата.
(2) Серию комплексов лекарственного средства на основе полифенола флавоноидного ряда и фосфолипида (подаваемых в соответствии с содержанием лекарственного средства 20 мг/г для получения композиций SEDDS-31, SEDDS-32, SEDDS-33 и SEDDS-34 и подаваемых в соответствии с нагрузкой лекарственного средства 100 мг/г для получения композиций SEDDS-35, SEDDS-36, SEDDS-37 и SEDDS-38) взвешивали, помещали в чистый самоэмульгирующийся концентрат на стадии (1) и помещали в осциллятор с воздушной баней при температуре 25°C и скорости вращения 210 об/мин. После полного растворения комплекса лекарственного средства на основе полифенола флавоноидного ряда и фосфолипида получали самоэмульгирующуюся композицию лекарственного средства на основе полифенола флавоноидного ряда. Определяли нагрузку лекарственного средства и размер частиц после эмульгирования. Получали самоэмульгирующиеся композиции лекарственного средства на основе полифенола флавоноидного ряда с различной нагрузкой лекарственного средства и различными размерами частиц. Результаты показаны в таблице 9.
Таблица 9. Самоэмульгирующиеся композиции лекарственного средства на основе полифенола флавоноидного ряда, полученные с использованием различных комплексов лекарственного средства на основе полифенола флавоноидного ряда и фосфолипида
Как видно из результатов примеров 6-14, все самоэмульгирующиеся композиции лекарственного средства на основе полифенола флавоноидного ряда по настоящему изобретению могут быстро эмульгировать с образованием наноразмерных капель. Самоэмульгирующиеся композиции лекарственного средства на основе полифенола флавоноидного ряда с различной нагрузкой лекарственного средства получены в примерах 7-12. Самоэмульгирующаяся композиция лекарственного средства на основе полифенола флавоноидного ряда по настоящему изобретению характеризуется нагрузкой лекарственного средства более чем 100 мг/г, если требуется.
Тестовый пример 1. Исследование физической стабильности самоэмульгирующейся композиции байкалеина по настоящему изобретению, самоэмульгирующихся микроэмульсий флавоноидного полифенола в документах 2-7 и самоэмульгирующейся композиции в сравнительном примере 1
(1) Сравнительный пример 1. Получение самоэмульгирующейся композиции байкалеина, инкапсулирующей ингредиент байкалеина.
Масляную фазу, эмульгатор и соэмульгатор точно взвешивали с этилолеатом в качестве масляной фазы, Tween 80 в качестве эмульгатора и транскутолом HP в качестве соэмульгатора, масляную фазу, эмульгатор и соэмульгатор точно взвешивали в соотношении 2:5:3, помещали в соответствующий контейнер и смешивали до однородности с получением чистого самоэмульгирующегося концентрата. Ингредиент байкалеина взвешивали, помещали в чистый самоэмульгирующийся концентрат и помещали в осциллятор с воздушной баней при температуре 25°C и скоростью вращения 210 об/мин, оставляли осциллировать в течение 24 часов и центрифугировали при 12000 об/мин в течение 15 мин. Супернатант отбирали с получением самоэмульгирующейся композиции байкалеинового ингредиента, инкапсулирующей байкалеин.
(2) Сравнительный пример 2. Получение самоэмульгирующейся композиции для комплекса силимарин-фосфолипид
В соответствии со способом в Studies on Self-Microemulsifying Drug Delivery Systems (SMEDDS) of Silymarin and Silymarin-Phospholipid Complex [D] (Linjie LIU, Шэньян, Шэньянский фармацевтический университет, 2007) с ацетоном в качестве растворителя, силимарин и фосфолипиды сои с массовым соотношением 1:1 нагревали с обратным холодильником при 55°C, концентрировали при пониженном давлении до объема жидкости, быстро добавляли к н-гексану с получением желтого осадка. Верхнюю жидкость, которая представляла собой желто-белую эмульсию, фильтровали при пониженном давлении, и осадок промывали н-гексаном, и высушивали в вакуумном сушильном шкафу при комнатной температуре с получением желто-белых твердых веществ, т.е. комплекса силимарин-фосфолипид. Взвешивали 70 г комплекса силимарин-фосфолипид, добавляли 250 г смеси этилолеата и МСТ (1:1), перемешивали на вортексе до растворения, добавляли 200 г Cremophor EL и 50 г транскутола и осторожно перемешивали на водяной бане при 37°C с получением самоэмульгирующейся композиции.
(3) В соответствии с рецептурами и способами получения, описанными в документах 2-7 (как описано в уровне техники настоящей заявки), были получены соответственно самоэмульгирующаяся микроэмульсия проантоцианидина YZ-1, самоэмульгирующаяся микроэмульсия кверцетина YZ-2, самоэмульгирующаяся микроэмульсия куркумина YZ-3, самоэмульгирующаяся микроэмульсия ресвератрола YZ-4, самоэмульгирующаяся микроэмульсия байкалеина YZ-5 и самоэмульгирующаяся микроэмульсия байкалеина YZ-6.
(4) YZ-1, YZ-2, YZ-3, YZ-4, YZ-5, YZ-6, самоэмульгирующуюся композицию в сравнительном примере 1, и самоэмульгирующуюся композицию силимарина в сравнительном примере 2, и самоэмульгирующуюся композицию байкалеина, самоэмульгирующуюся композицию проантоцианидина, самоэмульгирующуюся композицию кверцетина, самоэмульгирующуюся композицию куркумина и самоэмульгирующуюся композицию ресвератрола, полученные в приведенных выше примерах настоящего изобретения, помещали при 4°C и комнатной температуре в течение 5 дней, одного месяца и двух месяцев по отдельности. Наблюдали за изменениями внешнего вида и исследовали физическую стабильность. Соответствующие результаты показаны в таблице 10.
Таблица 10
Результаты показывают, что серии самоэмульгирующихся композиций лекарственного средства на основе полифенола флавоноидного ряда, полученные в соответствии с документами 2-7 и сравнительными примерами 1 и 2, легко образуют полутвердые вещества или осадки после размещения при 4°C, и осадки лекарственного средства появляются после размещения при комнатной температуре в течение 1-2 месяцев, демонстрируя плохую стабильность.
Самоэмульгирующиеся композиции лекарственного средства на основе полифенола флавоноидного ряда с комплексами лекарственного средства на основе полифенола флавоноидного ряда и фосфолипида в качестве носителей в настоящем изобретении по-прежнему остаются светлыми и прозрачными по внешнему виду и имеют высокую стабильность после размещения при 4°C и комнатной температуре в течение 2 месяцев.
Тестовый пример 2. Исследование фармакокинетики плазмы
(1) Получение самоэмульгирующейся композиции байкалеина с комплексом байкалеин-фосфолипид в качестве промежуточного соединения
(a) Байкалеин и фосфолипиды соевых бобов подавали в массовом соотношении 1:3,5 (вес./вес.), обеспечивали реакцию сочетания с тетрагидрофураном в качестве растворителя, затем удаляли органический растворитель и высушивали с получением комплекса байкалеин-фосфолипид. (b) Масляную фазу, эмульгатор и соэмульгатор точно взвешивали с этилолеатом в качестве масляной фазы, Tween 80 в качестве эмульгатора и транскутолом HP в качестве соэмульгатора, масляную фазу, эмульгатор и соэмульгатор точно взвешивали в соотношении 2:5:3, помещали в соответствующий контейнер и смешивали до однородности с получением чистого самоэмульгирующегося концентрата. (c) Соответствующее количество комплекса байкалеин-фосфолипид на стадии (a) взвешивали, помещали в чистый самоэмульгирующийся концентрат на стадии (b) и помещали в осциллятор на воздушной бане с температурой 25°C и скоростью вращения 210 об/мин. После полного растворения комплекса байкалеин-фосфолипид получали самоэмульгирующуюся композицию байкалеина. Самоэмульгирующаяся композиция была полностью эмульгирована в течение 1 мин после 100-кратного разбавления водой, и при этом было определено, что размер частиц составлял 10 нм, и нагрузка лекарственного средства составляла 20 мг/г.
(2) Тестовые группы
Тестовая группа A: вводили самоэмульгирующуюся композицию байкалеина, полученную с комплексом байкалеин-фосфолипид в качестве промежуточного соединения на предыдущей стадии (1) настоящего изобретения (далее обозначенную как BAPC-SMEDDS).
Тестовая группа B: вводили самоэмульгирующуюся композицию байкалеина, инкапсулирующую ингредиент байкалеина в сравнительном примере 1 (далее обозначенную как OBA-SMEDDS).
Тестовая группа C: вводили ингредиент байкалеина (далее обозначенный как BA).
(3) Тестируемые животные
Крыс Sprague-Dawley (самцы, 200 г) кормили в течение одной недели перед тестами, им запрещалось есть, но не пить за ночь перед тестами, и им свободно давали воду во время тестов.
(4) Режим введения и дозировка
Разделяли случайным образом 15 крыс на три группы (тестовая группа A, тестовая группа B и тестовая группа C по отдельности) с 5 крысами в каждой группе. Через желудочный зонд (2-3 мл) вводили дозу 40 мг/кг. Отбирали 0,3 мл крови из ретроорбитального венозного сплетения через 5, 15, 30, 45, 60 и 75 мин и через 3, 6, 8, 10, 12 и 24 ч после введения, помещали в предварительно гепаринизированную коническую центрифужную пробирку объемом 1,5 мл и центрифугировали при 4000 об/мин в течение 15 мин Верхнюю плазму аспирировали, хранили в холодильнике при -80°C и оттаивали при нормальной температуре перед определением.
(5) Определение концентрации в плазме
Обработка образцов плазмы: отбирали 100 мкл плазмы, помещали в коническую центрифужную пробирку объемом 1,5 мл, добавляли 10 мкл аскорбиновой кислоты (200 мг/мл), 20 мкл раствора внутреннего стандарта (500 нг/мл) и 300 мкл метанола, перемешивали на вортексе в течение 60 с и центрифугировали при 12000 об/мин в течение 10 мин Затем супернатант аспирировали, помещали в центрифужную пробирку, концентрировали посредством центрифугирования для удаления растворителя (40°C), добавляли 200 мкл смеси метанол:вода (80:20) до растворения, перемешивали на вортексе в течение 30 с и центрифугировали при 12000 об/мин в течение 5 мин. Инъектировали 20 мкл супернатанта и определяли концентрацию в плазме при следующих условиях хроматографии (жидкостная хроматография-масс-спектрометрия).
Условия HPLC
Хроматографическая колонка: колонка Agilent ZORBAX SB C18 (250 мм × 4,6 мм, 5 мкм);
скорость потока: 1,0 мл/мин;
объем инъекции: 20 мкл;
температура колонки: 25°C;
Подвижная фаза (градиент элюирования, см. таблицу 11): ацетонитрил-0,1% муравьиная кислота в качестве элюента.
Таблица 11. Градиентное элюирование подвижной фазы LC
Условия масс-спектрометрии:
источник ионов электрораспыления (ESI), режим положительных ионов, контрольное наблюдение множественных реакций (MRM).
Другие параметры: давление распылителя 40 фунтов/кв. дюйм, скорость потока сушильного газа 9 л/мин, температура сушильного газа 350°C, капиллярное напряжение 4000 В и соотношение деления 1:2.
Ионная пара выявления MRM для количественного определения: байкалин [M+H] + 447,0 → 271,1;
байкалеин [M+H] + 271,1 → 122,8;
6-гидроксифлавон [M+H] + 239,0 → 137,0.
(6) Результаты тестов
6.1. После приема внутрь байкалеин быстро метаболизируется в байкалин в эпителиальных клетках кишечника и тканях печени. Кривая «концентрация-время» байкалина в плазме крови и соответствующие фармакокинетические параметры показаны на ФИГ. 1 и в таблице 12.
Результаты показывают, что Cmax и AUC(0-t) самоэмульгирующейся композиции байкалеина с комплексом байкалеин-фосфолипид в качестве промежуточного соединения по настоящему изобретению в 7,7 и 4,5 раза выше, чем у ингредиента байкалеина соответственно и в 1,9 раза и 1,3 раза выше, чем у самоэмульгирующейся композиции байкалеина, инкапсулирующей байкалеин, соответственно. Относительная биодоступность BAPC-SMEDDS и относительная биодоступность OBA-SMEDDS (относительно ингредиента байкалеина), рассчитанная на основе концентрации байкалина в плазме, составляла 448,7% и 342,5% соответственно.
Таблица 12. Фармакокинетические параметры байкалина в плазме крови
6.2. Кривая «концентрация-время» байкалеина в плазме крови и соответствующие фармакокинетические параметры показаны на ФИГ. 2 и в таблице 13. Cmax и AUC(0-t) самоэмульгирующейся композиции байкалеина с комплексом байкалеин-фосфолипид в качестве промежуточного соединения по настоящему изобретению в 4,6 и 3,7 раза выше, чем у ингредиента байкалеина соответственно и в 1,9 раза и 1,2 раза выше, чем у самоэмульгирующейся композиции байкалеина, инкапсулирующей байкалеин, соответственно. Относительная биодоступность BAPC-SMEDDS и относительная биодоступность OBA-SMEDDS (относительно ингредиента байкалеина), рассчитанная на основе концентрации байкалеина в плазме, составляла 374,4% и 302,3% соответственно.
Таблица 13. Фармакокинетические параметры байкалеина в плазме крови
Группа изобретений относится к области фармацевтики, а именно к самоэмульгирующейся композиции лекарственного средства на основе полифенола флавоноидного ряда для получения лекарственных средств для лечения заболеваний, способу получения вышеуказанной композиции, фармацевтической композиции для получения лекарственных средств для лечения заболеваний, содержащей вышеуказанную самоэмульгирующуюся композицию, и применению вышеуказанной самоэмульгирующейся композиции или вышеуказанной фармацевтической композиции для получения лекарственных средств для лечения заболеваний. Самоэмульгирующаяся композиция лекарственного средства на основе полифенола флавоноидного ряда для получения лекарственных средств для лечения заболеваний, выбранных из группы: против бактерий, против вирусов, противовоспалительных средств, средств для подавления аллергии, средств для регуляции иммунитета, противоопухолевых средств, антиоксидантов, омолаживающих средств, средств против ультрафиолетового излучения, средств для лечения недостатка гормонов, средств против гипертонии, средств для снижения содержания жиров в крови, средств против атеросклероза, средств против сенильной деменции, средств для лечения энтеровирусного везикулярного стоматита, средств против остеопороза или средств для защиты печени, содержащая комплекс лекарственного средства на основе полифенола флавоноидного ряда и фосфолипида, масляную фазу, эмульгатор и соэмульгатор, где лекарственное средство на основе полифенола флавоноидного ряда представляет собой байкалеин; массовое соотношение байкалеина и фосфолипида составляет 1:1-1:8; масляная фаза представляет собой одно или более, выбранных из группы, состоящей из этилолеата, изопропилмиристата и глицерида каприловой/каприновой кислоты; эмульгатор представляет собой одно или более, выбранных из группы, состоящей из полиэтиленгликольглицерида каприловой/каприновой кислоты, Tween 80, октилфенилполиоксиэтиленового эфира; соэмульгатор представляет собой монокаприлата пропиленгликоля и/или моноэтилового эфира диэтиленгликоля; и в пересчете на общую массовую долю масляной фазы, эмульгатора и соэмульгатора, составляющую 100%, масляная фаза составляет 10-30%, эмульгатор составляет 40-60% и соэмульгатор составляет 30-40%. Способ получения вышеуказанной самоэмульгирующейся композиции лекарственного средства на основе полифенола флавоноидного ряда, включающий следующие стадии получения: (1) получают комплекс лекарственного средства на основе полифенола флавоноидного ряда и фосфолипида: лекарственное средство на основе полифенола флавоноидного ряда и фосфолипид растворяют в органическом растворителе, обеспечивают реакцию сочетания и высушивают с удалением органического растворителя с получением комплекса лекарственного средства на основе полифенола флавоноидного ряда и фосфолипида; (2) получают самоэмульгирующуюся композицию лекарственного средства на основе полифенола флавоноидного ряда: комплекс лекарственного средства на основе полифенола флавоноидного ряда и фосфолипида, полученный на стадии (1), полностью смешивают с масляной фазой, эмульгатором и соэмульгатором в любой последовательности. Фармацевтическая композиция для получения лекарственных средств для лечения заболеваний, выбранных из группы: против бактерий, против вирусов, противовоспалительных средств, средств для подавления аллергии, средств для регуляции иммунитета, противоопухолевых средств, антиоксидантов, омолаживающих средств, средств против ультрафиолетового излучения, средств для лечения недостатка гормонов, средств против гипертонии, средств для снижения содержания жиров в крови, средств против атеросклероза, средств против сенильной деменции, средств для лечения энтеровирусного везикулярного стоматита, средств против остеопороза или средств для защиты печени, содержащая вышеуказанную самоэмульгирующуюся композицию лекарственного средства на основе полифенола флавоноидного ряда и фармацевтически приемлемое вспомогательное вещество. Применение вышеуказанной самоэмульгирующейся композиции лекарственного средства на основе полифенола флавоноидного ряда или вышеуказанной фармацевтической композиции для получения лекарственных средств для лечения заболеваний, выбранных из группы: против бактерий, против вирусов, противовоспалительных средств, средств для подавления аллергии, средств для регуляции иммунитета, противоопухолевых средств, антиоксидантов, омолаживающих средств, средств против ультрафиолетового излучения, средств для лечения недостатка гормонов, средств против гипертонии, средств для снижения содержания жиров в крови, средств против атеросклероза, средств против сенильной деменции, средств для лечения энтеровирусного везикулярного стоматита, средств против остеопороза или средств для защиты печени. Вышеуказанная группа изобретений позволяет увеличить нагрузку композиции лекарственным средством, увеличить стабильность и биодоступность композиций. 4 н. и 13 з.п. ф-лы, 2 ил., 13 табл., 16 пр.
1. Самоэмульгирующаяся композиция лекарственного средства на основе полифенола флавоноидного ряда для получения лекарственных средств для лечения заболеваний, выбранных из группы: против бактерий, против вирусов, противовоспалительных средств, средств для подавления аллергии, средств для регуляции иммунитета, противоопухолевых средств, антиоксидантов, омолаживающих средств, средств против ультрафиолетового излучения, средств для лечения недостатка гормонов, средств против гипертонии, средств для снижения содержания жиров в крови, средств против атеросклероза, средств против сенильной деменции, средств для лечения энтеровирусного везикулярного стоматита, средств против остеопороза или средств для защиты печени, содержащая комплекс лекарственного средства на основе полифенола флавоноидного ряда и фосфолипида, масляную фазу, эмульгатор и соэмульгатор, где лекарственное средство на основе полифенола флавоноидного ряда представляет собой байкалеин;
массовое соотношение байкалеина и фосфолипида составляет 1:1-1:8;
масляная фаза представляет собой одно или более, выбранных из группы, состоящей из этилолеата, изопропилмиристата и глицерида каприловой/каприновой кислоты;
эмульгатор представляет собой одно или более, выбранных из группы, состоящей из полиэтиленгликольглицерида каприловой/каприновой кислоты, Tween 80, октилфенилполиоксиэтиленового эфира;
соэмульгатор представляет собой монокаприлата пропиленгликоля и/или моноэтилового эфира диэтиленгликоля; и
в пересчете на общую массовую долю масляной фазы, эмульгатора и соэмульгатора, составляющую 100%, масляная фаза составляет 10-30%, эмульгатор составляет 40-60% и соэмульгатор составляет 30-40%.
2. Самоэмульгирующаяся композиция лекарственного средства на основе полифенола флавоноидного ряда по п. 1, где самоэмульгирующаяся композиция лекарственного средства на основе полифенола флавоноидного ряда имеет размер частиц после эмульгирования 10-1000 нм.
3. Самоэмульгирующаяся композиция лекарственного средства на основе полифенола флавоноидного ряда по п. 1 или 2, где фосфолипиды представляют собой одно или более, выбранных из группы, состоящей из природных фосфолипидов и синтетических фосфолипидов;
где природные фосфолипиды включают одно или более, выбранных из группы, состоящей из фосфолипида соевых бобов и фосфолипида яичного желтка;
где синтетические фосфолипиды включают одно или более, выбранных из группы, состоящей из фосфоглицерида, сфингомиелина, фосфатидилхолина, фосфатидилэтаноламина, фосфатидилсерина, фосфатидилинозитола,
фосфатидилсеринглицерина, глицерофосфатидной кислоты,
дистеарилфосфатидилхолина, дипальмитоилфосфатидилхолина, дипальмитоилфосфатидилэтаноламина и димиристоилфосфатидилхолина.
4. Самоэмульгирующаяся композиция лекарственного средства на основе полифенола флавоноидного ряда по п. 3, где синтетические фосфолипиды представляют собой одно или более, выбранных из группы, состоящей из фосфатидилхолина, фосфатидилэтаноламина, фосфатидилглицерина и глицерофосфатидной кислоты.
5. Самоэмульгирующаяся композиция лекарственного средства на основе полифенола флавоноидного ряда по п. 1 или 2, где глицерид каприловой/каприновой кислоты представляет собой триглицерид каприловой/каприновой кислоты.
6. Самоэмульгирующаяся композиция лекарственного средства на основе полифенола флавоноидного ряда по п. 1 или 2, где самоэмульгирующаяся композиция лекарственного средства на основе полифенола флавоноидного ряда характеризуется нагрузкой лекарственного средства, составляющей 10-110 мг/г.
7. Самоэмульгирующаяся композиция лекарственного средства на основе полифенола флавоноидного ряда по п. 6, где самоэмульгирующаяся композиция лекарственного средства на основе полифенола флавоноидного ряда характеризуется нагрузкой лекарственного средства, составляющей 10-100 мг/г.
8. Способ получения самоэмульгирующейся композиции лекарственного средства на основе полифенола флавоноидного ряда по любому из пп. 1-7, включающий следующие стадии получения:
(1) получают комплекс лекарственного средства на основе полифенола флавоноидного ряда и фосфолипида: лекарственное средство на основе полифенола флавоноидного ряда и фосфолипид растворяют в органическом растворителе, обеспечивают реакцию сочетания и высушивают с удалением органического растворителя с получением комплекса лекарственного средства на основе полифенола флавоноидного ряда и фосфолипида;
(2) получают самоэмульгирующуюся композицию лекарственного средства на основе полифенола флавоноидного ряда: комплекс лекарственного средства на основе полифенола флавоноидного ряда и фосфолипида, полученный на стадии (1), полностью смешивают с масляной фазой, эмульгатором и соэмульгатором в любой последовательности.
9. Способ по п. 8, где на стадии (1) органический растворитель представляет собой одно или более, выбранных из группы, состоящей из этилацетата, тетрагидрофурана, метанола, ацетона, этанола, абсолютного этанола, н-пропанола, изопропанола, н-бутанола, изобутанола, трет-бутанола, диэтилового эфира, метилэтилового эфира, диоксана, бутанона, петролейного эфира, гексана, циклогексана, дихлорметана, хлороформа, тетрахлорида углерода, DMSO и DMF.
10. Способ по п. 9, где на стадии (1) органический растворитель представляет собой одно или более, выбранных из группы, состоящей из этилацетата, тетрагидрофурана, метанола, этанола, циклогексана, DMSO и DMF.
11. Способ по п. 8, где на стадии (2) комплекс лекарственного средства на основе полифенола флавоноидного ряда и фосфолипида, полученный на стадии (1), полностью смешивают непосредственно с масляной фазой, эмульгатором и соэмульгатором.
12. Способ по п. 8, где на стадии (2) масляную фазу, эмульгатор и соэмульгатор смешивают до однородности с получением чистого самоэмульгирующегося концентрата, а затем комплекс лекарственного средства на основе полифенолафлавоноидного ряда и фосфолипида, полученный на стадии (1), добавляют к полученному чистому самоэмульгирующемуся концентрату и полностью смешивают с ним.
13. Способ по п. 8, где на стадии (2) комплекс лекарственного средства на основе полифенола флавоноидного ряда и фосфолипида, полученный на стадии (1), растворяют в любом из масляной фазы, эмульгатора или соэмульгатора, а затем добавляют два других из масляной фазы, эмульгатора или соэмульгатора и полностью смешивают.
14. Фармацевтическая композиция для получения лекарственных средств для лечения заболеваний, выбранных из группы: против бактерий, против вирусов, противовоспалительных средств, средств для подавления аллергии, средств для регуляции иммунитета, противоопухолевых средств, антиоксидантов, омолаживающих средств, средств против ультрафиолетового излучения, средств для лечения недостатка гормонов, средств против гипертонии, средств для снижения содержания жиров в крови, средств против атеросклероза, средств против сенильной деменции, средств для лечения энтеровирусного везикулярного стоматита, средств против остеопороза или средств для защиты печени, содержащая самоэмульгирующуюся композицию лекарственного средства на основе полифенола флавоноидного ряда по любому из пп. 1-7 и фармацевтически приемлемое вспомогательное вещество.
15. Фармацевтическая композиция по п. 14, где лекарственная форма фармацевтической композиции предусматривает препарат для перорального введения, препарат для инъекции, препарат для трансдермального введения, препарат для введения через слизистые оболочки, препарат для введения посредством ингаляции в легкие или препарат для энтерального введения.
16. Фармацевтическая композиция по п. 14, где лекарственная форма фармацевтической композиции предусматривает капли, жидкости для перорального введения, таблетки, капсулы, гранулы, инфузионные гранулы, пленки, гель, порошки, эмульсии, микропилюли, суппозитории, аэрозоли, спреи, порошковые аэрозоли, пластыри, лейкопластыри, растворы, мази или крем.
17. Применение самоэмульгирующейся композиции лекарственного средства на основе полифенола флавоноидного ряда по любому из пп. 1-7 или фармацевтической композиции по любому из пп. 14-16 для получения лекарственных средств для лечения заболеваний, выбранных из группы: против бактерий, против вирусов, противовоспалительных средств, средств для подавления аллергии, средств для регуляции иммунитета, противоопухолевых средств, антиоксидантов, омолаживающих средств, средств против ультрафиолетового излучения, средств для лечения недостатка гормонов, средств против гипертонии, средств для снижения содержания жиров в крови, средств против атеросклероза, средств против сенильной деменции, средств для лечения энтеровирусного везикулярного стоматита, средств против остеопороза или средств для защиты печени.
| WU H | |||
| et al | |||
| Combined use of phospholipid complexes and self-emulsifying microemulsions for improving the oral absorption of a BCS class IV compound, baicalin // Acta Pharmaceutica Sinica B | |||
| Способ защиты переносных электрических установок от опасностей, связанных с заземлением одной из фаз | 1924 |
|
SU2014A1 |
| Очаг для массовой варки пищи, выпечки хлеба и кипячения воды | 1921 |
|
SU4A1 |
| Искусственный двухслойный мельничный жернов | 1921 |
|
SU217A1 |
| LIU W | |||
| et al | |||
| Preparation and evaluation of self-microemulsifying drug delivery system of baicalein // Fitoterapia | |||
| Изложница с суживающимся книзу сечением и с вертикально перемещающимся днищем | 1924 |
|
SU2012A1 |
Авторы
Даты
2023-04-18—Публикация
2020-04-08—Подача