Изобретение относится к области органической химии, а именно к новым борсодержащим производным природных азагетероциклических соединений, которые обладают низкой токсичностью, способностью накапливаться в опухолевых клетках и могут найти применение в качестве агентов для бор-нейтронозахватной терапии опухолевых заболеваний.
На сегодняшний день онкологические заболевания имеют широчайшее распространение по всему миру. Несмотря на имеющиеся успехи в области терапии опухолей, число зарегистрированных случаев рака увеличивается с каждым годом. По данным Международного агентства по изучению рака, в 2020 г. выявлено около 19,3 миллионов новых случаев заболевания раком; смертность от онкологических заболеваний достигла в 2020 г. 10 миллионов человек [Sung H. et al. CA: Cancer J. Clin. 2021, 71, 209]. Подходы к лечению большинства видов рака включают в себя хирургическое лечение, медикаментозную терапию, радиотерапию и комбинацию данных методов [Miller K.D. et al. CA: Cancer J. Clin. 2022, in press. DOI: 10.3322/caac.21731]. В последнее время в качестве самостоятельного и вспомогательного метода лечения неоперабельных форм рака используется бор-нейтронозахватная терапия (БНЗТ) [Miyatake S.-I. et al. J. Neuro-Oncol. 2020, 149, 1; Malouff T.D. et al. Front. Oncol. 2021, 11, 601820].
БНЗТ представляет собой современный бинарный подход к лечению опухолей. Данный метод предусматривает комбинированное использование двух компонентов: химического агента, доставляющего бор в опухолевые клетки, и облучения тепловыми или надтепловыми нейтронами. Тепловые нейтроны избирательно взаимодействуют с атомами 10B, вызывая их распад с испусканием альфа-частиц и ядер 7Li, длина пробега которых сопоставима с размером одной клетки. Избирательная доставка соединений, содержащих один или несколько атомов 10B, в опухолевые клетки делает возможным их избирательное повреждение под действием тепловых нейтронов. На сегодняшний день в клинике для БНЗТ используются два соединения: натриевая соль меркапто-клозо-додекаборана (борокаптат натрия, BSH) и 4-боронофенилаланин (BPA), отличающиеся низкой избирательностью биораспределения (BSH) и низким содержанием бора (BPA). Важным современным подходом к созданию новых, более эффективных, агентов для БНЗТ является получение борсодержащих аналогов биомолекул, способных избирательно транспортироваться в опухолевые клетки.
Известно, что клетки различных видов опухолей отличаются высоким уровнем накопления фолиевой кислоты и ее производных [Hilgenbrink A.R. et al. J. Pharm. Sci. 2005, 94, 2135; Ebrahimnejad P. et al. Drug Discovery Today 2022, 27, 471; Martín-Sabroso C. et al. Pharmaceutics 2022, 14, 14]. Фолиевая кислота использована в качестве основы потенциальных агенты доставки бора для БНЗТ [Achilli C. et al., Chem. Biol. Drug Des. 2014, 83, 532; Kettenbach K. et al. Radiochim. Acta 2015, 103, 799]. Синтез конъюгатов фолиевой кислоты с дикарба-клозо-додекабораном (клозо-карбораном), содержащих не более 11,3% бора по массе, отличается сложностью выделения и очистки. Амид фолиевой кислоты, содержащий остаток 4-аминофенилборной кислоты, обладает высокой гемотоксичностью
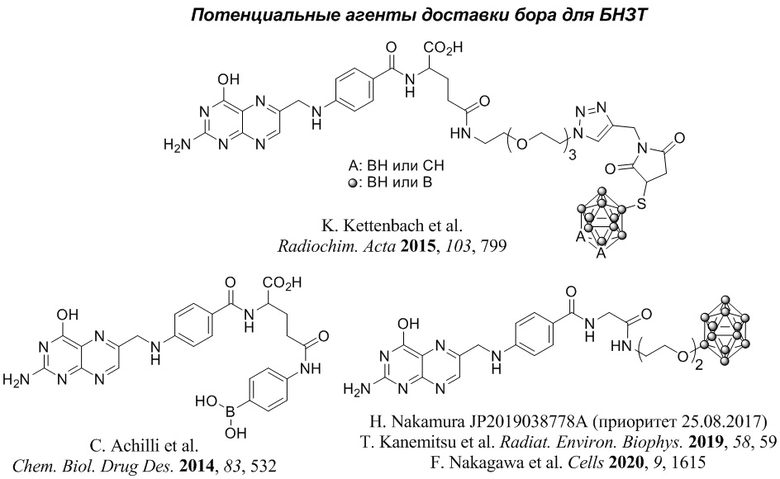
Известны также производные птероевой кислоты, содержащие остатки клозо-додекаборана, которые могут быть использованы в бор-нейтронозахватной терапии для лечения, прежде всего, глиом [Nakamura H. Патент JP 2019038778A (приоритет 25.08.2017); Nakagawa F. et al. Cells 2020, 9, 1615; Kanemitsu T. et al. Radiat. Environ. Biophys. 2019, 58, 59]. Существенным недостатком соединений данной группы является неспособность преодолевать гематоэнцефалический барьер и необходимость интратуморального введения для терапии глиомы.
Литературные данные свидетельствуют о том, что борсодержащие липосомы и наночастицы, содержащие остатки фолиевой кислоты, способны избирательно накапливаться в опухоли [Dai C.X. et al. Sci. China Life Sci. 2013, 56, 163; Achilli C. et al. Nanomedicine (N. Y., NY, U. S.) 2014, 10, 589; Singh A. et al. J. Biomed. Nanotechnol. 2019, 15, 1714]. Однако получение данных агентов доставки бора отличается высокой сложностью, требует использования дорогостоящего узкоспециализированного оборудования и тщательного физико-химического контроля на всех стадиях, а потенциальная гемотоксичность и сложность преодоления гисто-гематических барьеров осложняет использование на живых моделях [Wu G. et al. Anti-Cancer Agents Med. Chem. 2006, 6, 167].
Наиболее близким аналогом (прототипом) нашего технического решения являются α- и γ-замещенные производные фолиевой кислоты, имеющие борсодержащий заместитель полиэдрического строения и линкерный фрагмент, пригодные для использования в бор-нейтронозахватной терапии [Ollson L.-I. et al. Патент SE 528407 C2 (приоритет 19.08.2005)].

К существенным недостаткам прототипа следует относить низкий выход конечных соединений (7.5% на стадии получения моно-амида фолиевой кислоты) и сложная процедура их очистки, предусматривающая использование препаративной ВЭЖХ.
Задача предлагаемого изобретения – получение новой группы соединений, которые отличаются высоким содержанием бора, умеренной цитотоксичностью, способностью к транспортировке бора в опухолевые клетки и являются потенциальными препаратами для бор-нейтронозахватной терапии. Предпочтительно, чтобы растворимость соединений в воде составляла не менее 5 мг/мл, а выход при их синтезе составлял более 50% на каждой стадии.
Для решения поставленной задачи было решено проводить функционализацию фолиевой кислоты по обеим карбоксильным группам (для увеличения содержания бора и упрощения процедуры выделения и очистки соединений), а качестве борсодержащих фрагментов использовать первичные амины, содержащие остаток 7,8-дикарба-нидо-ундекаборана (нидо-карборана), который несет отрицательный заряд и может образовывать водорастворимые соли с ионами металлов.
Техническим результатом данного изобретения является создание новой группы химических соединений – бис-амидов фолиевой кислоты, содержащих остатки нидо-карборана, общей формулы 1.

Соединения формулы 1 могут быть получены исходя из (1,2-дикарба-клозо-додекаборан-1-ил)уксусной кислоты (2), 3-амино-1,2-дикарба-клозо-додекаборана (3) и трет-бутоксикарбонил-производных этилендиамина и 6-аминогексановой кислоты. Например, в результате конденсации кислоты 2 с Boc-этилендиамином методом смешанных ангидридов получен N1-Boc-N2-(клозо-карборан-1-ил)ацетилэтилендиамин (4a). В результате деборирования соединения 4a под действием фторида цезия и последующего удаления Boc-группы действием соляной кислоты получен 1-аммонио-2-(7,8-дикарба-нидо-ундекаборан-7-ил)ацетиламиноэтан (5a). Ацилирование 3-амино-клозо-карборана (3) Boc-6-аминогексановой кислотой методом смешанных ангидридов позволило получить 3-(6-Boc-аминогексаноил)амино-клозо-карборан (4b). Деборирование соединения 4b под действием фторида цезия и последующего удаления Boc-группы действием соляной кислоты давало 3-(6-аммониогексаноиламино)-7,8-дикарба-нидо-ундекаборан (5b).

Конденсацией фолиевой кислоты с аминами 5a,b карбодиимидным методом в присутствии 1-гидроксибензтриазола и триэтиламина получены соответствующие бис-амиды фолиевой кислоты 1a,b (общий выход соединений 1a и 1b до 70% и до 51% соответственно, считая на исходные производные клозо-карборана 2 и 3).
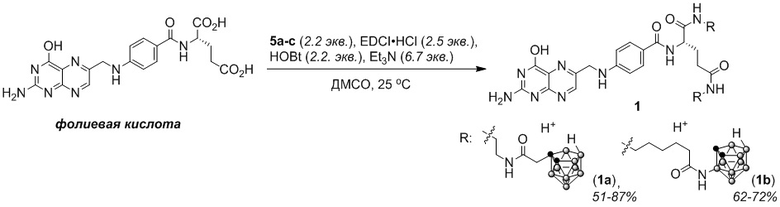
Растворимость конъюгатов 1a и 1b в 0,5% растворе NaHCO3 составляет 5,0–6,5 мг/мл, что открывает перспективы их использования для доставки бора в опухолевые клетки с целью бор-нейтронозахватной терапии.
Карборансодержащие производные фолиевой кислоты, описанные в настоящем изобретении, имеют следующие преимущества:
1. высокое содержание бора (20,9-22,0%) (позволяет использовать соединения в нетоксичных дозах и/или с природным изотопным распределением бора);
2. высокая растворимость в воде (5 мг/мл и выше) (делает возможным использование в опытах как in vitro, так и in vivo);
3. умеренная цитотоксичность (LD50 не менее 1,62 мг/мл для здоровых клеток) (снижает риск возникновения побочных эффектов);
4. способность обеспечивать накопление бора клетками, на поверхности которых имеются фолатные рецепторы (до 7,0 мкг B/106 клеток в случае глиобластомы U87 MG) (позволяет избирательно воздействовать на опухолевые клетки, в т.ч. неспособные накапливать BPA и BSH);
5. Простота получения (для очистки используется колоночная флеш-хроматография и переосаждение; нет необходимости в использовании сложных и высокотехнологичных методов, таких как препаративная ВЭЖХ).
Полученные соединения анализируют следующими методами:
Температуры плавления определяют на приборе SMP3 (Barloworld Scientific, UK). Удельное вращение определяют на поляриметре Perkin Elmer 341. Элементный анализ проводят на анализаторе Perkin Elmer 2400 серии II. Спектры ЯМР 1H, 11B и 13C регистрируют на приборе Bruker Avance 500 (рабочая частота 500, 160 и 125 МГц соответственно) в CDCl3 (соединение 4a) и (CD3)2SO (в остальных случаях) при 25°C с использованием тетраметилсилана в качестве внутреннего стандарта и комплекса BF3×Et2O в качестве внешнего стандарта. Химические сдвиги приведены в миллионных долях (м.д.), константы спин-спинового взаимодействия (J) – в герцах. Масс-спектры высокого разрешения (HRMS) получены на приборе Bruker maXis Impact HD; ионизация электрораспылением в позитивном или негативном режимах с прямым вводом образцов, газ-носитель – азот (скорость потока 4 л/мин).
Характеристики новых соединений 1a-c, 4a,b, 5а-c приведены в примерах конкретного выполнения.
Структуры полученных соединений подтверждают методами масс-спектрометрии высокого разрешения, элементного анализа, спектроскопии ЯМР 1H и 13С. Индивидуальность соединений подтверждают методами ТСХ и ЯМР 1H.
(1,2-Дикарба-клозо-додекаборан-1-ил)уксусную кислоту (2) и 3-амино-1,2-дикарба-клозо-додекаборан (3) получают из 1,2-дикарба-клозо-додекаборана в соответствии с литературными методами [Haushalter R.C. et al. J. Am. Chem. Soc. 1981, 103, 2620; Zakharkin L.I. et al. J. Organomet. Chem. 1969, 16, 371].
Примеры конкретного выполнения
Пример 1. Синтез 1-аммонио-2-(7,8-дикарба-нидо-ундекаборан-7-ил)ацетиламиноэтана (5a).
1-трет-Бутоксикарбониламино-2-(1,2-дикарба-клозо-додекаборан-1-ил)ацетил-аминоэтан (4a) (стадия 1).
К раствору (орто-карборан-1-ил)уксусной кислоты (2) (1,02 г, 5,02 ммоль) и N-метилморфолина (0,55 мл, 5,02 ммоль) в ТГФ (42 мл), охлажденному до −12 °C, добавляют этилхлорформиат (0,48 мл, 5,02 ммоль). Смесь перемешивают при −12 °C в течение 15 мин, затем добавляют раствор N-Boc-этилендиамина (0,92 г, 5,77 ммоль) и N,N-диэтиланилина (1,12 г, 7,53 ммоль) в ТГФ (35 мл). Реакционную смесь перемешивают при 20 °C в течение 20 ч, затем упаривают. К остатку добавляют EtOAc (50 мл) и последовательно промывают 10% раствором лимонной кислоты (3 × 25 мл), насыщенным раствором NaCl (2 × 25 мл), 5% раствором NaHCO3 (2 × 25 мл) и водой (25 мл). Органический слой высушивают Na2SO4, упаривают. Остаток перекристаллизовывают из смеси гексан–EtOAc (20 : 3 мл). Выход 1,41 г (82%), бесцветный порошок, т. пл. 142 °С (гексан–EtOAc). Спектр ЯМР 1H: δ = 1,46 (с, 9 H, Boc); 1,5–3,0 (уш. с, 9 Н, 9 × ВН); 3,05 (с, 2 Н, CH2-карборан); 3,28–3,34 (м, 4 Н, 2 × CH2-этилендиамин); 4,59 (с, 1 Н, СН-карборан); 4,93 (уш. с, 1 H, NH); 6,97 (c, 1 H, NH). Спектр ЯМР 11В{H}: δ = −2,20; −5,27; −9,56 (3 B); −10,67 (2 B); −11,85; −12,75 (2 B). Спектр ЯМР 13С{H}: δ = 28,35 (3C); 39,78; 41,91; 43,42; 58,68; 69,11; 80,67; 157,66; 166,75. HRMS (ESI+): найдено m/z 369,2944 [M + Na]+; вычислено для C11H2811B10N2NaO3 369,2923.
1-Аммонио-2-(7,8-дикарба-нидо-ундекаборан-7-ил)ацетиламиноэтан (5a) (стадия 2).
К раствору соединения 4a (1,35 г, 3,93 ммоль) в EtOH (110 мл) добавляют CsF (1,79 г, 11,79 ммоль). Смесь кипятят с обратным холодильником (на глицериновой бане) в течение 15 ч, затем упаривают. К остатку добавляют EtOAc (75 мл), полученный раствор промывают водой (3 × 40 мл). Органический слой высушивают Na2SO4 и упаривают. К остатку добавляют 1,4-диоксан (30 мл) и HCl конц. (6,6 мл, 79,15 ммоль). Смесь перемешивают при 20 °C в течение 3 ч, затем упаривают. К остатку добавляют EtOAc (50 мл) и воду (30 мл). Органический слой отделяют, промывают водой (2 × 20 мл), высушивают Na2SO4, упаривают. Выход 0,90 г (98%), бесцветная пена. Спектр ЯМР 1H: δ = −3,0…−2,3 (уш. с, 1 H, BH); −0,7…2,7 (уш. с, 8 Н, 8 × ВН); 1,86 (с, 1 Н, CH-карборан); 2,11 (д, J = 14,7 Гц, 1 Н, H-2’B); 2,42 (д, J = 14.7 Гц, 1 Н, H-2’A); 2,78–2,87 (м, 2 Н, 2 × H-2); 3,19–3,34 (м, 2 Н, 2 × H-1); 7,64 (т, J = 5,5 Гц, 1 H, NH); 7,67 (c, 3 H, NH3+). Спектр ЯМР 11В: δ = −10,68 (д, J = 133,4 Гц, 2 B); −14,30 (д, J = 146,0 Гц, 1 B); −16,98…−18,70 (м, 3 B); −22,21 (д, J = 164,5 Гц, 1 B); −33,34 (д, J = 103,8 Гц, 1 B); −37,17 (д, J = 107,4 Гц, 1 B). Спектр ЯМР 13С{H}: δ = 36,39; 40,5 (уш. с); 45,19; 46,34 (уш. с); 54,43 (уш. с); 171,98. Найдено: C 36,84; H 9,43; N 10,37. Вычислено для C8H25B9N2O (M 234,54): C 36,59; H 9,60; N 10,67. HRMS (ESI−): найдено m/z 235,2421 [M − H]−; вычислено для C6H2011B9N2O 235,2419.
Пример 2. Синтез 3-(6-аммониогексаноиламино)-7,8-дикарба-нидо-ундекаборана (5b).
3-[6-(трет-Бутоксикарбониламино)гексаноиламино]-1,2-дикарба-клозо-додекаборан (4b) (стадия 1).
К раствору Boc-6-аминогексановой кислоты (1,17 г, 5,07 ммоль) и N-метилморфолина (0,56 мл, 5,07 ммоль) в ТГФ (50 мл), охлажденному до −12 °C, добавляют этилхлорформиат (0,49 мл, 5,07 ммоль). Смесь перемешивают при −12 °C в течение 15 мин, затем добавляют раствор 3-амино-орто-карборана (3) (0,70 г, 4,41 ммоль) и N,N-диэтиланилина (1,32 г, 8,82 ммоль) в ТГФ (25 мл). Реакционную смесь перемешивают при 20 °C в течение 20 ч, затем упаривают. К остатку добавляют EtOAc (50 мл) и последовательно промывают 10% раствором лимонной кислоты (3 × 25 мл), насыщенным раствором NaCl (2 × 25 мл), 5% раствором NaHCO3 (2 × 25 мл) и водой (25 мл). Органический слой высушивают Na2SO4, упаривают. Остаток очищают флеш-хроматографией (элюент C6H6–EtOAc 9 : 1). Фракции, содержащие целевое соединение, объединяют, упаривают. Остаток растворяют в CH2Cl2 (50 мл), раствор промывают 8% водным раствором NaHCO3 (3 × 40 мл). Органический слой высушивают Na2SO4, упаривают. Выход 1,46 г (89%), бесцветный порошок, т. пл. 132–133 °С. Спектр ЯМР 1H: δ = 1,18–1,26 (м, 2 Н, 2 × H-4); 1,32–1,37 (м, 2 Н, 2 × H-3); 1,37 (с, 9 H, Boc); 1,4–2,8 (уш. с, 9 Н, 9 × ВН); 1,45–1,51 (м, 2 Н, 2 × H-5); 2,15–2,18 (м, 2 Н, 2 × H-2); 2,86–2,90 (м, 2 Н, 2 × H-6); 5,06 (с, 2 Н, 2×СН-карборан); 6,75 (т, 1 H, J = 5,3 Гц, NH-6); 8,22 (c, 1 H, NH-карборан). Спектр ЯМР 11В{H}: δ = −5,58 (3 B); −10,73; −13,46 (2 B); −15,11 (2 B). Спектр ЯМР 13С{H}: δ = 24,51; 25,84; 28,21 (3C); 29,21; 36,51; ~39,5 (перекрывается с сигналом DMSO-d6); 56,99 (2 C); 77,23; 155,51; 176,49. HRMS (ESI+): найдено m/z 375,3434 [M + H]+; вычислено для C13H3311B10N2O3 375,3438.
3-(6-Аммониогексаноиламино)-7,8-дикарба-нидо-ундекаборан (5b) (стадия 2).
К раствору соединения 4b (1,46 г, 3,93 ммоль) в EtOH (110 мл) добавляют CsF (1,79 г, 11,79 ммоль). Смесь кипятят с обратным холодильником (на глицериновой бане) в течение 15 ч, затем упаривают. К остатку добавляют EtOAc (75 мл), полученный раствор промывают водой (3 × 40 мл). Органический слой высушивают Na2SO4 и упаривают. К остатку добавляют 1,4-диоксан (30 мл) и HCl конц. (6,6 мл, 79,15 ммоль). Смесь перемешивают при 20 °C в течение 3 ч, затем упаривают. К остатку добавляют EtOAc (50 мл) и воду (30 мл). Органический слой отделяют, промывают водой (2 × 20 мл), высушивают Na2SO4, упаривают. Остаток очищают флеш-хроматографией (элюент CH2Cl2–EtOH 8 : 2) с последующей перекристаллизацией из смеси гексан–CH2Cl2–MeOH 15 : 15 : 1. Выход 0,83 г (80%), бесцветный порошок, т. пл. 328–331 °С (разл.). Спектр ЯМР 1H: δ = −3,2…−2,6 (уш. с, 1 H, BH); −0,8–2,6 (уш. с, 8 Н, 8 × ВН); 1,19–1,26 (м, 2 Н, 2 × H-4); 1,38–1,44 (м, 2 Н, 2 × H-3); 1,46–1,53 (м, 2 Н, 2 × H-5); 2,01–2,04 (м, 2 Н, 2 × H-2); 2,28 (с, 2 Н, 2 × СН-карборан); 2,74–2,77 (м, 2 Н, 2 × H-6); 6,85 (с, 1 H, NH); 7,60 (уш. c, 3 H, NH3+). Спектр ЯМР 11В: δ = −9,75 (с, 1 B); −11,5…−12,3 (м, 2 B); −18,10 (д, J = 133,2 Гц, 2 B); −21,81 (д, J = 138,2 Гц, 2 B); −36,5…−38,7 (м, 2 B). Спектр ЯМР 13С{H}: δ = 24,62; 25,41; 26,83; 36,60; 38,75; 44,58 (2C); 174,86. Найдено: C 36,84; H 9,43; N 10,37. Вычислено для C8H25B9N2O (M 262,59): C 36,59; H 9,60; N 10,67. HRMS (ESI+): найдено m/z 287,2706 [M + Na]+; вычислено для C8H2511B9N2NaO 287,2697.
Пример 3. (2S)-2-[(4-{[(2-Амино-4-гидроксиптеридин-6-ил)метил]амино}фенил)-формамидо]-N1,N5-бис-{2-[(7,8-дикарба-нидо-ундекаборан-7-ил)ацетиламино]этил}-пентандиамид, гемигидрат (1a).
К раствору фолиевой кислоты дигидрата (0,37 г, 0,77 ммоль), амина 5a по примеру 1 (0,40 г, 1,69 ммоль), 1-гидроксибензтриазола гидрата (0,26 г, 1,69 ммоль) и триэтиламина (0,72 мл, 5,16 ммоль) в ДМСО (17 мл) добавляют N-(3-диметиламинопропил)-N’-этилкарбодиимида гидрохлорид (0,37 г, 1,92 ммоль). Реакционную смесь перемешивают при 20 °C в течение 48 ч, затем выливают в воду (100 мл). К суспензии добавляют 1 н. NaOH (15 мл), полученный раствор последовательно промывают EtOAc (3 × 25 мл) и гексаном (25 мл). Органический слой промывают 0,5 н. NaOH (20 мл). Объединенный водный раствор подкисляют 4 н. HCl (~8 мл) до pH 1–2 и оставляли при 5–10 °C на 72 ч. Осадок отфильтровывают, сушат и очищают флеш-хроматографией (элюент BuOH–EtOH–16% водн. NH4OH 5 : 7 : 3). Фракции, содержащие целевое соединение, объединяют и упаривают. Остаток промывают 1 н. HCl (15 мл), затем сушат в вакууме над P2O5 и KOH. Аналитически чистый образец соединения 1a получают в результате обработки ацетонитрилом (13 мл на 0,5 г соединения 1a) с последующим центрифугированием (15000 мин−1 при 10 °C, 5 мин). Выход 0,47 г (69%), темно-оранжевый порошок, т. пл. >350 °C. [α]20 = +1,2 (589 нм), +1,6 (578 нм), +1,4 (546 нм) (c 0,25, MeOH–ацетон 1 : 1). Спектр ЯМР 1H: δ = −2,93…−2,39 (уш. с, 2 H, 2 × BH); −0,6–2,3 (м, 18 H, 18 × BH); 1,84 (с, 2 H, 2 × CH-карборан); 1,94–2,07 (м, 3 H, 2 × H-3 Glu и H-2B-карборан I); 2,10–2,16 (м, 2 H, 2 × H-4 Glu); 2,36 (д, J = 14,1 Гц, 1 H, H-2A-карборан I); 2,38 (д, J = 14,3 Гц, 1 H, H-2B-карборан II); 2,76 (д, J = 14,3 Гц, 1 H, H-2A-карборан II); 2,98–3,14 (м, 8 H, 4 × CH2-этилендиамин); 4,25 (уш. с, 1 H, H-2 Glu); 4,60 (с, 2 H, CH2-птероил); 4,5–6,5 (уш. с, 4 H, OH, NH+ и NH2+ птероил); 6,64 (д, J = 8,1 Гц, 2 H, птероил); 7,40–7,44 (м, 2 H, 2 × NH); 7,67 (д, J = 8,1 Гц, 2 H, птероил); 7,83 (с, 1 H, NH); 7,91 (с, 1 H, NH); 8,06 (уш. с, 1 H, NH); 8,19 (уш. с, 2 H, NH2-птероил); 8,75 (с, 1 H, CH-птероил). Спектр ЯМР 11В{H}: δ = −37,2 (2 B); −33,4 (2 B); −22,2 (2 B); −19,0…−17,0 (уш. с, 6 B); −14,2 (2 B); −10,7 (4 B). Спектр ЯМР 13С{H}: δ = 27,31; 31,93; 38,07; 38,13; 38,46; 38,49; 45,26; 45,31; 45,70; 46,0–46,8 (уш. с, 2 C); 53,18; 54,1–55,0 (уш. с, 2 C); 111,24 (2 C); 121,68; 127,96; 129,02 (2 C); 147,54; 148,06; 150,36; 151,96; 152,22; 158,78; 166,08; 171,03; 171,07; 171,81; 171,86. Найдено: C 42,36; H 6,53; N 17,19. Рассчитано для C31H57B18N11O6 × 0,5H2O (M 883,46): C 42,15; H 6,62; N 17,44. HRMS: найдено m/z 437,8040 [M − 2H]2−; вычислено для [C31H5511B18N11O6]2− 437,8011; найдено m/z 899,5944 [M − 2H + Na]−; вычислено для C31H5611B18N11NaO6 899,5993.
Расчетное содержание бора 22,02% (по массе). Расчетное содержание бора-10 4,36% (по массе).
Пример 4. Аналогично примеру 3 получают соединение 1b из соединения 5b.
(2S)-2-[(4-{[(2-Амино-4-гидроксиптеридин-6-ил)метил]амино}фенил)-формамидо]-N1,N5-бис-{5-[(7,8-дикарба-нидо-ундекаборан-3-ил)аминокарбонил]-пентил}пентандиамид (1b). Выход 0,48 г (67%), оранжевый порошок, т. пл. 240-245 °C (разл.) (MeCN). [α]20 = −38,7 (578 нм); −50,3 (546 нм) (c 0,44, 1% водн. NaHCO3). Спектр ЯМР 1H: δ = −3,15…−2,72 (уш. с, 2 H, 2 × BH); −0,7–2,6 (м, 18 H, 18 × BH); 1,09–1,20 (м, 4 H, 4 × H-4 гексаноил); 1,26–1,42 (м, 8 H, 4 × H-3 и 4 × H-5 гексаноил); 1,81–1,97 (м, 2 H, 2 × H-3 Glu); 1,97–2,00 (м, 4 H, 4 × H-2 гексаноил); 2,07–2,13 (м, 2 H, 2 × H-4 Glu); 2,92–3,06 (м, 4 H, 4 × H-6 гексаноил); 4,23–4,29 (м, 1 H, H-2 Glu); 4,59 (с, 2 H, CH2-птероил); 4,7–8,0 (уш. с, 4 H, NH+, NH2+ и OH птероил); 6,64 (д, J = 8,5 Гц, 2 H, птероил); 6,88 (с, 2 H, 2 × NH); 7,65 (д, J = 8,5 Гц, 2 H, птероил); 7,74–7,83 (м, 2 H, 2 × NH); 7,85–8,20 (м, 3 H, NH и NH2 птероил); 8,75 (с, 1 H, CH-птероил). Спектр ЯМР 11В{H}: δ = −38,4 (2 B); −37,5 (2 B); −22,4 (уш. с, 4 B); −21,3 (2 B); −18,6 (2 B); −17,6 (2 B); −15,4…−8,6 (уш. с, 4 B). Спектр ЯМР 13С{H}: δ = 25,58; 25,62; 26,57; 26,67; 28,16; 29,37 (2 C); 32,54; 37.33 (2 C); 38,95 (2 C); 44,72–45,44 (уш. с, 4 C); 46,19; 53,73; 111,78 (2 C); 122,27; 128,48; 129,47 (2 C); 148,01; 148,05; 150,86; 152,30; 153,01; 159,22; 166,42; 171,99; 172,08; 176,02 (2 C). Найдено: C 44,95; H 6,93; N 16,60. Рассчитано для C35H65B18N11O6 (M 930,56): C 45,18; H 7,04; N 16,56. HRMS: найдено m/z 465,8356 [M − 2H]2−; вычислено для [C35H6311B18N11O6]2− 465,8324.
Расчетное содержание бора 20,91% (по массе). Расчетное содержание бора-10 4,14% (по массе).
Биологическая активность
Новые соединения исследованы в федеральном государственном бюджетном научном учреждении «Федеральный исследовательский центр Институт цитологии и генетики Сибирского отделения Российской академии наук» (г. Новосибирск).
Культуры клеток
Изучение цитотоксичности соединений и накопления бора клетками в опытах in vitro проводилось с использованием МТТ-теста на моделях линий клеток с диплоидным набором хромосом:
– DU-145 (карцинома предстательной железы человека);
– MDA-MB-231 (аденокарцинома молочной железы человека);
– SK-Mel 28 (меланома человека);
– T98G (глиобластома человека);
– U87 MG (глиобластома человека);
– BJ-5at (фибробласты кожи человека, здоровые клетки);
– ФЭЧ (фибробласты эмбриона человека, здоровые клетки).
Линии клеток BJ-5ta (ATCCCRL-4001™), U87 MG (ATCCHTB-14™), T98G (ATCCCRL-1690™), SK-Mel-28 (ATCCHTB-72™), MDA-MB-231 (ATCCCRM-HTB-26™), DU-145 (ATCCHTB-81™) получены из криобанка центра коллективного пользования «SPF-виварий» ФИЦ ИЦиГ СО РАН. Клетки ФЭЧ получены из коллекции клеточных культур ГНЦ ВБ «Вектор» (р.п. Кольцово, Новосибирская обл., Россия) и хранились в криобанке центра коллективного пользования «SPF-виварий» ИЦиГ СО РАН.
Клетки культивировали в атмосфере 5% CO2 в питательной среде DMEM/F12 (1 : 1) (ООО «БиолоТ», Россия) с добавлением 10% фетальной бычьей сыворотки (Invitrogen, USA). Подсчет клеток проводили на автоматическом счетчике клеток Countess (Invitrogen, USA).
Тестирование цитотоксичности
МТТ-тест основан на способности дегидрогеназ живых метаболически активных клеток восстанавливать бесцветный водорастворимый 3-(4,5-метилтиазол-2-ил)-2,5-дифенил тетразолия бромид (МТТ) в нерастворимый формазан. Оптическая плотность растворенных в органических растворителях (например, диметилсульфоксиде) кристаллов формазана пропорциональна количеству метаболически активных клеток, что является адекватным показателем жизнеспособности клеток в культуре. Данный метод позволяет оценить специфическую гибель клеток, вызванную тем или иным цитотоксическим агентом.
Для проведения МТТ-теста клетки засевали в 96-ячеечные планшеты в количестве 2×104 клеток на ячейку и культивировали в течение 24 ч. Готовили исходные растворы соединений 1a и 1b в 0,5% водном NaHCO3 (концентрация 5,0 мг/мл). Для полного растворения соединений 1a,b смесь перемешивали в течение 10 мин, затем инкубировали при температуре 37 °C в течение 20 мин и обрабатывали ультразвуком (ультразвуковой гомогенизатор Sonicator Q700, Qsonica L.C.C., USA) в течение 30 минут. В качестве отрицательного контроля использовали питательную среду без добавок. Исходные растворы добавляли в питательную среду с клетками в объёме 1/5 от общего объема среды в лунке, в результате чего концентрация соединений 1a и 1b в среде составляла 1.00 мг/мл. Затем готовили серию двукратных разведений исходных растворов и добавляли их в питательную среду с клетками таким образом, чтобы получить питательные среды с концентрацией соединений 1a и 1b 0,50, 0,25, 0,125, 0,063, 0,031, 0,016 и 0,008 мг/мл. Продолжительность инкубирования клеток составляла 3 суток при 37 °C в атмосфере, содержащей 5% CO2. Затем из каждой ячейки удаляли питательную среду, добавляли раствор MTT [3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide] в питательной среде DME/F12 (1 : 1) (концентрация MTT 5 мг/мл), инкубировали в течение 4 ч, затем удаляли надосадочную жидкость и растворяли осадок формазана в ДМСО (100 мкл). Оптическую плотность полученных растворов определяли на приборе Multiskan Sky High Microplate Spectrophotometer (Thermo Fisher Scientific Inc., USA) при длине волны 595 нм. Исходя из оптической плотности, определяли выживаемость клеток; выживаемость клеток в отрицательном контроле была принята за 100%. На основе полученных данных определяли выживаемость клеток и полулетальные концентрации (LC50), т. е. концентрации соединений, которые вызывают гибель 50% клеток.
Исследование токсичности каждого вещества в отношении клеток каждой линии проводили в трех параллелях; для расчета LC50 использовали среднее значение. Определение жизнеспособности клеток в диапазоне значения LC50 проводили в трех параллелях.
Выживаемость клеток (VC, %) в присутствии исследуемого вещества рассчитывают по формуле:

где ОП – средняя оптическая плотность растворов формазана в ДМСО.
Полулетальную концентрацию соединений (LC50) определяют графически по дозозависимой кривой выживаемости клеток при различных концентрациях препаратов в программе Microsoft Excel. В случаях, когда определение LC50 графически по дозозависимой кривой выживаемости клеток невозможно, величину LD50 рассчитывают в программе Microsoft Excel.
В таблице 1 представлены значения LC50 для соединений 1a,b в отношении клеток различных опухолевых линий, а также фибробластов человека BJ-5at и ФЭЧ, рассчитанные на основании данных МТТ-теста.
Таблица 1 – Экспериментальные значения LC50 соединений 1a,b, рассчитанные на основании данных MTT-теста
Конъюгаты фолиевой кислоты 1a и 1b обладали низкой токсичностью в отношении фибробластов человека (BF-5at и ФЭЧ), величина LC50 находилась в интервале 1,62–2,10 мг/мл. Токсичность соединений 1a,b в отношении опухолевых клеток линий DU-145, MDA-MB-231, SK-Mel 28 и T98G была умеренной (LD50 0,37–1,22 мг/мл). При этом производное 1a отличалось несколько большей токсичностью по сравнению с соединением 1b. Наименьшая токсичность среди опухолевых клеток наблюдалась в отношении клеток SK-Mel 28, известных тем, что экспрессируют фолатные рецепторы, но в то же время способны к выведению аналогов фолиевой кислоты из клеток [Chen K.G. et al. Proc. Natl. Acad. Sci. USA 2006, 103, 9903].
Наибольшая токсичность тестируемых соединений наблюдалась в отношении клеток глиобластомы U87 MG, которые известны активной экспрессией фолатных рецепторов [McCord E. et al. ACS Omega 2021, 6, 4111]. Инкубирование в присутствии соединения 1a в концентрации выше 0,03 мг/мл или соединения 1b в концентрации выше 0,42 мг/мл в течение 72 ч приводило к снижению выживаемость клеток U87 MG на 50% и более.
Тестирование накопления бора клетками
Исходные растворы соединений 1a и 1b в 0,5% водном NaHCO3 (концентрация 5.0 мг/мл добавляют в питательную среду, содержащую от 3×106 до 5×106 клеток, в объёме 1/10 от общего объёма среды в лунке (концентрация тестируемого соединения в среде 0.50 мг/мл в случае клеток BJ5-at, SK-Mel 28, T98G, DU-145 и MDA-MB-231) или 1/20 от общего объёма среды в лунке (концентрация тестируемого соединения в среде 0.25 мг/мл в случае клеток U87 MG). В качестве контроля используют клетки, культивируемые без добавления тестируемых соединений. Клетки инкубируют при 37 °C в атмосфере, содержащей 5% CO2.
После инкубирования клеток в течение различного времени (10 мин, 30 мин, 1 ч, 3 ч, 6 ч и 8 ч) культуральную среду отделяют от клеток, клетки снимают с подложки раствором трипсин–версен (1 : 1) (Биолот, Россия) и подсчитывают количество клеток. Полученную клеточную суспензию разделяют на 3 равные части, центрифугируют (1000 об/мин, 5 мин) и отделяют клетки от супернатанта. К полученным клеткам добавляют свежеперегнанную 16 M азотную кислоту (1,0 мл), смесь выдерживают при 95±1 °C в течение 30-40 мин, затем охлаждают до 20 °C, добавляют деионизованную воду (3,0 мл). Содержание бора в полученных растворах определяют на атомно-эмиссионном спектрометре высокого разрешения с индуктивно-связанной плазмой iCAP 6500 DUO (Thermo Scientific, USA) по методике [Цыганкова А.Р. и др. Изв. АН, Сер. хим. 2020, 601]. Регистрацию аналитического сигнала проводили при аксиальном обзоре плазмы для двух аналитических линий – В 249,678 нм и В 249,773 нм. Градуировочные зависимости строили с использованием сертифицированного одноэлементного раствора ионов бора ГСО 7345-96.
Исследование содержания бора в клетках каждой линии после инкубирования в присутствии карборанил-производных фолиевой кислоты проводили в трех параллелях. Результаты представлены в таблице 2.
Производные фолиевой кислоты 1a,b, содержащие остатки нидо-карборана, обладали способностью доставлять бора в опухолевые клетки. В целом, инкубирование клеток в присутствии производного 3-амино-нидо-карборана 1b обеспечивало лучшее накопление бора клетками по сравнению с использованием производного (нидо-карборан-7-ил)уксусной кислоты 1a. Содержание бора в клетках глиобластомы U87 MG и аденокарциномы молочной железы MDA-MB-231 после инкубирования в присутствии соединения 1b достигало 7,0 и 2,5 мкг B / 106 клеток соответственно. Применяемые в клинике препараты для БНЗТ обеспечивают существенно меньший уровень накопления бора клетками глиомы (до 1,1 мкг B / 106 клеток в случае BPA [Dahlström M. et al. J. Neuro-Oncol. 2004, 68, 199; Wang P. et al. BMC Cancer 2010, 10, 661] и до 0,2 мкг B / 106 клеток в случае BSH [Doi A. et al. J. Neuro-Oncol. 2008, 87, 287]). Предложенные ранее агенты для БНЗТ на основе птероевой кислоты обеспечивают накопление бора клетками глиомы U87 MG и карциномы KB на уровне 1,2–1,8 мкг B / 106 клеток [Kettenbach K. et al. Radiochim. Acta 2015, 103, 799; Nakagawa F. et al. Cells 2020, 9, 1615]. Использование карборансодержащего производного фолиевой кислоты, описанного в прототипе, позволяло достичь накопления бора клетками глиобластомы не более 0,79 мкг B / г клеток [Ollson L.-I. et al. Патент SE 528407 C2 (приоритет 19.08.2005)].
Таблица 2 – Экспериментальные значения содержания бора в клетках (мкг B/106 клеток) после инкубирования в присутствии соединений 1a,b в концентрации 0,5 мг/мл
* Концентрация соединений 1a,b в питательной среде составляла 0,25 мг/мл.
бис-Амиды фолиевой кислоты с двумя остатками нидо-карборана содержат 18 атомов бора в молекуле и могут рассматриваться в качестве потенциальных агентов для БНЗТ опухолей, клетки которых экспрессируют фолатные рецепторы. Так, умеренная цитотоксичность и высокий уровень накопления соединения 1b клетками глиобластомы в опытах in vitro позволяет рассчитывать на возможность использования данного производного даже с природным распределением изотопов бора для успешной реализации БНЗТ.
Предложен способ получения соединений общей формулы 1, способных доставлять бор в опухолевые клетки, содержащие фолатные рецепторы, предусматривающий использование легкодоступных реагентов, отличающийся простотой проведения синтетических операций.
| название | год | авторы | номер документа |
|---|---|---|---|
| КАРБОРАНОВЫЕ ПРОИЗВОДНЫЕ 4,4-ДИФТОР-4-БОРА-3а,4а-ДИАЗА-s-ИНДАЦЕНА, ПРОЯВЛЯЮЩИЕ ПРОТИВООПУХОЛЕВУЮ АКТИВНОСТЬ | 2022 |
|
RU2789401C1 |
| КАРБОРАНИЛЬНЫЕ ПРОИЗВОДНЫЕ ФТОРИРОВАННЫХ ПОРФИРИНОВ И ИХ МЕТАЛЛОКОМПЛЕКСЫ, ПРОЯВЛЯЮЩИЕ СВОЙСТВА ФОТОСЕНСИБИЛИЗАТОРА, И СПОСОБ ИХ ПОЛУЧЕНИЯ | 2008 |
|
RU2402554C2 |
| КАРБОРАНИЛПОРФЕРИНЫ И ИХ ПРИМЕНЕНИЕ | 2007 |
|
RU2477161C2 |
| СПОСОБ РЕГИОСЕЛЕКТИВНОГО СИНТЕЗА МОНОГАЛОГЕНПРОИЗВОДНЫХ 1,2-,1,7-,1,12-ДИКАРБА-КЛОЗО-ДОДЕКАБОРАНОВ(12) С ИСПОЛЬЗОВАНИЕМ УЛЬТРАЗВУКОВОЙ АКТИВАЦИИ | 2013 |
|
RU2536686C1 |
| МЕТАЛЛОКОМПЛЕКСЫ КАРБОРАНИЛПОРФИРИНОВ, ОБЛАДАЮЩИЕ ПРОТИВООПУХОЛЕВОЙ АКТИВНОСТЬЮ | 2002 |
|
RU2236411C2 |
| СПОСОБ РЕГИОСЕЛЕКТИВНОГО СИНТЕЗА МОНОГАЛОГЕНПРОИЗВОДНЫХ 1,2-,1,7-,1,12-ДИКАРБА-КЛОЗО-ДОДЕКАБОРАНОВ(12) С ИСПОЛЬЗОВАНИЕМ КОМПЛЕКСНОЙ АКТИВАЦИИ | 2013 |
|
RU2535677C1 |
| СПОСОБ РЕГИОСЕЛЕКТИВНОГО СИНТЕЗА МОНОГАЛОГЕНПРОИЗВОДНЫХ 1,2-, 1,7-, 1,12-ДИКАРБА-КЛОЗО-ДОДЕКАБОРАНОВ(12) | 2013 |
|
RU2521592C1 |
| СОЕДИНЕНИЯ БОРА, ПРИГОДНЫЕ ПРИ БОРНЕЙТРОНОЗАХВАТНОЙ ТЕРАПИИ | 2006 |
|
RU2423368C2 |
| Борированные производные фторированных бактериохлоринов и их металлокомплексов, обладающие противоопухолевой активностью | 2015 |
|
RU2615770C1 |
| 4-[(Пурин-6-ил)аминополиметиленкарбонил]-производные 3,4-дигидро-3-метил-7,8-дифтор-2H-[1,4]бензоксазина, обладающие противоопухолевой активностью | 2021 |
|
RU2760305C1 |
Изобретение относится к бис-амидам фолиевой кислоты общей формулы I, имеющим два заместителя, каждый из которых содержит 9 атомов бора. Техническим результатом изобретения является создание новой группы химических соединений – бис-амидов фолиевой кислоты, содержащих остатки нидо-карборана и обладающих низкой токсичностью, способностью накапливаться в опухолевых клетках, которые могут найти применение в качестве агентов для бор-нейтронозахватной терапии опухолевых заболеваний. 2 табл., 4 пр.
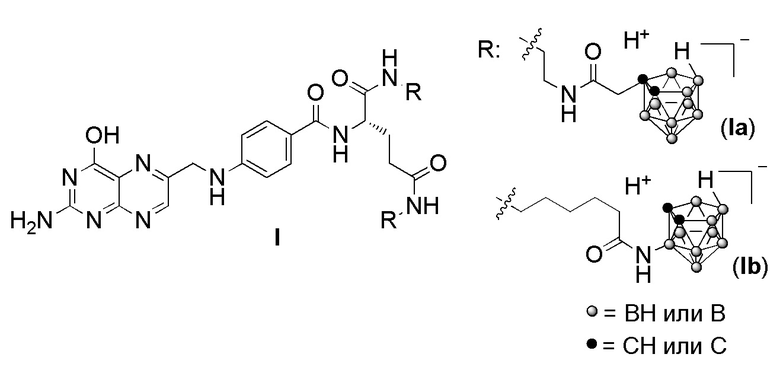
бис-Амиды фолиевой кислоты, имеющие два заместителя, каждый из которых содержит 9 атомов бора, общей формулы I,
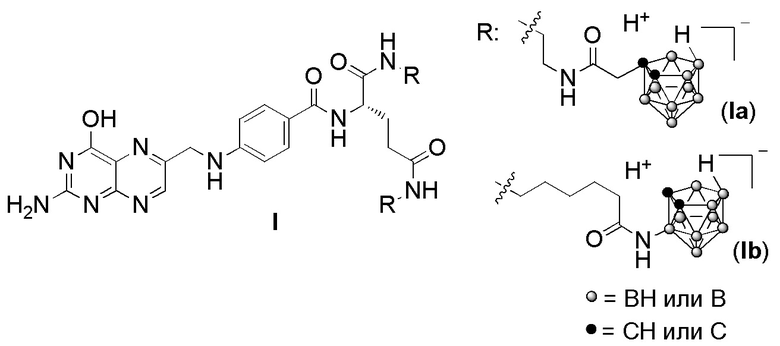
обеспечивающие накопление бора в опухолевых клетках.
| СОЕДИНЕНИЯ БОРА, ПРИГОДНЫЕ ПРИ БОРНЕЙТРОНОЗАХВАТНОЙ ТЕРАПИИ | 2006 |
|
RU2423368C2 |
| KETTENBACH K | |||
| et al, Synthesis and evaluation of boron folates for Boron-Neutron-Capture-Therapy (BNCT), Radiochim Acta, 2015, vol | |||
| Клапанный регулятор для паровозов | 1919 |
|
SU103A1 |
| Походная разборная печь для варки пищи и печения хлеба | 1920 |
|
SU11A1 |
| Ртутный разрежающий насос | 1922 |
|
SU799A1 |
| ACHILLI C | |||
| et al, Folic Acid-Conjugated 4-Amino-Phenylboronate, a Boron-Containing Compound Designed for Boron Neutron Capture Therapy, is an Unexpected Agonist for | |||
Авторы
Даты
2023-04-24—Публикация
2022-09-07—Подача