Изобретение относится к области органической химии, а именно к новым азотсодержащим гетероциклическим соединениям, которые обладают противоопухолевой активностью и могут найти применение в медицине.
Распространенность онкологических заболеваний в мире колоссальна. Несмотря на имеющиеся успехи в области терапии опухолей, число зарегистрированных случаев рака увеличивается с каждым годом. По данным Международного агентства по изучению рака, в 2020 г. выявлено около 19,3 миллионов новых случаев заболевания раком; смертность от онкологических заболеваний достигла в 2020 г. 10 миллионов человек. Значительную долю в числе летальных случаев занимают рак легкого (18,0%), толстого кишечника и прямой кишки (9,4%), печени (8,3%), желудка (7,7%) и молочной железы (6,9%) [CA: Cancer J. Clin. 2021, doi 10.3322/caac.21660].
Создание новых средств для лечения онкологических заболеваний, в первую очередь наиболее летальных форм, представляет собой исключительно важную задачу. Получение новых соединений, обладающих высокой токсичностью в отношении опухолевых клеток и хорошо переносимых в терапевтических дозах, способно заложить основу для новых схем лечения онкологических заболеваний и содействовать снижению смертности от рака.
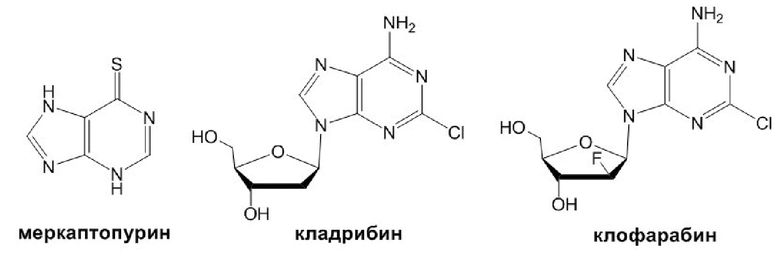
Пуринсодержащие соединения (например, нуклеиновые кислоты) играют важную роль в обмене веществ и жизнедеятельности клеток. Этим обусловлено то, что среди производных пурина обнаружено немало соединений, обладающих антинеопластической активностью. К производным пурина, используемым в клинической практике для лечения онкологических заболеваний, относятся меркаптопурин, кладрибин, клофарабин и другие.
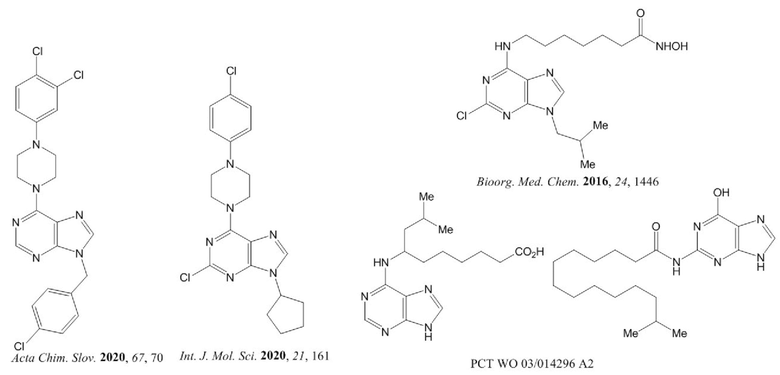
В последние годы обнаружено, что некоторые производные пурина, имеющие в структуре остатки гетероциклических аминов (в том числе пиперазина, морфолина), обладают высокой токсичностью в отношении опухолевых клеток [Kucukdumlu A. et al. Acta Chim. Slov. 2020, 67, 70; Salas C.O. et al. Int. J. Mol. Sci. 2020, 21, 161]. Среди производных пурина, содержащих остатки длинноцепочечных ω-аминоалкановых кислот, имеющих структурное сходство с соединениями общей формулы 1, известны соединения, обладающие заметной противоопухолевой активностью в опытах in vitro [Yang Z. et al. Патент WO 03/014296 A2 (приоритет 03.08.2001)], а также ингибиторы гистон-деацетилазы с антипролиферативной активностью [Liu R. et al. Bioorg. Med. Chem. 2016, 24, 1446].
Наиболее близким аналогом (прототипом) нашего технического решения являются амиды N-(2-аминопурин-6-ил)-6-аминокапроновой кислоты, обладающие противоопухолевой активностью [Краснов В.П. и др. Патент RU 2015101582 (приоритет 21.01.2015)].
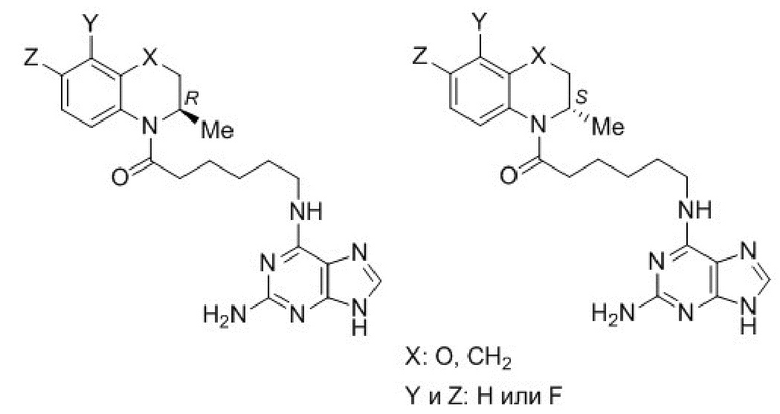
Задача предлагаемого изобретения - получение новой группы соединений, обладающих противоопухолевой активностью и низкой токсичностью, расширяющей арсенал известных противоопухолевых средств.
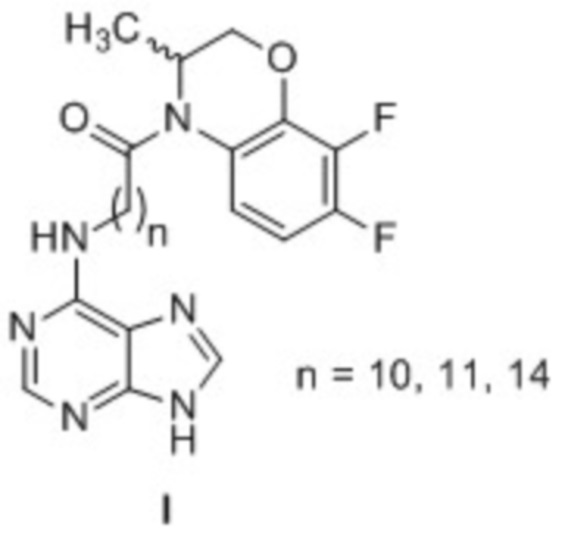
Техническим результатом данного изобретения является создание новой группы химических соединений - 4-[(пурин-6-ил)аминополиметиленкарбонил]-производных 3,4-дигидро-3-метил-7,8-дифтор-2H-[1,4]бензоксазина общей формулы 1.

Соединения формулы 1, их физико-химические характеристики, а также способ получения в литературе не описаны.
Соединения формулы 1 могут быть получены исходя из рацемического 3,4-дигидро-3-метил-7,8-дифтор-2H-[1,4]бензоксазина (2) и соответствующих ω-фталимидокислот 3a-c. Например, в результате ацилирования амина 2 кислотами 3a-c с использованием хлорангидридного метода синтезированы рацемические N-(6-фталимидополиметиленкарбонил) производные 3,4-дигидро-3-метил-7,8-дифтор-2H-[1,4]бензоксазина 5a-c. В результате удаления фталоильной защиты гидразинолизом и последующей реакции нуклеофильного замещения с 6-хлорпурином получены соответствующие конъюгаты пурина 1a-c (с общим выходом 28-46%, считая на две стадии).
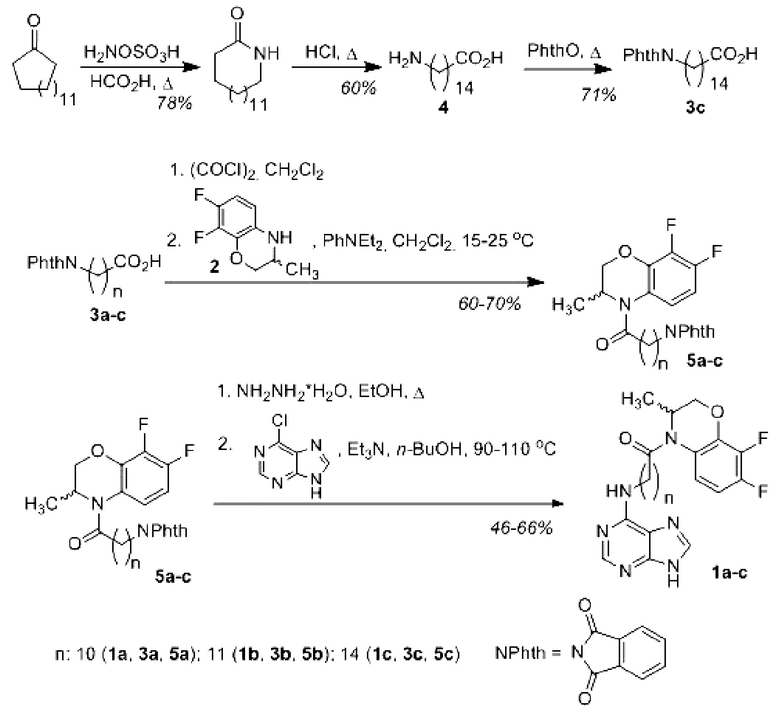
Общая методика осуществления получения соединений 1a-c
Фталоил-аминокислоты 3a,b получают из соответствующих ω-аминокислот в соответствии с литературным методом [Tomar R. et al. Tetrahedron 2019, 75, 2447-2465].
К раствору циклопентадеканона (4,94 г, 22,0 ммоль) в муравьиной кислоте (25 мл) добавляют суспензию гидроксиламин-O-сульфоновой кислоты (4,33 г, 33,0 ммоль) в муравьиной кислоте (25 мл). Реакционную смесь кипятят с обратным холодильником в течение 12-20 ч, затем выливают в 200 мл воды и экстрагируют этилацетатом (3 × 30 мл). Объединенные органические слои промывают водным раствором NaHCO3 (5 × 20 мл), водным раствором NaCl (3 × 20 мл), сушат MgSO4 и упаривают. Остаток очищают флеш-хроматографией на силикагеле (элюент этилацетат), получая лактам 15-аминопентадекановой кислоты (выход 74-82%).
Лактам 15-аминопентадекановой кислоты (4,09 г, 17,1 ммоль) растворяют в 6 н. HCl (150 мл) и кипятят с обратным холодильником в течение 19 ч, затем охлаждают до 20°C. Осадок отфильтровывают, суспендируют в 100 мл воды и нейтрализуют водным раствором NaHCO3. Осадок отфильтровывают и промывают на фильтре охлажденной смесью вода-ДМСО (1 : 1), получая 15-аминопентадекановую кислоту (4) (выход 55-65%).
Смесь 15-фталимидопентадекановой кислоты (4) (2,57 г, 10,0 ммоль) и фталевого ангидрида (1,48 г, 10,0 ммоль) нагревают в течение 2 ч при 170-190°C. Реакционную смесь охлаждают до 20-30°C, обрабатывают гексаном. Осадок отфильтровывают и перекристаллизовывают из смеси вода-этанол, получая кислоту 3c (выход 67-75%).
К раствору N-фталоиламинокислоты 3a-c (3,90 ммоль) в дихлорметане (8 мл) добавляют оксалилхлорид (0,82 мл, 9,75 ммоль). Реакционную смесь перемешивают при 15-25°C в течение 6 ч, затем упаривают досуха. Остаток растирают в сухом гексане, отфильтровывают и растворяют в дихлорметане (20 мл). Полученный раствор добавляют к раствору 3-метил-7,8-дифтор-3,4-дигидро-2H-1,4-бензоксазина (2) (0,72 г, 3,90 ммоль) и N,N-диэтиланилина (0,63 мл, 3,90 ммоль) в дихлорметане (20 мл). Реакционную смесь перемешивают при температуре 15-25°C в течение 6-48 ч, затем промывают водным раствором HCl (3 × 5 мл), насыщенным водным раствором NaCl (5 × 10 мл), водным раствором NaHCO3 (3 × 10 мл) и водой (3 × 10 мл). Органический слой отделяют, сушат MgSO4 и упаривают при пониженном давлении. Остаток очищают флеш-хроматографией на силикагеле (элюент гексан-этилацетат или бензол-этилацетат), получая амиды 3a-c (выход 60-70%).
K раствору соответствующего амида 5a-c (1,91 ммоль) в этаноле (14 мл) добавляют гидразин гидрат (0,17 мл, 3,43 ммоль). Реакционную смесь кипятят в течение 80-140 мин, затем упаривают досуха. К остатку добавляют диэтиловый эфир (25 мл) и выдерживают в холоде в течение 12 ч. Осадок отфильтровывают, промывают диэтиловым эфиром (3 × 3 мл). Фильтрат упаривают досуха, остаток растворяют в н-бутаноле (4 мл). К раствору добавляют 6-хлорпурин (0,12 г, 0,80 ммоль) и раствор триэтиламина (0,19 мл, 1,35 ммоль) в н-бутаноле (4 мл). Реакционную смесь нагревают при 80-110°C в течение 10 ч, затем охлаждают и добавляют н-бутанол (4 мл). Раствор промывают водным раствором HCl (3 × 5 мл), насыщенным водным раствором NaCl (5 × 10 мл), водой (3 × 10 мл) и упаривают досуха. Остаток очищают флеш-хроматографией на силикагеле (элюент CHCl3-EtOH).
Полученные соединения анализируют следующими методами.
Температуры плавления определяют на приборе SMP3 (Barloworld Scientific, UK). Удельное вращение определяют на поляриметре Perkin Elmer 341. Элементный анализ проводят на анализаторе Perkin Elmer 2400 серии II. Спектры ЯМР 1H, 19F и 13C регистрируют на приборе Bruker Avance 500 (рабочая частота 500, 470 и 125 МГц соответственно) в (CD3)2SO с использованием тетраметилсилана и гексафторбензола в качестве внутренних стандартов. Спектры ЯМР 1H и 19F регистрируют при температуре 100°C (соединения 1a-c, 5a-с) или 25°C (соединения 3a-c, 4). Спектры ЯМР 13C регистрируют при температуре 25°C. Химические сдвиги приведены в миллионных долях (м.д.), константы спин-спинового взаимодействия (J) - в герцах.
Характеристики новых соединений 1a-c, 3c, 4, 5а-c приведены в примерах конкретного выполнения.
Примеры конкретного выполнения
Пример 1. Синтез 15-фталимидопентадекановой кислоты (3c).
Лактам 15-аминопентадекановой кислоты (стадия 1).
К раствору циклопентадеканона (4,94 г, 22,0 ммоль) в муравьиной кислоте (25 мл) добавляют суспензию гидроксиламин-O-сульфоновой кислоты (4,33 г, 33,0 ммоль) в муравьиной кислоте (25 мл). Реакционную смесь кипятят с обратным холодильником в течение 16 ч, затем выливают в 200 мл воды и экстрагируют этилацетатом (3 × 30 мл). Объединенные органические слои промывают 5% раствором NaHCO3 (5 × 20 мл), насыщенным раствором NaCl (3 × 20 мл), сушат MgSO4 и упаривают. Остаток очищают флеш-хроматографией на силикагеле (элюент этилацетат). Выход 4,11 г (78%). Бесцветный порошок, 134-135°С (лит. т. пл. 134-135,5°С [J. Med. Chem. 1971, 14, 501]). Спектр ЯМР 1H: δ = 1,20-1,32 (м, 20 H, 10×CH2); 1,32-1,40 (м, 2 H, CH2); 1,45-1,55 (м, 2 H, CH2); 2,02-2,06 (м, 2 H, CH2CO); 3,04-3,12 (м, 2 H, CH2N); 7,72-7,80 (м, 1 H, NH) м. д. Найдено: C 75,26; H 12,21; N 5,85. Вычислено для C15H29NO (M 239,40): C 75,43; H 12,43; N 5,81.
15-Аминопентадекановая кислота (4) (стадия 2).
Раствор лактама 15-аминопентадекановой кислоты (4,09 г, 17,1 ммоль) в 6 н. HCl (150 мл) кипятят с обратным холодильником в течение 19 ч, затем охлаждают до 20°C. Осадок отфильтровывают, суспендируют в 100 мл воды и добавляют 5% раствор NaHCO3 до pH 6. Осадок отфильтровывают и промывают на фильтре охлажденной смесью вода-ДМСО (1:1). Выход 2,64 г (60%). Бесцветный порошок, т. пл. 180-181°С (лит. т. пл. 180-182°С [Eur. J. Org. Chem. 1999, 87]). Спектр ЯМР 1H: δ = 1,26-1,42 (м, 20 H, 10×CH2); 1,57-1,66 (м, 2 H, CH2); 1,66-1,74 (м, 2 H, CH2); 2,33-2,39 (м, 2 H, 2×H-2); 3,02-3,10 (м, 2H, 2×H-15). Найдено: C 70,16; H 12,01; N 5,32. Вычислено для C15H31NO2 (M 257,42): C 69,99; H 12,14; N 5,44.
15-Фталимидопентадекановая кислота (3c) (стадия 3).
Смесь 15-фталимидопентадекановой кислоты (4) (2,57 г, 10,0 ммоль) и фталевого ангидрида (1,48 г, 10,0 ммоль) нагревают в течение 2 ч при 180°C. Реакционную смесь охлаждают до 20°C, обрабатывают гексаном. Осадок отфильтровывают и перекристаллизовывают из смеси вода-этанол. Выход 2,75 г (71%). Бесцветный порошок, т. пл. 95-96 °С. Спектр ЯМР 1H: δ = 1,16-1,30 (м, 20 H, 10×CH2); 1,42-1,52 (м, 2 H, CH2); 1,52-1,63 (м, 2 H, CH2); 2,13-2,22 (м, 2 H, 2×H-2); 3,52-3,59 (м, 2 H, 2×H-15); 7,80-7,90 (м, 4 H, Phth); 11,96 (с, 1 H, CO2H) м. д. Спектр ЯМР 13C: δ = 24,5; 26,2; 27,8; 28,4; 28,5; 28,7; 28,8; 28,9 (2С); 29,0 (2C); 33,6; 37,3; 122,9 (2С); 131,6 (2С); 134,3 (2С); 167,9 (2С); 174,5. Найдено: C 71,37; H 8,81; N 3,75. Вычислено для C23H33NO4 (M 387,52): C 71,29; H 8,58; N 3,61.
Пример 2. Синтез соединения 1a из кислоты 3a.
(RS)-3,4-Дигидро-3-метил-4-(11-фталимидоундеканоил)-7,8-дифтор-2H-[1,4]бензоксазин (5a) (стадия 1).
К раствору 11-фталимидоундекановой кислоты (3a) (1,29 г, 3,90 ммоль) в дихлорметане (8 мл) добавляют оксалилхлорид (0,82 мл, 9,75 ммоль). Реакционную смесь перемешивают при 15-25°C в течение 6 ч, затем упаривают досуха. Остаток растирают в сухом гексане, отфильтровывают и растворяют в дихлорметане (20 мл). Полученный раствор добавляют к раствору 3-метил-7,8-дифтор-3,4-дигидро-2H-1,4-бензоксазина (2) (0,72 г, 3,90 ммоль) и N,N-диэтиланилина (0,63 мл, 3,90 ммоль) в дихлорметане (20 мл). Реакционную смесь перемешивают при 20°C в течение 48 ч, затем промывают 4 н. HCl (3 × 5 мл), насыщенным водным раствором NaCl (5 × 10 мл), 5% раствором NaHCO3 (3 × 10 мл) и водой (3 × 10 мл). Органический слой отделяют, сушат MgSO4 и упаривают при пониженном давлении. Остаток очищают колоночной флеш-хроматографией на силикагеле (элюент бензол-этилацетат от 95 : 5 к 9 : 1). Выход 1,26 г (65%). Бесцветный порошок, т. пл. 87-88°С. Спектр ЯМР 1H: δ = 1,12 (д, J = 6,9 Гц, 3 H, Me бензоксазин); 1,20-1,35 (м, 12 H, 6×CH2); 1,52-1,66 (м, 4 H, 4×CH2); 2,42-2,48 (м, 1 H, H-2B ундеканоил, перекрывание с сигналом ДМСО); 2,57 (д. т, J = 15,9, 7,3 Гц, 1 H, H-2A ундеканоил); 3,54-3,60 (м, 2H, 2×H-11 ундеканоил); 4,13 (д. д, J = 10,9, 2,8 Гц, 1 H, H-2B бензоксазин); 4,33 (д. д, J = 10,9, 1,5 Гц, 1 H, H-2A бензоксазин); 4,73 (к. д. д, J = 7,0, 2,8, 1,5 Гц, 1 H, H-3 бензоксазин); 6,84 (д. д. д, J = 9,9, 9,8, 8,2 Гц, 1 H, H-6 бензоксазин); 7,52-7,58 (м, 1 H, H-5 бензоксазин); 7,76-7,86 (м, 4 H, Phth) м.д. Спектр ЯМР 13C: δ = 15,1; 24,6; 26,1; 27,8; 28,4; 28,5; 28,6; 33,4; 37,3; 44,8; 69,8; 106,7 (д, J = 17,9 Гц); 119,2; 121,8; 122,9 (2С); 131,5 (2С); 134,3 (2С); 135,7 (д, J = 7,8 Гц); 138,9 (д. д, J = 243,3, 15,4 Гц); 146,5 (д. м, J = 242,5 Гц); 167,8 (2С); 170,9 м.д. Спектр ЯМР 19F: δ = 1,97 (д. д. д, J = 20.9, 8.2, 2.4 Гц, 1F, F-8); 20,00-20,15 (м, 1 F, F-7) м.д. Найдено: C 67,25; H 6,70; F 7,31; N 5,51. Вычислено для C28H32F2N2O4 (M 498,57): C 67,45; H 6,47; F 7,62; N 5,62.
(RS)-3,4-Дигидро-3-метил-4-[11-(пурин-6-иламино)ундеканоил]-7,8-дифтор-2H-[1,4]бензоксазин (1a) (стадия 2).
K раствору амида 5a (0,95 г, 1,91 ммоль) в этаноле (14 мл) добавляют гидразин гидрат (0,17 мл, 3,43 ммоль). Реакционную смесь кипятят в течение 120 мин, затем упаривают досуха. К остатку добавляют диэтиловый эфир (25 мл) и выдерживают при температуре -16°C в течение 12 ч. Осадок отфильтровывают, промывают диэтиловым эфиром (3 × 3 мл). Фильтрат упаривают досуха, остаток растворяют в н-бутаноле (4 мл). К раствору добавляют 6-хлорпурин (0,12 г, 0,80 ммоль) и раствор триэтиламина (0,19 мл, 1,35 ммоль) в н-бутаноле (4 мл). Реакционную смесь нагревают при 80-110°C в течение 10 ч, затем охлаждают и добавляют н-бутанол (4 мл). Раствор промывают 4 н. HCl (3 × 5 мл), насыщенным раствором NaCl (5 × 10 мл), водой (3 × 10 мл) и упаривают досуха. Остаток очищают колоночной флеш-хроматографией на силикагеле (элюент CHCl3-EtOH). Выход 0,41 г (47%). Светло-желтый порошок, т. пл. 74-75°С. Спектр ЯМР 1H: δ = 1,12 (д, J = 6,9 Гц, 3 H, Me бензоксазин); 1,22-1,38 (м, 12 H, 6×CH2); 1,52-1,66 (м, 4 H, 4×CH2); 2,42-2,48 (м, 1 H, H-2B ундеканоил, перекрывание с сигналом ДМСО); 2,52-2,62 (м, 1H, H-2A ундеканоил); 3,52-3,60 (м, 2 H, 2×H-11 ундеканоил); 4,13 (д. д, J = 10,9, 2,9 Гц, 1 H, H-2B бензкосазин); 4,33 (д. д, J = 10,9, 1,4 Гц, 1 H, H-2A бензкосазин); 4,74 (к. д. д, J = 6,8, 2,7, 1,4 Гц, 1 H, H-3 бензоксазин); 6,84 (д. д. д, J = 9,8, 9,8, 8,3 Гц, 1 H, H-6 бензкосазин); 6,94 (уш. с, 1 H, NH-6 пурин); 7,53-7,58 (м, 1 H, H-5 бензоксазин); 7,95 (с, 1 H, H-8 пурин); 8,15 (с, 1 H, H-2 пурин); 12,42 (уш. с, 1 Н, NH-9 пурин) м.д. Спектр ЯМР 13C: δ = 15,1; 24,6; 26,4; 28,5; 28,7 (2C); 28,8; 28,9; 29,1; 33,4; 39,5 (перекрывание с сигналом ДМСО-d6); 44,6; 69,9; 106,7 (д, J = 17,9 Гц); 118,6; 119,2; 121,8; 135,7 (д. д, J = 9,7, 2,5 Гц); 138,4; 138,9 (д. д, J = 243,4, 15,4 Гц); 146,5 (д. м, J = 242,5 Гц); 149,3; 152,3; 154,5; 171,0 м.д. Спектр ЯМР 19F: δ = 1,98 (д. д. д, J = 21,0, 8,2, 2,4 Гц, 1 F, F-8); 20,02-20,16 (м, 1 F, F-7) м.д. Найдено: C 60,33; H 6,35; F 8,51; N 18,58. Вычислено для C23H28F2N6O2 (M 458,51): C 60,25; H 6,16; F 8,29; N 18,33.
Пример 3. Аналогично примеру 2 из соединения 3b получают соединение 1b через промежуточное соединение 5b.
(RS)-3,4-Дигидро-3-метил-4-(12-фталимидододеканоил)-7,8-дифтор-2H-[1,4]бензоксазин (5b).
Выход 1,40 г (70%). Бесцветный порошок, т. пл. 63-64°С. Спектр ЯМР 1H: δ = 1,12 (д, J = 6,9 Гц, 3 H, Me бензоксазин); 1,20-1,33 (м, 14 H, 7×CH2); 1,53-1,65 (м, 4 H, 4×CH2); 2,43-2,50 (м, 1 H, H-2B додеканоил, перекрывание с сигналом ДМСО); 2,57 (д. т, J = 15,6, 7,3 Гц, 1 H, H-2A додеканоил); 3,43-3,60 (м, 2 H, 2×H-12 додеканоил); 4,13 (д. д, J = 10.9, 2.9 Гц, 1 H, H-2B бензоксазин); 4,33 (д. д, J = 10,9, 1,4 Гц, 1 H, H-2A бензоксазин); 4,74 (к.д. д, J = 6,9, 2,7, 1,5, 1 H, H-3 бензоксазин); 6,84 (д. д. д, J = 9,8, 9,7, 8,3, 1 H, H-6 бензоксазин); 7,52-7,60 (м, 1 H, H-5 бензоксазин); 7,77-7,85 (м, 4 H, Phth) м. д. Спектр ЯМР 13C: δ = 15,1; 24,6; 26,1; 27,8; 28,4; 28,5; 28,7 (2C); 28,8 (2С); 33,4; 37,3; 44,9; 69,8; 106,7 (д, J = 17,9 Гц); 119,2; 121,8; 122,9 (2С); 131,5 (2С); 134,3 (2С); 135,7 (д. д, J = 9,7, 2,5 Гц); 138,9 (д. д, J = 243,3, 15,4 Гц); 146,5 (д. м, J = 241,9 Гц); 167,8 (2С); 171,0 м. д. Спектр ЯМР 19F: δ = 1,97 (д. д. д, J = 21,1, 8,2, 2,3 Гц, 1 F, F-8); 20,02-20,16 (м, 1 F, F-7) м. д. Найдено: C 67,89; H 6,64; F 7,50; N 5,26. Вычислено для C29H34F2N2O4 (M 512,60): C 67,95; H 6,69; F 7,41; N 5,47.
(RS)-3,4-Дигидро-3-метил-4-[12-(пурин-6-иламино)додеканоил]-7,8-дифтор-2H-[1,4]бензоксазин (1b). Выход 0,27 г (66%). Светло-желтый порошок, т. пл. 62-63°С. Спектр ЯМР 1H: δ = 1,12 (д, J = 6,9 Гц, 3 H, Me бензоксазин); 1,20-1,40 (м, 14 H, 7×CH2); 1,53-1,65 (м, 4 H, 2×CH2); 2,42-2,50 (м, 1 H, H-2B додеканоил, перекрывание с сигналом ДМСО); 2,53-2,62 (м, 1 H, H-2A додеканоил); 3,51-3,62 (м, 2 H, 2×H-12 додеканоил); 4,13 (д. д, J = 10,9, 2,7 Гц, 1 H, H-2B бензоксазин); 4,33 (д, J = 11,0 Гц, 1 H, H-2A бензоксазин); 4,70-4,78 (м, 1 H, H-3 бензоксазин); 6,84 (д. д. д, J = 9,8, 9,7, 8,4 Гц, 1 H, H-6 бензоксазин); 6,94 (уш. с, 1 H, N6H пурин); 7,50-7,60 (м, 1 H, H-5 бензоксазин); 7,94 (с, 1 H, H-8 пурин); 8,14 (с, 1 H, H-2 пурин); 12,49 (уш. с, 1 H, N9H пурин) м. д. Спектр ЯМР 13C: δ = 15,1; 24,6; 26,4; 28,5; 28,8 (2C); 28,9 (2C); 29,0; 29,1; 33,4; 40,0 (перекрывание с сигналом ДМСО-d6); 44,7; 69,9; 106,8 (д, J = 17,9 Гц); 118,7; 119,3; 121,8; 135,7 (д, J = 8,4 Гц); 138,4; 138,9 (д. д, J = 243,4, 15,4 Гц); 146,5 (д. м, J = 240,4 Гц); 149,3; 152,3; 154,4; 171,0 м. д. Спектр ЯМР 19F: δ = 1,98 (д. д. д, J = 21,0, 8,3, 1,9 Гц, 1 F, F-8); 20,00-20,20 (м, 1 F, F-7). Найдено: C 62,29; H 6,75; F 7,51; N 17,01. Вычислено для C26H34F2N6O2 (M 500,59): C 62,38; H 6,85; F 7,59; N 16,79.
Пример 4. Аналогично примеру 2 из соединения 3c получают соединение 1c через промежуточное соединение 5c.
(RS)-3,4-Дигидро-3-метил-4-(15-фталимидопентадеканоил)-7,8-дифтор-2H-[1,4]бензоксазин (5c). Выход 1,30 г (60%). Бесцветный порошок, т. пл. 86-87°С. Спектр ЯМР 1H: δ = 1,12 (д, J = 6,9 Гц, 3 H, Me бензоксазин); 1,20-1,34 (м, 20 H, 10×CH2); 1,54-1,65 (м, 4 H, 2×CH2); 2,42-2,50 (м, 1 H, H-2B пентадеканоил, перекрывание с сигналом ДМСО); 2,57 (д. т, J = 15,8, 7,2 Гц, 1 H, H-2A пентадеканоил); 3,54-3,60 (м, 2 H, 2×H-15 пентадеканоил); 4,13 (д. д, J = 10,9, 3,0 Гц, 1 H, H-2B бензоксазин); 4,33 (д. д, J = 10,9, 1,5 Гц, 1 H, H-2A бензоксазин); 4,74 (к. д. д, J = 6,8, 2,7, 1,5 Гц, 1 H, H-3 бензоксазин); 6,84 (д. д. д, J = 9,8, 9,8, 8,3 Гц, 1 H, H-6 бензоксазин); 7,52-7,58 (м, 1 H, H-5 бензоксазин); 7,78-7,85 (м, 4 H, Phth) м. д. Спектр ЯМР 13C: δ = 15,1; 24,6; 26,1; 27,8; 28,4; 28,5; 28,7 (2С); 28,8 (2С); 28,9 (3С); 33,4; 37,3; 44,7; 69,9; 106,7 (д, J = 17,9 Гц); 119,2; 121,8; 122,9 (2С); 131,5 (2С); 134,3 (2С); 135,7 (д, J = 8,5 Гц); 138,9 (д. д, J = 243,4, 15,4 Гц); 146,5 (д. м, J = 239,3 Гц); 167,9 (2С); 171,0 м. д. Спектр ЯМР 19F: δ = 1,99 (д. д. д, J = 21,0, 8,3, 2,3 Гц, 1 F, F-8); 20,00-20,18 (м, 1 F, F-7) м. д. Найдено: C 69,37; H 7,39; F 6,78; N 4,84. Вычислено для C32H40F2N2O4 (M 554,68): C 69,29; H 7,27; F 6,85; N 5,05.
(RS)-3,4-Дигидро-3-метил-4-[15-(пурин-6-иламино)пентадеканоил]-7,8-дифтор-3,4-дигидро-2H-1,4-бензоксазин (1c). Выход 0,20 г (46%). Светло-желтый порошок, т. пл. 65-66°С. Спектр ЯМР 1H: δ = 1,12 (д, J = 6,9 Гц, 3 H, Me бензоксазин); 1,20-1,40 (м, 20 H, 10×CH2); 1,52-1,70 (м, 4 H, 2×CH2); 2,40-2,50 (м, 1 H, H-2B пентадеканоил, перекрывание с сигналом ДМСО); 2,53-2,63 (м, 1 H, H-2A пентадеканоил); 3,55-3,65 (м, 2 H, м, 2×H-15 пентадеканоил); 4,13 (д. д, J = 11,0, 2,8 Гц, 1 H, H-2B бензоксазин); 4,33 (д. д, J = 10,9, 1,4 Гц, 1 H, H-2A бензоксазин); 4,74 (к. д. д, J = 6,9, 2,6, 1,4 Гц, 1 H, H-3 бензоксазин); 6,84 (д. д. д, J = 9,8, 9,8, 8,3 Гц, 1 H, H-6 бензоксазин); 7,50-7,58 (м, 1 H, H-5 бензоксазин); 7,61 (уш. с, 1 H, N6H пурин); 8,08 (с, 1 H, H-8 пурин); 8,23 (с, 1 H, H-2 пурин) м. д. (сигнал N9H пурина не проявляется). Спектр ЯМР 13C: δ = 15,1; 24,6; 26,3; 28,5; 28,7; 28,8; 28,9 (6С); 33,4; 40,3 (перекрывание с сигналом ДМСО-d6); 44,8; 69,9; 106,8 (д, J = 17,9 Гц); 116,3; 119,3; 121,8; 135,7 (д, J = 8,6 Гц); 139,0 (д. д, J = 243,4, 15,4 Гц); 140,0; 146,5 (д. м, J = 239,3 Гц); 149,4; 150,5; 153,0; 171,0 м. д. Спектр ЯМР 19F: δ = 2,00 (д. д. д, J = 21,0, 8,2, 2,2 Гц, 1 F, F-8); 20,00-20,22 (м, 1F, F-7) м. д. Найдено: C 63,81; H 7,37; F 6,67; N 15,36. Вычислено для C29H40F2N6O2×0,2H2O (M 546,28): C 63,76; H 7,45; F 6,96; N 15,38.
Биологическая активность
Новые соединения исследованы в федеральном государственном бюджетном учреждении «Национальный медицинский исследовательский центр имени Н.Н. Блохина» Министерства здравоохранения Российской Федерации (г. Москва) и в Центре биологических исследований и биоинженерии центральной научно-исследовательской лаборатории федерального государственного бюджетного образовательного учреждения высшего образования «Сибирский государственный медицинский университет» (г. Томск).
Изучение противоопухолевой активности в опытах in vitro соединений проводились с использованием МТТ-теста на моделях линий клеток:
- A549 (карцинома легкого человека (немелкоклеточный рак));
- SK-BR-3 (аденокарцинома молочной железы человека);
- SNU-1 (карцинома желудка человека);
- Jurkat (острый Т-лимфобластный лейкоз);
- СТ-26 (колоректальная карцинома мыши);
- MDA-MB231 (аденокарцинома молочной железы человека);
- 4Т1 (карцинома молочной железы мыши);
- COLO201 (колоректальная аденокарцинома человека);
- HepG2 (гепатоцеллюлярная карцинома человека);
- WI-38 (фибробласты легкого человека, здоровые клетки).
Клеточные линии A549, SK-BR-3, SNU-1, WI-38, CT-26, MDA-MB231, 4T1 и HepG2 являются адгезионными клеточными культурами. Клеточные линии Jurkat и COLO201 являются частично адгезионными и частично суспензионными культурами.
МТТ-тест основан на способности дегидрогеназ живых метаболически активных клеток восстанавливать бесцветный водорастворимый 3-(4,5-метилтиазол-2-ил)-2,5-дифенил тетразолия бромид (МТТ) в нерастворимый формазан. Оптическая плотность растворенных в органических растворителях (например, диметилсульфоксиде) кристаллов формазана пропорциональна количеству метаболически активных клеток, что является адекватным показателем жизнеспособности клеток в культуре. Данный метод позволяет оценить специфическую гибель клеток, вызванную тем или иным цитотоксическим агентом.
Клетки культивировали при 37°C в атмосфере, содержащей 5% CO2. Состав полных питательных сред для культивирования каждой из исследуемых клеточных линий представлен в табл. 1.
Для открепления с флаконов адгезионных культур использовали раствор Трипсин-ЭДТА (ПанЭко). Подсчитывали клетки в камере Горяева.
Для постановки МТТ-теста клетки в полной питательной среде (200 мкл для культур A549, SK-BR-3, SNU-1, Jurkat и WI-38 или 90 мкл для культур CT-26, MDA-MB231, 4T1, COLO201, HepG2) рассаживали в плоскодонные планшеты по 10 тыс. клеток на лунку (культуры A549, SK-BR-3, SNU-1, WI-38, CT-26, MDA-MB231, 4T1, HepG2) или по 20 тыс. на лунку (культуры Jurkat, COLO201).
На первом этапе эксперимента через сутки в лунки с клетками добавляли препараты в конечных концентрациях от 1×10−4 до 1×10−10 моль/л (культуры A549, SK-BR-3, SNU-1, Jurkat и WI-38) или от 1×10−3 до 1×10−8 моль/л (культуры CT-26, MDA-MB231, 4T1, COLO201, HepG2), растворенные в ДМСО (концентрация ДМСО в лунках в итоге составляла 1%). В контрольные лунки добавляли ДМСО в той же концентрации, что и в опытных лунках, и полную питательную среду. В качестве неспецифического положительного контроля в соответствующие лунки вносили по 10 мкл 0,1% раствора детергента Тритон Х-100.
После внесения тестируемых соединений планшеты с клетками инкубировали в течение 72 ч в атмосфере 5% CO2. После инкубирования из лунок удаляли питательную среду (в случае клеточных линий SNU-1, Jurkat и COLO201 предварительно выполняли центрифугирование планшетов при 1500 об/мин в течение 6 мин) и вносили в каждую лунку раствор MTT-реагента [3-(4,5-метилтиазол-2-ил)-2,5-дифенил тетразолия бромида] в полной питательной среде до конечной концентрации 0,5 мг/мл. Планшеты термостатировали при 37°C в течение 2 ч (в случае культур CT-26, MDA-MB231, 4T1, COLO201, HepG2) или 4 ч (в случае культур A549, SK-BR-3, SNU-1, Jurkat, WI-38), затем удаляли надосадочную жидкость и растворяли осадок формазана в ДМСО. Оптическую плотность раствора в каждой лунке измеряли при длине волны 540 нм и референсной длине волны 650 нм. Величина поглощения прямо пропорциональна числу живых клеток.
На втором этапе исследования для более точного определения IC50 (концентрации, вызывающей гибель 50% клеток) оценивали цитотоксический эффект субстанций в концентрациях, близких к найденной на 1 этапе IC50.
Исследование цитотоксической активности каждого вещества в отношении клеток каждой линии проводили в трех параллелях; для расчета IC50 использовали среднее значение. Определение жизнеспособности клеток в диапазоне значения IC50 проводили в двух параллелях.
Расчет жизнеспособности клеток после инкубации в присутствии тестируемых соединений выполняли в отношении жизнеспособности клеток в контрольных экспериментах. Процентное содержание жизнеспособных клеток (ЖС, %) рассчитывали по формуле (1):

где ОПТО/ПС - оптическая плотность растворов в лунках, содержавших исследуемые соединения;
ОПК - оптическая плотность растворов в контрольных лунках, не содержавших исследуемых соединений.
Обработку экспериментальных данных проводили с использованием программных пакетов GraphPad Prism 5.0, GraphPad Prism 7 (GraphPad Software, Inc., США) и Microsoft Office Excel. Для всех данных применяли описательную статистику. Нормальность распределения данных проверяли с использованием теста Шапиро-Уилкса. Согласно руководству по проведению доклинических исследований, новое потенциальное противоопухолевое соединение считается цитотоксически активным, если его IC50 ≤ 1×10−4 моль/л [Руководство по проведению доклинических исследований лекарственных средств. Часть первая (под ред. А.Н. Миронова). - М.: Гриф и К, 2013. - 944 с.].
Инкубация опухолевых клеток различных линий в присутствии соединений 1a-c в течение 72 ч приводит к выраженному цитотоксическому эффекту. Наиболее высокую чувствительность к исследуемым веществам среди клеточных линий, использованных в эксперименте, проявили клетки линии карциномы молочной железы мыши 4Т1, карциномы желудка человека SNU-1 и острого Т-лимфобластного лейкоза Jurkat. Наибольшую активность проявляло соединение 1a. Клеточная линия нормальных фибробластов (WI-38) менее чувствительна к действию соединений 1a-c в концентрации 1×10−4 моль/л по сравнению с большинством опухолевых клеточных линий.
В таблице 2 представлены значения IC50 для соединений 1a-c в отношении клеток различных опухолевых линий, а также фибробластов человека WI-38, рассчитанные на основании данных МТТ-теста, в диапазоне концентраций близких к IC50.
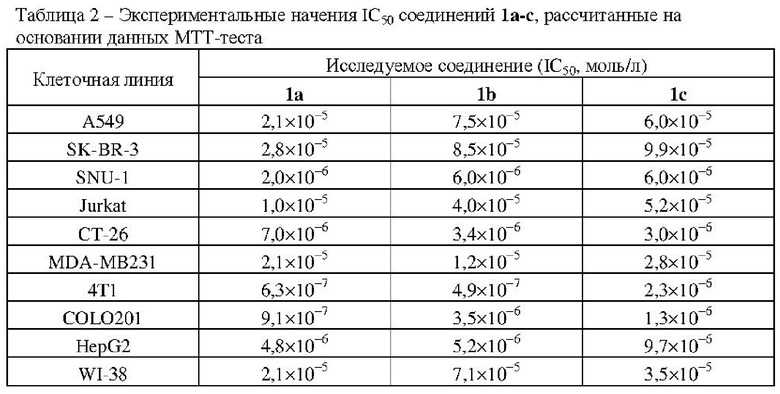
Сравнение значений IC50 показывает, что исследуемые пуринил-производные (RS)-ω-аминоалканоил-3,4-дигидро-3-метил-7,8-дифтор-2H-[1,4]бензоксзаина, в особенности соединения 1a и 1b, обладают выраженным цитотоксическим действием в отношении клеток тестируемых линий. Токсичность в отношении большинства культур опухолевых клеток в экспериментах превосходила токсичность в отношении нормальных клеток (фибробласты легкого человека WI-38). Клеточная линия нормальных фибробластов WI-38 оказалась менее чувствительной к наиболее высокой исследованной концентрации 1×10−4 моль/л, чем опухолевые клеточные линии (21 % выживших клеток против 6-8%).
Таким образом, установлена высокая цитотоксическая активность соединений 1a-c в отношении клеток опухолевых линий CT-26, MDA-MB231, 4T1, COLO201, HepG2. Рассчитанное значение IC50 для всех тестируемых веществ составляет 4,9×10−7÷9,9×10−5 моль/л. Установлено, что наибольшей чувствительностью к соединениям 1a-c среди изученных клеточных линий обладает линия карциномы молочной железы мыши 4Т1 (IC50 ≤ 2,3×10−6 моль/л), колоректальной аденокарциномы человека COLO201 (IC50 ≤ 3,5×10−6 моль/л), рака желудка SNU-1 (IC50 ≤ 6,0×10−6 моль/л), гепатоцеллюлярной карциномы человека HepG2 (IC50 ≤ 9,7×10−6 моль/л) и Т-лимфобластного лейкоза Jurkat (IC50 ≤ 5,2×10−5 моль/л).
Производные пурина общей формулы 1, содержащие остаток 3,4-дигидро-3-метил-7,8-дифтор-2H-[1,4]бензоксзаина и остатки ω-аминоалкановых кислот в качестве линкера, обладают высокой цитотоксической активностью. В исследовании использовали клеточные линии опухолей человека (рак легкого, рак молочной железы, рак желудка, лейкоз) и клеточную линию нормальной ткани (фибробласты легкого). IC50 в отношении широкого круга культур опухолевых клеток не превышают 1×10−4 моль/л. Показано, что фибробласты менее чувствительны к действию тестируемых соединений в концентрации 1×10−4 моль/л, чем опухолевые клетки. Установлено, что клеточные линии обладают разной чувствительностью к исследованным веществам (высокочувствительными являются клеточные линии карциномы молочной железы мыши 4Т1, колоректальной аденокарциномы человека COLO201, гепатоцеллюлярной карциномы человека HepG2, рака желудка SNU-1 и Т-клеточного лейкоза Jurkat).
| название | год | авторы | номер документа |
|---|---|---|---|
| АМИДЫ N-(2-АМИНОПУРИН-6-ИЛ)-6-АМИНОКАПРОНОВОЙ КИСЛОТЫ, ОБЛАДАЮЩИЕ ПРОТИВООПУХОЛЕВОЙ АКТИВНОСТЬЮ, И СПОСОБ ИХ ПОЛУЧЕНИЯ | 2015 |
|
RU2599577C2 |
| (3S)-4-[6-(Пурин-6-иламино)гексаноил]-3,4-дигидро-3-метил-7,8-дифтор-2Н-[1,4]бензоксазин и (3R)-4-[6-(Пурин-6-иламино)гексаноил]-3,4-дигидро-3-метил-7,8-дифтор-2Н-[1,4]бензоксазин, обладающие противовирусной активностью | 2016 |
|
RU2644351C1 |
| ПРОИЗВОДНЫЕ 7-ИЗОИНДОЛИНИЛХИНОЛОНА И 7-ИЗОИНДОЛИНИЛНАФТИРИДОНА | 1993 |
|
RU2111964C1 |
| УСИЛИТЕЛЬ ПРОТИВООПУХОЛЕВОГО ВОЗДЕЙСТВИЯ, СОДЕРЖАЩИЙ СОЕДИНЕНИЕ ПИРРОЛОПИРИМИДИНА | 2016 |
|
RU2710380C1 |
| ИНГИБИТОРЫ ПРОТЕИНКИНАЗ ДЛЯ УСИЛЕНИЯ РЕГЕНЕРАЦИИ ПЕЧЕНИ ИЛИ СНИЖЕНИЯ ИЛИ ПРЕДОТВРАЩЕНИЯ ГИБЕЛИ ГЕПАТОЦИТОВ | 2019 |
|
RU2822216C2 |
| Соединения фторхинолонового ряда на основе производных пиридоксина, обладающие антибактериальными свойствами | 2019 |
|
RU2713932C1 |
| 6-5 КОНДЕНСИРОВАННЫЕ КОЛЬЦА КАК ИНГИБИТОРЫ С5а | 2018 |
|
RU2780338C2 |
| НОВЫЕ СОЕДИНЕНИЯ КАК ПОТЕНЦИАЛЬНЫЕ ИНДУКТОРЫ ТЕРМИНАЛЬНОЙ ДИФФЕРЕНЦИАЦИИ КЛЕТОК ОПУХОЛИ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ | 1992 |
|
RU2128643C1 |
| ГЕТЕРОЦИКЛИЧЕСКИЕ ПРОИЗВОДНЫЕ И ИХ ПРИМЕНЕНИЕ | 2015 |
|
RU2711502C2 |
| БЕНЗОКСАЗИН-ОКСАЗОЛИДИНОНОВОЕ СОЕДИНЕНИЕ, ЗАМЕЩЕННОЕ АЗОТСОДЕРЖАЩИМ ГЕТЕРОЦИКЛОМ, СПОСОБ ЕГО ПОЛУЧЕНИЯ И ПРИМЕНЕНИЕ | 2018 |
|
RU2744784C1 |
Изобретение относится к 4-[(пурин-6-ил)аминополиметиленкарбонил]-производным 3,4-дигидро-3-метил-7,8-дифтор-2H-[1,4]бензоксазина общей формулы I. Технический результат – получены новые соединения, которые могут найти применение в медицине в качестве средств, обладающих противоопухолевой активностью. 2 табл., 4 пр.
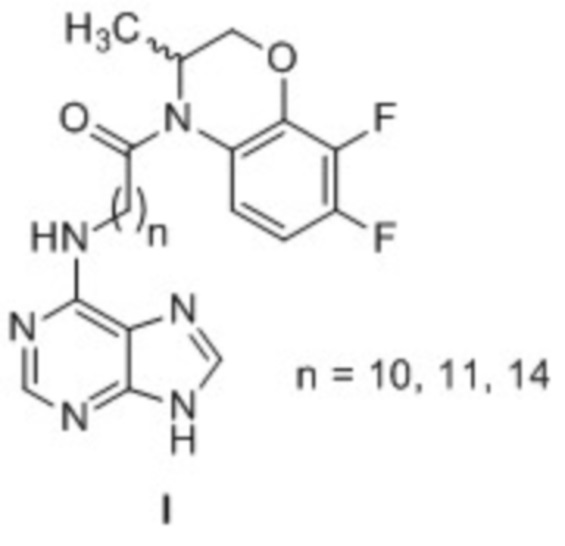
4-[(Пурин-6-ил)аминополиметиленкарбонил]-производные 3,4-дигидро-3-метил-7,8-дифтор-2H-[1,4]бензоксазина общей формулы I
 ,
,
обладающие противоопухолевой активностью.
| (3S)-4-[6-(Пурин-6-иламино)гексаноил]-3,4-дигидро-3-метил-7,8-дифтор-2Н-[1,4]бензоксазин и (3R)-4-[6-(Пурин-6-иламино)гексаноил]-3,4-дигидро-3-метил-7,8-дифтор-2Н-[1,4]бензоксазин, обладающие противовирусной активностью | 2016 |
|
RU2644351C1 |
| АМИДЫ N-(2-АМИНОПУРИН-6-ИЛ)-6-АМИНОКАПРОНОВОЙ КИСЛОТЫ, ОБЛАДАЮЩИЕ ПРОТИВООПУХОЛЕВОЙ АКТИВНОСТЬЮ, И СПОСОБ ИХ ПОЛУЧЕНИЯ | 2015 |
|
RU2599577C2 |
| KRASNOV V.P | |||
| ET AL., Mendeleev Communications, 25, 2015, pp.412-414 | |||
| WO 2003014296 A2, 20.02.2003 | |||
| FR 2851248 B1, 08.04.2005. | |||
Авторы
Даты
2021-11-23—Публикация
2021-04-26—Подача