ОБЛАСТЬ ТЕХНИКИ
[0001] Настоящее изобретение относится к области конъюгатов антитело-лекарственное средство, и, в частности, к конъюгату антитело-лекарственное средство, нагруженному бинарными токсинами посредством антитела.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ ИЗОБРЕТЕНИЯ
[0002] Конъюгат антитело-лекарственное средство (ADC) относится к биологическому лекарственному средству, в котором биологически активное лекарственное средство (препарат) связано с антителом (антитело) посредством химического линкера (линкер). ADC похож на точно наведенную систему вооружения, в которой биологически активное лекарственное средство действует, как уничтожающая амуниция для точного поражения больных клеток под руководством антитела. Следовательно, ADC совмещает двойные преимущества высокой эффективности молекул цитотоксического лекарственного средства и высокого нацеливания антител.
[0003] К марту 2021 г. только 11 конъюгатов антитело-лекарственное средство были одобрены во всем мире (как показано в таблице 1), и все они являются молекулами ADC, в которых одно нацеливающее антитело связано с одной молекулой токсина. Из-за ограниченного количества антигенов на поверхности опухолевых клеток уровень экспрессии антигена, требуемый для эффективного действия ADC, варьируется в зависимости от характеристик различных антигенов. ADC требует по меньшей мере 104 антигенов/клетку для обеспечения доставки летальных количеств цитотоксических лекарственных средств. В идеале антиген, на который нацелено антитело ADC, должен быть однородно распределен на поверхности опухолевых клеток и иметь высокое количество копий (>105/клетку). Однако реальность такова, что обычно существует только ограниченное количество антигенов на поверхности опухолевых клеток (около 5000 на 106 антигенов/клетку), идеальное среднее значение DAR ADC составляет 3,5-4 (например, среднее значение DAR Брентуксимаба ведотина составляет 4, и среднее значение DAR трастузумаба эмтанзина составляет 3,5), и количество лекарственного средства, доставляемого в опухолевые клетки, является очень низким, так что лекарственный эффект на опухолевые клетки является плохим, что также расценивается, как одна из основных причин клинических неудач ADC.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
[0004] Для решения вышеуказанных проблем настоящее изобретение предлагает конъюгат антитело-лекарственное средство, способное быть нагруженным бинарными токсинами. Конкретно, настоящее изобретение относится к конъюгату антитело-лекарственное средство, содержащему следующую структуру:

[0005] где:
[0006] Ab представляет собой антитело или антиген-связывающий фрагмент;
[0007] S представляет собой атом серы в сульфгидрильном остатке, образованном после открытия межцепочечной дисульфидной связи на Ab;
[0008] Aa представляет собой фрагмент аминокислоты, включающий одну или более аминокислот;
[0009] G представляет собой необязательный расщепляемый фрагмент;
[0010] D1 представляет собой MMAF;
[0011] D2 представляет собой фрагмент второго активного лекарственного средства, иного чем MMAF;
[0012] p представляет собой целое число, выбираемое из 1, 2, 3, 4, 5, 6, 7, и 8.
[0013] Антитело или антиген-связывающий фрагмент Ab реагирует с антигенами, связанными с раком, инфекционным заболеванием или аутоиммунным заболеванием, или их эпитопами; Необязательно, Ab является интактным антителом, фрагментом (таким как Fab, Fab', F(ab)2, и F(ab')2) или субфрагментом (таким как одноцепочечная конструкция), полученным из мышиного, химерного, примата, гуманизированного или человеческого моноклонального антитела, и антитело включает биспецифическое антитело и мультиспецифическое антитело. Необязательно, Ab представляет собой интактную форму мышиного, химерного, антитела приматов, гуманизированного или человеческого моноклонального антитела, и Ab имеет Fc домен и шарнирный домен человеческого антитела IgG1 или человеческого антитела IgG4, или форму с частичными мутациями, заменами или делециями аминокислот.
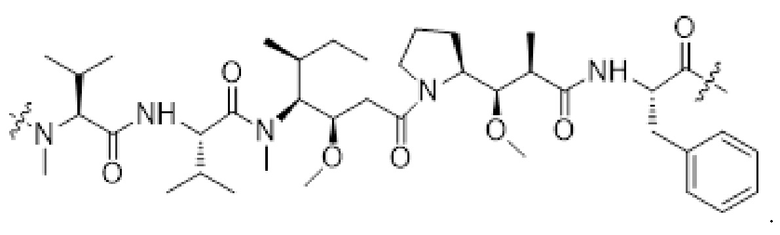
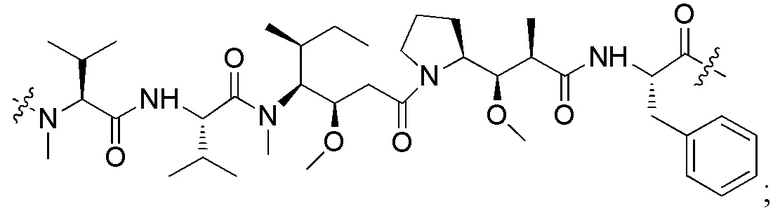
[0014] Первый фрагмент активного лекарственного средства D1 выбран из цитотоксических средств ауристатина; предпочтительно, первый фрагмент активного лекарственного средства D1 содержит свободную карбоксильную группу.
[0015] В некоторых предпочтительных вариантах осуществления изобретения, первый фрагмент активного лекарственного средства D1 выбран из следующей структуры или его таутомера, мезомера, рацемата, энантиомера, диастереоизомера или их смеси, или их фармацевтически приемлемой соли или сольвата:
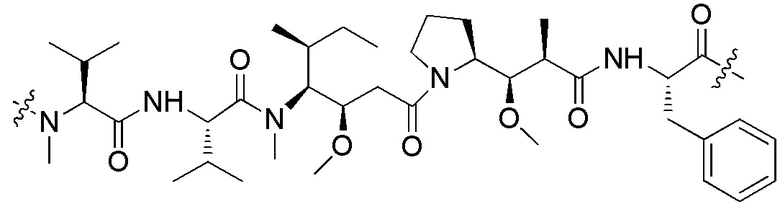 .
.
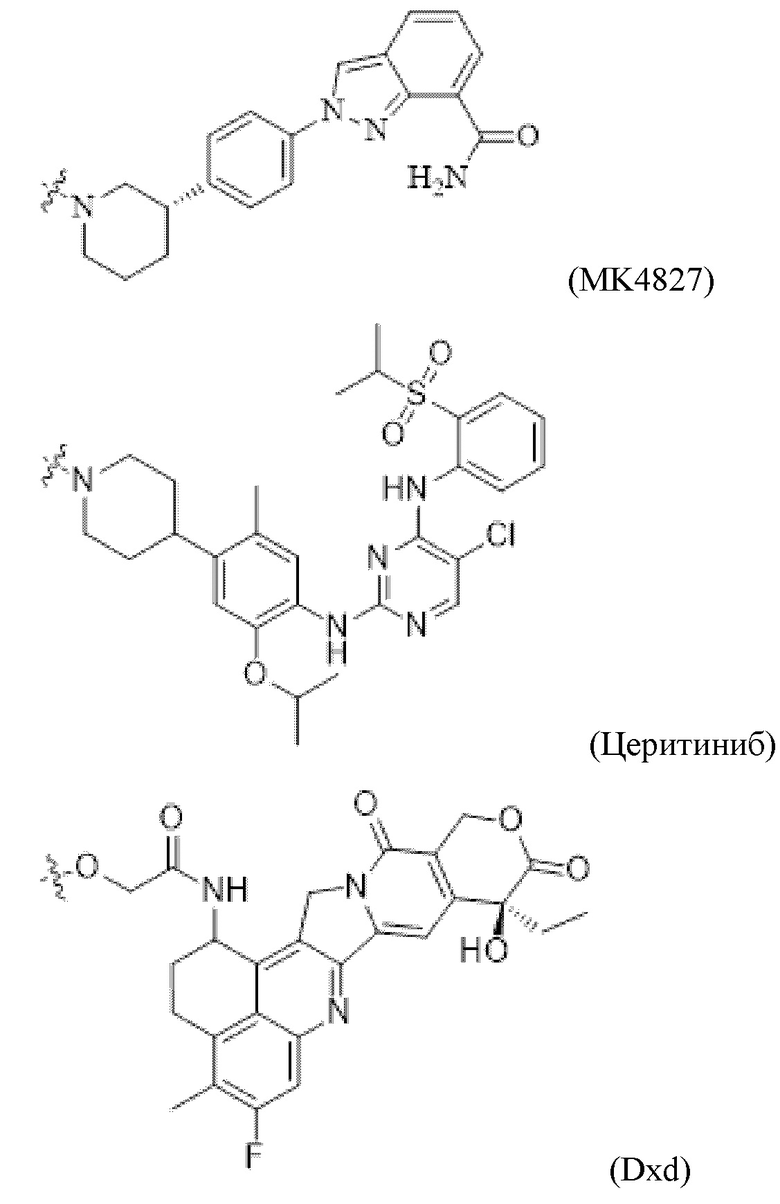
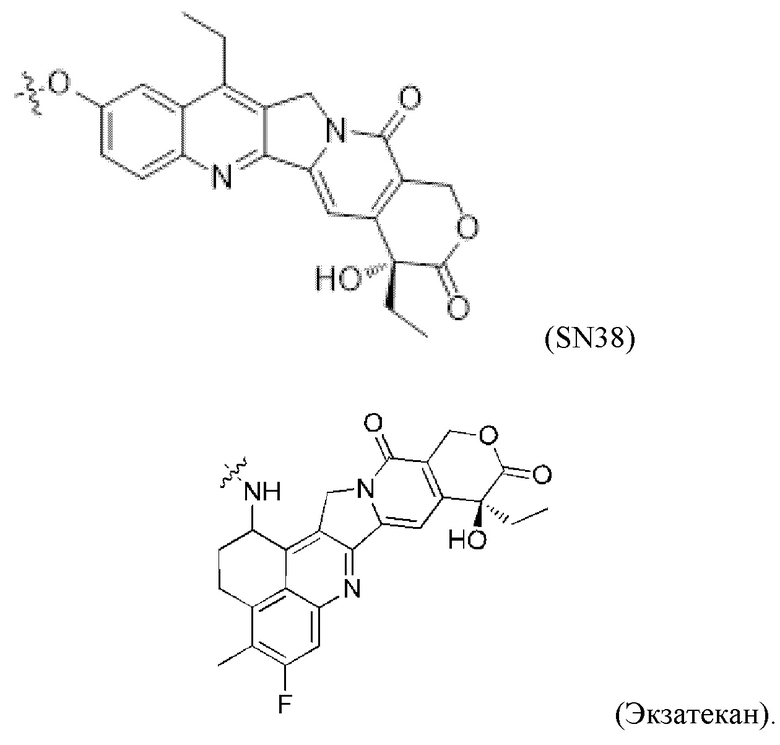
[0016] Второй фрагмент активного лекарственного средства D2 выбран из группы, состоящей из цитотоксической молекулы, иммуноактиватора и радиоизотопа; цитотоксическая молекула включает, без ограничения, ингибитор тубулина, средство, повреждающее ДНК, ингибитор топоизомеразы, ингибитор ALK, и ингибитор PARP; более предпочтительно, ингибитор тубулина включает, без ограничения, цитотоксические молекулы доластатина и ауристатина, цитотоксические молекулы майтанзина; средство, повреждающее ДНК, включающее без ограничения калихимицины, дуокармицины и антрамицины производные PBD; ингибитор топоизомеразы включает камптотецины и производные камптотецинов; более предпочтительно, цитотоксические молекулы ауристатина включают, без ограничения MMAE или MMAF или их производные, и цитотоксические молекулы майтанзина включают, без ограничения DM1, DM4 или их производные.
[0017] В некоторых предпочтительных вариантах осуществления изобретения, фрагмент второго активного лекарственного средства D2 выбран из ингибитора ALK, ингибитора PARP, и ингибитора топоизомеразы.
[0018] В некоторых более предпочтительных вариантах осуществления изобретения фрагмент второго активного лекарственного средства D2 выбран из следующих структур или их таутомера, мезомера, рацемата, энантиомера, диастереомера или их смеси, или их фармацевтически приемлемой соли или сольвата:

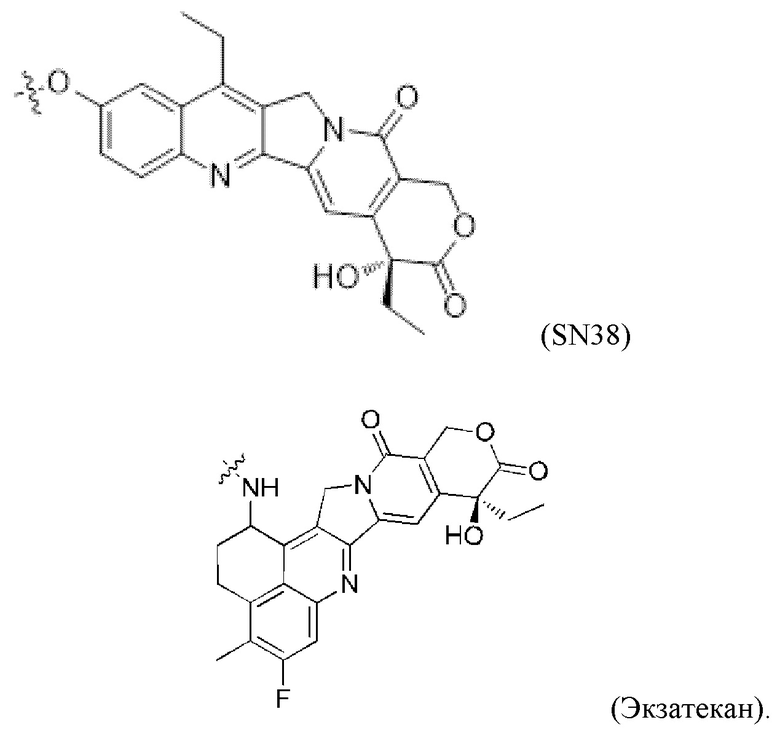
[0019] В некоторых предпочтительных вариантах осуществления изобретения фрагмент первого активного лекарственного средства D1 и фрагмент второго активного лекарственного средства D2 представляют собой MMAF и SN38, соответственно.
[0020] В некоторых предпочтительных вариантах осуществления изобретения, фрагмент первого активного лекарственного средства D1 и фрагмент второго активного лекарственного средства D2 представляют собой MMAF и MK4827, соответственно.
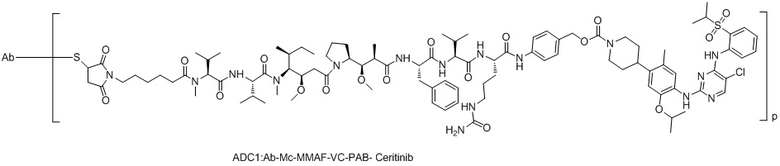
[0021] В некоторых предпочтительных вариантах осуществления изобретения, фрагмент первого активного лекарственного средства D1 и фрагмент второго активного лекарственного средства D2 представляют собой MMAF и церитиниб, соответственно.
[0022] В некоторых предпочтительных вариантах осуществления изобретения, фрагмент первого активного лекарственного средства D1 и фрагмент второго активного лекарственного средства D2 представляют собой MMAF и Dxd, соответственно.
[0023] В некоторых предпочтительных вариантах осуществления изобретения, фрагмент первого активного лекарственного средства D1 и фрагмент второго активного лекарственного средства D2 представляют собой MMAF и Экзатекан, соответственно.
[0024] Фрагмент аминокислоты Aa может содержать одну аминокислоту, выбранную из группы, состоящей из -глицина-, -аланина-, -валина-, -лейцина-, -изолейцина-, -пролина-, -фенилаланина-, -триптофана-, -метионина-, -тирозина-, -серина-, -треонина-, -цистеина-, -аспарагина-, -глютамина-, -аспарагиновой кислоты-, -глютаминовой кислоты-, -лизина-, -аргинина-, -гистидина-, -цитруллина-, -лизин(тритила)-, -лизин(монометокситритила)-, и -лизин(фторенилметоксикарбонила)-; предпочтительно, Aa выбран из группы, состоящей из -валина-, -цитруллина-, -аланина-, -лизина-, -лизин(тритила)-, -лизин(монометокситритила)-, -лизин(фторенилметоксикарбонила)-, -аргинина-, -фенилаланина-, -глицин-, -лейцина-, и -изолейцина-.
[0025] Фрагмент аминокислоты Aa может содержать две аминокислоты и они могут быть одинаковыми или разными. Каждую из них независимо выбран из группы, состоящей из -глицина-, -аланина-, -валина-, -лейцина-, -изолейцина-, -пролина-, -фенилаланина-, -триптофана-, -метионина-, -тирозина-, -серина-, -треонина-, -цистеина-, -аспарагина-, -глютамина-, -аспарагиновой кислоты-, -глютаминовой кислоты-, -лизина-, -аргинина-, -гистидина-, -цитруллина-, -лизин(тритила)-, -лизин(монометокситритила)-, и -лизин(фторенилметоксикарбонила)-; предпочтительно, аминокислоту выбран из группы, состоящей из -валина-, -цитруллина-, -аланина-, -лизина-, -лизин(тритила)-, -лизин(монометокситритила)-, -лизин(фторенилметоксикарбонила)-, -аргинина-, -фенилаланина-, -глицин-, -лейцина-, и -изолейцина-.
[0026] Фрагмент аминокислоты Aa может содержать три аминокислоты, и они могут быть одинаковыми или разными. Каждую из них независимо выбран из группы, состоящей из -глицина-, -аланина-, -валина-, -лейцина-, -изолейцина-, -пролина-, -фенилаланина-, -триптофана-, -метионина-, -тирозина-, -серина-, -треонина-, -цистеина-, -аспарагина-, -глютамина-, -аспарагиновой кислоты-, -глютаминовой кислоты-, -лизина-, -аргинина-, -гистидина-, -цитруллина-, -лизин(тритила)-, -лизин(монометокситритила)-, и -лизин(фторенилметоксикарбонила)-; предпочтительно, аминокислоту выбран из группы, состоящей из -валина-, -цитруллина-, -аланина-, -лизина-, -лизин(тритила)-, -лизин(монометокситритила)-, -лизин(фторенилметоксикарбонила)-, -аргинина-, -фенилаланина-, -глицина-, -лейцина-, и -изолейцина-.
[0027] Фрагмент аминокислоты Aa может содержать четыре аминокислоты, и они могут быть одинаковыми или разными. Каждую из них независимо выбран из группы, состоящей из -глицин-, -аланина-, -валина-, -лейцина-, -изолейцина-, -пролина-, -фенилаланина-, -триптофана-, -метионина-, -тирозина-, -серина-, -треонина-, -цистеина-, -аспарагина-, -глютамина-, - аспарагиновой кислоты-, -глютаминовой кислоты-, -лизина-, -аргинина-, -гистидина-, -цитруллина-, -лизин(тритила)-, -лизин(монометокситритила)-, и -лизин(фторенилметоксикарбонила)-; предпочтительно, аминокислоту выбран из группы, состоящей из -валина-, -цитруллина-, -аланина-, -лизина-, -лизин(тритила)-, -лизин(монометокситритила)-, -лизин(фторенилметоксикарбонила)-, -аргинина-, -фенилаланина-, -глицина-, -лейцина-, и -изолейцина-; n представляет собой целое число, выбираемое из 0 и 1, и когда n представляет собой 0, AA4 и D2 являются непосредственно ковалентно связанными.
[0028] В некоторых предпочтительных вариантах осуществления изобретения фрагмент аминокислоты Aa выбран из группы, состоящей из -валин-цитруллина- (-Val-Cit-), -валин-аланина- (-Val-Ala-), -валин-лизина- (-Val-Lys-), -валин-лизина(тритил)- (-Val-Lys(Trt)-), -валин-лизин(монометокситритила)- (-Val-Lys(Mmt)-), -валин-лизин(фторенилметоксикарбонила)- (-Val-Lys(Fmoc)-), -валин-аргинина- (-Val-Arg-), -фенилаланин-цитруллина- (-Phe-Cit-), -фенилаланин-лизина- (-Phe-Lys-), -фенилаланин-лизин(тритила)- (-Phe-Lys(Trt)-), -фенилаланин-лизин(монометокситритила)- (-Phe-Lys(Mmt)-), -фенилаланин-лизин(фторенилметоксикарбониал)- (-Phe-Lys(Fmoc)-), -лейцин-цитруллина- (-Leu-Cit-), -изолейцин-цитруллина- (-Ile-Cit-), и -фенилаланин-аргинина- (-Phe-Arg-);
[0029] В других предпочтительных вариантах осуществления изобретения фрагментом аминокислоты Aa является -фенилаланин-аргинин-аргинин- (-Ala-Arg-Arg-);
[0030] В других предпочтительных вариантах осуществления изобретения фрагмент аминокислоты Aa выбран из группы, состоящей из -глицин-глицин-фенилаланин-глицина- (-Gly-Gly-Phe-Gly-), -глицин-фенилаланин-лейцин-глицина- (-Gly-Phe-Leu-Gly-), и -аланин-лейцин-аланин-лейцина (-Ala-Leu-Ala-Leu-).
[0031] Необязательно, структура аминокислотного фрагмента Aa может быть выбрана из следующего:


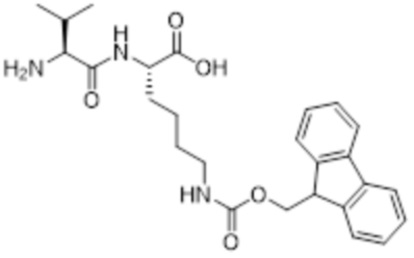
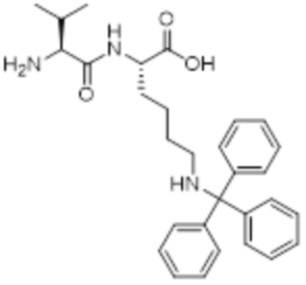
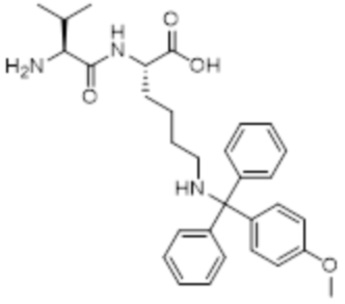

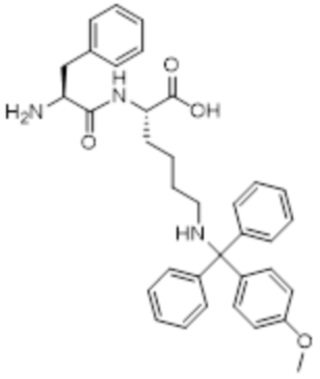
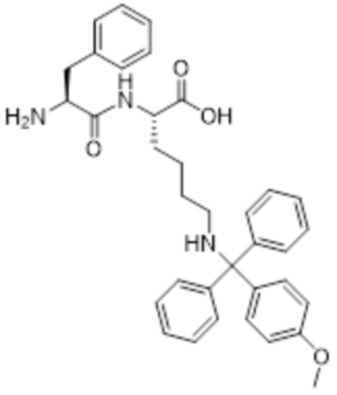
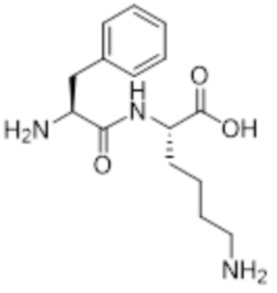
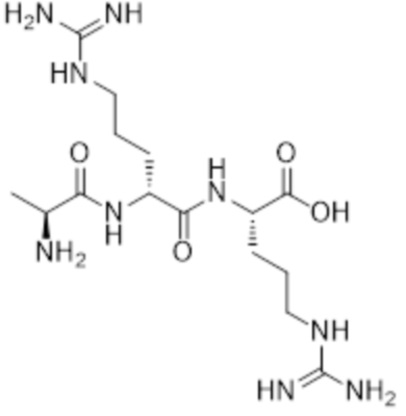
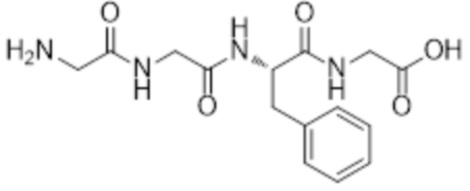
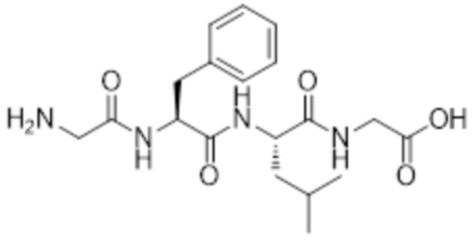
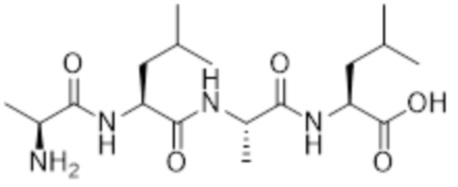
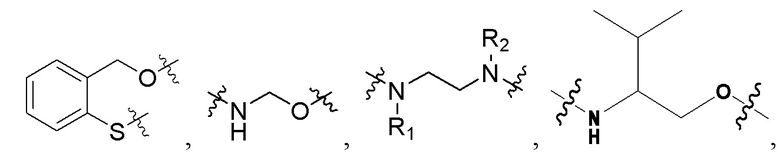
[0032] В некоторых определенных вариантах осуществления изобретения саморазрушающийся фрагмент G отсутствует или его выбран из следующих структур:

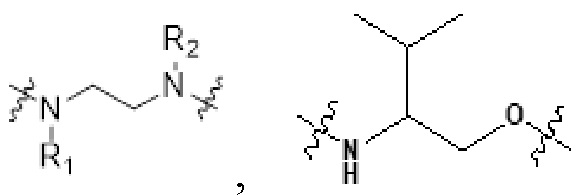 , где R1 и R2 являются любыми группами заместителями; предпочтительно, R1 и R2 независимо выбран из H, C1-C10 алкила и
, где R1 и R2 являются любыми группами заместителями; предпочтительно, R1 и R2 независимо выбран из H, C1-C10 алкила и 
[0033] Когда саморазрушающийся фрагмент G отсутствует, последняя группа аминокислоты Aa ковалентно связана со вторым активным лекарственным средством D2.
[0034] Необязательно, саморазрушающийся фрагмент G выбран из следующих структур:
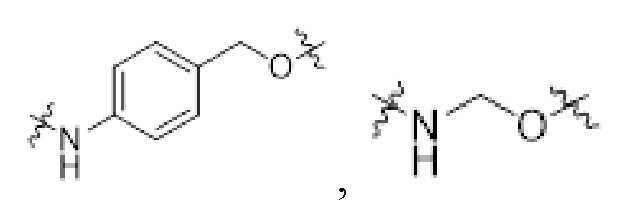
[0035] В некоторых специфических вариантах осуществления изобретения конъюгат антитело-лекарственное средство выбран из следующих структур, где p представляет собой целое число, выбираемое из 1, 2, 3, 4, 5, 6, 7, и 8:
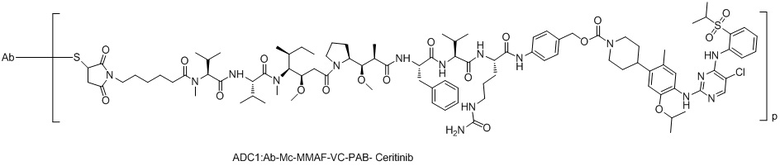 ,
,
ADC1::Ab-Mc-MMAF-VC-PAB-Церитиниб
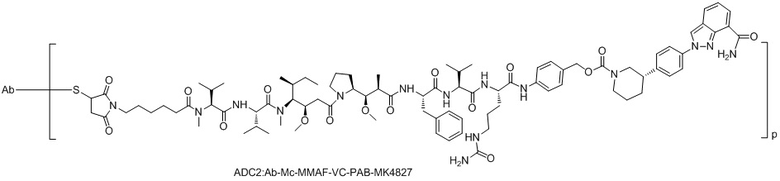
ADC2: Ab-Mc-MMAF-VC-PAB-МК4827

ADC3: Ab-Mc-MMAF-VC-PAB-DMEDA-PEG(N3)-SN38
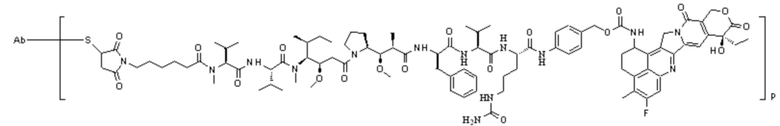
ADC4: Ab-MC-MMAF-VC-PAB-Экзатекан
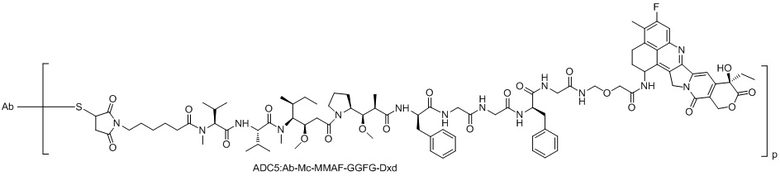
ADC5: Ab-Mc-MMAF-GGFG-Dxd.
[0036] Настоящее изобретение также относится к применению конъюгата антитела-лекарственного средства любого из вышеуказанных в получении лекарственного препарата для лечения или профилактики рака, инфекционных заболеваний или аутоиммунных заболеваний.
[0037] Рак относится к гематопоэтической опухоли, карциноме, саркоме, меланоме или глиальной опухоли, например, без ограничения, выбираемой из группы, состоящей из рака молочной железы, рака яичника, рака шейки матки, рака матки, рака предстательной железы, рака почки, рака уретры, рака мочевого пузыря, рака печени, рака желудка, рака эндометрия, рака слюнной железы, рака пищевода, рака легкого, рака толстой кишки, рака прямой кишки, колоректального рака, рака кости, рака кожи, рака щитовидной железы, рака поджелудочной железы, меланомы, глиомы, нейробластомы, полиморфной глиомы, саркомы, лимфомы, лейкоза и других солидных опухолей или гематологических опухолей.
[0038] Аутоиммунные заболевания относятся к заболеваниям, вызываемым иммунным ответом организма на его собственные ткани, таким как, без ограничения: иммуноопосредованная тромбоцитопения, дерматомиозит, синдром Шегрена, рассеянный склероз, хорея Сиденхема, миастения гравис, системная красна волчанка, волчаночный нефрит, ревматическая лихорадка, ревматоидный артрит, полигландулярный синдром, буллезный пемфигоид, диабет, пурпура Геноха-Шенлейна, пост-стрептококковый нефрит, узловатая эритема, артериит Такаясу, болезнь Аддисона, саркоидоз, язвенный колит, полиморфная эритема, IgA нефропатия, узловой полиартериит, анкилозирующий спондилит, синдром Гудпасчера, облитерирующий тромбоангиит, первичный билиарный цирроз, тиреоидит Хашимото, тиреотоксикоз, склеродермия, хронический активный гепатит, полимиозит/дерматомиозит, полихондрит, вульгарная пузырчатка, гранулематоз Вегенера, мембранозная нефропатия, амиотрофический боковой склероз, сухотка спинного мозга, гигантоклеточный артериит/полимиалгия, пернициозная анемия, быстропрогрессирующий гломерулонефрит, фиброзный альвеолит, ювенильный диабет и новые заболевания.
[0039] Инфекционные заболевания главным образом относятся к патогенным биологическим инфекциям, включая без ограничения: вирус иммунодефицита человека (ВИЧ), микобактерию туберкулеза, стрептококк агалактика, метициллин-резистентный золотистый стафилококк, пневмофильную легионеллу, пиогенный стрептококк, кишечную палочку, нейсерию гонореи, нейсерию менингита, пневмококк, гемофильную палочку типа B, бледную трепонему, спирохету болезни Лайма, вирус западного Нила, синегнойную палочку, микобактерию лепры, Bacillus abortus, вирус бешенства, вирус гриппа, цитомегаловирус, вирус простого герпеса тип I, вирус простого герпеса тип II, человеческий парвовирус сыворотки, респираторный синцитиальный вирус, вирус ветряной оспы, вирус гепатита В, вирус кори, аденовирус, человеческий вирус Т-клеточного лейкоза, вирус Эпштейн-барра, вирус мышиного лейкоза, вирус краснухи, вирус везикулярного стоматита, Sindbis virus, лимфоцитарный хориоидный вирус менингита, вирус бородавок, вирус синего языка овец, вирус Сендай, вирус кошачьего лейкоза, реовирус, вирус полиомиелита, вирус обезьян 40, мышиный вирус опухоли молочной железы, вирус лихорадки денге, вирус краснухи, Plasmodium falciparum, Plasmodium vivax, Toxoplasma murine, Trypanosoma japonicum, Trypanosoma cruzi, Trypanosoma Rhodesia, Trypanosoma brucei, Schistosoma mansonii, Schistosoma japonicum, Babesia bovis, Eimeria tenella, Onchocercia, Leishmania tropicalis, Trichinella spiralis, Theileria parvum, Vesicular tapeworm, Taenia ovis, Beef tapeworm, Echinococcus granulosus, Mesocestoides corti, Mycoplasma arthritis, Mycoplasma hyorhinis, Mycoplasma orale, Mycoplasma arginine, Acholeplasma laidlawii, Mycoplasma salivarius, Mycoplasma pneumonia и новые заболевания.
[0040] Настоящее изобретение также обеспечивает промежуточное соединение, структура которого показана в следующей формуле:
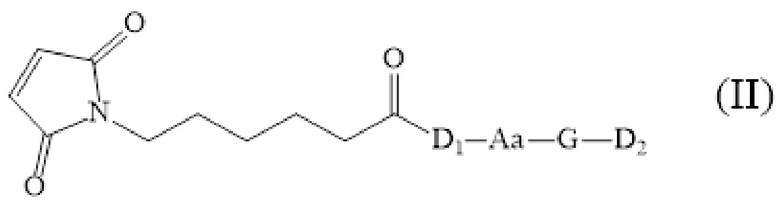
[0041] где:
[0042] Aa представляет собой фрагмент аминокислоты, включающий одну или более аминокислот;
[0043] G представляет собой необязательно расщепляемый фрагмент;
[0044] D1 представляет собой MMAF;
[0045] D2 представляет собой домен второго активного лекарственного средства, иного чем MMAF.
[0046] Фрагмент первого активного лекарственного средства D1 выбран из цитотоксических средств ауристатина; предпочтительно, фрагмент первого активного лекарственного средства D1 содержит свободную карбоксильную группу.
[0047] В некоторых предпочтительных вариантах осуществления изобретения фрагмент первого активного лекарственного средства D1 выбран из следующей структуры или его таутомера, мезомера, рацемата, энантиомера, диастереомера или их смеси, или их фармацевтически приемлемой соли или сольвата:
[0048] Фрагмент второго активного лекарственного средства D2 выбран из группы, состоящей из цитотоксической молекулы, иммунного стимулятора и радиоизотопа; цитотоксическая молекула без ограничения включает ингибитор тубулина, средство, повреждающее ДНК, ингибитор топоизомеразы, ингибитор ALK и ингибитор PARP; более предпочтительно, ингибитор тубулина включает, без ограничения, цитотоксические молекулы доластатина и ауристатина, цитотоксические молекулы майтанзина; средство, повреждающее ДНК, также включает, без ограничения калихимицины, дуокармицины и антрамицины, производные PBD; ингибитор топоизомеразы включает камптотецины и производные камптотецина; более предпочтительно, цитотоксические молекулы ауристатина включают, без ограничения MMAE или MMAF или их производное, и цитотоксические молекулы майтанзина включают, без ограничения DM1, DM4 или их производные.
[0049] В некоторых предпочтительных вариантах осуществления изобретения фрагмент второго активного лекарственного средства D2 выбран из ингибитора ALK, ингибитора PARP, и ингибитора топоизомеразы.
[0050] В некоторых более предпочтительных вариантах осуществления изобретения фрагмент второго активного лекарственного средства D2 выбран из следующей структуры или ее таутомера, мезомера, рацемата, энантиомера, диастереомера или их смеси, или их фармацевтически приемлемой соли или сольвата:
[0051] В некоторых предпочтительных вариантах осуществления изобретения фрагмент первого активного лекарственного средства D1 и фрагмент второго активного лекарственного средства D2 представляют собой MMAF и SN38, соответственно.
[0052] В некоторых предпочтительных вариантах осуществления изобретения фрагмент первого активного лекарственного средства D1 и фрагмент второго активного лекарственного средства D2 представляют собой MMAF и MK4827, соответственно.
[0053] В некоторых предпочтительных вариантах осуществления изобретения фрагмент первого активного лекарственного средства D1 и фрагмент второго активного лекарственного средства D2 представляют собой MMAF и Церитиниб, соответственно.
[0054] В некоторых предпочтительных вариантах осуществления изобретения фрагмент первого активного лекарственного средства D1 и фрагмент второго активного лекарственного средства D2 представляют собой MMAF и Dxd, соответственно.
[0055] В некоторых предпочтительных вариантах осуществления изобретения фрагмент первого активного лекарственного средства D1 и фрагмент второго активного лекарственного средства D2 представляют собой MMAF и Экзатекан, соответственно.
[0056] Аминокислота Aa может содержать одну аминокислоту, выбранную из группы, состоящей из -глицина-, -аланина-, -валина-, -лейцина-, -изолейцина-, -пролина-, -фенилаланина-, -триптофана-, -метионина-, -тирозина-, -серина-, -треонина-, -цистеина-, -аспарагина-, -глютамина-, -аспарагиновой кислоты-, -глютаминовой кислоты-, -лизина-, -аргинина-, -гистидина-, -цитруллина-, -лизин(тритила)-, -лизин(монометокситритила)-, и -лизин(фторенилметоксикарбонила)-; предпочтительно, Aa выбран из группы, состоящей из -валина-, -цитруллина-, -аланина-, -лизина-, -лизин(тритила)-, -лизин(монометокситритила)-, -лизин(фторенилметоксикарбонила)-, -аргинина-, -фенилаланина-, -глицин-, -лейцина-, и -изолейцина-.
[0057] Фрагмент аминокислоты Aa может содержать две аминокислоты, они могут быть одинаковыми или разными. Всех их независимо выбран из группы, состоящей из -глицина-, -аланина-, -валина-, -лейцина-, -изолейцина-, -пролина-, -фенилаланина-, -триптофана-, -метионина-, -тирозина-, -серина-, -треонина-, -цистеина-, -аспарагина-, -глютамина-, -аспарагиновой кислоты-, -глютаминовой кислоты-, -лизина-, -аргинина-, -гистидина-, -цитруллина-, -лизин(тритила)-, -лизин(монометокситритила)-, и -лизин (фторенилметоксикарбонила)-; предпочтительно, аминокислоту выбран из группы, состоящей из -валина-, -цитруллина-, -аланина-, -лизина-, -лизин(тритила)-, -лизин(монометокситритила)-, -лизин(фторенилметоксикарбонила)-, -аргинина-, -фенилаланина-, -глицина-, -лейцина-, и -изолейцина-.
[0058] Фрагмент аминокислоты Aa может содержать три аминокислоты, они могут быть одинаковыми или различными. Все их независимо выбран из группы, состоящей из -глицина-, -аланина-, -валина-, -лейцина-, -изолейцина-, -пролина-, -фенилаланина-, -триптофана-, -метионина-, -тирозина-, -серина-, -треонина-, -цистеина-, -аспарагина-, -глютамина-, -аспарагиновой кислоты-, -глютаминовой кислоты-, -лизина-, -аргинина-, -гистидина-, -цитруллина-, -лизин(тритила)-, -лизин(монометокситритила)-, и -лизин(фторенилметоксикарбонила)-; предпочтительно, аминокислоту выбран из группы, состоящей из -валина-, -цитруллина-, -аланина-, -лизина-, -лизин(тритила)-, -лизин(монометокситритила)-, -лизин(фторенилметоксикарбонила)-, -аргинина-, -фенилаланина-, -глицин-, -лейцина-, и -изолейцина-.
[0059] Фрагмент аминокислоты Aa может содержать четыре аминокислоты, которые могут быть одинаковыми или различными. Все их независимо выбран из группы, состоящей из -глицина-, -аланина-, -валина-, -лейцина-, -изолейцина-, -пролина-, -фенилаланина-, -триптофана-, -метионина-, -тирозина-, -серина-, -треонина-, -цистеина-, -аспарагина-, -глютамина-, -аспарагиновой кислоты-, -глютаминовой кислоты-, -лизина-, -аргинина-, -гистидина-, -цитруллина-, -лизин(тритила)-, -лизин(монометокситритила)-, и -лизин(фторенилметоксикарбонила)-; предпочтительно, аминокислоту выбран из группы, состоящей из -валина-, -цитруллина-, -аланина-, -лизина-, -лизин(тритила)-, -лизин(монометокситритила)-, -лизин(фторенилметоксикарбонила)-, -аргинина-, -фенилаланина-, -глицин-, -лейцина-, и -изолейцина-; n представляет собой целое число, выбираемое из 0 и 1, и где n составляет 0, AA4 непосредственно ковалентно связана с D2.
[0060] В некоторых предпочтительных вариантах осуществления изобретения фрагмент аминокислоты Aa выбран из группы, состоящей из -валин-цитруллина- (-Val-Cit-), -валин-аланина- (-Val-Ala-), -валин-лизина- (-Val-Lys-), -валин-лизин(тритила)- (-Val-Lys(Trt)-), -валин-лизин(монометокситритила)- (-Val-Lys(Mmt)-), -валин-лизин(фторенилметоксикарбонила)- (-Val-Lys(Fmoc)-), -валин-аргинина- (-Val-Arg-), -фенилаланин-цитруллина- (-Phe-Cit-), -фенилаланин-лизина- (-Phe-Lys-), -фенилаланин-лизина(тритил)- (-Phe-Lys(Trt)-), -фенилаланин-лизин(монометокситритила)- (-Phe-Lys(Mmt)-), -фенилаланин-лизин(фторенилметоксикарбонила)- (-Phe-Lys(Fmoc)-), -лейцин-цитруллина- (-Leu-Cit-), -изолейцин-цитруллина- (-Ile-Cit-), и -фенилаланин-аргинина- (-Phe-Arg-);
[0061] В других предпочтительных вариантах осуществления изобретения, фрагмент аминокислоты Aa представляет собой -фенилаланин-аргинин-аргинин- (-Ala-Arg-Arg-);
[0062] В некоторых предпочтительных вариантах осуществления изобретения, фрагмент аминокислоты Aa выбран из группы, состоящей из -глицин-глицин-фенилаланин-глицина- (-Gly-Gly-Phe-Gly-), -глицин-фенилаланин-лейцин-глицина- (-Gly-Phe-Leu-Gly-), и -аланин-лейцин-аланин-лейцина (-Ala-Leu-Ala-Leu-).
[0063] Необязательно, структура фрагмента аминокислоты Aa может быть выбрана из следующего:















[0064] В некоторых определенных вариантах осуществления изобретения саморазрушающийся фрагмент G отсутствует или его выбран из следующих структур:

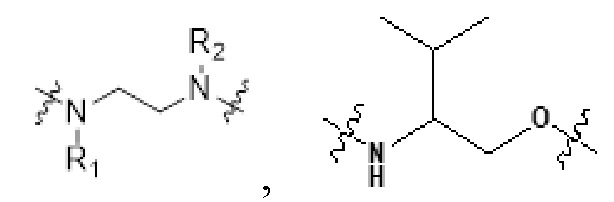 , где R1 и R2 являются любыми группами заместителями; предпочтительно, R1 и R2 независимо выбран из H, C1-C10 алкила и
, где R1 и R2 являются любыми группами заместителями; предпочтительно, R1 и R2 независимо выбран из H, C1-C10 алкила и 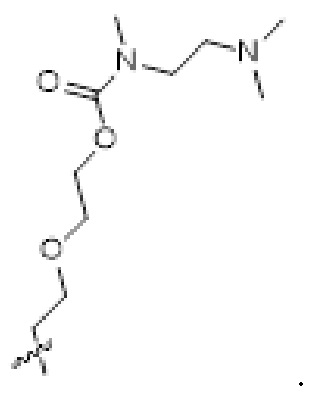 .
.
[0065] Когда саморазрушающийся фрагмент G отсутствует, последняя группа аминокислоты Aa ковалентно связана со вторым активным лекарственным средством D2.
[0066] Необязательно, саморазрушающийся фрагмент G выбран из следующих структур:
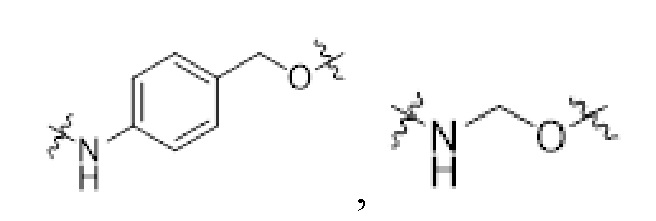
[0067] В некоторых определенных вариантах осуществления изобретения соединение выбран из следующих структур:
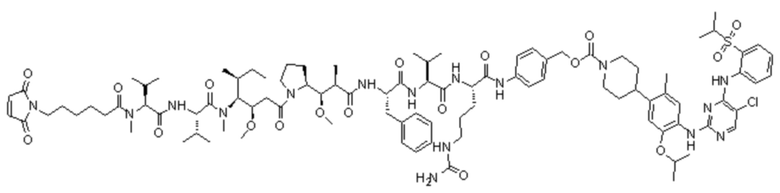
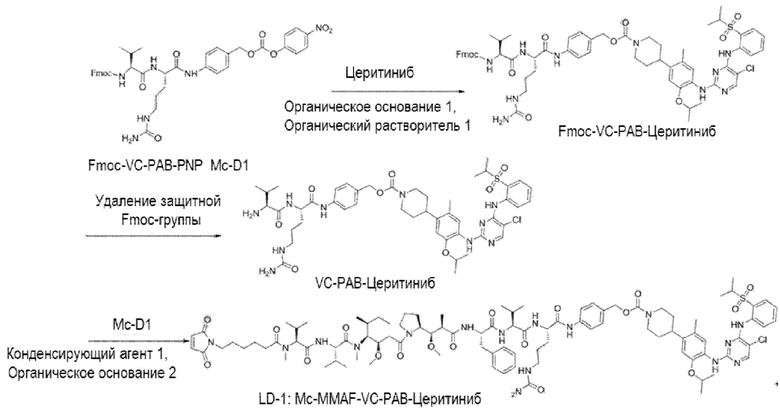
LD-1: Mc-MMAF-VC-PAB-Церитиниб
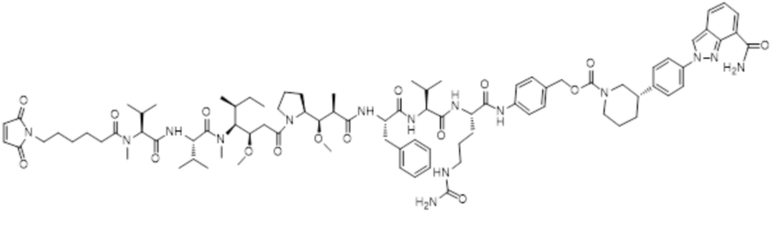
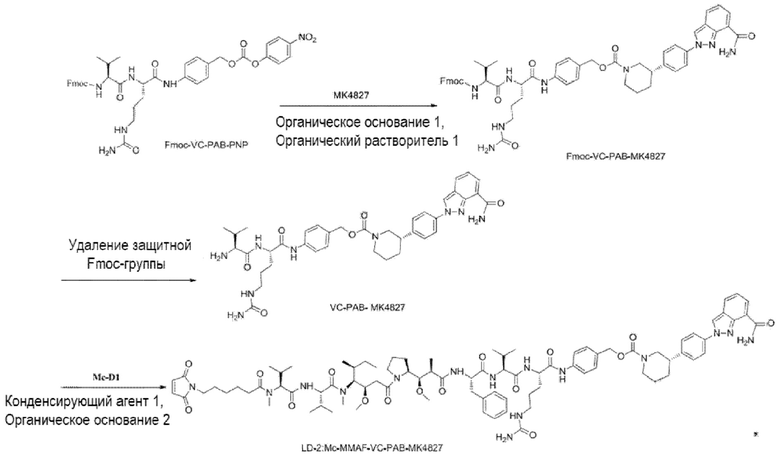
LD-2: Mc-MMAF-VC-PAB-МК4827
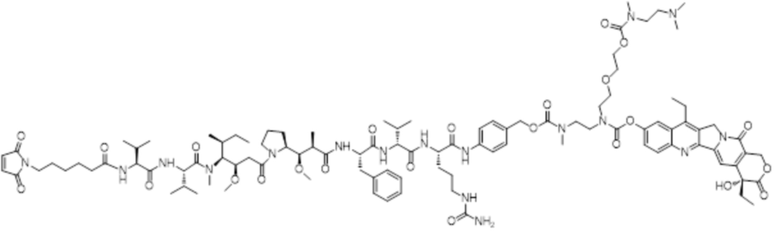
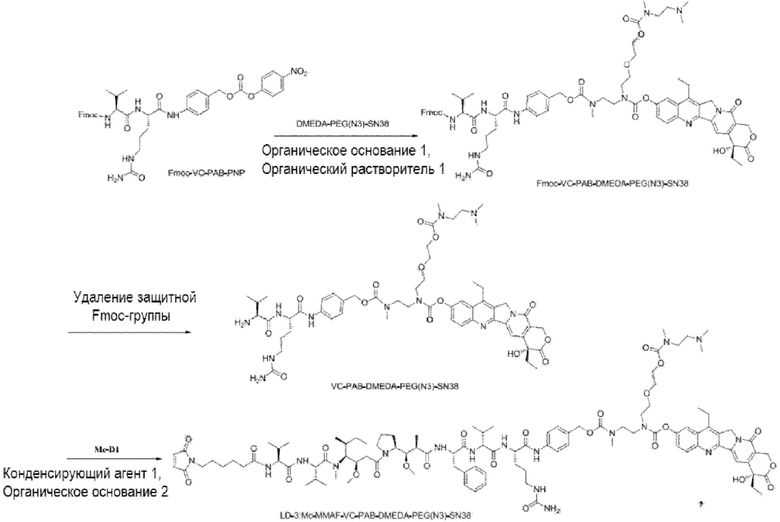
LD-3: Mc-MMAF-VC-PAB-DMEDA-PEG(N3)-SN38
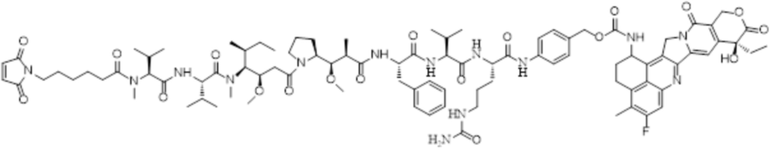
LD-4: MC-MMAF-VC-PAB-Экзатекан
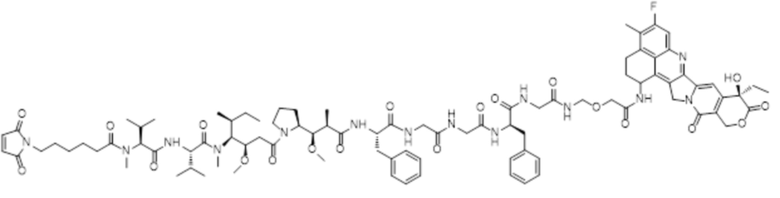
LD-5: Mc-MMAF-GGFG-Dxd.
[0068] Настоящее изобретение также обеспечивает применение соединение по любому из вышеуказанного в получении лекарственного препарата для лечения или профилактики рака, инфекционного заболевания или аутоиммунного заболевания.
[0069] Настоящее изобретение также обеспечивает способ синтеза вышеупомянутого промежуточного соединения, где путем синтеза способа является:

[0070] Способ синтеза включает следующие стадии:
[0071] Стадия 1: Растворение соединения Fmoc-Aa-G, фрагмента второго активного лекарственного средства D2, и органического состояния 1 в соответствующем количестве органического растворителя 1, и их контакт и реакция для получения соединения Fmoc-Aa-G-D2;
[0072] Стадия 2: Удаление защитной группы Fmoc с соединения Fmoc-Aa-G-D2 для получения соединения Aa-G-D2;
[0073] Стадия 3: Растворение Aa-G-D2, соединения Mc-D1, и конденсирующего средства 1 в соответствующем количестве органического растворителя 2, и их контакт и реакция для получения соединения Mc-D1-Aa-G-D2;
[0074] где, органическое основание 1 выбран из одного или более из N, N-диизопропилэтиламина, триэтиламина, и пиридина; органический растворитель 1 и органический растворитель 2 каждый независимо выбран из одного или обоих из DMF и DMA; конденсирующее средство 1 выбран из одного или более из TSTU, HATU, HBTU, HCTU, PyBop, CDMT, и T3P.
[0075] В некоторых специфических вариантах осуществления настоящее изобретение также обеспечивает применение вышеуказанного способа синтеза, где способ синтеза используют для пути синтеза для получения специфического промежуточного соединения и путь синтеза выбран из следующего:
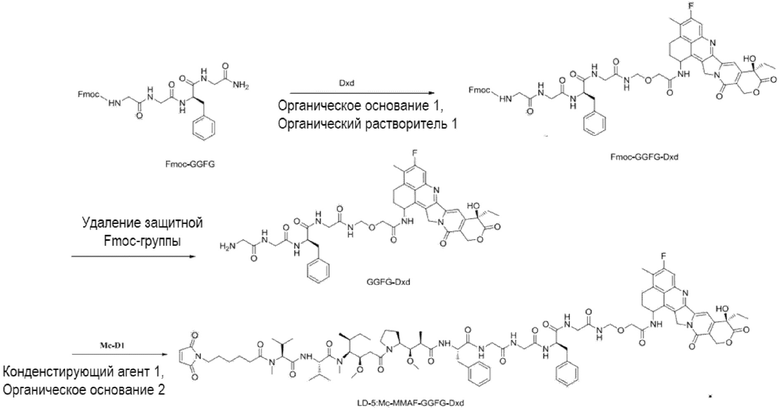
[0076] В настоящем изобретении неожиданно обнаружили, что посредством соединения MMAF и фрагмента другого лекарственного средства в ряду на месте связывания цистеина на антителе посредством линкера, оба могут оказывать значительный синергический эффект, посредством этого существенно улучшая эффект уничтожения опухолевых клеток. Это обеспечивает новое решение для разработки высокоэффективных и низкотоксичных ADC.
ПОДРОБНОЕ ОПИСАНИЕ
Определения
[0077] Если не указано иначе, все технические и научные термины, используемые в настоящем описании, согласуются с обычным пониманием таковых обычным специалистом в области техники, к которой относится настоящее изобретение. Хотя любые способы и материалы, сходные или эквивалентные таковым, описанным в настоящем описании, также могут использоваться в практике или тестировании настоящего изобретения, предпочтительные способы и материалы описаны в настоящем описании. При описании и заявлении настоящего изобретения следующие термины используют в соответствии со следующими определениями.
[0078] Когда в настоящем изобретении используют торговое наименование заявитель предполагает включать композицию, генерическое лекарственное средство и активное лекарственное средство с торговым наименованием.
[0079] Если не указано наоборот, термины, используемые в спецификации и формуле изобретения, имеют те же значения, как указано далее.
[0080] Термин "конъюгат антитело-лекарственное средство (ADC)", используемый в настоящем описании, относится к соединению в котором антитело или антиген-связывающий фрагмент, связывающий фрагмент и фрагмент активного лекарственного средства, связаны вместе посредством химической реакции, и структура обычно состоит из трех частей: антитело или антителоподобный лиганд, лекарственная часть (т.е. фрагмент активного лекарственного средства), и линкер, который связывает антитело или антителоподобный лиганд с частью лекарственного средства.
[0081] Термин "антитело", используемый в настоящем описании, относится к макромолекулярному соединению, которое может распознавать и связываться с антигеном или рецептором, ассоциированным с клеткой мишенью. Эффект антитела представляет собой презентацию лекарственного средства целевой клеточной популяции, с которой связывается антитело. Такие антитела включают, без ограничения, белковые гормоны, лектины, факторы роста, антитела или другие молекулы, которые могут связываться с клетками. В некоторых определенных вариантах осуществления изобретения антиген, с которым связывается антитело, включает, без ограничения: карбоангидразу IX, B7, CCCL19, CCCL21, CSAp, HER-2/neu, BrE3, CD1, CD1a, CD2, CD3, CD4, CD5, CD8, CD11A, CD14, CD15, CD16, CD18, CD19, CD20, CD21, CD22, CD23, CD25, CD29, CD30, CD32b, CD33, CD37, CD38, CD40, CD40L, CD44, CD45, CD46, CD52, CD54, CD55, CD59, CD64, CD67, CD70, CD74, CD79a, CD80, CD83, CD95, CD126, CD133, CD138, CD147, CD154, CEACAM5, CEACAM-6, альфа-фетопротеин (AFP), VEGF, ED-B фибронектин, EGP-1, EGP-2, EGF рецептор (ErbB1), ErbB2, ErbB3, фактор H, FHL-1, Flt-3, рецептор фолата, Ga 733, GROB, HMGB-1, фактор, индуцируемый гипоксией (HIF), HM1.24, HER-2/neu, инсулиноподобный фактор роста (ILGF), IFN-γ, IFN-α, IFN-β, IL-2R, IL-4R, IL-6R, IL-13R, IL-15R, IL-17R, IL-18R, IL-2, IL-6, IL-8, IL-12, IL-15, IL-17, IL-18, IL-25, IP-10, IGF-1R, Ia, HM1.24, ганглиозид, HCG, HLA-DR, CD66a-d, MAGE, McRP, McP-1, MIP-1A, MIP-1B, фактор, ингибирующий миграцию макрофагов (MIF), MUC1, MUC2, MUC3, MUC4, MUC5, плацентарный фактор роста (PlGF), PSA (простат специфический антиген), PSMA, PSMA димер, PAM4 антиген, NCA-95, NCA-90, A3, A33, Ep-CAM, KS-1, Le(y), мезотелин, S100, тенасцин, TAC, Tn антиген, Thomas-Friedenreich антиген, антиген некроза опухоли, антиген ангиогенеза опухоли, TNF-α, TRAIL рецепторы (R1 и R2), VEGFR, RANTES, T101, антиген раковых стволовых клеток, факторы комплемента C3, C3a, C3b, C5a, C5, и онкогенные продукты. В некоторых определенных вариантах осуществления изобретения антитело включает, без ограничения: анти-EGFRvIII антитело, анти-DLL-3 антитело, анти-PSMA антитело, анти-CD70 антитело, анти-MUC16 антитело, анти-ENPP3 антитело, анти-TDGF1 антитело, анти-ETBR антитело, анти-MSLN антитело, анти-TIM-1 антитело, анти-LRRC15 антитело, анти-LIV-1 антитело, анти-CanAg/AFP антитело, анти-кладин 18.2 антитело, анти-мезотелин антитело, анти-HER2 (ErbB2) антитело, анти-EGFR антитело, анти-c-MET антитело, анти-SLITRK6 антитело, анти-KIT/CD117 антитело, анти-STEAP1 антитело, анти-SLAMF7/CS1 антитело, анти-NaPi2B/SLC34A2 антитело, анти-GPNMB антитело, анти-HER3 (ErbB3) антитело, анти-MUC1/CD227 антитело, анти-AXL антитело, анти-CD166 антитело, анти-B7-H3 (CD276) антитело, анти-PTK7/CCK4 антитело, анти-PRLR антитело, анти-EFNA4 антитело, анти-5T4 антитело, анти-NOTCH3 антитело, анти-Nectin 4 антитело, анти-TROP-2 антитело, анти-CD142 антитело, анти-CA6 антитело, анти-GPR20 антитело, анти-CD174 антитело, анти-CD71 антитело, анти-EphA2 антитело, анти-LYPD3 антитело, анти-FGFR2 антитело, анти-FGFR3 антитело, анти-FRα антитело, анти-CEACAMs антитело, анти-GCC антитело, анти-Интегрин Av антитело, анти-CAIX антитело, анти-P-кадгерин антитело, анти-GD3 антитело, анти-кадгерин 6 антитело, анти-LAMP1 антитело, анти-FLT3 антитело, анти-BCMA антитело, анти-CD79b антитело, анти-CD19 антитело, анти-CD33 антитело, анти-CD56 антитело, анти-CD74 антитело, анти-CD22 антитело, анти-CD30 антитело, анти-CD37 антитело, анти-CD138 антитело, анти-CD352 антитело, анти-CD25 антитело или анти-CD123 антитело и новые открытые целевые антитела.
[0082] Антитело по настоящему изобретению включает мышиное антитело, химерное антитело, антитело приматов, гуманизированное антитело, и полностью человеческое антитело, предпочтительно гуманизированное антитело и полностью человеческое антитело.
[0083] Термин "мышиное антитело" в настоящем описании относится к антителу, полученному от мышей на основании знаний и умений в области техники. Во время получения, тестируемому пациенту вводят специфический антиген и затем разделяют гибридные экспрессируемые антитела с желаемой последовательностью или функциональными свойствами.
[0084] Термин "химерное антитело" представляет собой антитело, образуемое посредством сшивки вариабельного участка мышиного антитела с постоянным участком человеческого антитела, что может уменьшать иммунный ответ, индуцированный мышиным антителом. Для получения химерного антитела необходимо сначала получить гибридому, секретирующую мышиные специфические моноклональные антитела, затем клонировать гены в вариабельном участке из клеток мышиной гибридомы, затем клонировать гены в постоянном участке человеческого антитела, как необходимо, и затем связать мышиный ген вариабельного участка и человеческий ген постоянного участка вместе для получения химерного гена с целью вставки в вектор экспрессии, и наконец, молекула химерного антитела экспрессируется в системе эукариот или системе прокариот.
[0085] Термин "гуманизированное антитело", также называемое CDR-привитое антитело, относится к антителу, полученному посредством трансплантации мышиной последовательности CDR в рамки вариабельного участка последовательности человеческого антитела, т.е. различные типы рамок последовательности человеческого зародыша антитела, которые могут преодолевать гетерогенную реакцию, индуцированную химерными антителами из-за большого количества компонентов мышиного белка, которые они несут. Такие каркасные последовательности могут быть получены из общественных баз данных ДНК или опубликованных ссылок, которые включают последовательности генов зародышевого антитела. Например, зародышевые последовательности ДНК человеческих вариабельных участков генов тяжелых цепей и легких цепей могут быть обнаружены в "VBase" базе данных человеческих зародышевых последовательностей (доступной на Интернет сайте www.mrccpe.com/ac.uk/vbase), а также в Kabat, EA, et al., 1991, Sequences of Proteins of Immunological Interest, 5th edition. Во избежание снижения полученной активности вместе со снижением иммуногенности, каркасная последовательность вариабельного участка человеческого антитела может быть подвергнута минимальным обратимым мутациям или реверсивным мутациям для сохранения активности. Гуманизированное антитело по настоящему изобретению также включает гуманизированное антитело, которое дополнительно подвергают созреванию афинности для CDR посредством фагового отображения. Документы, которые дополнительно описывают способы использования мышиных антител, включенных в гуманизацию, включают, например, Queen et al., Proc., Natl. Acad. Sci. USA, 88, 2869, 1991 и способ Winter et al. [Jones., Nature, 321,522, (1986)], Riechmann, et al. [Nature, 332, 323-327, 1988), Verhoeyen, et al., Science, 239, 1534 (1988)].
[0086] Термин "полностью гуманизированное антитело", "полностью человеческое антитело", "интактное гуманизированное антитело" или "человеческое антитело", также известное как "полностью человеческое моноклональное антитело", относится к антителу, чьи вариабельные участки и постоянные участки оба человеческого происхождения с устранением иммуногенности и токсических побочных эффектов. Разработка моноклональных антител проходит через четыре стадии, а именно: мышиные моноклональные антитела, химерные моноклональные антитела, гуманизированные моноклональные антитела и полностью человеческие моноклональные антитела. Настоящее изобретение адаптирует полностью человеческое моноклональное антитело. Связанные методики для получения полностью человеческих антител главным образом включают: человеческая гибридомная методика, методика EBV трансформированных B лимфоцитов, методика фагового отображения, методика получения антител трансгенных мышей и методика получения антител одиночных B клеток.
[0087] Термин "антиген-связывающий фрагмент", как используется в настоящем описании, относится к одному или более фрагментам антитела, которые сохраняют способность специфически связываться с антигеном. Примеры связывающих фрагментов, содержащихся в "антиген-связывающем фрагменте" включают (i) Fab фрагмент, который представляет собой одновалентный фрагмент, состоящий из VL, VH, CL и CH1 фрагментов; (ii) F(ab')2 фрагмент, который является двухвалентным фрагментом, включающим два Fab фрагмента, связанные дисульфидным мостиком в шарнирной области, (iii) Fd фрагмент, состоящий из доменов VH и CH1; (iv) Fv фрагмент, состоящий из доменов VH и VL одной ветви антитела; (v) одиночный домен или dAb фрагмент (Ward et al., (1989) Nature 341:544-546), состоящий из VH домена; (vi) выделенный комплементарный детерминантный участок (CDR); и (vii) комбинация двух или более отдельных CDR, которые могут необязательно быть связаны синтетическим линкером. Кроме того, хотя два домена VL и VH Fv фрагмента кодируются отдельными генами, они могут быть связаны посредством синтетического линкера с использованием рекомбинантных методик, так что Fv фрагмент может быть получен в виде одиночной белковой цепи, в которой участки VL и VH объединяются с образованием одновалентной молекулы (называемое как одноцепочечный Fv (scFv); см, например, Bird et al. (1988) Science 242:423-426 и Huston et al. (1988) Proc. NatL. Acad. Sci. USA 85: 5879-5883). Такие одноцепочечные антитела включают термин "антиген-связывающий фрагмент" антител. Такие фрагменты антител получают с использованием обычных методик, известных специалисту в области техники, и скринируется в отношении применимости так же, как для интактных антител. Антиген-связывающий фрагмент может быть получен методикой рекомбинантной ДНК или посредством ферментативной или химической фрагментации интактного иммуноглобулина. Антителами могут быть антитела различных изотипов, например, IgG (например, IgG1, IgG2, IgG3 или IgG4 подтипы), IgA1, IgA2, IgD, IgE или lgM антитела.
[0088] Термин Fab представляет собой фрагмент антитела с молекулярной массой около 50000 и антиген-связывающей активностью среди фрагментов, полученных посредством обработки молекулы IgG антитела протеазой папаина (которая отщепляет остаток аминокислоты в положении 224 H цепи), где около половины N-концевой стороны H цепи и полностью L цепь связаны вместе посредством дисульфидной связи.
[0089] Термин F(ab')2 представляет собой фрагмент антитела с молекулярной массой около 100000 и антиген-связывающей активностью и включает два Fab участка, связанные вместе в шарнирном участке, полученным посредством разрушения низшей части двух дисульфидных связей в шарнирном участке IgG ферментом пепсином.
[0090] Термин Fab' представляет собой фрагмент антитела с молекулярной массой около 50000 и антиген-связывающей активностью, полученный посредством отщепления дисульфидной связи шарнирного участка вышеуказанного F(ab')2. Кроме того, Fab' может быть получен посредством вставки ДНК, кодирующей Fab' фрагмент антитела в прокариотический вектор экспрессии или эукариотический вектор экспрессии и затем внесение вектора в организм прокариот или эукариот для экспрессии Fab'.
[0091] Термин "одноцепочечный конструкт", включающий без ограничения "одноцепочечное антитело", "одноцепочечный Fv" и "scFv", обозначает молекулу, включающую вариабельный домен или участок тяжелой цепи антитела (т.е. VH), связанный с вариабельным доменом или участком легкой цепи антитела (т.е., VL) посредством линкера. Такие молекулы scFv могут иметь общую структуру NH2-VL-линкер-VH-COOH или NH2-VH-линкер-VL-COOH. Подходящий линкер в предшествующей области техники включает повторяющуюся GGGGS последовательность аминокислот или их вариант, например, с использованием 1-4 повторяющихся варианта (Holliger et al. (1993), proc. Natl. Acad. Sci. USA 90: 6444-6448). Другие линкеры, которые могут быть использованы в настоящем изобретении, описаны Alfthan et al. (1995), Protein Eng. 8: 725-731; Choi et al. (2001), Eur. J. Immunol. 1.31: 94-106; Hu et al. (1996), Cancer Res. 56: 3055-3061; Kipriyanov et al. (1999), J. Mol. Biol. 293:41-56 and Roovers et al. (2001), Cancer Immunol.
[0092] Методики получения антител или их антиген-связывающих фрагментов против фактически любого целевого антигена хорошо известны в области техники. Например, см. Kohler and Milstein, Nature 256:495 (1975), и Coligan et al. (eds.), CURRENT PROTOCOLS IN IMMUNOLOGY, Vol. 1, pages 2.5.1-2.6.7 (John Wiley & Sons, 1991). Коротко, моноклональные антитела могут быть получены, как указано далее: инъекция мышам композиции, включающей антиген, и получение селезенки для получения B лимфоцитов, которые затем сшивают с клетками миеломы для получения гибридом, затем клонирование гибридом, выбор позитивных клонов, которые продуцируют антитело к антигену, культивирование клонов, которые продуцируют антитело к антигену и выделение антитело из культур гибридомы. Антитела могут быть выделены и очищены из культур гибридомы посредством множества хорошо известных методик. Такие методики выделения включают протеин A или протеин G сефарозную афинную хроматографию, хроматографию по размеру и ионообменную хроматографию. Например, см. Coligan страницы 2.7.1-2.7.12 и страницы 2.9.1-2.9.3. См. также Baines et al., "Purification of Immunoglobulin G (IgG)" в Methods IN MOLECULAR BIOLOGY, Volume 10, Page 79-104 (The Humana Press, Inc. 1992). После исходного выявления антител против иммуногена, антитела могут быть секвенированы и впоследствии получены рекомбинантной методикой. Гуманизация и химеризация мышиных антител и фрагментов антител хорошо известны специалисту в области техники.
[0093] Термин "связующий фрагмент" относится к химическому структурному фрагменту или связи, которые связывают один конец с фрагментом, связывающим антитело/антиген и другим концом лекарственное средство, таким образом действуя, как "мостик" для связывания антитело/антиген-связывающего фрагмента с молекулой лекарственного средства. Он может включать линкер, спейсер и фрагмент аминокислоты, и может быть синтезирован способами, известными в области техники, таким как таковые, описанные в US2005-0238649A1. Как используется в настоящем описании, "связывающий фрагмент" может быть поделен на две категории: нерасщепляемые линкеры и расщепляемые линкеры.
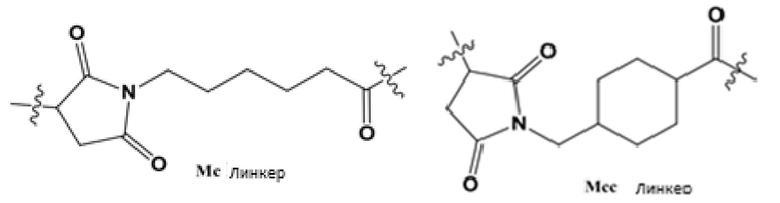
[0094] Нерасщепляемый линкер представляет собой относительно стабильный линкер, чью структуру сложно расщепить или разрушить in vivo. Для конюгата антитело-лекарственное средство, содержащего нерасщепляемый линкер, механизмом высвобождения лекарственного средства является: конъюгат связывается с антигеном и затем поглощается эндоцитозом; антитело гидролизируется в лизосоме и активная молекула, состоящая из лекарственного средства, линкера и остатков аминокислот антитела, высвобождается. Полученное изменение в структуре лекарственного средства не нарушает цитотоксичности лекарственного средства. Однако, когда активная молекула является заряженной (из-за остатков аминокислот), она не может проникнуть в соседние клетки. Следовательно, такие активные лекарственные средства не могут уничтожать опухолевые клетки, которые не экспрессируют целевой антиген (антиген-негативные клетки) (эффект «свидетеля») (Bioconjugate Chem. 2010, 21, 5-13). Обычные линкеры, такие как Mc линкер и Mcc линкер, показаны на следующей структуре.
[0095] Расщепляемый линкер, как используется наименование, может быть расщеплен в клетке мишени и высвободить активное лекарственное средство (низкомолекулярное лекарственное средство как таковое). Расщепляемый линкер может быть поделен на два основных класса: химически лабильный линкер и ферментативно-лабильный линкер.
[0096] Химически лабильный линкер может быть селективно расщеплен из-за различных свойств плазмы и цитоплазмы. Такие свойства включают pH, концентрацию глютатиона и подобные.
[0097] pH-чувствительный линкер часто называют как кислото-лабильный линкер. Такой линкер является относительно стабильным в нейтральной среде крови (pH 7,3-7,5), но гидролизуется в немного кислых эндосомах (pH 5,0-6,5) и лизосомах (pH 4,5-5,0). Большинство первого поколения конъюгатов антитела-лекарственного средства используют такой тип линкера, такой как гидразон, карбонат, ацеталь, кетали. Конъюгаты антитело-лекарственное средство с использованием такого типа линкера обычно имеют более короткий период полужизни (2-3 дня) из-за ограниченной стабильности кислото-лабильного линкера в плазме. Такие короткие периоды полужизни в некоторой степени ограничивают применение pH-чувствительного линкера в новом поколении конъюгатов антитело-лекарственное средство.
[0098] Глютатион-чувствительный линкер также известен, как дисульфидный линкер. Высвобождение лекарственного средства вызывается разницей между высокой концентрацией (в миллимолярном диапазоне) внутриклеточного глютатиона и относительно низкой концентрацией глютатиона (микромолярный диапазон) в крови. Это имеет место в особенности в случае опухолевых клеток, в которых низкое содержание кислорода приводит к усилению активности редуктазы, таким образом приводя к более высокой концентрации глютатиона. Дисульфидная связь является термодинамически стабильной и, следовательно, имеет лучшую стабильность в плазме.
[0099] Ферментативно-лабильный линкер, такой как пептидный линкер, способен лучше контролировать высвобождение лекарственного средства. Пептидный линкер способен эффективно отщепляться протеазой в лизосомах, такой как Катепсин B или плазмин (содержание этого фермента увеличивается в некоторых опухолевых клеток). Такая пептидная связь считается очень стабильной в циркуляции в плазме, так как внеклеточная несоответствующая pH и ингибиторы протеазы сыворотки обычно инактивируются вне клетки. В свете высокой стабильности в плазме и хорошей селективности внутриклеточного отщепления и эффективности, ферментативно-лабильные линкеры широко используются в качестве расщепляемых линкеров для конъюгатов антитело-лекарственное средство.
[00100] Суицидный линкер является обычно химерным между расщепляемым линкером и активным лекарственным средством или, как таковой, частью расщепляемого линкера. Механизмом суицидного линкера является таковой, когда расщепляемый линкер разрушается в подходящих условиях, суицидный линкер может спонтанно производить перестроение структуры для высвобождения активного лекарственного средства, связанного с ним. Обычными суицидными линкерами являются такие как п-аминобензильные спирты (PAB).
[00101] Термины "токсин", "лекарственное средство", "часть лекарственного средства" и "фрагмент лекарственного средства", используемые в настоящем описании, обычно относятся к той же структуре и могут быть использованы под любым наименованием в настоящем описании. Они в широком смысле относятся к любому соединению, имеющему желаемую биологическую активность и реакционноспособную функциональную группу для получения конъюгата по настоящему изобретению. Желаемая биологическая активность включает диагностику, излечение, облегчение, лечение и профилактику заболеваний у людей или других животных. Когда новые лекарственные средства непрерывно открывают и разрабатывают, новые лекарственные средства охватываются лекарственными средствами, описанными в настоящем описании. Они могут быть любыми веществами, которые могут обладать отрицательными эффектами на рост или пролиферацию клеток, и могут быть низкомолекулярными токсинами и их производными из бактерий, грибов, растений или животных, включая производные камптотецина, такие как Экзатекан, майтанзиноид и их производные (CN101573384), такие как DM1, DM3 и DM4, ауристатин F (AF) и их производные, такие как MMAF, MMAE и 3024 (WO 2016/127790A1), токсин дифтерии, экзотоксин, цепь А рицина, цепь А абрина, модеццин, α-сарцин, токсический белок Aleutites fordii, токсический белок dianthin, токсический белок Phytolaca americana (PAPI, PAPII и PAP-S), ингибитор Momordica charantia, курцин, кротин, ингибитор sapaonaria officinalis, гелонин, митогеллин, рестриктотоцин, феномицин, экономицин и трихотецены.
[00102] Трехбуквенный код и однобуквенный код термина "аминокислота" используются, как описано в J. biol. Chem, 1968, 243, 3558. Термин "аминокислота" включает, без ограничения "кислую аминокислоту", "натуральную аминокислоту", и "ненатуральную аминокислоту". "Кислая аминокислота» относится к аминокислоте, чья изоэлектрическая точка составляет менее чем 7, и часто содержит одну или более кислых групп, такие как карбоксильные группы, которые могут быть эффективно ионизированы в негативные ионы в структуре для увеличения гидрофильности. Кислые аминокислоты могут быть натуральными или ненатуральными аминокислотами. "Натуральная аминокислота" относится к аминокислоте, синтезированной микроорганизмами. Натуральные аминокислоты обычно L-типа, но существует несколько ограничений, таких как глицин, включая натуральный и биосинтетический. "Ненатуральная аминокислота" относится к аминокислоте, полученной синтетическими средствами.
[00103] Наиболее важно, специалист в области техники понимает, что соединения и способы, заявленные в настоящем описании, могут использовать множество антител, известных в области техники. Используемые антитела могут быть куплены из множества источников или получены методиками, известными в области техники. Кроме того, соединения и способы, заявленные в настоящем описании, могут использовать множество связующих фрагментов, известных в области техники и используемые связующие фрагменты могут быть куплены из множества источников или получены методиками, известными специалисту в области техники. Следовательно, выбор антитела и линкерного фрагмента не должен рассматриваться как ограничение соединений и способов, заявленных в настоящем описании
[Примеры]
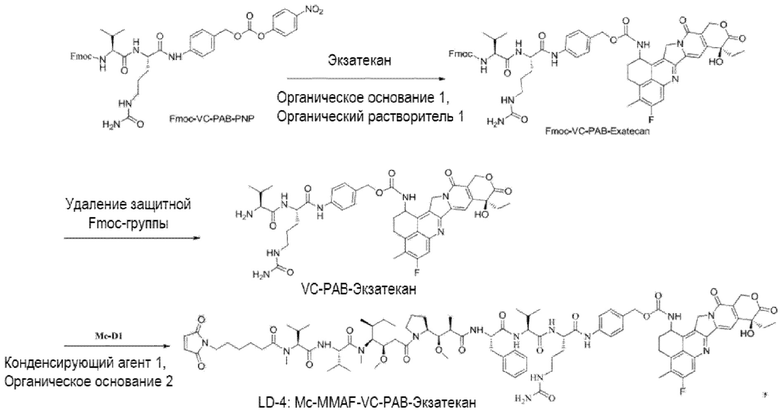
[00104] Пример 1. Получение соединения L-D (т.е. соединение линкерная группа-группа двойного токсина)
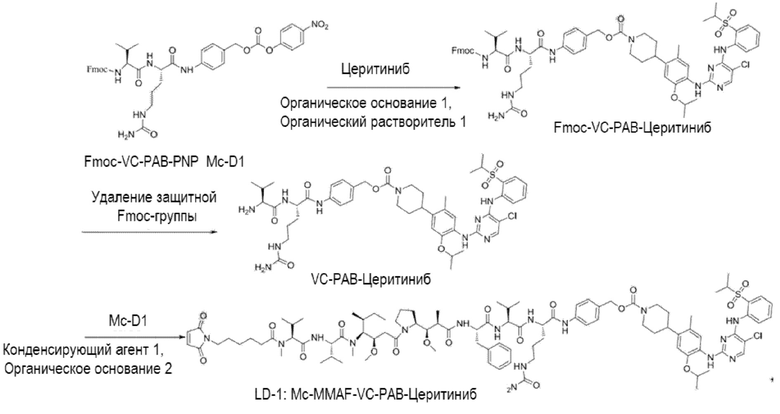
(1) Получение соединения LD-1 (т.е. Mc-MMAF-VC-PAB-церитиниб)

[00105] 75,6 мг Fmoc-VC-PAB-PNP и 50,0 мг церитиниба добавляли к 5 мл N, N-диметилформамида и 49 мкл N, N-диизопропилэтиламина для реакции при комнатной температуре до конца реакции. Растворитель выпаривали. После очистки Flash методом получали 80,0 мг сырого Fmoc-VC-PAB-церитиниба. ЖХ-МС: [M+H]+: 1185,2; [M-H]-: 1183,7.
[00106] 8 мл N, N-диметилформамида и 2 мл N, N-диизопропилэтиламина добавляли к сырому Fmoc-VC-PAB-церитинибу для реакции при комнатной температуре до конца реакции. Растворитель выпаривали. После очистки жидкостной хроматографией получали 50,0 мг чистого VC-PAB-церитиниба. ЖХ-МС: [M+H]+: 963,4, [M-H]-: 961,6.
[00107] 20,0 мг Mc-MMAF и 9,8 мг TSTU добавляли к 14,2 мкл N, N-диизопропилэтиламина и 18,8 мг VC-PAB-церитиниба для реакции при комнатной температуре до конца реакции. Растворитель откручивали. После очистки препаративной жидкостной хроматографией получали 12,0 мг чистого Mc-MMAF-VC-PAB-церитиниба. ЖХ-МС: [M+H]+: =1869,8, [M-H]-: =1868,2.
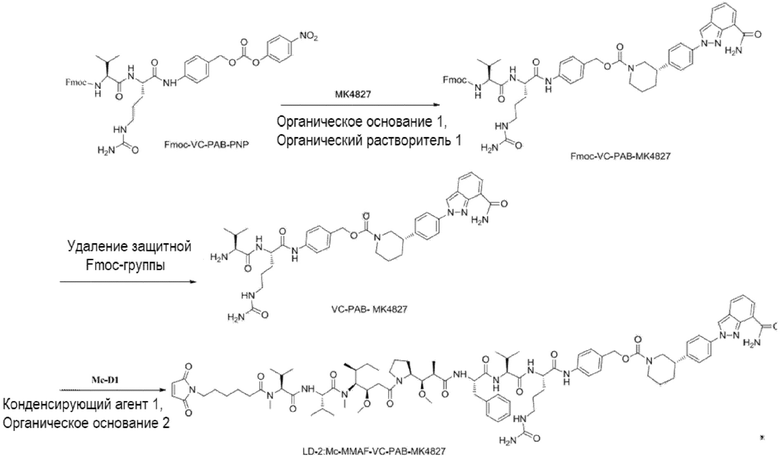
(2) Получение соединения LD-2 (т.е., Mc-MMAF-VC-PAB-MK4827)
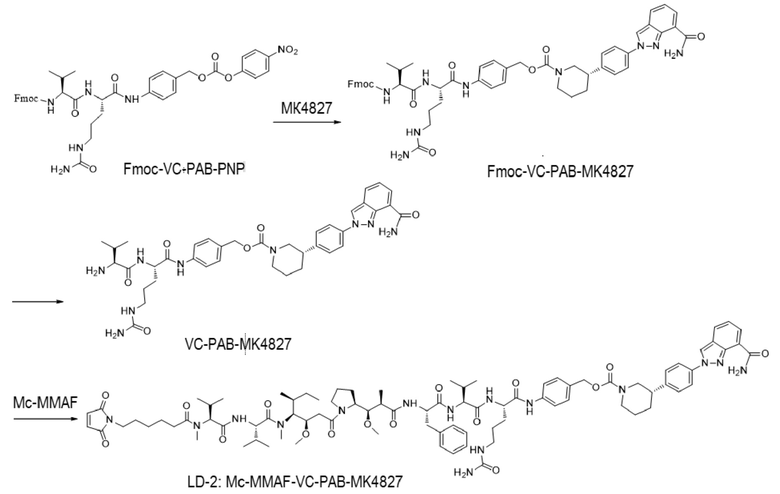
[00108] 131,7 мг Fmoc-VC-PAB-PNP и 50,0 мг MK4827 (т.е. Нирапариб) добавляли к 5 мл N, N-диметилформамида и 78 мкл N, N-диизопропилэтиламина для реакции при комнатной температуре до конца реакции. Растворитель откручивали. После очистки Flash методом получали 98,0 мг сырого Fmoc-VC-PAB-MK4827. ЖХ-МС: [M+H]+: 947,5; [M-H+HCOOH]-: 992,4.
[00109] 8 мл N, N-диметилформамида и 2 мл N, N-диизопропилэтиламина добавляли к вышеуказанному сырому Fmoc-VC-PAB-MK4827 для реакции при комнатной температуре до конца реакции. Растворитель откручивали. После очистки препаративной жидкостной хроматографией получал, 60,0 мг чистого VC-PAB-MK4827. ЖХ-МС: [M+H]+: 725,4, [M-H+HCOOH]-: 770,0.
[00110] 20,0 мг Mc-MMAF и 9,8 мг TSTU добавляли к 14,2 мкл N, N-диизопропилэтиламина и 18,8 мг VC-PAB-MK4827 для реакции при комнатной температуре до конца реакции в течение 16 часов. Растворитель откручивали. После очистки препаративной жидкостной хроматографией получали 7,0 мг чистого Mc-MMAF-VC-PAB-MK4827. ЖХ-МС: [M+H]+: m/z=1632,6, [M-H+HCOOH]-: m/z=1677,5.
(3) Получение других соединений
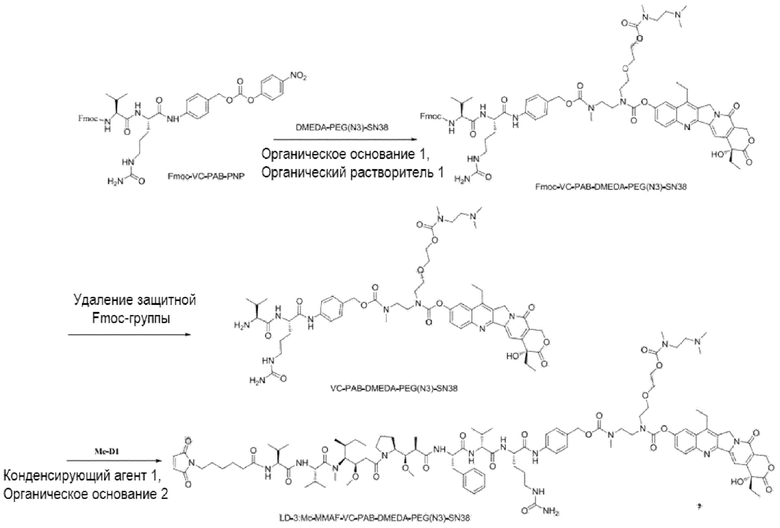
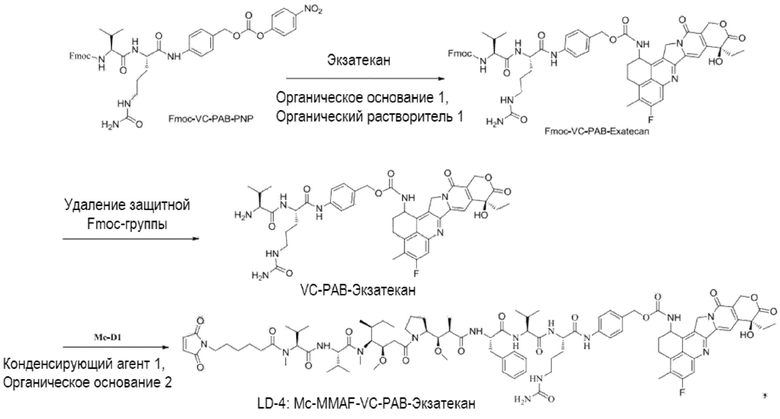
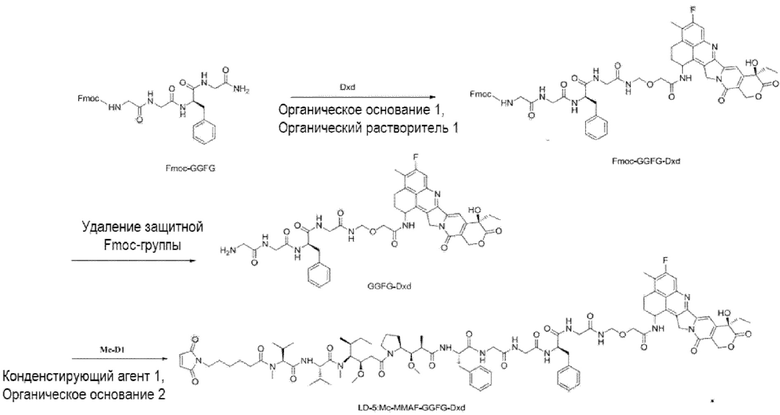
[00111] Со ссылкой на способы получения соединения 1 и соединения 2, получали соединение LD-3 (т.е., Mc-MMAF-VC-PAB-DMEDA-PEG(N3)-SN38), соединение LD-4 (т.е., Mc-MMAF-VC -PAB-экзатекан) и соединение LD-5 (т.е. Mc-MMAF-GGFG-Dxd).
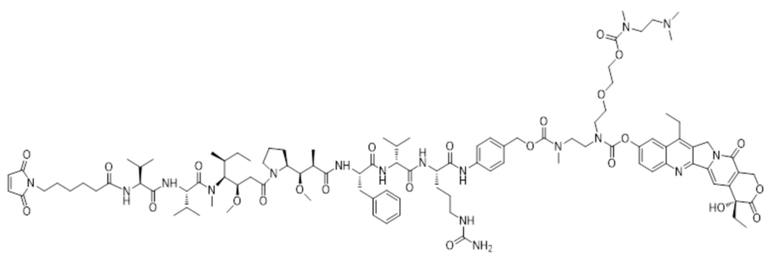
LD 3: Mc-MMAF-VC-PAB-DMEDA-PEG(N3)-SN38)

LD-4: Mc-MMAF-VC -PAB-Экзатекан
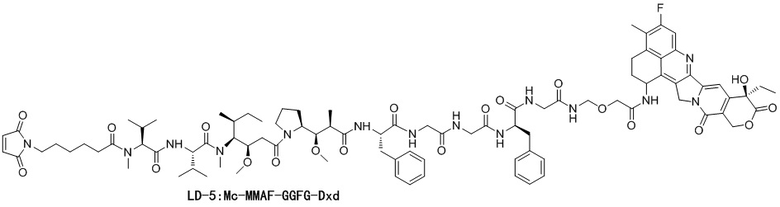
LD-5: Mc-MMAF-GGFG-Dxd
[00112] Пример 2. Получение конъюгата антитела-лекарственного средства
[00113] Конъюгаты антитела-лекарственного средства (ADC) получали с использованием обычного метода связывания: восстанавливающее средство и протективное средство получали, как указано далее, с очищенной водой: 1-20 мМ TCEP (трис-2-карбоксиэтилфосфин) и 1-20 мМ DTPA (диэтилентриамин пентацетатная кислота) материнской жидкости. Количество восстанавливающего средства может быть добавлено с определенным диапазоном концентрации в соответствии с требуемой скоростью связывания, и может быть смешано с определенной концентрацией моноклонального антитела (например: 5-30 мг/мл) в соответствии с определенным объемным соотношением (1:1), с молярным соотношением конечной концентрации TCEP к антителу, составляющим 0,5-6,0:1. Реакцию проводили при перемешивании при 25°C в течение 1 ч. Антитело после восстановления TCEP может быть непосредственно связано.
[00114] Определенную концентрацию (5 мМ) соединения линкер-активное лекарственное средство получали для растворения в 25% DMSO (диметил сульфоксид), и лекарственное средство медленно добавляли в соответствии с молярным соотношением лекарственного средства к сульфгидрильной группе 0,3~2,8:1. Реакцию проводили при перемешивании при 25°C в течение 1-4 ч. После завершения реакции PBS буфер использовали для центрифугирования и ультрафильтрации три раза для удаления остаточного непрореагировавшего лекарственного средства и свободных мелких молекул, таких как DMSO. Связывание определяли посредством SDS-PAGE электрофореза и гидрофобной интерактивной хроматографии высокоэффективного метода в жидкой фазе (HIC-ВЭЖХ).
[00115] ADC1 (т.е. Ab-Mc-MMAF-VC-PAB-церитиниб), ADC2 (т.е. Ab-Mc-MMAF-VC-PAB-MK4827), ADC3 (т.е. Ab-Mc-MMAF-VC-PAB-DMEDA-PEG(N3)-SN38), ADC4 (т.е. Ab-Mc-MMAF-VC-PAB-экзатекан), и ADC5 (т.е. Ab-Mc-MMAF-GGFG-Dxd) получали способом, представленным в этом примере, где p представляет собой целое число, выбираемое из 1, 2, 3, 4, 5, 6, 7, и 8, и используемым Ab является HER2 антитело.
 ,
,
ADC1::Ab-Mc-MMAF-VC-PAB-Церитиниб

ADC2: Ab-Mc-MMAF-VC-PAB-МК4827

ADC3: Ab-Mc-MMAF-VC-PAB-DMEDA-PEG(N3)-SN38

ADC4: Ab-MC-MMAF-VC-PAB-Экзатекан

ADC5: Ab-Mc-MMAF-GGFG-Dxd.
[00116] Пример 3. Оценка выживаемости клеток in vitro
(1) Оценка активности клеток рака молочной железы SK-BR-3
[00117] В этом примере метод ингибирования пролиферации клеток использовали для оценки эффекта Her2 mAb-Mc-MMAF-VC-PAB-MK4827 и Her2 mAb-Mc-MMAF-VC-PAB-DMEDA-PEG(N3)-SN38 на выживаемость клеток рака молочной железы SK-BR-3.
[00118] После переваривания SK-BR-3 клеток трипсином, клетки доводили до плотности клеток 50000 клеток/мл, и добавляли в планшеты для культивирования клеток при 100 мкл/ячейку, и затем инкубировали при 37°C, 5% CO2 инкубатор в течение 14-20 ч. Тестируемые образцы (см. Таблицу 2 для группы образца и контрольной группы) серийно разводили базальной средой, и переносили в планшеты для культивирования клеток, сеяли клетки по 100 мкл/ячейку, и затем инкубировали при 37°C, 5% CO2 инкубатор в течение 70-74 ч. CCK-8 разводили в 10 раз культуральной средой и старую культуральную среду в 96-луночных планшетах удаляли пипеткой, затем 100 мкл разведенного раствора CCK-8 добавляли в каждую ячейку с последующим развитием окраски в условиях 5% CO2 в течение 2-4 ч. После центрифугирования для удаления пузырьков измерение длины волны 450 нм/655 нм выбирали на счетчике микропланшетов для считывания.
[00119] Результаты в таблице 3 показывают ингибирующий эффект HER2 mAb-Mc-MMAF-VC-PAB-MK4827 на клетки SK-BR-3 лучше, чем таковой HER2 mAb-Mc-MMAF, HER2 mAb-Mc-VC-PAB-MK4827, смеси HER2 mAb-Mc-MMAF и HER2 mAb-Mc-VC-PAB-MK4827, HER2 антитела; ингибирующий эффект HER2 mAb-Mc-MMAF-VC-PAB-DMEDA-PEG(N3)-SN38 на клетки SK-BR-3 лучше чем HER2 mAb-Mc-MMAF, HER2 mAb-Mc-VC-PAB-DMEDA-PEG(N3)-SN38, смеси HER2 mAb-Mc-MMAF и HER2 mAb-Mc-VC-PAB-DMEDA-PEG(N3)-SN38, HER2 антитела. И два токсина в серии двойного токсина давали синергический эффект.
(2) Оценка активности в отношении клеток рака желудка SK-BR-3
[00120] В этом примере, метод ингибирования пролиферации клеток использовали для оценки эффекта Her2 mAb-Mc-MMAF-VC-PAB-DMEDA-PEG(N3)-SN38 на выживаемость клеток рака желудка NCI-N87.
[00121] После переваривания клеток NCI-N87 трипсином, клетки разводили до плотности клеток 50000 клеток/мл, и добавляли в планшеты для культивирования клеток по 100 мкл/ячейку, и затем инкубировали при 37°C, 5% CO2 инкубатор в течение 14-20 ч. Тестируемые образцы (см. таблицу 4 для группы образца и контрольной группы) серийно разводили базальной средой и переносили в планшеты для культивирования клеток, сеяли с клетками при 100 мкл/ячейку, и затем инкубировали при 37°C, 5% CO2 инкубатор в течение 70-74 ч. CCK-8 разводили 10 раз культуральной средой и старую культуральную среду в 96-луночных планшетах удаляли пипеткой, затем 100 мкл разведенного раствора CCK-8 добавляли к каждой ячейке с последующим развитием окрашивания в условиях 5% CO2 в течение 2-4 ч. После центрифугирования для удаления пузырьков измерение длины волны 450 нм/655 нм выбирали на счетчике микропланшетов для считывания.
[00122] Результаты в таблице 5 показывают, что ингибирующий эффект HER2 mAb-Mc-MMAF-VC-PAB-DMEDA-PEG(N3)-SN38 на клетки NCI-N87 лучше, чем таковой смеси HER2 mAb-Mc-MMAF и HER2 mAb-Mc-VC-PAB-DMEDA-PEG(N3)-SN38, и HER2 антитела. И два токсина в группе серии двойных токсинов давали заметный синергический эффект.
[00123] Настоящее изобретение проиллюстрировано различными специфическими примерами. Однако специалист в области техники может понимать, что настоящее изобретение не ограничено различными специфическими вариантами осуществления изобретения. Специалисты в области техники могут осуществлять модификации или изменения настоящего изобретения, и различные технические характеристики, упомянутые на всем протяжении текста, могут быть скомбинированы друг с другом без отклонения от рамок и тенденции настоящего изобретения. Такие изменения и модификации находятся в рамках настоящего изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| Олигопептидное линкерное промежуточное соединение и способ его получения | 2019 |
|
RU2775973C1 |
| АНТИ-НЕR2 АНТИТЕЛО И ЕГО КОНЪЮГАТ | 2014 |
|
RU2656161C1 |
| ПРИМЕНЕНИЕ КОНЪЮГАТА АНТИ-HER2 АНТИТЕЛО-ЛЕКАРСТВЕННОЕ СРЕДСТВО ПРИ ЛЕЧЕНИИ УРОТЕЛИАЛЬНОЙ КАРЦИНОМЫ | 2019 |
|
RU2750817C1 |
| АНТИ-CD79b АНТИТЕЛА И ИММУНОКОНЪЮГАТЫ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2008 |
|
RU2511410C2 |
| АНТИ-CD79b АНТИТЕЛА И ИММУНОКОНЪЮГАТЫ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2009 |
|
RU2553566C2 |
| МОНОМЕТИЛВАЛИНОВЫЕ СОЕДИНЕНИЯ, СПОСОБНЫЕ ОБРАЗОВЫВАТЬ КОНЪЮГАТЫ С ЛИГАНДАМИ | 2004 |
|
RU2448117C2 |
| Конъюгаты антитело-лекарственное средство и их применение | 2019 |
|
RU2787617C2 |
| АНТИТЕЛА И ИММУНОКОНЪЮГАТЫ И ИХ ПРИМЕНЕНИЯ | 2007 |
|
RU2436796C9 |
| АНТИТЕЛА ПРОТИВ TENB2, СКОНСТРУИРОВАННЫЕ С ЦИСТЕИНОМ, И КОНЪЮГАТЫ АНТИТЕЛО - ЛЕКАРСТВЕННОЕ СРЕДСТВО | 2008 |
|
RU2505544C2 |
| АНТИТЕЛА И ИММУНОКОНЪЮГАТЫ И ИХ ПРИМЕНЕНИЯ | 2007 |
|
RU2639543C9 |
Изобретение относится к конъюгату антитело-лекарственное средство, нагруженному бинарными токсинами. Посредством контакта MMAF с фрагментом другого лекарственного средства в ряду на сайтах связывания цистеина на антителе, оба могут оказывать синергический эффект, посредством этого эффективно улучшая эффект уничтожения опухолевых клеток. Это обеспечивает новое решение для разработки высокоэффективных и низкотоксичных ADC. 4 н. и 10 з.п. ф-лы, 5 табл., 3 пр.
1. Конъюгат антитело-лекарственное средство со следующей структурной формулой:
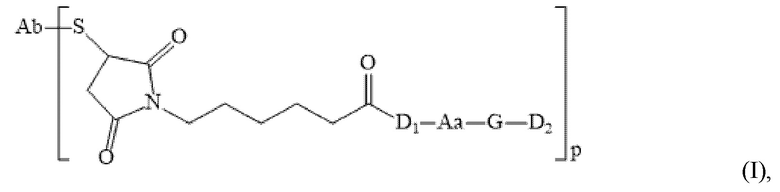
где
Ab представляет собой антитело или антиген-связывающий фрагмент;
S представляет собой атом серы в сульфгидрильном остатке, образованным после открытия межцепочечной дисульфидной связи на Ab;
Aa представляет собой аминокислотный фрагмент, содержащий одну или более аминокислот, где аминокислотный фрагмент Aa выбран из группы, состоящей из -глицин-, -аланин-, -валин-,
-лейцин-, -изолейцин-, -пролин-, -фенилаланин-, -триптофан-,
-метионин-, -тирозин-, -серин-, -треонин-, -цистеин-,
-аспарагин-, -глутамин-, -аспарагиновая кислота-, -глутаминовая кислота-, -лизин-, -аргинин-, -гистидин-, -цитруллин-,
-лизин(тритил)-, -лизин(монометокситритил)-, -лизин(флуоренил-метоксикарбонил)-; -валин-цитруллин- (-Val-Cit-),
-валин-аланин- (-Val-Ala-), -валин-лизин- (-Val-Lys-),
-валин-лизин(тритил)- (-Val-Lys(Trt)-),
-валин-лизин(монометокситритил)- (-Val-Lys(Mmt)-),
-валин-лизин(флуоренилметоксикарбонил)- (-Val-Lys(Fmoc)-),
-валин-аргинин- (-Val-Arg-), -фенилаланин-цитруллин-
(-Phe-Cit-), -фенилаланин-лизин- (-Phe-Lys-), -фенилаланин-лизин(тритил)- (-Phe-Lys(Trt)-), -фенилаланин-лизин-(монометокситритил)- (-Phe-Lys(Mmt)-), -фенилаланин-лизин-(флуоренилметоксикарбонил)- (-Phe-Lys(Fmoc)-), -лейцин-цитруллин- (-Leu-Cit-), -изолейцин-цитруллин- (-Ile-Cit-),
-фенилаланин-аргинин- (-Phe-Arg-); -фенилаланин-аргинин-аргинин- (-Ala-Arg-Arg-); -глицин-глицин-фенилаланин-глицин- (-Gly-Gly-Phe-Gly-), -глицин-фенилаланин-лейцин-глицин- (-Gly-Phe-Leu-Gly-) и -аланин-лейцин-аланин-лейцин- (-Ala-Leu-Ala-Leu-);
G представляет собой необязательный разрушающийся фрагмент, который представляет собой ноль или выбран из следующих структур:
где R1 и R2 независимо выбраны из H, C1-C10 алкила и 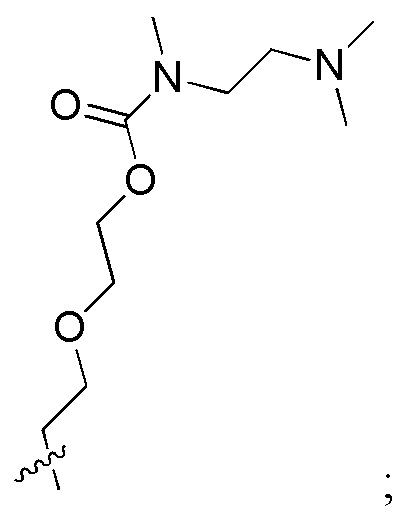
D1 представляет собой MMAF, который имеет структуру:

D2 представляет собой фрагмент второго активного лекарственного средства, отличного от D1 и D2 выбран из группы, состоящей из цитотоксической молекулы, иммуноактиватора и радиоизотопа;
цитотоксическая молекула включает, но ими не ограничивается, ингибитор тубулина, средство, повреждающее ДНК, ингибитор топоизомеразы, ингибитор ALK, и ингибитор PARP;
более предпочтительно, ингибитор тубулина включает, но ими не ограничивается, цитотоксические молекулы долостатина и ауристатина, цитотоксические молекулы майтанзина;
средства, повреждающие ДНК, включают, но ими не ограничиваются, калихемицины, дуокармицины и антрамицины производные PBD;
ингибитор топоизомеразы включает камптотецины и производные камптотецина;
более предпочтительно, цитотоксические молекулы ауристатина включают, но ими не ограничиваются, MMAE или MMAF или их производное, и цитотоксические молекулы майтанзина включают, но ими не ограничиваются, DM1, DM4 или их производные;
p равно целое число, выбранное из 1, 2, 3, 4, 5, 6, 7, и 8;
или его фармацевтически приемлемая соль.
2. Конъюгат антитело-лекарственное средство или его фармацевтически приемлемая соль по п. 1, где Ab представляет собой интактное антитело мышиного антитела, химерного антитела, гуманизированного антитела, или полного человеческого антитела; или его антиген-связывающий фрагмент.
3. Конъюгат антитело-лекарственное средство или его фармацевтически приемлемая соль по п. 2, где антиген-связывающий фрагмент включает Fab, Fab', F(ab)2, F(ab')2; антитело включает биспецифическое антитело и мультиспецифическое антитело.
4. Конъюгат антитело-лекарственное средство или его фармацевтически приемлемая соль по п. 3, где Ab имеет Fc домен и/или петлевой домен человеческого антитела IgG1 или человеческого IgG4, или образует с частичными мутациями, замещениями и делециями аминокислот.
5. Конъюгат антитело-лекарственное средство или его фармацевтически приемлемая соль по п. 1, где домен второго активного лекарственного средства D2 не является ингибитором тубулина.
6. Конъюгат антитело-лекарственное средство или его фармацевтически приемлемая соль по п. 1, где фрагмент второго активного лекарственного средства D2 выбран из группы, состоящей из MK4827, церитиниба, Dxd, SN38 и Экзатекана.
7. Конъюгат антитело-лекарственное средство или его фармацевтически приемлемая соль по п. 1, где конъюгат антитело-лекарственное средство выбран из следующих структур,
где p представляет собой целое число, выбираемое из 1, 2, 3, 4, 5, 6, 7, и 8:
 ,
,
ADC1: Ab-Mc-MMAF-VC-PAB-Церитиниб
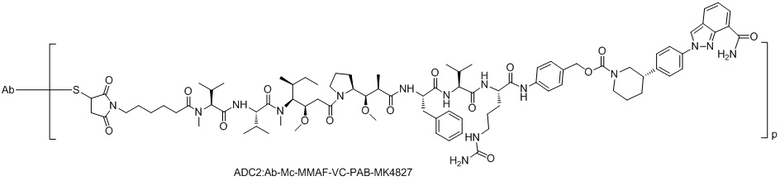
ADC2: Ab-Mc-MMAF-VC-PAB-МК4827
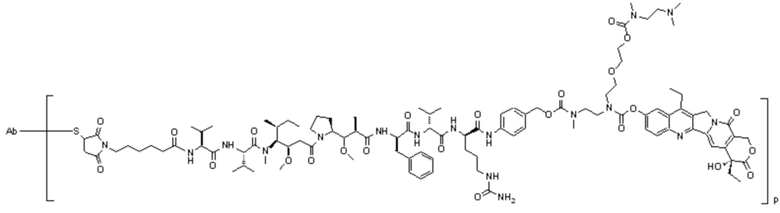
ADC3: Ab-Mc-MMAF-VC-PAB-DMEDA-PEG(N3)-SN38
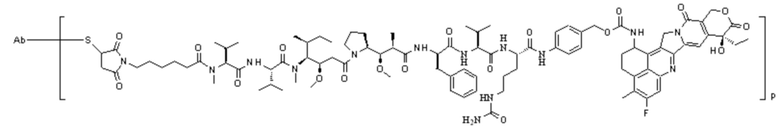
ADC4: Ab-MC-MMAF-VC-PAB-Экзатекан
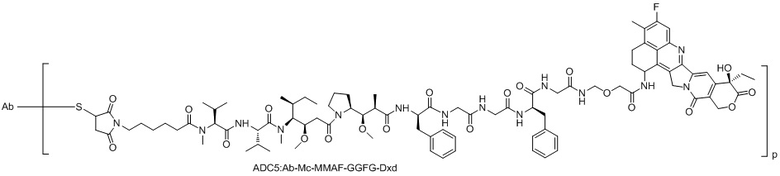
ADC5: Ab-Mc-MMAF-GGFG-Dxd.
8. Применение конъюгата антитело-лекарственное средство или его фармацевтически приемлемой соли по любому из пп. 1-7 для получения лекарственного препарата для лечения или профилактики рака.
9. Промежуточное соединение со структурой, показанной следующей формулой:
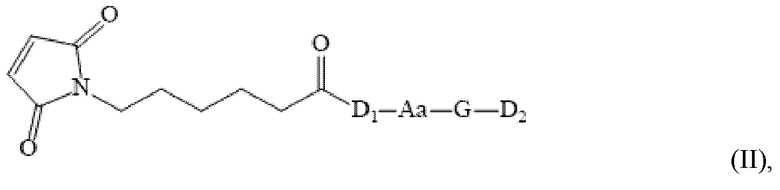
где:
Aa представляет собой аминокислотный фрагмент, содержащий одну или более аминокислот, где аминокислотный фрагмент Аа выбран из группы, состоящей из -глицин-, -аланин-, -валин-,
-лейцин-, -изолейцин-, -пролин-, -фенилаланин-, -триптофан-,
-метионин-, -тирозин-, -серин-, -треонин-, -цистеин-,
-аспарагин-, -глутамин-, -аспарагиновая кислота-, -глутаминовая кислота-, -лизин-, -аргинин-, -гистидин-, -цитруллин-,
-лизин(тритил)-, -лизин(монометокситритил)-,
-лизин(флуоренилметоксикарбонил)-; -валин-цитруллин-
(-Val-Cit-), -валин-аланин- (-Val-Ala-), -валин-лизин- (-Val-Lys-), -валин-лизин(тритил)- (-Val-Lys(Trt)-), -валин-лизин(монометокситритил)- (-Val-Lys(Mmt)-), -валин-лизин(флуоренилметоксикарбонил)- (-Val-Lys(Fmoc)-), -валин-аргинин- (-Val-Arg-), -фенилаланин-цитруллин- (-Phe-Cit-),
-фенилаланин-лизин- (-Phe-Lys-), -фенилаланин-лизин(тритил)- (-Phe-Lys(Trt)-), -фенилаланин-лизин(монометокситритил)-
(-Phe-Lys(Mmt)-), -фенилаланин-лизин(флуоренилметоксикарбонил)- (-Phe-Lys(Fmoc)-), -лейцин-цитруллин- (-Leu-Cit-), -изолейцин-цитруллин- (-Ile-Cit-), -фенилаланин-аргинин- (-Phe-Arg-);
-фенилаланин-аргинин-аргинин- (-Ala-Arg-Arg-); -глицин-глицин-фенилаланин-глицин- (-Gly-Gly-Phe-Gly-), -глицин-фенилаланин-лейцин-глицин- (-Gly-Phe-Leu-Gly-) и -аланин-лейцин-аланин-лейцин- (-Ala-Leu-Ala-Leu-);
G представляет собой необязательный разрушающийся фрагмент, который представляет собой ноль или выбран из следующих структур:
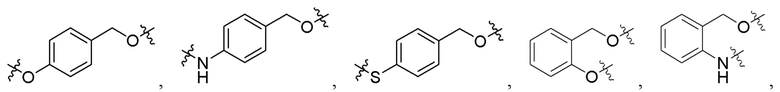
где R1 и R2 независимо выбраны из H, C1-C10 алкила и 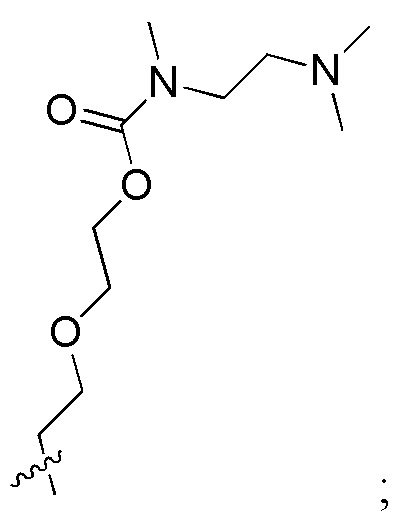
D1 представляет собой MMAF, который имеет структуру:
D2 представляет собой фрагмент второго активного лекарственного средства, отличного от D1, и D2 выбран из группы, состоящей из цитотоксической молекулы, иммуноактиватора и радиоизотопа;
цитотоксическая молекула включает, но ими не ограничивается, ингибитор тубулина, ДНК повреждающее средство, ингибитор топоизомеразы, ингибитор ALK и ингибитор PARP;
более предпочтительно, ингибитор тубулина включает, но ими не ограничивается, цитотоксические молекулы доластатина и ауристатина, цитотоксические молекулы майтанзина;
ДНК повреждающее средство включает, но ими не ограничивается, каликемицины, дуокармицины и антрамицины производные PBD;
ингибитор топоизомеразы включает камптотецины и производные камптотецина;
более предпочтительно, цитотоксические молекулы ауристатина включают, но ими не ограничивается, MMAE или MMAF или их производное, и цитотоксические молекулы майтанзина включают, но ими не ограничивается, DM1, DM4 или их производные.
10. Соединение по п. 9, где фрагмент второго активного лекарственного средства D2 не является ингибитором тубулина.
11. Соединение по п. 9, где фрагмент второго активного лекарственного средства D2 выбран из группы, состоящей из MK4827, церитиниба, Dxd, SN38 и экзатекана.
12. Соединение по п. 9, где соединение выбрано из следующих структур:
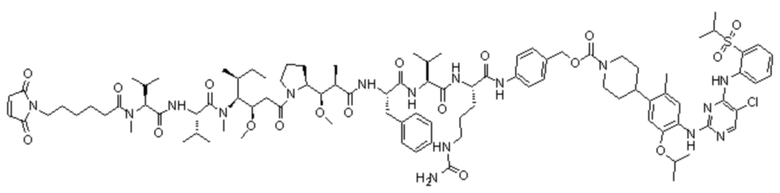
LD-1: Mc-MMAF-VC-PAB-Церитиниб
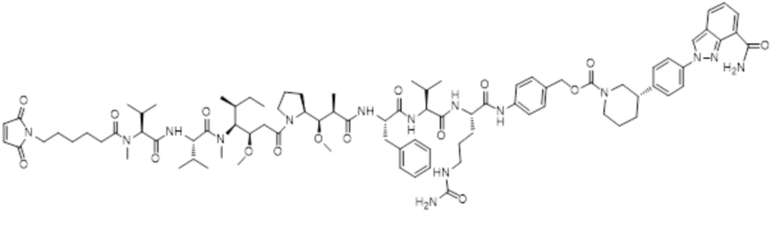
LD-2: Mc-MMAF-VC-PAB-МК4827
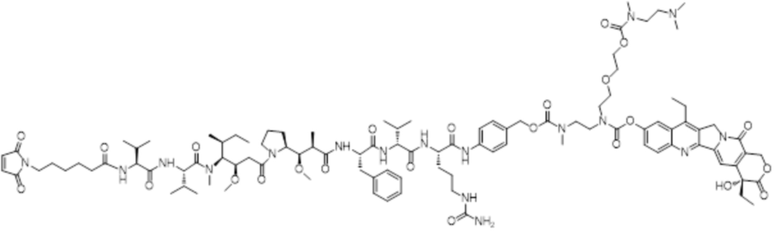
LD-3: Mc-MMAF-VC-PAB-DMEDA-PEG(N3)-SN38
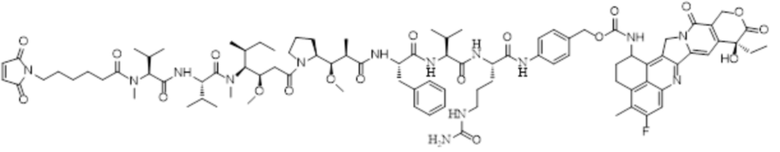
LD-4: MC-MMAF-VC-PAB-Экзатекан
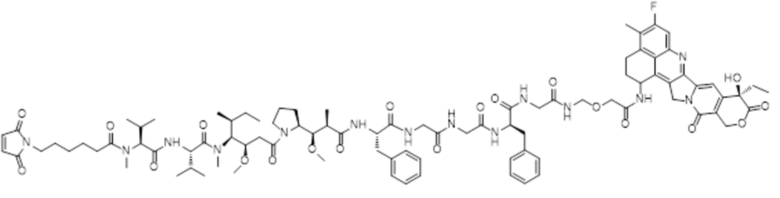
LD-5: Mc-MMAF-GGFG-Dxd.
13. Способ синтеза соединения по п. 9, где путем синтеза метода синтеза является:
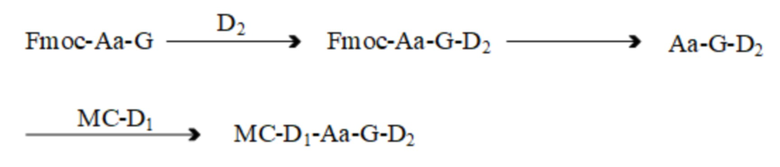 ;
;
способ синтеза включает следующие стадии:
стадия 1: растворение соединения Fmoc-Aa-G, фрагмента второго активного лекарственного средства D2, и органического основания 1 в соответствующем количестве органического растворителя 1, и возможность их контакта и реакции для получения соединения Fmoc-Aa-G-D2;
стадия 2: удаление защитной группы Fmoc с соединения Fmoc-Aa-G-D2 для получения соединения Aa-G-D2;
стадия 3: растворение соединения Aa-G-D2, соединения Mc-D1, и конденсирующего средства 1 в соответствующем количестве органического растворителя 2, и возможность их контакта и реакции для получения соединения Mc-D1-Aa-G-D2;
где органическое основание 1 выбран из одного или более из N, N-диизопропилэтиламина, триэтиламина, и пиридина; органический растворитель 1 и органический растворитель 2 каждый независимо выбран из одного или обоих из DMF и DMA; конденсирующее средство 1 выбран из одного или более из TSTU, HATU, HBTU, HCTU, PyBop, CDMT, и T3P;
где Аа, G, D1 и D2 определены в п. 9.
14. Способ синтеза по п. 13, где соединение выбрано из структуры, показанной в п. 12, и путь синтеза выбран из следующего:
| МОНОМЕТИЛВАЛИНОВЫЕ СОЕДИНЕНИЯ, СПОСОБНЫЕ ОБРАЗОВЫВАТЬ КОНЪЮГАТЫ С ЛИГАНДАМИ | 2004 |
|
RU2448117C2 |
| EP 3828196 A1, 02.06.2021 | |||
| КОНЪЮГАТ ЛИГАНД - ЦИТОТОКСИЧЕСКОЕ ЛЕКАРСТВЕННОЕ СРЕДСТВО, СПОСОБ ЕГО ПОЛУЧЕНИЯ И ЕГО ПРИМЕНЕНИЯ | 2015 |
|
RU2685728C2 |
| CN 110997010 A, 10.04.2020 | |||
| WO 2020073345 A1, 16.04.2020. | |||
Авторы
Даты
2023-04-28—Публикация
2021-07-19—Подача