ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
[0001] Настоящее изобретение относится к фармацевтической композиции конъюгата антитела к Her2-лекарственного средства, который относится к области противоопухолевых лекарственных средств.
[0002]
УРОВЕНЬ ТЕХНИКИ
[0001] Направленная противоопухолевая биотерапия привлекает все больше внимания в исследовании лечения рака. Среди таких средств терапия моноклональными антителами обладает высокой специфичностью в отношении мишени и низким уровнем побочных эффектов, но имеет относительно ограниченную эффективность при использовании в отдельности. В настоящее время наиболее успешно применяемыми противоопухолевыми средствами на основе моноклональных антител являются лекарственные средства, направленно воздействующие на лимфоцитарные опухоли, такие как неходжкинскую лимфому (НХЛ), хронический лимфолейкоз (ХЛЛ) и т.д.
[0002] ErbB2, также известный как Her2/neu, является вторым представителем семейства EGFR, который играет биологическую роль, образуя гетеродимер с другими тремя представителями семейства EGFR. Ген neu, кодирующий ErbB2, был впервые выделен из нейробластомы крысы. Ген, гомологичный гену neu в соматических клетках человека, называемый Her2, расположен на длинном плече хромосомы 17 (17q21.1). ErbB2, продукт, кодируемый Her2, состоит из 1255 аминокислот и имеет молекулярную массу около 185 кДа, в положениях 720-987 которого находится активный тирозинкиназный домен. Помимо действия через сигнальные пути PI3K и MAPK, ErbB2 может снижать экспрессию циклина D и c-myc, снижая, таким образом, экспрессию ингибитора циклин-зависимой киназы (CDK) p27kipl. Активность CDK2 ингибируется, что приводит к пролиферации клеток. В ходе постоянных и глубоких исследований было обнаружено, что HER2 экспрессируется и оверэкспрессируется в различных опухолях. Таким образом, существует острая потребность в лекарственных средствах, направленно воздействующих на HER2, для эффективного лечения злокачественных опухолей. В настоящее время на рынке присутствуют три моноклональных антитела, направленно воздействующих на Her2 (см. Таблицу 1).
[0003] Таблица 1 Одобренные FDA лекарственные средства на основе моноклональных антител, направленно воздействующих на Her2
[0004] На основе характеристик направленного воздействия антител появилось новое поколение лекарственных средств биологического направленного действия, конъюгат антитело-лекарственное средство (ADC). ADC состоит из трех частей: антитела, цитотоксина и соединяющего их линкера. После конъюгирования моноклонального антитела с цитотоксином конъюгат антитело-лекарственное средство использует направляющее действие моноклонального антитела для специфического распознавания рецептора на поверхности раковой клетки, связывается с рецептором, после чего проникает в клетку и высвобождает цитотоксическое вещество при посредстве внутриклеточной протеазы, останавливая размножение раковых клеток и вызывая их гибель. В уровне техники для получения антитела обычно используют культуру клеток млекопитающего, и высокоочищенное антитело конъюгируют с цитотоксином, таким как MMAE, через линкер с получением конъюгата антитела-лекарственного средства (ADC). Технология конъюгирования антител с лекарственными средствами объединяет низкомолекулярный лекарственный токсин и биологический белок, при этом он обладает преимуществами их обоих, становясь терапевтическим продуктом нового поколения, который значительно повышает эффективность лекарственного средства при одновременном снижении токсических и побочных эффектов. В настоящее время на рынке присутствуют четыре препарата ADC, одобренные FDA США (см. Таблицу 2).
Таблица 2 Четыре препарата ADC, доступные на рынке
[0005] Как и другие лекарственные средства на основе биомакромолекул, ADC склонны к деградации, например, окислению, дезамидированию и фрагментации, или к образованию микрочастиц и агрегатов. Кроме того, сама конъюгация может снижать стабильность и изменять физико-химические свойства антитела. Например, конъюгирование DM1 с антителом к HER2 трастузумабом приводит к потере стабильности CH2 домена антитела (Ссылка 1: Physicochemical Stability of the Antibody-Drug Conjugate Trastuzumab-DM1: Changes due to Modification and Conjugation Processes. Aditya A. Wakankar et al., Bioconjugate Chemistry 2010: 21 (9), 1588-1595). Лекарство ADC обычно является гидрофобно и в целом может быть менее растворимым, чем неконъюгированное антитело, и поэтому становится в большей степени склонным к агрегации, образованию микрочастиц или поверхностной адсорбции. Для получения лекарственных средств ADC, которые являются стабильными при транспортировке и хранении, каждый вспомогательный компонент в фармацевтической композиции требуется тщательно подбирать. Вспомогательные компоненты ADC, представленные в настоящее время на рынке, показаны в Таблице 3. Поскольку типы вспомогательных компонентов, используемых в составе ADC, присутствующих в настоящее время на рынке, очень ограничены, и при этом существует множество вариантов выбора соответствующего компонента в составе, разработка комбинации вспомогательных веществ в составе ADC, которые являются стабильными во время транспортировки и хранения, включает скрининг большого количества вспомогательных компонентов, кроме того, определение подходящей концентрации требует больших усилий и времени.
Таблица 3 Вспомогательные компоненты препаратов ADC, присутствующих на рынке
Сахароза
Натрия хлорид
Одноосновного фосфата натрия моногидрат
Двухосновный фосфат натрия безводный
Натрия цитрата дигидрат
α, α-Трегалозы дигидрат
Полисорбат 80
янтарная кислота
Полисорбат 20
Натрия гидроксид
Полисорбат 80
Натрия хлорид
Трометамин
[0006] Также по вспомогательным компонентам представленных выше четырех составов ADC можно заметить, что каждый состав уникален по используемым вспомогательным компонентам. Из-за низкой стабильности и сложной структуры лекарственных средств на основе моноклональных антител такие лекарственные средства чрезвычайно сложно производить и хранить. Из-за гетерогенной структуры антител, в частности, определяющих комплементарность областей (CDR) и Fc гликозилирования, разработку различных композиций моноклональных антител требуется проводить индивидуально в зависимости от конкретного случая (Ссылка 2: Monoclonal antibodies: formulations of marketed products and recent advances in novel delivery system, Yanan Cui et al., Drug Development and Industrial Pharmacy, Том 43, №4, стр. 519-530, 2017). Кроме того, разработка составов ADC более уникальна из-за последующего использования конъюгирования и молекулы токсина.
[0007] В заявке на патент (CN105008398A или WO2015074528A1) раскрыт конъюгат гуманизированного антитела RC48 с лекарственным средством, в котором гуманизированное антитело RC48 представляет собой моноклональное антитело, направленно взаимодействующее с Her2 (антитело, секретированное из клеток яичников хомяка (клетки СНО), которые были депонированы в Китайском центре Коллекции типовых культур под депозитарным номером C2013170, или антитело, полученное на его основе), а цитотоксин является монометилуристатином E (MMAE), который представляет собой производное доластатина. Линкером в этом ADC является малеимидо-капроил-валин-цитруллин-п-аминоБензилоксикарбонил (mc-VC-PAB), и конъюгат рекомбинантного гуманизированного моноклонального антитела Her2-MMAE сформирован из моноклонального антитела и MMAE, связанных линкером через цистеин. Данное лекарственное средство показало хорошие терапевтические эффекты при Her2-положительной опухоли.
[0008] Предварительные эксперименты показали, что после очистки конъюгат рекомбинантного гуманизированного моноклонального антитела против Her2 с MMAE имеет плохую растворимость в обычном буфере, при этом начинают появляться видимые нерастворимые микрочастицы, что не соответствует стандартам для инъекции. Однако если необходимо достичь клинически эффективной терапевтической дозы, концентрация белка должна быть выше 5 мг/мл. Следовательно, существует потребность в решении проблемы нерастворимых частиц при обеспечении некоторой эффективной концентрации. Кроме того, когда раствор белка лиофилизируют в вакууме, необходимо добавлять лиопротектор для защиты белка от разрушения в ходе лиофилизации и в то же время для обеспечения хорошего внешнего вида лиофилизированного порошка. Чтобы избежать медленного разложения лиофилизированного порошка белка во время длительного хранения, необходимо добавлять соответствующий стабилизатор белка. Чтобы разработать и определить подходящий стабилизатор белка, необходимо провести множество экспериментов.
[0009] Таким образом, цель настоящего изобретения состоит в разработке комбинации вспомогательных веществ для конъюгата моноклонального антитела против Her2 с MMAE посредством обширного скрининга, а также скрининга диапазона концентраций для достижения следующих технических эффектов: конъюгат моноклонального антитела против Her2 с MMAE может хорошо растворяться до и после лиофилизации, при этом нерастворимые микрочастицы, как и видимый осадок, соответствуют стандартам для введения человеку путем инъекции; кроме того, конъюгат может быть стабильным в течение длительного времени во время лиофилизации и хранения, не поддаваться полимеризации или разложению после восстановления и при этом сохранять хорошую биологическую активность.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
[0010] В настоящем изобретении предложена водная жидкая фармацевтическая композиция конъюгата антитела-лекарственного средства, где композиция включает конъюгат антитела-лекарственного средства, невосстанавливающий сахар, аминокислоту и солюбилизатор; где невосстанавливающий сахар выбран из маннита, сахарозы, трегалозы и их комбинации; аминокислота выбрана из гистидина, аланина, аргинина, глицина, глутаминовой кислоты и их комбинации; и солюбилизатор выбран из глицерина, Tween 80 и их комбинации.
[0011] В некоторых вариантах осуществления концентрация маннита составляет 100-300 ммоль/л, предпочтительно 190-300 ммоль/л, более предпочтительно 200-260 ммоль/л, наиболее предпочтительно 240-260 ммоль/л. Концентрация сахарозы составляет 0-100 ммоль/л, предпочтительно 40-100 ммоль/л, более предпочтительно 60-100 ммоль/л, наиболее предпочтительно 40-60 ммоль/л.
[0012] В некоторых вариантах осуществления гистидин представляет собой гидрохлорид гистидина в концентрации 0-100 ммоль/л, предпочтительно 5-50 ммоль/л, более предпочтительно 5-20 ммоль/л, наиболее предпочтительно 10 ммоль/л. Аргинин представляет собой гидрохлорид аргинина в концентрации 0-160 ммоль/л, предпочтительно 20-100 ммоль/л, более предпочтительно 30-90 ммоль/л, наиболее предпочтительно приблизительно 35 ммоль/л.
[0013] В некоторых вариантах осуществления содержание глицерина составляет 0-1%, предпочтительно 0,2-0,5% (масс./об.). Процентное содержание Tween 80 по массе составляет 0-0,02% (масс./об.).
[0014] Кроме того, антитело в конъюгате антитела-лекарственного средства представляет собой моноклональное антитело против HER2; и лекарственным средством, с которым конъюгировано антитело, является MMAE, MMAF, DM1, DM4 или их производное.
[0015] Кроме того, конъюгат антитела против HER2 с лекарственным средством представляет собой моноклональное антитело против HER2-vc-MMAE, где моноклональное антитело против HER2 соединено с MMAE через линкер vc, при этом структура, образующаяся при соединении линкера и MMAE, является следующей:
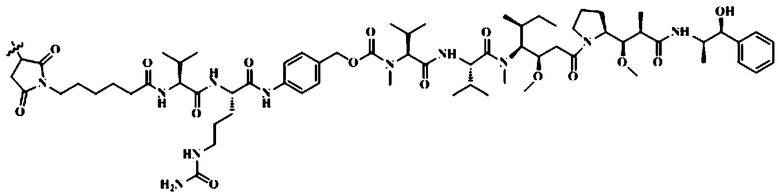
[0016] Кроме того, моноклональное антитело против HER2 включает тяжелую цепь и легкую цепь,
(i) тяжелая цепь включает CDR-области 1-3, имеющие аминокислотные последовательности, показанные в SEQ ID NO: 1, 2 и 3, соответственно; и/или
(ii) легкая цепь включает CDR-области 1-3, имеющие аминокислотные последовательности, показанные в SEQ ID NO: 4, 5 и 6, соответственно.
[0017] Кроме того, моноклональное антитело предпочтительно является химерным антителом или гуманизированным антителом.
[0018] В некоторых вариантах осуществления концентрация моноклонального антитела против HER2-vc-MMAE составляет 5-30 мг/мл.
[0019] В некоторых вариантах осуществления невосстанавливающий сахар представляет собой 240-260 ммоль/л маннита и/или 40 ммоль/л-60 ммоль/л сахарозы, аминокислота представляет собой 8-12 ммоль/л гидрохлорида гистидина, и солюбилизатор представляет собой 0-0,02% (масс./об.) Tween 80.
[0020] В некоторых вариантах осуществления, где невосстанавливающий сахар представляет собой приблизительно 260 ммоль/л маннита и приблизительно 40 ммоль/л сахарозы, аминокислота представляет собой приблизительно 10 ммоль/л гидрохлорида гистидина, концентрация конъюгата антитела-лекарственного средства составляет приблизительно 10 мг/мл, а солюбилизатор представляет собой приблизительно 0,02% (масс./об.) Tween 80.
[0021] В некоторых вариантах осуществления, где невосстанавливающий сахар представляет собой приблизительно 240 ммоль/л маннита и приблизительно 60 ммоль/л сахарозы, аминокислота представляет собой приблизительно 10 ммоль/л гидрохлорида гистидина, концентрация конъюгата антитела-лекарственного средства составляет приблизительно 10 мг/мл, а солюбилизатор представляет собой приблизительно 0,02% (масс./об.) Tween 80.
[0022] Кроме того, композиция имеет pH 4,5-7, предпочтительно 5,6-6,8, более предпочтительно 5,6-6,5, 5,6-6,4, 5,6-6,3, 6,1-6,4 или 6,1-6,3.
[0023] pH композици доводят NaOH или соляной кислотой.
[0024] В некоторых вариантах осуществления лиофилизированную фармацевтическую композицию получают при лиофилизации вышеуказанной водной жидкой фармацевтической композиции.
[0025] Кроме того, перед лиофилизацией водная жидкая фармацевтическая композиция включает приблизительно 260 ммоль/л маннита, приблизительно 40 ммоль/л сахарозы, приблизительно 10 ммоль/л гидрохлорида гистидина, приблизительно 0,02% (масс./об.) Tween 80 и приблизительно 10 мг/мл моноклонального антитела против HER2-vc-MMAE, и имеет pH 5,6-6,8.
[0026] Кроме того, перед лиофилизацией водная жидкая фармацевтическая композиция включает приблизительно 240 ммоль/л маннита, приблизительно 60 ммоль/л сахарозы, приблизительно 10 ммоль/л гидрохлорида гистидина, 0,02% Tween 80 и приблизительно 10 мг/мл моноклонального антитела против HER2-vc-MMAE, и имеет pH 5,6-6,8.
[0027] Кроме того, перед лиофилизацией невосстанавливающие сахара, содержащиеся в водной жидкой фармацевтической композиции, представляют собой маннит и сахарозу в концентрациях приблизительно 47,36 мг/мл и приблизительно 13,69 мг/мл, соответственно, и аминокислота представляет собой гидрохлорид гистидина в концентрации приблизительно 2,10 мг/мл, и солюбилизатор представляет собой Tween 80 в количестве приблизительно 0,02% (масс./об.).
[0028] Кроме того, перед лиофилизацией невосстанавливающие сахара, содержащиеся в водной жидкой фармацевтической композиции, представляют собой маннит и сахарозу в концентрациях приблизительно 43,72 мг/мл и приблизительно 20,54 мг/мл, соответственно, и аминокислота представляет собой гидрохлорид гистидина в концентрации приблизительно 2,10 мг/мл, и солюбилизатор является Tween 80 в количестве приблизительно 0,02% (масс./об.).
[0029] В настоящем изобретении также предложено применение вышеуказанных фармацевтических композиций в производстве лекарственного средства для лечения заболевания, вызванного нарушением экспрессии Her2, предпочтительно рака; более предпочтительно Her2-положительного рака; более предпочтительно рака молочной железы, рака яичника, рака желудка, уротелиального рака, гастроэзофагеального рака, рака пищевода, рака эндометрия, рака легкого или рака мочевого пузыря (Ссылка 3: Human Epidermal Growth Factor Receptor 2 (HER2) in Cancers: Overexpression and Therapeutic Implications, Nida Iqbal and Naveed Iqbal, Molecular Biology International, Том 2014, идентификатор статьи 852748; и Ссылка 4: CN201810998055.4).
[0030] В настоящем изобретении также предложен способ получения фармацевтической композиции конъюгата антитела-лекарственного средства, включающий:
(1) приготовление композиции любого из указанного выше; и
(2) оценку стабильности конъюгата антитела-лекарственного средства в композиции.
[0031] КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
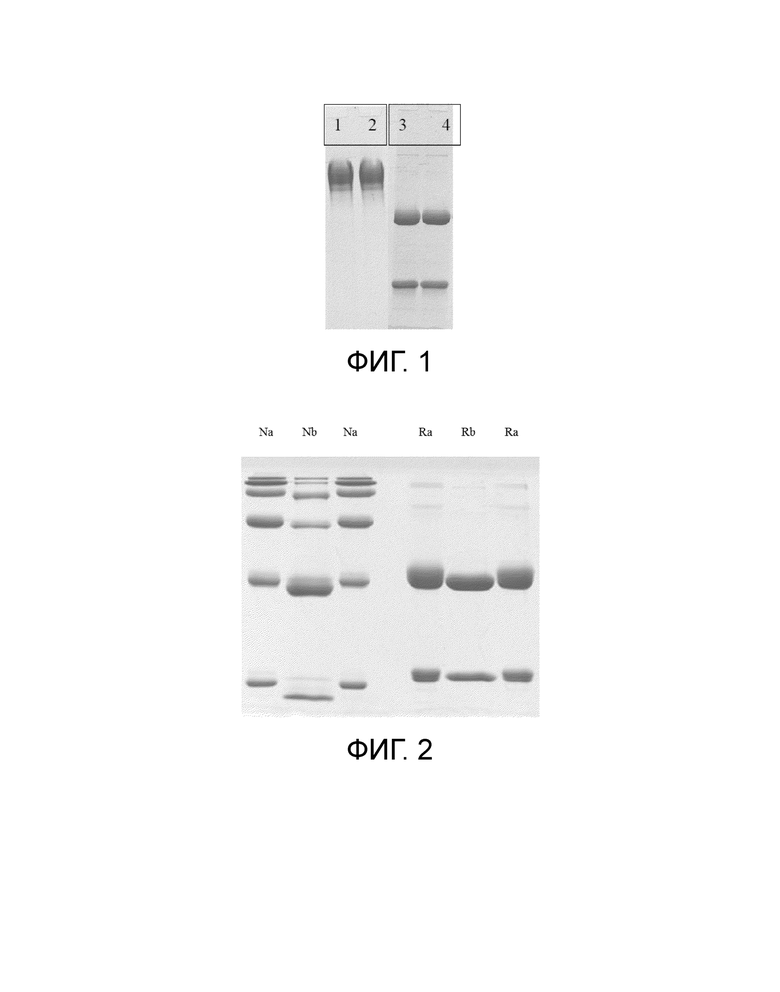
[0032] На Фигуре 1 показан электрофорез в ДСН-ПААГ голого антитела после очистки, где 1-2: невосстанавливающий электрофорез; и 3-4: восстанавливающий электрофорез. Результат на Фигуре 1 показывает, что чистота моноклонального антитела, полученного в эксперименте, удовлетворяет требованиям дальнейших экспериментов.
[0033] На Фигуре 2 показан электрофорез ADC в 10% ДСН-ПААГ после конъюгирования, где, Na: невосстанавливающий электрофорез; Nb: невосстанавливающий электрофорез после восстановления антитела TCEP; Ra: восстанавливающий электрофорез RC48-vc-MMAE; и Rb: восстанавливающий электрофорез после восстановления антитела TCEP. Результат на Фигуре 2 показывает, что чистота полученного ADC после конъюгирования удовлетворяет требованиям дальнейших экспериментов.
ПРИМЕРЫ
Пример 1 Очистка антитела
[0034] Полученное в Мышиных моноклональное антитело mRC48 и родственное гуманизированное антитело RC48 получали на основе способов, описанных в Примере заявки на патент (CN105008398A или WO2015074528A1), где RC48 включает константную область тяжелой цепи IgG1κ человека и вариабельную область тяжелой цепи RC48-VH, и константную область легкой цепи IgG1κ человека и вариабельную область легкой цепи RC48-VL. Каждый из указанных выше фрагментов амплифицировали и затем субклонировали в вектор экспрессии pcDNA3.0, соответственно. Сконструированные плазмиды трансфицировали в суспендированные клетки СНО (Invitrogen). Клетки культивировали в стандартных условиях. После израсходования питательных веществ в среде и прекращения роста клеток, культуральную смесь собирали. Затем клетки разделяли с помощью центрифугирования или фильтрации и супернатант, содержащий белок антитела, собирали и наносили на колонку для аффинной хроматографии с белком A для первой очистки. Элюированный целевой белок наносили на хроматографическую колонку, заполненную катионным наполнителем, для второй очистки. Целевой белок собирали и затем наносили на третью колонку для третьей очистки в режиме проскока целевого белка. Затем очищенный белок, который прошел исследование по различным показателям, концентрировали с помощью ультрафильтрации с получением белка с концентрацией приблизительно 20-30 мг/мл, который представлял собой стоковый раствор белка антитела, и который можно было хранить при -80°C в течение длительного времени.
[0035] Где CDR-последовательность антитела RC48 является следующей.
Таблица 4 CDR-последовательности антитела RC48
Пример 2 Конъюгирование антитела с MMAE
[0036] Конъюгирование гуманизированного антитела RC48 с молекулами лекарственного средства
[0037] Сначала стоковые растворы TCEP (трис-2-карбоксиэтилфосфина) и DTPA (диэтилентриаминпентауксусной кислоты) растворяли/разбавляли в буфере для конъюгирования соответственно, а затем смешивали с моноклональным антителом в соотношении 1:1 по объему (об:об=1:1), при котором молярное отношение конечной концентрации TCEP к антителу составляло 1,9:1, конечная концентрация DTPA составляла 1 ммоль/л, и проводили реакцию с перемешиванием при 25°C в течение 2 ч. Восстановительная реакция с ТСЕР имеет хорошую воспроизводимость, при этом количество свободного тиола после восстановления может достигать 3,5-4,5.
[0038] После восстановления с использованием TCEP антитело можно непосредственно подвергать последующему конъюгированию. Лекарственные средства (vc-MMAE, vc-MMAF, mc-MMAF) растворяли в ДМСО (диметилсульфоксиде) в концентрации 10 ммоль/л. Лекарственные средства медленно добавляли в молярном соотношении лекарственного средства и тиола к антителу 1,1:1 и проводили реакцию с перемешиванием при 25°C в течение 2 часов. Концентрацию свободного тиола определяли при 412 нм с помощью метода DTNB (близкая к нулю), остаточные непрореагировавшие лекарственные средства и свободные малые молекулы, такие как ДМСО, удаляли при очистке, и результат конъюгирования определяли с помощью электрофореза в ДСН-ПААГ, методами SEC и ВЭЖХ. Реакция конъюгирования имеет хорошую воспроизводимость, при этом свободный тиол может быть полностью конъюгирован со степенью конъюгирования 3,5-4,5.
Пример 3 Влияние pH на растворение и чистоту конъюгата рекомбинантного гуманизированного антитела к Her-2-MMAE (RC48-vc-MMAE)
[0039] Экспериментальная методика
[0040] 2 г конъюгата рекомбинантного гуманизированного моноклонального антитела против Her2-MMAE для инъекций подвергали ультрафильтрации и диализу в буфере, содержащем 0,1 моль/л лимонной кислоты, 0,02 моль/л тригидроксиметиламинометана, 0,02 моль/л дигидрофосфата натрия и 0,15 моль/л хлорида натрия в диализном отношении не меньше 104 раз. Полученный раствор делили на 13 равных частей и каждую часть концентрировали до концентрации белка 10 мг/мл с помощью центрифужной ультрафильтрационной пробирки с размером пор 30 кДа, а затем доводили pH до 4,2, 4,6, 5,0, 5,4, 5,6, 5,8, 6,0, 6,2, 6,4, 6,6, 6,8, 7,0 или 7,4 соляной кислотой или раствором гидроксида натрия. Наблюдали прозрачный раствор и обнаруживали изменение концентрации (результаты показаны в Таблице 5). Образцы соответственно фильтровали в стерильные флаконы для пенициллина объемом 20 мл с помощью стерильного шприцевого фильтра с размером пор мембраны 0,22 мкм в чистом боксе, используя по 3 флакона для каждого значения pH. Каждый флакон закрывали стерильной резиновой пробкой, фиксировали алюминиевым колпачком и хранили при 25°C. Образцы отбирали стерильным шприцем через 0 час, 1 день, 3 дня и 7 дней для анализа методом SEC ВЭЖХ, результаты представлены в Таблице 6.
[0041] Исследования показали, что pH белка в экспериментальных условиях оказывает огромное влияние на растворение белка. Белок образовывал осадок ниже pH 5,4 и хорошо растворялся выше pH 5,6; при этом белковые агрегаты не были повышены после 3 дней и немного повышены после 7 дней, при хранении ниже pH 6,8, постепенно повышались выше pH 7,0, и чем выше был pH, тем больше агрегатов образовывалось (см. Таблицу 5 и Таблицу 6).
Таблица 5 Прозрачность раствора и концентрация белка
Таблица 6 Чистота
Пример 4 Скрининг вспомогательных веществ
[0042] С помощью анализа большого объема информации и скрининга в 5 экспериментах на ранней стадии, сахароза, маннит, глицерин, гистидин, аргинин, полисорбат 80 (т.е. Tween 80) и подобные были предварительно идентифицированы в качестве вероятных вспомогательных веществ для дальнейшего скрининга, после чего проводили следующие исследования.
Таблица 7 Скрининг вспомогательных веществ для инъекции RC48-vc-MMAE
(ммоль/л)
(ммоль/л)
(ммоль/л)
(ммоль/л)
(%)
(%)
(мг/мл)
Таблица 8 Прозрачность RC48-vc-MMAE инъекции
[0043] Примечание: "-" означает, что количество белых точек (видимых частиц осадка) меньше 3, "+" означает, что количество белых точек (видимых частиц осадка) в пределах 3-5, и "++" означает, что количество белых точек (видимых частиц осадка) больше 5.
Таблица 9 Чистота инъекции RC48-vc-MMAE
[0044] Из приведенных выше результатов можно видеть, что добавление аргинина не оказывало очевидного эффекта на удаление видимого осадка белка. Тогда как добавление сахарозы, глицерина и полисорбата 80 может улучшить состояние белка. Таким образом, было определено, что соответствующее количество сахарозы может быть добавлено к препарату для защиты белка, а глицерин и полисорбат 80 могут быть добавлены для ускорения растворения белка.
Пример 5 Вакуумная лиофилизация
[0045] Стоковый раствор белка извлекали из морозильной камеры на -80°C, размораживали, аккуратно разбавляли "1× буфером для композиции" до концентрации белка 10 мг/мл и фасовали в стерильные, апирогенные стандартные флаконы для лиофилизированного пенициллина на 20 мл, по 6 мл на флакон, и затем подвергали лиофилизации в вакууме.
[0046] Условия лиофилизации
[0047] Предварительное замораживание: -45°C в течение 5 часов;
[0048] Первичная сушка: -26°C в течение 40 часов при уровне вакуума 10-15 Па; и
[0049] Вторичная сушка: 25°C в течение 10 часов, при уровне вакуума 10-15 Па.
[0050] После лиофилизации флакон укупоривали резиновой пробкой в вакууме, извлекали из лиофилизатора и фиксировали алюминиевым колпачком.
Пример 6: Скрининг составов
[0051] На основе составов, разработанных в Таблице 10, исследовали внешний вид и стабильность формирования лиофилизированных порошков композиций. После лиофилизации образцы хранили при 4°C и 37°C. Внешний вид образцов наблюдали в дни 0, 1, 3 и 7, соответственно, и отбирали соответствующие составы с лучшим внешним видом и формой. Результаты показаны в Таблице 11.
Таблица 10 Список составов буферов для инъекции RC48-vc-MMAE
(ммоль/л)
(ммоль/л)
(ммоль/л)
(%)
(%)
(мг/мл)
Таблица 11 Визуальное исследование внешнего вида лиофилизированных порошков
[0052] Примечание: 1) "-" означает, что объем продукта уменьшается меньше чем до половины его объема до лиофилизации; "-" означает, что объем продукта уменьшается больше чем до половины его объема до лиофилизации; "+" означает, что только край немного сжимается, а объем продукта при этом остается по существу таким же, как до лиофилизации; и "++" означает, что объем совершенно не изменяется, и объем продукта совпадает с объемом до лиофилизации. 2) Установленными стандартами внешнего вида лиофилизированных порошков являются: однородный цвет, ровные и плотные поры, а также объем и форма до и после лиофилизации, которые по существу не изменяются, демонстрируя цельную или губчатую структуру. Из Таблицы 11 можно видеть, что композиция, содержащая глицерин в своем составе, показала небольшую усадку после помещения на 37°C на один день и показала очевидную усадку и схлопывание после помещения на 37°C на семь дней. Таким образом, глицерин был исключен в качестве вспомогательного вещества для композиции ADC.
Пример 7 Определение состава и анализ стабильности лиофилизированных порошков
[0053] Формулы B7-B12 исключали после контроля внешнего вида лиофилизированных порошков. Вспомогательные вещества составов B1-B6 также проверяли путем контроля на влагосодержание, видимый осадок, нерастворимые микрочастицы и стабильность.
[0054] Лиофилизированные порошки каждого состава хранили при 37°C, 25°C и 4°C, а отбирали пробы в разное время и подвергали анализам ДСН-ПААГЭ, обращенно-фазовой ВЭЖХ, анализу связывания лиганда, биологической активности, влагосодержания, внешнего вида, значения pH, наличия видимого осадка, нерастворимых микрочастиц и т.п.
Таблицы 12 Визуальное исследование внешнего вида лиофилизированных порошков
[0055] Примечание: "-" означает, что объем продукта уменьшается меньше чем до половины его объема до лиофилизации; "-" означает, что объем продукта уменьшается больше чем до половины его объема до лиофилизации; "+" означает, что только край немного сжимается, а объем остается по существу таким же, как до лиофилизации; и "++" означает, что сжатие вообще отсутствует, а объем продукта совпадает с объемом до лиофилизации.
[0056] Из Таблицы 12 можно увидеть, что внешний вид лиофилизированных порошков всех составов B1-B6 удовлетворяет требованиям стандарта.
[0057] Три образца были отобраны из каждого состава и исследованы на влагосодержание согласно установленному методу. Среднее значение влагосодержания было вычислено, результаты показаны в Таблице 12.
Таблица 12 Влагосодержание лиофилизированных порошков
[0058] Влагосодержание всех формул B1, B2, B3, B4, B5 и B6 составляло меньше 3%, что соответствовало установленному значению.
[0059] По пять образцов каждого состава выбирали случайным образом и исследовали наличие видимого осадка после повторного растворения образца согласно установленному методу. Затем выбирали три из пяти образцов каждого состава и измеряли содержание нерастворимых микрочастиц согласно установленному методу. Результаты показаны в Таблице 13.
Таблица 13 Видимый осадок и нерастворимые микрочастицы после повторного растворения лиофилизированных порошков
(среднее количиство)
[0060] На основе результатов присутствия видимого осадка и нерастворимых микрочастиц можно видеть, что составы B1, B3 и B5 не удовлетворяли требованиям и поэтому были исключены.
Таблица 14 Результаты анализа стабильности после хранения при 37°C в течение 1 месяца
(IC50)(пМ)
(IC50)(пМ)
(%)
(>10 мкм)
(>25 мкм)
Таблица 15 Результаты анализа стабильности после хранения при 25°C в течение 3 месяцев
(IC50)(пМ)
(IC50)(пМ)
(%)
(>10 мкм)
(>25 мкм)
Таблица 16 Результаты анализа стабильности после хранения при 4°C в течение 6 месяцев
(IC50)(пМ)
(IC50)(пМ)
(%)
(>10 мкм)
(>25 мкм)
Примечание: стандарт внешнего вида: "-" означает, что объем продукта уменьшается меньше чем до половины его объема до лиофилизации; "-" означает, что объем продукта уменьшается больше чем до половины его объема до лиофилизации; "+" означает, что только край немного сжимается, а объем продукта остается по существу таким же, как до лиофилизации; и "++" означает, что сжатие вообще отсутствует, а объем продукта совпадает с объемом до лиофилизации.
[0061] Из приведенных выше результатов видно, что продукты составов B2 и B4 имеют лучшую стабильность при различных температурах (4°C, 25°C, 37°C), тогда как продукт состава B6 содержит много нерастворимых частиц, и поэтому был исключен. Из приведенных выше тестов видно, что лиофилизированные порошки формул B2 и B4 обладают превосходными характеристиками с точки зрения внешнего вида, влагосодержания, видимых осадков и нерастворимых микрочастиц после повторного растворения лиофилизированного порошка, и стабильности.
[0062] На основании приведенных выше экспериментальных данных можно увидеть, что выбор конкретных вспомогательных веществ из класса таких соединений, как невосстанавливающие сахара, аминокислоты и солюбилизатор, оказывает непредсказуемое влияние на готовую композицию. В случае конъюгата моноклонального антитела к Her2-лекарственного средства согласно настоящему изобретению необходимо провести большое количество экспериментов для проверки различных свойств, чтобы в итоге получить хорошую комбинацию компонентов. Например, добавление аргинина не оказывает очевидного влияния на устранение видимых осадков белка, а добавление сахарозы, глицерина и полисорбата 80 может снизить агрегацию белка. Однако добавление глицерина сделает лиофилизированный продукт склонным к явной усадке и ухудшению внешнего вида восстановленного водного раствора после восстановления. Кроме того, слишком высокая концентрация сахарозы или слишком низкая концентрация маннозы приведет к увеличению содержания нерастворимого вещества после восстановления. Специалистам в данной области будет сложно спрогнозировать эти результаты до проведения соответствующих исследований. Кроме того, поскольку композиция ADC включает комбинированное применение множества вспомогательных веществ, исследований долговременной стабильности и других факторов, это довольно сильно осложняет разработку композиции ADC. Путем большого количества экспериментов авторы изобретения определили комбинацию композиции Her2 ADC с превосходными характеристиками во всех отношениях. Конъюгат моноклонального антитела против Her2-MMAE может хорошо растворяться до и после лиофилизации, и при этом содержание нерастворимых микрочастиц и видимых осадков соответствует стандартам для инъекции человеку; в то же время конъюгат может оставаться стабильным в течение длительного времени во время лиофилизации и хранения, в особенности, он сохраняет хорошую стабильность после длительного хранения при высокой температуре 25°C или 37°C. Кроме того, композиция ADC не поддается полимеризации или разложению после восстановления и сохраняет хорошую биологическую активность.
--->
СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> Rongchang Biopharmaceutical (Yantai) Co., Ltd.
<120> ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ КОНЪЮГАТА АНТИТЕЛА
К HER2-ЛЕКАРСТВЕННОГО СРЕДСТВА
<130> Unitalen 0413
<150> CN 201910231203.4
<151> 2019-03-26
<160> 6
<170> PatentIn version 3.5
<210> 1
<211> 5
<212> БЕЛОК
<213> Mus musculus
<400> 1
Asp Tyr Tyr Ile His
1 5
<210> 2
<211> 17
<212> БЕЛОК
<213> Mus musculus
<400> 2
Arg Val Asn Pro Asp His Gly Asp Ser Tyr Tyr Asn Gln Lys Phe Lys
1 5 10 15
Asp
<210> 3
<211> 9
<212> БЕЛОК
<213> Mus musculus
<400> 3
Ala Arg Asn Tyr Leu Phe Asp His Trp
1 5
<210> 4
<211> 11
<212> БЕЛОК
<213> Mus musculus
<400> 4
Lys Ala Ser Gln Asp Val Gly Thr Ala Val Ala
1 5 10
<210> 5
<211> 7
<212> БЕЛОК
<213> Mus musculus
<400> 5
Trp Ala Ser Ile Arg His Thr
1 5
<210> 6
<211> 7
<212> БЕЛОК
<213> Mus musculus
<400> 6
His Gln Phe Ala Thr Tyr Thr
1 5
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| АНТИ-НЕR2 АНТИТЕЛО И ЕГО КОНЪЮГАТ | 2014 |
|
RU2656161C1 |
| ПРИМЕНЕНИЕ КОНЪЮГАТА АНТИ-HER2 АНТИТЕЛО-ЛЕКАРСТВЕННОЕ СРЕДСТВО ПРИ ЛЕЧЕНИИ УРОТЕЛИАЛЬНОЙ КАРЦИНОМЫ | 2019 |
|
RU2750817C1 |
| КОМПОЗИЦИИ, СОДЕРЖАЩИЕ КОНЪЮГАТЫ АНТИТЕЛО-ЛЕКАРСТВЕННОЕ СРЕДСТВО ДУОКАРМИЦИН | 2016 |
|
RU2687237C1 |
| ПОЛУЧЕНИЕ КОНЪЮГАТА АНТИТЕЛО-ЛЕКАРСТВЕННОЕ СРЕДСТВО И ЕГО ЛИОФИЛИЗАЦИЯ | 2018 |
|
RU2789476C2 |
| КОНЪЮГАТЫ АНТИТЕЛО-ЛЕКАРСТВЕННОЕ СРЕДСТВО (ADC) С ДУОКАРМИЦИНОМ, ПРИМЕНЯЕМЫЕ ДЛЯ ЛЕЧЕНИЯ РАКА ЭНДОМЕТРИЯ | 2015 |
|
RU2686085C2 |
| КОНЪЮГАТ ЛИГАНД - ЦИТОТОКСИЧЕСКОЕ ЛЕКАРСТВЕННОЕ СРЕДСТВО, СПОСОБ ЕГО ПОЛУЧЕНИЯ И ЕГО ПРИМЕНЕНИЯ | 2015 |
|
RU2685728C2 |
| Фармацевтический состав слитого белка taci-fc | 2020 |
|
RU2779387C1 |
| СПОСОБ ДВОЙНОЙ КОНЪЮГАЦИИ ДЛЯ ПОЛУЧЕНИЯ КОНЪЮГАТОВ АНТИТЕЛО-ЛЕКАРСТВЕННОЕ СРЕДСТВО | 2018 |
|
RU2771310C2 |
| КОНЪЮГАТЫ ПРОИЗВОДНОГО АНТРАЦИКЛИНА, СПОСОБЫ ИХ ПОЛУЧЕНИЯ И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ ПРОТИВООПУХОЛЕВЫХ СОЕДИНЕНИЙ | 2009 |
|
RU2523419C2 |
| ЛИНКЕР ДЛЯ КОНЪЮГАТОВ АНТИТЕЛО-ЛЕКАРСТВЕННОЕ СРЕДСТВО И ИХ ПРИМЕНЕНИЕ | 2019 |
|
RU2792201C2 |
Группа изобретений относится к области медицины, а именно к водной жидкой фармацевтической композиции конъюгата антитела-лекарственного средства для лечения заболевания, вызванного нарушением экспрессии HER2, где композиция включает конъюгат антитела-лекарственного средства, невосстанавливающий сахар, аминокислоту и солюбилизатор, конъюгат антитело-лекарственное средство представляет собой моноклональное антитело против HER2-vc-MMAE, где моноклональное антитело против HER2 связано с MMAE через линкер vc, и структура линкера и MMAE после соединения следующая:
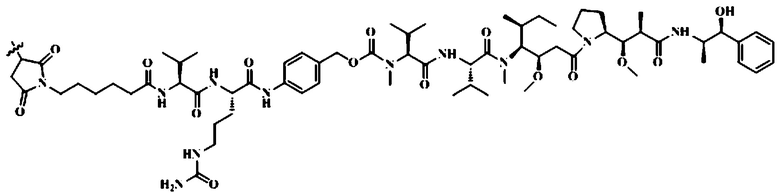 ;
;
антитело в составе конъюгата антитело-лекарственное средство содержит тяжелую цепь и легкую цепь, где тяжелая цепь содержит CDR 1-3, имеющие аминокислотные последовательности, как показано в SEQ ID NO: 1, 2 и 3, соответственно, и где легкая цепь содержит CDR 1-3, имеющие аминокислотные последовательности, как показано в SEQ ID NO: 4, 5 и 6, соответственно; концентрация моноклонального антитела против HER2-vc-MMAE составляет 5-30 мг/мл; невосстанавливающий сахар составляет 240-260 ммоль/л маннита и 40-60 ммоль/л сахарозы, аминокислота составляет 8-12 ммоль/л гидрохлорида гистидина, и солюбилизатор составляет 0-0,02% мас./об. Tween 80; водный жидкий фармацевтический состав имеет pH 5,6-6,8, также относится к лиофилизированной фармацевтической композиции конъюгата антитела-лекарственного средства для лечения заболевания, вызванного нарушением экспрессии HER2, и также относится к применению фармацевтической композиции в производстве лекарственного средства для лечения заболевания, вызванного нарушением экспрессии HER2. Группа изобретений обеспечивает получение конъюгата моноклонального антитела против Her2 с MMAE, который может хорошо растворяться до и после лиофилизации, при этом нерастворимые микрочастицы, как и видимый осадок, соответствуют стандартам для введения человеку путем инъекции; кроме того, конъюгат может быть стабильным в течение длительного времени во время лиофилизации и хранения, не поддаваться полимеризации или разложению после восстановления и при этом сохранять хорошую биологическую активность. 3 н. и 9 з.п., 2 ил., 16 табл., 7 пр.
1. Водная жидкая фармацевтическая композиция конъюгата антитела-лекарственного средства для лечения заболевания, вызванного нарушением экспрессии HER2, где
композиция включает конъюгат антитела-лекарственного средства, невосстанавливающий сахар, аминокислоту и солюбилизатор,
конъюгат антитело-лекарственное средство представляет собой моноклональное антитело против HER2-vc-MMAE, где моноклональное антитело против HER2 связано с MMAE через линкер vc, и структура линкера и MMAE после соединения следующая:
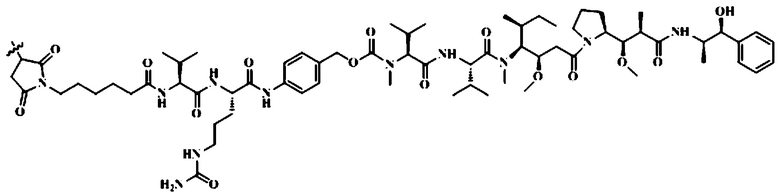 ;
;
антитело в составе конъюгата антитело-лекарственное средство содержит тяжелую цепь и легкую цепь, где тяжелая цепь содержит CDR 1-3, имеющие аминокислотные последовательности, как показано в SEQ ID NO: 1, 2 и 3, соответственно, и где легкая цепь содержит CDR 1-3, имеющие аминокислотные последовательности, как показано в SEQ ID NO: 4, 5 и 6, соответственно;
концентрация моноклонального антитела против HER2-vc-MMAE составляет 5-30 мг/мл; невосстанавливающий сахар составляет 240-260 ммоль/л маннита и 40-60 ммоль/л сахарозы, аминокислота составляет 8-12 ммоль/л гидрохлорида гистидина, и солюбилизатор составляет 0-0,02% мас./об. Tween 80;
водный жидкий фармацевтический состав имеет pH 5,6-6,8.
2. Водная жидкая фармацевтическая композиция по п.1, где моноклональное антитело является химерным антителом или гуманизированным антителом.
3. Водная жидкая фармацевтическая композиция по п.1 или 2, где невосстанавливающий сахар представляет собой 260 ммоль/л маннита и 40 ммоль/л сахарозы, аминокислота представляет собой 10 ммоль/л гидрохлорида гистидина, концентрация конъюгата моноклонального антитела против HER2-vc-MMAE составляет 10 мг/мл, и солюбилизатор представляет собой 0,02% мас./об. Tween 80.
4. Водная жидкая фармацевтическая композиция по п.1 или 2, где невосстанавливающий сахар представляет собой 240 ммоль/л маннита и 60 ммоль/л сахарозы, аминокислота представляет собой 10 ммоль/л гидрохлорида гистидина, концентрация конъюгата моноклонального антитела против HER2-vc-MMAE составляет 10 мг/мл, и солюбилизатор представляет собой 0,02% мас./об. Tween 80.
5. Водная жидкая фармацевтическая композиция по п.1 или 2, где композиция имеет pH 4,5-7.
6. Лиофилизированная фармацевтическая композиция конъюгата антитела-лекарственного средства для лечения заболевания, вызванного нарушением экспрессии HER2, где лиофилизированная фармацевтическая композиция получена путем лиофилизации водной жидкой фармацевтической композиции по любому из пп.1-5.
7. Лиофилизированная фармацевтическая композиция по п.6, где водная жидкая фармацевтическая композиция включает 260 ммоль/л маннита, 40 ммоль/л сахарозы, 10 ммоль/л гидрохлорида гистидина, 0,02% мас./об. Tween 80 и 10 мг/мл конъюгата моноклонального антитела против HER2-vc-MMAE.
8. Лиофилизированная фармацевтическая композиция по п.6, где водная жидкая фармацевтическая композиция включает 240 ммоль/л маннита, 60 ммоль/л сахарозы, 10 ммоль/л гидрохлорида гистидина, 0,02% мас./об. Tween 80 и 10 мг/мл конъюгата моноклонального антитела против HER2-vc-MMAE.
9. Лиофилизированная фармацевтическая композиция по п.6, где невосстанавливающие сахара в водной жидкой фармацевтической композиции представляют собой маннит и сахарозу в концентрациях 47,36 мг/мл и 13,69 мг/мл, соответственно, и аминокислота представляет собой гидрохлорид гистидина в концентрации 2,10 мг/мл, и солюбилизатор представляет собой Tween 80 в количестве 0,02% мас./об.
10. Лиофилизированная фармацевтическая композиция по п.6, где невосстанавливающие сахаров в водной жидкой фармацевтической композиции представляют собой маннит и сахарозу в концентрациях 43,72 мг/мл и 20,54 мг/мл, соответственно, и аминокислота представляет собой гидрохлорид гистидина в концентрации 2,10 мг/мл, и солюбилизатор представляет собой Tween 80 в количестве 0,02% мас./об.
11. Применение фармацевтической композиции по любому из пп.1-10 в производстве лекарственного средства для лечения заболевания, вызванного нарушением экспрессии HER2.
12. Применение по п.11, где заболевание, вызванное нарушением экспрессии HER2, представляет собой рак.
| US 2014286969 A1, 25.09.2014 | |||
| US 2011256135 A1, 20.10.2011 | |||
| US 2018200382 A1, 19.07.2018 | |||
| US 2016304621 A1, 20.10.2016 | |||
| Hongwen Lia et al., An anti-HER2 antibody conjugated with monomethyl auristatin E is highly effective in HER2-positive human gastric cancer / Cancer Biology & Therapy, 2016, pp.1-30 | |||
| US 2019030180 A1, 31.01.2019 | |||
| US 2018243435 |
Авторы
Даты
2023-05-02—Публикация
2020-03-25—Подача