Область техники, к которой относится изобретение
[0001]
Настоящее изобретение относится к специфической композиции, включающей конъюгат антитело-лекарственное средство, и к способу лиофилизации композиции.
Уровень техники
[0002]
Конъюгат антитело-лекарственное средство (ADC), содержащий лекарственное средство с цитотоксичностью, конъюгированное с антителом, антиген которого экспрессируется на поверхности раковых клеток и которое также связывается с антигеном, способным к клеточной интернализации, и поэтому может доставлять лекарственное средство селективно к раковым клеткам, как ожидается, может таким образом вызывать аккумуляцию лекарственного средства в раковых клетках и убивать раковые клетки (Непатентная литература 1-5).
[0003]
В качестве одного такого конъюгата антитело-лекарственное средство известен конъюгат антитело-лекарственное средство, включающий антитело и экзатекан, который является ингибитором топоизомеразы I, в качестве его компонентов (патентная литература 1-8 и непатентная литература 6, 7). Поскольку эти конъюгаты антитело-лекарственное средство проявляют особенно высокий противоопухолевый эффект и обладают безопасностью, они в настоящее время находятся на стадии клинических исследований.
[0004]
В качестве композиций таких конъюгатов антитело-лекарственное средство, известны композиция конъюгата антитело-лекарственное средство, включающая майнтанзиноид в качестве компонента (Патентная литература 9-12), композиция конъюгата антитело-лекарственное средство, включающая монометил ауристатин E в качестве компонента (Патентная литература 13-15), композиция конъюгата антитело-лекарственное средство, включающая SN-38 в качестве компонента (Патентная литература 16) и т.п.
Перечень цитируемых документов
Патентная литература
[0005]
Патентная литература 1: Международная публикация № WO 2014/057687
Патентная литература 2: Международная публикация № WO 2014/061277
Патентная литература 3: Международная публикация № WO 2015/098099
Патентная литература 4: Международная публикация № WO 2015/115091
Патентная литература 5: Международная публикация № WO 2015/146132
Патентная литература 6: Международная публикация № WO 2015/155976
Патентная литература 7: Международная публикация № WO 2015/155998
Патентная литература 8: Международная публикация № WO 2018/135501
Патентная литература 9: Международная публикация № WO 2004/004639
Патентная литература 10: Международная публикация № WO 2004/110498
Патентная литература 11: Международная публикация № WO 2007/019232
Патентная литература 12: Международная публикация № WO 2015/059147
Патентная литература 13: Международная публикация № WO 2010/081004
Патентная литература 14: Международная публикация № WO 2014/143765
Патентная литература 15: Международная публикация № WO 2015/157286
Патентная литература 16: Международная публикация № WO 2014/092804
Непатентная литература
[0006]
Непатентная литература 1: Ducry, L., et al., Bioconjugate Chem. (2010) 21, 5-13.
Непатентная литература 2: Alley, S. C, et al., Current Opinion в Chemical Biology (2010) 14, 529-537.
Непатентная литература 3: Damle N. K Expert Opin. Biol. Ther. (2004) 4, 1445-1452.
Непатентная литература 4: Senter P. D, et al., Nature Biotechnology (2012) 30, 631-637.
Непатентная литература 5: Howard A. et al, J Clin Oncol 29: 398-405.
Непатентная литература 6: Ogitani Y. et al., Clinical Cancer Research (2016) 22 (20), 5097-5108.
Непатентная литература 7: Ogitani Y. et al., Cancer Science (2016) 107, 1039-1046.
Сущность изобретения
Техническая задача
[0007]
В композициях антител образование агрегатов и образование продуктов разложения вызывает нежелательные с медицинской точки зрения эффекты, например, они становятся фактором иммуногенности или вызывают венозные расстройства у пациентов, принимающих такие препараты. Таким образом, при получении композиций антител необходимо подавлять образование агрегатов и образование продуктов разложения, и в связи с этим были исследованы различные фармацевтические композиции (например, в форме водной композиции для инъекций и лиофилизированной композиции для инъекций).
Однако, для получения композиций конъюгатов антитело-лекарственное средство требуются более сложные исследования, поскольку необходимо учитывать не только конкретные свойства антитела как части конъюгата, но также конкретные свойства части лекарственное средство-линкер.
Кроме того, при получении лиофилизированной композиции для инъекций из водного раствора, содержащего сахарозу или трегалозу, имеются проблемы, такие как (1) процесс первичной сушки долгий, и (2) имеется тенденция усыхания лиофилизированной лепешки.
Таким образом, основной целью настоящего изобретения является обеспечение, для специфического конъюгата антитело-лекарственное средство, фармацевтическй композиции (особенно в форме водной композиции для инъекций и лиофилизированной композиции для инъекций), в которой образование агрегатов и образование продуктов разложения подавляется, и эффективного способа лиофилизации водного раствора для получения лиофилизированной композиции для инъекций.
Решение задачи
[0008]
Для специфического конъюгата антитело-лекарственное средство авторы настоящего изобретения нашли фармацевтическую композицию (в частности, в форме водной композиции для инъекций и лиофилизированной композиции для инъекций), в которой образование агрегатов и образование продуктов разложения подавляется, а также нашли эффективный способ лиофилизации водного раствора для получения лиофилизированной композиции для инъекций.
[0009]
Более определенно, настоящее изобретение относится к следующему.
[1] Фармацевтическая композиция, включающая
(i) конъюгат антитело-лекарственное средство,
(ii) гистидиновый буфер,
(iii) сахарозу или трегалозу и
(iv) поверхностно-активное вещество,
где конъюгат антитело-лекарственное средство представляет собой конъюгат антитело-лекарственное средство, в котором фрагмент лекарственное средство-линкер, представленный следующей формулой:
[0010]
[Формула 1]
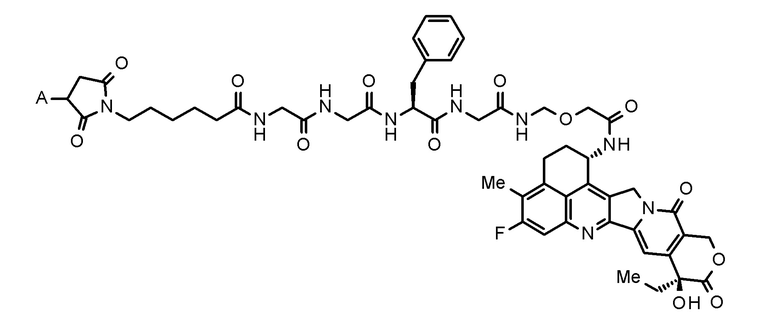
[0011]
где A представляет собой положение связывания с антителом,
конъюгирован с антителом через тиоэфирную связь.
[2] Фармацевтическая композиция в соответствии с [1], где поверхностно-активное вещество представляет собой полисорбат 80 или полисорбат 20.
[3] Фармацевтическая композиция в соответствии с [1] или [2], включающая,
(i) на 20 мг конъюгата антитело-лекарственное средство,
(ii) 3-80 ммоль гистидинового буфера,
(iii) 24-320 мг сахарозы или трегалозы и
(iv) 0,05-1,6 мг полисорбата 80 или полисорбата 20.
[4] Фармацевтическая композиция в соответствии с любым из [1] - [3], включающая,
(i) на 20 мг конъюгата антитело-лекарственное средство,
(ii) 10-40 ммоль гистидинового буфера,
(iii) 90 мг сахарозы или 100 мг гидрата трегалозы и
(iv) 0,2-0,4 мг полисорбата 80 или полисорбата 20.
[5] Фармацевтическая композиция в соответствии с [1] или [2], включающая
(i) конъюгат антитело-лекарственное средство,
(ii) гистидиновый буфер,
(iii) сахарозу и
(iv) полисорбат 80 или полисорбат 20.
[0012]
[6] Фармацевтическая композиция в соответствии с [1], [2] или [5], включающая,
(i) на 20 мг конъюгата антитело-лекарственное средство,
(ii) 3-80 ммоль гистидинового буфера,
(iii) 24-320 мг сахарозы и
(iv) 0,05-1,6 мг полисорбата 80 или полисорбата 20.
[7] Фармацевтическая композиция в соответствии с [1], [2], [5] или [6], включающая,
(i) на 20 мг конъюгата антитело-лекарственное средство,
(ii) 10-40 ммоль гистидинового буфера,
(iii) 90 мг сахарозы и
(iv) 0,2-0,4 мг полисорбата 80 или полисорбата 20.
[8] Фармацевтическая композиция в соответствии с любым из [1] - [7], включающая,
(i) на 20 мг конъюгата антитело-лекарственное средство,
(ii) 10 или 25 ммоль гистидинового буфера,
(iii) 90 мг сахарозы и
(iv) 0,2 или 0,3 мг полисорбата 80 или полисорбата 20.
[9] Фармацевтическая композиция в соответствии с любым из [1] - [8], где pH композиции, когда конъюгат антитело-лекарственное средство растворяют в воде при концентрации 20 мг/мл, составляет 4,0-7,0.
[10] Фармацевтическая композиция в соответствии с любым из [1] - [9], где среднее количество конъюгированных звеньев лекарственное средство-линкер на молекулу антитела в конъюгате антитело-лекарственное средство находится в пределах от 2 до 8.
[0013]
[11] Фармацевтическая композиция в соответствии с любым из [1] - [10], где антитело в конъюгате антитело-лекарственное средство представляет собой анти-HER2 антитело, анти-HER3 антитело, анти-TROP2 антитело, анти-B7-H3 антитело или анти-GPR20 антитело.
[12] Фармацевтическая композиция в соответствии с [11], где антитело в конъюгате антитело-лекарственное средство представляет собой анти-HER2 антитело.
[13] Фармацевтическая композиция в соответствии с [12], где анти-HER2 антитело представляет собой антитело, включающее тяжелую цепь, состоящую из аминокислотной последовательности, состоящей из аминокислотных остатков 1-449 SEQ ID NO: 1, и легкую цепь, состоящую из аминокислотной последовательности, состоящей из аминокислотных остатков 1-214 SEQ ID NO: 2, или антитело, включающее тяжелую цепь, состоящую из аминокислотной последовательности, представленной SEQ ID NO: 1, и легкую цепь, состоящую из аминокислотной последовательности, представленной SEQ ID NO: 2.
[14] Фармацевтическая композиция в соответствии с [12] или [13], где среднее количество конъюгированных звеньев лекарственное средство-линкер на молекулу антитела в конъюгате антитело-лекарственное средство находится в пределах от 7 до 8.
[15] Фармацевтическая композиция в соответствии с [12] - [14], включающая,
(i) на 20 мг конъюгата антитело-лекарственное средство,
(ii) 25 ммоль гистидинового буфера,
(iii) 90 мг сахарозы и
(iv) 0,3 мг полисорбата 80,
где pH композиции, когда конъюгат антитело-лекарственное средство растворяют в воде при концентрации 20 мг/мл, составляет 5,5.
[0014]
[16] Фармацевтическая композиция в соответствии с [12] - [14], включающая,
(i) на 20 мг конъюгата антитело-лекарственное средство,
(ii) 0,89 мг L-гистидина и 4,04 мг L-гистидина гидрохлорида гидрата,
(iii) 90 мг сахарозы и
(iv) 0,3 мг полисорбата 80.
[17] Фармацевтическая композиция в соответствии с любым из [12] - [14], включающая
(i) 100 мг конъюгата антитело-лекарственное средство,
(ii) 4,45 мг L-гистидина и 20,2 мг L-гистидина гидрохлорида гидрата,
(iii) 450 мг сахарозы и
(iv) 1,5 мг полисорбата 80.
[18] Фармацевтическая композиция в соответствии с [11], где антитело в конъюгате антитело-лекарственное средство представляет собой анти-HER3 антитело.
[19] Фармацевтическая композиция в соответствии с [18], где анти-HER3 антитело представляет собой антитело, включающее тяжелую цепь, состоящую из аминокислотной последовательности, представленной SEQ ID NO: 3, и легкую цепь, состоящую из аминокислотной последовательности, представленной SEQ ID NO: 4, или вариант антитела, в котором лизиновый остаток на карбокси-конце тяжелой цепи делетирован.
[20] Фармацевтическая композиция в соответствии с [18] или [19], где среднее количество конъюгированных звеньев лекарственное средство-линкер на молекулу антитела в конъюгате антитело-лекарственное средство находится в пределах от 7 до 8.
[0015]
[21] Фармацевтическая композиция в соответствии с любым из [18] - [20], включающая,
(i) на 20 мг конъюгата антитело-лекарственное средство,
(ii) 25 ммоль гистидинового буфера,
(iii) 90 мг сахарозы и
(iv) 0,3 мг полисорбата 20,
где pH композиции, когда конъюгат антитело-лекарственное средство растворяют в воде при концентрации 20 мг/мл, составляет 5,4.
[22] Фармацевтическая композиция в соответствии с любым из [18] - [20], включающая,
(i) на 20 мг конъюгата антитело-лекарственное средство,
(ii) 0,81 мг L-гистидина и 4,14 мг L-гистидина гидрохлорида гидрата,
(iii) 90 мг сахарозы и
(iv) 0,3 мг полисорбата 20.
[23] Фармацевтическая композиция в соответствии с любым из [18] - [20], включающая
(i) 100 мг конъюгата антитело-лекарственное средство,
(ii) 4,06 мг L-гистидина и 20,7 мг L-гистидина гидрохлорида гидрата,
(iii) 450 мг сахарозы и
(iv) 1,5 мг полисорбата 20.
[24] Фармацевтическая композиция в соответствии с [11], где антитело в конъюгате антитело-лекарственное средство представляет собой анти-TROP2 антитело.
[25] Фармацевтическая композиция в соответствии с [24], где анти-TROP2 антитело представляет собой антитело, включающее тяжелую цепь, состоящую из аминокислотной последовательности, состоящей из аминокислотных остатков 20-470 SEQ ID NO: 5, и легкую цепь, состоящую из аминокислотной последовательности, состоящей из аминокислотных остатков 21-234 SEQ ID NO: 6, или вариант антитела, в котором лизиновый остаток на карбокси-конце тяжелой цепи делетирован.
[0016]
[26] Фармацевтическая композиция в соответствии с [24] или [25], где среднее количество конъюгированных звеньев лекарственное средство-линкер на молекулу антитела в конъюгате антитело-лекарственное средство находится в пределах от 3 до 5.
[27] Фармацевтическая композиция в соответствии с любым из [24] - [26], включающая,
(i) на 20 мг конъюгата антитело-лекарственное средство,
(ii) 10 ммоль гистидинового буфера,
(iii) 90 мг сахарозы и
(iv) 0,2 или 0,3 мг полисорбата 80,
где pH композиции, когда конъюгат антитело-лекарственное средство растворяют в воде при концентрации 20 мг/мл, составляет 6,0.
[28] Фармацевтическая композиция в соответствии с любым из [24] - [26], включающая,
(i) на 20 мг конъюгата антитело-лекарственное средство,
(ii) 0,78 мг L-гистидина и 1,05 мг L-гистидина гидрохлорида гидрата,
(iii) 90 мг сахарозы и
(iv) 0,2 или 0,3 мг полисорбата 80.
[29] Фармацевтическая композиция в соответствии с любым из [24] - [26], включающая
(i) 100 мг конъюгата антитело-лекарственное средство,
(ii) 3,88 мг L-гистидина и 5,26 мг L-гистидина гидрохлорида гидрата,
(iii) 450 мг сахарозы и
(iv) 1,0 или 1,5 мг полисорбата 80.
[30] Фармацевтическая композиция в соответствии с [11], где антитело в конъюгате антитело-лекарственное средство представляет собой анти-B7-H3 антитело.
[0017]
[31] Фармацевтическая композиция в соответствии с [30], где анти-B7-H3 антитело представляет собой антитело, включающее тяжелую цепь, состоящую из аминокислотной последовательности, состоящей из аминокислотных остатков 20-471 SEQ ID NO: 7, и легкую цепь, состоящую из аминокислотной последовательности, состоящей из аминокислотных остатков 21-233 SEQ ID NO: 8, или вариант антитела, в котором лизиновый остаток на карбокси-конце тяжелой цепи делетирован.
[32] Фармацевтическая композиция в соответствии с [30] или [31], где среднее количество конъюгированных звеньев лекарственное средство-линкер на молекулу антитела в конъюгате антитело-лекарственное средство находится в пределах от 3 до 5.
[33] Фармацевтическая композиция в соответствии с любым из [30] - [32], включающая,
(i) на 20 мг конъюгата антитело-лекарственное средство,
(ii) 10 ммоль гистидинового буфера,
(iii) 90 мг сахарозы и
(iv) 0,2 или 0,3 мг полисорбата 20,
где pH композиции, когда конъюгат антитело-лекарственное средство растворяют в воде при концентрации 20 мг/мл, составляет 5,9.
[34] Фармацевтическая композиция в соответствии с любым из [30] - [32], включающая,
(i) на 20 мг конъюгата антитело-лекарственное средство,
(ii) 0,65 мг L-гистидина и 1,22 мг L-гистидина гидрохлорида гидрата,
(iii) 90 мг сахарозы и
(iv) 0,2 или 0,3 мг полисорбата 20.
[35] Фармацевтическая композиция в соответствии с любым из [30] - [32], включающая
(i) 100 мг конъюгата антитело-лекарственное средство,
(ii) 3,23 мг L-гистидина и 6,12 мг L-гистидина гидрохлорида гидрата,
(iii) 450 мг сахарозы и
(iv) 1,0 или 1,5 мг полисорбата 20.
[0018]
[36] Фармацевтическая композиция в соответствии с [11], где антитело в конъюгате антитело-лекарственное средство представляет собой анти-GPR20 антитело.
[37] Фармацевтическая композиция в соответствии с [36], где анти-GPR20 антитело представляет собой антитело, включающее тяжелую цепь, состоящую из аминокислотной последовательности, состоящей из аминокислотных остатков 20-472 SEQ ID NO: 9, и легкую цепь, состоящую из аминокислотной последовательности, состоящей из аминокислотных остатков 21-234 SEQ ID NO: 10, или вариант антитела, в котором лизиновый остаток на карбокси-конце тяжелой цепи делетирован.
[38] Фармацевтическая композиция в соответствии с [36] или [37], где среднее количество конъюгированных звеньев лекарственное средство-линкер на молекулу антитела в конъюгате антитело-лекарственное средство находится в пределах от 7 до 8.
[39] Фармацевтическая композиция в соответствии с любым из [36] - [38], включающая,
(i) на 20 мг конъюгата антитело-лекарственное средство,
(ii) 10 ммоль гистидинового буфера,
(iii) 90 мг сахарозы и
(iv) 0,3 мг полисорбата 80,
где pH композиции, когда конъюгат антитело-лекарственное средство растворяют в воде при концентрации 20 мг/мл, составляет 5,4.
[40] Фармацевтическая композиция в соответствии с любым из [36] - [38], включающая,
(i) на 20 мг конъюгата антитело-лекарственное средство,
(ii) 0,32 мг L-гистидина и 1,66 мг L-гистидина гидрохлорида гидрата,
(iii) 90 мг сахарозы и
(iv) 0,3 мг полисорбата 80.
[0019]
[41] Фармацевтическая композиция в соответствии с любым из [36] - [38], включающая
(i) 100 мг конъюгата антитело-лекарственное средство,
(ii) 1,62 мг L-гистидина и 8,29 мг L-гистидина гидрохлорида гидрата,
(iii) 450 мг сахарозы и
(iv) 1,5 мг полисорбата 80.
[42] Фармацевтическая композиция, включающая,
(i) на 20 мг конъюгата антитело-лекарственное средство,
(ii) 0,89 мг L-гистидина и 4,04 мг L-гистидина гидрохлорида гидрата,
(iii) 90 мг сахарозы и
(iv) 0,3 мг полисорбата 80,
где конъюгат антитело-лекарственное средство представляет собой конъюгат антитело-лекарственное средство, в котором фрагмент лекарственное средство-линкер, представленный следующей формулой:
[0020]
[Формула 2]
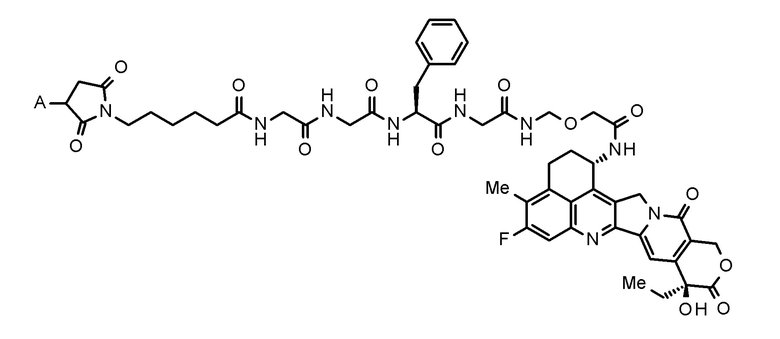
[0021]
где A представляет собой положение связывания с антителом,
конъюгирован с антителом через тиоэфирную связь.
[43] Фармацевтическая композиция в соответствии с [42], включающая
(i) 100 мг конъюгата антитело-лекарственное средство,
(ii) 4,45 мг L-гистидина и 20,2 мг L-гистидина гидрохлорида гидрата,
(iii) 450 мг сахарозы и
(iv) 1,5 мг полисорбата 80.
[44] Фармацевтическая композиция в соответствии с [42] или [43], где среднее количество конъюгированных звеньев лекарственное средство-линкер на молекулу антитела в конъюгате антитело-лекарственное средство находится в пределах от 7 до 8.
[45] Фармацевтическая композиция в соответствии с любым из [42] - [44], где антитело в конъюгате антитело-лекарственное средство представляет собой анти-HER2 антитело.
[0022]
[46] Фармацевтическая композиция в соответствии с [45], где анти-HER2 антитело представляет собой антитело, включающее тяжелую цепь, состоящую из аминокислотной последовательности, состоящей из аминокислотных остатков 1-449 SEQ ID NO: 1, и легкую цепь, состоящую из аминокислотной последовательности, состоящей из аминокислотных остатков 1-214 SEQ ID NO: 2.
[47] Фармацевтическая композиция в соответствии с [45], где анти-HER2 антитело представляет собой антитело, включающее тяжелую цепь, состоящую из аминокислотной последовательности, представленной SEQ ID NO: 1, и легкую цепь, состоящую из аминокислотной последовательности, представленной SEQ ID NO: 2.
[48] Фармацевтическая композиция, включающая,
(i) на 20 мг конъюгата антитело-лекарственное средство,
(ii) 0,81 мг L-гистидина и 4,14 мг L-гистидина гидрохлорида гидрата,
(iii) 90 мг сахарозы и
(iv) 0,3 мг полисорбата 20,
где конъюгат антитело-лекарственное средство представляет собой конъюгат антитело-лекарственное средство, в котором фрагмент лекарственное средство-линкер, представленный следующей формулой:
[0023]
[Формула 3]
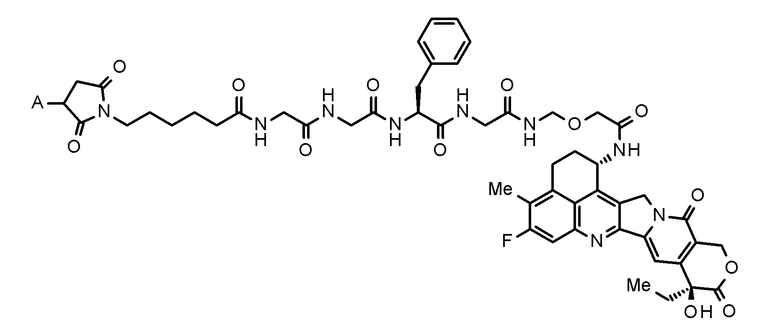
[0024]
где A представляет собой положение связывания с антителом,
конъюгирован с антителом через тиоэфирную связь.
[49] Фармацевтическая композиция в соответствии с [48], включающая
(i) 100 мг конъюгата антитело-лекарственное средство,
(ii) 4,06 мг L-гистидина и 20,7 мг L-гистидина гидрохлорида гидрата,
(iii) 450 мг сахарозы и
(iv) 1,5 мг полисорбата 20.
[50] Фармацевтическая композиция в соответствии с [48] или [49], где среднее количество конъюгированных звеньев лекарственное средство-линкер на молекулу антитела в конъюгате антитело-лекарственное средство находится в пределах от 7 до 8.
[0025]
[51] Фармацевтическая композиция в соответствии с любым из [48] - [50], где антитело в конъюгате антитело-лекарственное средство представляет собой анти-HER3 антитело.
[52] Фармацевтическая композиция в соответствии с [51], где анти-HER3 антитело представляет собой антитело, включающее тяжелую цепь, состоящую из аминокислотной последовательности, представленной SEQ ID NO: 3, и легкую цепь, состоящую из аминокислотной последовательности, представленной SEQ ID NO: 4.
[53] Фармацевтическая композиция в соответствии с [52], где анти-HER3 антитело не содержит лизиновый остаток на карбокси-конце тяжелой цепи.
[54] Фармацевтическая композиция, включающая,
(i) на 20 мг конъюгата антитело-лекарственное средство,
(ii) 0,78 мг L-гистидина и 1,05 мг L-гистидина гидрохлорида гидрата,
(iii) 90 мг сахарозы и
(iv) 0,2 или 0,3 мг полисорбата 80,
где конъюгат антитело-лекарственное средство представляет собой конъюгат антитело-лекарственное средство, в котором фрагмент лекарственное средство-линкер, представленный следующей формулой:
[0026]
[Формула 4]
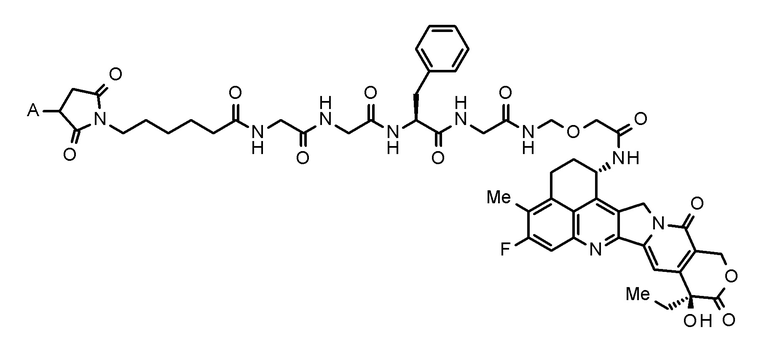
[0027]
где A представляет собой положение связывания с антителом,
конъюгирован с антителом через тиоэфирную связь.
[55] Фармацевтическая композиция в соответствии с [54], включающая
(i) 100 мг конъюгата антитело-лекарственное средство,
(ii) 3,88 мг L-гистидина и 5,26 мг L-гистидина гидрохлорида гидрата,
(iii) 450 мг сахарозы и
(iv) 1,0 или 1,5 мг полисорбата 80.
[56] Фармацевтическая композиция в соответствии с [54] или [55], где среднее количество конъюгированных звеньев лекарственное средство-линкер на молекулу антитела в конъюгате антитело-лекарственное средство находится в пределах от 3 до 5.
[57] Фармацевтическая композиция в соответствии с любым из [54] - [56], где антитело в конъюгате антитело-лекарственное средство представляет собой анти-TROP2 антитело.
[58] Фармацевтическая композиция в соответствии с [57], где анти-TROP2 антитело представляет собой антитело, включающее тяжелую цепь, состоящую из аминокислотной последовательности, состоящей из аминокислотных остатков 20-470 SEQ ID NO: 5, и легкую цепь, состоящую из аминокислотной последовательности, состоящей из аминокислотных остатков 21-234 SEQ ID NO: 6.
[59] Фармацевтическая композиция в соответствии с [58], где анти-TROP2 антитело не содержит лизиновый остаток на карбокси-конце тяжелой цепи.
[60] Фармацевтическая композиция, включающая,
(i) на 20 мг конъюгата антитело-лекарственное средство,
(ii) 0,65 мг L-гистидина и 1,22 мг L-гистидина гидрохлорида гидрата,
(iii) 90 мг сахарозы и
(iv) 0,2 или 0,3 мг полисорбата 20,
где конъюгат антитело-лекарственное средство представляет собой конъюгат антитело-лекарственное средство, в котором фрагмент лекарственное средство-линкер, представленный следующей формулой:
[0028]
[Формула 5]
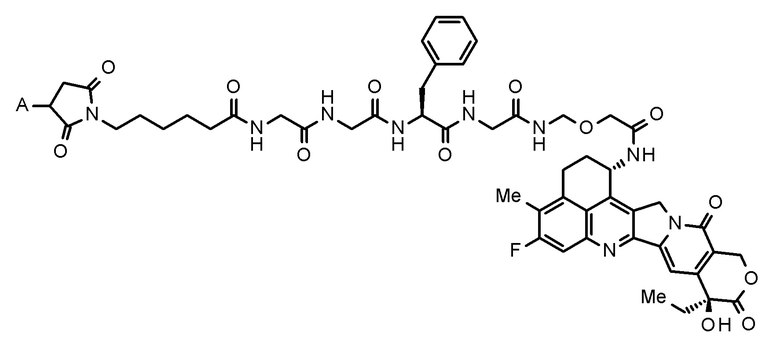
[0029]
где A представляет собой положение связывания с антителом,
конъюгирован с антителом через тиоэфирную связь.
[61] Фармацевтическая композиция в соответствии с [60], включающая
(i) 100 мг конъюгата антитело-лекарственное средство,
(ii) 3,23 мг L-гистидина и 6,12 мг L-гистидина гидрохлорида гидрата,
(iii) 450 мг сахарозы и
(iv) 1,0 или 1,5 мг полисорбата 20.
[62] Фармацевтическая композиция в соответствии с [60] или [61], где среднее количество конъюгированных звеньев лекарственное средство-линкер на молекулу антитела в конъюгате антитело-лекарственное средство находится в пределах от 3 до 5.
[63] Фармацевтическая композиция в соответствии с любым из [60] - [62], где антитело в конъюгате антитело-лекарственное средство представляет собой анти-B7-H3 антитело.
[64] Фармацевтическая композиция в соответствии с [63], где анти-B7-H3 антитело представляет собой антитело, включающее тяжелую цепь, состоящую из аминокислотной последовательности, состоящей из аминокислотных остатков 20-471 SEQ ID NO: 7, и легкую цепь, состоящую из аминокислотной последовательности, состоящей из аминокислотных остатков 21-233 SEQ ID NO: 8.
[65] Фармацевтическая композиция в соответствии с [64], где анти-B7-H3 антитело не содержит лизиновый остаток на карбокси-конце тяжелой цепи.
[66] Фармацевтическая композиция, включающая,
(i) на 20 мг конъюгата антитело-лекарственное средство,
(ii) 0,32 мг L-гистидина и 1,66 мг L-гистидина гидрохлорида гидрата,
(iii) 90 мг сахарозы и
(iv) 0,3 мг полисорбата 80
где, конъюгат антитело-лекарственное средство представляет собой конъюгат антитело-лекарственное средство, в котором фрагмент лекарственное средство-линкер, представленный следующей формулой:
[0030]
[Формула 6]
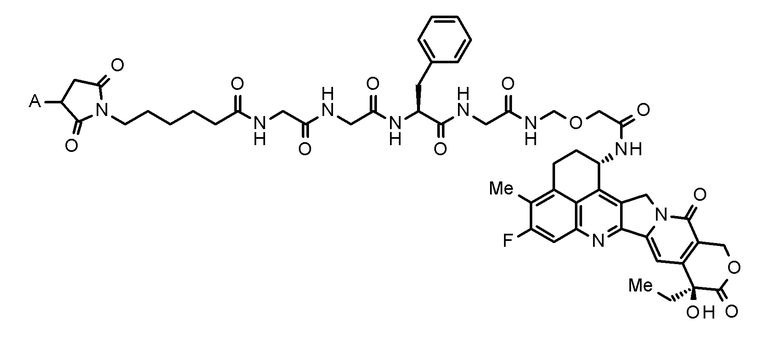
[0031]
где A представляет собой положение связывания с антителом,
конъюгирован с антителом через тиоэфирную связь.
[67] Фармацевтическая композиция в соответствии с [66], включающая
(i) 100 мг конъюгата антитело-лекарственное средство,
(ii) 1,62 мг L-гистидина и 8,29 мг L-гистидина гидрохлорида гидрата,
(iii) 450 мг сахарозы и
(iv) 1,5 мг полисорбата 80.
[68] Фармацевтическая композиция в соответствии с [66] или [67], где среднее количество конъюгированных звеньев лекарственное средство-линкер на молекулу антитела в конъюгате антитело-лекарственное средство находится в пределах от 7 до 8.
[69] Фармацевтическая композиция в соответствии с любым из [66] - [68], где антитело в конъюгате антитело-лекарственное средство представляет собой анти-GPR20 антитело.
[70] Фармацевтическая композиция в соответствии с [69], где анти-GPR20 антитело представляет собой антитело, включающее тяжелую цепь, состоящую из аминокислотной последовательности, состоящей из аминокислотных остатков 20-472 SEQ ID NO: 9, и легкую цепь, состоящую из аминокислотной последовательности, состоящей из аминокислотных остатков 21-234 SEQ ID NO: 10.
[0032]
[71] Фармацевтическая композиция в соответствии с [70], где анти-GPR20 антитело не содержит лизиновый остаток на карбокси-конце тяжелой цепи.
[72] Фармацевтическая композиция в соответствии с любым из [1] - [71], где композиция находится в форме инъекции.
[73] Фармацевтическая композиция в соответствии с [72], где композиция находится в форме водной композиции для инъекций.
[74] Фармацевтическая композиция в соответствии с [73], где концентрация конъюгата антитело-лекарственное средство составляет 20 мг/мл.
[75] Фармацевтическая композиция в соответствии с [73] или [74], где композиция является замороженной.
[0033]
[76] Фармацевтическая композиция в соответствии с [72], где композиция находится в форме лиофилизированной композиции для инъекций.
[77] Фармацевтическая композиция в соответствии с [76], где композицию хранят в темном флаконе.
[78] Фармацевтическая композиция в соответствии с любым из [1] - [77], где композиция предназначена для лечения рака.
[79] Способ получения фармацевтической композиции в соответствии с [76], включающий стадии
(1) получения водного раствора, включающего предварительно определенные количества
(i) конъюгата антитело-лекарственное средство,
(ii) гистидинового буфера,
(iii) сахарозы или трегалозы и
(iv) поверхностно-активного вещества,
(2) при необходимости, корректировку pH водного раствора, а затем
(3) лиофилизации водного раствора.
[80] Способ получения в соответствии с [79], где стадия лиофилизации водного раствора включает процесс отжига при температуре полки, которая близка к эвтектической точке водного раствора,
где близость к эвтектической точке означает диапазон от температуры, которая на 1,5°C ниже эвтектической точки, до температуры, которая на 1,5°C выше эвтектической точки.
[0034]
[81] Способ получения в соответствии с [80], где стадия лиофилизации водного раствора включает процесс отжига при температуре полки, которая равна эвтектической точке водного раствора.
[82] Способ получения в соответствии с [80] или [81], отличающийся тем, что время процесса первичной сушки уменьшено по сравнению с тем, когда осуществляют отжиг при температуре полки, которая на 5°C ниже эвтектической точки.
[83] Способ получения в соответствии с любым из [80] - [82], отличающийся тем, что получают лиофилизированную лепешку, имеющую меньшую усадку по сравнению с той, которую получают при осуществлении отжига при температуре полки, которая на 5°C ниже эвтектической точки.
[84] Способ получения в соответствии с [79], где стадия лиофилизации водного раствора включает способ осуществления отжига при температуре полки от -4 до -1°C.
[85] Способ получения в соответствии с [79], где стадия лиофилизации водного раствора включает способ осуществления отжиг при температуре полки от -4 до -2°C.
[0035]
[86] Способ получения в соответствии с [79], где стадия лиофилизации водного раствора включает способ осуществления отжига при температуре полки -2,5°C.
[87] Способ получения в соответствии с любым из [84] - [86], где стадия лиофилизации водного раствора также включает процесс первичной сушки при температуре полки от -5 до 5°C в условиях вакуума от 5 до 15 Па.
[88] Способ получения в соответствии с любым из [84] - [86], где стадия лиофилизации водного раствора также включает процесс первичной сушки при температуре полки 0°C в условиях вакуума 10 Па.
[89] Способ получения в соответствии с [87] или [88], где стадия лиофилизации водного раствора также включает процесс вторичной сушки при температуре полки от 40 до 50°C в условиях вакуума от 5 до 15 Па.
[90] Способ получения в соответствии с [87] или [88], где стадия лиофилизации водного раствора также включает процесс вторичной сушки при температуре полки 45°C в условиях вакуума 10 Па.
[0036]
[91] Набор, включающий фармацевтическую композицию в соответствии с [42] или [43] и воду для инъекций.
[92] Набор в соответствии с [91], где вода для инъекций хранится в ампуле.
[93] Способ получения лиофилизированной композиции для инъекций, включающий процесс отжига водного раствора, содержащего сахарозу или трегалозу, при температуре полки, которая близка к эвтектической точке водного раствора,
где близость к эвтектической точке означает диапазон от температуры, которая на 1,5°C ниже эвтектической точки, до температуры, которая на 1,5°C выше эвтектической точки.
[94] Способ получения лиофилизированной композиции для инъекций, включающий процесс отжига водного раствора, содержащего сахарозу или трегалозу, при температуре полки, которая равна эвтектической точке водного раствора.
Полезные эффекты изобретения
[0037]
Настоящее изобретение может обеспечить фармацевтическую композицию (особенно в форме водной композиции для инъекций и лиофилизированной композиции для инъекций), которая подавляет образование агрегатов и образование продуктов разложения, а также может обеспечить эффективный способ лиофилизации из водного раствора с получением лиофилизированной композиции для инъекций, в которую включен специфический конъюгат антитело-лекарственное средство.
Краткое описание чертежей
[0038]
[Фиг. 1] Фиг. 1 представляет диаграмму, показывающую аминокислотную последовательность тяжелой цепи анти-HER2 антитела (SEQ ID NO: 1).
[Фиг. 2] Фиг. 2 представляет диаграмму, показывающую аминокислотную последовательность легкой цепи анти-HER2 антитела (SEQ ID NO: 2).
[Фиг. 3] Фиг. 3 представляет диаграмму, связанную со скринингом эксципиентов. Ось абсцисс показывает период времени для каждой композиции, а ось ординат показывает содержание агрегатов.
[Фиг. 4] Фиг. 4 представляет диаграмму, связанную со скринингом буферов. Ось абсцисс показывает период времени для каждой композиции, а ось ординат показывает содержание агрегатов.
[Фиг. 5] Фиг. 5 представляет диаграмму, связанную со скринингом pH. Ось абсцисс показывает период времени для каждой композиции, а ось ординат показывает содержание агрегатов.
[Фиг. 6] Фиг. 6 представляет диаграмму, связанную со скринингом pH. Ось абсцисс показывает период времени для каждой композиции, а ось ординат показывает содержание NPI.
[Фиг. 7] Фиг. 7 представляет диаграмму, связанную со скринингом поверхностно-активных веществ. Ось абсцисс показывает период времени для каждой композиции, а ось ординат показывает относительное содержание нерастворимых микрочастиц меньше чем 10 мм. На чертежах "PS" означает полисорбат, "PS20" означает полисорбат 20, и "PS80" означает полисорбат 80.
[Фиг. 8] Фиг. 8 представляет диаграмму, связанную с исследованием флаконов. Ось абсцисс показывает количество светового облучения, а ось ординат показывает содержание агрегатов.
[Фиг. 9] Фиг. 9 представляет диаграмму, связанную с исследованием флаконов. Ось абсцисс показывает количество светового облучения, а ось ординат показывает содержание IoP.
[Фиг. 10] Фиг. 10 представляет контурную кривую температуры продукта водного раствора (1) при варьировании температуры полки и степени вакуумирования камеры в процессе первичной сушки.
[0039]
[Фиг. 11] Фиг. 11 представляет контурную кривую времени сушки водного раствора (1) при варьировании температуры полки и степени вакуумирования камеры в процессе первичной сушки.
[Фиг. 12] Фиг. 12 представляет диаграмму, показывающую температуру продукта (в процессе отжига) и формы лиофилизированных лепешей при осуществлении отжига с температурами полок от -7 до 0,5°C и лиофилизации.
[Фиг. 13] Фиг. 13 представляет диаграмму, показывающую термическую денатурацию конъюгата антитело-лекарственное средство (1), определенную с использованием капиллярного дифференциального сканирующего калориметра.
[Фиг. 14] Фиг. 14 представляет диаграмму, показывающую аминокислотную последовательность тяжелой цепи анти-HER3 антитела (SEQ ID NO: 3).
[Фиг. 15] Фиг. 15 представляет диаграмму, показывающую аминокислотную последовательность легкой цепи анти-HER3 антитела (SEQ ID NO: 4).
[Фиг. 16] Фиг. 16 представляет диаграмму, показывающую аминокислотную последовательность тяжелой цепи анти-TROP2 антитела (SEQ ID NO: 5).
[Фиг. 17] Фиг. 17 представляет диаграмму, показывающую аминокислотную последовательность легкой цепи анти-TROP2 антитела (SEQ ID NO: 6).
[Фиг. 18] Фиг. 18 представляет диаграмму, показывающую аминокислотную последовательность тяжелой цепи анти-B7-H3 антитела (SEQ ID NO: 7).
[Фиг. 19] Фиг. 19 представляет диаграмму, показывающую аминокислотную последовательность легкой цепи анти-B7-H3 антитела (SEQ ID NO: 8).
[Фиг. 20] Фиг. 20 представляет диаграмму, показывающую аминокислотную последовательность тяжелой цепи анти-GPR20 антитела (SEQ ID NO: 9).
[Фиг. 21] Фиг. 21 представляет диаграмму, показывающую аминокислотную последовательность легкой цепи анти-GPR20 антитела (SEQ ID NO: 10).
Описание вариантов осуществления
[0040]
Далее предпочтительные способы осуществления настоящего изобретения описаны со ссылкой на чертежи. Варианты осуществления, описанные ниже, представлены исключительно для иллюстрации одного примера типичного варианта осуществления настоящего изобретения и не предназначены для ограничения объема настоящего изобретения.
[0041]
[Конъюгат антитело-лекарственное средство]
Конъюгат антитело-лекарственное средство, используемый в настоящем изобретении, представляет собой конъюгат антитело-лекарственное средство, в котором фрагмент лекарственное средство-линкер, представленный следующей формулой:
[0042]
[Формула 7]
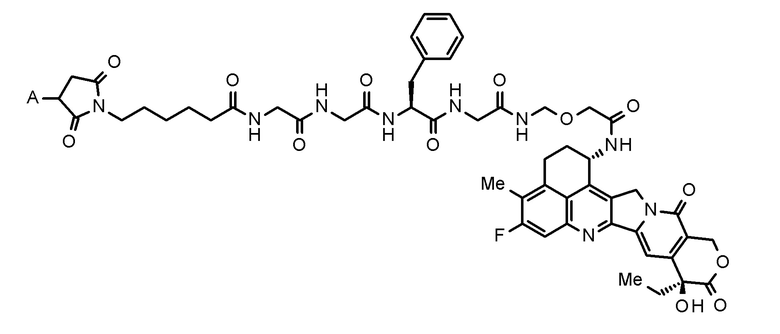
[0043]
где A представляет собой положение связывания с антителом,
конъюгирован с антителом через тиоэфирную связь.
[0044]
В настоящем изобретении частичная структура, состоящая из линкера и лекарственного средства, в конъюгате антитело-лекарственное средство указана как "лекарственное средство-линкер". Лекарственное средство-линкер часть связана с тиольной группой (иными словами, с атомом серы цистеинового остатка), образованной на участке межцепочечной дисульфидной связи (два участка между тяжелыми цепями и два участка между тяжелой цепью и легкой цепью) антитела.
[0045]
Лекарственное средство-линкер по настоящему изобретению включает экзатекан (IUPAC название: (1S,9S)-1-амино-9-этил-5-фтор-1,2,3,9,12,15-гексагидро-9-гидрокси-4-метил-10H,13H-бензо[de]пирано[3',4':6,7]индолизино[1,2-b]хинолин 13-дион, (также имеющий химическое название: (1S,9S)-1-амино-9-этил-5-фтор-2,3-дигидро-9-гидрокси-4-метил-1H,12H-бензо[de]пирано[3',4':6,7]индолизино[1,2-b]хинолин-10,13(9H,15H)-дион)), который является ингибитором топоизомеразы I, в качестве компонента. Экзатекан представляет собой производное касптотецина, обладающее противоопухолевым эффектом, представленное следующей формулой:
[0046]
[Формула 8]
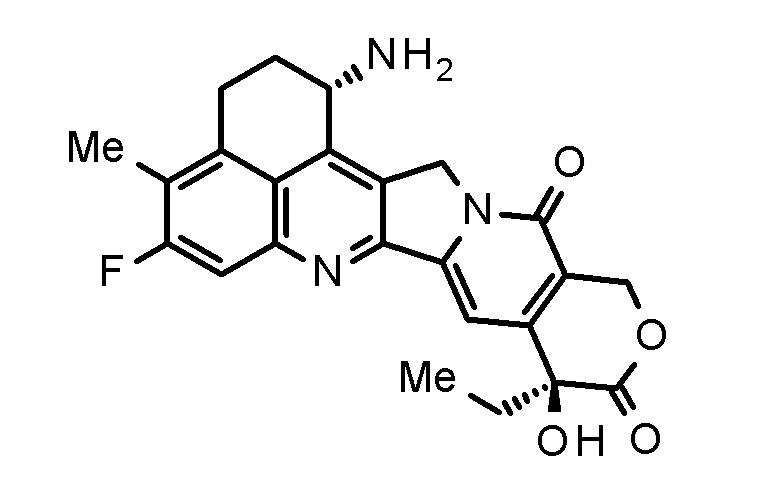
[0048]
Конъюгат антитело-лекарственное средство, используемый в настоящем изобретении, также может быть представлен следующей формулой:
[0049]
[Формула 9]
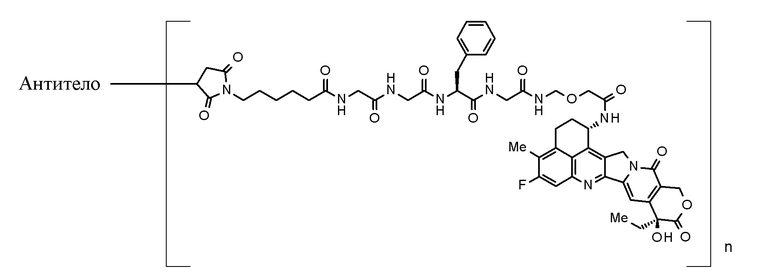
[0050]
где лекарственное средство-линкер часть конъюгирована с антителом через тиоэфирную связь. Значение n представляет собой такое значение, которое называют средним количеством конъюгированных молекул лекарственного средства (DAR; отношение лекарственного средства-к-антителу), и означает среднее количество звеньев лекарственное средство-линкер, конъюгированных в расчете на молекулу антитела.
После того как он мигрирует в раковые клетки, конъюгат антитело-лекарственное средство, используемый в настоящем изобретении, высвобождает соединение, представленное следующей формулой:
[0051]
[Формула 10]
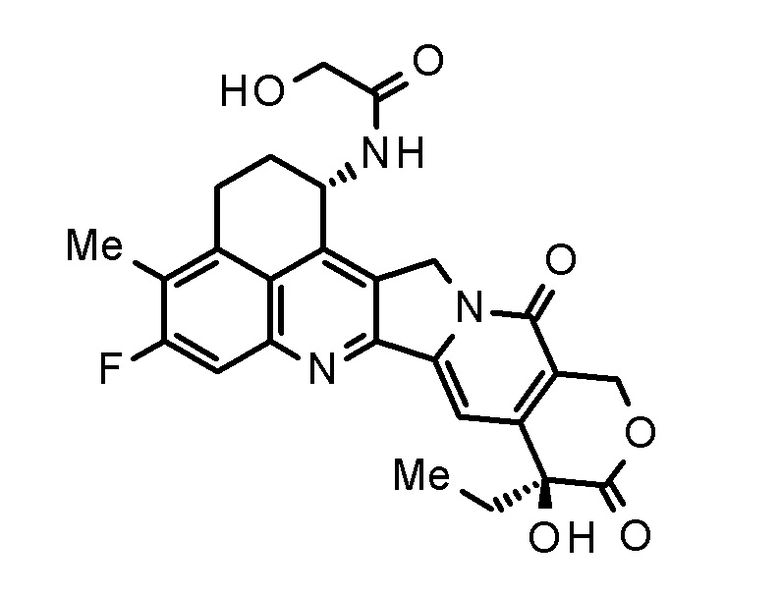
[0052]
имеет ингибирующий топоизомеразу I эффект (далее указан как "соединение (1)").
Было сделано заключение, что соединение (1) образуется путем разложения аминальной структуры соединения, представленного следующей формулой:
[0053]
[Формула 11]
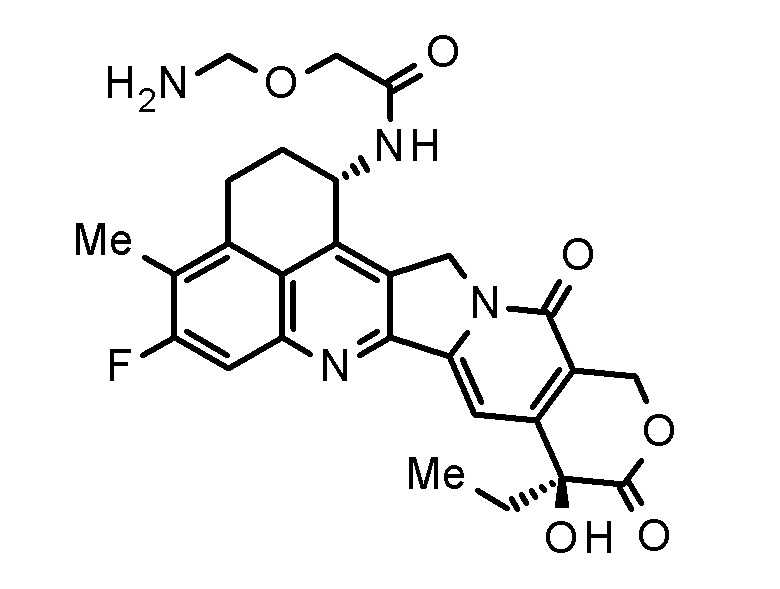
[0054]
которое, как считают, образуется путем расщепления линкерной части конъюгата антитело-лекарственное средство, используемого в настоящем изобретении.
[0055]
Известно, что конъюгат антитело-лекарственное средство, используемый в настоящем изобретении, обладает неспецифическим эффектом (Ogitani Y. et al., Cancer Science (2016) 107, 1039-1046).
Неспецифический эффект проявляется через процесс, в котором конъюгат антитело-лекарственное средство, используемый в настоящем изобретении, интернализуется в раковых клетках, экспрессирующих мишень, и высвобожденное соединение (1) затем проявляет противоопухолевый эффект также на раковых клетках, которые присутствуют в окружении и не экспрессируют мишень.
[0056]
[Антитело в конъюгате антитело-лекарственное средство]
Антитело в конъюгате антитело-лекарственное средство, используемом в настоящем изобретении, может происходить из любого вида, и предпочтительно представляет собой антитело, человека, крысы, мыши или кролика. В случаях, когда антитело происходит из вида отличного от человека, оно предпочтительно химеризировано или гуманизировано хорошо известным способом. Антитело по настоящему изобретению может быть поликлональным антителом или моноклональным антителом, и предпочтительно представляет собой моноклональное антитело.
[0057]
Антитело в конъюгате антитело-лекарственное средство в настоящем изобретении представляет собой антитело, предпочтительно имеющее такое свойство, как способность к нацеливания на раковые клетки, и предпочтительно представляет собой антитело, обладающее, например, свойством распознавания раковой клетки, свойством связывания с раковой клеткой, свойством интернализации в раковой клетке и/или убивающей раковую клетку активностью.
[0058]
Связывающую активность антитела против раковых клеток можно подтвердить с использованием проточной цитометрии. Интернализацию антитела в раковых клетках можно подтвердить с использованием (1) анализа визуализации антитела, включенного в клетки, при помощи флуоресцентного микроскопа с использованием вторичного антитела (флуоресцентно меченного), связывающегося с терапевтическим антителом (Cell Death and Differentiation (2008) 15, 751-761), (2) анализа, измеряющего интенсивность флуоресценции, включенной в клетки, с использованием вторичного антитела (флуоресцентно меченного), связывающегося с терапевтическим антителом (Molecular Biology of the Cell, Vol. 15, 5268-5282, December 2004), или (3) Mab-ZAP анализа с использованием иммунотоксина, связывающегося с терапевтическим антителом, где токсин высвобождается при инкорпорировании в клетки для ингибирования клеточного роста (Bio Techniques 28: 162-165, January 2000). В качестве иммунотоксина можно использовать рекомбинантный комплексный белок каталитической области дифтерийного токсина и белок G.
[0059]
Противоопухолевую активность антитела можно подтвердить in vitro путем определения ингибиторной активности против клеточного роста. Например, раковую клеточную линию, сверхэкспрессирующю белок-мишень для антитела, культивируют и антитело добавляют в систему культивирования при различных концентрациях для определения ингибиторной активности против фокусообразования, колониеобразования и роста сфероидов. Противоопухолевую активность можно подтвердить in vivo, например, путем введения антитела бестимусной мыши с трансплантированной раковой клеточной линией, высокоэкспрессирующей белок-мишень, и определения изменения в раковой клетке.
[0060]
Поскольку соединение, конъюгированное в конъюгате антитело-лекарственное средство, проявляет противоопухолевый эффект, предпочтительно, но не принципиально, чтобы антитело само обладало противоопухолевым эффектом. Для специфичности противоопухолевого соединения и селективного проявления цитотоксической активности против раковых клеток важно, а также предпочтительно, чтобы антитело обладало свойством интернализации для мигрирования в раковые клетки.
Антитело в конъюгате антитело-лекарственное средство, используемом в настоящем изобретении, может быть получено с использованием процедуры, известной из уровня техники. Например, антитело по настоящему изобретению можно получить с использованием способа, обычно осуществляемого в данной области техники, который включает иммунизацию животных антигенным полипептидом и сбор и очистку антител, продуцируемых in vivo. Происхождение антигена не ограничено человеком, и животных можно иммунизировать антигеном, происходящим из отличного от человека животного, такого как мышь, крыса и т.п. В этом случае, можно протестировать перекрестную реактивность антител, связывающихся с полученным гетерологичным антигеном с человеческими антигенами, для скрининга на антитело, применимого для заболевания человека.
[0061]
Альтернативно, антитело-продуцирующие клетки, которые продуцируют антитела против антигена, сливают с миеломными клетками в соответствии со способом, известным из уровня техники (например, Kohler and Milstein, Nature (1975) 256, p. 495-497; и Kennet, R. ed., Monoclonal Antibodies, p. 365-367, Plenum Press, N.Y. (1980)), для получения гибридом, из которых, в свою очередь, можно получить моноклональные антитела.
[0062]
Антиген можно получить методами генетической инженерии для получения клеток-хозяев, продуцирующих ген, кодирующий антигенный белок. В частности, получают векторы, которые обеспечивают возможность экспрессии антигена, и переносят в клетки-хозяева так, чтобы этот ген экспрессировался. Антиген, экспрессированный таким образом, можно очистить. Антитело также можно получить способом иммунизации животных с использованием описанных выше генноинженерных антиген-экспрессирующих клеток или клеточной линии, экспрессирующей антиген.
[0063]
Антитело в конъюгате антитело-лекарственное средство, используемом в настоящем изобретении, предпочтительно представляет собой рекомбинантное антитело, полученное путем искусственной модификации в целях снижения гетерологичной антигенности для человека, такое как химерное антитело или гуманизированное антитело, или предпочтительно представляет собой антитело, содержащее только последовательность гена антитела человеческого происхождения, т.е. человеческого антитела. Эти антитела можно получить с использованием известного способа.
[0064]
В качестве примера химерного антитела можно привести антитело, в котором вариабельные и константные области антитела происходят из разных видов, например, химерное антитело, в котором вариабельная область антитела мышиного или крысиного происхождения связана с константной областью антитела человеческого происхождения (Proc. Natl. Acad. Sci. U.S.A., 81, 6851-6855,(1984)).
[0065]
В качестве примера гуманизированного антитела можно привести антитело, полученное путем встраивания только определяющей комплементарность области (CDR) гетерологичного антитела в антитело человеческого происхождения (Nature (1986) 321, pp. 522-525), и антитело, полученное путем прививки части аминокислотных остатков каркасной области гетерологичного антитела, а также последовательности CDR гетерологичного антитела к человеческому антителу способом CDR-прививки (WO 90/07861), и антитело, гуманизированное с использованием стратегии мутагенеза с конверсией генов (Патент США № 5821337).
[0066]
В качестве примера человеческого антитела можно привести антитело, полученное с использованием продуцирующей человеческое антитело мыши, имеющей фрагмент человеческой хромосомы, включающий гены тяжелой цепи и легкой цепи человеческого антитела (см., например, Tomizuka, K. et al., Nature Genetics (1997) 16, p.133-143; Kuroiwa, Y. et. al., Nucl. Acids Res. (1998) 26, p.3447-3448; Yoshida, H. et. al., Animal Cell Technology: Basic and Applied Aspects vol.10, p.69-73 (Kitagawa, Y., Matsuda, T. and Iijima, S. eds.), Kluwer Academic Publishers, 1999; Tomizuka, K. et. al., Proc. Natl. Acad. Sci. USA (2000) 97, p.722-727). Альтернативно, в качестве примера можно привести антитело, полученное путем скрининга из библиотеки человеческих антител методом фагового дисплея (см., например, Wormstone, I. M. et al, Investigative Ophthalmology & Visual Science (2002) 43(7), p. 2301-2308; Carmen, S. et al., Briefings in Functional Genomics and Proteomics (2002), 1(2), p.189-203;. Siriwardena, D. et al, Ophthalmology (2002) 109(3), p.427-431).
[0067]
В настоящее изобретение также включены модифицированные варианты антитела в конъюгате антитело-лекарственное средство, используемом в настоящем изобретении. Модифицированный вариант относится к варианту, получаемому, когда антитело по настоящему изобретению подвергают химической или биологической модификации. Примеры химически модифицированного варианта включают варианты, включающие связывание химического фрагмента с аминокислотным скелетом, варианты, включающие связывание химического фрагмента с N-связанной или O-связанной углеводной цепью и т.д. Примеры биологически модифицированного варианта включают варианты, полученные посттрансляционной модификацией (такие как N-связанное или O-связанное гликозилирование, N- или C-концевой процессинг, дезамидирование, изомеризация аспарагиновой кислоты или окисление метионина), и варианты, в которых метиониновый остаток был добавлен к N-концу путем экспрессии в прокариотической клетке-хозяине. Кроме того, в понятие “модифицированный вариант” также включено антитело, меченное так, чтобы обеспечить возможность детекции или выделения антитела или антигена в соответствии с настоящим изобретением, например, фермент-меченное антитело, флуоресцентно-меченное антитело и аффинно-меченное антитело. Такой модифицированный вариант антитела в соответствии с настоящим изобретением полезен для улучшения стабильности и удержания в крови антитела, снижения его антигенности, детекции или выделения антитела или антигена и т.д.
[0068]
Кроме того, регулируя модификацию гликана, который связан с антителом по настоящему изобретению (гликозилирование, дефукозилирование и т. Д.), можно усилить антитело-зависимую клеточную цитотоксическую активность. Методы регулирования модификации гликана антител известны из WO 99/54342, WO 00/61739, WO 02/31140 и т.д. Однако методы этим не ограничиваются. Антитело по настоящему изобретению также включает антитела, в которых регулируется модификация гликана
[0069]
Известно, что лизиновый остаток на карбокси-конце тяжелой цепи антитела, продуцируемого в культивируемой клетке млекопитающего, делетирован (Journal of Chromatography A, 705: 129-134 (1995)), и также известно, что два аминокислотных остатка (глицин и лизин) на карбокси-конце тяжелой цепи антитела, продуцируемого в культивируемой клетке млекопитающего, делетированы, и пролиновый остаток, новопоявившийся на карбокси-конце, амидирован (Analytical Biochemistry, 360: 75-83 (2007)). Однако такая делеция и модификация последовательности тяжелой цепи не влияет на аффинность связывания с антигеном и эффекторную функцию (активация комплемента, антитело-зависимая клеточная цитотоксичность и т.д.) антитела. Поэтому антитело в соответствии с настоящим изобретением также включает антитела, подвергаемые такой модификации, и функциональные фрагменты антител, а также включает делеционные варианты, в которых одна или две аминокислоты были делетированы на карбокси-конце тяжелой цепи, варианты, полученные путем амидирования делеционных вариантов (например, тяжелая цепь, в которой карбокси-концевой пролиновый остаток амидирован), и т.п. Тип делеционного варианта, включающий делецию на карбокси-конце тяжелой цепи антитела в соответствии с настоящим изобретением, не ограничивается описанными выше вариантами при условии, что аффинность связывания с антигеном и эффекторная функция сохраняются. Две тяжелые цепи, образующие антитело в соответствии с настоящим изобретением, могут быть одного типа, выбранного из группы, состоящей из полноразмерной тяжелой цепи и описанного выше делеционного варианта, или могут представлять собой комбинацию таких двух типов. Количество каждого делеционного варианта может зависеть от типа культивируемых клеток млекопитающего, которые продуцируют антитело в соответствии с настоящим изобретением, и условий культивирования; однако предпочтительным примером является антитело, в котором один аминокислотный остаток на карбокси-конце делетирован в обеих из двух тяжелых цепей в антителе в соответствии с настоящим изобретением.
[0070]
В качестве изотипов антитела в соответствии с настоящим изобретением, можно указать, например, IgG (IgG1, IgG2, IgG3, IgG4), и предпочтительными являются IgG1 или IgG2.
[0071]
Примеры антител в конъюгате антитело-лекарственное средство, используемом в настоящем изобретении, могут включать, но не ограничиваются этим, анти-HER2 антитело, анти-HER3 антитело, анти-TROP2 антитело, анти-B7-H3 антитело, анти-CD3 антитело, анти-CD30 антитело, анти-CD33 антитело, анти-CD37 антитело, анти-CD56 антитело, анти-CD98 антитело, анти-DR5 антитело, анти-EGFR антитело, анти-EPHA2 антитело, анти-FGFR2 антитело, анти-FGFR4 антитело, анти-FOLR1 антитело, анти-VEGF антитело и анти-GPR20 антитело, и в качестве предпочтительных можно указать анти-HER2 антитело, анти-HER3 антитело, анти-TROP2 антитело, анти-B7-H3 антитело и анти-GPR20.
[0072]
В настоящем изобретении термин "анти-HER2 антитело" относится к антителу, которое специфически связывается с HER2 (человеческий рецептор эпидермального фактора роста типа 2; ErbB-2), и предпочтительно обладает активностью интернализации в HER2-экспрессирующих клетках путем связывания с HER2.
[0073]
Примеры анти-HER2 антитела включают трастузумаб (Патент США № 5821337) и пертузумаб (Международная публикация № WO 01/00245), и предпочтительным примером является трастузумаб.
[0074]
В настоящем изобретении термин "трастузумаб" означает гуманизированное анти-HER2 моноклональное антитело, включающее тяжелую цепь, состоящую из аминокислотной последовательности, состоящей из аминокислотных остатков 1-449 SEQ ID NO: 1 (Фиг. 1), и легкую цепь, состоящую из аминокислотной последовательности, состоящей из аминокислотных остатков 1-214 SEQ ID NO: 2 (Фиг. 2).
[0075]
В настоящем изобретении термин "анти-HER3 антитело" относится к антителу, которое специфически связывается с HER3 (человеческий рецептор эпидермального фактора роста типа 3; ErbB-3), и предпочтительно обладает активностью интернализации в HER3-экспрессирующих клетках путем связывания с HER3 на поверхности HER3-экспрессирующих клеток.
[0076]
Примеры анти-HER3 антитела включают Патритумаб (U3-1287), U1-59 (Международная публикация № WO 2007/077028), MM-121 (серибантумаб), анти-ERBB3 антитело, описанное в Международной публикации № WO 2008/100624, RG-7116 (Лумретузумаб) и LJM-716 (Элгемтумаб) и Патритумаб, и предпочтительным примером является U1-59.
[0077]
В настоящем изобретении термин "анти-TROP2 антитело" относится к антителу, которое специфически связывается с TROP2 (TACSTD2: опухоль-ассоциированный кальциевый сигнальный трансдуктор 2; EGP-1), и предпочтительно обладает активностью интернализации в TROP2-экспрессирующих клетках путем связывания с TROP2.
[0078]
Примеры анти-TROP2 антитела включают hTINA1-H1L1 (Международная публикация № WO 2015/098099).
[0079]
В настоящем изобретении термин "анти-B7-H3 антитело" относится к антителу, которое специфически связывается с B7-H3 (B-клеточный антиген #7 гомолог 3; PD-L3; CD276), и предпочтительно обладает активностью интернализации в B7-H3-экспрессирующих клетках путем связывания с B7-H3.
[0080]
Примеры анти-B7-H3 антитела включают M30-H1-L4 (Международная публикация № WO 2014/057687).
[0081]
В настоящем изобретении термин "анти-GPR20 антитело" относится к антителу, которое специфически связывается с GPR20 (сопряженный с G-белком рецептор 20), и предпочтительно обладает активностью интернализации в GPR20-экспрессирующих клетках путем связывания с GPR20.
Примеры анти-GPR20 антитела включают h046-H4e/L7 (Международная публикация № WO 2018/135501).
[0082]
[Промежуточное соединение лекарственное средство-линкер для применения в получении конъюгата антитело-лекарственное средство]
Промежуточное соединение лекарственное средство-линкер для применения в получении конъюгата антитело-лекарственное средство в соответствии с настоящим изобретением представлено следующей формулой.
[0083]
[Формула 12]
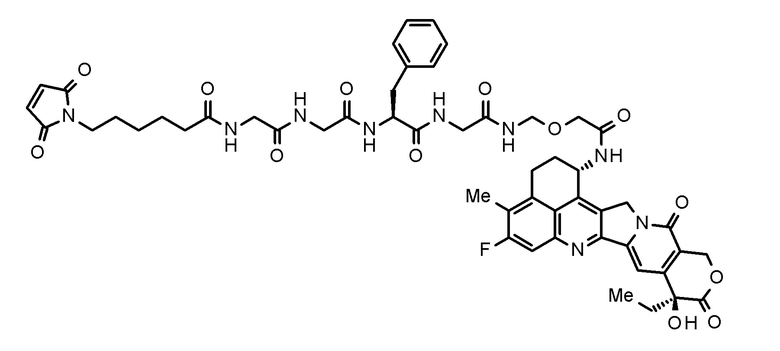
[0084]
Промежуточное соединение лекарственное средство-линкер можно получить руководствуясь описанием, представленным в Международной публикации № WO 2014/057687, Международной публикации № WO 2015/098099, Международной публикации № WO 2015/115091, Международной публикации № WO 2015/155998 и т.д.
[0085]
[Конъюгация между антителом и промежуточным соединением лекарственное средство-линкер]
Конъюгат антитело-лекарственное средство, используемый в настоящем изобретении можно получить путем взаимодействия описанного выше промежуточного соединения лекарственное средство-линкер с антителом, содержащим тиольную группу (альтернативно указана как сульфгидрильная группа).
[0086]
Антитело, содержащее сульфгидрильную группу, можно получить способом, хорошо известным из уровня техники (Hermanson, G. T, Bioconjugate Techniques, pp.56-136, pp.456-493, Academic Press(1996)). Например, с использованием 0,3-3 молярных эквивалентов восстановителя, такого как трис(2-карбоксиэтил)фосфин гидрохлорид (TCEP), в расчете на межцепочечный дисульфид в антителе и взаимодействия с антителом в буферном растворе, содержащем хелатирующий агент, такой как этилендиаминтетрауксусная кислота (EDTA), можно получить антитело, содержащее сульфгидрильную группу с частично или полностью восстановленными межцепочечными дисульфидами в антителе.
[0087]
Кроме того, с использованием 2-20 молярных эквивалентов промежуточного соединения лекарственное средство-линкер в расчете на антитело, содержащее сульфгидрильную группу, можно получить конъюгат антитело-лекарственное средство, в котором 2-8 молекул лекарственного средства конъюгированы в расчете на молекулу антитела.
[0088]
Среднее количество конъюгированных молекул лекарственного средства на молекулу антитела в полученном конъюгате антитело-лекарственное средство можно определить, например, методом расчета, основанном на измерении УФ-поглощения для конъюгата антитело-лекарственное средство и его предшественника перед конъюгацией при двух длинах волн 280 нм и 370 нм (УФ метод), или методом расчета, основанном на количественном определении, используя измерения методом ВЭЖХ, для фрагментов, полученных обработкой конъюгата антитело-лекарственное средство восстановителем (метод ВЭЖХ).
[0089]
Реакцию конъюгации между антителом и промежуточным соединением лекарственное средство-линкер и расчет среднего количества конъюгированных молекул лекарственного средства на молекулу антитела конъюгата антитело-лекарственное средство можно осуществить руководствуясь описанием, представленным в Международной публикации № WO 2014/057687, Международной публикации № WO 2015/098099, Международной публикации № WO 2015/115091, Международной публикации № WO 2015/155998, Международной публикации № WO 2018/135501 и т.д.
[0090]
В настоящем изобретении термин "анти-HER2 конъюгат антитело-лекарственное средство" относится к конъюгату антитело-лекарственное средство, в котором антитело в конъюгате антитело-лекарственное средство представляет собой анти-HER2 антитело.
[0091]
Анти-HER2 антитело предпочтительно представляет собой антитело, включающее тяжелую цепь, состоящую из аминокислотной последовательности, состоящей из аминокислотных остатков 1-449 SEQ ID NO: 1, и легкую цепь, состоящую из аминокислотной последовательности, состоящей из аминокислотных остатков 1-214 SEQ ID NO: 2, или антитело, включающее тяжелую цепь, состоящую из аминокислотной последовательности, представленной SEQ ID NO: 1, и легкую цепь, состоящую из аминокислотной последовательности, представленной SEQ ID NO: 2.
[0092]
Среднее количество конъюгированных звеньев лекарственное средство-линкер на молекулу антитела в анти-HER2 конъюгате антитело-лекарственное средство, используемом в настоящем изобретении, предпочтительно составляет 2-8, более предпочтительно 3-8, еще более предпочтительно 7-8, еще более предпочтительно 7,5-8 и еще более предпочтительно около 8.
[0093]
Конъюгат анти-HER2 антитело-лекарственное средство, используемый в настоящем изобретении, можно получить руководствуясь описанием, представленным в Международной публикации № WO 2015/115091 и т.д.
[0094]
В настоящем изобретении термин "конъюгат анти-HER3 антитело-лекарственное средство" относится к конъюгату антитело-лекарственное средство, в котором антитело в конъюгате антитело-лекарственное средство представляет собой анти-HER3 антитело.
[0095]
Анти-HER3 антитело предпочтительно представляет собой антитело, включающее тяжелую цепь, состоящую из аминокислотной последовательности, представленной SEQ ID NO: 3, и легкую цепь, состоящую из аминокислотной последовательности, представленной SEQ ID NO: 4, или вариант антитела, в котором лизиновый остаток на карбокси-конце тяжелой цепи делетирован.
[0096]
Среднее количество конъюгированных звеньев лекарственное средство-линкер на молекулу антитела в конъюгате анти-HER3 антитело-лекарственное средство, используемом в настоящем изобретении, предпочтительно составляет 2-8, более предпочтительно 3-8, еще более предпочтительно 7-8, еще более предпочтительно 7,5-8 и еще более предпочтительно около 8.
[0097]
Конъюгат анти-HER3 антитело-лекарственное средство, используемый в настоящем изобретении, можно получить руководствуясь описанием, представленным в Международной публикации № WO 2015/155998 и т.д.
[0098]
В настоящем изобретении термин "конъюгат анти-TROP2 антитело-лекарственное средство" относится к конъюгату антитело-лекарственное средство, в котором антитело в конъюгате антитело-лекарственное средство представляет собой анти-TROP2 антитело.
[0099]
Анти-TROP2 антитело предпочтительно представляет собой антитело, включающее тяжелую цепь, состоящую из аминокислотной последовательности, состоящей из аминокислотных остатков 20-470 SEQ ID NO: 5, и легкую цепь, состоящую из аминокислотной последовательности, состоящей из аминокислотных остатков 21-234 SEQ ID NO: 6, или вариант антитела, в котором лизиновый остаток на карбокси-конце тяжелой цепи делетирован.
[0100]
Среднее количество конъюгированных звеньев лекарственное средство-линкер на молекулу антитела в конъюгате анти-TROP2 антитело-лекарственное средство, используемом в настоящем изобретении, предпочтительно составляет 2-8, более предпочтительно 3-5, еще более предпочтительно 3,5-4,5 и еще более предпочтительно около 4.
[0101]
Конъюгат анти-TROP2 антитело-лекарственное средство, используемый в настоящем изобретении, можно получить руководствуясь описанием, представленным в Международной публикации № WO 2015/098099 и т.д.
[0102]
В настоящем изобретении термин "конъюгат анти-B7-H3 антитело-лекарственное средство" относится к конъюгату антитело-лекарственное средство, в котором антитело в конъюгате антитело-лекарственное средство представляет собой анти-B7-H3 антитело.
[0103]
Анти-B7-H3 антитело предпочтительно представляет собой антитело, включающее тяжелую цепь, состоящую из аминокислотной последовательности, состоящей из аминокислотных остатков 20-471 SEQ ID NO: 7, и легкую цепь, состоящую из аминокислотной последовательности, состоящей из аминокислотных остатков 21-233 SEQ ID NO: 8, или вариант антитела, в котором лизиновый остаток на карбокси-конце тяжелой цепи делетирован.
[0104]
Среднее количество конъюгированных звеньев лекарственное средство-линкер на молекулу антитела в конъюгате анти-B7-H3 антитело-лекарственное средство, используемом в настоящем изобретении, предпочтительно составляет 2-8, более предпочтительно 3-5, еще более предпочтительно 3,5-4,5 и еще более предпочтительно около 4.
[0105]
Конъюгат анти-B7-H3 антитело-лекарственное средство, используемый в настоящем изобретении, можно получить руководствуясь описанием, представленным в Международной публикации № WO 2014/057687 и т.д.
[0106]
В настоящем изобретении термин "конъюгат анти-GPR20 антитело-лекарственное средство" относится к конъюгату антитело-лекарственное средство, в котором антитело в конъюгате антитело-лекарственное средство представляет собой анти-GPR20 антитело.
[0107]
Анти-GPR20 антитело предпочтительно представляет собой антитело, включающее тяжелую цепь, состоящую из аминокислотной последовательности, состоящей из аминокислотных остатков 20-472 SEQ ID NO: 9, и легкую цепь, состоящую из аминокислотной последовательности, состоящей из аминокислотных остатков 21-234 SEQ ID NO: 10, или вариант антитела, в котором лизиновый остаток на карбокси-конце тяжелой цепи делетирован.
[0108]
Среднее количество конъюгированных звеньев лекарственное средство-линкер на молекулу антитела в е анти-GPR20 антитело-лекарственное средство, используемом в настоящем изобретении, предпочтительно составляет 2-8, более предпочтительно 3-8, еще более предпочтительно 7-8, еще более предпочтительно 7,5-8 и еще более предпочтительно около 8.
[0109]
Конъюгат анти-GPR20 антитело-лекарственное средство, используемый в настоящем изобретении, можно получить руководствуясь описанием, представленным в Международной публикации № WO 2018/135501 и т.д.
[0110]
[Фармацевтические композиции]
Далее будет описана фармацевтическая композиция в соответствии с настоящим изобретением.
Фармацевтическая композиция в соответствии с настоящим изобретением включает
(i) конъюгат антитело-лекарственное средство,
(ii) гистидиновый буфер,
(iii) сахарозу или трегалозу и
(iv) поверхностно-активное вещество,
где конъюгат антитело-лекарственное средство представляет собой конъюгат антитело-лекарственное средство, в котором фрагмент лекарственное средство-линкер, представленный следующей формулой:
[0111]
[Формула 13]
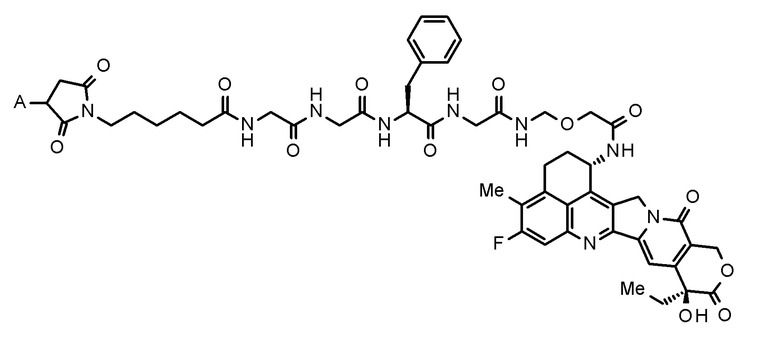
[0112]
где A представляет собой положение связывания с антителом,
конъюгирован с антителом через тиоэфирную связь.
В настоящем изобретении термин "гистидиновый буфер" означает смесь гистидина и соли гистидина (продукт присоединения кислоты), предпочтительно смесь L-гистидина и L-гистидина гидрохлорида (и/или его гидрата). Вода, в которой растворен гистидиновый буфер в настоящем изобретении, эквивалентна гистидиновому буферному раствору.
[0113]
Количество гистидинового буфера предпочтительно составляет 3-80 ммоль на 20 мг конъюгата антитело-лекарственное средство, более предпочтительно 10-80 ммоль на 20 мг конъюгата антитело-лекарственное средство, еще более предпочтительно 10-40 ммоль на 20 мг конъюгата антитело-лекарственное средство, еще более предпочтительно 10-25 ммоль на 20 мг конъюгата антитело-лекарственное средство и еще более предпочтительно 10 или 25 ммоль на 20 мг конъюгата антитело-лекарственное средство.
[0114]
Следует отметить, что pH состояния, когда фармацевтическая композиция по настоящему изобретению растворена в воде, зависит от соотношения содержания гистидина и солей гистидина в гистидиновом буферном растворе. Другими словами, путем регулирования соотношения содержания гистидина и солей гистидина можно обеспечить фармацевтическую композицию, имеющую желаемый pH в состоянии, растворенном в воде.
[0115]
pH фармацевтической композиции по настоящему изобретению, когда конъюгат антитело-лекарственное средство растворяют в воде при концентрации 20 мг/мл, составляет 4,0-7,0, предпочтительно 5,0-6,0. Кроме того, в зависимости от типа антитела в конъюгате антитело-лекарственное средство, можно выбрать более подходящий pH.
Количество сахарозы или трегалозы предпочтительно составляет 24-320 мг на 20 мг конъюгата антитело-лекарственное средство. Что касается сахарозы, ее количество более предпочтительно составляет 90 мг. Что касается трегалозы, в расчете на гидрат трегалозы, ее количество более предпочтительно составляет 100 мг. Из сахарозы и трегалозы, в фармацевтических композициях по настоящему изобретению более предпочтительно использовать сахарозу.
В настоящем изобретении термин "поверхностно-активное вещество" относится к веществу, содержащему гидрофильную группу и гидрофобную группу, и которое используют в качестве одного из составляющих фармацевтической композиции. Поверхностно-активное вещество в настоящем изобретении предпочтительно представляет собой полисорбат, такой как полисорбат 80 (Tween 80), полисорбат 20 (Tween20) и полисорбат 60 (Tween 60), полиоксиэтилен(160) полиоксипропилен(30) гликоль, полиоксиэтилен-гидрированное касторовое масло 60, или полиоксиэтилированное касторовое масло, или лаурилсульфат натрия, и более предпочтительно полисорбат 80 или полисорбат 20.
[0116]
Количество полисорбата 80 или полисорбата 20 составляет, на 20 мг конъюгата антитело-лекарственное средство, предпочтительно 0,05-1,6 мг, более предпочтительно 0,1-1,6 мг, еще более предпочтительно 0,2-0,4 мг, еще более предпочтительно 0,2-0,3 мг и еще более предпочтительно 0,2 или 0,3 мг.
Принимая во внимание все вышеизложенное, фармацевтическая композиция по изобретению предпочтительно представляет собой
фармацевтическую композицию, включающую,
(i) на 20 мг конъюгата антитело-лекарственное средство,
(ii) 3-80 ммоль гистидинового буфера,
(iii) 24-320 мг сахарозы или трегалозы и
(iv) 0,05-1,6 мг полисорбата 80 или полисорбата 20,
более предпочтительно,
фармацевтическую композицию, включающую,
(i) на 20 мг конъюгата антитело-лекарственное средство,
(ii) 10-40 ммоль гистидинового буфера,
(iii) 90 мг сахарозы или 100 мг гидрат трегалозы и
(iv) 0,2-0,4 мг полисорбата 80 или полисорбата 20,
еще более предпочтительно,
фармацевтическую композицию, включающую,
(i) на 20 мг конъюгата антитело-лекарственное средство,
(ii) 10 или 25 ммоль гистидинового буфера,
(iii) 90 мг сахарозы и
(iv) 0,2 или 0,3 мг полисорбата 80 или полисорбата 20.
В пересчете на водный раствор, включающий конъюгат антитело-лекарственное средство при концентрации 20 мг/мл, описанная выше фармацевтическая композиция может быть представлена следующим образом.
[0117]
А именно, фармацевтическая композиция по настоящему изобретению, предпочтительно представляет собой
фармацевтическую композицию, включающую
(i) 20 мг/мл конъюгата антитело-лекарственное средство,
(ii) гистидиновый буфер,
(iii) сахарозу или трегалозу и
(iv) поверхностно-активное вещество и
(v) воду,
более предпочтительно,
фармацевтическую композицию, включающую
(i) 20 мг/мл конъюгата антитело-лекарственное средство,
(ii) 3-80 мМ гистидинового буфера,
(iii) 2,4-32% сахарозы или трегалозы,
(iv) 0,005-0,16% полисорбата 80 или полисорбата 20 и
(v) воду,
еще более предпочтительно,
фармацевтическую композицию, включающую
(i) 20 мг/мл конъюгата антитело-лекарственное средство,
(ii) 10-40 мМ гистидинового буфера,
(iii) 9% сахарозы или 10% трегалозы,
(iv) 0,02-0,04% полисорбата 80 или полисорбата 20 и
(v) воду,
еще более предпочтительно,
фармацевтическую композицию, включающую
(i) 20 мг/мл конъюгата антитело-лекарственное средство,
(ii) 10 или 25 мМ гистидинового буфера,
(iii) 9% сахарозы и
(iv) 0,02 или 0,03% полисорбата 80 или полисорбата 20 и
(v) воду.
[0118]
В настоящем изобретении "%" содержания сахарозы и трегалозы относится к массовому% на 1 мл воды. Таким образом, например, "9% сахарозы" означает, что композиция содержит 90 мг сахарозы на 1 мл воды, и "10% гидрата трегалозы" означает, что композиция содержит 100 мг гидрата трегалозы на 1 мл воды.
[0119]
Подобным образом, в настоящем изобретении "%", указывающий содержание полисорбата 80 и полисорбата 20, относится к массовому% на 1 мл воды. Таким образом, например, "0,03% полисорбата 80" означает, что композиция содержит 0,3 мг полисорбата 80 на 1 мл воды, и "0,03% полисорбата 20" означает, что композиция содержит 0,3 мг полисорбата 20 на 1 мл воды.
[0120]
Что касается фармацевтической композиции по настоящему изобретению, в зависимости от типа антитела в конъюгате антитело-лекарственное средство, можно выбрать более подходящие композиции.
[0121]
Например, когда антитело в конъюгате антитело-лекарственное средство представляет собой анти-HER2 антитело (предпочтительно антитело, включающее тяжелую цепь, состоящую из аминокислотной последовательности, состоящей из аминокислотных остатков 1-449 SEQ ID NO: 1, и легкую цепь, состоящую из аминокислотной последовательности, состоящей из аминокислотных остатков 1-214 SEQ ID NO: 2, или антитело, включающее тяжелую цепь, состоящую из аминокислотной последовательности, представленной SEQ ID NO: 1, и легкую цепь, состоящую из аминокислотной последовательности, представленной SEQ ID NO: 2), фармацевтическая композиция по настоящему изобретению предпочтительно представляет собой фармацевтическую композицию, включающую,
(i) на 20 мг конъюгата антитело-лекарственное средство,
(ii) 25 ммоль гистидинового буфера,
(iii) 90 мг сахарозы и
(iv) 0,3 мг полисорбата 80.
Кроме того, pH фармацевтической композиции, когда конъюгат антитело-лекарственное средство растворяют в воде при концентрации 20 мг/мл, составляет предпочтительно 5,3-5,7, более предпочтительно 5,4-5,6, еще более предпочтительно 5,5.
[0122]
Когда количество гистидинового буфера выражено как содержание L-гистидина и L-гистидина гидрохлорида, описанная выше фармацевтическая композиция, когда ее pH составляет 5,5, может быть представлена как фармацевтическая композиция, включающая,
(i) на 20 мг конъюгата антитело-лекарственное средство,
(ii) 0,89 мг L-гистидина и 4,04 мг L-гистидина гидрохлорида гидрата,
(iii) 90 мг сахарозы и
(iv) 0,3 мг полисорбата 80.
[0123]
Кроме того, в пересчете на стандартную композицию, включающую 100 мг конъюгата антитело-лекарственное средство, описанная выше фармацевтическая композиция, когда ее pH составляет 5,5, может быть представлена как фармацевтическая композиция, включающая
(i) 100 мг конъюгата антитело-лекарственное средство,
(ii) 4,45 мг L-гистидина и 20,2 мг L-гистидина гидрохлорида гидрата,
(iii) 450 мг сахарозы и
(iv) 1,5 мг полисорбата 80.
[0124]
Альтернативно, в пересчете на водный раствор, включающий конъюгат антитело-лекарственное средство при концентрации 20 мг/мл, описанная выше фармацевтическая композиция может быть представлена как фармацевтическая композиция, включающая
(i) 20 мг/мл конъюгата антитело-лекарственное средство,
(ii) 25 мМ гистидинового буфера,
(iii) 9% сахарозы,
(iv) 0,03% полисорбата 80 и
(v) воду,
где pH композиции составляет 5,5.
[0125]
Когда антитело в конъюгате антитело-лекарственное средство представляет собой анти-HER3 антитело (предпочтительно, антитело, включающее тяжелую цепь, состоящую из аминокислотной последовательности, представленной SEQ ID NO: 3, и легкую цепь, состоящую из аминокислотной последовательности, представленной SEQ ID NO: 4, или вариант антитела, в котором лизиновый остаток на карбокси-конце тяжелой цепи делетирован), фармацевтическая композиция по настоящему изобретению предпочтительно представляет собой фармацевтическую композицию, включающую,
(i) на 20 мг конъюгата антитело-лекарственное средство,
(ii) 25 ммоль гистидинового буфера,
(iii) 90 мг сахарозы и
(iv) 0,3 мг полисорбата 20.
Кроме того, pH фармацевтической композиции, когда конъюгат антитело-лекарственное средство растворяют в воде при концентрации 20 мг/мл, составляет предпочтительно 5,2-5,6, более предпочтительно 5,3-5,5, еще более предпочтительно 5,4.
[0126]
Когда количество гистидинового буфера выражено как содержание L-гистидина и L-гистидина гидрохлорида, описанная выше фармацевтическая композиция, когда ее pH составляет 5,4, может быть представлена как фармацевтическая композиция, включающая,
(i) на 20 мг конъюгата антитело-лекарственное средство,
(ii) 0,81 мг L-гистидина и 4,14 мг L-гистидина гидрохлорида гидрата,
(iii) 90 мг сахарозы и
(iv) 0,3 мг полисорбата 20.
[0127]
Кроме того, в пересчете на стандартную композицию, включающую 100 мг конъюгата антитело-лекарственное средство, описанная выше фармацевтическая композиция, когда ее pH составляет 5,4, может быть представлена как фармацевтическая композиция, включающая
(i) 100 мг конъюгата антитело-лекарственное средство,
(ii) 4,06 мг L-гистидина и 20,7 мг L-гистидина гидрохлорида гидрата,
(iii) 450 мг сахарозы и
(iv) 1,5 мг полисорбата 20.
[0128]
Альтернативно, в пересчете на водный раствор, включающий конъюгат антитело-лекарственное средство при концентрации 20 мг/мл, описанная выше фармацевтическая композиция может быть представлена как фармацевтическая композиция, включающая
(i) 20 мг/мл конъюгата антитело-лекарственное средство,
(ii) 25 мМ гистидинового буфера,
(iii) 9% сахарозы,
(iv) 0,03% полисорбата 20 и
(v) воду,
где pH композиции составляет 5,4.
[0129]
Когда антитело в конъюгате антитело-лекарственное средство представляет собой анти-TROP2 антитело (предпочтительно, антитело, включающее тяжелую цепь, состоящую из аминокислотной последовательности, состоящей из аминокислотных остатков 20-470 SEQ ID NO: 5, и легкую цепь, состоящую из аминокислотной последовательности, состоящей из аминокислотных остатков 21-234 SEQ ID NO: 6, или вариант антитела, в котором лизиновый остаток на карбокси-конце тяжелой цепи делетирован), фармацевтическая композиция по настоящему изобретению предпочтительно представляет собой
фармацевтическую композицию, включающую,
(i) на 20 мг конъюгата антитело-лекарственное средство,
(ii) 10 ммоль гистидинового буфера,
(iii) 90 мг сахарозы и
(iv) 0,2 или 0,3 мг полисорбата 80.
Кроме того, pH фармацевтической композиции, когда конъюгат антитело-лекарственное средство растворяют в воде при концентрации 20 мг/мл, составляет предпочтительно 5,8-6,2, более предпочтительно 5,9-6,1, еще более предпочтительно 6,0.
[0130]
Когда количество гистидинового буфера выражено как содержание L-гистидина и L-гистидина гидрохлорида, описанная выше фармацевтическая композиция, когда ее pH составляет 6,0, предпочтительно может быть представлена как фармацевтическая композиция, включающая,
(i) на 20 мг конъюгата антитело-лекарственное средство,
(ii) 0,78 мг L-гистидина и 1,05 мг L-гистидина гидрохлорида гидрата,
(iii) 90 мг сахарозы и
(iv) 0,2 или 0,3 мг полисорбата 80.
[0131]
В пересчете на стандартную композицию, включающую 100 мг конъюгата антитело-лекарственное средство, описанная выше фармацевтическая композиция, когда ее pH составляет 6,0, может быть представлена как фармацевтическая композиция, включающая
(i) 100 мг конъюгата антитело-лекарственное средство,
(ii) 3,88 мг L-гистидина и 5,26 мг L-гистидина гидрохлорида гидрата,
(iii) 450 мг сахарозы и
(iv) 1,0 или 1,5 мг полисорбата 80.
[0132]
Альтернативно, в пересчете на водный раствор, включающий конъюгат антитело-лекарственное средство при концентрации 20 мг/мл, описанная выше фармацевтическая композиция может быть представлена как фармацевтическая композиция, включающая
(i) 20 мг/мл конъюгата антитело-лекарственное средство,
(ii) 10 мМ гистидинового буфера,
(iii) 9% сахарозы,
(iv) 0,02 или 0,03% полисорбата 80 и
(v) воду,
где pH композиции составляет 6,0.
[0133]
Когда антитело в конъюгате антитело-лекарственное средство представляет собой анти-B7-H3 антитело (предпочтительно, где антитело представляет собой антитело, включающее тяжелую цепь, состоящую из аминокислотной последовательности, состоящей из аминокислотных остатков 20-471 SEQ ID NO: 7, и легкую цепь, состоящую из аминокислотной последовательности, состоящей из аминокислотных остатков 21-233 SEQ ID NO: 8, или вариант антитела, в котором лизиновый остаток на карбокси-конце тяжелой цепи делетирован), фармацевтическая композиция по настоящему изобретению предпочтительно представляет собой фармацевтическую композицию, включающую,
(i) на 20 мг конъюгата антитело-лекарственное средство,
(ii) 10 ммоль гистидинового буфера,
(iii) 90 мг сахарозы и
(iv) 0,2 или 0,3 мг полисорбата 20.
Кроме того, pH фармацевтической композиции, когда конъюгат антитело-лекарственное средство растворяют в воде при концентрации 20 мг/мл, составляет предпочтительно 5,7-6,1, более предпочтительно 5,8-6,0, еще более предпочтительно 5,9.
[0134]
Когда количество гистидинового буфера выражено как содержание L-гистидина и L-гистидина гидрохлорида, описанная выше фармацевтическая композиция, когда ее pH составляет 5,9, может быть представлена как фармацевтическая композиция, включающая,
(i) на 20 мг конъюгата антитело-лекарственное средство,
(ii) 0,65 мг L-гистидина и 1,22 мг L-гистидина гидрохлорида гидрата,
(iii) 90 мг сахарозы и
(iv) 0,2 или 0,3 мг полисорбата 20.
[0135]
Кроме того, в пересчете на стандартную композицию, включающую 100 мг конъюгата антитело-лекарственное средство, описанная выше фармацевтическая композиция, когда ее pH составляет 5,9, может быть представлена как фармацевтическая композиция, включающая
(i) 100 мг конъюгата антитело-лекарственное средство,
(ii) 3,23 мг L-гистидина и 6,12 мг L-гистидина гидрохлорида гидрата,
(iii) 450 мг сахарозы и
(iv) 1,0 или 1,5 мг полисорбата 20.
[0136]
Альтернативно, в пересчете на водный раствор, включающий конъюгат антитело-лекарственное средство при концентрации 20 мг/мл, описанная выше фармацевтическая композиция может быть представлена как фармацевтическая композиция, включающая
(i) 20 мг/мл конъюгата антитело-лекарственное средство,
(ii) 10 мМ гистидинового буфера,
(iii) 9% сахарозы и
(iv) 0,02 или 0,03% полисорбата 20 и
(v) воду,
где pH композиции составляет 5,9.
[0137]
Когда антитело в конъюгате антитело-лекарственное средство представляет собой анти-GPR20 антитело (предпочтительно, антитело, включающее тяжелую цепь, состоящую из аминокислотной последовательности, состоящей из аминокислотных остатков 20-472 SEQ ID NO: 9, и легкую цепь, состоящую из аминокислотной последовательности, состоящей из аминокислотных остатков 21-234 SEQ ID NO: 10, или вариант антитела, в котором лизиновый остаток на карбокси-конце тяжелой цепи делетирован, фармацевтическая композиция по настоящему изобретению предпочтительно представляет собой композицию, включающую,
(i) на 20 мг конъюгата антитело-лекарственное средство,
(ii) 10 ммоль гистидинового буфера,
(iii) 90 мг сахарозы и
(iv) 0,3 мг полисорбата 80.
Кроме того, pH фармацевтической композиции, когда конъюгат антитело-лекарственное средство растворяют в воде при концентрации 20 мг/мл, составляет предпочтительно 5,2-5,6, более предпочтительно 5,3-5,5, еще более предпочтительно 5,4.
[0138]
Когда количество гистидинового буфера выражено как содержание L-гистидина и L-гистидина гидрохлорида, описанная выше фармацевтическая композиция, когда ее pH составляет 5,4, предпочтительно может быть представлена как фармацевтическая композиция, включающая,
(i) на 20 мг конъюгата антитело-лекарственное средство,
(ii) 0,32 мг L-гистидина и 1,66 мг L-гистидина гидрохлорида гидрата,
(iii) 90 мг сахарозы и
(iv) 0,3 мг полисорбата 80.
[0139]
Кроме того, в пересчете на стандартную композицию, включающую 100 мг конъюгата антитело-лекарственное средство, описанная выше фармацевтическая композиция, когда ее pH составляет 5,4, может быть представлена как фармацевтическая композиция, включающая
(i) 100 мг конъюгата антитело-лекарственное средство,
(ii) 1,62 мг L-гистидина и 8,29 мг L-гистидина гидрохлорида гидрата,
(iii) 450 мг сахарозы и
(iv) 1,5 мг полисорбата 80.
[0140]
Альтернативно, в пересчете на водный раствор, включающий конъюгат антитело-лекарственное средство при концентрации 20 мг/мл, описанная выше фармацевтическая композиция может быть представлена как фармацевтическая композиция, включающая
(i) 20 мг/мл конъюгата антитело-лекарственное средство,
(ii) 10 мМ гистидинового буфера,
(iii) 9% сахарозы и
(iv) 0,03% полисорбата 80 и
(v) воду,
где pH композиции составляет 5,4.
[0141]
Фармацевтическая композиция по настоящему изобретению предпочтительно находится в форме композиции для инъекции, более предпочтительно водной композиции для инъекции или лиофилизированной композиции для инъекции, еще более предпочтительно лиофилизированной композиции для инъекции.
[0142]
В настоящем изобретении термин "композиция для инъекции" относится к фармацевтической композиции для введения иглой в биологические ткани, например внутривенно, внутрикожно, подкожно, внутримышечно и интраперитонеально. Композиция инъекции по настоящему изобретению включает не только жидкие композиции для инъекций, но также твердые композиции для инъекций, растворяемые перед применением в жидкостях. Для жидкой композиции для инъекций растворителем может быть вода или растворитель, отличный от воды, или смешанный растворитель, состоящий из воды и растворителя, отличного от воды.
[0143]
В настоящем изобретении, термин "водная композиция для инъекции" относится к фармацевтической композиции, которая находится в форме жидкой композиции для инъекций, в которой растворителем является вода (предпочтительно вода для инъекций).
В настоящем изобретении термин "лиофилизированная композиция для инъекций" представляет собой твердую композицию для инъекций, которую можно использовать путем растворения при применении в воде (предпочтительно, воде для инъекций), которую получают путем лиофилизации водного раствора, включающего предварительно определенное количество фармацевтического компонента.
Когда фармацевтическая композиция по настоящему изобретению находится в форме водной композиции для инъекций, концентрация конъюгата антитело-лекарственное средство составляет предпочтительно 5-60 мг/мл, более предпочтительно 15-40 мг/мл, еще предпочтительнее 20 мг/мл.
Когда фармацевтическая композиция по настоящему изобретению находится в форме водной композиции для инъекций, фармацевтическую композицию по настоящему изобретению предпочтительно можно хранить в замороженном состоянии.
[0144]
Когда фармацевтическая композиция по настоящему изобретению находится в форме лиофилизированной композиции для инъекций, фармацевтическую композицию по настоящему изобретению предпочтительно можно хранить в темном флаконе.
[0145]
Когда фармацевтическая композиция по настоящему изобретению находится в форме лиофилизированной композиции для инъекций, можно подходящим образом использовать набор, включающий фармацевтическую композицию по настоящему изобретению и воду для инъекций. В этом случае вода для инъекций предпочтительно может храниться в ампуле.
[0146]
Лиофилизированную композицию для инъекций, где содержание конъюгата антитело-лекарственное средство, используемого в настоящем изобретении, составляет 20 мг, можно подходящим образом использовать путем повторного растворения в 1 мл воды для инъекций. Кроме того, лиофилизированную композицию для инъекций, где содержание конъюгата антитело-лекарственное средство, используемого в настоящем изобретении, составляет 100 мг, можно подходящим образом использовать путем повторного растворения в 5 мл воды для инъекций.
[0147]
Когда фармацевтическая композиция по настоящему изобретению находится в форме лиофилизированной композиции для инъекций, способ получения фармацевтической композиции по настоящему изобретению предпочтительно включает стадии
(1) получения водного раствора, включающего предварительно определенные количества
(i) конъюгата антитело-лекарственное средство,
(ii) гистидинового буфера,
(iii) сахарозы или трегалозы и
(iv) поверхностно-активного вещества,
(2) при необходимости, корректировку pH водного раствора, и затем
(3) лиофилизации водного раствора.
Стадия лиофилизации водного раствора предпочтительно включает процесс отжига при температуре полки близкой к эвтектической точке водного раствора. В данном случае, "близко к эвтектической точке" означает диапазон от температуры, которая на 1,5°C ниже эвтектической точки, до температуры, которая на 1,5°C выше эвтектической точки.
В настоящем изобретении термин "отжиг" означает процесс роста кристаллов льда в замороженном веществе при температуре продукта, равной или превышающей температуру стеклования (Tg'). По мере того как кристаллы льда становятся больше, проходы воды (водяного пара), которая сублимируется при сушке, становятся больше. Это уменьшает сопротивление сублимации и, как можно ожидать, улучшит форму лиофилизированной лепешки и сократит время сушки.
В настоящем изобретении термин "температура полки" означает температуру в аппарате (в системе) для осуществления лиофилизации.
В настоящем изобретении термин "температура продукта" означает температуру объекта (продукта), подлежащего лиофилизации.
В настоящем изобретении термин "лиофилизированная лепешка" означает лиофилизированное вещество (твердое вещество, имеющее пористую структуру), полученное в результате серии лиофилизационных процессов.
Отжиг, как описано выше, можно подходящим образом осуществить от температуры на 1,5°C ниже эвтектической точки водного раствора до температуры на 1,5°C выше эвтектической точки, более предпочтительно можно осуществить при температуре полки, которая равна эвтектической точке водного раствора.
Эти способы получения предпочтительно отличаются тем, что время для процесса первичной сушки уменьшено по сравнению с тем, когда отжиг осуществляют при температуре полки, которая на 5°C ниже эвтектической точки. Кроме того, эти способы получения предпочтительно отличаются тем, что получают лиофилизированную лепешку, имеющую меньшую усадку по сравнению с той, которую получают при осуществлении отжига при температуре полки, которая на 5°C ниже эвтектической точки.
[0148]
Поскольку эвтектическая точка фармацевтической композиции по настоящему изобретению находится в пределах от около -3°C до около -1°C, отжиг предпочтительно можно осуществить при температуре полки от -4,5°C до 0,5°C, более предпочтительно при температуре полки от -4 до -1°C, еще более предпочтительно при температуре полки от -4 до -2°C, еще более предпочтительно при температуре полки от -3 до -2°C, и еще более предпочтительно при температуре полки -2,5°C.
[0149]
После отжига осуществляют первый процесс сушки и второй процесс сушки, затем получают фармацевтическую композицию по настоящему изобретению в форме лиофилизированной композиции для инъекций.
[0150]
В настоящем изобретении термин "процесс первичной сушки" является одним из процессов получения лиофилизированной композиции для инъекций, и означает процесс сублимации свободной воды в замороженном продукте.
В настоящем изобретении термин "процесс вторичной сушки" является одним из процессов получения лиофилизированной композиции для инъекций, и означает процесс сублимации воды, связанной с растворенным веществом (связанной воды).
[0151]
Процесс первичной сушки можно осуществить предпочтительно при температуре полки от -5 до 5°C в условиях вакуума от 5 до 15 Па, более предпочтительно при температуре полки от -4 до 4°C в условиях вакуума от 7 до 13 Па, еще более предпочтительно при температуре полки от -3 до 3°C в условиях вакуума от 8 до 12 Па, еще более предпочтительно при температуре полки от -2 до 2°C в условиях вакуума от 9 до 11 Па, еще более предпочтительно при температуре полки от -1 до 1°C в условиях вакуума от 9 о 11 Па, и еще более предпочтительно при температуре полки 0°C в условиях вакуума около 10 Па.
[0152]
Процесс вторичной сушки можно осуществить предпочтительно при температуре полки от 40 до 50°C в условиях вакуума от 5 до 15 Па или без вакуума, более предпочтительно при температуре полки 42-48°C в условиях вакуума от 7 до 13 Па, еще более предпочтительно при температуре полки 44-46°C в условиях вакуума от 9 до 11 Па, и еще более предпочтительно при температуре полки 45°C в условиях вакуума 10 Па.
[0153]
Качество фармацевтических композиций по настоящему изобретению можно подтвердить путем определения стабильности при хранении через 1 месяц, 3 месяца, 6 месяцев, 12 месяцев, 18 месяцев, 24 месяца или 36 месяцев в условиях 50°C, при 40°C/75%RH, при 25°C/60%RH или при 5°C, используя в качестве показателей концентрацию белка, влажность, нерастворимые микрочастицы, DAR, содержание мономеров, агрегатов и фрагментов, NPI, IoP, заряженные изомеры и pH. Кроме того, в зависимости от типа антитела в конъюгате антитело-лекарственное средство, качество можно определить с использованием в качестве показателя, например, активности или силы связывания (Биоанализ) с антигеном. Кроме того, также можно осуществить оценку качества с использованием дистрибуции лекарственного средства или rCE-SDS в качестве показателя, и оценку качества путем наблюдения свойств (внешний вид). Когда фармацевтическая композиция находится в форме водной композиции для инъекций, качество можно определить с использованием осмотического давления в качестве показателя, а когда фармацевтическая композиция находится в форме лиофилизированной композиции для инъекций, качество можно определить с использованием времени повторного растворения в качестве показателя. Используя такие оценки качества, также можно подтвердить превосходство фармацевтической композиции по настоящему изобретению по сравнению с существующими фармацевтическими композициями.
Ожидается, что способ лиофилизации по настоящему изобретению будет иметь широкую применимость, не только для фармацевтической композиции, включающей конъюгат антитело-лекарственное средство, используемый в настоящем изобретении, но также для водного раствора, содержащего сахарозу или трегалозу.
Таким образом, способ получения лиофилизированной композиции для инъекций, включающй процесс отжига водного раствора, содержащего сахарозу или трегалозу, при температуре полки близкой к эвтектической точки водного раствора, где “близко к эвтектической точке” означает диапазон от температуры, которая на 1,5°C ниже эвтектической точки, до температуры, которая на 1,5°C выше эвтектической точки, также включен в объем настоящего изобретения.
Кроме того, отжиг подходящим образом можно осуществить при температуре полки равной эвтектической точке водных растворов, содержащих сахарозу или трегалозу.
Эти способы получения предпочтительно отличаются тем, что время для процесса первичной сушки уменьшено по сравнению с тем, когда осуществляют отжиг при температуре полки, которая на 5°C ниже эвтектической точки.
[0154]
Кроме того, эти способы получения предпочтительно отличаются тем, что получают лиофилизированную лепешку, имеющую меньшую усадку по сравнению с той, которую получают при осуществлении отжига при температуре полки, которая на 5°C ниже эвтектической точки.
[0155]
[Применение фармацевтической композиции]
Фармацевтическая композиция по настоящему изобретению, как можно ожидать, будет проявлять терапевтический эффект при применении в качестве системной терапии для пациентов и, кроме того, при местном применении на раковых тканях.
[0156]
Фармацевтическую композицию по настоящему изобретению предпочтительно можно использовать для млекопитающего, но более предпочтительно ее используют для человека.
[0157]
Примеры пути введения, который можно использовать для введения фармацевтических композиций по настоящему изобретению, включают внутривенный, внутрикожный, подкожный, внутримышечный и интраперитонеальный пути, но предпочтительным путем введения является внутривенное введение.
[0158]
Когда фармацевтические композиции по настоящему изобретению находятся в форме водной композиции для инъекций, водную композицию для инъекций можно предпочтительно вводить внутривенно после разбавления подходящим разбавителем. Примеры разбавителя включают раствор глюкозы (предпочтительно 5% раствор глюкозы) и физиологический раствор.
[0159]
Когда фармацевтическая композиция по настоящему изобретению находится в форме лиофилизированной композиции для инъекций, лиофилизированную композицию для инъекций можно растворить водой (предпочтительно, водой для инъекций) и вводить внутривенно после разбавления подходящим разбавителем. Примеры разбавителя включают раствор глюкозы (предпочтительно 5% раствор глюкозы) и физиологический раствор.
[0160]
Фармацевтическая композиция по настоящему изобретению может проявлять фармацевтический эффект даже при небольшой дозировке, когда конъюгат антитело-лекарственное средство имеет более высокое сродство к антигену, то есть выраженное как константа диссоциации (Kd значение) более высокое сродство (более низкое значение Kd) к антигену для конъюгата антитело-лекарственное средство по настоящему изобретению. Таким образом, дозировка фармацевтической композиции по настоящему изобретению может быть определена с учетом ситуации, связанной со сродством к антигену. Когда фармацевтическую композицию по настоящему изобретению вводят человеку, например, около 0,001-100 мг/кг в виде конъюгата антитело-лекарственное средство, где "мг/кг" означает дозу конъюгата антитело-лекарственное средство на 1 кг массы тела человека, ее можно вводить один раз или можно вводить несколькими частями с интервалом 1-180 дней. Например, когда конъюгат антитело-лекарственное средство, используемый в настоящем изобретении, представляет собой конъюгат анти-HER2 антитело-лекарственное средство, примеры способа введения фармацевтической композиции по настоящему изобретению включают введение 0,8 мг/кг - 8 мг/кг раз в три недели, более предпочтительно 0,8 мг/кг, 1,6 мг/кг, 3,2 мг/кг, 5,4 мг/кг, 6,4 мг/кг, 7,4 мг/кг или 8 мг/кг раз в три недели, еще более предпочтительно 5,4 мг/кг, 6,4 мг/кг, 7,4 мг/кг или 8 мг/кг раз в три недели, и еще более предпочтительно 5,4 мг/кг, 6,4 мг/кг, 7,4 мг/кг или 8 мг/кг раз в три недели, и еще более предпочтительно 5,4 мг/кг и 6,4 мг/кг раз в три недели.
[0161]
Фармацевтическую композицию по настоящему изобретению можно использовать для лечения рака, предпочтительно ее можно использовать для лечения по меньшей мере одного рака, выбранного из группы, состоящей из рака молочной железы, рака желудка (также называемого аденокарциномой желудка), колоректального рака (также называемый раком толстой кишки и прямой кишки, включая рак толстой кишки и рак прямой кишки), рака легких (включая мелкоклеточный рак легкого и немелкоклеточный рак легкого), рака пищевода, рака слюнной железы, аденокарциномы гастроэзофагеального перехода, рака желчного протока, болезни Педжета, рака поджелудочной железы, рака яичников, саркомы матки, рака уротелия, рака предстательной железы, рака мочевого пузыря, желудочно-кишечной стромальной опухоли, рака шейки матки, плоскоклеточной карциномы, перитонеального рака, рака печени, гепатоцеллюлярной карциномы, рака толстой кишки, рака прямой кишки, рака эндометрия, рака матки, рака почки, рака влагалища, рака щитовидной железы, рака полового члена, лейкоза, злокачественной лимфомы, плазмоцитомы, миеломы, опухолей нервной эпителиальной ткани, опухоли нервной оболочки, рака головы и шеи, рака кожи, рака горла, рака желчного пузыря, рака желчных протоков, мезотелиомы и саркомы. Например, когда конъюгаты антитело-лекарственное средство, используемые в настоящем изобретении, представляют собой конъюгат анти-HER2 антитело-лекарственное средство, фармацевтические композиции по настоящему изобретению более предпочтительно можно использовать для лечения по меньшей мере одного рака, выбранного из группы, состоящей из рака молочной железы, рака желудка, колоректального рака, немелкоклеточного рака легкого, рака пищевода, рака слюнной железы, аденокарциномы гастроэзофагеального перехода, рака желчных протоков, болезни Педжета, рака поджелудочной железы, рака яичников и саркомы матки; более предпочтительно можно использовать для лечения по меньшей мере одного рака, выбранного из группы, состоящей из рака молочной железы, рака желудка, колоректального рака, немелкоклеточного рака легкого, рака пищевода, рака слюнной железы, аденокарциномы гастроэзофагеального перехода, рака желчных протоков и болезни Педжета; и еще более предпочтительно можно использовать для лечения рака молочной железы, рака желудка, колоректального рака или немелкоклеточного рака легкого
[0162]
Фармацевтическую композицию по настоящему изобретению можно выборочно использовать в качестве средства для лекарственной терапии, которая является основным методом лечения рака и, как следствие, может задерживать развитие раковых клеток, ингибировать их рост и дополнительно убивать раковые клетки. Эти эффекты могут дать возможность больным раком не иметь симптомов, вызываемых раком, или достигать улучшения качества жизни (QOL) больных раком и достигать терапевтического эффекта, поддерживая жизнь больных раком. Даже если фармацевтическая композиция и способ лечения по настоящему изобретению не обеспечивают уничтожение раковых клеток, они могут обеспечить достижение более высокого QOL у раковых пациентов при одновременном достижении более длительной выживаемости путем ингибирования или контроля роста раковых клеток.
[0163]
В такой лекарственной терапии фармацевтическую композицию по настоящему изобретению можно использовать отдельно, и, кроме того, ее можно использовать в комбинации с дополнительной терапией в адъювантной терапии и можно сочетать с хирургическим вмешательством, лучевой терапией, гормональной терапией и т.п. Кроме того, ее также можно использовать для лекарственной терапии в неоадъювантной терапии.
[0164]
В дополнение к терапевтическому применению, как описано выше, для фармацевтической композиции в соответствии с настоящим изобретением можно ожидать, например, профилактического эффекта, такого как подавление роста мелких метастатических раковых клеток и дальнейшее их уничтожение. Например, можно ожидать эффекта ингибирования и уничтожения раковых клеток в жидкости организма в ходе метастазирования или эффекта, например, ингибирования и уничтожения малых раковых клеток сразу после имплантации в любую ткань. Соответственно, можно ожидать ингибирования метастазирования рака или профилактического эффекта, в частности, после хирургического удаления рака.
[0165]
Фармацевтическую композицию по настоящему изобретению можно вводить в комбинации с другими средствами для лечения рака. Противораковый эффект может быть соответственно усилен. Примеры других средств для лечения рака, используемых для таких целей, включают 5-фторурацил (5-FU), пертузумаб, трастузумаб, паклитаксел, карбоплатин, цисплатин, гемцитабин, капецитабин, иринотекан (СРТ-11), доцетаксел, пеметрексед, сорабенфиб, винбластин, винорелбин, эверолимс, танеспимицин, бевацизумаб, оксалиплатин, лапатиниб, трастузумаб эмтанзин (T-DM1) или средства, описанные в международной публикации № WO 2003/038043, аналоги LH-RH (лейпрорелин, госерелин и т.п.), эстрамустин фосфат, антагонисты эстрогена (тамоксифен, ралоксифен и т.п.) и ингибиторы ароматазы (анастрозол, летрозол, экземестан и т.п.), но не ограничиваются этим, при условии, что они являются средствами, обладающими противоопухолевой активностью.
Примеры
[0166]
Настоящее изобретение конкретно описано при помощи примеров, представленных ниже. Однако настоящее изобретение не ограничивается этим. Также, это никоим образом нельзя рассматривать как ограничение.
[0167]
[Пример 1: Получение конъюгата антитело-лекарственное средство (1)]
В соответствии со способом получения, описанным в Международной публикации № WO 2015/115091, с использованием гуманизированного анти-HER2 антитела (трастузумаб) получали конъюгат антитело-лекарственное средство, в котором фрагмент лекарственное средство-линкер, представленный следующей формулой:
[0168]
[Формула 14]
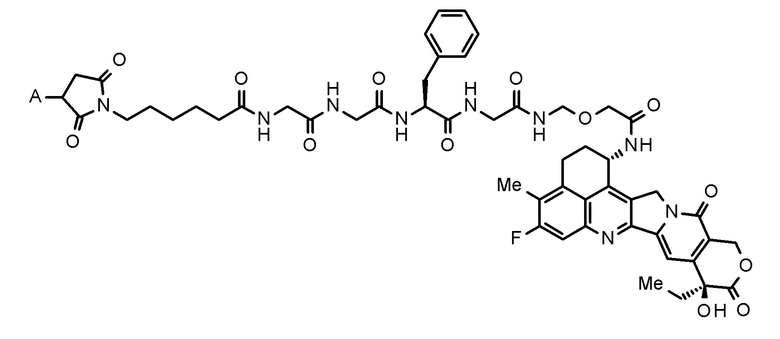
[0169]
где A представляет собой положение связывания с антителом, конъюгирован с антителом через тиоэфирную связь (далее указан как конъюгат антитело-лекарственное средство (1)). Конъюгат антитело-лекарственное средство (1) имел значение DAR равное 7,8.
[0170]
[Пример 2: Получение композиции конъюгата антитело-лекарственное средство (1)]
Способ получения композиции (1)
Водный раствор (pH 5,8), содержащий конъюгат антитело-лекарственное средство (1) (20 мг/мл), 10 мМ гистидинового буфера, 11,1% гидрата трегалозы и 0,02% полисорбата 20, отмеривали в диализную кассету (диализная мембрана, Slide-A-lyzer, MWCO 20,000) и диализовали с буфером, содержащим эксципиент целевой композиции, при объеме, превышающем объем образца, введенного в диализную кассету, в 50 раз или более. Диализ осуществляли два раза при 5°C в течение 5 часов или больше. После диализа осуществляли соответственно концентрирование или разбавление, чтобы получить концентрацию белка около 20 мг/мл. Этот раствор фильтровали через 0,22 мкм фильтр. Отфильтрованным раствором заполняли стеклянные флаконы по 1 мл, флаконы неплотно закрывали резиновыми пробками и лиофилизацию осуществляли в условиях, показанных в Таблице 1. После лиофилизации флаконы, закрытые резиновыми пробками, герметично закрывали крышками. Процедуры фильтрования и заполнения осуществляли в чистом боксе.
[0171]
[0172]
Способ получения композиции (2)
Водный раствор (pH 5,8), содержащий конъюгат антитело-лекарственное средство (1) (20 мг/мл), 10 мМ гистидинового буфера, 11,1% гидрата трегалозы, и 0,02% полисорбата 20, распределяли в наборе UF мембран (AMICON ULTRA-15, 30кДа) и центрифугировали при 3000 об/мин и 5°C до уменьшения концентрации примерно в 2 раза. Полисорбат 20, содержащийся в концентрированном растворе, удаляли адсорбированием на гидрофобном адсорбенте (Amberlite XAD7HP). Полученный химический раствор после удаления полисорбата 20 вводили в диализную кассету (диализная мембрана, Slide-A-lyzer, MWCO 20,000) и диализовали с буфером, содержащим эксципиент целевой композиции при объеме, превышающем объем образца, введенного в диализную кассету, в 50 раз или более. Диализ осуществляли два раза при 5°C в течение 5 часов или больше. После диализа осуществляли соответственно концентрирование или разбавление, чтобы получить концентрацию белка около 20 мг/мл, и затем полисорбат 20 или полисорбат 80 добавляли к полученному раствору и смешивали. Этот раствор фильтровали через 0,22 мкм фильтр. Отфильтрованным раствором заполняли стеклянные флаконы по 1 мл, флаконы неплотно закрывали резиновыми пробками и лиофилизацию осуществляли в условиях, показанных в Таблице 2. После лиофилизации флаконы, закрытые резиновыми пробками, герметично закрывали крышками. Процедуры фильтрования и заполнения осуществляли в чистом боксе.
[0173]
[0174]
[Пример 3: Испытание стабильности]
Лиофилизированные композиции для инъекций хранили при 40°C/75% RH в течение 3 месяцев. Их стабильность сравнивали и оценивали, используя в качестве показателей концентрацию белка (измеренную УФ методом), влажность (измеренную методом Карла Фишера), нерастворимые микрочастицы (измеренные методом Micro Flow Imaging), отношение лекарственного средства к антителу (DAR) (измеренное методом ВЭЖХ), относительное содержание мономеров, агрегатов и фрагментов (измеренные методом SE-ВЭЖХ (SEC)), небелковые примеси (NPI) (измеренные методом ВЭЖХ), загрязнение полезной нагрузки (IoP) (измеренное методом ВЭЖХ), заряженные изомеры (измеренные методом капиллярного зонного электрофореза (CZE)), pH и HER2-связывающую активность (измеренную методом ELISA).
[0175]
[Пример 4: Скрининг эксципиентов]
Эксципиент лиофилизированных композиций для инъекций выбирали из 10% трегалозы гидрата, 9% сахарозы и 5% сорбита, которые действительно используются в биофармацевтике и в этих концентрациях делают осмотическое давление по существу изотоническим. Другие компоненты в лиофилизированных композициях для инъекций обычно включали конъюгат антитело-лекарственное средство (1) (20 мг/мл), 40 мМ гистидинового буфера и 0,02% полисорбата 20, и pH композиций устанавливали на уровне 5,8.
[0176]
Результаты показаны в Таблице 3. Было обнаружено, что образование агрегатов было меньше, когда использовали 9% сахарозы или 10% трегалозы гидрата по сравнению с тем, когда использовали 5% сорбита. В частности, было обнаружено, что образование агрегатов становится наименьшим, когда используют 9% сахарозы (Фиг. 3).
[0177]
(частиц/мл)
[0178]
[Пример 5: Скрининг буферов]
Буфер лиофилизированных композиций для инъекций выбирали из гистидина, лимонной кислоты, фосфорной кислоты, янтарной кислоты и глутаминовой кислоты, которые используются в биофармацевтическе и имеют буферную способность при около pH 4 -pH 7. Концентрация этих буферов была одинаковой 25 мМ. Другие компоненты в лиофилизированных композициях для инъекций обычно включали конъюгаты антитело-лекарственное средство (1) (20 мг/мл), 10% гидрата трегалозы и 0,02% полисорбата 20, и pH композиций устанавливали на уровне 5,8.
[0179]
Результаты показаны в Таблице 4. Было обнаружено, что образование агрегатов становится наименьшим, когда используют гистидин в качестве буфера (Фиг. 4).
[0180]
(частиц/мл)
[0180]
[Пример 6: Скрининг pH]
Для pH восстановленных лиофилизированных композиций для инъекций, pH выбирали из pH 4 - pH 7 с учетом использования гистидинового буфера, который был выбран путем скрининга буферов, и биосовместимости и безопасности, например, раздражения при введении путем внутривенной капельной инфузии. Другие компоненты в лиофилизированных композициях для инъекций обычно включали конъюгаты антитело-лекарственное средство (1) (20 мг/мл), 9% сахарозы и 25 мМ гистидинового буфера и 0,02% полисорбата 20. Получение образцов осуществляли способом получения композиции (1).
[0182]
Результаты показаны в Таблице 5. Было обнаружено, что с увеличением pH увеличивается количество агрегатов (Фиг. 5), и с уменьшением pH увеличивается содержание NPI (Фиг. 6). Следовательно, было обнаружено, что можно подавлять увеличение содержания агрегатов и подавлять увеличение содержания NPI с хорошим балансом, когда pH равен 5,5.
[0183]
(частиц/мл)
[0184]
[Пример 7: Тестирование концентрации буфера]
Концентрацию гистидинового буфера, который был выбран в качестве буфера лиофилизированных композиций для инъекций, выбирали из диапазона 10 мМ - 40 мМ. Другие компоненты в лиофилизированных композициях для инъекций обычно включали конъюгаты антитело-лекарственное средство (1) (20 мг/мл), 9% сахарозы и 0,02% полисорбата 20, и pH композициий был 5,5. Получение образцов осуществляли в соответствии со способом получения композиции (1).
[0185]
Результаты показаны в Таблице 6. Любой из образцов показал сопоставимую стабильность, когда концентрация гистидинового буфера была 10 мМ - 40 мМ.
[0186]
(частиц/мл)
[0187]
[Пример 8: Скрининг поверхностно-активных веществ]
Как ожидается, в лиофилизированной композиции для инъекций поверхностно-активное вещество должно служить в качестве межфазного защитного агента слоя с концентрацией белка в процессе замораживания или в качестве межфазного защитного агента против микропузырьков, образуемых в процессе повторного растворения лиофилизированного препарата. С учетом этого, 0,02% - 0,04% полисорбата 20 (Tween 20) и полисорбата 80 (Tween 80) исследовали в качестве поверхностно-активных веществ. Другие компоненты в лиофилизированных композициях для инъекций обычно включали конъюгаты антитело-лекарственное средство (1) (20 мг/мл), 9% сахарозы и 25 мМ гистидинового буфера, и pH композиций устанавливали на уровне 5,5. Получение образцов осуществляли в соответствии со способом получения композиции (2).
[0188]
Результаты показаны в Таблицах 7 и 8 (где "PS" означает полисорбат, "PS20" означает полисорбат 20 и "PS80" означает полисорбат 80. Уменьшение количества мелких частиц наблюдали при использовании 0,02% - 0,04% полисорбата 20 или 80, и было обнаружено, что использование 0,02% - 0,04% полисорбата 80 особенно уменьшает количество микрочастиц (Фиг. 7).
[0189]
(частиц/мл)
[0190]
(частиц/мл)
[0191]
[Пример 9: Исследование флаконов]
В каждый из темных стеклянных флаконов и прозрачных стеклянных флаконов загружали лиофилизированную композицию для инъекций и сравнивали и исследовали изменение качества композиции при воздействии света под белой флуоресцентной лампой 1000 люкс. Компоненты лиофилизированных композиций для инъекций обычно включали конъюгат антитело-лекарственное средство (1) (20 мг/мл), 9% сахарозы, 25 мМ гистидинового буфера и 0,02% полисорбата 20, и pH композиций устанавливали на уровне 5,5. Получение образцов осуществляли в соответствии со способом получения композиции (1).
Результаты показаны в Таблице 9. Было обнаружено, что образование агрегатов (Фиг. 8) и IoP (Фиг. 9) больше подавлялись при использовании флаконов из темного стекла по сравнению с тем, когда использовали прозрачные стеклянные флаконы.
[0192]
[0193]
[Пример 10: Установление способа лиофилизации]
Важными физическими свойствами в качестве показателей при установлении способа лиофилизации композиций для инъекций являются температура стеклования, при которой происходит замораживание (Tg') содержащего лекарственное средство водного раствора, подлежащего лиофилизации, и температура разрушения (Tc) полученной лепешки, имеющей пористую структуру, которую получают в процессе лиофилизации. Путем сушки при температуре продукта, равной или меньше чем Tg' или Tc, получают лиофилизированную массу, имеющую пористую структуру подобную лепешке. Процесс сушки в основном состоит из первой стадии сушки для сублимации свободной воды в замороженном веществе и стадию вторичной сушки для сублимации воды, связанной с растворенными веществами (связанной воды). В процессе первичной сушки целесообразно, чтобы свободная вода сублимировалась при температуре продукта, равной или меньше чем Tg', а также возможна ее сублимация при температуре продукта равной или меньше чем Tc.
Для водного раствора, включающего конъюгат антитело-лекарственное средство (1) (20 мг/мл), 9% сахарозы, 25 мМ гистидинового буфера и 0,03% полисорбата 80 и имеющего pH 5,5 (далее указан как "водный раствор (1)"), Tg' равна -31°C, и Tc равна -27°C.
Исследование способов лиофилизации осуществляли путем внесения 5,2-5,5 мл водного раствора (1) в стеклянные флаконы, имеющие объем около 10 мл.
[0194]
(1) Исследование параметров процесса первичной сушки
Наиболее важными параметрами процесса первичной сушки являются температура полки и степень вакуумирования камеры. Форма (стабильность) и способность к повторному растворению лиофилизированной лепешки и время сушки существенно зависят от этих параметров, таким образом, температуру полки в диапазоне от -20°C до 0°C и степень вакуумирования камеры в диапазоне от 5 Па до 15 Па исследовали с использованием специально разработанного экспериментального метода. Лиофилизацию осуществляли с использованием параметров, показанных в Таблице 9 (температура полки при отжиге была -7°C).
[0195]
[0196]
Фиг. 10 представляет контурную кривую температуры продукта водного раствора (1) при варьировании температуры полки и степени вакуумирования камеры в процессе первичной сушки. Температура продукта показала общую тенденцию изменения температуры продукта, характеризующуюся тем, что в условиях низкой температуры полки и высокой степени вакуумирования камеры температура продукта в процессе первичной сушки становится ниже, тогда как в условиях высокой температуры полки и низкой степени вакуумирования камеры температура продукта становится выше. При температуре полки -20°C - 0°C и степени вакуумирования камеры 5 Па - 15 Па температура продукта показала Tc или меньше. Однако было обнаружено, что частичные разрушения происходят в пористой структуре лиофилизированной лепешки при параметрах за пределами части, очерченной треугольником, и внешний вид лиофилизированной лепешки становится сжатым (усадка).
Фиг. 11 представляет контурную кривую времени сушки водного раствора (1) при варьировании температуры полки и степени вакуумирования камеры в процессе первичной сушки. Время сушки показало общую тенденцию изменения скорости сушки, характеризующуюся тем, что в условиях низкой температуры полки и высокой степени вакуумирования камеры время первичной сушки становится более долгим, тогда как в условиях высокой температуры полки и низкой степени вакуумирования камеры время сушки становится короче. Наблюдалась взаимосвязь между временем сушки и температурой продукта. Что касается параметров в области, очерченной треугольником, на контурном графике температуры продукта, было обнаружено, что можно получить лиофилизированную лепешку хорошей формы, но для этого требуется длительный процесс первичной сушки.
Поскольку желательно, чтобы форма лиофилизированной лепешки не имела усадочного состояния с точки зрения качества внешнего вида, на основании результатов этого исследования стало очевидно, что процесс первичной сушки занимает по меньшей мере 58 часов. Таким образом, был сделан вывод, что общее время лиофилизации составляет 81 час, поскольку для процесса замораживания требуется по меньшей мере 11 часов, а для процессов вторичной сушки и разгрузки требуется по меньшей мере 12 часов. Другими словами, было подсчитано, что для процесса лиофилизации требуется 3 дня или более и что время изготовления требует 5 дней при добавлении даты начала и даты окончания лиофилизации.
Однако для лиофилизации желательно недолгое время или короткий период с точки зрения эффективности производства и стоимости изготовления. Таким образом, необходимость длительного процесса лиофилизации считалась проблемой.
Чтобы решить эту проблему и получить лиофилизированную лепешку, имеющую меньшую усадку, даже когда время процесса первичной сушки сокращено, осуществляли исследование параметров отжига, сфокусированное на стадии отжига, которая, как можно ожидать, улучшит пористую структуру лиофилизированной лепешки.
[0197]
(2) Установка параметров отжига
Важным параметром в процессе отжига является температура полки. Изменяя температуру полки, можно регулировать температуру продукта замороженного вещества.
В этом исследовании осуществляли оптимизацию температуры полки при отжиге с учетом пористой структуры лиофилизированной лепешки, получаемой в результате сублимации льда в кристаллах льда. Температура полки при отжиге была традиционно установлена так, чтобы был запас безопасности с точки зрения эвтектики. Учитывая это, отжиг осуществляли при температуре полки -7°С, поскольку точка эвтектики водного раствора (1) составляет -2,5°С. Кроме того, для роста кристаллов льда в замороженном веществе и снижения устойчивости льда к сублимации, чтобы сушка проходила ровно и чтобы затем получить пористую структуру, имеющую небольшую удельную площадь поверхности, которая почти не вызывает усадки в лиофилизированной лепешке, были также предприняты попытки отжига при температуре полки выше -7°C. Соответственно, при установке диапазона температур полки при отжиге от -7°С до 0,5°С для получения пористой структуры, имеющей небольшую удельную площадь поверхности, исследовали улучшение качества по внешнему виду лиофилизированной лепешки. Лиофилизацию в этом исследовании осуществляли с использованием параметров, показанных в Таблице 11, и время первичной сушки было установлено в общей сложности около 42 часов.
[0198]
[0199]
Отжиг осуществляли при температуре полки в диапазоне от -7°C до 0,5°C. Температура продукта (при отжиге) и форма лиофилизированной лепешки, когда была осуществлена лиофилизация, показаны на Фиг. 12. Когда температуре продукта при отжиге была в диапазоне от -7,0°C до -4,6°C, наблюдали сильную усадку лиофилизированной лепешки из донной части флакона в направлении ниже, а когда температура продукта была в диапазоне от -4,2°C до -3,4°C, наблюдали небольшую усадку. Однако, когда температура продукта была в диапазоне от -2,6°C до -1,5°C, получали лиофилизированную лепешку, не имеющую никакой усадки. Исходя из этих результатов, было обнаружено, что при осуществлении отжига при температуре полки, которая ближе к эвтектической точке, усадка лиофилизированной лепешки уменьшается, а когда отжиг осуществляют при температуре полки около эвтектической точки, можно получить лиофилизированную лепешку, не имеющую никакой усадки. Кроме того, было обнаружено, что, даже когда температура продукта повышается до -1,5°C, т.е. выше эвтектической точки, твердое состояние сохраняется, и можно получить лиофилизированную лепешку нормальной формы.
Хотя отжиг обычно осуществляли при температуре полки примерно на 5°C ниже точки эвтектики, настоящее исследование показало, что путем отжига при температуре, близкой к точке эвтектики, можно получить лиофилизированную лепешку, имеющую лучший внешний вид. На основании результатов этого исследования температура отжига была установлена от -4°C до -2°C, что является температурой, близкой к точке эвтектики.
Кроме того, на основании результатов этого исследования было обнаружено, что при отжиге при температуре, близкой к точке эвтектики, время процесса первичной сушки может быть сокращено примерно на 40 часов. На основании результатов, приведенных на Фиг. 10 и 11, в качестве параметров первичной сушки были установлены температура полки -5°C и степень вакуумирования камеры 7 Па, поскольку это рассматривалось как условие, позволяющее осуществлять сушку при относительно низкой температуре продукта, и, как ожидается, может сократить время сушки примерно на 18 часов.
[0200]
(3) Установка параметров процесса вторичной сушки
Процесс вторичной сушки представляет собой процесс сушки воды, связанной с растворенным веществом (связанной воды), и общеизвестно, что степень высушивания после вторичной сушки сильно влияет на стабильность при хранении лиофилизированной композиции для инъекций. Хотя количество связанной воды можно уменьшить при осуществлении сушки при более высоких температурах, часть, представляющая собой антитело, из конъюгата антитело-лекарственное средство обычно является лабильной к нагреванию. Ввиду этого, начало термической денатурации белков измеряли при помощи капиллярного дифференциального сканирующего калориметра. Как показано на Фиг. 13, начало термической денатурации конъюгата антитело-лекарственное средство (1) происходило при 52-53°С, таким образом, сухость (остаточную влагу) оценивали при установке температуры полки вторичной сушки на 50°С или меньше.
Оценку сухости осуществляли при температуре полки процесса вторичной сушки в диапазоне от 30 до 50°С. Лиофилизацию в этом исследовании осуществляли с использованием параметров, указанных в Таблице 12.
[0201]
[0202]
Результаты анализа остаточной влаги в лиофилизированных композициях для инъекций при каждой температуре полки вторичной сушки показаны в Таблице 13. Было подтверждено, что стабильность сохраняется до тех пор, пока остаточная влага в лиофилизированной композиции для инъекции не составит 5%. Однако для достижения более высокого уровня стабильности остаточная влага в композиции была установлена на уровне 1% или менее. Хотя остаточная влага более или менее зависит от условий первичной сушки, было подтверждено, что содержание остаточной влаги становится равным 1% или менее, когда температура полки вторичной сушки находится в диапазоне от 40°С до 50°С. На основании начала термической денатурации и результатов этого исследования было установлено промежуточное значение 45°С с диапазоном от 40°С до 50°С в качестве температуры полки при вторичной сушке.
[0203]
[0204]
(4) Заключение
Эксципиенты в лиофилизированных композициях для инъекций биофармацевтических препаратов (белковые фармацевтические препараты) оказывают криопротекторное действие на белки, и для фармацевтических композиций обычно выбирают невосстанавливающие дисахариды, такие как сахароза и трегалоза, которые не имеют риска реакции Майяра во время хранения. Эти дисахариды имеют более низкие Tg' и Tc, чем у других сахаридов, поэтому для них требуется сушка при низких температурах полки, чтобы температура продукта не превышала Tg' и Tc. Таким образом, существуют проблемы, заключающиеся в том, что процесс лиофилизации становится более продолжительным и что лиофилизированная лепешка имеет тенденцию к усадке. Считалось также, что водный раствор (1) имеет те же проблемы, поэтому для решения этих проблем были осуществлены исследования первой сушки, процесса отжига и процесса вторичной сушки, и на основании результатов этих исследований способ лиофилизации водного раствора (1) был установлен так, как показано в Таблице 14. Особенностью этого способа лиофилизации являются параметры отжига, и было обнаружено, что при отжиге при температуре, близкой к точке эвтектики, лиофилизированную лепешку, имеющую существенно уменьшенную усадку, можно получить за короткий период времени.
[0205]
[0206]
Для лиофилизированных композиций для инъекций, полученных способом лиофилизации по настоящему изобретению, стабильность при хранении через 1 месяц при 50°C, 3 месяца при 40°C/75% RH, 3 месяца при 25°C/60% RH и 3 месяца при 5°C оценивали, используя в качестве показателей концентрацию белка, влажность, количество нерастворимых микрочастиц, DAR, содержание мономеров, агрегатов и фрагментов, NPI, IoP, заряженные изомеры и pH. В результате было обнаружено, что никаких существенных изменений качества не наблюдается.
[0207]
[Пример 11: Оценка длительной стабильности при хранении]
Для лиофилизированной композиции для инъекций, полученной в Примере 10, стабильность при хранении через 6 месяцев при 40°C/75% RH, 12 месяцев при 25°C/60% RH и 18 месяцев при 5°C оценивали, используя в качестве показателей концентрацию белка, влажность, количество нерастворимых микрочастиц, DAR, содержание мономеров, агрегатов и фрагментов, NPI, IoP, заряженные изомеры и pH. В результате было обнаружено, что никаких существенных изменений качества не наблюдается.
[0208]
[Пример 12: Дополнительное исследование способа лиофилизации]
(1) Установка параметров отжига
В качестве способа лиофилизации водных растворов (1) для роста кристаллов льда в замороженном веществе использовали способ отжига при поддержании температуры полки при -2,5°С в течение 120 минут. Однако было обнаружено, что в течение 120 минут не удалось повысить температуру в верхней части замороженного продукта до -2,5°С, таким образом, рост кристаллов льда становится недостаточным и лиофилизированная лепешка слегка сжимается. Кроме того, было обнаружено, что когда время отжига увеличивается до 240 минут, температура верхней части замороженного продукта достигает -2,5°С, таким образом, установленное время отжига было изменено на 4 часа. Было обнаружено, что при изменении времени отжига до 4 часов рост кристаллов льда становится достаточным, поэтому скорость сублимации воды увеличивается, а время первичной сушки сокращается.
[0209]
(2) Установка параметров процесса первичной сушки
Отжиг осуществляли при -2,5°C в течение 4 часов и параметры процесса первичной сушки исследовали для температур полки от -10°C до 15°C и степени вакуумирования камеры от 4 Па до 30 Па. Лиофилизацию осуществляли с использованием параметров, показанных в Таблице 15.
[0210]
[0211]
Когда температура полки была в диапазоне от -10°C до 10°C и степень вакуумирования камеры была 4 Па - 30 Па, температура продукта была Tc или меньше, и лиофилизированная лепешка имела форму без какой-либо усадки или разрушения.
[0212]
В частности, температура полки от -5°C до 5°C и степень вакуумирования камеры от 5 Па до 15 Па считались особенно безопасными диапазонами, а также, с учетом времени сушки, в качестве подходящих условий были установлены температура полки 0°C и степень вакуумирования камеры 10 Па, которые являются промежуточными значениями в этих диапазонах.
[0213]
(3) Заключение
На основании указанных выше результатов, способ лиофилизации водного раствора (1) был установлен, как показано в Таблице 16.
[0214]
[0215]
Для лиофилизированной композиции для инъекций, полученной способом лиофилизации по настоящему изобретению, стабильность при хранении через 3 месяца при 40°C/75% RH оценивали, используя в качестве показателей концентрацию белка, влажность, количество нерастворимых микрочастиц, DAR, содержание мономеров, агрегатов и фрагментов, NPI, IoP, заряженные изомеры и pH. Существенных изменений качества от исходного момента времени не наблюдалось.
[0216]
[Пример 13: Исследование других композиций и условий лиофилизации]
(1) Получение композиции
Активные фармацевтические ингредиенты (конъюгат антитело-лекарственное средство (1) (20 мг/мл), 25 мМ гистидина, 9% сахарозы, рН 5,5) распределяли в наборе UF мембран (AMICON ULTRA-15, 30кДа) и центрифугировали при 3000 об/мин и 5°C до уменьшения концентрации примерно в 3 раза. Полученные концентрированные активные фармацевтические ингредиенты вводили в диализную кассету (диализная мембрана, Slide-A-lyzer, MWCO 20,000) и диализовали с буфером целевой композиции до 50-кратного или более объема образца, введенного в диализную кассету. Диализ осуществляли дважды в течение более 5 часов при 5°С. После диализа осуществляли соответвенно концентрирование или разбавление, чтобы концентрация белка составила около 5 мг/мл или около 50 мг/мл, а затем добавляли полисорбат 80 и смешивали с получением водного раствора, содержащего конъюгат антитело-лекарственное средство (1) (5 мг/мл), 8% сахарозы, 20 мМ гистидинового буфера и 0,04% полисорбата 80 и имеющего рН 4,0 (далее указан как "водный раствор (2) "); водного раствора, содержащего конъюгат антитело-лекарственное средство (1) (50 мг/мл), 6% сахарозы, 40 мМ гистидинового буфера и 0,04% полисорбата 80 и имеющего рН 7,0 (далее указан как "водный раствор (3)"); водного раствора, содержащего конъюгат антитело-лекарственное средство (1) (5 мг/мл), 8% гидрата трегалозы, 20 мМ гистидинового буфера и 0,04% полисорбата 80 и имеющего рН 4,0 (далее указан как "водный раствор (4)"); и водного раствора, содержащего конъюгат антитело-лекарственное средство (1) (50 мг/мл), 6% гидрата трегалозы, 40 мМ гистидинового буфера и 0,04% полисорбата 80 и имеющего рН 7,0 (далее указан как "водный раствор (5)").
В расчете на 20 мг конъюгата антитело-лекарственное средство (1), водный раствор (2) включает 320 мг сахарозы, 80 мМ гистидинового буфера и 1,6 мг полисорбата 80; водный раствор (3) включает 24 мг сахарозы, 16 мМ гистидинового буфера и 0,16 мг полисорбата 80; водный раствор (4) включает 320 мг гидрата трегалозы, 80 мМ гистидинового буфера и 1,6 мг полисорбата 80; и водный раствор (5) включает 24 мг гидрата трегалозы, 16 мМ гистидинового буфера и 0,16 мг полисорбата 80.
Эти растворы фильтровали через 0,22 мкм фильтр. По 5 мл каждого отфильтрованного раствора вносили в темный стеклянный флакон, и, в случае лиофилизированной композиции, флаконы неплотно закрывали резиновыми пробками, и лиофилизацию осуществляли в условиях, показанных в Таблице 17. После лиофилизации флаконы, закрытые резиновыми пробками, герметично закрывали крышками.
[0217]
[0218]
(2) Испытание стабильности
Для лиофилизированных композиций для инъекций, полученных способом лиофилизации по настоящему изобретению, стабильность при хранении при 40°C/75% RH оценивали, используя в качестве показателей концентрацию белка, влажность, количество нерастворимых микрочастиц, DAR, содержание мономеров, агрегатов и фрагментов, NPI, IoP, заряженные изомеры и pH.
[0219]
[Пример 14: Исследование получения и формулирования композиции конъюгата антитело-лекарственное средство (2)]]
Руководствуясь описанием способа получения в Международной публикации № WO 2015/155998, с использованием анти-HER3 антитела (антитело, включающее тяжелую цепь, состоящую из аминокислотной последовательности, представленной SEQ ID NO: 3, и легкую цепь, состоящую из аминокислотной последовательности, представленной SEQ ID NO: 4) получали конъюгат антитело-лекарственное средство, в котором фрагмент лекарственное средство-линкер, представленный следующей формулой:
[0220]
[Формула 15]
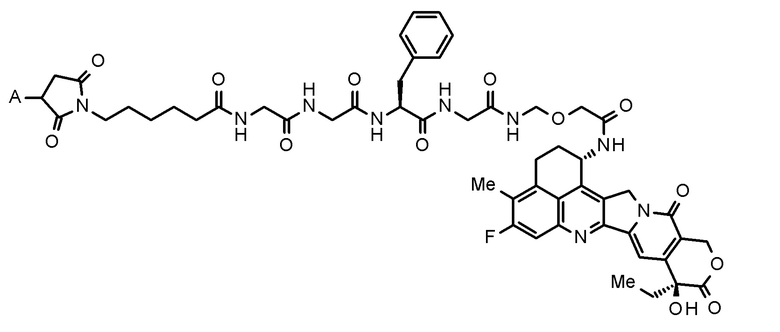
[0221]
где A представляет собой положение связывания с антителом,
конъюгирован с антителом через тиоэфирную связь (далее указан как "конъюгат антитело-лекарственное средство (2)"). DAR конъюгата антитело-лекарственное средство (2) равно 7,7.
[0222]
Для конъюгата антитело-лекарственное средство (2) скрининг композиций (20 мг/мл конъюгата антитело-лекарственное средство (2), 9% сахарозы, 25 мМ гистидинового буфера, 0,01-0,1% полисорбата 20, pH 4,9-5,9) осуществляли таким же способом, как способы Примеров 2-8. В результате было обнаружено, что водный раствор, включающий конъюгат антитело-лекарственное средство (2) (20 мг/мл), 9% сахарозы, 25 мМ гистидинового буфера и 0,03% полисорбата 20 и имеющий pH 5,4 (далее указан как "водный раствор (6)"), является предпочтительной композицией.
[0223]
[Пример 15: Исследование получения и формулирования композиции конъюгата антитело-лекарственное средство (3)]
Руководствуясь описанием способа получения в Международной публикации № WO 2015/098099, с использованием анти-TROP2 антитела (антитело, включающее тяжелую цепь, состоящую из аминокислотной последовательности, состоящей из аминокислотных остатков 20-470 SEQ ID NO: 5, и легкую цепь, состоящую из аминокислотной последовательности, состоящей из аминокислотных остатков 21-234 SEQ ID NO: 6) получали конъюгат антитело-лекарственное средство, в котором фрагмент лекарственное средство-линкер, представленный следующей формулой:
[0224]
[Формула 16]
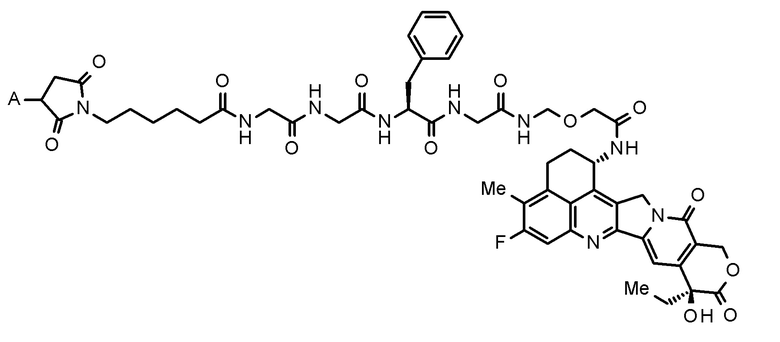
[0225]
где A представляет собой положение связывания с антителом,
конъюгирован с анти-TROP2 антителом через тиоэфирную связь (далее указан как "конъюгат антитело-лекарственное средство (3)"). DAR конъюгата антитело-лекарственное средство (3) равно 4,3.
[0226]
Для конъюгата антитело-лекарственное средство (3) скрининг композиций (конъюгат антитело-лекарственное средство (3) (20 мг/мл), сахароза (3-9%), гистидиновый буфер (3-15 мМ), полисорбат 20 или полисорбат 80 (0,01-0,1%), pH 5-7; или конъюгат антитело-лекарственное средство (3) (15-40 мг/мл), 9% сахарозы, 10 мМ гистидинового буфера, 0,02% полисорбата 80, pH 6,0) осуществляли таким же способом, как способы Примеров 2-8. В результате было обнаружено, что водный раствор, включающий конъюгат антитело-лекарственное средство (3) (20 мг/мл), 9% сахарозы, 10 мМ гистидинового буфера и 0,02% полисорбата 80 и имеющий pH 6,0 (далее указан как "водный раствор (7)"); а также водный раствор, включающий конъюгат антитело-лекарственное средство (3) (20 мг/мл), 9% сахарозы, 10 мМ гистидинового буфера и 0,03% полисорбата 80 и имеющий pH 6,0 (далее указан как "водный раствор (8)") являются предпочтительными композициями.
[0227]
[Пример 16: Исследование получения и формулирования композиции конъюгата антитело-лекарственное средство (4)]
Руководствуясь описанием способа получения в Международной публикации № WO 2014/057687, с использованием анти-B7-H3 антитела (антитело, включающее тяжелую цепь, состоящую из аминокислотной последовательности, состоящей из аминокислотных остатков 20-470 SEQ ID NO: 7, и легкую цепь, состоящую из аминокислотной последовательности, состоящей из аминокислотных остатков 21-233 SEQ ID NO: 8) получали конъюгат антитело-лекарственное средство, в котором фрагмент лекарственное средство-линкер, представленный следующей формулой:
[0228]
[Формула 17]
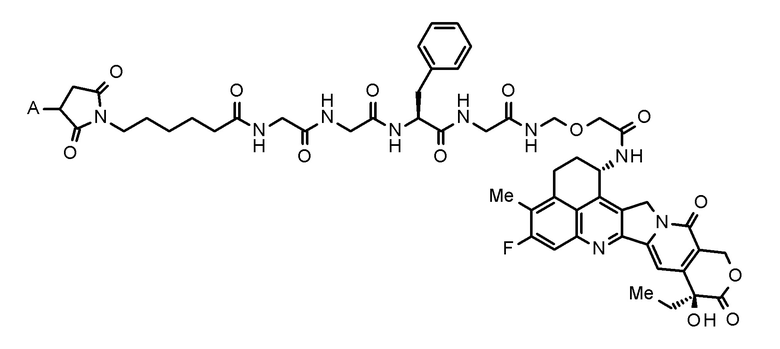
[0229]
где A представляет собой положение связывания с антителом,
конъюгирован с анти-B7-H3 антителом через тиоэфирную связь (далее указан как "конъюгат антитело-лекарственное средство (4)"). DAR конъюгата антитело-лекарственное средство (4) равно 4,6.
[0230]
Для конъюгата антитело-лекарственное средство (4) скрининг композиций (конъюгат антитело-лекарственное средство (4) (20 мг/мл), 9% сахарозы или 10% гидрата трегалозы, 10 мМ гистидинового буфера или 10 мМ сукцинатного буфера, полисорбат 20 или полисорбат 80 (0,005-0,04%), pH 5,2-6,2; или конъюгат антитело-лекарственное средство (4) (20-60 мг/мл), 9% сахарозы, 10 мМ гистидинового буфера, полисорбат 20 (0,005-0,04%), pH 5,2-6,2) осуществляли таким же способом, как способы Примеров 2-8. В результате было обнаружено, что водный раствор, включающий конъюгат антитело-лекарственное средство (4) (20 мг/мл), 9% сахарозы, 10 мМ гистидинового буфера и 0,02% полисорбата 20 и имеющий pH 5,9 (далее указан как "водный раствор (9)"); а также водный раствор, включающий конъюгат антитело-лекарственное средство (4) (20 мг/мл), 9% сахарозы, 10 мМ гистидинового буфера и 0,03% полисорбата 20 и имеющий pH 5,9 (далее указан как "водный раствор (10)") являются предпочтительными композициями.
[0231]
[Пример получения 17: Исследование получения и формулирования композиции конъюгата антитело-лекарственное средство (5)]
Руководствуясь описанием способа получения в Международной публикации № WO 2018/135501, с использованием анти-GPR20 антитела (антитело, включающее тяжелую цепь, состоящую из аминокислотной последовательности, состоящей из аминокислотных остатков 20-470 SEQ ID NO: 9, и легкую цепь, состоящую из аминокислотной последовательности, состоящей из аминокислотных остатков 21-234 SEQ ID NO: 10) получали конъюгат антитело-лекарственное средство, в котором фрагмент лекарственное средство-линкер, представленный следующей формулой:
[0232]
[Формула 18]
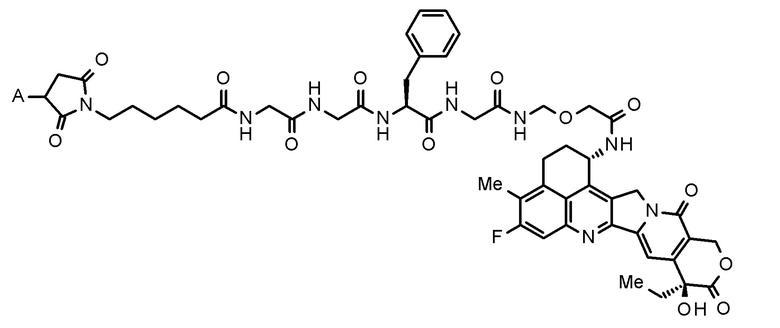
[0233]
где A представляет собой положение связывания с антителом,
конъюгирован с анти-GPR20 антителом через тиоэфирную связь (далее указан как "конъюгат антитело-лекарственное средство (5)"). DAR конъюгата антитело-лекарственное средство (5) равно 7,8.
[0234]
Для конъюгата антитело-лекарственное средство (5) скрининг композиции (конъюгат антитело-лекарственное средство (5) (20-60 мг/мл), 9% сахарозы, 10 мМ гистидинового буфера и полисорбат 80 (0,01-0,1%), pH 5,0-6,5) осуществляли таким же способом, как способы Примеров 2-8. В результате было обнаружено, что водный раствор, включающий конъюгат антитело-лекарственное средство (5) (20 мг/мл), 9% сахарозы, 10 мМ гистидинового буфера и 0,03% полисорбата 80 и имеющий pH 5,4 (далее указан как "водный раствор (11)"), является предпочтительной композицией.
[0235]
[Пример 18: Получение лиофилизированной композиции для инъекций и испытание стабильности]
Водные растворы (6) - (11), отрегулированные в Примерах 14-17, лиофилизировали таким же способом, как описано в Примерах 10 и 12, соответственно, с получением лиофилизированных композиций для инъекций.
Для этих полученных лиофилизированных композиций для инъекций стабильность при хранении через 1 месяц и 3 месяца при 40°C/75% RH оценивали, используя в качестве показателей концентрацию белка, влажность, количество нерастворимых микрочастиц, DAR, содержание мономеров, агрегатов и фрагментов, NPI, IoP, заряженные изомеры и pH. Существенных изменений качества от исходного момента времени не наблюдалось.
Текст перечня последовательностей на естественном языке
[0236]
SEQ ID NO: 1 - Аминокислотная последовательность тяжелой цепи анти-HER2 антитела
SEQ ID NO: 2 - Аминокислотная последовательность легкой цепи анти-HER2 антитела
SEQ ID NO: 3 - Аминокислотная последовательность тяжелой цепи анти-HER3 антитела
SEQ ID NO: 4 - Аминокислотная последовательность легкой цепи анти-HER3 антитела
SEQ ID NO: 5 - Аминокислотная последовательность тяжелой цепи анти-TROP2 антитела
SEQ ID NO: 6 - Аминокислотная последовательность легкой цепи анти-TROP2 антитела
SEQ ID NO: 7 - Аминокислотная последовательность тяжелой цепи анти-B7-H3 антитела
SEQ ID NO: 8 - Аминокислотная последовательность легкой цепи анти-B7-H3 антитела
SEQ ID NO: 9 - Аминокислотная последовательность тяжелой цепи анти-GPR20 антитела
SEQ ID NO: 10 - Аминокислотная последовательность легкой цепи анти-GPR20 антитела
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> DAIICHI SANKYO COMPANY, LIMITED
<120> ПОЛУЧЕНИЕ КОНЪЮГАТА АНТИТЕЛО-ЛЕКАРСТВЕННОЕ СРЕДСТВО И ЕГО
ЛИОФИЛИЗАЦИЯ
<130> DSPCT-FP1822
<150> JP2017-160071
<151> 2017-08-23
<160> 10
<170> PatentIn version 3.5
<210> 1
<211> 450
<212> Белок
<213> Искусственная последовательность
<220>
<223> Тяжелая цепь анти-HER2 антитела
<400> 1
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Asn Ile Lys Asp Thr
20 25 30
Tyr Ile His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Arg Ile Tyr Pro Thr Asn Gly Tyr Thr Arg Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Ala Asp Thr Ser Lys Asn Thr Ala Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ser Arg Trp Gly Gly Asp Gly Phe Tyr Ala Met Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val
115 120 125
Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala
130 135 140
Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser
145 150 155 160
Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val
165 170 175
Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro
180 185 190
Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys
195 200 205
Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp
210 215 220
Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly
225 230 235 240
Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile
245 250 255
Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu
260 265 270
Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His
275 280 285
Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg
290 295 300
Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys
305 310 315 320
Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu
325 330 335
Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr
340 345 350
Thr Leu Pro Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu
355 360 365
Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp
370 375 380
Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val
385 390 395 400
Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp
405 410 415
Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His
420 425 430
Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro
435 440 445
Gly Lys
450
<210> 2
<211> 214
<212> Белок
<213> Искусственная последовательность
<220>
<223> Легкая цепь анти-HER2 антитела
<400> 2
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Asp Val Asn Thr Ala
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ser Ala Ser Phe Leu Tyr Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Arg Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln His Tyr Thr Thr Pro Pro
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Arg Thr Val Ala Ala
100 105 110
Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly
115 120 125
Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala
130 135 140
Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln
145 150 155 160
Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser
165 170 175
Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr
180 185 190
Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser
195 200 205
Phe Asn Arg Gly Glu Cys
210
<210> 3
<211> 447
<212> Белок
<213> Искусственная последовательность
<220>
<223> Тяжелая цепь анти-HER3 антитела
<400> 3
Gln Val Gln Leu Gln Gln Trp Gly Ala Gly Leu Leu Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Ala Val Tyr Gly Gly Ser Phe Ser Gly Tyr
20 25 30
Tyr Trp Ser Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Ile
35 40 45
Gly Glu Ile Asn His Ser Gly Ser Thr Asn Tyr Asn Pro Ser Leu Lys
50 55 60
Ser Arg Val Thr Ile Ser Val Glu Thr Ser Lys Asn Gln Phe Ser Leu
65 70 75 80
Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys Ala
85 90 95
Arg Asp Lys Trp Thr Trp Tyr Phe Asp Leu Trp Gly Arg Gly Thr Leu
100 105 110
Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu
115 120 125
Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys
130 135 140
Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser
145 150 155 160
Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser
165 170 175
Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser
180 185 190
Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn
195 200 205
Thr Lys Val Asp Lys Arg Val Glu Pro Lys Ser Cys Asp Lys Thr His
210 215 220
Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val
225 230 235 240
Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr
245 250 255
Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu
260 265 270
Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys
275 280 285
Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser
290 295 300
Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys
305 310 315 320
Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile
325 330 335
Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro
340 345 350
Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu
355 360 365
Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn
370 375 380
Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser
385 390 395 400
Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg
405 410 415
Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu
420 425 430
His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
435 440 445
<210> 4
<211> 220
<212> Белок
<213> Искусственная последовательность
<220>
<223> Легкая цепь анти-HER3 антитела
<400> 4
Asp Ile Glu Met Thr Gln Ser Pro Asp Ser Leu Ala Val Ser Leu Gly
1 5 10 15
Glu Arg Ala Thr Ile Asn Cys Arg Ser Ser Gln Ser Val Leu Tyr Ser
20 25 30
Ser Ser Asn Arg Asn Tyr Leu Ala Trp Tyr Gln Gln Asn Pro Gly Gln
35 40 45
Pro Pro Lys Leu Leu Ile Tyr Trp Ala Ser Thr Arg Glu Ser Gly Val
50 55 60
Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr
65 70 75 80
Ile Ser Ser Leu Gln Ala Glu Asp Val Ala Val Tyr Tyr Cys Gln Gln
85 90 95
Tyr Tyr Ser Thr Pro Arg Thr Phe Gly Gln Gly Thr Lys Val Glu Ile
100 105 110
Lys Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp
115 120 125
Glu Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn
130 135 140
Phe Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu
145 150 155 160
Gln Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp
165 170 175
Ser Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr
180 185 190
Glu Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser
195 200 205
Ser Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
210 215 220
<210> 5
<211> 470
<212> Белок
<213> Искусственная последовательность
<220>
<223> Тяжелая цепь анти-TROP2 антитела
<400> 5
Met Lys His Leu Trp Phe Phe Leu Leu Leu Val Ala Ala Pro Arg Trp
1 5 10 15
Val Leu Ser Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys
20 25 30
Pro Gly Ala Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe
35 40 45
Thr Thr Ala Gly Met Gln Trp Val Arg Gln Ala Pro Gly Gln Gly Leu
50 55 60
Glu Trp Met Gly Trp Ile Asn Thr His Ser Gly Val Pro Lys Tyr Ala
65 70 75 80
Glu Asp Phe Lys Gly Arg Val Thr Ile Ser Ala Asp Thr Ser Thr Ser
85 90 95
Thr Ala Tyr Leu Gln Leu Ser Ser Leu Lys Ser Glu Asp Thr Ala Val
100 105 110
Tyr Tyr Cys Ala Arg Ser Gly Phe Gly Ser Ser Tyr Trp Tyr Phe Asp
115 120 125
Val Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys
130 135 140
Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly
145 150 155 160
Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro
165 170 175
Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr
180 185 190
Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val
195 200 205
Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn
210 215 220
Val Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys Arg Val Glu Pro
225 230 235 240
Lys Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu
245 250 255
Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp
260 265 270
Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp
275 280 285
Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly
290 295 300
Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn
305 310 315 320
Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp
325 330 335
Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro
340 345 350
Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu
355 360 365
Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Glu Glu Met Thr Lys Asn
370 375 380
Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile
385 390 395 400
Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr
405 410 415
Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys
420 425 430
Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys
435 440 445
Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu
450 455 460
Ser Leu Ser Pro Gly Lys
465 470
<210> 6
<211> 234
<212> Белок
<213> Искусственная последовательность
<220>
<223> Легкая цепь анти-TROP2 антитела
<400> 6
Met Val Leu Gln Thr Gln Val Phe Ile Ser Leu Leu Leu Trp Ile Ser
1 5 10 15
Gly Ala Tyr Gly Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser
20 25 30
Ala Ser Val Gly Asp Arg Val Thr Ile Thr Cys Lys Ala Ser Gln Asp
35 40 45
Val Ser Thr Ala Val Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro
50 55 60
Lys Leu Leu Ile Tyr Ser Ala Ser Tyr Arg Tyr Thr Gly Val Pro Ser
65 70 75 80
Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser
85 90 95
Ser Leu Gln Pro Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln His Tyr
100 105 110
Ile Thr Pro Leu Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys Arg
115 120 125
Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln
130 135 140
Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr
145 150 155 160
Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser
165 170 175
Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr
180 185 190
Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys
195 200 205
His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro
210 215 220
Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
225 230
<210> 7
<211> 471
<212> Белок
<213> Искусственная последовательность
<220>
<223> Тяжелая цепь анти-B7-H3 антитела
<400> 7
Met Lys His Leu Trp Phe Phe Leu Leu Leu Val Ala Ala Pro Arg Trp
1 5 10 15
Val Leu Ser Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys
20 25 30
Pro Gly Ser Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe
35 40 45
Thr Asn Tyr Val Met His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu
50 55 60
Glu Trp Met Gly Tyr Ile Asn Pro Tyr Asn Asp Asp Val Lys Tyr Asn
65 70 75 80
Glu Lys Phe Lys Gly Arg Val Thr Ile Thr Ala Asp Glu Ser Thr Ser
85 90 95
Thr Ala Tyr Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val
100 105 110
Tyr Tyr Cys Ala Arg Trp Gly Tyr Tyr Gly Ser Pro Leu Tyr Tyr Phe
115 120 125
Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr
130 135 140
Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser
145 150 155 160
Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu
165 170 175
Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His
180 185 190
Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser
195 200 205
Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys
210 215 220
Asn Val Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys Arg Val Glu
225 230 235 240
Pro Lys Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro
245 250 255
Glu Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys
260 265 270
Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val
275 280 285
Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp
290 295 300
Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr
305 310 315 320
Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp
325 330 335
Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu
340 345 350
Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg
355 360 365
Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Glu Glu Met Thr Lys
370 375 380
Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp
385 390 395 400
Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys
405 410 415
Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser
420 425 430
Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser
435 440 445
Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser
450 455 460
Leu Ser Leu Ser Pro Gly Lys
465 470
<210> 8
<211> 233
<212> Белок
<213> Искусственная последовательность
<220>
<223> Легкая цепь анти-B7-H3 антитела
<400> 8
Met Val Leu Gln Thr Gln Val Phe Ile Ser Leu Leu Leu Trp Ile Ser
1 5 10 15
Gly Ala Tyr Gly Glu Ile Val Leu Thr Gln Ser Pro Ala Thr Leu Ser
20 25 30
Leu Ser Pro Gly Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Ser Arg
35 40 45
Leu Ile Tyr Met His Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg
50 55 60
Pro Leu Ile Tyr Ala Thr Ser Asn Leu Ala Ser Gly Ile Pro Ala Arg
65 70 75 80
Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser
85 90 95
Leu Glu Pro Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Trp Asn Ser
100 105 110
Asn Pro Pro Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Arg Thr
115 120 125
Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu
130 135 140
Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro
145 150 155 160
Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly
165 170 175
Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr
180 185 190
Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His
195 200 205
Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val
210 215 220
Thr Lys Ser Phe Asn Arg Gly Glu Cys
225 230
<210> 9
<211> 472
<212> Белок
<213> Искусственная последовательность
<220>
<223> Тяжелая цепь анти-GPR20 антитела
<400> 9
Met Lys His Leu Trp Phe Phe Leu Leu Leu Val Ala Ala Pro Arg Trp
1 5 10 15
Val Leu Ser Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys
20 25 30
Pro Gly Ala Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe
35 40 45
Thr Ser Tyr Tyr Ile Ser Trp Ile Arg Gln Ala Pro Gly Gln Gly Leu
50 55 60
Lys Tyr Met Gly Phe Ile Asn Pro Gly Ser Gly His Thr Asn Tyr Asn
65 70 75 80
Glu Lys Phe Lys Gly Arg Val Thr Ile Thr Ala Asp Lys Ser Ser Ser
85 90 95
Thr Ala Thr Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val
100 105 110
Tyr Tyr Cys Ala Arg Gly Ala Gly Gly Phe Leu Arg Ile Ile Thr Lys
115 120 125
Phe Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Ala Ser
130 135 140
Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr
145 150 155 160
Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro
165 170 175
Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val
180 185 190
His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser
195 200 205
Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile
210 215 220
Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys Arg Val
225 230 235 240
Glu Pro Lys Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala
245 250 255
Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro
260 265 270
Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val
275 280 285
Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val
290 295 300
Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln
305 310 315 320
Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln
325 330 335
Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala
340 345 350
Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro
355 360 365
Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Glu Glu Met Thr
370 375 380
Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser
385 390 395 400
Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr
405 410 415
Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr
420 425 430
Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe
435 440 445
Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys
450 455 460
Ser Leu Ser Leu Ser Pro Gly Lys
465 470
<210> 10
<211> 234
<212> Белок
<213> Искусственная последовательность
<220>
<223> Легкая цепь анти-GPR20 антитела
<400> 10
Met Val Leu Gln Thr Gln Val Phe Ile Ser Leu Leu Leu Trp Ile Ser
1 5 10 15
Gly Ala Tyr Gly Asp Thr Gln Leu Thr Gln Ser Pro Ser Ser Leu Ser
20 25 30
Ala Ser Val Gly Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Lys Ser
35 40 45
Val Ser Thr Tyr Ile His Trp Tyr Gln Gln Lys Pro Gly Lys Gln Pro
50 55 60
Lys Leu Leu Ile Tyr Ser Ala Gly Asn Leu Glu Ser Gly Val Pro Ser
65 70 75 80
Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser
85 90 95
Ser Leu Gln Pro Glu Asp Phe Ala Asn Tyr Tyr Cys Gln Gln Ile Asn
100 105 110
Glu Leu Pro Tyr Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Arg
115 120 125
Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln
130 135 140
Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr
145 150 155 160
Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser
165 170 175
Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr
180 185 190
Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys
195 200 205
His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro
210 215 220
Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
225 230
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ АНТИ-TRBV9 АНТИТЕЛА И ЕЕ ПРИМЕНЕНИЕ | 2022 |
|
RU2826886C1 |
| СОВМЕСТНЫЕ СОСТАВЫ АНТИ-LAG3 АНТИТЕЛА И АНТИ-PD-1 АНТИТЕЛА | 2019 |
|
RU2822192C2 |
| КОНЪЮГАТЫ АНТИТЕЛ С ЛЕКАРСТВЕННЫМИ ВЕЩЕСТВАМИ И ИХ ПРИМЕНЕНИЕ ДЛЯ ЛЕЧЕНИЯ РАКОВЫХ ЗАБОЛЕВАНИЙ | 2019 |
|
RU2799547C2 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ АНТИТЕЛО К SOST, И ЕЕ ПРИМЕНЕНИЯ | 2018 |
|
RU2779430C2 |
| АНТИ-CDH6-АНТИТЕЛО И КОНЪЮГАТ АНТИ-CDH6-АНТИТЕЛО-ЛЕКАРСТВЕННОЕ СРЕДСТВО | 2018 |
|
RU2798285C2 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ АНТИТЕЛО К LAG-3, И ЕЕ ПРИМЕНЕНИЕ | 2018 |
|
RU2771384C2 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ОСНОВЕ АНТИТЕЛ К CD40 И ЕЕ ПРИМЕНЕНИЕ | 2019 |
|
RU2778572C1 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ АНТИТЕЛА К PCSK-9, И ЕЕ ПРИМЕНЕНИЕ | 2018 |
|
RU2782792C2 |
| АНТИТЕЛА К CD38 И СОСТАВЫ | 2020 |
|
RU2826957C2 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, ВКЛЮЧАЮЩАЯ ВАРИАНТ РН20 ГИАЛУРОНИДАЗЫ ЧЕЛОВЕКА, И ЛЕКАРСТВЕННОЕ СРЕДСТВО ДЛЯ ПОДКОЖНОГО ВВЕДЕНИЯ | 2020 |
|
RU2810952C2 |

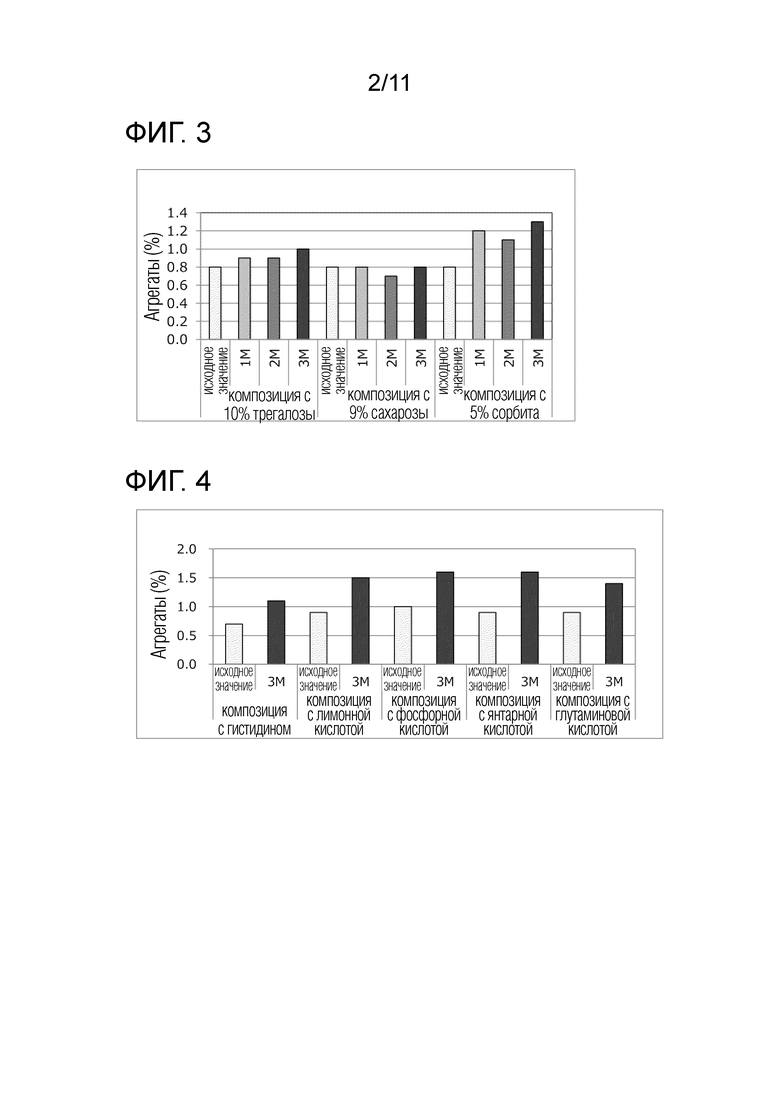
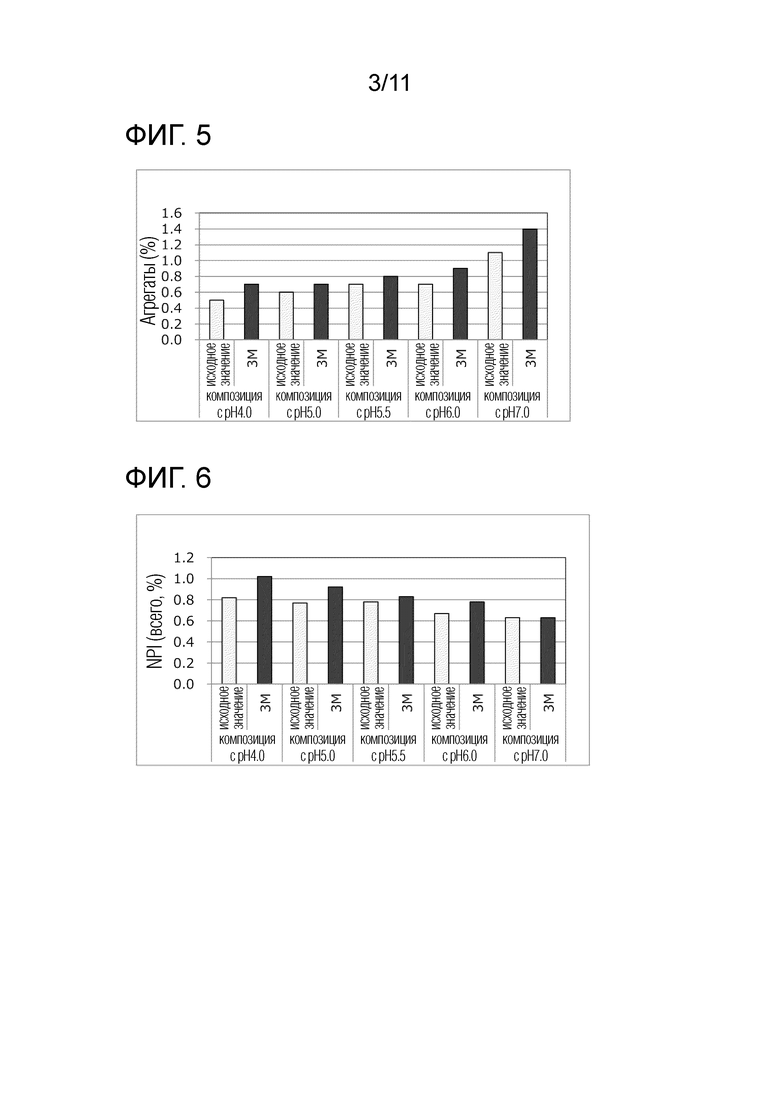
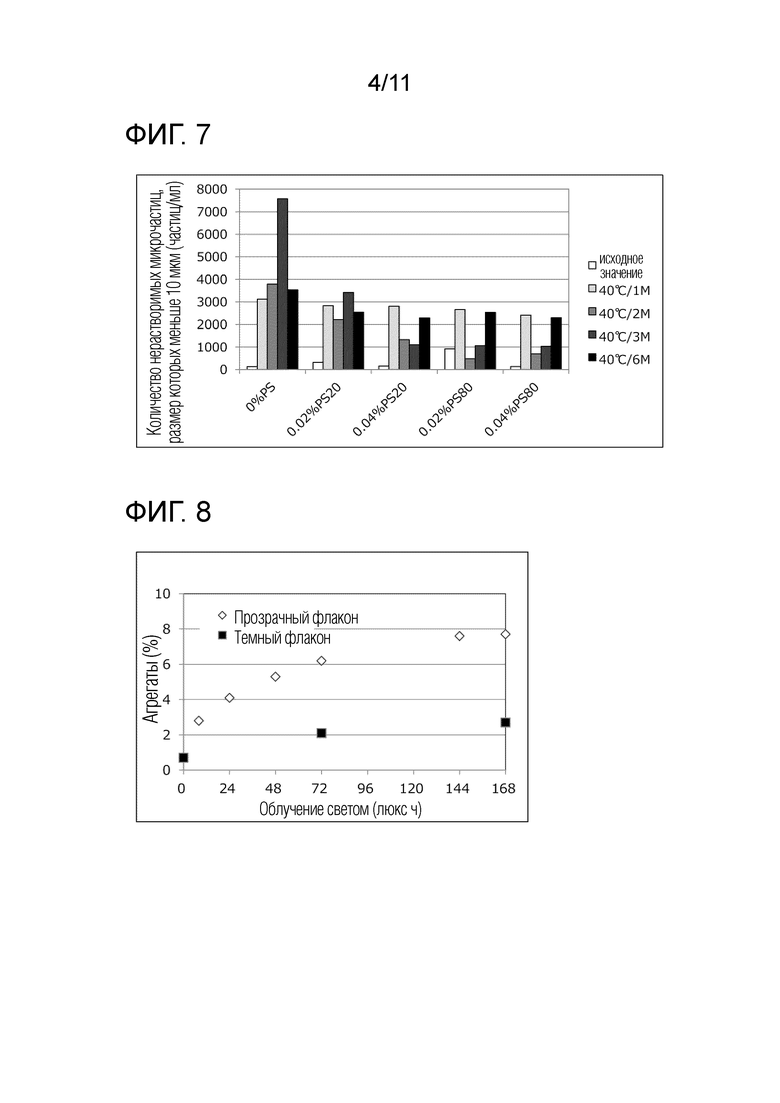
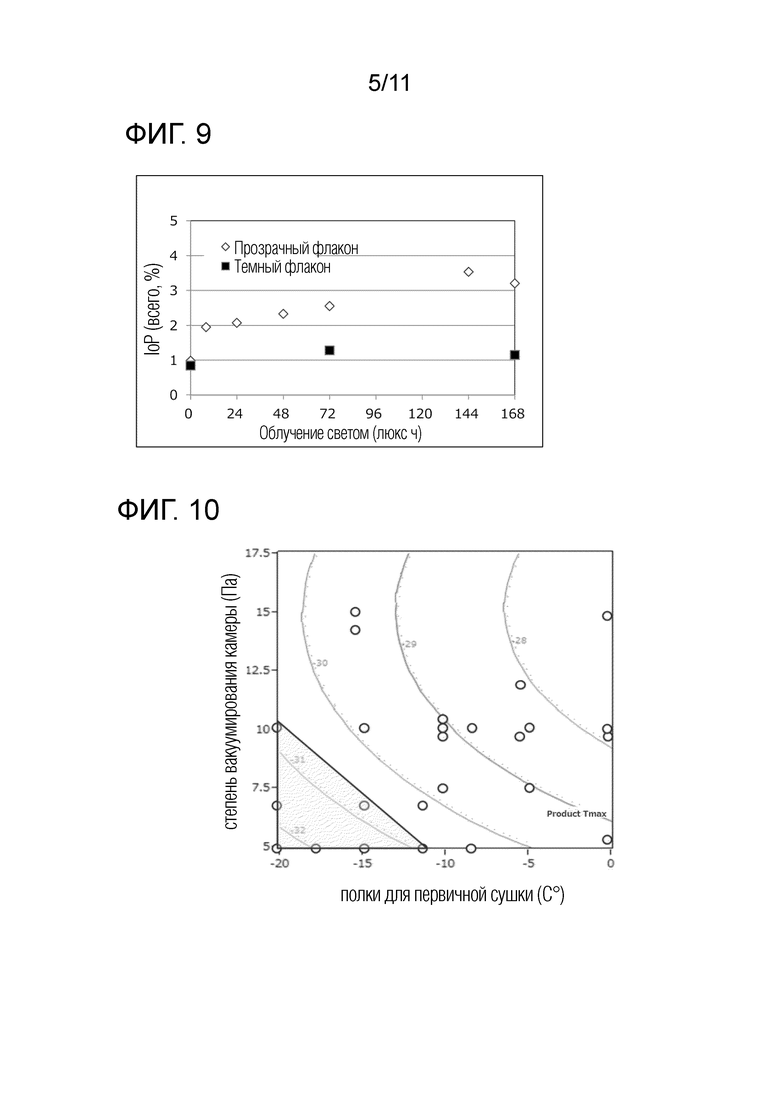
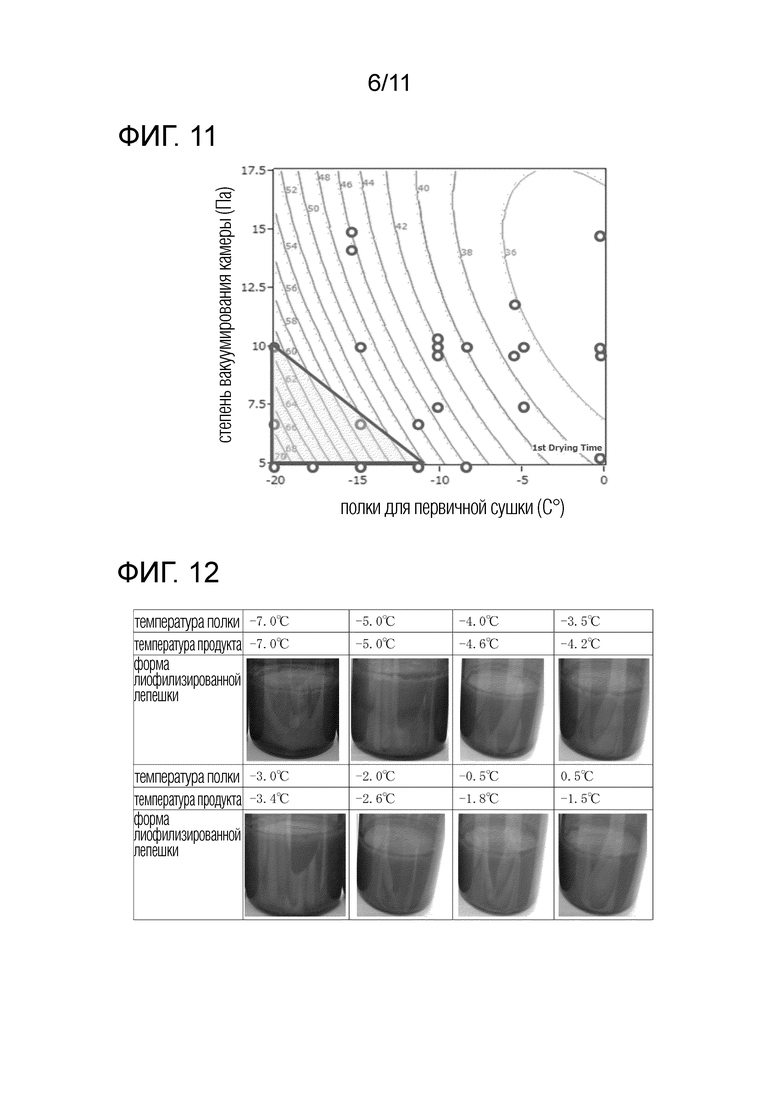
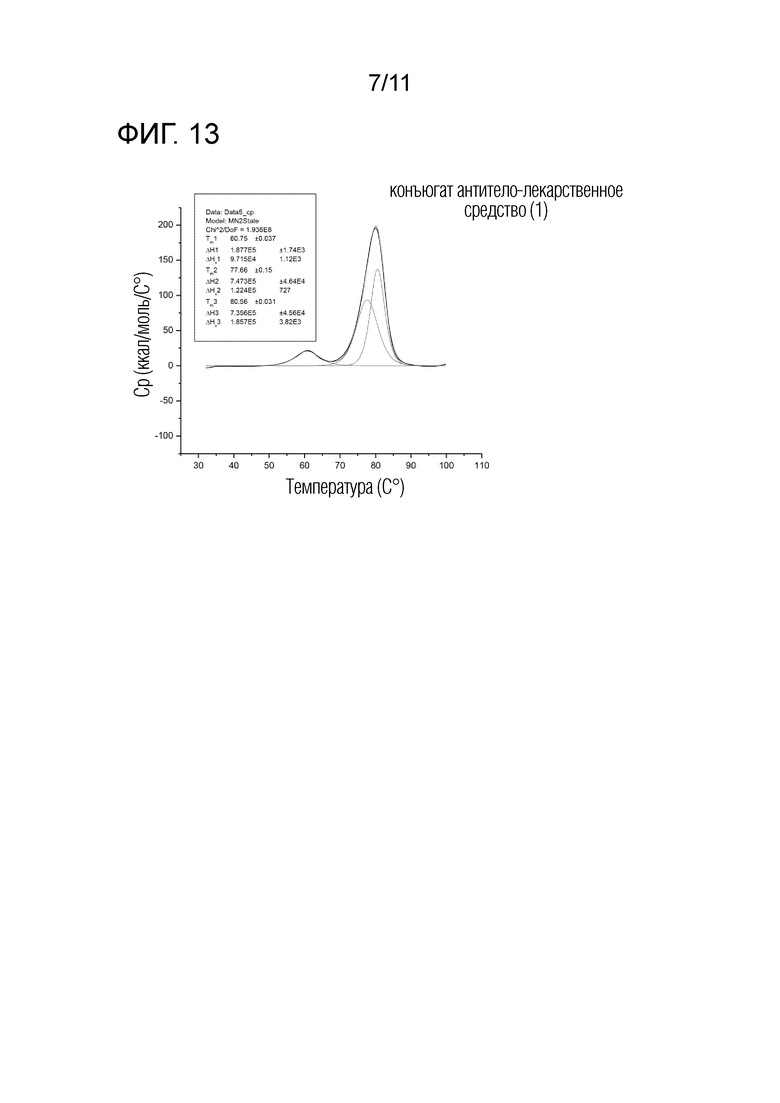




Группа изобретений относится к области медицины, а именно к фармацевтической композиции, включающей (i) конъюгат антитело-лекарственное средство, (ii) гистидиновый буфер, (iii) сахарозу и (iv) полисорбат 80 или полисорбат 20, где конъюгат антитело-лекарственное средство представляет собой конъюгат антитело-лекарственное средство, в котором фрагмент лекарственное средство-линкер, представленный следующей формулой:
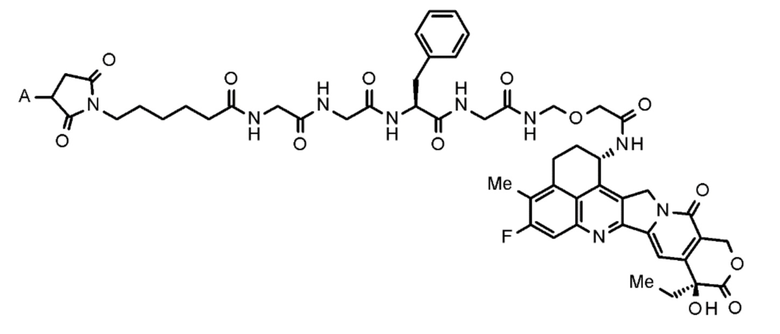 ,
,
где A представляет собой положение связывания с антителом, конъюгирован с антителом через тиоэфирную связь и где количество полисорбата 80 или полисорбата 20 составляет 0,2-0,4 мг на 20 мг конъюгата антитело-лекарственное средство, также относится к способу получения фармацевтической композиции, включающему стадии: (1) получения водного раствора, включающего (i) конъюгат антитело-лекарственное средство, (ii) гистидиновый буфер, (iii) сахарозу и (iv) полисорбат 80 или полисорбат 20, и затем (2) лиофилизацию водного раствора, также относится к способу получения фармацевтической композиции, включающему стадии: (1) получение водного раствора, включающего (i) конъюгат антитело-лекарственное средство, (ii) гистидиновый буфер, (iii) сахарозу и (iv) полисорбат 80 или полисорбат 20, (2) корректировку pH водного раствора и затем (3) лиофилизацию водного раствора. Группа изобретений обеспечивает уменьшение количества микрочастиц в композиции, содержащей конъюгат антитело-лекарственное средство. 3 н. и 46 з.п. ф-лы, 18 пр., 17 табл., 21 ил.
1. Фармацевтическая композиция, включающая
(i) конъюгат антитело-лекарственное средство,
(ii) гистидиновый буфер,
(iii) сахарозу и
(iv) полисорбат 80 или полисорбат 20,
где конъюгат антитело-лекарственное средство представляет собой конъюгат антитело-лекарственное средство, в котором фрагмент лекарственное средство-линкер, представленный следующей формулой:
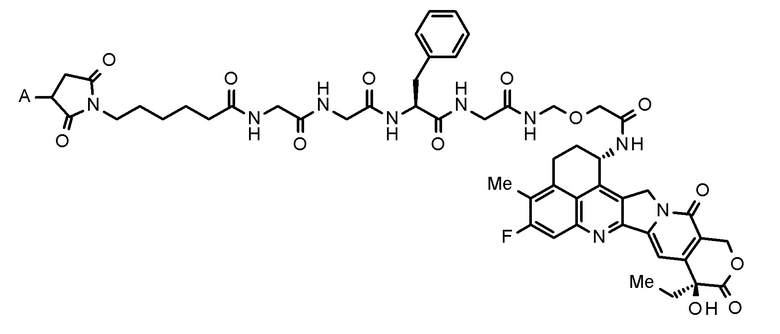
где A представляет собой положение связывания с антителом,
конъюгирован с антителом через тиоэфирную связь,
и где количество полисорбата 80 или полисорбата 20 составляет 0,2-0,4 мг на 20 мг конъюгата антитело-лекарственное средство.
2. Фармацевтическая композиция по п.1, где количество полисорбата 80 или полисорбата 20 составляет 0,2-0,3 мг на 20 мг конъюгата антитело-лекарственное средство.
3. Фармацевтическая композиция по п.2, где количество полисорбата 80 или полисорбата 20 составляет 0,2 или 0,3 мг на 20 мг конъюгата антитело-лекарственное средство.
4. Фармацевтическая композиция по любому из пп.1-3, где количество сахарозы составляет 24-320 мг на 20 мг конъюгата антитело-лекарственное средство.
5. Фармацевтическая композиция по п.4, где количество сахарозы составляет 90 мг на 20 мг конъюгата антитело-лекарственное средство.
6. Фармацевтическая композиция по любому из пп.1-5, где гистидиновый буфер представляет собой смесь L-гистидина и L-гистидина гидрохлорида.
7. Фармацевтическая композиция по п.6, где гистидиновый буфер представляет собой смесь L-гистидина и L-гистидина гидрохлорида гидрата.
8. Фармацевтическая композиция по любому из пп.1-7, где pH композиции, когда конъюгат антитело-лекарственное средство растворяют в воде при концентрации 20 мг/мл, составляет 4,0-7,0.
9. Фармацевтическая композиция по любому из пп.1-8, где антитело в конъюгате антитело-лекарственное средство представляет собой анти-HER2 антитело, анти-HER3 антитело, анти-TROP2 антитело, анти-B7-H3 антитело или анти-GPR20 антитело.
10. Фармацевтическая композиция по п.9, где антитело в конъюгате антитело-лекарственное средство представляет собой анти-HER2 антитело.
11. Фармацевтическая композиция по п.10, где анти-HER2 антитело представляет собой антитело, включающее тяжелую цепь, состоящую из аминокислотной последовательности, состоящей из аминокислотных остатков 1-449 SEQ ID NO: 1, и легкую цепь, состоящую из аминокислотной последовательности, состоящей из аминокислотных остатков 1-214 SEQ ID NO: 2, или антитело, включающее тяжелую цепь, состоящую из аминокислотной последовательности, представленной SEQ ID NO: 1, и легкую цепь, состоящую из аминокислотной последовательности, представленной SEQ ID NO: 2.
12. Фармацевтическая композиция по п.10 или 11, где среднее количество конъюгированных звеньев лекарственное средство-линкер на молекулу антитела в конъюгате антитело-лекарственное средство находится в пределах от 7 до 8.
13. Фармацевтическая композиция по любому из пп.10-12, включающая
(i) 20 мг конъюгата антитело-лекарственное средство,
(ii) 0,89 мг L-гистидина и 4,04 мг L-гистидина гидрохлорида гидрата,
(iii) 90 мг сахарозы и
(iv) 0,3 мг полисорбата 80.
14. Фармацевтическая композиция по любому из пп.10-12, включающая
(i) 100 мг конъюгата антитело-лекарственное средство,
(ii) 4,45 мг L-гистидина и 20,2 мг L-гистидина гидрохлорида гидрата,
(iii) 450 мг сахарозы и
(iv) 1,5 мг полисорбата 80.
15. Фармацевтическая композиция по п.9, где антитело в конъюгате антитело-лекарственное средство представляет собой анти-HER3 антитело.
16. Фармацевтическая композиция по п.15, где анти-HER3 антитело представляет собой антитело, включающее тяжелую цепь, состоящую из аминокислотной последовательности, представленной SEQ ID NO: 3, и легкую цепь, состоящую из аминокислотной последовательности, представленной SEQ ID NO: 4, или вариант антитела, в котором лизиновый остаток на карбокси-конце тяжелой цепи делетирован.
17. Фармацевтическая композиция по п.15 или 16, где среднее количество конъюгированных звеньев лекарственное средство-линкер на молекулу антитела в конъюгате антитело-лекарственное средство находится в пределах от 7 до 8.
18. Фармацевтическая композиция по любому из пп.15-17, включающая
(i) 20 мг конъюгата антитело-лекарственное средство,
(ii) 0,81 мг L-гистидина и 4,14 мг L-гистидина гидрохлорида гидрата,
(iii) 90 мг сахарозы и
(iv) 0,3 мг полисорбата 20.
19. Фармацевтическая композиция по любому из пп.15-17, включающая
(i) 100 мг конъюгата антитело-лекарственное средство,
(ii) 4,06 мг L-гистидина и 20,7 мг L-гистидина гидрохлорида гидрата,
(iii) 450 мг сахарозы и
(iv) 1,5 мг полисорбата 20.
20. Фармацевтическая композиция по п.9, где антитело в конъюгате антитело-лекарственное средство представляет собой анти-TROP2 антитело.
21. Фармацевтическая композиция по п.20, где анти-TROP2 антитело представляет собой антитело, включающее тяжелую цепь, состоящую из аминокислотной последовательности, состоящей из аминокислотных остатков 20-470 SEQ ID NO: 5, и легкую цепь, состоящую из аминокислотной последовательности, состоящей из аминокислотных остатков 21-234 SEQ ID NO: 6, или вариант антитела, в котором лизиновый остаток на карбокси-конце тяжелой цепи делетирован.
22. Фармацевтическая композиция по п.20 или 21, где среднее количество конъюгированных звеньев лекарственное средство-линкер на молекулу антитела в конъюгате антитело-лекарственное средство находится в пределах от 3 до 5.
23. Фармацевтическая композиция по любому из пп.20-22, включающая
(i) 20 мг конъюгата антитело-лекарственное средство,
(ii) 0,78 мг L-гистидина и 1,05 мг L-гистидина гидрохлорида гидрата,
(iii) 90 мг сахарозы и
(iv) 0,2 или 0,3 мг полисорбата 80.
24. Фармацевтическая композиция по любому из пп.20-22, включающая
(i) 100 мг конъюгата антитело-лекарственное средство,
(ii) 3,88 мг L-гистидина и 5,26 мг L-гистидина гидрохлорида гидрата,
(iii) 450 мг сахарозы и
(iv) 1,0 или 1,5 мг полисорбата 80.
25. Фармацевтическая композиция по п.9, где антитело в конъюгате антитело-лекарственное средство представляет собой анти-B7-H3 антитело.
26. Фармацевтическая композиция по п.25, где анти-B7-H3 антитело представляет собой антитело, включающее тяжелую цепь, состоящую из аминокислотной последовательности, состоящей из аминокислотных остатков 20-471 SEQ ID NO: 7, и легкую цепь, состоящую из аминокислотной последовательности, состоящей из аминокислотных остатков 21-233 SEQ ID NO: 8, или вариант антитела, в котором лизиновый остаток на карбокси-конце тяжелой цепи делетирован.
27. Фармацевтическая композиция по п.25 или 26, где среднее количество конъюгированных звеньев лекарственное средство-линкер на молекулу антитела в конъюгате антитело-лекарственное средство находится в пределах от 3 до 5.
28. Фармацевтическая композиция по любому из пп.25-27, включающая
(i) 20 мг конъюгата антитело-лекарственное средство,
(ii) 0,65 мг L-гистидина и 1,22 мг L-гистидина гидрохлорида гидрата,
(iii) 90 мг сахарозы и
(iv) 0,2 или 0,3 мг полисорбата 20.
29. Фармацевтическая композиция по любому из пп.25-27, включающая
(i) 100 мг конъюгата антитело-лекарственное средство,
(ii) 3,23 мг L-гистидина и 6,12 мг L-гистидина гидрохлорида гидрата,
(iii) 450 мг сахарозы и
(iv) 1,0 или 1,5 мг полисорбата 20.
30. Фармацевтическая композиция по п.9, где антитело в конъюгате антитело-лекарственное средство представляет собой анти-GPR20 антитело.
31. Фармацевтическая композиция по п.30, где анти-GPR20 антитело представляет собой антитело, включающее тяжелую цепь, состоящую из аминокислотной последовательности, состоящей из аминокислотных остатков 20-472 SEQ ID NO: 9, и легкую цепь, состоящую из аминокислотной последовательности, состоящей из аминокислотных остатков 21-234 SEQ ID NO: 10, или вариант антитела, в котором лизиновый остаток на карбокси-конце тяжелой цепи делетирован.
32. Фармацевтическая композиция по п.30 или 31, где среднее количество конъюгированных звеньев лекарственное средство-линкер на молекулу антитела в конъюгате антитело-лекарственное средство находится в пределах от 7 до 8.
33. Фармацевтическая композиция по любому из пп.30-32, включающая
(i) 20 мг конъюгата антитело-лекарственное средство,
(ii) 0,32 мг L-гистидина и 1,66 мг L-гистидина гидрохлорида гидрата,
(iii) 90 мг сахарозы и
(iv) 0,3 мг полисорбата 80.
34. Фармацевтическая композиция по любому из пп.30-32, включающая
(i) 100 мг конъюгата антитело-лекарственное средство,
(ii) 1,62 мг L-гистидина и 8,29 мг L-гистидина гидрохлорида гидрата,
(iii) 450 мг сахарозы и
(iv) 1,5 мг полисорбата 80.
35. Фармацевтическая композиция по любому из пп.1-34, где композиция находится в форме композиции для инъекции.
36. Фармацевтическая композиция по п.35, где композиция находится в форме водной композиции для инъекции.
37. Фармацевтическая композиция по п.36, где концентрация конъюгата антитело-лекарственное средство составляет 20 мг/мл.
38. Фармацевтическая композиция по п.36 или 37, где композиция является замороженной.
39. Фармацевтическая композиция по п.35, где композиция находится в форме лиофилизированной композиции для инъекции.
40. Фармацевтическая композиция по п.39, где композицию хранят в темном флаконе.
41. Фармацевтическая композиция по любому из пп.1-40, где композиция предназначена для лечения рака.
42. Способ получения фармацевтической композиции по п.39, включающий стадии:
(1) получения водного раствора, включающего
(i) конъюгат антитело-лекарственное средство,
(ii) гистидиновый буфер,
(iii) сахарозу и
(iv) полисорбат 80 или полисорбат 20,
и затем
(2) лиофилизацию водного раствора.
43. Способ получения фармацевтической композиции по п.39, включающий стадии:
(1) получения водного раствора, включающего
(i) конъюгат антитело-лекарственное средство,
(ii) гистидиновый буфер,
(iii) сахарозу и
(iv) полисорбат 80 или полисорбат 20,
(2) корректировку pH водного раствора, и затем
(3) лиофилизацию водного раствора.
44. Способ получения по п.42 или 43, где стадия лиофилизации водного раствора включает процесс отжига при температуре полки, которая близка к эвтектической точке водного раствора,
где близость к эвтектической точке означает диапазон от температуры, которая на 1,5°C ниже эвтектической точки, до температуры, которая на 1,5°C выше эвтектической точки.
45. Способ получения по п.44, отличающийся тем, что время процесса первичной сушки уменьшено по сравнению с тем, когда осуществляют отжиг при температуре полки, которая на 5°C ниже эвтектической точки.
46. Способ получения по п.44 или 45, отличающийся тем, что получают лиофилизированную лепешку, имеющую меньшую усадку по сравнению с той, которую получают, когда осуществляют отжиг при температуре полки, которая на 5°C ниже эвтектической точки.
47. Способ получения по п.42 или 43, где стадия лиофилизации водного раствора включает способ осуществления отжига при температуре полки от -4 до -1°C.
48. Способ получения по п.47, где стадия лиофилизации водного раствора также включает процесс первичной сушки при температуре полки от -5 до 5°C в условиях вакуума от 5 до 15 Па.
49. Способ получения по п.48, где стадия лиофилизации водного раствора также включает процесс вторичной сушки при температуре полки от 40 до 50°C в условиях вакуума от 5 до 15 Па.
| US 2014286969 A1, 25.09.2014 | |||
| US 20160333112 A1, 17.11.2016 | |||
| WO 2015155998 A1, 15.10.2015 | |||
| US 2016297890 A1, 13.10.2016 | |||
| US 2015297748 A1, 22.10.2015 | |||
| US 20100105627 A1, 29.04.2010 | |||
| WO 2017009255 A1, 19.01.2017. |
Авторы
Даты
2023-02-03—Публикация
2018-08-22—Подача