ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится к бивалентным биспецифическим моноклональным антителам (bbmAb) или их вариантам и способам получения таких антител путем совместной экспрессии так называемых модифицированных по типу "выступ во впадину" производных двух разных моноклональных антител с мутацией Fc-доменов в линиях клеток млекопитающих.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
Биспецифические антитела, т.е. антитела, связывающиеся с двумя различными эпитопами, хорошо известны из уровня техники. Одним из подходов к получению биспецифических антител является так называемый подход «выступы во впадины» (KiH), описанный, например, в Merchant et al., Nat. Biotechnol., 16:677-681 (1998), где первая тяжелая цепь IgG модифицирована так, что она отображает впадинообразную структуру, путем введения точечных мутаций, таких как Y349C, T366S, L368A, Y407V; и где вторая тяжелая цепь IgG модифицирована так, что она отображает выступообразную структуру, путем введения точечных мутаций S354C, T366W ((Merchant et al., Nat. Biotechnol., 16:677-681 (1998), page 678, table 1). Затем две разные структуры IgG взаимодействуют с образованием бивалентного биспецифического антитела (bbmAb), то есть гетеротетрамерного белка, состоящего из двух разных легких и двух разных тяжелых цепей.
При экспрессии двух KiH-модифицированных mAb в одной и той же линии клеток-хозяев желаемое bbmAb статистически составляет только 25% экспрессируемого белка, а 75% являются так называемыми технологическими примесями (Klein, Ch. et al., 2012).
В данной области техники известны некоторые подходы для преодоления этого, например, содействие правильному формированию bbmAb путем применения дополнительных модификаций последовательности для обеспечения правильного связывания H-L (для обзора см. Klein, Ch. et al., 2012; Kontermann R. and Brinkmann , U., 2015). Однако такие дополнительные модификации могут увеличить риск образования антител к лекарственным средствам.
Другой подход к получению bbmAb раскрыт в WO12023053A2 или WO04009618A2 с использованием общей тяжелой или легкой цепи в сочетании с различными вариабельными областями цепей. Однако поддержание какой-либо тяжелой цепи постоянной значительно уменьшает разнообразие репертуара антител, где можно проводить скрининг связующих средств.
Еще один подход к образованию bbmAb раскрыт в US9212230 и предусматривает отдельную экспрессию и очистку mAb, несущих различные модификации. Полученные в результате mAb в конечном итоге подвергают перетасовке in vitro, чтобы получить желаемое bbmAb. Такая перетасовка in vitro является сложной дополнительной стадией процесса, которая требует тщательной проверки и аналитической оценки и может значительно увеличить затраты.
Таким образом, существующие способы получения bbmAb могут либо ограничивать разнообразие репертуара антител, доступных для скрининга связующих средств, либо могут не обеспечивать достаточный общий выход, чистоту и качество продукта при достаточно экономически эффективном способе, позволяющем получать продукт в масштабе, приемлемом для клинической разработки и коммерциализации. Кроме того, любая модификация белковых цепей по своей природе увеличивает риск индукции образования антител к лекарственным средствам. Поэтому подходы, которые требуют минимальной белковой инженерии, могут быть клинически выгодными.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Существует необходимость в создании улучшенного способа получения бивалентных биспецифических антител. В частности, существует потребность в способе получения бивалентных биспецифических моноклональных антител (bbmAb), обеспечивающем достаточный общий выход, чистоту и качество продукта для продолжения клинической разработки и коммерческого производства при разумных затратах.
Настоящее изобретение предусматривает, помимо прочего, способ получения bbmAb с одним или несколькими из следующих преимуществ: он позволяет применять большой репертуар антител для идентификации связующих средств, так как не требуется наличие общих легких или тяжелых цепей, он не требует какой-либо обширной белковой инженерии, помимо мутации, вызывающей димеризацию H-цепи, и, следовательно, ограничивает риск образования антител к лекарственным средствам, является экономически эффективным, поскольку экспрессия осуществляется в общей линии клеток, поэтому bbmAb могут быть получены в одном процессе культивирования клеток без необходимости специальной перетасовки in vitro, и он обеспечивает получение высококачественного материала, подходящего для применения в медицинских целях, поскольку технологические примеси могут быть эффективно удалены.
Настоящее изобретение может быть применимо для идентификации антител типа каппа и лямбда, где легкие цепи не проявляют сильного неизбирательного связывания с соответствующей тяжелой цепью. Это делает антитела пригодными к применению в способах по настоящему изобретению. Преимущество способа может заключаться в том, что можно отменять отбор комбинаций антител, в которых обе легкие цепи обмениваются своими исходными партнерами по связыванию, являющимися тяжелыми цепями, что приводит к образованию технологической примеси типа H1L2-H2L1. Это является преимущественным, потому что убавлять количество таких технологических примесей, используя современные способы очистки, нелегко.
Как будет показано ниже, варианты осуществления изобретения позволяют получать bbmAb путем применения совместной экспрессии в CHO с выходом и качеством, подходящими для клинической разработки и коммерциализации биологических препаратов.
В первом аспекте настоящего изобретения предложено биспецифическое антитело, подходящее для совместной экспрессии в общей клетке-хозяине, где антитело содержит а) первую часть, которая представляет собой иммуноглобулин с вариабельной областью легкой лямбда-цепи дикого типа (VL1) и вариабельной областью тяжелой цепи дикого типа (VH1), которые специфично связываются с первой мишенью, и первой константной областью тяжелой цепи (CH1) с модификацией, обеспечивающей гетеродимеризацию, и b) вторую часть, которая представляет собой иммуноглобулин с вариабельной областью легкой каппа-цепи дикого типа (L2) и вариабельной областью тяжелой цепи дикого типа (H2), которые специфично связываются со второй мишенью, отличной от первой мишени, и второй константной областью тяжелой цепи (CH2) с модификацией, обеспечивающей гетеродимеризацию, которая является комплементарной модификации, обеспечивающей гетеродимеризацию, первой константной области тяжелой цепи, где первая часть и вторая часть при совместной экспрессии в общей клетке-хозяине образуют биспецифическое антитело.
В дополнительном варианте осуществления первого аспекта биспецифическое антитело, подходящее для совместной экспрессии в общей клетке-хозяине, после очистки биспецифического антитела путем удаления ошибочно спаренных фрагментов от биспецифического антитела с правильным спариванием представляет собой биспецифическое антитело, чистое на по меньшей мере 60% (по массе), 70% (по массе), 80% (по массе), 85% (по массе), как, например, чистое на по меньшей мере 90% (по массе), чистое на 95% (по массе), 96% (по массе), 97% (по массе), 98% (по массе) или 99% (по массе).
Первая и вторая константные области тяжелой цепи биспецифического антитела могут относиться к IgA, IgD, IgE, IgG или IgM человека, предпочтительно IgD, IgE или IgG. В предпочтительном варианте осуществления первая и вторая константные области тяжелой цепи относятся к IgG1, IgG2, IgG3 или IgG4 человека, наиболее предпочтительно IgG1. В одном варианте осуществления первая вариабельная область легкой цепи относится к типу лямбда, а вторая вариабельная область легкой цепи относится к типу каппа.
В особенно предпочтительном варианте осуществления первая вариабельная область легкой цепи относится к типу лямбда 1, а вторая вариабельная область легкой цепи относится к типу каппа 6.
Первая и вторая константные области тяжелой цепи могут относиться к IgG1, где первая константная область тяжелой цепи содержит точечные мутации, образующие структуру выступа, а вторая константная область тяжелой цепи содержит точечные мутации, образующие структуру впадины, или первая константная область тяжелой цепи содержит точечные мутации, образующие структуру впадины, а вторая константная область тяжелой цепи содержит точечные мутации, образующие структуру выступа. Необязательно, первая и вторая константные области тяжелой цепи могут дополнительно содержать мутации, которые приводят к образованию дисульфидного мостика.
В одном варианте осуществления биспецифическое антитело содержит первый домен VH1 иммуноглобулина, первый домен VL1 иммуноглобулина, второй домен VH2 иммуноглобулина и второй домен VL2 иммуноглобулина, где первый домен VH1 иммуноглобулина содержит (например, последовательно) гипервариабельные области CDR1, CDR2 и CDR3, причем указанная CDR1 имеет аминокислотную последовательность под SEQ ID NO:76, указанная CDR2 имеет аминокислотную последовательность под SEQ ID NO:77, и указанная CDR3 имеет аминокислотную последовательность под SEQ ID NO:78; или гипервариабельные области CDR1, CDR2 и CDR3, причем указанная CDR1 имеет аминокислотную последовательность под SEQ ID NO:79, указанная CDR2 имеет аминокислотную последовательность под SEQ ID NO:80, и указанная CDR3 имеет аминокислотную последовательность под SEQ ID NO:81; и первый домен VL1 иммуноглобулина содержит (например, последовательно) гипервариабельные области CDR1, CDR2 и CDR3, причем указанная CDR1 имеет аминокислотную последовательность под SEQ ID NO:92, указанная CDR2 имеет аминокислотную последовательность под SEQ ID NO:93, и указанная CDR3 имеет аминокислотную последовательность под SEQ ID NO:94, или гипервариабельные области CDR1, CDR2 и CDR3, причем указанная CDR1 имеет аминокислотную последовательность под SEQ ID NO:95, указанная CDR2 имеет аминокислотную последовательность под SEQ ID NO:96, и указанная CDR3 имеет аминокислотную последовательность под SEQ ID NO:97; второй домен VH2 иммуноглобулина содержит (например, последовательно) гипервариабельные области CDR1, CDR2 и CDR3, причем указанная CDR1 имеет аминокислотную последовательность под SEQ ID NO:44, указанная CDR2 имеет аминокислотную последовательность под SEQ ID NO:45, и указанная CDR3 имеет аминокислотную последовательность под SEQ ID NO:46; или гипервариабельные области CDR1, CDR2 и CDR3, причем указанная CDR1 имеет аминокислотную последовательность под SEQ ID NO:47, указанная CDR2 имеет аминокислотную последовательность под SEQ ID NO:48, и указанная CDR3 имеет аминокислотную последовательность под SEQ ID NO:49; и второй домен VL2 иммуноглобулина содержит (например, последовательно) гипервариабельные области CDR1, CDR2 и CDR3, причем указанная CDR1 имеет аминокислотную последовательность под SEQ ID NO:60, указанная CDR2 имеет аминокислотную последовательность под SEQ ID NO:61, и указанная CDR3 имеет аминокислотную последовательность под SEQ ID NO:62, или гипервариабельные области CDR1, CDR2 и CDR3, причем указанная CDR1 имеет аминокислотную последовательность под SEQ ID NO:63, указанная CDR2 имеет аминокислотную последовательность под SEQ ID NO:64, и указанная CDR3 имеет аминокислотную последовательность под SEQ ID NO:65.
В одном варианте осуществления биспецифическое антитело содержит первый домен VH1 иммуноглобулина, первый домен VL1 иммуноглобулина, второй домен VH2 иммуноглобулина и второй домен VL2 иммуноглобулина, где первый домен VH1 иммуноглобулина содержит аминокислотную последовательность под SEQ ID NO: 85, первый домен VL1 иммуноглобулина содержит аминокислотную последовательность под SEQ ID NO: 101, второй домен VH2 иммуноглобулина содержит аминокислотную последовательность под SEQ ID NO: 53, второй домен VL2 иммуноглобулина содержит аминокислотную последовательность под SEQ ID NO: 69.
В одном варианте осуществления биспецифическое антитело содержит первую тяжелую цепь иммуноглобулина, первую легкую цепь иммуноглобулина, вторую тяжелую цепь иммуноглобулина и вторую легкую цепь иммуноглобулина, где первая тяжелая цепь иммуноглобулина содержит аминокислотную последовательность под SEQ ID NO: 87, первая легкая цепь иммуноглобулина содержит аминокислотную последовательность под SEQ ID NO: 103, вторая тяжелая цепь иммуноглобулина содержит аминокислотную последовательность под SEQ ID NO: 55, вторая легкая цепь иммуноглобулина содержит аминокислотную последовательность SEQ ID NO: 71.
В соответствии со вторым аспектом предложен способ отбора биспецифического антитела в соответствии с первым аспектом, причем указанный способ включает: первую стадию отбора первой части и второй части; вторую стадию совместной экспрессии первой части и второй части в общей клетке-хозяине с получением в результате этого биспецифического антитела, содержащего первую часть и вторую часть; третью стадию очистки биспецифического антитела путем удаления ошибочно спаренных фрагментов от биспецифического антитела с правильным спариванием. В варианте осуществления третья стадия очистки приводит к получению биспецифического антитела, чистого на по меньшей мере 60% (по массе), 70% (по массе), 80% (по массе), 85% (по массе), как, например, чистого на по меньшей мере 90% (по массе), чистого на 95% (по массе), 96% (по массе), 97% (по массе), 98% (по массе) или 99% (по массе).
В соответствии с третьим аспектом предложен способ получения биспецифического антитела в соответствии с первым аспектом путем совместной экспрессии в общей клетке-хозяине, причем указанный способ включает: первую стадию получения по меньшей мере одного вектора, кодирующего первую часть и вторую часть; вторую стадию введения по меньшей мере одного вектора в общую клетку-хозяина; третью стадию отбора клеток, специфично экспрессирующих биспецифическое антитело; четвертую стадию культивирования отобранных клеток в условиях, в которых клетки экспрессируют биспецифическое антитело; и пятую стадию очистки биспецифического антитела, которое является чистым на по меньшей мере 60% (по массе), 70% (по массе), 80% (по массе), 85% (по массе), как, например, чистым на по меньшей мере 90% (по массе), чистым на 95% (по массе), 96% (по массе), 97% (по массе), 98% (по массе) или 99% (по массе).
В варианте осуществления первая стадия включает получение первого вектора, кодирующего первую часть, и второго вектора, кодирующего вторую часть.
В соответствии с четвертым аспектом система экспрессии содержит по меньшей мере один вектор, содержащий полинуклеотид, кодирующий первую часть или вторую часть биспецифического антитела в соответствии с первым аспектом и селектируемый маркер.
В варианте осуществления система экспрессии содержит полинуклеотид, кодирующий первый селектируемый маркер (sm I); и полинуклеотид, кодирующий второй селектируемый маркер (sm II), который отличается от первого селектируемого маркера (sm I).
В варианте осуществления первый селектируемый маркер (sm I) представляет собой переносчик фолата или полинуклеотид, кодирующий мутантный рецептор фолата, где мутантный рецептор фолата характеризуется пониженной аффинностью связывания фолата по сравнению с рецептором фолата дикого типа, и второй селектируемый маркер (sm II) представляет собой DHFR.
В варианте осуществления первый селектируемый маркер (sm I) представляет собой ген устойчивости к гигромицину, а второй селектируемый маркер (sm II) представляет собой ген устойчивости к Neo/G418.
В варианте осуществления система экспрессии содержит два вектора экспрессии, где первый вектор содержит полинуклеотид, кодирующий по меньшей мере первый селектируемый маркер (sm I), и по меньшей мере полинуклеотиды, кодирующие первую часть; и второй вектор содержит полинуклеотид, кодирующий по меньшей мере второй селектируемый маркер (sm II), и по меньшей мере полинуклеотиды, кодирующие вторую часть.
Система экспрессии может содержать стоп-кодон ниже полинуклеотидов, кодирующих тяжелую цепь, и полинуклеотид, кодирующий мембранный якорь иммуноглобулина, расположенный ниже стоп-кодона.
В соответствии с пятым аспектом предложен способ отбора общей клетки-хозяина для применения в способе в соответствии с предыдущими аспектами, включающий первую стадию получения множества клеток-хозяев, содержащих систему экспрессии в соответствии с предыдущими аспектами; и культивирование указанного множества клеток-хозяев в условиях, селективных для селектируемого маркера, за счет чего обеспечивается получение клетки-хозяина, экспрессирующей продукт, представляющий интерес.
В варианте осуществления селективная культуральная среда выбрана из группы, включающей среду, содержащую фолат в лимитирующей концентрации; и/или содержащую фолиевую кислоту в концентрации 500 нМ или меньше; и/или содержащую фолиевую кислоту в концентрации, выбранной из: 1000 нМ - 100 пМ; 100 нМ - 1 нМ; 15 нМ - 1 нМ; 10 нМ - 1 нМ и 10 нМ - 2,5 нМ; и/или содержащую ингибитор DHFR; и/или содержащую антифолат; и/или содержащую антифолат в концентрации 500 нМ или меньше; и/или содержащую МТХ в концентрации, выбранной из: 500 нМ - 3 нМ; 100 нМ - 10 нМ; 50 нМ - 10 нМ и 50 нМ; и/или содержащую антифолат в концентрации до 20-кратной относительно концентрации фолата; и/или содержащую антифолат в 10-20-кратной концентрации относительно концентрации фолата; и/или содержащую фолиевую кислоту в концентрации до 15 нМ и МТХ в концентрации от эквимолярной до 20-кратной.
В варианте осуществления клетка-хозяин содержит систему экспрессии, в которой по меньшей мере часть первой или второй части экспрессируется в виде слитого полипептида, содержащего трансмембранный якорь иммуноглобулина или его фрагмент, где указанный слитый полипептид представляется на поверхности указанной клетки-хозяина, и способ дополнительно включает стадию приведения множества клеток-хозяев в контакт с детекторным соединением, связывающим слитый полипептид; отбора по меньшей мере одной клетки-хозяина на основании наличия или количества детекторного соединения, связанного с клеточной поверхностью.
В варианте осуществления детекторное соединение содержит первую или вторую мишень или их производные и детекторную метку.
В варианте осуществления пятая стадия очистки биспецифического антитела включает аффинную хроматографию и/или ионообменную хроматографию.
В варианте осуществления хроматография включает в себя первую стадию захвата; вторую стадию заключительной очистки и необязательно третью стадию заключительной очистки.
В варианте осуществления первую стадию захвата выполняют согласно принципу, выбранному из группы, состоящей из аффинной хроматографии на основе связывания с Fc-фрагментом, как, например, с использованием белка A или белка G, аффинной хроматографии на основе специфичного связывания с легкой лямбда-цепью, хорошо известной в данной области техники и свободно доступной на рынке, например, с использованием LambdaFabSelect™, аффинной хроматографии на основе специфичного связывания с легкой каппа-цепью, хорошо известной в данной области техники и свободно доступной на рынке, например, с использованием KappaSelect™, аффинной хроматографии с использованием антиидиотипических антител, как, например, на основе связывания с первой частью или второй частью, аффинной хроматографии с использованием мишеней, такой как аффинная хроматография с использованием первой мишени или второй мишени, ионообменной хроматографии, хорошо известной в данной области и свободно доступной на рынке, как, например, с использованием Capto™ Adhere или Fractogel™ EMD SO3, и хроматографии гидрофобных взаимодействий.
В варианте осуществления вторую стадию заключительной очистки выполняют согласно принципу, выбранному из группы, состоящей из аффинной хроматографии на основе связывания с Fc-фрагментом, как, например, с использованием белка A или белка G, аффинной хроматографии на основе специфичного связывания с легкой лямбда-цепью, как, например, с использованием LambdaFabSelect™, аффинной хроматографии на основе специфичного связывания с легкой каппа-цепью, как, например, с использованием KappaSelect™, аффинной хроматографии с использованием антиидиотипических антител, как, например, на основе связывания с первой частью или второй частью, аффинной хроматографии с использованием мишеней, такой как аффинная хроматография с использованием первой мишени или второй мишени, ионообменной хроматографии, как, например, с использованием Capto™ Adhere или Fractogel™ EMD SO3, хроматографии гидрофобных взаимодействий и инактивации вирусов.
В варианте осуществления третью стадию заключительной очистки выполняют согласно принципу, выбранному из группы, состоящей из аффинной хроматографии на основе связывания с Fc-фрагментом, как, например, с использованием белка A или белка G, аффинной хроматографии на основе специфичного связывания с легкой лямбда-цепью, как, например, с использованием LambdaFabSelect™, аффинной хроматографии на основе специфичного связывания с легкой каппа-цепью, как, например, с использованием KappaSelect™, аффинной хроматографии с использованием антиидиотипических антител, как, например, на основе связывания с первой частью или второй частью, аффинной хроматографии с использованием мишеней, такой как аффинная хроматография с использованием первой мишени или второй мишени, ионообменной хроматографии, как, например, с использованием Capto™ Adhere или Fractogel™ EMD SO3, хроматографии гидрофобных взаимодействий и инактивации вирусов.
В варианте осуществления способ включает первую стадию захвата белком A, таким как MabSelect™ SuRe™, вторую стадию аффинной хроматографии на основе связывания с легкой лямбда-цепью, как, например, с использованием LambdaFabSelect™, и третью стадию аффинной хроматографии на основе связывания с легкой каппа-цепью, как, например, с использованием KappaSelect™; или первую стадию с использованием белка A, такого как MabSelect™ SuRe™, вторую стадию аффинной хроматографии на основе связывания с легкой каппа-цепью, как, например, с использованием KappaSelect™, и третью стадию аффинной хроматографии на основе связывания с легкой лямбда-цепью, как, например, с использованием LambdaFabSelect™; или первую стадию аффинной хроматографии на основе связывания с легкой каппа-цепью, как, например, с использованием KappaSelect™, и вторую стадию аффинной хроматографии на основе связывания с легкой лямбда-цепью, как, например, с использованием LambdaFabSelect™; или первую стадию аффинной хроматографии на основе связывания с легкой лямбда-цепью, как, например, с использованием LambdaFabSelect™, и вторую стадию аффинной хроматографии на основе связывания с легкой каппа-цепью, как, например, с использованием KappaSelect™.
В варианте осуществления линия клеток выбрана из группы, состоящей из клеток CHO, непродуцирующей гибридомы, такой как Sp 2/0 или NS0, линии клеток человеческого происхождения, такой как HEK или PER.C6, линии клеток, полученной из почки новорожденного хомячка (BHK), линии клеток дрожжей или нитчатых грибов, прокариотических бактерий, таких как E. coli или Pseudomonas fluorescens, линии клеток растительного происхождения, линии клеток водорослей и инфузорий.
В соответствии с шестым аспектом предложена фармацевтическая композиция, содержащая антитело в соответствии с первым аспектом и фармацевтически приемлемый носитель.
В соответствии с седьмым аспектом предложено антитело в соответствии с первым аспектом или фармацевтическая композиция в соответствии с шестым аспектом для применения в качестве лекарственного препарата.
В соответствии с седьмым аспектом предложено антитело в соответствии с первым аспектом или фармацевтическая композиция в соответствии с шестым аспектом для применения при лечении заболевания, связанного с инфламмасомами.
В соответствии с восьмым аспектом предложено антитело в соответствии с первым аспектом или фармацевтическая композиция в соответствии с шестым аспектом для применения при лечении заболевания, связанного с инфламмасомами, где заболевание, связанное с инфламмасомами, выбрано из группы, состоящей из серповидноклеточной анемии, васкулопатии, ишемического/реперфузионного повреждения, сердечно-сосудистого заболевания, заболевания периферических артерий, атеросклероза, сосудистой дисфункции, ишемии скелетных мышц, легочного саркоидоза, фиброза, малярии, гемодиализ-зависимого хронического заболевания почек и болезни Крона.
В соответствии с девятым аспектом предложен способ лечения нарушения, связанного с инфламмасомами, включающий введение субъекту, страдающему нарушением, связанным с инфламмасомами, эффективного количества антитела в соответствии с первым аспектом или фармацевтической композиции в соответствии с шестым аспектом.
Нарушение, связанное с инфламмасомами, может представлять собой серповидноклеточную анемию, васкулопатию, ишемическое/реперфузионное повреждение, сердечно-сосудистое заболевание, заболевание периферических артерий, атеросклероз, сосудистую дисфункцию, ишемию скелетных мышц, легочный саркоидоз, фиброз, малярию, гемодиализ-зависимое хроническое заболевание почек или болезнь Крона.
КРАТКОЕ ОПИСАНИЕ ФИГУР
Фиг. 1 представляет собой схематическое представление структуры вектора в соответствии с вариантом осуществления.
На фиг. 2А - 2Е показаны хроматограммы в соответствии с вариантом осуществления. Фиг. 2А представляет собой хроматограмму RP-UV дегликозилированного интактного bbmAb в соответствии с вариантом осуществления. Фиг. 2B представляет собой масс-спектр интактного дегликозилированного bbmAb1 после деконволюции в соответствии с вариантом осуществления. Фиг. 2C представляет собой хроматограмму RP-UV, на которой показаны расщепленные с помощью папаина фрагменты bbmAb в соответствии с вариантом осуществления. Фиг. 2D представляет собой хроматограмму RP-UV, на которой показаны расщепленные посредством IdeS фрагменты bbmAb в соответствии с вариантом осуществления. Фиг. 2E представляет собой хроматограмму RP-UV, на которой показаны дегликозилированные и восстановленные посредством DTT фрагменты bbmAb в соответствии с вариантом осуществления.
На фиг. 3А - 3D показаны хроматограммы RP-UV в соответствии с вариантом осуществления. Фиг. 3А представляет собой хроматограмму, на которой показан профиль чистоты экспрессии bbmAb в соответствии с вариантом осуществления после культивирования. Фиг. 3В представляет собой хроматограмму bbmAb в соответствии с вариантом осуществления после захвата посредством LambdaFabSelect™. Фиг. 3С представляет собой хроматограмму bbmAb в соответствии с вариантом осуществления после захвата посредством MabSelect™ SuRe™. Фиг. 3D представляет собой хроматограмму bbmAb в соответствии с вариантом осуществления после захвата посредством LambdaFabSelect™, заключительной очистки посредством Fractogel™ EMD SO3 и ультрафильтрации.
Фиг. 4А - 4М представляют собой схематическое представление различных вариантов ошибок спаривания в биспецифических антителах. На фиг. 4A схематично представлен мономер с выступом mAb1 (в лямбда-цепи), где цифра 1 представляет вариабельный домен тяжелой цепи, цифра 2 представляет первый константный домен тяжелой цепи, цифра 3 представляет второй константный домен тяжелой цепи, а цифра 4 представляет третий константный домен тяжелой цепи. Цифра 5 представляет вариабельный домен легкой цепи, а цифра 6 представляет вариабельный домен тяжелой цепи. На фиг. 4В схематично представлен гомодимер с выступом mAb1 (в лямбда-цепи). На фиг. 4C схематично представлен мономер со впадиной mAb2 (в каппа-цепи), где цифра 7 представляет вариабельный домен тяжелой цепи, цифра 8 представляет первый константный домен тяжелой цепи, цифра 9 представляет второй константный домен тяжелой цепи, а цифра 10 представляет третий константный домен тяжелой цепи. Цифра 11 представляет вариабельный домен легкой цепи, а цифра 12 представляет вариабельный домен тяжелой цепи. На фиг. 4D схематично представлен гомодимер со впадиной mAb2 (в каппа-цепи). На фиг. 4E схематично представлен гомодимер с выступом mAb1 с одним ошибочным спариванием CH/LC. На фиг. 4F схематично представлен гомодимер с выступом mAb1 с двумя ошибочными спариваниями CH/LC. На фиг. 4G схематично представлен гомодимер с выступом mAb1 с одним ошибочным спариванием CH/LC. На фиг. 4H схематично представлен гомодимер со впадиной mAb2 с одним ошибочным спариванием CH/LC. На фиг. 4I схематично представлен гомодимер со впадиной mAb2 с двумя ошибочными спариваниями CH/LC. На фиг. 4J схематично представлен гомодимер со впадиной mAb2 с одним ошибочным спариванием CH/LC. На фиг. 4K схематично представлено bbmAb1 с одним ошибочным спариванием в каппа-цепи (CH/LC). На фиг. 4L схематично представлен гомодимер bbmAb1 с одним ошибочным спариванием в лямбда-цепи (CH/LC). На фиг. 4M схематично представлен гомодимер bbmAb1 с двумя ошибочными спариваниями CH/LC.
На фиг. 5 показаны кривые титрования при определении аффинности на основе ECL в соответствии с примером.
На фиг. 6A - 6B показаны два графика в соответствии с примером.
На фиг. 7A - 7B показаны два графика в соответствии с примером.
На фиг. 8А - 8В показаны уровни экспрессии мРНК в соответствии с примером.
На фиг. 9A - 9B показаны уровни экспрессии мРНК в соответствии с примером.
На фиг. 10A - 10B показаны два графика в соответствии с примером.
Фиг. 11 представляет собой график, на котором показаны статистические корреляции в соответствии с примером.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение, помимо прочего, основано на неожиданном обнаружении того, что определенные антитела с легкой цепью типа лямбда (λ) можно совместно экспрессировать с определенными антителами с легкой цепью типа каппа (κ) с образованием желаемого bbmAb.
Не желая ограничиваться какой-либо теорией, полагают, что CDR каждой легкой цепи и/или тяжелой цепи могут значительно влиять на то, какую легкую цепь типа лямбда (λ) можно совместно экспрессировать с определенными антителами с легкой цепью типа каппа (κ) для успешного получения bbmAb.
Антитела с легкой цепью типа лямбда (λ), которые можно совместно экспрессировать с определенными антителами с легкой цепью типа каппа (κ) с образованием желаемого bbmAb, в дальнейшем также именуемые моноспецифическими связующими средствами, можно получать либо с помощью технологий, предлагающих возможность получения обоих типов антител типа каппа или лямбда, таких как фаг-дисплейные библиотеки, например, HuUCAL GOLD® или HuCAL PLATINUM® (MorphoSys), либо посредством использования трансгенных мышей, где соответствующие последовательности иммуноглобулина человека были введены в геном животного с помощью генной инженерии, например, с помощью антител OmniAb (OMT), Kymouse™ (Kymab), Trianni Mouse™ (Trianni) или AlivaMab Mouse (Ablexis) (ссылка) можно получать антитела типа каппа или лямбда. Способы получения таких моноспецифических связующих средств хорошо известны в экспертной области и широко применяются для получения разнообразных наборов моноспецифических связующих средств типа каппа или лямбда в отношении соответствующей мишени, представляющей интерес. Для отдельных моноспецифических связующих средств определяют характеристики соответствующих биологических параметров, таких как аффинность или активность, а также их подвергают скринингу, например, на физико-химические характеристики, имеющие отношение к оценке так называемых характеристик возможности разработки, которые также очень хорошо известны из уровня техники (например, Lorenz et al., American Pharmaceutical Review, August 2014). Моноспецифические связующие средства, которые показывают лучшие характеристики, в конечном итоге совместно экспрессируются, например, в клетках СНО, как более подробно описано ниже. Путем совместной экспрессии тестируют только те комбинации, где связывание антитела типа каппа с первой мишенью сочетается со связыванием антитела типа лямбда со второй мишенью, и наоборот. Для полученного продукта совместной экспрессии и соответствующих технологических примесей определяют подробные характеристики для отбора комбинации, которая обеспечивает получение наилучшего профиля, особенно для тех, которые демонстрируют лишь низкую степень неизбирательного связывания одной легкой цепи (например, L1, легкая цепь 1, например лямбда) с неправильной тяжелой цепью (например, H2, тяжелая цепь 2). Преимущество способа может заключаться в том, что можно отменять отбор комбинаций антител, в которых обе легкие цепи обмениваются своими исходными партнерами по связыванию, являющимися тяжелыми цепями, что приводит к образованию технологической примеси типа H1L2-H2L1. Это является преимущественным, потому что убавлять количество таких технологических примесей, используя современные способы очистки, нелегко. Процедура совместной экспрессии отдельных антител и анализа продукта совместной экспрессии описана более подробно ниже.
В качестве примеров использовали специфичные антитела, в первую очередь mAb2, которые связываются с IL-1β, с легкой цепью Vκ6, и mAb1, которые связываются с IL-18, с легкой цепью Vλ1.
В одном предпочтительном варианте осуществления использовали KiH-модификацию Fc-области двух антител согласно Ridgway et al., (1996). Также тестировали другие антитела.
Как будет показано в приведенных ниже конкретных примерах, в предпочтительном варианте осуществления bbmAb1 экспрессируется с помощью одной общей линии клеток, которая обеспечивает достаточный общий выход, чистоту и качество продукта, необходимые для биологических или диагностических исследований, для продолжения клинической разработки и коммерциализации.
1. Определения
Для целей толкования данного описания будут применяться следующие определения, и при необходимости термины, используемые в единственном числе, будут также включать множественное число, и наоборот. Дополнительные определения приведены в подробном описании.
Термин "IL-18" является синонимом полипептида IL-18, полипептида интерлейкина-18, IFN-гамма-индуцирующего фактора, или интерферон-гамма-индуцирующего фактора, или IFN-γ-индуцирующего фактора. Термин "IL-18" относится к IL-18 человека, если не указан другой вид. IL-18 хорошо известен специалистам в данной области, и, например, его можно получить у MBL® International Corporation под № продукта B001-5. Во всем данном описании термин IL-18 взаимозаменяемо охватывает как про-IL-18 (предшественник зрелого IL-18 перед расщеплением протеазой), так и зрелый IL-18 (после расщепления протеазой), если не указано, что имеется в виду про- или зрелая форма.
Термин "IL-1β" или "IL-1b" является синонимом полипептида IL-1β и полипептида интерлейкина-1β. Термин "IL-1β" относится к IL-1β человека, если не указан другой вид. IL-1β хорошо известен специалистам в данной области, и, например, его можно получить у Sino Biological под номером продукта № 10139-HNAE-5.
Термин "антитело" относится к интактному иммуноглобулину или его функциональному фрагменту. Встречающиеся в природе антитела обычно содержат тетрамер, который обычно состоит из по меньшей мере двух тяжелых (Н) цепей и из по меньшей мере двух легких (L) цепей. Каждая тяжелая цепь состоит из вариабельной области тяжелой цепи (сокращенно обозначаемой в данном документе как VH) и константной области тяжелой цепи, обычно состоящей из трех доменов (CH1, CH2 и CH3). Тяжелые цепи могут иметь любой изотип, включая IgG (подтипы IgG1, IgG2, IgG3 и IgG4), IgA (подтипы IgA1 и IgA2), IgM и IgE. Каждая легкая цепь состоит из вариабельной области легкой цепи (сокращенно обозначаемой в данном документе как VL) и константной области легкой цепи (CL). Легкая цепь включает каппа-цепи (κ) и лямбда-цепи (λ). Вариабельная область тяжелой и легкой цепи обычно отвечает за распознавание антигена, в то время как константная область тяжелой и легкой цепи может опосредовать связывание иммуноглобулина с тканями или факторами хозяина, которые включают различные клетки иммунной системы (например, эффекторные клетки) и первый компонент (Clq) классического пути активации системы комплемента. Области VH и VL могут быть дополнительно подразделены на области гипервариабельности, называемые определяющими комплементарность областями (CDR), которые чередуются с более консервативными областями, называемыми каркасными областями (FR). Каждая VH и VL состоит из трех CDR и четырех FR, расположенных от амино-конца до карбокси-конца в следующем порядке: FR1, CDR1, FR2, CDR2, FR3, CDR3, FR4. Вариабельные области тяжелой и легкой цепей содержат связывающий домен, который взаимодействует с антигеном.
Термин "антигенсвязывающая часть" антитела (или просто "антигенная часть"), используемый в данном документе, относится к полноразмерному антителу или одному или нескольким фрагментам антитела, которые сохраняют способность специфично связываться с антигенами IL-18 или IL-1β. Было показано, что антигенсвязывающую функцию антитела могут осуществлять фрагменты полноразмерного антитела. Примеры связывающих фрагментов, охватываемых термином "антигенсвязывающая часть" антитела, включают Fab-фрагмент, моновалентный фрагмент, состоящий из доменов VL, VH, CL и CH1; F(ab)2-фрагмент, бивалентный фрагмент, содержащий два Fab-фрагмента, связанные посредством дисульфидного мостика в шарнирной области; Fd-фрагмент, состоящий из доменов VH и CH1; Fv-фрагмент, состоящий из доменов VL и VH одного плеча антитела; фрагмент dAb (Ward et al., 1989 Nature 341:544-546), который состоит из домена VH; и выделенная определяющая комплементарность область (CDR).
Кроме того, хотя два домена Fv-фрагмента, VL и VH, кодируются отдельными генами, они могут быть объединены путем применения методов рекомбинации посредством гибкого линкера, который позволяет преобразовать их в единичную белковую цепь, в которой пары областей VL и VH образуют моновалентные молекулы (известные как единичная цепь Fv (scFv); см., например, Bird et al., (1988) Science 242:423-426; и Huston et al., (1988) Proc. 85:5879-5883). Предусматривается, что такие одноцепочечные антитела также охватываются термином "антигенсвязывающая часть" антитела. Эти фрагменты антител получают с помощью традиционных методик, известных специалистам в данной области, и фрагменты подвергают скринингу на пригодность таким же способом, как и интактные антитела.
Термин "выделенный" означает во всем данном описании, что иммуноглобулин, антитело или полинуклеотид, в зависимости от обстоятельств, существуют в физической среде, отличной от той, в которой они могут встречаться в природе.
Во всем данном описании определяющие комплементарность области ("CDR") определены согласно определению Kabat, если не указано, что CDR определены согласно другому определению. Точные границы аминокислотной последовательности указанной CDR могут быть определены с использованием любой из ряда широко известных схем, в том числе описанных в Kabat et al. (1991), "Sequences of Proteins of Immunological Interest," 5th Ed. Public Health Service, National Institutes of Health, Bethesda, MD (схема нумерации "Kabat"), Al-Lazikani et al., (1997) JMB 273, 927-948 (схема нумерации "Chothia") и нумерация ImMunoGenTics (IMGT) (Lefranc, M.-P., The Immunologist, 7, 132-136 (1999); Lefranc, M.-P. et al., Dev. Comp. Immunol., 27, 55-77 (2003) (схема нумерации "IMGT"). Например, в случае классических форматов согласно Kabat аминокислотные остатки CDR в вариабельном домене тяжелой цепи (VH) нумеруются как 31-35 (HCDR1), 50-65 (HCDR2) и 95-102 (HCDR3); а аминокислотные остатки CDR в вариабельном домене легкой цепи (VL) нумеруются как 24-34 (LCDR1), 50-56 (LCDR2) и 89-97 (LCDR3). Согласно Chothia аминокислоты CDR в VH нумеруются как 26-32 (HCDR1), 52-56 (HCDR2) и 95-102 (HCDR3); а аминокислотные остатки в VL нумеруются как 26-32 (LCDR1), 50-52 (LCDR2) и 91-96 (LCDR3). При объединении определений CDR согласно Kabat и согласно Chothia CDR состоят из аминокислотных остатков 26-35 (HCDR1), 50-65 (HCDR2) и 95-102 (HCDR3) в VH человека и аминокислотных остатков 24-34 (LCDR1), 50-56 (LCDR2) и 89-97 (LCDR3) в VL человека. Согласно IMGT аминокислотные остатки CDR в VH нумеруются как примерно 26-35 (CDR1), 51-57 (CDR2) и 93-102 (CDR3), а аминокислотные остатки CDR в VL нумеруются как примерно 27-32 (CDR1), 50-52 (CDR2) и 89-97 (CDR3) (нумерация в соответствии с "Kabat"). Согласно IMGT области CDR антитела можно определять с применением программы IMGT/DomainGapAlign.
Принято, что области CDR в тяжелой цепи обычно обозначаются как H-CDR1, H-CDR2 и H-CDR3, а в легкой цепи - как L-CDR1, LCDR2 и L-CDR3. Они пронумерованы последовательно в направлении от амино-конца к карбокси-концу.
Используемые в данном документе термины "моноклональное антитело" или "композиция на основе моноклональных антител" относятся к препарату из молекул антитела одного молекулярного состава. Композиция на основе моноклональных антител проявляет одну специфичность и аффинность связывания в отношении конкретного эпитопа.
Подразумевается, что термин "антитело человека", используемый в данном документе, включает в себя антитела, имеющие вариабельные области, в которых как каркасные области, так и области CDR получены из последовательностей человеческого происхождения. Кроме того, если антитело содержит константную область, то константная область также происходит из таких последовательностей человека, например, последовательностей человека зародышевого типа, или мутантных вариантов последовательностей человека зародышевого типа, или антитела, содержащего консенсусные каркасные последовательности, полученные посредством анализа каркасных последовательностей человека, например, как описано в Knappik, et al., (2000) J. Mol. Biol; 296:57-86).
Антитела человека по настоящему изобретению могут включать в себя аминокислотные остатки, не кодируемые последовательностями человека (например, мутации, введенные посредством случайного или сайт-специфического мутагенеза in vitro или посредством соматической мутации in vivo). Однако подразумевается, что используемый в данном документе термин "антитело человека" не включает антитела, в которых последовательности CDR, полученные из последовательностей зародышевого типа от другого вида млекопитающего, такого как мышь, были привиты на каркасные последовательности человека.
Термин "моноклональное антитело человека" относится к антителам, проявляющим одну специфичность связывания, которые имеют вариабельные области, в которых как каркасные области, так и области CDR получены из последовательностей человека.
Термин "рекомбинантное антитело человека", используемый в данном документе, включает все антитела человека, получаемые, экспрессируемые, создаваемые или выделяемые посредством рекомбинантных способов, такие как антитела, выделенные из животного (например, мыши), которое является трансгенным или трансхромосомным по генам иммуноглобулинов человека, или гибридомы, полученной из него, антитела, выделенные из клетки-хозяина, трансформированной для экспрессии антитела человека, например, из трансфектомы, антитела, выделенные из рекомбинантной комбинаторной библиотеки антител человека, и антитела, получаемые, экспрессируемые, создаваемые или выделяемые с помощью любых других способов, которые включают сплайсинг всего гена иммуноглобулина человека или его части. Такие рекомбинантные антитела человека имеют вариабельные области, в которых каркасные области и CDR-области получены из последовательностей иммуноглобулина человека зародышевого типа. Однако в определенных вариантах осуществления такие рекомбинантные антитела человека могут быть подвергнуты мутагенезу in vitro (или, в случае применения животного, трансгенного по последовательностям Ig человека, соматическому мутагенезу in vivo), и, таким образом, аминокислотные последовательности областей VH и VL рекомбинантных антител представляют собой последовательности, которые, хотя и получены из последовательностей VH и VL человека зародышевого типа или родственны им, могут не существовать в естественных условиях в репертуаре антител человека зародышевого типа in vivo.
Фразы "антитело, распознающее антиген" и "антитело, специфичное в отношении антигена" используются в данном документе взаимозаменяемо с термином "антитело, которое специфично связывается с антигеном".
Предполагается, что используемый в данном документе термин "связывающая молекула, которая специфично связывается с IL-18", относится к связывающей молекуле, которая связывается с IL-18 человека с KD 100 нМ или меньше, 10 нМ или меньше, 1 нМ или меньше.
Предполагается, что используемый в данном документе термин "связывающая молекула, которая специфично связывается с IL-1β", относится к связывающей молекуле, которая связывается с IL-1β человека с KD 100 нМ или меньше, 10 нМ или меньше, 1 нМ или меньше.
Предполагается, что термин связывающая молекула, которая "перекрестно реагирует с антигеном, отличным от IL-18", относится к связывающей молекуле, которая связывается с этим антигеном с KD 100 нМ или меньше, 10 нМ или меньше, 1 нМ или меньше. Предполагается, что термин "связывающая молекула, которая перекрестно реагирует с антигеном, отличным от IL-1β", относится к связывающей молекуле, которая связывает этот антиген с KD 100 нМ или меньше, 10 нМ или меньше, 1 нМ или меньше.
Предполагается, что термин "связывающая молекула, которая не вступает в перекрестную реакцию с конкретным антигеном", относится к связывающей молекуле, которая демонстрирует практически невыявляемое связывание с этими белками в стандартных анализах связывания.
Предполагается, что используемый в данном документе термин "антагонист" относится к связывающей молекуле, которая ингибирует активность передачи сигнала в присутствии активирующего соединения. Например, в случае IL-18 антагонист IL-18 будет связывающей молекулой, ингибирующей активность передачи сигнала в присутствии IL-18 в анализе клеток человека, таком как анализ IL-18-зависимого продуцирования интерферона-гамма (IFN-γ) в клетках крови человека. Примеры анализа IL-18-зависимого продуцирования IFN-γ в клетках крови человека более подробно описаны в примерах ниже.
Термин "бивалентное биспецифическое антитело" или "бивалентные биспецифические антитела" относится к антителам, которые связываются с двумя различными мишенями, такими как IL-18 и IL-1β.
Биспецифические антитела представляют собой "гетеродимеры", что означает, что одна часть происходит от первого антитела, специфичного для первой мишени, а другая часть - от второго антитела, специфичного для второй мишени. "Модификация, обеспечивающая гетеродимеризацию" представляет собой модификацию одной или обеих частей антител, образующих гетеродимерное биспецифическое антитело, предназначенную для способствования такому образованию. Примером модификаций, обеспечивающих гетеродимеризацию, Fc-доменов двух частей IgG1 антител, предназначенных для образования биспецифического антитела, является "выступ" с объемной боковой цепью аминокислоты (aa) (S354C, T366W) в первой тяжелой цепи и "впадина" с небольшими боковыми цепями аминокислот (Y349C, T366S, L368A, Y407V), которая была введена во вторую тяжелую цепь, а также дополнительный дисульфидный мостик в области CH3, соединяющий обе тяжелые цепи (Merchant et al., Nat. Biotechnol., 16:677-681 (1998), page 678, table 1).
Предполагается, что используемый в данном документе термин "антитело без агонистической активности" относится к связывающей молекуле, которая значительно не повышает активность передачи сигнала, зависимую от мишени, в отсутствие и/или в присутствии мишени в клеточном анализе, как, например, в случае IL-18 значительно не увеличивает IL-18-зависимую активность передачи сигнала в отсутствие и/или в присутствии IL-18 в анализе продуцирования IFN-γ в клетках крови человека. Такие анализы описаны более подробно в примерах ниже.
Предполагается, что термины "Kassoc" или "Ka", используемые в данном документе, относятся к скорости ассоциации для конкретного взаимодействия связывающая молекула-антиген, тогда как термины "Kdis" или "Kd", используемые в данном документе, как предполагается, относятся к скорости диссоциации для конкретного взаимодействия связывающая молекула-антиген. Предполагается, что термин "KD", используемый в данном документе, относится к константе диссоциации, которую получают из отношения Kd к Ka (т.е. Kd/Ka) и которая выражена в виде молярной концентрации (М). Значения KD для антител можно определить с помощью способов, хорошо известных из уровня техники. Способ определения KD антитела реализуется с помощью поверхностного плазмонного резонанса, как, например, в системе Biacore®.
Используемый в данном документе термин "аффинность" относится к силе взаимодействия между связывающей молекулой и антигеном в отдельных антигенных сайтах.
Используемый в данном документе термин "высокая аффинность" для антитела относится к антителу, которое характеризуется KD, составляющей 1 нМ или меньше, в отношении антигена-мишени.
Используемый в данном документе термин "субъект" включает в себя человека или отличное от человека животное.
Термин "отличное от человека животное" включает всех позвоночных, например, млекопитающих и отличных от млекопитающих животных, как, например, приматов, отличных от человека, овец, собак, кошек, лошадей, коров, кур, земноводных и пресмыкающихся.
Используемый в данном документе термин "оптимизированная нуклеотидная последовательность" означает, что данная нуклеотидная последовательность была изменена таким образом, чтобы она кодировала аминокислотную последовательность с использованием кодонов, которые являются предпочтительными в продуцирующей клетке или организме, обычно в эукариотической клетке, например, клетке Pichia pastoris, клетке яичника китайского хомячка (CHO) или клетке человека. Оптимизированную нуклеотидную последовательность конструируют таким образом, чтобы полностью сохранить аминокислотную последовательность, изначально кодируемую первоначальной нуклеотидной последовательностью, которая также известна как "исходная" последовательность. Оптимизированные последовательности в данном документе были сконструированы так, чтобы иметь кодоны, которые являются предпочтительными в клетках СНО млекопитающих; однако в данном документе также предусматривается оптимизированная экспрессия этих последовательностей в других эукариотических клетках.
Термин "идентичность" относится к сходству между по меньшей мере двумя различными последовательностями. Эта идентичность может быть выражена как процентная идентичность и определена с помощью стандартных алгоритмов выравнивания, например, средства поиска основного локального выравнивания (BLAST) (Altshul et al., (1990) J Mol Biol; 215:403-410); алгоритма Needleman et al., (1970) J Mol Biol; 48:444-453 или алгоритма Meyers et al., (1988) Comput Appl Biosci; 4:11-17. Набором параметров может быть весовая матрица Blosum 62 со штрафом за открытие гэпа 12, штрафом за продолжение гэпа 4 и штрафом за сдвиг рамки гэпа 5. Процентную идентичность двух аминокислотных или нуклеотидных последовательностей можно также определить с помощью алгоритма E. Meyers и W. Miller, (1989) CABIOS; 4(1):1-17, который был включен в программу ALIGN (версия 2.0), с применением таблицы весов замен остатков PAM 120, штрафа за продолжение гэпа 12 и штрафа за открытие гэпа 4. Процентная идентичность обычно рассчитывается путем сравнения последовательностей одинаковой длины.
Термин "иммунный ответ" относится к действию, например, лимфоцитов, антигенпрезентирующих клеток, фагоцитарных клеток, гранулоцитов и растворимых макромолекул, продуцируемых вышеуказанными клетками или печенью (в том числе антител, цитокинов и системы комплемента), которое приводит к селективному повреждению, уничтожению или удалению из организма человека инвазивных патогенов, клеток или тканей, инфицированных патогенами, раковых клеток, или, в случае аутоиммунной реакции или патологического воспаления, нормальных клеток или тканей человека.
"Путь передачи сигнала" или "активность передачи сигнала" относится к биохимической причинно-следственной связи, обычно инициируемой белок-белковым взаимодействием, таким как связывание фактора роста с рецептором, которое приводит к передаче сигнала от одной части клетки к другой части клетки. Обычно передача включает специфичное фосфорилирование одного или нескольких остатков тирозина, серина или треонина в одном или нескольких белках в серии реакций, вызывающих передачу сигнала. Предпоследние процессы обычно включают ядерные события, приводящие к изменению экспрессии генов.
Термин "нейтрализует" и его грамматические варианты означают во всем данном описании, что биологическая активность мишени снижается полностью или частично в присутствии связывающего белка или антитела, в зависимости от обстоятельств.
Термин "нуклеиновая кислота" или "полинуклеотид" относится к дезоксирибонуклеиновой кислоте (ДНК) или рибонуклеиновой кислоте (РНК) и их полимерам в однонитевой или двухнитевой форме. Если специально не ограничено, то данный термин охватывает нуклеиновые кислоты, содержащие известные аналоги природных нуклеотидов, которые обладают свойствами связывания, сходными со свойствами эталонной нуклеиновой кислоты, и метаболизируются посредством механизма, сходного с механизмом для встречающихся в природе нуклеотидов. Если не указано иное, конкретная последовательность нуклеиновой кислоты также косвенно охватывает ее варианты с консервативными модификациями (например, с заменами вырожденными кодонами), аллели, ортологи, SNP и комплементарные последовательности, а также явно указанную последовательность. В частности, замены вырожденными кодонами можно осуществлять путем получения последовательностей, в которых в третьем положении одного или нескольких выбранных (или всех) кодонов произведена замена любым из канонических оснований и/или остатками дезоксиинозина (Batzer et al., Nucleic Acid Res. 19:5081 (1991); Ohtsuka et al., J. Biol. Chem. 260:2605-2608 (1985); и Rossolini et al., Mol. Cell. Probes 8:91-98 (1994)).
Нуклеотид в "полинуклеотиде" или "нуклеиновой кислоте" может содержать модификации, в том числе модификации оснований, такие как бромуридиновые и инозиновые производные, модификации рибозы, такие как фосфотиоат, фосфодитиоат, фосфоселеноат, фосфодиселеноат, фосфоранилотиоат, фосфоранилидат и фосфорамидат.
Термин "вектор" означает любую молекулу или объект (например, нуклеиновую кислоту, плазмиду, бактериофаг или вирус), который подходит для трансформации или трансфекции клетки-хозяина и содержит последовательности нуклеиновых кислот, которые направляют и/или контролируют (вместе с клеткой-хозяином) экспрессию одной или нескольких гетерологичных кодирующих областей, функционально связанных с ними.
Термин "совместная экспрессия" означает, что разные полипептиды экспрессируются вместе в одной клетке-хозяине, общей для всех полипептидов. Совместная экспрессия биспецифического антитела означает, что различные части, образующие функциональное биспецифическое антитело, экспрессируются в одной общей клетке-хозяине. Совместная экспрессия может быть достигнута путем включения нескольких векторов экспрессии в клетку-хозяина, в которой происходит экспрессия, как, например, по одному вектору для каждой половины биспецифического антитела, или путем включения одного вектора экспрессии, кодирующего все части биспецифического антитела.
Термин "ошибочно спаренный" означает, что различные части предполагаемого белкового комплекса, такого как биспецифическое антитело, не связываются в комплекс, как предполагалось, что означает, что белковый комплекс не выглядит или не ведет себя так, как предполагалось. Примеры ошибочного спаривания применительно к биспецифическому антителу показаны на рисунке 4.
"Консервативный вариант" последовательности, кодирующей связывающую молекулу, антитело или его фрагмент, относится к последовательности, содержащей консервативные модификации аминокислот. Предполагается, что термин "консервативные модификации аминокислот" относится к модификациям аминокислот, которые не оказывают значительного влияния на характеристики связывания антитела, содержащего аминокислотную последовательность, или не изменяют их. Такие консервативные модификации включают аминокислотные замены, добавления и делеции. Консервативные аминокислотные замены представляют собой замены, при которых аминокислотный остаток заменяется аминокислотным остатком, имеющим сходную боковую цепь. Семейства аминокислотных остатков, имеющих сходные боковые цепи, были определены в уровне техники. Эти семейства включают аминокислоты с основными боковыми цепями (например, лизин, аргинин, гистидин), кислыми боковыми цепями (например, аспарагиновая кислота, глутаминовая кислота), незаряженными полярными боковыми цепями (например, глицин, аспарагин, глутамин, серин, треонин, тирозин, цистеин, триптофан), неполярными боковыми цепями (например, аланин, валин, лейцин, изолейцин, пролин, фенилаланин, метионин), бета-разветвленными боковыми цепями (например, треонин, валин, изолейцин) и ароматическими боковыми цепями (например, тирозин, фенилаланин, триптофан, гистидин). Модификации могут быть введены в связывающий белок по настоящему изобретению с помощью стандартных методик, известных из уровня техники, таких как сайт-направленный мутагенез и ПЦР-опосредованный мутагенез. Консервативная замена аминокислот также может охватывать не встречающиеся в природе аминокислотные остатки, которые обычно включаются посредством химического синтеза пептидов, а не посредством синтеза в биологических системах. Не встречающиеся в природе аминокислоты включают без ограничения пептидомиметические, перевернутые или инвертированные формы аминокислотных фрагментов.
Термин "эпитоп" представляет собой часть антигена, которая распознается иммунной системой, как, например, антителом или его фрагментом. В рамках настоящего описания термин "эпитоп" используется взаимозаменяемо как для конформационных эпитопов, так и для линейных эпитопов. Конформационный эпитоп состоит из прерывистых участков аминокислотной последовательности антигена, в то время как линейный эпитоп образован непрерывной последовательностью аминокислот антигена.
Термины "лечить", "лечит", "лечение", "предупреждать", "предупреждает" или "предупреждение" включают терапевтическое лечение, профилактическое лечение и применения, при которых снижается риск развития у субъекта нарушения или другого фактора риска. Лечение не требует полного излечения нарушения и включает уменьшение симптомов или основных факторов риска. Как используется в данном документе, антитело человека или его фрагмент содержит вариабельные области тяжелой или легкой цепи или полноразмерные тяжелые или легкие цепи, которые являются "продуктом" или "полученными из" конкретной последовательности зародышевого типа, если вариабельные области или полноразмерные цепи антитела получены из системы, в которой используются гены иммуноглобулинов человека зародышевого типа. Такие системы предусматривают иммунизацию трансгенной мыши, несущей гены иммуноглобулинов человека, антигеном, представляющим интерес, или скрининг библиотеки генов иммуноглобулинов человека, представленных на фаге, с использованием антигена, представляющего интерес. Антитело человека или его фрагмент, которое является "продуктом" или "полученным из" последовательности иммуноглобулина человека зародышевого типа, может быть идентифицировано в качестве такового посредством сравнения аминокислотной последовательности антитела человека с аминокислотными последовательностями иммуноглобулинов человека зародышевого типа и отбора последовательности иммуноглобулина человека зародышевого типа, которая является наиболее близкой по последовательности (т. е. имеет наибольший % идентичности) к последовательности антитела человека. Антитело человека, которое является "продуктом" или "полученным из" конкретной последовательности иммуноглобулина человека зародышевого типа, может содержать отличия в аминокислотах по сравнению с последовательностью зародышевого типа вследствие, например, естественных соматических мутаций или преднамеренного введения сайт-направленной мутации. Тем не менее, отобранное антитело человека, как правило, является на по меньшей мере 90% идентичным по аминокислотной последовательности аминокислотной последовательности, кодируемой геном иммуноглобулина человека зародышевого типа, и содержит аминокислотные остатки, которые идентифицируют антитело человека как человеческое по сравнению с аминокислотными последовательностями иммуноглобулина зародышевого типа других видов (например, последовательностями зародышевого типа мыши). В определенных случаях антитело человека может быть на по меньшей мере 60%, 70%, 80%, 90%, или на по меньшей мере 95%, или даже на по меньшей мере 96%, 97%, 98% или 99% идентичным по аминокислотной последовательности аминокислотной последовательности, кодируемой геном иммуноглобулина зародышевого типа. Как правило, у антитела человека, полученного из конкретной последовательности человека зародышевого типа, будут проявляться отличия не более чем по 10 аминокислотам от аминокислотной последовательности, кодируемой геном иммуноглобулина человека зародышевого типа. В определенных случаях у антитела человека может проявляться отличие не более чем по 5 или даже не более чем по 4, 3, 2 или 1 аминокислоте от аминокислотной последовательности, кодируемой геном иммуноглобулина зародышевого типа.
Антитела человека могут быть получены посредством ряда способов, известных специалистам в данной области. Антитела человека могут быть получены посредством гибридомного способа с использованием линий клеток миеломы человека или гетеромиеломы мыши и человека (Kozbor, J. Immunol; (1984) 133:3001; Brodeur, Monoclonal Isolated Antibody Production Techniques and Applications, pp 51-63, Marcel Dekker Inc, 1987). Альтернативные способы включают применение фаговых библиотек или трансгенных мышей, при этом в обоих из них используются репертуары вариабельных областей антител человека (Winter G; (1994) Annu Rev Immunol 12:433-455, Green LL, (1999) J Immunol Methods 231:11-23).
В настоящее время доступно несколько линий трансгенных мышей, в которых локусы их генов иммуноглобулинов мыши заменены генными сегментами иммуноглобулинов человека (Tomizuka K, (2000) Proc Natl Acad Sci, 97:722-727; Fishwild DM (1996) Nature Biotechnol 14:845 - 851; Mendez MJ, (1997) Nature Genetics 15:146-156). После антигенной стимуляции такие мыши способны продуцировать репертуар антител человека, из которого могут быть отобраны представляющие интерес антитела. Особо следует отметить систему Trimera™ (Eren R et al, (1988) Immunology 93:154-161), где лимфоциты человека трансплантируют облученным мышам, систему выделения отобранных антител из лимфоцитов (SLAM, Babcook et al, Proc Natl Acad Sci (1996) 93:7843-7848), где лимфоциты человека (или других видов) подвергаются эффективной обширной объединенной процедуре получения выделенных антител in vitro с последующей процедурой деконволюции, предельного разведения и отбора, и Xenomouse™ (Abgenix Inc). Альтернативный подход доступен от Morphotek Inc с использованием технологии Morphodoma™.
Технологию фагового дисплея можно применять для получения антител человека и их фрагментов (McCafferty; (1990) Nature, 348:552-553 и Griffiths AD et al (1994) EMBO 13:3245-3260). Согласно этой методике гены вариабельного домена выделенного антитела клонируют в рамке в основной или минорный ген белковой оболочки нитевидного бактериофага, такого как M13 или fd, и представляют (обычно с помощью хелперного фага) в виде функционально изолированных фрагментов антитела на поверхности фаговой частицы. Отбор на основе функциональных свойств выделенного антитела приводит к отбору гена, кодирующего выделенное антитело, проявляющее эти свойства. Методику фагового дисплея можно применять для отбора антигенспецифичных антител из библиотек, состоящих из В-клеток человека, взятых у людей, страдающих заболеванием или нарушением, или, в качестве альтернативы, у неиммунизированных доноров-людей (Marks; J Mol Bio (1991) 222:581-591). Если требуется интактное выделенное антитело человека, содержащее Fc-домен, необходимо повторно клонировать фрагмент, полученный посредством методики фагового дисплея, в векторы экспрессии млекопитающих, содержащие желаемые константные области, и создать стабильно экспрессирующие линии клеток.
Методику созревания аффинности (Marks; Biotechnol (1992) 10:779-783) можно применять для обеспечения аффинности связывания, при которой аффинность первичного выделенного антитела человека улучшается путем последовательной замены вариабельных областей цепей H и L на встречающиеся в природе варианты и отбора на основе улучшенной аффинности связывания. В настоящее время также доступны варианты этой методики, такие как "эпитопный импринтинг" (WO 93/06213; Waterhouse; Nucl Acids Res (1993) 21:2265-2266).
Термин "чистый", используемый применительно к очищенному биспецифическому антителу, относится к чистоте и идентичности различных комбинаций биспецифических антител и конструкций после совместной экспрессии в выбранных клетках в условиях, в которых клетки экспрессируют биспецифическое антитело, и после очистки с помощью белка A с использованием подхода масс-скрининга посредством UPLC-MS для интактных белков. "Чистый" или "чистота" относится к относительному количественному определению образованных гетеро- и гомодимеров bbmAb. При применении способа по настоящему изобретению можно было наблюдать правильно образованные гетеродимерные bbmAb1 и bbmAb2 с относительной чистотой более 85% на основании интенсивности сигнала массы интактного белка.
2. Антитело к IL-18
Особенно предпочтительными антителами к IL-18 или их антигенсвязывающими фрагментами, которые применяются в раскрытых способах, являются антитела человека.
Для удобства поиска аминокислотные последовательности гипервариабельных областей специфичного антитела к IL-18, называемого mAb1, на основе определения Kabat и определения Chothia, а также доменов VL и VH и полных тяжелых и легких цепей представлены в таблице 1 ниже.
Таблица 1. Аминокислотные последовательности гипервариабельных областей (CDR), вариабельных доменов (VH и VL) и полных цепей mAb1. ДНК, кодирующая VL mAb1, представлена под SEQ ID NO:18. ДНК, кодирующая VH mAb1, представлена под SEQ ID NO:8.
В одном варианте осуществления антитело к IL-18 или его антигенсвязывающий фрагмент содержат по меньшей мере один вариабельный домен тяжелой цепи (VH) иммуноглобулина, содержащий гипервариабельные области CDR1, CDR2 и CDR3, причем указанная CDR1 имеет аминокислотную последовательность под SEQ ID NO:1, указанная CDR2 имеет аминокислотную последовательность под SEQ ID NO:2, и указанная CDR3 имеет аминокислотную последовательность под SEQ ID NO:3. В одном варианте осуществления антитело к IL-18 или его антигенсвязывающий фрагмент содержат по меньшей мере один вариабельный домен тяжелой цепи (VH) иммуноглобулина, содержащий гипервариабельные области CDR1, CDR2 и CDR3, причем указанная CDR1 имеет аминокислотную последовательность под SEQ ID NO:4, указанная CDR2 имеет аминокислотную последовательность под SEQ ID NO:5, и указанная CDR3 имеет аминокислотную последовательность под SEQ ID NO:6.
В одном варианте осуществления антитело к IL-18 или его антигенсвязывающий фрагмент содержат по меньшей мере один вариабельный домен легкой цепи (VL) иммуноглобулина, содержащий гипервариабельные области CDR1, CDR2 и CDR3, причем указанная CDR1 имеет аминокислотную последовательность под SEQ ID NO:11, указанная CDR2 имеет аминокислотную последовательность под SEQ ID NO:12, и указанная CDR3 имеет аминокислотную последовательность под SEQ ID NO:13. В одном варианте осуществления антитело к IL-18 или его антигенсвязывающий фрагмент содержат по меньшей мере один вариабельный домен легкой цепи (VL) иммуноглобулина, содержащий гипервариабельные области CDR1, CDR2 и CDR3, причем указанная CDR1 имеет аминокислотную последовательность под SEQ ID NO:14, указанная CDR2 имеет аминокислотную последовательность под SEQ ID NO:15, и указанная CDR3 имеет аминокислотную последовательность под SEQ ID NO:16.
В одном варианте осуществления антитело к IL-18 или его антигенсвязывающий фрагмент содержат по меньшей мере один домен VH иммуноглобулина и по меньшей мере один домен VL иммуноглобулина, где: а) домен VH иммуноглобулина содержит (например, последовательно) i) гипервариабельные области CDR1 , CDR2 и CDR3, причем указанная CDR1 имеет аминокислотную последовательность под SEQ ID NO:1, указанная CDR2 имеет аминокислотную последовательность под SEQ ID NO:2, и указанная CDR3 имеет аминокислотную последовательность под SEQ ID NO:3; или ii) гипервариабельные области CDR1, CDR2 и CDR3, причем указанная CDR1 имеет аминокислотную последовательность под SEQ ID NO:4, указанная CDR2 имеет аминокислотную последовательность под SEQ ID NO:5, и указанная CDR3 имеет аминокислотную последовательность под SEQ ID NO:6; и b) домен VL иммуноглобулина содержит (например, последовательно) i) гипервариабельные области CDR1, CDR2 и CDR3, причем указанная CDR1 имеет аминокислотную последовательность под SEQ ID NO:11, указанная CDR2 имеет аминокислотную последовательность под SEQ ID NO:12, и указанная CDR3 имеет аминокислотную последовательность под SEQ ID NO:13, или ii) гипервариабельные области CDR1, CDR2 и CDR3, причем указанная CDR1 имеет аминокислотную последовательность под SEQ ID NO:14, указанная CDR2 имеет аминокислотную последовательность под SEQ ID NO:15, и указанная CDR3 имеет аминокислотную последовательность под SEQ ID NO:16.
В одном варианте осуществления антитело к IL-18 или его антигенсвязывающий фрагмент содержат а) вариабельный домен тяжелой цепи (VH) иммуноглобулина, содержащий аминокислотную последовательность, представленную под SEQ ID NO:7; b) вариабельный домен легкой цепи (VL) иммуноглобулина, содержащий аминокислотную последовательность, представленную под SEQ ID NO:17; c) домен VH иммуноглобулина, содержащий аминокислотную последовательность, представленную под SEQ ID NO:7, и домен VL иммуноглобулина, содержащий аминокислотную последовательность, представленную под SEQ ID NO:17; d) домен VH иммуноглобулина, содержащий гипервариабельные области, представленные под SEQ ID NO:1, SEQ ID NO:2 и SEQ ID NO:3; e) домен VL иммуноглобулина, содержащий гипервариабельные области, представленные под SEQ ID NO:11, SEQ ID NO:12 и SEQ ID NO:13; f) домен VH иммуноглобулина, содержащий гипервариабельные области, представленные под SEQ ID NO:4, SEQ ID NO:5 и SEQ ID NO:6; g) домен VL иммуноглобулина, содержащий гипервариабельные области, представленные под SEQ ID NO:14, SEQ ID NO:15 и SEQ ID NO:16; h) домен VH иммуноглобулина, содержащий гипервариабельные области, представленные под SEQ ID NO:1, SEQ ID NO:2 и SEQ ID NO:3, и домен VL иммуноглобулина, содержащий гипервариабельные области, представленные под SEQ ID NO:11, SEQ ID NO:12 и SEQ ID NO:13; i) домен VH иммуноглобулина, содержащий гипервариабельные области, представленные под SEQ ID NO:4, SEQ ID NO:5 и SEQ ID NO:6, и домен VL иммуноглобулина, содержащий гипервариабельные области, представленные под SEQ ID NO:14, SEQ ID NO:15 и SEQ ID NO:16; j) легкую цепь, содержащую SEQ ID NO:19; k) тяжелую цепь, содержащую SEQ ID NO:9; или l) легкую цепь, содержащую SEQ ID NO:19, и тяжелую цепь, содержащую SEQ ID NO:9.
В некоторых вариантах осуществления антитело к IL-18 или его антигенсвязывающий фрагмент (например, mAb1) содержат три CDR под SEQ ID NO:7. В других вариантах осуществления антитело к IL-18 или его антигенсвязывающий фрагмент содержат три CDR под SEQ ID NO:17. В других вариантах осуществления антитело к IL-18 или его антигенсвязывающий фрагмент содержат три CDR под SEQ ID NO:7 и три CDR под SEQ ID NO:17. В некоторых вариантах осуществления антитело к IL-18 или его антигенсвязывающий фрагмент содержат три CDR под SEQ ID NO:9. В других вариантах осуществления антитело к IL-18 или его антигенсвязывающий фрагмент содержат три CDR под SEQ ID NO:19. В других вариантах осуществления антитело к IL-18 или его антигенсвязывающий фрагмент содержат три CDR под SEQ ID NO:9 и три CDR под SEQ ID NO:19.
В одном варианте осуществления антитело к IL-18 или его антигенсвязывающий фрагмент (например, mAb1) выбраны из антитела человека к IL-18, которое содержит по меньшей мере а) тяжелую цепь иммуноглобулина или ее фрагмент, которые содержат вариабельный домен, содержащий последовательно гипервариабельные области CDR1, CDR2 и CDR3 и константную часть тяжелой цепи человека или ее фрагмент; причем указанная CDR1 имеет аминокислотную последовательность под SEQ ID NO:1, указанная CDR2 имеет аминокислотную последовательность под SEQ ID NO:2, и указанная CDR3 имеет аминокислотную последовательность под SEQ ID NO:3; и b) легкую цепь иммуноглобулина или ее фрагмент, которые содержат вариабельный домен, содержащий последовательно гипервариабельные области CDR1, CDR2 и CDR3 и константную часть легкой цепи человека или ее фрагмент, причем указанная CDR1 имеет аминокислотную последовательность под SEQ ID NO:11, указанная CDR2 имеет аминокислотную последовательность под SEQ ID NO:12, и указанная CDR3 имеет аминокислотную последовательность под SEQ ID NO:13.
В одном варианте осуществления антитело к IL-18 или его антигенсвязывающий фрагмент (например, mAb1) выбраны из антитела человека к IL-18, которое содержит по меньшей мере а) тяжелую цепь иммуноглобулина или ее фрагмент, которые содержат вариабельный домен, содержащий последовательно гипервариабельные области CDR1, CDR2 и CDR3 и константную часть тяжелой цепи человека или ее фрагмент; причем указанная CDR1 имеет аминокислотную последовательность под SEQ ID NO:4, указанная CDR2 имеет аминокислотную последовательность под SEQ ID NO:5, и указанная CDR3 имеет аминокислотную последовательность под SEQ ID NO:6; и b) легкую цепь иммуноглобулина или ее фрагмент, которые содержат вариабельный домен, содержащий последовательно гипервариабельные области CDR1, CDR2 и CDR3 и константную часть легкой цепи человека или ее фрагмент, причем указанная CDR1 имеет аминокислотную последовательность под SEQ ID NO:14, указанная CDR2 имеет аминокислотную последовательность под SEQ ID NO:15, и указанная CDR3 имеет аминокислотную последовательность под SEQ ID NO:16.
В одном варианте осуществления антитело к IL-18 или его антигенсвязывающий фрагмент выбраны из одноцепочечного антитела или его антигенсвязывающего фрагмента, которые содержат антигенсвязывающий участок, содержащий: а) первый домен, содержащий последовательно гипервариабельные области CDR1, CDR2 и CDR3, причем указанная CDR1 имеет аминокислотную последовательность под SEQ ID NO:1, указанная CDR2 имеет аминокислотную последовательность под SEQ ID NO:2, и указанная CDR3 имеет аминокислотную последовательность под SEQ ID NO:3; и b) второй домен, содержащий последовательно гипервариабельные области CDR1, CDR2 и CDR3, причем указанная CDR1 имеет аминокислотную последовательность под SEQ ID NO:11, указанная CDR2 имеет аминокислотную последовательность под SEQ ID NO:12, и указанная CDR3 имеет аминокислотная последовательность под SEQ ID NO:13; и c) пептидный линкер, который связан с N-концом первого домена и с C-концом второго домена либо с C-концом первого домена и с N-концом второго домена.
В одном варианте осуществления антитело к IL-18 или его антигенсвязывающий фрагмент (например, mAb1) выбраны из одноцепочечного антитела или его антигенсвязывающего фрагмента, которые содержат антигенсвязывающий участок, содержащий: а) первый домен, содержащий последовательно гипервариабельные области CDR1, CDR2 и CDR3, причем указанная CDR1 имеет аминокислотную последовательность под SEQ ID NO:4, указанная CDR2 имеет аминокислотную последовательность под SEQ ID NO:5, и указанная CDR3 имеет аминокислотную последовательность под SEQ ID NO:6; и b) второй домен, содержащий последовательно гипервариабельные области CDR1, CDR2 и CDR3, причем указанная CDR1 имеет аминокислотную последовательность под SEQ ID NO:14, указанная CDR2 имеет аминокислотную последовательность под SEQ ID NO:15, и указанная CDR3 имеет аминокислотная последовательность под SEQ ID NO:16; и c) пептидный линкер, который связан с N-концом первого домена и с C-концом второго домена либо с C-концом первого домена и с N-концом второго домена.
Домен VH или VL антитела к IL-18 или его антигенсвязывающего фрагмента, применяемого в раскрытых способах, может включать в себя домены VH и/или VL, которые практически идентичны доменам VH или VL, представленным под SEQ ID NO:7 и 17. Антитело человека к IL-18, раскрытое в данном документе, может содержать тяжелую цепь, которая практически идентична представленной под SEQ ID NO:9, и/или легкую цепь, которая практически идентична представленной под SEQ ID NO:19. Антитело человека к IL-18, раскрытое в данном документе, может содержать тяжелую цепь, которая содержит SEQ ID NO:9, и легкую цепь, которая содержит SEQ ID NO:19. Антитело человека к IL-18, раскрытое в данном документе, может содержать: а) одну тяжелую цепь, содержащую вариабельный домен, содержащий аминокислотную последовательность, практически идентичную последовательности, представленной под SEQ ID NO:7, и константную часть тяжелой цепи человека; и b) одну легкую цепь, содержащую вариабельный домен, содержащий аминокислотную последовательность, практически идентичную последовательности, представленной под SEQ ID NO:17, и константную часть легкой цепи человека.
Другими предпочтительными антагонистами IL-18 (например, антителами) для применения в раскрытых способах, наборах и схемах лечения являются те, которые изложены в патенте США № 9376489, который включен в данный документ посредством ссылки во всей своей полноте.
3. Антитело к IL-1β
Особенно предпочтительными антителами к IL-1β или их антигенсвязывающими фрагментами, которые применяются в раскрытых способах, являются антитела человека.
Для удобства поиска аминокислотные последовательности гипервариабельных областей специфичного антитела к IL-1β, называемого mAb2, на основе определения Kabat и определения Chothia, а также доменов VL и VH и полных тяжелых и легких цепей представлены в таблице 2 ниже.
Таблица 2. Аминокислотные последовательности гипервариабельных областей (CDR), вариабельных доменов (VH и VL) и полных цепей mAb2. ДНК, кодирующая VL mAb2, представлена под SEQ ID NO:38. ДНК, кодирующая VH mAb2, представлена под SEQ ID NO:27.
В одном варианте осуществления антитело к IL-1β или его антигенсвязывающий фрагмент содержат по меньшей мере один вариабельный домен тяжелой цепи (VH) иммуноглобулина, содержащий гипервариабельные области CDR1, CDR2 и CDR3, причем указанная CDR1 имеет аминокислотную последовательность под SEQ ID NO:21, указанная CDR2 имеет аминокислотную последовательность под SEQ ID NO:22, и указанная CDR3 имеет аминокислотную последовательность под SEQ ID NO:23. В одном варианте осуществления антитело к IL-1β или его антигенсвязывающий фрагмент содержат по меньшей мере один вариабельный домен тяжелой цепи (VH) иммуноглобулина, содержащий гипервариабельные области CDR1, CDR2 и CDR3, причем указанная CDR1 имеет аминокислотную последовательность под SEQ ID NO:24, указанная CDR2 имеет аминокислотную последовательность под SEQ ID NO:25, и указанная CDR3 имеет аминокислотную последовательность под SEQ ID NO:26.
В одном варианте осуществления антитело к IL-1β или его антигенсвязывающий фрагмент содержат по меньшей мере один вариабельный домен легкой цепи (VL) иммуноглобулина, содержащий гипервариабельные области CDR1, CDR2 и CDR3, причем указанная CDR1 имеет аминокислотную последовательность под SEQ ID NO:31, указанная CDR2 имеет аминокислотную последовательность под SEQ ID NO:32, и указанная CDR3 имеет аминокислотную последовательность под SEQ ID NO:33. В одном варианте осуществления антитело к IL-1β или его антигенсвязывающий фрагмент содержат по меньшей мере один вариабельный домен легкой цепи (VL) иммуноглобулина, содержащий гипервариабельные области CDR1, CDR2 и CDR3, причем указанная CDR1 имеет аминокислотную последовательность под SEQ ID NO:34, указанная CDR2 имеет аминокислотную последовательность под SEQ ID NO:35, и указанная CDR3 имеет аминокислотную последовательность под SEQ ID NO:36.
В одном варианте осуществления антитело к IL-1β или его антигенсвязывающий фрагмент содержат по меньшей мере один домен VH иммуноглобулина и по меньшей мере один домен VL иммуноглобулина, где: а) домен VH иммуноглобулина содержит (например, последовательно) i) гипервариабельные области CDR1, CDR2 и CDR3, причем указанная CDR1 имеет аминокислотную последовательность под SEQ ID NO:21, указанная CDR2 имеет аминокислотную последовательность под SEQ ID NO:22, и указанная CDR3 имеет аминокислотную последовательность под SEQ ID NO:23; или ii) гипервариабельные области CDR1, CDR2 и CDR3, причем указанная CDR1 имеет аминокислотную последовательность под SEQ ID NO:24, указанная CDR2 имеет аминокислотную последовательность под SEQ ID NO:25, и указанная CDR3 имеет аминокислотную последовательность под SEQ ID NO:26; и b) домен VL иммуноглобулина содержит (например, последовательно) i) гипервариабельные области CDR1, CDR2 и CDR3, причем указанная CDR1 имеет аминокислотную последовательность под SEQ ID NO:31, указанная CDR2 имеет аминокислотную последовательность под SEQ ID NO:32, и указанная CDR3 имеет аминокислотную последовательность под SEQ ID NO:33, или ii) гипервариабельные области CDR1, CDR2 и CDR3, причем указанная CDR1 имеет аминокислотную последовательность под SEQ ID NO:34, указанная CDR2 имеет аминокислотную последовательность под SEQ ID NO:35, и указанная CDR3 имеет аминокислотную последовательность под SEQ ID NO:36.
В одном варианте осуществления антитело к IL-1β или его антигенсвязывающий фрагмент содержат а) вариабельный домен тяжелой цепи (VH) иммуноглобулина, содержащий аминокислотную последовательность, представленную под SEQ ID NO:27; b) вариабельный домен легкой цепи (VL) иммуноглобулина, содержащий аминокислотную последовательность, представленную под SEQ ID NO:37; c) домен VH иммуноглобулина, содержащий аминокислотную последовательность, представленную под SEQ ID NO:27, и домен VL иммуноглобулина, содержащий аминокислотную последовательность, представленную под SEQ ID NO:37; d) домен VH иммуноглобулина, содержащий гипервариабельные области, представленные под SEQ ID NO:21, SEQ ID NO:22 и SEQ ID NO:23; e) домен VL иммуноглобулина, содержащий гипервариабельные области, представленные под SEQ ID NO:31, SEQ ID NO:32 и SEQ ID NO:33; f) домен VH иммуноглобулина, содержащий гипервариабельные области, представленные под SEQ ID NO:24, SEQ ID NO:25 и SEQ ID NO:26; g) домен VL иммуноглобулина, содержащий гипервариабельные области, представленные под SEQ ID NO:34, SEQ ID NO:35 и SEQ ID NO:36; h) домен VH иммуноглобулина, содержащий гипервариабельные области, представленные под SEQ ID NO:21, SEQ ID NO:22 и SEQ ID NO:23, и домен VL иммуноглобулина, содержащий гипервариабельные области, представленные под SEQ ID NO:31, SEQ ID NO:32 и SEQ ID NO:33; i) домен VH иммуноглобулина, содержащий гипервариабельные области, представленные под SEQ ID NO:24, SEQ ID NO:25 и SEQ ID NO:26, и домен VL иммуноглобулина, содержащий гипервариабельные области, представленные под SEQ ID NO:34, SEQ ID NO:35 и SEQ ID NO:36; j) легкую цепь, содержащую SEQ ID NO:37; k) тяжелую цепь, содержащую SEQ ID NO:29; или l) легкую цепь, содержащую SEQ ID NO:39, и тяжелую цепь, содержащую SEQ ID NO:29.
В некоторых вариантах осуществления антитело к IL-1β или его антигенсвязывающий фрагмент (например, mAb2) содержат три CDR под SEQ ID NO:37. В других вариантах осуществления антитело к IL-1β или его антигенсвязывающий фрагмент содержат три CDR под SEQ ID NO:27. В других вариантах осуществления антитело к IL-1β или его антигенсвязывающий фрагмент содержат три CDR под SEQ ID NO:37 и три CDR под SEQ ID NO:27. В некоторых вариантах осуществления антитело к IL-1β или его антигенсвязывающий фрагмент содержат три CDR под SEQ ID NO:39. В других вариантах осуществления антитело к IL-1β или его антигенсвязывающий фрагмент содержат три CDR под SEQ ID NO:29. В других вариантах осуществления антитело к IL-1β или его антигенсвязывающий фрагмент содержат три CDR под SEQ ID NO:39 и три CDR под SEQ ID NO:29.
В одном варианте осуществления антитело к IL-1β или его антигенсвязывающий фрагмент (например, mAb2) выбраны из антитела человека к IL-1β, которое содержит по меньшей мере а) тяжелую цепь иммуноглобулина или ее фрагмент, которые содержат вариабельный домен, содержащий последовательно гипервариабельные области CDR1, CDR2 и CDR3 и константную часть тяжелой цепи человека или ее фрагмент; причем указанная CDR1 имеет аминокислотную последовательность под SEQ ID NO:21, указанная CDR2 имеет аминокислотную последовательность под SEQ ID NO:22, и указанная CDR3 имеет аминокислотную последовательность под SEQ ID NO:23; и b) легкую цепь иммуноглобулина или ее фрагмент, которые содержат вариабельный домен, содержащий последовательно гипервариабельные области CDR1, CDR2 и CDR3 и константную часть легкой цепи человека или ее фрагмент, причем указанная CDR1 имеет аминокислотную последовательность под SEQ ID NO:31, указанная CDR2 имеет аминокислотную последовательность под SEQ ID NO:32, и указанная CDR3 имеет аминокислотную последовательность под SEQ ID NO:33.
В одном варианте осуществления антитело к IL-1β или его антигенсвязывающий фрагмент (например, mAb2) выбраны из антитела человека к IL-1β, которое содержит по меньшей мере а) тяжелую цепь иммуноглобулина или ее фрагмент, которые содержат вариабельный домен, содержащий последовательно гипервариабельные области CDR1, CDR2 и CDR3 и константную часть тяжелой цепи человека или ее фрагмент; причем указанная CDR1 имеет аминокислотную последовательность под SEQ ID NO:24, указанная CDR2 имеет аминокислотную последовательность под SEQ ID NO:25, и указанная CDR3 имеет аминокислотную последовательность под SEQ ID NO:26; и b) легкую цепь иммуноглобулина или ее фрагмент, которые содержат вариабельный домен, содержащий последовательно гипервариабельные области CDR1, CDR2 и CDR3 и константную часть легкой цепи человека или ее фрагмент, причем указанная CDR1 имеет аминокислотную последовательность под SEQ ID NO:34, указанная CDR2 имеет аминокислотную последовательность под SEQ ID NO:35, и указанная CDR3 имеет аминокислотную последовательность под SEQ ID NO:36.
В одном варианте осуществления антитело к IL-1β или его антигенсвязывающий фрагмент выбраны из одноцепочечного антитела или его антигенсвязывающего фрагмента, которые содержат антигенсвязывающий участок, содержащий: а) первый домен, содержащий последовательно гипервариабельные области CDR1, CDR2 и CDR3, причем указанная CDR1 имеет аминокислотную последовательность под SEQ ID NO:21, указанная CDR2 имеет аминокислотную последовательность под SEQ ID NO:22, и указанная CDR3 имеет аминокислотную последовательность под SEQ ID NO:23; и b) второй домен, содержащий последовательно гипервариабельные области CDR1, CDR2 и CDR3, причем указанная CDR1 имеет аминокислотную последовательность под SEQ ID NO:31, указанная CDR2 имеет аминокислотную последовательность под SEQ ID NO:32, и указанная CDR3 имеет аминокислотная последовательность под SEQ ID NO:33; и c) пептидный линкер, который связан с N-концом первого домена и с C-концом второго домена либо с C-концом первого домена и с N-концом второго домена.
В одном варианте осуществления антитело к IL-1β или его антигенсвязывающий фрагмент (например, mAb2) выбраны из одноцепочечного антитела или его антигенсвязывающего фрагмента, которые содержат антигенсвязывающий участок, содержащий: а) первый домен, содержащий последовательно гипервариабельные области CDR1, CDR2 и CDR3, причем указанная CDR1 имеет аминокислотную последовательность под SEQ ID NO:24, указанная CDR2 имеет аминокислотную последовательность под SEQ ID NO:25, и указанная CDR3 имеет аминокислотную последовательность под SEQ ID NO:26; и b) второй домен, содержащий последовательно гипервариабельные области CDR1, CDR2 и CDR3, причем указанная CDR1 имеет аминокислотную последовательность под SEQ ID NO:34, указанная CDR2 имеет аминокислотную последовательность под SEQ ID NO:35, и указанная CDR3 имеет аминокислотная последовательность под SEQ ID NO:36; и c) пептидный линкер, который связан с N-концом первого домена и с C-концом второго домена либо с C-концом первого домена и с N-концом второго домена.
Домен VH или VL антитела к IL-1β или его антигенсвязывающего фрагмента, применяемого в раскрытых способах, может включать в себя домены VH и/или VL, которые практически идентичны доменам VH или VL, представленным под SEQ ID NO:27 и 37. Антитело человека к IL-1β, раскрытое в данном документе, может содержать тяжелую цепь, которая практически идентична представленной под SEQ ID NO:29, и/или легкую цепь, которая практически идентична представленной под SEQ ID NO:39. Антитело человека к IL-1β, раскрытое в данном документе, может содержать тяжелую цепь, которая содержит SEQ ID NO:29, и легкую цепь, которая содержит SEQ ID NO:39. Антитело человека к IL-1β, раскрытое в данном документе, может содержать: а) одну тяжелую цепь, содержащую вариабельный домен, содержащий аминокислотную последовательность, практически идентичную последовательности, представленной под SEQ ID NO:27, и константную часть тяжелой цепи человека; и b) одну легкую цепь, содержащую вариабельный домен, содержащий аминокислотную последовательность, практически идентичную последовательности, представленной под SEQ ID NO:37, и константную часть легкой цепи человека.
Другими предпочтительными антагонистами IL-1β (например, антителами) для применения в раскрытых способах, наборах и схемах лечения являются те, которые изложены в патентах США №№ 7446175, или 7993878, или 8273350, которые включены в данный документ посредством ссылки во всей своей полноте.
4. Модификации Fc-областей
В качестве дополнения или альтернативы модификациям, осуществляемым в пределах каркасных или CDR-областей, антитела по настоящему изобретению можно конструировать таким образом, чтобы они включали модификации в пределах Fc-области, как правило, для изменения одного или нескольких функциональных свойств антитела, таких как период полужизни в сыворотке крови, фиксация комплемента, связывание с Fc-рецептором и/или антигензависимая клеточная цитотоксичность. Кроме того, антитело по настоящему изобретению может быть химически модифицировано (например, к антителу могут быть прикреплены один или несколько химических фрагментов), или оно может быть модифицировано с изменением характера его гликозилирования, опять-таки для изменения одного или нескольких функциональных свойств антитела. Каждый из данных вариантов осуществления более подробно описан ниже. Нумерация остатков в Fc-области соответствует системе нумерации EU по Edelman et al., PNAS, 1969 May, 63(1):78-85.
В одном варианте осуществления шарнирную область CH1 модифицируют таким образом, что число остатков цистеина в шарнирной области изменяется, например, увеличивается или уменьшается. Данный подход дополнительно описан в патенте США № 5677425 авторства Bodmer et al. Число остатков цистеина в шарнирной области CH1 изменяют, например, чтобы облегчить сборку легкой и тяжелой цепей или чтобы увеличить или уменьшить стабильность антитела.
В другом варианте осуществления область Fc-шарнир антитела подвергают мутации для уменьшения биологического периода полужизни антитела. Более конкретно, одну или несколько аминокислотных мутаций вводят в пограничную область между доменами CH2-CH3 фрагмента Fc-шарнир, благодаря чему антитело характеризуется нарушенным связыванием с белком A стафилококка (SpA) по сравнению со связыванием нативного домена Fc-шарнир с SpA. Данный подход более подробно описан в патенте США № 6165745 авторства Ward et al.
В другом варианте осуществления антитело модифицируют для увеличения его биологического периода полужизни. Возможны различные подходы. Например, можно вводить одну или несколько из следующих мутаций: T252L, T254S, T256F, как описано в патенте США № 6277375 авторства Ward. В качестве альтернативы, для увеличения биологического периода полужизни антитело можно изменять в пределах области CH1 или CL таким образом, чтобы оно содержало эпитоп для связывания с рецептором реутилизации, взятый из двух петель домена CH2 из Fc-области IgG, как описано в патентах США №№ 5869046 и 6121022 авторства Presta et al.
В других вариантах осуществления Fc-область изменяют путем замены по меньшей мере одного аминокислотного остатка на отличающийся аминокислотный остаток для изменения эффекторных функций антитела. Например, одну или несколько аминокислот можно заменить на отличающийся аминокислотный остаток таким образом, чтобы антитело характеризовалось измененной аффинностью в отношении эффекторного лиганда, но сохраняло способность к связыванию антигена исходного антитела. Эффекторный лиганд, аффинность в отношении которого изменяют, может представлять собой, например, Fc-рецептор или компонент C1 системы комплемента. Данный подход подробно описан, например, в патентах США №№ 5624821 и 5648260, оба авторства Winter et al.
В другом варианте осуществления одну или несколько аминокислот, выбранных из аминокислотных остатков, можно заменить на отличающийся аминокислотный остаток таким образом, чтобы антитело характеризовалось измененным связыванием C1q и/или пониженной или устраненной комплементзависимой цитотоксичностью (CDC). Данный подход более подробно описан в патенте США № 6194551 авторства Idusogie et al.
В другом варианте осуществления один или несколько аминокислотных остатков изменяют для изменения таким образом способности антитела к фиксации комплемента. Этот подход дополнительно описан в публикации согласно PCT WO 94/29351 авторства Bodmer et al.
В еще одном варианте осуществления Fc-область модифицируют для повышения способности антитела опосредовать антителозависимую клеточную цитотоксичность (ADCC) и/или для повышения аффинности антитела в отношении Fcγ-рецептора посредством модификации одной или нескольких аминокислот. Этот подход дополнительно описан в публикации согласно PCT WO 00/42072 авторства Presta. Более того, сайты связывания в IgG1 человека для FcγRI, FcγRII, FcγRIII и FcRn были картированы, и были описаны варианты с улучшенным связыванием (см. Shields, R.L. et al., (2001) J Biol Chem 276:6591-6604).
В определенных вариантах осуществления используется Fc-домен изотипа IgG1. В некоторых конкретных вариантах осуществления используется мутантный вариант Fc-фрагмента IgG1, например, "молчащий" Fc-фрагмент IgG1, который снижает или устраняет способность слитого полипептида опосредовать антителозависимую клеточную цитотоксичность (ADCC) и/или связываться с Fcγ-рецептором. Пример "молчащего" мутантного изотипа IgG1, в котором остаток лейцина заменен остатком аланина в положениях аминокислот 234 и 235, описан в Hezareh et al., J. Virol (2001); 75(24):12161-8.
В некоторых вариантах осуществления Fc-домен является мутантной формой, в которой предотвращается гликозилирование в положении 297 Fc-домена. Например, Fc-домен содержит аминокислотную замену остатка аспарагина в положении 297. Примером такой аминокислотной замены является замена N297 глицином или аланином.
"Молчащие" эффекторные функции могут быть получены посредством мутации в Fc-области антител и были описаны в уровне техники: LALA и N297A (Strohl, W., 2009, Curr. Opin. Biotechnol. vol. 20(6):685-691); а также D265A (Baudino et al., 2008, J. Immunol. 181:6664-69; Strohl, W., выше) и DAPA (D265A и P329A) (Shields RL., J Biol Chem. 2001;276(9):6591-604; публикация заявки на патент США US2015/0320880). Примеры антител с "молчащим" Fc-доменом IgG1 включают так называемую мутантную форму LALA, содержащую мутации L234A и L235A в аминокислотной последовательности Fc-домена IgG1. Другой пример "молчащего" антитела IgG1 содержит мутацию D265A. Другим примером "молчащего" антитела IgG1 является так называемая мутантная форма DAPA, содержащая мутации D265A и P329A в аминокислотной последовательности Fc-домена IgG1. Другое "молчащее" антитело IgG1 содержит мутацию N297A, которая дает в результате агликозилированные/негликозилированные антитела. Дополнительные мутации Fc-домена для обеспечения "молчащей" эффекторной функции описаны в публикации согласно PCT № WO2014/145806 (например, на фиг. 7 в WO2014/145806), включенной в данный документ посредством ссылки во всей своей полноте. Один пример "молчащего" антитела IgG1 из WO2014/145806 содержит мутации E233P, L234V, L235A и S267K и делецию G236 (G236del). Другой пример "молчащего" антитела IgG1 из WO2014/145806 содержит мутации E233P, L234V и L235A и делецию G236 (G236del). Другой пример "молчащего" антитела IgG1 из WO2014/145806 содержит мутацию S267K.
В еще одном варианте осуществления модифицируют характер гликозилирования антитела. Например, можно получать агликозилированное антитело (т.е. антитело, у которого отсутствует гликозилирование). Характер гликозилирования можно изменять, например, для повышения аффинности антитела в отношении антигена. Такие модификации углеводов можно осуществлять, например, посредством изменения одного или нескольких сайтов гликозилирования в пределах последовательности антитела. Например, можно произвести одну или несколько аминокислотных замен, которые приводят к устранению одного или нескольких сайтов гликозилирования в каркасной области вариабельной области, тем самым устраняя гликозилирование в этом сайте. Такое агликозилирование может повышать аффинность антитела в отношении антигена. Такой подход подробно описан, например, в патентах США №№ 5714350 и 6350861 авторства Co et al.
В качестве дополнения или альтернативы может быть получено антитело, которое характеризуется измененным типом гликозилирования, как, например, гипофукозилированное антитело, имеющее уменьшенные количества фукозильных остатков, или антитело, имеющее повышенное содержание структур с остатком GlcNAc в точке ветвления. Было продемонстрировано, что такой измененный характер гликозилирования повышает способность антител к ADCC. Такие модификации углеводов можно осуществлять, например, посредством экспрессии антитела в клетке-хозяине с измененным механизмом гликозилирования. Клетки с измененным механизмом гликозилирования были описаны в уровне техники, и их можно применять в качестве клеток-хозяев, в которых экспрессируются рекомбинантные антитела по настоящему изобретению, с получением таким образом антитела с измененным характером гликозилирования. Например, в EP 1176195 авторства Hang et al. описывается линия клеток с функциональным нарушением гена FUT8, который кодирует фукозилтрансферазу, в результате чего антитела, экспрессируемые в такой линии клеток, проявляют гипофукозилирование. Следовательно, в одном варианте осуществления антитела по настоящему изобретению продуцируются посредством рекомбинантной экспрессии в линии клеток, которая демонстрирует характер гипофукозилирования, например, в линии клеток млекопитающих с недостаточной экспрессией гена FUT8, кодирующего фукозилтрансферазу. В публикации согласно PCT WO 03/035835 авторства Presta описываются клетки Lecl3 в качестве варианта линии клеток CHO с пониженной способностью к прикреплению фукозы к связанным посредством Asn (297) углеводам, что также приводит к гипофукозилированию антител, экспрессируемых в такой клетке-хозяине (см. также Shields, R.L. et al., 2002 J. Biol. Chem. 277:26733-26740). В публикации согласно PCT WO 99/54342 авторства Umana et al. описываются линии клеток, сконструированные для экспрессии гликозилтрансфераз, модифицирующих гликопротеины (например, бета-(1,4)-N-ацетилглюкозаминилтрансферазы III (GnTIII)), в результате чего антитела, экспрессируемые в сконструированных линиях клеток, характеризуются повышенным содержанием структур с остатком GlcNAc в точке ветвления, что приводит к повышенной активности ADCC у антител (см. также Umana et al., 1999 Nat. Biotech. 17:176-180). В качестве альтернативы, антитела по настоящему изобретению могут быть получены в дрожжах или нитчатых грибах, сконструированных для обеспечения характера гликозилирования, подобного таковому у млекопитающих, и способных продуцировать антитела, лишенные фукозы в качестве характера гликозилирования (см., например, ЕР1297172В1).
Другой модификацией антител в данном документе, которая рассматривается в настоящем изобретении, является пегилирование. Антитело может быть пегилировано, например, для увеличения биологического периода полужизни антитела (например, в сыворотке крови). Для пегилирования антитела антитело или его фрагмент, как правило, вводят в реакцию с полиэтиленгликолем (PEG), таким как реакционноспособный сложный эфир или альдегидное производное PEG, в условиях, при которых одна или несколько групп PEG присоединяются к антителу или фрагменту антитела. Пегилирование можно осуществлять посредством реакции ацилирования или реакции алкилирования с реакционноспособной молекулой PEG (или аналогичным реакционноспособным водорастворимым полимером). Предполагается, что используемый в данном документе термин "полиэтиленгликоль" охватывает любую из форм PEG, которые применяли для дериватизации других белков, как, например, моно(C1-C10)алкокси- или арилоксиполиэтиленгликоль или полиэтиленгликоль-малеимид. В определенных вариантах осуществления антитело, подлежащее пегилированию, представляет собой агликозилированное антитело. Способы пегилирования белков известны из уровня техники и могут применяться по отношению к антителам по настоящему изобретению. См., например, EP 0154316 авторства Nishimura et al. и EP 0401384 авторства Ishikawa et al.
Другая модификация антител, которая рассматривается в настоящем изобретении, представляет собой конъюгирование или белковое слияние по меньшей мере антигенсвязывающей области антитела по настоящему изобретению с сывороточным белком, таким как человеческий сывороточный альбумин или его фрагмент, для увеличения периода полужизни полученной молекулы. Такой подход описан, например, в Ballance et al. EP0322094.
Другая модификация антител, которая рассматривается в настоящем изобретении, представляет собой одну или несколько модификаций для повышения образования гетеродимерного биспецифического антитела. Различные подходы, доступные в данной области техники, могут быть использованы для усиления димеризации двух доменов тяжелых цепей биспецифических антител, например, bbmAb, как описано, например, в EP 1870459A1; патенте США № 5582996; патенте США № 5731168; патенте США № 5910573; патенте США № 5932448; патенте США № 6833441; патенте США № 7183076; публикации заявки на патент США № 2006204493A1 и публикации согласно РСТ № WO2009/089004A1, содержание которых включено в данный документ во всей своей полноте.
Получение биспецифических антител с использованием подхода "выступы во впадины" описано, например, в публикации согласно РСТ № WO1996/027011, Ridgway et al. (1996) и Merchant et al. (1998).
(1) Выступ во впадину (KIH)
Полиспецифические молекулы, например, полиспецифические антитела или антителоподобные молекулы по настоящему изобретению, могут содержать одну или несколько, например, множество, мутаций в одном или нескольких константных доменах, например, в доменах СН3. В одном примере полиспецифическая молекула по настоящему изобретению содержит два полипептида, каждый из которых содержит константный домен тяжелой цепи антитела, например, домен СН2 или СН3. В одном примере два константных домена тяжелой цепи, например, домены CH2 или CH3 полиспецифической молекулы, содержат одну или несколько мутаций, которые обеспечивают возможность гетеродимерной ассоциации между двумя цепями. В одном аспекте одна или несколько мутаций расположены в домене СН2 двух тяжелых цепей полиспецифического, например, биспецифического, антитела или антителоподобной молекулы. В одном аспекте одна или несколько мутаций расположены в доменах СН3 по меньшей мере двух полипептидов полиспецифической молекулы. В одном аспекте одна или несколько мутаций в первом полипептиде полиспецифической молекулы, содержащем константный домен тяжелой цепи, создают "выступ", а одна или несколько мутаций во втором полипептиде полиспецифической молекулы, содержащем константный домен тяжелой цепи, создают "впадину", так что гетеродимеризация полипептида полиспецифической молекулы, содержащего константный домен тяжелой цепи, приводит к тому, что "выступ" контактирует (например, взаимодействует, например, домен СН2 первого полипептида взаимодействует с доменом СН2 второго полипептида, или домен СН3 первого полипептида взаимодействует с доменом СН3 второго полипептида) со "впадиной". Используемый в данном документе термин "выступ" относится к по меньшей мере одной боковой цепи аминокислоты, которая выступает над поверхностью контакта первого полипептида полиспецифической молекулы, содержащего константный домен тяжелой цепи, и поэтому способна располагаться в компенсирующей "впадине" на поверхности контакта со вторым полипептидом полиспецифической молекулы, содержащим константный домен тяжелой цепи, в целях стабилизации гетеромультимера и, таким образом, способствования, например, образованию гетеромультимера вместо образования гомомультимера. Выступ может существовать на исходной поверхности контакта или может быть введен синтетически (например, путем изменения нуклеиновой кислоты, кодирующей поверхность контакта). Предпочтительными остатками для введения с целью образования выступа обычно являются встречающиеся в природе аминокислотные остатки, и они предпочтительно выбраны из аргинина (R), фенилаланина (F), тирозина (Y) и триптофана (W). Наиболее предпочтительными являются триптофан и тирозин. В предпочтительном варианте исходный остаток для образования выступа имеет небольшой объем боковой цепи, такой как у аланина, аспарагина, аспарагиновой кислоты, глицина, серина, треонина или валина.
"Впадина" относится к по меньшей мере одной боковой цепи аминокислоты, которая углублена в поверхность контакта второго полипептида полиспецифической молекулы, содержащего константный домен тяжелой цепи, и, следовательно, создает условия для размещения соответствующего "выступа" на прилегающей поверхности контакта первого полипептида полиспецифической молекулы, содержащего константный домен тяжелой цепи. Впадина может существовать на исходной поверхности контакта или может быть введена синтетически (например, путем изменения нуклеиновой кислоты, кодирующей поверхность контакта). Предпочтительными остатками для введения с целью образования впадины обычно являются встречающиеся в природе аминокислотные остатки, и они предпочтительно выбраны из аланина (A), серина (S), треонина (T) и валина (V). Наиболее предпочтительными являются серин, аланин или треонин. В предпочтительном варианте исходный остаток для образования впадины имеет большой объем боковой цепи, такой как у тирозина, аргинина, фенилаланина или триптофана.
В предпочтительном варианте осуществления первый домен СН3 является мутантным по остатку 366, 405 или 407 в соответствии с системой нумерации EU по Edelman et al., PNAS, 1969 May, 63 (1):78-85, с созданием "выступа" или "впадины" (как описано выше), а второй домен CH3, который гетеродимеризуется с первым доменом CH3, является мутантным по: остатку 407, если остаток 366 является мутантным в первом домене CH3, остатку 349, если остаток 405 является мутантным в первом домене CH3, или остатку 366, если остаток 407 является мутантным в первом домене СН3, в соответствии с системой нумерации EU по Edelman et al., PNAS, 1969 May, 63(1):78-85, с созданием "впадины" или "выступа", комплементарных "выступу" или "впадине" первого домена CH3.
В другом предпочтительном варианте осуществления первый домен СН3 является мутантным по остатку 366 в соответствии с системой нумерации EU по Edelman et al., PNAS, 1969 May, 63 (1):78-85, с созданием "выступа" или "впадины" (как описано выше), а второй домен СН3, который гетеродимеризуется с первым доменом СН3, является мутантным по остаткам 366, 368 и/или 407 в соответствии с системой нумерации EU по Edelman et al., PNAS, 1969 May, 63 (1):78-85, с созданием "впадины" или "выступа", комплементарных "выступу" или "впадине" первого домена CH3. В одном варианте осуществления мутация в первом домене CH3 обуславливает введение остатка тирозина (Y) в положении 366. В варианте осуществления мутация первого CH3 представляет собой T366Y. В одном варианте осуществления мутация в первом домене CH3 обуславливает введение остатка триптофана (W) в положении 366. В варианте осуществления мутация первого CH3 представляет собой T366W. В вариантах осуществления мутация во втором домене CH3, который гетеродимеризуется с первым доменом CH3, мутантным в положении 366 (например, содержащим тирозин (Y) или триптофан (W), введенный в положении 366, например, содержащим мутацию T366Y или T366W), включает в себя мутацию в положении 366, мутацию в положении 368 и мутацию в положении 407 в соответствии с системой нумерации EU по Edelman et al., PNAS, 1969 May, 63 (1):78-85. В вариантах осуществления мутация в положении 366 обуславливает введение остатка серина (S), мутация в положении 368 обуславливает введение аланина (A), а мутация в положении 407 обуславливает введение валина (V). В вариантах осуществления мутации включают в себя T366S, L368A и Y407V. В одном варианте осуществления первый домен CH3 полиспецифической молекулы содержит мутацию T366Y, а второй домен CH3, который гетеродимеризуется с первым доменом CH3, содержит мутации T366S, L368A и Y407V, или наоборот. В одном варианте осуществления первый домен CH3 полиспецифической молекулы содержит мутацию T366W, а второй домен CH3, который гетеродимеризуется с первым доменом CH3, содержит мутации T366S, L368A и Y407V, или наоборот.
Дополнительные стерические или "асимметричные" (например, по типу "выступ во впадину") мутации описаны в публикации согласно PCT №№ WO2014/145806 (например, на фиг. 3, фиг. 4 и фиг. 12 в WO2014/145806), публикации согласно PCT № WO2014/110601 и публикациях согласно PCT №№ WO 2016/086186, WO 2016/086189, WO 2016/086196 и WO 2016/182751, содержание которых включено в данный документ во всей своей полноте. Пример KIH-варианта включает константную область первой цепи, содержащую мутации L368D и K370S, в паре с константной областью второй цепи, содержащей мутации S364K и E357Q.
Дополнительные пары мутаций по типу "выступ во впадину", подходящие для применения в любой из полиспецифических молекул по настоящему изобретению, дополнительно описаны, например, в WO 1996/027011 и Merchant et al., Nat. Biotechnol., 16:677-681 (1998), содержание которых включено в данный документ посредством ссылки во всей своей полноте.
В любом из вариантов осуществления, описанных в данном документе, домены СН3 могут дополнительно подвергаться мутации с целью введения пары остатков цистеина. Не ограничиваясь какой-либо теорией, полагают, что введение пары остатков цистеина, способных образовывать дисульфидную связь, обеспечивает стабильность гетеродимеризованной полиспецифической молекулы. В вариантах осуществления первый домен CH3 содержит цистеин в положении 354 в соответствии с системой нумерации EU по Edelman et al., PNAS, 1969 May, 63 (1):78-85, а второй домен CH3, который гетеродимеризуется с первым доменом СН3, содержит цистеин в положении 349 в соответствии с системой нумерации EU по Edelman et al., PNAS, 1969 May, 63 (1):78-85. В вариантах осуществления первый домен CH3 полиспецифической молекулы содержит цистеин в положении 354 (например, содержит мутацию S354C) и тирозин (Y) в положении 366 (например, содержит мутацию T366Y), а второй домен CH3, который гетеродимеризуется с первым доменом СН3, содержит цистеин в положении 349 (например, содержит мутацию Y349C), серин в положении 366 (например, содержит мутацию T366S), аланин в положении 368 (например, содержит мутацию L368A) и валин в положении 407 (например, содержит мутацию Y407V). В вариантах осуществления первый домен CH3 полиспецифической молекулы содержит цистеин в положении 354 (например, содержит мутацию S354C) и триптофан (W) в положении 366 (например, содержит мутацию T366W), а второй домен CH3, который гетеродимеризуется с первым доменом СН3, содержит цистеин в положении 349 (например, содержит мутацию Y349C), серин в положении 366 (например, содержит мутацию T366S), аланин в положении 368 (например, содержит мутацию L368A) и валин в положении 407 (например, содержит мутацию Y407V).
(2) Альтернативные выступы и впадины: гетеродимеризация IgG
В одном аспекте гетеродимеризация полипептидных цепей (например, полуантител) полиспецифической молекулы усиливается путем введения одной или нескольких мутаций в домен СН3, полученный из антитела класса IgG1. В варианте осуществления мутации содержат мутацию K409R в одном домене CH3 в паре с мутацией F405L во втором домене CH3 в соответствии с системой нумерации EU по Edelman et al., PNAS, 1969 May, 63 (1):78-85. Дополнительные мутации могут также, или в качестве альтернативы, находиться в положениях 366, 368, 370, 399, 405, 407 и 409 в соответствии с системой нумерации EU по Edelman et al., PNAS, 1969 May, 63 (1):78-85. Предпочтительно, гетеродимеризация полипептидов, содержащих такие мутации, достигается в восстанавливающих условиях, например, 10-100 мМ 2-MEA (например, 25, 50 или 100 мМ 2-MEA) в течение 1-10, например, 1,5-5, например, 5 часов при 25-37°С, например, 25°С или 37°С.
Описанные в данном документе замены аминокислот вводят в домены СН3 с использованием методик, которые хорошо известны из уровня техники. Обычно ДНК, кодирующая тяжелую(тяжелые) цепь(цепи), является генетически сконструированной с использованием методик, описанных в Mutagenesis: a Practical Approach. Мутагенез, опосредованный олигонуклеотидами, является предпочтительным способом получения замещенных вариантов ДНК, кодирующей две гибридные тяжелые цепи. Эта методика хорошо известна из уровня техники, как описано в Adelman et al., (1983) DNA, 2:183.
Стратегия гетеродимеризации IgG описана, например, в WO 2008/119353, WO 2011/131746 и WO 2013/060867, содержание которых включено в данный документ посредством ссылки во всей своей полноте.
В любом из вариантов осуществления, описанных в данном документе, домены СН3 могут дополнительно подвергаться мутации с целью введения пары остатков цистеина. Не ограничиваясь какой-либо теорией, полагают, что введение пары остатков цистеина, способных образовывать дисульфидную связь, обеспечивает стабильность гетеродимеризованной полиспецифической молекулы. В вариантах осуществления первый домен CH3 содержит цистеин в положении 354 в соответствии с системой нумерации EU по Edelman et al., PNAS, 1969 May, 63 (1):78-85, а второй домен CH3, который гетеродимеризуется с первым доменом СН3, содержит цистеин в положении 349 в соответствии с системой нумерации EU по Edelman et al., PNAS, 1969 May, 63 (1):78-85.
(3) Полярный мостик
В одном аспекте гетеродимеризация полипептидных цепей (например, полуантител) полиспецифической молекулы усиливается путем введения мутаций, обоснованием для которых служит "образование полярного мостика", которое необходимо для способствования взаимодействию остатков на поверхности контакта двух полипептидных цепей с остатками со сходными (или дополняющими) физическими свойствами в гетеродимерной конфигурации и в то же время с остатками с другими физическими свойствами в гомодимерной конфигурации. В частности, эти мутации разработаны таким образом, что при образовании гетеродимера полярные остатки взаимодействуют с полярными остатками, тогда как гидрофобные остатки взаимодействуют с гидрофобными остатками. Напротив, при образовании гомодимера остатки подвергаются мутации таким образом, что полярные остатки взаимодействуют с гидрофобными остатками. Благоприятные взаимодействия в гетеродимерной конфигурации и неблагоприятные взаимодействия в гомодимерной конфигурации совместно функционируют для повышения вероятности того, что домены CH3 будут образовывать гетеродимеры вместо гомодимеров.
В иллюстративном варианте осуществления вышеуказанные мутации образуются в одном или нескольких положениях остатков 364, 368, 399, 405, 409 и 411 домена СН3, при этом нумерация аминокислот соответствует системе нумерации EU по Edelman et al., PNAS, 1969 May, 63 (1):78-85.
В одном аспекте одна или несколько мутаций, выбранные из группы, состоящей из: Ser364Leu, Thr366Val, Leu368Gln, Asp399Lys, Phe405Ser, Lys409Phe и Thr411Lys, вводятся в один из двух доменов CH3. (Ser364Leu: исходный остаток серина в положении 364 заменен на лейцин; Thr366Val: исходный остаток треонина в положении 366 заменен на валин; Leu368Gln: исходный остаток лейцина в положении 368 заменен на глутамин; Asp399Lys: исходный остаток аспарагиновой кислоты в положении 399 заменен на лизин; Phe405Ser: исходный остаток фенилаланина в положении 405 заменен на серин; Lys409Phe: исходный остаток лизина в положении 409 заменен на фенилаланин; Thr411Lys: исходный остаток треонина в положении 411 заменен на лизин).
В другом аспекте в другой СН3 могут быть введены одна или несколько мутаций, выбранные из группы, состоящей из: Tyr407Phe, Lys409Gln и Thr411Asp (Tyr407Phe: исходный остаток тирозина в положении 407 заменен на фенилаланин; Lys409Glu: исходный остаток лизина в положении 409 заменен на глутаминовую кислоту; Thr411Asp: исходный остаток треонина в положении 411 заменен на аспарагиновую кислоту).
В дополнительном аспекте один домен CH3 содержит одну или несколько мутаций, выбранных из группы, состоящей из: Ser364Leu, Thr366Val, Leu368Gln, Asp399Lys, Phe405Ser, Lys409Phe и Thr411Lys, тогда как другой домен CH3 содержит одну или несколько мутаций, выбранных из группы, состоящей из: Tyr407Phe, Lys409Gln и Thr411Asp.
В одном иллюстративном варианте осуществления исходный остаток треонина в положении 366 одного домена СН3 заменен на валин, тогда как исходный остаток тирозина в положении 407 другого домена СН3 заменен на фенилаланин.
В другом иллюстративном варианте осуществления исходный остаток серина в положении 364 одного домена СН3 заменен на лейцин, тогда как исходный остаток лейцина в положении 368 того же домена СН3 заменен на глутамин.
В еще одном иллюстративном варианте осуществления исходный остаток фенилаланина в положении 405 одного домена СН3 заменен на серин, а исходный остаток лизина в положении 409 этого домена СН3 заменен на фенилаланин, тогда как исходный остаток лизина в положении 409 другого домена СН3 заменен на глутамин.
В еще одном иллюстративном варианте осуществления исходный остаток аспарагиновой кислоты в положении 399 одного домена СН3 заменен на лизин, а исходный остаток треонина в положении 411 того же домена СН3 заменен на лизин, тогда как исходный остаток треонина в положении 411 другого домена СН3 заменен на аспарагиновую кислоту.
Описанные в данном документе замены аминокислот вводят в домены СН3 с использованием методик, которые хорошо известны из уровня техники. Обычно ДНК, кодирующая тяжелую(тяжелые) цепь(цепи), является генетически сконструированной с использованием методик, описанных в Mutagenesis: a Practical Approach. Мутагенез, опосредованный олигонуклеотидами, является предпочтительным способом получения замещенных вариантов ДНК, кодирующей две гибридные тяжелые цепи. Эта методика хорошо известна из уровня техники, как описано в Adelman et al., (1983) DNA, 2:183.
Стратегия образования полярных мостиков описана, например, в WO 2006/106905, WO 2009/089004 и K.Gunasekaran, et al. (2010) The Journal of Biological Chemistry, 285:19637-19646, содержание которых включено в данный документ посредством ссылки во всей своей полноте.
Дополнительные мутации с образованием полярных мостиков описаны, например, в публикации согласно PCT № WO2014/145806 (например, на фиг. 6 в WO2014/145806), публикации согласно PCT № WO2014/110601 и публикациях согласно PCT №№ WO 2016/086186, WO 2016/086189, WO 2016/086196 и WO 2016/182751, содержание которых включено в данный документ во всей своей полноте. Пример варианта с полярным мостиком включает константную цепь, содержащую мутации N208D, Q295E, N384D, Q418E и N421D.
В любом из вариантов осуществления, описанных в данном документе, домены СН3 могут дополнительно подвергаться мутации с целью введения пары остатков цистеина. Не ограничиваясь какой-либо теорией, полагают, что введение пары остатков цистеина, способных образовывать дисульфидную связь, обеспечивает стабильность гетеродимеризованной полиспецифической молекулы. В вариантах осуществления первый домен CH3 содержит цистеин в положении 354 в соответствии с системой нумерации EU по Edelman et al., PNAS, 1969 May, 63 (1):78-85, а второй домен CH3, который гетеродимеризуется с первым доменом СН3, содержит цистеин в положении 349 в соответствии с системой нумерации EU по Edelman et al., PNAS, 1969 May, 63 (1):78-85.
Дополнительные стратегии усиления гетеродимеризации описаны, например, в WO2016/105450, WO2016/086186, WO2016/086189, WO2016/086196, WO2016/141378, а также WO2014/145806 и WO2014/110601, полное содержание каждой из которых включено в данный документ посредством ссылки во всей своей полноте. Любая из указанных стратегий может быть использована в полиспецифической молекуле, описанной в данном документе.
В вариантах осуществления две или более из обсуждаемых в данном документе модификаций объединены в одном биспецифическом антителе, например, bbmAb.
5. Пример 1. Получение bbmAb bbmAb1
В качестве примера, получение конкретного bbmAb описано ниже, чтобы дать возможность специалисту в данной области реализовать на практике настоящее изобретение.
Полученное bbmAb bbmAb1 представляет собой биспецифический IgG1 с "молчащими" мутациями LALA, одновременно связывающийся с двумя различными мишенями IL-1β и IL-18. В антителе объединены два разных антигенсвязывающих плеча (Fab-фрагменты), при этом в основе Fab, направленного против IL-1β, лежит mAb2, и он содержит легкую каппа-цепь (Vk6). В основе Fab, направленного против IL-18, лежит mAb1, и он состоит из легкой лямбда-цепи (Vλ1). Для управления гетеродимеризацией Fc-домена во время экспрессии "выступ" с объемной боковой цепью аминокислоты (aa) (S354C и T366W) в тяжелой цепи mAb1 и "впадина" с небольшими боковыми цепями аминокислот (Y349C, T366S, L368A, Y407V) были введены в тяжелую цепь mAb2.
Для удобства поиска аминокислотные последовательности гипервариабельных областей bbmAb1 на основе определения Kabat и определения Chothia, а также доменов VL и VH и полных тяжелых и легких цепей представлены в таблице 3 ниже.
Таблица 3. Аминокислотные последовательности гипервариабельных областей (CDR), вариабельных доменов (VH и VL) и полных цепей bbmAb1. ДНК, кодирующая первый VL, представлена под SEQ ID NO:102, а ДНК, кодирующая второй VL, представлена под SEQ ID NO: 70. ДНК, кодирующая первый VH, представлена под SEQ ID NO:86, а ДНК, кодирующая второй VH, представлена под SEQ ID NO: 54.
В одном варианте осуществления биспецифическое антитело к IL-18/IL-1β содержит первый вариабельный домен тяжелой цепи (VH1) иммуноглобулина, содержащий гипервариабельные области CDR1, CDR2 и CDR3, причем указанная CDR1 имеет аминокислотную последовательность под SEQ ID NO:76, указанная CDR2 имеет аминокислотную последовательность под SEQ ID NO:77, и указанная CDR3 имеет аминокислотную последовательность под SEQ ID NO:78. В одном варианте осуществления биспецифическое антитело к IL-18/IL-1β содержит первый вариабельный домен тяжелой цепи (VH1) иммуноглобулина, содержащий гипервариабельные области CDR1, CDR2 и CDR3, причем указанная CDR1 имеет аминокислотную последовательность под SEQ ID NO:79, указанная CDR2 имеет аминокислотную последовательность под SEQ ID NO:80, и указанная CDR3 имеет аминокислотную последовательность под SEQ ID NO:81. В одном варианте осуществления биспецифическое антитело к IL-18/IL-1β содержит первый вариабельный домен тяжелой цепи (VH1) иммуноглобулина, содержащий гипервариабельные области CDR1, CDR2 и CDR3, причем указанная CDR1 имеет аминокислотную последовательность под SEQ ID NO:82, указанная CDR2 имеет аминокислотную последовательность под SEQ ID NO:83, и указанная CDR3 имеет аминокислотную последовательность под SEQ ID NO:84.
В одном варианте осуществления биспецифическое антитело к IL-18/IL-1β содержит второй вариабельный домен тяжелой цепи (VH2) иммуноглобулина, содержащий гипервариабельные области CDR1, CDR2 и CDR3, причем указанная CDR1 имеет аминокислотную последовательность под SEQ ID NO:44, указанная CDR2 имеет аминокислотную последовательность под SEQ ID NO:45, и указанная CDR3 имеет аминокислотную последовательность под SEQ ID NO:46. В одном варианте осуществления биспецифическое антитело к IL-18/IL-1β содержит второй вариабельный домен тяжелой цепи (VH2) иммуноглобулина, содержащий гипервариабельные области CDR1, CDR2 и CDR3, причем указанная CDR1 имеет аминокислотную последовательность под SEQ ID NO:47, указанная CDR2 имеет аминокислотную последовательность под SEQ ID NO:48, и указанная CDR3 имеет аминокислотную последовательность под SEQ ID NO:49. В одном варианте осуществления биспецифическое антитело к IL-18/IL-1β содержит второй вариабельный домен тяжелой цепи (VH2) иммуноглобулина, содержащий гипервариабельные области CDR1, CDR2 и CDR3, причем указанная CDR1 имеет аминокислотную последовательность под SEQ ID NO:50, указанная CDR2 имеет аминокислотную последовательность под SEQ ID NO:51, и указанная CDR3 имеет аминокислотную последовательность под SEQ ID NO:52.
В одном варианте осуществления биспецифическое антитело к IL-18/IL-1β содержит первый вариабельный домен легкой цепи (VL1) иммуноглобулина, содержащий гипервариабельные области CDR1, CDR2 и CDR3, причем указанная CDR1 имеет аминокислотную последовательность под SEQ ID NO:92, указанная CDR2 имеет аминокислотную последовательность под SEQ ID NO:93, и указанная CDR3 имеет аминокислотную последовательность под SEQ ID NO:94. В одном варианте осуществления биспецифическое антитело к IL-18/IL-1β содержит первый вариабельный домен легкой цепи (VL1) иммуноглобулина, содержащий гипервариабельные области CDR1, CDR2 и CDR3, причем указанная CDR1 имеет аминокислотную последовательность под SEQ ID NO:95, указанная CDR2 имеет аминокислотную последовательность под SEQ ID NO:96, и указанная CDR3 имеет аминокислотную последовательность под SEQ ID NO:97. В одном варианте осуществления биспецифическое антитело к IL-18/IL-1β содержит первый вариабельный домен легкой цепи (VL1) иммуноглобулина, содержащий гипервариабельные области CDR1, CDR2 и CDR3, причем указанная CDR1 имеет аминокислотную последовательность под SEQ ID NO:98, указанная CDR2 имеет аминокислотную последовательность под SEQ ID NO:99, и указанная CDR3 имеет аминокислотную последовательность под SEQ ID NO:100.
В одном варианте осуществления биспецифическое антитело к IL-18/IL-1β содержит второй вариабельный домен легкой цепи (VL2) иммуноглобулина, содержащий гипервариабельные области CDR1, CDR2 и CDR3, причем указанная CDR1 имеет аминокислотную последовательность под SEQ ID NO:60, указанная CDR2 имеет аминокислотную последовательность под SEQ ID NO:61, и указанная CDR3 имеет аминокислотную последовательность под SEQ ID NO:62. В одном варианте осуществления биспецифическое антитело к IL-18/IL-1β содержит второй вариабельный домен легкой цепи (VL2) иммуноглобулина, содержащий гипервариабельные области CDR1, CDR2 и CDR3, причем указанная CDR1 имеет аминокислотную последовательность под SEQ ID NO:63, указанная CDR2 имеет аминокислотную последовательность под SEQ ID NO:64, и указанная CDR3 имеет аминокислотную последовательность под SEQ ID NO:65. В одном варианте осуществления биспецифическое антитело к IL-18/IL-1β содержит второй вариабельный домен легкой цепи (VL2) иммуноглобулина, содержащий гипервариабельные области CDR1, CDR2 и CDR3, причем указанная CDR1 имеет аминокислотную последовательность под SEQ ID NO:66, указанная CDR2 имеет аминокислотную последовательность под SEQ ID NO:67, и указанная CDR3 имеет аминокислотную последовательность под SEQ ID NO:68.
В одном варианте осуществления биспецифическое антитело к IL-18/IL-1β содержит первый домен VH1 иммуноглобулина и первый домен VL1 иммуноглобулина, где: a) первый домен VH1 иммуноглобулина содержит (например, последовательно) i) гипервариабельные области CDR1, CDR2 и CDR3, причем указанная CDR1 имеет аминокислотную последовательность под SEQ ID NO:76, указанная CDR2 имеет аминокислотную последовательность под SEQ ID NO:77, и указанная CDR3 имеет аминокислотную последовательность под SEQ ID NO:78; или ii) гипервариабельные области CDR1, CDR2 и CDR3, причем указанная CDR1 имеет аминокислотную последовательность под SEQ ID NO:79, указанная CDR2 имеет аминокислотную последовательность под SEQ ID NO:80, и указанная CDR3 имеет аминокислотную последовательность под SEQ ID NO:81; или iii) гипервариабельные области CDR1, CDR2 и CDR3, причем указанная CDR1 имеет аминокислотную последовательность под SEQ ID NO:82, указанная CDR2 имеет аминокислотную последовательность под SEQ ID NO:83, и указанная CDR3 имеет аминокислотную последовательность под SEQ ID NO:84, и b) первый домен VL1 иммуноглобулина содержит (например, последовательно) i) гипервариабельные области CDR1, CDR2 и CDR3, причем указанная CDR1 имеет аминокислотную последовательность под SEQ ID NO:92, указанная CDR2 имеет аминокислотную последовательность под SEQ ID NO:93, и указанная CDR3 имеет аминокислотную последовательность под SEQ ID NO:94, или ii) гипервариабельные области CDR1, CDR2 и CDR3, причем указанная CDR1 имеет аминокислотную последовательность под SEQ ID NO:95, указанная CDR2 имеет аминокислотную последовательность под SEQ ID NO:96, и указанная CDR3 имеет аминокислотную последовательность под SEQ ID NO:97, или iii) гипервариабельные области CDR1, CDR2 и CDR3, причем указанная CDR1 имеет аминокислотную последовательность под SEQ ID NO:98, указанная CDR2 имеет аминокислотную последовательность под SEQ ID NO:99, и указанная CDR3 имеет аминокислотную последовательность под SEQ ID NO:100.
В одном варианте осуществления биспецифическое антитело к IL-18/IL-1β содержит второй домен VH2 иммуноглобулина и второй домен VL2 иммуноглобулина, где: a) второй домен VH2 иммуноглобулина содержит (например, последовательно) i) гипервариабельные области CDR1, CDR2 и CDR3, причем указанная CDR1 имеет аминокислотную последовательность под SEQ ID NO:44, указанная CDR2 имеет аминокислотную последовательность под SEQ ID NO:45, и указанная CDR3 имеет аминокислотную последовательность под SEQ ID NO:46; или ii) гипервариабельные области CDR1, CDR2 и CDR3, причем указанная CDR1 имеет аминокислотную последовательность под SEQ ID NO:47, указанная CDR2 имеет аминокислотную последовательность под SEQ ID NO:48, и указанная CDR3 имеет аминокислотную последовательность под SEQ ID NO:49; или iii) гипервариабельные области CDR1, CDR2 и CDR3, причем указанная CDR1 имеет аминокислотную последовательность под SEQ ID NO:50, указанная CDR2 имеет аминокислотную последовательность под SEQ ID NO:51, и указанная CDR3 имеет аминокислотную последовательность под SEQ ID NO:52, и b) второй домен VL2 иммуноглобулина содержит (например, последовательно) i) гипервариабельные области CDR1, CDR2 и CDR3, причем указанная CDR1 имеет аминокислотную последовательность под SEQ ID NO:60, указанная CDR2 имеет аминокислотную последовательность под SEQ ID NO:61, и указанная CDR3 имеет аминокислотную последовательность под SEQ ID NO:62, или ii) гипервариабельные области CDR1, CDR2 и CDR3, причем указанная CDR1 имеет аминокислотную последовательность под SEQ ID NO:63, указанная CDR2 имеет аминокислотную последовательность под SEQ ID NO:64, и указанная CDR3 имеет аминокислотную последовательность под SEQ ID NO:65, или iii) гипервариабельные области CDR1, CDR2 и CDR3, причем указанная CDR1 имеет аминокислотную последовательность под SEQ ID NO:66, указанная CDR2 имеет аминокислотную последовательность под SEQ ID NO:67, и указанная CDR3 имеет аминокислотную последовательность под SEQ ID NO:68.
В одном варианте осуществления биспецифическое антитело к IL-18/IL-1β содержит: а) первый вариабельный домен тяжелой цепи (VH1) иммуноглобулина, содержащий аминокислотную последовательность, представленную под SEQ ID NO:85; b) первый вариабельный домен легкой цепи (VL1) иммуноглобулина, содержащий аминокислотную последовательность, представленную под SEQ ID NO:101; c) первый домен VH1 иммуноглобулина, содержащий аминокислотную последовательность, представленную под SEQ ID NO:85, и первый домен VL1 иммуноглобулина, содержащий аминокислотную последовательность, представленную под SEQ ID NO:101; d) первый домен VH1 иммуноглобулина, содержащий гипервариабельные области, представленные под SEQ ID NO:76, SEQ ID NO:77 и SEQ ID NO:78; e) домен VL1 иммуноглобулина, содержащий гипервариабельные области, представленные под SEQ ID NO:92, SEQ ID NO:93 и SEQ ID NO:94; f) первый домен VH1 иммуноглобулина, содержащий гипервариабельные области, представленные под SEQ ID NO:79, SEQ ID NO:80 и SEQ ID NO:81; g) первый домен VL1 иммуноглобулина, содержащий гипервариабельные области, представленные под SEQ ID NO:95, SEQ ID NO:96 и SEQ ID NO:97; h) первый домен VH1 иммуноглобулина, содержащий гипервариабельные области, представленные под SEQ ID NO:76, SEQ ID NO:77 и SEQ ID NO:78, и первый домен VL1 иммуноглобулина, содержащий гипервариабельные области, представленные под SEQ ID NO:92, SEQ ID NO:93 и SEQ ID NO:94; i) первый домен VH1 иммуноглобулина, содержащий гипервариабельные области, представленные под SEQ ID NO:79, SEQ ID NO:80 и SEQ ID NO:81, и первый домен VL1 иммуноглобулина, содержащий гипервариабельные области, представленные под SEQ ID NO:95, SEQ ID NO:96 и SEQ ID NO:97; j) первую легкую цепь, содержащую SEQ ID NO:103; k) первую тяжелую цепь, содержащую SEQ ID NO:87; или l) первую легкую цепь, содержащую SEQ ID NO:103, и первую тяжелую цепь, содержащую SEQ ID NO:87.
В одном варианте осуществления биспецифическое антитело к IL-18/IL-1β содержит: а) второй вариабельный домен тяжелой цепи (VH2) иммуноглобулина, содержащий аминокислотную последовательность, представленную под SEQ ID NO:53; b) второй вариабельный домен легкой цепи (VL2) иммуноглобулина, содержащий аминокислотную последовательность, представленную под SEQ ID NO:69; c) второй домен VH2 иммуноглобулина, содержащий аминокислотную последовательность, представленную под SEQ ID NO:53, и второй домен VL2 иммуноглобулина, содержащий аминокислотную последовательность, представленную под SEQ ID NO:69; d) второй домен VH2 иммуноглобулина, содержащий гипервариабельные области, представленные под SEQ ID NO:44, SEQ ID NO:45 и SEQ ID NO:46; e) второй домен VL2 иммуноглобулина, содержащий гипервариабельные области, представленные под SEQ ID NO:60, SEQ ID NO:61 и SEQ ID NO:62; f) второй домен VH2 иммуноглобулина, содержащий гипервариабельные области, представленные под SEQ ID NO:47, SEQ ID NO:48 и SEQ ID NO:49; g) второй домен VL2 иммуноглобулина, содержащий гипервариабельные области, представленные под SEQ ID NO:63, SEQ ID NO:64 и SEQ ID NO:65; h) второй домен VH2 иммуноглобулина, содержащий гипервариабельные области, представленные под SEQ ID NO:44, SEQ ID NO:45 и SEQ ID NO:46, и второй домен VL2 иммуноглобулина, содержащий гипервариабельные области, представленные под SEQ ID NO:60, SEQ ID NO:61 и SEQ ID NO:62; i) второй домен VH2 иммуноглобулина, содержащий гипервариабельные области, представленные под SEQ ID NO:47, SEQ ID NO:48 и SEQ ID NO:49, и второй домен VL2 иммуноглобулина, содержащий гипервариабельные области, представленные под SEQ ID NO:63, SEQ ID NO:64 и SEQ ID NO:65; j) вторую легкую цепь, содержащую SEQ ID NO:81; k) вторую тяжелую цепь, содержащую SEQ ID NO:55; или l) вторую легкую цепь, содержащую SEQ ID NO:81, и вторую тяжелую цепь, содержащую SEQ ID NO:55.
В некоторых вариантах осуществления биспецифическое антитело к IL-18/IL-1β содержит три CDR под SEQ ID NO:53. В других вариантах осуществления биспецифическое антитело к IL-18/IL-1β содержит три CDR под SEQ ID NO:69. В других вариантах осуществления биспецифическое антитело к IL-18/IL-1β содержит три CDR под SEQ ID NO:53 и три CDR под SEQ ID NO:69. В некоторых вариантах осуществления биспецифическое антитело к IL-18/IL-1β содержит три CDR под SEQ ID NO:85. В других вариантах осуществления биспецифическое антитело к IL-18/IL-1β содержит три CDR под SEQ ID NO:101. В других вариантах осуществления биспецифическое антитело к IL-18/IL-1β содержит три CDR под SEQ ID NO:85 и три CDR под SEQ ID NO:101.
В некоторых вариантах осуществления биспецифическое антитело к IL-18/IL-1β содержит три CDR под SEQ ID NO:85. В других вариантах осуществления биспецифическое антитело к IL-18/IL-1β содержит три CDR под SEQ ID NO:101. В других вариантах осуществления биспецифическое антитело к IL-18/IL-1β содержит три CDR под SEQ ID NO:85 и три CDR под SEQ ID NO:101. В некоторых вариантах осуществления биспецифическое антитело к IL-18/IL-1β содержит три CDR под SEQ ID NO:53. В других вариантах осуществления биспецифическое антитело к IL-18/IL-1β содержит три CDR под SEQ ID NO:69. В других вариантах осуществления биспецифическое антитело к IL-18/IL-1β содержит три CDR под SEQ ID NO:53 и три CDR под SEQ ID NO:69. В варианте осуществления биспецифическое антитело к IL-18/IL-1β содержит три CDR под SEQ ID NO:85, три CDR под SEQ ID NO:101, три CDR под SEQ ID NO:53 и три CDR под SEQ ID NO:69.
В одном варианте осуществления первая часть биспецифического антитела к IL-18/IL-1β выбрана из антитела человека к IL-18, которое содержит по меньшей мере а) тяжелую цепь иммуноглобулина или ее фрагмент, которые содержат вариабельный домен, содержащий последовательно гипервариабельные области CDR1, CDR2 и CDR3 и константную часть тяжелой цепи человека или ее фрагмент; причем указанная CDR1 имеет аминокислотную последовательность под SEQ ID NO:76, указанная CDR2 имеет аминокислотную последовательность под SEQ ID NO:77, и указанная CDR3 имеет аминокислотную последовательность под SEQ ID NO:78; и b) легкую цепь иммуноглобулина или ее фрагмент, которые содержат вариабельный домен, содержащий последовательно гипервариабельные области CDR1, CDR2 и CDR3 и константную часть легкой цепи человека или ее фрагмент, причем указанная CDR1 имеет аминокислотную последовательность под SEQ ID NO:92, указанная CDR2 имеет аминокислотную последовательность под SEQ ID NO:93, и указанная CDR3 имеет аминокислотную последовательность под SEQ ID NO:94. Кроме того, вторая часть биспецифического антитела к IL-18/IL-1β выбрана из антитела человека к IL-1β, которое содержит по меньшей мере а) тяжелую цепь иммуноглобулина или ее фрагмент, которые содержат вариабельный домен, содержащий последовательно гипервариабельные области CDR1, CDR2 и CDR3 и константную часть тяжелой цепи человека или ее фрагмент; причем указанная CDR1 имеет аминокислотную последовательность под SEQ ID NO:44, указанная CDR2 имеет аминокислотную последовательность под SEQ ID NO:45, и указанная CDR3 имеет аминокислотную последовательность под SEQ ID NO:46; и b) легкую цепь иммуноглобулина или ее фрагмент, которые содержат вариабельный домен, содержащий последовательно гипервариабельные области CDR1, CDR2 и CDR3 и константную часть легкой цепи человека или ее фрагмент, причем указанная CDR1 имеет аминокислотную последовательность под SEQ ID NO:60, указанная CDR2 имеет аминокислотную последовательность под SEQ ID NO:61, и указанная CDR3 имеет аминокислотную последовательность под SEQ ID NO:62.
В одном варианте осуществления первая часть биспецифического антитела к IL-18/IL-1β выбрана из антитела человека к IL-18, которое содержит по меньшей мере а) тяжелую цепь иммуноглобулина или ее фрагмент, которые содержат вариабельный домен, содержащий последовательно гипервариабельные области CDR1, CDR2 и CDR3 и константную часть тяжелой цепи человека или ее фрагмент; причем указанная CDR1 имеет аминокислотную последовательность под SEQ ID NO:76, указанная CDR2 имеет аминокислотную последовательность под SEQ ID NO:77, и указанная CDR3 имеет аминокислотную последовательность под SEQ ID NO:78; и b) легкую цепь иммуноглобулина или ее фрагмент, которые содержат вариабельный домен, содержащий последовательно гипервариабельные области CDR1, CDR2 и CDR3 и константную часть легкой цепи человека или ее фрагмент, причем указанная CDR1 имеет аминокислотную последовательность под SEQ ID NO:92, указанная CDR2 имеет аминокислотную последовательность под SEQ ID NO:93, и указанная CDR3 имеет аминокислотную последовательность под SEQ ID NO:94. Кроме того, вторая часть биспецифического антитела к IL-18/IL-1β выбрана из антитела человека к IL-1β, которое содержит по меньшей мере а) тяжелую цепь иммуноглобулина или ее фрагмент, которые содержат вариабельный домен, содержащий последовательно гипервариабельные области CDR1, CDR2 и CDR3 и константную часть тяжелой цепи человека или ее фрагмент; причем указанная CDR1 имеет аминокислотную последовательность под SEQ ID NO:44, указанная CDR2 имеет аминокислотную последовательность под SEQ ID NO:45, и указанная CDR3 имеет аминокислотную последовательность под SEQ ID NO:46; и b) легкую цепь иммуноглобулина или ее фрагмент, которые содержат вариабельный домен, содержащий последовательно гипервариабельные области CDR1, CDR2 и CDR3 и константную часть легкой цепи человека или ее фрагмент, причем указанная CDR1 имеет аминокислотную последовательность под SEQ ID NO:60, указанная CDR2 имеет аминокислотную последовательность под SEQ ID NO:61, и указанная CDR3 имеет аминокислотную последовательность под SEQ ID NO:62.
Первый домен VH1 или VL1 биспецифического антитела к IL-18/IL-1β, применяемого в раскрытых способах, может включать в себя первый домен VH1 и/или первый домен VL1, которые практически идентичны доменам VH или VL, представленным под SEQ ID NO:85 и 101. Биспецифическое антитело к IL-18/IL-1β, раскрытое в данном документе, может содержать первую тяжелую цепь, которая практически идентична представленной под SEQ ID NO:87, и/или первую легкую цепь, которая практически идентична представленной под SEQ ID NO:103. Биспецифическое антитело к IL-18/IL-1β, раскрытое в данном документе, может содержать первую тяжелую цепь, которая содержит SEQ ID NO:87, и первую легкую цепь, которая содержит SEQ ID NO:103. Биспецифическое антитело к IL-18/IL-1β, раскрытое в данном документе, может содержать: а) первую тяжелую цепь, содержащую вариабельный домен, содержащий аминокислотную последовательность, практически идентичную последовательности, представленной под SEQ ID NO:85, и константную часть тяжелой цепи человека, содержащую модификацию, обеспечивающую гетеродимеризацию; и b) первую легкую цепь, содержащую вариабельный домен, содержащий аминокислотную последовательность, практически идентичную последовательности, представленной под SEQ ID NO:101, и константную часть легкой цепи человека. Константная часть тяжелой цепи человека может относиться к IgG1. В одном варианте осуществления IgG1 представляет собой IgG1 человека без эффекторных мутаций. В одном варианте осуществления IgG1 тяжелой цепи человека содержит "молчащую" мутацию N297A, D265A или комбинацию L234A и L235A. В одном конкретном варианте осуществления IgG1 тяжелой цепи человека содержит "молчащую" мутацию, которая представляет собой комбинацию L234A и L235A, в соответствии с SEQ ID NO:87.
Второй домен VH2 или VL2 биспецифического антитела к IL-18/IL-1β, применяемого в раскрытых способах, может включать в себя второй домен VH2 и/или первый домен VL2, которые практически идентичны доменам VH или VL, представленным под SEQ ID NO:53 и 69. Биспецифическое антитело к IL-18/IL-1β, раскрытое в данном документе, может содержать вторую тяжелую цепь, которая практически идентична представленной под SEQ ID NO:55, и/или вторую легкую цепь, которая практически идентична представленной под SEQ ID NO:71. Биспецифическое антитело к IL-18/IL-1β, раскрытое в данном документе, может содержать вторую тяжелую цепь, которая содержит SEQ ID NO:53, и вторую легкую цепь, которая содержит SEQ ID NO:69. Биспецифическое антитело к IL-18/IL-1β, раскрытое в данном документе, может содержать: а) вторую тяжелую цепь, содержащую вариабельный домен, содержащий аминокислотную последовательность, практически идентичную последовательности, представленной под SEQ ID NO:53, и константную часть тяжелой цепи человека, содержащую модификацию, обеспечивающую гетеродимеризацию, которая является комплементарной модификации, обеспечивающей гетеродимеризацию, первой тяжелой цепи; и b) вторую легкую цепь, содержащую вариабельный домен, содержащий аминокислотную последовательность, практически идентичную последовательности, представленной под SEQ ID NO:69, и константную часть легкой цепи человека. Константная часть тяжелой цепи человека может относиться к IgG1. В одном варианте осуществления IgG1 представляет собой IgG1 человека без эффекторных мутаций. В одном варианте осуществления IgG1 тяжелой цепи человека содержит "молчащую" мутацию N297A, D265A или комбинацию L234A и L235A. В одном конкретном варианте осуществления IgG1 тяжелой цепи человека содержит "молчащую" мутацию, которая представляет собой комбинацию L234A и L235A, в соответствии с SEQ ID NO:55.
Другими предпочтительными антагонистами IL-18 (например, антителами) для применения в качестве первой части биспецифического антитела в раскрытых способах, наборах и схемах лечения являются те, которые изложены в патенте США № 9376489, который включен в данный документ посредством ссылки во всей своей полноте.
Другими предпочтительными антагонистами IL-1β (например, антителами) для применения в качестве второй части биспецифического антитела в раскрытых способах, наборах и схемах лечения являются те, которые изложены в патентах США №№ 7446175, или 7993878, или 8273350, которые включены в данный документ посредством ссылки во всей своей полноте.
(1) Конструирование векторов
Два вектора, вектор A и вектор B, были получены в соответствии со следующей схемой. Вектор А был сконструирован для части антитела mAb1 (IgG1 к IL18). Константная область тяжелой цепи 1 была модифицирована двумя точечными мутациями по типу замены T на W, как видно в положении 366 в SEQ ID NO: 87, и S на C, как видно в положении 354 в SEQ ID NO: 87, для образования структуры выступа и обеспечения образования Cys-мостиков. Кроме того, константная область тяжелой цепи 1 была модифицирована точечными мутациями по типу замены L на A, как видно в положении 234 в SEQ ID NO: 87, и L на A, как видно в положении 235 в SEQ ID NO: 87 (так называемыми LALA), для частичного подавления эффекторных функций Fc-домена. Антитело содержит вариабельную область легкой цепи, которая относится к типу лямбда 1, Vλ1.
Вектор B был сконструирован для части антитела mAb2 (IgG1 к IL-1β). Константная область тяжелой цепи 2 была модифицирована четырьмя точечными мутациями по типу замены T на S, как видно в положении 366 в SEQ ID NO: 55, L на A, как видно в положении 368 в SEQ ID NO: 55, Y на V, как видно в положении 407 в SEQ ID NO: 55, и Y на C, как видно в положении 349 в SEQ ID NO: 55, для образования структуры впадины и обеспечения образования дополнительных Cys-мостиков. Структура впадины взаимодействует со структурой выступа для способствования получению биспецифического антитела. Кроме того, константная область тяжелой цепи 2 была модифицирована двумя мутациями LALA по типу замены L на A, как видно в положении 234 в SEQ ID NO: 55, L на A, как видно в положении 235 в SEQ ID NO: 55, для подавления эффекторных функций Fc-домена. Антитело содержит вариабельную область легкой цепи, которая относится к типу каппа 6, Vκ6.
Векторы A и B несут комбинацию селектируемых маркеров DHFR и гена устойчивости к неомицину, а также селектируемых маркеров FOLR и гена устойчивости к гигромицину соответственно. Фолиевая кислота представляет собой витамин, необходимый для синтеза пуринов и метионина, которые клетки млекопитающих должны поглощать из культуральной среды. "Рецептор фолиевой кислоты" (FolR), присутствующий в экспрессионной плазмиде A, представляет собой мутантную форму FolR с измененной аффинностью к фолатам, облегчающую транспорт фолиевой кислоты из среды в клетки млекопитающих. С учетом того, что рецепторы фолиевой кислоты с высокой аффинностью слабо экспрессируются в культивируемых клетках СНО, клетки, экспрессирующие рекомбинантный FolR, обладают явным преимуществом роста в условиях низкого содержания фолата (50 нМ). Селектируемый маркер FolR кодировался в векторе B.
В дополнение к FolR, "дигидрофолатредуктаза" (DHFR) присутствует в векторе A в качестве селектируемого маркера. DHFR превращает фолиевую кислоту в жизненно важные предшественники для синтеза пуринов и метионина. MTX является химическим аналогом фолиевой кислоты. Он конкурирует за свободные сайты связывания на DHFR и тем самым блокирует фермент. Клетки, сверхэкспрессирующие экзогенный DHFR, могут справляться с повышенными концентрациями MTX, давая клеткам явное селективное преимущество при росте в среде, дополненной MTX. Комбинированный отбор по FolR и DHFR хорошо известен специалисту в данной области и раскрыт, например, в патентном документе WO 2010/097240A1, включенном в данный документ посредством ссылки во всей своей полноте. MTX хорошо известен специалисту в данной области и раскрыт, например, в патентном документе WO 2010/097239A1, включенном в данный документ посредством ссылки во всей своей полноте. Векторы экспрессии хорошо известны специалисту в данной области и раскрыты, например, в патентном документе WO 2009/080720A1, включенном в данный документ посредством ссылки во всей своей полноте.
Схематическое представление двух векторов показано на фиг. 1.
(2) Линия клеток-хозяев и трансфекция
Исходную линию клеток СНО использовали в качестве линии клеток-хозяев для получения линии клеток, экспрессирующих bbmAb1. Линию клеток-хозяев получали из линии клеток CHO-K1, хорошо известной специалисту в данной области, способом, описанным, например, в патентных заявках WO 2015092737 и WO 2015092735, обе из которых включены в данный документ посредством ссылки во всей своей полноте.
Один флакон с линией СНО использовали для получения линии рекомбинантных клеток, экспрессирующих bbmAb1. Линию СНО получали в среде с определенным химическим составом.
Клетки выращивали в среде для культивирования с определенным химическим составом.
Для каждой трансфекции добавляли один мкг линеаризованной плазмидной ДНК SwaI, векторы экспрессии A и B, кодирующие bbmAb. Реакцию трансфекции проводили в среде для культивирования с определенным химическим составом.
Трансфекции выполняли посредством электропорации с использованием системы AMAXA Gene Pulser в соответствии с инструкциями производителя. Исходные клетки СНО, используемые для трансфекции, находились в фазе экспоненциального роста с жизнеспособностью клеток более 95%. Всего было выполнено три трансфекции с использованием 5×106 клеток для каждой трансфекции.
Сразу после трансфекции клетки переносили во встряхиваемые колбы, содержащие среду для культивирования с определенным химическим составом.
Пулы клеток инкубировали в течение 48 часов при 36,5°С и 10% СО2 перед началом процесса отбора.
(3) Отбор и сортировка клеток
Процедуру отбора осуществляли с использованием селектируемого маркера, кодируемого отдельными векторами экспрессии A и B, как описано выше. Оба белка (FolR и DHFR) участвуют в одном и том же молекулярном пути; FolR транспортирует фолиевую кислоту, а также аналог фолата MTX в клетку, DHFR превращает ее в жизненно важные предшественники для синтеза пуринов и метионина. Объединяя их на основе селективного принципа, можно использовать особую строгую схему отбора для обогащения рекомбинантными клетками, экспрессирующими оба рекомбинантных белка.
Через 48 ч после трансфекции и роста в условиях низкого содержания фолата применяли дополнительное селективное давление путем добавления 10 нМ MTX к среде для культивирования с определенным химическим составом. Через 22 дня после начала отбора посредством MTX появились популяции пулов, состоящие преимущественно из устойчивых к MTX клеток. После восстановления пулов клетки замораживали, и получали клеточные осадки. Для определения концентрации bbmAb были сформированы стандартные партии в среде для культивирования с определенным химическим составом.
Применяли методику HPLC с использованием белка A для определения всех видов продуктов и технологических примесей, содержащих Fc-часть, при этом обращенно-фазовую хроматографию (RPC) применяли для получения характеристической хроматограммы распределения отдельных фракций - отнесение отдельных пиков проводили по методике MS.
Пулы клеток СНО, продуцирующие bbmAb1, применяли для процедуры клонирования методом FACS, чтобы получить индивидуализированные клональные клеточные линии в качестве исходного материала для всех дальнейших оценок. Отбор клеток с использованием анализа методом FACS описан, например, в заявке на патент US20110281751, включенной в данный документ посредством ссылки во всей своей полноте.
Отдельные клональные линии клеток CHO, экспрессирующие bbmAb1, получали с помощью сортировки клеток с активацией флуоресценции (FACS). Для обеспечения возможности FACS-сортировки клетки инкубировали с FITC-меченным Fab-фрагментом антитела к IgG1 в течение 30 минут и дважды промывали в PBS перед использованием в процессе сортировки одиночных клеток с помощью FACS, хорошо известном специалисту в данной области.
FACS-сортировку клеток проводили с помощью FACS Aria (Becton Dickinson), оснащенной модулем автоматического осаждения клеток (ACDU), с использованием программного обеспечения FACS Diva.
Чтобы гарантировать, что прибор для FACS будет сортировать только одиночные клетки, настройки были скорректированы в соответствии с режимом точности для одиночных клеток с использованием форсунки диаметром 130 мкм, а также соответствующей скорости потока, обеспечивающей хорошее качество сортировки.
В режиме для одиночных клеток маска чистоты была установлена на максимум, поэтому сортировались только капли без частиц или дополнительных клеток.
Фазовая маска была установлена на половину максимума, поэтому отклонялись только частицы, расположенные в центре отсортированной капли. Траектория капель и точность подсчета были оптимизированы за счет выхода, чтобы увеличить вероятность того, что каждая капля содержала не более 1 одиночной клетки.
Для проверки и документального подтверждения моноклонального происхождения и для подтверждения статуса одиночной клетки в день 0 после FACS-клонирования были получены изображения всех лунок 96-луночных планшетов с использованием системы визуализации.
Изображение дня 0, относящееся к клону для продуцирования bbmAb1, визуально проверяли в двух экземплярах, подтверждая, что на изображении соответствующей лунки, полученном с помощью системы визуализации, была идентифицирована только одна одиночная клетка.
Это подчеркнуло происхождение клона для продуцирования bbmAb1 от одиночной клетки.
(4) Размножение клеток
После FACS-клонирования в течение первых недель клоны обрабатывали роботизированной системой, а позже обрабатывали вручную, постадийно размножая от культивирования в 96 лунках, 24 лунках до культивирования в шейкере и, наконец, культивирования в биореакторе, хорошо известных специалисту в данной области, чтобы оценить показатели функционирования (производительность и качество экспрессии bbmAb).
Во время размножения/культивирования рекомбинантные клетки СНО культивировали в среде для культивирования с определенным химическим составом, дополненной метотрексатом (МТХ) в конечной концентрации 10 нМ.
Клетки пересеивали 2-3 раза в неделю в свежую среду и поддерживали в фазе логарифмического роста в течение всего исследования.
Продуктивность оценивали с помощью HPLC с использованием белка А, исходный профиль качества продукта определяли с помощью обращенно-фазовой хроматографии (RPC).
Все замороженные запасы были получены в среде для культивирования с добавлением 7,5% DMSO.
(5) Стабильность клонов
Выделенные bbmAb из пулов и клонов тщательно оценивали с помощью различных аналитических методик, чтобы оценить характеристики продукта и параметры качества для обеспечения выбора наиболее подходящего продуцирующего клона.
Кроме того, проводили избыточный анализ стабильности продуцирования для продуцирующих клонов для обеспечения выбора наиболее подходящих продуцирующих клонов.
Для оценки стабильности клонов применяли различные современные аналитические методики: аффинную жидкостную хроматографию, обращенно-фазовую хроматографию, FACS и MS.
(6) Производство
(a) Предшествующие стадии обработки
Материал bbmAb получали во встряхиваемых колбах либо в культурах с подпиткой в биореакторе WAVE. Замороженный запас пулов или клонов, таких как PSL, размораживали и размножали в течение необходимого периода времени в среде с определенным химическим составом, чтобы получить необходимое количество клеток для посева продуцирующей культуры, обычно при плотности посева клеток 4,0×105 клеток/мл. Отдельную культуру культивировали в течение периода 13-14 дней. Во время культивирования выполняли внутрипроизводственный контроль для отслеживания концентрации bbmAb и профиля качества в надосадочной жидкости. В конце процесса культивирования клетки отделяли от надосадочной жидкости культуры клеток посредством центрифугирования (например, с помощью шейкера) либо посредством глубокой фильтрации с последующей стерилизующей фильтрацией перед дальнейшей DSP-обработкой.
(b) Последующие стадии обработки
Исходя из структуры формата и подхода на основе совместной экспрессии, в надосадочной жидкости после культивирования клеток и удаления клеточного дебриса ожидали не только интактный продукт bbmAb1 и типичные примеси, такие как агрегаты, ДНК и белки клетки-хозяина, но также мономеры, гомодимеры и характеризующиеся ошибочным спариванием легкой/тяжелой цепей варианты bbmAb1, полученные из mAb1 и mAb2, как показано на фиг. 4. Предполагается, что варианты bbmAb1 с ошибочным спариванием легкой/тяжелой цепей (фиг. 4E-4M) обладают такими же биофизическими свойствами, что и интактное bbmAb1, которое нельзя легко удалить в препаративном масштабе.
Подход I. Очистка посредством захвата с помощью MabSelect™ SuRe™, заключительной очистки с помощью LambdaFabSelect™ и KappaSelect™
bbmAb1 и варианты bbmAb1, несущие Fc-часть, отбирали из бесклеточной надосадочной жидкости посредством первой стадии аффинной жидкостной хроматографии (ALC) на MabSelect™ SuRe™. Варианты bbmAb1, содержащие только легкие каппа-цепи (mAb2 со впадиной, фиг. 4C и 4D), и HCP удаляли посредством первой заключительной очистки с помощью LambdaFabSelect™, а варианты bbmAb1, содержащие только легкие лямбда-цепи (mAb1 с выступом, фиг. 4A и 4B), и HCP удаляли посредством второй стадии заключительной очистки с помощью KappaSelect ™.
Хроматографию проводили при комнатной температуре, используя время удерживания (RT) 4 минуты в течение всего способа. Все колонки перед загрузкой уравновешивали с помощью 4 объемов колонки (CV) 20 мМ Na2HPO4/NaH2PO4, pH 7,0. Для удаления неспецифично связанных примесей из продукта, таких как белки клетки-хозяина (HCP), компоненты среды и ДНК, хроматографическую колонку промывали с помощью 4 CV 250 мМ аргинина-HCl, 1 М NaCl, 88 мМ NaOH, pH 9,0 и 3 CV уравновешивающего буфера после загрузки бесклеточной надосадочной жидкости, содержащей bbmAb1, из встряхиваемой колбы в колонку для ALC. bbmAb1 и возможные варианты bbmAb1 элюировали из хроматографической колонки с помощью 50 мМ уксусной кислоты, рН 3,0, и, соответственно, 50 мМ уксусной кислоты/HCl, рН 2,0 для элюирования из KappaSelect™ и LambdaFabSelect™. Сбор пиков продукта начинали и заканчивали при 0,5 AU/см или 0,25 AU/см (280 нм). pH элюатов, содержащих bbmAb1, доводили до ~pH 5,0 с помощью 0,1 или 1 M Трис перед хранением при 2-8°С соответственно для аналитической оценки.
Подход II. Очистка посредством захвата с помощью LambdaFabSelect™, заключительной очистки с помощью Capto™ Adhere и Fractogel™ EMD SO3
Во втором подходе интактные bbmAb1 и варианты bbmAb1, содержащие только легкие лямбда-цепи (мономер и гомодимер mAb1 с выступом, фиг. 4А и 4В), отбирали из бесклеточной надосадочной жидкости посредством аффинной жидкостной хроматографии на LambdaFabSelect™. Для инактивации потенциально присутствующих оболочечных вирусов проводили обработку элюата после ALC при низком pH с последующими двумя стадиями хроматографической заключительной очистки с помощью Capto Adhere и Fractogel™ EMD SO3 для удаления технологических примесей, ДНК и HCP. Потенциально присутствующие вирусы затем удаляли посредством нанофильтрации перед конечной стадией концентрирования и замены буфера с помощью тангенциальной поточной фильтрации.
a) Аффинная жидкостная хроматография (ALC) на LambdaFabSelect™
ALC проводили при 18-28°C, используя время удерживания (RT) 3,6-4,4 минуты в течение всего способа. Сначала колонку для ALC уравновешивали с помощью 4-6 CV 20 мМ Na2HPO4/NaH2PO4, pH 7,0. Затем очищенную бесклеточную надосадочную жидкость, содержащую bbmAb1, из биореактора WAVE или других биореакторов загружали в колонку LambdaFabSelect™ при плотности загрузки 7-23 г/л. Промывание колонки с помощью 4-6 CV 250 мМ аргинина-HCl, 1 М NaCl, 88 мМ NaOH, pH 9,0 и второе промывание с помощью 3-5 CV уравновешивающего буфера проводили перед элюированием продукта с помощью 4-6 CV 50 мМ уксусной кислоты. Пик продукта собирали при 0,5-2,0 AU/см (280 нм) в восходящем режиме и 0,5-2,0 AU/см (280 нм) в нисходящем режиме. Колонку LambdaFabSelect™ очищали с помощью 3-5 CV 120 мМ фосфорной кислоты, 167 мМ уксусной кислоты, pH 1,5 перед повторным уравновешиванием с помощью 3-5 CV 20 мМ Na2HPO4/NaH2PO4, pH 7,0 и хранением в 4-6 CV 20% этанола.
b) Инактивация вирусов
pH элюата после ALC доводили до рН 3,4-3,6 с помощью 0,3 М фосфорной кислоты. После этого раствор белка затем инкубировали в течение 60-90 мин при этом низком рН перед тем, как довести рН до 7,3-7,7 с помощью 1 М Трис. Стадию глубокой фильтрации с использованием фильтров Millipore B1HC Pod применяли с использованием скорости потока 100-300 л/м2/час перед стерилизующей фильтрацией с помощью стерильного фильтра Sartopore™ с размером пор 0,45/0,2 мкм.
c) Мультимодальная анионообменная хроматография (MAC) на Capto™ Adhere
MAC проводили в проточном режиме при 18-28°C, используя время удерживания 4-6 минуты в течение всего способа. Сначала колонку для MAC уравновешивали с помощью 7-9 CV 20 мМ трис/трис-HCl, pH 7,5. Затем обработанный при низких значениях pH элюат после ALC загружали в колонку Capto™ Adhere, используя плотность загрузки 175-350 г/л. Таким образом, сбор пика продукта начинали при 0,5-2,0 AU/см (280 нм) в восходящем режиме. Затем колонку MAC промывали с помощью 5-7 CV уравновешивающего буфера, и сбор пика продукта заканчивали при 0,5-2,0 AU/см (280 нм) в нисходящем режиме. Затем белок с колонки Capto™ Adhere снимали с помощью 6-8 CV 100 мМ уксусной кислоты с последующей стадией безразборной очистки с помощью 3-5 CV 0,5 М NaOH и хранением в 3-5 CV 0,1 М NaOH.
d) Катионообменная хроматография (CEC) на Fractogel™ EMD SO3
CEC на Fractogel™ EMD SO3 проводили в режиме связывания-элюирования при 18-28°C. Во время уравновешивания, снятия белков, CIP и хранения использовали время удерживания 6-8 минут, а во время загрузки, промывки и элюирования использовали время удерживания 8-10 минут. Колонку для CEC уравновешивали с помощью 6-8 CV 20 мМ янтарной кислоты, 35,1 мМ NaOH, pH 6,0. Затем продукт перколяции после MAC загружали в колонку при плотности загрузки 35-70 г/л. Затем колонку для CEC промывали с помощью 5-7 CV уравновешивающего буфера. Элюирование проводили с использованием линейного градиента концентрации солей от 10 до 90% 20 мМ янтарной кислоты, 500 мМ NaCl, 37,4 мМ NaOH, pH 6,0 на 15 CV. Пик продукта bbmAb1 собирали, начиная с 0,1-0,4 AU/см в восходящем режиме до 20-40% максимальной высоты пика при 300 нм. Белок с колонки Fractogel™ EMD SO3 снимали с помощью 3-5 CV 1 М NaCl с последующей стадией безразборной очистки с помощью 3-5 CV 0,5 М NaOH и хранением в 3-5 CV 0,1 М NaOH.
e) Нанофильтрация
Потенциально присутствующие вирусы удаляли посредством нанофильтрации с помощью нанофильтра Planova™ 20N и предфильтра Millipore SHR-P с размером пор 0,5/0,1 мкм. Предварительную фильтрацию и нанофильтрацию выполняли, применяя дифференциальное давление 0,7-0,9 бар.
f) Тангенциальная поточная фильтрация и составление
Для концентрирования и диафильтрации bbmAb1 проводили стадию тангенциальной поточной фильтрации на мембранах Millipore™ Pellicon™ 3 RC с порогом отсечения 30 кДа при 18-28°C. Сначала раствор белка bbmAb1, подвергнутый нанофильтрации, концентрировали при максимальной плотности загрузки от 1000 г/м2 до 60-80 г/л, используя давление потока подачи от 0,5 до 1,2 бар и трансмембранное давление (TMP) 0,3-0,6 бар. Затем bbmAb1 подвергали диафильтрации против 7-9 диафильтрационных объемов 20 мМ гистидина/гистидина-HCl, pH 6,0, при давлении потока подачи от 0,8 до 1,8 бар и TMP 0,4-0,9 бар. Выполняли вторую стадию концентрирования до 134±10 г/л при давлении потока подачи 1,4-3,0 бар и TMP от 0,7 до 1,5 бар. Раствор белка bbmAb1, подвергнутый ультрафильтрации, в конечном счете составляли в концентрации 100±10 г/л и 0,04% (вес/объем) полисорбата 20. Конечное лекарственное вещество (DS) фильтруют через фильтр с размером пор 0,2 мкм и хранят в замороженном виде при ≤ -60°C.
(7) Аналитическое определение характеристик и оценка чистоты
(a) LC-MS-скрининг интактных bbmAb и их вариантов
100 мкг очищенных с помощью белка А образцов bbmAb лиофилизировали в 96-луночном планшете и дегликозилировали с помощью PNGазы F (New England Biolabs) в течение 18 часов при 37°С в 100 мкл 50 мМ буфера трис-HCl, рН 7,5. Образцы измеряли с помощью LC-ESI-MS на системе для UPLC H-класса (Waters), подсоединенной к масс-спектрометру Q-TOF Synapt G2 (Waters). Колонку для микрообессоливания MassPREP 2,1×5 мм (Waters) использовали при температуре колонки 80°C. Линейный градиент применяли при 0,3 мл/мин с подвижной фазой A: 0,1% муравьиная кислота в воде, подвижной фазой B: 0,1% FA в ацетонитриле: 0-2 мин 5% B, 2-12 мин 5-90% B, с последующими несколькими стадиями промывки при 0,5 мл/мин. Параметры MS: режим разрешения ESI+, напряжение на капилляре 3 кВ, напряжение на пробоотборном конусе 40 В, температура источника 150°С, температура десольватации 400°С. Система была откалибрована с помощью калибровочного раствора NaCl, соединение с фиксированной массой представляло собой лейцин-энкефалин. Данные обрабатывали с помощью автоматической деконволюции MaxEnt1 (диапазон масс 60-150 кДа, подавление гармоник) с использованием программного обеспечения UNIFI 1.6 (Waters). Идентификация и относительное количественное определение соединений bbmAb и их вариантов с ошибками спаривания основана на сопоставлении теоретически ожидаемой массы и относительной интенсивности сигнала массы в масс-спектре после деконволюции.
(b) Получение характеристик bbmAb1 с помощью LC-MS
Интактное дегликозилированное bbmAb. Очищенное антитело bbmAb1 разводили в 20 мМ трис-HCl, рН 7,5 до 1 мг/мл и дегликозилировали в течение 4 ч при 37°С, используя 2 мкл фермента PNGазы F (New England Biolabs). Расщепление останавливали путем добавления трифторуксусной кислоты (TFA) до 2%.
Восстановленное дегликолизированное bbmAb. bbmAb1 разводили до 5 мг/мл в 20 мкл 0,1 М трис-HCl, рН 7,5. Добавляли 2 мкл PNGазы F и инкубировали в течение 4 ч при 37°С, затем к смеси добавляли 80 мкл денатурирующего буфера (50 мМ трис-HCl, рН 8,0, 6 М гидрохлорида гуанидина) и 1 мкл 1 М DTT. После инкубирования в течение 1 часа при 37°С образец подкисляли с помощью 1 мкл TFA.
Расщепление bbmAb с помощью папаина до Fab и Fc. bbmAb1 смешивали с буфером для расщепления (20 мМ янтарной кислоты, 35,1 мМ NaOH, pH 6,0, 1 мМ Cys-HCl, 1 мМ EDTA) до 5 мг/мл, затем добавляли протеазу папаин (Roche, Германия) до конечной концентрации 5 мкг/мл (соотношение протеаза/белок 1:1000) и инкубировали в течение 2 часов при 37°С при встряхивании. После инкубирования реакцию в растворе останавливали путем добавления раствора йодацетамида до конечной концентрации 1,2 мМ.
Расщепление bbmAb с помощью IdeS до F(ab')2 и Fc. 100 мкг bbmAb1 смешивали с буфером для расщепления (50 мМ фосфата натрия, 150 мМ NaCl, рН 6,6) и расщепляли с помощью 100 ед. протеазы IdeS (Fabricator, Genovis) в течение ночи при 37°С. После инкубирования реакцию в растворе останавливали путем добавления TFA до 2% конечной концентрации.
Расщепление восстановленного белка под действием LysC - пептидное картирование. (Согласно Rombach-Riegraf et al., PlosOne 2014) 200 мкг белка денатурировали с помощью 150 мкл денатурирующего раствора (6 М гидрохлорида гуанидина, 50 мМ трис-HCl, 5 мМ Na2EDTA, рН 8,0) и восстанавливали путем добавления 1,5 мкл 1 М DTT и инкубирования при 37°С в течение одного часа. Алкилирование осуществляли путем добавления 3 мкл 1 М йодацетамида с последующим инкубированием при 37°С в темноте. Реакцию останавливали с помощью 1 мкл 1 М DTT. После восстановления/алкилирования к образцу добавляли 750 мкл буфера для расщепления (50 мМ трис-HCl, рН 8). Затем образец расщепляли путем двух добавлений 4 мкл 1 мкг/мкл раствора эндопротеиназы LysC (Wako (Осака, Япония)) и инкубирования при 37°С в течение 1 часа и 3 часов соответственно. Для гашения расщепления добавляли 5 мкл TFA.
Измерения методом LC-MS. Образцы белков подвергали воздействию системы LC-MS с использованием системы Waters для UPLC H-класса, оснащенной колонкой BEH C4 RP (1,7 мкм, 2,1×100 мм, 300  , Waters) и масс-спектрометром TOF Xevo G2 (Waters, Милфорд). Элюенты представляли собой A: 0,1% TFA в воде и B: 0,09% TFA в ацетонитриле: Колонку устанавливали на 80°С. Скорость потока составляла 0,2 мл/мин. Белки элюировали с использованием 40-минутного градиента следующим образом: 0-5 мин 10% B, 5-10 мин 10-30% B, 10-25 мин 30-40% B, 25-26 мин 40-95% B, 26-28 мин 95%, 28-40 мин 10% B.
, Waters) и масс-спектрометром TOF Xevo G2 (Waters, Милфорд). Элюенты представляли собой A: 0,1% TFA в воде и B: 0,09% TFA в ацетонитриле: Колонку устанавливали на 80°С. Скорость потока составляла 0,2 мл/мин. Белки элюировали с использованием 40-минутного градиента следующим образом: 0-5 мин 10% B, 5-10 мин 10-30% B, 10-25 мин 30-40% B, 25-26 мин 40-95% B, 26-28 мин 95%, 28-40 мин 10% B.
Настройки MS: режим ESI (+) TOF, режим разрешения, диапазон масс 400-4000 Да, время сканирования 1 с, напряжение на капилляре 3 кВ, напряжение на пробоотборном конусе 25 В-40 В. Система была откалибрована с помощью раствора NaCsI.
Продукты расщепления пептидов анализировали с помощью RP-LC-MS на системе для UPLC H-класса (Waters), соединенной с масс-спектрометром Q-TOF Synapt G2 (Waters), используя CSH130 C18 2,1 мм x 150, 1,7 мкм (Waters, Милфорд). Подвижная фаза A: 0,1% TFA в воде, и подвижная фаза B: 0,09% TFA в ацетонитриле: Пептиды элюировали из колонки с использованием следующего градиента: 0-5 мин 0% B, 5-10 мин 0-2% B, 10-40 мин 2-20% B, 40-120 мин 20-40% B, 120-135 мин 40-70% при температуре колонки 40°C. UV-хроматограммы регистрировали при 214 нм, и сбор данных MS проводили в положительном режиме разрешения ES(+) в качестве эксперимента по методу MSE с использованием низкоэнергетической (4 эВ) и высокоэнергетической фрагментации (30-55 В). Соединение с фиксированной массой представляло собой лейцин-энкефалин (Waters).
Обработку и оценку данных проводили с помощью программного обеспечения MassLynx 4.2 или UNIFI 1.6 (Waters). Алгоритм MaxEnt1 использовали для деконволюции масс-спектров белка. Расчет теоретической массы проводили с использованием программного обеспечения GPMAW 9.2 (данные Lighthouse).
(c) Обращенно-фазовая хроматография
Образцы bbmAb анализировали с помощью системы для HPLC Agilent 1260 с использованием колонки Poroshell 300 SB-C8 RP, 2,1 мм х 75 мм, 5 мкм (Agilent). Температуру колонки устанавливали на 80°С, скорость потока составляла 2 мл/мин, подвижная фаза А: 90% воды, 10% ацетонитрила, 0,1% TFA, 0,3% PEG-300, подвижная фаза B: 10% воды, 90% ацетонитрила, 0,1% TFA, 0,3% PEG-300. Используемый градиент представлял собой: 0-5 мин 22-37% B, 5,0-5,1 мин 100% B, 5,1-6 мин 100% B, 6,1-8,5 мин 22% B. UV-сигнал регистрировали при 210 нм. Сбор и оценку данных контролировали и проводили с помощью программного обеспечения Chromeleon™ 6.8 (Thermo Scientific).
(d) Эксклюзионная хроматография
Образец bbmAb1 подвергали воздействию геля TSK G3000SWXL (Tosoh № 808541, 5 мкм, 7,8 мм х 300 мм) в колонке SEC с размером пор 250 A с использованием системы Agilent 1260. Подвижная фаза представляла собой 150 мМ раствора фосфата калия, рН 6,5, скорость потока составляла 0,4 мл/мин, температура колонки составляла 30°С. UV-сигнал регистрировали при 210 нм. Сбор данных и интегрирование пиков проводили с помощью Chromeleon™ 6.8 (Thermo Scientific).
(e) Капиллярный электрофорез CE-SDS
Для CE-SDS в невосстанавливающих условиях образец bbmAb смешивали с буфером для образцов (0,1 фосфата натрия/1,0% SDS, pH 6,6) и затем смешивали с раствором йодацетамида. Для CE-SDS в восстанавливающих условиях белок смешивали с буфером для образцов на основе 0,1 М Трис/1% SDS, рН 8,0 и восстанавливали с помощью 5% (об./об.) меркаптоэтанола. Оба образца проходили стадию термической денатурации при 70°С в течение 10 минут.
Образцы анализировали в системе Beckman PA 800, оснащенной капилляром из плавленого кремния без покрытия (50 мкм, 375 OD, 67 см, Beckman) с общей длиной капилляра 30 см, который заполняли буферным разделяющим гелем Beckman для SDS-MW. Разделение проводили от отрицательной к положительной полярности при 15 кВ и температуре капилляра 25°C, выявление с помощью UV-излучения осуществляли при 214 нм. Электрофореграммы обрабатывали и интегрировали с помощью программного обеспечения Chromeleon™ 6.8.
(f) Капиллярный зональный электрофорез CZE
Разделение проводили на фармацевтической аналитической системе Beckman Counter PA 800, оснащенной детектором UV-излучения, работающим при 214 нм. Белок разделяли на капилляре из плавленого кремния (ID 50 мкм) общей длиной 40 см с напряжением на капилляре 20 кВ при 25°С и положительной полярностью. Подвижный буфер: 400 мМ 6-аминокапроновой кислоты/уксусной кислоты, рН 5,7, с 2 мМ TETA и 0,03% Tween 20. Интегрирование пиков выполняли с помощью программного обеспечения Chromeleon™ 6.8.
(8) Аналитические результаты
Чистоту и принадлежность различных комбинаций и конструкций биспецифических антител после совместной экспрессии анализировали после очистки с помощью белка А с использованием подхода масс-скрининга посредством UPLC-MS для интактных белков. Этот подход применяли для подтверждения и относительного количественного определения образовавшихся гетеро- и гомодимеров из надосадочной жидкости культуры клеток. Правильно образованные гетеродимерные bbmAb1 и bbmAb2 могут наблюдаться с относительной чистотой более 85% на основании интенсивности сигнала массы интактного белка. Основными примесями, наблюдаемыми на экране, были антитела с ошибочным спариванием с двумя легкими каппа-цепями, двумя легкими лямбда-цепями и димерными молекулами из HC со впадиной.
Таблица 4. Обобщенные аналитические результаты, полученные для bbmAb1-bbmAb11.
впадина
KH:L2L2
KH:L1L1
5%
10%
KH:L1L1
KH:L2L2
6%
10%
KH:L1L1
HH:L1L1 (димер H)
35%
11%
KH:L2L2
HH:L1L1 (димер H)
KH:L2L2
9%
11%
17%
HH:L2L2 (димер H)
47%
KH:L2L2
KH:L1L1
HH:L1L1 (димер H)
21%
20%
9%
HH:L2L2 (димер H)
Частичное Ab: H:L2, H:L2+Cys
20%
KH:L2L2
KH:L1L1
HH:L2L2 (димер H)
34%
17%
14%
KH:L1L1
HH:L1L1 (димер H)
KH:L2L2
23%
12%
7%
KH:L1L1
HH:L1L1 (димер H)
"Скобка" HC bsAb
Частичное Ab: H:L1, H:L1+Cys
22%
23%
10%
HH:L1L1 (димер H)
KH:L1L1
Частичное Ab: H:L1, H:L1+Cys
41%
10%
Обозначение l относится к лямбда-цепи, k относится к каппа-цепи.
mAb3 представляет собой антитело типа VH3, Vk1.
mAb4 представляет собой антитело типа VH3, Vk1.
mAb5 представляет собой привитый вариант mAb1 (VH1, Vl1).
mAb6 представляет собой привитый вариант mAb2 (VH1_46, Vk3).
mAb7 представляет собой антитело типа VH3, Vk1.
mAb8 представляет собой антитело типа VH1_2, Vk2.
mAb9 представляет собой антитело типа VH5, Vk6.
mAb10 представляет собой антитело типа VH1_46, Vk6.
mAb11 представляет собой антитело типа VH3, Vk3.
mAb12 представляет собой антитело типа VH3, Vk2.
Для bbmAb1 получали более подробные характеристики для оценки всех образовавшихся вариантов продукта и примесей после различных стадий очистки с помощью LC-MS с использованием нескольких способов получения образца и других методик разделения. Массу интактного прошедшего 2 стадии (связывание с лямбда-цепью/CEC) очистки продукта определяли после дегликозилирования с помощью фермента PNGазы F и последующего введения в установку для RP-LC-MS. Масс-спектр интактного bbmAb1 после деконволюции подтвердил правильное образование гетеродимера с модификацией по типу "выступ во впадину" после совместной экспрессии и лямбда-селективной очистки. Никаких крупных примесей, таких как гомодимеры или частичные антитела, не было обнаружено после лямбда-селективной очистки. Принадлежность четырех различных цепей антител может быть подтверждена после восстановления и дегликозилирования образца.
Чтобы проверить наличие ошибочного спаривания цепей и других незначительных примесей, очищенный образец расщепляли протеазой папаином для анализа отдельных Fab- и Fc-фрагментов. Измеренные массы фрагментов вновь подтвердили правильное образование различных Fab-плеч (выступ-лямбда, впадина-каппа), а также правильное образование Fc-фрагмента с модификацией по типу "выступ во впадину". Fab-фрагмент с ошибочным спариванием (Fab4, выступ-каппа) может наблюдаться на уровнях < 1%. Был протестирован альтернативный подход с образованием Fab-фрагментов с помощью ограниченного расщепления под действием LysC, что позволяет быстрее получить образец во время отбора пула и клонов.
Другая стратегия расщепления с использованием фермента IdeS (Fabricator) была протестирована для получения Fc- и F(ab')2-фрагментов. В этом эксперименте наблюдали массу гетеродимера Fc и правильно образованный гетеродимер F(ab')2. Присутствие Fc-гетеродимера также является доказательством правильного образования дополнительного дисульфидного мостика в Fc-части bbmAb1, так как в противном случае образовывался бы только Fc/2-фрагмент меньшей массы.
Пептидное картирование с помощью LC-MS с использованием LysC может подтвердить принадлежность молекулы с общим охватом последовательности пептидов 99%.
Конкретные результаты для очищенных образцов показаны на фиг. 2. В частности, RP-UV-хроматограмма дегликозилированного интактного биспецифического mAb показана на фиг. 2А. Расщепленные с помощью папаина фрагменты bbmAb1 показаны на фиг. 2С. Расщепленные с помощью IdeS фрагменты bbmAb1 показаны на фиг. 2D. Дегликозилированные и восстановленные с помощью DTT фрагменты bbmAb1 показаны на фиг. 2E. Масс-спектр интактного дегликозилированного биспецифического mAb bbmAb1 после деконволюции показан на фиг. 2В.
Результаты показаны в таблице 5.
Таблица 5. Отнесение измеренных масс bbmAb1 с помощью RP-LC-MS
(Да)
Повышенная чистота, которой достигли после применения различных стадий, описанных выше, показана на фиг. 3. Фиг. 3А представляет собой хроматограмму, на которой показан профиль экспрессии после культивирования, фиг. 3В представляет собой хроматограмму после захвата с помощью LambdaFabSelect™, фиг. 3С представляет собой хроматограмму после захвата с помощью MabSelect™ SuRe™, а фиг. 3D представляет собой хроматограмму после захвата с помощью LambdaFabSelect™, заключительной очистки с помощью Fractogel™ EMD SO3 и ультрафильтрации.
Конечное прошедшее 2 стадии очистки (связывание с лямбда-цепью/CEC) биспецифическое bbmAb1 дополнительно анализировали с помощью способов, перечисленных в таблице 6. В целом материал демонстрирует высокую чистоту при низком уровне агрегатов или продуктов распада, как выявляется с помощью нескольких способов разделения, таких как эксклюзионная хроматография (SEC), CE-SDS и капиллярный зональный электрофорез (CZE).
Таблица 6. Аналитические данные чистоты очищенного bbmAb1
Также тестировали дополнительные комбинации других антител. В таблице 4 показаны обобщенные полученные аналитические результаты.
6. Пример 2. Активность bbmAb1 in vitro
Связывающую активность bbmAb1 тестировали в различных клеточных анализах.
(1) Материалы и способы
(а) Для анализов титрования при равновесии в растворе (SET)
Использовали следующий материал.
Рекомбинантный IL-18 человека, биотинилированный (BTP25828)
Рекомбинантный IL-1β яванского макака (Novartis)
Антитело к IgG человека, меченное SULFO-TAG (Meso Scale discovery (MSD) № R32AJ-5)
Антитело козы, специфичное к Fab человека, конъюгированное со сложным NHS-эфиром SULFO-TAG MSD (Jackson Immuno Research № 109-005-097, MSD № R91AN-1), в BSA (Sigma № A-9647)
Буфер для считывания T MSD с поверхностно-активным веществом (MSD № R92TC-1)
Фосфатно-солевой буфер (PBS) 10x (Teknova № P0195), трис-буферный солевой раствор, pH 7,5 (TBS) 10x (Teknova № T1680), Tween-20 (Fluka № 93773)
Полипропиленовый титрационный микропланшет (MTP) (Greiner № 781280)
384-луночные планшеты, стандартные (MSD № L21XA)
(b) Для клеточных анализов и анализов SET
mAb2, описанное в разделе антитела к IL-1β.
mAb1, описанное в разделе антитела к IL-18.
bbmAb1, описанное в примере 1.
Рекомбинантный IL-18 человека (BTP 25829), приобретенный в MBL Int. Corp. (№ B001-5)
Рекомбинантный IL-1β игрунки (Novartis)
Рекомбинантный IL-18 игрунки (Novartis)
Рекомбинантный IL-12 человека (№ 573008) был получен из линии клеток KG-1 Biolegend (ATCC № CCL-246)
Нормальные дермальные фибробласты человека (№ CC-2509) были приобретены у Lonza
Фибробласты кожи игрунки (№ 42637F (510))
Клетки HEK-Blue™, экспрессирующие IL-18/IL-1β, (№ hkb-il18) были приобретены у InvivoGen
РВМС были выделены из лейкоцитарной пленки, полученной от Blutspendezentrum Bern
Кровь игрунки была получена от SILABE, Нидеросберген
ELISA для IL-6: человека (BioLegend, № 430503); игрунки (U-CyTech biosciences, CT974-5)
ELISA для IFNγ: человека (BD555142), игрунки (U-CyTech biosciences № CT340A)
Наборы для анализов QUANTI-Blue™ (№ rep-qb1) для определения SEAP были приобретены у InvivoGen
Среда для клеток: RPMI 1640 (Invitrogen №31870) с добавлением 10% фетальной бычьей сыворотки (Invitrogen № 10108-157), 1% L-глутамина (Invitrogen № 25030-03), 1% пенициллина/стрептомицина (Invitrogen № 15140-148), 10 мкМ 2-меркаптоэтанола (Gibco № 31350-010), 5 мМ Hepes (Gibco №15630-080)
96-луночные планшеты с круглым дном, обработанные для культивирования тканей (Costar № 3799)
96-луночные планшеты с плоским дном, обработанные для культивирования тканей (Costar № 3596)
Ficoll-Paque™ Plus (GE Healthcare Life Sciences №17-1440-02) PBS 1X, без кальция и магния (Gibco №14190094)
Пробирки Leucosep с пористым барьером, 50 мл, полипропилен (Greiner Bio-One № 227290), полипропиленовые конические пробирки Falcon на 15 мл (BD № 352096)
Полипропиленовые конические пробирки Falcon на 50 мл (BD №352070)
(c) Измерения аффинности с помощью SET
Анализ SET в отношении связывания с отдельной мишенью
В буфере для образцов (PBS, содержащем 0,5% бычьего сывороточного альбумина (BSA) и 0,02% Tween-20) готовили 22 серийных 1,6-кратных разведения антигенов (наивысшая концентрация: huIL-18, 5 нМ; marIL-18, 10 нМ; huIL-1β, 0,5 нМ; marIL-1β, 0,5 нМ) и добавляли постоянную концентрацию антитела (для считывания показаний IL-18 10 пМ, для считывания показаний IL-1β 1 пМ). Объем 60 мкл/лунка каждой смеси антиген-антитело распределяли в двух повторностях в 384-луночный полипропиленовый титрационный микропланшет (MTP). Буфер для образцов служил в качестве отрицательного контроля, а образец, содержащий только антитела, в качестве положительного контроля (максимальный сигнал электрохемилюминесценции без антигена, Bmax). Планшет закрывали и инкубировали в течение ночи (o/n, по меньшей мере 16 часов) при комнатной температуре (к. т.) на шейкере.
Считывание показаний IL-18: покрытый стрептавидином 384-луночный планшет MTP MSD покрывали с помощью 30 мкл/лунка биотинилированного huIL-18 (0,1 мкг/мл, PBS) и инкубировали в течение 1 часа при к. т. на шейкере.
Считывание показаний IL-1β: стандартный 384-луночный планшет MTP MSD покрывали с помощью 30 мкл/лунка huIL-1 (3 мкг/мл, PBS), разведенного в PBS, в качестве средства захвата и инкубировали в течение ночи при 4°C.
Планшет блокировали с помощью 50 мкл/лунка блокирующего буфера (PBS, содержащего 5% BSA) в течение 1 часа (ч) при комнатной температуре (к. т.). После промывания (TBST, TBS, содержащим 0,05% Tween 20) объем 30 мкл/лунка уравновешенной смеси антиген-антитело переносили с полипропиленового MTP в покрытый планшет MSD и инкубировали в течение 20 мин при к. т. После дополнительной стадии промывки в каждую лунку добавляли 30 мкл меченного SULFO-TAG детекторного антитела к IgG (0,5 мкг/мл), разведенного в буфере для образцов, и инкубировали в течение 30 мин. при к. т. на шейкере. Планшет MSD промывали, и добавляли 35 мкл/лунка буфера для считывания MSD и инкубировали в течение 5 минут при к. т. Электрохемилюминесцентные (ECL) сигналы генерировались и измерялись с помощью MSD Sector Imager 6000.
Анализы SET в отношении одновременного связывания с мишенями
Анализ SET проводили описанным выше способом, за исключением следующего. В анализе A процесс уравновешивания (смесь антитело/антиген) проводили в присутствии избытка одной мишени (500 пМ IL-18 или IL-1β) с оцениванием при этом KD другой мишени.
В анализе B процесс уравновешивания (смесь антитело/антиген) проводили с обоими мишенями в серийных разведениях в одной смеси одновременно (постоянная концентрация антитела 10 пМ, наивысшая концентрация антигена, см. выше). Затем эту же смесь анализировали в отношении концентрации в ней свободных антител на планшетах, покрытых IL-18 и IL-1β, как описано выше.
Данные SET экспортировали в Xlfit, расширительное программное обеспечение для MS Excel. Средние сигналы ECL рассчитывали на основании измерений в двух повторностях в каждом анализе. В данные вносили поправку на исходные показатели путем вычитания наименьшего значения из всех точек данных, и их наносили на график в зависимости от соответствующей концентрации антигена для получения кривых титрования. Значения KD определяли путем аппроксимации графика в соответствии со следующим:
Модель связывания 1:2 для моноспецифического Ab
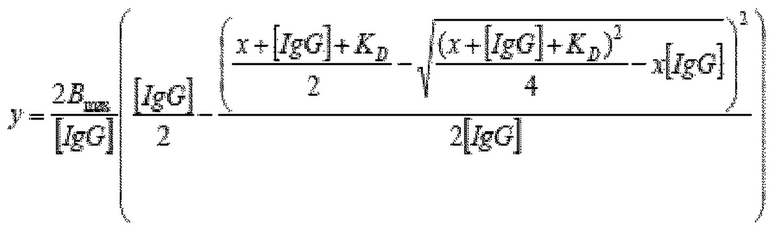
Модель связывания 1:1 для биспецифического Ab с модификацией по типу "выступ во впадину"
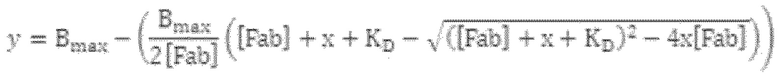
где
y: сигнал ECL c вычтенным значением для холостого образца
Bmax: максимальный сигнал ECL при нулевой концентрации антигена
[IgG]: применяемая концентрация антитела
[Fab]: применяемая общая концентрация Fab
KD: равновесная константа диссоциации
х: применяемая концентрация антигена
(d) Культивирование клеток
Клетки KG-1 выращивали в RPMI 1640 с добавлением 10% фетальной бычьей сыворотки, 1% L-глутамина и 1% пенициллина/стрептомицина при плотности от 2×105 до 1×106 жизнеспособных клеток/мл.
Нормальные фибробласты человека и фибробласты игрунки выращивали в FBM (Clonetics, CC-3131), содержащей bFGF (1 нг/мл, CC-4065), инсулин (5 мкг/мл, CC-4021) и 2% FCS (CC-4101). В качестве голодной среды использовали базальную среду для фибробластов (LONZA № CC-3131).
Клетки HEK-Blue™ IL-18/IL-1β выращивали в среде для роста (DMEM, 4,5 г/л глюкозы, 10% (об./об.) фетальной бычьей сыворотки, 50 ед/мл пенициллина, 50 мг/мл стрептомицина, 100 мг/мл Normocin™, 2 мМ L-глутамина с добавлением 30 мкг/мл бластицидина, 200 мкг/мл HygroGold™ и 100 мкг/мл Zeocin™.
Мононуклеарные клетки периферической крови человека (РВМС) были свежевыделенными из лейкоцитарной пленки с помощью пробирок LeucoSep в соответствии с инструкциями производителя. Вкратце, 13 мл Ficoll-Paque предварительно загружали в пробирку LeucoSep объемом 14 мл посредством центрифугирования в течение 30 с при 1000×g. Гепаринизированные образцы цельной крови разбавляли равными объемами PBS, и 25 мл разбавленной крови добавляли в пробирку LeucoSep. Пробирки для разделения клеток центрифугировали в течение 15 минут при 800×g без перерыва при комнатной температуре. Слой суспензии клеток собирали, и клетки дважды промывали в PBS (в течение 10 минут при 640 и 470×g, соответственно, для двух последовательных промывок) и ресуспендировали в культуральной среде перед подсчетом.
Кровь игрунки собирали в гепаринизированные пробирки и фильтровали с использованием клеточного фильтра с размером пор 70 мкм (BD Biosciences №352350)
(e) Анализы нейтрализации IL-1β
Анализ индуцированного IL-1β продуцирования IL-6 в фибробластах проводили в основном, как описано (Gram 2000), лишь с незначительными модификациями. Вкратце, фибробласты высевали при плотности 5×103 клеток на лунку (в 100 мкл) в 96-луночный планшет для тканевых культур с плоским дном. На следующий день клетки подвергали голоданию в течение 5 ч в голодной среде перед добавлением смеси рекомбинантный IL-1β/раствор соединения (концентрация IL-1β указана в таблице). Смесь IL-1β/раствор соединения готовили заранее посредством инкубирования рекомбинантного IL-1β с соединением в диапазоне концентраций в течение 30 минут при 37°C. Образцы надосадочной жидкости культуры клеток собирали после инкубирования o/n при 37°C, и определяли количество высвободившегося IL-6 с помощью ELISA. Анализ индуцированного IL-1β продуцирования IL-6 в РВМС проводили согласно следующему. PBMC высевали при 3×105 клеток на лунку (в 100 мкл) в 96-луночный планшет для тканевых культур и инкубировали со смесью рекомбинантный IL-1β/раствор соединения в течение 24 ч при 37°C (концентрация IL-1β указана в таблице). Смесь IL-1β/раствор соединения готовили заранее посредством инкубирования рекомбинантного IL-1β с соединением в диапазоне концентраций в течение 30 минут при 37°C. Образцы надосадочной жидкости культуры клеток собирали после 24-часовой стимуляции, и определяли количество высвободившегося IL-6 с помощью ELISA.
(f) Анализы нейтрализации IL-18
Анализ проводили в основном согласно следующему. Клетки KG-1 (которые предварительно подвергали голоданию в течение 1 ч в PBS+1% FCS) или PBMC при плотности 3×105 на лунку высевали в 96-луночные планшеты для культур клеток с круглым дном и инкубировали со смесью растворов рекомбинантных IL-18/IL-12 вместе с соединениями в диапазоне концентраций (концентрации IL-18/IL-12 указаны в таблице). После инкубирования в течение 24 часов при 37°C образцы надосадочной жидкости собирали, и определяли количество высвободившегося IFNγ с помощью ELISA. Для анализов с кровью игрунки использовали 85 мкл крови на лунку.
(g) Двойная нейтрализация IL-1β/IL-18 в клетках HEK-Blue™
Анализ проводили в основном так, как описано в процедурах обработки от производителя. Вкратце, клетки HEK-Blue™ высевали при плотности 4×104 на лунку в 96-луночные планшеты для культуры клеток и инкубировали со смесью растворов рекомбинантных IL-1β и IL-18 (для получения сигнала SEAP 1:1) вместе с соединениями в диапазоне концентраций. После инкубирования в течение 24 часов при 37°C образцы надосадочной жидкости собирали, и определяли количество высвободившегося SEAP с помощью способа QUANTI-Blue™ в соответствии с инструкциями производителя.
Все данные экспортировали в программное обеспечение EXCEL, а значения IC50 рассчитывали путем построения кривых зависимости доза-эффект для функций подбора логистической кривой с использованием программного обеспечения EXCEL/XLfit4 или GraphPad Prism.
(2) Результаты
(а) Аффинность к рекомбинантным IL-1β и IL-18 человека и игрунки
Аффинность связывания bbmAb1 с рекомбинантными белками IL-1β и IL-18 человека и игрунки измеряли посредством титрования при равновесии в растворе (SET) (фиг. 5), а полученные значения KD сравнивали с таковыми для связывания mAb2 с IL-1β и mAb1 с IL-18. На фиг. 5 показаны кривые титрования для определения аффинности на основании ECL в растворе с постоянной концентрацией антитела: для считывания показаний IL-18 10 пМ, для считывания показаний IL-1β 1 пМ; разведения антигена: наивысшая концентрация: huIL-18 5 нМ; marIL-18 10 нМ; huIL-1β 0,5 нМ; marIL-1β 0,5 нМ. Сплошные линии представляют данные, подобранные с помощью модели, описанной выше. Пунктирными линиями показан 95% доверительный интервал, n=3.
При сравнении аффинности связывания в анализе связывания с отдельной мишенью bbmAb1 показал сходное среднее значение KD по сравнению с mAb1 в отношении IL-18 человека и игрунки (таблица 7). Для связывания IL-1β человека среднее значение KD было немного выше для bbmAb1 (2,6 пМ) по сравнению с mAb2 (0,6 пМ), но по-прежнему находилось в том же диапазоне низких значений пМ. Последующие измерения в анализе одновременного связывания с двумя мишенями (таблица 8) подтвердили, что значения KD для связывания bbmAb1 с IL-1β были сходны со значениями для mAb2 в материале как доклинического, так и клинического применения. Таким образом, bbmAb1 обладает значениями аффинности связывания с двумя мишенями у людей и игрунок, которые сходны с mAb2 и mAb1 соответственно.
Таблица 7. Значения аффинности к рекомбинантным IL-1β и IL-18 человека (hu) и игрунки (mar), измеренные с помощью SET (определение связывания с отдельной мишенью)
В дополнение к результатам анализа связывания с отдельной мишенью исследовали значения аффинности одновременного связывания bbmAb1 с двумя мишенями (таблица 8) посредством применения избытка одной мишени во время оценки значений KD для связывания с другой мишенью (анализ A) или применения смеси обеих мишеней в серийных разведениях (анализ B). Одновременное определение аффинности к IL-1β/IL-18 не выявило существенных различий между анализом A (избыток одного антигена) и анализом B (смесь обоих антигенов в серийных разведениях), что доказало тот факт, что обе мишени связываются одновременно, не влияя на связывание другой мишени. Кроме того, значения KD, полученные с помощью анализов одновременного двойного связывания, были сходны со значениями KD, полученными с помощью стандартного анализа (таблица 7; в отсутствие второго антигена), что доказало тот факт, что bbmAb1 может связывать оба антигена независимо. Таким образом, bbmAb1 связывает одновременно и независимо как IL-1β, так и IL-18 человека и в полной мере перекрестно реагирует с соответствующими белками игрунки.
Таблица 8. Значения аффинности к рекомбинантным IL-1β и IL-18 человека (hu) и игрунки (mar), измеренные с помощью SET (определения одновременного связывания с мишенями)
(b) Нейтрализующая активность bbmAb1 в анализах с использованием клеток человека и игрунки
Оценивали нейтрализующую активность bbmAb1 в отношении обоих цитокинов (IL1β и IL-18) (в сравнении с mAb2 и mAb1). Кроме того, оценивали эффективность bbmAb1 в отношении нейтрализации IL-1β и IL-18 игрунки с использованием систем анализа клеток игрунки (см. раздел d).
(c) Отдельная и одновременная нейтрализация IL-1β и IL-18 в клетках человека
Нейтрализующую активность bbmAb1 в отношении IL-1β оценивали по ингибированию продуцирования IL-6, индуцированного рекомбинантным IL-1β, в дермальных фибробластах человека (IL-1β использовали при 6 пМ) и в PBMC человека (IL-1β использовали при 60 пМ). Нейтрализующую активность bbmAb1 в отношении IL-18 измеряли по ингибированию продуцирования IFN-γ, индуцированного рекомбинантной IL-18, в клетках KG-1 и PBMC человека (оба типа клеток активировали с помощью 3 нМ рекомбинантного IL-18 человека вместе с 1 нг/мл рекомбинантного IL-12 человека). Ингибирующую активность bbmAb1 в отношении IL-1β и IL-18 всегда сравнивали с таковой у mAb2 или mAb1 соответственно. В зависимости от анализов средние значения IC50 для bbmAb1 находились в диапазонах суб-нМ или одноразрядных нМ и были в 2-4 раза выше при прямом сравнении mAb2 (для IL-1β) и mAb1 (для IL-18) соответственно (таблица 9 и таблица 10). Моновалентный формат bbmAb1 по сравнению с бивалентным форматом mAb2/mAb1, а также потенциально мутации KiH могут быть причинами этого небольшого различия в эффективности bbmAb1.
Таблица 9. Средние значения IC50 для нейтрализации IL-1β с помощью bbmAb1 по сравнению с mAb2 в дермальных фибробластах человека и PBMC человека. *Ингибирование продуцирования IL-6, стимулированного рекомбинантным IL-1β человека, в дермальных фибробластах или PBMC человека (6 пМ для дермальных фибробластов и 60 пМ для PBMC). Показаны средние значения ± SEM (n=3 для PBMC и n=6 для дермальных фибробластов человека)
IC50 [нМ]
IC50 [нМ]
Таблица 10. Средние значения IC50 для нейтрализации IL-18 с помощью bbmAb1 по сравнению с mAb1 в клетках KG-1 и PBMC человека. **Ингибирование продуцирования IFNγ, стимулированного рекомбинантным IL-18 человека (3 нМ) и IL-12 человека (1 нг/мл), в клетках KG-1 или PBMC. Показаны средние значения ± SEM (n=3 для KG-1 и n=4 для PBMC)
IC50 [нМ]
IC50 [нМ]
bbmAb1 было способно одновременно нейтрализовать биологическую активность как IL-1β, так и IL-18, как продемонстрировано на репортерных клетках HEK Blue™, продуцирующих SEAP в ответ на стимуляцию 1+1 рекомбинантными IL-1β и IL-18 (таблица 11). Подобное ингибирование SEAP в этой аналитической системе было возможно только с помощью комбинации mAb2 и mAb1, но не с помощью применения отдельных антител.
Таблица 11. Средние значения IC50 для одновременной нейтрализации IL-1β и IL-18 по репортерной активности SEAP в клетках HEK Blue™. Показаны средние значения ± SEM для n=5 экспериментов.
(d) Нейтрализующая активность bbmAb1 в отношении IL-1β игрунки и IL-18 игрунки в анализах клеток игрунки
Чтобы продемонстрировать ингибирующую активность bbmAb1 у игрунок, с клетками игрунок проводили анализы in vitro, аналогичные анализам с клетками человека, однако с использованием рекомбинантных IL-1β и IL-18 игрунок для стимуляции. При оценке ингибирования продуцирования IL-6, индуцированного рекомбинантной IL-1β игрунки, в дермальных фибробластах игрунки bbmAb1 проявлял активность в диапазоне суб-нМ со значениями IC50 в 2-3 раза выше по сравнению с mAb2 (таблица 12). При тестировании bbmAb1 с дермальными фибробластами человека, стимулированными IL-1β игрунки, получали профиль ингибирования, сходный с таковым для IL-6 человека.
Таблица 12. Ингибирование продуцирования IL-6, индуцированного рекомбинантным IL-1β игрунки, в фибробластах игрунки и человека посредством bbmAb1. *Ингибирование продуцирования IL-6, стимулированного рекомбинантным IL-1β игрунки (18 пМ), в дермальных фибробластах игрунки или человека. Показаны результаты 3 отдельных экспериментов (A, B и C).
IC50 [нМ]
IC50 [нМ]
Значения нМ IC50 bbmAb1 от одноразрядных до двухразрядных подтвердили нейтрализующую активность bbmAb1 в отношении IL-18 игрунки, протестированную в анализе продуцирования IFNγ с использованием клеток крови игрунки (таблицы 3-7). При тестировании bbmAb1 с использованием PBMC человека, стимулированных IL-18 игрунки, получали профиль ингибирования, сходный с таковым при измерении продуцирования IFNγ человека.
Таким образом, было показано, что bbmAb1 в полной мере перекрестно реагирует с IL-1β игрунки и IL-18 игрунки в функциональных анализах с использованием иммунореактивных клеток игрунки.
Таблица 13. Средние значения IC50 для ингибирования продуцирования IFNγ, индуцированного рекомбинантным IL-18 игрунки, в цельной крови игрунки или PBMC человека. **Ингибирование продуцирования IFNγ, стимулированного рекомбинантным IL-18 игрунки (указанная концентрация) и IL-12 человека (10 нг/мл), в цельной крови игрунки (n=для 3 каждого соединения/условия) или PBMC человека (n=6). Показаны средние значения ± SEM.
Кровь игрунки
IC50 [нМ]
PBMC человека
IC50 [нМ]
Во множестве различных клеточных анализов было продемонстрировано, что биспецифическое mAb к IL-1β/IL-18 формата KiH bbmAb1 сохраняет высокую аффинность связывания, а также активность нейтрализации цитокинов в отношении двух отдельных мишеней IL-1β и IL-18 по сравнению с исходными mAb mAb2 и mAb1. Свойства двойной нейтрализации в отношении IL-1β и IL-18 были продемонстрированы у bbmAb1 не только для цитокинов/клеток человека, но также для соответствующих цитокинов/клеток игрунки, что облегчает проведение соответствующих токсикологических исследований. Более чем в 2-4 раза более высокие значения IC50, которые были получены в некоторых клеточных анализах нейтрализации IL-1β и IL-18, могут быть следствием моновалентного связывания bbmAb1 в отличие от бивалентного связывания mAb2 и mAb1 соответственно. Тем не менее, двойная нейтрализация цитокинов с помощью bbmAb1 может приводить к аддитивной или синергической ингибирующей активности in vivo, которая может не быть должным образом представлена в клеточных системах авторов настоящего изобретения in vitro.
7. Пример 3. Эффекты комбинированной стимуляции и блокады IL-1β и IL-18 в PBMC
Зависимое от активации инфламмасомами расщепление эффекторных цитокинов IL-1β и IL-18 приводит к индукции вторичных провоспалительных медиаторов и способствует накоплению/активации иммунных клеток не только системно, но также и в месте воспаления. На двух разных мышиных моделях смертельного системного воспаления (a) в модели инъекции LPS и (b) на мышах с FCAS (активация миссенс-мутаций в NLRP3), одновременное отсутствие/ингибирование как IL-1β, так и IL-18 в лучшей степени защищало от смертности по сравнению с отсутствием/ингибированием только IL-1β или только IL-18, что демонстрирует аддитивные или синергические механизмы иммунной активации (Brydges 2013, van den Berghe 2014). bbmAb1 представляет собой реактивное биспецифическое mAb к IL-1β/IL-18 человека/игрунки без перекрестной реактивности в отношении грызунов и, следовательно, не может тестироваться в мышиных моделях. Поэтому авторы настоящего изобретения использовали LPS/IL-12, чтобы имитировать зависимую от инфламмасом активацию пути in vitro для стимуляции PBMC человека для выявления аддитивных или синергических ингибирующих эффектов комбинированной нейтрализации IL-1β/IL-18 с помощью bbmAb1, и осуществили объективный анализ экспрессии генов с использованием микроматриц. В качестве дополняющей активности авторы настоящего изобретения также сравнивали профили экспрессии генов PBMC от разных доноров, стимулированных либо комбинацией рекомбинантного IL-1β и рекомбинантного IL-18, либо только отдельными цитокинами.
(1) Материалы и способы
(а) Культивирование клеток и ELISA
RPMI 1640 (Invitrogen № 31870 или Gibco № 61870-010) с добавлением 10% фетальной бычьей сыворотки (Invitrogen № 10108-157), 1% L-глутамина (Invitrogen № 25030-03), 1% пенициллина/стрептомицина (Invitrogen № 15140-148), 10 мкМ 2-меркаптоэтанола (Gibco № 31350-010), 5 мМ Hepes (Gibco № 15630-080)
Рекомбинантный IL-1β человека приобретали у Sino Biological Inc. (№ 10139-HNAE-5)
Рекомбинантный IL-18 человека приобретали у MBL (№ B001-5)
Рекомбинантный IL-12 человека приобретали у Biolegend (№ 573008)
ELISA для IFNγ: Стандартный набор MAX, BioLegend, № 430103 или набор для ELISA IFNγ человека BD OptEIA, BD № 555142
ELISA для IL-6: Стандартный набор MAX, BioLegend, № 430503
ELISA для IL-26: Cloud Clone Corp №SEB695Hu
mAb2, описанное в разделе антитела к IL-1β.
mAb1, описанное в разделе антитела к IL-18.
bbmAb1, описанное в примере 1.
LPS из Salmonella enterica серотипа enteritidis, Sigma № L7770
РВМС выделяли из лейкоцитарной пленки, полученной от Blutspendezentrum Bern
96-луночные планшеты с круглым дном, обработанные для культивирования тканей (Costar № 3799), 96-луночные планшеты с плоским дном, обработанные для культивирования тканей (Costar № 3596) Ficoll-Paque™ Plus (GE Healthcare Life Sciences № 17-1440-02), PBS 1X, без кальция и магния (Gibco № 14190094)
Полипропиленовые конические пробирки Falcon на 15 мл (BD № 352096), полипропиленовые конические пробирки Falcon на 50 мл (BD № 352070)
Пробирки LeucosepTM с пористым барьером, 50 мл, Greiner Bio-One № 227290
Клеточный фильтр с размером пор 70 мкм, BD Biosciences № 352350
Трипановый синий, Sigma № T8154
Выделение РНК, количественные и качественные измерения и qPCR:
Вода без нуклеаз, Ambion № AM9938
RNaseZAP, Ambion № AM9780
Пробирки Eppendorf на 1,5 мл, стерильные, без РНКазы и ДНКазы
Буфер RLT, Qiagen № 1015762
Набор RNeasy Mini, Qiagen № 74104
Набор ДНКаз без РНКазы, Qiagen № 79254
Набор Agilent RNA 6000 Nano, Agilent № 5067-1511
Станция для заправки чипов, Agilent № 5065-4401
Вихревой смеситель IKA
RNaseZAP®, Ambion № 9780
Биоанализатор Agilent 2100
Набор для синтеза кДНК путем обратной транскрипции высокой емкости, Applied Biosystems, № PN4374966
Пробирки для ПЦР на 0,2 мл, тонкостенные, с матовыми крышками, без НКаз, Ambion № AM12225
384-луночный реакционный планшет MicroAmp Optical, Applied Biosystems № 4309849
Мастер-микс TaqMan GenEx, Applied Biosystems № 4369514
ПЦР-праймер (Applied Biosystems)
Получение PBMC. PBMC выделяли из лейкоцитарной пленки с помощью центрифугирования в градиенте Ficoll-Paque в пробирках Leucosep в соответствии с инструкциями производителя. Вкратце, 15 мл Histopaque помещали в пробирки LeucosepTM на 50 мл и центрифугировали в течение 30 с при 1300 об/мин при к. т. С помощью пипетки на поверхность раствора Histopaque добавляли 30 мл разбавленной суспензии лейкоцитарной пленки и центрифугировали в течение 15 минут при к. т. при 1000 g без перерыва. Плазму крови удаляли (приблизительно 20 мл), и собирали пограничное кольцо (= РВМС человека) и переносили в пробирку Falcon на 50 мл. Пробирку заполняли 50 мл стерильного PBS и центрифугировали один раз при 1200 об/мин в течение 5 минут при к. т. Данное центрифугирование повторяли 2 раза. Надосадочную жидкость осторожно удаляли, а клетки ресуспендировали в 50 мл PBS с 2% FCS и 2 мМ EDTA. Суспензию клеток фильтровали с помощью клеточного фильтра с размером пор 70 мкм, и клетки подсчитывали, используя окрашивание трипановым синим (500 мкл трипанового синего+200 мкл клеток +300 мкл PBS).
Стимуляция PBMC с помощью LPS/IL-12. Продуцирование цитокинов в образцах надосадочной жидкости обеспечивали согласно следующему. 250000 клеток/лунка в конечном объеме 100 мкл распределяли в 96-луночных планшетах с круглым дном. LPS использовали в концентрациях от 0,3 мкг/мл до 3000 мкг/мл вместе с рекомбинантным IL-12 в концентрации 10 нг/мл. Образцы надосадочной жидкости собирали после 24 часов при 37°С и 10% СО2.
Экстракцию РНК из клеточных осадков проводили согласно следующему. 3×106 клеток/лунка в конечном объеме 1000 мкл распределяли в 24-луночных планшетах с плоским дном. LPS использовали при 3 мкг/мл вместе с рекомбинантным IL-12 в концентрации 10 нг/мл. Клетки собирали через 24 часа при 37°С и 10% СО2.
Стимуляция РВМС рекомбинантными цитокинами: 7×106 PBMC на лунку 12-луночного планшета использовали в 1,5 мл конечной полной среды RPMI. Рекомбинантные цитокины добавляли в следующих конечных концентрациях: 10 нг/мл рекомбинантного IL-1β, 3 нМ рекомбинантного IL-18, 1 нг/мл рекомбинантного IL-12. Как образцы надосадочной жидкости, так и клетки собирали через 4 часа и 24 часа при 37°C и 10% CO2.
Выделение, количественная и качественная оценка РНК. Клетки осаждали, а осадок лизировали в 350 мкл буфера Qiagen RTL с 2% β-меркаптоэтанолом и замораживали при -20°С или -80°С до тех пор, пока не были собраны все образцы в исследовании. Выделение РНК проводили с использованием стандартного протокола Qiagen. Вкратце, 350 мкл 70% этанола добавляли во все образцы перед переносом в центрифужную колонку RNeasy и центрифугировали в течение 15 с при 8000g. После удаления фильтрата добавляли 350 мкл буфера RW1, и колонку центрифугировали в течение 15 с при 8000g для промывания мембраны центрифужной колонки. Раствор инкубационной смеси с ДНКазой I получали в соответствии с инструкциями производителя и добавляли в центрифужную колонку RNeasy и инкубировали в течение 15 минут при к.т. После промывки с помощью 350 мкл и 500 мкл буфера RW1 центрифужную колонку RNeasy помещали в новую пробирку для сбора на 2 мл и центрифугировали на полной скорости в течение 1 мин. Наконец, РНК собирали посредством добавления 35 мкл воды без РНКазы непосредственно на мембрану центрифужной колонки и центрифугировали в течение 1 мин при 8000g для илюирования РНК. Количество РНК измеряли, используя Nanodrop ND-1000, и РНК хранили при -20°С. Измерения RIN выполняли для оценки качества РНК в соответствии с инструкциями производителя. Вкратце, 1 мкл РНК или маркера молекулярной массы вносили пипеткой на чип Agilent RNA 6000 Nano и измеряли с использованием биоанализатора Agilent 2100.
Анализ экспрессии генов цитокинов с помощью qPCR
Способ выполняли в соответствии с инструкциями производителя. Вкратце, 400 нг РНК подвергали обратной транскрипции в соответствии с инструкциями с использованием набора для синтеза кДНК путем обратной транскрипции высокой емкости. Растворы кДНК разбавляли 1/10 в воде, не содержащей РНК/ДНК, и 1 мкл кДНК переносили в 384-луночный реакционный планшет, а затем смешивали с 1 мкл 20X меченного FAM зонда TaqMan® для анализа экспрессии гена-мишени, и 10 мкл 2x мастер-микса для экспрессии генов TaqMan®, и 10 мкл воды, не содержащей РНК/ДНК. Планшет загружали в систему для ПЦР в режиме реального времени ViiA™ 7 от Applied Biosystems, и использовали следующие настройки прибора:
Гены "домашнего хозяйства", используемые для этого исследования, представляли собой HPRT1 и RLP27. Следующую формулу использовали для расчета относительных уровней экспрессии генов-мишеней:
1) Ct [эталон] = (Ct [HPRT1] + Ct [RLP27]) /2
2) dCt [эталон] = 40 - Ct [эталон]
3) dCt [мишень] = Ct [мишень] - Ct [эталон]
4) ddCt=dCt [эталон] - dCt [мишень]
5) Относительная экспрессия гена-мишени=2^ddCt
Микроматричные анализы выполняли согласно следующему. Образцы обрабатывали в CiToxLAB France на микрочипах Affymetrix HG_U133_Plus2. Их нормализовали методом RMA и анализировали с помощью GeneSpring 11.5.1 (Agilent Technologies, Санта-Клара, Калифорния). Анализ пути проводили с использованием Ingenuity Pathway Analysis (IPA) и Nextbio (Illumina). Два набора данных обрабатывали независимо.
Первоначально данные подвергали стандартному контролю качества (QC) с помощью CiToxLAB, внутреннему контролю качества с использованием R-скрипта (MA_AffyQC.R) в пакете программ Rstudio и в GeneSpring (PCA, контроли гибридизации). Впоследствии их подвергали фильтрации для устранения недостоверных уровней экспрессии. Объекты (наборы зондов) сохраняли, если по меньшей мере 100 процентов образцов в любом 1 из условий эксперимента имели значения выше 20-го процентиля.
Дифференциально экспрессируемые гены (DEG) идентифицировали с использованием функции "фильтрация на вулканной диаграмме" в GeneSpring. При использовании отфильтрованных генов (экспрессия от 20,0 до 100,0 процентилей) с непарным T-критерием наборы зондов со скорректированным p-значением ниже 0,05 и кратностью изменения выше 2,0 считались свидетельствующими о дифференциальной экспрессии. Там, где это было возможно, т. е. при исследовании с LPS (NUID-0000-0202-4150), использовали поправку Бенджамини-Хохберга для множественных тестирований.
Для экспериментов по стимуляции цитокинов синергизм рассчитывали по следующей формуле: сигнал A+B/(сигнал A+сигнал B - контроль) ≥1,5
Соответствующие сигнатуры (или списки DEG) использовали для вычисления p-значений с помощью точного критерия Фишера, который представляет статистическую значимость наблюдения перекрывания между сигнатурой и "списком генов, ассоциированных с заболеванием" (при сравнении пораженных и непораженных тканей) из общедоступных наборов данных. Для этого списки загружали в механизм корреляции Illumina BaseSpace (ранее Nextbio) и сравнивали с помощью функции мета-анализа и поиска по ключевым словам для выявления заболеваний.
Все данные экспортировали в программное обеспечение EXCEL, а значения IC50 рассчитывали путем построения кривых зависимости доза-эффект для функций подбора логистической кривой с использованием программного обеспечения EXCEL/XLfit4 или GraphPad Prism. Различия между группами лечения анализировали с помощью однофакторного дисперсионного анализа с последующим множественным сравнением Даннетта с использованием программного обеспечения GraphPad Prism, и результаты считали статистически значимыми при p <0,05.
(2) Результаты
(a) bbmAb1 является высокоэффективным при ингибировании индуцированного с помощью LPS/IL-12 продуцирования IFNγ в цельной крови
Воздействие на цельную кровь человека LPS с добавлением 10 нг/мл IL-12 приводит к ответу с выработкой IFNγ, который в значительной степени, но не исключительно, зависит от "нативного" IL-18, продуцируемого клетками крови. Добавление IL-12 усиливает LPS-индуцированные ответы с выработкой IFNγ, вероятно, путем активации рецепторов IL-18 на иммунореактивных клетках.
В используемых экспериментальных условиях нейтрализация IL-18 с помощью mAb1 приводила лишь к неполному ингибированию продуцирования IFNγ, при этом блокада IL-1β (с помощью mAb2) оказывала лишь незначительное влияние на ответ с выработкой IFNγ. Интересно, что комбинированное ингибирование IL-1β и IL-18 с помощью bbmAb1 либо с помощью комбинации mAb2 и mAb1 было более глубоким, и при этом происходило полное ингибирование продуцирования IFNγ, по сравнению с нейтрализацией отдельных цитокинов (фиг. 6). На фиг. 6 показано ингибирование IFNγ, индуцированного LPS (0,3 мкг/мл)/IL-12, в цельной крови с помощью bbmAb1, mAb2, mAb1 или комбинации mAb2 и mAb1 (комбинированных) (типичная кривая ингибирования показана на фиг. 6A). Показано процентное ингибирование IFNγ у n=4 отдельных доноров в цельной крови с помощью bbmAb1, mAb1 или mAb2, используемых при 100 нМ (средние значения и SEM показаны на фиг. 6B).
Помимо IFNγ, ни один из других протестированных цитокинов (IL-2, -4, -6, -8, -10, -13 и TNFα) не подвергался аддитивному ингибированию путем комбинированной нейтрализации IL-1β и IL-18 в клеточном анализе авторов настоящего изобретения (данные не показаны). Активность bbmAb1 была в том же диапазоне, что и для комбинации (комбинированных) mAb2 и mAb1, с учетом моновалентного формата биспецифической молекулы.
(b) IFNγ подвергается аддитивному ингибированию с помощью bbmAb1 (т. е. путем комбинированного ингибирования IL-1β/IL-18) по сравнению с ингибированием только IL-1β или только IL-18 в PBMC, активированных с помощью LPS/IL-12 человека.
Требовалась объективная оценка данных транскриптомики для выявления дополнительных аддитивных эффектов (кроме IFNγ) при комбинированном ингибировании IL-1β/IL-18 с помощью bbmAb1. Поскольку цельная кровь не является оптимальной для транскриптомного анализа, авторы настоящего изобретения адаптировали условия анализа стимуляции посредством LPS/IL–12, описанные в разделе материалов и способов выше, для образцов РВМС человека. Используя PBMC от 9 доноров, авторы настоящего изобретения смогли подтвердить, что bbmAb1 аддитивно ингибировал секрецию белка IFNγ в образцах надосадочной жидкости PBMC (фиг. 7). По сравнению с экспериментами с цельной кровью продуцирование IFNγ ингибировалось при концентрациях, примерно в 10 раз более низких, чем для соответствующих применяемых mAb. Важно отметить, что подобный паттерн ингибирования был продемонстрирован на уровне мРНК для IFNγ (фиг. 7), что подтвердило пригодность образцов для объективного анализа экспрессии генов с использованием микроматриц. На фиг. 7 показано ингибирование индуцированного с помощью LPS (0,3 мкг/мл)/IL-12 продуцирования белка IFNγ (фиг. 7A) и экспрессии гена IFNγ (фиг. 7B) посредством bbmAb1, mAb2 и mAb1 (каждого в концентрации 10 нМ) в PBMC человека. Показан процент ингибирования у n=9 доноров ± SEM. *** р <0,05 (однофакторный дисперсионный анализ)
Микроматричный анализ Affymetrix проводили с n=5 отдельными донорами с PBMC, которые были отобраны из экспериментов по стимуляции с помощью LPS/IL-12, описанных в разделе материалов и способов выше. К сожалению, общая оценка профилей экспрессии генов свидетельствовала о сильном эффекте стимуляции с помощью LPS/IL-12, и PCA показал кластеризацию по донору, а не по соединению в группах, получавших стимуляцию или не получавших стимуляцию. Тем не менее, сравнение образцов, стимулированных с помощью LPS/IL-12, со стимулированными образцами с добавлением bbmAb1 по дифференциально экспрессируемым генам выявило короткий список генов, экспрессия которых понижается посредством комбинированной блокады IL-1β/IL-18 с помощью bbmAb1 (таблица 14). Помимо сильного понижения экспрессии гена IFNγ, что повторно подтвердило данные микроматричного анализа авторов настоящего изобретения, ген IL-26 был еще одним геном цитокинов, подвергающимся аддитивному ингибированию с помощью bbmAb1 по сравнению с ингибированием только IL-1β (с помощью mAb2) или ингибированием только IL-18 (с помощью mAb1) (см. фиг. 8). На фиг. 8 и фиг. 9 показаны полученные по данным микроматричного анализа уровни экспрессии генов для IFNγ и IL-26 и ингибирование с помощью bbmAb1, mAb2 и mAb1 (по 10 нМ каждого) в PBMC, стимулированных с помощью LPS (0,3 мкг/мл)/IL-12, через 24 часа. Значения у отдельных доноров показаны на фигуре 8A (IFNγ) и фиг. 8B (IL-26), а процент ингибирования (среднее ± SEM) у n=5 доноров показан на фиг. 9A (IFNγ) и фиг. 9B (IL-26).
Таблица 14. Дифференциально экспрессируемые гены (только гены с пониженной экспрессией среди группы, получавшей bbmAb1, и контрольной группы в образцах, стимулированных с помощью LPS/IL-12). FC=кратность изменения.
(c) IL-26 представляет собой другой провоспалительный цитокин, подвергающийся аддитивному ингибированию с помощью bbmAb1 в PBMC, стимулированных с помощью LPS/IL-12.
Чтобы дополнительно подтвердить, что управляемая LPS/IL-12 экспрессия гена IL-26 и продуцирование белка наиболее эффективно ингибируются путем комбинированной блокады IL-1β/IL-18 с помощью bbmAb1, исследование распространили на общее количество n=9 доноров РВМС, и исследовали экспрессию гена IL-26 с помощью qPCR, а продуцирование белка IL-26 с помощью ELISA. Как показано на фиг. 10, это в значительной степени подтвердило ингибирование экспрессии гена IL-26, полученное с помощью подхода с использованием микроматриц (фиг. 10А). Интересно, что уровни белка IL-26 в образцах надосадочной жидкости только частично снижались через 24 часа при добавлении mAb (фиг. 10B). Причины этих различий неизвестны, однако могут быть связаны с кинетическими различиями между экспрессией гена IL-26 и продуцированием белка, а также с различиями в потреблении IL-26 по сравнению с IFNγ. Тем не менее, bbmAb1 проявило себя лучше в отношении снижения уровней белка IL-26 в образцах надосадочной жидкости РВМС по сравнению с mAb2 и mAb1. На фигуре 10 показано ингибирование индуцированной с помощью LPS (0,3 мкг/мл)/IL-12 экспрессии гена IL-26 (определено с помощью qPCR) (фиг. 10A) и уровней белка IL-26 (фиг. 10B) посредством bbmAb1, mAb2 и mAb1 (по 10 нМ каждого) в PBMC человека. Показан процент ингибирования у n=9 отдельных доноров PBMC (среднее значение и SEM). *** р <0,05 (однофакторный дисперсионный анализ).
(d) Сигнальные сигнатуры IL1-β/IL18 коррелируют с заболеванием
Ранее установленные условия культивирования PBMC, где стимуляция с помощью рекомбинантного IL-1β приводила к продуцированию IL-6 либо стимуляция с помощью рекомбинантных IL-18/IL-12 приводила к продуцированию IFNγ, объединяли для выявления аддитивных или синергических нижележащих генов-мишеней или сигнатур (данные не показаны). С PBMC от n=4 доноров, отобранных в два разных момента времени (6 ч и 24 ч), проводили оценку с помощью микроматричного анализа Affymetrix для объективной оценки профилей экспрессии генов. Были выявлены гены, которые были синергично активированы в моменты времени 6 часов и 24 часа при комбинированной стимуляции с помощью IL-1β и IL-18 (данные не показаны). Добавление IL-12 к комбинации IL-1β/IL-18 в значительной степени увеличивало синергизм для ряда генов с повышенной экспрессией. Полученные сигнальные сигнатуры одиночной или комбинированной стимуляции пути IL-1β/IL-18 (только гены с повышенной экспрессией) использовали для детального исследования набора данных от пациентов с несколькими аутоиммунными заболеваниями. Например, корреляция с общедоступными наборами данных о саркоидозе показана в качестве примера на фиг. 11. P-значения (рассчитанные с помощью точного критерия Фишера) показывают значительную корреляцию с данными нескольких общедоступных исследований, в которых сравниваются здоровые и больные ткани пациентов с саркоидозом. Ткани включают кожу, а также легкие, слезные железы и передний отдел глазницы. Во всех наборах данных комбинация передачи сигналов с помощью IL1β/IL18 демонстрирует наилучшую корреляцию с заболеванием, за которой следуют IL-1β и IL-18. Показаны дифференциально экспрессируемые на повышенном уровне гены IL-1β/IL-18 (DEG) в PBMC (ось x) по сравнению с DEG в 5 различных тканях, пораженных саркоидозом, при "сравнении пораженных и здоровых". P-значения (ось y) представляют статистическую значимость наблюдения перекрывания между сигнатурой и "списком генов, ассоциированных с заболеванием". Черный столбец представляет собой кожу при саркоидозном поражении кожи в сравнении с кожей у здоровых пациентов. Светло-серый столбец представляет собой кожу при саркоидозном поражении кожи в сравнении с непораженной кожей. Белый столбец представляет собой слезные железы у пациентов с саркоидозом в сравнении с нормальными пациентами. Темно-серый столбец представляет собой ткани переднего отдела глазницы у пациентов с саркоидозом в сравнении с нормальными пациентами. Полосатый столбец представляет собой образцы легких с прогрессирующим фиброзным легочным саркоидозом в сравнении с узелковым самоограничивающимся легочным саркоидозом.
(е) Заключение
LPS и рекомбинантный IL-12 применяли для имитации зависимой от патоген-ассоциированного молекулярного паттерна (PAMP) активации инфламмасомы NLRP3 в течение первых 24 часов культивирования in vitro. Было продемонстрировано, что комбинированное ингибирование IL-1β и IL-18 с помощью bbmAb1 действует аддитивно, обеспечивая уменьшение/ингибирование продуцирования IFNγ в РВМС, стимулированных с помощью LPS/IL-12. Ранее было описано, что IL-12 действует синергично с IL-18, индуцируя продуцирование IFNγ в T-, B-, NK-клетках, макрофагах и дендритных клетках (как рассмотрено в Nakanishi, 2001), но в настоящее время дополнительный стимулирующий эффект IL-1β в отношении продуцирования IFNγ может быть продемонстрирован в используемых условиях эксперимента. Таким образом, совместное инкубирование РВМС с LPS/IL-12 эффективно стимулирует продуцирование "нативных" IL-1β и IL-18, которые способствуют сильному ответу с выработкой IFNγ. Путем применения объективного микроматричного анализа данных транскриптомики идентифицировали дополнительные гены, которые подвергались аддитивному понижению экспрессии путем комбинированной нейтрализации IL-1β/IL-18 по сравнению с блокадой только IL-1β или IL-18. Среди них был IL-26, член подсемейства цитокинов IL-20 (IL-19, IL-20, IL-22, IL-24 и IL-26), который сохраняется у большинства видов позвоночных, но отсутствует у большинства линий грызунов (включая мышей и крыс) (Donnelly 2010). Он передает сигналы через гетеродимерный рецепторный комплекс, состоящий из цепей IL-20R1 и IL-10R2. Рецепторы IL-26 в основном экспрессируются на негемопоэтических типах клеток, особенно на эпителиальных клетках. Повышенные уровни IL-26 были зарегистрированы в сыворотке крови и особенно в синовиальной жидкости пациентов с RA (Corvaisier 2012), где он может действовать как фактор, способствующий росту и дифференцировке клеток Th17. К сожалению, обнаружению дополнительных генов/путей, индуцируемых с помощью комбинированной блокады IL-1β и IL-18, препятствовал сильный эффект стимуляции с помощью LPS/IL-12 образцов РВМС. Тем не менее, и IFNγ, и IL-26, и в некоторой степени IL-22 также были среди генов, которые синергично активировались с помощью комбинированной стимуляции рекомбинантными IL-1β и IL-18 в PBMC, что подтверждает, что эти два фактора являются нижележащими эффекторами в этом пути активации. Таким образом, подсемейство цитокинов IL-20 (включая IL-26 и IL-22), по-видимому, сильно зависит от одновременных сигналов от IL-1β и IL-18. При всей осторожности относительно селективности отдельных сигнальных сигнатур, а также потенциальной эффективности блокирования, эти сравнения полезны для того, чтобы показать, что соответствующие пути активны при таких заболеваниях, как саркоидоз.
8. Пример 4. Терапевтическое применение
Комбинированное нацеливание на IL-1β и IL-18 может представлять собой более эффективную стратегию лечения, чем блокада отдельных цитокинов при воспалительных заболеваниях, обусловленных инфламмасомами, в которых участвуют компоненты как врожденного, так и адаптивного иммунитета. Одновременная нейтрализация IL-1β и IL-18 нацелена на компоненты как врожденного, так и адаптивного иммунитета, включая нейтрофилы, клетки Th1/Tc1 и NK, молекулы адгезии на иммунных и эндотелиальных клетках и провоспалительные цитокины (например, IL-6, IFNγ и IL-17). Преимущество блокирования как IL-1β, так и IL-18 подтверждается данными, полученными в доклинической мышиной модели семейного холодового аутоиммунного синдрома (FCAS), который обусловлен конститутивной активацией инфламмасомы NLRP3 и повышенной выработкой IL-1β и IL-18 (Brydges 2013). В ней у мышей было достигнуто частичное выздоровление после заболевания FCAS, когда передача сигналов IL-1β или IL-18 была генетически устранена, что демонстрирует участие обоих цитокинов в патогенезе заболевания. Важно, что у мышей с FCAS, у которых отсутствует передача сигналов как IL-18, так и IL-1β, наблюдались еще меньшие проявления заболевания по сравнению с мышами, у которых только один из двух цитокинов был инактивирован, что демонстрирует аддитивные эффекты двойной нейтрализации IL-1β/IL-18. Аддитивные эффекты нейтрализации IL-1β и IL-18 были также продемонстрированы в другой мышиной модели, где мышам вводили высокие дозы LPS, чтобы вызвать септический шок (van den Berghe 2014). В этой модели генетический дефицит как IL-1β, так и IL-18 либо комбинированная нейтрализация обоих цитокинов нейтрализующими антителами полностью предупреждали смертность от LPS, тогда как дефицит/нейтрализация одного цитокина оказывали лишь частичный защитный эффект.
Общая клиническая стратегия для биспецифического антитела, которое нацеливается одновременно как на IL-1β, так и на IL-18, может представлять собой более эффективное средство лечения, чем доступные в настоящее время варианты. Для выявления заболеваний-кандидатов использовали доклинические и трансляционные исследования, чтобы продемонстрировать активное участие нисходящих сигнальных путей как IL-1β, так и IL-18 в патофизиологических процессах, лежащих в основе заболеваний-кандидатов. Существует новое доказательство того, что хронический легочный саркоидоз является заболеванием, обусловленным инфламмасомами, с вовлечением как врожденного, так и адаптивного иммунитета. Кроме того, первоначальные результаты указывают на важную роль эффекторных цитокинов как IL-1β, так и IL-18 в этом заболевании. Таким образом, саркоидоз представляет собой идеальную возможность продемонстрировать двойную специфичность bbmAb1 при заболевании с установленным хроническим воспалением тканей. Эффективность применения bbmAb1 при саркоидозе может привести к развитию этого подхода в отношении других интерстициальных заболеваний легких, таких как гиперчувствительные (профессиональные) заболевания легких, вызванные кремнием или бериллием. Другими заболеваниями-кандидатами являются гранулематозные воспаления, затрагивающие ткани других органов, например, болезнь Крона.
Воспаление сосудов с повреждением тканей и эндотелиальной дисфункцией также представляет потенциальную мишень для bbmAb1. Дисфункциональные эндотелиальные клетки могут отвечать на эффективное противовоспалительное лечение, что приводит к улучшению сосудистого кровотока даже при наличии постоянных внутрисосудистых дефектов. В недавних литературных свидетельствах было выявлено, что серповидноклеточная анемия (SCD) имеет сильный обусловленный инфламмасомами компонент, благодаря высокой частоте конститутивного внутрисосудистого гемолиза. Активация инфламмасом из-за высвобождения сигналов опасности (мочевой кислоты, комплекса гем/Fe3+, других внутриклеточных компонентов) в результате хронического лизиса эритроцитов запускает рецепторы инфламмасомы, их активацию и приводит к внутрисосудистому воспалительному каскаду, что обуславливает повышение экспрессии молекул адгезии эндотелиальных клеток, активацию нейтрофилов и тромбоцитов и приводит к хронической активации эндотелиальных клеток. Это постоянное воспаление сосудов у пациентов с SCD приводит к рецидивирующим, болезненным вазоокклюзионным кризам и повреждению тканей вследствие обострения хронического процесса. Предварительные свидетельства, лежащие в самом документе, подтверждают участие IL-18, а также IL-1β в патогенезе заболевания, лежащем в основе SCD. Таким образом, снижение базального воспаления у пациентов с SCD путем лечения с помощью bbmAb1 может ослабить хроническое фоновое воспаление и предупредить острые кризы с ассоциированным ишемическим повреждением органов, предупредить острые серповидноклеточные кризы и связанные с ними ишемические повреждения органов, а также улучшить общее качество жизни пациентов за счет снижения ассоциированной хронической боли и усталости. Демонстрация терапевтической эффективности bbmAb1 у пациентов с SCD может привести к развитию этого подхода в отношении других хронических заболеваний или обострений хронических воспалительных заболеваний, связанных с высокой частотой гемолиза, таких как малярия и гемодиализ-зависимое хроническое заболевание почек. Дополнительными показаниями, в отношении которых может быть полезной как модуляция IL-1β, так и модуляция IL-18, являются показания, ассоциированные с ишемическим/реперфузионным повреждением тканей, такие как сердечно-сосудистые заболевания, или с улучшенным заживлением ран всех типов, но, в частности, наиболее тяжелых повреждений мягких тканей вследствие ожога.
Таким образом, в варианте осуществления настоящего изобретения способ лечения нарушения, связанного с инфламмасомами, включает введение субъекту, страдающему нарушением, связанным с инфламмасомами, эффективного количества bbmAb, раскрытого в данном документе, такого как bbmAb1. Потенциальными нарушениями, связанными с инфламмасомами, являются криопирин-ассоциированный аутовоспалительный синдром (CAPS), семейная средиземноморская лихорадка (FMF), системный ювенильный идиопатический артрит (SJIA), волчаночный нефрит, диабетическая нефропатия, острое повреждение почек, почечная гипертензия, IgA-нефропатия, гломерулонефрит (GN), лобно-височная деменция (FTD), болезнь Альцгеймера (AD), эпилепсия, инсульт, болезнь Паркинсона (PD), депрессия, саркоидоз, такой как легочный саркоидоз, панкреатит, идиопатический легочный фиброз (IPF), неалкогольный стеатогепатит (NASH), атеросклероз, гигантоклеточный артериит, васкулиты, ассоциированные с антинейтрофильными цитоплазматическими антителами (ANCA), возрастная макулярная дегенерация (AMD), реакция "трансплантат против хозяина", сахарный диабет 2 типа, акне, серповидноклеточная анемия, васкулопатии, ишемическое/реперфузионное повреждение, сердечно-сосудистое заболевание, заболевание периферических артерий (PAD), атеросклероз, сосудистая дисфункция, ишемия скелетных мышц, фиброз, малярия, гемодиализ-зависимое хроническое заболевание почек или болезнь Крона.
В одном варианте осуществления предложен способ лечения у субъекта серповидноклеточной анемии, васкулопатии, ишемического/реперфузионного повреждения, сердечно-сосудистого заболевания, заболевания периферических артерий, атеросклероза, сосудистой дисфункции, ишемии скелетных мышц, легочного саркоидоза, фиброза, малярии, гемодиализ-зависимого хронического заболевания почек или болезни Крона путем введения эффективного количества bbmAb, раскрытого в данном документе, такого как bbmAb1, субъекту.
9. Пример 5. Фармацевтические композиции
В данном документе представлены фармацевтические композиции, содержащие антитела bbmAb, такие как bbmAb1, составленные вместе с фармацевтически приемлемым носителем. Композиции могут дополнительно содержать одно или несколько других терапевтических средств, которые являются подходящими для лечения заболевания. Фармацевтически приемлемые носители усиливают или стабилизируют композицию, или их можно применять для облегчения получения композиции. Фармацевтически приемлемые носители включают растворители, дисперсионные среды, средства для покрытия, антибактериальные и противогрибковые средства, изотонические и замедляющие всасывание средства и т. п., которые являются физиологически совместимыми.
Фармацевтическая композиция, описанная в данном документе, может быть введена с помощью ряда способов, известных в данной области техники. Путь и/или способ введения меняются в зависимости от требуемых результатов. Предпочтительно, чтобы введение было внутривенным, внутримышечным, внутрибрюшинным или подкожным, или введение осуществляли вблизи участка-мишени. Фармацевтически приемлемый носитель должен быть подходящим для интравитреального, внутривенного, внутримышечного, подкожного, парентерального, позвоночного или эпидермального введения (например, посредством инъекции или инфузии). В зависимости от пути введения активное соединение, т. е. bbmAb, может быть покрыто материалом для защиты соединения от действия кислот и других естественных условий, которые могут инактивировать соединение.
Композиция должна быть стерильной и текучей. Надлежащую текучесть можно поддерживать, например, посредством применения покрытия, такого как лецитин, посредством поддержания необходимого размера частиц в случае дисперсии и посредством применения поверхностно-активных веществ. Во многих случаях предпочтительным является включение в композицию изотонических средств, например, сахаров, полиспиртов, таких как маннит или сорбит, и хлорида натрия. Длительное всасывание инъекционных композиций может обеспечиваться благодаря включению в композицию средства, которое замедляет всасывание, например, моностеарата алюминия или желатина.
Фармацевтические композиции, описанные в данном документе, можно получить в соответствии со способами, хорошо известными и обычно осуществляемыми в данной области техники. См., например, Remington: The Science and Practice of Pharmacy, Mack Publishing Co., 20th ed., 2000; и Sustained and Controlled Release Drug Delivery Systems, J.R. Robinson, ed., Marcel Dekker, Inc., New York, 1978. Фармацевтические композиции предпочтительно изготовляют в соответствии с положениями GMP. Как правило, в фармацевтических композициях, описанных в данном документе, используют терапевтически эффективную дозу или эффективную дозу bbmAb. bbmAb составляют в фармацевтически приемлемые лекарственные формы с помощью традиционных способов, известных специалистам в данной области. Схемы введения доз корректируют для обеспечения оптимального требуемого ответа (например, терапевтического ответа). Например, можно вводить одну болюсную дозу, можно вводить несколько разделенных доз в течение некоторого времени, или дозу можно пропорционально уменьшать или увеличивать в соответствии с потребностями терапевтической ситуации. Особенно преимущественным является составление композиций для парентерального применения в единичной лекарственной форме для удобства введения и однородности дозирования. Единичная лекарственная форма, применяемая в данном документе, относится к физически дискретным единицам, подходящим в качестве единичных доз для субъектов, подлежащих лечению; при этом каждая единица содержит предварительно определенное количество активного соединения, рассчитанное для получения требуемого терапевтического эффекта, в сочетании с необходимым фармацевтическим носителем.
Фактические уровни дозы активных ингредиентов в фармацевтических композициях, описанных в данном документе, можно изменять для того, чтобы получить количество активного ингредиента, которое является эффективным для достижения требуемого терапевтического ответа в отношении конкретного пациента, композиции и способа введения, не являясь токсичным для пациента. Выбранный уровень дозы зависит от ряда фармакокинетических факторов, в том числе активности конкретных используемых композиций, описанных в данном документе, или их присутствия в форме сложного эфира, соли или амида, пути введения, времени введения, скорости выведения конкретного используемого соединения, длительности лечения, других лекарственных средств, соединений и/или материалов, применяемых в комбинации с конкретными используемыми композициями, возраста, пола, массы тела, состояния, общего состояния здоровья и анамнеза пациента, подлежащего лечению, и подобных факторов.
Врач или ветеринар может начинать введение доз антител, описанных в данном документе, применяемых в фармацевтической композиции, с уровней, более низких, чем уровни, которые необходимы для достижения требуемого терапевтического эффекта, и постепенно повышать дозу до тех пор, пока не будет достигнут требуемый эффект. В целом, эффективные дозы композиций, описанных в данном документе, для лечения изнуряющих нарушений, описанных в данном документе, меняются в зависимости от многих разных факторов, в том числе от способов введения, участка-мишени, физиологического состояния пациента, от того, является ли пациентом человек или животное, от других вводимых лекарственных препаратов и от того, является ли лечение профилактическим или терапевтическим. Дозы для лечения необходимо подбирать для оптимизации безопасности и эффективности. В случае системного введения антитела доза находится в диапазоне от приблизительно 0,0001 до 100 мг/кг и чаще 0,01-15 мг/кг массы тела получающего его пациента. Для интравитреального введения антитела доза находится в диапазоне от 0,1 мг/глаз до 5 мг/глаз. Иллюстративная схема лечения предусматривает системное введение один раз в две недели, или один раз в месяц, или один раз в 3-6 месяцев. Иллюстративная схема лечения предусматривает системное введение один раз в две недели, или один раз в месяц, или один раз в 3-6 месяцев, или по мере необходимости (PRN).
Биологические терапевтические препараты, такие как bbmAb1, обычно вводят несколько раз. Интервалы между отдельными дозами могут составлять неделю, месяц или год. Интервалы также могут быть нерегулярными, на что указывает измерение уровней bbmAb1 в крови у пациента. Кроме этого, альтернативные интервалы введения доз могут быть определены врачом, и их можно вводить ежемесячно или по мере необходимости для обеспечения эффективности. В некоторых способах системного введения дозу корректируют для достижения концентрации антитела в плазме крови, составляющей 1-1000 мкг/мл, и в некоторых способах 25-500 мкг/мл. В качестве альтернативы антитело можно вводить в виде состава с замедленным высвобождением, в этом случае требуется менее частое введение. Доза и частота меняются в зависимости от периода полужизни антитела у пациента. В целом, антитела человека демонстрируют более длительный период полужизни, чем химерные антитела и антитела, отличные от человеческих. Доза и частота введения могут меняться в зависимости от того, является ли лечение профилактическим или терапевтическим. В профилактических путях применения относительно низкую дозу вводят с относительно большими интервалами в течение длительного периода времени. Некоторые пациенты продолжают получать лечение до конца своей жизни. В терапевтических путях применения иногда необходимо введение относительно высокой дозы с относительно короткими интервалами до тех пор, пока прогрессирование заболевания не уменьшится или не завершится, и предпочтительно до тех пор, пока у пациента не будет наблюдаться частичное или полное облегчение симптомов заболевания. После этого пациенту можно осуществлять введение по профилактической схеме.
ТАБЛИЦА ПОСЛЕДОВАТЕЛЬНОСТЕЙ
Аминокислотные и нуклеотидные последовательности, применимые для реализации на практике настоящего изобретения, раскрыты в таблице 15.
Таблица 15. Последовательности согласно вариантам осуществления настоящего изобретения
AGCTGCAAGGCCAGCGGCGGCACCTTCAAGAGCTACGCCATCAGCTGGGTGAGGCAGGCC
CCCGGCCAGGGCCTGGAGTGGATGGGCAACATCATCCCCATGACCGGCCAGACCTACTAC
GCCCAGAAGTTCCAGGGCAGGGTGACCATCACCGCCGACGAGAGCACCAGCACCGCCTAC
ATGGAGCTGAGCAGCCTGAGGAGCGAGGACACCGCCGTGTACTACTGCGCCAGGGCCGCC
TACCACCCCCTGGTGTTCGACAACTGGGGCCAGGGCACCCTGGTGACCGTGAGCAGCGCC
AGCACCAAGGGCCCCAGCGTGTTCCCCCTGGCCCCCAGCAGCAAGAGCACCAGCGGCGGC
ACCGCCGCCCTGGGCTGCCTGGTGAAGGACTACTTCCCCGAGCCCGTGACCGTGAGCTGG
AACAGCGGCGCCCTGACCAGCGGCGTGCACACCTTCCCCGCCGTGCTGCAGAGCAGCGGC
CTGTACAGCCTGAGCAGCGTGGTGACCGTGCCCAGCAGCAGCCTGGGCACCCAGACCTAC
ATCTGCAACGTGAACCACAAGCCCAGCAACACCAAGGTGGACAAGAGGGTGGAGCCCAAG
AGCTGCGACAAGACCCACACCTGCCCCCCCTGCCCCGCCCCCGAGGCCGCCGGCGGCCCC
AGCGTGTTCCTGTTCCCCCCCAAGCCCAAGGACACCCTGATGATCAGCAGGACCCCCGAG
GTGACCTGCGTGGTGGTGGACGTGAGCCACGAGGACCCCGAGGTGAAGTTCAACTGGTAC
GTGGACGGCGTGGAGGTGCACAACGCCAAGACCAAGCCCAGGGAGGAGCAGTACAACAGC
ACCTACAGGGTGGTGAGCGTGCTGACCGTGCTGCACCAGGACTGGCTGAACGGCAAGGAG
TACAAGTGCAAGGTGAGCAACAAGGCCCTGCCCGCCCCCATCGAGAAGACCATCAGCAAG
GCCAAGGGCCAGCCCAGGGAGCCCCAGGTGTACACCCTGCCCCCCAGCAGGGAGGAGATG
ACCAAGAACCAGGTGAGCCTGACCTGCCTGGTGAAGGGCTTCTACCCCAGCGACATCGCC
GTGGAGTGGGAGAGCAACGGCCAGCCCGAGAACAACTACAAGACCACCCCCCCCGTGCTG
GACAGCGACGGCAGCTTCTTCCTGTACAGCAAGCTGACCGTGGACAAGAGCAGGTGGCAG
CAGGGCAACGTGTTCAGCTGCAGCGTGATGCACGAGGCCCTGCACAACCACTACACCCAG
AAGAGCCTGAGCCTGAGCCCCGGCAAG
AGGACCGGCCCCTTCGACTACTGGGGCCAGGGCACCCTGGTGACCGTGAGCAGC
AGCTGCGCCGCCAGCGGCTTCACCTTCAGCGTGTACGGCATGAACTGGGTGAGGCAGGCC
CCCGGCAAGGGCCTGGAGTGGGTGGCCATCATCTGGTACGACGGCGACAACCAGTACTAC
GCCGACAGCGTGAAGGGCAGGTTCACCATCAGCAGGGACAACAGCAAGAACACCCTGTAC
CTGCAGATGAACGGCCTGAGGGCCGAGGACACCGCCGTGTACTACTGCGCCAGGGACCTG
AGGACCGGCCCCTTCGACTACTGGGGCCAGGGCACCCTGGTGACCGTGAGCAGCGCCAGC
ACCAAGGGCCCCAGCGTGTTCCCCCTGGCCCCCAGCAGCAAGAGCACCAGCGGCGGCACC
GCCGCCCTGGGCTGCCTGGTGAAGGACTACTTCCCCGAGCCCGTGACCGTGAGCTGGAAC
AGCGGCGCCCTGACCAGCGGCGTGCACACCTTCCCCGCCGTGCTGCAGAGCAGCGGCCTG
TACAGCCTGAGCAGCGTGGTGACCGTGCCCAGCAGCAGCCTGGGCACCCAGACCTACATC
TGCAACGTGAACCACAAGCCCAGCAACACCAAGGTGGACAAGAGGGTGGAGCCCAAGAGC
TGCGACAAGACCCACACCTGCCCCCCCTGCCCCGCCCCCGAGCTGCTGGGCGGCCCCAGC
GTGTTCCTGTTCCCCCCCAAGCCCAAGGACACCCTGATGATCAGCAGGACCCCCGAGGTG
ACCTGCGTGGTGGTGGACGTGAGCCACGAGGACCCCGAGGTGAAGTTCAACTGGTACGTG
GACGGCGTGGAGGTGCACAACGCCAAGACCAAGCCCAGGGAGGAGCAGTACAACAGCACC
TACAGGGTGGTGAGCGTGCTGACCGTGCTGCACCAGGACTGGCTGAACGGCAAGGAGTAC
AAGTGCAAGGTGAGCAACAAGGCCCTGCCCGCCCCCATCGAGAAGACCATCAGCAAGGCC
AAGGGCCAGCCCAGGGAGCCCCAGGTGTACACCCTGCCCCCCAGCAGGGAGGAGATGACC
AAGAACCAGGTGAGCCTGACCTGCCTGGTGAAGGGCTTCTACCCCAGCGACATCGCCGTG
GAGTGGGAGAGCAACGGCCAGCCCGAGAACAACTACAAGACCACCCCCCCCGTGCTGGAC
AGCGACGGCAGCTTCTTCCTGTACAGCAAGCTGACCGTGGACAAGAGCAGGTGGCAGCAG
GGCAACGTGTTCAGCTGCAGCGTGATGCACGAGGCCCTGCACAACCACTACACCCAGAAG
AGCCTGAGCCTGAGCCCCGGCAAG
По всему тексту настоящей заявки может быть несоответствие между текстом описания (например, в таблице 15) и перечнем последовательностей, при этом текст описания имеет преимущественную силу.
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> NOVARTIS AG
<120> СПОСОБ ПОЛУЧЕНИЯ БИСПЕЦИФИЧЕСКИХ АНТИТЕЛ, БИСПЕЦИФИЧЕСКИЕ АНТИТЕЛА И
ТЕРАПЕВТИЧЕСКОЕ ПРИМЕНЕНИЕ ТАКИХ АНТИТЕЛ
<130> PAT057716-WO-PCT
<140>
<141>
<150> 62/518,090
<151> 2017-06-12
<160> 104
<170> PatentIn версия 3.5
<210> 1
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 1
Ser Tyr Ala Ile Ser
1 5
<210> 2
<211> 17
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 2
Asn Ile Ile Pro Met Thr Gly Gln Thr Tyr Tyr Ala Gln Lys Phe Gln
1 5 10 15
Gly
<210> 3
<211> 10
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 3
Ala Ala Tyr His Pro Leu Val Phe Asp Asn
1 5 10
<210> 4
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 4
Gly Gly Thr Phe Lys Ser Tyr
1 5
<210> 5
<211> 6
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 5
Ile Pro Met Thr Gly Gln
1 5
<210> 6
<211> 10
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 6
Ala Ala Tyr His Pro Leu Val Phe Asp Asn
1 5 10
<210> 7
<211> 119
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 7
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ser
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Gly Thr Phe Lys Ser Tyr
20 25 30
Ala Ile Ser Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Asn Ile Ile Pro Met Thr Gly Gln Thr Tyr Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Ile Thr Ala Asp Glu Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Ala Ala Tyr His Pro Leu Val Phe Asp Asn Trp Gly Gln Gly
100 105 110
Thr Leu Val Thr Val Ser Ser
115
<210> 8
<211> 356
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 8
gaggtgcagc tggtgcagag cggcgccgag gtgaagaagc ccggcagcag cgtgaaggtg 60
agctgcaagg ccagcggcgg caccttcaag agctacgcca tcagctgggt gaggcaggcc 120
cccggccagg gcctggagtg gatgggcaac atcatcccca tgaccggcca gacctactac 180
gcccagaagt tccagggcag ggtgaccatc accgccgacg agagcaccag caccgcctac 240
atggagctga gcagcctgag gagcgaggac accgccgtgt actactgcgc cagggccgcc 300
taccaccccc tggtgttcga caactgggcc agggcaccct ggtgaccgtg agcagc 356
<210> 9
<211> 449
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 9
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ser
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Gly Thr Phe Lys Ser Tyr
20 25 30
Ala Ile Ser Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Asn Ile Ile Pro Met Thr Gly Gln Thr Tyr Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Ile Thr Ala Asp Glu Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Ala Ala Tyr His Pro Leu Val Phe Asp Asn Trp Gly Gln Gly
100 105 110
Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe
115 120 125
Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu
130 135 140
Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp
145 150 155 160
Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu
165 170 175
Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser
180 185 190
Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro
195 200 205
Ser Asn Thr Lys Val Asp Lys Arg Val Glu Pro Lys Ser Cys Asp Lys
210 215 220
Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Ala Ala Gly Gly Pro
225 230 235 240
Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser
245 250 255
Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp
260 265 270
Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn
275 280 285
Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val
290 295 300
Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu
305 310 315 320
Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys
325 330 335
Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr
340 345 350
Leu Pro Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr
355 360 365
Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu
370 375 380
Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu
385 390 395 400
Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys
405 410 415
Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu
420 425 430
Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly
435 440 445
Lys
<210> 10
<211> 1347
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 10
gaggtgcagc tggtgcagag cggcgccgag gtgaagaagc ccggcagcag cgtgaaggtg 60
agctgcaagg ccagcggcgg caccttcaag agctacgcca tcagctgggt gaggcaggcc 120
cccggccagg gcctggagtg gatgggcaac atcatcccca tgaccggcca gacctactac 180
gcccagaagt tccagggcag ggtgaccatc accgccgacg agagcaccag caccgcctac 240
atggagctga gcagcctgag gagcgaggac accgccgtgt actactgcgc cagggccgcc 300
taccaccccc tggtgttcga caactggggc cagggcaccc tggtgaccgt gagcagcgcc 360
agcaccaagg gccccagcgt gttccccctg gcccccagca gcaagagcac cagcggcggc 420
accgccgccc tgggctgcct ggtgaaggac tacttccccg agcccgtgac cgtgagctgg 480
aacagcggcg ccctgaccag cggcgtgcac accttccccg ccgtgctgca gagcagcggc 540
ctgtacagcc tgagcagcgt ggtgaccgtg cccagcagca gcctgggcac ccagacctac 600
atctgcaacg tgaaccacaa gcccagcaac accaaggtgg acaagagggt ggagcccaag 660
agctgcgaca agacccacac ctgccccccc tgccccgccc ccgaggccgc cggcggcccc 720
agcgtgttcc tgttcccccc caagcccaag gacaccctga tgatcagcag gacccccgag 780
gtgacctgcg tggtggtgga cgtgagccac gaggaccccg aggtgaagtt caactggtac 840
gtggacggcg tggaggtgca caacgccaag accaagccca gggaggagca gtacaacagc 900
acctacaggg tggtgagcgt gctgaccgtg ctgcaccagg actggctgaa cggcaaggag 960
tacaagtgca aggtgagcaa caaggccctg cccgccccca tcgagaagac catcagcaag 1020
gccaagggcc agcccaggga gccccaggtg tacaccctgc cccccagcag ggaggagatg 1080
accaagaacc aggtgagcct gacctgcctg gtgaagggct tctaccccag cgacatcgcc 1140
gtggagtggg agagcaacgg ccagcccgag aacaactaca agaccacccc ccccgtgctg 1200
gacagcgacg gcagcttctt cctgtacagc aagctgaccg tggacaagag caggtggcag 1260
cagggcaacg tgttcagctg cagcgtgatg cacgaggccc tgcacaacca ctacacccag 1320
aagagcctga gcctgagccc cggcaag 1347
<210> 11
<211> 13
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 11
Ser Gly Ser Ser Ser Asn Ile Gly Asn His Tyr Val Asn
1 5 10
<210> 12
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 12
Arg Asn Asn His Arg Pro Ser
1 5
<210> 13
<211> 11
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 13
Gln Ser Trp Asp Tyr Ser Gly Phe Ser Thr Val
1 5 10
<210> 14
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 14
Ser Ser Ser Asn Ile Gly Asn His Tyr
1 5
<210> 15
<211> 3
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 15
Arg Asn Asn
1
<210> 16
<211> 8
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 16
Trp Asp Tyr Ser Gly Phe Ser Thr
1 5
<210> 17
<211> 110
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 17
Asp Ile Val Leu Thr Gln Pro Pro Ser Val Ser Gly Ala Pro Gly Gln
1 5 10 15
Arg Val Thr Ile Ser Cys Ser Gly Ser Ser Ser Asn Ile Gly Asn His
20 25 30
Tyr Val Asn Trp Tyr Gln Gln Leu Pro Gly Thr Ala Pro Lys Leu Leu
35 40 45
Ile Tyr Arg Asn Asn His Arg Pro Ser Gly Val Pro Asp Arg Phe Ser
50 55 60
Gly Ser Lys Ser Gly Thr Ser Ala Ser Leu Ala Ile Thr Gly Leu Gln
65 70 75 80
Ser Glu Asp Glu Ala Asp Tyr Tyr Cys Gln Ser Trp Asp Tyr Ser Gly
85 90 95
Phe Ser Thr Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu
100 105 110
<210> 18
<211> 330
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 18
gatatcgtcc tgactcagcc ccctagcgtc agcggcgctc ccggtcagag agtgactatt 60
agctgtagcg gctctagctc taatatcggt aatcactacg tgaactggta tcagcagctg 120
cccggcaccg cccctaagct gctgatctat agaaacaatc accggcctag cggcgtgccc 180
gataggttta gcggatctaa gtcaggcact agcgctagtc tggctatcac cggactgcag 240
tcagaggacg aggccgacta ctactgtcag tcctgggact atagcggctt tagcaccgtg 300
ttcggcggag gcactaagct gaccgtgctg 330
<210> 19
<211> 216
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 19
Asp Ile Val Leu Thr Gln Pro Pro Ser Val Ser Gly Ala Pro Gly Gln
1 5 10 15
Arg Val Thr Ile Ser Cys Ser Gly Ser Ser Ser Asn Ile Gly Asn His
20 25 30
Tyr Val Asn Trp Tyr Gln Gln Leu Pro Gly Thr Ala Pro Lys Leu Leu
35 40 45
Ile Tyr Arg Asn Asn His Arg Pro Ser Gly Val Pro Asp Arg Phe Ser
50 55 60
Gly Ser Lys Ser Gly Thr Ser Ala Ser Leu Ala Ile Thr Gly Leu Gln
65 70 75 80
Ser Glu Asp Glu Ala Asp Tyr Tyr Cys Gln Ser Trp Asp Tyr Ser Gly
85 90 95
Phe Ser Thr Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu Gly Gln
100 105 110
Pro Lys Ala Ala Pro Ser Val Thr Leu Phe Pro Pro Ser Ser Glu Glu
115 120 125
Leu Gln Ala Asn Lys Ala Thr Leu Val Cys Leu Ile Ser Asp Phe Tyr
130 135 140
Pro Gly Ala Val Thr Val Ala Trp Lys Ala Asp Ser Ser Pro Val Lys
145 150 155 160
Ala Gly Val Glu Thr Thr Thr Pro Ser Lys Gln Ser Asn Asn Lys Tyr
165 170 175
Ala Ala Ser Ser Tyr Leu Ser Leu Thr Pro Glu Gln Trp Lys Ser His
180 185 190
Arg Ser Tyr Ser Cys Gln Val Thr His Glu Gly Ser Thr Val Glu Lys
195 200 205
Thr Val Ala Pro Thr Glu Cys Ser
210 215
<210> 20
<211> 648
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 20
gatatcgtcc tgactcagcc ccctagcgtc agcggcgctc ccggtcagag agtgactatt 60
agctgtagcg gctctagctc taatatcggt aatcactacg tgaactggta tcagcagctg 120
cccggcaccg cccctaagct gctgatctat agaaacaatc accggcctag cggcgtgccc 180
gataggttta gcggatctaa gtcaggcact agcgctagtc tggctatcac cggactgcag 240
tcagaggacg aggccgacta ctactgtcag tcctgggact atagcggctt tagcaccgtg 300
ttcggcggag gcactaagct gaccgtgctg ggtcagccta aggctgcccc cagcgtgacc 360
ctgttccccc ccagcagcga ggagctgcag gccaacaagg ccaccctggt gtgcctgatc 420
agcgacttct acccaggcgc cgtgaccgtg gcctggaagg ccgacagcag ccccgtgaag 480
gccggcgtgg agaccaccac ccccagcaag cagagcaaca acaagtacgc cgccagcagc 540
tacctgagcc tgacccccga gcagtggaag agccacaggt cctacagctg ccaggtgacc 600
cacgagggca gcaccgtgga aaagaccgtg gccccaaccg agtgcagc 648
<210> 21
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 21
Val Tyr Gly Met Asn
1 5
<210> 22
<211> 17
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 22
Ile Ile Trp Tyr Asp Gly Asp Asn Gln Tyr Tyr Ala Asp Ser Val Lys
1 5 10 15
Gly
<210> 23
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 23
Asp Leu Arg Thr Gly Pro Phe Asp Tyr
1 5
<210> 24
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 24
Gly Phe Thr Phe Ser Val Tyr
1 5
<210> 25
<211> 6
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 25
Trp Tyr Asp Gly Asp Asn
1 5
<210> 26
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 26
Asp Leu Arg Thr Gly Pro Phe Asp Tyr
1 5
<210> 27
<211> 118
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 27
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Val Tyr
20 25 30
Gly Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Ile Ile Trp Tyr Asp Gly Asp Asn Gln Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Gly Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Asp Leu Arg Thr Gly Pro Phe Asp Tyr Trp Gly Gln Gly Thr
100 105 110
Leu Val Thr Val Ser Ser
115
<210> 28
<211> 354
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 28
caggtgcagc tggtggagag cggcggcggc gtggtgcagc ccggcaggag cctgaggctg 60
agctgcgccg ccagcggctt caccttcagc gtgtacggca tgaactgggt gaggcaggcc 120
cccggcaagg gcctggagtg ggtggccatc atctggtacg acggcgacaa ccagtactac 180
gccgacagcg tgaagggcag gttcaccatc agcagggaca acagcaagaa caccctgtac 240
ctgcagatga acggcctgag ggccgaggac accgccgtgt actactgcgc cagggacctg 300
aggaccggcc ccttcgacta ctggggccag ggcaccctgg tgaccgtgag cagc 354
<210> 29
<211> 448
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 29
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Val Tyr
20 25 30
Gly Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Ile Ile Trp Tyr Asp Gly Asp Asn Gln Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Gly Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Asp Leu Arg Thr Gly Pro Phe Asp Tyr Trp Gly Gln Gly Thr
100 105 110
Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro
115 120 125
Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly
130 135 140
Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn
145 150 155 160
Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln
165 170 175
Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser
180 185 190
Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser
195 200 205
Asn Thr Lys Val Asp Lys Arg Val Glu Pro Lys Ser Cys Asp Lys Thr
210 215 220
His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser
225 230 235 240
Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg
245 250 255
Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro
260 265 270
Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala
275 280 285
Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val
290 295 300
Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr
305 310 315 320
Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr
325 330 335
Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu
340 345 350
Pro Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys
355 360 365
Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser
370 375 380
Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp
385 390 395 400
Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser
405 410 415
Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala
420 425 430
Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
435 440 445
<210> 30
<211> 1344
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 30
caggtgcagc tggtggagag cggcggcggc gtggtgcagc ccggcaggag cctgaggctg 60
agctgcgccg ccagcggctt caccttcagc gtgtacggca tgaactgggt gaggcaggcc 120
cccggcaagg gcctggagtg ggtggccatc atctggtacg acggcgacaa ccagtactac 180
gccgacagcg tgaagggcag gttcaccatc agcagggaca acagcaagaa caccctgtac 240
ctgcagatga acggcctgag ggccgaggac accgccgtgt actactgcgc cagggacctg 300
aggaccggcc ccttcgacta ctggggccag ggcaccctgg tgaccgtgag cagcgccagc 360
accaagggcc ccagcgtgtt ccccctggcc cccagcagca agagcaccag cggcggcacc 420
gccgccctgg gctgcctggt gaaggactac ttccccgagc ccgtgaccgt gagctggaac 480
agcggcgccc tgaccagcgg cgtgcacacc ttccccgccg tgctgcagag cagcggcctg 540
tacagcctga gcagcgtggt gaccgtgccc agcagcagcc tgggcaccca gacctacatc 600
tgcaacgtga accacaagcc cagcaacacc aaggtggaca agagggtgga gcccaagagc 660
tgcgacaaga cccacacctg ccccccctgc cccgcccccg agctgctggg cggccccagc 720
gtgttcctgt tcccccccaa gcccaaggac accctgatga tcagcaggac ccccgaggtg 780
acctgcgtgg tggtggacgt gagccacgag gaccccgagg tgaagttcaa ctggtacgtg 840
gacggcgtgg aggtgcacaa cgccaagacc aagcccaggg aggagcagta caacagcacc 900
tacagggtgg tgagcgtgct gaccgtgctg caccaggact ggctgaacgg caaggagtac 960
aagtgcaagg tgagcaacaa ggccctgccc gcccccatcg agaagaccat cagcaaggcc 1020
aagggccagc ccagggagcc ccaggtgtac accctgcccc ccagcaggga ggagatgacc 1080
aagaaccagg tgagcctgac ctgcctggtg aagggcttct accccagcga catcgccgtg 1140
gagtgggaga gcaacggcca gcccgagaac aactacaaga ccaccccccc cgtgctggac 1200
agcgacggca gcttcttcct gtacagcaag ctgaccgtgg acaagagcag gtggcagcag 1260
ggcaacgtgt tcagctgcag cgtgatgcac gaggccctgc acaaccacta cacccagaag 1320
agcctgagcc tgagccccgg caag 1344
<210> 31
<211> 11
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 31
Arg Ala Ser Gln Ser Ile Gly Ser Ser Leu His
1 5 10
<210> 32
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 32
Tyr Ala Ser Gln Ser Phe Ser
1 5
<210> 33
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 33
His Gln Ser Ser Ser Leu Pro Phe Thr
1 5
<210> 34
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 34
Ser Gln Ser Ile Gly Ser Ser
1 5
<210> 35
<211> 3
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 35
Tyr Ala Ser
1
<210> 36
<211> 6
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 36
Ser Ser Ser Leu Pro Phe
1 5
<210> 37
<211> 107
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 37
Glu Ile Val Leu Thr Gln Ser Pro Asp Phe Gln Ser Val Thr Pro Lys
1 5 10 15
Glu Lys Val Thr Ile Thr Cys Arg Ala Ser Gln Ser Ile Gly Ser Ser
20 25 30
Leu His Trp Tyr Gln Gln Lys Pro Asp Gln Ser Pro Lys Leu Leu Ile
35 40 45
Lys Tyr Ala Ser Gln Ser Phe Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Asn Ser Leu Glu Ala
65 70 75 80
Glu Asp Ala Ala Ala Tyr Tyr Cys His Gln Ser Ser Ser Leu Pro Phe
85 90 95
Thr Phe Gly Pro Gly Thr Lys Val Asp Ile Lys
100 105
<210> 38
<211> 321
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 38
gagatcgtgc tgacccagtc acccgacttt cagtcagtga cccctaaaga aaaagtgact 60
atcacctgta gggcctccca gtctatcggc tctagcctgc actggtatca gcagaagccc 120
gatcagtcac ctaagctgct gattaagtac gcctctcagt cctttagcgg cgtgccctct 180
aggtttagcg gctcaggctc aggcaccgac ttcaccctga ctatcaatag cctggaagcc 240
gaggacgccg ctgcctacta ctgtcatcag tcaagtagcc tgcccttcac cttcggccct 300
ggcactaaag tggatattaa g 321
<210> 39
<211> 214
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 39
Glu Ile Val Leu Thr Gln Ser Pro Asp Phe Gln Ser Val Thr Pro Lys
1 5 10 15
Glu Lys Val Thr Ile Thr Cys Arg Ala Ser Gln Ser Ile Gly Ser Ser
20 25 30
Leu His Trp Tyr Gln Gln Lys Pro Asp Gln Ser Pro Lys Leu Leu Ile
35 40 45
Lys Tyr Ala Ser Gln Ser Phe Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Asn Ser Leu Glu Ala
65 70 75 80
Glu Asp Ala Ala Ala Tyr Tyr Cys His Gln Ser Ser Ser Leu Pro Phe
85 90 95
Thr Phe Gly Pro Gly Thr Lys Val Asp Ile Lys Arg Thr Val Ala Ala
100 105 110
Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly
115 120 125
Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala
130 135 140
Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln
145 150 155 160
Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser
165 170 175
Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr
180 185 190
Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser
195 200 205
Phe Asn Arg Gly Glu Cys
210
<210> 40
<211> 642
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 40
gagatcgtgc tgacccagtc acccgacttt cagtcagtga cccctaaaga aaaagtgact 60
atcacctgta gggcctccca gtctatcggc tctagcctgc actggtatca gcagaagccc 120
gatcagtcac ctaagctgct gattaagtac gcctctcagt cctttagcgg cgtgccctct 180
aggtttagcg gctcaggctc aggcaccgac ttcaccctga ctatcaatag cctggaagcc 240
gaggacgccg ctgcctacta ctgtcatcag tcaagtagcc tgcccttcac cttcggccct 300
ggcactaaag tggatattaa gcgtacggtg gccgctccca gcgtgttcat cttccccccc 360
agcgacgagc agctgaagag cggcaccgcc agcgtggtgt gcctgctgaa caacttctac 420
ccccgggagg ccaaggtgca gtggaaggtg gacaacgccc tgcagagcgg caacagccag 480
gagagcgtca ccgagcagga cagcaaggac tccacctaca gcctgagcag caccctgacc 540
ctgagcaagg ccgactacga gaagcataag gtgtacgcct gcgaggtgac ccaccagggc 600
ctgtccagcc ccgtgaccaa gagcttcaac aggggcgagt gc 642
<210> 41
<211> 10
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 41
Gly Phe Thr Phe Ser Val Tyr Gly Met Asn
1 5 10
<210> 42
<211> 17
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 42
Ile Ile Trp Tyr Asp Gly Asp Asn Gln Tyr Tyr Ala Asp Ser Val Lys
1 5 10 15
Gly
<210> 43
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 43
Asp Leu Arg Thr Gly Pro Phe Asp Tyr
1 5
<210> 44
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 44
Val Tyr Gly Met Asn
1 5
<210> 45
<211> 17
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 45
Ile Ile Trp Tyr Asp Gly Asp Asn Gln Tyr Tyr Ala Asp Ser Val Lys
1 5 10 15
Gly
<210> 46
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 46
Asp Leu Arg Thr Gly Pro Phe Asp Tyr
1 5
<210> 47
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 47
Gly Phe Thr Phe Ser Val Tyr
1 5
<210> 48
<211> 6
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 48
Trp Tyr Asp Gly Asp Asn
1 5
<210> 49
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 49
Asp Leu Arg Thr Gly Pro Phe Asp Tyr
1 5
<210> 50
<211> 8
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 50
Gly Phe Thr Phe Ser Val Tyr Gly
1 5
<210> 51
<211> 8
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 51
Ile Trp Tyr Asp Gly Asp Asn Gln
1 5
<210> 52
<211> 11
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 52
Ala Arg Asp Leu Arg Thr Gly Pro Phe Asp Tyr
1 5 10
<210> 53
<211> 118
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 53
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Val Tyr
20 25 30
Gly Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Ile Ile Trp Tyr Asp Gly Asp Asn Gln Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Gly Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Asp Leu Arg Thr Gly Pro Phe Asp Tyr Trp Gly Gln Gly Thr
100 105 110
Leu Val Thr Val Ser Ser
115
<210> 54
<211> 354
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 54
caggtgcagc tggtggaatc aggcggcgga gtggtgcagc ctggtagatc actgagactg 60
agctgcgctg ctagtggctt cacctttagc gtctacggaa tgaactgggt ccgacaggcc 120
cctgggaaag gcctggagtg ggtggcaatt atctggtacg acggcgataa tcagtactac 180
gccgatagcg tgaagggacg gttcactatc tctagggata actctaagaa caccctgtac 240
ctgcagatga acggcctgag agccgaggac accgccgtct actactgcgc tagggacctg 300
agaaccggcc ccttcgacta ctggggacag ggcaccctgg tcaccgtgtc tagc 354
<210> 55
<211> 448
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 55
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Val Tyr
20 25 30
Gly Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Ile Ile Trp Tyr Asp Gly Asp Asn Gln Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Gly Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Asp Leu Arg Thr Gly Pro Phe Asp Tyr Trp Gly Gln Gly Thr
100 105 110
Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro
115 120 125
Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly
130 135 140
Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn
145 150 155 160
Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln
165 170 175
Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser
180 185 190
Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser
195 200 205
Asn Thr Lys Val Asp Lys Arg Val Glu Pro Lys Ser Cys Asp Lys Thr
210 215 220
His Thr Cys Pro Pro Cys Pro Ala Pro Glu Ala Ala Gly Gly Pro Ser
225 230 235 240
Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg
245 250 255
Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro
260 265 270
Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala
275 280 285
Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val
290 295 300
Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr
305 310 315 320
Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr
325 330 335
Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Cys Thr Leu
340 345 350
Pro Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu Ser Cys
355 360 365
Ala Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser
370 375 380
Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp
385 390 395 400
Ser Asp Gly Ser Phe Phe Leu Val Ser Lys Leu Thr Val Asp Lys Ser
405 410 415
Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala
420 425 430
Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
435 440 445
<210> 56
<211> 1344
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 56
caggtgcagc tggtggaatc aggcggcgga gtggtgcagc ctggtagatc actgagactg 60
agctgcgctg ctagtggctt cacctttagc gtctacggaa tgaactgggt ccgacaggcc 120
cctgggaaag gcctggagtg ggtggcaatt atctggtacg acggcgataa tcagtactac 180
gccgatagcg tgaagggacg gttcactatc tctagggata actctaagaa caccctgtac 240
ctgcagatga acggcctgag agccgaggac accgccgtct actactgcgc tagggacctg 300
agaaccggcc ccttcgacta ctggggacag ggcaccctgg tcaccgtgtc tagcgcctct 360
actaagggcc caagcgtgtt ccccctggcc cctagctcta agtctactag cggaggcacc 420
gccgctctgg gctgcctggt caaggactac ttccccgagc ccgtgaccgt cagctggaat 480
agcggcgctc tgactagcgg agtgcacacc ttccccgccg tgctgcagtc tagcggcctg 540
tatagcctgt ctagcgtcgt gaccgtgcct agctctagcc tgggcactca gacctatatc 600
tgtaacgtga accacaagcc ctctaacact aaggtggaca agcgggtgga acctaagtcc 660
tgcgataaga ctcacacctg tcctccctgc cctgcccctg aggctgccgg aggacctagc 720
gtgttcctgt tcccacctaa gcctaaagac accctgatga tctctaggac ccccgaagtg 780
acctgcgtgg tggtggacgt ctcacacgag gaccctgaag tgaagtttaa ttggtacgtg 840
gacggcgtgg aagtgcacaa cgctaagact aagcctagag aggaacagta taactctacc 900
tatagggtcg tcagcgtgct gacagtgctg caccaggact ggctgaacgg gaaagagtat 960
aagtgtaaag tgtctaacaa ggccctgcca gcccctatcg aaaagactat ctctaaggct 1020
aaggggcagc ctagagaacc ccaagtgtgc actctgcccc ctagtagaga agagatgact 1080
aagaatcagg tgtcactgag ctgtgccgtg aagggcttct accctagcga tatcgccgtg 1140
gagtgggaga gcaacggcca gcccgagaac aactacaaga ccaccccccc agtgctggac 1200
agcgacggca gcttcttcct ggtgagcaag ctgaccgtgg acaagtccag gtggcagcag 1260
ggcaacgtgt tcagctgcag cgtgatgcac gaggccctgc acaaccacta cacccagaag 1320
tccctgagcc tgagccccgg caag 1344
<210> 57
<211> 11
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 57
Arg Ala Ser Gln Ser Ile Gly Ser Ser Leu His
1 5 10
<210> 58
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 58
Tyr Ala Ser Gln Ser Phe Ser
1 5
<210> 59
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 59
His Gln Ser Ser Ser Leu Pro Phe Thr
1 5
<210> 60
<211> 11
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 60
Arg Ala Ser Gln Ser Ile Gly Ser Ser Leu His
1 5 10
<210> 61
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 61
Tyr Ala Ser Gln Ser Phe Ser
1 5
<210> 62
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 62
His Gln Ser Ser Ser Leu Pro Phe Thr
1 5
<210> 63
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 63
Ser Gln Ser Ile Gly Ser Ser
1 5
<210> 64
<211> 3
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 64
Tyr Ala Ser
1
<210> 65
<211> 6
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 65
Ser Ser Ser Leu Pro Phe
1 5
<210> 66
<211> 6
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 66
Gln Ser Ile Gly Ser Ser
1 5
<210> 67
<211> 10
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 67
Tyr Ala Ser Gln Ser Phe Ser Gly Val Pro
1 5 10
<210> 68
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 68
His Gln Ser Ser Ser Leu Pro Phe Thr
1 5
<210> 69
<211> 107
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 69
Glu Ile Val Leu Thr Gln Ser Pro Asp Phe Gln Ser Val Thr Pro Lys
1 5 10 15
Glu Lys Val Thr Ile Thr Cys Arg Ala Ser Gln Ser Ile Gly Ser Ser
20 25 30
Leu His Trp Tyr Gln Gln Lys Pro Asp Gln Ser Pro Lys Leu Leu Ile
35 40 45
Lys Tyr Ala Ser Gln Ser Phe Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Asn Ser Leu Glu Ala
65 70 75 80
Glu Asp Ala Ala Ala Tyr Tyr Cys His Gln Ser Ser Ser Leu Pro Phe
85 90 95
Thr Phe Gly Pro Gly Thr Lys Val Asp Ile Lys
100 105
<210> 70
<211> 321
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 70
gagatcgtgc tgacccagtc acccgacttt cagtcagtga cccctaaaga aaaagtgact 60
atcacctgta gggcctccca gtctatcggc tctagcctgc actggtatca gcagaagccc 120
gatcagtcac ctaagctgct gattaagtac gcctctcagt cctttagcgg cgtgccctct 180
aggtttagcg gctcaggctc aggcaccgac ttcaccctga ctatcaatag cctggaagcc 240
gaggacgccg ctgcctacta ctgtcatcag tcaagtagcc tgcccttcac cttcggccct 300
ggcactaaag tggatattaa g 321
<210> 71
<211> 214
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 71
Glu Ile Val Leu Thr Gln Ser Pro Asp Phe Gln Ser Val Thr Pro Lys
1 5 10 15
Glu Lys Val Thr Ile Thr Cys Arg Ala Ser Gln Ser Ile Gly Ser Ser
20 25 30
Leu His Trp Tyr Gln Gln Lys Pro Asp Gln Ser Pro Lys Leu Leu Ile
35 40 45
Lys Tyr Ala Ser Gln Ser Phe Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Asn Ser Leu Glu Ala
65 70 75 80
Glu Asp Ala Ala Ala Tyr Tyr Cys His Gln Ser Ser Ser Leu Pro Phe
85 90 95
Thr Phe Gly Pro Gly Thr Lys Val Asp Ile Lys Arg Thr Val Ala Ala
100 105 110
Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly
115 120 125
Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala
130 135 140
Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln
145 150 155 160
Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser
165 170 175
Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr
180 185 190
Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser
195 200 205
Phe Asn Arg Gly Glu Cys
210
<210> 72
<211> 642
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 72
gagatcgtgc tgacccagtc acccgacttt cagtcagtga cccctaaaga aaaagtgact 60
atcacctgta gggcctccca gtctatcggc tctagcctgc actggtatca gcagaagccc 120
gatcagtcac ctaagctgct gattaagtac gcctctcagt cctttagcgg cgtgccctct 180
aggtttagcg gctcaggctc aggcaccgac ttcaccctga ctatcaatag cctggaagcc 240
gaggacgccg ctgcctacta ctgtcatcag tcaagtagcc tgcccttcac cttcggccct 300
ggcactaaag tggatattaa gcgtacggtg gccgctccca gcgtgttcat cttccccccc 360
agcgacgagc agctgaagag cggcaccgcc agcgtggtgt gcctgctgaa caacttctac 420
ccccgggagg ccaaggtgca gtggaaggtg gacaacgccc tgcagagcgg caacagccag 480
gagagcgtca ccgagcagga cagcaaggac tccacctaca gcctgagcag caccctgacc 540
ctgagcaagg ccgactacga gaagcataag gtgtacgcct gcgaggtgac ccaccagggc 600
ctgtccagcc ccgtgaccaa gagcttcaac aggggcgagt gc 642
<210> 73
<211> 10
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 73
Gly Gly Thr Phe Lys Ser Tyr Ala Ile Ser
1 5 10
<210> 74
<211> 17
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 74
Asn Ile Ile Pro Met Thr Gly Gln Thr Tyr Tyr Ala Gln Lys Phe Gln
1 5 10 15
Gly
<210> 75
<211> 10
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 75
Ala Ala Tyr His Pro Leu Val Phe Asp Asn
1 5 10
<210> 76
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 76
Ser Tyr Ala Ile Ser
1 5
<210> 77
<211> 17
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 77
Asn Ile Ile Pro Met Thr Gly Gln Thr Tyr Tyr Ala Gln Lys Phe Gln
1 5 10 15
Gly
<210> 78
<211> 10
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 78
Ala Ala Tyr His Pro Leu Val Phe Asp Asn
1 5 10
<210> 79
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 79
Gly Gly Thr Phe Lys Ser Tyr
1 5
<210> 80
<211> 6
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 80
Ile Pro Met Thr Gly Gln
1 5
<210> 81
<211> 10
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 81
Ala Ala Tyr His Pro Leu Val Phe Asp Asn
1 5 10
<210> 82
<211> 8
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 82
Gly Gly Thr Phe Lys Ser Tyr Ala
1 5
<210> 83
<211> 8
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 83
Ile Ile Pro Met Thr Gly Gln Thr
1 5
<210> 84
<211> 12
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 84
Ala Arg Ala Ala Tyr His Pro Leu Val Phe Asp Asn
1 5 10
<210> 85
<211> 119
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 85
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ser
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Gly Thr Phe Lys Ser Tyr
20 25 30
Ala Ile Ser Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Asn Ile Ile Pro Met Thr Gly Gln Thr Tyr Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Ile Thr Ala Asp Glu Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Ala Ala Tyr His Pro Leu Val Phe Asp Asn Trp Gly Gln Gly
100 105 110
Thr Leu Val Thr Val Ser Ser
115
<210> 86
<211> 357
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 86
gaggtgcagc tggtgcagtc aggcgccgaa gtgaagaaac ccggctctag cgtgaaagtc 60
agctgtaaag ctagtggcgg caccttcaag tcctacgcta ttagctgggt cagacaggcc 120
ccaggtcagg gcctggagtg gatgggcaat attatcccta tgaccggtca gacctactac 180
gctcagaaat ttcagggtag agtgactatc accgccgacg agtctactag caccgcctat 240
atggaactgt ctagcctgag atcagaggac accgccgtct actactgcgc tagagccgcc 300
tatcaccccc tggtgttcga taactggggt cagggcaccc tggtcaccgt gtctagc 357
<210> 87
<211> 449
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 87
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ser
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Gly Thr Phe Lys Ser Tyr
20 25 30
Ala Ile Ser Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Asn Ile Ile Pro Met Thr Gly Gln Thr Tyr Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Ile Thr Ala Asp Glu Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Ala Ala Tyr His Pro Leu Val Phe Asp Asn Trp Gly Gln Gly
100 105 110
Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe
115 120 125
Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu
130 135 140
Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp
145 150 155 160
Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu
165 170 175
Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser
180 185 190
Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro
195 200 205
Ser Asn Thr Lys Val Asp Lys Arg Val Glu Pro Lys Ser Cys Asp Lys
210 215 220
Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Ala Ala Gly Gly Pro
225 230 235 240
Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser
245 250 255
Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp
260 265 270
Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn
275 280 285
Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val
290 295 300
Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu
305 310 315 320
Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys
325 330 335
Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr
340 345 350
Leu Pro Pro Cys Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu Trp
355 360 365
Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu
370 375 380
Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu
385 390 395 400
Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys
405 410 415
Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu
420 425 430
Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly
435 440 445
Lys
<210> 88
<211> 1347
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 88
gaggtgcagc tggtgcagtc aggcgccgaa gtgaagaaac ccggctctag cgtgaaagtc 60
agctgtaaag ctagtggcgg caccttcaag tcctacgcta ttagctgggt cagacaggcc 120
ccaggtcagg gcctggagtg gatgggcaat attatcccta tgaccggtca gacctactac 180
gctcagaaat ttcagggtag agtgactatc accgccgacg agtctactag caccgcctat 240
atggaactgt ctagcctgag atcagaggac accgccgtct actactgcgc tagagccgcc 300
tatcaccccc tggtgttcga taactggggt cagggcaccc tggtcaccgt gtctagcgct 360
agcactaagg gcccctcagt gttccccctg gcccctagct ctaagtctac tagcggcggc 420
accgccgctc tgggctgcct ggtgaaagac tacttccccg agcccgtgac cgtgtcatgg 480
aatagcggcg ctctgactag cggagtgcac accttccccg ccgtgctgca gtctagcggc 540
ctgtatagcc tgtctagcgt ggtgaccgtg cctagctcta gcctgggcac tcagacctac 600
atctgtaacg tgaaccacaa gccctctaac actaaggtgg acaagcgggt ggaacctaag 660
tcctgcgata agactcacac ctgtcccccc tgccctgccc ctgaggctgc cggaggacct 720
agcgtgttcc tgttcccacc taagcctaag gacaccctga tgatctctag gacccccgaa 780
gtgacctgcg tggtggtgga tgtgtctcac gaggaccctg aagtgaagtt caattggtac 840
gtggacggcg tggaagtgca caacgctaag actaagccta gagaggaaca gtataactcc 900
acctatagag tggtgtcagt gctgaccgtg ctgcatcagg actggctgaa cggcaaagag 960
tataagtgta aagtctctaa caaggccctg ccagccccta tcgaaaagac tatctctaag 1020
gctaagggcc agcctagaga acctcaggtg tacaccctgc ccccctgtag agaagagatg 1080
actaagaatc aggtgtccct gtggtgtctg gtgaaaggct tctaccctag cgatatcgcc 1140
gtggaatggg agtctaacgg ccagcccgag aacaactata agactacccc ccctgtgctg 1200
gatagcgacg gctcattctt cctgtactct aagctgaccg tggacaagtc taggtggcag 1260
cagggcaatg tgtttagctg tagcgtgatg cacgaggccc tgcataatca ctacactcag 1320
aagtcactga gcctgagccc cggcaag 1347
<210> 89
<211> 13
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 89
Ser Gly Ser Ser Ser Asn Ile Gly Asn His Tyr Val Asn
1 5 10
<210> 90
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 90
Arg Asn Asn His Arg Pro Ser
1 5
<210> 91
<211> 11
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 91
Gln Ser Trp Asp Tyr Ser Gly Phe Ser Thr Val
1 5 10
<210> 92
<211> 13
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 92
Ser Gly Ser Ser Ser Asn Ile Gly Asn His Tyr Val Asn
1 5 10
<210> 93
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 93
Arg Asn Asn His Arg Pro Ser
1 5
<210> 94
<211> 11
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 94
Gln Ser Trp Asp Tyr Ser Gly Phe Ser Thr Val
1 5 10
<210> 95
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 95
Ser Ser Ser Asn Ile Gly Asn His Tyr
1 5
<210> 96
<211> 3
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 96
Arg Asn Asn
1
<210> 97
<211> 8
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 97
Trp Asp Tyr Ser Gly Phe Ser Thr
1 5
<210> 98
<211> 8
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 98
Ser Ser Asn Ile Gly Asn His Tyr
1 5
<210> 99
<211> 3
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 99
Arg Asn Asn
1
<210> 100
<211> 11
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 100
Gln Ser Trp Asp Tyr Ser Gly Phe Ser Thr Val
1 5 10
<210> 101
<211> 110
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 101
Asp Ile Val Leu Thr Gln Pro Pro Ser Val Ser Gly Ala Pro Gly Gln
1 5 10 15
Arg Val Thr Ile Ser Cys Ser Gly Ser Ser Ser Asn Ile Gly Asn His
20 25 30
Tyr Val Asn Trp Tyr Gln Gln Leu Pro Gly Thr Ala Pro Lys Leu Leu
35 40 45
Ile Tyr Arg Asn Asn His Arg Pro Ser Gly Val Pro Asp Arg Phe Ser
50 55 60
Gly Ser Lys Ser Gly Thr Ser Ala Ser Leu Ala Ile Thr Gly Leu Gln
65 70 75 80
Ser Glu Asp Glu Ala Asp Tyr Tyr Cys Gln Ser Trp Asp Tyr Ser Gly
85 90 95
Phe Ser Thr Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu
100 105 110
<210> 102
<211> 330
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 102
gatatcgtcc tgactcagcc ccctagcgtc agcggcgctc ccggtcagag agtgactatt 60
agctgtagcg gctctagctc taatatcggt aatcactacg tgaactggta tcagcagctg 120
cccggcaccg cccctaagct gctgatctat agaaacaatc accggcctag cggcgtgccc 180
gataggttta gcggatctaa gtcaggcact agcgctagtc tggctatcac cggactgcag 240
tcagaggacg aggccgacta ctactgtcag tcctgggact atagcggctt tagcaccgtg 300
ttcggcggag gcactaagct gaccgtgctg 330
<210> 103
<211> 216
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 103
Asp Ile Val Leu Thr Gln Pro Pro Ser Val Ser Gly Ala Pro Gly Gln
1 5 10 15
Arg Val Thr Ile Ser Cys Ser Gly Ser Ser Ser Asn Ile Gly Asn His
20 25 30
Tyr Val Asn Trp Tyr Gln Gln Leu Pro Gly Thr Ala Pro Lys Leu Leu
35 40 45
Ile Tyr Arg Asn Asn His Arg Pro Ser Gly Val Pro Asp Arg Phe Ser
50 55 60
Gly Ser Lys Ser Gly Thr Ser Ala Ser Leu Ala Ile Thr Gly Leu Gln
65 70 75 80
Ser Glu Asp Glu Ala Asp Tyr Tyr Cys Gln Ser Trp Asp Tyr Ser Gly
85 90 95
Phe Ser Thr Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu Gly Gln
100 105 110
Pro Lys Ala Ala Pro Ser Val Thr Leu Phe Pro Pro Ser Ser Glu Glu
115 120 125
Leu Gln Ala Asn Lys Ala Thr Leu Val Cys Leu Ile Ser Asp Phe Tyr
130 135 140
Pro Gly Ala Val Thr Val Ala Trp Lys Ala Asp Ser Ser Pro Val Lys
145 150 155 160
Ala Gly Val Glu Thr Thr Thr Pro Ser Lys Gln Ser Asn Asn Lys Tyr
165 170 175
Ala Ala Ser Ser Tyr Leu Ser Leu Thr Pro Glu Gln Trp Lys Ser His
180 185 190
Arg Ser Tyr Ser Cys Gln Val Thr His Glu Gly Ser Thr Val Glu Lys
195 200 205
Thr Val Ala Pro Thr Glu Cys Ser
210 215
<210> 104
<211> 648
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 104
gatatcgtcc tgactcagcc ccctagcgtc agcggcgctc ccggtcagag agtgactatt 60
agctgtagcg gctctagctc taatatcggt aatcactacg tgaactggta tcagcagctg 120
cccggcaccg cccctaagct gctgatctat agaaacaatc accggcctag cggcgtgccc 180
gataggttta gcggatctaa gtcaggcact agcgctagtc tggctatcac cggactgcag 240
tcagaggacg aggccgacta ctactgtcag tcctgggact atagcggctt tagcaccgtg 300
ttcggcggag gcactaagct gaccgtgctg ggtcagccta aggctgcccc cagcgtgacc 360
ctgttccccc ccagcagcga ggagctgcag gccaacaagg ccaccctggt gtgcctgatc 420
agcgacttct acccaggcgc cgtgaccgtg gcctggaagg ccgacagcag ccccgtgaag 480
gccggcgtgg agaccaccac ccccagcaag cagagcaaca acaagtacgc cgccagcagc 540
tacctgagcc tgacccccga gcagtggaag agccacaggt cctacagctg ccaggtgacc 600
cacgagggca gcaccgtgga aaagaccgtg gccccaaccg agtgcagc 648
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| БИСПЕЦИФИЧЕСКОЕ АНТИТЕЛО | 2020 |
|
RU2814713C2 |
| МОНОКЛОНАЛЬНОЕ АНТИТЕЛО ИЛИ ЕГО АНТИГЕНСВЯЗЫВАЮЩИЙ ФРАГМЕНТ, КОТОРОЕ СПЕЦИФИЧЕСКИ СВЯЗЫВАЕТСЯ С IL-4Rα, И ЕГО ПРИМЕНЕНИЕ | 2021 |
|
RU2808563C2 |
| БИСПЕЦИФИЧЕСКОЕ АНТИТЕЛО | 2019 |
|
RU2796019C2 |
| АНТИ-CEACAM1 АНТИТЕЛО И ЕГО ПРИМЕНЕНИЕ | 2018 |
|
RU2754876C2 |
| АНТИ-IL-5 АНТИТЕЛА | 2017 |
|
RU2758008C2 |
| ЧЕЛОВЕЧЕСКИЕ МОНОКЛОНАЛЬНЫЕ АНТИТЕЛА К ЧЕЛОВЕЧЕСКОМУ ИНТЕРЛЕЙКИНУ-4 (hIL-4) | 2005 |
|
RU2382049C2 |
| АНТИТЕЛА, СПЕЦИФИЧНЫЕ К FLT3, И ИХ ПРИМЕНЕНИЯ | 2018 |
|
RU2758513C2 |
| УСОВЕРШЕНСТВОВАННЫЕ ПРОКОАГУЛЯНТНЫЕ АНТИТЕЛА | 2019 |
|
RU2810748C2 |
| АНТИТЕЛА, СПЕЦИФИЧНЫЕ К ММР9 | 2015 |
|
RU2714043C2 |
| МОНОКЛОНАЛЬНЫЕ АНТИТЕЛА К ИНТЕРЛЕЙКИНУ-31 ДЛЯ ВЕТЕРИНАРНОГО ПРИМЕНЕНИЯ | 2019 |
|
RU2795411C2 |
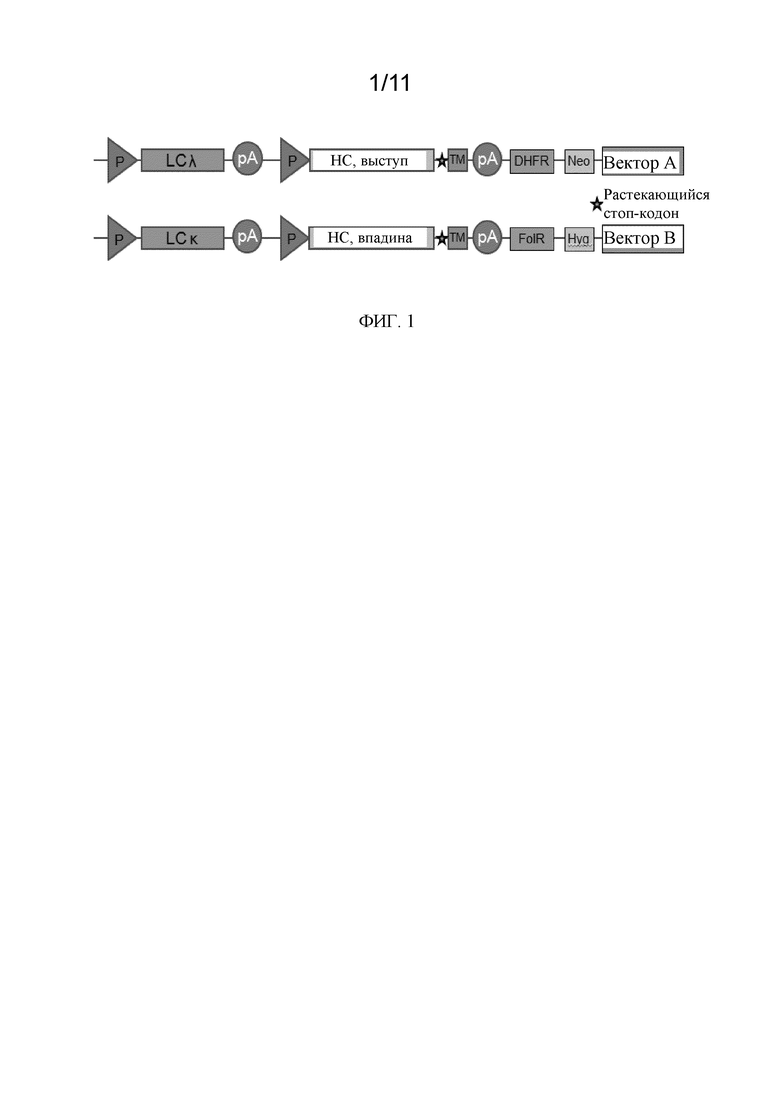
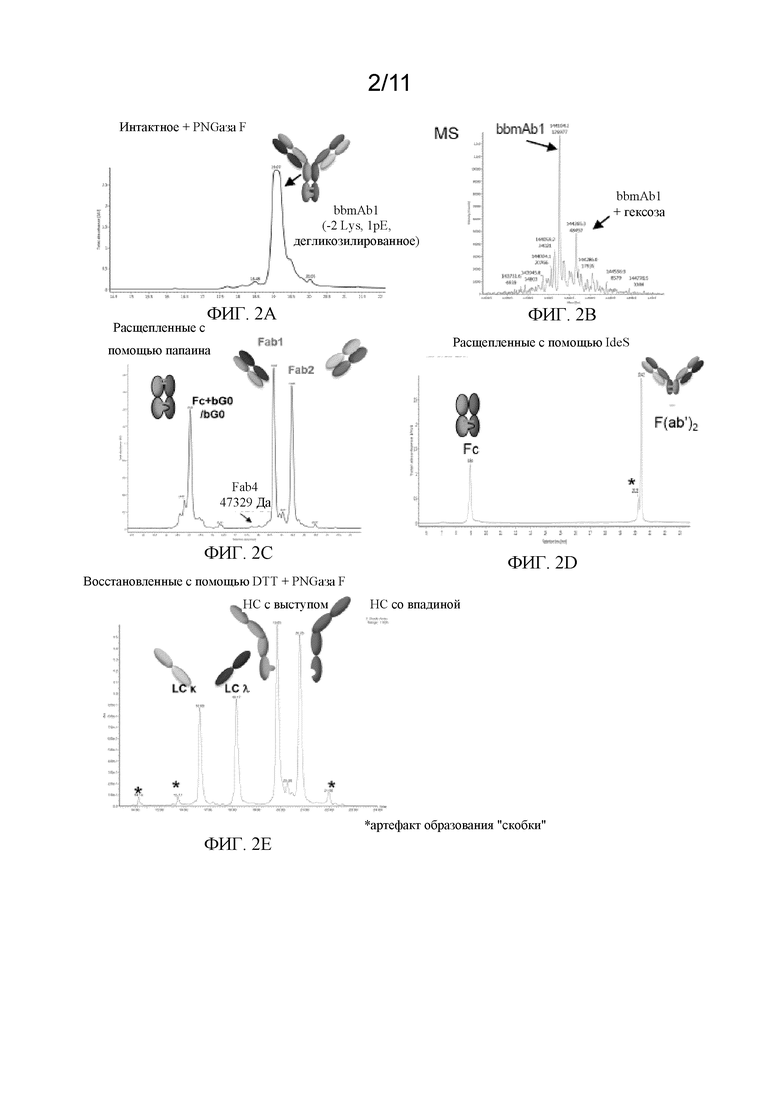
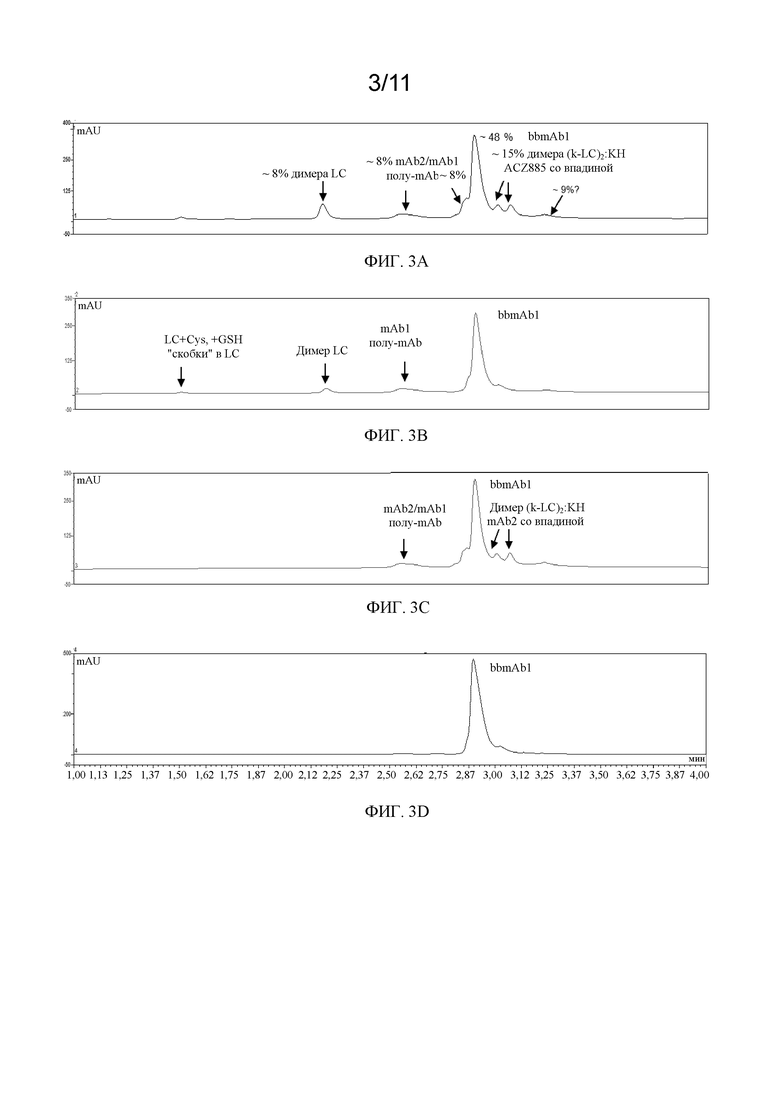
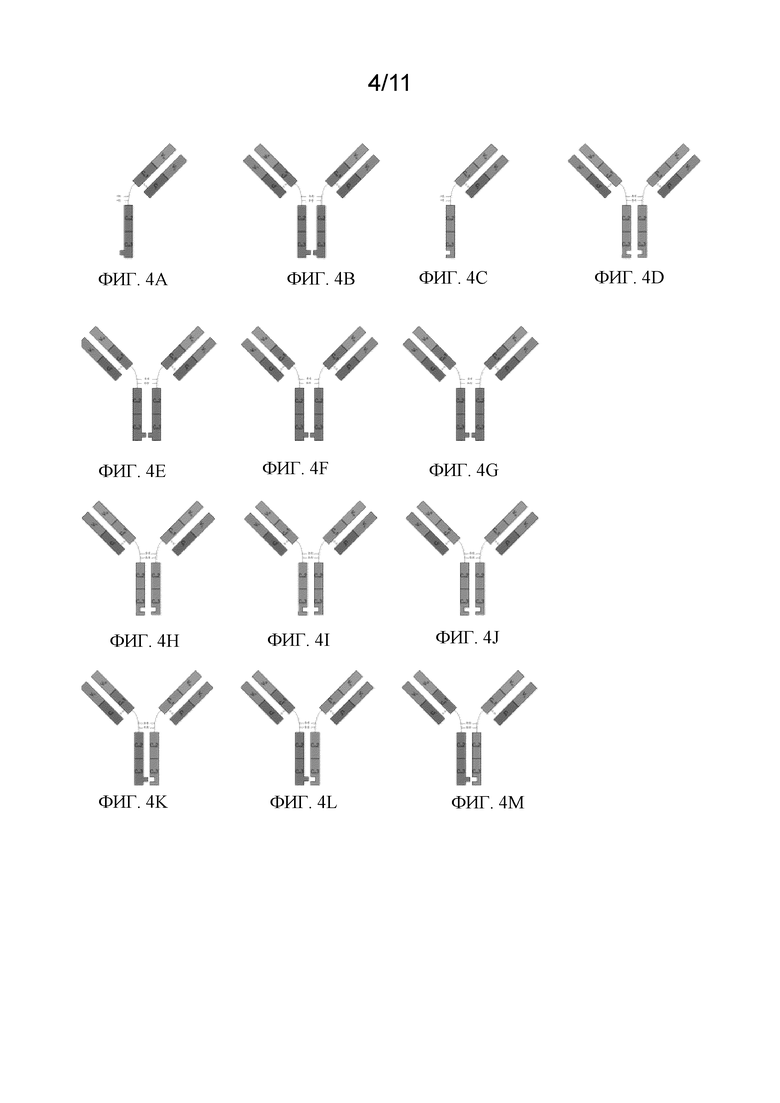
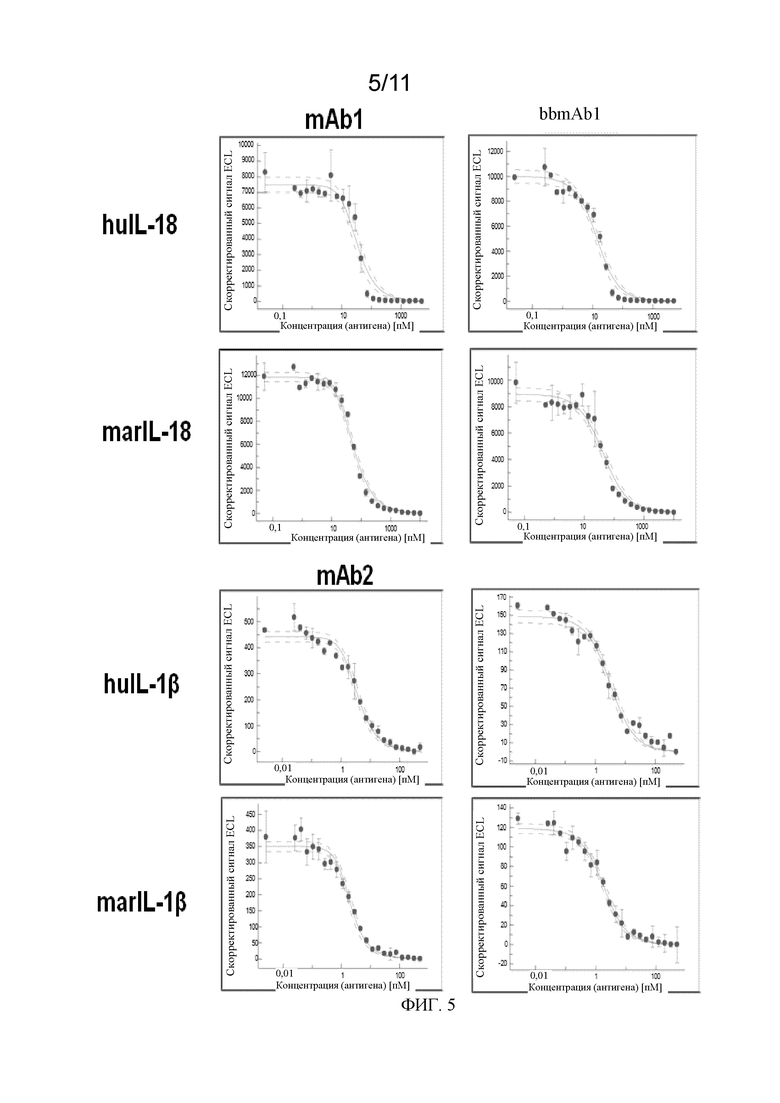
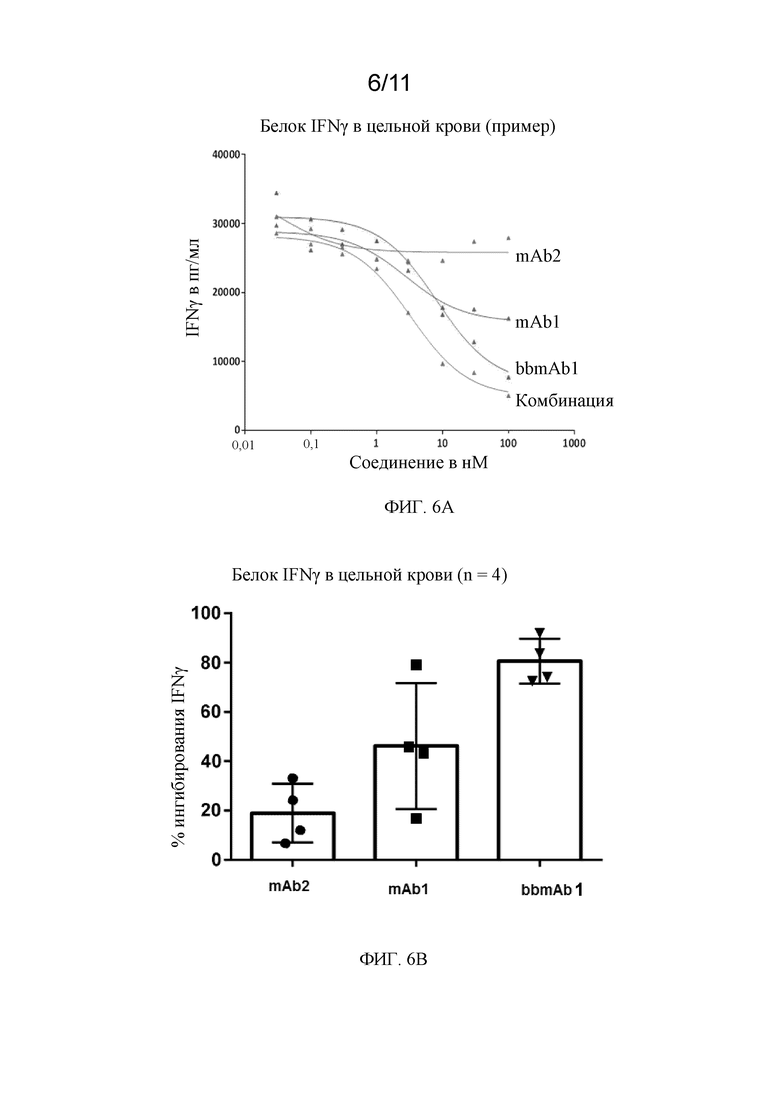
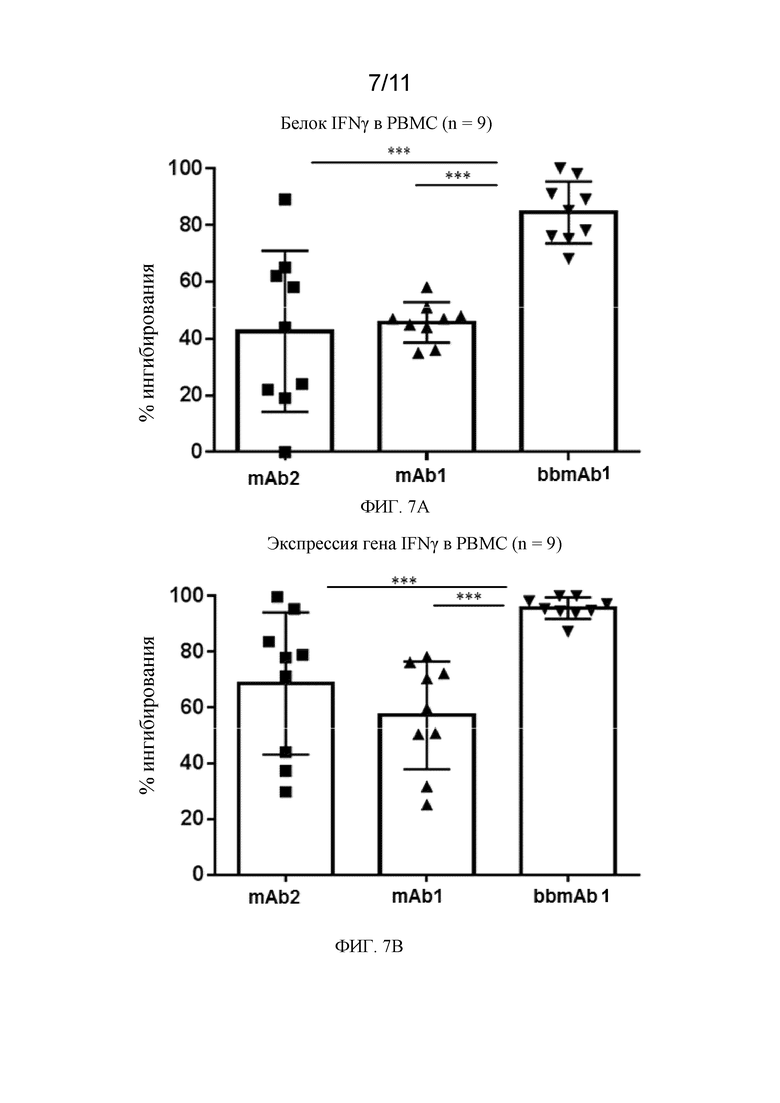
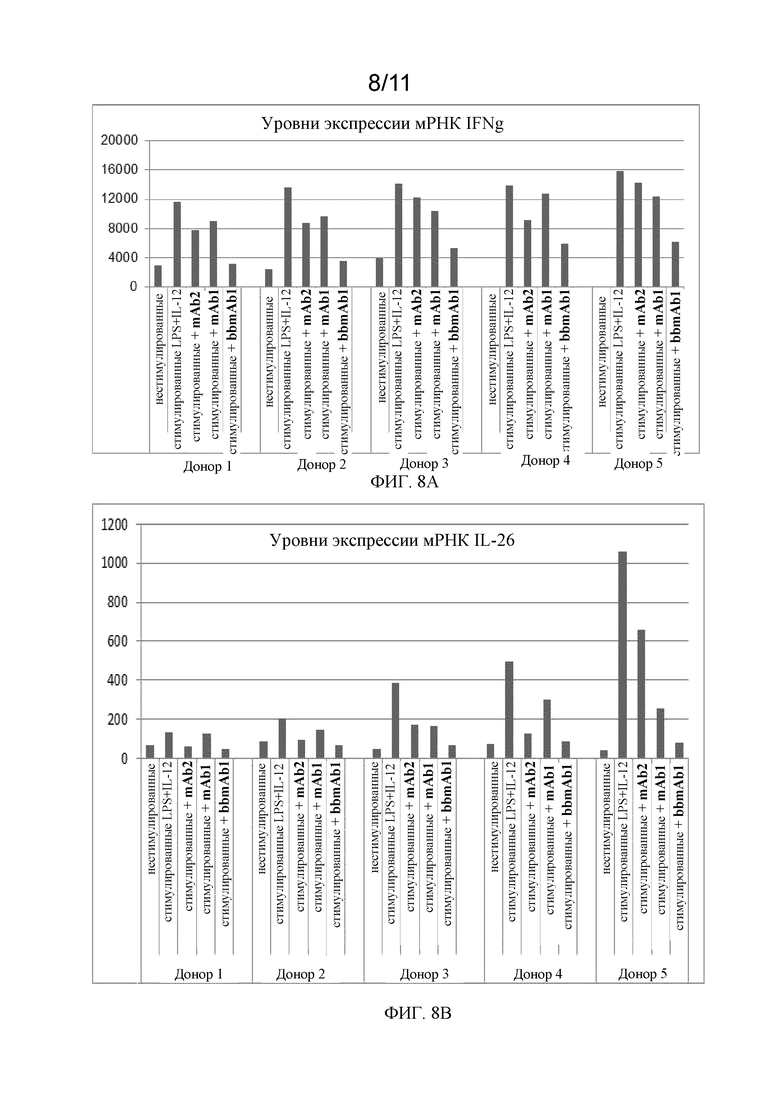
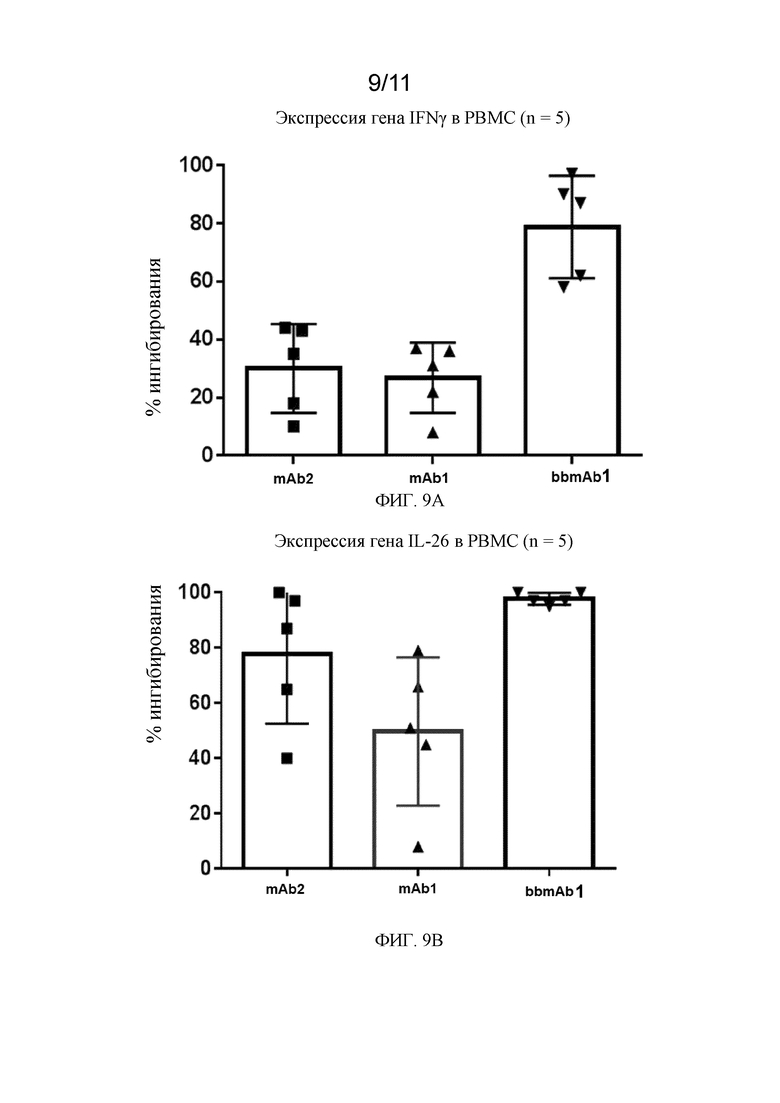
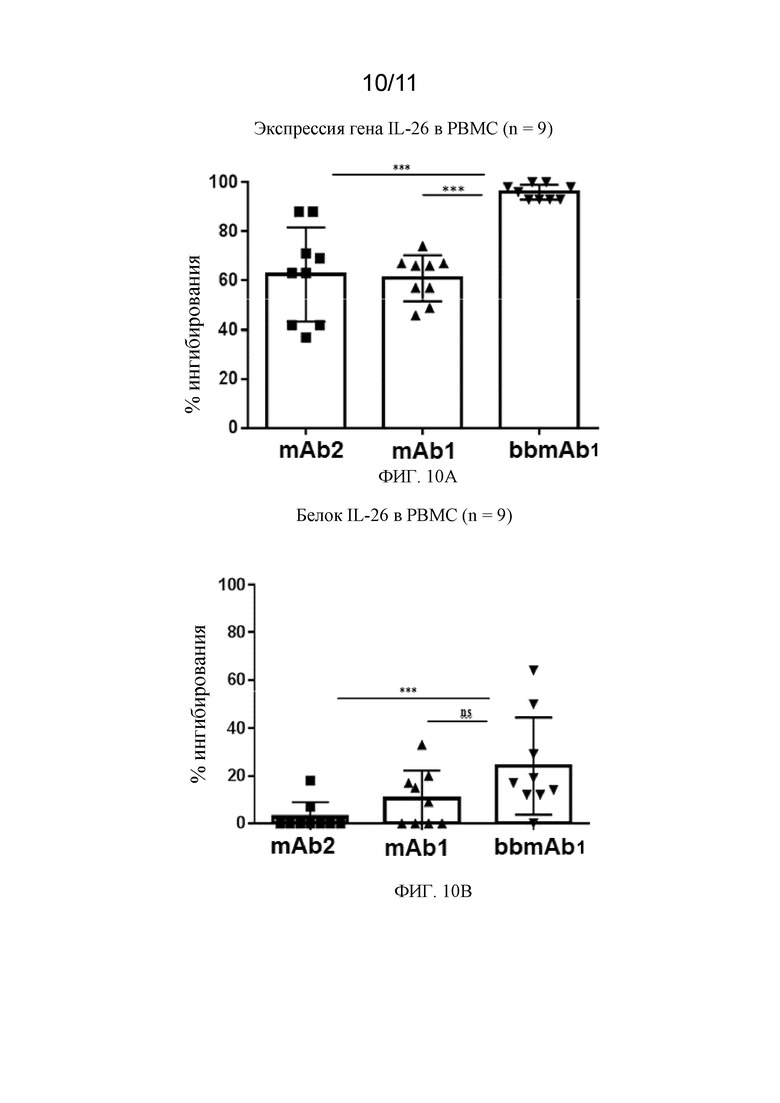
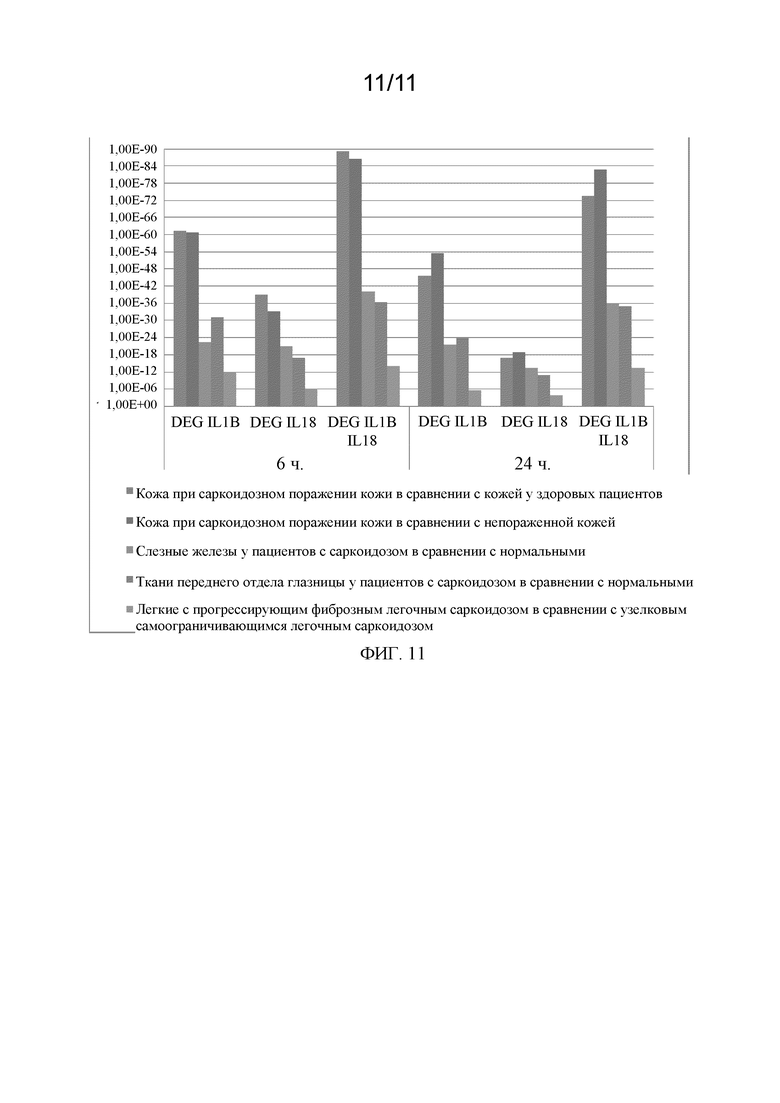
Изобретение относится к области биотехнологии, в частности к биспецифическому антителу, связывающемуся с IL-1β и IL18, а также к способу его получения. Изобретение эффективно для лечения нарушения, связанного с инфламмасомами. 4 н. и 3 з.п. ф-лы, 11 ил., 15 табл., 5 пр.
1. Биспецифическое антитело, связывающееся с IL-1β и IL18, где антитело содержит:
а) первую часть, которая представляет собой иммуноглобулин с первой вариабельной областью легкой лямбда–цепи дикого типа (VL1) и первой вариабельной областью тяжелой цепи дикого типа (VH1), которые специфично связываются с IL18, и первой константной областью тяжелой цепи (CH1) с модификацией, обеспечивающей гетеродимеризацию, и
b) вторую часть, которая представляет собой иммуноглобулин со второй вариабельной областью легкой каппа–цепи дикого типа (VL2) и второй вариабельной областью тяжелой цепи дикого типа (VH2), которые специфично связываются с IL-1β, и второй константной областью тяжелой цепи (CH2) с модификацией, обеспечивающей гетеродимеризацию, которая является комплементарной модификации, обеспечивающей гетеродимеризацию, первой константной области тяжелой цепи,
где первая часть и вторая часть при совместной экспрессии в общей клетке–хозяине образуют биспецифическое антитело, где первая и вторая константные области тяжелой цепи относятся к IgG1, и где:
c) первая константная область тяжелой цепи содержит точечные мутации, образующие структуру выступа, а вторая константная область тяжелой цепи содержит точечные мутации, образующие структуру впадины, или
d) первая константная область тяжелой цепи содержит точечные мутации, образующие структуру впадины, а вторая константная область тяжелой цепи содержит точечные мутации, образующие структуру выступа, и необязательно первая и вторая константные области тяжелой цепи содержат мутации, которые приводят к образованию дисульфидного мостика,
где:
e) первый домен VH1 иммуноглобулина содержит аминокислотную последовательность под SEQ ID NO: 85,
f) первый домен VL1 иммуноглобулина содержит аминокислотную последовательность под SEQ ID NO: 101,
g) второй домен VH2 иммуноглобулина содержит аминокислотную последовательность под SEQ ID NO: 53, и
h) второй домен VL2 иммуноглобулина содержит аминокислотную последовательность под SEQ ID NO: 69.
2. Биспецифическое антитело по п. 1, содержащее первую тяжелую цепь иммуноглобулина, первую легкую цепь иммуноглобулина, вторую тяжелую цепь иммуноглобулина и вторую легкую цепь иммуноглобулина, где:
i) первая тяжелая цепь иммуноглобулина содержит аминокислотную последовательность под SEQ ID NO: 87,
j) первая легкая цепь иммуноглобулина содержит аминокислотную последовательность под SEQ ID NO: 103,
k) вторая тяжелая цепь иммуноглобулина содержит аминокислотную последовательность под SEQ ID NO: 55, и
l) вторая легкая цепь иммуноглобулина содержит аминокислотную последовательность под SEQ ID NO: 71.
3. Способ получения биспецифического антитела по пп. 1, 2 путем совместной экспрессии в общей клетке–хозяине, при этом указанный способ включает:
a) первую стадию получения по меньшей мере одного вектора, кодирующего первую часть a. и вторую часть b. в соответствии с п. 1 или тяжелую и легкую цепи в соответствии с i)-l) п. 2;
b) вторую стадию введения по меньшей мере одного вектора из стадии a. в общую клетку–хозяина;
c) третью стадию отбора клеток, специфично экспрессирующих биспецифическое антитело, кодируемое по меньшей мере одним вектором из стадии a.;
d) четвертую стадию культивирования клеток, отобранных на стадии c., в условиях, в которых клетки экспрессируют биспецифическое антитело; и
e) пятую стадию очистки биспецифического антитела, которое является чистым на по меньшей мере 60% по массе, 70% по массе, 80% по массе или 85% по массе, как, например, чистым на по меньшей мере 90% по массе, чистым на 95% по массе, 96% по массе, 97% по массе, 98% по массе или 99% по массе.
4. Применение биспецифического антитела по любому из пп. 1, 2 в качестве лекарственного препарата для лечения заболевания, связанного с инфламмасомами.
5. Применение по п. 4, где заболевание, связанное с инфламмасомами, выбрано из группы, состоящей из серповидноклеточной анемии, васкулопатии, ишемического/реперфузионного повреждения, сердечно–сосудистого заболевания, заболевания периферических артерий, атеросклероза, сосудистой дисфункции, ишемии скелетных мышц, легочного саркоидоза, фиброза, малярии, гемодиализ–зависимого хронического заболевания почек и болезни Крона.
6. Способ лечения нарушения, связанного с инфламмасомами, включающий введение субъекту, страдающему нарушением, связанным с инфламмасомами, эффективного количества биспецифического антитела по пп. 1, 2.
7. Способ по п. 6, где нарушение, связанное с инфламмасомами, представляет собой серповидноклеточную анемию, васкулопатию, ишемическое/реперфузионное повреждение, сердечно–сосудистое заболевание, заболевание периферических артерий, атеросклероз, сосудистую дисфункцию, ишемию скелетных мышц, легочный саркоидоз, фиброз, малярию, гемодиализ–зависимое хроническое заболевание почек или болезнь Крона.
| WO2017059551 A1, 13.04.2013 | |||
| WO2013096291 A2, 27.06.2013 | |||
| GIOVANNI MAGISTRELLI et al., Optimizing assembly and production of native bispecific antibodies by codon de-optimization, MABS, 2017, VOL | |||
| Разборный с внутренней печью кипятильник | 1922 |
|
SU9A1 |
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| WO2014037899 A2, 13.03.2014 | |||
| US7993878 B2, 09.08.2011 | |||
| ULRICH BRINKMANN et al., The making of bispecific antibodies, MABS, 10 Jan | |||
Авторы
Даты
2023-05-02—Публикация
2018-06-08—Подача