Перекрестная ссылка на связанные заявки
Настоящая заявка испрашивает приоритет по предварительной заявки США № 62/438 502, поданной 23 декабря 2016 года, раскрытие которой включено в настоящее описание ссылкой во всей полноте.
Перечень последовательностей
Настоящая заявка включает перечень последовательностей, который был представлен в электронном виде в формате ASCII и настоящим полностью включен ссылкой. Указанная копия ASCII, созданная 30 ноября 2017 года, называется 102085.000906_sl.txt и имеет размер 93 529 байт.
Область техники, к которой относится изобретение
В настоящем документе раскрыты новые молекулы антител, которые иммуноспецифично связывают IL-5, и применения раскрытых антител.
Предшествующий уровень техники
Интерлейкин-5 (IL-5) представляет собой цитокин Т-хелперов 2 (Th2), который вызывает пролиферацию и дифференцировку как В-клеток, так и эозинофилов. В В-клетках IL-5 также увеличивает секрецию иммуноглобулинов. IL-5 является ключевым модулятором эозинофилов, где он также регулирует созревание, миграцию в ткани, выживание и предотвращение апоптоза.
Посредством двух отдельных мотивов IL5 связывается со своим специфическим рецептором (IL5-Rα) и сигнальным рецептором, общей β-цепью (βс) для интерлейкина-3 (IL-3) и гранулоцитарно-макрофагального колониестимулирующего фактора (GMCSF). Сообщалось, что аффинность IL-5 к IL5-Rα находится в средне-низком диапазоне нМ (0,2-100 нМ); она смещается в диапазон средних пМ (~ 100 пМ) в присутствии βс. IL5-R специфически связывается с IL-5, который затем рекрутирует βc на IL-5R.
Терапевтический потенциал направленного воздействия на интерлейкин-5 (IL-5) был продемонстрирован в результате обширной проверки в литературных данных и недавними положительными данными III фазы клинического исследования для реслизумаба и меполизумаба.
Сущность изобретения
В настоящем документе раскрыты молекулы антител человека, которые иммуноспецифично связываются с IL-5 человека с равновесной константой аффинности (KD), равной, по меньшей мере, около 40 пМ, определенной поверхностным плазмонным резонансом.
Также предлагаются молекулы антитела, включающие CDR1 тяжелой цепи, включающую аминокислотную последовательность SEQ ID NO: 4, CDR2 тяжелой цепи, включающую аминокислотную последовательность SEQ ID NO: 6, CDR3 тяжелой цепи, включающую аминокислотную последовательность, SEQ ID NO: 8, CDR1 легкой цепи, включающую аминокислотную последовательность SEQ ID NO: 5, 21, 24, 27, 30, 33, 36, 39 или 66, CDR2 легкой цепи, включающую аминокислотную последовательность SEQ ID NO: 7, 42 или 45 и CDR3 легкой цепи, включающую аминокислотную последовательность SEQ ID NO: 15, 48, 51, 54, 57, 60 или 63.
Раскрытые молекулы антитела могут включать вариабельную область тяжелой цепи, включающую аминокислотную последовательность, которая, по меньшей мере, на 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична аминокислотной последовательности SEQ ID NO: 16 и вариабельную области легкой цепи, включающую аминокислотную последовательность, которая, по меньшей мере, на 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична аминокислотной последовательности SEQ ID NO: 17, 22, 25, 28, 31, 34, 37, 40, 43, 46, 49, 52, 55, 58, 61, 64 или 67, где вариабельность (то есть, по меньшей мере, 90%, 95 %, 96%, 97%, 98%, 99% или 100% идентичности) имеет место за пределами последовательности CDR.
Описанные молекулы антитела могут включать тяжелую цепь, включающую аминокислотную последовательность, которая, по меньшей мере, на 90%, 95%, 96%, 97%, 98%, 99%, или 100% идентична аминокислотной последовательности SEQ ID NO: 18 или 20 и легкую цепь, включающую аминокислотную последовательность, которая, по меньшей мере, на 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична аминокислотной последовательности SEQ ID NO : 19, 23, 26, 29, 32, 35, 38, 41, 44, 47, 50, 53, 56, 59, 62, 65 или 68, где вариабельность (то есть, по меньшей мере, 90%, 95%, 96%, 97%, 98%, 99% или 100% идентичности) имеет место за пределами последовательности CDR.
Также представлены молекулы нуклеиновой кислоты, кодирующие раскрытые молекулы антител, векторы, содержащие молекулы нуклеиновой кислоты, и клетки, трансформированные для экспрессии раскрытых молекул антител.
Также раскрыты фармацевтические композиции, содержащие любую из молекул антител, раскрытых в данном документе.
Настоящее изобретение также относится к способам лечения объекта, имеющего эозинофильную астму, синдром гиперэозинофилии, полипы носа с эозинофильной вовлечением, эозинофильный гранулематоз с поливаскулитом, атопический дерматит или эозинофильный эзофагит, включающий введение объекту терапевтически эффективного количества любого из описанных в данном документе молекул антител или содержащих их фармацевтических композиций, для лечения эозинофильной астмы, гиперэозинофильного синдрома, полипоза носа с эозинофильным поражением, эозинофильного гранулематоза с полиангиитом, атопического дерматита или эозинофильного эзофагита.
Также предлагается применение эффективного количества любого из описанных в данном документе молекул антител, или содержащих их фармацевтических композиций, при лечении эозинофильной астмы, гиперэозинофильного синдрома, полипоза носа с эозинофильным вовлечением, эозинофильного гранулематоза с полиангиитом, атопического дерматита или эозинофильного эзофагита.
Кроме того, предлагается применение любой из описанных в данном документе молекул антител, или содержащих их фармацевтических композиций, в производстве лекарственного средства, предназначенного для лечения эозинофильной астмы, гиперэозинофильного синдрома, полипоза носа с эозинофильной вовлечением, эозинофильного гранулематоза с полиангиитом атопического дерматита или эозинофильного эзофагита.
Краткое описание чертежей
Краткое описание, а также последующее подробное описание далее понимаются при чтении в сочетании с прилагаемыми чертежами. С целью иллюстрации раскрытых молекул антител, способов и применений на чертежах показаны примерные воплощения молекул антител, способов и применений; однако молекулы, способы и применения антител не ограничиваются раскрытыми конкретными воплощениями. На чертежах:
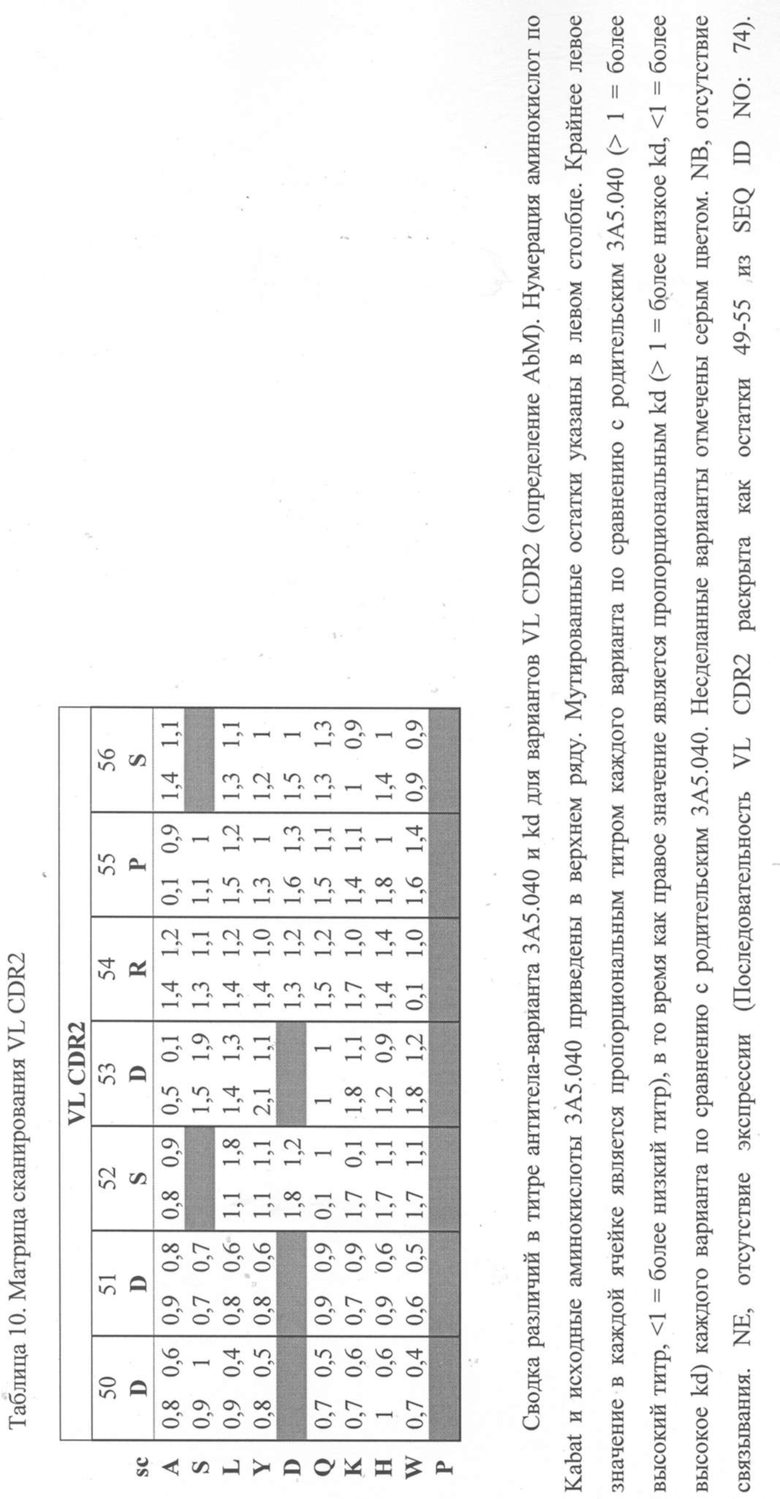
Фиг. 1 иллюстрирует анализ TF-1.6G4, показывающий, что вариант антитела 3A5.001 (в формате IgG4) сохраняет эффективность, эквивалентную исходному антителу 3A5 (в формате IgG1).
Фиг. 2 иллюстрирует анализ TF-1.6G4, показывающий, что вариант антитела 3A5.040 сохраняет эффективность, эквивалентную исходному антителу 3A5.001.
Фиг. 3 представляет собой графическую матрицу, показывающую положение и идентичность различных единичных аминокислотных замен, которые были сгенерированы в 3A5.040 VH CDR, при выравнивании с исходной последовательностью 3A5.040 VH (верхняя последовательность). Рамки содержат остатки, которые были обозначены как остатки CDR согласно номенклатуре AbM. В дополнение к остаткам CDR были сделаны варианты с номерами остатков по Kabat 93 и 94 (рядом с CDR3 HC), как описано в примере «Функциональное тестирование и характеризация антител». Различные последовательности, приведенные на этой фигуре, представлены в SEQ ID NO: 73.
Фиг. 4 представляет собой графическую матрицу, показывающую положение и идентичность различных единичных аминокислотных замен, которые были сгенерированы для CDR 3A5.040 VL, выровненные с исходной последовательностью 3A5.040 VL (верхняя последовательность). Рамки содержат остатки, которые были обозначены как остатки CDR согласно номенклатуре AbM. Различные последовательности, приведенные на этой фигуре, представлены в SEQ ID NO: 74.
Фиг. 5 иллюстрирует примерные консенсусные последовательности CDR легкой цепи, выровненные с последовательностью 3A5.040 VL (верхняя последовательность). Варианты 3A5.040 VL CDR с одной аминокислотной заменой, которые показали потенциальные улучшения в соответствии с критериями включения, описанными в Примерах (отношение kd варианта к kd 3A5.040 ≥ 1,5) и (отношение уровня экспрессии варианта к уровню экспрессии 3A5.040 ≥0,5) были включены в консенсусные последовательности. Определения и нумерация CDR соответствуют номенклатуре AbM и Kabat соответственно. Рамками указаны положения CDR. Различные последовательности, приведенные на этой фигуре, представлены в SEQ ID NO: 75.
Фиг. 6 иллюстрирует мультиконцентрационный кинетический анализ Biacore связывания антитела 3A5.046 с рекомбинантным IL-5 человека при 2,5, 1,25, 0,625, 0,313 и 0,156 мкг/мл. Сенсограммы показывают снижение концентрации IL-5 с порядка 2,5 мкг/мл IL-5 на верхней кривой до 0,156 мкг/мл IL-5 на нижней кривой.
Фиг. 7А и фиг. 7B иллюстрируют пролиферацию клеток TF-1.6G4 в ответ на IL-5 и эффективность ингибирования пролиферации, управляемой IL-5, с помощью 3A5.046. 3A5.046 был более сильным ингибитором IL-5 человека (фиг. 7A) и IL-5 яванского макака (фиг. 7B), чем меполизумаб.
Фиг. 8А и фиг. 8В показан пример ELISA, разработанного с использованием антитела 3А5 и контрольного захватывающего антитела (R & D Systems). ELISA был способен обнаружить рекомбинантный IL-5 (фиг. 8A) и IL-5, полученный из CD3/CD28/IL-33, активированных первичных Т-клеток человека от 3 доноров (фиг. 8B). фиг. 8B верхняя панель: донор 1, фиг. 8B средняя панель: донор 3; фиг. 8В нижняя панель: донор 4.
Фиг. 9 иллюстрирует результаты эксперимента, в котором CD34+ клетки пуповинной крови дифференцировались в фенотипически зрелые эозинофилы с использованием IL-5 и других цитокинов, как описано в примерах. Антитело 3А5.046 было более сильным, чем меполизумаб, при ингибировании индуцированной IL-5 дифференцировки эозинофилов.
Фиг. 10А, фиг. 10B, фиг. 10C, фиг. 10D и фиг. 10E иллюстрируют результаты анализа перекрестной реактивности Biacore антитела 3A5.046, связывающегося с IL-5 человека (фиг. 10A), IL-5 яванского макака (фиг. 10B), IL-5 мыши (фиг. 10C), IL-5 крысы (фиг. 10D) и IL-5 морской свинки (фиг. 10E). Сенсограммы с двойными ссылками показаны для связывания с цитокинами в концентрации 1 мкг/мл или 10 мкг/мл.
Фиг. 11А, фиг. 11B, фиг. 11C и фиг. 11D иллюстрируют результаты специфичности анализа Biacore для антитела 3A5.046. Сенсограммы с двойными ссылками показаны для связывания с цитокинами при 10 мкг/мл (фиг. 11A и фиг. 11B) или 1 мкг/мл (фиг. 11C и фиг. 11D).
Фиг. 12 иллюстрирует результаты провокационной пробы Ascaris suum (A. suum в модели эозинофилии дыхательных путей у яванского макака. На 2-й день наблюдалось существенное различие в количестве эозинофилов в легких (BALF) при сравнении животных, обработанных 3A5.046, и животных, получавших носитель (плацебо) (p <0,01; тест Манна-Уитни).
Фиг. 13А и фиг. 13B иллюстрируют ответ эозинофилов в крови в течение 10 дней после провокационной пробы A. suum у яванского макака, которых предварительно обрабатывали 3A5.046 или контрольным антителом с сопоставимым изотипом («плацебо») за неделю до провокационной пробы A. suum (фиг. 13A). Фигура 13В иллюстрирует дополнительные детали подсчета эозинофилов в крови у животных, получавших антитело 3А5.046, до 45 дней после провокационной пробы (52 дня после введения дозы). Количество эозинофилов оставалось ниже исходного уровня в течение, по меньшей мере, 45 дней после провокационной пробы после однократного приема 3A5.046 за неделю до провокационной пробы.
На фиг. 14 показаны уровни эозинофилов BALF в крысиной модели knock-in (KI) с IL-5 человека в ответ на провокационную пробу Alternaria alternata. Эта модель может быть использована для проверки эффективности антитела против IL-5 для модуляции количества эозинофилов BALF после провокационной пробы Alternaria.
Подробное описание иллюстративных воплощений
Описанные молекулы антител, способы и применения могут быть поняты более легко при ссылке на следующее подробное описание в сочетании с сопровождающими фигурами, которые составляют часть данного описания. Следует понимать, что раскрытые молекулы антител, способы и применения не ограничиваются конкретными молекулами антител, способами и применениями, описанными и/или показанными в данном документе, и что терминология, используемая в данном документе, предназначена для описания конкретных воплощений только в качестве примера и не предназначена для ограничения заявленных молекул антител, способов и применений.
Если специально не указано иное, любое описание относительно возможного механизма или способа действия или причины улучшения предназначено только для иллюстрации, и раскрытые молекулы, способы и применения антител не должны быть ограничены правильностью или неправильностью любого такого предложенного механизма или способа действия или причины для улучшения.
По всему тексту описания относятся к молекулам антител и способам применения указанных молекул антител. В тех случаях, когда раскрытие описывает или заявляет признак или воплощение, связанные с молекулой антитела, такой признак или воплощение в равной степени применимы к способам применения указанной молекулы антитела. Аналогичным образом, когда в описании описывается или заявляется признак или воплощение, связанные со способом применения молекулы антитела, такой признак или воплощение в равной степени применимы к молекуле антитела.
Если диапазон числовых значений приведен или установлен в данном документе, то этот диапазон включает его конечные точки и все отдельные целые числа и дроби в пределах диапазона, а также включает каждый из более узких диапазонов, образованных всеми возможными комбинациями этих конечных точек и внутренних целых чисел и дробей для формирования подгрупп большей группы значений в пределах указанного диапазона в той же степени, как если бы каждый из этих более узких диапазонов был явно указан. Когда диапазон числовых значений указан в данном документе как превышающий заявленное значение, диапазон, тем не менее, конечен и ограничен на своем верхнем конце значением, которое действует в контексте изобретения, как описано в данном документе. Если диапазон числовых значений указан в данном документе как меньший, чем указанное значение, диапазон, тем не менее, ограничен на своем нижнем конце ненулевым значением. Не предполагается, что объем изобретения ограничен конкретными значениями, указанными при определении диапазона. Все диапазоны включаются и комбинируются.
Ссылка на конкретное числовое значение включает, по меньшей мере, это конкретное значение, если контекст явно не предписывает иное.
Когда значения выражены в виде аппроксимаций с использованием предшествующего «около», будет понятно, что конкретное значение образует другой воплощение. Термин «около» при использовании в отношении числовых диапазонов, предельных значений или конкретных значений используется для обозначения того, что приведенные значения могут отличаться на величину до 10% от указанного значения. Таким образом, термин «около» используется для охвата отклонений ± 10% или менее, отклонений ± 5% или менее, отклонений ± 1% или менее, отклонений ± 0,5% или менее или отклонений ± 0,1% или менее указанного значения.
Следует отметить, что некоторые признаки раскрытых молекул антител, способов и применений, которые, для ясности, описаны в настоящее описание в контексте отдельных воплощений, также могут быть представлены в комбинации в одном воплощении. И наоборот, различные признаки раскрытых молекул антител, способов и применений, которые для краткости описаны в контексте одного воплощения, также могут быть предоставлены отдельно или в любой субкомбинации.
При использовании в данном документе терминов в единственном числе они также включают в себя множественное число.
Различные термины, относящиеся к аспектам описания, используются в описании и формуле изобретения. Такие термины должны иметь свое обычное значение в данной области, если не указано иное. Другие конкретно определенные термины должны толковаться в соответствии с определениями, представленными в настоящем документе.
Термин «включающий» предназначен для включения, но без обязательного ограничения, примеров, охватывающих термины «состоящий по существу из» и «состоящий из»; аналогично, термин «состоящий по существу из» предназначен для включения, но без обязательного ограничения, примеров, охватываемых термином «состоящий из».
Термин «молекула антитела» имеет значение в широком смысле и включает полноразмерные молекулы иммуноглобулинов и антигенсвязывающие фрагменты.
Иммуноглобулины могут быть отнесены к пяти основным классам, а именно: IgA, IgD, IgE, IgG, IgM, в зависимости от аминокислотной последовательности константного домена тяжелой цепи. IgA и IgG дополнительно подразделяются на изотипы IgA1, IgA2, IgG1, IgG2, IgG3 и IgG4. Легкие цепи антител любого вида позвоночных могут быть отнесены к одному из двух четко различимых типов, а именно каппа (κ) и лямбда (λ), на основе аминокислотных последовательностей их постоянных доменов.
«Антигенсвязывающий фрагмент» относится к части молекулы иммуноглобулина, которая сохраняет антигенсвязывающие свойства родительского полноразмерного антитела (т.е. «его антигенсвязывающий фрагмент»). Типичные антигенсвязывающие фрагменты могут иметь: области, определяющие комплементарность тяжелой цепи (HCDR) 1, 2 и/или 3; области, определяющие комплементарность легкой цепи (LCDR) 1, 2 и/или 3; вариабельную область тяжелой цепи (VH); вариабельную область легкой цепи (VL); и их комбинации. Антигенсвязывающие фрагменты включают: Fab-фрагмент, одновалентный фрагмент, состоящий из доменов VL, VH, константного домена легкой цепи (CL) и константного домена тяжелой цепи 1 (CH1); фрагмент F(ab)2, двухвалентный фрагмент, содержащий два фрагмента Fab, связанных дисульфидным мостиком в шарнирной области; фрагмент Fd, состоящий из доменов VH и CH1; фрагмент Fv, состоящий из доменов VL и VH одного плеча антитела; и фрагмент доменного антитела (dAb) (Ward et al., Nature 341: 544- 546, 1989), который состоит из домена VH или домена VL. Домены VH и VL могут быть сконструированы и связаны вместе через синтетический линкер для образования различных типов конструкций одноцепочечных антител, где домены VH/VL спариваются внутримолекулярно или межмолекулярно в тех случаях, когда домены VH и VL экспрессируются отдельным одноцепочечным антителом конструкции для образования моновалентного сайта связывания антигена, такого как одноцепочечный Fv (scFv) или диатело, описанное, например, в публикации международного патента № WO1998/44001, WO1988/01649, WO1994/13804 и WO1992/01047. Эти фрагменты антител получают с использованием методов, хорошо известных специалистам в данной области техники, и фрагменты проверяют на пригодность таким же образом, как и полноразмерные антитела.
Выражение «иммуноспецифически связывается» относится к способности раскрытых молекул антител преимущественно связываться с его мишенью (IL-5, в случае молекул анти-IL-5 антител) без преимущественного связывания других молекул в образце, содержащем смешанную популяцию молекул. Молекулы антител, которые иммуноспецифически связывают IL-5, по существу не содержат других антител, обладающих различной антигенной специфичностью (например, антитело против IL-5 по существу не содержит антител, которые специфически связывают антигены, отличные от IL-5). Однако молекулы антител, которые иммуноспецифически связывают IL-5, могут иметь перекрестную реактивность с другими антигенами, такими как ортологи IL-5 человека, в том числе IL-5 Macaca flavicularis (яванского макака). Молекулы антител, раскрытые в данном документе, способны иммуноспецифически связывать как природно-продуцированный IL-5 человека, так и IL-5, который рекомбинантно продуцируется в клетках млекопитающих или прокариот.
Вариабельные области антитела состоят из четырех «каркасных» областей, прерываемых тремя «антигенсвязывающими сайтами». Сайты связывания антигена задают с использованием различных определений: (i) Области определения комплементарности (CDR), три в VH (HCDR1, HCDR2, HCDR3) и три в VL (LCDR1, LCDR2, LCDR3), на основании вариабельности последовательности (Wu and Kabat J Exp Med 132: 211-50, 1970; Kabat et al. Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, Md., 1991); и (ii) «Гипервариабельные области» («HVR» или «HV»), три в VH (H1, H2, H3) и три в VL (L1, L2, L3), которым относят те области вариабельных доменов антител, которые являются гипервариабельными по структуре, как определено Chothia и Lesk (Chothia and Lesk Mol Biol 196: 901-17, 1987). Определение CDR AbM также широко используется; это компромисс между схемами нумерации Kabat и Chothia и назван так, потому что он использовался программным обеспечением Oxford Molecular для моделирования антител AbM (Rees, AR, Searle, SMJ, Henry, AHand Pedersen, JT (1996) In Sternberg M.J.E. (ed.), Protein Structure Prediction. Oxford University Press, Oxford, 141–172). Другие определения включают «IMGT-CDR» (Lefranc et al., Dev Comparat Immunol 27: 55-77, 2003) и «использование остатков, определяющих специфичность» (SDRU) (Almagro Mol Recognit 17: 132-43, 2004). Международная база данных ImMunoGeneTics (IMGT) (http://www_imgt_org) обеспечивает стандартизированную нумерацию и определение антигенсвязывающих сайтов. Соответствие между CDR, HV и границами IMGT описано в Lefranc et al., Dev Comparat Immunol. 27: 55-77, 2003.
«Каркас» или «каркасные последовательности» представляют собой остальные последовательности вариабельной области, отличные от тех, которые определены как антигенсвязывающие участки. Поскольку сайты связывания антигена могут быть определены различными терминами, как описано выше, точная аминокислотная последовательность каркаса зависит от того, как был определен сайт связывания антигена. «Человеческое антитело», «полностью человеческое антитело» и подобные термины относятся к антителу, имеющему вариабельные области тяжелой и легкой цепи, в которых как каркас, так и сайты связывания антигена получены из последовательностей человеческого происхождения. Если антитело содержит константную область, константная область также происходит от последовательностей человеческого происхождения. Человеческое антитело содержит вариабельные области тяжелой и/или легкой цепи, которые «получены» из последовательностей человеческого происхождения, если вариабельные области антитела получены из системы, в которой используются гены человеческого иммуноглобулина зародышевой линии или перегруппированные иммуноглобулины. Такие системы включают библиотеки генов иммуноглобулинов человека, презентируемые на фаге, и трансгенных животных, отличных от человека, таких как мышь, несущие локусы иммуноглобулина человека, как описано в данном документе. «Человеческое антитело» может содержать аминокислотные различия по сравнению с последовательностями человеческой зародышевой линии или перестроенных иммуноглобулинов, например, вследствие естественных соматических мутаций или преднамеренного введения замен в вариабельный домен (каркас и сайты связывания антигена) или константный домен. Как правило, «человеческое антитело» идентично, по меньшей мере, на около 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% по аминокислотной последовательности с аминокислотной последовательностью, кодируемой геном иммуноглобулина зародышевой линией человека или перестроенным геном иммуноглобулина. В некоторых случаях «человеческое антитело» может содержать консенсусные каркасные последовательности, полученные из анализа каркасных последовательностей человека, например, как описано в Knappik et al., J Mol Biol 296: 57-86, 2000, или синтетический HCDR3, включенный в библиотеки генов человеческих иммуноглобулинов, презентируемых на фаге, как описано, например, в Shi et al., J Mol Biol 397: 385-96, 2010 и межд. пат. публ. № WO2009/085462. Антитела, в которых сайты связывания антигена происходят из вида, не являющегося человеком, не включены в определение «человеческого антитела».
Человеческие антитела, полученные из последовательностей иммуноглобулина человека, могут быть получены с использованием систем, таких как фаговый дисплей, включающий синтетические CDR, и/или синтетические каркасы, или могут быть подвергнуты мутагенезу in vitro для улучшения свойств антител в вариабельных областях или константных областях или в обоих, что приводит к антителам, которые в природе не существуют в репертуаре человеческих антител зародышевой линии in vivo.
«Рекомбинантное антитело» включает все антитела, которые получены, экспрессированы, созданы или выделены рекомбинантными способами, такими как: антитела, выделенные из животного (например, мыши), которое является трансгенным или трансхромосомные гены иммуноглобулинов человека или гибридомы приготовленные из них (описанные ниже); антитела, выделенные из клетки-хозяина, трансформированной для экспрессии антитела; антитела, выделенные из библиотеки рекомбинантных комбинаторных антител; и антитела, полученные, экспрессированные, созданные или выделенные любыми другими способами, которые включают сплайсинг последовательностей генов иммуноглобулина человека с другими последовательностями ДНК, или антитела, которые генерируются in vitro с использованием обмена Fab-плечей.
«Моноклональное антитело» относится к популяции молекул антител одного молекулярного состава. Композиция моноклонального антитела проявляет одну специфичность связывания и аффинность к конкретному эпитопу или, в случае биспецифического моноклонального антитела, специфичность двойного связывания к двум отдельным эпитопам. Таким образом, моноклональное антитело относится к популяции антител с одним аминокислотным составом в каждой тяжелой и каждой легкой цепях, за исключением возможных хорошо известных изменений, таких как удаление С-концевого лизина из тяжелой цепи антитела. Моноклональные антитела могут иметь гетерогенное гликозилирование в популяции антител. Моноклональное антитело может быть моноспецифичным или полиспецифичным, или моновалентным, бивалентным или поливалентным. Биспецифическое антитело включено в термин моноклональное антитело.
«Эпитоп» относится к части антигена, с которой антитело специфически связывается. Эпитопы обычно состоят из химически активных (таких как полярные, неполярные или гидрофобные) поверхностных группировок групп, таких как боковые цепи аминокислот или полисахаридов, и могут иметь специфические трехмерные структурные характеристики, а также специфические характеристики заряда. Эпитоп может состоять из смежных и/или смежных аминокислот, которые образуют конформационную пространственную единицу. Для непрерывного эпитопа аминокислоты из разных частей линейной последовательности антигена находятся в непосредственной близости в 3-мерном пространстве посредством сворачивания молекулы белка.
«Вариант» относится к полипептиду или полинуклеотиду, который отличается от эталонного полипептида или эталонного полинуклеотида одной или несколькими модификациями, например, заменой, вставкой или делецией. Используемый в данном документе термин «мутация» предназначен для обозначения одной или нескольких преднамеренных замен, которые сделаны в полипептиде или полинуклеотиде.
В данном описании «на 90% идентичен» включает, по меньшей мере, на 90% идентичен, 91% идентичен, 92% идентичны, 93% идентичен, 94% идентичен, на 95% идентичен, 96% идентичен, 97% идентичен, 98% идентичен, 99% идентичен или 100% идентичен эталонному элементу (например, биологической последовательности). В текущем описании термин «% идентичен» используется для описания ряда последовательностей. Следует понимать, что термин «% идентичен» означает, что при сравнении двух последовательностей в указанной области две последовательности имеют указанное количество идентичных остатков в одном и том же положении. Уровень идентичности может быть определен с использованием CLUSTAL W с параметрами по умолчанию.
Термины «лечить», «лечение» и тому подобные термины относятся как к терапевтическому лечению, так и к профилактическим или превентивным мерам, и включают уменьшение тяжести и/или частоты симптомов, устранение симптомов и/или основной причины симптомов, уменьшение частоты или вероятность появления симптомов и/или их первопричины, улучшение или устранение повреждений, вызванных, прямо или косвенно, эозинофильной астмой, гиперэозинофильным синдромом, полипозом носа с эозинофильным поражением, эозинофильным гранулематозом с полиангиитом, атопическим дерматитом или эозинофильным эзофагитом. Лечение также включает продление выживаемости по сравнению с ожидаемой выживаемостью объекта, не получающего лечение. Объекты, подлежащие лечению, включают тех, у кого есть состояние или расстройство, а также тех, кто склонен иметь это состояние или расстройство, или тех, у кого необходимо предотвратить состояние или расстройство.
При использовании в данном описании термин «введение объекту» и подобные термины указывают на процедуру, с помощью которой раскрытые молекулы антитела или композиции, содержащие их, инъецируют в тело пациента таким образом, что целевые клетки, ткани или сегменты организма объекта связываются с раскрытыми молекулами антител.
Выражение «терапевтически эффективное количество» относится к количеству молекул антител, как описано в данном документе, эффективным для достижения конкретного биологического или терапевтического результата, таких как, без ограничения указанным, биологические или терапевтические результаты, раскрытые, описанные, или приведенные в качестве примеров в данном описании. Терапевтически эффективное количество может варьировать в зависимости от таких факторов, как болезненное состояние, возраст, пол и масса индивидуума и способность композиции вызывать желаемый ответ у объекта. Типичные показатели количества терапевтического эффекта включают, например, улучшение самочувствия пациента, уменьшение симптомов заболевания, остановку или замедление прогрессирования симптомов заболевания и/или отсутствие симптомов заболевания.
Следующие сокращения используются в данном документе: Alternaria alternata (Alternaria), Ascaris suum (А. suum); область, определяющая комплементарность (CDR); тяжелая цепь (HC); легкая цепь (LC); вариабельная область тяжелой цепи (VH); вариабельная область легкой цепи (VL); поверхностный плазмонный резонанс (SPR).
Молекулы антител
Раскрытое в данном документе, являются молекулами антител человека, которые иммуноспецифично связываются с IL-5 человека. Молекулы человеческого антитела могут иммуноспецифически связываться с IL-5 человека с равновесной константой аффинности (KD), по меньшей мере, около 40 пМ, что определено поверхностным плазмонным резонансом (SPR). Используемый в данном документе термин «по меньшей мере около 40 пМ» означает, что раскрытые антитела иммуноспецифически связывают IL-5 человека с KD, меньшим или равным около 40 пМ. Например, раскрытые антитела могут иммуноспецифично связывать IL-5 человека с KD, равным около 40, около 30, около 20, около 10 или менее чем 10 пМ.
Описанные молекулы человеческого антитела могут включать CDR1 тяжелой цепи, включающую аминокислотную последовательность SEQ ID NO: 4, CDR2 тяжелой цепи, включающую аминокислотную последовательность SEQ ID NO: 6, CDR3 тяжелой цепи, включающую аминокислотную последовательность SEQ ID NO: 8, консенсусную CDR1 легкой цепи, включающую аминокислотную последовательность SEQ ID NO: 1, консенсусную CDR2 легкой цепи, включающую аминокислотную последовательность SEQ ID NO: 2, и консенсусную CDR3 легкой цепи, включающую аминокислотную последовательность SEQ ID NO: 3.
Консенсусная CDR1, легкой цепи включает аминокислотную последовательность GX1X2X3X4X5X6KX7X8Y (SEQ ID NO: 1), в которой:
X1 представляет собой G или K;
Х2 представляет собой N или D;
X3 представляет собой N или H;
X4 представляет собой I или A;
X5 представляет собой G или D;
X6 представляет собой S или K;
X7 представляет собой N или H; и
X8 представляет собой V или A.
В некоторых воплощениях аминокислотная последовательность CDR1 легкой цепи может включать GGNNIGSKNVY (SEQ ID NO: 5). В некоторых воплощениях аминокислотная последовательность CDR1 легкой цепи может включать GKNNIGSKNVY (SEQ ID NO: 21). В некоторых воплощениях аминокислотная последовательность CDR1 легкой цепи может включать GGDNIGSKNVY (SEQ ID NO: 24). В некоторых воплощениях аминокислотная последовательность CDR1 легкой цепи может включать GGNHIGSKNVY (SEQ ID NO: 27). В некоторых воплощениях аминокислотная последовательность CDR1 легкой цепи может включать GGNNAGSKNVY (SEQ ID NO: 30). В некоторых воплощениях аминокислотная последовательность CDR1 легкой цепи может включать GGNNIDSKNVY (SEQ ID NO: 66). В некоторых воплощениях аминокислотная последовательность CDR1 легкой цепи может включать GGNNIGKKNVY (SEQ ID NO: 33). В некоторых воплощениях аминокислотная последовательность CDR1 легкой цепи может включать GGNNIGSKHVY (SEQ ID NO: 36). В некоторых воплощениях аминокислотная последовательность CDR1 легкой цепи может включать GGNNIGSKNAY (SEQ ID NO: 39).
Аминокислотная последовательность CDR2 легкой цепи включает DDX8X9RPS (SEQ ID NO: 2), в которой:
Х8 представляет собой S или L; и
X9 представляет собой D или S.
В некоторых воплощениях, аминокислотная последовательность CDR2 легкой цепи может включать DDSDRPS (SEQ ID NO: 7). В некоторых воплощениях аминокислотная последовательность CDR2 легкой цепи может включать DDLDRPS (SEQ ID NO: 42). В некоторых воплощениях аминокислотная последовательность CDR2 легкой цепи может включать DDSSRPS (SEQ ID NO: 45).
Аминокислотная последовательность CDR3 легкой цепи содержит QVWX10SSSDX11VX12 (SEQ ID NO: 3), в которой:
Х10 представляет собой D или L;
X11 представляет собой H, S, Y или D; и
X12 представляет собой V, A или W.
В некоторых воплощениях аминокислотная последовательность CDR3 легкой цепи может включать QVWDSSSDHVV (SEQ ID NO: 15). В некоторых воплощениях аминокислотная последовательность CDR3 легкой цепи может включать QVWLSSSDHVV (SEQ ID NO: 48). В некоторых воплощениях аминокислотная последовательность CDR3 легкой цепи может включать QVWDSSSDSVV (SEQ ID NO: 51). В некоторых воплощениях аминокислотная последовательность CDR3 легкой цепи может включать QVWDSSSDYVV (SEQ ID NO: 54). В некоторых воплощениях аминокислотная последовательность CDR3 легкой цепи может включать QVWDSSSDDVV (SEQ ID NO: 57). В некоторых воплощениях аминокислотная последовательность CDR3 легкой цепи может включать QVWDSSSDHVA (SEQ ID NO: 60). В некоторых воплощениях аминокислотная последовательность CDR3 легкой цепи может включать QVWDSSSDHVW (SEQ ID NO: 63).
Описанные молекулы человеческого антитела могут включать CDR1 тяжелой цепи, включающую аминокислотную последовательность SEQ ID NO: 4, CDR2 тяжелой цепи, включающую аминокислотную последовательность SEQ ID NO: 6, CDR3 тяжелой цепи, включающую аминокислотную последовательность SEQ ID NO: 8, CDR1 легкой цепи, включающую аминокислотную последовательность SEQ ID NO: 5, 21, 24, 27, 30, 33, 36, 39 или 66, CDR2 легкой цепи, включающую аминокислотную последовательность SEQ ID NO: 7, 42 или 45 и CDR3 легкой цепи, включающую аминокислотную последовательность SEQ ID NO: 15, 48, 51, 54, 57, 60 или 63. Типичные молекулы антител содержат CDR1 тяжелой цепи, включающую аминокислотную последовательность SEQ ID NO: 4, CDR2 тяжелой цепи, включающую аминокислотную последовательность SEQ ID NO: 6, CDR3 тяжелой цепи, включающую аминокислотную последовательность SEQ ID NO: 8 и
а. CDR1 легкой цепи, включающую аминокислотную последовательность SEQ ID NO: 5, CDR2 легкой цепи, включающую аминокислотную последовательность SEQ ID NO: 7, и CDR3 легкой цепи, включающую аминокислотную последовательность SEQ ID NO: 15;
b. CDR1 легкой цепи, включающую аминокислотную последовательность SEQ ID NO: 21, CDR2 легкой цепи, включающую аминокислотную последовательность SEQ ID NO: 7, и CDR3 легкой цепи, включающую аминокислотную последовательность SEQ ID NO: 15;
с. CDR1 легкой цепи, включающую аминокислотную последовательность SEQ ID NO: 24, CDR2 легкой цепи, включающую аминокислотную последовательность SEQ ID NO: 7, и CDR3 легкой цепи, включающую аминокислотную последовательность SEQ ID NO: 15;
d. CDR1 легкой цепи, включающую аминокислотную последовательность SEQ ID NO: 27, CDR2 легкой цепи, включающую аминокислотную последовательность SEQ ID NO: 7, и CDR3 легкой цепи, включающую аминокислотную последовательность SEQ ID NO: 15;
е. CDR1 легкой цепи, включающую аминокислотную последовательность SEQ ID NO: 30, CDR2 легкой цепи, включающую аминокислотную последовательность SEQ ID NO: 7, и CDR3 легкой цепи, включающую аминокислотную последовательность SEQ ID NO: 15;
f. CDR1 легкой цепи, включающую аминокислотную последовательность SEQ ID NO: 33, CDR2 легкой цепи, включающую аминокислотную последовательность SEQ ID NO: 7, и CDR3 легкой цепи, включающую аминокислотную последовательность SEQ ID NO: 15;
g. CDR1 легкой цепи, включающую аминокислотную последовательность SEQ ID NO: 36, CDR2 легкой цепи, включающую аминокислотную последовательность SEQ ID NO: 7, и CDR3 легкой цепи, включающую аминокислотную последовательность SEQ ID NO: 15;
h. CDR1 легкой цепи, включающую аминокислотную последовательность SEQ ID NO: 39, CDR2 легкой цепи, включающую аминокислотную последовательность SEQ ID NO: 7, и CDR3 легкой цепи, включающую аминокислотную последовательность SEQ ID NO: 15;
i. CDR1 легкой цепи, включающую аминокислотную последовательность SEQ ID NO: 66, CDR2 легкой цепи, включающую аминокислотную последовательность SEQ ID NO: 7, и CDR3 легкой цепи, включающую аминокислотную последовательность SEQ ID NO: 15;
j. CDR1 легкой цепи, включающую аминокислотную последовательность SEQ ID NO: 5, CDR2 легкой цепи, включающую аминокислотную последовательность SEQ ID NO: 42, и CDR3 легкой цепи, включающую аминокислотную последовательность SEQ ID NO: 15;
k. CDR1 легкой цепи, включающую аминокислотную последовательность SEQ ID NO: 5, CDR2 легкой цепи, включающую аминокислотную последовательность SEQ ID NO: 45, и CDR3 легкой цепи, включающую аминокислотную последовательность SEQ ID NO: 15;
l. CDR1 легкой цепи, включающую аминокислотную последовательность SEQ ID NO: 5, CDR2 легкой цепи, включающую аминокислотную последовательность SEQ ID NO: 7, и CDR3 легкой цепи, включающую аминокислотную последовательность SEQ ID NO: 48;
m. CDR1 легкой цепи, включающую аминокислотную последовательность SEQ ID NO: 5, CDR2 легкой цепи, включающую аминокислотную последовательность SEQ ID NO: 7, и CDR3 легкой цепи, включающую аминокислотную последовательность SEQ ID NO: 51;
n. CDR1 легкой цепи, включающую аминокислотную последовательность SEQ ID NO: 5, CDR2 легкой цепи, включающую аминокислотную последовательность SEQ ID NO: 7, и CDR3 легкой цепи, включающую аминокислотную последовательность SEQ ID NO: 54;
о. CDR1 легкой цепи, включающую аминокислотную последовательность SEQ ID NO: 5, CDR2 легкой цепи, включающую аминокислотную последовательность SEQ ID NO: 7, и CDR3 легкой цепи, включающую аминокислотную последовательность SEQ ID NO: 57;
p. CDR1 легкой цепи, включающую аминокислотную последовательность SEQ ID NO: 5, CDR2 легкой цепи, включающую аминокислотную последовательность SEQ ID NO: 7, и CDR3 легкой цепи, включающую аминокислотную последовательность SEQ ID NO: 60; или
q. CDR1 легкой цепи, включающую аминокислотную последовательность SEQ ID NO: 5, CDR2 легкой цепи, включающую аминокислотную последовательность SEQ ID NO: 7, и CDR3 легкой цепи, включающую аминокислотную последовательность SEQ ID NO: 63;
где положение аминокислотных остатков CDR определяется в соответствии с AbM.
Описанные молекулы антитела могут включать вариабельную область тяжелой цепи, включающую аминокислотную последовательность, которая, по меньшей мере, на 90%, 95%, 96%, 97%, 98%, 99%, или 100% идентична аминокислотной последовательности, SEQ ID NO: 16 и вариабельную области легкой цепи, включающую аминокислотную последовательность, которая, по меньшей мере, на 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична аминокислотной последовательности SEQ ID NO: 17, 22, 25, 28, 31, 34, 37, 40, 43, 46, 49, 52, 55, 58, 61, 64 или 67, где вариабельность (то есть, по меньшей мере, 90%, 95 %, 96%, 97%, 98%, 99% или 100% идентичности) имеет место за пределами последовательности CDR. Типичные молекулы антител представлены в Таблице 1 и Таблице 15.
Таблица 1. Сводная информация о цепи/доменном составе антител
(SEQ ID)
(SEQ ID)
(SEQ ID)
(SEQ ID)
(SEQ ID NO: 10)
(SEQ ID NO: 11)
(SEQ ID NO: 12)
(SEQ ID NO: 13)
(SEQ ID NO: 10)
(SEQ ID NO: 11)
(SEQ ID NO: 14)
(SEQ ID NO: 13)
(SEQ ID NO: 16)
(SEQ ID NO: 17)
(SEQ ID NO: 18)
(SEQ ID NO: 19)
(SEQ ID NO: 16)
(SEQ ID NO: 17)
(SEQ ID NO: 20)
(SEQ ID NO: 19)
(SEQ ID NO: 16)
(SEQ ID NO: 22)
(SEQ ID NO: 18)
G25K
(SEQ ID NO: 23)
(SEQ ID NO: 16)
(SEQ ID NO: 25)
(SEQ ID NO: 18)
N26D
(SEQ ID NO: 26)
(SEQ ID NO: 16)
(SEQ ID NO: 28)
(SEQ ID NO: 18)
N27H
(SEQ ID NO: 29)
(SEQ ID NO: 16)
I28A
(SEQ ID NO: 31)
(SEQ ID NO: 18)
I28A
(SEQ ID NO: 32)
(SEQ ID NO: 16)
G29D
(SEQ ID NO: 67)
(SEQ ID NO: 18)
G29D
(SEQ ID NO: 68)
(SEQ ID NO: 16)
(SEQ ID NO: 34)
(SEQ ID NO: 18)
S30K
(SEQ ID NO: 35)
(SEQ ID NO: 16)
(SEQ ID NO: 37)
(SEQ ID NO: 18)
N32H
(SEQ ID NO: 38)
(SEQ ID NO: 16)
V33A
(SEQ ID NO: 40)
(SEQ ID NO: 18)
V33A
(SEQ ID NO: 41)
(SEQ ID NO: 16)
S52L
(SEQ ID NO: 43)
(SEQ ID NO: 18)
S52L
(SEQ ID NO: 44)
(SEQ ID NO: 16)
D53S
(SEQ ID NO: 46)
(SEQ ID NO: 18)
D53S
(SEQ ID NO: 47)
(SEQ ID NO: 16)
D92L
(SEQ ID NO: 49)
(SEQ ID NO: 18)
D92L
(SEQ ID NO: 50)
(SEQ ID NO: 16)
H95bS
(SEQ ID NO: 52)
(SEQ ID NO: 18)
H95bS
(SEQ ID NO: 53)
(SEQ ID NO: 16)
H95bY
(SEQ ID NO: 55)
(SEQ ID NO: 18)
H95bY
(SEQ ID NO: 56)
(SEQ ID NO: 16)
H95bD
(SEQ ID NO: 58)
(SEQ ID NO: 18)
H95bD
(SEQ ID NO: 59)
(SEQ ID NO: 16)
(SEQ ID NO: 61)
(SEQ ID NO: 18)
V97A
(SEQ ID NO: 62)
(SEQ ID NO: 16)
V97W
(SEQ ID NO: 64)
(SEQ ID NO: 18)
V97W
(SEQ ID NO: 65)
*Строчная буква «b» в каждой из этих последовательностей относится к нумерации Kabat для положения CDR. Нумерация по Kabat допускает CDR переменного размера, используя буквенно-цифровую нумерацию для обозначения вставок аминокислот в определенных положениях. В этих последовательностях CDR присутствовали дополнительные аминокислоты, которые были пронумерованы как положения 95a и 95b (соответствующие положениям Kabat 95A и 95B соответственно). Так, например, для антитела 3A5.276 H95bS указывает на мутацию гистидина («H») в серин («S») в положении 95B в соответствии с числом Kabat относительно цепи VL 3A5.040. Поэтому в данном документе используется строчная запись, чтобы отличить число Kabat, отдельно от мутации в указанном положении Kabat.
В некоторых воплощениях, раскрытые молекулы антитела могут включать вариабельную область тяжелой цепи, включающую аминокислотную последовательность, которая, по меньшей мере, на 90%, 95%, 96%, 97%, 98%, 99%, или 100% идентична аминокислотной последовательности SEQ ID NO: 16 и
а. вариабельную область легкой цепи, включающую аминокислотную последовательность, которая, по меньшей мере, на 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична аминокислотной последовательности SEQ ID NO: 17;
b. вариабельную область легкой цепи, включающую аминокислотную последовательность, которая, по меньшей мере, на 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична аминокислотной последовательности SEQ ID NO: 22;
с. вариабельную область легкой цепи, включающую аминокислотную последовательность, которая, по меньшей мере, на 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична аминокислотной последовательности SEQ ID NO: 25;
d. вариабельную область легкой цепи, включающую аминокислотную последовательность, которая, по меньшей мере, на 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична аминокислотной последовательности SEQ ID NO: 28;
е. вариабельную область легкой цепи, включающую аминокислотную последовательность, которая, по меньшей мере, на 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична аминокислотной последовательности SEQ ID NO: 31;
f. вариабельную область легкой цепи, включающую аминокислотную последовательность, которая, по меньшей мере, на 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична аминокислотной последовательности SEQ ID NO: 34;
g. вариабельную область легкой цепи, включающую аминокислотную последовательность, которая, по меньшей мере, на 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична аминокислотной последовательности SEQ ID NO: 37;
h. вариабельную область легкой цепи, включающую аминокислотную последовательность, которая, по меньшей мере, на 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична аминокислотной последовательности SEQ ID NO: 40;
i. вариабельную область легкой цепи, включающую аминокислотную последовательность, которая, по меньшей мере, на 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична аминокислотной последовательности SEQ ID NO: 43;
j. вариабельную область легкой цепи, включающую аминокислотную последовательность, которая, по меньшей мере, на 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична аминокислотной последовательности SEQ ID NO: 46;
k. вариабельную область легкой цепи, включающую аминокислотную последовательность, которая, по меньшей мере, на 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична аминокислотной последовательности SEQ ID NO: 49;
l. вариабельную область легкой цепи, включающую аминокислотную последовательность, которая, по меньшей мере, на 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична аминокислотной последовательности SEQ ID NO: 52;
m. вариабельную область легкой цепи, включающую аминокислотную последовательность, которая, по меньшей мере, на 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична аминокислотной последовательности SEQ ID NO: 55;
n. вариабельную область легкой цепи, включающую аминокислотную последовательность, которая, по меньшей мере, на 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична аминокислотной последовательности SEQ ID NO: 58;
о. вариабельную область легкой цепи, включающую аминокислотную последовательность, которая, по меньшей мере, на 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична аминокислотной последовательности SEQ ID NO: 61;
p. вариабельную область легкой цепи, включающую аминокислотную последовательность, которая, по меньшей мере, на 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична аминокислотной последовательности SEQ ID NO: 64; или
q. вариабельную область легкой цепи, включающую аминокислотную последовательность, которая, по меньшей мере, на 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична аминокислотной последовательности SEQ ID NO: 67,
где вариабельность (то есть идентичность, по меньшей мере, на 90%, 95%, 96%, 97%, 98%, 99% или 100%) имеет место вне последовательности CDR.
Описанные молекулы антитела могут включать одну или несколько мутаций, делеций или вставок, в каркасных и/или константных областях. В некоторых воплощениях молекула антитела IgG4 может содержать мутацию S228P. S228 расположена в шарнирной области молекулы антитела IgG4. Мутация серина («S») на пролин («P») служит для стабилизации шарнира IgG4 и предотвращения обмена Fab-плечами in vitro и in vivo. В некоторых воплощениях молекулы антитела могут включать одну или несколько модификаций, которые увеличивают время полувыведения молекул антител in vivo. Например, в некоторых воплощениях антитело может содержать мутацию M252Y, мутацию S254T и мутацию T256E (в совокупности называемые мутацией «YTE»). M252, S254 и T256 расположены в домене CH2 тяжелой цепи. Мутация этих остатков на тирозин («Y»), треонин («T») и глутамат («E»), соответственно, защищает молекулы антител от лизосомальной деградации, тем самым увеличивая период полувыведения в сыворотке молекул антител. На основании примера других антител предполагается, что введение мутации YTE в антитело против IL-5 может обеспечить достаточное продление периода полувыведения в сыворотке, чтобы обеспечить режимы введения с интервалами между дозами 3 месяца или более. В некоторых воплощениях молекулы антитела могут включать делецию С-концевого остатка лизина тяжелой цепи. Удаление С-концевого остатка лизина тяжелой цепи снижает гетерогенность молекул антител при продуцировании клетками млекопитающих. В некоторых воплощениях молекулы антител могут включать комбинацию мутаций, делеций или вставок. Например, в некоторых аспектах раскрытые молекулы антитела могут включать мутацию S228P и делецию С-концевого остатка лизина тяжелой цепи. Раскрытые антитела, содержащие последовательность тяжелой цепи SEQ ID NO: 18, например, содержат мутацию S228P и делецию С-концевого остатка лизина тяжелой цепи. В некоторых аспектах раскрытая молекула антитела может содержать мутацию S228P, мутацию M252Y, мутацию S254T, мутацию T256E и делецию С-концевого остатка лизина тяжелой цепи. Например, антитело 3А5.046, которое содержит тяжелую цепь SEQ ID NO: 20, содержит мутацию S228P, мутацию M252Y, мутацию S254T, мутацию T256E и делецию С-концевого остатка лизина тяжелой цепи.
Молекула антитела может содержать константную область тяжелой цепи IgG1 или IgG4 и константную область легкой цепи лямбда. В некоторых воплощениях молекула антитела включает константную область тяжелой цепи IgG1 и константную область легкой цепи лямбда (например, антитело 3A5). В некоторых воплощениях молекула антитела включает константную область тяжелой цепи IgG4 и константную область легкой цепи лямбда.
Описанные молекулы антитела могут включать тяжелую цепь, включающую аминокислотную последовательность, которая, по меньшей мере, на 90%, 95%, 96%, 97%, 98%, 99%, или 100% идентична аминокислотной последовательности SEQ ID NO: 18 или 20 и легкую цепь, включающую аминокислотную последовательность, которая, по меньшей мере, на 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична аминокислотной последовательности SEQ ID NO: 19, 23, 26, 29, 32, 35, 38, 41, 44, 47, 50, 53, 56, 59, 62, 65 или 68, где вариабельность (т.е. идентичность, по меньшей мере, 90%) имеет место за пределами последовательности CDR. Типичные молекулы антител представлены в Таблице 1 и Таблице 15. В некоторых воплощениях молекулы антитела могут включать тяжелую цепь, включающую аминокислотную последовательность, которая, по меньшей мере, на 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична аминокислотной последовательности SEQ. ID №: 18 и
а. легкую цепь, включающую аминокислотную последовательность, которая, по меньшей мере, на 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична аминокислотной последовательности SEQ ID NO: 19;
b. легкую цепь, включающую аминокислотную последовательность, которая, по меньшей мере, на 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична аминокислотной последовательности SEQ ID NO: 23;
с. легкую цепь, включающую аминокислотную последовательность, которая, по меньшей мере, на 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична аминокислотной последовательности SEQ ID NO: 26;
d. легкую цепь, включающую аминокислотную последовательность, которая, по меньшей мере, на 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична аминокислотной последовательности SEQ ID NO: 29;
е. легкую цепь, включающую аминокислотную последовательность, которая, по меньшей мере, на 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична аминокислотной последовательности SEQ ID NO: 32;
f. легкую цепь, включающую аминокислотную последовательность, которая, по меньшей мере, на 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична аминокислотной последовательности SEQ ID NO: 35;
g. легкую цепь, включающую аминокислотную последовательность, которая, по меньшей мере, на 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична аминокислотной последовательности SEQ ID NO: 38;
h. легкую цепь, включающую аминокислотную последовательность, которая, по меньшей мере, на 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична аминокислотной последовательности SEQ ID NO: 41;
i. легкую цепь, включающую аминокислотную последовательность, которая, по меньшей мере, на 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична аминокислотной последовательности SEQ ID NO: 44;
j. легкую цепь, включающую аминокислотную последовательность, которая, по меньшей мере, на 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична аминокислотной последовательности SEQ ID NO: 47;
k. легкую цепь, включающую аминокислотную последовательность, которая, по меньшей мере, на 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична аминокислотной последовательности SEQ ID NO: 50;
l. легкую цепь, включающую аминокислотную последовательность, которая, по меньшей мере, на 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична аминокислотной последовательности SEQ ID NO: 53;
m. легкую цепь, включающую аминокислотную последовательность, которая, по меньшей мере, на 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична аминокислотной последовательности SEQ ID NO: 56;
n. легкую цепь, включающую аминокислотную последовательность, которая, по меньшей мере, на 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична аминокислотной последовательности SEQ ID NO: 59;
о. легкую цепь, включающую аминокислотную последовательность, которая, по меньшей мере, на 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична аминокислотной последовательности SEQ ID NO: 62;
p. легкую цепь, включающую аминокислотную последовательность, которая, по меньшей мере, на 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична аминокислотной последовательности SEQ ID NO: 65; или
q. легкую цепь, включающую аминокислотную последовательность, которая, по меньшей мере, на 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична аминокислотной последовательности SEQ ID NO: 68,
где вариабельность (то есть идентичность, по меньшей мере, на 90%, 95%, 96%, 97%, 98%, 99% или 100%) имеет место вне последовательности CDR.
Описанные молекулы антитела могут включать тяжелую цепь, включающую аминокислотную последовательность, которая, по меньшей мере, на 90%, 95%, 96%, 97%, 98%, 99%, или 100% идентична аминокислотной последовательности SEQ ID NO: 20 и легкую цепь, включающую аминокислотную последовательность, которая, по меньшей мере, на 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична аминокислотной последовательности SEQ ID NO: 19 где вариабельность (то есть идентичность, по меньшей мере, на 90%, 95%, 96%, 97%, 98%, 99% или 100%) имеет место вне последовательности CDR.
В некоторых воплощениях молекулы антитела являются полными молекулами антител длиной (с или без удаления С-концевого остатка лизина тяжелой цепи). В других воплощениях молекулы антитела представляют собой антигенсвязывающие фрагменты. Подходящие фрагменты, связывающие антитела, включают, без ограничения указанным, фрагмент Fab, фрагмент Fab2 или одноцепочечное антитело.
Молекулы антител могут иметь одно или несколько из следующих свойств:
а. связываться с IL-5 человека с равновесной константой аффинности (KD), равной, по меньшей мере, около 40 пМ, определенной по поверхностным плазмонным резонансом;
b. уменьшать связывание IL-5 с рецептором IL-5;
с. иметь период полувыведения в сыворотке, по меньшей мере, около 20 дней; или
d. связывать IL-5 человека и яванского макака, но не IL-5 мыши, крысы или морской свинки.
Также предлагаются фармацевтические композиции, содержащие любую из раскрытых молекул антител.
Также предлагаются молекулы нуклеиновых кислот, кодирующие любые из раскрытых молекул антител и векторы, содержащие раскрытые молекулы нуклеиновых кислот.
Также предлагаются клетки, трансформированные для экспрессии любой из раскрытых молекул антител.
Способы и применения
Описанные молекулы антител или фармацевтические композиции, содержащие их, могут быть использованы для лечения эозинофильной астмы, гиперэозинофильного синдрома, полипоза носа с эозинофильным поражением, эозинофильного гранулематоза с полиангиитом, атопического дерматита и эозинофильного эзофагита. Любые характеристики молекулы антитела, раскрытые в данном документе, в равной степени применимы к антителам, используемым в раскрытых способах и применениях.
Раскрытое в данном документе представляет собой способы лечения объекта, имеющего эозинофильную астму, синдром гиперэозинофилии, полипоз носа с эозинофильной вовлечением, эозинофильный гранулематоз с поливаскулитом, атопический дерматит или эозинофильный эзофагит, включающие введение объекту терапевтически эффективного количества любой из молекул антител, описанные или фармацевтические композиции, содержащие его, для лечения эозинофильной астмы, гиперэозинофильного синдрома, полипоза носа с эозинофильным поражением, эозинофильного гранулематоза с полиангиитом, атопического дерматита или эозинофильного эзофагита.
Также предлагается применение эффективного количества любой из описанных молекул антител, или содержащих их фармацевтических композиций, при лечении эозинофильной астмы, гиперэозинофильного синдрома, полипоза носа с эозинофильным вовлечением, эозинофильного гранулематоза с поливаскулитом, атопического дерматита или эозинофильного эзофагита.
Кроме того, предлагается применение любой из описанных молекул антител, или фармацевтических композиций, содержащих их, в производстве лекарственного средства, предназначенного для лечения эозинофильной астмы, гиперэозинофильного синдрома, полипоза носа с эозинофильным вовлечением, эозинофильного гранулематоза с с полиангиитом, атопического дерматита или эозинофильного эзофагита.
ПРИМЕРЫ
Следующие примеры приведены для дальнейшего описания некоторых из воплощений, раскрытых в данном документе. Примеры предназначены для иллюстрации, а не для ограничения раскрытых воплощений.
Получение антител против IL-5 человека
Антитела против IL-5 человека были получены из трансгенных крыс (OMT) с клонированными в их геномы человеческими V-генами, которые продуцируют антитела с человеческими V-доменами и крысиными Fc-доменами. Вкратце, трансгенных крыс генетически иммунизировали ДНК, кодирующей IL-5, четыре раза в течение 21 дня (в дни 0, 7, 14, 21) и стимулировали рекомбинантным IL-5 человека на 28 день протокола иммунизации. Титры сывороточных антител определяли в дни 0 и 38 протокола иммунизации с помощью анализа ELISA с использованием рекомбинантного IL-5 человека. Вкратце, сыворотки от каждого животного разводили в PBS 1% BSA и тестировали с использованием планшетов ELISA, покрытых 1 мкг/мл IL-5 человека или BSA в качестве контроля. Конъюгат козьего антитела против крысиных IgG с R-фикоэритрином (SouthernBiotech, № 3030-09) использовали в качестве вторичного антитела в концентрации 10 мкг/мл. Конкретные животные были выбраны для слияния гибридом на основе этих сывороточных титров.
Для получения гибридом, которые продуцируют моноклональные антитела к IL-5 человека, спленоциты и/или клетки лимфатических узлов от иммунизированных животных выделяли и объединяли с клетками P3X63Ag8.653 несекретирующей мышиной миеломы (АТСС, CRL-1580). Клетки высевали при около 1 × 105 клеток/мл в планшеты для микротитрования с плоским дном с последующей двухнедельной инкубацией в селективной среде, которая включала 10% фетальной клональной сыворотки и 1 х HAT (Sigma). Гибридомы размножали путем последовательных пассажей через четыре смены среды в 96-луночных планшетах (96-луночные стадии 1-4), затем во флаконах T25 и, наконец, T75.
Надосадочные жидкости гибридомных клонов анализировали во время процесса размножения гибридом, первоначально в ELISA на цельных клетках с использованием клеток, трансфицированных GPI-заякоренным IL-5 человека, а затем ELISA с использованием теста ELISA на рекомбинантный IL-5 человека (последний как описано выше). Гибридомы, которые пережили процесс масштабирования до стадии Т75 и которые давали сигналы связывания выше заданного порога в обоих из этих анализов, были заморожены в виде клеточных гранул для клонирования и секвенирования Ig v-доменов. После этих стадий скрининга приблизительно 20 гибридом, продуцирующих химерные IgG, отобрали для клонирования.
Человеческие v-домены из кандидатных химерных IgG выделяли путем получения кДНК из клеточных осадков гибридом, ПЦР-амплификации v-областей, субклонирования и секвенирования ДНК. В результате секвенирования этих гибридом было получено около 35 комбинаций тяжелых и легких цепей. Все антитела клонировали в экспрессирующий вектор для млекопитающих и транзиторно трансфицировали в клетки HEK-293. Антитела очищали с использованием стандартных протоколов очистки с протеином А.
Функциональное тестирование и характеризация антител
Отдельные антитела в формате человеческого IgG1 сначала анализировали на специфичность в ELISA с IL-5 человека. Вкратце, антитела разводили в PBS 0,1% BSA и тестировали с использованием планшетов для ELISA, покрытых 1 мкг/мл IL-5 человека или нерелевантного контрольного белка. Антитело против IgG, конъюгированное с пероксидазой хрена, использовали в качестве вторичного антитела.
Антитела, которые показали иммуноспецифическое связывание с IL-5 человека были ранжированы по активности в анализе IL-5-зависимой пролиферации Т-клеток человека с помощью человеческих клеток TF-1.6G4 (производные от линии эритролейкозных клеток человека TF-1). Клеточную линию TF-1.6G4 субклонировали и отбирали для усиления поверхностной экспрессии IL-5R и последовательного пролиферативного ответа на IL-5 человека. Клеточную линию TF-1.6G4 поддерживали в культуре в соответствии со стандартными условиями, используемыми для линии эритролейкозных клеток человека TF-1 (ATCC: CRL-2003). Вкратце, разведения каждого антитела инкубировали в присутствии 45 пМ IL-5 человека и 5 × 104 клеток TF-1.6G4 на лунку в течение 48 часов и определяли пролиферацию клеток с использованием CellTiter-Glo® Luminescent Cell Viability. Assay (Promega, Висконсин). Все кривые пролиферации и ингибирования были построены с использованием трех- или четырехпараметрической модели доза-ответ в программном обеспечении GraphPad Prism 6 (версия 6.04). Таблица 2 суммирует эти результаты.
Таблица 2. Сводка данных скрининга и характеризации первоначальной тестовой панели в формате IgG1.
В Таблице 2 результаты тестов ранжированы в порядке эффективности анализа на TF1.6G4. Первоначальная тестовая панель была выбрана на основе активности, аффинности, ингибирования IL-5R и последовательностей (иммуногенность и проявляющая способность).
Для определения аффинности тестируемых антител к рекомбинантному IL-5 человека и их активности при ингибировании связывания IL-5Rα с IL-5 человека были использованы анализы Biacore. Таблица 2 суммирует эти результаты. Аффинность связывания тестируемых антител с IL-5 человека (KD; фиг. 6) определяли с помощью системы Biacore T200 (GE Healthcare), покрывая сенсорный чип Biacore «Series S Sensor Chip Protein A» (GE Healthcare) выбранным очищенным антителом IgG с уровнем захвата 75 RU, затем вводили рекомбинантный IL-5 человека со скоростью 60 мкл/мин в 7-стадийном диапазоне двукратного серийного разведения, начиная с 1 мкг/мл. Все эксперименты проводили с использованием буфера HBS-EP+ (GE Healthcare). Полученные сенсограммы имели двойной контроль (значения тестируемой проточной ячейки вычитали из значений проточной ячейки контроля (поверхность с протеином A без антитела), а также пустого буфера). Константы связывания определяли путем подгонки модели связывания Ленгмюра 1:1 к сенсограммам с двойным контролем.
Для того, чтобы определить, ингибирует ли каждое тестируемое антитело связывание IL-5 с IL-5Rα, использовали либо систему Biacore T200, либо систему Biacore 3000 (GE Healthcare). Чип датчика Biacore CM5 сначала дериватизировали с помощью набора для захвата Fab (GE Healthcare) в соответствии с инструкциями производителя на двух соседних (тестируемая и контрольная) проточных ячейках. Эту поверхность использовали для захвата каждого очищенного тестируемого антитела IgG на одной тестируемой проточной ячейке. Затем через тестовую и контрольную проточные ячейки вводили рекомбинантный IL-5 человека в концентрации 5 мкг/мл или пустой буфер для насыщения поверхности тестируемой проточной ячейки и контроля неспецифической ассоциации IL-5, соответственно. Вторую инъекцию очищенного тестируемого антитела IgG в концентрации 10 мкг/мл или пустого буфера выполняли на тестируемой проточной ячейке для блокирования свободных сайтов связывания IL-5 и контроля диссоциации тестируемого антитела IgG от антитела, захватывающего Fab, соответственно.
Последующие инъекции IL-5Rα-Fc (R & D Systems) в концентрации 5 или 20 мкг/мл или пустого буфера через обе проточные ячейки использовали для определения блокирует ли тестируемое антитело IgG, взаимодействие между IL-5 и IL-5Rα или для контроля диссоциации антитела IgG от антитела захвата Fab во время этой стадии. Антитела, которые ингибировали связывание IL-5 с IL-5R, демонстрировали заметно сниженный сигнал при инъекции IL-5R (Таблица 2). Способ тройного вычитания контроля использовали для анализа данных, как описано выше. Все данные были экспортированы из оценочного программного обеспечения Biacore и вычтены в программном обеспечении Excel (Microsoft). Все эксперименты проводили с использованием буфера HBS-EP+ (GE Healthcare).
На основании этих результатов была выбрана меньшая панель тестируемых антител (3A5, 2В4 и 5H11 в Таблице 2). Антитела были переформатированы в человеческий IgG4 и протестированы в тех же анализах. IgG4-версия антитела 3A5 (первоначально IgG1) была обозначена как 3A5.001. Было продемонстрировано, что это полностью человеческое антитело обладает эффективностью, эквивалентной исходному тесту 3A5 в формате IgG1 (фиг.1).
Вариант антитела 3A5.001 (обозначенный 3A5.040) получали с конкретными аминокислотными заменами (VH: S[68]T, N[82A]S; VL: S[2]Y, I[3]V, Y[92]D, где остатки в квадратных скобках представляют положения Kabat), введенные в области V-домена для удаления спрогнозированных Т-клеточных эпитопов. Было продемонстрировано, что в анализе с TF-1.6G4 антитело 3A5.040 обладает активностью, эквивалентной его родительскому антителу 3A5.001 (фиг.2).
Сканирование CDR антитела 3А5.040
Получение вариантов антитела 3A5.040 - Варианты антитела 3A5.040 с одной мутацией были сделаны путем замены одной из группы из девяти репрезентативных аминокислот -А, S, L, Y, D, Q, K, H, W- в каждом аминокислотном положении в CDR1 легкой цепи (CDR-L1), CDR2 легкой цепи (CDR-L2), CDR1 тяжелой цепи (CDR-H1) и CDR2 тяжелой цепи (CDR-H2) (определенных по номенклатуре AbM). Варианты антител также были созданы путем замены одной из группы из десяти репрезентативных аминокислот-A, S, L, Y, D, Q, K, H, W, P- в каждом аминокислотном положении CDR в CDR3 легкой цепи (CDR-L3), CDR3 тяжелой цепи (CDR-H3) и в положениях Kabat 93 и 94 в вариабельной области тяжелой цепи. Полный список всех созданных вариантов одного мутантного антитела показан на фиг. 3 (вариабельная тяжелая цепь) и фиг. 4 (вариабельная легкая цепь), соответственно.
Конструирование векторов экспрессии антител - Варианты вариабельной области были получены с помощью обратной трансляции аминокислотных последовательностей в ДНК-последовательности, которые впоследствии были синтезированы de novo путем сборки синтетических олигонуклеотидов. Варианты вариабельной тяжелой цепи (VH) субклонировали в экспрессирующий вектор для млекопитающих, содержащий константную область человека, для получения полноразмерных тяжелых цепей антител человека (домены CH1, шарнирные, CH2 и CH3 тяжелой цепи человеческого IgG4). Сходным образом варианты вариабельной легкой цепи (VL) субклонировали в экспрессирующий вектор для млекопитающих, содержащий константную область легкой цепи лямбда человека, для получения полноразмерных лямбда-цепей антител.
Экспрессия вариантов антител - антитела были получены путем совместной трансфекции отдельных экспрессирующих векторов, кодирующих тяжелые цепи и легкие цепи антитела в клетках EXPI293® (Life Technologies, Карлсбад, Калифорния). Каждая цепь с одной мутацией была спарена с родительской цепью для экспрессии белка в системе EXPI293®. Для каждых 20 мл трансфекции требовалось 3,6 × 107 клеток в 20 мл среды для экспрессии EXPI293®. За день до трансфекции клетки высевали с плотностью 0,9 × 106 жизнеспособных клеток/мл и инкубировали в течение ночи при 37 °С в увлажненной атмосфере с 8% СО2 в воздухе на орбитальном шейкере, вращающемся со скоростью 200 об/мин. В день трансфекции количество клеток и их жизнеспособность определяли с использованием автоматического счетчика клеток. Использовали только культуры с> 98% жизнеспособных клеток. Для каждых 20 мл трансфекции липид-ДНК-комплексы готовили путем разбавления 10 мкг ДНК тяжелой цепи и 10 мкг ДНК легкой цепи в среде со сниженным количеством сыворотки OPTI-MEM® I (Life Technologies, Карлсбад, Калифорния) (кат. № 31985-062) до общего объема 1,0 мл. 54 мкл реагента EXPIFECTAMINE® 293 (Life Technologies, Карлсбад, Калифорния) разводили в среде OPTI-MEM® I до общего объема 1,0 мл. Оба флакона осторожно перемешивали и инкубировали в течение 5 минут при комнатной температуре. После инкубации разбавленную ДНК смешивали с разведенным реагентом EXPIFECTAMINE® 293 и смесью ДНК- реагент EXPIFECTAMINE® 293 и инкубировали еще 20 минут при комнатной температуре для образования комплексов ДНК- реагент EXPIFECTAMINE® 293. После инкубации 2 мл комплекса ДНК- реагент EXPIFECTAMINE® 293 добавляли в каждую биореакторную пробирку емкостью 50 мл (TPP Techno Plastic Products AG). 2 мл среды OPTI-MEM® I (Life Technologies, Карлсбад, Калифорния) добавляли в пробирку с отрицательным контролем вместо комплекса ДНК- реагент EXPIFECTAMINE® 293. Клетки инкубировали в инкубаторе при 37 °С с увлажненной атмосферой с 8% СО2 в воздухе на орбитальном шейкере, вращающемся со скоростью 200 об/мин. Приблизительно через 16-18 часов после трансфекции в каждый биореактор добавляли 100 мкл усилителя трансфекции «EXPIFECTAMINE® 293 Transfection Enhancer 1» и 1,0 мл усилителя трансфекции «EXPIFECTAMINE® 293 Transfection Enhancer 2». Надосадочные жидкости собирали через около 48 часов после трансфекции.
Очистка вариантов антител - Каждый вариант антитела экспрессировали в клетках EXPI293® либо в 20, либо в 100 мл клеточной культуры. Культуры центрифугировали в 50 мл пробирках типа «Falcon» при 3000 g в течение 20 минут и надосадочные жидкости фильтровали с использованием фильтра 0,22 мкм. Надосадочные жидкости очищали с использованием робота Gilson ASPEC GX274. Вкратце, картриджи SPE (Agilent, 12131014), заполненные 1,2 мл смолой с протеином А MABSELECT SURE® (GE Healthcare), предварительно уравновешивали 3 объемами колонки 1X PBS. Надосадочную жидкость пропускали через колонки с последующей промывкой 4 мл 1X PBS. Каждую колонку промывали 9 мл 1 М лимонной кислоты, рН 2,9. Антитела элюировали 2 мл 0,1 М лимонной кислоты, рН 2,9. Антитела обессоливали в Sørensens PBS (5 мМ KH2PO4, 3 мМ Na2HPO4 2H2O, 145,4 мМ NaCl (pH ~ 5,8)) с использованием колонок PD-10 (GE Healthcare).
Определение титра вариантного антитела 3A5.040 в надосадочной жидкости с помощью Biacore - надосадочную жидкость, содержащую антитела из экспрессии в клетках EXPI293® анализировали с использованием чипа Protein A series S на Biacore T200 для того, чтобы определить их титр и ранжировать их по отношению к родительскому антителу 3А5.040. Каждый образец надосадочной жидкости разбавляли рабочим буфером (1 × HBS-EP+, 350 мМ NaCl) и переносили инъекцией со скоростью 60 мкл/мин в проточную ячейку (FC) 2. Результирующий уровень захвата в единицах ответа (RU) измеряли на FC 2-1 путем вычитания точки отчета через 5 секунд после начала цикла из точки отчета через 5 секунд после введения. Поверхность регенерировали путем впрыскивания 50 мМ NaOH в течение 12 с при скорости потока 60 мкл/мин на FC 1 и 2 каждые 4 цикла. После каждой регенерации поверхность и сенсограмму стабилизировали в течение 120 с путем введения рабочего буфера. Из-за большого количества антител, которые были подвергнуты скринингу таким образом, было проведено множество прогонов партий.
Уровни захвата (в единицах ответа Biacore «RU»), полученные для каждого образца надосадочной жидкости были скорректированы путем умножения значения, полученного для каждой инъекции 30 сек на коэффициент разбавления надосадочной жидкости, что позволяет сравнить уровни захвата между надосадочными жидкостями разбавленными в разной степени среди разных экспериментальных прогонов. Относительный уровень экспрессии антител (титр) каждого мутанта сравнивали с надосадочной жидкостью, специфичной для партии 3A5.040 (Таблица 3) с использованием следующей формулы:
(скорректированный RU эталонного 3A5.040 для 30-секундной инъекции/скорректированный RU вариантного антитела для 30-секундной инъекции) x 100 = пропорциональный титр родительского антитела (% титра 3A5.040) Формула 1
Вариантные антитела с более высоким титром, чем родительское антитело 3A5.040 имели значение «% титра 3A5.040» > 100%, а антитела с более низким титром, имеют значение <100%. Это позволило идентифицировать вариантные антитела, которые могли бы иметь улучшенную экспрессию по сравнению с родительским антителом 3A5.040. Титры некоторых вариантов не определяли анализом Biacore образцов надосадочных жидкостей, но экспрессировали и очищали, как указано выше, и их очищенные выходы определяли спектрофотометрическим анализом (A280), а затем сравнивали с родительским антителом 3A5.040 (Таблица 5).
Определение IL-5-связывающей кинетики вариантного антитела 3A5.040 с помощью Biacore - Надосадочную жидкость, содержащую антитела из экспрессии в клетках EXPI293® или очищенные антитела анализировали с использованием чипа Protein A series S в системе Biacore T200 (GE Healthcare), определяли их аффинность связывания с рекомбинантным IL-5 человека и ранжировали их по отношению к родительскому антителу 3A5.040.
Каждое антитело разводили в рабочем буфере (1 х HBS-EP+, 350 мМ NaCl), и захватывали при 60 мкл/мин до около 50 RU на FC 2. Затем поверхность и сенсограмму стабилизировали в течение 120 с путем введения рабочего буфера. Рекомбинантный IL-5 человека в концентрации 5 мкг/мл или рабочий буфер вводили в FC 1 и 2 со скоростью потока 60 мкл/мин в течение 70 с. IL-5 давали возможность диссоциировать в рабочем буфере в течение 300 с. Поверхность регенерировали путем впрыскивания 50 мМ NaOH в течение 12 с при скорости потока 60 мкл/мин в FC 1 и 2. Буфер вводили для дальнейшего дрейфа при очистке в течение 60 с при скорости потока 60 мкл/мин на FC 1 и 2. Поверхность стабилизировали в течение 300 с с помощью проточного буфера над FC 1 и 2. Надосадочную жидкость, содержащую родительское антитело 3A5.040 и которое было трансфецировано каждой партией, прогоняли примерно каждые 25 циклов в течение каждого прогона. Очищенный образец 3А5.040 и изотипического контрольного IgG4 лямбда прогоняли с каждой партией для измерения вариативности результатов между анализами. Из-за большого количества антител, которые были подвергнуты скринингу таким образом, было проведено множество прогонов партий.
Данные имели двойной контроль (проточная ячейка 2 вычиталась из проточной ячейки 1 и пустого буфера) и сенсограммы подгонялись к модели связывания Ленгмюра 1:1 с помощью программного обеспечения Biacore Evaluation. Значение kd (скорость диссоциации) рассчитывали для каждого образца надосадочной жидкости 3A5.040 на протяжении всего цикла, и они были усреднены для получения эталонного kd, за исключением прогона 2.1, в котором был только один образец надосадочной жидкости 3A5.040 (Таблица 3 и Таблицы 6-11). Рассчитанное значение kd для каждого антитела надосадочной жидкости сравнивали со средним эталонным kd 3A5.040 по следующей формуле:
(эталонное kd 3A5.040/kd вариантного антитела) x 100 = пропорциональное kd родительского антитела (% 3A5.040 kd)
Формула 2
Вариантные антитела с более низким kd (более медленная скорость диссоциации), чем родительское антитело 3A5.040, имели значение «% 3A5.040 kd»> 100%, а антитела с более высоким kd (более быстрой скоростью диссоциации) имели значение <100 %. Это позволило идентифицировать вариантные антитела, которые могли бы улучшить кинетику связывания с IL-5 и, следовательно, улучшить функцию по сравнению с родительским антителом, 3A5.040. Для вариантов, в которых был получен только очищенный белок (Таблица 6), кинетический анализ Biacore проводили в трех повторах, как указано выше, с использованием этих очищенных антител, а средние значения из каждого анализа в трех повторах использовали для выполнения расчета пропорционального kd, как указано выше (Таблица 4 и таблицы 8-11).
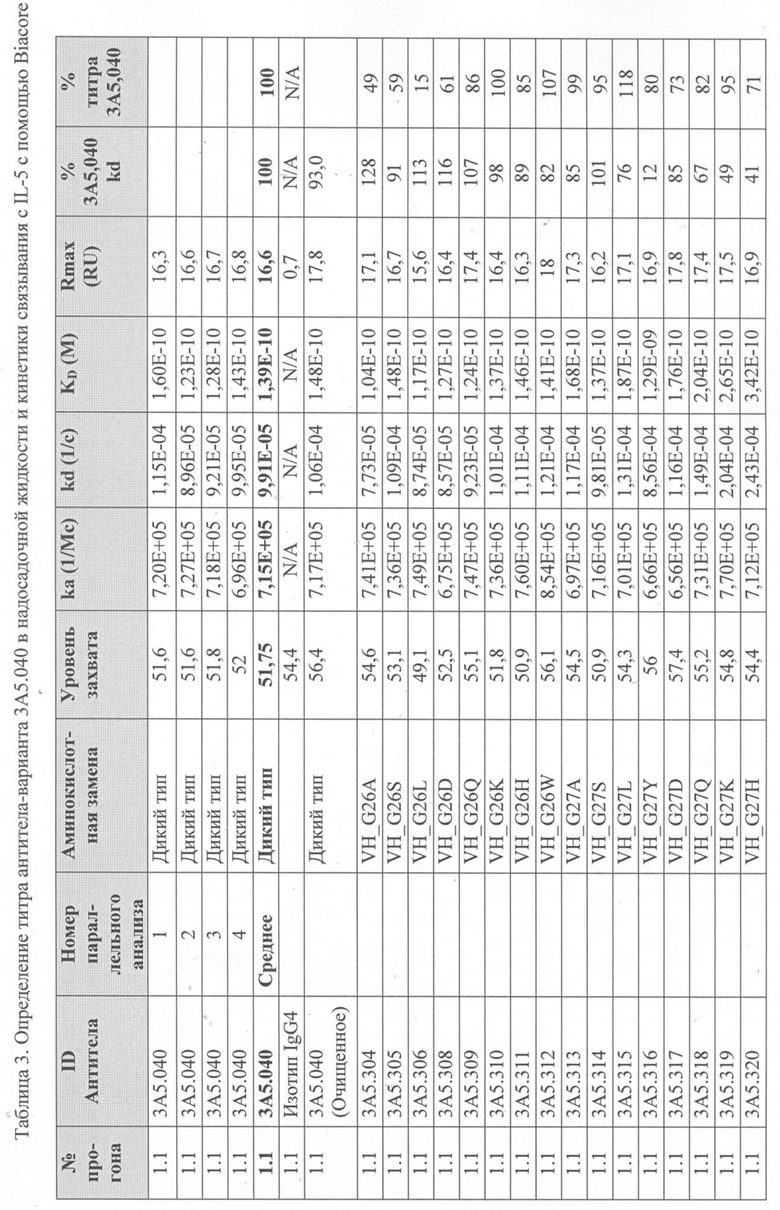
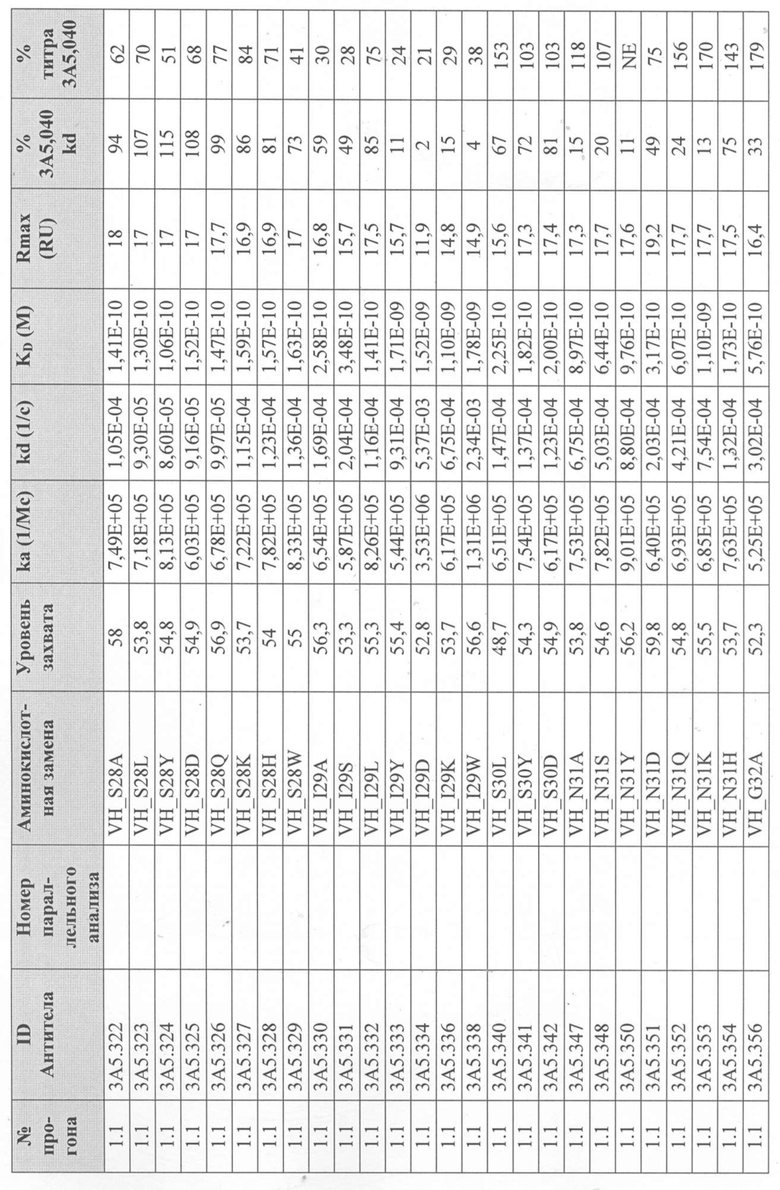
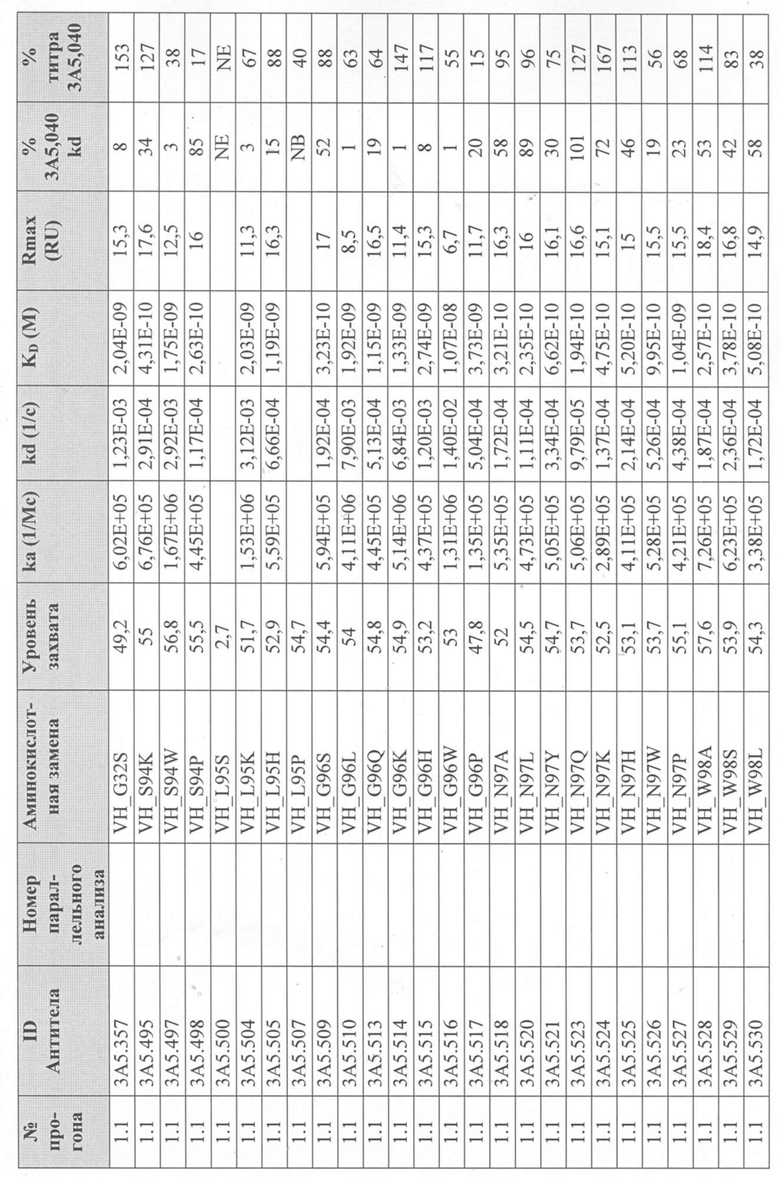
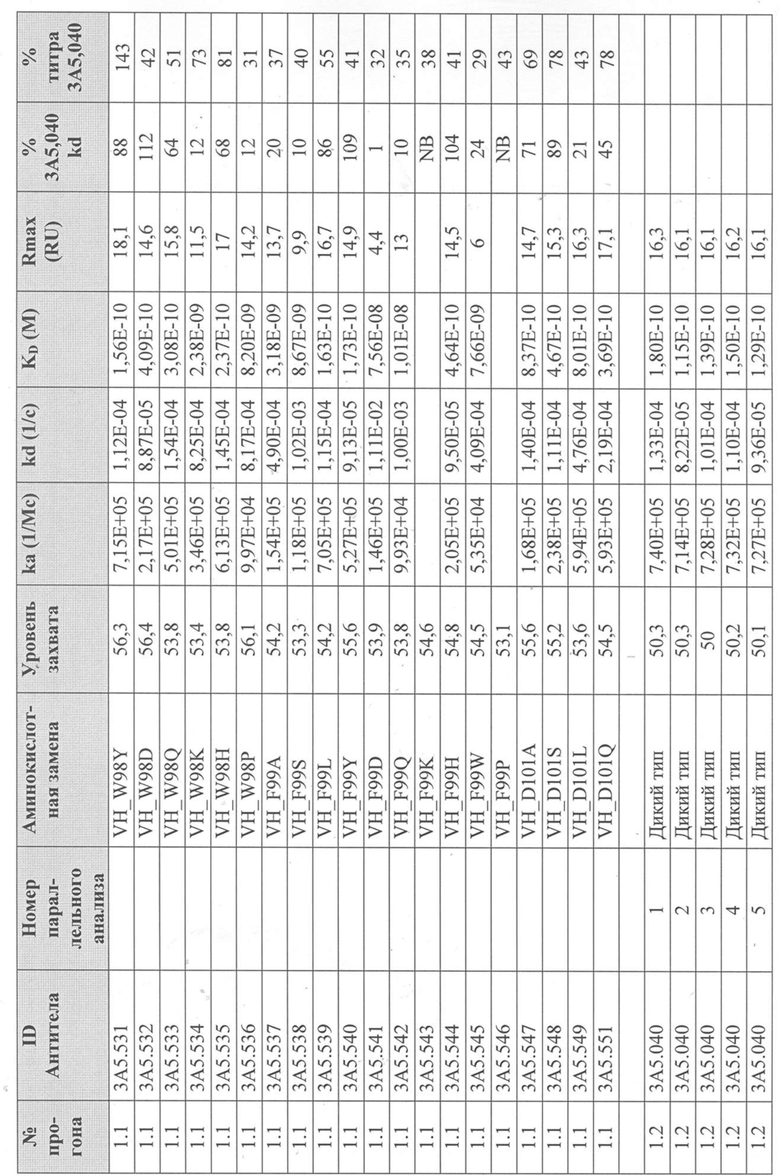
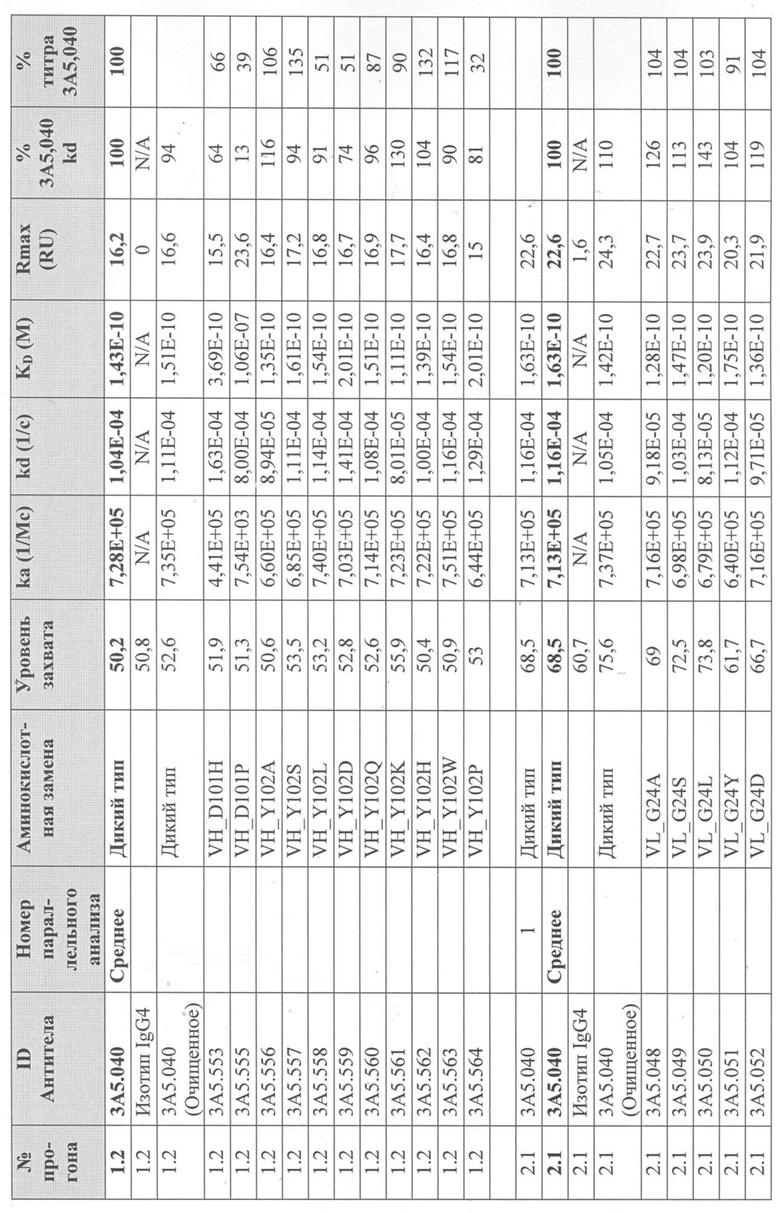
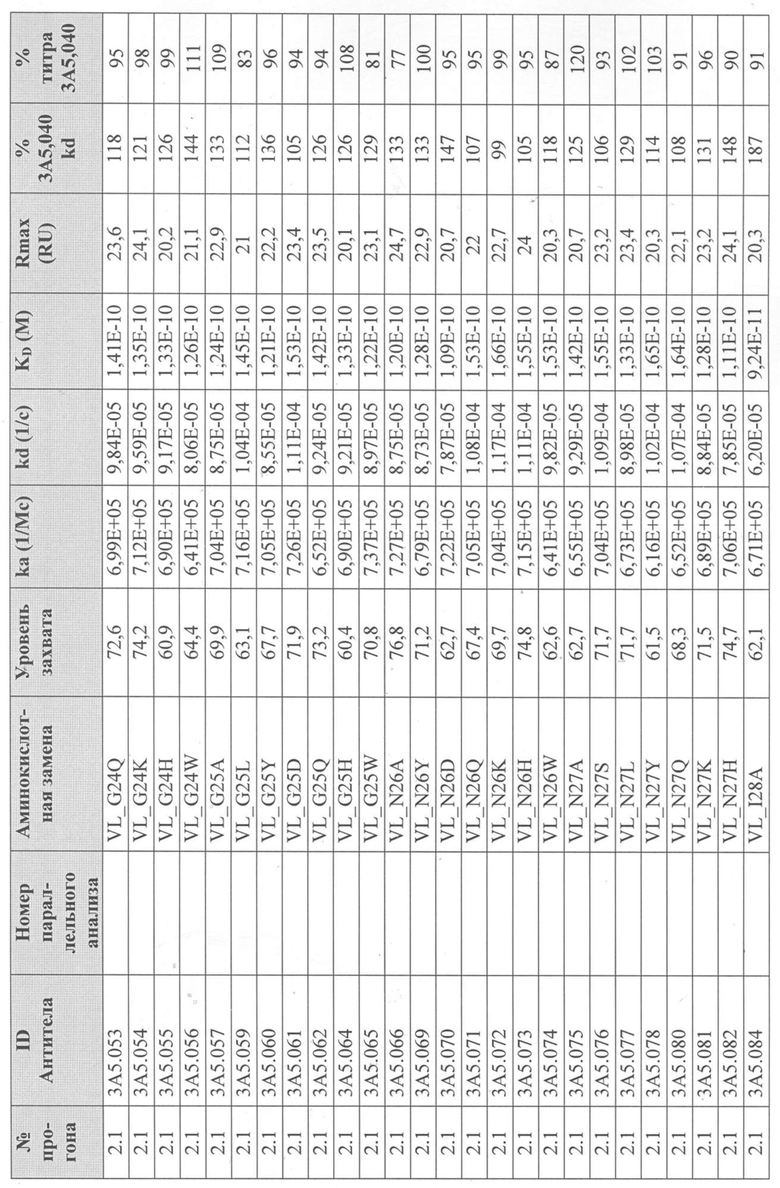
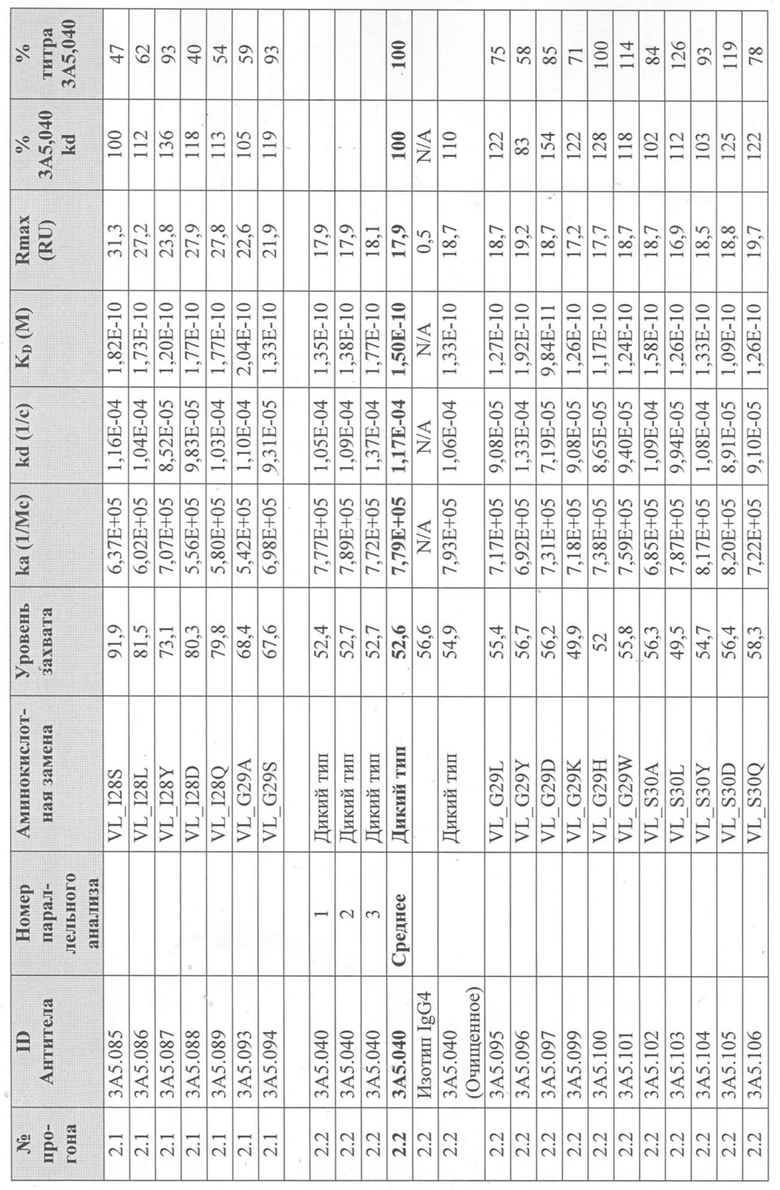
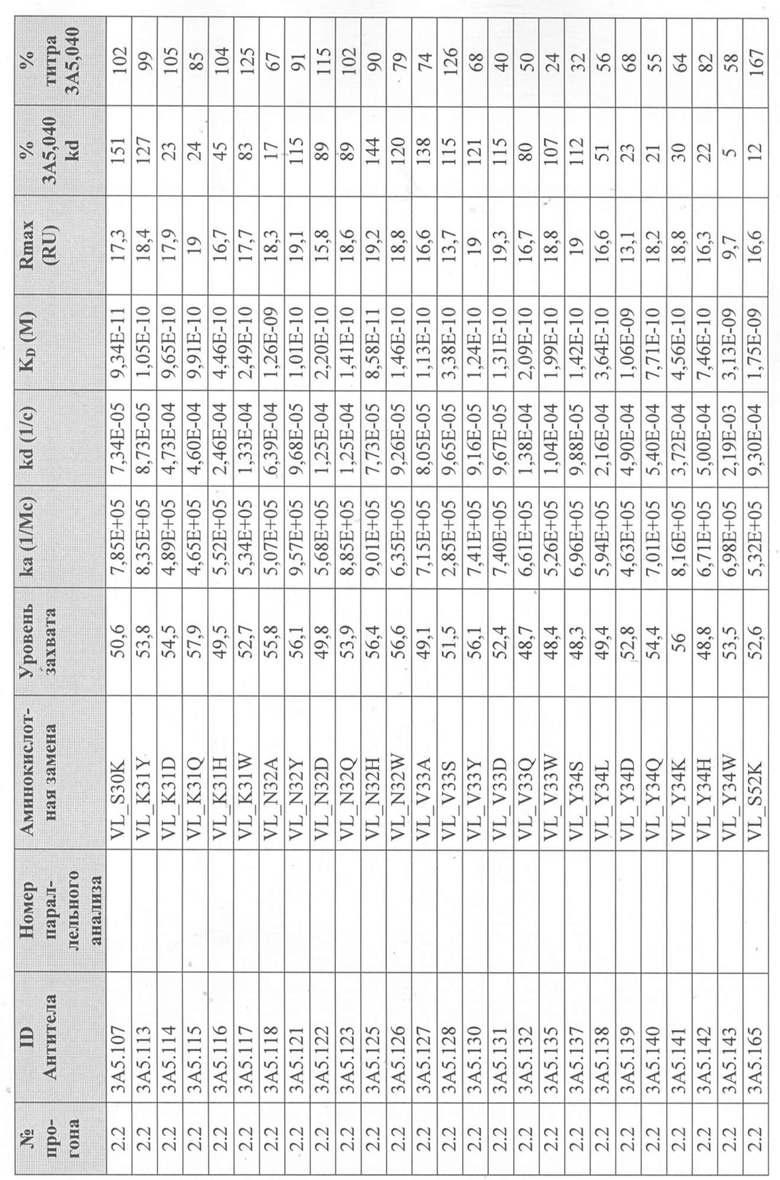
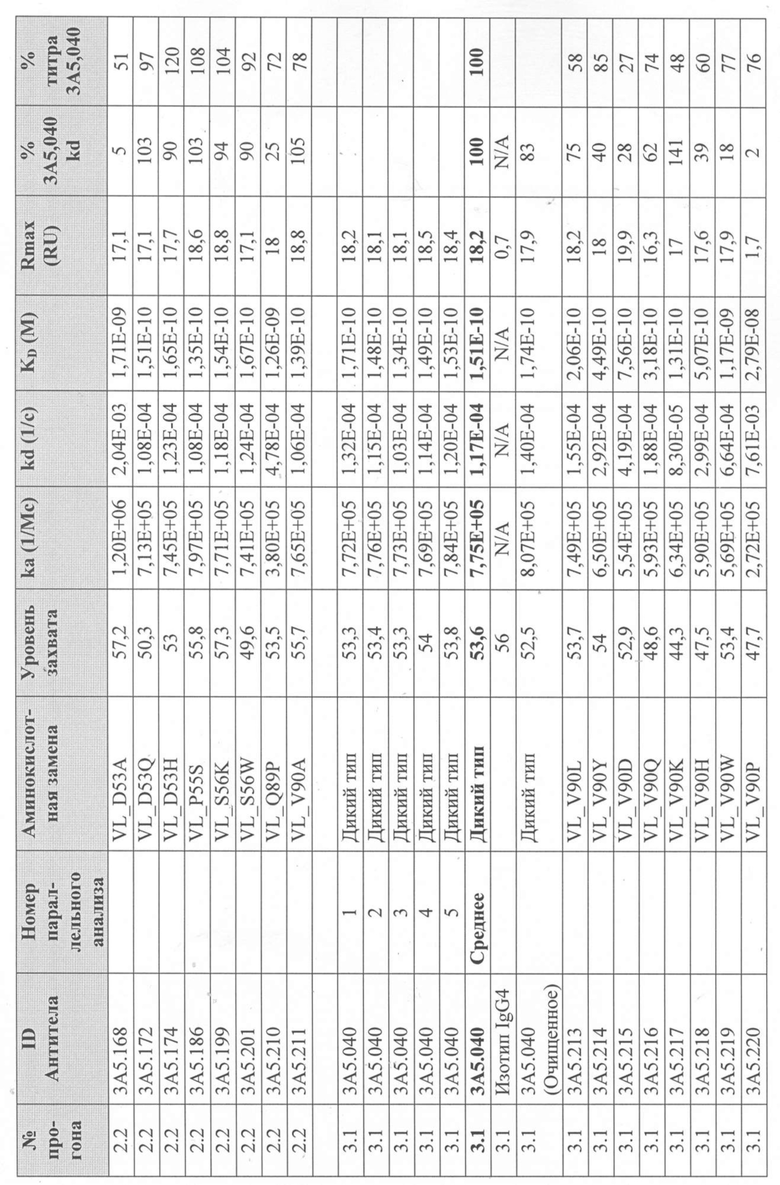
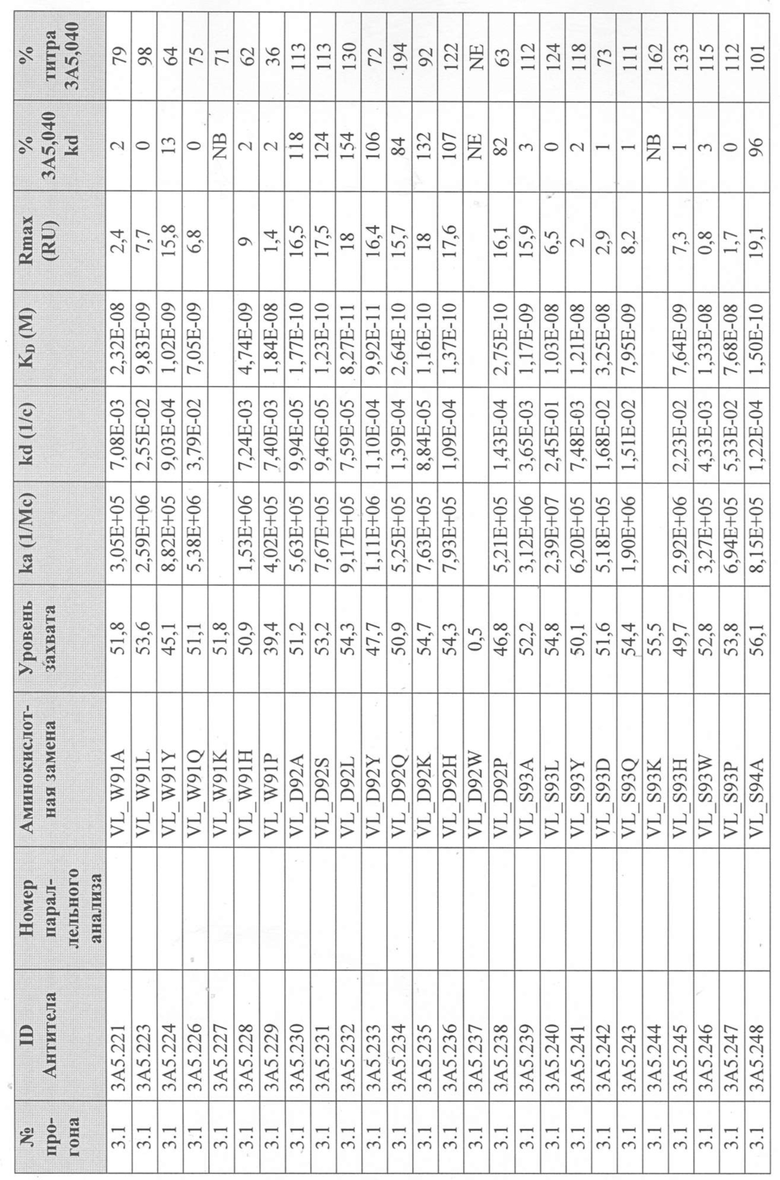
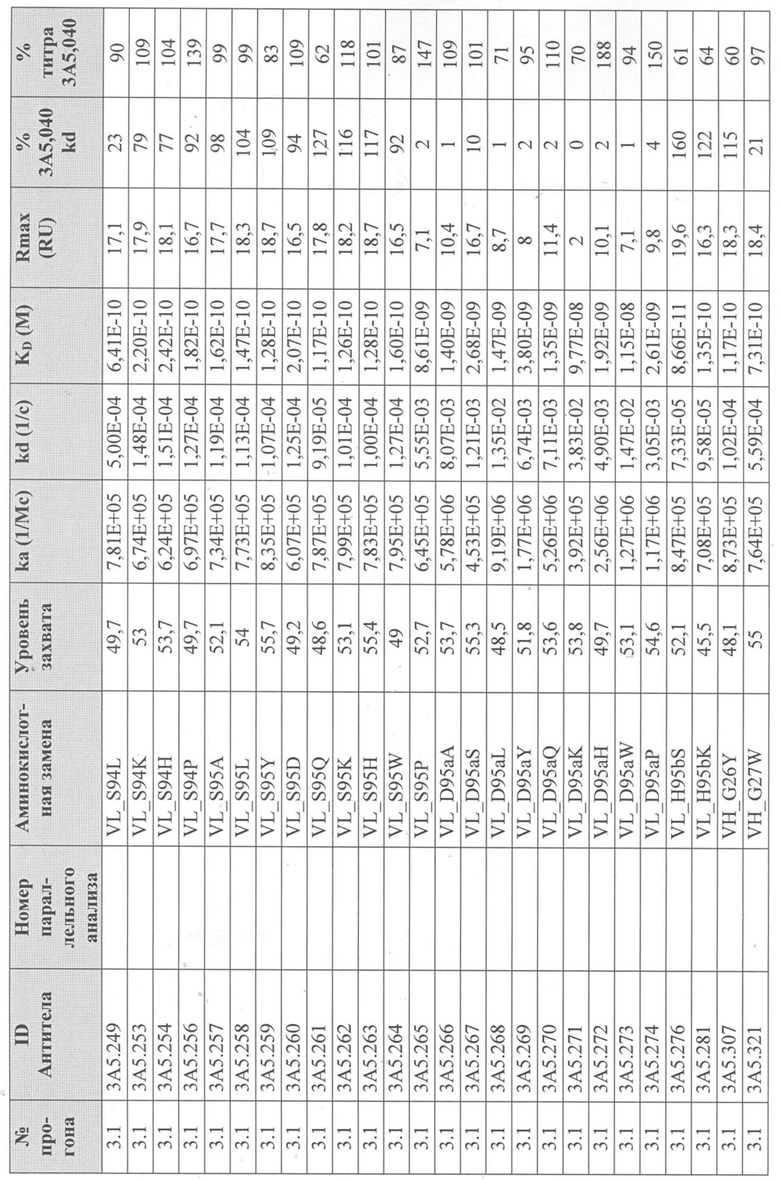

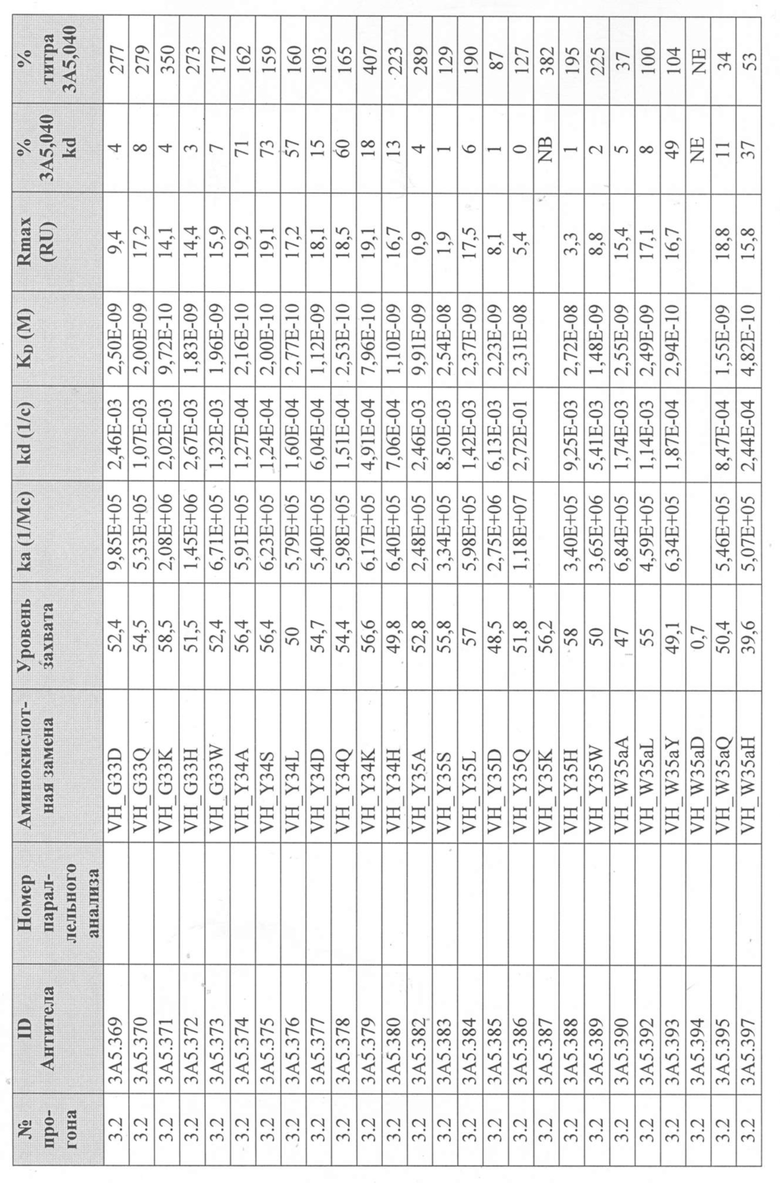
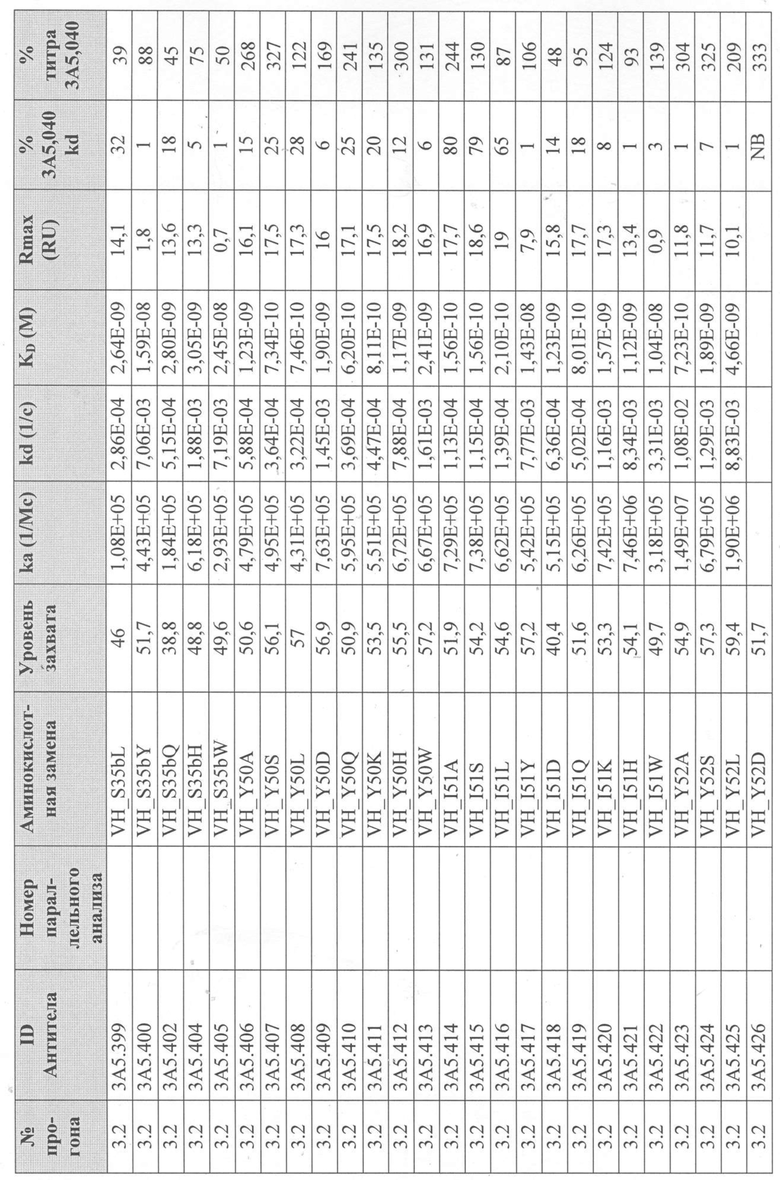
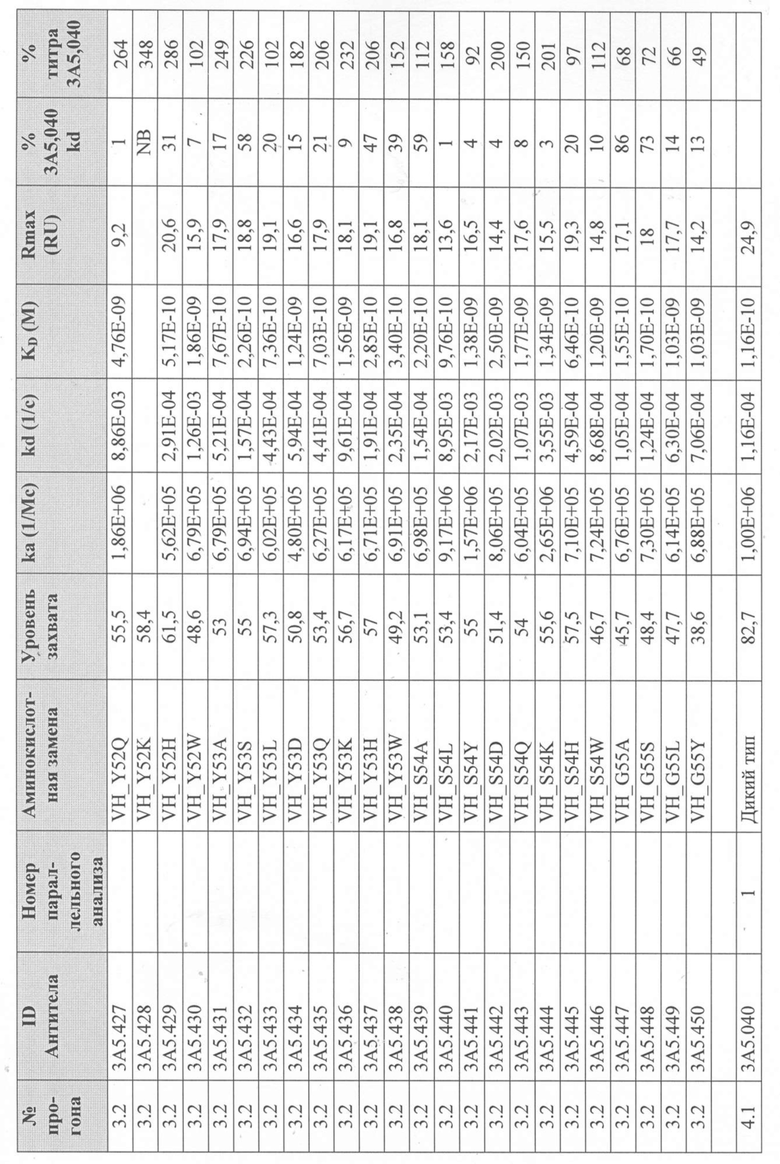
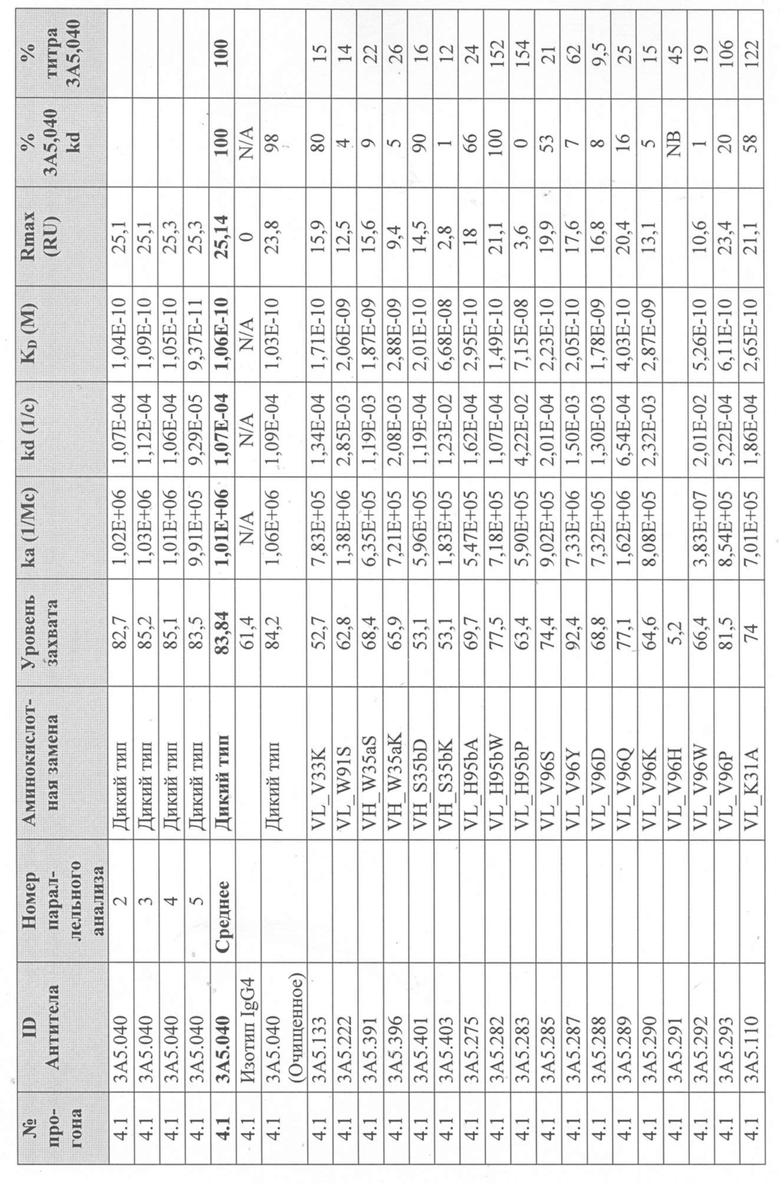
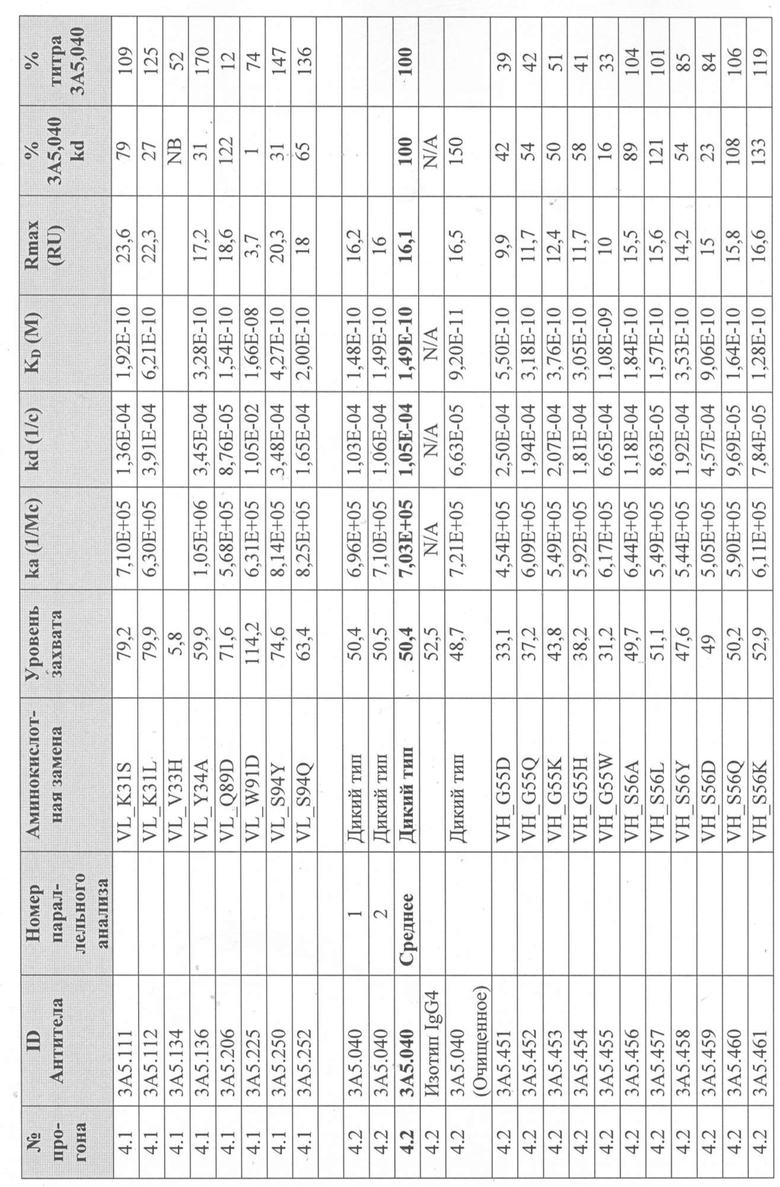
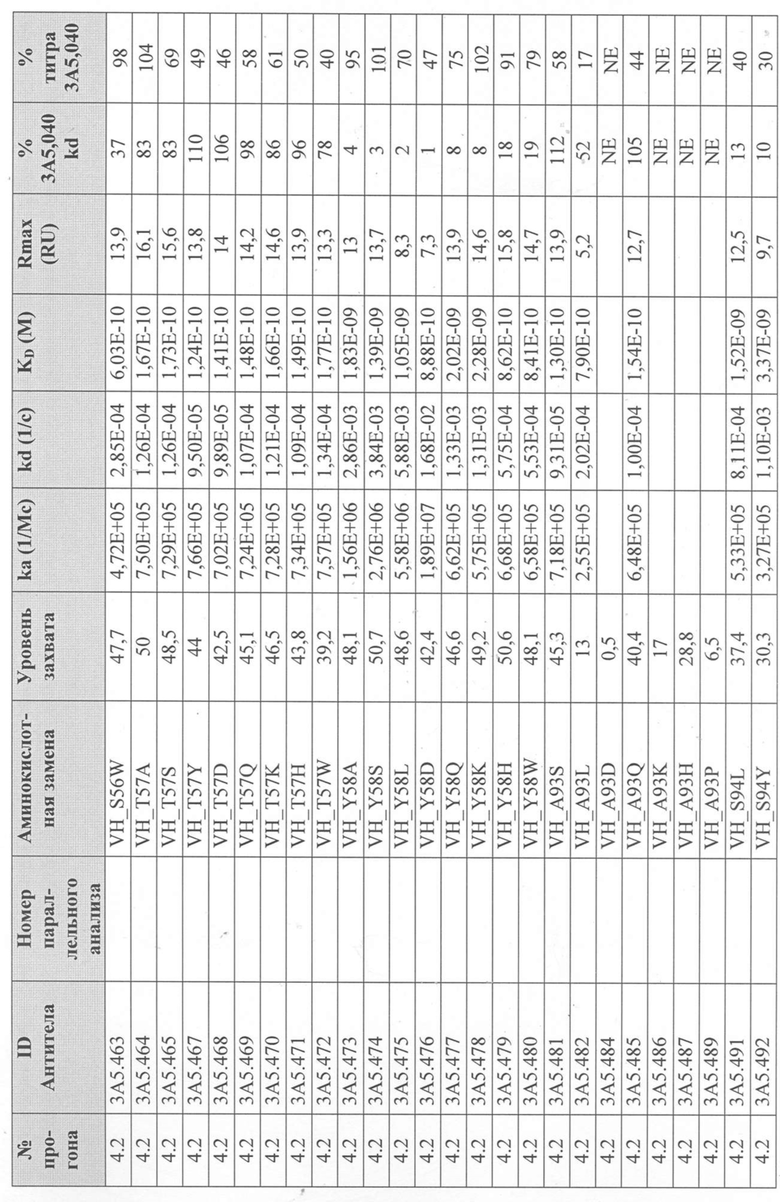
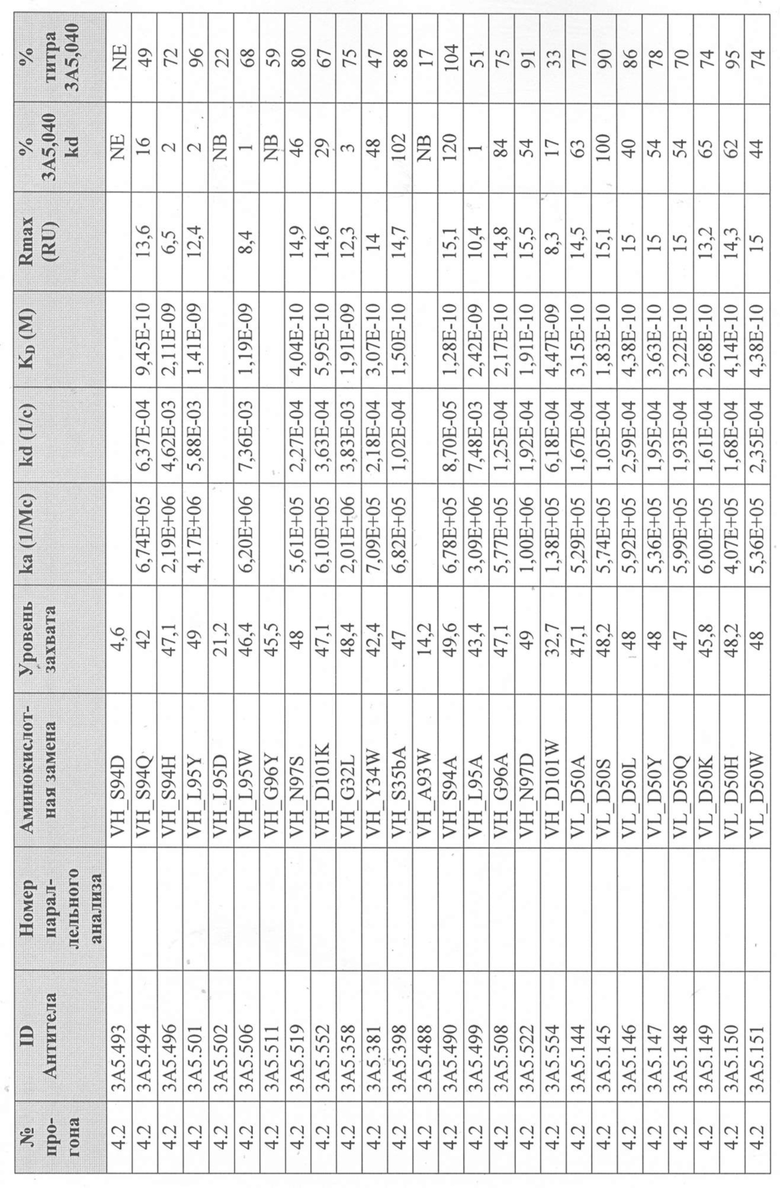
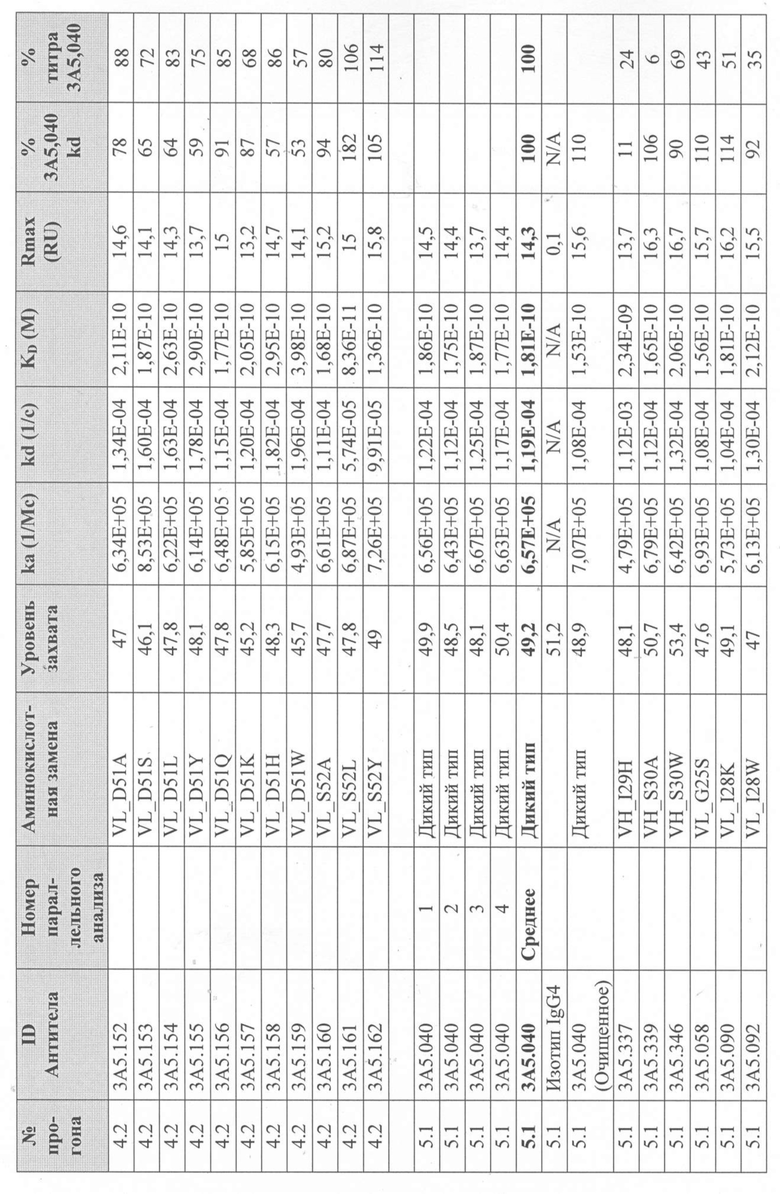

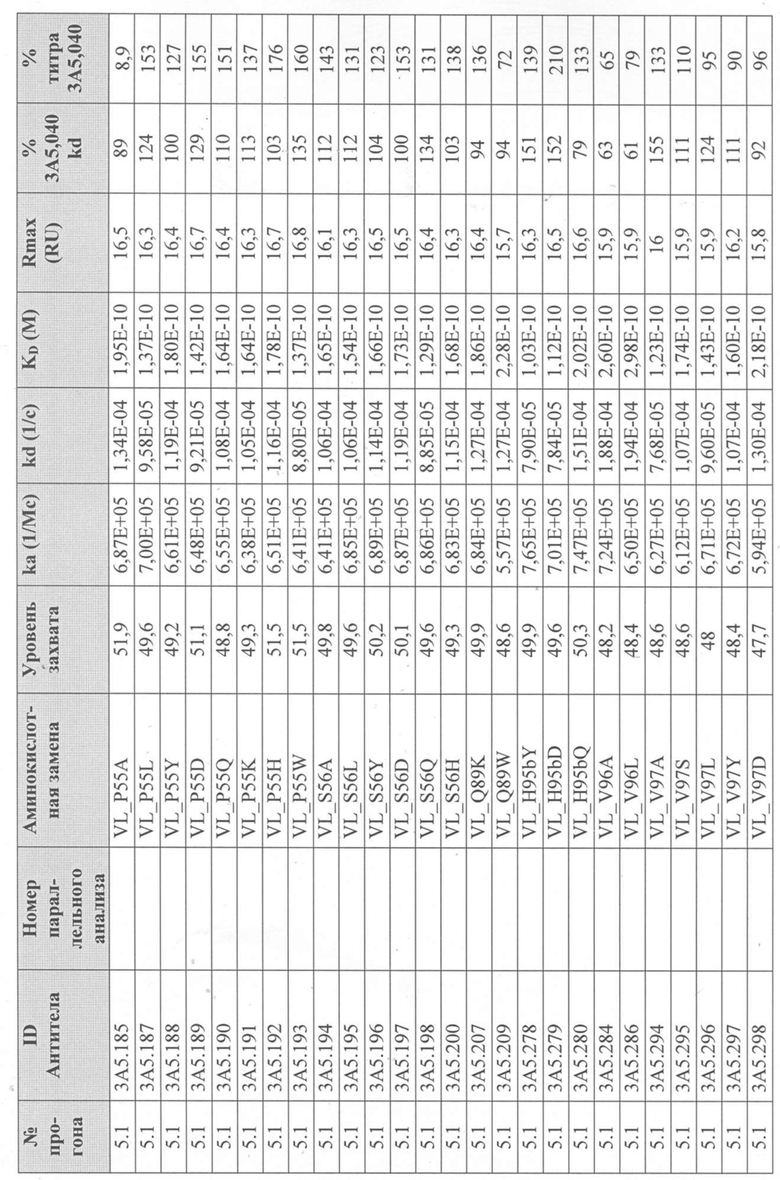
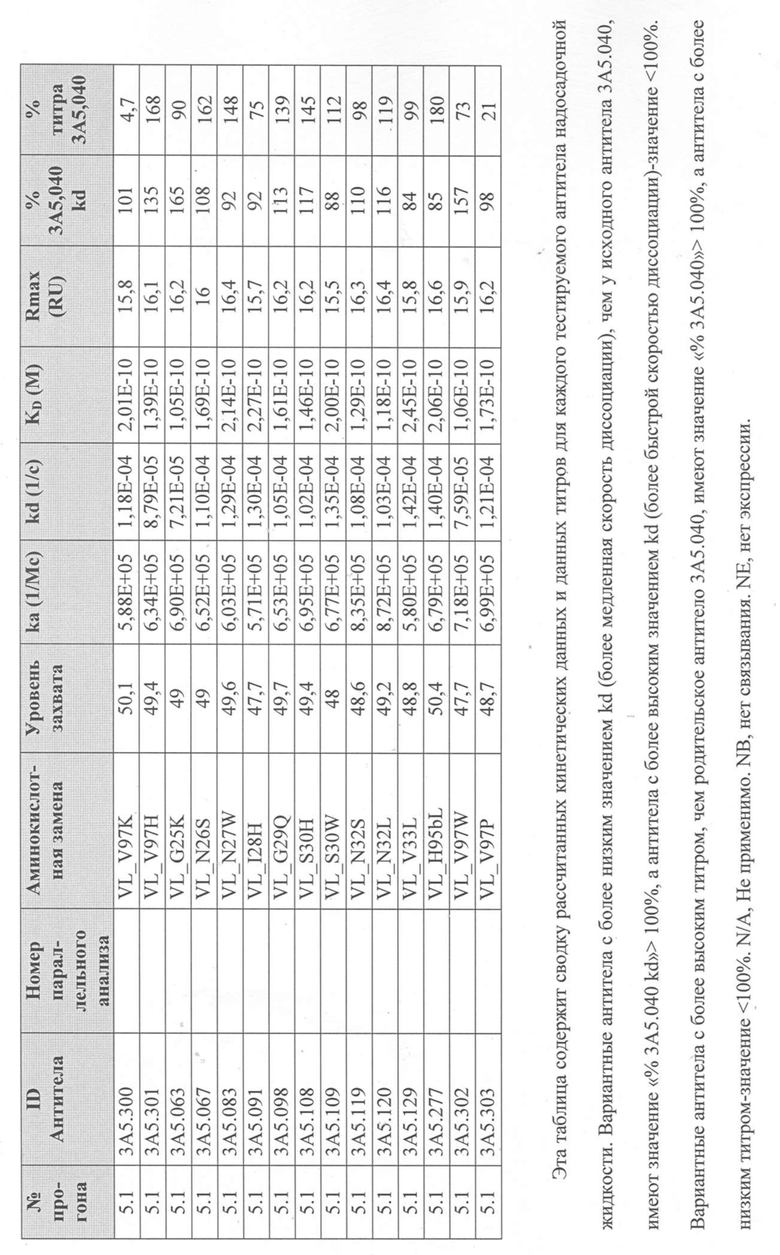
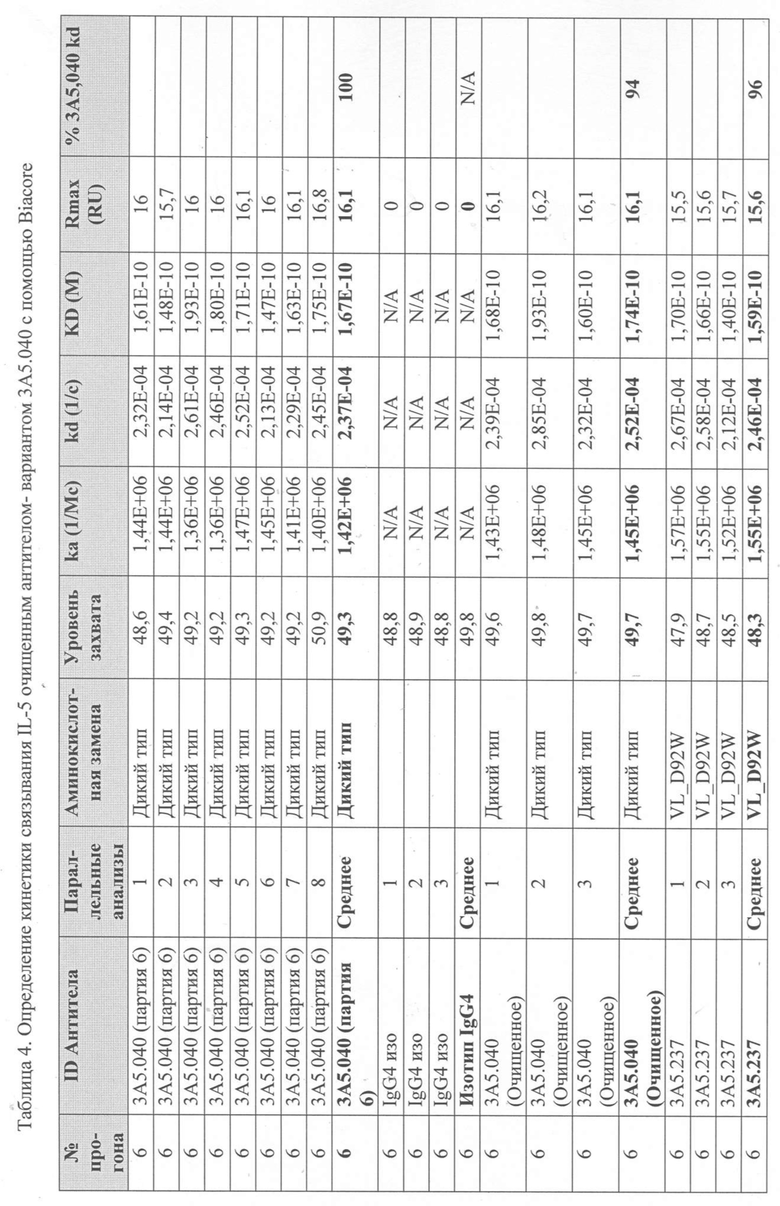
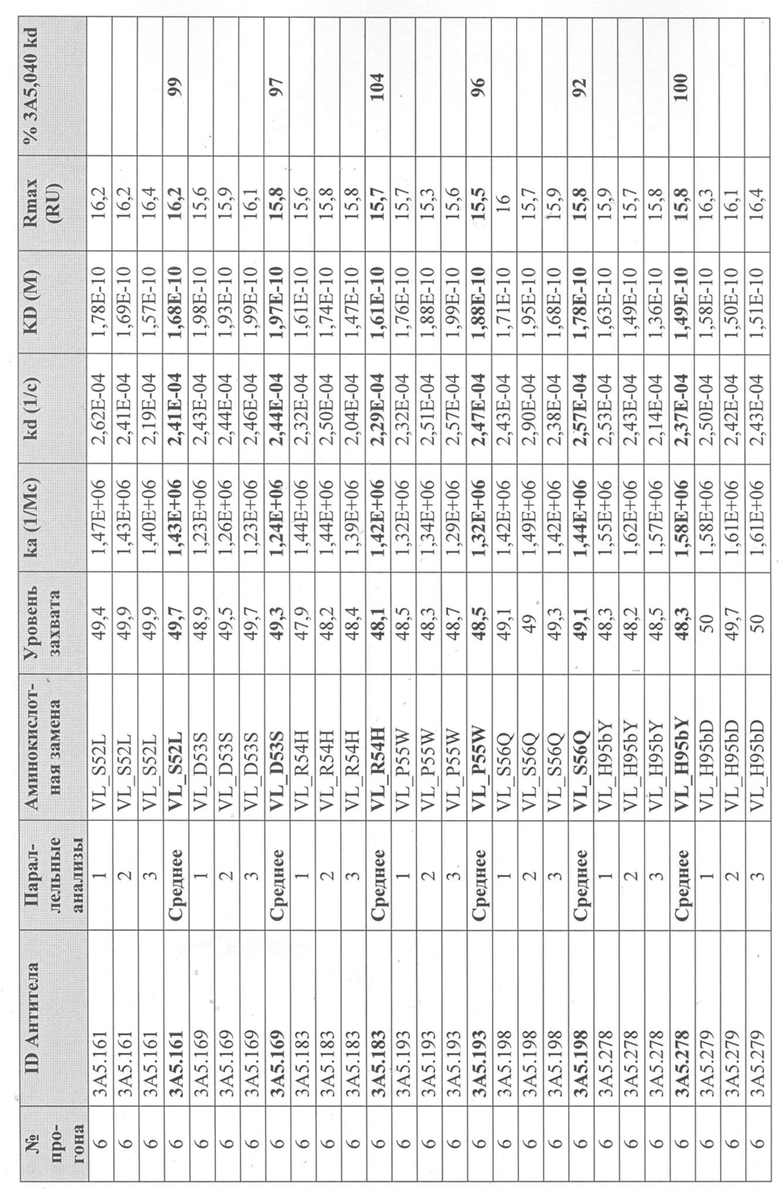
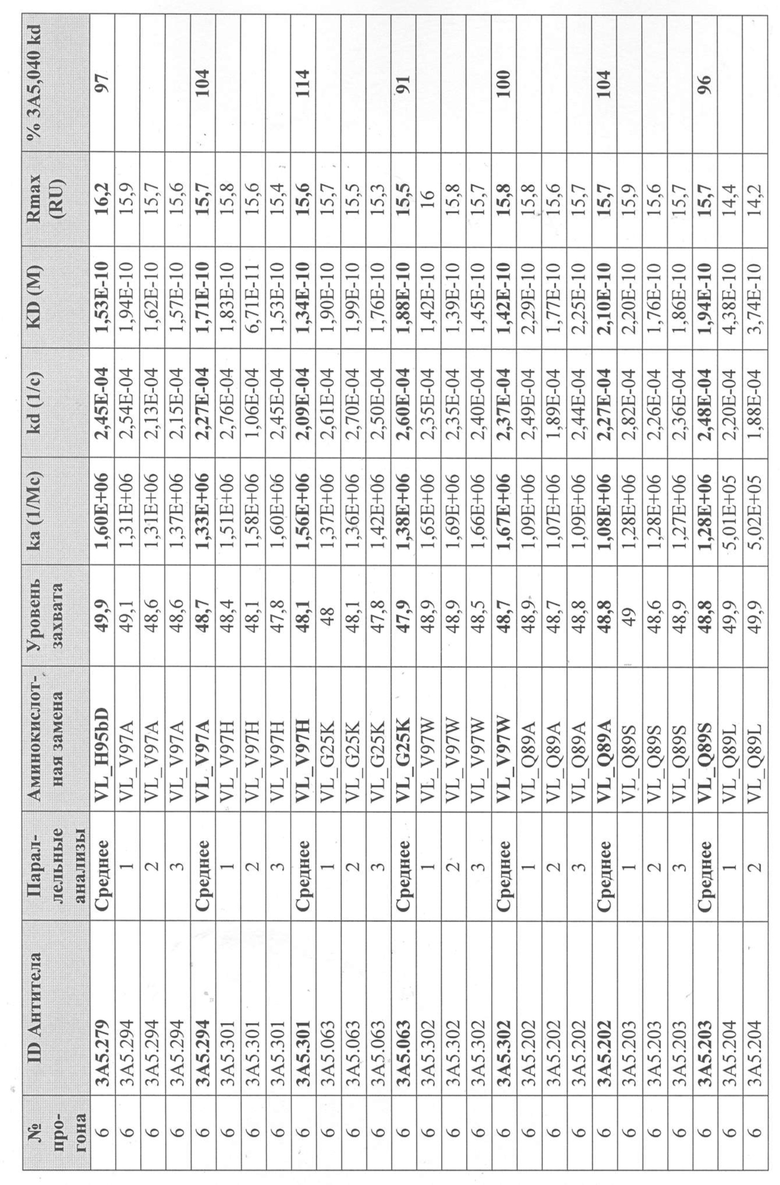
Таблица 5. Выход экспрессии очищенного белка для выбранных антител-вариантов 3A5.040





Создание экспрессирующего вектора
Нуклеотидная последовательность может влиять на экспрессию гена и последующий уровень экспрессии белка. Исследовали несколько различных нуклеотидных последовательностей на предмет оптимальной экспрессии 3А5.046. Эти последовательности приведены в следующей таблице:
Таблица 12. Нуклеотидная последовательность
Измерение аффинности антитела 3A5.046 к рекомбинантному IL-5 человека с помощью SPR
Аффинность антител 3A5.046 к рекомбинантному IL-5 человека была определена с использованием системы Biacore T200 (GE Healthcare). Вкратце, коммерческое мышиное антитело против IgG человека (Thermo Scientific) было присоединено к двум смежным (контрольной и тестовой) проточным ячейкам на чипе Biacore CM5 (GE Healthcare) в соответствии с рекомендациями производителя. Антитело 3А5.046 было захвачено при низкой плотности (около 125 RU) на поверхности тестируемой проточной ячейки, и разведения рекомбинантного IL-5 человека или пустого буфера были инъецированы через тестовую и контрольную проточную ячейку со скоростью 30 мкл/мин (фиг. 6, Таблица 13).
Полученные сенсограммы имели двойной контроль (значения тестовой проточной ячейки вычитались из значений проточной ячейки контроля (поверхность, связанная с анти-IgG человека без покрытого антитела), а также пустого буфера). Вычтенные сенсограммы из инъекций IL-5 человека при 2,5, 1,25, 0,625, 0,313 и 0,156 мкг/мл были подогнаны к модели связывания Ленгмюра 1:1 с использованием программного обеспечения Biacore Evaluation для определения констант связывания из анализов в двух повторах (Таблица 13).
Таблица 13. Кинетические константы из мультиконцентрационного кинетического анализа Biacore связывания антитела 3A5.046 с рекомбинантным IL-5 человека при 2,5, 1,25, 0,625, 0,313 и 0,156 мкг/мл.
Эти результаты показывают, что антитело 3A5.046 имеет высокую аффинность к рекомбинантному IL-5 человека.
Активность 3A5.046 по сравнению с меполизумабом в анализе пролиферации клеточной линии TF-1.6G4
3A5.046 и меполизумаб использовали в анализе пролиферации клеточной линии TF-1.6G4. 3A5.046 и меполизумаб ингибировали пролиферацию, вызванную IL-5 человека, со средним IC50 13,8 пМ и 534 пМ, соответственно (см. Таблицу 14 и фиг. 7А). Оба антитела продемонстрировали ингибирование IL-5 яванского макака на клеточной линии TF1.6G4 (фиг.7B), со средним IC50 для 3A5.046, равным 43,8 пМ, и для меполизумаба, равным 584 пМ.
Таблица 14
Обнаружение нативного IL5 из первичных клеток с помощью ELISA с использованием анти-IL-5 антител по изобретению
Антитело 3A5 было использовано в качестве захватывающего реагента в сэндвич-ELISA. В сочетании с коммерчески доступным детектирующим антителом (TRFk5R; R & D systems, # MAB405) может быть проведена количественная оценка уровней рекомбинантного IL-5 в образцах буфера с добавкой определяемого вещества (фиг. 8). Затем этот способ был применен для обнаружения нативного IL-5, секретируемого первичными клетками. Стимулировали CD4+ Т-клетки от четырех доноров для секреции IL-5. Уровни IL-5 затем определяли с использованием сэндвич-ELISA с антителом 3A5 в качестве реагента для захвата. Три из четырех донорских Т-клеток ответили на стимуляцию Т-клеток и имели определяемые уровни IL-5 в надосадочной жидкости клеточной культуры (фиг. 8). Аналогичные исследования были выполнены с IL-5 человека, секретируемом первичными человеческими донорскими CD4+ T-клетками, с использованием антитела 3A5.046 в качестве агента захвата, и полученные результаты соответствовали результатам, полученным с антителом 3A5 (данные не показаны).
Ингибирование анти-IL-5 антителом дифференцировки эозинофилов
Анализ на выживание с использованием CD34+ клеток пуповинной крови был использован для оценки способности анти-IL-5 антител ингибировать IL-5 зависимую дифференцировку клеток-предшественников костного мозга в эозинофилы и оценки способности анти-IL-5 антител ингибировать фенотипически зрелую выживаемость эозинофилов. В контрольных клетках, обработанных IL-5, фенотипически зрелые эозинофилы были преобладающей популяцией на 28 день (Фигура 9, заштрихованная область на графике). Антитело 3A5.046 способно ингибировать дифференцировку CD34+ клеток пуповинной крови, инкубированных с IL-5 в течение 28 дней, в эозинофилы. Антитело 3A5.046 было более сильным ингибитором IL-5-опосредованной дифференцировки эозинофилов, чем меполизумаб (фиг. 9).
Рентгеноструктурный анализ
Молекулярную структуру комплекса между Fab антитела 3A5.046 и рекомбинантным IL-5 человека исследовали с помощью рентгеновской кристаллографии. Чтобы подготовиться к экспериментам с рентгеновской кристаллографией, 3A5.046 гидролизовали папаином, который расщепляет интактное антитело в шарнирной области, разделяя домены Fc и Fab. Fab 3A5.046 очищали стандартной аффинной хроматографией с протеином А и включали в комплекс с рекомбинантным негликозилированным IL-5 человека. Комплекс 3А5.046 Fab: IL-5 человека очищали для экспериментов по кристаллизации с использованием стандартной эксклюзионной хроматографии. Комплекс использовали в варьирующих концентрациях в коммерчески доступных скринингах кристаллизации белков типа sparse matrix (разреженная матрица) для широкого отбора условий кристаллизации. Оптимизации любых условий «попадания», которые обеспечивают кристаллы комплекса из скринингов кристаллизации белков типа sparse matrix (разреженная матрица), проводили для улучшения морфологии кристалла и дифракции кристалла по мере необходимости.
Кристаллы комплекса 3A5.046 Fab: IL-5 человека, собирали, быстро замораживали в жидком азоте и транспортировали к синхротронному комплексу для дифракционных тестов и сбора данных. Кристаллическое дифракционное тестирование выполняли на синхротроне, который создает высокоэнергетические рентгеновские микропучки для получения дифракции высокого разрешения. Таким образом получали данные дифракции рентгеновских лучей на кристаллах комплекса 3A5.046 Fab: IL-5 человека. Исходная структурная модель комплекса может быть получена с использованием стандартных методов молекулярного замещения с опубликованными молекулярными структурами IL-5 и Fab в качестве матриц. Окончательная структура комплекса Fab и IL-5 человека 3A5.046 может быть получена путем итеративного уточнения модели структуры до тех пор, пока ошибки подгонки не станут лучше, чем 30% (конечный Rfree равен 0,3), а параметры химической связи (например, распределение длин и углов связей, стереохимия и водородные связи) не будут находиться в допустимых пределах.
Характеризация связывания антитела 3A5.046 с IL-5 из модельных видов, отличных от человека
Антитело 3A5.046 было проверено с помощью анализа Biacore с использованием системы T200 (GE Healthcare) на предмет связывания с рекомбинантными цитокинами IL-5 человека, IL-5 крысы, IL-5 мыши и IL-5 морской свинки. Эта панель нечеловеческих IL-5 была выбрана для представления основных видов животных моделей, используемых при доклинической разработке. Изотипное контрольное антитело (IgG4) и антитело 3A5.046 иммобилизовали на проточных ячейках 1 и 2 чипа CM5 серии S (GE Healthcare), соответственно, с использованием стандартных способов аминного сочетания. Цитокины разбавляли до 1 и 10 μг/мл в рабочем буфере HBS-EP+ (GE Healthcare) и впрыскивали через проточные ячейки 1 и 2. Инъекции только буфера через проточные ячейки 1 и 2 были включены для двойного контроля. Анализ данных проводился с использованием оценочного программного обеспечения Biacore T200. Полученные сенсограммы имели двойной контроль (значения тестируемой проточной ячейки вычитались из значений контрольной проточной ячейки, а также пустого буфера).
Было обнаружено, что антитело 3A5.046 связывается с IL-5 человека и IL-5 яванского макака, но не с IL-5 мыши, IL-5 крысы или IL-5 морской свинки (фиг. 10A -. Фиг 10E). Это указывало на то, что 3A5.046 можно использовать в доклинических моделях с яванским макаком.
Антитело 3A5.046 не связывается с другими человеческими цитокинами, близко родственными с IL-5
Антитело 3A5.046 было проверено с помощью анализа Biacore с использованием системы T200 (GE Healthcare) на предмет связывания с рекомбинантными человеческими цитокинами IL-2, IL-3, IL-4, IL-5, гранулоцитарно-макрофагальным колониестимулирующим фактором (GM-CSF), макрофагальным колониестимулирующим фактором (M-CSF) и гормоном роста (GH). Эта репрезентативная группа близкородственных человеческих цитокинов была выбрана на основании их структурного и функционального сходства с IL-5 человека. Контрольное изотипическое антитело (IgG4) и антитело 3A5.046 были иммобилизованы на проточных ячейках 1 и 2 чипа CM5 серии S (GE Healthcare), соответственно, с использованием стандартных способов аминного сочетания. Цитокины разбавляли до 1 и 10 μг/мл в рабочем буфере HBS-EP+ (GE Healthcare) и инъецировали через проточные ячейки 1 и 2. Инъекции только буфера через проточные ячейки 1 и 2 были включены для двойного контроля. Анализ данных проводился с использованием оценочного программного обеспечения Biacore T200. Полученные сенсограммы имели двойной контроль (значения тестируемой проточной ячейки вычитались из значений контрольной проточной ячейки, а также пустого буфера).
Было обнаружено, что антитело 3A5.046 связывается только с IL-5 человека, но не с человеческими цитокинами IL-2, IL-3, IL-4, GM-CSF, M-CSF, или GH (фиг.11А-фиг. 11D), демонстрируя, таким образом, высокую специфичность 3A5.046 к IL-5 человека.
Оценка антител 3A5.046 на модели эозинофилии дыхательных путей яванского макака, индуцированной Ascaris suum.
Антитело 3A5.046 тестировали с использованием модели острой эозинофилии дыхательных путей у яванского макака с Ascaris suum, как описано в Hart, T.K., et al., Preclinical efficacy and safety of mepolizumab (SB-240563), a humanized monoclonal antibody to IL-5, in cynomolgus monkeys. J Allergy Clin Immunol, 2001. 108(2): p. 250-7.
Шестнадцать самок яванского макака, которые были ранее сенсибилизированы к Ascaris suum, оценивали по уровню остаточной чувствительности с помощью интрадермальной контрольной провокационной пробы A. suum. Четырнадцать из этих животных были отобраны для участия в исследовании на основании ответа на провокационную пробу, кожных волдырей, и рандомизированы на две группы по n = 7 на группу. Через две недели после внутрикожного тестирования кожной сыворотки были взяты исходные образцы крови и жидкости бронхоальвеолярного лаважа (BALF) (день 8). Приблизительно через 24 часа после сбора исходной пробы животных обрабатывали либо плацебо (содержащим водный буфер pH 6,3 с 200 мМ аргинином и 25 мМ гистидином), либо антителом 3A5,046 (10 мг/кг внутривенно, в водном буфере pH 6,3 с 200 мМ аргинином и 25 мМ гистидина) в виде слепого исследования (день 7). Через одну неделю после лечения плацебо или антителом выполняли вторую внутрикожную инъекцию A. suum и всем животным давали инъекцию A. suum путем доставки равного количества экстракта A. suum (Greer Laboratories Inc .; 5 мг/мл в стерильной воде) через небулайзер PARI LC (день 0). Диаметр кожных волдырей измеряли через 15 минут после провокационной пробы. Через два дня после ингаляционной провокационной пробы A. suum были взяты образцы крови и BALF. Дополнительные образцы крови для гематологических конечных точек и PK-анализа собирали еженедельно, начиная с 10-го дня и до 45-го дня.
Существенных различий в реакции кожных волдырей между первой и второй интрадермальными провокационными пробами A. suum обнаружено не было. У всех животных было выявлено увеличение эозинофилов в BALF в результате провокационной пробы A. suum, но у животных, получавших антитело 3A5.046, это увеличение было незначительным. В BALF у животных, получавших антитело 3A5.046, эозинофилов было значительно меньше, чем через 48 часов после провокационной пробы A. suum у животных, получавших плацебо (p <0,01; тест Манна-Уитни; фиг. 12).
Провокационная проба A. suum также приводила к значительному увеличению эозинофилов в крови по сравнению с исходным уровнем у животных, получавших плацебо, до 10-го дня после провокационной пробы (фиг. 13A). Обработка антителом 3A5.046 приводила к значительному снижению уровня эозинофилов в крови до уровней ниже исходного уровня (фиг. 13A), и это снижение количества эозинофилов в крови сохранялось в течение, по меньшей мере, 52 дней после начальной дозы (фиг. 13B).
Таким образом, обработка с помощью 3A5.046 значительно снизила индуцированную A. suum эозинофилию дыхательных путей через 48 часов после провокационной пробы, и значительно уменьшила количество эозинофилов в крови, ниже базовых уровней, в течение, по меньшей мере, 52 дней после однократного внутривенного (IV) дозы 10 мг/кг.
Исследование функции антител в модели эозинофилии дыхательных путей на крысах с гуманизированным IL-5
Alternaria alternata (Alternaria) является грибным аллергеном, который, как известно, вызывает астму у людей и может привести к эозинофилии и астма-подобным симптомам у грызунов. При провокационной пробе Alternaria, у knock-in крыс с гуманизированным IL-5 (животные, у которых крысиный IL-5 был заменен IL-5 человека), наблюдается повышенный уровень эозинофилов в жидкости бронхоальвеолярного лаважа (BALF) из легких (фиг. 14).
Одиночную интратрахеальную инстилляцию суспензии Alternaria вводили гуманизированным крысам IL-5, и образцы крови и BALF отбирали через 2, 3 или 4 дня после введения Alternaria. Обычно в этой модели эозинофилы значительно повышены в образцах BALF и могут быть либо увеличены, либо неизменны в образцах крови. Тестовые антитела вводили до индукции эозинофилии с помощью Alternaria и оценивали по их способности снижать количество эозинофилов в BALF и крови.
Специалисты в данной области техники будет очевидно, что многочисленные изменения и модификации могут быть сделаны к предпочтительным воплощениям настоящего изобретения, и что такие изменения и модификации могут быть сделаны без отхода от сущности настоящего изобретения. Поэтому предполагается, что прилагаемая формула изобретения охватывает все такие эквивалентные варианты, которые соответствуют истинному духу и объему изобретения.
Раскрытия каждого патента, патентной заявки и публикации, цитируемые или описанные в этом документе, настоящим включены в данное описание посредством ссылки в полном объеме.
Таблица 15. Последовательности
SEQ ID NO: 1
SEQ ID NO: 2
SEQ ID NO: 3
SEQ ID NO: 4
SEQ ID NO: 5
SEQ ID NO: 6
SEQ ID NO: 7
SEQ ID NO: 8
SEQ ID NO: 9
SEQ ID NO: 10
SEQ ID NO: 11
SEQ ID NO: 12
SEQ ID NO: 13
SEQ ID NO: 4
SEQ ID NO: 5
SEQ ID NO: 6
SEQ ID NO: 7
SEQ ID NO: 8
SEQ ID NO: 9
SEQ ID NO: 10
SEQ ID NO: 11
SEQ ID NO: 14
SEQ ID NO: 13
SEQ ID NO: 4
SEQ ID NO: 5
SEQ ID NO: 6
SEQ ID NO: 7
SEQ ID NO: 8
SEQ ID NO: 15
SEQ ID NO: 16
SEQ ID NO: 17
SEQ ID NO: 18
SEQ ID NO: 19
SEQ ID NO: 4
SEQ ID NO: 5
SEQ ID NO: 6
SEQ ID NO: 7
SEQ ID NO: 8
SEQ ID NO: 15
SEQ ID NO: 16
SEQ ID NO: 17
SEQ ID NO: 20
SEQ ID NO: 19
SEQ ID NO: 4
SEQ ID NO: 21
SEQ ID NO: 6
SEQ ID NO: 7
SEQ ID NO: 8
SEQ ID NO: 15
SEQ ID NO: 16
G25K
SEQ ID NO: 22
SEQ ID NO: 18
G25K
SEQ ID NO: 23
SEQ ID NO: 4
SEQ ID NO: 24
SEQ ID NO: 6
SEQ ID NO: 7
SEQ ID NO: 8
SEQ ID NO: 15
SEQ ID NO: 16
N26D
SEQ ID NO: 25
SEQ ID NO: 18
N26D
SEQ ID NO: 26
SEQ ID NO: 4
SEQ ID NO: 27
SEQ ID NO: 6
SEQ ID NO: 7
SEQ ID NO: 8
SEQ ID NO: 15
SEQ ID NO: 16
N27H
SEQ ID NO: 28
SEQ ID NO: 18
N27H
SEQ ID NO: 29
SEQ ID NO: 4
SEQ ID NO: 30
SEQ ID NO: 6
SEQ ID NO: 7
SEQ ID NO: 8
SEQ ID NO: 15
SEQ ID NO: 16
I28A
SEQ ID NO: 31
SEQ ID NO: 18
I28A
SEQ ID NO: 32
SEQ ID NO: 4
SEQ ID NO: 33
SEQ ID NO: 6
SEQ ID NO: 7
SEQ ID NO: 8
SEQ ID NO: 15
SEQ ID NO: 16
S30K
SEQ ID NO: 34
SEQ ID NO: 18
S30K
SEQ ID NO: 35
SEQ ID NO: 4
SEQ ID NO: 36
SEQ ID NO: 6
SEQ ID NO: 7
SEQ ID NO: 8
SEQ ID NO: 15
SEQ ID NO: 16
N32H
SEQ ID NO: 37
SEQ ID NO: 18
N32H
SEQ ID NO: 38
SEQ ID NO: 4
SEQ ID NO: 39
SEQ ID NO: 6
SEQ ID NO: 7
SEQ ID NO: 8
SEQ ID NO: 15
SEQ ID NO: 16
V33A
SEQ ID NO: 40
SEQ ID NO: 18
V33A
SEQ ID NO: 41
SEQ ID NO: 4
SEQ ID NO: 5
SEQ ID NO: 6
SEQ ID NO: 42
SEQ ID NO: 8
SEQ ID NO: 15
SEQ ID NO: 16
S52L
SEQ ID NO: 43
SEQ ID NO: 18
S52L
SEQ ID NO: 44
SEQ ID NO: 4
SEQ ID NO: 5
SEQ ID NO: 6
SEQ ID NO: 45
SEQ ID NO: 8
SEQ ID NO: 15
SEQ ID NO: 16
D53S
SEQ ID NO: 46
SEQ ID NO: 18
D53S
SEQ ID NO: 47
SEQ ID NO: 4
SEQ ID NO: 5
SEQ ID NO: 6
SEQ ID NO: 7
SEQ ID NO: 8
SEQ ID NO: 48
SEQ ID NO: 16
D92L
SEQ ID NO: 49
SEQ ID NO: 18
D92L
SEQ ID NO: 50
SEQ ID NO: 4
SEQ ID NO: 5
SEQ ID NO: 6
SEQ ID NO: 7
SEQ ID NO: 8
SEQ ID NO: 51
SEQ ID NO: 16
H95bS
SEQ ID NO: 52
SEQ ID NO: 18
H95bS
SEQ ID NO: 53
SEQ ID NO: 4
SEQ ID NO: 5
SEQ ID NO: 6
SEQ ID NO: 7
SEQ ID NO: 8
SEQ ID NO: 54
SEQ ID NO: 16
H95bY
SEQ ID NO: 55
SEQ ID NO: 18
H95bY
SEQ ID NO: 56
SEQ ID NO: 4
SEQ ID NO: 5
SEQ ID NO: 6
SEQ ID NO: 7
SEQ ID NO: 8
SEQ ID NO: 57
SEQ ID NO: 16
H95bD
SEQ ID NO: 58
SEQ ID NO: 18
H95bD
SEQ ID NO: 59
SEQ ID NO: 4
SEQ ID NO: 5
SEQ ID NO: 6
SEQ ID NO: 7
SEQ ID NO: 8
SEQ ID NO: 60
SEQ ID NO: 16
V97A
SEQ ID NO: 61
SEQ ID NO: 18
V97A
SEQ ID NO: 62
SEQ ID NO: 4
SEQ ID NO: 5
SEQ ID NO: 6
SEQ ID NO: 7
SEQ ID NO: 8
SEQ ID NO: 63
SEQ ID NO: 16
V97W
SEQ ID NO: 64
SEQ ID NO: 18
V97W
SEQ ID NO: 65
SEQ ID NO: 4
SEQ ID NO: 66
SEQ ID NO: 6
SEQ ID NO: 7
SEQ ID NO: 8
SEQ ID NO: 15
SEQ ID NO: 16
G29D
SEQ ID NO: 67
SEQ ID NO: 18
G29D
SEQ ID NO: 68
SEQ ID NO: 69
SEQ ID NO: 70
SEQ ID NO: 71
SEQ ID NO: 72
ВОПЛОЩЕНИЯ
Следующий список воплощений предназначен для дополнения, а не для искажения или замены предыдущих описаний.
Воплощение 1. Молекула человеческого антитела, которая иммуноспецифически связывается с IL-5 человека с равновесной константой аффинности (KD), равной, по меньшей мере, около 40 пМ, которая определена поверхностным плазмонным резонансом.
Воплощение 2. Молекула антитела человека, которая иммуноспецифически связывается с IL-5 человека, причем молекула антитела включает:
CDR1 тяжелой цепи, включающую аминокислотную последовательность SEQ ID NO: 4, CDR2 тяжелой цепи, включающую аминокислотную последовательность SEQ ID NO: 6, CDR3 тяжелой цепи, включающую аминокислотную последовательность SEQ ID NO: 8, CDR1 легкой цепи, включающую аминокислотную последовательность SEQ ID NO: 5, 21, 24, 27, 30, 33, 36, 39 или 66, CDR2 легкой цепи, включающую аминокислотную последовательность SEQ ID NO: 7, 42 или 45, и CDR3 легкой цепи, включающую аминокислотную последовательность SEQ ID NO: 15, 48, 51, 54, 57, 60 или 63.
Воплощение 3. Молекула антитела по воплощению 1 или 2, где молекула антитела включает CDR1 тяжелой цепи, включающую аминокислотную последовательность SEQ ID NO: 4, CDR2 тяжелой цепи, включающую аминокислотную последовательность SEQ ID NO: 6, CDR3 тяжелой цепи содержащий аминокислотную последовательность SEQ ID NO: 8, и
а. CDR1 легкой цепи, включающую аминокислотную последовательность SEQ ID NO: 5, CDR2 легкой цепи, включающую аминокислотную последовательность SEQ ID NO: 7, и CDR3 легкой цепи, включающую аминокислотную последовательность SEQ ID NO: 15;
b. CDR1 легкой цепи, включающую аминокислотную последовательность SEQ ID NO: 21, CDR2 легкой цепи, включающую аминокислотную последовательность SEQ ID NO: 7, и CDR3 легкой цепи, включающую аминокислотную последовательность SEQ ID NO: 15;
с. CDR1 легкой цепи, включающую аминокислотную последовательность SEQ ID NO: 24, CDR2 легкой цепи, включающую аминокислотную последовательность SEQ ID NO: 7, и CDR3 легкой цепи, включающую аминокислотную последовательность SEQ ID NO: 15;
d. CDR1 легкой цепи, включающую аминокислотную последовательность SEQ ID NO: 27, CDR2 легкой цепи, включающую аминокислотную последовательность SEQ ID NO: 7, и CDR3 легкой цепи, включающую аминокислотную последовательность SEQ ID NO: 15;
е. CDR1 легкой цепи, включающую аминокислотную последовательность SEQ ID NO: 30, CDR2 легкой цепи, включающую аминокислотную последовательность SEQ ID NO: 7, и CDR3 легкой цепи, включающую аминокислотную последовательность SEQ ID NO: 15;
f. CDR1 легкой цепи, включающую аминокислотную последовательность SEQ ID NO: 33, CDR2 легкой цепи, включающую аминокислотную последовательность SEQ ID NO: 7, и CDR3 легкой цепи, включающую аминокислотную последовательность SEQ ID NO: 15;
g. CDR1 легкой цепи, включающую аминокислотную последовательность SEQ ID NO: 36, CDR2 легкой цепи, включающую аминокислотную последовательность SEQ ID NO: 7, и CDR3 легкой цепи, включающую аминокислотную последовательность SEQ ID NO: 15;
h. CDR1 легкой цепи, включающую аминокислотную последовательность SEQ ID NO: 39, CDR2 легкой цепи, включающую аминокислотную последовательность SEQ ID NO: 7, и CDR3 легкой цепи, включающую аминокислотную последовательность SEQ ID NO: 15;
i. CDR1 легкой цепи, включающую аминокислотную последовательность SEQ ID NO: 66, CDR2 легкой цепи, включающую аминокислотную последовательность SEQ ID NO: 7, и CDR3 легкой цепи, включающую аминокислотную последовательность SEQ ID NO: 15;
j. CDR1 легкой цепи, включающую аминокислотную последовательность SEQ ID NO: 5, CDR2 легкой цепи, включающую аминокислотную последовательность SEQ ID NO: 42, и CDR3 легкой цепи, включающую аминокислотную последовательность SEQ ID NO: 15;
k. CDR1 легкой цепи, включающую аминокислотную последовательность SEQ ID NO: 5, CDR2 легкой цепи, включающую аминокислотную последовательность SEQ ID NO: 45, и CDR3 легкой цепи, включающую аминокислотную последовательность SEQ ID NO: 15;
l. CDR1 легкой цепи, включающую аминокислотную последовательность SEQ ID NO: 5, CDR2 легкой цепи, включающую аминокислотную последовательность SEQ ID NO: 7, и CDR3 легкой цепи, включающую аминокислотную последовательность SEQ ID NO: 48;
m. CDR1 легкой цепи, включающую аминокислотную последовательность SEQ ID NO: 5, CDR2 легкой цепи, включающую аминокислотную последовательность SEQ ID NO: 7, и CDR3 легкой цепи, включающую аминокислотную последовательность SEQ ID NO: 51;
n. CDR1 легкой цепи, включающую аминокислотную последовательность SEQ ID NO: 5, CDR2 легкой цепи, включающую аминокислотную последовательность SEQ ID NO: 7, и CDR3 легкой цепи, включающую аминокислотную последовательность SEQ ID NO: 54;
о. CDR1 легкой цепи, включающую аминокислотную последовательность SEQ ID NO: 5, CDR2 легкой цепи, включающую аминокислотную последовательность SEQ ID NO: 7, и CDR3 легкой цепи, включающую аминокислотную последовательность SEQ ID NO: 57;
p. CDR1 легкой цепи, включающую аминокислотную последовательность SEQ ID NO: 5, CDR2 легкой цепи, включающую аминокислотную последовательность SEQ ID NO: 7, и CDR3 легкой цепи, включающую аминокислотную последовательность SEQ ID NO: 60; или
q. CDR1 легкой цепи, включающую аминокислотную последовательность SEQ ID NO: 5, CDR2 легкой цепи, включающую аминокислотную последовательность SEQ ID NO: 7, и CDR3 легкой цепи, включающую аминокислотную последовательность SEQ ID NO: 63;
где положение аминокислотных остатков CDR определяется в соответствии с AbM.
Воплощение 4. Молекула антитела по воплощению 3, где молекула антитела включает CDR1 тяжелой цепи, включающую аминокислотную последовательность SEQ ID NO: 4, CDR2 тяжелой цепи, включающую аминокислотную последовательность SEQ ID NO: 6, CDR3 тяжелой цепи, включающую аминокислотную последовательность SEQ ID NO: 8, CDR1 легкой цепи, включающую аминокислотную последовательность SEQ ID NO: 5, CDR2 легкой цепи, включающую аминокислотную последовательность SEQ ID NO: 7, и CDR3 легкой цепи, включающую аминокислотную последовательность SEQ ID NO: 15.
Воплощение 5. Молекула антитела по любому из предыдущих воплощений, где молекула антитела включает вариабельную область тяжелой цепи, включающую аминокислотную последовательность, которая, по меньшей мере, на 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична аминокислотной последовательности SEQ ID NO: 16 и
а. вариабельную область легкой цепи, включающую аминокислотную последовательность, которая, по меньшей мере, на 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична аминокислотной последовательности SEQ ID NO: 17;
b. вариабельную область легкой цепи, включающую аминокислотную последовательность, которая, по меньшей мере, на 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична аминокислотной последовательности SEQ ID NO: 22;
с. вариабельную область легкой цепи, включающую аминокислотную последовательность, которая, по меньшей мере, на 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична аминокислотной последовательности SEQ ID NO: 25;
d. вариабельную область легкой цепи, включающую аминокислотную последовательность, которая, по меньшей мере, на 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична аминокислотной последовательности SEQ ID NO: 28;
е. вариабельную область легкой цепи, включающую аминокислотную последовательность, которая, по меньшей мере, на 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична аминокислотной последовательности SEQ ID NO: 31;
f. вариабельную область легкой цепи, включающую аминокислотную последовательность, которая, по меньшей мере, на 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична аминокислотной последовательности SEQ ID NO: 34;
g. вариабельную область легкой цепи, включающую аминокислотную последовательность, которая, по меньшей мере, на 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична аминокислотной последовательности SEQ ID NO: 37;
h. вариабельную область легкой цепи, включающую аминокислотную последовательность, которая, по меньшей мере, на 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична аминокислотной последовательности SEQ ID NO: 40;
i. вариабельную область легкой цепи, включающую аминокислотную последовательность, которая, по меньшей мере, на 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична аминокислотной последовательности SEQ ID NO: 43;
j. вариабельную область легкой цепи, включающую аминокислотную последовательность, которая, по меньшей мере, на 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична аминокислотной последовательности SEQ ID NO: 46;
k. вариабельную область легкой цепи, включающую аминокислотную последовательность, которая, по меньшей мере, на 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична аминокислотной последовательности SEQ ID NO: 49;
l. вариабельную область легкой цепи, включающую аминокислотную последовательность, которая, по меньшей мере, на 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична аминокислотной последовательности SEQ ID NO: 52;
m. вариабельную область легкой цепи, включающую аминокислотную последовательность, которая, по меньшей мере, на 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична аминокислотной последовательности SEQ ID NO: 55;
n. вариабельную область легкой цепи, включающую аминокислотную последовательность, которая, по меньшей мере, на 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична аминокислотной последовательности SEQ ID NO: 58;
о. вариабельную область легкой цепи, включающую аминокислотную последовательность, которая, по меньшей мере, на 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична аминокислотной последовательности SEQ ID NO: 61;
p. вариабельную область легкой цепи, включающую аминокислотную последовательность, которая, по меньшей мере, на 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична аминокислотной последовательности SEQ ID NO: 64; или
q. вариабельную область легкой цепи, включающую аминокислотную последовательность, которая, по меньшей мере, на 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична аминокислотной последовательности SEQ ID NO: 67.
Воплощение 6. Молекула антитела по любому из предыдущих воплощений, где молекула антитела включает вариабельную область тяжелой цепи, включающую аминокислотную последовательность, которая, по меньшей мере, на 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична аминокислотной последовательности SEQ ID NO: 16 и вариабельную области легкой цепи, включающую аминокислотную последовательность, которая, по меньшей мере, на 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична к аминокислотной последовательности SEQ ID NO: 17.
Воплощение 7. Молекула антитела по любому из предыдущих воплощений, где молекула антитела включает:
а. мутацию S228P;
b. мутацию M252Y, мутацию S254T и мутацию T256E;
с. делецию С-концевого остатка лизина тяжелой цепи; или
d. любую комбинацию a-c.
Воплощение 8. Молекула антитела по воплощению 7, где молекула антитела включает мутацию S228P и делецию С-концевого остатка лизина тяжелой цепи.
Воплощение 9. Молекула антитела по воплощению 7, где молекула антитела включает мутацию S228P, мутацию M252Y, мутацию S254T, мутацию T256E и делецию С-концевого остатка лизина тяжелой цепи.
Воплощение 10. Молекула антитела по любому из предыдущих воплощений, где молекула антитела включает константную область тяжелой цепи IgG4 и константную область легкой цепи лямбда.
Воплощение 11. Молекула антитела по любому из предыдущих воплощений, где молекула антитела включает тяжелую цепь, включающую аминокислотную последовательность, которая идентична, по меньшей мере, на 90%, 95%, 96%, 97%, 98%, 99% или 100% аминокислотной последовательности SEQ ID NO: 18 и
а. легкую цепь, включающую аминокислотную последовательность, которая, по меньшей мере, на 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична аминокислотной последовательности SEQ ID NO: 19;
b. легкую цепь, включающую аминокислотную последовательность, которая, по меньшей мере, на 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична аминокислотной последовательности SEQ ID NO: 23;
с. легкую цепь, включающую аминокислотную последовательность, которая, по меньшей мере, на 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична аминокислотной последовательности SEQ ID NO: 26;
d. легкую цепь, включающую аминокислотную последовательность, которая, по меньшей мере, на 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична аминокислотной последовательности SEQ ID NO: 29;
е. легкую цепь, включающую аминокислотную последовательность, которая, по меньшей мере, на 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична аминокислотной последовательности SEQ ID NO: 32;
f. легкую цепь, включающую аминокислотную последовательность, которая, по меньшей мере, на 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична аминокислотной последовательности SEQ ID NO: 35;
g. легкую цепь, включающую аминокислотную последовательность, которая, по меньшей мере, на 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична аминокислотной последовательности SEQ ID NO: 38;
h. легкую цепь, включающую аминокислотную последовательность, которая, по меньшей мере, на 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична аминокислотной последовательности SEQ ID NO: 41;
i. легкую цепь, включающую аминокислотную последовательность, которая, по меньшей мере, на 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична аминокислотной последовательности SEQ ID NO: 44;
j. легкую цепь, включающую аминокислотную последовательность, которая, по меньшей мере, на 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична аминокислотной последовательности SEQ ID NO: 47;
k. легкую цепь, включающую аминокислотную последовательность, которая, по меньшей мере, на 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична аминокислотной последовательности SEQ ID NO: 50;
l. легкую цепь, включающую аминокислотную последовательность, которая, по меньшей мере, на 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична аминокислотной последовательности SEQ ID NO: 53;
m. легкую цепь, включающую аминокислотную последовательность, которая, по меньшей мере, на 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична аминокислотной последовательности SEQ ID NO: 56;
n. легкую цепь, включающую аминокислотную последовательность, которая, по меньшей мере, на 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична аминокислотной последовательности SEQ ID NO: 59;
о. легкую цепь, включающую аминокислотную последовательность, которая, по меньшей мере, на 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична аминокислотной последовательности SEQ ID NO: 62;
p. легкую цепь, включающую аминокислотную последовательность, которая, по меньшей мере, на 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична аминокислотной последовательности SEQ ID NO: 65; или
q. легкую цепь, включающую аминокислотную последовательность, которая, по меньшей мере, на 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична аминокислотной последовательности SEQ ID NO: 68.
Воплощение 12. Молекула антитела по любому из воплощений 1-10, где молекула антитела включает тяжелую цепь, включающую аминокислотную последовательность, которая, по меньшей мере, на 90%, 95%, 96%, 97%, 98%, 99% или 100%. идентична аминокислотной последовательности SEQ ID NO: 20 и легкой цепи, содержащей аминокислотную последовательность, которая, по меньшей мере, на 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична аминокислотной кислотная последовательность SEQ ID NO: 19.
Воплощение 13. Молекула антитела по воплощению 2 или воплощению 3, где молекула антитела представляет собой Fab-фрагмент, Fab2-фрагмент или одноцепочечное антитело.
Воплощение 14. Молекула антитела по любому из предыдущих воплощений, где молекула антитела обладает одним или несколькими из следующих свойств:
а. уменьшает связывание IL-5 с рецептором IL-5;
b. имеет период полувыведения в сыворотке, по меньшей мере, около 20 дней; или
с. связывает IL-5 человека и яванского макака, но не IL-5 мыши, крысы или морской свинки.
Воплощение 15. Молекула антитела по воплощению 2, где молекула антитела связывается с IL-5 человека с равновесной константой аффинности (KD), по меньшей мере, около 40 пМ, определенной поверхностным плазмонным резонансом.
Воплощение 16. Фармацевтическая композиция, содержащая молекулу антитела по любому из воплощений 1-15.
Воплощение 17. Молекула нуклеиновой кислоты, кодирующая молекулу антитела по любому из воплощений 1-15.
Воплощение 18. Вектор, содержащий молекулу нуклеиновой кислоты по воплощению 17.
Воплощение 19. Клетка, трансформированная для экспрессии молекулы антитела по любому из воплощений 1-15.
Воплощение 20. Способ лечения объекта, страдающего эозинофильной астмой, гиперэозинофильным синдромом, полипозом носа с эозинофильным поражением, эозинофильным гранулематозом с полиангиитом, атопическим дерматитом или эозинофильным эзофагитом, включающий:
введение объекту терапевтически эффективного количества молекулы антитела по любому из воплощений 1-15 или фармацевтической композиции по воплощению 16 для лечения эозинофильной астмы, гиперэозинофильного синдрома, полипоза носа с эозинофильным поражением, эозинофильного гранулематоза с полиангиитом, атопического дерматита или эозинофильного эзофагита.
Воплощение 21. Применение эффективного количества молекулы антитела по любому из воплощений 1-15 или фармацевтической композиции по воплощению 16 для лечения эозинофильной астмы, гиперэозинофильного синдрома, полипоза носа с эозинофильным поражением, эозинофильного гранулематоза с полиангиитом, атопического дерматита или эозинофильного эзофагита.
Воплощение 22. Применение молекулы антитела по любому из воплощений 1-15 или фармацевтической композиции по воплощению 16 при изготовлении лекарственного средства для лечения эозинофильной астмы, гиперэозинофильного синдрома, полипоза носа с эозинофильным поражением, эозинофильного гранулематоза с полиангиитом, атопического дерматита или эозинофильного эзофагита.
--->
СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> CEPHALON, INC.
<120> АНТИ-IL-5 АНТИТЕЛА
<130> 102085.000906
<140>
<141>
<150> 62/438,502
<151> 2016-12-23
<160> 75
<170> PatentIn version 3.5
<210> 1
<211> 11
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
пептид
<220>
<221> МОД_ОСТ
<222> (2)..(2)
<223> Gly или Lys
<220>
<221> МОД_ОСТ
<222> (3)..(3)
<223> Asn или Asp
<220>
<221> МОД_ОСТ
<222> (4)..(4)
<223> Asn или His
<220>
<221> МОД_ОСТ
<222> (5)..(5)
<223> Ile или Ala
<220>
<221> МОД_ОСТ
<222> (6)..(6)
<223> Gly или Asp
<220>
<221> МОД_ОСТ
<222> (7)..(7)
<223> Ser или Lys
<220>
<221> МОД_ОСТ
<222> (9)..(9)
<223> Asn или His
<220>
<221> МОД_ОСТ
<222> (10)..(10)
<223> Val или Ala
<400> 1
Gly Xaa Xaa Xaa Xaa Xaa Xaa Lys Xaa Xaa Tyr
1 5 10
<210> 2
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
пептид
<220>
<221> МОД_ОСТ
<222> (3)..(3)
<223> Ser или Leu
<220>
<221> МОД_ОСТ
<222> (4)..(4)
<223> Asp или Ser
<400> 2
Asp Asp Xaa Xaa Arg Pro Ser
1 5
<210> 3
<211> 11
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
пептид
<220>
<221> МОД_ОСТ
<222> (4)..(4)
<223> Asp или Leu
<220>
<221> МОД_ОСТ
<222> (9)..(9)
<223> His, Ser, Tyr или Asp
<220>
<221> МОД_ОСТ
<222> (11)..(11)
<223> Val, Ala или Trp
<400> 3
Gln Val Trp Xaa Ser Ser Ser Asp Xaa Val Xaa
1 5 10
<210> 4
<211> 12
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
пептид
<400> 4
Gly Gly Ser Ile Ser Asn Gly Gly Tyr Tyr Trp Ser
1 5 10
<210> 5
<211> 11
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
пептид
<400> 5
Gly Gly Asn Asn Ile Gly Ser Lys Asn Val Tyr
1 5 10
<210> 6
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
пептид
<400> 6
Tyr Ile Tyr Tyr Ser Gly Ser Thr Tyr
1 5
<210> 7
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
пептид
<400> 7
Asp Asp Ser Asp Arg Pro Ser
1 5
<210> 8
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
пептид
<400> 8
Leu Gly Asn Trp Phe Asp Tyr
1 5
<210> 9
<211> 11
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
пептид
<400> 9
Gln Val Trp Tyr Ser Ser Ser Asp His Val Val
1 5 10
<210> 10
<211> 117
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 10
Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Gln
1 5 10 15
Thr Leu Ser Leu Thr Cys Thr Val Ser Gly Gly Ser Ile Ser Asn Gly
20 25 30
Gly Tyr Tyr Trp Ser Trp Ile Arg Gln His Pro Gly Lys Gly Leu Glu
35 40 45
Trp Ile Gly Tyr Ile Tyr Tyr Ser Gly Ser Thr Tyr Tyr Asn Pro Ser
50 55 60
Leu Lys Ser Arg Val Ser Ile Ser Val Asp Thr Ser Lys Asn Gln Phe
65 70 75 80
Ser Leu Lys Leu Asn Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr
85 90 95
Cys Ala Ser Leu Gly Asn Trp Phe Asp Tyr Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 11
<211> 109
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 11
Ser Ser Ile Leu Thr Gln Pro Pro Ser Val Ser Val Ala Pro Gly Gln
1 5 10 15
Thr Ala Arg Ile Thr Cys Gly Gly Asn Asn Ile Gly Ser Lys Asn Val
20 25 30
Tyr Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Val Leu Val Val His
35 40 45
Asp Asp Ser Asp Arg Pro Ser Gly Ile Pro Glu Arg Phe Ser Gly Ser
50 55 60
Asn Ser Gly Asn Thr Ala Thr Leu Thr Ile Ser Arg Val Glu Val Gly
65 70 75 80
Asp Glu Ala Asp Tyr Ser Cys Gln Val Trp Tyr Ser Ser Ser Asp His
85 90 95
Val Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu Gly
100 105
<210> 12
<211> 446
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 12
Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Gln
1 5 10 15
Thr Leu Ser Leu Thr Cys Thr Val Ser Gly Gly Ser Ile Ser Asn Gly
20 25 30
Gly Tyr Tyr Trp Ser Trp Ile Arg Gln His Pro Gly Lys Gly Leu Glu
35 40 45
Trp Ile Gly Tyr Ile Tyr Tyr Ser Gly Ser Thr Tyr Tyr Asn Pro Ser
50 55 60
Leu Lys Ser Arg Val Ser Ile Ser Val Asp Thr Ser Lys Asn Gln Phe
65 70 75 80
Ser Leu Lys Leu Asn Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr
85 90 95
Cys Ala Ser Leu Gly Asn Trp Phe Asp Tyr Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu
115 120 125
Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys
130 135 140
Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser
145 150 155 160
Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser
165 170 175
Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser
180 185 190
Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn
195 200 205
Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys Thr His
210 215 220
Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val
225 230 235 240
Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr
245 250 255
Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu
260 265 270
Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys
275 280 285
Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser
290 295 300
Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys
305 310 315 320
Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile
325 330 335
Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro
340 345 350
Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Thr Cys Leu
355 360 365
Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn
370 375 380
Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser
385 390 395 400
Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg
405 410 415
Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu
420 425 430
His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly
435 440 445
<210> 13
<211> 214
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 13
Ser Ser Ile Leu Thr Gln Pro Pro Ser Val Ser Val Ala Pro Gly Gln
1 5 10 15
Thr Ala Arg Ile Thr Cys Gly Gly Asn Asn Ile Gly Ser Lys Asn Val
20 25 30
Tyr Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Val Leu Val Val His
35 40 45
Asp Asp Ser Asp Arg Pro Ser Gly Ile Pro Glu Arg Phe Ser Gly Ser
50 55 60
Asn Ser Gly Asn Thr Ala Thr Leu Thr Ile Ser Arg Val Glu Val Gly
65 70 75 80
Asp Glu Ala Asp Tyr Ser Cys Gln Val Trp Tyr Ser Ser Ser Asp His
85 90 95
Val Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu Gly Gln Pro Lys
100 105 110
Ala Ala Pro Ser Val Thr Leu Phe Pro Pro Ser Ser Glu Glu Leu Gln
115 120 125
Ala Asn Lys Ala Thr Leu Val Cys Leu Ile Ser Asp Phe Tyr Pro Gly
130 135 140
Ala Val Thr Val Ala Trp Lys Ala Asp Ser Ser Pro Val Lys Ala Gly
145 150 155 160
Val Glu Thr Thr Thr Pro Ser Lys Gln Ser Asn Asn Lys Tyr Ala Ala
165 170 175
Ser Ser Tyr Leu Ser Leu Thr Pro Glu Gln Trp Lys Ser His Arg Ser
180 185 190
Tyr Ser Cys Gln Val Thr His Glu Gly Ser Thr Val Glu Lys Thr Val
195 200 205
Ala Pro Thr Glu Cys Ser
210
<210> 14
<211> 443
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 14
Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Gln
1 5 10 15
Thr Leu Ser Leu Thr Cys Thr Val Ser Gly Gly Ser Ile Ser Asn Gly
20 25 30
Gly Tyr Tyr Trp Ser Trp Ile Arg Gln His Pro Gly Lys Gly Leu Glu
35 40 45
Trp Ile Gly Tyr Ile Tyr Tyr Ser Gly Ser Thr Tyr Tyr Asn Pro Ser
50 55 60
Leu Lys Ser Arg Val Ser Ile Ser Val Asp Thr Ser Lys Asn Gln Phe
65 70 75 80
Ser Leu Lys Leu Asn Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr
85 90 95
Cys Ala Ser Leu Gly Asn Trp Phe Asp Tyr Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu
115 120 125
Ala Pro Cys Ser Arg Ser Thr Ser Glu Ser Thr Ala Ala Leu Gly Cys
130 135 140
Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser
145 150 155 160
Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser
165 170 175
Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser
180 185 190
Leu Gly Thr Lys Thr Tyr Thr Cys Asn Val Asp His Lys Pro Ser Asn
195 200 205
Thr Lys Val Asp Lys Arg Val Glu Ser Lys Tyr Gly Pro Pro Cys Pro
210 215 220
Pro Cys Pro Ala Pro Glu Phe Leu Gly Gly Pro Ser Val Phe Leu Phe
225 230 235 240
Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val
245 250 255
Thr Cys Val Val Val Asp Val Ser Gln Glu Asp Pro Glu Val Gln Phe
260 265 270
Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro
275 280 285
Arg Glu Glu Gln Phe Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr
290 295 300
Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val
305 310 315 320
Ser Asn Lys Gly Leu Pro Ser Ser Ile Glu Lys Thr Ile Ser Lys Ala
325 330 335
Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Gln
340 345 350
Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly
355 360 365
Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro
370 375 380
Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser
385 390 395 400
Phe Phe Leu Tyr Ser Arg Leu Thr Val Asp Lys Ser Arg Trp Gln Glu
405 410 415
Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His
420 425 430
Tyr Thr Gln Lys Ser Leu Ser Leu Ser Leu Gly
435 440
<210> 15
<211> 11
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
пептид
<400> 15
Gln Val Trp Asp Ser Ser Ser Asp His Val Val
1 5 10
<210> 16
<211> 117
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 16
Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Gln
1 5 10 15
Thr Leu Ser Leu Thr Cys Thr Val Ser Gly Gly Ser Ile Ser Asn Gly
20 25 30
Gly Tyr Tyr Trp Ser Trp Ile Arg Gln His Pro Gly Lys Gly Leu Glu
35 40 45
Trp Ile Gly Tyr Ile Tyr Tyr Ser Gly Ser Thr Tyr Tyr Asn Pro Ser
50 55 60
Leu Lys Ser Arg Val Thr Ile Ser Val Asp Thr Ser Lys Asn Gln Phe
65 70 75 80
Ser Leu Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr
85 90 95
Cys Ala Ser Leu Gly Asn Trp Phe Asp Tyr Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 17
<211> 109
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 17
Ser Tyr Val Leu Thr Gln Pro Pro Ser Val Ser Val Ala Pro Gly Gln
1 5 10 15
Thr Ala Arg Ile Thr Cys Gly Gly Asn Asn Ile Gly Ser Lys Asn Val
20 25 30
Tyr Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Val Leu Val Val His
35 40 45
Asp Asp Ser Asp Arg Pro Ser Gly Ile Pro Glu Arg Phe Ser Gly Ser
50 55 60
Asn Ser Gly Asn Thr Ala Thr Leu Thr Ile Ser Arg Val Glu Val Gly
65 70 75 80
Asp Glu Ala Asp Tyr Ser Cys Gln Val Trp Asp Ser Ser Ser Asp His
85 90 95
Val Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu Gly
100 105
<210> 18
<211> 443
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 18
Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Gln
1 5 10 15
Thr Leu Ser Leu Thr Cys Thr Val Ser Gly Gly Ser Ile Ser Asn Gly
20 25 30
Gly Tyr Tyr Trp Ser Trp Ile Arg Gln His Pro Gly Lys Gly Leu Glu
35 40 45
Trp Ile Gly Tyr Ile Tyr Tyr Ser Gly Ser Thr Tyr Tyr Asn Pro Ser
50 55 60
Leu Lys Ser Arg Val Thr Ile Ser Val Asp Thr Ser Lys Asn Gln Phe
65 70 75 80
Ser Leu Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr
85 90 95
Cys Ala Ser Leu Gly Asn Trp Phe Asp Tyr Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu
115 120 125
Ala Pro Cys Ser Arg Ser Thr Ser Glu Ser Thr Ala Ala Leu Gly Cys
130 135 140
Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser
145 150 155 160
Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser
165 170 175
Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser
180 185 190
Leu Gly Thr Lys Thr Tyr Thr Cys Asn Val Asp His Lys Pro Ser Asn
195 200 205
Thr Lys Val Asp Lys Arg Val Glu Ser Lys Tyr Gly Pro Pro Cys Pro
210 215 220
Pro Cys Pro Ala Pro Glu Phe Leu Gly Gly Pro Ser Val Phe Leu Phe
225 230 235 240
Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val
245 250 255
Thr Cys Val Val Val Asp Val Ser Gln Glu Asp Pro Glu Val Gln Phe
260 265 270
Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro
275 280 285
Arg Glu Glu Gln Phe Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr
290 295 300
Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val
305 310 315 320
Ser Asn Lys Gly Leu Pro Ser Ser Ile Glu Lys Thr Ile Ser Lys Ala
325 330 335
Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Gln
340 345 350
Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly
355 360 365
Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro
370 375 380
Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser
385 390 395 400
Phe Phe Leu Tyr Ser Arg Leu Thr Val Asp Lys Ser Arg Trp Gln Glu
405 410 415
Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His
420 425 430
Tyr Thr Gln Lys Ser Leu Ser Leu Ser Leu Gly
435 440
<210> 19
<211> 214
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 19
Ser Tyr Val Leu Thr Gln Pro Pro Ser Val Ser Val Ala Pro Gly Gln
1 5 10 15
Thr Ala Arg Ile Thr Cys Gly Gly Asn Asn Ile Gly Ser Lys Asn Val
20 25 30
Tyr Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Val Leu Val Val His
35 40 45
Asp Asp Ser Asp Arg Pro Ser Gly Ile Pro Glu Arg Phe Ser Gly Ser
50 55 60
Asn Ser Gly Asn Thr Ala Thr Leu Thr Ile Ser Arg Val Glu Val Gly
65 70 75 80
Asp Glu Ala Asp Tyr Ser Cys Gln Val Trp Asp Ser Ser Ser Asp His
85 90 95
Val Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu Gly Gln Pro Lys
100 105 110
Ala Ala Pro Ser Val Thr Leu Phe Pro Pro Ser Ser Glu Glu Leu Gln
115 120 125
Ala Asn Lys Ala Thr Leu Val Cys Leu Ile Ser Asp Phe Tyr Pro Gly
130 135 140
Ala Val Thr Val Ala Trp Lys Ala Asp Ser Ser Pro Val Lys Ala Gly
145 150 155 160
Val Glu Thr Thr Thr Pro Ser Lys Gln Ser Asn Asn Lys Tyr Ala Ala
165 170 175
Ser Ser Tyr Leu Ser Leu Thr Pro Glu Gln Trp Lys Ser His Arg Ser
180 185 190
Tyr Ser Cys Gln Val Thr His Glu Gly Ser Thr Val Glu Lys Thr Val
195 200 205
Ala Pro Thr Glu Cys Ser
210
<210> 20
<211> 443
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 20
Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Gln
1 5 10 15
Thr Leu Ser Leu Thr Cys Thr Val Ser Gly Gly Ser Ile Ser Asn Gly
20 25 30
Gly Tyr Tyr Trp Ser Trp Ile Arg Gln His Pro Gly Lys Gly Leu Glu
35 40 45
Trp Ile Gly Tyr Ile Tyr Tyr Ser Gly Ser Thr Tyr Tyr Asn Pro Ser
50 55 60
Leu Lys Ser Arg Val Thr Ile Ser Val Asp Thr Ser Lys Asn Gln Phe
65 70 75 80
Ser Leu Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr
85 90 95
Cys Ala Ser Leu Gly Asn Trp Phe Asp Tyr Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu
115 120 125
Ala Pro Cys Ser Arg Ser Thr Ser Glu Ser Thr Ala Ala Leu Gly Cys
130 135 140
Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser
145 150 155 160
Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser
165 170 175
Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser
180 185 190
Leu Gly Thr Lys Thr Tyr Thr Cys Asn Val Asp His Lys Pro Ser Asn
195 200 205
Thr Lys Val Asp Lys Arg Val Glu Ser Lys Tyr Gly Pro Pro Cys Pro
210 215 220
Pro Cys Pro Ala Pro Glu Phe Leu Gly Gly Pro Ser Val Phe Leu Phe
225 230 235 240
Pro Pro Lys Pro Lys Asp Thr Leu Tyr Ile Thr Arg Glu Pro Glu Val
245 250 255
Thr Cys Val Val Val Asp Val Ser Gln Glu Asp Pro Glu Val Gln Phe
260 265 270
Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro
275 280 285
Arg Glu Glu Gln Phe Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr
290 295 300
Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val
305 310 315 320
Ser Asn Lys Gly Leu Pro Ser Ser Ile Glu Lys Thr Ile Ser Lys Ala
325 330 335
Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Gln
340 345 350
Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly
355 360 365
Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro
370 375 380
Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser
385 390 395 400
Phe Phe Leu Tyr Ser Arg Leu Thr Val Asp Lys Ser Arg Trp Gln Glu
405 410 415
Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His
420 425 430
Tyr Thr Gln Lys Ser Leu Ser Leu Ser Leu Gly
435 440
<210> 21
<211> 11
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
пептид
<400> 21
Gly Lys Asn Asn Ile Gly Ser Lys Asn Val Tyr
1 5 10
<210> 22
<211> 109
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 22
Ser Tyr Val Leu Thr Gln Pro Pro Ser Val Ser Val Ala Pro Gly Gln
1 5 10 15
Thr Ala Arg Ile Thr Cys Gly Lys Asn Asn Ile Gly Ser Lys Asn Val
20 25 30
Tyr Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Val Leu Val Val His
35 40 45
Asp Asp Ser Asp Arg Pro Ser Gly Ile Pro Glu Arg Phe Ser Gly Ser
50 55 60
Asn Ser Gly Asn Thr Ala Thr Leu Thr Ile Ser Arg Val Glu Val Gly
65 70 75 80
Asp Glu Ala Asp Tyr Ser Cys Gln Val Trp Asp Ser Ser Ser Asp His
85 90 95
Val Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu Gly
100 105
<210> 23
<211> 214
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 23
Ser Tyr Val Leu Thr Gln Pro Pro Ser Val Ser Val Ala Pro Gly Gln
1 5 10 15
Thr Ala Arg Ile Thr Cys Gly Lys Asn Asn Ile Gly Ser Lys Asn Val
20 25 30
Tyr Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Val Leu Val Val His
35 40 45
Asp Asp Ser Asp Arg Pro Ser Gly Ile Pro Glu Arg Phe Ser Gly Ser
50 55 60
Asn Ser Gly Asn Thr Ala Thr Leu Thr Ile Ser Arg Val Glu Val Gly
65 70 75 80
Asp Glu Ala Asp Tyr Ser Cys Gln Val Trp Asp Ser Ser Ser Asp His
85 90 95
Val Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu Gly Gln Pro Lys
100 105 110
Ala Ala Pro Ser Val Thr Leu Phe Pro Pro Ser Ser Glu Glu Leu Gln
115 120 125
Ala Asn Lys Ala Thr Leu Val Cys Leu Ile Ser Asp Phe Tyr Pro Gly
130 135 140
Ala Val Thr Val Ala Trp Lys Ala Asp Ser Ser Pro Val Lys Ala Gly
145 150 155 160
Val Glu Thr Thr Thr Pro Ser Lys Gln Ser Asn Asn Lys Tyr Ala Ala
165 170 175
Ser Ser Tyr Leu Ser Leu Thr Pro Glu Gln Trp Lys Ser His Arg Ser
180 185 190
Tyr Ser Cys Gln Val Thr His Glu Gly Ser Thr Val Glu Lys Thr Val
195 200 205
Ala Pro Thr Glu Cys Ser
210
<210> 24
<211> 11
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
пептид
<400> 24
Gly Gly Asp Asn Ile Gly Ser Lys Asn Val Tyr
1 5 10
<210> 25
<211> 109
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 25
Ser Tyr Val Leu Thr Gln Pro Pro Ser Val Ser Val Ala Pro Gly Gln
1 5 10 15
Thr Ala Arg Ile Thr Cys Gly Gly Asp Asn Ile Gly Ser Lys Asn Val
20 25 30
Tyr Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Val Leu Val Val His
35 40 45
Asp Asp Ser Asp Arg Pro Ser Gly Ile Pro Glu Arg Phe Ser Gly Ser
50 55 60
Asn Ser Gly Asn Thr Ala Thr Leu Thr Ile Ser Arg Val Glu Val Gly
65 70 75 80
Asp Glu Ala Asp Tyr Ser Cys Gln Val Trp Asp Ser Ser Ser Asp His
85 90 95
Val Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu Gly
100 105
<210> 26
<211> 214
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 26
Ser Tyr Val Leu Thr Gln Pro Pro Ser Val Ser Val Ala Pro Gly Gln
1 5 10 15
Thr Ala Arg Ile Thr Cys Gly Gly Asp Asn Ile Gly Ser Lys Asn Val
20 25 30
Tyr Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Val Leu Val Val His
35 40 45
Asp Asp Ser Asp Arg Pro Ser Gly Ile Pro Glu Arg Phe Ser Gly Ser
50 55 60
Asn Ser Gly Asn Thr Ala Thr Leu Thr Ile Ser Arg Val Glu Val Gly
65 70 75 80
Asp Glu Ala Asp Tyr Ser Cys Gln Val Trp Asp Ser Ser Ser Asp His
85 90 95
Val Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu Gly Gln Pro Lys
100 105 110
Ala Ala Pro Ser Val Thr Leu Phe Pro Pro Ser Ser Glu Glu Leu Gln
115 120 125
Ala Asn Lys Ala Thr Leu Val Cys Leu Ile Ser Asp Phe Tyr Pro Gly
130 135 140
Ala Val Thr Val Ala Trp Lys Ala Asp Ser Ser Pro Val Lys Ala Gly
145 150 155 160
Val Glu Thr Thr Thr Pro Ser Lys Gln Ser Asn Asn Lys Tyr Ala Ala
165 170 175
Ser Ser Tyr Leu Ser Leu Thr Pro Glu Gln Trp Lys Ser His Arg Ser
180 185 190
Tyr Ser Cys Gln Val Thr His Glu Gly Ser Thr Val Glu Lys Thr Val
195 200 205
Ala Pro Thr Glu Cys Ser
210
<210> 27
<211> 11
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
пептид
<400> 27
Gly Gly Asn His Ile Gly Ser Lys Asn Val Tyr
1 5 10
<210> 28
<211> 109
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 28
Ser Tyr Val Leu Thr Gln Pro Pro Ser Val Ser Val Ala Pro Gly Gln
1 5 10 15
Thr Ala Arg Ile Thr Cys Gly Gly Asn His Ile Gly Ser Lys Asn Val
20 25 30
Tyr Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Val Leu Val Val His
35 40 45
Asp Asp Ser Asp Arg Pro Ser Gly Ile Pro Glu Arg Phe Ser Gly Ser
50 55 60
Asn Ser Gly Asn Thr Ala Thr Leu Thr Ile Ser Arg Val Glu Val Gly
65 70 75 80
Asp Glu Ala Asp Tyr Ser Cys Gln Val Trp Asp Ser Ser Ser Asp His
85 90 95
Val Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu Gly
100 105
<210> 29
<211> 214
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 29
Ser Tyr Val Leu Thr Gln Pro Pro Ser Val Ser Val Ala Pro Gly Gln
1 5 10 15
Thr Ala Arg Ile Thr Cys Gly Gly Asn His Ile Gly Ser Lys Asn Val
20 25 30
Tyr Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Val Leu Val Val His
35 40 45
Asp Asp Ser Asp Arg Pro Ser Gly Ile Pro Glu Arg Phe Ser Gly Ser
50 55 60
Asn Ser Gly Asn Thr Ala Thr Leu Thr Ile Ser Arg Val Glu Val Gly
65 70 75 80
Asp Glu Ala Asp Tyr Ser Cys Gln Val Trp Asp Ser Ser Ser Asp His
85 90 95
Val Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu Gly Gln Pro Lys
100 105 110
Ala Ala Pro Ser Val Thr Leu Phe Pro Pro Ser Ser Glu Glu Leu Gln
115 120 125
Ala Asn Lys Ala Thr Leu Val Cys Leu Ile Ser Asp Phe Tyr Pro Gly
130 135 140
Ala Val Thr Val Ala Trp Lys Ala Asp Ser Ser Pro Val Lys Ala Gly
145 150 155 160
Val Glu Thr Thr Thr Pro Ser Lys Gln Ser Asn Asn Lys Tyr Ala Ala
165 170 175
Ser Ser Tyr Leu Ser Leu Thr Pro Glu Gln Trp Lys Ser His Arg Ser
180 185 190
Tyr Ser Cys Gln Val Thr His Glu Gly Ser Thr Val Glu Lys Thr Val
195 200 205
Ala Pro Thr Glu Cys Ser
210
<210> 30
<211> 11
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
пептид
<400> 30
Gly Gly Asn Asn Ala Gly Ser Lys Asn Val Tyr
1 5 10
<210> 31
<211> 109
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 31
Ser Tyr Val Leu Thr Gln Pro Pro Ser Val Ser Val Ala Pro Gly Gln
1 5 10 15
Thr Ala Arg Ile Thr Cys Gly Gly Asn Asn Ala Gly Ser Lys Asn Val
20 25 30
Tyr Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Val Leu Val Val His
35 40 45
Asp Asp Ser Asp Arg Pro Ser Gly Ile Pro Glu Arg Phe Ser Gly Ser
50 55 60
Asn Ser Gly Asn Thr Ala Thr Leu Thr Ile Ser Arg Val Glu Val Gly
65 70 75 80
Asp Glu Ala Asp Tyr Ser Cys Gln Val Trp Asp Ser Ser Ser Asp His
85 90 95
Val Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu Gly
100 105
<210> 32
<211> 214
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 32
Ser Tyr Val Leu Thr Gln Pro Pro Ser Val Ser Val Ala Pro Gly Gln
1 5 10 15
Thr Ala Arg Ile Thr Cys Gly Gly Asn Asn Ala Gly Ser Lys Asn Val
20 25 30
Tyr Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Val Leu Val Val His
35 40 45
Asp Asp Ser Asp Arg Pro Ser Gly Ile Pro Glu Arg Phe Ser Gly Ser
50 55 60
Asn Ser Gly Asn Thr Ala Thr Leu Thr Ile Ser Arg Val Glu Val Gly
65 70 75 80
Asp Glu Ala Asp Tyr Ser Cys Gln Val Trp Asp Ser Ser Ser Asp His
85 90 95
Val Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu Gly Gln Pro Lys
100 105 110
Ala Ala Pro Ser Val Thr Leu Phe Pro Pro Ser Ser Glu Glu Leu Gln
115 120 125
Ala Asn Lys Ala Thr Leu Val Cys Leu Ile Ser Asp Phe Tyr Pro Gly
130 135 140
Ala Val Thr Val Ala Trp Lys Ala Asp Ser Ser Pro Val Lys Ala Gly
145 150 155 160
Val Glu Thr Thr Thr Pro Ser Lys Gln Ser Asn Asn Lys Tyr Ala Ala
165 170 175
Ser Ser Tyr Leu Ser Leu Thr Pro Glu Gln Trp Lys Ser His Arg Ser
180 185 190
Tyr Ser Cys Gln Val Thr His Glu Gly Ser Thr Val Glu Lys Thr Val
195 200 205
Ala Pro Thr Glu Cys Ser
210
<210> 33
<211> 11
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
пептид
<400> 33
Gly Gly Asn Asn Ile Gly Lys Lys Asn Val Tyr
1 5 10
<210> 34
<211> 109
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 34
Ser Tyr Val Leu Thr Gln Pro Pro Ser Val Ser Val Ala Pro Gly Gln
1 5 10 15
Thr Ala Arg Ile Thr Cys Gly Gly Asn Asn Ile Gly Lys Lys Asn Val
20 25 30
Tyr Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Val Leu Val Val His
35 40 45
Asp Asp Ser Asp Arg Pro Ser Gly Ile Pro Glu Arg Phe Ser Gly Ser
50 55 60
Asn Ser Gly Asn Thr Ala Thr Leu Thr Ile Ser Arg Val Glu Val Gly
65 70 75 80
Asp Glu Ala Asp Tyr Ser Cys Gln Val Trp Asp Ser Ser Ser Asp His
85 90 95
Val Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu Gly
100 105
<210> 35
<211> 214
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 35
Ser Tyr Val Leu Thr Gln Pro Pro Ser Val Ser Val Ala Pro Gly Gln
1 5 10 15
Thr Ala Arg Ile Thr Cys Gly Gly Asn Asn Ile Gly Lys Lys Asn Val
20 25 30
Tyr Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Val Leu Val Val His
35 40 45
Asp Asp Ser Asp Arg Pro Ser Gly Ile Pro Glu Arg Phe Ser Gly Ser
50 55 60
Asn Ser Gly Asn Thr Ala Thr Leu Thr Ile Ser Arg Val Glu Val Gly
65 70 75 80
Asp Glu Ala Asp Tyr Ser Cys Gln Val Trp Asp Ser Ser Ser Asp His
85 90 95
Val Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu Gly Gln Pro Lys
100 105 110
Ala Ala Pro Ser Val Thr Leu Phe Pro Pro Ser Ser Glu Glu Leu Gln
115 120 125
Ala Asn Lys Ala Thr Leu Val Cys Leu Ile Ser Asp Phe Tyr Pro Gly
130 135 140
Ala Val Thr Val Ala Trp Lys Ala Asp Ser Ser Pro Val Lys Ala Gly
145 150 155 160
Val Glu Thr Thr Thr Pro Ser Lys Gln Ser Asn Asn Lys Tyr Ala Ala
165 170 175
Ser Ser Tyr Leu Ser Leu Thr Pro Glu Gln Trp Lys Ser His Arg Ser
180 185 190
Tyr Ser Cys Gln Val Thr His Glu Gly Ser Thr Val Glu Lys Thr Val
195 200 205
Ala Pro Thr Glu Cys Ser
210
<210> 36
<211> 11
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
пептид
<400> 36
Gly Gly Asn Asn Ile Gly Ser Lys His Val Tyr
1 5 10
<210> 37
<211> 109
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 37
Ser Tyr Val Leu Thr Gln Pro Pro Ser Val Ser Val Ala Pro Gly Gln
1 5 10 15
Thr Ala Arg Ile Thr Cys Gly Gly Asn Asn Ile Gly Ser Lys His Val
20 25 30
Tyr Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Val Leu Val Val His
35 40 45
Asp Asp Ser Asp Arg Pro Ser Gly Ile Pro Glu Arg Phe Ser Gly Ser
50 55 60
Asn Ser Gly Asn Thr Ala Thr Leu Thr Ile Ser Arg Val Glu Val Gly
65 70 75 80
Asp Glu Ala Asp Tyr Ser Cys Gln Val Trp Asp Ser Ser Ser Asp His
85 90 95
Val Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu Gly
100 105
<210> 38
<211> 214
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 38
Ser Tyr Val Leu Thr Gln Pro Pro Ser Val Ser Val Ala Pro Gly Gln
1 5 10 15
Thr Ala Arg Ile Thr Cys Gly Gly Asn Asn Ile Gly Ser Lys His Val
20 25 30
Tyr Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Val Leu Val Val His
35 40 45
Asp Asp Ser Asp Arg Pro Ser Gly Ile Pro Glu Arg Phe Ser Gly Ser
50 55 60
Asn Ser Gly Asn Thr Ala Thr Leu Thr Ile Ser Arg Val Glu Val Gly
65 70 75 80
Asp Glu Ala Asp Tyr Ser Cys Gln Val Trp Asp Ser Ser Ser Asp His
85 90 95
Val Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu Gly Gln Pro Lys
100 105 110
Ala Ala Pro Ser Val Thr Leu Phe Pro Pro Ser Ser Glu Glu Leu Gln
115 120 125
Ala Asn Lys Ala Thr Leu Val Cys Leu Ile Ser Asp Phe Tyr Pro Gly
130 135 140
Ala Val Thr Val Ala Trp Lys Ala Asp Ser Ser Pro Val Lys Ala Gly
145 150 155 160
Val Glu Thr Thr Thr Pro Ser Lys Gln Ser Asn Asn Lys Tyr Ala Ala
165 170 175
Ser Ser Tyr Leu Ser Leu Thr Pro Glu Gln Trp Lys Ser His Arg Ser
180 185 190
Tyr Ser Cys Gln Val Thr His Glu Gly Ser Thr Val Glu Lys Thr Val
195 200 205
Ala Pro Thr Glu Cys Ser
210
<210> 39
<211> 11
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
пептид
<400> 39
Gly Gly Asn Asn Ile Gly Ser Lys Asn Ala Tyr
1 5 10
<210> 40
<211> 109
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 40
Ser Tyr Val Leu Thr Gln Pro Pro Ser Val Ser Val Ala Pro Gly Gln
1 5 10 15
Thr Ala Arg Ile Thr Cys Gly Gly Asn Asn Ile Gly Ser Lys Asn Ala
20 25 30
Tyr Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Val Leu Val Val His
35 40 45
Asp Asp Ser Asp Arg Pro Ser Gly Ile Pro Glu Arg Phe Ser Gly Ser
50 55 60
Asn Ser Gly Asn Thr Ala Thr Leu Thr Ile Ser Arg Val Glu Val Gly
65 70 75 80
Asp Glu Ala Asp Tyr Ser Cys Gln Val Trp Asp Ser Ser Ser Asp His
85 90 95
Val Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu Gly
100 105
<210> 41
<211> 214
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 41
Ser Tyr Val Leu Thr Gln Pro Pro Ser Val Ser Val Ala Pro Gly Gln
1 5 10 15
Thr Ala Arg Ile Thr Cys Gly Gly Asn Asn Ile Gly Ser Lys Asn Ala
20 25 30
Tyr Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Val Leu Val Val His
35 40 45
Asp Asp Ser Asp Arg Pro Ser Gly Ile Pro Glu Arg Phe Ser Gly Ser
50 55 60
Asn Ser Gly Asn Thr Ala Thr Leu Thr Ile Ser Arg Val Glu Val Gly
65 70 75 80
Asp Glu Ala Asp Tyr Ser Cys Gln Val Trp Asp Ser Ser Ser Asp His
85 90 95
Val Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu Gly Gln Pro Lys
100 105 110
Ala Ala Pro Ser Val Thr Leu Phe Pro Pro Ser Ser Glu Glu Leu Gln
115 120 125
Ala Asn Lys Ala Thr Leu Val Cys Leu Ile Ser Asp Phe Tyr Pro Gly
130 135 140
Ala Val Thr Val Ala Trp Lys Ala Asp Ser Ser Pro Val Lys Ala Gly
145 150 155 160
Val Glu Thr Thr Thr Pro Ser Lys Gln Ser Asn Asn Lys Tyr Ala Ala
165 170 175
Ser Ser Tyr Leu Ser Leu Thr Pro Glu Gln Trp Lys Ser His Arg Ser
180 185 190
Tyr Ser Cys Gln Val Thr His Glu Gly Ser Thr Val Glu Lys Thr Val
195 200 205
Ala Pro Thr Glu Cys Ser
210
<210> 42
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
пептид
<400> 42
Asp Asp Leu Asp Arg Pro Ser
1 5
<210> 43
<211> 109
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 43
Ser Tyr Val Leu Thr Gln Pro Pro Ser Val Ser Val Ala Pro Gly Gln
1 5 10 15
Thr Ala Arg Ile Thr Cys Gly Gly Asn Asn Ile Gly Ser Lys Asn Val
20 25 30
Tyr Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Val Leu Val Val His
35 40 45
Asp Asp Leu Asp Arg Pro Ser Gly Ile Pro Glu Arg Phe Ser Gly Ser
50 55 60
Asn Ser Gly Asn Thr Ala Thr Leu Thr Ile Ser Arg Val Glu Val Gly
65 70 75 80
Asp Glu Ala Asp Tyr Ser Cys Gln Val Trp Asp Ser Ser Ser Asp His
85 90 95
Val Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu Gly
100 105
<210> 44
<211> 214
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 44
Ser Tyr Val Leu Thr Gln Pro Pro Ser Val Ser Val Ala Pro Gly Gln
1 5 10 15
Thr Ala Arg Ile Thr Cys Gly Gly Asn Asn Ile Gly Ser Lys Asn Val
20 25 30
Tyr Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Val Leu Val Val His
35 40 45
Asp Asp Leu Asp Arg Pro Ser Gly Ile Pro Glu Arg Phe Ser Gly Ser
50 55 60
Asn Ser Gly Asn Thr Ala Thr Leu Thr Ile Ser Arg Val Glu Val Gly
65 70 75 80
Asp Glu Ala Asp Tyr Ser Cys Gln Val Trp Asp Ser Ser Ser Asp His
85 90 95
Val Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu Gly Gln Pro Lys
100 105 110
Ala Ala Pro Ser Val Thr Leu Phe Pro Pro Ser Ser Glu Glu Leu Gln
115 120 125
Ala Asn Lys Ala Thr Leu Val Cys Leu Ile Ser Asp Phe Tyr Pro Gly
130 135 140
Ala Val Thr Val Ala Trp Lys Ala Asp Ser Ser Pro Val Lys Ala Gly
145 150 155 160
Val Glu Thr Thr Thr Pro Ser Lys Gln Ser Asn Asn Lys Tyr Ala Ala
165 170 175
Ser Ser Tyr Leu Ser Leu Thr Pro Glu Gln Trp Lys Ser His Arg Ser
180 185 190
Tyr Ser Cys Gln Val Thr His Glu Gly Ser Thr Val Glu Lys Thr Val
195 200 205
Ala Pro Thr Glu Cys Ser
210
<210> 45
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
пептид
<400> 45
Asp Asp Ser Ser Arg Pro Ser
1 5
<210> 46
<211> 109
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 46
Ser Tyr Val Leu Thr Gln Pro Pro Ser Val Ser Val Ala Pro Gly Gln
1 5 10 15
Thr Ala Arg Ile Thr Cys Gly Gly Asn Asn Ile Gly Ser Lys Asn Val
20 25 30
Tyr Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Val Leu Val Val His
35 40 45
Asp Asp Ser Ser Arg Pro Ser Gly Ile Pro Glu Arg Phe Ser Gly Ser
50 55 60
Asn Ser Gly Asn Thr Ala Thr Leu Thr Ile Ser Arg Val Glu Val Gly
65 70 75 80
Asp Glu Ala Asp Tyr Ser Cys Gln Val Trp Asp Ser Ser Ser Asp His
85 90 95
Val Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu Gly
100 105
<210> 47
<211> 214
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 47
Ser Tyr Val Leu Thr Gln Pro Pro Ser Val Ser Val Ala Pro Gly Gln
1 5 10 15
Thr Ala Arg Ile Thr Cys Gly Gly Asn Asn Ile Gly Ser Lys Asn Val
20 25 30
Tyr Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Val Leu Val Val His
35 40 45
Asp Asp Ser Ser Arg Pro Ser Gly Ile Pro Glu Arg Phe Ser Gly Ser
50 55 60
Asn Ser Gly Asn Thr Ala Thr Leu Thr Ile Ser Arg Val Glu Val Gly
65 70 75 80
Asp Glu Ala Asp Tyr Ser Cys Gln Val Trp Asp Ser Ser Ser Asp His
85 90 95
Val Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu Gly Gln Pro Lys
100 105 110
Ala Ala Pro Ser Val Thr Leu Phe Pro Pro Ser Ser Glu Glu Leu Gln
115 120 125
Ala Asn Lys Ala Thr Leu Val Cys Leu Ile Ser Asp Phe Tyr Pro Gly
130 135 140
Ala Val Thr Val Ala Trp Lys Ala Asp Ser Ser Pro Val Lys Ala Gly
145 150 155 160
Val Glu Thr Thr Thr Pro Ser Lys Gln Ser Asn Asn Lys Tyr Ala Ala
165 170 175
Ser Ser Tyr Leu Ser Leu Thr Pro Glu Gln Trp Lys Ser His Arg Ser
180 185 190
Tyr Ser Cys Gln Val Thr His Glu Gly Ser Thr Val Glu Lys Thr Val
195 200 205
Ala Pro Thr Glu Cys Ser
210
<210> 48
<211> 11
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
пептид
<400> 48
Gln Val Trp Leu Ser Ser Ser Asp His Val Val
1 5 10
<210> 49
<211> 109
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 49
Ser Tyr Val Leu Thr Gln Pro Pro Ser Val Ser Val Ala Pro Gly Gln
1 5 10 15
Thr Ala Arg Ile Thr Cys Gly Gly Asn Asn Ile Gly Ser Lys Asn Val
20 25 30
Tyr Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Val Leu Val Val His
35 40 45
Asp Asp Ser Asp Arg Pro Ser Gly Ile Pro Glu Arg Phe Ser Gly Ser
50 55 60
Asn Ser Gly Asn Thr Ala Thr Leu Thr Ile Ser Arg Val Glu Val Gly
65 70 75 80
Asp Glu Ala Asp Tyr Ser Cys Gln Val Trp Leu Ser Ser Ser Asp His
85 90 95
Val Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu Gly
100 105
<210> 50
<211> 214
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 50
Ser Tyr Val Leu Thr Gln Pro Pro Ser Val Ser Val Ala Pro Gly Gln
1 5 10 15
Thr Ala Arg Ile Thr Cys Gly Gly Asn Asn Ile Gly Ser Lys Asn Val
20 25 30
Tyr Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Val Leu Val Val His
35 40 45
Asp Asp Ser Asp Arg Pro Ser Gly Ile Pro Glu Arg Phe Ser Gly Ser
50 55 60
Asn Ser Gly Asn Thr Ala Thr Leu Thr Ile Ser Arg Val Glu Val Gly
65 70 75 80
Asp Glu Ala Asp Tyr Ser Cys Gln Val Trp Leu Ser Ser Ser Asp His
85 90 95
Val Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu Gly Gln Pro Lys
100 105 110
Ala Ala Pro Ser Val Thr Leu Phe Pro Pro Ser Ser Glu Glu Leu Gln
115 120 125
Ala Asn Lys Ala Thr Leu Val Cys Leu Ile Ser Asp Phe Tyr Pro Gly
130 135 140
Ala Val Thr Val Ala Trp Lys Ala Asp Ser Ser Pro Val Lys Ala Gly
145 150 155 160
Val Glu Thr Thr Thr Pro Ser Lys Gln Ser Asn Asn Lys Tyr Ala Ala
165 170 175
Ser Ser Tyr Leu Ser Leu Thr Pro Glu Gln Trp Lys Ser His Arg Ser
180 185 190
Tyr Ser Cys Gln Val Thr His Glu Gly Ser Thr Val Glu Lys Thr Val
195 200 205
Ala Pro Thr Glu Cys Ser
210
<210> 51
<211> 11
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
пептид
<400> 51
Gln Val Trp Asp Ser Ser Ser Asp Ser Val Val
1 5 10
<210> 52
<211> 109
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 52
Ser Tyr Val Leu Thr Gln Pro Pro Ser Val Ser Val Ala Pro Gly Gln
1 5 10 15
Thr Ala Arg Ile Thr Cys Gly Gly Asn Asn Ile Gly Ser Lys Asn Val
20 25 30
Tyr Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Val Leu Val Val His
35 40 45
Asp Asp Ser Asp Arg Pro Ser Gly Ile Pro Glu Arg Phe Ser Gly Ser
50 55 60
Asn Ser Gly Asn Thr Ala Thr Leu Thr Ile Ser Arg Val Glu Val Gly
65 70 75 80
Asp Glu Ala Asp Tyr Ser Cys Gln Val Trp Asp Ser Ser Ser Asp Ser
85 90 95
Val Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu Gly
100 105
<210> 53
<211> 214
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 53
Ser Tyr Val Leu Thr Gln Pro Pro Ser Val Ser Val Ala Pro Gly Gln
1 5 10 15
Thr Ala Arg Ile Thr Cys Gly Gly Asn Asn Ile Gly Ser Lys Asn Val
20 25 30
Tyr Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Val Leu Val Val His
35 40 45
Asp Asp Ser Asp Arg Pro Ser Gly Ile Pro Glu Arg Phe Ser Gly Ser
50 55 60
Asn Ser Gly Asn Thr Ala Thr Leu Thr Ile Ser Arg Val Glu Val Gly
65 70 75 80
Asp Glu Ala Asp Tyr Ser Cys Gln Val Trp Asp Ser Ser Ser Asp Ser
85 90 95
Val Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu Gly Gln Pro Lys
100 105 110
Ala Ala Pro Ser Val Thr Leu Phe Pro Pro Ser Ser Glu Glu Leu Gln
115 120 125
Ala Asn Lys Ala Thr Leu Val Cys Leu Ile Ser Asp Phe Tyr Pro Gly
130 135 140
Ala Val Thr Val Ala Trp Lys Ala Asp Ser Ser Pro Val Lys Ala Gly
145 150 155 160
Val Glu Thr Thr Thr Pro Ser Lys Gln Ser Asn Asn Lys Tyr Ala Ala
165 170 175
Ser Ser Tyr Leu Ser Leu Thr Pro Glu Gln Trp Lys Ser His Arg Ser
180 185 190
Tyr Ser Cys Gln Val Thr His Glu Gly Ser Thr Val Glu Lys Thr Val
195 200 205
Ala Pro Thr Glu Cys Ser
210
<210> 54
<211> 11
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
пептид
<400> 54
Gln Val Trp Asp Ser Ser Ser Asp Tyr Val Val
1 5 10
<210> 55
<211> 109
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 55
Ser Tyr Val Leu Thr Gln Pro Pro Ser Val Ser Val Ala Pro Gly Gln
1 5 10 15
Thr Ala Arg Ile Thr Cys Gly Gly Asn Asn Ile Gly Ser Lys Asn Val
20 25 30
Tyr Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Val Leu Val Val His
35 40 45
Asp Asp Ser Asp Arg Pro Ser Gly Ile Pro Glu Arg Phe Ser Gly Ser
50 55 60
Asn Ser Gly Asn Thr Ala Thr Leu Thr Ile Ser Arg Val Glu Val Gly
65 70 75 80
Asp Glu Ala Asp Tyr Ser Cys Gln Val Trp Asp Ser Ser Ser Asp Tyr
85 90 95
Val Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu Gly
100 105
<210> 56
<211> 214
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 56
Ser Tyr Val Leu Thr Gln Pro Pro Ser Val Ser Val Ala Pro Gly Gln
1 5 10 15
Thr Ala Arg Ile Thr Cys Gly Gly Asn Asn Ile Gly Ser Lys Asn Val
20 25 30
Tyr Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Val Leu Val Val His
35 40 45
Asp Asp Ser Asp Arg Pro Ser Gly Ile Pro Glu Arg Phe Ser Gly Ser
50 55 60
Asn Ser Gly Asn Thr Ala Thr Leu Thr Ile Ser Arg Val Glu Val Gly
65 70 75 80
Asp Glu Ala Asp Tyr Ser Cys Gln Val Trp Asp Ser Ser Ser Asp Tyr
85 90 95
Val Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu Gly Gln Pro Lys
100 105 110
Ala Ala Pro Ser Val Thr Leu Phe Pro Pro Ser Ser Glu Glu Leu Gln
115 120 125
Ala Asn Lys Ala Thr Leu Val Cys Leu Ile Ser Asp Phe Tyr Pro Gly
130 135 140
Ala Val Thr Val Ala Trp Lys Ala Asp Ser Ser Pro Val Lys Ala Gly
145 150 155 160
Val Glu Thr Thr Thr Pro Ser Lys Gln Ser Asn Asn Lys Tyr Ala Ala
165 170 175
Ser Ser Tyr Leu Ser Leu Thr Pro Glu Gln Trp Lys Ser His Arg Ser
180 185 190
Tyr Ser Cys Gln Val Thr His Glu Gly Ser Thr Val Glu Lys Thr Val
195 200 205
Ala Pro Thr Glu Cys Ser
210
<210> 57
<211> 11
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
пептид
<400> 57
Gln Val Trp Asp Ser Ser Ser Asp Asp Val Val
1 5 10
<210> 58
<211> 109
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 58
Ser Tyr Val Leu Thr Gln Pro Pro Ser Val Ser Val Ala Pro Gly Gln
1 5 10 15
Thr Ala Arg Ile Thr Cys Gly Gly Asn Asn Ile Gly Ser Lys Asn Val
20 25 30
Tyr Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Val Leu Val Val His
35 40 45
Asp Asp Ser Asp Arg Pro Ser Gly Ile Pro Glu Arg Phe Ser Gly Ser
50 55 60
Asn Ser Gly Asn Thr Ala Thr Leu Thr Ile Ser Arg Val Glu Val Gly
65 70 75 80
Asp Glu Ala Asp Tyr Ser Cys Gln Val Trp Asp Ser Ser Ser Asp Asp
85 90 95
Val Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu Gly
100 105
<210> 59
<211> 214
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 59
Ser Tyr Val Leu Thr Gln Pro Pro Ser Val Ser Val Ala Pro Gly Gln
1 5 10 15
Thr Ala Arg Ile Thr Cys Gly Gly Asn Asn Ile Gly Ser Lys Asn Val
20 25 30
Tyr Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Val Leu Val Val His
35 40 45
Asp Asp Ser Asp Arg Pro Ser Gly Ile Pro Glu Arg Phe Ser Gly Ser
50 55 60
Asn Ser Gly Asn Thr Ala Thr Leu Thr Ile Ser Arg Val Glu Val Gly
65 70 75 80
Asp Glu Ala Asp Tyr Ser Cys Gln Val Trp Asp Ser Ser Ser Asp Asp
85 90 95
Val Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu Gly Gln Pro Lys
100 105 110
Ala Ala Pro Ser Val Thr Leu Phe Pro Pro Ser Ser Glu Glu Leu Gln
115 120 125
Ala Asn Lys Ala Thr Leu Val Cys Leu Ile Ser Asp Phe Tyr Pro Gly
130 135 140
Ala Val Thr Val Ala Trp Lys Ala Asp Ser Ser Pro Val Lys Ala Gly
145 150 155 160
Val Glu Thr Thr Thr Pro Ser Lys Gln Ser Asn Asn Lys Tyr Ala Ala
165 170 175
Ser Ser Tyr Leu Ser Leu Thr Pro Glu Gln Trp Lys Ser His Arg Ser
180 185 190
Tyr Ser Cys Gln Val Thr His Glu Gly Ser Thr Val Glu Lys Thr Val
195 200 205
Ala Pro Thr Glu Cys Ser
210
<210> 60
<211> 11
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
пептид
<400> 60
Gln Val Trp Asp Ser Ser Ser Asp His Val Ala
1 5 10
<210> 61
<211> 109
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 61
Ser Tyr Val Leu Thr Gln Pro Pro Ser Val Ser Val Ala Pro Gly Gln
1 5 10 15
Thr Ala Arg Ile Thr Cys Gly Gly Asn Asn Ile Gly Ser Lys Asn Val
20 25 30
Tyr Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Val Leu Val Val His
35 40 45
Asp Asp Ser Asp Arg Pro Ser Gly Ile Pro Glu Arg Phe Ser Gly Ser
50 55 60
Asn Ser Gly Asn Thr Ala Thr Leu Thr Ile Ser Arg Val Glu Val Gly
65 70 75 80
Asp Glu Ala Asp Tyr Ser Cys Gln Val Trp Asp Ser Ser Ser Asp His
85 90 95
Val Ala Phe Gly Gly Gly Thr Lys Leu Thr Val Leu Gly
100 105
<210> 62
<211> 214
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 62
Ser Tyr Val Leu Thr Gln Pro Pro Ser Val Ser Val Ala Pro Gly Gln
1 5 10 15
Thr Ala Arg Ile Thr Cys Gly Gly Asn Asn Ile Gly Ser Lys Asn Val
20 25 30
Tyr Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Val Leu Val Val His
35 40 45
Asp Asp Ser Asp Arg Pro Ser Gly Ile Pro Glu Arg Phe Ser Gly Ser
50 55 60
Asn Ser Gly Asn Thr Ala Thr Leu Thr Ile Ser Arg Val Glu Val Gly
65 70 75 80
Asp Glu Ala Asp Tyr Ser Cys Gln Val Trp Asp Ser Ser Ser Asp His
85 90 95
Val Ala Phe Gly Gly Gly Thr Lys Leu Thr Val Leu Gly Gln Pro Lys
100 105 110
Ala Ala Pro Ser Val Thr Leu Phe Pro Pro Ser Ser Glu Glu Leu Gln
115 120 125
Ala Asn Lys Ala Thr Leu Val Cys Leu Ile Ser Asp Phe Tyr Pro Gly
130 135 140
Ala Val Thr Val Ala Trp Lys Ala Asp Ser Ser Pro Val Lys Ala Gly
145 150 155 160
Val Glu Thr Thr Thr Pro Ser Lys Gln Ser Asn Asn Lys Tyr Ala Ala
165 170 175
Ser Ser Tyr Leu Ser Leu Thr Pro Glu Gln Trp Lys Ser His Arg Ser
180 185 190
Tyr Ser Cys Gln Val Thr His Glu Gly Ser Thr Val Glu Lys Thr Val
195 200 205
Ala Pro Thr Glu Cys Ser
210
<210> 63
<211> 11
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
пептид
<400> 63
Gln Val Trp Asp Ser Ser Ser Asp His Val Trp
1 5 10
<210> 64
<211> 109
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 64
Ser Tyr Val Leu Thr Gln Pro Pro Ser Val Ser Val Ala Pro Gly Gln
1 5 10 15
Thr Ala Arg Ile Thr Cys Gly Gly Asn Asn Ile Gly Ser Lys Asn Val
20 25 30
Tyr Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Val Leu Val Val His
35 40 45
Asp Asp Ser Asp Arg Pro Ser Gly Ile Pro Glu Arg Phe Ser Gly Ser
50 55 60
Asn Ser Gly Asn Thr Ala Thr Leu Thr Ile Ser Arg Val Glu Val Gly
65 70 75 80
Asp Glu Ala Asp Tyr Ser Cys Gln Val Trp Asp Ser Ser Ser Asp His
85 90 95
Val Trp Phe Gly Gly Gly Thr Lys Leu Thr Val Leu Gly
100 105
<210> 65
<211> 214
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 65
Ser Tyr Val Leu Thr Gln Pro Pro Ser Val Ser Val Ala Pro Gly Gln
1 5 10 15
Thr Ala Arg Ile Thr Cys Gly Gly Asn Asn Ile Gly Ser Lys Asn Val
20 25 30
Tyr Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Val Leu Val Val His
35 40 45
Asp Asp Ser Asp Arg Pro Ser Gly Ile Pro Glu Arg Phe Ser Gly Ser
50 55 60
Asn Ser Gly Asn Thr Ala Thr Leu Thr Ile Ser Arg Val Glu Val Gly
65 70 75 80
Asp Glu Ala Asp Tyr Ser Cys Gln Val Trp Asp Ser Ser Ser Asp His
85 90 95
Val Trp Phe Gly Gly Gly Thr Lys Leu Thr Val Leu Gly Gln Pro Lys
100 105 110
Ala Ala Pro Ser Val Thr Leu Phe Pro Pro Ser Ser Glu Glu Leu Gln
115 120 125
Ala Asn Lys Ala Thr Leu Val Cys Leu Ile Ser Asp Phe Tyr Pro Gly
130 135 140
Ala Val Thr Val Ala Trp Lys Ala Asp Ser Ser Pro Val Lys Ala Gly
145 150 155 160
Val Glu Thr Thr Thr Pro Ser Lys Gln Ser Asn Asn Lys Tyr Ala Ala
165 170 175
Ser Ser Tyr Leu Ser Leu Thr Pro Glu Gln Trp Lys Ser His Arg Ser
180 185 190
Tyr Ser Cys Gln Val Thr His Glu Gly Ser Thr Val Glu Lys Thr Val
195 200 205
Ala Pro Thr Glu Cys Ser
210
<210> 66
<211> 11
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
пептид
<400> 66
Gly Gly Asn Asn Ile Asp Ser Lys Asn Val Tyr
1 5 10
<210> 67
<211> 109
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 67
Ser Tyr Val Leu Thr Gln Pro Pro Ser Val Ser Val Ala Pro Gly Gln
1 5 10 15
Thr Ala Arg Ile Thr Cys Gly Gly Asn Asn Ile Asp Ser Lys Asn Val
20 25 30
Tyr Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Val Leu Val Val His
35 40 45
Asp Asp Ser Asp Arg Pro Ser Gly Ile Pro Glu Arg Phe Ser Gly Ser
50 55 60
Asn Ser Gly Asn Thr Ala Thr Leu Thr Ile Ser Arg Val Glu Val Gly
65 70 75 80
Asp Glu Ala Asp Tyr Ser Cys Gln Val Trp Asp Ser Ser Ser Asp His
85 90 95
Val Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu Gly
100 105
<210> 68
<211> 214
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 68
Ser Tyr Val Leu Thr Gln Pro Pro Ser Val Ser Val Ala Pro Gly Gln
1 5 10 15
Thr Ala Arg Ile Thr Cys Gly Gly Asn Asn Ile Asp Ser Lys Asn Val
20 25 30
Tyr Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Val Leu Val Val His
35 40 45
Asp Asp Ser Asp Arg Pro Ser Gly Ile Pro Glu Arg Phe Ser Gly Ser
50 55 60
Asn Ser Gly Asn Thr Ala Thr Leu Thr Ile Ser Arg Val Glu Val Gly
65 70 75 80
Asp Glu Ala Asp Tyr Ser Cys Gln Val Trp Asp Ser Ser Ser Asp His
85 90 95
Val Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu Gly Gln Pro Lys
100 105 110
Ala Ala Pro Ser Val Thr Leu Phe Pro Pro Ser Ser Glu Glu Leu Gln
115 120 125
Ala Asn Lys Ala Thr Leu Val Cys Leu Ile Ser Asp Phe Tyr Pro Gly
130 135 140
Ala Val Thr Val Ala Trp Lys Ala Asp Ser Ser Pro Val Lys Ala Gly
145 150 155 160
Val Glu Thr Thr Thr Pro Ser Lys Gln Ser Asn Asn Lys Tyr Ala Ala
165 170 175
Ser Ser Tyr Leu Ser Leu Thr Pro Glu Gln Trp Lys Ser His Arg Ser
180 185 190
Tyr Ser Cys Gln Val Thr His Glu Gly Ser Thr Val Glu Lys Thr Val
195 200 205
Ala Pro Thr Glu Cys Ser
210
<210> 69
<211> 351
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полинуклеотид
<400> 69
caggtgcagc tgcaggaatc tggccctggc ctggtcaagc ccagccagac cctgagcctg 60
acctgtaccg tgtccggcgg cagcatcagc aacggcggct actactggtc ctggatcaga 120
cagcaccccg gcaagggcct ggaatggatc ggctacatct actacagcgg cagcacctac 180
tacaacccca gcctgaagtc cagagtgacc atcagcgtgg acaccagcaa gaaccagttc 240
agcctgaagc tgagcagcgt gacagccgcc gacaccgccg tgtactactg cgccagcctg 300
ggcaattggt tcgactactg gggccagggc accctcgtga cagtgtcctc a 351
<210> 70
<211> 978
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полинуклеотид
<400> 70
gctagcacca agggccccag cgtgttcccc ctggcccctt gtagcagaag caccagcgag 60
agcacagccg ccctgggctg cctggtgaaa gactacttcc ccgagcccgt caccgtgtcc 120
tggaacagcg gagccctgac cagcggcgtg cacacctttc cagccgtgct gcagagcagc 180
ggcctgtaca gcctgagcag cgtggtgaca gtgccctcca gcagcctggg caccaagacc 240
tacacctgta acgtggacca caagcccagc aacaccaagg tggacaagcg ggtggaatct 300
aagtacggcc caccctgccc cccctgccct gcccctgaat ttctgggcgg accctccgtg 360
ttcctgttcc ccccaaagcc caaggacacc ctgtatatca ctcgggagcc cgaagtgacc 420
tgcgtggtgg tggacgtgtc ccaggaagat cccgaggtcc agttcaattg gtacgtggac 480
ggcgtggaag tgcacaacgc caagaccaag cccagagagg aacagttcaa cagcacctac 540
cgggtggtgt ccgtgctgac cgtgctgcac caggactggc tgaacggcaa agagtacaag 600
tgcaaagtct ccaacaaggg cctgcccagc tccatcgaga aaaccatcag caaggccaag 660
ggccagcccc gcgagcctca ggtgtacaca ctgcccccca gccaggaaga gatgaccaag 720
aaccaggtgt ccctgacctg tctggtgaaa ggcttctacc ccagcgatat cgccgtggaa 780
tgggagagca acggccagcc cgagaacaac tacaagacca ccccccctgt gctggacagc 840
gacggcagct tcttcctgta ctcccggctg accgtggaca agagccggtg gcaggaaggc 900
aacgtcttca gctgcagcgt gatgcacgag gccctgcaca accactacac ccagaagtcc 960
ctgagcctga gcctgggc 978
<210> 71
<211> 327
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полинуклеотид
<400> 71
agctacgtgc tgacccagcc tcctagcgtg tccgtggccc ctggccagac cgccagaatc 60
acctgtggcg gcaacaacat cggcagcaag aacgtgtact ggtatcagca gaagcccggc 120
caggcccccg tgctggtggt gcacgacgac agcgacagac ccagcggcat ccccgagcgg 180
ttcagcggca gcaacagcgg caataccgcc accctgacca tcagccgggt ggaagtgggc 240
gacgaggccg actacagctg ccaggtctgg gacagcagca gcgaccacgt ggtgttcggc 300
ggaggcacca agctgaccgt cctaggt 327
<210> 72
<211> 315
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полинуклеотид
<400> 72
cagcccaagg ccgctcccag cgtgaccctg ttccccccaa gcagcgagga actgcaggcc 60
aacaaggcca ccctggtgtg cctgatcagc gacttctacc ctggggccgt gaccgtggcc 120
tggaaggccg atagcagccc tgtgaaggcc ggcgtggaaa ccaccacccc ctccaagcag 180
agcaacaaca aatacgccgc cagcagctac ctgtccctga cccccgagca gtggaagtcc 240
caccggtcct acagctgcca ggtgacacac gagggcagca ccgtggaaaa gaccgtggcc 300
cccaccgagt gcagc 315
<210> 73
<211> 117
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<220>
<221> МОД_ОСТ
<222> (26)..(26)
<223> Gly, Ala, Ser, Leu, Tyr, Asp, Gln, Lys, His или Trp
<220>
<221> МОД_ОСТ
<222> (27)..(27)
<223> Gly, Ala, Ser, Leu, Tyr, Asp, Gln, Lys, His или Trp
<220>
<221> МОД_ОСТ
<222> (28)..(28)
<223> Ser, Ala, Leu, Tyr, Asp, Gln, Lys, His или Trp
<220>
<221> МОД_ОСТ
<222> (29)..(29)
<223> Ile, Ala, Ser, Leu, Tyr, Asp, Gln, Lys, His или Trp
<220>
<221> МОД_ОСТ
<222> (30)..(30)
<223> Ser, Ala, Leu, Tyr, Asp, Gln, Lys, His или Trp
<220>
<221> МОД_ОСТ
<222> (31)..(31)
<223> Asn, Ala, Ser, Leu, Tyr, Asp, Gln, Lys, His или Trp
<220>
<221> МОД_ОСТ
<222> (32)..(32)
<223> Gly, Ala, Ser, Leu, Tyr, Asp, Gln, Lys, His или Trp
<220>
<221> МОД_ОСТ
<222> (33)..(33)
<223> Gly, Ala, Ser, Leu, Tyr, Asp, Gln, Lys, His или Trp
<220>
<221> МОД_ОСТ
<222> (34)..(34)
<223> Tyr, Ala, Ser, Leu, Asp, Gln, Lys, His или Trp
<220>
<221> МОД_ОСТ
<222> (35)..(35)
<223> Tyr, Ala, Ser, Leu, Asp, Gln, Lys, His или Trp
<220>
<221> МОД_ОСТ
<222> (36)..(36)
<223> Trp, Ala, Ser, Leu, Tyr, Asp, Gln, Lys или His
<220>
<221> МОД_ОСТ
<222> (37)..(37)
<223> Ser, Ala, Leu, Tyr, Asp, Gln, Lys, His или Trp
<220>
<221> МОД_ОСТ
<222> (52)..(52)
<223> Tyr, Ala, Ser, Leu, Asp, Gln, Lys, His или Trp
<220>
<221> МОД_ОСТ
<222> (53)..(53)
<223> Ile, Ala, Ser, Leu, Tyr, Asp, Gln, Lys, His или Trp
<220>
<221> МОД_ОСТ
<222> (54)..(54)
<223> Tyr, Ala, Ser, Leu, Asp, Gln, Lys, His или Trp
<220>
<221> МОД_ОСТ
<222> (55)..(55)
<223> Tyr, Ala, Ser, Leu, Asp, Gln, Lys, His или Trp
<220>
<221> МОД_ОСТ
<222> (56)..(56)
<223> Ser, Ala, Leu, Asp, Gln, Lys, His или Trp
<220>
<221> МОД_ОСТ
<222> (57)..(57)
<223> Gly, Ala, Ser, Leu, Tyr, Asp, Gln, Lys, His или Trp
<220>
<221> МОД_ОСТ
<222> (58)..(58)
<223> Ser, Ala, Leu, Tyr, Asp, Gln, Lys, His или Trp
<220>
<221> МОД_ОСТ
<222> (59)..(59)
<223> Thr, Ala, Ser, Leu, Tyr, Asp, Gln, Lys, His или Trp
<220>
<221> МОД_ОСТ
<222> (60)..(60)
<223> Tyr, Ala, Ser, Leu, Asp, Gln, Lys, His или Trp
<220>
<221> МОД_ОСТ
<222> (98)..(98)
<223> Ala, Ser, Leu, Tyr, Asp, Gln, Lys, His, Trp или Pro
<220>
<221> МОД_ОСТ
<222> (99)..(99)
<223> Ser, Ala, Leu, Tyr, Asp, Gln, Lys, His, Trp или Pro
<220>
<221> МОД_ОСТ
<222> (100)..(100)
<223> Leu, Ala, Ser, Tyr, Asp, Gln, Lys, His, Trp или Pro
<220>
<221> МОД_ОСТ
<222> (101)..(101)
<223> Gly, Ala, Ser, Leu, Tyr, Asp, Gln, Lys, His, Trp или Pro
<220>
<221> МОД_ОСТ
<222> (102)..(102)
<223> Asn, Ala, Ser, Leu, Tyr, Asp, Gln, Lys, His, Trp или Pro
<220>
<221> МОД_ОСТ
<222> (103)..(103)
<223> Trp, Ala, Ser, Leu, Tyr, Asp, Gln, Lys, His или Pro
<220>
<221> МОД_ОСТ
<222> (104)..(104)
<223> Phe, Ala, Ser, Leu, Tyr, Asp, Gln, Lys, His, Trp или Pro
<220>
<221> МОД_ОСТ
<222> (105)..(105)
<223> Asp, Ala, Ser, Leu, Tyr, Gln, Lys, His, Trp или Pro
<220>
<221> МОД_ОСТ
<222> (106)..(106)
<223> Tyr, Ala, Ser, Leu, Asp, Gln, Lys, His, Trp или Pro
<400> 73
Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Gln
1 5 10 15
Thr Leu Ser Leu Thr Cys Thr Val Ser Xaa Xaa Xaa Xaa Xaa Xaa Xaa
20 25 30
Xaa Xaa Xaa Xaa Xaa Trp Ile Arg Gln His Pro Gly Lys Gly Leu Glu
35 40 45
Trp Ile Gly Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Tyr Asn Pro Ser
50 55 60
Leu Lys Ser Arg Val Thr Ile Ser Val Asp Thr Ser Lys Asn Gln Phe
65 70 75 80
Ser Leu Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr
85 90 95
Cys Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 74
<211> 109
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<220>
<221> МОД_ОСТ
<222> (23)..(23)
<223> Gly, Ala, Ser, Leu, Tyr, Asp, Gln, Lys, His или Trp
<220>
<221> МОД_ОСТ
<222> (24)..(24)
<223> Gly, Ala, Ser, Leu, Tyr, Asp, Gln, Lys, His или Trp
<220>
<221> МОД_ОСТ
<222> (25)..(25)
<223> Asn, Ala, Ser, Leu, Tyr, Asp, Gln, Lys, His или Trp
<220>
<221> МОД_ОСТ
<222> (26)..(26)
<223> Asn, Ala, Ser, Leu, Tyr, Asp, Gln, Lys, His или Trp
<220>
<221> МОД_ОСТ
<222> (27)..(27)
<223> Ile, Ala, Ser, Leu, Tyr, Asp, Gln, Lys, His или Trp
<220>
<221> МОД_ОСТ
<222> (28)..(28)
<223> Gly, Ala, Ser, Leu, Tyr, Asp, Gln, Lys, His или Trp
<220>
<221> МОД_ОСТ
<222> (29)..(29)
<223> Ser, Ala, Leu, Tyr, Asp, Gln, Lys, His или Trp
<220>
<221> МОД_ОСТ
<222> (30)..(30)
<223> Lys, Ala, Ser, Leu, Tyr, Asp, Gln, His или Trp
<220>
<221> МОД_ОСТ
<222> (31)..(31)
<223> Asn, Ala, Ser, Leu, Tyr, Asp, Gln, Lys, His или Trp
<220>
<221> МОД_ОСТ
<222> (32)..(32)
<223> Val, Ala, Ser, Leu, Tyr, Asp, Gln, Lys, His или Trp
<220>
<221> МОД_ОСТ
<222> (33)..(33)
<223> Tyr, Ala, Ser, Leu, Asp, Gln, Lys, His или Trp
<220>
<221> МОД_ОСТ
<222> (49)..(49)
<223> Asp, Ala, Ser, Leu, Tyr, Gln, Lys, His или Trp
<220>
<221> МОД_ОСТ
<222> (50)..(50)
<223> Asp, Ala, Ser, Leu, Tyr, Gln, Lys, His или Trp
<220>
<221> МОД_ОСТ
<222> (51)..(51)
<223> Ser, Ala, Leu, Tyr, Asp, Gln, Lys, His или Trp
<220>
<221> МОД_ОСТ
<222> (52)..(52)
<223> Asp, Ala, Ser, Leu, Tyr, Gln, Lys, His или Trp
<220>
<221> МОД_ОСТ
<222> (53)..(53)
<223> Arg, Ala, Ser, Leu, Tyr, Asp, Gln, Lys, His или Trp
<220>
<221> МОД_ОСТ
<222> (54)..(54)
<223> Pro, Ala, Ser, Leu, Tyr, Asp, Gln, Lys, His или Trp
<220>
<221> МОД_ОСТ
<222> (55)..(55)
<223> Ser, Ala, Leu, Tyr, Asp, Gln, Lys, His или Trp
<220>
<221> МОД_ОСТ
<222> (88)..(88)
<223> Gln, Ala, Ser, Leu, Tyr, Asp, Lys, His, Trp или Pro
<220>
<221> МОД_ОСТ
<222> (89)..(89)
<223> Val, Ala, Ser, Leu, Tyr, Asp, Gln, Lys, His, Trp или Pro
<220>
<221> МОД_ОСТ
<222> (90)..(90)
<223> Trp, Ala, Ser, Leu, Tyr, Asp, Gln, Lys, His или Pro
<220>
<221> МОД_ОСТ
<222> (91)..(91)
<223> Asp, Ala, Ser, Leu, Tyr, Gln, Lys, His, Trp или Pro
<220>
<221> МОД_ОСТ
<222> (92)..(92)
<223> Ser, Ala, Leu, Tyr, Asp, Gln, Lys, His, Trp или Pro
<220>
<221> МОД_ОСТ
<222> (93)..(93)
<223> Ser, Ala, Leu, Tyr, Asp, Gln, Lys, His, Trp или Pro
<220>
<221> МОД_ОСТ
<222> (94)..(94)
<223> Ser, Ala, Leu, Tyr, Asp, Gln, Lys, His, Trp или Pro
<220>
<221> МОД_ОСТ
<222> (95)..(95)
<223> Asp, Ala, Ser, Leu, Tyr, Gln, Lys, His, Trp или Pro
<220>
<221> МОД_ОСТ
<222> (96)..(96)
<223> His, Ala, Ser, Leu, Tyr, Asp, Gln, Lys, Trp или Pro
<220>
<221> МОД_ОСТ
<222> (97)..(97)
<223> Val, Ala, Ser, Leu, Tyr, Asp, Gln, Lys, His, Trp или Pro
<220>
<221> МОД_ОСТ
<222> (98)..(98)
<223> Val, Ala, Ser, Leu, Tyr, Asp, Gln, Lys, His, Trp или Pro
<400> 74
Ser Tyr Val Leu Thr Gln Pro Pro Ser Val Ser Val Ala Pro Gly Gln
1 5 10 15
Thr Ala Arg Ile Thr Cys Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa
20 25 30
Xaa Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Val Leu Val Val His
35 40 45
Xaa Xaa Xaa Xaa Xaa Xaa Xaa Gly Ile Pro Glu Arg Phe Ser Gly Ser
50 55 60
Asn Ser Gly Asn Thr Ala Thr Leu Thr Ile Ser Arg Val Glu Val Gly
65 70 75 80
Asp Glu Ala Asp Tyr Ser Cys Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa
85 90 95
Xaa Xaa Phe Gly Gly Gly Thr Lys Leu Thr Val Leu Gly
100 105
<210> 75
<211> 109
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<220>
<221> МОД_ОСТ
<222> (24)..(24)
<223> Gly или Lys
<220>
<221> МОД_ОСТ
<222> (25)..(25)
<223> Asn или Asp
<220>
<221> МОД_ОСТ
<222> (26)..(26)
<223> Asn или His
<220>
<221> МОД_ОСТ
<222> (27)..(27)
<223> Ile или Ala
<220>
<221> МОД_ОСТ
<222> (28)..(28)
<223> Gly или Asp
<220>
<221> МОД_ОСТ
<222> (29)..(29)
<223> Ser или Lys
<220>
<221> МОД_ОСТ
<222> (31)..(31)
<223> Asn или His
<220>
<221> МОД_ОСТ
<222> (32)..(32)
<223> Val или Ala
<220>
<221> МОД_ОСТ
<222> (51)..(51)
<223> Ser или Leu
<220>
<221> МОД_ОСТ
<222> (52)..(52)
<223> Asp или Ser
<220>
<221> МОД_ОСТ
<222> (91)..(91)
<223> Asp или Leu
<220>
<221> МОД_ОСТ
<222> (96)..(96)
<223> His, Ser, Tyr или Asp
<220>
<221> МОД_ОСТ
<222> (98)..(98)
<223> Val, Ala или Trp
<400> 75
Ser Tyr Val Leu Thr Gln Pro Pro Ser Val Ser Val Ala Pro Gly Gln
1 5 10 15
Thr Ala Arg Ile Thr Cys Gly Xaa Xaa Xaa Xaa Xaa Xaa Lys Xaa Xaa
20 25 30
Tyr Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Val Leu Val Val His
35 40 45
Asp Asp Xaa Xaa Arg Pro Ser Gly Ile Pro Glu Arg Phe Ser Gly Ser
50 55 60
Asn Ser Gly Asn Thr Ala Thr Leu Thr Ile Ser Arg Val Glu Val Gly
65 70 75 80
Asp Glu Ala Asp Tyr Ser Cys Gln Val Trp Xaa Ser Ser Ser Asp Xaa
85 90 95
Val Xaa Phe Gly Gly Gly Thr Lys Leu Thr Val Leu Gly
100 105
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| АНТИТЕЛА К РЕЦЕПТОРУ IL4 ДЛЯ ПРИМЕНЕНИЯ В ВЕТЕРИНАРИИ | 2019 |
|
RU2837141C2 |
| ТЕРАПЕВТИЧЕСКИЕ АНТИТЕЛА ПРОТИВ ЛИГАНДА CD40 | 2018 |
|
RU2770209C2 |
| БИСПЕЦИФИЧЕСКОЕ АНТИТЕЛО ПРОТИВ ВИРУСА БЕШЕНСТВА И ЕГО ПРИМЕНЕНИЕ | 2019 |
|
RU2764740C1 |
| АНТИ-IL31 АНТИТЕЛА ДЛЯ ПРИМЕНЕНИЯ В ВЕТЕРИНАРИИ | 2020 |
|
RU2835543C1 |
| Биспецифическое антитело анти-HER2/анти-4-1BB и его применение | 2020 |
|
RU2831838C2 |
| МОЛЕКУЛЫ АНТИТЕЛ ПРОТИВ ВИРУСА BK | 2021 |
|
RU2835801C1 |
| АНТИТЕЛО К CLDN-18.2 И ЕГО ПРИМЕНЕНИЕ | 2021 |
|
RU2829997C1 |
| МОЛЕКУЛЫ АНТИ-SIGLEC-9 АНТИТЕЛА | 2020 |
|
RU2833330C1 |
| НАЦЕЛЕННЫЕ НА ОПУХОЛЬ АГОНИСТИЧЕСКИЕ CD28-АНТИГЕНСВЯЗЫВАЮЩИЕ МОЛЕКУЛЫ | 2019 |
|
RU2837821C1 |
| БИСПЕЦИФИЧНЫЙ СЛИТЫЙ БЕЛОК И ЕГО ПРИМЕНЕНИЕ | 2021 |
|
RU2801528C2 |

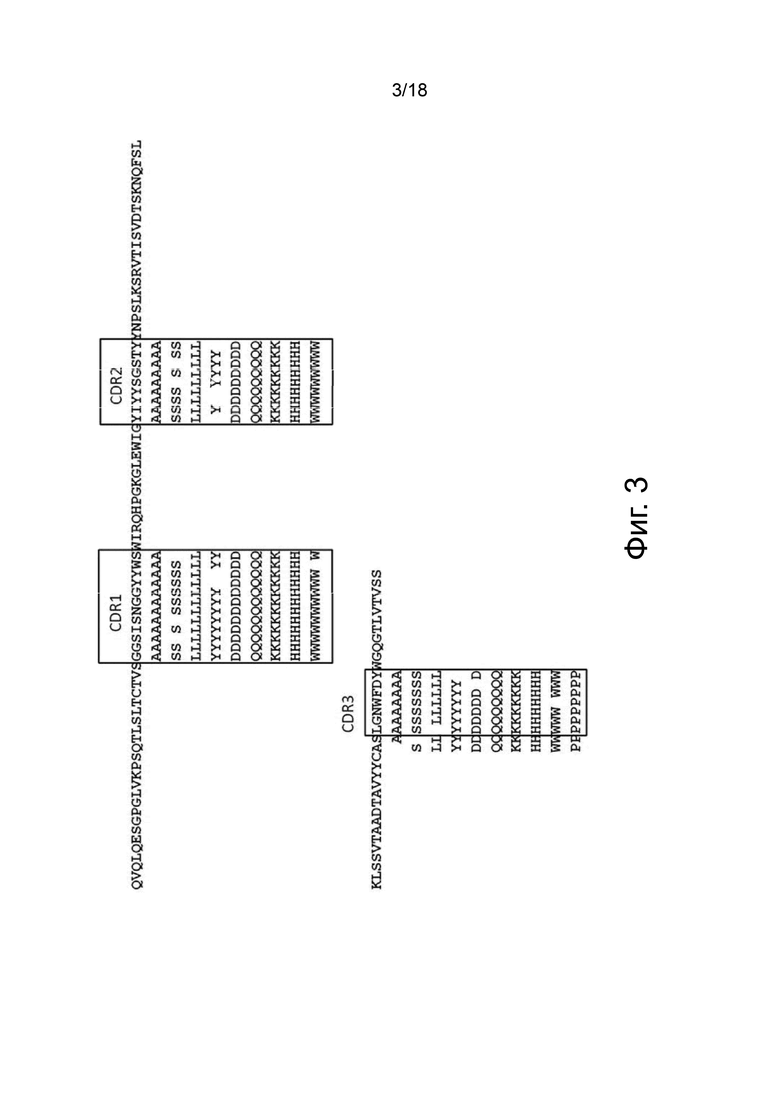
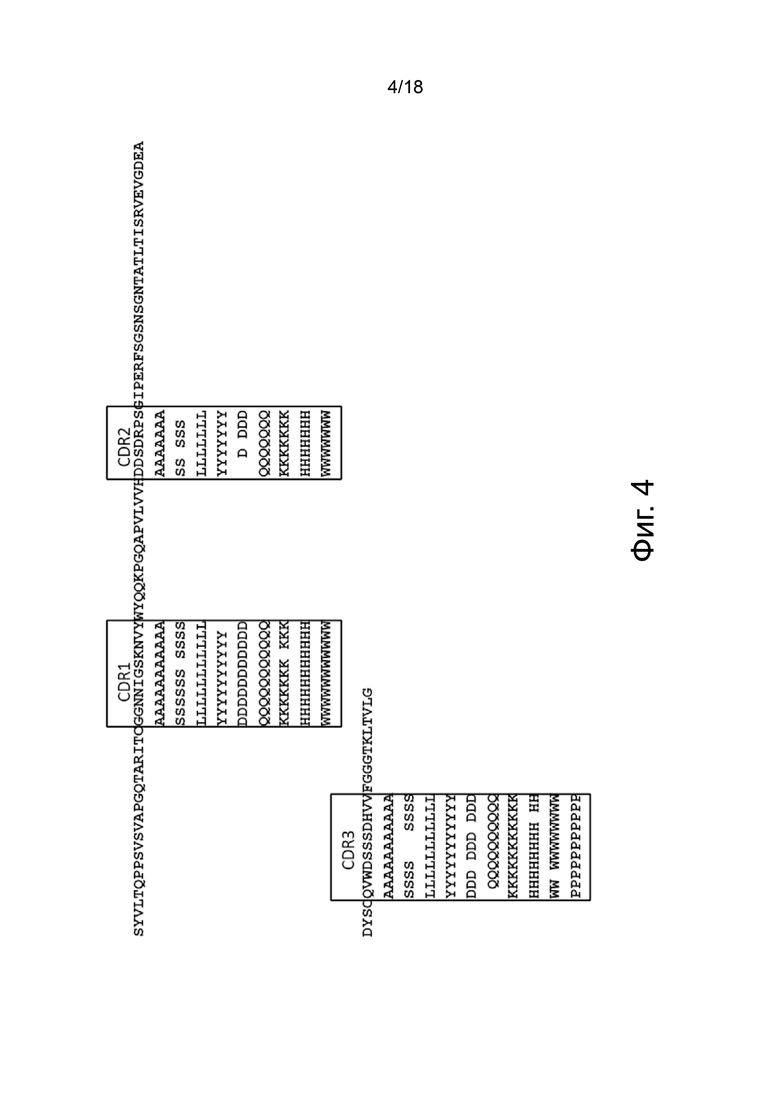
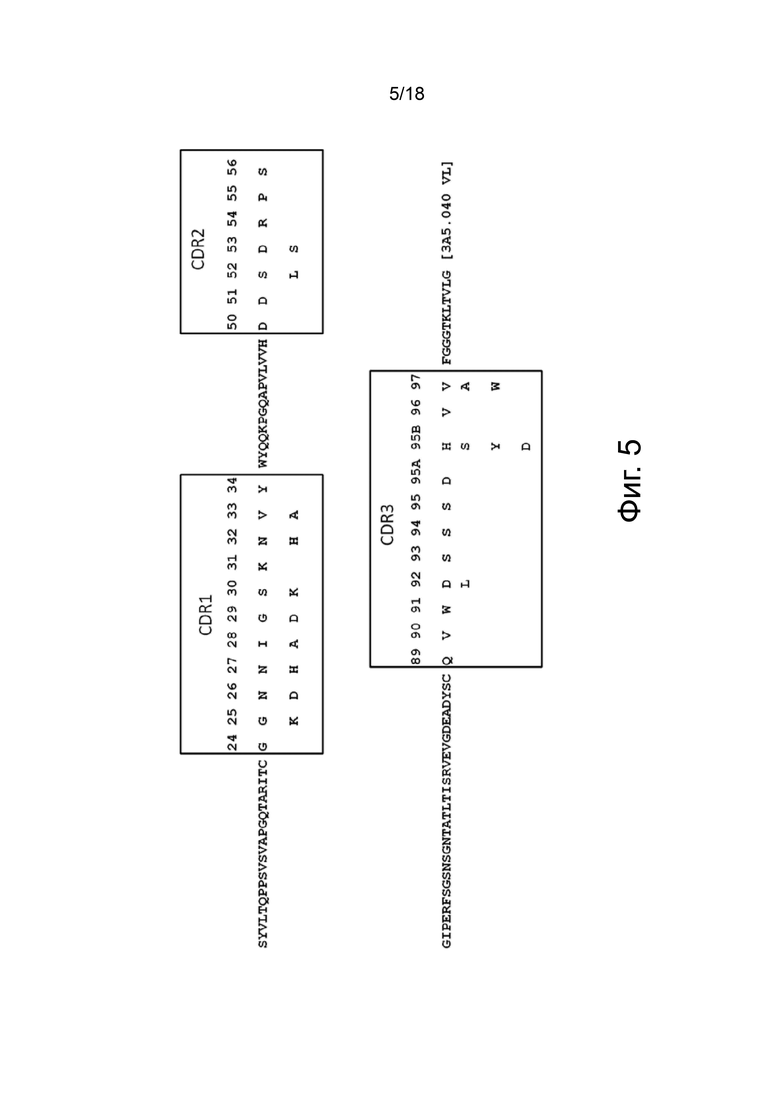
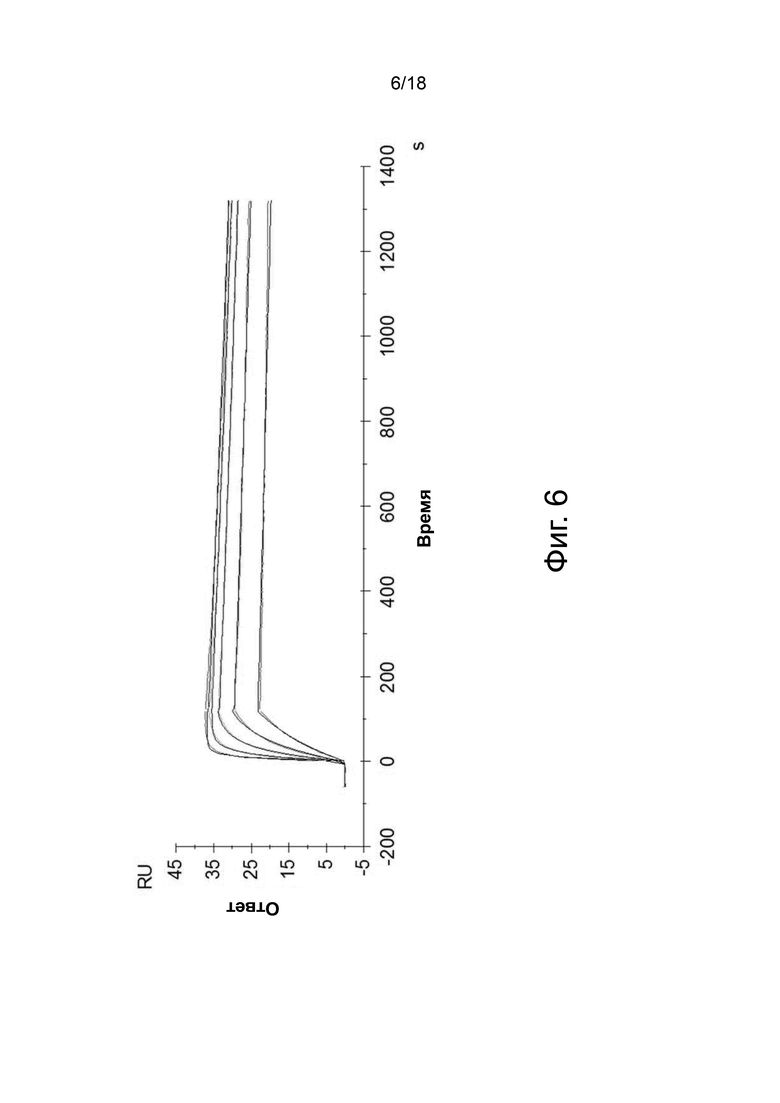
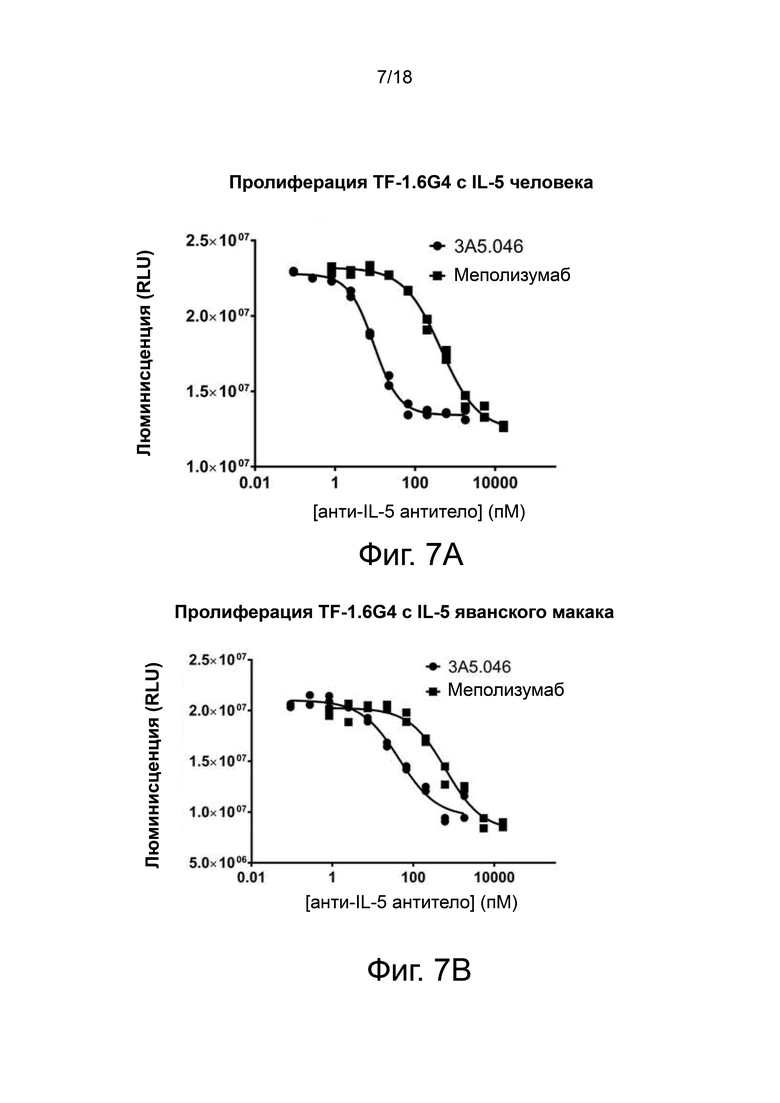
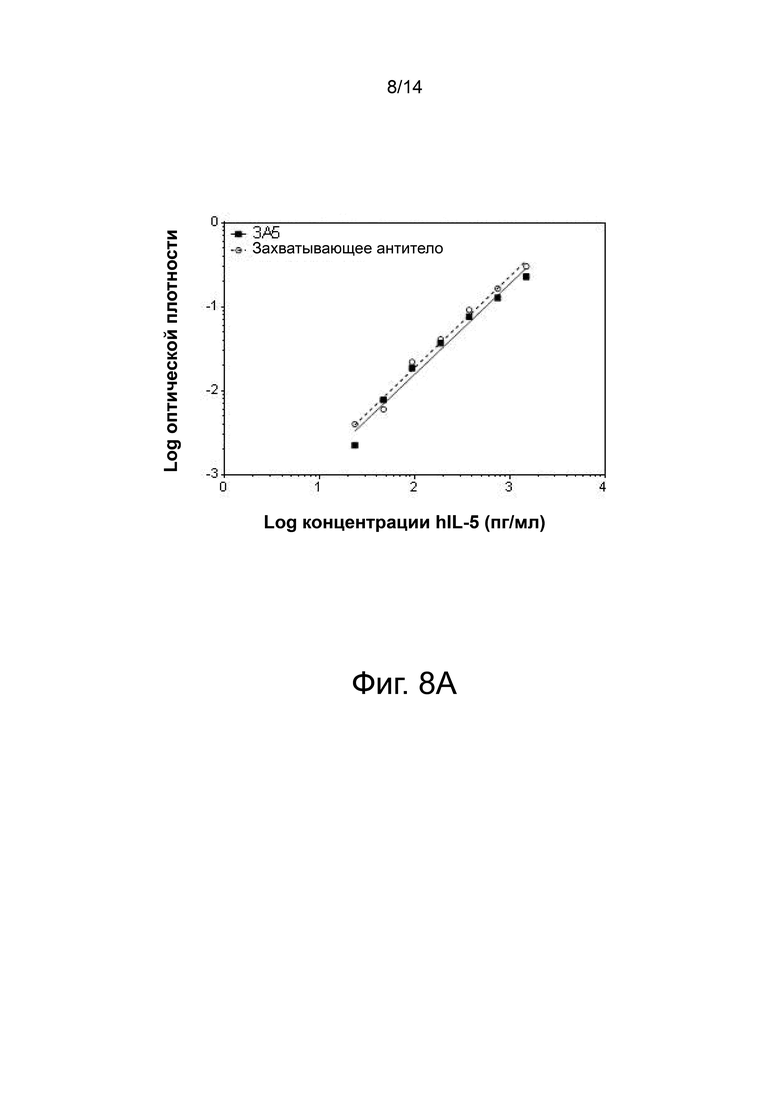
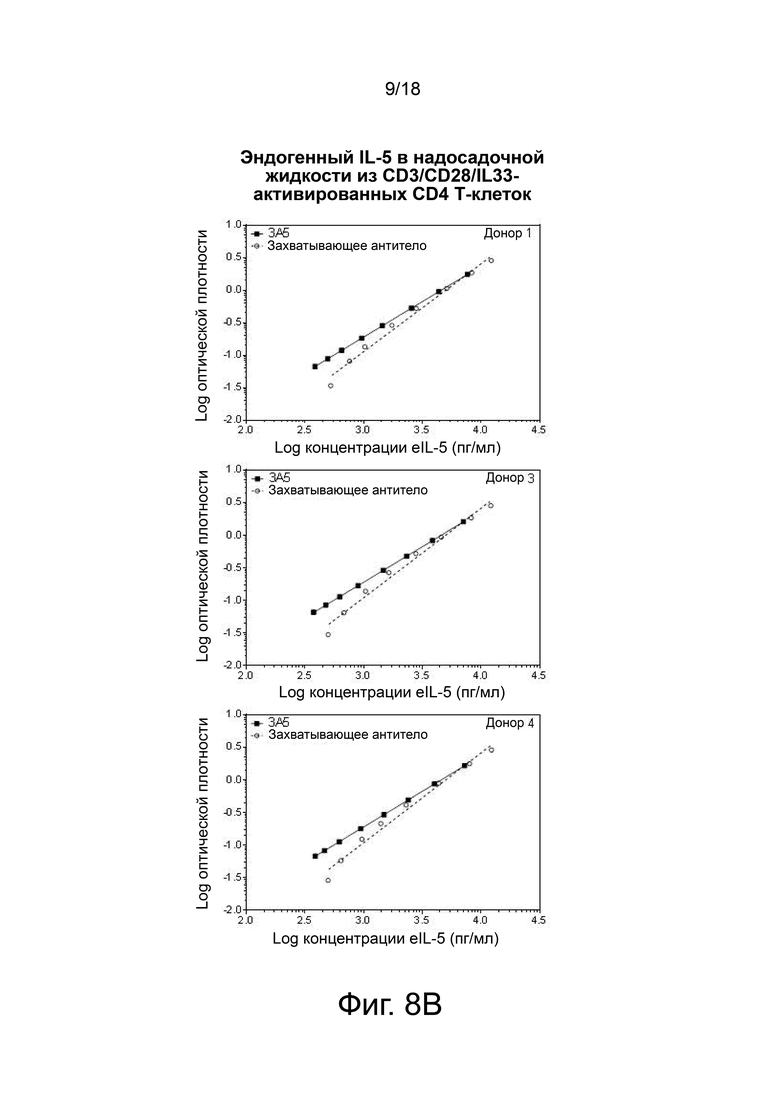

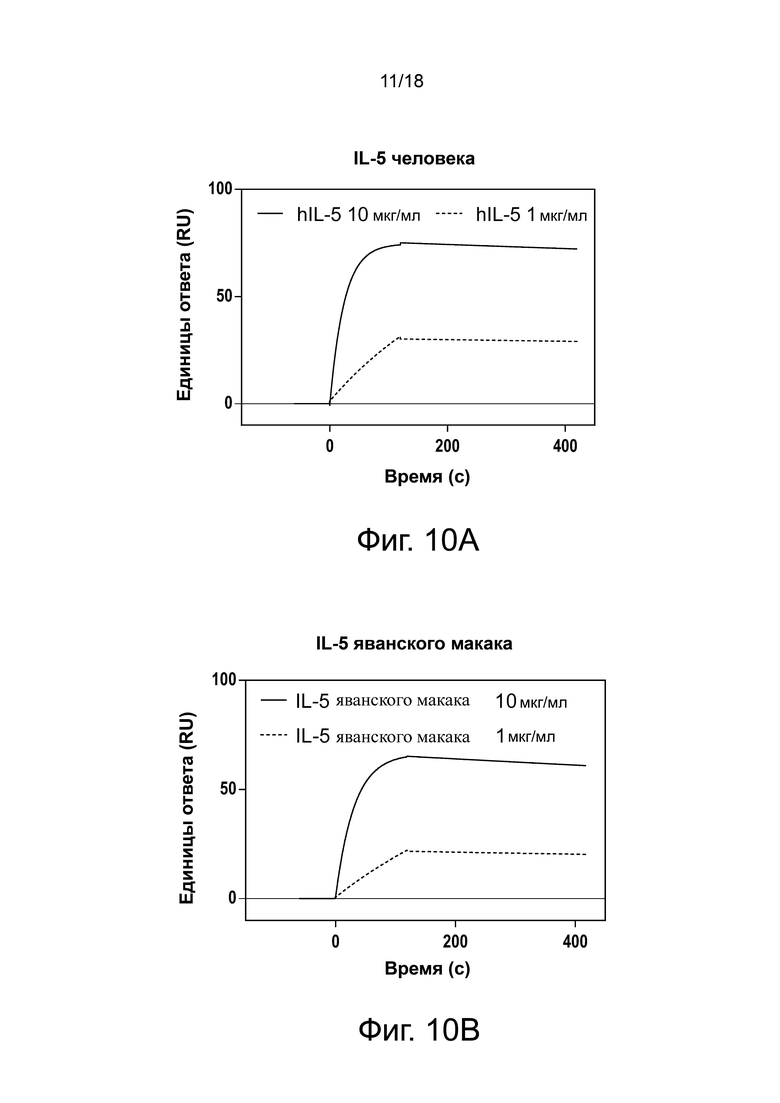
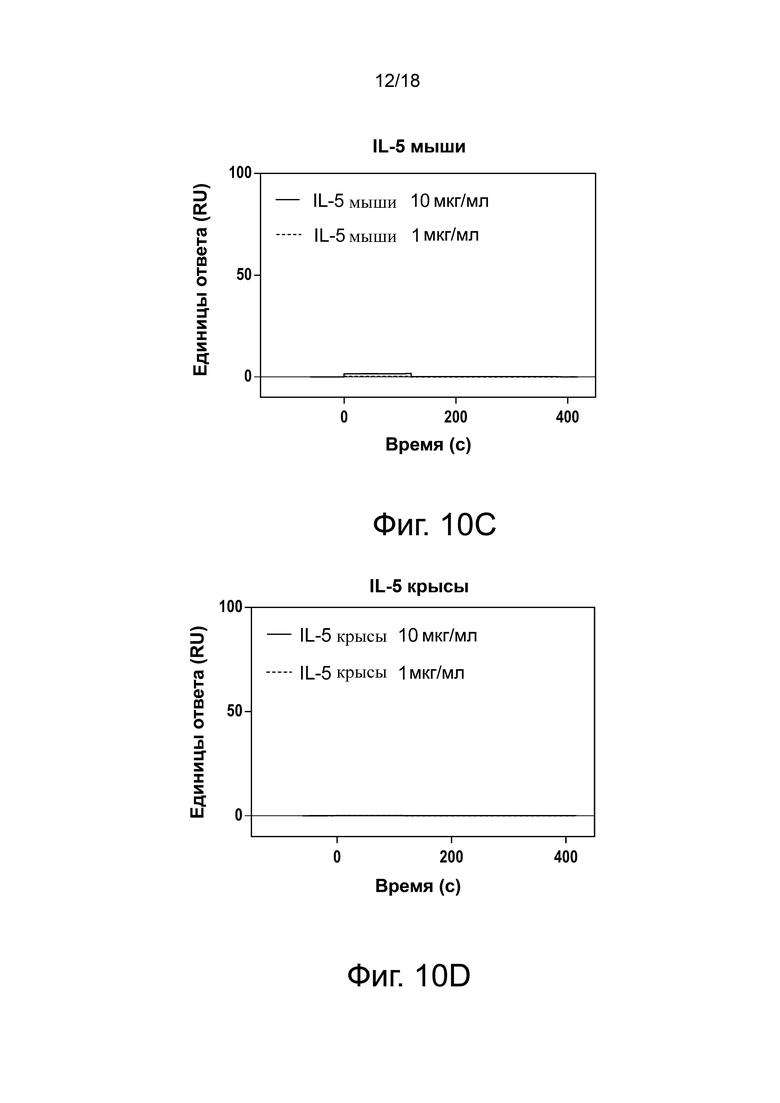
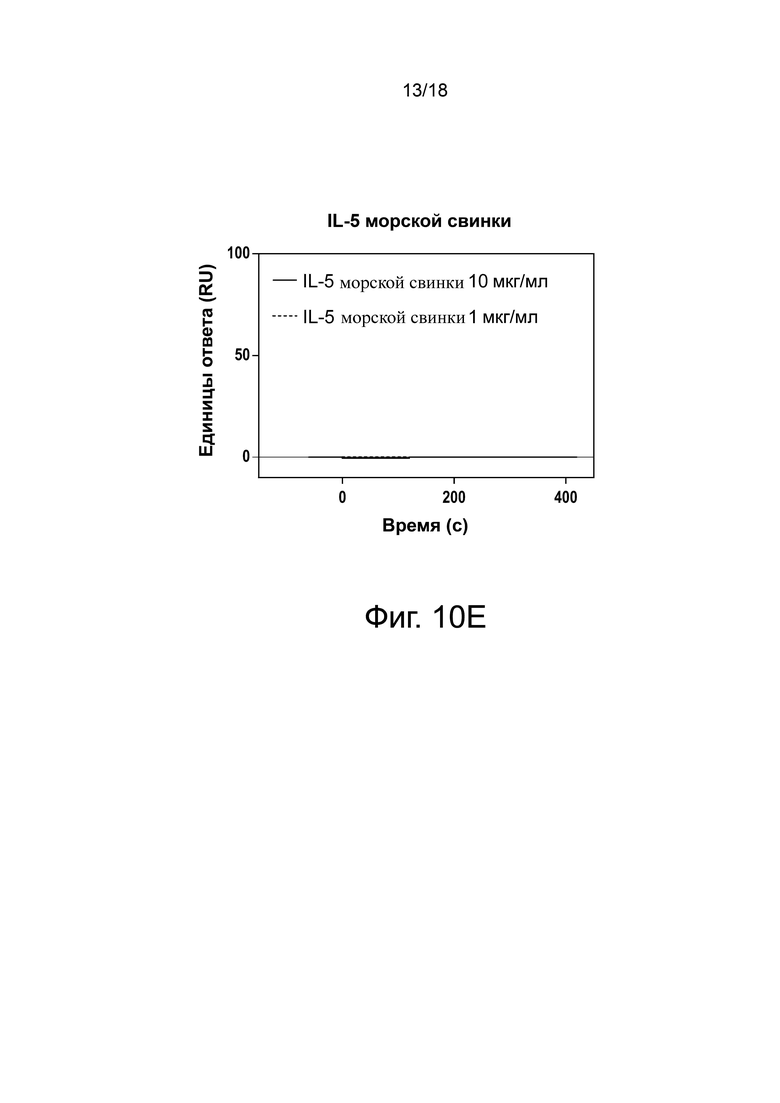
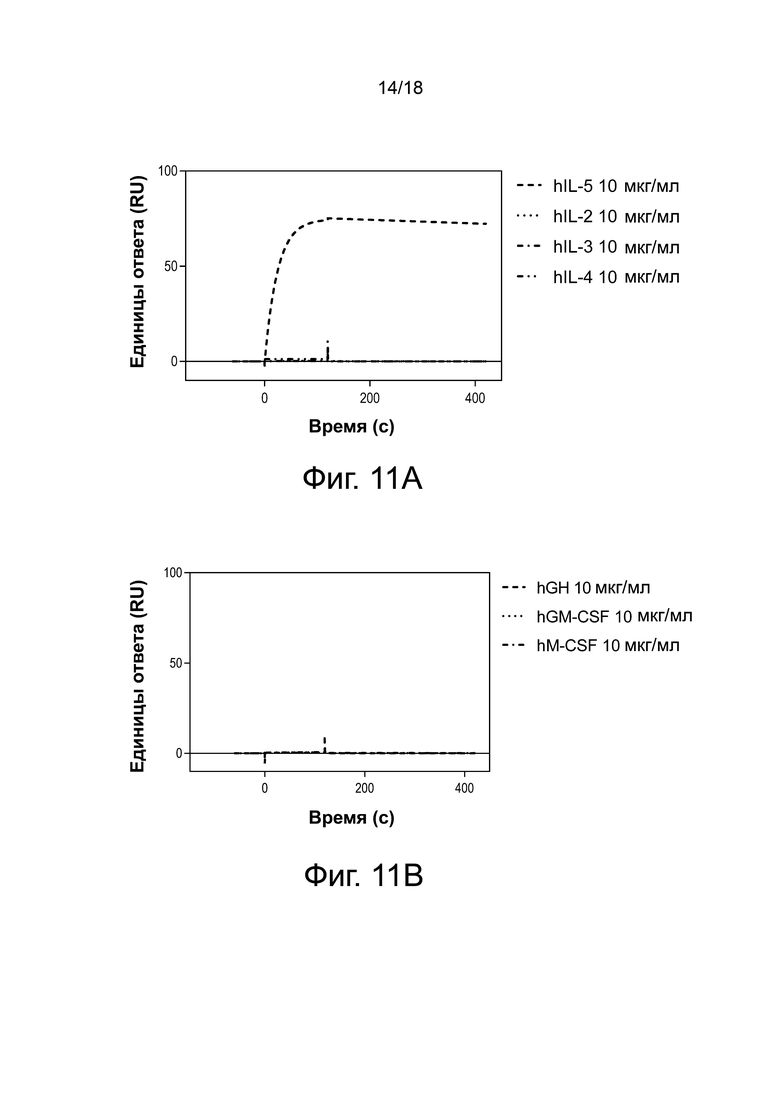
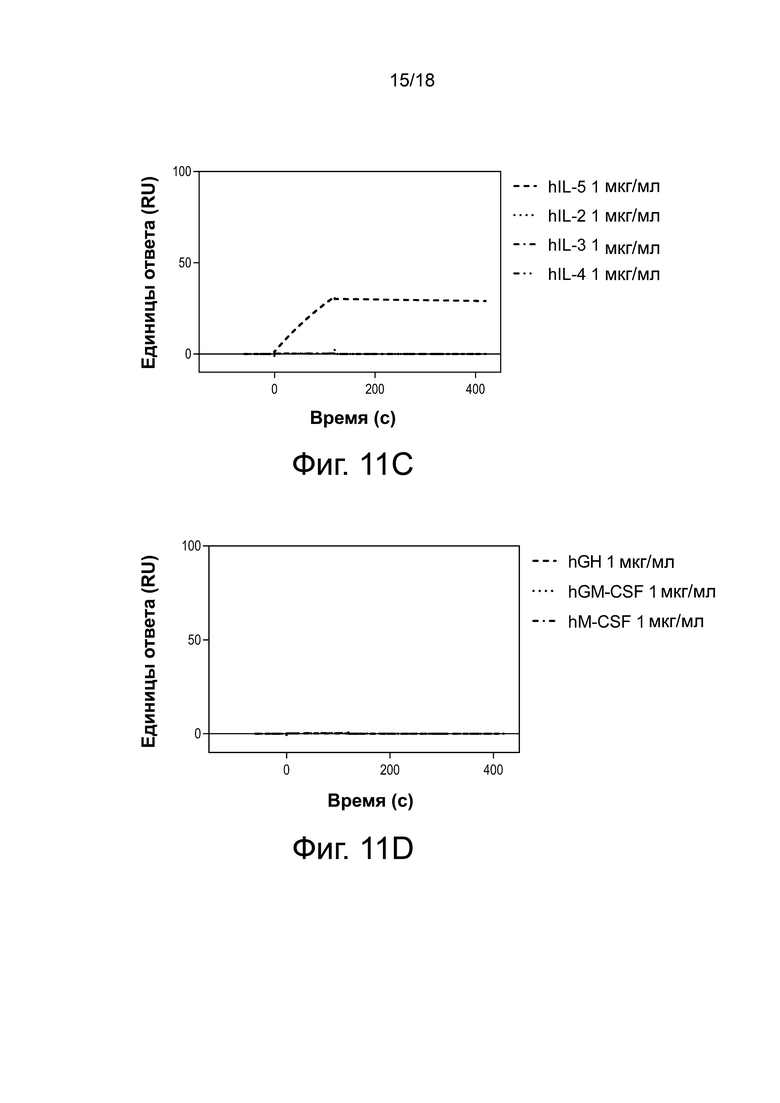
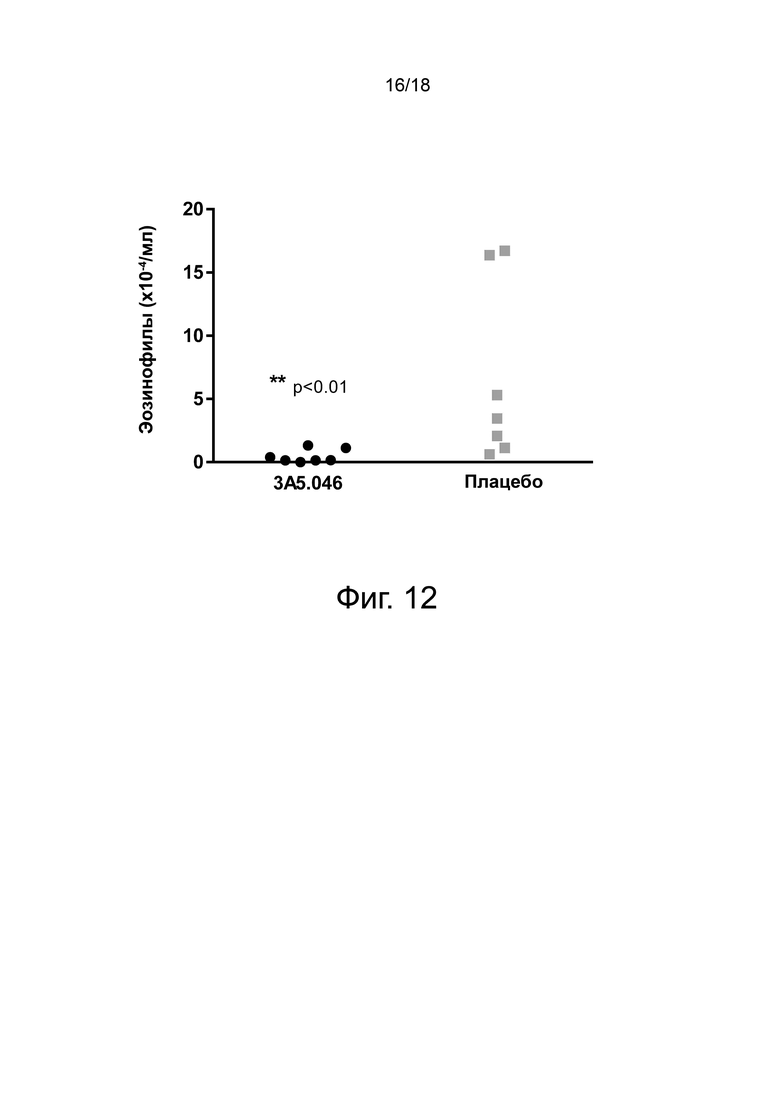


Изобретение относится к области биотехнологии. Предложены варианты человеческого антитела, которые иммуноспецифически связываются с IL-5 человека. Также предложены нуклеиновая кислота, экспрессирующий вектор и клетка для экспрессии антител по изобретению. Кроме того, изобретение относится к применению указанных антител и содержащих их фармацевтических композиций для лечения эозинофильной астмы, гиперэозинофильного синдрома, полипоза носа с эозинофильным поражением, эозинофильного гранулематоза с полиангиитом, атопического дерматита или эозинофильного эзофагита. Молекулы антител могут связываться с IL-5 человека с равновесной константой аффинности (KD), по меньшей мере, около 40 пМ, которая определена поверхностным плазмонным резонансом. 8 н. и 12 з. п. ф-лы, 24 ил., 15 табл.
1. Молекула человеческого антитела, которая иммуноспецифически связывается с IL-5 человека, отличающаяся тем, что включает CDR1 тяжелой цепи, включающую аминокислотную последовательность SEQ ID NO: 4, CDR2 тяжелой цепи, включающую аминокислотную последовательность SEQ ID NO: 6, CDR3 тяжелой цепи, включающую аминокислотную последовательность SEQ ID NO: 8, и
а. CDR1 легкой цепи, включающую аминокислотную последовательность SEQ ID NO: 5, CDR2 легкой цепи, включающую аминокислотную последовательность SEQ ID NO: 7, и CDR3 легкой цепи, включающую аминокислотную последовательность SEQ ID NO: 15;
b. CDR1 легкой цепи, включающую аминокислотную последовательность SEQ ID NO: 21, CDR2 легкой цепи, включающую аминокислотную последовательность SEQ ID NO: 7, и CDR3 легкой цепи, включающую аминокислотную последовательность SEQ ID NO: 15;
с. CDR1 легкой цепи, включающую аминокислотную последовательность SEQ ID NO: 24, CDR2 легкой цепи, включающую аминокислотную последовательность SEQ ID NO: 7, и CDR3 легкой цепи, включающую аминокислотную последовательность SEQ ID NO: 15;
d. CDR1 легкой цепи, включающую аминокислотную последовательность SEQ ID NO: 27, CDR2 легкой цепи, включающую аминокислотную последовательность SEQ ID NO: 7, и CDR3 легкой цепи, включающую аминокислотную последовательность SEQ ID NO: 15;
е. CDR1 легкой цепи, включающую аминокислотную последовательность SEQ ID NO: 30, CDR2 легкой цепи, включающую аминокислотную последовательность SEQ ID NO: 7, и CDR3 легкой цепи, включающую аминокислотную последовательность SEQ ID NO: 15;
f. CDR1 легкой цепи, включающую аминокислотную последовательность SEQ ID NO: 33, CDR2 легкой цепи, включающую аминокислотную последовательность SEQ ID NO: 7, и CDR3 легкой цепи, включающую аминокислотную последовательность SEQ ID NO: 15;
g. CDR1 легкой цепи, включающую аминокислотную последовательность SEQ ID NO: 36, CDR2 легкой цепи, включающую аминокислотную последовательность SEQ ID NO: 7, и CDR3 легкой цепи, включающую аминокислотную последовательность SEQ ID NO: 15;
h. CDR1 легкой цепи, включающую аминокислотную последовательность SEQ ID NO: 39, CDR2 легкой цепи, включающую аминокислотную последовательность SEQ ID NO: 7, и CDR3 легкой цепи, включающую аминокислотную последовательность SEQ ID NO: 15;
i. CDR1 легкой цепи, включающую аминокислотную последовательность SEQ ID NO: 66, CDR2 легкой цепи, включающую аминокислотную последовательность SEQ ID NO: 7, и CDR3 легкой цепи, включающую аминокислотную последовательность SEQ ID NO: 15;
j. CDR1 легкой цепи, включающую аминокислотную последовательность SEQ ID NO: 5, CDR2 легкой цепи, включающую аминокислотную последовательность SEQ ID NO: 42, и CDR3 легкой цепи, включающую аминокислотную последовательность SEQ ID NO: 15;
k. CDR1 легкой цепи, включающую аминокислотную последовательность SEQ ID NO: 5, CDR2 легкой цепи, включающую аминокислотную последовательность SEQ ID NO: 45, и CDR3 легкой цепи, включающую аминокислотную последовательность SEQ ID NO: 15;
l. CDR1 легкой цепи, включающую аминокислотную последовательность SEQ ID NO: 5, CDR2 легкой цепи, включающую аминокислотную последовательность SEQ ID NO: 7, и CDR3 легкой цепи, включающую аминокислотную последовательность SEQ ID NO: 48;
m. CDR1 легкой цепи, включающую аминокислотную последовательность SEQ ID NO: 5, CDR2 легкой цепи, включающую аминокислотную последовательность SEQ ID NO: 7, и CDR3 легкой цепи, включающую аминокислотную последовательность SEQ ID NO: 51;
n. CDR1 легкой цепи, включающую аминокислотную последовательность SEQ ID NO: 5, CDR2 легкой цепи, включающую аминокислотную последовательность SEQ ID NO: 7, и CDR3 легкой цепи, включающую аминокислотную последовательность SEQ ID NO: 54;
о. CDR1 легкой цепи, включающую аминокислотную последовательность SEQ ID NO: 5, CDR2 легкой цепи, включающую аминокислотную последовательность SEQ ID NO: 7, и CDR3 легкой цепи, включающую аминокислотную последовательность SEQ ID NO: 57;
p. CDR1 легкой цепи, включающую аминокислотную последовательность SEQ ID NO: 5, CDR2 легкой цепи, включающую аминокислотную последовательность SEQ ID NO: 7, и CDR3 легкой цепи, включающую аминокислотную последовательность SEQ ID NO: 60; или
q. CDR1 легкой цепи, включающую аминокислотную последовательность SEQ ID NO: 5, CDR2 легкой цепи, включающую аминокислотную последовательность SEQ ID NO: 7, и CDR3 легкой цепи, включающую аминокислотную последовательность SEQ ID NO: 63;
где положение аминокислотных остатков CDR определяется в соответствии с AbM.
2. Молекула антитела по п. 1, отличающаяся тем, что включает CDR1 тяжелой цепи, включающую аминокислотную последовательность SEQ ID NO: 4, CDR2 тяжелой цепи, включающую аминокислотную последовательность SEQ ID NO: 6, CDR3 тяжелой цепи, включающую аминокислотную последовательность SEQ ID NO: 8, CDR1 легкой цепи, включающую аминокислотную последовательность SEQ ID NO: 5, CDR2 легкой цепи, включающую аминокислотную последовательность SEQ ID NO: 7, и CDR3 легкой цепи, включающую аминокислотную последовательность SEQ ID NO: 15.
3. Молекула антитела по п. 1 или 2, отличающаяся тем, что включает вариабельную область тяжелой цепи, включающую аминокислотную последовательность, которая по меньшей мере на 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична аминокислотной последовательности SEQ ID NO: 16, и
а. вариабельную область легкой цепи, включающую аминокислотную последовательность, которая по меньшей мере на 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична аминокислотной последовательности SEQ ID NO: 17;
b. вариабельную область легкой цепи, включающую аминокислотную последовательность, которая по меньшей мере на 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична аминокислотной последовательности SEQ ID NO: 22;
с. вариабельную область легкой цепи, включающую аминокислотную последовательность, которая по меньшей мере на 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична аминокислотной последовательности SEQ ID NO: 25;
d. вариабельную область легкой цепи, включающую аминокислотную последовательность, которая по меньшей мере на 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична аминокислотной последовательности SEQ ID NO: 28;
е. вариабельную область легкой цепи, включающую аминокислотную последовательность, которая по меньшей мере на 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична аминокислотной последовательности SEQ ID NO: 31;
f. вариабельную область легкой цепи, включающую аминокислотную последовательность, которая по меньшей мере на 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична аминокислотной последовательности SEQ ID NO: 34;
g. вариабельную область легкой цепи, включающую аминокислотную последовательность, которая по меньшей мере на 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична аминокислотной последовательности SEQ ID NO: 37;
h. вариабельную область легкой цепи, включающую аминокислотную последовательность, которая по меньшей мере на 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична аминокислотной последовательности SEQ ID NO: 40;
i. вариабельную область легкой цепи, включающую аминокислотную последовательность, которая по меньшей мере на 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична аминокислотной последовательности SEQ ID NO: 43;
j. вариабельную область легкой цепи, включающую аминокислотную последовательность, которая по меньшей мере на 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична аминокислотной последовательности SEQ ID NO: 46;
k. вариабельную область легкой цепи, включающую аминокислотную последовательность, которая по меньшей мере на 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична аминокислотной последовательности SEQ ID NO: 49;
l. вариабельную область легкой цепи, включающую аминокислотную последовательность, которая по меньшей мере на 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична аминокислотной последовательности SEQ ID NO: 52;
m. вариабельную область легкой цепи, включающую аминокислотную последовательность, которая по меньшей мере на 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична аминокислотной последовательности SEQ ID NO: 55;
n. вариабельную область легкой цепи, включающую аминокислотную последовательность, которая по меньшей мере на 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична аминокислотной последовательности SEQ ID NO: 58;
о. вариабельную область легкой цепи, включающую аминокислотную последовательность, которая по меньшей мере на 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична аминокислотной последовательности SEQ ID NO: 61;
p. вариабельную область легкой цепи, включающую аминокислотную последовательность, которая по меньшей мере на 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична аминокислотной последовательности SEQ ID NO: 64; или
q. вариабельную область легкой цепи, включающую аминокислотную последовательность, которая по меньшей мере на 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична аминокислотной последовательности SEQ ID NO: 67.
4. Молекула антитела по любому из предыдущих пунктов, отличающаяся тем, что включает вариабельную область тяжелой цепи, включающую аминокислотную последовательность, которая по меньшей мере на 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична аминокислотной последовательности SEQ ID NO: 16, и вариабельную область легкой цепи, включающую аминокислотную последовательность, которая по меньшей мере на 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична аминокислотной последовательности SEQ ID NO: 17.
5. Молекула антитела по любому из предыдущих пунктов, отличающаяся тем, что включает
а. мутацию S228P;
b. мутацию M252Y, мутацию S254T и мутацию T256E;
с. делецию С-концевого остатка лизина тяжелой цепи; или
d. любую комбинацию a-c.
6. Молекула антитела по п. 5, отличающаяся тем, что включает мутацию S228P и делецию С-концевого остатка лизина тяжелой цепи.
7. Молекула антитела по п. 5, отличающаяся тем, что включает мутацию S228P, мутацию M252Y, мутацию S254T, мутацию T256E и делецию С-концевого остатка лизина тяжелой цепи.
8. Молекула антитела по любому из предыдущих пунктов, отличающаяся тем, что включает константную область тяжелой цепи IgG4 и константную область легкой цепи лямбда.
9. Молекула антитела по любому из предыдущих пунктов, отличающаяся тем, что включает тяжелую цепь, включающую аминокислотную последовательность, которая по меньшей мере на 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична аминокислотной последовательности SEQ ID NO: 18, и
а. легкую цепь, включающую аминокислотную последовательность, которая по меньшей мере на 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична аминокислотной последовательности SEQ ID NO: 19;
b. легкую цепь, включающую аминокислотную последовательность, которая по меньшей мере на 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична аминокислотной последовательности SEQ ID NO: 23;
с. легкую цепь, включающую аминокислотную последовательность, которая по меньшей мере на 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична аминокислотной последовательности SEQ ID NO: 26;
d. легкую цепь, включающую аминокислотную последовательность, которая по меньшей мере на 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична аминокислотной последовательности SEQ ID NO: 29;
е. легкую цепь, включающую аминокислотную последовательность, которая по меньшей мере на 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична аминокислотной последовательности SEQ ID NO: 32;
f. легкую цепь, включающую аминокислотную последовательность, которая по меньшей мере на 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична аминокислотной последовательности SEQ ID NO: 35;
g. легкую цепь, включающую аминокислотную последовательность, которая по меньшей мере на 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична аминокислотной последовательности SEQ ID NO: 38;
h. легкую цепь, включающую аминокислотную последовательность, которая по меньшей мере на 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична аминокислотной последовательности SEQ ID NO: 41;
i. легкую цепь, включающую аминокислотную последовательность, которая по меньшей мере на 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична аминокислотной последовательности SEQ ID NO: 44;
j. легкую цепь, включающую аминокислотную последовательность, которая по меньшей мере на 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична аминокислотной последовательности SEQ ID NO: 47;
k. легкую цепь, включающую аминокислотную последовательность, которая по меньшей мере на 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична аминокислотной последовательности SEQ ID NO: 50;
l. легкую цепь, включающую аминокислотную последовательность, которая по меньшей мере на 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична аминокислотной последовательности SEQ ID NO: 53;
m. легкую цепь, включающую аминокислотную последовательность, которая по меньшей мере на 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична аминокислотной последовательности SEQ ID NO: 56;
n. легкую цепь, включающую аминокислотную последовательность, которая по меньшей мере на 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична аминокислотной последовательности SEQ ID NO: 59;
о. легкую цепь, включающую аминокислотную последовательность, которая по меньшей мере на 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична аминокислотной последовательности SEQ ID NO: 62;
p. легкую цепь, включающую аминокислотную последовательность, которая по меньшей мере на 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична аминокислотной последовательности SEQ ID NO: 65; или
q. легкую цепь, включающую аминокислотную последовательность, которая по меньшей мере на 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична аминокислотной последовательности SEQ ID NO: 68.
10. Молекула антитела по любому из пп. 1-8, отличающаяся тем, что включает тяжелую цепь, включающую аминокислотную последовательность, которая по меньшей мере на 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична аминокислотной последовательности SEQ ID NO: 20, и легкую цепь, содержащую аминокислотную последовательность, которая по меньшей мере на 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична аминокислотной последовательности SEQ ID NO: 19.
11. Молекула антитела по п. 1, отличающаяся тем, что представляет собой Fab-фрагмент, Fab2-фрагмент или одноцепочечное антитело.
12. Молекула антитела по любому из предшествующих пунктов, отличающаяся тем, что обладает одним или несколькими из следующих свойств:
а. уменьшает связывание IL-5 с рецептором IL-5;
b. имеет период полувыведения в сыворотке по меньшей мере около 20 дней; или
с. связывает IL-5 человека и яванского макака, но не IL-5 мыши, крысы или морской свинки.
13. Молекула антитела по п. 1, отличающаяся тем, что связывается с IL-5 человека с равновесной константой аффинности (KD), равной по меньшей мере около 40 пМ, которая определена поверхностным плазмонным резонансом.
14. Фармацевтическая композиция для лечения эозинофильной астмы, гиперэозинофильного синдрома, полипоза носа с эозинофильным поражением, эозинофильного гранулематоза с полиангиитом, атопического дерматита или эозинофильного эзофагита, содержащая терапевтически эффективное количество молекулы антитела по любому из пп. 1-13.
15. Молекула нуклеиновой кислоты, кодирующая молекулу антитела по любому из пп. 1-13.
16. Экспрессирующий вектор, включающий молекулу нуклеиновой кислоты по п. 15.
17. Клетка для экспрессии молекулы антитела по любому из пп. 1-15, содержащая экспрессирующий вектор по п. 16.
18. Способ лечения объекта, страдающего эозинофильной астмой, гиперэозинофильным синдромом, полипозом носа с эозинофильным поражением, эозинофильным гранулематозом с полиангиитом, атопическим дерматитом или эозинофильным эзофагитом, включающий:
введение объекту терапевтически эффективного количества молекулы антитела по любому из пп. 1-13 или фармацевтической композиции по п. 14 для лечения эозинофильной астмы, гиперэозинофильного синдрома, полипоза носа с эозинофильным поражением, эозинофильного гранулематоза с полиангиитом, атопического дерматита или эозинофильного эзофагита.
19. Применение эффективного количества молекулы антитела по любому из пп. 1-13 или фармацевтической композиции по п. 14 при лечении эозинофильной астмы, гиперэозинофильного синдрома, полипоза носа с эозинофильным вовлечением, эозинофильного гранулематоза с полиангиитом, атопического дерматита или эозинофильного эзофагита.
20. Применение молекулы антитела по любому из пп. 1-13 или фармацевтической композиции по п. 14 при изготовлении лекарственного средства для лечения эозинофильной астмы, гиперэозинофильного синдрома, полипоза носа с эозинофильным вовлечением, эозинофильного гранулематоза с полиангиитом, атопического дерматита или эозинофильного эзофагита.
| WO 9621000 A2, 11.07.1996 | |||
| WO 03085089 A2, 16.10.2003 | |||
| STROHL W.R., Optimization of Fc-mediated effector functions of monoclonal antibodies, Current Opinion in Biotechnology, 2009, Volume 20, Issue 6, pp.685-691 | |||
| ЧУЧАЛИН А.Г., Новые перспективы в терапии бронхиальной астмы, Пульмонология, 2011, Номер 4, с.5-12 | |||
| КОЛХИР П.В., СМОЛКИН Ю.С., |
Авторы
Даты
2021-10-25—Публикация
2017-12-20—Подача