Заявленная группа изобретений относится к биотехнологии, а именно к биоэнергетике и технической микробиологии, и предназначена для выработки электрической энергии с помощью микроорганизмов в микробных топливных элементах. Группа изобретений может быть использована для генерации энергии в электроприборах, генераторах на транспорте, в домах, на электростанциях и т.д., а также для биологической очистки сточных вод.
УРОВЕНЬ ТЕХНИКИ
Микробные топливные элементы представляют собой быстро развивающуюся технологию, основанную на возобновляемых источниках энергии. Наиболее перспективное их применение, связано с совмещением технологии биологической очистки сточных вод с производством электроэнергии.
Микробные топливные элементы обладают также перспективами внедрения и в других промышленных областях: создание биометрических датчиков, оценки состояния окружающей среды и степени ее загрязненности; микробных электролизных элементов для получения водорода; источников питания для роботизированной автономной и радиоуправляемой техники, и т.д.
В непатентной литературе в качестве близких аналогов можно указать следующие источники:
1) Karthikeyan, Rengasamy, et al. "Effect of composites based nickel foam anode in microbial fuel cell using Acetobacter aceti and Gluconobacter roseus as a biocatalysts." Bioresource technology 217 (2016): 113-120;
2) Rengasamy, Karthikeyan, and Sheela Berchmans. "Simultaneous degradation of bad wine and electricity generation with the aid of the coexisting biocatalysts Acetobacter aceti and Gluconobacter roseus." Bioresource Technology 104 (2012): 388-393;
3) Al-Shehri, A.N., Ghanem, K.М., Al-Garni, S. Μ. A comparative study for electricity generation in microbial fuel cell reactor with and without mediators. / Scientific Research and Essays. Vol. 6 (9), 2011, pp. 6197-6202;
5) Pham TH, Aelterman P, Verstraete W (2009) Bioanode performance in bioelectrochemical systems: recent improvement and prospects. Trends Biotechnol 27(3):168-178;
6) Malvankar NS, Tuominen MT, Lovely DR (2012) Biofilm conductivity is a decisive variable for high-current-density Geobacter sulfurreducens microbial fuel cells. Energy Environ Sci 5(2):5790-5797.
Из приведенных выше источников наиболее релевантна к предлагаемому изобретению статья (шестой источник), касающаяся электропроводности биопленки как решающего параметра для Geobacter sulfurreducens микробных топливных элементов с высокой плотностью тока. В статье идет речь о том, что текущие выходы микробных топливных ячеек (МФУ) слишком малы для большинства предполагаемых практических применений. Большинство усилий по дальнейшей оптимизации были сосредоточены на модификациях архитектуры топливной ячейки или электродных материалов, при этом мало изучались свойства микроорганизмов, которые наиболее важны для получения максимального тока. Geobacter sulphurreducens производит самую высокую плотность тока из всех известных чистых культур; тесно связан с видами геобактерий, которые часто преобладают в анодных биопленках, собирающих электроэнергию из органических отходов; и производит высокопроводящие анодные биопленки.
В патентной литературе авторами группы изобретений также были найдены различные микробные топливные элементы и способы генерации энергии микроорганизмами.
Так, из патентного документа RU153691U1 (опубликовано 27.07.2015) известен микробный биотопливный элемент, который в общем виде представляет собой ячейку, имеющую отсек для подсоединения электродов, анодную 3 и катодную камеры 4. Камеры отделены друг от друга протонообменной мембраной 5. Обе камеры оборудованы устройствами для подвода и отвода газа. В анодной камере создавали анаэробные условия. Это достигалось подачей аргона. Барботирование аргоном, кроме того, обеспечивает перемешивание суспензии и предотвращает оседание микроорганизмов на дно отсека. В качестве суспензии микробных клеток использован штамм Micrococcus luteus 1-й. Технический эффект - повышение выхода электроэнергии и интенсификация утилизации компонентов сточных вод.
В патентном документе CN 104934622 А (опубликовано 23.08.2015) описан однокамерный микробный топливный элемент с внутренней циркуляцией, который содержит реакционный контейнер, содержащий внешний цилиндр и центральный цилиндр. Центральный цилиндр расположен во внешнем цилиндре. В реакционном контейнере образуется анаэробная среда, а внутреннее циркуляционное устройство расположено в реакционном контейнере, первое циркуляционное отверстие и второе циркуляционное отверстие образованы в центральном цилиндре. Внутреннее циркуляционное устройство может быть использовано для продвижения сточных вод в центральном цилиндре для истечения из центрального цилиндра через второе циркуляционное отверстие, а сточные воды снаружи центрального цилиндра проходят в центральный цилиндр через первое циркуляционное отверстие, или может использоваться для продвижения сточных вод в центральном цилиндре для истечения из центрального цилиндра через первое циркуляционное отверстие и сточные воды вне центрального цилиндра проходят в центральный цилиндр через второе циркуляционное отверстие так, что реализуется циркуляционный поток сточных вод в реакционном контейнере. Реакционный контейнер снабжен впускным отверстием для воды и выпускным отверстием для воды. Реакционный контейнер снабжен внутри анодом, способным выращивать электрический микроорганизм, и катодом, способным восстанавливать кислород электронами и протонами, и резистор включен последовательно между анодом и катодом и протоны, генерируемые микроорганизмами, вырабатывающими электричество, могут быть перенесены на катод вместе с сточными водами в реакционном контейнере.
Патентный документ US 20100304189 B2 (опубликовано 02.12.2010) раскрывает варианты осуществления изобретения, которые относятся к способу получения генетически модифицированных штаммов электроаллергенных микробов, которые специально приспособлены для получения электрического тока в микробных топливных элементах, а также штаммов, продуцируемых такими способами, и топливных элементов с использованием таких штаммов. В предпочтительных вариантах осуществления изобретение относится к генетически модифицированным штаммам сероредукторов Geobacter и к способам применения таких штаммов.
В патентном документе CN106684417А (опубликовано 17.05.2017) раскрыта микробиальная топливная ячейка для синхронного производства электричества и хитозана. Микробный топливный элемент отличается тем, что анод микробиальной топливной ячейки синхронно производит электричество и хитозан с использованием водных остатков и панцирей креветок и крабов; микробный топливный элемент производит электричество, а катод синхронно удаляет тяжелые металлы. Анодная камера содержит электрод, водные остатки, анаэробные микроорганизмы, рибофлавин и субстрат; катодная камера содержит электрод и подложку из тяжелого металла; катод соединен с анодом посредством резистора и провода. Микроорганизмы в анодной камере разрушают водные остатки с использованием самосекреций для генерирования энергии, обеспечивающей ацетат вещества; рибофлавин используют в качестве электронной среды, так что эффективность производства электроэнергии микробиального топливного элемента значительно повышается; при использовании внешней схемы вырабатываемые электроны передаются на катод, так что тяжелый металл удаляется.
Наиболее близким аналогом к предлагаемому изобретению является патентный документ WO/2018/098349 (опубликовано 31.05.2018), в котором раскрыты способы, микробные топливные элементы и микробные консорциумы для генерирования электрического тока, которые включают в себя обеспечение микробного консорциума в анодной камере микробиального топливного элемента, где микробный консорциум включает: 1) сконструированный метаноген, который содержит гетерологичную последовательность нуклеиновой кислоты, кодирующую метил-кофермент м-редуктазу, полученную из анаэробного метанового Окислителя 2) экзоэлектрогеновый микроорганизм, который продуцирует электропроводящие добавки и/или один или более типов электронных носителей, и 3) шлам, метан-акклиматизированный шлам, иловой изолирующий компонент, метан-акклиматизированный белковый изолят, выбранный из Paracoccus spp., Geotoga spp., Geobacter spp., Methmethyarina spp., Garciella spp., гуминовых Кислот; или комбинации любых двух или более из них.
Общими недостатками приведенных выше известных технических решений являются малые величины выходного напряжения, а также то, что известные топливные микробные элементы не обладают автономностью, а зависят от условий окружающей внешней среды и требуют определенного места расположения. При этом попытки повысить величину выходного напряжения сильно усложняют и укрупняют конструкцию устройств.
Таким образом, проведенный анализ уровня техники показал, что существует необходимость создания микробного топливного элемента и способа генерации энергии микроорганизмами, которые устраняли бы приведенные недостатки известных решений.
РАСКРЫТИЕ ИЗОБРЕТЕНИЯ
Техническими результатами, на достижение которых направлено предлагаемое изобретение, являются:
- увеличение мощности микробного топливного элемента за счет повышения эффективности производства электроэнергии микроорганизмами;
- обеспечение внутрисистемного цикла жизнедеятельности микроорганизмов в единой среде в анодной и катодной камерах (пространствах);
- обеспечение мобильности установки и размещения ее в любых естественных условиях;
- длительная автономность установки при сохранении ее мобильности.
Достижение указанных технических результатов обеспечивается установкой замкнутого биоэлектрохимического цикла для генерации энергии, которая представляет собой микробный топливный элемент, который содержит корпус цилиндрической формы с размещенными в нем биоэлектродами разных электрических потенциалов, вокруг которых образуются анодное и катодное пространства, биоэлектроды имеют выводы для замыкания электрической сети и генерации электричества, при этом оба вида биоэлектродов в корпусе цилиндрической формы микробного топливного элемента погружены в одну и ту же анаэробную питательную среду, оптимальную для одновременного развития как электрогенных микроорганизмов на аноде, так и электротрофных микроорганизмов на катоде, катодное пространство инокулировано чистой культурой электротрофного микроорганизма, анодное инокулировано чистой культурой электрогенного микроорганизма, при этом корпус цилиндрической формы выполнен с возможностью обеспечения обмена источниками углерода и энергии между анодной и катодной культурами, при этом источником углерода и энергии для электрогенных микроорганизмов на аноде является ацетат, синтезируемый электротрофными микроорганизмами в биопленке на катоде, а источником углерода для электротрофных микроорганизмов на катоде является СО2 в форме газа или солей угольной кислоты, образующийся в результате окисления ацетата электрогенными микроорганизмами в биопленке на аноде, при этом часть генерируемого тока в форме свободных электронов потребляется катодными электротрофными микроорганизмами.
В корпусе цилиндрической формы могут быть размещены, по меньшей мере один биоанод и, по меньшей мере один биокатод.
Множество биоэлектродов разных электрических потенциалов расположено в корпусе цилиндрической формы в эффективном для показателей конечных электрических характеристик установки порядке.
В качестве анодных электрогенных микроорганизмов, инокулированных в анодное пространство, могут быть выбраны: Clostridium butyricum EG3, Aeromonas hydrophila PA3, Geopsychrobacter electrodiphilus, Ochrobactrum anthropi YZ-1, Rhodopseudomonas palustris DX-1, Thermincola potens JR, Brevibacteria sp, Arcobacter sp, Shewanella marisflavi EP1, Comamonas denitrificans DX-4, Citrobacter sp. SX‐1, Geobacter bremensis, Bacillus pseudofirmus MC02, Tolumonas osonensis OCF, Geobacter sulfurreducens D8, Geobacter Sulfurreducens PCA, Geobacter Sulfurreducens KN400, Raoultella electrica, Enterobacter sp. R2B1, Geobacter sp. SD-1, Klebsiella sp. MC-1, Citrobacter freundii Z7, Desulfuromonas soudanensis WTL, Delftia sp. WE1-13 Azonexus sp. WE2-4, Cloacibacterium normanense RA1, Micrococcus luteus RA2, Diaphorobacter oryzae RA3, Pseudomonas aeruginosa RA5, Paenibacillus sp., Geobacter metallireducens, Aeromonas sp., Enterbacter sp., Geobacter sulfurreducens subsp. ethanolicus CL-1, Citrobacter sp. KVM11, Kluyvera georgiana MCC 3673, Citrobacter sp. strain ND-2, Ca. Brocadia, Ca. Scalindua, Enterobacter cloacae, Escherichia coli W3110, Escherichia coli BL21, Escherichia coli DH5α, Shewanella putrefacians, Tolumonas osonensis, Acetobacter aceti, Arcobacter butzleri, Bacillus subtilis, Corynebacterium strain MFC03, Gluconobacter roseus, Klebsiella aerogenes, Klebsiella pneumoniae, Lysinibacillus sphaericus D-8, Lysinibacillus sphaericus VA5, Proteus vulgaris, Rhodoferax ferrireducens., Sporomusa ovata.
В качестве катодных электротрофных микроорганизмов, инокулированных в катодное пространство, могут быть выбраны: Dechlorospirillum strain VDY, Labrenzia aggregate, Hyphomonas adhaerens, Bacillus firmus, Marinobacter, Phaeobacter daeponensis, Candidatus, H. Aquamarina, Roseobacter sp., Silicibacter, Winogradskyella poriferorum, Acinetobacter johsonii, Thioclava electrotropha, Halomonas sp., Idiomarina sp., Marinobacter sp., Pseudomonas sp., Thalassospira sp., Bacillus sp. strain H, Sporomusa ovata, Micrococcus luteus RA2, Sporomusa acidovorans, Sporomusa malonica, Sporomusa aerivorans, Rhodopseudomonas palustris, Clostridium ljungdahlii, Clostridium pasteurianum, Cupriavidus metallidurans, Acidithiobacillus thiooxidans, Thiobacillus denitrifican, Sulfurimonas denitrificans, Desulfosporosinus orientis, Desulfovibrio piger.
Анодное и катодное пространства могут быть разделены мембраной, проницаемой для ацетата и СО2 в форме газа или солей угольной кислоты. В качестве мембраны может быть выбрана ионообменная мембрана. В качестве мембраны может быть выбрана протонообменная мембрана с высоким количеством карбоксигрупп.
Установка замкнутого биоэлектрохимического цикла может дополнительно быть оснащена системой удаления осадков, образующихся в процессе жизнедеятельности микроорганизмов.
Вторым изобретением группы, которое позволяет достичь указанные технические результаты, предлагается способ генерации энергии микроорганизмами, характеризующийся тем, что для его осуществления последовательно выполняют следующие действия:
- сборку установки замкнутого биоэлектрохимического цикла для генерации энергии,
- обеспечение стерильности установки и питательной среды путем автоклавирования,
- заполнение анодного и катодного пространств в корпусе цилиндрической формы одной и той же анаэробной питательной средой и поддержание анаэробных условий барботированием газом, очищенным от кислорода,
- инокуляцию в анодное пространство чистой культуры электрогенных микроорганизмов, предварительно выращенной до максимально возможной плотности клеток, для формирования на аноде электрогенной биопленки, микроорганизмы которой потребляют ацетат,
- инокуляцию в катодное пространство чистой культуры электротрофных микроорганизмов, предварительно выращенной до максимально возможной плотности клеток, для формирования на катоде электротрофной биопленки, потребляющей CO2 в форме газа или солей угольной кислоты,
- достижение равновесия процессов полного окисления ацетата электрогенными микроорганизмами на аноде и потребления СО2 в форме газа или солей угольной кислоты в ацетат электротрофными микроорганизмами на катоде, обеспечение равномерной циркуляции ацетата и СО2 в форме газа или солей угольной кислоты между катодным и анодным пространствами.
Для предварительного выращивания биопленки анодных электрогенных микроорганизмов в питательную среду анодного пространства добавляют ацетат.
Для предварительного выращивания биопленки катодных электротрофных микроорганизмов катодное пространство продувают водородом особой чистоты.
Для предварительного выращивания биопленки катодных электротрофных микроорганизмов в катодное пространство добавляют соли формиата.
Для предварительного выращивания биопленки катодных электротрофных микроорганизмов в катодное пространство добавляют органическое соединение углерода.
Для предварительного выращивания биопленки катодных электротрофных микроорганизмов в катодное пространство добавляют фруктозу.
Для предварительного выращивания биопленки катодных электротрофных микроорганизмов в катодное пространство добавляют квантовые точки.
Барботирование осуществляют азотом, аргоном, водородом, углекислым газом, или смесью данных газов.
Для регулирования скорости процесса варьируют содержание анионов вольфрамата в питательной среде.
Равномерная циркуляция питательной среды между катодным и анодным пространствами может дополнительно обеспечиваться системой удаления осадков, образующихся в процессе жизнедеятельности микроорганизмов.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
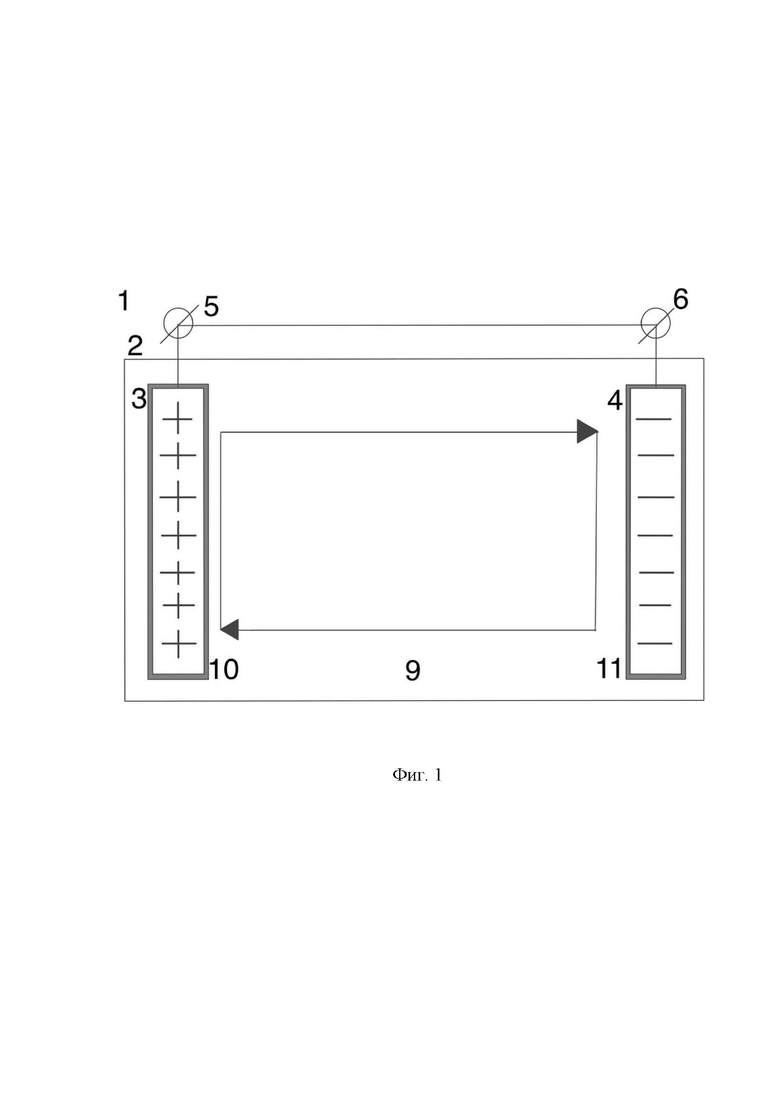
На Фиг. 1 показан схематический вид установки электрического микробиологического цикла с двумя биоэлектродами разных электрических потенциалов.
На Фиг. 2 показан схематический вид установки электрического микробиологического цикла с двумя биоэлектродами разных электрических потенциалов и проницаемой мембраной, разделяющей катодной и анодное пространства.
На Фиг. 3 показан вид схематический вид установки электрического микробиологического цикла с множеством параллельных биоэлектродов разных электрических потенциалов.
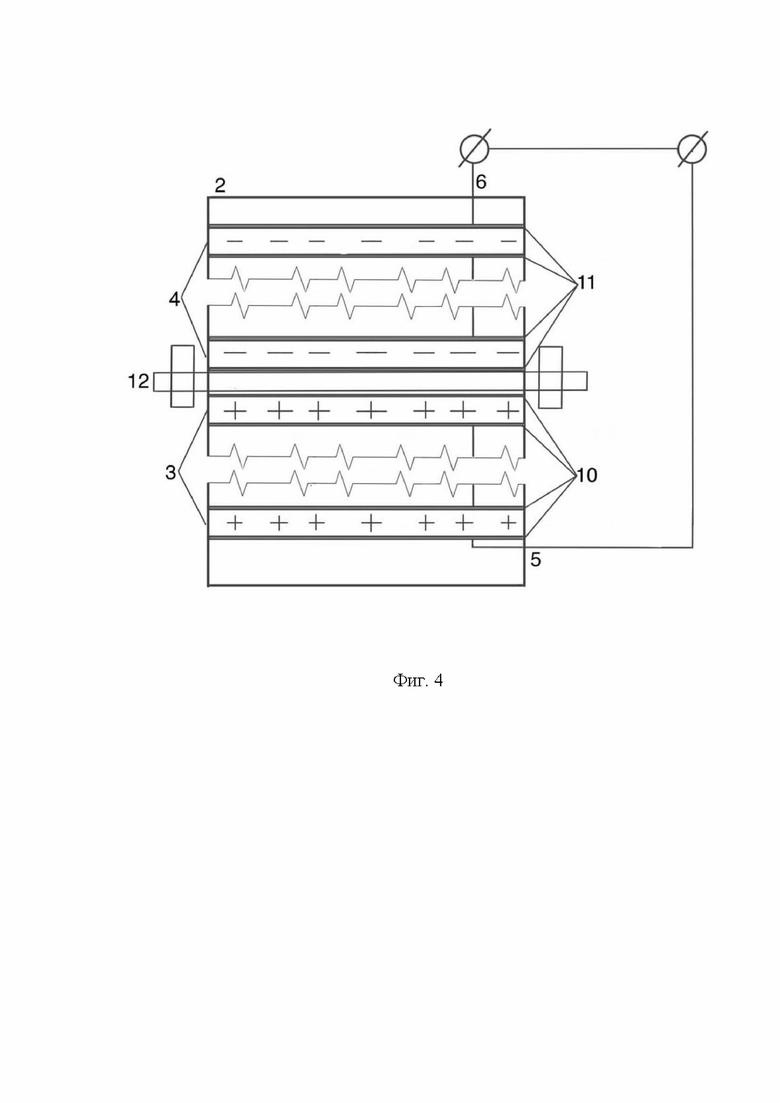
На Фиг. 4 показан вид схематический вид установки электрического микробиологического цикла с множеством параллельных биоэлектродов разных электрических потенциалов и проницаемой мембраной, разделяющей катодной и анодное пространства.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Согласно первому изобретению предлагаемой группы изобретений, установка замкнутого биоэлектрохимического цикла (1) представляет собой микробный топливный элемент, характеризующийся тем, что содержит корпус цилиндрической формы (2) (Фиг. 1-4).
В корпусе цилиндрической формы (2) расположены биоэлектроды разных электрических потенциалов - биоаноды и биокатоды. Согласно изобретению в корпусе цилиндрической формы (2) могут быть размещены, по меньшей мере один биоанод (3) и, по меньшей мере один биокатод (4) (Фиг. 1, 2). В случае, когда в корпусе цилиндрической формы (2) размещают множество биоанодов и биокатодов, то такое множество биоэлектродов разных электрических потенциалов (Фиг. 3, 4) расположено в корпусе цилиндрической формы (2) в эффективном для показателей конечных электрических характеристик установки (1) порядке.
Биоэлектроды разных электрических потенциалов (биоаноды и биокатоды) имеют выводы для замыкания электрической сети и генерации электричества: выводы (5) - биоаноды, выводы (6) - биокатоды (Фиг. 1-4).
Биоэлектроды в предлагаемой конструкции установки электрического микробиологического цикла могут быть изготовлены в двух исполнениях.
Первое исполнение - это электрод в виде стальной сетки с покрытием из графена. Толщина стальной сетки составляет 0.2 мкм.
Второе исполнение - это в виде углеродного войлока с покрытием из графена. Толщина углеродного войлока составляет 3 мм. Углеродный войлок обладает высокой пористостью (до 70%) и развитой удельной поверхностью (до 5 м2/г).
Графеновое покрытие может быть нанесено посредством погружения электрода в водную взвесь графена или посредством нанесения водной взвеси графена на поверхность электрода с помощью красильной кисти. Водная взвесь графена для нанесения изготавливается посредством электролитической эксфолиации графитовой бумаги в хлопья размером до 2 мкм. Затем хлопья повергаются ультразвуковой обработке в течение 24 часов до достижения взвесью вязкой консистенции, пригодной для нанесения покрытия. Полученные данным способом частицы графена содержат менее 5,5 ат.% кислорода, имеют площадь поверхности по БЭТ не менее 30 м2/г и среднее аспектное отношение 3:1. Наносимые на электроды покрытия обладают высокой электропроводностью - не менее 1000 см/м.
Вокруг биоанода (3) и биокатода (4) образуются анодное (7) и катодное (8) пространства.
В анодном (7) и катодном (8) пространствах корпуса цилиндрической формы (2) создана единая анаэробная среда (9) с одинаковым составом, обеспечивающая создание внутрисистемного цикла жизнедеятельности микроорганизмов. Т.е. оба вида биоэлектродов (3 и 4) в корпусе цилиндрической формы (2) микробного топливного элемента погружены в одну и ту же анаэробную питательную среду (9), оптимальную для одновременного развития как электрогенных микроорганизмов на аноде (3), так и электротрофных микроорганизмов на катоде (4).
В качестве среды может быть выбрана питательная среда (9), содержащая следующие компоненты: хлорид аммония (NH4Cl), сульфат магния (MgSO4 × 7 H2O), хлорид кальция (CaCl2 × 2 H2O), хлорид натрия (NaCl), гидроселенит натрия (NaHSeO3), сульфат железа (FeSO4 × 7 H2O), дрожжевой экстракт, фосфаты калия и натрия (K2HPO4, KH2PO4, NaH2PO4), карбонат натрия (NaHCO3), сульфид натрия (Na2S), ацетат натрия (CH3COONa), фумарат натрия, L-цистеин, вольфрамат натрия (Na2WO4), а также витамины (биотин, фолиевая кислота, пиридоксин, тиамин, рибофлавин, никотиновая кислота, пантотеновая кислота, витамин В12, пара-аминобензойная кислота, липолевая кислота) и микрокомпоненты (катионы магния, марганца, железа, кобольта, кальция, цинка, меди, а также сульфат, хлорид, вольфрамат и молибдат анионы).
Способность питательной среды (9), которая является буферным раствором, сохранять свой pH определяется его буферной емкостью. Буферная емкость используемой среды (9) может обеспечиваться карбонатной или фосфатной буферной системой или их комбинацией. pH используемой среды находится в диапазоне от 6 до 8.
Анаэробные условия обеспечиваются подачей газа, очищенного от кислорода, барботирование которым дополнительно позволяет перемешивать среду (9) и предотвращать оседание микроорганизмов (10, 11) на дно корпуса цилиндрической формы (2). В частности, барботирование можно осуществлять азотом, аргоном, водородом, углекислым газом, или смесью данных газов.
В анодном пространстве (7) инокулированы (засеяны) анодные микроорганизмы (10) в виде чистой культуры электрогенных микроорганизмов, предварительно выращенной до максимально возможной плотности клеток, для формирования на аноде (3) электрогенной биопленки, микроорганизмы которой потребляют ацетат (молекулы ацетата), который образуется из процессов, происходящих в катодной камере (8), т.е. продуцируемые посредством катодных микроорганизмов (11).
Таким образом, источником углерода и энергии для электрогенных микроорганизмов на аноде (3) - анодных электрогенных микроорганизмов (10) - является ацетат, синтезируемый электротрофными микроорганизмами в биопленке на катоде (4).
В качестве анодных электрогенных микроорганизмов (10), инокулированных в анодном пространстве (7), могут быть выбраны: Clostridium butyricum EG3, Aeromonas hydrophila PA3, Geopsychrobacter electrodiphilus, Ochrobactrum anthropi YZ-1, Rhodopseudomonas palustris DX-1, Thermincola potens JR, Brevibacteria sp, Arcobacter sp, Shewanella marisflavi EP1, Comamonas denitrificans DX-4, Citrobacter sp. SX‐1, Geobacter bremensis, Bacillus pseudofirmus MC02, Tolumonas osonensis OCF, Geobacter sulfurreducens D8, Geobacter Sulfurreducens PCA, Geobacter Sulfurreducens KN400, Raoultella electrica, Enterobacter sp. R2B1, Geobacter sp. SD-1, Klebsiella sp. MC-1, Citrobacter freundii Z7, Desulfuromonas soudanensis WTL, Delftia sp. WE1-13 Azonexus sp. WE2-4, Cloacibacterium normanense RA1, Micrococcus luteus RA2, Diaphorobacter oryzae RA3, Pseudomonas aeruginosa RA5, Paenibacillus sp., Geobacter metallireducens, Aeromonas sp., Enterbacter sp., Geobacter sulfurreducens subsp. ethanolicus CL-1, Citrobacter sp. KVM11, Kluyvera georgiana MCC 3673, Citrobacter sp. strain ND-2, Ca. Brocadia, Ca. Scalindua, Enterobacter cloacae, Escherichia coli W3110, Escherichia coli BL21, Escherichia coli DH5α, Shewanella putrefacians, Tolumonas osonensis, Acetobacter aceti, Arcobacter butzleri, Bacillus subtilis, Corynebacterium strain MFC03, Gluconobacter roseus, Klebsiella aerogenes, Klebsiella pneumoniae, Lysinibacillus sphaericus D-8, Lysinibacillus sphaericus VA5, Proteus vulgaris, Rhodoferax ferrireducens, Sporomusa ovata.
В катодном пространстве (8) инокулированы (засеяны) катодные микроорганизмы (11) в виде чистой культуры электротрофных микроорганизмов, предварительно выращенной до максимально возможной плотности клеток, для формирования на катоде (4) электротрофной биопленки, микроорганизмы которой потребляют CO2 в форме газа или солей угольной кислоты, продуцируемый процессами, происходящими в анодном пространстве (7).
Таким образом, источником углерода для электротрофных микроорганизмов на катоде (4) - катодных электротрофных микроорганизмов (11) - является СО2 в форме газа или солей угольной кислоты, образующийся в результате окисления ацетата электрогенными микроорганизмами в биопленке на аноде (3).
Катодными электротрофными микроорганизмами (11) потребляется часть генерируемого тока в форме свободных электронов.
В качестве катодных электротрофных микроорганизмов (11), инокулированных в катодном пространстве (8), могут быть выбраны: Dechlorospirillum strain VDY, Labrenzia aggregate, Hyphomonas adhaerens, Bacillus firmus, Marinobacter, Phaeobacter daeponensis, Candidatus, H. Aquamarina, Roseobacter sp., Silicibacter, Winogradskyella poriferorum, Acinetobacter johsonii, Thioclava electrotropha, Halomonas sp., Idiomarina sp., Marinobacter sp., Pseudomonas sp., Thalassospira sp., Bacillus sp. strain H, Sporomusa ovata, Micrococcus luteus RA2, Sporomusa acidovorans, Sporomusa malonica, Sporomusa aerivorans, Rhodopseudomonas palustris, Clostridium ljungdahlii, Clostridium pasteurianum, Cupriavidus metallidurans, Acidithiobacillus thiooxidans, Thiobacillus denitrifican, Sulfurimonas denitrificans, Desulfosporosinus orientis, Desulfovibrio piger.
Анодные электрогенные микроорганизмы (10) и катодные электротрофные микроорганизмы (11) совместно с единой анаэробной питательной средой (9) образуют внутрисистемный цикл жизнедеятельности микроорганизмов.
Анодное (7) и катодное (8) пространства могут быть разделены проницаемой мембраной (12) (Фиг. 2, 4).
В качестве мембраны (12) может быть выбрана любая мембрана, проницаемая для источников углерода для используемых микроорганизмов. Мембрана разделяет катодное и анодное пространства по размеру пор. Например, может быть выбрана ионообменная мембрана.
В частности, конструкционно мембрана (12) может представлять собой протонообменную мембрану с высоким количеством карбоксигрупп, которые обеспечивают перенос протонов в рабочем растворе. Содержание воды в мембране характеризуется параметром λ, который равен отношению молекул воды к количеству сульфонных групп. Протон в мембране переносится в виде иона гидроксония H3O+, причем коэффициент диффузии иона гидроксония через мембрану в несколько раз превышает коэффициент диффузии воды при λ>10.
Установка замкнутого биоэлектрохимического цикла (1) может дополнительно быть оснащена системой удаления осадков, образующихся в процессе жизнедеятельности микроорганизмов. Конструкция установки (1) позволяет подключить внешнее устройство для фильтрации питательной среды (9), сохранив анаэробность анодного (7) и катодного (8) пространств. Данная система является опциональной. Общий принцип работы такой системы заключается в выведении питательной среды (9) из установки (1) по специальной трубке, содержащей фильтр, и обратное её введение в установку.
Вторым изобретением предлагаемой группы изобретений является способ генерации энергии микроорганизмами.Для осуществления способа генерации энергии микроорганизмами последовательно выполняют следующие действия.
Собирают установку электрического микробиологического цикла (1) согласно первому изобретению предлагаемой группы изобретений, которая представляет собой микробный топливный элемент, содержащий корпус цилиндрической формы (2) (Фиг. 1-4). В корпусе цилиндрической формы (2) расположены биоэлектроды разных электрических потенциалов, биоаноды и биокатоды (Фиг. 1-4). Биоэлектроды разных электрических потенциалов (биоаноды и биокатоды) имеют выводы для замыкания электрической сети и генерации электричества: выводы (5) - биоаноды, выводы (6) - биокатоды (Фиг. 1-4). Биоэлектроды в предлагаемой конструкции установки электрического микробиологического цикла могут быть изготовлены в виде стальной сетки с покрытием из графена или в виде углеродного войлока с покрытием из графена.
Вокруг биоанода (3) и биокатода (4) образуются анодное (7) и катодное (8) пространства. Оба вида биоэлектродов (3 и 4) в корпусе цилиндрической формы (2) микробного топливного элемента погружены в одну и ту же анаэробную питательную среду (9), обеспечивающую создание внутрисистемного цикла жизнедеятельности микроорганизмов, т.е. оптимальную для одновременного развития как электрогенных микроорганизмов на аноде (3), так и электротрофных микроорганизмов на катоде (4).
Далее, собранную установку электрического микробиологического цикла (1) автоклавируют, обеспечивая ее стерильность. Автоклавирование может быть осуществлено в любом стандартном автоклаве, который обеспечивает достаточную стерилизацию установки (1) и питательной среды (9).
В стерильную установку электрического микробиологического цикла (1) подают питательную среду (9), заполняя ею анодное (7) и катодное (8) пространства корпуса цилиндрической формы (2), формируя единую питательную среду (9) с одинаковым составом в пространствах. Анаэробность среды (9) обеспечивают барботированием газом, очищенным от кислорода. В качестве газа выбирают аргон, азот, водород, углекислый газ, или их смесь. Барботирование газом дополнительно позволяет перемешивать среду (9) и предотвращать оседание микроорганизмов (10, 11) на дно корпуса цилиндрической формы (2).
Далее, в анодное пространство (7) инокулируют чистую культуру электрогенных микроорганизмов (10), предварительно выращенную до максимально возможной плотности клеток, для формирования на аноде (3) электрогенной биопленки, микроорганизмы которой потребляют ацетат.
Для предварительного выращивания биопленки анодных электрогенных микроорганизмов (10) в питательную среду (9) анодного пространства (7) добавляют ацетат.
В катодное пространство (8) инокулируют чистую культуру электротрофных микроорганизмов (11), предварительно выращенную до максимально возможной плотности клеток, для формирования на катоде (4) электротрофной биопленки, потребляющей CO2 в форме газа или солей угольной кислоты.
Для предварительного выращивания биопленки катодных электротрофных микроорганизмов (11) катодное пространство (8) продувают водородом особой чистоты. Также для продувки может быть использована смесь водорода особой чистоты с азотом и/или углекислым газом.
Для предварительного выращивания биопленки катодных электротрофных микроорганизмов (11) в катодное пространство (8) добавляют соли формиата.
Для предварительного выращивания биопленки катодных электротрофных микроорганизмов (11) в катодное пространство (8) добавляют органическое соединение углерода. В качестве органического соединения углерода может быть добавлена фруктоза.
Для предварительного выращивания биопленки катодных электротрофных микроорганизмов (11) в катодное пространство (8) добавляют квантовые точки. Квантовые точки добавляются в питательную среду (9) в виде устойчивого водного раствора (квантовые точки + H2O) с концентрацией 20%.
Предварительное выращивание биопленки катодных электротрофных микроорганизмов (11) в катодном пространстве (8) может совмещать продувку и добавление солей формиата, органического соединения углерода, квантовых точек.
Далее достигают равновесия процессов превращения ацетата в углекислый газ анодными микроорганизмами (10) и превращения углекислого газа в ацетат катодными микроорганизмами (11) и обеспечивают равномерную циркуляцию питательной среды (9).
Для регулирования скорости процесса может быть варьировано содержание анионов вольфрамата. Анионы вольфрамата добавляются в рабочую питательную среду (9) в дополнение к остальным микроэлементам. Их выбор обусловлен присутствием вольфрам-зависимых ферментов в метаболической цепи ацетогенеза. Используется диапазон концентраций от 0,01 до 0,1 мкМ (мкмоль/л). При увеличении концентрации анионов вольфрамата наблюдается увеличение скорости продуцирования ацетата катодными электротрофными микроорганизмами (11).
Для обеспечения равномерной циркуляции питательной среды (9) между катодным (8) и анодным (7) пространствами установка замкнутого биоэлектрохимического цикла (1) может дополнительно оснащаться системой удаления осадков, образующихся в процессе жизнедеятельности микроорганизмов. Конструкция установки (1) позволяет подключить внешнее устройство для фильтрации питательной среды (9), сохранив анаэробность анодного (7) и катодного (8) пространств. Данная система является опциональной. Общий принцип работы такой системы заключается в выведении питательной среды (9) из установки (1) по специальной трубке, содержащей фильтр, и обратное её введение в установку.
ОСУЩЕСТВЛЕНИЕ ИЗОБРЕТЕНИЯ
Авторами были проведены испытания заявленной группы изобретений, которые осуществляли следующим образом.
Собрали установку замкнутого биоэлектрохимического цикла (1), которая представляет собой микробный топливный элемент, содержащий корпус цилиндрической формы (2) с двумя биоэлектродами разных электрических потенциалов, биоанод (3) и биокатод (4) с выводами (5) и (6). Биоанод изготовлен в виде стальной сетки с покрытием из графена, биокатод - в виде углеродного войлока с покрытием из графена.
Также, были протестированы установки, в которых было по три, пять и десять биоэлектродов разных электрических потенциалов. При этом биоаноды (3) и биокатоды (4) были изготовлены как в виде стальной сетки с покрытием из графена, так и в виде углеродного войлока с покрытием из графена. Указанные биоэлектроды были расположены в корпусе цилиндрической формы в эффективном для показателей конечных электрических характеристик установки порядке (показатели приведены в Таблице 5).
Далее, собранную установку замкнутого биоэлектрохимического цикла (1) автоклавировали в автоклаве марки TUTTNAUER 2540MK, обеспечив ее стерильность, и соответственно стерильность подаваемой в нее питательной среды (9).
Анодное (7) и катодное (8) пространство корпуса цилиндрической формы (2) заполнили одной и той же питательной средой (9), т.е. состав питательной среды (9) в обоих пространствах одинаков. Анаэробность среды (9) обеспечили барботированием газом, очищенным от кислорода.
Исследованные составы среды питательных сред и использованных газов приведены в Таблице 1.
Гидрофосфат натрия - 0,6 г/л
Хлорид калия - 0,1 г/л
Ацетат натрия - 0,82 г/л
Гидрокарбонат натрия - 2,5 г/л
Сульфид натрия - 50мМ
Стандартный раствор витаминов
Стандартный раствор микроэлементов
Гидрофосфат натрия - 0,6 г/л
Хлорид калия - 0,1 г/л
Ацетат натрия - 0,82 г/л
Гидрокарбонат натрия - 2,5 г/л
Сульфид натрия - 50мМ
Стандартный раствор витаминов
Стандартный раствор микроэлементов
Дрожжевой экстракт - 0,1 г/л
Гидрофосфат натрия - 0,6 г/л
Хлорид калия - 0,1 г/л
Ацетат натрия - 0,82 г/л
Гидрокарбонат натрия - 2,5 г/л
Сульфид натрия - 50мМ
Стандартный раствор витаминов
Стандартный раствор микроэлементов
Дрожжевой экстракт - 0,1 г/л
Квантовые точки - 0,5 г/л
В Таблице 2 приведен стандартный раствор витаминов, добавляется из расчёта 10 мл на литр среды.
В Таблице 3 приведен стандартный раствор микроэлементов, добавляется из расчёта 10 мл на литр среды.
Эксперимент с составом питательной среды № 6 проводили в установке, анодное и катодное пространства которой были разделены протонообменной мембраной Dupont (Nafion 324) улучшенного типа (с высоким количеством карбоксигрупп). В эксперименте № 5 использовали обычную ионообменную мембрану.
Далее, в анодное пространство (7) инокулировали анодные электрогенные микроорганизмы (10), а в катодное пространство (8) инокулировали катодные электротрофные микроорганизмы (11), предварительно вырастив их до формирования биопленки. Испытания проводили с разными анодными (10) и катодными (11) микроорганизмами. Данные приведены в Таблице 4.
Гидрофосфат натрия - 0,6 г/л
Хлорид калия - 0,1 г/л
Гидрокарбонат натрия - 2,5 г/л
Сульфид натрия - 50мМ
Стандартный раствор витаминов
Стандартный раствор микроэлементов
Гидрофосфат натрия - 0,6 г/л
Хлорид калия - 0,1 г/л
Гидрокарбонат натрия - 2,5 г/л
Сульфид натрия - 50мМ
Стандартный раствор витаминов
Стандартный раствор микроэлементов
Гидрофосфат натрия - 0,6 г/л
Хлорид калия - 0,1 г/л
Гидрокарбонат натрия - 2,5 г/л
Сульфид натрия - 50мМ
Стандартный раствор витаминов
Стандартный раствор микроэлементов
Гидрофосфат натрия - 0,6 г/л
Хлорид калия - 0,1 г/л
Гидрокарбонат натрия - 2,5 г/л
Сульфид натрия - 50мМ
Стандартный раствор витаминов
Стандартный раствор микроэлементов
Гидрофосфат натрия - 0,6 г/л
Хлорид калия - 0,1 г/л
Гидрокарбонат натрия - 2,5 г/л
Сульфид натрия - 50мМ
Стандартный раствор витаминов
Стандартный раствор микроэлементов
Гидрофосфат натрия - 0,6 г/л
Хлорид калия - 0,1 г/л
Гидрокарбонат натрия - 2,5 г/л
Сульфид натрия – 50 мМ
Стандартный раствор витаминов
Стандартный раствор микроэлементов
Гидрофосфат натрия - 0,6 г/л
Хлорид калия - 0,1 г/л
Гидрокарбонат натрия - 2,5 г/л
Сульфид натрия - 50мМ
Стандартный раствор витаминов
Стандартный раствор микроэлементов
Гидрофосфат натрия - 0,6 г/л
Хлорид калия - 0,1 г/л
Гидрокарбонат натрия - 2,5 г/л
Сульфид натрия - 50мМ
Стандартный раствор витаминов
Стандартный раствор микроэлементов
Гидрофосфат калия - 1,5 г/л
Хлорид калия - 0,1 г/л
Сульфат магния - 0,2 г/л
Сульфид натрия – 50 мМ
Стандартный раствор витаминов
Стандартный раствор микроэлементов
Гидрофосфат калия - 1,5 г/л
Хлорид калия - 0,1 г/л
Сульфат магния - 0,2 г/л
Сульфид натрия – 50 мМ
Стандартный раствор витаминов
Стандартный раствор микроэлементов
Гидрофосфат натрия - 0,6 г/л
Хлорид калия - 0,1 г/л
Гидрокарбонат натрия - 2,5 г/л
Сульфид натрия – 50 мМ
Стандартный раствор витаминов
Стандартный раствор микроэлементов
Гидрофосфат натрия - 0,6 г/л
Хлорид калия - 0,1 г/л
Гидрокарбонат натрия - 2,5 г/л
Сульфид натрия – 50 мМ
Стандартный раствор витаминов
Стандартный раствор микроэлементов
Гидрофосфат натрия - 0,6 г/л
Хлорид калия - 0,1 г/л
Гидрокарбонат натрия - 2,5 г/л
Сульфид натрия – 50 мМ
Стандартный раствор витаминов
Стандартный раствор микроэлементов
Эксперименты с составами питательной среды № 14 и № 15 (Таблица 2) проводили в установке, дополнительно оснащенной системой удаления осадков.
Исследование осуществления группы предлагаемых изобретений было проведено в различных естественных условиях - при комнатной температуре и в термостатических условиях (термостатический бокс). В Таблице 5 приведены сведения для установки на основе пары микроорганизмов Geobacter sulfurreducens и Sporomusa ovata.
В отношении автономности авторы подчеркивают, что эксперименты продолжаются и продолжают тестироваться установки электрического микробиологического цикла, на которых осуществляется способ генерации энергии микроорганизмами, которые автономно работают более 1,5 лет.
Установки № 5 и № 10 были перевезены из термостатируемого бокса в лабораторную комнату с колеблющимися комнатной температурой, влажностью и наличием естественного освящения для имитации реальных условий эксплуатации установки. Результаты исследования показали неизменность характеристик установок и бесперебойность их работы. Мобильность установки достигается, в том числе за счет цилиндрической формы корпуса, которая позволяет устанавливать установку как горизонтально, так и вертикально (на оба основания). Кроме того, установка в рабочем состоянии полностью герметична и не требует наличия какого-либо дополнительного оборудования.
В результате проведенных исследований было установлено, что при использовании заявленного изобретения обеспечивается внутрисистемный цикл жизнедеятельности микроорганизмов в единой (одной и той же) среде в анодном и катодном пространствах. При этом, эффективность производства электроэнергии микроорганизмами возрастает, за счет чего увеличивается мощность микробного топливного элемента.
Кроме того, все исследуемые варианты воплощения группы изобретений показали, что предлагаемые установка замкнутого биоэлектрохимического цикла и способ генерации энергии микроорганизмами обеспечивают мобильность установки и размещения ее в любых естественных условиях, а также длительную автономность установки при сохранении ее мобильности.
| название | год | авторы | номер документа |
|---|---|---|---|
| Микробный топливный элемент | 2024 |
|
RU2833628C1 |
| ЯЧЕЙКА МИКРОБНОГО ТОПЛИВНОГО ЭЛЕМЕНТА ДЛЯ ГЕНЕРАЦИИ ЭЛЕКТРОЭНЕРГИИ ИЗ СТОЧНЫХ ВОД | 2023 |
|
RU2809834C1 |
| СПОСОБЫ И СИСТЕМЫ С ИСПОЛЬЗОВАНИЕМ ИОНОФОРОВ ДЛЯ КОНТРОЛЯ КОНТАМИНАЦИИ ПРИ ФЕРМЕНТАЦИИ ГАЗООБРАЗНЫХ СУБСТРАТОВ | 2017 |
|
RU2765490C2 |
| Двухсекционная установка для получения электрической энергии из сине-зеленых водорослей | 2019 |
|
RU2726327C1 |
| Биотопливный элемент | 2017 |
|
RU2657289C1 |
| Способ изготовления печатного источника энергии на основе цианобактерий и печатный источник энергии | 2022 |
|
RU2790356C1 |
| Установка для получения электрической энергии из сине-зеленых водорослей | 2019 |
|
RU2699123C1 |
| Биосенсор для определения наличия органических веществ в воде | 2017 |
|
RU2650634C1 |
| СПОСОБ ПРЕОБРАЗОВАНИЯ СОЕДИНЕНИЯ СЕРЫ | 2019 |
|
RU2780483C2 |
| СПОСОБ УДАЛЕНИЯ ИОНОВ ОДНОГО ИЛИ БОЛЕЕ МЕТАЛЛОВ ИЗ ВОДЫ | 1993 |
|
RU2135421C1 |


Изобретение относится к области электротехники, а именно к выработке электрической энергии в микробном топливном элементе и может быть использовано одновременно с биологической очисткой сточных вод. Увеличение мощности микробного топливного элемента является техническим результатом изобретения, который достигается за счет того, что установка содержит корпус цилиндрической формы, электроды, размещенные в анаэробной питательной среде, катодное пространство заполнено чистой культурой электротрофного микроорганизма, анодное пространство чистой культурой электрогенного микроорганизма, источником углерода на аноде является ацетат, а источником углерода на катоде СО2 в форме газа или солей угольной кислоты. Также предложен способ генерации электрический энергии с участием микроорганизмов, включающий сборку установки, автоклавирование, заполнение анодного и катодного пространств одной и той же анаэробной питательной средой и поддержание анаэробных условий, инокуляцию чистых культур микроорганизмов в анодное и катодное пространства, предварительно выращенных до максимально возможной плотности клеток, достижение равновесия процессов, обеспечение равномерной циркуляции между катодным и анодным пространствами. 2 н. и 17 з.п. ф-лы, 4 ил., 5 табл.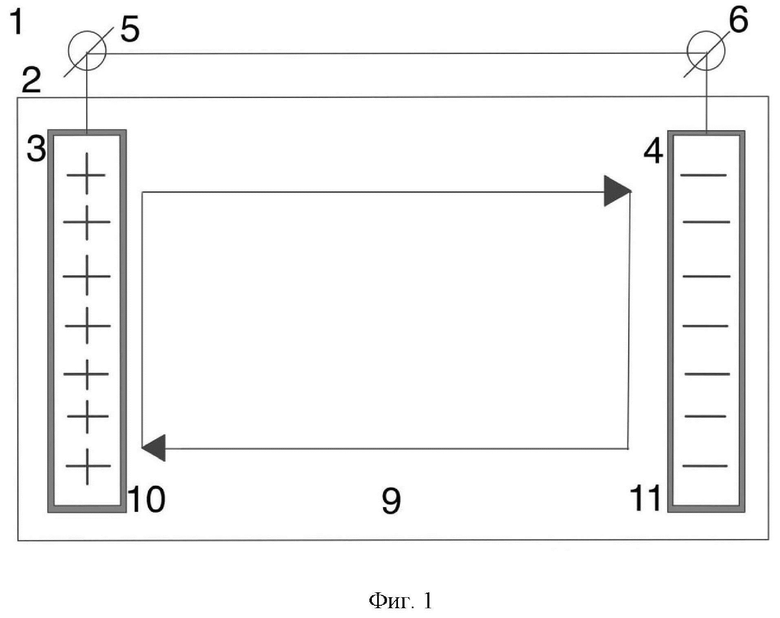
1. Установка замкнутого биоэлектрохимического цикла для генерации энергии, характеризующаяся тем, что представляет собой микробный топливный элемент, который содержит корпус цилиндрической формы с размещенными в нем биоэлектродами разных электрических потенциалов, вокруг которых образуются анодное и катодное пространства, биоэлектроды имеют выводы для замыкания электрической сети и генерации электричества, при этом оба вида биоэлектродов в корпусе цилиндрической формы микробного топливного элемента погружены в одну и ту же анаэробную питательную среду, оптимальную для одновременного развития как электрогенных микроорганизмов на аноде, так и электротрофных микроорганизмов на катоде, катодное пространство инокулировано чистой культурой электротрофного микроорганизма, анодное нокулировано чистой культурой электрогенного микроорганизма, при этом корпус цилиндрической формы выполнен с возможностью обеспечения обмена источниками углерода и энергии между анодной и катодной культурами, при этом источником углерода и энергии для электрогенных микроорганизмов на аноде является ацетат, синтезируемый электротрофными микроорганизмами в биопленке на катоде, а источником углерода для электротрофных микроорганизмов на катоде является СО2 в форме газа или солей угольной кислоты, образующийся в результате окисления ацетата электрогенными микроорганизмами в биопленке на аноде, при этом часть генерируемого тока в форме свободных электронов потребляется катодными электротрофными микроорганизмами.
2. Установка по п. 1, отличающаяся тем, что в корпусе цилиндрической формы могут быть размещены, по меньшей мере, один биоанод и, по меньшей мере, один биокатод.
3. Установка по п. 1, отличающаяся тем, что множество биоэлектродов разных электрических потенциалов расположено в корпусе цилиндрической формы в эффективном для показателей конечных электрических характеристик установки порядке.
4. Установка по п. 1, отличающаяся тем, что в качестве анодных электрогенных микроорганизмов, инокулированных в анодное пространство, могут быть выбраны: Clostridium butyricum EG3, Aeromonas hydrophila РА3, Rhodopseudomonas palustris DX-1, Geobacter bremensis, Geobacter sulfurreducens D8, Geobacter Sulfurreducens PCA, Geobacter Sulfurreducens KN400, Geobacter sp.SD-1, Geobacter metallireducens, Aeromonas sp., Geobacter sulfurreducens subsp.ethanolicus CL-1, Sporomusa ovata.
5. Установка по п. 1, отличающаяся тем, что в качестве катодных электротрофных микроорганизмов, инокулированных в катодное пространство, могут быть выбраны: Sporomusa ovata, Sporomusa acidovorans, Sporomusa malonica, Sporomusa aerivorans, Rhodopseudomonas palustris, Clostridium ljungdahlii, Clostridium pasteurianum.
6. Установка по п. 1, отличающаяся тем, что анодное и катодное пространства могут быть разделены мембраной, проницаемой для ацетата и СО2 в форме газа или солей угольной кислоты.
7. Установка по п. 6, отличающаяся тем, что в качестве мембраны может быть выбрана ионообменная мембрана.
8. Установка по п. 6, отличающаяся тем, что в качестве мембраны может быть выбрана протонообменная мембрана с высоким количеством карбоксигрупп.
9. Установка по п. 1, отличающаяся тем, что установка замкнутого биоэлектрохимического цикла может дополнительно быть оснащена системой удаления осадков, образующихся в процессе жизнедеятельности микроорганизмов.
10. Способ генерации энергии микроорганизмами, характеризующийся тем, что для его осуществления последовательно выполняют следующие действия:
- сборку установки замкнутого биоэлектрохимического цикла для генерации энергии согласно любому из пп. 1-9,
- обеспечение стерильности установки и питательной среды путем автоклавирования,
- заполнение анодного и катодного пространств в корпусе цилиндрической формы одной и той же анаэробной питательной средой и поддержание анаэробных условий барботированием газом, очищенным от кислорода,
- инокуляцию в анодное пространство чистой культуры электрогенных микроорганизмов, предварительно выращенной до максимально возможной плотности клеток, для формирования на аноде электрогенной биопленки, микроорганизмы которой потребляют ацетат,
- инокуляцию в катодное пространство чистой культуры электротрофных микроорганизмов, предварительно выращенной до максимально возможной плотности клеток, для формирования на катоде электротрофной биопленки, потребляющей СО2 в форме газа или солей угольной кислоты,
- достижение равновесия процессов полного окисления ацетата электрогенными микроорганизмами на аноде и потребления СО2 в форме газа или солей угольной кислоты в ацетат электротрофными микроорганизмами на катоде, обеспечение равномерной циркуляции ацетата и СО2 в форме газа или солей угольной кислоты между катодным и анодным пространствами.
11. Способ по п. 10, отличающийся тем, что для предварительного выращивания биопленки анодных электрогенных микроорганизмов в питательную среду анодного пространства добавляют ацетат.
12. Способ по п. 10, отличающийся тем, что для предварительного выращивания биопленки катодных электротрофных микроорганизмов катодное пространство продувают водородом особой чистоты.
13. Способ по п. 10, отличающийся тем, что для предварительного выращивания биопленки катодных электротрофных микроорганизмов в катодное пространство добавляют соли формиата.
14. Способ по п. 10, отличающийся тем, что для предварительного выращивания биопленки катодных электротрофных микроорганизмов в катодное пространство добавляют глюкозу, дрожжевой экстракт, яблочную кислоту.
15. Способ по п. 14, отличающийся тем, что для предварительного выращивания биопленки катодных электротрофных микроорганизмов в катодное пространство добавляют фруктозу.
16. Способ по п. 10, отличающийся тем, что для предварительного выращивания биопленки катодных электротрофных микроорганизмов в катодное пространство добавляют квантовые точки.
17. Способ по п. 10, отличающийся тем, что барботирование осуществляют азотом, аргоном, водородом, углекислым газом или смесью данных газов.
18. Способ по п. 10, отличающийся тем, что для регулирования скорости процесса варьируют содержание анионов вольфрамата в питательной среде.
19. Способ по п. 10, отличающийся тем, что равномерная циркуляция питательной среды между катодным и анодным пространствами может дополнительно обеспечиваться системой удаления осадков, образующихся в процессе жизнедеятельности микроорганизмов.
| WO 2018098349 A1, 31.05.2018 | |||
| 0 |
|
SU153691A1 | |
| CN 104934622 A, 23.09.2015 | |||
| US 20100304189 A1, 02.12.2010 | |||
| CN 106684417 A, 17.05.2017 | |||
| УСТРОЙСТВО для БИОЛОГИЧЕСКОЙ очистки сточныхвод | 0 |
|
SU170868A1 |
| KR 20100109096 A, 08.10.2010. | |||
Авторы
Даты
2023-05-15—Публикация
2021-11-13—Подача