Лучевая терапия (далее - ЛТ) является эффективным методом лечения больных с новообразованиями. Терапевтический эффект достигается за счет повреждающего опухолевые клетки действия ионизирующего излучения. Известно, что плотно-ионизирующие виды излучений, обладающие высокой относительной биологической эффективностью (далее - ОБЭ), наносят более сложные для репарации повреждения. К таким излучениям относят ускоренные заряженные частицы и нейтроны, используемые, в том числе, при облучении радиорезистентных видов рака. Однако источники фотонного излучения (гамма-излучение, рентгеновское излучение, электроны) получили более широкое распространение благодаря низкой стоимости установок для их получения и возможности их внутриклинического размещения.
Недостатком фотонной ЛТ считается невысокая ОБЭ фотонов в случае лечения пациентов с радиорезистентными видами опухолей. Для увеличения эффективности фотонной ЛТ используется ряд методов, заключающихся в сочетании воздействия фотонов и плотно-ионизирующих видов излучений в одном курсе ЛТ.
В частности, известен способ нейтронно-фотонной терапии [RU 2582214 С2, Мардынский Ю.А., Гулидов И.А., Сысоев А.С. и др. Способ нейтронно-фотонной лучевой терапии больных раком молочной железы], при котором ежедневно проводят облучение опухоли нейтронами в дозах от 0,2 до 0,4 Гр до достижения суммарной очаговой дозы (далее - СОД) 2,0 Гр. Затем проводят гамма-облучение в разовой очаговой дозе (далее - РОД) от 1,0 до 2,0 Гр до СОД от 45 до 47 Гр. Отмечается, что данный способ позволяет достичь полной регрессии опухоли при отсутствии лучевых осложнений.
Также известен способ лечения больных с местными рецидивами рака молочной железы [RU 2286818 С2, Мусабаева Л.И., Жогина Ж.А., Великая В.В., Лисин В.А. Способ лечения местных рецидивов рака молочной железы], согласно которому проводят терапию быстрыми нейтронами с энергией 6,3 МэВ 2 раза в неделю с РОД 1,6-2,0 Гр до СОД 6,6±1,5 Гр, затем гамма- или электронную терапию с РОД 2,0-3,0, 5 фракций в неделю. СОД нейтронно-фотонной терапии составляет 60 Гр.
Кроме этого, известен способ сочетанной нейтронно-фотонной ЛТ больных местно-распространенными опухолями молочной железы [Halpern J., Maor М.Н., Hussey D.H., Henkelmann G.C., Sampiere V., McNeese M.D. Locally advanced breast cancer treated with neutron beams: long-term follow-up in 28 patients, Int. J. Radiat. Oncol. Biol. Phys, 1990, 18(4), pp. 825-31], заключающийся в проведении курса нейтронной терапии с РОД 1,2-1,5 Гр в течении двух недель по 3 сеанса в неделю. Затем проводят курс фотонной ЛТ с РОД 2 Гр 5 раз в неделю до СОД 62-72 Гр. ОБЭ быстрых нейтронов было принято за 4,0, при этом вклад нейтронного излучения в полном курсе нейтронно-фотонной ЛТ составил 50-60%.
Следует отметить, что для фотонного и нейтронного излучений характерна высокая проникающая способность и практически одинаковое энерговыделение по длине трека частицы в объекте облучения. В контексте ЛТ это означает, что при облучении опухолевых очагов, расположенных глубоко в теле пациента, также происходит повреждение здоровых тканей, окружающих опухоль и находящихся в поле облучения. Это приводит к появлению выраженных лучевых осложнений, что является явным недостатком фотонной и нейтронной ЛТ в случае глубоко расположенных опухолей.
Таким образом, недостатком описанных выше способов является возможность их применения без проявления лучевых реакций только для лечения пациентов с поверхностно расположенными новообразованиями. Для облучения глубинных опухолевых очагов целесообразно использовать ускоренные заряженные частицы, которые позволяют подводить высокую дозу к опухоли при низкой дозовой нагрузке на здоровые ткани. При этом величина ОБЭ излучения в области пика Брэгга, где при облучении находится опухоль, как правило, превышает ОБЭ излучения в областях до и после пика Брэгга, в которых находятся здоровые ткани, что является еще одним фактором, увеличивающим эффективность терапии.
Было показано, что в расширенном пике Брэгга протонов величина ОБЭ может варьировать от 0,9 до 2,1 (in vitro) и от 0,7 до 1,6 (in vivo) [Paganetti Н., Niemierko А., Ancukiewicz М., Gerweck L.E., Goitein M, Loeffler J.S., Suit H.D. Relative biological effectiveness (RBE) values for proton beam therapy, Int J Radiat Oncol Biol Phys, 2002, Jun 1, 53(2), pp. 407-21]. Однако на практике в большинстве клинических протоколов используется среднее значение коэффициента ОБЭ протонного излучения - 1,1. Вследствие схожести биологических свойств протоны можно рассматривать в качестве замены фотонного излучения, позволяющей проводить более конформное облучение опухоли. При терапии больных с радиорезистентными видами рака протоны не обладают высокой эффективностью и в этом случае могут быть применены схемы, аналогичные нейтронно-фотонной ЛТ, но обладающие большей конформностью распределения. В качестве излучения с высокой биологической эффективностью рассматривают ускоренные тяжелые ионы, из которых наиболее распространенными в клинической практике являются ионы углерода. Применение этих частиц позволяет создать высокий градиент доз между опухолевыми и нормальными тканями пациента и увеличить эффективность воздействия на опухоль за счет высокого значения коэффициента ОБЭ ионов углерода. Существует ряд работ, описывающих сочетанное использование протонов или фотонов и ускоренных тяжелых ионов в одном курсе облучения.
В частности, известен способ лечения пациентов с аденоидно-кистозными карциномами посредством сочетанного облучения модулированным по интенсивности фотонным излучением и ионами углерода [Schultz-Ertner D., Didinger В., Nikoghosyan A., Jäkel О., Zuna I., Wannenmacher M., Debus J. Optimization of Radiation Therapy for Locally Advanced Adenoid Cystic Carcinomas with Infiltration of the Skull Base Using Photon Intensity-Modulated Radiation Therapy (IMRT) and a Carbon Ion Boost, Strahlenther Onkol, 2003, №5, pp. 345-351]. Согласно предложенному способу, СОД фотонов составляла 54 Гр, ионы углерода использовали в качестве буста - для доведения СОД до 72 Гр(ОБЭ) на ограниченный объем опухоли. Отмечалось снижение средних доз на органы риска и улучшение покрытия опухоли.
Похожий способ был предложен в работе [Jensen A.D., Nikoghosyan A., Poulakis М., Höss A., Habeber Т., Jäkel О., Mtinter M.W., Schulz-Ertner D., Huber P.E., Debus J. Combined intensity-modulated radiotherapy plus raster-scanned carbon ion boost for advanced adenoid cystic carcinoma of the head and neck results in superior locoregional control and overall survival, Cancer, 2015, pp. 3001-3009], где пациентам с аденоидно-кистозной карциномой головы и шеи проводилось облучение ионами углерода с РОД 3 Гр до СОД ионов углерода 18 Гр, затем проводили облучение модулированным по интенсивности фотонным излучением до СОД 54 Гр. Отмечалось увеличение контроля роста опухоли и повышение общей выживаемости и выживаемости без прогрессирования, относительно пациентов, получавших только облучение модулированным по интенсивности фотонным излучением.
К недостатку этих способов можно отнести использование фотонной ЛТ. Несмотря на то, что модулированное по интенсивности лучевое облучение обладает лучшей конформностью относительно предшествующих ему способов облучения, физические характеристики фотонного излучения приводят к повышенному облучению тканей как до облучаемого объема опухоли, так и после. Использование протонной терапии позволяет за счет физических свойств этого вида излучения существенно снизить дозу на здоровые ткани, находящиеся на пути прохождения пучка.
В частности, известен способ лечения пациентов со злокачественными глиомами сочетанной протонно-ионной ЛТ [Kong L., Gao J., Hu J., Lu R., Yang J., Qiu X., Hu W., Lu J.J. Carbon ion radiotherapy boost in the treatment of glioblastoma: a randomized phase I/III clinical trial, Cancer Commun (Lond), 2019, 39: 5]. В данном способе ионы углерода предложено использовать в качестве буста к протонной ЛТ. В рамках клинических испытаний планировалось провести три фракции ионной ЛТ с РОД 3-6 Гр(ОБЭ), затем 30 фракций протонной ЛТ с РОД 1,67-2 Гр(ОБЭ). Предполагалось, что предварительное облучение ионами углерода будет способствовать преодолению резистентности опухоли, увеличению терапевтического эффекта и снижению общей токсичности. Недостатком способа может оказаться низкий вклад ионного излучения в дозу, который не превышает 25%, что не позволяет в полной мере использовать преимущества терапии тяжелыми ионами.
Также известен способ подведения дозы разными типами частиц, а именно: протонами и ионами углерода, а также ионами углерода и ионами гелия, с одного направления [Kopp В., Mein S., Dokic I., Harrabi S., Böhlen T.T., Haberer Т., Debus J., Abdollahi A., Mairani A. Development and Validation of Single Field Multi-Ion Particle Therapy Treatments, Int J Radiat Oncol Biol Phys, 2020, Volume 106, Issue 1, p. 194-205]. Преимуществом известного способа является уменьшение объема облучаемых здоровых тканей за счет однопольного облучения, а также равномерное распределение биологической дозы по всему объему опухоли благодаря перераспределению физической дозы от каждого вида ионов с учетом их физических характеристик. К недостатку можно отнести то, что облучение опухоли и окружающих здоровых тканей предполагается без временного интервала между фракциями, что приводит к большему повреждению нормальных тканей.
Ближайшим аналогом предлагаемого изобретения является способ, описанный в [Трошина М.В., Корякина Е.В., Потетня В.И., Лычагин А.А., Корякин С.Н. Комбинированное воздействие протонов и ионов углерода на клетки китайского хомячка В14-150, Перспективные направления в онкологии, радиобиологии и радиологии: материалы V конференции молодых ученых, посвященной памяти академика А.Ф. Цыба, Обнинск, ФГБУ "ВНИИГМИ-МЦД", 2019, стр. 102-103]. Известный способ предполагает облучение опухолевых клеток линии В14-150 (фибросаркома) последовательно ионами углерода и протонами с временным интервалом между фракциями 2 ч. Рассмотрены две последовательности воздействия: «протоны - ионы углерода» и «ионы углерода - протоны», а также две схемы облучения: 1) доза протонов 6 Гр + доза ионов углерода 0,5 Гр; 2) доза протонов 4,5 Гр + доза ионов углерода 1 Гр. Сделан вывод о большей эффективности схем облучения, в которых воздействие ионами углерода осуществляется первой фракцией. Недостатком является то, что в известном способе выбран интервал между воздействиями 2 часа, что может быть недостаточно для транспортировки объектов между облучательными установками. При фракционированном облучении в терапии выбирают интервалы времени, за которые клетки нормальных тканей, находящихся в поле облучения, могут восстановиться от индуцируемых излучением повреждений. Поэтому увеличение временного интервала между фракциями может привести к дополнительному снижению лучевых реакций нормальных тканей.
Техническая проблема, решаемая заявленным изобретением, состоит в создании способа снижения жизнеспособности клеток фибросаркомы при сочетанном облучении ускоренными заряженными частицами до уровня эффекта не ниже независимого действия двух видов излучений.
При этом достигается технический результат, заключающийся в снижении жизнеспособности клеток фибросаркомы за счет вклада в суммарную дозу ионного излучения (в данном случае - ионов углерода) с высокой биологической эффективностью и уменьшении физической дозы излучения на окружающие опухоль ткани посредством добавления ускоренных ионов с низкой линейной передачей энергии, в качестве которых используют протоны.
Техническая проблема решается, а указанный технический результат достигается в результате создания способа снижения жизнеспособности клеток фибросаркомы посредством сочетанного облучения разными видами ускоренных заряженных частиц, включающего воздействие ионизирующим излучением на суспензию или монослой клеток фибросаркомы, находящиеся в стационарной фазе роста культуры, в котором используют два вида ионизирующего излучения: ускоренные ионы углерода и протоны, при этом воздействие осуществляют двумя фракциями с временным интервалом 4 часа между ними в последовательности «ионы углерода - протоны» в дозах ионов углерода и протонов 1,8 и 3 Гр, соответственно.
В частном варианте реализации, при воздействии на суспензию или монослой клеток фибросаркомы линии В14-150 вклад ионов углерода в суммарную дозу излучения с учетом коэффициента относительной биологической эффективности ионов углерода и протонов составляет не менее 50%.
Изобретение поясняется описанием, экспериментальным исследованием и иллюстрациями.
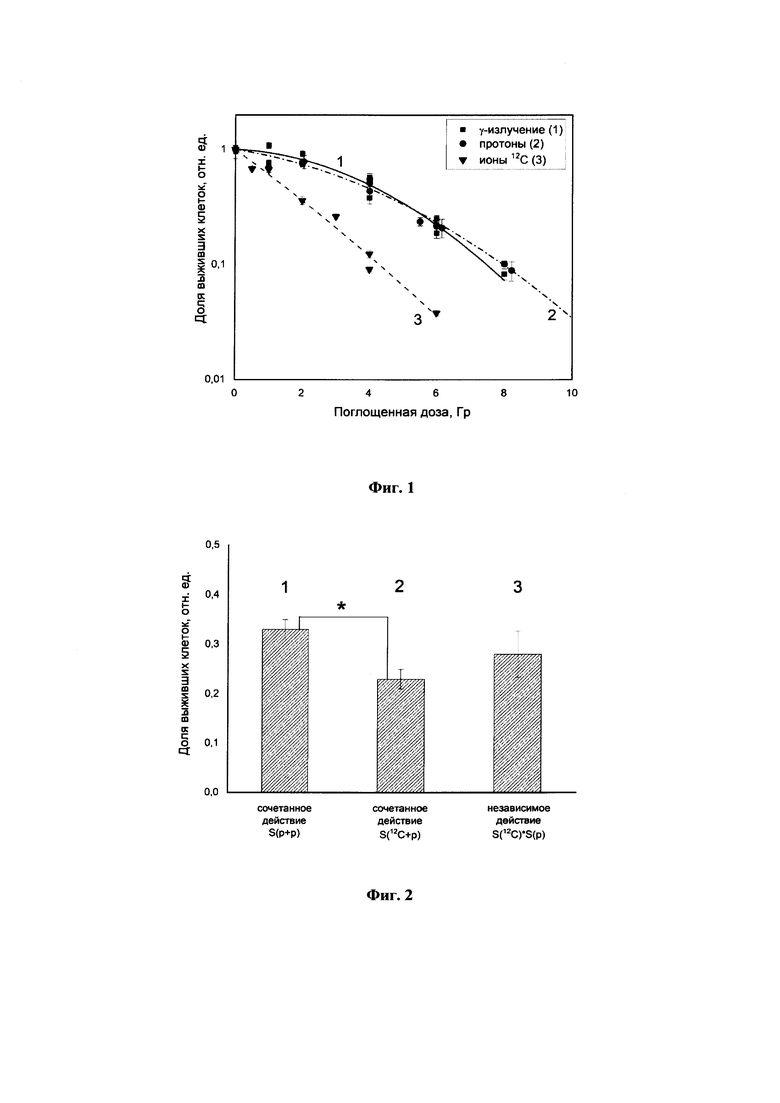
Фиг. 1 - графическое изображение зависимости выживаемости клеток фибросаркомы линии В14-150 от поглощенной дозы: 1 - гамма-излучения 60Со, 2 - протонного излучения, 3 - излучения ионов углерода.
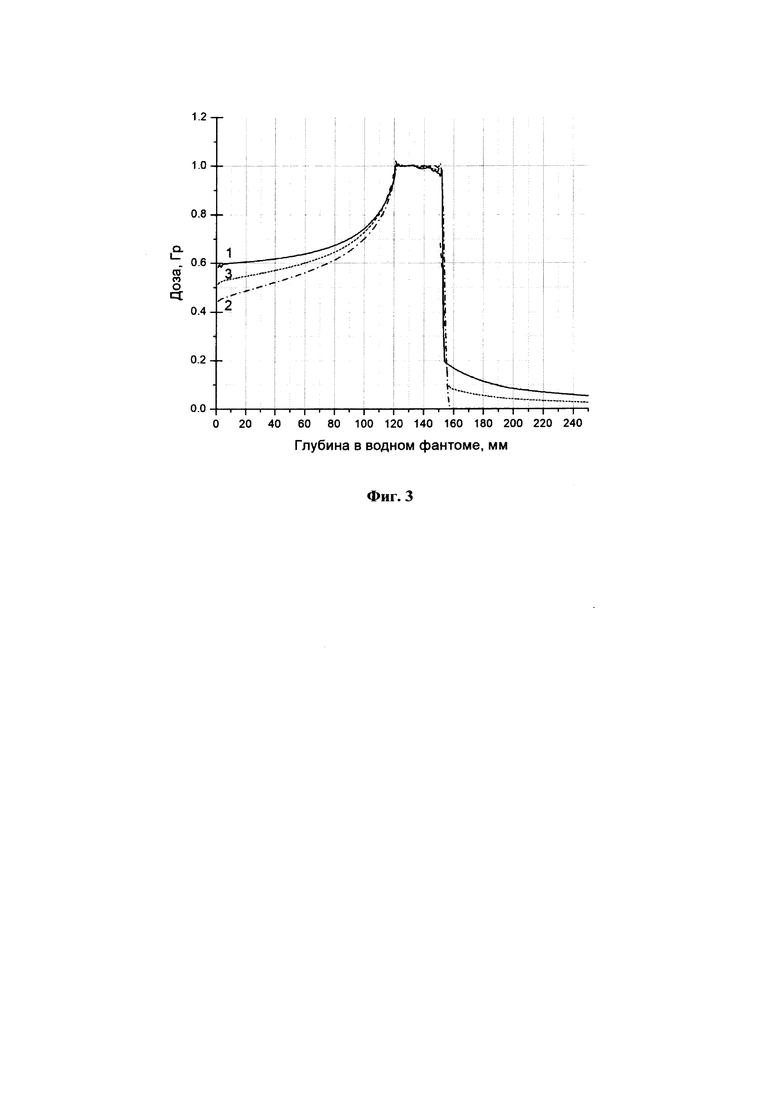
Фиг. 2 - графическое изображение уровней эффекта последовательного облучения клеток фибросаркомы линии В14-150 двумя фракциями с временным интервалом 4 ч между облучениями: 1 - облучение одной фракцией ионов углерода в дозе 1,8 Гр и одной фракцией протонного излучения в дозе 3 Гр; 2 - облучение двумя фракциями протонного излучения в дозе 3 Гр каждая; 3 - уровень эффекта сочетанного воздействия ионами углерода в дозе 1,8 Гр и протонами в дозе 3 Гр, рассчитанный из предположения независимого действия двух видов излучений. Знаком «*» обозначено статистически значимое отличие уровней эффекта (р<0,05).
Фиг. 3 - графическое изображение дозовых распределений в водном фантоме: 1 - модифицированный по энергии пучок ионов углерода, 2 - модифицированный по энергии пучок протонов, 3 - распределение, включающее равные вклады ионов углерода и протонов в суммарную физическую дозу. Все распределения нормированы на дозу 1 Гр в расширенном пике Брэгга.
Способ осуществляют следующим образом.
Этап 1.
Определяют дозу излучения ионов углерода, эквивалентную протонному излучению. Для этого биологические объекты облучают в возрастающих физических дозах: гамма-излучения, принимаемого за стандартное, протонного излучения и излучения ионов углерода. В качестве биологического объекта используют суспензию или монослой клеток фибросаркомы в стационарной фазе роста культуры. При воздействии гамма-излучением биологические объекты располагают на такой глубине в водном или тканеэквивалентном фантоме, где выполняется равновесие вторичных заряженных частиц. Облучение клеток протонами и ионами углерода выполняют в расширенном пике Брэгга. Строят зависимости биологического эффекта от физической дозы излучения. С помощью полученных данных определяют коэффициенты ОБЭ протонного излучения и излучения ионов углерода.
Этап 2.
Для сочетанного облучения клеток выбирают суммарную биологическую дозу исходя из чувствительности клеток фибросаркомы и используемого биологического метода. Из этой величины вклад ионов углерода с учетом ОБЭ выбирается не менее 50% от биологической дозы. Для определения физической дозы каждого вида излучения, которая должна быть подведена к биологическому объекту, величину биологической дозы делят на значение коэффициента ОБЭ, определенное на этапе 1, при выбранном уровне эффекта.
Этап 3.
Суспензию или монослой клеток фибросаркомы облучают в водном фантоме в расширенном пике Брэгга пучка ионов углерода. Облучение ионами углерода проводят в условиях, аналогичных тем, в которых проводили определение коэффициента ОБЭ ионов углерода, согласно этапу 1. После облучения биологический объект извлекают из водного фантома и выдерживают при комнатной температуре (около 25°С) в течении 4 ч.
Этап 4.
По истечении временного интервала (4 ч) суспензию или монослой клеток, облученных согласно этапу 3, облучают в водном фантоме в расширенном пике Брэгга протонов. Облучение протонами проводят в условиях, аналогичных тем, в которых проводили определение коэффициентов ОБЭ протонов, согласно этапу 1. После облучения клетки при пониженной температуре, необходимой для торможения процессов восстановления, доставляют в биологическую лабораторию для оценки биологического эффекта.
Таким образом, вклад ионного излучения с повышенной биологической эффективностью в суммарную дозу с учетом коэффициента ОБЭ составляет не менее 50%, что может являться более эффективным в случае, в том числе, радиорезистентных опухолевых клеток.
В качестве примера реализации способа было проведено экспериментальное исследование, заключающееся в облучении клеток фибросаркомы В14-150 (китайский хомячок, стационарная фаза роста культуры), согласно схеме облучения, включающей воздействие излучением ионов углерода и протонным излучением. Клетки инкубировали в культуральных флаконах с площадью ростовой поверхности 25 см2, в питательной среде DMEM с добавлением 10% эмбриональной телячьей сыворотки, глутамина и антибиотиков до формирования конфлюэнтного монослоя. Затем флаконы с монослоем клеток заполняли раствором Хенкса и подвергали облучению.
На первом этапе клетки были облучены: 1) в центре расширенного пика Брэгга протонов (ширина пика 15 мм) в диапазоне доз 0,5-8 Гр; 2) в центре расширенного пика Брэгга ионов углерода (ширина пика Брэгга 30 мм) в диапазоне доз 0,5-6 Гр. Облучение ионами углерода проводили на пучке ионов углерода с начальной энергией 400 МэВ/н (ЦКП ИФВЭ, г. Протвино). Флаконы с монослоем клеток устанавливали в водном фантоме на глубине, соответствующей центру расширенного пика Брэгга. Облучение клеток протонами проводили на комплексе протонной терапии «Прометеус» (МРНЦ, г. Обнинск). Флаконы с клетками помещали в водный фантом таким образом, чтобы монослой клеток находился в центре расширенного пика Брэгга протонов. Исследования проводили с использованием теста клоногенной активности клеток. Полученные результаты были нанесены на график (фиг.1) совместно с данными для гамма-излучения, полученными ранее для этой линии клеток. Были определены коэффициенты ОБЭ, которые при уровне выживаемости 10% составили 1,0 для протонного излучения и 1,7 для ионов углерода.
Суммарная доза соответствовала 6 Гр, что является достаточным условием для определения эффекта по тесту клоногенной активности клеток. С учетом полученных значений ОБЭ физические дозы для протонного излучения составили 3 Гр, для ионного - 1,8 Гр.
В экспериментальном исследовании были реализованы две схемы облучения, поясняющие эффективность предложенного способа.
Согласно первой схеме, облучение монослоя опухолевых клеток проводили в водном фантоме ионами углерода в физической дозе 1,8 Гр, выдерживали 4 ч при комнатной температуре и проводили облучение пучком протонов в дозе 3 Гр.
Вторая схема реализуется путем облучения монослоя опухолевых клеток двумя фракциями протонного излучения с временным интервалом между воздействиями 4 ч. Условия облучения аналогичны первой схеме и этапу облучения клеток для определения коэффициентов ОБЭ, описанному выше.
После окончания облучения клетки доставляли в биологическую лабораторию. Из флаконов сливали среду, снимали клетки с поверхности флаконов смесью трипсина и версена, затем их ресуспендировали в бессывороточной среде, готовили суспензию клеток, подсчитывали в камере Горяева концентрацию клеток. В чашку Петри диаметром 10 см добавляли 10 мл питательной среды с повышенным содержанием эмбриональной телячьей сыворотки (20%) и высевали по 9000-10000 клеток. Чашки Петри с облученными клетками помещали в СО2-инкубатор и инкубировали 7-8 дней до формирования видимых колоний клеток. После окончания инкубации удаляли питательную среду из чашек Петри, затем чашки промывали в проточной воде и высушивали на воздухе. Подсчет колоний клеток выполняли с помощью полуавтоматических счетчиков колоний. Эффект оценивали как отношение количества выросших колоний к количеству посеянных клеток. Данные представлены на фиг. 2 в виде гистограммы.
Пример показывает, что доля выживших клеток фибросаркомы линии В14-150 после воздействия двумя фракциями протонного излучения (1 на фиг. 2) выше, чем после воздействия на клетки ионами углерода и протонами (2 на фиг. 2). Различия являются значимыми по t-критерию Стьюдента (р<0,05). Сравнение уровня сочетанного воздействия (1 на фиг. 2) с величиной эффекта, рассчитанного из предположения независимости действия двух типов излучений (3 на фиг. 2), показывает отсутствие статистически значимых различий. Из полученных данных следует, что выбранная в примере схема сочетанного облучения «ионы углерода + протоны» позволяет достичь большего эффекта, чем схема «протоны + протоны» при одинаковом уровне суммарных доз.
При этом вклад протонного излучения в суммарную дозу позволяет снизить физическую дозу в области до и после расширенного пика Брэгга. На фиг. 3 представлены дозовые распределения для ионов углерода и протонов, а также распределение, включающее равные вклады этих видов излучения в суммарную дозу. Для удобства сравнения распределения нормированы на дозу в расширенном пике Брэгга, равную 1 Гр. На фиг. 3 хорошо видно, что при одинаковой физической дозе в области пика Брэгга, где происходит облучение опухолевых клеток, доза ионов углерода перед пиком, а также за ним, ниже, чем протонов.
Таким образом, предложенный способ сочетанного облучения позволяет достичь снижения физической дозы в областях до и после пика Брэгга (где при проведении лучевой терапии находятся нормальные ткани) при уровне эффекта в расширенном пике Брэгга (в котором при лучевой терапии находятся опухоль) не ниже независимого действия излучения.
Предложенный способ может быть использован при разработке терапевтических схем для целей лечения пациентов со злокачественными новообразованиями методом лучевой терапии, а именно, сочетанной лучевой терапии, в которой применяются разные виды ионизирующих излучений.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ОЦЕНКИ ГЕНЕТИЧЕСКИХ НАРУШЕНИЙ В КЛЕТКАХ, РАСПОЛОЖЕННЫХ ДО ОБЛУЧАЕМОГО ОБЪЕМА ПРИ СОЧЕТАННОЙ ИОН-ПРОТОННОЙ ЛУЧЕВОЙ ТЕРАПИИ | 2024 |
|
RU2830520C2 |
| СПОСОБ ПОВЫШЕНИЯ ЧАСТОТЫ ОБРАЗОВАНИЯ ДВУНИТЕВЫХ РАЗРЫВОВ ДНК В КЛЕТКАХ ЧЕЛОВЕКА ПРИ ДЕЙСТВИИ ИОНИЗИРУЮЩИХ ИЗЛУЧЕНИЙ В УСЛОВИЯХ ВЛИЯНИЯ РАДИОМОДИФИКАТОРОВ | 2018 |
|
RU2699670C1 |
| СПОСОБ ПРОТОННОЙ ТЕРАПИИ СОЛИДНОЙ КАРЦИНОМЫ ЭРЛИХА | 2023 |
|
RU2808984C1 |
| СПОСОБ НЕЙТРОННО-ФОТОННОЙ ТЕРАПИИ БОЛЬНЫХ РАКОМ МОЛОЧНОЙ ЖЕЛЕЗЫ | 2014 |
|
RU2582214C2 |
| СПОСОБ ПОВЫШЕНИЯ ЭФФЕКТИВНОСТИ ДЕЙСТВИЯ ПРОТОННОЙ ТЕРАПИИ НА СТВОЛОВЫЕ КЛЕТКИ МЕЛАНОМЫ | 2022 |
|
RU2798733C2 |
| Способ определения поглощенной дозы ядер отдачи | 2020 |
|
RU2743417C1 |
| СПОСОБ ФОТОН-ЗАХВАТНОЙ ТЕРАПИИ ОПУХОЛЕЙ | 2004 |
|
RU2270045C1 |
| Способ повышения эффективности действия ионизирующих излучений на меланому | 2021 |
|
RU2774032C1 |
| СПОСОБ ЛЕЧЕНИЯ МЕСТНЫХ РЕЦИДИВОВ РАКА МОЛОЧНОЙ ЖЕЛЕЗЫ | 2004 |
|
RU2286818C2 |
| СПОСОБ ЛУЧЕВОЙ ТЕРАПИИ | 2001 |
|
RU2209643C2 |
Изобретение относится к области биотехнологии, а именно к лучевой терапии, и направлено на снижение жизнеспособности опухолевых клеток посредством сочетанного облучения разными видами ускоренных заряженных частиц. Для снижения жизнеспособности опухолевых клеток осуществляют воздействие ионизирующим излучением на суспензию или монослой опухолевых клеток, находящихся в стационарной фазе роста культуры. Используют два вида ионизирующего излучения: ускоренные ионы углерода и протоны. Воздействие осуществляют двумя фракциями с временным интервалом 4 часа между ними в последовательности «ионы углерода - протоны». Изобретение обеспечивает снижение жизнеспособности опухолевых клеток и уменьшение физической дозы излучения на окружающие опухоль ткани. 1 з.п. ф-лы, 3 ил.
1. Способ снижения жизнеспособности клеток фибросаркомы посредством сочетанного облучения разными видами ускоренных заряженных частиц, включающий воздействие ионизирующим излучением на суспензию или монослой клеток фибросаркомы, находящихся в стационарной фазе роста культуры, отличающийся тем, что используют два вида ионизирующего излучения: ускоренные ионы углерода и протоны, при этом воздействие осуществляют двумя фракциями с временным интервалом 4 ч между ними в последовательности «ионы углерода - протоны» в дозах ионов углерода и протонов 1,8 и 3 Гр, соответственно.
2. Способ по п. 1, отличающийся тем, что при воздействии на суспензию или монослой клеток фибросаркомы вклад ионов углерода в суммарную дозу излучения с учетом коэффициента относительной биологической эффективности ионов углерода и протонов составляет не менее 50%.
| ТРОШИНА М.В | |||
| и др., Комбинированная протон-ионная терапия: радиобиологические предпосылки и возможности, МЕДИЦИНСКАЯ ФИЗИКА, 2021, No | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Веникодробильный станок | 1921 |
|
SU53A1 |
| ТРОШИНА М.В | |||
| и др., Комбинированное воздействие протонов и ионов углерода на клетки китайского хомячка В14-150, Перспективные направления в онкологии, радиобиологии и радиологии: материалы V | |||
Авторы
Даты
2023-07-05—Публикация
2022-08-10—Подача