Область техники, к которой относится изобретение.
Способ относится к области экспериментальной медицины, онкологии, лучевой терапии, в частности, к применению эффекта радиосенсибилизации при бинарном воздействии протонного излучения и металлических наночастиц висмута (далее - НЧ Bi), введенных в опухоль (карцинома Эрлиха).
Проблема заболеваемости злокачественными новообразованиями в последние десятилетия становится все более актуальной для современного общества и занимает одно из ведущих мест в структуре проблем заболеваемости населения. С каждым годом количество выявляемых новых случаев продолжает неуклонно расти. Так, в 2021 г. в Российской Федерации было выявлено 580415 случаев злокачественных новообразований (Каприн А.Д., Старинский В.В., Шахзадова А.О. Состояние онкологической помощи населению России в 2021 году, 2022).
Одним из наиболее перспективных способов лучевого лечения онкологических пациентов является протонная терапия. Благодаря особому пространственному распределению дозы ионизирующего излучения с максимальной потерей энергии частиц в конце траектории их движения (пик Брэгга), потоки заряженных частиц обеспечивают облучение опухолевой ткани без превышения толерантных доз для нормальных тканей, даже если мишень вплотную прилегает к критическим структурам организма.
Однако биологическая эффективность протонного излучения в плане элиминации злокачественных новообразований относительно невелика и лишь в 1,1-1,3 раза превышает эффективность фотонного излучения, что не позволяет преодолеть радиорезистентность части опухолей и в ряде случаев приводит к неудовлетворительным клиническим результатам лечения.
Уровень техники.
Известно использование в радиотерапии онкологических заболеваний сенсибилизаторов (физических и химических), повышающих чувствительность гипоксических клеток солидных опухолей к действию излучения (Некласова Н.Ю. и др. Модификация радиочувствительности нормальных и опухолевых тканей при лучевой терапии злокачественных новообразований, Радиационная биология, Радиоэкология, 2014, том 54, №6, стр. 597-605).
Hao Wang и соавторы в 2018 году, основываясь на структурах, разделили известные радиосенсибилизаторы на 3 группы: низкомолекулярные химические вещества, наноструктуры и макромолекулы (Gong L. et al. Application of Radiosensitizers in Cancer Radiotherapy. Int J Nanomedicine, 2021, Vol. 16, pp. 1083-1102; Wang H. et al. Cancer Radiosensitizers. Trends Pharmacol Sci, 2018, Vol. 39, №1, pp. 24-48).
Наиболее распространенными и изученными являются радиосенсибилизаторы, действующие на основе кислородного эффекта - электронно-акцепторные соединения. Механизм их действия заключается в возможности выступать в роли акцептора атома кислорода с последующим свободным высвобождением его в гипоксических зонах опухоли.
Однако применение таких соединений (производных имидазола, в том числе, метронидазола) в высоких дозах нередко сопровождается выраженными токсическими эффектами, проявляющимися даже при субпороговых концентрациях препарата (Ягубов С.А. Фармакологический анализ модифицирующего действия метронидазола на противоопухолевую активность и токсические свойства цитостатиков, дис. к.м.н.: 14.01.12, ФГБУ НМИЦ онкологии им. Н.Н. Блохина Минздрава России, Москва, 2020).
В последние годы ряд исследователей показал перспективность использования малоразмерных структур, в частности, наночастиц различных металлов и их соединений (золота, оксида железа, платины и др.), для радиосенсибилизации лучевой терапии (В. Shameer Ahmed et al. Evaluation of Gold, Silver and Silver-Gold (Bimetallic) Nanoparticles as Radiosensitizers for Radiation Therapy in Cancer Treatment, Cancer Oncol. Res., 2016, Vol. 4, №3, pp. 42-51; Gong L. et al. Application of Radiosensitizers in Cancer Radiotherapy, Int J Nanomedicine, 2021, Vol. 16, pp. 1083-1102; Meidanchi A. et al. ZnFe2O4 nanoparticles as radiosensitizers in radiotherapy of human prostate cancer cells, Mater Sci Eng C, Mater Biol Appl, 2015, Vol. 46, pp. 394-399; Wang H. et al. Cancer Radiosensitizers, Trends Pharmacol Sci, 2018, Vol. 39, №1, pp .24-48). Наночастицы таких металлов и их соединений усиливают действие радиации за счет увеличения вероятности фотоэлектрических взаимодействий, что в основном связано с высоким коэффициентом поглощения металлических атомов. Металлические наноматериалы сенсибилизируют опухолевые клетки и повышают выход активных форм кислорода (АФК) и биологических эффектов, которые приводят к гибели клеток. В частности, было показано, что наночастицы золота являются эффективными радиосенсибилизаторами в исследованиях in vitro и in vivo (Hainfeld J. F. et al. Gold nanoparticles: A new X-ray contrast agent, Br. J. Radiol, 2006, Vol. 79, №939, pp. 48-53; Li J. et al. A novel functional CT contrast agent for molecular imaging of cancer, Phys Med Biol, 2010, Vol. 55, №15, pp. 4389-4397).
Однако, несмотря на успешную разработку новых наноматериалов-радиосенсибилизаторов, результат все еще не может удовлетворить потребности в клинической практике. Поэтому возникает острая необходимость в поиске новых мишеней лучевой терапии и новых механизмов сенсибилизации.
В литературе встречаются следующие способы применения радиосенсибилизаторов в лучевой терапии.
Известны способы применения имидазола и его производных при сенсибилизации радиотерапии онкологических заболеваний (RU 2568115 С2) и моно-β-(2'-метил-5'-нитромидазолил-1')-этилового эфира янтарной кислоты (RU 2052991 С1).
Однако недостатками известных способов является высокая токсичность таких соединений, кроме того, воздействие осуществляется исключительно на клетки, находящиеся в условиях гипоксии. Экспериментальные и клинические данные сообщают об усилении противоопухолевого эффекта и токсичности некоторых цитостатиков при совместном введении с некоторыми производными имидазола, к которым относится и метронидазол (Ягубов С.А. и др. Влияние метронидазола на противоопухолевую активность и токсичность 5-фторурацила, Онкология, журнал им. П.А. Герцена, 2017, вып.6, №3, стр. 29-34). Кроме того, имеются данные о способности метронидазола к мутагенной, канцерогенной активности, индуцированию токсичности в центральной и периферической нервной системе (см. Bonda, С, Evans, M.S. Metronidazole CNS toxicity, Acta. Neurol. Belg., 2015, Vol. 115, №4, pp. 709-710; Cação G. et al. Metronidazole-induced central and peripheral nervous system toxicity, Neurol. Sci. 2015; 36(9): 1737-1739).
Известен способ усиления противоопухолевого эффекта лучевой терапии путем предварительного введения β-формы метилурацила в дозе 5-50 мг/кг за 15 мин до облучения (RU 2044545 С1).
Недостатком известного способа является малая растворимость метилурацила в воде, что снижает биофармацевтические характеристики препаратов на его основе. Кроме того, было установлено, что при большом количестве препарата в среде (50 мкг/мл) в клетках могут появляться патологические митозы (Степанюк Т.И., Корецкая Н.В. Влияние интерферона и метацила на процесс деления клеток ФЛ в культуре ткани, Микробиология, эпидемиология, клиника инфекционных болезней, 1978, вып.9, стр. 69-72).
Известно применение наноалмазов для генерации свободных радикалов для терапевтических целей при облучении (RU 2643582 С2), основанное на генерации свободных радикалов на поверхности наноалмазов, когда их подвергают облучению, например, ионизирующего излучения. Для повышения эффективности наноалмазов можно получать комплексы наноалмазов с радиосенсибилизирующим средством, таким, как химическая молекула или интерферирующая РНК, направленная на репарирующий ген. В данном способе описано получение композиции, предназначенной для радиосенсибилизации опухолевых клеток. Наночастицы алмазов получают путем измельчения синтетического алмаза или детонации, с последующим гидрированием водородной плазмой при микроволновом облучении и графитизацей обжигом в вакууме при высокой температуре.
Недостатком данного способа является дороговизна исходного материала для синтеза наночастиц и использование сложных методов, требующих высокостоящего оборудования.
Известен способ лечения рака молочной железы ЕМТ-6, трансплантированной на бедро задней конечности мышам линии Balb/C, с помощью рентгеновского облучения в комбинации с наночастицами золота (Au) (US 7530940 В2). Опухолевые узлы животных подвергали локальному лучевому рентгеновскому облучению на установке Siemens Stabilipan (250 кВп) в дозе 26 Гр. За 2-4 минуты до облучения животным в хвостовую вену вводили наночастицы Au со средним диаметром Au около 2 нм для получения концентрации наночастиц в опухоли примерно 0,3% или 0,15% относительно массы (30 мг Au/мл или 15 мг Au/мл, соответственно). Применение комбинации «наночастицы Au + рентгеновское облучение» повышало выживаемость животных по сравнению с контролем облучения (20%) как при введении 15 мг Au/мл (50%), так и при введении 30 мг Au/мл (86%).
Недостатками известного способа являются дороговизна (высокая стоимость получения таких наночастиц Au), способ введения (затрата большого количества времени на проведение манипуляций), использование рентгеновского облучения, обладающего низкой проникающей способностью, что не позволяет применять данный способ для лечения опухолей, локализованных глубоко в теле.
Известен способ применения конъюгированных с TRAIL магнитных композитных наночастиц желатин/оксид железа (NP-TRAIL) для синергического воздействия в сочетании с γ-облучением для подавления роста глиом (RU 2472530 С2). Клетки линий А172, U251, U87 и LN-18 подвергали однократному воздействию γ-излучения в дозе 10 Гр с последующим культивированием с NP-TRAIL (5 нг TRAIL/мл) в течение двух часов. Апоптоз, индуцированный в результате данной комбинированной обработки, был значительно повышен, добавление низких доз γ-облучения преодолевает устойчивость некоторых глиомных клеток к NP-TRAIL.
Недостатком известного способа является отсутствие экспериментальных данных in vivo, подтверждающих синергическое воздействия NP-TRAIL в сочетании с γ-облучением для подавления роста опухолей, кроме этого, использование γ-излучения сопряжено с риском развития осложнений лучевой терапии.
Известен способ применения радиосенсибилизирующего вещества аскорбата лития (LiC6H7O6). В качестве растворителя использован физиологический раствор (RU 2720455 С1). Предварительное культивирование с 25 мкл аксорбата лития (концентрация - 1,2 ммоль/л) клеток линии Jurkat с последующим облучением на рентгеновской установке с интенсивностью 20 мГр/сек в суммарной дозе 3 Гр увеличивало долю апоптотических клеток по сравнению с контролем облучения.
Недостатком известного способа является отсутствие данных о безопасности и эффективности этого вещества in vivo.
Известен способ фотон-захватной терапии опухолей, включающий облучение аденокарциномы Эрлиха у мышей линии СВА γ-излучением (60Со) на установке РОКУС AM в дозе 20 Гр с предварительным введением в опухоль 0,6 мл коллоидного золота, раствора «ултравист-300» (раствора йопромида) или их комбинации (RU 2533267 С1). Продолжительность жизни животных, подвергшихся облучению без предварительного введения, составила 54,75±3,66 дней, получавших перед облучением раствор коллоидного золота - 59,25±2,78 дней; раствор «ультравист-300» - 62,00±0,57 дней, раствор коллоидного золота + «ултравсит-300» - 62,5±0,87 дней.
Недостатком известного способа является использование γ-излучения, что сопряжено с риском развития осложнений лучевой терапии. Увеличение продолжительности жизни после лучевой терапии с предварительным введением данных радиосенсибилизаторов составляет всего 8-10%, вместе с тем, объем опытных групп составляет всего 4 особи, что может быть недостаточным для проведения статистического анализа.
Наиболее близким аналогом к заявляемому способу является способ, описанный в исследовании (Jong-Ki Kim et al. Enhanced proton treatment in mouse tumors through proton irradiated nanoradiator effects on metallic nanoparticles, Phys. Med. Biol, 2012, Vol. 57, pp. 8309-8323). В данном исследовании использовали металлические наночастицы AuNPs с лигандным покрытием (диэтилентриаминпентауксусной кислоты и цистеина) и покрытые альгинатом суперпарамагнитные наночастицы FeNPs в сочетании с протонным пучком с энергией 45 МэВ в лечении модели опухоли СТ26 у мышей линии Balb/c. Животным однократно вводили наночастицы AuNPs или FeNPs в концентрации 100-300 мг/кг массы тела мышей в объеме 50 мкл в физиологическом растворе как самостоятельно, так и в сочетании с облучением протонами в дозах 10-41 Гр. Протонный пучок использовался для облучения наночастиц с единственным пиком Брэгга, заданным так, чтобы он возникал внутри объема опухоли (полностью поглощался) или возникал после прохождения пучка через все тело. Наночастицы вводились в хвостовую вену животных за 24 часа до протонного облучения. Воздействию пучка протонов подвергалась только область опухоли окружающие нормальные ткани экранировались с помощью акрилатных блоков и болюса, расположенных внутри коллиматора пучка с переменным диаметром для корректировки размера опухоли. В исследовании прослеживалась зависимость опухолевой регрессии в каждой экспериментальной группе от дозы протонов и количества металлических наночастиц. Относительно более высокий процент опухолевой регрессии наблюдался у мышей, которые получали наночастицы на основе AuNP по сравнению наночастицами на основе FeNP при заданных дозах протонов и дозах введения частиц.
Недостаток известного способа состоит в том, что применяемые в настоящее время инъекционные концентрации металлических наночастиц 100-300 мг/кг являются достаточно большими для использования в организме человека (Murillo et al, 2005), что требует их дальнейшего изучения для обеспечения желаемой селективности опухоли при снижении дозы введения. Еще одним недостатком известного способа, по мнению авторов, является сверхвысокая мощность дозы (2000 Гр/ч), что неприемлемо для клинической практики, где допустимая применяемая мощность дозы равна 30 Гр/ч (Jong-Ki Kim et al, 2012).
Задачей изобретения является создание способа лечения солидной карциномы Эрлиха (далее - СКЭ), заключающийся в повышении безопасности воздействия протонного излучения за счет применения клинически допустимой мощности дозы в сочетании с предварительным введением металлических наночастиц при одновременном обеспечении высокой эффективности воздействия.
Раскрытие сущности изобретения.
Указанная задача решается тем, что за 15 минут до облучения пучками протонов в дозе 10 Гр или 31 Гр внутриопухолево вводят наночастицы висмута, покрытые Pluronic-F127 в количестве 1,5 мг/мышь в виде 100 мкл 1,5% суспензии на основе фосфатно-солевого буфера или покрытые полиэтиленгликолем наночастицы висмута в количестве 1,5 мг/мышь в виде 100 мкл 1,5% суспензии на основе фосфатно-солевого буфера, после чего опухоль облучают пучками протонов при клинически допустимой мощности дозы 30 Гр/ч.
Краткое описание чертежей.
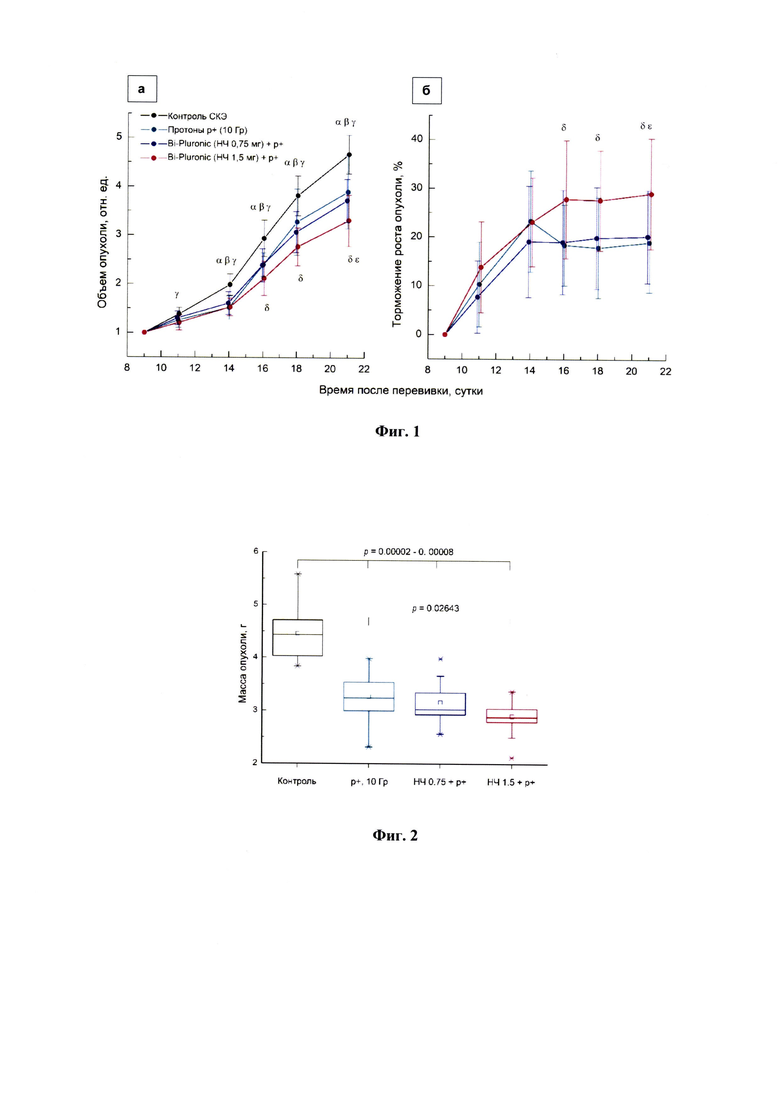
Фиг.1 - влияние локального облучения пучками протонов (10 Гр) отдельно и в сочетании с предварительным внутриопухолевым введением НЧ Bi-Pluronic в дозах 0,75 или 1,5 мг на: а) динамику роста СКЭ; б) показатель торможения роста СКЭ. Графические отклонения соответствуют стандартному отклонению (SD). Группы животных:
- (черная) - контроль СКЭ - нелеченные животные с привитой СКЭ;
- (зеленая) - протоны р+(10 Гр) - животные с СКЭ, получившие локальное облучение протонами в дозе 10 Гр;
- (синяя) - НЧ - Bi-Pluronic (НЧ 0,75 мг) + протоны р+ - животные с СКЭ, получившие НЧ Bi-Pluronic в дозе 0,75 мг за 15 минут до локального облучения протонами в дозе 10 Гр;
- (красная) НЧ Bi-Pluronic (НЧ 1,5 мг) + протоны р+ - животные с СКЭ, получившие НЧ Bi-Pluronic в дозе 0,75 мг за 15 минут до локального облучения протонами в дозе 10 Гр.
Символы α, β, γ, δ, ε - достоверные различия между группами:
α - контроль/ протоны р+;
β - контроль/(НЧ 0,75 мг + протоны р+);
γ - контроль/(НЧ 1,5 мг + протоны р+);
δ - протоны р+/(НЧ 1,5 мг + протоны р+);
ε - (НЧ 0,75 мг + протоны р+)/(НЧ 1,5 мг + протоны р+).
Фиг. 2 - бокс-диаграмма распределения массы опухолевых узлов СКЭ у мышей экспериментальных групп, извлеченных на 21-е сутки роста (р - уровень значимости статистических различий).
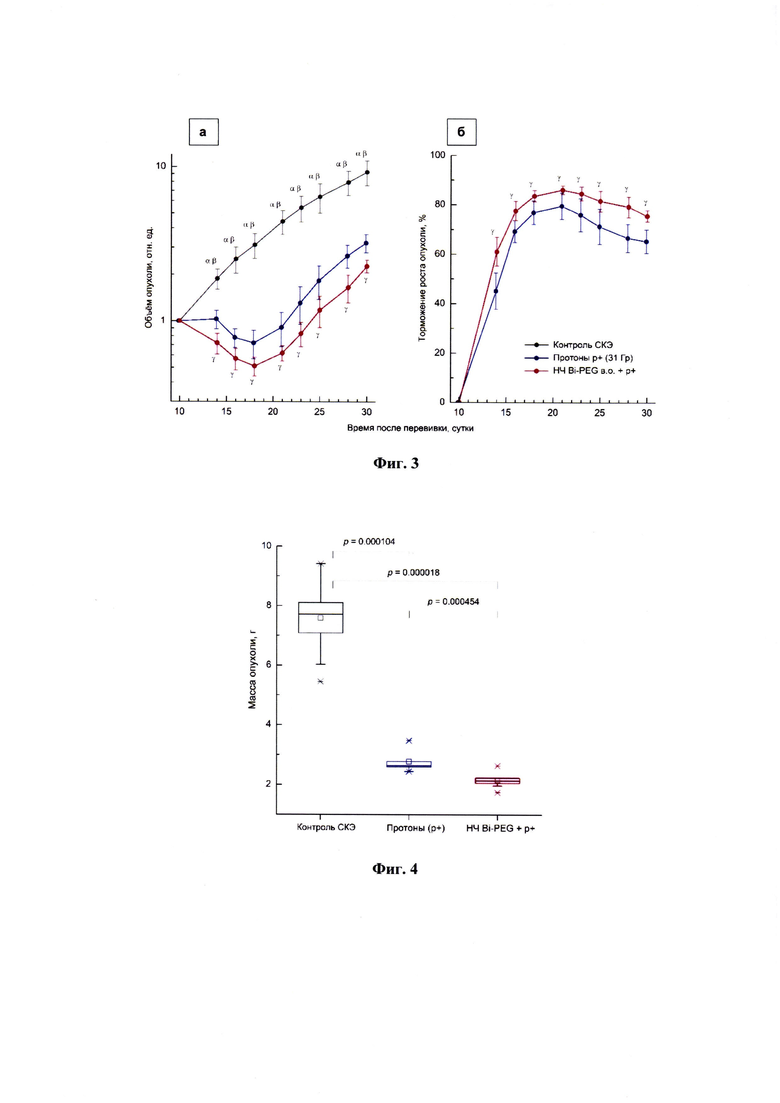
Фиг. 3 - влияние локального облучения пучками протонов (31 Гр) отдельно и в сочетании с предварительным внутриопухолевым введением НЧ Bi-PEG-COOH в дозе 1,5 мг на: а) динамику роста СКЭ; б) показатель торможения роста опухоли. Графические отклонения соответствуют SD. Группы животных:
- (черная) контроль СКЭ - нелеченные животные с привитой СКЭ;
- (синяя) протоны р+(31 Гр) - животные с СКЭ, получившие локальное облучение протонами в дозе 31 Гр;
- (красная) НЧ Bi-PEG-COOH (НЧ Bi-PEG) + протоны р+ - животные с СКЭ, получившие наночастицы Bi-PEG-COOH за 15 минут до локального облучения протонами в дозе 31 Гр.
α - достоверные различия между группам контроль/протоны р+(р<0,001);
β - достоверные различия между группами контроль/НЧ Bi-PEG + протоны р+(р<0,001);
γ - достоверные различия между группами протоны/НЧ Bi-PEG + протоны р+(Р<0,001).
Фиг. 4 - бокс-диаграмма распределения массы опухолевых узлов СКЭ у мышей экспериментальных групп, извлеченных на 30-е сутки роста (р - уровень значимости статистических различий).
Осуществление изобретения.
Для лечения СКЭ мышам, за 15 минут до облучения пучками протонов в дозе 10 Гр или 31 Гр внутриопухолево вводят наночастицы висмута, покрытые Pluronic-F127 в количестве 1,5 мг/мышь в виде 100 мкл 1,5% суспензии на основе фосфатно-солевого буфера, или покрытые полиэтиленгликолем (далее - пегилированные) наночастицы висмута в количестве 1,5 мг/мышь в виде 100 мкл 1,5% суспензии на основе фосфатно-солевого буфера, после чего опухоль облучают пучками протонов при клинически допустимой мощности дозы 30 Гр/ч.
Информация о результатах экспериментальных исследований.
Для изучения in vivo были использованы два типа НЧ Bi, различающихся покрытием поверхности: наночастицы, покрытые амфифильной молекулой Pluronic-F127 и наночастицы, покрытые полимером Silane-PEG-COOH, 5кДа. Для покрытия были получены НЧ Bi методом фемтосекундной лазерной абляции в ацетоне с последующей фрагментацией лазерными импульсами с энергией 70 мкДж. Полученные наночастицы, по данным сканирующей электронной микроскопии, имели сферическую форму и логнормальное распределение по размеру со средним размером 25±17 нм. Рентгеновский кристаллографический анализ подтвердил высокую кристалличность получившихся пегилированных НЧ Bi (НЧ Bi-PEG-COOH) с параметрами решетки а=4,547 Å и с=11,862 Å и отсутствием других кристаллических фаз. Гидродинамический размер частиц в воде составил 75±32 нм.
Для покрытия НЧ Bi Pluronic-F127 плюроник инкубировался с частицами в ацетоне, после чего коллоид высушивался до порошка и ресуспендировался в дистиллированной воде. Метод динамического светорассеяния показал, что НЧ Bi-Pluronic имели гидродинамический размер 102±37 нм в воде и 124±42 нм в PBS. Более того, частицы сохраняли коллоидную стабильность в воде более, чем в течение 1 суток. Потенциал кинетического слоя НЧ составил - 8±14 мВ. Для введения лабораторным животным были подготовлены 2 суспензии НЧ с концентрацией висмута равной 15 мг/мл и 7,5 мг/мл, соответственно.
Для покрытия НЧ Bi полиэтиленгликолем (PEG) Silane-PEG-COOH инкубировался с НЧ в этаноле при добавлении гидроксида аммония. Гидролиз производных силана приводил к осаждению цепей полиэтиленгликоля на поверхность НЧ. Метод динамического светорассеяния показал, что НЧ имели гидродинамический размер 88±32 нм в воде и 95±23 нм в PBS. Более того, НЧ сохраняли коллоидную стабильность в воде более, чем в течение 1 суток. Потенциал кинетического слоя НЧ составил - 27±13 мВ. Для введения лабораторным животным была подготовлена суспензия НЧ с концентрацией висмута равной 15 мг/мл.
Пример 1.
Исследование радиомодифицирующего эффекта непегилированных наночастиц висмута (НЧ Bi-Pluronic) при однократном внутриопухолевом введении и локальном воздействии протонного излучения в дозе 10 Гр.
Исследование радиомодифицирующего эффекта наночастиц висмута Bi-Pluronic в сочетании с протонным облучением проведено на СКЭ у мышей. СКЭ перевивали самкам мышей F1 (CBA×C57BL/6j) путем подкожного введения в область латеральной поверхности правого бедра 2,5⋅106 опухолевых клеток в 0,2 мл среды 199 (Пан-Эко, РФ). После трансплантации неоплазии животных распределяли в 4 группы: контрольную и три опытных группы, по 20-21 мыши в каждой. Воздействия на животных проводили на 9-10 сутки после трансплантации. Суспензии наночастиц висмута (НЧ Bi-Pluronic) в дозе 0,75 или 1,5 мг на мышь (100 мкл 0,75% или 1,5% суспензии на основе PBS) вводили внутриопухолево за 15 минут до облучения. Далее животное фиксировали на пластиковой станине с латеральным отведением облучаемой конечности, на бедро которой предварительно была трансплантирована СКЭ. Облучали при локальном воздействии протонного излучения в модифицированном пике Брэгга (ширина пика - 35 мм, энергия протонов - 95-105 МэВ) область бедра в поле 20×20 мм.
Динамику веса животных и динамику роста опухоли оценивали каждые 2-3 суток, данные заносили в протокол исследований.
Объем опухолевого узла рассчитывали по формуле:
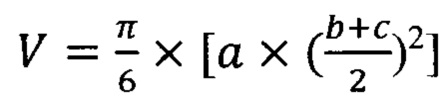 ,
,
где а, b, с - измеренные показатели объема опухолевого узла.
Индекс торможения роста опухоли (далее - ТРО) вычисляли по формуле:
ТРО=(VK-V0)/VK×100%,
где VK и V0 - средний объем опухолевого узла в контрольной и опытной группах, соответственно, мм3.
Статистическую обработку и графическое представление полученных результатов проводили при помощи пакетов прикладных программ «Microsoft Excel», STATISTICA 10, Origin 2017.
В качестве источника сканирующего пучка протонов использовали комплекс протонной терапии (КПТ) «Прометеус», расположенный в Медицинском радиологическом научном центре им. А.Ф. Цыба (г.Обнинск). Для проведения радиобиологических исследований вместо кресла пациента устанавливали специальную платформу, на которой размещали зафиксированное животное. Измерения распределения поглощенной дозы по глубине проводились в моторизированном 3Д водном фантоме МР3-Р (PTW Freiburg, Германия) посредством перемещения ионизационной камеры Type Roos (PTW Freiburg, Германия) вдоль оси пучка по направлению от выходного окна ускорителя. В качестве электрометра использовался двухканальный Tandem XDR (PTW Freiburg, Германия). На основании полученного глубинного дозового распределения для модифицированного пучка протонов определяли водный эквивалент толщины для полиметилметакрилата (далее - ПММА), который создавал водную толщину, для облучения мишени в модифицированной кривой Брэгга. Равномерность поля облучения определяли в системе планирования комплекса протонной терапии. Установка объектов относительно центра поля осуществлялась по перекрестью лазерных линий комплекса.
Результаты исследования показали (см. Фиг. 1, а, б), что однократное локальное воздействие протонами в дозе 10 Гр на бедро мышей с привитой СКЭ в этом исследовании вызывало достоверное противоопухолевое действие. ТРО после облучения протонами нарастало в первые 5 суток и далее до конца наблюдения сохранялось на стабильном значимом уровне (ТРО - 20-25%). Предварительное (за 15 мин до облучения) однократное внутриопухолевое введение НЧ Bi-Pluronic в дозе 0,75 мг не сопровождалось значимой модификацией противоопухолевых эффектов протонного излучения. По всем показателям опухоли СКЭ у мышей, получивших только протонное воздействие, и у мышей, получивших перед облучением НЧ в дозе 0,75 мг, на всех этапах наблюдения статистически не различались.
Вместе с тем, предварительное однократное внутриопухолевое введение НЧ Bi-Pluronic в дозе 1,5 мг сопровождалось умеренным, но статистически значимым (р=0,02-0,04) возрастанием противоопухолевых эффектов протонов (Фиг. 1, а, б). ТРО у мышей, получивших такое сочетанное воздействие, нарастало в первые 7 суток и далее до конца наблюдения сохранялось на стабильном уровне (ТРО - 25-30%). И на поздних сроках развития неоплазии (16-21 сутки) размеры опухолевых узлов, индексы ТРО, а также терминальная масса опухолей у мышей этой группы были статистически достоверно ниже показателей животных, получивших только облучение протонами (Фиг. 2).
Пример 2.
Исследование радиомодифицирующего эффекта пегилированных наночастиц висмута при однократном внутриопухолевом введении и локальном воздействии протонного излучения в дозе 31 Гр.
Проведено исследование радиомодифицирующей активности пегилированных НЧ висмута (Bi-PEG-COOH) при однократном внутриопухолевом введении в дозе 1,5 мг (100 мкл 1,5% суспензии на основе PBS) и локальном воздействии протонного излучения в дозе 31 Гр на СКЭ у мышей-самок Fi (CBA×C57B1/6j). Методика трансплантации, дизайн исследования и дозиметрическое сопровождение описаны в примере 1.
Полученные данные свидетельствуют, что локальное облучение опухоли протонами в дозе 31 Гр сопровождалось выраженным противоопухолевым действием. Наблюдался значительный (на 25-30%) регресс опухолевых узлов и длительная (на 10-12 суток) задержка роста СКЭ, при этом индекс ТРО достигал 60-80% (Фиг. 3, а, б). На терминальной стадии этого эксперимента облученные протонами опухолевые узлы СКЭ по массе статистически достоверно были меньше опухолей контрольных животных (Фиг. 4).
При такой высокой дозе протонного воздействия радиомодифицирующие эффекты НЧ Bi-PEG-COOH также были качественно более выражены, чем в предшествующих экспериментах. У мышей, получавших комбинированное воздействие (НЧ Bi-PEG-COOH + протоны р+), значительно возрастали все регистрируемые показатели: глубина регресса опухолей - до 50%, длительность задержки роста - до 15-16 суток, и индекс ТРО - до 75-85% (Фиг. 3, а, б). При этом уровень статистической значимости проявления радиосенсибилизирующего действия НЧ Bi-PEG-COOH на всех этапах наблюдения был очень убедительным - р<0,001.
Значительную выраженность радиосенсибилизирующей активности НЧ Bi-PEG-COOH при высоких дозах протонного облучения подтверждали и данные терминальных наблюдений - опухолевые узлы СКЭ у мышей, получавших комбинированное воздействие (НЧ Bi-PEG-COOH 1,5 мг + протоны р+ 31 Гр), по массе статистически достоверно были меньше опухолей животных, получавших только воздействие пучков протонов в дозе 31 Гр (Фиг. 4).
Вывод.
Проведенное исследование показало, что прямая внутриопухолевая инъекция радиосенсибилизаторов в сочетании с протонным облучением ограничивает системную токсичность и может значительно повысить концентрацию радиосенсибилизатора в опухоли по сравнению с системным внутривенным введением, что оказывает выраженное статистически значимое противоопухолевое действие на СКЭ у мышей.
Предложенный способ позволит расширить возможности терапии злокачественных новообразований, т.к. НЧ висмута обладают подходящими физическими и химическими свойствами, которые потенциально способны усиливать радиационное воздействие путем сенсибилизации биологических мишеней, и могут явиться перспективными радиосенсибилизирующими агентами в радиотерапии неоплазий.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ повышения эффективности действия ионизирующих излучений на меланому | 2021 |
|
RU2774032C1 |
| Способы комбинированной терапии злокачественных новообразований с использованием наночастиц оксида железа | 2023 |
|
RU2816227C1 |
| СПОСОБ ПОВЫШЕНИЯ ЭФФЕКТИВНОСТИ ДЕЙСТВИЯ ПРОТОННОЙ ТЕРАПИИ НА СТВОЛОВЫЕ КЛЕТКИ МЕЛАНОМЫ | 2022 |
|
RU2798733C2 |
| Коньюгат на основе магнитных наночастиц для терапии солидных опухолей и способ его получения | 2023 |
|
RU2830006C1 |
| СПОСОБ ФОТОН-ЗАХВАТНОЙ ТЕРАПИИ ОПУХОЛЕЙ | 2013 |
|
RU2533267C1 |
| Полимерные носители био- и фотоактивных наноструктурированных компонентов, способ их получения и применение в комбинированной локальной АФК-опосредованной и фототермической терапии злокачественных новообразований | 2023 |
|
RU2815030C1 |
| СПОСОБ ПОДАВЛЕНИЯ РОСТА ОПУХОЛЕЙ | 2008 |
|
RU2383370C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ ВЛИЯНИЯ НАНОДИСПЕРСНОЙ МЕДИ НА РОСТ ОПУХОЛЕЙ В ЭКСПЕРИМЕНТЕ | 2009 |
|
RU2417453C1 |
| Средство для использования в фотон-захватной терапии злокачественных солидных новообразований | 2015 |
|
RU2611379C1 |
| СПОСОБ ЛЕЧЕНИЯ ЛЕЙКОЗА У ЛАБОРАТОРНЫХ ЖИВОТНЫХ | 2009 |
|
RU2410091C1 |
Изобретение относится к области медицины, а именно онкологии, лучевой терапии, и может быть использовано при протонной терапии солидной карциномы Эрлиха. Способ включает введение наночастиц в качестве радиосенсибилизатора, после чего опухоль облучают пучками протонов в дозе 10 Гр или 31 Гр. За 15 минут до облучения пучками протонов внутриопухолево вводят наночастицы висмута, покрытые Pluronic-F 127 в количестве 1,5 мг/мышь в виде 100 мкл 1,5% суспензии на основе фосфатно-солевого буфера или покрытые полиэтиленгликолем наночастицы висмута в количестве 1,5 мг/мышь в виде 100 мкл 1,5% суспензии на основе фосфатно-солевого буфера, после чего опухоль облучают пучками протонов при клинически допустимой мощности дозы 30 Гр/ч. Использование изобретения позволяет повысить безопасность воздействия протонного излучения за счет применения клинически допустимой мощности дозы в сочетании с предварительным введением металлических наночастиц при одновременном обеспечении высокой эффективности воздействия. 4 ил., 2 пр.
Способ протонной терапии солидной карциномы Эрлиха, в котором предварительно вводят наночастицы в качестве радиосенсибилизатора, после чего опухоль облучают пучками протонов в дозе 10 Гр или 31 Гр, отличающийся тем, что за 15 минут до облучения пучками протонов внутриопухолево вводят наночастицы висмута, покрытые Pluronic-F 127 в количестве 1,5 мг/мышь в виде 100 мкл 1,5% суспензии на основе фосфатно-солевого буфера или покрытые полиэтиленгликолем наночастицы висмута в количестве 1,5 мг/мышь в виде 100 мкл 1,5% суспензии на основе фосфатно-солевого буфера, после чего опухоль облучают пучками протонов при клинически допустимой мощности дозы 30 Гр/ч.
| СПОСОБ ФОТОН-ЗАХВАТНОЙ ТЕРАПИИ ОПУХОЛЕЙ | 2004 |
|
RU2270045C1 |
| СПОСОБ ПЛАЗМОННО-РЕЗОНАНСНОЙ ФОТОТЕРМИЧЕСКОЙ ТЕРАПИИ ОПУХОЛЕЙ В ЭКСПЕРИМЕНТЕ | 2015 |
|
RU2614507C1 |
| НОВЫЕ СУСПЕНЗИИ ОСНОВАННЫХ НА ЗОЛОТЕ И ПЛАТИНЕ БИМЕТАЛЛИЧЕСКИХ НАНОКРИСТАЛЛОВ, ЭЛЕКТРОХИМИЧЕСКИЕ СПОСОБЫ ИХ ПРОИЗВОДСТВА И ИХ ПРИМЕНЕНИЯ | 2012 |
|
RU2617055C2 |
| Многоступенчатая активно-реактивная турбина | 1924 |
|
SU2013A1 |
| ШЕВЧЕНКО О | |||
| В | |||
| и др | |||
| Обзор по контрастным гибридным наноразмерным препаратам на основе тантала, висмута и железа для диагностики и терапии рака//Вестник Дальневосточного отделения Российской академии наук | |||
| Способ восстановления спиралей из вольфрамовой проволоки для электрических ламп накаливания, наполненных газом | 1924 |
|
SU2020A1 |
| Бесколесный шариковый ход для железнодорожных вагонов | 1917 |
|
SU97A1 |
Авторы
Даты
2023-12-05—Публикация
2023-07-13—Подача