ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится к новому производному диазабициклооктана формулы (I), его фармацевтически приемлемой соли или сольвату. Также настоящее изобретение относится к способу его получения и его применению в качестве ингибитора β-лактамазы для лечения бактериальных инфекций. Данное изобретение также относится к фармацевтической композиции и способу лечения бактериальной инфекции с применением соединения в соответствии с данным изобретением.
УРОВЕНЬ ТЕХНИКИ
Пенициллины и цефалоспорины являются β-лактамными антибиотиками, которые наиболее широко и часто используются в клинической медицине. Тем не менее, приобретение различными патогенами устойчивости к β-лактамным антибиотикам оказывает значительное отрицательное действие на сохранение эффективного лечения бактериальных инфекций. Наиболее значительным известным механизмом, относящимся к приобретению бактериальной устойчивости, является образование A, B и D класса β-лактамаз, имеющих сериновый остаток в активном центре. Эти ферменты разрушают β-лактамные антибиотики, что приводит к потере антимикробной активности. Класс А β-лактамаз преимущественно гидролизует пенициллины, а класс С β-лактамаз имеет субстратный профиль, благоприятствующий цефалоспоринам. Коммерчески доступными известными ингибиторами β-лактамазы являются клавулановая кислота, сульбактам и тазобактам, и эти ингибиторы являются эффективными в основном против бактерий, производящий А класс β-лактамазы, и применяются в виде смеси с антибиотиками пенициллинового ряда. Тем не менее, 250 типов или более β-лактамаз описаны в настоящее время, и среди них, в дополнение к увеличению класса С β-лактамаз, β-лактамаз расширенного спектра (БЛРС), принадлежащих к классу А и D β-лактамаз, другие устойчивые бактерии, которые производят класс KPC-2 β-лактамаз, разрушающих даже карбапенем как последнюю возможность β-лактамового антибиотика, считаются проблемой. Разработка нового ингибитора крайне желательна, так как коммерчески доступные ингибиторы не эффективны против таких β-лактамаз.
Кроме того, в последнее время, инфекционные заболевания, вызванные указанными выше устойчивыми бактериями в качестве патогенных бактерий, были найдены не только в тяжелых инфекционных заболеваниях, но также, периодически, во внебольничных инфекционных заболеваниях, поэтому разработка нового ингибитора, который может применяться в сочетании с лекарственным средством первой альтернативы (например, пенициллины или цефалоспорины) в городе крайне необходима. Однако хотя имеются доклады, касающиеся потенциальных ингибиторов, и доклады, касающиеся лечения тяжелых инфекционных заболеваний, разрабатываются только несколько кандидатов.
В последние годы, в US 7112592 (Патентный документ 1), US 7612087 (Патентный документ 2) и WO 2009/091856 (Патентный документ 3) описано, что определенные виды производных диазабициклооктана являются многообещающими соединениями для лечения инфекционных заболеваний в качестве антибиотиков, имеющие β-лактамовую структуру или не содержащие ингибитор β-лактамазы. В качестве способа их получения, кроме способов, указанных в цитированных выше документах, известен способ, описанный в WO 2010/126820 A2 (Патентный документ 4).
ДОКУМЕНТЫ ИЗВЕСТНОГО УРОВНЯ ТЕХНИКИ
ПАТЕНТНЫЕ ДОКУМЕНТЫ
Патентный документ 1: патент США № 7112592
Патентный документ 2: патент США № 7612087
Патентный документ 3: WO 2009/091856 A2
Патентный документ 4: WO 2010/126820 A2
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
ПРОБЛЕМЫ, КОТОРЫЕ РЕШАЕТ ДАННОЕ ИЗОБРЕТЕНИЕ
Доступные в настоящее время ингибиторы β-лактамазы являются недостаточными для ингибирования постоянно увеличивающейся β-лактамазы, и требуются новые ингибиторы β-лактамазы для трудного лечения бактериальных инфекционных заболеваний, вызванных устойчивыми бактериями, которые производят β-лактамазу класса С, β-лактамазу расширенного спектра (БЛРС), принадлежащую к классу А и D или класс KPC-2 β-лактамаз, разрушающих даже карбапенем как последнюю возможность β-лактамового антибиотика.
СРЕДСТВА ДЛЯ РЕШЕНИЯ ПРОБЛЕМ
Авторы данного изобретения провели исследования нового ингибитора β-лактамазы, эффективного против бактерий, производящих β-лактамазу, которые в настоящее время вызывают описанные выше проблемы, особенно β-лактамазы класса A, класса С и класса D, и в результате было найдено новое производное диазабициклооктана, представленное формулой (I). Также было обнаружено, что соединение в соответствии с данным изобретением значительно восстанавливает противомикробное действие объединения β-лактамового антибиотика против устойчивых бактерий при применении в сочетании с β-лактамовым антибиотиком.
Также был определен способ соединения формулы с (II), которое включено в формулу (I) в соответствии с данным изобретением:

в представленных выше формулах (I) и (II) А является Ra(Rb)N- или RcO-; B является NH или NC1-6 алкилом; С является бензилом, Н или SO3M, где М является Н, неорганическим катионом или органическим катионом; Ra и Rb каждый, независимо друг от друга, являются Н, С1-6 алкилом или ацилом; Rc является С1-6 алкилом или гетероциклилом; А может быть модифицирован от 0 до 4 заместителями Fn1, где заместитель Fn1 может быть далее замещен; Fn1 является С1-6 алкилом, O= или Rg-(CH2)0-3-, где Rg является гетероциклилом, фенилом, гетероарилом, ацилом, RdO2S-, Re(Rf)N-, Re(Rf)NCO-, ReO-, ReOCO- или защитной группой, где Rd представляет С1-6 алкил или МО-; Re и Rf каждый, независимо друг от друга, являются Н или С1-6 алкилом, а также между Ra и Rb, между Rc и В, и между Re и Rf может быть закрыто связыванием с получением гетероциклила, имеющего, по крайней мере, один атом азота.
Первоначально, для исследования способа получения соединения, представленного указанной выше (II), способ с применением эквивалента фосгена и амина, описанный в патенте США № 7112592 или патенте США № 7612087, или способ, в котором соединение обрабатывают трифосгеном и 10% водным раствором фосфорной кислоты, как описано в WO 2009/133442 А1 или WO 2010/126820 А2, применяют к соединению, представленному формулой (IV-с):

в указанной выше формуле (IV-с), В и Rc такие же, как определены для соединения формулы (II), и OBn является бензилокси,
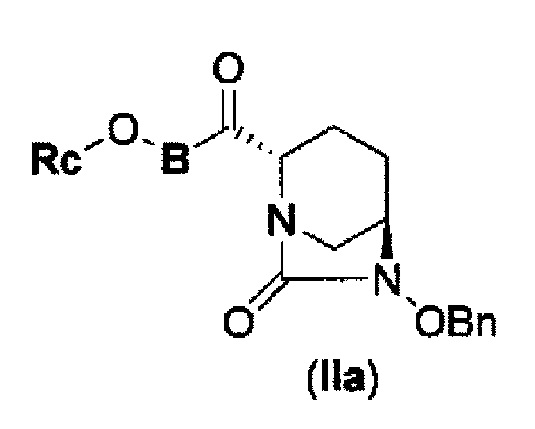
соединение, представленное формулой (IV-с), имеет N-алкоксикарбамоил, показывающий слабую кислотность в боковой цепи в положении 2 так, что соединение, имеющее структуру диазабициклооктана, представлено формулой (IIa):
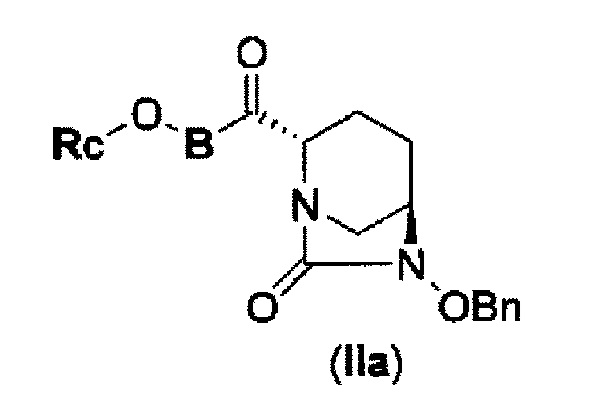
в представленной выше формуле (IIa), Rc и В такие же, как определены для соединения формулы (II), и OBn является бензилокси,
может быть получено только с очень незначительным выходом.
Также способ, описанный в WO 2009/133442 A1 или WO 2010/126820 A2, вводит боковую цепь в положении 2 на исходной стадии процесса получения, что не дешево, а, следовательно, способ не обязательно интересен для коммерческого процесса производства, и желательна разработка способа получения, который может быть легко переведен в промышленные масштабы.
Поэтому, авторы данного изобретения нашли соединения, представленные следующей формулой (IV-a2), (IV-a3) или (IV-a4):

в представленных выше формулах (IV-a2), (IV-a3) или (IV-a4), ТФА является трифторацетилом, Вос является трет-бутоксикарбонилом, Теос является 2-триметилсилилэтоксикарбонилом, и OBn является бензилокси,
в качестве более полезных исходных материалов и постоянно изучали их для того, чтобы привести их к соединениями указанной выше формулы (IV-c) и указанной выше формулы (IIa).
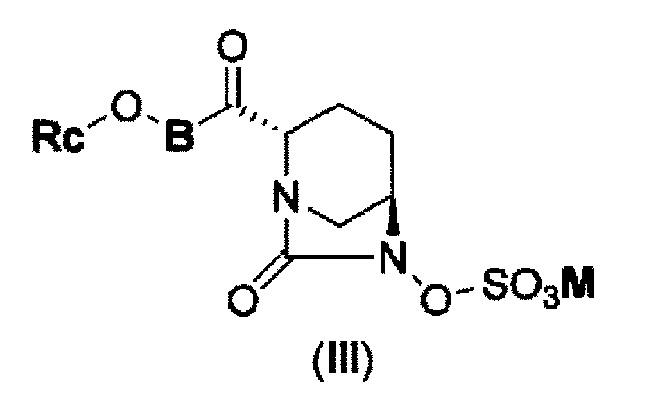
В результате, был получен способ получения соединения, представленного формулой (III)
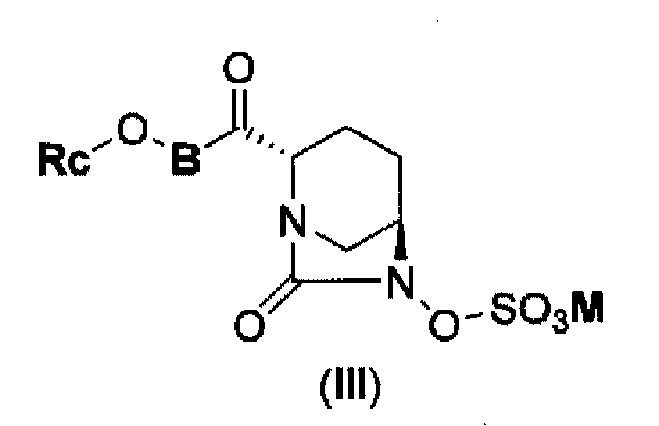
в указанной выше формуле (III) Rc, В и М имеют те же значения, которые определены для соединения указанной выше формулы (II),
которое включено в соединение указанной выше формулы (II).
То есть, настоящее изобретение относится к
(1) производному диазабициклооктана, представленному формулой (I),
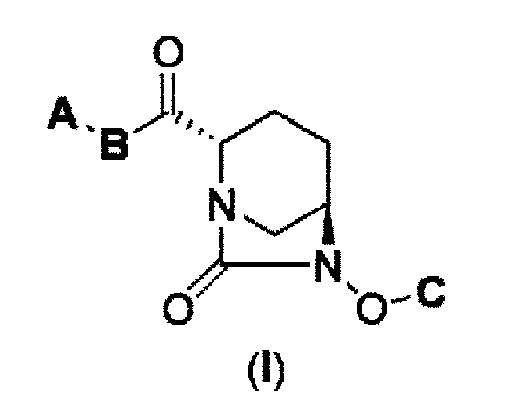
В представленной выше формуле (I), А является Ra(Rb)N- или RCO-; B является NH или NC1-6 алкилом; С является бензилом, Н или SO3M, где М является Н, неорганическим катионом или органическим катионом; Ra и Rb каждый, независимо друг от друга, являются Н, С1-6 алкилом или ацилом; Rc является С1-6 алкилом или гетероциклилом; А может быть модифицирован от 0 до 4 заместителями Fn1, где заместитель Fn1 может быть далее замещен; Fn1 является С1-6 алкилом, O= или Rg-(CH2)0-3-, где Rg является гетероциклилом, фенилом, гетероарилом, ацилом, RdO2S-, Re(Rf)N-, Re(Rf)NCO-, ReO-, ReOCO- или защитной группой, где Rd представляет С1-6 алкил или МО-; Re и Rf каждый, независимо друг от друга, являются Н или С1-6 алкилом, а также между Ra и Rb, между Rc и В, и между Re и Rf может быть закрыто связыванием с получением гетероциклила, имеющего, по крайней мере, один атом азота, его фармацевтически приемлемой соли или сольвату.
Также, в соответствии с другим аспектом настоящего изобретения, оно относится к
(2) производному диазабициклооктана, представленному следующей формулой (II):
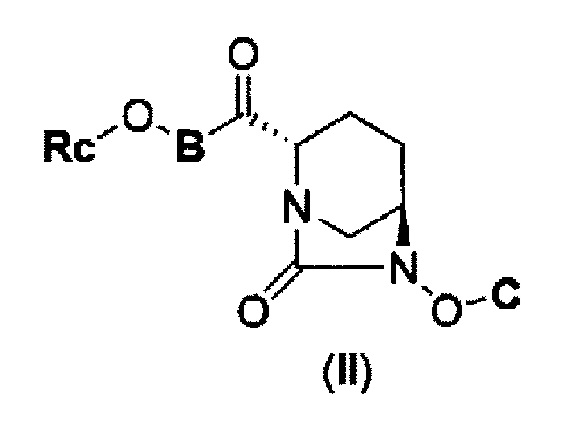
В представленной выше формуле (II) Rc является С1-6 алкилом или гетероциклилом; В является NH или NC1-6 алкилом; С является бензилом, Н или SO3М, где М является Н, неорганическим катионом или органическим катионом; Rc может быть модифицирован от 0 до 4 заместителями Fn1, где заместитель Fn1 может быть далее замещен; Fn1 является С1-6 алкилом, O= или Rg-(CH2)0-3-, где Rg является гетероциклилом, фенилом, гетероарилом, ацилом, RdO2S-, Re(Rf)N-, Re(Rf)NCO-, ReO-, ReOCO- или защитной группой, где Rd представляет С1-6 алкил или МО-; Re и Rf каждый, независимо друг от друга, являются Н или С1-6 алкилом, а также между Rc и В, и между Re и Rf может быть закрыто связыванием с получением гетероциклила, имеющего, по крайней мере, один атом азота,
его фармацевтически приемлемой соли или сольвату.
Также, в соответствии с другим аспектом настоящего изобретения, оно относится к
(3) новому производному диазабициклооктана, представленному следующей формулой (IIа):

В представленной выше формуле (IIa), OBn является бензилокси и Rc и В имеют те же значения, которые определены для соединения указанной выше формулы (II), его фармацевтически приемлемой соли или сольвату, которое включено в указанную выше формулу (II).
Также, в соответствии с другим аспектом настоящего изобретения, оно относится к
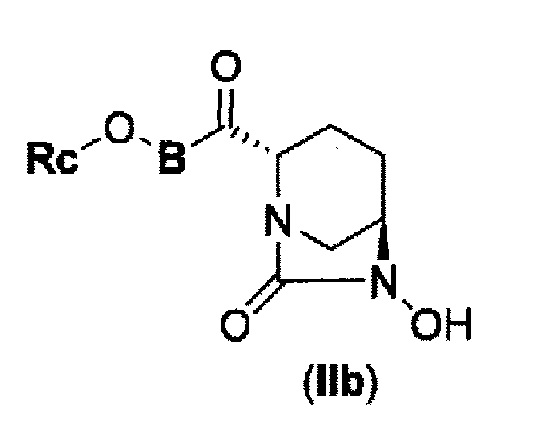
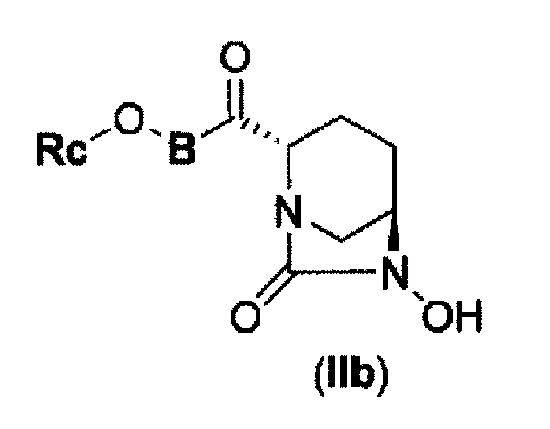
(4) производному диазабициклооктана, представленному следующей формулой (IIb),
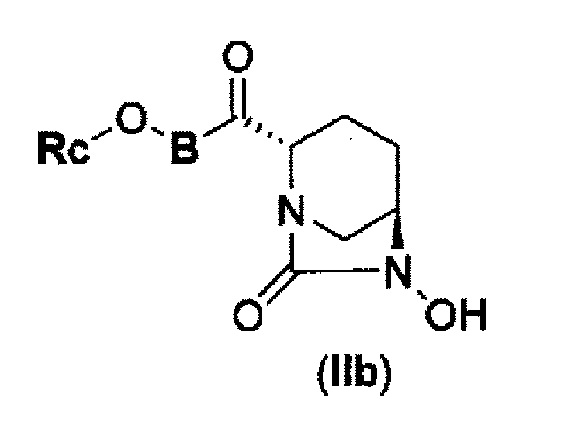
В представленной выше формуле (IIb), Rc и В имеют те же значения, которые определены для соединения указанной выше формулы (II), его фармацевтически приемлемой соли или сольвату, которое включено в указанную выше формулу (II).
Также, в соответствии с другим аспектом настоящего изобретения, оно относится к
(5) производному диазабициклооктана, представленному следующей формулой (III):
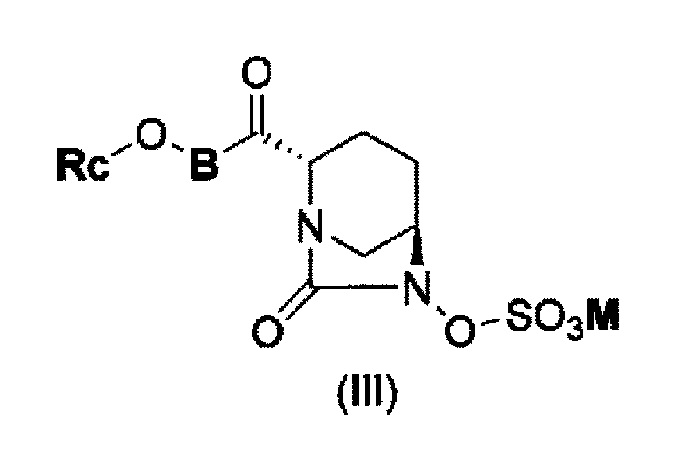
в представленной выше формуле (III) Rc, В и М имеют те же значения, которые определены для соединения указанной выше формулы (II), его фармацевтически приемлемой соли или сольвату.
Также, в соответствии с другим аспектом настоящего изобретения, оно относится к
(6) соединению по любому из указанных выше пунктов (1) - (5), которое представлено одной из следующих формул:
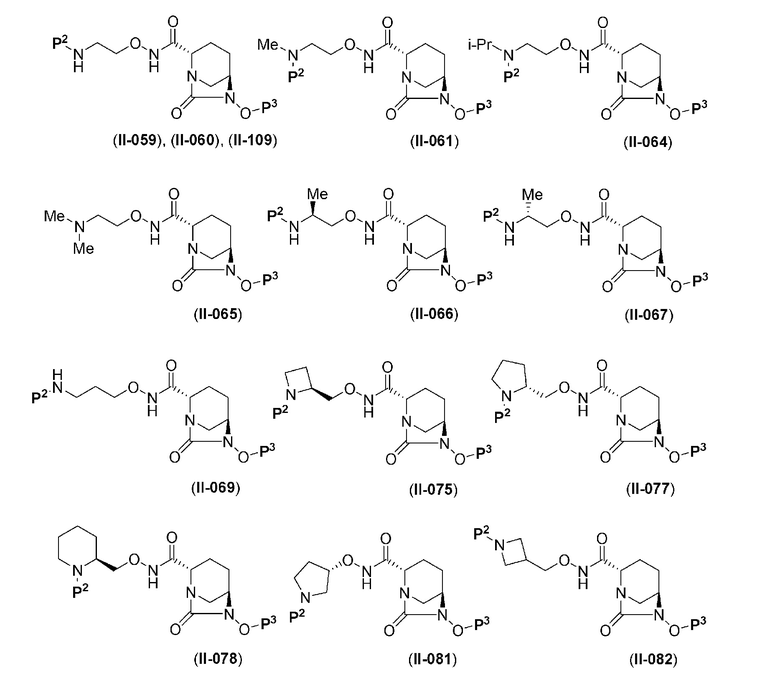
в представленных выше формулах Р2 является трет-бутоксикарбонилом (Вос), бензилоксикарбонилом или (Cbz) или Н; Р3 является бензилом (Bn), Н или SO3М; где М является Н, натрием, пиридинием или тетрабутиламмонием,
его фармацевтически приемлемой соли или сольвату.
Еще один аспект настоящего изобретения относится к
(7) соединению по любому из указанных выше пунктов (1) - (3), которое включает
(2S,5R)-N-(2-аминоэтокси)-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбоксамид,
(2S,5R)-N-[2-(метиламино)этокси]-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбоксамид,
(2S,5R)-7-оксо-N-[2-(пропан-2-иламино)этокси]-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбоксамид,
(2S,5R)-N-[2-(диметиламино)этокси]-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбоксамид,
(2S,5R)-N-{[(2S)-2-аминопропил]окси}-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбоксамид,
(2S,5R)-N-{[(2R)-2-аминопропил]окси}-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбоксамид,
(2S,5R)-N-(3-аминопропокси)-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбоксамид,
(2S,5R)-N-[(2S)-азетидин-2-илметокси]-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбоксамид,
(2S,5R)-7-оксо-N-[(2R)-пирролидин-2-илметокси]-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбоксамид,
(2S,5R)-7-оксо-N-[(2S)-пиперидин-2-илметокси]-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбоксамид,
(2S,5R)-7-оксо-N-[(3S)-пирролидин-3-илокси]-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбоксамид, или
(2S,5R)-N-(азетидин-3-илметокси)-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбоксамид,
его фармацевтически приемлемую соль или сольват.
Также, согласно другому аспекту данного изобретения, оно относится к (8) фармацевтической композиции, содержащей производное диазабициклооктана, представленное приведенной выше формулой (I), его фармацевтически приемлемую соль или сольват, и, необязательно, фармацевтически приемлемый носитель.
Кроме того, в соответствии с другим аспектом настоящего изобретения, оно относится (9) к фармацевтической композиции в соответствии с пунктом (8) для введения в сочетании с β-лактамовым антибиотиком.
Кроме того, в соответствии с другим аспектом настоящего изобретения, оно относится к (10) фармацевтической композиции по пунктам (8) или (9) для лечения бактериальной инфекции.
Кроме того, в соответствии с другим аспектом настоящего изобретения, оно относится к (11) ингибитору β-лактамазы, содержащему производное диазабициклооктана, представленные указанной выше формулой (I), его фармацевтически приемлемую соль или сольват.
Согласно другому аспекту настоящего изобретения, оно относится к (12) фармацевтической композиции, содержащей указанный выше ингибитор β-лактамазы, β-лактамовый антибиотик и, необязательно, фармацевтически приемлемый носитель.
Кроме того, в соответствии с другим аспектом настоящего изобретения, оно относится к (13) фармацевтической композиции, содержащей указанный выше ингибитор β-лактамазы, β-лактамовый антибиотик, выбранный из группы, включающей ампициллин, амоксициллин, пиперациллин, тикарциллин, фломоксеф, цефотаксим, цефтриаксон, цефтазидим, цефепим, цефтаролин, цефтолозан, имипенем, меропенем, биапенем, дорипенем, эртапенем и азтреонам, и, необязательно, фармацевтически приемлемый носитель.
Кроме того, в соответствии с другим аспектом настоящего изобретения предложен способ лечения бактериальных инфекций, и представлен (14) способ лечения бактериальной инфекции, который включает введение указанного выше ингибитора β-лактамазы и β-лактамового антибиотика в сочетании.
Кроме того, в соответствии с другим аспектом настоящего изобретения предложен способ лечения бактериальных инфекций, и представлен (15) способ лечения бактериальной инфекции, который включает введение ингибитора β-лактамазы и β-лактамового антибиотика, выбранного из группы, включающей ампициллин, амоксициллин, пиперациллин, тикарциллин, фломоксеф, цефотаксим, цефтриаксон, цефтазидим, цефепим, цефтаролин, цефтолозан, имипенем, меропенем, биапенем, дорипенем, эртапенем и азтреонам, в сочетании.
Кроме того, в соответствии с другим аспектом настоящего изобретения предложен способ лечения бактериальных инфекций и предложен способ лечения отдельной или смешанной бактериальной инфекции, вызванной, по крайней мере, одной из Escherichia coli, Klebsiella pneumoniae, Enterobacter croacare, Citrobacter freundii, Serratia marcescens, Morganella morganii, Pseudomonas aeruginosa и Acinetobacter baumannii, который включает введение ингибитора β-лактамазы и β-лактамного антибиотика, выбранного из группы, включающей ампициллин, амоксициллин, пиперациллин, тикарциллин, фломоксеф, цефотаксим, цефтриаксон, цефтазидим, цефепим, цефтаролин, цефтолозан, имипенем, меропенем, биапенем, дорипенем, эртапенем и азтреонам, в сочетании.
Кроме того, в соответствии с другим аспектом настоящего изобретения, оно относится к способу получения соединения, представленного следующей формулой (III):
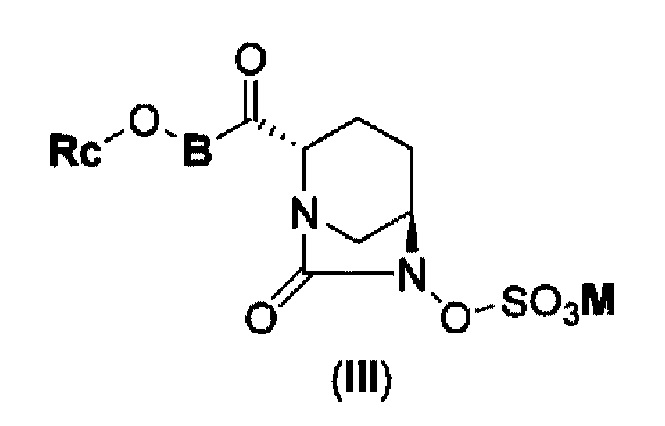
в представленной выше формуле (III) Rc, В и М имеют те же значения, которые определены для соединения указанной выше формулы (II),
которая включена в представленную выше формулу (II), который включает (16) сочетание соединения, представленного следующей формулой (IV-a):

в указанной выше формуле (IV-а), P1 является защитной группой, которая может быть удалена кислотой, основанием или нуклеофильным агентом; и OBn является бензилокси,
с соединением RcOBH с применением активного сложного эфира, активного амида или дегидратирующего конденсирующего агента с получением соединения, представленного следующей формулой (IV-b):

в указанной выше формуле (IV-b), Р1 является защитной группой, которая может быть удалена кислотой, основанием или нуклеофильным агентом; Rc и В имеют значения, определенные для указанной выше формулы (II), и OBn является бензилокси,
снятие защиты Р1, которая является защитной группой, с получением соединения, представленного следующей формулой (IV-c):
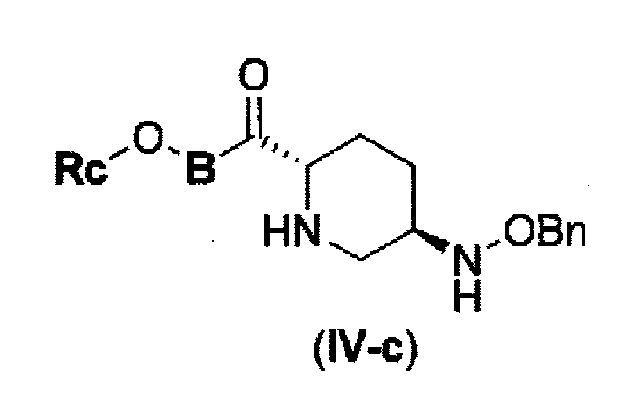
в указанной выше формуле (IV-с), Rc и В имеют значения, определенные для указанной выше формулы (II), и OBn является бензилокси,
силилирование соединения в реакционной системе с последующим подверганием реакции образования внутримолекулярной мочевины с получением соединения, представленного следующей формулой (IIa):
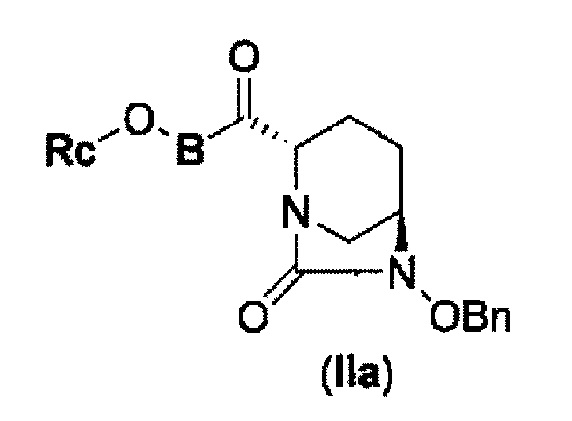
в указанной выше формуле (IIa), Rc и В имеют значения, определенные для указанной выше формулы (II), и OBn является бензилокси,
затем, удаление бензила или бензилокси в положении 6 с применением катализатора гидрогенолиза в атмосфере водорода с получением соединения, представленного следующей формулой (IIb):
в указанной выше формуле (IIb), Rc и В имеют значения, определенные для указанной выше формулы (II),
и сульфирование гидроксильной группы в положении 6 в присутствии основания и, если необходимо, снятие защиты в боковой цепи: RcOB- с получением соединения, представленного следующей формулой (III).
Кроме того, в соответствии с другим аспектом настоящего изобретения, оно относится к способу получения соединения, представленного следующей формулой (IIa):

в указанной выше формуле (IIa), OBn является бензилокси и Rc и В имеют значения, определенные для указанной выше формулы (II),
которая включена в представленную выше формулу (II), который включает
(17) сочетание соединения, представленного следующей формулой (IV-a):
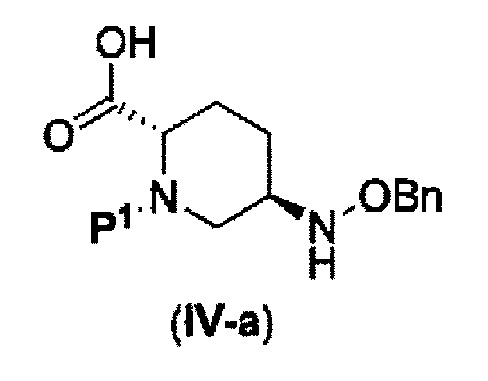
в указанной выше формуле (IV-а) P1 является защитной группой, которая может быть удалена кислотой, основанием или нуклеофильным агентом; и OBn является бензилокси,
с соединением: RcOBH с применением активного сложного эфира, активного амида или дегидратирующего конденсирующего агента с получением соединения, представленного следующей формулой (IV-b):
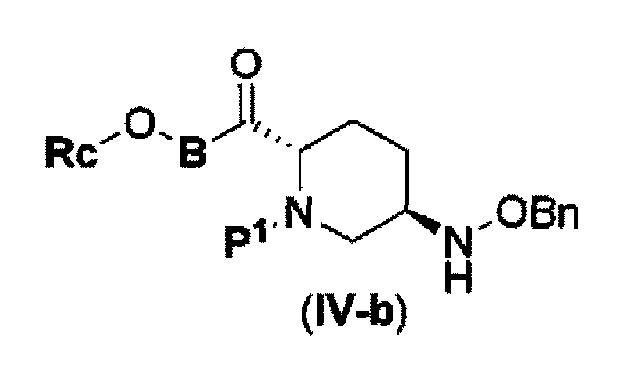
в указанной выше формуле (IV-b), Р1 является защитной группой, которая может быть удалена кислотой, основанием или нуклеофильным агентом; Rc и В имеют значения, определенные для указанной выше формулы (II), и OBn является бензилокси,
снятие защиты Р1, которая является защитной группой, с получением соединения, представленного следующей формулой (IV-c):
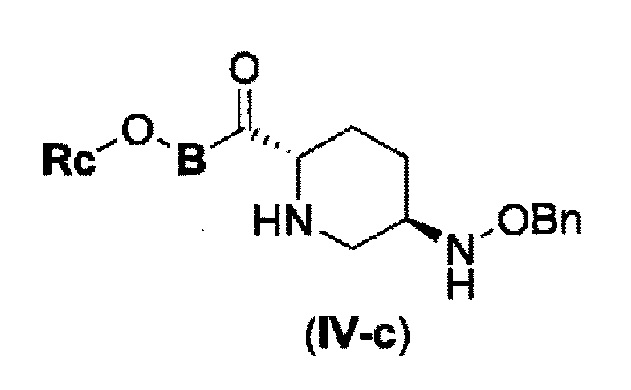
в указанной выше формуле (IV-с), Rc и В имеют значения, определенные для указанной выше формулы (II), и OBn является бензилокси,
силилирование соединения в реакционной системе с последующим подверганием реакции образования внутримолекулярной мочевины с получением соединения, представленного следующей формулой (IIa).
Кроме того, в соответствии с другим аспектом настоящего изобретения, оно относится к способу получения соединения, представленного следующей формулой (IIa):
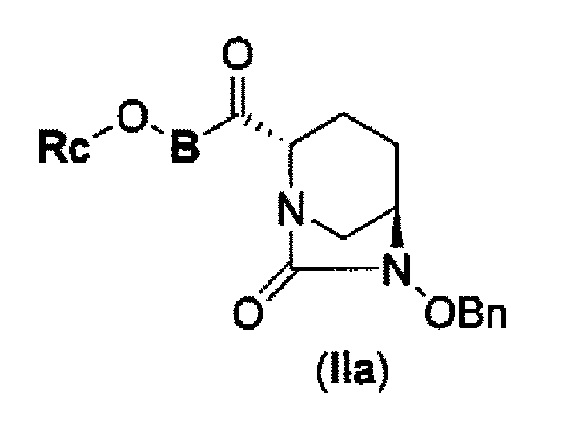
в указанной выше формуле (IIa), OBn является бензилокси и Rc и В имеют значения, определенные для указанной выше формулы (II),
которая включена в представленную выше формулу (II), который включает
(18) силилирование представленного следующей формулой (IV-c):
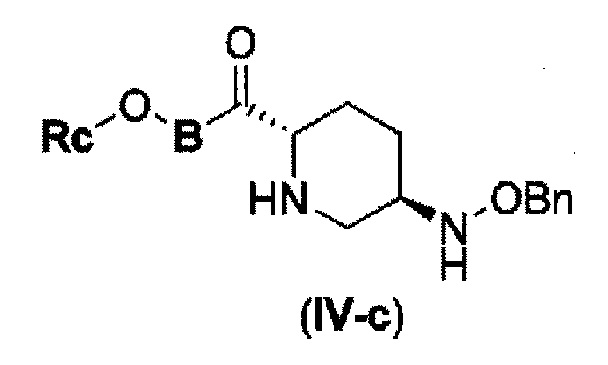
в указанной выше формуле (IV-с), Rc и В имеют значения, определенные для указанной выше формулы (II), и OBn является бензилокси,
в реакционной системе с последующей реакцией формирования внутримолекулярной мочевины с получением соединения, представленного следующей формулой (IIа).
Кроме того, в соответствии с другим аспектом настоящего изобретения, оно относится к способу получения соединения, представленного следующей формулой (III):
в указанной выше формуле (III), Rc, В и М имеют значения, определенные для указанной выше формулы (II),
которая включена в представленную выше формулу (II), который включает
(19) удаление бензила или бензилокси в положении 6 соединения, представленного следующей формулой (IIa):
в указанной выше формуле (IIa), Rc и В имеют значения, определенные для указанной выше формулы (II), и OBn является бензилокси,
с применением катализатора гидрогенолиза в атмосфере водорода с получением соединения, представленного следующей формулой (IIb):
в указанной выше формуле (IIb), Rc и В имеют значения, определенные для указанной выше формулы (II),
и сульфирование гидроксильной группы в положении 6 в присутствии основания и, если необходимо, снятие защиты в боковой цепи: RcOB- с получением соединения, представленного следующей формулой (III).
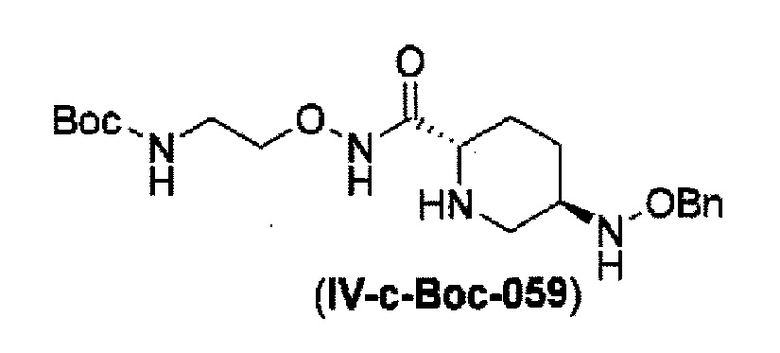
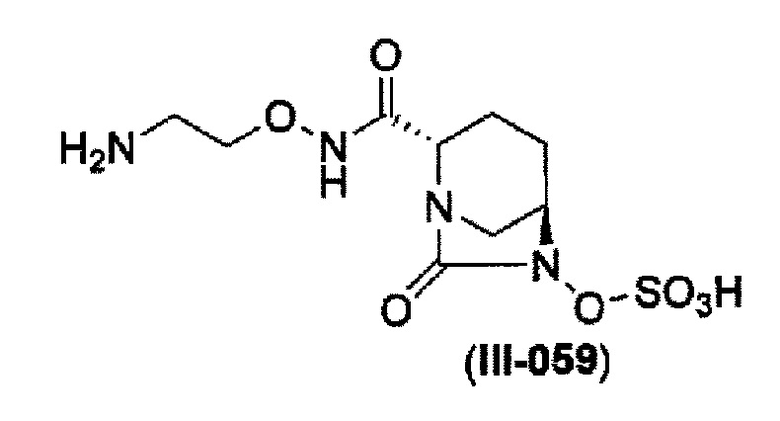
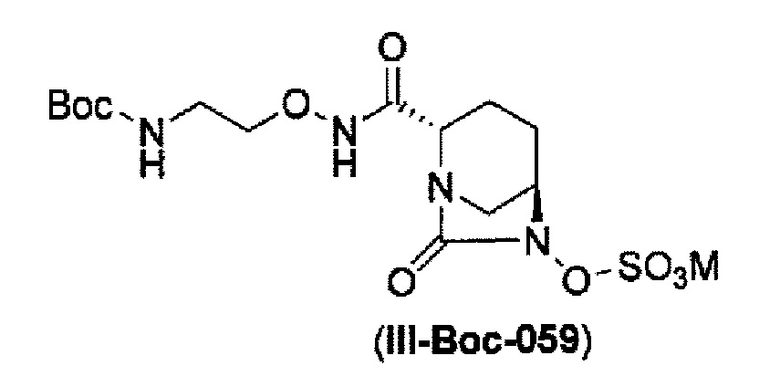
Кроме того, в соответствии с другим аспектом настоящего изобретения, оно относится к способу получения (2S,5R)-N-(2-аминоэтокси)-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбоксамида, представленного следующей формулой (III-059):
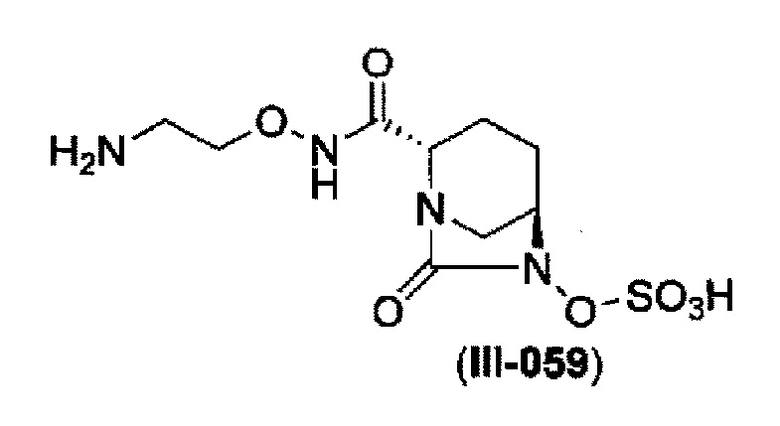
который включает
(20) среди соединений, представленных следующими формулами (IV-a2), (IV-а3) и (IV-a4):
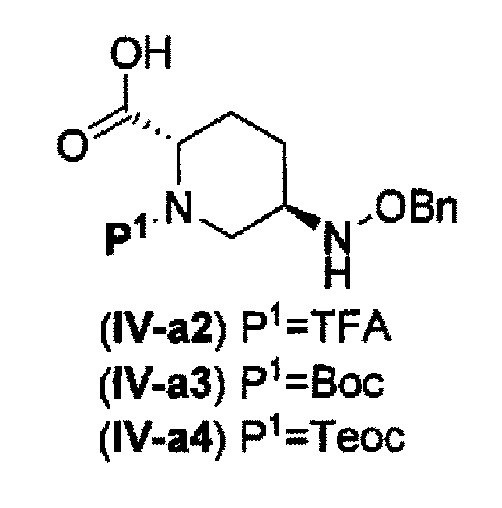
в указанной выше формуле (IV-a2), (IV-а3) или (IV-а4), ТФА является трифторацетилом, Вос является трет-бутоксикарбонилом, Теос является 2-триметилсилилэтоксикарбонилом и OBn является бензилокси,
сочетание соединения, представленного формулой (IV-a2) или (IV-a4) с трет-бутил 2-(аминоокси)этилкарбаматом с применением активного сложного эфира, активного амида или дегидратирующего конденсирующего агента, или
сочетание соединения, представленного формулой (IV-a3) с бензил 2-(аминоокси)-этилкарбаматом с применением активного сложного эфира, активного амида или дегидратирующего конденсирующего агента,
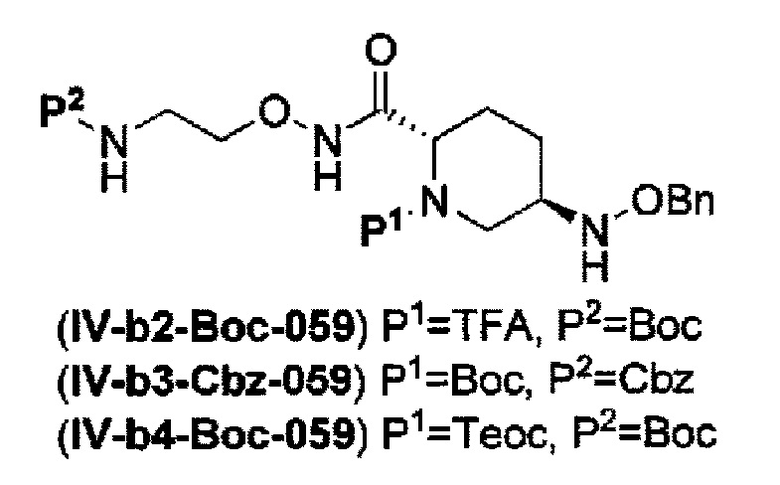
с получением соединения, представленного следующей формулой (IV-b2-Вос-059), (IV-b3-Cbz-059) или (IV-b4-Вoc-059):
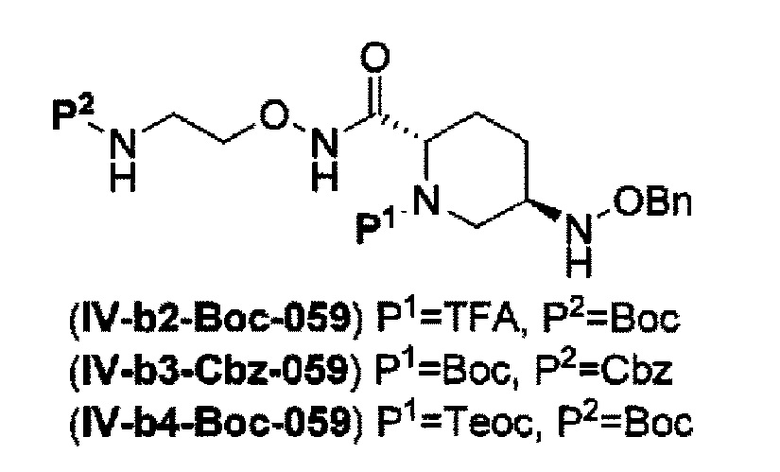
в указанной выше формуле (IV-b2-Вос-059), (IV-b3-Cbz-059) или (IV-b4-Вoc-059), ТФА является трифторацетилом, Вос является трет-бутоксикарбонилом, Cbz является бензилоксикарбонилом, Теос является 2-триметилсилилэтоксикарбонилом и OBn является бензилокси,
удаление трифторацетила соединения, представленного формулой (IV-b2-Вос-059) обработкой основанием с получением соединения, представленного следующей формулой (IV-с-Вос-059):
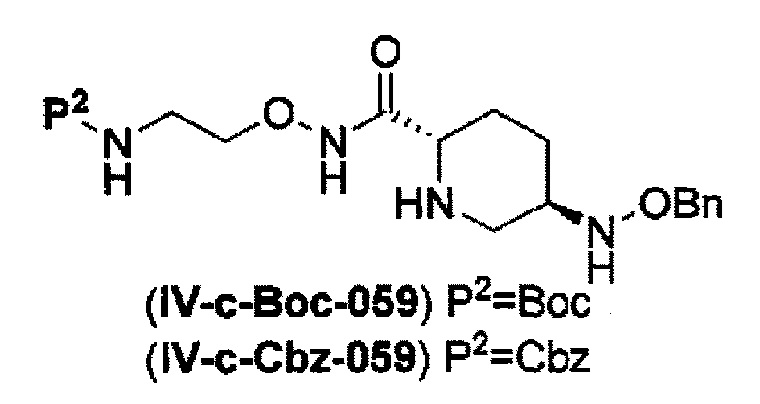
в указанной выше формуле (IV-с-Вос-059), Вос является трет-бутоксикарбонилом, Cbz является бензилоксикарбонилом и OBn является бензилокси,
удаление трет-бутоксикарбонила соединения, представленного формулой (IV-b3-CBZ-059) обработкой кислотой с получением соединения, представленного следующей формулой (IV-с-Cbz-059), или
удаление 2-триметилсилилэтоксикарбонила соединения, представленного формулой (IV-b4-Вос-059) фторидом с получением соединения, представленного следующей формулой (IV-с-Вос-059),
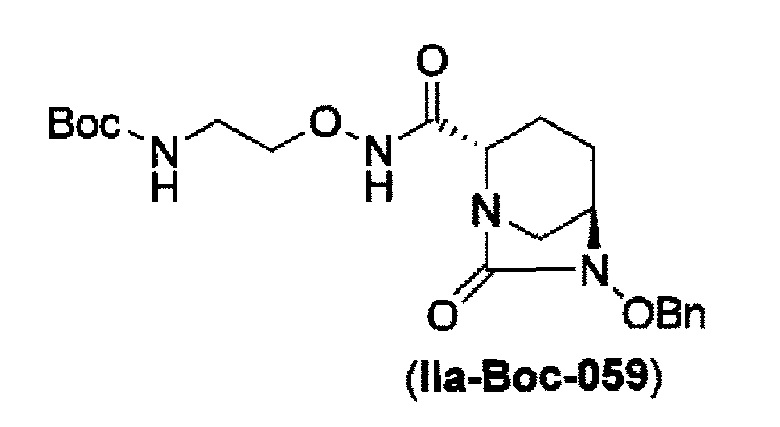
затем, после силилирования указанного выше (IV-с-Вос-059) или (IV-с-Cbz-059) в реакционной системе, реакция формирования внутримолекулярной мочевины с получением соединения, представленного следующей формулой (IIa-Вос-059) или (IIa-Cbz-059):
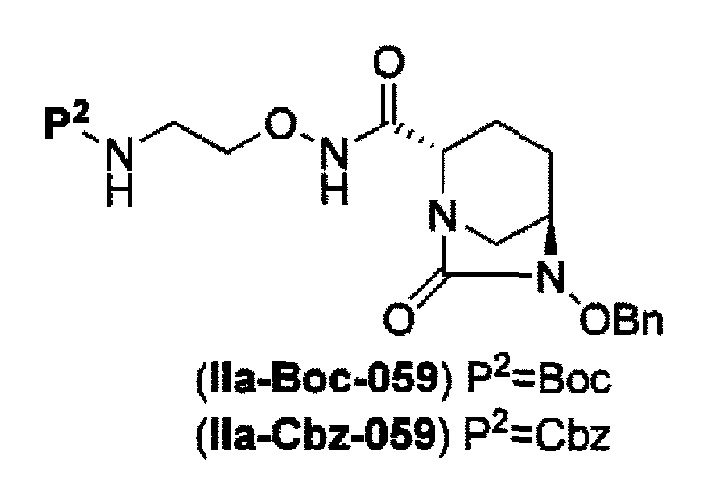
в указанной выше формуле (IIa-Вос-059) или (IIa-Cbz-059) Вос является трет-бутоксикарбонилом, Cbz является бензилоксикарбонилом и OBn является бензилокси,
удаление бензила из бензилокси в положении 6 соединения, представленного формулой (IIa-Вос-059) с применением катализатора гидрогенолиза в атмосфере водорода, или
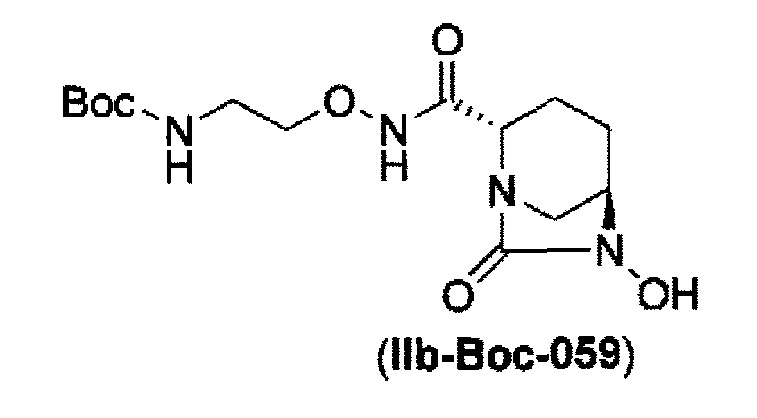
удаление бензила из бензилокси в положении 6 соединения, представленного формулой (IIa-Cbz-059) с применением катализатора гидрогенолиза в атмосфере водорода, и одновременное трет-бутоксикарбонилирование его в присутствии ди-трет-бутоксидикарбоната с получением соединения, представленного следующей формулой (IIb-Вос-059):
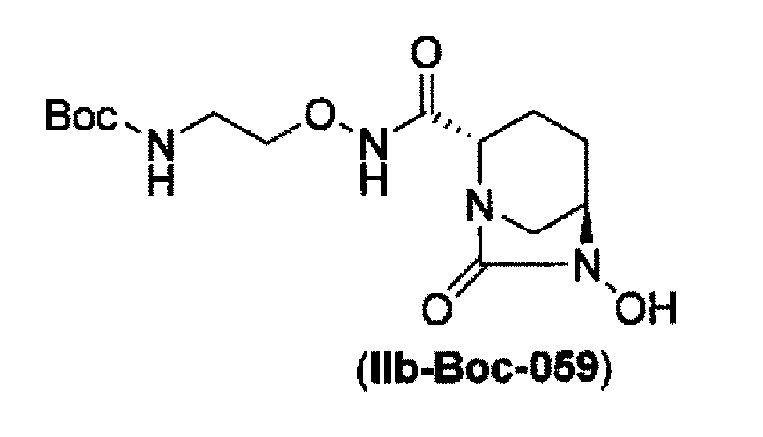
в указанной выше формуле (IIb-Вос-059) Вос является трет-бутоксикарбонилом,
сульфирование гидроксильной группы в положении 6 с получением соединения, представленного следующей формулой (III-Вос-059):
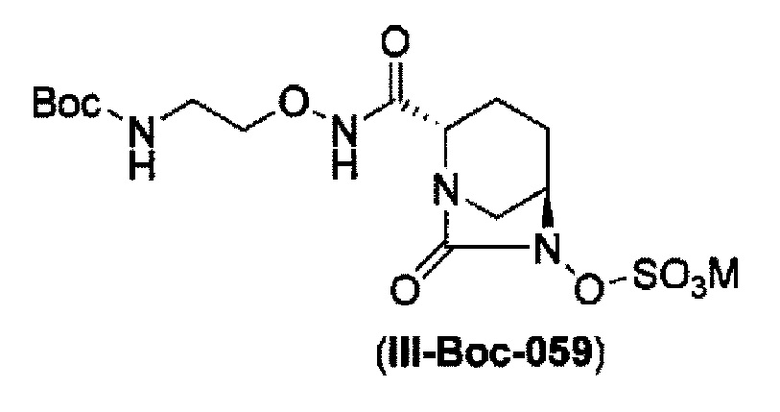
в указанной выше формуле (III-Вос-059), Вос является трет-бутоксикарбонилом и М является Н, пиридинием, натрием или тетрабутиламмонием,
и снятие защиты с трет-бутоксикарбонила обработкой кислотой с получением соединения, представленного следующей формулой (III-059).
Кроме того, в соответствии с другим аспектом настоящего изобретения, оно относится к способу получения трет-бутил {2-[({[(2S,5R)-6-бензилокси-7-оксо-1,6-диазабицикло[3.2.1]окто-2-ил]карбонил}амино)окси]этил}карбамата или бензил {2-[({[(2S,5R)-6-бензилокси-7-оксо-1,6-диазабицикло[3.2.1]окто-2-ил]карбонил}амино)окси]этил}карбамата, представленных следующими формулами (IIа-Вос-059) или (IIa-Cbz-059):
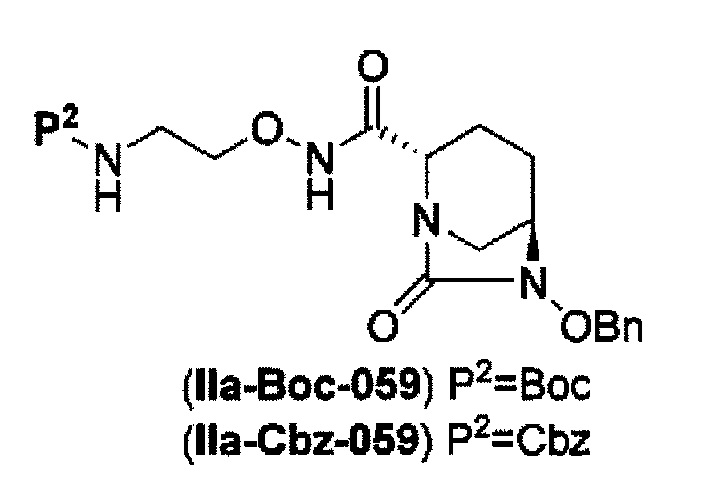
в указанных выше формулах (IIa-Вос-059) или (IIa-Cbz-059), Вос является трет-бутоксикарбонилом, Cbz является бензилоксикарбонилом и OBn является бензилокси,
который включает
(21) среди соединений, представленных следующими формулами (IV-a2), (IV-а3) и (IV-a4):
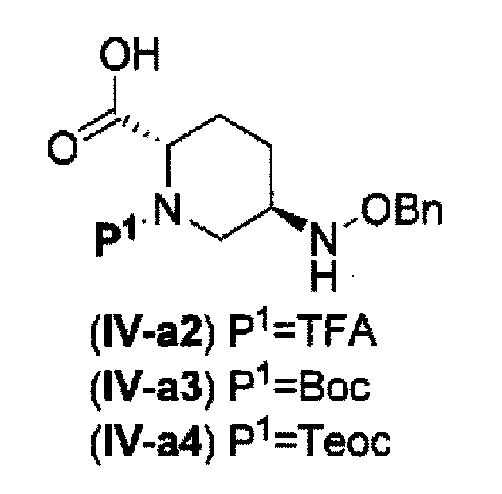
в указанных выше формулах (IV-a2), (IV-а3) и (IV-a4), ТФА является трифторацетилом, Вос является трет-бутоксикарбонилом, Теос является 2-триметилсилилэтоксикарбонилом и OBn является бензилокси,
сочетание каждого из соединений, представленных формулами (IV-a2) и (IV-a4) с применением трет-бутил 2-(аминоокси)этилкарбамата, гидрохлорида 1-этил-3-(3-диметиламинопропил)карбодиимида и моногидрата 1-гидроксибензотриазола в сочетании,
сочетание соединения, представленного формулой (IV-а3), с применением бензил 2-(аминоокси)этилкарбамата, гидрохлорида 1-этил-3-(3-диметиламинопропил)карбодиимида и моногидрата 1-гидроксибензотриазола в сочетании,
с получением соединения, представленного указанной выше формулой (IV-b2-Вос-059), (IV-b3-Cbz-059) или (IV-b4-Вос-059):
в указанных выше формулах (IV-b2-Вос-059), (IV-b3-Cbz-059) или (IV-b4-Вос-059), TFA является трифторацетилом, Вос является трет-бутоксикарбонилом, Cbz является бензилоксикарлонилом, Теос является 2-триметилсилилэтоксикарбонилом и OBn является бензилокси,
удаление трифторацетила из соединения, представленного формулой (IV-b2-Вос-059) с применением основания, выбранного из гидроксида лития, гидроксида натрия и гидроксида калия, с получением соединения, представленного указанной выше формулой (IV-c-Вос-059):
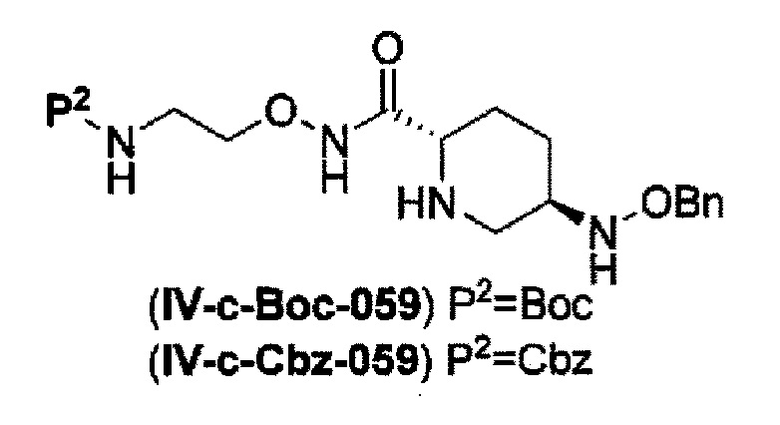
в указанной выше формуле (IV-c-Вос-059) Вос является трет-бутоксикарбонилом, Cbz является бензилоксикарлонилом, и OBn является бензилокси,
удаление трет-бутоксикарбонила из соединения, представленного формулой (IV-b3-Cbz-059) с применением кислоты, выбранной из хлористоводородной кислоты, серной кислоты, метансульфоновой кислоты и трифторуксусной кислоты с получением соединения, представленного указанной выше формулой (IV-c-Cbz-059), или
удаление 2-триметилсилилэтоксикарбонила из соединения, представленного формулой (IV-b4-Вос-059) с применением фторида тетрабутиламмония с получением соединения, представленного указанной выше формулой (IV-c-Вос-059), и
силилирование соединения, представленного формулой (IV-b4-Вос-059) или (IV-c-Cbz-059) с применением хлортриалкилсилана в реакционной системе с последующим образованием внутримолекулярной мочевины с применением фосгена или дифосгена с получением соединения, представленного формулой (IIа-Вос-059) или (IIa-Cbz-059).
В соответствии с другим аспектом настоящего изобретения, оно относится к способу получения трет-бутил {2-[({[(2S,5R)-6-бензилокси-7-оксо-1,6-диазабицикло[3.2.1]окто-2-ил]карбонил}амино)окси]этил}карбамата или бензил {2-[({[(2S,5R)-6-бензилокси-7-оксо-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}амино)окси]этил}карбамата, представленного следующей формулой (IIа-Вос-059) или (IIa-Cbz-059):

в указанной выше формуле (IIа-Вос-059) или (IIa-Cbz-059) Вос является трет-бутоксикарбонилом, Cbz является бензилоксикарлонилом, и OBn является бензилокси,
который включает
(22) силилирование соединения, представленного следующей формулой (IV-c-Вос-059) или (IV-c-Cbz-059):
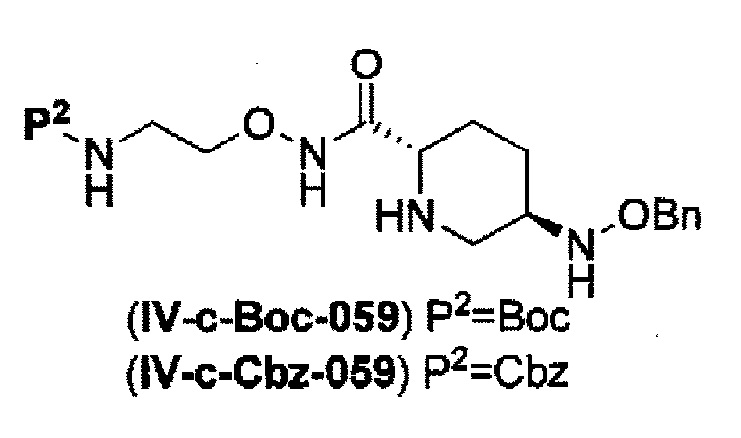
в указанной выше формуле (IV-c-Вос-059) или (IV-c-Cbz-059) Вос является трет-бутоксикарбонилом, Cbz является бензилоксикарлонилом, и OBn является бензилокси,
с применением хлортриметилсилана в реакционной системе с последующим образованием внутримолекулярной мочевины с применением фосгена или дифосгена с получением соединения, представленного формулой (IIа-Вос-059) или (IIa-Cbz-059).
В соответствии с другим аспектом настоящего изобретения, оно относится к способу получения (2S,5R)-N-(2-аминоэтокси)-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбоксамида, представленного следующей формулой (III-059):
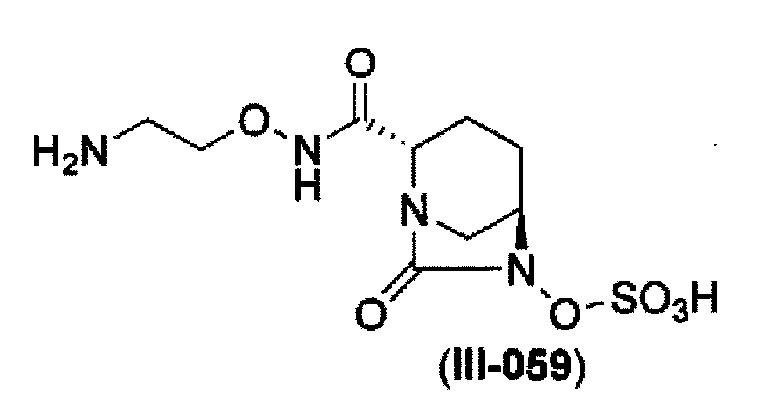
который включает
(23) среди соединений, представленных следующими формулами (IIa-Вос-059) и (IIa-Cbz-059):
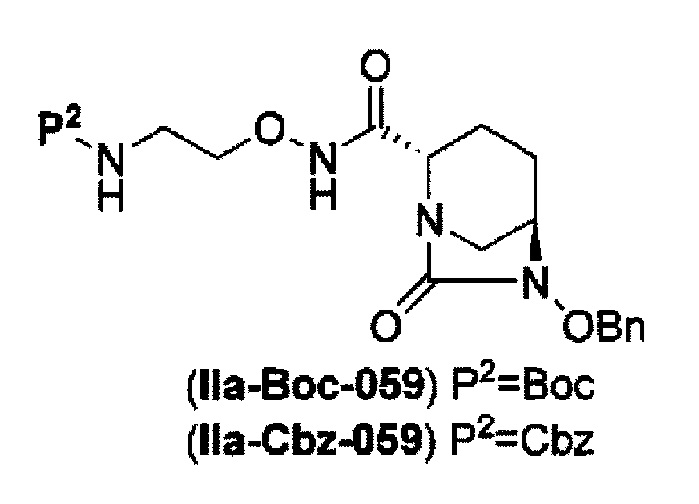
в указанной выше формуле (IIa-Вос-059) и (IIa-Cbz-059), Вос является трет-бутоксикарбонилом, Cbz является бензилоксикарлонилом, и OBn является бензилокси,
удаление бензила из бензилокси в положении 6 соединения, представленного формулой (IIa-Вос-059) с применением палладия на угле в атмосфере водорода, или удаление бензила из бензилокси в положении 6 соединения, представленного формулой (IIa-Cbz-059) с применением палладия на угле в атмосфере водорода в присутствии ди-трет-бутоксидикарбоната, и одновременное трет-бутоксикарбонилирование с получением соединения, представленного формулой (IIa-Вос-059):
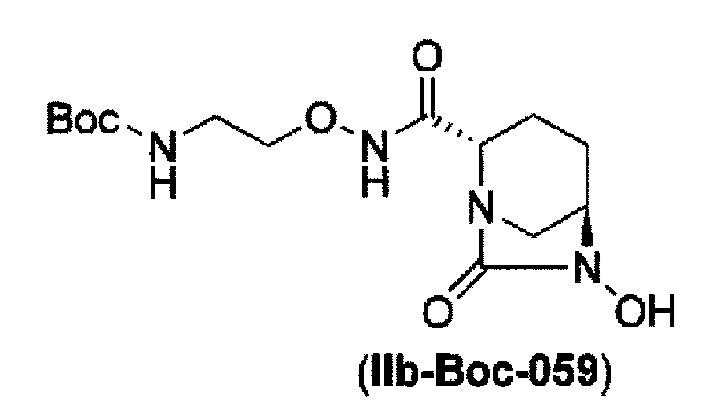
в указанной выше формуле (IIb-Вос-059), Вос является трет-бутоксикарбонилом,
сульфирование гидроксильной группы в положении 6 с применением комплекса триоксид серы-пиридин в присутствии пиридина, 2-пиколина или 2,6-лутидина, с получением соединения, представленного формулой (IIIb-Вос-059):
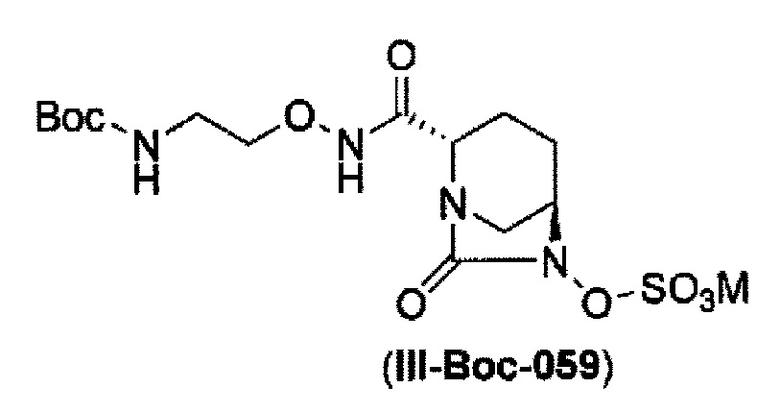
в указанной выше формуле (III-Вос-059), Вос является трет-бутоксикарбонилом и М является Н, придинием, натрием или тетрабутиламмонием,
и снятие защиты трет-бутоксикарбонила кислотой, выбранной из хлористоводородной кислоты, серной кислоты, метансульфоновой кислоты, трифторуксусной кислоты и тетрафторборной кислоты с получением соединения, представленного формулой (III-059).
Кроме того, в соответствии с другим аспектом настоящего изобретения, оно относится к способу получения трет-бутил {2-[({[(2S,5R)-6-бензилокси-7-оксо-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}амино)окси]этил}карбамата, представленного следующей формулой (IIa-Вос-059):
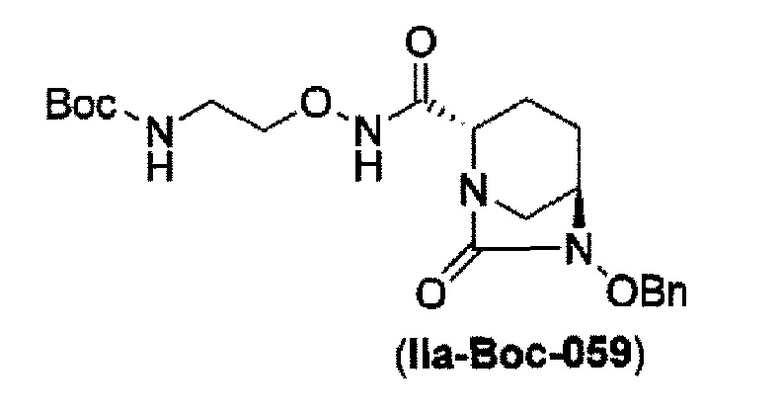
в указанной выше формуле (IIа-Вос-059), Вос является трет-бутоксикарбонилом и OBn является бензилокси,
который включает
(24) силилирование соединения, представленного следующей формулой (IV-c-Вос-059):
в указанной выше формуле (IV-c-Вос-059), Вос является трет-бутоксикарбонилом и OBn является бензилокси,
с применением триэтиламина и хлортриметилсилана в реакционной системе с последующим образованием внутримолекулярной мочевины с применением фосгена или дифосгена с каталитическим количеством 4-диметиламинпиридина с получением соединения, представленного формулой (IIa-Вос-059).
Кроме того, в соответствии с другим аспектом настоящего изобретения, оно относится к способу получения (2S,5R)-N-(2-аминоэтокси)-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбоксамида, представленного следующей формулой (III-059):
который включает
(25) удаление бензила из бензилокси в положении 6 соединения, представленного формулой (IIa-Вос-059):
в указанной выше формуле (IIа-Вос-059) Вос является трет-бутоксикарбонилом и OBn является бензилокси,
с применением палладия-на-угле в атмосфере водорода с получением соединения, представленного формулой (IIb-Вос-059):
в указанной выше формуле (IIb-Вос-059) Вос является трет-бутоксикарбонилом,
сульфатирование гидроксильной группы в положении 6 с применением комплекса триоксид серы - пиридин в присутствии пиридина, 2-пиколина или 2,6-лутидина с получением соединения, представленного формулой (III-Вос-059):
в указанной выше формуле (III-Вос-059), Вос является трет-бутоксикарбонилом и М является Н, придинием, натрием или тетрабутиламмонием,
и снятие защиты трет-бутоксикарбонила кислотой, выбранной из хлористоводородной кислоты, серной кислоты, метансульфоновой кислоты, трифторуксусной кислоты и тетрафторборной кислоты с получением соединения, представленного формулой (III-059).
Кроме того, в соответствии с другим аспектом настоящего изобретения, оно относится к способу получения (2S,5R)-метил 5-(бензилоксиамино)пиперидин-2-карбоксилата или его гидрохлорида, который включает (26) подвергание новой (2S,5S)-5-гидроксипиперидин-2-карбоновой кислоты или ее гидрохлорида метильной этерификации, трифторацетилированию, бензилоксиаминированию С5 гидроксильной группы и удаление трифторацетила, где каждая стадия проходит без очистки, с последующей кристаллизацией в виде гидрохлорида, выделяя и очищая (2S,5R)-метил 5-(бензилоксиамино)пиперидин-2-карбоксилат или его гидрохлорид.
Еще один аспект настоящего изобретения относится к (27) соединениям, представленным формулами:
в представленной выше формуле, ТФА является трифторацетилом, ОМе является метокси, Вос является трет-бутоксикарбонилом, Теос является 2-триметилсилилэтоксикарбонилом и OBn является бензилокси.
ЭФФЕКТЫ ИЗОБРЕТЕНИЯ
Новые производные диазабициклооктана, представленные указанной выше формулой (I), представленные в данном изобретении, обладают сильным ингибирующим действием против различных видов β-лактамаз. В частности, они обладают сильным ингибирующим действием против класса А, класса C и класса D β-лактамаз. Более конкретно, они обладают сильным ингибирующим действием против класса С β-лактамазы, β-лактамазы расширенного спектра (БЛРС) и класса KPC-2 β-лактамазы, и антимикробное действие существующего β-лактамового антибиотика против бактерий, производящих эти β-лактамазы, устойчивые к β-лактамовому антибиотику, может быть в значительной степени восстановлено в сочетании с соединением в соответствии с данным изобретением.
Кроме того, способ получения соединения, представленного следующей формулой (II):

в приведенной выше формуле (II), Rc является С1-6 алкилом или гетероциклилом; В является NH или NC1-6 алкилом; С является бензилом, Н или SO3М, где М является Н, неорганическим катионом или органическим катионом; Rc может быть модифицирован от 0 до 4 заместителями Fn1, где заместитель Fn1 может быть далее замещен; Fn1 является С1-6 алкилом, O= или Rg-(CH2)0-3-, где Rg является гетероциклилом, фенилом, гетероарилом, ацилом, RdO2S-, Re(Rf)N-, Re(Rf)NCO-, ReO-, ReOCO- или защитной группой, где Rd представляет С1-6 алкил или МО-; Re и Rf каждый, независимо друг от друга, являются Н или С1-6 алкилом, а также между Ra и Rb, между Rc и В, и между Re и Rf может быть закрыто связыванием с получением гетероциклила, имеющего, по крайней мере, один атом азота,
которое включено в соединение формулы (I), представленный данным изобретением, является способом получения, который может быть очень полезным в качестве коммерческого способа получения.
КРАТКОЕ ОПИСАНИЕ ФИГУР
На фиг. 1 показано антибактериальное действие к 5 штаммам KPC-2 или 3 штаммам-продуцентам K. pneumoniae.
На фиг. 2 показано антибактериальное действие к 5 штаммам конститутивной экспрессии AmpC, P. aeruginosa.
На фиг. 3 показано антибактериальное действие к 5 штаммам конститутивной экспрессии AmpC, Enterobacteriaceae.
На фиг. 4 показано антибактериальное действие к 5 штаммам IMP типа штаммов, производящих металло-β-лактамазу, Enterobacteriaceae.
На фиг. 5 показано антибактериальное действие к 5 штаммам, производящим CTX-M-15 (БЛРС), E. coli.
ЛУЧШИЙ СПОСОБ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
Как описано выше, в данном изобретении представлено новое производное диазабициклооктана, представленное следующей формулой (I), его фармацевтически приемлемая соль или сольват, и ингибитор β-лактамазы, включающий соединение формулы (I):
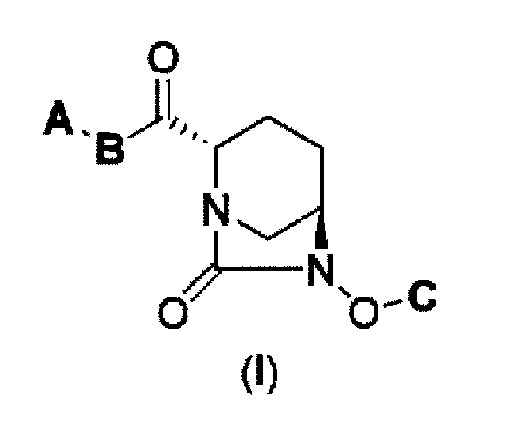
в представленной выше формуле (I) А является Ra(Rb)N- или RcO-; B является NH или NC1-6 алкилом; С является бензилом, Н или SO3M, где М является Н, неорганическим катионом или органическим катионом; Ra и Rb каждый, независимо друг от друга, являются Н, С1-6 алкилом или ацилом; Rc является С1-6 алкилом или гетероциклилом; А может быть модифицирован от 0 до 4 заместителями Fn1, где заместитель Fn1 может быть далее замещен; Fn1 является С1-6 алкилом, O= или Rg-(CH2)0-3-, где Rg является гетероциклилом, фенилом, гетероарилом, ацилом, RdO2S-, Re(Rf)N-, Re(Rf)NCO-, ReO-, ReOCO- или защитной группой, где Rd представляет С1-6 алкил или МО-; Re и Rf каждый, независимо друг от друга, являются Н или С1-6 алкилом, а также между Ra и Rb, между Rc и В, и между Re и Rf может быть закрыто связыванием с получением гетероциклила, имеющего, по крайней мере, один атом азота.
Далее новое производное диазабициклооктана, представленное формулой (I) в соответствии с данным изобретением и способ его получения, ингибитор β-лактамазы, и применение соединения в соответствии с данным изобретением для лечения бактериальной инфекции, объясняется более подробно, но настоящее изобретение не ограничено объемом представленных конкретных примеров.
Термин "соль", применяемый в данном описании, означает фармацевтически приемлемую соль, и включает основно-аддитивную соль, включающую неорганическое основание или органическое основание, и кислотно-аддитивную соль, включающую неорганическую кислоту и органическую кислоту.
Термин "неорганический катион" относится к щелочному металлу или щелочноземельному металлу, и т.д., и термин "органический катион" относится к аммониевой соли, образованной из моно- или тризамещенного амина, и четвертичной аммониевой соли, полученной из тетра-замещенного амина или замещенного гетероароматического кольца.
Если "М" является Н и соединение в соответствии с данным изобретением имеет аминогруппу, циклические амины или ароматические амины, которые могут быть протонированы в молекуле, аминогруппа, циклические амины или ароматические амины в молекуле ведут себя как протонированная аммониевая соль, и соединение может принимать форму внутренней соли, которая также рассматривается как часть соединения в соответствии с данным изобретением. Далее, если "М" является органическим катионом и присутствует в молекуле соединения в соответствии с данным изобретением в виде четвертичной аммониевой соли, оно также может иметь форму внутренней соли, которая также рассматривается как часть соединения в соответствии с данным изобретением.
Термин "модифицированный" означает замену Н в А или заместителе Fn1 и связывается с или заместителем Fn1.
Фразы "А может быть модифицирован от 0 до 4 заместителями Fn1, где заместитель Fn1 может быть далее замещен" означают, что Fn1, который модифицирует A-(Fn1)0-4, А-(Fn1)(Fn1)0-3, А-(Fn1)2(Fn1)0-2 и А-(Fn1)3(Fn1)0-1, и т.д.
В качестве конкретных примеров "защитной группы" могут быть указаны триалкилсилил и защитная группа карбаматного типа, предпочтительно, триизопропилсилил, трет-бутилдиметилсилил, трет-бутоксикарбонил или бензилоксикарбонил, которые являются защитной группой для аминогруппы и гидроксильной группы, описанной в Protective Groups in Organic Synthesis (Т. W. Greene et al., Wiley, New York (1999)).
Растворителем, содержащимся в «сольвате», может быть вода, метанол, этанол, изопропанол, ацетон и метилэтилкетон, более предпочтительно, вода.
Термин "С1-6 алкил" означает алкильную группу, имеющую от 1 до 6 атомов углерода, которая может быть прямой, разветвленной или циклической.
Термин "ацил" означает формил, бензоил, фенилацетил, С1-6 алкилкарбонил, гетероциклилкарбонил и гетероарилкарбонил.
Термин "гетероциклил" означает 3-7 членное моноциклическое насыщенное гетероциклическое кольцо или неароматическое кольцо, содержащее от 1 до 3 атомов азота, атомов кислорода и/или атомов серы в общем.
Термин «гетероарил» означает 5-6 членное моноциклическое гетероароматическое кольцо, имеющее от 1 до 4 атомов азота, атомов кислорода и/или атомов серы в общем.
Термины "Ra(Rb)N-" и "Re(Rf)N-" означают аминогруппу, замещенную Ra и Rb, или Re и Rf.
Термин "RсO-" означает окси, связанный с Rc, т.е. алкокси или гетероциклилокси, и термин "ReO-" означает окси, связанный с Re, т.е. алкокси или гидрокси.
Термин "RdO2S-" означает сульфонил, связанный с Рd.
Термин "Re(Rf)NCO-" означает карбонил, связанный с Re(Rf)N-.
Термин "ReOCO-" означает карбонил, связанный с ReO-.
Термин "O=" означает оксогруппу.
Конкретные примеры оснований, которые образуют "основно-аддитивные соли», могут включать гидроксид лития, гидроксид натрия, гидроксид калия, гидрокарбонат натрия, гидрокарбонат калия, карбонат натрия, карбонат калия, карбонат лития, карбонат кальция, ацетат натрия, ацетат калия, цитрат тринатрия, дигидроцитрат натрия, цитрат трикалия, дигидроцитрат калия, аммиак, метиламин, этиламин, диметиламин, диэтиламин, триметиламин, триэтиламин, N-метилморфолин, этаноламин и триэтаноламин и т. д., предпочтительно, гидроксид натрия, гидрокарбонат натрия, карбонат натрия, ацетат натрия, цитрат тринатрия, дигидроцитрат натрия и триэтаноламин, и т.д.
Конкретные примеры кислот, которые образуют «кислотно-аддитивные соли" включают хлористоводородную кислоту, бромистоводородную кислоту, йодистоводородную кислоту, серную кислоту, серную кислоту, полусерную кислоту, тиоциановую кислоту, уксусную кислоту, масляную кислоту, пропионовую кислоту, циклопентанпропионовую кислоту, пивалиновую кислоту, гептановую кислоту, гексановую кислоту, 3-фенилпропионовую кислоту, ундекановую кислоту, молочную кислоту, щавелевую кислоту, малоновую кислоту, янтарную кислоту, лимонную кислоту, винную кислоту, яблочную кислоту, малеиновую кислоту, фумаровую кислоту, адипиновую кислоту, альгиновую кислоту, аспарагиновую кислоту, бензойную кислоту, диглюконовую кислоту, никотиновую кислоту, памовую кислоту, пектиновую кислоту, глюкогептоновую кислоту, глицерофосфорную кислоту, бензолсульфоновую кислоту, тозиловую кислоту, метансульфоновую кислоту, этансульфоновую кислоту, камфорсульфоновую кислоту, додецилсерную кислоту, 2-гидроксиэтансульфоновую кислоту и 2-нафталинсульфоновую кислоту, и т.д., предпочтительно, хлористоводородную кислоту, серную кислоту, уксусную кислоту, молочную кислоту, яблочную кислоту, лимонную кислоту, метансульфоновую кислоту и тозиловую кислоту, и т.д.
Конкретные примеры "неорганического катиона" включают натрий, калий, литий, кальций и т.д., предпочтительно, натрий и калий.
Конкретные примеры "органического катиона" включают метиламмоний, этиламмоний, диметиламмоний, диэтиламмоний, диизопропиламмоний, пиридиний, триметиламмоний, триэтиламмоний, циклогексиламмоний, дициклогексиламмоний, диизопропилэтиламмоний, пиридиний, тетраметиламмоний, тетраэтиламмоний, тетрабутиламмоний, триэтилбензиламмоний, N,N'-диметилимидазолий, N-метилпиридиний и т.д., предпочтительно, пиридиний и тетрабутиламмоний.
Конкретные примеры "C1-6 алкила" включают С1-6 алкильную группу, такую как, метил, этил, пропил, изопропил, бутил, трет-бутил, втор-бутил, изобутил, пентил, 1,1-диметилпропил, 1,2-диметилпропил, неопентил, 1-метилбутил, 2-метилбутил, изопентил и гексил, С3-6 циклоалкильную группу, такую как циклопропил, циклобутил, циклопентил и циклогексил, или метильную группу, замещенную С3-5 циклоалкильной группой, такой как циклопропилметил, циклобутилметил, циклопентилметил, предпочтительно метил, этил, пропил, изопропил, бутил, трет-бутил, циклопропил, циклобутил, циклопропилметил и циклобутилметил.
Конкретные примеры "гетероциклила" включают группу, полученную из азиридина, оксирана, тиирана, азетидина, оксетана, тиетана, пирролидина, тетрагидрофурана, тетрагидротиофена, имидазолидина, оксазолидина, тиазолидина, пиразолидина, пиперидина, тетрагидро-2Н-пирана, тетрагидро-2Н-тиопирана, гексагидропиридазина, пиперазина, морфолина, тиоморфолина, 1,2-оксазолидина, 1,2-оксазинана, 1,4-диоксана, 1,2-тиазинана, азепана, оксепана, тиепана, 1,4-диазепана, 1,4-оксазепана, 1,4-тиазепана, 1,2,5-триазепана, 1,4,5-оксадиазепана, 1,2,5-оксадиазепана, 1,4,5-тиадиазепана, 1,5,2-диоксазепана, 1,5,2-оксатиазепана, 3,4-дигидро-2Н-пиррола, 4,5-дигидро-1Н-пиразола, 4,5-дигидро-1Н-имидазола, 4,5-дигидро-1,2-оксазола, 4,5-дигидро-1,3-оксазола, 4,5-дигидро-1,3-тиазола, 2,3,4,5-тетрагидропиридина, 1,2,3,6 тетрагидропиразина, 5,6-дигидро-4Н-1,2-оксазина, от 3,6-дигидро--2-H-1,4-оксазина и т.д., предпочтительно, группу, полученную из азетидина, пирролидина, тетрагидрофурана, пиперидина, тетрагидро-2Н-пирана, имидазолидина, оксазолидина, 1,2-оксазолидина, гексагидропиридазина, пиперазина, морфолина, 1,2-оксазинана, азепана, 1,4-диазепана и 1,2-оксазепана.
Конкретные примеры защитной группы для "гетероциклила", в которой "связан трет-бутоксикарбонил или бензилоксикарбонил" включают группу, полученную из 1-(трет-бутоксикарбонил)азетидина, 1-(трет-бутоксикарбонил)пирролидина, 1,3-ди(трет-бутоксикарбонил)имидазолидина, 3-(трет-бутоксикарбонил)оксазолидина, 1,3-ди(трет-бутоксикарбонил)пиразолидина, 1-(трет-бутоксикарбонил)пиперидина, 1,2-ди(трет-бутоксикарбонил)гексагидропиридазина, 1,4-ди(трет-бутоксикарбонил)пиперазина, 4-(трет-бутоксикарбонил)морфолина, 2-(трет-бутоксикарбонил)-1,2-оксазолидина, 2-(трет-бутоксикарбонил)-1,2-оксазинана, 1-(трет-бутоксикарбонил)азепана, 1,4-ди(трет-бутоксикарбонил)-1,4-диазепана, 1-(бензилоксикарбонил)азетидина, 1-(бензилоксикарбонил)пирролидина, 1,3-ди(бензилоксикарбонил)имидазолидина, 3-(бензилоксикарбонил)оксазолидина, 1,3-ди(бензилоксикарбонил)пиразолидина, 1-(бензилоксикарбонил)пиперидина, 1,2-ди(бензилоксикарбонил)гексагидропиридазина, 1,4-ди(бензилоксикарбонил)пиперазина, 4-(бензилоксикарбонил)морфолина, 2-(бензилоксикарбонил)-1,2-оксазолидина, 2-(бензилоксикарбонил)-1,2-оксазинана, 1-(бензилоксикарбонил)азепана, 1,4-ди(бензилоксикарбонил)-1,4-диазепана и т.д., и, конечно, конкретные примеры, имеющие указанную выше защитную группу, включены в конкретные примеры, имеющие гетероциклил, которые описаны ниже.
Конкретные примеры "гетероарила" включают группу, полученную из пиррола, фурана, тиофена, пиразола, имидазола, 1,2-оксазола, 1,3-оксазола, 1,2-тиазола, 1,3-тиазола, 1,2,3-триазола, 1,2,4-триазола, 1,2,3-оксадиазола, 1,3,4-оксадиазола, 1,2,3-тиадиазола, 1,3,4-тиадиазола, тетразола, пиридина, пиридазина, пиримидина, пиразина, 1,2,4-триазина, 1,3,5-триазина и т.д., предпочтительно группу, полученную из пиррола, фурана, имидазола, оксазола и пиридина.
Конкретные примеры защитной группы для "гетероарила," с которым "связан трет-бутоксикарбонил или бензилоксикарбонил" включают группу, полученную из 1-трет-бутоксикарбонилпиррола, 1-трет-бутоксикарбонилпиразола, 1-трет-бутоксикарбонилимидазола, 1-трет-бутоксикарбонил-1,2,3-триазола, 1-трет-бутоксикарбонил-1,2,4-триазола, 1-трет-бутоксикарбонилтетразола, 1-бензилоксикарбонилпиррола, 1-бензилоксикарбонилпиразола, 1-бензилоксикарбонилимидазола, 1-бензилоксикарбонил-1,2,3-триазола, 1-бензилоксикарбонил-1,2,4-триазола, 1-бензилоксикарбонилтетразола и т.д., и, конечно, конкретные примеры, имеющие указанную выше защитную группу, включены в конкретные примеры, имеющие гетероарил, которые описаны ниже.
Конкретные примеры "C1-6 алкилкарбонила" включают ацетил, пропаноил, бутаноил, изобутаноил, пентаноил, 2,2-диметилпропаноил, 2-метилбутаноил, 3-метилбутаноил, гексаноил, циклопропанкарбонил, циклобутанкарбонил, циклопентанкарбонил, циклогексанкарбонил, 2-циклопропилацетил, 2-циклобутилацетил, 2-циклопентилацетил, и т.д.
Конкретные примеры "гетероциклилкарбонила" включают азиридин-2-ил-карбонил, оксиран-2-илкарбонил, тииран-2-илкарбонил, азетидин-2-илкарбонил, азетидин-3-илкарбонил, оксетан-2-илкарбонил, оксетан-3-илкарбонил, тиетан-2-илкарбонил, тиетан-3-илкарбонил, пирролидин-2-илкарбонил, пирролидин-3-илкарбонил, тетрагидрофуран-2-илкарбонил, тетрагидрофуран-3-илкарбонил, тетрагидротиофен-2-илкарбонил, тетрагидротиофен-3-илкарбонил, пиразолидин-3-илкарбонил, пиразолидин-4-илкарбонил, 1,2-оксазолидин-3-илкарбонил, 1,2-оксазолидин-4-илкарбонил, 1,2-оксазолидин-5-илкарбонил, пиперидин-2-ил-карбонил, пиперидин-3-илкарбонил, пиперидин-4-илкарбонил, тетрагидро-2Н-пиран-2-илкарбонил, тетрагидро-2H-пиран-3-илкарбонил, тетрагидро-2Н-пиран-4-илкарбонил, тетрагидро-2Н-тиопиран-2-илкарбонил, тетрагидро-2Н-тиопиран-3-илкарбонил, тетрагидро-2H-тиопиран-4-илкарбонил, гексагидропиридазин-3-илкарбонил, гексагидропиридазин-4-илкарбонил, пиперазин-2-илкарбонил, морфолин-2-илкарбонил, морфолин-3-илкарбонил, тио-морфолин-2-илкарбонил, тиоморфолин-3-илкарбонил, 1,2-оксазинан-3-илкарбонил, 1,2-оксазинан-4-илкарбонил, 1,2-оксазинан-5-илкарбонил, 1,2-оксазинан-6-илкарбонил, 1,4-диоксан-2-илкарбонил, 1,2-тиазинан-3-илкарбонил, 1,2-тиазинан-4-илкарбонил, 1,2-тиазинан-5-илкарбонил, 1,2-тиазинан-6-илкарбонил, азепан-2-илкарбонил, азепан-3-илкарбонил, азепан-4-илкарбонил, оксепан-2-илкарбонил, оксепан-3-илкарбонил, оксепан-4-илкарбонил, тиепан-2-илкарбонил, тиепан-3-илкарбонил, тиепан-4-илкарбонил, 1,4-диазепан-2-илкарбонил, 1,4-диазепан-5-илкарбонил, 1,4-диазепан-6-илкарбонил, 1,4-оксазепан-2-илкарбонил, 1,4-оксазепан-3-илкарбонил, 1,4-оксазепан-5-илкарбонил, 1,4-оксазепан-6-илкарбонил, 1,4-оксазепан-7-илкарбонил, 1,4-тиазепан-2-илкарбонил, 1,4-тиазепан-3-илкарбонил, 1,4-тиазепан-5-илкарбонил, 1,4-тиазепан-6-илкарбонил, 1,4-тиазепан-7-илкарбонил, 1,2,5-триазепан-3-илкарбонил, 1,2,5-триазепан-4-илкарбонил, 1,4,5-оксадиазепан-2-илкарбонил, 1,4,5-оксадиазепан-3-илкарбонил, 1,2,5-оксадиазепан-3-илкарбонил, 1,2,5-оксадиазепан-4-илкарбонил, 1,2,5-оксадиазепан-6-илкарбонил, 1,2,5-оксадиазепан-7-илкарбонил, 1,4,5-тиадиазепан-2-илкарбонил, 1,4,5-тиадиазепан-3-илкарбонил, 1,5,2-диоксазепан-3-илкарбонил, 1,5,2-диоксазепан-4-илкарбонил, 1,5,2-диоксазепан-6-илкарбонил, 1,5,2-диоксазепан-7-илкарбонил, 1,5,2-оксатиазепан-3-илкарбонил, 1,5,2-оксатиазепан-4-илкарбонил, 1,5,2-оксатиазепан-6-илкарбонил, 1,5,2-оксатиазепан-7-илкарбонил и т.д. Конечно, конкретные примеры, включают такие, к которым трет-бутоксикарбонил или бензилоксикарбонил присоединен в качестве защитной группы.
Конкретные примеры "гетероарилкарбонила" включают пиррол-2-илкарбонил, пиррол-3-илкарбонил, фуран-2-илкарбонил, фуран-3-илкарбонил, тиофен-2-илкарбонил, тиофен-3-илкарбонил, пиразол-3-илкарбонил, пиразол-4-илкарбонил, имидазол-2-илкарбонил, имидазол-4-илкарбонил, 1,2-оксазол-3-илкарбонил, 1,2-оксазол-4-ил-карбонил, 1,2-оксазол-5-илкарбонил, 1,3-оксазол-2-илкарбонил, 1,3-оксазол-4-илкарбонил, 1,3-оксазол-5-илкарбонил, 1,2-тиазол-3-илкарбонил, 1,2-тиазол-4-илкарбонил, 1,2-тиазол-5-илкарбонил, 1,3-тиазол-2-илкарбонил, 1,3-тиазол-4-илкарбонил, 1,3-тиазол-5-илкарбонил, 1,2,3-триазол-4-илкарбонил, 1,2,3-оксадиазол-4-илкарбонил, 1,2,3-оксадиазол-5-илкарбонил, 1,2,3-тиадиазол-4-илкарбонил, 1,2,3-тиадиазол-5-илкарбонил, 1,2,4-триазол-3-илкарбонил, 1,3,4-оксадиазол-2-илкарбонил, 1,3,4-тиадиазол-2-илкарбонил, тетразол-5-илкарбонил, пиридин-2-илкарбонил, пиридин-3-илкарбонил, пиридин-4-илкарбонил, пиридазин-3-илкарбонил, пиридазин-4-илкарбонил, пиримидин-2-илкарбонил, пиримидин-4-илкарбонил, пиримидин-5-илкарбонил, пиразин-2-илкарбонил, 1,2,4-триазин-3-илкарбонил, 1,2,4-триазин-5-илкарбонил, 1,2,4-триазин-6-илкарбонил, 1,3,5-триазин-2-илкарбонил и т.д. Конечно, конкретные примеры, включают такие, к которым трет-бутоксикарбонил или бензилоксикарбонил присоединен в качестве защитной группы.
К указанному выше "ацилу" добавляют формил, бензоил или фенилацетил, предпочтительно, формил, бензоил, ацетил, фенилацетил, пропаноил, бутаноил, 2-метилпропаноил, 2,2-диметилпропаноил, азетидин-2-илкарбонил, азетидин-3-илкарбонил, пирролидин-2-илкарбонил, пирролидин-3-илкарбонил, тетрагидрофуран-3-илкарбонил, пиперидин-2-илкарбонил, пиперидин-3-илкарбонил, пиперидин-4-илкарбонил, тетрагидро-2Н-пиран-2-илкарбонил, тетрагидро-2Н-пиран-3-илкарбонил, тетрагидро-2Н-пиран-4-илкарбонил, фуран-2-илкарбонил, 1,3-оксазол-2-илкарбонил, 1,3-оксазол-4-илкарбонил, пиридин-2-илкарбонил, пиридин-3-илкарбонил и пиридин-4-илкарбонил.
Конкретные примеры Re(RF)N- включают амино, метиламино, этиламино, пропиламино, изопропиламино, бутиламино, трет-бутиламино, втор-бутиламино, изо-бутиламино, пентиламино, 1,1-диметилпропиламино, 1,2-диметилпропиламино, неопентиламино, 1-метилбутиламино, 2-метилбутиламино, изопентиламино, гексиламино, N,N-диметиламино, N,N-диэтиламино, N,N-дипропиламино, N,N-ди(изопропил)амино, N,N-дибутиламино, N,N-ди(трет-бутил)амино, N,N-ди(втор-бутил)амино, N,N-ди(изобутил)амино, N,N-дипентиламино, N,N-ди(1,1-диметилпропил)амино, N,N-ди(1,2-диметилпропил)амино, N,N-ди(неопентил)амино, N,N-ди(1-метилбутил)амино, N,N-ди(2-метилбутил)амино, N,N-ди(изопентил)амино, N,N-ди(гексил)амино и т.д., предпочтительно, амино, метиламино, этиламино, пропиламино, изопропиламино, N,N-диметиламино и N,N-диэтиламино. Конечно, конкретные примеры, включают такие, к которым трет-бутоксикарбонил или бензилоксикарбонил присоединен в качестве защитной группы.
Конкретные примеры Re(Rf)NCO- включают аминокарбонил, метиламинокарбонил, этиламинокарбонил, пропиламинокарбонил, изопропиламинокарбонил, бутиламинокарбонил, трет-бутиламинокарбонил, втор-бутиламинокарбонил, изобутиламинокарбонил, пентиламинокарбонил, 1,1-диметилпропиламинокарбонил, 1,2-диметилпропиламинокарбонил, неопентиламинокарбонил, 1-метилбутиламинокарбонил, 2-метилбутиламинокарбонил, изопентиламинокарбонил, гексиламинокарбонил, N,N-диметиламинокарбонил, N,N-диэтиламинокарбонил, N,N-дипропиламинокарбонил, N,N-ди(изопропил)аминокарбонил, N,N-дибутиламинокарбонил, N,N-ди(трет-бутил)аминокарбонил, N,N-ди-(втор-бутил)аминокарбонил, N,N-ди(изобутил)аминокарбонил, N,N-дипентиламинокарбонил, N,N-ди(1,1-диметилпропил)аминокарбонил, N,N-ди(1,2-диметилпропил)аминокарбонил, N,N-ди(неопентил)аминокарбонил, N,N-ди(1-метилбутил)аминокарбонил, N,N-ди(2-метилбутил)аминокарбонил, N,N-ди(изопентил)аминокарбонил и т.д., которые получены из конкретных примеров Re(Rf)N-, описанных выше, предпочтительно, диметиламинокарбонил или диэтиламинокарбонил.
Конкретные примеры ReO- включают гидрокси, метокси, этокси, пропокси, изопропокси, бутокси, трет-бутокси, втор-бутокси, изобутокси, пентокси, 1,1-диметилпропокси, 1,2-диметилпропокси, неопентокси, 1-метилбутокси, 2-метилбутокси, изопентокси, гексилокси, бензилокси, циклопропокси, циклобутокси, циклопентилокси, циклогексилокси, циклопропилметокси, циклобутилметокси, циклопентилметокси, и т.д., предпочтительно гидрокси, метокси, этокси, пропокси, изопропокси, трет-бутокси, циклопропокси и циклобутилметокси. Конечно, конкретные примеры, включают такие, к которым триизопропилсилил включен в триалкилсилилокси в качестве защитной группы.
Конкретные примеры ReOCO- включают метоксикарбонил, этоксикарбонил, пропоксикарбонил, изопропоксикарбонил, бутоксикарбонил, трет-бутоксикарбонил, втор-бутоксикарбонил, изо-бутоксикарбонил, пентоксикарбонил, 1,1-диметилпропоксикарбонил, 1,2-диметилпропоксикарбонил, неопентоксикарбонил, 1-метилбутоксикарбонил, 2-метилбутоксикарбонил, изопентоксикарбонил, гексилоксикарбонил и т.д., которые получены из конкретных примеров ReO-, описанных выше, предпочтительно, метоксикарбонил, этоксикарбонил, трет-бутоксикарбонил и бензилоксикарбонил, метоксикарбонил, модифицированный фенилом, который определен Fn1.
Конкретные примеры RdO2S- включают метилсульфонил, этилсульфонил, пропилсульфонил, изопропилсульфонил, бутилсульфонил, трет-бутилсульфонил, втор-бутилсульфонил, изобутилсульфонил, пентилсульфонил, 1,1-диметилпропилсульфонил, 1,2-диметилпропилсульфонил, неопентилсульфонил, 1-метилбутилсульфонил, 2-метилбутилсульфонил, изопентилсульфонил, гексилсульфонил, циклопропансульфонил, циклобутансульфонил, циклопентилсульфонил, циклогексилсульфонил, циклопропилметансульфонил, циклобутилметансульфонил, циклопентилметансульфонил и т.д., предпочтительно, сульфокси и метансульфонил.
Конкретные примеры Ra(Rb)N- включают указанный выше С1-6 алкил, ацил и Re(Rf)N-, предпочтительно, амино, метиламино, этиламино, пропиламино, изопропиламино, трет-бутиламино, изобутиламино, N,N-диметиламино, N,N-диэтиламино, N,N-ди(изопропил)амино, ацетиламино, пропаноиламино, изобутаноиламино, фенилацетиламино, бензоиламино, [(азетидин-2-ил)карбонил]амино, [(азетидин-3-ил)карбонил]амино, [(пирролидин-2-ил)карбонил]амино, [(пирролидин-3-ил)карбонил]амино, [(тетрагидрофуран-3-ил)карбонил]амино, [(тетрагидротиофен-3-ил)карбонил]амино, [(пиразолидин-3-ил)карбонил]амино, [(пиразолидин-4-ил)карбонил]амино, [(1,2-оксазолидин-3-ил)карбонил]амино, [(пиперидин-2-ил)карбонил]амино, [(пиперидин-3-ил)карбонил]амино, [(пиперидин-4-ил)карбонил]амино, [(тетрагидро-2Н-пиран-2-ил)карбонил]амино, [(тетрагидро-2Н-пиран-4-ил)карбонил]амино, [(тетрагидро-2Н-тиопиран-4-ил)карбонил]амино, [(гексагидропиридазин-3-ил)карбонил]амино, [(гексагидропиридазин-4-ил)карбонил]амино, [(пиперазин-2-ил)карбонил]амино, [(морфолин-2-ил)карбонил]амино, [(морфолин-3-ил)карбонил]амино, [(тиоморфолин-2-ил)карбонил]амино, [(тиоморфолин-3-ил)карбонил]амино, [(1,2-оксазинан-3-ил)карбонил]амино, [(азепан-2-ил)карбонил]амино, [(азепан-4-ил)карбонил]амино, [(оксепан-2-ил)карбонил]амино, [(оксепан-4-ил)карбонил]амино, [(1,4-диазепан-2-ил)карбонил]амино, [(1,4-диазепан-6-ил)карбонил]амино, пиррол-2-илкарбониламино, пиррол-3-илкарбониламино, фуран-2-илкарбониламино, фуран-3-илкарбониламино, пиразол-3-илкарбониламино, пиразол-4-илкарбониламино, имидазол-2-илкарбониламино, имидазол-4-илкарбониламино, 1,2-оксазол-3-илкарбониламино, 1,2-оксазол-4-илкарбониламино, 1,2-оксазол-5-илкарбониламино, 1,3-оксазол-2-илкарбониламино, 1,3-оксазол-4-илкарбониламино, 1,3-оксазол-5-илкарбониламино, 1,3-тиазол-2-илкарбониламино, 1,3-тиазол-4-илкарбониламино, 1,3-тиазол-5-илкарбониламино, 1,2,3-триазол-4-илкарбониламино, 1,2,3-триазол-5-илкарбониламино, 1,2,3-оксадиазол-4-илкарбониламино, 1,2,3-оксадиазол-5-илкарбониламино, 1,2,4-триазол-3-илкарбониламино, 1,3,4-оксадиазол-3-илкарбониламино, тетразол-5-илкарбониламино, пиридин-2-илкарбониламино, пиридин-3-илкарбониламино, пиридин-4-илкарбониламино, пиридазин-3-илкарбониламино, пиридазин-4-илкарбониламино, пиримидин-2-илкарбониламино, пиримидин-4-илкарбониламино, пиразин-2-илкарбониламино, 1,2,4-триазин-3-илкарбониламино, 1,2,4-триазин-5-илкарбониламино, 1,2,4-триазин-6-илкарбониламино, 1,3,5-триазин-2-илкарбониламино и т.д. Кроме того, конкретные примеры вариантов, когда Ra и Rb из Ra(Rb)N- связаны с образованием гетероциклила, включают азетидин-1-ил, пирролидин-1-ил, пиперидин-1-ил, азепан-1-ил, 2-оксоазетидин-1-ил, 2-оксопирролидин-1-ил, 2-оксопиперидин-1-ил, 2-оксоазепан-1-ил и т.д. Конечно, указанные выше конкретные примеры включают такие, к которым трет-бутоксикарбонил или бензилоксикарбонил присоединен в качестве защитной группы.
Предпочтительные конкретные примеры С1-6 алкокси, представленные конкретными примерами указанного выше ReO- и RсO-, полученными из гетероциклила, включают метокси, этокси, пропокси, изопропокси, циклобутилметокси, азетидин-3-илокси, оксетан-3-илокси, тиетан-3-илокси, пирролидин-3-илокси, тетрагидрофуран-3-илокси, тетрагидротиофен-3-илокси, пиразолидин-4-илокси, пиперидин-3-илокси, пиперидин-4-илокси, тетрагидро-2Н-пиран-3-илокси, тетрагидро-2Н-пиран-4-илокси, тетрагидро-2Н-тиопиран-3-илокси, тетрагидро-2Н-тиопиран-4-илокси, гексагидропиридазин-4-илокси, 1,2-оксазолидин-4-илокси, 1,2-оксазинан-4-илокси, 1,2-оксазинан-5-илокси, 1,2-тиазинан-4-илокси, 1,2-тиазинан-5-илокси, азепан-3-илокси, азепан-4-илокси, оксепан-3-илокси, оксепан-4-илокси, тиепан-3-илокси, тиепан-4-илокси, 1,4-диазепан-6-илокси, 1,4-оксазепан-6-илокси, 1,4-тиазепан-6-илокси и т.д. Кроме того, в RcO-B-, конкретные примеры гетероциклила, образованного связыванием Rc кольца и B, включают 1,2-оксазолидин, 1,2-оксазинан, 1,2-оксазепан, и т.д. Конечно, указанные выше конкретные примеры включают такие, к которым трет-бутоксикарбонил или бензилоксикарбонил присоединен в качестве защитной группы.
Далее, подробные примеры варианта, в котором С1-6 алкил, ацил или гетероциклил, которые образуют указанные выше Ra(Rb)N-или RcO-, модифицирован С1-6 алкилом, O=, Rg-(CH2)0-3-, гетероциклилом, фенилом, гетероарилом, ацилом, RdO2S-, Re(Rf)N-, Re(Rf)NCO-, ReO- и ReOCO-, которые определены Fn1 или защитной группой, более подробно описаны в типовых примерах, но, конечно, примеры не ограничены объемом конкретных примеров, которые иллюстрированы.
Конкретные примеры C1-6 алкила, модифицированного амино (H2N-), который является примером Re(Rf)N-, включают 2-аминоэтил, 2-аминопропил, 3-аминопропил, 2-амино-1-метилэтил, 2-аминобутил, 3-аминобутил, 4-аминобутил, 2-амино-1,1-диметилэтил, 2-амино-1-метилпропил, 3-амино-2-метилпропил и т.д. Конечно варианты, к которым присоединены защитный трет-бутоксикарбонил или бензилоксикарбонил, которые включены ReOCO-, включены в указанные выше конкретные примеры.
Кроме того, СН2 к которому присоединен амино, в 2-аминоэтиле в указанных выше конкретных примерах, модифицирован O= (оксо) с получением производного аминокарбонилалкила, включенного в Re(Rf)NCO-, включает 2-(амино)-2-оксоэтил, 2-(метиламино)-2-оксоэтил, 2-(этиламино)-2-оксоэтил, 2-оксо-2-(пропиламино)этил, 2-(изопропиламино)-2-оксоэтил, 2-(трет-бутиламино)-2-оксоэтил, 2-(изобутиламино)-2-оксоэтил и т.д.
Кроме того, конкретные примеры, в которых указанное выше производное 2-аминоэтила модифицировано метилсульфонилом в качестве типового примера RdO2S-, ацетилом в качестве типового примера ацила или карбамоила (H2NCO-), в качестве типового примера Re(Rf)NCO-, включает 2-(метилсульфониламино)этил, 2-(метилсульфониламино)пропил, 3-(метилсульфониламино)пропил, 2-(метилсульфониламино)-1-метилэтил, 2-(метилсульфониламино)бутил, 3-(метилсульфониламино)бутил, 4-(метилсульфониламино)бутил, 2-(метилсульфониламино)-1,1-диметилэтил, 2-(метилсульфониламино)-1-метилпропил, 3-(метилсульфониламино)-2-метилпропил, 2-(ацетиламино)этил, 2-(ацетиламино)пропил, 3-(ацетиламино)пропил, 2-(ацетиламино)-1-метилэтил, 2-(ацетиламино)бутил, 3-(ацетиламино)бутил, 4-(ацетиламино)бутил, 2-(ацетиламино)-1,1-диметилэтил, 2-(ацетиламино)-1-метилпропил, 3-(ацетиламино)-2-метилпропил, 2-(карбамоиламино)этил, 2-(карбамоиламино)пропил, 3-(карбамоиламино)пропил, 2-(карбамоиламино)-1-метилэтил, 2-(карбамоиламино)бутил, 3-(карбамоиламино)бутил, 4-(карбамоиламино)бутил, 2-(карбамоиламино)-1,1-диметилэтил, 2-(карбамоиламино)-1-метилпропил, 3-(карбамоиламино)-2-метилпропил и т.д.
Конкретные примеры, в которых С1-6 алкил модифицирован гидрокси (НО-) в качестве типового примера ReO-, включают 2-гидроксиэтил, 2-гидроксипропил, 3-гидроксипропил, 2-гидрокси-1-метилэтил, 2-гидроксибутил, 3-гидроксибутил, 4-гидроксибутил, 1,1-диметил-2-гидроксиэтил, 2-гидрокси-1-метилпропил, 3-гидрокси-2-метилпропил и т.д. Конечно, указанные выше конкретные примеры включают такие, в которых гидрокси защищен триизопропилсилилом, включенным в триалкилсилил.
Конкретные примеры варианта, в котором этил в качестве типового примера С1-6 алкила модифицирован метилсульфонилом в качестве типового примера RdO2S-, включают 2-(метилсульфонил)этил.
Конкретные примеры, в которых С1-6 алкилкарбонил, фенилацетил или бензоил, модифицированы амино (H2N-) в качестве типового примера Re(Rf)N-, включают 2-аминоацетил, 2-аминопропаноил, 3-аминопропаноил, 2-аминобутаноил, 3-аминобутаноил, 4-аминобутаноил, 3-амино-2-метилпропаноил, 2-(2-аминофенил)ацетил, 2-(3-аминофенил)ацетил, 2-(4-аминофенил)ацетил, 2-[2-(аминометил)фенил]ацетил, 2-[3-(аминометил)фенил]ацетил, 2-[4-(аминометил)фенил]ацетил, 2-аминобензоил, 3-аминобензоил, 4-аминобензоил, 2-(аминометил)бензоил, 3-(аминометил)бензоил, 4-(аминометил)бензоил и т.д. Конечно примеры, к которым трет-бутоксикарбонил или бензилоксикарбонил присоединен в качестве защитной группы, включены в конкретные примеры.
Конкретные примеры С1-6 алкилкарбонила, фенилацетила или бензоила, модифицированных гидроксилом (НО-) в качестве типового примера ReO-, включают 2-гидроксиацетил, 2-гидроксипропаноил, 3-гидроксипропаноил, 2-гидроксибутаноил, 3-гидроксибутаноил, 4-гидроксибутаноил, 3-гидрокси-2-метилпропаноил, 2-(2-гидроксифенил)ацетил, 2-(3-гидроксифенил)ацетил, 2-(4-гидроксифенил)ацетил, 2-гидроксибензоил, 3-гидроксибензоил, 4-гидроксибензоил и т.д. Конечно примеры, в которых гидрокси защищен триизопропилсилилом, включенным в триалкилсилил, включены в указанные выше конкретные примеры.
Конкретные примеры, в которых метил или этил в качестве типовых примеров С1-6 алкила модифицированы гетероциклилом, включают азетидин-2-илметил, азетидин-3-илметил, пирролидин-2-илметил, пирролидин-3-илметил, тетрагидрофуран-3-илметил, тетрагидротиофен-3-илметил, пиразолидин-4-илметил, 1,2-оксазолидин-3-илметил, пиперидин-2-илметил, пиперидин-3-илметил, пиперидин-4-илметил, тетрагидро-2Н-пиран-4-илметил, тетрагидро-2Н-тиопиран-4-илметил, гексагидропиридазин-4-илметил, пиперазин-2-илметил, 1,2-оксазинан-3-илметил, морфолин-2-илметил, морфолин-3-илметил, тиоморфолин-2-илметил, тиоморфолин-3-илметил, азепан-2-илметил, азепан-4-илметил, оксепан-2-илметил, оксепан-4-илметил, 1,4-диазепан-2-илметил, 1,4-диазепан-6-илметил, 2-(азетидин-1-ил)этил, 2-(пирролидин-1-ил)этил, 2-(пиразолидин-1-ил)этил, 2-(пиперидин-1-ил)этил, 2-(гексагидропиридазин-1-ил)этил, 2-(пиперазин-1-ил)этил, 2-(морфолин-4-ил)этил, 2-(тиоморфолин-4-ил)этил, 2-(1,2-оксазолидин-2-ил)этил, 2-(1,2-оксазинан-2-ил)этил, 2-(азепан-1-ил)этил, 2-(1,4-диазепан-1-ил)этил и т.д. Конечно примеры, к которым трет-бутоксикарбонил или бензилоксикарбонил присоединен в качестве защитной группы, включены в конкретные примеры.
Кроме того, конкретные примеры, в которых этил из указанного выше производного гетероциклилэтила модифицирован O= (оксо) с получением аминокарбонила, включенного в Re(Rf)NCO-, включают 2-(азетидин-1-ил)оксоэтил, 2-оксо-(пирролидин-1-ил)этил, 2-оксо-(пиразолидин-1-ил)этил, 2-оксо-(пиперидин-1-ил)этил, 2-(гексагидропиридазин-1-ил)-2-оксоэтил, 2-оксо-(пиперазин-1-ил)этил, 2-(морфолин-4-ил)-2-оксоэтил, 2-оксо-(тиоморфолин-4-ил)этил, 2-(1,2-оксазолидин-2-ил)-2-оксоэтил, 2-(1,2-оксазинан-2-ил)-2-оксоэтил, 2-(азепан-1-ил)-2-оксоэтил, 2-(1,4-диазепан-1-ил)-2-оксоэтил и т.д. Конечно, указанные выше примеры включают такие, к которым трет-бутоксикарбонил или бензилоксикарбонил присоединен в качестве защитной группы.
Конкретные примеры, в которых в Re(Rf)NCO-, Re и Rf, модифицированные Fn1, связаны с получением гетероциклила, включают азетидин-1-илкарбонил, пирролидин-1-илкарбонил, 1,2-оксазолидин-2-илкарбонил, пиразолидин-1-илкарбонил, пиперидин-1-илкарбонил, гексагидропиридазин-1-илкарбонил, пиперазин-1-илкарбонил, морфолин-4-илкарбонил, тиоморфолин-4-илкарбонил, 1,2-оксазинан-2-илкарбонил, азепан-1-илкарбонил, 1,4-диазепан-1-илкарбонил и т.д.
Конкретные примеры, в которых метил или этил в качестве типовых примеров С1-6 алкила модифицированы гетероарилом, включают пиррол-2-илметил, фуран-2-илметил, пиразол-3-илметил, пиразол-4-илметил, имидазол 2-илметил, имидазол-4-илметил, 1,2-оксазол-3-илметил, 1,3-оксазол-2-илметил, 1,3-оксазол-4-илметил, 1,3-тиазол-2-илметил, 1,3-тиазол-4-илметил, 1,2,3-триазол-4-илметил, 1,2,3-оксадиазол-4-илметил, 1,2,4-триазол-3-илметил, 1,3,4-оксадиазол-2-илметил, тетразол-5-илметил, пиридин-2-илметил, пиридин-3-илметил, пиридин-4-илметил, пиридазин-3-илметил, пиридазин-4-илметил, пиримидин-2-илметил, пиримидин-4-илметил, пиразин-2-илметил, 1,2,4-триазин-3-илметил, 1,2,4-триазин-5-илметил, 1,3,5-триазин-2-илметил, 2-(пиррол-1-ил)этил, 2-(пиразол-1-ил)этил, 2-(имидазол-1-ил)этил, 2-(1,2,3-триазол-1-ил)этил, 2-(1,2,4-триазол-4-ил)этил, 2-(тетразол-1-ил)этил и т.д. Конечно, указанные выше примеры включают такие, к которым трет-бутоксикарбонил или бензилоксикарбонил присоединен в качестве защитной группы.
Конкретные примеры, в которых гетероциклил модифицирован метилом в качестве типовых примеров С1-6 алкила, включают 1-метилазетидин, 3-метилазетидин, 1-метилпирролидин, 3-метилпирролидин, 1-метилимидазолидин, 3-метилоксазолидин, 1-метилпиразолидин, 1-метилпиперидин, 4-метилпиперидин, 2-метилтетрагидро-2Н-пиран, 4-метилтетрагидро-2Н-пиран, 1-метилпиперазин, 1,4-диметилпиперазин, 4-метилморфолин, 4-метилтиоморфолин, 1-метилазепан, 1-метил-1,4-диазепан, 1,4-диметил-1,4-диазепан и т.д. Конечно, указанные выше примеры включают такие, к которым трет-бутоксикарбонил или бензилоксикарбонил присоединен в качестве защитной группы.
Конкретные примеры гетероциклила, модифицированного O= (оксо), включают 2-оксоазетидин, 2-оксопирролидин, 3-оксопиразолидин, 2-оксоимидазолидин, 3-оксо-1,2-оксазолидин, 2-оксооксазолидин, 2-оксопиперидин, 3-оксогексагидропиридазин, 2-оксопиперазин, 3-оксоморфолин, 3-оксо-1,2-оксазинан, 2-оксоазепан, 2-оксо-1,4-диазепан, 5-оксо-1,4-диазепан и т.д.
Конкретные примеры, в которых этил в качестве типового примера С1-6 алкила модифицирован гетероциклилом, где гетероциклил модифицирован O= (оксо), включают 2-(2-оксоазетидин-1-ил)этил, 2-(2-оксопирролидин-1-ил)этил, 2-(2-оксоимидазолидин-3-ил)этил, 2-(2-оксооксазолидин-3-ил)этил, 2-(3-оксопиразолидин-1-ил)этил, 2-(2-оксопиперидин-1-ил)этил, 2-(3-оксогексагидропиридазин-1-ил)этил, 2-(2-оксопиперазин-1-ил)этил, 2-(3-оксоморфолин-4-ил)этил, 2-(3-оксо-1,2-оксазолидин-2-ил)этил, 2-(3-оксо-1,2-оксазинан-2-ил)этил, 2-(2-оксоазепан-1-ил)этил, 2-(2-оксо-1,4-диазепан-1-ил)этил, 2-(5-оксо-1,4-диазепан-1-ил)этил и т.д.
Конкретные примеры гетероциклилкарбонила, в котором гетероциклил модифицирован O= (оксо), включают 4-оксоазетидин-2-илкарбонил, 5-оксопирролидин-2-илкарбонил, 2-оксоимидазолидин-4-илкарбонил, 2-оксооксазолидин-4-илкарбонил, 5-оксопиразолидин-3-илкарбонил, 6-оксопиперидин-2-илметил, 2-оксопиперидин-4-илкарбонил, 6-оксогексагидропиридазин-3-илкарбонил, 3-оксогексагидропиридазин-4-илкарбонил, 5-оксопиперазин-2-илкарбонил, 6-оксопиперазин-2-илкарбонил, 5-оксоморфолин-2-илкарбонил, 5-оксоморфолин-3-илкарбонил, 3-оксотиоморфолин-2-илкарбонил, 5-оксотиоморфолин-3-илкарбонил, 7-оксоазепан-2-илкарбонил, 2-оксоазепан-4-илкарбонил, 7-оксо-1,4-диазепан-2-илкарбонил, 2-оксо-1,4-диазепан-6-илкарбонил и т.д. Конечно, указанные выше примеры включают такие, к которым трет-бутоксикарбонил или бензилоксикарбонил присоединен в качестве защитной группы.
Конкретные примеры гетероциклила, модифицированного амино (H2N-) в качестве типового примера Re(Rf)N-, включают группу, полученную из 3-аминоазетидина, 3-аминопирролидина, 3-аминотетрагидрофурана, 3-аминотетрагидротиофена, 4-аминопиразолидина, 4-аминопиперидина, 4-аминотетрагидро-2Н-пирана, 4-аминотетрагидро-2Н-тиопирана, 4-аминогексагидропиридазина, 4-амино-1,2-оксазолидина, 4-амино-1,2-оксазинана, 4-аминоазепана, 4-аминооксепана, 6-амино-1,4-диазепана и т.д. Конечно, указанные выше примеры включают такие, к которым трет-бутоксикарбонил или бензилоксикарбонил присоединен в качестве защитной группы.
Конкретные примеры гетероциклила, модифицированного гидрокси (HO-) в качестве типового примера ReO-, включают группу, полученную из 3-гидроксиазетидина, 3-гидроксипирролидина, 4-гидроксипиразолидина, 4-гидрокситетрагидрофурана, 4-гидрокситетрагидротиофена, 3-гидроксипиперидина, 4-гидроксипиперидина, 4-гидрокситетрагидро-2Н-тиопирана, 4-гидроксигексагидропиридазина, 4-гидрокси-1,2-оксазолидина, 4-гидрокси-1,2-оксазинана, 4-гидроксиазепана, 6-гидрокси-1,4-диазепана и т.д. Конечно, указанные выше конкретные примеры включают такие, в которых группа гидрокси защищена триизопропилсилилом, гетероциклил защищен трет-бутоксикарбонилом или бензилоксикарбонилом.
Конкретные примеры гетероарила, модифицированного метилом в качестве типовых примеров С1-6 алкила, включают группу, полученную из 1-метилпиррола, 2-метилпиррола, 3-метилпиррола, 1-метилпиразола, 3-метилпиразола, 4-метилпиразола, 2-метилимидазола, 4-метилимидазола, 4-метил-1,2-оксазола, 5-метил-1,2-оксазола, 2-метил-1,3-оксазола, 4-метил-1,3-оксазола, 5-метил-1,3-оксазола, 1-метил-1,2,3-триазола, 4-метил-1,2,3-триазола, 1-метил-1,2,4-триазола, 3-метил-1,2,4-триазола, 1-метилтетразола, 5-метилтетразола, 2-метил-1,3,4-оксадиазола, 2-метилпиридина, 3-метилпиридина, 4-метилпиридина, 3-метилпиридазина, 4-метилпиридазина, 2-метилпиримидина, 4-метилпиримидина, 2-метилпиразина, 3-метил-1,2,4-триазина, 5-метил-1,2,4-триазина, 6-метил-1,2,4-триазина, 2-метил-1,3,5-триазина и т.д. Конечно, указанные выше примеры включают такие, к которым трет-бутоксикарбонил или бензилоксикарбонил присоединен в качестве защитной группы.
Конкретные примеры гетероарила, модифицированного амино (H2N-) в качестве типового примера Re(Rf)N-, включают группу, полученную 2-аминопиррола, 3-аминопиррола, 2-аминофурана, 3-аминофурана, 3-аминопиразола, 4-аминопиразола, 2-аминоимидазола, 3-амино-1,2-оксазола, 2-амино-1,3-оксазола, 2-аминотиазола, 4-амино-1,2,3-триазола, 3-амино-1,2,4-триазола, 2-амино-1,3,4-тиадиазола, 5-аминотетразола, 2-амино-1,3,4-оксадиазола, 2-аминопиридина, 3-аминопиридазина, 2-аминопиримидина, 3-амино-1,2,4-триазина, 2-амино-1,3,5-триазина и т.д. Конечно, указанные выше примеры включают такие, к которым трет-бутоксикарбонил или бензилоксикарбонил присоединен в качестве защитной группы.
Конкретные примеры гетероарила, модифицированного гидрокси (HO-) в качестве типового примера ReO-, включают группу, полученную 2-гидроксипиррола, 3-гидроксипиррола, 2-гидроксифурана, 3-гидроксифурана, 3-гидроксипиразола, 4-гидроксипиразола, 2-гидроксиимидазола, 3-гидрокси-1,2-оксазола, 2-гидрокси-1,3-оксазола, 2-гидрокситиазола, 4-гидрокси-1,2,3-триазола, 3-гидрокси-1,2,4-триазола, 5-гидрокситетразола, 2-гидрокси-1,3,4-оксадиазола, 2-гидроксипиридина, 3-гидроксипиридазина, 2-гидроксипиримидина, 3-гидрокси-1,2,4-триазина, 2-гидрокси-1,3,5-триазина и т.д. Конечно, указанные выше конкретные примеры включают такие, в которых группа гидрокси защищена триизопропилсилилом и гетероарил защищен трет-бутоксикарбонилом или бензилоксикарбонилом.
В качестве конкретных примеров Ra(Rb)N-, содержащего указанный выше С1-6 алкил или ацил, предпочтительными являются амино, метиламино, этиламино, пропиламино, изопропиламино, диметиламино, диэтиламино, фениламино, ацетиламино, пропаноиламино, бутаноиламино, 2-метилпропаноиламино, 2,2-диметилпропаноиламино, 2-аминоацетиламино, 3-аминопропаноиламино, 2-метоксиацетиламино, фенилацетиламино, 2-(4-аминофенил)ацетиламино, 2-(4-аминометилфенил)ацетиламино, бензоиламино, 4-аминобензоиламино, 4-аминометилбензоиламино, [(азетидин-2-ил)карбонил]амино, [(пирролидин-2-ил)карбонил]амино, [(пирролидин-3-ил)карбонил]амино, [(пиперидин-2-ил)карбонил]амино, [(пиперидин-3-ил)карбонил]амино, [(пиперидин-4-ил)карбонил]амино, [(4-циклопентилметилпиперидин-2-ил)карбонил]амино, [(тетрагидро-2Н-пиран-4-ил)карбонил]амино, [(5-оксопирролидин-2-ил)карбонил]амино, фуран-2-илкарбониламино, 1,3-оксазол-4-илкарбониламино, пиридин-2-илкарбониламино, пиридин-3-илкарбониламино, пиридин-4-илкарбониламино, метансульфониламино, диметиламинокарбониламино, диэтиламинокарбониламино, фениламинокарбониламино, морфолин-4-илкарбониламино, метоксикарбониламино, этоксикарбониламино, трет-бутоксикарбониламино и т.д. Кроме того, конкретные примеры для вариантов, в которых в Ra(Rb)N-, Ra и Rb, модифицированные Fn1, связаны с получением гетероциклила, включают азетидин-1-ил, пирролидин-1-ил, пиперидин-1-ил, пиперазин-1-ил, морфолин-4-ил, тиоморфолин-4-ил, азепан-1-ил, 1,4-диазепан-1-ил, 2-оксоазетидин-1-ил, 2-оксопирролидин-1-ил, 2-оксопиперидин-1-ил, 2-оксопиперазин-1-ил, 3-оксоморфолин-4-ил, 2-оксоазепан-1-ил, 2-оксо-1,4-диазепан-1-ил и т.д. Конечно, свободные NH или HO, модифицированные защитной группой, такой как трет-бутоксикарбонил, бензилоксикарбонил или триизопропилсилил, включены в указанный выше Ra(Rb)N-, при необходимости.
Кроме того конкретные примеры RcO-, включающей указанные выше С1-6 алкокси и гетероциклилокси, включают, предпочтительно, метокси, этокси, пропокси, изопропокси, циклобутилметокси, азетидин-3-илокси, пирролидин-3-илокси, тетрагидрофуран-3-илокси, тетрагидротиофен-3-илокси, пиразолидин-4-илокси, пиперидин-3-илокси, пиперидин-4-илокси, тетрагидро-2Н-пиран-4-илокси, тетрагидро-2Н-тиопиран-4-илокси, 1,2-оксазолидин-4-илокси, 1,2-оксазинан-4-илокси, 1,2-оксазинан-5-илокси, азепан-3-илокси, азепан-4-илокси, 1,4-диазепан-6-илокси, 1,4-оксазепан-6-илокси, 2-аминоэтокси, 2-(метиламино)этокси, 2-(пропиламино)этокси, 2-(изопропиламино)этокси, 2-(диметиламино)этокси, 2-гидроксиэтокси, 2-метоксиэтокси, 2-аминопропокси, 3-аминопропокси, 2-амино-1-метилэтокси, 2-амино-2-оксоэтокси, 2-(диметиламино)-2-оксоэтокси, 2-(метилсульфонил)этокси, (азетидин-2-ил)метокси, (азетидин-3-ил)метокси, (пирролидин-2-ил)метокси, (пирролидин-3-ил)метокси, (пиперидин-2-ил)метокси, (пиперидин-3-ил)метокси, (пиперидин-4-ил)метокси, (4-оксоазетидин-2-ил)метокси, (5-оксопирролидин-2-ил)метокси, (6-оксопиперидин-2-ил)метокси, 2-(азетидин-1-ил)этокси, 2-(пирролидин-1-ил)этокси, 2-(пиперидин-1-ил)этокси, 2-(морфолин-4-ил)этокси, 2-(пиперазин-1-ил)этокси, 2-(1,4-диазепан-1-ил)этокси, 2-(азетидин-1-ил)-2-оксоэтокси, 2-оксо-2-(пирролидин-1-ил)этокси, 2-оксо-2-(пиперидин-1-ил)этокси, 2-оксо-2-(пиперазин-1-ил)этокси, 2-(морфолин-4-ил)-2-оксоэтокси, 2-(1,4-диазепан-1-ил)-2-оксоэтокси, 2-(2-оксоазетидин-1-ил)этокси, 2-(2-оксопирролидин-1-ил)этокси, 2-(2-оксопиперидин-1-ил)этокси, 2-(2-оксоимидазолидин-1-ил)этокси, 2-(2-оксо-1,3-оксазолидин-3-ил)этокси, 2-(пиррол-1-ил)этокси, 2-(имидазол-1-ил)этокси, 2-(2-сульфонат-1Н-имидазол-1-ий-1-ил)этокси. Кроме того, конкретные примеры гетероциклила, полученного соединением Rc и B или Rc и B, модифицированных Fn1, в RcO-B- включают 1,2-оксазолидин-2-ил, 1,2-оксазинан-2-ил, 1,2-оксазепан-2-ил, 1,2,5-оксадиазепан-2-ил, 1,5,2-диоксазепан-5-ил, и т.д. Конечно, свободные NH или HO, модифицированные защитной группой, такой как трет-бутоксикарбонил, бензилоксикарбонил или триизопропилсилил, включены в указанный выше RcO-, при необходимости.
Более конкретные примеры соединений, представленных в соответствии с данным изобретением, включают следующие соединения:
(2S,5R)-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбогидразид,
трет-бутил 2-{[(2S,5R)-6-бензилокси-7-оксо-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}гидразинкарбоксилат,
трет-бутил 2-{[(2S,5R)-6-гидрокси-7-оксо-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}гидразинкарбоксилат,
трет-бутил 2-{[(2S,5R)-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}гидразинкарбоксилат тетрабутиламмония,
трет-бутил 1-метил-2-{[(2S,5R)-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}гидразинкарбоксилата натрия,
трет-бутил 2-{[(2S,5R)-6-бензилокси-7-оксо-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}-1-метилгидразинкарбоксилат,
трет-бутил 2-{[(2S,5R)-6-гидрокси-7-оксо-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}-1-метилгидразинкарбоксилат,
трет-бутил 2-{[(2S,5R)-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}-1-метилгидразинкарбоксилат пиридиния,
(2S,5R)-N'-метил-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбогидразид,
(2S,5R)-N',N'-диметил-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбогидразид натрия,
(2S,5R)-6-бензилокси-N’,N’-диметил-7-оксо-1,6-диазабицикло[3.2.1]октан-2-карбогидразид,
(2S,5R)-N’,N’-диметил-6-гидрокси-7-оксо-1,6-диазабицикло[3.2.1]октан-2-карбогидразид,
(2S,5R)-N’,N’-диметил-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбогидразид пиридиния,
(2S,5R)-N'-ацетил-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбогидразид натрия,
(2S,5R)-N'-ацетил-6-бензилокси-7-оксо-1,6-диазабицикло[3.2.1]октан-2-карбогидразид,
(2S,5R)-N'-ацетил-6-гидрокси-7-оксо-1,6-диазабицикло[3.2.1]октан-2-карбогидразид,
(2S,5R)-N'-ацетил-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбогидразид тетрабутиламмония,
(2S,5R)-7-оксо-6-N'-пропаноил-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбогидразид натрия,
(2S,5R)-6-бензилокси-7-оксо-1,6-диазабицикло-N'-пропаноил-1,6-диазабицикло[3.2.1]октан-2-карбогидразид,
(2S,5R)-6-гидрокси-7-оксо-N'-пропаноил-1,6-диазабицикло[3.2.1]октан-2-карбогидразид,
(2S,5R)-7-оксо-N'-пропаноил-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбогидразид пиридиния,
(2S,5R)-N'-(2-метилпропаноил)-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбогидразид натрия,
(2S,5R)-6-бензилокси-N'-(2-метилпропаноил)-7-оксо-1,6-диазабицикло[3.2.1]октан-2-карбогидразид,
(2S,5R)-6-гидрокси-N'-(2-метилпропаноил)-7-оксо-1,6-диазабицикло[3.2.1]октан-2-карбогидразид,
(2S,5R)-N'-(2-метилпропаноил)-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбогидразид пиридиния,
(2S,5R)-N'-(2,2-диметилпропаноил)-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбогидразид натрия,
(2S,5R)-6-бензилокси-N'-(2,2-диметилпропаноил)-7-оксо-1,6-диазабицикло[3.2.1]октан-2-карбогидразид,
(2S,5R)-N'-(2,2-диметилпропаноил)-6-гидрокси-7-оксо-1,6-диазабицикло[3.2.1]октан-2-карбогидразид,
(2S,5R)-N'-(2,2-диметилпропаноил)-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбогидразид пиридиния,
(2S,5R)-N'-ацетил-N'-метил-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбогидразид натрия,
(2S,5R)-N'-ацетил-6-бензилокси-N'-метил-7-оксо-1,6-диазабицикло[3.2.1]октан-2-карбогидразид,
(2S,5R)-N'-ацетил-6-гидрокси-N'-метил-7-оксо-1,6-диазабицикло[3.2.1]октан-2-карбогидразид,
(2S,5R) -N'-ацетил-N'-метил-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбогидразид пиридиния,
(2S,5R)-N'-(аминоацетил)-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбогидразид,
трет-бутил [2(2-{[(2S,5R)-6-бензилокси-7-оксо-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}гидразинил)-2-оксоэтил]карбамат,
трет-бутил [2(2-{[(2S,5R)-6-гидрокси-7-оксо-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}гидразинил)-2-оксоэтил]карбамат,
трет-бутил [2-(2-{[(2S,5R)-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}гидразинил)-2-оксоэтил]карбамат пиридиния,
(2S,5R)-N'-(3-аминопропаноил)-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбогидразид,
трет-бутил [3-(2-{[(2S,5R)-6-бензилокси-7-оксо-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}гидразинил)-3-оксопропил]карбамат,
трет-бутил [3-(2-{[(2S,5R)-6-гидрокси-7-оксо-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}гидразинил)-3-оксопропил]карбамат,
трет-бутил [3-(2-{[(2S,5R)-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}гидразинил)-3-оксопропил]карбамат пиридиния,
(2S,5R)-N'-[(4-аминофенил)ацетил]-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбогидразид,
трет-бутил {4-[2-(2-{[(2S,5R)-6-бензилокси-7-оксо-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}гидразинил)-2-оксоэтил]фенил}карбамат,
трет-бутил {4-[2-(2-{[(2S,5R)-6-гидрокси-7-оксо-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}гидразинил)-2-оксоэтил]фенил}карбамат,
трет-бутил {4-[2-(2-{[(2S,5R)-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}гидразинил)-2-оксоэтил]фенил}карбамат тетрабутиламмония,
(2S,5R)-N'-(метоксиацетил)-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбогидразид натрия,
(2S,5R)-6-бензилокси-N'-(метоксиацетил)-7-оксо-1,6-диазабицикло[3.2.1]октан-2-карбогидразид,
(2S,5R)-6-гидрокси-N'-(метоксиацетил)-7-оксо-1,6-диазабицикло[3.2.1]октан-2-карбогидразид,
(2S,5R)-N'-(метоксиацетил)-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбогидразид пиридиния,
(2S,5R)-N'-бензоил-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбогидразид натрия,
(2S,5R)-N'-бензоил-6-бензилокси-7-оксо-1,6-диазабицикло[3.2.1]октан-2-карбогидразид,
(2S,5R)-N'-бензоил-6-гидрокси-7-оксо-1,6-диазабицикло[3.2.1]октан-2-карбогидразид,
(2S,5R)-N'-бензоил-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбогидразид пиридиния,
(2S,5R)-N'-(4-аминобензоил)-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбогидразид,
трет-бутил {4-[(2-{[(2S,5R)-6-бензилокси-7-оксо-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}гидразинил)карбонил]фенил}карбамат,
трет-бутил {4-[(2-{[(2S,5R)-6-гидрокси-7-оксо-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}гидразинил)карбонил]фенил}карбамат,
трет-бутил {4-[(2-{[(2S,5R)-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}гидразинил)карбонил]фенил}карбамат тетрабутиламмония,
(2S,5R)-N'-(4-(аминометил)бензоил)-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбогидразид,
трет-бутил {4-[(2-{[(2S,5R)-6-бензилокси-7-оксо-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}гидразинил)карбонил]бензил}карбамат,
трет-бутил {4-[(2-{[(2S,5R)-6-гидрокси-7-оксо-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}гидразинил)карбонил]бензил}карбамат,
трет-бутил {4-[(2-{[(2S,5R)-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}гидразинил)карбонил]бензил}карбамат пиридиния,
(2S,5R)-7-оксо-N-(2-оксопирролидин-1-ил)-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбоксамид натри,
(2S,5R)-6-бензилокси-7-оксо-N-(2-оксопирролидин-1-ил)-1,6-диазабицикло[3.2.1]октан-2-карбоксамид,
(2S,5R)-6-гидрокси-7-оксо-N-(2-оксопирролидин-1-ил)-1,6-диазабицикло[3.2.1]октан-2-карбоксамид,
(2S,5R)-7-оксо-N-(2-оксопирролидин-1-ил)-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбоксамид пиридиния,
(2S,5R)-7-оксо-6-(сульфоокси)-N'-(тетрагидро-2Н-пиран-4-илкарбонил)-1,6-диазабицикло[3.2.1]октан-2-карбогидразид натрия,
(2S,5R)-6-бензилокси-7-оксо-N'-(тетрагидро-2Н-пиран-4-илкарбонил)-1,6-диазабицикло[3.2.1]октан-2-карбогидразид,
(2S,5R)-6-гидрокси-7-оксо-N'-(тетрагидро-2Н-пиран-4-илкарбонил)-1,6-диазабицикло[3.2.1]октан-2-карбогидразид,
(2S,5R)-7-оксо-6-(сульфоокси)-N'-(тетрагидро-2Н-пиран-4-илкарбонил)-1,6-диазабицикло[3.2.1]октан-2-карбогидразид пиридиния,
(2S,5R)-7-оксо-N'-(пиперидин-4-илкарбонил)-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбогидразид,
трет-бутил 4-[(2-{[(2S,5R)-6-бензилокси-7-оксо-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}гидразинил)карбонил]пиперидин-1-карбоксилат,
трет-бутил 4-[(2-{[(2S,5R)-6-гидрокси-7-оксо-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}гидразинил)карбонил]пиперидин-1-карбоксилат,
трет-бутил 4-[(2-{[(2S,5R)-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}гидразинил)карбонил]пиперидин-1-карбоксилат пиридиния,
(2S,5R)-7-оксо-N'-[(2S)-пиперидин-2-илкарбонил]-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбогидразид,
трет-бутил (2S)-2-[(2-{[(2S,5R)-6-бензилокси-7-оксо-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}гидразинил)карбонил]пиперидин-1-карбоксилат,
трет-бутил (2S)-2-[(2-{[(2S,5R)-6-гидрокси-7-оксо-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}гидразинил)карбонил]пиперидин-1-карбоксилат,
трет-бутил (2S)-2-[(2-{[(2S,5R)-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}гидразинил)карбонил]пиперидин-1-карбоксилат тетрабутиламмония,
(2S,5R)-7-оксо-N'-[(2R)-пиперидин-2-илкарбонил]-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбогидразид,
трет-бутил (2R)-2-[(2-{[(2S,5R)-6-бензилокси-7-оксо-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}гидразинил)карбонил]пиперидин-1-карбоксилат,
трет-бутил (2R)-2-[(2-{[(2S,5R)-6-гидрокси-7-оксо-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}гидразинил)карбонил]пиперидин-1-карбоксилат,
трет-бутил (2R)-2-[(2-{[(2S,5R)-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}гидразинил)карбонил]пиперидин-1-карбоксилат тетрабутиламмония,
(2S,5R)-7-оксо-N'-[(2S)-пирролидин-2-илкарбонил]-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбогидразид,
трет-бутил (2S)-2-[(2-{[(2S,5R)-6-бензилокси-7-оксо-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}гидразинил)карбонил]пирролидин-1-карбоксилат,
трет-бутил (2S)-2-[(2-{[(2S,5R)-6-гидрокси-7-оксо-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}гидразинил)карбонил]пирролидин-1-карбоксилат,
трет-бутил (2S)-2-[(2-{[(2S,5R)-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}гидразинил)карбонил]пирролидин-1-карбоксилат тетрабутиламмония,
(2S,5R)-7-оксо-N'-[(2R)-пирролидин-2-илкарбонил]-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбогидразид,
трет-бутил (2R)-2-[(2-{[(2S,5R)-6-бензилокси-7-оксо-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}гидразинил)карбонил]пирролидин-1-карбоксилат,
трет-бутил (2R)-2-[(2-{[(2S,5R)-6-гидрокси-7-оксо-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}гидразинил)карбонил]пирролидин-1-карбоксилат,
трет-бутил (2R)-2-[(2-{[(2S,5R)-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}гидразинил)карбонил]пирролидин-1-карбоксилат тетрабутиламмония,
(2S,5R)-N'-{[(2S,4R)-4-циклопропилметилпиперидин-2-ил]карбонил}-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбогидразид,
трет-бутил (2S,4R)-2-[(2-{[(2S,5R)-6-бензилокси-7-оксо-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}гидразинил)карбонил]-4-циклопропилметилпиперидин-1-карбоксилат,
трет-бутил (2S,4R)-4-циклопропилметил-2-[(2-{[(2S,5R)-6-гидрокси-7-оксо-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}гидразинил)карбонил]пиперидин-1-карбоксилат,
трет-бутил (2S,4R)-4-циклопропилметил-2-[(2-{[(2S,5R)-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}гидразинил)карбонил]пиперидин-1-карбоксилат тетрабутиламмония,
(2S,5R)-7-оксо-N'-{[(2S)-5-оксопирролидин-2-ил]карбонил}-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбогидразид натрия,
трет-бутил (2S)-2-[(2-{[(2S,5R)-6-бензилокси-7-оксо-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}гидразинил)карбонил]-5-оксопирролидин-1-карбоксилат,
трет-бутил (2S)-2-[(2-{[(2S,5R)-6-гидрокси-7-оксо-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}гидразинил)карбонил]-5-оксопирролидин-1-карбоксилат,
трет-бутил (2S)-2-[(2-{[(2S,5R)-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}гидразинил)карбонил]-5-оксопирролидин-1-карбоксилат тетрабутиламмония,
(2S,5R)-7-оксо-N'-{[(2R)-5-оксопирролидин-2-ил]карбонил}-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбогидразид натрия,
трет-бутил (2R)-2-[(2-{[(2S,5R)-6-бензилокси-7-оксо-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}гидразинил)карбонил]-5-оксопирролидин-1-карбоксилат,
трет-бутил (2R)-2-[(2-{[(2S,5R)-6-гидрокси-7-оксо-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}гидразинил)карбонил]-5-оксопирролидин-1-карбоксилат,
трет-бутил (2R)-2-[(2-{[(2S,5R)-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}гидразинил)карбонил]-5-оксопирролидин-1-карбоксилат тетрабутиламмония,
(2S,5R)-N'-(фуран-2-илкарбонил)-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбогидразид натрия,
(2S,5R)-6-бензилокси-N'-(фуран-2-илкарбонил)-7-оксо-1,6-диазабицикло[3.2.1]октан-2-карбогидразид,
(2S,5R)-N'-(фуран-2-илкарбонил)-6-гидрокси-7-оксо-1,6-диазабицикло[3.2.1]октан-2-карбогидразид,
(2S,5R)-N'-(фуран-2-илкарбонил)-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбогидразид пиридиния,
(2S,5R)-N'-(1,3-оксазол-4-илкарбонил)-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбогидразид натрия,
(2S,5R)-6-бензилокси-N'-(1,3-оксазол-4-илкарбонил)-7-оксо-1,6-диазабицикло[3.2.1]октан-2-карбогидразид,
(2S,5R)-6-гидрокси-N'-(1,3-оксазол-4-илкарбонил)-7-оксо-1,6-диазабицикло[3.2.1]октан-2-карбогидразид,
(2S,5R)-N'-(1,3-оксазол-4-илкарбонил)-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбогидразид пиридиния,
(2S,5R)-7-оксо-N'-(пиридин-3-илкарбонил)-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбогидразид натрия,
(2S,5R)-6-бензилокси-7-оксо-N'-(пиридин-3-илкарбонил)-1,6-диазабицикло[3.2.1]октан-2-карбогидразид,
(2S,5R)-6-гидрокси-7-оксо-N'-(пиридин-3-илкарбонил)-1,6-диазабицикло[3.2.1]октан-2-карбогидразид,
(2S,5R)-7-оксо-N'-(пиридин-3-илкарбонил)-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбогидразид пиридиния,
(2S,5R)-7-оксо-N'-(пиридин-4-илкарбонил)-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбогидразид натрия,
(2S,5R)-6-бензилокси-7-оксо-N'-(пиридин-4-илкарбонил)-1,6-диазабицикло[3.2.1]октан-2-карбогидразид,
(2S,5R)-6-гидрокси-7-оксо-N'-(пиридин-4-илкарбонил)-1,6-диазабицикло[3.2.1]октан-2-карбогидразид,
(2S,5R)-7-оксо-N'-(пиридин-4-илкарбонил)-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбогидразид пиридиния,
N,N-диметил-2-{[(2S,5R)-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}гидразинкарбоксамид натрия,
2-{[(2S,5R)-6-бензилокси-7-оксо-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}-N,N-диметилгидразинкарбоксамид,
2-{[(2S,5R)-6-гидрокси-7-оксо-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}-N,N-диметилгидразинкарбоксамид,
2-{[(2S,5R)-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}-N,N-диметилгидразинкарбоксамид пиридиния,
N,N-диэтил-2-{[(2S,5R)-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}гидразинкарбоксамид натрия,
2-{[(2S,5R)-6-бензилокси-7-оксо-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}-N,N-диэтилгидразинкарбоксамид,
N,N-диэтил-2-{[(2S,5R)-6-гидрокси-7-оксо-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}гидразинкарбоксамид,
N,N-диэтил-2-{[(2S,5R)-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}гидразинкарбоксамид пиридиния,
2-{[(2S,5R)-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}-N-фенилгидразинкарбоксамид натрия,
2-{[(2S,5R)-6-бензилокси-7-оксо-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}-N-фенилгидразинкарбоксамид,
2-{[(2S,5R)-6-гидрокси-7-оксо-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}-N-фенилгидразинкарбоксамид,
2-{[(2S,5R)-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}-N-фенилгидразинкарбоксамид пиридиния,
(2S,5R)-N'-(морфолин-4-илкарбонил)-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбогидразид натрия,
(2S,5R)-6-бензилокси-N'-(морфолин-4-илкарбонил)-7-оксо-1,6-диазабицикло[3.2.1]октан-2-карбогидразид,
(2S,5R)-6-гидрокси-N'-(морфолин-4-илкарбонил)-7-оксо-1,6-диазабицикло[3.2.1]октан-2-карбогидразид,
(2S,5R)-N'-(морфолин-4-илкарбонил)-7-оксо-6-(сульфоокси)-1,6-диазабицикло [3.2.1]октан-2-карбогидразид пиридиния,
метил 2-{[(2S,5R)-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}гидразинкарбоксилат натрия,
метил 2-{[(2S,5R)-6-бензилокси-7-оксо-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}гидразинкарбоксилат,
метил 2-{[(2S,5R)-6-гидрокси-7-оксо-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}гидразинкарбоксилат,
метил 2-{[(2S,5R)-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}гидразинкарбоксилат тетрабутиламмония,
этил 2-{[(2S,5R)-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}гидразинкарбоксилат натрия,
этил 2-{[(2S,5R)-6-бензилокси-7-оксо-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}гидразинкарбоксилат,
этил 2-{[(2S,5R)-6-гидрокси-7-оксо-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}гидразинкарбоксилат,
этил 2-{[(2S,5R)-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}гидразинкарбоксилат пиридиния,
трет-бутил 2-{[(2S,5R)-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}гидразинкарбоксилат натрия,
трет-бутил 2-{[(2S,5R)-6-бензилокси-7-оксо-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}гидразинкарбоксилат,
трет-бутил 2-{[(2S,5R)-6-гидрокси-7-оксо-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}гидразинкарбоксилат,
трет-бутил 2-{[(2S,5R)-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}гидразинкарбоксилат пиридиния,
(2S,5R)-N'-(метилсульфонил)-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбогидразид натрия,
(2S,5R)-6-бензилокси-N'-(метилсульфонил)-7-оксо-1,6-диазабицикло[3.2.1]октан-2-карбогидразид,
(2S,5R)-6-гидрокси-N'-(метилсульфонил)-7-оксо-1,6-диазабицикло[3.2.1]октан-2-карбогидразид,
(2S,5R)-N'-(метилсульфонил)-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбогидразид пиридиния,
(2S,5R)-N-(морфолин-4-ил)-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбоксамид натрия,
(2S,5R)-6-бензилокси-N-(морфолин-4-ил)-7-оксо-1,6-диазабицикло[3.2.1]октан-2-карбоксамид,
(2S,5R)-6-гидрокси-N-(морфолин-4-ил)-7-оксо-1,6-диазабицикло[3.2.1]октан-2-карбоксамид,
(2S,5R)-N-(морфолин-4-ил)-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбоксамид пиридиния,
(2S,5R)-N-метокси-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбоксамид натрия,
(2S,5R)-6-бензилокси-N-метокси-7-оксо-1,6-диазабицикло[3.2.1]октан-2-карбоксамид,
(2S,5R)-6-гидрокси-N-метокси-7-оксо-1,6-диазабицикло[3.2.1]октан-2-карбоксамид,
(2S,5R)-N-метокси-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбоксамид тетрабутиламмония,
(2S,5R)-N-этокси-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбоксамид натрия,
(2S,5R)-6-бензилокси-N-этокси-7-оксо-1,6-диазабицикло[3.2.1]октан-2-карбоксамид,
(2S,5R)-N-этокси-6-гидрокси-7-оксо-1,6-диазабицикло[3.2.1]октан-2-карбоксамид,
(2S,5R)-N-этокси-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбоксамид пиридиния,
(2S,5R)-N-(циклобутилметокси)-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбоксамид натрий,
(2S,5R)-6-бензилокси-N-(циклобутилметокси)-7-оксо-1,6-диазабицикло[3.2.1]октан-2-карбоксамид,
(2S,5R)-N-(циклобутилметокси)-6-гидрокси-7-оксо-1,6-диазабицикло[3.2.1]октан-2-карбоксамид,
(2S,5R)-N-(циклобутилметокси)-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбоксамид пиридиния,
(2S,5R)-N-(2-аминоэтокси)-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбоксамид,
трет-бутил {2-[({[(2S,5R)-6-бензилокси-7-оксо-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}амино)окси]этил}карбамат,
трет-бутил {2-[({[(2S,5R)-6-гидрокси-7-оксо-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}амино)окси]этил}карбамат,
трет-бутил {2-[({[(2S,5R)-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}амино)окси]этил}карбамат тетрабутиламмония,
трет-бутил {2-[({[(2S,5R)-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}амино)окси]этил}карбамат пиридиния,
трет-бутил {2-[({[(2S,5R)-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}амино)окси]этил}карбамат натрия,
(2S,5R)-N-[2-(метиламино)этокси]-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбоксамид,
трет-бутил {2-[({[(2S,5R)-6-бензилокси-7-оксо-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}амино)окси]этил}метилкарбамат,
трет-бутил {2-[({[(2S,5R)-6-гидрокси-7-оксо-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}амино)окси]этил}метилкарбамат,
трет-бутил {2-[({[(2S,5R)-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}амино)окси]этил}метилкарбамат тетрабутиламмония,
(2S,5R)-N-[2-(этиламино)этокси]-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбоксамид,
трет-бутил {2-[({[(2S,5R)-6-бензилокси-7-оксо-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}амино)окси]этил}этилкарбамат,
трет-бутил этил{2-[({[(2S,5R)-6-гидрокси-7-оксо-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}амино)окси]этил}карбамат,
трет-бутил {2-[({[(2S,5R)-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}амино)окси]этил}этилкарбамат тетрабутиламмония,
(2S,5R)-7-оксо-N-[2-(пропиламино)этокси]-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбоксамид,
трет-бутил {2-[({[(2S,5R)-6-бензилокси-7-оксо-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}амино)окси]этил}пропилкарбамат,
трет-бутил {2-[({[(2S,5R)-6-гидрокси-7-оксо-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}амино)окси]этил}пропилкарбамат,
трет-бутил {2-[({[(2S,5R)-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}амино)окси]этил}пропилкарбамат тетрабутиламмония,
(2S,5R)-7-оксо-N-[2-(пропан-2-иламино)этокси]-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбоксамид,
трет-бутил {2-[({[(2S,5R)-6-бензилокси-7-оксо-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}амино)окси]этил}пропан-2-илкарбамат,
трет-бутил {2-[({[(2S,5R)-6-гидрокси-7-оксо-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}амино)окси]этил}пропан-2-илкарбамат,
трет-бутил {2-[({[(2S,5R)-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}амино)окси]этил}пропан-2-илкарбамат тетрабутиламмония,
(2S,5R)-N-[2-(диметиламино)этокси]-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбоксамид,
(2S,5R)-6-бензилокси-N-[2-(диметиламино)этокси]-7-оксо-1,6-диазабицикло[3.2.1]октан-2-карбоксамид,
(2S,5R)-N-[2-(диметиламино)этокси]-6-гидрокси-7-оксо-1,6-диазабицикло[3.2.1]октан-2-карбоксамид,
(2S,5R)-N-[2-(диметиламино)этокси]-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбоксамид пиридиния,
(2S,5R)-N-{[(2S)-2-аминопропил]окси}-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбоксамид,
трет-бутил {(2S)-1-[({[(2S,5R)-6-бензилокси-7-оксо-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}амино)окси]-2-ил}карбамат,
трет-бутил {(2S)-1-[({[(2S,5R)-6-гидрокси-7-оксо-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}амино)окси]-2-ил}карбамат,
трет-бутил {(2S)-1-[({[(2S,5R)-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}амино)окси]пропан-2-ил}карбамат тетрабутиламмония,
(2S,5R)-N-{[(2R)-2-аминопропил]окси}-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбоксамид,
трет-бутил {(2R)-1-[({[(2S,5R)-6-бензилокси-7-оксо-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}амино)окси]-2-ил}карбамат,
трет-бутил {(2R)-1-[({[(2S,5R)-6-гидрокси-7-оксо-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}амино)окси]пропан-2-ил}карбамат,
трет-бутил {(2R)-1-[({[(2S,5R)-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}амино)окси]пропан-2-ил}карбамат тетрабутиламмония,
(2S,5R)-N-{[(2S)-1-аминопропан-2-ил]окси}-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбоксамид,
трет-бутил {(2S)-2-[({[(2S,5R)-6-бензилокси-7-оксо-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}амино)окси]пропил}карбамат,
трет-бутил {(2S)-2-[({[(2S,5R)-6-гидрокси-7-оксо-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}амино)окси]пропил}карбамат,
трет-бутил {(2S)-2-[({[(2S,5R)-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}амино)окси]пропил}карбамат тетрабутиламмония,
(2S,5R)-N-(3-аминопропокси)-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбоксамид,
трет-бутил {3-[({[(2S,5R)-6-бензилокси-7-оксо-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}амино)окси]пропил}карбамат,
трет-бутил {3-[({[(2S,5R)-6-гидрокси-7-оксо-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}амино)окси]пропил}карбамат,
трет-бутил {3-[({[(2S,5R)-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}амино)окси]пропил}карбамат тетрабутиламмония,
(2S,5R)-2-(1,2-оксазолидин-2-илкарбонил)-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-7-он натрия,
(2S,5R)-6-бензилокси-2-(1,2-оксазолидин-2-илкарбонил)-1,6-диазабицикло[3.2.1]октан-7-он,
(2S,5R)-6-гидрокси-2-(1,2-оксазолидин-2-илкарбонил)-1,6-диазабицикло[3.2.1]октан-7-он,
(2S,5R)-2-(1,2-оксазолидин-2-илкарбонил)-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-7-он пиридиния,
(2S,5R)-2-(1,2-оксазинан-2-илкарбонил)-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-7-он натрия,
(2S,5R)-6-бензилокси-2-(1,2-оксазинан-2-илкарбонил)-1,6-диазабицикло[3.2.1]октан-7-он,
(2S,5R)-6-гидрокси-2-(1,2-оксазинан-2-илкарбонил)-1,6-диазабицикло[3.2.1]октан-7-он,
(2S,5R)-2-(1,2-оксазинан-2-илкарбонил)-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-7-он пиридиния,
(2S,5R)-N-[2-(морфолин-4-ил)этокси]-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбоксамид натрия,
(2S,5R)-6-бензилокси-N-[2-(морфолин-4-ил)этокси]-7-оксо-1,6-диазабицикло[3.2.1]октан-2-карбоксамид,
(2S,5R)-6-гидрокси-N-[2-(морфолин-4-ил)этокси]-7-оксо-1,6-диазабицикло[3.2.1]октан-2-карбоксамид,
(2S,5R)-N-[2-(морфолин-4-ил)этокси]-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбоксамид пиридиния,
(2S,5R)-7-оксо-N-[2-(пиперазин-1-ил)этокси]-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбоксамид,
трет-бутил-4-{2-[({[(2S,5R)-6-бензилокси-7-оксо-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}амино)окси]этил}пиперазин-1-карбоксилат,
трет-бутил 4-{2-[({[(2S,5R)-6-гидрокси-7-оксо-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}амино)окси]этил}пиперазин-1-карбоксилат,
трет-бутил 4-{2-[({[(2S,5R)-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}амино)окси]этил}пиперазин-1-карбоксилат тетрабутиламмония,
(2S,5R)-7-оксо-N-[2-(1,4-диазепан-1-ил)этокси]-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбоксамид,
трет-бутил 4-{2-[({[(2S,5R)-6-бензилокси-7-оксо-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}амино)окси]этил}-1,4-диазепан-1-карбоксилат,
трет-бутил 4-{2-[({[(2S,5R)-6-гидрокси-7-оксо-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}амино)окси]этил}-1,4-диазепан-1-карбоксилат,
трет-бутил 4-{2-[({[(2S,5R)-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}амино)окси]этил}-1,4-диазепан-1-карбоксилат пиридиния,
(2S,5R)-N-[(2S)-азетидин-2-илметокси]-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбоксамид,
трет-бутил (2S)-2-{[({[(2S,5R)-6-бензилокси-7-оксо-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}амино)окси]метил}азетидин-1-карбоксилат,
трет-бутил (2S)-2-{[({[(2S,5R)-6-гидрокси-7-оксо-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}амино)окси]метил}азетидин-1-карбоксилат,
трет-бутил (2S)-2-{[({[(2S,5R)-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}амино)окси]метил}азетидин-1-карбоксилат тетрабутиламмония,
(2S,5R)-7-оксо-N-[(2S)-пирролидин-2-илметокси]-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбоксамид,
трет-бутил (2S)-2-{[({[(2S,5R)-6-бензилокси-7-оксо-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}амино)окси]метил}пирролидин-1-карбоксилат,
трет-бутил (2S)-2-{[({[(2S,5R)-6-гидрокси-7-оксо-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}амино)окси]метил}пирролидин-1-карбоксилат,
трет-бутил (2S)-2-{[({[(2S,5R)-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}амино)окси]метил}пирролидин-1-карбоксилат пиридиния,
(2S,5R)-7-оксо-N-[(2R)-пирролидин-2-илметокси]-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбоксамид,
трет-бутил (2R)-2-{[({[(2S,5R)-6-бензилокси-7-оксо-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}амино)окси]метил}пирролидин-1-карбоксилат,
трет-бутил (2R)-2-{[({[(2S,5R)-6-гидрокси-7-оксо-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}амино)окси]метил}пирролидин-1-карбоксилат,
трет-бутил (2R)-2-{[({[(2S,5R)-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}амино)окси]метил}пирролидин-1-карбоксилат тетрабутиламмония,
(2S,5R)-7-оксо-N-[(2S)-пиперидин-2-илметокси]-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбоксамид,
трет-бутил (2S)-2-{[({[(2S,5R)-6-бензилокси-7-оксо-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}амино)окси]метил}пиперидин-1-карбоксилат,
трет-бутил (2S)-2-{[({[(2S,5R)-6-гидрокси-7-оксо-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}амино)окси]метил}пиперидин-1-карбоксилат,
трет-бутил (2S)-2-{[({[(2S,5R)-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}амино)окси]метил}пиперидин-1-карбоксилат тетрабутиламмония,
(2S,5R)-N-(азетидин-3-илокси)-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбоксамид,
трет-бутил 3-[({[(2S,5R)-6-бензилокси-7-оксо-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}амино)окси]азетидин-1-карбоксилат,
трет-бутил 3-[({[(2S,5R)-6-гидрокси-7-оксо-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}амино)окси]азетидин-1-карбоксилат,
трет-бутил-3-[({[(2S,5R)-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}амино)окси]азетидин-1-карбоксилат тетрабутиламмония,
(2S,5R)-7-оксо-N-[(3R)-пирролидин-3-илокси]-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбоксамид,
трет-бутил (3R)-3-[({[(2S,5R)-6-бензилокси-7-оксо-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}амино)окси]пирролидин-1-карбоксилат,
трет-бутил (3R)-3-[({[(2S,5R)-6-гидрокси-7-оксо-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}амино)окси]пирролидин-1-карбоксилат,
трет-бутил (3R)-3-[({[(2S,5R)-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}амино)окси]пирролидин-1-карбоксилат тетрабутиламмония,
(2S,5R)-7-оксо-N-[(3S)-пирролидин-3-илокси]-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбоксамид,
трет-бутил (3S)-3-[({[(2S,5R)-6-бензилокси-7-оксо-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}амино)окси]пирролидин-1-карбоксилат,
трет-бутил (3S)-3-[({[(2S,5R)-6-гидрокси-7-оксо-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}амино)окси]пирролидин-1-карбоксилат,
трет-бутил (3S)-3-[({[(2S,5R)-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}амино)окси]пирролидин-1-карбоксилат тетрабутиламмония,
(2S,5R)-N-(азетидин-3-илметокси)-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбоксамид,
трет-бутил 3-{[({[(2S,5R)-6-бензилокси-7-оксо-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}амино)окси]метил}азетидин-1-карбоксилат,
трет-бутил 3-{[({[(2S,5R)-6-гидрокси-7-оксо-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}амино)окси]метил}азетидин-1-карбоксилат,
трет-бутил-3-{[({[(2S,5R)-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}амино)окси]метил}азетидин-1-карбоксилат тетрабутиламмония,
(2S,5R)-7-оксо-N-[(3R)-пиперидин-3-илметокси]-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбоксамид,
трет-бутил (3R)-3-{[({[(2S,5R)-6-бензилокси-7-оксо-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}амино)окси]метил}пиперидин-1-карбоксилат,
трет-бутил (3R)-3-{[({[(2S,5R)-6-гидрокси-7-оксо-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}амино)окси]метил}пиперидин-1-карбоксилат,
трет-бутил (3R)-3-{[({[(2S,5R)-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}амино)окси]метил}пиперидин-1-карбоксилат тетрабутиламмония,
(2S,5R)-7-оксо-N-(пиперидин-4-илокси)-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбоксамид,
трет-бутил 4-[({[(2S,5R)-6-бензилокси-7-оксо-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}амино)окси]пиперидин-1-карбоксамид,
трет-бутил 4-[({[(2S,5R)-6-гидрокси-7-оксо-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}амино)окси]пиперидин-1-карбоксилат,
трет-бутил 4-[({[(2S,5R)-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}амино)окси]пиперидин-1-карбоксилат тетрабутиламмония,
(2S,5R)-7-оксо-N-(пиперидин-4-илметокси)-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбоксамид,
трет-бутил 4-{[({[(2S,5R)-6-бензилокси-7-оксо-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}амино)окси]метил}пиперидин-1-карбоксилат,
трет-бутил 4-{[({[(2S,5R)-6-гидрокси-7-оксо-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}амино)окси]метил}пиперидин-1-карбоксилат,
трет-бутил 4-{[({[(2S,5R)-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}амино)окси]метил}пиперидин-1-карбоксилат тетрабутиламмония,
(2S,5R)-N-[2-(1Н-имидазол-1-ил)этокси]-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбоксамид натрия,
(2S,5R)-6-бензилокси-N-[2-(1Н-имидазол-1-ил)этокси]-7-оксо-1,6-диазабицикло[3.2.1]октан-2-карбоксамид,
(2S,5R)-6-гидрокси-N-[2-(1Н-имидазол-1-ил)этокси]-7-оксо-1,6-диазабицикло[3.2.1]октан-2-карбоксамид,
(2S,5R)-N-[2-(1Н-имидазол-1-ил)этокси]-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбоксамид пиридиния,
(2S,5R)-7-оксо-N-[2-(1Н-пиррол-1-ил)этокси]-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбоксамид натрия,
(2S,5R)-6-бензилокси-7-оксо-N-[2-(1Н-пиррол-1-ил)этокси]-1,6-диазабицикло[3.2.1]октан-2-карбоксамид,
(2S,5R)-6-гидрокси-7-оксо-N-[2-(1Н-пиррол-1-ил)этокси]-1,6-диазабицикло[3.2.1]октан-2-карбоксамид,
(2S,5R)-7-оксо-N-[2-(1Н-пиррол-1-ил)этокси]-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбоксамид пиридиния,
1-{2-[({[(2S,5R)-7-оксо-6-(сульфонатокси)-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}амино)окси]этил}-1Н-имидазол-2-сульфонат динатрия,
(2S,5R)-6-бензилокси-N-[2-(1Н-имидазол-1-ил)этокси]-7-оксо-1,6-диазабицикло[3.2.1]октан-2-карбоксамид,
(2S,5R)-6-гидрокси-N-[2-(1Н-имидазол-1-ил)этокси]-7-оксо-1,6-диазабицикло[3.2.1]октан-2-карбоксамид,
1-{2-[({[(2S,5R)-7-оксо-6-(сульфонатокси)-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}амино)окси]этил}-1Н-имидазол-1-ий-2-сульфонат пиридиния,
(2S,5R)-N-[2-(диметиламино)-2-оксоэтокси]-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбоксамид натрия,
(2S,5R)-6-бензилокси-N-[2-(диметиламино)-2-оксоэтокси]-7-оксо-1,6-диазабицикло[3.2.1]октан-2-карбоксамид,
(2S,5R)-N-[2-(диметиламино)-2-оксоэтокси]-6-гидрокси-7-оксо-1,6-диазабицикло[3.2.1]октан-2-карбоксамид,
(2S,5R)-N-[2-(диметиламино)-2-оксоэтокси]-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбоксамид пиридиния,
(2S,5R)-7-оксо-N-[2-оксо-2-(пиперазин-1-ил)этокси]-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбоксамид,
трет-бутил 4-{[({[(2S,5R)-6-бензилокси-7-оксо-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}амино)окси]ацетил}пиперазин-1-карбоксилат,
трет-бутил 4-{[({[(2S,5R)-6-гидрокси-7-оксо-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}амино)окси]ацетил}пиперазин-1-карбоксилат,
трет-бутил 4-{[({[(2S,5R)-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}амино)окси]ацетил}пиперазин-1-карбоксилат тетрабутиламмония,
(2S,5R)-N-[2-(морфолин-4-ил)-2-оксоэтокси]-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбоксамид натрия,
(2S,5R)-6-бензилокси-N-[2-(морфолин-4-ил)-2-оксоэтокси]-7-оксо-1,6-диазабицикло[3.2.1]октан-2-карбоксамид,
(2S,5R)-6-гидрокси-N-[2-(морфолин-4-ил)-2-оксоэтокси]-7-оксо-1,6-диазабицикло[3.2.1]октан-2-карбоксамид,
(2S,5R)-N-[2-(морфолин-4-ил)-2-оксоэтокси]-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбоксамид пиридиния,
(2S,5R)-N-[2-(1,4-диазепан-1-ил)-2-оксоэтокси]-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбоксамид,
трет-бутил 4-{[({[(2S,5R)-6-бензилокси-7-оксо-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}амино)окси]ацетил}-1,4-диазепан-1-карбоксилат,
трет-бутил 4-{[({[(2S,5R)-6-гидрокси-7-оксо-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}амино)окси]ацетил}-1,4-диазепан-1-карбоксилат,
трет-бутил 4-{[({[(2S,5R)-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}амино)окси]ацетил}-1,4-диазепан-1-карбоксилат тетрабутиламмония,
(2S,5R)-7-оксо-N-[2-(2-оксопирролидин-1-ил)этокси]-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбоксамид натрия,
(2S,5R)-6-бензилокси-7-оксо-N-[2-(2-оксопирролидин-1-ил)этокси]-1,6-диазабицикло[3.2.1]октан-2-карбоксамид,
(2S,5R)-6-гидрокси-7-оксо-N-[2-(2-оксопирролидин-1-ил)этокси]-1,6-диазабицикло[3.2.1]октан-2-карбоксамид,
(2S,5R)-7-оксо-N-[2-(2-оксопирролидин-1-ил)этокси]-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбоксамид пиридиния,
(2S,5R)-7-оксо-N-[2-(2-оксоимидазолин-1-ил)этокси]-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбоксамид натрия,
(2S,5R)-6-бензилокси-7-оксо-N-[2-(2-оксоимидазолин-1-ил)этокси]-1,6-диазабицикло[3.2.1]октан-2-карбоксамид,
(2S,5R)-6-гидрокси-7-оксо-N-[2-(2-оксоимидазолидин-1-ил)этокси]-1,6-диазабицикло[3.2.1]октан-2-карбоксамид,
(2S,5R)-7-оксо-N-[2-(2-оксоимидазолидин-1-ил)этокси]-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбоксамид пиридиния,
(2S,5R)-N-(2-гидроксиэтокси)-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбоксамид натрия,
(2S,5R)-6-бензилокси-7-оксо-N-(2-триизопропилсилилоксиэтокси)-1,6-диазабицикло[3.2.1]октан-2-карбоксамид,
(2S,5R)-6-гидрокси-7-оксо-N-(2-триизопропилсилилоксиэтокси)-1,6-диазабицикло[3.2.1]октан-2-карбоксамид,
(2S,5R)-7-оксо-6-(сульфоокси)-N-(2-триизопропилсилилоксиэтокси)-1,6-диазабицикло[3.2.1]октан-2-карбоксамид тетрабутиламмония,
(2S,5R)-N-(2-метоксиэтокси)-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбоксамид натрия,
(2S,5R)-6-бензилокси-N-(2-метоксиэтокси)-7-оксо-1,6-диазабицикло[3.2.1]октан-2-карбоксамид,
(2S,5R)-6-гидрокси-N-(2-метоксиэтокси)-7-оксо-1,6-диазабицикло[3.2.1]октан-2-карбоксамид,
(2S,5R)-N-(2-метоксиэтокси)-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбоксамид пиридиния,
(2S,5R)-N-[2-(метилсульфонил)этокси]-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбоксамид натрия,
(2S,5R)-6-бензилокси-N-[2-(метилсульфонил)этокси]-7-оксо-1,6-диазабицикло[3.2.1]октан-2-карбоксамид,
(2S,5R)-6-гидрокси-N-[2-(метилсульфонил)этокси]-7-оксо-1,6-диазабицикло[3.2.1]октан-2-карбоксамид,
(2S,5R)-N-[2-(метилсульфонил)этокси]-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбоксамид пиридиния,
{2-[({[(2S,5R)-6-бензилокси-7-оксо-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}амино)окси]этил}карбамат бензила, и
трет-бутил {2-[({[(2S,5R)-6-гидрокси-7-оксо-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}амино)окси]этил}карбамат.
Кроме того, в качестве конкретных примеров соединений в соответствии с данным изобретением предпочтительно указаны следующие группы соединений.
в указанных выше формулах P2 является трет-бутоксикарбонилом (Вoc), бензилоксикарбонилом (Cbz) или Н, P3 является бензилом (Bn), Н или SO3M; где М является Н, натрием, пиридинием или тетрабутиламмонием.
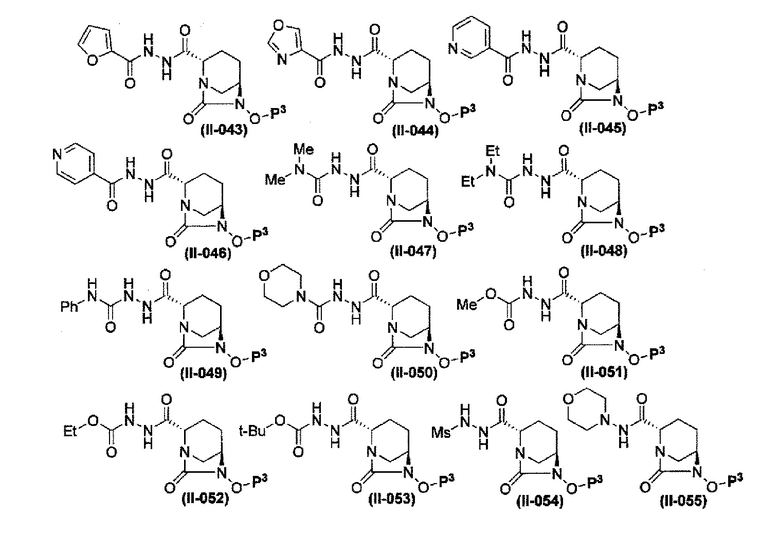
в указанных выше формулах P2 является трет-бутоксикарбонилом (Вoc), бензилоксикарбонилом (Cbz) или Н, P3 является бензилом (Bn), Н или SO3M; где М является Н, натрием, пиридинием или тетрабутиламмонием и Ms является метилсульфонилом.
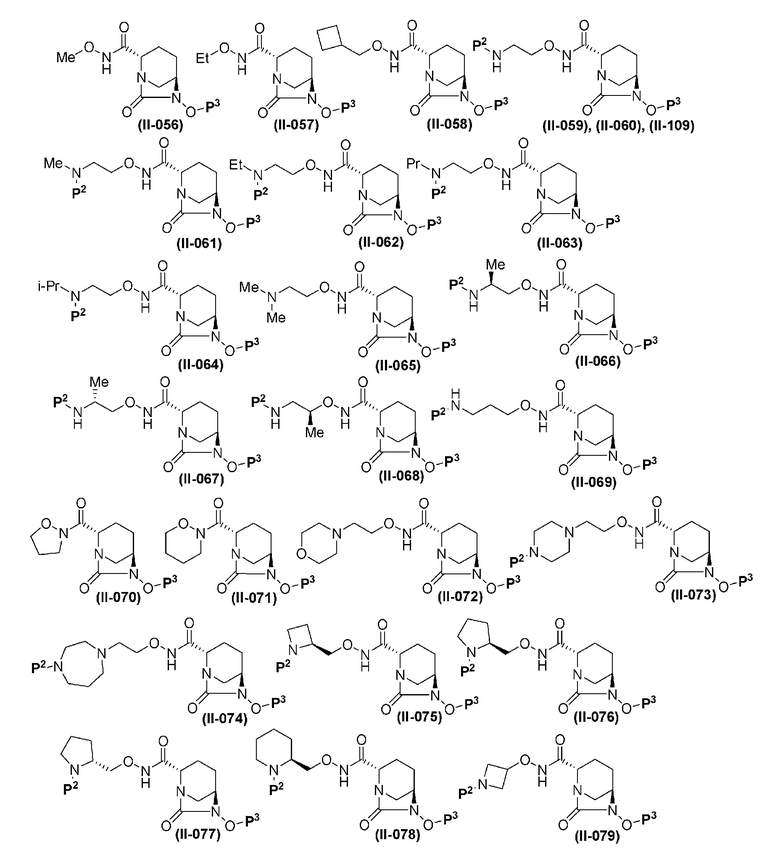
в указанных выше формулах P2 является трет-бутоксикарбонилом (Вoc), бензилоксикарбонилом (Cbz) или Н, P3 является бензилом (Bn), Н или SO3M; где М является Н, натрием, пиридинием или тетрабутиламмонием.
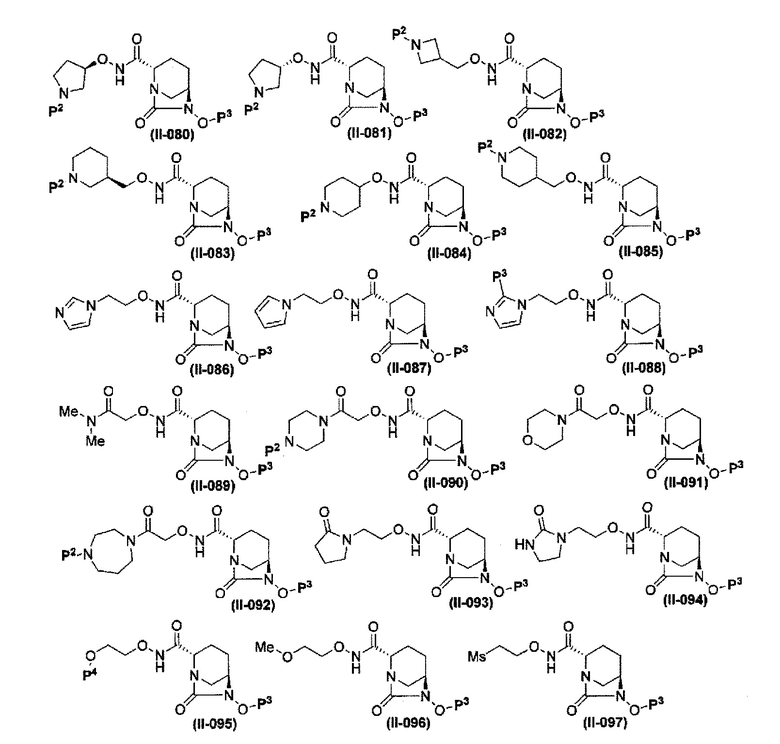
в указанных выше формулах P2 является трет-бутоксикарбонилом (Вoc), бензилоксикарбонилом (Cbz) или Н, P3 является бензилом (Bn), Н или SO3M; где М является Н, натрием, пиридинием или тетрабутиламмонием; и P4 является триизопропилсилилом или Н.
Более предпочтительно, конкретные примеры включают:
трет-бутил {2-[({[(2S,5R)-6-бензилокси-7-оксо-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}амино)окси]этил}карбамат,
трет-бутил {2-[({[(2S,5R)-6-гидрокси-7-оксо-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}амино)окси]этил}карбамат,
трет-бутил {2-[({[(2S,5R)-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}амино)окси]этил}карбамат пиридиния,
трет-бутил {2-[({[(2S,5R)-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}амино)окси]этил}карбамат натрия,
трет-бутил {2-[({[(2S,5R)-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}амино)окси]этил}карбамат тетрабутиламмония,
(2S,5R)-N-(2-аминоэтокси)-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбоксамид,
бензил {2-[({[(2S,5R)-6-бензилокси-7-оксо-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}амино)окси]этил}карбамат,
(2S,5R)-N-[2-(метиламино)этокси]7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбоксамид,
трет-бутил {2-[({[(2S,5R)-6-бензилокси-7-оксо-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}амино)окси]этил}метилкарбамат,
трет-бутил {2-[({[(2S,5R)-6-гидрокси-7-оксо-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}амино)окси]этил}метилкарбамат,
трет-бутил {2-[({[(2S,5R)-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}амино)окси]этил}метилкарбамат тетрабутиламмония,
(2S,5R)-7-оксо-N-[2-(пропан-2-иламино)этокси]-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбоксамид,
трет-бутил {2-[({[(2S,5R)-6-бензилокси-7-оксо-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}амино)окси]этил}пропан-2-илкарбамат,
трет-бутил {2-[({[(2S,5R)-6-гидрокси-7-оксо-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}амино)окси]этил}пропан-2-илкарбамат,
трет-бутил {2-[({[(2S,5R)-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}амино)окси]этил}пропан-2-илкарбамат тетрабутиламмония,
(2S,5R)-N-[2-(диметиламино)этокси]-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбоксамид,
(2S,5R)-6-бензилокси-N-[2-(диметиламино)этокси]-7-оксо-1,6-диазабицикло[3.2.1]октан-2-карбоксамид,
(2S,5R)-N-[2-(диметиламино)этокси]-6-гидрокси-7-оксо-1,6-диазабицикло[3.2.1]октан-2-карбоксамид,
(2S,5R)-N-[2-(диметиламино)этокси]-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбоксамид пиридиния,
(2S,5R)-N-{[(2S)-2-аминопропил]окси}-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбоксамид,
трет-бутил {(2S)-1-[({[(2S,5R)-6-бензилокси-7-оксо-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}амино)окси]пропан-2-ил}карбамат,
трет-бутил {(2S)-1-[({[(2S,5R)-6-гидрокси-7-оксо-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}амино)окси]пропан-2-ил}карбамат,
трет-бутил {(2S)-1-[({[(2S,5R)-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}амино)окси]пропан-2-ил}карбамат тетрабутиламмония,
(2S,5R)-N-{[(2R)-2-аминопропил]окси}-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбоксамид,
трет-бутил {(2R)-1-[({[(2S,5R)-6-бензилокси-7-оксо-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}амино)окси]пропан-2-ил}карбамат,
трет-бутил {(2R)-1-[({[(2S,5R)-6-гидрокси-7-оксо-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}амино)окси]пропан-2-ил}карбамат,
трет-бутил {(2R)-1-[({[(2S,5R)-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}амино)окси]пропан-2-ил}карбамат тетрабутиламмония,
(2S,5R)-N-(3-аминопропокси)-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбоксамид,
трет-бутил {3-[({[(2S,5R)-6-бензилокси-7-оксо-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}амино)окси]пропил}карбамат,
трет-бутил {3-[({[(2S,5R)-6-гидрокси-7-оксо-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}амино)окси]пропил}карбамата,
трет-бутил {3-[({[(2S,5R)-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}амино)окси]пропил}карбамат тетрабутиламмония,
(2S,5R)-N-[(2S)-азетидин-2-илметокси]7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбоксамид,
трет-бутил (2S)-2-{[({[(2S,5R)-6-бензилокси-7-оксо-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}амино)окси]метил}азетидин-1-карбоксилат,
трет-бутил (2S)-2-{[({[(2S,5R)-6-гидрокси-7-оксо-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}амино)окси]метил}азетидин-1-карбоксилат,
трет-бутил (2S)-2{[({[(2S,5R)-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}амино)окси]метил}азетидин-1-карбоксилат тетрабутиламмония,
(2S,5R)-7-оксо-N-[(2R)-пирролидин-2-илметокси]-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбоксамид,
трет-бутил (2R)-2-{[({[(2S,5R)-6-бензилокси-7-оксо-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}амино)окси]метил}пирролидин-1-карбоксилат,
трет-бутил (2R)-2-{[({[(2S,5R)-6-гидрокси-7-оксо-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}амино)окси]метил}пирролидин-1-карбоксилат,
трет-бутил (2R)-2-{[({[(2S,5R)-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}амино)окси]метил}пирролидин-1-карбоксилат тетрабутиламмония,
(2S,5R)-7-оксо-N-[(2S)-пиперидин-2-илметокси]-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбоксамид,
трет-бутил (2S)-2-{[({[(2S,5R)-6-бензилокси-7-оксо-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}амино)окси]метил}пиперидин-1-карбоксилат,
трет-бутил (2S)-2-{[({[(2S,5R)-6-гидрокси-7-оксо-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}амино)окси]метил}пиперидин-1-карбоксилат,
трет-бутил (2S)-2-{[({[(2S,5R)-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}амино)окси]метил}пиперидин-1-карбоксилат тетрабутиламмония,
(2S,5R)-7-оксо-N-[(3S)-пирролидин-3-илокси]6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбоксамид,
трет-бутил (3S)-3-[({[(2S,5R)-6-бензилокси-7-оксо-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}амино)окси]пирролидин-1-карбоксилат,
трет-бутил (3S)-3-[({[(2S,5R)-6-гидрокси-7-оксо-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}амино)окси]пирролидин-1-карбоксилат,
трет-бутил (3S)-3-[({[(2S,5R)-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}амино)окси]пирролидин-1-карбоксилат тетрабутиламмония,
(2S,5R)-N-(азетидин-3-илметокси)-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбоксамид,
трет-бутил 3-{[({[(2S,5R)-6-бензилокси-7-оксо-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}амино)окси]метил}азетидин-1-карбоксилат,
трет-бутил 3-{[({[(2S,5R)-6-гидрокси-7-оксо-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}амино)окси]метил}азетидин-1-карбоксилат, и
трет-бутил 3-{[({[(2S,5R)-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}амино)окси]метил}азетидин-1-карбоксилат тетрабутиламмония,
и следующие группы соединений.
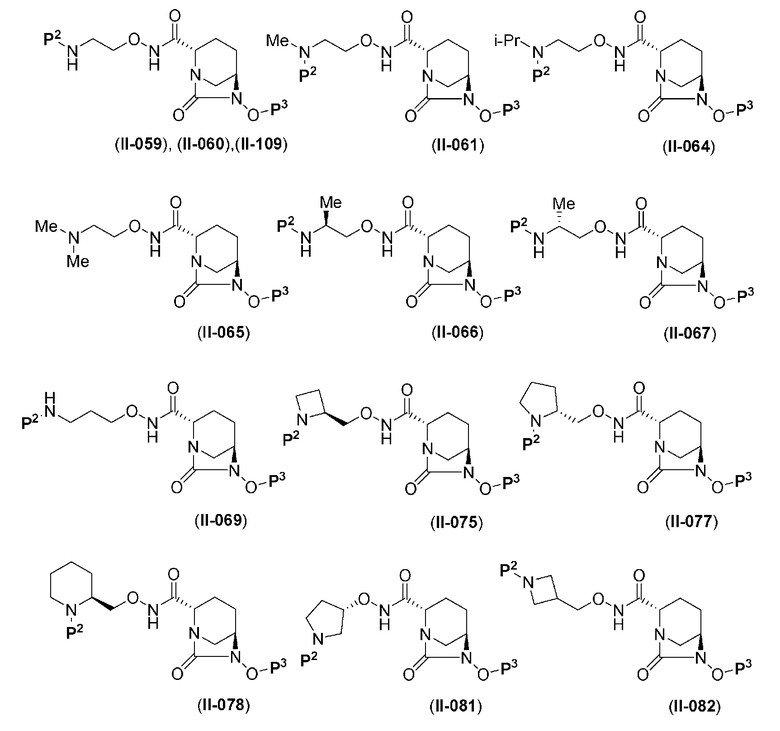
в указанных выше формулах P2 является трет-бутоксикарбонилом (Вoc), бензилоксикарбонилом (Cbz) или Н, P3 является бензилом (Bn), Н или SO3M; где М является Н, натрием, пиридинием или тетрабутиламмонием.
Наиболее предпочтительно,
(2S,5R)-N-(2-аминоэтокси)-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбоксамид,
(2S,5R)-N-[2-(метиламино)этокси]-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбоксамид,
(2S,5R)-7-оксо-N-[2-(пропан-2-иламино)этокси]-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбоксамид,
(2S,5R)-N-[2-(диметиламино)этокси]-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбоксамид,
(2S,5R)-N-{[(2S)-2-аминопропил]окси}-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбоксамид,
(2S,5R)-N-{[(2R)-2-аминопропил]окси}-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбоксамид,
(2S,5R)-N-(3-аминопропокси)-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбоксамид,
(2S,5R)-N-[(2S)-азетидин-2-илметокси]7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбоксамид,
(2S,5R)-7-оксо-N-[(2R)-пирролидин-2-илметокси]-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбоксамид,
(2S,5R)-7-оксо-N-[(2S)-пиперидин-2-илметокси]-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбоксамид,
(2S,5R)-7-оксо-N-[(3S)-пирролидин-3-илокси]-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбоксамид, и
(2S,5R)-N-(азетидин-3-илметокси)-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбоксамид.
Лекарственное средство, предусмотренное в настоящем изобретении, содержит вещество, выбранное из группы, включающей соединение, представленное формулами (I), (II) или (III) и его фармацевтически приемлемую соль и его гидрат или сольват в качестве эффективного ингредиента, для введения перорально или парентерально и, предпочтительно, введения парентерально. Соединение по настоящему изобретению и β-лактамовый антибиотик могут вводиться методом, в котором отдельно приготовленные соответствующие медикаменты в момент использования вводят одновременно или отдельно в сочетании, или методом, в котором оба медикамента предварительно смешивают обычно с помощью одной или более добавок (носителей) для препаратов с получением фармацевтической композиции и для ее введения.
Конкретные примеры фармацевтических композиций для перорального введения, могут включать таблетки, капсулы, гранулы, порошки, пилюли, водные и неводные растворы для перорального введения и суспензии.
Способы введения для парентерального введения могут включать интраназальный, глазные капли, ушные капли, подкожный, трахеобронхиальный, эндоректальный, мочевой, подкожный, внутримышечный и внутривенный.
Конкретные примеры фармацевтических композиций для парентерального введения в виде внутривенного введения могут включать раствор для инъекций для внутривенного введения, для которого порошкообразную форму фармацевтической композиции растворяют в приемлемом растворителе. Приемлемый растворитель включает, например, стерильную воду для инъекций, физиологический раствор, раствор глюкозы, раствор Рингера, бактериостатическую воду для инъекций, содержащую метилпарабен и пропилпарабен, или бактериостатическую воду для инъекций, содержащую бензиловый спирт.
Фармацевтическая композиция в форме порошка для парентерального введения может быть получена стерилизацией соединения в соответствии с данным изобретением, которое является активным ингредиентом, и β-лактамного антибиотика, помещением в герметичный флакон и лиофилизацией, или помещением фармацевтической композиции в состоянии стерилизованного порошка в герметично закрытый флакон. Предпочтительные конкретные способы стерилизации включают:
способ, при котором из отдельных или смешанных растворов удаляют эндотоксины, фильтруют нерастворимые вещества, затем кристаллизуют, насыпают в герметично закрытый сосуд и облучают гамма-лучами;
способ, при котором из отдельных или смешанных растворов удаляют эндотоксины, фильтруют в асептических условиях, затем стерилизуют, например, паровой стерилизацией под давлением и импульсным облучением, и лиофилизируют;
способ, при котором из отдельных или смешанных растворов удаляют эндотоксины, фильтруют в асептической атмосфере, затем засыпают в герметичный флакон, замораживают и покрывают и затем лиофилизируют;
способ, при котором из каждого раствора соединения отдельно удаляют эндотоксины, фильтруют в асептических условиях и кристаллизуют в асептической атмосфере;
способ, при котором одно из лекарственных средств в форме стерилизованного порошка, кристаллизованного в асептических условиях, накладывают в асептической атмосфере поверх другого лекарственного средства в форме стерилизованного порошка, который лиофилизирован в герметичном флаконе;
и
способ, при котором одно из лекарственных средств в форме стерилизованного порошка, лиофилизированное, и другое лекарственное средство в форме стерилизованного порошка, кристаллизованное в асептической атмосфере, смешивают в асептической атмосфере.
Более предпочтительным является способ, при котором из отдельных или смешанных растворов удаляют эндотоксины, фильтруют в асептической атмосфере, затем засыпают в герметичный флакон, замораживают и покрывают и затем лиофилизируют, или способ, при котором из каждого раствора соединения отдельно удаляют эндотоксины, фильтруют в асептических условиях и кристаллизуют в асептической атмосфере.
Представленная выше фармацевтическая композиция может храниться при комнатной температуре или ниже до получения из нее внутривенного раствора, ее растворяют непосредственно перед применением. Концентрация соединения в соответствии с данным изобретением в восстановленном внутривенном растворе составляет, например, от 1 мг/мл до 50 мг/мл.
Доза для введения и количество введений фармацевтической композиции в соответствии с данным изобретением конкретно не ограничена, и доза для введения и количество введений необязательно определяется в зависимости от различных условий, таких как терапевтические или профилактические цели, тип заболевания, возраст, масса тела и симптомы пациента. Эффективная концентрация в крови соединения в соответствии с данным изобретением для применения в сочетании с β-лактамовыми антибиотиками скорректирована так, чтобы составлять 1 мкг/мл или более во время введения β-лактамового антибиотика. Доза соединения в соответствии с данным изобретением для внутривенного введения составляет, предпочтительно, от 2 до 75 мг/кг на один прием, и для перорального введения составляет, предпочтительно, от 4 до 300 мг/кг несколько раз в день в зависимости от количества введений β-лактамового антибиотика, которое составляет, предпочтительно, от 2 до 6 раз.
β-Лактамовый антибиотик, который может применяться в сочетании с соединением в соответствии с данным изобретением, включает пенициллин, цефем и карбапенем.
Конкретные примеры пенициллинов включают бензилпенициллин, фенетициллин, клоксациллин, диклоксациллин, ампициллин, циклациллин, амоксициллин, талампициллин, бекампициллин, ленампициллин, аспоксициллин, пиперациллин, сульбенициллин, пивмециллинам, сультамициллин, феноксиметилпенициллин, карбенициллин, азидоциллин, пропициллин, эпициллин, тикарциллин, пирбенициллин, азлоциллин, мезлоциллин и другие известные пенициллины.
Конкретные примеры цефемов включают цефаклор, цефазолин, цефатризин, цефадроксил, цефапирин, цефамандол нафат, цефадрин, цефалексин, цефалотин, цефепим, цефокситин, цефиксим, цефтазидим, цефдиторен, цефдинир, цефсулодин, цефоселис, цефозопран, цефотаксим, цефтазидим, цефтаролин, цефотиам, цефтизоксим, цефтибутен, цефтезол, цеффтерам, цефтриаксон, цефоницид, цефпирамид, цефпиром, цефбуперазон, цефпрозил, цефоперазон, цефподоксим, цефминокс, цефметазол, цефменоксим, цефрадин, цефроксадин, цефуроксим, цефтолозан (CXA101, гидросульфат (6R,7R)-3-[5-амино-4-[3-(2-аминоэтил)уреидо]-1-метил-1Н-пиразол-2-ий-2-илметил]-7-[2-(5-амино-1,2,4-тиадиазол-3-ил)-2-[(Z)-1-карбокси-1-метилэтоксиимино]ацетамид]-3-цефем-4-карбоновой кислоты)и другие известные цефемы.
Примеры карбапенемов включают имипенем, панипенем, меропенем, биапенем, дорипенем, эртапенем и тебипенем, и в сочетании с ними может применяться DHP-1 ингибитор, такой как циластатин, по мере необходимости.
Примеры β-лактамовых антибиотиков, отличных от карбапенемов, пенициллинов и цефемов включают β-лактамовые антибиотики, такие как азтреонам, карумонам, латамоксеф, фломоксеф, лоракарбеф, фаропенем и ритипенем.
Примеры пенициллинов, особенно подходящих для применения в сочетании с соединением в соответствии с данным изобретением, включают ампициллин, амоксициллин, карбенициллин, пиперациллин, азлоциллин, мезлоциллин и тикарциллин. Такие пенициллины могут применяться, например, в форме фармацевтически приемлемых солей, таких как соли натрия. В другом варианте, ампициллин или амоксициллин могут применяться в сочетании с соединением формулы (I)в форме суспензии для инъекций или в форме тонкоизмельченных частиц амфотерного иона (тригидрат ампициллина или тригидрат амоксициллина) для суспензии для инъекций.
Особенно предпочтительными цефемами для совместного введения с соединением в соответствии с данным изобретением включают цефотаксим, цефтриаксон, цефтазидим, цефепим и т.д., и они могут применяться в форме фармацевтически приемлемой соли, такой как натриевая соль.
Особенно подходящие карбапенемы для совместного введения с соединением в соответствии с данным изобретением включают имипенем, меропенем, биапенем, дорипенем и эртапенем.
Примером особенно подходящего β-лактамового антибиотика для совместного введения с соединением в соответствии с данным изобретением является азтреонам.
Применение соединения в соответствии с данным изобретением и β-лактамового антибиотика в сочетании может применяться для лечения инфекции, вызванной штаммами производящими β-лактамазу класса А и класса С, и штаммами, производящими БЛРС и KPC2 карбапенемазу, в дополнение к бактериальной инфекции, включенной в противомикробный спектр антибиотиков.
Штаммы, производящие β-лактамазу класса А и класса С, и штаммы, производящие БЛРС и KPC2 карбапенемазу включают Escherichia coli, Klebsiella pneumoniae, Enterobacter croacare, Citrobacter freundii, Serratia marcescens, Morganella morganii, Pseudomonas aeruginosa и Acinetobacter baumannii.
Далее более подробно объясняется общий способ получения настоящего соединения.
Соединения, используемые для исследования и оценки данного изобретения, могут быть синтезированы с применением соединения, формирующего боковую цепь (А-BH), и карбоновой кислоты, представленной формулой (6b) согласно схеме 1:
Схема 1
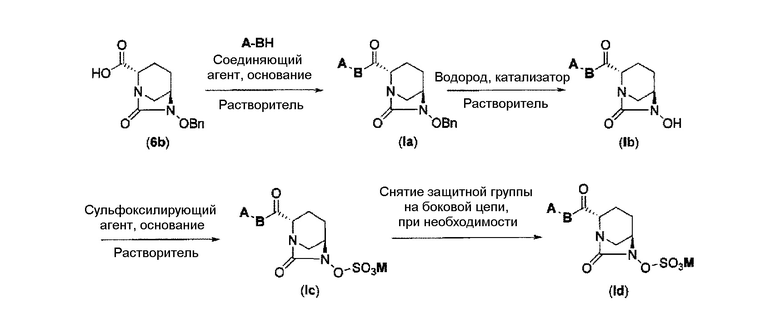
на показанной выше схеме OBn является бензилокси,
включая способ, описанный в патенте США № 7112592, проведя модификацию и улучшение условий реакции, стадии последующей обработки и стадии очистки с учетом реакционной способности соответствующих функциональных групп или стабильности, характерной для соответствующих соединений.
То есть, оптически активную карбоновую кислоту формулы (6b) и образующее боковую цепь соединение (А-ВН) обрабатывают способом, выбранным из способа ангидрида смешанной кислоты, способа активной этерификации, способа активного амидирования или дегидратации конденсирующего агента в присутствии основания с получением соединения, представленного формулой (Ia), бензил из бензилокси формулы (Ia) подвергают реакции гидрогенолиза в атмосфере водорода в присутствии катализатора, выбранного из оксида платины, оксида палладия, палладиевой черни и палладия на угле и, при необходимости, в присутствии ди-трет-бутоксидикарбоната, с получением соединения, представленного формулой (Ib), гидроксильную группу формулы (Ib) сульфируют сульфатирующим агентом, выбранным из комплекса триоксид серы - пиридин, комплекса триоксид серы - диметилформамид и хлорсульфоновой кислоты в присутствии основания, выбранного из пиридина, 2-пиколина и 2,6-лутидина и 2,4,6-коллидина с получением соединения, представленного формулой (Ic) и, при необходимости, защитную группу осторожно обрабатывают амино группой (например, трет-бутоксикарбонильной группой (Boc)), при необходимости, защитную группу осторожно обрабатывают кислотой (например, выбранное из хлористоводородной кислоты, серной кислоты, метансульфоновой кислоты, п-толуолсульфоновой кислоты, трифторметансульфоновой кислоты, трифторуксусной кислоты или тетрафторборной кислоты, и т.д.) для снятия защиты, и затем, соединение, представленное формулой (Id), очищают октадецилом колоночной хроматографией на силикагеле, колоночной хроматографией с использованием синтетической смолы, такой как DIAION HP21 (от Mitsubishi Chemical Corporation), SEPABEADS SP207 (от Mitsubishi Chemical Corporation) или препаративной ВЭЖХ и т.д. при подходящем рН и т.д., с получением целевого соединения.
Оптически активная карбоновая кислота, представленная формулой (6b), может быть синтезирована по следующей схеме 2:
Схема 2

на представленной выше схеме Cbz представляет бензилоксикарбонил, t-Bu представляет трет-бутил, АТФК представляет ангидрид трифторуксусной кислоты, ТФА, связанный с соединением, представляет трифторацетил, Тf2O представляет ангидрид трифторметансульфоновой кислоты, Bn2ONH представляет бензилоксиамин, ДМАП представляет 4-диметиламинопиридин, ТФК отдельно описанная на схеме представляет трифторуксусную кислоту, OBn представляет бензилокси и LiOH представляет гидроксид лития,
и способы представлены в Примерах настоящего изобретения.
То есть, бензилоксикарбонил из известного соединения, представленного формулой (1), удаляют реакцией гидрогенолиза в присутствии катализатора, такого как палладий на угле в атмосфере водорода с получением соединения, представленного формулой (2); превращение его взаимодействием с ангидридом трифторуксусной кислоты в присутствии триэтиламина с получением соединения, представленного формулой (3); взаимодействие его гидроксильной группы в положении 5 с ангидридом трифторметансульфоновой кислоты в присутствии 2,6-лутидина, затем с бензилоксиамином с получением соединения, представленного формулой (IV); удаление трифторацетила с применением гидроксида натрия с получением соединения, представленного формулой (4а), или удаление трифторацетила с применением гидрохлорида - метанола и реакции обмена сложного эфира одновременно, с получением соединения, представленного формулой (4b); их взаимодействие с дифосгеном или фосгеном в присутствии триэтиламина или 4-диметиламинопиридина с получением соединения, представленного формулой (5а) или (5b); и расщепление сложного эфира в положении 2 обработкой кислотой с применением трифторуксусной кислоты, и т.д. или обработкой основанием с применением гидроксида лития и т.д., с получением (2S,5R)-6-(бензилокси)-7-оксо-1,6-диазабицикло[3.2.1]октан-2-карбоновой кислоты, представленной формулой (6b). Или еще, коммерчески доступную (2S,5S)-5-гидроксипиперидин-2-карбоновую кислоту, представленную формулой (7) или ее гидрохлорид превращают в соединение, представленное формулой (10) или (4b) способом, описанным выше, без очистки, и выделяют в виде гидрохлорида, далее получают (2S,5R)-6-(бензилокси)-7-оксо-1,6-диазабицикло[3.2.1]октан-2-карбоновую кислоту, представленную формулой (6b).
Из образующих боковые цепи соединений A-BH, конкретное производное гидразина, представленное Ra(Rb)N-BH, может быть синтезировано по представленной ниже схеме 3:
Схема 3

на представленной выше схеме, Cbz представляет бензилоксикарбонил.
То есть, оно может быть легко синтезировано взаимодействием сложного эфира и моногидрата гидразина, амидированием хлорангидрида и гидразина N-бензилоксикарбонила в присутствии подходящего основания, или амидированием карбоновой кислоты и гидразина N-бензилоксикарбонила с применением дегидратирующего конденсирующего агента или метода смешанного ангидрида кислоты, с последующим гидрогенолизом бензилоксикарбонильной группы в присутствии катализатора, такого как палладий на угле.
Кроме того, конкретный алкоксиамин, представленный RcOBH, синтезируют способом, показанным на следующей схеме 4:
Схема 4
То есть, он может быть легко синтезирован сочетанием N-гидроксифталимида и подходящего спиртового производного с применением реакции Мицунобу, или взаимодействием с алкилирующим агентом, имеющим уходящую группу, такую как алкилгалогенид и метилсульфонилоксигруппу с последующим снятием защиты фталимида органическим основанием, таким как моногидрат гидразина или метиламин.
Далее более подробно представлен способ получения соединения, представленного следующей формулой (III):

в представленной выше формуле (III), Rc является С1-6 алкилом или гетероциклилом; В является NH или NC1-6 алкилом; М является Н, неорганическим катионом или органическим катионом; Rc может быть модифицирован от 0 до 4 заместителями Fn1, где заместитель Fn1 может быть далее замещен; Fn1 является С1-6 алкилом, O= или Rg-(CH2)0-3-, где Rg является гетероциклилом, фенилом, гетероарилом, ацилом, RdO2S-, Re(Rf)N-, Re(Rf)NCO-, ReO-, ReOCO- или защитной группой, где Rd представляет С1-6 алкил или МО-; Re и Rf каждый, независимо друг от друга, являются Н или С1-6 алкилом; и между Rc и В и между Re и Rf может быть закрыто связыванием с получением гетероциклила, имеющего, по крайней мере, один атом азота,
представленного в данном изобретении.
В способе получения в соответствии с данным изобретением, в качестве подходящей защитной группы, представленной P1, в исходном материале, представленном следующей формулой (IV-a):
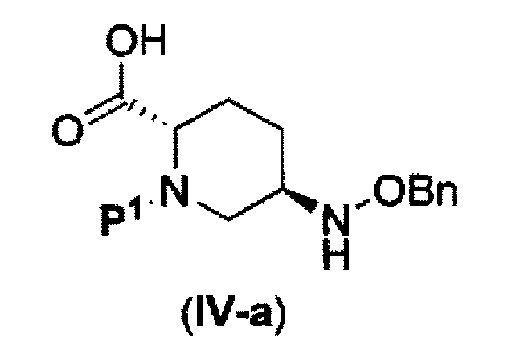
в указанной выше формуле (IV-а), P1 является защитной группой, которая может быть удалена кислотой, основанием или нуклеофильным агентом; и OBn является бензилокси,
может применяться защитная группа для аминокислоты, которая может быть удалена кислотой, основанием или нуклеофильным агентом, описана в Protective Groups in Organic Synthesis (Т. W. Greene et al., Wiley, New York (1999)). Более конкретно, она включает трет-бутоксикарбонил, 2-триметилсилилэтоксикарбонил, 1,1-диметилпропинилоксикарбонил, 1-метил-1-(4-бифенилил)этоксикарбонил, 1-метилциклобутоксикарбонил, 1-адамантилоксикарбонил, дифенилметоксикарбонил, 9-флуоренилметоксикарбонил, 1,1-диметил-2-цианоэтоксикарбонил, формил, трихлорацетил, трифторацетил, бензолсульфенил, 2-нитробензолсульфенил, 2-триметилсилилэтансульфонил, 2-нитробензолсульфонил, 4-нитробензолсульфонил, 2,4-динитробензолсульфонил, 2-нафталинсульфонил, 9-антраценсульфонил и бензолтиазолсульфонил, предпочтительно, трет-бутоксикарбонил, 2-триметилсилилэтоксикарбонил, трифторацетил, 9-флуоренилметоксикарбонил, 2-нитробензолсульфонил и 4-нитробензолсульфонил.
Стадия получения соединения, представленного следующей формулой (IV-b):
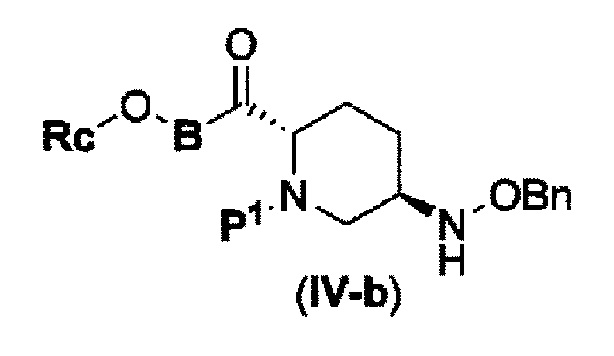
в указанной выше формуле (IV-b), Р1 является защитной группой, которая может быть удалена кислотой, основанием или нуклеофильным агентом; Rc и В имеют значения, определенные для соединения, представленного формулой (III), и OBn является бензилокси,
включающая сочетание соединения, представленного формулой (IV-а) с соединением, образующим боковую цепь: RcOBH, может проводиться способом, в котором соединение, представленное формулой (IV-а) обрабатывают с использованием активного сложного эфира, активного амида или дегидратирующего конденсирующего агента в подходящем растворителе.
Сочетание с применением дегидратирующего конденсирующего агента проводят во многих случаях добавлением активной эфирной группы или активной амидной группы в качестве катализатора с получением активного сложного эфира или активного амида в реакционной системе, и конкретные примеры представлены и объяснены ниже.
Растворителем, применяемым для дегидратирующего конденсирующего агента, является вода, метанол, этанол, изопропанол, этилацетат, толуол, тетрагидрофуран, диоксан, ацетонитрил, дихлорметан, хлороформ, диметилформамид, диметилацетамид и т.д., предпочтительно, этилацетат, тетрагидрофуран, дихлорметан, ацетонитрил, диметилформамид, диметилацетамид, который может применяться отдельно или в смеси.
Если применяют активный этерифицирующий агент или активный амидирующий агент, реакцию проводят в присутствии основания, если это необходимо. Основанием, используемым в данной реакции, является триэтиламин, диизопропилэтиламин, трибутиламин, N-метилморфолин и 4-диметиламинопиридин, предпочтительно, триэтиламин, и его применяют в количестве от 1 до 3 эквивалентов, в зависимости от соединения, представленного формулой (IV-а), предпочтительно, от 1 до 1,5 эквивалентов.
В качестве дегидратирующего конденсирующего агента могут применяться отдельно карбодиимид, такой как N,N'-диизопропилкарбодиимид, N,N'-дициклогексилкарбодиимид и гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида, или в сочетании с активной амидной группой или группой сложного эфира, такой как имидазол, моногидрат 1-гидроксибензотриазола, N-гидроксисукцинимид и 2-гидроксипиридин-N-оксид, а также активным этерифицирующим агентом или активным амидирующим агентом, таким как карбонилдиимидазол, гексафторфосфат бензотриазол-1-илокситрис(диметиламино)фосфония, иодид 2-хлор-1-метилпиридиния и хлорид 4-(4,6-диметокси-1,3,5-триазин-2-ил)-4-метилморфолиния, предпочтительно, гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида в сочетании с моногидратом 1-гидроксибензотриазола, или выбранный иодид 2-хлор-1-метилпиридиния, и агент применяют в интервале от 1,0 до 2,0 эквивалентов по отношению к соединению, представленному формулой (IV-а), более предпочтительно, от 1,0 до 1,5 эквивалента. Температура реакции составляет от -40°С до комнатной температуры, предпочтительно, от -20°С до комнатной температуры. Реакцию проводят в течение времени от 30 минут до 1 дня, предпочтительно, от 2 часов до 16 часов.
Соединение, представленное формулой (IV-b), может быть выделено разбавлением реакционной смеси соответствующим растворителем после завершения реакции, последовательным промыванием водой, разбавленной кислотой, водным раствором основания (например, разбавленной хлористоводородной кислотой, моногидросульфатом калия, лимонной кислотой или водным раствором бикарбоната натрия, насыщенным физиологическим раствором) и выпариванием растворителя с концентрацией реакционной смеси. Органическим растворителем, используемым для разбавления, является диэтиловый эфир, этилацетат, бутилацетат, толуол, дихлорметан и хлороформ, предпочтительно, этилацетат.
Затем, стадия снятия защиты с соединения, представленного указанной выше формулой (IV-b) с получением соединения, представленного формулой (IV-с):

в указанной выше формуле (IV-c), Rc и В имеют значения, определенные для соединения, представленного формулой (III), и OBn является бензилокси,
может проводиться следующим образом.
Растворителем, используемым при удалении защиты в кислых условиях, является вода, метанол, этанол, изопропанол, этилацетат, тетрагидрофуран, диоксан, дихлорметан, хлороформ, 1,2-дихлорэтан и 2,2,2-трифторэтанол и т.д., предпочтительно, вода, метанол, этанол, этилацетат, диоксан и дихлорметан, которые могут применяться по отдельности или в сочетании.
Кислотой, используемой при удалении защиты в кислых условиях, является хлористоводородная кислота, серная кислота, фосфорная кислота, муравьиная кислота, трифторуксусная кислота, метансульфоновая кислота, трифторметансульфоновая кислота, хлорметансульфоновая кислота, тетрафторборная кислота и т.д., предпочтительно, хлористоводородная кислота, серная кислота, трифторуксусная кислота, метансульфоновая кислота и тетрафторборная кислота, более предпочтительно хлористоводородная кислота или трифторуксусная кислота. Кислоту применяют в количестве от 1 эквивалента к количеству растворителя, по отношению к соединению, представленному формулой (IV-b), предпочтительно, в 5-кратном количестве к количеству растворителя. Температура реакции составляет в интервале от -25°С до 50°С, предпочтительно, от -10°С до 30°С. Реакцию проводят в течение времени от 30 минут до 16 часов, предпочтительно, от 30 минут до 5 часов.
Растворителем, используемым при удалении защиты в щелочных условиях или с применением нуклеофильного агента, является вода, метанол, этанол, изопропанол, тетрагидрофуран, диоксан, ацетонитрил, диметилформамид, диметилацетамид, и 2,2,2-трифторэтанол и т.д., предпочтительно, вода, метанол, тетрагидрофуран и диоксан, которые могут применяться по отдельности или в сочетании.
Основанием, используемым при удалении защиты в щелочных условиях, является гидроксид лития, гидроксид натрия, гидроксид калия, гидроксид цезия, карбонат лития, карбонат натрия, карбонат калия, карбонат цезия и т.д., предпочтительно, гидроксид лития, гидроксид натрия и гидроксид калия, и его применяют в количестве от 2 до 5 эквивалентов по отношению к соединению, представленному формулой (IV-b), предпочтительно, в количестве от 2 до 4 эквивалентов. Температура реакции составляет в интервале от -25°С до 50°С, предпочтительно, от 0°С до 10°С. Реакцию проводят в течение времени от 30 минут до 16 часов, предпочтительно, от 30 минут до 5 часов.
Нуклеофильным агентом, используемым при удалении защиты с применением нуклеофильного агента, является тиол, такой как этантиол, тиогликолевая кислота и тиофенол; и фторид, такой как гидрофторид пиридина, фторид натрия, фторид калия, фторид цезия и фторид тетрабутиламмония, предпочтительно, фторид тетрабутиламмония, и его применяют в количестве от 2 до 4 эквивалентов по отношению к соединению, представленному формулой (IV-b) предпочтительно, от 2 до 3 эквивалентов. Температура реакции составляет в интервале от 0°С до 100°С, предпочтительно, от 25°С до 60°С. Реакцию проводят в течение времени от 2 часов до 48 часов, предпочтительно, от 8 часов до 24 часов.
Соединение, представленное формулой (IV-с), имеющее RcONHCO группу со свойствами слабой кислоты, является амфотерным веществом, так, чтобы получить оптимальный диапазон рН для получения соединения в виде свободного основания. Оптимальный рН составляет от PH6 до 9, предпочтительно, от рН6 до 8.
Соединение, представленное формулой (IV-с), может быть выделено разбавлением реакционной смеси органическим растворителем, доведением до оптимального рН как указано выше, и экстракцией растворителем. Органическим растворителем, используемым для разбавления щелочной реакционной смеси, является диэтиловый эфир, этилацетат, бутилацетат, толуол, дихлорметан и хлороформ, предпочтительно, этилацетат или дихлорметан.
Затем стадию силилирования соединения, представленного формулой (IV-с), в реакционной системе с непрерывным образованием внутримолекулярной мочевины с получением соединения, представленного следующей формулой (IIa):
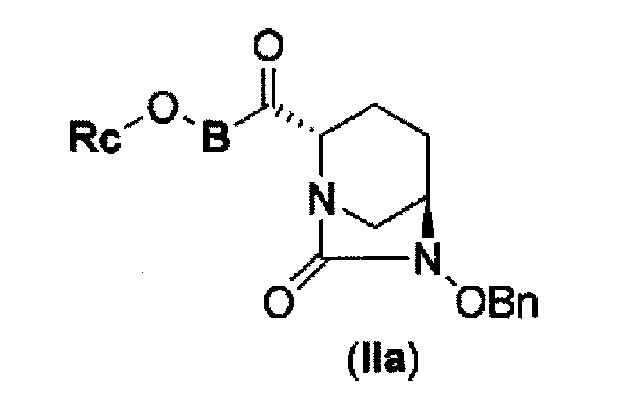
в указанной выше формуле (IIa), Rc и В имеют значения, определенные для соединения, представленного формулой (III), и OBn является бензилокси,
может проводиться следующим образом.
Растворителем, используемым в реакции, может быть этилацетат, тетрагидрофуран, диоксан, ацетонитрил, диметилформамид, диметилацетамид и т.д., предпочтительно, ацетонитрил.
Основанием, используемым в данной реакции, является триэтиламин, диизопропилэтиламин, трибутиламин, N-метилморфолин, предпочтительно триэтиламин, и его применяют в количестве от 3 до 6 эквивалентов по отношению к соединению, представленному формулой (IV-с), предпочтительно, 3-4 эквивалентов.
Силилирующим агентом, используемым в реакции, является хлортриалкилсилан, такой как хлортриметилсилан, хлортриэтилсилан, хлортриизопропилсилан и хлор-трет-бутилдиметилсилан; трифторметансульфонат триметилсилила и трифторметансульфонат трет-бутилдиметилсилила, предпочтительно, хлортриалкилсилан, такой как хлортриметилсилан, и его применяют в количестве от 1 до 3 эквивалентов по отношению к соединению, представленному формулой (IV-с), предпочтительно, от 1 до 1,5 эквивалентов.
Агентом, образующим мочевину, используемым в реакции, является фосген, дифосген, трифосген и карбонилдиимидазол, и предпочтительно, фосген и дифосген, и его применяют в количестве от 0,5 до 2 эквивалентов по отношению к соединению, представленному формулой (IV-с), предпочтительно, от 0,5 до 1,0 эквивалентов. Одновременно, для завершения образования мочевины, каталитическое количество 4-диметиламинопиридина применяют в количестве 0,1 до 1 эквивалента по отношению к соединению формулы (IV-с), предпочтительно, 0,1 до 0,2 эквивалента.
Температура реакции составляет от -25 до 50°С, предпочтительно, от -15 до 30°С. Реакцию проводят в течение времени от 10 минут до 24 часов, предпочтительно, от 1 часа до 16 часов.
Полученное соединение, представленное формулой (V-2), может быть выделено обычной последующей обработкой, такой как выпаривание органического растворителя в реакционной смеси с ее концентрацией, разбавление растворителем, промывание кислотой и основанием, выпаривание растворителя с концентрацией смеси, и осаждение.
Затем, стадию получения соединения, представленного следующей формулой (IIb):
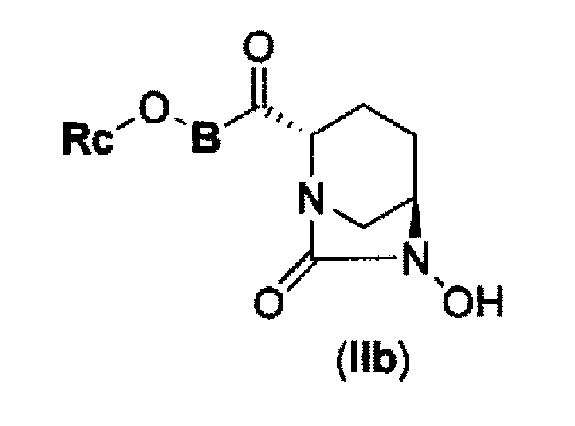
в указанной выше формуле (IIb), Rc и В имеют значения, определенные для соединения, представленного формулой (III),
отщеплением бензильной группы из бензилоксигруппы в положении 6 соединения, представленного указанной выше формулой (IIa), с применением катализатора гидрогенолиза в атмосфере водорода, проводят следующим образом.
Растворителем, используемым в этой реакции, является вода, метанол, этанол, изопропанол, этилацетат, тетрагидрофуран и диоксан, предпочтительно, метанол или тетрагидрофуран, которые применяют отдельно или в сочетании.
Катализатором гидрогенолиза является оксид платины, гидроксид палладия, палладиевая чернь или палладий на угле, предпочтительно, палладий на угле.
Катализатор применяют в количестве от 5 до 100% массовых по отношению к соединению формулы (IIa), предпочтительно, от 5 до 30% массовых.
Источником водорода, используемым для гидрогенолиза, является газообразный водород, и давление водорода выбирают в интервале от атмосферного давления до 1 МПа, предпочтительно, от атмосферного давления до 0,5 МПа. В другом варианте, источником водорода может быть формиат аммония, циклогексен или циклогексадиен. Применяемое количество водорода может быть, по крайней мере, стехиометрическим количеством.
Температура реакции гидрогенолиза составляет от 10 до 50°С, предпочтительно, от 15 до 30°С. Реакцию проводят в течение времени от 0,5 до 3 часов, предпочтительно, от 0,5 до 2 часов.
Если аминогруппа и бензилоксикарбонильная группа присутствует в качестве защитной группы в боковой цепи Rc соединения, представленного формулой (IIa), они могут быть защищены снова трет-бутоксикарбонильной группой в присутствии ди-трет-бутоксикарбонилдикарбоната в указанной выше реакции гидрогенолиза.
Добавляемое количество ди-трет-бутоксикарбонилдикарбоната составляет от 1 до 2 эквивалентов, по отношению к соединению формулы (IIа), предпочтительно от 1 до 1,2 эквивалентов. После завершения реакции соединение, представленное формулой (IIb), может быть выделено обычными методами, такими как фильтрация катализатора и выпаривание растворителя с концентрированием смеси.
Затем, стадию получения соединения, представленного указанной выше формулой (III) сульфатированием гидроксильной группы в положении 6 соединения, представленное формулой (IIb), в присутствии основания, и удалением защитной группы на боковой цепи (RcO), при необходимости, можно выполнить следующим образом.
Растворителем, используемым для сульфатирования, может быть вода, метанол, этанол, изопропанол, дихлорметан, хлороформ, 1,2-дихлорэтан, пиридин, ацетонитрил и диметилформамид, предпочтительно, дихлорметан, пиридин и ацетонитрил, которые применяют отдельно или в сочетании.
Основанием, используемым в данной реакции, может быть триэтиламин, трибутиламин, диизопропилэтиламин, N-метилморфолин, пиридин, 2-пиколин, 3-пиколин, 2,6-лутидин, 2,4,6-коллидин, 4-диметиламинопиперидин и N-метилимидазол, предпочтительно, пиридин, 2-пиколин и 2,6-лутидин, и его применяют в количестве 1,0 к количеству растворителя, по отношению к соединению, представленному формулой (IIb), предпочтительно, 3,0 к количеству растворителя.
Продуктом, применяемым в качестве сульфатирующего агента, является хлорсульфоновая кислота, комплекс триоксид серы-пиридин, комплекс триоксид серы-диметилформамид, комплекс триоксид серы-триметиламин и комплекс триоксид серы-триэтиламин, предпочтительно, комплекс триоксид серы-пиридин или комплекс триоксид серы-диметилформамид, и его применяют в количестве от 1 до 4 эквивалентов в расчете на соединение, представленное формулой (IIb), предпочтительно, от 2 до 3 эквивалентов. Температура реакции составляет от 0 до 50°С, предпочтительно, от 10 до 30°С. Реакцию проводят в течение времени от 12 до 48 часов, предпочтительно, в течение времени от 12 до 24 часов.
После завершения реакции, соединение, представленное формулой (III) может быть получено в виде пиридиниевой соли сульфоновой кислоты фильтрацией и выпариванием растворителя с концентрацией реакционной смеси, и обработкой водным раствором неорганического основания, содержащего натрий, таким как водный раствор бикарбоната натрия, с получением натриевой соли, добавлением от 1 до 3 молярных эквивалентов гидросульфата тетрабутиламмония к водному раствору натриевой соли, и экстрагированием органическим растворителем, таким как этилацетат, с получением соли тетрабутиламмония, и указанный выше водный раствор доводят до оптимального рН с получением внутримолекулярной соли, для использования на следующей стадии, или продукт очищают с получением соединения, представленного формулой (III), в качестве конечной формы.
Здесь оптимальным рН является диапазон рН, при котором соединение, представленное формулой (III), может существовать стабильно в виде внутримолекулярной соли. Интервал pH от 4 до 7 выбирают для выделения соединения в виде внутримолекулярной соли, более предпочтительно, pH от 5 до 6.
Если защитная группа (например, трет-бутоксикарбонильная группа) присутствует на боковой цепи (RcO) формулы (III), она также используется на стадии снятия защиты.
Для снятия защиты с трет-бутоксикарбонильной группы на боковой цепи (RcO) применяют снятие защиты в кислых условиях.
Растворителем, применяемым для реакции, является вода, метанол, этанол, изопропанол, этилацетат, тетрагидрофуран, диоксан, дихлорметан, хлороформ, 1,2-дихлорэтан, 2,2,2-трифторэтанол и т.д., предпочтительно, дихлорметан, этилацетат или 2,2,2-трифторэтанол.
Кислотой, используемой при удалении защиты в кислых условиях, является хлористоводородная кислота, серная кислота, фосфорная кислота, муравьиная кислота, трифторуксусная кислота, метансульфоновая кислота, трифторметансульфоновая кислота, хлорметансульфоновая кислота, тетрафторборная кислота и т.д., предпочтительно хлористоводородная кислота, серная кислота, трифторуксусная кислота, метансульфоновая кислота и тетрафторборная кислота. Более предпочтительно, хлористоводородная кислота, серная кислота и трифторуксусная кислота. Кислоту применяют в количестве от 1 эквивалента к количеству растворителя по отношению к соединению формулы (III), предпочтительно, к 3-кратном количестве к количеству растворителя. Температура реакции составляет от -25 до 50°С, предпочтительно, от -10 до 30°С. Реакцию проводят в течение времени от 30 минут до 5 часов, предпочтительно, от 30 минут до 1 часа.
После завершения снятия защиты растворитель реакционной смеси выпаривают с концентрацией смеси, или слабый растворитель добавляют для осаждения неочищенного продукта и затем смесь разбавляют до водного раствора с оптимальным рН в интервале от pH5 до 6 и затем снова осаждают, или очищают с применением октадецила-двуокиси кремния (СОД), синтетического полимера, такого как Diaion HP-20 и Sepabeads SP207, и ионообменной смолы, такой как DOWEX 50W-X8 (Na форма), с дальнейшим осаждением или лиофилизацией с получением соединения, представленного формулой (III), в конечной форме.
Далее подробно объясняется способ осаждения соединения, представленного указанной выше формулой (III), и (2S,5R)-7-оксо-N-(2-аминоэтокси)-6-сульфоокси-1,6-диазабицикло[3.2.1]октан-2-карбоксамида, представленного формулой (III-059):
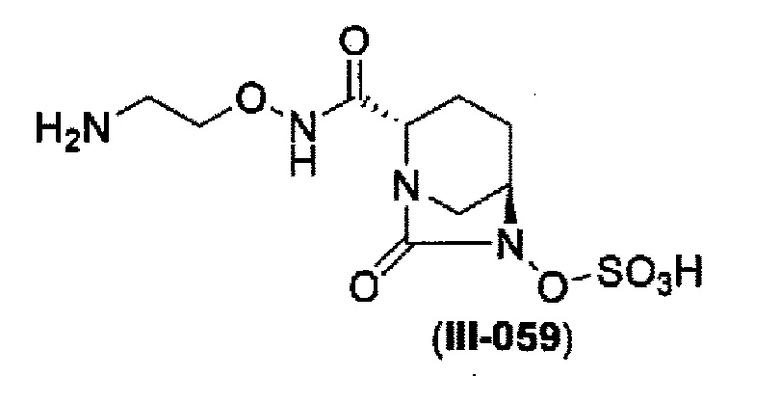
Стадия получения (2S,5R)-метил 5-(бензилоксиамино)пиперидин-2-карбоксилата, представленного указанной выше формулой (4b), или его гидрохлорида может проводиться следующим образом.
Метиловую этерификацию коммерчески доступной (2S,5S)-5-гидроксипиперидин-2-карбоновой кислоты, представленной формулой (7), или ее гидрохлорида осуществляют в метаноле при нагревании в присутствии подходящей кислоты. Применяемой кислотой является хлористый водород, серная кислота, перхлорная кислота, метансульфоновая кислота, п-толуолсульфоновая кислота, предпочтительно, хлористый водород. При использовании хлористого водорода, его используют в количестве от 3 до 6 эквивалентов, предпочтительно, от 4 до 5 эквивалентов по отношению к соотношению молярного числа/массы, полученного из потребленного количества кислоты/основания соединения, представленного формулой (7). Реакцию проводят при кипении с обратным холодильником в течение от 2 до 4 часов, предпочтительно, 3 часов. После завершения реакции остаток, полученный концентрацией реакционной смеси, подщелачивают и экстрагируют подходящим органическим растворителем для выделения (2S,5S)-метил 5-гидроксипиперидин-2-карбоксилата, представленного формулой (8). Применяемым основанием может быть гидроксид натрия, карбонат натрия и карбонат калия, предпочтительно, карбонат калия. Растворителем, применяемым для экстрагирования, может быть диэтиловый эфир, этилацетат, дихлорметан, хлороформ, предпочтительно, этилацетат. Выделенное соединение, представленное формулой (8), может применяться на следующей стадии без дальнейшей очистки.
Трифторацетилирование (2S,5S)-метил 5-гидроксипиперидин-2-карбоксилата, представленного формулой (8), проводят взаимодействием с ангидридом трифторуксусной кислоты в присутствии триэтиламина. Ангидрид трифторуксусной кислоты применяют в количестве от 0,9 до 1,3 эквивалентов, предпочтительно, 1,0 эквивалента по отношению к сумме соотношения молярного числа/массы соединения, представленного формулой (8), полученного способом предварительно меченной ВЭЖХ, и соотношения молярного числа/массы, полученного из количества потребленной кислоты. Кроме того, триэтиламин применяют в количестве, вдвое больше, чем количество ангидрида трифторуксусной кислоты. Растворитель реакции выбирают из дихлорметана, хлороформа, дихлорэтана, этилацетата и тетрагидрофурана, предпочтительно, этилацетата. Реакцию проводят при температуре от -70°С до 0°С, предпочтительно, от -40°С до 0°С, и время реакции составляет от 60 до 120 минут, предпочтительно, от 60 до 90 минут. (2S,5S)-метил 5-гидрокси-1-(2,2,2-трифторацетил)пиперидин-2-карбоксилат, представленный формулой (9), выделяют добавлением воды к реакционной смеси для гидролиза трифторацетоксигруппы только в положении 5, с последующим промыванием обычной кислотой/основанием и концентрацией смеси при пониженном давлении. Выделенное соединение, представленное формулой (9), может применяться на следующей стадии без дальнейшей очистки.
Стадия бензилоксиаминирования гидроксильной группы в положении 5 (2S,5S)-метил 5-гидрокси-1-(2,2,2-трифторацетил)пиперидин-2-карбоксилата, представленного формулой (9), может проводиться взаимодействием с ангидридом трифторметансульфоновой кислоты в количестве от 1 до 1,1 эквивалентов, предпочтительно, одного эквивалента, в присутствии 2,6-лутидина в количестве от 1 до 1,2 эквивалента, предпочтительно, 1,1 эквивалента по отношению к титру ВЭЖХ соединения, представленного формулой (9), в реакционной системе с получением сложного эфира трифторметансульфоновой кислоты, затем взаимодействием полученного соединения с бензилоксиамином в количестве от 1 до 3 эквивалентов, предпочтительно 2 эквивалентов, в присутствии 2,6-лутидина в количестве от 1 до 1,2 эквивалента, предпочтительно, 1,1 эквивалента. Растворитель реакции выбирают из дихлорметана, хлороформа, 1,2-дихлорметана, тетрагидрофурана и ацетонитрила, предпочтительно, ацетонитрила. Реакцию проводят при температуре от -50°С до 50°С, предпочтительно, от -35°С до 0°С, и время реакции составляет от 1 до 5 дней, предпочтительно, от 2 до 3 дней. (2S,5R)-метил 5-(бензилоксиамино)-1-(2,2,2-трифторацетил)пиперидин-2-карбоксилат, представленный формулой (10), может быть выделен и очищен концентрацией реакционной смеси при пониженном давлении, разбавлением остатка растворителем, таким как этилацетат, и т.д., промыванием обычной кислотой/основанием, и концентрацией смеси при пониженном давлении с получением неочищенного соединения, представленного формулой (10), затем, растворением неочищенного продукта в этилацетате и добавлением раствора хлористого водорода-этилацетата с получением гидрохлорида соединения, представленного формулой (10).
Удаление 2,2,2-трифторацетильной группы (2S,5R)-метил 5-(бензилоксиамино)-1-(2,2,2-трифторацетил)пиперидин-2-карбоксилата, представленного формулой (10), может проводиться в метаноле при нагревании в присутствии подходящей кислоты. Применяемой кислотой является хлористый водород, серная кислота, перхлорная кислота, метансульфоновая кислота и п-толуолсульфоновая кислота, предпочтительно, хлористый водород. Применяемое количество хлористого водорода составляет от 10 до 20 эквивалентов, предпочтительно от 13 до 18 эквивалентов по отношению к соединению, представленному формулой (10). Время реакции составляет от 1 до 4 дней, предпочтительно, от 1 до 3 дней. При использовании кислоты, отличной от хлористого водорода, остаток, полученный концентрированием реакционной смеси при пониженном давлении, подщелачивают, свободное основание (2S,5R)-5-(бензилоксиамино)пиперидин-2-карбоксилата, представленное формулой (4b), экстрагируют один раз подходящим органическим растворителем и затем добавляют кислоту, выбранную из щавелевой кислоты и хлористого водорода, для выделения и очищения целевого соединения в виде соли. В случае использования хлористого водорода, реакционную смесь концентрируют, и добавляют этилацетат в качестве слабого растворителя для выделения и очистки гидрохлорида соединения, представленного формулой (4b).
Здесь, соединение, представленное формулой (4b), может быть легко выделено и очищено в виде гидрохлорида кристаллизацией так, чтобы получить промежуточное соединение, очень выгодное промышленно.
Соединение, представленное следующей формулой (IV-a2), (IV-a3) или (IV-a4):
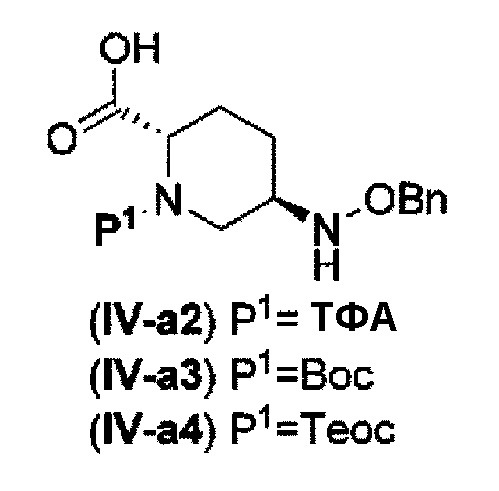
в указанной выше формуле IV-a2), (IV-a3) или (IV-a4) ТФА является трифторацетилом, Вос является трет-бутоксикарбонилом, Теос является 2-триметилсилилэтоксикарбонилом и OBn является бензилокси,
может быть получено по следующей схеме 5:
Схема 5
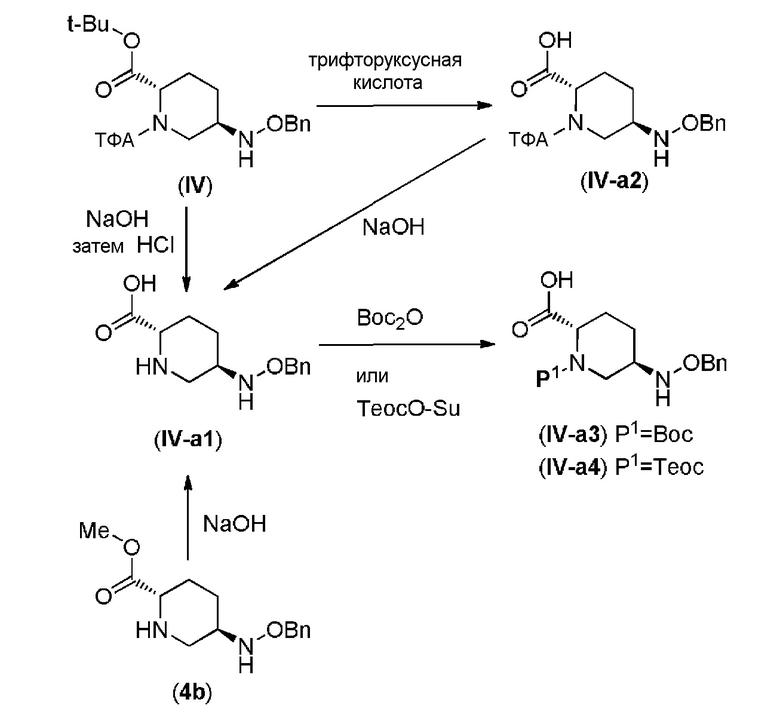
на указанной выше схеме, свободный ТФК является трифторуксусной кислотой, ТФК, связанный с химической формулой, является трифторацетилом, t-Bu является трет-бутилом, OBn является бензилокси, Boc2О является ди-трет-бутоксидикарбонатом, TeocO-Su является N-(2-триметилсилилэтоксикарбонилокси)сукцинимидом, Вос является трет-бутоксикарбонилом и Теос является 2-триметилсилилэтоксикарбонилом,
из соединения, представленного формулой (IV) или (4b) на схеме синтеза 2 оптически активной карбоновой кислоты (6b), способом, показанным в примерах.
То есть, соединение, представленное формулой (IV-a2), может быть получено расщеплением трет-бутокси эфира соединения, представленного формулой (IV), с количеством трифторуксусной кислоты, достаточным для растворения и галогеновом серийном растворителе, таком как дихлорметан или хлороформ.
Также соединение, представленное формулой (IV-a1), может быть получено удалением трифторацетила из соединения, представленного формулой (IV), с основанием, выбранным из гидроксида натрия и гидроксида калия в гидрированном диоксане, расщеплением трет-бутокси эфира кислотой, выбранной из хлористоводородной кислоты, серной кислоты, трифторуксусной кислоты или метансульфоновой кислоты с получением соединения, представленного формулой (IV-a1), которое может применяться на следующей стадии после выделения или без выделения. Кроме того, метиловый эфир гидрохлорида соединения, представленного формулой (4b), отщепляют в тех же основных условиях с получением раствора соединения, представленного формулой (IV-a1), и соединение может применяться на следующей стадии без очистки.
Соединения, представленные формулами (IV-a3) и (IV-a4), может быть получено растворением соединения, представленного формулой (IV-a1), в водном диоксане или водном тетрагидрофуране и взаимодействием с трет-бутоксикарбонилирующим агентом, выбранным из Boc2O (ди-трет-бутоксидикарбоната), Boc-ON (2-(трет-бутоксикарбонилоксиимино)-2-фенилацетонитрила) и Boc-OSu (N-(трет-бутоксикарбонилокси)сукцинимида), или с N-(2-триметилсилилэтоксикарбонилокси)сукцинимидом в присутствии основания, выбранного из гидроксида натрия, карбоната натрия и триэтиламина.
(2S,5R)-5-(бензилоксиамино)пиперидин-2-карбоновая кислота,
(2S,5R)-5-(бензилоксиамино)-1-(2,2,2-трифторацетил)пиперидин-2-карбоновая кислота,
(2S,5R)-5-(бензилоксиамино)-1-(трет-бутоксикарбонил)пиперидин-2-карбоновая кислота, и
(2S,5R)-5-(бензилоксиамино)-1-((2-(триметилсилил)этокси)карбонил)пиперидин-2-карбоновая кислота,
которые имеют формулы (IV-a1), (IV-a2), (IV-a3) и (IV-a4), соответственно, на указанной выше схеме 5, являются новыми соединениями, и они являются полезными не только в области настоящего изобретения, но также общими исходными материалами.
В указанных формулах (IV-a2), (IV-a3) и (IV-a4) стадию получения соединения, представленного следующей формулой (IV-b2-Вос-059), (IV-b3-Cbz-059), (IV-b4-Вос-059):
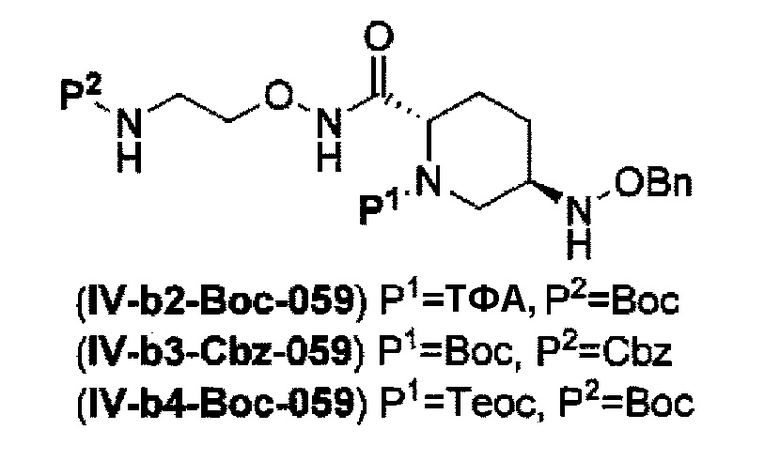
в указанных выше формулах (IV-b2-Вос-059), (IV-b3-Cbz-059), (IV-b4-Вос-059), ТФА является трифторацетилом, Вос является трет-бутоксикарбонилом, Cbz является бензилоксикарбонилом, Теос является 2-триметилсилилэтоксикарбонилом и OBn является бензилокси,
сочетанием соединений, представленных формулами (IV-a2) и (IV-a4) способом с применением трет-бутил 2-(аминоокси)этилкарбамата и активного сложного эфира, активного амида или дегидратирующего конденсирующего агента, и сочетанием соединения, представленного формулой (IV-a3), способом с применением бензил 2-(аминоокси)этилкарбамата и активного сложного эфира, активного амида или дегидратирующего конденсирующего агента, проводится следующим образом.
Количество трет-бутил 2-(аминоокси)этилкарбамата или бензил 2-(аминоокси)этилкарбамата составляет от 1 до 2 эквивалентов по отношению к соединению, представленному формулой (IV-a2), (IV-a3) или (IV-a4), предпочтительно от 1,0 до 1,5 эквивалентов.
Сочетание с использованием дегидратирующего конденсирующего агента проводят во многих случаях добавлением активной эфирной группы или активной амидной группы в качестве катализатора с получением активного сложного эфира или активного амида в реакционной системе, конкретные примеры представлены и объяснены ниже.
При применении дегидратирующего конденсирующего агента используют растворитель, выбранный из этилацетата, толуола, тетрагидрофурана, диоксана, ацетонитрила, дихлорметана, хлороформа, диметилформамида, диметилацетамида и т.д., и предпочтительно, этилацетата, тетрагидрофурана, дихлорметана, ацетонитрила, диметилформамида и диметилацетамида.
При использовании активного этерифицирующего агента в качестве активного амидирующего агента, реакцию проводят в присутствии основания, если это необходимо. Основание, используемое в данной реакции, включает триэтиламин, диизопропилэтиламин, трибутиламин, N-метилморфолин и 4-диметиламинопиридин, предпочтительно триэтиламин, и его применяют в количестве от 1 до 3 эквивалентов по отношению к соединению, представленному формулой (IV-b2-Вос-059), (IV-b3-Cbz-059), (IV-b4-Вос-059), в случае необходимости, предпочтительно, от 1 до 1,5 эквивалентов.
В качестве дегидратирующего конденсирующего агента может применяться только карбодиимид, такой как N,N'-диизопропилкарбодиимид, N,N'-дициклогексилкарбодиимид и гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида, или в сочетании с активной эфирной группой, такой, как и моногидрат 1-гидроксибензотриазола, N-гидроксисукцинимид и·2-гидроксипиридин-N-оксид, а также активный амидирующий агент или активный этерифицирующий агент, такой как карбонилдиимидазол, гексафторфосфат бензотриазол-1-илокси-трис(диметиламино)фосфония, йодид 2-хлор-1-метилпиридиния и хлорид 4-(4,6-диметокси-1,3,5-триазин-2-ил)-4-метилморфолиния, предпочтительно, гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида в сочетании с моногидратом 1-гидроксибензотриазола, или выбранный йодид 2-хлор-1-метилпиридиния и гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида применяют в количестве от 1 до 2 эквивалентов и моногидрата 1-гидроксибензотриазола в количестве от 1 до 2 эквивалентов, по отношению к соединению, представленному формулой (IV-a2), (IV-a3) или (IV-a4), предпочтительно, от 1 до 1,3 эквивалента гидрохлорида 1-этил-3-(3-диметиламинопропил)карбодиимида и от 0,1 до 0,3 эквивалента моногидрата 1-гидроксибензотриазола. Температура реакции составляет от -40°С до комнатной температуры, предпочтительно, от -20°С до комнатной температуры. Реакцию проводят в течение от 30 минут до 1 дня, предпочтительно, от 2 часов до 16 часов.
Соединение формулы (IV-b2-Вос-059), (IV-b3-Cbz-059) или (IV-b4-Вос-059), которое является продуктом сочетания, может быть выделено после завершения реакции разбавлением реакционной смеси подходящим растворителем, последовательным промыванием водой, разбавленной кислотой, водным щелочным раствором (например, разбавленной хлористоводородной кислотой, моногидросульфатом калия, лимонной кислотой или водным раствором бикарбоната натрия) и выпариванием растворителя с концентрацией реакционной смеси. Органическим растворителем, используемым для разбавления, может быть диэтиловый эфир, этилацетат, бутилацетат, толуол, дихлорметан и хлороформ, предпочтительно, этилацетат.
Затем, стадию удаления трифторацетильной группы соединения, представленного указанной выше формулой (IV-b2-Вос-059) обработкой основанием с получением соединения, представленного следующей формулой (IV-c-Вос-059):
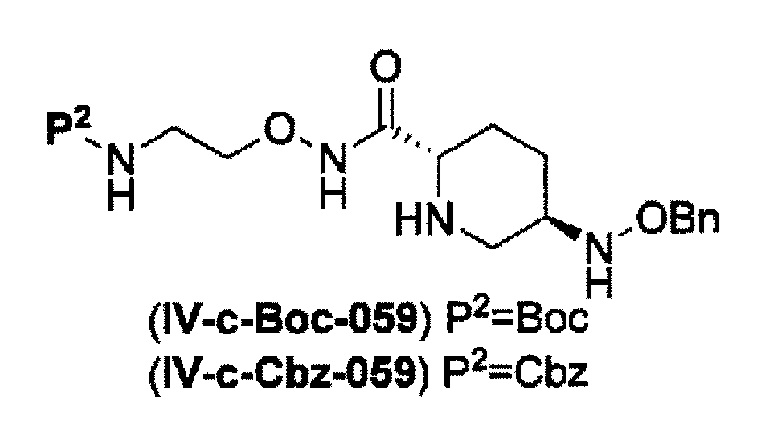
в указанных выше формулах (IV-c-Вос-059) или (IV-c-Cbz-059), Вос является трет-бутоксикарбонилом, Cbz является бензилоксикарбонилом и OBn является бензилокси,
проводят следующим образом.
Растворителем, используемым для удаления трифторацетильной группы, является вода, метанол, этанол, изопропанол, тетрагидрофуран, диоксан, дихлорметан, хлороформ, 1,2-дихлорэтан и т.д., предпочтительно, вода, метанол, тетрагидрофуран и диоксан, которые могут применяться отдельно или в сочетании, более предпочтительно, водный диоксан или тетрагидрофуран.
Основанием является гидроксид лития, гидроксид натрия, гидроксид калия, гидроксид цезия, карбонат лития, карбонат натрия, карбонат калия, карбонат цезия и т.д., предпочтительно, гидроксид лития, гидроксид натрия и гидроксид калия, более предпочтительно, гидроксид натрия, и его применяют в количестве от 2 до 4 эквивалентов по отношению к соединению, представленному формулой (IV-b2), предпочтительно, от 2 до 3 эквивалентов.
Температура реакции составляет от -20°С до 30°С, предпочтительно, от 0 до 10°С. Время реакции составляет от 1 до 16 часов, предпочтительно, от 1 до 3 часов.
Соединение, представленное формулой (IV-c-Вос-059), имеющее группу RcONHCO, которая показывает свойства слабой кислоты, является амфотерным веществом, чтобы получить оптимальный интервал рН для получения соединения в виде свободного основания. Оптимальный рН составляет от pH6 до 9, предпочтительно, от pH6 до 8.
Соединение, представленное формулой (IV-c-Вос-059), может быть выделено разбавлением реакционной смеси органическим растворителем, доведением смеси до оптимального рН и экстрагированием смеси с растворителем. Органическим растворителем, применяемым для разбавления щелочной реакционной смеси, является диэтиловый эфир, этилацетат, бутилацетат, толуол, дихлорметан и хлороформ, предпочтительно, этилацетат или дихлорметан.
Кроме того, стадию удаления трет-бутоксикарбонильной группы соединения, представленного указанной выше формулой (IV-b3-Cbz-059), обработкой кислотой с получением соединения представленной выше формулы (IV-с-Cbz-059), проводят следующим образом.
Растворителем, используемым для удаления трет-бутоксикарбонильной группы, может быть вода, метанол, этанол, изопропанол, этилацетат, диоксан, дихлорметан, хлороформ, 1,2-дихлорэтан и 2,2,2-трифторэтанол, предпочтительно, метанол, этанол, этилацетат, диоксан и дихлорметан, которые могут быть использованы отдельно или в сочетании.
Кислотой, используемой в реакции, является хлористоводородная кислота, серная кислота, фосфорная кислота, муравьиная кислота, трифторуксусная кислота, метансульфоновая кислота, трифторметансульфоновая кислота, хлорметансульфоновая кислота и тетрафторборная кислота, предпочтительно, хлористоводородная кислота, серная кислота, метансульфоновая кислоты и трифторуксусная кислота, более предпочтительно, хлористоводородная кислота или трифторуксусная кислота. Кислота используется в количестве 1 эквивалента к количеству растворителя по отношению к соединению, представленному формулой (IV-b3-Cbz-059), предпочтительно в 5 кратном количестве к количеству растворителя.
Температура реакции составляет от -25 до 50°С, предпочтительно, от -10 до 30°С. Время реакции составляет от 1 до 6 часов, предпочтительно, от 1 до 3 часов.
Соединение, представленное формулой (IV-с-Cbz-059), имеющее группу RcONHCO, которая показывает свойства слабой кислоты, является амфотерным веществом, чтобы получить оптимальный интервал рН для получения соединения в виде свободного основания. Оптимальный рН составляет от pH6 до 9, предпочтительно, от pH6 до 8.
Соединение, представленное формулой (IV-c-Cbz-059), может быть выделено разбавлением реакционной смеси органическим растворителем, доведением смеси до оптимального рН и экстрагированием смеси с растворителем. Органическим растворителем, применяемым для разбавления щелочной реакционной смеси, является диэтиловый эфир, этилацетат, бутилацетат, толуол, дихлорметан и хлороформ, предпочтительно, этилацетат или дихлорметан.
Стадию удаления 2-триметилсилилэтоксикарбонила из соединения, представленного формулой (IV-b4-Вос-059) фторидом с получением соединения, представленного указанной выше формулой (IV-c-Вос-059), можно проводить следующим образом.
Растворителем, используемым для удаления 2-триметилсилилэтоксикарбонила, может быть вода, метанол, этанол, изопропанол, этилацетат, диоксан, тетрагидрофуран, ацетонитрил, диметилформамид и диметилацетамид, предпочтительно, диоксан, тетрагидрофуран и ацетонитрил.
Фторидом, применяемым для реакции, является фторид натрия, фторид калия, фторид цезия, фтористоводородная кислота, фтористый водород - пиридин, фторид тетрабутиламмония, предпочтительно, фторид тетрабутиламмония, и его применяют в количестве от 2 до 6 эквивалентов по отношению к соединению, представленному формулой (IV-b4-Вос-059), предпочтительно, от 2 до 3 эквивалентов.
Температура реакции составляет от 0 до 100°С, предпочтительно, от 25 до 60°С. Реакцию проводят в течение времени от 1 до 48 часов, предпочтительно, от 12 до 24 часов.
Соединение, представленное формулой (IV-c-Boc-059), может быть выделено разбавлением реакционной смеси органическим растворителем, доведением смеси до оптимального рН и экстрагированием смеси с растворителем по методике, описанной для формулы (IV-b2-Вос-059). Органическим растворителем, применяемым для разбавления щелочной реакционной смеси, является диэтиловый эфир, этилацетат, бутилацетат, толуол, дихлорметан и хлороформ, предпочтительно, этилацетат.
Затем, стадию получения соединения, представленного следующей формулой (IIa-Вос-059) или (IIa-Cbz-059):
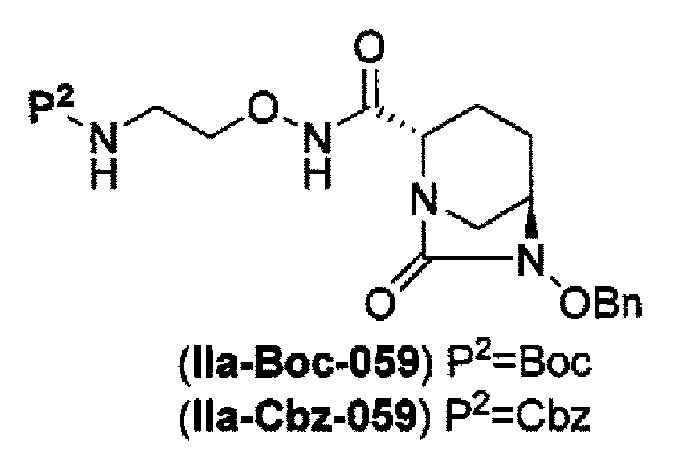
в указанных выше формулах (IIa-Вос-059) или (IIa-Cbz-059), Вос является трет-бутоксикарбонилом, Cbz является бензилоксикарбонилом и OBn является бензилокси,
силилированием соединения, представленного указанной выше формулой (IV-c-Вос-059) или (IV-c-Cbz-059) в реакционной системе, при непрерывном проведении реакции образования внутримолекулярной мочевины, проводят следующим образом.
Растворителем, используемым в реакции, является этилацетат, тетрагидрофуран, диоксан, ацетонитрил, диметилформамид, диметилацетамид, дихлорметан, хлороформ, 1,2-дихлорэтан и т.д., предпочтительно, ацетонитрил.
Органическим основанием, используемым в этой реакции, является триэтиламин, диизопропилэтиламин, трибутиламин, N-метилморфолин и т.д., предпочтительно, триэтиламин, и его применяют в количестве от 3 до 6 эквивалентов по отношению к соединению, представленному формулой (IV-с-Вос-059) или формулой (IV-c-Cbz-059), предпочтительно, от 3 до 4 эквивалентов.
Силилирующим агентом, используемым в реакции, является хлортриалкилсилан, такой как хлортриметилсилан, хлортриэтилсилан, хлортриизопропилсилан и хлор-трет-бутилдиметилсилан; триметилсилил трифторметансульфонат и трет-бутилдиметилсилил трифторметансульфонат, предпочтительно, хлортриметилсилан, и его применяют в количестве от 1 до 3 эквивалентов по отношению к соединению, представленному формулой (IV-с-Вос-059) или формулой (IV-c-Cbz-059), предпочтительно, от 1 до 2 эквивалентов.
Агентом, образующим мочевину, используемым в реакции, является фосген, дифосген, трифосген и карбонилдиимидазол, предпочтительно, фосгена и дифосгена, и его применяют в количестве от 0,5 до 2 эквивалентов по отношению к соединению, представленному формулой (IV-с-Вос-059) или формулой (IV-c-Cbz-059), предпочтительно, от 0,5 до 1,0 эквивалента. В это время, для завершения образования мочевины, каталитическое количество 4-диметиламинопиридина используют в количестве от 0,1 до 1 эквивалента по отношению к соединению, представленному формулой (IV-с), предпочтительно, от 0,1 до 0,2 эквивалента. Температура реакции составляет от -25 до 50°С, предпочтительно, от -15 до 30°С. Реакцию проводят в течение времени от 10 минут до 24 часов, предпочтительно, от 10 минут до 16 часов.
Полученное соединение, представленное формулой (IIa-Вос-059) или (IIa-Cbz-059), может быть выделено обычной последующей обработкой, такой как выпаривание органического растворителя из реакционной смеси для ее концентрации, разбавление растворителем, промывание кислотой и основанием, сушка и выпаривание растворителя для концентрации смеси.
Затем, стадию получения соединения, представленного следующей формулой (IIb-Вос-059):
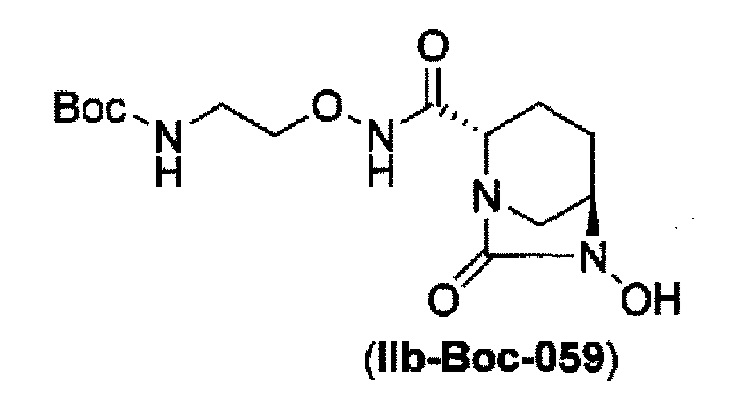
в указанной выше формуле (IIb-Вос-059), Вос является трет-бутоксикарбонилом,
расщеплением бензила из бензилокси в положении 6 соединения, представленного формулой (IIa-Boc-059) с применением катализатора гидрогенолиза в атмосфере водорода, или
удалением бензила из бензилокси в положении 6 соединения, представленного формулой (IIa-Cbz-059) с применением катализатора гидрогенолиза в атмосфере водорода, с одновременным трет-бутоксикарбонилированием, проводят следующим образом.
Растворителем, используемым в этой реакции, является вода, метанол, этанол, изопропанол, этилацетат, тетрагидрофуран и диоксан, предпочтительно, метанол или тетрагидрофуран, которые могут применяться отдельно или в сочетании.
Катализатором гидрогенолиза является оксид платины, гидроксид палладия, палладиевая чернь или палладий на угле, предпочтительно, палладий на угле.
Катализатор применяют в количестве от 5 до 50% массовых в сухом весе по отношению к соединению, представленному формулой (V-2), предпочтительно, от 5 до 20% массовых.
Источником водорода, используемым для гидрогенолиза, является газообразный водород, и давление водорода выбирают в интервале от атмосферного давления до 1 МПа, более предпочтительно, от атмосферного давления до 0,5 МПа. Альтернативно, в качестве источника водорода можно использовать формиат аммония, циклогексен или циклогексадиен. Подаваемое количество водорода является, по крайней мере, стехиометрическим количеством.
Температура реакции гидрогенолиза составляет от 10 до 50°С, предпочтительно, от 15 до 30°С. Реакцию проводят в течение времени от 0,5 до 3 часов, предпочтительно, от 0,5 до 2 часов. Так же, как для соединения, представленного формулой (IIa-Cbz-059), если соединение имеет бензилоксикарбонил, отделяемый от бензилокси в положении 6, оно может быть защищено снова трет-бутоксикарбонилом в присутствии ди-трет-бутоксикарбонилдикарбоната одновременно с указанной выше реакцией гидрогенолиза.
Количество добавляемого ди-трет-бутоксикарбонилдикарбоната составляет от 1 до 2 эквивалентов по отношению к соединению, представленному формулой (IIa-Cbz-059), предпочтительно, от 1 до 1,2 эквивалентов. После завершения реакции соединение, представленное формулой (IIb-Вос-059), полученное в реакционной системе, может быть выделено обычными операциями, такими как фильтрация катализатора и выпаривание растворителя для концентрации смеси.
Затем, стадию получения соединения, представленного следующей формулой (III-Вос-059):
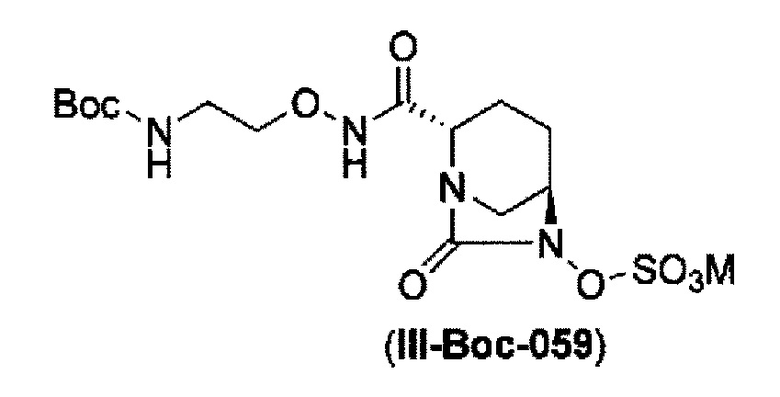
в указанной выше формуле (III-Вос-059), Вос является трет-бутоксикарбонилом, и М является Н, пиридинием, натрием или тетрабутиламмонием,
сульфатированием гидроксильной группы в положении 6 соединения, представленного формулой (IIb-Вос-059) в присутствии органического основания, можно проводить следующим образом.
Растворителем, применяемым для сульфирования, является вода, метанол, этанол, изопропанол, дихлорметан, хлороформ, 1,2-дихлорэтан, пиридин, ацетонитрил, диметилформамид и т.д., предпочтительно, дихлорметан, пиридин или ацетонитрил.
Органическим основанием, используемым в этой реакции, является триэтиламин, трибутиламин, диизопропилэтиламин, N-метилморфолин, пиридин, 2-пиколин, 3-пиколин, 2,6-лутидин, 2,4,6-коллидин, 4-диметиламинопиперидин и N-метилимидазол, предпочтительно, пиридин, 2-пиколин и 2,6-лутидин, и его применяют в количестве 1,0 к количеству растворителя, по отношению к соединению, представленному формулой (IIb-Вос-059), предпочтительно, в количестве 3,0 к количеству растворителя.
Материал, используемый в качестве сульфатирующего агента, является хлорсульфоновая кислота, комплекс триоксид серы - пиридин, комплекс триоксид серы - диметилформамид, комплекс триоксид серы - триметиламин и комплекс триоксид серы - триэтиламин, предпочтительно, комплекс триоксид серы - пиридин, и его применяют в количестве от 1 до 4 эквивалентов в расчете на соединение, представленное формулой (IIb-Вос-059), предпочтительно, от 1 до 3 эквивалентов.
Температура реакции составляет от 0 до 50°С, предпочтительно, от 10 до 30°С. Реакцию проводят в течение времени от 12 до 48 часов, предпочтительно, от 12 до 24 часов.
После завершения реакции соединение, представленное формулой (III-Вос-059) может быть получено в виде пиридиниевой соли сульфоновой кислоты фильтрацией и выпариванием растворителя для концентрации реакционной смеси, и обработкой водным раствором неорганического основания, содержащим натрий, таким как водный раствор бикарбоната натрия, с получением натриевой соли, удалением избытка органического основания промыванием растворителем, и добавлением от 1 до 3 молярных эквивалентов, предпочтительно, от 1 до 2 эквивалентов гидросульфата тетрабутиламмония, и экстрагированием органическим растворителем, таким как этилацетат, с получением соли тетрабутиламмония, которая может применяться на следующей стадии без очистки.
Далее, стадию получения указанного выше (III-059) снятием защиты трет-бутоксикарбонила с соединения, представленного формулой (III-Вос-059) кислотой, выбранной из хлористоводородной кислоты, серной кислоты, метансульфоновой кислоты, трифторуксусной кислоты и тетрафторборной кислоты, проводят следующим образом.
Растворителем, применяемым в реакции, является вода, метанол, этанол, изопропанол, этилацетат, тетрагидрофуран, диоксан, дихлорметан, хлороформ, 1,2-дихлорэтан, 2,2,2-трифторэтанол и т.д., предпочтительно, дихлорметан или 2,2,2-трифторэтанол.
Кислотой, используемой при удалении защиты в кислых условиях, является хлористоводородная кислота, серная кислота, фосфорная кислота, муравьиная кислота, трифторуксусная кислота, метансульфоновая кислота, трифторметансульфоновая кислота, хлорметансульфоновая кислота, тетрафторборная кислота и т.д., предпочтительно, хлористоводородная кислота, серная кислота, трифторуксусная кислота, метансульфоновая кислота и тетрафторборная кислота. Кислоту применяют в количестве 1 эквивалента к количеству растворителя по отношению к соединению, представленному формулой (III-Вос-059), предпочтительно, в 5-кратном количестве к количеству растворителя. Реакцию проводят при температуре от -25 до 50°С, предпочтительно, от -10 до 30°С. Реакцию проводят в течение времени от 30 минут до 5 часов, предпочтительно, от 30 минут до 1 часа.
После завершения снятия защиты, растворитель из реакционной смеси выпаривают для концентрации смеси, полученный остаток превращают в водный раствор с оптимальным рН и подвергают очистке октадецилом - двуокисью кремния (ODS), синтетическим полимером, таким как HP-20 и SP207, или ионообменной смолой, такой как Dowex 50W-X8 (Na типа), выпаривают растворитель для концентрации смеси и повторного осаждения или лиофилизации для получения соединения, представленного формулой (III-059).
Здесь оптимальный рН означает рН, при котором соединение, представленное формулой (III-059), способно существовать стабильно в виде внутримолекулярной соли. Интервал pH от 4 до 7 выбирают так, чтобы выделить соединение в виде внутримолекулярной соли, более предпочтительно, от pH 5 до 6.
ПРИМЕРЫ
Далее настоящее изобретение иллюстрировано более подробно с помощью примеров, но настоящее изобретение не ограничивается этими примерами и возможны различные модификации.
Ссылочный пример 1
(2S,5S)-1-Бензил 2-трет-бутил 5-гидроксипиперидин-1,2-дикарбоксилат (1)
Стадия 1: (S)-1-Бензил-2-трет-бутил 5-оксопирролидин-1,2-дикарбоксилат
(S)-1-(Бензилоксикарбонил)-5-оксопирролидин-2-карбоновую кислоту (100 г) растворяют в безводном хлористом метилене (2 л) и при охлаждении льдом добавляют концентрированную серную кислоту (10 мл) и изобутен (213 г), затем смесь перемешивают в течение ночи при температуре + 20°С или менее. Реакционную смесь добавляют в холодный водный раствор карбоната натрия, обращая внимание на вспенивание, затем органическую фазу отделяют, промывают насыщенным солевым раствором и сушат над безводным сульфатом магния, затем растворитель концентрируют при пониженном давлении. Остаток подвергают хроматографии на колонке с силикагелем, (гексан/этилацетат=7/3) и кристаллизуют из смеси гексан/этилацетат с получением 80 г указанного в заголовке соединения в виде бесцветного кристаллического порошка (выход: 67%). Энантиомерный избыток 99,9% эи или более (CHIRALPAK AD-H, 4,6×150 мм, УФ 210 нм, гексан/этанол=2/1, скорость потока 1 мл/мин, время удерживания 4,2 мин).
[α]20D -43,3° (с 0,52 в CHCl3), согласно не патентному документу [Journal of Medicinal Chemistry 1991, 34(3), 956-968. Dolence, EK.; Lin, CE.; Miller, MJ.; Payne, SM. "Synthesis and siderophore activity of albomycin-like peptides derived from N5-acetyl-N5-hydroxy-L-ornithine"] -41,8° (с 6,71, CHCl3); 1H ЯМР (400 МГц, CDCl3): δ 1,39 (с, 9H), 2,04 (м, 1H), 2,32 (м, 1H), 2,51 (ддд, J=17,6, 9,5, 3,2 Гц, 1H), 2,62 (ддд, J=17,6, 10,5, 9,5 Гц, 1H), 4,55 (дд, J=9,5, 2,7 Гц, 1H), 5,25 (д, J=12,2 Гц, 1H), 5,30 (д, J=12,2 Гц, 1H), 7,26-7,41 (м, 5H); МС m/z 320 (M+H).
Стадия 2: гексаноат (S)-трет-Бутил 2-(бензилоксикарбониламино)-5-оксо-6-диметилсульфоксония
К раствору йодида триметилсульфоксония (70,2 г) в обезвоженном N,N-диметилформамиде (585 мл) в атмосфере аргона добавляют трет-бутоксид калия (36,8 г, 279 ммоль), затем перемешивают при комнатной температуре в течение 1 часа. Затем при температуре ниже 5°С или менее добавляют (S)-1-бензил 2-трет-бутил 5-оксопирролидин-1,2-дикарбоксилат (87,0 г) в течение 20 мин (промывают обезвоженным N,N-диметилформамидом (87 мл)), затем оставляют взаимодействовать при той же температуре в течение 1 часа. Реакционную смесь добавляют в ледяную воду (2,6 л), насыщают хлоридом натрия, экстрагируют этилацетатом (2,6 л × 1 раз, 1,3 л × два раза, 650 мл × 4 раза), и растворитель органического слоя выпаривают при пониженном давлении. Полученный остаток очищают хроматографией на колонке с силикагелем (гептан/этилацетат=1/2→этилацетат/метанол=19/1→9/1) с получением 112,3 г указанного в заголовке соединения в виде бледно-желтого масла (количественный выход).
1H ЯМР (400 МГц, CDCl3): δ 1,46 (с, 9H), 1,95 (м, 1H), 2,09 (м, 1H), 2,23-2,32 (м, 2H), 3,32 (с, 3H), 3,33 (с, 3H), 4,22 (м, 1H), 4,37 (с, 1H), 5,07 (д, J=12,0 Гц, 1H), 5,13 (д, J=12,0 Гц, 1H), 5,75 (шир.д, J=8,0 Гц, 1H), 7,30-7,36 (м, 5H); МС m/z 412 (M+H).
Стадия 3: (S)-1-Бензил 2-трет-бутил 5-оксопиперидин-1,2-дикарбоксилат
Гексаноат (S)-трет бутил 2-(бензилоксикарбониламино)-5-оксо-6-диметиламиносульфоксония (24,8 г) растворяют в 1,2-дихлорэтане (774 мл) и после дегазации добавляют ди-μ-хлорбис[(η-циклоокта-1,5-диен)дииридий (388,5 мг) в атмосфере аргона, затем повышают температуру и оставляют взаимодействовать при +70°С в течение 2 часов. Растворитель реакционной смеси выпаривают при пониженном давлении и полученный остаток очищают с помощью хроматографии на колонке с силикагелем (гексан/этилацетат=2/1) с получением 14,55 г указанного в заголовке соединения красного масла (выход 76%).
1H ЯМР (400 МГц, CDCl3): δ 1,38 (с, 4,5H), 1,47 (с, 4,5H), 2,12-2,48 (м, 4H), 3,93 (д, J=19,0 Гц, 0,5H), 4,00 (д, J=18,8 Гц, 0,5H), 4,37 (д, J=18,8 Гц, 0,5H), 4,46 (д, J=19,0 Гц, 0,5H), 4,62 (дд, J=7,3, 6,6 Гц, 0,5H), 4,77 (дд, J=6,6, 5,9 Гц, 0,5H), 5,10-5,23 (м, 2H), 7,34-7,35 (м, 5H); МС m/z 334 (M+H).
Стадия 4: (2S,5S)-1-Бензил 2-трет-бутил 5-гидрокси-пиперидин-1,2-дикарбоксилат (1)
Раствор (S)-1-бензил 2-трет-бутил-5-оксопиперидин-1,2-дикарбоксилата (14,55 г) в этаноле (437 мл) охлаждают льдом и добавляют боргидрид натрия (1,65 г), затем дают возможность взаимодействовать при охлаждении льдом в течение 20 минут. К реакционной смеси добавляют по каплям насыщенный водный раствор хлорида аммония до окончания выделения пузырьков газа, и полученную соль растворяют добавлением воды. Органический растворитель смеси выпаривают при пониженном давлении, и водный слой остатка экстрагируют этилацетатом. Органический слой промывают насыщенным солевым раствором, затем сушат над безводным сульфатом магния и растворитель выпаривают при пониженном давлении. Остаток очищают с помощью хроматографии на колонке с силикагелем, (гексан/этилацетат=3/1→2/1), с получением 13,35 г указанного в заголовке соединения в виде бесцветного масла (выход 91%). Энантиомерный избыток 98,8% эи (CHIRALPAK AD-H, 4,6×150 мм, УФ 210 нм, гексан/этанол=4/1, скорость потока 1 мл/мин, время удерживания 9,1 мин).
[α]20D -29,7° (с 1,3, CHCl3), согласно не патентному документу [Tetrahedron Asymmetry 2006, 17(17), 2479-2486. Jung, JC.; Avery, MA. "Diastereoselective synthesis of (2S,5S)-and (2S,5R)-N-benzyloxycarbonyl-5-hydroxypipecolic acids from trans-4-hydroxy-L-proline"] -27,9° (с 2,0, CHCl3); 1H ЯМР (400 МГц, CDCl3): δ 1,42 (с, 4,5H), 1,46 (с, 4,5H), 1,66-1,75 (м, 2H), 1,96-2,00 (м, 2H), 2,24-2,30 (м, 1H), 2,74-2,80 (м, 0,5H), 2,84-2,90 (м, 0,5H), 3,64 (шир.с, 1H), 4,15-4,20 (м, 0,5H), 4,23-4,27 (м, 0,5H), 4,65 (д, J=5,4 Гц, 0,5H), 4,78 (д, J=4,6 Гц, 0,5H), 5,07 (д, J=12,5 Гц, 1H), 5,21 (д, J=12,5 Гц, 1H), 7,26-7,37 (м, 5H); МС m/ z 334 (M+H).
Последовательный синтез (2S,5S)-1-бензил 2-трет-бутил 5-гидрокси-пиперидин-1,2-дикарбоксилата (1)
Гексаноат (S)-трет-бутил 2-(бензилоксикарбониламино)-5-оксо-6-диметилсульфоксония (112,3 г, 272 ммоль) растворяют в 1,2-дихлорэтане (3,4 л) и, после дегазации, добавляют ди-μ-хлорбис-[(η-циклоокта-1,5-диен)]дииридий (I) (1,83 г) в атмосфере аргона, затем повышают температуру до +70°С в течение 1,75 часа и оставляют взаимодействовать в течение 1 часа. После охлаждения до комнатной температуры, растворитель из реакционной смеси выпаривают при пониженном давлении, и полученный остаток растворяют в этаноле (1,1 л). Смесь охлаждают льдом и добавляют боргидрид натрия (5,14 г) в течение 10 мин, затем оставляют взаимодействовать при охлаждении льдом в течение 20 минут. К реакционной смеси добавляют по каплям насыщенный водный раствор хлорида аммония (265 мл) до превращения вспенивания, и полученную соль растворяют добавлением воды (250 мл). Органический растворитель выпаривают при пониженном давлении, и водный слой остатка экстрагируют этилацетатом (0,9 л ×3 раза). Растворитель отгоняют при пониженном давлении, и полученный остаток подвергают хроматографии на колонке с силикагелем (гептан/этилацетат=3/1→2/1) с получением 66,82 г указанного в заголовке соединения в виде бесцветного масла (выход: 73%). Результаты измерений согласуются с теми, которые получены на стадии 4 ссылочного примера 1.
Ссылочный пример 2
Тетрагидро-2Н-пиран-4-карбогидразид
Раствор метил тетрагидро-2Н-пиран-4-карбоксилата (1,44 г, 10,0 ммоль) в метаноле (50 мл) перемешивают при 50°С. К реакционной смеси добавляют моногидрат гидразина (0,675 г) с последующим перемешиванием при той же температуре в течение 2 часов, после завершения реакции, реакционную смесь концентрируют и разбавляют метиленхлоридом, затем раствор промывают насыщенным водным раствором бикарбоната натрия и насыщенным солевым раствором, и органический слой сушат над сульфатом магния и растворитель отгоняют при пониженном давлении с получением 952 мг указанного в заголовке соединения (выход 66,1%).
1H ЯМР (400 МГц, CD3OD): δ 1,59-1,83 (м, 4H), 2,37-2,60 (м, 1H), 3,38-3,47 (м, 2H), 3,87-3,96 (м, 2H); МС m/z 145 [M+H]+.
Ссылочный пример 3
Бензил 2-(фуран-2-карбонил)гидразинкарбоксилат
Бензил гидразинкарбоксилат (1,66 г, 10,0 ммоль) растворяют в тетрагидрофуране (20 мл) и воде (20 мл) и добавляют гидрокарбонат натрия (1,68 г). При охлаждении льдом, постепенно добавляют хлорид фуран-2-карбонила (1,30 г, 10 ммоль), затем перемешивают в течение 1 часа. После завершения реакции, к реакционному раствору добавляют 300 мл этилацетата, затем промывают насыщенным раствором хлорида аммония и насыщенным солевым раствором. Органический слой сушат над сульфатом магния, растворитель выпаривают при пониженном давлении и в полученном остатке растворяют 5 мл этилацетата, затем постепенно добавляют гексан (100 мл) с получением 2,30 г указанного в заголовке соединения в виде твердого вещества (выход: 88,4%).
1H ЯМР (400 МГц, CDCl3): δ 5,18 (с, 2H), 6,51 (м, 1H), 6,91 (шир.с, 1H), 7,17 (м, 1H), 7,33 (м, 5H), 7,47 (м, 1H), 8,17 (шир.с, 1H); МС m/z 261 [M+H]+.
Ссылочный пример 4
(R)-трет-Бутил 2-(2-((бензилокси)карбонил)гидразинкарбонил)-5-оксопирролидин-1-карбоксилат
Раствор (R)-1-(трет-бутоксикарбонил)-5-оксопирролидин-2-карбоновой кислоты (1,146 г, 5,00 ммоль) в сухом метиленхлориде (25 мл) охлаждают до 0°С в атмосфере аргона и постепенно добавляют по каплям изобутилхлорформиат (0,682 г) так, чтобы не превышать 0°С. Далее, постепенно добавляют триэтиламин (0,505 г) так, чтобы не превышать 0°С, затем перемешивают в течение 30 минут с получением смешанного ангидрида кислоты в реакционной системе. К этой реакционной смеси постепенно добавляют бензил гидразинкарбоксилат (0,830 г), после добавления температуру повышают до комнатной температуры и перемешивают в течение 1 часа. Эту реакционную смесь промывают 0,5 М хлористоводородной кислотой и насыщенным солевым раствором, органический слой сушат над сульфатом магния и затем выпаривают при пониженном давлении. Полученный остаток очищают с помощью хроматографии на колонке с силикагелем (гексан/этилацетат=4/1→0/1→этилацетат/метанол=30/1) с получением 1,53 г указанного в заголовке соединения (выход 80,1%).
1H ЯМР (400 МГц, CDCl3): δ 1,45 (с, 9H), 2,20 (м, 2H), 2,45 (м, 1H), 2,63 (м, 1H), 4,59 (шир.с, 1H), 5,16 (м, 2H), 6,84 (шир.с, 1H), 7,33 (м, 5H), 8,17 (шир.с, 1H); МС m/z 378 [M+H]+.
Ссылочный пример 5
(S)-трет-Бутил 2-(2-((бензилокси)карбонил)гидразинкарбонил)пирролидин-1-карбоксилат
(S)-1-(трет-бутоксикарбонил)-пирролидин-2-карбоновую кислоту (1,076 г, 5,00 ммоль) перемешивают в атмосфере аргона при комнатной температуре с сухим метиленхлоридом (16 мл). Затем добавляют гидрохлорид N-этил-N'-(3-диметиламинопропил)карбодиимида (EDC, 1,15 г), моногидрат 1-гидроксибензотриазола (HOBt•H2O, 0,918 г) и триэтиламин (1,01 г), затем перемешивают в течение 10 минут. Добавляют бензил гидразинкарбоксилат (1,66 г), затем перемешивают в течение 18 часов. После завершения реакции реакционный раствор промывают 0,5 М хлористоводородной кислоты и насыщенным раствором соли, затем органический слой сушат над сульфатом магния, растворитель выпаривают при пониженном давлении, после чего полученный остаток очищают с помощью хроматографии на колонке с силикагелем (гексан/этилацетат=4/1→0/1→этилацетат/метанол=30/1) с получением 1,48 г указанного в заголовке соединения (выход 81,6%).
1H ЯМР (400 МГц, CDCl3): δ: 1,45 (с, 9H), 1,64 (м, 1H), 1,87-2,16 (м, 2H), 2,38 (м, 1H), 3,31-3,45 (м, 2H), 4,32 (м, 1H), 5,14-5,19 (м, 2H), 6,68 (шир.с, 1H), 7,34-7,40 (м, 5H), 8,76 (шир.с, 1H); МС m/z 364 [M+H]+.
Ссылочный пример 6
(S)-трет-Бутил 2-(2-((бензилокси)карбонил)гидразин-карбонил)-5-оксопирролидин-1-карбоксилат
(S)-трет-Бутил 2-(2-((бензилокси)карбонил)гидразинкарбонил)пирролидин-1-карбоксилат (1,089 г, 3,00 ммоль), описанный в ссылочном примере 5, растворяют в метаноле (15 мл), добавляют 10% палладий на угле (50% содержание воды, 200 мг), затем перемешивают при комнатной температуре в течение 1 часа в атмосфере водорода. Катализатор из реакционной смеси фильтруют через Целит, и растворитель концентрируют при пониженном давлении с получением 595,5 мг указанного в заголовке соединения (выход 86,6%).
1H ЯМР (400 МГц, CD3OD): δ 1,41-1,45 (м, 9H), 1,80-1,99 (м, 3H), 2,15-2,22 (м, 1H), 2,26-3,50 (м, 2H), 4,08-4,15 (м, 1H); МС m/z 230 [M+H]+.
Ссылочный пример 7
трет-Бутил (2-((1,3-диоксоизоиндолин-2-ил)окси)этил)карбамат
трет-Бутил (2-гидроксиэтил)карбамат (1,61 г, 10,0 ммоль) перемешивают в атмосфере аргона при комнатной температуре с безводным тетрагидрофураном (50 мл). Далее добавляют трифенилфосфин (2,75 г) и N-гидроксифталимид (Pht-OH, 1,71 г). После охлаждения льдом реакционной смеси постепенно добавляют по каплям диэтилазодикарбоксилат (DEAD, 1,82 г), и смесь перемешивают при комнатной температуре в течение 24 часов. После завершения реакции, остаток, полученный после отгонки растворителя при пониженном давлении, очищают хроматографией на колонке с силикагелем (гексан/этилацетат=4/1→1/1) с получением 2,61 г указанного в заголовке соединения (выход 85,2%).
1H ЯМР (400 МГц, CDCl3): δ 1,45 (с, 9H), 3,40-3,44 (м, 2H), 4,22-4,24 (м, 2H), 5,62 (шир.с, 1H), 7,73-7,85 (м, 4H); МС m/z 307 [M+H]+.
Ссылочный пример 8
трет-Бутил (2-((1,3-диоксоизоиндолин-2-ил)окси)этил)карбамат
трет-Бутил (2-бромэтил)карбамат (5,00 г, 23,5 ммоль) перемешивают в атмосфере аргона при комнатной температуре с ацетонитрилом (74 мл). Затем добавляют N-гидроксифталимид (Pht-ОН, 3,83 г) и триэтиламин (5,64 г), затем реакционную смесь перемешивают при 70°С в течение 24 часов. После завершения реакции реакционный раствор концентрируют, разбавляют этилацетатом и промывают 0,5М хлористоводородной кислотой и насыщенным водным раствором бикарбоната натрия, и органический слой сушат над сульфатом магния, к остатку, полученному после выпаривания растворителя при пониженном давлении, добавляют этилацетат (10 мл), затем добавляют гексан с получением 4,72 г указанного в заголовке соединения (выход 65,7%). Результаты измерений сопоставимы с результатами измерений для соединения из ссылочного примера 7.
Ссылочный пример 9
трет-Бутил 2-(аминоокси)этилкарбамат
К раствору трет-бутил (2-((1,3-диоксоизоиндолин-2-ил)окси)этил)карбамата (1,83 г, 6,00 ммоль), описанному в ссылочном примере 7 в метиленхлориде (11 мл) постепенно добавляют 9,8М раствор метиламина в метаноле (1,83 мл), затем перемешивают в течение 2 часов. Реакционный раствор фильтруют, и фильтрат упаривают при пониженном давлении, затем экстрагируют 0,5М хлористоводородной кислотой (24 мл). К полученному водному слою добавляют метиленхлорид и 1M гидроксид натрия (18 мл), экстрагируя целевой продукт метиленхлоридом. Полученный органический слой сушат над сульфатом магния, и растворитель выпаривают при пониженном давлении. Получают 1,038 г указанного в заголовке соединение в виде неочищенного продукта (выход 98%).
1H ЯМР (400 МГц, CDCl3): δ 1,45 (м, 9H), 3,35-3,36 (м, 2H), 3,70-3,72 (м, 2H), 4,91 (шир.с, 1H), 5,47 (шир.с, 2H); МС m/z 177 [M+H]+.
Ссылочный пример 10
Бензил (2-((1,3-диоксоизоиндолин-2-ил)окси)этил)карбамат
Бензил (2-гидроксиэтил)карбамат (5,857 г, 30,0 ммоль) перемешивают в атмосфере аргона при комнатной температуре с сухим тетрагидрофураном (150 мл). Далее добавляют трифенилфосфин (7,90 г) и N-гидроксифталимид (Pht-OH, 4,89 г). После охлаждения льдом к реакционной смеси постепенно добавляют по каплям раствор 2,2M диэтилазодикарбоксилата в толуоле (13,7 мл), и смесь перемешивают в течение ночи при комнатной температуре. После завершения реакции остаток, полученный после выпаривания растворителя при пониженном давлении, очищают хроматографией на колонке с силикагелем (гексан/этилацетат=1/1) с получением 9,36 г указанного в заголовке соединения (выход 92%).
1H ЯМР (400 МГц, CDCl3): δ 3,50-3,54 (м, 2H), 4,26-4,34 (м, 2H), 5,14 (шир.с, 2H), 5,98 (шир.с, 1H), 7,18-7,40 (м, 5H), 7,75-8,06 (м, 4H); МС m/z 358 [M+H]+.
Ссылочный пример 11
Бензил 2-(аминоокси)этилкарбамат
К раствору бензил (2-((1,3-диоксоизоиндолин-2-ил)окси)этил)карбамата (9,36 г, 27,50 ммоль), описанного в ссылочном примере 10, в метиленхлориде (51 мл) постепенно добавляют раствор 9,8М метиламина в метаноле (8,50 мл), затем перемешивают в течение 2 часов. Реакционный раствор отгоняют при пониженном давлении, добавляют метиленхлорид (50 мл) и воду (80 мл), доводят до рН 1 добавлением 5М хлористоводородной кислотой, отделяют водный слой и затем промывают метиленхлоридом (50 мл). К полученному водному слою добавляют метиленхлорид (50 мл), доводят до рН11 добавлением 5М гидроксида натрия, органический слой разделяют и затем водный слой дважды экстрагируют метиленхлоридом (50 мл). Объединенные органические слои промывают 50% водным раствором карбоната калия, затем сушат над безводным карбонатом калия, и растворитель выпаривают при пониженном давлении. Полученный остаток очищают с помощью хроматографии на колонке с силикагелем (этилацетат) с получением 5,61 г указанного в заголовке соединения (97% выход).
1H ЯМР (400 МГц, CDCl3): δ 3,42-3,46 (м, 2H), 3,72-3,74 (м, 2H), 5,10 (с, 2H), 5,15 (шир.с, 1H), 7,29-7,39 (м, 5H); МС m/z 211 [M+H]+.
Ссылочный пример 12
2-(2-((Триизопропилсилил)окси)этокси)изоиндолин-1,3-дион
Стадия 1
2-(2-Гидроксиэтокси)изоиндолин-1,3-дион
К раствору N-гидроксифталимида (2,20 г, 13,5 ммоль) и ацетата натрия (3,30 г) в диметилсульфоксиде (40 мл) добавляют 2-бромэтанол (2,88 мл) в атмосфере аргона при комнатной температуре. Реакционную смесь перемешивают при 70°С в течение 5 часов, затем охлаждают до комнатной температуры, добавляют воду (40 мл) и экстрагируют метиленхлоридом. Полученный органический слой промывают водой, 2,5М хлористоводородной кислотой и насыщенным раствором соли. Промытый органический слой сушат над сульфатом магния, полученный после выпаривания растворителя при пониженном давлении остаток перекристаллизовывают из этанола и воды с получением 1,86 г указанного в заголовке соединения (выход 66%).
1H ЯМР (400 МГц, CD3OD): δ 3,84 (т, J=4,6 Гц, 2H), 4,26 (т, J=4,6 Гц, 2H), 7,89-7,80 (м, 4H); МС m/z 208 [M+H]+.
Стадия 2
2-(2-((Триизопропилсилил)окси)этокси)изоиндолин-1,3-дион
К раствору 2-(2-гидроксиэтокси)изоиндолин-1,3-диона (622 мг, 3,00 ммоль) в дегидратированном метиленхлориде (6 мл) добавляют имидазол (306 мг) и хлортриизопропилсилан (TIPSCl, 963 мкл) в атмосфере аргона при комнатной температуре. После перемешивания смеси при комнатной температуре в течение ночи, 2М хлористоводородную кислоту добавляют для остановки реакции, затем метиленхлорид отгоняют при пониженном давлении. Полученный водный слой экстрагируют этилацетатом, затем промывают водный слой насыщенным солевым раствором, и затем сушат над сульфатом магния. Полученный остаток очищают с помощью хроматографии на колонке с силикагелем (гексан/этилацетат=9/1→2/1) с получением 1,04 г указанного в заголовке соединения (выход 95%).
1H ЯМР (400 МГц, CDCl3): δ 0,93-1,06 (м, 21H), 4,09 (т, J=4,8 Гц, 2H), 4,33 (т, J=4,8 Гц, 2H), 7,70-7,76 (м, 2H), 7,80-7,86 (м, 2H); МС m/z 364 [M+H]+.
Ссылочный пример 13
(R)-трет-Бутил 3-(аминоокси)пирролидин-1-карбоксилат
К (R)-трет-бутил 3-((1,3-диоксоизоиндолин-2-ил)окси)пирролидин-1-карбоксилату (2,73 г, 8,21 ммоль), полученному способом, аналогичным ссылочному примеру 7 из (R)-трет-бутил-3-гидроксипирролидин-1-карбоксилата в метаноле (43 мл), постепенно добавляют моногидрат гидразина (1,54 г), затем перемешивают в течение 2 часов. Реакционный раствор фильтруют, и остаток, полученный после отгонки фильтрата при пониженном давлении, очищают хроматографией на колонке с силикагелем (гексан/этилацетат=4/1→0/1), с получением 1,30 г указанного в заголовке соединения (выход 78,3%).
1H ЯМР (400 МГц CDCl3): δ 1,45 (м, 9H), 1,86-1,88 (м, 1H), 2,01-2,06 (м, 1H), 3,26-3,60 (м, 4H), 4,42 (шир.с, 1H); МС m/z 203 [M+H]+.
Ссылочный пример 14
трет-Бутил 4-(2-((1,3-диоксоизоиндолин-2-ил)окси)ацетил)-1,4-диазепин-1-карбоксилат
трет-Бутил 1,4-диазепин-1-карбоксилат (2,00 г, 10,0 ммоль) перемешивают в атмосфере аргона при охлаждении льдом с безводным тетрагидрофураном (50 мл). После добавления триэтиламина (1,01 г), постепенно добавляют хлорацетилхлорид (1,01 г). После завершения реакции добавляют N-гидроксифталимид (1,95 г) и триэтиламин (2,22 г). Реакционную смесь перемешивают при 60°С в течение 22 часов. После завершения реакции реакционный раствор концентрируют, затем разбавляют этилацетатом, промывают 8% лимонной кислотой и насыщенным водным раствором бикарбоната натрия, сушат органический слой над сульфатом магния. Остаток, полученный при выпаривании растворителя при пониженном давлении, очищают хроматографией на колонке с силикагелем и (гексан/этилацетат=4/1→0/1) с получением 3,74 г указанного в заголовке соединения (выход 93,0%).
1H ЯМР (400 МГц, CDCl3): δ 1,45 (м, 9H), 1,85-1,99 (м, 2H), 3,37-4,11 (м, 8H), 4,84 (шир.с, 2H), 7,71-7,84 (м, 4H); МС m/z 404 [M+H]+.
Сравнительный пример 15
трет-Бутил 4-(2-(аминоокси)ацетил)-1,4-диазепин-1-карбоксилат
К трет-бутил 4-(2-((1,3-диоксоизоиндолин-2-ил)окси)ацетил)-1,4-диазепин-1-карбоксилата (2,14 г, 5,30 ммоль), описанному в ссылочном примере 14, в метаноле (16 мл) постепенно добавляют 9,8М раствор метиламина в метаноле (1,62 мл) с последующим перемешиванием в течение 2 часов. Остаток, полученный дистилляцией реакционного раствора при пониженном давлении, растворяют в этилацетате (50 мл), затем экстрагируют 0,25 М хлористоводородной кислоты (20 мл). К полученному водному слою добавляют метиленхлорид и 0,3М гидроксид натрия (40 мл), и целевое соединение экстрагируют метиленхлоридом. Полученный органический слой сушат над сульфатом магния, и растворитель выпаривают при пониженном давлении. Получают 1,298 г указанного в заголовке соединения в виде неочищенного продукта (выход 89,6%).
1H ЯМР (400 МГц, CDCl3): δ 1,45 (м, 9H), 1,85-1,99 (м, 2H), 3,36-3,63 (м, 8H), 4,37 (м, 2H), 5,92 (шир.с, 2H); МС m/z 274 [M+H]+.
Ссылочный пример 16
трет-Бутил 2-(аминоокси)этил(метил)карбамат
Указанное в заголовке соединение получают из трет-бутил 2-гидроксиэтил(метил)карбамата в соответствии с методом, описанным в ссылочном примере 7 и ссылочном примере 13.
1H ЯМР (400 МГц, CDCl3): δ 1,46 (с, 9H), 2,88 (шир.с, 3H), 3,36-3,53 (м, 2H), 3,75 (т, J=6,2 Гц, 2H), 5,30-5,75 (м, 2H); МС m/z 191 [M+H]+.
Ссылочный пример 17
трет-Бутил (2-(аминоокси)этил)(изопропил)карбамат
Указанное в заголовке соединение получают из трет-бутил 2-гидроксиэтил(изопропил)карбамата в соответствии с методом, описанным в ссылочном примере 7 и ссылочном примере 15.
1H ЯМР (400 МГц, CDCl3): δ 1,15 (д, J=6,4 Гц, 6H), 1,47 (с, 9H), 3,22-3,44 (м, 2H), 3,72 (т, J=6,4 Гц, 2H), 3,82-4,45 (м, 1H), 5,30-5,71 (м, 2H); МС m/z 219 [M+H]+.
Сравнительный пример 18
Дигидрохлорид 2-(аминоокси)-N,N-диметилэтанамин
Указанное в заголовке соединение получают по J. Med. Chem., 2000, 43(15), стр. 2332-2349.
1H ЯМР (400 МГц, CDCl3): δ 2,80 (с, 6H), 3,43 (т, J=4,6 Гц, 2H), 4,44 (д, J=4,6 Гц, 2H), 11,2 (шир.с, 2H); МС m/z 105 [M-2HCl+H]+.
Ссылочный пример 19
(S)-трет-Бутил (1-(аминоокси)пропан-2-ил)карбамат
Указанное в заголовке соединение получают из (S)-трет-бутил 1-гидроксипропан-2-илкарбамата в соответствии с методом, описанным в ссылочном примере 7 и ссылочном примере 15.
1H ЯМР (400 МГц, CDCl3): δ 1,12 (д, J=6,8 Гц, 3H), 1,45 (с, 9H), 3,43-3,54 (м, 1H), 3,64 (дд, J=11,2, 4,0 Гц, 1H), 4,00 (шир.с, 1H), 4,64 (шир.с, 1H), 5,57 (шир.с, 1H), 6,64 (шир.с, 1H); МС m/z 191 [M+H]+.
Ссылочный пример 20
трет-Бутил 3-(аминоокси)пропилкарбамат
Указанное в заголовке соединение получают из трет-бутил 3-гидроксипропилкарбамата в соответствии с методом, описанным в ссылочном примере 7 и ссылочном примере 13.
1H ЯМР (400 МГц, CDCl3): δ 1,44 (с, 9H), 1,68-1,82 (м, 2H), 3,14-3,27 (м, 2H), 3,73 (т, J=6,0 Гц, 2H), 4,77 (шир.с, 1H), 5,40 (шир.с, 2H); МС m/z 191 [M+H]+.
Ссылочный пример 21
(S)-трет-Бутил 2-((аминоокси)метил)азетидин-1-карбоксилат
Указанное в заголовке соединение получают из (S)-трет-бутил 2-(гидроксиметил)азетидин-1-карбоксилата в соответствии с методом, описанным в ссылочном примере 7 и ссылочном примере 15.
1H ЯМР (400 МГц, CDCl3): δ 1,45 (с, 9H), 1,97-2,11 (м, 1H), 2,19-2,30 (м, 1H), 3,78-3,93 (м, 4H), 4,42 (шир.с, 1H), 5,62 (шир.с, 1H); МС m/ z 203 [M+H]+.
Ссылочный пример 22
(R)-трет-Бутил 2-(аминоокси)пирролидин-1-карбоксилат
Указанное в заголовке соединение получают из (R)-трет-бутил 2-(гидроксиметил)пирролидин-1-карбоксилата в соответствии с методом, описанным в ссылочном примере 7 и ссылочном примере 13.
1H ЯМР (400 МГц, CDCl3): δ 1,47 (с, 9H), 1,68-1,97 (м, 4H) 3,33 (шир.с, 2H), 3,56 (шир.с, 1H), 3,61-3,82 (м, 1H), 3,88-4,26 (м, 1H), 5,37-5,74 (м, 2H); МС m/z 217 [M+H]+.
Ссылочный пример 23
(S)-трет-Бутил 2-((аминоокси)метил)пиперидин-1-карбоксилат
Указанное в заголовке соединение получают из (S)-трет-бутил 2-(гидроксиметил)пиперидин-1-карбоксилата в соответствии с методом, описанным в ссылочном примере 7 и ссылочном примере 15.
1H ЯМР (400 МГц, CDCl3): δ 1,32-1,76 (м, 6H), 1,47 (с, 9H), 2,71-2,84 (м, 1H), 3,56 (дд, J=11,2, 5,2 Гц, 1H), 3,86-4,04 (м, 2H), 4,59 (шир.с, 1H), 5,64 (шир.с, 2H); МС m/z 231 [M+H]+.
Ссылочный пример 24
(S)-трет-Бутил 3-(аминоокси)пирролидин-1-карбоксилат
(S)-трет-Бутил 3-((1,3-диоксоизоиндолин-2-ил)окси)пирролидин-1-карбоксилат (2,91 г, 8,77 ммоль) полученный из (R)-трет-бутил-3-гидроксипирролидин-1-карбоксилата в соответствии с методом, описанным в ссылочном примере 7, постепенно добавляют к метанолу (43 мл) и моногидрату гидразина (1,54 г), затем перемешивают в течение 3 часов. Реакционный раствор фильтруют и остаток, полученный при дистилляции фильтрата при пониженном давлении, подвергают хроматографии на колонке с силикагелем (гексан/этилацетат=4/1→0/1) с получением 1,75 г указанного в заголовке соединения (выход 98,7%).
1H ЯМР (400 МГц, CDCl3): δ 1,42 (м, 9H), 1,86 (м, 1H), 2,01-2,06 (м, 1H), 3,28-3,60 (м, 4H), 4,23 (шир.с, 1H); МС m/z 203 [M+H]+.
Ссылочный пример 25
трет-Бутил 3-((аминоокси)метил)азетидин-1-карбоксилат
Указанное в заголовке соединение получают из трет-бутил 3-(гидроксиметил)азетидин-1-карбоксилата в соответствии с методом, описанным в ссылочном примере 7 и ссылочном примере 15.
1H ЯМР (400 МГц, CDCl3): δ 1,43 (с, 9H), 2,68-2,90 (м, 1H), 3,57-3,88 (м, 4H), 3,88-4,09 (м, 2H), 5,43 (шир.с, 2H); МС m/z 203 [M+H]+.
Пример 1
(2S,5S)-трет-Бутил 5-гидроксипиперидин-2-карбоксилат (2)
К раствору (2S,5S)-1-бензил 2-трет-бутил 5-гидроксипиперидин-1,2-дикарбоксилата (67,2 г), описанного в ссылочном примере 1, в этаноле (900 мл) добавляют 10% палладий на угле (содержание воды около 50%, 10,1 г) и смесь энергично перемешивают в атмосфере водорода при комнатной температуре в течение ночи. Катализатор из смеси отфильтровывают через Целит, и фильтрат концентрируют с получением 39,3 г указанного в заголовке соединения в виде бесцветного твердого вещества (выход 97%). Энантиомерный избыток 99% эи или более (CHIRALPAK AD-H, 4,6×150 мм, УФ 210 нм, диэтиламин/гексан/этанол=0,1/80/20, скорость потока 1 мл/мин, время удерживания 6,3 мин).
[α]20D -28,7° (c 1,01, CHCl3); 1H ЯМР (400 МГц, CDCl3): δ 1,47 (с, 9H), 1,63 (м, 1H), 1,79-1,84 (м, 3H), 2,82 (дд, J=12,2, 2,2 Гц, 1H), 3,02 (ддд, J=12,2, 3,7, 1,7 Гц, 1H), 3,21 (м, 1H), 3,80 (м, 1H); МС m/z 202 [M+H]+.
Пример 2
(2S,5S)-трет-Бутил 5-гидрокси-1-(2,2,2-трифторацетил)пиперидин-2-карбоксилат (3)
Раствор (2S,5S)-трет-бутил 5-гидроксипиперидин-2-карбоксилата (39,14 г, 194 ммоль) в сухом тетрагидрофуране (450 мл) охлаждают до температуры от -3 до -5°С в атмосфере аргона, затем добавляют триэтиламин (78,7 г) и по каплям добавляют трифторуксусный ангидрид (81,5 г) в течение 30 мин. Реакционную смесь подвергают взаимодействию при температуре от -3 до -5°С в течение 1 часа, затем добавляют воду (90 мл), повышают температуру до комнатной температуры и перемешивают в течение 1 часа. К реакционной смеси добавляют воду (740 мл), экстрагируют этилацетатом (450 мл × три раза) и последовательно промывают объединенные органические слои 5% водным раствором лимонной кислоты (450 мл), 6,5% водным раствором бикарбоната натрия (450 мл) и водой (450 мл). Остаток, полученный при отгонке растворителя при пониженном давлении, подвергают хроматографии на колонке с силикагелем (гексан/этилацетат=2/1) с получением 50,06 г указанного в заголовке соединения в виде бледно-желтого твердого вещества (выход 87%). Энантиомерный избыток 99% эи или более (CHIRALPAK AD-H, 4,6×150 мм, УФ 210 нм, гексан/этанол=4/1, скорость потока 1 мл/мин, время удерживания 4,2 мин).
[α]20D -54,1° (с 0,73, CHCl3); 1H ЯМР (400 МГц, CDCl3): δ получают в виде смеси 2 ротамеров (7:3) 1,26-1,43 (м, 1H), 1,46 (с, 2,7H), 1,47 (с, 6,3H), 1,68-1,77 (м, 1H), 1,81 (д, J=4,8 Гц, 0,3H), 1,89 (д, J=5,2 Гц, 0,7H), 2,05-2,08 (м, 1H), 2,36-2,42 (м, 1H), 2,77 (дд, J=12,2, 12,0 Гц, 0,3H), 3,12 (дд, J=13,2, 10,7 Гц, 0,7H), 3,68-3,77 (м, 1H), 4,00 (м, 1H), 4,52-4,60 (м, 0,6H), 5,07 (д, J=5,9 Гц, 0,7H); МС m/z 298 [M+H]+.
Пример 3
(2S,5R)-трет-Бутил 5-(бензилоксиамино)-1-(2,2,2-трифторацетил)пиперидин-2-карбоксилат (IV)
Раствор (2S,5S)-трет-бутил 5-гидрокси-1-(2,2,2-трифторацетил)пиперидин-2-карбоксилата (10,22 г, 34,38 ммоль) в обезвоженном ацетонитриле (113 мл) охлаждают до температуры от -30 до -40°С в атмосфере аргона, затем добавляют 2,6-лутидин (4,4 мл), затем по каплям добавляют ангидрид трифторметансульфокислоты (5,92 мл) в течение 10 минут, и далее подвергают взаимодействию при -30°С в течение 15 минут. К этой реакционной смеси добавляют бензилоксиамин (8,46 г) (промытый ацетонитрилом (5 мл)), затем повышают температуру до 0°С в течение 30 минут, затем добавляют 2,6-лутидин (4,4 мл) и подвергают взаимодействию при температуре от 0 до 5°С в течение 3,5 дней. Эту реакционную смесь концентрируют при пониженном давлении, полученный остаток разбавляют этилацетатом (200 мл), затем последовательно промывают водой (200 мл), 10% водным раствором лимонной кислоты (200 мл × три раза), 6,5% водным раствором бикарбоната натрия (100 мл) и насыщенным раствором соли (100 мл). Каждый водный слой повторно экстрагируют этилацетатом (100 мл), органические слои объединяют и сушат над безводным сульфатом магния, и растворитель выпаривают при пониженном давлении. Полученный остаток очищают хроматографией на колонке с силикагелем (гексан/этилацетат=4/1) с получением 11,69 г указанного в заголовке соединения в виде бесцветного масла (выход 85%). Энантиомерный избыток 99,0% эи (CHIRALPAK AD-H, 4,6×150 мм, УФ 210 нм, гексан/этанол=9/1, скорость потока 1 мл/мин, время удерживания 4,5 мин).
[α]20D -45,6° (с 0,73, CHCl3); 1H ЯМР (400 МГц, CDCl3): δ получают в виде смеси 2 ротамеров (7:3) 1,46 (с, 2,7H), 1,48 (с, 6,3H), 1,62-1,65 (м, 2H), 1,93-2,05 (м, 2H), 3,13 (м, 0,3H), 3,24-3,29 (м, 1H), 3,46 (м, 0,7H), 4,12 (м, 0,3H), 4,58-4,77 (м, 2,7H), 5,06 (м, 0,7H), 5,38 (м, 1H), 7,30-7,36 (м, 5H); МС m/z 403 [M+H]+.
Пример 4
(2S,5R)-трет-Бутил 5-(бензилоксиамино)пиперидин-2-карбоксилат (4а)
К раствору (2S,5R)-трет-бутил 5-(бензилоксиамино)-1-(2,2,2-трифторацетил)пиперидин-2-карбоксилата (6,91 г, в 17,17 ммоль) в 1,4-диоксане (34 мл) добавляют воду (9,2 мл), затем добавляют по каплям 2,5М гидроксид натрия (13,7 мл) при охлаждении льдом, и оставляют взаимодействовать при той же температуре в течение 0,5 часов. К реакционной смеси добавляют уксусную кислоту (примерно 1 мл), затем концентрируют при пониженном давлении и полученный концентрированный остаток экстрагируют этилацетатом (58 мл, 29 мл). Каждый органический слой промывают 50% водным раствором карбоната калия, и объединенные органические слои сушат над безводным сульфатом натрия и выпаривают растворитель при пониженном давлении. Полученный остаток очищают с помощью хроматографии на колонке с силикагелем (гексан/этилацетат=4/1→0/1→этилацетат/метанол=19/1) с получением 4,74 г указанного в заголовке соединения в виде бесцветного масла (выход 90%). Энантиомерный избыток 98,9% эи (CHIRALPAK AD-H, 4,6×150 мм, УФ 210 нм, диэтиламин/гексан/этанол=0,1/80/20, скорость потока 1 мл/мин, время удерживания 5,5 мин).
[α]20D -2,8° (с 0,73, CHCl3); 1H ЯМР (400 МГц, CDCl3): δ 1,28 (м, 1H, 1,42-1,46 (м, 10H), 1,92 (м, 1H), 2,04 (ддд, J=12,9, 7,3, 4,0 Гц, 1H), 2,43 (дд, J=12,0, 9,8 Гц, 1H), 2,98 (м, 1H), 3,16 (дд, J=11,0, 3,2 Гц, 1H), 3,57 (ддд, J=12,0, 4,2, 2,0 Гц, 1H), 4,68 (с, 2H), 7,29-7,35 (м, 5H); МС m/z 307 [M+H]+.
Пример 5
Последовательный синтез (2S,5R)-трет-Бутил 5-(бензилоксиамино)пиперидин-2-карбоксилата (4а)
Раствор (2S,5S)-трет-Бутил 5-гидрокси-1-(2,2,2-трифторацетил)пиперидин-2-карбоксилата (47,9 г, 161 ммоль) в сухом ацетонитриле (318 мл) охлаждают до температуры от -30 до -40°С в атмосфере аргона, затем добавляют 2,6-лутидин (20,5 мл), затем добавляют по каплям ангидрид трифторметансульфокислоты (28,4 мл) в течение 40 минут, и затем подвергают взаимодействию при -30°С в течение 15 минут. К этой реакционной смеси добавляют бензилоксиамин (39,7 г) (промытый ацетонитрилом (11 мл)) в течение 8 минут, затем повышают температуру до 0°С в течение 30 минут, добавляют еще 2,6-лутидин (20,5 мл) и подвергают взаимодействию при температуре от 0 до 5°С в течение 2 дней. Реакционную смесь концентрируют при пониженном давлении, полученный остаток разбавляют этилацетатом (960 мл) и последовательно промывают водой (960 мл), 10% раствором лимонной кислоты (960 мл × три раза), 6,5% водным раствором бикарбоната натрия (480 мл) и насыщенным раствором соли (480 мл). Каждый водный слой повторно экстрагируют этилацетатом (960 мл), органические слои объединяют и растворитель выпаривают при пониженном давлении. Полученный остаток растворяют в растворе 1,4-диоксана (320 мл) и воде (86 мл), затем по каплям добавляют 2,5М гидроксид натрия (128 мл) при охлаждении льдом и оставляют взаимодействовать при той же температуре в течение 0,5 часов. К реакционной смеси добавляют уксусную кислоту (около 9,3 мл), затем концентрируют при пониженном давлении, и полученный остаток экстрагируют этилацетатом (580 мл, 290 мл). Каждый органический слой промывают 50% водным раствором карбоната калия (580 мл), затем объединенные органические слои и растворитель выпаривают при пониженном давлении. Полученный остаток очищают с помощью хроматографии на колонке с силикагелем (гексан/этилацетат=4/1→0/1→этилацетат/метанол=100/1→19/1) с получением 36,58 г указанного в заголовке соединения в виде бесцветного масла (выход 74%). Данные измерений сопоставимы с данными из примера 4.
Пример 6
(2S,5R)-трет-Бутил 6-(бензилокси)-7-оксо-1,6-диазабицикло[3.2.1]октан-2-карбоксилат (5a)
К раствору (2S,5R)-трет-бутил 5-(бензилокси)аминопиперидин-2-карбоксилата (4,14 г, 13,51 ммоль) в сухом ацетонитриле (615 мл) добавляют триэтиламин (4,9 мл) в атмосфере аргона при 0°С, затем добавляют по каплям дифосген (1,18 мл) в течение 5 минут и перемешивают при той же температуре в течение 10 минут. К этому раствору добавляют 4-диметиламинопиридин (182 мг), затем температуру повышают до комнатной температуры и оставляют взаимодействовать в течение 3 часов. Реакционную смесь концентрируют при пониженном давлении до объема одной десятой, полученный концентрированный раствор разбавляют этилацетатом, затем последовательно промывают водой, 5% водным раствором лимонной кислоты, 6,5% водным раствором бикарбоната натрия и насыщенным раствором соли, сушат над безводным сульфатом магния растворитель выпаривают при пониженном давлении. Полученный остаток очищают с помощью хроматографии на колонке с силикагелем (гексан/этилацетат=2/1) с получением 3,09 г указанного в заголовке соединения (выход 69%). Полученное твердое вещество перекристаллизовывают из этилацетата-гексана, образовавшийся осадок отфильтровывают. Влажные кристаллы промывают гексаном, затем сушат при комнатной температуре при пониженном давлении с получением указанного в заголовке соединения в виде бесцветного кристаллического порошка. Энантиомерный избыток 99,4% эи (CHIRALPAK AD-H, 4,6×150 мм, гексан/этанол=2/1, УФ 210 нм, скорость потока 1 мл/мин, время удерживания 8,0 мин).
Мр 83°С; [α]20D +5,9° (с 0,61, CHCl3); 1H ЯМР (400 МГц, CDCl3): δ 1,48 (с, 9H), 1,62 (м, 1H), 2,00-2,10 (м, 3H), 2,98 (д, J=11,7 Гц, 1H), 3,03 (м, 1H), 3,30 (м, 1H), 4,01 (м, 1H), 4,90 (д, J=11,5 Гц, 1H), 5,06 (д, J=11,5 Гц, 1H), 7,35-7,42 (м, 5H); МС m/z 333 [M+H]+.
В диаграмме порошковой рентгеновской дифракции кристалл указанного в заголовке соединения показывает характеристические пики, показанные в таблице 1. Для измерения в качестве оборудования для проведения порошковой дифракции рентгеновских лучей используют RINT2100 от Rigaku Corporation, в котором измерение проводят с CuKα1 в качестве источника рентгеновских лучей, напряжение на трубке 40 кВ, ток трубки 40 мА, скорость сканирования 4°/мин и интервал сканирования 2Θ = от 3 до 40°.
Порошковая рентгенограмма соединения (5а)
Пример 7
(2S,5R)-трет-Бутил 6-(бензилокси)-7-оксо-1,6-диазабицикло[3.2.1]октан-2-карбоксилат (5а): реакция с фосгеном
К раствору (2S,5R)-трет-бутил 5-(бензилоксиамино)пиперидин-2-карбоксилата (3,0 г, 9,791 ммоль) в сухом ацетонитриле (150 мл) в атмосфере аргона при комнатной температуре добавляют триэтиламин (3,82 мл) и 4-диметиламинопиридин (120 мг), и вводят фосген (полученный добавлением дифосгена (1,548 г) по каплям к активированному углю (1 г), нагретому до 60°С в течение 1,5 часов) в потоке аргона, затем перемешивают в течение ночи. Избыток фосгена разлагают концентрированным водным раствором аммиака (0,6 мл), и растворитель реакционной смеси концентрируют при пониженном давлении. Остаток разбавляют этилацетатом (50 мл), промывают последовательно водой (50 мл), 5% водным раствором лимонной кислоты (50 мл), 6,5% водным раствором бикарбоната натрия (25 мл) и насыщенным раствором соли, затем сушат над безводным сульфатом магния и растворитель выпаривают при пониженном давлении. Полученный остаток очищают с помощью хроматографии на колонке с силикагелем (гексан/этилацетат=2/1) с получением 2,25 г указанного в заголовке соединения (выход 69%). Полученное твердое вещество перекристаллизовывают из этилацетата-гексана, полученный осадок отфильтровывают. Влажный кристалл промывают гексаном и затем сушат при пониженном давлении при комнатной температуре с получением указанного в заголовке соединения в виде бесцветного кристаллического порошка. Данные измерений сопоставимы с данными из примера 6.
Пример 8
Циклогексиламин (2S,5R)-6-(бензилокси)-7-оксо-1,6-диазабицикло[3.2.1]октан-2-карбоксилата (6а)
К раствору (2S,5R)-трет-Бутил 6-(бензилокси)-7-оксо-1,6-диазабицикло[3.2.1]октан-2-карбоксилата (270 мг, 0,842 ммоль) в метиленхлориде (2 мл) добавляют трифторуксусную кислоту (2 мл) в атмосфере аргона при 0°С, и температуру повышают до комнатной температуры, затем подвергают взаимодействию в течение 4 часов. Реакционную смесь концентрируют, и полученный остаток разбавляют этилацетатом, последовательно промывают водой и насыщенным солевым раствором, сушат над безводным сульфатом магния и растворитель выпаривают при пониженном давлении. Полученный остаток растворяют в этилацетате (2,5 мл) и затем добавляют раствор циклогексиламина (149 мг) в диэтиловом эфире при комнатной температуре с последующим перемешиванием при 0°С в течение 1 часа. Полученный осадок отфильтровывают, и фильтровальную лепешку промывают диэтиловым эфиром, затем сушат при комнатной температуре при пониженном давлении и получают 270 мг указанного в заголовке соединения в виде бесцветного кристаллического порошка (выход 86%).
Мр 175°С; [α]20D -36,8° (с 0,50, Н2O); 1H ЯМР (400 МГц, диметилсульфоксид): δ 1,00-1,30 (м, 5H), 1,53-1,95 (м, 8H), 2,04-2,09 (м, 1H), 2,76 (д, J=11,6 Гц, 1H), 2,80-2,93 (м, 1H), 3,19 (д, J=11,2 Гц, 1H), 3,33 (шир.с, 2H), 3,40 (д, J=7,2 Гц, 1H), 3,51 (шир.с, 1H), 4,87 (д, J=11,6 Гц, 1H), 4,93 (д, J=11,6 Гц, 1H), 7,30-7,45 (м, 5H), 8,04 (шир.с, 1H); МС m/z 100, 277 [M-C6H13N+H]+.
В диаграмме порошковой рентгеновской дифракции кристалл указанного в заголовке соединения показывает характеристические пики, представленные в таблице 2. Для измерения в качестве оборудования для проведения порошковой дифракции рентгеновских лучей используют RINT2100 от Rigaku Corporation, в котором измерение проводят с CuKα1 в качестве источника рентгеновских лучей, напряжение на трубке 40 кВ, ток трубки 40 мА, скорость сканирования 4°/мин и интервал сканирования 2Θ = от 3 до 40°.
Порошковая рентгенограмма соединения (6а)
Пример 9
(2S,5R)-6-(Бензилокси)-7-оксо-1,6-диазабицикло[3.2.1]октан-2-карбоновая кислота (6b)
Циклогексиламин (230 мг) (2S,5R)-6-(бензилокси)-7-оксо-1,6-диазабицикло[3.2.1]октан-2-карбоновой кислоты растворяют в насыщенном водном растворе дигидрофосфата натрия, затем экстрагируют 4 раза этилацетатом и объединенные органические слои промывают насыщенным солевым раствором и затем сушат над безводным сульфатом магния. Растворитель выпаривают при пониженном давлении и сушат в вакууме с получением 161 мг указанного в заголовке соединения в виде бесцветного пенообразного твердого вещества (выход 87%). Энантиомерный избыток 99,9% эи или более (CHIRALPAK AD-H, 4,6×150 мм, трифторуксусная кислота/гексан/этанол=0,1/80/20, УФ 210 нм, скорость потока 1 мл/мин, время удерживания 15,5 мин).
[α]D20 +11,5° (с 0,56, CHCl3); 1H ЯМР (400 МГц, CDCl3): δ 1,67 (м, 1H), 2,04-2,26 (м, 3Н), 2,85 (д, J=12,0 Гц, 1H), 3,13 (м, 1H), 3,35 (м, 1Н), 4,12 (м, 1Н), 4,91 (д, J=11,3 Гц, 1H), 5,06 (д, J=11,3 Гц, 1H), 7,37-7,44 (м, 5H); МС m/z 277 [M+H]+.
Пример 10
(2S,5R)-6-(Бензилокси)-7-оксо-1,6-диазабицикло[3.2.1]октан-2-карбоновая кислота (6b); обработка хлористоводородной кислотой с последующей кристаллизацией
Циклогексиламин (2S,5R)-6-(Бензилокси)-7-оксо-1,6-диазабицикло[3.2.1]октан-2-карбоновой кислоты (3,75 г, 10,0 ммоль) растворяют в воде (50 мл). Добавляют этилацетат (100 мл) и 1М хлористоводородную кислоту (20 мл). Смесь перемешивают, затем экстрагируют три раза этилацетатом (каждый раз 100 мл). Органический слой сушат над безводным сульфатом магния, растворитель концентрируют до 10 мл при пониженном давлении. Постепенно добавляют 120 мл гексана при перемешивании при охлаждении льдом и полученный осадок отфильтровывают. Полученный осадок отфильтровывают. После промывания влажных кристаллов гексаном, их сушат при комнатной температуре при пониженном давлении с получением 2,44 г указанного в заголовке соединения в виде бесцветного кристаллического порошка. Т.пл. 116°С; другие данные измерений сопоставимы с данными из примера 9.
В диаграмме порошковой рентгеновской дифракции кристалл указанного в заголовке соединения показывает характеристические пики, показанные в таблице 3. Для измерения в качестве оборудования для проведения порошковой дифракции рентгеновских лучей используют RINT2100 от Rigaku Corporation, в котором измерение проводят с CuKα1 в качестве источника рентгеновских лучей, напряжение на трубке 40 кВ, ток трубки 40 мА, скорость сканирования 4°/мин и интервал сканирования 2Θ = от 3 до 40°.
Порошковая рентгенограмма соединения (6b)
Пример 11
Дигидрохлорид (2S,5R)-5-(бензилоксиамино)пиперидин-2-карбоновой кислоты (IV-a1)
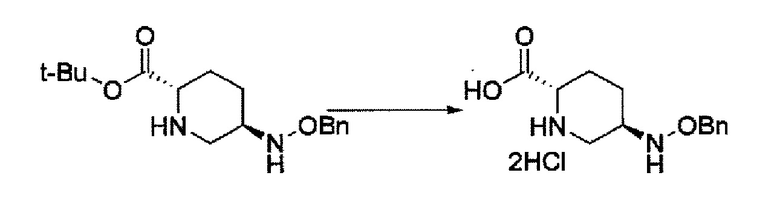
К 5M хлористоводородной кислоте (500 мл) добавляют (2S,5R)-трет-бутил 5-(бензилоксиамино)пиперидин-2-карбоксилат (46,69 г), и смесь перемешивают при 65°С в течение 2 часов. Реакционный раствор охлаждают до комнатной температуры, остаток, полученный концентрированием растворителя при пониженном давлении, растворяют в воде (500 мл), затем добавляют активированный уголь (2,7 г) и перемешивают в течение 30 минут. Активированный уголь удаляют фильтрованием, фильтрат концентрируют досуха и сушат в вакууме в течение ночи с получением 49,3 г указанного в заголовке соединения бледно-желтого твердого вещества (количественный выход).
1H ЯМР (400 МГц, D2O): δ 1,39-1,49 (м, 1H), 1,59-1,70 (м, 1H), 1,88-1,95 (м, 1H), 2,20-2,28 (м, 1H), 2,78 (т, J=11,8 Гц, 1H), 3,19-3,28 (м, 1H), 3,48-3,52 (м, 1H), 3,68-3,72 (м, 1H), 3,57 (с, 3H), 3,70 (дд, J=3,4, 12,6 Гц), 4,68 (с, 2H), 7,26-7,32 (м, 5H); МС m/z 251 [M-2HCl+H]+.
Пример 12
Дигидрохлорид (2S,5R)-метил 5-(бензилоксиамино)пиперидин-2-карбоксилата (4b)

К 2М гидрохлорида в метаноле (7 мл) добавляют дигидрохлорид (2S,5R)-5-(бензилокси)пиперидин-2-карбоновой кислоты (176 мг), затем кипятят с обратным холодильником в течение 3 часов, реакционную смесь концентрируют при пониженном давлении, сушат в вакууме в течение ночи с получением указанного в заголовке соединения в виде бледно-желтого твердого вещества (количественный выход).
1H ЯМР (400 МГц, D2O): δ 1,40-1,51 (м, 1H), 1,61-1,72 (м, 1H), 1,90-1,94 (м, 1H), 2,25-2,30 (м, 1H), 2,80 (т, J=11,2 Гц, 1H), 3,19-3,27 (м, 1H), 3,51-3,55 (м, 1H), 3,66 (с, 3H), 3,87-3,91 (м, 1H), 4,68 (с, 2H), 7,27 (с, 5H); МС m/z 265 [M-2HCl+H]+.
Пример 13
(2S,5R)-Метил 5-(бензилоксиамино)пиперидин-2-карбоксилат (4b)
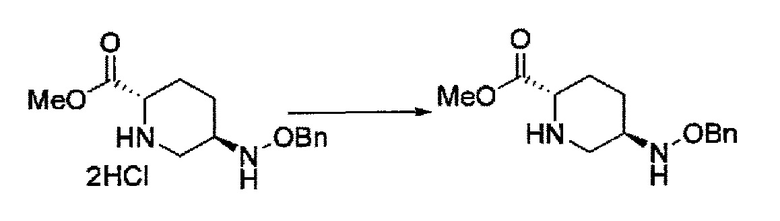
К дигидрохлориду (2S,5R)-метил 5-(бензилоксиамино)пиперидин-2-карбоксилата (1,319 г) добавляют этилацетат (20 мл) и 50% водный раствор карбоната калия (20 мл) для жидкостного разделения, и водный слой три раза экстрагируют этилацетатом (15 мл). Органический слой промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и фильтруют, затем концентрируют при пониженном давлении и сушат в вакууме в течение ночи с получением 975 мг указанного в заголовке соединения (выход 94%).
1H ЯМР (400 МГц, CDCl3): δ 1,25-1,35 (м, 1H), 1,49-1,59 (м, 1H), 1,89-2,11 (м, 2H), 2,45 (т, J=11,7 Гц, 1H), 2,96-3,03 (м, 1H), 3,28-3,92 (м, 2H), 3,72 (с, 3H), 4,68 (с, 2H), 7,26-7,35 (м, 5H); МС m/z 265 [M+H]+.
Пример 14
Прямой синтез дигидрохлорида (2S,5R)-метил-5-(бензилоксиамино)пиперидин-2-карбоксилата (4b)
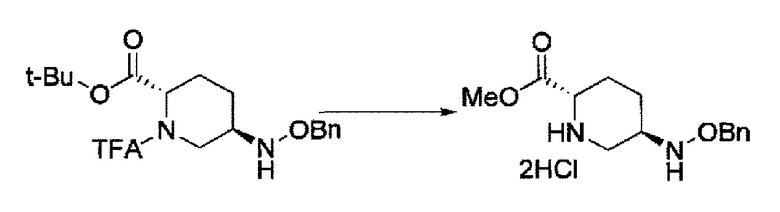
Неочищенный продукт (507 мг, 1,26 ммоль (2S,5R)-трет-бутил 5-(бензилоксиамино)-1-(2,2,2-трифторацетил)пиперидин-2-карбоксилата, описанного в примере 3, растворяют в 2М растворе хлористого водорода в метаноле (10,3 мл) и нагревают с обратным холодильником в течение 33 часов. Реакционную смесь концентрируют при пониженном давлении до объема приблизительно 3,6 мл и этилацетат (10,3 мл) добавляют к концентрированному раствору для осаждения. Полученный осадок собирают путем вакуумной фильтрации, фильтровальную лепешку промывают небольшим количеством этилацетата, затем сушат в сквозном потоке с получением 290 мг указанного в заголовке соединения в виде белого порошка (выход 68%). Данные измерений сопоставимы с данными из примера 12.
Пример 15
(2S,5R)-метил 6-(бензилокси)-7-оксо-1,6-диазабицикло[3.2.1]октан-2-карбоксилат (5b)
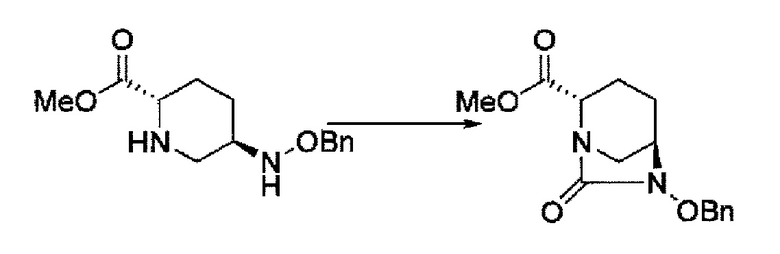
К (2S,5R)-метил 5-(бензилоксиамино)пиперидин-2-карбоксилату (1,154 г, 4,37 ммоль) добавляют сухой ацетонитрил (198 мл), затем охлаждают на льду. По каплям добавляют последовательно триэтиламин (1,60 мл) и дифосген (0,389 мл) при 5°С или ниже, и смесь перемешивают при 2°С в течение 20 минут. Затем к реакционной смеси добавляют 4-диметиламинопиридин (70,0 мг) и смесь перемешивают при комнатной температуре в течение 10 часов. Реакционную смесь концентрируют при пониженном давлении, затем проводят замещение и концентрируют этилацетатом три раза и раствор концентрируют до 30 мл. Добавляют этилацетат (20 мл) и воду (40 мл), затем проводят жидкостное разделение, и водный слой экстрагируют этилацетатом (30 мл) два раза. Объединенные органические слои промывают 5% водным раствором лимонной кислоты (40 мл), 6,5% водным раствором бикарбоната натрия (30 мл) и 5% насыщенным раствором соли (30 мл) и сушат над безводным сульфатом натрия, фильтруют и концентрируют при пониженном давлении. 1,16 г полученного остатка разбавляют этилацетатом (5,5 мл) и добавляют н-гексан (11 мл) и затравочные кристаллы инокулируют для кристаллизации. Затем добавляют н-гексан (49 мл) и перемешивают при 0°С в течение 1 часа. Затем кристаллы отфильтровывают, промывают н-гексаном (60 мл) и затем сушат в вакууме с получением 882,3 мг указанного в заголовке соединения в виде бесцветного кристаллического порошка (выход 71%).
Мр 86°С; [α]20D +5,3° (с 1,10, CHCl3); 1H ЯМР (400 МГц, CDCl3): δ 1,65-1,70 (м, 1H), 2,03-2,12 (м, 3H), 2,90 (д, J=12,0 Гц, 1H), 3,07 (м, 1H), 3,79 (с, 3H), 4,12 (дд, J=4,6, 4,4 Гц, 1H), 4,91 (д, J=11,2 Гц, 1H), 5,06 (д, J=11,2 Гц, 1H), 7,35-7,44 (м, 5H); МС m/z 291 [M+H]+.
В диаграмме порошковой рентгеновской дифракции кристалл указанного в заголовке соединения показывает характеристические пики, показанные в таблице 4. Для измерения в качестве оборудования для проведения порошковой дифракции рентгеновских лучей используют RINT2100 от Rigaku Corporation, в котором измерение проводят с CuKα1 в качестве источника рентгеновских лучей, напряжение на трубке 40 кВ, ток трубки 40 мА, скорость сканирования 4°/мин и интервал сканирования 2Θ = от 3 до 40°.
Порошковая рентгенограмма соединения (5b)
Пример 16
(2S,5R)-6-(Бензилокси)-7-оксо-1,6-диазабицикло[3.2.1]октан-2-карбоксилат (6b): Синтез из (5b)
К (2S,5R)-метил 6-(бензилокси)-7-оксо-1,6-диазабицикло[3.2.1]октан-2-карбоксилату (809,0 мг, 2,79 ммоль) добавляют тетрагидрофуран (8 мл) и воду (3,6 мл), затем по каплям добавляют 0,5М водный раствор гидроксида лития (6,41 мл) при 4,9°С в течение 10 минут. Реакционный раствор перемешивают при 2°С в течение 2 часов, затем добавляют воду (30 мл) и промывают этилацетатом (25 мл). К отделенному водному слою добавляют этилацетат (15 мл), водный слой доводят до pH 4,0 добавлением 1М водным раствором хлористоводородной кислоты и экстрагируют два раза этилацетатом (этилацетат: общий объем 65 мл). Отделенный водный слой доводят до pH 3,4 добавлением 1М водного раствора хлористоводородной кислоты и экстрагируют один раз этилацетатом, затем водный слой доводят до pH 2,4 и дважды экстрагируют этилацетатом. Экстракционную жидкость, полученную после пяти экстракций этилацетатом (175 мл), промывают насыщенным солевым раствором (40 мл), сушат над безводным сульфатом натрия, фильтруют и концентрируют при пониженном давлении. 759,1 мг полученного остатка разбавляют этилацетатом (5 мл) и добавляют н-гексан (3 мл) и затравочные кристаллы инокулируют для кристаллизации. Затем добавляют раствор этилацетата/н-гексана (5/3) (8 мл) и перемешивают, затем добавляют н-гексан (20 мл) и перемешивают при 4°С в течение 14 часов. Кристаллы отфильтровывают, промывают н-гексаном (55 мл), затем сушат в вакууме с получением 633,6 мг указанного в заголовке соединения в виде бесцветного кристаллического порошка (выход 82%). Данные измерений сопоставимы с данными из примера 9.
Пример 17
(2S,5R)-7-Оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбоксамид
Стадия 1
трет-Бутил 2-{[(2S,5R)-6-бензилокси-7-оксо-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}гидразинкарбоксилат
К раствору карбоновой кислоты (6b, 371 мг, 1,34 ммоль) из примера 9 или 16 в тетрагидрофуране (7 мл) добавляют триэтиламин (0,227 мл) и изобутилхлорформиат (218 мкл) при охлаждении на льду, затем смесь перемешивают при 0°С в течение 15 мин. К реакционному раствору добавляют трет-бутил карбазат (245 мг) при 0°С, и смесь перемешивают при комнатной температуре в течение 1,5 часов, затем концентрируют при пониженном давлении. Полученный остаток очищают с помощью хроматографии на колонке с силикагелем (гексан/этилацетат=1/1-0/1) с получением 583 мг указанного в заголовке соединения (98% выход).
[α]D20 +54,3° (с 0,56, CHCl3); 1H ЯМР (400 МГц, CDCl3): δ 1,47 (с, 9H), 1,56-1,67 (м, 1H), 1,90-2,05 (м, 2H), 2,34-2,41 (м, 1H), 3,04-3,17 (м, 2H), 3,26-3,31 (м, 1H), 4,00 (д, J=7,6 Гц, 1H), 4,91 (д, J=11,2 Гц, 1H), 5,06 (д, J=11,2 Гц, 1H), 6,31 (шир.с, 1H), 7,34-7,46 (м, 5H), 8,14 (д, J=2,8 Гц, 1H); МС m/z 391 [M+H]+.
Стадия 2
трет-Бутил 2-{[(2S,5R)-6-гидрокси-7-оксо-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}гидразинкарбоксилат
Соединение (573 мг, 1,47 ммоль), полученное на стадии 1, растворяют в метаноле (10 мл) и добавляют 10% палладий на угле (содержание воды 50%, 126 мг), смесь перемешивают в атмосфере водорода при комнатной температуре в течение 55 минут. Катализатор из реакционной смеси фильтруют через Целит, растворитель концентрируют при пониженном давлении с получением 423 мг указанного в заголовке соединения (выход 96%).
1H ЯМР (400 МГц, CD3OD): δ 1,48 (с, 9H), 1,70-1,82 (м, 1H), 1,86-1,98 (м, 1H), 2,01-2,12 (м, 1H), 2,27 (шир.дд, J=14,6, 6,6 Гц, 1H), 3,11-3,25 (м, 2H), 3,70 (шир.с, 1H), 3,91 (шир.д, J=7,2 Гц, 1H); МС m/z 301 [M+H]+.
Стадия 3
(2S,5R)-7-Оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбоксамид
К раствору соединения (421 мг, 1,40 ммоль) со стадии 2 в пиридине (10 мл) добавляют комплекс триоксид серы - пиридин (1,01 г), и смесь перемешивают при комнатной температуре в течение ночи. К реакционной смеси после фильтрации добавляют метиленхлорид, затем концентрируют при пониженном давлении и доводят до рН 8 добавлением насыщенного наполовину водного раствора бикарбоната натрия. Водный слой промывают метиленхлоридом. Затем к водному слою добавляют гидросульфат тетрабутиламмония (564 мг) и метиленхлорид, затем перемешивают в течение 15 минут. Водный слой экстрагируют метиленхлоридом, затем полученный органический слой сушат над безводным сульфатом натрия, после фильтрации, и концентрируют при пониженном давлении с получением 841 мг трет-бутил 2-{[(2S,5R)-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}гидразинкарбоксилата тетрабутиламмония.
1H ЯМР (400 МГц, CDCl3): δ 1,01 (т, J=7,4 Гц, 12H), 1,40-1,53 (м, 8H), 1,49 (с, 9H), 1,60-1,75 (м, 9H), 1,84-1,98 (м, 1H), 2,15-2,24 (м, 1H), 2,35-2,44 (м, 1H), 3,06-3,18 (м, 1H), 3,24-3,36 (м, 8H), 3,39 (шир.д, J=11,6 Гц, 1H), 3,97 (шир.д, J=7,2 Гц, 1H), 4,36 (шир.с, 1H), 6,31 (шир.с, 1H), 8,59-8,67 (м, 1H); МС m/z 381 [M-Bu4N+2H]+.
Всю указанную выше соль тетрабутиламмония растворяют в метиленхлориде (15 мл), добавляют трифторуксусную кислоту (5 мл) и перемешивают при комнатной температуре в течение 1 часа. Затем реакционную смесь концентрируют при пониженном давлении, и полученный остаток промывают диэтиловым эфиром и сушат. Полученный неочищенный продукт доводят до рН 8 добавлением водного раствора бикарбоната натрия и очищают хроматографией на колонке с октадецилсиликагелем получены с получением 227 мг указанного в заголовке соединения (2 стадии, выход 58%).
[α]D20 -52,9° (с 0,15, H2O); 1H ЯМР (400 МГц, D2O): δ 1,63-1,73 (м, 1H), 1,76-1,87 (м, 1H), 1,90-1,99 (м, 1H), 2,00-2,09 (м, 1H), 2,97 (д, J=12,2 Гц, 1H), 3,17 (шир.д, J=12,2 Гц, 1H), 3,92 (д, J=7,2 Гц, 1H), 4,04-4,08 (м, 1H); МС m/z 281 [M+H]+.
Пример 18
трет-Бутил 1-метил-2-{[(2SR,5RS)-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}гидразинкарбоксилат натрия
Стадия 1
трет-Бутил 2-{[(2SR,5RS)-6-бензилокси-7-оксо-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}-1-метилгидразинкарбоксилат
К раствору (2SR,5RS)-6-(бензилокси)-7-оксо-1,6-диазабицикло[3.2.1]октан-2-карбоновой кислоты (400 мг, 1,45 ммоль) и трет-бутил 1-метилгидразинкарбоксилата (232 мг) в тетрагидрофуране (14 мл) добавляют триэтиламин (972 мкл) и йодид 2-хлор-1-метилпиридин-1-ия (554 мг), и смесь перемешивают при комнатной температуре в течение ночи. К реакционному раствору добавляют насыщенный водный раствор бикарбоната натрия, затем экстрагируют хлороформом. Органический слой сушат над сульфатом натрия и затем концентрируют. Полученный неочищенный продукт очищают с помощью хроматографии на колонке с силикагелем с получением 458 мг указанного в заголовке соединения (выход 78%).
1H ЯМР (400 МГц, CDCl3): δ 1,29-1,40 (м, 10H), 1,53-1,60 (м, 2H), 2,24-2,30 (м, 1H), 2,96-3,24 (м, 6H), 3,87 (д, J=1,7, 1H), 4,83 (д, J=2,8, 1H), 4,97 (д, J=2,8, 1H), 7,26-7,36 (м, 5H).
Стадия 2
трет-Бутил 2-{[(2SR,5RS)-6-гидрокси-7-оксо-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}-1-метилгидразинкарбоксилат
К раствору соединения (485 мг, 1,20 ммоль) со стадии 1 в метаноле (14 мл) добавляют 50% палладий на угле (содержание воды 50%, 50 мг), смесь перемешивают в атмосфере водорода при комнатной температуре в течение 2 часов. Катализатор из реакционной смеси фильтруют через ПТФЭ мембрану, затем концентрируют при пониженном давлении. Полученный неочищенный продукт очищают с помощью хроматографии на колонке с силикагелем с получением 359 мг указанного в заголовке соединения (выход 95%). МС м/z 315 [М+Н]+.
Стадия 3
трет-бутил 1-метил-2-{[(2SR,5RS)-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}гидразинкарбоксилат натрия
К раствору всего количества соединения со стадии 2 в метиленхлориде (10,0 мл) добавляют 2,6-лутидин (842 мкл) и комплекс триоксид серы - пиридин (273 мг), и смесь перемешивают при комнатной температуре в течение ночи. К реакционному раствору добавляют хлороформ, затем проводят жидкостное разделение водой. Полученный трет-бутил 2-{[(2SR,5RS)-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}-1-метилгидразинкарбоксилат пиридиния, полученный в водном слое, нейтрализуют насыщенным водным раствором бикарбоната натрия и очищают хроматографией на колонке с октадецилсиликагелем с получением 114 мг указанного в заголовке соединения (выход 23%).
1H ЯМР (400 МГц, D2O): δ 1,47 (с, 9H), 1,84 (м, 1H), 1,96-2,04 (м, 1Н), 2,11-2,15 (м, 1H), 2,23-2,28 (м, 1H), 3,11 (с, 3Н), 3,18 (д, J=3,0, 1H), 3,41 (д, J=2,7, 1H), 4,15 (д, J=1,9, 1H), 4,25 (шир.с, 1H); МС m/z 393 [M-Na]-.
Пример 19
(2SR,5RS)-N'-Метил-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбогидразид
трет-Бутил 1-метил-2-{[(2SR,5RS)-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}гидразинкарбоксилат натрия (100 мг, 0,24 ммоль) из примера 18 подвергают реакции снятия защиты с трифторуксусной кислотой и очищают хроматографией на колонке с октадецилсиликагелем с получением 41 мг указанного в заголовке соединения (выход 58%).
1H ЯМР (400 МГц, D2O): δ 1,63-1,71 (м, 1H), 1,74-1,84 (м, 1H), 1,90-1,96 (м, 1H), 2,00-2,06 (м, 1H), 3,40 (с, 3H), 2,95 (д, J=3,0, 1H), 3,15 (д, J=3,0, 1H), 3,89 (д, J=1,6, 1H), 4,04 (шир.с, 1H), МС m/ z 293 [M-H]-
Пример 20
(2SR,5RS)-N’,N’-диметил-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбогидразид натрия
Стадия 1
(2SR,5RS)-6-Бензилокси-N',N'-диметил-7-оксо-1,6-диазабицикло[3.2.1]октан-2-карбогидразид
По методике, аналогичной примеру 18, из (2SR,5RS)-6-(бензилокси)-7-оксо-1,6-диазабицикло[3.2.1]октан-2-карбоновой кислоты (200 мг, 0,72 ммоль) и 1,1-диметилгидразина (48 мг) получают 150 мг указанного в заголовке соединения (выход 65%).
1H ЯМР (400 МГц, CDCl3): δ 1,53 (м, 1H), 1,75-1,88 (м, 2H), 2,21-2,27 (м, 1H), 2,46 (с, 6H), 2,61 (д, J=2,6, 1H), 2,89 (д, J=2,6, 1H), 3,19-3,21 (м, 1H), 3,75 (д, J=1,9, 1H), 4,78 (д, J=2,9, 1H), 4,92 (д, J=2,9, 1H), 7,16-7,31 (м, 5H).
Стадия 2
(2SR,5RS)-N’,N’-диметил-6-гидрокси-7-оксо-1,6-диазабицикло[3.2.1]октан-2-карбогидразид
По методике, аналогичной примеру 18, из всего количества соединения со стадии 1 получают 101 мг указанного в заголовке соединения (выход 94%). МС м/z 229 [М+Н]+.
Стадия 3
(2SR,5RS)-N’,N’-диметил-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбогидразид натрия
По методике, аналогичной примеру 18, (2SR,5RS)-N’,N’-диметил-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбогидразид пиридиния, полученный из всего количества соединения со стадии 2, нейтрализуют насыщенным водным раствором бикарбоната натрия и очищают хроматографией на колонке с октадецилсиликагелем с получением 65 мг указанного в заголовке соединения (выход 44%).
1H ЯМР (400 МГц, D2O): δ 1,80-1,98 (м, 2H), 2,07-2,20 (м, 2H), 2,59 (с, 6H), 3,11 (д, J=3,0, 1H), 3,33 (д, J=3,0, 1H), 4,01 (д, J=1,3, 1H), 4,22 (шир.с, 1H); МС m/z 307 [M-Na]-.
Пример 21
(2S,5R)-N'-ацетил-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбогидразид натрия
Стадия 1
(2S,5R)-N'-ацетил-6-бензилокси-7-оксо-1,6-диазабицикло[3.2.1]октан-2-карбогидразид
К раствору карбоновой кислоты (6b, 2,37 г, 8,57 ммоль) примера 9 или 16 в тетрагидрофуране (50 мл) добавляют триэтиламин (1,39 мл) и изобутилхлорформиат (1,32 мл) при охлаждении льдом, затем перемешивают при 0°С в течение 20 минут. К реакционному раствору добавляют ацетогидразид (807 мг) при 0°С, перемешивают при комнатной температуре в течение 40 минут и концентрируют при пониженном давлении. Полученный остаток очищают хроматографией на колонке с силикагелем (гексан/этилацетат=9/1) с получением 2,61 г указанного в заголовке соединения (выход 92%).
[α]D20 +92,3° (c 0,65, CHCl3); 1H ЯМР (400 МГц, CDCl3): δ 1,57-1,70 (м, 1H), 1,90-2,15 (м, 2H), 2,06 (с, 3H), 2,30-2,39 (м, 1H), 3,08 (шир.д, J=12,0 Гц, 1H), 3,13 (д, J=12,0 Гц, 1H), 3,31-3,37 (м, 1H), 4,02 (д, J=7,6 Гц, 1H), 4,92 (д, J=11,4 Гц, 1H), 5,06 (д, J=11,4 Гц, 1H), 7,33-7,50 (м, 5H), 7,72 (шир.с, 1H), 8,55 (шир.с, 1H); МС m/z 333 [M+H]+.
Стадия 2
(2S,5R)-N'-ацетил-6-гидрокси-7-оксо-1,6-диазабицикло[3.2.1]октан-2-карбогидразид
Соединение (2,48 г, 7,46 ммоль) со стадии 1 растворяют в метаноле (50 мл) и добавляют 10% палладий на угле (содержание воды 50%, 313 мг) и перемешивают в атмосфере водорода при комнатной температуре в течение 40 минут. Катализатор в реакционной смеси фильтруют через Целит и растворитель концентрируют при пониженном давлении с получением 1,88 г указанного в заголовке соединения (выход количественный).
[α]D20 -30,5° (с 0,59, MeOH); 1H ЯМР (400 МГц, CD3OD): δ: 1,70-1,79 (м, 1H), 1,87-2,11 (м, 2H), 2,00 (с, 3H), 2,27 (шир.дд, J=15,0, 6,6 Гц, 1H), 3,15 (шир.д, J=12,0 Гц, 1H), 3,24 (д, J=12,0 Гц, 1H), 3,67-3,73 (м, 1H), 3,95 (д, J=7,2 Гц, 1H); МС m/z 243 [M+H]+.
Стадия 3
(2S,5R)-N'-ацетил-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбогидразид натрия
К раствору соединения (1,87 г, 7,71 ммоль) со стадии 2 в пиридине (35 мл) добавляют комплекс триоксид серы - пиридин (5,51 г), и смесь перемешивают при комнатной температуре в течение ночи. В реакционный раствор добавляют метиленхлорид и фильтруют, затем концентрируют при пониженном давлении. К полученному остатку добавляют толуол, подвергают азеотропной перегонке и концентрируют досуха. Смесь добавляют к насыщенному водному раствору первичного кислого фосфата натрия (200 мл), промывают этилацетатом. Затем добавляют гидросульфат тетрабутиламмония (3,17 г) и этилацетат, перемешивают в течение 10 минут и затем разделяют слои. Органический слой сушат над безводным сульфатом натрия, фильтруют и концентрируют при пониженном давлении. Полученный остаток очищают с помощью хроматографии на колонке с силикагелем (метиленхлорид/ацетон/триэтиламин=49/49/2) с получением 3,27 г (2S,5R)-N'-ацетил-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбоксамида тетрабутиламмония.
1H ЯМР (400 МГц, CDCl3): δ 1,01 (т, J=7,3 Гц, 12H), 1,45 (секст, J=7,3 Гц, 8H), 1,60-1,82 (м, 9H), 1,86-1,98 (м, 1H), 2,08 (с, 3H), 2,13-2,24 (м, 1H), 2,35 (шир.дд, J=15,2, 6,8 Гц, 1H), 3,17 (д, J=12,0 Гц, 1H), 3,23-3,40 (м, 8H), 3,37 (шир.д, J=12,0 Гц, 1H), 4,00 (д, J=7,6 Гц, 1H), 4,34 (шир.с, 1H), 7,92 (шир.с, 1H), 8,62 (шир.с, 1H); МС m/z 323 [M-Bu4N+2H]+.
Полученную выше соль тетрабутиламмония обрабатывают DOWEX (Na форма) и подвергают хроматографии на колонке с октадецилсиликагелем (вода) с получением 1,73 г указанного в заголовке соединения (выход 65%).
[α]D21 -44,9° (c 0,55, H2O); 1H ЯМР (400 МГц, D2O): δ 1,64-1,75 (м, 1H), 1,75-1,91 (м, 1H), 1,91-2,02 (м, 1H), 1,95 (с, 3H), 2,05-2,14 (м, 1H), 3,09 (д, J=12,6 Гц, 1H), 3,23 (шир.д, J=12,6 Гц, 1H), 4,05 (b r d, J=7,2 Гц, 1H), 4,09 (шир.дд, J=5,8, 3,0 Гц, 1H); МС m/z 323 [M-Na+2H]+; Ма^ж8, 2%. Содержание Na 8,2%.
Пример 22
(2S,5R)-7-оксо-N'-пропаноил-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбоксамид натрия
Стадия 1
(2S,5R)-6-Бензилокси-7-оксо-N'-пропаноил-1,6-диазабицикло[3.2.1]октан-2-карбогидразид
К раствору карбоновой кислоты из примера 9 или 16 (6b, 354 мг, 1,28 ммоль) в тетрагидрофуране (10 мл) добавляют триэтиламин (0,216 мл) и изобутилхлорформиат (208 мкл) при охлаждении льдом, затем перемешивают при 0°С в течение 15 минут. К реакционному раствору добавляют раствор пропионилгидразида (161 мг, получен по методике ссылочного примера 3 и ссылочного примера 6) в тетрагидрофуране (3 мл) при 0°С, затем перемешивают при комнатной температуре в течение 1 часа и затем концентрируют при пониженном давлении. Полученный остаток очищают с помощью хроматографии на колонке с силикагелем (гексан/этилацетат=1/1-0/1) с получением 425 мг указанного в заголовке соединения (выход 96%).
[α]D21+95,6° (c 0,46, CHCl3); 1H ЯМР (400 МГц, CDCl3): δ 1,20 (т, J=7,6 Гц, 3H), 1,56-1,66 (м, 1H), 1,91-2,05 (м, 2H), 2,25-2,40 (м, 3H), 3,09 (шир.д, J=12,0 Гц, 1H), 3,17 (д, J=12,0 Гц, 1H), 3,29-3,34 (м, 1H), 4,02 (д, J=7,6 Гц, 1H), 4,92 (д, J=11,4 Гц, 1H), 5,06 (д, J=11,4 Гц, 1H), 7,33-7,46 (м, 5H), 7,58 (шир.д, J=3,0 Гц, 1H), 8,50 (шир.д, J=3,0 Гц, 1H); МС m/z 347 [M+H]+.
Стадия 2
(2S,5R)-6-Гидрокси-7-оксо-N'-пропаноил-1,6-диазабицикло[3.2.1]октан-2-карбогидразид
Соединение (417 мг, 1,20 ммоль) с указанной выше стадии 1 растворяют в метаноле (10 мл), добавляют 10% палладий на угле (50% содержание воды, 110 мг), перемешивают в атмосфере водорода при комнатной температуре в течение 50 минут. Катализатор в реакционной смеси фильтруют через Целит, и растворитель концентрируют при пониженном давлении с получением 297 мг указанного в заголовке соединения (выход 96%).
1H ЯМР (400 МГц, CD3OD): δ 1,17 (т, J=7,6 Гц, 3H), 1,69-1,79 (м, 1H), 1,88-1,99 (м, 1H), 2,02-2,11 (м, 1H), 2,24-2,32 (м, 1H), 2,28 (кв., J=7,6 Гц, 2H), 3,16 (шир.д, J=11,6 Гц, 1H), 3,26 (д, J=11,6 Гц, 1H), 3,68-3,72 (м, 1H), 3,95 (д, J=7,6 Гц, 1H); МС m/z 257 [M+H]+.
Стадия 3
(2S,5R)-7-оксо-N'-пропаноил-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбогидразид натрия
К раствору соединения (296 мг, 1,15 ммоль) с указанной выше стадии 2 в пиридине (7,5 мл) добавляют комплекс триоксид серы - пиридин (843 мг), и смесь перемешивают при комнатной температуре в течение ночи. К реакционному раствору добавляют метиленхлорид, затем фильтруют и концентрируют при пониженном давлении. К остатку добавляют толуол с последующей азеотропной перегонкой. Получают (2S,5R)-7-оксо-N'-пропаноил-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбогидразид пиридиния, затем нейтрализуют наполовину насыщенным водным раствором бикарбоната натрия и очищают хроматографией на колонке с октадецилсиликагелем с получением 357 мг указанного в заголовке соединения (выход 86%).
[α]D21 -46,7° (с 0,28, H2O); 1H ЯМР (400 МГц, D2O): δ 1,02 (т, J=7,6 Гц, 3H), 1,64-1,76 (м, 1H), 1,78-1,90 (м, 1H), 1,93-2,02 (м, 1H), 2,10 (шир.дд, J=15,6, 7,2 Гц, 1H), 2,22 (кв., J=7,6 Гц, 2H), 3,10 (д, J=12,0 Гц, 1H), 3,23 (шир.д, J=12,0 Гц, 1H), 4,04 (д, J=7,2 Гц, 1H), 4,07-4,12 (м, 1H); МС m/z 337 [M-Na+2H]+.
Пример 23
(2S,5R)-N'-(2-метилпропаноил)-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбоксамид натрия
Стадия 1
(2S,5R)-6-Бензилокси-N'-(2-метилпропаноил)-7-оксо-1,6-диазабицикло[3.2.1]октан-2-карбогидразид
По методике примера 17 из карбоновой кислоты (6b, 363 мг, 1,31 ммоль) из Примера 9 или 16 и изобутирогидразида (190 мг), получают 440 мг указанного в заголовке соединения (выход 93%).
[α]D20 +86,6° (с 0,50, CHCl3); 1H ЯМР (400 МГц, CDCl3): δ 1,21 (д, J=6,8 Гц, 3H), 1,23 (д, J=6,8 Гц, 3H), 1,55-1,63 (м, 1H), 1,91-2,07 (м, 2H), 2,30-2,38 (м, 1H), 2,48 (септ., J=6,8 Гц, 1H), 3,09 (шир.д, J=12,0 Гц, 1H), 3,18 (д, J=12,0 Гц, 1H), 3,28-3,32 (м, 1H), 4,02 (шир.д, J=7,6 Гц, 1H), 4,92 (д, J=11,4 Гц, 1H), 5,06 (д, J=11,4 Hz, 1H), 7,34-7,53 (м, 6H), 8,47 (шир.д, J=3,6 Гц, 1H); МС m/z 361 [M+H]+.
Стадия 2
(2S,5R)-6-гидрокси-N'-(2-метилпропаноил)-7-оксо-1,6-диазабицикло[3.2.1]октан-2-карбогидразид
По методике примера 17 из соединения (426 мг, 1,18 ммоль) из приведенной выше стадии 1 получают 308 мг указанного в заголовке соединения (выход 97%).
1H ЯМР (400 МГц, CD3OD): δ 1,16 (д, J=7,0 Гц, 3H), 1,17 (д, J=7,0 Гц, 3H), 1,70-1,79 (м, 1H), 1,87-1,99 (м, 1H), 2,02-2,12 (м, 1H), 2,27 (шир.дд, J=15,0, 7,0 Гц, 1H), 2,53 (септ., J=7,0 Гц, 1H), 3,16 (шир.д, J=12,0 Гц, 1H), 3,27 (д, J=12,0 Гц, 1H), 3,67-3,73 (м, 1H), 3,94 (шир.д, J=7,6 Гц, 1H); МС m/z 271 [M+H]+.
Стадия 3
(2S,5R)-N'-(2-метилпропаноил)-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбогидразид натрия
По методике примера 22 из соединения (303 мг, 1,12 ммоль) из указанной выше стадии 2 получают (2S,5R)-N'-(2-метилпропаноил)-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбогидразид и нейтрализуют насыщенным водным раствором бикарбоната натрия с последующей очисткой хроматографией на колонке с октадецилсиликагелем, и получают 261 мг указанного в заголовке соединения (выход 62%).
[a]D20 -40,3° (c 0,94, H2O); 1H ЯМР (400 МГц, D2O): δ 1,01 (д, J=6,8 Гц, 6H), 1,62-1,73 (м, 1H), 1,76-1,88 (м, 1H), 1,91-2,00 (м, 1H), 2,08 (шир.дд, J=15,6, 6,8 Гц, 1H), 2,46 (септ., J=6,8 Гц, 1H), 3,09 (д, J=12,4 Гц, 1H), 3,21 (шир.д, J=12,4 Гц, 1H), 4,03 (д, J=7,6 Гц, 1H), 4,06-4,10 (м, 1H); МС m/z 351 [M-Na+2H]+.
Пример 24
(2S,5R)-N'-(2,2-диметилпропаноил)-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбогидразид натрия
Стадия 1
(2S,5R)-6-Бензилокси-N'-(2,2-диметилпропаноил)-7-оксо-1,6-диазабицикло[3.2.1]октан-2-карбогидразид
По методике примера 18 из карбоновой кислоты (6b, 400 мг, 1,44 ммоль) из Примера 9 или 16 и гидразида пивалиновой кислоты (185 мг, 1,59 ммоль) получают 506 мг указанного в заголовке соединения (выход 93%).
1H ЯМР (400 МГц, CDCl3): δ 1,14 (с, 9H), 1,49-1,54 (м, 1H), 1,77-1,88 (м, 2H), 2,14-2,19 (м, 1H), 2,93 (д, J=2,9, 1H), 3,11 (д, J=2,9, 1H), 3,18 (шир.с, 1H), 3,85 (д, J=1,8, 1H), 4,78 (д, J=2,8, 1H), 4,92 (д, J=2,8, 1H), 7,18-7,31 (м, 5H), 8,51 (с, 1H), 5,52 (с, 1H); МС m/z 375 [M+H]+.
Стадия 2
(2S,5R)-N'-(2,2-Диметилпропаноил)-6-гидрокси-7-оксо-1,6-диазабицикло[3.2.1]октан-2-карбогидразид
По методике примера 17 из всего количества соединения из представленной выше стадии 1 получают указанное в заголовке соединение (количественный выход).
Стадия 3
(2S,5R)-N'-(2,2-диметилпропаноил)-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбогидразид натрия
По методике примера 18 из всего количества соединения из представленной выше стадии 2 и очисткой хроматографией на колонке с октадецилсиликагелем получают 404 мг указанного в заголовке соединения (выход 77%).
1H ЯМР (400 МГц, D2O): δ 1,09 (с, 3H), 1,10 (с, 3H), 1,11 (д, J=0, 2, 3H), 1,67-1,73 (м, 1H), 1,74-1,88 (м, 1H), 1,95-1,99 (м, 1H), 2,08-2,14 (м, 1H), 3,14 (д, J=3,1, 1H), 3,22 (д, J=3,2, 1H), 3,70 (д, J=0,6, 1H), 4,04 (д, J=1,9, 1H), 4,10 (д, J=0,7, 1H); МС m/z 365 [M-Na+2H]+, 363 [M-Na]-.
Пример 25
(2SR,5RS)-N'-ацетил-N'-метил-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбогидразид натрия
Стадия 1
(2SR,5RS)-N'-Ацетил-6-бензилокси-N'-метил-7-оксо-1,6-диазабицикло[3.2.1]октан-2-карбогидразид
По методике примера 17 из (2SR,5RS)-6-(бензилокси)-7-оксо-1,6-диазабицикло[3.2.1]октан-2-карбоновой кислоты (148 мг, 0,536 ммоль) и N-метилацетогидразида (64,0 мг, полученного из метилгидразина и уксусного ангидрида) получают 221 мг указанного в заголовке соединения (выход 88%).
1H ЯМР (400 МГц, CDCl3): δ 1,59-1,73 (м, 1H), 1,88-2,10 (м, 2H), 2,02 (с, 1,8H), 2,17 (с, 1,2H), 2,31-2,39 (м, 1H), 2,69 (д, J=11,6 Гц, 0,6H), 3,07 (шир.д, J=11,6 Гц, 0,4H), 3,11-3,38 (м, 2H), 3,13 (с, 1, 8H), 3,30 (с, 1,2H), 4,01 (д, J=7,2 Гц, 1H), 4,92 (д, J=11,6 Гц, 1H), 5,06 (д, J=11,6 Гц, 0,4H), 5,07 (д, J=11,2 Гц, 0,6H), 7,31-7,53 (м, 5H), 8,49 (шир.с, 0,4H), 8,58 (шир.с, 0,6H); МС m/z 347 [M+H]+.
Стадия 2
(2SR,5RS)-N'-Ацетил-6-гидрокси-N'-метил-7-оксо-1,6-диазабицикло[3.2.1]октан-2-карбогидразид
По методике примера 17 из соединения (216 мг, 0,624 ммоль) из указанной выше стадии 1 получают 156 мг указанного в заголовке соединения (выход 98%).
1H ЯМР (400 МГц, CD3OD): δ 1,74-1,83 (м, 1H), 1,89-2,04 (м, 1H), 2,01 (с, 2,5H), 2,06-2,14 (м, 1H), 2,17 (с, 0,5H), 2,22-2,32 (м, 1H), 2,96 (д, J=11,6 Гц, 0,8H), 3,06-3,24 (м, 1,2H), 3,11 (с, 2,5H), 3,28 (с, 0,5H), 3,68-3,74 (м, 1H), 3,96 (шир.д, J=7,6 Гц, 1H); МС m/z 257 [M+H]+.
Стадия 3
(2SR,5RS)-N'-ацетил-N'-метил-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбогидразид натрия
По методике примера 22 получают соединение (150 мг, 0,585 ммоль) из указанной выше стадии 2, (2SR,5RS)-N'-ацетил-N'-метил-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбогидразид пиридиния, нейтрализуют насыщенным водным раствором бикарбоната натрия и затем очищают хроматографией на колонке Diaion HP21 (Mitsubishi Chemical) с получением 148 мг указанного в заголовке соединения (выход 71%).
1H ЯМР (400 МГц, D2O): δ 1,67-1,80 (м, 1H), 1,80-2,04 (м, 2H), 1,93 (с, 2,4H), 2,05-2,16 (м, 1H), 2,09 (с, 0,6H), 2,98 (д, J=12,0 Гц, 0,8H), 3,00 (с, 2,4H), 3,11 (д, J=12,0 Гц, 0,2H), 3,18 (с, 0,6H), 3,20 (шир.д, J=12,0 Гц, 0,2H), 3,28 (шир.д, J=12,0 Гц, 0,8H), 4,01-4,15 (м, 2H); МС m/z 337 [M-Na+2H]+.
Пример 26
(2SR,5RS)-N'-(Аминоацетил)-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбогидразид
Стадия 1
трет-Бутил [2-(2-{[(2SR,5RS)-6-бензилокси-7-оксо-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}гидразинил)-2-оксоэтил]карбамат
К раствору (2SR,5RS)-6-(бензилокси)-7-оксо-1,6-диазабицикло[3.2.1]октан-2-карбоновой кислоты (153 мг, 0,554 ммоль) в тетрагидрофуране (3 мл) добавляют триэтиламин (0,232 мл) и изобутилхлорформиат (89,1 мкл) при охлаждении льдом и смесь перемешивают при 0°С в течение 45 мин. К реакционному раствору добавляют раствор трет-бутил 2-гидразинил-2-оксоэтилкарбамата (129 мг, полученного по методике ссылочного примера 5 и ссылочного примера 6) в тетрагидрофуране (3 мл) при 0°С, и перемешивают при комнатной температуре в течение 2,5 часов и концентрируют при пониженном давлении. Полученный остаток очищают с помощью хроматографии на колонке с силикагелем (гексан/этилацетат=7/3-0/10) с получением 179 мг указанного в заголовке соединения (72% выход).
1H ЯМР (400 МГц, CDCl3): δ 1,45 (с, 9H), 1,57-1,70 (м, 1H), 1,91-2,06 (м, 2H), 2,28-2,38 (м, 1H), 3,07 (шир.д, J=12,0 Гц, 1H), 3,12 (д, J=12,0 Гц, 1H), 3,29-3,34 (м, 1H), 3,88 (дд, J=16,3, 6,1 Гц, 1H), 3,92 (дд, J=16,3, 6,1 Гц, 1H), 4,02 (шир.д, J=7,2 Гц, 1H), 4,91 (д, J=11,2 Гц, 1H), 5,05 (д, J=11,2 Гц, 1H), 5,24 (шир.т, J=6,1 Гц, 1H), 7,34-7,46 (м, 5H), 8,42 (шир.с, 1H), 8,53 (шир.с, 1H); МС m/z 448 [M+H]+.
Стадия 2
трет-бутил [2-(2-{[(2SR,5RS)-6-гидрокси-7-оксо-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}гидразинил)-2-оксоэтил]карбамат
Соединение (176 мг, 0,394 ммоль) из указанной выше стадии 1 растворяют в метаноле (4 мл), добавляют 10% палладий на угле (содержание воды 50%, 42,4 мг) и перемешивают в атмосфере водорода при комнатной температуре в течение 40 минут. Катализатор из реакционной смеси фильтруют через Целит, растворитель концентрируют при пониженном давлении с получением 140 мг указанного в заголовке соединения (выход количественный).
1H ЯМР (400 МГц, CD3OD): δ 1,45 (с, 9H), 1,69-1,79 (м, 1H), 1,87-2,00 (м, 1H), 2,01-2,11 (м, 1H), 2,27 (шир.дд, J=15,0, 6,6 Гц, 1H), 3,16 (шир.д, J=12,0 Гц, 1H), 3,24 (д, J=12,0 Гц, 1H), 3,67-3,73 (м, 1H), 3,81 (с, 2H), 3,95 (шир.д, J=7,2 Гц, 1H); МС m/z 358 [M+H]+.
Стадия 3
(2SR,5RS)-N'-(Аминоацетил)-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбогидразид
К раствору соединения (137 мг, 0,382 ммоль) из указанной выше стадии 2 в пиридине (4 мл) добавляют комплекс триоксид серы - пиридин (276 мг), и смесь перемешивают при комнатной температуре в течение ночи. К реакционной смеси добавляют метиленхлорид, затем фильтруют и концентрируют при пониженном давлении. К полученному остатку добавляют толуол, затем подвергают азеотропной перегонке. Получают 405 мг трет-бутил [2-(2-{[(2SR,5RS)-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}гидразинил)-2-оксоэтил]карбамата пиридиния. МС м/z 438 [М-С5Н5N+Н]+.
Общее количество соли пиридиния растворяют в метиленхлориде (5 мл) и добавляют трифторуксусную кислоту (1,7 мл), смесь перемешивают при комнатной температуре в течение 3,5 часов. Реакционный раствор концентрируют при пониженном давлении. Полученный остаток промывают диэтиловым эфиром и доводят до рН 7 добавлением водного раствора бикарбоната натрия и лиофилизируют. Полученный неочищенный продукт очищают на Sepabeads SP207 (Mitsubishi Chemical) (ацетонитрил/вода=0/100-10/90). После лиофилизации получают 42,6 мг указанного в заголовке соединения (2 стадии, выход 33%).
1H ЯМР (400 МГц, D2O): δ 1,63-1,74 (м, 1H), 1,78-1,89 (м, 1H), 1,92-2,02 (м, 1H), 2,05-2,14 (м, 1H), 3,08 (д, J=12,4 Гц, 1H), 3,23 (шир.д, J=12,4 Гц, 1H), 4,06 (шир.д, J=6,4 Гц, 1H), 4,07-4,12 (м, 1H); МС m/z 338 [M+H]+.
Пример 27
(2S,5R)-N'-(3-Аминопропаноил)-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбогидразид
Стадия 1
трет-Бутил [3-(2-{[(2S,5R)-6-бензилокси-7-оксо-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}гидразинил)-3-оксопропил]карбамат
К раствору карбоновой кислоты (6b, 390 мг, 1,41 ммоль) из примера 9 или 16 в метиленхлориде (14,1 мл) добавляют триэтиламин (393 мкл), гидрохлорид N-этил-N'-(3-диметиламинопропил)карбодиимида (406 мг), моногидрат 1-гидроксибензотриазола (324,6 мг) и трет-бутил (3-гидразинил-3-оксопропил)карбамат (430,8 мг, получено по методике ссылочного примера 2), и смесь перемешивают при комнатной температуре в течение ночи. Реакционный раствор концентрируют при пониженном давлении и полученный остаток очищают с помощью хроматографии на колонке с силикагелем (этилацетат) с получением 347,3 мг указанного в заголовке соединения (выход 53,3%).
1H ЯМР (400 МГц, CD3OD): δ 1,32 (с, 9H), 1,55-1,63 (м, 1H), 1,75-1,91 (м, 2H), 2,11-2,17 (м, 1H), 2,31-2,34 (т, J=6,4 Гц, 2H), 2,92-2,95 (шир.д, J=11,6 Гц, 1H), 3,09-3,12 (д, J=11,6 Гц, 1H), 3,20-3,26 (т, J=6,4 Гц, 2H), 3,47 (шир.с, 1H), 3,86-3,88 (д, J=7,6 Гц, 1H), 4,82-4,85 (д, J=11,2 Гц, 1H), 4,89-4,92 (д, J=11,2 Гц, 1H), 7,27-7,31 (м, 3H), 7,35-7,38 (м, 2H); МС m/z 462 [M+H]+.
Стадия 2
трет-Бутил [3-(2-{[(2S,5R)-6-гидрокси-7-оксо-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}гидразинил)-3-оксопропил]карбамат
Общее количество соединения из указанной выше стадии 1 растворяют в метаноле (7,5 мл), добавляют 10% палладий на угле (содержание воды 50%, 69 мг) и перемешивают в атмосфере водорода при комнатной температуре в течение 1 часа. Катализатор из реакционной смеси фильтруют через Целит и растворитель концентрируют при пониженном давлении с получением указанного в заголовке соединения (выход количественный).
Стадия 3
(2S,5R)-N'-(3-Аминопропаноил)-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбогидразид
К раствору общего количества соединения из указанной выше стадии 2 в пиридине (7,5 мл) добавляют комплекс триоксид серы - пиридин (598,4 мг), и смесь перемешивают при комнатной температуре в течение ночи. К реакционной смеси добавляют метиленхлорид, фильтруют и концентрируют при пониженном давлении. К полученному остатку добавляют толуол, затем подвергают азеотропной перегонке. Получают трет-бутил [3-(2-{[(2S,5R)-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}гидразинил)-3-оксопропил]карбамат пиридиния (количественный выход). МС м/z 450 [М-С5Н5N-Н]-.
Общее количество соли пиридиния подвергают реакции снятия защиты с помощью трифторуксусной кислоты и очищают хроматографией на колонке с силикагелем с получением 191 мг указанного в заголовке соединения (выход 72,3%).
1H ЯМР (400 МГц, D2O): δ 1,62-1,70 (м, 1H), 1,76-1,86 (м, 1H), 1,92-1,95 (м, 1H), 2,04-2,09 (м, 1H), 2,60-2,63 (т, J=6,8 Гц, 2H), 3,04-3,07 (д, J=12,0 Гц, 1H), 3,13-3,16 (т, J=6,8 Гц, 2H), 3,18-3,22 (д, J=11,6 Гц, 1H), 4,02-4,03 (д, J=7,2 Гц, 1H), 4,06 (шир.с, 1H); МС m/z 352 [M+H]+.
Пример 28
(2S,5R)-N'-[(4-Аминофенил)ацетил]-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбогидразид
Стадия 1
трет-Бутил {4-[2-(2-{[(2S,5R)-6-бензилокси-7-оксо-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}гидразинил)-2-оксоэтил]фенил}карбамат
По методике примера 27, из карбоновой кислоты (6b, 390 мг, 1,41 ммоль) из примера 9 или 16 и трет-бутил (4-(2-гидразинил-2-оксоэтил)фенил)карбамата (682,6 мг, получен по методике ссылочного примера 5 и ссылочного примера 6) получают 550,8 мг указанного в заголовке соединения (выход 74,6%).
1H ЯМР (400 МГц, CDCl3): δ 1,45 (с, 9H), 1,56-1,64 (м, 1H), 1,86-1,97 (м, 2H), 2,27-2,33 (м, 1H), 3,03-3,06 (шир.д, J=11,6 Гц, 1H), 3,12-3,15 (д, J=11,6 Гц, 1H), 3,27 (шир.с, 1H), 3,75 (с, 2H), 3,96-3,98 (д, J=6,8 Гц, 1H), 4,87-4,89 (д, J=11,2 Гц, 1H), 5,01-5,04 (д, J=11,6 Гц, 1H), 6,47 (с, 1H), 7,21-7,24 (шир.д, J=10,8 Гц, 2H), 7,32-7,49 (м, 7H), 8,47 (шир.с, 1H); МС m/z 524 [M+H]+.
Стадия 2
трет-Бутил 4-{[2-(2-{[(2S,5R)-6-гидрокси-7-оксо-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}гидразинил)-2-оксоэтил]фенил}карбамат
По методике примера 17, из общего количества соединения со стадии 1 выше получают 425 мг указанного в заголовке соединения (выход 93,2%). МС м/z 434 [М+Н]+.
Стадия 3
(2S,5R)-N'-[(4-Аминофенил)ацетил]-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбогидразид
По методике примера 17, из общего количества соединения со стадии 2, получают трет-бутил 4-{[2-(2-{[(2S,5R)-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}гидразинил)-2-оксоэтил]фенил}карбамат тетрабутиламмония (количественный выход). МС м/z 512 [М-Bu4N]-.
Общее количество соли пиридиния подвергают реакции снятия защиты с помощью трифторуксусной кислоты и очищают хроматографией на колонке с силикагелем с получением 226 мг указанного в заголовке соединения (выход 55,8%).
1H ЯМР (400 МГц, D2O): δ 1,61-1,69 (м, 1H), 1,74-1,84 (м, 1H), 1,90-1,94 (м, 1H), 2,03-2,08 (м, 1H), 3,03-3,06 (д, J=12,0 Гц, 1H), 3,16-3,19 (д, J=12,0 Гц, 1H), 3,43 (шир.с, 2H), 3,99-4,01 (д, J=7,6 Гц, 1H), 4,05 (шир.с, 1H), 6,67-6,69 (д, J=8,4 Гц, 1H), 7,00-7,02 (д, J=8,4 Гц, 1H); МС m/z 412 [M-H]-.
Пример 29
(2S,5R)-N'-(Метоксиацетил)-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбогидразид натрия
Стадия 1
(2S,5R)-6-Бензилокси-N'-(метоксиацетил)-7-оксо-1,6-диазабицикло[3.2.1]октан-2-карбогидразид
По методике примера 27 из карбоновой кислоты (6b, 390 мг, 1,41 ммоль) из примера 9 или 16 и 2-метоксиацетогидразида (220,7 мг) получают 397,1 мг указанного в заголовке соединения (выход 77,7%).
1H ЯМР (400 МГц, CDCl3): δ 1,50-1,59 (м, 1H), 1,85-1,94 (м, 2H), 2,26-2,33 (м, 1H), 3,01-3,04 (шир.д, J=12,4 Гц, 1H), 3,06-3,09 (д, J=12,0 Гц, 1H), 3,24 (с, 1H), 3,39 (с, 3H), 3,97-4,00 (м, 3H), 4,83-4,86 (д, J=11,6 Гц, 1H), 4,97-5,00 (д, J=11,6 Гц, 1H), 7,27-7,37 (м, 5H), 8,22 (м, 1H), 8,44 (м, 1H); МС m/z 363 [M+H]+.
Стадия 2
(2S,5R)-6-гидрокси-N'-(метоксиацетил)-7-оксо-1,6-диазабицикло[3.2.1]октан-2-карбогидразид
По методике примера 17, из общего количества соединения со стадии 1 получают указанное в заголовке соединение (выход количественный). МС м/z 273 [М+Н]+.
Стадия 3
(2S,5R)-N'-(метоксиацетил)-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбогидразид натрия
По методике примера 22, из общего количества соединения со стадии 2 получают (2S,5R)-N'-(метоксиацетил)-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбогидразид пиридиния и нейтрализуют насыщенным водным раствором бикарбоната натрия. После очистки колоночной хроматографией Sepabeads SP207 (Mitsubishi Chemical) получают 134,4 мг указанного в заголовке соединения (выход 32,7%).
1H ЯМР (400 МГц, D2O): δ 1,65-1,73 (м, 1H), 1,77-1,87 (м, 1H), 1,93-1,96 (м, 1H), 2,05-2,11 (м, 1H), 3,06-3,09 (шир.д, J=12,0 Гц, 1H), 3,19-3,22 (д, J=12,8 Гц, 1H), 3,31 (с, 3H), 3,97-4,04 (м, 3H), 4,07 (с, 1H); МС m/z 353 [M-Na+2H]+.
Пример 30
(2SR,5RS)-N'-бензоил-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбогидразид натрия
Стадия 1
(2SR,5RS)-N'-Бензоил-6-бензилокси-7-оксо-1,6-диазабицикло[3.2.1]октан-2-карбогидразид
К раствору (2SR,5RS)-6-(бензилокси)-7-оксо-1,6-диазабицикло[3.2.1]октан-2-карбоновой кислоты (100,0 мг, 0,36 ммоль) и бензогидразида (54,2 мг) в тетрагидрофуране (4 мл) добавляют триэтиламин (231 мкл) и йодид 2-хлор-1-метилпиридин-1-ия (138,7 мг), затем смесь перемешивают при комнатной температуре в течение ночи. К реакционному раствору добавляют насыщенный водный раствор бикарбоната натрия, экстрагируют хлороформом. Органический слой сушат над сульфатом натрия и затем концентрируют. Полученный неочищенный продукт очищают с помощью хроматографии на колонке с силикагелем с получением 123,0 мг указанного в заголовке соединения (выход 86%). МС м/z 395 [М+Н]+.
Стадия 2
(2SR,5RS)-N'-Бензоил-6-гидрокси-7-оксо-1,6-диазабицикло[3.2.1]октан-2-карбогидразид
К раствору общего количества из указанной выше стадии 1 в метаноле (3 мл) добавляют 50% палладий на угле (содержание воды 50%, 20 мг) и смесь перемешивают в атмосфере водорода при комнатной температуре в течение 1 часа. Катализатор из реакционной смеси фильтруют через ПТФЭ мембрану, затем концентрируют при пониженном давлении. Полученный неочищенный продукт очищают с помощью хроматографии на колонке с силикагелем с получением 30 мг указанного в заголовке соединения (выход 32%).
1H ЯМР (400 МГц, CD3OD): δ 1,76-1,80 (м, 1H), 1,94-2,00 (м, 1H), 2,29-2,31 (м, 1H), 3,20-3,38 (м, 1H), 3,73 (шир.с, 1H), 4,02 (д, J=1,9, 1H), 7,47-7,90 (м, 1H); m/z 305 [M+H]+.
Стадия 3
(2SR,5RS)-N'-бензоил-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбогидразид натрия
К раствору общего количества из указанной выше стадии 2 в метиленхлориде (2,0 мл) добавляют 2,6-лутидин (145 мкл) и комплекс триоксид серы - пиридин (63 мг), и смесь перемешивают при комнатной температуре в течение ночи. К реакционному раствору добавляют хлороформ, затем проводят жидкостное разделение водой. Водный слой концентрируют до 1 мл при пониженном давлении, затем очищают хроматографией на колонке с октадецилсиликагелем. Полученный (2SR,5RS)-N'-бензоил-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбогидразид пиридиния подвергают реакции обмена соли с применением Dowex-Na типа с получением 4 мг указанного в заголовке соединения (выход 37%).
1H ЯМР (400 МГц, D2O): δ 1,73-1,75 (м, 1H), 1,82-1,95 (м, 1H), 2,10-2,15 (м, 1H), 3,16 (д, J=3,2, 1H), 3,26 (д, J=3,0, 1H), 4,09 (м, 2H), 7,39-7,54 (м, 5H); МС m/z 385 [M-Na+2H]+.
Пример 31
(2S,5R)-N'-(4-Аминобензоил)-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбогидразид
Стадия 1
трет-Бутил {4-[(2-{[(2S,5R)-6-бензилокси-7-оксо-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}гидразинил)карбонил]фенил}карбамат
По методике примера 27 из карбоновой кислоты (6b, 390 мг, 1,41 ммоль) из примера 9 или 16 и трет-бутил (4-(гидразинкарбонил)фенил)карбамата (653 мг, полученного по методике ссылочного примера 5 и ссылочного примера 6) получают 689,5 мг указанного в заголовке соединения (выход 96,0%).
1H ЯМР (400 МГц, CD3OD): δ 1,52 (с, 9H), 1,68-1,75 (м, 1H), 1,89-2,00 (м, 2H), 2,24-2,30 (м, 1H), 3,07-3,10 (д, J=10,8 Гц, 1H), 3,30 (м, 1H), 3,58 (шир.с, 1H), 4,02-4,04 (д, J=7,6 Гц, 1H), 4,93-4,59 (д, J=11,6 Гц, 1H), 5,00-5,03 (д, J=11,6 Гц, 1H), 7,33-7,41 (м, 3H), 7,46-7,48 (м, 2H), 7,51 (д, J=8,8 Гц, 2H), 7,80(д, J=8,8 Гц, 2H); МС m/z 510 [M+H]+.
Стадия 2
трет-Бутил {4-[(2-{[(2S,5R)-6-гидрокси-7-оксо-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}гидразинил)карбонил]фенил}карбамат
По методике примера 17, из общего количества соединения со стадии 1 получают указанное в заголовке соединение (выход количественный). МС м/z 420 [М+Н]+.
Стадия 3
(2S,5R)-N'-(4-Аминобензоил)-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбогидразид
По методике примера 17, из общего количества соединения со стадии 2 получают трет-бутил {4-[(2-{[(2S,5R)-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}гидразинил)карбонил]фенил}карбамат тетрабутиламмония (количественный выход). МС м/z 498 [М-Bu4N]- .
Общее количество соли тетрабутиламмония подвергают реакции снятия защиты с помощью трифторуксусной кислоты и очищают хроматографией на колонке с октадецилсиликагелем с получением 127,4 мг указанного в заголовке соединения (выход 23,6%).
1H ЯМР (400 МГц, D2O): δ 1,65-1,73 (м, 1H), 1,78-1,88 (м, 1H), 1,93-1,97 (м, 1H), 2,08-2,13 (м, 1H), 3,14-3,17 (д, J=12,0 Гц, 1H), 3,26-3,26 (д, J=12,0 Гц, 1H), 4,07 (м, 2H), 6,69-6,71 (д, J=8,4 Гц, 2H), 7,52-7,54 (д, J=8,4 Гц, 2H); МС m/z 400 [M+H]+.
Пример 32
(2SR,5RS)-N'-(4-(Аминометил)бензоил)-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбогидразид
Стадия 1
трет-Бутил {4-[(2-{[(2SR,5RS)-6-бензилокси-7-оксо-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}гидразинил)карбонил]бензил}карбамат
По методике примера 27, из (2SR,5RS)-6-(бензилокси)-7-оксо-1,6-диазабицикло[3.2.1]октан-2-карбоновой кислоты (200 мг, 0,724 ммоль) и трет-бутил 4-(гидразинкарбонил)бензилкарбамата (226 мг, полученного по методике ссылочного примера 5 и ссылочного примера 6) получают 288,7 мг указанного в заголовке соединения (выход 76,1%).
1H ЯМР (400 МГц, CDCl3): δ 1,49 (с, 9H), 1,62 (м, 1H), 1,95-2,05 (м, 2H), 2,34-2,39 (м, 1H), 3,14 (шир.д, J=11,6 Гц, 1H), 3,20 (д, J=1 1,6 Гц, 1H), 3,34 (с, 1H), 4,07 (д, J=6,8 Гц, 1H), 4,36 (шир.д, J=5,6 Гц, 2H), 4,92 (д, J=11,6 Гц, 1H), 5,06 (д, J=11,4 Гц, 1H), 7,34-7,52 (м, 7H), 7,83 (д, J=8,4 Гц, 2H); МС m/z 524 [M+H]+.
Стадия 2
трет-Бутил {4-[(2-{[(2SR,5RS)-6-гидрокси-7-оксо-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}гидразинил)карбонил]бензил}карбамат
По методике примера 17, из общего количества соединения со стадии 1, получают 216,1 мг указанного в заголовке соединения (выход 90,4%).
1H ЯМР (400 МГц, CD3OD): δ 1,45 (с, 9H), 1,74-1,82 (м, 1H), 1,91-2,03 (м, 1H), 2,09-2,20 (м, 1H), 2,29-2,34 (м, 1H), 3,20-3,30 (м, 2H), 3,74 (с, 1H), 4,02 (д, J=7,6 Гц, 1H), 4,29 (шир.с, 2H), 7,39 (д, J=8,0 Гц, 2H), 7,86 (д, J=8,0 Гц, 2H);
Стадия 3
(2SR,5RS)-N'-(4-(Аминометил)бензоил)-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбогидразид
По методике примера 26, из общего количества соединения со стадии 2 получают трет-бутил {4-[(2-{[2SR,5RS)-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}гидразинил)карбонил]бензил}карбамат пиридиния (количественный выход).
1H ЯМР (400 МГц, D2O): δ 1,29 (с, 9H), 1,74-1,76 (м, 1H), 1,81-1,89 (м, 1H), 1,96-1,91 (м, 1H), 2,11-2,15 (м, 1H), 3,18 (д, J=12,8 Гц, 1H), 3,27 (д, J=12,8 Гц, 1H), 3,59 (с, 1H), 4,12 (д, J=4,4 Гц, 1H), 4,19 (шир.с, 2H), 7,32 (д, J=7,6 Гц, 2H), 7,68 (д, J=7,6 Гц, 2H), 7,91-8,63 (м, 5H):
Общее количество соли пиридина подвергают реакции снятия защиты с помощью трифторуксусной кислоты и очищают Diaion HP21 (Mitsubishi Chemical) с получением 100,3 мг указанного в заголовке соединения (выход 48,7%).
1H ЯМР (400 МГц, D2O): δ 1,80-1,88 (м, 1H), 1,94-2,00 (м, 1H), 2,08 (м, 1H), 2,24-2,28 (м, 1H), 3,30 (д, J=12,4 Гц, 1H), 3,40 (д, J=1 2,0 Гц, 1H), 4,20-4,24 (м, 4H), 7,62 (д, J=8,0 Гц, 2H), 7,93 (д, J=8,0 Гц, 2H); МС m/z 414 [M+H]+.
Пример 33
(2SR,5RS)-7-оксо-N-(2-оксопирролидин-1-ил)-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбоксамид натрия
Стадия 1
(2SR,5RS)-6-бензилокси-7-оксо-N-(2-оксопирролидин-1-ил)-1,6-диазабицикло[3.2.1]октан-2-карбоксамид
По методике примера 17, из (2SR,5RS)-6-(бензилокси)-7-оксо-1,6-диазабицикло[3.2.1]октан-2-карбоновой кислоты (164 мг, 0,594 ммоль) и гидрохлорида 1-аминопирролидин-2-она (101 мг), получают 128 мг указанного в заголовке соединения (выход 60%).
1H ЯМР (400 МГц, CDCl3): δ 1,57-1,70 (м, 1H), 1,88-2,22 (м, 4H), 2,30-2,52 (м, 3H), 3,09 (шир.д, J=12,0 Гц, 1H), 3,22 (д, J=12,0 Гц, 1H), 3,30-3,35 (м, 1H), 3,46 (ддд, J=8,5, 8,5, 4,8 Гц, 1H), 3,73 (кв., J=7,7 Гц, 1H), 4,02 (шир.д, J=7,6 Гц, 1H), 4,92 (д, J=11,2 Гц, 1H), 5,06 (д, J=11,2 Гц, 1H), 7,35-7,46 (м, 5H), 8,34 (шир.с, 1H); МС m/z 359 [M+H]+.
Стадия 2
(2SR,5RS)-6-гидрокси-7-оксо-N-(2-оксопирролидин-1-ил)-1,6-диазабицикло[3.2.1]октан-2-карбоксамид
По методике примера 17, из соединения (126 мг, 0,352 ммоль) из приведенной выше стадии 1 получают указанное в заголовке соединение (выход количественный).
1H ЯМР (400 МГц, CD3OD): δ 1,70-1,80 (м, 1H), 1,88-2,00 (м, 1H), 2,02-2,19 (м, 3H), 2,27 (шир.дд, J=15,0, 7,0 Гц, 1H), 2,40-2,47 (м, 2H), 3,16 (шир.д, J=11,6 Гц, 1H), 3,21 (д, J=11,6 Гц, 1H), 3,52-3,65 (м, 2H), 3,68-3,73 (м, 1H), 3,96 (д, J=7,6 Гц, 1H); МС m/z 269 [M+H]+
Стадия 3
(2SR,5RS)-7-оксо-N-(2-оксопирролидин-1-ил)-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбоксамид натрия
К раствору общего количества соединения со стадии 2 в пиридине (3,5 мл) добавляют комплекс триоксид серы - пиридин (248 мг), и смесь перемешивают при комнатной температуре в течение ночи. К реакционной смеси добавляют метиленхлорид, фильтруют и затем концентрируют при пониженном давлении. К полученному остатку добавляют толуол, затем подвергают азеотропной перегонке. Получают 178 мг (2SR,5RS)-7-оксо-N-(2-оксопирролидин-1-ил)-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбоксамид пиридиния. МС м/z 349 [М-С5Н5NH]+.
Общее количество полученной выше соли пиридиния добавляют в воду и насыщенный водный раствор бикарбоната натрия и доводят до рH 7, с последующей лиофилизацией. Полученный неочищенный продукт очищают Diaion HP21 (Mitsubishi Chemical) (ацетонитрил/вода=100/0-90/10), с последующей лиофилизацией, и получают 103 мг указанного в заголовке соединения (2 стадии, выход 79%).
1H ЯМР (400 МГц, D2O): δ 1,65-1,74 (м, 1H), 1,77-1,89 (м, 1H), 1,92-2,14 (м, 2H), 2,03 (кв., J=7,6 Гц, 2H), 2,38 (т, J=7,6 Гц, 2H), 3,06 (д, J=12,0 Гц, 1H), 3,23 (шир.д, J=12,0 Гц, 1H), 3,49 (т, J=7,6 Гц, 2H), 4,05 (шир.д, J=6,8 Гц, 1H), 4,08 (шир.дд, J=5,8, 3,0 Гц, 1H); МС m/z 349 [M-Na+2H]+.
Пример 34
(2S,5R)-7-оксо-6-(сульфоокси)-N'-(тетрагидро-2Н-пиран-4-илкарбонил)-1,6-диазабицикло[3.2.1]октан-2-карбогидразид натрия
Стадия 1
(2S,5R)-6-Бензилокси-7-оксо N'-(тетрагидро-2Н-пиран-4-илкарбонил)-1,6-диазабицикло[3.2.1]октан-2-карбогидразид
По методике примера 27, из карбоновой кислоты (6b, 390 мг, 1,41 ммоль) из примера 9 или 16 и тетрагидро-2Н-пиран-4-карбогидразида (952 мг), описанного в ссылочном примере 2, получают 309,8 мг указанного в заголовке соединения (выход 54,5%).
1H ЯМР (400 МГц, CD3OD): δ 1,69-2,00 (м, 7H), 2,20-2,25 (м, 1H), 2,49-2,57 (м, 1H), 3,02 (шир.д, J=12,0 Гц, 1H), 3,20 (д, J=12,0 Гц, 1H), 3,41-3,47 (м, 2H), 3,56 (с, 1H), 3,94-3,97 (м, 3H), 4,91-4,94 (д, J=11,2 Гц, 1H), 4,98-5,01 (д, J=11,2 Гц, 1H), 7,34-7,47 (м, 5H); МС m/z 403 [M+H]+.
Стадия 2
(2S,5R)-6-Гидрокси-7-оксо-N'-(тетрагидро-2Н-пиран-4-илкарбонил)-1,6-диазабицикло[3.2.1]октан-2-карбогидразид
По методике примера 17, из общего количества соединения со стадии 1 получают указанное в заголовке соединение (выход количественный). МС м/z 313 [М+Н]+.
Стадия 3
(2S,5R)-7-оксо-6-(сульфоокси)-N'-(тетрагидро-2Н-пиран-4-илкарбонил)-1,6-диазабицикло[3.2.1]октан-2-карбогидразид натрия
По методике примера 22, из общего количества соединения со стадии 2 получают (2S,5R)-7-оксо-6-(сульфоокси)-N'-(тетрагидро-2Н-пиран-4-илкарбонил)-1,6-диазабицикло[3.2.1]октан-2-карбогидразид пиридиния и нейтрализуют насыщенным водным раствором бикарбоната натрия, затем очищают колоночной хроматографией Sepabeads SP207 (Mitsubishi Chemical) с получением 198,9 мг указанного в заголовке соединения (выход 62,4%).
1H ЯМР (400 МГц, D2O): δ 1,57-1,66 (м, 5H), 1,76-1,86(м, 1H), 1,93 (м, 1H), 2,05-2,09 (м, 1H), 2,52-2,56 (м, 1H), 3,07-3,10 (шир.д, J=12,0 Гц, 1H), 3,20-3,23 (д, J=12,0 Гц, 1H), 3,36-3,41 (м, 2H), 3,86-3,89 (д, J=10,0 Гц, 2H), 4,02-4,04 (J=7,6 Гц, 1H), 4,07(с, 1H); МС m/z 393 [M-Na+2H]+.
Пример 35
(2S,5R)-7-Оксо-N'-(пиперидин-4-илкарбонил)-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбоксамид
Стадия 1
трет-Бутил 4-[(2-{[(2S,5R)-6-бензилокси-7-оксо-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}гидразинил)карбонил]пиперидин-1-карбоксилат
По методике примера 27, из карбоновой кислоты (6b, 390 мг, 1,41 ммоль) из примера 9 или 16 и трет-бутил 4-(гидразинкарбонил)пиперидин-1-карбоксилата (642 мг, полученного по методике ссылочного примера 5 и ссылочного примера 6) получают 552,7 мг указанного в заголовке соединения (выход 78,1%).
1H ЯМР (400 МГц, CDCl3): δ 1,42 (с, 9H), 1,60-1,71 (м, 3H), 1,77-1,92 (м, 2H), 1,96-2,02 (м, 2H), 2,28-2,36 (м, 2H), 2,72-2,78 (дд, J=12 Гц, 2H), 3,06-3,09 (шир.д, J=12,0 Гц, 1H), 3,14-3,17 (д, J=11,6 Гц, 1H), 3,28 (шир.с, 1H), 4,00-4,01 (д, J=7,2 Гц, 1H), 4,07-4,12 (дд, J=14,4 Гц, 2H), 4,87-4,90 (д, 11,2 Гц, 1H), 5,02-5,04 (д, J=11,6 Гц, 1H), 7,23-7,41 (м, 5H), 7,57 (шир.с, 1H), 8,58 (шир.с, 1H); МС m/z 502 [M+H]+.
Стадия 2
трет-Бутил 4-[(2-{[(2S,5R)-6-гидрокси-7-оксо-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}гидразинил)карбонил]пиперидин-1-карбоксилат
По методике примера 17, из общего количества соединения со стадии 1 получают 423,8 мг указанного в заголовке соединения (выход 93,6%). МС м/z 412 [М+Н]+.
Стадия 3
(2S,5R)-7-Оксо-N'-(пиперидин-4-илкарбонил)-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбогидразид
По методике примера 26, из общего количества соединения со стадии 2, получают трет-бутил 4-[(2-{[(2S,5R)-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}гидразинил)карбонил]пиперидин-1-карбоксилат пиридиния (количественный выход). МС м/z 492 [М-С5Н5NH]+.
Общее количество соли пиридина подвергают реакции снятия защиты с помощью трифторуксусной кислоты и очищают хроматографией на колонке с октадецилсиликагелем с получением 150 мг указанного в заголовке соединения (выход 37,2%).
1H ЯМР (400 МГц, D2O): δ 1,62-2,10 (м, 8H), 2,57-2,63 (м, 1H), 2,91-2,96 (дд, J=11,6, 12,8 Гц, 2H), 3,05-3,08 (д, J=12,4 Гц, 1H), 3,19-3,22 (д, J=12,0 Гц, 1H), 3,33-3,36 (д, J=13,2 Гц, 2H), 4,01-4,03 (д, J=7,6 Гц, 1H), 4,07 (шир.с, 1H); МС m/z 392 [M+H]+.
Пример 36
(2S,5R)-7-Оксо-N'-[(2S)-пиперидин-2-илкарбонил]-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбогидразид
Стадия 1
трет-Бутил (2S)-2-[(2-{[(2S,5R)-6-бензилокси-7-оксо-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}гидразинил)карбонил]пиперидин-1-карбоксилат
По методике примера 27, из карбоновой кислоты (6b, 390 мг, 1,41 ммоль) из примера 9 или 16 и (S)-трет-бутил 2-(гидразинкарбонил)пиперидин-1-карбоксилата (634 мг, полученного по методике ссылочного примера 5 и ссылочного примера 6) получают 567 мг указанного в заголовке соединения (выход 80%).
1H ЯМР (400 МГц, CDCl3): δ 1,35-1,72 (м, 6H), 1,49 (с, 9H), 1,90-2,10 (м, 2H), 2,16-2,40 (м, 2H), 2,98-3,37 (м, 5H), 3,96-4,08 (м, 2H), 4,85 (шир.с, 1H), 4,92 (д, J=11,2 Гц, 1H), 5,06 (д, J=11,2 Гц, 1H), 7,33-7,47 (м, 5H), 8,30 (шир.с, 1H); МС m/z 502 [M+H]+.
Стадия 2
трет-Бутил (2S)-2-[(2-{[(2S,5R)-6-гидрокси-7-оксо-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}гидразинил)карбонил]пиперидин-1-карбоксилат
По методике примера 17, из общего количества соединения со стадии 1 получают указанное в заголовке соединение (выход количественный). МС м/z 410 [М-Н]-.
Стадия 3
(2S,5R)-7-Оксо-N'-[(2S)-пиперидин-2-илкарбонил]-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбогидразид
К раствору общего количества соединения из указанной выше стадии 2 в пиридине (11,3 мл) добавляют комплекс триоксид серы - пиридин (899 мг), и смесь перемешивают при комнатной температуре в течение ночи. К реакционной смеси добавляют пиридин, фильтруют и затем концентрируют при пониженном давлении. К полученному остатку добавляют толуол, затем подвергают азеотропной перегонке и концентрируют досуха. Добавляют водный раствор дигидрофосфата натрия (15 мл), водный слой промывают этилацетатом и затем гидросульфатом тетрабутиламмония (421 мг) и этилацетатом (30 мл), и смесь перемешивают в течение 10 минут. Вводный слой экстрагируют этилацетатом, затем полученный органический слой сушат над безводным сульфатом натрия, фильтруют и концентрируют при пониженном давлении с получением трет-бутил (2S)-2-[(2-{[(2S,5R)-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}гидразинил)карбонил]пиперидин-1-карбоксилата тетрабутиламмония (количественный выход).
1H ЯМР (400 МГц, CDCl3): δ 1,01 (т, J=7,4 Гц, 12H), 1,30-1,75 (м, 23H), 1,44 (с, 9H), 1,84-1,98 (м, 2H), 2,13-2,42 (м, 2H), 2,97-3,12 (м, 1H), 3,20-3,46 (м, 10H), 3,80-4,15 (м, 2H), 4,36 (шир.с, 1H), 4,86 (шир.с, 1H), 8,43 (шир.с, 1H); МС m/z 490 [M-Bu4N]-.
Общее количество полученной соли тетрабутиламмония растворяют в метиленхлориде (5,7 мл), и добавляют трифторуксусную кислоту (5,7 мл) при охлаждении льдом, и смесь перемешивают при 0°С в течение 30 минут. Реакционный раствор концентрируют при пониженном давлении и полученный остаток промывают диэтиловым эфиром, доводят до рН 7 водным раствором бикарбоната натрия, очищают хроматографией на колонке с октадецилсиликагелем (вода) и лиофилизируют. Получают 104 мг указанного в заголовке соединения (3 стадии, выход 23%).
1H ЯМР (400 МГц, D2O): δ 1,42-2,17 (м, 10H), 2,83-2,97 (м, 1H), 3,06 (д, J=12,0 Гц, 1H), 3,23 (шир.д, J=12,0 Гц, 1H), 3,34 (шир.д, J=12,0 Гц, 1H), 3,81 (дд, J=12,0, 3,0 Гц, 1H), 3,99-4,13 (м, 2H); МС m/z 392 [M+H]+.
Пример 37
(2S,5R)-7-Оксо-N'-[(2R)-пиперидин-2-илкарбонил]-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбогидразид
Стадия 1
трет-Бутил (2R)-2-[(2-{[(2S,5R)-6-бензилокси-7-оксо-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}гидразинил)карбонил]пиперидин-1-карбоксилат
По методике примера 27, из карбоновой кислоты (6b, 390 мг, 1,41 ммоль) из примера 9 или 16 и (R)-трет-бутил 2-(гидразинкарбонил)пиперидин-1-карбоксилата (630 мг, полученного по методике ссылочного примера; добавление водорода) с получением 648 мг указанного в заголовке соединения (выход 92%).
1H ЯМР (400 МГц, CDCl3): δ 1,35-1,72 (м, 6H), 1,49 (с, 9H), 1,90-2,06 (м, 2H), 2,15-2,40 (м, 2H), 2,80-3,32 (м, 5H), 3,94-4,07 (м, 2H), 4,86 (шир.с, 1H), 4,92 (д, J=11,4 Гц, 1H), 5,06 (д, J=11,4 Гц, 1H), 7,34-7,45 (м, 5H), 8,40 (шир.с, 1H); МС m/z 502 [M+H]+.
Стадия 2
трет-Бутил (2R)-2-[(2-{[(2S,5R)-6-гидрокси-7-оксо-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}гидразинил)карбонил]пиперидин-1-карбоксилат
По методике примера 17, из общего количества соединения со стадии 1 получают указанное в заголовке соединение (выход количественный).
1H ЯМР (400 МГц, CD3OD): δ 1,35-1,60 (м, 2H), 1,46 (с, 9H), 1,60-1,82 (м, 4H), 1,87-2,15 (м, 2H), 2,17-2,34 (м, 2H), 3,10-3,20 (м, 2H), 3,24-3,36 (м, 2H), 3,67-3,73 (м, 1H), 3,91-4,05 (м, 2H); МС m/z 412 [M +H]+.
Стадия 3
(2S,5R)-7-Оксо-N'-[(2R)-пиперидин-2-илкарбонил]-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбогидразид
По методике примера 17, из общего количества соединения со стадии 2 получают трет-бутил (2R)-2-[(2-{[(2S,5R)-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}гидразинил)карбонил]пиперидин-1-карбоксилат тетрабутиламмония (количественный выход). МС м/z 490 [М-Bu4N]-.
Общее количество полученной выше соли тетрабутиламмония подвергают реакции снятия защиты с помощью трифторуксусной кислоты и очищают хроматографией на колонке с октадецилсиликагелем с получением 158,8 мг указанного в заголовке соединения (3 стадии, выход 31%).
1H ЯМР (400 МГц, D2O): δ 1,42-1,88 (м, 7H), 1,91-2,01 (м, 1H), 2,03-2,17 (м, 2H), 2,88-2,98 (м, 1H), 3,05 (д, J=12,0 Гц, 1H), 3,22 (шир.д, J=12,0 Гц, 1H), 3,35 (шир.д, J=12,8 Гц, 1H), 3,89 (дд, J=12,0, 3,2 Гц, 1H), 3,99-4,13 (м, 2H); МС m/z 392 [M+H]+.
Пример 38
(2S,5R)-7-Оксо-N'-[(2S)-пирролидин-2-илкарбонил]-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбогидразид
Стадия 1
трет-Бутил (2S)-2-[(2-{[(2S,5R)-6-бензилокси-7-оксо-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}гидразинил)карбонил]пирролидин-1-карбоксилат
По методике примера 27, из карбоновой кислоты (6b, 390 мг, 1,41 ммоль) из примера 9 или 16 и (S)-трет-бутил 2-(гидразин-карбонил)пирролидин-1-карбоксилата (573 мг), описанного в ссылочном примере 6, получают 555 мг указанного в заголовке соединения (выход 80,1%).
1H ЯМР (400 МГц, CD3OD): δ 1,41 (с, 9H), 1,70-1,73 (м, 1H), 1,86-2,09 (м, 5H), 2,13-2,28 (м, 2H), 3,01-3,04 (шир.д, J=11,6 Гц, 1H), 3,15-3,21 (т, J=11,6 Гц, 1H), 3,31-3,40 (м, 1H), 3,48-3,56 (м, 2H), 3,94-3,96 (д, J=7,2 Гц, 1H), 4,23-4,26 (д, J=7,2 Гц, 1H), 4,91-4,94 (д, J=11,6 Гц, 1H), 4,98-5,01 (д, J=11,6 Гц, 1H), 7,34-7,40 (м, 3H), 7,45-7,47 (м, 2H); МС m/z 488 [M+H]+.
Стадия 2
трет-Бутил (2S)-2-[(2-{[(2S,5R)-6-гидрокси-7-оксо-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}гидразинил)карбонил]пиперидин-1-карбоксилат
По методике примера 17, из общего количества соединения со стадии 1 получают указанное в заголовке соединение (выход количественный).
1H ЯМР (400 МГц, CD3OD): δ 1,41 (с, 9H), 1,70-1,75 (м, 1H), 1,82-2,04 (м, 5H), 2,18-2,27 (м, 2H), 3,09-3,21 (м, 2H), 3,32-3,37 (м, 1H), 3,46-3,51 (м, 1H), 3,65 (шир.с, 1H), 3,89-3,91 (д, J 7,6 Гц, 1H), 4,20-4,23 (м, 1H); МС m/z 398 [M+H]+.
Стадия 3
(2S,5R)-7-оксо-N'-[(2S)-пирролидин-2-илкарбонил]-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбогидразид
По методике примера 17, из общего количества соединения со стадии 2 получают 782,1 мг трет-бутил (2S)-2-[(2-{[(2S,5R)-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}гидразинил)карбонил]пирролидин-1-карбоксилат тетрабутиламмония (выход 96,3%). МС м/z 476 [М-Bu4N]-.
Общее количество полученной выше соли тетрабутиламмония подвергают реакции снятия защиты с помощью трифторуксусной кислоты и очищают хроматографией на колонке с октадецилсиликагелем с получением 143,8 мг указанного в заголовке соединения (выход 35,2%).
1H ЯМР (400 МГц, D2O): δ 1,66-1,85 (м, 6H), 2,04-2,16 (м, 2H), 2,99-3,30 (м, 4H), 3,87-4,18 (м, 3H); МС m/z 378 [M+H]+.
Пример 39
(2S,5R)-7-оксо-N'-[(2R)-пирролидин-2-илкарбонил]-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбогидразид
Стадия 1
трет-бутил (2R)-2-[(2-{[(2S,5R)-6-бензилокси-7-оксо-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}гидразинил)карбонил]пирролидин-1-карбоксилат
По методике примера 27, из карбоновой кислоты (6b, 390 мг, 1,41 ммоль) из примера 9 или 16 и (R)-трет-бутил 2-(гидразинкарбонил)пирролидин-1-карбоксилата (573 мг, полученного по методике ссылочного примера 5 и ссылочного примера 6), с получением 624,3 мг указанного в заголовке соединения (выход 90,8%).
1H ЯМР (400 МГц, CDCl3): δ 1,40 (с, 9H), 1,52-1,57 (м, 1H), 1,81-1,97 (м, 5H), 2,25-2,56 (м, 2H), 3,01-3,07 (м, 2H), 3,17 (шир.с, 1H), 3,17-3,42 (м, 2H), 3,94-3,96 (д, J=7,2 Гц, 1H), 4,30 (м, 1H), 4,82-4,85 (д, J=11,2 Гц, 1H), 4,97-5,00 (д, J=11,2 Гц, 1H), 7,27-7,37 (м, 5H), 8,37 (шир.с, 1H), 8,94 (шир.с, 1H); МС m/z 488 [M+H]+.
Стадия 2
трет-Бутил (2R)-2-[(2-{[(2S,5R)-6-гидрокси-7-оксо-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}гидразинил)карбонил]пирролидин-1-карбоксилат
По методике примера 17, из общего количества соединения со стадии 1 получают указанное в заголовке соединение (выход количественный).
1H ЯМР (400 МГц, CDCl3): δ 1,40 (с, 9H), 1,52-1,57 (м, 1H), 1,81-1,97 (м, 5H), 2,25-2,56 (м, 2H), 3,01-3,07 (м, 2H), 3,17 (шир.с, 1H), 3,17-3,42 (м, 2H), 3,94-3,96 (д, J=7,2 Гц, 1H), 4,30 (м, 1H), 4,82-4,85 (д, J=11,2 Гц, 1H), 4,97-5,00 (д, J=11,2 Гц, 1H), 7,27-7,37 (м, 5H), 8,37 (шир.с, 1H), 8,94 (шир.с, 1H); МС m/z 398 [M+H]+.
Стадия 3
(2S,5R)-7-Оксо-N'-[(2R)-пирролидин-2-илкарбонил]-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбогидразид
По методике примера 17, из общего количества соединения со стадии 2 получают трет-бутил (2R)-2-[(2-{[(2S,5R)-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}гидразинил)карбонил]пирролидин-1-карбоксилат тетрабутиламмония (количественный выход). Затем общее количество соли тетрабутиламмония подвергают реакции снятия защиты с помощью трифторуксусной кислоты и очищают хроматографией на колонке с октадецилсиликагелем с получением 132,5 мг указанного в заголовке соединения (выход 27,4%).
1H ЯМР (400 МГц, D2O): δ 1,68-1,71 (м, 1H), 1,76-1,88 (м, 4H), 1,92 (м, 1H), 2,04-2,18 (м, 2H), 2,99-3,02 (д, J=12,0 Гц, 1H), 3,04-3,21 (м, 3H), 3,92-4,00 (м, 2H), 4,06 (шир.с, 1H); МС m/z 378 [M+H]+.
Пример 40
(2S,5R)-N'-{[(2S,4R)-4-Циклопропилметилпиперидин-2-ил]карбонил}-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбогидразид
Стадия 1
трет-Бутил (2S,4R)-2-[(2-{[(2S,5R)-6-бензилокси-7-оксо-1,6-диазобицикло[3.2.1]окт-2-ил]карбонил}гидразинил)карбонил]-4-циклопропилметилпиперидин-1-карбоксилат
По методике примера 27, из карбоновой кислоты (6b, 390 мг, 1,41 ммоль) из примера 9 или 16 и (2S,4R)-трет-бутил 4-(циклопропилметил)-2-(гидразинкарбонил)пиперидин-1-карбоксилата (595 мг, полученного по методике ссылочного примера 5 и ссылочного примера 6), с получением 707,6 мг указанного в заголовке соединения (выход 90,3%).
1H ЯМР (400 МГц, CDCl3): δ 0,01 (м, 2H), 0,40-0,42 (м, 2H), 0,66 (м, 1H), 1,18-1,68 (м, 8H), 1,46 (с, 9H), 1,82-2,17 (м, 2H), 2,30-2,34 (м, 1H), 3,10-3,18 (м, 2H), 3,29-3,33 (м, 2H), 3,65 (м, 1H), 4,01-4,02 (д, J=7,2 Гц, 1H), 4,40-4,44 (м, 1H), 4,89-4,92 (д, J=11,6 Гц, 1H), 5,04-5,07 (д, J=11,2 Гц, 1H), 7,26-7,44 (м, 5H), 8,02 (шир.с, 1H), 8,39 (шир.с, 1H); МС m/z 556 [M+H]+.
Стадия 2
трет-Бутил (2S,4R)-4-циклопропилметил-2-[(2-{[(2S,5R)-6-гидрокси-7-оксо-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}гидразинил)карбонил]пиперидин-1-карбоксилат
По методике примера 17, из общего количества соединения со стадии 1 получают указанное в заголовке соединение (выход количественный).
1H ЯМР (400 МГц, CD3OD): δ 0,01 (м, 2H), 0,38 (м, 2H), 0,67 (м, 1H), 1,21-1,24 (м, 2H), 1,42 (с, 9H), 1,70-1,94 (м, 6H), 2,06-2,10 (м, 2H), 2,19-2,25 (м, 1H), 3,10-3,26 (м, 4H), 3,66 (м, 1H), 3,90-3,92 (д, J=7,2 Гц, 1H), 4,25 (м, 1H); МС m/z 466 [M+H]+.
Стадия 3
(2S,5R)-N'-{[(2S,4R)-4-Циклопропилметилпиперидин-2-ил]карбонил}-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбогидразид
По методике примера 17, из общего количества соединения со стадии 2 получают 993,5 мг трет-бутил (2S,4R)-4-циклопропилметил-2-[(2-{[(2S,5R)-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}гидразинил)карбонил]пиперидин-1-карбоксилат тетрабутиламмония (выход 98,9%). МС м/z 544 [М-Bu4N]-.
Общее количество полученной выше соли тетрабутиламмония подвергают реакции снятия защиты с помощью трифторуксусной кислоты и очищают хроматографией на колонке с октадецилсиликагелем с получением 221,9 мг указанного в заголовке соединения (выход 39,5%).
1H ЯМР (400 МГц, D2O): δ 0,01 (м, 2H), 0,37-0,42 (м, 2H), 0,66-0,70 (м, 1H), 1,18-1,22 (м, 2H), 1,31-1,41 (м, 1H), 1,42-1,52 (дд, J=13,2 Гц, 1H), 1,73-2,06 (м, 5H), 2,15-2,20 (м, 1H), 2,32-2,35 (м, 1H), 3,01-3,05 (тд, J=2,8, 13,2 Гц, 1H), 3,13-3,16 (д, J=12,0 Гц, 1H), 3,30-3,33 (д, J=12,4 Гц, 1H), 3,46-3,49 (д, J=13,2 Гц, 1H), 3,98-4,02 (дд, 2,8, 12,8 Гц, 1H), 4,12-4,14 (д, 8,8 Гц, 1H), 4,18 (шир.с, 1H); МС m/z 446 [M+H]+.
Пример 41
(2S,5R)-7-оксо-N'-{[(2S)-5-оксопирролидин-2-ил]карбонил}-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбогидразид натрия
Стадия 1
трет-Бутил (2S)-2-[(2-{[(2S,5R)-6-бензилокси-7-оксо-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}гидразинил)карбонил]-5-оксопирролидин-1-карбоксилат
По методике примера 27, из карбоновой кислоты (6b, 390 мг, 1,41 ммоль) из примера 9 или 16 и (S)-трет-бутил 2-(гидразин-карбонил)-5-оксопирролидин-1-карбоксилат (730 мг, полученного по методике ссылочного примера 5 и ссылочного примера 6), с получением 643,5 мг указанного в заголовке соединения (выход 90,9%).
1H ЯМР (400 МГц, CDCl3): δ 1,50 (с, 9H), 1,57-1,66 (м, 1H), 1,89-2,02 (м, 2H), 2,21-2,31 (м, 3H), 2,42-2,49 (м, 1H), 2,72-2,81 (м, 1H), 3,06 (м, 2H), 3,29 (шир.с, 1H), 4,01-4,02 (д, J=6,8 Гц, 1H), 4,59-4,62 (м, 1H), 4,87-4,90 (д, J=11,6 Гц, 1H), 5,02-5,05 (д, J=11,2 Гц, 1H), 7,34-7,41 (м, 5H), 8,25 (шир.с, 1H), 8,52 (шир.с, 1H); МС m/z 502 [M+H]+.
Стадия 2
трет-Бутил (2S)-2-[(2-{[(2S,5R)-6-гидрокси-7-оксо-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}гидразинил)карбонил]-5-оксопирролидин-1-карбоксилат
По методике примера 17, из общего количества соединения со стадии 1 получают указанное в заголовке соединение (выход количественный).
1H ЯМР (400 МГц, CD3OD): δ 1,45 (с, 9H), 1,76 (м, 1H), 1,88-1,99 (м, 1H), 2,05-2,19 (м, 2H), 2,22-2,26 (м, 1H), 2,34-2,50 (м, 2H), 2,58-2,68 (м, 1H), 3,12-3,16 (шир.д, J=12,4 Гц, 1H), 3,20-3,37 (д, J=12,0 Гц, 1H), 3,70 (шир.с, 1H), 3,94-3,96 (д, J=7,6 Гц, 1H), 4,66-4,69 (д, J=9,2 Гц, 1H); МС m/z 412 [M+H]+.
Стадия 3
(2S,5R)-7-оксо-N'-{[(2S)-5-оксопирролидин-2-ил]карбонил}-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбогидразид натрия
По методике примера 17, из общего количества соединения со стадии 2 получают трет-бутил (2S)-2-[(2-{[(2S,5R)-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}гидразинил)карбонил]-5-оксопирролидин-1-карбоксилат тетрабутиламмония (количественный выход). Затем общее количество соли тетрабутиламмония подвергают реакции снятия защиты с помощью трифторуксусной кислоты и очищают хроматографией на колонке с октадецилсиликагелем с получением 292,6 мг указанного в заголовке соединения (выход 55,9%).
1H ЯМР (400 МГц, D2O): δ 1,63-1,70 (м, 1H), 1,76-1,86 (м, 1H), 1,92-2,10 (м, 3H), 2,23-2,49 (м, 3H), 3,06-3,09 (д, J=12,0 Гц, 1H), 3,19-3,22 (д, J=12,0 Гц, 1H), 4,02-4,04 (д, J=11,2 Гц, 1H), 4,07 (шир.с, 1H), 4,27-4,30 (дд, J=5,2, 8,8 Гц, 1H); МС m/z 392 [M-Na+2H]+.
Пример 42
(2S,5R)-7-оксо-N'-{[(2R)-5-оксопирролидин-2-ил]карбонил}-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбогидразид натрия
Стадия 1
трет-Бутил (2R)-2-[(2-{[(2S,5R)-6-бензилокси-7-оксо-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}гидразинил)карбонил]-5-оксопирролидин-1-карбоксилат
По методике примера 27, из карбоновой кислоты (6b, 390 мг, 1,41 ммоль) из примера 9 или 16 и (R)-трет-бутил 2-(гидразин-карбонил)-5-оксопирролидин-1-карбоксилата (730 мг, полученного по методике ссылочного примера 6 и ссылочного примера 4), с получением 431,2 мг указанного в заголовке соединения (выход 60,9%).
1H ЯМР (400 МГц, CDCl3): δ 1,44 (с, 9H), 1,56 (м, 1H), 1,81-1,91 (м, 2H), 2,14-2,28 (м, 3H), 2,34-2,44 (м, 1H), 2,64-2,73 (м, 1H), 3,00-3,17 (м, 2H), 3,20 (с, 1H), 3,92-3,94 (д, J=7,2 Гц, 1H), 4,51-4,53 (д, J=5,6 Гц, 1H), 4,82-4,85 (д, J=11,2 Гц, 1H), 4,96-4,99 (д, J=11,6 Гц, 1H), 7,29-7,36 (м, 5H), 8,13 (шир.с, 1H), 8,43 (шир.с, 1H); МС m/z 502 [M+H]+.
Стадия 2
трет-Бутил (2R)-2-[(2-{[(2S,5R)-6-гидрокси-7-оксо-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}гидразинил)карбонил]-5-оксопирролидин-1-карбоксилат
По методике примера 17, из общего количества соединения со стадии 1 получают указанное в заголовке соединение (выход количественный). МС м/z 412 [М+Н]+.
Стадия 3
(2S,5R)-7-оксо-N'-{[(2R)-5-оксопирролидин-2-ил]карбонил}-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбогидразид натрия
По методике примера 17, из общего количества соединения со стадии 2 получают трет-бутил (2R)-2-[(2-{[(2S,5R)-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}гидразинил)карбонил]-5-оксопирролидин-1-карбоксилат тетрабутиламмония (количественный выход). МС м/z 490 [М-Bu4N]-.
Общее количество полученной выше соли тетрабутиламмония подвергают реакции снятия защиты с помощью трифторуксусной кислоты и очищают хроматографией на колонке с октадецилсиликагелем с получением 179,5 мг указанного в заголовке соединения (выход 50,5%).
1H ЯМР (400 МГц, D2O): δ 1,67-1,71 (м, 1H), 1,78-1,86 (м, 1H), 1,92-2,16 (м, 3H), 2,26-2,45 (м, 3H), 3,04-3,07 (д, J=12,4 Гц, 1H), 3,19-3,22 (шир.д, J=12,0 Гц, 1H), 4,01-4,03 (д, J=8,4 Гц, 1H), 4,06 (шир.с, 1H), 4,22-4,28 (дд, J=4,8, 8,8 Гц, 1H); МС m/z 392 [M-Na+2H]+.
Пример 43
(2S,5R)-N'-(фуран-2-илкарбонил)-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбогидразид натрия
Стадия 1
(2S,5R)-6-бензилокси-N'-(фуран-2-илкарбонил)-7-оксо-1,6-диазабицикло[3.2.1]октан-2-карбогидразид
По методике примера 27, из карбоновой кислоты (6b, 552 мг, 2,00 ммоль) из примера 9 или 16 и фуран-2-карбоксамида (390 мг, получен по методике ссылочного примера 6 из соединения, описанного в ссылочном примере 3), с получением 291,8 мг указанного в заголовке соединения (выход 37,9%).
1H ЯМР (400 МГц, CDCl3): δ 1,57-1,65 (м, 1H), 1,89-2,02 (м, 2H), 2,33-2,38 (м, 1H), 3,10-3,13 (д, J=11,6 Гц, 1H), 3,21-3,24 (д, J=12,0 Гц, 1H), 3,31 (с, 1H), 4,07-4,12 (м, 1H), 4,89-4,92 (д, J=11,2 Гц, 1H), 5,03-5,06 (д, J=11,2 Гц, 1H), 6,50-6,52 (дд, J=1,6, 3,2 Гц, 1H), 7,17 (д, J=3,2 Гц, 1H), 7,32-7,43 (м, 5H), 7,47 (д, J=1,6 Гц, 1H), 8,41 (м, 1H), 8,62 (м, 1H); МС m/z 385 [M+H]+.
Стадия 2
(2S,5R)-N'-(Фуран-2-илкарбонил)-6-гидрокси-7-оксо-1,6-диазабицикло[3.2.1]октан-2-карбогидразид
По методике примера 17, из общего количества соединения со стадии 1 получают указанное в заголовке соединение (выход количественный). МС м/z 295 [М+Н]+.
Стадия 3
(2S,5R)-N'-(фуран-2-илкарбонил)-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбогидразид натрия
По методике примера 22, из общего количества соединения со стадии 2 получают (2S,5R)-N'-(фуран-2-илкарбонил)-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбогидразид пиридиния и нейтрализуют насыщенным водным раствором бикарбоната натрия и затем очищают хроматографией на колонке с октадецилсиликагелем с получением 54,8 мг указанного в заголовке соединения (выход 18,2%).
1H ЯМР (400 МГц, D2O): δ 1,66-1,74 (м, 1H), 1,80-1,97 (м, 2H), 2,08-2,17 (м, 1H), 3,11-3,14 (д, J=12,0 Гц, 1H), 3,23-3,26 (д, J=12,4 Гц, 1H), 4,09 (м, 2H), 6,51 (д, J=3,6 Гц, 1H), 7,13 (д, J=3,6 Гц, 1H), 7,58 (с, 1H); МС m/z 375 [M-Na+2H]+.
Пример 44
(2S,5R)-N'-(1,3-оксазол-4-илкарбонил)-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбогидразид натрия
Стадия 1
(2S,5R)-6-Бензилокси-N'-(1,3-оксазол-4-илкарбонил)-7-оксо-1,6-диазабицикло[3.2.1]октан-2-карбогидразид
По методике примера 27, из карбоновой кислоты (6b, 390 мг, 1,41 ммоль) из примера 9 или 16 и оксазол-4-карбогидразида (613 мг, получен по методике ссылочного примера 2), получают 335,2 мг указанного в заголовке соединения (выход 61,7%).
1H ЯМР (400 МГц, CDCl3): δ 1,63-1,65 (м, 1H), 1,80-2,00 (м, 2H), 2,29-2,37 (м, 1H), 3,08-3,11 (шир.д, J=13,2 Гц, 1H), 3,15-3,18 (д, J=1 2,0 Гц, 1H), 3,30 (шир.с, 1H), 4,07-4,08 (д, J=7,2 Гц, 1H), 4,87-4,91 (д, J=11,2 Гц, 1H), 5,02-5,06 (д, J=11,2 Гц, 1H), 7,34-7,42 (м, 5H), 7,88 (с, 1H), 8,25 (с, 1H), 8,61 (шир.с, 1H), 8,73 (шир.с, 1H); МС m/z 386 [M+H]+.
Стадия 2
(2S,5R)-6-Гидрокси-N'-(1,3-оксазол-4-илкарбонил)-7-оксо-1,6-диазабицикло[3.2.1]октан-2-карбогидразид
По методике примера 17, из общего количества соединения со стадии 1 получают указанное в заголовке соединение (выход количественный). МС м/z 296 [М+Н]+.
Стадия 3
(2S,5R)-N'-(1,3-оксазол-4-илкарбонил)-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбогидразид натрия
По методике примера 22, из общего количества соединения со стадии 2 получают (2S,5R)-N'-(1,3-оксазол-4-илкарбонил)-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбогидразид пиридиния и нейтрализуют насыщенным водным раствором бикарбоната натрия и затем очищают хроматографией на колонке с октадецилсиликагелем с получением 195 мг указанного в заголовке соединения (выход 56,5%).
1H ЯМР (400 МГц, D2O): δ 1,70-1,73 (м, 1H), 1,75-1,88 (м, 1H), 1,93-1,97 (м, 1H), 2,06-2,14 (м, 1H), 3,09-3,12 (д, J=12,0 Гц, 1H), 3,18-3,24 (шир.д, J=12,8 Гц, 1H), 4,04-4,06 (д, J=7,6 Гц, 1H), 4,08-4,09 (м, 1H), 8,05 (с, 1H), 8,27 (с, 1H); МС m/z 376 [M-Na+2H]+.
Пример 45
(2S,5R)-7-оксо-N'-(пиридин-3-илкарбонил)-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбогидразид натрия
Стадия 1
(2S,5R)-6-Бензилокси-7-оксо-N'-(пиридин-3-илкарбонил)-1,6-диазабицикло[3.2.1]октан-2-карбогидразид
Раствор карбоновой кислоты (6b, 390 мг, 1,41 ммоль) из примера 9 или 16 в сухом метиленхлориде (14,1 мл) охлаждают до 0°С в атмосфере аргона и постепенно добавляют изобутилхлорформиат (231,1 мг) так, чтобы температура не превышала 0°С. Далее, постепенно добавляют триэтиламин (185 мг), так, чтобы температура не превышала 0°С, смесь перемешивают в течение 30 минут с получением смешанного ангидрида кислоты в реакционной системе. К этой реакционной смеси постепенно добавляют гидразид никотиновой кислоты (580 мг). После добавления температуру повышают до комнатной температуры и перемешивают в течение 1 часа. Эту реакционную смесь промывают 0,5М соляной кислоты и насыщенным солевым раствором, и органический слой сушат над сульфатом магния и упаривают при пониженном давлении. Полученный остаток очищают с помощью хроматографии на колонке с силикагелем (гексан/этилацетат=4/1-0/1, этилацетат/метанол=30/1) с получением 439,5 мг указанного в заголовке соединения в виде бесцветного масла (выход 78,8%).
1H ЯМР (400 МГц, CD3OD): δ 1,68-1,75 (м, 1H), 1,88-2,02 (м, 2H), 2,25-2,30 (м, 1H), 3,08-3,11 (д, J=12,4 Гц, 1H), 3,28-3,33 (м, 1H), 3,60 (шир.с, 1H), 4,03-4,08 (д, J=12,0 Гц, 1H), 4,90 (д, J=11,2 Гц, 1H), 5,00 (д, J=11,2 Гц, 1H), 7,33-7,41 (м, 3H), 7,45-7,48 (м, 2H), 7,54-7,58 (дд, J=5,0, 8,0 Гц, 1H), 8,26-8,29 (дд, J=2,0, 8,0 Гц, 1H), 8,71-8,72 (дд, J=1,2, 4,8 Гц, 1H), 9,00-9,01 (дд, J=0,8, 2,0 Гц, 1H); МС m/z 396 [M+H]+.
Стадия 2
(2S,5R)-6-гидрокси-7-оксо-N'-(пиридин-3-илкарбонил)-1,6-диазабицикло[3.2.1]октан-2-карбогидразид
Общее количество соединения со стадии 1 выше растворяют в метаноле (11 мл) и добавляют 10% палладий на угле (содержание воды 50%, 80 мг), затем перемешивают в атмосфере водорода при комнатной температуре в течение 1 часа. Катализатор из реакционной смеси фильтруют через Целит и растворитель концентрируют при пониженном давлении с получением 319,7 мг указанного в заголовке соединения (выход 94,3%). МС м/z 306 [М+Н]+.
Стадия 3
(2S,5R)-7-оксо-N'-(пиридин-3-илкарбонил)-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбогидразид натрия
К раствору общего количества соединения со стадии 2 в пиридине (10,0 мл) добавляют комплекс триоксид серы - пиридин (796 мг), и смесь перемешивают при комнатной температуре в течение ночи. К реакционной смеси добавляют метиленхлорид, затем фильтруют и концентрируют при пониженном давлении. К полученному остатку добавляют толуол, затем проводят азеотропную перегонку. Получают (2S,5R)-7-оксо-N'-(пиридин-3-илкарбонил)-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбогидразид пиридиния и нейтрализуют насыщенным водным раствором бикарбоната натрия, затем очищают хроматографией на колонке с октадецилсиликагелем с получением 193,1 мг указанного в заголовке соединения (выход 45,6%).
1H ЯМР (400 МГц, D2O): δ 1,67-1,75 (м, 1H), 1,80-1,90 (м, 1H), 1,95-1,99 (м, 1H), 2,06-2,16 (м, 1H), 3,14-3,18 (д, J=12,4 Гц, 1H), 3,25-3,28 (шир.д, J=12,0 Гц, 1H), 4,10 (м, 2H), 7,46-7,49 (дд, J=5,2, 8,0 Гц, 1H), 8,12-8,14 (д, J=8,0 Гц, 1H), 8,58-8,60 (д, J=5,2 Гц, 1H), 8,81 (с, 1H); МС m/z 386 [M-Na+2H]+.
Пример 46
(2S,5R)-7-оксо-N'-(пиридин-4-илкарбонил)-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбогидразид натрия
Стадия 1
(2S,5R)-6-Бензилокси-7-оксо-N'-(пиридин-4-илкарбонил)-1,6-диазабицикло[3.2.1]октан-2-карбогидразид
По методике примера 27, из карбоновой кислоты (6b, 390 мг, 1,41 ммоль) из примера 9 или 16 и гидразида изоникотиновой кислоты (580,1 мг, коммерчески доступный) получают указанное в заголовке соединение (количественный выход).
1H ЯМР (500 МГц, CDCl3): δ 1,60 (м, 1H), 1,97-2,04 (м, 2H), 2,34-2,36 (м, 1H), 3,15 (м, 2H), 3,35 (шир.с, 1H), 4,08-4,12 (м, 1H), 4,92-4,94 (д, J=11,0 Гц, 1H), 5,06-5,08 (д, J=11,0 Гц, 1H), 7,26-7,46 (м, 5H), 7,67-7,68 (м, 2H), 8,78-8,79 (м, 2H); МС m/z 396 [M+H]+.
Стадия 2
(2S,5R)-6-Гидрокси-7-оксо-N'-(пиридин-4-илкарбонил)-1,6-диазабицикло[3.2.1]октан-2-карбогидразид
По методике примера 17, из общего количества соединения со стадии 1 получают указанное в заголовке соединение (выход количественный).
1H ЯМР (400 МГц, CD3OD): δ 1,69-1,77 (м, 1H), 1,86-1,97 (м, 1H), 2,02-2,11 (м, 1H), 2,19-2,31 (м, 1H), 3,16-3,36 (м, 2H), 3,68 (шир.с, 1H), 3,97-3,99 (д, J=6,8 Гц, 1H), 7,79-7,80 (д, J=6,0 Гц, 2H), 8,65-8,65 (д, J=6,4 Гц, 2H); МС m/z 306 [M+H]+.
Стадия 3
(2S,5R)-7-оксо-N'-(пиридин-4-илкарбонил)-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбогидразид натрия
По методике примера 26 из общего количества соединения из указанной выше стадии 2 получают (2S,5R)-7-оксо-N'-(пиридин-4-илкарбонил)-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбогидразид и нейтрализуют насыщенным водным раствором бикарбоната натрия, затем очищают хроматографией на колонке с октадецилсиликагелем с получением 255,9 мг указанного в заголовке соединения (выход 44,5%).
1H ЯМР (400 МГц, D2O): δ 1,65-1,73 (м, 1H), 1,78-1,86 (м, 1H), 1,93-197 (м, 1H), 2,04-2,14 (м, 1H), 3,12-3,15 (д, J=12,0 Гц, 1H), 3,23-3,26 (д, J=6,8 Гц, 1H), 4,08-4,10 (м, 2H), 7,72-7,73 (д, J=4,4 Гц, 2H), 8,60-8,61 (д, J=5,2 Гц, 2H); МС m/z 386 [M-Na+2H]+.
Пример 47
N,N-диметил-2-{[(2S,5R)-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}гидразинкарбоксамид натрия
Стадия 1
2-{[(2S,5R)-6-Бензилокси-7-оксо-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}-N,N-диметилгидразинкарбоксамид
По методике примера 45 из карбоновой кислоты (6b, 400 мг, 1,41 ммоль) из примера 9 или 16 и N,N-диметилгидразинкарбоксамида (491 мг, получен по методике ссылочного примера 3 и ссылочного примера 6) получают 385,2 мг указанного в заголовке соединения (выход 73,6%).
1H ЯМР (400 МГц, CDCl3): δ 1,61 (м, 1H), 1,90-2,02 (м, 2H), 2,32-2,37 (м, 1H), 2,95 (с, 6H), 3,05-3,08 (д, J=12,8 Гц, 1H), 3,25 (шир.с, 1H), 3,29-3,32 (д, J=12,0 Гц, 1H), 3,99-4,01 (д, J=6,8 Гц, 1H), 4,87-4,90 (д, J=11,2 Гц, 1H), 5,02-5,05 (д, J=11,2 Гц, 1H), 6,39 (шир.с, 1H), 7,34-7,41 (м, 5H), 8,24 (шир.с, 1H); МС m/z 361 [M+H]+.
Стадия 2
2-{[(2S,5R)-6-гидрокси-7-оксо-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}-N,N-диметилгидразинкарбоксамид
По методике примера 17, из общего количества соединения со стадии 1 получают указанное в заголовке соединение (выход количественный). МС м/z 272 [М+Н]+.
Стадия 3
N,N-диметил-2-{[(2S,5R)-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}гидразинкарбоксамид натрия
По методике примера 22, из общего количества соединения со стадии 2 получают 2-{[(2S,5R)-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}-N,N-диметилгидразинкарбоксамид пиридиния и нейтрализуют насыщенным водным раствором бикарбоната натрия и затем очищают хроматографией на колонке с октадецилсиликагелем с получением 305,2 мг указанного в заголовке соединения (выход 77,1%).
1H ЯМР (400 МГц, D2O): δ 1,64-1,72 (м, 1H), 1,76-1,87 (м, 1H), 1,93-1,98 (м, 1H), 2,07-2,12 (м, 1H), 2,81 (с, 6H), 3,11-3,14 (д, J=12,4 Гц, 1H), 3,20-3,23 (д, J=12,4 Гц, 1H), 4,01-4,03 (д, J=11,2 Гц, 1H), 4,08-4,09 (м, 1H); МС m/z 352 [M-Na+2H]+.
Пример 48
N,N-диэтил 2-{[(2S,5R)-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}гидразинкарбоксамид натрия
Стадия 1
2-{[(2S,5R)-6-Бензилокси-7-оксо-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}-N,N-диэтилгидразинкарбоксамид
По методике примера 27, из карбоновой кислоты (6b, 390 мг, 1,41 ммоль) из примера 9 или 16 и N,N-диэтилгидразинкарбоксамида (656 мг, получен по методике ссылочного примера 3 и ссылочного примера 6) получают 108,6 мг указанного в заголовке соединения (выход 19,7%).
1H ЯМР (400 МГц, CDCl3): δ 1,16-1,19 (т, J=7,2 Гц, 6H), 1,55-1,62 (м, 1H), 1,89-2,05 (м, 2H), 2,24-2,36 (м, 1H), 3,06-3,09 (шир.д, J=12,4 Гц, 1H), 3,18-3,38 (м, 6H), 4,00-4,02 (шир.д, J=7,6 Гц, 1H), 4,87-4,90 (д, J=11,2 Гц, 1H), 5,04-5,06 (д, J=11,2 Гц, 1H), 6,36 (шир.с, 1H), 7,24-7,40 (м, 5H), 8,32 (шир.с, 1H); МС m/z 390 [M+H]+.
Стадия 2
N,N-Диэтил 2-{[(2S,5R)-6-гидрокси-7-оксо-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}гидразинкарбоксамид
По методике примера 17, из общего количества соединения со стадии 1 получают указанное в заголовке соединение (выход количественный). МС м/z 300 [М+Н]+.
Стадия 3
N,N-диэтил 2-{[(2S,5R)-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}гидразинкарбоксамид натрия
По методике примера 22, из общего количества соединения со стадии 2 получают N,N-диэтил 2-{[(2S,5R)-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}гидразинкарбоксамид пиридиния и нейтрализуют насыщенным водным раствором бикарбоната натрия и затем очищают хроматографией на колонке с октадецилсиликагелем с получением 63,0 мг указанного в заголовке соединения (выход 56,4%).
1H ЯМР (400 МГц, D2O): δ 0,97-1,01 (т, J=7,2 Гц, 6H), 1,62-1,68 (м, 1H), 1,70-1,85 (м, 1H), 1,92-1,96 (м, 1H), 2,05-2,11 (м, 1H), 3,09-3,22 (м, 6H), 3,99-4,01 (д, J=7,8 Гц, 1H), 4,06 (шир.с, 1H); МС m/z 380 [M-Na+2H]+.
Пример 49
2-{[(2SR,5RS)-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}-N-фенилгидразинкарбоксамид натрия
Стадия 1
2-{[(2SR,5RS)-6-Бензилокси-7-оксо-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}-N-фенилгидразинкарбоксамид
По методике примера 30 из (2SR,5RS)-6-(бензилокси)-7-оксо-1,6-диазабицикло[3.2.1]октан-2-карбоновой кислоты (100 мг, 0,36 ммоль) и N-фенилгидразинкарбоксамида (60 мг) получают 134 мг указанного в заголовке соединения (выход 94%). МС м/z 410 [М+Н]+.
Стадия 2
{[2SR,5RS)-6-гидрокси-7-оксо-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}-N-фенилгидразинкарбоксамид
По методике примера 17, из общего количества соединения со стадии 1 получают 35 мг указанного в заголовке соединения (выход 33%).
1H ЯМР (400 МГц, CD3OD): δ 1,76-1,82 (м, H), 1,91-1,98 (м, H), 2,04-2,08 (м, 1H), 2,25-2,31 (м, 1H), 3,17 (д, J=3,0, 1H), 3,25 (д, J=3,0, 1H), 3,70 (шир.с, 1H), 4,00 (д, J=1,8, 1H), 7,00 (дд, J=2,1, 2,2, 1H), 7,23-7,28 (м, 1H), 7,39-7,42 (м, 1H); m/z 320 [M+H]+.
Стадия 3
2-{[(2SR,5RS)-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}-N-фенилгидразинкарбоксамид натрия
По методике примера 30, 2-{[(2SR,5RS)-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}-N-фенилгидразинкарбоксамид пиридиния получают из соединения (30 мг, 0,10 ммоль) из указанной выше стадии 2, нейтрализуют насыщенным водным раствором бикарбоната натрия и затем очищают хроматографией на колонке с октадецилсиликагелем с получением 19 мг указанного в заголовке соединения (выход 43%).
1H ЯМР (400 МГц, D2O): δ 1,65-1,73 (м, 1H), 1,78-1,88 (м, 1H), 1,93-1,97 (м, 1H), 2,06-2,12 (м, 1H), 3,08 (д, J=3,0, 1H), 3,22 (д, J=3,2, 1H), 4,06 (м, 2H), 7,18-7,27 (м, 5H); МС m/z 400 [M-Na+2H]+.
Пример 50
(2S,5R)-N'-(морфолин-4-илкарбонил)-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбогидразид натрия
Стадия 1
(2S,5R)-6-Бензилокси-N'-(морфолин-4-илкарбонил)-7-оксо-1,6-диазабицикло[3.2.1]октан-2-карбогидразид
По методике примера 27, из карбоновой кислоты (6b, 390 мг, 1,41 ммоль) из примера 9 или 16 и морфолин-4-карбогидразида (584,3 мг, получен по методике ссылочного примера 3 и ссылочного примера 6) получают 323 мг указанного в заголовке соединения (выход 56,8%).
1H ЯМР (400 МГц, CDCl3): δ 1,58-1,65 (м, 1H), 1,91-2,02 (м, 2H), 2,32-2,37 (м, 1H), 3,06-3,09 (д, J=11,6 Гц, 1H), 3,24-3,27 (м, 1H), 3,36-3,46 (м, 4H), 3,63-3,69 (м, 4H), 4,00-4,02 (шир.д, J=7,6 Гц, 1H), 4,88-4,90 (д, J=11,2 Гц, 1H), 5,02-5,05 (д, J=11,2 Гц, 1H), 6,52 (шир.с, 1H), 7,34-7,42 (м, 5H), 8,30 (шир.с, 1H); МС m/z 404 [M+H]+.
Стадия 2
(2S,5R)-6-Гидрокси-N'-(морфолин-4-илкарбонил)-7-оксо-1,6-диазабицикло[3.2.1]октан-2-карбогидразид
По методике примера 17, из общего количества соединения со стадии 1 получают указанное в заголовке соединение (выход количественный). МС м/z 314 [М+Н]+.
Стадия 3
(2S,5R)-N'-(морфолин-4-илкарбонил)-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбогидразид натрия
По методике примера 22, из общего количества соединения со стадии 2 получают (2S,5R)-N'-(морфолин-4-илкарбонил)-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбогидрозид пиридиния и нейтрализуют насыщенным водным раствором бикарбоната натрия и затем очищают хроматографией на колонке с октадецилсиликагелем с получением 152 мг указанного в заголовке соединения (выход 45,7%).
1H ЯМР (400 МГц, D2O): δ 1,65-1,72 (м, 1H), 1,78-1,88 (м, 1H), 1,94-1,98 (м, 1H), 2,07-2,13 (м, 1H), 3,10-3,13 (д, J=12,0 Гц, 1H), 3,21-3,24 (д, J=12,0 Гц, 1H), 3,32-3,35 (м, 4H), 3,61-3,63 (м, 4H), 4,02-4,04 (д, J=7,6 Гц, 1H), 4,08 (шир.с, 1H); МС m/z 394 [M-Na+2H]+.
Пример 51
Метил 2-{[(2S,5R)-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}гидразинкарбоксилат натрия
Стадия 1
Метил {[(2S,5R)-6-бензилокси-7-оксо-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}гидразинкарбоксилат
По методике примера 17, из карбоновой кислоты (6b, 1,30 г, 4,71 ммоль) из примера 9 или 16 и метилкарбазата (538 мг) получают 1,64 г указанного в заголовке соединения (количественный выход).
[α]D20 +53,2° (с 0,60, CHCl3); 1H ЯМР (400 МГц, CDCl3): δ 1,56-1,68 (м, 1H), 1,90-2,08 (м, 2H), 2,30-2,40 (м, 1H), 3,02-3,20 (м, 2H), 3,30 (шир.с, 1H), 3,76 (шир.с, 3H), 4,01 (д, J=7,2 Гц, 1H), 4,91 (д, J=1 1,4 Гц, 1H), 5,06 (д, J=11,4 Гц, 1H), 6,59 (шир.с, 1H), 7,33-7,46 (м, 5H), 8,23 (шир.д, J=2,4 Гц, 1H); МС m/z 349 [M+H]+.
Стадия 2
Метил 2-{[(2S,5R)-6-гидрокси-7-оксо-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}гидразинкарбоксилат
По методике примера 17, из соединения (2,11 г, 6,06 ммоль) из приведенной выше стадии 1 получают 1,22 г указанного в заголовке соединения (выход 78%).
[α]D20 -34,8° (c 0,57, MeOH); 1H ЯМР (400 МГц, CD3OD): δ 1,70-1,79 (м, 1H), 1,87-1,98 (м, 1H), 2,02-2,12 (м, 1H), 2,26 (шир.дд, J=14,6, 6,6 Гц, 1H), 3,12-3,25 (м, 2H), 3,67-3,75 (м, 1H), 3,72 (с, 3H), 3,92 (шир.д, J=7,6 Гц, 1H); МС m/z 259 [M+H]+.
Стадия 3
Метил 2-{[(2S,5R)-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}гидразинкарбоксилат натрия
К раствору соединения (1,21 г, 4,70 ммоль) со стадии 2 выше, в пиридине (30 мл) добавляют комплекс триоксид серы - пиридин (3,39 г), и смесь перемешивают при комнатной температуре в течение ночи. К реакционной смеси добавляют метиленхлорид, фильтруют и затем концентрируют при пониженном давлении. К полученному остатку добавляют толуол и подвергают азеотропной перегонке и концентрации досуха. Добавляют насыщенный водный раствор дигидрофосфата натрия (100 мл), водный слой промывают этилацетатом, добавляют гидросульфат тетрабутиламмония (1,93 г) и этилацетат (10 мл) и перемешивают в течение 10 минут. Водный слой экстрагируют этилацетатом. Затем полученный органический слой сушат над безводным сульфатом натрия, фильтруют и концентрируют при пониженном давлении. Полученный остаток очищают с помощью хроматографии на колонке с силикагелем (метиленхлорид/ацетон/триэтиламин=49/49/2) с получением 2,09 г метил 2-{[(2S,5R)-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}гидразидкарбоксилата тетрабутиламмония.
1H ЯМР (400 МГц, CDCl3): δ 1,01 (т, J=7,4 Гц, 12H), 1,45 (секст., J=7,4 Гц, 8H), 1,60-1,75 (м, 9H), 1,86-1,98 (м, 1H), 2,15-2,24 (м, 1H), 2,37 (шир.дд, J=15,0, 7,0 Гц, 1H), 3,05-3,20 (м, 1H), 3,25-3,34 (м, 8H), 3,38 (шир.д, J=11,6 Гц, 1H), 3,78 (с, 3H), 3,99 (д, J=7,6 Гц, 1H), 4,35 (шир.с, 1H), 6,55 (шир.с, 1H), 8,28 (шир.с, 1H); МС m/z 339 [M-Bu4N+2H]+.
После обработки общего количества соли тетрабутиламмония с помощью DOWEX (Na тип) полученный неочищенный продукт очищают на SP207 (ацетонитрил/вода=0/100-5/95) и лиофилизируют 880 мг указанного в заголовке соединения (выход 52%).
[a]D21 -37,6° (c 0,36, H2O); 1H ЯМР (400 МГц, D2O): δ 1,62-1,73 (м, 1H), 1,76-1,88 (м, 1H), 1,92-2,00 (м, 1H), 2,08 (шир.дд, J=15,6, 6,8 Гц, 1H), 3,04 (шир.д, J=12,0 Гц, 1H), 3,21 (шир.д, J=12,0 Гц, 1H), 3,61 (с, 3H), 4,02 (шир.д, J=7,6 Гц, 1H), 4,04-4,10 (м, 1H); МС m/z 339 [M-Na+2H]+; Содержание Na 7,9%.
Пример 52
Этил 2-{[(2S,5R)-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}гидразинкарбоксилат натрия
Стадия 1
Этил 2-{[(2S,5R)-6-бензилокси-7-оксо-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}гидразинкарбоксилат
По методике примера 17, из карбоновой кислоты (6b, 352 мг, 1.27 ммоль) из примера 9 или 16 и этилкарбазата (184 мг) получают 388 мг указанного в заголовке соединения (выход 84%).
[α]D20 +53,4° (c 0,64, CHCl3); 1H ЯМР (400 МГц, CDCl3): δ 1,28 (т, J=7,2 Гц, 3H), 1,55-1,66 (м, 1H), 1,90-2,05 (м, 2H), 2,31-2,40 (м, 1H), 3,03-3,17 (м, 2H), 3,27-3,32 (м, 1H), 4,01 (д, J=7,2 Гц, 1H), 4,20 (кв., J=7,2 Гц, 2H), 4,92 (д, J=11,2 Гц, 1H), 5,06 (д, J=11,2 Гц, 1H), 6,47 (шир.с, 1H), 7,35-7,46 (м, 5H), 8,19 (шир.с, 1H); МС m/z 363 [M+H]+.
Стадия 2
Этил 2-{[(2S,5R)-6-гидрокси-7-оксо-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}гидразинкарбоксилат
По методике примера 17, из соединения (369 мг, 1,02 ммоль) из приведенной выше стадии 1 получают указанное в заголовке соединение (количественный выход).
[α]D20 -29,9° (с 0,62, MeOH); 1H ЯМР (400 МГц, CD3OD): δ 1,27 (шир.т, J=7,2 Гц, 3H), 1,68-1,82 (м, 1H), 1,87-1,99 (м, 1H), 2,01-2,15 (м, 1H), 2,27 (шир.дд, J=15,0, 6,6 Гц, 1H), 3,11-3,25 (м, 2H), 3,70 (шир.с, 1H), 3,92 (шир.д, J=7,2 Гц, 1H), 4,16 (кв., J=7,2 Гц, 2H); МС m/z 273 [M+H]+.
Стадия 3
Этил 2-{[(2S,5R)-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}гидразинкарбоксилат натрия
По методике примера 22, из общего количества соединения со стадии 2 получают этил 2-{[(2S,5R)-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}гидразидкарбоксилат пиридиния и нейтрализуют насыщенным водным раствором бикарбоната натрия, затем очищают хроматографией на колонке Diaion HP21 (Mitsubishi Chemical) с получением 108 мг указанного в заголовке соединения (2 стадии, выход 29%).
[α]D21 -34,5° (с 0,52, H2O); 1H ЯМР (400 МГц, D2O): δ 1,11 (шир.т, J=7,2 Гц, 3H), 1,61-1,72 (м, 1H), 1,75-1,88 (м, 1H), 1,90-2,00 (м, 1H), 2,08 (шир.дд, J=15,2, 7,2 Гц, 1H), 3,03 (шир.д, J=12,0 Гц, 1H), 3,21 (шир.д, J=12,0 Гц, 1H), 4,05 (шир.д, J=7,6 Гц, 1H), 4,04 (кв., J=7,2 Гц, 2H), 4,07 (шир.с, 1H); МС m/z 353 [M-Na+2H]+.
Пример 53
трет-Бутил 2-{[(2SR,5RS)-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}гидразинкарбоксилат натрия
Стадия 1
трет-Бутил 2-{[(2SR,5RS)-6-бензилокси-7-оксо-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}гидразинкарбоксилат
По методике примера 18 из (2SR,5RS)-6-(бензилокси)-7-оксо-1,6-диазабицикло[3.2.1]октан-2-карбоновой кислоты (280 мг, 1,01 ммоль) и трет-бутил гидразинкарбоксилата (147 мг) получают 299 мг указанного в заголовке соединения (выход 68%).
1H ЯМР (400 МГц, CDCl3): δ 1,33 (с, 9H), 1,49-1,55 (м, 1H), 1,74-1,91 (м, 2H), 2,18-2,23 (м, 1H), 2,96 (м, 2H), 3,18 (шир.с, 1H), 3,78 (д, J=1,9, 1H), 4,78 (д, J=2,8, 1H), 4,93 (д, J=2,8, 1H), 6,69 (с, 1H), 7,19-7,32 (м, 5H), 8,31 (с, 1H), МС m/z 391 [M+H]+.
Стадия 2
трет-Бутил 2-{[(2SR,5RS)-6-гидрокси-7-оксо-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}гидразинкарбоксилат
По методике примера 17, из (310 мг, 0,79 ммоль) из приведенной выше стадии 1 получают 200 мг указанного в заголовке соединения (выход 84%). МС м/z 301 [М+Н]+.
Стадия 3
трет-Бутил 2-{[(2SR,5RS)-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}гидразинкарбоксилат натрия
По методике примера 18 трет-бутил 2-{[(2SR, 5RS)-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}гидразинкарбоксилат пиридиния, полученный из соединения (118 мг, 0,39 ммоль) с указанной выше стадии 2, нейтрализуют насыщенным водным раствором бикарбоната натрия и затем очищают хроматографией на колонке с октадецилсиликагелем с получением 73 мг указанного в заголовке соединения (выход 46%).
1H ЯМР (400 МГц, D2O): δ 1,47 (с, 9H), 1,84-1,88 (м, 1H), 1,93-2,03 (м, 1H), 2,10-2,14 (м, 1H), 2,22-2,28 (м, 1H), 3,20 (д, J=3,0, 1H), 3,38 (д, J=3,1, 1H), 4,16 (д, J=1,7, 1H), 4,24 (шир.с, 1H); МС m/z 379 [M-Na]-.
Пример 54
(2S,5R)-N'-(метилсульфонил)-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбогидразид натрия
Стадия 1
(2S,5R)-6-Бензилокси-N'-(метилсульфонил)-7-оксо-1,6-диазабицикло[3.2.1]октан-2-карбогидразид
По методике примера 17, из карбоновой кислоты (6b, 345 мг, 1,25 ммоль) из примера 9 или 16 и гидразида метансульфонила (193 мг) получают 359 мг указанного в заголовке соединения (выход 78%).
[α]D20+22,8° (с 0,55, CHCl3); 1H ЯМР (400 МГц, CDCl3): δ 1,54-1,66 (м, 1H), 1,96-2,09 (м, 2H), 2,26-2,36 (м, 1H), 2,74 (д, J=12,0 Гц, 1H), 3,02 (с, 3H), 3,11 (шир.д, J=12,0 Гц, 1H), 3,31-3,34 (м, 1H), 4,08 (д, J=7,6 Гц, 1H), 4,91 (д, J=11,4 Гц, 1H), 5,06 (д, J=11,4 Гц, 1H), 6,78 (шир.с, 1H), 7,35-7,48 (м, 5H), 8,71 (шир.с, 1H); МС m/z 369 [M+H]+.
Стадия 2
(2S,5R)-6-Гидрокси-N'-(метилсульфонил)-7-оксо-1,6-диазабицикло[3.2.1]октан-2-карбогидразид
По методике примера 17, из соединения (347 мг, 0,943 ммоль) из приведенной выше стадии 1 получают 259 мг указанного в заголовке соединения (выход количественный).
1H ЯМР (400 МГц, CD3OD): δ 1,71-1,84 (м, 1H), 1,88-2,01 (м, 1H), 2,02-2,15 (м, 1H), 2,20-2,30 (м, 1H), 2,98-3,09 (м, 1H), 3,01 (с, 3H), 3,15 (шир.д, J=10,4 Гц, 1H), 3,67-3,75 (м, 1H), 3,93 (шир.д, J=7,6 Гц, 1H); МС m/z 279 [M+H]+.
Стадия 3
(2S,5R)-N'-(метилсульфонил)-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбогидразид натрия
По методике примера 22, из соединения (253 мг, 0,909 ммоль) из приведенной выше стадии 2 получают (2S,5R)-N'-(метилсульфонил)-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбогидразид пиридиния и нейтрализуют насыщенным водным раствором бикарбоната натрия и затем очищают хроматографией на колонке с октадецилсиликагелем с получением 65,9 мг указанного в заголовке соединения (выход 19%).
[α]D20 -44,1° (c 0,10, H2O); 1H ЯМР (400 МГц, D2O): δ 1,63-1,72 (м, 1H), 1,75-1,88 (м, 1H), 1,90-2,00 (м, 1H), 2,07 (шир.дд, J=15,4, 7,0 Гц, 1H), 2,94 (д, J=12,0 Гц, 1H), 2,99 (с, 3H), 3,20 (шир.д, J=12,0 Гц, 1H), 4,01 (д, J=7,2 Гц, 1H), 4,03-4,09 (м, 1H); МС m/z 359 [M- Na+2H]+.
Пример 55
(2SR,5RS)-N-(морфолин-4-ил)-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбоксамид натрия
Стадия 1
(2SR,5RS)-6-Бензилокси-N-(морфолин-4-ил)-7-оксо-1,6-диазабицикло[3.2.1]октан-2-карбоксамид
К раствору (2SR,5RS)-6-(бензилокси)-7-оксо-1,6-диазабицикло[3.2.1]октан-2-карбоновой кислоты (142 мг, 0,513 ммоль) в метиленхлориде (3,5 мл) добавляют триэтиламин (226 мкл), гидрохлорид N-этил-N'-(3-диметиламинопропил)карбодиимида (125 мг), моногидрат 1-гидроксибензотриазола (100 мг) и морфолин-4-амин (62,7 мкл), затем перемешивают при комнатной температуре в течение ночи. Реакционный раствор концентрируют при пониженном давлении и очищают с помощью хроматографии на колонке с силикагелем (этилацетат) с получением 149 мг указанного в заголовке соединения (выход 80%).
1H ЯМР (400 МГц, CDCl3): δ 1,57-1,66 (м, 1H), 1,86-2,06 (м, 2H), 2,37 (шир.дд, J=14,2, 6,8 Гц, 1H), 2,72 (д, J=11,8 Гц, 1H), 2,74-2,88 (м, 4H), 3,01 (шир.д, J=11,8 Гц, 1H), 3,28-3,33 (м, 1H), 3,81 (т, J=4,6 Гц, 4H), 3,90 (шир.д, J=7,6 Гц, 1H), 4,91 (д, J=11,4 Гц, 1H), 5,06 (д, J=11,4 Гц, 1H), 7,32-7,48 (м, 6H); МС m/z 361 [M+H]+.
Стадия 2
(2SR,5RS)-6-гидрокси-N-(морфолин-4-ил)-7-оксо-1,6-диазабицикло[3.2.1]октан-2-карбоксамид
По методике примера 17, из соединения (170 мг, 0,471 ммоль) из приведенной выше стадии 1 получают указанное в заголовке соединение (выход количественный).
1H ЯМР (400 МГц, CD3OD): δ 1,74-1,84 (м, 1H), 1,85-1,97 (м, 1H), 2,02-2,11 (м, 1H), 2,21 (шир.дд, J=14,8, 7,2 Гц, 1H), 2,81 (шир.т, J=4,4 Гц, 4H), 3,01 (д, J=11,6 Гц, 1H), 3,12 (шир.д, J=11,6 Гц, 1H), 3,69 (шир.с, 1H), 3,76 (шир.т, J=4,4 Гц, 4H), 3,81 (шир.д, J=7,6 Гц, 1H); МС m/z 271 [M+H]+.
Стадия 3
(2SR,5RS)-N-(морфолин-4-ил)-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбоксамид натрия
По методике примера 22, из общего количества соединения со стадии 2 получают (2SR,5RS)-N-(морфолин-4-ил)-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбоксамид пиридиния и нейтрализуют насыщенным водным раствором бикарбоната натрия, затем очищают хроматографией на колонке Sepabeads SP207 (Mitsubishi Chemical) с получением 104 мг указанного в заголовке соединения (2 стадии, выход 63%).
1H ЯМР (400 МГц, D2O): δ 1,65-1,85 (м, 2H), 1,90-1,99 (м, 1H), 2,00-2,08 (м, 1H), 2,68-2,80 (м, 4H), 3,97 (д, J=12,0 Гц, 1H), 3,18 (шир.д, J=12,0 Гц, 1H), 3,70 (шир.т, J=4,6 Гц, 4H), 3,89 (шир.д, J=7,0 Гц, 1H), 4,07 (шир.дд, J=5,6, 2,8 Гц, 1H); МС m/z 351 [M-Na+2H]+.
Пример 56
(2S,5R)-N-Метокси-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбоксамид натрия
Стадия 1
(2S,5R)-6-Бензилокси-N-метокси-7-оксо-1,6-диазабицикло[3.2.1]октан-2-карбоксамид
К раствору карбоновой кислоты (6b, 965 мг, 3,49 ммоль) из примера 9 или 16 в тетрагидрофуране (20 мл) добавляют триэтиламин (1,95 мл), гидрохлорид N-этил-N'-(3-диметиламинопропил)карбодиимида (802 мг), моногидрат 1-гидроксибензотриазола (658 мг) и гидрохлорид O-метилгидроксиамина (363 мг), и смесь перемешивают при комнатной температуре в течение ночи. Реакционный раствор концентрируют при пониженном давлении и полученный остаток очищают с помощью хроматографии на колонке с силикагелем (гексан/этилацетат=9/1-0/10) с получением 773 мг указанного в заголовке соединения (72% выход).
[α]D20 -19,8° (с 0,60, CHCl3); 1H ЯМР (400 МГц, CDCl3): δ 1,60-1,71 (м, 1H), 1,88-2,07 (м, 2H), 2,32 (шир.дд, J=14,2, 7,4 Гц, 1H), 2,80 (д, J=11,6 Гц, 1H), 3,00 (шир.д, J=11,6 Гц, 1H), 3,30-3,35 (м, 1H), 3,78 (с, 3H), 3,94 (д, J=7,6 Гц, 1H), 4,90 (д, J=11,6 Гц, 1H), 5,0 (д, J=11,6 Гц, 1H), 7,34-7,46 (м, 5H), 9,22 (шир.с, 1H); МС m/z 30 [M+H]+.
Стадия 2
(2S,5R)-6-Гидрокси-N-метокси-7-оксо-1,6-диазабицикло[3.2.1]октан-2-карбоксамид
По методике примера 17, из соединения (770 мг, 2,52 ммоль) из приведенной выше стадии 1 получают 486 мг указанного в заголовке соединения (выход 90%).
[α]D20 -76,8° (c 0,34, MeOH); 1H ЯМР (400 МГц, CD3OD): δ 1,74-1,84 (м, 1H), 1,86-1,98 (м, 1H), 2,03-2,13 (м, 1H), 2,20 (шир.дд, J=15,0, 7,0 Гц, 1H), 3,05 (д, J=11,8 Гц, 1H), 3,12 (шир.д, J=11,8 Гц, 1H), 3,66-3,74 (м, 1H), 3,71 (с, 3H), 3,82 (шир.д, J=7,6 Гц, 1H); МС m/z 216 [M+H]+.
Стадия 3
(2S,5R)-N-Метокси-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбоксамид натрия
По методике примера 17, из соединения (483 мг, 2,24 ммоль) из приведенной выше стадии 2 получают 963 мг (2S,5R)-N-метокси-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбоксамид тетрабутиламмония.
1H ЯМР (400 МГц, CDCl3): δ 0,93 (т, J=7,4 Гц, 12H), 1,37 (секст., J=7,4 Гц, 8H), 1,53-1,72 (м, 9H), 1,77-1,90 (м, 1H), 2,05-2,15 (м, 1H), 2,27 (шир.дд, J=14,8, 6,4 Гц, 1H), 2,84 (д, J=11,6 Гц, 1H), 3,14-3,31 (м, 9H), 3,73 (с, 3H), 3,87 (шир.д, J=7,6 Гц, 1H), 4,25 (шир.с, 1H), 9,32 (шир.с, 1H); МС m/z 296 [M-Na+2H]+.
Общее количество соли тетрабутиламмония подвергают реакции ионного обмена на DOWEX (тип Na) и затем очищают хроматографией на колонке с октадецилсиликагелем с получением 401 мг указанного в заголовке соединения (выход 56%).
[α]D20 -49,0° (с 0,85, H2O); 1H ЯМР (400 МГц, D2O): δ 1,66-1,87 (м, 2H), 1,91-2,07 (м, 2H), 3,02(д, J=12,0 Гц, 1H), 3,18 (шир.д, J=12,0 Гц, 1H), 3,62 (с, 3H), 3,92 (дд, J=8,0, 2,4 Гц, 1H), 4,07 (дд, J=6,0, 2,8 Гц, 1H); МС m/z 296 [M+H]+; Содержание Na 10,9%.
Пример 57
(2SR,5RS)-N-Этокси-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбоксамид натрия
Стадия 1
(2SR,5RS)-6-Бензилокси-N-этокси-7-оксо-1,6-диазабицикло[3.2.1]октан-2-карбоксамид
По методике примера 27 из (2SR,5RS)-6-(бензилокси)-7-оксо-1,6-диазабицикло[3.2.1]октан-2-карбоновой кислоты (150 мг, 0,58 ммоль) и гидрохлорида O-этилгидроксиламина (85 мг) с получением 95 мг указанного в заголовке соединения (выход 39%). МС м/z 320 [М+Н]+.
Стадия 2
(2SR,5RS)-N-Этокси-6-гидрокси-7-оксо-1,6-диазабицикло[3.2.1]октан-2-карбоксамид
По методике примера 17, из общего количества соединения со стадии 1 получают 88 мг указанного в заголовке соединения (выход 96%).
Стадия 3
(2SR,5RS)-N-Этокси-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбоксамид натрия
По методике примера 18, из общего количества соединения со стадии 2 получают (2SR,5RS)-N-этокси-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбоксамид пиридиния и нейтрализуют водным раствором бикарбоната натрия, затем очищают хроматографией на колонке с октадецилсиликагелем с получением 30 мг указанного в заголовке соединения (выход 24%).
1H ЯМР (400 МГц, D2O): δ 1,09 (т, J=1,7, 3H), 1,66-1,86 (м, 2H), 1,91-2,02 (м, 2H), 3,00 (д, J=3,0, 1H), 3,17 (д, J=2,9, 1H), 3,84 (кв., J=1,7, 2H), 3,92 (д, J=1,7, 1H), 4,06 (м, 1H); МС m/z 308 [M-Na]-.
Пример 58
(2S,5R)-N-(Циклобутилметокси)-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбоксамид натрия
Стадия 1
(2S,5R)-6-Бензилокси-N-(циклобутилметокси)-7-оксо-1,6-диазабицикло[3.2.1]октан-2-карбоксамид
По методике примера 45, из карбоновой кислоты (6b, 379 мг, 1,37 ммоль) из примера 9 или 16 и O-(циклобутилметил)гидроксиламина (274 мг, полученного по методике ссылочного примера 7 и ссылочного примера 15) получают 359,4 мг указанного в заголовке соединения (выход 73%).
1H ЯМР (400 МГц, CDCl3): δ 1,55-2,15 (м, 9H), 2,28-2,39 (м, 1H), 2,59-2,72 (м, 1H), 2,77 (д, J=11,6 Гц, 1H), 3,00 (шир.д, J=11,6 Гц, 1H), 3,26-3,34 (м, 1H), 3,83-3,89 (м, 1H), 3,90-3,97 (м, 2H), 4,90 (д, J=11,4 Гц, 1H), 5,05 (д, J=11,4 Гц, 1H), 7,34-7,46 (м, 5H), 8,98 (с, 1H); МС m/z 360 [M+H]+.
Стадия 2
(2S,5R)-N-(Циклобутилметокси)-6-гидрокси-7-оксо-1,6-диазабицикло[3.2.1]октан-2-карбоксамид
По методике примера 17, из общего количества соединения со стадии 1 получают указанное в заголовке соединение (выход количественный). МС м/z 270 [М+Н]+.
Стадия 3
(2S,5R)-N-(Циклобутилметокси)-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбоксамид натрия
По методике примера 18, из общего количества соединения со стадии 2 получают (2S,5R)-N-(циклобутилметокси)-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбоксамид пиридиния и нейтрализуют насыщенным водным раствором бикарбоната натрия, затем очищают хроматографией на колонке с октадецилсиликагелем с получением 157,8 мг указанного в заголовке соединения (2 стадии, выход 42%).
1H ЯМР (400 МГц, D2O): δ 1,55-1,86 (м, 6H), 1,88-2,07 (м, 4H), 2,46-2,57 (м, 1H), 3,00 (д, J=12,0 Гц, 1H), 3,18 (шир.д, J=12,0 Гц, 1H), 3,79 (д, J=7,2 Гц, 2H), 3,87-3,94 (м, 1H), 4,05-4,10 (м, 1H); МС m/z 350 [M-Na+2H]+.
Пример 59
(2S,5R)-N-(2-Аминоэтокси)-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбоксамид (II-059)
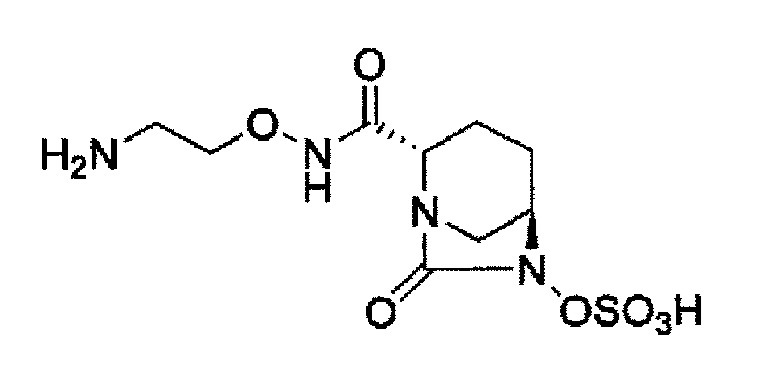
Стадия 1
трет-Бутил {2-[({[(2S,5R)-6-бензилокси-7-оксо-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}амино)окси]этил}карбамат
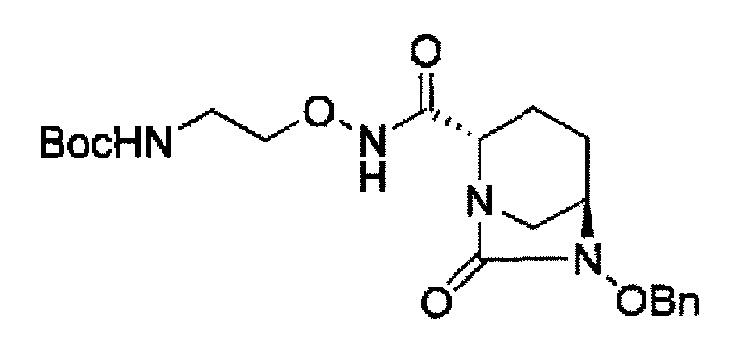
К раствору карбоновой кислоты (6b, 1,34 г, 4,87 ммоль) из примера 9 или 16 в метиленхлориде (35 мл) добавляют триэтиламин (2,71 мл), гидрохлорид N-этил-N'-(3-диметиламинопропил)карбодиимида (1,41 г), моногидрат 1-гидроксибензотриазола (1,15 г) и трет-бутил 2-(аминоокси)этилкарбамат (1,12 г), описанный в ссылочном примере 9, затем перемешивают при комнатной температуре в течение ночи. К остатку, полученному концентрацией реакционного раствора при пониженном давлении, добавляют воду, затем экстрагируют этилацетатом. Полученный органический слой промывают 0,1М хлористоводородной кислотой, насыщенным водным раствором бикарбоната натрия и насыщенным водным раствором хлорида натрия, сушат над безводным сульфатом натрия, фильтруют и концентрируют. Полученный остаток очищают с помощью хроматографии на колонке с силикагелем (гексан/этилацетат=8/2-0/10) с получением 1,77 г указанного в заголовке соединения (выход 84%).
[α]D20 -0,08° (c 0,29, CHCl3); 1H ЯМР (400 МГц, CDCl3): δ 1,44 (с, 9H), 1,56-1,70 (м, 1H), 1,90-2,09 (м, 2H), 2,25-2,38 (м, 1H), 2,76 (д, J=11,6 Гц, 1H), 3,03 (шир.д, J=11,6 Гц, 1H), 3,24-3,47 (м, 3H), 3,84-4,01 (м, 3H), 4,90 (д, J=11,6 Гц, 1H), 5,05 (д, J=11,6 Гц, 1H), 5,44 (шир.с, 1H), 7,34-7,48 (м, 5H), 9,37 (шир.с, 1H); МС m/z 435 [M+H]; энантиомерный избыток 99,9% эи или более (CHIRALPAK AD-H, 4,6 × 150 мм, гексан/этанол=2/1, УФ 210 нм, скорость потока 1 мл/мин; время удерживания 4,95 мин. (2R,5S), 6,70 мин (2S,5R).
Стадия 2
трет-Бутил {2-[({[(2S,5R)-6-гидрокси-7-оксо-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}амино)окси]этил}карбамат
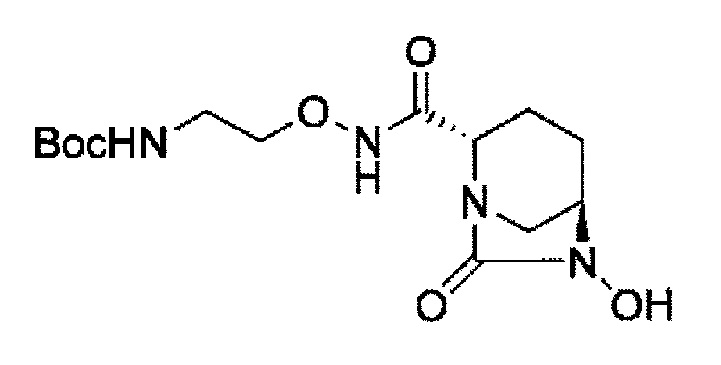
К раствору соединения (3,91г, 9,01 ммоль), полученного на вышеописанной стадии 1 в метаноле (80 мл) добавляют 10% палладий на угле в качестве катализатора (содержание воды 50%, 803 мг) и смесь перемешивают в атмосфере водорода в течение 45 минут. Реакционную смесь фильтруют через Целит и концентрируют при пониженном давлении с получением 3,11 г указанного в заголовке соединения (выход количественный).
1H ЯМР (400 МГц, CD3OD): δ 1,44 (с, 9H), 1,73-1,83 (м, 1H), 1,86-1,99 (м, 1H), 2,01-2,12 (м, 1H), 2,22 (шир.дд, J=15,0, 7,0 Гц, 1H), 3,03 (д, J=12,0 Гц, 1H), 3,12 (шир.д, J=12,0 Гц, 1H), 3,25-3,35 (м, 2H), 3,68-3,71 (м, 1H), 3,82-3,91 (м, 3H); МС m/z 345 [M+H]+.
Стадия 3
(2S,5R)-N-(2-Аминоэтокси)-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбоксамид
К раствору соединения (3,09 г, 8,97 ммоль) из приведенной выше стадии 2 в метиленхлориде (80 мл) добавляют 2,6-лутидин (3,20 мл) и комплекс триоксид серы - пиридин (3,58 г), и смесь перемешивают при комнатной температуре в течение ночи. Реакционный раствор выливают в наполовину насыщенный водный раствор бикарбоната натрия, и водный слой промывают хлороформом. В водный слой добавляют гидросульфата тетрабутиламмония (3,47 г) и хлороформ (30 мл) и перемешивают в течение 10 минут. Водный слой экстрагируют хлороформом, и полученный органический слой сушат над безводным сульфатом натрия, фильтруют и концентрируют при пониженном давлении с получением 5,46 г трет-бутил {2-[({[(2S,5R)-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}амино)окси]этил}карбамат тетрабутиламмония (выход 91%).
1H ЯМР (400 МГц, CDCl3): δ 1,01 (т, J=7,4 Гц, 12H), 1,37-1,54 (м, 8H), 1,45 (с, 9H), 1,57-1,80 (м, 9H), 1,85-1,98 (м, 1H), 2,14-2,24 (м, 1H), 2,30-2,39 (м, 1H), 2,83 (д, J=11,6 Гц, 1H), 3,20-3,50 (м, 11H), 3,85-3,99 (м, 3H), 4,33-4,38 (м, 1H), 5,51 (шир.с, 1H), 9,44 (шир.с, 1H); МС m/z 425 [M-Bu4N+2H]+.
К раствору соли тетрабутиламмония (5,20 г, 7,82 ммоль) в метиленхлориде (25 мл) добавляют трифторуксусную кислоту (25 мл) при охлаждении льдом, и смесь перемешивают при 0°С в течение 1 часа. Реакционный раствор концентрируют при пониженном давлении. Полученный остаток промывают диэтиловым эфиром и доводят до рН 7 водным раствором бикарбоната натрия и затем очищают хроматографией на колонке с октадецилсиликагелем (воды) и затем лиофилизируют в получением 1,44 г указанного в заголовке соединения (выход 57%).
[α]D24 -63,5° (с 0,83, H2O); 1H ЯМР (400 МГц, D2O): δ 1,66-1,76 (м, 1H), 1,76-1,88 (м, 1H), 1,91-2,00 (м, 1H), 2,00-2,08 (м, 1H), 3,02(д, J=12,0 Гц, 1H), 3,15 (т, J=5,0 Гц, 2H), 3,18 (шир.д, J=12,0 Гц, 1H), 3,95 (дд, J=7,8, 2,2 Гц, 1H), 4,04 (т, J=5,0 Гц, 2H), 4,07 (дд, J=6,4, 3,2 Гц, 1H); МС m/z 325 [M+H]+.
Пример 60
трет-бутил {2-[({[(2S,5R)-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}амино)окси]этил}карбамат натрия (II-060)
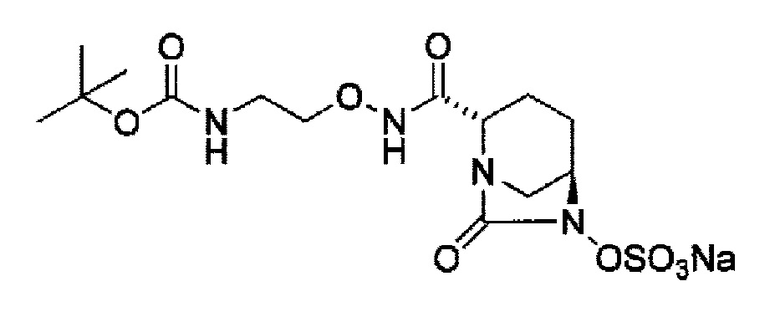
Из соединения (1,700 г, 4,938 ммоль) со стадии 2 примера 59 получают трет-бутил {2-[({[(2S,5R)-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}амино)окси]этил}карбамат пиридиния и нейтрализуют насыщенным водным раствором бикарбоната натрия, затем очищают хроматографией на колонке с октадецилсиликагелем с получением 926,7 мг указанного в заголовке соединения (выход 43,6%).
1H ЯМР (400 МГц, D2O): δ 1,28 (с, 9H), 1,68-1,83 (м, 2H), 1,92-2,07 (м, 2H), 3,00-3,03 (д, J=12,8 Гц, 1H), 3,16-3,22 (м, 3H), 3,81-3,84 (д, J=4,8 Гц, 2H), 3,90-3,92 (д, J=6,4 Гц, 1H), 4,06-4,07 (шир.с, 1H); МС m/z 423 [M-Na]-.
Пример 61
(2S,5R)-N-[2-(Метиламино)этокси]7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбоксамид (II-061)
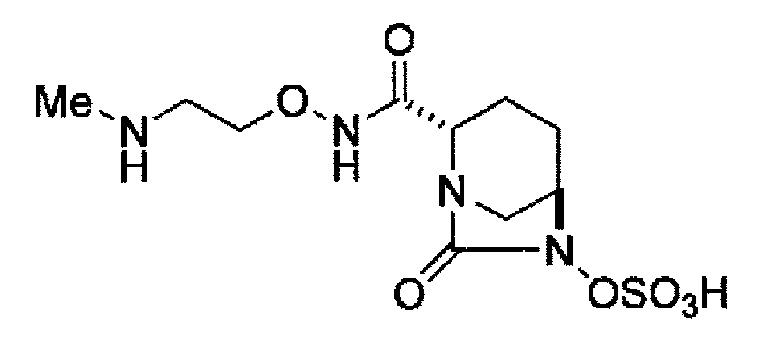
Стадия 1
трет-Бутил {2-[({[(2S,5R)-6-бензилокси-7-оксо-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}амино)окси]этил}метилкарбамат
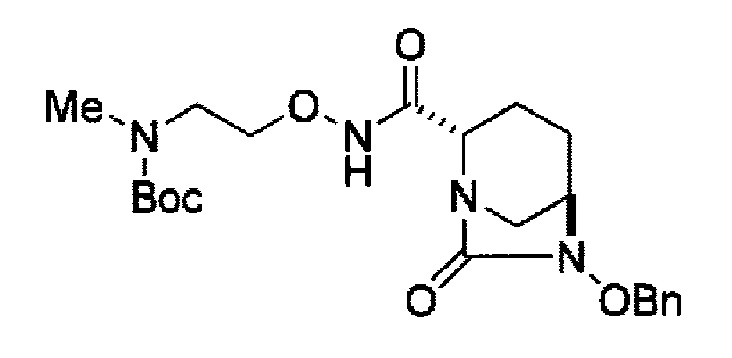
По методике примера 27 из карбоновой кислоты (6b, 390 мг, 1,41 ммоль) из примера 9 или 16 и трет-бутил (2-(аминоокси)этил)(метил)карбамата (436 мг), описанного в ссылочном примере 16, получают 347,8 мг указанного в заголовке соединения (выход 55%).
1H ЯМР (400 МГц, CDCl3): δ 1,46 (с, 9H), 1,58-1,70 (м, 1H), 1,88-2,07 (м, 2H), 2,25-2,36 (м, 1H), 2,70-3,08 (м, 2H), 2,88 (с, 3H), 3,23-3,41 (м, 2H), 3,51-3,68 (м, 1H), 3,83-4,10 (м, 3H), 4,90 (д, J=11,4 Гц, 1H), 5,06 (д, J=11,4 Гц, 1H), 7,32-7,47 (м, 5H), 10,11 (шир.с, 1H); МС m/z 449 [M+H]+.
Стадия 2
трет-бутил {2-[({[(2S,5R)-6-Гидрокси-7-оксо-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}амино)окси]этил}метилкарбамат
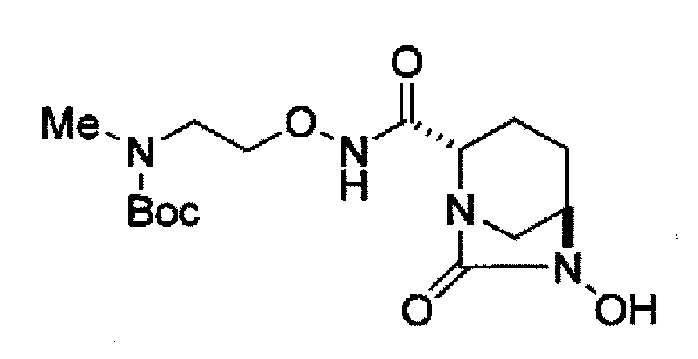
По методике примера 17, из общего количества соединения из указанной выше стадии 1, получают указанное в заголовке соединение (выход количественный).
1H ЯМР (400 МГц, CD3OD): δ 1,46 (с, 9H), 1,73-1,83 (м, 1H), 1,86-2,00 (м, 1H), 2,01-2,13 (м, 1H), 2,14-2,28 (м, 1H), 2,93 (с, 3H), 3,04 (д, J=10,8 Гц, 1H), 3,08-3,18 (м, 1H), 3,43-3,55 (м, 2H), 3,65-3,72 (м, 1H), 3,79-3,88 (м, 1H), 3,92-4,05 (м, 2H); МС m/z 359 [M+H]+.
Стадия 3
(2S,5R)-N-[2-(Метиламино)этокси]-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбоксамид
По методике примера 59, из общего количества соединения из указанной выше стадии 2, получают трет-бутил {2-[({[(2S,5R)-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}амино)окси]этил}метилкарбамат тетрабутиламмония (количественный выход).
1H ЯМР (400 МГц, CDCl3): δ 1,01 (т, J=7,2 Гц, 12H), 1,36-1,53 (м, 8H), 1,47 (с, 9H), 1,57-1,77 (м, 9H), 1,83-1,98(м, 1H), 2,13-2,25 (м, 1H), 2,28-2,40 (м, 1H), 2,82-2,96 (м, 4H), 3,22-3,42 (м, 11H), 3,60-4,08 (м, 3H), 4,34 (шир.с, 1H), 10,15 (шир.с, 1H); МС m/z 437 [M-Bu4N]-.
Общее количество полученной выше соли тетрабутиламмония подвергают реакции снятия защиты с применением трифторуксусной кислоты и очищают хроматографией на колонке с октадецилсиликагелем с получением 149,4 мг указанного в заголовке соединения (3 стадии, 57% выход).
1H ЯМР (500 МГц, D2O): δ 1,73-1,97 (м, 2H), 1,98-2,07 (м, 1H), 2,08-2,18 (м, 1H), 2,74 (с, 3H), 3,09 (д, J=12,0 Гц, 1H), 3,21-3,32 (м, 3H), 4,04 (дд, J=7,5, 2,0 Гц, 1H), 4,10-4,23 (м, 3H); МС m/z 337 [M-H]-.
Пример 62
(2S,5R)-N-[2-(Этиламино)этокси]-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбоксамид
Стадия 1
трет-Бутил {2-[({[(2S,5R)-6-бензилокси-7-оксо-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}амино)окси]этил}этилкарбамат
По методике примера 27 из карбоновой кислоты (6b, 414 мг, 1,50 ммоль) из примера 9 или 16 и трет-бутил (2-(аминоокси)этил)(этил)карбамата (744 мг, полученного по методике ссылочного примера 7 и ссылочного примера 15) получают 541,6 мг указанного в заголовке соединения (выход 78%).
1H ЯМР (400 МГц, CDCl3): δ 1,11 (т, J=7,2 Гц, 3H), 1,46 (с, 9H), 1,58-1,74 (м, 1H), 1,89-2,08 (м, 2H), 2,24-2,38 (м, 1H), 2,72-2,91 (м, 1H), 2,92-3,11 (м, 1H), 3,12-3,42 (м, 4H), 3,43-3,66 (м, 1H), 3,85-4,05 (м, 3H), 4,90 (д, J=11,4 Гц, 1H), 5,06 (д, J=11,4 Гц, 1H), 7,33-7,47 (м, 5H), 10,18 (шир.с, 1H); МС m/z 463 [M+H]+.
Стадия 2
трет-Бутил этил {2-[({[(2S,5R)-6-гидрокси-7-оксо-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}амино)окси]этил}карбамат
По методике примера 17, из общего количества соединения из указанной выше стадии 1, получают указанное в заголовке соединение (выход количественный).
1H ЯМР (400 МГц, CD3OD): δ 1,22 (т, J=7,0 Гц, 3H), 1,46 (с, 9H), 1,73-1,84 (м, 1H), 1,86-1,98 (м, 1H), 2,02-2,12 (м, 1H), 2,14-2,27 (м, 1H), 3,04 (д, J=11,6 Гц, 1H), 3,09-3,18 (м, 1H), 3,25-3,37 (м, 2H), 3,43-3,54 (м, 2H), 3,66-3,72 (м, 1H), 3,79-3,88 (м, 1H), 3,89-4,03 (м, 2H); МС m/z 373 [M+H]+.
Стадия 3
(2S,5R)-N-[2-(Этиламино)этокси]-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбоксамид
По методике примера 59, из общего количества соединения из указанной выше стадии 2, получают трет-бутил {2-[({[(2S,5R)-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}амино)окси]этил}этилкарбамат тетрабутиламмония (количественный выход). МС м/z 451 [М-Bu4N]-.
Общее количество полученной выше соли тетрабутиламмония подвергают реакции снятия защиты с применением трифторуксусной кислоты и очищают хроматографией на колонке с октадецилсиликагелем с получением 166,6 мг указанного в заголовке соединения (3 стадии, 40% выход).
1H ЯМР (500 МГц, D2O): δ 1,25 (т, J=7,3 Гц, 3H), 1,73-1,83 (м, 1H), 1,84-1,95 (м, 1H), 1,97-2,15 (м, 2H), 3,05-3,13 (м, 3H), 3,22-3,29 (м, 3H), 3,99-4,04 (м, 1H), 4,10-4,17 (м, 3H); МС m/z 353 [M+H]+.
Пример 63
(2S,5R)-7-Оксо-N-[2-(пропиламино)этокси]-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбоксамид
Стадия 1
трет-Бутил {2-[({[(2S,5R)-6-бензилокси-7-оксо-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}амино)окси]этил}пропилкарбамат
По методике примера 45 из карбоновой кислоты (6b, 414 мг, 1,50 ммоль) из примера 9 или 16 и трет-бутил (2-(аминоокси)этил)(пропил)карбамата (801 мг, полученного по методике ссылочного примера 7 и ссылочного примера 15) получают 552,2 мг указанного в заголовке соединения (выход 77%).
1H ЯМР (400 МГц, CDCl3): δ 0,87 (т, J=7,2 Гц, 3H), 1,45 (с, 9H), 1,53 (секст., J=7,2 Гц, 2H), 1,58-1,73 (м, 1H), 1,87-2,07 (м, 2H), 2,23-2,36 (м, 1H), 2,83 (д, J=11,2 Гц, 1H), 2,96-3,40 (м, 5H), 3,44-3,64 (м, 1H), 3,83-4,07 (м, 3H), 4,90 (д, J=11,4 Гц, 1H), 5,06 (д, J=11,4 Гц, 1H), 7,32-7,48 (м, 5H), 10,20 (шир.с, 1H); МС m/z 477 [M+H]+
Стадия 2
трет-Бутил {2-[({[(2S,5R)-6-гидрокси-7-оксо-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}амино)окси]этил}пропилкарбамат
По методике примера 17, из общего количества соединения из указанной выше стадии 1, получают 436,7 мг указанного в заголовке соединения (97% выход).
1H ЯМР (400 МГц, CD3OD): δ 0,89 (т, J=7,5 Гц, 3H), 1,40-1,61 (м, 2H), 1,46 (с, 9H), 1,66-2,00 (м, 2H), 2,02-2,28 (м, 2H), 3,04 (д, J=11,6 Гц, 1H), 3,09-3,19 (м, 1H), 3,24 (т, J=7,2 Гц, 2H), 3,42-3,56 (м, 2H), 3,62-3,74 (м, 1H), 3,79-4,05 (м, 3H); МС m/z 387 [M+H]+.
Стадия 3
(2S,5R)-7-Оксо-N-[2-(пропиламино)этокси]-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбоксамид
По методике примера 59, из общего количества соединения из указанной выше стадии 2, получают трет-бутил {2-[({[(2S,5R)-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}амино)окси]этил}пропилкарбамат тетрабутиламмония (количественный выход). МС м/z 465 [М-Bu4N]-.
Общее количество полученной выше соли тетрабутиламмония подвергают реакции снятия защиты с применением трифторуксусной кислоты и очищают хроматографией на колонке с октадецилсиликагелем с получением 226,9 мг указанного в заголовке соединения (3 стадии, 53% выход).
1H ЯМР (500 МГц, D2O): δ 0,92 (т, J=7,5 Гц, 3H), 1,66 (секст., J=7,5 Гц, 2H), 1,74-1,82 (м, 1H), 1,83-1,94 (м, 1H), 1,97-2,13 (м, 2H), 3,00 (т, J=7,5 Гц, 2H), 3,11 (д, J=12,0 Гц, 1H), 3,21-3,29 (м, 3H), 3,96-4,03 (м, 1H), 4,09-4,17 (м, 3H); МС m/z 367 [M+H]+.
Пример 64
(2S,5R)-7-Оксо-N-[2-(пропан-2-иламино)этокси]-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбоксамид (II-064)
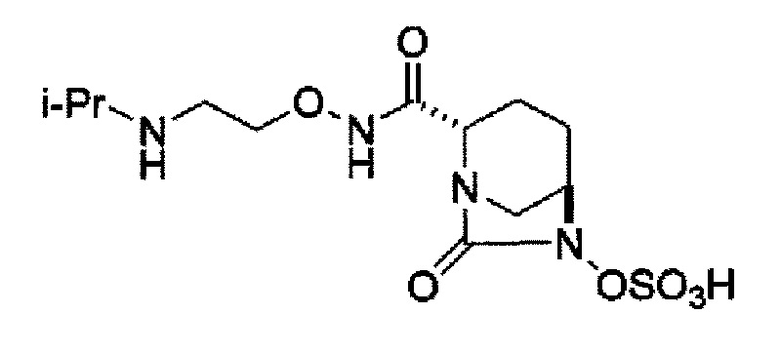
Стадия 1
трет-Бутил {2-[({[(2S,5R)-6-бензилокси-7-оксо-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}амино)окси]этил}пропан-2-илкарбамат

По методике примера 45 из карбоновой кислоты (6b, 414 мг, 1,50 ммоль) из примера 9 или 16 и трет-бутил (2-(аминоокси)этил)(изопропил)карбамата (596 мг), описанного в ссылочном примере 17, получают 578,4 мг указанного в заголовке соединения (выход 81%).
1H ЯМР (400 МГц, CDCl3): δ 1,15 (д, J=6,8 Гц, 6H), 1,46 (с, 9H), 1,55-1,70 (м, 1H), 1,89-2,07 (м, 2H), 2,25-2,37 (м, 1H), 2,73-2,90 (м, 1H), 2,98-3,08 (м, 1H), 3,22-3,38 (м, 2H), 3,40-3,60 (м, 1H), 3,83-4,06 (м, 4H), 4,90 (д, J=11,2 Гц, 1H), 5,06 (д, J=11,2 Гц, 1H), 7,35-7,46 (м, 5H), 10,29 (шир.с, 1H); МС m/z 477 [M+H]+.
Стадия 2
трет-Бутил {2-[({[(2S,5R)-6-гидрокси-7-оксо-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}амино)окси]этил}пропан-2-илкарбамат
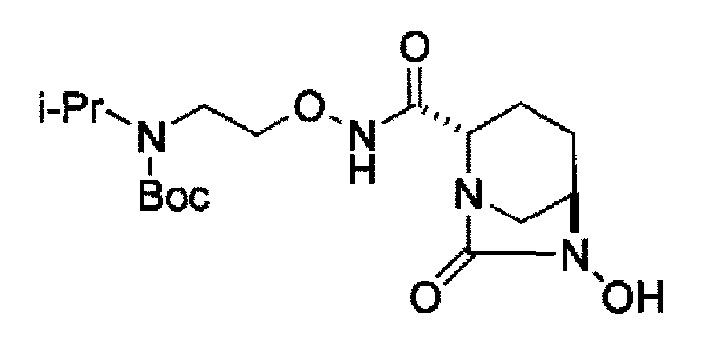
По методике примера 17, из общего количества соединения из указанной выше стадии 1, получают указанное в заголовке соединение (выход количественный).
1H ЯМР (400 МГц, CD3OD): δ 1,09-1,23 (м, 6H), 1,46 (с, 9H), 1,73-2,27 (м, 4H), 3,06 (д, J=11,6 Гц, 1H), 3,08-3,50 (м, 4H), 3,64-3,73 (м, 1H), 3,79-3,98 (м, 3H); МС m/z 387 [M+H]+.
Стадия 3
(2S,5R)-7-Оксо-N-[2-(пропан-2-иламино)этокси]-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбоксамид
По методике примера 59, из общего количества соединения из указанной выше стадии 2, получают трет-бутил {2-[({[(2S,5R)-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}амино)окси]этил}пропан-2-илкарбамат тетрабутиламмония (количественный выход).
1H ЯМР (400 МГц, CDCl3): δ 1,01 (д, J=7,4 Гц, 12H), 1,10-1,20 (м, 6H), 1,33-1,77 (м, 17H), 1,46 (с, 9H), 1,84-1,97 (м, 1H), 2,12-2,25 (м, 1H), 2,28-2,40 (м, 1H), 2,79-2,95 (м, 1H), 3,17-3,45 (м, 9H), 3,50-3,67 (м, 1H), 3,80-4,07 (м, 5H), 4,34 (шир.с, 1H), 10,36 (шир.с, 1H); МС m/z 465 [M-Bu4N]-.
Общее количество полученной выше соли тетрабутиламмония подвергают реакции снятия защиты с применением трифторуксусной кислоты и очищают хроматографией на колонке с октадецилсиликагелем с получением 252,1 мг указанного в заголовке соединения (3 стадии, 57% выход).
1H ЯМР (500 МГц, D2O): δ 1,28 (д, J=6,5 Гц, 6H), 1,74-1,83 (м, 1H), 1,85-1,96 (м, 1H), 1,98-2,14 (м, 2H), 3,11 (д, J=12,5 Гц, 1H), 3,22-3,30 (м, 3H), 3,40 (quint, J=6,5 Гц, 1H), 4,01 (шир.д, J=5,5 Гц, 1H), 4,09-4,18 (м, 3H); МС m/z 367 [M+H]+.
Пример 65
(2S,5R)-N-[2-(Диметиламино)этокси]-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбоксамид
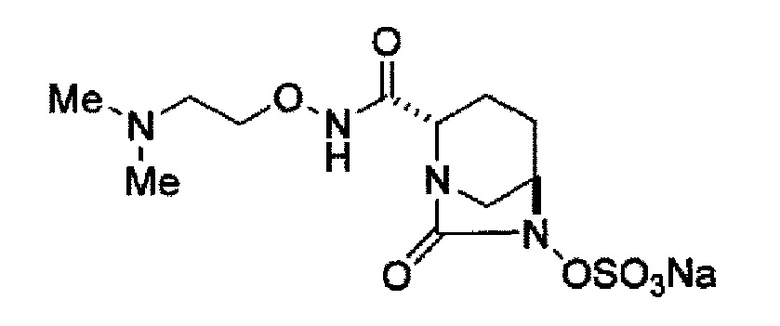
Стадия 1
(2S,5R)-6-Бензилокси-N-[2-(диметиламино)этокси]-7-оксо-1,6-диазабицикло[3.2.1]октан-2-карбоксамид

Раствор карбоновой кислоты (6b, 553 мг, 2,00 ммоль) из примера 9 или 16 в безводном метиленхлориде (10 мл) охлаждают до 0°С в атмосфере аргона, затем по каплям добавляют изобутилхлорформиат (289 мкл, 2,20 ммоль). Затем добавляют триэтиламин (293 мкл), и перемешивают в течение 30 минут. Затем в реакционной системе получают смешанный ангидрид кислоты. К реакционной смеси постепенно добавляют дигидрохлорид 2-(аминоокси)-N,N-диметилэтанамина (591 мг), описанный в ссылочном примере 18 и триэтиламин (930 мкл) при промывании безводным метиленхлоридом (7,0 мл), затем перемешивают при той же температуре в течение 1 часа. Реакционную смесь фильтруют через фильтровальную бумагу Kiriyama. Затем остаток промывают метанолом и фильтрат концентрируют при пониженном давлении. Полученный остаток растворяют в метиленхлориде и воде, и органический слой экстрагируют метиленхлоридом и сушат над сульфатом магния, затем выпаривают при пониженном давлении. Остаток очищают с помощью хроматографии на колонке с силикагелем (аминосиликагель, хлороформ/метанол=10/1) с получением 291,1 мг указанного в заголовке соединения в виде бесцветного масла (выход 40%).
1H ЯМР (400 МГц, CDCl3): δ 1,45-1,85 (м, 4H), 2,29 (с, 6H), 2,60 (т, J=5,2 Гц, 2H), 2,81 (д, J=11,6 Гц, 1H), 2,97 (шир.д, J=11,6 Гц, 1H), 3,28-3,34 (м, 1H), 3,92-4,07 (м, 3H), 4,90 (д, J=11,6 Гц, 1H), 5,05 (д, J=11,6 Гц, 1H), 7,35-7,48 (м, 5H); МС m/z 363 [M+H]+.
Стадия 2
(2S,5R)-N-[2-(Диметиламино)этокси]-6-гидрокси-7-оксо-1,6-диазабицикло[3.2.1]октан-2-карбоксамид
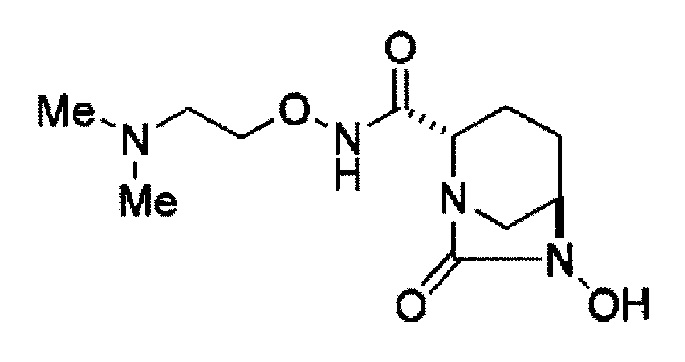
По методике примера 17, из общего количества соединения из указанной выше стадии 1, получают указанное в заголовке соединение (выход количественный).
1H ЯМР (400 МГц, CDCl3): δ 1,74-1,84 (м, 1H), 1,87-1,98 (м, 1H), 2,03-2,12 (м, 1H), 2,15-2,24 (м, 1H), 2,36 (с, 6H), 2,67-2,74 (м, 2H), 3,07 (шир.д, J=11,6 Гц, 1H), 3,12 (шир.д, J=11,6 Гц, 1H), 3,67-3,72 (м, 1H), 3,83 (шир.д, J=6,4 Гц, 1H), 3,96-4,06 (м, 2H); МС m/z 273 [M+H]+.
Стадия 3
(2S,5R)-N-[2-(Диметиламино)этокси]-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбоксамид
По методике примера 18, из общего количества соединения из указанной выше стадии 2, получают (2S,5R)-N-[2-(диметиламино)этокси]-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбоксамид пиридиния и нейтрализуют насыщенным водным раствором бикарбоната натрия, затем очищают хроматографией на колонке с октадецилсиликагелем с получением 130,7 мг указанного в заголовке соединения (2 стадии, 43% выход).
1H ЯМР (400 МГц, D2O): δ 1,68-1,84 (м, 2H), 1,86-2,04 (м, 2H), 2,80 (с, 6H), 3,09-3,17 (м, 2H), 3,17-3,29 (м, 2H), 3,80-3,90 (м, 1H), 4,02-4,13 (м, 3H); МС m/z 353 [M+H]+.
Пример 66
(2S,5R)-N-{[(2S)-2-Аминопропил]окси}-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбоксамид (II-066)
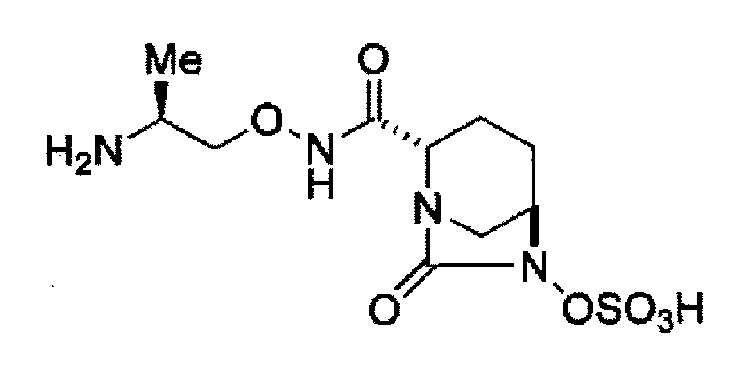
Стадия 1
трет-Бутил {(2S)-1-[({[(2S,5R)-6-бензилокси-7-оксо-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}амино)окси]-2-ил}карбамат

По методике примера 45 из карбоновой кислоты (6b, 414 мг, 1,50 ммоль) из примера 9 или 16 и (S)-трет-бутил (1-(аминоокси)пропан-2-ил)карбамата (550 мг), описанного в ссылочном примере 19, получают 585,6 мг указанного в заголовке соединения (выход 87%).
1H ЯМР (400 МГц, CDCl3): δ 1,17 (д, J=6,4 Гц, 3H), 1,44 (с, 9H), 1,55-1,70 (м, 1H), 1,90-2,10 (м, 2H), 2,26-2,34 (м, 1H), 2,80 (д, J=12,0 Гц, 1H), 3,06 (шир.д, J=12,0 Гц, 1H), 3,27-3,34 (м, 1H), 3,64-3,74 (м, 1H), 3,86-3,98 (м, 3H), 4,81 (шир.д, J=7,6 Гц, 1H), 4,90 (д, J=11,6 Гц, 1H), 5,05 (д, J=11,6 Гц, 1H), 7,34-7,45 (м, 5H), 9,68 (шир.с, 1H); МС m/z 449 [M+H]+.
Стадия 2
трет-Бутил {(2S)-1-[({[(2S,5R)-6-гидрокси-7-оксо-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}амино)окси]пропан-2-ил}карбамат
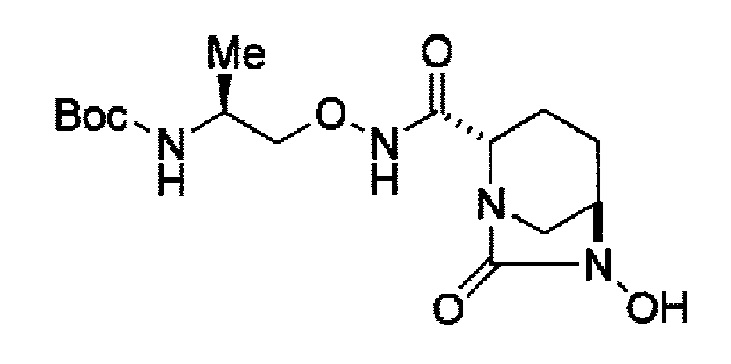
По методике примера 17, из общего количества соединения из указанной выше стадии 1, получают указанное в заголовке соединение (выход количественный).
1H ЯМР (400 МГц, CD3OD): δ 1,16 (д, J=6,4 Гц, 3H), 1,44 (с, 9H), 1,74-1,84 (м, 1H), 1,86-1,98 (м, 1H), 2,03-2,12 (м, 1H), 2,21 (шир.дд, J=15,2, 6,8 Гц, 1H), 3,06 (д, J=12,0 Гц, 1H), 3,14 (шир.д, J=12,0 Гц, 1H), 3,68-3,72 (м, 1H), 3,74-3,87 (м, 4H); МС m/z 359 [M+H]+.
Стадия 3
(2S,5R)-N-{[(2S)-2-Аминопропил]окси}-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбоксамид
По методике примера 59, из общего количества соединения из указанной выше стадии 2, получают трет-бутил {(2S)-1-[({[(2S,5R)-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}амино)окси]пропан-2-ил}карбамат тетрабутиламмония (количественный выход). МС м/z 437 [М-Bu4N]-.
Общее количество полученной выше соли тетрабутиламмония подвергают реакции снятия защиты с применением трифторуксусной кислоты и очищают хроматографией на колонке с октадецилсиликагелем с получением 117,1 мг указанного в заголовке соединения (3 стадии, 26% выход).
1H ЯМР (400 МГц, D2O): δ 1,17 (д, J=6,8 Гц, 3H), 1,66-1,89 (м, 2H), 1,91-2,08 (м, 2H), 3,02 (д, J=12,0 Гц, 1H), 3,18 (шир.д, J=12,0 Гц, 1H), 3,47-3,58 (м, 1H), 3,82 (дд, J=11,8, 9,4 Гц, 1H), 3,92-4,02 (м, 2H), 4,05-4,10 (м, 1H); МС m/z 339 [M+H]+.
Пример 67
(2S,5R)-N-{[(2R)-2-Аминопропил]окси}-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбоксамид (II-067)
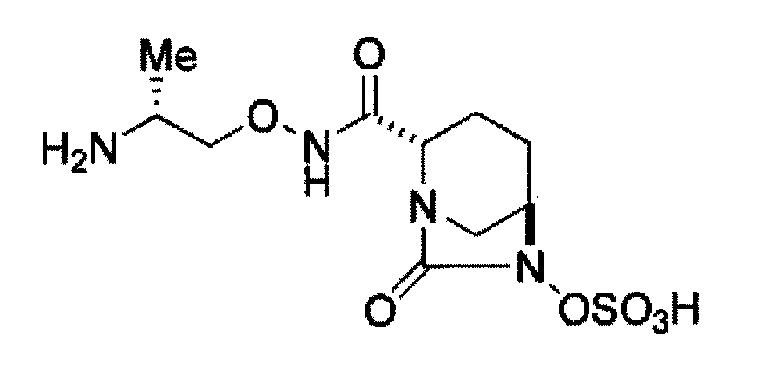
Стадия 1
трет-бутил {(2R)-1-[({[(2S,5R)-6-бензилокси-7-оксо-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}амино)окси]пропан-2-ил}карбамат
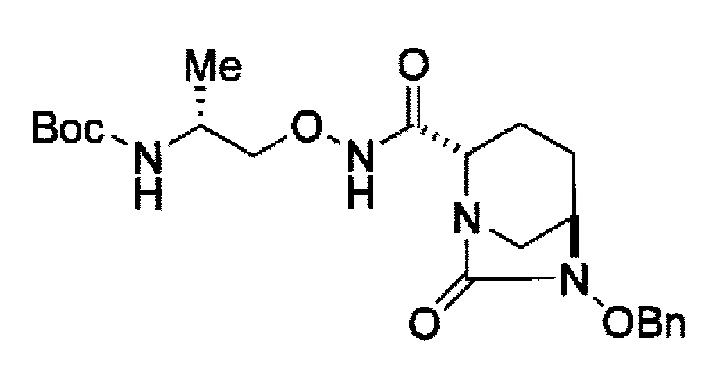
По методике примера 45 из карбоновой кислоты (6b, 414 мг, 1,50 ммоль) из примера 9 или 16 и (R)-трет-бутил (1-(аминоокси)-2-ил)карбамата (569 мг, полученного по методике ссылочного примера 7 и ссылочного примера 15) получают 625 мг указанного в заголовке соединения (выход 93%).
1H ЯМР (400 МГц, CDCl3): δ 1,14 (д, J=6,4 Гц, 3H), 1,43 (с, 9H), 1,53-1,70 (м, 1H), 1,90-2,06 (м, 2H), 2,28-2,36 (м, 1H), 2,79 (д, J=12,0 Гц, 1H), 3,02 (шир.д, J=12,0 Гц, 1H), 3,28-3,33 (м, 1H), 3,56-3,68 (м, 1H), 3,84 (дд, J=11,2, 3,6 Гц, 1H), 3,92-4,04 (м, 2H), 4,66 (шир.д, J=8,0 Гц, 1H), 4,91 (д, J=11,2 Гц, 1H), 5,06 (д, J=11,2 Гц, 1H), 7,35-7,45 (м, 5H), 9,94 (шир.с, 1H); МС m/z 449 [M+H]+.
Стадия 2
трет-Бутил {(2R)-1-[({[(2S,5R)-6-гидрокси-7-оксо-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}амино)окси]пропан-2-ил}карбамат

По методике примера 17, из общего количества соединения из указанной выше стадии 1, получают указанное в заголовке соединение (выход количественный).
1H ЯМР (400 МГц, CD3OD): δ 1,15 (д, J=6,4 Гц, 3H), 1,44 (с, 9H), 1,73-1,84 (м, 1H), 1,86-2,00 (м, 1H), 2,01-2,12 (м, 1H), 2,19-2,29 (м, 1H), 3,06 (д, J=11,6 Гц, 1H), 3,10-3,20 (м, 1H), 3,67-3,72 (м, 1H), 3,73-3,92 (м, 4H); МС m/z 359 [M+H]+.
Стадия 3
(2S,5R)-N-{[(2R)-2-Аминопропил]окси}-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбоксамид
По методике примера 59, из общего количества соединения из указанной выше стадии 2, получают трет-бутил {(2R)-1-[({[(2S,5R)-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}амино)окси]пропан-2-ил}карбамат тетрабутиламмония (количественный выход). МС м/z 437 [М-Bu4N]-.
Общее количество полученной выше соли тетрабутиламмония подвергают реакции снятия защиты с применением трифторуксусной кислоты и очищают хроматографией на колонке с октадецилсиликагелем с получением 212,6 мг указанного в заголовке соединения (3 стадии, 45% выход).
1H ЯМР (400 МГц, D2O): δ 1,17 (д, J=6,8 Гц, 3H), 1,66-1,78 (м, 1H), 1,78-1,88 (м, 1H), 1,90-2,06 (м, 2H), 3,02 (д, J=12,0 Гц, 1H), 3,18 (шир.д, J=12,0 Гц, 1H), 3,48-3,58 (м, 1H), 3,83 (дд, J=11,8, 9,0 Гц, 1H), 3,94 (шир.д, J=7,2 Гц, 1H), 3,98 (дд, J=11,8, 3,4 Гц, 1H), 4,06-4,10 (м, 1H); МС m/z 339 [M+H]+.
Пример 68
(2S,5R)-N-{[(2S)-1-Аминопропан-2-ил]окси}-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбоксамид
Стадия 1
трет-Бутил {(2S)-2-[({[(2S,5R)-6-бензилокси-7-оксо-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}амино)окси]пропил}карбамат
По методике примера 45 из карбоновой кислоты (6b, 414 мг, 1,50 ммоль) из примера 9 или 16 и (S)-трет-бутил 2-(аминоокси)пропил)карбамата (597 мг, полученного по методике ссылочного примера 7 и ссылочного примера 15) получают 626,6 мг указанного в заголовке соединения (выход 93%).
1H ЯМР (400 МГц, CDCl3): δ 1,22 (д, J=6,4 Гц, 3H), 1,40-1,70 (м, 1H), 1,44 (с, 9H), 1,92-2,08 (м, 2H), 2,27-2,36 (м, 1H), 2,77 (д, J=11,6 Гц, 1H), 2,94-3,08 (м, 2H), 3,30-3,35 (м, 1H), 3,38-3,50 (м, 1H), 3,95-4,05 (м, 2H), 4,91 (д, J=11,4 Гц, 1H), 5,05 (д, J=11,4 Гц, 1H), 5,48-5,60 (м, 1H), 7,35-7,45 (м, 5H), 9,25 (шир.с, 1H); МС m/z 449 [M+H]+.
Стадия 2
трет-Бутил {(2S)-2-[({[(2S,5R)-6-гидрокси-7-оксо-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}амино)окси]пропил}карбамат
По методике примера 17, из общего количества соединения из указанной выше стадии 1, получают указанное в заголовке соединение (выход количественный).
1H ЯМР (400 МГц, CD3OD): δ 1,20 (д, J=6,4 Гц, 3H), 1,44 (с, 9H), 1,74-1,85 (м, 1H), 1,86-2,00 (м, 1H), 2,01-2,12 (м, 1H), 2,16-2,25 (м, 1H), 3,06 (д, J=11,6 Гц, 1H), 3,10-3,18 (м, 2H), 3,23-3,38 (м, 1H), 3,66-3,73 (м, 1H), 3,83-3,90 (м, 1H), 3,92-4,01 (м, 1H); МС m/z 359 [M+H]+.
Стадия 3
(2S,5R)-N-{[(2S)-1-Аминопропан-2-ил]окси}-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбоксамид
По методике примера 59, из общего количества соединения из указанной выше стадии 2, получают трет-бутил {(2S)-2-[({[(2S,5R)-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}амино)окси]пропил}карбамат тетрабутиламмония (количественный выход). МС м/z 437 [М-Bu4N]-.
Общее количество полученной выше соли тетрабутиламмония подвергают реакции снятия защиты с применением трифторуксусной кислоты и очищают хроматографией на колонке с октадецилсиликагелем с получением 175,0 мг указанного в заголовке соединения (3 стадии, 37% выход).
1H ЯМР (400 МГц, D2O): δ 1,19 (д, J=6,4 Гц, 3H), 1,67-1,88 (м, 2H), 1,91-2,10 (м, 2H), 2,91-3,00 (м, 1H), 3,01-3,13 (м, 2H), 3,19 (шир.д, J=12,4 Гц, 1H), 3,95 (шир.д, J=7,2 Гц, 1H), 4,08 (шир.с, 1H), 4,11-4,20 (м, 1H); МС m/z 339 [M+H]+.
Пример 69
(2S,5R)-N-(3-Аминопропокси)-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбоксамид (II-069)

Стадия 1
трет-Бутил {3-[({[(2S,5R)-6-бензилокси-7-оксо-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}амино)окси]пропил}карбамат
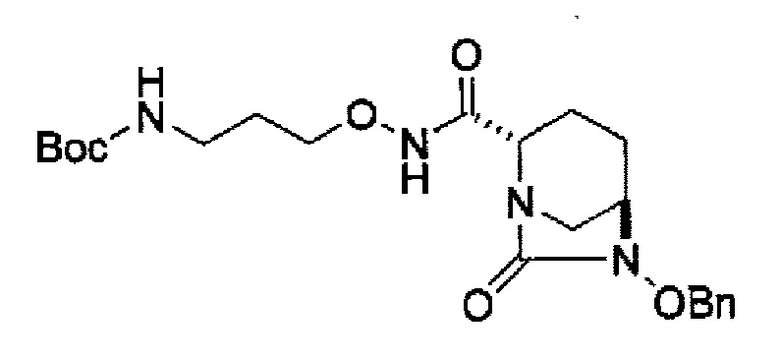
По методике примера 27 из карбоновой кислоты (6b, 390 мг, 1,41 ммоль) из примера 9 или 16 и трет-бутил (3-(аминоокси)пропил)карбамата (730 мг), описанного в ссылочном примере 20, получают 398,1 мг указанного в заголовке соединения (выход 63%).
1H ЯМР (400 МГц, CDCl3): δ 1,44 (с, 9H), 1,50-1,67 (м, 1H), 1,75-1,86 (м, 2H), 1,88-2,07 (м, 2H), 2,28-2,37 (м, 2H), 2,77 (д, J=11,0 Гц, 1H), 3,01 (шир.д, J=11,0 Гц, 1H), 3,20-3,38 (м, 3H), 3,89-4,04 (м, 3H), 4,90 (д, J=11,4 Гц, 1H), 5,05 (д, J=11,4 Гц, 1H), 5,17 (шир.с, 1H), 7,36-7,45 (м, 5H), 9,21 (шир.с, 1H); МС m/z 449 [M+H]+.
Стадия 2
трет-Бутил {3-[({[(2S,5R)-6-гидрокси-7-оксо-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}амино)окси]пропил}карбамат
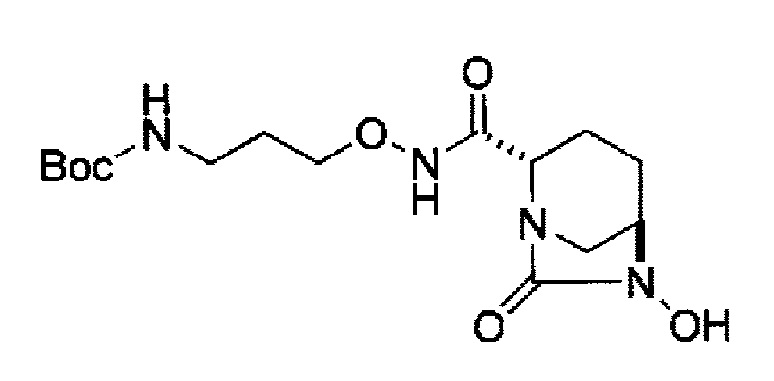
По методике примера 17, из соединения (392,8 мг, 876 мкмоль) из указанной выше стадии 1, получают указанное в заголовке соединение (выход количественный).
1H ЯМР (400 МГц, CD3OD): δ 1,43 (с, 9H), 1,73-1,99 (м, 4H), 2,01-2,12 (м, 1H), 2,13-2,24 (м, 1H), 3,07 (д, J=11,6 Гц, 1H), 3,09-3,21 (м, 3H), 3,69 (шир.с, 1H), 3,80-3,96 (м, 3H); МС m/z 359 [M+H]+.
Стадия 3
(2S,5R)-N-(3-Аминопропокси)-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбоксамид
По методике примера 59, из общего количества соединения из указанной выше стадии 2, получают трет-бутил {3-[({[(2S,5R)-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}амино)окси]пропил}карбамат тетрабутиламмония (количественный выход).
1H ЯМР (400 МГц, CDCl3): δ 1,01 (т, J=7,4 Гц, 12H), 1,33-1,53 (м, 8H), 1,47 (с, 9H), 1,55-1,96 (м, 12H), 2,14-2,23 (м, 1H), 2,31-2,41 (м, 1H), 2,85 (шир.д, J=11,2 Гц, 1H), 3,15-3,42 (м, 11H), 3,88-4,07 (м, 3H), 4,35 (шир.с, 1H), 5,27 (шир.с, 1H), 9,26 (шир.с, 1H); МС m/z 437 [M-Bu4N]-.
Общее количество полученной выше соли тетрабутиламмония подвергают реакции снятия защиты с применением трифторуксусной кислоты и очищают хроматографией на колонке с октадецилсиликагелем с получением 138,4 мг указанного в заголовке соединения (3 стадии, 47% выход).
1H ЯМР (400 МГц, D2O): δ 1,67-2,05 (м, 6H), 3,00-3,19 (м, 4H), 3,82-3,94 (м, 3H), 4,05-4,10 (м, 1H); МС m/z 337 [M-H]-.
Пример 70
(2S,5R)-2-(1,2-Оксазолидин-2-илкарбонил)-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-7-он натрия
Стадия 1
(2S,5R)-6-Бензилокси-2-(1,2-оксазолидин-2-илкарбонил)-1,6-диазабицикло[3.2.1]октан-7-он
По методике примера 27 из карбоновой кислоты (6b, 550 мг, 2,00 ммоль) из примера 9 или 16 и гидрохлорида 1,2-оксазолидина (328,6 мг, коммерчески доступный), получают 588 мг указанного в заголовке соединения (выход 88,7%).
1H ЯМР (400 МГц, CDCl3): δ 1,26-2,34 (м, 6H), 2,95 (м, 1H), 3,33 (м, 2H), 3,74 (м, 2H), 3,98-4,42 (м, 3H), 4,92 (м, 1H), 5,03-5,06 (м, 1H), 7,26-7,52 (м, 5H); МС m/z 332 [M+H]+.
Стадия 2
(2S,5R)-6-Гидрокси-2-(1,2-оксазолидин-2-илкарбонил)-1,6-диазабицикло[3.2.1]октан-7-он
По методике примера 17, из общего количества соединения из указанной выше стадии 1, получают указанное в заголовке соединение (выход количественный). МС м/z 242 [М+Н]+.
Стадия 3
(2S,5R)-2-(1,2-Оксазолидин-2-илкарбонил)-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-7-он натрия
По методике примера 22, из общего количества соединения из указанной выше стадии 2, получают (2S,5R)-2-(1,2-оксазолидин-2-илкарбонил)-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-7-он пиридиния и нейтрализуют насыщенным водным раствором бикарбоната натрия, затем очищают хроматографией на колонке с октадецилсиликагелем с получением 281,3 мг указанного в заголовке соединения (выход 46,9%).
1H ЯМР (400 МГц, D2O): δ 1,79-1,98 (м, 4H), 2,28-2,30 (м, 2H), 3,13-3,24 (м, 2H), 3,61-4,33 (м, 6H); МС m/z 322 [M-Na+2H]+.
Пример 71
(2S,5R)-2-(1,2-Оксазинан-2-илкарбонил)-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-7-он натрия
Стадия 1
(2S,5R)-6-Бензилокси-2-(1,2-оксазинан-2-илкарбонил)-1,6-диазабицикло[3.2.1]октан-7-он
По методике примера 27 из карбоновой кислоты (6b, 552 мг, 2,00 ммоль) из примера 9 или 16 и 1,2-оксазинана (261 мг), получают 679 мг указанного в заголовке соединения (выход 98,3%).
1H ЯМР (400 МГц, CDCl3): δ 1,63-2,10 (м, 8H), 2,93-2,96 (шир.д, J=9,2 Гц, 1H), 3,28-3,31 (д, J=11,6 Гц, 1H), 3,34 (с, 1H), 3,61 (шир.с, 1H), 3,93-4,14 (м, 3H), 4,47 (шир.с, 1H), 4,89-4,92 (д, J=11,2 Гц, 1H), 5,03-5,06 (д, J=11,6 Гц, 1H), 7,23-7,52 (м, 5H); МС m/z 346[M+H]+.
Стадия 2
(2S,5R)-6-Гидрокси-2-(1,2-оксазинан-2-илкарбонил)-1,6-диазабицикло[3.2.1]октан-7-он
По методике примера 17, из общего количества соединения из указанной выше стадии 1, получают указанное в заголовке соединение (выход количественный). МС м/z 256 [М+Н]+.
Стадия 3
(2S,5R)-2-(1,2-Оксазинан-2-илкарбонил)-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-7-он натрия
По методике примера 22, из общего количества соединения из указанной выше стадии 2, получают (2S,5R)-2-(1,2-оксазинан-2-илкарбонил)-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-7-он пиридиния и нейтрализуют насыщенным водным раствором бикарбоната натрия, затем очищают хроматографией на колонке с октадецилсиликагелем с получением 297 мг указанного в заголовке соединения (выход 42,4%).
1H ЯМР (400 МГц, D2O): δ 1,64-1,97 (м, 8H), 2,99-3,16 (м, 1H), 3,21-3,24 (д, J=12,0 Гц, 1H), 3,54-4,37 (м, 6H); МС m/z 336 [M-Na+2H]+.
Пример 72
(2S,5R)-N-[2-(Морфолин-4-ил)этокси]-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбоксамид натрия
Стадия 1
(2S,5R)-6-Бензилокси-N-[2-(морфолин-4-ил)этокси]-7-оксо-1,6-диазабицикло[3.2.1]октан-2-карбоксамид
По методике примера 45 из карбоновой кислоты (6b, 414 мг, 1,50 ммоль) из примера 9 или 16 и O-(2-морфолиноэтил)гидроксиламина (306 мг, Huhu Technology) получают 629,6 мг указанного в заголовке соединения (количественный выход).
1H ЯМР (400 МГц, CDCl3): δ 1,60-1,73 (м, 1H), 1,85-2,06 (м, 2H), 2,33 (шир.дд, J=14,4, 7,6 Гц, 1H), 2,46-2,60 (м, 4H), 2,62-2,74 (м, 2H), 2,80 (д, J=11,8 Гц, 1H), 2,98 (шир.д, J=11,8 Гц, 1H), 3,28-3,34 (м, 1H), 3,70-3,81 (м, 4H), 3,93 (шир.д, J=7,2 Гц, 1H), 3,97-4,11 (м, 2H), 4,90 (д, J=11,2 Гц, 1H), 5,06 (д, J=11,2 Гц, 1H), 7,35-7,45 (м, 5H), 9,93 (шир.с, 1H); МС m/z 405 [M+H]+.
Стадия 2
(2S,5R)-6-Гидрокси-N-[2-(морфолин-4-ил)этокси]-7-оксо-1,6-диазабицикло[3.2.1]октан-2-карбоксамид
По методике примера 17, из общего количества соединения из указанной выше стадии 1, получают 452,4 мг указанного в заголовке соединения (выход 96%).
1H ЯМР (400 МГц, CD3OD): δ 1,77-1,85 (м, 1H), 1,86-1,98 (м, 1H), 2,03-2,13 (м, 1H), 2,16-2,25 (м, 1H), 2,50-2,61 (м, 4H), 2,68 (т, J=5,4 Гц, 2H), 3,05 (д, J=11,6 Гц, 1H), 3,12 (шир.д, J=11,6 Гц, 1H), 3,67-3,74 (м, 5H), 3,84 (шир.д, J=7,2 Гц, 1H), 4,02-4,06 (м, 2H); МС m /z 315 [M+H]+.
Стадия 3
(2S,5R)-N-[2-(Морфолин-4-ил)этокси]-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбоксамид натрия
По методике примера 18, из общего количества соединения из указанной выше стадии 2, получают (2S,5R)-N-[2-(морфолин-4-ил)этокси]-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбоксамид пиридиния и нейтрализуют насыщенным водным раствором бикарбоната натрия, затем очищают хроматографией на колонке с октадецилсиликагелем с получением 30,9 мг указанного в заголовке соединения (4 стадии, выход 21%).
1H ЯМР (500 МГц, D2O): δ 1,77-1,87 (м, 2H), 1,93-2,06 (м, 2H), 2,51-2,65 (м, 4H), 2,67 (т, J=5,5 Гц, 2H), 3,16 (шир.д, J=11,8 Гц, 1H), 3,24 (д, J=11,8 Гц, 1H), 3,66-3,76 (м, 4H), 3,85 (шир.д, J=5,0 Гц, 1H), 3,95 (т, J=5,5 Гц, 2H), 4,13 (шир.с, 1H); МС m/z 395 [M-Na+2H]+.
Пример 73
(2S,5R)-7-Оксо-N-[2-(пиперазин-1-ил)этокси]-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбоксамид
Стадия 1
трет-Бутил 4-{2-[({[(2S,5R)-6-бензилокси-7-оксо-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}амино)окси]этил}пиперазин-1-карбоксилат
По методике примера 27 из карбоновой кислоты (6b, 552 мг, 2,00 ммоль) из примера 9 или 16 и трет-бутил 4-(2-(аминоокси)этил)пиперазин-1-карбоксилата (735 мг, полученного по методике ссылочного примера 7 и ссылочного примера 15) получают 476,5 мг указанного в заголовке соединения (выход 47,3%).
1H ЯМР (400 МГц, CDCl3): δ 1,45 (с, 9H), 1,64-2,06 (м, 3H),2,30-2,35 (м, 1H), 2,58-2,66 (м, 4H), 2,68-2,69 (м, 2H), 2,77-2,80 (д, J=11,6 Гц, 1H), 2,96-2,99 (д, J=11,6 Гц, 1H), 3,31 (шир.с, 1H), 3,79-3,82 (м, 4H), 3,92-3,94 (д, J=8,0 Гц, 1H), 3,99-4,09 (м, 2H), 4,88-4,92 (д, J=11,2 Гц, 1H), 5,04-5,07 (д, J=11,6 Гц, 1H), 7,34-7,42 (м, 5H); МС m/z 504 [M+H]+.
Стадия 2
трет-Бутил 4-{2-[({[(2S,5R)-6-гидрокси-7-оксо-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}амино)окси]этил}пиперазин-1-карбоксилат
По методике примера 17, из общего количества соединения из указанной выше стадии 1, получают указанное в заголовке соединение (выход количественный). МС м/z 414 [М+Н]+.
Стадия 3
(2S,5R)-7-Оксо-N-[2-(пиперазин-1-ил)этокси]-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбоксамид
По методике примера 59, из общего количества соединения из указанной выше стадии 2, получают трет-бутил-4-{2-[({[(2S,5R)-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}амино)окси]этил}пиперазин-1-карбоксилат тетрабутиламмония (количественный выход). МС м/z 492 [М-Bu4N]-.
Общее количество полученной выше соли тетрабутиламмония подвергают реакции снятия защиты с применением трифторуксусной кислоты и очищают хроматографией на колонке с октадецилсиликагелем с получением 12,3 мг указанного в заголовке соединения (выход 3,3%).
1H ЯМР (400 МГц, D2O): δ 1,74 (м, 2H), 1,76 (м, 2H), 2,65-2,69 (м, 6H), 2,96 (м, 4H), 2,98-2,99 (д, J=5,2 Гц, 1H), 3,17-3,20 (д, J=10,8 Гц, 1H), 3,86-3,89 (м, 3H), 4,04 (шир.с, 1H); МС m/z 394 [M+H]+.
Пример 74
(2S,5R)-7-Оксо-N-[2-(1,4-диазепан-1-ил)этокси]-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбоксамид
Стадия 1
трет-Бутил 4-{2-[({[(2S,5R)-6-бензилокси-7-оксо-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}амино)окси]этил}-1,4-диазепин-1-карбоксилат
По методике примера 17 из карбоновой кислоты (6b, 548 мг, 1,98 ммоль) из примера 9 или 16 и трет-бутил 4-(2-(аминоокси)этил)-1,4-диазепин-1-карбоксилата (921 мг, полученного по методике ссылочного примера 7 и ссылочного примера 15) получают 1,13 г указанного в заголовке соединения. МС м/z 518 [М+Н]+.
Стадия 2
трет-Бутил 4-{2-[({[(2S,5R)-6-гидрокси-7-оксо-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}амино)окси]этил}-1,4-диазепин-1-карбоксилат
По методике примера 17, из общего количества соединения из указанной выше стадии 1, получают 910 мг указанного в заголовке соединения. МС м/z 428 [М+Н]+.
Стадия 3
(2S,5R)-7-Оксо-N-[2-(1,4-диазепан-1-ил)этокси]-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбоксамид
К раствору общего количества соединения из указанной выше стадии 2 в метиленхлориде (20 мл) добавляют 2,6-лутидин (692 мкл) и добавляют комплекс триоксид серы - пиридин (945 мг), и смесь перемешивают при комнатной температуре в течение ночи. После завершения реакции реакционную смесь фильтруют, и фильтрат концентрируют с получением 1,67 г трет-бутил 4-{2-[({[(2S,5R)-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}амино)окси]этил}-1,4-диазепин-1-карбоксилата пиридиния. МС м/z 506 [М-С5Н5NH]-.
Полученную выше соль пиридиния (1,00 г, 1,19 ммоль) растворяют в метиленхлориде (2,0 мл) и добавляют трифторуксусную кислоту (2,0 мл) при охлаждении льдом, и смесь перемешивают при 0°С в течение 30 минут. Реакционный раствор концентрируют при пониженном давлении, и полученный остаток промывают диэтиловым эфиром и доводят до рН 7 водным раствором бикарбоната натрия, затем очищают хроматографией на колонке с октадецилсиликагелем с получением (метанол/вода=0/10-5/5). После лиофилизации получают 111 мг указанного в заголовке соединения (4 стадии, 23% выход).
1H ЯМР (400 МГц, D2O): δ 1,64-2,07 (м, 6H), 2,73-2,85 (м, 4H), 2,90-3,04 (м, 3H), 3,13-3,28 (м, 5H), 3,90-3,98 (м, 3H), 4,05-4,09 (м, 5H); МС m/z 408 [M+H]+.
Пример 75
(2S,5R)-N-[(2S)-Азетидин-2-илметокси]-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбоксамид (II-075)
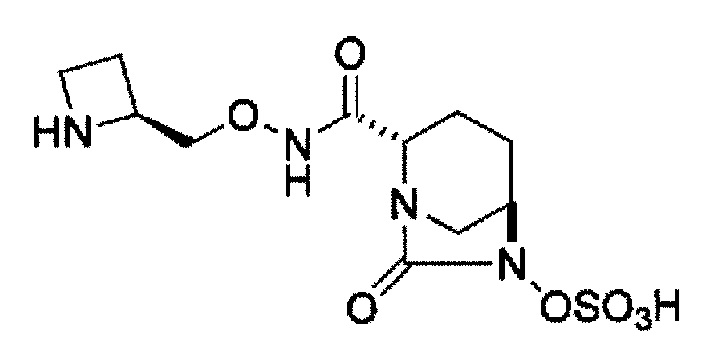
Стадия 1
трет-Бутил (2S)-2-{[({[(2S,5R)-6-бензилокси-7-оксо-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}амино)окси]метил}азетидин-1-карбоксилат
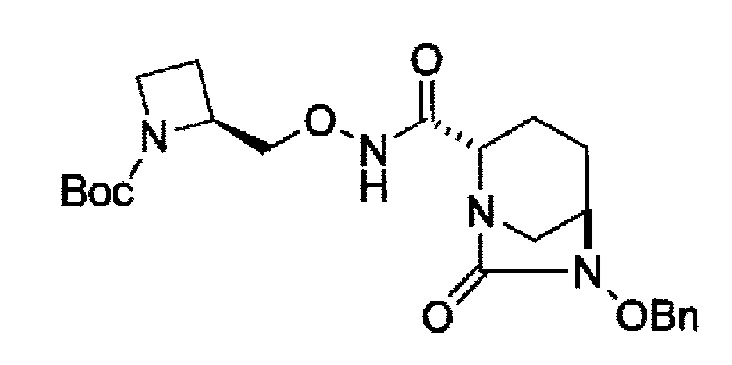
По методике примера 45 из карбоновой кислоты (6b, 553 мг, 2,00 ммоль) из примера 9 или 16 и (S)-трет-бутил 2-((аминоокси)метил)азетидин-1-карбоксилата (578 мг), описанного в ссылочном примере 21, получают 760,1 мг указанного в заголовке соединения (выход 83%).
1H ЯМР (400 МГц, CDCl3): δ 1,46 (с, 9H), 1,56-1,70 (м, 1H), 1,88-2,07 (м, 3H), 2,23-2,34 (м, 2H), 2,84 (д, J=11,6 Гц, 1H), 3,02 (д, J=11,6 Гц, 1H), 3,28 (шир.с, 1H), 3,77-4,03 (м, 4H), 4,06-4,15 (м, 1H), 4,37-4,48 (м, 1H), 4,89 (д, J=11,6 Гц, 1H), 5,04 (д, J=11,6 Гц, 1H), 7,34-7,44 (м, 5H), 10,63 (шир.с, 1H); МС m/z 461 [M+H]+.
Стадия 2
трет-Бутил (2S)-2-{[({[(2S,5R)-6-гидрокси-7-оксо-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}амино)окси]метил}азетидин-1-карбоксилат
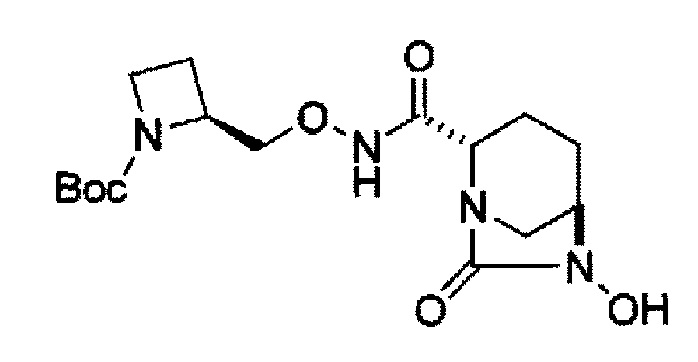
По методике примера 17, из соединения (699 мг, 1,52 ммоль) из указанной выше стадии 1, получают указанное в заголовке соединение (выход количественный).
1H ЯМР (400 МГц, CD3OD): δ 1,44 (с, 9H), 1,74-1,85 (м, 1H), 1,86-1,99 (м, 1H), 2,02-2,14 (м, 1H), 2,16-2,40 (м, 3H), 3,06 (д, J=11,6 Гц, 1H), 3,10-3,17 (м, 1H), 3,67-3,74 (м, 1H), 3,75-3,93 (м, 3H), 4,01 (дд, J=10,6, 10,6 Гц, 1H), 4,14 (дд, J=10,6, 10,6 Гц, 1H), 4,37-4,47 (м, 1H); МС m/z 371 [M+H]+.
Стадия 3
(2S,5R)-N-[(2S)-Азетидин-2-илметокси]7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбоксамид
По методике примера 59, из общего количества соединения из указанной выше стадии 2, получают трет-бутил (2S)-2-{[({[(2S,5R)-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}амино)окси]метил}азетидин-1-карбоксилат тетрабутиламмония (выход количественный).
1H ЯМР (400 МГц, CDCl3): δ 1,01 (т, J=7,2 Гц, 12H), 1,30-2,10 (м, 19H), 1,46 (с, 9H), 2,12-2,39 (м, 3H), 2,89 (шир.д, J=12,0 Гц, 1H), 3,23-3,39 (м, 9H), 3,76-3,93 (м, 3H), 3,95-4,06 (м, 1H), 4,08-4,18 (м, 1H), 4,33 (шир.с, 1H), 4,37-4,50 (м, 1H); МС m/z 449 [M-Bu4N]-.
Общее количество полученной выше соли тетрабутиламмония подвергают реакции снятия защиты с применением трифторуксусной кислоты и очищают хроматографией на колонке с октадецилсиликагелем с получением 172,3 мг указанного в заголовке соединения (3 стадии, выход 32%).
1H ЯМР (500 МГц, D2O): δ 1,71-1,83 (м, 1H), 1,84-1,97 (м, 1H), 1,98-2,16 (м, 2H), 2,36-2,49 (м, 1H), 2,50-2,61 (м, 1H), 3,10 (д, J=12,0 Гц, 1H), 3,22-3,30 (м, 1H), 3,92-4,12 (м, 5H), 4,25-4,36 (м, 1H), 4,68-4,77 (м, 1H); МС m/z 351 [M+H]+.
Пример 76
(2S,5R)-7-Ооксо-N-[(2S)-пирролидин-2-илметокси]-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбоксамид
Стадия 1
трет-Бутил (2S)-2-{[({[(2S,5R)-6-бензилокси-7-оксо-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}амино)окси]метил}пирролидин-1-карбоксилат
По методике примера 27 из карбоновой кислоты (6b, 390 мг, 1,41 ммоль) из примера 9 или 16 и (S)-трет-бутил 2-(аминоокси)метил)пирролидин-1-карбоксилата (649 мг, полученного по методике ссылочного примера 7 и ссылочного примера 13), получают 477 мг указанного в заголовке соединения (выход 71%).
1H ЯМР (400 МГц, CDCl3): δ 1,46 (с, 9H), 1,62-1,77 (м, 1H), 1,70-2,07 (м, 6H), 2,21-2,37 (м, 1H), 2,88 (шир.д, J=12,4 Гц, 1H), 2,98-3,10 (м, 1H), 3,25-3,38 (м, 3H), 3,65-4,05 (м, 3H), 4,08-4,24 (м, 1H), 4,90 (д, J=11,6 Гц, 1H), 5,05 (д, J=11,6 Гц, 1H), 7,32-7,46 (м, 5H), 10,22 (с, 1H); МС m/z 475 [M+H]+.
Стадия 2
трет-бутил (2S)-2-{[({[(2S,5R)-6-гидрокси-7-оксо-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}амино)окси]метил}пирролидин-1-карбоксилат
По методике примера 17, из общего количества соединения из указанной выше стадии 1, получают указанное в заголовке соединение (выход количественный).
1H ЯМР (400 МГц, CD3OD): δ 1,46 (с, 9H), 1,72-2,27 (м, 8H), 2,99-3,18 (м, 2H), 3,25-3,56 (м, 2H), 3,66-4,10 (м, 5H); МС m/z 385 [M+H]+.
Стадия 3
(2S,5R)-7-Оксо-N-[(2S)-пирролидин-2-илметокси]-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбоксамид
По методике примера 26, из общего количества соединения из указанной выше стадии 2, получают 385,6 мг трет-бутил (2S)-2-{[({[(2S,5R)-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}амино)окси]метил}пирролидин-1-карбоксилат пиридиния (71%).
1H ЯМР (400 МГц, CDCl3): δ 1,45 (с, 9H), 1,65-2,57 (м, 8H), 2,96-3,12 (м, 1H), 3,25-3,44 (м, 4H), 3,68-4,18 (м, 3H), 4,25 (шир.с, 1H), 7,92-8,00 (м, 2H), 8,45 (дд, J=7,6, 7,6 Гц, 1H), 8,98-9,07 (м, 1H), 10,61 (шир.с, 1H); МС m/z 463 [M-C5H5NH]-.
Общее количество полученной выше соли пиридиния подвергают реакции снятия защиты с применением трифторуксусной кислоты и очищают хроматографией на колонке с октадецилсиликагелем с получением 58,1 мг указанного в заголовке соединения (3 стадии, выход 16%).
1H ЯМР (400 МГц, D2O): δ 1,78-2,12 (м, 8H), 3,04 (д, J=12,4 Гц, 1H), 3,18 (шир.д, J=12,4 Гц, 1H), 3,24 (т, J=7,2 Гц, 2H), 3,83 (ддд, J=8,2, 8,2, 3,4 Гц, 1H), 3,89-3,97 (м, 2H), 4,04-4,11 (м, 2H); МС m/z 365 [M+H]+.
Пример 77
(2S,5R)-7-Оксо-N-[(2R)-пирролидин-2-илметокси]-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбоксамид (II-077)

Стадия 1
трет-Бутил (2R)-2-{[({[(2S,5R)-6-бензилокси-7-оксо-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}амино)окси]метил}пирролидин-1-карбоксилат
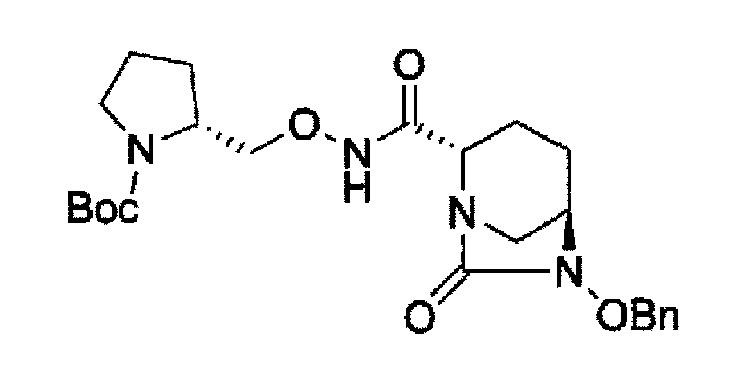
По методике примера 27 из карбоновой кислоты (6b, 390 мг, 1,41 ммоль) из примера 9 или 16 и (R)-трет-Бутил 2-((аминоокси)метил)пирролидин-1-карбоксилат (796 мг), описанного в ссылочном примере 22, получают 336 мг указанного в заголовке соединения (выход 50%).
1H ЯМР (400 МГц, CDCl3): δ 1,45 (с, 9H), 1,52-1,72 (м, 1H), 1,80-2,09 (м, 6H), 2,27-2,39 (м, 1H), 2,84 (шир.д, J=12,4 Гц, 1H), 2,96-3,08 (м, 1H), 3,28-3,44 (м, 3H), 3,60-3,86 (м, 2H), 3,89-4,06 (м, 1H), 4,14-4,29 (м, 1H), 4,90 (д, J=11,2 Гц, 1H), 5,06 (д, J=11,2 Гц, 1H), 7,32-7,47 (м, 5H), 10,56 (с, 1H); МС m/z 475 [M+H]+.
Стадия 2
трет-Бутил (2R)-2-{[({[(2S,5R)-6-гидрокси-7-оксо-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}амино)окси]метил}пирролидин-1-карбоксилат
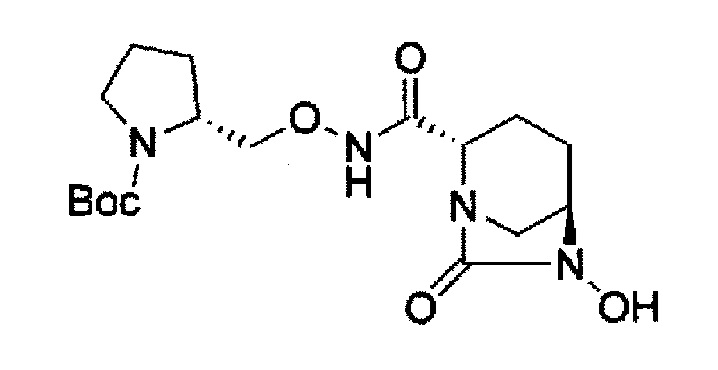
По методике примера 17, из общего количества соединения из указанной выше стадии 1, получают указанное в заголовке соединение (выход количественный).
1H ЯМР (400 МГц, CD3OD): δ 1,46 (с, 9H), 1,73-2,27 (м, 8H), 3,06 (д, J=11,6 Гц, 1H), 3,09-3,18 (м, 1H), 3,24-3,40 (м, 2H), 3,67-3,71 (м, 1H), 3,73-4,12 (м, 4H); МС m/z 385 [M+H]+.
Стадия 3
(2S,5R)-7-Оксо-N-[(2R)-пирролидин-2-илметокси]-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбоксамид
По методике примера 59, из общего количества соединения из указанной выше стадии 2, получают трет-бутил (2R)-2-{[({[(2S,5R)-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}амино)окси]метил}пирролидин-1-карбоксилат тетрабутиламмония (количественный выход).
1H ЯМР (400 МГц, CDCl3): δ 1,01 (т, J=7,4 Гц, 12H), 1,34-1,51 (м, 8H), 1,46 (с, 9H), 1,55-1,78 (м, 10H), 1,80-2,01 (м, 4H), 2,11-2,23 (м, 1H), 2,29-2,42 (м, 1H), 2,88 (шир.д, J=11,2 Гц, 1H), 3,21-3,43 (м, 10H), 3,60-3,86 (м, 2H), 3,88-4,07 (м, 2H), 4,16-4,28 (м, 1H), 4,34 (шир.с, 1H), 10,62 (шир.с, 1H); МС m/z 463 [M-Bu4N+2H]+.
Общее количество полученной выше соли тетрабутиламмония подвергают реакции снятия защиты с применением трифторуксусной кислоты и очищают хроматографией на колонке с октадецилсиликагелем с получением 77,4 мг указанного в заголовке соединения (3 стадии, выход 30%).
1H ЯМР (500 МГц, D2O): δ 1,66-2,18 (м, 8H), 3,14 (д, J=12,8 Гц, 1H), 3,23 (шир.д, J=12,8 Гц, 1H), 3,30 (т, J=7,3 Гц, 2H), 3,89 (ддд, J=8,2, 8,2, 3,4 Гц, 1H), 3,92-4,01 (м, 2H), 4,09-4,18 (м, 2H); МС m/z 365 [M+H]+.
Пример 78
(2S,5R)-7-Оксо-N-[(2S)-пиперидин-2-илметокси]-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбоксамид (II-078)
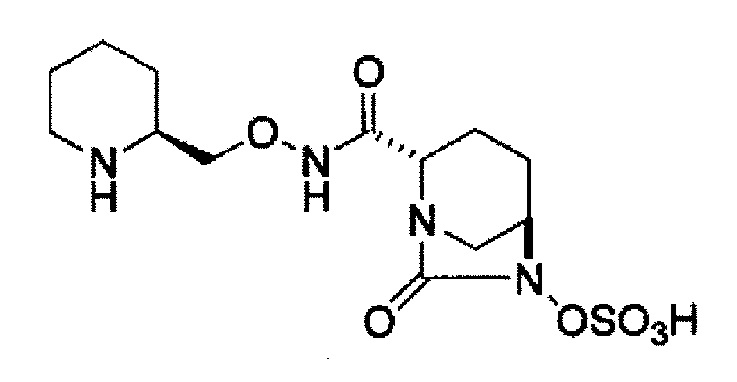
Стадия 1
трет-Бутил (2S)-2-{[({[(2S,5R)-6-бензилокси-7-оксо-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}амино)окси]метил}пиперидин-1-карбоксилат
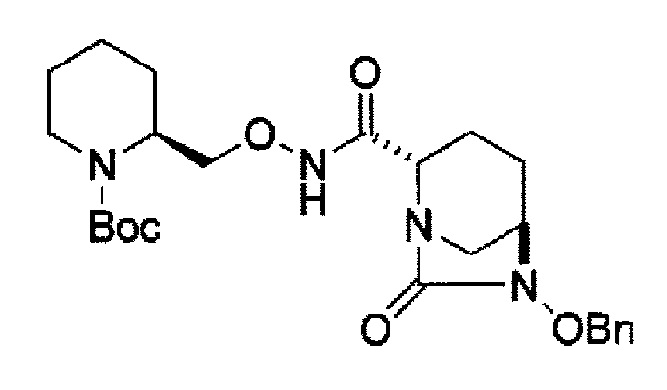
По методике примера 45 из карбоновой кислоты (6b, 553 мг, 2,00 ммоль) из примера 9 или 16 и (S)-трет-Бутил 2-((аминоокси)метил)пиперидин-1-карбоксилата (300 мг), описанного в ссылочном примере 23, получают 353,3 мг указанного в заголовке соединение (выход 72%).
1H ЯМР (400 МГц, CDCl3): δ 1,30-1,75 (м, 7H), 1,46 (с, 9H), 1,90-2,10 (м, 2H), 2,22-2,34 (м, 1H), 2,72-2,90 (м, 1H), 2,85 (д, J=11,2 Гц, 1H), 3,09 (шир.д, J=11,2 Гц, 1H), 3,26-3,32 (м, 1H), 3,68-3,84 (м, 1H), 3,90-4,01 (м, 2H), 4,06-4,15 (м, 1H), 4,44-4,58 (м, 1H), 4,90 (д, J=11,4 Гц, 1H), 5,05 (д, J=11,4 Гц, 1H), 7,35-7,46 (м, 5H), 10,14 (шир.с, 1H); МС m/z 489 [M+H]+.
Стадия 2
трет-Бутил (2S)-2-{[({[(2S,5R)-6-гидрокси-7-оксо-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}амино)окси]метил}пиперидин-1-карбоксилат
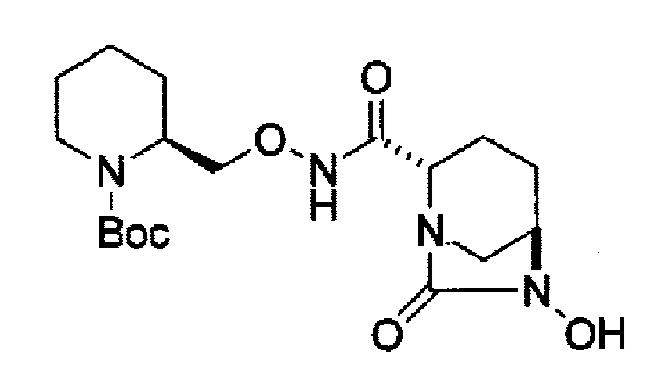
По методике примера 17, из общего количества соединения из указанной выше стадии 1, получают указанное в заголовке соединение (выход количественный).
1H ЯМР (400 МГц, CD3OD): δ 1,33-1,70 (м, 5H), 1,45 (с, 9H), 1,74-2,00 (м, 3H), 2,03-2,12 (м, 1H), 2,17-2,26 (м, 1H), 2,82-2,93 (м, 1H), 3,06 (д, J=12,0 Гц, 1H), 3,14 (шир.д, J=12,0 Гц, 1H), 3,68-3,92 (м, 1H), 3,84 (шир.д, J=6,8 Гц, 1H), 3,92-4,08 (м, 3H), 4,43-4,51 (м, 1H); МС m/z 399 [M+H]+.
Стадия 3
(2S,5R)-7-Оксо-N-[(2S)-пиперидин-2-илметокси]-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбоксамид
По методике примера 59, из общего количества соединения из указанной выше стадии 2, получают трет-бутил (2S)-2-{[({[(2S,5R)-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}амино)окси]метил}пиперидин-1-карбоксилат тетрабутиламмония (количественный выход).
1H ЯМР (400 МГц, CDCl3): δ 1,01 (т, J=7,2 Гц, 12H), 1,14-1,79 (м, 23H), 1,45 (с, 9H), 1,84-2,00 (м, 1H), 2,12-2,23 (м, 1H), 2,24-2,38 (м, 1H), 2,72-2,83 (м, 1H), 2,92 (шир.д, J=12,8 Гц, 1H), 3,21-3,34 (м, 8H), 3,36-3,45 (м, 1H), 3,72-4,18 (м, 4H), 4,35 (шир.с, 1H), 4,45-4,56 (м, 1H); МС m/z 477 [M-Bu4N]-.
Общее количество полученной выше соли тетрабутиламмония подвергают реакции снятия защиты с применением трифторуксусной кислоты и очищают хроматографией на колонке с октадецилсиликагелем с получением 52,8 мг указанного в заголовке соединения (3 стадии, выход 19%).
1H ЯМР (400 МГц, D2O): δ 1,31-1,60 (м, 3H), 1,68-1,89 (м, 5H), 1,92-2,10 (м, 2H), 2,82-2,91 (м, 1H), 3,05 (д, J=12,0 Гц, 1H), 3,18 (шир.д, J=12,0 Гц, 1H), 3,26-3,40 (м, 2H), 3,87 (дд, J=11,8, 9,0 Гц, 1H), 3,94 (шир.д, J=7,2 Гц, 1H), 3,97 (дд, J=11,8, 3,4 Гц, 1H), 4,07-4,12 (м, 1H); МС m/z 377 [M-H]-.
Пример 79
(2S,5R)-N-(Азетидин-3-илокси)-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбоксамид
Стадия 1
трет-Бутил 3-[({[(2S,5R)-6-бензилокси-7-оксо-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}амино)окси]азетидин-1-карбоксилат
По методике примера 27 из карбоновой кислоты (6b, 390 мг, 1,41 ммоль) из примера 9 или 16 и трет-бутил-3-(аминоокси)азетидин-1-карбоксилата (375 мг, полученного по методике ссылочного примера 7 и ссылочного примера 13), получают 558 мг указанного в заголовке соединения (выход 84%).
[α]D24 -17,0° (с 0,30, CHCl3); 1H ЯМР (400 МГц, CDCl3): δ 1,43 (с, 9H), 1,57-1,70 (м, 1H), 1,84-2,07 (м, 2H), 2,31 (шир.дд, J=14,6, 7,4 Гц, 1H), 2,41 (д, J=11,4 Гц, 1H), 3,01 (шир.д, J=11,4 Гц, 1H), 3,29-3,34 (м, 1H), 3,93-4,03 (м, 2H), 4,05-4,16 (м, 2H), 4,69-4,76 (м, 1H), 4,90 (д, J=11,6 Гц, 1H), 5,05 (д, J=11,6 Гц, 1H), 7,33-7,45 (м, 5H), 8,18 (шир.с, 1H); МС m/z 447 [M+H]+.
Стадия 2
трет-Бутил 3-[({[(2S,5R)-6-гидрокси-7-оксо-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}амино)окси]азетидин-1-карбоксилат
По методике примера 17, из соединения (543 мг, 1,22 ммоль) из указанной выше стадии 1, получают 428 мг указанного в заголовке соединения (99%).
1H ЯМР (400 МГц, CD3OD): δ 1,44 (с, 9H), 1,72-1,84 (м, 1H), 1,85-1,99 (м, 1H), 2,00-2,11 (м, 1H), 2,15-2,24 (м, 1H), 3,00 (д, J=11,6 Гц, 1H), 3,11 (шир.д, J=11,6 Гц, 1H), 3,69 (шир.с, 1H), 3,85 (шир.д, J=7,6 Гц, 1H), 3,88-4,00 (м, 2H), 4,03-4,17 (м, 2H), 4,67-4,76 (м, 1H); МС m/z 357 [M+H]+.
Стадия 3
(2S,5R)-N-(Азетидин-3-илокси)-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбоксамид
По методике примера 59, из общего количества соединения (424 мг, 1,19 ммоль) из указанной выше стадии 2, получают 739 мг трет-бутил 3-[({[(2S,5R)-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}амино)окси]азетидин-1-карбоксилата (выход 91%).
1H ЯМР (400 МГц, CDCl3): δ 1,01 (т, J=7,4 Гц, 12H), 1,37-1,53 (м, 8H), 1,44 (с, 9H), 1,57-1,78 (м, 9H), 1,83-1,96 (м, 1H), 2,14-2,23 (м, 1H), 2,34 (шир.дд, J=15,0, 7,0 Гц, 1H), 2,79 (д, J=11,6 Гц, 1H), 3,23-3,40 (м, 9H), 3,93 (шир.д, J=7,6 Гц, 1H), 3,95-4,15 (м, 4H), 4,33-4,38 (м, 1H), 4,70-4,78 (м, 1H), 9,24 (шир.с, 1H); МС m/z 435 [M-Bu4 N]-.
Соль тетрабутиламмония (720 мг, 1,06 ммоль) подвергают реакции снятия защиты с применением трифторуксусной кислоты и очищают хроматографией на колонке с октадецилсиликагелем с получением 144 мг указанного в заголовке соединения (выход 40%).
[α]D25 -69,2° (с 0,32, H2O); 1H ЯМР (400 МГц, D2O): δ 1,67-1,78 (м, 1H), 1,78-1,89 (м, 1H), 1,92-2,09 (м, 2H), 3,00 (д, J=12,2 Гц, 1H), 3,20 (шир.д, J=12,2 Гц, 1H), 3,97 (шир.д, J=7,2 Гц, 1H), 4,04-4,14 (м, 3H), 4,25-4,33 (м, 2H), 4,76-4,84 (м, 1H); МС m/z 337 [M+H]+.
Пример 80
(2S,5R)-7-Оксо-N-[(3R)-пирролидин-3-илокси]-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбоксамид
Стадия 1
трет-Бутил (3R)-3-[({[(2S,5R)-6-бензилокси-7-оксо-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}амино)окси]пирролидин-1-карбоксилат
По методике примера 27 из карбоновой кислоты (6b, 553 мг, 2,00 ммоль) из примера 9 или 16 и (R)-трет-бутил 3-(аминоокси)пирролидин-1-карбоксилата (606 мг), описанного в ссылочном примере 13, получают 904,6 мг указанного в заголовке соединения (выход 98,3%).
1H ЯМР (400 МГц, CDCl3): δ 1,46 (с, 9H), 1,61-1,68 (м, 1H), 1,83-2,09 (м, 3H), 2,13-2,19 (м, 1H), 2,28-2,34 (м, 1H), 2,75 (д, J=11,6 Гц, 1H), 3,03 (шир.д, J=11,6 Гц, 1H), 3,31-3,37 (м, 5H), 3,96 (д, J=6,8 Гц, 1H), 4,68 (шир.с, 1H), 4,90 (д, J=11,6 Гц, 1H), 5,05 (д, J=11,6 Гц, 1H), 7,26-7,43 (м, 5H), 9,06-9,20 (м, 1H); МС m/z 461 [M+H]+
Стадия 2
трет-Бутил (3R)-3-[({[(2S,5R)-6-гидрокси-7-оксо-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}амино)окси]пирролидин-1-карбоксилат
По методике примера 17, из соединения (805 мг, 1,75 ммоль) из указанной выше стадии 1, получают указанное в заголовке соединение (количественный выход).
1H ЯМР (400 МГц, CD3OD): δ 1,46 (с, 9H), 1,75-2,12 (м, 4H), 2,15-2,28 (м, 2H), 3,06 (д, J=11,6 Гц, 1H), 3,13 (шир.д, J=11,6 Гц, 1H), 3,25-3,50 (м, 2H), 3,60 (шир.д, J=12,8 Гц, 1H), 3,70 (шир.с, 1H), 3,87 (шир.д, J=7,2 Гц, 1H), 4,34-4,38 (м, 1H), 4,56-4,63 (м, 1H); МС m/z 371 [M+H]+.
Стадия 3
(2S,5R)-7-Оксо-N-[(3R)-пирролидин-3-илокси]-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбоксамид
По методике примера 59, из общего количества соединения из указанной выше стадии 2, получают трет-бутил (3R)-3-[({[(2S,5R)-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}амино)окси]пирролидин-1-карбоксилат тетрабутиламмония (количественный выход). МС м/z 449 [М-Bu4N]-.
Общее количество полученной выше соли тетрабутиламмония подвергают реакции снятия защиты с применением трифторуксусной кислоты и очищают хроматографией на колонке с октадецилсиликагелем с получением 204,7 мг указанного в заголовке соединения (3 стадии, выход 33%).
1H ЯМР (400 МГц, D2O): δ 1,67-1,88 (м, 2H), 1,92-2,15 (м, 3H), 2,17-2,26 (м, 1H), 3,02 (д, J=12,0 Гц, 1H), 3,20 (шир.д, J=12,0 Гц, 1H), 3,27-3,44 (м, 3H), 3,48 (д, J=12,8 Гц, 1H), 3,96 (шир.д, J=7,2 Гц, 1H), 4,06-4,11 (м, 1H), 4,69-4,74 (м, 1H); МС m/z 349 [M-H]-.
Пример 81
(2S,5R)-7-Оксо-N-[(3S)-пирролидин-3-илокси]-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбоксамид (II-081)
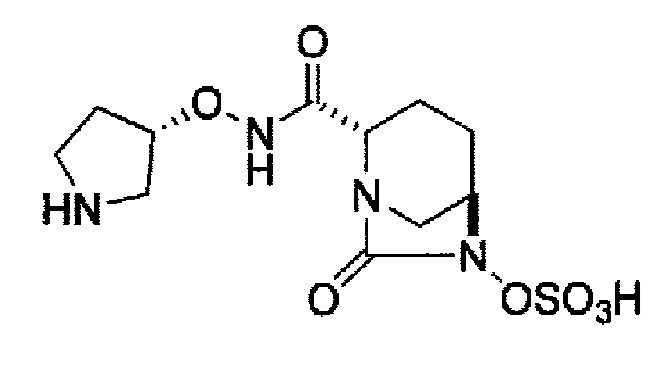
Стадия 1
трет-Бутил (3S)-3-[({[(2S,5R)-6-бензилокси-7-оксо-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}амино)окси]пирролидин-1-карбоксилат
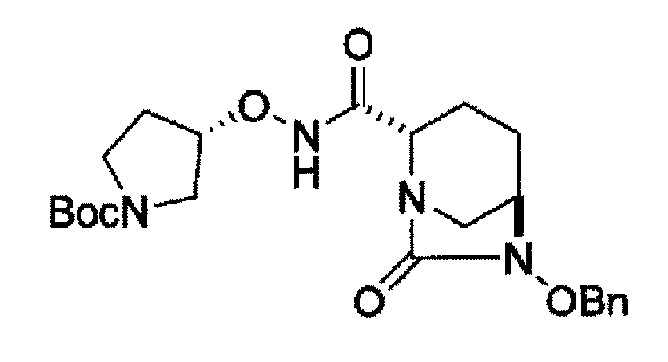
По методике примера 27 из карбоновой кислоты (6b, 553 мг, 2,00 ммоль) из примера 9 или 16 и (S)-трет-бутил 3-(аминоокси)пирролидин-1-карбоксилата (606 мг), описанного в ссылочном примере 24, получают 920,4 мг указанного в заголовке соединения (количественный выход).
1H ЯМР (400 МГц, CDCl3): δ 1,46 (с, 9H), 1,61-1,68 (м, 1H), 1,89-2,09 (м, 3H), 2,15-2,19 (м, 1H), 2,28-2,34 (м, 1H), 2,75 (д, J=11,6 Гц, 1H), 2,95-3,06 (м, 1H), 3,31 (шир.с, 1H), 3,35-3,68 (м, 4H), 3,97 (д, J=7,6 Гц, 1H), 4,60 (шир.д, J=23,2 Гц, 1H), 4,90 (д, J=11,6 Гц, 1H), 5,05 (д, J=11,6 Гц, 1H), 7,26-7,43 (м, 5H), 9,08 (шир.д, J=2 3,2 Гц, 1H); МС m/z 461 [M+H]+.
Стадия 2
трет-Бутил (3S)-3-[({[(2S,5R)-6-гидрокси-7-оксо-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}амино)окси]пирролидин-1-карбоксилат

По методике примера 17, из соединения (869 мг, 1,89 ммоль) из указанной выше стадии 1, получают указанное в заголовке соединение (количественный выход).
1H ЯМР (400 МГц, CD3OD): δ 1,47 (с, 9H), 1,75-2,12 (м, 4H), 2,13-2,25 (м, 2H), 3,05 (д, J=12,0 Гц, 1H), 3,13 (шир.д, J=12,0 Гц, 1H), 3,25-3,50 (м, 2H), 3,61 (шир.д, J=13,2 Гц, 1H), 3,70 (шир.с, 1H), 3,86 (шир.д, J=7,2 Гц, 1H), 4,32-4,38 (м, 1H), 4,54-4,62 (м, 1H); МС m/z 371 [M+H]+.
Стадия 3
(2S,5R)-7-Оксо-N-[(3S)-пирролидин-3-илокси]-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбоксамид
По методике примера 59, из общего количества соединения из указанной выше стадии 2, получают трет-бутил (3S)-3-[({[(2S,5R)-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}амино)окси]пирролидин-1-карбоксилат тетрабутиламмония (количественный выход). МС м/z 449 [М-Bu4N]-.
Общее количество полученной выше соли тетрабутиламмония подвергают реакции снятия защиты с применением трифторуксусной кислоты и очищают хроматографией на колонке с октадецилсиликагелем с получением 170,7 мг указанного в заголовке соединения (3 стадии, выход 26%).
1H ЯМР (400 МГц, D2O): δ 1,71-1,92 (м, 2H), 1,95-2,18 (м, 3H), 2,21-2,30 (м, 1H), 3,07 (д, J=12,2 Гц, 1H), 3,24 (шир.д, J=12,2 Гц, 1H), 3,31-3,45 (м, 3H), 3,51 (д, J=13,6 Гц, 1H), 3,99 (шир.д, J=6,0 Гц, 1H), 4,10-4,14 (м, 1H), 4,72-4,77 (м, 1H); МС m/z 349 [M-H]-.
Пример 82
(2S,5R)-N-(Азетидин-3-илметокси)-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбоксамид (II-082 )
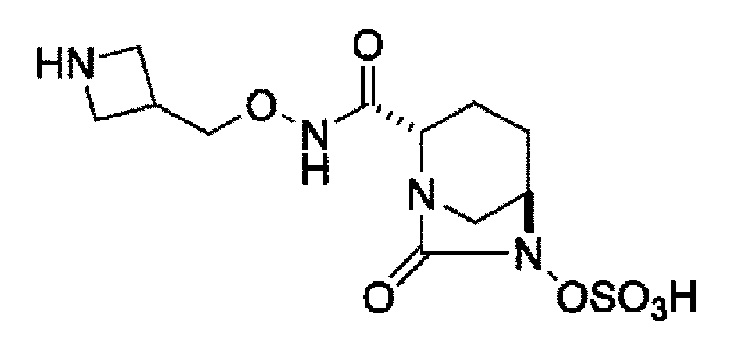
Стадия 1
трет-бутил 3-{[({[(2S,5R)-6-бензилокси-7-оксо-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}амино)окси]метил}азетидин-1-карбоксилат
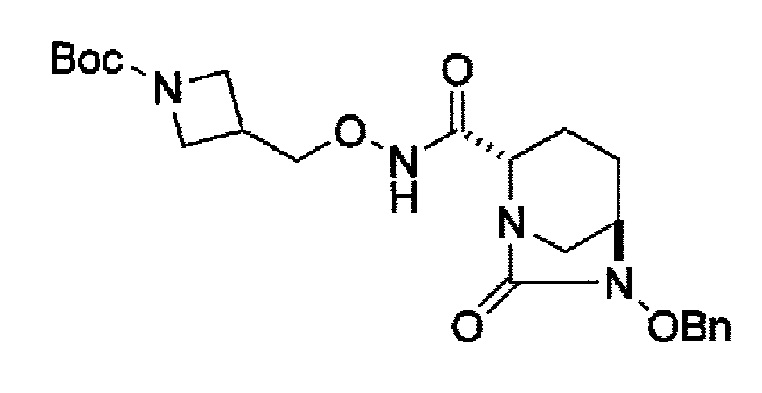
По методике примера 45 из карбоновой кислоты (6b, 553 мг, 2,00 ммоль) из примера 9 или 16 и трет-бутил 3-((аминоокси)метил)азетидин-1-карбоксилата (564 мг), описанного в ссылочном примере 25, получают 699,7 мг указанного в заголовке соединения (выход 76%).
1H ЯМР (400 МГц, CDCl3): δ 1,43 (с, 9H), 1,54-1,70 (м, 1H), 1,87-2,06 (м, 2H), 2,27-2,35 (м, 1H), 2,75 (д, J=11,6 Гц, 1H), 2,80-2,90 (м, 1H), 3,01 (шир.д, J=11,6 Гц, 1H), 3,32 (шир.с, 1H), 3,68-3,76 (м, 2H), 3,94 (шир.д, J=7,6 Гц, 1H), 4,00-4,15 (м, 4H), 4,90 (д, J=11,8 Гц, 1H), 5,05 (д, J=11,8 Гц, 1H), 7,35-7,44 (м, 5H), 9,08 (шир.с, 1H); МС m/z 461 [M+H]+.
Стадия 2
трет-Бутил 3-{[({[(2S,5R)-6-гидрокси-7-оксо-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}амино)окси]метил}азетидин-1-карбоксилат
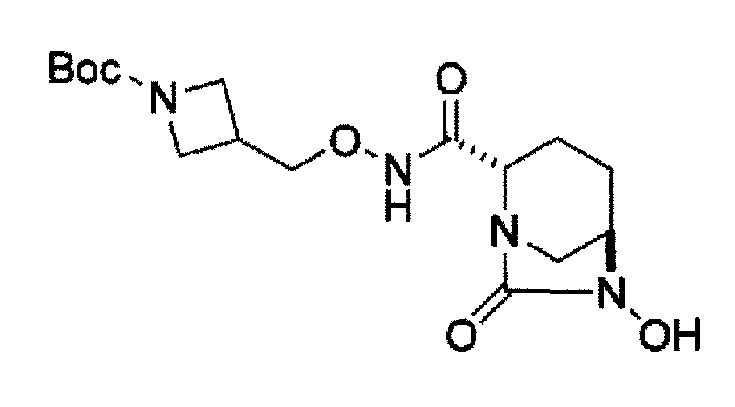
По методике примера 17, из соединения (642 мг, 1,39 ммоль) из указанной выше стадии 1, получают указанное в заголовке соединение (количественный выход).
1H ЯМР (400 МГц, CD3OD): δ 1,43 (с, 9H), 1,74-1,85 (м, 1H), 1,86-1,97 (м, 1H), 2,04-2,13 (м, 1H), 2,16-2,24 (м, 1H), 2,84-2,94 (м, 1H), 3,05 (д, J=11,6 Гц, 1H), 3,13 (шир.д, J=11,6 Гц, 1H), 3,68-3,82 (м, 3H), 3,83 (шир.д, J=6,8 Гц, 1H), 3,97-4,06 (м, 4H); МС m/z 371 [M+H]+.
Стадия 3
(2S,5R)-N-(Азетидин-3-илметокси)-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбоксамид
По методике примера 59, из общего количества соединения из указанной выше стадии 2, получают трет-бутил 3-{[({[(2S,5R)-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}амино)окси]метил}азетидин-1-карбоксилат тетрабутиламмоний (количественный выход).
1H ЯМР (400 МГц, CDCl3): δ 1,01 (т, J=7,2 Гц, 12H), 1,37-1,51 (м, 8H), 1,46 (с, 9H), 1,54-1,75 (м, 9H), 1,82-1,97 (м, 1H), 2,13-2,25 (м, 1H), 2,29-2,40 (м, 1H), 2,77-2,95 (м, 2H), 3,24-3,40 (м, 9H), 3,64-4,16 (м, 7H), 4,36 (шир.с, 1H), 9,16 (шир.с, 1H); МС m/z 449 [M-Bu4N]-.
Общее количество полученной выше соли тетрабутиламмония подвергают реакции снятия защиты с применением трифторуксусной кислоты и очищают хроматографией на колонке с октадецилсиликагелем с получением 164,7 мг указанного в заголовке соединения (3 стадии, выход 34%).
1H ЯМР (400 МГц, D2O): δ 1,65-1,89 (м, 2H), 1,92-2,06 (м, 2H), 3,06 (д, J=12,4 Гц, 1H), 3,10-3,22 (м, 2H), 3,90-4,00 (м, 5H), 4,07-4,14 (м, 3H); МС m/z 351 [M+H]+.
Пример 83
(2S,5R)-7-Оксо-N-[(3R)-пиперидин-3-илметокси]-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбоксамид
Стадия 1
трет-Бутил (3R)-3-{[({[(2S,5R)-6-бензилокси-7-оксо-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}амино)окси]метил}пиперидин-1-карбоксилат
По методике примера 27 из карбоновой кислоты (6b, 390 мг, 1,41 ммоль) из примера 9 или 16 и (R)-трет-бутил 3-((аминоокси)метил)пиперидин-1-карбоксилата (527 мг, полученного по методике ссылочного примера 7 и ссылочного примера 13), получают 333 мг указанного в заголовке соединения (выход 48%).
1H ЯМР (400 МГц, CDCl3): δ 1,15-2,10 (м, 8H), 1,45 (с, 9H), 2,25-2,40 (м, 1H), 2,70-3,08 (м, 4H), 3,27-3,37 (м, 1H), 3,65-4,00 (м, 5H), 4,90 (д, J=11,2 Гц, 1H), 5,05 (д, J=11,2 Гц, 1H), 7,34-7,46 (м, 5H), 9,22 (шир.с, 1H); МС m/z 489 [M+H]+.
Стадия 2
трет-Бутил (3R)-3-{[({[(2S,5R)-6-гидрокси-7-оксо-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}амино)окси]метил}пиперидин-1-карбоксилат
По методике примера 17, из общего количества соединения из указанной выше стадии 1, получают указанное в заголовке соединение (выход количественный).
1H ЯМР (400 МГц, CD3OD): δ 1,24-1,37 (м, 1H), 1,40-1,56 (м, 1H), 1,45 (с, 9H), 1,64-1,73 (м, 1H), 1,75-2,00 (м, 4H), 2,03-2,13 (м, 1H), 2,15-2,26 (м, 1H), 2,65-2,95 (м, 2H), 3,06 (д, J=12,0 Гц, 1H), 3,13 (шир.д, J=12,0 Гц, 1H), 3,67-3,91 (м, 5H), 4,01-4,08 (м, 1H); МС m/z 399 [M+H]+.
Стадия 3
(2S,5R)-7-Оксо-N-[(3R)-пиперидин-3-илметокси]-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбоксамид
По методике примера 59, из общего количества соединения из указанной выше стадии 2, получают трет-бутил (3R)-3-{[({[(2S,5R)-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}амино)окси]метил}пиперидин-1-карбоксилат тетрабутиламмоний (количественный выход).
1H ЯМР (400 МГц, CDCl3): δ 1,01 (дд, J=7,6, 6,8 Гц, 12H), 1,11-1,99 (м, 23H), 1,46 (с, 9H), 2,12-2,24 (м, 1H), 2,30-2,42 (м, 1H), 2,67-2,96 (м, 3H), 3,19-3,38 (м, 9H), 3,70-3,99 (м, 5H), 4,35 (шир.с, 1H), 9,16 (шир.с, 1H); МС m/z 477 [M-Bu4N]-.
Общее количество полученной выше соли тетрабутиламмония подвергают реакции снятия защиты с применением трифторуксусной кислоты и очищают хроматографией на колонке с октадецилсиликагелем с получением 106 мг указанного в заголовке соединения (3 стадии, выход 41%).
1H ЯМР (400 МГц, CDCl3): δ 1,16-1,28 (м, 1H), 1,54-1,88 (м, 5H), 1,92-2,16 (м, 3H), 2,72 (т, J=12,2 Гц, 1H), 2,81 (ддд, J=12,8, 12,8, 3,5 Гц, 1H), 3,02 (д, J=12,0 Гц, 1H), 3,15-3,28 (м, 2H), 3,37-3,44 (м, 1H), 3,70 (дд, J=10,3, 7,6 Гц, 1H), 3,79 (дд, J=10,3, 5,0 Гц, 1H), 3,88-3,94 (м, 1H), 4,06-4,10 (м, 1H); МС m/z 377 [M-H]-.
Пример 84
(2S,5R)-7-Оксо-N-(пиперидин-4-илокси)-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбоксамид
Стадия 1
трет-Бутил 4-[({[(2S,5R)-6-бензилокси-7-оксо-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}амино)окси]пиперидин-1-карбоксилат
По методике примера 27 из карбоновой кислоты (6b, 552 мг, 2,00 ммоль) из примера 9 или 16 и трет-бутил 4-(аминоокси)пиперидин-1-карбоксилата (1,08 г, полученного по методике ссылочного примера 7 и ссылочного примера 13), получают 688,5 мг указанного в заголовке соединения (выход 72,5%).
1H ЯМР (400 МГц, CDCl3): δ 1,43 (с, 9H), 1,58-1,66 (м, 5H), 1,85-2,02 (м, 2H), 2,27 (м, 1H), 2,75-2,77 (шир.д, J=11,6 Гц, 1H), 2,99-3,02 (д, J=11,6 Гц, 1H), 3,07-3,13 (м, 2H), 3,29 (с, 1H), 3,71-3,77 (м, 2H), 3,94-3,96 (д, J=7,2 Гц, 1H), 3,98-4,08 (м, 1H), 4,86-4,90 (д, J=11,2 Гц, 1H), 5,01-5,05 (д, J=11,2 Гц, 1H), 7,34-7,41 (м, 5H), 9,02 (шир.с, 1H); МС m/z 475 [M+H]+.
Стадия 2
трет-Бутил 4-[({[(2S,5R)-6-гидрокси-7-оксо-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}амино)окси]пиперидин-1-карбоксилат
По методике примера 17, из общего количества соединения из указанной выше стадии 1, получают указанное в заголовке соединение (выход количественный). МС м/z 385 [М+Н]+.
Стадия 3
(2S,5R)-7-Оксо-N-(пиперидин-4-илокси)-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбоксамид
По методике примера 17, из общего количества соединения из указанной выше стадии 2, получают трет-бутил 4-[({[(2S,5R)-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}амино)окси]пиперидин-1-карбоксилат тетрабутиламмоний (количественный выход). МС м/z 463 [М-Bu4N]-.
Общее количество полученной выше соли тетрабутиламмония подвергают реакции снятия защиты с применением трифторуксусной кислоты и очищают хроматографией на колонке с октадецилсиликагелем с получением 216,3 мг указанного в заголовке соединения (выход 40,9%).
1H ЯМР (400 МГц, D2O): δ 1,69-2,08 (м, 8H), 2,99-3,06 (м, 3H), 3,18-3,21 (д, J=12,0 Гц, 1H), 3,26-3,31 (м, 2H), 3,96-3,97 (д, J=3,2 Гц, 1H), 4,08-4,12 (м, 2H); МС m/z 365 [M+H]+.
Пример 85
(2S,5R)-7-Оксо-N-(пиперидин-4-илметокси)-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбоксамид
Стадия 1
трет-Бутил 4-{[({[(2S,5R)-6-бензилокси-7-оксо-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}амино)окси]метил}пиперидин-1-карбоксилат
По методике примера 27 из карбоновой кислоты (6b, 390 мг, 1,41 ммоль) из примера 9 или 16 и трет-бутил 4-((аминоокси)метил)пиперидин-1-карбоксилата (749 мг, полученного по методике ссылочного примера 7 и ссылочного примера 13), получают 360,3 мг указанного в заголовке соединения (выход 52%).
1H ЯМР (400 МГц, CDCl3): δ 1,12-1,30 (м, 2H), 1,45 (с, 9H), 1,55-1,69 (м, 1H), 1,70-1,79 (м, 2H), 1,80-2,07 (м, 3H), 2,27-2,38 (м, 1H), 2,60-2,80 (м, 2H), 2,76 (д, J=11,8 Гц, 1H), 3,01 (шир.д, J=11,8 Гц, 1H), 3,31 (шир.с, 1H), 3,68-3,83 (м, 2H), 3,94 (шир.д, J=7,2 Гц, 1H), 4,02-4,20 (м, 2H), 4,91 (д, J=11,4 Гц, 1H), 5,05 (д, J=11,4 Гц, 1H), 7,35-7,44 (м, 5H), 9,04 (шир.с, 1H); МС m/z 489 [M+H]+.
Стадия 2
трет-Бутил 4-{[({[(2S,5R)-6-гидрокси-7-оксо-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}амино)окси]метил}пиперидин-1-карбоксилат
По методике примера 17, из общего количества соединения из указанной выше стадии 1, получают указанное в заголовке соединение (выход количественный).
1H ЯМР (400 МГц, CD3OD): δ 1,11-1,23 (м, 2H), 1,45 (с, 9H), 1,74-1,97 (м, 5H), 2,02-2,11 (м, 1H), 2,15-2,23 (м, 1H), 2,66-2,88 (м, 2H), 3,06 (д, J=11,2 Гц, 1H), 3,09-3,16 (м, 1H), 3,67-3,76 (м, 3H), 3,82 (шир.д, J=6,8 Гц, 1H), 4,07 (шир.д, J=13,6 Гц, 2H); МС m/z 399 [M+H]+
Стадия 3
(2S,5R)-7-Оксо-N-(пиперидин-4-илметокси)-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбоксамид
По методике примера 17, из общего количества соединения из указанной выше стадии 2, получают 504 мг трет-бутил 4-{[({[(2S,5R)-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}амино)окси]метил}пиперидин-1-карбоксилат тетрабутиламмония (выход 95%).
1H ЯМР (400 МГц, CDCl3): δ 1,01 (т, J=7,2 Гц, 12H), 1,17-1,82 (м, 21H), 1,43 (с, 9H), 1,82-1,95 (м, 2H), 2,12-2,22 (м, 1H), 2,31-2,40 (м, 1H), 2,63-2,78 (м, 2H), 2,84 (д, J=12,0 Гц, 1H), 3,16-3,38 (м, 9H), 3,70-3,86 (м, 2H), 3,91 (шир.д, J=7,6 Гц, 1H), 4,00-4,19 (м, 2H), 4,34 (шир.с, 1H), 9,15 (шир.с, 1H); МС m/z 477 [M-Bu4N]-.
Общее количество полученной выше соли тетрабутиламмония подвергают реакции снятия защиты с применением трифторуксусной кислоты и очищают хроматографией на колонке с октадецилсиликагелем с получением 103 мг указанного в заголовке соединения (3 стадии, выход 37%).
1H ЯМР (400 МГц, D2O): δ 1,30-1,46 (м, 2H), 1,68-2,11 (м, 7H), 2,85-2,95 (м, 2H), 3,03 (д, J=12,0 Гц, 1H), 3,19 (шир.д, J=12,0 Гц, 1H), 3,34 (шир.д, J=12,0 Гц, 2H), 3,73 (д, J=6,0 Гц, 2H), 3,93 (д, J=7,2 Гц, 1H), 4,06-4,14 (м, 1H); МС m/z 377 [M-H]-.
Пример 86
(2S,5R)-N-[2-(1Н-Имидазол-1-ил)этокси]7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбоксамид натрия
Стадия 1
(2S,5R)-6-Бензилокси-N-[2-(1Н-имидазол-1-ил)этокси]-7-оксо-1,6-диазабицикло[3.2.1]октан-2-карбоксамид
По методике примера 45 из карбоновой кислоты (6b, 552 мг, 2,00 ммоль) из примера 9 или 16 и O-(2-(1Н-имидазол-1-ил)этил)гидроксиламина (386 мг, полученного по методике ссылочного примера 7 и ссылочного примера 13), получают 770 мг указанного в заголовке соединения (количественный выход).
1H ЯМР (400 МГц, CD3OD): δ 1,70-1,71 (м, 1H), 1,81-1,96 (м, 2H), 2,09-2,14 (м, 1H), 2,90-2,93 (шир.д, J=11,6 Гц, 1H), 3,14 (м, 1H), 3,80-3,85 (м, 2H), 4,12 (м, 1H), 4,22-4,35 (м, 2H), 4,85-4,96 (дд, J=11,2 Гц, 2H), 7,05 (с, 1H), 7,22-7,41 (м, 6H), 8,05 (с, 1H); МС m/z 386 [M+H]+.
Стадия 2
(2S,5R)-6-Гидрокси-N-[2-(1Н-имидазол-1-ил)этокси]-7-оксо-1,6-диазабицикло[3.2.1]октан-2-карбоксамид
По методике примера 17, из общего количества соединения из указанной выше стадии 1, получают указанное в заголовке соединение (выход количественный). МС м/z 296 [М+Н]+.
Стадия 3
(2S,5R)-N-[2-(1Н-Имидазол-1-ил)этокси]7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбоксамид натрия
По методике примера 18, из общего количества соединения из указанной выше стадии 2, получают (2S,5R)-N-[2-(1Н-имидазол-1-ил)этокси]-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбоксамид пиридиния и нейтрализуют насыщенным водным раствором бикарбоната натрия и затем очищают с помощью хроматографии на колонке с октадецилсиликагелем с получением 63,6 мг указанного в заголовке соединения (выход 8,00%).
1H ЯМР (400 МГц, D2O): δ 1,66-1,85 (м, 2H), 1,97-2,09 (м, 2H), 2,94-2,97 (д, J=12,0 Гц, 1H), 3,14-3,17 (д, J=11,6 Гц, 1H), 3,87-3,89 (д, J=7,2 Гц, 1H), 4,07 (с, 1H), 4,13-4,15 (м, 2H), 4,23-4,26 (м, 2H), 7,00 (с, 1H), 7,19 (с, 1H), 7,86 (с, 1H); МС m/z 376 [M-Na+2H]+.
Пример 87
(2S,5R)-7-Оксо-N-[2-(1Н-пиррол-1-ил)этокси]-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбоксамид натрия
Стадия 1
(2S,5R)-6-Бензилокси-7-оксо-N-[2-(1Н-пиррол-1-ил)этокси]-1,6-диазабицикло[3.2.1]октан-2-карбоксамид
По методике примера 27 из карбоновой кислоты (6b, 690 мг, 2,50 ммоль) из примера 9 или 16 и O-(2-(1Н-пиррол-1-ил)этил)гидроксиламина (450,5 мг, полученного по методике ссылочного примера 7 и ссылочного примера 15), получают 506 мг указанного в заголовке соединения (выход 52,6%).
1H ЯМР (400 МГц, CDCl3): δ 1,60-1,65 (м, 1H), 1,87-2,03 (м, 2H), 2,26-2,31 (м, 1H), 2,66-2,69 (д, J=11,6 Гц, 1H), 2,93-2,96 (шир.д, J=11,6 Гц, 1H), 3,29 (шир.с, 1H), 3,88-3,90 (д, J=7,6 Гц, 1H), 4,09-4,23 (м, 4H), 4,87-4,90 (д, J=11,6 Гц, 1H), 5,02-5,05 (д, J=11,6 Гц, 1H), 6,17 (с, 2H), 6,71 (с, 2H), 7,33-7,43 (м, 5H); МС m/z 385 [M+H ]+.
Стадия 2
(2S,5R)-6-Гидрокси-7-оксо-N-[2-(1Н-пиррол-1-ил)этокси]-1,6-диазабицикло[3.2.1]октан-2-карбоксамид
По методике примера 17, из общего количества соединения из указанной выше стадии 1, получают указанное в заголовке соединение (выход количественный). МС м/z 295 [М+Н]+.
Стадия 3
(2S,5R)-7-Оксо-N-[2-(1Н-пиррол-1-ил)этокси]-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбоксамид натрия
По методике примера 22, из общего количества соединения из указанной выше стадии 2, получают (2S,5R)-7-оксо-N-[2-(1Н-пиррол-1-ил)этокси]-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбоксамид пиридиния и нейтрализуют насыщенным водным раствором бикарбоната натрия и затем очищают с помощью хроматографии на колонке с октадецилсиликагелем с получением 153 мг указанного в заголовке соединения (выход 29,4%).
1H ЯМР (400 МГц, D2O): δ 1,64-1,83 (м, 2H), 1,91-2,08 (м, 2H), 2,91-2,94 (д, J=12,0 Гц, 1H), 3,13-3,16 (шир.д, J=12,0 Гц, 1H), 3,87-3,89 (д, J=11,6 Гц, 1H), 4,05-4,09 (м, 5H), 6,17 (с, 2H), 6,74 (с, 2H); МС m/z 375 [M-Na+2H]+.
Пример 88
1-{2-[({[(2S,5R)-7-оксо-6-(сульфонатокси)-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}амино)окси]этил}-1Н-имидазол-2-сульфонат динатрия
Фракция, полученная после очистки хроматографией на колонке с октадецилсиликагелем в примере 86, стадия 3, дает 71,6 мг указанного в заголовке соединения (выход 7,16%).
1H ЯМР (400 МГц, D2O): δ 1,66-1,73 (м, 1H), 1,76-1,86 (м, 1H), 1,92-2,08 (м, 2H), 2,96-2,99 (д, J=12,0 Гц, 1H), 3,17-3,20 (д, J=12,4 Гц, 1H), 3,92-3,94 (д, J=8,0 Гц, 1H), 4,07-4,08 (д, J=3,2 Гц, 1H), 4,22-4,24 (м, 2H), 4,41-4,44 (м, 2H), 7,53 (с, 1H), 7,61 (с, 1H); МС m /z 456 [M-2Na+3H]+.
Пример 89
(2S,5R)-N-[2-(диметиламино)-2-оксоэтокси]-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбоксамид натрия
Стадия 1
(2S,5R)-6-Бензилокси-N-[2-(диметиламино)-2-оксоэтокси]-7-оксо-1,6-диазабицикло[3.2.1]октан-2-карбоксамид
По методике примера 45 из карбоновой кислоты (6b, 552 мг, 2,00 ммоль) из примера 9 или 16 и 2-(аминоокси)-N,N-диметилацетамида (244 мг, Huhu Technology) получают 269,2 мг указанного в заголовке соединения (выход 46%).
1H ЯМР (400 МГц, CDCl3): δ 1,50-1,70 (м, 1H), 1,87-2,10 (м, 2H), 2,24-2,37 (м, 1H), 2,78 (д, J=12,0 Гц, 1H), 2,91 (с, 3H), 2,97 (с, 3H), 3,03 (шир.д, J=12,0 Гц, 1H), 3,26-3,32 (м, 1H), 3,90-3,96 (м, 1H), 4,50-4,67 (м, 2H), 4,90 (д, J=11,4 Гц, 1H), 5,04 (д, J=11,4 Гц, 1H), 7,35-7,45 (м, 5H), 10,04 (шир.с, 1H); МС m/z 377 [M+H]+.
Стадия 2
(2S,5R)-N-[2-(Диметиламино)-2-оксоэтокси]-6-гидрокси-7-оксо-1,6-диазабицикло[3.2.1]октан-2-карбоксамид
По методике примера 17, из общего количества соединения из указанной выше стадии 1, получают указанное в заголовке соединение (выход количественный).
1H ЯМР (400 МГц, CD3OD): δ 1,73-1,84 (м, 1H), 1,85-1,99 (м, 1H), 2,02-2,12 (м, 1H), 2,16-2,26 (м, 1H), 2,95 (с, 3H), 3,02-3,15 (м, 2H), 3,05 (с, 3H), 3,67-3,73 (м, 1H), 3,85 (шир.д, J=7,2 Гц, 1H), 4,57-4,68 (м, 2H); МС m/z 287 [M+H]+.
Стадия 3
(2S,5R)-N-[2-(диметиламино)-2-оксоэтокси]-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбоксамид натрия
По методике примера 18, из общего количества соединения из указанной выше стадии 2, получают (2S,5R)-N-[2-(диметиламино)-2-оксоэтокси]-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбоксамид пиридиния и нейтрализуют насыщенным водным раствором бикарбоната натрия и затем очищают с помощью хроматографии на колонке с октадецилсиликагелем с получением 180,0 мг указанного в заголовке соединения (2 стадии, выход 65%).
1H ЯМР (500 МГц, D2O): δ 1,72-1,85 (м, 2H), 1,89-2,20 (м, 2H), 2,86 (с, 3H), 2,99 (с, 3H), 3,11 (шир.д, J=11,8 Гц, 1H), 3,28 (шир.д, J=11,8 Гц, 1H), 3,76-3,81 (м, 1H), 4,08-4,12 (м, 1H), 4,49 (с, 2H); МС m/z 367 [M-Na+2H]+.
Пример 90
(2S,5R)-7-Оксо-N-[2-оксо-2-(пиперазин-1-ил)этокси]-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбоксамид
Стадия 1
трет-Бутил 4-{[({[(2S,5R)-6-бензилокси-7-оксо-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}амино)окси]ацетил}пиперазин-1-карбоксилат
По методике примера 27 из карбоновой кислоты (6b, 552 мг, 2,00 ммоль) из примера 9 или 16 и трет-бутил 4-(2-(аминоокси)ацетил)пиперазин-1-карбоксилата (686,2 мг, полученного по методике ссылочного примера 14 и ссылочного примера 15), получают 499,8 мг указанного в заголовке соединения (выход 48,3%).
1H ЯМР (400 МГц, CDCl3): δ 1,43 (с, 9H),1,67 (м, 1H), 1,90-2,04 (м, 2H), 2,26-2,31 (м, 1H), 2,75-2,78 (д, J=11,6 Гц, 1H), 3,01-3,04 (д, J=11,6 Гц, 1H), 3,33 (м, 3H), 3,45 (м, 4H), 3,58 (м, 2H), 3,92-3,94 (д, J=11,2 Гц, 1H), 4,53-4,56 (д, J=14,4 Гц, 1H), 4,60-4,63 (д, J=14,4 Гц, 1H), 4,88-4,92 (д, J=11,6 Гц, 1H), 5,02-5,07 (д, J=11,6 Гц, 1H), 7,26-7,43 (м, 5H); МС m/z 518 [M+H]+.
Стадия 2
трет-Бутил 4-{[({[(2S,5R)-6-гидрокси-7-оксо-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}амино)окси]ацетил}пиперазин-1-карбоксилат
По методике примера 17, из общего количества соединения из указанной выше стадии 1, получают указанное в заголовке соединение (выход количественный). МС м/z 428 [М+Н]+.
Стадия 3
(2S,5R)-7-Оксо-N-[2-оксо-2-(пиперазин-1-ил)этокси]-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбоксамид
По методике примера 17, из общего количества соединения из указанной выше стадии 2, получают трет-бутил 4-{[({[(2S,5R)-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}амино)окси]ацетил}пиперазин-1-карбоксилат тетрабутиламмония (количественный выход).
1H ЯМР (400 МГц, CDCl3): δ 1,00 (м, 12H), 1,40 (м, 8H), 1,43 (с, 9H),1,62 (м, 8H), 1,84-1,94 (м, 1H), 2,08 (м, 1H), 2,16-2,20 (м, 1H), 2,29-2,34 (м, 1H), 2,81-2,84 (д, J=12,0 Гц, 1H), 3,35-3,37 (м, 3H), 3,45 (м, 4H), 3,54 (м, 2H), 3,89-3,92 (д, J=12,4 Гц, 1H), 4,09-4,14 (м, 8H), 4,31 (шир.с, 1H), 4,51-4,59 (д, J=14,4 Гц, 1H), 4,61-4,65 (д, J=14,4 Гц, 1H); МС m/z 508 [M-Bu4N+H]+.
Общее количество полученной выше соли тетрабутиламмония подвергают реакции снятия защиты с применением трифторуксусной кислоты и очищают хроматографией на колонке с октадецилсиликагелем с получением 149,8 мг указанного в заголовке соединения (выход 38,1%).
1H ЯМР (400 МГц, D2O): δ 1,17-1,89 (м, 2H), 1,96-2,12 (м, 2H), 3,05-3,08 (д, J=12,4 Гц, 1H), 3,19-3,26 (дт, J=5,2, 16,8 Гц, 4H), 3,22 (м, 1H), 3,68-3,75 (дт, J=5,2, 16,8 Гц, 4H), 3,94-3,96 (д, J=5,6 Гц, 1H), 4,11-4,12 (шир.с, 1H), 4,61-4,68 (м, 2H); МС m/z 408 [M+H]+.
Пример 91
(2S,5R)-N-[2-(морфолин-4-ил)-2-оксоэтокси]-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбоксамид натрия
Стадия 1
(2S,5R)-6-Бензилокси-N-[2-(морфолин-4-ил)-2-оксоэтокси]-7-оксо-1,6-диазабицикло[3.2.1]октан-2-карбоксамид
По методике примера 27 из карбоновой кислоты (6b, 690 мг, 2,50 ммоль) из примера 9 или 16 и 2-(аминоокси)-1-морфолиноэтанона (641 мг, полученного по методике ссылочного примера 14 и ссылочного примера 15), получают 941,9 мг указанного в заголовке соединения (выход 90,0%).
1H ЯМР (400 МГц, CDCl3): δ 1,61-1,66 (м, 1H), 1,91-2,04 (м, 2H), 2,21-2,31 (м, 1H), 2,77-2,79 (д, J=11,6 Гц, 1H), 2,96-2,97 (д, J=4,4 Гц, 1H), 3,01-3,04 (шир.д, J=11,2 Гц, 1H), 3,29-3,38 (м, 4H), 3,57-3,70 (м, 4H), 3,92-3,94 (д, J=7,2 Гц, 1H), 4,52-4,66 (дд, J=11,6,1 4,4 Гц, 2H), 4,87-4,91 (д, J=11,6 Гц, 1H), 5,02-5,05 (д, J=11,6 Гц, 1H), 7,36-7,47 (м, 5H); МС m/z 419 [M+H]+.
Стадия 2
(2S,5R)-6-Гидрокси-N-[2-(морфолин-4-ил)-2-оксоэтокси]-7-оксо-1,6-диазабицикло[3.2.1]октан-2-карбоксамид
По методике примера 17, из общего количества соединения из указанной выше стадии 1, получают указанное в заголовке соединение (выход количественный). МС м/z 329 [М+Н]+.
Стадия 3
(2S,5R)-N-[2-(морфолин-4-ил)-2-оксоэтокси]-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбоксамид натрия
По методике примера 22, из общего количества соединения из указанной выше стадии 2, получают (2S,5R)-N-[2-(морфолин-4-ил)-2-этокси]-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбоксамид пиридиния и нейтрализуют насыщенным водным раствором бикарбоната натрия и затем очищают с помощью хроматографии на колонке с октадецилсиликагелем с получением 152 мг указанного в заголовке соединения (выход 15,7%).
1H ЯМР (400 МГц, D2O): δ 1,67-1,85 (м, 2H), 1,92-2,04 (м, 2H), 3,00-3,03 (д, J=12,0 Гц, 1H), 3,15-3,18 (д, J=12,0 Гц, 1H), 3,37-3,47 (м, 4H), 3,60-3,62 (м, 4H), 3,90-3,92 (д, J=6,4 Гц, 1H), 4,6 (шир.с, 1H), 4,62-4,68 (м, 2H); МС m/z 409 [M-Na+2H]+.
Пример 92
(2S,5R)-N-[2-(1,4-Диазепан-1-ил)-2-оксоэтокси]-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбоксамид
Стадия 1
трет-Бутил 4-{[({[(2S,5R)-6-бензилокси-7-оксо-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}амино)окси]ацетил}-1,4-диазепин-1-карбоксилат
По методике примера 27 из карбоновой кислоты (6b, 690 мг, 2,50 ммоль) из примера 9 или 16 и трет-бутил-4-(2-(аминоокси)ацетил)-1,4-диазепин-1-карбоксилата (1,298 г), описанного в ссылочном примере 15, получают 517,6 мг указанного в заголовке соединения (выход 38,9%).
1H ЯМР (400 МГц, CDCl3): δ 1,44 (с, 9H), 1,58 (м, 1H), 1,83-1,96 (м, 3H), 2,27 (м, 1H), 2,75 (м, 1H), 2,99 (м, 1H), 3,30-3,80 (м, 9H), 3,90 (шир.с, 1H), 4,58 (м, 2H), 4,88 (м, 1H), 5,03 (м, 1H), 7,24-7,37 (м, 5H); МС m/z 532 [M+H]+.
Стадия 2
трет-Бутил 4-{[({[(2S,5R)-6-гидрокси-7-оксо-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}амино)окси]ацетил}-1,4-диазепин-1-карбоксилат
По методике примера 17, из общего количества соединения из указанной выше стадии 1, получают указанное в заголовке соединение (выход количественный). МС м/z 442 [М+Н]+.
Стадия 3
(2S,5R)-N-[2-(1,4-Диазепан-1-ил)-2-оксоэтокси]-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбоксамид
По методике примера 17, из общего количества соединения из указанной выше стадии 2, получают трет-бутил 4-{[({[(2S,5R)-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}амино)окси]ацетил}-1,4-диазепин-1-карбоксилат тетрабутиламмония (количественный выход). МС м/z 520 [М-Bu4N]-.
Полученную выше соль тетрабутиламмония (742,4 мг, 0,973 ммоль) подвергают реакции снятия защиты с применением трифторуксусной кислоты и очищают хроматографией на колонке с октадецилсиликагелем с получением 153,1 мг указанного в заголовке соединения (выход 37,3%).
1H ЯМР (400 МГц, D2O): δ 1,71-1,89 (м, 2H), 1,97-2,16 (м, 4H), 3,06-3,10 (д, J=12,0 Гц, 1H), 3,19-3,22 (д, J=12,4 Гц, 1H), 3,25-3,29 (м, 3H), 3,36-3,39 (м, 2H), 3,50-3,60 (м, 2H), 3,73-3,75 (м, 2H), 3,94-3,95 (д, J=7,2 Гц, 1H), 4,11 (с, 1H), 4,62-4,69 (м, 2H); МС m/z 422 [М+Н]+.
Пример 93
(2S,5R)-7-оксо-N-[2-(2-оксопирролидин-1-ил)этокси]-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбоксамид натрия
Стадия 1
(2S,5R)-6-Бензилокси-7-оксо-N-[2-(2-оксопирролидин-1-ил)этокси]-1,6-диазабицикло[3.2.1]октан-2-карбоксамид
По методике примера 27 из карбоновой кислоты (6b, 550 мг, 2,00 ммоль) из примера 9 или 16 и 1-(2-(аминоокси)этил)пирролидин-2-она (518,4 мг) получают 699,5 мг указанного в заголовке соединения (выход 86,9%).
1H ЯМР (400 МГц, CDCl3): δ 1,60-1,66 (м, 1H), 1,92-2,11 (м, 4H), 2,26-2,31 (м, 1H), 2,40-2,44 (м, 2H), 2,78-2,81 (шир.д, J=12,0 Гц, 1H), 3,06-3,09 (д, J=11,6 Гц, 1H), 3,27 (шир.с, 1H), 3,33-3,38 (м, 1H), 3,44-3,54 (м, 2H), 3,68-3,74 (м, 1H), 3,94-4,14 (м, 3H), 4,87-4,90 (д, J=11,2 Гц, 1H), 5,02-5,04 (д, J=11,2 Гц, 1H), 7,26-7,42 (м, 5H), 10,10 (шир.с, 1H); МС m/z 403 [M+H]+.
Стадия 2
(2S,5R)-6-Гидрокси-7-оксо-N-[2-(2-оксопирролидин-1-ил)этокси]-1,6-диазабицикло[3.2.1]октан-2-карбоксамид
По методике примера 17, из общего количества соединения из указанной выше стадии 1, получают указанное в заголовке соединение (выход количественный). МС м/z 313 [М+Н]+.
Стадия 3
(2S,5R)-7-оксо-N-[2-(2-оксопирролидин-1-ил)этокси]-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбоксамид натрия
По методике примера 22, из общего количества соединения из указанной выше стадии 2, получают (2S,5R)-7-оксо-N-[2-(оксопирролидин-1-ил)этокси]-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбоксамид пиридиния и нейтрализуют насыщенным водным раствором бикарбоната натрия и затем очищают с помощью хроматографии на колонке с октадецилсиликагелем с получением 460,6 мг указанного в заголовке соединения (выход 64,2%).
1H ЯМР (400 МГц, D2O): δ 1,67-1,73 (м, 1H), 1,79-1,87 (м, 1H), 1,90-2,06 (м, 4H), 2,30-2,34 (т, J=8,4 Гц, 1H), 3,01-3,08 (д, J=12,4 Гц, 1H), 3,19-3,22 (д, J=12,0 Гц, 1H), 3,38-3,50 (м, 4H), 3,93-3,99 (м, 3H), 4,09 (шир.с, 1H); МС m/z 393 [M-Na+2H]+.
Пример 94
(2S,5R)-7-Оксо-N-[2-(2-оксоимидазолидин-1-ил)этокси]-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбоксамид натрия
Стадия 1
(2S,5R)-6-Бензилокси-7-оксо-N-[2-(2-оксоимидазолидин-1-ил)этокси]-1,6-диазабицикло[3.2.1]октан-2-карбоксамид
По методике примера 45 из карбоновой кислоты (6b, 390 мг, 1,41 ммоль) из примера 9 или 16 и 1-(2-(аминоокси)этил)имидазолидин-2-она (512 мг, полученного по методике ссылочного примера 7 и ссылочного примера 15), получают 347 мг указанного в заголовке соединения (выход 61%).
1H ЯМР (400 МГц, CDCl3): δ 1,50-1,68 (м, 1H), 1,91-2,06 (м, 2H), 2,24-2,35 (м, 1H), 2,80 (д, J=12,0 Гц, 1H), 3,06 (шир.д, J=12,0 Гц, 1H), 3,21-3,39 (м, 2H), 3,40-3,68 (м, 5H), 3,92-4,06 (м, 3H), 4,32 (шир.с, 1H), 4,89 (д, J=11,6 Гц, 1H), 5,04 (д, J=11,6 Гц, 1H), 7,33-7,44 (м, 5H), 10,10 (шир.с, 1H); МС m/z 404 [M+H]+.
Стадия 2
(2S,5R)-6-Гидрокси-7-оксо-N-[2-(2-оксоимидазолидин-1-ил)этокси]-1,6-диазабицикло[3.2.1]октан-2-карбоксамид
По методике примера 17, из общего количества соединения из указанной выше стадии 1, получают указанное в заголовке соединение (выход количественный).
1H ЯМР (400 МГц, CD3OD): δ 1,74-1,84 (м, 1H), 1,87-2,13 (м, 2H), 2,16-2,27 (м, 1H), 3,04 (д, J=11,6 Гц, 1H), 3,11-3,18 (м, 1H), 3,27-3,49 (м, 4H), 3,58-3,66 (м, 2H), 3,67-3,73 (м, 1H), 3,85 (шир.д, J=7,6 Гц, 1H), 3,92-4,05 (м, 2H); МС m/z 314 [M+H]+.
Стадия 3
(2S,5R)-7-Оксо-N-[2-(2-оксоимидазолидин-1-ил)этокси]-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбоксамид натрия
К раствору общего количества соединения из указанной выше стадии 2 в метиленхлориде (8,6 мл) добавляют 2,6-лутидин (300 мкл) и комплекс триоксид серы - пиридин (410 мг), и смесь перемешивают при комнатной температуре в течение ночи. К реакционному раствору добавляют метиленхлорид, затем фильтруют концентрируют при пониженном давлении. К полученным 486,7 мг (2S,5R)-7-оксо-N-[2-(2-оксоимидазолидин-1-ил)этокси]-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбоксамида пиридиния добавляют водный раствор бикарбоната натрия, затем лиофилизируют. Получают неочищенный продукт. Полученный неочищенный продукт очищают хроматографией на колонке с октадецилсиликагелем с получением 36,8 мг указанного в заголовке соединения (2 стадии, выход 10%).
1H ЯМР (400 МГц, D2O): δ 1,59-2,08 (м, 4H), 3,02 (д, J=12,6 Гц, 1H), 3,18 (шир.д, J=12,6 Гц, 1H), 3,27-3,49 (м, 4H), 3,59-3,67 (м, 2H), 3,90-3,98 (м, 3H), 4,05-4,10 (м, 1H); МС m/z 394 [M-Na+2H]+.
Пример 95
(2S,5R)-N-(2-Гидроксиэтокси)-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбоксамид натрия
Стадия 1
(2S,5R)-6-Бензилокси-7-оксо-N-(2-триизопропилсилилоксиэтокси)-1,6-диазабицикло[3.2.1]октан-2-карбоксамид
По методике примера 45 из карбоновой кислоты (6b, 553 мг, 2,00 ммоль) из примера 9 или 16 и O-(2-((триизопропилсилил)окси)этил)гидроксиламина (630 мг, полученного по методике ссылочного примера 15 из соединения ссылочного примера 12), получают 695,0 мг указанного в заголовке соединения (выход 71%).
1H ЯМР (400 МГц, CDCl3): δ 1,00-1,20 (м, 21H), 1,57-1,70 (м, 1H), 1,88-2,10 (м, 2H), 2,28-2,37 (м, 1H), 2,78 (д, J=11,6 Гц, 1H), 2,98 (шир.д, J=11,6 Гц, 1H), 3,31 (шир.с, 1H), 3,87-4,08 (м, 5H), 4,90 (д, J=11,4 Гц, 1H), 5,05 (д, J=11,4 Гц, 1H), 7,35-7,45 (м, 5H), 9,38 (шир.с, 1H); МС m/z 492 [M+H]+.
Стадия 2
(2S,5R)-6-Гидрокси-7-оксо-N-(2-триизопропилсилилоксиэтокси)-1,6-диазабицикло[3.2.1]октан-2-карбоксамид
По методике примера 17, из общего количества соединения из указанной выше стадии 1, получают 530,7 мг указанного в заголовке соединения (выход 94%).
1H ЯМР (400 МГц, CD3OD): δ 1,00-1,20 (м, 21H), 1,74-1,85 (м, 1H), 1,86-1,99 (м, 1H), 2,01-2,13 (м, 1H), 2,15-2,25 (м, 1H), 3,06 (д, J=1 1,6 Гц, 1H), 3,12 (шир.д, J=11,6 Гц, 1H), 3,69 (шир.с, 1H), 3,82 (шир.д, J=7,2 Гц, 1H), 3,90-4,01 (м, 4H); МС m/z 402 [M+H]+.
Стадия 3
(2S,5R)-N-(2-Гидроксиэтокси)-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбоксамид натрия
По методике примера 59, из общего количества соединения из указанной выше стадии 2, получают (2S,5R)-7-оксо-6-(сульфоокси)-N-(2-триизопропилсилилоксиэтокси)-1,6-диазабицикло[3.2.1]октан-2-карбоксамид тетрабутиламмония (количественный выход).
1H ЯМР (400 МГц, CDCl3): δ 0,87-1,19 (м, 33H), 1,36-1,98 (м, 18H), 2,13-2,23 (м, 1H), 2,31-2,42 (м, 1H) 2,85 (шир.д, J=11,6 Гц, 1H), 3,21-3,38 (м, 9H), 3,83-4,17 (м, 5H), 4,35 (шир.с, 1H), 9,37 (шир.с, 1H); МС m/z 480 [M-Bu4N]-.
Общее количество полученной выше соли тетрабутиламмония подвергают реакции снятия защиты с применением трифторуксусной кислоты и очищают хроматографией на колонке с октадецилсиликагелем с получением 140,2 мг указанного в заголовке соединения (3 стадии, выход 29%).
1H ЯМР (400 МГц, D2O): δ 1,65-1,88 (м, 2H), 1,91-2,08 (м, 2H), 3,04 (д, J=12,0 Гц, 1H), 3,18 (шир.д, J=12,0 Гц, 1H), 3,63-3,69 (м, 2H), 3,85-3,96 (м, 3H), 4,05-4,09 (м, 1H); МС m/z 324 [M-Na]-.
Пример 96
(2S,5R)-N-(2-метоксиэтокси)-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбоксамид натрия
Стадия 1
(2S,5R)-6-Бензилокси-N-(2-метоксиэтокси)-7-оксо-1,6-диазабицикло[3.2.1]октан-2-карбоксамид
По методике примера 45 из карбоновой кислоты (6b, 414 мг, 1,50 ммоль) из примера 9 или 16 и O-(2-метоксиэтил)гидроксиламина (190 мг, Huhu Technology) получают 386,7 мг указанного в заголовке соединения (выход 74%).
1H ЯМР (400 МГц, CDCl3): δ 1,57-1,72 (м, 1H), 1,88-2,10 (м, 2H), 2,29-2,37 (м, 1H), 2,78 (д, J=11,8 Гц, 1H), 2,99 (шир.д, J=11,8 Гц, 1H), 3,30 (шир.с, 1H), 3,39 (с, 3H), 3,63 (т, J=4,4 Гц, 2H), 3,95 (шир.д, J=7,6 Гц, 1H), 4,01-4,15 (м, 2H), 4,90 (д, J=11,4 Гц, 1H), 5,05 (д, J=11,4 Гц, 1H), 7,35-7,45 (м, 5H), 9,32 (шир.с, 1H); МС m/z 350 [M+H]+.
Стадия 2
(2S,5R)-6-Гидрокси-N-(2-метоксиэтокси)-7-оксо-1,6-диазабицикло[3.2.1]октан-2-карбоксамид
По методике примера 17, из общего количества соединения из указанной выше стадии 1, получают 272,4 мг указанного в заголовке соединения (выход 95%).
1H ЯМР (400 МГц, CD3OD): δ 1,74-1,85 (м, 1H), 1,86-1,98 (м, 1H), 2,02-2,12 (м, 1H), 2,16-2,25 (м, 1H), 3,08 (д, J=11,6 Гц, 1H), 3,12 (b r d, J=11,6 Гц, 1H), 3,37 (с, 3H), 3,61-3,65 (м, 2H), 3,67-3,72 (м, 1H), 3,82 (шир.д, J=8,4 Гц, 1H), 3,99-4,03 (м, 2H); МС m/z 260 [M+H]+.
Стадия 3
(2S,5R)-N-(2-метоксиэтокси)-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбоксамид натрия
По методике примера 18, из общего количества соединения из указанной выше стадии 2, получают (2S,5R)-N-(2-метоксиэтокси)-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбоксамид пиридиния и нейтрализуют насыщенным водным раствором бикарбоната натрия и затем очищают с помощью хроматографии на колонке с октадецилсиликагелем с получением 247,4 мг указанного в заголовке соединения (2 стадии, выход 62%).
1H ЯМР (500 МГц, D2O): δ 1,69-1,78 (м, 1H), 1,78-1,88 (м, 1H), 1,93-2,01 (м, 1H), 2,01-2,09 (м, 1H), 3,06 (д, J=12,3 Гц, 1H), 3,20 (шир.д, J=12,3 Гц, 1H), 3,28 (с, 3H), 3,57-3,62 (м, 2H), 3,94 (шир.д, J=6,5 Гц, 1H), 3,94-3,99 (м, 2H), 4,08-4,13 (м, 1H); МС m/z 340 [M-Na+2H]+.
Пример 97
(2S,5R)-N-[2-(метилсульфонил)этокси]-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбоксамид натрия
Стадия 1
(2S,5R)-6-Бензилокси-N-[2-(метилсульфонил)этокси]-7-оксо-1,6-диазабицикло[3.2.1]октан-2-карбоксамид
По методике примера 45 из карбоновой кислоты (6b, 414 мг, 1,50 ммоль) из примера 9 или 16 и O-(2-(метилсульфонил)этил)гидроксиламина (279 мг, Huhu Technology) получают 293 мг указанного в заголовке соединения (выход 49%).
1H ЯМР (400 МГц, CDCl3): δ 1,44-1,70 (м, 1H), 1,90-2,10 (м, 2H), 2,24-2,36 (м, 1H), 2,74 (д, J=12,0 Гц, 1H), 3,04 (шир.д, J=12,0 Гц, 1H), 3,12 (с, 3H), 3,31-3,39 (м, 3H), 3,96 (шир.д, J=7,6 Гц, 1H), 4,38 (шир.т, J=5,4 Гц, 2H), 4,91 (д, J=11,4 Гц, 1H), 5,05 (д, J=11,4 Гц, 1H), 7,36-7,45 (м, 5H), 9,31 (шир.с, 1H); МС m/z 398 [M+H]+.
Стадия 2
(2S,5R)-6-Гидрокси-N-[2-(метилсульфонил)этокси]-7-оксо-1,6-диазабицикло[3.2.1]октан-2-карбоксамид
По методике примера 17, из общего количества соединения из указанной выше стадии 1, получают указанное в заголовке соединение (выход количественный).
1H ЯМР (400 МГц, CD3OD): δ 1,77-1,86 (м, 1H), 1,87-1,99 (м, 1H), 2,03-2,13 (м, 1H), 2,17-2,26 (м, 1H), 3,04 (д, J=12,0 Гц, 1H), 3,07-3,18 (м, 4H), 3,46 (т, J=5,6 Гц, 2H), 3,68-3,74 (м, 1H), 3,86 (шир.д, J=6,4 Гц, 1H), 4,30 (т, J=5,6 Гц, 2H); МС m/z 308 [M+H]+.
Стадия 3
(2S,5R)-N-[2-(метилсульфонил)этокси]-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбоксамид натрия
К раствору общего количества соединения из указанной выше стадии 2 в метиленхлориде (7,4 мл) добавляют 2,6-лутидин (257 мкл) и комплекс триоксид серы - пиридин (352 мг), и смесь перемешивают при комнатной температуре в течение ночи. Полученный (2S,5R)-N-[2-(метилсульфонил)этокси]-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбоксамид пиридиния нейтрализуют добавлением насыщенного водного раствора бикарбоната натрия. Органический растворитель отгоняют при пониженном давлении, затем лиофилизируют с получением неочищенного продукта. Полученный неочищенный продукт очищают хроматографией на колонке с октадецилсиликагелем с получением 51,1 мг указанного в заголовке соединения (2 стадии, выход 17%).
1H ЯМР (400 МГц, D2O): δ 1,65-1,86 (м, 2H), 1,90-2,06 (м, 2H), 3,00-3,10 (м, 1H), 3,05 (с, 3H), 3,06 (д, J=12,0 Гц, 1H), 3,15 (шир.д, J=12,0 Гц, 1H), 3,49 (шир.т, J=5,6 Гц, 2H), 3,86-3,93 (м, 1H), 4,05-4,09 (м, 1H), 4,22 (шир.т, J=5,6 Гц, 1H); МС m/z 388 [M-Na+2H]+.
Пример 98
(2S,5R)-5-(Бензилоксиамино)-1-(2,2,2-трифторацетил)пиперидин-2-карбоновая кислота (IV-a2)

Раствор (2S,5R)-трет-бутил 5-(бензилоксиамино)-1-(2,2,2-трифторацетил)пиперидин-2-карбоксилата (1,50 г, 3,73 ммоль) в метиленхлориде (5,0 мл) охлаждают льдом и добавляют трифторуксусную кислоту (5,0 мл) и оставляют взаимодействовать при той же температуре в течение 30 минут и затем при комнатной температуре в течение 2 часов. Реакционную смесь концентрируют при пониженном давлении, затем к остатку добавляют воду и 6,5% водный раствор бикарбоната натрия. После доведения рН до около рН 8 водный слой промывают этилацетатом. К этому водному слою добавляют 5% водный раствор гидросульфата калия. После доведения рН до около рН 5,6 водный слой экстрагируют этилацетатом. Затем органический слой промывают насыщенным раствором соли, сушат над безводным сульфатом магния, растворитель отгоняют при пониженном давлении с получением 0,913 г указанного в заголовке соединения (выход 71%).
1H ЯМР (400 МГц, CDCl3): δ получают в виде смеси двух ротамеров (приблизительно 6:4). 1,68-1,76 (м, 2H), 2,05-2,08 (м, 2H), 3,14 (д, J=14,4 Гц, 0,4H), 3,27 (м, 1H), 3,48 (м, 0,6H), 4,15 (м, 1H), 4,58-4,75 (м, 3H), 5,20 (м, 1H), 4,30-4,38 (м, 5H); МС m/z 347 [M+H]+.
Пример 99
(2S,5R)-5-((Бензилокси)амино)-1-(трет-бутоксикарбонил)пиперидин-2-карбоновая кислота (IV-a3)
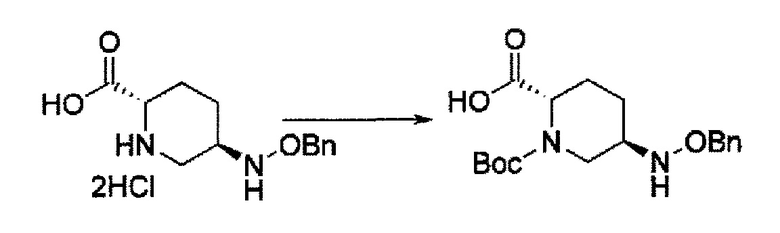
Дигидрохлорид (2S,5R)-5-(бензилоксиамино)пиперидин-2-карбоновой кислоты (2,00 г, 6,19 ммоль), описанный в примере 11, добавляют к 1,4-диоксану (10 мл) и воде (15 мл), затем добавляют 5М водный раствор гидроксида натрия (3,7 мл) и перемешивают при охлаждении льдом. Добавляют карбонат калия (854 мг) и дикарбонат ди-трет-бутоксикарбонила (1,69 г) к смеси, и температуру повышают до комнатной температуры с последующим перемешиванием в течение ночи. Полученный раствор концентрируют, и водный раствор доводят до pH 3,3 добавлением моногидрата лимонной кислоты, затем дважды экстрагируют этилацетатом (20 мл) и промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и фильтруют. Растворитель концентрируют при пониженном давлении. Полученный остаток подвергают хроматографии на колонке с силикагелем (этилацетат) с получением 1,879 г указанного в заголовке соединения (выход 87%).
1H ЯМР (400 МГц, CDCl3): δ 1,46 (с, 9H), 1,50-1,72 (м, 2H), 1,98-2,10 (м, 2H), 3,12-3,19 (м, 2H), 4,13-4,20 (м, 1H), 4,76 (д, J=11,5 Гц, 1Н), 4,70 (д, J=11,5 Гц, 1H), 4,85-4,92 (м, 1H), 7,26-7,35 (м, 5H); МС m/z 351 [M+H]+.
Пример 100
Последовательный синтез (2S,5R)-5-((бензилокси)амино)-1-(трет-бутоксикарбонил)пиперидин-2-карбоновой кислоты (IV-а3)
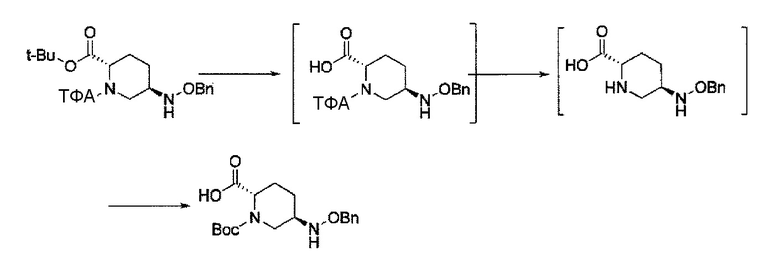
Раствор (2S,5R)-трет-бутил 5-(бензилоксиамино)-1-(2,2,2-трифторацетил)пиперидин-2-карбоксилата (66,8 г, 166,0 ммоль), описанного в примере 3, в метиленхлориде (135 мл) охлаждают на льду и добавляют трифторуксусную кислоту (135 мл) и оставляют взаимодействовать при той же температуре в течение 30 минут и затем при комнатной температуре в течение 2 часов, и реакционную смесь концентрируют при пониженном давлении. Остаток растворяют в этилацетате (500 мл) и промывают 25% цитратом мононатрия (200 мл) и насыщенным раствором соли (200 мл), сушат над безводным сульфатом магния и растворитель выпаривают при пониженном давлении. Остаток растворяют в 1,4-диоксане (133 мл), и к нему добавляют 5М гидроксид натрия (133 мл) при охлаждении льдом и перемешивают в течение 1 часа, затем смесь концентрируют при пониженном давлении. После промывки водного слоя простым эфиром (200 мл) рН доводят до pH 10 добавлением 5М хлористоводородной кислоты (55 мл) и добавляют карбонат калия (23 г) и ди-трет-бутилдикарбонат (44 г), затем перемешивают в течение ночи. Органический растворитель из смеси концентрируют при пониженном давлении и концентрированную смесь промывают простым эфиром (200 мл). Водный слой доводят до pH 3,9 лимонной кислотой и экстрагируют этилацетатом (500 мл, 250 мл). Органический слой промывают насыщенным раствором соли (250 мл) и сушат над безводным сульфатом натрия. Растворитель концентрируют при пониженном давлении с получением 48,02 г указанного в заголовке соединения (выход 83%). Данные измерений для этого продукта соответствуют данным из примера 99.
Пример 101
(2S,5R)-5-((Бензилокси)амино)-1-(2-триметилсилилэтоксикарбонил)пиперидин-2-карбоновая кислота (IV-а4)
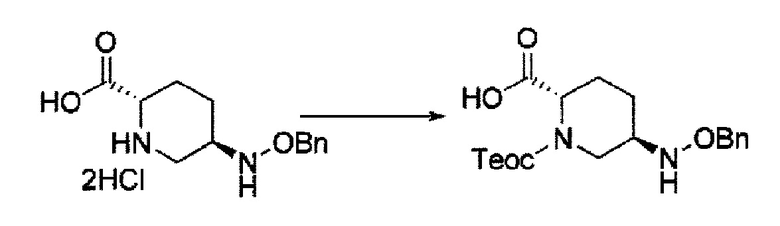
К дигидрохлориду (2S,5R)-5-(бензилоксиамино)пиперидин-2-карбоновой кислоты (3,23 г, 10 ммоль), описанному в примере 11, добавляют 1,4-диоксан (10 мл), воду (15 мл) и 5М гидроксид натрия (6 мл) и перемешивают при охлаждении льдом. К смеси добавляют карбонат калия (1,38 г), N-(триметилсилилэтилоксикарбонилокси)сукцинимид (2,85 г), и температуру повышают до комнатной температуры с последующим перемешиванием в течение ночи. Смесь доводят до рН 4 моногидратом лимонной кислоты и дважды экстрагируют этилацетатом (50 мл). Органический слой промывают водой и насыщенным солевым раствором и концентрируют при пониженном давлении. Остаток подвергают хроматографии на колонке с силикагелем (этилацетат/гексан=1:1→1:0) с получением 3,41 г указанного в заголовке соединения (выход 86%).
1H ЯМР (400 МГц, CDCl3): δ 0,01 (с, 9H), 0,97 (т, J=8,3 Гц, 2H), 1,59-1,68 (м, 2H), 1,97-2,02 (м, 2H), 3,00-3,25 (м, 2H), 4,08-4,19 (м, 3H), 4,65 (д, J=11,3 Гц, 1H), 4,71 (д, J=11,3 Гц, 1H), 4,72-4,89 (м, 1H), 7,23-7,32 (м, 5H); МС m/z 395 [M+H]+.
Пример 102
(2S,5R)-N-(2-трет-Бутоксикарбониламиноэтокси)-5-(бензилоксиамино)-1-(2,2,2-трифторацетил)пиперидин-2-карбоксамид (IV-b2-Вос-059)

(2S,5R)-5-(Бензилоксиамино)-1-(2,2,2-трифторацетил)пиперидин-2-карбоновую кислоту (0,879 г, 2,54 ммоль), описанную в примере 98, и трет-бутил 2-(аминоокси)этилкарбамат (0,559 г) из ссылочного примера 9 растворяют в N,N-диметилформамиде (11 мл) и туда добавляют моногидрат 1-гидроксибензотриазола (0,489 г) при охлаждении льдом. К смеси добавляют гидрохлорид N-этил-N'-(3-диметиламинопропил)карбодиимида (0,613 г) и температуру повышают до комнатной температуры с последующим взаимодействием в течение 3 часов. Воду добавляют к реакционной смеси и экстрагируют этилацетатом. После последовательного промывания органического слоя 10% водным раствором лимонной кислоты, водой, 6,5% водным раствором бикарбоната натрия и насыщенным раствором соли, и затем растворитель отгоняют при пониженном давлении. Полученный масляный остаток очищают с помощью хроматографии на колонке с силикагелем (н-гексан/этилацетат=1/2) с получением 1,07 г указанного в заголовке соединения (выход 84%).
1H ЯМР (400 МГц, CDCl3): δ получают в виде смеси двух ротамеров (приблизительно 7:3). 1,26 (м, 0,3H), 1,44 (с, 9H), 1,70 (м, 0,7H), 1,81-2,12 (м, 3H), 3,10 (шир.д, J=14,4 Гц, 0,3H), 3,30 (м, 3H), 3,54 (шир.д, J=12,4 Гц, 0,7H), 3,87 (м, 2H), 4,15 (д, J=13,2 Гц, 0,7H), 4,58-4,79 (м, 2,6H), 4,90 (м, 0,7H), 4,97 (м, 0,3H), 5,11 (м, 0,7H), 5,33 (м, 1H), 7,26-7,38 (м, 5H), 9,75 (шир.с, 0,7H), 10,48 (шир.с, 0,3H); МС m/z 505 [M+H]+.
Пример 103
(2S,5R)-N-(2-трет-Бутоксикарбониламиноэтокси)-5-(бензилокси)пиперидин-2-карбоксамид (IV-c-Вос-059)
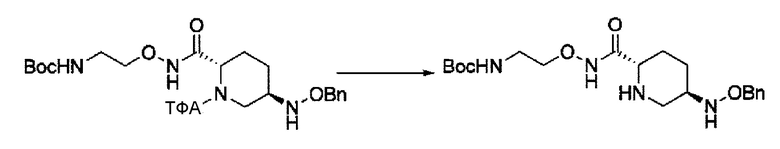
(2S,5R)-N-(2-трет-Бутоксикарбониламиноэтокси)-5-(бензилоксиамино)-1-(2,2,2-трифторацетил)пиперидин-2-карбоксамид (1,07 г, 2,06 ммоль) растворяют в 1,4-диоксане (4,2 мл), к смеси добавляют воду (1,1 мл) и охлаждают на льду. К смеси добавляют 1М водный раствор гидроксида натрия (6,3 мл) и подвергают взаимодействию при той же температуре в течение 2,5 часов. рН доводят до приблизительно рН 7 добавлением уксусной кислоты к реакционной смеси. Органический растворитель выпаривают при пониженном давлении. Полученный водный раствор экстрагируют этилацетатом. Затем органический слой промывают насыщенным раствором соли и сушат над безводным сульфатом натрия, и растворитель выпаривают при пониженном давлении. Полученный маслянистый остаток очищают с помощью хроматографии на колонке с силикагелем (этилацетат/метанол=9/1) с получением 0,80 г указанного в заголовке соединения (выход 93%).
1H ЯМР (400 МГц, CDCl3): δ 1,36-1,44 (м, 10H), 1,74 (м, 1H), 1,95 (м, 1H), 2,10 (м, 1H), 2,68 (м, 1H), 3,14 (м, 1H), 3,33 (м, 2H), 3,42 (м, 1H), 3,50 (м, 1H), 3,88 (м, 2H), 4,66 (с, 2H), 5,49 (шир.м, 1H), 7,29-7,37 (м, 5H); МС m/z 409 [M+H]+.
Пример 104
(2S,5R)-N-(2-трет-Бутоксикарбониламиноэтокси)-5-(бензилоксиамино)-1-[2-(триметилсилил)этилоксикарбонил]пиперидин-2-карбоксамид (IV-b4-059)
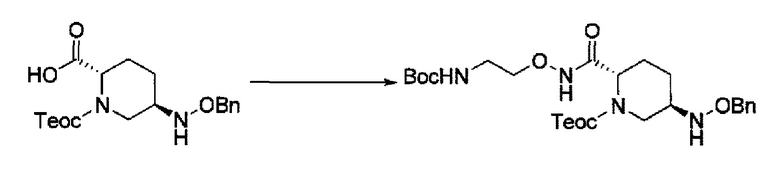
(2S,5R)-5-(Бензилоксиамино)-1-((2-(триметилсилил)этокси)карбонил)пиперидин-2-карбоновую кислоту (601 мг, 1,52 ммоль), описанную в примере 101, и трет-бутил 2-(аминоокси)этилкарбамат (303 мг, 1,72 ммоль), описанный в ссылочном примере 9, растворяют в N,N-диметилформамиде (5,8 мл), добавляют моногидрат 1-гидроксибензотриазола (264 мг) с последующим охлаждением льдом. Добавляют гидрохлорид N-этил-N'-(3-диметиламинопропил)карбодиимида (330 мг), температуру повышают до комнатной температуры и проводят реакцию в течение 5 часов. Воду добавляют к реакционной смеси и экстрагируют этилацетатом. Затем органический слой промывают последовательно 10% водным раствором лимонной кислоты, водой, 6,5% водным раствором бикарбоната натрия и насыщенным раствором соли, органический слой сушат над безводным сульфатом магния и растворитель выпаривают при пониженном давлении. Полученный маслянистый остаток очищают с помощью хроматографии на колонке с силикагелем (н-гексан/этилацетат=1/2) с получением 450 мг указанного в заголовке соединения (выход 54%).
1H ЯМР (400 МГц, CDCl3): δ 0,01 (с, 9H), 0,98 (м, 2H), 1,42 (с, 9H), 1,58 (м, 1H), 1,84-1,96 (м, 3H), 3,04 (м, 1H), 3,18 (шир.с, 1H), 3,28 (м, 1H), 3,35 (м, 1H), 3,85 (м, 2H), 4,16-4,35 (м, 3H), 4,63-4,75 (м, 3H), 5,32-5,70 (шир.м, 2H), 4,26-4,33 (м, 5H), 9,44 (шир.с, 1H); МС m/z 553 [M+H]+.
Пример 105
Синтез из трет-бутил 2-((2S,5R)-5-(бензилоксиамино)пиперидин-2-карбоксамид)этилкарбамат (IV-c-Вос-059): (IV-b4-Вос-059)
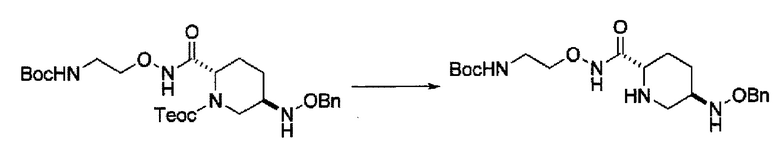
(2S,5R)-N-(2-трет-Бутоксикарбониламиноэтокси)-5-(бензилоксиамино)-1-[2-(триметилсилил)этилоксикарбонил]пиперидин-2-карбоксамид (417 мг, 0,754 ммоль) растворяют в тетрагидрофуране (5,5 мл), добавляют 1,0М раствор фтортетра-н-бутиламмония в тетрагидрофуране (1,9 мл), затем реакцию проводят при 50°С в течение 24 часов. Реакционную смесь разбавляют этилацетатом, и промывают последовательно 6,5% водным раствором бикарбоната натрия, водой и насыщенным солевым раствором, затем органический слой сушат над безводным сульфатом натрия и растворитель выпаривают при пониженном давлении. Полученный маслянистый остаток очищают с помощью хроматографии на колонке с силикагелем (этилацетат→этилацетат/метанол=9/1) с получением 250 мг указанного в заголовке соединения (выход 81%). Данные измерений для этого продукта согласуются с данными из примера 103.
Пример 106
(2S,5R)-N-(2-Бензилоксикарбониламиноэтокси)-5-(бензилоксиамино)-1-(трет-бутоксикарбонил)пиперидин-2-карбоксамид (IV-c-Cbz-059)
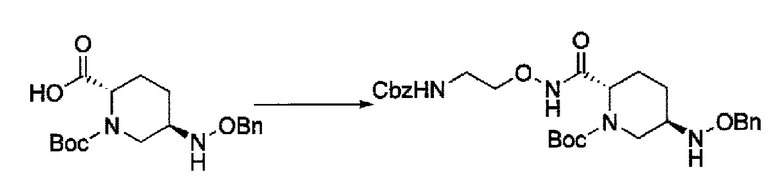
(2S,5R)-5-((Бензилокси)амино)-1-(трет-бутоксикарбонил)пиперидин-2-карбоновую кислоту (1,879 г, 5,362 ммоль), описанную в примере 99 или 100, бензил 2-(аминоокси)этилкарбамат (1,41 г, 6,707 ммоль) из ссылочного примера 11 и моногидрат 1-гидроксибензотриазола (220 мг) растворяют в метиленхлориде (20 мл), затем перемешивают на льду. Туда добавляют гидрохлорид N-этил-N'-(3-диметиламинопропил)карбодиимида (1,29 г) и температуру повышают до комнатной температуры и перемешивают в течение ночи. Смесь последовательно разбавляют метиленхлоридом (20 мл) и промывают последовательно водой, 10% водным раствором лимонной кислоты, насыщенным водным раствором бикарбоната натрия и насыщенным солевым раствором, сушат над сульфатом магния. Растворитель концентрируют при пониженном давлении с получением 2,91 г указанного в заголовке соединения (количественный выход).
1H ЯМР (400 МГц, CDCl3): δ 1,46 (с, 9H), 1,50-1,93 (м, 4H), 3,40 (м, 2H), 3,89 (м, 2H), 4,15-4,21 (м, 1H), 4,61 (м, 1H), 4,69 (д, J=11,6 Гц, 1H),4,76 (д,J=11,6 Гц, 1H),5,11 (с, 2H), 5,86 (с, 1H), 7,27-7,36 (м, 5H), 9,28 (с, 1H); МС m/z 543 [M+H]+.
Пример 107
(2S,5R)-N-(2-Бензилоксикарбониламиноэтокси)-5-(бензилоксиамино)пиперидин-2-карбоксамид (IV-c-Cbz-059)

(2S,5R)-N-(2-Бензилоксикарбониламиноэтокси)-5-(бензилоксиамино)-1-(трет-бутоксикарбонил)пиперидин-2-карбоксамид (2,91 г, 5,362 ммоль) растворяют в 1,4-диоксане (5 мл), добавляют при охлаждении льдом 4М раствор хлористоводородной кислоты в диоксане (10 мл). После перемешивания в течение 2 часов смесь концентрируют при пониженном давлении, растворяют в воде (30 мл) и промывают простым эфиром. Водный слой охлаждают льдом и рН доводят до приблизительно рН 7 с помощью 5М гидроксида натрия и уксусной кислоты и затем экстрагируют этилацетатом. Органический слой промывают насыщенным солевым раствором и сушат над безводным сульфатом натрия, и затем растворитель концентрируют при пониженном давлении. Остаток подвергают хроматографии на колонке с силикагелем (хлороформ→хлороформ/метанол=3:1) с получением 2,27 г указанного в заголовке соединения (выход 95%).
1H ЯМР (400 МГц, CDCl3): δ 1,22-1,34 (м, 1H), 1,50-1,58 (м, 1H), 1,89-1,92 (м, 1H), 1,92-2,06 (м, 1H), 2,43-2,48 (м, 1H), 2,95 (м, 1H), 3,23-3,27 (м, 1H), 3,40-3,42 (м, 2H), 3,71-3,73 (м, 2H), 3,89-3,92 (м, 2H), 4,66 (с, 2H), 5,11 (с, 2H), 5,91 (с, 1H), 7,26-7,52 (м, 10H); МС m/z 443 [M+H]+.
Пример 108
Бензил {2-[({[(2S,5R)-6-бензилокси-7-оксо-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}амино)окси]этил}карбамат (IIa-Cbz-059)
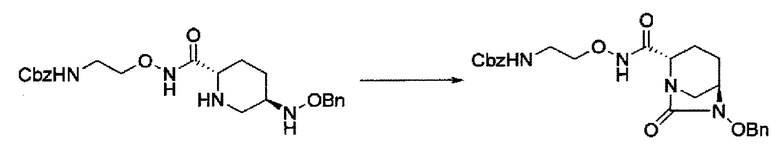
Раствор (2S,5R)-N-(2-бензилоксикарбониламиноэтокси)-5-(бензилокси)пиперидин-2-карбоксамида (642 мг, 1,451 ммоль) в ацетонитриле (66 мл) охлаждают льдом, добавляют триэтиламин (709 мкл) и хлортриметилсилан (203 мкл), перемешивают в течение 1 часа. К реакционной смеси добавляют трихлорметилхлорформиат (105 мкл), и смесь перемешивают при той же температуре в течение 20 минут. К реакционному раствору затем добавляют 4-(диметиламино)пиридин (18 мг), температуру повышают до комнатной температуры и перемешивают в течение ночи. Реакционную смесь концентрируют при пониженном давлении и полученный остаток разбавляют этилацетатом, затем промывают последовательно водой, 5% водным раствором лимонной кислоты, 6,5% водным раствором бикарбоната натрия и насыщенным раствором соли. Затем органический слой сушат над безводным сульфатом магния и растворитель выпаривают при пониженном давлении. Полученный остаток очищают с помощью хроматографии на колонке с силикагелем (н-гексан/этилацетат=1/3) с получением 407 мг указанного в заголовке соединения (выход 60%).
1H ЯМР (400 МГц, CDCl3): δ 1,59-1,65 (м, 1H), 1,91-2,02 (м, 2H), 2,26-2,31 (м, 1H), 2,71-2,74 (д, J=11,6 Гц, 1H), 2,99-3,02 (шир.д, J=11,2 Гц, 1H), 3,28 (с, 1H), 3,31-3,39 (м, 1H), 3,46-3,49 (м, 1H), 3,88-3,97 (м, 3H), 4,88-4,91 (д, J=11,6 Гц, 1H), 5,03-5,06 (д, J=11,6 Гц, 1H), 5,11 (с, 2H), 5,83 (шир.с, 1H), 7,27-7,43 (м, 10H), 9,36 (шир.с, 1H); МС m/z 469 [M+H]+.
Пример 109
(2S,5R)-N-(2-трет-Бутоксикарбониламиноэтокси)-6-(бензилокси)-7-оксо-1,6-диазабицикло[3.2.1]октан-2-карбоксамид (IIa-Вос-059)
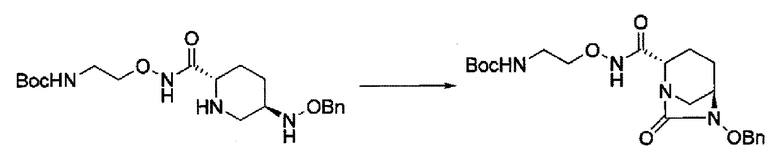
Раствор (2S,5R)-N-(2-трет-бутоксикарбониламиноэтокси)-5-(бензилокси)пиперидин-2-карбоксамида (368 мг, 0,901 ммоль), описанного в примере 103 или 105 в ацетонитриле (40,9 мл) охлаждают льдом, добавляют триэтиламин (440 мкл) и хлортриметилсилан (126 мкл) и полученную смесь перемешивают в течение 1 часа. К реакционной смеси добавляют трихлорметилхлорформиат (66,0 мкл) с последующим перемешиванием при той же температуре в течение 30 минут. Затем к реакционному раствору добавляют 4-(диметиламино)пиридин (10,2 мг) и температуру повышают до комнатной температуры и проводят реакцию в течение 4 часов. Реакционную смесь концентрируют при пониженном давлении, и полученный остаток разбавляют этилацетатом, затем промывают последовательно водой, 5% водным раствором лимонной кислоты, 6,5% водным раствором бикарбоната натрия и насыщенным солевым раствором. Затем органический слой сушат над безводным сульфатом магния растворитель выпаривают при пониженном давлении. Полученный маслянистый остаток очищают с помощью хроматографии на колонке с силикагелем (н-гексан/этилацетат=2/3) с получением 202 мг указанного в заголовке соединения в виде бесцветного твердого вещества (выход 52%). Данные измерений для этого продукта соответствуют данным для примера 59.
Пример 110
трет-Бутил {2-[({[(2S,5R)-6-гидрокси-7-оксо-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}амино)окси]этил}карбамат (IIb-Вос-059)

трет-Бутил {2-[({[(2S,5R)-6-бензилокси-7-оксо-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}амино)окси]этил}карбамат (43,4 г, 100 ммоль) растворяют в тетрагидрофуране (475 мл). После подтверждения растворения добавляют воду (25 мл) и выстаивают в атмосфере аргона. Добавляют 10% Pd/C (8,68 г, влажность 50%), и смесь энергично перемешивают в атмосфере водорода в течение 3 часов. Конечную точку подтверждают ТСХ и катализатор фильтруют через Целит. Растворитель из фильтрата концентрируют при пониженном давлении. Концентрированный остаток дважды обрабатывают для замещения и концентрации этилацетатом (100 мл) и один раз метиленхлоридом (100 мл) с получением 34,5 г указанного в заголовке соединения (выход количественный). Данные измерений для этого продукта соответствуют данным для примера 59.
Пример 111
трет-Бутил {2-[({[(2S,5R)-6-гидрокси-7-оксо-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}амино)окси]этил}карбамат (IIb-Вос-059): синтез из (IIa-Cbz-059)
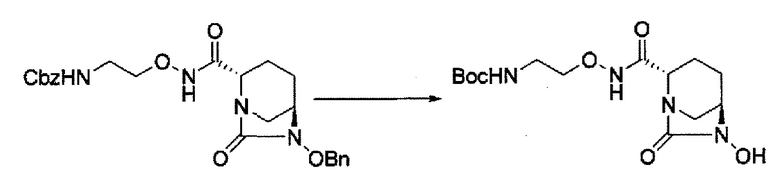
Бензил {2-[({[(2S,5R)-6-бензилокси-7-оксо-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}амино)окси]этил}карбамат (468 мг, 1,00 ммоль), описанный в примере 108, и ди-трет-бутоксикарбонилбутилдикарбонат (240 мг) растворяют в тетрагидрофуране (6,6 мл) и добавляют 10% Pd/C (93 мг, 50% влажность), энергично перемешивают в течение 3 часов в атмосфере водорода. Конечную точку подтверждают ТСХ и затем катализатор фильтруют через Целит. Растворитель из фильтрата концентрируют при пониженном давлении с получением 403,7 мг указанного в заголовке соединения (количественный выход). Данные измерений для этого продукта соответствуют данным для примера 59.
Пример 112
трет-Бутил {2-[({[(2S,5R)-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}амино)окси]этил}карбамат тетрабутиламмония (III-Вос-059)
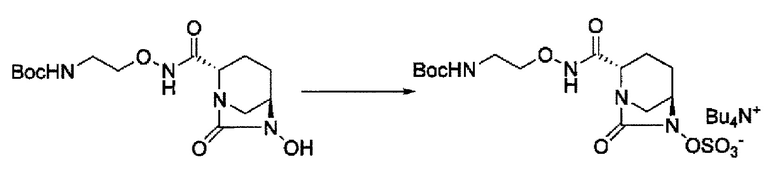
К раствору трет-бутил {2-[({[(2S,5R)-6-гидрокси-7-оксо-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}амино)окси]этил}карбамат (34,5 г, 100 ммоль) в метиленхлориде (500 мл) последовательно добавляют 2,6-лутидин (32,8 г) и комплекс триоксид серы - пиридин (51,9 г) и перемешивают в течение 24 часов. Завершение реакции подтверждают ВЭЖХ, реакционную смесь фильтруют и фильтрат добавляют в 8% водный раствор бикарбоната натрия (1 л) и промывают метиленхлоридом (500 мл). В водный слой добавляют этилацетат (1 л), затем добавляют гидросульфат тетрабутиламмония (37,34 г), обращая внимание на вспенивание, и перемешивают в течение 30 минут. После жидкостного разделения жидкости водный слой дважды экстрагируют этилацетатом (500 мл). Объединенные органические слои сушат над сульфатом магния, и растворитель концентрируют при пониженном давлении с получением 53,9 г указанного в заголовке соединения (выход 81,1%). Данные измерений для этого продукта соответствуют данным для примера 59.
Пример 113
(2S,5R)-N-(2-Аминоэтокси)-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]октан-2-карбоксамид (III-059)

Раствор трет-бутил {2-[({[(2S,5R)-7-оксо-6-(сульфоокси)-1,6-диазабицикло[3.2.1]окт-2-ил]карбонил}амино)окси]этил}карбамата тетрабутиламмония (68,9 г, 104 ммоль) в метиленхлориде (170 мл) охлаждают до -20°С и добавляют трифторуксусную кислоту (170 мл) при -15°С или менее в течение 20 минут, затем перемешивают при 0°С в течение 35 минут. К реакционной смеси добавляют диэтиловый эфир (510 мл) и смесь перемешивают при 0°С в течение 40 минут. Осажденное твердое вещество фильтруют через воронку Кирияма и промывают диэтиловым эфиром (450 мл), затем сушат в вакууме с получением неочищенного продукта (39,5 г). Остаток добавляют к 0,5М буферу ацетат натрия/уксусная кислота (400 мл, pH 5,6) и затем доводят до pH 5,6 5М водным раствором гидроксида натрия и затем очищают хроматографией на колонке с октадецилсиликагелем (вода) с получением 24,8 г указанного в заголовке соединения (выход 74%). Данные измерений для этого продукта соответствуют данным для примера 59.
Пример 114
Дигидрохлорид (2S,5R)-метил 5-(бензилоксиамино)пиперидин-2-карбоксилат (4b); Синтез из соединения (2) через гидрохлорид (2S,5S)-5-гидроксипиперидин-2-карбоновой кислоты (7)
Стадия 1
Гидрохлорид (2S,5S)-5-гидроксипиперидин-2-карбоновая кислота (7)
(2S,5S)-трет-Бутил 5-гидроксипиперидин-2-карбоксилат (126,22 г, 0,63 моль), описанный в примере 1, постепенно добавляют в 5M хлористоводородную кислоту (630 мл) при комнатной температуре, затем нагревают до 65°С и перемешивают в течение 2 часов. Затем реакционный раствор охлаждают до комнатной температуры и реакционный растворитель концентрируют при пониженном давлении. Остаток растворяют в воде (500 мл) и добавляют активированный уголь (6,5 г), перемешивают при комнатной температуре в течение 30 минут. Активированный уголь фильтруют через Целит. Целит дважды промывают водой (100 мл) и фильтрат объединяют, затем концентрируют при пониженном давлении. Остаток (150 г) охлаждают льдом, затем засевают и перемешивают. К смеси по каплям добавляют ацетон (650 мл) в течение 30 мин, затем перемешивают в течение 30 минут. Осевшие кристаллы фильтруют в потоке аргона, затем промывают ацетоном. После удаления жидкости и сушки в вакууме в течение ночи получают 108,79 г указанного в заголовке соединения в виде бесцветных порошкообразных кристаллов (выход 96%).
1H ЯМР (400 МГц, D2O): δ 1,66-2,23 (м, 4H), 3,25 (д, J=3,4 Гц, 1H), 3,38 (д, J=3,4 Гц, 1H), 4,00 (дд, J=11,7, 3,7 Гц, 1H), 4,22 (шир.с, 1H); МС m/z: 146 (M-HCl+H)+.
Стадия 2
Гидрохлорид (2S,5S)-метил 5-гидроксипиперидин-2-карбоксилат (8)
К гидрохлориду (2S,5S)-5-гидроксипиперидин-2-карбоновой кислоты (26,46 г, 0,146 моль) добавляют 2М хлористый водород - метанол (230 мл), затем нагревают с обратным холодильником. Через 1,5 часа реакционный раствор концентрируют, затем замещают и концентрируют метанолом (200 мл) три раза. Остаток сушат в вакууме с получением 28,55 г указанного в заголовке соединения в виде бесцветного кристаллического порошка (количественный выход).
1H ЯМР (400 МГц, D2O): δ 1,74-2,06 (м, 4H), 3,12 (дд, J=2,0, 13,2 Гц, 1H), 3,25-3,29 (м, 1H), 3,72 (с, 3H), 3,98 (дд, J=3,8, 12,2 Гц, 1H), 4,09 (шир.с, 1H); МС m/z: 160 (M-HCl+H)+.
Стадия 3
(2S,5S)-Метил 5-гидрокси-1-(2,2,2-трифторацетил)пиперидин-2-карбоксилат (9)
К суспензии гидрохлорида (2S,5S)-метил 5-гидроксипиперидин-2-карбоксилата (26,80 г, 0,137 моль) в обезвоженном тетрагидрофуране (440 мл) добавляют триэтиламин (91,0 мл) при охлаждении льдом, затем по каплям добавляют ангидрид трифторуксусной кислоты (39,5 мл) при 10°С или ниже в течение 1 часа. Реакционную суспензию перемешивают в течение 70 минут, постепенно увеличивая температуру до комнатной температуры. К реакционному раствору добавляют воду (80 мл), затем перемешивают при комнатной температуре в течение 30 мин. Затем смесь добавляют в воду (1000 мл) и экстрагируют три раза этилацетатом (500 мл + 2×250 мл). Органический слой промывают 1М хлористоводородной кислотой (300 мл), насыщенным водным раствором бикарбоната натрия (200 мл) и насыщенным раствором соли (2×150 мл), сушат и затем концентрируют при пониженном давлении с получением 34,65 г указанного в заголовке соединения в виде масла (выход 99%).
1H ЯМР (400 МГц, CDCl3): δ получают в виде смеси двух ротамеров (приблизительно 7:3). 1,34-1,44 (м, 1H), 1,73-1,83 (м, 1H), 2,00-2,10 (м, 2H), 2,39-2,45 (м, 1H), 2,75 (т, J=11,5 Гц, 0,3H), 3,11 (дд, J=5,7, 13,4 Гц, 0,7H), 3,79 (с, 2, 1H), 3,81 (с, 0,9H), 4,00-4,06 (м, 0,7H), 4,58-4,67 (м, 0,3H), 4,62 (м, 0,3H), 5,20 (д, J=5,9 Гц, 0,7H); МС m/z: 256 (M+H)+.
Стадия 4
Гидрохлорид (2S,5R)-метил 5-(бензилоксиамино)-1-(2,2,2-трифторацетил)пиперидин-2-карбоксилат (10)
Раствор (2S,5S)-метил 5-гидрокси-1-(2,2,2-трифторацетил)пиперидин-2-карбоксилат (32,71 г, 0,128 моль) в безводном ацетонитриле (250 мл) охлаждают до -30°С с последующим добавлением 2,6-лутидина (16,9 мл) и добавлением трифторметансульфонового ангидрида (22,5 мл) при температуре от -36 до -30°С в течение 15 минут. После перемешивания при -32°С в течение 25 минут по каплям добавляют бензилоксиамин (32,25 г) при температуре -32°С или ниже, затем промывают ацетонитрилом (10 мл). После постепенного нагревания реакционной смеси до 0°С добавляют 2,6-лутидин (16,9 мл) и перемешивают при 4°С в течение 2 дней. Реакционную смесь концентрируют до 150 мл, затем разбавляют этилацетатом (750 мл) и промывают водой (750 мл), 10% водным раствором лимонной кислоты (3×750 мл), насыщенным водным раствором бикарбоната натрия (375 мл) и насыщенным раствором соли (400 мл). Каждый водный слой повторно экстрагируют этилацетатом (400 мл) и объединенные органические слои сушат над безводным сульфатом натрия, фильтруют и затем концентрируют при пониженном давлении с получением 46,93 г остатка. 38,24 г полученного остатка берут и разбавляют этилацетатом (120 мл). При комнатной температуре 1М хлористый водород - этилацетат 160 мл (0,160 моль) добавляют для кристаллизации и добавляют гексан (560 мл). После перемешивания при 0°С в течение 3 часов кристаллы фильтруют, промывают гексаном (400 мл) и затем сушат в вакууме с получением 30,36 г указанного в заголовке соединения в виде кристаллического порошка (выход 73%).
1H ЯМР (400 МГц, CD3OD): δ получают в виде смеси двух ротамеров. 2,00-2,09 (м, 3H), 2,23-2,24 (м, 1H), 3,33- 3,42 (м, 0,5H), 3,74 (дд, J=3,2, 15,6 Гц, 0,5H), 3,79 (с, 2H), 3,81 (с, 1H), 3,89 (шир.с, 1H), 4,29 (д, J=15,9 Гц, 0,5H), 4,81 (д, J=14,4 Гц, 0,5H), 5,08-5,16 (м, 2,5H); МС m/z: 361 (M-HCl+H)+.
Стадия 5
Дигидрохлорид (2S,5R)-метил 5-(бензилоксиамино)пиперидин-2-карбоксилат (4b)
К гидрохлориду (2S,5R)-метил 5-(бензилоксиамино)-1-(2,2,2-трифторацетил)пиперидин-2-карбоксилата (1,951 г, 4,92 ммоль) добавляют 2М хлористый водород - метанол (40 мл), затем нагревают с обратным холодильником в течение 3 дней. Затем реакционный раствор концентрируют до 14 мл и добавляют этилацетат (40 мл) для осаждения кристаллов. Суспензию перемешивают при комнатной температуре в течение 1,5 часов, затем фильтруют через воронку Кирияма, промывают этилацетатом (80 мл) и сушат в вакууме с получением 1,439 г указанного в заголовке соединения в виде кристаллического порошка (выход 87%). Данные измерений для этого продукта соответствуют данным для примера 12.
Пример 115
Дигидрохлорид (2S,5R)-5-(бензилоксиамино)пиперидин-2-карбоксилата (4b); Синтез из коммерчески доступной (2S,5S)-5-гидроксипиперидин-2-карбоновой кислоты (7)
Стадия 1
Гидрохлорид (2S,5S)-метил 5-гидроксипиперидин-2-карбоксилат (8)
В 2М хлористый водород - метанол (12,8 л) добавляют коммерчески доступную (2S,5S)-5-гидроксипиперидин-2-карбоновую кислоту (содержание 84%, нетто 912,22 г, промытая 2М хлористым водородом - метанолом 3,1 л), и смесь нагревают с обратным холодильником в течение 3 часов (внутренняя температура 63-67°С). Реакционную смесь охлаждают, добавляют 1,4-диоксан (12,8 л) и растворитель выпаривают при пониженном давлении. К остатку (4,1 кг) добавляют этилацетат (18,3 л) и охлажденный льдом 44% водный раствор карбоната калия (23,7 л), затем отделяют органический слой. Водный слой затем экстрагируют этилацетатом (3×18,3 л). 50% водный раствор карбоната калия (7,3 л) отделяют в каждом органическом слое, органические слои объединяют, сушат над безводным карбонатом калия (2,37 кг) и фильтруют, и растворитель отгоняют при пониженном давлении. Остаток растворяют в толуоле (9,1 л) и добавляют активированный уголь (9,2 г), затем и перемешивают в течение 30 минут, фильтруют и растворитель отгоняют при пониженном давлении. Остаток замещают этилацетатом (9,1 л) и концентрируют с получением 1130 г указанного в заголовке соединения в виде бледно-желтого масла (содержание 78,9%, нетто 891,57 г, выход 89%).
Стадия 2
(2S,5S)-Метил-5-гидрокси-1-(2,2,2-трифторацетил)пиперидин-2-карбоксилат (9)
Раствор (2S,5S)-метил 5-гидроксипиперидин-2-карбоксилата (содержание 78,8%, нетто 459,48 г) в обезвоженном этилацетате (7,4 л) охлаждают до -40°С и по каплям добавляют триэтиламин (1300г) и затем ангидрид трифторуксусной кислоты (1349 г), промытый обезвоженным этилацетатом (100 мл) при температуре от -40 до -12°С в течение 30 минут. Температуру повышают -2°С в течение 15 минут после завершения добавления по каплям, затем перемешивают в течение 75 мин. Затем к смеси добавляют воду (1277 мл), перемешивают при 25°С в течение 1 часа. Смесь добавляют в воду (8,4 л) (промытую этилацетатом 4,5 л), затем экстрагируют этилацетатом (2×9,8 л). Объединенные органические слои последовательно промывают 1М хлористоводородной кислотой (8,5 л), насыщенным водным раствором бикарбоната натрия (8,5 л) и насыщенным раствором соли (8,5 л), затем сушат над безводным сульфатом натрия (1,8 кг) и фильтруют. После выпаривания растворителя органического слоя при пониженном давлении, к остатку добавляют этилацетат (3,6 л), затем замещают и концентрируют. Остаток сушат в вакууме с получением 793,4 г указанного в заголовке соединения (содержание 81,5%, нетто 648,66 г, выход 88).
Стадия 3
(2S,5R)-Метил 5-(бензилоксиамино)-1-(2,2,2-трифторацетил)пиперидин-2-карбоксилат (10)
Раствор (2S,5S)-метил 5-гидрокси-1-(2,2,2-трифторацетил)пиперидин-2-карбоксилат (содержание 81,5%, нетто 556,23 г) в обезвоженном ацетонитриле (4,0 л) охлаждают до -40°С, добавляют 2,6-лутидин (259,24 г) (промывают ацетонитрилом (100 мл) и по каплям добавляют ангидрид трифторметансульфокислоты (645,72 г) при температуре от -43 до -37°С в течение 1 часа и 10 минут (промывают ацетонитрилом 100 мл). Затем реакционную смесь перемешивают при -35°С в течение 50 мин, по каплям добавляют бензилоксиамин (550,27 г) при -35°С или менее, затем промывают ацетонитрилом (500 мл). Затем реакционную смесь постепенно нагревают до -5°С, добавляют 2,6-лутидин (259,24 г), перемешивают при 5°С в течение 40 часов. Смесь концентрируют до 1,8 л, затем разбавляют этилацетатом (12,4 л) и промывают водой (12,4 л), 10% водным раствором лимонной кислоты (4×8 л + 4,7 л), насыщенным водным раствором бикарбоната натрия (6,3 л) и насыщенным солевым раствором (7,2 л). Органический слой сушат над безводным сульфатом натрия, фильтруют и концентрируют при пониженном давлении. Остаток сушат в вакууме с получением 867,73 г указанного в заголовке соединения (содержание 71,56%, выход 79%).
Стадия 4
Гидрохлорид (2S,5R)-метил 5-(бензилоксиамино)-1-(2,2,2-трифторацетил)пиперидин-2-карбоксилат (10)
(2S,5R)-Метил 5-(бензилоксиамино)-1-(2,2,2-трифторацетил)пиперидин-2-карбоксилат (содержание 70,13%, нетто 673,20 г) разбавляют этилацетатом (4,8 л) и добавляют активированный уголь (48 г), перемешивают в течение 1 часа. Смесь фильтруют и промывают этилацетатом (2 л). Фильтрат разбавляют этилацетатом (4,7 л) и добавляют 1М раствор хлористого водорода - этилацетата (2,7 л) при комнатной температуре, затем перемешивают в течение 15 минут. Затем добавляют гексан 28,6 л, и смесь охлаждают до 0°С. После перемешивания и созревания в течение 3 часов кристаллы отфильтровывают, промывают смесью гексан/этилацетат=4/1 (3 л) и затем сушат в вакууме с получением указанного в заголовке соединения (содержание 91,72%, выход 90%).
Стадия 5
Дигидрохлорид (2S,5R)-метил 5-(бензилоксиамино)пиперидин-2-карбоксилат (4b)
(2S,5R)-Метил 5-(бензилоксиамино)-1-(2,2,2-трифторацетил)пиперидин-2-карбоксилат (содержание 92,01%, нетто 732,25 г) растворяют в 2М растворе хлористого водорода - метанола (15 л), нагревают с обратным холодильником в течение 27 часов. Смесь охлаждают до комнатной температуры и концентрируют до 3 л при пониженном давлении. К смеси добавляют метанол (2,7 л), затем добавляют этилацетат (16,3 л) и смесь перемешивают в течение 1 часа. Осажденные кристаллы фильтруют, промывают этилацетатом (3×1,1 л) и сушат в вакууме с получением 572,0 г указанного в заголовке соединения (содержание 98,06%, выход 92%). Данные измерений для этого продукта соответствуют данным для примера 12.
Пример 116
(2S,5R)-5-((Бензилокси)амино)-1-(трет-бутоксикарбонил)пиперидин-2-карбоновая кислота (IV-а3)
Дигидрохлорид (2S,5R)-метил 5-(бензилоксиамино)пиперидин-2-карбоксилат (4b), описанный в примере 12 (6,64 г, 20 ммоль), растворяют в воде (40 мл) и добавляют 1,4-диоксан (27 мл), затем охлаждают льдом. Добавляют 5M водный раствор гидроксида натрия (13,2 мл), затем перемешивают в течение 1 часа. К реакционной смеси добавляют 5M хлористоводородную кислоту (1,2 мл), карбонат калия (2,76 г), дикарбонат ди-трет-бутоксикарбонила (4,8 г), затем нагревают до комнатной температуры и перемешивают в течение ночи. Водный раствор, полученный после концентрации реакционной смеси, промывают простым эфиром, затем доводят до pH 3,3 добавлением моногидрата лимонной кислоты, экстрагируют два раза этилацетатом (50 мл), промывают насыщенным раствором соли, сушат над безводным сульфатом натрия, фильтруют и растворитель концентрируют при пониженном давлении. Получают 6,87 г указанного в заголовке соединения (количественный выход). Данные измерений для этого продукта соответствуют данным для примера 99.
Пример 117
Получение фермента β-лактамазы
Применяя геном Pseudomonas aeruginosa ATCCBAA-47, плазмид pBR322, Klebsiella pneumoniae ATCCBAA-1705 и P. aeruginosa MSC17696 в качестве шаблона каждую ДНК для кодирования β-лактамазы, AmpC, ТЕМ-1, КРС-2 или OXA-2 домена, за исключением сигнального пептида, расширяют с помощью ПЦР. Каждый из продуктов ПЦР вводят в pET-28b(+)вектор (Merck), вводят в Escherichia coli BL21(DE3) (Merck) и после индукции 1 мМ изопропил-β-D-(-)-тиогалактопиранозида (Nacalai Tesque) культивируют в течение ночи при 20°С для экспрессии AmpC, ТЕМ-1, КРС-2 или OXA-2. После сбора бактериальных клеток AmpC очищают из клеточного экстракта, полученного с помощью ультразвука, с применением CM Sepharose Fast Flow (GE Healthcare) и HiTrap Heparin HP (GE Healthcare) при 4°С. ТЕМ-1 очищают HiTrap SPHP (GE Healthcare), HiTrap Q (GE Healthcare) и Mono Q (GE Healthcare), и KPC-2 очищают HiTrap SPHP. OXA-2 очищают HiTrap SPHP и HiTrap Heparin HP.
Пример 118
Ингибирование β-лактамазы
Для измерения ингибирующего действия в отношении β-лактамазы, 100 мкМ (конечная концентрация) нитроцефина (Oxoid) применяют в качестве субстрата, и 2,5% ДМСО, 10 мкг/мл бычьего сывороточного альбумина (Sigma-Aldrich) и 50 мМ фосфатного буфера при pH 7 применяют в качестве реакционного раствора. В каждую лунку 96-луночного планшета добавляют тестируемые соединения, тазобактам (TAZ, LKT Laboratories), NXL104 (полученного по методике патентного документа 1, чистота 99,5%, Meiji Seika Pharma Co., Ltd.) или МК-7655 (полученного по методу патентного документа, чистота 99,4%, Meiji Seika Pharma Co., Ltd.) и AmpC, ТЕМ-1, KPC-2 или OXA-2 (конечные концентрации 0,5 нМ, 0,1 нМ, 0,5 нМ или 2 нМ, соответственно), затем предварительно инкубируют при 30°С в течение 10 минут. В каждую добавляют нитроцефин для смешивания, затем инкубируют при 30°С в течение 20 минут, Multiscan Ascent (Thermo Fisher Scientific) применяют для измерения длины волны 492 нм, тем самым измеряя гидролитическую активность нитроцефина в отношении β-лактамазы, для определения ингибирующего действия на фермент. В качестве контроля готовят реакционный раствор, не содержащий β-лактамазу, и концентрацию тестируемого соединения, показывающую 50% ингибирование, определяют как значение IC50. В качестве силы ингибирования, значения менее 0,1 мкМ, менее 1 мкМ, менее 3 мкМ, менее 10 мкМ и 10 мкМ или более показывают с A, B, C, D и E, соответственно. Результаты показаны в таблице 5.
Класс А β-лактамаза: KPC-2, ТЭМ-1
Класс С β-лактамазы: AmpC
Класс D β-лактамаза: OXA-2 (БЛРС)
119 Пример
Синергетический эффект
Синергетический эффект тестируемого соединения с β-лактамовым агентом в отношении бактерий оценивают с применением конститутивно-экспрессирующего штамма AmpC, P. aeruginosa ATCCBAA-47CR, выбранного из ATCCBAA-47 через воздействие агента, штамма, производящего KPC-2, K. pneumonia ATCCBAA-1705, и штамма, производящего CTX-M-15 (БЛРС) и OXA-1, E. coli MSC19503. С применением пиперациллина (PIPC, Sigma-Aldrich) в качестве β-лактамного агента, минимальную ингибирующую концентрацию (МИК) PIPC измеряют способом разведения в планшете с агаром по методу Института Клинических и Лабораторных Стандартов (метод ИКЛС). То есть, планшет с агаром, содержащий PIPC в каждой концентрации корректируют в обычном отношении 2 серии разведений в агаре Мюллер-Хинтон (MHA, Becton, Dickinson and Company) и получают тестируемое соединение, имеющее 1/4 или 1/8 соответствующее концентрации PIPC, и бактерии культивируют в течение ночи в катион-корректированном бульоне Мюллера-Хинтона (CAMHB, Becton, Dickinson and Company) корректируют в той же среде так, чтобы получить 104 КОЕ/месте и засевают на планшет, содержащий агент. Этот планшет культивируют в течение ночи при 35°С, и найденную минимальную концентрацию агента, при которой отсутствует рост бактерий, определяют как МИК. Антибактериальное действие только PIPC в отношении AmpC, конститутивно-экспрессирующей P. aeruginosa, KPC-2, производящей К. pneumonia и CTX-M-15 (БЛРС) и OXA-1, производящей E.coli, показано при 64 мкг/мл, >128 мкг/мл, >128 мкг/мл, соответственно, и значения, при которых отмечено антибактериальное действие PIPC, которые составляют менее 1/16, менее 1/4 и менее 1/1, и не восстанавливаются синергетическим действием тестируемых соединений, показаны с A, B, C и D, соответственно. Результаты показаны в таблице 6.
Класс A β-лактамаза: KPC-2, CTX-M-15 (БЛРС)
Класс C β-лактамаза: AmpC
Класса D β-лактамаза: OXA-1
Пример 120
Синергетическое действие тестируемых соединений, синтезированных в примерах 59, 61 и 69, с β-лактамовым агентом в отношении бактерий оценивают с применением KPC-2, производящей штамм K. Pneumoniae ATCCBAA-1705, CTX-M-15 (БЛРС) и OXA-1, производящих штамм, Е. coli MSC19503, и AmpC, конститутивно экспрессирующей штамм P. aeruginosa ATCCBAA-47CR. С применением ампициллина (ABPC, Sigma-Aldrich), амоксициллина (AMPC, Sigma-Aldrich), пиперациллина (PIPC), цефтазидима (CAZ, Sigma-Aldrich), цефепима (CFPM, United States Pharmacopeial Convention), цефотаксима (CTX, Sigma-Aldrich), цефтриаксона (CTRX, Sigma-Aldrich), имипенема (IPM, United States Pharmacopeial Convention), биапенема (BIPM, Meiji Seika Pharma), меропенема (MEPM, United States Pharmacopeial Convention), дорипенема (DRPM, Sequoia Research Products), цефминокса (CMNX, Meiji Seika Pharma), фломоксефа (FMOX, Shionogi & Co, Ltd), азтреонама (AZT, United States Pharmacopeial Convention) в качестве β-лактамного агента. МИК каждого β-лактамного агента измеряют методом микроразведения в бульоне на основе способа CLSI. То есть, получают жидкую среду, содержащую 4 мкг/мл (конечная концентрация) тестируемого соединения, TAZ, NXL104 или МК-7655 и β-лактамовый агент и тестируемое соединение в каждой концентрации доводят до общего соотношения 2 серии разведения в CAMHB, и бактерии культивируют в течение ночи в CAMHB, доводят в той же среде так, чтобы получить 105 КОЕ/мл и инокулируют в жидкой среде, содержащей агент. Эту жидкую среду, содержащую агент, культивируют в течение ночи при 35°С, и определяют минимальную концентрацию агента, при которой отсутствует рост бактерий, как МИК. Результаты показаны в таблицах 7-9.
Пример 121
Синергетическое действие тестируемых соединений, синтезированных в примерах 59, 61 и 69, с β-лактамовым агентом в отношении бактерий оценивают с применением 5 штаммов из каждого из KPC-2 или 3 производящих штаммов, K. pneumonia, AmpC конститутивно экспрессирующей штамм, P. aeruginosa, AmpC конститутивно экспрессирующей штамм, Enterobacteriaceae, производящего металло-β-лактамазу штамм типа IMP, Enterobacteriaceae, CTX-M-15 (БЛРС) производящей штамм E. coli. Применяя PIPC в качестве β-лактамового агента, МИК β-лактамового агента измеряют на методом разведений на планшете с агаром на основе способа CLSI. То есть, планшет с агаром, содержащий 4 мкг/мл (конечная концентрация) тестируемого соединения, TAZ, NXL104 или МК-7655 и β-лактамовый агент и тестируемое соединение в каждой концентрации доводят до общего соотношения 2 серии разведения в MHA, и бактерии культивируют в течение ночи в CAMHB, доводят в той же среде так, чтобы получить 104 КОЕ/мл и инокулируют на планшет, содержащий агент. Этот планшет, содержащий агент, культивируют в течение ночи при 35°С, и определяют минимальную концентрацию агента, при которой отсутствует рост бактерий, как МИК. Результаты показаны на Фигурах 1-5.
Пример 122
Измерение действия против туберкулезной бациллы
Комбинированное действие соединения из примера 59 с β-лактамовым агентом против туберкулезной бациллы оценивают с применением клинических изолятов туберкулеза с мультилекарственной резистентностью (МЛУ-ТБ), туберкулеза с широкой лекарственной устойчивостью (ШЛУ-ТБ) и чувствительного туберкулеза (H37Rv). С применением меропенема (MEPM), биапенема (МБМВ), тебипенема (TBPM, Meiji Seika Pharma), ампициллина (ABPC), амоксициллина (AMPC) в качестве β-лактамового агента, МИК каждого β-лактамого агента измеряют методом разведения в жидкой среде на основе способа BrothMIC MTB-I (Kyokuto Pharmaceutical Industrial Co., Ltd.). То есть, получают жидкую среду, содержащую 4 мкг/мл (конечная концентрация) соединения из примера 50 и β-лактамовый агент в каждой концентрации, скорректированной в общем отношении 2 серии разведений в жидкой среде Middlebrook 7H9 (Becton, Dichkinson and Company), содержащей 5% бычий сывороточный альбумин, 2% декстрозу, 0,005% каталазу бычьей печени и 0,05% Tween-80, и бактериальную суспензию, доведенную до OD660=0,16-0,2, инокулируют с 200-кратным разведением. Среду культивируют в течение 7 дней при 37°С в увлажненных условиях, и минимальную концентрацию агента, при которой отсутствует рост бактерий, определяют как МИК.
В результате, антибактериальная активность (мкг/мл) отдельного β-лактамового агента к МЛУ-ТБ, ШЛУ-ТБ и H37Rv равна 16, 4 и 1 для MEPM, 16, 2 и 1 для BIPM, 4, 1 и 0,5 для TBPM, 128, 32 и 16 для ABPC и 128, 64 и 16 для AMPC, и антибактериальная активность при использовании в сочетании с соединением из примера 59 равна 8, 1 и 0,5 для MEPM, 4, 1 и 1 для BIPM, 2, 0,5 и 0,25 для TBPM, 32, 16 и 2 для ABPC и 64, 16 и 26 для AMPC.
| название | год | авторы | номер документа |
|---|---|---|---|
| НОВЫЙ ИНГИБИТОР бета-ЛАКТАМАЗЫ И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2013 |
|
RU2693898C2 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНОГО ДИАЗАБИЦИКЛООКТАНА И ЕГО ПРОМЕЖУТОЧНОГО СОЕДИНЕНИЯ | 2014 |
|
RU2719480C2 |
| ИНГИБИТОРЫ БЕТА-ЛАКТАМАЗ | 2009 |
|
RU2445314C9 |
| КРИСТАЛЛИЧЕСКИЕ ФОРМЫ ПРОИЗВОДНОГО ДИАЗАБИЦИКЛООКТАНА И СПОСОБ ИХ ПОЛУЧЕНИЯ | 2014 |
|
RU2801220C2 |
| КРИСТАЛЛИЧЕСКИЕ ФОРМЫ ПРОИЗВОДНОГО ДИАЗАБИЦИКЛООКТАНА И СПОСОБ ИХ ПОЛУЧЕНИЯ | 2014 |
|
RU2695219C2 |
| КРИСТАЛЛИЧЕСКИЕ ФОРМЫ ПРОИЗВОДНОГО ДИАЗАБИЦИКЛООКТАНА И СПОСОБ ИХ ПОЛУЧЕНИЯ | 2023 |
|
RU2838718C2 |
| КРИСТАЛЛИЧЕСКИЕ ФОРМЫ ПРОИЗВОДНОГО ДИАЗАБИЦИКЛООКТАНА И СПОСОБ ИХ ПОЛУЧЕНИЯ | 2023 |
|
RU2840014C2 |
| СПОСОБ ПОЛУЧЕНИЯ (2S, 5R)-МОНО-{ [(4-АМИНОПИПЕРИДИН-4-ИЛ)КАРБОНИЛ]-7-ОКСО-1, 6-ДИАЗАБИЦИКЛО[3.2.1]ОКТ-6-ИЛ} ОВОГО СЛОЖНОГО ЭФИРА СЕРНОЙ КИСЛОТЫ | 2013 |
|
RU2621051C2 |
| АЗОТСОДЕРЖАЩИЕ БИЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ | 2020 |
|
RU2835672C1 |
| (2S,5R)-5-[(бензилокси)амино]пиперидин-2-карбоксамид | 2012 |
|
RU2610091C2 |
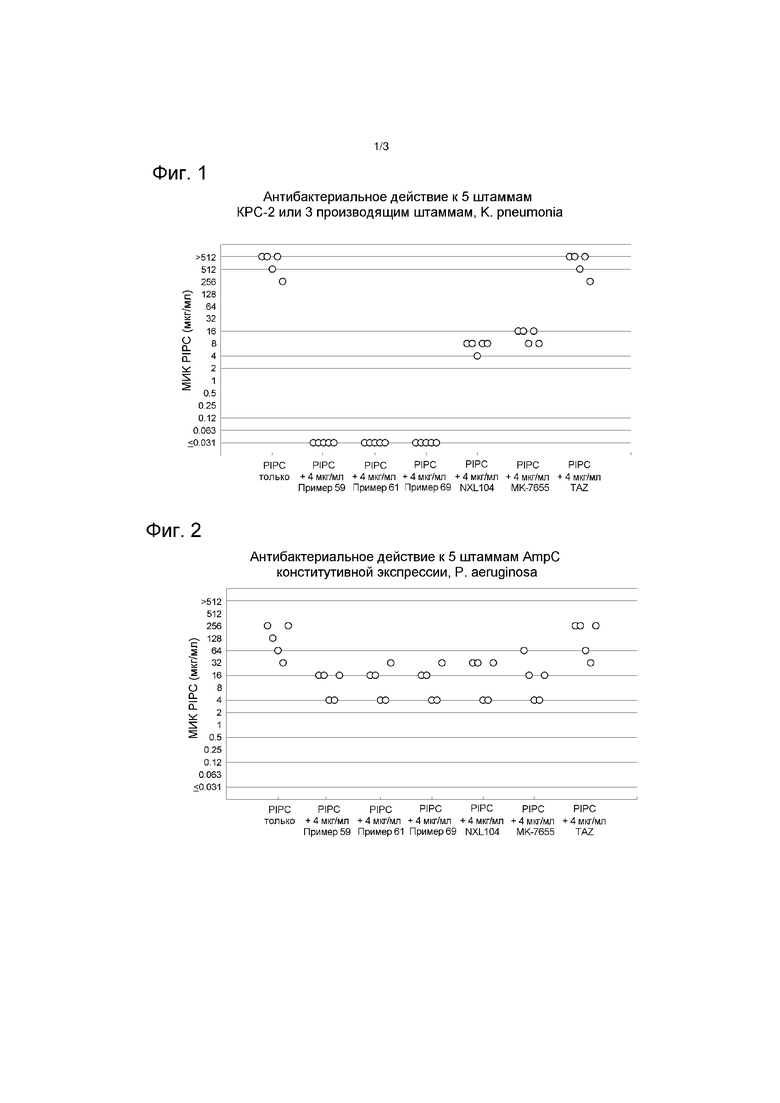
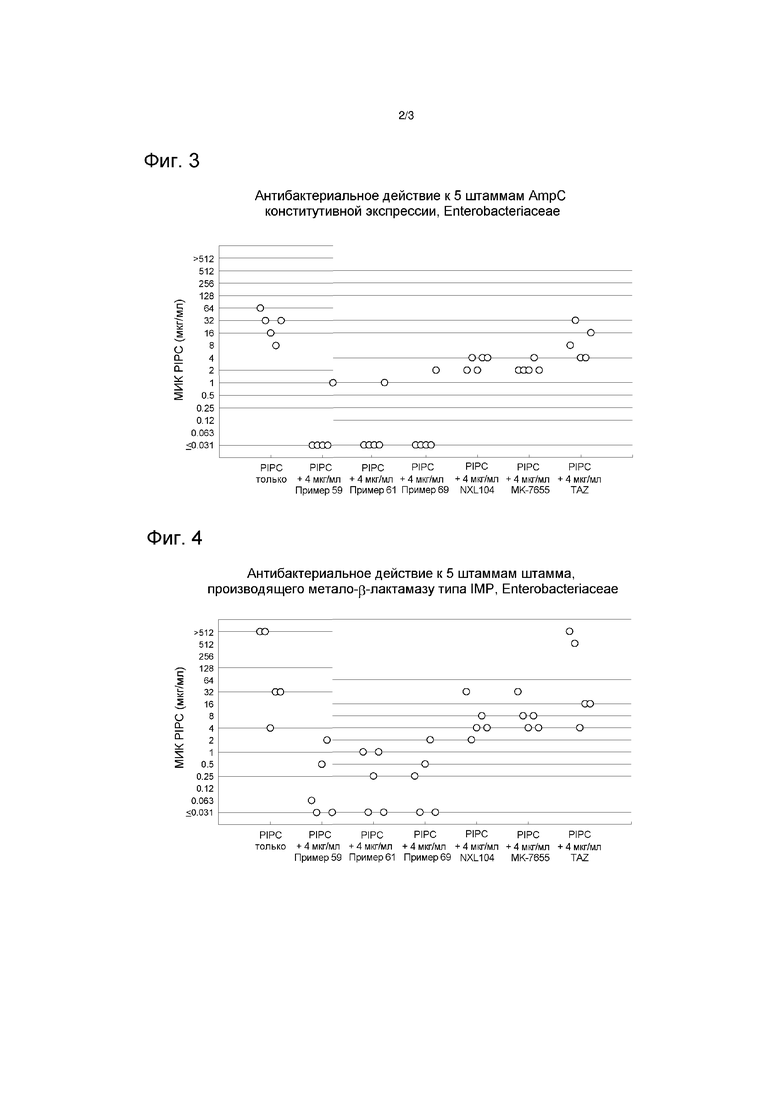
Изобретение относится к промежуточным соединениям формулы (I), где А является Ra(Rb)N- или RcO-; B является NH; C является бензилом, H или SO3M, где М является пиридинием или тетрабутиламмонием; Ra и Rb - каждый, независимо друг от друга, является Н, метилом, бензоилом, C1-4 алкилкарбонилом, гетероциклилкарбонилом, где гетероциклил выбирают из тетрагидропирана, пиперидина и пирролидина, и гетероарилкарбонилом, где гетероарил выбирают из фурана, оксазола и пиридина; Rc является С1-3 алкилом или 4-6-членным гетероциклилом, имеющим один атом азота, который выбирают из азетидина, пирролидина и пиперидина; А может быть модифицирован от 0 до 3 заместителями Fn1, где заместитель Fn1, который может модифицировать А, может быть дополнительно модифицирован Fn1; Fn1 является С1-6 алкилом, который выбирают из циклопропилметила и циклобутила, O= или Rg-(CH2)0-1-, где Rg является 4-7-членным гетероциклилом, содержащим 1-2 гетероатома, выбранных из атома азота и атома кислорода, который выбран из азетидина, пирролидина, пиперидина, морфолина, имидзолидина, пиперазина и диазепана, фенилом, 5-членным гетероарилом, имеющим 1-2 атома азота, который выбран из пиррола и имидазола, RdO2S-, Re(Rf)N-, Re(Rf)NCO-, ReO-, ReOCO- или защитной группой, где Rd представляет метил; Re и Rf - каждый, независимо друг от друга, является Н или С1-4 алкилом, и дополнительно Ra и Rb могут быть замкнуты путем связывания с получением 5-6-членного гетероциклила, имеющего по меньшей мере один атом азота или азота и атом кислорода, который выбран из пирролидина и морфолина, Rc и В могут быть замкнуты путем связывания с получением 5-6-членного гетероциклила, имеющего атом азота и атом кислорода, который выбран из оксазолидина и оксазинана, и Re и Rf могут быть замкнуты путем связывания с получением морфолина, защитную группу выбирают из трет-бутоксикарбонила, бензилоксикарбонила и триизопропилсилила, или их фармацевтически приемлемым солям. Также изобретение относится к промежуточным соединениям формулы (II), (IIa), (IIb) и (III), а также к способам их получения. Изобретение обеспечивает способы получения и промежуточные соединения для получения эффективных ингибиторов β-лактамазы для лечения бактериальных инфекций. 12 н. и 1 з.п. ф-лы, 5 ил., 9 табл., 122 пр.
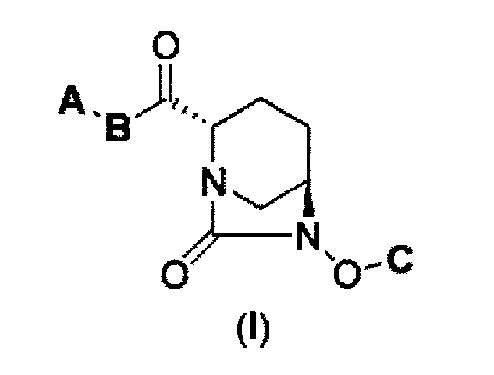

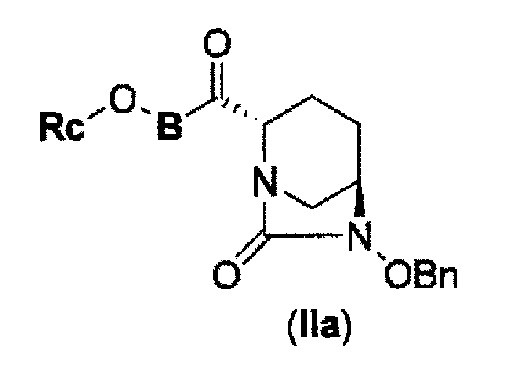
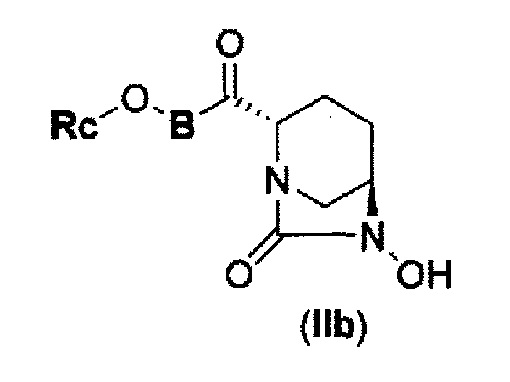
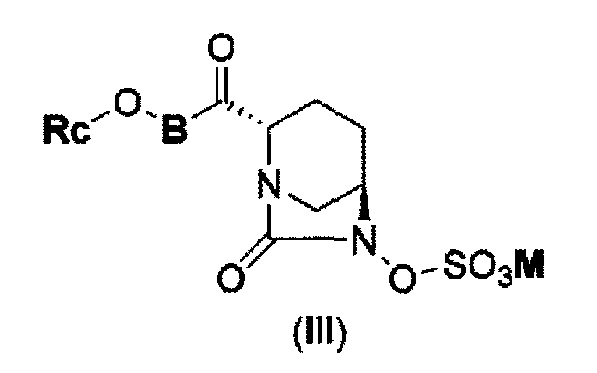
1. Производное диазабициклооктана, представленное следующей формулой (I):
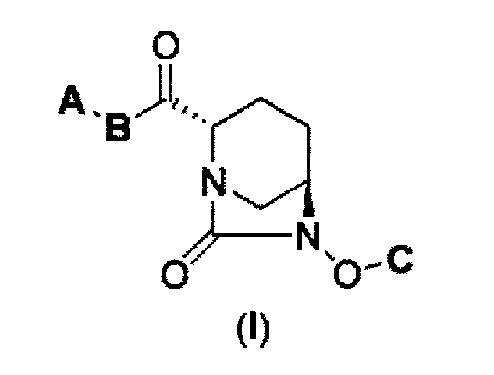 ,
,
в представленной выше формуле (I)
А является Ra(Rb)N- или RcO-;
B является NH;
C является бензилом, H или SO3M, где М является пиридинием или тетрабутиламмонием;
Ra и Rb - каждый, независимо друг от друга, является Н, метилом, бензоилом, C1-4 алкилкарбонилом, гетероциклилкарбонилом, где гетероциклил выбирают из тетрагидропирана, пиперидина и пирролидина, и гетероарилкарбонилом, где гетероарил выбирают из фурана, оксазола и пиридина;
Rc является С1-3 алкилом или 4-6-членным гетероциклилом, имеющим один атом азота, который выбирают из азетидина, пирролидина и пиперидина;
А может быть модифицирован от 0 до 3 заместителями Fn1, где заместитель Fn1, который может модифицировать А, может быть дополнительно модифицирован Fn1;
Fn1 является С1-6 алкилом, который выбирают из циклопропилметила и циклобутила, O= или Rg-(CH2)0-1-, где
Rg является 4-7-членным гетероциклилом, содержащим 1-2 гетероатома, выбранных из атома азота и атома кислорода, который выбран из азетидина, пирролидина, пиперидина, морфолина, имидзолидина, пиперазина и диазепана, фенилом, 5-членным гетероарилом, имеющим 1-2 атома азота, который выбран из пиррола и имидазола, RdO2S-, Re(Rf)N-, Re(Rf)NCO-, ReO-, ReOCO- или защитной группой, где
Rd представляет метил;
Re и Rf - каждый, независимо друг от друга, является Н или С1-4 алкилом, и дополнительно
Ra и Rb могут быть замкнуты путем связывания с получением 5-6-членного гетероциклила, имеющего по меньшей мере один атом азота или азота и атом кислорода, который выбран из пирролидина и морфолина, Rc и В могут быть замкнуты путем связывания с получением 5-6-членного гетероциклила, имеющего атом азота и атом кислорода, который выбран из оксазолидина и оксазинана, и Re и Rf могут быть замкнуты путем связывания с получением морфолина,
защитную группу выбирают из трет-бутоксикарбонила, бензилоксикарбонила и триизопропилсилила,
или его фармацевтически приемлемая соль.
2. Производное диазабициклооктана, представленное следующей формулой (II):
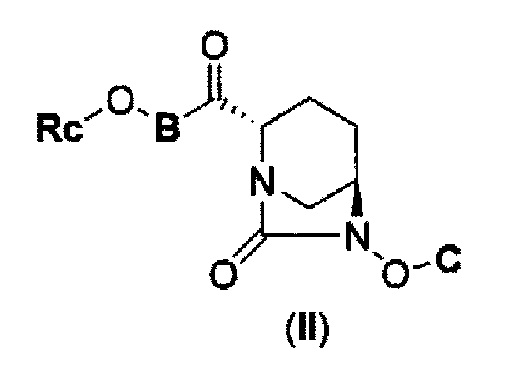 ,
,
в представленной выше формуле (II)
Rc является С1-3 алкилом или 4-6-членным гетероциклилом, имеющим один атом азота, который выбирают из азетидина, пирролидина и пиперидина;
B является NH;
C является бензилом, H или SO3M, где М является пиридинием или тетрабутиламмонием;
Rc может быть модифицирован от 0 до 3 заместителями Fn1, где заместитель Fn1, который может модифицировать Rc, может быть далее модифицирован Fn1;
Fn1 является циклобутилом, O= или Rg, где
Rg является 4-7-членным гетероциклилом, имеющим 1-2 гетероатома, выбранных из атома азота и атома кислорода, который выбран из азетидина, пирролидина, пиперидина, морфолина, имидзолидина, пиперазина и диазепана, 5-членным гетероарилом, имеющим 1-2 атома азота, который выбирают из пиррола и имидазола, RdO2S-, Re(Rf)N-, ReO-, ReOCO- или защитной группой, где
Rd представляет метил;
Re и Rf - каждый, независимо друг от друга, является Н или С1-4 алкилом, и дополнительно
Rc и В могут быть замкнуты путем связывания с получением 5-6-членного гетероциклила, имеющего атом азота и атом кислорода, который выбран из оксазолидина и оксазинана,
защитную группу выбирают из трет-бутоксикарбонила, бензилоксикарбонила и триизопропилсилила
или его фармацевтически приемлемая соль.
3. Производное диазабициклооктана, представленное следующей формулой (IIa):
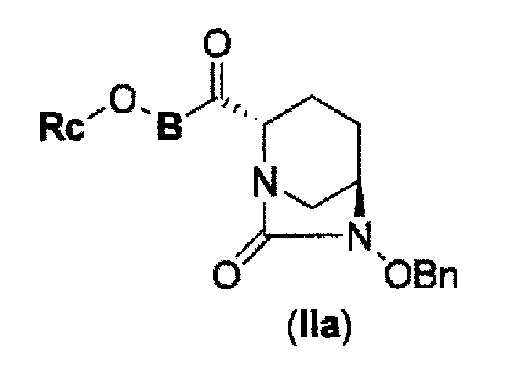 ,
,
в представленной выше формуле (IIa) OBn является бензилокси, и Rc и В такие же, как определены для соединения по п.2,
или его фармацевтически приемлемая соль.
4. Производное диазабициклооктана, представленное следующей формулой (IIb):
 ,
,
в представленной выше формуле (IIb) Rc и В такие же, как определены для соединения по п.2,
его фармацевтически приемлемая соль.
5. Производное диазабициклооктана, представленное следующей формулой (III):
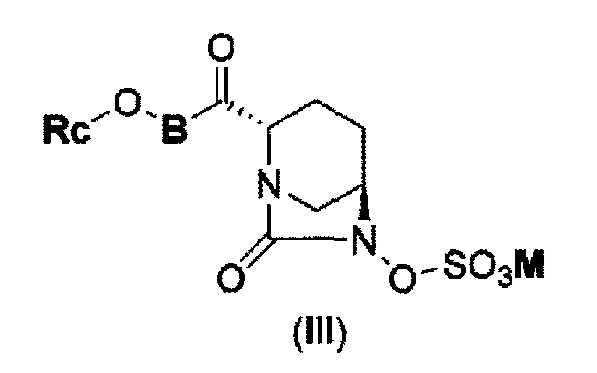 ,
,
в представленной выше формуле (III) Rc, В и М такие же, как определены для соединения по п.2,
или его фармацевтически приемлемая соль.
6. Соединение по любому из пп.1-5, которое представлено следующими формулами:
в представленных выше формулах Р2 является трет-бутоксикарбонилом (Вос), бензилоксикарбонилом (Cbz) или Н; когда P2 является H, P3 является бензилом (Bn), H или SO3M, где M является пиридинием или тетрабутиламмонием, и, когда P2 является трет-бутоксикарбонилом (Boc) или бензилоксикарбонилом (Cbz), Р3 является бензилом (Bn), Н или SO3М; где М является пиридинием или тетрабутиламмонием,
или его фармацевтически приемлемая соль.
7. Способ получения соединения по п.5, представленного следующей формулой (III):
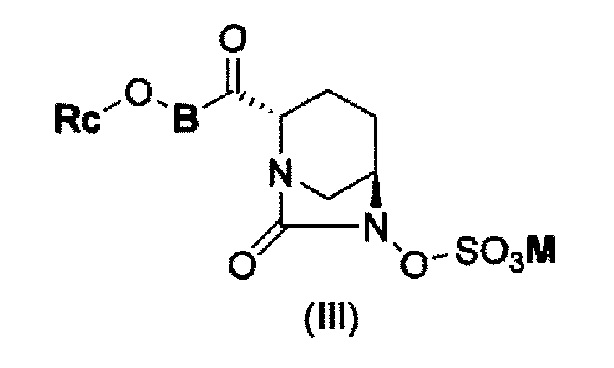 ,
,
в представленной выше формуле (III) Rc, В и М имеют те же значения, которые определены для соединения по п.2,
которая включена в п.2,
включающий
сочетание соединения, представленного следующей формулой (IV-a):
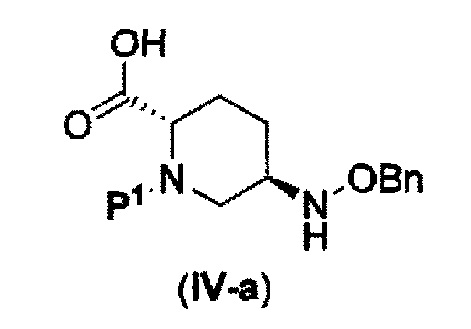 ,
,
в указанной выше формуле (IV-а) P1 является защитной группой, которая может быть удалена кислотой, основанием или нуклеофильным агентом; и OBn является бензилокси,
с соединением RcOBH с применением активного сложного эфира, активного амида или дегидратирующего конденсирующего агента с получением соединения, представленного следующей формулой (IV-b):
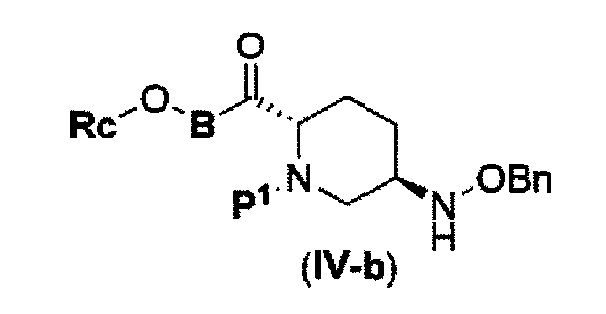 ,
,
в указанной выше формуле (IV-b) Р1 является защитной группой, которая может быть удалена кислотой, основанием или нуклеофильным агентом; Rc и В имеют значения, определенные для соединения по п.2, и OBn является бензилокси,
снятие защиты Р1, который является защитной группой, с получением соединения, представленного следующей формулой (IV-c):
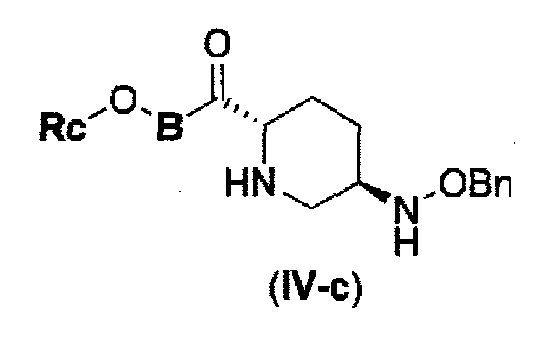 ,
,
в указанной выше формуле (IV-с) Rc и В имеют значения, определенные для соединения по п.2, и OBn является бензилокси,
силилирование соединения в реакционной системе с последующим подверганием реакции образования внутримолекулярной мочевины с получением соединения, представленного следующей формулой (IIa):
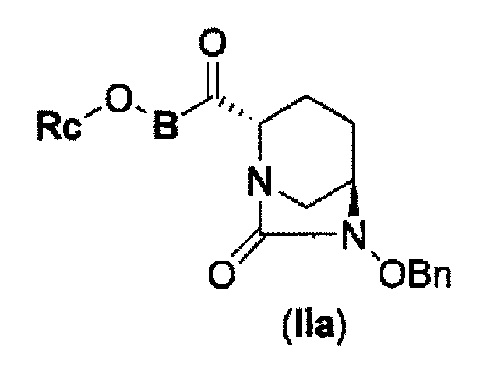
в указанной выше формуле (IIа), Rc и В имеют значения, определенные для соединения по п.2, и OBn является бензилокси,
затем удаление бензила из бензилокси в положении 6 с применением катализатора гидрогенолиза в атмосфере водорода с получением соединения, представленного следующей формулой (IIb):
 ,
,
в указанной выше формуле (IIb) Rc и В имеют значения, определенные для соединения по п.2,
и сульфирование гидроксильной группы в положении 6 в присутствии основания и, если необходимо, снятие защиты в боковой цепи: RcOB-.
8. Способ получения соединения по п.3, представленного следующей формулой (IIa):
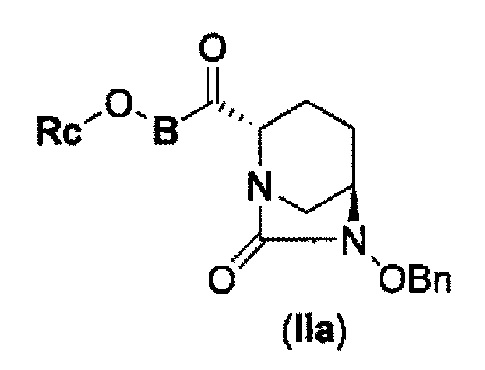 ,
,
в указанной выше формуле (IIа) Rc и В имеют значения, определенные для соединения по п.2, и OBn является бензилокси,
которая включена в п.2, включающий
сочетание соединения, представленного следующей формулой (IV-a):
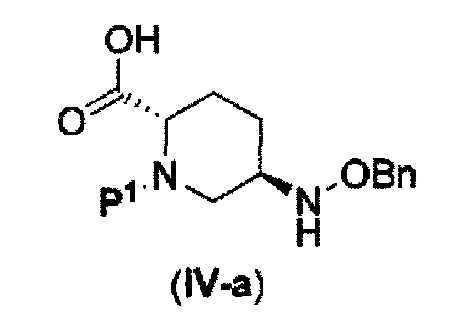
в указанной выше формуле (IV-а), P1 является защитной группой, которая может быть удалена кислотой, основанием или нуклеофильным агентом; и OBn является бензилокси,
с соединением RcOBH с применением активного сложного эфира, активного амида или дегидратирующего конденсирующего агента с получением соединения, представленного следующей формулой (IV-b):
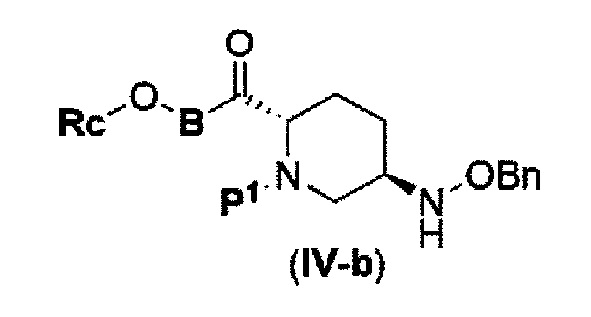 ,
,
в указанной выше формуле (IV-b) Р1 является защитной группой, которая может быть удалена кислотой, основанием или нуклеофильным агентом; Rc и В имеют значения, определенные для соединения по п.2, и OBn является бензилокси,
снятие защиты Р1, который является защитной группой, с получением соединения, представленного следующей формулой (IV-c):
 ,
,
в указанной выше формуле (IV-с) Rc и В имеют значения, определенные для соединения по п.2, и OBn является бензилокси,
силилирование соединения в реакционной системе с последующей реакцией формирования внутримолекулярной мочевины.
9. Способ получения соединения по п.3, представленного следующей формулой (IIa):
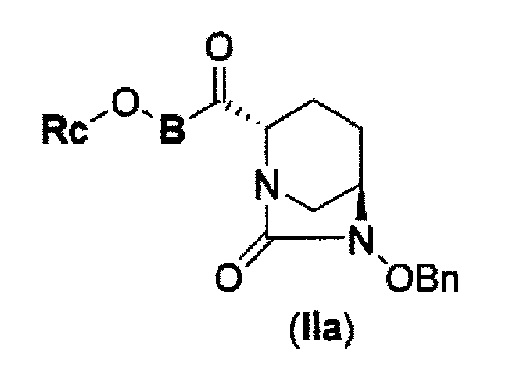 ,
,
в указанной выше формуле (IIа) Rc и В имеют значения, определенные для соединения по п.2, и OBn является бензилокси,
которая включена в п.2,
включающий
силилирование соединения, представленного следующей формулой (IV-c):
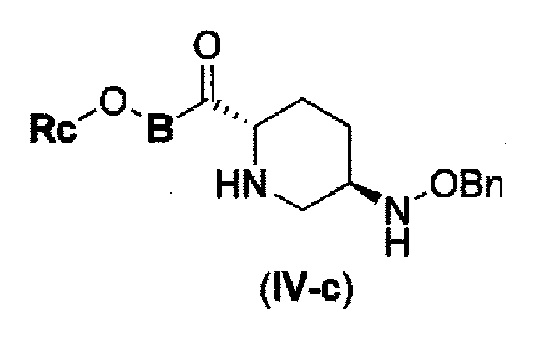 ,
,
в указанной выше формуле (IV-с) Rc и В имеют значения, определенные для соединения по п.2, и OBn является бензилокси,
в реакционной системе с последующей реакцией формирования внутримолекулярной мочевины.
10. Способ получения соединения, представленного следующей формулой (III):
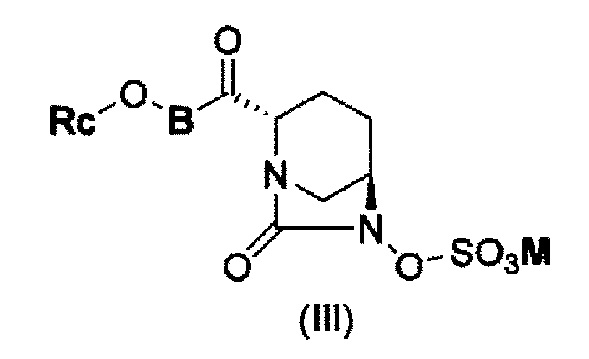 ,
,
в указанной выше формуле (III) Rc, В и М имеют значения, определенные для соединения по п.2,
которая включена в п.2,
включающий
удаление бензила из бензилокси в положении 6 соединения, представленного следующей формулой (IIa):
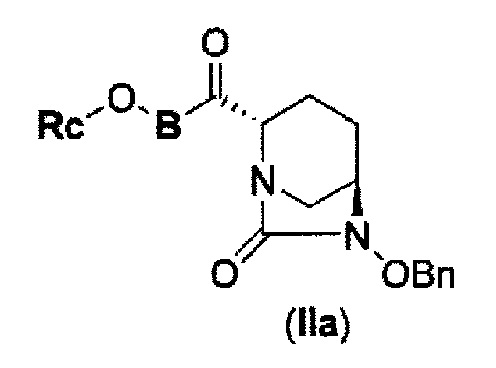 ,
,
в указанной выше формуле (IIа) Rc и В имеют значения, определенные для соединения по п.2, и OBn является бензилокси,
с применением катализатора гидрогенолиза в атмосфере водорода с получением соединения, представленного следующей формулой (IIb):
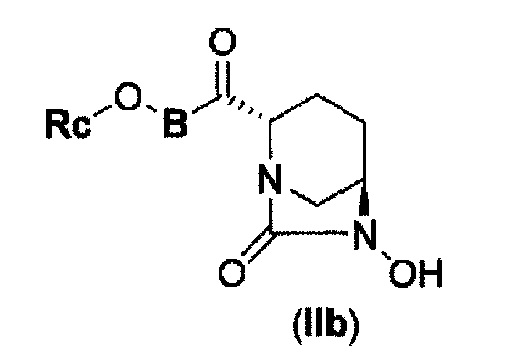 ,
,
в указанной выше формуле (IIb) Rc и В имеют значения, определенные для соединения по п.2,
и сульфирование гидроксильной группы в положении 6 в присутствии основания и, если необходимо, снятие защиты в боковой цепи: RcOB-.
11. Способ получения соединения, представленного следующей формулой (III-Boc-059):
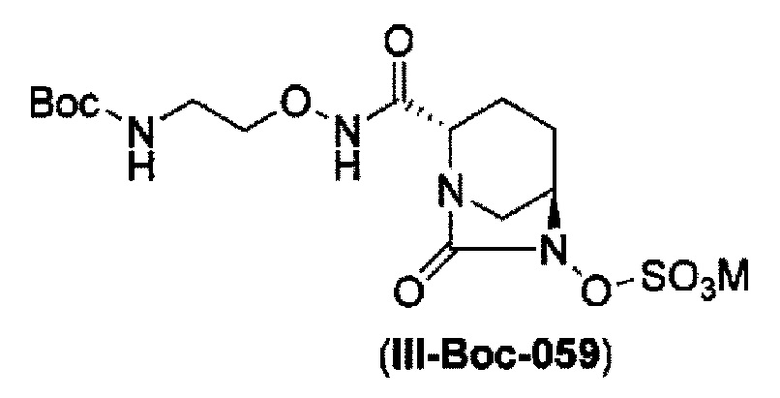 ,
,
в указанной выше формуле (III-Boc-059) Boc является трет-бутоксикарбонилом и M является пиридинием или тетрабутиламмонием, включающий
среди соединений, представленных следующими формулами (IV-a2), (IV-а3) и (IV-a4):

в указанной выше формуле (IV-a2), (IV-а3) или (IV-а4) ТФА является трифторацетилом, Вос является трет-бутоксикарбонилом, Теос является 2-триметилсилилэтоксикарбонилом и OBn является бензилокси,
сочетание соединения, представленного формулой (IV-a2) или (IV-a4), с трет-бутил 2-(аминоокси)этилкарбаматом с применением активного сложного эфира, активного амида или дегидратирующего конденсирующего агента, или
сочетание соединения, представленного формулой (IV-a3), с бензил 2-(аминоокси)этилкарбаматом с применением активного сложного эфира, активного амида или дегидратирующего конденсирующего агента,
с получением соединения, представленного следующей формулой (IV-b2-Вос-059), (IV-b3-Cbz-059) или (IV-b4-Вoc-059):
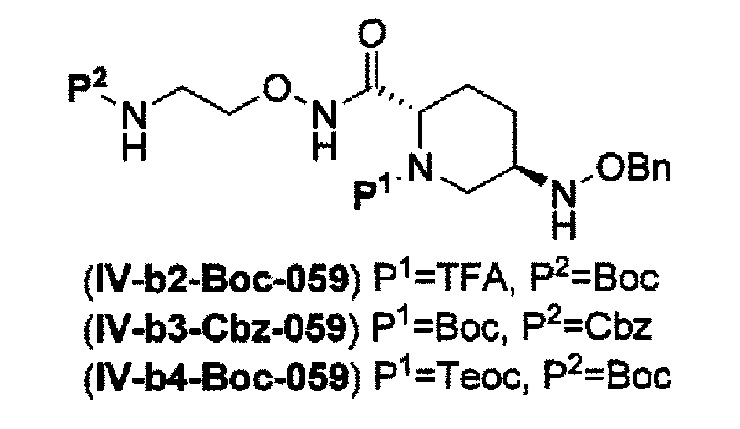 ,
,
в указанной выше формуле (IV-b2-Вос-059), (IV-b3-Cbz-059) или (IV-b4-Вoc-059) ТФА является трифторацетилом, Вос является трет-бутоксикарбонилом, Cbz является бензилоксикарбонилом, Теос является 2-триметилсилилэтоксикарбонилом и OBn является бензилокси,
снятие защиты с трифторацетила соединения, представленного формулой (IV-b2-Вос-059), обработкой основанием с получением соединения, представленного следующей формулой (IV-с-Вос-059):
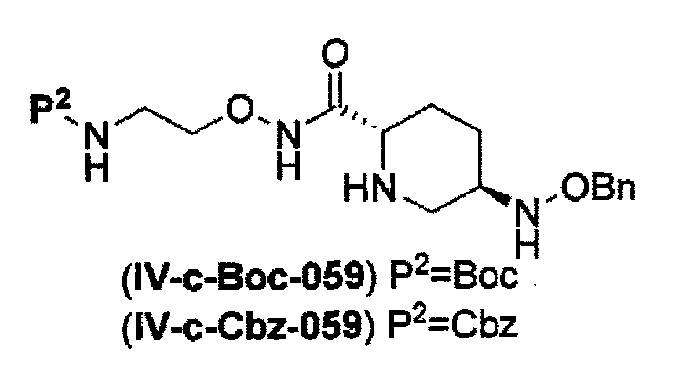 ,
,
в указанной выше формуле (IV-с-Вос-059) или (IV-c-Cbz-059) Вос является трет-бутоксикарбонилом, Cbz является бензилоксикарбонилом и OBn является бензилокси,
удаление трет-бутоксикарбонила соединения, представленного формулой (IV-b3-Cbz-059), обработкой кислотой с получением соединения, представленного следующей формулой (IV-с-Cbz-059), или
удаление 2-триметилсилилэтоксикарбонила соединения, представленного формулой (IV-b4-Вос-059), фторидом с получением соединения, представленного следующей формулой (IV-с-Вос-059),
затем, после силилирования указанного выше соединения (IV-с-Вос-059) или (IV-с-Cbz-059) в реакционной системе, реакция формирования внутримолекулярной мочевины с получением соединения, представленного следующей формулой (IIa-Вос-059) или (IIa-Cbz-059):
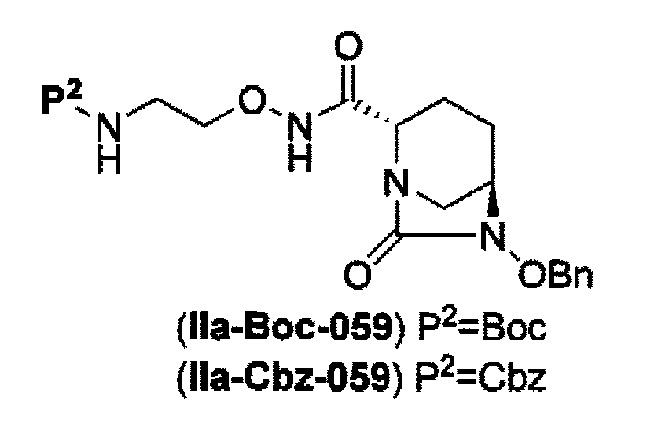 ,
,
в указанной выше формуле (IIa-Вос-059) или (IIa-Cbz-059) Вос является трет-бутоксикарбонилом, Cbz является бензилоксикарбонилом и OBn является бензилокси,
удаление бензила из бензилокси в положении 6 соединения, представленного формулой (IIa-Вос-059), с применением катализатора гидрогенолиза в атмосфере водорода, или
удаление бензила из бензилокси в положении 6 соединения, представленного формулой (IIa-Cbz-059), с применением катализатора гидрогенолиза в атмосфере водорода и одновременное трет-бутоксикарбонилирование его в присутствии ди-трет-бутоксидикарбоната с получением соединения, представленного следующей формулой (IIb-Вос-059):
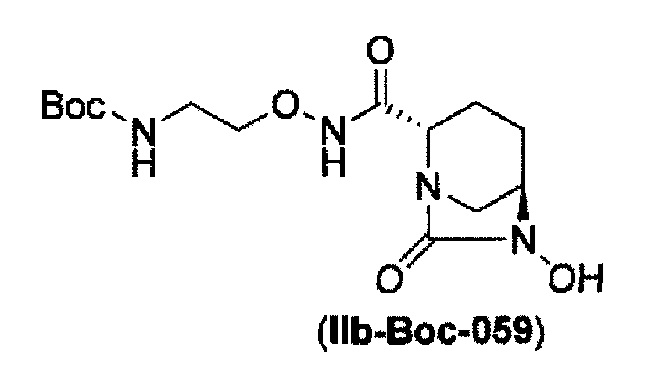 ,
,
в указанной выше формуле (IIb-Вос-059) Вос является трет-бутоксикарбонилом,
сульфирование гидроксильной группы в положении 6.
12. Способ получения соединения, представленного следующей формулой (III-Boc-059):
 ,
,
в указанной выше формуле (III-Boc-059) Boc является трет-бутоксикарбонилом и M является пиридинием или тетрабутиламмонием,
включающий
среди соединений, представленных следующими формулами (IIa-Вос-059) и (IIa-Cbz-059):
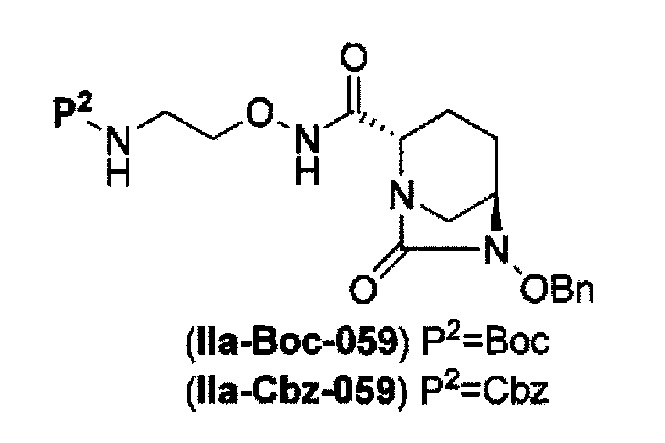 ,
,
в указанных выше формулах (IIa-Вос-059) и (IIa-Cbz-059) Вос является трет-бутоксикарбонилом, Cbz является бензилоксикарбонилом, и OBn является бензилокси,
удаление бензила из бензилокси в положении 6 соединения, представленного формулой (IIa-Вос-059), с применением палладия на угле в атмосфере водорода, или
удаление бензила из бензилокси в положении 6 соединения, представленного формулой (IIa-Cbz-059), с применением палладия на угле в атмосфере водорода в присутствии ди-трет-бутоксидикарбоната и одновременное трет-бутоксикарбонилирование с получением соединения, представленного формулой (IIb-Вос-059):
 ,
,
в указанной выше формуле (IIb-Вос-059) Вос является трет-бутоксикарбонилом,
сульфирование гидроксильной группы в положении 6 с применением комплекса триоксид серы - пиридин в присутствии пиридина, 2-пиколина или 2,6-лутидина.
13. Способ получения соединения, представленного следующей формулой (III-Boc-059):
 ,
,
в указанной выше формуле (III-Boc-059) Boc является трет-бутоксикарбонилом и M является пиридинием или тетрабутиламмонием,
включающий
удаление бензила из бензилокси в положении 6 соединения, представленного формулой (IIa-Вос-059):
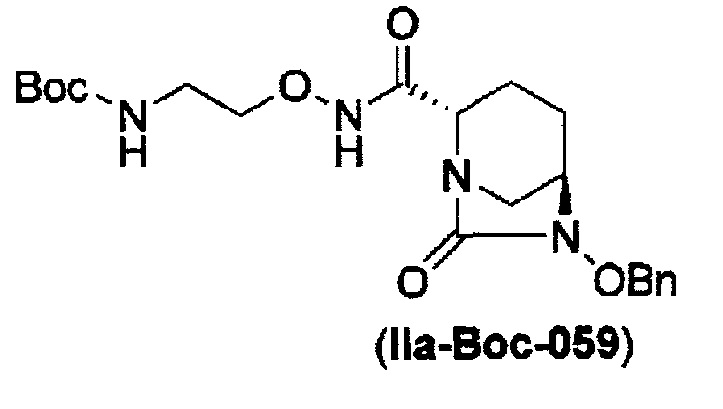 ,
,
в указанной выше формуле (IIа-Вос-059) Вос является трет-бутоксикарбонилом и OBn является бензилокси,
с применением палладия-на-угле в атмосфере водорода с получением соединения, представленного формулой (IIb-Вос-059):
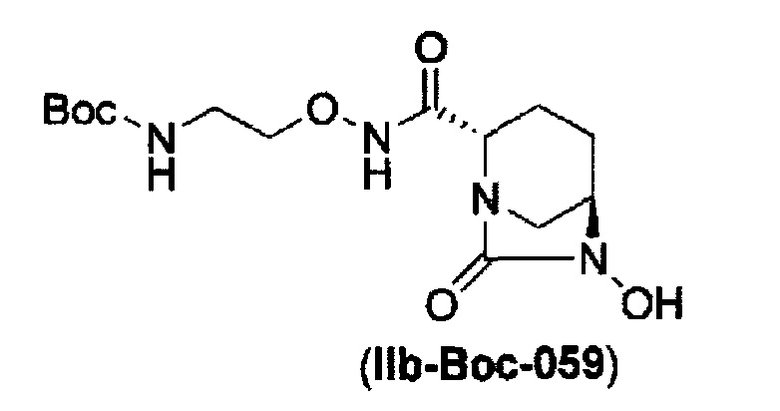 ,
,
в указанной выше формуле (IIb-Вос-059) Вос является трет-бутоксикарбонилом,
сульфатирование гидроксильной группы в положении 6 с применением комплекса триоксид серы - пиридин в присутствии пиридина, 2-пиколина или 2,6-лутидина.
| Топчак-трактор для канатной вспашки | 1923 |
|
SU2002A1 |
| WO 2011042560 A1, 14.04.2011 | |||
| MANGION I.K | |||
| et al | |||
| A concise synthesis of a β-lactamase inhibitor, Organic Letters 2011, Vol.13, No.20, p.5480-5483 | |||
| Приспособление для суммирования отрезков прямых линий | 1923 |
|
SU2010A1 |
| Изложница с суживающимся книзу сечением и с вертикально перемещающимся днищем | 1924 |
|
SU2012A1 |
| Способ приготовления лака | 1924 |
|
SU2011A1 |
| Способ приготовления лака | 1924 |
|
SU2011A1 |
| Способ обработки целлюлозных материалов, с целью тонкого измельчения или переведения в коллоидальный раствор | 1923 |
|
SU2005A1 |
| Способ обработки целлюлозных материалов, с целью тонкого измельчения или переведения в коллоидальный раствор | 1923 |
|
SU2005A1 |
Авторы
Даты
2023-07-17—Публикация
2019-06-28—Подача