РОДСТВЕННЫЕ ЗАЯВКИ
[0001] Данная заявка заявляет приоритет предварительной заявки США № 62/714100, поданной 3 августа 2018 года, полное содержание которой включено в данную заявку посредством ссылки.
УРОВЕНЬ ТЕХНИКИ ИЗОБРЕТЕНИЯ
[0002] Заболевания нервной системы представляют собой совместно основную причину инвалидности у человека, согласно оценкам глобального бремени заболевания. Даже эти основные заболевания нервной системы, лечение которых одобрено органами здравоохранения, включая психические заболевания, такие как шизофрения, неврологические заболевания, такие как болезнь Альцгеймера, и нарушения нейрогенеза, такие как синдром нарушения внимания с гиперактивностью, плохо поддаются лечению, так как одобренные способы лечения имеют ограниченную эффективность и серьезные побочные эффекты, что приводит к тяжелому бремени неудовлетворенной медицинской потребности. Кроме того, существует много серьезных и редких расстройств нервной системы, для которых не одобрены способы лечения, такие как нарушения нервно-психического развития аутического спектра и многие расстройства, связанные с нарушениями интеллектуальной деятельности, и которые, следовательно, связаны с выраженной неудовлетворенной медицинской потребностью.
[0003] N-метил-D-аспартат-(NMDA) подтип лигандзависимых рецепторов ионных каналов представляет собой разнообразное семейство глутаматных рецепторов, широко принятых для опосредования синаптической передачи, ключевых механизмов синаптической пластичности и динамического соединения нейрональной сети, необходимой для нормального развития и функционирования нервной системы.
[0004] NMDA-рецептор состоит из четырех белковых субъединиц, двух субъединиц GluN1 и двух субъединиц GluN2. Субъединица GluN1 получена из единственного гена (GRIN1), повсеместно экспрессируется в нервной системе и является общей для всех NMDA-рецепторов. Четыре различных субъединицы GluN2, GluN2A-D, получают из отдельных генов (GRIN2A-D), которые дифференциально экспрессируются в различных областях нервной системы и в отдельных популяциях нейронов в конкретной области. Также была идентифицирована субъединица GluN3, но ее функция менее понятна. Дополнительно, отдельные нейроны могут экспрессировать более чем одну субъединицу GluN2, и отдельные рецепторы NMDA, экспрессированные такими нейронами, могут содержать две из одинаковых субъединиц GluN2 (например, субъединицы 2 GluN2B) или две различные субъединицы (одна субъединица GluN2A и одна субъединица GluN2B). Кроме того, все субъединицы NMDA-рецептора экспрессируются в виде различных вариантов сплайсинга мРНК. Таким образом, NMDA-рецепторы нативной нервной системы сильно различаются по своему составу.
[0005] Исследование молекулярной основы NMDA-рецепторной функции продолжает представлять собой важную область. Поскольку глутамат является основным возбуждающим нейромедиатором, дисфункция глутаматной нейротрансмиссии и NMDA рецептор-зависимых механизмов синаптической передачи, пластичность и соединение нейрональных сетей широко вовлечены в заболевания нервной системы. Соответственно, соединения, которые способны модулировать NMDA-рецепторы, могут быть полезны для лечения расстройств и заболеваний нервной системы, например шизофрении, болезни Альцгеймера, синдрома нарушения внимания с гиперактивностью и аутизма.
РАСКРЫТИЕ ИЗОБРЕТЕНИЯ
[0006] В данной заявке представлено Соединение 1, 5-(3-хлор-4-фторфенил)-7-циклопропил-3-(2-(3-фтор-3-метилазетидин-1-ил)-2-оксоэтил)-3,7-дигидро-4Н-пирроло [2,3-d] пиримидин-4-он, имеющее следующую структуру:
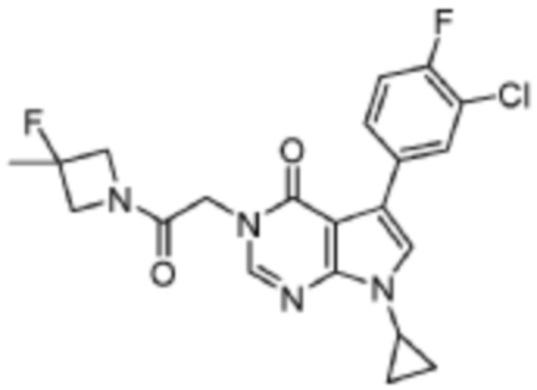
[0007] Соединение 1 представляет собой гетероциклический пирролопиримидиноновый аналог, который модулирует NMDA-рецепторы (например, позитивную аллостерическую модуляцию NMDA-рецепторов) и, может быть, использован для лечения психических, неврологических расстройств, расстройств нервно-психического развития, а также заболеваний нервной системы.
[0008] Гетероциклические модуляторы NMDA-рецептора были ранее описаны, например, в WO 2017/100591. В WO 2017/100591 описан широкий диапазон гетероциклических каркасов, включая пирролопиразиноны, тиенопиридиноны, имидазопиразиноны, пирролопиридиноны и пирролопиримидиноны. Эффективность соединений в WO 2017/100591 оценивали на основе способности соединений обращать подавление Ca2+ ответа, опосредованного Ro 25-6981, сильнодействующего и селективного антагониста NMDA-глутаматных рецепторов, содержащих субъединицу NR2B, и 5,7-дихлоркинуреновую кислоту (DCKA), селективный антагонист NMDA-рецептора, действующий на глициновый сайт комплекса NMDA-рецептора.
Эффективность в анализе Ro 25-698l/DCKA количественно оценивали по % ответу (как показано, например, в Таблице 49 в WO 2017/100591) и/или по % максимального измеренного повышения эффективности. Из наиболее эффективных двадцати одного аналога, представленных в WO 2017/100591, в Ro 25-6981/DCKA анализе и ранжированных по % восстановленного ответа, ни одно из них, как было показано, не является аналогом пирролопиримидинона.
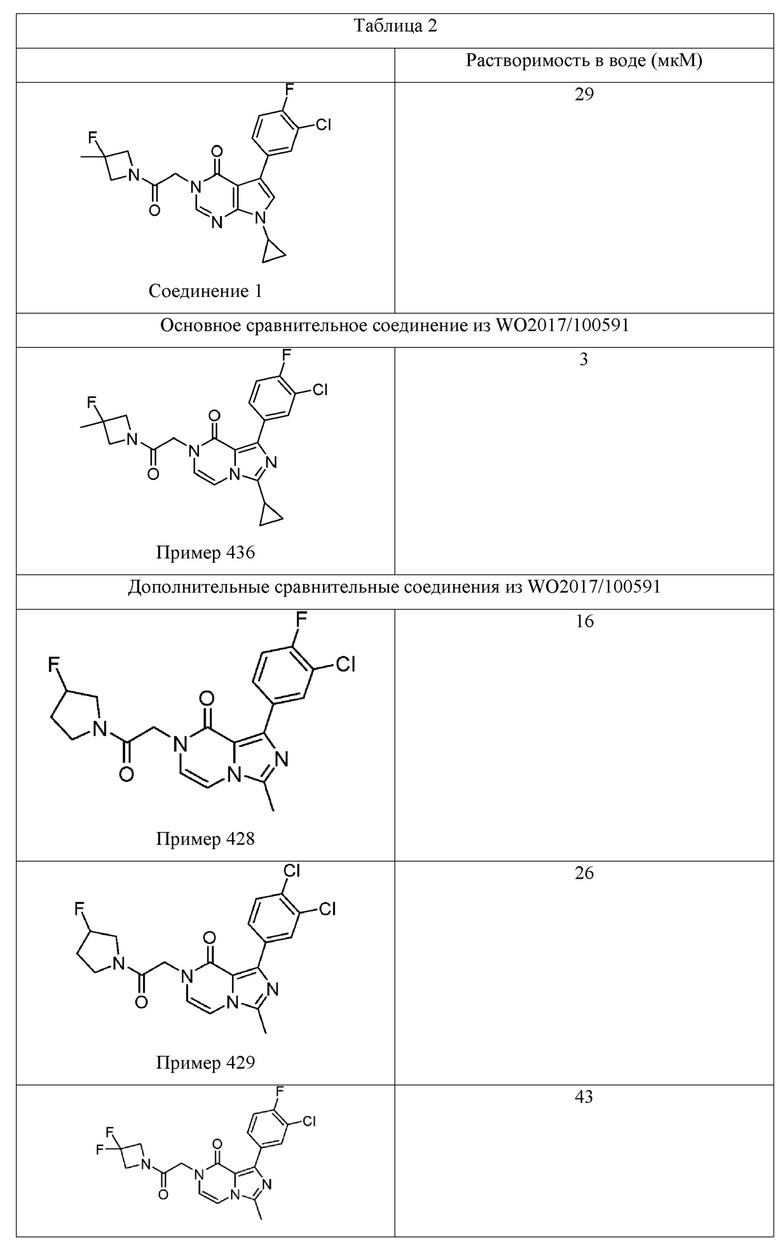
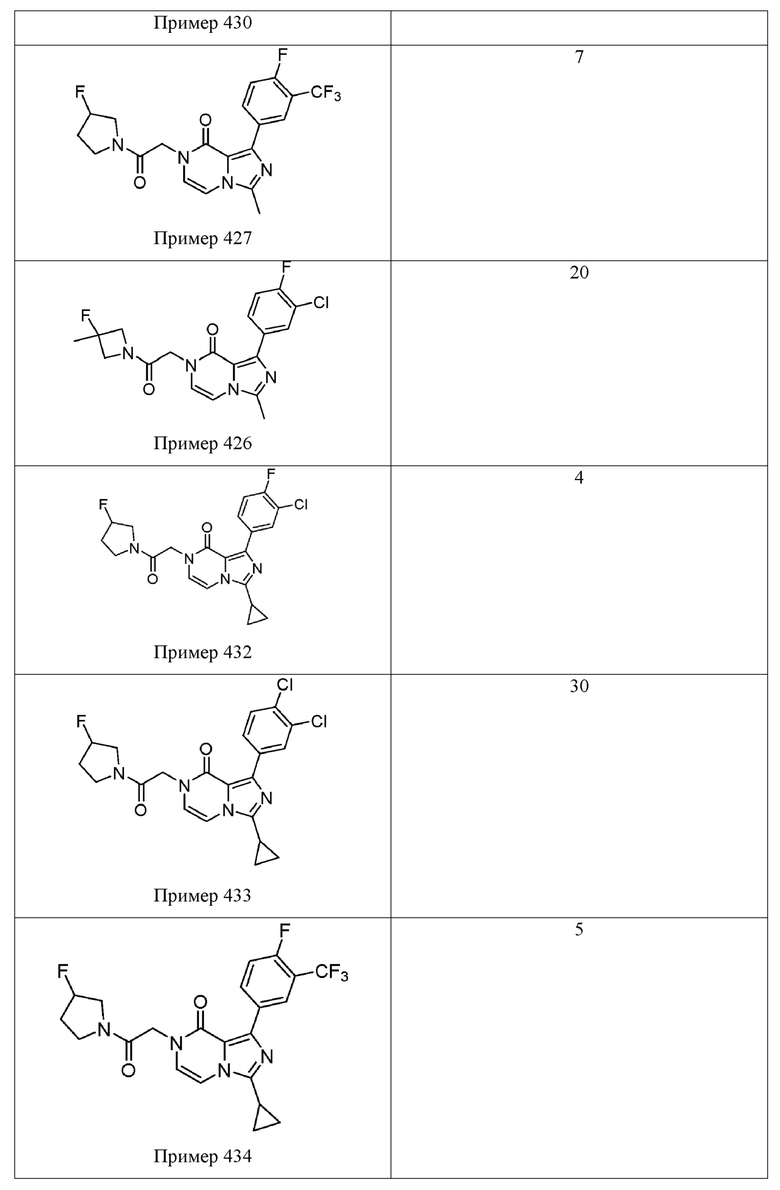
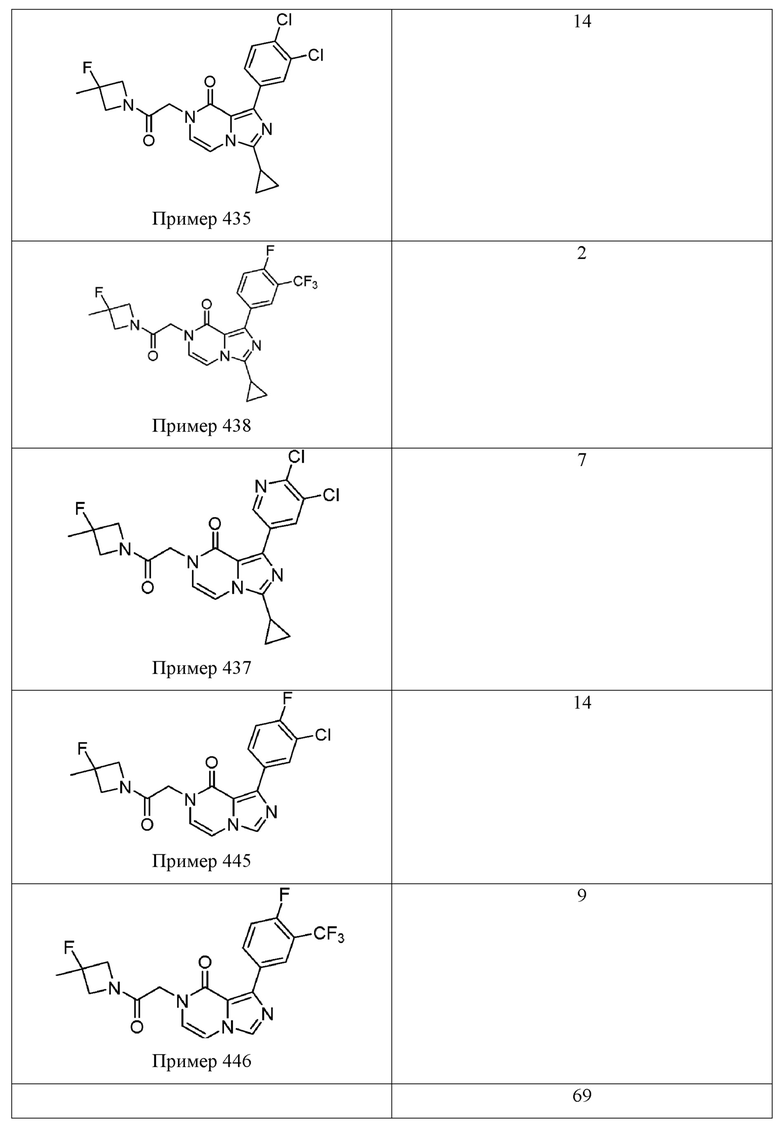
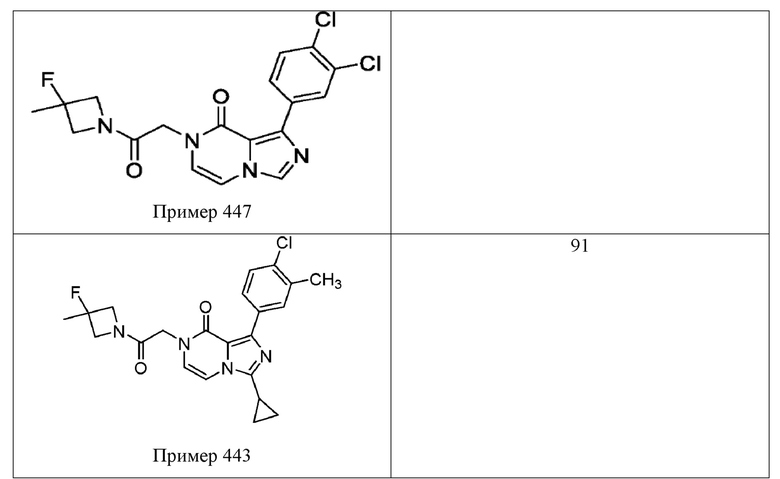
[0009] Существует сорок восемь пирроло[2,3-d]пиримидин-4-онов, приведенных в качестве примеров в WO 2017/100591. Данный каркас пирроло[2,3-d]пиримидин-4-он является идентичным гетероциклическому каркасу Соединения 1. Наиболее эффективным примером пирроло[2,3-d]пиримидин-4-она на основе % ответа, восстановленного в анализе Ro 25-6981/DCKA, приведенном в качестве примера в WO 2017/100591, является пример 174 (91% восстановленного ответа). См. например, Таблицу 49 в WO 2017/100591. Как показано в Таблице 1 ниже, Соединение 1 в приблизительно три раза превосходит Пример 174 по эффективности, в раскрытом ооцитном NR2B PAM анализе усиления действия. Другой пример пирроло[2,3-d] пиримидин-4-она приведен в Примере 181 в WO 2017/100591. Как было определено, это соединение является наиболее эффективным приведенным в качестве примера пирроло[2,3-d] пиримидин-4-оном на основе максимального измеренного усиления действия (%) в анализе Ro 25-698l/DCKA. См. Таблицу 1, приведенную ниже, для сравнения Примеров 174 и 181 в этих двух считываниях показаний эффективности из данного анализа Ro 25-698l/DCKA. Аналогично результатам Примера 174 было установлено, что Соединение 1 является более эффективным (приблизительно в 2,5 раза) в описанном тесте усиления действия ооцита NR2B PAM. Вместе эти результаты подтверждают преимущество клинической эффективности Соединения 1 по сравнению с другими каркасами на основе пирроло[2,3-d]пиримидин-4-она.
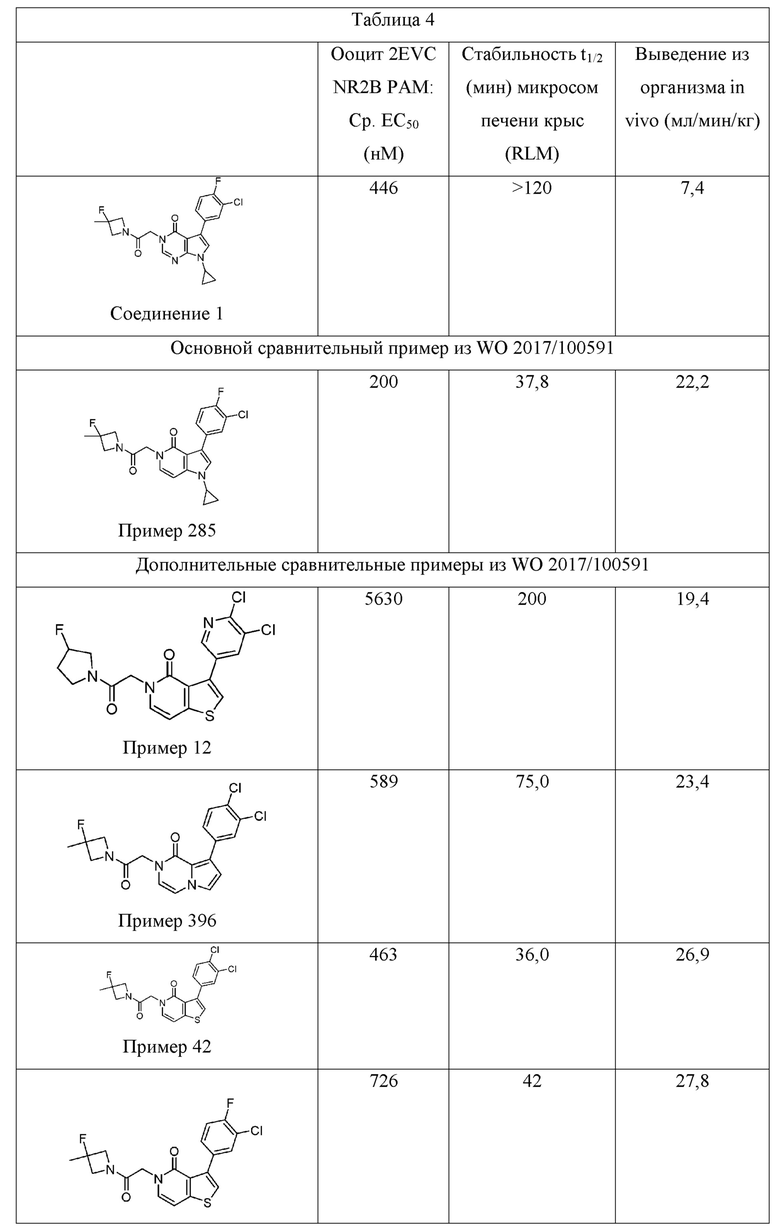
[0010] В терминах структурно родственных аналогов, WO 2017/100591 описывает структурный изомер Соединения 1 (т. е. Пример 436), а также один вариант азота (т. е. Пример 285). Несмотря на эти структурные подобия, было установлено, что Соединение 1 обладает превосходной растворимостью в воде, микросомальной стабильностью и/или фармакокинетическими свойствами по сравнению с этими двумя соединениями. В Таблице 2, например, показано, что Соединение 1 имеет приблизительно 10-кратное увеличение растворимости в воде по сравнению с Примером 436, структурным изомером Соединения 1. Было обнаружено, что Соединение 1 обладает превосходной проницаемостью клеток (32×10-6 см/с для А→B и B→А) и не является субстратом для эффлюкса в MDR1-трансфецированных клетках MDCK (коэффициент эффлюкса = 0,99). См. Таблицу 3. Таблица 4 показывает, что Соединение 1 демонстрирует значительно улучшенную микросомальную стабильность печени крыс в сравнении с Примером 285 (t1/2 > 120 мин по сравнению с 37,8 мин, соответственно), а также демонстрирует значительно улучшенное выведение из организма in vivo у крыс по сравнению с Примером 285 (выведение из организма IV = 7,4 мл/мин/кг по сравнению с 22,2 мл/мин/кг) и несколькими другими аналогами, представленными в WO 2017/100591.
[0011] Приведенные выше данные подтверждают многочисленные клинические преимущества Соединения 1, тем самым обеспечивая решение для нахождения альтернативных NMDA модуляторов, имеющих, например, улучшенную активность, повышенную растворимость, благоприятную микросомальную стабильность и in vivo выведение из организма и превосходную клеточную проницаемость.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
[0012] Фиг.1 иллюстрирует эффект усиления познавательной функции при пероральном приеме Соединения 1 (0,3, 1,0 и 3,0 мг/кг) по сравнению с фенциклидин (PCP)-индуцированным когнитивным нарушением в тесте распознавания новых объектов (NOR) у крыс.
[0013] На Фиг.2 показаны результаты, полученные при использовании Соединения 1 в модели негативности рассогласования эффективности.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
1. Соединения
[0014] В данной заявке представлено соединение, имеющее следующую структуру:
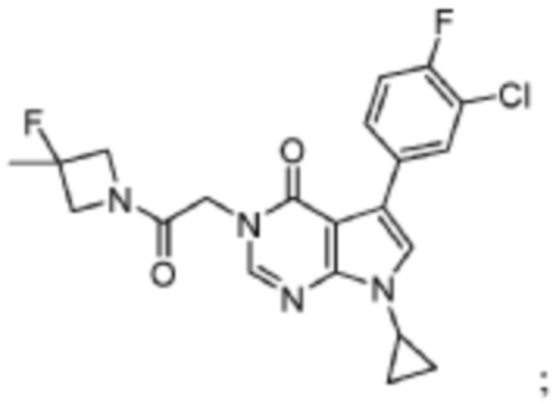
или его фармацевтически приемлемая соль.
2. Определения
[0015] Используемые в данной заявке термины "субъект" и "пациент" могут использоваться взаимозаменяемо, и означают млекопитающих, нуждающихся в лечении, например, домашних животных (например, собак, кошек и т.п.), сельскохозяйственных животных (например, коров, свиней, лошадей, овец, коз и т.п.) и лабораторных животных (например, крыс, мышей, морских свинок и т.п.). Обычно субъектом является человек, нуждающийся в лечении.
[0016] Включены фармацевтически приемлемые соли, а также нейтральные формы соединений, описанных в данной заявке. Для применения в лекарственных средствах соли данных соединений относятся к нетоксичным «фармацевтически приемлемым солям». Фармацевтически приемлемые солевые формы включают фармацевтически приемлемые кислотные/анионные или основные/катионные соли. Фармацевтически приемлемые основные/катионные соли включают соли натрия, калия, кальция, магния, диэтаноламина, н-метил-D-глюкамина, L-лизина, L-аргинина, аммония, этаноламина, пиперазина и триэтаноламина. Фармацевтически приемлемые кислотные/анионные соли включают, например, ацетат, бензолсульфонат, бензоат, бикарбонат, битартрат, карбонат, цитрат, дигидрохлорид, глюконат, глутамат, гликолиларзанилат, гексилрезорцинат, гидробромид, гидрохлорид, малат, малеат, малонат, мезилат, нитрат, салицилат, стеарат, сукцинат, сульфат, тартрат и тозилат.
[0017] Термин "фармацевтически приемлемый носитель" относится к нетоксичному носителю, адъюванту или носителю, которые не разрушают фармакологическую активность соединения, с которым они составлены в композицию. Фармацевтически приемлемые носители, адъюванты или носители, которые могут быть использованы в композициях, описанных в данной заявке, включают, но не ограничиваются приведенным, ионообменные вещества, оксид алюминия, стеарат алюминия, лецитин, белки сыворотки, такие как сывороточный альбумин человека, буферные вещества, такие как фосфаты, глицин, сорбиновая кислота, сорбат калия, неполные глицеридные смеси насыщенных растительных жирных кислот, воду, соли или электролиты, такие как протамин сульфат, динатрий кислый фосфат, кислый фосфат калия, хлорид натрия, соли цинка, коллоидный диоксид кремния, трисиликат магния, поливинилпирролидон, вещества на основе целлюлозы, полиэтиленгликоль, натрийкарбоксиметилцеллюлозу, полиакрилаты, воски, полиэтилен-полиоксипропилен-блок-полимеры, полиэтиленгликоль и шерстяный жир (ланолин).
[0018] Термин «фармацевтически приемлемые» означает молекулярные субстанции и композиции, которые не вызывают неблагоприятной, аллергической или других нежелательных реакций при введении животному или человеку, если это необходимо.
[0019] Термины "лечение" и "лечить" относятся к обратному ходу, облегчению, уменьшению вероятности развития или торможению развития заболевания, или расстройства или одного, или более симптомов, как описано в настоящей заявке. В некоторых вариантах воплощения изобретения лечение может быть введено после того, как развивается один или более симптомов, то есть терапевтическое лечение. В других вариантах воплощения изобретения лечение может быть введено в отсутствии симптомов. Например, лечение может вводиться восприимчивому индивидууму до начала симптомов (например, в свете истории симптомов и/или в свете генетических или других факторов восприимчивости), то есть профилактическое лечение. Лечение также может продолжаться после того, как симптомы устранены, например, для предотвращения или задержки их рецидивов.
[0020] Термин "эффективное количество" или "терапевтически эффективное количество" включает в себя количество соединения, описанного в данной заявке, которое будет вызывать биологический или медицинский ответ субъекта, например, дозу от 0,01 до 100 мг/кг массы тела/день.
[0021] «Соединение 1» и «5-(3-хлор-4-фторфенил)-7-циклопропил-3-(2-(3-фтор-3-метилазетидин-1-ил)-2-оксоэтил)-3,7-дигидро-4H-пирроло[2,3-d]пиримидин-4-он» используются взаимозаменяемо, и каждый термин относится к соединению, имеющему следующую формулу:

[0022] «PAM» относится к «позитивному аллостерическому модулятору».
3. Применение, получение и введение
[0023] В одном аспекте Соединение 1 или его фармацевтически приемлемая соль и композиции, описанные в данной заявке, полезны при лечении заболеваний и/или расстройств, связанных с активностью рецепторов NMDA. Такие заболевания и/или расстройства включают, например, психические, неврологические расстройства, расстройства нервно-психического развития, а также заболевания нервной системы.
[0024] В другом аспекте, Соединение 1 или его фармацевтически приемлемая соль и композиции, описанные в данной заявке, полезны для модулирования активности NMDA-рецептора.
[0025] В другом аспекте, Соединение 1 или его фармацевтически приемлемая соль и композиции, описанные в данной заявке, полезны для лечения шизофрении, болезни Альцгеймера, синдрома дефицита внимания и гиперактивности, аутизма и других связанных с нервной системой состояний.
[0026] В другом аспекте, Соединение 1 или его фармацевтически приемлемая соль и композиции, описанные в данной заявке, полезны для лечения шизофрении, включая позитивные, негативные и когнитивные симптомы. Шизофрения является изнурительным психическим расстройством, охватывающим три области симптомов: позитивный (психоз, галлюцинация, бред), негативный (синдром отмены) и когнитивный (глобальное снижение когнитивной способности). Позитивные симптомы шизофрении, как правило, появляются на ранней стадии взрослого возраста и их лечат антипсихотическими медикаментами. Однако когнитивные дефициты являются тяжелыми, появляются на подростковой продромной стадии, устойчивы к антипсихотической терапии и являются ведущей причиной нетрудоспособности в течение жизни, как измерено с помощью нарушенной глобальной функции (неспособность жить независимо, безработица и т.п.). Гипофункция NMDA-рецептора является ведущей гипотезой о причине шизофрении. Эта гипотеза подтверждается существенными клиническими данными, включая клиническую фармакологию, электрофизиологию, визуализацию, познавательную способность, нейроинформатику, нейроанатомические исследования и генетику. В частности, несколько линий данных свидетельствуют о гипофункции NMDA-рецепторов при шизофрении. См. Frank S. Menniti, Craig W. Lindsley, P. Jeffrey Conn, Jayvardhan Pandit, Panayiotis Zagouras, and Robert A. Volkmann, Allosteric Modulators for the Treatment of Schizophrenia: Targeting Glutamatergic Networks. Curr Top Med Chem. 2013; 13(1): 26-54.
[0027] В другом аспекте Соединение 1 или его фармацевтически приемлемая соль и композиции, описанные в данной заявке, полезны для улучшения когнитивной и глобальной функции и/или предотвращения возникновения шизофрении, например, у людей с риском развития шизофрении.
[0028] В другом аспекте Соединение 1 или его фармацевтически приемлемая соль и композиции, описанные в данной заявке, полезны для лечения когнитивных и эмоциональных нарушений и других симптомов, связанных с типичными психиатрическими расстройствами, включая большое депрессивное расстройство, и включая, но не ограничиваясь приведенным, страдающих от шизоаффективного расстройства, биполярного расстройства, обсессивно-компульсивного расстройства, дисфобного расстройства, дистимического расстройства, психотической депрессии, посттравматического стрессового расстройства и других тревожных расстройств. Например, в данной заявке представлены способы лечения расстройства дефицита внимания, ADHD (расстройства гиперактивности с дефицитом внимания), шизофрении, тревожности, улучшения состояния при опиатной, никотиновой и/или этанольной зависимости (например, способ лечения такой зависимости или облегчение побочных эффектов при отмене такой зависимости), повреждения спинного мозга, диабетической ретинопатии, травматического повреждения головного мозга и/или посттравматического стрессового синдрома у пациента, нуждающегося в таком лечении, которое включает введение Соединения 1 или его фармацевтически приемлемой соли или его композиции.
[0029] В другом аспекте Соединение 1 или его фармацевтически приемлемая соль и композиции, описанные в данной заявке, полезны для лечения когнитивных и эмоциональных нарушений и других симптомов, являющихся результатом неврологических заболеваний, включая, но не ограничиваясь приведенным, пациента, страдающего от умеренного когнитивного нарушения или любой формы деменции, болезни Альцгеймера, болезни Паркинсона, болезни Хантингтона, бокового амиотрофического склероза, рассеянного склероза и судорожных расстройств.
[0030] В другом аспекте Соединение 1 или его фармацевтически приемлемая соль и композиции, описанные в данной заявке, полезны для лечения дисфункции, вызванной нарушениями нервно-психического развития, например аномальным развитием головного мозга, включая, но не ограничиваясь приведенным, синдром Ретта, синдром дефицита внимания и гиперактивности, аутизм и нарушения аутистического спектра, такие как синдром Фелан-МакДермида, и другие формы умственной отсталости, такие как синдром ломкой Х хромосомы, туберозный склероз, синдром Смита-Лемли-Опитца, синдрома Дауна и детские эпилепсии или нарушения спектра эпилепсии/афазии, такие как доброкачественная частичная эпилепсия в детском возрасте с центрально-височными пиками (BECTS) или синдромом Ландау-Клеффнера (LKS). Также предложен способ лечения пациентов, страдающих от аномальной функции мозга, возникающей из-за инфекций центральной нервной системы, воздействия токсических агентов или других ксенобиотиков, или встречающихся в природе токсинов, и/или аутоиммунных нарушений, включая, но не ограничиваясь приведенным, анти-NMDA-рецепторный энцефалит.
[0031] В другом аспекте Соединение 1 или его фармацевтически приемлемая соль и композиции, описанные в данной заявке, полезны для лечения субъектов, имеющих гипофункцию NMDA-рецептора.
[0032] В данной заявке представлен способ лечения субъекта, страдающего заболеванием, расстройством или состоянием, описанным в данной заявке, включающий введение данному субъекту терапевтически эффективного количества Соединения 1 или его фармацевтически приемлемой соли или его композиции.
[0033] Также представлено применение Соединения 1 или его фармацевтически приемлемой соли или его композиции для получения лекарственного средства для лечения заболевания, расстройства или состояния, описанных в настоящей заявке.
[0034] Также представлено Соединение 1 или его фармацевтически приемлемая соль или его композиция для применения при лечении заболевания, расстройства или состояния, описанных в настоящей заявке.
[0035] В одном аспекте, предложены фармацевтически приемлемые композиции, содержащие Соединение 1 и фармацевтически приемлемый носитель. Эти композиции могут быть использованы для лечения одного или более из заболеваний, расстройств и состояний, описанных выше.
[0036] Раскрытые композиции можно вводить перорально, парентерально, путем ингаляции, местно, ректально, назально, буккально, вагинально или через имплантируемый резервуар. Термин "парентеральный", как он использован в данной заявке, включает подкожные, внутривенные, внутримышечные, внутрисуставные, интрасиновиальные, интрастернальные, интратекальные, внутрипеченочные, внутриочаговые и внутричерепные инъекции или инфузионные способы. В данную заявку включены жидкие стандартные лекарственные формы, инъекционные формы, твердые дисперсионные формы и стандартные лекарственные формы для местного или трансдермального введения соединения.
[0037] Количество Соединения 1, которое может быть скомбинировано с материалами носителя для получения композиции в единичной стандартной лекарственной форме, будет меняться в зависимости от пациента, подлежащего лечению, и конкретного способа введения. В некоторых вариантах воплощения изобретения, согласно данному изобретению, композиции могут быть получены таким образом, что доза в пределах от 0,01 до 100 мг/кг массы тела/день данного соединения, такая как, например, 0,1-100 мг/кг массы тела/день, может быть введена пациенту, получающему данные композиции.
[0038] Также следует понимать, что конкретная доза и режим лечения для любого конкретного пациента будут зависеть от различных факторов, включая возраст, массу тела, общее состояние здоровья, пол, диету, время введения, скорость выведения, комбинацию лекарственных средств, оценку лечащего врача и тяжесть конкретного заболевания, подвергающегося лечению. Количество предусмотренного соединения в композиции будет также зависеть от конкретного соединения в композиции.
[0039] Комбинированная терапия с использованием терапевтически эффективного количества Соединения 1 или его фармацевтически приемлемой соли и эффективного количества одного или более дополнительных фармацевтически активных агентов также включена в данную заявку. В одном аспекте, например, предлагается применение Соединения 1 или его фармацевтически приемлемой соли, и эффективного количества одного или более атипичных антипсихотических средств для лечения расстройства или заболевания, описанного в настоящей заявке. Атипичные антипсихотические средства включают, например, луразидон, кветиапин, оланзапин, азенапин, рисперидон, зипразидон, клозапин, мелперон, карипразин, арипипразол, пимавансерин, ITI-007, RP506 и ремоксиприд.
Примеры
[0040] Приведенные ниже репрезентативные примеры предназначены для пояснения настоящего изобретения и не предназначены, и не должны рассматриваться как ограничивающие объем данного изобретения.
Пример 1. Получение 5-(3-хлор-4-фторфенил)-7-циклопропил-3-(2-(3-фторо-3-метилазетидин-1-ил)-2-оксоэтил)-3,7-дигидро -4Н-пирроло[2,3-d] пиримидин-4-она
(Соединение 1)
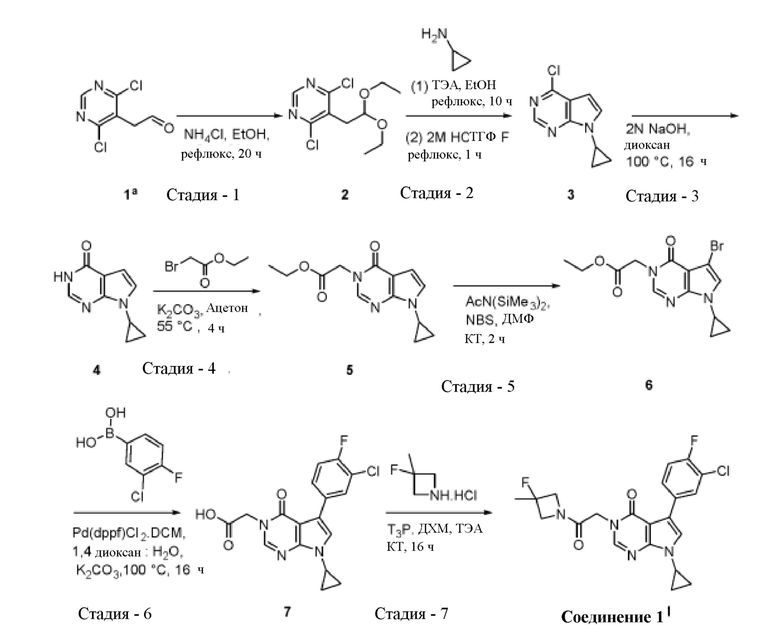
Стадия 1: Получение 4,6-дихлор-5-(2,2-диэтоксиэтил)пиримидина (2):
[0041] К раствору 2-(4,6-дихлорпиримидин-5-ил)ацетальдегида (1, 5 г, 26,17 ммоль) в этаноле (250 мл) добавляли хлорид аммония (2,11 г, 39,52 ммоль) и реакционную смесь кипятили с обратным холодильником в течение 20 ч. Реакционную смесь концентрировали; остаток разбавляли водой (50 мл) и экстрагировали этилацетатом (2×100 мл). Объединенный органический слой сушили над безводным сульфатом натрия, фильтровали и концентрировали с получением титульного соединения 4,6-дихлор-5-(2,2-диэтоксиэтил)пиримидина (2, 6,9 г, неочищенного) в виде бесцветного масла. Вычислено (М+Н): 265,04; Найдено (М+Н): 265.
Стадия 2: Получение 4-хлор-7-циклопропил-7Н-пирроло[2,3-d] пиримидина (3):
[0042] К раствору 4,6-дихлор-5-(2,2-диэтоксиэтил) пиримидина (2, 6,9 г, 26,02 ммоль) и триэтиламина (3,63 мл, 26,02 ммоль) в этаноле (150 мл) добавляли циклопропиламин (2 мл, 28,62 ммоль) и реакционную смесь кипятили с обратным холодильником в течение 10 часов. Реакционную смесь упаривали в вакууме; остаток разбавляли водой (100 мл) и экстрагировали этилацетатом (2×200 мл). Объединенный органический слой сушили над безводным сульфатом натрия, фильтровали и концентрировали. Остаток растворяли в тетрагидрофуране (150 мл), добавляли 2М соляную кислоту (75 мл) и реакционную смесь кипятили с обратным холодильником в течение 1 часа. Реакционную смесь концентрировали, остаток растворяли в воде (100 мл), подщелачивали до рН 10 раствором гидроксида натрия и экстрагировали этилацетатом (2×200 мл). Объединенный органический слой сушили над безводным сульфатом натрия, фильтровали и концентрировали с получением титульного соединения 4-хлор-7-циклопропил-7Н-пирроло[2,3-d]пиримидина (3, 5 г, неочищенного) в виде коричневатого полутвердого вещества. Вычислено (М+Н): 194,04; Найдено (М+Н): 194.
Стадия 3: Получение 7-циклопропил -3,7-дигидро -4 Н-пирроло [2,3-d] пиримидин-4-она (4):
[0043] Раствор 4-хлор-7-циклопропил-7Н-пирроло[2,3-d]пиримидина (3, 19 г, 98,44 ммоль) в диоксане (400 мл) и 2N растворе гидроксида натрия (400 мл) нагревали при 100°С в течение 16 ч. Реакционную смесь концентрировали для удаления диоксана. Водный остаток разбавляли водой (~200 мл) и подкисляли до рН ~4-6 с использованием 1,5N раствора соляной кислоты. Осажденное твердое вещество фильтровали, промывали гексаном и сушили под вакуумом с получением титульного соединения 7-циклопропил -3,7-дигидро-4Н-пирроло[2,3-d]пиримидин-4-она (4, 14,93 г, 87% выход) в виде коричневатого твердого вещества. Вычислено (М+Н): 176,07; Найдено (М+Н): 176.
Стадия-4: Получение этил 2-(7-циклопропил-4-оксо-4,7-дигидро-3Н-пирроло[2,3-d] пиримидин-3-ил)ацетата (5):
[0044] К раствору 7-циклопропил -3,7-дигидро -4Н-пирроло [2,3-d]пиримидин-4-она (4, 2,7 г, 15,41 ммоль) в ацетоне (60 мл) добавляли этил-2-бромацетат (5,1 г, 30,8 ммоль) и карбонат калия (6,2 г, 46,2 ммоль) при комнатной температуре и реакционную смесь перемешивали при 55°С в течение 4 ч. Реакционную смесь охлаждали до комнатной температуры и фильтровали. Твердое вещество промывали этилацетатом (100 мл) и объединенный фильтрат выпаривали с получением неочищенного продукта, который очищали колоночной хроматографией на силикагеле, используя 40% этилацетат в гексане, с получением титульного соединения этил 2-(7-циклопропил-4-оксо-4,7-дигидро-3Н-пирроло[2,3-d]пиримидин-3-ил)ацетата (5, 3,5 г, 87% выход) в виде грязно- белого твердого вещества. Вычислено (М+Н): 262,11; Найдено (М+Н): 262.
Стадия-5: Получение этил 2-(5-бром-7-циклопропил-4-оксо-4,7-дигидро-3Н-пирроло [2,3-d]пиримидин-3-ил)ацетата (6):
[0045] К перемешиваемому раствору этил 2-(7-циклопропил-4-оксо-4,7-дигидро-3Н-пирроло[2,3-d]пиримидин-3-ил)ацетата (5, 3 г, 11,4 ммоль) в N,N-диметилформамиде (200 мл) добавляли N,O-(бис-триметилсилил)ацетамид (5,1 г, 25 ммоль) и N-бромсукцинимид (2,02 г, 11,4 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение 2 ч. Реакционную смесь гасили холодной водой (400 мл) и экстрагировали этилацетатом (2×200 мл). Объединенный органический слой сушили над безводным сульфатом натрия, фильтровали и концентрировали. Неочищенный продукт очищали колоночной хроматографией на силикагеле, используя 35% этилацетат в гексане, с получением титульного соединения этил 2-(5-бром-7-циклопропил-4-оксо -4,7-дигидро -3Н-пирроло[2,3-d] пиримидин-3-ил)ацетата (6, 2,1 г, 54% выход) в виде грязно-белого твердого вещества. Вычислено (М+Н): 340,02; Найдено (М+Н): 340.
Стадия 6: Получение 2-(5-(3-хлор-4-фторфенил)-7-циклопропил-4-оксо-4,7-дигидро-3H-пирроло [2,3-d]пиримидин-3-ил)уксусной кислоты (7):
[0046] К раствору этил 2-(5-бром-7-циклопропил-4-оксо-4,7-дигидро -3Н-пирроло[2,3-d] пиримидин-3-ил)ацетата (6, 7,5 г, 22,04 ммоль) и (3-хлор-4-фторфенил)бороновой кислоты (5,76 г, 33,07 ммоль) в смеси 1,4-диоксан: вода (250 мл, 4: 1) добавляли карбонат калия (9,15 г, 66,14 ммоль). Реакционную смесь продували аргоном в течение 20 мин. Затем добавляли [1,1'-бис(дифенилфосфино)ферроцен]дихлорпалладий (II), комплекс с дихлорметаном (0,9 г, 1,10 ммоль) и реакционную смесь перемешивали при 100°С в течение 16 ч. Реакционную смесь фильтровали через слой целита, фильтрат разбавляли водой (100 мл) и промывали этилацетатом (2×200 мл). Органический слой отбрасывали. Водный слой подкисляли 1,5 N соляной кислотой, осажденное твердое вещество фильтровали и сушили под вакуумом с получением титульного соединения 2-(5-(3-хлор-4-фторфенил)-7-циклопропил-4-оксо-4,7-дигидро -3Н-пирроло [2,3-d]пиримидин-3-ил) уксусной кислоты (7, 6 г, неочищенный) в виде грязно-белого твердого вещества. Вычислено (М+Н): 362,06; Найдено (М+Н): 362,1.
Стадия-7: Получение 5-(3-хлор-4-фторфенил)-7-циклопропил-3-(2-(3-фтор-3-метилазетидин-1-ил)-2-оксоэтил)-3,7-дигидро -4 H-пирроло [2,3-d] пиримидин-4-она:
[0047] К перемешиваемому раствору 2-(5-(3-хлор-4-фторфенил)-7-циклопропил-4-оксо -4,7-дигидро -3Н-пирроло [2,3-d]пиримидин-3-ил) уксусной кислоты (7, 1,8 г, 4,9 ммоль) в дихлорметане (70 мл) добавляли триэтиламин (1,36 мл, 9,9 ммоль) и гидрохлорид 3-фтор-3-метилазетидина (1,24 г, 9,9 ммоль) при комнатной температуре. Реакционную смесь перемешивали в течение 10 минут, затем добавляли при 0°С безводный раствор пропилфосфоновой кислоты (T3P) (6,33 мл, 9,9 ммоль, 50% в этилацетате) и реакционную смесь перемешивали при комнатной температуре в течение 16 часов. Реакционную смесь разбавляли водой (50 мл) и экстрагировали дихлорметаном (3×70 мл). Объединенный органический слой сушили над безводным сульфатом натрия, фильтровали и выпаривали с получением неочищенного продукта, который очищали колоночной хроматографией на силикагеле, используя 4% метанол в дихлорметане, с получением титульного соединения 5-(3-хлор-4-фторфенил)-7-циклопропил-3-(2-(3-фтор-3-метилазетидин-1-ил)-2-оксоэтил)-3,7-дигидро -4Н-пирроло [2,3-d] пиримидин-4-она (Соединение 1, 1,1 г, выход 51%) в виде белого твердого вещества. Вычислено (M+H): 433,12; Найдено (M+Н): 433,1; 1H ЯМР (400 Мгц, ДМСО-d6) δ (ppm): 8,26 (d, j=6 Гц, 1Н), 8,15 (s, 1Н), 7,93-7,91 (m, 1Н), 7,58 (s, 1Н), 7,35 (t, j=8,8 Гц, 1Н), 4,67 (s, 2Н), 4,45-4,32 (m, 2Н), 4,05-3,97 (m, 2Н), 3,64-3,59 (m, 1Н). 1,61 (d, j=22 Гц, 3H), 1,10-1,00 (m, 4H). Чистота по данным ВЭЖХ: 99,28%.
Пример 2 - Альтернативное получение 5-(3-хлор-4-фторфенил)-7-циклопропил-3-(2-(3-фтор-3-метилазетидин-1-ил)-2-оксоэтил)-3,7-дигидро -4H-пирроло[2,3-d] пиримидин-4-она (Соединение 1)
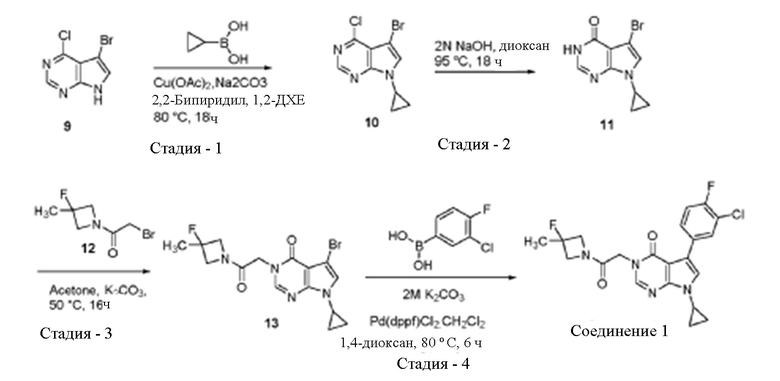
Стадия 1: Получение 5-бром-4-хлор-7-циклопропил -7Н-пирроло [2,3-d] пиримидина
10:
[0048] К раствору 5-бром-4-хлор -7H-пирроло [2,3-d] пиримидина 9 (10,0 г, 43,10 ммоль) в 1,2-дихлорэтане (100,0 мл) добавляли циклопропилбороновую кислоту (7,41 г, 86,20 ммоль), карбонат натрия (10,0 г, 86,20 ммоль) и 2,2'-бипиридил (6,70 г, 43,53 ммоль). Затем в реакционную смесь продували кислород в течение 30 минут и добавляли ацетат меди (8,21 г, 45,25 ммоль). Суспензию перемешивали при 80°С в течение 18 ч. После завершения реакционную смесь гасили 1N раствором соляной кислоты при комнатной температуре (до рН=1,0). Раствор экстрагировали дихлорметаном (4×100 мл) и объединенный органический слой сушили над безводным сульфатом натрия. Раствор концентрировали и остаток очищали колоночной хроматографией на силикагеле (используя 10% этилацетат в гексане) с получением титульного соединения 5-бром-4-хлор-7-циклопропил-7Н-пирроло[2,3-d]пиримидина 10 в виде грязно-белого твердого вещества. Выход: 8,00 г, 68,4%. Масс-спектр (ESI): m/z 271,94 [M+l]+.
Стадия 2: Синтез 5-бромо-7-циклопропил -3,7-дигидро-4Н-пирроло[2,3-d] пиримидин-4-она (11):
[0049] Раствор 5-бром-4-хлор-7-циклопропил-7Н-пирроло[2,3-d] пиримидина 10 (8,00 г, 29,52 ммоль) в диоксане (40,00 мл) и 2N растворе гидроксида натрия (40,00 мл) нагревали при 95°С в течение 18 часов. После завершения реакционную смесь концентрировали для удаления диоксана. Водный остаток разбавляли водой (прибл. 50 мл) и подкисляли до рН приблизительно 3 с использованием 1N раствора соляной кислоты. Осажденное твердое вещество фильтровали, промывали гексаном и сушили в вакууме с получением титульного соединения 5-бром-7-циклопропил-3,7-дигидро-4Н-пирроло[2,3-d] пиримидин-4-она 11 в виде твердого вещества грязно-белого цвета. Выход: 5,80 г, 77,70%. Масс-спектр (ESI) m/z 254,05 [M+l]+.
Синтез промежуточного 2-бромо-1-(3-фтор-3-метилазетидин-1-ил)этан-1-она (12)
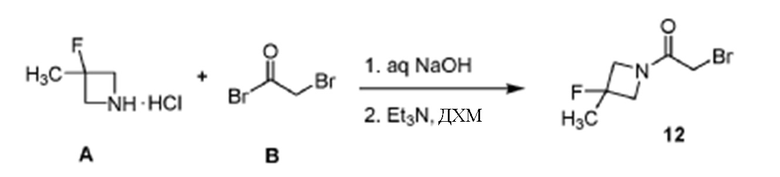
[0050] К перемешиваемому раствору соединения А (44,0 г, 352 ммоль) в ДХМ (400 мл) добавляли NaOH (1,0 мМ раствор, 14,0 г, 352 ммоль) и перемешивали двухфазный раствор при комнатной температуре в течение 30 мин. Раствор разделяли и водную фазу экстрагировали ДХМ (50 мл). Объединенный органический слой сушили над безводным Na2SO4 и переносили в RBF. Раствор охлаждали до -10°С и затем медленно добавляли бромацетилбромид В (106, 5 мл, 528 ммоль) (для поддержания внутренней температуры при -5°С) и перемешивали при той же температуре в течение 2 ч. После завершения реакционную смесь гасили холодным насыщенным раствором NaHCO3 и оба слоя разделяли. Органический слой сушили над безводным Na2SO4 и концентрировали при пониженном давлении. Маслянистый остаток быстро испаряли через колонку с силикагелем (20-30% EtOAc в гексане), с получением 2-бром-1-(3-фтор-3-метилазетидин-1-ил)этан-1-она 12 в виде светло-коричневого масла. Выход: 53,0 г (73%). Масс-спектр (ESI) m/z 209,98 [M+l]+.
Стадия 3. Синтез 5-бром-7-циклопропил-3-(2-(3-фтор-3-метилазетидин-1-ил)-2-оксоэтил)-3,7-дигидро -4Н-пирроло [2,3-d] пиримидин-4-она 13
[0051] К раствору 5-бром-7-циклопропил-3-(2-(3-фтор-3-метилазетидин-1-ил))-2-оксоэтил)-3,7-дигидро-4Н-пирроло[2,3-d]пиримидин-4-она 11 (11,0 г, 43 ммоль) в ацетоне (110 мл) добавляли 2-бром-1-(3-фтор-3-метилазетидин-1-ил)этан-1-он 12 (10,9 г, 52 ммоль) и K2CO3 (11,8 г, 86 ммоль) при комнатной температуре. Реакционную смесь перемешивали при 60°С в течение 16 ч. После завершения реакционную смесь охлаждали до комнатной температуры, фильтровали через Целит® и промывали ацетоном (500 мл). Объединенный фильтрат упаривали, получая сырой продукт, который очищали путем тщательного промывания диэтиловым эфиром с получением титульного соединения 5-бром-7-циклопропил-3-(2-(3-фтор-3-метилазетидин-1-ил)-2-оксоэтил)-3,7-дигидро-4Н-пирроло[2,3-d]пиримидин-4-она 13 в виде светло-коричневого твердого вещества. Выход: 14,9 г (89,7%). Масс-спектр (ESI) m/z 294,23 [M+l]+.
Стадия 4: Синтез 5-(3-хлор-4-фторфенил)-7-циклопропил-3-(2-(3-фтор-3-метилазетидин-1-ил)-2-оксоэтил)-3,7-дигидро -4H-пирроло[2,3-d] пиримидин-4-она
(Соединение 1)
[0052] К раствору 5-бромо-7-циклопропил-3,7-дигидро -4Н-пирроло [2,3-d] пиримидин-4-она 13 (0,5 г, 1,3 ммоль) в 1,4-диоксане (4,0 мл) добавляли (3-хлор-4-фторфенил) бороновую кислоту (0,22 г, 1,3 ммоль) и K2CO3 (0,36 г, 2,6 ммоль, 2М раствор). Реакционную смесь сначала дегазировали аргоном в течение 10 минут и затем добавляли PdCl2 (dppf) ДХМ (0,047 г, 0,065 ммоль) в атмосфере аргона. Реакционную смесь перемешивали при 80°С в течение 6 часов. После завершения реакционную смесь охлаждали до комнатной температуры, фильтровали и промывали ДХМ (30 мл). Объединенный фильтрат выпаривали, с получением неочищенного продукта, который очищали колоночной хроматографией на силикагеле (5-6% метанол в ДХМ) и промывали ТГФ, с получением титульного соединения 5-(3-хлор-4-фторфенил)-7-циклопропил-3-(2-(3-фтор-3-метилазетидин-1-ил)-2-оксоэтил)-3,7-дигидро-4H-пирроло [2,3-d]пиримидин-4-она (Соединение 1) в виде светло-серого твердого вещества. Выход 0,170 г (30%) Масс-спектр (ESI) m/z 433,23 [M+l]+.
Биологические анализы
[0053] Как показано данными, представленными ниже, Соединение 1 является сильным позитивным аллостерическим модулятором для всех подтипов NR2A, NR2B, NR2C и NR2D NMDA.
Ооцитная 2EVC NR2A активность PAM
[0054] В 2-электродном гальваническом зажиме (2EVC) тестирования ооцитов, экспрессирующих hNR2A и активированных 7 мкМ глутамата и 13 мкМ глицина, измеряли усиление действия тока (100% усиление действия эквивалентно удвоению тока, индуцированного глутаматом/глицином), и активность Соединения 1. EC50 относится к концентрации соединения, которая дает полумаксимальный ответ.
Ооцитная 2 EVC NR2C активность PAM
[0055] Описание: В 2-электродном гальваническом зажиме (2EVC) тестирования ооцитов, экспрессирующих hNR2C и активированных 10 мкМ глутамата и 10 мкМ глицина, измеряли усиление действия тока (100% усиление действия эквивалентно удвоению тока, индуцированного глутаматом/глицином), и активность Соединения 1. EC50 относится к концентрации соединения, которая дает полумаксимальный ответ.
Ооцитная 2 EVC NR2D активность PAM
[0056] Описание: В 2-электродном гальваническом зажиме (2EVC) тестирования ооцитов, экспрессирующих hNR2D и активированных 10 мкМ глютамата и 10 мкМ глицина, измеряли усиление действия тока (100% усиление действия эквивалентно удвоению тока, индуцированного глутаматом/глицином), и активность Соединения 1. EC50 относится к концентрации соединения, которая дает полумаксимальный ответ.
Ооцитная 2 EVC NR2B активность PAM
[0057] В 2-электродном гальваническом зажиме напряжения (2EVC) тестирования ооцитов, экспрессирующих hNR2B и активированных 5 мкМ глутамата и 3 мкМ глицина, измеряли усиление действия тока (100% усиление действия эквивалентно удвоению тока, индуцированного глутаматом/глицином), и активность Соединения 1. EC50 относится к концентрации соединения, которая дает полумаксимальный ответ.
[0058] Как показано в приведенной ниже Таблице 1, Соединение 1 сравнивали с Примером 174 (наиболее эффективное иллюстративное соединение, тестируемое в анализе Ro 25-698l/DCKA, количественно определяли по % ответной реакции) и Примером 181 (наиболее эффективное иллюстративное соединение, тестируемое в анализе Ro 25-6981/DCKA, количественно определяли по % максимального измеренного усиления действия). Как показано в Таблице, Соединение 1 является приблизительно в три раза и в 2,5 раза более сильнодействующим в тесте потенциирования ооцитов NR2B PAM, чем в Примере 174 и Примере 181, соответственно. Это улучшение является полезным потому, что более высокая эффективность в анализе потенциирования ооцитов NR2B является, в одном аспекте, ожидаемой для обеспечения улучшенного терапевтического эффекта у человека.
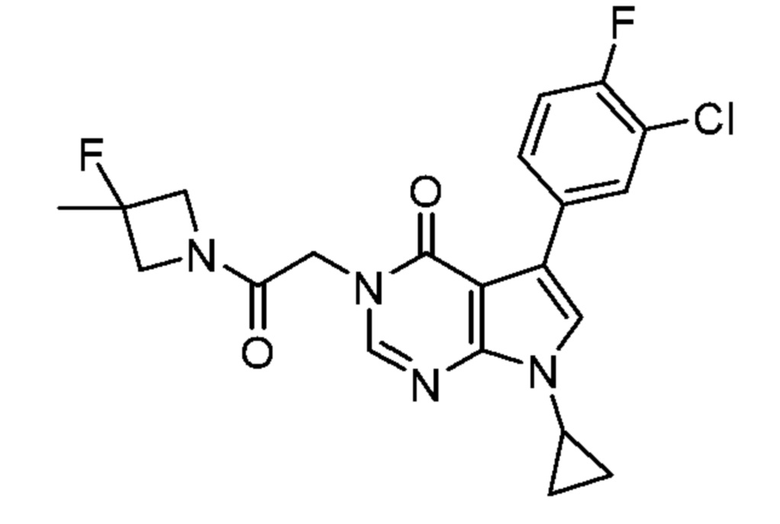
Соединение 1
Пример 174 Пример 181
Пример 181
Определения растворимости
[0059] Растворимость Соединения 1 исследовали и сравнивали с Примером 436 из WO 2017/100591, структурным изомером (имидазопиразиноновым каркасом) Соединения 1, который продемонстрировал активность (выход 100%) в анализе Ro 25-6981/DCKA. Растворимость в воде испытываемого соединения определяли в фосфатном буферном растворе, рН 7,4, измеренном способом встряхивания в колбе. В этом анализе исходный раствор испытываемого соединения в ДМСО добавляли к буферу с последующим уравновешиванием (встряхиванием), фильтрацией и определением растворимого количества с помощью ВЭЖХ-УФ. Как показано в Таблице, было обнаружено, что Соединение 1 имеет приблизительно 10-кратное увеличение растворимости в воде (29 мкМ по сравнению с 3 мкМ) по сравнению со структурным изомером Примера 436. Другие имидазопиразиноновые сравнительные примеры из WO 2017/100591 приведены для сравнения. Все сравнительные аналоги являются активными, а данные усиления действия доступны в WO 2017/100591. Это усовершенствование является полезным потому, что улучшенная растворимость в воде, в одном аспекте, как ожидается, обеспечивает улучшенную эффективность in vivo у человека.
Определения проницаемости и эффлюкса
[0060] Монослойные системы состоят из плотного слоя клеток, выращенных на пористом носителе для разделения двух жидких отделений. О них широко сообщалось как о наиболее сложных инструментах in vitro для среды для высокопроизводительного моделирования важных фармакокинетических барьеров, таких как кишечный эпителий, гематоэнцефалический барьер и т.п. (J Pharm Sci 2012 Apr; 101 (4): 1337-1354). Две системы, которые широко применяются в исследованиях монослойных систем, представляют собой клеточную линию карциномы ободочной кишки человека Caco-2 и MDR1-трансфецированные клетки MDCKII и LLC-PK1. В монослойных анализах измеряют поток соединения через монослой клеток. Однонаправленный поток рассматриваемого соединения определяют, применяя его либо к апикальной, либо к базальной боковой стороне слоя клеток и выполняя мониторинг разрешенного во времени перераспределения его между двумя отделениями. Векторное транспортное соотношение (часто называемое коэффициентом эффлюкса) определяют путем применения двунаправленных измерений апикально-базолатеральное (A-B) и базолатерально- апикальное (B-A). В общем случае соотношение выше 2 или ниже 0,5 указывает на вклад активного транспортного процесса в чистый поток соединения. При отсутствии таких транспортных процессов это соотношение составляет приблизительно 1.
[0061] Как показано в Таблице 3, Соединение 1 хорошо проникает через мембраны и не подвергается эффлюксу в анализе эффлюкса MDCK.
Определение стабильности человеческих микросом и микросом крыс
[0062] Печень является наиболее важным местом метаболизма лекарственного средства в организме.
Приблизительно 60% имеющихся в продаже соединений выводятся из организма с помощью CYP-опосредованного метаболизма в печени (McGinnity, D. F.; Soars, M. G.; Urbanowicz, R. A. and Riley, R. J.; Drug Metab. Disp. 32, 1247, (2004)). Микросомы печени представляют собой субклеточные фракции, которые содержат мембранносвязанные ферменты, метаболизирующие лекарство. Микросомы можно использовать для определенных видов выведения из организма in vitro соединения. Применение специфических микросом может быть использовано для понимания различий между видами.
[0063] Как показано, Соединение 1 демонстрирует хорошую стабильность в микросомах печени человека (HLM) и превосходную стабильность в микросомах печени крыс (RLM).
Выведение из организма in vivo
[0064] Соединение 1 также проявляет улучшенную микросомальную стабильность in vitro и выведение из организма in vivo в фармакокинетическом исследовании IV крыс. Как показано ниже, выведение из организма in vivo Соединения 1 значительно ниже, чем у структурно родственных NMDA, приведенных в качестве примеров в WO 2017/100591, для которых доступны данные выведения из организма крыс IV. Особо следует отметить Пример 285, аналог пирролопиридинона, который демонстрировал превосходное усиление действия в анализе Ro 25-6981/DCKA, и был исключительно структурно сходным с Соединением 1. Также представлены данные стабильности микросом крыс. Эти улучшения выведения из организма in vitro и in vivo являются полезными, потому что сниженное выведение из организма, в одном аспекте, как ожидается, обеспечивает улучшенную эффективность in vivo у человека.
Фармакология
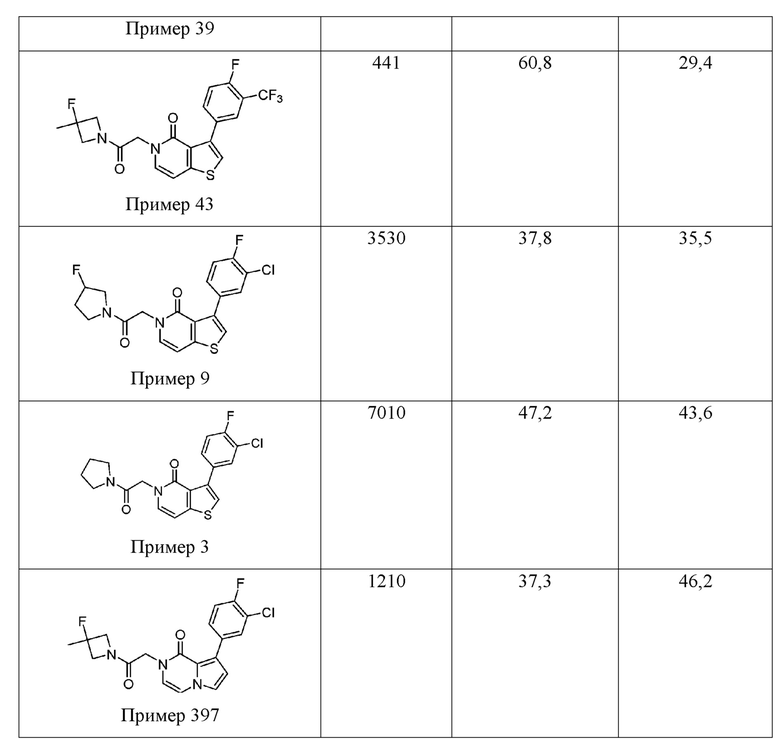
[0065] А. Распознавание новых объектов
[0066] Эффект усиления познавательной способности при пероральном приеме Соединения 1 (0,3, 1,0 и 3,0 мг/кг) тестировали на вызванном фенциклидином (РСР) когнитивном нарушении в тесте распознавания нового объекта у крыс (NOR). Это экспериментальные протокольные тесты для устранения дефицита памяти для распознавания объектов, вызываемого хроническим введением антагониста NMDA-рецептора, PCP.
[0067] Крыс обрабатывали дважды в день в течение 7 дней либо носителем с физиологическим раствором (контрольная группа), либо PCP (5 мг/кг, внутрибрюшинно). После 14-дневного периода промывки без лечения крыс тестировали в парадигме NOR. Вкратце, тестирование включает в себя два сеанса (T1 и T2), каждый из которых длится 3 минуты, через 1 час каждый. Носитель или Соединение 1 вводили до испытания Т1. На сеансе Т1 крыс помещали в испытательную зону с двумя идентичными объектами и давали возможность свободно исследовать, в то время как время, затрачиваемое ими на исследование каждого объекта, было зарегистрировано. На сеансе T2 крыс возвращали в зону тестирования, где один из объектов остается одним и тем же, а другой был заменен новым объектом. Время, затраченное на исследование нового объекта, в сравнении со временем, затраченным на исследование знакомого объекта, регистрируют и сравнивают с временем исследования объекта Т1.
[0068] По сравнению с контрольными животными, обработанными с использованием контроля-физиологического раствора, животные, обработанные PCP, показали значительное уменьшение времени, затрачиваемого на исследование нового объекта, подтверждая вызванный PCP дефицит у NOR. Как видно из данных на Фиг. 1, введение Соединения 1 (0,3 и 1,0 мг/кг, перорально) значительно устраняет этот дефицит, что проявляется в увеличении времени исследования нового объекта по сравнению с обработанными PCP крысами. 1 мг/кг дозы Соединения 1 полностью устранял РСР-вызванный дефицит, поскольку время исследования в этих дозах существенно не отличалось от времени, затраченном контрольными животными, получавшими физиологический раствор.
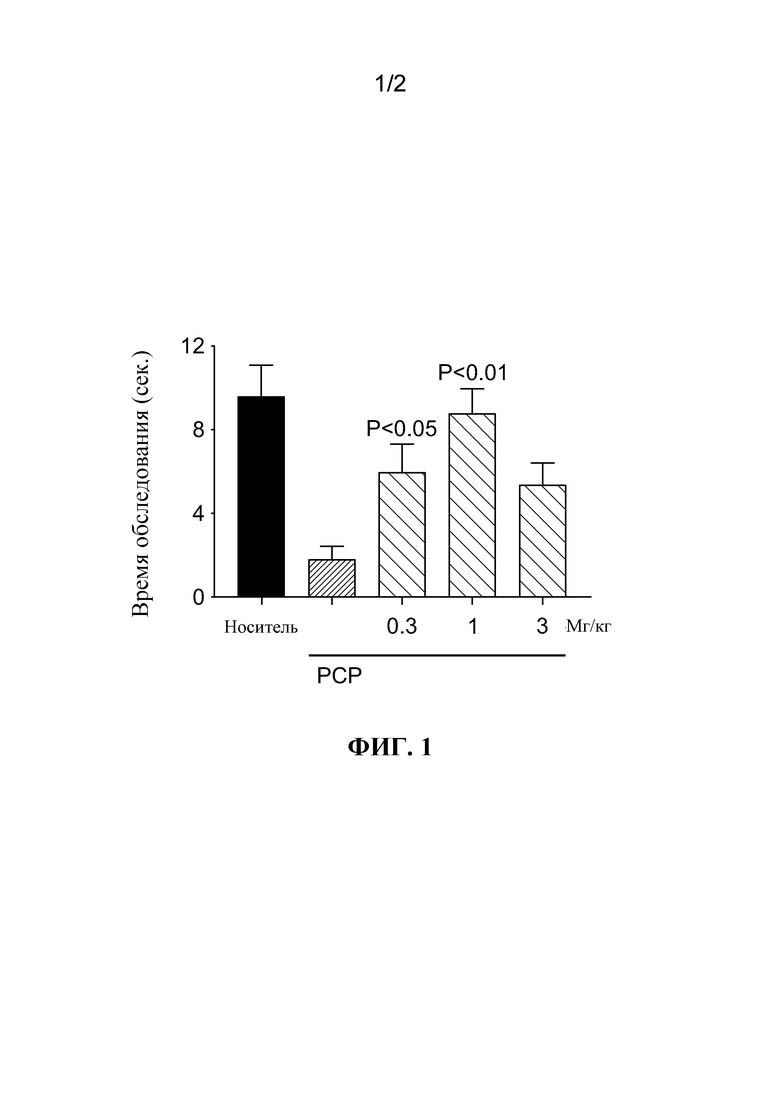
[0069] В. Модель эффективности негативности рассогласовывания
[0070] Патофизиологические биомаркеры гипофункции NMDA-рецептора при шизофрении включают в себя измерения ЭЭГ ранних событий слуховой обработки, такие как «негативность рассогласования», ЭЭГ событийно-обусловленный потенциал (ERP), который измеряет предвнимательное слуховое обнаружение новизны. MMN представляет собой переходную меру слухового обнаружения новизны у крыс и людей, и коррелируется с когнитивной и глобальной функцией у пациентов с шизофренией. Антагонисты NMDA-рецептора, PCP, МК-801 и кетамин вызывают острую недостаточность MMN у крыс (все три NMDAr-антагониста) и человеческих субъектов (кетамин).
[0071] Крысам с имплантированными лобными электродами ЭЭГ представляли различные звуковые стимулы, включающие протокол нетипичного слухового триггера. Вкратце, 1000 стандартных тонов по 6,0 кГц были доставлены с вероятностью 90%, и 100 девиантных тонов по 8,0 кГц доставляли с вероятностью 10% в псевдослучайном порядке (триггерная последовательность), и затем эта последовательность повторялась с 8 кГц тоном в качестве стандарта и 6 кГц тоном в качестве девианта (триггерная последовательность). MMN вычисляется как разность потенциалов, полученная вычитанием усредненного стандартного тонового отклика 8 кГц (триггер) из усредненного амплитудно-частотного отклика на 8 кГц (триггер) в каждый момент времени 1 мс по сравнению с периодами записи ЭЭГ от 50 мс до 150 мс после начала этих 50 мс слуховых тональных сигналов.
[0072] В 4-кратном перекрестном дизайне крысам вводили основу или Соединение 1 (60 мг/кг) дважды с промежутком 4 часа. Затем крысам вводили физиологический раствор или МК-801 (0,2 мг/кг, IP) непосредственно перед тестовыми сеансами. Тестовые сеансы состояли из трех 20-минутных триггерных блоков. Как показано на Фиг. 2, введение основы плюс МК-801 значительно снижало MMN по сравнению с введением основы и физиологического раствора. Кроме того, введение Соединения 1 (60 мг/кг BID) предотвращало нарушение MMN посредством МК-801, так что MMN, зарегистрированный после Соединения 1 плюс МК-801, более не отличался от MMN, зарегистрированного после введения основы и физиологического раствора, и был значительно больше по сравнению с MMN, зарегистрированным после введения основы и МК-801.
[0073] Хотя нами был описан ряд вариантов воплощения настоящего изобретения, очевидно, что основные примеры авторов изобретения могут быть изменены для обеспечения других вариантов воплощения изобретения, в которых используются соединения и способы настоящего изобретения. Поэтому следует понимать, что объем настоящего изобретения должен определяться прилагаемой формулой изобретения, а не конкретными вариантами воплощения изобретения, которые были представлены в качестве примера.
[0074] Содержание всех ссылок (включая литературные ссылки, выданные патенты, опубликованные патентные заявки и одновременно находящиеся в настоящее время на рассмотрении патентные заявки), процитированные во всей данной заявке, включены в данную заявку во всей своей полноте посредством ссылки. Если не указано иное, все технические и научные термины, используемые в данной заявке, соответствуют значению, общеизвестному специалисту в данной области техники.
| название | год | авторы | номер документа |
|---|---|---|---|
| 3,3-ДИФТОРПИПЕРИДИНКАРБАМАТНЫЕ ГЕТЕРОЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ В КАЧЕСТВЕ АНТАГОНИСТОВ NR2B NMDA-РЕЦЕПТОРА | 2016 |
|
RU2735277C2 |
| ПИРИДОПИРИМИДИНОНЫ И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ МОДУЛЯТОРОВ РЕЦЕПТОРА N-МЕТИЛ-D-АСПАРТАТА | 2016 |
|
RU2717665C2 |
| ЗАМЕЩЕННЫЕ ДИГИДРО БЕНЗОЦИКЛОАЛКИЛОКСИМЕТИЛ ОКСАЗОЛОПИРИМИДИНОНЫ, ИХ ПОЛУЧЕНИЕ И ПРИМЕНЕНИЕ | 2010 |
|
RU2543384C2 |
| ЦИКЛОПРОПИЛПИПЕРИДИНОВЫЕ ИНГИБИТОРЫ ТРАНСПОРТЕРА ГЛИЦИНА | 2005 |
|
RU2387644C2 |
| АМИДНЫЕ ПРОИЗВОДНЫЕ КАРБОНОВОЙ КИСЛОТЫ, СПОСОБ ИХ ПОЛУЧЕНИЯ И ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ НА ИХ ОСНОВЕ | 2001 |
|
RU2271361C2 |
| СОЕДИНЕНИЯ И СПОСОБЫ | 2015 |
|
RU2711442C2 |
| ПОЛОЖИТЕЛЬНЫЕ АЛЛОСТЕРИЧЕСКИЕ МОДУЛЯТОРЫ МУСКАРИНОВОГО АЦЕТИЛХОЛИНОВОГО РЕЦЕПТОРА M4 | 2017 |
|
RU2750935C2 |
| 3-ФТОРПИПЕРИДИНЫ В КАЧЕСТВЕ АНТАГОНИСТОВ NMDA/NR2B | 2004 |
|
RU2339630C2 |
| ОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ | 2017 |
|
RU2733975C2 |
| ПИРРОЛОПИРИМИДИНОВЫЕ СОЕДИНЕНИЯ И ИХ ПРИМЕНЕНИЯ | 2011 |
|
RU2563644C2 |
Изобретение относится к 5-(3-хлор-4-фторфенил)-7-циклопропил-3-(2-(3-фтор-3-метилазетидин-1-ил)-2-оксоэтил)-3,7-дигидро-4H-пирроло[2,3-d]пиримидин-4-ону формулы
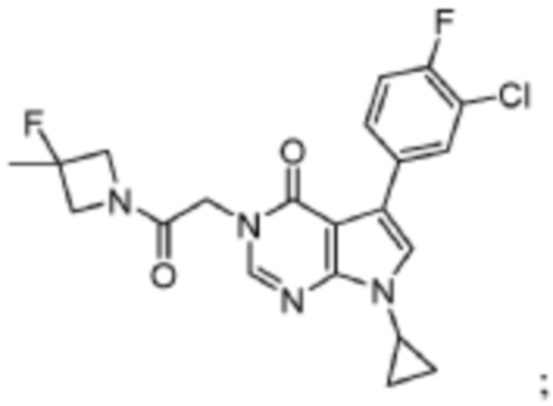
или его фармацевтически приемлемой соли. Также предложена фармацевтическая композиция, содержащая указанное соединение или его фармацевтически приемлемую соль. Предложенное соединение способно модулировать активность NMDA-рецепторов и может применяться при лечении психиатрических, неврологических расстройств и расстройств нервно-психического развития, а также заболеваний нервной системы. 2 н. и 10 з.п. ф-лы, 2 ил., 4 табл., 2 пр.
1. Соединение формулы
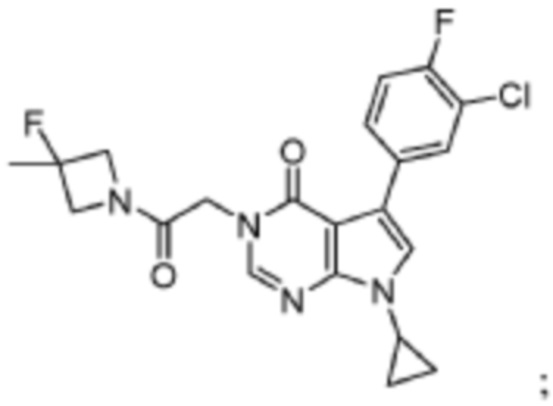
или его фармацевтически приемлемая соль.
2. Фармацевтическая композиция для модулирования активности NMDA-рецепторов, содержащая соединение по п. 1 или его фармацевтически приемлемую соль и фармацевтически приемлемый носитель.
3. Соединение по п. 1 или его фармацевтически приемлемая соль, предназначенное для лечения нейропсихиатрического расстройства, расстройства нервно-психического развития или неврологического расстройства.
4. Соединение по п. 3, где нейропсихиатрическое расстройство представляет собой шизофрению, шизоаффективное расстройство, биполярное расстройство или депрессию.
5. Соединение по п. 3, где расстройство нервно-психического развития представляет собой синдром нарушения внимания с гиперактивностью, расстройство аутистического спектра или задержку умственного развития.
6. Соединение по п. 5, где задержка умственного развития представляет собой синдром Фелана-МакДермида, синдром Смита-Лемли-Опитца, синдром ломкой Х хромосомы или синдром Ретта.
7. Соединение по п. 3, где неврологическое расстройство представляет собой судорожное или эпилептическое расстройство, нейродегенеративное нарушение, афазию или энцефалит.
8. Соединение по п. 7, отличающийся тем, что неврологическое расстройство представляет собой болезнь Альцгеймера или анти-NMDA-рецепторный энцефалит (ANRE).
9. Соединение по п. 1 или его фармацевтически приемлемая соль, предназначенное для лечения шизофрении.
10. Соединение по п. 1 или его фармацевтически приемлемая соль, предназначенное для лечения позитивных симптомов шизофрении.
11. Соединение по п. 1 или его фармацевтически приемлемая соль для лечения негативных симптомов шизофрении.
12. Соединение по п. 1 или его фармацевтически приемлемая соль для лечения когнитивных симптомов шизофрении.
| WO 2017100591 A1, 15.07.2017 | |||
| WO 2016081649 A1, 26.05.2016 | |||
| WO 2016034703 A1, 10.03.2016 | |||
| АМИДНЫЕ ПРОИЗВОДНЫЕ КАРБОНОВОЙ КИСЛОТЫ, СПОСОБ ИХ ПОЛУЧЕНИЯ И ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ НА ИХ ОСНОВЕ | 2001 |
|
RU2271361C2 |
Авторы
Даты
2023-07-17—Публикация
2019-08-02—Подача