ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
В данной заявке содержится перечень последовательностей, который был представлен в электронном виде в формате ASCII и полностью включен в данный документ посредством ссылки. Указанная копия ASCII, созданная 6 июня 2019 года, называется 50474- 162W02_Sequence_Listing_02.06.19_ST25 и имеет размер 293 645 байт.
ОБЛАСТЬ ТЕХНИКИ
Данное изобретение относится в целом к биспецифичным антигенсвязывающим молекулам, их композициям и способам для лечения заболеваний, таких как рак.
УРОВЕНЬ ТЕХНИКИ
Манипулирование межклеточными контактактами между отдельными типами клеток у пациента представляет собой перспективный подход для лечения различных болезненных состояний. Так, например, биспецифичные антигенсвязывающие молекулы (например, биспецифичные антитела), имеющие два плеча, каждое из которых, специфично к различному антигену-мишени, находятся в разработке в направлении их способности осуществлять контакт иммунных клеток с клетками-мишенями. Применение таких биспецифичных антител было многообещающим при различных расстройствах, таких как рак, в которых эффективное иммуно-опосредованное уничтожение клеток-мишеней опухоли наблюдались в клинических испытаниях. Для придания специфичности к опухоли, нацеленные на опухоли плечи биспецифичных антител были разработаны для нацеливания на антигены, которые избыточно экспрессируются на опухолевых клетках.
Существующие биспецифичные антитела могут иметь ряд ограничений, в том числе короткий период полураспада и токсичность для здоровых тканей. Биспецифичные антитела, которые полагаются на избыточную экспрессию опухолевыми клетками антигена-мишени, часто убивают здоровые, неопухолевые клетки, которые экспрессируют нормальные уровни антигена. Такие целевые эффекты вне опухоли ограничивают терапевтический индекс терапии биспецифичным антителом путем ограничения максимальной дозы переносимой субъектом. Таким образом, существует неудовлетворенная потребность в области разработки биспецифичных антигенсвязывающих молекул (например, биспецифичных антител) с повышенной селективностью по отношению к клетке-мишени или ткани.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Данное изобретение относится к биспецифичным антигенсвязывающим молекулам, имеющим моновалентное плечо и бивалентное плечо (например, Т-клеточно-зависимым биспецифичным (TDB- T cell-dependent bispecific) антителам, имеющим моновалентное плечо и бивалентное плечо).
В одном аспекте данное изобретение относится к биспецифичной антигенсвязывающей молекуле, содержащей моновалентное плечо и бивалентное плечо, при этом: (а) моновалентное плечо содержит первый антигенсвязывающий фрагмент, при этом С-конец указанного первого антигенсвязывающего фрагмента, слит с N-концом первой Fc-субъединицы; (b) бивалентное плечо содержит второй антигенсвязывающий фрагмент и третий антигенсвязывающий фрагмент, при этом С-конец третьего антигенсвязывающего фрагмента слит с N-концом второго антигенсвязывающего фрагмента, и СС-конец второго антигенсвязывающего фрагмента, слит с N-концом второй Fc-субъединицы; и (с) первая Fc-субъединица связана со второй Fc-субъединицей с образованием Fc-домена, при этом первый антигенсвязывающий фрагмент способен специфично связываться с первым антигеном-мишенью, а каждый из второго антигенсвязывающего фрагмента и третьего антигенсвязывающего фрагмента способен специфично связываться со вторым антигеном клетки-мишени. В некоторых вариантах осуществления первый антиген-мишень представляет собой активирующий Т-клетки антиген, такой, как CD3 и/или второй антиген клетки-мишени представляет собой опухолевый антиген (например, HER2). В некоторых вариантах осуществления, опухолевый антиген экспрессируется на (а) опухолевых клетках субъекта и (b) на по меньшей мере одном типе неопухолевых клеток у субъекта.
В некоторых вариантах осуществления отношение количества копий антигена на неопухолевых клетках к количеству антигена на опухолевых клетках составляет от 1:10 до 1:1000 (например, от 1:100 до 1:200). В некоторых вариантах осуществления данного изобретения количество копий опухолевого антигена от 102 до 105 на неопухолевую клетку и от 103 до 107 на клетку опухоли.
В некоторых вариантах осуществления, количество копий опухолевого антигена (например, среднее количество копий опухолевого антигена; например, количество копий HER2, например, среднее количество копий HER2) на опухолевую клетку (например, HER2-позитивные опухолевые клетки) больше, чем 105 на клетку (например, от 105 до 107 на клетку, или от 105 до 106 на клетку). В некоторых вариантах осуществления, количество копий опухолевого антигена (например, среднее количество копий опухолевого антигена, например, количество копий HER2, например, среднее количество копий HER2) составляет ≥ 200 000 на опухолевую клетку (например, HER2-положительные опухолевые клетки). В некоторых вариантах осуществления, количество копий опухолевого антигена (например, среднее количество копий опухолевого антигена, например, количество копий HER2, например, среднее количество копий HER2) составляет ≤ 200 000 на неопухолевую клетку (например, не нераковую клетку, например, здоровую клетку).
В некоторых вариантах осуществления аффинность моновалентного связывания (kd) второго антигенсвязывающего фрагмента и/или третьего антигенсвязывающего фрагмента, составляет от 10 нМ до 100 нМ (например, от 20 нМ до 90 нМ, 30 нМ до 80 нМ, от 40 нМ до 60 нМ, например, от 25 нМ до 55 нМ). В одном варианте осуществления данного изобретения аффинность моновалентного связывания (kd) второго антигенсвязывающего фрагмента и/или третьего антигенсвязывающего фрагмента составляет от 20 нМ до 50 нМ. В одном варианте осуществления данного изобретения аффинность моновалентного связывания (kd) второго антигенсвязывающего фрагмента и третьего антигенсвязывающего фрагмента составляет от 20 нМ до 50 нМ.
В некоторых вариантах осуществления моновалентная kd второго антигенсвязывающего фрагмента представляет собой kd второго антигенсвязывающего фрагмента в формате Fab, как измерено с помощью поверхностного плазменного резонанса (например, Biacore® поверхностного плазменного резонанса), и при этом моновалентная kd третьего антигенсвязывающего фрагмента представляет собой kd третьего антигенсвязывающего фрагмента в формате Fab, как измерено с помощью поверхностного плазменного резонанса (например, Biacore® поверхностного плазменного резонанса).
В некоторых вариантах осуществления данного изобретения, скорость моновалентной диссоциации второго антигенсвязывающего фрагмента и/или третьего антигенсвязывающего фрагмента составляет от 10-3/секунду до 10-1/секунду (например, от 10-2/секунду до 30-2/секунду). В некоторых вариантах осуществления моновалентная kd первого антигенсвязывающего фрагмента, составляет от 10 нМ до 100 нМ (например, от 20 нМ до 90 нМ, от 20 нМ до 80 нМ, от 30 нМ до 70 нМ, или от 40 нМ до 60 нМ).
В любом из предыдущих вариантов осуществления, первый антигенсвязывающий фрагмент может быть молекулой Fab (FabA), содержащей вариабельную область тяжелой цепи (VHA) и вариабельную область легкой цепи (VLA); второй антигенсвязывающий фрагмент представляет собой молекулу Fab (FabB1), содержащую вариабельную область тяжелой цепи (VHB1) и вариабельную область легкой цепи (VLB1); и/или третий антигенсвязывающий фрагмент представляет собой молекулу Fab (FabB2), содержащую вариабельную область тяжелой цепи (VHB2) и вариабельную область легкой цепи (VLB2). Таким образом, в некоторых вариантах осуществления первый антигенсвязывающий фрагмент представляет собой FabA, содержащий VHA-область и VLA-область, второй антигенсвязывающий фрагмент представляет собой FabB1 содержащий VHB1-область и VLB1-область, и третий антигенсвязывающий фрагмент представляет собой FabB2, содержащий VHB2-область и VLB2-область.
В некоторых вариантах осуществления VHB1 и VHB2 имеют по меньшей мере 95% идентичности последовательности. Дополнительно или альтернативно, VLB1 и VLB2 имеют по меньшей мере 95% идентичности последовательности. Дополнительно или альтернативно, VHB1 и VHB2 имеют по меньшей мере 95% идентичности последовательности и/или VLB1 и VLB2 имеют по меньшей мере 95% идентичности последовательности.
В некоторых вариантах осуществления VHB1-область и/или VHB2-область содержит аминокислотную замену в одном, двух, трех, или всех четырех остатках N54, D98, F100 и/или Y102, в соответствии с системой нумерации по Кабату. Например, VHB1-область и/или VHB2-область могут иметь аминокислотную замену в одном, двух, трех, четырех, или всех пяти из следующих остатков: N54E, D98A, D98T, F100A и/или Y102V, в соответствии с системой нумерации по Кабату.
В некоторых вариантах осуществления VLB1-область и/или VLB2-область содержит аминокислотную замену в одном, двух, или всех трех остатках N30, Y55 и/или Н91 в соответствии с системой нумерации по Кабату. Например, VLB1-область и/или VLB2-область может иметь аминокислотную замену в одном, двух или всех трех из следующих остатков: N30S, Y55E и/или Н91А.
В некоторых вариантах осуществления биспецифичная антигенсвязывающая молекула имеет VHB1-область, которая содержит одну, две или все три из следующих HVR: (a) HVR-H1, содержащую аминокислотную последовательность из SEQ ID NO: 11; (b) HVR-H2, содержащую аминокислотную последовательность из SEQ ID NO: 12; и (с) HVR-H3, содержащую аминокислотную последовательность из SEQ ID NO: 13. В некоторых вариантах осуществления VHB1-область содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности с SEQ ID NO: 17 (например, по меньшей мере 96% идентичности последовательности с SEQ ID NO: 17 по меньшей мере 97% идентичности последовательности с SEQ ID NO: 17 по меньшей мере 98% идентичности последовательности с SEQ ID NO: 17 по меньшей мере 99% идентичности последовательности с SEQ ID NO: 17 или 100% идентичности последовательности с SEQ ID NO: 17). В некоторых вариантах осуществления данного изобретения VHB1-область содержит аминокислотную последовательность SEQ ID NO: 17. В некоторых вариантах осуществления VLB1-область содержит одну, две или все три из следующих HVR: (a) HVR-L1, содержащую аминокислотную последовательность из SEQ ID NO: 14; (b) HVR-L2, содержащую аминокислотную последовательность из SEQ ID NO: 15; и (с) HVR-L3, содержащую аминокислотную последовательность из SEQ ID NO: 16. В некоторых вариантах осуществления VLB1-область содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности с SEQ ID NO: 18 (например, по меньшей мере 96% идентичности последовательности с SEQ ID NO: 18 по меньшей мере 97% идентичности последовательности с SEQ ID NO: 18 по меньшей мере 98% идентичности последовательности с SEQ ID NO: 18 по меньшей мере 99% идентичности последовательности с SEQ ID NO: 18 или 100% идентичности последовательности с SEQ ID NO: 18). В некоторых вариантах осуществления данного изобретения VLB1-область содержит аминокислотную последовательность SEQ ID NO: 18.
В некоторых вариантах осуществления данного изобретения VHB1 содержит следующие HVR: (a) HVR-H1, содержащую аминокислотную последовательность из SEQ ID NO: 11; (b) HVR-H2, содержащую аминокислотную последовательность из SEQ ID NO: 12; и (с) HVR-H3, содержащую аминокислотную последовательность из SEQ ID NO: 13; и VLB1 содержит следующие HVR: (d) HVR-L1, содержащую аминокислотную последовательность из SEQ ID NO: 14; (е) HVR-L2, содержащую аминокислотную последовательность из SEQ ID NO: 15; и (f) HVR-L3, содержащую аминокислотную последовательность из SEQ ID NO: 16. В некоторых вариантах осуществления VHB1-область содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности с SEQ ID NO: 17 (например, по меньшей мере 96% идентичности последовательности с SEQ ID NO: 17 по меньшей мере 97% идентичности последовательности с SEQ ID NO: 17 по меньшей мере 98% идентичности последовательности с SEQ ID NO: 17 по меньшей мере 99% идентичности последовательности с SEQ ID NO: 17 или 100% идентичности последовательности с SEQ ID NO: 17); и VLB1-область содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности с SEQ ID NO: 18 (например, по меньшей мере 96% идентичности последовательности с SEQ ID NO: 18 по меньшей мере 97% идентичности последовательности с SEQ ID NO: 18 по меньшей мере 98% идентичности последовательности с SEQ ID NO: 18 по меньшей мере 99% идентичности последовательности с SEQ ID NO: 18 или 100% идентичности последовательности с SEQ ID NO: 18). Например, в некоторых вариантах осуществления VHB1-область содержит аминокислотную последовательность из SEQ ID NO: 17; и VLB1-область содержит аминокислотную последовательность из SEQ ID NO: 18.
В некоторых вариантах осуществления VHB2-область содержит одну, две или все три из следующих HVR: (а) HVR-H1, содержащую аминокислотную последовательность из SEQ ID NO: 11; (b) HVR-H2, содержащую аминокислотную последовательность из SEQ ID NO: 12; и (с) HVR-H3, содержащую аминокислотную последовательность из SEQ ID NO: 13; В некоторых вариантах осуществления VHB2-область содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности с SEQ ID NO: 17 (например, по меньшей мере 96% идентичности последовательности с SEQ ID NO: 17 по меньшей мере 97% идентичности последовательности с SEQ ID NO: 17 по меньшей мере 98% идентичности последовательности с SEQ ID NO: 17 по меньшей мере 99% идентичности последовательности с SEQ ID NO: 17 или 100% идентичности последовательности с SEQ ID NO: 17). В некоторых вариантах осуществления данного изобретения VHB2-область содержит аминокислотную последовательность SEQ ID NO: 17. В некоторых вариантах осуществления VLB2-область содержит одну, две или все три из следующих HVR: (a) HVR-L1, содержащую аминокислотную последовательность из SEQ ID NO: 14; (b) HVR-L2, содержащую аминокислотную последовательность из SEQ ID NO: 15; и (с) HVR-L3, содержащую аминокислотную последовательность из SEQ ID NO: 16. В некоторых вариантах осуществления VLB2-область содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности с SEQ ID NO: 18 (например, по меньшей мере 96% идентичности последовательности с SEQ ID NO: 18 по меньшей мере 97% идентичности последовательности с SEQ ID NO: 18 по меньшей мере 98% идентичности последовательности с SEQ ID NO: 18 по меньшей мере 99% идентичности последовательности с SEQ ID NO: 18 или 100% идентичности последовательности с SEQ ID NO: 18). В некоторых вариантах осуществления данного изобретения VLB2-область содержит аминокислотную последовательность SEQ ID NO: 18.
В некоторых вариантах осуществления данного изобретения VHB2 содержит следующие HVR: (a) HVR-H1, содержащую аминокислотную последовательность из SEQ ID NO: 11; (b) HVR-H2, содержащую аминокислотную последовательность из SEQ ID NO: 12; и (с) HVR-H3, содержащую аминокислотную последовательность из SEQ ID NO: 13; и VLB2 содержит следующие HVR: (d) HVR-L1, содержащую аминокислотную последовательность из SEQ ID NO: 14; (е) HVR-L2, содержащую аминокислотную последовательность из SEQ ID NO: 15; и (f) HVR-L3, содержащую аминокислотную последовательность из SEQ ID NO: 16. В некоторых вариантах осуществления VHB2-область содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности с SEQ ID NO: 17 (например, по меньшей мере 96% идентичности последовательности с SEQ ID NO: 17 по меньшей мере 97% идентичности последовательности с SEQ ID NO: 17 по меньшей мере 98% идентичности последовательности с SEQ ID NO: 17 по меньшей мере 99% идентичности последовательности с SEQ ID NO: 17 или 100% идентичности последовательности с SEQ ID NO: 17); и VLB2-область содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности с SEQ ID NO: 18 (например, по меньшей мере 96% идентичности последовательности с SEQ ID NO: 18 по меньшей мере 97% идентичности последовательности с SEQ ID NO: 18 по меньшей мере 98% идентичности последовательности с SEQ ID NO: 18 по меньшей мере 99% идентичности последовательности с SEQ ID NO: 18 или 100% идентичности последовательности с SEQ ID NO: 18). В некоторых вариантах осуществления VHB2-область содержит аминокислотную последовательность из SEQ ID NO: 17; и VLB2-область содержит аминокислотную последовательность из SEQ ID NO: 18. В некоторых вариантах осуществления VLB1-область и/или VLB2-область содержат аминокислотную замену в Н91. Например; в некоторых вариантах осуществления, остаток Н91 замещен аминокислотой, имеющей неполярную боковую цепь. В некоторых вариантах осуществления VLB1-область и/или VLB2-область содержат аминокислотную замену Н91А. В некоторых вариантах осуществления VLB1-область и/или VLB2-область содержат аминокислотную замену в Y55. Например, в некоторых вариантах осуществления, остаток Y55 замещен аминокислотой, имеющей кислотную боковую цепь. В некоторых вариантах осуществления VLB1-область и/или VLB2-область содержат аминокислотную замену Y55E. В некоторых вариантах осуществления VHB1-область и/или VHB2-область содержат аминокислотную замену в F100 и/или Y102. Например, в некоторых вариантах осуществления, остаток F100 и/или остаток Y102 замещен аминокислотой, имеющей неполярную боковую цепь. В некоторых вариантах осуществления VHB1-область и/или VHB2-область содержат аминокислотную замену F100A и/или Y102V.
В некоторых вариантах осуществления VLB1-область и/или VLB2-область содержат один или более остатков улучшающих стабильность (liability fixed residues), например, один или более остатков улучшающих стабильность, содержащих аминокислотную замену N30S. Дополнительно или альтернативно, VHB1-область и/или VHB2-область может иметь один или более остатков улучшающих стабильность, например, один или более остатков улучшающих стабильность, содержащих одну или более аминокислотных замен, выбранных из группы, состоящей из N54E, D98A и D98T. В некоторых вариантах осуществления биспецифичная антигенсвязывающая молекула имеет VHB1-область, которая содержит одну, две или все три из следующих HVR: (a) HVR-H1, содержащую аминокислотную последовательность из SEQ ID NO: 11; (b) HVR-H2, содержащую аминокислотную последовательность из SEQ ID NO: 19; и (с) HVR-H3, содержащую аминокислотную последовательность из SEQ ID NO: 20. В некоторых вариантах осуществления VHB1-область содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности с SEQ ID NO: 24 (например, по меньшей мере 96% идентичности последовательности с SEQ ID NO: 24 по меньшей мере 97% идентичности последовательности с SEQ ID NO: 24 по меньшей мере 98% идентичности последовательности с SEQ ID NO: 24 по меньшей мере 99% идентичности последовательности с SEQ ID NO: 24 или 100% идентичности последовательности с SEQ ID NO: 24). В некоторых вариантах осуществления данного изобретения VHB1-область содержит аминокислотную последовательность SEQ ID NO: 24. В некоторых вариантах осуществления VLB1-область содержит одну, две или все три из следующих HVR: (a) HVR-L1, содержащую аминокислотную последовательность SEQ ID NO: 21; (b) HVR-L2, содержащую аминокислотную последовательность SEQ ID NO: 22; и (с) HVR-L3, содержащую аминокислотную последовательность SEQ ID NO: 26. В некоторых вариантах осуществления VLB1-область содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности с SEQ ID NO: 27 (например, по меньшей мере 96% идентичности последовательности с SEQ ID NO: 27 по меньшей мере 97% идентичности последовательности с SEQ ID NO: 27 по меньшей мере 98% идентичности последовательности с SEQ ID NO: 27 по меньшей мере 99% идентичности последовательности с SEQ ID NO: 27 или 100% идентичности последовательности с SEQ ID NO: 27). В некоторых вариантах осуществления данного изобретения VLB1-область содержит аминокислотную последовательность SEQ ID NO: 27. Например, в некоторых вариантах осуществления биспецифичные антигенсвязывающие молекулы представляют собой биспецифичные антигенсвязывающие молекулы анти-HER2 (например, 4D5 H91A-Fab-IgG TDB).
В некоторых вариантах осуществления данного изобретения VHB1 содержит следующие HVR: (a) HVR-H1, содержащую аминокислотную последовательность из SEQ ID NO: 11; (b) HVR-H2, содержащую аминокислотную последовательность из SEQ ID NO: 19; и (с) HVR-H3, содержащую аминокислотную последовательность из SEQ ID NO: 20; и vlb1 содержит следующие HVR: (d) HVR-L1, содержащую аминокислотную последовательность из SEQ ID NO: 21; (е) HVR-L2, содержащую аминокислотную последовательность из SEQ ID NO: 22; и (f) HVR-L3, содержащую аминокислотную последовательность из SEQ ID NO: 26. В некоторых вариантах осуществления VHB1-область содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности с SEQ ID NO: 24 (например, по меньшей мере 96% идентичности последовательности с SEQ ID NO: 24 по меньшей мере 97% идентичности последовательности с SEQ ID NO: 24 по меньшей мере 98% идентичности последовательности с SEQ ID NO: 24 по меньшей мере 99% идентичности последовательности с SEQ ID NO: 24 или 100% идентичности последовательности с SEQ ID NO: 24); и VLB1-область содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности с SEQ ID NO: 27 (например, по меньшей мере 96% идентичности последовательности с SEQ ID NO: 27 по меньшей мере 97% идентичности последовательности с SEQ ID NO: 27 по меньшей мере 98% идентичности последовательности с SEQ ID NO: 27 по меньшей мере 99% идентичности последовательности с SEQ ID NO: 27 или 100% идентичности последовательности с SEQ ID NO: 27). Например, в некоторых вариантах осуществления VHB1-область содержит аминокислотную последовательность из SEQ ID NO: 24; и VLB1-область содержит аминокислотную последовательность из SEQ ID NO: 27. Например, в некоторых вариантах осуществления биспецифичные антигенсвязывающие молекулы представляют собой биспецифичные антигенсвязывающие молекулы анти-HER2 (например, 4D5 H91A-1Fab-IgG TDB). В некоторых вариантах осуществления VHB2-область содержит одну, две или все три из следующих HVR: (а) HVR-H1, содержащую аминокислотную последовательность из SEQ ID NO: 11; (b) HVR-H2, содержащую аминокислотную последовательность из SEQ ID NO: 19; и (с) HVR-H3, содержащую аминокислотную последовательность из SEQ ID NO: 20; В некоторых вариантах осуществления VHB2-область содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности с SEQ ID NO: 24 (например, по меньшей мере 96% идентичности последовательности с SEQ ID NO: 24 по меньшей мере 97% идентичности последовательности с SEQ ID NO: 24 по меньшей мере 98% идентичности последовательности с SEQ ID NO: 24 по меньшей мере 99% идентичности последовательности с SEQ ID NO: 24 или 100% идентичности последовательности с SEQ ID NO: 24). В некоторых вариантах осуществления данного изобретения VHB2-область содержит аминокислотную последовательность SEQ ID NO: 24. В некоторых вариантах осуществления VLB2-область содержит одну, две или все три из следующих HVR: (a) HVR-L1, содержащую аминокислотную последовательность из SEQ ID NO: 21; (b) HVR-L2, содержащую аминокислотную последовательность из SEQ ID NO: 22; и (с) HVR-L3, содержащую аминокислотную последовательность из SEQ ID NO: 26; В некоторых вариантах осуществления VLB2-область содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности с SEQ ID NO: 27 (например, по меньшей мере 96% идентичности последовательности с SEQ ID NO: 18 по меньшей мере 97% идентичности последовательности с SEQ ID NO: 27 по меньшей мере 98% идентичности последовательности с SEQ ID NO: 27 по меньшей мере 99% идентичности последовательности с SEQ ID NO: 27 или 100% идентичности последовательности с SEQ ID NO: 27). В некоторых вариантах осуществления данного изобретения VLB2-область содержит аминокислотную последовательность SEQ ID NO: 27. Например, в некоторых вариантах осуществления биспецифичные антигенсвязывающие молекулы представляют собой биспецифичные антигенсвязывающие молекулы анти-HER2 (например, 4D5 H91A-1Fab-IgG TDB).
В некоторых вариантах осуществления данного изобретения VHB2 содержит следующие HVR: (a) HVR-H1, содержащую аминокислотную последовательность из SEQ ID NO: 11; (b) HVR-H2, содержащую аминокислотную последовательность из SEQ ID NO: 19; и (с) HVR-H3, содержащую аминокислотную последовательность из SEQ ID NO: 20; и VLB2 содержит следующие HVR: (d) HVR-L1, содержащую аминокислотную последовательность из SEQ ID NO: 21; (е) HVR-L2, содержащую аминокислотную последовательность из SEQ ID NO: 22; и (f) HVR-L3, содержащую аминокислотную последовательность из SEQ ID NO: 26. В некоторых вариантах осуществления VHB2-область содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности с SEQ ID NO: 24 (например, по меньшей мере 96% идентичности последовательности с SEQ ID NO: 24 по меньшей мере 97% идентичности последовательности с SEQ ID NO: 24 по меньшей мере 98% идентичности последовательности с SEQ ID NO: 24 по меньшей мере 99% идентичности последовательности с SEQ ID NO: 24 или 100% идентичности последовательности с SEQ ID NO: 24); и VLB2-область содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности с SEQ ID NO: 27 (например, по меньшей мере 96% идентичности последовательности с SEQ ID NO: 27 по меньшей мере 97% идентичности последовательности с SEQ ID NO: 27 по меньшей мере 98% идентичности последовательности с SEQ ID NO: 27 по меньшей мере 99% идентичности последовательности с SEQ ID NO: 27 или 100% идентичности последовательности с SEQ ID NO: 27). В некоторых вариантах осуществления VHB2-область содержит аминокислотную последовательность из SEQ ID NO: 24; и VLB2-область содержит аминокислотную последовательность из SEQ ID NO: 27. Например, в некоторых вариантах осуществления биспецифичные антигенсвязывающие молекулы представляют собой биспецифичные антигенсвязывающие молекулы анти-HER2 (например, 4D5 H91A-1Fab-IgG TDB). В некоторых вариантах осуществления биспецифичная антигенсвязывающая молекула имеет VHB1-область, которая содержит одну, две или все три из следующих HVR: (a) HVR-H1, содержащую аминокислотную последовательность из SEQ ID NO: 11; (b) HVR-H2, содержащую аминокислотную последовательность из SEQ ID NO: 19; и (с) HVR-H3, содержащую аминокислотную последовательность из SEQ ID NO: 32; В некоторых вариантах осуществления VHB1-область содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности с SEQ ID NO: 33 (например, по меньшей мере 96% идентичности последовательности с SEQ ID NO: 33 по меньшей мере 97% идентичности последовательности с SEQ ID NO: 33 по меньшей мере 98% идентичности последовательности с SEQ ID NO: 33 по меньшей мере 99% идентичности последовательности с SEQ ID NO: 33 или 100% идентичности последовательности с SEQ ID NO: 33). В некоторых вариантах осуществления данного изобретения VHB1-область содержит аминокислотную последовательность SEQ ID NO: 33. В некоторых вариантах осуществления VLB1-область содержит одну, две или все три из следующих HVR: (a) HVR-L1, содержащую аминокислотную последовательность из SEQ ID NO: 21; (b) HVR-L2, содержащую аминокислотную последовательность из SEQ ID NO: 22; и (с) HVR-L3, содержащую аминокислотную последовательность из SEQ ID NO: 23; В некоторых вариантах осуществления VLB1-область содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности с SEQ ID NO: 25 (например, по меньшей мере 96% идентичности последовательности с SEQ ID NO: 25 по меньшей мере 97% идентичности последовательности с SEQ ID NO: 25 по меньшей мере 98% идентичности последовательности с SEQ ID NO: 25 по меньшей мере 99% идентичности последовательности с SEQ ID NO: 25 или 100% идентичности последовательности с SEQ ID NO: 25). В некоторых вариантах осуществления данного изобретения VLB1-область содержит аминокислотную последовательность SEQ ID NO: 25. Например, в некоторых вариантах осуществления биспецифичные антигенсвязывающие молекулы представляют собой биспецифичные антигенсвязывающие молекулы анти-HER2 (например, 4D5 D98A.F100A.Y102V-1Fab-IgG TDB).
В некоторых вариантах осуществления данного изобретения VHB1 содержит следующие HVR: (a) HVR-H1, содержащую аминокислотную последовательность из SEQ ID NO: 11; (b) HVR-H2, содержащую аминокислотную последовательность из SEQ ID NO: 19; и (с) HVR-H3, содержащую аминокислотную последовательность из SEQ ID NO: 32; и vlb1 содержит следующие HVR: (d) HVR-L1, содержащую аминокислотную последовательность из SEQ ID NO: 21; (е) HVR-L2, содержащую аминокислотную последовательность из SEQ ID NO: 22; и (f) HVR-L3, содержащую аминокислотную последовательность из SEQ ID NO: 23. В некоторых вариантах осуществления VHB1-область содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности с SEQ ID NO: 33 (например, по меньшей мере 96% идентичности последовательности с SEQ ID NO: 33 по меньшей мере 97% идентичности последовательности с SEQ ID NO: 33 по меньшей мере 98% идентичности последовательности с SEQ ID NO: 33 по меньшей мере 99% идентичности последовательности с SEQ ID NO: 33 или 100% идентичности последовательности с SEQ ID NO: 33); и VLB1-область содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности с SEQ ID NO: 25 (например, по меньшей мере 96% идентичности последовательности с SEQ ID NO: 25 по меньшей мере 97% идентичности последовательности с SEQ ID NO: 25 по меньшей мере 98% идентичности последовательности с SEQ ID NO: 25 по меньшей мере 99% идентичности последовательности с SEQ ID NO: 25 или 100% идентичности последовательности с SEQ ID NO: 25). Например, в некоторых вариантах осуществления VHB1-область содержит аминокислотную последовательность SEQ ID NO: 33; и VLB1-область содержит аминокислотную последовательность SEQ ID NO: 25. Например, в некоторых вариантах осуществления биспецифичные антигенсвязывающие молекулы представляют собой биспецифичные антигенсвязывающие молекулы анти-HER2 (например, 4D5 D98A.F100A.Y102V-1Fab-IgG TDB).
В некоторых вариантах осуществления VHB2-область содержит одну, две или все три из следующих HVR: (a) HVR-H1, содержащую аминокислотную последовательность из SEQ ID NO: 11; (b) HVR-H2, содержащую аминокислотную последовательность из SEQ ID NO: 19; и (с) HVR-H3, содержащую аминокислотную последовательность из SEQ ID NO: 32; В некоторых вариантах осуществления VHB2-область содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности с SEQ ID NO: 33 (например, по меньшей мере 96% идентичности последовательности с SEQ ID NO: 33 по меньшей мере 97% идентичности последовательности с SEQ ID NO: 33 по меньшей мере 98% идентичности последовательности с SEQ ID NO: 33 по меньшей мере 99% идентичности последовательности с SEQ ID NO: 33 или 100% идентичности последовательности с SEQ ID NO: 33). В некоторых вариантах осуществления данного изобретения VHB2-область содержит аминокислотную последовательность SEQ ID NO: 33. В некоторых вариантах осуществления VLB2-область содержит одну, две или все три из следующих HVR: (a) HVR-L1, содержащую аминокислотную последовательность из SEQ ID NO: 21; (b) HVR-L2, содержащую аминокислотную последовательность из SEQ ID NO: 22; и (с) HVR-L3, содержащую аминокислотную последовательность из SEQ ID NO: 23; В некоторых вариантах осуществления VLB2-область содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности с SEQ ID NO: 25 (например, по меньшей мере 96% идентичности последовательности с SEQ ID NO: 25 по меньшей мере 97% идентичности последовательности с SEQ ID NO: 25 по меньшей мере 98% идентичности последовательности с SEQ ID NO: 25 по меньшей мере 99% идентичности последовательности с SEQ ID NO: 25 или 100% идентичности последовательности с SEQ ID NO: 25). В некоторых вариантах осуществления данного изобретения VLB2-область содержит аминокислотную последовательность SEQ ID NO: 25. Например, в некоторых вариантах осуществления биспецифичные антигенсвязывающие молекулы представляют собой биспецифичные антигенсвязывающие молекулы анти-HER2 (например, 4D5 D98A.F100A.Y102V-1Fab-IgG TDB).
В некоторых вариантах осуществления данного изобретения VHB2 содержит следующие HVR: (a) HVR-H1, содержащую аминокислотную последовательность из SEQ ID NO: 11; (b) HVR-H2, содержащую аминокислотную последовательность из SEQ ID NO: 19; и (с) HVR-H3, содержащую аминокислотную последовательность из SEQ ID NO: 32; и VLB2 содержит следующие HVR: (d) HVR-L1, содержащую аминокислотную последовательность из SEQ ID NO: 21; (е) HVR-L2, содержащую аминокислотную последовательность из SEQ ID NO: 22; и (f) HVR-L3, содержащую аминокислотную последовательность из SEQ ID NO: 23. В некоторых вариантах осуществления VHB2-область содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности с SEQ ID NO: 33 (например, по меньшей мере 96% идентичности последовательности с SEQ ID NO: 33 по меньшей мере 97% идентичности последовательности с SEQ ID NO: 33 по меньшей мере 98% идентичности последовательности с SEQ ID NO: 33 по меньшей мере 99% идентичности последовательности с SEQ ID NO: 33 или 100% идентичности последовательности с SEQ ID NO: 33); и VLB2-область содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности с SEQ ID NO: 25 (например, по меньшей мере 96% идентичности последовательности с SEQ ID NO: 25 по меньшей мере 97% идентичности последовательности с SEQ ID NO: 25 по меньшей мере 98% идентичности последовательности с SEQ ID NO: 25 по меньшей мере 99% идентичности последовательности с SEQ ID NO: 25 или 100% идентичности последовательности с SEQ ID NO: 25). В некоторых вариантах осуществления VHB2-область содержит аминокислотную последовательность из SEQ ID NO: 33; и VLB2-область содержит аминокислотную последовательность из SEQ ID NO: 25. Например, в некоторых вариантах осуществления биспецифичные антигенсвязывающие молекулы представляют собой биспецифичные антигенсвязывающие молекулы анти-HER2 (например, 4D5 D98A.F100A.Y102V-1Fab-IgG TDB).
В некоторых вариантах осуществления биспецифичная антигенсвязывающая молекула имеет VHB1-область, которая содержит одну, две или все три из следующих HVR: (a) HVR-H1, содержащую аминокислотную последовательность из SEQ ID NO: 11; (b) HVR-H2, содержащую аминокислотную последовательность из SEQ ID NO: 36; и (с) HVR-H3, содержащую аминокислотную последовательность из SEQ ID NO: 37; В некоторых вариантах осуществления VHB1-область содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности с SEQ ID NO: 41 (например, по меньшей мере 96% идентичности последовательности с SEQ ID NO: 41 по меньшей мере 97% идентичности последовательности с SEQ ID NO: 41 по меньшей мере 98% идентичности последовательности с SEQ ID NO: 41 по меньшей мере 99% идентичности последовательности с SEQ ID NO: 41 или 100% идентичности последовательности с SEQ ID NO: 41). В некоторых вариантах осуществления данного изобретения VHB1-область содержит аминокислотную последовательность SEQ ID NO: 41. В некоторых вариантах осуществления VLB1-область содержит одну, две или все три из следующих HVR: (a) HVR-L1, содержащую аминокислотную последовательность из SEQ ID N0: 21; (b) HVR-L2, содержащую аминокислотную последовательность из SEQ ID NO: 29; и (с) HVR-L3, содержащую аминокислотную последовательность из SEQ ID NO: 26; В некоторых вариантах осуществления VLB1-область содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности с SEQ ID NO: 48 (например, по меньшей мере 96% идентичности последовательности с SEQ ID NO: 48 по меньшей мере 97% идентичности последовательности с SEQ ID NO: 48 по меньшей мере 98% идентичности последовательности с SEQ ID NO: 48 по меньшей мере 99% идентичности последовательности с SEQ ID NO: 48 или 100% идентичности последовательности с SEQ ID NO: 48). В некоторых вариантах осуществления данного изобретения VLB1-область содержит аминокислотную последовательность SEQ ID NO: 48. Например, в некоторых вариантах осуществления биспецифичные антигенсвязывающие молекулы представляют собой биспецифичные антигенсвязывающие молекулы анти-HER2 (например, 4D5 Y55E.H91A.N54E.D98T-Fab-IgG TDB).
В некоторых вариантах осуществления данного изобретения VHB1 содержит следующие HVR: (a) HVR-H1, содержащую аминокислотную последовательность из SEQ ID NO: 11; (b) HVR-H2, содержащую аминокислотную последовательность из SEQ ID NO: 36; и (с) HVR-H3, содержащую аминокислотную последовательность из SEQ ID NO: 37; и vlbi содержит следующие HVR: (d) HVR-L1, содержащую аминокислотную последовательность из SEQ ID NO: 21; (е) HVR-L2, содержащую аминокислотную последовательность из SEQ ID NO: 29; и (f) HVR-L3, содержащую аминокислотную последовательность из SEQ ID NO: 26. В некоторых вариантах осуществления VHB1-область содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности с SEQ ID NO: 41 (например, по меньшей мере 96% идентичности последовательности с SEQ ID NO: 41 по меньшей мере 97% идентичности последовательности с SEQ ID NO: 41 по меньшей мере 98% идентичности последовательности с SEQ ID NO: 41 по меньшей мере 99% идентичности последовательности с SEQ ID NO: 41 или 100% идентичности последовательности с SEQ ID NO: 41); и VLB1-область содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности с SEQ ID NO: 48 (например, по меньшей мере 96% идентичности последовательности с SEQ ID NO: 48 по меньшей мере 97% идентичности последовательности с SEQ ID NO: 48 по меньшей мере 98% идентичности последовательности с SEQ ID NO: 48 по меньшей мере 99% идентичности последовательности с SEQ ID NO: 48 или 100% идентичности последовательности с SEQ ID NO: 48). Например, в некоторых вариантах осуществления VHB1-область содержит аминокислотную последовательность из SEQ ID NO: 41; и VLB1-область содержит аминокислотную последовательность из SEQ ID NO: 48. Например, в некоторых вариантах осуществления биспецифичные антигенсвязывающие молекулы представляют собой биспецифичные антигенсвязывающие молекулы анти-HER2 (например, 4D5 Y55E.H91A.N54E.D98T-1Fab-IgG TDB).
В некоторых вариантах осуществления VHB2-область содержит одну, две или все три из следующих HVR: (а) HVR-H1, содержащую аминокислотную последовательность из SEQ ID NO: 11; (b) HVR-H2, содержащую аминокислотную последовательность из SEQ ID NO: 36; и (с) HVR-H3, содержащую аминокислотную последовательность из SEQ ID NO: 37; В некоторых вариантах осуществления VHB2-область содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности с SEQ ID NO: 41 (например, по меньшей мере 96% идентичности последовательности с SEQ ID NO: 41 по меньшей мере 97% идентичности последовательности с SEQ ID NO: 41 по меньшей мере 98% идентичности последовательности с SEQ ID NO: 41 по меньшей мере 99% идентичности последовательности с SEQ ID NO: 41 или 100% идентичности последовательности с SEQ ID NO: 41). В некоторых вариантах осуществления данного изобретения VHB2-область содержит аминокислотную последовательность SEQ ID NO: 41. В некоторых вариантах осуществления VLB2-область содержит одну, две или все три из следующих HVR: (a) HVR-L1, содержащую аминокислотную последовательность из SEQ ID NO: 21; (b) HVR-L2, содержащую аминокислотную последовательность из SEQ ID NO: 29; и (с) HVR-L3, содержащую аминокислотную последовательность из SEQ ID NO: 26; В некоторых вариантах осуществления VLB2-область содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности с SEQ ID NO: 48 (например, по меньшей мере 96% идентичности последовательности с SEQ ID NO: 48 по меньшей мере 97% идентичности последовательности с SEQ ID NO: 48 по меньшей мере 98% идентичности последовательности с SEQ ID NO: 48 по меньшей мере 99% идентичности последовательности с SEQ ID NO: 48 или 100% идентичности последовательности с SEQ ID NO: 48). В некоторых вариантах осуществления данного изобретения VLB2-область содержит аминокислотную последовательность SEQ ID NO: 48. Например, в некоторых вариантах осуществления биспецифичные антигенсвязывающие молекулы представляют собой биспецифичные антигенсвязывающие молекулы анти-НЕР2 (например, 4D5 Y55E.H91A.N54E.D98T-1Fab-IgG TDB).
В некоторых вариантах осуществления данного изобретения VHB2 содержит следующие HVR: (a) HVR-H1, содержащую аминокислотную последовательность из SEQ ID NO: 11; (b) HVR-H2, содержащую аминокислотную последовательность из SEQ ID NO: 36; и (с) HVR-H3, содержащую аминокислотную последовательность из SEQ ID NO: 37; и VLB2 содержит следующие HVR: (d) HVR-L1, содержащую аминокислотную последовательность из SEQ ID NO: 21; (е) HVR-L2, содержащую аминокислотную последовательность из SEQ ID NO: 29; и (f) HVR-L3, содержащую аминокислотную последовательность из SEQ ID NO: 26. В некоторых вариантах осуществления VHB2-область содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности с SEQ ID NO: 41 (например, по меньшей мере 96% идентичности последовательности с SEQ ID NO: 41 по меньшей мере 97% идентичности последовательности с SEQ ID NO: 41 по меньшей мере 98% идентичности последовательности с SEQ ID NO: 41 по меньшей мере 99% идентичности последовательности с SEQ ID NO: 41 или 100% идентичности последовательности с SEQ ID NO: 41); и VLB2-область содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности с SEQ ID NO: 48 (например, по меньшей мере 96% идентичности последовательности с SEQ ID NO: 48 по меньшей мере 97% идентичности последовательности с SEQ ID NO: 48 по меньшей мере 98% идентичности последовательности с SEQ ID NO: 48 по меньшей мере 99% идентичности последовательности с SEQ ID NO: 48 или 100% идентичности последовательности с SEQ ID NO: 48). В некоторых вариантах осуществления VHB2-область содержит аминокислотную последовательность из SEQ ID NO: 41; и VLB2-область содержит аминокислотную последовательность из SEQ ID NO: 48. Например, в некоторых вариантах осуществления биспецифичные антигенсвязывающие молекулы представляют собой биспецифичные антигенсвязывающие молекулы анти-HER2 (например, 4D5 Y55E.H91A.N54E.D98T-1Fab-IgGTDB).
В некоторых вариантах осуществления биспецифичная антигенсвязывающая молекула имеет VHB1-область, которая содержит одну, две или все три из следующих HVR: (a) HVR-H1, содержащую аминокислотную последовательность из SEQ ID NO: 11; (b) HVR-H2, содержащую аминокислотную последовательность из SEQ ID NO: 36; и (с) HVR-H3, содержащую аминокислотную последовательность из SEQ ID NO: 43; В некоторых вариантах осуществления VHB1-область содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности с SEQ ID NO: 44 (например, по меньшей мере 96% идентичности последовательности с SEQ ID NO: 44 по меньшей мере 97% идентичности последовательности с SEQ ID NO: 44 по меньшей мере 98% идентичности последовательности с SEQ ID NO: 44 по меньшей мере 99% идентичности последовательности с SEQ ID NO: 44 или 100% идентичности последовательности с SEQ ID NO: 44). В некоторых вариантах осуществления данного изобретения VHB1-область содержит аминокислотную последовательность SEQ ID NO: 44. В некоторых вариантах осуществления VLB1-область содержит одну, две или все три из следующих HVR: (a) HVR-L1, содержащую аминокислотную последовательность из SEQ ID NO: 21; (b) HVR-L2, содержащую аминокислотную последовательность из SEQ ID NO: 29; и (с) HVR-L3, содержащую аминокислотную последовательность из SEQ ID NO: 26; В некоторых вариантах осуществления VLB1-область содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности с SEQ ID NO: 48 (например, по меньшей мере 96% идентичности последовательности с SEQ ID NO: 48 по меньшей мере 97% идентичности последовательности с SEQ ID NO: 48 по меньшей мере 98% идентичности последовательности с SEQ ID NO: 48 по меньшей мере 99% идентичности последовательности с SEQ ID NO: 48 или 100% идентичности последовательности с SEQ ID NO: 48). В некоторых вариантах осуществления данного изобретения VLB1-область содержит аминокислотную последовательность SEQ ID NO: 48. Например, в некоторых вариантах осуществления биспецифичные антигенсвязывающие молекулы представляют собой биспецифичные антигенсвязывающие молекулы анти-HER2 (например, 4D5 Y55E.H91A.N54E.D98T.Y102V-1Fab-IgG TDB).
В некоторых вариантах осуществления данного изобретения VHB1 содержит следующие HVR: (a) HVR-H1, содержащую аминокислотную последовательность из SEQ ID NO: 11; (b) HVR-H2, содержащую аминокислотную последовательность из SEQ ID NO: 36; и (с) HVR-H3, содержащую аминокислотную последовательность из SEQ ID NO: 43; и VLB1 содержит следующие HVR: (d) HVR-L1, содержащую аминокислотную последовательность из SEQ ID NO: 21; (е) HVR-L2, содержащую аминокислотную последовательность из SEQ ID NO: 29; и (f) HVR-L3, содержащую аминокислотную последовательность из SEQ ID NO: 26. В некоторых вариантах осуществления VHB1-область содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности с SEQ ID NO: 44 (например, по меньшей мере 96% идентичности последовательности с SEQ ID NO: 44 по меньшей мере 97% идентичности последовательности с SEQ ID NO: 44 по меньшей мере 98% идентичности последовательности с SEQ ID NO: 44 по меньшей мере 99% идентичности последовательности с SEQ ID NO: 44 или 100% идентичности последовательности с SEQ ID NO: 44); и VLB1-область содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности с SEQ ID NO: 48 (например, по меньшей мере 96% идентичности последовательности с SEQ ID NO: 48 по меньшей мере 97% идентичности последовательности с SEQ ID NO: 48 по меньшей мере 98% идентичности последовательности с SEQ ID NO: 48 по меньшей мере 99% идентичности последовательности с SEQ ID NO: 48 или 100% идентичности последовательности с SEQ ID NO: 48). Например, в некоторых вариантах осуществления VHB1-область содержит аминокислотную последовательность SEQ ID NO: 41; и VLB1-область содержит аминокислотную последовательность SEQ ID NO: 48. Например, в некоторых вариантах осуществления биспецифичные антигенсвязывающие молекулы представляют собой биспецифичные антигенсвязывающие молекулы анти-HER2 (например, 4D5 Y55E.H91A.N54E.D98T.Y102V-1Fab-IgG TDB).
В некоторых вариантах осуществления VHB2-область содержит одну, две или все три из следующих HVR: (a) HVR-H1, содержащую аминокислотную последовательность SEQ ID NO: 11; (b) HVR-H2, содержащую аминокислотную последовательность SEQ ID NO: 36; и (с) HVR-Н3, содержащую аминокислотную последовательность SEQ ID NO: 43; В некоторых вариантах осуществления VHB2-область содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности с SEQ ID NO: 44 (например, по меньшей мере 96% идентичности последовательности с SEQ ID NO: 44 по меньшей мере 97% идентичности последовательности с SEQ ID NO: 44 по меньшей мере 98% идентичности последовательности с SEQ ID NO: 44 по меньшей мере 99% идентичности последовательности с SEQ ID NO: 44 или 100% идентичности последовательности с SEQ ID NO: 44). В некоторых вариантах осуществления данного изобретения VHB2-область содержит аминокислотную последовательность SEQ ID NO: 44. В некоторых вариантах осуществления VLB2-область содержит одну, две или все три из следующих HVR: (a) HVR-L1, содержащую аминокислотную последовательность SEQ ID NO: 21; (b) HVR-L2, содержащую аминокислотную последовательность SEQ ID NO: 29; и (с) HVR-L3, содержащую аминокислотную последовательность SEQ ID NO: 26; В некоторых вариантах осуществления VLB2-область содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности с SEQ ID NO: 48 (например, по меньшей мере 96% идентичности последовательности с SEQ ID NO: 48 по меньшей мере 97% идентичности последовательности с SEQ ID NO: 48 по меньшей мере 98% идентичности последовательности с SEQ ID NO: 48 по меньшей мере 99% идентичности последовательности с SEQ ID NO: 48 или 100% идентичности последовательности с SEQ ID NO: 48). В некоторых вариантах осуществления данного изобретения VLB2-область содержит аминокислотную последовательность SEQ ID NO: 48. Например, в некоторых вариантах осуществления биспецифичные антигенсвязывающие молекулы представляют собой биспецифичные антигенсвязывающие молекулы анти-HER2 (например, 4D5 Y55E.H91A.N54E.D98T.Y102V-1Fab-IgG TDB).
В некоторых вариантах осуществления данного изобретения VHB2 содержит следующие HVR: (a) HVR-H1, содержащую аминокислотную последовательность из SEQ ID NO: 11; (b) HVR-H2, содержащую аминокислотную последовательность из SEQ ID NO: 36; и (с) HVR-H3, содержащую аминокислотную последовательность из SEQ ID NO: 43; и VLB2 содержит следующие HVR: (d) HVR-L1, содержащую аминокислотную последовательность из SEQ ID NO: 21; (е) HVR-L2, содержащую аминокислотную последовательность из SEQ ID NO: 29; и (f) HVR-L3, содержащую аминокислотную последовательность из SEQ ID NO: 26. В некоторых вариантах осуществления VHB2-область содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности с SEQ ID NO: 44 (например, по меньшей мере 96% идентичности последовательности с SEQ ID NO: 44 по меньшей мере 97% идентичности последовательности с SEQ ID NO: 44 по меньшей мере 98% идентичности последовательности с SEQ ID NO: 44 по меньшей мере 99% идентичности последовательности с SEQ ID NO: 44 или 100% идентичности последовательности с SEQ ID NO: 44); и VLB2-область содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности с SEQ ID NO: 48 (например, по меньшей мере 96% идентичности последовательности с SEQ ID NO: 48 по меньшей мере 97% идентичности последовательности с SEQ ID NO: 48 по меньшей мере 98% идентичности последовательности с SEQ ID NO: 48 по меньшей мере 99% идентичности последовательности с SEQ ID NO: 48 или 100% идентичности последовательности с SEQ ID NO: 48). В некоторых вариантах осуществления VHB2-область содержит аминокислотную последовательность SEQ ID NO: 44; и VHB2-область содержит аминокислотную последовательность SEQ ID NO: 48. Например, в некоторых вариантах осуществления биспецифичные антигенсвязывающие молекулы представляют собой биспецифичные антигенсвязывающие молекулы анти-HER2 (например, 4D5 Y55E.H91A.N54E.D98T.Y102V-1Fab-IgG TDB).
В некоторых вариантах осуществления биспецифичная антигенсвязывающая молекула имеет VHB1-область, которая содержит одну, две или все три из следующих HVR: (a) HVR-H1, содержащую аминокислотную последовательность из SEQ ID NO: 11; (b) HVR-H2, содержащую аминокислотную последовательность из SEQ ID NO: 36; и (с) HVR-H3, содержащую аминокислотную последовательность из SEQ ID NO: 37; В некоторых вариантах осуществления VHB1-область содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности с SEQ ID NO: 41 (например, по меньшей мере 96% идентичности последовательности с SEQ ID NO: 41 по меньшей мере 97% идентичности последовательности с SEQ ID NO: 41 по меньшей мере 98% идентичности последовательности с SEQ ID NO: 41 по меньшей мере 99% идентичности последовательности с SEQ ID NO: 41 или 100% идентичности последовательности с SEQ ID NO: 41). В некоторых вариантах осуществления данного изобретения VHB1-область содержит аминокислотную последовательность SEQ ID NO: 41. В некоторых вариантах осуществления VLB1-область содержит одну, две или все три из следующих HVR: (a) HVR-L1, содержащую аминокислотную последовательность из SEQ ID NO: 38; (b) HVR-L2, содержащую аминокислотную последовательность из SEQ ID NO: 29; и (с) HVR-L3, содержащую аминокислотную последовательность из SEQ ID NO: 26; В некоторых вариантах осуществления VLB1-область содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности с SEQ ID NO: 49 (например, по меньшей мере 96% идентичности последовательности с SEQ ID NO: 49 по меньшей мере 97% идентичности последовательности с SEQ ID NO: 49 по меньшей мере 98% идентичности последовательности с SEQ ID NO: 49 по меньшей мере 99% идентичности последовательности с SEQ ID NO: 49 или 100% идентичности последовательности с SEQ ID NO: 49). В некоторых вариантах осуществления данного изобретения VLB1-область содержит аминокислотную последовательность SEQ ID NO: 49. Например, в некоторых вариантах осуществления биспецифичные антигенсвязывающие молекулы представляют собой биспецифичные антигенсвязывающие молекулы анти-HER2 (например, 4D5 N30S.Y55E.H91A.N54E.D98T-1Fab-IgG TDB).
В некоторых вариантах осуществления данного изобретения VHB1 содержит следующие HVR: (a) HVR-H1, содержащую аминокислотную последовательность SEQ ID NO: 11; (b) HVR-H2, содержащую аминокислотную последовательность SEQ ID NO: 36; и (с) HVR-Н3, содержащую аминокислотную последовательность SEQ ID NO: 37; и vlbi содержит следующие HVR: (d) HVR-L1, содержащую аминокислотную последовательность из SEQ ID NO: 38; (е) HVR-L2, содержащую аминокислотную последовательность из SEQ ID NO: 29; и (f) HVR-L3, содержащую аминокислотную последовательность из SEQ ID NO: 26. В некоторых вариантах осуществления VHB1-область содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности с SEQ ID NO: 41 (например, по меньшей мере 96% идентичности последовательности с SEQ ID NO: 41 по меньшей мере 97% идентичности последовательности с SEQ ID NO: 41 по меньшей мере 98% идентичности последовательности с SEQ ID NO: 41 по меньшей мере 99% идентичности последовательности с SEQ ID NO: 41 или 100% идентичности последовательности с SEQ ID NO: 41); и VLB1-область содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности с SEQ ID NO: 49 (например, по меньшей мере 96% идентичности последовательности с SEQ ID NO: 49 по меньшей мере 97% идентичности последовательности с SEQ ID NO: 49 по меньшей мере 98% идентичности последовательности с SEQ ID NO: 49 по меньшей мере 99% идентичности последовательности с SEQ ID NO: 49 или 100% идентичности последовательности с SEQ ID NO: 49). Например, в некоторых вариантах осуществления VHB1-область содержит аминокислотную последовательность SEQ ID NO: 41; и VLB1-область содержит аминокислотную последовательность SEQ ID NO: 49. Например, в некоторых вариантах осуществления биспецифичные антигенсвязывающие молекулы представляют собой биспецифичные антигенсвязывающие молекулы анти-HER2 (например, 4D5 N30S.Y55E.H91A.N54E.D98T-1Fab-IgGTDB).
В некоторых вариантах осуществления VHB2-область содержит одну, две или все три из следующих HVR: (a) HVR-H1, содержащую аминокислотную последовательность из SEQ ID NO: 11; (b) HVR-H2, содержащую аминокислотную последовательность из SEQ ID NO: 36; и (с) HVR-H3, содержащую аминокислотную последовательность из SEQ ID NO: 37; В некоторых вариантах осуществления VHB2-область содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности с SEQ ID NO: 41 (например, по меньшей мере 96% идентичности последовательности с SEQ ID NO: 41 по меньшей мере 97% идентичности последовательности с SEQ ID NO: 41 по меньшей мере 98% идентичности последовательности с SEQ ID NO: 41 по меньшей мере 99% идентичности последовательности с SEQ ID NO: 41 или 100% идентичности последовательности с SEQ ID NO: 41). В некоторых вариантах осуществления данного изобретения VHB2-область содержит аминокислотную последовательность SEQ ID NO: 41. В некоторых вариантах осуществления VLB2-область содержит одну, две или все три из следующих HVR: (a) HVR-L1, содержащую аминокислотную последовательность из SEQ ID N0: 38; (b) HVR-L2, содержащую аминокислотную последовательность из SEQ ID NO: 29; и (с) HVR-L3, содержащую аминокислотную последовательность из SEQ ID NO: 26; В некоторых вариантах осуществления VLB2-область содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности с SEQ ID NO: 49 (например, по меньшей мере 96% идентичности последовательности с SEQ ID NO: 49 по меньшей мере 97% идентичности последовательности с SEQ ID NO: 49 по меньшей мере 98% идентичности последовательности с SEQ ID NO: 49 по меньшей мере 99% идентичности последовательности с SEQ ID NO: 49 или 100% идентичности последовательности с SEQ ID NO: 49). В некоторых вариантах осуществления данного изобретения VLB2-область содержит аминокислотную последовательность SEQ ID NO: 49. Например; в некоторых вариантах осуществления биспецифичные антигенсвязывающие молекулы представляют собой биспецифичные антигенсвязывающие молекулы анти-HER2 (например, 4D5 N30S.Y55E.H91A.N54E.D98T-1Fab-IgG TDB). В некоторых вариантах осуществления данного изобретения VHB2 содержит следующие HVR: (a) HVR-H1, содержащую аминокислотную последовательность из SEQ ID NO: 11; (b) HVR-H2, содержащую аминокислотную последовательность из SEQ ID NO: 36; и (с) HVR-H3, содержащую аминокислотную последовательность из SEQ ID NO: 37; и VL.B2 содержит следующие HVR: (d) HVR-L1, содержащую аминокислотную последовательность из SEQ ID NO: 38; (е) HVR-L2, содержащую аминокислотную последовательность из SEQ ID NO: 29; и (f) HVR-L3, содержащую аминокислотную последовательность из SEQ ID NO: 26. В некоторых вариантах осуществления VHB2-область содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности с SEQ ID NO: 41 (например, по меньшей мере 96% идентичности последовательности с SEQ ID NO: 41 по меньшей мере 97% идентичности последовательности с SEQ ID NO: 41 по меньшей мере 98% идентичности последовательности с SEQ ID NO: 41 по меньшей мере 99% идентичности последовательности с SEQ ID NO: 41 или 100% идентичности последовательности с SEQ ID NO: 41); и VLB2-область содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности с SEQ ID NO: 49 (например, по меньшей мере 96% идентичности последовательности с SEQ ID NO: 49 по меньшей мере 97% идентичности последовательности с SEQ ID NO: 49 по меньшей мере 98% идентичности последовательности с SEQ ID NO: 49 по меньшей мере 99% идентичности последовательности с SEQ ID NO: 49 или 100% идентичности последовательности с SEQ ID NO: 49). В некоторых вариантах осуществления VHB2-область содержит аминокислотную последовательность SEQ ID NO: 41; и VLB2-область содержит аминокислотную последовательность SEQ ID NO: 49. Например, в некоторых вариантах осуществления биспецифичные антигенсвязывающие молекулы представляют собой биспецифичные антигенсвязывающие молекулы анти-HER2 (например, 4D5 N30S.Y55E.H91A.N54E.D98T-1Fab-IgG TDB).
В некоторых вариантах осуществления биспецифичная антигенсвязывающая молекула имеет VHB1-область, которая содержит одну, две или все три из следующих HVR: (a) HVR-H1, содержащую аминокислотную последовательность SEQ ID NO: 11; (b) HVR-H2, содержащую аминокислотную последовательность SEQ ID NO: 36; и (с) HVR-Н3, содержащую аминокислотную последовательность SEQ ID NO: 43; В некоторых вариантах осуществления VHB1-область содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности с SEQ ID NO: 44 (например, по меньшей мере 96% идентичности последовательности с SEQ ID NO: 44 по меньшей мере 97% идентичности последовательности с SEQ ID NO: 44 по меньшей мере 98% идентичности последовательности с SEQ ID NO: 44 по меньшей мере 99% идентичности последовательности с SEQ ID NO: 44 или 100% идентичности последовательности с SEQ ID NO: 44). В некоторых вариантах осуществления данного изобретения VHB1-область содержит аминокислотную последовательность SEQ ID NO: 44. В некоторых вариантах осуществления VLB1-область содержит одну, две или все три из следующих HVR: (a) HVR-L1, содержащую аминокислотную последовательность из SEQ ID NO: 38; (b) HVR-L2, содержащую аминокислотную последовательность из SEQ ID NO: 29; и (с) HVR-L3, содержащую аминокислотную последовательность из SEQ ID NO: 26; В некоторых вариантах осуществления VLB1-область содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности с SEQ ID NO: 49 (например, по меньшей мере 96% идентичности последовательности с SEQ ID NO: 49 по меньшей мере 97% идентичности последовательности с SEQ ID NO: 49 по меньшей мере 98% идентичности последовательности с SEQ ID NO: 49 по меньшей мере 99% идентичности последовательности с SEQ ID NO: 49 или 100% идентичности последовательности с SEQ ID NO: 49). В некоторых вариантах осуществления данного изобретения VLai-область содержит аминокислотную последовательность SEQ ID NO: 49. Например, в некоторых вариантах осуществления биспецифичные антигенсвязывающие молекулы представляют собой биспецифичные антигенсвязывающие молекулы анти-HER2 (например, 4D5 N30S.Y55E.H91A.N54E.D98T.Y102V-1Fab-IgG TDB).
В некоторых вариантах осуществления данного изобретения VHB1 содержит следующие HVR: (a) HVR-H1, содержащую аминокислотную последовательность из SEQ ID NO: 11; (b) HVR-H2, содержащую аминокислотную последовательность из SEQ ID NO: 36; и (с) HVR-H3, содержащую аминокислотную последовательность из SEQ ID NO: 43; и VLB1 содержит следующие HVR: (d) HVR-L1, содержащую аминокислотную последовательность SEQ ID NO: 38; (e) HVR-L2, содержащую аминокислотную последовательность SEQ ID NO: 29; и (f) HVR-L3, содержащую аминокислотную последовательность SEQ ID NO: 26. В некоторых вариантах осуществления VHB1-область содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности с SEQ ID NO: 44 (например, по меньшей мере 96% идентичности последовательности с SEQ ID NO: 44 по меньшей мере 97% идентичности последовательности с SEQ ID NO: 44 по меньшей мере 98% идентичности последовательности с SEQ ID NO: 44 по меньшей мере 99% идентичности последовательности с SEQ ID NO: 44 или 100% идентичности последовательности с SEQ ID NO: 44); и VLB1-область содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности с SEQ ID NO: 49 (например, по меньшей мере 96% идентичности последовательности с SEQ ID NO: 49 по меньшей мере 97% идентичности последовательности с SEQ ID NO: 49 по меньшей мере 98% идентичности последовательности с SEQ ID NO: 49 по меньшей мере 99% идентичности последовательности с SEQ ID NO: 49 или 100% идентичности последовательности с SEQ ID NO: 49). Например, в некоторых вариантах осуществления VHB1-область содержит аминокислотную последовательность из SEQ ID NO: 44; и VHB1-область содержит аминокислотную последовательность из SEQ ID NO: 49. Например, в некоторых вариантах осуществления биспецифичные антигенсвязывающие молекулы представляют собой биспецифичные антигенсвязывающие молекулы анти-HER2 (например, 4D5 N30S.Y55E.H91A.N54E.D98T.Y102V-1Fab-IgGTDB).
В некоторых вариантах осуществления VHB2-область содержит одну, две или все три из следующих HVR: (a) HVR-H1, содержащую аминокислотную последовательность SEQ ID NO: 11; (b) HVR-H2, содержащую аминокислотную последовательность SEQ ID NO: 36; и (с) HVR-Н3, содержащую аминокислотную последовательность SEQ ID NO: 43; В некоторых вариантах осуществления VHB2-область содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности с SEQ ID NO: 44 (например, по меньшей мере 96% идентичности последовательности с SEQ ID NO: 44 по меньшей мере 97% идентичности последовательности с SEQ ID NO: 44 по меньшей мере 98% идентичности последовательности с SEQ ID NO: 44 по меньшей мере 99% идентичности последовательности с SEQ ID NO: 44 или 100% идентичности последовательности с SEQ ID NO: 44). В некоторых вариантах осуществления данного изобретения VHB2-область содержит аминокислотную последовательность SEQ ID NO: 44. В некоторых вариантах осуществления VLB2-область содержит одну, две или все три из следующих HVR: (a) HVR-L1, содержащую аминокислотную последовательность из SEQ ID NO: 38; (b) HVR-L2, содержащую аминокислотную последовательность из SEQ ID NO: 29; и (с) HVR-L3, содержащую аминокислотную последовательность из SEQ ID NO: 26; В некоторых вариантах осуществления VLB2-область содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности с SEQ ID NO: 49 (например, по меньшей мере 96% идентичности последовательности с SEQ ID NO: 49 по меньшей мере 97% идентичности последовательности с SEQ ID NO: 49 по меньшей мере 98% идентичности последовательности с SEQ ID NO: 49 по меньшей мере 99% идентичности последовательности с SEQ ID NO: 49 или 100% идентичности последовательности с SEQ ID NO: 49). В некоторых вариантах осуществления данного изобретения VLB2-область содержит аминокислотную последовательность SEQ ID NO: 49. Например, в некоторых вариантах осуществления биспецифичные антигенсвязывающие молекулы представляют собой биспецифичные антигенсвязывающие молекулы анти-HER2 (например, 4D5 N30S.Y55E.H91A.N54E.D98T.Y102V-1Fab-IgG TDB).
В некоторых вариантах осуществления данного изобретения VHB2 содержит следующие HVR: (a) HVR-H1, содержащую аминокислотную последовательность из SEQ ID NO: 11; (b) HVR-H2, содержащую аминокислотную последовательность из SEQ ID NO: 36; и (с) HVR-H3, содержащую аминокислотную последовательность из SEQ ID NO: 43; и VLB2 содержит следующие HVR: (d) HVR-L1, содержащую аминокислотную последовательность из SEQ ID NO: 38; (е) HVR-L2, содержащую аминокислотную последовательность из SEQ ID NO: 29; и (f) HVR-L3, содержащую аминокислотную последовательность из SEQ ID NO: 26. В некоторых вариантах осуществления VHB2-область содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности с SEQ ID NO: 44 (например, по меньшей мере 96% идентичности последовательности с SEQ ID NO: 44 по меньшей мере 97% идентичности последовательности с SEQ ID NO: 44 по меньшей мере 98% идентичности последовательности с SEQ ID NO: 44 по меньшей мере 99% идентичности последовательности с SEQ ID NO: 44 или 100% идентичности последовательности с SEQ ID NO: 44); и VLB2-область содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности с SEQ ID NO: 49 (например, по меньшей мере 96% идентичности последовательности с SEQ ID NO: 49 по меньшей мере 97% идентичности последовательности с SEQ ID NO: 49 по меньшей мере 98% идентичности последовательности с SEQ ID NO: 49 по меньшей мере 99% идентичности последовательности с SEQ ID NO: 49 или 100% идентичности последовательности с SEQ ID NO: 49). В некоторых вариантах осуществления VHB2-область содержит аминокислотную последовательность SEQ ID NO: 44; и VLB2-область содержит аминокислотную последовательность SEQ ID NO: 49. Например, в некоторых вариантах осуществления биспецифичные антигенсвязывающие молекулы представляют собой биспецифичные антигенсвязывающие молекулы анти-HER2 (например, 4D5 N30S.Y55E.H91A.N54E.D98T.Y102V-1Fab-IgGTDB).
В некоторых вариантах осуществления биспецифичная антигенсвязывающая молекула по любому из предшествующих вариантов осуществления, имеет VHA-область, содержащую одну, две или все три из следующих HVR: (a) HVR-H1, содержащую аминокислотную последовательность из SEQ ID NO: 1; (b) HVR-H2, содержащую аминокислотную последовательность из SEQ ID NO: 2; и (с) HVR-Н3, содержащую аминокислотную последовательность из SEQ ID NO: 3; В некоторых вариантах осуществления VHA-область содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности с SEQ ID NO: 7 (например, по меньшей мере 96% идентичности последовательности с SEQ ID NO: 7 по меньшей мере 97% идентичности последовательности с SEQ ID NO: 7 по меньшей мере 98% идентичности последовательности с SEQ ID NO: 7 по меньшей мере 99% идентичности последовательности с SEQ ID NO: 7 или 100% идентичности последовательности с SEQ ID NO: 7). В некоторых вариантах осуществления данного изобретения VHA-область содержит аминокислотную последовательность SEQ ID NO: 7. В некоторых вариантах осуществления vla-область содержит одну, две или все три из следующих HVR: (a) HVR-L1, содержащую аминокислотную последовательность из SEQ ID NO: 4; (b) HVR-L2, содержащую аминокислотную последовательность из SEQ ID NO: 5; и (с) HVR-L3, содержащую аминокислотную последовательность из SEQ ID NO: 6; В некоторых вариантах осуществления VLA-область содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности с SEQ ID NO: 8 (например, по меньшей мере 96% идентичности последовательности с SEQ ID NO: 8 по меньшей мере 97% идентичности последовательности с SEQ ID NO: 8 по меньшей мере 98% идентичности последовательности с SEQ ID NO: 8 по меньшей мере 99% идентичности последовательности с SEQ ID NO: 8 или 100% идентичности последовательности с SEQ ID NO: 8). В некоторых вариантах осуществления данного изобретения VLA-область содержит аминокислотную последовательность SEQ ID NO: 8. Например, в некоторых вариантах осуществления биспецифичные антигенсвязывающие молекулы представляют собой анти-CD3 биспецифичную антигенсвязывающую молекулу (например, анти-CD3/HER2 1Fab-IgG TDB, например, анти-CD3/HER2 1Fab-IgG TDB, имеющую 40G5c CD3-связывающий домен).
В некоторых вариантах осуществления данного изобретения vha содержит следующие HVR: (a) HVR-H1, содержащую аминокислотную последовательность из SEQ ID NO: 1; (b) HVR-H2, содержащую аминокислотную последовательность из SEQ ID NO: 2; и (с) HVR-H3, содержащую аминокислотную последовательность из SEQ ID NO: 3; и vla содержит следующие HVR: (d) HVR-L1, содержащую аминокислотную последовательность из SEQ ID NO: 4; (е) HVR-L2, содержащую аминокислотную последовательность из SEQ ID NO: 5; и (f) HVR-E3, содержащую аминокислотную последовательность из SEQ ID NO: 6. В некоторых вариантах осуществления VHA-область содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности с SEQ ID NO: 7 (например, по меньшей мере 96% идентичности последовательности с SEQ ID NO: 7 по меньшей мере 97% идентичности последовательности с SEQ ID NO: 7 по меньшей мере 98% идентичности последовательности с SEQ ID NO: 7 по меньшей мере 99% идентичности последовательности с SEQ ID NO: 7 или 100% идентичности последовательности с SEQ ID NO: 7); и VLA-область содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности с SEQ ID NO: 8 (например, по меньшей мере 96% идентичности последовательности с SEQ ID NO: 8 по меньшей мере 97% идентичности последовательности с SEQ ID NO: 8 по меньшей мере 98% идентичности последовательности с SEQ ID NO: 8 по меньшей мере 99% идентичности последовательности с SEQ ID NO: 8 или 100% идентичности последовательности с SEQ ID NO: 8). В некоторых вариантах осуществления vha-область содержит аминокислотную последовательность из SEQ ID NO: 7; и vla-область содержит аминокислотную последовательность из SEQ ID NO: 8. Например, в некоторых вариантах осуществления биспецифичные антигенсвязывающие молекулы представляют собой анти-cd3 биспецифичную антигенсвязывающую молекулу (например, анти-CD3/HER2 1Fab-IgG TDB, например, анти-CD3/HER2 1Fab-IgG TDB, имеющую 40G5c CD3-связывающий домен).
В другом аспекте данное изобретение относится к биспецифичной антигенсвязывающей молекуле, содержащей моновалентное плечо и бивалентное плечо, при этом: (а) моновалентное плечо содержит Fab, при этом С-конец указанного Fab слит с N-концом первой Fc-субъединицы, и при этом Fab содержит следующие HVR: (i) HVR-H1, содержащую аминокислотную последовательность из SEQ ID NO: I, (ii) HVR-H2, содержащую аминокислотную последовательность из SEQ ID NO: 2, (iii) HVR-H3, содержащую аминокислотную последовательность из SEQ ID NO: 3, (iv) HVR-L1, содержащую аминокислотную последовательность из SEQ ID NO: 4, (v) HVR-L2, содержащую аминокислотную последовательность из SEQ ID NO: 5, и (vi) HVR-L3, содержащую аминокислотную последовательность из SEQ ID NO: 6; (b) бивалентное плечо содержит FabB1 и FabB2, при этом С-конец FabB2 слит с N-концом FabB1, и С-конец FabB1 слит с N-концом второй Fc-субъединицы, при этом каждый из FabB1 и FabB2 содержит следующие HVR: (i) HVR-H1, содержащую аминокислотную последовательность из SEQ ID NO: I l, (ii) HVR-H2, содержащую аминокислотную последовательность из SEQ ID NO: 12, (iii) HVR-H3, содержащую аминокислотную последовательность из SEQ ID NO: 13, (iv) HVR-L1, содержащую аминокислотную последовательность из SEQ ID NO: 14, (v) HVR-L2, содержащую аминокислотную последовательность из SEQ ID NO: 15, (vi) HVR-L3, содержащую аминокислотную последовательность из SEQ ID NO: 16; и (с) первая Fc-субъединица ассоциируется со второй Fc-субъединицей с образованием Fc-домена. В некоторых вариантах осуществления (a) Fab содержит VHA-область и VLA-область, при этом VHA-область содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности с SEQ ID NO: 7, и VLA-область содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности с SEQ ID NO: 8; (b) FabB1 содержит VLB1-область и VLB1-область, при этом VHB1-область содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности с SEQ ID NO: 17, и VLB1-область содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности с SEQ ID NO: 18; и (с) FabB2 содержит VHB2-область и VLB2-область, при этом VHB2-область содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности с SEQ ID NO: 17, и VLB2-область содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности с SEQ ID NO: 18. Например, в некоторых вариантах осуществления (а) VHA-область содержит аминокислотную последовательность из SEQ ID NO: 7, и VLA-область содержит аминокислотную последовательность из SEQ ID NO: 8; (b) VHB1-область содержит аминокислотную последовательность из SEQ ID NO: 17, и VLB1-область содержит аминокислотную последовательность из SEQ ID NO: 18; и (с) VHB2-область содержит аминокислотную последовательность из SEQ ID NO: 17, и VLB2-область содержит аминокислотную последовательность из SEQ ID NO: 18.
В другом аспекте данное изобретение относится к биспецифичной антигенсвязывающей молекуле, содержащей моновалентное плечо и бивалентное плечо, при этом: (а) моновалентное плечо содержит FabA, при этом С-конец FabA слит с N-концом первой Fc-субъединицы, и при этом FabA содержит следующие HVR: (i) HVR-H1, содержащую аминокислотную последовательность из SEQ ID NO: I, (ii) HVR-H2, содержащую аминокислотную последовательность из SEQ ID NO: 2, (iii) HVR-H3, содержащую аминокислотную последовательность из SEQ ID NO: 3, (iv) HVR-L1, содержащую аминокислотную последовательность из SEQ ID NO: 4, (v) HVR-E2, содержащую аминокислотную последовательность из SEQ ID NO: 5, и (vi) HVR-L3, содержащую аминокислотную последовательность из SEQ ID NO: 6; (b) бивалентное плечо содержит FabB1 и FabB2, при этом С-конец FabB2 слит с N-концом FabB1, и С-конец FabB1 слит с N-концом второй Fc-субъединицы, при этом каждый из FabB1 и FabB2 содержит следующие HVR: (i) HVR-H1, содержащую аминокислотную последовательность из SEQ ID NO: 11, (ii) HVR-H2, содержащую аминокислотную последовательность из SEQ ID NO: 19, (iii) HVR-Н3, содержащую аминокислотную последовательность из SEQ ID NO: 20, (iv) HVR-L1, содержащую аминокислотную последовательность из SEQ ID NO: 22, (v) HVR-L2, содержащую аминокислотную последовательность из SEQ ID NO: 22, (vi) HVR-L3, содержащую аминокислотную последовательность из SEQ ID NO: 26; и (с) первая Fc-субъединица ассоциируется со второй Fc-субъединицей с образованием Fc-домена. В некоторых вариантах осуществления (а) FabA содержит VHA-область и VLA-область, при этом VHA-область содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности с SEQ ID NO: 7, и VLA-область содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности с SEQ ID NO: 8; (b) FabB1 содержит VHB1-область и VLB1-область, при этом VHB1-область содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности с SEQ ID NO: 24, и VLB1-область содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности с SEQ ID NO: 27; и (с) FabB2 содержит VHB2-область и VLB2-область, при этом VHB2-область содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности с SEQ ID NO: 24, и VLB2-область содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности с SEQ ID NO: 27. Например, в некоторых вариантах осуществления (а) VHA-область содержит аминокислотную последовательность из SEQ ID NO: 7, и VLA-область содержит аминокислотную последовательность из SEQ ID NO: 8; (b) VHB1-область содержит аминокислотную последовательность из SEQ ID NO: 24, и VLB1-область содержит аминокислотную последовательность из SEQ ID NO: 27; и (с) VHB2-область содержит аминокислотную последовательность из SEQ ID NO: 24, и VLB2-область содержит аминокислотную последовательность из SEQ ID NO: 27.
В еще одном аспекте данное изобретение обеспечивает биспецифичную антигенсвязывающую молекулу, содержащую моновалентное плечо и бивалентное плечо, при этом: (а) моновалентное плечо содержит FabA, при этом С-конец FabA слит с N-концом первой Fc-субъединицы, и при этом FabA содержит следующие HVR: (i) HVR-H1, содержащую аминокислотную последовательность из SEQ ID NO: I, (ii) HVR-H2, содержащую аминокислотную последовательность из SEQ ID NO: 2, (iii) HVR-H3, содержащую аминокислотную последовательность из SEQ ID NO: 3, (iv) HVR-L1, содержащую аминокислотную последовательность из SEQ ID NO: 4, (v) HVR-L2, содержащую аминокислотную последовательность из SEQ ID NO: 5, и (vi) HVR-L3, содержащую аминокислотную последовательность из SEQ ID NO: 6; (b) бивалентное плечо содержит FabB1 и FabB2, при этом С-конец Fab2 слит с N-концом FabB1, и С-конец FabB1 слит с N-концом второй Fc-субъединицы, при этом каждый из FabB1 и FabB2 содержит следующие HVR: (i) HVR-H1, содержащую аминокислотную последовательность из SEQ ID NO: 11, (ii) HVR-H2, содержащую аминокислотную последовательность из SEQ ID NO: 19, (iii) HVR-H3, содержащую аминокислотную последовательность из SEQ ID NO: 32, (iv) HVR-L1, содержащую аминокислотную последовательность из SEQ ID NO: 21, (v) HVR-L2, содержащую аминокислотную последовательность из SEQ ID NO: 22, (vi) HVR-L3, содержащую аминокислотную последовательность из SEQ ID NO: 23; и (с) первая Fc-субъединица ассоциируется со второй Fc-субъединицей с образованием Fc-домена. В некоторых вариантах осуществления (а) FabA содержит VHA-область и VLA-область, при этом VHA-область содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности с SEQ ID NO: 7, и VLA-область содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности с SEQ ID NO: 8; (b) FabB1 содержит VHB1-область и VLB1-область, при этом VHB1-область содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности с SEQ ID NO: 33, и VLB1-область содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности с SEQ ID NO: 25; и (с) FabB2 содержит VHB2-область и VLB2-область, при этом VHB2-область содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности с SEQ ID NO: 33, и VLB2-область содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности с SEQ ID NO: 25. Например, в некоторых вариантах осуществления (а) VHA-область содержит аминокислотную последовательность из SEQ ID NO: 7, и VLA-область содержит аминокислотную последовательность из SEQ ID NO: 8; (b) VHB1-область содержит аминокислотную последовательность из SEQ ID NO: 33, и VLB1-область содержит аминокислотную последовательность из SEQ ID NO: 25; и (с) VHB2-область содержит аминокислотную последовательность из SEQ ID NO: 33, и VLB2-область содержит аминокислотную последовательность из SEQ ID NO: 25.
В другом аспекте данное изобретение относится к биспецифичной антигенсвязывающей молекуле, содержащей моновалентное плечо и бивалентное плечо, при этом: (а) моновалентное плечо содержит FabA, при этом С-конец FabA слит с N-концом первой Fc-субъединицы, и при этом FabA содержит следующие HVR: (i) HVR-H1, содержащую аминокислотную последовательность из SEQ ID NO: I, (ii) HVR-H2, содержащую аминокислотную последовательность из SEQ ID NO: 2, (iii) HVR-H3, содержащую аминокислотную последовательность из SEQ ID NO: 3, (iv) HVR-L1, содержащую аминокислотную последовательность из SEQ ID NO: 4, (v) HVR-L2, содержащую аминокислотную последовательность из SEQ ID NO: 5, и (vi) HVR-L3, содержащую аминокислотную последовательность из SEQ ID NO: 6; (b) бивалентное плечо содержит FabB1 и FabB2, при этом С-конец FabB2 слит с N-концом FabB1, и С-конец FabB1 слит с N-концом второй Fc-субъединицы, при этом каждый из FabB1 и FabB2 содержит следующие HVR: (i) HVR-H1, содержащую аминокислотную последовательность из SEQ ID NO: 11, (ii) HVR-H2, содержащую аминокислотную последовательность из SEQ ID NO: 36, (iii) HVR-H3, содержащую аминокислотную последовательность из SEQ ID NO: 37, (iv) HVR-L1, содержащую аминокислотную последовательность из SEQ ID NO: 21, (v) HVR-L2, содержащую аминокислотную последовательность из SEQ ID NO: 29, (vi) HVR-L3, содержащую аминокислотную последовательность из SEQ ID NO: 26; и (с) первая Fc-субъединица ассоциируется со второй Fc-субъединицей с образованием Fc-домена. В некоторых вариантах осуществления (а) FabA содержит VHA-область и VLA-область, при этом VHA-область содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности с SEQ ID NO: 7, и VLA-область содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности с SEQ ID NO: 8; (b) FabB1 содержит VHB1-область и VLB1-область, при этом VHB1-область содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности с SEQ ID NO: 41, и VLB1-область содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности с SEQ ID NO: 48; и (с) FabB2 содержит VHB2-область и VLB2-область, при этом VHB2-область содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности с SEQ ID NO: 41, и VLB2-область содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности с SEQ ID NO: 48. Например, в некоторых вариантах осуществления (а) VHA-область содержит аминокислотную последовательность из SEQ ID NO: 7, и VLA-область содержит аминокислотную последовательность из SEQ ID NO: 8; (b) VHB1-область содержит аминокислотную последовательность из SEQ ID NO: 41, и VLB1-область содержит аминокислотную последовательность из SEQ ID NO: 48; и (с) VHB2-область содержит аминокислотную последовательность из SEQ IDNO: 41, и VLB2-область содержит аминокислотную последовательность из SEQ ID NO: 48.
В другом аспекте данное изобретение относится к биспецифичной антигенсвязывающей молекуле, содержащей моновалентное плечо и бивалентное плечо, при этом: (а) моновалентное плечо содержит FabA, при этом С-конец FabA слит с N-концом первой Fc-субъединицы, и при этом FabA содержит следующие HVR: (i) HVR-H1, содержащую аминокислотную последовательность из SEQ ID NO: I, (ii) HVR-H2, содержащую аминокислотную последовательность из SEQ ID NO: 2, (iii) HVR-H3, содержащую аминокислотную последовательность из SEQ ID NO: 3, (iv) HVR-L1, содержащую аминокислотную последовательность из SEQ ID NO: 4, (v) HVR-L2, содержащую аминокислотную последовательность из SEQ ID NO: 5, и (vi) HVR-L3, содержащую аминокислотную последовательность из SEQ ID NO: 6; (b) бивалентное плечо содержит FabB1 и FabB2, при этом С-конец FabB2 слит с N-концом FabB1, и С-конец FabB1 слит с N-концом второй Fc-субъединицы, при этом каждый из FabB1 и FabB2 содержит следующие HVR: (i) HVR-H1, содержащую аминокислотную последовательность из SEQ ID NO: 11, (ii) HVR-H2, содержащую аминокислотную последовательность из SEQ ID NO: 36, (iii) HVR-H3, содержащую аминокислотную последовательность из SEQ ID NO: 43, (iv) HVR-L1, содержащую аминокислотную последовательность из SEQ ID NO: 21, (v) HVR-L2, содержащую аминокислотную последовательность из SEQ ID NO: 29, (vi) HVR-L3, содержащую аминокислотную последовательность из SEQ ID NO: 26; и (с) первая Fc-субъединица ассоциируется со второй Fc-субъединицей с образованием Fc-домена. В некоторых вариантах осуществления (а) FabA содержит VHA-область и VLA-область, при этом VHA-область содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности с SEQ ID NO: 7, и VLA-область содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности с SEQ ID NO: 8; (b) FabB1 содержит VHB1-область и VLB1-область, при этом VHB1-область содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности с SEQ ID NO: 44, и VLB1-область содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности с SEQ ID NO: 48; и (с) FabB2 содержит VHB2-область и VLB2-область, при этом VHB2-область содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности с SEQ ID NO: 44, и VLB2-область содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности с SEQ ID NO: 48. Например, в некоторых вариантах осуществления (а) VHA-область содержит аминокислотную последовательность из SEQ ID NO: 7, и VLA-область содержит аминокислотную последовательность из SEQ ID NO: 8; (b) VHB1-область содержит аминокислотную последовательность из SEQ ID NO: 44, и VLB1-область содержит аминокислотную последовательность из SEQ ID NO: 48; и (с) VHB2-область содержит аминокислотную последовательность из SEQ ID NO: 44, и VLB2-область содержит аминокислотную последовательность из SEQ ID NO: 48. Например, в некоторых вариантах осуществления биспецифичные антигенсвязывающие молекулы представляют собой биспецифичные антигенсвязывающие молекулы анти-CD3/HER2 (например, анти-CD3/HER2 1Fab-IgG TDB, например, анти-CD3/HER2 1Fab-IgG TDB, имеющую 40G5c CD3-связывающий домен и два домена, связывающих 4D5 Y55E.H91A.N54E.D98T.Y102V HER2).
В еще одном аспекте, данное изобретение относится к биспецифичной антигенсвязывающей молекуле, содержащей моновалентное плечо и бивалентное плечо, при этом: (а) моновалентное плечо содержит FabA, при этом С-конец FabA слит с N-концом первой Fc-субъединицы, и при этом FabA содержит следующие HVR: (i) HVR-H1, содержащую аминокислотную последовательность из SEQ ID NO: I, (ii) HVR-H2, содержащую аминокислотную последовательность из SEQ ID NO: 2, (iii) HVR-H3, содержащую аминокислотную последовательность из SEQ ID NO: 3, (iv) HVR-L1, содержащую аминокислотную последовательность из SEQ ID NO: 4, (v) HVR-L2, содержащую аминокислотную последовательность из SEQ ID NO: 5, и (vi) HVR-L3, содержащую аминокислотную последовательность из SEQ ID NO: 6; (b) бивалентное плечо содержит FabB1 и FabB2, при этом С-конец FabB2 слит с N-концом FabB1, и С-конец FabB1 слит с N-концом второй Fc-субъединицы, при этом каждый из FabB1 и FabB2 содержит следующие HVR: (i) HVR-H1, содержащую аминокислотную последовательность из SEQ ID NO: 11, (ii) HVR-H2, содержащую аминокислотную последовательность из SEQ ID NO: 36, (iii) HVR-Н3, содержащую аминокислотную последовательность из SEQ ID NO: 37, (iv) HVR-L1, содержащую аминокислотную последовательность из SEQ ID NO: 38, (v) HVR-L2, содержащую аминокислотную последовательность из SEQ ID NO: 29, (vi) HVR-L3, содержащую аминокислотную последовательность из SEQ ID NO: 26; и (с) первая Fc-субъединица ассоциируется со второй Fc-субъединицей с образованием Fc-домена. В некоторых вариантах осуществления (а) FabA содержит VHA-область и VLA-область, при этом VHA-область содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности с SEQ ID NO: 7, и VLA-область содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности с SEQ ID NO: 8; (b) FabB1 содержит VHB1-область и VLB1-область, при этом VHB1-область содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности с SEQ ID NO: 41, и VLB1-область содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности с SEQ ID NO: 49; и (с) FabB2 содержит VHB2-область и VLB2-область, при этом VHB2-область содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности с SEQ ID NO: 41, и VLB2-область содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности с SEQ ID NO: 49. Например, в некоторых вариантах осуществления (а) VHA-область содержит аминокислотную последовательность из SEQ ID NO: 7, и VLA-область содержит аминокислотную последовательность из SEQ ID NO: 8; (b) VHB1-область содержит аминокислотную последовательность из SEQ ID NO: 41, и VLB1-область содержит аминокислотную последовательность из SEQ ID NO: 49; и (с) VHB2-область содержит аминокислотную последовательность из SEQ IDNO: 41, и VLB2-область содержит аминокислотную последовательность из SEQ ID NO: 49. Например, в некоторых вариантах осуществления биспецифичные антигенсвязывающие молекулы представляют собой биспецифичные антигенсвязывающие молекулы анти-CD3/HER2 (например, анти-CD3/HER2 1Fab-IgG TDB, например, анти-CD3/HER2 1Fab-IgG TDB, имеющую 40G5c CD3-связывающий домен и два домена, связывающих 4D5 N30S.Y55E.H91A.N54E.D98T HER2).
В другом аспекте данное изобретение относится к биспецифичной антигенсвязывающей молекуле, содержащей моновалентное плечо и бивалентное плечо, при этом: (а) моновалентное плечо содержит FabA, при этом С-конец FabA слит с N-концом первой Fc-субъединицы, и при этом FabA содержит следующие HVR: (i) HVR-H1, содержащую аминокислотную последовательность из SEQ ID NO: I, (ii) HVR-H2, содержащую аминокислотную последовательность из SEQ ID NO: 2, (iii) HVR-H3, содержащую аминокислотную последовательность из SEQ ID NO: 3, (iv) HVR-L1, содержащую аминокислотную последовательность из SEQ ID NO: 4, (v) HVR-L2, содержащую аминокислотную последовательность из SEQ ID NO: 5, и (vi) HVR-L3, содержащую аминокислотную последовательность из SEQ ID NO: 6; (b) бивалентное плечо содержит FabB1 и FabB2, при этом С-конец FabB2 слит с N-концом FabB1, и С-конец FabB1 слит с N-концом второй Fc-субъединицы, при этом каждый из FabB1 и FabB2 содержит следующие HVR: (i) HVR-H1, содержащую аминокислотную последовательность из SEQ ID NO: 11, (ii) HVR-H2, содержащую аминокислотную последовательность из SEQ ID NO: 36, (iii) HVR-H3, содержащую аминокислотную последовательность из SEQ ID NO: 43, (iv) HVR-L1, содержащую аминокислотную последовательность из SEQ ID NO: 38, (v) HVR-L2, содержащую аминокислотную последовательность из SEQ ID NO: 29, (vi) HVR-L3, содержащую аминокислотную последовательность из SEQ ID NO: 26; и (с) первая Fc-субъединица ассоциируется со второй Fc-субъединицей с образованием Fc-домена. В некоторых вариантах осуществления (а) FabA содержит VHA-область и VLA-область, при этом VHA-область содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности с SEQ ID NO: 7, и VLA-область содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности с SEQ ID NO: 8; (b) FabB1 содержит VHB1-область и VLB1-область, при этом VHB1-область содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности с SEQ ID NO: 44, и VLB1-область содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности с SEQ ID NO: 49; и (с) FabB2 содержит VHB2-область и VLB2-область, при этом VHB2-область содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности с SEQ ID NO: 44, и VLB2-область содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности с SEQ ID NO: 49. Например, в некоторых вариантах осуществления (а) VHA-область содержит аминокислотную последовательность из SEQ ID NO: 7, и VLA-область содержит аминокислотную последовательность из SEQ ID NO: 8; (b) VHB1-область содержит аминокислотную последовательность из SEQ ID NO: 44, и VLB1-область содержит аминокислотную последовательность из SEQ ID NO: 49; и (с) VHB2-область содержит аминокислотную последовательность из SEQ ID NO: 44, и VLB2-область содержит аминокислотную последовательность из SEQ ID NO: 49. Например, в некоторых вариантах осуществления биспецифичные антигенсвязывающие молекулы представляют собой биспецифичные антигенсвязывающие молекулы анти-CD3/HER2 (например, анти-CD3/HER2 1Fab-IgG TDB, например, анти-CD3/HER2 1Fab-IgG TDB, имеющую 40G5c CD3-связывающий домен и два домена, связывающих 4D5 N30S.Y55E.H91A.N54E.D98T.Y102V HER2).
В некоторых вариантах осуществления любого из предшествующих аспектов, Fc-домен представляет собой Fc-домен IgG (например, Fc-домен IgG1 или IgG4). Fc-домен может быть Fc-доменом человека. В некоторых вариантах осуществления Fc-домен, содержит одну или несколько аминокислотных замен, которые уменьшают связывание с Fc-рецептором и/или эффекторную функцию. Например, в некоторых вариантах осуществления один или более аминокислотных замен, которые уменьшают связывание с Fc-рецептором и/или эффекторную функцию находятся в одном или более положений, выбранных из группы, состоящей из L234, L235 и Р329 (например, при этом каждая из первой Fc-субъединицы и второй Fc-субъединицы содержат аминокислотные замены L234A, L235A и P329G). В некоторых вариантах осуществления один или несколько аминокислотных замен, которые уменьшают связывание с Ес-рецептором и/или эффекторную функцию находятся в N297 (например, N297G). В некоторых вариантах осуществления Fc-рецептор представляет собой Fcγ-рецептор. В некоторых вариантах осуществления эффекторная функция представляет собой антитело-зависимую клеточно-опосредованную цитотоксичность (АЗКЦ). В некоторых вариантах осуществления любого из предшествующих аспектов, Fc-домен содержит модификацию, осуществленную для способствования ассоциации первой Fc-субъединицы со второй Fc-субъединицей. В некоторых вариантах осуществления, аминокислотный остаток в СН3-домене второй Fc-субъединицы заменен аминокислотным остатком, имеющим больший объем боковой цепи, тем самым создавая выпуклость в СН3-домене второй Fc-субъединицы, которая может быть расположена в полости в СН3-домене первой Fc-субъединицы, и аминокислотный остаток в СН3-домене первой Fc-субъединицы заменен аминокислотным остатком, имеющим меньший объем боковой цепи, тем самым формируя полость в пределах СН3-домена первой Fc-субъединицы, в пределах которой может разместится выступ в СН3-домене второй Fc-субъединицы. В некоторых вариантах осуществления СН3-домен второй Fc-субъединицы содержит аминокислотную замену Т366, и СН3-домен первой Fc-субъединицы содержит аминокислотные замены в одном, двух или всех трех из Т366, L368 и/или Y407. В некоторых вариантах осуществления СН3-домен второй Fc-субъединицы содержит аминокислотную замену T366W, и СН3-домен первой Fc-субъединицы содержит одну, две или все три аминокислотных замены T366S, L368A и/или Y407V.
В некоторых вариантах осуществления любого из предшествующих аспектов, С-конец третьего антигенсвязывающего фрагмента, слит с N-концом второго антигенсвязывающего фрагмента с помощью пептидного линкера. Пептидный линкер может иметь длину 5-20 аминокислот (например, длину 5-10, 10-15, 15-20 или, например, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, или 20 аминокислот).
В некоторых вариантах осуществления данного изобретения пептидный линкер содержит аминокислотную последовательность SEQ ID NO: 50. В некоторых вариантах осуществления, антигенсвязывающая молекула содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности с SEQ ID NO: 55 (например, по меньшей мере 96% идентичности последовательности с SEQ ID NO: 55 по меньшей мере 97% идентичности последовательности с SEQ ID NO: 55 по меньшей мере 98% идентичности последовательности с SEQ ID NO: 55 по меньшей мере 99% идентичности последовательности с SEQ ID NO: 55 или 100% идентичности последовательности с SEQ ID NO: 55). В некоторых вариантах осуществления, антигенсвязывающая молекула содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности SEQ ID NO: 59 (например, по меньшей мере 96% идентичности последовательности с SEQ ID NO: 59 по меньшей мере 97% идентичности последовательности с SEQ ID NO: 59, по меньшей мере 98% последовательности идентичности с SEQ ID NO: 59 по меньшей мере 99% идентичности последовательности с SEQ ID NO: 59 или 100% идентичности последовательности с SEQ ID NO: 59). В некоторых вариантах осуществления, антигенсвязывающая молекула содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности SEQ ID NO: 63 (например, по меньшей мере 96% идентичности последовательности с SEQ ID NO: 63 по меньшей мере 97% идентичности последовательности с SEQ ID NO: 63, по меньшей мере 98% последовательности идентичности с SEQ ID NO: 63 по меньшей мере 99% идентичности последовательности с SEQ ID NO: 63 или 100% идентичности последовательности с SEQ ID NO: 63). В некоторых вариантах осуществления, антигенсвязывающая молекула содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности SEQ ID NO: 83 (например, по меньшей мере 96% идентичности последовательности с SEQ ID NO: 83 по меньшей мере 97% идентичности последовательности с SEQ ID NO: 83, по меньшей мере 98% последовательности идентичности с SEQ ID NO: 83 по меньшей мере 99% идентичности последовательности с SEQ ID NO: 83 или 100% идентичности последовательности с SEQ ID NO: 83). В некоторых вариантах осуществления, антигенсвязывающая молекула содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности SEQ ID NO: 85 (например, по меньшей мере 96% идентичности последовательности с SEQ ID NO: 85 по меньшей мере 97% идентичности последовательности с SEQ ID NO: 85, по меньшей мере 98% последовательности идентичности с SEQ ID NO: 85 по меньшей мере 99% идентичности последовательности с SEQ ID NO: 85 или 100% идентичности последовательности с SEQ ID NO: 85). В некоторых вариантах осуществления, антигенсвязывающая молекула содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности SEQ ID NO: 87 (например, по меньшей мере 96% идентичности последовательности с SEQ ID NO: 87 по меньшей мере 97% идентичности последовательности с SEQ ID NO: 87, по меньшей мере 98% последовательности идентичности с SEQ ID NO: 87 по меньшей мере 99% идентичности последовательности с SEQ ID NO: 87 или 100% идентичности последовательности с SEQ ID NO: 87). В некоторых вариантах осуществления, антигенсвязывающая молекула содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности SEQ ID NO: 89 (например, по меньшей мере 96% идентичности последовательности с SEQ ID NO: 89 по меньшей мере 97% идентичности последовательности с SEQ ID NO: 89, по меньшей мере 98% последовательности идентичности с SEQ ID NO: 89 по меньшей мере 99% идентичности последовательности с SEQ ID NO: 89 или 100% идентичности последовательности с SEQ ID NO: 89).
В некоторых вариантах осуществления данного изобретения пептидный линкер содержит аминокислотную последовательность SEQ ID NO: 51. В некоторых вариантах осуществления, антигенсвязывающая молекула содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности с SEQ ID NO: 56 (например, по меньшей мере 96% идентичности последовательности с SEQ ID NO: 56 по меньшей мере 97% идентичности последовательности с SEQ ID NO: 56 по меньшей мере 98% идентичности последовательности с SEQ ID NO: 56 по меньшей мере 99% идентичности последовательности с SEQ ID NO: 56 или 100% идентичности последовательности с SEQ ID NO: 56). В некоторых вариантах осуществления, антигенсвязывающая молекула содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности SEQ ID NO: 60 (например, по меньшей мере 96% идентичности последовательности с SEQ ID NO: 60 по меньшей мере 97% идентичности последовательности с SEQ ID NO: 60, по меньшей мере 98% последовательности идентичности с SEQ ID NO: 60 по меньшей мере 99% идентичности последовательности с SEQ ID NO: 60 или 100% идентичности последовательности с SEQ ID NO: 60). В некоторых вариантах осуществления, антигенсвязывающая молекула содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности SEQ ID NO: 64 (например, по меньшей мере 96% идентичности последовательности с SEQ ID NO: 64 по меньшей мере 97% идентичности последовательности с SEQ ID NO: 64, по меньшей мере 98% последовательности идентичности с SEQ ID NO: 64 по меньшей мере 99% идентичности последовательности с SEQ ID NO: 64 или 100% идентичности последовательности с SEQ ID NO: 64). В некоторых вариантах осуществления, антигенсвязывающая молекула содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности SEQ ID NO: 84 (например, по меньшей мере 96% идентичности последовательности с SEQ ID NO: 84 по меньшей мере 97% идентичности последовательности с SEQ ID NO: 84, по меньшей мере 98% последовательности идентичности с SEQ ID NO: 84 по меньшей мере 99% идентичности последовательности с SEQ ID NO: 84 или 100% идентичности последовательности с SEQ ID NO: 84). В некоторых вариантах осуществления, антигенсвязывающая молекула содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности SEQ ID NO: 86 (например, по меньшей мере 96% идентичности последовательности с SEQ ID NO: 86 по меньшей мере 97% идентичности последовательности с SEQ ID NO: 86, по меньшей мере 98% последовательности идентичности с SEQ ID NO: 86 по меньшей мере 99% идентичности последовательности с SEQ ID NO: 86 или 100% идентичности последовательности с SEQ ID NO: 86). В некоторых вариантах осуществления, антигенсвязывающая молекула содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности SEQ ID NO: 88 (например, по меньшей мере 96% идентичности последовательности с SEQ ID NO: 88 по меньшей мере 97% идентичности последовательности с SEQ ID NO: 88, по меньшей мере 98% последовательности идентичности с SEQ ID NO: 88 по меньшей мере 99% идентичности последовательности с SEQ ID NO: 88 или 100% идентичности последовательности с SEQ ID NO: 88). В некоторых вариантах осуществления, антигенсвязывающая молекула содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности SEQ ID NO: 90 (например, по меньшей мере 96% идентичности последовательности с SEQ ID NO: 90 по меньшей мере 97% идентичности последовательности с SEQ ID NO: 90, по меньшей мере 98% последовательности идентичности с SEQ ID NO: 90 по меньшей мере 99% идентичности последовательности с SEQ ID NO: 90 или 100% идентичности последовательности с SEQ ID NO: 90).
В другом аспекте данное изобретение предоставляет выделенную нуклеиновую кислоту, кодирующую биспецифичную антигенсвязывающую молекулу по любому из предшествующих аспектов.
В другом аспекте данное изобретение относится к вектору, содержащему выделенную нуклеиновую кислоту, кодирующую биспецифичную антигенсвязывающую молекулу по любому из предшествующих аспектов.
В другом аспекте данное изобретение относится к клетке-хозяину (например, изолированной клетке-хозяину), содержащий вектор, содержащий выделенную нуклеиновую кислоту, кодирующую биспецифичную антигенсвязывающую молекулу по любому из предшествующих аспектов. В одном варианте осуществления данного изобретения клетка-хозяин представляет собой эукариотическую клетку, например, клетку яичника китайского хомячка (СНО). В одном варианте осуществления данного изобретения клетка-хозяин является прокариотической, например, клеткой Е. coli.
В другом аспекте данное изобретение относится к способу получения биспецифичной антигенсвязывающей молекулы по любому из предшествующих аспектов. В некоторых вариантах осуществления данного изобретения способ включает культивирование любой из клеток-хозяев, описанных выше (например, клетки-хозяина, содержащей вектор, содержащий выделенную нуклеиновую кислоту, кодирующую биспецифичную антигенсвязывающую молекулу по любому из предшествующих аспектов) в культуральной среде. В некоторых вариантах осуществления данного изобретения способ дополнительно включает выделение биспецифичной антигенсвязывающей молекулы из клеток-хозяев или культуральной среды.
В другом аспекте данное изобретение относится к набору выделенных нуклеиновых кислот, кодирующих биспецифичную антигенсвязывающую молекулу по любому из предшествующих аспектов (например, набор, включающеий два, три, четыре, или более выделенных нуклеиновых кислот, кодирующих биспецифичную антигенсвязывающую молекулу по любому из предшествующих аспектов). В некоторых вариантах осуществления набор выделенных нуклеиновых кислот включает в себя первую выделенную нуклеиновую кислоту, и вторую выделенную нуклеиновую кислоту, при этом первая выделенная нуклеиновая кислота кодирует одну или несколько аминокислотных последовательностей первого плеча биспецифичной антигенсвязывающей молекулы, а вторая выделенная нуклеиновая кислота кодирует одну или несколько аминокислотных последовательности второго плеча биспецифичной антигенсвязывающей молекулы.
В другом аспекте данное изобретение предоставляет набор векторов, причем каждый вектор набора содержит выделенную нуклеиновую кислоту из набора выделенных нуклеиновых кислот, при этом набор выделенных нуклеиновых кислот, кодирует биспецифичную антигенсвязывающую молекулу по любому из предшествующих аспектов (например, набор, включающий две, три, четыре, или более изолированных нуклеиновых кислот, кодирующих биспецифичную антигенсвязывающую молекулу по любому из предшествующих аспектов).
В другом аспекте данное изобретение предоставляет набор клеток-хозяев (например, набор из выделенных клеток-хозяев). В некоторых вариантах осуществления каждая клетка-хозяин множества содержит выделенную нуклеиновую кислоту из набора выделенных нуклеиновых кислот, при этом набор выделенных нуклеиновых кислот, кодирует биспецифичную антигенсвязывающую молекулу по любому из предшествующих аспектов (например, набор, включающий две три, четыре или более выделенных нуклеиновых кислоты, кодирующих биспецифичную антигенсвязывающую молекулу по любому из предшествующих аспектов). В некоторых вариантах осуществления каждая клетка-хозяин набора содержит вектор, содержащий выделенную нуклеиновую кислоту из набора выделенных нуклеиновых кислот, при этом набор выделенных нуклеиновых кислот, кодирует биспецифичную антигенсвязывающую молекулу по любому из предшествующих аспектов (например, набор, содержащий две, три, четыре или более изолированных нуклеиновых кислот, кодирующих биспецифичную антигенсвязывающая молекулу по любому из предшествующих аспектов). В некоторых вариантах осуществления набор клеток-хозяев содержит клетки млекопитающих (например, клетки СНО). В некоторых вариантах осуществления набор клеток-хозяев содержит прокариотические клетки (например, клетки Е. coli).
В другом аспекте данное изобретение относится к способу получения биспецифичной антигенсвязывающей молекулы по любому из предшествующих аспектов, причем способ включает культивирование набора клеток-хозяев предыдущего аспекта в культуральной среде. В некоторых вариантах осуществления данного изобретения способ дополнительно включает выделение биспецифичной антигенсвязывающей молекулы из клеток-хозяев или культуральной среды.
В другом аспекте данное изобретение относится к иммуноконъюгату, содержащему биспецифичную антигенсвязывающую молекулу по любому из предшествующих аспектов и цитотоксическое средство.
В еще одном аспекте, данное изобретение относится к композиции, содержащей биспецифичные антигенсвязывающие молекулы по любому из предшествующих аспектов. В некоторых вариантах осуществления данного изобретения композиция дополнительно содержит фармацевтически приемлемое вспомогательное вещество или разбавитель. В некоторых вариантах осуществления данного изобретения композиция представляет собой фармацевтическую композицию. В некоторых вариантах осуществления данного изобретения композиция дополнительно содержит антагонист связывания оси PD-1, или дополнительный терапевтический агент.
В другом аспекте данное изобретение относится к биспецифичной антигенсвязывающей молекуле по любому из предшествующих аспектов данного изобретения для применения в качестве лекарственного средства. Например, в некоторых вариантах осуществления, биспецифичные антигенсвязывающие молекулы, описанные в данном документе, предназначены для применения при обработке или замедлении прогрессирования клеточного пролиферативного нарушения (например, рака) или аутоиммунного расстройства у субъекта, нуждающегося в этом. В некоторых вариантах осуществления биспецифичные антигенсвязывающие молекулы по любому из предшествующих аспектов, предназначены для использования в повышении иммунной функции у субъекта, имеющего клеточное пролиферативное нарушение (например, рак, например, HER2-положительный рак) или аутоиммунное нарушение.
В другом аспекте данное изобретение относится к применению биспецифичной антигенсвязывающей молекулы по любому из предшествующих аспектов, в производстве лекарственного средства для лечения или замедлений прогрессирования расстройства. В другом аспекте данное изобретение относится к применению биспецифичной антигенсвязывающей молекулы или композиции любого из предыдущих аспектов при изготовлении лекарственного средства для усиления иммунной функции у субъекта, страдающего какой-либо патологией. В некоторых вариантах осуществления расстройство представляет собой клеточное пролиферативное расстройство (например, рак, например, НЕК2-положительный рак) или аутоиммунное заболевание.
В другом аспекте данное изобретение относится к способу лечения или замедления прогрессирования какой или патологии у субъекта, нуждающегося в этом, причем способ включает введение субъекту биспецифичной антигенсвязывающей молекулы по любому из предшествующих аспектов данного изобретения. В другом аспекте данное изобретение относится к способу усиления иммунной функции у субъекта, имеющего расстройство, причем способ включает введение субъекту биспецифичной антигенсвязывающей молекулы по любому из предшествующих аспектов. В некоторых вариантах осуществления расстройство представляет собой клеточное пролиферативное расстройство (например, рак, например, HER2-положительный рак) или аутоиммунное заболевание.
В другом аспекте данное изобретение относится к способу лечения или задержки прогрессирования расстройства у субъекта, нуждающегося в этом, при этом способ включает: (а) определение экспрессии HER2 в опухолевой клетке, при этом опухолевая клетка экспрессирует HER2 в среднем количестве 200 000 или более копий на клетку; и (b) введение субъекту биспецифичной антигенсвязывающей молекулы по любому из предшествующих аспектов. В некоторых вариантах осуществления расстройство представляет собой клеточное пролиферативное расстройство (например, рак, например, HER2-положительный рак) или аутоиммунное заболевание.
В другом аспекте данное изобретение относится к способу усиления иммунной функции у субъекта, имеющего расстройство, причем способ включает: (а) определение экспрессии HER2 в опухолевой клетке, при этом опухолевая клетка экспрессирует HER2 в среднем количестве 200 000 или более копий на клетку; и (b) введение субъекту биспецифичной антигенсвязывающей молекулы по любому из предшествующих аспектов. В некоторых вариантах осуществления расстройство представляет собой клеточное пролиферативное расстройство (например, рак, например, HER2-положительный рак) или аутоиммунное заболевание.
В некоторых вариантах осуществления любого из предшествующих аспектов, рак выбран из группы, состоящей из рака молочной железы, рака желудка, колоректального рака, немелкоклеточного рака легкого, рака почки, рака мочевого пузыря, рака поджелудочной железы, рака предстательной железы, рака печени, рака головы и шеи, меланомы, рака яичников, мезотелиомы, глиобластомы, рака эндометрия и остеосаркомы. В некоторых вариантах осуществления рак является HER2-положительным раком (например, HER2-положительный рак груди, HER2-положительный рак желудка, HER2-положительный колоректальный рак, HER2-положительный немелкоклеточный рак легкого, HER2- положительный рак почки, HER2-положительный рак мочевого пузыря, HER2-положительный рак поджелудочной железы, HER2-положительный рак простаты, HER2-положительный рак печени, HER2-положительный рак головы и шеи, HER2-положительная меланома, HER2-положительный рак яичников, HER2-положительная мезотелиома, HER2-положительная глиобластома, HER2-положительный рак эндометрия, или HER2-положительная остеосаркома).
В некоторых вариантах осуществления HER2-положительный рак (например, HER2-положительный рак молочной железы, HER2-положительный рак желудка, HER2-положительный колоректальный рак, HER2-положительный немелкоклеточный рак легкого, HER2-положительный рак почки, HER2-положительный рак мочевого пузыря, HER2-положительного рак поджелудочной железы, HER2-положительный рак простаты, HER2-положительный рак печени, HER2-положительный рак головы и шеи, HER2-положительная меланома, HER2-положительный рак яичников, HER2-положительная мезотелиома, HER2-положительная глиобластома, HER2-положительный рак эндометрия, или HER2-положительная остеосаркома) характеризуются опухолевыми клетками, которые экспрессируют HER2 в количестве копий (например, среднее количество копий) по меньшей мере 200 000 на клетку (например, по меньшей мере 250 000 копий HER2 на клетку, по меньшей мере 300 000 копий HER2 на клетку, по меньшей мере 400 000 копий HER2 на клетку, по меньшей мере 500 000 копий HER2 на клетку, по меньшей мере 600 000 копий HER2 на клетку, по меньшей мере 700 000 копий HER2 на клетку, по меньшей мере 750 000 копий HER2 на клетку, по меньшей мере 800 000 копий HER2 на клетку, по меньшей мере 900 000 копий HER2 на клетку, по меньшей мере 1 000 000 копий HER2 на клетку, по меньшей мере 1 200 000 копий HER2 на клетку, по меньшей мере 1 500 000 копий HER2 на клетку, по меньшей мере 2 000 000 копий HER2 на клетку, по меньшей мере 2500 000 копий HER2 на клетку, по меньшей мере 3 000 000 копий HER2 на клетку, или более, например, от 200 000 до 3 000 000 копий HER2 на клетку, от 250 000 до 2 500 000 копий HER2 на клетку, от 300 000 до 2 000 000 копий HER2 на клетку, от 400 000 до 1 500 000 копий HER2 на клетку, или от 500 000 до 1 000 000 копий HER2 на клетку, например, от 200 000 до 1 000 000 копий HER2 на клетку (например, от 200 000 до 250 000 копий HER2 на клетку, от 250 000 до 300 000 копий HER2 на клетку, от 300 000 до 400 000 копий HER2 на клетку, от 400 000 до 500 000 копий HER2 на клетку, от 500 000 до 750 000 копий HER2 на клетку, или от 750 000 до 1 000 000 копий HER2 на клетку) или от 1 000 000 до 3 000 000 копий HER2 на клетку (например, от 1 000 000 до 1 500 000 копий HER2 на клетку, от 1 500 000 до 2 000 000 копий HER2 на клетку, от 2 000 000 до 2 500 000 копий HER2 на клетку, или от 2 500 000 до 3 000 000 копий HER2 на клетку).
В некоторых вариантах осуществления любого из предшествующих аспектов, биспецифичные антигенсвязывающие молекулы вводят субъекту в дозе от около 0,01 мг/кг до около 10 мг/кг (например, около от 0,1 мг/кг до около 10 мг/кг, например, от около 1 мг/кг).
В некоторых вариантах осуществления, антагонист связывания оси PD-1 и/или дополнительный терапевтический агент вводят субъекту. В некоторых вариантах осуществления данного изобретения антагонист связывания оси PD-1, или дополнительный терапевтический агент вводят до или после введения биспецифичной антигенсвязывающей молекулы. В некоторых вариантах осуществления данного изобретения антагонист связывания оси PD-1, или дополнительный терапевтический агент вводят одновременно с биспецифичной антигенсвязывающей молекулой. В некоторых вариантах осуществления, антагонист связывания оси PD-1 выбран из группы, состоящей из антагониста связывания PD-L1 (например, атезолизумаба (MPDL3280A), YW243.55.S70, MDX-1105, MEDI4736 (дурвалумаба) и MSB0010718C (авелумаба)), антагониста связывания PD-1 (например, MDX-1106 (ниволумаба), МК-3475 (пембролизумаба), СТ-011 (пидилизумаба), MEDI-0680 (AMP-514), PDR001 (спартализумаба), REGN2810 (немипилимаба), и BGB-108), а также антагониста связывания PD-L2, (например, антитела или иммуноадгезина).
В некоторых вариантах осуществления биспецифичные антигенсвязывающие молекулы вводят подкожно, внутривенно, внутримышечно, местно, перорально, трансдермально, внутрибрюшинно, интраорбитально, путем имплантации, путем ингаляции, интратекально, интравентрикулярно или интраназально. Например, в некоторых вариантах осуществления, биспецифичные антигенсвязывающие молекулы вводят подкожно. В других вариантах осуществления биспецифичные антигенсвязывающие молекулы вводят внутривенно. В некоторых вариантах осуществления любого из предшествующих аспектов субъект представляет собой человека.
В другом аспекте данное изобретение относится к набору, содержащему: (а) композицию, содержащую биспецифичные антигенсвязывающие молекулы по любому из предшествующих аспектов; и (b) листок-вкладыш, содержащий инструкции для введения композиции субъекту для лечения или задержки прогрессирования расстройства (например, клеточной пролиферативной патологии (например, рака) или аутоиммунного расстройства). В некоторых вариантах осуществления данного изобретения композиция дополнительно содержит фармацевтически приемлемое вспомогательное вещество или разбавитель.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
Фиг. 1 представляет собой иммуноблот, демонстрирующий относительную экспрессию белка HER2 клетками SKBR3 и клетками MCF7.
Фиг. 2A-2F представляют собой графики, демонстрирующие кривые доза-ответ относительного уничтожения клеток SKBR3 (открытые квадраты) и клеток MCF7 (сплошные точки) различными моновалентными HER2 TDB (IgG TDB) молекулами. Данные представлены в виде среднего значения±стандартное отклонение. Фиг. 2А представляет собой график, демонстрирующий кривые доза-ответ уничтожения клеток-мишеней с помощью антитела дикого типа 4D5 IgG TDB (трастузумаб). Фиг. 2 В представляет собой график, демонстрирующий кривые доза-ответ уничтожения клеток-мишеней с помощью варианта антитела 4D5, Y55E.Y102V-TDB. Фиг. 2С представляет собой график, демонстрирующий кривые доза-ответ уничтожения клеток-мишеней с помощью варианта антитела 4D5, Y55E.D98A.F100A.Y102V-IgG TDB. Фиг. 2D представляет собой график, демонстрирующий кривые доза-ответ уничтожения клеток-мишеней с помощью варианта антитела 4D5, D98A.F100A.Y102V-IgG TDB. Фиг. 2Е представляет собой график, демонстрирующий кривые доза-ответ уничтожения клеток-мишеней с помощью варианта антитела 4D5, H91A-IgG TDB. Фиг. 2F представляет собой график, демонстрирующий кривые доза-ответ уничтожения клеток-мишеней с помощью варианта антитела 4D5, Y100A-IgG TDB.
Фиг. 3 представляет собой схематическое изображение иллюстративного трехвалентного антитела формата 1Fab-IgG TDB. Антитело имеет бивалентное плечо с двумя анти-HER2-связывающими фрагментами и моновалентное плечо с одним анти-CD3-связывающим фрагментом.
Фиг. 4А представляет собой график, демонстрирующий кривые доза-ответ, которые измеряют связывание различных антител 1Fab-IgG TDB, по отношению к антителу дикого типа 4D5 IgG TDB к SKBR3, как и количественно с помощью проточной цитометрии. Сплошные, направленные вниз треугольники представляют антитело дикого типа 4D5 IgG TDB (трастузумаб); сплошные квадраты представляют вариант антитела 4D5, H91A-IgG TDB; сплошные направленные вверх треугольники представляют собой вариант антитела 4D5 D98A.F100A.Y102V-IgG TDB; открытые направленные вниз треугольники представляют собой вариант антитела 4D5, Y102V-IgG TDB; и открытые ромбы представляют собой вариант антитела 4D5 Y55E.Y102V-IgG TDB.
Фиг. 4В представляет собой график, демонстрирующий кривые доза-ответ измерения связывания различных антител IFab-IgG TDB, по сравнению с антителом дикого типа 4D5 IgG TDB с MCF7 с помощью проточной цитометрии. Сплошные, направленные вниз треугольники представляют антитело дикого типа 4D5 IgG TDB (трастузумаб); сплошные квадраты представляют вариант антитела 4D5, H91A-IgG TDB; сплошные направленные вверх треугольники представляют собой вариант антитела 4D5 D98A.F100A.Y102V-IgG TDB; открытые направленные вниз треугольники представляют собой вариант антитела 4D5, Y102V-IgG TDB; и открытые ромбы представляют собой вариант антитела 4D5 Y55E.Y102V-IgG TDB.
Фиг. 5А представляет собой график, демонстрирующий индукцию апоптоза в клетках SKBR3 в результате применения различных антител 1Fab-IgG TDB, по сравнению с антителом дикого типа 4D5 IgG TDB, как измерено по активности каспаз 3/7 с течением времени. Сплошные точки представляют антитело дикого типа 4D5 IgG TDB (трастузумаб); открытые квадраты представляют собой вариант антитела 4D5, H91A-IgG TDB; сплошные треугольники представляют собой вариант антитела 4D5, D98A.F100A.Y102V-IgG TDB; открытые треугольники представляют собой вариант антитела 4D5 Y102V-IgG TDB; и открытые ромбы представляют собой вариант антитела 4D5 Y55E.Y102V-IgG TDB. Данные представлены в виде среднего значения±стандартное отклонение. Фиг. 5В представляет собой график, демонстрирующий индукцию апоптоза в клетках MCF-7 в результате различных антител 1Fab-IgG TDB, по сравнению с антителом дикого типа 4D5 IgG TDB, как измерено по активности каспаз 3/7 с течением времени. Сплошные точки представляют антитело дикого типа 4D5 IgG TDB (трастузумаб); открытые квадраты представляют собой вариант антитела 4D5, H91A-IgG TDB; сплошные треугольники представляют собой вариент антитела 4D5, D98A.F100A.Y102V-IgG TDB; открытые треугольники представляют собой вариант антитела 4D5 Y102V-IgG TDB; и открытые ромбы представляют собой вариант антитела 4D5 Y55E.Y102V-IgG TDB. Данные представлены в виде среднего значения ± стандартное отклонение.
Фиг. 6А представляет собой график, демонстрирующий цитотоксичность в клетках SKBR3 в ответ на инкубацию с 50 нг/мл различных антител 1Fab-IgG TDB, по сравнению с антителом дикого типа 4D5 IgG TDB, как измерено с помощью CELLTITER-GLO® анализа. Первый столбец (на левой стороне) представляет собой антитело дикого типа 4D5 TDB (трастузумаб); второй столбец представляет собой вариант антитела 4D5, H91A-IgG TDB; третий столбец представляет собой вариант антитела 4D5 D98A.F100A.Y102V-IgG TDB; четвертый столбец представляет собой вариант антитела 4D5, Y102V-IgG TDB; и пятый столбец (справа) представляет собой вариант антитела 4D5, Y55E.Y102V-IgG TDB. Данные представлены в виде среднего значения ± стандартное отклонение.
Фиг. 6В представлен график, демонстрирующий цитотоксичность в клетках MCF- 7 в ответ на инкубации с 50 нг/мл различных антител 1Fab-IgG TDB, по сравнению с антителом дикого типа 4D5 IgG TDB, как измерено с помощью Celltiter-GLO® анализа. Первый столбик (на левой стороне) представляет собой дикий тип 4D5 TDB антитело (трастузумаб); второй столбик представляет собой вариант антитела 4D5, H91A-IgG TDB; третий столбик представляет собой антитело 4D5 вариант, D98A.F100A.Y102V-IgG TDB; четвертый столбик представляет собой вариант антитела 4D5, Y102V-IgG TDB; и пятый столбик (справа) представляет собой вариант антитела 4D5, Y55E.Y102V-IgG TDB. Данные представлены в виде среднего значения ± стандартное отклонение.
Фиг. 6С представляет собой график, демонстрирующий цитотоксичность в клетках MCF-7 в ответ на инкубации с 50 мкг/мл антител различных 1Fab-IgG TDB, по сравнению с антителом дикого типа 4D5 IgG TDB, как измерено с помощью Celltiter-GLO® анализа. Первый столбик (на левой стороне) представляет собой дикий тип 4D5 TDB антитело (трастузумаб); второй столбик представляет собой вариант антитела 4D5, H91A-IgG TDB; третий столбик представляет собой антитело 4D5 вариант, D98A.F100A.Y102V-IgG TDB; четвертый столбик представляет собой вариант антитела 4D5, Y102V-IgG TDB; и пятый столбик (справа) представляет собой вариант антитела 4D5, Y55E.Y102V-IgG TDB. Данные представлены в виде среднего значения ± стандартное отклонение.
Фиг. 7А представляет собой график, демонстрирующий кривые дозы-ответ, измерения связывания различных антител 1Fab-IgG TDB с клетками SKBR3, по сравнению с антителом дикого типа 4D5 IgG TDB (трастузумаб, сплошные треугольники) с помощью проточной цитометрии. Открытые треугольники представляют собой вариант антитела 4D5 Y55E.H91A-1Fab-IgG TDB; квадраты представляют собой вариант антитела 4D5 Y100Aa-1Fab-IgG TDB; и круги представляют собой вариант антитела 4D5, H91A.N30A-1Fab-IgG TDB.
Фиг. 7В представляет собой график, демонстрирующий кривые доза-ответ измерения связывание различных антител 1Fab-IgG TDB с клетками MCF-7, по сравнению с антителом дикого типа 4D5 IgG TDB (трастузумаб, сплошные треугольники) с помощью проточной цитометрии. Открытые треугольники представляют собой вариант антитела 4D5 Y55E.H91A-1Fab-IgG TDB; квадраты представляют собой вариант антитела 4D5 Y100Aa-1Fab-IgG TDB; и круги представляют собой вариант антитела 4D5, H91A.N30A-1Fab-IgG TDB.
Фиг. 8 представляет собой график, демонстрирующий кривые доза-ответ измерения цитотоксичности различных антител 1Fab-IgG TDB по отношению к клетками SKBR3, как измерено с помощью Celltiter-GLO® анализа. Открытые квадраты представляют вариант антитела 4D5 H91A-1Fab-IgG TDB; сплошные квадраты представляют вариант антитела 4D5 Y100Aa-1Fab-IgG TDB; и круги представляют вариант антитела 4D5, H91A.N30A-1Fab-IgG TDB. Данные представлены в виде среднего значения ± стандартное отклонение. Фиг. 9 представляет собой график, демонстрирующий кривые доза-ответ, сравнивающий цитотоксичность антитела4 IgG TDB относительно антител 4D5 H91A-1Fab-IgG TDB. Цитотоксичность, индуцированная антителом 4D5 IgG TDB в клетках SKBR3 и клетках MCF7 представлена сплошными кругами и сплошными квадратами, соответственно. Цитотоксичность, индуцированная антителами 4D5 H91A-1Fab-IgG TDB в клетках SKBR3 и клетках MCF7 представлена открытыми треугольниками и открытыми квадратами, соответственно. Данные представлены в виде среднего значения ± стандартное отклонение.
Фиг. 10 представляет собой график, демонстрирующий результаты анализа сиквенирования РНК экспрессии ErbB2 РНК в 90 раковых клеточных линиях молочной железы. Клеточные линии были классифицированы, как клеточные линии имеющие низкую экспрессию ErbB2, среднюю экспрессию ErbB2 и высокую экспрессию ErbB2.
Фиг. 11А представляет собой график, демонстрирующий цитотоксичность 4D5 IgG TDB антител в концентрации 50 нг/мл на клеточных линиях с низкой экспрессией ErbB2 (MDA-MB-436, РСЗ, MCF7/neo-CL3, MDA-MB-231, LS1034, и НТ55), на клеточных линиях со средней экспрессией ErbB2 (MDA-MB-453, MDA-MB-175-VII, JIMT-1, и MKN7), и на клеточных линиях с высокой экспрессией ErbB2 (MDA-MB-361, SKBR3, ВТ474-М1, SK-OV-3 и KPL4). Данные представлены в виде среднего значения ± стандартное отклонение.
Фиг. 11В представлен график, демонстрирующий цитотоксичность 4D5 IgG TDB антител в концентрации 50 мкг/мл на клеточных линиях с низкой экспрессией ErbB2 (MDA-MB-436, РС3, MCF7/neo-CL3, MDA-MB-231, LS1034, и НТ55), на клеточных линиях со средней экспрессией ErbB2 (MDA-MB-453, MDA-MB-175-VII, JIMT-1, и MKN7), и на клеточных линиях с высокой экспрессией ErbB2 (MDA-MB-361, SKBR3, ВТ474-М1, SK-OV-3 и KPL4). Данные представлены в виде среднего значения ± стандартное отклонение.
Фиг. 11С представляет собой график, демонстрирующий влияние антител 4D5 TDB при концентрации 50 нг/мл на активацию CD8+ Т-клеток человека, которые культивировали с клеточными линиями с низкой экспрессией ErbB2 (MDA-MB-436, РС3, MCF7/neo-CL3, MDA-MB-231, LS1034, и НТ55), с клеточными линиями с средней экспрессией ErbB2 (MDA-MB-453, MDA-MB-175-VII, JIMT-1, и MKN7), и с клеточными линиями с высокой экспрессией ErbB2 (MDA-MB-361, SKBR3, ВТ474-М1, SK-OV-3 и KPL4). Активацию Т-клеток измеряли по двойной экспрессии CD69 и CD45. Данные представлены в виде среднего значения ± стандартное отклонение.
Фиг. 11D представляет собой иммуноблот, демонстрирующий экспрессию белка HER2 каждой из клеточных линий, представленных на фиг. 11А-11С.
Фиг. 12А представляет собой график, демонстрирующий цитотоксичность 4D5 H91A-1Fab-IgG TDB антител в концентрации 50 нг/мл на клеточных линиях с низкой экспрессией ErbB2 (MDA-MB-436, РС3, MCF7/neo-CL3, MDA-MB-231, LS1034, и НТ55), на клеточных линиях со средней экспрессией ErbB2 (MDA-MB- 453, MDA-MB-175-VII, ЛМТ-1, и MKN7), и на клеточных линиях с высокой экспрессией ErbB2 (MDA-MB-361, SKBR3, ВТ474-М1, SK-OV-3 и KPL4). Данные представлены в виде среднего значения ± стандартное отклонение.
Фиг. 12В представляет собой график, демонстрирующий цитотоксичность 4D5 Н91 A-1Fab-IgG TDB1Fab-IgG TDB антител в концентрации 50 мкг/мл на клеточных линиях с низкой экспрессией ErbB2 (MDA-MB-436, РСЗ, MCF7/neo-CL3, MDA-MB-231, LS1034, и НТ55), на клеточных линиях со средней экспрессией ErbB2 (MDA-MB-453, MDA-MB-175-VII, ЛМТ-1, и MKN7), и на клеточных линиях с высокой экспрессией ErbB2 (MDA-MB-361, SKBR3, ВТ474-M1, SK-OV-3 и KPL4). Данные представлены в виде среднего значения ± стандартное отклонение.
Фиг. 12С представляет собой график, демонстрирующий эффект антител 4D5 H91A-1Fab-IgG TDB при концентрации 50 нг/мл на активацию CD8+ Т-клеток человека, которые культивировали с клеточными линиями с низкой экспрессией ErbB2 (MDA-MB-436, РС3, MCF7/neo-CL3, MDA-MB-231, LS1034, и НТ55), с клеточными линиями с средней экспрессией ErbB2 (MDA-MB-453, MDA-MB-175-VII, ЛМТ-1, и MKN7), и с клеточными линиями с высокой экспрессией ErbB2 (MDA-MB-361, SKBR3, ВТ474-М1, SK-OV-3 и KPL4). Активацию Т-клеток измеряли по двойной экспрессии CD69 и CD45. Данные представлены в виде среднего значения ± стандартное отклонение.
Фиг. 12D представляет собой иммуноблот, демонстрирующий экспрессию белка HER2 каждой из клеточных линий, представленных на фиг. 12А-12С. Фиг. 13 представляет собой график, демонстрирующий кривые доза-ответ измерения цитотоксичности антител 4D5 H91A-IgG TDB (квадраты) и антител 4D5 H91A-1Fab-IgG TDB (кружки) на HBL-100 клетках.
Фиг. 14А представляет собой график, демонстрирующий кривые доза-ответ измерения цитотоксичности различных концентраций антител 4D5 H91A-IgG TDB на HBL-100 клетках с течением времени. Сплошные кружки представляют дозу 5000 нг/мл 4D5 H91A-IgG TDB, открытые квадраты представляют дозу 500 нг/мл 4D5 H91A-IgG TDB, сплошные направленные вверх треугольники представляют в дозе 50 нг/мл 4D5 H91A-IgG TDB, открытые направленные вниз треугольники представляют дозу 5 нг/мл 4D5 H91A-IgG TDB, открытые ромбы представляют дозу 0,5 нг/мл 4D5 H91A-IgG TDB и сплошные ромбы представляют собой необработанный контроль.
Фиг. 14В представляет собой график, демонстрирующий кривые доза-ответ измерения цитотоксичности различных концентраций антител 4D5 H91A-1Fab-IgG TDB на HBL-100 клетках с течением времени. Сплошные кружки представляют дозу 5000 нг/мл 4D5 H91A-1Fab-IgG TDB, открытые квадраты представляют дозу 500 нг/мл 4D5 Н91А-1Fab-IgG TDB, сплошные направленные вверх треугольники представляют дозу 50 нг/мл 4D5 H91A-1Fab-IgG TDB, открытые направленный вниз треугольники представляют дозу 5 нг/мл 4D5 Н91А-1Fab-IgG TDB, открытые ромбы представляют дозу 0,5 нг/мл 4D5 Н91А-1Fab-IgG TDB и сплошные ромбы представляют необработанный контроль. Фиг. 15А представляет собой набор графиков, демонстрирующих эффект уничтожения 4D5 H91A-IgG TDB и 4D5 H91A-1Fab-IgG TDB на клеточных линиях, экспрессирующих возрастающее количество HER2, слева направо, как продемонстрировано на нижележащих иммуноблоте и графике.
Фиг. 15В представляет собой серию микрофотографий, демонстрирующих результаты IHC и FISH анализов обнаружения относительной экспрессии HER2.
Фиг. 15С представляет собой график, демонстрирующий уничтожение клеток, охарактеризованных на фиг. 15В с помощью 4D5 H91A-1Fab-IgG TDB.
Фиг. 16 представляет собой иммуноблот, демонстрирующий экспрессию белка HER2 в клетках MCF7, клетках НТ55 и HER2-амплифицированных клетках KPL4.
Фиг. 17 представляет собой решетчатый график, демонстрирующий объем опухоли KPL4 в течении курса обработки различными дозами антител 4D5 Н91А-1Fab-IgG TDB или антител дикого типа 4D5 TDB мышей с добавлением человеческих МКПК. Мыши с развитыми опухолями KPL4 получали однократную внутривенную дозу в день 0 в указанных дозах. Каждая панель в решетке изображает одну группу дозы, как указано в заголовке панели. Жирные, сплошные черные линии представляют собой аппроксимированный объем опухоли для каждой группы дозы. Пунктирные жирные линии представляют аппроксимированный объем опухоли для контрольной группы, которая получала гистидин буфер-носитель. Пунктирные линии с открытыми кружками представляют собой отдельные животное. Сплошные линии со сплошными точками представляют животных, которые были удалены из исследования. Пунктирные горизонтальные серые линии отмечают объем опухоли 500 мм3.
Фиг. 18 представляет собой решетчатый график, демонстрирующий объем опухоли НТ55 в ходе обработки различными дозами антител 4D5 H91A-1Fab-IgG TDB или антител дикого типа 4D5 IgG TDB у мышей с добавлением человеческих МКПК. Мыши с развитыми опухолями НТ55 получали однократную внутривенную дозу в день 0 в указанных дозах. Каждая панель в решетке изображает одну группу дозы, как указано в заголовке панели. Жирные, сплошные черные линии представляют собой аппроксимированный объем опухоли для каждой группы дозы. Пунктирные жирные линии представляют аппроксимированный объем опухоли для контрольной группы, которая получала гистидин буфер-носитель. Пунктирные линии с открытыми кружками представляют собой отдельных животных. Сплошные линии со сплошными точками представляют животных, которые были удалены из исследования. Пунктирные горизонтальные серые линии отмечают объем опухоли 500 мм3,
Фиг. 19 представляет собой решетчатый график, демонстрирующий объем опухоли KPL4 в ходе курса обработки различными дозами антител 4D5 D98A.F100A.Y102V-1Fab-IgG TDB или антител дикого типа 4D5 IgG TDB в мышах с добавлением человеческих МКПК. Мыши с развитыми опухолями KPL4 получали однократную внутривенную дозу в день 0 в указанных дозах. Каждая панель в решетке изображает одну группу дозы, как указано в заголовке панели. Жирные, сплошные черные линии представляют собой аппроксимированный объем опухоли для каждой группы дозы. Пунктирные жирные линии представляют аппроксимированный объем опухоли для контрольной группы, которая получала гистидин буфер-носитель. Пунктирные линии с открытыми кружками представляют собой отдельные животное. Сплошные линии со сплошными точками представляют животных, которые были удалены из исследования. Пунктирные горизонтальные красные линии отмечают объем опухоли 500 мм3,
Фиг. 20 представляет собой график, демонстрирующий кривые доза-ответ измерения цитотоксичности антител 4D5 H91A-1Fab-IgG TDB (сплошные кружки) и антител 4D5 D98A.F100A.Y102V-1Fab-IgG TDB (открытые квадраты) на клетках SKBR3. Данные представлены в виде среднего значения ± стандартное отклонение.
Фиг. 21А представляет собой график, демонстрирующий уничтожение с помощью антител 4D5 H91A-1Fab-IgG TDB клеточных линий экспрессирующих высокий уровень HER2 (n=20). Клеточные линии, экспрессирующие высокий уровень HER2, характеризуются высокой экспрессией Erb2 РНК. Данные представлены в виде среднего значения ± стандартное отклонение.
Фиг. 21В представляет собой график, демонстрирующий уничтожение с помощью антител 4D5 D98A.F100A.Y102V-1Fab-IgG TDB клеточных линий экспрессирующих высокий уровень HER2 (n=20). Клеточные линии, экспрессирующие высокий уровень HER2, характеризуются высокой экспрессией Erb2 РНК. Данные представлены в виде среднего значения ± стандартное отклонение.
Фиг. 22 представляет собой график, демонстрирующий относительную активность уничтожения клеточных линий экспрессирующих высокий уровень HER2 с помощью антител 4D5 D98A.F100.Y102V-1Fab-IgG TDB по сравнению к антителам 4D5 H91A-1Fab-IgG TDB. Данные получены из фиг. 20А и 20В.
Фиг. 23А представляет собой график, демонстрирующий уничтожение с помощью антител 4D5 H91A-1Fab-IgG TDB клеточных линий, экспрессирующих средний уровень HER2 (n=12). Уничтожение клеток SKBR3 дано в качестве положительного контроля. Клеточные линии, экспрессирующие средний уровень HER2, характеризуются средней экспрессией Erb2 РНК. Данные представлены в виде среднего значения ± стандартное отклонение.
Фиг. 23В представляет собой график, демонстрирующий уничтожение с помощью антител 4D5 D98A.F100A.Y102V-1Fab-IgG TDB клеточных линий, экспрессирующих средний уровень HER2 (n=12). Уничтожение клеток SKBR3 дано в качестве положительного контроля. Клеточные линии, экспрессирующие средний уровень HER2, характеризуются средней экспрессией Erb2 РНК. Данные представлены в виде среднего значения ± стандартное отклонение.
Фиг. 24 представляет собой график, демонстрирующий относительную эффективность уничтожения клеточных линий, экспрессирующих средний уровень HER2 с помощью антител 4D5 D98A.F100.Y102V-1Fab-IgG TDB по сравнению с антителами 4D5 H91A-1Fab-IgG TDB. Данные получены из фиг. 22А и 22В.
Фиг. 25А представляет собой график, демонстрирующий уничтожение с помощью антител 4D5 H91A-1Fab-IgG TDB клеточных линий, экспрессирующих низкий уровень HER2 (n=12). Уничтожение клеток SKBR3 дано в качестве положительного контроля. Клеточные линии, экспрессирующие низкий уровень HER2, характеризуются низкой экспрессии Erb2 РНК. Данные представлены в виде среднего значения ± стандартное отклонение.
Фиг. 25В представляет собой график, демонстрирующий уничтожение с помощью антител 4D5 D98A.F100A. Y102V-1Fab-IgG TDB клеточных линий, экспрессирующих низкий уровень HER2 (n=12). Уничтожение клеток SKBR3 дано в качестве положительного контроля. Клеточные линии, экспрессирующие низкий уровень HER2, характеризуются низкой экспрессии Erb2 РНК. Данные представлены в виде среднего значения ± стандартное отклонение.
Фиг. 26 представляет собой график, демонстрирующий относительную активность уничтожения клеточных линий, экспрессирующих низкий уровень HER2 с помощью антител 4D5 D98A.F100.Y102V-1Fab-IgG TDB по сравнению с антителами 4D5 H91A-1Fab-IgG TDB. Данные получены из фиг. 24А и 24В.
Фиг. 27А представляет собой схематическое изображение, демонстрирующее положение и последовательности двух пептидных линкеров испытанных на фиг. 27В. Каждый пептидный линкер соединяет С-конец константной области тяжелой цепи (СН) дистального Fab с N-концом вариабельной области тяжелой цепи (VH) проксимального Fab. DKTHTGGGGSGG (SEQ ID NO: 52) представлена открытыми квадратами и DKTHT (SEQ ID NO: 50) представлена сплошными кругами, на фиг. 27В.
Фиг. 27В представляет собой график, демонстрирующий кривые доза-ответ измерения связывания с MCF7 клетками антител 4D5 H91A-1Fab-IgG TDB, имеющих DKTHTGGGGSGG линкер (открытые квадраты), по сравнению с антителами 4D5 H91A-1Fab-IgG TDB, которые имеют DKTHT линкер (сплошные кружки). Данные представлены в виде среднего значения ± стандартное отклонение.
Фиг. 27С представляет собой график, демонстрирующий кривые измерения уничтожения клеток SKBR3 с помощью антител 4D5 H91A-1Fab-IgG TDB, имеющих DKTHTGGGGSGG линкер (открытые квадраты), по сравнению с антителами 4D5 H91A-1Fab-IgG TDB, имеющими DKTHT линкер (сплошные кружки). Данные представлены в виде среднего значения ± стандартное отклонение.
Фиг. 28А представляет собой серию иммуноблотов, демонстрирующих эффект анти-HER2-CD3 1Fab-IgG на экспрессию pAKTS473 и pHER3 SKBR3 клетками с течением времени.
Фиг. 28В представляет график, демонстрирующий кривые доза-ответ измерения количества живых клеток SKBR3 в ответ на обработку с помощью анти-HER2-CD3 1Fab-IgG, анти-HER2-CD3 IgG TDB и трастузумабом.
Фиг. 29А представляет собой сенсограмму, демонстрирующую кинетику связывания Fab 4D5 дикого типа непосредственно с иммобилизованным человеческим HER2 (внеклеточный домен; Novus Biologicals), как измерено с использованием Biacore® поверхностного плазмонного резонанса. Образцы Fab 4D5 дикого типа варьировали в концентрации от 0,27 нМ до 200 нМ, в 3-кратном разбавлении.
Фиг. 29В представляет собой сенсограмму, демонстрирующую кинетику связывания 4D5 Y55E. Y102V-Fab непосредственно с иммобилизованным человеческим HER2 (внеклеточный домен; Novus Biologicals), как измерено с использованием Biacore® поверхностного плазмонного резонанса. Образцы 4D5 Y55E.Y102V-Fab варьировали в концентрации от 0,27 нМ до 200 нМ, в 3-кратном разбавлении.
Фиг. 29С представляет собой сенсограмму, демонстрирующую кинетику связывания 4D5 D98A.F100A.Y102V-Fab непосредственно с иммобилизованным человеческим HER2 (внеклеточного домена; Novus Biologicals), как измерено с использованием Biacore® поверхностного плазмонного резонанса. Образцы 4D5 D98A.F100A.Y102V-Fab варьировали в концентрации от 0,27 нМ до 200 нМ, в 3- кратном разбавлении.
Фиг. 29D представляет собой сенсограмму, демонстрирующую кинетику связывания 4D5 H91A-Fab непосредственно с иммобилизованным человеческим HER2 (внеклеточный домен; Novus Biologicals), как измерено с использованием Biacore® поверхностного плазмонного резонанса. Образцы 4D5 H91A-Fab варьировали в концентрации от 0,27 нМ до 200 нМ, в 3-кратном разбавлении.
Фиг. 30А представляет собой сенсограмму, демонстрирующую кинетику связывания 4D5 N30S-Fab непосредственно с иммобилизованным человеческим HER2 (внеклеточный домен; Novus Biologicals), как измерено с использованием Biacore® поверхностного плазмонного резонанса. Образцы 4D5 N30S-Fab варьировали в концентрации от 0,27 нМ до 200 нМ, в 3-кратном разбавлении.
Фиг. 30В представляет собой сенсограмму, демонстрирующую кинетику связывания 4D5 N54E.D98T-Fab непосредственно с иммобилизованным человеческим HER2 (внеклеточный домен; Novus Biologicals), как измерено с использованием Biacore® поверхностного плазмонного резонанса. Образцы 4D5 N54E.D98T-Fab варьировали в концентрации от 0,27 нМ до 200 нМ, в 3-кратном разбавлении.
Фиг. 30С представляет собой сенсограмму, демонстрирующую кинетику связывания 4D5 N30S.N54E.D98T-Fab непосредственно с иммобилизованным человеческим HER2 (внеклеточного домена; Novus Biologicals), как измерено с использованием Biacore® поверхностного плазмонного резонанса. Образцы 4D5 N30S.N54E.D98T-Fab варьировали в концентрации от 0,27 нМ до 200 нМ, в 3- кратном разбавлении.
Фиг. 31А представляет собой сенсограмму, демонстрирующую кинетику связывания 4D5 N30S. Y55E.N54E.D98T. Y102V-Fab непосредственно с иммобилизованным человеческим HER2 (внеклеточный домен; Novus Biologicals), как измерено с использованием Biacore® поверхностного плазмонного резонанса. Образцы 4D5 N30S.Y55E.N54E.D98T.Y102V-Fab варьировали в концентрации от 0,27 нМ до 200 нМ, в 3-кратном разбавлении.
Фиг. 31В представляет собой сенсограмму, демонстрирующую кинетику связывания 4D5 N30S.N54E.D98T.F100A. Y102V-Fab непосредственно с иммобилизованным человеческим HER2 (внеклеточный домен; Novus Biologicals), как измерено с использованием Biacore® поверхностного плазмонного резонанса. Образцы 4D5 N30S.N54E.D98T.F100A.Y102V-Fab варьировали в концентрации от 0,27 нМ до 200 нМ, в 3-кратном разбавлении.
Фиг. 31С представляет собой сенсограмму, демонстрирующую кинетику связывания 4D5 N30S.H91A.N54E.D98T-Fab непосредственно с иммобилизованным человеческим HER2 (внеклеточного домена; Novus Biologicals), как измерено с использованием Biacore® поверхностного плазмонного резонанса. Образцы 4D5 N30S.H91A.N54E.D98T-Fab варьировали в концентрации от 0,27 нМ до 200 нМ, в 3-кратном разбавлении.
Фиг. 32А-32K представляют собой серию сенсограмм, демонстрирующих кинетику связывания антител 4D5 IgG TDB с человеческим HER2, как измерено с использованием Biacore® поверхностного плазмонного резонанса. Фиг. 32А представляет собой сенсограмму, демонстрирующую кинетику связывания 4D5 IgG TDB дикого типа; Фиг. 32В представляет собой сенсограмму, демонстрирующую кинетику связывания 4D5 H91A-IgG TDB; Фиг. 32С представляет собой сенсограмму, демонстрирующую кинетику связывания 4D5 Y55E.H91A-IgG TDB; Фиг. 32D представляет собой сенсограмму, демонстрирующую кинетику связывания 4D5 Y55E.D98A.F100A.Y102V-IgG TDB; Фиг. 32Е представляет собой сенсограмму, демонстрирующую кинетику связывания 4D5 D98A.F100A.Y102V-IgG TDB; Фиг. 32F представляет собой сенсограмму, демонстрирующую кинетику связывания 4D5 H91A.D98A.F100A.Y102V-IgG TDB; Фиг. 32G представляет собой сенсограмму, демонстрирующую кинетику связывания 4D5 Y55E.H91A.D98A.F100A.Y102V-IgG TDB; Фиг. 32Н представляет собой сенсограмму, демонстрирующую кинетику связывания 4D5 Y55E.Y102V-IgG TDB; Фиг. 32I представляет собой сенсограмму, демонстрирующую кинетику связывания 4D5 Y102V-IgG TDB; фиг. 32J представляет собой сенсограмму, демонстрирующую кинетику связывания 4D5 Н91 A.Y102V-IgG TDB; и фиг. 32K представляет собой сенсограмму, демонстрирующую кинетику связывания 4D5 Y55E.H91A.Y102V-IgG TDB.
Фиг. 33А представляет собой график, демонстрирующий кривые доза-ответ измерения уничтожения клеток SKBR3 с помощью антител 4D5 Y55E.H91A.N54E.D98T.Y102V-1Fab-IgG TDB (лот 1) (открытые квадраты); антител 4D5 Y55E.H91A.N54E.D98T-1Fab-IgG TDB (сплошные квадраты); антител 4D5 Y55E.H91A.N54E.D98T.Y102V-1Fab-IgG TDB (лот 2) (открытые направленные вниз треугольники); или антител 4D5 H91A-1Fab-IgG TDB (сплошные, направленные вверх треугольники).
Фиг. 33В представляет собой график, демонстрирующий кривые доза-ответ измерения уничтожения клеток MCF7 с помощью антител 4D5 Y55E.H91A.N54E.D98T.Y102V-1Fab-IgG TDB (лот 1) (открытые квадраты); антител 4D5 Y55E.H91A.N54E.D98T-1Fab-IgG TDB (сплошные квадраты); антител 4D5 Y55E.H91A.N54E.D98T.Y102V-1Fab-IgG TDB (лот 2) (открытые, направленные вниз треугольники); или антител 4D5 H91A-1Fab-IgG-антитело TDB (сплошные, направленные вверх треугольники).
Фиг. 34А представляет собой график, демонстрирующий кривые доза-ответ измерения связывания различных 1Fab-IgG TDB вариантова с клетками SKBR8, как измерено с помощью проточной цитометрии. Открытые квадраты представляют антитела 4D5 Y55E.H91A.N54E.D98T.Y102V-1Fab-IgG TDB (лот 1); сплошные квадраты представляют антитела 4D5 Y55E.H91A.N54E.D98T-1Fab-IgG TDB; открытые, направленные вниз треугольники представляют антитела 4D5 Y55E.H91A.N54E.D98T.Y102V-1Fab-IgG TDB (лот 2); и сплошные направленные вверх треугольники представляют антитела 4D5 H91A-1Fab-IgG TDB.
Фиг. 34В представляет собой график, демонстрирующий кривые доза-ответ измерения связывания различных 1Fab-IgG TDB вариантов с клетками MCF7, как измерено с помощью проточной цитометрии. Открытые квадраты представляют антитела 4D5 Y55E.H91A.N54E.D98T.Y102V-1Fab-IgG TDB (лот 1); сплошные квадраты представляют антитела 4D5 Y55E.H91A.N54E.D98T-1Fab-IgG TDB; открытые, направленные вниз треугольники представляют антитела 4D5 Y55E.H91A.N54E.D98T.Y102V-1Fab-IgG TDB (лот 2); и сплошные направленные вверх треугольники представляют антитела 4D5 H91A-1Fab-IgG TDB.
Фиг. 35А представляет собой схематическое изображение, демонстрирующее связывание и активность анти-HER2-CD3 IgG TDB с высокой аффинностью моновалентного связывания.
Фиг. 35В представляет собой схематическое изображение, демонстрирующее связывание и активность анти-HER2-CD3 IgG TDB с низкой аффинностью моновалентного связывания.
Фиг. 35С представляет собой схематическое изображение, демонстрирующее, что бивалентное HER2 связывание с соответствующей аффинностью (моновалентная KD 20-50 нМ) приводит к высокому уровню связывания с HER2-избыточно-экспрессирующими клетками за счет авидности анти-HER2-CD3 1Fab-IgG TDB.
Фиг. 36 демонстрирует кристаллическую структуру внеклеточного домена (ECD - extracellular domain) HER2 с выделением областей, с которыми связываются различные антитела к HER2.
Фиг. 37 представляет собой график, демонстрирующий кривые доза-ответ измерения уничтожения клеток-мишеней SKBR3 с помощью 38E4vl 4D5-H91A 1Fab-IgG TDB (открытые кружки); клеток-мишеней SKBR3 с помощью 40G5c 4D5-H91A 1Fab-IgG TDB (сплошные кружки); клеток-мишеней MCF7 с помощью 38E4vl 4D5-H91A 1Fab-IgG TDB (открытые квадраты); и клеток-мишеней MCF7 с помощью 40G5c 4D5-H91A 1Fab-IgG TDB (сплошные квадраты).
Фиг. 38А представляет собой график, демонстрирующий уровень 4D5 Н91А 1Fab-IgG TDB и 4D5 IgG TDB-индуцированной HER2 независимой активации Т-клеток, как испытанного в присутствии и в отсутствие HER2 экспрессирующих клеток.
Фиг. 38В представляет собой график, демонстрирующий уровень 4D5 Н91А 1Fab-IgG TDB и 4D5 IgG TDB-индуцированной HER2 независимой активации Т-клеток при испытании в присутствии и в отсутствие бивалентных анти-CD3 ОКТ3
Фиг. 38С представляет собой серию графиков, демонстрирующих маркеры крови для воспаления (С-реактивный белок; СРБ), активации Т-клеток (синдром скопления лейкоцитов по краю участка воспаления (lymphocyte margination)), а также повреждение печени (аланин и аспартат аминотрансферазы; АЛТ и ACT), как измерено через два дня и восемь дней после введения яванским макакам дозы Н91А 1Fab-IgG TDB или контроля-носителя.
Фиг. 38D представляет собой график и сводную таблицу, демонстрирующую параметры ФК, измеренные с помощью ИФА с макак вводили Н91А 1Fab-IgG TDB при 20 мг/кг и 3 мг/кг дозы.
Фиг. 38Е представляет собой график, демонстрирующий уровни Н91А 1Fab-IgG TDB в сыворотке яванского макака через 7 дней и 14 дней после введения дозы, которым вводили МКПК здорового донора и SKBR3 клетки в течение 24 часов с использованием, указанных разведений. Параллельные эксперименты проводились с использованием разведений свежего 4D5-H91A 1Fab-IgG TDB (контроль).
Фиг. 39 представляет собой диаграмму, демонстрирующую влияние различных аминокислотных замен на аффинность связывания Fab-вариантов анти-HER2 4D5.
ПОДРОБНОЕ ОПИСАНИЕ ВАРИАНТОВ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
I. ОПРЕДЕЛЕНИЯ
Термин "около", используемый в данном документе, относится к обычному диапазону ошибок для соответствующего значения и хорошо известному специалисту в данной области техники. В данном документе применение "около» по отношению к величине или параметру включает (и описывает) варианты осуществления, которые относятся непосредственно к этой величине или параметру.
"Аффинность" относится к силе суммы всех нековалентных взаимодействий между одиночным сайтом связывания молекулы (например, антитела) и ее партнера по связыванию (например, антигена). Если не указано иное, в данном документе "аффинность связывания" относится к присущей молекуле аффинности связывания, отражающей взаимодействие между членами пары связывающихся компонентов (например, антителом и антигеном) при их соотношении 1:1. Аффинность молекулы X к ее партнеру Y в целом можно выразить в виде константы диссоциации (KD). Аффинность может быть измерена с помощью общепринятых способов, известных в данной области техники, включая те, которые описаны в данном документе. Конкретные иллюстративные и примерные варианты осуществления для измерения аффинности связывания описаны ниже. Как использовано в данном описании, термин «специфично связывается с» или «специфичный к», как используется в данном документе, относится к измеряемым и воспроизводимым взаимодействиям, таким как связывание между мишенью и антителом, которые определяющими для присутствия мишени в присутствии гетерогенной популяции молекул, включая биологические молекулы. Например, антитело, которое специфично связывается с мишенью (которая может быть эпитопом) представляет собой антитело, которое связывает эту мишень с большей аффинностью, авидностью, легче и/или с большей продолжительностью, чем оно связывается с другими мишенями. В одном варианте осуществления данного изобретения степень связывания антитела с неспецифичной мишенью составляет менее чем около 10% связывания антитела с мишенью при измерении, например, с помощью радиоиммуннологического анализа (РИА). В некоторых вариантах осуществления антитело, которое специфично связывается с мишенью имеет константу равновесной диссоциации (KD) ≤1 мкМ, ≤100 нМ, ≤10 нМ, ≤1 нМ или ≤0,1 нМ. Согласно определенным вариантам осуществления данного изобретения антитело специфично связывается с эпитопом на белке, который является консервативным в указанном белке из разных видов. В другом варианте специфичнуюкое связывание может включать, но не требует эксклюзивного связывания.
Термин «антитело» в данном документе используется в самом широком смысле и включает различные структуры антител, включая моноклональные антитела, поликлональные антитела, полиспецифичные антитела (например, биспецифичные антитела) и фрагменты антител, при условии, что они проявляют желательную антигенсвязывающую активность, но не ограничивается ими. «Фрагмент антитела» относится к молекуле, отличной от интактного антитела, которая содержит часть интактного антитела, которая связывает антигеном, с которым связывается интактное антитело. Примеры фрагментов антител включают Fv, Fab, Fab', Fab'-SH, F(ab')2-фрагменты; диатела; линейные антитела; молекулы одноцепочечных антител (например, scFv); и полиспецифичнуюкие антитела, образованные из фрагментов антител, но не ограничиваются ими. Под «связывающим доменом» подразумевается часть соединения или молекулы, которая специфично связывается с целевым эпитопом, антигеном, лигандом или рецептором. Связывающие домены включают, но не ограничиваются этим, антитела (например, моноклональные, поликлональные, рекомбинантные, гуманизированные и химерные антитела), фрагменты антител или их части (например, Fab-фрагменты, F(ab')2, scFv-антитела, SMIP, доменные антитела, диатела, минитела, scFv-Fc, аффитела, нанотела и VH- и/или VL-домены антител), рецепторы, лиганды, аптамеры и другие молекулы, имеющие определенного партнера по связыванию. «Аффинно-созревшее антитело» относится к антителу с одним или более изменениями в одном или более гипервариабельных участках (HVR) по сравнению с исходным антителом, которое не содержит такие изменения, при этом такие изменения приводят к улучшению аффинности антитела в отношении антигена.
Как использовано в данном описании, термин «моновалентный», например, в контексте моновалентного плеча биспецифичной антигенсвязывающей молекулы, относится к молекуле или ее части (например, части антигенсвязывающей молекулы, например, одному из двух плеч биспецифичной антигенсвязывающей молекулы), которые имеют единственный антигенсвязывающий фрагмент. Таким образом, моновалентная молекула или ее часть способна специфично связываться только с одним антигеном. «Аффинность моновалентного связывания» или «моновалентная KD» одного из двух антигенсвязывающих фрагментов бивалентного плеча биспецифичного антитела (например, один из HER2 антигенсвязывающих фрагментов в 1Fab-IgG TDB) относится к аффинности связывания антигенсвязывающего фрагмента в моновалентной форме, то есть, в качестве моновалентного плеча биспецифичного антитела, способного специфично связываться с двумя различными антигенами или в качестве молекулы Fab.
Как использовано в данном описании, термин «бивалентный», например, в контексте бивалентного плеча биспецифичной антигенсвязывающей молекулы, относится к молекуле или ее части (например, часть антигенсвязывающей молекулы, например, одному из двух плеч биспецифичной антигенсвязывающей молекулы), которые имеют только два антигенсвязывающих фрагмента, каждый из которых способен специфично связываться с антигеном. Таким образом, бивалентная молекула или ее часть способна специфично связываться с двумя антигенами или двумя различными эпитопами на одном и том же антигене (например, двумя HER2-антигенами, экспрессированными на поверхности одной клетки опухоли).
Употребляемый в данном документе термин «кластер дифференцировки 3» или «CD3» относится, если не указано иное, к любому нативному CD3 из любого источника, относящегося к позвоночным, включая млекопитающих, таких как приматы (например, люди) и грызуны (например, мыши и крысы), включая, например, цепи CD3ε, CD3γ, CD3α и CD3β. Данный термин включает «полноразмерный» непроцессированный CD3 (например, непроцессированный или немодифицированный CD3ε или CD3γ), а также любую форму CD3, которая образуется в результате процессинга в клетке. Данный термин также включает варианты CD3 природного происхождения, включая, например, сплайсинговые варианты или аллельные варианты. CD3 включает, например, человеческий белок CD3ε (NCBI RefSeq No. NP 000724), длина которого составляет 207 аминокислот, и человеческий белок CD3γ (NCBI RefSeq No. NP 000064), длина которого составляет 182 аминокислоты.
Термины «антитело против CD3» и «антитело, которое связывается с CD3» относятся к антителу, которое способно связывать CD3 с достаточной аффинностью, чтобы антитело можно было применять в качестве диагностического и/или терапевтического агента для нацеливания на CD3. В одном варианте осуществления данного изобретения степень связывания антитела против CD3 с неродственным, не являющимся CD3 белком составляет менее чем около 10% от связывания антитела с CD3 согласно данным, например, радиоиммуноанализа (РИА). В некоторых вариантах осуществления данного изобретения антитело, которое связывается с CD3, имеет константу диссоциации (KD) ≤ 1 мкМ, ≤100 нМ, ≤10 нМ, ≤1 нМ, ≤0,1 нМ, ≤0,01 нМ, или ≤0,001 нМ (например, 10-8 М или менее, например, от 10-8 М до 10-13 М, например, от 10-9 М до 10-13 М). В определенных вариантах осуществления данного изобретения антитело против CD3 связывается с эпитопом CD3, который является консервативным для CD3 из разных видов.
В данном документе термин «Fc-область» или «Fc-домен» используется для определения С-концевой области тяжелой цепи иммуноглобулина, которая содержит по меньшей мере часть константной области. Термин включает Fc-области с нативной последовательностью и варианты Fc-областей. В одном варианте осуществления данного изобретения Fc-область тяжелой цепи человеческого IgG находится в пределах от Cys226 или от Pro230 до карбоксильного конца тяжелой цепи. Однако С-концевой лизин (Lys447) Fc-области может присутствовать или может не присутствовать. Термин охватывает усеченные Fc-области, такие как те, которые имеют С-концевое усечение (например, AGK усечение, например, как описано в Hu, et al., Biotechnol. Prog. 2017, 33: 786-794 and Jiang, et al., J. Pharm. Sci. 2016, 105: 2066-2072. Если в данном документе не указано иное, нумерация аминокислотных остатков в Fc-области или константной области соответствует системе нумерации EU, также называемой индексом EU, как это описано в Kabat et al., Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, MD, 1991. «Субъединица» Fc-домена, как используется в данном описании, относится к одному из двух полипептидов, образующих димерный Fc-домен, т.е. полипептид, включающий С-концевые константные области тяжелой цепи иммуноглобулина, способные к стабильной самоассоциации. В одном варианте осуществления субъединица Fc-домена IgG содержит константные домены СН2 IgG и СН3 IgG.
«Каркас» или «FR» относится к остаткам вариабельного домена, отличным от остатков гипервариабельного участка (HVR). FR вариабельного домена обычно состоит из четырех FR-доменов: FR1, FR2, FR3 и FR4. Соответственно, последовательности HVR и FR обычно встречаются в VH (или VL) в следующем порядке: FR1-H1(L1)-FR2-H2(L2)-FR3-H3(L3)-FR4.
Термины «полноразмерное антитело», «интактное антитело» и «полное антитело» взаимозаменяемо употребляются в данном документе для обозначения антитела, имеющего структуру, в значительной степени сходную со структурой нативного антитела, или содержащего тяжелые цепи, которые содержат Fc-домен, согласно определению в данном документе.
«Человеческое антитело» представляет собой антитело, которое содержит аминокислотную последовательность, которая соответствует последовательности антитела, вырабатываемого человеком или клеткой человека или происходящего из источника, отличного от человека, который использует репертуар человеческих антител или другие последовательности, кодирующие человеческие антитела. Это определение человеческого антитела конкретно исключает гуманизированное антитело, содержащее антигенсвязывающие остатки из вида, отличного от человека. Антитела человека можно получить, используя различные методики, известные в данной области техники, в том числе библиотеки фагового дисплея. Hoogenboom and Winter, J. Mol. Biol., 227:381 (1991); Marks et al, J. Mol. Biol., 222:581 (1991). Также доступными для получения моноклональных человеческих антител являются методы, описанные в Cole et al., Monoclonal Antibodies and Cancer Therapy, Alan R. Liss, p.77 (1985); Boerner et al.,J. Immunol., 147(1):86-95 (1991). Смотрите также ван Dijk and van de Winkel, Curr. Opin. Pharmacol., 5: 368-74 (2001). Антитела человека можно получить путем введения антигена в организм трансгенного животного, модифицированного с целью продукции таких антител в ответ на антигенную стимуляцию, причем эндогенные локусы указанного животного отключены, например, иммунизированные ксеномыши (о технологии XENOMOUSE™ см., например, патенты США №6075181 и 6150584). Кроме того, информацию об антителах человека, полученных посредством технологии В-клеточных гибридом человека, см., например, в публикации Li et al, Proc. Natl. Acad. Sci. USA, 103:3557-3562 (2006)
«Человеческий консенсусный каркас» это каркас, который представляет наиболее часто встречающиеся остатки аминокислот в группе каркасных последовательностей VL или VH человеческого иммуноглобулина. Как правило, группа последовательностей VL или VH человеческого иммуноглобулина получена из подгруппы последовательностей вариабельных доменов. Как правило, подгруппа последовательностей представляет собой подгруппу по классификации Kabat et al., Sequences of Proteins of Immunological Interest, Fifth Edition, NIH Publication 91-3242, Bethesda MD (1991), vols. 1-3. В одном из вариантов реализации изобретения, для VL, подгруппа представляет собой подгруппу каппа I по Kabat et al., выше. В одном из вариантов реализации изобретения, для VH, подгруппа представляет собой подгруппу III по Kabat et al., выше.
«Гуманизированное» антитело относится к химерному антителу, содержащему остатки аминокислот из HVR из вида, отличного от человека, и остатки аминокислот человеческих FR. В некоторых вариантах осуществления данного изобретения гуманизированное антитело будет содержать по существу все из по меньшей мере одного и, как правило, двух вариабельных доменов, в которых все или, по существу, все HVR (например, CDR) соответствуют таковым из антител нечеловеческого происхождения, и все или по существу все FR соответствуют таковым из человеческого антитела. Гуманизированное антитело, необязательно, может содержать по меньшей мере часть константной области антитела, происходящей из человеческого антитела. «Гуманизированная форма» антитела, например, антитела нечеловеческого происхождения, относится к антителу, подвергшемуся гуманизации.
Термин «моноклональное антитело» в данном документе относится к антителу, полученному из популяции практически однородных антител, т.е., отдельные антитела, составляющие популяцию, являются идентичными и/или связывают один и тот же эпитоп, за исключением возможных вариантных антител, например, содержащих естественные мутации или возникающих во время продукции моноклонального антитела, причем такие варианты присутствуют в незначительных количествах. В отличие от препаратов поликлональных антител, которые обычно включают разные антитела, направленные против разных детерминант (эпитопов), каждое моноклональное антитело препарата моноклональных антител направлено против одной детерминанты на антигене. Таким образом, определение "моноклональный" указывает на характеристику антитела, полученного по существу из однородной популяции антител, и не должно быть истолковано как необходимость получения антитела каким-или конкретным способом. Например, моноклональные антитела для применения в соответствии с данным изобретением могут быть получены с помощью различных методик, включая, но не ограничиваясь ими, способ гибридомы, способы рекомбинантной ДНК, способы фагового дисплея и способы с использованием трансгенных животных, содержащих все или часть локусов человеческого иммуноглобулина, такие способы и другие типичные способы получения моноклональных антител описаны в данном документе.
«Нативные антитела» относятся к природным молекулам иммуноглобулинов с различной структурой. Например, нативные антитела IgG представляют собой гетеротетрамерные гликопротеины массой около 150000 Дальтон, состоящие из двух идентичных легких цепей и двух идентичных тяжелых цепей, которые связаны дисульфидной связью. В направлении от N-конца к С-концу каждая тяжелая цепь имеет вариабельную область (VH), также называемую вариабельным тяжелым доменом или вариабельным доменом тяжелой цепи, за которой следуют три константных домена (CH1, СН2 и СН3). Аналогичным образом, в направлении от N-конца к С-концу каждая легкая цепь имеет вариабельную область (VL), также называемую вариабельным легким доменом или вариабельным доменом легкой цепи, за которой следует константный легкий домен (CL). Легкая цепь антитела может быть отнесена к одному из двух типов, называемых каппа (κ) и лямбда (λ), на основании аминокислотной последовательности своего константного домена.
Используемый в данном документе термин «гипервариабельный участок» или «HVR» относится к каждому из участков вариабельного домена антитела, которые являются гипервариабельными по последовательности («определяющие комплементарность участки» или «CDR») и/или образуют структурно определенные петли («гипервариабельные петли») и/или содержат контактирующие с антигенами остатки («антигенные контакты»). Как правило, антитела содержат шесть HVR; три в VH (H1, Н2, Н3), и три в VL (LI, L2, L3). Иллюстративные HVR в данном документе включают:
(a) гипервариабельные петли, присутствующие в остатках аминокислот 26-32 (L1), 50-52 (L2), 91-96 (L3), 26-32 (H1), 53-55 (Н2) и 96-101 (Н3) (Chothia and Lesk, J.Mol. Biol. 196:901-917 (1987));
(b) CDR находятся на аминокислотных остатках 24-34 (L1), 50-56 (L2), 89-97 (L3), 31-35b (H1), 50-65 (H2) и 95-102 (Н3) (Kabat et al., Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, MD (1991));
(c) антигенные контакты,находятся на аминокислотных остатках 27 с-36 (L1), 46-55 (L2), 89-96 (L3), 30-35b (H1), 47-58 (Н2) и 93-101 (Н3) (MacCallum et al. J. Mol. Biol. 262: 732-745 (1996)); и
(d) комбинации (a), (b) и/или (с), включая остатки аминокислот HVR 46-56 (L2), 47-56 (L2), 48-56 (L2), 49-56 (L2), 26-35 (H1), 26-35b (H1), 49-65 (H2), 93-102 (Н3) и 94-102 (Н3).
Если не указано иное, остатки HVR и другие остатки в вариабельном домене (например, остатки FR) нумеруются в данном документе в соответствии с Kabat et al., выше.
Термин «вариабельная область» или «вариабельный домен» относится к домену тяжелой или легкой цепей антитела, который участвует в связывании антитела с антигеном. Вариабельные домены тяжелой цепи и легкой цепи (VH и VL, соответственно) нативного антитела обычно имеют сходные структуры, причем каждый домен содержит четыре консервативных каркасных участка (FR) и три гипервариабельных участка (HVR). (См., например, Kindt et al. Kuby Immunology, 6th ed. W.H. Freeman and Co., стр. 91 (2007).) Одного домена VH или VL может быть достаточно для придания антигенсвязывающей специфичности. Кроме того, антитела, которые связывают конкретный антиген, могут быть выделены с использованием домена VH или VL из антитела, которое связывает антиген, для скрининга библиотеки комплементарных доменов VL или VH, соответственно. Смотри, например, Portolano et al., J. Immunol. 150:880-887 (1993); Clarkson et al., Nature 352:624-628 (1991).
«Иммуноконъюгат» представляет собой антитело, конъюгированное с одной или более гетерологичными молекулами, включая, но не ограничиваясь им, цитотоксический агент.
«Выделенное» антитело представляет собой антитело, которое было отделено от компонента его естественного окружения. В некоторых вариантах осуществления данного изобретения антитело является очищенным до более чем 95% или 99% чистоты, определяемой, например, посредством электрофореза (например, ДСН-ПААГ-электрофорез, изоэлектрического фокусирования (ИЭФ), капиллярного электрофореза) или метода хроматографии (например, ионообменной или обращенно-фазовой ВЭЖХ). Обзор методов оценки чистоты антител см., например, в Flatman et al., J. Chromatogr. В 848:79-87 (2007).
«Процент (%) идентичности аминокислотных последовательностей» относительно контрольной полипептидной последовательности определяется как процентная доля аминокислотных остатков в кандидатной последовательности, которые являются идентичными с аминокислотными остатками в контрольной полипептидной последовательности, после выравнивания последовательностей и внесения, в случае необходимости, промежутков для достижения максимальной идентичности последовательностей, но без учета каких-или консервативных замен как части идентичности последовательностей. Выравнивание в целях определения процента идентичности аминокислотной последовательности может быть достигнуто различными способами, которые известны в данной области техники, например, с использованием общедоступного компьютерного программного обеспечения, такого как программное обеспечение BLAST, BLAST-2, ALIGN или Megalign (DNASTAR). Специалисты в данной области техники могут определить подходящие параметры для выравнивания последовательностей, включая любые алгоритмы, необходимые для достижения максимального выравнивания по всей длине сравниваемых последовательностей. Однако для целей данного описания значения процента (%) идентичности аминокислотных последовательностей получают с использованием компьютерной программы сравнения последовательностей ALIGN-2. Компьютерная программа для выравнивания последовательностей ALIGN-2 была разработана Genentech, Inc., а исходная программа была подана вместе с документацией пользователя в Бюро регистрации авторских прав США, Вашингтон, округ Колумбия, 20559, где она зарегистрирована под номером регистрации авторского права США TXU510087. Программа ALIGN-2 общедоступна от Genentech, Inc., Южный Сан-Франциско, Калифорния или может быть скомпилирована из исходного кода. Программа ALIGN-2 должна быть скомпилирована для использования в операционной системе UNIX, включая Digital UNIX V4.0D. Все параметры сравнения последовательностей устанавливаются программой ALIGN-2 и не изменяются.
В тех случаях, когда для сравнения аминокислотных последовательностей используется ALIGN-2, % идентичности аминокислотной последовательности данной аминокислотной последовательности А к, с, или по сравнению с данной аминокислотной последовательностью В (что в альтернативном варианте может быть сформулировано как данная аминокислотная последовательность А, которая имеет или содержит определенный % идентичности аминокислотной последовательности к, с или по сравнению с данной аминокислотной последовательностью В) рассчитывают следующим образом:
100-кратное отношение X/Y
где X представляет собой количество аминокислотных остатков, оцененных программой выравнивания последовательностей ALIGN-2 как идентичные совпадения при программном выравнивании А и В, и при этом Y представляет общее количество аминокислотных остатков в В. Следует понимать, что там, где длина аминокислотной последовательности А не равняется длине аминокислотной последовательности В, % идентичности аминокислотной последовательности А к В не будет равен % идентичности аминокислотной последовательности В к А. Если специально не указано иное, все значения % идентичности аминокислотной последовательности, которые используется в данном документе, получают, как описано в предыдущем абзаце с использованием компьютерной программы ALIGN-2.
Как использовано в данном описании, термин «улучшение стабильности» (и его любая грамматическая форма) относится к аминокислотной замене, сконфигурированный для повышения химической стабильности антитела (например, снижения скорости дезамидировани и/или изомеризации), например, путем замены аминокислотного остатка склонного к дезамидированию или изомеризации на сравнительно инертный аминокислотный остаток или путем замены аминокислоты фланкирующей остаток склонный к дезаминированию или изомеризации на сравнительно инертеный аминокислотный остаток. Примеры улучшения стабильности для уменьшения дезамидирования включают замену аспарагина на серии или глутаминовую кислоту (например, N30S или N54E). Примеры улучшения стабильности для уменьшения изомеризации включают замену аспарагиновой кислоты на аланин или треонин (например, D98A или D98T).
«Выделенная» нуклеиновая кислота относится к молекуле нуклеиновой кислоты, которая была отделена от компонента ее естественного окружения. Выделенная нуклеиновая кислота включает молекулу нуклеиновой кислоты, содержащуюся в клетках, которые обычно содержат молекулу нуклеиновой кислоты, но молекула нуклеиновой кислоты присутствует внехромосомно или в хромосомном местоположении, которое отличается от ее природного хромосомного местоположения.
«Выделенная нуклеиновая кислота, кодирующая антитело против CD3» относится к одной или более молекулам нуклеиновых кислот, кодирующим тяжелые и легкие цепи антитела (или их фрагменты), включая молекулы нуклеиновых кислот в одном векторе или отдельных векторах и молекулы нуклеиновых кислот, присутствующие в одной или более местах в клетке-хозяине.
В данном документе термин «вектор» относится к молекуле нуклеиновой кислоты, способной амплифицировать другую нуклеиновую кислоту, с которой она соединена. Термин включает вектор в виде самореплицирующейся структуры нуклеиновой кислоты, а также вектор, внедренный в геном клетки-хозяина, в которую его внедрили. Некоторые векторы способны управлять экспрессией нуклеиновых кислот, с которыми они функционально связаны. Такие векторы называются в данном документе «векторы экспрессии».
Термины «клетка-хозяин», «линия клеток-хозяев» и «культура клеток-хозяев» используются взаимозаменяемо и относятся к клеткам, в которые была введена экзогенная нуклеиновая кислота, включая потомство таких клеток. Клетки-хозяева включают «трансформанты» и «трансформированные клетки», которые включают первично трансформированные клетки и полученное от них потомство вне зависимости от числа пассажей. Потомство может не быть полностью идентичным исходной клетке по содержанию нуклеиновых кислот, и может содержать мутации. Термин включает мутантное потомство, которое имеет ту же функцию или биологическую активность, которую выявили с помощью скрининга или отобрали из исходных трансформированных клеток.
Термин «вкладыш в упаковку» используется для обозначения инструкций, обычно включаемых в коммерческие упаковки терапевтических продуктов, которые содержат информацию о показаниях, применении, дозировке, введении, комбинированной терапии, противопоказаниях и/или предупреждениях относительно использования таких терапевтических продуктов. Термин «фармацевтический состав» относится к препарату, который находится в форме, обеспечивающей реализацию биологической активности содержащегося в нем активного ингредиента, и который не содержит дополнительные компоненты, которые являются неприемлемо токсичными для субъекта, которому будет введен состав.
«Фармацевтически приемлемый носитель» относится к ингредиенту в фармацевтическом составе, отличному от активного ингредиента, который нетоксичен для субъекта. Фармацевтически приемлемый носитель включает, но не ограничивается ими, буфер, вспомогательное вещество, стабилизатор или консервант.
Используемый в данном документе термин «введение» означает способ введения субъекту дозы соединения (например, антитела против CD3 согласно данному изобретению или нуклеиновой кислоты, кодирующей антитело против CD3 согласно данному изобретению) или композиции (например, фармацевтической композиции, например, фармацевтической композиции, содержащей антитело против CD3 согласно данному изобретению). Композиции, применяемые в описанных в данном документе способах, можно вводить, например, внутримышечно, внутривенно, интрадермально, чрескожно, внутриартериально, внутрибрюшинно, внутриочагово, интракраниально, внутрисуставно, внутрь простаты, внутриплеврально, интратрахеально, интраназально, интравитреально, внутривагинально, ректально, местно, внутриопухолево, перитонеально, подкожно, субконъюнктивально, интравезикулярно, мукозально, интраперикардиально, внутрипуповинно, интраокулярно, перорально, местно, локально, путем ингаляции, путем инъекции, путем инфузии, путем длительной инфузии, путем локализованной перфузии непосредственно через клетки-мишени, при помощи катетера, при помощи лаважа, в кремах или в липидных композициях. Способ введения может изменяться в зависимости от различных факторов (например, соединения или композиции для введения, степени тяжести патологического состояния, заболевания или нарушения, подлежащего лечению). В данном документе термин «лечение» (и его грамматические варианты, такие как «лечить» или «лечащий») относится к клиническому вмешательству с целью изменения естественного течения заболевания индивидуума, которого лечат, и может проводиться как для профилактики, так и при течении клинической патологии. Желаемые эффекты лечения включают, без ограничения, предотвращение возникновения или рецидива заболевания, частичное снятие симптомов, уменьшение каких-или прямых или косвенных патологических последствий заболевания, предотвращение метастазирования, снижение скорости прогрессирования заболевания, улучшение или временное облегчение болезненного состояния, и ремиссию или улучшение прогноза. Согласно некоторым вариантам осуществления данного изобретения антитела согласно данному изобретению применяют для задержки развития заболевания или для замедления прогрессирования заболевания.
В контексте данного документа «замедление прогрессирования» нарушения или заболевания означает отсрочивать, тормозить, замедлять, задерживать, стабилизировать и/или откладывать развитие заболевания или нарушения (например, клеточно-пролиферативного нарушения, например, рака). Это замедление может быть разным по продолжительности, в зависимости от истории болезни и/или индивидуума, которого лечат. Для специалиста в данной области техники очевидно, что существенное или значительное замедление может, на практике, включать предотвращение развития заболевания у субъекта. Например, можно замедлить позднюю стадию рака, такую как развитие метастаз. Под термином «снижать» или «ингибировать» подразумевается способность приводить к общему снижению, составляющему, например, 20% или более, 50 или более или 75%, 85%, 90%, 95% или более. В определенных вариантах осуществления данного изобретения термины снижать или ингибировать могут относиться к эффекторной функции антитела, которая опосредуется Fc-областью антитела, при этом такие эффекторные функции включают, в частности, комплемент-зависимую цитотоксичность (КЗЦ), антитело-зависимую клеточную цитотоксичность (АЗКЦ) и антитело-зависимый клеточный фагоцитоз (АЗКФ). «Субъект» или «индивид» представляет собой млекопитающее. Млекопитающие включают одомашненных животных (например, коров, овец, кошек, собак и лошадей), приматов (например, людей и приматов, не являющихся людьми, таких как обезьяны), кроликов и грызунов (например, мышей и крыс). В определенных вариантах осуществления данного изобретения субъект или индивид является человеком.
«Нарушением» является любое состояние, которое может быть улучшено вследствие лечения, включая, но не ограничиваясь этим, хронические и острые нарушения или заболевания, включая те патологические состояния, которые провоцируют у млекопитающего соответствующее нарушение. Термины "клеточное пролиферативное расстройство" и "пролиферативное расстройство" относятся к расстройствам, которые связаны с определенной степенью аномальной пролиферации клеток. В одном варианте осуществления данного изобретения клеточное пролиферативное расстройство представляет собой рак. В одном варианте осуществления данного изобретения клеточное пролиферативное расстройство представляет собой опухоль.
Термины «рак» и «раковый» относятся к или описывают физиологическое состояние млекопитающих, которое, как правило, характеризуется нерегулируемым ростом клеток. Это определение включает доброкачественные и злокачественные опухоли. Под «ранней стадией рака» или «ранней стадии опухоли» подразумевается рак, который не является инвазивным или метастатическим или классифицируется как рак Стадии 0, 1 или 2. Примеры рака включают, но не ограничиваются ими, рак молочной железы, рак желудка, колоректальный рак, немелкоклеточный рак легких клеток, неходжкинскую лимфому (НХЛ), лимфому В-клеток, В клеточный лейкоз, множественную миелому, рак почки, рак предстательной железы, рак печени, рак головы и шеи, меланому, рак яичника, мезотелиому, глиобластому, диффузную крупноклеточную В-клеточную лимфому (DLBCL) В-подобных клеток терминального центра (GCB), DLBCL В-подобных активированных клеток (ABC), фолликулярную лимфому (FL) DLBCL, мантийно клеточную лимфому (MCL), острый миелоидный лейкоз (ОМЛ), хронический лимфоидный лейкоз (ХЛЛ), лимфому маргинальной зоны (MZL), лейкоз малых лимфоцитов (SLL), лимфоплазмоцитарную лимфому (LL), макроглобулинемию Вальденстрема (WM), лимфому центральной нервной системы (CNSL), лимфому Беркитта (ЛБ), В-клеточный пролимфоцитарный лейкоз, лимфомы маргинальной зоны селезенки, лейкозы ворсистых клеток, лимфомы/лейкоза селезенки, диффузную красной пульпы мелкоклеточную В клеточную лимфому селезенки, вариант волосатоклеточного лейкоза, болезнь тяжелой цепи α болезнь тяжелой цепи γ, болезнь тяжелой цепи μ, миелому плазматических клеток, одиночную плазмоцитому кости, внекостную плазмоцитому, экстранодальную лимфому маргинальной зоны лимфоидной ткани ассоциированную с мукозой (MALT-лимфом), узловую лимфому маргинальной зоны, педиатрическую узловую лимфому маргинальной зоны, педиатрическую фоликулярную лимфому, первичную кожную лимфому фолликулярного центра, богатую Т- клеткми/гистиоцитами крупноклеточную В-клеточную лимфому, первичную DLBCL центральной нервной системы, первичная кожная DLBCL (ножной тип), вирус Эпштейн-Барр (EBV)-положительную DLBCL людей преклонного возраста, DLBCL ассоциированную с хроническим воспалением, лимфоматоидный гранулематоз, первичную медиастинальную (тимус) крупноклеточную В-клеточную лимфому, внутрисосудистую крупноклеточную В-клеточную лимфому, киназа анапластической лимфомы (ALK)-положительную крупноклеточную В-клеточную лимфому, плазмабластическую лимфому, крупноклеточную В-клеточную лимфому, возникающую при HHV8-ассоциированной мультицентрической болезни Каслмана, неклассифицируемую крупноклеточную В-клеточную лимфому с промежуточными признаками между диффузной крапноклеточной В клеточной лимфомой и классической лимфомой Ходжкина)). В некоторых вариантах осуществления рак является HER2- положительным раком (например, HER2-положительным раком молочной железы или HER2-положительным раком желудка).
Термин «HER2-положительный» рак включает раковые клетки, которые имеют более высокий, чем нормальный уровень HER2. Примеры HER2-положительного рака включают HER2-положительный рак молочной железы и HER2-положительный рак желудка. Необязательно, HER2-положительный рак имеет иммуногистохимический (IHC) балл 2+ или 3+ и/или степень амплификации in situ гибридизации (ISH)≥2.0.
Термин «опухоль» в данном документе относится ко всем вариантам роста и пролиферации опухолевых клеток, злокачественным или доброкачественным, и всем предраковым и раковым клеткам и тканям. Термины «рак», «раковый», «клеточное пролиферативное расстройство» «пролиферативное расстройство» и «опухоль» не являются взаимоисключающими в данном документе.
Термин «опухолевый антиген», используемый в данном документе, может быть понят как те антигены, которые представлены на опухолевых клетках. Эти антигены могут быть представлены на поверхности клеток в виде внеклеточной части, которая часто находится в сочетании с трансмембранным и цитоплазматическими частями молекулы. Эти антигены могут иногда быть представлены только опухолевыми клетками, и никогда нормальными клетками. Опухолевые антигены могут быть экспрессированы исключительно на опухолевые клетках или могут представлять собой мутацию конкретной опухоли по сравнению с нормальными клетками. В этом случае они называются опухоль-специфические антигены. Более распространенные являются опухолевые антигены, которые представлены опухолевыми клетками и нормальными клетками, и они называются опухоль-ассоциированными антигенами. Эти ассоциированные с опухолью антигены могут избыточно экспрессироваться по сравнению с нормальными клетками или доступны для связывания антитела в опухолевых клетках за счет менее компактной структуры ткани опухоли по сравнению с нормальной тканью.
«Эффективное количество» соединения, например, биспецифичной антигенсвязывающей молекулы согласно изобретению или содержащей его композиции (например, фармацевтической композиции), представляет собой по меньшей мере минимальное количество, необходимое для достижения желаемого терапевтического или профилактического результата, такого как определяемое улучшение или предотвращение конкретного нарушения (например, клеточно-пролиферативного нарушения, например, рака). Эффективное количество в данном документе может варьироваться в зависимости от таких факторов, как состояние болезни, возраста, пола и массы пациента и от способности антитела вызывать желаемый ответ у индивидуума. Эффективное количество является таким, для которого любые токсические или вредные эффекты лечения перевешиваются терапевтически благоприятными эффектами. Для профилактического применения, благоприятные или желаемые результаты включают результаты, такие как устранение или снижение риска, уменьшения тяжести или задержки начала заболевания, в том числе биохимические, гистологические и/или поведенческие симптомы заболевания, его осложнения и промежуточные патологические фенотипы, присутствовавшие при развитии заболевания. Для терапевтического применения, благоприятные или желаемые результаты включают клинические результаты, такие как снижение одного или более симптомов, в результате заболевания, повышения качества жизни людей, страдающих от этой болезни, уменьшение дозы других лекарственных средств, необходимых для лечения заболевания, усиление эффекта другого препарата, среди которых таргетинг, замедление прогрессирования заболевания и/или увеличения выживаемости индивидуума. В случае рака или опухоли эффективное количество лекарственного средства может иметь эффект в снижении количества раковых клеток; уменьшении размера опухоли; ингибировании (т.е., замедлить до некоторой степени или желательно остановить) инфильтрации раковых клеток в периферические органы; ингибировании (т.е., замедлить до некоторой степени и желательно остановить) метастазирования опухоли; ингибировании до некоторой степени роста опухоли; и/или облегчении до некоторой степени одного или более симптомов, связанных с расстройством. Эффективное количество можно вводить в один или более приемов. Для целей данного изобретения эффективное количество лекарственного средства, соединения или фармацевтической композиции представляет собой количество, достаточное для достижения профилактического или терапевтического воздействия или непосредственно, или косвенно. Как понимается в клиническом контексте эффективное количество лекарственного средства, соединения или фармацевтической композиции может или не может быть достигнуто в комбинации с другим препаратом, соединением или фармацевтической композицией. Таким образом, "эффективное количество" может рассматриваться в контексте введения одного или более терапевтических агентов, и один агент может рассматриваться как получаемый в эффективном количестве, если в комбинации с одним или более другими агентами желаемый результат может быть достигнут.
Термин "антагонист связывания оси PD-1" относится к молекуле, которая ингибирует взаимодействие партнера, связывающегося с осью PD-1, или одного, или более из своих партнеров по связыванию, с тем, чтобы устранить Т-клеточную дисфункцию, которая происходит в следствие сигналинга в оси PD-1, с результатом в том, чтобы восстановить или усилить Т-клеточную функцию (например, пролиферацию, продукцию цитокинов, и/или уничтожение клеток-мишеней). Как использовано в данном описании, антагонист связывания оси PD-1 включает в себя антагониста связывания PD-1 и антагониста связывания PD-L1, а также молекулы, которые препятствуют взаимодействию между PD-L1 и PD-1 (например, PD-L2-Fc слияние).
Термин "антагонисты связывания PD-1" представляет собой молекулу, которая снижает, блокирует, ингибирует, подавляет или нарушает сигнальную трансдукцию, возникающую из-за взаимодействия PD-1 с одним или более его партнерами по связыванию, такими как PD-L1, PD-L2. В некоторых вариантах осуществления данного изобретения антагонист связывания PD-1 представляет собой молекулу, которая ингибирует связывание PD-1 с его партнерами по связыванию. В конкретном аспекте антагонист связывания PD-1 ингибирует связывание PD-1 с PD-L1 и/или PD-L2. Например, антагонисты связывания PD-1 включают антитела анти-PD-1, их антигенсвязывающие фрагменты, иммуноадгезины, гибридные белки, олигопептиды и другие молекулы, которые снижают, блокируют, ингибируют, подавляют или нарушают сигнальную трансдукцию, возникающую из-за взаимодействия PD-1 с PD-L1 и/или PD-L2. В одном варианте осуществления данного изобретения антагонист связывания PD-L1 уменьшает негативный костимулирующий сигнал, опосредованный или осуществляемый с помощью клеточных поверхностных белков, экспрессируемых на Т-лимфоцитах, которые опосредуют сигналинг через PD-L1, так как делают дисфункциональную Т-клетку менее дисфункциональной. В некоторых вариантах осуществления данного изобретения антагонист связывания PD-1 представляет собой антитело анти-PD-1. В конкретном аспекте антагонист связывания PD-1 представляет собой MDX-1106 (ниволумаб), описанный в данном документе. В другом конкретном аспекте антагонист связывания PD-1 представляет собой МК-3475 (ламбролизумаб), описанный в данном документе. В другом конкретном аспекте антагонист связывания PD-1 представляет собой СТ-011 (пидилизумаб), описанный в данном документе. В другом конкретном аспекте антагонист связывания PD-1 представляет собой MEDI-0680, описанный в данном документе. В другом конкретном аспекте антагонист связывания PD-1 представляет собой PDR001, описанный в данном документе. В другом конкретном аспекте антагонист связывания PD-1 представляет собой REGN2810, описанный в данном документе. В другом конкретном варианте осуществления данного изобретения антагонист связывания PD-1 представляет собой BGB-108. В другом конкретном аспекте антагонист связывания PD-1 представляет собой АМР-224, описанный в данном документе.
Термин "антагонисты связывания PD-L1" относится к молекуле, которая снижает, блокирует, ингибирует, подавляет или нарушает сигнальную трансдукцию, возникающую из-за взаимодействия PD-L1 с одним или более его партнерами по связыванию, такими как PD-1, В7-1. В некоторых вариантах осуществления данного изобретения антагонист связывания PD-L1 представляет собой молекулу, которая ингибирует связывание PD-L1 с его партнерами по связыванию. В конкретном аспекте антагонист связывания PD-L1 ингибирует связывание PD-L1 с PD-1 и/или В7-1. В некоторых вариантах осуществления данного изобретения антагонисты связывания PD-L1 включают антитела анти-PD-L1, их антигенсвязывающие фрагменты, иммуноадгезины, гибридные белки, олигопептиды и другие молекулы, которые снижают, блокируют, ингибируют, подавляют или нарушают сигнальную трансдукцию, возникающую из-за взаимодействия PD-L1 с одним или более его партнерами по связыванию, такими как PD-1, В7-1. В одном варианте осуществления данного изобретения антагонист связывания PD-L1 уменьшает негативный костимулирующий сигнал, опосредованный или осуществляемый с помощью клеточных поверхностных белков, экспрессируемых на Т-лимфоцитах, которые опосредуют сигналинг через PD-L1, таким образом делая дисфункциональную Т-клетку менее дисфункциональной (например, повышая эффекторный отклик на распознавание антигена). В некоторых вариантах осуществления данного изобретения антагонист связывания PD-L1 представляет собой антитело против PD-L1. В конкретном аспекте антитело против PD-L1 представляет собой YW243.55.S70, описанное в данном документе. В другом конкретном аспекте антитело против PD-L1 представляет собой MDX-1105, описанное в данном документе. В еще одном конкретном аспекте антитело против PD-L1 представляет собой атезолизумаб (регистрационный номер CAS: 1422185-06-5), также известное как MPDL3280A, описанное в данном документе. В еще одном конкретном аспекте антитело против PD-L1 представляет собой MEDI4736 (друвалумаб), описанное в данном документе. В еще одном конкретном аспекте антитело против PD-L1 представляет собой MSB0010718C (авелумаб), описанное в данном документе. Термины «лиганд 1 запрограммированной смерти» и «PD-L1» относятся в данном описании к полипептиду с нативной последовательностью PD-L1, вариантам полипептида (т.е., вариантам полипептида PD-L1), а также фрагментам последовательности нативного полипептида и вариантами полипептида (которые дополнительно определены в данном описании). Полипептид PD-L1, описанный в данном документе, может быть, выделен из различных источников, например, из типов тканей человека или из другого источника, или получен рекомбинантным или синтетическим способами.
Термин «PD-L1 полипептид с нативной последовательностью» включает в себя полипептид, имеющий такую же аминокислотную последовательность, что и соответствующий PD-L1 полипептид, полученный из природы. А «вариант полипептида PD-L1», или его варианты, означает полипептид, PD-L1, обычно активный полипептид PD-L1, как определено в данном документе, имеющий по меньшей мере около 80% идентичности аминокислотной последовательности с любой из нативных последовательностей PD-L1, как описано в данном документе. Такие варианты PD-L1 включают в себя полипептид, например, PD-L1 полипептиды, в которых один или несколько аминокислотных остатков добавлены или удалены на N- или С-конце нативной аминокислотной последовательности. Обычно вариант полипептида PD-L1, будет иметь по меньшей мере, около 80% идентичности аминокислотной последовательности, альтернативно по меньшей мере около 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичности аминокислотной последовательности с нативной последовательностью полипептида PD-L1, как описано в данном документе. Обычно, PD-L1 варианты полипептида по меньшей мере около 10 аминокислот в длину, альтернативно по меньшей мере около 20, 30, 40, 50, 60, 70, 80, 90, 100, 110, 120, 130, 140, 150, 160, 170, 180, 190, 200, 210, 220, 230, 240, 250, 260, 270, 280, 281, 282, 283, 284, 285, 286, 287, 288 или 289 аминокислот в длину или более. Необязательно, PD-L1 варианты полипептида будут иметь не более чем одну консервативную аминокислотную замену по сравнению с нативной последовательностью полипептида PD-L1, в качестве альтернативы не больше, чем 2, 3, 4, 5, 6, 7, 8, 9 или 10 консервативных аминокислотных замен по сравнению с нативной последовательностью полипептида PD-L1.
Термин «антагонисты связывания PD-L2" относится к молекуле, которая снижает, блокирует, ингибирует, подавляет или нарушает сигнальную трансдукцию, возникающую из-за взаимодействия PD-L2 с одним или более его партнерами по связыванию, такими как PD-1. В некоторых вариантах осуществления данного изобретения антагонист связывания PD-L2 представляет собой молекулу, которая ингибирует связывание PD-L2 с одним или более его партнерами по связыванию. В конкретном аспекте антагонист связывания PD-L2 ингибирует связывание PD-L2 с PD-1. В некоторых вариантах осуществления данного изобретения антагонисты связывания PD-L2 включают антитела анти-PD-L2, их антигенсвязывающие фрагменты, иммуноадгезины, гибридные белки, олигопептиды и другие молекулы, которые снижают, блокируют, ингибируют, подавляют или нарушают сигнальную трансдукцию, возникающую из-за взаимодействия PD-L2 с одним или более его партнерами по связыванию, такими как PD-1. В одном варианте осуществления данного изобретения антагонист связывания PD-L2 уменьшает негативный костимулирующий сигнал, опосредованный или осуществляемый с помощью клеточных поверхностных белков, экспрессируемых на Т-лимфоцитах, которые опосредуют сигналинг через PD-L2, чтобы сделать дисфункциональную Т-клетку менее дисфункциональной (например, повышая эффекторный отклик на распознавание антигена). В некоторых вариантах реализации изобретения антагонист связывания PD-L2 представляет собой иммуноадгезин.
II КОМПОЗИЦИИ
В одном аспекте данное изобретение основано, частично, на биспецифичных антигенсвязывающих молекулах (например, биспецифичных антителах). В некоторых вариантах осуществления, биспецифичные антигенсвязывающие молекулы имеют моновалентное плечо, способное специфично связываться с первым антигеном (например, антигеном Т-клеток, например, CD3) и бивалентное плечо, способное специфично связываться с двумя дополнительными антигенами (например, опухолевыми антигенами, например, двумя HER2 антигенами). Например, бивалентное плечо может содержать два антигенсвязывающих фрагмента, каждый из которых способен специфично связываться с антигеном- мишенью (например, HER2), чтобы увеличить авидность биспецифичной антигенсвязывающей молекулы к клетке, экспрессирующей высокие уровни антигена-мишени. Биспецифичные антигенсвязывающие молекулы по данному изобретению могут быть использованы, например, для лечения или замедления развития клеточного пролиферативного нарушения (например, рака) или аутоиммунного расстройства, или для улучшения иммунной функции у субъекта, имеющего такое расстройство.
1Fab-IgG, TDBs по данному изобретению селективно убивают опухолевые клетки, которые избыточно экспрессируют целевой опухолевый антиген с высокой активностью, в то же время не убивают клетки, которые экспрессируют низкие количества целевого опухолевого антигена, например, клетки нормальных или здоровых тканей человека. Селективность основана на авидности двух низкоафинных направленных против опухолевого антигена Fab плечах к высокой плотности антигена на клетках, которые избыточно экспрессируют опухолевый антиген. Увеличенная селективность к клеткам избыточно экспрессирующим опухолевый антиген снижает целевые неблагоприятные эффекты TDB. Например, при использовании HER2 в качестве целевого опухолевого антигена, анти-HER2-IgG TDB с высокоафинным моновалентным связыванием с HER2 связывается как с клетками избыточно экспрессирующими HER2, так и с клетками, которые экспрессируют низкий уровень HER2. Терапевтический индекс этого TDB основан на более высокой активности на HER2-избыточно-экспрессирующих клетках из-за высокой плотности HER2. При высоких дозах TDB, высокоафинное HER2-IgG1 TDB может повлиять на клетки, которые экспрессируют низкий уровень HER2 и поэтому имеет риск целевого автоиммунитета вне опухоли на нормальных тканях (фиг. 35А). Конструирование HER2-связывающего плеча для снижения его афинности результирует в сниженном связывании и TDB активности на обоих, HER2 избыточно экспрессирующих клетках и клетках, которые экспрессируют низкий уровень HER2, но не улучшает селективность (фиг. 35В). Бивалентное связывание HER2 с надлежащей аффинностью (моновалентная KD ~ 20-50 нм) приводит к высокому уровню связывания с HER2-избыточно-экспрессирующими клетками за счет авидности анти-HER2 1Fab-IgG TDB. Эффект авидности зависит от высокой плотности HER2 и 1Fab-IgG TDB, следовательно, не связывается с клетками, экспрессирующими низкие уровни HER2, например, клетками нормальных или здоровых тканей человека. Поскольку связывание с клетками коррелирует со способностью TDB привлекать активность клеток Т, анти-HER2 1Fab-IgG TDB избирательно убивает только клетки, которые более экспрессируют HER2 и имеет пониженный риск индуцирования целевого аутоиммунитета вне опухоли на нормальных тканях (фиг.35С).
Иллюстративные Биспецифичпые антигенсвязывающие молекулы В одном аспекте данное изобретение относится к выделеным биспецифичным антигенсвязывающим молекулам (например, биспецифичным антителам), имеющим моновалентное плечо и бивалентное плечо. Например, в одном аспекте, данное изобретение относится к биспецифичной антигенсвязывающей молекуле, имеющей моновалентное плечо и бивалентное плечо, в которой (а) моновалентное плечо содержит первый антигенсвязывающего фрагмент, и (b) бивалентное плечо содержит второй антигенсвязывающий фрагмент и третий антигенсвязывающий фрагмент. В некоторых вариантах осуществления С-конец первого антигенсвязывающего фрагмента, слит с N-концом первой Fc-субъединицы, С-конец третьего антигенсвязывающего фрагмента, слит с N-концом второго антигенсвязывающего фрагмента, и С-конец второго антигенсвязывающего фрагмента, слит с N-концом второй Fc-субъединицы. В некоторых вариантах осуществления первая Fc-субъединица связывается со второй Fc-субъединицей с образованием Fc-домена. В некоторых вариантах осуществления первый антигенсвязывающий фрагмент может специфично связываться с первым антигеном клетки-мишени, а каждый из второго антигенсвязывающего фрагмента и третьего антигенсвязывающего фрагмента способен специфично связываться с антигеном второй клетки-мишени (например, в том же эпитопе или в различных эпитопах на втором антигене-мишени клетки).
Первый антигенсвязывающий фрагмент может быть молекулой Fab (FabA), Содержащий вариабельную область тяжелой цепи (VHA) и вариабельную область легкой цепи (VLA); второй антигенсвязывающий фрагмент может быть молекулой Fab (FabB1), содержащей вариабельную область тяжелой цепи (VHB1) и вариабельную область легкой цепи (VLB1); и/или третий антигенсвязывающий фрагмент может быть молекулой Fab (FabB2), содержащей вариабельную область тяжелой цепи (VHB2) и вариабельную область легкой цепи (VLB2). Таким образом, в некоторых случаях, первый антигенсвязывающий фрагмент может быть Fab содержащий VHA-область и VLA-область, второй антигенсвязывающий фрагмент может быть FabB1 содержащий VHB1-область и VLB1-область, и третий антигенсвязывающий фрагмент может быть FabB2 содержащий VHB2-область и VLB2-область. VHB1 и VHB2 могут иметь идентичность последовательности по меньшей мере 95% (например, 95%, 96%, 97%, 98%, 99% или 100% идентичности последовательности). Дополнительно или альтернативно, VLB1 и VLB2 могут иметь идентичность последовательности по меньшей мере 95% (например, 95%, 96%, 97%, 98%, 99% или 100% идентичности последовательности).
Термин 1Fab-IgG молекула относится к биспецифичной антигенсвязывающей молекуле, имеющей первый антигенсвязывающий фрагмент, второй антигенсвязывающий фрагмент и третий антигенсвязывающий фрагмент, при этом первый антигенсвязывающий фрагмент представляет собой FabA содержащий VHA-область и VLA-область, второй антигенсвязывающий фрагмент представляет собой FabB1 содержащий VHB1-область и VLB1-область, и третий антигенсвязывающий фрагмент представляет собой FabB2 содержащий VHB2-область и VLB2-область, при этом VHB1 и VHB2 имеют по меньшей мере 95% идентичности последовательности (например, 95%, 96%, 97%, 98%, 99% или 100% идентичности последовательности), и VLB1 и VLB2 имеют по меньшей мере идентичности последовательностей 95% (например, 95%, 96%, 97%, 98%, 99% или 100% идентичности последовательности). 1Fab-IgG молекулы имеют моновалентное плечо, содержащее первый антигенсвязывающий фрагмент, который связывает первый антиген-мишень и бивалентное плечо, содержащее второй и третий антигенсвязывающие фрагменты, при этом каждая из второй и третьей антигенсвязывающих молекул специфично связывает второй антиген-мишень клетки. В некоторых вариантах осуществления 1Fab-IgG молекула представляет собой 1Fab-IgG Т-клеточно зависимой биспецифичной молекулой (1Fab-IgG TDB), где моновалентное плечо специфично связывает антиген на поверхности Т-клетки, и каждый антигенсвязывающий фрагмент бивалентного плеча специфично связывается с антигеном на поверхности второй клетки-мишени (например, опухолевой клетки). Как и в случае с TDB, бивалентные IgG стандартного формата (IgG TDB), 1Fab-IgG TDB рекрутируют цитолитические Т-клетки, чтобы уничтожить клетки, экспрессирующие целевой антиген. Например, анти-CD3/HER2 1Fab-IgG TDB имеет моновалентное плечо, которое специфично связывается с CD3 (например, молекулой CD3 на поверхности Т-клеток) и бивалентное плечо, которое имеет два антигенсвязывающих фрагмента, каждый из которых специфично связываются с HER2 (например, молекулой HER2 на поверхности опухолевых клеток). Эти два антигенсвязывающих фрагмента на бивалентном плече могут связываться с одним и тем же эпитопом, или каждый антигенсвязывающий фрагмент на бивалентном плече может связать свой отличный от другого эпитоп на том же антигене. В одном варианте осуществления данного изобретения бивалентное плечо связывается с тем же эпитопом, что и 4D5. В одном варианте осуществления данного изобретения бивалентное плечо связывается с доменом IV HER2. В одном варианте осуществление изобретения антигенсвязывающий фрагмент на моновалентном плече, специфичном к CD3, представляет собой 40G5c Fab, и каждый из этих двух антигенсвязывающих фрагментов на бивалентном плечо, специфичном к HER2, является вариантом 4D5 Fab. Конкретные варианты проиллюстрированы в данном описании.
Полученные биспецифичные антигенсвязывающие молекулы по данному изобретению могут обеспечить повышенную чувствительность к клеткам, которые предпочтительно экспрессируют высокую плотность антигена (например, опухолевого антигена), что во многих случаях, уменьшает повреждение здоровых тканей (например, путем активации Т-клетки, чтобы атаковать опухолевые клетки, а не здоровые клетки, экспрессирующие низкие уровни опухолевого антигена). Соответственно, в некоторых вариантах осуществления, опухолевый антиген экспрессируется на (а) опухолевых клетках у субъекта, и (b) по меньшей мере в одном типе неопухолевых клеток у субъекта (например, в более низкой плотности, чем его экспрессия на опухолевых клетках). В некоторых вариантах осуществления отношение количества копий антигена на неопухолевых клетках к количеству антигена на опухолевых клетках составляет от 1:2 до 1:1000000 (например, от 1:3 до 1:500000, от 1:4 до 1:100000, от 1:5 до 1:50 000, от 1:6 до 1:40000, от 1:7 до 1:20000, от 1:8 до 1:10000, от 1:9 до 1:5000, от 1:10 до 1:1000, от 1:20 до 1:500, от 1:50 до 1:400, или от 1:100 до 1:200, например, от 1:2 до 1:10, от 1:10 до 1:20, от 1:20 до 1:50, от 1:50 до 1:100, от 1:100 до 1:200, от 1:200 до 1:300, от 1:300 до 1:400, от 1:400 до 1:500, от 1:500 до 1:600, от 1:600 до 1:700, от 1:700 до 1:800, от 1:800 до 1:900, от 1:900 до 1:1000, от 1:1000 до 1:5000, от 1:5000 до 1:10000, от 1:10000 до 1:50000, от 1:50000 до 1:100000, 1:100000 до 1:500000, или от 1:500000 до 1:1000000, например, около 1:2, 1:3, 1:4, 1:5, 1:6, 1:7, 1:8, 1:9, об 1:10, около 1:15, 1:20, 1:25, около около 1:30, 1:35, 1:40, около около 1:50, около 1:60, около 1:70, около 1:80, около 1:90, 1:100, 1:125, 1:150, 1:175, 1:200, около 1:300, 1:400, 1:500, 1:1000, 1:10 000, 1:100 000, или около от 1:1000000).
В некоторых вариантах осуществления, количество копий опухолевого антигена на неопухолевую клетку составляет от 101 до 106 (например, от 101 до 106, от 101 до 105, от 101 до 104, от 101 до 103, от 101 до 102, от 102 до 106, от 102 до 105, от 102 до 104, от 102 до 103, от 103 до 106, от 103 до 105, от 103 до 104, от 104 до 106, от 104 до 105 или от 105 до 106, например, около 101, 102, 103, 104, 105 или 106). В некоторых вариантах осуществления данного изобретения количество копий опухолевого антигена на клетку опухоли составляет от 102 до 107 (например, от 102 до 107, от 102 до 106, от 102 до 105, от 102 до 104, от 102 до 103, от 103 до 107, от 103 до 106, от 103 до 105, от 103 до 104, от 104 до 107, от 104 до 106, от 104 до 105, от 105 до 107, от 105 до 106 или от 106 до 107, например, около 102, 103, 104, 105, 106 или 107).
В некоторых вариантах осуществления данного изобретения количество копий опухолевого антигена от 101 до 106 на неопухолевую клетку и от 102 до 108 на опухолевую клетку (например, от 102 до 105 на неопухолевую клетку и от 103 до 107 на опухолевую клетку, от 102 до 105 на неопухолевую клетку и от 104 до 107 на опухолевую клетку, от 103 до 105 на неопухолевую клетку и от 105 до 107 на опухолевую клетку, от 103 до 104 на неопухолевую клетку и от 105 до 106 на опухолевую клетку, или от 104 до 105 на неопухолевую клетку и от 106 до 107 на опухолевую клетку).
В некоторых вариантах осуществления, количество копий опухолевого антигена (например, среднее количество копий опухолевого антигена, например, количество копий HER2, например, среднее количество копий HER2) составляет от 101 до 2,0×105 на неопухолевую клетку и по меньшей мере 2,0×105 на опухолевую клетку.
Опухолевые клетки, связанные антигенсвязывающей молекулой по данному изобретению могут экспрессировать HER2 в количестве копий (например, в среднем количестве копий) по меньшей мере 200000 на клетку (например, по меньшей мере 250000 копий HER2 на клетку, по меньшей мере 300000 копий HER2 на клетку, по меньшей мере 400000 копий HER2 на клетку, по меньшей мере 500000 копий HER2 на клетку, по меньшей мере 600000 копий HER2 на клетку, по меньшей мере 700000 копий HER2 на клетку, по меньшей мере 750000 копий HER2 на клетку, по меньшей мере 800000 копий HER2 на клетку по меньшей мере 900000 копий HER2 на клетку, по меньшей мере 1000000 копий HER2 на клетку, по меньшей мере 1200000 копий HER2 на клетку, по меньшей мере 1500000 копий HER2 на клетку, по меньшей мере 2000000 копий HER2 на клетку, по меньшей мере 2500000 копий HER2 на клетку, в не менее 3000000 копий HER2 на клетку, или более, например, от 200000 до 3000000 копий HER2 на клетку, от 250000 до 2500000 копий HER2 на клетку, от 300000 до 2000000 копий HER2 на клетку, от 400000 до 1500000 копий HER2 на клетку, или из 500000 до 1000000 копий HER2 на клетку, например, от 200000 до 1000000 копий HER2 на клетку (например, от 200000 до 250000 копий HER2 на клетку, от 250000 до 300000 копий HER2 на клетку, от 300000 до 400000 копий HER2 на клетку, от 400000 до 500000 копий HER2 на клетку, от 500000 до 750000 копий HER2 на клетку, или от 750000 до 1000000 копий HER2 на клетку) или от 1000000 до 3000000 копий HER2 на клетку (например, от 1000000 до 1500000 копий HER2 на клетку, от 1500000 до 2000000 копий HER2 на клетку, от 2000000 до 2500000 копий HER2 на клетку, или от 2500000 до 3000000 копий HER2 на клетку). Таким образом, HER2-позитивные опухолевые клетки, имеющие какие- или из указанных выше характеристик экспрессии HER2 могут быть преимущественно уничтожены (например, избирательно уничтожены) с помощью Т-клеток после связывания антигенсвязывающей молекулы по данному изобретению, по сравнению с неопухолевыми клетками, которые имеют низкую или отсутствующую экспрессию HER2 (например, менее чем 200000 копий HER2 на клетку, например, от 0 до 200000 копий HER2 на клетку, от 0 до 150000 копий HER2 на клетку, от 0 до 100000 копий HER2 на клетку, от 0 до 50000 копий HER2 на клетку, от 0 до 20000 копий HER2 на клетку, от 0 до 10000 копий HER2 на клетку, от 0 до 5000 копий HER2 на клетку, или от 0 до 1000 копий HER2 на клетку).
Количество копий опухолевого антигена (например, среднее количество копий опухолевого антигена, например, количество копий HER2, например, среднее количество копий HER2) может быть измерено с использованием любых подходящих средств, известных в данной области техники или описанных в данном документе. Например, количество копий HER2 может быть измерено с помощью флуоресцентного количественного метода проточной цитометрии (например, с использованием гранул известных молекул эквивалентного растворимого флуорохрома (MESF)).
В некоторых вариантах осуществления аффинность моновалентного связывания (KD) второго антигенсвязывающего фрагмента и/или третьего антигенсвязывающего фрагмента, составляет от 10 нМ до 100 нМ (например, от 20 нМ до 90 нМ, 30 нМ до 80 нМ, от 40 нМ до 60 нМ, например, от 25 нМ до 55 нМ). В одном варианте осуществления данного изобретения аффинность моновалентного связывания (KD) второго антигенсвязывающего фрагмента и/или третьего антигенсвязывающего фрагмента составляет от 20 нМ до 50 нМ. В одном варианте осуществления данного изобретения аффинность моновалентного связывания (KD) второго антигенсвязывающего фрагмента и третьего антигенсвязывающего фрагмента составляет от 20 нМ до 50 нМ. В некоторых вариантах осуществления данного изобретения, скорость моновалентной диссоциации второго антигенсвязывающего фрагмента и/или третьего антигенсвязывающего фрагмента составляет от 10-3/секунду до 10-1/секунду (например, от 10-2/секунду до 30-2/секунду).
В некоторых вариантах осуществления первый антиген-мишень представляет собой активирующий Т-клетки антиген, такой, как CD3. Различные агенты, связывающие антигены Т-клеток, известны в данной области техники и пригодны для использования как часть данного изобретения. Например, в некоторых вариантах осуществления данного изобретения, подходящий первый антигенсвязывающий фрагмент представляет собой клон антитела 40G5c или его фрагмент и/или его вариант, например, как описано в публикации США №2015/0166661, которая включена в данное описание в качестве ссылки во всей своей полноте. В конкретных вариантах осуществления первый антигенсвязывающий фрагмент представляет собой анти-CD3-Fab (например, 40G5c), содержащее HVR-H1 из SEQ ID NO: 1, HVR-H2 из SEQ ID NO: 2, HVR-Н3 из SEQ ID NO: 3 HVR-L1, из SEQ ID NO: 4 HVR-L2, из SEQ ID NO: 5, и HVR-L3, из SEQ ID NO: 6. В некоторых вариантах осуществления первый антигенсвязывающий фрагмент представляет собой анти-CD3-Fab-(например, 40G5c), содержащий VH из SEQ ID NO: 7 и VL из SEQ ID NO: 8. Аминокислотные последовательности 40G5c также приведены в Таблице 1.

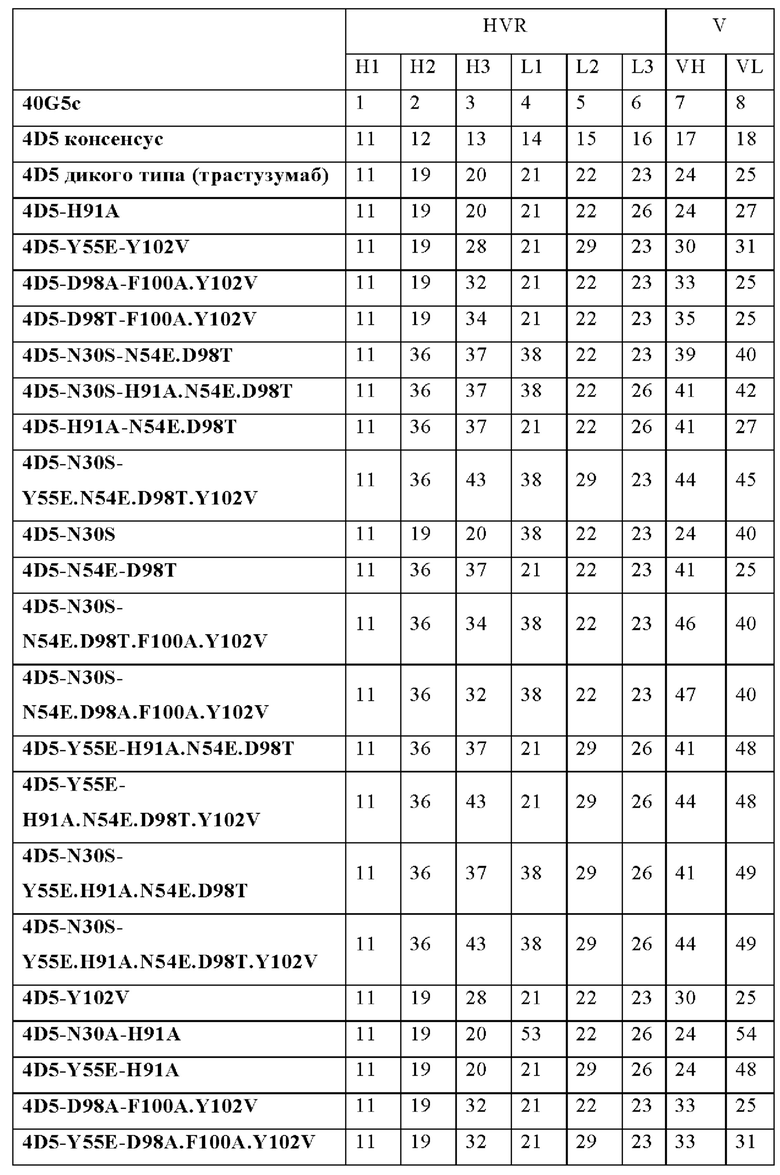
В некоторых вариантах осуществления первый антигенсвязывающий фрагмент связывается с человеческим CD3 полипептидом или полипептидом CD3 яванских макак (яванцев). В некоторых вариантах осуществления данного изобретения полипептид CD3 человека или полипептид CD3 яванского макака представляет собой полипептид CD3ε человека или полипептид CD3ε яванского макака, соответственно. В некоторых вариантах осуществления данного изобретения полипептид CD3 человека или полипептид CD3 яванского макака представляет собой полипептид CD3γ человека или полипептид CD3γ яванского макака, соответственно. Дополнительные антигенсвязывающие фрагменты (например, молекулы Fab), которые связываются с CD3, известны в данной области и описаны, например, в публикации США 2015/0166661, и могут быть адаптированы для применения в качестве части данного изобретения.
В некоторых вариантах осуществления моновалентная KD первого антигенсвязывающего фрагмента по отношению к полипептиду CD3ε человека составляет 250 нМ или меньше. В некоторых вариантах осуществления анти-CD3 антитело связывает полипептид CD3ε человека с KD 100 нМ или менее. В некоторых вариантах осуществления анти-CD3 антитело связывает полипептид CD3ε человека с KD 15 нМ или менее. В некоторых вариантах осуществления анти-CD3 антитело связывает полипептид CD3ε человека с KD 10 нМ или менее. В некоторых вариантах осуществления анти-CD3 антитело связывает полипептид CD3ε человека с KD 5 нМ или менее. В некоторых вариантах осуществления моновалентная KD первого антигенсвязывающего фрагмента, составляет от 10 нМ до 100 нМ (например, от 20 нМ до 90 нМ, от 20 нМ до 80 нМ, от 30 нМ до 70 нМ, или от 40 нМ до 60 нМ).
В некоторых вариантах осуществления второй антиген-мишень клетки представляет собой опухолевый антиген.
Опухолевый антиген может быть HER2. Подходящим вторым и/или третьим антигенсвязывающий фрагментом, который связывает HER2 является антитело 4D5, или его фрагмент и/или его вариант. Аминокислотные последовательности 4D5, и варианты его замены, продемонстрированы в Таблице 1 и описаны, например, в публикации США №2015/0166661, которая включена в данное описание в качестве ссылки во всей своей полноте. В одном варианте осуществления, второй и/или третий антигенсвязывающий фрагмент связывается с тем же эпитопом, что и антитело 4D5 (его гуманизированный вариант известен как трастузумаб (HERCEPTIN®; Genentech, Inc., South San Francisco, CA), Molina, et al., Cancer Research 2001, 61 (12): 4744-4749). В одном варианте осуществления, второй и третий антигенсвязывающий фрагмент связывается с тем же эпитопом, что и антитело 4D5.
В одном варианте осуществления, второй и/или третий антигенсвязывающий фрагмент связываются с тем же эпитопом, что и антитело 2С4 (его гуманизированная версия известна как пертузумаб (PERJETA®; Genentech, Inc., South San Francisco, CA), Franklin et al. Cancer Cell 2004, 5: 317-328). В одном варианте осуществления, второй и третий антигенсвязывающий фрагмент связывается с тем же эпитопом, что и антитело 2С4.
В одном варианте осуществления, второй и/или третий антигенсвязывающий фрагмент связывается с тем же эпитопом, что и антитело 7С2 (патент США N 9518118). В одном варианте осуществления, второй и третий антигенсвязывающий фрагмент связывается с тем же эпитопом, что и антитело 7С2.
Фиг. 36 демонстрирует кристаллическую структуру ECD HER2 и выделяет области, с которыми различные HER2 антитела связываются. 4D5 связывается с эпитопом в области IV HER2, который является областью белка, расположенной ближе всего к клеточной мембране. 2С4 связывается с эпитопом в домене II HER2, что составляет 50 ангстрем от области, с которой связывается hu4D5. 7С2 связывается с эпитопом в области I HER2, который расположен в 100 ангстремах от области HER2, с которой связывается hu4D5.
В одном варианте осуществления, второй и/или третий антигенсвязывающий фрагмент связываются с доменом IV HER2. В одном варианте осуществления, второй и третий антигенсвязывающий фрагмент связываются с доменом IV HER2. В одном варианте осуществления, второй и/или третий антигенсвязывающий фрагмент связываются с доменом II HER2. В одном варианте осуществления, второй и третий антигенсвязывающий фрагмент связываются с доменом II HER2. В одном варианте осуществления, второй и/или третий антигенсвязывающий фрагмент связывается с доменом I HER2. В одном варианте осуществления, второй и третий антигенсвязывающий фрагмент связывается с доменом I HER2. В одном варианте осуществления второй связывающий фрагмент связывается с доменом IV HER2, и третий антигенсвязывающий фрагмент связывается с доменом I HER2.
В одном варианте осуществления второй связывающий фрагмент связывается с доменом IV HER2, и третий антигенсвязывающий фрагмент связывается с доменом II HER2.
В одном варианте осуществления второй связывающий фрагмент связывается с доменом II HER2, и третий антигенсвязывающий фрагмент связывается с доменом I HER2.
В некоторых вариантах осуществления биспецифичная антигенсвязывающая молекула по любому из предшествующих вариантов осуществления, имеет VHA-область, содержащую одну, две или все три из следующих HVR: (a) HVR-H1, содержащую аминокислотную последовательность из SEQ ID NO: 1; (b) HVR-H2, содержащую аминокислотную последовательность из SEQ ID NO: 2; и (с) HVR-Н3, содержащую аминокислотную последовательность из SEQ ID NO: 3; В некоторых вариантах осуществления VHA-область содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности с SEQ ID NO: 7 (например, по меньшей мере 96% идентичности последовательности с SEQ ID NO: 7 по меньшей мере 97% идентичности последовательности с SEQ ID NO: 7 по меньшей мере 98% идентичности последовательности с SEQ ID NO: 7 по меньшей мере 99% идентичности последовательности с SEQ ID NO: 7 или 100% идентичности последовательности с SEQ ID NO: 7). В некоторых вариантах осуществления данного изобретения VHA-область содержит аминокислотную последовательность SEQ ID NO: 7. В некоторых вариантах осуществления VLA-область содержит одну, две или все три из следующих HVR: (a) HVR-L1, содержащую аминокислотную последовательность из SEQ ID NO: 4; (b) HVR-L2, содержащую аминокислотную последовательность из SEQ ID NO: 5; и (с) HVR-L3, содержащую аминокислотную последовательность из SEQ ID NO: 6; В некоторых вариантах осуществления VLA-область содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности с SEQ ID NO: 8 (например, по меньшей мере 96% идентичности последовательности с SEQ ID NO: 8 по меньшей мере 97% идентичности последовательности с SEQ ID NO: 8 по меньшей мере 98% идентичности последовательности с SEQ ID NO: 8 по меньшей мере 99% идентичности последовательности с SEQ ID NO: 8 или 100% идентичности последовательности с SEQ ID NO: 8). В некоторых вариантах осуществления данного изобретения VLA-область содержит аминокислотную последовательность SEQ ID NO: 8. Например, в некоторых вариантах осуществления биспецифичная антигенсвязывающая молекула представляет собой анти-CD3 биспецифичную антигенсвязывающую молекулу (например, анти-CD3/HER2 1Fab-IgG TDB, например, анти-CD3/HER2 1Fab-IgG TDB, имеющую 40G5c CD3-связывающий домен).
В некоторых вариантах осуществления данного изобретения VHA содержит следующие HVR: (a) HVR-H1, содержащую аминокислотную последовательность из SEQ ID NO: 1; (b) HVR-H2, содержащую аминокислотную последовательность из SEQ ID NO: 2; и (с) HVR-H3, содержащую аминокислотную последовательность из SEQ ID NO: 3; и VLA содержит следующие HVR: (d) HVR-L1, содержащую аминокислотную последовательность из SEQ ID NO: 4; (е) HVR-L2, содержащую аминокислотную последовательность из SEQ ID NO: 5; и (f) HVR-L3, содержащую аминокислотную последовательность из SEQ ID NO: 6. В некоторых вариантах осуществления VHA-область содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности с SEQ ID NO: 7 (например, по меньшей мере 96% идентичности последовательности с SEQ ID NO: 7 по меньшей мере 97% идентичности последовательности с SEQ ID NO: 7 по меньшей мере 98% идентичности последовательности с SEQ ID NO: 7 по меньшей мере 99% идентичности последовательности с SEQ ID NO: 7 или 100% идентичности последовательности с SEQ ID NO: 7); и VLA-область содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности с SEQ ID NO: 8 (например, по меньшей мере 96% идентичности последовательности с SEQ ID NO: 8 по меньшей мере 97% идентичности последовательности с SEQ ID NO: 8 по меньшей мере 98% идентичности последовательности с SEQ ID NO: 8 по меньшей мере 99% идентичности последовательности с SEQ ID NO: 8 или 100% идентичности последовательности с SEQ ID NO: 8). В некоторых вариантах осуществления VHA-область содержит аминокислотную последовательность из SEQ ID NO: 7; и VLA-область содержит аминокислотную последовательность из SEQ ID NO: 8. Например, в некоторых вариантах осуществления биспецифичная антигенсвязывающая молекула представляет собой анти-CD3 биспецифичную антигенсвязывающую молекулу (например, анти-CD3/HER2 1Fab-IgG TDB, например, анти-CD3/HER2 1Fab-IgG TDB, имеющую 40G5c CD3-связывающий домен).
В некоторых вариантах осуществления VHB1-область и/или VHB2-область содержит аминокислотную замену в одном, двух, трех, или всех четырех остатках N54, D98, F100 и/или Y102, в соответствии с системой нумерации по Кабату. Например, VH B1-область и/или VHB2-область могут иметь аминокислотную замену в одном, двух, трех, четырех, или всех пяти из следующих остатков: N54E, D98A, D98T, F100A и/или Y102V, в соответствии с системой нумерации по Кабату.
В некоторых вариантах осуществления VLB1-область и/или VLB2-область содержит аминокислотную замену в одном, двух, или всех трех остатках N30, Y55 и/или Н91 в соответствии с системой нумерации по Кабату. Например, VLB1-область и/или VLB2-область может иметь аминокислотную замену в одном, двух или всех трех из следующих остатков: N30S, Y55E и/или Н91А.
В некоторых вариантах осуществления биспецифичная антигенсвязывающая молекула имеет VHB1-область, которая содержит одну, две или все три из следующих HVR: (a) HVR-H1, содержащую аминокислотную последовательность из SEQ ID NO: 11; (b) HVR-H2, содержащую аминокислотную последовательность из SEQ ID NO: 12; и (с) HVR-H3, содержащую аминокислотную последовательность из SEQ ID NO: 13; В некоторых вариантах осуществления VHB1-область содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности с SEQ ID NO: 17 (например, по меньшей мере 96% идентичности последовательности с SEQ ID NO: 17 по меньшей мере 97% идентичности последовательности с SEQ ID NO: 17 по меньшей мере 98% идентичности последовательности с SEQ ID NO: 17 по меньшей мере 99% идентичности последовательности с SEQ ID NO: 17 или 100% идентичности последовательности с SEQ ID NO: 17). В некоторых вариантах осуществления данного изобретения VHB1-область содержит аминокислотную последовательность SEQ ID NO: 17. В некоторых вариантах осуществления VLB1-область содержит одну, две или все три из следующих HVR: (a) HVR-L1, содержащую аминокислотную последовательность из SEQ ID NO: 14; (b) HVR-L2, содержащую аминокислотную последовательность из SEQ ID NO: 15; и (с) HVR-L3, содержащую аминокислотную последовательность из SEQ ID NO: 16; В некоторых вариантах осуществления VLB1-область содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности с SEQ ID NO: 18 (например, по меньшей мере 96% идентичности последовательности с SEQ ID NO: 18 по меньшей мере 97% идентичности последовательности с SEQ ID NO: 18 по меньшей мере 98% идентичности последовательности с SEQ ID NO: 18 по меньшей мере 99% идентичности последовательности с SEQ ID NO: 18 или 100% идентичности последовательности с SEQ ID NO: 18). В некоторых вариантах осуществления данного изобретения VLB1-область содержит аминокислотную последовательность SEQ ID NO: 18.
В некоторых вариантах осуществления данного изобретения VHB1 содержит следующие HVR: (a) HVR-H1, содержащую аминокислотную последовательность из SEQ ID NO: 11; (b) HVR-H2, содержащую аминокислотную последовательность из SEQ ID NO: 12; и (с) HVR-H3, содержащую аминокислотную последовательность из SEQ ID NO: 13; и VLB1 содержит следующие HVR: (d) HVR-L1, содержащую аминокислотную последовательность из SEQ ID NO: 14; (е) HVR-L2, содержащую аминокислотную последовательность из SEQ ID NO: 15; и (1) HVR-L3, содержащую аминокислотную последовательность из SEQ ID NO: 16. В некоторых вариантах осуществления VHB1-область содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности с SEQ ID NO: 17 (например, по меньшей мере 96% идентичности последовательности с SEQ ID NO: 17 по меньшей мере 97% идентичности последовательности с SEQ ID NO: 17 по меньшей мере 98% идентичности последовательности с SEQ ID NO: 17 по меньшей мере 99% идентичности последовательности с SEQ ID NO: 17 или 100% идентичности последовательности с SEQ ID NO: 17); и VLB1-область содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности с SEQ ID NO: 18 (например, по меньшей мере 96% идентичности последовательности с SEQ ID NO: 18 по меньшей мере 97% идентичности последовательности с SEQ ID NO: 18 по меньшей мере 98% идентичности последовательности с SEQ ID NO: 18 по меньшей мере 99% идентичности последовательности с SEQ ID NO: 18 или 100% идентичности последовательности с SEQ ID NO: 18). Например, в некоторых вариантах осуществления VHB1-область содержит аминокислотную последовательность из SEQ ID NO: 17; и VLB1-область содержит аминокислотную последовательность из SEQ ID NO: 18.
В некоторых вариантах осуществления VHB2-область содержит одну, две или все три из следующих HVR: (a) HVR-H1, содержащую аминокислотную последовательность из SEQ ID NO: 11; (b) HVR-H2, содержащую аминокислотную последовательность из SEQ ID NO: 12; и (с) HVR-H3, содержащую аминокислотную последовательность из SEQ ID NO: 13; В некоторых вариантах осуществления VHB2-область содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности с SEQ ID NO: 17 (например, по меньшей мере 96% идентичности последовательности с SEQ ID NO: 17 по меньшей мере 97% идентичности последовательности с SEQ ID NO: 17 по меньшей мере 98% идентичности последовательности с SEQ ID NO: 17 по меньшей мере 99% идентичности последовательности с SEQ ID NO: 17 или 100% идентичности последовательности с SEQ ID NO: 17). В некоторых вариантах осуществления данного изобретения VHB2-область содержит аминокислотную последовательность SEQ ID NO: 17. В некоторых вариантах осуществления VLB2-область содержит одну, две или все три из следующих HVR: (a) HVR-L1, содержащую аминокислотную последовательность из SEQ ID NO: 14; (b) HVR-L2, содержащую аминокислотную последовательность из SEQ ID NO: 15; и (с) HVR-L3, содержащую аминокислотную последовательность из SEQ ID NO: 16; В некоторых вариантах осуществления VLB2-область содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности с SEQ ID NO: 18 (например, по меньшей мере 96% идентичности последовательности с SEQ ID NO: 18 по меньшей мере 97% идентичности последовательности с SEQ ID NO: 18 по меньшей мере 98% идентичности последовательности с SEQ ID NO: 18 по меньшей мере 99% идентичности последовательности с SEQ ID NO: 18 или 100% идентичности последовательности с SEQ ID NO: 18). В некоторых вариантах осуществления данного изобретения VLB2-область содержит аминокислотную последовательность SEQ ID NO: 18.
В некоторых вариантах осуществления данного изобретения VHB2 содержит следующие HVR: (a) HVR-H1, содержащую аминокислотную последовательность из SEQ ID NO: 11; (b) HVR-H2, содержащую аминокислотную последовательность из SEQ ID NO: 12; и (с) HVR-H3, содержащую аминокислотную последовательность из SEQ ID NO: 13; и VLB2 содержит следующие HVR: (d) HVR-L1, содержащую аминокислотную последовательность из SEQ ID NO: 14; (е) HVR-L2, содержащую аминокислотную последовательность из SEQ ID NO: 15; и (f) HVR-L3, содержащую аминокислотную последовательность из SEQ ID NO: 16. В некоторых вариантах осуществления VHB2-область содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности с SEQ ID NO: 17 (например, по меньшей мере 96% идентичности последовательности с SEQ ID NO: 17 по меньшей мере 97% идентичности последовательности с SEQ ID NO: 17 по меньшей мере 98% идентичности последовательности с SEQ ID NO: 17 по меньшей мере 99% идентичности последовательности с SEQ ID NO: 17 или 100% идентичности последовательности с SEQ ID NO: 17); и VLB2-область содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности с SEQ ID NO: 18 (например, по меньшей мере 96% идентичности последовательности с SEQ ID NO: 18 по меньшей мере 97% идентичности последовательности с SEQ ID NO: 18 по меньшей мере 98% идентичности последовательности с SEQ ID NO: 18 по меньшей мере 99% идентичности последовательности с SEQ ID NO: 18 или 100% идентичности последовательности с SEQ ID NO: 18). В некоторых вариантах осуществления VHB2-область содержит аминокислотную последовательность из SEQ ID NO: 17; и VLB2-область содержит аминокислотную последовательность из SEQ ID NO: 18. В некоторых вариантах осуществления VLB1-область и/или VLB2-область содержат аминокислотную замену в Н91. Например, в некоторых вариантах осуществления, остаток Н91 замещен аминокислотой, имеющей неполярную боковую цепь. В некоторых вариантах осуществления VLB1-область и/или VLB2-область содержат аминокислотную замену Н91А. В некоторых вариантах осуществления VLB1-область и/или VLB2-область содержат аминокислотную замену в Y55. Например, в некоторых вариантах осуществления, остаток Y55 замещен аминокислотой, имеющей кислотную боковую цепь. В некоторых вариантах осуществления VLB1-область и/или VLB2-область содержат аминокислотную замену Y55E. В некоторых вариантах осуществления VHB1-область и/или VHB2-область содержат аминокислотную замену в F100 и/или Y102. Например, в некоторых вариантах осуществления, остаток F100 и/или остаток Y102 замещен аминокислотой, имеющей неполярную боковую цепь. В некоторых вариантах осуществления VHB1-область и/или VHB2-область содержат аминокислотную замену F100A и/или Y102V.
В некоторых вариантах осуществления биспецифичные антигенсвязывающие фрагменты, VLB1-область и/или VLB2-область содержат один или более остатков улучшающих стабильность, например, один или более остатков улучшающих стабильность, содержащих аминокислотную замену N30S. Дополнительно или альтернативно, VHB1-область и/или VHB2-область может иметь один или более остатков улучшающих стабильность, например, один или более остатков улучшающих стабильность, содержащих одну или более аминокислотных замен, выбранных из группы, состоящей из N54E, D98A и D98T.
Биспецифичная антигенсвязывающая молекула может иметь мутацию в остатке Н91 легкой цепи второго и/или третьего антигенсвязывающего фрагмента (например, Н91А). Например, в некоторых вариантах осуществления биспецифичная антигенсвязывающая молекула имеет VHB1-область, которая содержит одну, две или все три из следующих HVR: (a) HVR-H1, содержащую аминокислотную последовательность из SEQ ID NO: 11; (b) HVR-H2, содержащую аминокислотную последовательность из SEQ ID NO: 19; и (с) HVR-Н3, содержащую аминокислотную последовательность из SEQ ID NO: 20; В некоторых вариантах осуществления VHB1-область содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности с SEQ ID NO: 24 (например, по меньшей мере 96% идентичности последовательности с SEQ ID NO: 24 по меньшей мере 97% идентичности последовательности с SEQ ID NO: 24 по меньшей мере 98% идентичности последовательности с SEQ ID NO: 24 по меньшей мере 99% идентичности последовательности с SEQ ID NO: 24 или 100% идентичности последовательности с SEQ ID NO: 24). В некоторых вариантах осуществления данного изобретения VHB1-область содержит аминокислотную последовательность SEQ ID NO: 24. В некоторых вариантах осуществления VLB1-область содержит одну, две или все три из следующих HVR: (a) HVR-L1, содержащую аминокислотную последовательность из SEQ ID NO: 21; (b) HVR-L2, содержащую аминокислотную последовательность из SEQ ID NO: 22; и (с) HVR-L3, содержащую аминокислотную последовательность из SEQ ID NO: 26; В некоторых вариантах осуществления VLB1-область содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности с SEQ ID NO: 27 (например, по меньшей мере 96% идентичности последовательности с SEQ ID NO: 27 по меньшей мере 97% идентичности последовательности с SEQ ID NO: 27 по меньшей мере 98% идентичности последовательности с SEQ ID NO: 27 по меньшей мере 99% идентичности последовательности с SEQ ID NO: 27 или 100% идентичности последовательности с SEQ ID NO: 27). В некоторых вариантах осуществления данного изобретения VLB1-область содержит аминокислотную последовательность SEQ ID NO: 27.
В некоторых вариантах осуществления данного изобретения VHB1 содержит следующие HVR: (a) HVR-H1, содержащую аминокислотную последовательность из SEQ ID NO: 11; (b) HVR-H2, содержащую аминокислотную последовательность из SEQ ID NO: 19; и (с) HVR-H3, содержащую аминокислотную последовательность из SEQ ID NO: 20; и VLB1 содержит следующие HVR: (d) HVR-L1, содержащую аминокислотную последовательность из SEQ ID NO: 21; (е) HVR-L2, содержащую аминокислотную последовательность из SEQ ID NO: 22; и (f) HVR-L3, содержащую аминокислотную последовательность из SEQ ID NO: 26. В некоторых вариантах осуществления VHB1-область содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности с SEQ ID NO: 24 (например, по меньшей мере 96% идентичности последовательности с SEQ ID NO: 24 по меньшей мере 97% идентичности последовательности с SEQ ID NO: 24 по меньшей мере 98% идентичности последовательности с SEQ ID NO: 24 по меньшей мере 99% идентичности последовательности с SEQ ID NO: 24 или 100% идентичности последовательности с SEQ ID NO: 24); и VLB1-область содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности с SEQ ID NO: 27 (например, по меньшей мере 96% идентичности последовательности с SEQ ID NO: 27 по меньшей мере 97% идентичности последовательности с SEQ ID NO: 27 по меньшей мере 98% идентичности последовательности с SEQ ID NO: 27 по меньшей мере 99% идентичности последовательности с SEQ ID NO: 27 или 100% идентичности последовательности с SEQ ID NO: 27). Например, в некоторых вариантах осуществления VHB1-область содержит аминокислотную последовательность из SEQ ID NO: 24; и VLB1-область содержит аминокислотную последовательность из SEQ ID NO: 27.
В некоторых вариантах осуществления VHB2-область содержит одну, две или все три из следующих HVR: (a) HVR-H1, содержащую аминокислотную последовательность из SEQ ID NO: 11; (b) HVR-H2, содержащую аминокислотную последовательность из SEQ ID NO: 19; и (с) HVR-H3, содержащую аминокислотную последовательность из SEQ ID NO: 20; В некоторых вариантах осуществления VHB2-область содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности с SEQ ID NO: 24 (например, по меньшей мере 96% идентичности последовательности с SEQ ID NO: 24 по меньшей мере 97% идентичности последовательности с SEQ ID NO: 24 по меньшей мере 98% идентичности последовательности с SEQ ID NO: 24 по меньшей мере 99% идентичности последовательности с SEQ ID NO: 24 или 100% идентичности последовательности с SEQ ID NO: 24). В некоторых вариантах осуществления данного изобретения VHB2-область содержит аминокислотную последовательность SEQ ID NO: 24. В некоторых вариантах осуществления VLB2-область содержит одну, две или все три из следующих HVR: (a) HVR-L1, содержащую аминокислотную последовательность из SEQ ID NO: 21; (b) HVR-L2, содержащую аминокислотную последовательность из SEQ ID NO: 22; и (с) HVR-L3, содержащую аминокислотную последовательность из SEQ ID NO: 26; В некоторых вариантах осуществления VLB2-область содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности с SEQ ID NO: 27 (например, по меньшей мере 96% идентичности последовательности с SEQ ID NO: 18 по меньшей мере 97% идентичности последовательности с SEQ ID NO: 27 по меньшей мере 98% идентичности последовательности с SEQ ID NO: 27 по меньшей мере 99% идентичности последовательности с SEQ ID NO: 27 или 100% идентичности последовательности с SEQ ID NO: 27). В некоторых вариантах осуществления данного изобретения VLB2-область содержит аминокислотную последовательность SEQ ID NO: 27.
В некоторых случаях VHB2 содержит следующие HVR: (a) HVR-H1, содержащую аминокислотную последовательность из SEQ ID NO: 11; (b) HVR-H2, содержащую аминокислотную последовательность из SEQ ID NO: 19; и (с) HVR-Н3, содержащую аминокислотную последовательность из SEQ ID NO: 20; и VLB2 содержит следующие HVR: (d) HVR-L1, содержащую аминокислотную последовательность из SEQ ID NO: 21; (е) HVR-L2, содержащую аминокислотную последовательность из SEQ ID NO: 22; и (f) HVR-L3, содержащую аминокислотную последовательность из SEQ ID NO: 26. В некоторых вариантах осуществления VHB2-область содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности с SEQ ID NO: 24 (например, по меньшей мере 96% идентичности последовательности с SEQ ID NO: 24 по меньшей мере 97% идентичности последовательности с SEQ ID NO: 24 по меньшей мере 98% идентичности последовательности с SEQ ID NO: 24 по меньшей мере 99% идентичности последовательности с SEQ ID NO: 24 или 100% идентичности последовательности с SEQ ID NO: 24); и VLB2-область содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности с SEQ ID NO: 27 (например, по меньшей мере 96% идентичности последовательности с SEQ ID NO: 27 по меньшей мере 97% идентичности последовательности с SEQ ID NO: 27 по меньшей мере 98% идентичности последовательности с SEQ ID NO: 27 по меньшей мере 99% идентичности последовательности с SEQ ID NO: 27 или 100% идентичности последовательности с SEQ ID NO: 27). В некоторых вариантах осуществления VHB2-область содержит аминокислотную последовательность из SEQ ID NO: 24; и VLB2-область содержит аминокислотную последовательность из SEQ ID NO: 27. Например, в некоторых вариантах осуществления биспецифичные антигенсвязывающие молекулы представляют собой биспецифичные антигенсвязывающие молекулы анти-HER2 (например, 4D5 H91A-1Fab-IgG TDB). В других случаях, биспецифичные антигенсвязывающие молекулы могут иметь мутации остатков D98, F100 и Y102 тяжелой цепи второго и/или третьего антигенсвязывающего фрагмента (например, D98A, F100A и Y102V). В некоторых вариантах осуществления биспецифичная антигенсвязывающая молекула имеет VHB1-область, которая содержит одну, две или все три из следующих HVR: (а) HVR-H1, содержащую аминокислотную последовательность из SEQ ID NO: 11; (b) HVR-H2, содержащую аминокислотную последовательность из SEQ ID NO: 19; и (с) HVR-H3, содержащую аминокислотную последовательность из SEQ ID NO: 32; В некоторых вариантах осуществления VHB1-область содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности с SEQ ID NO: 33 (например, по меньшей мере 96% идентичности последовательности с SEQ ID NO: 33 по меньшей мере 97% идентичности последовательности с SEQ ID NO: 33 по меньшей мере 98% идентичности последовательности с SEQ ID NO: 33 по меньшей мере 99% идентичности последовательности с SEQ ID NO: 33 или 100% идентичности последовательности с SEQ ID NO: 33). В некоторых вариантах осуществления данного изобретения VHB1-область содержит аминокислотную последовательность SEQ ID NO: 33. В некоторых вариантах осуществления VLB1-область содержит одну, две или все три из следующих HVR: (a) HVR-L1, содержащую аминокислотную последовательность из SEQ ID NO: 21; (b) HVR-L2, содержащую аминокислотную последовательность из SEQ ID NO: 22; и (с) HVR-L3, содержащую аминокислотную последовательность из SEQ ID NO: 23; В некоторых вариантах осуществления VLB1-область содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности с SEQ ID NO: 25 (например, по меньшей мере 96% идентичности последовательности с SEQ ID NO: 25 по меньшей мере 97% идентичности последовательности с SEQ ID NO: 25 по меньшей мере 98% идентичности последовательности с SEQ ID NO: 25 по меньшей мере 99% идентичности последовательности с SEQ ID NO: 25 или 100% идентичности последовательности с SEQ ID NO: 25). В некоторых вариантах осуществления данного изобретения VLB1-область содержит аминокислотную последовательность SEQ ID NO: 25.
В некоторых вариантах осуществления данного изобретения VHB1 содержит следующие HVR: (a) HVR-H1, содержащую аминокислотную последовательность из SEQ ID NO: 11; (b) HVR-H2, содержащую аминокислотную последовательность из SEQ ID NO: 19; и (с) HVR-H3, содержащую аминокислотную последовательность из SEQ ID NO: 32; и VLB1 содержит следующие HVR: (d) HVR-L1, содержащую аминокислотную последовательность из SEQ ID NO: 21; (е) HVR-L2, содержащую аминокислотную последовательность из SEQ ID NO: 22; и (f) HVR-L3, содержащую аминокислотную последовательность из SEQ ID NO: 23. В некоторых вариантах осуществления VHB1-область содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности с SEQ ID NO: 33 (например, по меньшей мере 96% идентичности последовательности с SEQ ID NO: 33 по меньшей мере 97% идентичности последовательности с SEQ ID NO: 33 по меньшей мере 98% идентичности последовательности с SEQ ID NO: 33 по меньшей мере 99% идентичности последовательности с SEQ ID NO: 33 или 100% идентичности последовательности с SEQ ID NO: 33); и VLB1-область содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности с SEQ ID NO: 25 (например, по меньшей мере 96% идентичности последовательности с SEQ ID NO: 25 по меньшей мере 97% идентичности последовательности с SEQ ID NO: 25 по меньшей мере 98% идентичности последовательности с SEQ ID NO: 25 по меньшей мере 99% идентичности последовательности с SEQ ID NO: 25 или 100% идентичности последовательности с SEQ ID NO: 25). Например, в некоторых вариантах осуществления VHB1-область содержит аминокислотную последовательность из SEQ ID NO: 33; и VLB1-область содержит аминокислотную последовательность из SEQ ID NO: 25.
В некоторых вариантах осуществления VHB2-область содержит одну, две или все три из следующих HVR: (a) HVR-H1, содержащую аминокислотную последовательность из SEQ ID NO: 11; (b) HVR-H2, содержащую аминокислотную последовательность из SEQ ID NO: 19; и (с) HVR-H3, содержащую аминокислотную последовательность из SEQ ID NO: 32; В некоторых вариантах осуществления VHB2-область содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности с SEQ ID NO: 33 (например, по меньшей мере 96% идентичности последовательности с SEQ ID NO: 33 по меньшей мере 97% идентичности последовательности с SEQ ID NO: 33 по меньшей мере 98% идентичности последовательности с SEQ ID NO: 33 по меньшей мере 99% идентичности последовательности с SEQ ID NO: 33 или 100% идентичности последовательности с SEQ ID NO: 33). В некоторых вариантах осуществления данного изобретения VHB2-область содержит аминокислотную последовательность SEQ ID NO: 33. В некоторых вариантах осуществления VLB2-область содержит одну, две или все три из следующих HVR: (a) HVR-L1, содержащую аминокислотную последовательность из SEQ ID NO: 21; (b) HVR-L2, содержащую аминокислотную последовательность из SEQ ID NO: 22; и (с) HVR-L3, содержащую аминокислотную последовательность из SEQ ID NO: 23; В некоторых вариантах осуществления VLB2-область содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности с SEQ ID NO: 25 (например, по меньшей мере 96% идентичности последовательности с SEQ ID NO: 25 по меньшей мере 97% идентичности последовательности с SEQ ID NO: 25 по меньшей мере 98% идентичности последовательности с SEQ ID NO: 25 по меньшей мере 99% идентичности последовательности с SEQ ID NO: 25 или 100% идентичности последовательности с SEQ ID NO: 25). В некоторых вариантах осуществления данного изобретения VLB2-область содержит аминокислотную последовательность SEQ ID NO: 25.
В некоторых вариантах осуществления данного изобретения VHB2 содержит следующие HVR: (a) HVR-H1, содержащую аминокислотную последовательность из SEQ ID NO: 11; (b) HVR-H2, содержащую аминокислотную последовательность из SEQ ID NO: 19; и (с) HVR-H3, содержащую аминокислотную последовательность из SEQ ID NO: 32; и VLB2 содержит следующие HVR: (d) HVR-L1, содержащую аминокислотную последовательность из SEQ ID NO: 21; (е) HVR-L2, содержащую аминокислотную последовательность из SEQ ID NO: 22; и (f) HVR-L3, содержащую аминокислотную последовательность из SEQ ID NO: 23. В некоторых вариантах осуществления VHB2-область содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности с SEQ ID NO: 33 (например, по меньшей мере 96% идентичности последовательности с SEQ ID NO: 33 по меньшей мере 97% идентичности последовательности с SEQ ID NO: 33 по меньшей мере 98% идентичности последовательности с SEQ ID NO: 33 по меньшей мере 99% идентичности последовательности с SEQ ID NO: 33 или 100% идентичности последовательности с SEQ ID NO: 33); и VLB2-область содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности с SEQ ID NO: 25 (например, по меньшей мере 96% идентичности последовательности с SEQ ID NO: 25 по меньшей мере 97% идентичности последовательности с SEQ ID NO: 25 по меньшей мере 98% идентичности последовательности с SEQ ID NO: 25 по меньшей мере 99% идентичности последовательности с SEQ ID NO: 25 или 100% идентичности последовательности с SEQ ID NO: 25). В некоторых вариантах осуществления VHB2-область содержит аминокислотную последовательность из SEQ ID NO: 33; и VLB2-область содержит аминокислотную последовательность из SEQ ID NO: 25. Например, в некоторых вариантах осуществления биспецифичные антигенсвязывающие молекулы представляют собой биспецифичные антигенсвязывающие молекулы анти-HER2 (например, 4D5 D98A.F100A.Y102V-1Fab-IgG TDB).
В других вариантах осуществления биспецифичные антигенсвязывающие молекулы могут иметь мутации в остатках Y55 и Н91 легкой цепи и в остатках N54 и D98 тяжелой цепи второго и/или третьего антигенсвязывающего фрагмента (например, Y55E, Н91А, N54E и D98T). В некоторых вариантах осуществления биспецифичная антигенсвязывающая молекула имеет VHB1-область, которая содержит одну, две или все три из следующих HVR: (a) HVR-H1, содержащую аминокислотную последовательность из SEQ ID NO: 11; (b) HVR-H2, содержащую аминокислотную последовательность из SEQ ID NO: 36; и (с) HVR-Н3, содержащую аминокислотную последовательность из SEQ ID NO: 37; В некоторых вариантах осуществления VHB1-область содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности с SEQ ID NO: 41 (например, по меньшей мере 96% идентичности последовательности с SEQ ID NO: 41 по меньшей мере 97% идентичности последовательности с SEQ ID NO: 41 по меньшей мере 98% идентичности последовательности с SEQ ID NO: 41 по меньшей мере 99% идентичности последовательности с SEQ ID NO: 41 или 100% идентичности последовательности с SEQ ID NO: 41). В некоторых вариантах осуществления данного изобретения VHB1-область содержит аминокислотную последовательность SEQ ID NO: 41. В некоторых вариантах осуществления VLB1-область содержит одну, две или все три из следующих HVR: (a) HVR-L1, содержащую аминокислотную последовательность из SEQ ID NO: 21; (b) HVR-L2, содержащую аминокислотную последовательность из SEQ ID NO: 29; и (с) HVR-L3, содержащую аминокислотную последовательность из SEQ ID NO: 26; В некоторых вариантах осуществления VLB1-область содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности с SEQ ID NO: 48 (например, по меньшей мере 96% идентичности последовательности с SEQ ID NO: 48 по меньшей мере 97% идентичности последовательности с SEQ ID NO: 48 по меньшей мере 98% идентичности последовательности с SEQ ID NO: 48 по меньшей мере 99% идентичности последовательности с SEQ ID NO: 48 или 100% идентичности последовательности с SEQ ID NO: 48). В некоторых вариантах осуществления данного изобретения VLB1-область содержит аминокислотную последовательность SEQ ID NO: 48.
В некоторых вариантах осуществления данного изобретения VHB1 содержит следующие HVR: (a) HVR-H1, содержащую аминокислотную последовательность из SEQ ID NO: 11; (b) HVR-H2, содержащую аминокислотную последовательность из SEQ ID NO: 36; и (с) HVR-H3, содержащую аминокислотную последовательность из SEQ ID NO: 37; и VLB1 содержит следующие HVR: (d) HVR-L1, содержащую аминокислотную последовательность из SEQ ID NO: 21; (е) HVR-L2, содержащую аминокислотную последовательность из SEQ ID NO: 29; и (f) HVR-L3, содержащую аминокислотную последовательность из SEQ ID NO: 26. В некоторых вариантах осуществления VHB1-область содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности с SEQ ID NO: 41 (например, по меньшей мере 96% идентичности последовательности с SEQ ID NO: 41 по меньшей мере 97% идентичности последовательности с SEQ ID NO: 41 по меньшей мере 98% идентичности последовательности с SEQ ID NO: 41 по меньшей мере 99% идентичности последовательности с SEQ ID NO: 41 или 100% идентичности последовательности с SEQ ID NO: 41); и VLB1-область содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности с SEQ ID NO: 48 (например, по меньшей мере 96% идентичности последовательности с SEQ ID NO: 48 по меньшей мере 97% идентичности последовательности с SEQ ID NO: 48 по меньшей мере 98% идентичности последовательности с SEQ ID NO: 48 по меньшей мере 99% идентичности последовательности с SEQ ID NO: 48 или 100% идентичности последовательности с SEQ ID NO: 48). Например, в некоторых вариантах осуществления VHB1-область содержит аминокислотную последовательность из SEQ ID NO: 41; и VLB1-область содержит аминокислотную последовательность из SEQ ID NO: 48.
В некоторых вариантах осуществления VHB2-область содержит одну, две или все три из следующих HVR: (a) HVR-H1, содержащую аминокислотную последовательность из SEQ ID NO: 11; (b) HVR-H2, содержащую аминокислотную последовательность из SEQ ID NO: 36; и (с) HVR-H3, содержащую аминокислотную последовательность из SEQ ID NO: 37; В некоторых вариантах осуществления VHB2-область содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности с SEQ ID NO: 41 (например, по меньшей мере 96% идентичности последовательности с SEQ ID NO: 41 по меньшей мере 97% идентичности последовательности с SEQ ID NO: 41 по меньшей мере 98% идентичности последовательности с SEQ ID NO: 41 по меньшей мере 99% идентичности последовательности с SEQ ID NO: 41 или 100% идентичности последовательности с SEQ ID NO: 41). В некоторых вариантах осуществления данного изобретения VHB2-область содержит аминокислотную последовательность SEQ ID NO: 41. В некоторых вариантах осуществления VLB2-область содержит одну, две или все три из следующих HVR: (a) HVR-L1, содержащую аминокислотную последовательность из SEQ ID NO: 21; (b) HVR-L2, содержащую аминокислотную последовательность из SEQ ID NO: 29; и (с) HVR-L3, содержащую аминокислотную последовательность из SEQ ID NO: 26; В некоторых вариантах осуществления VLB2-область содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности с SEQ ID NO: 48 (например, по меньшей мере 96% идентичности последовательности с SEQ ID NO: 48 по меньшей мере 97% идентичности последовательности с SEQ ID NO: 48 по меньшей мере 98% идентичности последовательности с SEQ ID NO: 48 по меньшей мере 99% идентичности последовательности с SEQ ID NO: 48 или 100% идентичности последовательности с SEQ ID NO: 48). В некоторых вариантах осуществления данного изобретения VLB2-область содержит аминокислотную последовательность SEQ ID NO: 48.
В некоторых вариантах осуществления данного изобретения VHB2 содержит следующие HVR: (a) HVR-H1, содержащую аминокислотную последовательность из SEQ ID NO: 11; (b) HVR-H2, содержащую аминокислотную последовательность из SEQ ID NO: 36; и (с) HVR-H3, содержащую аминокислотную последовательность из SEQ ID NO: 37; и VLB2 содержит следующие HVR: (d) HVR-L1, содержащую аминокислотную последовательность из SEQ ID NO: 21; (е) HVR-L2, содержащую аминокислотную последовательность из SEQ ID NO: 29; и (f) HVR-L3, содержащую аминокислотную последовательность из SEQ ID NO: 26. В некоторых вариантах осуществления VHB2-область содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности с SEQ ID NO: 41 (например, по меньшей мере 96% идентичности последовательности с SEQ ID NO: 41 по меньшей мере 97% идентичности последовательности с SEQ ID NO: 41 по меньшей мере 98% идентичности последовательности с SEQ ID NO: 41 по меньшей мере 99% идентичности последовательности с SEQ ID NO: 41 или 100% идентичности последовательности с SEQ ID NO: 41); и VLB2-область содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности с SEQ ID NO: 48 (например, по меньшей мере 96% идентичности последовательности с SEQ ID NO: 48 по меньшей мере 97% идентичности последовательности с SEQ ID NO: 48 по меньшей мере 98% идентичности последовательности с SEQ ID NO: 48 по меньшей мере 99% идентичности последовательности с SEQ ID NO: 48 или 100% идентичности последовательности с SEQ ID NO: 48). В некоторых вариантах осуществления VHB2-область содержит аминокислотную последовательность из SEQ ID NO: 41; и VLB2-область содержит аминокислотную последовательность из SEQ ID NO: 48. Например, в некоторых вариантах осуществления биспецифичные антигенсвязывающие молекулы представляют собой биспецифичные антигенсвязывающие молекулы анти-HER2 (например, 4D5 Y55E.H91A.N54E.D98T-1Fab-IgG TDB).
В других вариантах осуществления биспецифичные антигенсвязывающие молекулы могут иметь мутации в остатках Y55 и Н91 легкой цепи и в остатках N54, D98 и Y102 тяжелой цепи второго и/или третьего антигенсвязывающего фрагмента (например, Y55E, Н91А, N54E, D98T и Y102). В некоторых вариантах осуществления биспецифичная антигенсвязывающая молекула имеет VHB1-область, которая содержит одну, две или все три из следующих HVR: (a) HVR-H1, содержащую аминокислотную последовательность из SEQ ID NO: 11; (b) HVR-H2, содержащую аминокислотную последовательность из SEQ ID NO: 36; и (с) HVR-H3, содержащую аминокислотную последовательность из SEQ ID NO: 43; В некоторых вариантах осуществления VHB1-область содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности с SEQ ID NO: 44 (например, по меньшей мере 96% идентичности последовательности с SEQ ID NO: 44 по меньшей мере 97% идентичности последовательности с SEQ ID NO: 44 по меньшей мере 98% идентичности последовательности с SEQ ID NO: 44 по меньшей мере 99% идентичности последовательности с SEQ ID NO: 44 или 100% идентичности последовательности с SEQ ID NO: 44). В некоторых вариантах осуществления данного изобретения VHB1-область содержит аминокислотную последовательность SEQ ID NO: 44. В некоторых вариантах осуществления VLB1-область содержит одну, две или все три из следующих HVR: (a) HVR-L1, содержащую аминокислотную последовательность из SEQ ID NO: 21; (b) HVR-L2, содержащую аминокислотную последовательность из SEQ ID NO: 29; и (с) HVR-L3, содержащую аминокислотную последовательность из SEQ ID NO: 26; В некоторых вариантах осуществления VLB1-область содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности с SEQ ID NO: 48 (например, по меньшей мере 96% идентичности последовательности с SEQ ID NO: 48 по меньшей мере 97% идентичности последовательности с SEQ ID NO: 48 по меньшей мере 98% идентичности последовательности с SEQ ID NO: 48 по меньшей мере 99% идентичности последовательности с SEQ ID NO: 48 или 100% идентичности последовательности с SEQ ID NO: 48). В некоторых вариантах осуществления данного изобретения VLB1-область содержит аминокислотную последовательность SEQ ID NO: 48.
В некоторых вариантах осуществления данного изобретения VHB1 содержит следующие HVR: (a) HVR-H1, содержащую аминокислотную последовательность из SEQ ID NO: 11; (b) HVR-H2, содержащую аминокислотную последовательность из SEQ ID NO: 36; и (с) HVR-H3, содержащую аминокислотную последовательность из SEQ ID NO: 43; и VLB1 содержит следующие HVR: (d) HVR-L1, содержащую аминокислотную последовательность из SEQ ID NO: 21; (е) HVR-L2, содержащую аминокислотную последовательность из SEQ ID NO: 29; и (f) HVR-L3, содержащую аминокислотную последовательность из SEQ ID NO: 26. В некоторых вариантах осуществления VHB1-область содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности с SEQ ID NO: 44 (например, по меньшей мере 96% идентичности последовательности с SEQ ID NO: 44 по меньшей мере 97% идентичности последовательности с SEQ ID NO: 44 по меньшей мере 98% идентичности последовательности с SEQ ID NO: 44 по меньшей мере 99% идентичности последовательности с SEQ ID NO: 44 или 100% идентичности последовательности с SEQ ID NO: 44); и VLB1-область содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности с SEQ ID NO: 48 (например, по меньшей мере 96% идентичности последовательности с SEQ ID NO: 48 по меньшей мере 97% идентичности последовательности с SEQ ID NO: 48 по меньшей мере 98% идентичности последовательности с SEQ ID NO: 48 по меньшей мере 99% идентичности последовательности с SEQ ID NO: 48 или 100% идентичности последовательности с SEQ ID NO: 48). Например, в некоторых вариантах осуществления VHB1-область содержит аминокислотную последовательность из SEQ ID NO: 41; и VLB1-область содержит аминокислотную последовательность из SEQ ID NO: 48.
В некоторых вариантах осуществления VHB2-область содержит одну, две или все три из следующих HVR: (a) HVR-H1, содержащую аминокислотную последовательность из SEQ ID NO: 11; (b) HVR-H2, содержащую аминокислотную последовательность из SEQ ID NO: 36; и (с) HVR-H3, содержащую аминокислотную последовательность из SEQ ID NO: 43; В некоторых вариантах осуществления VHB2-область содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности с SEQ ID NO: 44 (например, по меньшей мере 96% идентичности последовательности с SEQ ID NO: 44 по меньшей мере 97% идентичности последовательности с SEQ ID NO: 44 по меньшей мере 98% идентичности последовательности с SEQ ID NO: 44 по меньшей мере 99% идентичности последовательности с SEQ ID NO: 44 или 100% идентичности последовательности с SEQ ID NO: 44). В некоторых вариантах осуществления данного изобретения VHB2-область содержит аминокислотную последовательность SEQ ID NO: 44. В некоторых вариантах осуществления VLB2-область содержит одну, две или все три из следующих HVR: (a) HVR-L1, содержащую аминокислотную последовательность из SEQ ID NO: 21; (b) HVR-L2, содержащую аминокислотную последовательность из SEQ ID NO: 29; и (с) HVR-L3, содержащую аминокислотную последовательность из SEQ ID NO: 26; В некоторых вариантах осуществления VLB2-область содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности с SEQ ID NO: 48 (например, по меньшей мере 96% идентичности последовательности с SEQ ID NO: 48 по меньшей мере 97% идентичности последовательности с SEQ ID NO: 48 по меньшей мере 98% идентичности последовательности с SEQ ID NO: 48 по меньшей мере 99% идентичности последовательности с SEQ ID NO: 48 или 100% идентичности последовательности с SEQ ID NO: 48). В некоторых вариантах осуществления данного изобретения VLB2-область содержит аминокислотную последовательность SEQ ID NO: 48.
В некоторых вариантах осуществления данного изобретения VHB2 содержит следующие HVR: (a) HVR-H1, содержащую аминокислотную последовательность из SEQ ID NO: 11; (b) HVR-H2, содержащую аминокислотную последовательность из SEQ ID NO: 36; и (с) HVR-H3, содержащую аминокислотную последовательность из SEQ ID NO: 43; и VLB2 содержит следующие HVR: (d) HVR-L1, содержащую аминокислотную последовательность из SEQ ID NO: 21; (е) HVR-L2, содержащую аминокислотную последовательность из SEQ ID NO: 29; и (f) HVR-L3, содержащую аминокислотную последовательность из SEQ ID NO: 26. В некоторых вариантах осуществления VHB2-область содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности с SEQ ID NO: 44 (например, по меньшей мере 96% идентичности последовательности с SEQ ID NO: 44 по меньшей мере 97% идентичности последовательности с SEQ ID NO: 44 по меньшей мере 98% идентичности последовательности с SEQ ID NO: 44 по меньшей мере 99% идентичности последовательности с SEQ ID NO: 44 или 100% идентичности последовательности с SEQ ID NO: 44); и VLB2-область содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности с SEQ ID NO: 48 (например, по меньшей мере 96% идентичности последовательности с SEQ ID NO: 48 по меньшей мере 97% идентичности последовательности с SEQ ID NO: 48 по меньшей мере 98% идентичности последовательности с SEQ ID NO: 48 по меньшей мере 99% идентичности последовательности с SEQ ID NO: 48 или 100% идентичности последовательности с SEQ ID NO: 48). В некоторых вариантах осуществления VHB2-область содержит аминокислотную последовательность из SEQ ID NO: 44; и VLB2-область содержит аминокислотную последовательность из SEQ ID NO: 48. Например, в некоторых вариантах осуществления биспецифичные антигенсвязывающие молекулы представляют собой биспецифичные антигенсвязывающие молекулы анти-HER2 (например, 4D5 Y55E.H91A.N54E.D98T.Y102V-1Fab-IgG TDB).
В других вариантах осуществления биспецифичные антигенсвязывающие молекулы могут иметь мутации в остатках N30, Y55 и Н91 легкой цепи и в остатках N54 и D98 тяжелой цепи второго и/или третьего антигенсвязывающего фрагмента (например, N30S, Y55E, Н91А, N54E и D98T). В некоторых вариантах осуществления биспецифичная антигенсвязывающая молекула имеет VHB1-область, которая содержит одну, две или все три из следующих HVR: (a) HVR-H1, содержащую аминокислотную последовательность из SEQ ID NO: 11; (b) HVR-H2, содержащую аминокислотную последовательность из SEQ ID NO: 36; и (с) HVR-H3, содержащую аминокислотную последовательность из SEQ ID NO: 37; В некоторых вариантах осуществления VHB1-область содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности с SEQ ID NO: 41 (например, по меньшей мере 96% идентичности последовательности с SEQ ID NO: 41 по меньшей мере 97% идентичности последовательности с SEQ ID NO: 41 по меньшей мере 98% идентичности последовательности с SEQ ID NO: 41 по меньшей мере 99% идентичности последовательности с SEQ ID NO: 41 или 100% идентичности последовательности с SEQ ID NO: 41). В некоторых вариантах осуществления данного изобретения VHB1-область содержит аминокислотную последовательность SEQ ID NO: 41. В некоторых вариантах осуществления VLB1-область содержит одну, две или все три из следующих HVR: (a) HVR-L1, содержащую аминокислотную последовательность из SEQ ID NO: 38; (b) HVR-L2, содержащую аминокислотную последовательность из SEQ ID NO: 29; и (с) HVR-L3, содержащую аминокислотную последовательность из SEQ ID NO: 26; В некоторых вариантах осуществления VLB1-область содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности с SEQ ID NO: 49 (например, по меньшей мере 96% идентичности последовательности с SEQ ID NO: 49 по меньшей мере 97% идентичности последовательности с SEQ ID NO: 49 по меньшей мере 98% идентичности последовательности с SEQ ID NO: 49 по меньшей мере 99% идентичности последовательности с SEQ ID NO: 49 или 100% идентичности последовательности с SEQ ID NO: 49). В некоторых вариантах осуществления данного изобретения VLB1-область содержит аминокислотную последовательность SEQ ID NO: 49.
В некоторых вариантах осуществления данного изобретения VHB1 содержит следующие HVR: (a) HVR-H1, содержащую аминокислотную последовательность из SEQ ID NO: 11; (b) HVR-H2, содержащую аминокислотную последовательность из SEQ ID NO: 36; и (с) HVR-H3, содержащую аминокислотную последовательность из SEQ ID NO: 37; и VLB1 содержит следующие HVR: (d) HVR-L1, содержащую аминокислотную последовательность из SEQ ID NO: 38; (е) HVR-L2, содержащую аминокислотную последовательность из SEQ ID NO: 29; и (f) HVR-L3, содержащую аминокислотную последовательность из SEQ ID NO: 26. В некоторых вариантах осуществления VHB1-область содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности с SEQ ID NO: 41 (например, по меньшей мере 96% идентичности последовательности с SEQ ID NO: 41 по меньшей мере 97% идентичности последовательности с SEQ ID NO: 41 по меньшей мере 98% идентичности последовательности с SEQ ID NO: 41 по меньшей мере 99% идентичности последовательности с SEQ ID NO: 41 или 100% идентичности последовательности с SEQ ID NO: 41); и VLB1-область содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности с SEQ ID NO: 49 (например, по меньшей мере 96% идентичности последовательности с SEQ ID NO: 49 по меньшей мере 97% идентичности последовательности с SEQ ID NO: 49 по меньшей мере 98% идентичности последовательности с SEQ ID NO: 49 по меньшей мере 99% идентичности последовательности с SEQ ID NO: 49 или 100% идентичности последовательности с SEQ ID NO: 49). Например, в некоторых вариантах осуществления VHB1-область содержит аминокислотную последовательность из SEQ ID NO: 41; и VLB1-область содержит аминокислотную последовательность из SEQ ID NO: 49.
В некоторых вариантах осуществления VHB2-область содержит одну, две или все три из следующих HVR: (a) HVR-H1, содержащую аминокислотную последовательность из SEQ ID NO: 11; (b) HVR-H2, содержащую аминокислотную последовательность из SEQ ID NO: 36; и (с) HVR-H3, содержащую аминокислотную последовательность из SEQ ID NO: 37; В некоторых вариантах осуществления VHB2-область содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности с SEQ ID NO: 41 (например, по меньшей мере 96% идентичности последовательности с SEQ ID NO: 41 по меньшей мере 97% идентичности последовательности с SEQ ID NO: 41 по меньшей мере 98% идентичности последовательности с SEQ ID NO: 41 по меньшей мере 99% идентичности последовательности с SEQ ID NO: 41 или 100% идентичности последовательности с SEQ ID NO: 41). В некоторых вариантах осуществления данного изобретения VHB2-область содержит аминокислотную последовательность SEQ ID NO: 41. В некоторых вариантах осуществления VLB2-область содержит одну, две или все три из следующих HVR: (a) HVR-L1, содержащую аминокислотную последовательность из SEQ ID NO: 38; (b) HVR-L2, содержащую аминокислотную последовательность из SEQ ID NO: 29; и (с) HVR-L3, содержащую аминокислотную последовательность из SEQ ID NO: 26; В некоторых вариантах осуществления VLB2-область содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности с SEQ ID NO: 49 (например, по меньшей мере 96% идентичности последовательности с SEQ ID NO: 49 по меньшей мере 97% идентичности последовательности с SEQ ID NO: 49 по меньшей мере 98% идентичности последовательности с SEQ ID NO: 49 по меньшей мере 99% идентичности последовательности с SEQ ID NO: 49 или 100% идентичности последовательности с SEQ ID NO: 49). В некоторых вариантах осуществления данного изобретения VLB2-область содержит аминокислотную последовательность SEQ ID NO: 49.
В некоторых вариантах осуществления данного изобретения VHB2 содержит следующие HVR: (a) HVR-H1, содержащую аминокислотную последовательность из SEQ ID NO: 11; (b) HVR-H2, содержащую аминокислотную последовательность из SEQ ID NO: 36; и (с) HVR-H3, содержащую аминокислотную последовательность из SEQ ID NO: 37; и VLB2 содержит следующие HVR: (d) HVR-L1, содержащую аминокислотную последовательность из SEQ ID NO: 38; (е) HVR-L2, содержащую аминокислотную последовательность из SEQ ID NO: 29; и (f) HVR-L3, содержащую аминокислотную последовательность из SEQ ID NO: 26. В некоторых вариантах осуществления VHB2-область содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности с SEQ ID NO: 41 (например, по меньшей мере 96% идентичности последовательности с SEQ ID NO: 41 по меньшей мере 97% идентичности последовательности с SEQ ID NO: 41 по меньшей мере 98% идентичности последовательности с SEQ ID NO: 41 по меньшей мере 99% идентичности последовательности с SEQ ID NO: 41 или 100% идентичности последовательности с SEQ ID NO: 41); и VLB2-область содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности с SEQ ID NO: 49 (например, по меньшей мере 96% идентичности последовательности с SEQ ID NO: 49 по меньшей мере 97% идентичности последовательности с SEQ ID NO: 49 по меньшей мере 98% идентичности последовательности с SEQ ID NO: 49 по меньшей мере 99% идентичности последовательности с SEQ ID NO: 49 или 100% идентичности последовательности с SEQ ID NO: 49). В некоторых вариантах осуществления VHB2-область содержит аминокислотную последовательность из SEQ ID NO: 41; и VLB2-область содержит аминокислотную последовательность из SEQ ID NO: 49. Например, в некоторых вариантах осуществления биспецифичные антигенсвязывающие молекулы представляют собой биспецифичные антигенсвязывающие молекулы анти-HER2 (например, 4D5 N30S.Y55E.H91A.N54E.D98T-1Fab-IgG TDB).
В других вариантах осуществления биспецифичные антигенсвязывающие молекулы могут иметь мутации в остатках N30, Y55 и Н91 легкой цепи и в остатках N54, D98 и Y102 тяжелой цепи второго и/или третьего антигенсвязывающего фрагмента (например, N30S, Y55E, Н91А, N54E, D98T и Y102V). В некоторых вариантах осуществления биспецифичная антигенсвязывающая молекула имеет VHB1-область, которая содержит одну, две или все три из следующих HVR: (a) HVR-H1, содержащую аминокислотную последовательность из SEQ ID NO: 11; (b) HVR-H2, содержащую аминокислотную последовательность из SEQ ID NO: 36; и (с) HVR-H3, содержащую аминокислотную последовательность из SEQ ID NO: 43; В некоторых вариантах осуществления VHB1-область содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности с SEQ ID NO: 44 (например, по меньшей мере 96% идентичности последовательности с SEQ ID NO: 44 по меньшей мере 97% идентичности последовательности с SEQ ID NO: 44 по меньшей мере 98% идентичности последовательности с SEQ ID NO: 44 по меньшей мере 99% идентичности последовательности с SEQ ID NO: 44 или 100% идентичности последовательности с SEQ ID NO: 44). В некоторых вариантах осуществления данного изобретения VHB1-область содержит аминокислотную последовательность SEQ ID NO: 44. В некоторых вариантах осуществления VLB1-область содержит одну, две или все три из следующих HVR: (a) HVR-L1, содержащую аминокислотную последовательность из SEQ ID NO: 38; (b) HVR-L2, содержащую аминокислотную последовательность из SEQ ID NO: 29; и (с) HVR-L3, содержащую аминокислотную последовательность из SEQ ID NO: 26; В некоторых вариантах осуществления VLB1-область содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности с SEQ ID NO: 49 (например, по меньшей мере 96% идентичности последовательности с SEQ ID NO: 49 по меньшей мере 97% идентичности последовательности с SEQ ID NO: 49 по меньшей мере 98% идентичности последовательности с SEQ ID NO: 49 по меньшей мере 99% идентичности последовательности с SEQ ID NO: 49 или 100% идентичности последовательности с SEQ ID NO: 49). В некоторых вариантах осуществления данного изобретения VLB1-область содержит аминокислотную последовательность SEQ ID NO: 49.
В некоторых вариантах осуществления данного изобретения VHB1 содержит следующие HVR: (a) HVR-H1, содержащую аминокислотную последовательность из SEQ ID NO: 11; (b) HVR-H2, содержащую аминокислотную последовательность из SEQ ID NO: 36; и (с) HVR-H3, содержащую аминокислотную последовательность из SEQ ID NO: 43; и VLB1 содержит следующие HVR: (d) HVR-L1, содержащую аминокислотную последовательность из SEQ ID NO: 38; (е) HVR-L2, содержащую аминокислотную последовательность из SEQ ID NO: 29; и (f) HVR-L3, содержащую аминокислотную последовательность из SEQ ID NO: 26. В некоторых вариантах осуществления VHB1-область содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности с SEQ ID NO: 44 (например, по меньшей мере 96% идентичности последовательности с SEQ ID NO: 44 по меньшей мере 97% идентичности последовательности с SEQ ID NO: 44 по меньшей мере 98% идентичности последовательности с SEQ ID NO: 44 по меньшей мере 99% идентичности последовательности с SEQ ID NO: 44 или 100% идентичности последовательности с SEQ ID NO: 44); и VLB1-область содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности с SEQ ID NO: 49 (например, по меньшей мере 96% идентичности последовательности с SEQ ID NO: 49 по меньшей мере 97% идентичности последовательности с SEQ ID NO: 49 по меньшей мере 98% идентичности последовательности с SEQ ID NO: 49 по меньшей мере 99% идентичности последовательности с SEQ ID NO: 49 или 100% идентичности последовательности с SEQ ID NO: 49). Например, в некоторых вариантах осуществления VHB1-область содержит аминокислотную последовательность из SEQ ID NO: 44; и VLB1-область содержит аминокислотную последовательность из SEQ ID NO: 49.
В некоторых вариантах осуществления VHB2-область содержит одну, две или все три из следующих HVR: (a) HVR-H1, содержащую аминокислотную последовательность из SEQ ID NO: 11; (b) HVR-H2, содержащую аминокислотную последовательность из SEQ ID NO: 36; и (с) HVR-H3, содержащую аминокислотную последовательность из SEQ ID NO: 43; В некоторых вариантах осуществления VHB2-область содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности с SEQ ID NO: 44 (например, по меньшей мере 96% идентичности последовательности с SEQ ID NO: 44 по меньшей мере 97% идентичности последовательности с SEQ ID NO: 44 по меньшей мере 98% идентичности последовательности с SEQ ID NO: 44 по меньшей мере 99% идентичности последовательности с SEQ ID NO: 44 или 100% идентичности последовательности с SEQ ID NO: 44). В некоторых вариантах осуществления данного изобретения VHB2-область содержит аминокислотную последовательность SEQ ID NO: 44. В некоторых вариантах осуществления VLB2-область содержит одну, две или все три из следующих HVR: (a) HVR-L1, содержащую аминокислотную последовательность из SEQ ID NO: 38; (b) HVR-L2, содержащую аминокислотную последовательность из SEQ ID NO: 29; и (с) HVR-L3, содержащую аминокислотную последовательность из SEQ ID NO: 26; В некоторых вариантах осуществления VLB2-область содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности с SEQ ID NO: 49 (например, по меньшей мере 96% идентичности последовательности с SEQ ID NO: 49 по меньшей мере 97% идентичности последовательности с SEQ ID NO: 49 по меньшей мере 98% идентичности последовательности с SEQ ID NO: 49 по меньшей мере 99% идентичности последовательности с SEQ ID NO: 49 или 100% идентичности последовательности с SEQ ID NO: 49). В некоторых вариантах осуществления данного изобретения VLB2-область содержит аминокислотную последовательность SEQ ID NO: 49.
В некоторых вариантах осуществления данного изобретения VHB2 содержит следующие HVR: (a) HVR-H1, содержащую аминокислотную последовательность из SEQ ID NO: 11; (b) HVR-H2, содержащую аминокислотную последовательность из SEQ ID NO: 36; и (с) HVR-H3, содержащую аминокислотную последовательность из SEQ ID NO: 43; и VLB2 содержит следующие HVR: (d) HVR-L1, содержащую аминокислотную последовательность из SEQ ID NO: 38; (е) HVR-L2, содержащую аминокислотную последовательность из SEQ ID NO: 29; и (f) HVR-L3, содержащую аминокислотную последовательность из SEQ ID NO: 26. В некоторых вариантах осуществления VHB2-область содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности с SEQ ID NO: 44 (например, по меньшей мере 96% идентичности последовательности с SEQ ID NO: 44 по меньшей мере 97% идентичности последовательности с SEQ ID NO: 44 по меньшей мере 98% идентичности последовательности с SEQ ID NO: 44 по меньшей мере 99% идентичности последовательности с SEQ ID NO: 44 или 100% идентичности последовательности с SEQ ID NO: 44); и VLB2-область содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности с SEQ ID NO: 49 (например, по меньшей мере 96% идентичности последовательности с SEQ ID NO: 49 по меньшей мере 97% идентичности последовательности с SEQ ID NO: 49 по меньшей мере 98% идентичности последовательности с SEQ ID NO: 49 по меньшей мере 99% идентичности последовательности с SEQ ID NO: 49 или 100% идентичности последовательности с SEQ ID NO: 49). В некоторых вариантах осуществления VHB2-область содержит аминокислотную последовательность из SEQ ID NO: 44; и VLB2-область содержит аминокислотную последовательность из SEQ ID NO: 49. Например, в некоторых вариантах осуществления биспецифичные антигенсвязывающие молекулы представляют собой биспецифичные антигенсвязывающие молекулы анти-HER2 (например, 4D5 N30S.Y55E.H91A.N54E.D98T.Y102V-1Fab-IgG TDB).
В некоторых вариантах осуществления VHB1 и/или VHB2 содержит следующие HVR: (a) HVR-H1, содержащую аминокислотную последовательность из SEQ ID NO: 11, (b) HVR-H2, содержащую аминокислотную последовательность из SEQ ID NO: 19, и (с) HVR-H3, содержащую аминокислоту последовательность из SEQ ID NO: 28; и VLB1 и/или VLB2 содержит следующие HVR: (d) HVR-L1, содержащую аминокислотную последовательность из SEQ ID NO: 21; (е) HVR-L2, содержащую аминокислотную последовательность из SEQ ID NO: 29; и (f) HVR-L3, содержащую аминокислотную последовательность из SEQ ID NO: 30. В некоторых вариантах осуществления VHB1 и/или VHB2 содержит по меньшей мере 95% идентичность аминокислотной последовательности, имеющие последовательности (например, по меньшей мере 96% по меньшей мере 97% по меньшей мере на 98% по меньшей мере 99% идентичности последовательности), или последовательность, SEQ ID NO: 30 и VLB1 и/или VLB2 содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности (например, по меньшей мере 96% по меньшей мере 97% по меньшей мере 98% по меньшей мере 99% идентичности последовательности), или последовательность, SEQ ID NO: 31.
В некоторых вариантах осуществления VHB1 и/или VHB2 содержит следующие HVR: (a) HVR-H1, содержащую аминокислотную последовательность из SEQ ID NO: 11, (b) HVR-H2, содержащую аминокислотную последовательность из SEQ ID NO: 19, и (с) HVR-H3, содержащую аминокислоту последовательность из SEQ ID NO: 34; и VLB1 и/или VLB2 содержит следующие HVR: (d) HVR-L1, содержащую аминокислотную последовательность из SEQ ID NO: 21; (е) HVR-L2, содержащую аминокислотную последовательность из SEQ ID NO: 22; и (f) HVR-L3, содержащую аминокислотную последовательность из SEQ ID NO: 23. В некоторых вариантах осуществления VHB1 и/или VHB2 содержит по меньшей мере 95% идентичность аминокислотной последовательности, имеющие последовательности (например, по меньшей мере 96% по меньшей мере 97% по меньшей мере на 98% по меньшей мере 99% идентичности последовательности), или последовательность, SEQ ID NO: 35 и VLB1 и/или VLB2 содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности (например, по меньшей мере 96% по меньшей мере 97% по меньшей мере 98% по меньшей мере 99% идентичности последовательности), или последовательность, SEQ ID NO: 25.
В некоторых вариантах осуществления VHB1 и/или VHB2 содержит следующие HVR: (a) HVR-H1, содержащую аминокислотную последовательность из SEQ ID NO: 11, (b) HVR-H2, содержащую аминокислотную последовательность из SEQ ID NO: 36, и (с) HVR-H3, содержащую аминокислоту последовательность из SEQ ID NO: 37; и VLB1 и/или VLB2 содержит следующие HVR: (d) HVR-L1, содержащую аминокислотную последовательность из SEQ ID NO: 38; (е) HVR-L2, содержащую аминокислотную последовательность из SEQ ID NO: 22; и (f) HVR-L3, содержащую аминокислотную последовательность из SEQ ID NO: 23. В некоторых вариантах осуществления VHB1 и/или VHB2 содержит по меньшей мере 95% идентичность аминокислотной последовательности, имеющие последовательности (например, по меньшей мере 96% по меньшей мере 97% по меньшей мере на 98% по меньшей мере 99% идентичности последовательности), или последовательность, SEQ ID NO: 39 и VLB1 и/или VLB2 содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности (например, по меньшей мере 96% по меньшей мере 97% по меньшей мере 98% по меньшей мере 99% идентичности последовательности), или последовательность, SEQ ID NO: 40.
В некоторых вариантах осуществления VHB1 и/или VHB2 содержит следующие HVR: (a) HVR-H1, содержащую аминокислотную последовательность из SEQ ID NO: 11, (b) HVR-H2, содержащую аминокислотную последовательность из SEQ ID NO: 36, и (с) HVR-H3, содержащую аминокислоту последовательность из SEQ ID NO: 37; и VLB1 и/или VLB2 содержит следующие HVR: (d) HVR-L1, содержащую аминокислотную последовательность из SEQ ID NO: 38; (е) HVR-L2, содержащую аминокислотную последовательность из SEQ ID NO: 22; и (f) HVR-L3, содержащую аминокислотную последовательность из SEQ ID NO: 26. В некоторых вариантах осуществления VHB1 и/или VHB2 содержит по меньшей мере 95% идентичность аминокислотной последовательности, имеющие последовательности (например, по меньшей мере 96% по меньшей мере 97% по меньшей мере на 98% по меньшей мере 99% идентичности последовательности), или последовательность, SEQ ID NO: 41 и VLB1 и/или VLB2 содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности (например, по меньшей мере 96% по меньшей мере 97% по меньшей мере 98% по меньшей мере 99% идентичности последовательности), или последовательность, SEQ ID NO: 42.
В некоторых вариантах осуществления VHB1 и/или VHB2 содержит следующие HVR: (a) HVR-H1, содержащую аминокислотную последовательность из SEQ ID NO: 11, (b) HVR-H2, содержащую аминокислотную последовательность из SEQ ID NO: 36, и (с) HVR-H3, содержащую аминокислоту последовательность из SEQ ID NO: 37; и VLB1 и/или VLB2 содержит следующие HVR: (d) HVR-L1, содержащую аминокислотную последовательность из SEQ ID NO: 21; (е) HVR-L2, содержащую аминокислотную последовательность из SEQ ID NO: 22; и (f) HVR-L3, содержащую аминокислотную последовательность из SEQ ID NO: 26. В некоторых вариантах осуществления VHB1 и/или VHB2 содержит по меньшей мере 95% идентичность аминокислотной последовательности, имеющие последовательности (например, по меньшей мере 96% по меньшей мере 97% по меньшей мере на 98% по меньшей мере 99% идентичности последовательности), или последовательность, SEQ ID NO: 41 и VLB1 и/или VLB2 содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности (например, по меньшей мере 96% по меньшей мере 97% по меньшей мере 98% по меньшей мере 99% идентичности последовательности), или последовательность, SEQ ID NO: 27.
В некоторых вариантах осуществления VHB1 и/или VHB2 содержит следующие HVR: (a) HVR-H1, содержащую аминокислотную последовательность из SEQ ID NO: 11, (b) HVR-H2, содержащую аминокислотную последовательность из SEQ ID NO: 36, и (с) HVR-H3, содержащую аминокислоту последовательность из SEQ ID NO: 43; и VLB1 и/или VLB2 содержит следующие HVR: (d) HVR-L1, содержащую аминокислотную последовательность из SEQ ID NO: 38; (е) HVR-L2, содержащую аминокислотную последовательность из SEQ ID NO: 29; и (f) HVR-L3, содержащую аминокислотную последовательность из SEQ ID NO: 23. В некоторых вариантах осуществления VHB1 и/или VHB2 содержит по меньшей мере 95% идентичность аминокислотной последовательности, имеющие последовательности (например, по меньшей мере 96% по меньшей мере 97% по меньшей мере на 98% по меньшей мере 99% идентичности последовательности), или последовательность, SEQ ID NO: 44 и VLB1 и/или VLB2 содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности (например, по меньшей мере 96% по меньшей мере 97% по меньшей мере 98% по меньшей мере 99% идентичности последовательности), или последовательность, SEQ ID NO: 45.
В некоторых вариантах осуществления VHB1 и/или VHB2 содержит следующие HVR: (a) HVR-H1, содержащую аминокислотную последовательность из SEQ ID NO: 11, (b) HVR-H2, содержащую аминокислотную последовательность из SEQ ID NO: 19, и (с) HVR-H3, содержащую аминокислоту последовательность из SEQ ID NO: 20; и VLB1 и/или VLB2 содержит следующие HVR: (d) HVR-L1, содержащую аминокислотную последовательность из SEQ ID NO: 38; (е) HVR-L2, содержащую аминокислотную последовательность из SEQ ID NO: 22; и (f) HVR-L3, содержащую аминокислотную последовательность из SEQ ID NO: 23. В некоторых вариантах осуществления VHB1 и/или VHB2 содержит по меньшей мере 95% идентичность аминокислотной последовательности, имеющие последовательности (например, по меньшей мере 96% по меньшей мере 97% по меньшей мере на 98% по меньшей мере 99% идентичности последовательности), или последовательность, SEQ ID NO: 24 и VLB1 и/или VLB2 содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности (например, по меньшей мере 96% по меньшей мере 97% по меньшей мере 98% по меньшей мере 99% идентичности последовательности), или последовательность, SEQ ID NO: 40.
В некоторых вариантах осуществления VHB1 и/или VHB2 содержит следующие HVR: (a) HVR-H1, содержащую аминокислотную последовательность из SEQ ID NO: 11, (b) HVR-H2, содержащую аминокислотную последовательность из SEQ ID NO: 36, и (с) HVR-H3, содержащую аминокислоту последовательность из SEQ ID NO: 37; и VLB1 и/или VLB2 содержит следующие HVR: (d) HVR-L1, содержащую аминокислотную последовательность из SEQ ID NO: 21; (е) HVR-L2, содержащую аминокислотную последовательность из SEQ ID NO: 22; и (f) HVR-L3, содержащую аминокислотную последовательность из SEQ ID NO: 23. В некоторых вариантах осуществления VHB1 и/или VHB2 содержит по меньшей мере 95% идентичность аминокислотной последовательности, имеющие последовательности (например, по меньшей мере 96% по меньшей мере 97% по меньшей мере на 98% по меньшей мере 99% идентичности последовательности), или последовательность, SEQ ID NO: 41 и VLB1 и/или VLB2 содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности (например, по меньшей мере 96% по меньшей мере 97% по меньшей мере 98% по меньшей мере 99% идентичности последовательности), или последовательность, SEQ ID NO: 25.
В некоторых вариантах осуществления VHB1 и/или VHB2 содержит следующие HVR: (a) HVR-H1, содержащую аминокислотную последовательность из SEQ ID NO: 11, (b) HVR-H2, содержащую аминокислотную последовательность из SEQ ID NO: 36, и (с) HVR-H3, содержащую аминокислоту последовательность из SEQ ID NO: 34; и VLB1 и/или VLB2 содержит следующие HVR: (d) HVR-L1, содержащую аминокислотную последовательность из SEQ ID NO: 38; (е) HVR-L2, содержащую аминокислотную последовательность из SEQ ID NO: 22; и (f) HVR-L3, содержащую аминокислотную последовательность из SEQ ID NO: 23. В некоторых вариантах осуществления VHB1 и/или VHB2 содержит по меньшей мере 95% идентичность аминокислотной последовательности, имеющие последовательности (например, по меньшей мере 96% по меньшей мере 97% по меньшей мере на 98% по меньшей мере 99% идентичности последовательности), или последовательность, SEQ ID NO: 46 и VLB1 и/или VLB2 содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности (например, по меньшей мере 96% по меньшей мере 97% по меньшей мере 98% по меньшей мере 99% идентичности последовательности), или последовательность, SEQ ID NO: 40.
В некоторых вариантах осуществления VHB1 и/или VHB2 содержит следующие HVR: (a) HVR-H1, содержащую аминокислотную последовательность из SEQ ID NO: 11, (b) HVR-H2, содержащую аминокислотную последовательность из SEQ ID NO: 36, и (с) HVR-H3, содержащую аминокислоту последовательность из SEQ ID NO: 32; и VLB1 и/или VLB2 содержит следующие HVR: (d) HVR-L1, содержащую аминокислотную последовательность из SEQ ID NO: 38; (е) HVR-L2, содержащую аминокислотную последовательность из SEQ ID NO: 22; и (f) HVR-L3, содержащую аминокислотную последовательность из SEQ ID NO: 23. В некоторых вариантах осуществления VHB1 и/или VHB2 содержит по меньшей мере 95% идентичность аминокислотной последовательности, имеющие последовательности (например, по меньшей мере 96% по меньшей мере 97% по меньшей мере на 98% по меньшей мере 99% идентичности последовательности), или последовательность, SEQ ID NO: 47 и VLB1 и/или VLB2 содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности (например, по меньшей мере 96% по меньшей мере 97% по меньшей мере 98% по меньшей мере 99% идентичности последовательности), или последовательность, SEQ ID NO: 40.
В некоторых вариантах осуществления VHB1 и/или VHB2 содержит следующие HVR: (a) HVR-H1, содержащую аминокислотную последовательность из SEQ ID NO: 11, (b) HVR-H2, содержащую аминокислотную последовательность из SEQ ID NO: 19, и (с) HVR-H3, содержащую аминокислоту последовательность из SEQ ID NO: 28; и VLB1 и/или VLB2 содержит следующие HVR: (d) HVR-L1, содержащую аминокислотную последовательность из SEQ ID NO: 21; (е) HVR-L2, содержащую аминокислотную последовательность из SEQ ID NO: 22; и (f) HVR-L3, содержащую аминокислотную последовательность из SEQ ID NO: 23. В некоторых вариантах осуществления VHB1 и/или VHB2 содержит по меньшей мере 95% идентичность аминокислотной последовательности, имеющие последовательности (например, по меньшей мере 96% по меньшей мере 97% по меньшей мере на 98% по меньшей мере 99% идентичности последовательности), или последовательность, SEQ ID NO: 30 и VLB1 и/или VLB2 содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности (например, по меньшей мере 96% по меньшей мере 97% по меньшей мере 98% по меньшей мере 99% идентичности последовательности), или последовательность, SEQ ID NO: 25.
В некоторых вариантах осуществления VHB1 и/или VHB2 содержит следующие HVR: (a) HVR-H1, содержащую аминокислотную последовательность из SEQ ID NO: 11, (b) HVR-H2, содержащую аминокислотную последовательность из SEQ ID NO: 19, и (с) HVR-H3, содержащую аминокислоту последовательность из SEQ ID NO: 20; и VLB1 и/или VLB2 содержит следующие HVR: (d) HVR-L1, содержащую аминокислотную последовательность из SEQ ID NO: 53; (е) HVR-L2, содержащую аминокислотную последовательность из SEQ ID NO: 22; и (f) HVR-L3, содержащую аминокислотную последовательность из SEQ ID NO: 26. В некоторых вариантах осуществления VHB1 и/или VHB2 содержит по меньшей мере 95% идентичность аминокислотной последовательности, имеющие последовательности (например, по меньшей мере 96% по меньшей мере 97% по меньшей мере на 98% по меньшей мере 99% идентичности последовательности), или последовательность, SEQ ID NO: 24 и VLB1 и/или VLB2 содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности (например, по меньшей мере 96% по меньшей мере 97% по меньшей мере 98% по меньшей мере 99% идентичности последовательности), или последовательность, SEQ ID NO: 54.
В некоторых вариантах осуществления VHB1 и/или VHB2 содержит следующие HVR: (a) HVR-H1, содержащую аминокислотную последовательность из SEQ ID NO: 11, (b) HVR-H2, содержащую аминокислотную последовательность из SEQ ID NO: 19, и (с) HVR-H3, содержащую аминокислоту последовательность из SEQ ID NO: 20; и VLB1 и/или VLB2 содержит следующие HVR: (d) HVR-L1, содержащую аминокислотную последовательность из SEQ ID NO: 21; (е) HVR-L2, содержащую аминокислотную последовательность из SEQ ID NO: 29; и (f) HVR-L3, содержащую аминокислотную последовательность из SEQ ID NO: 26. В некоторых вариантах осуществления VHB1 и/или VHB2 содержит по меньшей мере 95% идентичность аминокислотной последовательности, имеющие последовательности (например, по меньшей мере 96% по меньшей мере 97% по меньшей мере на 98% по меньшей мере 99% идентичности последовательности), или последовательность, SEQ ID NO: 24 и VLB1 и/или VLB2 содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности (например, по меньшей мере 96% по меньшей мере 97% по меньшей мере 98% по меньшей мере 99% идентичности последовательности), или последовательность, SEQ ID NO: 48.
В некоторых вариантах осуществления VHB1 и/или VHB2 содержит следующие HVR: (a) HVR-H1, содержащую аминокислотную последовательность из SEQ ID NO: 11, (b) HVR-H2, содержащую аминокислотную последовательность из SEQ ID NO: 19, и (с) HVR-H3, содержащую аминокислоту последовательность из SEQ ID NO: 32; и VLB1 и/или VLB2 содержит следующие HVR: (d) HVR-L1, содержащую аминокислотную последовательность из SEQ ID NO: 21; (е) HVR-L2, содержащую аминокислотную последовательность из SEQ ID NO: 22; и (f) HVR-L3, содержащую аминокислотную последовательность из SEQ ID NO: 23. В некоторых вариантах осуществления VHB1 и/или VHB2 содержит по меньшей мере 95% идентичность аминокислотной последовательности, имеющие последовательности (например, по меньшей мере 96% по меньшей мере 97% по меньшей мере на 98% по меньшей мере 99% идентичности последовательности), или последовательность, SEQ ID NO: 33 и VLB1 и/или VLB2 содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности (например, по меньшей мере 96% по меньшей мере 97% по меньшей мере 98% по меньшей мере 99% идентичности последовательности), или последовательность, SEQ ID NO: 25.
В некоторых вариантах осуществления VHB1 и/или VHB2 содержит следующие HVR: (a) HVR-H1, содержащую аминокислотную последовательность из SEQ ID NO: 11, (b) HVR-H2, содержащую аминокислотную последовательность из SEQ ID NO: 19, и (с) HVR-H3, содержащую аминокислоту последовательность из SEQ ID NO: 32; и VLB1 и/или VLB2 содержит следующие HVR: (d) HVR-L1, содержащую аминокислотную последовательность из SEQ ID NO: 21; (е) HVR-L2, содержащую аминокислотную последовательность из SEQ ID NO: 29; и (f) HVR-L3, содержащую аминокислотную последовательность из SEQ ID NO: 23. В некоторых вариантах осуществления VHB1 и/или VHB2 содержит по меньшей мере 95% идентичность аминокислотной последовательности, имеющие последовательности (например, по меньшей мере 96% по меньшей мере 97% по меньшей мере на 98% по меньшей мере 99% идентичности последовательности), или последовательность, SEQ ID NO: 33 и VLB1 и/или VLB2 содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности (например, по меньшей мере 96% по меньшей мере 97% по меньшей мере 98% по меньшей мере 99% идентичности последовательности), или последовательность, SEQ ID NO: 31.
В другом аспекте данное изобретение относится к биспецифичной антигенсвязывающей молекуле, содержащей моновалентное плечо и бивалентное плечо, при этом: (а) моновалентное плечо содержит Fab а, при этом С-конец FabA слит с N-концом первой Fc-субъединицы, и при этом FabA содержит следующие HVR: (i) HVR-H1, содержащую аминокислотную последовательность из SEQ ID NO: 1, (ii) HVR-H2, содержащую аминокислотную последовательность из SEQ ID NO: 2, (iii) HVR-H3, содержащую аминокислотную последовательность из SEQ ID NO: 3, (iv) HVR-L1, содержащую аминокислотную последовательность из SEQ ID NO: 4, (v) HVR-L2, содержащую аминокислотную последовательность из SEQ ID NO: 5, и (vi) HVR-L3, содержащую аминокислотную последовательность из SEQ ID NO: 6; (b) бивалентное плечо содержит FabB1 и FabB2, при этом С-конец FabB2 слит с N-концом FabB1, и С-конец FabB1 слит с N-концом второй Fc-субъединицы, при этом каждый из FabB1 и FabB2 содержит следующие HVR: (i) HVR-H1, содержащую аминокислотную последовательность из SEQ ID NO: 11, (ii) HVR-H2, содержащую аминокислотную последовательность из SEQ ID NO: 12, (iii) HVR-Н3, содержащую аминокислотную последовательность из SEQ ID NO: 13, (iv) HVR-L1, содержащую аминокислотную последовательность из SEQ ID NO: 14, (v) HVR-L2, содержащую аминокислотную последовательность из SEQ ID NO: 15, (vi) HVR-L3, содержащую аминокислотную последовательность из SEQ ID NO: 16; и (с) первая Fc-субъединица ассоциируется со второй Fc-субъединицей с образованием Fc-домена. В некоторых вариантах осуществления (a) FabA содержит VHA-область и VLA-область, при этом VHA-область содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности с SEQ ID NO: 7, и VLA-область содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности с SEQ ID NO: 8; (b) FabB1 содержит VHB1-область и VLB1-область, при этом VHB1-область содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности с SEQ ID NO: 17, и VLB1-область содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности с SEQ ID NO: 18; и (с) FabB2 содержит VHB2-область и VLB2-область, при этом VHB2-область содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности с SEQ ID NO: 17, и VLB2-область содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности с SEQ ID NO: 18. Например, в некоторых вариантах осуществления (а) VHA-область содержит аминокислотную последовательность из SEQ ID NO: 7, и VLA-область содержит аминокислотную последовательность из SEQ ID NO: 8; (b) VHB1-область содержит аминокислотную последовательность из SEQ ID NO: 17, и VLB1-область содержит аминокислотную последовательность из SEQ ID NO: 18; и (с) VHB2-область содержит аминокислотную последовательность из SEQ ID NO: 17, и VLB2-область содержит аминокислотную последовательность из SEQ ID NO: 18.
В другом аспекте данное изобретение относится к биспецифичной антигенсвязывающей молекуле, содержащей моновалентное плечо и бивалентное плечо, при этом: (а) моновалентное плечо содержит FabA, при этом С-конец FabA слит с N-концом первой Fc-субъединицы, и при этом FabA содержит следующие HVR: (i) HVR-H1, содержащую аминокислотную последовательность из SEQ ID NO: 1, (ii) HVR-H2, содержащую аминокислотную последовательность из SEQ ID NO: 2, (iii) HVR-H3, содержащую аминокислотную последовательность из SEQ ID NO: 3, (iv) HVR-L1, содержащую аминокислотную последовательность из SEQ ID NO: 4, (v) HVR-L2, содержащую аминокислотную последовательность из SEQ ID NO: 5, и (vi) HVR-L3, содержащую аминокислотную последовательность из SEQ ID NO: 6; (b) бивалентное плечо содержит FabB1 и FabB2, при этом С-конец FabB2 слит с N-концом FabB1, и С-конец FabB1 слит с N-концом второй Fc-субъединицы, при этом каждый из FabB1 и FabB2 содержит следующие HVR: (i) HVR-H1, содержащую аминокислотную последовательность из SEQ ID NO: 11, (ii) HVR-H2, содержащую аминокислотную последовательность из SEQ ID NO: 19, (iii) HVR-Н3, содержащую аминокислотную последовательность из SEQ ID NO: 20, (iv) HVR-L1, содержащую аминокислотную последовательность из SEQ ID NO: 22, (v) HVR-L2, содержащую аминокислотную последовательность из SEQ ID NO: 22, (vi) HVR-L3, содержащую аминокислотную последовательность из SEQ ID NO: 26; и (с) первая Fc-субъединица ассоциируется со второй Fc-субъединицей с образованием Fc-домена. В некоторых вариантах осуществления (a) FabA содержит VHA-область и VLA-область, при этом VHA-область содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности с SEQ ID NO: 7, и VLA-область содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности с SEQ ID NO: 8; (b) FabB1 содержит VHB1-область и VLB1-область, при этом VHB1-область содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности с SEQ ID NO: 24, и VLei-область содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности с SEQ ID NO: 27; и (с) FabB2 содержит VHB2-область и VLB2-область, при этом VHB2-область содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности с SEQ ID NO: 24, и VLB1-область содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности с SEQ ID NO: 27. Например, в некоторых вариантах осуществления (а) VHA-область содержит аминокислотную последовательность из SEQ ID NO: 7, и VLA-область содержит аминокислотную последовательность из SEQ ID NO: 8; (b) VHB1-область содержит аминокислотную последовательность из SEQ ID NO: 24, и VLB1-область содержит аминокислотную последовательность из SEQ ID NO: 27; и (с) VHB2-область содержит аминокислотную последовательность из SEQ ID NO: 24, и VLB2-область содержит аминокислотную последовательность из SEQ ID NO: 27.
В еще одном аспекте данное изобретение обеспечивает биспецифичную антигенсвязывающую молекулу, содержащую моновалентное плечо и бивалентное плечо, при этом: (а) моновалентное плечо содержит FabA, при этом С-конец FabA слит с N-концом первой Fc-субъединицы, и при этом FabA содержит следующие HVR: (i) HVR-H1, содержащую аминокислотную последовательность из SEQ ID NO: 1, (ii) HVR-H2, содержащую аминокислотную последовательность из SEQ ID NO: 2, (iii) HVR-H3, содержащую аминокислотную последовательность из SEQ ID NO: 3, (iv) HVR-L1, содержащую аминокислотную последовательность из SEQ ID NO: 4, (v) HVR-L2, содержащую аминокислотную последовательность из SEQ ID NO: 5, и (vi) HVR-L3, содержащую аминокислотную последовательность из SEQ ID NO: 6; (b) бивалентное плечо содержит FabB1 и FabB2, при этом С-конец FabB2 слит с N-концом FabB1, и С-конец FabB1 слит с N-концом второй Fc-субъединицы, при этом каждый из FabB1 и FabB2 содержит следующие HVR: (i) HVR-H1, содержащую аминокислотную последовательность из SEQ ID NO: 1 l, (ii) HVR-H2, содержащую аминокислотную последовательность из SEQ ID NO: 19, (iii) HVR-H3, содержащую аминокислотную последовательность из SEQ ID NO: 32, (iv) HVR-L1, содержащую аминокислотную последовательность из SEQ ID NO: 21, (v) HVR-L2, содержащую аминокислотную последовательность из SEQ ID NO: 22, (vi) HVR-L3, содержащую аминокислотную последовательность из SEQ ID NO: 23; и (с) первая Fc-субъединица ассоциируется со второй Fc-субъединицей с образованием Fc-домена. В некоторых вариантах осуществления (a) FabA содержит VHA-область и VLA-область, при этом VHA-область содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности с SEQ ID NO: 7, и VLA-область содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности с SEQ ID NO: 8; (b) FabB1 содержит VHB1-область и VLB1-область, при этом VHB1-область содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности с SEQ ID NO: 33, и VLB1-область содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности с SEQ ID NO: 25; и (с) FabB2 содержит VHB2-область и VLB2-область, при этом VHB2-область содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности с SEQ ID NO: 33, и VLB2-область содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности с SEQ ID NO: 25. Например, в некоторых вариантах осуществления (а) VHA-область содержит аминокислотную последовательность из SEQ ID NO: 7, и VLA-область содержит аминокислотную последовательность из SEQ ID NO: 8; (b) VHB1-область содержит аминокислотную последовательность из SEQ ID NO: 33, и VLB1-область содержит аминокислотную последовательность из SEQ ID NO: 25; и (с) VHB2-область содержит аминокислотную последовательность из SEQ ID NO: 33, и VLB2-область содержит аминокислотную последовательность из SEQ ID NO: 25.
В другом аспекте данное изобретение относится к биспецифичной антигенсвязывающей молекуле, содержащей моновалентное плечо и бивалентное плечо, при этом: (а) моновалентное плечо содержит FabA, при этом С-конец FabA слит с N-концом первой Fc-субъединицы, и при этом FabA содержит следующие HVR: (i) HVR-H1, содержащую аминокислотную последовательность из SEQ ID NO: 1, (ii) HVR-H2, содержащую аминокислотную последовательность из SEQ ID NO: 2, (iii) HVR-H3, содержащую аминокислотную последовательность из SEQ ID NO: 3, (iv) HVR-L1, содержащую аминокислотную последовательность из SEQ ID NO: 4, (v) HVR-L2, содержащую аминокислотную последовательность из SEQ ID NO: 5, и (vi) HVR-L3, содержащую аминокислотную последовательность из SEQ ID NO: 6; (b) бивалентное плечо содержит FabB1 и FabB2, при этом С-конец FabB2 слит с N-концом FabB1, и С-конец FabB1 слит с N-концом второй Fc-субъединицы, при этом каждый из FabB1 и FabB2 содержит следующие HVR: (i) HVR-H1, содержащую аминокислотную последовательность из SEQ ID NO: 11, (ii) HVR-H2, содержащую аминокислотную последовательность из SEQ ID NO: 36, (iii) HVR-Н3, содержащую аминокислотную последовательность из SEQ ID NO: 37, (iv) HVR-L1, содержащую аминокислотную последовательность из SEQ ID NO: 21, (v) HVR-L2, содержащую аминокислотную последовательность из SEQ ID NO: 29, (vi) HVR-L3, содержащую аминокислотную последовательность из SEQ ID NO: 26; и (с) первая Fc-субъединица ассоциируется со второй Fc-субъединицей с образованием Fc-домена. В некоторых вариантах осуществления (a) FabA содержит VHA-область и VLA-область, при этом VHA-область содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности с SEQ ID NO: 7, и VLA-область содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности с SEQ ID NO: 8; (b) FabB1 содержит VHB1-область и VLB1-область, при этом VHB1-область содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности с SEQ ID NO: 41, и VLei-область содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности с SEQ ID NO: 48; и (с) FabB2 содержит VHB2-область и VLB2-область, при этом VHB2-область содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности с SEQ ID NO: 41, и VLB2-область содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности с SEQ ID NO: 48. Например, в некоторых вариантах осуществления (а) VHA-область содержит аминокислотную последовательность из SEQ ID NO: 7, и VLA-область содержит аминокислотную последовательность из SEQ ID NO: 8; (b) VHB1-область содержит аминокислотную последовательность из SEQ ID NO: 41, и VLB1-область содержит аминокислотную последовательность из SEQ ID NO: 48; и (с) VHB2-область содержит аминокислотную последовательность из SEQ ID NO: 41, и VLB2-область содержит аминокислотную последовательность из SEQ ID NO: 48.
В другом аспекте данное изобретение относится к биспецифичной антигенсвязывающей молекуле, содержащей моновалентное плечо и бивалентное плечо, при этом: (а) моновалентное плечо содержит FabA, при этом С-конец FabA слит с N-концом первой Fc-субъединицы, и при этом FabA содержит следующие HVR: (i) HVR-H1, содержащую аминокислотную последовательность из SEQ ID NO: 1, (ii) HVR-H2, содержащую аминокислотную последовательность из SEQ ID NO: 2, (iii) HVR-H3, содержащую аминокислотную последовательность из SEQ ID NO: 3, (iv) HVR-L1, содержащую аминокислотную последовательность из SEQ ID NO: 4, (v) HVR-L2, содержащую аминокислотную последовательность из SEQ ID NO: 5, и (vi) HVR-L3, содержащую аминокислотную последовательность из SEQ ID NO: 6; (b) бивалентное плечо содержит FabB1 и FabB2, при этом С-конец FabB2 слит с N-концом FabB1, и С-конец FabB1 слит с N-концом второй Fc-субъединицы, при этом каждый из FabB1 и FabB2 содержит следующие HVR: (i) HVR-H1, содержащую аминокислотную последовательность из SEQ ID NO: 11, (ii) HVR-H2, содержащую аминокислотную последовательность из SEQ ID NO: 36, (iii) HVR-Н3, содержащую аминокислотную последовательность из SEQ ID NO: 43, (iv) HVR-L1, содержащую аминокислотную последовательность из SEQ ID NO: 21, (v) HVR-L2, содержащую аминокислотную последовательность из SEQ ID NO: 29, (vi) HVR-L3, содержащую аминокислотную последовательность из SEQ ID NO: 26; и (с) первая Fc-субъединица ассоциируется со второй Fc-субъединицей с образованием Fc-домена. В некоторых вариантах осуществления (a) FabA содержит VHA-область и VLA-область, при этом VHA-область содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности с SEQ ID NO: 7, и VLA-область содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности с SEQ ID NO: 8; (b) FabB1 содержит VHB1-область и VLB1-область, при этом VHB1-область содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности с SEQ ID NO: 44, и VLB1-область содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности с SEQ ID NO: 48; и (с) FabB2 содержит VHB2-область и VLB2-область, при этом VHB2-область содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности с SEQ ID NO: 44, и BLB1-область содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности с SEQ ID NO: 48. Например, в некоторых вариантах осуществления (а) VHA-область содержит аминокислотную последовательность из SEQ ID NO: 7, и VLA-область содержит аминокислотную последовательность из SEQ ID NO: 8; (b) VHB1-область содержит аминокислотную последовательность из SEQ ID NO: 44, и VLB1-область содержит аминокислотную последовательность из SEQ ID NO: 48; и (с) VHB2-область содержит аминокислотную последовательность из SEQ ID NO: 44, и VLB2-область содержит аминокислотную последовательность из SEQ ID NO: 48. Например, в некоторых вариантах осуществления биспецифичные антигенсвязывающие молекулы представляют собой биспецифичные антигенсвязывающие молекулы анти-CD3/HER2 (например, анти-CD3/HER2 1Fab-IgG TDB, например, анти-CD3/HER2 1Fab-IgG TDB, имеющую 40G5c CD3-связывающий домен и два 4D5 Y55E.H91A.N54E.D98T.Y102V связывающих HER2 домена).
В еще одном аспекте, данное изобретение относится к биспецифичной антигенсвязывающей молекуле, содержащей моновалентное плечо и бивалентное плечо, при этом: (а) моновалентное плечо содержит FabA, при этом С-конец FabA слит с N-концом первой Fc-субъединицы, и при этом FabA содержит следующие HVR: (i) HVR-H1, содержащую аминокислотную последовательность из SEQ ID NO: 1, (ii) HVR-H2, содержащую аминокислотную последовательность из SEQ ID NO: 2, (iii) HVR-H3, содержащую аминокислотную последовательность из SEQ ID NO: 3, (iv) HVR-L1, содержащую аминокислотную последовательность из SEQ ID NO: 4, (v) HVR-L2, содержащую аминокислотную последовательность из SEQ ID NO: 5, и (vi) HVR-L3, содержащую аминокислотную последовательность из SEQ ID NO: 6; (b) бивалентное плечо содержит FabB1 и FabB2, при этом С-конец FabB2 слит с N-концом FabB1, и С-конец FabB1 слит с N-концом второй Fc-субъединицы, при этом каждый из FabB1 и FabB2 содержит следующие HVR: (i) HVR-H1, содержащую аминокислотную последовательность из SEQ ID NO: 11, (ii) HVR-H2, содержащую аминокислотную последовательность из SEQ ID NO: 36, (iii) HVR-Н3, содержащую аминокислотную последовательность из SEQ ID NO: 37, (iv) HVR-L1, содержащую аминокислотную последовательность из SEQ ID NO: 38, (v) HVR-L2, содержащую аминокислотную последовательность из SEQ ID NO: 29, (vi) HVR-L3, содержащую аминокислотную последовательность из SEQ ID NO: 26; и (с) первая Fc-субъединица ассоциируется со второй Fc-субъединицей с образованием Fc-домена. В некоторых вариантах осуществления (a) FabA содержит VHA-область и VLA-область, при этом VHA-область содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности с SEQ ID NO: 7, и VLA-область содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности с SEQ ID NO: 8; (b) FabB1 содержит VHB1-область и VLB1-область, при этом VHB1-область содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности с SEQ ID NO: 41, и VLB1-область содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности с SEQ ID NO: 49; и (с) FabB2 содержит VHB2-область и VLB2-область, при этом VHB2-область содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности с SEQ ID NO: 41, и VLB2-область содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности с SEQ ID NO: 49. Например, в некоторых вариантах осуществления (а) VHA-область содержит аминокислотную последовательность из SEQ ID NO: 7, и VLA-область содержит аминокислотную последовательность из SEQ ID NO: 8; (b) VHB1-область содержит аминокислотную последовательность из SEQ ID NO: 41, и VLB1-область содержит аминокислотную последовательность из SEQ ID NO: 49; и (с) VHB2-область содержит аминокислотную последовательность из SEQ ID NO: 41, и VLB2-область содержит аминокислотную последовательность из SEQ ID NO: 49. Например, в некоторых вариантах осуществления биспецифичные антигенсвязывающие молекулы представляют собой биспецифичные антигенсвязывающие молекулы анти-CD3/HER2 (например, анти-CD3/HER2 1Fab-IgG TDB, например, анти-CD3/HER2 1Fab-IgG TDB, имеющую 40G5c CD3-связывающий домен и два 4D5 N30S.Y55E.H91A.N54E.D98T связывающих HER2 домена).
В другом аспекте данное изобретение относится к биспецифичной антигенсвязывающей молекуле, содержащей моновалентное плечо и бивалентное плечо, при этом: (а) моновалентное плечо содержит FabA, при этом С-конец FabA слит с N-концом первой Fc-субъединицы, и при этом FabA содержит следующие HVR: (i) HVR-H1, содержащую аминокислотную последовательность из SEQ ID NO: 1, (ii) HVR-H2, содержащую аминокислотную последовательность из SEQ ID NO: 2, (iii) HVR-H3, содержащую аминокислотную последовательность из SEQ ID NO: 3, (iv) HVR-L1, содержащую аминокислотную последовательность из SEQ ID NO: 4, (v) HVR-L2, содержащую аминокислотную последовательность из SEQ ID NO: 5, и (vi) HVR-L3, содержащую аминокислотную последовательность из SEQ ID NO: 6; (b) бивалентное плечо содержит FabB1 и FabB2, при этом С-конец FabB2 слит с N-концом FabB1, и С-конец FabB1 слит с N-концом второй Fc-субъединицы, при этом каждый из FabB1 и FabB2 содержит следующие HVR: (i) HVR-H1, содержащую аминокислотную последовательность из SEQ ID NO: 11, (ii) HVR-H2, содержащую аминокислотную последовательность из SEQ ID NO: 36, (iii) HVR-Н3, содержащую аминокислотную последовательность из SEQ ID NO: 43, (iv) HVR-L1, содержащую аминокислотную последовательность из SEQ ID NO: 38, (v) HVR-L2, содержащую аминокислотную последовательность из SEQ ID NO: 29, (vi) HVR-L3, содержащую аминокислотную последовательность из SEQ ID NO: 26; и (с) первая Fc-субъединица ассоциируется со второй Fc-субъединицей с образованием Fc-домена. В некоторых вариантах осуществления (a) FabA содержит VHA-область и VLA-область, при этом VHA-область содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности с SEQ ID NO: 7, и VLA-область содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности с SEQ ID NO: 8; (b) FabB1 содержит VHB1-область и VLB1-область, при этом VHB1-область содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности с SEQ ID NO: 44, и VLB1-область содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности с SEQ ID NO: 49; и (с) FabB2 содержит VHB2-область и VLB2-область, при этом VHB2-область содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности с SEQ ID NO: 44, и VLB2-область содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности с SEQ ID NO: 49. Например, в некоторых вариантах осуществления (а) VHA-область содержит аминокислотную последовательность из SEQ ID NO: 7, и VLA-область содержит аминокислотную последовательность из SEQ ID NO: 8; (b) VHB1-область содержит аминокислотную последовательность из SEQ ID NO: 44, и VLB1-область содержит аминокислотную последовательность из SEQ ID NO: 49; и (с) VHB2-область содержит аминокислотную последовательность из SEQ ID NO: 44, и VLB2-область содержит аминокислотную последовательность из SEQ ID NO: 49. Например, в некоторых вариантах осуществления биспецифичные антигенсвязывающие молекулы представляют собой биспецифичные антигенсвязывающие молекулы анти-CD3/HER2 (например, анти-CD3/HER2 1Fab-IgG TDB, например, анти-CD3/HER2 1Fab-IgG TDB, имеющую 40G5c CD3-связывающий домен и два 4D5 N30S. Y55E.H91A.N54E.D98T. Y102V связывающих HER2 домена).
Пептидные линкеры соединяющие второй и третий антигенсвязывающие фрагменты
В некоторых вариантах осуществления биспецифичная антигенсвязывающая молекула по данному изобретению имеет структуру, в которой С-конец третьего антигенсвязывающего фрагмента слит с N-концом второго антигенсвязывающего фрагмента с помощью пептидного линкера. Пептидный линкер может иметь длину 5-20 аминокислот (например, длину 5-10, 10-15, 15-20 или, например, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, или 20 аминокислот). В некоторых вариантах осуществления данного изобретения пептидный линкер представляет собой природную аминокислоту последовательность шарнирной области вариабельной тяжелой цепи (например, DKTHT; SEQ ID NO: 50). В качестве альтернативы, в некоторых вариантах осуществления данного изобретения пептидный линкер содержит G4SG2 линкер (SEQ ID NO: 51). В некоторых вариантах осуществления пептидный линкер содержит G4SG2 линкер и шарнирную-область (например, SEQ ID NO: 52).
Аминокислотные последовательности иллюстративных полипептидов тяжелой цепи, содержащих второй и третьи антигенсвязывающие фрагменты тяжелой цепи, с и без G4SG2 линкера, представлены в Таблице 2.
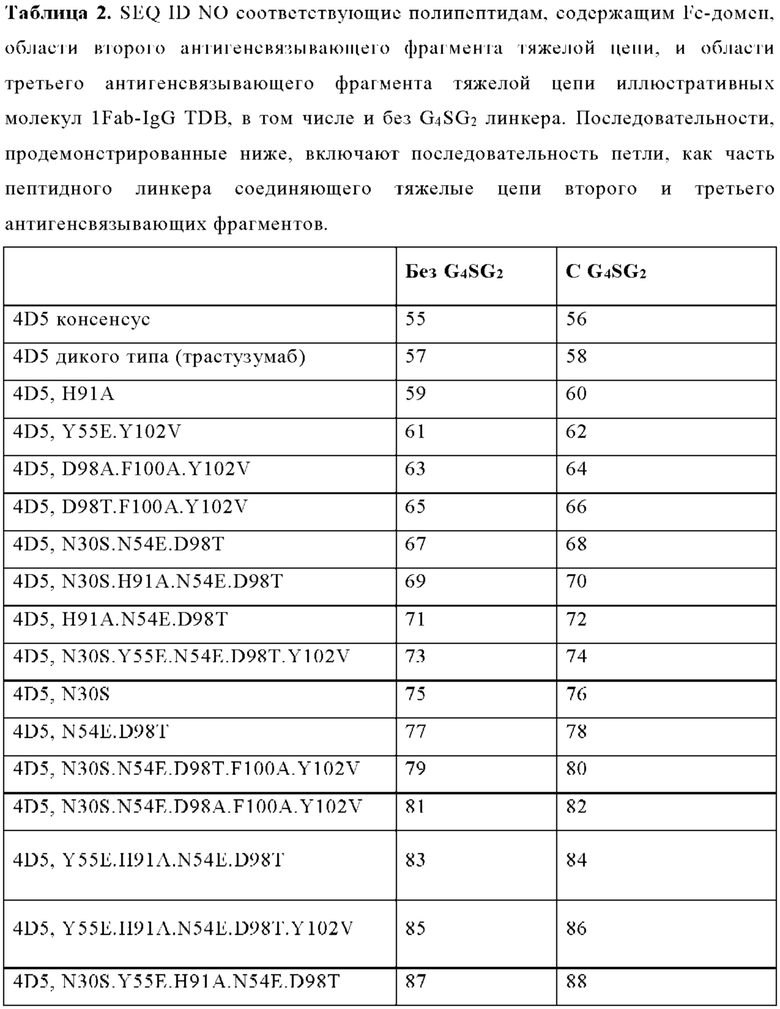
В частности, биспецифичная антигенсвязывающая молекула по данному изобретению может обладать пептидным линкером, содержащим аминокислотную последовательность из SEQ ID NO: 50. В некоторых вариантах осуществления, антигенсвязывающая молекула содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности с SEQ ID NO: 55 (например, по меньшей мере 96% идентичности последовательности с SEQ ID NO: 55 по меньшей мере 97% идентичности последовательности с SEQ ID NO: 55 по меньшей мере 98% идентичности последовательности с SEQ ID NO: 55 по меньшей мере 99% идентичности последовательности с SEQ ID NO: 55 или 100% идентичности последовательности с SEQ ID NO: 55). В других случаях, антигенсвязывающая молекула содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности SEQ ID NO: 59 (например, по меньшей мере 96% идентичности последовательности с SEQ ID NO: 59 по меньшей мере 97% идентичности последовательности с SEQ ID NO: 59, по меньшей мере 98% последовательности идентичности с SEQ ID NO: 59 по меньшей мере 99% идентичности последовательности с SEQ ID NO: 59 или 100% идентичности последовательности с SEQ ID NO: 59). С другой стороны, молекула антигенсвязывающая может содержать аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности SEQ ID NO: 63 (например, по меньшей мере 96% идентичности последовательности с SEQ ID NO: 63 по меньшей мере 97% идентичности последовательности с SEQ ID NO: 63, по меньшей мере 98% последовательности идентичности с SEQ ID NO: 63 по меньшей мере 99% идентичности последовательности с SEQ ID NO: 63 или 100% идентичности последовательности с SEQ ID NO: 63). В некоторых вариантах осуществления, антигенсвязывающая молекула содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности SEQ ID NO: 83 (например, по меньшей мере 96% идентичности последовательности с SEQ ID NO: 83 по меньшей мере 97% идентичности последовательности с SEQ ID NO: 83, по меньшей мере 98% последовательности идентичности с SEQ ID NO: 83 по меньшей мере 99% идентичности последовательности с SEQ ID NO: 83 или 100% идентичности последовательности с SEQ ID NO: 83). В других случаях, антигенсвязывающая молекула содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности SEQ ID NO: 85 (например, по меньшей мере 96% идентичности последовательности с SEQ ID NO: 85 по меньшей мере 97% идентичности последовательности с SEQ ID NO: 85, по меньшей мере 98% последовательности идентичности с SEQ ID NO: 85 по меньшей мере 99% идентичности последовательности с SEQ ID NO: 85 или 100% идентичности последовательности с SEQ ID NO: 85). В некоторых вариантах осуществления, антигенсвязывающая молекула содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности SEQ ID NO: 87 (например, по меньшей мере 96% идентичности последовательности с SEQ ID NO: 87 по меньшей мере 97% идентичности последовательности с SEQ ID NO: 87, по меньшей мере 98% последовательности идентичности с SEQ ID NO: 87 по меньшей мере 99% идентичности последовательности с SEQ ID NO: 87 или 100% идентичности последовательности с SEQ ID NO: 87). В некоторых вариантах осуществления, антигенсвязывающая молекула содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности SEQ ID NO: 89 (например, по меньшей мере 96% идентичности последовательности с SEQ ID NO: 89 по меньшей мере 97% идентичности последовательности с SEQ ID NO: 89, по меньшей мере 98% последовательности идентичности с SEQ ID NO: 89 по меньшей мере 99% идентичности последовательности с SEQ ID NO: 89 или 100% идентичности последовательности с SEQ ID NO: 89).
В других вариантах осуществления данного изобретения пептидный линкер содержит аминокислотную последовательность SEQ ID NO: 51. Антигенсвязывающая молекула может содержать аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности с SEQ ID NO: 56 (например, по меньшей мере 96% идентичности последовательности с SEQ ID NO: 56 по меньшей мере 97% идентичности последовательности с SEQ ID NO: 56 по меньшей мере 98% идентичности последовательности с SEQ ID NO: 56 по меньшей мере 99% идентичности последовательности с SEQ ID NO: 56 или 100% идентичности последовательности с SEQ ID NO: 56). В некоторых вариантах осуществления, антигенсвязывающая молекула может содержать аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности SEQ ID NO: 60 (например, по меньшей мере 96% идентичности последовательности с SEQ ID NO: 60 по меньшей мере 97% идентичности последовательности с SEQ ID NO: 60, по меньшей мере 98% последовательности идентичности с SEQ ID NO: 60 по меньшей мере 99% идентичности последовательности с SEQ ID NO: 60 или 100% идентичности последовательности с SEQ ID NO: 60). В некоторых вариантах осуществления, антигенсвязывающая молекула содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности SEQ ID NO: 64 (например, по меньшей мере 96% идентичности последовательности с SEQ ID NO: 64 по меньшей мере 97% идентичности последовательности с SEQ ID NO: 64, по меньшей мере 98% последовательности идентичности с SEQ ID NO: 64 по меньшей мере 99% идентичности последовательности с SEQ ID NO: 64 или 100% идентичности последовательности с SEQ ID NO: 64). В некоторых вариантах осуществления, антигенсвязывающая молекула содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности SEQ ID NO: 84 (например, по меньшей мере 96% идентичности последовательности с SEQ ID NO: 84 по меньшей мере 97% идентичности последовательности с SEQ ID NO: 84, по меньшей мере 98% последовательности идентичности с SEQ ID NO: 84 по меньшей мере 99% идентичности последовательности с SEQ ID NO: 84 или 100% идентичности последовательности с SEQ ID NO: 84). В некоторых вариантах осуществления, антигенсвязывающая молекула содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности SEQ ID NO: 86 (например, по меньшей мере 96% идентичности последовательности с SEQ ID NO: 86 по меньшей мере 97% идентичности последовательности с SEQ ID NO: 86, по меньшей мере 98% последовательности идентичности с SEQ ID NO: 86 по меньшей мере 99% идентичности последовательности с SEQ ID NO: 86 или 100% идентичности последовательности с SEQ ID NO: 86). В некоторых вариантах осуществления, антигенсвязывающая молекула содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности SEQ ID NO: 88 (например, по меньшей мере 96% идентичности последовательности с SEQ ID NO: 88 по меньшей мере 97% идентичности последовательности с SEQ ID NO: 88, по меньшей мере 98% последовательности идентичности с SEQ ID NO: 88 по меньшей мере 99% идентичности последовательности с SEQ ID NO: 88 или 100% идентичности последовательности с SEQ ID NO: 88). В некоторых вариантах осуществления, антигенсвязывающая молекула содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности SEQ ID NO: 90 (например, по меньшей мере 96% идентичности последовательности с SEQ ID NO: 90 по меньшей мере 97% идентичности последовательности с SEQ ID NO: 90, по меньшей мере 98% последовательности идентичности с SEQ ID NO: 90 по меньшей мере 99% идентичности последовательности с SEQ ID NO: 90 или 100% идентичности последовательности с SEQ ID NO: 90).
Fc-домены
Биспецифичные антигенсвязывающие молекулы по данному изобретению могут содержать Fc-домен. Fc-домен может быть Fc-доменом IgG (например, Fc-доменом IgG1 или IgG4). Например, Fc-домен может быть Fc-доменом человека. В некоторых вариантах осуществления Fc-домен, содержит одну или несколько аминокислотных замен, которые уменьшают связывание с Fc-рецептором и/или эффекторную функцию. Например, в некоторых вариантах осуществления одна или более аминокислотных замен, которые уменьшают связывание с Fc-рецептором и/или эффекторную функцию находятся в одном или более положений, выбранных из группы, состоящей из L234, L235 и Р329 (например, при этом каждая из первой Fc-субъединицы и второй Fc-субъединицы содержит аминокислотные замены L234A, L235A и P329G). Fc-рецептор может быть, например, Fcγ-рецептор. Таким образом, биспецифичные антигенсвязывающие молекулы по данному изобретению могут быть сконфигурированы, чтобы уменьшить антитело-зависимую клеточно-опосредованную цитотоксичность (АЗКЦ).
В некоторых случаях, Fc-домен содержит модификацию, осуществленную для способствования ассоциации первой Fc-субъединицы со второй Fc-субъединицей. Метод конструирования мультиспецифических антител «выступ-во-впадину» можно применять для получения первого плеча, содержащего выступ, и второго плеча, содержащего впадину, в которой возможно связывание выступа первого плеча. Выступ мультиспецифических антител по данному изобретению может представлять собой моновалентное плечо (например, анти-CD3 плечо) в одном варианте осуществления. Альтернативно, выступ из мультиспецифических антител по данному изобретению может представлять собой бивалентное плечо (например, анти-опухолевое плечо). Отверстие мультиспецифичнеских антител по данному изобретению может представлять собой моновалентное плечо (например, анти-CD3 плечо) в одном варианте осуществления. Альтернативно, отверстие из мультиспецифических антител по данному изобретению может представлять собой бивалентное плечо (например, анти-опухолевое плечо). Биспецифичные антитела также могут быть сконструированы с использованием технологии иммуноглобулина кроссовера (также известный как формат обмена домена Fab или CrossMab) технологии (см., например, в WO 2009/080253; Schaefer et al., Proc. Natl. Acad. Sci. USA, 108:11187-11192 (2011)). Биспецифичные антитела также могут быть получены путем конструирования электростатических направляющих эффектов для создания антител Fc-гетеродимерных молекул (WO 2009/089004 А1); путем сшивки двух или более антител или фрагментов (см., например, патент США №4676980, и Brennan et al., Science, 229: 81 (1985)); или с помощью лецинового зиппера для получения би-специфических антител (см, например, Kostelny et al., J. Immunol, 148(5): 1547-1553 (1992)).
Аминокислотный остаток в СН3-домене второй Fc-субъединицы может быть заменен на аминокислотный остаток, имеющий больший объем боковой цепи, тем самым создавая выпуклость (например, ручку) в пределах СН3-домена второй Fc-субъединицы, которая является позиционируемой в полости (например, отверстии) в пределах СН3-домена первой Fc-субъединицы, и аминокислотный остаток в СН3-домене первой Fc-субъединицы может быть заменен на аминокислотный остаток, имеющий меньший объем боковой цепи, тем самым генерируя полость (например, отверстие) в пределах СН3-домена первой Fc-субъединицы, в пределах может расположится выпуклость (например, выступ) в пределах СН3-домена второй Fc-субъединицы. В некоторых вариантах осуществления СН3-домен второй Fc-субъединицы содержит аминокислотную замену Т366, и СН3-домен первой Fc-субъединицы содержит аминокислотные замены в одном, двух или всех трех из Т366, L368 и/или Y407. В некоторых вариантах осуществления СН3-домен второй Fc-субъединицы содержит аминокислотную замену T366W, и СН3-домен первой Fc-субъединицы содержит одну, две или все три аминокислотных замены T366S, L368A и/или Y407V.
Это явно предполагается, что такие биспецифичные антигенсвязывающие молекулы или другие антитела, описанные в данном документе, для применения в любом из случаев, перечисленных в данном описании, могут иметь любой из признаков, по отдельности или в комбинации, описанных в разделах 1-6 ниже.
1. Аффинность антител
В некоторых вариантах осуществления данного изобретения антитело, которое связывается с биспецифичной антигенсвязывающей молекулой, имеет константу диссоциации (KD) ≤1 мкМ, ≤100 нМ, ≤10 нМ, ≤1 нМ, ≤0,1 нМ, ≤0,01 нМ, или ≤0,001 нМ (например, 10-8 М или менее, например, от 10-8 М до 10-13 М, например, от 10-9 М до 10-13 М).
В одном варианте осуществления данного изобретения KD измеряли анализом связывания антигена, меченного радиоактивным изотопом (РИА). В одном варианте осуществления данного изобретения РИА выполняли с использованием версии Fab представляющего интерес антитела и его антигена. Например, аффинность связывания Fab с антигеном в растворе измеряют путем уравновешивания Fab с минимальной концентрацией (125I)-меченого антигена в присутствии ряда титрующих концентраций немеченого антигена с последующим захватом связанного антигена на планшете, покрытом антителом к Fab (см., например, Chen et al., J. Mol. Biol. 293:865-881(1999)). Для определения условий анализа многолуночные планшеты MICROTITER® (Thermo Scientific) покрывали в течение ночи 5 мкг/мл антитела для захвата Fab (Cappel Labs) в 50 мМ растворе карбоната натрия (рН 9,6), а затем блокировали 2% (масс./об.) раствором бычьего сывороточного альбумина в PBS в течение двух-пяти часов при комнатной температуре (около 23°С). В неадсорбентном планшете (Nunc #269620) смешивали 100 пМ или 26 пМ [125I]-антигена с серийными разведениями целевого Fab (например, в соответствии с оценкой антитела против VEGF, Fab-12, в Presta et al., Cancer Res. 57:4593-4599 (1997)). Затем представляющий интерес Fab инкубировали в течение ночи; однако инкубацию можно продолжать в течение более длительного периода (например, около 65 часов), чтобы обеспечить достижение равновесия. Затем смесь переносили на планшет для захвата и инкубировали при комнатной температуре (например, в течение часа). Затем раствор удаляли и планшет промывали восемь раз 0,1% раствором полисорбата 20 (TWEEN-20®) в PBS. После высушивания планшетов добавляли 150 мкл сцинтиллятора (MICROSCINT-20™; Packard) на лунку и производили подсчет планшетов на гамма-счетчике TOPCOUNT™ (Packard) в течение десяти минут. Концентрации каждого Fab, которые дают 20% или менее от максимального связывания, отбирают для использования в количественных исследованиях конкурентного связывания.
Согласно еще одному варианту осуществления данного изобретения KD измеряют при помощи метода поверхностного плазмонного резонанса с использованием BIACORE®. Например, анализ с использованием BIACORE®-2000 или BIACORE®-3000 (BIACORE®, Inc., Пискатауэй, Нью-Джерси) выполняли при 25°C с чипами с иммобилизованным антигеном СМ5 при около 10 единицах ответа (ЕО). В одном варианте осуществления данного изобретения биосенсорные чипы на основе карбоксиметилированного декстрана (СМ5, BIACORE, Inc.) активируются N-этил-N'-(3-диметиламинопропил)-карбодиимид гидрохлоридом (EDC) и N-гидроксисукцинимидом (NHS) в соответствии с инструкциями изготовителя. Антиген разводят в 10 мкМ ацетате натрия, рН 4,8, до 5 мкг/мл (~0,2 мкМ) перед инъекцией при скорости потока 5 мкл/минута для достижения около 10 единиц ответа (ЕО) сопряженного белка. После впрыскивания антигена вводили 1 М этаноламина, чтобы блокировать не вступившие в реакцию группы. Для измерений кинетики двукратные серийные разведения Fab (от 0,78 нМ до 500 нМ) инъецируют в PBS с 0,05% полисорбата 20 (Tween-20™), поверхностно-активным веществом (PBST) при 25°С при скорости потока около 25 мкл/минимум Скорости ассоциации (кon) и скорость диссоциации (Koff) вычисляются с использованием простой один-к-одному Лэнгмюра модели связывания (Biacore® программного обеспечения для расчетов версии 3.2) путем одновременной подгонки ассоциации и диссоциации сенсограмм. Равновесную константу диссоциации (KD) рассчитывали как соотношение koff/kon. Смотрите, например, Chen и др., J. Mol. Biol. 293:865-881 (1999). Если скорость ассоциации превышает 106 М-1 с-1 согласно данным вышеописанного поверхностного плазмонного резонанса, то скорость ассоциации можно определить при помощи метода затухания флуоресценции, при котором измеряют повышение или снижение интенсивности флуоресценции (возбуждение = 295 нм; испускание = 340 нм, 16 нм полоса пропускания) при 25°С для 20 нМ антитела к антигену (Fab-формы) в PBS, рН 7,2, в присутствии увеличивающихся концентраций антигена, измеряемое при помощи спектрометра, такого как спектрофотометр с устройством остановки потока (Aviv Instruments) или спектрофотометр серии 8000 SLM-AMINCO™ (ThermoSpectronic) с перемешивающей кюветой.
2. Фрагменты антител
В некоторых случаях, биспецифичная антигенсвязывающая молекула, предоставленная в данном документе, содержит один или несколько фрагментов антител. Фрагменты антител включают, без ограничений, фрагменты бис-Fab, Fab, Fab', Fab'-SH, F(ab')2, Fv и scFv и другие фрагменты, описанные ниже. Для обзора некоторых фрагментов антител см. Hudson et al. Nat. Med. 9:129-134 (2003). Для обзора фрагментов scFv см., например, Pluckthun, in The Pharmacology of Monoclonal Antibodies, vol. 113, Rosenburg and Moore eds., (Springer-Verlag, New York), pp. 269-315 (1994); see also WO 93/16185; and U.S. Patent Nos. 5,571,894 and 5,587,458. Обсуждение фрагментов Fab и F(ab')2, содержащих остатки сохраняющие эпитоп связывания рецептора и имеющих увеличенное in vivo время полужизни, см. в патенте США №5869046.
Диатела представляют собой фрагменты антител с двумя антигенсвязывающими сайтами, которые могут быть бивалентными или биспецифичными. См., например, ЕР 404,097; WO 1993/01161; Hudson et al. Nat. Med. 9:129-134 (2003); and Hollinger et al. Proc. Natl. Acad. Sci. USA 90: 6444-6448 (1993). Тритела и тетратела также описаны в Hudson et al. Nat. Med. 9:129-134 (2003).
Однодоменные антитела представляют собой фрагменты антител, содержащие весь вариабельный домен тяжелой цепи или его часть или весь вариабельный домен легкой цепи антитела или его часть. В некоторых вариантах осуществления данного изобретения однодоменное антитело представляет собой человеческое однодоменное антитело (Domantis, Inc., Уолтем, Массачусетс; см., например, патент США №6248516).
Фрагменты антител могут быть получены различными способами, включая, без ограничений, протеолитическое расщепление интактного антитела, а также получение при помощи рекомбинантных клеток-хозяев (например, Е. coli или фага), как описано в данном документе.
3. Химерные и гуманизированные антитела
В некоторых случаях, биспецифичная антигенсвязывающая молекула предоставленная в данном документе, представляет собой химерное антитело. Определенные химерные антитела описаны, например, в патенте США №4816567; и Morrison et al. Proc. Natl. Acad. Sci. USA, 81:6851-6855 (1984)). В одном примере химерное антитело содержит вариабельную область нечеловеческого происхождения (например, вариабельную область, происходящую от антитела мыши, крысы, хомяка, кролика или примата, не являющегося человеком, например, обезьяны) и константную-область человека. В дополнительном примере химерное антитело представляет собой антитело с «переключенным классом», при этом класс или подкласс был изменен по сравнению с исходным антителом. Химерные антитела включают их антигенсвязывающие фрагменты. Согласно определенным вариантам осуществления данного изобретения химерное антитело представляет собой гуманизированное антитело. Как правило, антитело из вида, отличного от человека, гуманизируют для снижения иммуногенности для человека, сохраняя при этом специфичность и аффинность исходного антитела из вида, отличного от человека. Как правило, гуманизированное антитело содержит один или более вариабельных доменов, в которых HVR, например, CDR (или их фрагменты) происходят от антитела нечеловеческого происхождения, a FR (или их фрагменты) происходят от последовательностей антитела человека. Гуманизированное антитело, необязательно, также будет содержать по меньшей мере часть человеческой константной области. В некоторых вариантах осуществления некоторые FR-остатки в гуманизированном антителе заменяют соответствующими остатками антитела нечеловеческого происхождения (например, антитела, из которого получены остатки HVR), например, с целью восстановления или улучшения специфичности или аффинности антитела.
Гуманизированные антитела и способы их получения рассматриваются, например, в Almagro and Fransson, Front. Biosci. 13:1619-1633 (2008), и дополнительно описаны, например, в Riechmann et al., Nature 332:323-329 (1988); Queen et al., Proc. Natl. Acad. Sci. USA 86:10029-10033 (1989); Патент США №№5821337, 7527791, 6982321 и 7087409. Kashmiri et al, Methods 36:25-34 (2005) (описание пересадки области, определяющей специфичность (SDR - specificity determining region)); Padlan, Mol. Immunol. 28:489-498 (1991) (описание «изменения поверхности»); Dall'Acqua et al., Methods 36:43-60 (2005) (описание «FR перетасовки»); и Osbourn et al., Methods 36:61-68 (2005) and Klimka et al., Br. J. Cancer, 83:252-260 (2000) (описание подхода «направляемого выбора» к FR перетасовке).
Человеческие каркасные области, которые могут быть использованы для гуманизации включают, но не ограничиваются ими: каркасные области, выбранные с помощью метода «наилучшего соответствия» (см, например, Sims и др. J. Immunol. 151:2296 (1993)); каркасные области, полученные из консенсусной последовательности антител человека конкретной подгруппы вариабельных областей легких или тяжелых цепей (см., например, Carter et al. Proc. Natl. Acad. Sci. USA, 89:4285 (1992); and Presta et al. J. Immunol, 151:2623 (1993)); зрелые (соматически мутированные) каркасные области человека или каркасные области зародышевой линии человека (см, например, Almagro and Fransson, Front. Biosci. 13:1619-1633 (2008)); и каркасные области получены из скрининга библиотек FR (см, например, Baca et al., J. Biol. Chem. 272:10678-10684 (1997) и Rosok et al., J. Biol. Chem. 271:22611-22618 (1996)).
4. Антитела человека
В некоторых случаях, биспецифичная антигенсвязывающая молекула предоставленная в данном документе, представляет собой человеческое антитело. Человеческие антитела могут быть получены с использованием различных методик известных в данной области техники. Человеческие антитела, описаны в целом в van Dijk and van de Winkel, Curr. Opin. Pharmacol. 5: 368-74 (2001) and Lonberg, Curr. Opin. Immunol. 20:450-459 (2008).
Человеческие антитела можно получить путем введения иммуногена трансгенному животному, модифицированному с целью продукции интактных человеческих антител или интактных антител с человеческими вариабельными областями в ответ на антигенную стимуляцию. Такие животные, как правило, целиком или частично содержат локусы иммуноглобулинов человека, замещающие эндогенные локусы иммуноглобулинов или локализованные вне хромосом или случайным образом интегрированные в хромосомы животного. Как правило, у таких трансгенных мышей инактивированы эндогенные локусы иммуноглобулинов. Обзор способов получения антител человека из трансгенных животных см. в Lonberg, Nat. Biotech. 23:1117-1125 (2005). См. также, например, патенты США №6075181 и 6150584, в которых описана технология XENOMOUSE™; патент США №5770429 в котором описана технология HuMab®; патент №7041870, в котором описана технология K-М MOUSE®, и публикацию заявки на патент США № US 2007/0061900, в которой описана технология VELOCIMOUSE®). Вариабельные области человека из интактных антител, генерируемых такими животными, можно дополнительно модифицировать, например, путем объединения с другой константной-областью человека.
Антитела человека можно получить с помощью способов на основе гибридом. Описаны линии клеток миеломы человека и гетеромиеломы мыши-человека для продукции моноклональных антител человека. (См., например, Kozbor J. Immunol., 133: 3001 (1984); Brodeur et al., Monoclonal Antibody Production Techniques and Applications, pp. 51-63 (Marcel Dekker, Inc., New York, 1987); and Boerner et al., J. Immunol., 147: 86 (1991).) Антитела человека, полученные посредством технологии на основе В-клеточной гибридомы человека, также описаны в Li et al., PNAS USA, 103:3557-3562 (2006). Дополнительные способы включают способы, описанные, например, в патенте США №7189826 (где описана продукция моноклональных IgM-антител человека гибридомной линией) и статье Ni, Xiandai Mianyixue, 26(4):265-268 (2006) (где описаны гибридомы человек-человек). Технология на основе гибридомы человека (Trioma technology) также описана в статьях Vollmers and Brandlein, Histology and Histopathology, 20(3):927-937 (2005) и Vollmers and Brandlein, Methods and Findings in Experimental and Clinical Pharmacology, 27(3): 185-91 (2005).
Антитела человека также можно получать путем выделения последовательностей вариабельного домена Fv-клона из библиотек фагового дисплея человеческого происхождения. Такие последовательности вариабельного домена затем можно объединять с желательными константными доменами человека. Методики отбора антител человека из библиотек антител описаны ниже.
5. Антитела, полученные из библиотек
Антитела согласно изобретению можно выделить путем скрининга комбинаторных библиотек на предмет антител с желательной активностью или активностями. Например, в данной области техники известны различные способы получения библиотек фагового дисплея и скрининг таких библиотек на предмет антител, обладающих желательными характеристиками связывания. Такие методы рассматриваются, например, в Hoogenboom et al. in Methods in Molecular Biology 178:1-37 (O'Brien et al., ed., Human Press, Totowa, NJ, 2001) и далее описаны, например, в McCafferty et al., Nature 348:552-554; Clackson et al., Nature 352: 624-628 (1991); Marks et al., J. Mol. Biol. 222: 581-597 (1992); Marks and Bradbury, in Methods in Molecular Biology 248:161-175 (Lo, ed., Human Press, Totowa, NJ, 2003); Sidhu et al., J. Mol. Biol. 338(2): 299-310 (2004); Lee et al., J. Mol. Biol. 340(5): 1073-1093 (2004); Fellouse, Proc. Natl. Acad. Sci. USA 101(34): 12467-12472 (2004); and Lee et al., J. Immunol. Methods 284(1-2): 119-132(2004).
В некоторых способах на основе фагового дисплея репертуары VH- и VL-генов по отдельности клонировали с помощью полимеразной цепной реакции (ПЦР) и случайным образом рекомбинировали в фаговых библиотеках, которые затем можно подвергать скринингу на предмет антигенсвязывающего фага, как описано в статье Winter et al., Ann. Фаг обычно осуществляет дисплей фрагментов антитела в виде одноцепочечных Fv-фрагментов (scFv) или Fab-фрагментов. Библиотеки из иммунизированных источников позволяют получить антитела с высокой аффинностью к иммуногену без необходимости конструирования гибридом. В качестве альтернативы, можно клонировать наивный репертуар (например, человека) для получения единого источника антител к широкому спектру чужеродных антигенов и аутоантигенов без иммунизации, как описано в статье Griffiths et al., EMBO J, 12: 725-734 (1993). Наконец, наивные библиотеки можно также получить путем синтеза, клонируя сегменты V-генов стволовых клеток, не подвергавшиеся перестройке, и используя ПЦР-праймеры, содержащие случайные последовательности, для кодирования гипервариабельной области CDR3 и осуществления перестройки in vitro, как описано в статье Hoogenboom and Winter, J. Mol. Biol., 227: 381-388 (1992). Патентные публикации, в которых описаны фаговые библиотеки антител человека включают, например,: патент США №5750373 и патентные публикации США №2005/0079574, 2005/0119455, 2005/0266000, 2007/0117126, 2007/0160598, 2007/0237764, 2007/0292936 и 2009/0002360.
Антитела или фрагменты антител, выделенные из библиотек человеческих антител, считаются в данном документе человеческими антителами или фрагментами человеческих антител.
6. Варианты антигенсвязывающей молекулы
В некоторых случаях рассматриваются аминокислотные последовательности вариантов биспецифичных антигенсвязывающих молекул по данному изобретению. Например, желательным может быть улучшение аффинности связывания и/или других биологических свойств антитела. Варианты аминокислотной последовательности антитела могут быть получены путем введения соответствующих модификаций в нуклеотидную последовательность, кодирующую антитело, или с помощью пептидного синтеза. Такие модификации включают, например, делеции из аминокислотных последовательностей антител и/или вставки в них и/или замены остатков в них. Для получения конечной конструкции можно проводить любые комбинации делеций, вставок и замен, при условии, что конечная конструкция обладает необходимыми характеристиками, например, антигенсвязывающими.
В некоторых вариантах осуществления биспецифичная антигенсвязывающая молекула по данному изобретению содержит одну или несколько модификаций в VH/VL области и/или CH1/CL области для облегчения правильного спаривания тяжелых/легких цепей. В некоторых вариантах осуществление биспецифичная антигенсвязывающая молекула по данному изобретению содержит одну или несколько модификаций в Fc-области, чтобы облегчить гетеродимеризацию двух плеч биспецифичной антигенсвязывающей молекулы. Такие модификации в VH/VL области, CH1/CL области и/или FC области описаны в международной патентной публикации WO 2016/172485 No., который включен в данное описание посредством ссылки во всей своей полноте.
А. Варианты с заменой, вставкой и делецией
Согласно определенным вариантам осуществления данного изобретения предложены варианты антител, имеющие одну или более аминокислотных замен. Сайты, представляющие интерес для заместительного мутагенеза, включают HVR и FR. Консервативные замены продемонстрированы в Таблице 3 под заголовком «предпочтительные замены». Более существенные изменения представлены в Таблице 3 под заголовком «иллюстративные замены», и как дополнительно описано ниже со ссылкой на классы аминокислотных боковых цепей. Аминокислотные замены можно вносить в представляющее интерес антитело, и проводить скрининг полученных продуктов в отношении необходимой активности, например, сохранения/улучшения связывания антигена, снижения иммуногенности или улучшения антителозависимой клеточно-опосредованной цитотоксичности (АЗКЦ) или комплемент-зависимой токсичности (КЗЦ).
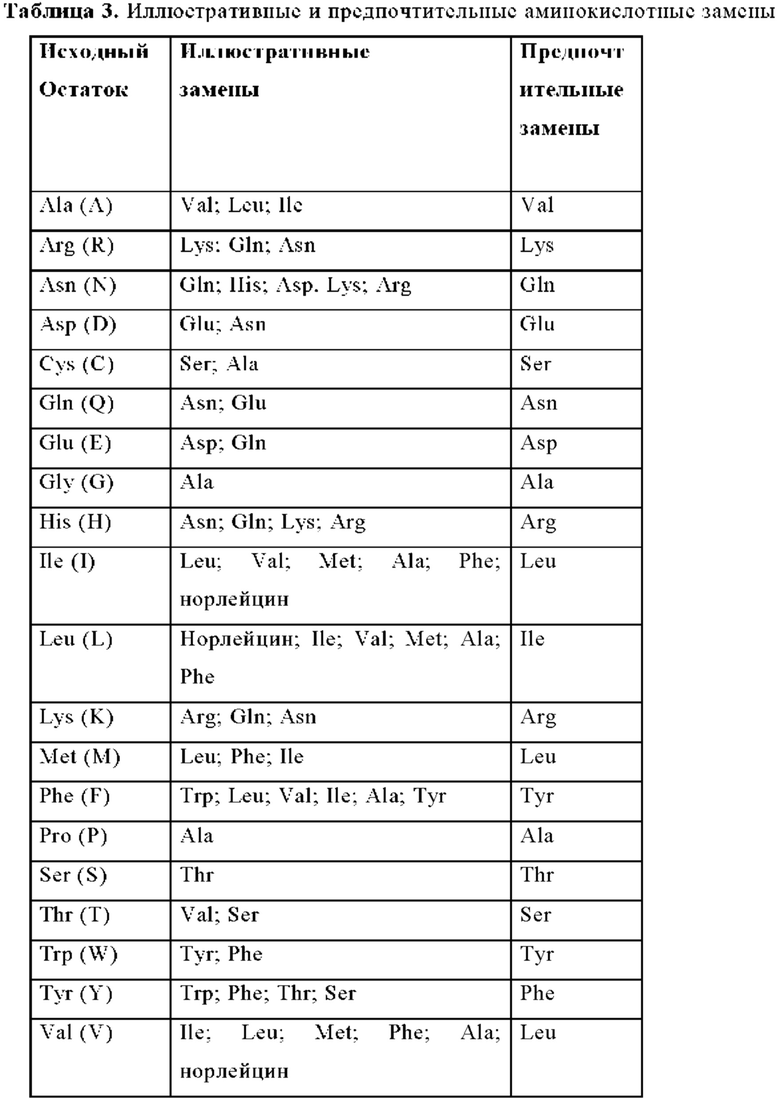
Аминокислоты можно поделить на группы в соответствии с общими свойствами боковых цепей:
1) гидрофобные: норлейцин, Met, Ala, Val, Leu, Ile;
(2) нейтральные гидрофильные: Cys, Ser, Thr, Asn, Gln;
(3) кислые: Asp, Glu;
(4) основные: His, Lys, Arg;
(5) остатки, влияющие на ориентацию цепи: Gly, Pro;
(6) ароматические: Trp, Tyr, Phe.
Неконсервативные замены повлекут за собой замену члена одного из этих классов другим классом.
Один из вариантов замены включает замену одного или более аминокислотных остатков гипервариабельной области родительского антитела (например, гуманизированного или человеческого антитела). Как правило, полученный(е) вариант(ы), отобранные для дальнейшего исследования, характеризуются модификациями (например, улучшением) определенных биологических свойств (например, повышенным аффинностям, сниженной иммуногенностью) по сравнению с исходным антителом и/или в значительной степени сохраняют определенные биологические свойства исходного антитела. Иллюстративный вариант замены представляет собой антитело с созревшей аффинностью, которое может быть беспрепятственно получено, например, с использованием методик созревания аффинности на основе фагового дисплея, таких как описанные в данном документе. Вкратце один или более аминокислотных остатков HVR подвергают мутации и вариантные антитела представляют на поверхности фага и проводят скрининг в отношении конкретного вида биологической активности (например, аффинности связывания).
Модификации (например, замены) в HVR можно осуществить, например, с целью улучшения аффинности антитела. Такие изменения могут быть сделаны в «горячих точках» HVR, т.е. в остатках, кодируемых кодонами, которые с высокой частотой подвергаются мутации во время процесса соматического созревания (см., например, Chowdhury, Methods Mol. Biol. 207:179-196 (2008)) и/или в остатках, которые контактируют с антигеном, при этом испытывают аффинность связывания полученного варианта VH или VL. Созревание аффинности путем конструирования и повторного отбора из вторичных библиотек было описано, например, в Methods in Molecular Biology 178:1-37 (O'Brien et al., ed., Human Press, Totowa, NJ, (2001).) В некоторых вариантах созревания аффинности многообразие вводится в вариабельные гены, выбранные для созревания любым из множества способов (например, ПЦР с внесением ошибок, перетасовка цепей или олигонуклеотидспецифичный мутагенез). Затем создается вторичная библиотека. После этого библиотеку подвергают скринингу для выявления любых вариантов антител с желательной аффинностью. Другой способ для внесения разнообразия включает подходы, направленные на HVR, в которых несколько аминокислотных остатков HVR (4-6 аминокислотных остатков подряд) являются рандомизированными. Остатки HVR, вовлеченные в связывание антигена, могут быть конкретно идентифицированы, например, с использованием аланин-сканирующего мутагенеза или моделирования. В частности, мишенями часто являются CDR-H3 и CDR-L3.
Согласно определенным вариантам осуществления данного изобретения замены, вставки или делеции могут происходить в пределах одного или более HVR, при условии, что такие изменения по существу не снижают способность антитела связываться с антигеном. Например, в HVR можно ввести консервативные модификации (например, консервативные замены, как предложено в данном документе), которые не снижают аффинность в значительной степени. Такие изменения могут, например, быть вне контактирующих с антигеном остатков в HVR. В определенных вариантах осуществления последовательностей VH и VL, представленных выше, каждый HVR или остается неизменным, или содержит не более одной, двух или трех аминокислотных замен.
Удобный способ выявления остатков или областей антитела, которые могут быть мишенями для мутагенеза, называется «аланин-сканирующим мутагенезом», описанным Cunningham and Wells (1989) Science, 244:1081-1085. В этом способе аминокислотный остаток или группу целевых аминокислотных остатков (например, заряженные аминокислотные остатки, такие как Arg, Asp, His, Lys и Glu) идентифицируют и заменяют нейтральной или отрицательно заряженной аминокислотой (например, аланином или полиаланином) для определения влияния на взаимодействие антитела с антигеном. Дополнительные замены могут быть введены в положениях аминокислот, демонстрирующих функциональную чувствительность к начальным заменам. В альтернативном или дополнительном варианте используют кристаллическую структуру комплекса антиген-антитело для идентификации точек контакта между антителом и антигеном. Такие контактные остатки и соседние остатки можно использовать в качестве мишеней или удалять из кандидатов для замены. Варианты можно подвергать скринингу с целью определения наличия у них желательных свойств.
Вставки аминокислотных последовательностей включают амино- и/или карбоксиконцевые слияния с диапазоном длины от одного остатка до полипептидов, содержащих сто или более остатков, а также вставки внутри последовательности одного или множества аминокислотных остатков. Примеры концевых вставок включают антитело с N-концевым метионильным остатком. Другие инсерционные варианты молекулы антитела включают слияние с N- или С-концом антитела с ферментом (например, для терапии ADEPT) или полипептидом, который увеличивает период полувыведения антитела из сыворотки.
В. Варианты по гликозилированию
В некоторых вариантах осуществления данного изобретения биспецифичную антигенсвязывающую молекулу согласно изобретению изменяли с целью увеличения или уменьшения степени гликозилирования антитела. Добавление или удаление участков гликозилирования в биспецифичную антигенсвязывающую молекулу согласно изобретению традиционно можно осуществлять путем изменения аминокислотной последовательности так, чтобы создать или удалить один или более участков гликозилирования.
Если антитело содержит Fc-домен, можно изменять присоединенный к ней углевод. Если антитело содержит Fc-домен, то присоединенный к ней углевод может быть изменен. Нативные антитела, вырабатываемые клетками млекопитающих, обычно содержат разветвленный биантенарный олигосахарид, который обычно прикреплен посредством N-связи к Asn297 СН2-домена Fc-области. См., например, Wright et al. TIBTECH 15:26-32 (1997). Олигосахарид может включать различные углеводы, например, маннозу, N-ацетилглюкозамин (GlcNAc), галактозу и сиаловую кислоту, а также фукозу, присоединенную к GlcNAc в «остове» биантеннальной олигосахаридной структуры. Согласно некоторым вариантам осуществления данного изобретения могут быть сделаны модификации олигосахарида в антителе согласно данному изобретению для создания вариантов антител с определенными улучшенными свойствами. В одном варианте осуществления данного изобретения предложены варианты антител против FcRH5, содержащие углеводную структуру с недостаточным количеством фукозы, присоединенной (непосредственно или косвенно) к Fc-области. Например, количество фукозы в таком антителе может составлять от 1%
до 80%, от 1% до 65%, от 5% до 65% или от 20% до 40%. Количество фукозы определяют путем расчета среднего количества фукозы в сахарной цепи в Asn297 по сравнению с сумме всех гликоструктур, прикрепленных к Asn 297 (например, сложных, гибридных и высокоманнозных структур), согласно результатам измерения методом масс-спектрометрии MALDI-TOF, например, как описано в WO 2008/077546. Asn297 относится к остатку аспарагина, расположенному в позиции 297 в Fc-области (согласно нумерации ЕС остатков Fc-области); при этом Asn297 также может быть расположен на около ±3 аминокислот выше или ниже позиции 297, т.е. между позициями 294 и 300, вследствие незначительных вариаций последовательностей в антителах. Такие варианты фукозилирования могут иметь улучшенную функцию АЗКЦ. Смотрите, например, публикации патентов США №№US 2003/0157108 и US 2004/0093621. Примеры публикаций, относящихся к «дефукозилированным» или «дефицитным по фукозе» вариантам антител, включают: US 2003/0157108; WO 2000/61739; WO 2001/29246; US 2003/0115614; US 2002/0164328; US 2004/0093621; US 2004/0132140; US 2004/0110704; US 2004/0110282; US 2004/0109865; WO 2003/085119; WO 2003/084570; WO 2005/035586; WO 2005/035778; WO 2005/053742; WO 2002/031140; Okazaki et al. J. Mol. Biol. 336:1239-1249 (2004); Yamane-Ohnuki et al. Biotech. Bioeng. 87: 614 (2004). Примеры клеточных линий, способных производить дефукозилированные антитела включают клетки СНО Lec13 дефицитные по фукозилированию белков (Ripka et al. Arch. Biochem. Biophys. 249:533-545 (1986); заявка на патент США№2003/0157108 Al; и WO 2004/056312 и Al, Adams et al., особенно в Примере 11), и нокаутных клеточных линиях, таких как клетки СНО нокаута по гену альфа-1,6-фукозилтрансферазы, FUT8 (см, например, Yamane-Ohnuki et al. Biotech. Bioeng. 87: 614 (2004); Kanda, Y. et al., Biotechnol. Bioeng., 94(4):680-688 (2006); и WO2003/085107).
Дополнительно предложены варианты биспецифичной антигенсвязывающей молекулы с бисектированными олигосахаридами, например, в которых биантеннальный олигосахарид, присоединенный к Fc-области антитела, бисектирован GlcNAc. Такие варианты антител могут иметь уменьшенное фукозилирование и/или улучшенную функцию АЗКЦ. Примеры таких вариантов антител описаны, например, в WO 2003/011878 (Jean-Mairet et al.); патенте США №6602684 (Umana et al.); и патенте США №2005/0123546 (Umana et al.). Согласно данному изобретению также предложены варианты антител с по меньшей мере одним остатком галактозы в олигосахариде, прикрепленном к Fc-области. Такие варианты антител могут обладать улучшенной КЗЦ-функцией. Такие варианты антител описаны, например, в WO 1997/30087 (Patel et al.); WO 1998/58964 (Raju, S.); и WO 1999/22764 (Raju, S.)-
С. Варианты no Fc-области
Согласно определенным вариантам осуществления данного изобретения одна или более модификаций аминокислот могут быть введены в Fc-домен антитела согласно данному изобретению с получением варианта по Fc-области. Вариант Fc-области может содержать последовательность человеческой Fc-области (например, человеческой Fc-области IgGl, IgG2, IgG3 или IgG4), содержащей аминокислотную модификацию (например, замену) в одной или более аминокислотных позициях.
Согласно некоторым вариантам осуществления данного изобретения предусмотрен вариант антитела, который обладает некоторыми, но не всеми эффекторными функциями, что делает его желательным кандидатом для вариантов применения, в которых важен период полужизни антитела в условиях in vivo, но при этом определенные эффекторные функции (такие как КЗЦ и АЗКЦ) не нужны или вредны. Для подтверждения снижения/ослабления КЗЦ- и/или АЗКЦ-активности можно выполнить анализ цитотоксичности in vitro и/или in vivo. Например, чтобы убедиться в отсутствии связывания антитела с FcR (и, следовательно, отсутствии АЗКЦ-активности) при сохранении способности связывания с FcRn, можно выполнить анализ связывания Fc-рецептора (FcR). Первичные клетки для опосредования АЗКЦ, NK клетки, экспрессируют только FcRIII, тогда как моноциты экспрессируют FcRI, FcRII и FcRIII. Экспрессия FcR на гемопоэтических клетках обобщенно описана в Таблице 3 на странице 464 Ravetch and Kinet, Аппи. Rev. Immunol. 9:457-492 (1991). He ограничивающие примеры анализов in vitro для оценки АЗКЦ активности представляющей интерес молекулы, описаны в патенте США №5500362 (см., например, Hellstrom, I. et al. Proc. Natl. Acad. Sci. USA 83:7059-7063 (1986)) и Hellstrom, I et al., Proc. Natl. Acad. Sci. USA 82:1499-1502 (1985); в патенте США №5821337 (см Bruggemann, М. et al., J. Exp.Med. 166:1351-1361 (1987)). В альтернативном варианте могут быть использованы нерадиоактивные методы анализа (см., например, ACTI™ нерадиоактивный анализ цитотоксичности для проточной цитометрии (CellTechnology, Inc. Маунтин-Вью, Калифорния; и CytoTox 96® нерадиоактивный анализ цитотоксичности (Promega, Мадисон, Висконсин). Эффекторные клетки, подходящие для таких количественных исследований, включают мононуклеарные клетки периферической крови (МКПК) и клетки-естественные киллеры (NK). Альтернативно или дополнительно, АЗКЦ-активность молекулы, представляющей интерес, можно оценить в условиях in vivo, например, в модели на животных, такой как та, которая раскрыта в Clynes et al. Proc. Natl. Acad. Sci. USA 95:652-656 (1998). Можно также осуществлять количественные исследования связывания C1q, чтобы подтвердить, что антитело не способно связывать C1q и, следовательно, не обладает КЗЦ-активностью. См., например, твердофазный ИФА связывания C1q и С3с в WO 2006/029879 и WO 2005/100402. Для оценки активации комплемента может быть выполнен анализ КЗЦ (см, например, Gazzano-Santoro et al., J. Immunol. Methods 202:163 (1996); Cragg et al., Blood. 101:1045-1052 (2003); and Cragg et al., Blood. 103:2738-2743 (2004)). Определение связывания с FcRn и in vivo клиренса/времени полужизни также может быть выполнено с использованием способов, известных в данной области техники (см., например, Petkova et al. Int'l. Immunol. 18(12):1759-1769 (2006)).
Антитела со сниженной эффекторной функцией включают те, которые содержат замены одного или более остатков Fc-области 238, 265, 269, 270, 297, 327 и 329 (патенты США №№6737056 и 8219149). Такие мутанты Fc включают мутантов Fc с заменами в двух или более аминокислотных положениях 265, 269, 270, 297 и 327, в том числе так называемые мутанты Fc "DANA" с заменой остатков 265 и 297 на аланин (патенты США №№7332581 и 8219149).
Описаны некоторые варианты антител с улучшенным или уменьшенным связыванием с FcR (Смотри, например, патент США №6737056, WO 2004/056312, и Shields et al., J. Biol. Chem. 9(2): 6591-6604 (2001).)
В некоторых вариантах осуществления данного изобретения вариант антитела содержит Fc-домен с одной или более аминокислотными заменами, которые улучшают АЗКЦ, например, с заменами в положениях 298, 333 и/или 334 Fc-области (нумерация остатков по системе EU).
В некоторых вариантах осуществления данного изобретения изменения сделаны в Fc области, что привело к изменению (то есть или к улучшению, или к ухудшению) связывания C1q и/или комплементзависимой цитотоксичности (КЗЦ), например, как описано в патенте США №6194551, международной патентной заявке WO 99/51642 и публикации Idusogie et al. J. Immunol. 164: 4178-4184 (2000).
Антитела с увеличенным периодом полужизни и улучшенным связыванием с неонатальным Fc-рецептором (FcRn), который отвечает за перенос материнских IgG плоду (Guyer et al., J. Immunol. 117:587 (1976) and Kim et al., J. Immunol. 24:249 (1994)), описаны в US2005/0014934A1 (Hinton et al.). Эти антитела содержат Fc-домен с одной или более заменами, которые улучшают связывание Fc-области с FcRn. Такие варианты Fc включают варианты с заменами в одном или более остатков Fc-области: 238, 256, 265, 272, 286, 303, 305, 307, 311, 312, 317, 340, 356, 360, 362, 376, 378, 380, 382, 413, 424 или 434, например, замену аминокислотного остатка 434 в Fc-области (патент США №7371826).
См. также Duncan & Winter, Nature 322:738-40 (1988); патент США №5648260; патент США №5624821; и WO 94/29351 в отношении других примеров вариантов FC-области.
D. Варианты антител, сконструированные с использованием остатков цистеина
В некоторых вариантах осуществления изобретения может быть желательно создать антитела, сконструированные с использованием цистеина, например, «thioMAb,» в которых один или более остатков замещены остатками цистеина. В конкретных вариантах осуществления замененные остатки встречаются в доступных сайтах антитела. При замене этих остатков цистеином реакционноспособные тиоловые группы, располагаются тем самым в доступных сайтах антитела и могут применяться для конъюгирования антитела с другими фрагментами, такими как фрагменты лекарственного препарата или фрагменты линкер-лекарственный препарат, для создания иммуноконъюгата, описанного далее в данном документе. Согласно определенным вариантам осуществления данного изобретения любой один или более из следующих остатков могут быть заменены цистеином: V205 (нумерация по Кабату) легкой цепи; А118 (нумерация по системе EU) тяжелой цепи; и S400 (нумерация по системе EU) Fc-области тяжелой цепи. Антитела, сконструированные с использованием остатков цистеина, можно получить, как описано, например, в патенте США №7521541.
Е. Производные антител
Согласно определенным вариантам осуществления данного изобретения антитело согласно данному изобретению может быть дополнительно модифицировано для включения дополнительных непротеиновых фрагментов, которые известны в данной области техники и легко доступны. Фрагменты, подходящие для дериватизации антитела, включают, но не ограничиваются ими, водорастворимые полимеры. Неограничивающие примеры водорастворимых полимеров включают, без ограничений, полиэтиленгликоль (ПЭГ), сополимеры этиленгликоля/пропиленгликоля, карбоксиметилцеллюлозу, декстран, поливиниловый спирт, поливинилпирролидон, поли-1,3-диоксолан, поли-1,3,6-триоксан, сополимер этилена/малеинового ангидрида, полиаминокислоты (или гомополимеры, или статистические сополимеры), декстран или поли(п-винилпирролидон) полиэтиленгликоль, гомополимеры пропропиленгликоля, сополимеры оксида/этиленоксида, полиоксиэтилированные полиолы (например, глицерин), поливиниловый спирт и их смеси. Пропионовый альдегид полиэтиленгликоля может иметь преимущества при изготовлении из-за его стабильности в воде. Полимер может иметь любую молекулярную массу и может быть разветвленным или неразветвленным. Количество полимеров, прикрепленных к антителу, может варьироваться, и если прикреплено более одного полимера, они могут представлять собой одинаковые или различные молекулы. В целом, количество и/или тип полимеров, применяемых для дериватизации, можно определить на основании соображений, которые включают, но не ограничиваются ими, конкретные свойства или функции антитела, которые нужно улучшить, в зависимости от того, будет ли производное антитела применяться в терапии при определенных условиях и т.д.
Согласно другому варианту реализации данного изобретения предложены конъюгаты антитела и небелкового фрагмента, которые могут быть селективно нагреты путем облучения. В одном случае небелковый фрагмент представляет собой углеродную нанотрубку (Кат и др., Proc. Natl. Acad. Sci. USA 102: 11600-11605 (2005)). Излучение может иметь любую длину волны и включает, но не ограничивается ими, длины волн, которые не вредят обычным клеткам, но которые нагревают непротеиновый фрагмент до температуры, при которой погибают клетки, расположенные проксимально по отношению к конъюгату антитело-небелковый фрагмент.
F. Иммуноконъюгаты
В данном документе также предложены иммуноконъюгаты, содержащие биспецифичную антигенсвязывающую молекулу конъюгированную с одним или более цитотоксическими агентами, например, химиотерапевтическими средствами или лекарственными веществами, ингибиторами роста, токсинами (например, белковыми токсинами, токсинами бактериального, грибкового, растительного или животного происхождения, обладающими ферментативной активностью, или их фрагментами) или радиоактивными изотопами. В одном случае, иммуноконъюгат представляет собой конъюгат антитело-лекарственное средство (ADC), при этом антитело конъюгируют с одним или более лекарственных средств, в том числе, но не ограничиваясь мейтансиноидом (см. патенты США №№5208020, 5416064 и Европейский патент ЕР 0425235 В1); ауристатином, таким как фрагменты DE и DF препарата монометилауристатина (ММАЕ и MMAF) (см. патенты США №№5635483 и 5780588 и 7498298.); доластатином; калихеамицином или его производным (см. патенты США №№5712374, 5714586, 5739116, 5767285, 5770701, 5770710, 5773001 и 5877296;.. Hinman et al., Cancer Res. 53:3336-3342 (1993); и Lode et al., Cancer Res. 58:2925-2928 (1998)); антрациклином, таким как дауномицин или доксорубицин (см Kratz et al., Current Med. Chem. 13:477-523 (2006); Jeffrey et al., Bioorganic & Med. Chem. Letters 16:358-362 (2006); Torgov et al., Bioconj. Chem. 16:717-721 (2005); Nagy et al., Proc. Natl. Acad. Sci. USA 97:829-834 (2000); Dubowchik et al., Bioorg. & Med. Chem. Letters 12:1529-1532 (2002); King et al., J. Med. Chem. 45:4336-4343 (2002); и патент США №6630579); метотрексатом; виндезином; таксаном, таким как доцетаксел, паклитаксел,ларотаксел, тесетаксел и оратаксел; трихотеценоом; и СС1065.
В другом варианте осуществления данного изобретения иммуноконъюгат содержит антитело, описанное в данном документе, конъюгированное с ферментативно активным токсином или его фрагментом, включая, но не ограничиваясь ими, цепь А дифтерийного токсина, несвязывающиеся активные фрагменты дифтерийного токсина, цепь А экзотоксина (из Pseudomonas aeruginosa), цепь А рицина, цепь А абрина, цепь А модекцина, альфа-сарцин, белки Aleurites fordii, диантиновые белки, белки Phytolaca americana (PAPI, PAPII и PAP-S), ингибитор из Momordica charantia, курцин, кротин, ингибитор из Saponaria officinalis, гелонин, митогеллин, рестриктоцин, феномицин, эномицин и трикотецены.
Согласно другому варианту реализации данного изобретения иммуноконъюгат содержит антитело, описанное в данном документе, конъюгированное с радиоактивным атомом с образованием радиоконъюгата. Различные радиоактивные изотопы доступны для получения радиоконъюгатов. Примеры включают Аt211Я131Я125, Y90, Re186, Re188, Sm153, Bi212, П32, Pb212 и радиоактивные изотопы Lu. Если радиоконъюгат применяют для детектирования, он может содержать радиоактивный атом для сцинтиграфических исследований, например, tc99m или 1123, или спиновую метку для ядерно-магнитного резонанса (ЯМР) (также известного как магнитно-резонансная томография, МРТ), такую как йод-123, йод-131, индий-111, фтор-19, углерод-13, азот-15, кислород-17, гадолиний, марганец или железо.
Конъюгаты антитела и цитотоксического агента могут быть получены при помощи множества агентов, связывающих бифункциональные белки, таких как N-сукцинимидил-3-(2-пиридилдитио)пропионат (SPDP), сукцинимидил-4-(N-малеимидометил)циклогексан-1-карбоксилат (SMCC), иминотиолан (IT), бифункциональные производные имидоэфиров (такие как диметиладипимидат HCl), активные сложные эфиры (такие, как дисукцинимидилсуберат), альдегиды (такие, как глутар альдегид), бис-азидо соединения (такие, как бис(р-азидобензоил)-гександиамин), производные бис-диазония (такие, как бис(р-диазоний бензоил)-этилендиамин), диизоцианаты (такие, как толуол 2,6-диизоцианат) и бис-активные соединения фтора (такие, как 1,5-дифтор-2,4-динитробензол). Например, иммунотоксин на основе рицина может быть получен, как описано в Vitetta et al., Science 238:1098, 1987. Меченная углеродом-14 1-изотиоцианатобензил-3-метилдиэтилентриаминопентауксусная кислота (МХ-DTPA) представляет собой типичный хелатирующий агент для конъюгации радионуклида с антителом. См. WO94/11026. Линкер может представлять собой «расщепляемый линкер», облегчающий высвобождение цитотоксического лекарственного препарата в клетке. Так, например, кислотно-лабильный линкер, чувствительный к пептидазе линкер, фотолабильный линкер, диметиловый линкер или дисульфид-содержащий линкер (Chari et al., Cancer Res. 52:127-131 (1992); патент США №5208020) может быть использован.
Иммуноконъюгаты или ADC прямо подразумевают, но не ограничиваются конъюгатами, полученными при помощи перекрестно-сшивающих реагентов, включая, без ограничений, BMPS, EMCS, GMBS, HBVS, LC-SMCC, MBS, МРВН, SBAP, SIA, SIAB, SMCC, SMPB, SMPH, сульфо-EMCS, сульфо-GMBS, сульфо-KMUS, сульфо-MBS, сульфо-SIAB, сульфо-SMCC и сульфо-SMPB, а также SVSB (сукцинимидил-(4-винилсульфон)бензоат), которые являются коммерчески доступными (например, от Pierce Biotechnology, Inc., Рокфорд, Иллинойс,США).
III. Рекомбинантные способы и композиции
Биспецифичные антигенсвязывающие молекулы по данному изобретению могут быть получены с использованием рекомбинантных способов и композиций, например, как описано в патенте США №4816567 и в публикации патента США №2013/0078249, которая включена в данное описание в качестве ссылки во всей своей полноте. В одном варианте осуществления предоставляется, выделенная нуклеиновая кислота (например, полинуклеотид), кодирующая биспецифичную антигенсвязывающую молекулу, описанную в данном документе. Такая нуклеиновая кислота может кодировать аминокислотную последовательность, содержащую VL и/или аминокислотную последовательность, содержащую VH, биспецифичной антигенсвязывающей молекулы (например, легкие и/или тяжелые цепи какого-или плеча биспецифичной антигенсвязывающей молекулы). Согласно дополнительному варианту реализации данного изобретения предложен один или более векторов (например, векторов экспрессии), содержащих такую нуклеиновую кислоту.
Полинуклеотиды, кодирующие биспецифичные антигенсвязывающие молекулы по данному изобретению могут быть экспрессированы в виде одной молекулы полинуклеотидной или нескольких (например, два или более) полинуклеотидов, которые коэкспрессированы. Полипептиды, кодируемые полинуклеотидами, которые коэкспрессированы, могут объединяться с помощью, например, дисульфидных связей или другими средствами, чтобы сформировать функциональную биспецифичную антигенсвязывающую молекулу. Так, например, легкая цепь, как часть антигенсвязывающего фрагмента может кодироваться с помощью полинуклеотида отдельного от части биспецифичной антигенсвязывающей молекулы, содержащей часть с тяжелой цепью антигенсвязывающего фрагмента, субъединицу Fc-домена и, необязательно, другой антигенсвязывающий фрагмент. При совместной экспрессии полипептиды тяжелой цепи будут ассоциироваться с полипептидами легкой цепи с образованием антигенсвязывающего фрагмента. В другом примере, часть биспецифичной антигенсвязывающей молекулы, содержащей одну из двух субъединиц Fc-домена и, необязательно, один или несколько антигенсвязывающих фрагментов могут быть закодированы с помощью полинуклеотида отдельного от части активирующей Т-клетки биспецифичной антигенсвязывающей молекулы, содержащей две другие субъединицы Fc-домена, и, необязательно, антигенсвязывающий фрагмент. При совместной экспрессии, субъединицы Fc-домена будут ассоциироваться с образованием Fc-домена.
В некоторых вариантах осуществления данного изобретения выделенный полинуклеотид согласно изобретению кодирует фрагмент биспецифичной антигенсвязывающей молекулы, содержащий первые и второй антигенсвязывающий фрагмент, и Fc-домен, состоящий из двух субъединиц. В одном варианте осуществления, выделенный полинуклеотид по данному изобретению кодирует первый антигенсвязывающий фрагмент и субъединицу Fc-домена. В другом варианте осуществления, выделенный полинуклеотид по данному изобретению кодирует тяжелую цепь второго антигенсвязывающего фрагмента и субъединицу Fc-домена. В более конкретном варианте осуществления данного изобретения выделенный полинуклеотид кодирует полипептид, отличающийся тем, тяжелая цепь Fab имеет общую С-концевую пептидную связь с субъединицей Fc-домена. В еще одном варианте осуществления данного изобретения выделенный полинуклеотид по данному изобретению кодирует тяжелую цепь третьего антигенсвязывающего фрагмента, тяжелую цепь второго связывающего фрагмента антигена, и субъединицу Fc-домена. В некоторых вариантах осуществления легкие цепи второго и третьего антигенсвязывающих фрагментов коэкспрессируются и ассоциируются с областями тяжелой цепи с образованием Fab-доменов.
Согласно дополнительному варианту реализации данного изобретения предложена клетка-хозяин, содержащая такую нуклеиновую кислоту. В одном таком варианте осуществления клетка-хозяин содержит (например, была трансформирована): (1) вектор, содержащий нуклеиновую кислоту, которая кодирует аминокислотную последовательность, содержащую по меньшей мере один VL биспецифичной антигенсвязывающей молекулы, и аминокислотную последовательность, содержащую по меньшей мере один VH биспецифичной антигенсвязывающей молекулы, или (2) первый вектор, содержащий нуклеиновую кислоту, которая кодирует аминокислотную последовательность, содержащую VL биспецифичной антигенсвязывающей молекулы, и второй вектор, содержащий нуклеиновую кислоту, которая кодирует аминокислотную последовательность, содержащую VH биспецифичной антигенсвязывающей молекулы. В одном варианте осуществления данного изобретения клетка-хозяин представляет собой эукариотическую клетку, например, клетку яичника китайского хомячка (СНО). В одном варианте осуществления данного изобретения предлагается способ получения антитела против CLL-1, причем способ включает культивирование клетки-хозяина, содержащей нуклеиновую кислоту, кодирующую антитело, как описано выше, в условиях, пригодных для экспрессии антитела, и, в некоторых случаях, извлечение антитела из клетки-хозяина (или среды, в которой культивируют клетку-хозяина).
Для рекомбинантной продукции антитела против CLL-1, нуклеиновая кислота, кодирующая антитело, например, как описано выше, является выделенной и вставлена в один или более векторов для дальнейшего клонирования и/или экспрессии в клетке-хозяине. Такая нуклеиновая кислота может быть легко выделена и сиквенирована с использованием обычных процедур (например, с использованием олигонуклеотидных зондов, которые способны специфично связываться с генами, кодирующими тяжелые и легкие цепи антитела). Подходящие клетки-хозяева для клонирования или экспрессии векторов, кодирующих антитела, включают прокариотические или эукариотические клетки, описанные в данном документе. Например, антитела могут вырабатываться в бактериях, в частности, если не требуется гликозилирование и эффекторная функция Fc. Для экспрессии фрагментов антитела и полипептидов в бактериях см., например, патенты США №5648237, 5789199 и 5840523. (См. также Charlton, Methods in Molecular Biology, Vol.248 (B.K.C. Lo, ed., Humana Press, Totowa, NJ, 2003), pp. 245-254, где описана экспрессия фрагментов антитела в Е. coli.) После экспрессии антитела можно выделить из бактериальной биомассы в растворимую фракцию и подвергать дальнейшей очистке.
IV. Фармацевтические препараты
Терапевтические препараты используемых антител, описанные в данном документе, применяемые в соответствии с данным изобретением, получают для хранения путем смешивания антитела с желательной степенью чистоты с необязательными фармацевтически приемлемыми носителями, вспомогательными веществами или стабилизаторами в виде лиофилизированных препаратов или водных растворов. Для получения общей информации о препаратах, см., например, Oilman et al. (eds.) The Pharmacological Bases of Therapeutics, 8th Ed., Pergamon Press, 1990; A. Gennaro (ed.), Remington's Pharmaceutical Sciences, 18th Edition, Mack Publishing Co., Pennsylvania, 1990; Avis et al. (eds.) Pharmaceutical Dosage Forms: Parenteral Medications Dekker, New York, 1993; Lieberman et al. (eds.) Pharmaceutical Dosage Forms: Tablets Dekker, New York, 1990; Lieberman et al. (eds.), Pharmaceutical Dosage Forms: Disperse Systems Dekker, New York, 1990; and Walters (ed.) Dermatological and Transdermal Formulations (Drugs and the Pharmaceutical Sciences), Vol 119, Marcel Dekker, 2002. Приемлемые носители, вспомогательные вещества или стабилизаторы являются нетоксичными для реципиентов в используемых дозировках и концентрациях, и включают буферные вещества, например, фосфат, цитрат и другие органические соли; антиоксиданты, включая аскорбиновую кислоту и метионин; консерванты (например, хлорид октадецилдиметилбензиламмония; хлорид гексаметония; хлорид бензалкония; хлорид бензэтония; фенол; бутиловый или бензиловый спирт; алкилпарабены, например, метил- или пропилпарабен; катехол; резорцин; циклогексанол; 3-пентанол; и m-крезол); низкомолекулярные (содержащие менее 10 остатков) полипептиды; белки, например, сывороточный альбумин, желатин или иммуноглобулины; гидрофильные полимеры, например, поливинилпирролидон; аминокислоты, например, глицин, глутамин, аспарагин, гистидин, аргинин или лизин; моносахариды, дисахариды и другие углеводы, включая глюкозу, маннозу или декстрины; хелатирующие агенты, например, ЭДТА; сахара, например, сахарозу, маннит, трегалозу или сорбит; солеобразующие противоионы, например, натрия; металлсодержащие комплексы (например, комплексы Zn-белок) и/или неионогенные ПАВ, например, TWEEN™, плюроники (PLURONICS™) или полиэтиленгликоль (ПЭГ).
Состав, описанный в данном документе, также может содержать более одного активного соединения (второе лекарственное средство, как отмечалось выше), предпочтительно с дополняющей активностью, которые не оказывают нежелательного действия друг на друга. Тип и эффективное количество таких лекарственных средств зависит, например, от количества и типа антагониста, присутствующего в составе, и клинических параметров субъектов. Активные ингредиенты можно включить в микрокапсулы, полученные, например, с помощью методик коацервации или межфазной полимеризации, например, микрокапсулы гидроксиметилцеллюлозы или желатина и полиметилметакрилата, соответственно, в коллоидные системы доставки лекарств (например, липосомы, альбуминовые микросферы, микроэмульсии, наночастицы и нанокапсулы) или в макроэмульсии. Такие методы раскрыты в Remington's Pharmaceutical Sciences 16th edition, Osol, A. Ed. (1980).
Могут быть получены препараты с замедленным высвобождением. Подходящие примеры препаратов замедленного высвобождения включают полупроницаемые матриксы твердых гидрофобных полимеров, содержащие антагонист и присутствующие в виде формованных изделий, например, пленок или микрокапсул. Примеры матриксов замедленного высвобождения включают полиэфиры, гидрогели (например, поли(2-гидроксиэтилметакрилат) или поливиниловый спирт), полилактиды (патент США №3773919), сополимеры L-глутаминовой кислоты и у-этил-Ь-глутамата, неразлагаемый этиленвинилацетат, разлагаемые сополимеры молочной кислоты-гликолевой кислоты, например, LUPRON DEPOT™ (микросферы для инъекций, содержащие сополимер молочной кислоты-гликолевой кислоты и лейпролидацетат) и поли-В-(-)-3-гидроксимасляную кислоту.
Композиции, предназначенные для применения in vivo, обычно являются стерильными. Это легко достигается путем фильтрации через мембраны для стерильной фильтрации.
V. Терапевтические Способы
Любая из биспецифичных антигенсвязывающих молекул по данному изобретению (например, биспецифичные антигенсвязывающие молекулы, имеющие моновалентное плечо, способное специфично связываться с первым антигеном и бивалентное плечо, способное специфично связываться с двумя вторыми антигенами) или их композиции могут быть использованы в любом из терапевтических способов, описанных в данной заявке.
В одном аспекте предложена биспецифичная антиген-связывающая молекула для применения в качестве лекарственного средства. Например, в некоторых вариантах осуществления, биспецифичные антигенсвязывающие молекулы, описанные в данном документе, предназначены для применения при обработке или замедлении прогрессирования клеточного пролиферативного нарушения (например, рака) или аутоиммунного расстройства у субъекта, нуждающегося в этом. В некоторых вариантах осуществления биспецифичная антигенсвязывающая молекула по любому из предшествующих аспектов, предназначена для использования в повышении иммунной функции у субъекта, имеющий клеточное пролиферативное нарушение (например, рак) или аутоиммунное расстройство. В некоторых вариантах осуществления данное изобретение относится к биспецифичной антигенсвязывающей молекулы для использования в способе улучшения иммунной функции у индивидуума, имеющего клеточное пролиферативное нарушение или аутоиммунное расстройство, включающий введение индивидууму эффективного количества биспецифичной антигенсвязывающей молекулы для активации эффекторных клеток (например, Т-клеток, например, CD8+ и/или CD4+ Т-клеток), расширения (увеличения) популяция эффекторных клеток, уменьшения популяции клеток-мишеней (например, популяции клеток, экспрессирующих антиген второй антиген клетки-мишени, который распознается биспецифичной антигенсвязывающей молекулой по данному изобретению) и/или уничтожения клетки-мишени (например, клетки-мишени опухоли).
Данное изобретение предусматривает использование биспецифичной антигенсвязывающей молекулы по данному изобретению в производстве лекарственного средства для лечения или замедления прогрессирования расстройства, такого как клеточное пролиферативное нарушение (например, рак) или аутоиммунное нарушение. В дополнительном варианте осуществления данного изобретения медикамент предназначен для применения в способе лечения клеточно-пролиферативного нарушения, включающем введение индивидууму, имеющему клеточное пролиферативное нарушение, эффективного количества лекарственного средства. В одном из таких вариантов осуществления данного изобретения данный способ дополнительно включает введение индивидууму эффективного количества по меньшей мере одного дополнительного терапевтического агента, например, как описано ниже. В еще одном варианте осуществления лекарственное средство предназначено для активации эффекторных клеток (например, Т-клеток, например, CD8+ и/или CD4+ Т-клеток), расширения (увеличения) популяция эффекторных клеток, уменьшения популяции клеток-мишеней (например, популяции клеток, экспрессирующих антиген второй антиген клетки-мишени, который распознается биспецифичной антигенсвязывающей молекулой по данному изобретению) и/или уничтожения клетки-мишени (например, клетки-мишени опухоли).
В другом аспекте данное изобретение относится к способу лечения или замедления прогрессирования нарушения у субъекта, нуждающегося в этом, причем способ включает введение субъекту биспецифичной антигенсвязывающей молекулы по любому из предшествующих аспектов данного изобретения. В одном варианте осуществления способ включает введение субъекту, имеющему такое клеточное пролиферативное нарушение или аутоиммунное нарушения, эффективного количества биспецифичной антигенсвязывающей молекулы (например, биспецифичной антигенсвязывающей молекулы, имеющей анти-CD3 моновалентное плечо и анти-опухолевый антиген клетки бивалентное плечо). В одном из таких вариантов осуществления данного изобретения данный способ дополнительно включает введение индивидууму эффективного количества по меньшей мере одного дополнительного терапевтического агента, например, как описано ниже.
В другом аспекте данное изобретение относится к способу усиления иммунной функции у субъекта, имеющего расстройство, причем способ включает введение субъекту биспецифичной антигенсвязывающей молекулы по любому из предшествующих аспектов (например, биспецифичной антигенсвязывающей молекулы имеющей анти-CD3 моновалентное плечо и анти-опухолевый антиген клетки бивалентное плечо). В некоторых вариантах осуществления расстройство представляет собой клеточное пролиферативное нарушение (например, рак) или аутоиммунное расстройство. В некоторых вариантах осуществления данного изобретения способ включает в себя введение эффективного количества биспецифичной антигенсвязывающей молекулы для активации эффекторных клеток (например, Т-клеток, например, CD8+ и/или CD4+ Т-клеток), расширения (увеличения) популяции эффекторных клеток, уменьшения популяции клеток-мишеней (например, популяции клеток, экспрессирующих второй антиген-мишень клетки, который распознается биспецифичной антигенсвязывающей молекулой по данному изобретению) и/или уничтожения клетки-мишени (например, клетки-мишени опухоли).
В некоторых вариантах осуществления биспецифичные антигенсвязывающие молекулы, предоставленные в данном описании, композиции и способы их использования, которые используются для лечения рака, таких как рак молочной железы, рак желудка, колоректальный рак, немелкоклеточный рак легких клеток, неходжкинская лимфома (НХЛ), лимфома В-клеток, В клеточный лейкоз, множественная миелома, рак почки, рак предстательной железы, рак печени, рак головы и шеи, меланома, рак яичника, мезотелиома, глиобластома, диффузная крупноклеточная В-клеточная лимфома (DLBCL) В-подобных клеток терминального центра (GCB), DLBCL В-подобных активированных клеток (ABC), фолликулярная лимфома (FL) DLBCL, мантийно клеточная лимфома (MCL), острый миелоидный лейкоз (ОМЛ), хронический лимфоидный лейкоз (ХЛЛ), лимфома маргинальной зоны (MZL), лейкоз малых лимфоцитов (SLL), лимфоплазмоцитарная лимфома (LL), макроглобулинемия Вальденстрема (WM), лимфома центральной нервной системы (CNSL), лимфома Беркитта (ЛБ), В-клеточный пролимфоцитарный лейкоз, лимфома маргинальной зоны селезенки, лейкозы ворсистых клеток, лимфома/лейкоз селезенки, диффузной красной пульпы мелкоклеточная В клеточная лимфома селезенки, вариант волосатоклеточного лейкоза, болезнь тяжелой цепи α, болезнь тяжелой цепи γ, болезнь тяжелой цепи μ, миелома плазматических клеток, одиночную плазмоцитома кости, внекостная плазмоцитома, экстранодальная лимфома маргинальной зоны лимфоидной ткани ассоциированная с мукозой (MALT-лимфома), узловая лимфома маргинальной зоны, педиатрическая узловая лимфома маргинальной зоны, педиатрическая фоликулярная лимфома, первичная кожная лимфома фолликулярного центра, богатая Т-клеткми/гистиоцитами крупноклеточная В-клеточная лимфома, первичная DLBCL центральной нервной системы, первичная кожная DLBCL (ножной тип), вирус Эпштейн-Барр (EBV)-положительная DLBCL людей преклонного возраста, DLBCL ассоциированная с хроническим воспалением, лимфоматоидный гранулематоз, первичная медиастинальная (тимус) крупноклеточная В-клеточная лимфома, внутрисосудистая крупноклеточная В-клеточная лимфома, киназа анапластической лимфомы (АЕК)-положительная крупноклеточная В-клеточная лимфома, плазмабластическая лимфома, крупноклеточная В-клеточная лимфома, возникающая при HHVS-ассоциированной мультицентрической болезни Каслмана, неклассифицируемая крупноклеточная В-клеточная лимфома с промежуточными признаками между диффузной крапноклеточной В клеточной лимфомой и классической лимфомой Ходжкина)). В некоторых вариантах осуществления биспецифичные антигенсвязывающие молекулы, предоставленная в данном описании, композиции и способы их использования, используются для лечения HER2-положительного рака (например, НЕ112-положительного рака молочной железы или HER2-положительного рака желудка).
Кроме того, данное изобретение обеспечивает комбинированную терапию, включая введение биспецифичной антигенсвязывающей молекулы с одним или несколькими дополнительными терапевтическими агентами (например, с одним, двумя, тремя, четырьмя, пятью или более дополнительными терапевтическими агентами) вводят параллельно или как часть комплекса схемы лечения. В одном варианте осуществления биспецифичные антигенсвязывающие молекулы вводят совместно с одним или несколькими биологическими модификаторами, выбранными из ингибитора Вс1-2 (например, GDC-0199/ABT-199), леналидомида (Revlimid®), ингибитора Р13К-дельта (например, иделалисиба (ZYDELIG®)), агониста, например, антитела-агониста, направленного против активирующей ко-стимулирующей молекулы, например, CD40, CD226, CD28, ОХ40 (например, AgonOX), GITR, CD137 (также известного как TNFRSF9, 4-1 ВВ или ILA), CD27 (например, CDX-1127), HVEM или CD 127, антагониста, например, антитела-антагониста, направленного против ингибирующей ко-стимулирующей молекулы, например, CTLA-4 (также известный как CD152), PD-1, TIM-3, BTLA, VISTA, LAG-3, В7-Н3, В7-Н4, IDO (например, 1-метил-D-триптофан (также известного как 1-D-MT)), TIGIT, MICA/B, GITR (например, TRX518) или аргиназы, иплимумаба (также известного как MDX-010, MDX-101, или YERVOY®), тремелимумаба (также известного как тицилимумаб или СР-675.206, урелумаба (также известного как BMS-663513), MGA271, антагониста, направленного против TGF-β, например, метелимумаба (также известного как САТ-192), фрезолимумаба (также известного как GC1008), LY2157299k и адаптивного переноса Т-клеток (например, цитотоксических Т-клеток) экспрессирующих химерный антигеннный рецептор (CAR), например, адаптивный перенос Т-клетки, содержащей доминантно-негативный TGF- β-рецептор, например, доминантно-негативный TGF-β рецептор типа II. В конкретном варианте осуществления, биологический модификатор представляет собой антагонист связывания оси PD-1. В некоторых вариантах осуществления данного изобретения антагонист связывания оси PD-1, или дополнительный терапевтический агент вводят до или после введения биспецифичной антигенсвязывающей молекулы. В некоторых вариантах осуществления данного изобретения антагонист связывания оси PD-1, или дополнительный терапевтический агент вводят одновременно с биспецифичной антигенсвязывающей молекулой. В некоторых вариантах осуществления, антагонист связывания оси PD-1 выбран из группы, состоящей из антагониста связывания PD-L1 (например, атезолизумаба (MPDL3280A), YW243.55.S70, MDX-1105, MEDI4736 (дурвалумаба) и MSB0010718C (авелумаба)), антагониста связывания PD-1 (например, MDX-1106 (ниволумаба), MK-3475 (пембролизумаба), СТ-011 (пидилизумаба), MEDI-0680 (АМР-514), PDR001 (спартализумаба), REGN2810 (цемипилимаба), и BGB-108), а также антагониста связывания PD-L2, (например, антитела или иммуноадгезина). Дополнительно или альтернативно, биспецифичная антигенсвязывающая молекула по данному изобретению может быть введена совместно с одним или несколькими химиотерапевтическими агентами (например, как часть способа лечения субъекта, имеющего клеточное пролиферативное нарушение, например, рак).
В дополнительном аспекте данного изобретения предлагается способ лечения HER2-положительного рака. В одном варианте осуществление способ включает введение индивидууму, имеющему HER2-положительный рак эффективного количества биспецифичной антигенсвязывающей молекулы по данному изобретению, такой как 1Fab-IgG TDB молекулы, имеющей анти-HER2 бивалентное плечо и анти-CD3 моновалентное плечо. В конкретном варианте осуществления анти-HER2 плечо обладает приемлемым профилем токсичности при введении в эффективной дозе пациенту. В одном из вариантов осуществления анти-CD3 плечо молекулы 1Fab-IgG TDB с приемлемым профилем токсичности представляет собой низкоаффинный анти-CD3 антигенсвязывающий фрагмент. В одном из вариантов осуществления анти-CD3 антигенсвязывающий фрагмент 1Fab-IgG TDB с приемлемым профилем токсичности представляет собой 40G5c. В конкретном варианте осуществления HER2-положительнй рак представляет собой HER2-положительный рак молочной железы или HER2-положительный рак желудка. HER2-положительный рак (например, HER2-положительный рак молочной железы или HER2-положительный рак желудка) может быть охарактеризован опухолевыми клетками, которые экспрессируют HER2 в количестве копий (например, среднем количестве копий) по меньшей мере 200000 на клетку (например, по меньшей мере 250000 копий HER2 на клетку, по меньшей мере 300000 копий HER2 на клетку, по меньшей мере 400000 копий HER2 на клетку, по меньшей мере 500000 копий HER2 на клетку, по меньшей мере 600000 копий HER2 на клетку, по меньшей мере 700000 копий HER2 на клетку, по меньшей мере 750000 копий HER2 на клетку, по меньшей мере 800000 копий HER2 на клетку, по меньшей мере 900000 копий HER2 на клетку, по меньшей мере 1000 000 копий HER2 на клетку, по меньшей мере 1200000 копий HER2 на клетку, по меньшей мере 1500000 копий HER2 на клетку, по меньшей мере 2000 000 копий HER2 на клетку, по меньшей мере 2500000 копий HER2 на клетку, по меньшей мере 3000 000 копий HER2 на клетку, или более, например, от 200000 до 2000 000 копий HER2 на клетку, от 300000 до 1500000 копий HER2 на клетку, от 400000 до 1200000 копий HER2 на клетку, или из 500,0 00 до 1000 000 копий HER2 на клетку, например, от 200000 до 1000 000 копий HER2 на клетку (например, от 200000 до 250000 копий HER2 на клетку, от 250000 до 300000 копий HER2 на клетку, от 300000 до 400000 копий HER2 на клетку, от 400000 500000 копий HER2 на клетку, от 500000 до 750000 копий HER2 на клетку, или от 750000 до 1000 000 копий HER2 на клетку) или от 1000 000 до 3000 000 копий HER2 на клетку (например, от 1000 000 до 1500000 копий HER2 на клетку, от 1500000 до 2000 000 копий HER2 на клетку, от 2,000,000 до 2,500,000 копий HER2 на клетку, или от 2500000 до 3000 000 копий HER2 на клетку).
В одном варианте осуществления биспецифичные антигенсвязывающие молекулы анти-HER2, вводят совместно с одним или несколькими дополнительными терапевтическими агентами, которые нацелены на HER путь. В одном варианте осуществления терапевтический агент, который нацелен на HER путь выбран из ингибитора EGFR, ингибитора HER2, ингибитора HER3 и/или ингибитора HER4. В одном варианте осуществления HER2 TDB (например, 1Fab-IgG TDB) вводят совместно с одним или более дополнительных терапевтических агентов, выбранных из трастузумаба (Herceptin®), T-DM1 (KADCYLA®) и пертузумаба (PERJETA®). В одном варианте осуществления анти-HER2/CD3 биспецифичную антигенсвязывающую молекулу вводят совместно с трастузумабом. В одном варианте осуществления анти-HER2/CD3 биспецифичную антигенсвязывающую молекулу вводят совместно с T-DM1. В одном варианте осуществления анти-HER2/CD3 биспецифичную антигенсвязывающую молекулу вводят совместно с пертузумабом. В одном варианте осуществления анти-HER2/CD3 биспецифичную антигенсвязывающую молекулу вводят совместно с трастузумабом и пертузумабом. В одном варианте осуществления анти-HER2/CD3 биспецифичную антигенсвязывающую молекулу вводят совместно с T-DM1 и пертузумабом.
Такие виды комбинированной терапии, отмеченные выше, охватывают комбинированное введение (при котором два или более терапевтических агентов включены в один и тот же или отдельные препараты) и раздельное введение, и в этом случае введение антитела согласно данному изобретению может происходить до, одновременно и/или после введения дополнительного терапевтического агента или агентов. В одном варианте осуществления данного изобретения введение антитела против CD3 и введение дополнительного терапевтического агента может разделять около одного месяца или около одной, двух или трех недель, или около одного, двух, трех, четырех, пяти или шести дней. Антитело согласно изобретению (и/или любой дополнительный терапевтический агент) можно вводить любым подходящим способом, в том числе внутривенно, подкожно, внутримышечно, местно, перорально, трансдермально, внутрибрюшинно, внутрикорбитально, путем имплантации, путем ингаляции, интратекально, интравентрикулярно или интраназально. Например, в некоторых вариантах осуществления, биспецифичные антигенсвязывающие молекулы вводят подкожно. В других вариантах осуществления биспецифичные антигенсвязывающие молекулы вводят внутривенно. В некоторых вариантах осуществление биспецифичная антигенсвязывающая молекула введенная путем подкожной инъекции проявляет менее токсичный ответ у пациента, чем та же биспецифичная антигенсвязывающая молекула введенная путем внутривенной инъекции. Введение дозы можно проводить любым удобным способом, например, путем инъекций, таких как внутривенные или подкожные инъекции, частично в зависимости от того, является ли введение кратковременным или постоянным. Согласно данному изобретению предусмотрены различные схемы дозирования, включая, но не ограничиваясь ими, однократное или многократное введение в различные моменты времени, болюсное введение и импульсную инфузию. Антитела согласно данному изобретению будут изготовлены, дозированы и введены способом, соответствующим требованиям надлежащей медицинской практики. Факторы, которые необходимо учитывать в данном случае, включают конкретное нарушение, которое лечат, конкретное млекопитающее, которое лечат, клиническое состояние отдельного пациента, причину нарушения, место доставки агента, способ введения, график введения и другие факторы, известные врачам. Биспецифичную антигенсвязывающую молекулу, необязательно, изготавливают с одним или более агентами, применяемыми в настоящее время для предотвращения или лечения рассматриваемого нарушения, однако это не является обязательным. Эффективное количество таких других агентов зависит от количества антитела, присутствующего в составе, типа нарушения или лечения и других факторов, которые обсуждались выше. Другие агенты обычно применяют в тех же дозировках и вводят с помощью путей, описанных в данном документе, или около от 1 до 99% дозировок, описанных в данном документе, или в любой дозировке и любым путем, который эмпирически/клинически определен как подходящий.
Для профилактики или лечения заболевания соответствующая доза биспецифичной антигенсвязывающей молекулы по данному изобретению (при использовании отдельно или в комбинации с одним или несколькими другими дополнительными терапевтическими агентами), будет зависеть от типа заболевания, подлежащего лечению, тяжести и течения заболевания, независимо от того, вводят ли биспецифичную антигенсвязывающую молекулу для профилактических или терапевтических целей, предыдущей терапии, истории болезни пациента и реакции на биспецифичную антигенсвязывающую молекулу и решения лечащего врача. Биспецифичную антигенсвязывающую молекулу вводят пациенту подходящим образом за один раз или в течение серии процедур. В качестве общей нормы терапевтически эффективное количество биспецифичной антигенсвязывающей молекулы, вводимой человеку, соответствует диапазону от около 0,01 до около 100 мг/кг массы тела пациента, вне зависимости от того, осуществляют одно введение или более. В некоторых вариантах осуществления данного изобретения ежедневно вводимое количество антитела составляет, например, от около 0,01 до около 45 мг/кг, от около 0,01 до около 40 мг/кг, от около 0,01 до около 35 мг/кг, от около 0,01 до около 30 мг/кг, от около 0,01 до около 25 мг/кг, от около 0,01 до около 20 мг/кг, от около 0,01 до около 15 мг/кг, от около 0,01 до около 10 мг/кг, от около 0,01 до около 5 мг/кг или от около 0,01 до около 1 мг/кг в день. В одном варианте осуществления данного изобретения биспецифичную антигенсвязывающую молекулу, описанную в данном документе, вводят человеку в дозе, составляющей около 100 мг, около 200 мг, около 300 мг, около 400 мг, около 500 мг, около 600 мг, около 700 мг, около 800 мг, около 900 мг, около 1000 мг, около 1100 мг, около 1200 мг, около 1300 мг или около 1400 мг, на 1 сутки 21-суточных циклов. Дозу можно вводить в виде однократной дозы или многократных доз (например, 2 или 3 доз), например, инфузий. В случае повторных введений в течение нескольких суток или более, в зависимости от состояния, лечение, как правило, проводят до достижения желаемой степени подавления симптомов заболевания. Одна иллюстративная доза антитела соответствует диапазону от около 0,05 мг/кг до около 10 мг/кг. Таким образом, пациенту можно вводить одну или более доз, составляющих около 0,5 мг/кг, 2,0 мг/кг, 4,0 мг/кг или 10 мг/кг (или любую их комбинацию). Такие дозы можно вводить с интервалами, например, каждую неделю или каждые три недели (например, чтобы пациент получал от около двух до около двадцати или, например, около шести доз антитела против CD3). Можно вводить начальную повышенную нагрузочную дозу, за которой следует одна или более пониженные дозы. Ход лечения можно контролировать с помощью обычных методик и анализов. В некоторых вариантах осуществления любого из предшествующих аспектов данного изобретения, субъект, больной, или индивидуум является человеком.
VI. Наборы
В данном документе предоставлены наборы, содержащие одну или несколько композиций, описанных в данном документе (например, композиция, содержащая любую одну или более из биспецифичных антигенсвязывающих молекул, описанных в данном документе, и фармацевтически приемлемый носитель) и вкладыш пакета для введения композиции субъекту для лечения или задержки прогрессирования расстройства (например, клеточного пролиферативного нарушения (например, рака, такого как рак молочной железы, рак желудка, колоректальный рак, немелкоклеточный рак легких клеток, неходжкинская лимфома (НХЛ), лимфома В-клеток, В клеточный лейкоз, множественная миелома, рак почки, рак предстательной железы, рак печени, рак головы и шеи, меланома, рак яичника, мезотелиома, глиобластома, диффузная крупноклеточная В-клеточная лимфома (DLBCL) В-подобных клеток терминального центра (GCB), DLBCL В-подобных активированных клеток (ABC), фолликулярная лимфома (FL) DLBCL, мантийно клеточная лимфома (MCL), острый миелоидный лейкоз (ОМЛ), хронический лимфоидный лейкоз (ХЛЛ), лимфома маргинальной зоны (MZL), лейкоз малых лимфоцитов (SLL), лимфоплазмоцитарная лимфома (LL), макроглобулинемия Вальденстрема (WM), лимфома центральной нервной системы (CNSL), лимфома Беркитта (ЛБ), В-клеточный пролимфоцитарный лейкоз, лимфома маргинальной зоны селезенки, лейкозы ворсистых клеток, лимфома/лейкоз селезенки, диффузной красной пульпы мелкоклеточная В клеточная лимфома селезенки, вариант волосатоклеточного лейкоза, болезнь тяжелой цепи а, болезнь тяжелой цепи у, болезнь тяжелой цепи γ, миелома плазматических клеток, одиночную плазмоцитома кости, внекостная плазмоцитома, экстранодальная лимфома маргинальной зоны лимфоидной ткани ассоциированная с мукозой (MALT-лимфома), узловая лимфома маргинальной зоны, педиатрическая узловая лимфома маргинальной зоны, педиатрическая фоликулярная лимфома, первичная кожная лимфома фолликулярного центра, богатая Т-клеткми/гистиоцитами крупноклеточная В-клеточная лимфома, первичная DLBCL центральной нервной системы, первичная кожная DLBCL (ножной тип), вирус Эпштейн-Барр (ЕВУ)-положительная DLBCL людей преклонного возраста, DLBCL ассоциированная с хроническим воспалением, лимфоматоидный гранулематоз, первичная медиастинальная (тимус) крупноклеточная В-клеточная лимфома, внутрисосудистая крупноклеточная В-клеточная лимфома, киназа анапластической лимфомы (ALK)-положительная крупноклеточная В-клеточная лимфома, плазмабластическая лимфома, крупноклеточная В-клеточная лимфома, возникающая при HHV8-ассоциированной мультицентрической болезни Каслмана, неклассифицируемая крупноклеточная В-клеточная лимфома с промежуточными признаками между диффузной крапноклеточной В клеточной лимфомой и классической лимфомой Ходжкина)). В некоторых вариантах осуществления рак является HER2-положительным раком (например, HER2-положительным раком молочной железы или HER2-положительным раком желудка). Дополнительно или альтернативно, набор может включать в себя пакет вставки для введения композиции субъекту для лечения или задержки прогрессирования аутоиммунного расстройства.
ПРИМЕРЫ
Ниже приведены примеры способов и композиций согласно данному изобретению. Следует понимать, что различные другие варианты осуществления могут быть осуществлены на практике с учетом общего описания, приведенного выше.
Пример 1. Материалы и способы
Синтез генов
Fab
Гены, кодирующие варианты Fab анти-HER2 (4D5-8; Carter et al., Proc. Natl. Acad. Sci. USA. 1992, 89: 4285-4289) были получены путем синтеза гена вариабельных доменов легкой цепи и тяжелой цепи. AHTH-Fab-HER2.4D5 и варианты были произведены в объеме 30 мл в клетках Expi293TTM и очищены в серийном режиме с использованием анти-Flag афинной смолы. После стадии промывки 3х PBS, Fab элюировали с помощью 50 мМ фосфорной кислоты (рН 3,0), нейтрализовали с помощью 20х PBS (рН 11,0) и фильтровали. Все Fab было чистоты > 95% и проверены с помощью масс-спектрометрии.
IgG TDB & 1Fab-IgG TDB
Выступ (анти-HER2.N297G.knob (4D5-8 and variants);Kelley and O'Connell, Biochemistry 1993, 32: 6828-6835) и отверстие (анти-CD3.N297G.hole (40G5c, если не указано иное)) полу-антитела были получены, как описано ранее (Dillon et al., MAbs 2017, 9: 213-230). Для 1Fab-IgG TDB конструкций, кодирующая область для анти-HER2 Fab (Е1-Т225) непосредственно предшествует кодирующей области последовательности анти-HER2.knob и они были синтезированы с использованием или без использования G4SGG линкера между ними.
Слияния 1Fab-IgG TDB с люциферазой
Зрелая последовательность белка для люциферазы (AAG54095.1) K18-D185 была слита на С-конце с анти-HER2.hu4D5 легкой цепи. AHTH-HER2.hu4D5 Fab с и без слияния легкой цепи с люциферазой продуцирует аналогичные кинетики связывания с HER2 с использованием Biacore® Т200 (GE Healthcare) и способом, описанными ниже.
Экспрессия и очистка белка
IgG TDB, 1Fab-IgG TDB и слияния с люциферазой 1Fab-IgG TDB были получены следующим образом. Полу-антитела анти-HER2.hu4D5.knob и варианты и анти-CD3.40G5c.hole были произведены в клетках СНО в масштабе ≥1L и очищены с помощью MabSelect SURE (GE Healthcare). Биспецифичные IgG TDB, 1Fab-IgG TDB, или сборка 1Fab-IgG TDB слитых с люциферазой из полу-антител проводили, как описано в Junttila et al., Cancer Res. 2014, 74: 5561-5571; Spiess et al., Ato. Biotechnol. 2013, 31: 753-758.
Вестерп-блот анализ HER2
Клеточные лизаты были получены с использованием Cell Signaling Technology буфера для лизиса. Количество белка было измерено с помощью ВСА реагентов для анализа (Pierce Cat. Nos. 23228 and 23224). 40 мкг белка наносили на ПААГ с ДСН и антитело против HER2 (Dako Cat. No. А0485) было использовано для обнаружения.
Иммуногистохимия (IHC)
Иммуногистохимию для HER2 проводили на пяти микрометровых фиксированных формалином, залитых в парафин образцах тканей и образцах для тканевых микромассивов (ТМА) с анти-HER-2/NEU (Ventana Medical Systems, клон 4 В5, Тускон, Аризона) кролика первичным моноклональным антителом кролика с использованием система Ventana Ultraview-Benchmark с обнаружением Вентана DAB. Результаты окрашивания были оценены как 0, 1+ , 2+ или 3+ с помощью рекомендаций директивы ASCO-CAP для клинической оценки HER2.
Флуоресцентная n-situ гибридизация (FISH)
Зонды
Имеющийся в продаже, одобренный FDA HER2 FISH зонд (PathVysion, Abbott Molecular) была использована Core Diagnostics для анализа клеточной линии ТМА. PathVysion HER-2 ДНК коктейль зондов состоит из двух меченых ДНК-зондов. LSI НЕК2-зонд, который охватывает весь ген HER2, был маркирован в SpectrumOrange. СЕР 17 зонд помечен в SpectrumGreen и гибридизуется с альфа-сателлитной ДНК, расположенной на центромере хромосомы 17 (17pl 1.1-ql 1.1). Включение СЕР 17 зонда позволяет определить относительное количество копий гена HER2.
Анализ
Пять-мкм срезы толщиной FFPE из блока ТМА были подвергнуты анализу FISH, как описано ранее, с модификациями. После инкубации в течение ночи при 56°С, слайды были депарафинизированы в трех промывках CitroSolv в течение пяти минут каждый, обезвоженных с помощью двух спиртовых промываний и высушены на воздухе. Впоследствии, срезы FFPE инкубировали в реагенте для предварительной обработки (Abbott Molecular, Иллинойс) в течение 30 минут при 80°С, а затем обрабатывали Протеазой II (Abbott Molecular, Иллинойс) перед дополнительными промывками в воде и сериями промывок в этаноле. Высушенные слайды затем коденатурировали при 76°С в течение шести минут с зондами и гибридизовали в течение ночи при 37°С (ThermoBrite; Abbott Molecular). Послегибридизационные мойки и контр-окрашивание проводили способом, аналогичному тем, которые были описаны ранее.
Срезы просматривали с помощью флуоресцентных микроскопов, оснащенных системами визуализации управляемыми компьютером (BioView Duet, BioView Ltd.). Минимум 50 неперекрывающихся опухолевых клеток из каждого образца были использованы для измерения HER2 и СЕР17 гибридизационных сигналов. Современные HER2 критерии оценки и рекомендации были использованы для анализа слайдов. Линия клеток считаются FISH-положительной, если она имела отношение HER2-k-CEP17 два или более или имела среднее количество копий HER2 более шести сигналов на ядро в клетках с отношением HER2-k-CEP17 менее двух. Образцы с отношением HER2-k-CEP17 менее двух и средним количеством HER2 копий менее четырех сигналов на ядро рассматривались как отрицательные, и образцы с отношением HER2-k-CEP17 менее двух и средним количеством копий HER2 от четырех до шести сигналов на ядро рассматривалось как неопределенные.
Клеточные анализы связывания HER2
Связывание клетками 1Fab-IgGs слияний с люциферазой - Прямой анализ связывания:
Клетки (SKBR3: 40000 на лунку, MCF7: 200000 на лунку) высевали в 96-луночные белые обработанные для клеточной культуры планшеты с плоским дном (Thermo Scientific, Кат.№136101) и дают возможность прикрепится в течение ночи. Клетки затем промывали буфером для связывания (PBS+ 3% БСА+ 0,05% азида натрия, рН 7,2) и различными концентрациями (0,002 нМ- 100 нМ) слитых белков TDB люциферазы в буфере для связывания были добавлены в каждую лунку. Затем планшеты инкубируют при 4°С в течение четырех часов, а затем промывают три раза буфером для связывания. После последней промывки, 20 мкл буфера для связывания, содержащего 50 мМ субстрата люциферазы (New England Biolab, Кат. №E3300L) добавляли в каждую лунку. Значения люминесценции читались на приборе для считывания планшетов Perkin Elmer Envision. Данные связывания были подогнаны с использованием модели GraphPad Prism «Опе Site-Specific Binding», чтобы определить аффинность связывания антитела.
Связывание клетками 1Fab-IgGs слияний с люциферазой - анализ конкурентного связывания:
Клетки высевали и промывали, как описано выше. Для измерения конкурентного связывания, фиксированную концентрацию слитого белка TDB люциферазы (15 нМ 4D5-WT или 50 нМ 4D5-H91A) смешивали с возрастающими концентрациями TDB (0,007 нМ-400 нМ) в буфере для связывания и добавляли к клеткам. Планшеты инкубировали в течение четырех часов при температуре 4°С, промывали, и считывали, как описано выше. Связывающие данные были пригодны с использованием модели GraphPad Prism «Опе Site-Fit Ki», чтобы определить аффинность связывания с антителом.
Связывание клеток по проточной цитометрии
MCF7 и SKBR3 клетки высевали при 100000 клеток на лунку в 96-луночные планшеты cU-образным дном в 50 мкл FACS буфера (1% BSA, 2 мМ ЭДТА в PBS). Тестовые изделия серийно разводили 1: 5 в FACS буфере, начиная с обоих 50 мкг/мл или 10 мкг/мл и инкубировали с клетками на льду в течение 30 минут. Клетки дважды промывали FACS буфером и ресуспендировали в 100 мкл Alexa 647 козьего антитела против человеческого IgG, Fey Фрагмент (Jackson ImmunoResearch Кат. №109-606-098), в разведении 1: 200 в FACS буфере и инкубировали на льду в течение 30 минут. Клетки ресуспендировали в 100 мкл FACS буфера, содержащих пропидии йодид (PI; eBioscience Кат. №00-6990-50) в разведении 1:100 и анализировали на BD FACSCaliber.
Фракционирование клеток крови
Мононуклеарные клетки периферической крови (МКПК) были выделены из крови здоровых добровольцев с использованием среды для разделения лимфоцитов (MP Biomedicals). CD8+ клетки экстрагировали из МКПК человека с помощью набора для выделения CD8+ клеток (Miltenyi Biotec Кат. №130-094-156) путем негативной селекции.
Активация Т-клеток
Все антитела для окрашивания клеток для проточной цитометрии были получены от BD Biosciences (Сан Хосе, Калифорния). Человеческие МКПК и клетки-мишени (10: 1 соотношение), инкубировали в присутствии тестируемого образца в течение 24 часов в 96-луночном планшете с плоским дном (BD). После инкубации клетки переносили в новый 96-луночный планшет с V-образным дном. Клетки костного мозга яванского макака окрашивали антителом против CD8-FITC, антителом против CD69-PE и антителом против CD25-APC. Поверхностная экспрессия CD69 и CD25 определялась на CD8+ Т-клетках с помощью проточной цитометрии. Процент CD8+ CD69+ CD25+ измеряли как параметр активации Т-клеток. Для определения НЕИ2-независимой активации Т-клеток, репортерные клетки Jurkat-Dual NF-kB/IRF (Invivogen Кат. №jktd-isnf) инкубировали при 37°С с TDB или ОКТ СЭ3-антителом в течение 24 часов. 10 мкл супернатанта удаляли из каждой лунки и добавляли 96-луночные белые планшеты с прозрачным дном. 100 мкл раствора Quantiluc (Invivogen) добавляли к собранным супернатантам и планшеты считывали на Perkin Elmer Envision планшетном ридере.
Апоптоз in vitro
Целевые клетки высевали при 10000 клеток на лунку в культуральной среде в 96-луночный черный планшет с прозрачный дном (Corning Кат. 3904) и помещали в 37°С, 5% СО2 инкубатор на ночь. Тестируемое изделие, 50000 очищенных CD8+ клеток и 1:1000 разведение реагента Каспазы 3/7 (Essen Кат. №4440) добавляли к предварительно высеянным клеткам и помещали в Incucyte zoom. Изображения получали через каждые четыре часа в течение 40 часов и анализировали на содержание количества апоптотических событий в мм2.
Жизнеспособность клеток
Клетки выращивали до слияния в среде RPMI с добавлением 10% FBS, пенициллина (100 ед/мл), стрептавидина (100 мкг/мл) и L-глутамата (0,2 мМ). Клетки диссоциировали с помощью среды для диссоциации на основе PBS и высевали в черные 96-луночные планшеты с прозрачным дном в плотности 10000 клеток на лунку. На четвертый день среду удаляли и планшеты промывали дважды PBS. Добавляли 100 мкл реагента Celltiter-GLO® Luminescent Cell Viability (Promega Кат. №G7570) и планшеты считывали на люминометре, как описано в инструкции.
Пролиферация клеток рака молочной железы
CD8+ клетки использовали в качестве эффекторов в соотношении эффектор-мишень 3: 1. Пролиферация/жизнеспособность клеток рака молочной железы была обнаружена с использованием анализа Celltiter-GLO® Luminescent Cell Viability (Promega). Для анализа 15×103 клеток на лунку высевали в 96-луночные планшеты и инкубировали в течение ночи для прикрепления клеток до обработки.
Эффективность in vivo
Самки NOD SCID гамма (NSG) мышей были получены из Jackson Laboratory. Человеческие МКПК были использованы в качестве эффекторных клеток в мышах. МКПК выделяли из крови здоровых доноров с использованием среды для отделения лимфоцитов (MP Biomedical, LLC, Салон, Огайо) и криоконсервировали при-80°С. Перед переносом в мышей МКПК оттаивали и культивировали в течение ночи в 10% FBS, содержащей RPMI среду при температуре 37°С, 5% CO2. МКПК инокулировали в мышей внутрибрюшинно через один день после инокуляции опухолевых клеток при концентрации 10×106 клеток на мышь, в объеме 100 мкл буфера сбалансированного солевого раствора Хэнкса (HBSS). Для того, чтобы оценить эффективность при обработке HER2 усиливаемого рака молочной железы, животных инокулировали 3×106 опухолевых клеток KPL-4 в HBSS/MATRIGEL® через подкожное введение в правую грудную жировую прослойку молочной железы. Для того, чтобы оценить активность в лечении опухолей с низким уровнем экспрессии HER2, животным подкожно инокулировали 5×106 опухолевых клеток НТ55 в HBSS. Обработки одиночной дозой вводили внутривенно в день 0, как указано в легендах фигур.
Исследование безопасности и фармакокинетики (ФК) на яванских макаках
Одиннадцать самок яванских макак (Масаса fascicularis; возраст и вес в начале дозирования были в диапазоне от 24-60 месяцев и 2-5 кг) были случайным образом распределены на три группы. Животные получали контроль-носитель (N=3) или анти-HER2-CD3 4D4-H91A 1Fab-IgG TDB в дозе 3 мг/кг (N=3), или TDB при 20 мг/кг (N=5) через одно-часовую внутривенную инфузию в объеме двух мл/кг/час. Животные были проверены два раза в день на какие-или нарушения и признаки боли или страданий. Дополнительные существенные параметры включали потребление пищи, вес тела, медосмотры, температуру тела, частоту дыхания и частоту сердечных сокращения.
ФК анализ
Кровь яванских макак собирали в разное время на протяжении всего исследования для оценки фармакокинетики. Крови давали свернуться при комнатной температуре в течение по меньшей мере 30 минут. Образцы центрифугировали при около 1500-2000 × g при 2-8°С в течение одного часа после сбора. Сыворотку собирали и хранили при-60°С до-80°С до отправки для анализа. Образцы сыворотки РК были проанализированы с помощью ИФА GRIP (Yang et al., Journal of Immunological Methods 2008, 335: 8-20). Профили зависимости сывороточной концентрации от времени были использованы для оценки следующих параметров ФК с использованием не-компартментального анализа (WinNonlin, версии 5.2.1; Pharsight Corporation, Маунтэйн Вью, Калифориния): общее воздействие лекарственного средства определяется как площадь под кривыми зависимости сывороточной концентрации от времени (AUC), клиренса антитела (CL), и наблюдаемой максимальной концентрацией в сыворотке крови (Cmax). Каждое животное анализировали отдельно, и результаты для каждой группы дозы были обобщены в виде среднего значения±стандартное отклонение (СО).
Клиническая патология
По крайней мере, дважды в течение фазы перед введением дозы и в дни исследования 2 и 8 кровь собирали в пробирки, содержащие антикоагулянт цитрат натрия для испытаний коагуляции или EDTA калия для гематологических тестов.
BIACORE®
Кинетику связывания Fab анти-HER2 или анти-HER-2/СВ3-Т-клеточно зависимых биспецифичных (TDB) антител измеряли с помощью поверхностного плазмонного резонанса на BIACORE® Т200 или 8К инструменте (GE Healthcare). Все кинетические эксперименты проводили при скорости потока 30 мкл/мин при 37°С, и в прогоночном буфере 10 мМ HEPES, рН 7,2, 150 мМ NaCl, 0,05% Tween 20, и 1 мМ ЭДТА (HBS-EP буфер). Внеклеточный домен (ECD) HER2 человека (Sino Biologicals 10004-Н08Н или Novus Biologicals NBP1-94702) или ECD HER2 яванского макака иммобилизовали на чипе датчика СМ5 через связывание на основе амина. Для человеческого ECD HER2 использовали 3-кратные серии разведения концентраций анти-HER2 Fab или TDB в диапазоне от 0,27 до 200 нМ для анализа связывания. Для ECD HER2 яванских макак использовали 1,5-кратные серии разведения концентраций анти-HER2 Fab или TDB в диапазоне от 87,8 до 1000 нМ для анализа связывания. Сенсограммы для связывания HER2 были записаны с использованием времени впрыска 180 секунд, за которым следует 300 секунд времени диссоциации и регенерация поверхности с помощью 50 мМ HCl. Все полученные сенсограммы для связывания антигена с антителами, анализировали с использованием 1:1 связывание Ленгмюра, за исключением связывания вариантов Fab 4D5 с HER2 яванского макака, которые использовали в качестве модели связывания стационарного состояния для расчета кинетики и константы связывания. В связи с требованием высоких концентраций Fab для измерения слабой аффинности к HER2 яванского макака, во всех вариантах Fab буфер был заменен на HBS-EP буфер перед экспериментом, чтобы предотвратить эффекты буфера и обеспечить точные измерения. Масса всех вариантов 4D5 была проверена с помощью масс-спектрометрии.
Пример 2. Аффинность к HER2 анти-HER2/CD3 IgG TDB имеет прямое влияние на активность уничтожения, но не на селективность в отношении клеток, избыточно экспрессирующих HER2
Было показано, что анти-HER-2/CD3 биспецифичные антитела, которые являются моновалентными в каждом связывающем плече, имеют сильную активность в HER2-амплифицированых in vitro и in vivo моделях рака молочной железы. Тем не менее, этот IgG TDB формат также сохраняет низкую активность в отношении уровня клеточных линий, экспрессирующих низкие уровни HER2, подобно нормальным HER2-позитивным человеческим эпителиальным клеткам. Желательно повысить селективность анти-HER2/CD3 TDB к HER2 амплифицированным клеткам, с тем чтобы свести к минимуму риск целевой активности вне опухоли и тем самым повысить терапевтический индекс TDB нацеленных на HER2. Первоначально исследовали влияние аффинности к HER2 на селективность IgG TDB к HER2-аплифицированным клеткам. Были получены несколько вариантов анти-HER2 4D5 с моновалентными аффинностями связывания в качестве Fab в диапазоне от 0,3 до 213 нМ (Таблица 4). Для всех вариантов, основной драйвер для снижения аффинности было увеличение (т.е. быстрее) скорость диссоциации (κd), В то время как скорость ассоциации (ka) оставалась неизменной.
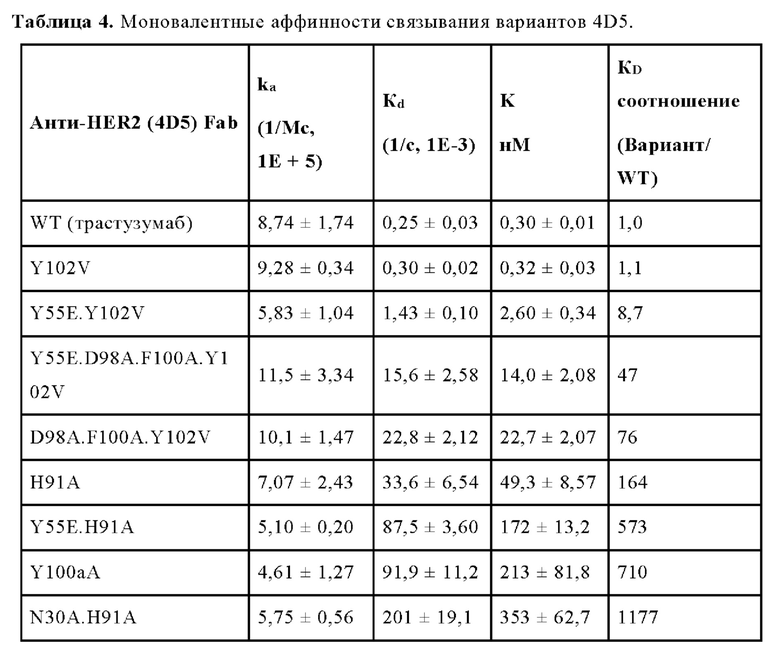
Для испытания первичной селективности, SKBR3 и MCF7 были использованы в качестве модельных клеточных линий. SKBR3 является HER2-амплифицированной клеточной линией рака молочной железы, тогда как MCF7 является линией клеток рака молочной железы, экспрессирующих низкие уровни HER2 (фиг. 1), аналогичные уровни обнаружены в нераковых клетках, таких как культивируемые кардиомиоциты (Junttila et al. Cancer Res. 74(19): 5561-5571, 2014). Известно, что число копий HER2 в клеточной мембране в SKBR3 и MCF7 клетках составляет 2×103 на клетку и 1,5×104 на клетку, соответственно, (Aguilar et al. Oncogene 18(44): 6050-6062, 1999). Уменьшение HER2 аффинности связывания постепенно снижало активность уничтожения анти-HER2 IgG TDB на оба SKBR3 и MCF7 клеточных линиях (фиг. 2A-2F). Активность уничтожения была практически элиминирована с помощью IgG TDB имеющими аффинность к HER2 49 нМ или выше. Аналогичные уровни снижения активности наблюдались в SKBR3 и MCF7 клетках. Таким образом, моновалентная HER2 аффинность играет ключевую роль в активности анти-HER2/CD3 IgG TDB но не влияет на селективность по отношению к клеткам избыточно экспрессирующим HER2.
Пример 3. Характеризация эффекта бивалентного связывания HER2 низкой аффинности на селективность к клеткам избыточно экспрессирующим HER2
Антитела, имеющие бивалентное связывание HER2 и моновалентное связывание CD3 (формат 1Fab-IgG TDB) были построены на основе аффинных вариантов моновалентного 4D5 (фиг. 3). 1Fab-IgG TDB были протестированы на связывание с клетками SKBR3 (фиг. 4А и 7А) и с клетками MCF-7 (фиг. 4 В и 7 В), и на способность опосредовать апоптоз (фиг. 5А и 5В) и уничтожение (фиг. 6А-6С и 8) SKBR3 и MCF7 клеток. Многие варианты 4D5 1Fab-IgG TDB продемонстрировали такое же связывание с SKBR3 и MCF7 клетками по сравнению с контрольным IgG TDB с моновалентным плечом с высокой аффинностью к HER2 основанным 4D5 дикого типа (трастузумаб; фиг. 4А и 4В). Y55E.H91A, Y100aA или N30A.H91A замены (моновалентная KD 172, 213 и 353 нМ, соответственно) привели к существенному снижению связывания с клетками в формате 1Fab-IgG TDB по сравнению с моновалентным форматом HER2 IgG TDB с высокой аффинностью (фиг. 7А и 7В). Пониженное связывание нашло свое отражение в существенно сниженной уровне уничтожения клеток SKBR3 (фиг. 8). Y102V и Y55E.Y102V замены (моновалентная KD 0,3 и 2,6 нМ соответственно) в формате 1Fab-IgG TDB привело к аналогичному связыванию с обеими клеточными линями SKBR3 и MCF7 по сравнению с контролем IgG TDB (фиг. 4А и 4В). Варианты Y102V и Y55E.Y102V 1Fab-IgG TDB продемонстрировали значительную эффективность в уничтожении клеток MCF7, экспрессирующих низкие уровни HER2, что согласовывалось со связыванием с клетками, и говорит о том, что эти изменения не улучшают селективность в отношении клеток, избыточно экспрессирующих HER2 (фиг. 5А, 5В, 6В и 6С).
Два варианта 4D5, D98A.F100A.Y102V и Н91А (моновалентная KD 23 и 49 нМ, соответственно) сохранили высокий уровень связывания с клетками SKBR3, демонстрируя при этом лишь минимальное связывание с клетками MCF7 (фиг. 4А, 4 В, 5А, и 5 В). Эти клеточное связывание отражено в активности уничтожения. В частности варианты D98A.F100A.Y102V и Н91А 1Fab-IgG TDB эффективно индуцируют апоптоз и уничтожение клеток SKBR3, но были неспособны опосредовать уничтожение клеток MCF7, экспрессирующих низкий уровень HER2, несмотря на очень высокие концентрации (50 нг/мл до 50 мкг/мл). Известно, что in vitro активность моновалентного высокоаффинного к HER2 HER2-IgG TDB насыщается при концентрации -10 нг/мл (Junttila et al. Cancer Res. 74(19): 5561-5571, 2014). Эти результаты свидетельствуют о том, что усиленная авидность IgG-1 Fab TDB, по сравнению с обычными антителами, дает возможность повысить селективность по отношению к клеткам с избыточной экспрессией HER2. Окно для моновалентной аффинности (KD), котрая приводила к увеличению селективности было в диапазоне 20-50 нм, измеренной, как Fab. Меньшее снижение аффинности не улучшает селективность и большее снижение аффинности значительно ухудшает эффективность TDB.
Пример 4. Характеризация повышенной селективности формата 1Fab-IgG TDB для клеток с избыточной экспрессией HER2
H91A-1Fab-IgG TDB вариант 4D5 был выбран для дальнейшего анализа активности in vitro. Исследование доза-ответ продемонстрировало, что 4D5 Н91А-1Fab-IgG TDB активность на SKBR3 была почти идентична по сравнению с моновалентным высокоаффинным к HER2 IgG TDB (фиг. 9, ЕС50 6,9 и 6,3 пМ, соответственно). В отличие от IgG TDB, никакой активности не было замечено на любом уровне дозы 1Fab-IgG TDB против клеток MCF7 (фиг. 9). 90 клеточных линий рака молочной железы были произвольно разделены на высоко (>400 нормализованных прочтений на килобазу длины транскрипта на миллион картированных прочтений (nRPKM))-, средне (50-400 nRPKM) и низко (<50 nRPKM). HER2- экспессирующие клетки на основе экспрессии HER2-PHK опубликованной в Klijn 2015 (фиг. 1, Klijn et al. Nat. Biotechnol. 33(3): 306-312, 2015). Исследования избирательности было расширено на 15 клеточных линий с переменными уровнями экспрессии HER2. На уровне высокой дозы (50 нг/мл), четкой корреляции не было замечено между активацией Т-клеток и экспрессией HER2 для моновалентной высокой аффинности HER2 IgG TDB (фиг. 11A-11D). Резкое отличие было в том, что активация Т-клеток индуцировалась только в клеточных линиях с наибольшим уровнем экспрессии HER2, когда Н91А аффинный вариант 1Fab-IgG TDB был испытан (фиг. 12A-12D). Аналогичным образом, уничтожение с помощью молекулы 1Fab-IgG TDB клеток-мишеней было ограничено высоко HER2-экспессирующими клеточными линиями, в то время как высокоаффинная к HER2 IgG TDB была широко активна также в отношении индукции уничтожения низко НЕРч.2-экспрессирующих клеток при использовании в высоких дозах (фиг. 11A-11D и 12A-12D). 50 нг/мл доза контрольного IgG TDB индуцировала активацию Т-клеток и уничтожение низко НЕ112-экспрессирующих клеток, в то время как 50 мкг/мл 1Fab-IgG TDB не повлияло на жизнеспособность клеток с низким уровнем HER2 экспрессии. Таким образом, было рассчитано, что улучшение селективности 1Fab-IgG TDB молекул по сравнению с контролем IgG TDB к HER2 составляет ≥1000 раз.
Активность была дополнительно испытаны в клеточных линиях человека нераковых тканей, полученных из легких, кожи и молочной железы. Низкий уровень экспрессии HER2 был подтвержден во всех протестированных незлокачественных клетках с помощью проточной цитометрии. Таблица 5 демонстрирует характеризацию этих клеток и связывание IgG TDB и 1Fab-IgG TDB.
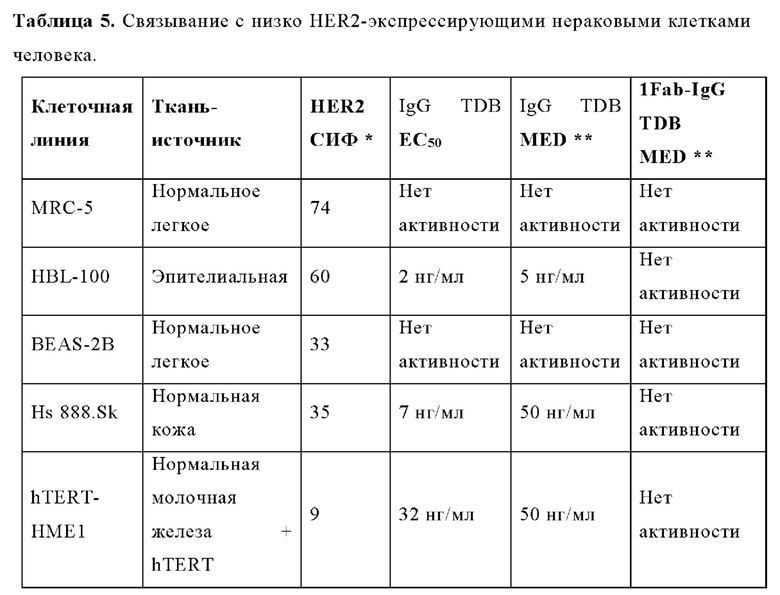
Н91А аффинный вариант 1Fab-IgG TDB продемонстрировал отсутствие апоптотической активности в отношении любых из 8 испытанных типов клеток при концентрациях ≤5 мкг/мл. Репрезентативное сравнение кривых доза-ответ между 1Fab-IgG и TDB IgG TDB культивированных с HBL-100 клетками демонстрирует, что H91A-IgG TDB эффективно убивает низко HER2-экспрессирующие клетки HBL-100, в отличие от Н91 A-1Fab-IgG TDB (фиг. 13). Кинетические анализы подтверждают дозозависимость уничтожения HBL-100 H91A-IgG TDB с течением времени и демонстрируют, что Н91 A-1Fab-IgG TDB-индуцированное уничтожение минимально в течение 70 часов (фиг. 14А и 14В). Эти результаты демонстрируют, что in vitro эффективность 1Fab-IgG TDB аналогична моновалентному высокоаффинному к HER2 IgG TDB в уничтожении высоко HER2-экспрессирующих клеточных линий. Тем не менее, 1Fab-IgG TDB не имели пригодной для обнаружения активности в отношении каких-или испытанных линий клеток с низким уровнем экспрессии HER2, что говорит о том, что они являются селективными к избыточно экспрессирующим HER2 клеткам. Затем исследовали порог уровня экспрессии HER2, который необходим для активности Н91А афинного варианта 1Fab-IgG TDB. При инкубации 1Fab-IgG TDB с 13 линиями клеток-мишеней, имеющих различные профили экспрессии HER2, уничтожение было обнаружено в клетках-мишенях, экспрессирующих HER2 в количестве копий больше, чем 200000 молекул HER2 на клетку (фиг. 15А). В частности, высокая активность уничтожения была обнаружена во всех клеточных линиях, экспрессирующих HER2 РНК≥489 nRPKM (т.е. клеточные линии, экспрессирующие HER2 в количестве копий ≥290 579). Минимальная активность была обнаружена во всех клеточных линиях, которые экспрессируют HER2 РНК ≤260 nRPKM (т.е. клеточные линии, экспрессирующие HER2 в количестве копий ≤146 208). Количество копий HER2 для каждой линии клеток измеряли с помощью FACS Quantum-Alexa647 MESF гранул и результаты представлены в Таблице 6 ниже.
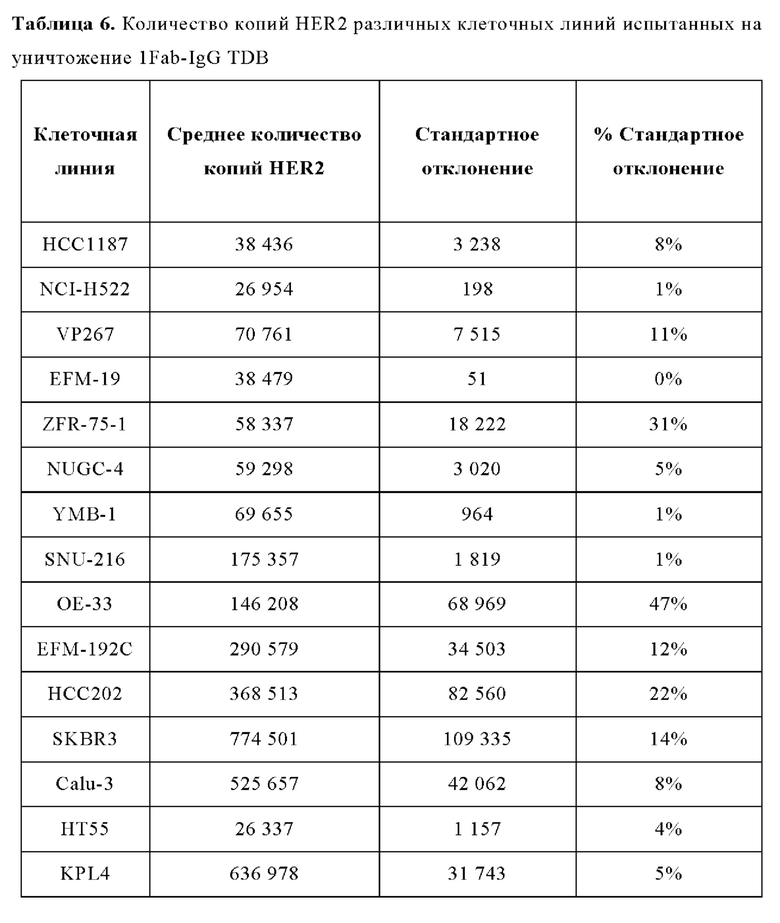

Активность была далее протестирована на диагностических тестах HER2, которые клинически проверены и используются для отбора пациентов. Из 20 испытанных клеточных линий существенную активность уничтожения наблюдали только в IHC 3+ , FISH+ линиях клеток с применением Н91А аффинного варианта 1Fab-IgG TDB (фиг. 15b и 15с).
Пример 5. Оценка in vivo селективности 1Fab-IgG TDB к опухолям, избыточно экспрессирующим HER2
Была оценена in vivo активность Н91А аффинного варианта 1Fab-IgG. NSG мышам, которым ввели человеческие МКПК, были привиты HER2-амплифицированные опухоли KPL4 или опухоли НТ55, которые экспрессируют сходный с MCF7 уровень HER2 (фиг. 16). H91A-1Fab-IgG TDB индуцировала регрессии дозы в ответ на одну 0,5-5 мг/кг дозу (фиг. 17), в то время как моновалентная высокоаффинная к HER2 IgG TDB индуцировала регрессию при дозе 0,05 мг/кг, что указывает на то, что 1Fab-IgG TDB является в около 10 раз менее активным in vivo. Как и ожидалось, на основе результатов in vitro, меньшая активность была обнаружена при обработке опухолей НТ55 (фиг. 18). Моновалентная высокоаффинная к HER2 IgG TDB индуцировала регрессии опухоли НТ55 при однократной дозе 0,1 мг/кг. Н91 A-1Fab-IgG TDB не имело никакой противоопухолевой активности при обработке опухолей НТ55 при дозах ≤50 мг/кг. Эти результаты продемонстрировали, что обе молекулы были сильнодействующими при обработке HER2-амплифицированных опухолей и обеспечивают поддержку положительного терапевтического индекса на основе уровня экспрессии HER2 при HER2-амплифицированном раковом заболевании. Н91 A-1Fab-IgG TDB HER2 TDB продемонстрировали ≥100 раз in vivo селективность в отношении HER2-амплифицированных опухолей по сравнению с опухолями, которые экспрессируют нормальные, низкие уровни HER2 (например, сходные с нормальными тканями человека).
Пример 6. Подгонка аффинности к HER2 для повышения селективности
Два 4D5 варианта, D98A.F100A.Y102V и Н91А (моновалентная KD 23 и 49 нМ, соответственно), которые продемонстрировали улучшенную селективность в формате 1Fab-IgG TDB, были выбраны для расширенной характеризации, чтобы определить оптимальную аффинность для достижения максимальной селективности к клеткам с избыточной экспрессией HER2. In vitro дозы анализа ответа в отношении клеток SKBr3, D98A.F100A.Y102V и Н91А варианты продемонстрировали практически идентичные активности (фиг. 20). Обе молекулы продемонстрировали устойчивую противоопухолевую активность при дозе 0,5 мг/кг при обработке HER2-амплифицированных KPL4 ксенотрансплантатов опухолей (фиг. 17 и 19). In vitro анализы активности были расширены путем обработки нескольких клеточных линий, экспрессирующих высокий, средний или низкий уровень HER2 высокой концентрацией (50 нг/мл) вариантов 1Fab-IgG TDB, H91A-1FabIg (фиг. 21А, 23А и 25А) и D98A.F100A.Y102V (фиг. 21 В, 23 В, 25 В). Ответы клеточных линий, как правило, похожи на обе молекулы. Тем не менее, наблюдалась очевидная тенденция, при которой эффективность варианта D98A.F100A.Y102V была выше по сравнению с вариантом Н91А (фиг. 22, 24 и 26). Поскольку эта тенденция была обнаружена в клетках с низким уровнем экспрессии HER2, было определено, что Н91А замещение в 4D5 HVR, который связывается с HER2 моновалентной KD 49 нМ приводит к максимальной селективности по отношению к клеткам с избыточной экспрессией HER2.
Пример 7. Характеризация влияние длины последовательности линкера
Для того, чтобы измерить влияние длины линкерной последовательности соединяющих анти-HER2 Fab в активности связывания бивалентной тяжелой цепи с HER2, две линкерные последовательности были протестированы (фиг. 27А). Все молекулы 1Fab-IgG TDB в предыдущих экспериментах содержали расширенную последовательность линкера (DKTHTGGGGSGG, SEQ ID NO: 52), в том числе в природной последовательности DKTHT (SEQ ID NO: 50), полученной из верхнего шарнира IgG1 дистального Fab, за которой следовало удлинение GGGGSGG (SEQ ID NO: 51). Расширенную линкерную последовательность сравнивали с молекулой 1Fab-IgG TDB, имеющей линкер природной последовательности DKTHT (SEQ ID NO: 50). Воздействие линкеров тестировали с использованием Н91 A-1Fab-IgG TDB. Никаких различий в связывании SKBR3 или MCF7 клеток не наблюдалось (фиг. 27В и 27С). In vitro дозы ответа в SKBr3 уничтожениях, а также более широкого скрининга активности клеточной линии, продемонстрировали практически идентичные активности между вариантами. Естественный вариант линкера вел себя аналогично в лечении KPL4 и НТ55 ксенотрансплантатов опухолей, по сравнению с расширенным линкером. Эти данные свидетельствуют о том, что анти-НЕИ2 1Fab-IgG TDB, имеющие моновалентную аффинность HER2 в пределах от KD 23 нМ до 49 нМ демонстрируют благоприятные профили активности. В этих исследованиях, максимальная селективность по сравнению с с клетками с избыточной экспрессией HER2 была достигнута с использованием варианта Н91А 4D5 (KD 49 нМ).
Пример 8. Т-клеточно-независимый анти-сигнальный эффект трастузумаба ослабляется в молекуле 1Fab-IgG TDB с бивалентным низкоаффинным связыванием с HER2
Связывание трастузумаба с избыточно экспрессированным HER2 в HER2-амплифицированных раковых клетках приводят к сильной интерференции PI3K сигналинга независимого от конститутивного лиганда, инициированного дерегулированным HER2-HER3 комплексом (Junttila et al. Cancer Res. 74(19): 5561-5571, 2014). Молекула 1Fab-IgG TDB связывает HER2 в бивалентной форме. In vitro обработка SKBR3 клеток с инкубацией с 1Fab-IgG TDB приводила к транзиторному недлительному уменьшению рАКТ, без пригодного для обнаружения эффекта на HER3 фосфорилирование (фиг. 28А). Кроме того, ни высокоаффинная к HER2 моновалентная IgG TDB, ни бивалентная низкоаффинная к HER2 1Fab-IgG TDB существенно влияли на пролиферацию/жизнеспособность клеток SKBR3 (фиг. 28В). Таким образом, бивалентное низкое аффинное связывание с HER2 не ингибирует пролиферацию HER2-амплифицированных клеток.
Пример 9. Сочетание вариантов 4D5 антитела с вариантами улучшения стабильности
Для того, чтобы повысить стабильность вариантов 4D5 антител афинности были введены улучшения стабильности. Для уменьшения дезамидирования остатке N30 легкой цепи 4D5 был замещен остатком серина (N30S) и остатка N54 тяжелой цепи 4D5 был замещен остатком глутаминовой кислоты (N54E). Для уменьшения изомеризации, остаток D98 тяжелой цепи 4D5 был замещен остатком аланина (D98A) и/или остатком треонина (D98T). Аффинности связывания Fab дикого типа 4D5 и их аффинные варианты (4D5 Y55E. Y102V-Fab, 4D5 D98A.F100A.Y102V-Fab, и 4D5 Н91 A-Fab, фиг 29A-29D.); вариантов улучшения стабильности (4D5 N30S-Fab, 4D5 N54E.D98T-Fab, и N30S.N54E.D98T-Fab; фиг. 30А-30С); и аффинные варианты с улучшением стабильности (4D5 N30S.Y55E.N54E.D98T.Y102V-Fab, 4D5 N30S.N54E.D98A.F100A.Y102V-Fab и 4D5 H91A.N30S.N54E.D98T-Fab; фиг. 31А-31С) были измерены с помощью Biacore®.
Аффинные варианты 4D5, имеющие улучшения стабильности, были получены и охарактеризованы. Молекулярные массы (ММ; дальтон) каждого варианта Fab 4D5 как измерено с помощью масс-спектрометрии и степень агрегации оценивали количественно с помощью хроматографии с исключением по размеру (SEC). Результаты приведены в Таблице 7 ниже. Наблюдаемое различие в ММ между наблюдаемыми и ожидаемыми значениями было связанно с обрезкой С-концевого лизина.
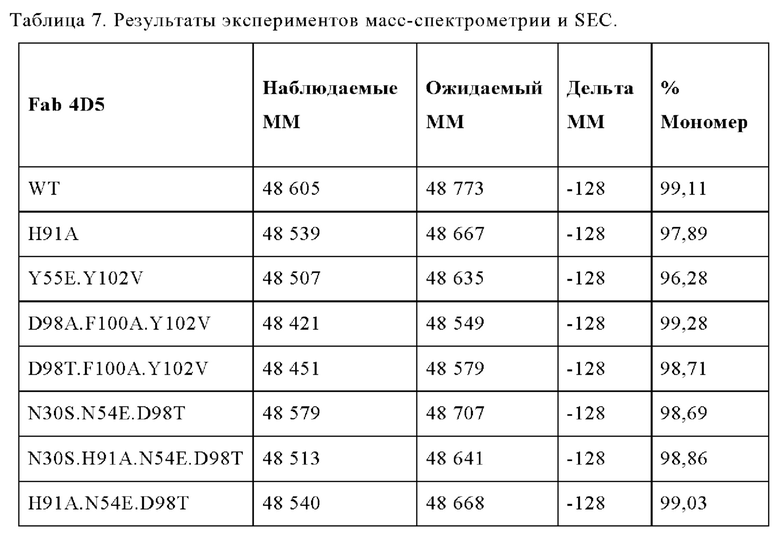
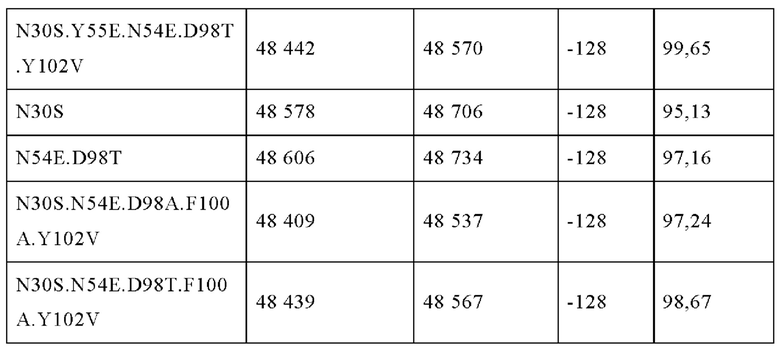
Варианты аффинных вариантов 4D5 были отформатированы в IgG TDB антитела, путем ассоциации моновалентного плеча 4D5 с анти-CD3 (40G5c N297G) плечем (см., например, публикации США №2015/095392, которая включена в данное описание посредством ссылки во всей ее полноте). Антитела были протестированы на связывание с человеческим HER2 с помощью Biacore®. Результаты продемонстрированы на фиг. 32А-3K и обобщены в Таблице 8 ниже.

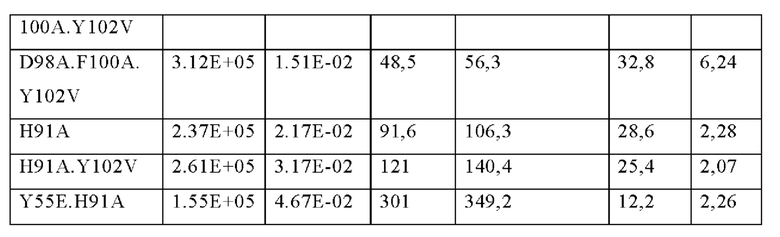
Не было обнаружено связывания у Н91 A.D98T.F100A. Y102V-IgG TDB, Y55E.H91A.D98A.F100A.Y102V-IgG TDB или Y55E.H91A.Y102V-IgG TDB вариантов. В целом, снизить значения KD (более сильные аффинности связывания) были в значительной степени связаны с медленными коэффициентами разъединения. В формате IgG TDB наблюдалась примерно в два раза более слабая аффинность по сравнению с форматом Fab (Таблицы 9 и 10). Однако, когда KD соотношение используют, при этом KD варианта 4D5 делится на KD дикого типа 4D5, результат представляет собой относительно постоянное значение 100-200 для варианта Н91А в любом формате IgG TDB или Fab.

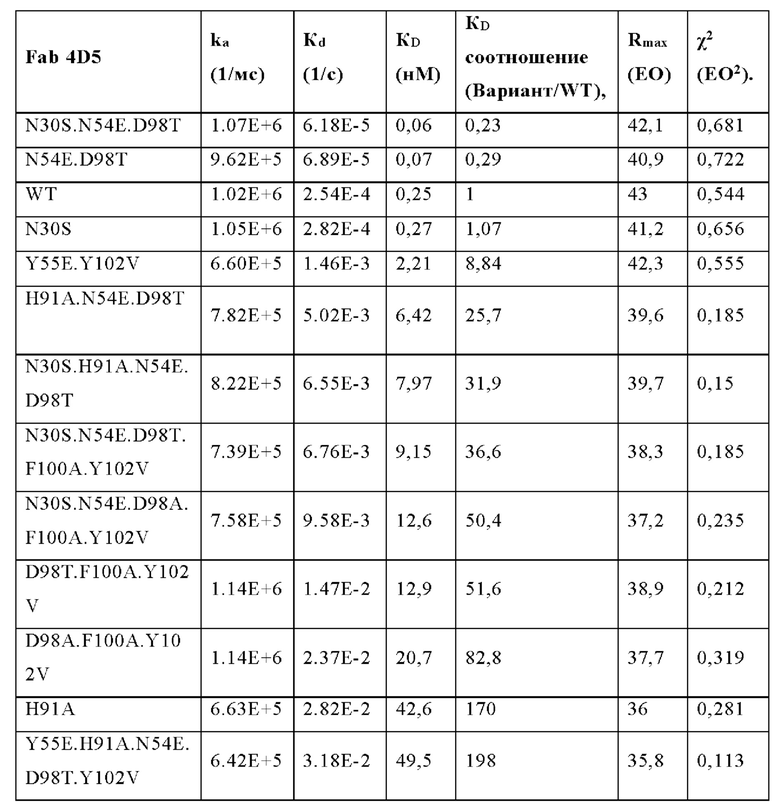
Панель вариантов 4D5 в формате Fab была создана, чтобы получить диапазон аффинности для скрининга или IgG TDB (Таблица 9) или в формате 1Fab-IgG TDB (Таблица 10). Поскольку аффинность и кинетика были наиболее желательными в варианте Н91А, была проведена ликвидация возможных молекулярных недостатков в этом варианте. Недостатки включали позиции легкой цепи N(30)T в HVR-L1 и позиции тяжелой цепи N(54)G в HVR-H2 и D(98)G в HVR-H3. Целью было предотвратить возможную D(98)G изомеризацию и возможное N(30)T и H(54)G деамидирование. Первоначально рациональный дизайн был использован для скрининга вариантов. Однако сочетание слабоаффинных вариантов с вариантами высокой аффинностью не дало прогнозируемой аффинности, и даже комбинации двух или трех вариантах привели к непредсказуемым результатам, как продемонстрировано на фиг. 38. Например, Y55E обычно ослабляля аффинность от 3,5- до 20 раз, но в одном случае дала небольшое увеличение аффинности. Н91А ослабляла аффинность от 91 до 163 раз и Y102V или повышала аффинность или не изменяла аффинность. Таким образом, небольшая матрица была протестирована с помощью N30S.N54E.D98A/T, чтобы исправить молекулярные недостатки. N30S была использована для предотвращения возможного дезамидирования в HVR-L1 и имела малый или не имела влияния на аффинность. N54E.D98T повышала аффинность до 0,07 нМ, так что мутации ослабления аффинности были необходимы для достижения KD около 50 нМ. Благодаря использованию мутаций аффинности Y55E, Н91А и/или Y102V в дополнение к улучшению стабильности были идентифицированы два варианта, имеющие аналогичные кинетики с Н91А (Таблица 10). 4D5 N30S.Y55E.H91 А.НС-N54E.D98T-Fab имеет улучшения стабильности во всех трех случаях, в то время как 4D5 Y55E.H91A.HC-N54E.D98T.Y102V-Fab содержит изменения двух остатков для улучшения стабильности, и оба имеют KD около 50 нМ. Другой вариант 4D5 N30S.Y55E.H91 A.N54E.D98T. Y102V-Fab демонстрировал последовательно несколько более быстрые скорости разъединения и имел KD 70 нМ.
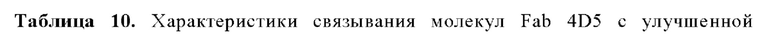

Как продемонстрировано в Таблице 11, моновалентная аффинность Fab 4D5 дикого типа к HER2 яванского макака (3,3 нМ) была примерно в 10 раз слабее, чем к HER2 человека (0,3 нМ). Аффинный вариант 4D5 H91A-Fab и варианты с улучшенной стабильностью демонстрировали моновалентные аффинности более, чем 300 нМ по отношению к HER2 яванского макака (Таблица 12). Тем не менее, отношение KD к белку HER2 яванского макака варианта 4D5 H91A-Fab яванского макака и 4D5 дикого типа было около 100-200, в аналогичном диапазоне, который наблюдался в формате человека.

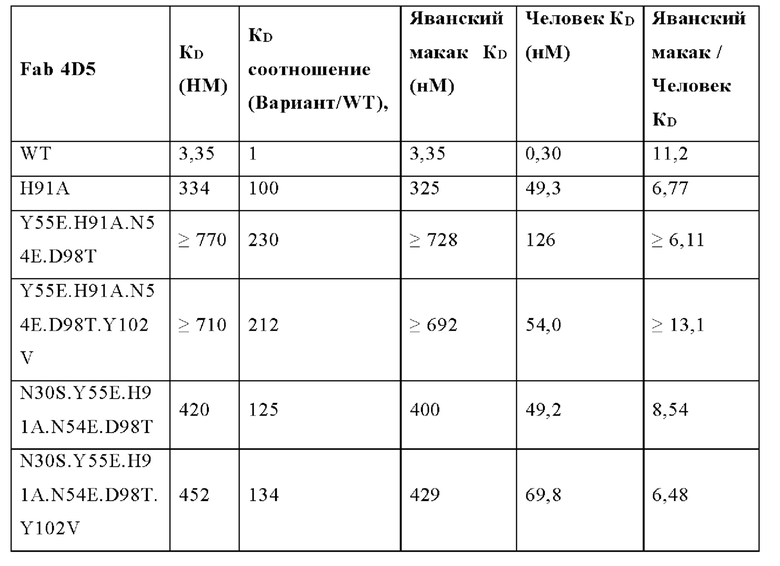
Пример 10. Характеризация аффинных вариантов 4D5 с улучшенной стабильностью
Несколько аффинных вариантов 4D5 с улучшенной стабильностью были выбраны для дальнейшей характеризации. Y55E.H91 A.N54E.D98T и Y55E.H91 A.N54E.D98T.Y102V варианты были отформатированы в антитело 1Fab-IgG TDB, имеющее естественный (короткий) линкер (шарнир; DKTHT) и было сравнено с H91A-1Fab-IgG в TDB а анализе доза-ответ для измерения уничтожения SKBR3 (фиг. 33А) или MCF7 (фиг. 33 В) клеток-мишеней. Каждую лунку засевали 1,5×104 SKBR3 или MCF7 клеток-мишеней и культивировали совместно с полученными из МКПК CD8+ эффекторными клетками в соотношении 1: 3 эффектор:мишень. Результаты приведены в Таблице 12, ниже.
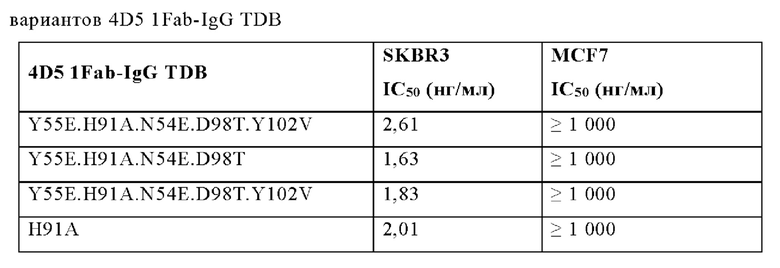
Связывание 4D5 Y55E.H91 A.N54E.D98T-1Fab-IgG TDB и 4D5 Y55E.H91A.N54E.D98T.Y102V антител с клетками SKBR3 (фиг. 34А) и клетками MCF7 (фиг. 34В) также было охарактеризовано с помощью проточной цитометрии. В целом, 4D5 Y55E.H91 A.N54E.D98T.Y102V-1Fab-IgG TDB была аналогична 4D5 H91A-1Fab-IgG TDB с точкой зрения цитотоксичности и связывания с клетками SKBR3 и клетками MCF7.
Пример 11. Аффинность связывания с клетками
Для того, чтобы понять вклад бивалентного взаимодействия с HER2 или авидности в аффинность к клеткам более детально были определены очевидные аффинности молекул 4D5-WT 1Fab-IgG TDB и 4D5-H91A 1Fab-IgG TDB с SKBR3, MCF7 и клетками трансфицированными для экспрессии HER2 яванских макак на уровнях, сопоставимых с MCF7. (Таблица 13). Несмотря на 164-кратную разницу между 4D5 и вариантом 4D5-H91A с ослабленной аффинностью в качестве моновалентного Fab, аффинности связывания с клетками SKBR3 молекул 1Fab-IgG были сравнимы, как определено по прямому связыванию клеток или по конкурентному анализу. Очевидная аффинность 4D5-H91A 1Fab-IgG TDB к HER2 экспрессированому на клетках SKBR3 находилась в диапазоне 1,5-5 нМ, что в ~ 10 раз выше по сравнению с аффинностью ее моновалентного Fab, измеренной Biacore®. Этот результат позволяет предположить, что низкая моновалентная аффинность Fab может быть компенсирована авидностью, которая опосредуется бивалентным связыванием с HER2 в клеточном контексте. В противоположность этому, 4D5-H91A 1Fab-IgG TDB не демонстрируют существенного связывания с MCF7 или клетками экспрессирующими HER2 яванского макака (KD>100 нМ для обоих в прямом связывании клетки и отсутствие связывания обнаружено при конкурентном связывании), что говорит о том, что меньшее количество копий HER2 не является достаточным для бивалентного связывания HER2. Результаты приведены в Таблице 13.

Также оценивали эффект аффинности связывания CD3 на TDB-опосредованное уничтожение клеток-мишеней. 4D5-H91A 1Fab-IgG TDB, имеющую плечо с низкой аффинностью 40G5c анти-CD3 («40G5c 4D5-H91A 1Fab-IgG TDB»; CD3-KD ~ 50 нМ) сравнили с аналогичной 4D5-H91A 1Fab-IgG TDB, имеющей высоко аффинное 38E4v1 анти-CD3 плечо («38E4vl 4D5-H91A 1Fab-IgG TDB»; CD3-KD~ 1 нМ). В анализе уничтожения клеток in vitro с использованием высокого HER2-экспрессирующей линии клеток-мишеней SKBr3, 40G5c 4D5-H91A 1Fab-IgG TDB продемонстрировал аналогичную эффективность в уничтожении клетки-мишени в качестве 38E4vl 4D5-H91A 1Fab-IgG TDB (фиг. 37). В противоположность этому, в аналогичном тесте с использованием низко HER2-экспессирующей целевой клеточной линии MCF-7, 38E4v1 4D5-H91A 1Fab-IgG TDB был значительно более эффективным, в уничтожении клеток мишеней, чем 40G5c 4D5-H91A 1Fab-IgG TDB, которая демонстрировала очень слабую способность уничтожения клеток. Эти результаты, суммированные в Таблице 14, ниже, демонстрируют, что низкий уровень анти-CD3 связывания значительно повышает способность 4D5-H91A 1Fab-IgG TDB к избирательному уничтожению клеток, которые экспрессируют высокие уровни HER2.
Пример 12. Высокая доза 4D5-H91A 1Fab-IgG TDB не приводит к HER2-независимой активации Т-клеток
FcγR связывание было ослаблено в TDB с помощью замены N297G в Fc-области. Чтобы подтвердить, что TDB не индуцируют независимую от мишени активацю Т-клеток при высокой концентрации, использовали репортерную клеточную линию Jurkat (фиг. 38А). Сильны сигнал был обнаружен, когда репортерные клетки стимулировали TDB в присутствии HER2 экспрессирующих клеток. Ни 4D5-WT IgG TDB, ни 4D5 Н91А 1Fab-IgG TDB не активировали Т-клетки в отсутствие HER2. Высокими уровнями TDB обрабатывали МКПК человека (фиг. 38В). Бивалентное анти-CD3 (ОКТ-3) индуцировало активацию Т-клеток при концентрации ≥10 нг/мл, в то время как активация Т-клеток не наблюдалась при концентрации 100 мкг/мл, что указывает на то, что ни тот ни другой формат TDB не индуцирует HER2-независимой активации Т-клеток при высоких концентрациях.
Пример 13. 4D5-H91A 1Fab-IgG TDB имеет ограниченную фармакологическую активность и хорошо переносится яванскими макаками
Ткани яванского макака (яванец) экспрессируют низкие уровни HER2, сходные с нормальными тканями человека. 4D5-H91A 1Fab-IgG TDB по существу не связываются или не индуцирует апоптоз клеток, которые экспрессируют от низких до умеренных уровней HER2 яванского макака (Таблица 13). Чтобы проверить переносимость 4D5-H91A 1Fab-IgG TDB, исследование переносимости разовой дозы были разработаны для изучения фармакодинамических (ФД) активности и фармакокинетики (ФК) у яванских макак. Самкам обезьян вводили дозы путем медленной внутривенной инфузии при уровне дозы 3 мг/кг (n=3) и 20 мг/кг (n=5). Переносимость/ФК/ФД показания включали клинические наблюдения, клиническую химию, гематологию, цитокины и ФК. Гистопатология не была включена в анализ. Не обнаруживались или обнаруживались минимальные изменения, связанные с тестируемой субстанцией при клинических наблюдениях (вес тела, частота сердечных сокращений, температура, частота дыхания). Иллюстративные TDB-ассоциированные фармакологические и клиническо-патологические ответы (Bargou et al., Science 2008, 321: 974-977; Lutterbuese et al., Proc. Nat. Acad. Sci. 2010, 107(28): 12605-12610) на удивление отсутствовали (фиг. 38С). Уровни С-реактивного белка (CRP; реактант острой фазы и маркер воспаления) остались на уровне фона. Не детектировалось синдрома скопления лейкоцитов по краю участка воспаления, повышения ферментов печени (аланин и аспартатаминотрансфераз; АЛТ и ACT) или повышения цитокинов периферической крови (не продемонстрировано), несмотря на высокую дозу TDB. В целом, 4D5-H91A 1Fab-IgG TDB хорошо переносятся при высоком уровне дозы и демонстрируют ограниченную фармакологическую активность у яванских макак.
Экспозиция TDB была подтверждена для обоих протестированных уровней доз и ФК характеристики были нормальными (фиг. 38D). Экспозиции были близки к пропорциональным для доз и сохранялись до последнего обработанного времени измерения (14 дней). Для того, чтобы подтвердить, что TDB не инактивируется у яванского макака, аликвоты сыворотки были извлечены из образцов, собранных через 7 дней и через 14 дней после дозы 20 мг/кг TDB, и разведения сыворотки были использованы для опосредования уничтожения клеток SKBR3 in vitro с помощью человеческих Т-клеток от здорового донора (фиг. 38Е). Измеренные концентрации TDB сыворотки в неразбавленных образцах были 193 и 65 мкг/мл для образцов 7 и 14 дней, соответственно. 100-кратное разведение сыворотки через 14 дней после введения дозы индуцировало подобный уровень SKBR3 уничтожения, по сравнению с максимальной активностью, достигнутой в параллельном анализе уничтожения с использованием свежего TDB при высокой (1 мкг/мл) концентрации, которая обычно является достаточной для насыщения активности. Вместе эти данные демонстрируют, что низкая экспрессия HER2 в нормальных тканях яванского макака не является достаточной для активации Т клеток или Т-клеточной активности вне опухоли в нормальных тканях, которые экспрессируют низкие уровни HER2.
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110>Genentech, Inc.
<120> БИСПЕЦИФИЧНЫЕ АНТИГЕНСВЯЗЫВАЮЩИЕ МОЛЕКУЛЫ И СПОСОБЫ ИХ
ПРИМЕНЕНИЯ
<130> 50474-162WO2
<150> 62/628,088
<151> 2018-02-08
<160> 98
<170>PatentIn версия 3.5
<210> 1
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 1
AsnTyrTyrIleHis
1 5
<210> 2
<211> 17
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 2
Trp Ile Tyr Pro Gly Asp Gly Asn Thr Lys Tyr Asn Glu Lys Phe Lys
1 5 10 15
Gly
<210> 3
<211> 10
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 3
Asp Ser Tyr Ser Asn Tyr Tyr Phe Asp Tyr
1 5 10
<210> 4
<211> 17
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 4
Lys Ser Ser Gln Ser Leu Leu Asn Ser Arg Thr Arg Lys Asn Tyr Leu
1 5 10 15
Ala
<210> 5
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 5
TrpAlaSerThrArgGluSer
1 5
<210> 6
<211> 8
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 6
ThrGlnSerPheIleLeuArgThr
1 5
<210> 7
<211> 119
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 7
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asn Tyr
20 25 30
Tyr Ile His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Trp Ile Tyr Pro Gly Asp Gly Asn Thr Lys Tyr Asn Glu Lys Phe
50 55 60
Lys Gly Arg Ala Thr Leu Thr Ala Asp Thr Ser Thr Ser Thr Ala Tyr
65 70 75 80
Leu Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Asp Ser Tyr Ser Asn Tyr Tyr Phe Asp Tyr Trp Gly Gln Gly
100 105 110
ThrLeuValThrValSerSer
115
<210> 8
<211> 112
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 8
AspIleValMetThrGlnSerProAspSerLeuAlaValSerLeuGly
1 5 10 15
Glu Arg Ala Thr Ile Asn Cys Lys Ser Ser Gln Ser Leu Leu Asn Ser
20 25 30
Arg Thr Arg Lys Asn Tyr Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln
35 40 45
Pro Pro Lys Leu Leu Ile Tyr Trp Ala Ser Thr Arg Glu Ser Gly Val
50 55 60
Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr
65 70 75 80
Ile Ser Ser Leu Gln Ala Glu Asp Val Ala Val Tyr Tyr Cys Thr Gln
85 90 95
Ser Phe Ile Leu Arg Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105 110
<210> 9
<211> 119
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 9
Gln Val Gln Leu Gln Gln Ser Gly Pro Glu Leu Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Ile Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asn Tyr
20 25 30
Tyr Ile His Trp Val Lys Gln Arg Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Trp Ile Tyr Pro Gly Asp Gly Asn Thr Lys Tyr Asn Glu Lys Phe
50 55 60
Lys Gly Lys Ala Thr Leu Thr Ala Asp Thr Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Gln Leu Ser Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Asp Ser Tyr Ser Asn Tyr Tyr Phe Asp Tyr Trp Gly Gln Gly
100 105 110
Thr Thr Leu Thr Val Ser Ser
115
<210> 10
<211> 112
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 10
AspIleValMetThrGlnSerProSerSerLeuAlaValSerAlaGly
1 5 10 15
GluLysValThrMetSerCysLysSerSerGlnSerLeuLeuAsnSer
20 25 30
ArgThrArgLysAsnTyrLeuAlaTrpTyrGlnGlnLysProGlyGln
35 40 45
Ser Pro Lys Leu Leu Ile Tyr Trp Ala Ser Thr Arg Glu Ser Gly Val
50 55 60
Pro Asp Arg Phe Thr Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr
65 70 75 80
Ile Ser Ser Val Gln Ala Glu Asp Leu Ala Val Tyr Tyr Cys Thr Gln
85 90 95
Ser Phe Ile Leu Arg Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 11
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 11
Asp Thr Tyr Ile His
1 5
<210> 12
<211> 17
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<220>
<221>MISC_FEATURE
<222> (6)..(6)
<223>Xaa представляет собой Asn или Glu
<400> 12
Arg Ile Tyr Pro Thr Xaa Gly Tyr Thr Arg Tyr Ala Asp Ser Val Lys
1 5 10 15
Gly
<210> 13
<211> 11
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<220>
<221>MISC_FEATURE
<222> (4)..(4)
<223>Xaa представляет собой Asp, Ala, или Thr
<220>
<221>MISC_FEATURE
<222> (6)..(6)
<223>Xaa представляет собой Phe или Ala
<220>
<221>MISC_FEATURE
<222> (11)..(11)
<223>Xaa представляет собой Tyr или Val
<400> 13
Trp Gly Gly Xaa Gly Xaa Tyr Ala Met Asp Xaa
1 5 10
<210> 14
<211> 11
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<220>
<221>MISC_FEATURE
<222> (7)..(7)
<223>Xaa представляет собой Asn, Ser, или Ala
<400> 14
ArgAlaSerGlnAspValXaaThrAlaValAla
1 5 10
<210> 15
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<220>
<221>MISC_FEATURE
<222> (6)..(6)
<223>Xaa представляет собой Tyr или Glu
<400> 15
Ser Ala Ser Phe Leu Xaa Ser
1 5
<210> 16
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<220>
<221>MISC_FEATURE
<222> (3)..(3)
<223>Xaa представляет собой His или Ala
<400> 16
Gln Gln Xaa Tyr Thr Thr Pro Pro Thr
1 5
<210> 17
<211> 120
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<220>
<221>MISC_FEATURE
<222> (55)..(55)
<223>Xaa представляет собой Asn или Glu
<220>
<221>MISC_FEATURE
<222> (102)..(102)
<223>Xaa представляет собой Asp, Ala, или Thr
<220>
<221>MISC_FEATURE
<222> (104)..(104)
<223>Xaa представляет собой Phe или Ala
<220>
<221>MISC_FEATURE
<222> (109)..(109)
<223>Xaa представляет собой Tyr или Val
<400> 17
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Asn Ile Lys Asp Thr
20 25 30
Tyr Ile His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Arg Ile Tyr Pro Thr Xaa Gly Tyr Thr Arg Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Ala Asp Thr Ser Lys Asn Thr Ala Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ser Arg Trp Gly Gly Xaa Gly Xaa Tyr Ala Met Asp Xaa Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 18
<211> 107
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<220>
<221>MISC_FEATURE
<222> (30)..(30)
<223>Xaa представляет собой Asn, Ser, или Ala
<220>
<221>MISC_FEATURE
<222> (55)..(55)
<223>Xaa представляет собой Tyr или Glu
<220>
<221>MISC_FEATURE
<222> (91)..(91)
<223>Xaa представляет собой His или Ala
<400> 18
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Asp Val Xaa Thr Ala
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ser Ala Ser Phe Leu Xaa Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Arg Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Xaa Tyr Thr Thr Pro Pro
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 19
<211> 17
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 19
Arg Ile Tyr Pro Thr Asn Gly Tyr Thr Arg Tyr Ala Asp Ser Val Lys
1 5 10 15
Gly
<210> 20
<211> 11
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 20
Trp Gly Gly Asp Gly Phe Tyr Ala Met Asp Tyr
1 5 10
<210> 21
<211> 11
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 21
ArgAlaSerGlnAspValAsnThrAlaValAla
1 5 10
<210> 22
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 22
SerAlaSerPheLeuTyrSer
1 5
<210> 23
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 23
Gln Gln His Tyr Thr Thr Pro Pro Thr
1 5
<210> 24
<211> 120
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 24
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Asn Ile Lys Asp Thr
20 25 30
Tyr Ile His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Arg Ile Tyr Pro Thr Asn Gly Tyr Thr Arg Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Ala Asp Thr Ser Lys Asn Thr Ala Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ser Arg Trp Gly Gly Asp Gly Phe Tyr Ala Met Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 25
<211> 107
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 25
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Asp Val Asn Thr Ala
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ser Ala Ser Phe Leu Tyr Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Arg Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln His Tyr Thr Thr Pro Pro
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 26
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 26
Gln Gln Ala Tyr Thr Thr Pro Pro Thr
1 5
<210> 27
<211> 107
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 27
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Asp Val Asn Thr Ala
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ser Ala Ser Phe Leu Tyr Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Arg Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Ala Tyr Thr Thr Pro Pro
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 28
<211> 11
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 28
Trp Gly Gly Asp Gly Phe Tyr Ala Met Asp Val
1 5 10
<210> 29
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 29
Ser Ala Ser Phe Leu Glu Ser
1 5
<210> 30
<211> 120
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 30
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Asn Ile Lys Asp Thr
20 25 30
Tyr Ile His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Arg Ile Tyr Pro Thr Asn Gly Tyr Thr Arg Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Ala Asp Thr Ser Lys Asn Thr Ala Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ser Arg Trp Gly Gly Asp Gly Phe Tyr Ala Met Asp Val Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 31
<211> 107
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 31
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Asp Val Asn Thr Ala
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ser Ala Ser Phe Leu Glu Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Arg Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln His Tyr Thr Thr Pro Pro
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 32
<211> 11
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 32
Trp Gly Gly Ala Gly Ala Tyr Ala Met Asp Val
1 5 10
<210> 33
<211> 120
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 33
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Asn Ile Lys Asp Thr
20 25 30
Tyr Ile His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Arg Ile Tyr Pro Thr Asn Gly Tyr Thr Arg Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Ala Asp Thr Ser Lys Asn Thr Ala Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ser Arg Trp Gly Gly Ala Gly Ala Tyr Ala Met Asp Val Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 34
<211> 11
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 34
Trp Gly Gly Thr Gly Ala Tyr Ala Met Asp Val
1 5 10
<210> 35
<211> 120
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 35
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Asn Ile Lys Asp Thr
20 25 30
Tyr Ile His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Arg Ile Tyr Pro Thr Asn Gly Tyr Thr Arg Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Ala Asp Thr Ser Lys Asn Thr Ala Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ser Arg Trp Gly Gly Thr Gly Ala Tyr Ala Met Asp Val Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 36
<211> 17
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 36
Arg Ile Tyr Pro Thr Glu Gly Tyr Thr Arg Tyr Ala Asp Ser Val Lys
1 5 10 15
Gly
<210> 37
<211> 11
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 37
Trp Gly Gly Thr Gly Phe Tyr Ala Met Asp Tyr
1 5 10
<210> 38
<211> 11
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 38
ArgAlaSerGlnAspValSerThrAlaValAla
1 5 10
<210> 39
<211> 120
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 39
GluValGlnLeuValGluSerGlyGlyGlyLeuValGlnProGlyGly
1 5 10 15
SerLeuArgLeuSerCysAlaAlaSerGlyPheAsnIleLysAspThr
20 25 30
TyrIleHisTrpValArgGlnAlaProGlyLysGlyLeuGluTrpVal
35 40 45
Ala Arg Ile Tyr Pro Thr Glu Gly Tyr Thr Arg Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Ala Asp Thr Ser Lys Asn Thr Ala Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ser Arg Trp Gly Gly Thr Gly Phe Tyr Ala Met Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 40
<211> 107
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 40
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Asp Val Ser Thr Ala
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ser Ala Ser Phe Leu Tyr Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Arg Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln His Tyr Thr Thr Pro Pro
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 41
<211> 120
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 41
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Asn Ile Lys Asp Thr
20 25 30
Tyr Ile His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Arg Ile Tyr Pro Thr Glu Gly Tyr Thr Arg Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Ala Asp Thr Ser Lys Asn Thr Ala Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ser Arg Trp Gly Gly Thr Gly Phe Tyr Ala Met Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 42
<211> 107
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 42
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Asp Val Ser Thr Ala
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ser Ala Ser Phe Leu Tyr Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Arg Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Ala Tyr Thr Thr Pro Pro
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 43
<211> 11
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 43
Trp Gly Gly Thr Gly Phe Tyr Ala Met Asp Val
1 5 10
<210> 44
<211> 120
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 44
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Asn Ile Lys Asp Thr
20 25 30
Tyr Ile His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Arg Ile Tyr Pro Thr Glu Gly Tyr Thr Arg Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Ala Asp Thr Ser Lys Asn Thr Ala Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ser Arg Trp Gly Gly Thr Gly Phe Tyr Ala Met Asp Val Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 45
<211> 107
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 45
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Asp Val Ser Thr Ala
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ser Ala Ser Phe Leu Glu Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Arg Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln His Tyr Thr Thr Pro Pro
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 46
<211> 120
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 46
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Asn Ile Lys Asp Thr
20 25 30
Tyr Ile His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Arg Ile Tyr Pro Thr Glu Gly Tyr Thr Arg Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Ala Asp Thr Ser Lys Asn Thr Ala Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ser Arg Trp Gly Gly Thr Gly Ala Tyr Ala Met Asp Val Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 47
<211> 120
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 47
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Asn Ile Lys Asp Thr
20 25 30
Tyr Ile His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Arg Ile Tyr Pro Thr Glu Gly Tyr Thr Arg Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Ala Asp Thr Ser Lys Asn Thr Ala Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ser Arg Trp Gly Gly Ala Gly Ala Tyr Ala Met Asp Val Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 48
<211> 107
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 48
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Asp Val Asn Thr Ala
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ser Ala Ser Phe Leu Glu Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Arg Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Ala Tyr Thr Thr Pro Pro
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 49
<211> 107
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 49
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Asp Val Ser Thr Ala
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ser Ala Ser Phe Leu Glu Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Arg Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Ala Tyr Thr Thr Pro Pro
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 50
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 50
Asp Lys Thr His Thr
1 5
<210> 51
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 51
Gly Gly Gly Gly Ser Gly Gly
1 5
<210> 52
<211> 12
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 52
Asp Lys Thr His Thr Gly Gly Gly Gly Ser Gly Gly
1 5 10
<210> 53
<211> 11
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 53
ArgAlaSerGlnAspValAlaThrAlaValAla
1 5 10
<210> 54
<211> 107
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 54
AspIleGlnMetThrGlnSerProSerSerLeuSerAlaSerValGly
1 5 10 15
AspArgValThrIleThrCysArgAlaSerGlnAspValAlaThrAla
20 25 30
ValAlaTrpTyrGlnGlnLysProGlyLysAlaProLysLeuLeuIle
35 40 45
TyrSerAlaSerPheLeuTyrSerGlyValProSerArgPheSerGly
50 55 60
Ser Arg Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Ala Tyr Thr Thr Pro Pro
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 55
<211> 678
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 55
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Asn Ile Lys Asp Thr
20 25 30
Tyr Ile His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Arg Ile Tyr Pro Thr Asn Gly Tyr Thr Arg Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Ala Asp Thr Ser Lys Asn Thr Ala Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ser Arg Trp Gly Gly Asp Gly Phe Tyr Ala Met Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val
115 120 125
Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala
130 135 140
Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser
145 150 155 160
Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val
165 170 175
Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro
180 185 190
Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys
195 200 205
Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp
210 215 220
Lys Thr His Thr Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val
225 230 235 240
Gln Pro Gly Gly Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Asn
245 250 255
Ile Lys Asp Thr Tyr Ile His Trp Val Arg Gln Ala Pro Gly Lys Gly
260 265 270
Leu Glu Trp Val Ala Arg Ile Tyr Pro Thr Asn Gly Tyr Thr Arg Tyr
275 280 285
Ala Asp Ser Val Lys Gly Arg Phe Thr Ile Ser Ala Asp Thr Ser Lys
290 295 300
Asn Thr Ala Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala
305 310 315 320
Val Tyr Tyr Cys Ser Arg Trp Gly Gly Asp Gly Phe Tyr Ala Met Asp
325 330 335
Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys
340 345 350
Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly
355 360 365
Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro
370 375 380
Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr
385 390 395 400
Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val
405 410 415
Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn
420 425 430
Val Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro
435 440 445
Lys Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu
450 455 460
Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp
465 470 475 480
Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp
485 490 495
Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly
500 505 510
Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Gly
515 520 525
Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp
530 535 540
Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro
545 550 555 560
Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu
565 570 575
Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Glu Glu Met Thr Lys Asn
580 585 590
Gln Val Ser Leu Trp Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile
595 600 605
Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr
610 615 620
Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys
625 630 635 640
Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys
645 650 655
Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu
660 665 670
SerLeuSerProGlyLys
675
<210> 56
<211> 685
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 56
GluValGlnLeuValGluSerGlyGlyGlyLeuValGlnProGlyGly
1 5 10 15
SerLeuArgLeuSerCysAlaAlaSerGlyPheAsnIleLysAspThr
20 25 30
TyrIleHisTrpValArgGlnAlaProGlyLysGlyLeuGluTrpVal
35 40 45
Ala Arg Ile Tyr Pro Thr Asn Gly Tyr Thr Arg Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Ala Asp Thr Ser Lys Asn Thr Ala Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ser Arg Trp Gly Gly Asp Gly Phe Tyr Ala Met Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val
115 120 125
Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala
130 135 140
Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser
145 150 155 160
Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val
165 170 175
Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro
180 185 190
Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys
195 200 205
Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp
210 215 220
Lys Thr His Thr Gly Gly Gly Gly Ser Gly Gly Glu Val Gln Leu Val
225 230 235 240
Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly Ser Leu Arg Leu Ser
245 250 255
Cys Ala Ala Ser Gly Phe Asn Ile Lys Asp Thr Tyr Ile His Trp Val
260 265 270
Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val Ala Arg Ile Tyr Pro
275 280 285
Thr Asn Gly Tyr Thr Arg Tyr Ala Asp Ser Val Lys Gly Arg Phe Thr
290 295 300
Ile Ser Ala Asp Thr Ser Lys Asn Thr Ala Tyr Leu Gln Met Asn Ser
305 310 315 320
Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Ser Arg Trp Gly Gly
325 330 335
Asp Gly Phe Tyr Ala Met Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr
340 345 350
Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro
355 360 365
Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val
370 375 380
Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala
385 390 395 400
Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly
405 410 415
Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly
420 425 430
Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys
435 440 445
Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys Thr His Thr Cys
450 455 460
Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu
465 470 475 480
Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu
485 490 495
Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys
500 505 510
Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys
515 520 525
Pro Arg Glu Glu Gln Tyr Gly Ser Thr Tyr Arg Val Val Ser Val Leu
530 535 540
Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys
545 550 555 560
Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys
565 570 575
Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser
580 585 590
Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu Trp Cys Leu Val Lys
595 600 605
Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln
610 615 620
Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly
625 630 635 640
Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln
645 650 655
Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn
660 665 670
His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
675 680 685
<210> 57
<211> 678
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 57
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Asn Ile Lys Asp Thr
20 25 30
Tyr Ile His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Arg Ile Tyr Pro Thr Asn Gly Tyr Thr Arg Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Ala Asp Thr Ser Lys Asn Thr Ala Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ser Arg Trp Gly Gly Asp Gly Phe Tyr Ala Met Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val
115 120 125
Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala
130 135 140
Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser
145 150 155 160
Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val
165 170 175
Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro
180 185 190
Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys
195 200 205
Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp
210 215 220
Lys Thr His Thr Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val
225 230 235 240
Gln Pro Gly Gly Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Asn
245 250 255
Ile Lys Asp Thr Tyr Ile His Trp Val Arg Gln Ala Pro Gly Lys Gly
260 265 270
Leu Glu Trp Val Ala Arg Ile Tyr Pro Thr Asn Gly Tyr Thr Arg Tyr
275 280 285
Ala Asp Ser Val Lys Gly Arg Phe Thr Ile Ser Ala Asp Thr Ser Lys
290 295 300
Asn Thr Ala Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala
305 310 315 320
Val Tyr Tyr Cys Ser Arg Trp Gly Gly Asp Gly Phe Tyr Ala Met Asp
325 330 335
Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys
340 345 350
Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly
355 360 365
Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro
370 375 380
Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr
385 390 395 400
Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val
405 410 415
Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn
420 425 430
Val Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro
435 440 445
Lys Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu
450 455 460
Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp
465 470 475 480
Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp
485 490 495
Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly
500 505 510
Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Gly
515 520 525
Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp
530 535 540
Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro
545 550 555 560
Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu
565 570 575
Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Glu Glu Met Thr Lys Asn
580 585 590
Gln Val Ser Leu Trp Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile
595 600 605
Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr
610 615 620
Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys
625 630 635 640
Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys
645 650 655
Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu
660 665 670
SerLeuSerProGlyLys
675
<210> 58
<211> 685
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 58
GluValGlnLeuValGluSerGlyGlyGlyLeuValGlnProGlyGly
1 5 10 15
SerLeuArgLeuSerCysAlaAlaSerGlyPheAsnIleLysAspThr
20 25 30
TyrIleHisTrpValArgGlnAlaProGlyLysGlyLeuGluTrpVal
35 40 45
Ala Arg Ile Tyr Pro Thr Asn Gly Tyr Thr Arg Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Ala Asp Thr Ser Lys Asn Thr Ala Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ser Arg Trp Gly Gly Asp Gly Phe Tyr Ala Met Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val
115 120 125
Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala
130 135 140
Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser
145 150 155 160
Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val
165 170 175
Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro
180 185 190
Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys
195 200 205
Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp
210 215 220
Lys Thr His Thr Gly Gly Gly Gly Ser Gly Gly Glu Val Gln Leu Val
225 230 235 240
Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly Ser Leu Arg Leu Ser
245 250 255
Cys Ala Ala Ser Gly Phe Asn Ile Lys Asp Thr Tyr Ile His Trp Val
260 265 270
Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val Ala Arg Ile Tyr Pro
275 280 285
Thr Asn Gly Tyr Thr Arg Tyr Ala Asp Ser Val Lys Gly Arg Phe Thr
290 295 300
Ile Ser Ala Asp Thr Ser Lys Asn Thr Ala Tyr Leu Gln Met Asn Ser
305 310 315 320
Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Ser Arg Trp Gly Gly
325 330 335
Asp Gly Phe Tyr Ala Met Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr
340 345 350
Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro
355 360 365
Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val
370 375 380
Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala
385 390 395 400
Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly
405 410 415
Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly
420 425 430
Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys
435 440 445
Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys Thr His Thr Cys
450 455 460
Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu
465 470 475 480
Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu
485 490 495
Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys
500 505 510
Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys
515 520 525
Pro Arg Glu Glu Gln Tyr Gly Ser Thr Tyr Arg Val Val Ser Val Leu
530 535 540
Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys
545 550 555 560
Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys
565 570 575
Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser
580 585 590
Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu Trp Cys Leu Val Lys
595 600 605
Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln
610 615 620
Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly
625 630 635 640
Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln
645 650 655
Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn
660 665 670
His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
675 680 685
<210> 59
<211> 678
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 59
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Asn Ile Lys Asp Thr
20 25 30
Tyr Ile His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Arg Ile Tyr Pro Thr Asn Gly Tyr Thr Arg Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Ala Asp Thr Ser Lys Asn Thr Ala Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ser Arg Trp Gly Gly Asp Gly Phe Tyr Ala Met Asp Val Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val
115 120 125
Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala
130 135 140
Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser
145 150 155 160
Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val
165 170 175
Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro
180 185 190
Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys
195 200 205
Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp
210 215 220
Lys Thr His Thr Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val
225 230 235 240
Gln Pro Gly Gly Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Asn
245 250 255
Ile Lys Asp Thr Tyr Ile His Trp Val Arg Gln Ala Pro Gly Lys Gly
260 265 270
Leu Glu Trp Val Ala Arg Ile Tyr Pro Thr Asn Gly Tyr Thr Arg Tyr
275 280 285
Ala Asp Ser Val Lys Gly Arg Phe Thr Ile Ser Ala Asp Thr Ser Lys
290 295 300
Asn Thr Ala Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala
305 310 315 320
Val Tyr Tyr Cys Ser Arg Trp Gly Gly Asp Gly Phe Tyr Ala Met Asp
325 330 335
Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys
340 345 350
Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly
355 360 365
Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro
370 375 380
Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr
385 390 395 400
Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val
405 410 415
Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn
420 425 430
Val Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro
435 440 445
Lys Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu
450 455 460
Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp
465 470 475 480
Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp
485 490 495
Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly
500 505 510
Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Gly
515 520 525
Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp
530 535 540
Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro
545 550 555 560
Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu
565 570 575
Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Glu Glu Met Thr Lys Asn
580 585 590
Gln Val Ser Leu Trp Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile
595 600 605
Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr
610 615 620
Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys
625 630 635 640
Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys
645 650 655
Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu
660 665 670
Ser Leu Ser Pro Gly Lys
675
<210> 60
<211> 685
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 60
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Asn Ile Lys Asp Thr
20 25 30
Tyr Ile His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Arg Ile Tyr Pro Thr Asn Gly Tyr Thr Arg Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Ala Asp Thr Ser Lys Asn Thr Ala Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ser Arg Trp Gly Gly Asp Gly Phe Tyr Ala Met Asp Val Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val
115 120 125
Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala
130 135 140
Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser
145 150 155 160
Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val
165 170 175
Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro
180 185 190
Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys
195 200 205
Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp
210 215 220
Lys Thr His Thr Gly Gly Gly Gly Ser Gly Gly Glu Val Gln Leu Val
225 230 235 240
Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly Ser Leu Arg Leu Ser
245 250 255
Cys Ala Ala Ser Gly Phe Asn Ile Lys Asp Thr Tyr Ile His Trp Val
260 265 270
Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val Ala Arg Ile Tyr Pro
275 280 285
Thr Asn Gly Tyr Thr Arg Tyr Ala Asp Ser Val Lys Gly Arg Phe Thr
290 295 300
Ile Ser Ala Asp Thr Ser Lys Asn Thr Ala Tyr Leu Gln Met Asn Ser
305 310 315 320
Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Ser Arg Trp Gly Gly
325 330 335
Asp Gly Phe Tyr Ala Met Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr
340 345 350
Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro
355 360 365
Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val
370 375 380
Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala
385 390 395 400
Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly
405 410 415
Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly
420 425 430
Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys
435 440 445
Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys Thr His Thr Cys
450 455 460
Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu
465 470 475 480
Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu
485 490 495
Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys
500 505 510
Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys
515 520 525
Pro Arg Glu Glu Gln Tyr Gly Ser Thr Tyr Arg Val Val Ser Val Leu
530 535 540
Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys
545 550 555 560
Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys
565 570 575
Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser
580 585 590
Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu Trp Cys Leu Val Lys
595 600 605
Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln
610 615 620
Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly
625 630 635 640
Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln
645 650 655
Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn
660 665 670
His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
675 680 685
<210> 61
<211> 678
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 61
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Asn Ile Lys Asp Thr
20 25 30
Tyr Ile His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Arg Ile Tyr Pro Thr Asn Gly Tyr Thr Arg Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Ala Asp Thr Ser Lys Asn Thr Ala Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ser Arg Trp Gly Gly Ala Gly Ala Tyr Ala Met Asp Val Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val
115 120 125
Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala
130 135 140
Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser
145 150 155 160
Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val
165 170 175
Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro
180 185 190
Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys
195 200 205
Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp
210 215 220
Lys Thr His Thr Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val
225 230 235 240
Gln Pro Gly Gly Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Asn
245 250 255
Ile Lys Asp Thr Tyr Ile His Trp Val Arg Gln Ala Pro Gly Lys Gly
260 265 270
Leu Glu Trp Val Ala Arg Ile Tyr Pro Thr Asn Gly Tyr Thr Arg Tyr
275 280 285
Ala Asp Ser Val Lys Gly Arg Phe Thr Ile Ser Ala Asp Thr Ser Lys
290 295 300
Asn Thr Ala Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala
305 310 315 320
Val Tyr Tyr Cys Ser Arg Trp Gly Gly Asp Gly Phe Tyr Ala Met Asp
325 330 335
Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys
340 345 350
Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly
355 360 365
Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro
370 375 380
Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr
385 390 395 400
Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val
405 410 415
Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn
420 425 430
Val Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro
435 440 445
Lys Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu
450 455 460
Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp
465 470 475 480
Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp
485 490 495
Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly
500 505 510
Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Gly
515 520 525
Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp
530 535 540
Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro
545 550 555 560
Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu
565 570 575
Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Glu Glu Met Thr Lys Asn
580 585 590
Gln Val Ser Leu Trp Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile
595 600 605
Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr
610 615 620
Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys
625 630 635 640
Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys
645 650 655
Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu
660 665 670
Ser Leu Ser Pro Gly Lys
675
<210> 62
<211> 685
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 62
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Asn Ile Lys Asp Thr
20 25 30
Tyr Ile His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Arg Ile Tyr Pro Thr Asn Gly Tyr Thr Arg Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Ala Asp Thr Ser Lys Asn Thr Ala Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ser Arg Trp Gly Gly Ala Gly Ala Tyr Ala Met Asp Val Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val
115 120 125
Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala
130 135 140
Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser
145 150 155 160
Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val
165 170 175
Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro
180 185 190
Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys
195 200 205
Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp
210 215 220
Lys Thr His Thr Gly Gly Gly Gly Ser Gly Gly Glu Val Gln Leu Val
225 230 235 240
Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly Ser Leu Arg Leu Ser
245 250 255
Cys Ala Ala Ser Gly Phe Asn Ile Lys Asp Thr Tyr Ile His Trp Val
260 265 270
Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val Ala Arg Ile Tyr Pro
275 280 285
Thr Asn Gly Tyr Thr Arg Tyr Ala Asp Ser Val Lys Gly Arg Phe Thr
290 295 300
Ile Ser Ala Asp Thr Ser Lys Asn Thr Ala Tyr Leu Gln Met Asn Ser
305 310 315 320
Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Ser Arg Trp Gly Gly
325 330 335
Asp Gly Phe Tyr Ala Met Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr
340 345 350
Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro
355 360 365
Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val
370 375 380
Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala
385 390 395 400
Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly
405 410 415
Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly
420 425 430
Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys
435 440 445
Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys Thr His Thr Cys
450 455 460
Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu
465 470 475 480
Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu
485 490 495
Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys
500 505 510
Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys
515 520 525
Pro Arg Glu Glu Gln Tyr Gly Ser Thr Tyr Arg Val Val Ser Val Leu
530 535 540
Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys
545 550 555 560
Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys
565 570 575
Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser
580 585 590
Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu Trp Cys Leu Val Lys
595 600 605
Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln
610 615 620
Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly
625 630 635 640
Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln
645 650 655
Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn
660 665 670
His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
675 680 685
<210> 63
<211> 678
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 63
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Asn Ile Lys Asp Thr
20 25 30
Tyr Ile His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Arg Ile Tyr Pro Thr Asn Gly Tyr Thr Arg Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Ala Asp Thr Ser Lys Asn Thr Ala Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ser Arg Trp Gly Gly Thr Gly Ala Tyr Ala Met Asp Val Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val
115 120 125
Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala
130 135 140
Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser
145 150 155 160
Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val
165 170 175
Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro
180 185 190
Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys
195 200 205
Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp
210 215 220
Lys Thr His Thr Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val
225 230 235 240
Gln Pro Gly Gly Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Asn
245 250 255
Ile Lys Asp Thr Tyr Ile His Trp Val Arg Gln Ala Pro Gly Lys Gly
260 265 270
Leu Glu Trp Val Ala Arg Ile Tyr Pro Thr Asn Gly Tyr Thr Arg Tyr
275 280 285
Ala Asp Ser Val Lys Gly Arg Phe Thr Ile Ser Ala Asp Thr Ser Lys
290 295 300
Asn Thr Ala Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala
305 310 315 320
Val Tyr Tyr Cys Ser Arg Trp Gly Gly Asp Gly Phe Tyr Ala Met Asp
325 330 335
Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys
340 345 350
Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly
355 360 365
Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro
370 375 380
Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr
385 390 395 400
Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val
405 410 415
Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn
420 425 430
Val Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro
435 440 445
Lys Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu
450 455 460
Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp
465 470 475 480
Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp
485 490 495
Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly
500 505 510
Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Gly
515 520 525
Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp
530 535 540
Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro
545 550 555 560
Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu
565 570 575
Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Glu Glu Met Thr Lys Asn
580 585 590
Gln Val Ser Leu Trp Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile
595 600 605
Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr
610 615 620
Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys
625 630 635 640
Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys
645 650 655
Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu
660 665 670
Ser Leu Ser Pro Gly Lys
675
<210> 64
<211> 685
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 64
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Asn Ile Lys Asp Thr
20 25 30
Tyr Ile His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Arg Ile Tyr Pro Thr Asn Gly Tyr Thr Arg Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Ala Asp Thr Ser Lys Asn Thr Ala Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ser Arg Trp Gly Gly Thr Gly Ala Tyr Ala Met Asp Val Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val
115 120 125
Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala
130 135 140
Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser
145 150 155 160
Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val
165 170 175
Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro
180 185 190
Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys
195 200 205
Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp
210 215 220
Lys Thr His Thr Gly Gly Gly Gly Ser Gly Gly Glu Val Gln Leu Val
225 230 235 240
Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly Ser Leu Arg Leu Ser
245 250 255
Cys Ala Ala Ser Gly Phe Asn Ile Lys Asp Thr Tyr Ile His Trp Val
260 265 270
Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val Ala Arg Ile Tyr Pro
275 280 285
Thr Asn Gly Tyr Thr Arg Tyr Ala Asp Ser Val Lys Gly Arg Phe Thr
290 295 300
Ile Ser Ala Asp Thr Ser Lys Asn Thr Ala Tyr Leu Gln Met Asn Ser
305 310 315 320
Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Ser Arg Trp Gly Gly
325 330 335
Asp Gly Phe Tyr Ala Met Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr
340 345 350
Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro
355 360 365
Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val
370 375 380
Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala
385 390 395 400
Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly
405 410 415
Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly
420 425 430
Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys
435 440 445
Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys Thr His Thr Cys
450 455 460
Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu
465 470 475 480
Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu
485 490 495
Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys
500 505 510
Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys
515 520 525
Pro Arg Glu Glu Gln Tyr Gly Ser Thr Tyr Arg Val Val Ser Val Leu
530 535 540
Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys
545 550 555 560
Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys
565 570 575
Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser
580 585 590
Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu Trp Cys Leu Val Lys
595 600 605
Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln
610 615 620
Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly
625 630 635 640
Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln
645 650 655
Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn
660 665 670
His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
675 680 685
<210> 65
<211> 678
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 65
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Asn Ile Lys Asp Thr
20 25 30
Tyr Ile His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Arg Ile Tyr Pro Thr Glu Gly Tyr Thr Arg Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Ala Asp Thr Ser Lys Asn Thr Ala Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ser Arg Trp Gly Gly Thr Gly Phe Tyr Ala Met Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val
115 120 125
Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala
130 135 140
Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser
145 150 155 160
Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val
165 170 175
Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro
180 185 190
Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys
195 200 205
Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp
210 215 220
Lys Thr His Thr Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val
225 230 235 240
Gln Pro Gly Gly Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Asn
245 250 255
Ile Lys Asp Thr Tyr Ile His Trp Val Arg Gln Ala Pro Gly Lys Gly
260 265 270
Leu Glu Trp Val Ala Arg Ile Tyr Pro Thr Asn Gly Tyr Thr Arg Tyr
275 280 285
Ala Asp Ser Val Lys Gly Arg Phe Thr Ile Ser Ala Asp Thr Ser Lys
290 295 300
Asn Thr Ala Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala
305 310 315 320
Val Tyr Tyr Cys Ser Arg Trp Gly Gly Asp Gly Phe Tyr Ala Met Asp
325 330 335
Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys
340 345 350
Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly
355 360 365
Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro
370 375 380
Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr
385 390 395 400
Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val
405 410 415
Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn
420 425 430
Val Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro
435 440 445
Lys Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu
450 455 460
Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp
465 470 475 480
Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp
485 490 495
Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly
500 505 510
Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Gly
515 520 525
Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp
530 535 540
Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro
545 550 555 560
Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu
565 570 575
Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Glu Glu Met Thr Lys Asn
580 585 590
Gln Val Ser Leu Trp Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile
595 600 605
Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr
610 615 620
Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys
625 630 635 640
Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys
645 650 655
Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu
660 665 670
Ser Leu Ser Pro Gly Lys
675
<210> 66
<211> 685
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 66
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Asn Ile Lys Asp Thr
20 25 30
Tyr Ile His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Arg Ile Tyr Pro Thr Glu Gly Tyr Thr Arg Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Ala Asp Thr Ser Lys Asn Thr Ala Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ser Arg Trp Gly Gly Thr Gly Phe Tyr Ala Met Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val
115 120 125
Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala
130 135 140
Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser
145 150 155 160
Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val
165 170 175
Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro
180 185 190
Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys
195 200 205
Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp
210 215 220
Lys Thr His Thr Gly Gly Gly Gly Ser Gly Gly Glu Val Gln Leu Val
225 230 235 240
Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly Ser Leu Arg Leu Ser
245 250 255
Cys Ala Ala Ser Gly Phe Asn Ile Lys Asp Thr Tyr Ile His Trp Val
260 265 270
Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val Ala Arg Ile Tyr Pro
275 280 285
Thr Asn Gly Tyr Thr Arg Tyr Ala Asp Ser Val Lys Gly Arg Phe Thr
290 295 300
Ile Ser Ala Asp Thr Ser Lys Asn Thr Ala Tyr Leu Gln Met Asn Ser
305 310 315 320
Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Ser Arg Trp Gly Gly
325 330 335
Asp Gly Phe Tyr Ala Met Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr
340 345 350
Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro
355 360 365
Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val
370 375 380
Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala
385 390 395 400
Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly
405 410 415
Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly
420 425 430
Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys
435 440 445
Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys Thr His Thr Cys
450 455 460
Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu
465 470 475 480
Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu
485 490 495
Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys
500 505 510
Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys
515 520 525
Pro Arg Glu Glu Gln Tyr Gly Ser Thr Tyr Arg Val Val Ser Val Leu
530 535 540
Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys
545 550 555 560
Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys
565 570 575
Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser
580 585 590
Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu Trp Cys Leu Val Lys
595 600 605
Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln
610 615 620
Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly
625 630 635 640
Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln
645 650 655
Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn
660 665 670
His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
675 680 685
<210> 67
<211> 678
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 67
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Asn Ile Lys Asp Thr
20 25 30
Tyr Ile His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Arg Ile Tyr Pro Thr Glu Gly Tyr Thr Arg Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Ala Asp Thr Ser Lys Asn Thr Ala Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ser Arg Trp Gly Gly Thr Gly Phe Tyr Ala Met Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val
115 120 125
Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala
130 135 140
Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser
145 150 155 160
Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val
165 170 175
Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro
180 185 190
Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys
195 200 205
Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp
210 215 220
Lys Thr His Thr Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val
225 230 235 240
Gln Pro Gly Gly Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Asn
245 250 255
Ile Lys Asp Thr Tyr Ile His Trp Val Arg Gln Ala Pro Gly Lys Gly
260 265 270
Leu Glu Trp Val Ala Arg Ile Tyr Pro Thr Asn Gly Tyr Thr Arg Tyr
275 280 285
Ala Asp Ser Val Lys Gly Arg Phe Thr Ile Ser Ala Asp Thr Ser Lys
290 295 300
Asn Thr Ala Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala
305 310 315 320
Val Tyr Tyr Cys Ser Arg Trp Gly Gly Asp Gly Phe Tyr Ala Met Asp
325 330 335
Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys
340 345 350
Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly
355 360 365
Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro
370 375 380
Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr
385 390 395 400
Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val
405 410 415
Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn
420 425 430
Val Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro
435 440 445
Lys Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu
450 455 460
Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp
465 470 475 480
Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp
485 490 495
Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly
500 505 510
Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Gly
515 520 525
Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp
530 535 540
Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro
545 550 555 560
Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu
565 570 575
Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Glu Glu Met Thr Lys Asn
580 585 590
Gln Val Ser Leu Trp Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile
595 600 605
Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr
610 615 620
Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys
625 630 635 640
Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys
645 650 655
Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu
660 665 670
Ser Leu Ser Pro Gly Lys
675
<210> 68
<211> 685
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 68
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Asn Ile Lys Asp Thr
20 25 30
Tyr Ile His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Arg Ile Tyr Pro Thr Glu Gly Tyr Thr Arg Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Ala Asp Thr Ser Lys Asn Thr Ala Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ser Arg Trp Gly Gly Thr Gly Phe Tyr Ala Met Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val
115 120 125
Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala
130 135 140
Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser
145 150 155 160
Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val
165 170 175
Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro
180 185 190
Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys
195 200 205
Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp
210 215 220
Lys Thr His Thr Gly Gly Gly Gly Ser Gly Gly Glu Val Gln Leu Val
225 230 235 240
Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly Ser Leu Arg Leu Ser
245 250 255
Cys Ala Ala Ser Gly Phe Asn Ile Lys Asp Thr Tyr Ile His Trp Val
260 265 270
Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val Ala Arg Ile Tyr Pro
275 280 285
Thr Asn Gly Tyr Thr Arg Tyr Ala Asp Ser Val Lys Gly Arg Phe Thr
290 295 300
Ile Ser Ala Asp Thr Ser Lys Asn Thr Ala Tyr Leu Gln Met Asn Ser
305 310 315 320
Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Ser Arg Trp Gly Gly
325 330 335
Asp Gly Phe Tyr Ala Met Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr
340 345 350
Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro
355 360 365
Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val
370 375 380
Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala
385 390 395 400
Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly
405 410 415
Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly
420 425 430
Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys
435 440 445
Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys Thr His Thr Cys
450 455 460
Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu
465 470 475 480
Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu
485 490 495
Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys
500 505 510
Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys
515 520 525
Pro Arg Glu Glu Gln Tyr Gly Ser Thr Tyr Arg Val Val Ser Val Leu
530 535 540
Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys
545 550 555 560
Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys
565 570 575
Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser
580 585 590
Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu Trp Cys Leu Val Lys
595 600 605
Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln
610 615 620
Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly
625 630 635 640
Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln
645 650 655
Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn
660 665 670
His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
675 680 685
<210> 69
<211> 678
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 69
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Asn Ile Lys Asp Thr
20 25 30
Tyr Ile His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Arg Ile Tyr Pro Thr Glu Gly Tyr Thr Arg Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Ala Asp Thr Ser Lys Asn Thr Ala Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ser Arg Trp Gly Gly Thr Gly Phe Tyr Ala Met Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val
115 120 125
Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala
130 135 140
Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser
145 150 155 160
Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val
165 170 175
Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro
180 185 190
Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys
195 200 205
Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp
210 215 220
Lys Thr His Thr Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val
225 230 235 240
Gln Pro Gly Gly Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Asn
245 250 255
Ile Lys Asp Thr Tyr Ile His Trp Val Arg Gln Ala Pro Gly Lys Gly
260 265 270
Leu Glu Trp Val Ala Arg Ile Tyr Pro Thr Asn Gly Tyr Thr Arg Tyr
275 280 285
Ala Asp Ser Val Lys Gly Arg Phe Thr Ile Ser Ala Asp Thr Ser Lys
290 295 300
Asn Thr Ala Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala
305 310 315 320
Val Tyr Tyr Cys Ser Arg Trp Gly Gly Asp Gly Phe Tyr Ala Met Asp
325 330 335
Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys
340 345 350
Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly
355 360 365
Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro
370 375 380
Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr
385 390 395 400
Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val
405 410 415
Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn
420 425 430
Val Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro
435 440 445
Lys Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu
450 455 460
Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp
465 470 475 480
Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp
485 490 495
Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly
500 505 510
Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Gly
515 520 525
Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp
530 535 540
Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro
545 550 555 560
Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu
565 570 575
Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Glu Glu Met Thr Lys Asn
580 585 590
Gln Val Ser Leu Trp Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile
595 600 605
Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr
610 615 620
Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys
625 630 635 640
Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys
645 650 655
Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu
660 665 670
Ser Leu Ser Pro Gly Lys
675
<210> 70
<211> 685
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 70
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Asn Ile Lys Asp Thr
20 25 30
Tyr Ile His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Arg Ile Tyr Pro Thr Glu Gly Tyr Thr Arg Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Ala Asp Thr Ser Lys Asn Thr Ala Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ser Arg Trp Gly Gly Thr Gly Phe Tyr Ala Met Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val
115 120 125
Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala
130 135 140
Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser
145 150 155 160
Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val
165 170 175
Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro
180 185 190
Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys
195 200 205
Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp
210 215 220
Lys Thr His Thr Gly Gly Gly Gly Ser Gly Gly Glu Val Gln Leu Val
225 230 235 240
Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly Ser Leu Arg Leu Ser
245 250 255
Cys Ala Ala Ser Gly Phe Asn Ile Lys Asp Thr Tyr Ile His Trp Val
260 265 270
Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val Ala Arg Ile Tyr Pro
275 280 285
Thr Asn Gly Tyr Thr Arg Tyr Ala Asp Ser Val Lys Gly Arg Phe Thr
290 295 300
Ile Ser Ala Asp Thr Ser Lys Asn Thr Ala Tyr Leu Gln Met Asn Ser
305 310 315 320
Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Ser Arg Trp Gly Gly
325 330 335
Asp Gly Phe Tyr Ala Met Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr
340 345 350
Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro
355 360 365
Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val
370 375 380
Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala
385 390 395 400
Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly
405 410 415
Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly
420 425 430
Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys
435 440 445
Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys Thr His Thr Cys
450 455 460
Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu
465 470 475 480
Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu
485 490 495
Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys
500 505 510
Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys
515 520 525
Pro Arg Glu Glu Gln Tyr Gly Ser Thr Tyr Arg Val Val Ser Val Leu
530 535 540
Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys
545 550 555 560
Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys
565 570 575
Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser
580 585 590
Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu Trp Cys Leu Val Lys
595 600 605
Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln
610 615 620
Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly
625 630 635 640
Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln
645 650 655
Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn
660 665 670
His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
675 680 685
<210> 71
<211> 678
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 71
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Asn Ile Lys Asp Thr
20 25 30
Tyr Ile His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Arg Ile Tyr Pro Thr Glu Gly Tyr Thr Arg Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Ala Asp Thr Ser Lys Asn Thr Ala Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ser Arg Trp Gly Gly Thr Gly Phe Tyr Ala Met Asp Val Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val
115 120 125
Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala
130 135 140
Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser
145 150 155 160
Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val
165 170 175
Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro
180 185 190
Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys
195 200 205
Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp
210 215 220
Lys Thr His Thr Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val
225 230 235 240
Gln Pro Gly Gly Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Asn
245 250 255
Ile Lys Asp Thr Tyr Ile His Trp Val Arg Gln Ala Pro Gly Lys Gly
260 265 270
Leu Glu Trp Val Ala Arg Ile Tyr Pro Thr Asn Gly Tyr Thr Arg Tyr
275 280 285
Ala Asp Ser Val Lys Gly Arg Phe Thr Ile Ser Ala Asp Thr Ser Lys
290 295 300
Asn Thr Ala Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala
305 310 315 320
Val Tyr Tyr Cys Ser Arg Trp Gly Gly Asp Gly Phe Tyr Ala Met Asp
325 330 335
Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys
340 345 350
Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly
355 360 365
Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro
370 375 380
Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr
385 390 395 400
Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val
405 410 415
Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn
420 425 430
Val Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro
435 440 445
Lys Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu
450 455 460
Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp
465 470 475 480
Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp
485 490 495
Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly
500 505 510
Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Gly
515 520 525
Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp
530 535 540
Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro
545 550 555 560
Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu
565 570 575
Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Glu Glu Met Thr Lys Asn
580 585 590
Gln Val Ser Leu Trp Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile
595 600 605
Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr
610 615 620
Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys
625 630 635 640
Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys
645 650 655
Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu
660 665 670
Ser Leu Ser Pro Gly Lys
675
<210> 72
<211> 685
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 72
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Asn Ile Lys Asp Thr
20 25 30
Tyr Ile His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Arg Ile Tyr Pro Thr Glu Gly Tyr Thr Arg Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Ala Asp Thr Ser Lys Asn Thr Ala Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ser Arg Trp Gly Gly Thr Gly Phe Tyr Ala Met Asp Val Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val
115 120 125
Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala
130 135 140
Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser
145 150 155 160
Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val
165 170 175
Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro
180 185 190
Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys
195 200 205
Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp
210 215 220
Lys Thr His Thr Gly Gly Gly Gly Ser Gly Gly Glu Val Gln Leu Val
225 230 235 240
Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly Ser Leu Arg Leu Ser
245 250 255
Cys Ala Ala Ser Gly Phe Asn Ile Lys Asp Thr Tyr Ile His Trp Val
260 265 270
Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val Ala Arg Ile Tyr Pro
275 280 285
Thr Asn Gly Tyr Thr Arg Tyr Ala Asp Ser Val Lys Gly Arg Phe Thr
290 295 300
Ile Ser Ala Asp Thr Ser Lys Asn Thr Ala Tyr Leu Gln Met Asn Ser
305 310 315 320
Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Ser Arg Trp Gly Gly
325 330 335
Asp Gly Phe Tyr Ala Met Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr
340 345 350
Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro
355 360 365
Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val
370 375 380
Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala
385 390 395 400
Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly
405 410 415
Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly
420 425 430
Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys
435 440 445
Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys Thr His Thr Cys
450 455 460
Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu
465 470 475 480
Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu
485 490 495
Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys
500 505 510
Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys
515 520 525
Pro Arg Glu Glu Gln Tyr Gly Ser Thr Tyr Arg Val Val Ser Val Leu
530 535 540
Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys
545 550 555 560
Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys
565 570 575
Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser
580 585 590
Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu Trp Cys Leu Val Lys
595 600 605
Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln
610 615 620
Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly
625 630 635 640
Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln
645 650 655
Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn
660 665 670
His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
675 680 685
<210> 73
<211> 678
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 73
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Asn Ile Lys Asp Thr
20 25 30
Tyr Ile His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Arg Ile Tyr Pro Thr Asn Gly Tyr Thr Arg Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Ala Asp Thr Ser Lys Asn Thr Ala Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ser Arg Trp Gly Gly Asp Gly Phe Tyr Ala Met Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val
115 120 125
Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala
130 135 140
Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser
145 150 155 160
Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val
165 170 175
Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro
180 185 190
Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys
195 200 205
Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp
210 215 220
Lys Thr His Thr Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val
225 230 235 240
Gln Pro Gly Gly Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Asn
245 250 255
Ile Lys Asp Thr Tyr Ile His Trp Val Arg Gln Ala Pro Gly Lys Gly
260 265 270
Leu Glu Trp Val Ala Arg Ile Tyr Pro Thr Asn Gly Tyr Thr Arg Tyr
275 280 285
Ala Asp Ser Val Lys Gly Arg Phe Thr Ile Ser Ala Asp Thr Ser Lys
290 295 300
Asn Thr Ala Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala
305 310 315 320
Val Tyr Tyr Cys Ser Arg Trp Gly Gly Asp Gly Phe Tyr Ala Met Asp
325 330 335
Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys
340 345 350
Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly
355 360 365
Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro
370 375 380
Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr
385 390 395 400
Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val
405 410 415
Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn
420 425 430
Val Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro
435 440 445
Lys Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu
450 455 460
Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp
465 470 475 480
Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp
485 490 495
Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly
500 505 510
Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Gly
515 520 525
Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp
530 535 540
Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro
545 550 555 560
Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu
565 570 575
Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Glu Glu Met Thr Lys Asn
580 585 590
Gln Val Ser Leu Trp Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile
595 600 605
Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr
610 615 620
Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys
625 630 635 640
Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys
645 650 655
Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu
660 665 670
Ser Leu Ser Pro Gly Lys
675
<210> 74
<211> 685
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 74
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Asn Ile Lys Asp Thr
20 25 30
Tyr Ile His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Arg Ile Tyr Pro Thr Asn Gly Tyr Thr Arg Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Ala Asp Thr Ser Lys Asn Thr Ala Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ser Arg Trp Gly Gly Asp Gly Phe Tyr Ala Met Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val
115 120 125
Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala
130 135 140
Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser
145 150 155 160
Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val
165 170 175
Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro
180 185 190
Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys
195 200 205
Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp
210 215 220
Lys Thr His Thr Gly Gly Gly Gly Ser Gly Gly Glu Val Gln Leu Val
225 230 235 240
Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly Ser Leu Arg Leu Ser
245 250 255
Cys Ala Ala Ser Gly Phe Asn Ile Lys Asp Thr Tyr Ile His Trp Val
260 265 270
Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val Ala Arg Ile Tyr Pro
275 280 285
Thr Asn Gly Tyr Thr Arg Tyr Ala Asp Ser Val Lys Gly Arg Phe Thr
290 295 300
Ile Ser Ala Asp Thr Ser Lys Asn Thr Ala Tyr Leu Gln Met Asn Ser
305 310 315 320
Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Ser Arg Trp Gly Gly
325 330 335
Asp Gly Phe Tyr Ala Met Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr
340 345 350
Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro
355 360 365
Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val
370 375 380
Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala
385 390 395 400
Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly
405 410 415
Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly
420 425 430
Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys
435 440 445
Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys Thr His Thr Cys
450 455 460
Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu
465 470 475 480
Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu
485 490 495
Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys
500 505 510
Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys
515 520 525
Pro Arg Glu Glu Gln Tyr Gly Ser Thr Tyr Arg Val Val Ser Val Leu
530 535 540
Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys
545 550 555 560
Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys
565 570 575
Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser
580 585 590
Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu Trp Cys Leu Val Lys
595 600 605
Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln
610 615 620
Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly
625 630 635 640
Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln
645 650 655
Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn
660 665 670
His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
675 680 685
<210> 75
<211> 678
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 75
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Asn Ile Lys Asp Thr
20 25 30
Tyr Ile His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Arg Ile Tyr Pro Thr Glu Gly Tyr Thr Arg Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Ala Asp Thr Ser Lys Asn Thr Ala Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ser Arg Trp Gly Gly Thr Gly Phe Tyr Ala Met Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val
115 120 125
Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala
130 135 140
Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser
145 150 155 160
Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val
165 170 175
Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro
180 185 190
Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys
195 200 205
Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp
210 215 220
Lys Thr His Thr Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val
225 230 235 240
Gln Pro Gly Gly Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Asn
245 250 255
Ile Lys Asp Thr Tyr Ile His Trp Val Arg Gln Ala Pro Gly Lys Gly
260 265 270
Leu Glu Trp Val Ala Arg Ile Tyr Pro Thr Asn Gly Tyr Thr Arg Tyr
275 280 285
Ala Asp Ser Val Lys Gly Arg Phe Thr Ile Ser Ala Asp Thr Ser Lys
290 295 300
Asn Thr Ala Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala
305 310 315 320
Val Tyr Tyr Cys Ser Arg Trp Gly Gly Asp Gly Phe Tyr Ala Met Asp
325 330 335
Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys
340 345 350
Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly
355 360 365
Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro
370 375 380
Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr
385 390 395 400
Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val
405 410 415
Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn
420 425 430
Val Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro
435 440 445
Lys Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu
450 455 460
Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp
465 470 475 480
Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp
485 490 495
Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly
500 505 510
Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Gly
515 520 525
Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp
530 535 540
Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro
545 550 555 560
Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu
565 570 575
Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Glu Glu Met Thr Lys Asn
580 585 590
Gln Val Ser Leu Trp Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile
595 600 605
Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr
610 615 620
Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys
625 630 635 640
Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys
645 650 655
Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu
660 665 670
Ser Leu Ser Pro Gly Lys
675
<210> 76
<211> 685
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 76
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Asn Ile Lys Asp Thr
20 25 30
Tyr Ile His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Arg Ile Tyr Pro Thr Glu Gly Tyr Thr Arg Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Ala Asp Thr Ser Lys Asn Thr Ala Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ser Arg Trp Gly Gly Thr Gly Phe Tyr Ala Met Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val
115 120 125
Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala
130 135 140
Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser
145 150 155 160
Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val
165 170 175
Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro
180 185 190
Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys
195 200 205
Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp
210 215 220
Lys Thr His Thr Gly Gly Gly Gly Ser Gly Gly Glu Val Gln Leu Val
225 230 235 240
Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly Ser Leu Arg Leu Ser
245 250 255
Cys Ala Ala Ser Gly Phe Asn Ile Lys Asp Thr Tyr Ile His Trp Val
260 265 270
Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val Ala Arg Ile Tyr Pro
275 280 285
Thr Asn Gly Tyr Thr Arg Tyr Ala Asp Ser Val Lys Gly Arg Phe Thr
290 295 300
Ile Ser Ala Asp Thr Ser Lys Asn Thr Ala Tyr Leu Gln Met Asn Ser
305 310 315 320
Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Ser Arg Trp Gly Gly
325 330 335
Asp Gly Phe Tyr Ala Met Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr
340 345 350
Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro
355 360 365
Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val
370 375 380
Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala
385 390 395 400
Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly
405 410 415
Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly
420 425 430
Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys
435 440 445
Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys Thr His Thr Cys
450 455 460
Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu
465 470 475 480
Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu
485 490 495
Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys
500 505 510
Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys
515 520 525
Pro Arg Glu Glu Gln Tyr Gly Ser Thr Tyr Arg Val Val Ser Val Leu
530 535 540
Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys
545 550 555 560
Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys
565 570 575
Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser
580 585 590
Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu Trp Cys Leu Val Lys
595 600 605
Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln
610 615 620
Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly
625 630 635 640
Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln
645 650 655
Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn
660 665 670
His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
675 680 685
<210> 77
<211> 678
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 77
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Asn Ile Lys Asp Thr
20 25 30
Tyr Ile His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Arg Ile Tyr Pro Thr Glu Gly Tyr Thr Arg Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Ala Asp Thr Ser Lys Asn Thr Ala Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ser Arg Trp Gly Gly Thr Gly Ala Tyr Ala Met Asp Val Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val
115 120 125
Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala
130 135 140
Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser
145 150 155 160
Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val
165 170 175
Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro
180 185 190
Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys
195 200 205
Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp
210 215 220
Lys Thr His Thr Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val
225 230 235 240
Gln Pro Gly Gly Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Asn
245 250 255
Ile Lys Asp Thr Tyr Ile His Trp Val Arg Gln Ala Pro Gly Lys Gly
260 265 270
Leu Glu Trp Val Ala Arg Ile Tyr Pro Thr Asn Gly Tyr Thr Arg Tyr
275 280 285
Ala Asp Ser Val Lys Gly Arg Phe Thr Ile Ser Ala Asp Thr Ser Lys
290 295 300
Asn Thr Ala Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala
305 310 315 320
Val Tyr Tyr Cys Ser Arg Trp Gly Gly Asp Gly Phe Tyr Ala Met Asp
325 330 335
Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys
340 345 350
Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly
355 360 365
Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro
370 375 380
Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr
385 390 395 400
Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val
405 410 415
Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn
420 425 430
Val Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro
435 440 445
Lys Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu
450 455 460
Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp
465 470 475 480
Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp
485 490 495
Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly
500 505 510
Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Gly
515 520 525
Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp
530 535 540
Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro
545 550 555 560
Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu
565 570 575
Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Glu Glu Met Thr Lys Asn
580 585 590
Gln Val Ser Leu Trp Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile
595 600 605
Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr
610 615 620
Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys
625 630 635 640
Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys
645 650 655
Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu
660 665 670
Ser Leu Ser Pro Gly Lys
675
<210> 78
<211> 685
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 78
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Asn Ile Lys Asp Thr
20 25 30
Tyr Ile His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Arg Ile Tyr Pro Thr Glu Gly Tyr Thr Arg Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Ala Asp Thr Ser Lys Asn Thr Ala Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ser Arg Trp Gly Gly Thr Gly Ala Tyr Ala Met Asp Val Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val
115 120 125
Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala
130 135 140
Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser
145 150 155 160
Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val
165 170 175
Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro
180 185 190
Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys
195 200 205
Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp
210 215 220
Lys Thr His Thr Gly Gly Gly Gly Ser Gly Gly Glu Val Gln Leu Val
225 230 235 240
Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly Ser Leu Arg Leu Ser
245 250 255
Cys Ala Ala Ser Gly Phe Asn Ile Lys Asp Thr Tyr Ile His Trp Val
260 265 270
Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val Ala Arg Ile Tyr Pro
275 280 285
Thr Asn Gly Tyr Thr Arg Tyr Ala Asp Ser Val Lys Gly Arg Phe Thr
290 295 300
Ile Ser Ala Asp Thr Ser Lys Asn Thr Ala Tyr Leu Gln Met Asn Ser
305 310 315 320
Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Ser Arg Trp Gly Gly
325 330 335
Asp Gly Phe Tyr Ala Met Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr
340 345 350
Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro
355 360 365
Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val
370 375 380
Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala
385 390 395 400
Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly
405 410 415
Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly
420 425 430
Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys
435 440 445
Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys Thr His Thr Cys
450 455 460
Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu
465 470 475 480
Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu
485 490 495
Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys
500 505 510
Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys
515 520 525
Pro Arg Glu Glu Gln Tyr Gly Ser Thr Tyr Arg Val Val Ser Val Leu
530 535 540
Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys
545 550 555 560
Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys
565 570 575
Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser
580 585 590
Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu Trp Cys Leu Val Lys
595 600 605
Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln
610 615 620
Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly
625 630 635 640
Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln
645 650 655
Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn
660 665 670
His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
675 680 685
<210> 79
<211> 678
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 79
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Asn Ile Lys Asp Thr
20 25 30
Tyr Ile His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Arg Ile Tyr Pro Thr Glu Gly Tyr Thr Arg Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Ala Asp Thr Ser Lys Asn Thr Ala Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ser Arg Trp Gly Gly Ala Gly Ala Tyr Ala Met Asp Val Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val
115 120 125
Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala
130 135 140
Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser
145 150 155 160
Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val
165 170 175
Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro
180 185 190
Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys
195 200 205
Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp
210 215 220
Lys Thr His Thr Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val
225 230 235 240
Gln Pro Gly Gly Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Asn
245 250 255
Ile Lys Asp Thr Tyr Ile His Trp Val Arg Gln Ala Pro Gly Lys Gly
260 265 270
Leu Glu Trp Val Ala Arg Ile Tyr Pro Thr Asn Gly Tyr Thr Arg Tyr
275 280 285
Ala Asp Ser Val Lys Gly Arg Phe Thr Ile Ser Ala Asp Thr Ser Lys
290 295 300
Asn Thr Ala Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala
305 310 315 320
Val Tyr Tyr Cys Ser Arg Trp Gly Gly Asp Gly Phe Tyr Ala Met Asp
325 330 335
Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys
340 345 350
Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly
355 360 365
Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro
370 375 380
Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr
385 390 395 400
Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val
405 410 415
Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn
420 425 430
Val Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro
435 440 445
Lys Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu
450 455 460
Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp
465 470 475 480
Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp
485 490 495
Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly
500 505 510
Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Gly
515 520 525
Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp
530 535 540
Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro
545 550 555 560
Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu
565 570 575
Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Glu Glu Met Thr Lys Asn
580 585 590
Gln Val Ser Leu Trp Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile
595 600 605
Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr
610 615 620
Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys
625 630 635 640
Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys
645 650 655
Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu
660 665 670
Ser Leu Ser Pro Gly Lys
675
<210> 80
<211> 685
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 80
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Asn Ile Lys Asp Thr
20 25 30
Tyr Ile His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Arg Ile Tyr Pro Thr Glu Gly Tyr Thr Arg Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Ala Asp Thr Ser Lys Asn Thr Ala Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ser Arg Trp Gly Gly Ala Gly Ala Tyr Ala Met Asp Val Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val
115 120 125
Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala
130 135 140
Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser
145 150 155 160
Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val
165 170 175
Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro
180 185 190
Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys
195 200 205
Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp
210 215 220
Lys Thr His Thr Gly Gly Gly Gly Ser Gly Gly Glu Val Gln Leu Val
225 230 235 240
Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly Ser Leu Arg Leu Ser
245 250 255
Cys Ala Ala Ser Gly Phe Asn Ile Lys Asp Thr Tyr Ile His Trp Val
260 265 270
Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val Ala Arg Ile Tyr Pro
275 280 285
Thr Asn Gly Tyr Thr Arg Tyr Ala Asp Ser Val Lys Gly Arg Phe Thr
290 295 300
Ile Ser Ala Asp Thr Ser Lys Asn Thr Ala Tyr Leu Gln Met Asn Ser
305 310 315 320
Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Ser Arg Trp Gly Gly
325 330 335
Asp Gly Phe Tyr Ala Met Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr
340 345 350
Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro
355 360 365
Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val
370 375 380
Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala
385 390 395 400
Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly
405 410 415
Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly
420 425 430
Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys
435 440 445
Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys Thr His Thr Cys
450 455 460
Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu
465 470 475 480
Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu
485 490 495
Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys
500 505 510
Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys
515 520 525
Pro Arg Glu Glu Gln Tyr Gly Ser Thr Tyr Arg Val Val Ser Val Leu
530 535 540
Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys
545 550 555 560
Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys
565 570 575
Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser
580 585 590
Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu Trp Cys Leu Val Lys
595 600 605
Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln
610 615 620
Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly
625 630 635 640
Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln
645 650 655
Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn
660 665 670
His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
675 680 685
<210> 81
<211> 678
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 81
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Asn Ile Lys Asp Thr
20 25 30
Tyr Ile His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Arg Ile Tyr Pro Thr Glu Gly Tyr Thr Arg Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Ala Asp Thr Ser Lys Asn Thr Ala Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ser Arg Trp Gly Gly Thr Gly Phe Tyr Ala Met Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val
115 120 125
Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala
130 135 140
Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser
145 150 155 160
Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val
165 170 175
Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro
180 185 190
Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys
195 200 205
Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp
210 215 220
Lys Thr His Thr Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val
225 230 235 240
Gln Pro Gly Gly Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Asn
245 250 255
Ile Lys Asp Thr Tyr Ile His Trp Val Arg Gln Ala Pro Gly Lys Gly
260 265 270
Leu Glu Trp Val Ala Arg Ile Tyr Pro Thr Asn Gly Tyr Thr Arg Tyr
275 280 285
Ala Asp Ser Val Lys Gly Arg Phe Thr Ile Ser Ala Asp Thr Ser Lys
290 295 300
Asn Thr Ala Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala
305 310 315 320
Val Tyr Tyr Cys Ser Arg Trp Gly Gly Asp Gly Phe Tyr Ala Met Asp
325 330 335
Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys
340 345 350
Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly
355 360 365
Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro
370 375 380
Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr
385 390 395 400
Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val
405 410 415
Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn
420 425 430
Val Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro
435 440 445
Lys Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu
450 455 460
Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp
465 470 475 480
Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp
485 490 495
Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly
500 505 510
Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Gly
515 520 525
Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp
530 535 540
Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro
545 550 555 560
Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu
565 570 575
Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Glu Glu Met Thr Lys Asn
580 585 590
Gln Val Ser Leu Trp Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile
595 600 605
Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr
610 615 620
Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys
625 630 635 640
Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys
645 650 655
Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu
660 665 670
Ser Leu Ser Pro Gly Lys
675
<210> 82
<211> 685
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 82
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Asn Ile Lys Asp Thr
20 25 30
Tyr Ile His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Arg Ile Tyr Pro Thr Glu Gly Tyr Thr Arg Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Ala Asp Thr Ser Lys Asn Thr Ala Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ser Arg Trp Gly Gly Thr Gly Phe Tyr Ala Met Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val
115 120 125
Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala
130 135 140
Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser
145 150 155 160
Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val
165 170 175
Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro
180 185 190
Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys
195 200 205
Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp
210 215 220
Lys Thr His Thr Gly Gly Gly Gly Ser Gly Gly Glu Val Gln Leu Val
225 230 235 240
Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly Ser Leu Arg Leu Ser
245 250 255
Cys Ala Ala Ser Gly Phe Asn Ile Lys Asp Thr Tyr Ile His Trp Val
260 265 270
Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val Ala Arg Ile Tyr Pro
275 280 285
Thr Asn Gly Tyr Thr Arg Tyr Ala Asp Ser Val Lys Gly Arg Phe Thr
290 295 300
Ile Ser Ala Asp Thr Ser Lys Asn Thr Ala Tyr Leu Gln Met Asn Ser
305 310 315 320
Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Ser Arg Trp Gly Gly
325 330 335
Asp Gly Phe Tyr Ala Met Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr
340 345 350
Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro
355 360 365
Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val
370 375 380
Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala
385 390 395 400
Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly
405 410 415
Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly
420 425 430
Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys
435 440 445
Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys Thr His Thr Cys
450 455 460
Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu
465 470 475 480
Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu
485 490 495
Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys
500 505 510
Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys
515 520 525
Pro Arg Glu Glu Gln Tyr Gly Ser Thr Tyr Arg Val Val Ser Val Leu
530 535 540
Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys
545 550 555 560
Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys
565 570 575
Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser
580 585 590
Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu Trp Cys Leu Val Lys
595 600 605
Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln
610 615 620
Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly
625 630 635 640
Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln
645 650 655
Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn
660 665 670
His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
675 680 685
<210> 83
<211> 678
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 83
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Asn Ile Lys Asp Thr
20 25 30
Tyr Ile His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Arg Ile Tyr Pro Thr Glu Gly Tyr Thr Arg Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Ala Asp Thr Ser Lys Asn Thr Ala Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ser Arg Trp Gly Gly Thr Gly Phe Tyr Ala Met Asp Val Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val
115 120 125
Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala
130 135 140
Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser
145 150 155 160
Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val
165 170 175
Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro
180 185 190
Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys
195 200 205
Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp
210 215 220
Lys Thr His Thr Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val
225 230 235 240
Gln Pro Gly Gly Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Asn
245 250 255
Ile Lys Asp Thr Tyr Ile His Trp Val Arg Gln Ala Pro Gly Lys Gly
260 265 270
Leu Glu Trp Val Ala Arg Ile Tyr Pro Thr Asn Gly Tyr Thr Arg Tyr
275 280 285
Ala Asp Ser Val Lys Gly Arg Phe Thr Ile Ser Ala Asp Thr Ser Lys
290 295 300
Asn Thr Ala Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala
305 310 315 320
Val Tyr Tyr Cys Ser Arg Trp Gly Gly Asp Gly Phe Tyr Ala Met Asp
325 330 335
Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys
340 345 350
Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly
355 360 365
Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro
370 375 380
Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr
385 390 395 400
Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val
405 410 415
Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn
420 425 430
Val Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro
435 440 445
Lys Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu
450 455 460
Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp
465 470 475 480
Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp
485 490 495
Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly
500 505 510
Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Gly
515 520 525
Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp
530 535 540
Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro
545 550 555 560
Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu
565 570 575
Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Glu Glu Met Thr Lys Asn
580 585 590
Gln Val Ser Leu Trp Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile
595 600 605
Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr
610 615 620
Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys
625 630 635 640
Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys
645 650 655
Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu
660 665 670
Ser Leu Ser Pro Gly Lys
675
<210> 84
<211> 685
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 84
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Asn Ile Lys Asp Thr
20 25 30
Tyr Ile His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Arg Ile Tyr Pro Thr Glu Gly Tyr Thr Arg Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Ala Asp Thr Ser Lys Asn Thr Ala Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ser Arg Trp Gly Gly Thr Gly Phe Tyr Ala Met Asp Val Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val
115 120 125
Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala
130 135 140
Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser
145 150 155 160
Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val
165 170 175
Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro
180 185 190
Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys
195 200 205
Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp
210 215 220
Lys Thr His Thr Gly Gly Gly Gly Ser Gly Gly Glu Val Gln Leu Val
225 230 235 240
Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly Ser Leu Arg Leu Ser
245 250 255
Cys Ala Ala Ser Gly Phe Asn Ile Lys Asp Thr Tyr Ile His Trp Val
260 265 270
Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val Ala Arg Ile Tyr Pro
275 280 285
Thr Asn Gly Tyr Thr Arg Tyr Ala Asp Ser Val Lys Gly Arg Phe Thr
290 295 300
Ile Ser Ala Asp Thr Ser Lys Asn Thr Ala Tyr Leu Gln Met Asn Ser
305 310 315 320
Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Ser Arg Trp Gly Gly
325 330 335
Asp Gly Phe Tyr Ala Met Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr
340 345 350
Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro
355 360 365
Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val
370 375 380
Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala
385 390 395 400
Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly
405 410 415
Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly
420 425 430
Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys
435 440 445
Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys Thr His Thr Cys
450 455 460
Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu
465 470 475 480
Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu
485 490 495
Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys
500 505 510
Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys
515 520 525
Pro Arg Glu Glu Gln Tyr Gly Ser Thr Tyr Arg Val Val Ser Val Leu
530 535 540
Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys
545 550 555 560
Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys
565 570 575
Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser
580 585 590
Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu Trp Cys Leu Val Lys
595 600 605
Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln
610 615 620
Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly
625 630 635 640
Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln
645 650 655
Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn
660 665 670
His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
675 680 685
<210> 85
<211> 678
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 85
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Asn Ile Lys Asp Thr
20 25 30
Tyr Ile His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Arg Ile Tyr Pro Thr Glu Gly Tyr Thr Arg Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Ala Asp Thr Ser Lys Asn Thr Ala Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ser Arg Trp Gly Gly Thr Gly Phe Tyr Ala Met Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val
115 120 125
Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala
130 135 140
Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser
145 150 155 160
Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val
165 170 175
Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro
180 185 190
Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys
195 200 205
Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp
210 215 220
Lys Thr His Thr Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val
225 230 235 240
Gln Pro Gly Gly Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Asn
245 250 255
Ile Lys Asp Thr Tyr Ile His Trp Val Arg Gln Ala Pro Gly Lys Gly
260 265 270
Leu Glu Trp Val Ala Arg Ile Tyr Pro Thr Asn Gly Tyr Thr Arg Tyr
275 280 285
Ala Asp Ser Val Lys Gly Arg Phe Thr Ile Ser Ala Asp Thr Ser Lys
290 295 300
Asn Thr Ala Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala
305 310 315 320
Val Tyr Tyr Cys Ser Arg Trp Gly Gly Asp Gly Phe Tyr Ala Met Asp
325 330 335
Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys
340 345 350
Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly
355 360 365
Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro
370 375 380
Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr
385 390 395 400
Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val
405 410 415
Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn
420 425 430
Val Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro
435 440 445
Lys Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu
450 455 460
Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp
465 470 475 480
Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp
485 490 495
Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly
500 505 510
Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Gly
515 520 525
Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp
530 535 540
Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro
545 550 555 560
Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu
565 570 575
Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Glu Glu Met Thr Lys Asn
580 585 590
Gln Val Ser Leu Trp Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile
595 600 605
Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr
610 615 620
Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys
625 630 635 640
Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys
645 650 655
Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu
660 665 670
Ser Leu Ser Pro Gly Lys
675
<210> 86
<211> 685
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 86
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Asn Ile Lys Asp Thr
20 25 30
Tyr Ile His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Arg Ile Tyr Pro Thr Glu Gly Tyr Thr Arg Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Ala Asp Thr Ser Lys Asn Thr Ala Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ser Arg Trp Gly Gly Thr Gly Phe Tyr Ala Met Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val
115 120 125
Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala
130 135 140
Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser
145 150 155 160
Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val
165 170 175
Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro
180 185 190
Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys
195 200 205
Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp
210 215 220
Lys Thr His Thr Gly Gly Gly Gly Ser Gly Gly Glu Val Gln Leu Val
225 230 235 240
Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly Ser Leu Arg Leu Ser
245 250 255
Cys Ala Ala Ser Gly Phe Asn Ile Lys Asp Thr Tyr Ile His Trp Val
260 265 270
Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val Ala Arg Ile Tyr Pro
275 280 285
Thr Asn Gly Tyr Thr Arg Tyr Ala Asp Ser Val Lys Gly Arg Phe Thr
290 295 300
Ile Ser Ala Asp Thr Ser Lys Asn Thr Ala Tyr Leu Gln Met Asn Ser
305 310 315 320
Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Ser Arg Trp Gly Gly
325 330 335
Asp Gly Phe Tyr Ala Met Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr
340 345 350
Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro
355 360 365
Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val
370 375 380
Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala
385 390 395 400
Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly
405 410 415
Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly
420 425 430
Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys
435 440 445
Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys Thr His Thr Cys
450 455 460
Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu
465 470 475 480
Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu
485 490 495
Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys
500 505 510
Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys
515 520 525
Pro Arg Glu Glu Gln Tyr Gly Ser Thr Tyr Arg Val Val Ser Val Leu
530 535 540
Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys
545 550 555 560
Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys
565 570 575
Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser
580 585 590
Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu Trp Cys Leu Val Lys
595 600 605
Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln
610 615 620
Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly
625 630 635 640
Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln
645 650 655
Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn
660 665 670
His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
675 680 685
<210> 87
<211> 678
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 87
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Asn Ile Lys Asp Thr
20 25 30
Tyr Ile His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Arg Ile Tyr Pro Thr Glu Gly Tyr Thr Arg Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Ala Asp Thr Ser Lys Asn Thr Ala Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ser Arg Trp Gly Gly Thr Gly Phe Tyr Ala Met Asp Val Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val
115 120 125
Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala
130 135 140
Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser
145 150 155 160
Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val
165 170 175
Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro
180 185 190
Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys
195 200 205
Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp
210 215 220
Lys Thr His Thr Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val
225 230 235 240
Gln Pro Gly Gly Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Asn
245 250 255
Ile Lys Asp Thr Tyr Ile His Trp Val Arg Gln Ala Pro Gly Lys Gly
260 265 270
Leu Glu Trp Val Ala Arg Ile Tyr Pro Thr Asn Gly Tyr Thr Arg Tyr
275 280 285
Ala Asp Ser Val Lys Gly Arg Phe Thr Ile Ser Ala Asp Thr Ser Lys
290 295 300
Asn Thr Ala Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala
305 310 315 320
Val Tyr Tyr Cys Ser Arg Trp Gly Gly Asp Gly Phe Tyr Ala Met Asp
325 330 335
Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys
340 345 350
Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly
355 360 365
Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro
370 375 380
Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr
385 390 395 400
Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val
405 410 415
Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn
420 425 430
Val Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro
435 440 445
Lys Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu
450 455 460
Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp
465 470 475 480
Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp
485 490 495
Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly
500 505 510
Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Gly
515 520 525
Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp
530 535 540
Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro
545 550 555 560
Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu
565 570 575
Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Glu Glu Met Thr Lys Asn
580 585 590
Gln Val Ser Leu Trp Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile
595 600 605
Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr
610 615 620
Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys
625 630 635 640
Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys
645 650 655
Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu
660 665 670
Ser Leu Ser Pro Gly Lys
675
<210> 88
<211> 685
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 88
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Asn Ile Lys Asp Thr
20 25 30
Tyr Ile His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Arg Ile Tyr Pro Thr Glu Gly Tyr Thr Arg Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Ala Asp Thr Ser Lys Asn Thr Ala Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ser Arg Trp Gly Gly Thr Gly Phe Tyr Ala Met Asp Val Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val
115 120 125
Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala
130 135 140
Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser
145 150 155 160
Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val
165 170 175
Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro
180 185 190
Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys
195 200 205
Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp
210 215 220
Lys Thr His Thr Gly Gly Gly Gly Ser Gly Gly Glu Val Gln Leu Val
225 230 235 240
Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly Ser Leu Arg Leu Ser
245 250 255
Cys Ala Ala Ser Gly Phe Asn Ile Lys Asp Thr Tyr Ile His Trp Val
260 265 270
Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val Ala Arg Ile Tyr Pro
275 280 285
Thr Asn Gly Tyr Thr Arg Tyr Ala Asp Ser Val Lys Gly Arg Phe Thr
290 295 300
Ile Ser Ala Asp Thr Ser Lys Asn Thr Ala Tyr Leu Gln Met Asn Ser
305 310 315 320
Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Ser Arg Trp Gly Gly
325 330 335
Asp Gly Phe Tyr Ala Met Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr
340 345 350
Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro
355 360 365
Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val
370 375 380
Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala
385 390 395 400
Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly
405 410 415
Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly
420 425 430
Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys
435 440 445
Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys Thr His Thr Cys
450 455 460
Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu
465 470 475 480
Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu
485 490 495
Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys
500 505 510
Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys
515 520 525
Pro Arg Glu Glu Gln Tyr Gly Ser Thr Tyr Arg Val Val Ser Val Leu
530 535 540
Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys
545 550 555 560
Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys
565 570 575
Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser
580 585 590
Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu Trp Cys Leu Val Lys
595 600 605
Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln
610 615 620
Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly
625 630 635 640
Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln
645 650 655
Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn
660 665 670
His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
675 680 685
<210> 89
<211> 678
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 89
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Asn Ile Lys Asp Thr
20 25 30
Tyr Ile His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Arg Ile Tyr Pro Thr Asn Gly Tyr Thr Arg Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Ala Asp Thr Ser Lys Asn Thr Ala Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ser Arg Trp Gly Gly Asp Gly Phe Tyr Ala Met Asp Val Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val
115 120 125
Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala
130 135 140
Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser
145 150 155 160
Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val
165 170 175
Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro
180 185 190
Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys
195 200 205
Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp
210 215 220
Lys Thr His Thr Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val
225 230 235 240
Gln Pro Gly Gly Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Asn
245 250 255
Ile Lys Asp Thr Tyr Ile His Trp Val Arg Gln Ala Pro Gly Lys Gly
260 265 270
Leu Glu Trp Val Ala Arg Ile Tyr Pro Thr Asn Gly Tyr Thr Arg Tyr
275 280 285
Ala Asp Ser Val Lys Gly Arg Phe Thr Ile Ser Ala Asp Thr Ser Lys
290 295 300
Asn Thr Ala Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala
305 310 315 320
Val Tyr Tyr Cys Ser Arg Trp Gly Gly Asp Gly Phe Tyr Ala Met Asp
325 330 335
Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys
340 345 350
Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly
355 360 365
Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro
370 375 380
Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr
385 390 395 400
Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val
405 410 415
Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn
420 425 430
Val Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro
435 440 445
Lys Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu
450 455 460
Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp
465 470 475 480
Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp
485 490 495
Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly
500 505 510
Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Gly
515 520 525
Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp
530 535 540
Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro
545 550 555 560
Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu
565 570 575
Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Glu Glu Met Thr Lys Asn
580 585 590
Gln Val Ser Leu Trp Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile
595 600 605
Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr
610 615 620
Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys
625 630 635 640
Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys
645 650 655
Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu
660 665 670
Ser Leu Ser Pro Gly Lys
675
<210> 90
<211> 685
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 90
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Asn Ile Lys Asp Thr
20 25 30
Tyr Ile His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Arg Ile Tyr Pro Thr Asn Gly Tyr Thr Arg Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Ala Asp Thr Ser Lys Asn Thr Ala Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ser Arg Trp Gly Gly Asp Gly Phe Tyr Ala Met Asp Val Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val
115 120 125
Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala
130 135 140
Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser
145 150 155 160
Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val
165 170 175
Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro
180 185 190
Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys
195 200 205
Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp
210 215 220
Lys Thr His Thr Gly Gly Gly Gly Ser Gly Gly Glu Val Gln Leu Val
225 230 235 240
Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly Ser Leu Arg Leu Ser
245 250 255
Cys Ala Ala Ser Gly Phe Asn Ile Lys Asp Thr Tyr Ile His Trp Val
260 265 270
Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val Ala Arg Ile Tyr Pro
275 280 285
Thr Asn Gly Tyr Thr Arg Tyr Ala Asp Ser Val Lys Gly Arg Phe Thr
290 295 300
Ile Ser Ala Asp Thr Ser Lys Asn Thr Ala Tyr Leu Gln Met Asn Ser
305 310 315 320
Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Ser Arg Trp Gly Gly
325 330 335
Asp Gly Phe Tyr Ala Met Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr
340 345 350
Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro
355 360 365
Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val
370 375 380
Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala
385 390 395 400
Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly
405 410 415
Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly
420 425 430
Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys
435 440 445
Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys Thr His Thr Cys
450 455 460
Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu
465 470 475 480
Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu
485 490 495
Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys
500 505 510
Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys
515 520 525
Pro Arg Glu Glu Gln Tyr Gly Ser Thr Tyr Arg Val Val Ser Val Leu
530 535 540
Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys
545 550 555 560
Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys
565 570 575
Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser
580 585 590
Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu Trp Cys Leu Val Lys
595 600 605
Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln
610 615 620
Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly
625 630 635 640
Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln
645 650 655
Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn
660 665 670
His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
675 680 685
<210> 91
<211> 678
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 91
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Asn Ile Lys Asp Thr
20 25 30
Tyr Ile His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Arg Ile Tyr Pro Thr Asn Gly Tyr Thr Arg Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Ala Asp Thr Ser Lys Asn Thr Ala Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ser Arg Trp Gly Gly Asp Gly Phe Tyr Ala Met Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val
115 120 125
Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala
130 135 140
Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser
145 150 155 160
Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val
165 170 175
Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro
180 185 190
Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys
195 200 205
Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp
210 215 220
Lys Thr His Thr Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val
225 230 235 240
Gln Pro Gly Gly Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Asn
245 250 255
Ile Lys Asp Thr Tyr Ile His Trp Val Arg Gln Ala Pro Gly Lys Gly
260 265 270
Leu Glu Trp Val Ala Arg Ile Tyr Pro Thr Asn Gly Tyr Thr Arg Tyr
275 280 285
Ala Asp Ser Val Lys Gly Arg Phe Thr Ile Ser Ala Asp Thr Ser Lys
290 295 300
Asn Thr Ala Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala
305 310 315 320
Val Tyr Tyr Cys Ser Arg Trp Gly Gly Asp Gly Phe Tyr Ala Met Asp
325 330 335
Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys
340 345 350
Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly
355 360 365
Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro
370 375 380
Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr
385 390 395 400
Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val
405 410 415
Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn
420 425 430
Val Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro
435 440 445
Lys Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu
450 455 460
Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp
465 470 475 480
Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp
485 490 495
Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly
500 505 510
Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Gly
515 520 525
Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp
530 535 540
Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro
545 550 555 560
Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu
565 570 575
Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Glu Glu Met Thr Lys Asn
580 585 590
Gln Val Ser Leu Trp Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile
595 600 605
Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr
610 615 620
Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys
625 630 635 640
Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys
645 650 655
Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu
660 665 670
Ser Leu Ser Pro Gly Lys
675
<210> 92
<211> 685
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 92
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Asn Ile Lys Asp Thr
20 25 30
Tyr Ile His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Arg Ile Tyr Pro Thr Asn Gly Tyr Thr Arg Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Ala Asp Thr Ser Lys Asn Thr Ala Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ser Arg Trp Gly Gly Asp Gly Phe Tyr Ala Met Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val
115 120 125
Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala
130 135 140
Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser
145 150 155 160
Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val
165 170 175
Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro
180 185 190
Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys
195 200 205
Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp
210 215 220
Lys Thr His Thr Gly Gly Gly Gly Ser Gly Gly Glu Val Gln Leu Val
225 230 235 240
Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly Ser Leu Arg Leu Ser
245 250 255
Cys Ala Ala Ser Gly Phe Asn Ile Lys Asp Thr Tyr Ile His Trp Val
260 265 270
Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val Ala Arg Ile Tyr Pro
275 280 285
Thr Asn Gly Tyr Thr Arg Tyr Ala Asp Ser Val Lys Gly Arg Phe Thr
290 295 300
Ile Ser Ala Asp Thr Ser Lys Asn Thr Ala Tyr Leu Gln Met Asn Ser
305 310 315 320
Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Ser Arg Trp Gly Gly
325 330 335
Asp Gly Phe Tyr Ala Met Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr
340 345 350
Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro
355 360 365
Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val
370 375 380
Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala
385 390 395 400
Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly
405 410 415
Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly
420 425 430
Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys
435 440 445
Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys Thr His Thr Cys
450 455 460
Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu
465 470 475 480
Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu
485 490 495
Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys
500 505 510
Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys
515 520 525
Pro Arg Glu Glu Gln Tyr Gly Ser Thr Tyr Arg Val Val Ser Val Leu
530 535 540
Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys
545 550 555 560
Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys
565 570 575
Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser
580 585 590
Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu Trp Cys Leu Val Lys
595 600 605
Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln
610 615 620
Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly
625 630 635 640
Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln
645 650 655
Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn
660 665 670
His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
675 680 685
<210> 93
<211> 678
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 93
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Asn Ile Lys Asp Thr
20 25 30
Tyr Ile His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Arg Ile Tyr Pro Thr Asn Gly Tyr Thr Arg Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Ala Asp Thr Ser Lys Asn Thr Ala Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ser Arg Trp Gly Gly Asp Gly Phe Tyr Ala Met Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val
115 120 125
Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala
130 135 140
Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser
145 150 155 160
Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val
165 170 175
Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro
180 185 190
Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys
195 200 205
Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp
210 215 220
Lys Thr His Thr Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val
225 230 235 240
Gln Pro Gly Gly Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Asn
245 250 255
Ile Lys Asp Thr Tyr Ile His Trp Val Arg Gln Ala Pro Gly Lys Gly
260 265 270
Leu Glu Trp Val Ala Arg Ile Tyr Pro Thr Asn Gly Tyr Thr Arg Tyr
275 280 285
Ala Asp Ser Val Lys Gly Arg Phe Thr Ile Ser Ala Asp Thr Ser Lys
290 295 300
Asn Thr Ala Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala
305 310 315 320
Val Tyr Tyr Cys Ser Arg Trp Gly Gly Asp Gly Phe Tyr Ala Met Asp
325 330 335
Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys
340 345 350
Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly
355 360 365
Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro
370 375 380
Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr
385 390 395 400
Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val
405 410 415
Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn
420 425 430
Val Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro
435 440 445
Lys Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu
450 455 460
Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp
465 470 475 480
Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp
485 490 495
Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly
500 505 510
Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Gly
515 520 525
Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp
530 535 540
Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro
545 550 555 560
Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu
565 570 575
Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Glu Glu Met Thr Lys Asn
580 585 590
Gln Val Ser Leu Trp Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile
595 600 605
Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr
610 615 620
Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys
625 630 635 640
Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys
645 650 655
Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu
660 665 670
Ser Leu Ser Pro Gly Lys
675
<210> 94
<211> 685
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 94
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Asn Ile Lys Asp Thr
20 25 30
Tyr Ile His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Arg Ile Tyr Pro Thr Asn Gly Tyr Thr Arg Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Ala Asp Thr Ser Lys Asn Thr Ala Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ser Arg Trp Gly Gly Asp Gly Phe Tyr Ala Met Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val
115 120 125
Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala
130 135 140
Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser
145 150 155 160
Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val
165 170 175
Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro
180 185 190
Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys
195 200 205
Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp
210 215 220
Lys Thr His Thr Gly Gly Gly Gly Ser Gly Gly Glu Val Gln Leu Val
225 230 235 240
Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly Ser Leu Arg Leu Ser
245 250 255
Cys Ala Ala Ser Gly Phe Asn Ile Lys Asp Thr Tyr Ile His Trp Val
260 265 270
Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val Ala Arg Ile Tyr Pro
275 280 285
Thr Asn Gly Tyr Thr Arg Tyr Ala Asp Ser Val Lys Gly Arg Phe Thr
290 295 300
Ile Ser Ala Asp Thr Ser Lys Asn Thr Ala Tyr Leu Gln Met Asn Ser
305 310 315 320
Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Ser Arg Trp Gly Gly
325 330 335
Asp Gly Phe Tyr Ala Met Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr
340 345 350
Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro
355 360 365
Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val
370 375 380
Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala
385 390 395 400
Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly
405 410 415
Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly
420 425 430
Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys
435 440 445
Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys Thr His Thr Cys
450 455 460
Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu
465 470 475 480
Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu
485 490 495
Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys
500 505 510
Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys
515 520 525
Pro Arg Glu Glu Gln Tyr Gly Ser Thr Tyr Arg Val Val Ser Val Leu
530 535 540
Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys
545 550 555 560
Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys
565 570 575
Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser
580 585 590
Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu Trp Cys Leu Val Lys
595 600 605
Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln
610 615 620
Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly
625 630 635 640
Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln
645 650 655
Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn
660 665 670
His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
675 680 685
<210> 95
<211> 678
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 95
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Asn Ile Lys Asp Thr
20 25 30
Tyr Ile His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Arg Ile Tyr Pro Thr Asn Gly Tyr Thr Arg Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Ala Asp Thr Ser Lys Asn Thr Ala Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ser Arg Trp Gly Gly Ala Gly Ala Tyr Ala Met Asp Val Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val
115 120 125
Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala
130 135 140
Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser
145 150 155 160
Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val
165 170 175
Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro
180 185 190
Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys
195 200 205
Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp
210 215 220
Lys Thr His Thr Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val
225 230 235 240
Gln Pro Gly Gly Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Asn
245 250 255
Ile Lys Asp Thr Tyr Ile His Trp Val Arg Gln Ala Pro Gly Lys Gly
260 265 270
Leu Glu Trp Val Ala Arg Ile Tyr Pro Thr Asn Gly Tyr Thr Arg Tyr
275 280 285
Ala Asp Ser Val Lys Gly Arg Phe Thr Ile Ser Ala Asp Thr Ser Lys
290 295 300
Asn Thr Ala Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala
305 310 315 320
Val Tyr Tyr Cys Ser Arg Trp Gly Gly Asp Gly Phe Tyr Ala Met Asp
325 330 335
Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys
340 345 350
Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly
355 360 365
Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro
370 375 380
Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr
385 390 395 400
Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val
405 410 415
Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn
420 425 430
Val Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro
435 440 445
Lys Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu
450 455 460
Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp
465 470 475 480
Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp
485 490 495
Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly
500 505 510
Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Gly
515 520 525
Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp
530 535 540
Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro
545 550 555 560
Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu
565 570 575
Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Glu Glu Met Thr Lys Asn
580 585 590
Gln Val Ser Leu Trp Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile
595 600 605
Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr
610 615 620
Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys
625 630 635 640
Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys
645 650 655
Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu
660 665 670
Ser Leu Ser Pro Gly Lys
675
<210> 96
<211> 685
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 96
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Asn Ile Lys Asp Thr
20 25 30
Tyr Ile His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Arg Ile Tyr Pro Thr Asn Gly Tyr Thr Arg Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Ala Asp Thr Ser Lys Asn Thr Ala Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ser Arg Trp Gly Gly Ala Gly Ala Tyr Ala Met Asp Val Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val
115 120 125
Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala
130 135 140
Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser
145 150 155 160
Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val
165 170 175
Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro
180 185 190
Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys
195 200 205
Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp
210 215 220
Lys Thr His Thr Gly Gly Gly Gly Ser Gly Gly Glu Val Gln Leu Val
225 230 235 240
Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly Ser Leu Arg Leu Ser
245 250 255
Cys Ala Ala Ser Gly Phe Asn Ile Lys Asp Thr Tyr Ile His Trp Val
260 265 270
Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val Ala Arg Ile Tyr Pro
275 280 285
Thr Asn Gly Tyr Thr Arg Tyr Ala Asp Ser Val Lys Gly Arg Phe Thr
290 295 300
Ile Ser Ala Asp Thr Ser Lys Asn Thr Ala Tyr Leu Gln Met Asn Ser
305 310 315 320
Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Ser Arg Trp Gly Gly
325 330 335
Asp Gly Phe Tyr Ala Met Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr
340 345 350
Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro
355 360 365
Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val
370 375 380
Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala
385 390 395 400
Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly
405 410 415
Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly
420 425 430
Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys
435 440 445
Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys Thr His Thr Cys
450 455 460
Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu
465 470 475 480
Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu
485 490 495
Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys
500 505 510
Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys
515 520 525
Pro Arg Glu Glu Gln Tyr Gly Ser Thr Tyr Arg Val Val Ser Val Leu
530 535 540
Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys
545 550 555 560
Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys
565 570 575
Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser
580 585 590
Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu Trp Cys Leu Val Lys
595 600 605
Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln
610 615 620
Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly
625 630 635 640
Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln
645 650 655
Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn
660 665 670
His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
675 680 685
<210> 97
<211> 678
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 97
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Asn Ile Lys Asp Thr
20 25 30
Tyr Ile His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Arg Ile Tyr Pro Thr Asn Gly Tyr Thr Arg Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Ala Asp Thr Ser Lys Asn Thr Ala Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ser Arg Trp Gly Gly Ala Gly Ala Tyr Ala Met Asp Val Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val
115 120 125
Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala
130 135 140
Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser
145 150 155 160
Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val
165 170 175
Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro
180 185 190
Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys
195 200 205
Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp
210 215 220
Lys Thr His Thr Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val
225 230 235 240
Gln Pro Gly Gly Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Asn
245 250 255
Ile Lys Asp Thr Tyr Ile His Trp Val Arg Gln Ala Pro Gly Lys Gly
260 265 270
Leu Glu Trp Val Ala Arg Ile Tyr Pro Thr Asn Gly Tyr Thr Arg Tyr
275 280 285
Ala Asp Ser Val Lys Gly Arg Phe Thr Ile Ser Ala Asp Thr Ser Lys
290 295 300
Asn Thr Ala Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala
305 310 315 320
Val Tyr Tyr Cys Ser Arg Trp Gly Gly Asp Gly Phe Tyr Ala Met Asp
325 330 335
Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys
340 345 350
Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly
355 360 365
Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro
370 375 380
Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr
385 390 395 400
Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val
405 410 415
Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn
420 425 430
Val Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro
435 440 445
Lys Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu
450 455 460
Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp
465 470 475 480
Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp
485 490 495
Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly
500 505 510
Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Gly
515 520 525
Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp
530 535 540
Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro
545 550 555 560
Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu
565 570 575
Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Glu Glu Met Thr Lys Asn
580 585 590
Gln Val Ser Leu Trp Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile
595 600 605
Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr
610 615 620
Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys
625 630 635 640
Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys
645 650 655
Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu
660 665 670
Ser Leu Ser Pro Gly Lys
675
<210> 98
<211> 685
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 98
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Asn Ile Lys Asp Thr
20 25 30
Tyr Ile His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Arg Ile Tyr Pro Thr Asn Gly Tyr Thr Arg Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Ala Asp Thr Ser Lys Asn Thr Ala Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ser Arg Trp Gly Gly Ala Gly Ala Tyr Ala Met Asp Val Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val
115 120 125
Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala
130 135 140
Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser
145 150 155 160
Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val
165 170 175
Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro
180 185 190
Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys
195 200 205
Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp
210 215 220
Lys Thr His Thr Gly Gly Gly Gly Ser Gly Gly Glu Val Gln Leu Val
225 230 235 240
Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly Ser Leu Arg Leu Ser
245 250 255
Cys Ala Ala Ser Gly Phe Asn Ile Lys Asp Thr Tyr Ile His Trp Val
260 265 270
Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val Ala Arg Ile Tyr Pro
275 280 285
Thr Asn Gly Tyr Thr Arg Tyr Ala Asp Ser Val Lys Gly Arg Phe Thr
290 295 300
Ile Ser Ala Asp Thr Ser Lys Asn Thr Ala Tyr Leu Gln Met Asn Ser
305 310 315 320
Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Ser Arg Trp Gly Gly
325 330 335
Asp Gly Phe Tyr Ala Met Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr
340 345 350
Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro
355 360 365
Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val
370 375 380
Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala
385 390 395 400
Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly
405 410 415
Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly
420 425 430
Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys
435 440 445
Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys Thr His Thr Cys
450 455 460
Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu
465 470 475 480
Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu
485 490 495
Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys
500 505 510
Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys
515 520 525
Pro Arg Glu Glu Gln Tyr Gly Ser Thr Tyr Arg Val Val Ser Val Leu
530 535 540
Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys
545 550 555 560
Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys
565 570 575
Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser
580 585 590
Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu Trp Cys Leu Val Lys
595 600 605
Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln
610 615 620
Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly
625 630 635 640
Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln
645 650 655
Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn
660 665 670
His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
675 680 685
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| АНТИТЕЛА ПРОТИВ СИГНАЛ-РЕГУЛЯТОРНОГО БЕЛКА АЛЬФА И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2017 |
|
RU2771964C2 |
| АНТИТЕЛА К ВИРУСУ ДЕНГЕ, ПОЛИПЕПТИДЫ, СОДЕРЖАЩИЕ ВАРИАНТЫ FC-ОБЛАСТЕЙ, И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2017 |
|
RU2758596C2 |
| АНТИТЕЛА ПРОТИВ ТАУ-БЕЛКА И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2016 |
|
RU2732122C2 |
| АНТИТЕЛА К ВИРУСУ ДЕНГЕ, ОБЛАДАЮЩИЕ ПЕРЕКРЕСТНОЙ РЕАКТИВНОСТЬЮ С ВИРУСОМ ЗИКА | 2019 |
|
RU2811697C2 |
| МУЛЬТИСПЕЦИФИЧЕСКАЯ АНТИГЕНСВЯЗЫВАЮЩАЯ МОЛЕКУЛА, ОБЛАДАЮЩАЯ ЗАМЕЩАЮЩЕЙ ФУНКЦИОНАЛЬНОЙ АКТИВНОСТЬЮ КОФАКТОРА КОАГУЛИРУЮЩЕГО ФАКТОРА КРОВИ VIII, И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ УКАЗАННУЮ МОЛЕКУЛУ В КАЧЕСТВЕ АКТИВНОГО ИНГРЕДИЕНТА | 2018 |
|
RU2812909C2 |
| АНТИТЕЛА К С5 И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2015 |
|
RU2746356C2 |
| БИСПЕЦИФИЧЕСКИЕ АНТИТЕЛА, СПЕЦИФИЧЕСКИ СВЯЗЫВАЮЩИЕСЯ С PD1 И LAG3 | 2018 |
|
RU2778805C2 |
| СЕЛЕКТИВНЫЕ В ОТНОШЕНИИ ИЗОФОРМЫ АНТИТЕЛА К TGF-БЕТА И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2021 |
|
RU2839151C1 |
| АНТИ-CD137 АНТИГЕНСВЯЗЫВАЮЩИЕ МОЛЕКУЛЫ И ИХ ПРИМЕНЕНИЕ | 2019 |
|
RU2829536C2 |
| АНТИТЕЛА К МИОСТАТИНУ, ПОЛИПЕПТИДЫ, СОДЕРЖАЩИЕ ВАРИАНТЫ FC-ОБЛАСТЕЙ, И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2016 |
|
RU2789884C2 |
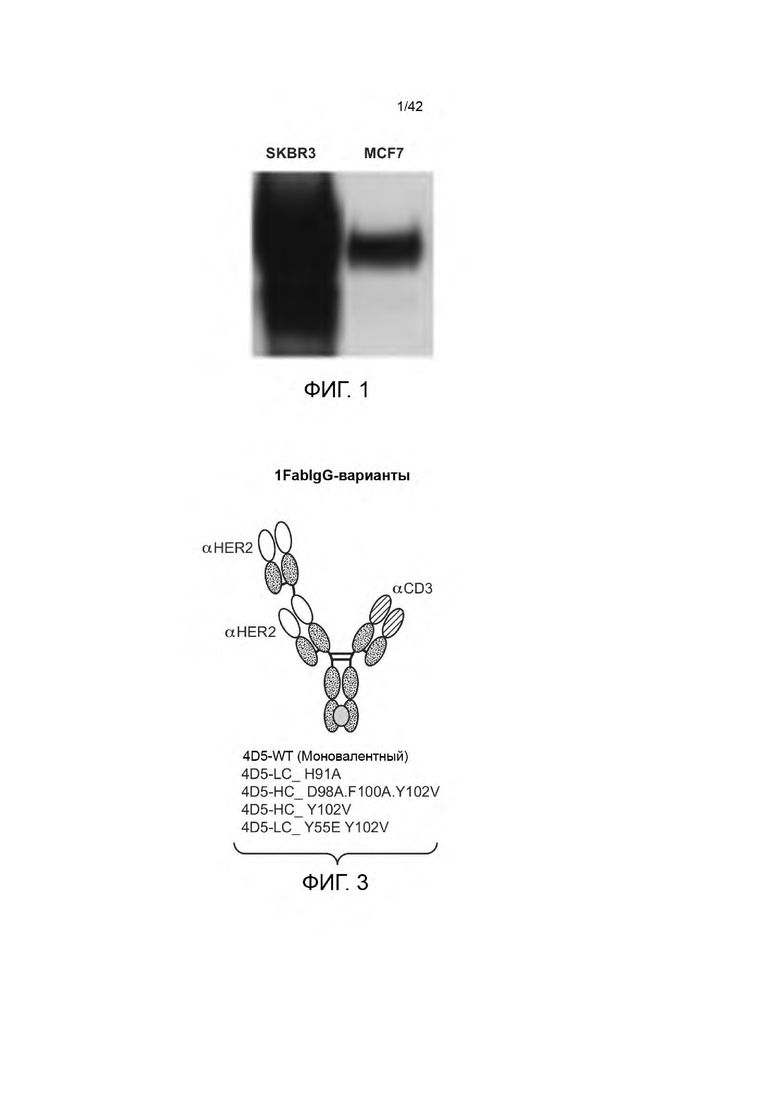

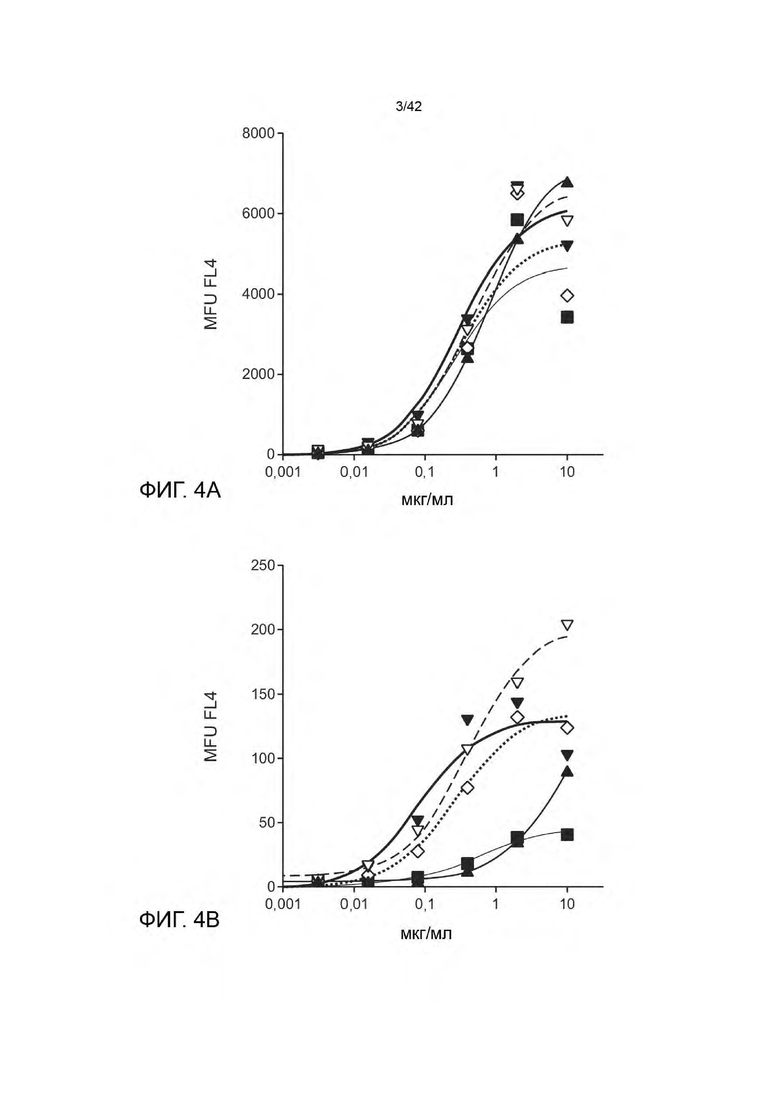
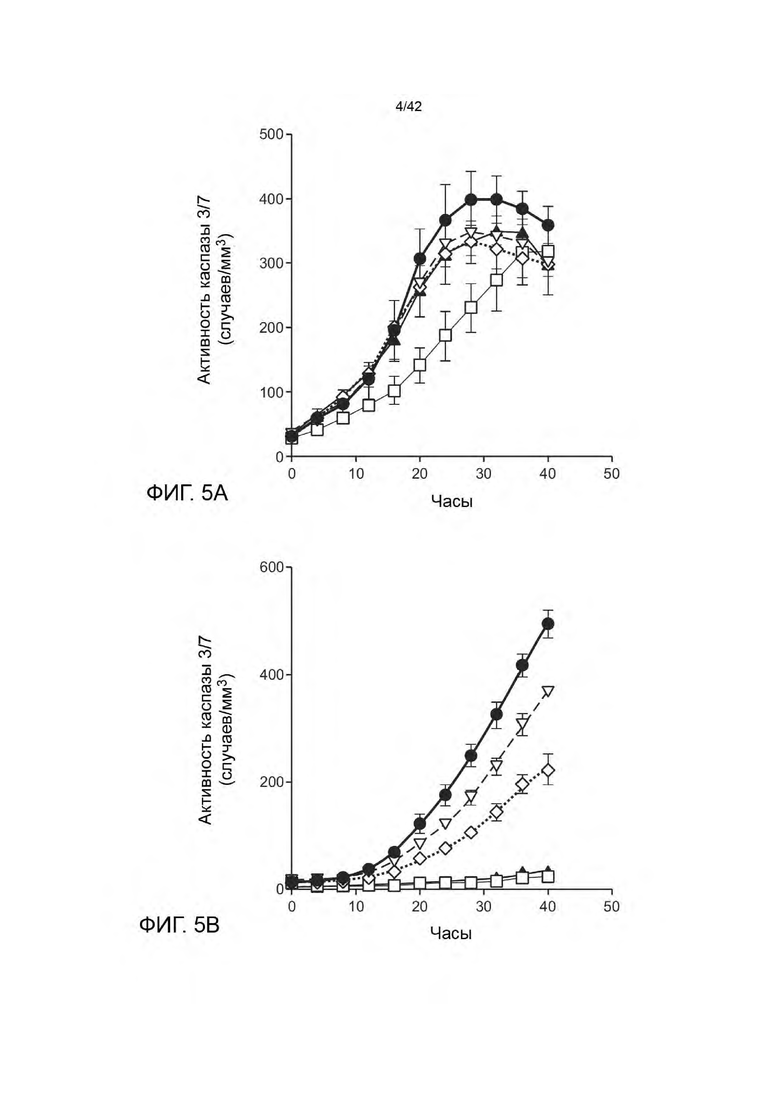

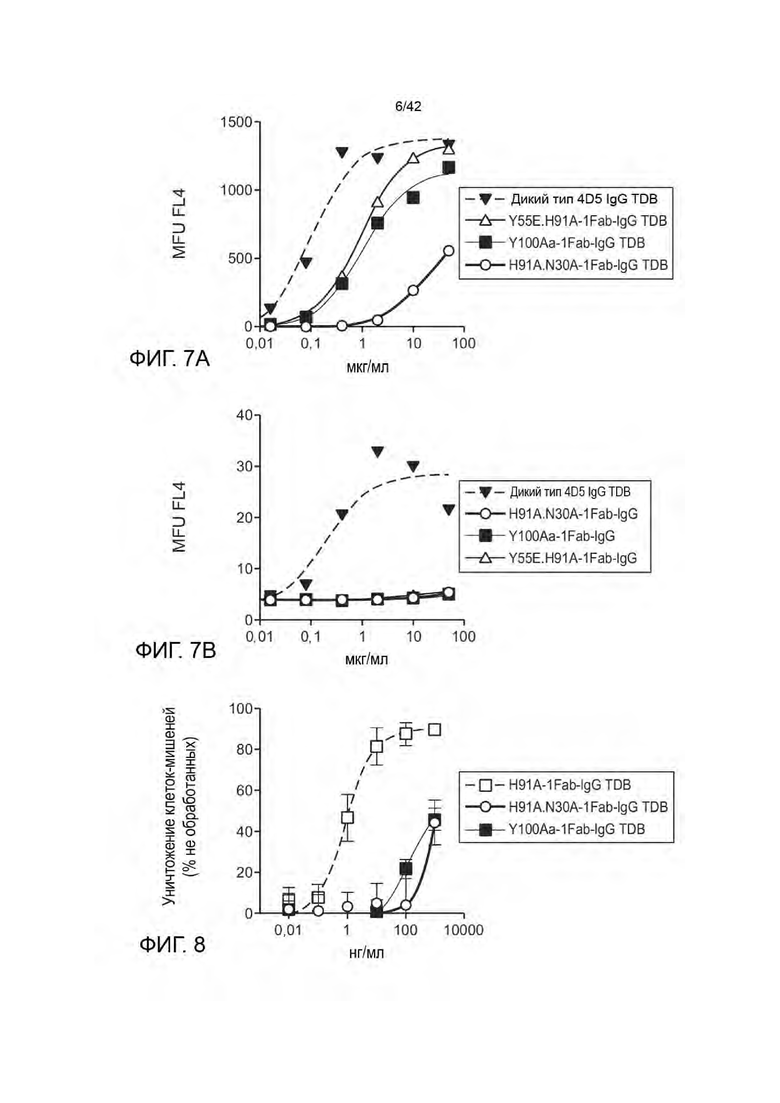
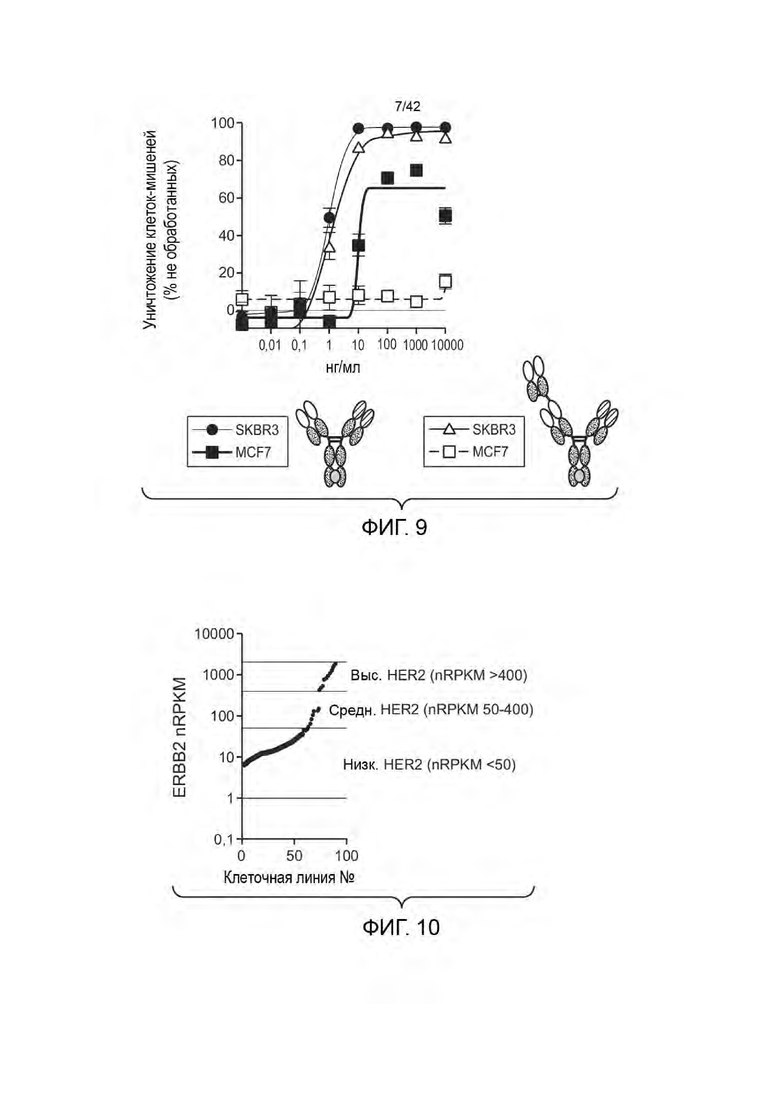
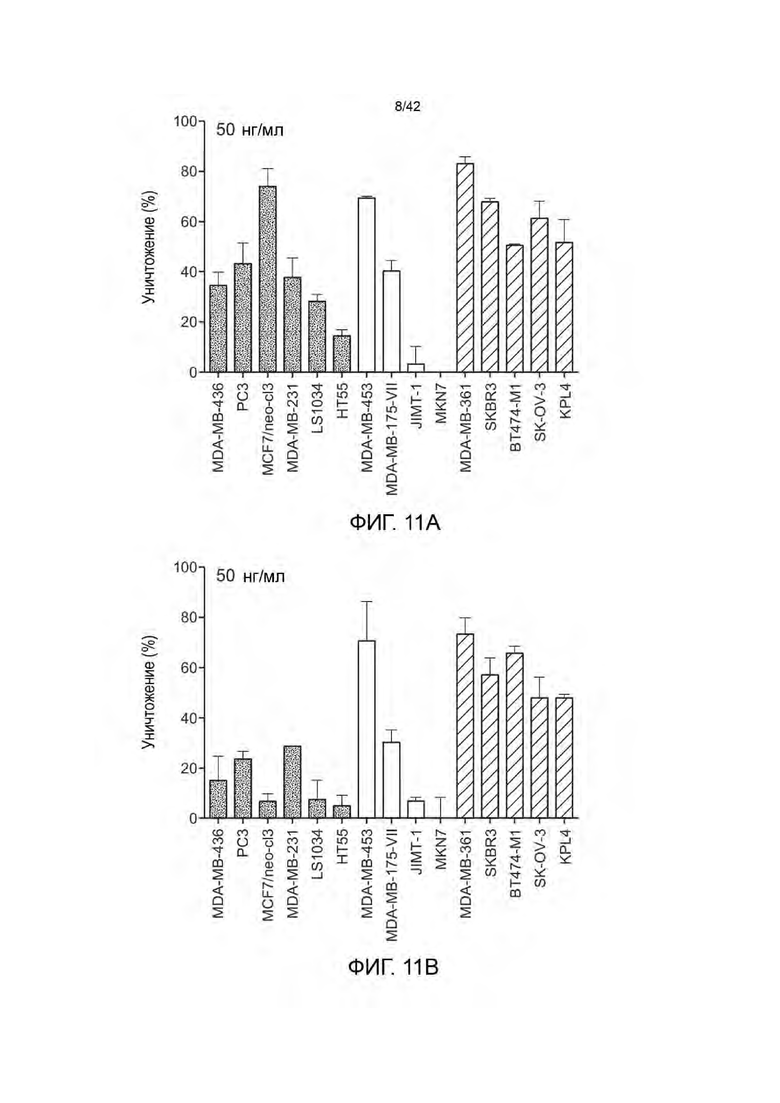
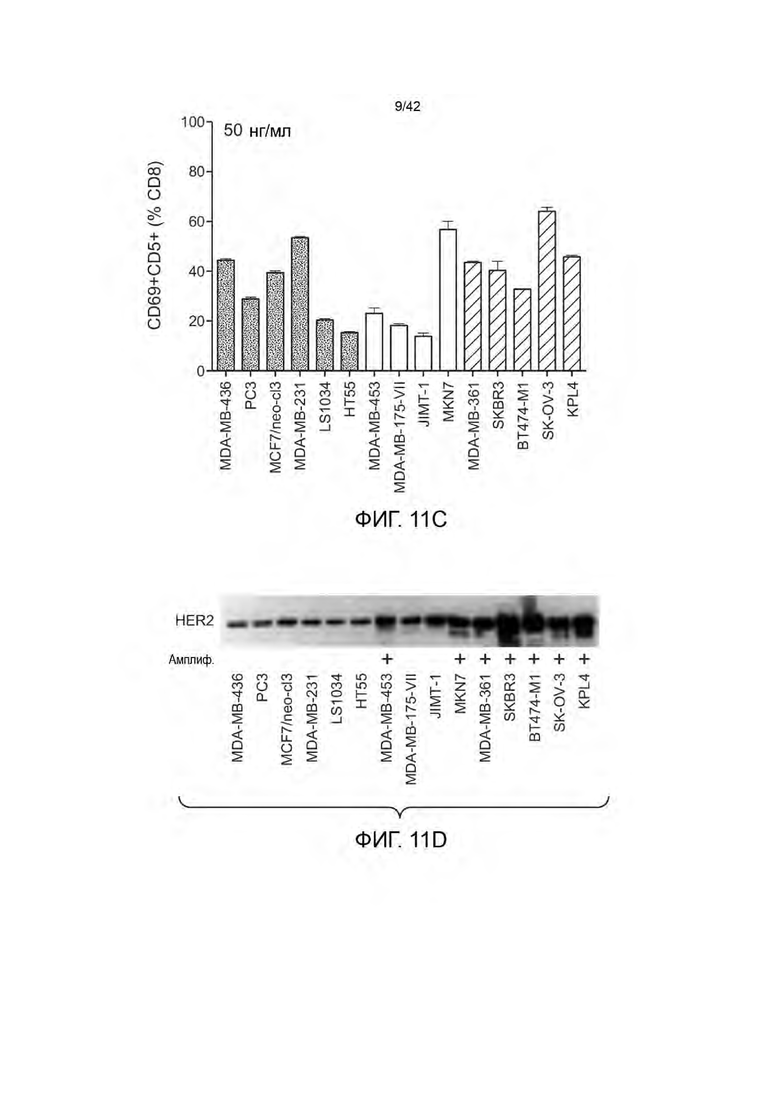
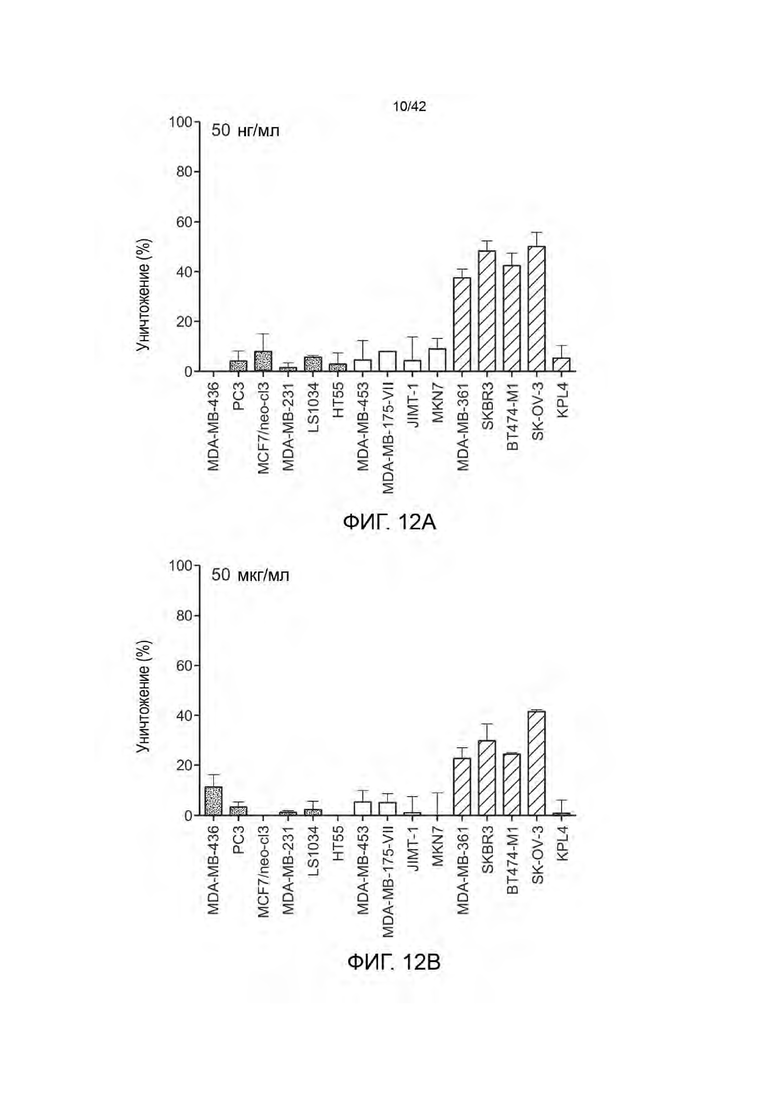
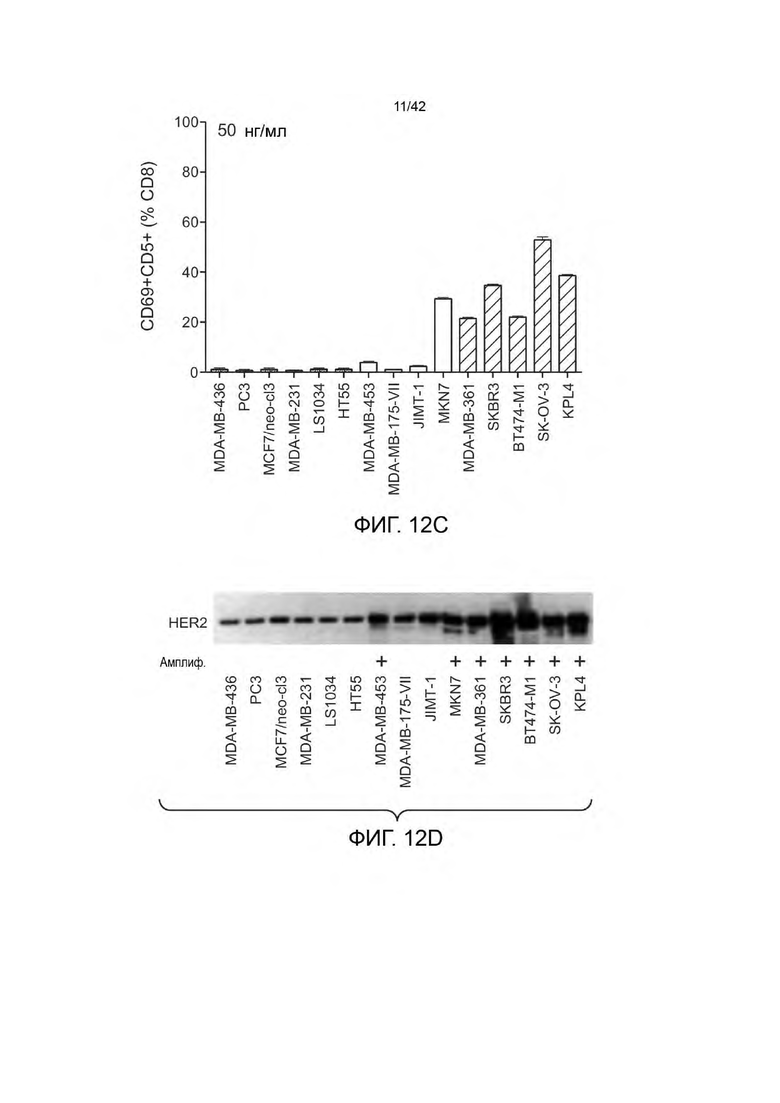
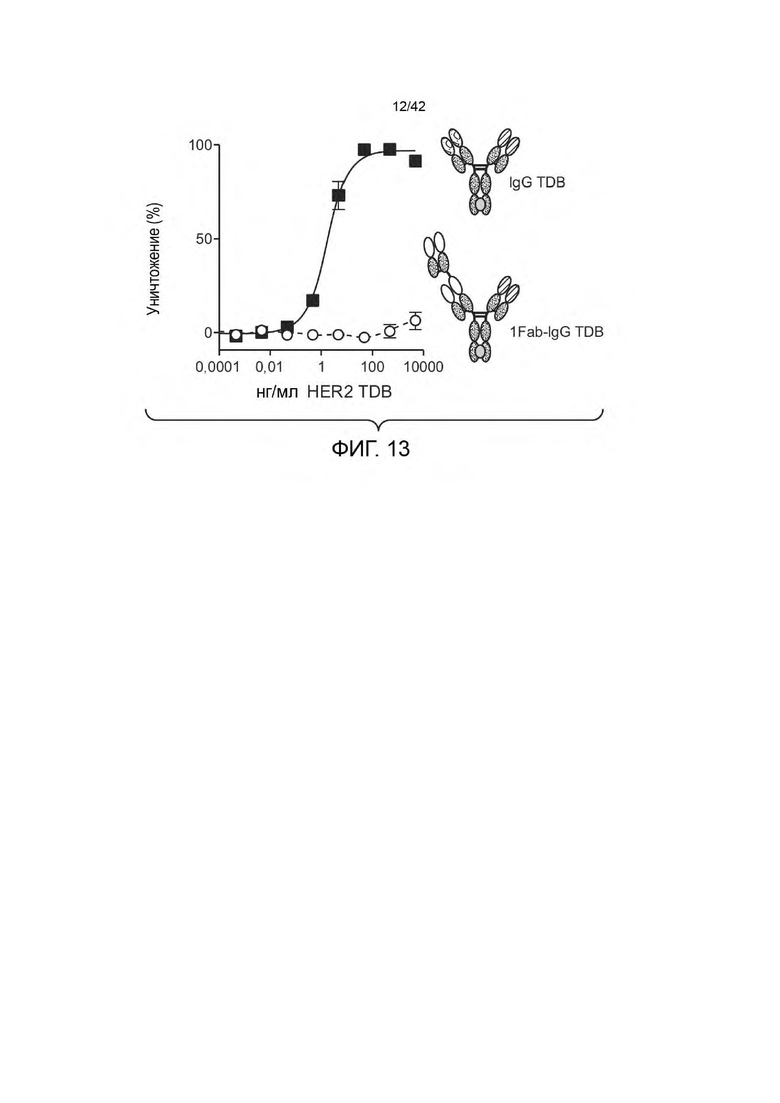
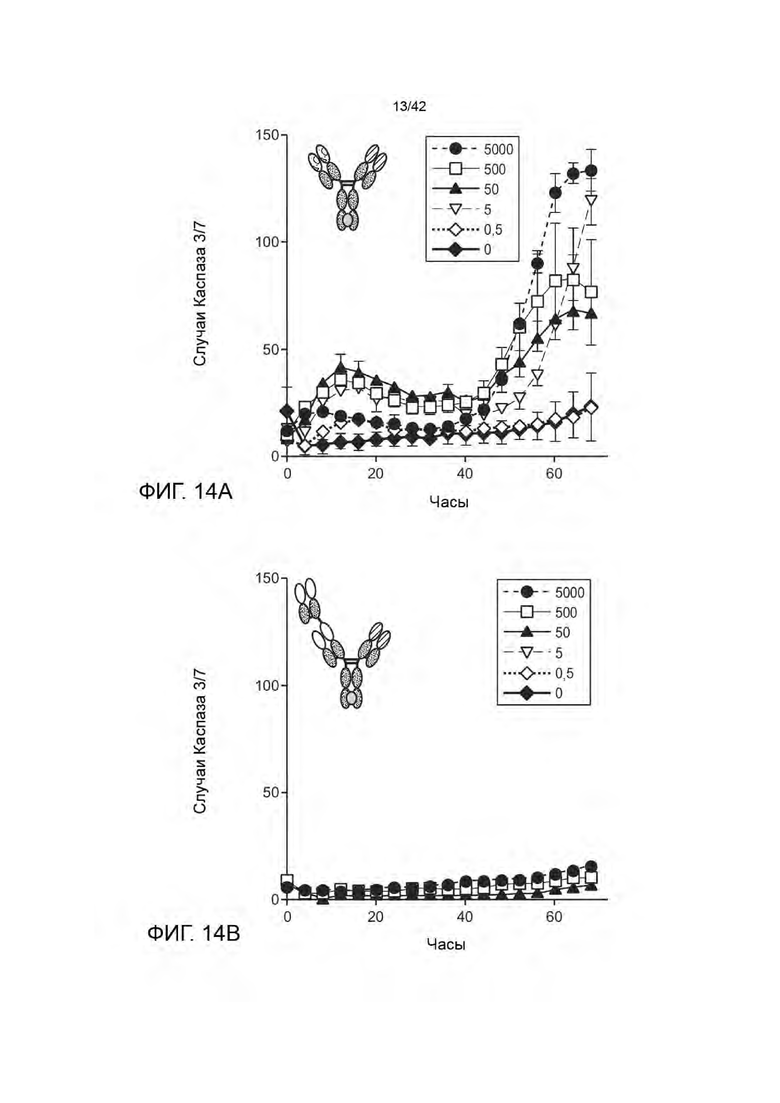
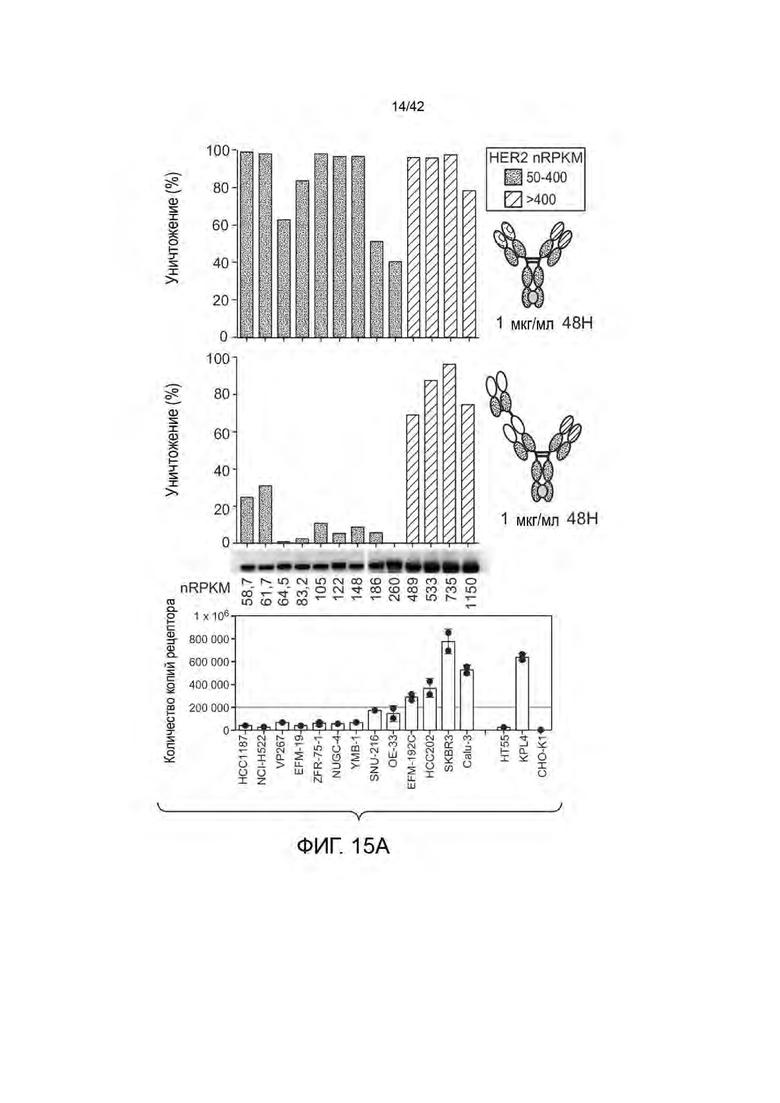
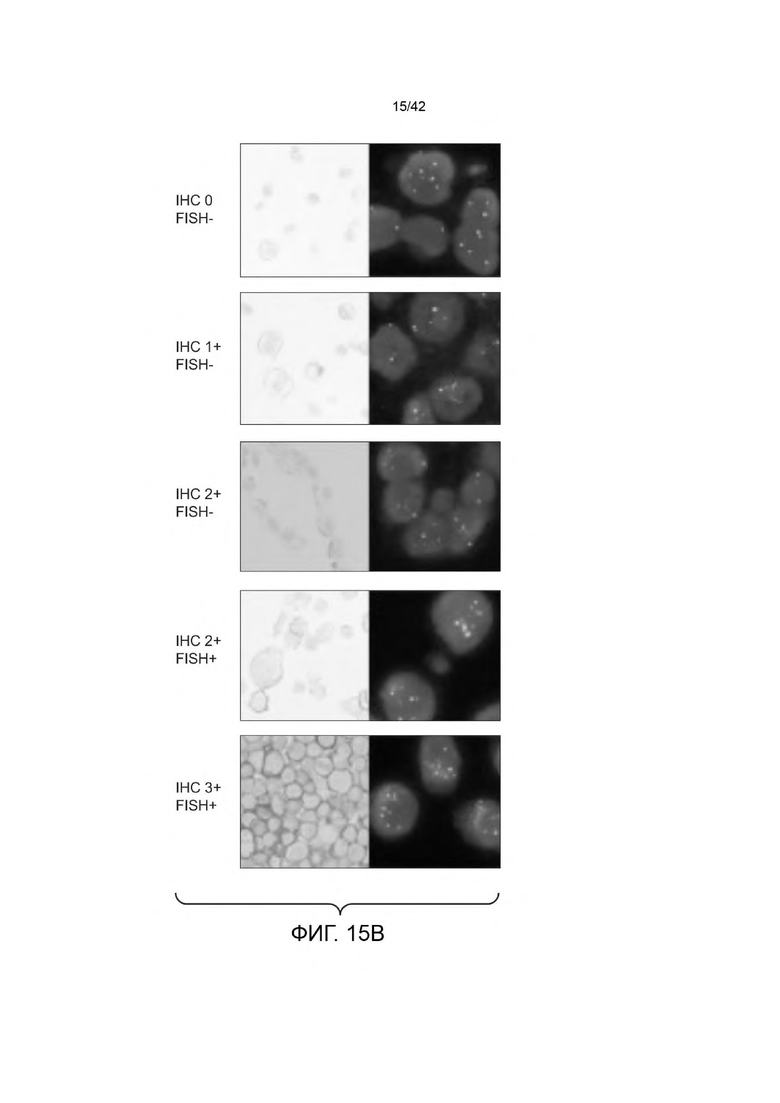

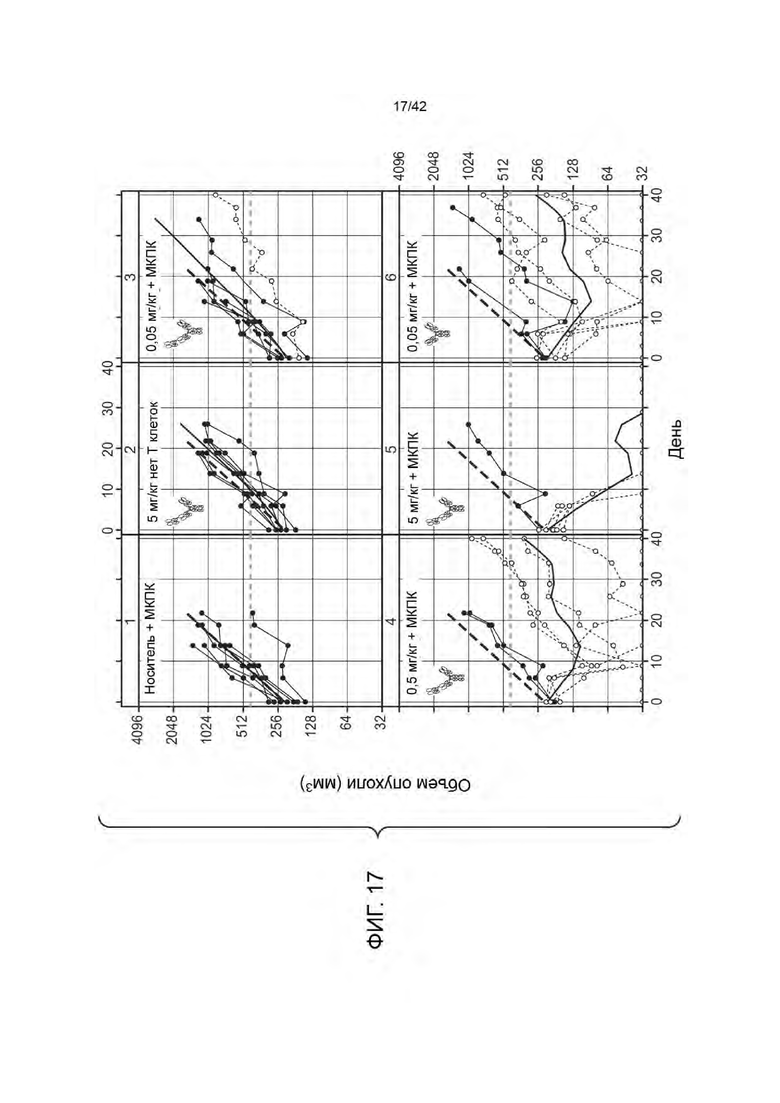
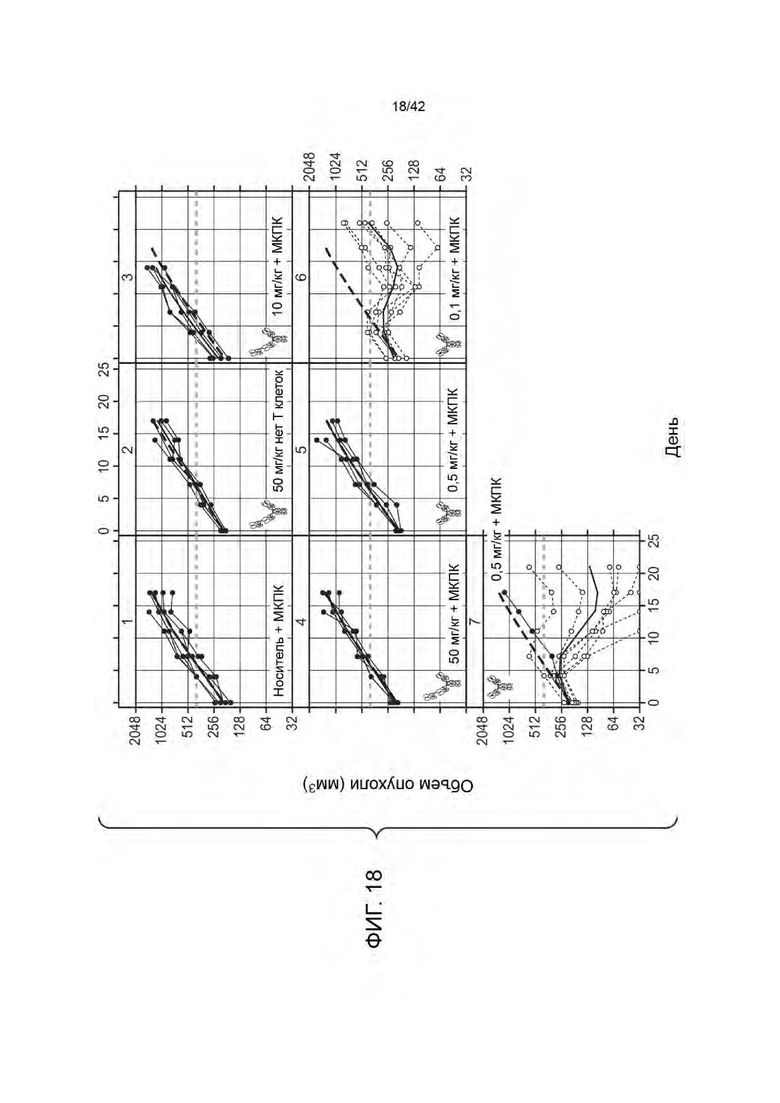
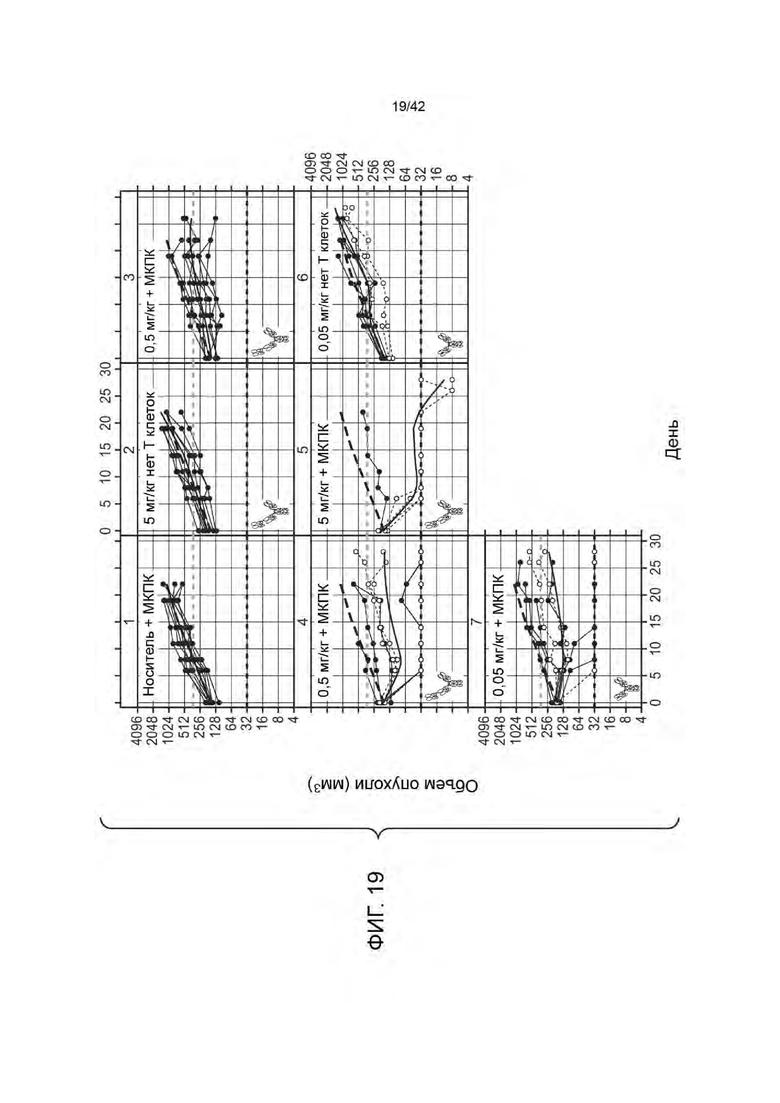
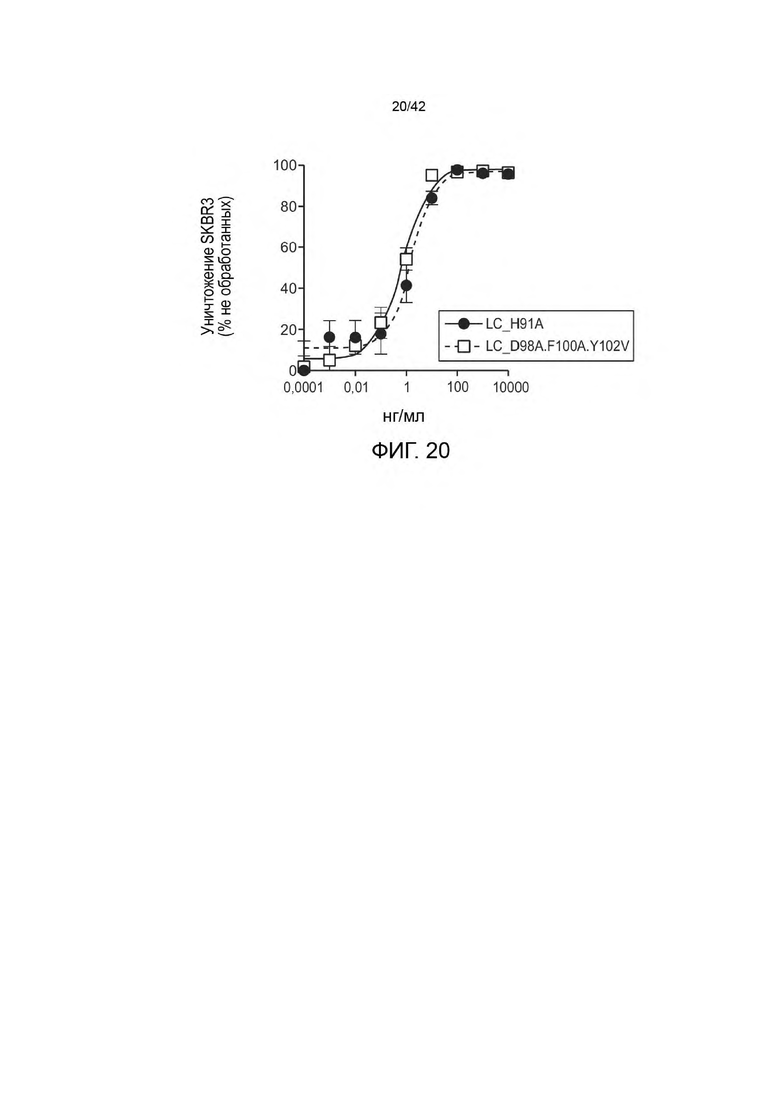
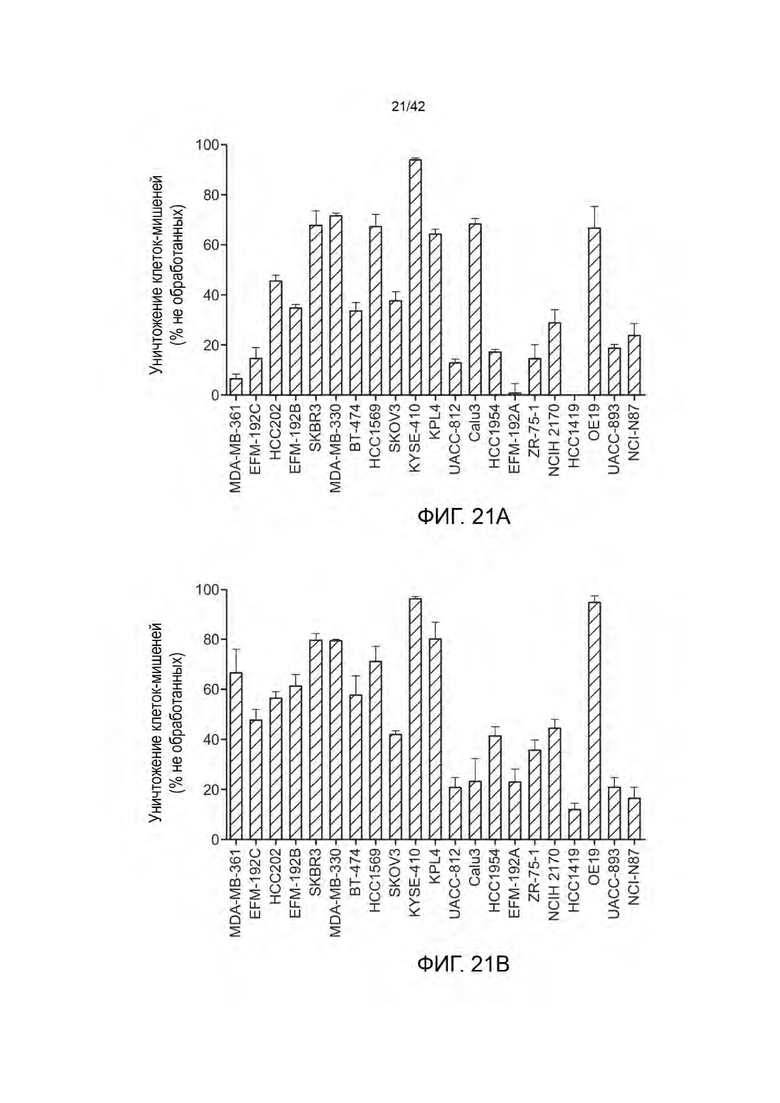
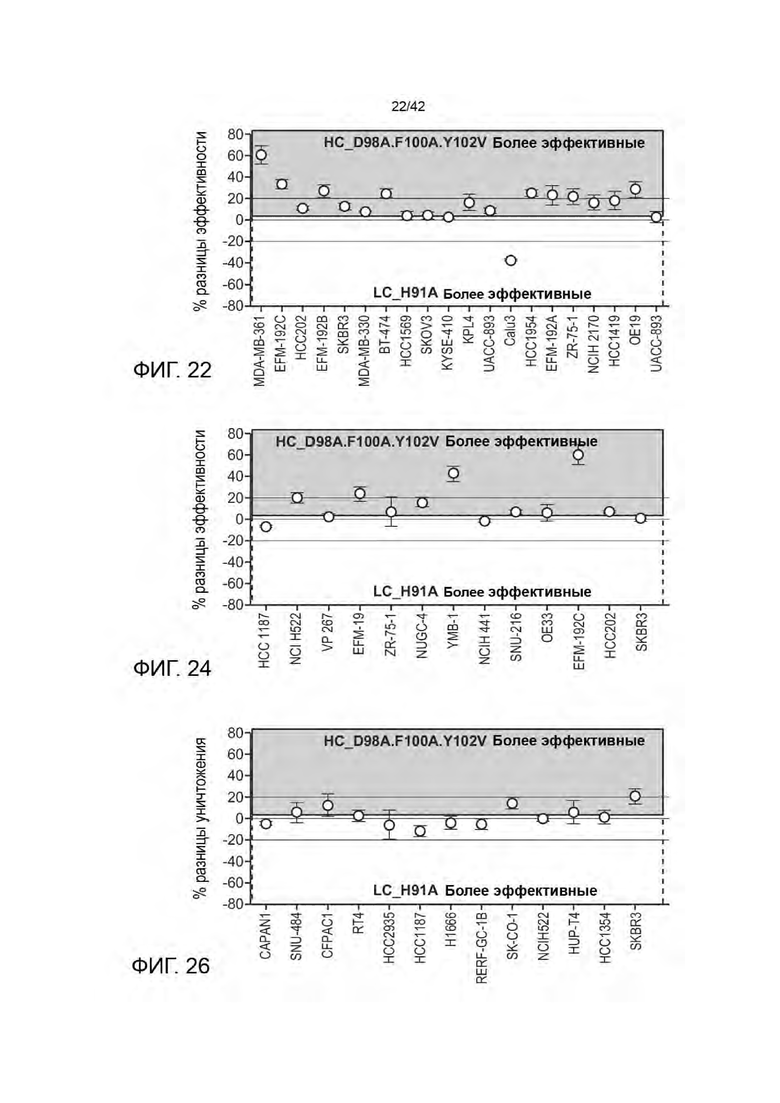
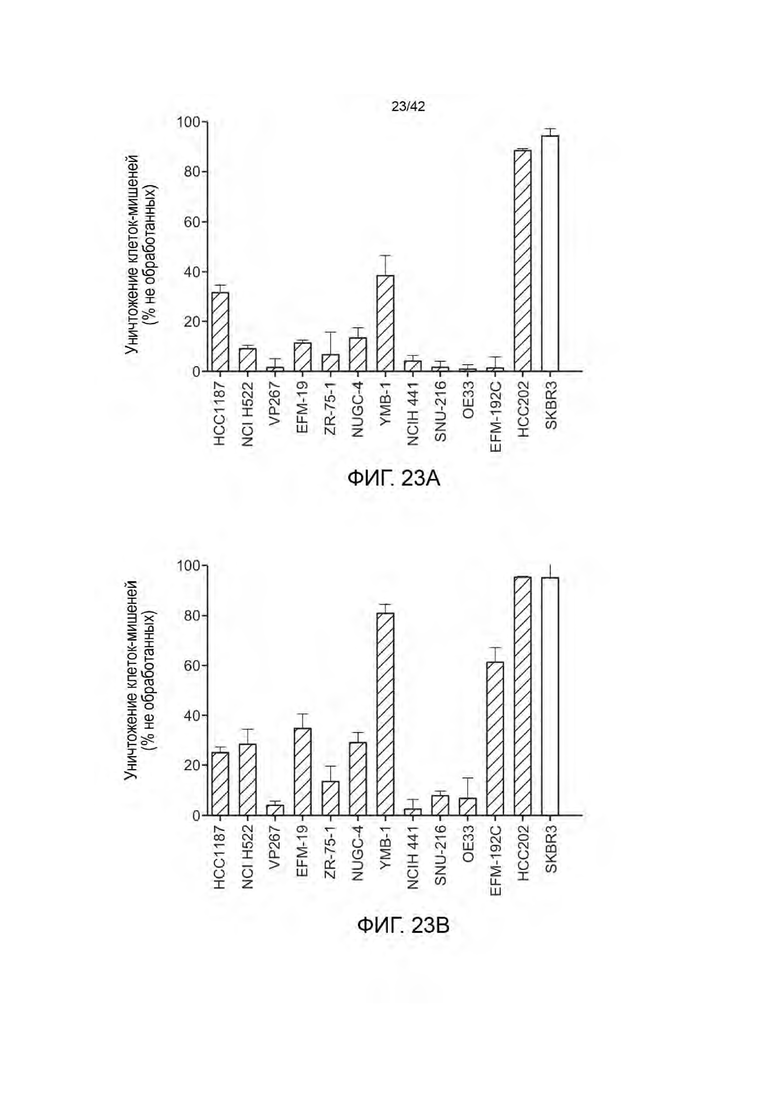
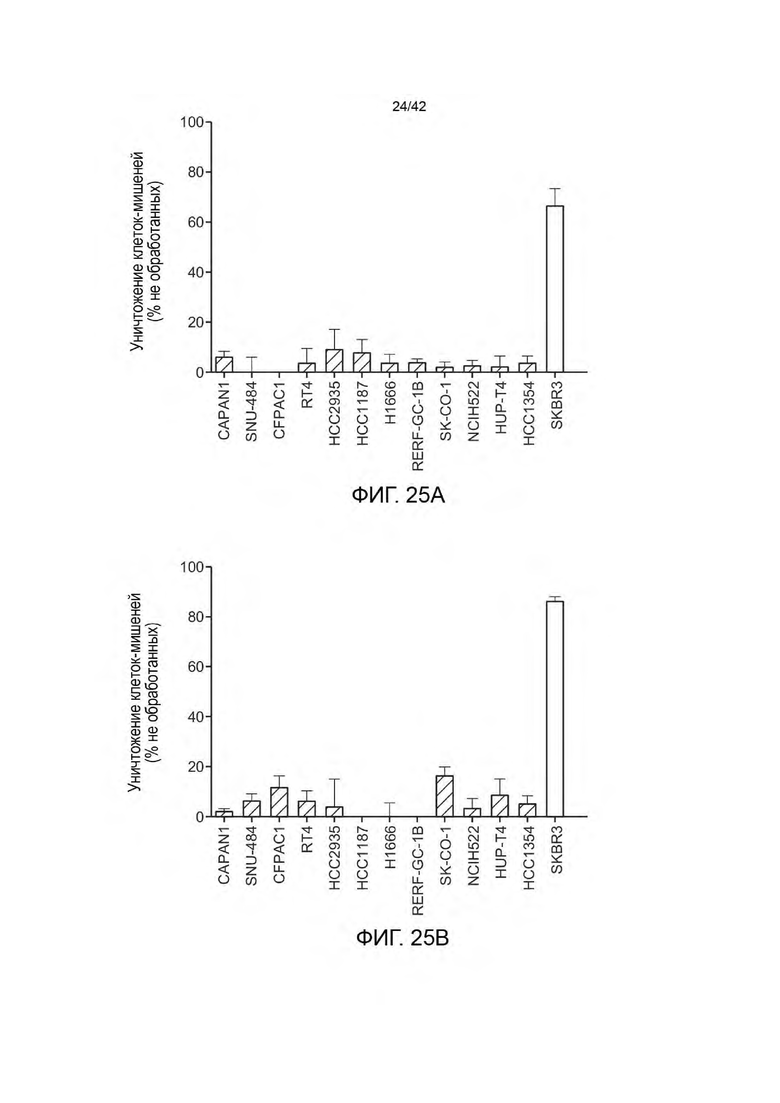
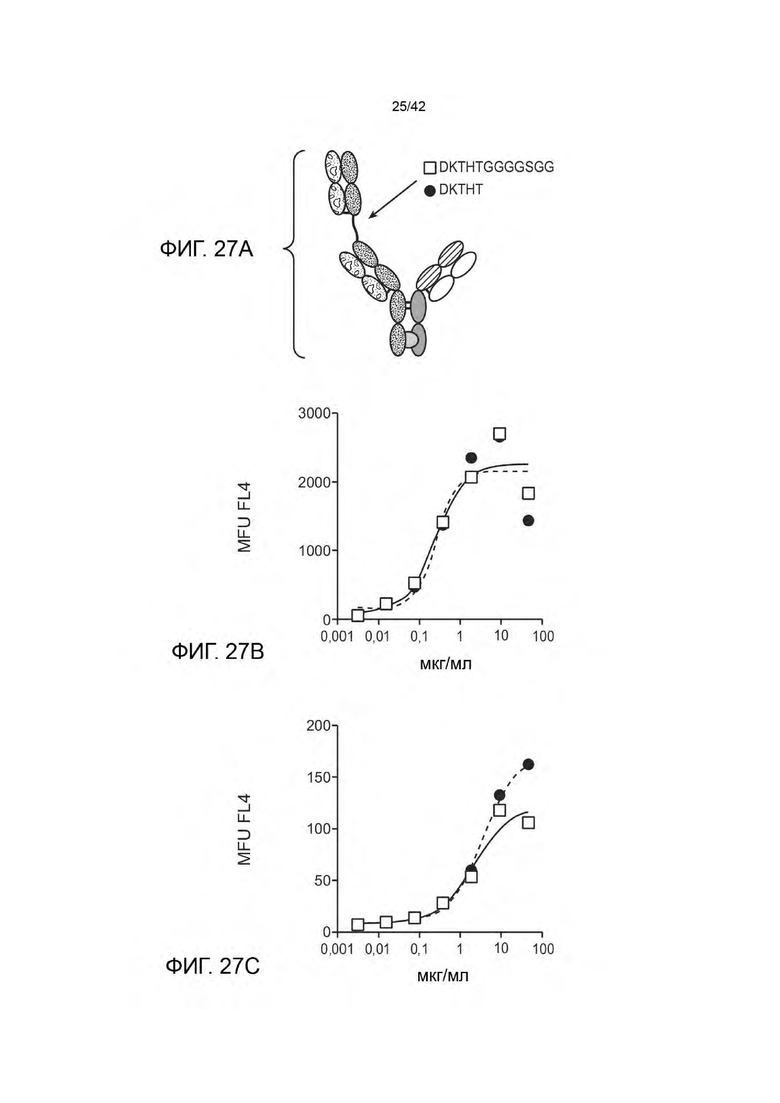
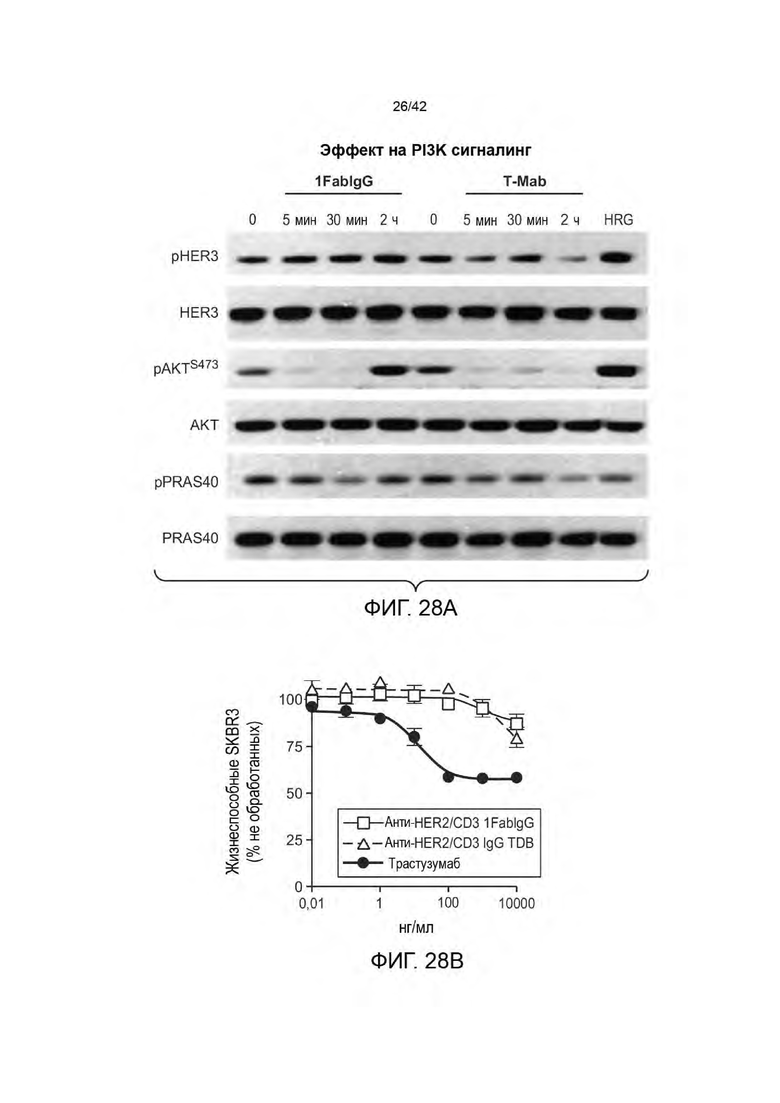

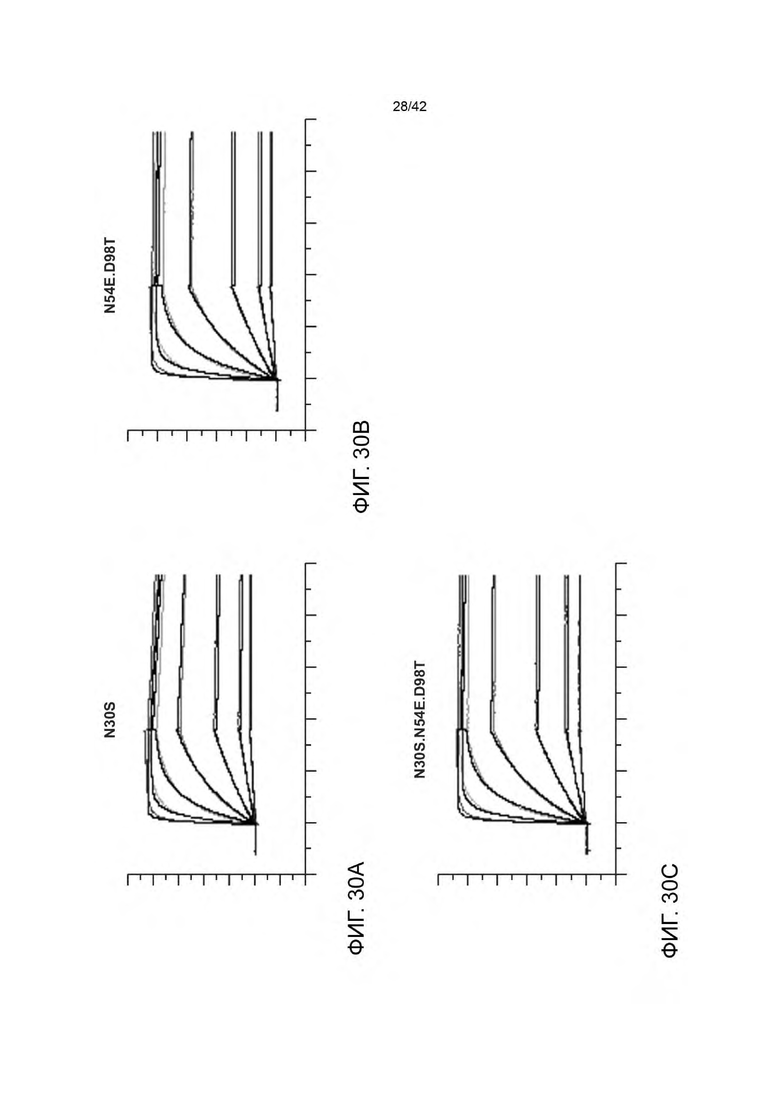
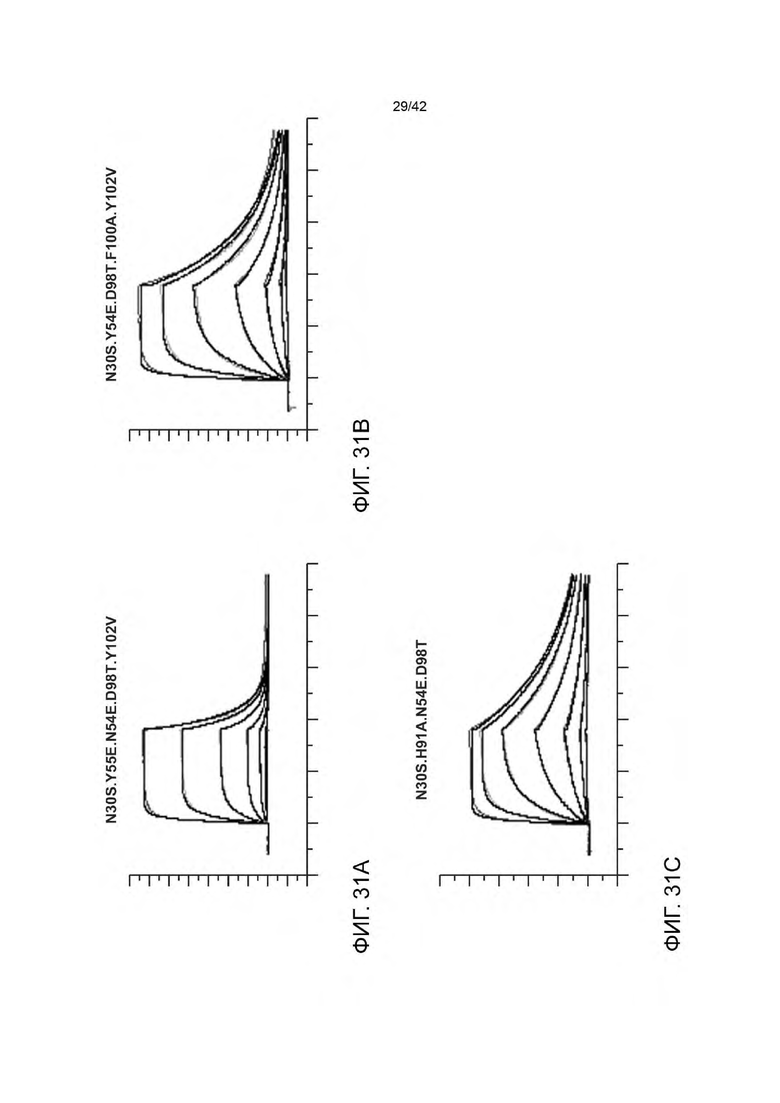

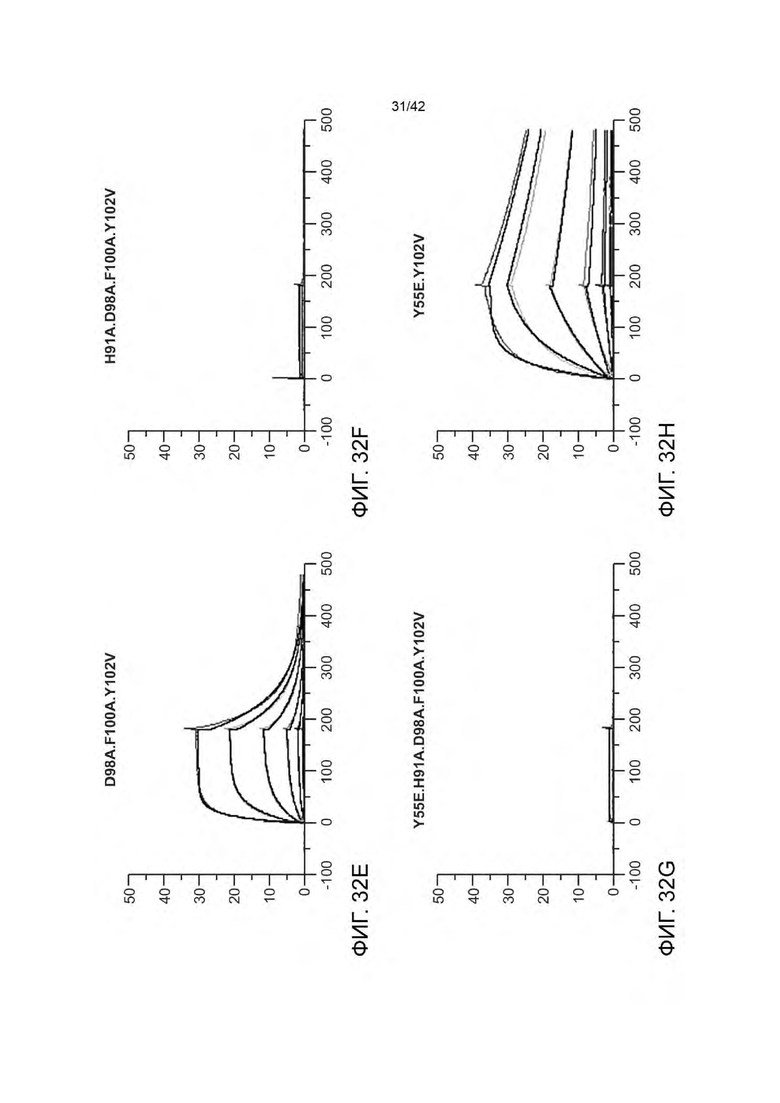
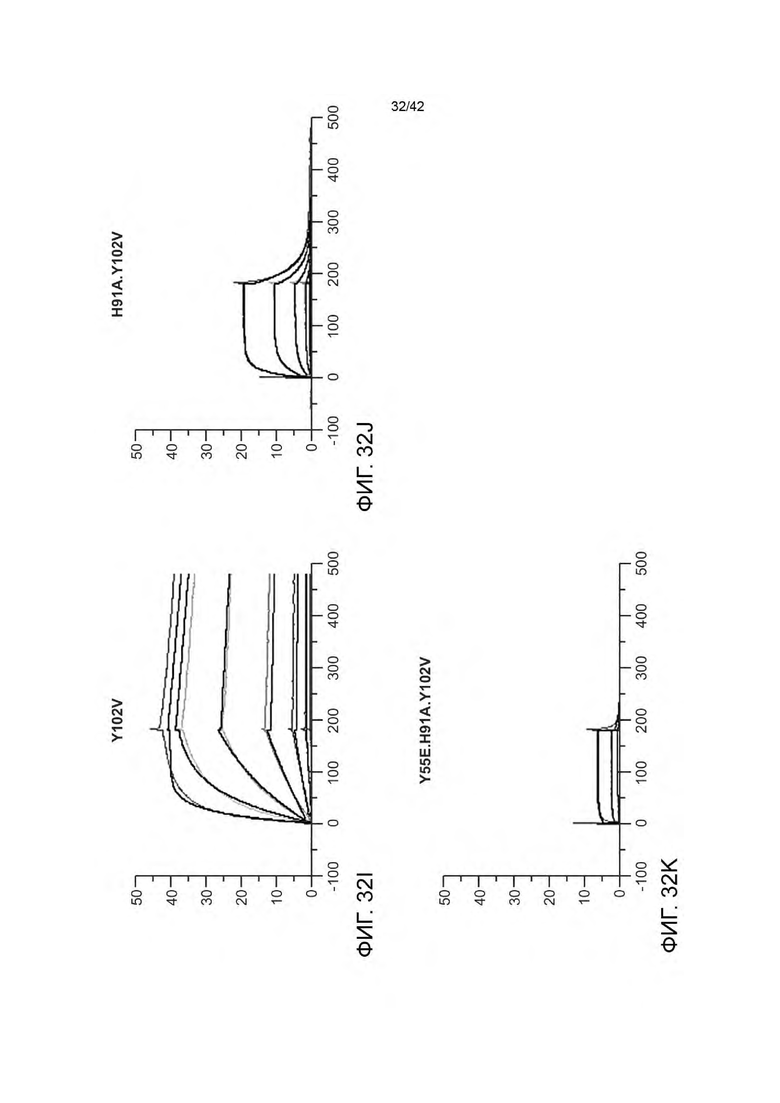
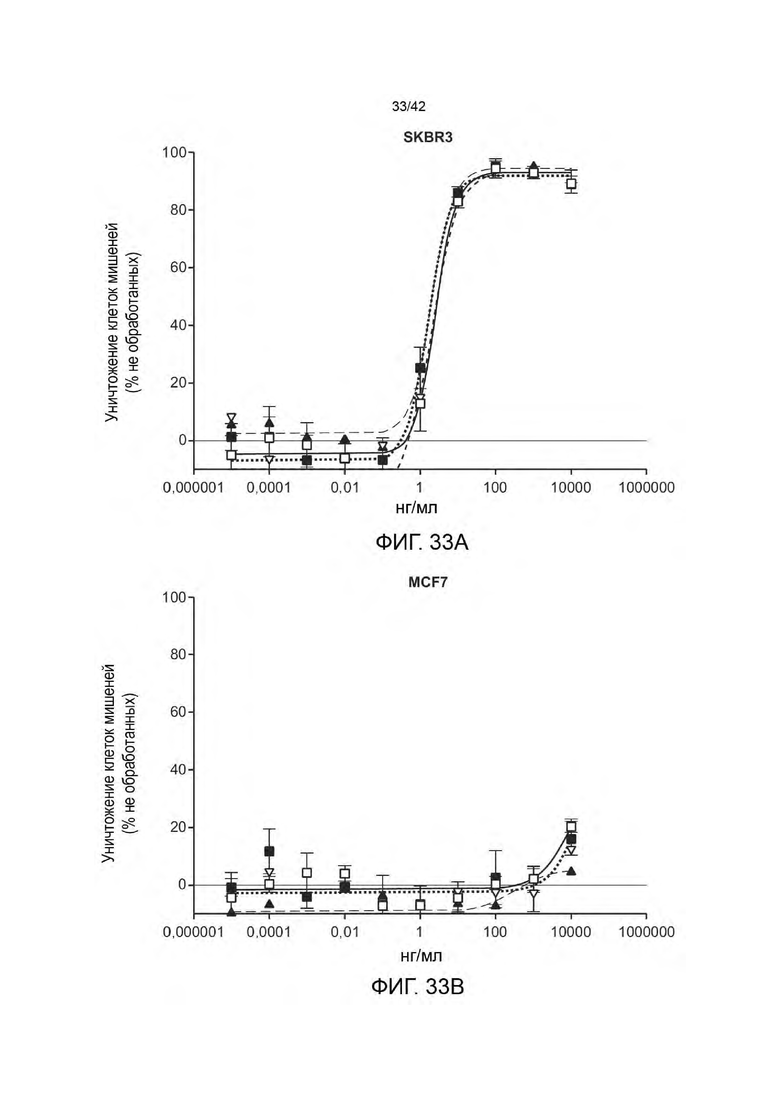
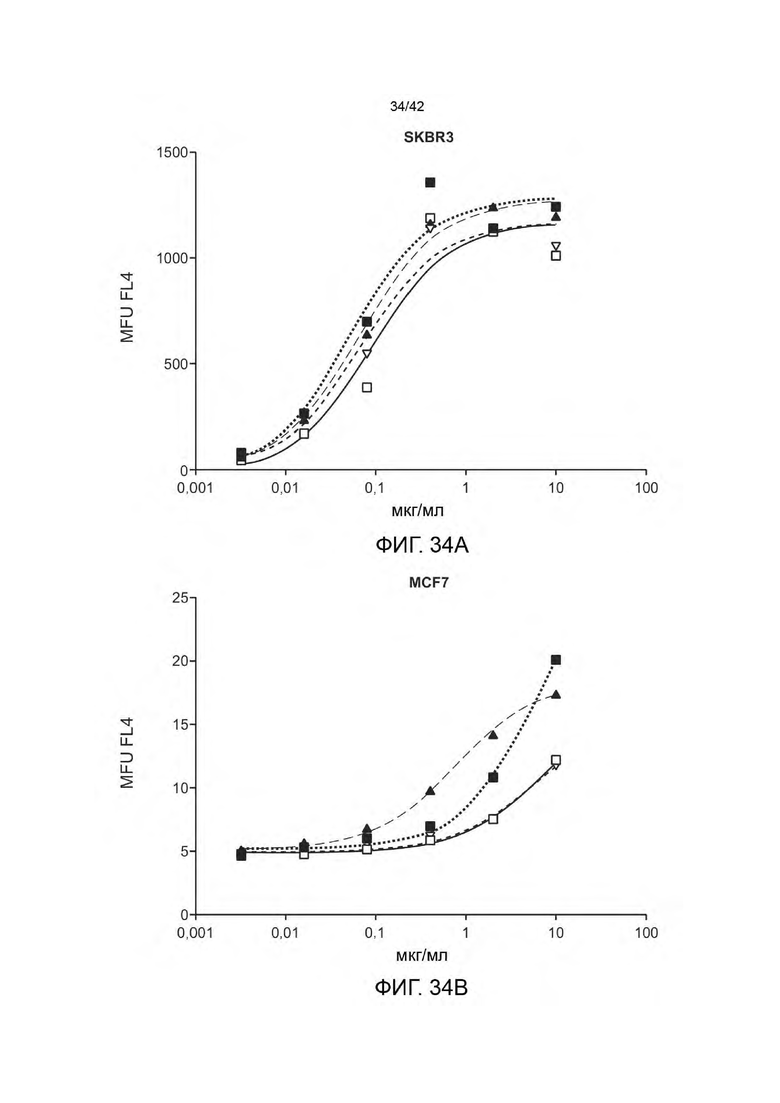
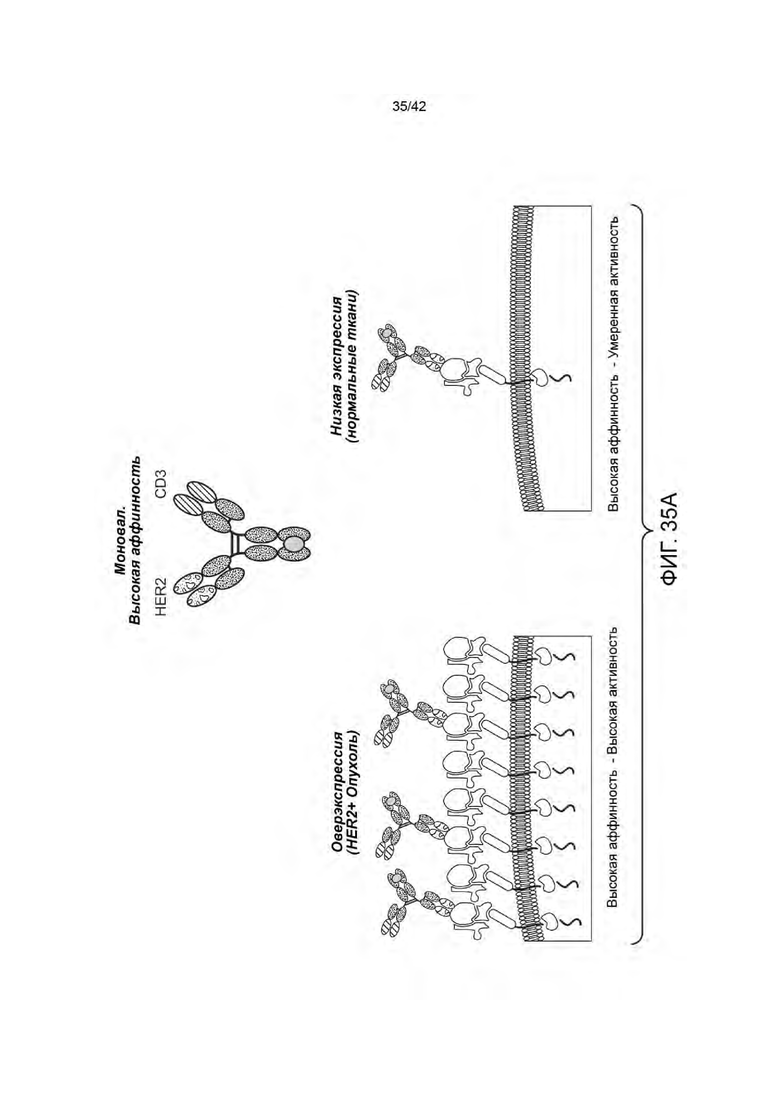
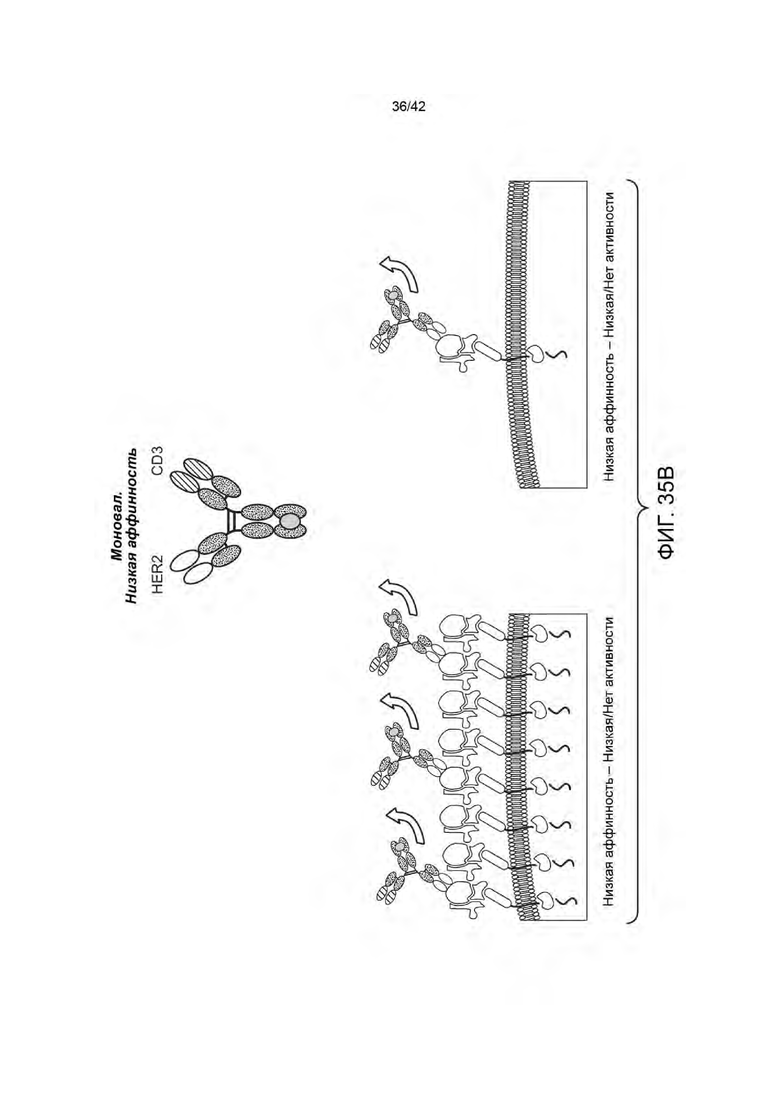
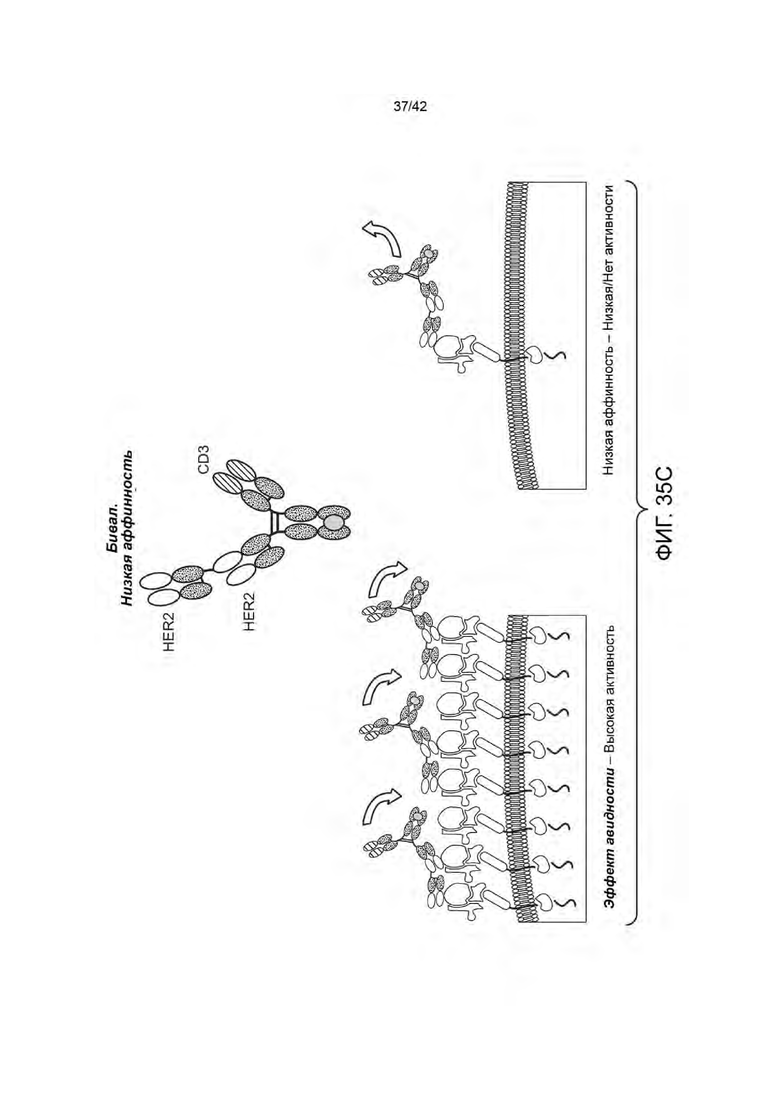
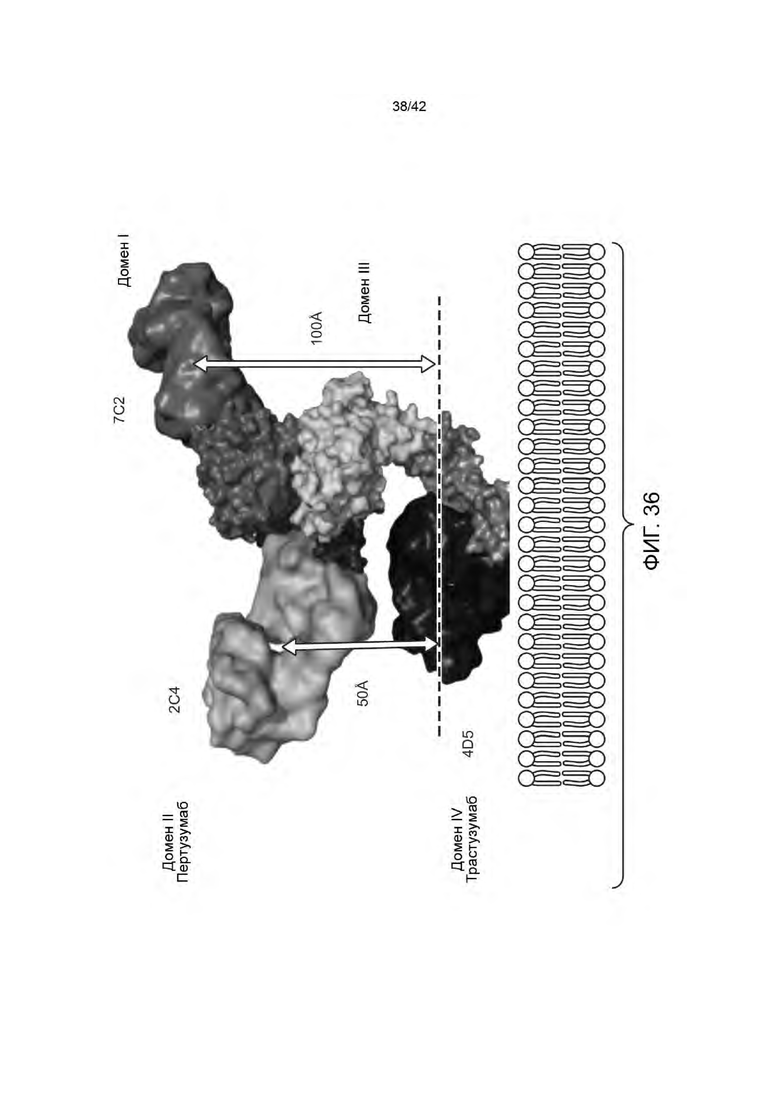
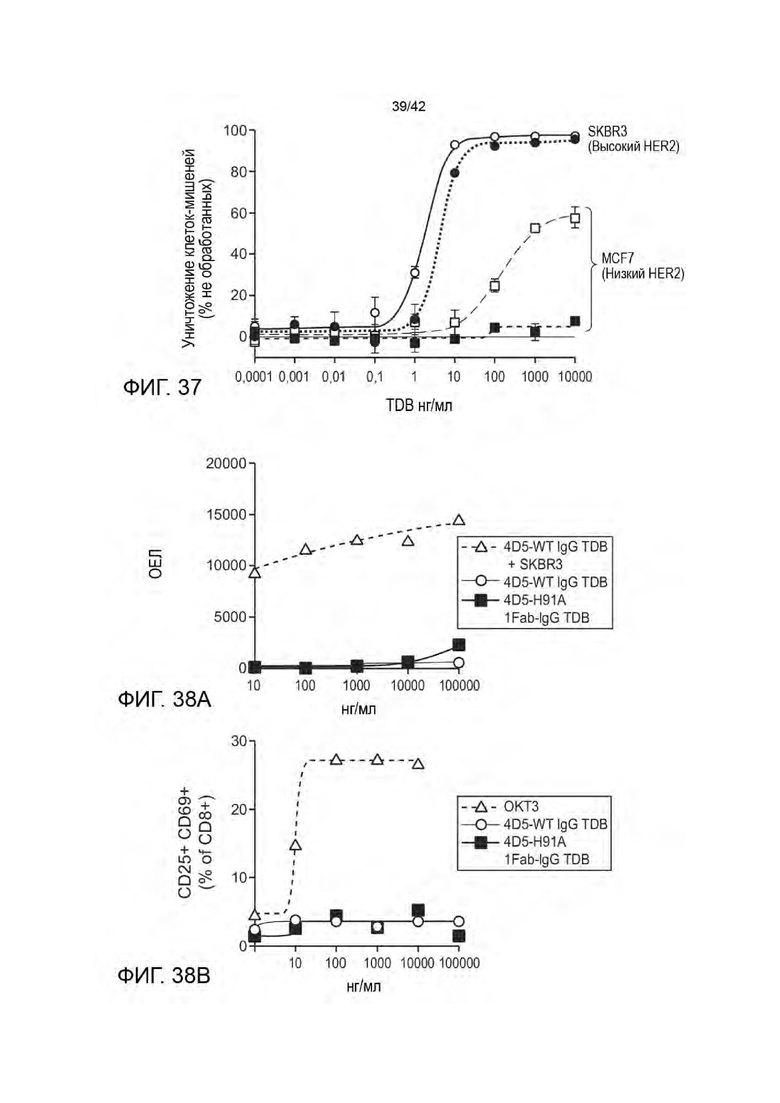
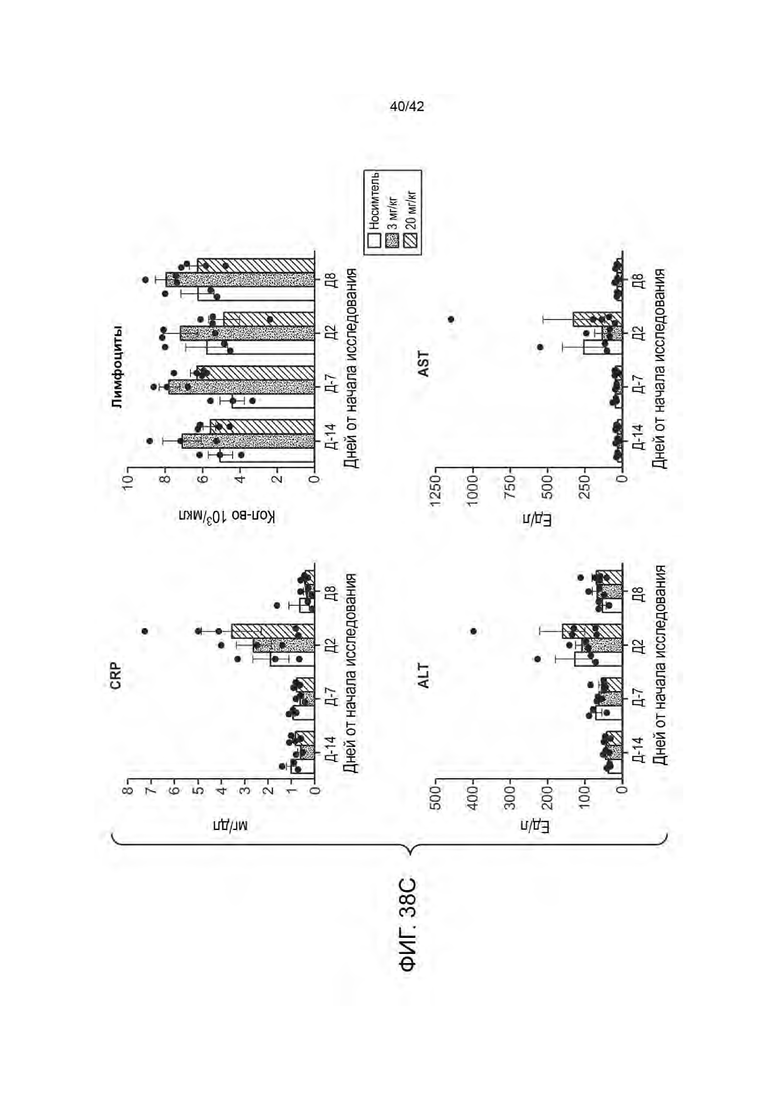
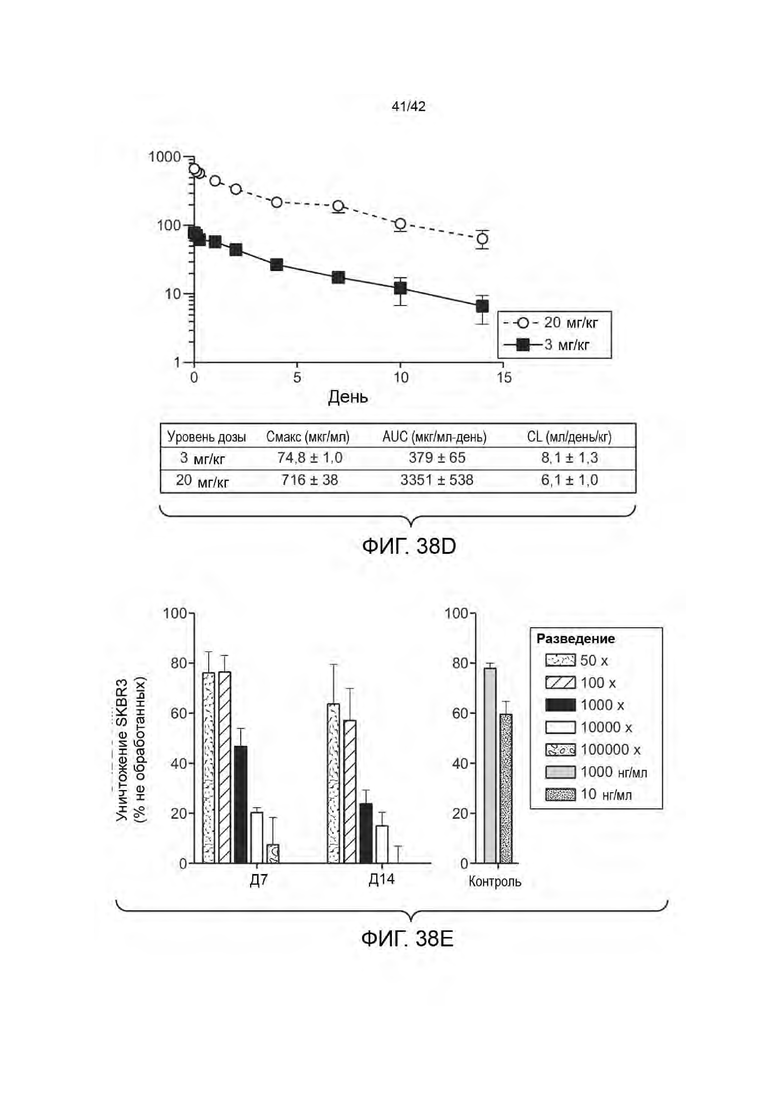
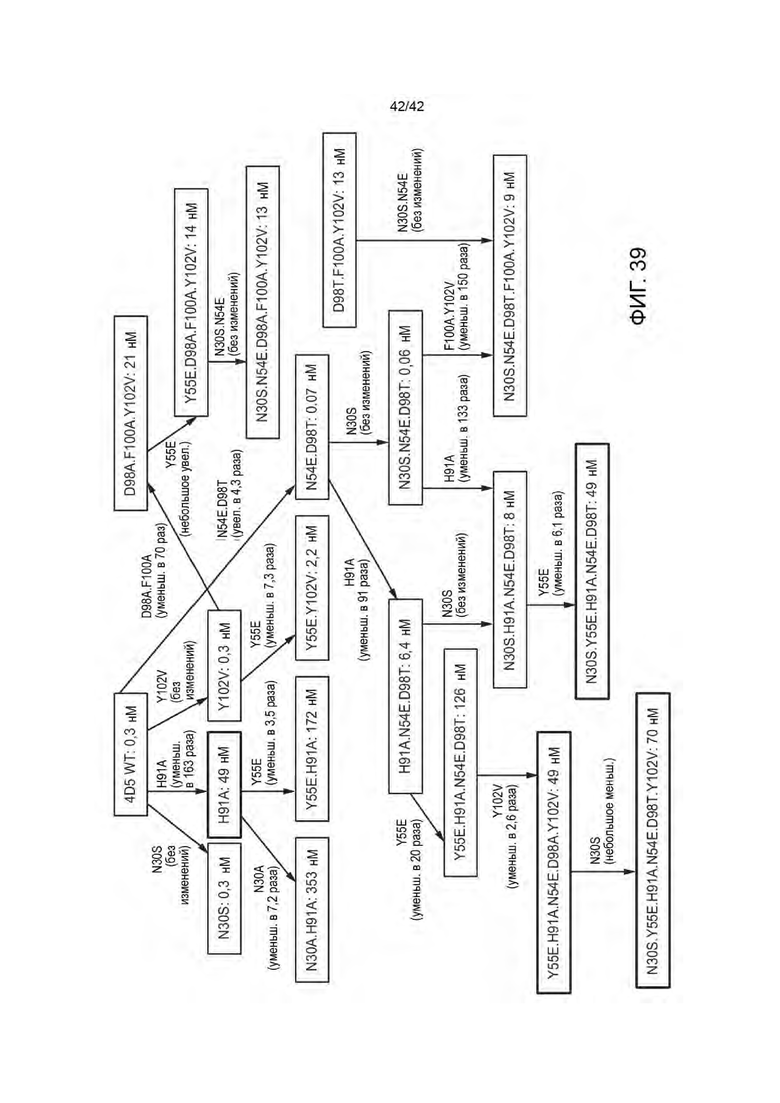
Группа изобретений относится к биотехнологии. Данное изобретение относится к биспецифичным антигенсвязывающим молекулам, имеющим моновалентное плечо, специфичное к первому антигену-мишени, такому как CD3, и бивалентное плечо, специфичное ко второму антигену-мишени, такому как HER2, способам их получения и применения. Также представлены: выделенная нуклеиновая кислота, кодирующая биспецифичную антигенсвязывающую молекулу, вектор экспрессии, клетка-хозяин для получения биспецифичной антигенсвязывающей молекулы, наборы для кодирования и получения биспецифичной антигенсвязывающей молекулы, иммуноконъюгат и композиция для лечения или замедления прогрессирования HER2-положительного рака, способ лечения или замедления прогрессирования HER2-положительного рака у субъекта, способ усиления иммунной функции у субъекта, имеющего HER2-положительнй рак и набор для лечения или замедления прогрессирования HER2-положительного рака у субъекта. Группа изобретений используется для лечения патологических состояний, таких как НЕR2-положительный рак. 20 н. и 42 з.п. ф-лы, 14 табл., 42 ил., 12 пр.
1. Биспецифичная антигенсвязывающая молекула, которая специфично связывается с CD3 и HER2, содержащая моновалентное плечо и бивалентное плечо, где:
(a) моновалентное плечо содержит FabA, где С-конец FabA слит с N-концом первой Fc-субъединицы и где FabA содержит следующие HVR:
(i) HVR-H1, содержащую аминокислотную последовательность из SEQ ID NO: 1,
(ii) HVR-H2, содержащую аминокислотную последовательность из SEQ ID NO: 2,
(iii) HVR-H3, содержащую аминокислотную последовательность из SEQ ID NO: 3,
(iv) HVR-L1, содержащую аминокислотную последовательность из SEQ ID NO: 4,
(v) HVR-L2, содержащую аминокислотную последовательность из SEQ ID NO: 5, и
(vi) HVR-L3, содержащую аминокислотную последовательность из SEQ ID NO: 6;
(b) бивалентное плечо содержит FabB1 и FabB2, где С-конец FabB2 слит с N-концом FabB1, а С-конец FabB1 слит с N-концом второй Fc-субъединицы, при этом каждый из FabB1 и FabB2 содержит следующие HVR:
(i) HVR-H1, содержащую аминокислотную последовательность из SEQ ID NO: 11,
(ii) HVR-H2, содержащую аминокислотную последовательность из SEQ ID NO: 19,
(iii) HVR-H3, содержащую аминокислотную последовательность из SEQ ID NO: 20,
(iv) HVR-L1, содержащую аминокислотную последовательность из SEQ ID NO: 21,
(v) HVR-L2, содержащую аминокислотную последовательность из SEQ ID NO: 22, и
(vi) HVR-L3, содержащую аминокислотную последовательность из SEQ ID NO: 26; и
(c) первая Fc-субъединица связывается со второй Fc-субъединицей с образованием Fc-домена.
2. Биспецифичная антигенсвязывающая молекула по п. 1, отличающаяся тем, что:
(a) FabA содержит VHA-область и VLA-область, при этом VHA-область содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности с SEQ ID NO: 7, и VLA-область содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности с SEQ ID NO: 8;
(b) FabB1 содержит VHB1-область и VLB1-область, при этом VHB1-область содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности с SEQ ID NO: 24, и VLB1-область содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности с SEQ ID NO: 27; и
(c) FabB2 содержит VHB2-область и VLB2-область, при этом указанная VHB2-область содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности с SEQ ID NO: 24, и VLB2-область содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности с SEQ ID NO: 27.
3. Биспецифичная антигенсвязывающая молекула по п. 2, отличающаяся тем, что:
(a) VHA-область содержит аминокислотную последовательность из SEQ ID NO: 7 и VLA-область содержит аминокислотную последовательность из SEQ ID NO: 8;
(b) VHB1-область содержит аминокислотную последовательность из SEQ ID NO: 24 и VLB1-область содержит аминокислотную последовательность из SEQ ID NO: 27; и
(c) VHB2-область содержит аминокислотную последовательность из SEQ ID NO: 24 и VLB2-область содержит аминокислотную последовательность из SEQ ID NO: 27.
4. Биспецифичная антигенсвязывающая молекула, которая специфично связывается с CD3 и HER2, содержащая моновалентное плечо и бивалентное плечо, при этом:
(a) моновалентное плечо содержит FabA, при этом С-конец указанного FabA слит с N-концом первой Fc-субъединицы, и при этом FabA содержит следующие HVR:
(i) HVR-H1, содержащую аминокислотную последовательность из SEQ ID NO: 1,
(ii) HVR-H2, содержащую аминокислотную последовательность из SEQ ID NO: 2,
(iii) HVR-H3, содержащую аминокислотную последовательность из SEQ ID NO: 3,
(iv) HVR-L1, содержащую аминокислотную последовательность из SEQ ID NO: 4,
(v) HVR-L2, содержащую аминокислотную последовательность из SEQ ID NO: 5, и
(vi) HVR-L3, содержащую аминокислотную последовательность из SEQ ID NO: 6;
(b) бивалентное плечо содержит FabB1 и FabB2, при этом С-конец FabB2 слит с N-концом FabB1 и С-конец FabB1 слит с N-концом второй Fc-субъединицы, при этом каждый из FabB1 и FabB2 содержат следующие HVR:
(i) HVR-H1, содержащую аминокислотную последовательность из SEQ ID NO: 11,
(ii) HVR-H2, содержащую аминокислотную последовательность из SEQ ID NO: 36,
(iii) HVR-H3, содержащую аминокислотную последовательность из SEQ ID NO: 37,
(iv) HVR-L1, содержащую аминокислотную последовательность из SEQ ID NO: 38,
(v) HVR-L2, содержащую аминокислотную последовательность из SEQ ID NO: 29, и
(vi) HVR-L3, содержащую аминокислотную последовательность из SEQ ID NO: 26; и
(c) первая Fc-субъединица связывается со второй Fc-субъединицей с образованием Fc-домена.
5. Биспецифичная антигенсвязывающая молекула по п. 4, отличающаяся тем, что:
(a) FabA содержит VHA-область и VLA-область, при этом VHA-область содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности с SEQ ID NO: 7, и VLA-область содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности с SEQ ID NO: 8;
(b) FabB1 содержит VHB1-область и VLB1-область, при этом VHB1-область содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности с SEQ ID NO: 41, и VLB1-область содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности с SEQ ID NO: 49; и
(c) FabB2 содержит VHB2-область и VLB2-область, при этом VHB2-область содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности с SEQ ID NO: 41, и VLB2-область содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности с SEQ ID NO: 49.
6. Биспецифичная антигенсвязывающая молекула по п. 5, отличающаяся тем, что:
(a) VHA-область содержит аминокислотную последовательность из SEQ ID NO: 7 и VLA-область содержит аминокислотную последовательность из SEQ ID NO: 8;
(b) VHB1-область содержит аминокислотную последовательность из SEQ ID NO: 41 и VLB1-область содержит аминокислотную последовательность из SEQ ID NO: 49; и
(c) VHB2-область содержит аминокислотную последовательность из SEQ ID NO: 41 и VLB2-область содержит аминокислотную последовательность из SEQ ID NO: 49.
7. Биспецифичная антигенсвязывающая молекула по любому из пп. 1-6, отличающаяся тем, что Fc-домен представляет собой Fc-домен IgG.
8. Биспецифичная антигенсвязывающая молекула по п. 7, отличающаяся тем, что домен IgG Fc представляет собой IgG1 или IgG4 Fc-домен.
9. Биспецифичная антигенсвязывающая молекула по любому из пп. 1-8, отличающаяся тем, что Fc-домен представляет собой Fc-домен человека.
10. Биспецифичная антигенсвязывающая молекула по любому из пп. 1-9, отличающаяся тем, что Fc-домен содержит одну или несколько аминокислотных замен, которые уменьшают связывание с Fc-рецептором и/или эффекторную функцию.
11. Биспецифичная антигенсвязывающая молекула по п. 10, отличающаяся тем, что одна или несколько аминокислотных замен, которые уменьшают связывание с Fc-рецептором и/или эффекторную функцию, находятся в N297.
12. Биспецифичная антигенсвязывающая молекула по п.11, отличающаяся тем, что каждая из первой и второй Fc-субъединицы содержит аминокислотную замену N297G.
13. Биспецифичная антигенсвязывающая молекула по п.10, отличающаяся тем, что одна или несколько аминокислотных замен, которые уменьшают связывание с Fc-рецептором и/или эффекторную функцию, выбраны из группы, состоящей из L234, L235 и P329.
14. Биспецифичная антигенсвязывающая молекула по п.13, где каждая из первой и второй Fc-субъединицы содержит аминокислотную замену, выбранную из группы, состоящей из L234A, L235A и P329G.
15. Биспецифичная антигенсвязывающая молекула по любому из пп. 1-14, отличающаяся тем, что Fc-домен содержит модификацию, выполненную для способствования ассоциации первой Fc-субъединицы со второй Fc-субъединицей, и где аминокислотный остаток в CH3-домене второй Fc-субъединицы заменен на аминокислотный остаток, имеющий больший объем боковой цепи, тем самым создавая выпуклость в пределах CH3-домена второй Fc-субъединицы, которая может быть расположена в полости в пределах CH3-домена первой Fc-субъединицы, а также аминокислотный остаток в CH3-домене первой Fc-субъединицы заменен на аминокислотный остаток, имеющий меньший объем боковой цепи, тем самым формируя полость внутри СН3-домена первой Fc-субъединицы, в пределах которого может разместиться выпуклость в домене CH3 второй Fc-субъединицы.
16. Биспецифичная антигенсвязывающая молекула по п. 15, отличающаяся тем, что СН3-домен второй Fc-субъединицы содержит аминокислотную замену T366 и СН3-домен первой Fc-субъединицы содержит аминокислотные замены в одном, двух или всех трех из T366, L368 и/или Y407.
17. Биспецифичная антигенсвязывающая молекула по п. 16, отличающаяся тем, что СН3-домен второй Fc-субъединицы содержит аминокислотную замену T366W и СН3-домен первой Fc-субъединицы содержит одну, две или все три аминокислотных замены T366S, L368A и/или Y407V.
18. Биспецифичная антигенсвязывающая молекула по любому из пп. 1-17, отличающаяся тем, что С-конец третьего антигенсвязывающего фрагмента слит с N-концом второго антигенсвязывающего фрагмента с помощью пептидного линкера.
19. Биспецифичная антигенсвязывающая молекула по п. 18, отличающаяся тем, что длина пептидного линкера составляет от 5 до 20 аминокислот.
20. Биспецифичная антигенсвязывающая молекула по п. 18, отличающаяся тем, что длина пептидного линкера составляет от 5 до 20 аминокислот и он содержит аминокислотную последовательность из SEQ ID NO: 50.
21. Выделенная нуклеиновая кислота, кодирующая биспецифичную антигенсвязывающую молекулу, которая специфично связывается с CD3 и HER2, по пп. 1-20.
22. Вектор экспрессии, содержащий выделенную нуклеиновую кислоту по п. 21.
23. Клетка-хозяин для получения биспецифичной антигенсвязывающей молекулы по пп. 1-20, содержащая выделенную нуклеиновую кислоту по п. 21 или вектор экспрессии по п. 22.
24. Клетка-хозяин по п. 23, отличающаяся тем, что клетка-хозяин представляет собой клетку млекопитающего.
25. Клетка-хозяин по п. 24, отличающаяся тем, что клетка млекопитающего представляет собой клетку яичника китайского хомячка (СНО).
26. Клетка-хозяин по п. 23, отличающаяся тем, что клетка-хозяин представляет собой прокариотическую клетку.
27. Клетка-хозяин по п. 26, отличающаяся тем, что прокариотическая клетка представляет собой клетку E. coli.
28. Способ получения биспецифичной антигенсвязывающей молекулы по любому из пп. 1-20, который включает культивирование клетки-хозяина по любому из пп. 23-27 в культуральной среде.
29. Способ по п. 28, который дополнительно включает извлечение биспецифичной антигенсвязывающей молекулы из клетки-хозяина или культуральной среды.
30. Набор для кодирования биспецифичной антигенсвязывающей молекулы, которая специфично связывается с CD3 и HER2, по любому из пп. 1-20, содержащий выделенную нуклеиновую кислоту по п. 21.
31. Набор для кодирования биспецифичной антигенсвязывающей молекулы, которая специфично связывается с CD3 и HER2, по любому из пп. 1-20, содержащий векторы экспрессии, в котором каждый вектор экспрессии из набора содержит выделенную нуклеиновую кислоту по п. 21.
32. Набор для получения биспецифичной антигенсвязывающей молекулы, которая специфично связывается с CD3 и HER2, по любому из пп. 1-20, содержащий клетки-хозяева, при этом каждая клетка-хозяин набора содержит выделенную нуклеиновую кислоту по п. 21 или вектор экспрессии по п. 22.
33. Набор по п. 32, отличающийся тем, что клетки-хозяева включают клетки млекопитающих или прокариотические клетки.
34. Набор по п. 33, отличающийся тем, что указанные клетки млекопитающих представляют собой клетки СНО или указанные прокариотические клетки представляют собой клетки E. coli.
35. Способ получения биспецифичной антигенсвязывающей молекулы по любому из пп. 1-20, который включает культивирование набора клеток-хозяев по пп. 32-34 в культуральной среде.
36. Способ по п. 35, который дополнительно включает извлечение биспецифичной антигенсвязывающей молекулы из набора клеток-хозяев или культуральной среды.
37. Иммуноконъюгат для лечения или замедления прогрессирования HER2-положительного рака, содержащий биспецифичную антигенсвязывающую молекулу по любому из пп. 1-20 и цитотоксический агент.
38. Композиции для лечения или замедления прогрессирования HER2-положительного рака, содержащая эффективное количество биспецифичной антигенсвязывающей молекулы по любому из пп. 1-20 и фармацевтически приемлемый носитель, вспомогательное вещество или разбавитель.
39. Композиция по п. 38, отличающаяся тем, что композиция дополнительно содержит антагонист связывания оси PD-1 или дополнительный терапевтический агент.
40. Применение биспецифичной антигенсвязывающей молекулы по любому из пп. 1-20 в производстве лекарственного средства для лечения или замедления прогрессирования HER2-положительного рак у субъекта, нуждающегося в этом, или для усиления иммунной функции у субъекта, имеющего HER2-положительный рак.
41. Применение по п. 40, в котором HER2-положительный рак характеризуется опухолевыми клетками, которые экспрессируют HER2 в среднем количестве 200000 или более копий на клетку.
42. Применение по п. 40 или 41, в котором HER2-положительный рак выбран из группы, состоящей из рака молочной железы, рака желудка, колоректального рака, немелкоклеточного рака легкого, рака почки, рака мочевого пузыря, рака поджелудочной железы, рака предстательной железы, рака печени, рака головы и шеи, меланомы, рака яичников, мезотелиомы, глиобластомы, рака эндометрия и остеосаркомы.
43. Биспецифичная антигенсвязывающая молекула по любому из пп. 1-20 для применения при лечении или замедлении прогрессирования HER2-положительного рака у субъекта, нуждающегося в этом, или в повышении иммунной функции у субъекта, имеющего HER2-положительный рак.
44. Биспецифичная антигенсвязывающая молекула для применения по п. 43, отличающаяся тем, что HER2-положительный рак характеризуется опухолевыми клетками, которые экспрессируют HER2 в среднем количестве 200000 или более копий на клетку.
45. Биспецифичная антигенсвязывающая молекула для применения по п. 43 или 44, отличающаяся тем, что HER2-положительный рак выбран из группы, состоящей из рака молочной железы, рака желудка, колоректального рака, немелкоклеточного рака легкого, рака почки, рака мочевого пузыря, рака поджелудочной железы, рака предстательной железы, рака печени, рака головы и шеи, меланомы, рака яичников, мезотелиомы, глиобластомы, рака эндометрия и остеосаркомы.
46. Способ лечения или замедления прогрессирования HER2-положительного рака у субъекта, нуждающегося в этом, при этом способ включает введение субъекту биспецифичной антигенсвязывающей молекулы по любому из пп. 1-20.
47. Способ усиления иммунной функции у субъекта, имеющего HER2-положительный рак, который включает введение субъекту биспецифичной антигенсвязывающей молекулы по любому из пп. 1-20.
48. Способ по п. 46 или 47, в котором HER2-положительный рак характеризуется опухолевыми клетками, которые экспрессируют HER2 в среднем количестве 200000 или более копий на клетку.
49. Способ по любому из пп. 46-48, отличающийся тем, что HER2-положительный рак выбран из группы, состоящей из рака молочной железы, рака желудка, колоректального рака, немелкоклеточного рака легкого, рака почки, рака мочевого пузыря, рака поджелудочной железы, рака предстательной железы, рака печени, рака головы и шеи, меланомы, рака яичников, мезотелиомы, глиобластомы, рака эндометрия и остеосаркомы.
50. Способ по любому из пп. 46-49, в котором биспецифичную антигенсвязывающую молекулу вводят в дозе от 0,01 до 10 мг/кг, от 0,1 до 10 мг/кг или 1 мг/кг.
51. Способ по любому из пп. 46-50, отличающийся тем, что биспецифичную антигенсвязывающую молекулу вводят совместно с антагонистом связывания оси PD-1 и/или дополнительным терапевтическим агентом.
52. Способ по п. 51, в котором антагонист связывания оси PD-1 или дополнительный терапевтический агент вводят одновременно с, до или после введения биспецифичной антигенсвязывающей молекулы.
53. Способ по п. 51 или 52, в котором антагонист связывания оси PD-1, выбран из группы, состоящей из антагониста связывания PD-L1, антагониста связывания PD-1 и антагониста связывания PD-L2.
54. Способ по п. 53, в котором антагонист связывания оси PD-1, представляет собой:
(i) антагонист связывания PD-1, выбранный из группы, состоящей из MDX 1106 (ниволумаб), MK-3475 (пембролизумаб), MEDI-0680 (AMP-514), PDR001 (спартализумаб), REGN2810(семиплимаб) и BGB-108;
(ii) антагонист связывания PD-L1, выбранный из группы, состоящей из MPDL3280A (атезолизумаб), MEDI4736 (дурвалумаб), MDX 1105 и MSB0010718C (авелумаб); или
(iii) антагонист связывания PD-L2, где антагонист связывания PD-L2 представляет собой антитело или иммуноадгезин.
55. Способ по любому из пп. 46-54, в котором биспецифичную антигенсвязывающую молекулу вводят подкожно, внутривенно, внутримышечно, местно, перорально, трансдермально, внутрибрюшинно, интраорбитально, путем имплантации, путем ингаляции, интратекально, интравентрикулярно или интраназально.
56. Способ по любому из пп. 46-55, в котором субъект представляет собой человека.
57. Набор для лечения или замедления прогрессирования HER2-положительного рака у субъекта, содержащий:
(a) композицию по п.38 или 39; и
(b) листовку-вкладыш в упаковку, содержащую инструкции по применению указанной композиции у субъекта для лечения или задержки прогрессирования HER2-положительного рака.
58. Набор по п. 57, отличающийся тем, что HER2-положительнй рак характеризуется опухолевыми клетками, которые экспрессируют HER2 в среднем количестве 200000 или более копий на клетку.
59. Биспецифичная антигенсвязывающая молекула, которая специфично связывается с CD3 и HER2, содержащая моновалентное плечо и бивалентное плечо, при этом:
(a) моновалентное плечо содержит FabA, при этом С-конец указанного FabA слит с N-концом первой Fc-субъединицы, и при этом FabA содержит следующие HVR:
(i) HVR-H1, содержащую аминокислотную последовательность из SEQ ID NO: 1,
(ii) HVR-H2, содержащую аминокислотную последовательность из SEQ ID NO: 2,
(iii) HVR-H3, содержащую аминокислотную последовательность из SEQ ID NO: 3,
(iv) HVR-L1, содержащую аминокислотную последовательность из SEQ ID NO: 4,
(v) HVR-L2, содержащую аминокислотную последовательность из SEQ ID NO: 5, и
(vi) HVR-L3, содержащую аминокислотную последовательность из SEQ ID NO: 6;
(b) бивалентное плечо содержит FabB1 и FabB2, при этом С-конец FabB2 слит с N-концом FabB1 и С-конец FabB1 слит с N-концом второй Fc-субъединицы, при этом каждый из FabB1 и FabB2 содержат следующие HVR:
(i) HVR-H1, содержащую аминокислотную последовательность из SEQ ID NO: 11,
(ii) HVR-H2, содержащую аминокислотную последовательность из SEQ ID NO: 19,
(iii) HVR-H3, содержащую аминокислотную последовательность из SEQ ID NO: 32,
(iv) HVR-L1, содержащую аминокислотную последовательность из SEQ ID NO: 21,
(v) HVR-L2, содержащую аминокислотную последовательность из SEQ ID NO: 22, и
(vi) HVR-L3, содержащую аминокислотную последовательность из SEQ ID NO: 23; и
(c) первая Fc-субъединица связывается со второй Fc-субъединицей с образованием Fc-домена,
необязательно при этом:
(a) FabA содержит VHA-область и VLA-область, при этом указанная VHA-область содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности с SEQ ID NO: 7, и VLA-область содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности с SEQ ID NO: 8;
(b) FabB1 содержит VHB1-область и VLB1-область, при этом VHB1-область содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности с SEQ ID NO: 33, и VLB1-область содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности с SEQ ID NO: 25; и
(c) FabB2 содержит VHB2-область и VLB2-область, при этом VHB2-область содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности с SEQ ID NO: 33, и VLB2-область содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности с SEQ ID NO: 25.
60. Биспецифичная антигенсвязывающая молекула, которая специфично связывается с CD3 и HER2, содержащая моновалентное плечо и бивалентное плечо, при этом:
(a) моновалентное плечо содержит FabA, при этом С-конец указанного FabA слит с N-концом первой Fc-субъединицы, и при этом FabA содержит следующие HVR:
(i) HVR-H1, содержащую аминокислотную последовательность из SEQ ID NO: 1,
(ii) HVR-H2, содержащую аминокислотную последовательность из SEQ ID NO: 2,
(iii) HVR-H3, содержащую аминокислотную последовательность из SEQ ID NO: 3,
(iv) HVR-L1, содержащую аминокислотную последовательность из SEQ ID NO: 4,
(v) HVR-L2, содержащую аминокислотную последовательность из SEQ ID NO: 5, и
(vi) HVR-L3, содержащую аминокислотную последовательность из SEQ ID NO: 6;
(b) бивалентное плечо содержит FabB1 и FabB2, при этом С-конец FabB2 слит с N-концом FabB1 и С-конец FabB1 слит с N-концом второй Fc-субъединицы, при этом каждый из FabB1 и FabB2 содержит следующие HVR:
(i) HVR-H1, содержащую аминокислотную последовательность из SEQ ID NO: 11,
(ii) HVR-H2, содержащую аминокислотную последовательность из SEQ ID NO: 36,
(iii) HVR-H3, содержащую аминокислотную последовательность из SEQ ID NO: 37,
(iv) HVR-L1, содержащую аминокислотную последовательность из SEQ ID NO: 21,
(v) HVR-L2, содержащую аминокислотную последовательность из SEQ ID NO: 29, и
(vi) HVR-L3, содержащую аминокислотную последовательность из SEQ ID NO: 26; и
(c) первая Fc-субъединица связывается со второй Fc-субъединицей с образованием Fc-домена,
необязательно при этом:
(a) FabA содержит VHA-область и VLA-область, при этом VHA-область содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности с SEQ ID NO: 7, и VLA-область содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности с SEQ ID NO: 8;
(b) FabB1 содержит VHB1-область и VLB1-область, при этом VHB1-область содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности с SEQ ID NO: 41, и VLB1-область содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности с SEQ ID NO: 48; и
(c) FabB2 содержит VHB2-область и VLB2-область, при этом VHB2-область содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности с SEQ ID NO: 41, и VLB2-область содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности с SEQ ID NO: 48.
61. Биспецифичная антигенсвязывающая молекула, которая специфично связывается с CD3 и HER2, содержащая моновалентное плечо и бивалентное плечо, при этом:
(a) моновалентное плечо содержит FabA, при этом С-конец указанного FabA слит с N-концом первой Fc-субъединицы, и при этом FabA содержит следующие HVR:
(i) HVR-H1, содержащую аминокислотную последовательность из SEQ ID NO: 1,
(ii) HVR-H2, содержащую аминокислотную последовательность из SEQ ID NO: 2,
(iii) HVR-H3, содержащую аминокислотную последовательность из SEQ ID NO: 3,
(iv) HVR-L1, содержащую аминокислотную последовательность из SEQ ID NO: 4,
(v) HVR-L2, содержащую аминокислотную последовательность из SEQ ID NO: 5, и
(vi) HVR-L3, содержащую аминокислотную последовательность из SEQ ID NO: 6;
(b) бивалентное плечо содержит FabB1 и FabB2, при этом С-конец FabB2 слит с N-концом FabB1 и С-конец FabB1 слит с N-концом второй Fc-субъединицы, при этом каждый из FabB1 и FabB2 содержит следующие HVR:
(i) HVR-H1, содержащую аминокислотную последовательность из SEQ ID NO: 11,
(ii) HVR-H2, содержащую аминокислотную последовательность из SEQ ID NO: 36,
(iii) HVR-H3, содержащую аминокислотную последовательность из SEQ ID NO: 43,
(iv) HVR-L1, содержащую аминокислотную последовательность из SEQ ID NO: 21,
(v) HVR-L2, содержащую аминокислотную последовательность из SEQ ID NO: 29, и
(vi) HVR-L3, содержащую аминокислотную последовательность из SEQ ID NO: 26; и
(c) первая Fc-субъединица связывается со второй Fc-субъединицей с образованием Fc-домена,
необязательно при этом:
(a) FabA содержит VHA-область и VLA-область, при этом VHA-область содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности с SEQ ID NO: 7, и VLA-область содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности с SEQ ID NO: 8;
(b) FabB1 содержит VHB1-область и VLB1-область, при этом VHB1-область содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности с SEQ ID NO: 44, и VLB1-область содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности с SEQ ID NO: 48; и
(c) FabB2 содержит VHB2-область и VLB2-область, при этом VHB2-область содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности с SEQ ID NO: 44, и VLB2-область содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности с SEQ ID NO: 48.
62. Биспецифичная антигенсвязывающая молекула, которая специфично связывается с CD3 и HER2, содержащая моновалентное плечо и бивалентное плечо, при этом:
(a) моновалентное плечо содержит FabA, при этом С-конец указанного FabA слит с N-концом первой Fc-субъединицы, и при этом FabA содержит следующие HVR:
(i) HVR-H1, содержащую аминокислотную последовательность из SEQ ID NO: 1,
(ii) HVR-H2, содержащую аминокислотную последовательность из SEQ ID NO: 2,
(iii) HVR-H3, содержащую аминокислотную последовательность из SEQ ID NO: 3,
(iv) HVR-L1, содержащую аминокислотную последовательность из SEQ ID NO: 4,
(v) HVR-L2, содержащую аминокислотную последовательность из SEQ ID NO: 5, и
(vi) HVR-L3, содержащую аминокислотную последовательность из SEQ ID NO: 6;
(b) бивалентное плечо содержит FabB1 и FabB2, при этом С-конец FabB2 слит с N-концом FabB1 и С-конец FabB1 слит с N-концом второй Fc-субъединицы, при этом каждый из FabB1 и FabB2 содержат следующие HVR:
(i) HVR-H1, содержащую аминокислотную последовательность из SEQ ID NO: 11,
(ii) HVR-H2, содержащую аминокислотную последовательность из SEQ ID NO: 36,
(iii) HVR-H3, содержащую аминокислотную последовательность из SEQ ID NO: 43,
(iv) HVR-L1, содержащую аминокислотную последовательность из SEQ ID NO: 38,
(v) HVR-L2, содержащую аминокислотную последовательность из SEQ ID NO: 29, и
(vi) HVR-L3, содержащую аминокислотную последовательность из SEQ ID NO: 26; и
(c) первая Fc-субъединица связывается со второй Fc-субъединицей с образованием Fc-домена,
необязательно при этом:
(a) FabA содержит VHA-область и VLA-область, при этом VHA-область содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности с SEQ ID NO: 7, и VLA-область содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности с SEQ ID NO: 8;
(b) FabB1 содержит VHB1-область и VLB1-область, при этом VHB1-область содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности с SEQ ID NO: 44, и VLB1-область содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности с SEQ ID NO: 49; и
(c) FabB2 содержит VHB2-область и VLB2-область, при этом VHB2-область содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности с SEQ ID NO: 44, и VLB2-область содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности последовательности с SEQ ID NO: 49.
| WO 2012143524 A2, 26.10.2012 | |||
| WO 2013026831 A1, 28.02.2013 | |||
| PSMA×CD3 БИСПЕЦИФИЧЕСКОЕ ОДНОЦЕПОЧЕЧНОЕ АНТИТЕЛО С МЕЖВИДОВОЙ СПЕЦИФИЧНОСТЬЮ | 2009 |
|
RU2559531C2 |
Авторы
Даты
2023-07-28—Публикация
2019-02-08—Подача