Настоящее изобретение относится к области химической технологии получения перфторированных виниловых эфиров, в частности, к способу получения перфтор-4-(фторсульфонил)бутилвинилового эфира, являющегося мономером линейного строения: FSO2-(CF2)4-О-CF=CF2, содержащего сульфонилфторидную группу и использующегося для получения сополимеров, находящих применение при производстве ионообменных мембран.
УРОВЕНЬ ТЕХНИКИ
В 1964 году американской фирмой «DuPont» был синтезирован перфторвиниловый мономер FSO2-CF2-CF2-О-CF(CF3)-CF2-О-CF=CF2, перфтор-(3,6-диокса-4-метил-7-октен)сульфонилфторид, который был успешно сополимеризован с тетрафторэтиленом с получением мембраны «Nafion®», обладающей протонной проводимостью. Указанный тип мембран был успешно применен для изготовления топливных элементов энергетических установок, в электролизерах (в т.ч. получения элементного хлора), а также в качестве гетерофазных катализаторов различных химических реакций. Несмотря на химическую инертность, термическую устойчивость, механическую прочность, а также хорошие электрохимические свойства, данный тип мембран не лишен недостатков. Их основным недостатком является потеря проводимости пропорционально росту температуры системы ввиду обезвоживания мембраны, начиная с температуры 80°С и практически полной потерей проводимости при температуре выше 100°С.
В последние годы были разработаны способы синтеза новых линейных перфторированных виниловых мономеров с концевой сульфофторидой группой, сополимеризацией которых с тетрафторэтиленом были получены протонопроводящие мембраны с укороченной боковой цепью, характеризующиеся улучшенными эксплуатационными характеристиками, а именно повышением рабочей температурой топливного элемента до 130°С. Одним из таких мономеров стал, запатентованный в 2003 г. американской компанией «3М», FSO2-(CF2)4-О-CF=CF2, перфтор-4-(фторсульфонил)бутилвиниловый эфир, сополимеризацией которого с тетрафорэтиленом была получена протонопроводящая мембрана «3М™ Ionomer».
Известен способ получения перфторированных виниловых эфиров, содержащих сульфонилфторидную концевую группу следующего структурного состава FSO2-(CF2)a-[CF2O(CF3)]b-1-CF2O-CF=CF2, где а=1-5, b=1-5 (CN 105753742, опубликован 09.03.2018). В частности, при а=3, b=1 формула соединения соответствуют заявленной.
На первой стадии исходное сырье иодперфторацилфторид I-(CF2)a-COF олигомеризуют с окисью гексафторпропилена с получением соответствующих иодперфтора-цилфторидов I-(CF2)a-[CF2O(CF3)]b-COF, где b - степень олигомеризации. На второй стадии выделенный олигомер при взаимодействии с карбонатом натрия и после термического разложения дает иодперфторвиниловый эфир I-(CF2)a-[CF2O(CF3)]b-1-CF2O-CF=CF2. В дальнейшем последовательной обработкой иодперфторвинилового эфира восстанавливающими, хлорирующими и фторирующими агентами получают перфторирован-ный виниловый эфир, содержащий сульфонилфторидную концевую группу.
Причины, препятствующие получению в известном способе требуемого технического результата, заключаются в:
- дороговизне и труднодоступности исходного сырья - иодперфторбутаноилфторида;
- проведении олигомеризации с невысокой степенью селективности получения продукта моноприсоединения окиси гексафторпропилена;
- проведении хлорирования в среде органического растворителя (четыреххлористый углерод, ацетон, диглим) с использованием специфических хлорирующих агентов (N-хлорсукцинимидов, PCl5).
Известен способ получения перфторированных виниловых эфиров, содержащих сульфонилфторидную концевую группу состава FSO2-CF2-(CF2)n-О-CF=CF2, где n=1-6 (CN 107298647, опубл. 22.02.2019). В частности, при n=3 формула соединения соответствуют заявленной.
На первой стадии хлоралкилвиниловый эфир Cl-СН2-(СН2)n-О-СН=СН2 реакцией сульфирования с последующим хлорированием получают хлоралкиловый эфир с концевой сульфохлоридной группой состава ClSO2-СН2-(СН2)n-О-CHCl-CH2Cl. На второй стадии хлоралкиловый эфир хлорангидрида сульфоновой кислоты подвергается исчерпывающему фторированию элементным фтором в растворителе с получением перфторалкиловых эфиров с концевой сульфофторидной группой состава FSO2-CF2-(CF2)n-О-CFCl-CF2Cl. На третьей стадии перфторалкиловые эфиры подвергают дегалогенированию с образованием перфторалкилвиниловых эфиров линейного строения с концевой сульфофторидной группой FSO2-CF2-(CF2)n-О-CF=CF2, где n=1-6.
Причины, препятствующие получению в известном способе требуемого технического результата, заключаются в:
- использовании на стадии фторирования элементного фтора - труднодоступного и некоммерческого реагента;
- использовании на стадии фторирования 20-кратного разбавления реакционной массы фторхлоруглеродным растворителем (хладон-11, хладон-113), что снижает производительность данного процесса до уровня, непригодного для промышленного производства;
- использовании мощных холодильных установок при проведении стадии фторирования элементным фтором (минус 60…минус 100°С).
Известен способ получения перфторированных виниловых эфиров, содержащих сульфонилфторидную концевую группу состава FSO2-(CF2)n-О-CF=CF2, где n=2-5, используя в качестве исходного соединения - сультон SO2(O)(CH2)n (US 6624328, опубликован 23.09.2003). В частности, при n=4 формула соединения соответствуют заявленной.
На первой стадии проводят электрохимическое фторирование исходного сультона SO2(O)(CH2)n с образованием FSO2-(CF2)(n-1)-COF. На второй стадии взаимодействием FSO2-(CF2)(n-1)-COF с окисью гексафторпропилена получают FSO2-(CF2)(n)-О-CF(CF3)-COF. На третьей стадии взаимодействием FSO2-(CF2)(n)-О-CF(CF3)- COF с солью металла М+P получают соль состава (FSO2-(CF2)(n)-О-CF(CF3)-СОО-)рМ+P, при термическом разложении которой образуется целевой перфторированный виниловый эфир FSO2-(CF2)(n)-О-CF=CF2.
Признаки, являющиеся общими для известного и заявляемого способов, заключаются в проведении конденсации FSO2-(CF2)3-COF с окисью гексафторпропилена в присутствии фторида калия, синтеза соли состава FSO2-(CF2)4-О-CF(CF3)-COONa с использованием карбоната натрия и термическом разложении соли с одновременной отгонкой целевого продукта.
Причины, препятствующие получению в известном способе требуемого технического результата, заключаются в:
- применение на стадии электрохимического фторирования специфического оборудования (электролизеров) ограничивает использование данного способа;
- образовании на стадии электрохимического фторирования большого количества опасных и токсичных отходов, что негативно сказывается на экологической составляющей данного способа;
- низкой селективности метода электрохимического фторирования, не позволяющего получить целевой продукт с высоким выходом.
Таким образом, существует необходимость разработки нового способа получения перфторированных виниловых эфиров линейного строения, содержащих сульфонилфторидную концевую группу, в частности перфтор-4-(фторсульфонил)бутилвинилового эфира, лишенного недостатков, присущих известным способам.
РАСКРЫТИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Задачей, стоящей перед авторами являлась разработка нового способа получения перфторированных виниловых эфиров линейного строения, содержащих сульфонилфторидную концевую группу, в частности перфтор-4-(фторсульфонил)бутилвинилового эфира, пригодного для реализации в промышленном масштабе с использованием коммерчески доступного сырья, реагентов, стандартного технологического оборудования, простых химических и технологических приемов синтеза и очистки, сопровождающихся получением полупродуктов с высокой селективностью, выходом и качественным составом.
В качестве исходного соединения для заявляемого способа получения перфтор-4-(фторсульфонил)бутилвинилового эфира был выбран 1-перфторбутен-4-сульфофторид, CF2=CF-CF2-CF2-SO2F.
Авторами, в качестве способа получения исходного соединения был выбран известный способ получения алкенов, содержащих сульфонилфторидную концевую группу состава CF=CF2-(CF2-CF2)n-SO2F, где n=1-5 (WO 2000024709, опубликован 04.05.2000), предполагающий получение исходного 1-перфторбутен-4-сульфофторида путем последовательного проведения:
- теломеризации 1,1,2-трифтор-1,2-дихлор-2-йодэтана с тетрафторэтиленом;
- получения 1,2-дихлорперфторбутилсульфофторида при последовательном восстановлении 1-йод-3,4-дихлорперфторбутана дитионитом натрия, обработку образующегося 1,2-дихлорперфторбутилсульфината натрия газообразным хлором в воде и фторирование 1,2-дихлорперфторбутилсульфохлорида фторидом щелочного металла в полярном апротонном растворителе;
- дегалогенирования 1,2-дихлорперфторбутилсульфофторида на цинковом порошке в диглиме и уксусной кислоте.
Задача разработки нового способа получения перфтор-4-(фторсульфонил)бутилвинилового эфира достигается путем реализации следующих химических превращений исходного 1-перфторбутен-4-сульфофторида:
- окисление 1-перфторбутен-4-сульфофторида и изомеризация образующегося 2-(перфтороксиран-2-ил)перфторэтан-1-сульфонилфторида:

- конденсация 4-сульфонилфторидперфторбутаноилфторида с окисью гексафторпропилена с образованием 2-(трифторметил)-3-окса-7-сульфонилфторидперфтор-гептаноилфторида:

- взаимодействие 2-(трифторметил)-3-окса-7-сульфонилфторидперфторгептаноил-фторида с суспензией карбоната натрия с образованием соответствующей соли и термическое разложение соли с выделением целевого продукта - перфтор-4-(фторсульфонил)бутилвинилового эфира:
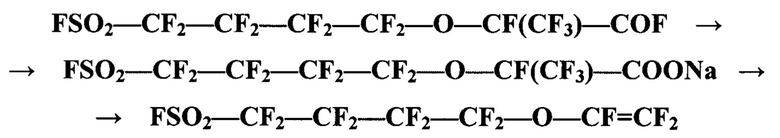
По заявляемому способу окисление 1-перфторбутен-4-сульфофторида проводят в автоклаве при температуре 20-70°С, предпочтительно 50-60°С. В качестве окислителя используют газообразный кислород, процесс окисления проводят при постоянном давлении кислорода 0,1-0,5 МПа, предпочтительно 0,3-0,5 МПа.
Окисление 1-перфторбутен-4-сульфофторида проводят при невысоких давлениях кислорода, что обеспечивает безопасное проведение данного процесса. За счет проведения окисления 1-перфторбутен-4-сульфофторида в отсутствии растворителя, производительность заявленного способа соответствует уровню промышленного производства.
В заявляемом способе окисления перфторбутен-4-сульфофторида кислородом авторы не исключают использования катализаторов, например, оксидов переходных металлов (циркония, церия, ванадия, молибдена, титана и пр.) или их композиций.
В качестве основного продукта окисления 1-перфторбутен-4-сульфофторида получают 2-(перфтороксиран-2-ил)перфторэтан-1-сульфонилфторид с выходом 85%.
По заявляемому способу изомеризацию 2-(перфтороксиран-2-ил)перфторэтан-1-сульфонилфторида проводят с использованием катализатора и инертного растворителя.
Во избежание сильного разогрева реакционной массы дозировку 2-(перфтороксиран-2-ил)перфторэтан-1-сульфонилфторида ведут в раствор катализатора при температуре 0-20°С, предпочтительно 10-15°С. В качестве катализатора используют третичные алкиламины, предпочтительно триэтиламин.
Реагенты расходуют в мольном отношении 2-(перфтороксиран-2-ил)перфторэтан-1-сульфонилфторид: растворитель/триэтиламин равном 1: (0,9-1,0): (0,04-0,08). Уровень достижимой конверсии составляет 100%. Увеличение количества катализатора не целесообразно, ввиду существенного снижения выхода продукта при незначительном увеличении скорости реакции изомеризации.
В качестве растворителя для проведения изомеризации используют полностью хлорфторзамещенные ациклические или циклические насыщенные углеводороды с температурой кипения более 100°С, предпочтительно более 120°С. В частности, в заявленном способе получения используют доступные изомеры тетрахлоргексафторбутана, например, 1,2,3,4- и 1,1,4,4-тетрахлорзамещенные перфторбутаны. Разница в температуре кипения растворителя и целевого продукта составляет более 50°С, что способствует их эффективному разделению.
В качестве основного продукта изомеризации 2-(перфтороксиран-2-ил)перфторэтан-1-сульфонилфторида получают 4-сульфонилфторидперфторбутаноилфторид, который количественно отделяют от верхнего слоя катализатора и подвергают очистке стандартными методами (фракционирование, ректификация).
По заявляемому способу конденсацию 4-сульфонилфторидперфторбутаноил-фторида с окисью гексафторпропилена проводят при интенсивном перемешивании при температуре 0…20°С, предпочтительно 10…15°С с постоянной подачей реагента по сифону в зону реакции.
По заявляемому способу конденсацию 4-сульфонилфторидперфторбутаноил-фторида проводят как при атмосферном давлении, так и при постоянном давлении окиси гексафторпропилена в диапазоне 0…0,1 МПа, предпочтительно 0,07…0,1 МПа.
В качестве каталитической системы используют суспензию фторида щелочного металла в полярном апротонном растворителе, в частности, в заявленном способе получения в качестве каталитической системы используют суспензию фторида калия в смесевом растворителе: ацетонитрил - диглим в объемном отношении 50:50.
Реагенты расходуют в мольном отношении 4-сульфонилфторидперфторбутаноилфторид: окись гексафторпропилена: смесевой растворитель (ацетонитрил/диглим): фторид калия равном 1: (1,15-1,2): (0,75-1,0): 0,1. Допускается повторное использование каталитической системы после ее отделения в виде верхнего слоя реакционной массы.
При достигнутой конверсии исходного ацилфторида на уровне 85% селективность получения продукта моноприсоединения составляет более 99%. Такой результат достигают за счет использования смесевого растворителя каталитической системы, в среде которой не протекает дальнейшая олигомеризация исходного ацилфторида с образованием продукта диприсоединения. Высокая степень селективности конденсации значительно упрощает процесс очистки целевого продукта моноприсоединения и увеличивает ее производительность.
Не вступивший в реакцию 4-сульфонилфторидперфторбутаноилфторид выделяют известным методом ректификации и направляют в рецикл для увеличения полноты переработки сырья. В качестве основного продукта конденсации получают 2-(трифторметил)-3-окса-7-сульфонилфторидперфторгептаноилфторид с выходом 95% по конвертированному ацилфториду.
В заявляемом способе получение перфтор-4-(фторсульфонил)бутилвинилового эфира проводят при взаимодействии 2-(трифторметил)-3-окса-7-сульфонилфторид-перфторгептаноилфторида с суспензией карбоната натрия в полярном апротонном растворителе с образованием натриевой соли 2-(трифторметил)-3-окса-7-сульфонилфторид-перфторгептановой кислоты. Суспензию полученной соли подвергают термическому разложению с образованием целевого продукта и его выделение из зоны реакции методом отгонки.
По заявляемому способу взаимодействие 2-(трифторметил)-3-окса-7-сульфонилфторидперфторгептаноилфторида с суспензией карбоната натрия в растворителе проводят при температуре 70-100°С, предпочтительно 85-95°С, с образованием натриевой соли 2-(трифторметил)-3-окса-7-сульфонилфторидперфторгептановой кислоты.
Реагенты расходуют в мольном отношении нитробензол: карбонат натрия: 2-(трифторметил)-3-окса-7-сульфонилфторидперфторгептаноилфторид равном (4,0-6,0):(1,1-1,2):1.
В качестве растворителя используют полярные апротонные растворители, такие как нитробензол, диглим, диметилформамид, сульфолан, предпочтительно использование нитробензола.
По заявляемому способу термическое разложение натриевой соли 2-(трифторметил)-3-окса-7-сульфонилфторидперфторгептановой кислоты проводят нагреванием суспензии соли в полярном апротонном растворителе до температуры 140-160°С с одновременной отгонкой целевого продукта перфтор-4-(фторсульфонил)бутилвинилового эфира из зоны реакции. Очистку целевого продукта от примесей проводят методом ректификации.
Таким образом, анализ известных способов получения перфторированных виниловых эфиров, содержащих сульфонилфторидную концевую группу, в частности перфтор-4-(фторсульфонил)бутилвинилового эфира, не позволил обнаружить решение, полностью совпадающее по совокупности признаков с заявляемым, что может указывать на его новизну.
Сведения, подтверждающие возможность осуществления изобретения, в том числе в соответствии с требованием «промышленная применимость», но не ограничивающие его, иллюстрируются следующими примерами.
ПРИМЕРЫ
Исходное соединение - 1-перфторбутен-4-сульфофторид, CF2=CF-CF2-CF2-SO2F, получен известным способом из 1,1,2-трифтор-1,2-дихлор-2-йодэтана, CF2Cl-CFClJ, согласно патенту WO 2000024709.
Пример 1. Получение 2-(перфтороксиран-2-ил)перфторэтан-1-сульфонилфторида
В автоклав из нержавеющей стали марки 12Х18Н10Т объемом 6,3 дм3, снабженный мешалкой турбинного типа и сифоном для подачи реакционного газа, при перемешивании загружали 2,6 кг 1-перфторбутен-4-сульфофторида. Содержимое автоклава продували кислородом и разогревали до температуры 50°С. Процесс окисления проводили при постоянном давлении кислорода в автоклаве 0,3-0,5 МПа и температуре 50-60°С.
После прекращения падения давления в автоклаве ниже 0,5 МПа стравливали давление до атмосферного. Содержимое реактора продували азотом и выгружали продукты окисления в количестве 2,47 кг, состава по ГЖХ: 0,5% карбонилфторид; 0,61% исходный продукт; 83,2% FSO2CF2CF2CF(O)CF2; 9,5% FSO2CF2CF2COF; 5,1% FSO2CF2CF2CF2COF.
Идентификацию примесей проводили методом хромато-масс-спектрометрии на хромато-масс-спектрометре Agilent 7890А/5975С (колонка 60 м × 0,25 мм HP-5MS).
Пример 2. Получение 2-(перфтороксиран-2-ил)перфторэтан-1-сульфонилфторида
Получение 2-(перфтороксиран-2-ил)перфторэтан-1-сульфонилфторида проводили аналогично примеру 1, но при температуре 60-70°С.
Получили продукты окисления в количестве 2,45 кг, состава по ГЖХ: 0,45% карбонилфторид; 0,3% исходный продукт; 82,1% FSO2CF2CF2CF(O)CF2; 9,7% FSO2CF2CF2COF; 6,4% FSO2CF2CF2CF2COF.
Пример 3. Получение 4-сульфонилфторидперфторбутаноилфторида
В реактор объемом 10 л при перемешивании загружали 3,8 л 1,2,3,4-тетрахлоргексафторбутана и 130 г (1,287 моль) триэтиламина. К полученному раствору постепенно добавляли 6500 г (23,2 моль) 2-(перфтороксиран-2-ил)перфторэтан-1-сульфонилфторида при температуре 10-15°С и выдерживали в течение 12-16 часов до полной конверсии исходного продукта. По окончании выдержки проводили выделение продуктов синтеза из реакционной массы, отделяя нижний фторорганический слой.
Нижний слой фракционировали на 1000 мм ректификационной насадочной колонне и получали 4,55 кг фракции (Ткип=76-77°С) очищенного 4-сульфонилфторидперфторбутаноилфторида (99,9%). Выход на очищенный продукт составляет 70%.
Пример 4. Получение 4-сульфонилфторидперфторбутаноилфторида
Синтез проводили аналогично описанному в примере 3, но добавляли 65 г (0,064 моль) триэтиламина. Время выдержки до полной конверсии исходного продукта составило 48 часов. Нижний слой фракционировали на 1000 мм ректификационной насадочной колонне и получали 4,78 кг фракции (Ткип=76-77°С) очищенного 4-сульфонилфторидперфторбутаноилфторида (99,9%). Выход на очищенный продукт составляет 73,5%).
Пример 5. Получение 4-сульфонилфторидперфторбутаноилфторида
Синтез проводили аналогично описанному в примере 3, но добавляли 260 г (2,57 моль) триэтиламина. Время выдержки до полной конверсии исходного продукта составило 4 часа. Нижний слой фракционировали на 1000 мм ректификационной насадочной колонне и получали 4,15 кг фракции (Ткип=76-77°С) очищенного 4-сульфонилфторидперфторбутаноилфторида (99,9%). Выход на очищенный продукт составляет 63,8%.
Пример 6. Конденсация 4-сульфонилфторидперфторбутаноилфторида с окисью гексафторпропилена
В круглодонную колбу объемом 6000 мл, снабженную механической мешалкой, терм о датчиком, сифоном для подачи реакционного газа и обратным холодильником загружали 5000 г (17,86 моль) 4-сульфонилфторидперфторбутаноилфторида, 350 мл ацетонитрила, 350 мл диглима и 100 г фторида калия. Содержимое колбы перемешивали при температуре 15-20°С в течение 1 часа, после чего при интенсивном перемешивании (400-500 мин-1) проводили барботаж 3400 г (20,48 моль) окиси гексафторпропилена при температуре 10-15°С и незначительном проскоке. По окончании дозировки получали следующий состав продуктов конденсации (по данным анализа ГЖХ): 2,4% CF3CF2COF; 5,1% CF3CF2CF2OCF(CF3)COF; 20,5% исходного продукта, 71,5% FSO2(CF2)4OCF(CF3)COF и 0,1% FSO2(CF2)3[CF2OCF(CF3)]2COF.
Отделяли из реакционной массы нижний фторорганический слой продуктов синтеза и проводили их фракционирование на 1000 мм ректификационной насадочной колонне, последовательно получая фракции, обогащенные CF3CF2CF2OCF(CF3)COF и исходным продуктом соответственно. В кубовом остатке получали очищенный FSO2(CF2)4OCF(CF3)COF (98%) с выходом 95,4%.
Пример 7. Конденсация 4-сульфонилфторидперфторбутаноилфторида с окисью гексафторпропилена
В автоклав из нержавеющей стали марки 12Х18Н10Т объемом 6,3 дм3, снабженный мешалкой турбинного типа и сифоном для подачи реакционного газа при перемешивании загружали 4400 г (15,71 моль) 4-сульфонилфторидперфторбутаноилфторида, 450 г ацетонитрила и 90 г фторида калия. Содержимое реактора перемешивали при температуре 15-20°С в течение 1 часа, после чего при интенсивном перемешивании (400-500 мин-1) проводили порционную подачу 4000 г (24,1 моль) окиси гексафторпропилена при температуре 15-20°С в интервале давлений 0,07-0,1 МПа. По окончании дозировки избыточное давление из автоклава стравливали до атмосферного и получали следующий состав продуктов конденсации (по данным анализа ГЖХ): 2,7% CF3CF2COF; 6,1% CF3CF2CF2OCF(CF3)COF; 15,5% исходного продукта, 75,2% FSO2(CF2)4OCF(CF3)COF и 0,15% FSO2(CF2)3[CF2OCF(CF3)]2COF.
Выделение продуктов реакции проводили аналогично примеру 6 с выходом 95,6%.
Пример 8. Получение перфтор-4-(фторсульфонил)бутилвинилового эфира
В круглодонную колбу объемом 4000 мл, снабженную механической лопастной мешалкой, термодатчиком, линией дозировочного насоса и обратным холодильником со сдувкой для отвода газа, загружали 1600 г свежеперегнанного нитробензола и 300 г (2,85 моль) карбоната натрия, прокаленного при температуре 200°С в течение 10 часов. Содержимое колбы при перемешивании нагревали до температуры 85°С и по каплям дозировали 1100 г (2,47 моль) 2-(трифторметил)-3-окса-7-сульфонилфторидперфторгептаноилфторида при температуре 85-100°С. При этом наблюдали образование натриевой соли 2-(трифторметил)-3-окса-7-сульфонилфторидперфторгептановой кислоты. Углекислый газ сдували через обратный холодильник.
По окончании газовыделения суспензию соли в нитробензоле нагревали до температуры 140-160°С и проводили ее термическое разложение с образованием перфтор-4-(фторсульфонил)бутилвинилового эфира и одновременным удалением последнего из зоны реакции отгонкой в охлаждаемый сборник. В результате получали 780 г целевого продукта. Выход 83%).
Пример 9. Получение перфтор-4-(фторсульфонил)бутилвинилового эфира
Синтез проводили аналогично описанному в примере 8, но с использованием 1300 г нитробензола и 287 г (2,7 моль) карбоната натрия.
В результате получали 751 г целевого продукта. Выход 80%.
Цитируемая литература
1. Патент CN 105753742, «Method for Preparing Perfluoroalkene Ether Sulfonyl Fluoride Compound», Kakuetsu Wei Shigesho, опубл. 09.03.2018.
2. Патент CN 107298647, «End Group is the Preparation Method of the Straight Chain Perfluoroalkyl Vinyl Ether of Sulfonyl Fluoride Group», Akira Koenaga, опубл. 22.02.2019.
3. Патент US 6624328, «Preparation of Perfluorinated Vinyl Ethers Having a Sulfonyl Fluoride End-Group», Miguel Antonio Guerra, заявлено 17.12.2002, опубл. 23.09.2003.
4. Патент WO 2000024709, «Monomers, Ionomers and Polymers for Electrochemical Uses», Farnham, William, Brown, заявлено 26.10.1998, опубл. 04.05.2000.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ 5-(ФТОРСУЛЬФОНИЛ)ПЕРФТОРПЕНТИЛВИНИЛОВОГО ЭФИРА | 2024 |
|
RU2840850C1 |
| СПОСОБ ПОЛУЧЕНИЯ ФТОРИРОВАННОГО СУЛЬФОНИЛФТОРИДА | 2004 |
|
RU2379285C2 |
| СПОСОБ ПОЛУЧЕНИЯ ПЕРФТОР-3-ОКСА-ПЕНТЕН-СУЛЬФОНИЛФТОРИДА | 2013 |
|
RU2546109C1 |
| СПОСОБ ПОЛУЧЕНИЯ СОДЕРЖАЩЕГО АТОМ ФТОРА СУЛЬФОНИЛФТОРИДНОГО СОЕДИНЕНИЯ | 2001 |
|
RU2278854C2 |
| Способ получения десфлурана | 2024 |
|
RU2833270C1 |
| ПЕРФТОР(2-ФТОРСУЛЬФАТЭТОКСИ)ПРОПИОНИЛ ФТОРИД | 2010 |
|
RU2443685C1 |
| Получение стабилизированного сополимера для протонпроводящих мембран | 2023 |
|
RU2820658C1 |
| СПОСОБ ПОЛУЧЕНИЯ ГАЛОИДИРОВАННЫХ 1,3-ДИОКСОЛАНОВ И ГАЛОИДИРОВАННЫЕ 1,3-ДИОКСОЛАНЫ | 1991 |
|
RU2039055C1 |
| СПОСОБ ПОЛУЧЕНИЯ ИМИННОЙ СОЛИ МХ+[N(CF3)2]Х И ЕЕ ПРИМЕНЕНИЕ | 2000 |
|
RU2243963C2 |
| Способ получения виниловых эфиров сульфонилфторидов | 1981 |
|
SU1080742A3 |
Изобретение относится к области химической технологии получения перфторированных виниловых эфиров, содержащих сульфонилфторидную группу, а именно к способу получения перфтор-4-(фторсульфонил)бутилвинилового эфира, который является «функциональным» мономером, сополимеризующимся с тетрафторэтиленом, с получением полимеров, предназначенных для производства ионообменных мембран с улучшенными эксплуатационными характеристиками. Способ заключается в том, что осуществляют окисление 1-перфторбутен-4-сульфофторида газообразным кислородом в мягких условиях, затем - каталитическую изомеризацию образующегося 2-(перфтороксиран-2-ил)перфторэтан-1-сульфонилфторида в среде инертного растворителя с получением преимущественно 4-сульфонилфторидперфторбутаноилфторида. Далее проводят конденсацию полученного 4-сульфонилфторидперфторбутаноилфторида с окисью гексафторпропилена в смеси полярных апротонных растворителей, а затем взаимодействие образующегося 2-(трифторметил)-3-окса-7-сульфонилфторидперфторгептаноилфторида с карбонатом натрия в полярном апротонном растворителе. После этого осуществляют термическое разложение образующейся натриевой соли 2-(трифторметил)-3-окса-7-сульфонилфторидперфторгептановой кислоты с одновременной отгонкой целевого продукта из зоны реакции. Техническим результатом является разработка способа получения перфтор-4-(фторсульфонил)бутилвинилового эфира, позволяющего создать технологию без использования элементного фтора, электрохимического фторирования, с использованием в качестве исходного сырья коммерчески доступных фторсодержащих соединений, а также проведением всех стадий синтеза и очистки в стандартном технологическом оборудовании с высокой селективностью получения промежуточных продуктов. 5 з.п. ф-лы, 9 пр.
1. Способ получения перфтор-4-(фторсульфонил)бутилвинилового эфира, заключающийся в том, что окисление 1-перфторбутен-4-сульфофторида проводят газообразным кислородом в мягких условиях; каталитическую изомеризацию образующегося 2-(перфтороксиран-2-ил)перфторэтан-1-сульфонилфторида проводят в среде инертного растворителя с получением преимущественно 4-сульфонилфторидперфторбутаноилфторида; конденсацию полученного 4-сульфонилфторидперфторбутаноилфторида с окисью гексафторпропилена проводят в смеси полярных апротонных растворителей; взаимодействие образующегося 2-(трифторметил)-3-окса-7-сульфонилфторидперфторгептаноилфторида с карбонатом натрия проводят в полярном апротонном растворителе, а термическое разложение образующейся натриевой соли 2-(трифторметил)-3-окса-7-сульфонилфторидперфторгептановой кислоты проводят с одновременной отгонкой целевого продукта из зоны реакции.
2. Способ по п. 1, характеризующийся тем, что окисление 1-перфторбутен-4-сульфофторида проводят при температуре 20-70°С и давлении 0,1-0,5 МПа.
3. Способ по п. 1, характеризующийся тем, что при изомеризации 2-(перфтороксиран-2-ил)перфторэтан-1-сульфонилфторида в качестве инертного растворителя используют 1,2,3,4-тетрахлоргексафторбутан.
4. Способ по п. 1, характеризующийся тем, что процесс конденсации 4-сульфонилфторидперфторбутаноилфторида с окисью гексафторпропилена протекает в каталитической системе, представляющей собой суспензию фторида калия в смесевом растворителе: ацетонитрил - диглим в объемном отношении 50:50.
5. Способ по п. 1, характеризующийся тем, что при синтезе и термическом разложении натриевой соли 2-(трифторметил)-3-окса-7-сульфонилфторидперфторгептановой кислоты в качестве полярного апротонного растворителя используют нитробензол.
6. Способ по п. 4, характеризующийся тем, что селективность получения FSO2(CF2)3[CF2OCF(CF3)]nCOF, где n=1, составляет более 99%.
| CN 107298647 B, 22.02.2019 | |||
| Daniel A | |||
| Hercules, DEVELOPMENT OF A PILOT-SCALE POLYMERIZATION FACILITY AND MONOMER PREPARATION FOR THE DETERMINATION OF REACTIVITY RATIOS FOR TETRAFLUOROETHYLENE (TFE)-BASED COPOLYMERS | |||
| A Dissertation Presented to the Graduate School of Clemson University, August 2016 | |||
| JP 2004018424 A, 22.01.2004 | |||
| JP 2004026728 A, |
Авторы
Даты
2023-07-31—Публикация
2022-08-17—Подача