Область техники
Изобретение относится к биотехнологии, медицинской промышленности и может быть использовано в производстве пробиотических лекарственных средств для комплексной профилактики и лечения лактационного мастита у кормящих грудью матерей.
Лактационный мастит относят к важным социальным проблемам, связанным с преждевременным прекращением грудного вскармливания детей и нарушением репродуктивного здоровья. Исключительно грудное вскармливание в первые 6 месяцев жизни ребенка рекомендовано ВОЗ [WHO. 2011. Exclusive breastfeeding for six months best for babies everywhere. Available at: https://www.who.int/mediacentre/news/statements/2011/breastfeeding_20110115/en/], поскольку грудное молоко обеспечивает ребенка всеми питательными веществами и элементами, необходимыми для нормального развития и роста.
В период лактации и грудного вскармливания ребенка частота встречаемости лактационного мастита у женщин в разных странах мира варьирует от 3 до 33% [WHO. 2000. Mastitis: causes end management. WHO, Geneva, Switzerland; American Academy of Pediatr. 2012. Breastfeeding and the use of human milk. Pediatrics. 129. e827-e841. Doi:10.1542/peds.2011-3552]. Заболевание представляет собой воспаление молочной железы у матери, вызываемое условно-патогенными и патогенными микроорганизмами. Мастит - следствие дисбиоза молочной железы матери в лактационный период грудного вскармливания ребенка. При дисбиозе в лактационный период в молочной железе увеличивается уровень бактерий S. aureus и S. epidermidis и уменьшается уровень лактобацилл. [Delgado S., Arroyo R., Martin R., Rodrigues J. PCR-DGGE assessment of the bacterial diversity of breast milk in women with lactational infectious mastitis. BMC Infect. Dis. 2008. 8. 51-58; Contreras G., Rodriguez J. Mastitis: Comparative etiology and epidemiology. J Mammary Gland Biol. Neoplasia 2011. 16: 339-356]. Для восстановления и поддержания нормальной микробиоты молочной железы актуально применение пробиотиков [Arroyo R., Martin V., Maldonado A., et al. Treatment of infectious mastitis during lactation: antibiotics versus oral administration of lactobacilli isolated from breast milk. Clin. Infect. Dis. 2010. 50 (12): 1551-1558]. Важной проблемой является пробиотическая профилактика и терапия лактационного мастита.
Известны штаммы вида Lactobacillus reuteri, применяемые для коррекции дисбиозов.
Так, известен штамм Lactobacilus reuteri DSM 17938 (АТСС 55730), выделенный из молока здоровой женщины. На его основе создан пробиотический препарат для устранения кишечных колик у новорожденных детей [Patent РСТ: WO 2007/142596, 2007; Патент № RU 2435 844 С2, 2011], однако отсутствуют данные об антагонистической активности штамма в отношении мастит-индуцирующих патогенов, а также данные о возможности применения этого штамма в качестве лекарственного средства для комплексной профилактики и лечения лактационного мастита у кормящих грудью матерей.
Известны штаммы Lactobacillus reuteri, обладающие широким спектром антагонистической активности к различным патогенам [US Patent No: 5439678, 1995; US Patent No: 5458875, 1995; US Patent No: 5534253, 1996; US Patent No: 5849289, 1998; US Patent No: 2013/0171253 A1, 2013], однако отсутствуют данные об антагонистической активности этих штаммов Lactobacillus reuteri в отношении мастит-индуцирующих патогенов, а также данные о возможности их применения в качестве лекарственного средства для комплексной профилактики и лечения лактационного мастита у кормящих грудью матерей.
Известны штаммы вида Lactobacillus fermentum, применяемые для коррекции дисбиозов.
Так, известен штамм Lactobacillus fermentum 90 - Ts-4, характеризующийся высокими адгезивными свойствами к влагалищному эпителию [Патент RU 2133272 С1, 1999], однако отсутствуют данные об антагонистической активности этого штамма в отношении мастит-индуцирующих патогенов, а также о возможности его применения в качестве лекарственного средства для комплексной профилактики и лечения лактационного мастита у кормящих грудью матерей.
Известен штамм Lactobacillus fermentum Z, выделенный у женщины репродуктивного возраста, обладающий антагонистической активностью к патогенным грамположительным и грамотрицательным бактериям, а также к грибам [Патент № RU 2412239 С2, 2011], однако отсутствуют данные об антагонистической активности этого штамма в отношении мастит-индуцирующих патогенов, а также данные о возможности его применения в качестве лекарственного средства для комплексной профилактики и лечения лактационного мастита у кормящих грудью матерей.
Известен штамм Lactobacillus fermentum МЕ-3 DSM 14241 [Patent WO 03002131; Патент RU 2284354 С2, 2006]. Штамм используется в приготовлении лекарственного продукта для профилактики и лечения кишечных и урогенитальных инфекций, а также используется в приготовлении продуктов функционального питания, однако отсутствуют данные о возможности его применения в качестве лекарственного средства для комплексной профилактики и лечения лактационного мастита у кормящих грудью матерей.
Известен штамм Lactobacillus fermentum TS 3-06 [Патент RU 2391395, 2010]. Штамм используется для изготовления бактериальных препаратов и производства жидкой молочной закваски в качестве продукта питания лечебно-профилактического назначения. Штамм обладает высокой скоростью роста и устойчивостью к воздействию экстремальных факторов, таких, как низкая кислотность и желчь, однако отсутствуют данные о возможности его применения в качестве лекарственного средства для комплексной профилактики и лечения лактационного мастита у кормящих грудью матерей.
Известен штамм Lactobacillus fermentum Lc40 (CECT5716), выделенный из молока здоровой женщины в период лактации и грудного вскармливания ребенка [Patent No: US 2004/0057943 А1]. На основе этого штамма создана биологически активная добавка (БАД) Лактанза. Клинические рандомизированные контролируемые испытания показали, что употребление Lactobacillus fermentum Lc40 (СЕСТ5716) женщинами в период грудного вскармливания снижает стафилококковую нагрузку в молоке кормящих женщин и способствует уменьшению частоты мастита [Maldonado-Lobon J., Diaz-Lopez М., Carputo R., et al. Lactobacillus fermentum Lc40 (CECT5716) reduces staphylococcus load in the breastmilk of lactating mothers suffering breast pain: a randomized controlled trial. Breastfeeding Med. 2015. 10: 425-432. https://doi.org/10.1089/bfm.2015.0070]. Недостатком штамма Lactobacillus fermentum Lc40 (CECT5716) является тот факт, что он оказывает бактериостатическое, но не бактерицидное действие на штаммы мастит-индуцирующего патогена S. aureus, которые после адгезии на поверхности эпителиоцитов молочной железы быстро проникают внутрь клеток, ускользая таким образом от бактериостатического контроля [Haggar A. et al. Extracellular adherence protein from Staphylococcus aureus enhances internalization into eukaryotic cells. 2003. V. 71. No. 5. P. 2310-2317; Brouillette E., Grondin G., Shkreta L. et al. In vivo and in vitro demonstration that Staphylococcus aureus is an intracellular pathogen in the presence or absence of fibronectin-binding proteins. Microb. Pathol. 2003. 35. 159-168]. Отсутствуют также данные о способности Lactobacillus fermentum Lc40 (CECT5716) элиминировать клетки S. aureus, находящиеся внутри эпителиоцитов молочной железы. В связи с этим, актуальной является разработка новых пробиотических лекарственных средств, оказывающих бактерицидное (бактериолитическое) действие на экстрацеллюлярные мастит-индуцирующие патогены молочной железы человека, способных также элиминировать интрацеллюлярные мастит-индуцирующие патогены, для комплексной профилактики и лечения лактационного мастита с преимущественным использованием штаммов, выделенных из молока здоровых женщин.
Раскрытие изобретения
Задачей заявленного изобретения является расширение ассортимента пробиотических лекарственных средств на основе новых штаммов лактобацилл, выделенных из женского молока, обладающих бактерицидной (бактериолитической) активностью к экстрацеллюлярным мастит-индуцирующим патогенам, а также способных элиминировать интрацеллюлярные мастит-индуцирующие патогены, для профилактики и лечения лактационного мастита у женщин в период грудного вскармливания ребенка.
Поставленная задача решена тем, что создан симбиотический консорциум на основе выделенных из женского молока пробиотических штаммов лактобацилл, обладающий бактерицидным (бактериолитическим) действием против экстрацеллюлярно обитающих в молочной железе мастит-индуцирующих патогенов, также способностью элиминировать эти патогены из эпителиоцитов молочной железы, для применения в медицине в качестве пробиотического лекарственного средства, предназначенного для комплексной профилактики и лечения лактационного мастита у женщин в период грудного вскармливания ребенка.
Штаммы симбиотическго консорциума L. reuteri MD IIE-43 и L. fermentum 3872 выделены из молока здоровых женщин, которые на момент обследования были клинически здоровы, не имели в анамнезе инфекционных заболеваний молочных желез, репродуктивного тракта, а также инфекционных заболеваний других систем и органов. Штаммы идентифицированы методом секвенирования гена 16S rRNA, отобраны и охарактеризованы в соответствии с требованиями по биобезопасности, которые приведены в Фармакопейной статье «Пробиотики для медицинского применения» Министерства здравоохранения Российской Федерации (Государственный стандарт качества лекарственных средств), опубликованной 19.09.2013 г. Штаммы депонированы (коллекционные номера L. reuteri BKM В-3144 D и L. fermentum BKM B-2793D) во Всероссийской коллекции микроорганизмов Института биохимии и физиологии микроорганизмов им. Г.К. Скрябина РАН Федерального исследовательского центра «Пущинский научный центр биологических исследований Российской академии наук» (ФИЦ ПНЦБИ РАН).
Активность (продуктивность) штаммов L. reuteri BKM В-3144 D и L. fermentum BKM В-2793 D.
На MRS -бульоне и других технологических средах продуктивность каждого штамма составляет 109 клеток/мл.
Безопасность штаммов L. reuteri BKM В-3144 D и L. fermentum BKM В-2793 D изучена в тестах in vivo согласно ОФС.1.7.2.0001.15.
Штаммы L. reuteri BKM В-3144 D и L. fermentum BKM В-2793 D безвредны, не обладают вирулентностью, токсигенностью и токсичностью.
Резистентность штаммов к желудочному и кишечному стрессу.
Штаммы L. reuteri BKM В-3144 D и L. fermentum BKM В-2793 D устойчивы к желудочному стрессу и кишечному стрессу.
Осуществление изобретения
Краткое описание изобретения.
Фиг. 1А, Б, В, Г. Антагонистическая активность штаммов L. reuteri BKM В-3144 D, L. fermentum BKM В-2793 D и их симбиотического консорциума к мастит-индуцирующему патогену S. aureus 8325-4.
Фиг. 1А. Интактные клетки мастит-индуцирующего патогена S. aureus 8325-4 (контроль).
Фиг. 1Б. Бактериолитическое действие клеток штамма L. reuteri BKM В-3144 D на клетки S. aureus 8325-4.
Фиг. 1В. Бактериолитическое действие клеток штамма L. fermentum BKM В-2793 D на клетки S. aureus 8325-4.
Фиг. 1Г. Бактериолитическое действие штаммов консорциума ЛМ-1 (L. reuteri BKM В-3144 D и L. fermentum BKM В-2793 D) на клетки S. aureus 8325-4.
Фиг. 2. Симбиотический консорциум лактобацилл ЛМ-1 (L. reuteri BKM B-3144D и L. fermentum BKM B-2793D) ингибирует продукцию IL-8 в эпителиоцитах MCF-7 молочной железы человека, индуцированную MALP2 (агонист TLR2/6) и LPS (агонист TLR4).
Примечания: 1 - интактные эпителиоциты MCF-7 (контроль); 2 - MALP2; 3 - MALP2+ЛМ-; 4 - LPS; 5 - LPS+ЛМ-1; 6 - ЛМ-1. ** р<0,01 - достоверность различий между LPS (4) и LPS+ЛМ-1 (5); *** р<0,001 - достоверность различий между MALP2 (2) и MALP2+ЛМ-1 (3).
Фиг. 3. Симбиотический консорциум лактобацилл ЛМ-1 (L. reuteri BKM B-3144D и L. fermentum BKM B-2793D) ингибирует продукцию IL-8, индуцированную агонистом MALP2 в первичных эпителиоцитах вымени коров.
Примечания: 1 - интактные эпителиоциты (контроль); 2 - MALP2; 3 - MALP2+ЛМ-1; 4 - MALP2+L. reuteri BKM B-3144D; 5 - MALP2+L. fermentum BKM B-2793D. * р<0,05 - достоверность различий между 1 и 4; 1 и 5; 3 и 4; 3 и 5. *** р<0,001 - достоверность различий между 2 и 3. Фиг. 4. Синергизм штаммов L. reuteri BKM B-3144D и L. fermentum BKM B-2793D, входящих в состав симбиотического консорциума ЛМ-1, при стимуляции продукции лактоферрина культурой первичных эпителиоцитов вымени коров.
Примечания: 1 - интактные эпителиоциты (контроль); 2 - L. reuteri BKM B-3144D; 3 - L. fermentum BKM B-2793D; 4 - ЛМ-1. * р<0,05 - достоверность различий между 1 и 2; 1 и 3. ** р<0,01 - достоверность различий между 1 и 4.
Фиг. 5. Синергизм штаммов L. reuteri BKM B-3144D и L. fermentum BKM B-2793D, входящих в состав симбиотического консорциума ЛМ-1, при стимуляции продукции лизоцима в клетках первичных эпителиоцитов вымени коров.
Примечания: 1 - интактные эпителиоциты; 2 - L. fermentum BKM B-2793D; 3 - L. reuteri BKM B-3144D; 4 - ЛМ-1. * р<0,05 - достоверность различий между 1 и 2; 1 и 3. ** р<0,01 - достоверность различий между 1 и 4.
Фиг. 6. Синергизм штаммов L. fermentum BKM B-2793D и L. reuteri BKM В-3144D, входящих в состав симбиотического консорциума ЛМ-1, при стимуляции продукции лактоферрина в клетках тканевых ММ6 макрофагов человека.
Примечания: 1 - интактные макрофаги ММ6; 2 - ММ6+L. fermentum BKM B-2793D; 3 - ММ6+L. reuteri BKM B-3144D; 4 - ММ6+ЛМ-1. ** р<0,01- достоверность различий между 1 и 2; 1 и 3. *** р<0,001 - достоверность различий между 1 и 4.
Фиг. 7. Синергизм консорциума штаммов L. fermentum BKM B-2793D и L. reuteri BKM B-3144D, входящих в состав симбиотического консорциума ЛМ-1, при стимуляции продукции лизоцима в клетках тканевых ММ6 макрофагов человека.
Примечания: 1 - интактные макрофаги (контроль); 2 - L. reuteri ВКМ B-3144D; 3 - L. fermentum BKM B-2793D; 4 - ЛМ-1. ** р<0,01 - достоверность различий между 1 и 2; 1 и 3. *** р<0,001- достоверность различий между 1 и 4.
Фиг. 8. Синергизм ингибирующего действия консорциума штаммов лактобацилл ЛМ-1 и лактоферрина на LPS-индуцированную продукцию IL-8, IL-1β и TNF-α клетками тканевых ММ6 макрофагов человека.
Примечания: 1 - интактные макрофаги (контроль); 2 - LPS 10 нг/мл; 3 - LPS 10 нг/мл + ЛФ 200 мкг/мл; 4 - LPS 10 нг/мл + ЛФ 200 мкг/мл + ЛМ-1 ((1.5×109 КОЕ /мл L. fermentum BKM B-2793D+1.5×109 КОЕ /мл L. reuteri BKM B-3144D). Время культивирования 16 часов ** р<0,01 - достоверность различий между 2 и 3; *** р<0,001 - достоверность различий между 2 и 4.
Фиг. 9. Симбиотический консорциум штаммов лактобацилл ЛМ-1 регулирует продукцию IL-10 и IL-12 в незрелых дендритных клетках человека.
Примечания: Количество НДК 105 клеток/мл. Соотношение НДК/лактобациллы 1:10. Время культивирования 24 часа. * р<0,05. ** р<0,01.
Фиг. 10. Динамика роста количества IgA-секретирующих клеток в молочных железах мышей, получавших перорально симбиотический консорциум штаммов лактобацилл ЛМ-1.
Примечание: * р<0,001 - достоверность различий между уровнем IgA+ клеток после пятидневного, семидневного приемов ЛМ-1 и контролем.
Фиг. 11. Увеличение количества IgA-секретирующих клеток в молочных железах мышей после перорального приема в течение пяти дней симбиотического консорциума лактобацилл ЛМ-1 и отдельных штаммов, входящих в его состав.
Примечание: * р<0,02 - достоверность различий между уровнем IgA+ клеток после приема ЛМ-1 и отдельных штаммов лактобацилл, входящих в его состав. *** р<0,001 - между ЛМ-1 и контролем.
Фиг. 12. Влияние перорального введения симбиотического консорциума штаммов лактобацилл ЛМ-1 на продукцию TGF-β и IgA антител иммунокомпетентными клетками Пейеровых бляшек мышей в системе in vitro.
Примечание: * р<0,05 - достоверность различий по сравнению с контролем.
Фиг. 13. Стимуляция продукции IL-6 симбиотическим консорциумом штаммов лактобацилл ЛМ-1 в эпителиоцитах MCF-7 молочной железы человека, активированных мастит-индуцирующим патогеном S. aureus 8325-4.
Примечания: в опытах использован инактивированный температурой штамм S. aureus 8325-4; MOI 10:1, время культивирования 6 ч. * р<0,05 - достоверность различий между интактными клетками MCF-7 и активированными S. aureus. ** р<0,01 и *** р<0,001 достоверность различий между клетками MCF-7, активированными S. aureus и активированными S. aureus + лактобациллы.
Фиг. 14. Ингибирование роста S. aureus 8325-4 внутри эпителиоцитов MCF-7 молочной железы человека при внесении в культуральную среду INF-γ.
Примечание: * р<0,01 - достоверность различий между INF-γ и К1, К2, IL-8, TNF-α, IL-1β.
Фиг.15. Влияние симбиотического консорциума штаммов лактобацилл ЛМ-1, добавленного в среду культивирования, на продукцию INF-γ и IL-4 спленоцитами мышей в системе in vitro.
Примечание: * р<0,01 - достоверность различий по сравнению с контролем.
Фиг. 16. Симбиотический консорциум штаммов лактобацилл ЛМ-1 повышает уровень INF-γ в крови мышей при пероральном введении.
Примечание: * р<0,05 - достоверность различий между контрольной и опытной группами мышей. 17. Ингибирование роста S. aureus 8325-4 в молочных железах лактирующих самок мышей, получавших per os консорциум штаммов ЛМ-1 (L. reuteri BKM В-3144D и L. fermentum BKM B-2793D) в течение 12 дней (7 дней до родов и 5 дней после родоразрешения) для профилактики лактационного мастита.
Примечания:
Острый лактационный мастит в опытной и контрольной группах лактирующих самок мышей индуцирован интрамаммарной инокуляцией S. aureus 8325-4 в дозе 1×104 КОЕ в объеме 50 мкл в каждую молочную железу (R4 и L4);
 - мыши, получавшие per os консорциум штаммов ЛМ-1 в дозе 109 КОЕ (5×108 КОЕ L. reuteri BKM B-3144D + 5×108 КОЕ L. fermentum BKM B-2793D) с профилактической целью в течение 12 дней (7дней до родов и 5 дней после родоразрешения) до индукции острого лактационного мастита (опыт);
- мыши, получавшие per os консорциум штаммов ЛМ-1 в дозе 109 КОЕ (5×108 КОЕ L. reuteri BKM B-3144D + 5×108 КОЕ L. fermentum BKM B-2793D) с профилактической целью в течение 12 дней (7дней до родов и 5 дней после родоразрешения) до индукции острого лактационного мастита (опыт);
 - мыши, получавшие per os стерильный ЗФР в течение 12 дней (7 дней до родов и 5 дней после родоразрешения) до индукции острого лактационного мастита (контроль).
- мыши, получавшие per os стерильный ЗФР в течение 12 дней (7 дней до родов и 5 дней после родоразрешения) до индукции острого лактационного мастита (контроль).
Осуществление изобретения подтверждается следующими примерами.
ЛМ-1 воздействует на 3 основных биомишени.
Биомишень 1: патогены, вызывающие мастит.
Биомишень 2: врожденный иммунитет (рецепторы TLR2/TLR6).
Биомишень 3: адаптивный гуморальный и клеточный иммунитет.
Примеры
Воздействие на Биомишень 1.
Пример 1.
Бактериолитическое действие штаммов L. reuteri BKM B-3144D, L. fermentum BKM B-2793D и их консорциума ЛМ-1 на мастит-индуцирующий патоген S. aureus 8325-4.
Метод определения бактериолитического действия лактобацилл L. reuteri BKM B-3144D, L. fermentum BKM B-2793D и их консорциума ЛМ-1 на S. aureus 8325-4.
Для изучения бактериолитического действия штаммов L. reuteri BKM B-3144D, L. fermentum BKM В-2793D и консорциума ЛМ-1 на S. aureus 8325-4 использовали метод сканирующей электронной микроскопии. Штаммы лактобацилл (18-часовая культура, выращенная на среде MRS, рН 6,5) перед смешиванием с патогеном дважды промывали ЗФР (рН 7,2) путем центрифугирования при 5000 об/мин в течение 15 мин и ресуспендировали в ЗФР. Штамм S. aureus 8325-4 (18-ти часовая культура, выращенная на среде TGYC, рН7.2) перед смешиванием с лактобациллами дважды промывали ЗФР (рН 7,2) путем центрифугирования при 5000 об/мин в течение 15 мин и ресуспендировали в ЗФР. Концентрацию бактерий определяли по оптической плотности и дополнительно контролировали высевом на плотную питательную среду. Далее готовили препараты, содержащие смеси суспензий бактерий: 1. - 4×107 КОЕ/мл S. aureus 8325-4 (контроль); 2. - 4×107 КОЕ/мл S. aureus 8325-4 + 4×108 КОЕ/мл L. reuteri BKM B-3144D; 3. - 4×107 КОЕ/мл S. aureus 8325-4 + 4×108 КОЕ/мл L. fermentum BKMB-27930; 4. - 4×107 КОЕ/мл S. aureus 8325-4 + 2×108 КОЕ/мл L. reuteri BKM B-3144D + 2×108 КОЕ/мл L. fermentum BKM B-2793D. Препараты культивировали в термостате при 37°С в течение 4-х часов, центрифугировали при 5000 об/мин в течение 15 мин и префиксировали путем ресуспендирования в какодилатном буфере, рН 7.2, содержащем 2.5% глютарового альдегида. Постфиксацию проводили в какодилатном буфере, рН 7.2, в который был добавлен 2% осмиум тетроксид. Препараты исследовали с помощью электронного сканирующего микроскопа (JEOL JSM 64000). Результаты исследований представлены на Фиг. 1А, Б, В, Г.
На Фиг. 1А показаны интактные клетки мастит-индуцирующего патогена S. aureus 8325-4 (контроль). Нативный пептидогликан формирует поверхностный ригидный нерастворимый защитный слой S. aureus [Vollmer W., Blanot D., de Pedro M. Peptidoglycan structure and architecture. FEMS Microbiol. Rev. 2008. 32: 149-167]. На Фиг. 1Б показано бактериолитическое действие штамма L. reuteri BKM B-3144D, продуцирующего бактериоцин реутерициклин. Этот бактериоцин не образует пор на клетке-мишени, а избирательно снижает трансмембранный протонный потенциал, проявляя бактериолитическое действие на клетки S. aureus 8325-4 [ М., Vogel R. Studies on the mode of action of reutericyclin. Appl. Environ. Microbiol. 2003. 69: 1305-1309;
М., Vogel R. Studies on the mode of action of reutericyclin. Appl. Environ. Microbiol. 2003. 69: 1305-1309;  M. Reutericuclin: biological activity, mode of action, and potential application. Appl. Microbiol. Bio-technol. 2004. Vol. 64. P. 326-332]. На Фиг. 1В показаны бактерицидные свойства штамма L. fermentum BKM В-2793 D, продуцирующего уникальный высокомолекулярный бактериолизин, относящийся к III классу. Этот бактериоцин оказывает выраженное бактериолитическое действие на клетки S. aureus 8325-4. Консорциум штаммов ЛМ-1 (L. reuteri BKM B-3144D+L. fermentum BKM В-2793 D) оказывает на патоген S. aureus 8325-4 бактериолитическое действие, реализуемое смесью высокомолекулярного бактериолизина, продуцируемого штаммом L. fermentum BKM В-2793 D, и реутерициклина, продуцируемого штаммом L. reuteri BKM B-3144D (Фиг. 1Г).
M. Reutericuclin: biological activity, mode of action, and potential application. Appl. Microbiol. Bio-technol. 2004. Vol. 64. P. 326-332]. На Фиг. 1В показаны бактерицидные свойства штамма L. fermentum BKM В-2793 D, продуцирующего уникальный высокомолекулярный бактериолизин, относящийся к III классу. Этот бактериоцин оказывает выраженное бактериолитическое действие на клетки S. aureus 8325-4. Консорциум штаммов ЛМ-1 (L. reuteri BKM B-3144D+L. fermentum BKM В-2793 D) оказывает на патоген S. aureus 8325-4 бактериолитическое действие, реализуемое смесью высокомолекулярного бактериолизина, продуцируемого штаммом L. fermentum BKM В-2793 D, и реутерициклина, продуцируемого штаммом L. reuteri BKM B-3144D (Фиг. 1Г).
Вывод. Штаммы L. reuteri BKM B-3144D, L. fermentum BKM B-2793D и их консорциум ЛМ-1 оказывают бактериолитическое действие на S. aureus 8325-4, использованный в опытах в качестве мастит-индуцирующего патоген.
Пример 2.
Антагонистическая активность штаммов L. reuteri BKM В-3144 D, L. fermentum BKM В-2793 D и их консорциума ЛМ-1 в отношении мастит-индуцирующих патогенов.
Метод оценки антагонистической активности.
Антагонистическую активность штаммов L. reuteri BKM В-3144 D, L. fermentum BKM В-2793 D и их консорциума ЛМ-1 изучали методом отсроченного антагонизма [Руководство по проведению доклинических исследований лекарственных средств (иммунобиологические лекарственные препараты). Часть вторая / под ред. А.Н. Миронова. - М.: Гриф и К, 2012. - 536 с] с использованием спектра индикаторных культур, включая клинические изоляты мастит-индуцирующих патогенов, обладающих антибиотикорезистентностью: Staphylococcus aureus 0-15, Staphylococcus aureus 8325-4 (резистентность к гентамицину), Staphylococcus aureus КИ-39 (резистентность к метициллину), Staphylococcus aureus КИ-12 (резистентность к оксациллину), Staphylococcus aureus КИ-17 (резистентность к эритромицину), Staphylococcus epidermidis АТСС 35984, Staphylococcus epidermidis КИ-Tan (резистентность к оксациллину), Staphylococcus epidermidis КИ-ИД (резистентность к клиндамицину), Streptococcus agalactiae КИ-50, Escherichia coli 0157:Н7, Escherichia coli АТСС 25922, Enterococcus faecalis АТСС 29212, Pseudomonas aeruginosa ATCC 27853.
Статистический анализ данных проводили с использованием t-критерия Стьюдента и стандартной программы Statistica 7.0.
Проведенные исследования позволили установить, что штаммы L. fermentum BKM В-2793 D и L. reuteri BKM В-3144 D, выделенные из молока здоровых женщин, а также их консорциум ЛМ-1 проявляют антагонистическую активность к мастит-индуцирующим патогенам (Таблица 1). Наиболее частые инфекционные агенты, вызывающие мастит - S. aureus и S. epidermidis, обладающие резистентностью к антибиотикам (гентамицин, метициллин, оксациллин, эритромицин, клиндамицин), оказались чувствительными к исследуемым лактобациллам L. fermentum BKM В-2793 D, L. reuteri BKM В-3144 D и их консорциуму ЛМ-1. Консорциум ЛМ-1 обладает более выраженной антагонистической активностью к мастит-индуцирующим патогенам по сравнению с отдельными штаммами лактобацилл, входящими в его состав.
Вывод. Консорциум штаммов лактобацилл ЛМ-1 обладает более выраженной антагонистической активностью к мастит-индуцирующим патогенам, включая штаммы, резистентные к антибиотикам, по сравнению с отдельными штаммами, входящими в его состав.

Пример 3.
Ингибирование адгезии мастит-индуцирующего патогена S. aureus 8325-4 на эпителиоцитах MCF-7 молочной железы человека симбиотическим консорциумом штаммов ЛМ-1 (L. reuteri BKM B-3144D, L. fermentum BKM B-2793D).
Метод определения уровня адгезивной активности штаммов L. reuteri BKM B-3144D, L. fermentum BKM B-2793D и S. aureus 8325-4 на биомодели перевиваемых эпителиоцитов MCF-7 молочной железы человека.
Для определения уровня адгезивной активности штаммов L. reuteri BKM B-3144D, L. fermentum BKM B-2793D и S. aureus 8325-4 в опытах использовали эпителиоциты перевиваемой клеточной линии MCF-7 молочной железы человека. В настоящее время эпителиоциты MCF-7 являются одной из наиболее распространенных релевантных клеточных биомоделей для исследований in vitro молочной железы человека [Lacroix М., Leclerq G. Relevance of breast tumors: an update. Breast Cancer Res.and Treatment. 2004. 83.3.249-289]. Штамм S. aureus 8325-4 был использован в качестве мастит-индуцирующего патогена, обладающего устойчивостью к гентамицину [Brouillette Е., Talbot В., Malouin F. The fibronectin-binding proteins of Staphylococcus aureus may promote mammary gland colonization in a lactating mouse model of mastitis. Infect. Immun. 2003. V. 71. No. 4. Р. 2292-2295]. Культуру MCF-7 эпителиоцитов выращивали на среде DMEM, содержащей 10% фетальной сыворотки теленка, 1% пенициллина и стрептомицина, 0,2 mM Hepes, 2 mM L-глутамина при 37°С в СО2 инкубаторе в атмосфере, содержащей 5% СО2. Эпителиоциты MCF-7 в концентрации 3,0×105 клеток/мл высевали на 6-ти луночные планшеты и культивировали 24 ч для формирования 70-80% монослоя. Планшеты с монослоем MCF-7 эпителиоцитов промывали трехкратно средой DMEM без сыворотки, затем на монослой клеток наносили среду DMEM, содержащую L-глутамин. Штаммы лактобацилл (18-часовая культура, выращенная на среде MRS, рН 6,5) перед добавлением к монослою MCF-7 эпителиоцитов дважды промывали ЗФР (рН 7,2) путем центрифугирования при 5000 об/мин в течение 15 мин и ресуспендировали в среде DMEM, содержащей L-глутамин. Концентрацию бактерий определяли по оптической плотности и контролировали высевом на плотную питательную среду. Множественность инфицирования (МОИ) составляла 200 бактерий на один MCF-7 эпителиоцит.
В первой серии экспериментов была изучена способность штаммов L. fermentum BKM B-2793D и L. reuteri BKM B-3144D к адгезии на поверхности монослоя MCF-7 эпителиоцитов. На монослой MCF-7 наносили клетки штаммов L. fermentum BKM B-2793D и L. reuteri BKM B-3144D. Планшеты, содержащие монослой MCF-7 эпителиоцитов с внесенными к ним лактобациллами инкубировали 5 ч при 37°С в СО2 инкубаторе в атмосфере, содержащей 5% СО2, затем лунки планшетов трижды промывали охлажденным ЗФР для удаления лактобацилл, не связавшихся с MCF-7 эпителиоцитами, фиксировали в холодном этаноле (3 мин), окрашивали по Романовскому-Гимза в течение 30 мин, промывали охлажденным ЗФР, высушивали при комнатной температуре и исследовали микроскопически. Определяли активность адгезии - количество MCF-7 эпителиоцитов из 100 проанализированных под микроскопом, содержащих на своей поверхности лактобациллы, в процентах, а также индекс адгезии штаммов лактобацилл, представляющий собой средний показатель адгезии (СПА), число микробов на поверхности одной клетки - микроб/клетка.
Индекс адгезии отдельных штаммов бактерий условно дифференцирован на четыре степени:
неадгезивную (СПА = 0);
слабоадгезивную (СПА = 1-5);
среднеадгезивную (СПА = 5-10);
высокоадгезивную (СПА выше 10).
Во второй серии экспериментов была изучена способность штамма S. aureus 8325-4 к адгезии на поверхности монослоя MCF-7 эпителиоцитов. Штамм S. aureus 8325-4 (18-ти часовая культура, выращенная на среде TGYC, рН 7.2) перед добавлением к монослою MCF-7 эпителиоцитов дважды промывали ЗФР (рН 7,2) путем центрифугирования при 5000 об/мин в течение 15 мин и ресуспендированы в среде DMEM, содержащей L-глутамин. Концентрацию бактерий определяли по оптической плотности и контролировали высевом на плотную питательную среду. Множественность инфицирования (МОИ) составляла 200 бактерий на один MCF-7 эпителиоцит.
На монослой MCF-7 эпителиоцитов наносили клетки штамма S. aureus 8325-4. Планшеты, содержащие монослой MCF-7 эпителиоцитов с внесенным к ним S. aureus 8325-4, инкубировали 5 ч при 37°С в СО2 инкубаторе в атмосфере, содержащей 5% СО2, затем лунки планшетов трижды промывали охлажденным ЗФР для удаления клеток штамма S. aureus 8325-4, не связавшихся с MCF-7 эпителиоцитами, фиксировали в холодном этаноле (3 мин), окрашивали по Романовскому-Гимза в течение 30 мин, промывали охлажденным ЗФР, высушивали при комнатной температуре и исследовали микроскопически. Определяли активность адгезии (%) и индекс адгезии клеток штамма S. aureus 8325-4.
В третьей серии экспериментов была изучена способность симбиотического консорциума штаммов ЛМ-1 (L. reuteri BKM B-3144D и L. fermentum BKM B-2793D), адгезированных на поверности монослоя MCF-7 эпителиоцитов обеспечивать колонизационную резистентность монослоя MCF-7 эпителиоцитов в отношении клеток штамма S. aureus 8325-4. На монослой MCF-7 эпителиоцитов наносили консорциум штаммов ЛМ-1 (L. reuteri BKM B-3144D и L. fermentum BKM B-2793D). МОИ составляла 200 бактерий на один MCF-7 эпителиоцит. Планшеты, содержащие монослой MCF-7 эпителиоцитов с внесенными к ним лактобациллами инкубировали 5 ч при 37°С в СО2 инкубаторе в атмосфере, содержащей 5% СО2, затем в лунки планшетов вносили клетки штамма S. aureus 8325-4 (МОИ составляла 200 бактерий на один MCF-7 эпителиоцит) и культивирование продолжали еще 5 часов. В качестве контроля служили планшеты с монослоем интактных MCF-7 эпителиоцитов без лактобацилл. На поверхность интактного монослоя MCF-7 эпителиоцитов наносили клетки штамма S. aureus 8325-4 (МОИ составляла 200 бактерий на один MCF-7 эпителиоцит) и инкубировали 5 ч при 37°С в СО2 инкубаторе в атмосфере, содержащей 5% СО2. Определяли активность адгезии - количество MCF-7 эпителиоцитов из 100 проанализированных под микроскопом, содержащих на своей поверхности лактобациллы и индекс адгезии.
Проведенные исследования позволили установить, что штаммы лактобацилл L. fermentum BKM В-2793D и L. reuteri BKM B-3144D являются высокоадгезивными для MCF-7 эпителиоцитов молочной железы человека. Высокая адгезивность пробиотических лактобацилл к эпителиоцитам молочной железы - важный критерий выбора штаммов с целью создания инновационного пробиотического препарата для профилактики и лечения лактационного мастита. Активность адгезии у L. fermentum BKM B-2793D и L. reuteri BKM B-3144D составляет 100±0%. Индекс адгезии у L. fermentum BKM В-2793D равен 32±6, у L. reuteri BKM B-3144D равен 21±5 клеток лактобацилл на один MCF-7 эпителиоцит, соответственно (Таблица 2).

Известно, что адгезины патогенных микроорганизмов относятся к факторам вирулентности [Rhem M.N. et al. The collagen-binding adhesin is a virulence factor in Staphylococcus aureus keratitis. Infect. Immun. 2000. V. 68. No. 6. Р. 3776-3779]. Адгезия патогенных микроорганизмов на клетках макроорганизма обеспечивает вирулентность этих патогенов. Согласно данным литературы на первой стадии инфекционного процесса адгезины мастит-индуцирующего S. aureus обеспечивают прикрепление бактериальной клетки данного патогена к поверхности эпителиоцитов молочной железы [Brouillette Е., Talbot В., Malouin F. The fibronectin-binding proteins of Staphylococcus aureus may promote mammary gland colonization in a lactating mouse model of mastitis. Infect. Immun. 2003. V. 71. No.4. P. 2292-2295]. На второй стадии инфекционного процесса адгезины S. aureus участвуют в интернализации клеток патогена в эпителиоциты молочной железы [Haggar A. et al. Extracellular adherence protein from Staphylococcus aureus enhances internalization into eukaryotic cells. 2003. V. 71. No. 5. Р. 2310-2317]. Проникновение клеток S. aureus в эпителиоциты молочной железы индуцирует развитие рецидивирующего лактационного мастита. Клетки S. aureus 8325-4 обладают высоким колонизационным потенциалом к интактным MCF-7 эпителиоцитам молочной железы человека. Установлено, что активность адгезии клеток S. aureus 8325-4 на поверхности интактных MCF-7 эпителиоцитов составляет 100±0% (Таблица 3).

Если монослой MCF-7 эпителиоцитов не экранирован консорциумом штаммов лактобацилл ЛМ-1, то при внесении в культуральную среду суспензии S. aureus 8325-4 происходит интенсивная колонизация MCF-7 эпителиоцитов внесенным патогеном. Адгезированные на поверхности MCF-7 монослоя клетки S. aureus 8325-4 не удаляются даже в процессе многократной промывки планшетов ЗФР, содержащих монослой интактных эпителиоцитов с адгезированным патогеном. Активность адгезии клеток S. aureus 8325-4 значительно снижается на поверхности MCF-7 эпителиоцитов, экранированных консорциумом штаммов лактобацилл ЛМ-1 (Таблица 3). Клетки S. aureus 8325-4 не могут прикрепиться к монослою MCF-7 эпителиоцитов в связи с эффективным экранированием специфических сайтов, используемых данным патогеном для адгезии, колонизации и последующего проникновения в эпителиоцит молочной железы. Симбиотический консорциум штаммов ЛМ-1 (L. reuteri BKM B-3144D и L. fermentum BKM B-2793D) эффективно защищает эпителиоциты MCF-7 от колонизации клетками S. aureus 8325-4, использованного в исследованиях в качестве мастит-индуцирующего патогена.
Вывод. Симбиотический консорциум штаммов ЛМ-1 (L. reuteri BKM В-3144D и L. fermentum BKM В-2793D) эффективно ингибирует адгезию мастит-индуцирующего патогена S. aureus 8325-4 на эпителиоцитах MCF-7 молочной железы человека.
Биомишень 2: врожденный иммунитет (рецепторы TLR2/6 и TLR4).
Воздействие на Биомишень 2.
Пример 4.
Взаимодействие ЛМ-1 с рецепторами врожденного иммунитета TLR2/6 и TLR4 на поверхности MCF-7 эпителиоцитов молочной железы человека и ингибирование продукции IL-8, являющегося биомаркером воспаления, вызываемого мастит-индуцирующими патогенами.
Метод определения биомишени 2.
В опытах использовали эпителиоциты перевиваемой клеточной линии MCF-7 молочной железы человека. Культуру MCF-7 эпителиоцитов выращивали на среде DMEM, содержащей 10% фетальной сыворотки теленка, 1% пенициллина и стрептомицина, 0,2 mM Hepes, 2 mM L-глутамина при 37°С в СО2 инкубаторе в атмосфере, содержащей 5% СО2. Далее эпителиоциты MCF-7 в концентрации 2,0×105 клеток/мл высевали на 24-луночные культуральные планшеты. В лунки под номером 2 дополнительно вносили по 50 nM MALP2 (агонист TLR2/6 рецепторов врожденного иммунитета). В лунки под номером 3 дополнительно вносили 50 nM MALP2+ЛМ-1 (1.5×109 L. fermentum BKM В-2793D + 1.5×109 L. reuteri BKM B-3144D). В лунки под номером 4 вносили 20 нг/мл LPS (агонист TLR4 рецепторов врожденного иммунитета). В лунки под номером 5 вносили по 20 нг/мл LPS+ЛМ-1 (1.5×109 L. fermentum BKM B-2793D + 1.5×109 L. reuteri BKM B-3144D). В лунки под номером 6 вносили ЛМ-1 (1.5×109 L. fermentum BKM B-2793D + 1.5×109 L. reuteri BKM B-3144D). Планшеты помещали в СО2 инкубатор на 16 часов при 37°С в атмосфере, содержащей 5% СО2. Продукцию IL-8 определяли в супернатантах MCF-7 эпителиоцитов методом sandwich ELISA после окончания культивирования клеток. Применяли тест-систему (ELISA kit Biosource International). Определение IL-8 проводили согласно инструкции, предложенной производителем.
Результаты исследований приведены на Фиг. 2. Продукция провоспалительного хемокина IL-8 эпителиоцитами MCF-7 молочной железы человека значительно повышается при внесении в культуральную среду MALP2 (агонист TLR2/6) или LPS (агонист TLR4). Цитокин IL-8 относится к СХС-хемокинам. Он выполняет роль хемотактического фактора и активатора нейтрофилов, особенно на этапе вовлечения их в процесс миграции в молочную железу. Toll-подобные рецепторы (TLRs) врожденного иммунитета экспрессируются на различных клетках, в том числе и на MCF-7 эпителиоцитах молочной железы человека. TLR4 относятся к первой линии защиты молочной железы от инфекционных патогенов [Medzhitov R. Toll-like receptors and innate immunity. Nature Rev.Immunol. 2001.1: 135-145. www.nature.com/reviews/Immunol]. Лактационный мастит представляет собой воспаление молочной железы у матери в период грудного вскармливания ребенка, вызываемое условно-патогенными и патогенными микроорганизмами. Воспаление возникает в результате исчезновения из микробиоты молочной железы лактобацилл, являющихся биомаркерами нормального состояния данного биотопа. [Fernandez L., Langa S., Martin V., et al. The human milk microbiota: origin and potential roles in health and disease. Pharmacol. Res. 2013. 69. 1-10; Jost Т., Lacroix C., Braegger C., et al. Assessment of bacterial diversity in breast milk using culture-dependent and culture-independent approaches. British Journal of Nutrition. 2013. 110. 1253-1262; Jost Т., Lacroix C., Braegger C., et al. Vertical mother-neonate transfer of maternal gut bacteria via breast-feeding. Environ. Microbiol. 2013. doi: 10.1111/1462-2920.12238; Ward Т., Hosid S., Ioshikhers I., et al. Human milk metagenome: a functional capacity analysis. BMC Microbiol.2013.13:116. http://ww.biomedcentral.com/1471-2180/13/1161. Симбиотический консорциум лактобацилл ЛМ-1 блокирует синтез IL-8 в MCF-7 эпителиоцитах, индуцированный агонистами MALP2 и LPS.
Вывод. Биомишенью 2 для симбиотического консорциума ЛМ-1 являются рецепторы врожденного иммунитета TLR2/6 и TLR4 на поверхности эпителиоцитов MCF-7 молочной железы человека. ЛМ-1 ингибирует продукцию хемокина IL-8, индуцированную MALP2 (агонист TLR2/6) и LPS (агонист TLR4).
Пример 5.
Ингибирование продукции IL-8, индуцированной MALP2 агонистом TLR2/6 рецепторов в первичных эпителиоцитов вымени коров штаммами L. fermentum BKM B-2793D, L. reuteri BKM B-3144D и их консорциумом ЛМ-1.
Метод получения первичных эпителиоцитов вымени коров.
Эпителиоциты получали по методу, предложенному в работе [Cifrian Е., Guidry С., O'Brien J., et al. Bovine mammary teat and ductal epithelial cell cultures. Am. J. Vet. Res. 1994B. 55. 239-246]. Ткань вымени коровы измельчали на мелкие кусочки, трижды промывали холодным ЗФР. Гомогенат трипсинизировали в ЗФР (Dulbecco В), содержащем 0.1% трипсина, 0.04% EDTA и 5 mg/ml коллагеназы D (Boehringer Mannheim, Almere, the Netherlands) при 37°C в водяной бане на качалке в течение 30 мин. Эпителиоциты выделяли пассажем через 100-μm нейлоновую вату (Falcon, Micronic, Lelystad, the Netherlands), центрифугировали (5 мин, 100 g), двухкратно отмывали ЗФР. Процедуру трипсинизации повторяли. Клетки центрифугировали (10 мин, 400 g). Осадок эпителиоцитов ресуспендировали в среде RPMI-1640, содержащей аминокислоты (0.1 mM L-метионин, 0.4 mM L-лизин), NaHCO3 (2g/1), неомицин сульфат, полимиксин В сульфат, 10% эмбриональной сыворотки теленка (ЭСТ), пролактин (1 μg/ml), гидрокортизон (1 μg/ml), инсулин (1 μg/ml). Клетки сеяли в культуральные матрасы 75-cm2 (Falcon) и выращивали в 5% атмосфере СО2 при 37°С в течение 3-х суток. Полученная культура клеток положительно окрашивались антицитокератиновыми антителами (DAKO, Glostrup, Denmark), что характерно для эпителиоцитов. Далее культуру эпителиоцитов в концентрации 2,0×105 клеток/мл, вносили в лунки 24-луночных планшетов (Falcon). Для культивирования клеток использовали среду RPMI-1640, содержащую аминокислоты (0.1 mM L-метионин, 0.4 mM L-лизин), NaHCO3 (2g/1),10% ЭСТ, пролактин (1 μg/ml), гидрокортизон (1 μg/ml), инсулин (1 μg/ml). Лунки под номером 1 содержали только культуру эпителиоцитов (контроль). В лунки под номером 2 дополнительно вносили 50 nM MALP2. В лунки под номером 3 дополнительно вносили 50 nM MALP2 + ЛМ-1 (1.5×109 КОЕ /мл L. fermentum BKM B-2793D + 1.5×109 КОЕ/мл L. reuteri BKM В-3144D). В лунки под номером 4 вносили 50 nM MALP2 + L. reuteri BKM В-3144D (3×109 КОЕ/мл). В лунки под номером 5 вносили 50 nM MALP2 + L. fermentum BKM B-2793D (3×109 КОЕ/мл). Планшеты помещали в СО2 инкубатор на 16 ч при 37°С в атмосфере, содержащей 5% СО2. Продукцию IL-8 определяли в супернатантах методом sandwich ELISA после культивирования клеток в течении 16 ч. Применяли тест-систему (ELISA kit Biosource International). Определение IL-8 проводили согласно инструкции, предложенной производителем. Результаты исследований приведены на Фиг. 3. Штаммы L. fermentum BKM B-2793D и L. reuteri BKM B-3144D ингибируют продукцию IL-8 в культуре первичных эпителиоцитов вымени коров. ЛМ-1 более эффективно ингибирует продукцию IL-8 в культуре первичных эпителиоцитов вымени коров по сравнению с отдельными штаммами лактобацилл L. fermentum BKM В-2793 D и L. reuteri BKM В-3144 D, входящими в его состав.
Вывод. Штаммы L. fermentum BKM B-2793D и L. reuteri BKM B-3144D ингибируют продукцию IL-8 в культуре первичных эпителиоцитов вымени коров. ЛМ-1 более эффективно ингибирует продукцию IL-8 по сравнению с отдельными штаммами лактобацилл (L. fermentum BKM В-2793 D и L. reuteri BKM В-3144 D), входящими в его состав.
Пример 6.
Стимуляция продукции лактоферрина и лизоцима штаммами L. fermentum BKM B-2793D, L. reuteri BKM B-3144D и их консорциумом ЛМ-1 в первичных эпителиоцитах вымени коров.
Первичные эпителиоциты вымени коров выращивали в культуральных матрасах 25-cm2 (Falcon) в среде RPMI-1640, содержащей аминокислоты (0.1 mM L-метионин, 0.4 mM L-лизин), NaHCO3 (2g/1), неомицин сульфат, полимиксин В сульфат, 10% ЭСТ, пролактин (1 μg/ml), гидрокортизон (1 μg/ml), инсулин (1 μg/ml). Культивирование проводили в 5% атмосфере СО2 при 37°С в течение 3-х суток. Далее культуру клеток пересевали в 24-луночные планшеты в концентрации 3,0×105 кл/мл. Лунки под номером 1 содержали только культуру первичных эпителиоцитов. В лунки под номером 2 дополнительно вносили L. reuteri BKM B-3144D (3×106 КОЕ/мл); в лунки под номером 3 дополнительно вносили L. fermentum BKM B-2793D (3×106 КОЕ/мл); в лунки под номером 4 дополнительно вносили ЛМ-1 (1.5×106 КОЕ /мл L. fermentum BKM B-2793D + 1.5×106 L. reuteri BKM В-3144D). Планшеты помещали в СО2 инкубатор на 24 часа при 37°С в атмосфере, содержащей 5% СО2. После окончания культивирования эпителиоцитов в супернатантах определяли уровень секреции лактоферрина и лизоцима методом sandwich ELISA. Для оценки концентрации лактоферрина применяли тест-систему ELISA, производимую Всероссийским научно-исследовательским институтом физиологии, биохимии и питания сельскохозяйственных животных, ГНУ (ВНИИФБиП). Чувствительность тест-системы 2 нг/мл. Для оценки концентрации лизоцима применяли Bovine Lysozyme ELISA kit (ELISAGenie, UK). Чувствительность тест-системы 1 нг/мл. Определение концентрации исследуемых белков проводили согласно инструкции, предложенной производителем. Результаты исследований приведены на Фиг. 4 и Фиг. 5. Штаммы L. fermentum BKM B-2793D и L. reuteri BKM B-3144D стимулируют продукцию лактоферрина и лизоцима в первичных эпителиоцитах вымени коров. Отмечается синергизм действия лактобацилл в составе консорциума ЛМ-1. Лактоферрин и лизоцим являются молекулярными факторами врожденного иммунитета. Они циркулируют в биологических жидкостях, защищают слизистые поверхности организма человека и животных от патогенов [Mathur N., Dwarcadas A., Sharma V. et al. Anti-infective factors in preterm human colostrum. Acta Paediatr. Scand. 1990. 79: 1039-1044; Thompson A., Bohling Т., Payvandi F., Rennard S. Lower respiratory tract lactoferrin and lysozyme arise primarily in the airways and are elevated in association with chronic bronchitis. J. Lab. Clin. Med. 1990. 115: 148-158]. Известно, что лактоферрин ингибирует адгезию и инвазию патогенов в эпителиоциты организма-хозяина [Kawasaki J., Tazume S., Shimizu K et al. Inhibitory effects of bovine lactoferrin on the adherence of enterotoxigenic Escherichia coli to host cells. Biosc. Biotechnol. Biochem. 2000. 64 348-354; Nascimento de Araujo A., Giugliano L. Human milk fractions inhibit the adherence of diffusely adherent Escherichia coli (DAEC) and enteroaggregative E. coli (EAEC) to Hela cells. FEMS Microbiol. Lett. 2000. 184: 91-94]. Лизоцим усиливает бактерицидное действие лактоферрина на патогены [Edde L., Hipolito R., Hwang F. et al. Lactoferrin protects neonatal rats from gut-related systemic infection. Am. J. Physiol. Gastrointest. Liver Physiol. 2001. 281: 1140-1150].
Вывод. Симбиотический консорциум ЛМ-1 (L. fermentum BKM B-2793D и L. reuteri BKM B-3144D) повышает продукцию основных протективных белков врожденного иммунитета лактоферрина и лизоцима в первичных эпителиоцитах вымени коров.
Пример 7.
Стимуляция продукции лактоферрина и лизоцима штаммами L. fermentum BKM В-2793 D, L. reuteri BKM B-3144D и их консорциумом ЛМ-1 в клетках тканевых макрофагов ММ6 человека.
Тканевые макрофаги ММ6 человека выращивали в среде RPMI-1640, содержащей 1% пенициллина и стрептомицина, в матрасах 25-cm2 (Falcon) в СО2 инкубаторе при 37°С, 5% СО2 в течение 24 ч. Далее культуру макрофагов ММ6 в концентрации 3×105 клеток/мл пересевали в среду RPMI-1640 в лунки 24-луночных планшетов (Falcon). Лунки под номером 1 содержали только культуру макрофагов ММ6. В лунки под номером 2 дополнительно вносили L. reuteri BKM B-3144D (3×106 КОЕ/мл); в лунки под номером 3 дополнительно вносили L. fermentum BKM B-2793D (3×106 КОЕ/мл); в лунки под номером 4 дополнительно вносили ЛМ-1 (1.5×106 КОЕ /мл L. fermentum BKM B-2793D + 1.5×106 L. reuteri BKM В-3144D). Планшеты помещали в СО2 инкубатор на 24 ч при 37°С в атмосфере, содержащей 5% СО2. После окончания культивирования тканевых макрофагов ММ6 в супернатантах определяли уровень секреции лактоферрина и лизоцима методом sandwich ELISA. Для оценки концентрации лактоферрина применяли тест-систему Human Lactoferrin ELISA kit (ELISAGenie, UK). Чувствительность тест-системы 1 нг/мл. Для оценки концентрации лизоцима применяли тест-систему Human Lysozyme ELISA kit (ELISAGenie, UK). Чувствительность тест-системы 1 нг/мл. Определение концентрации исследуемых белков проводили согласно инструкции, предложенной производителем.
Результаты исследований приведены на Фиг. 6 и Фиг. 7. Перевиваемые тканевые макрофаги ММ6 человека обладают выраженной способностью продуцировать лактоферрин и лизоцим в присутствии штаммов L. fermentum BKM B-2793D и L. reuteri BKM B-3144D. Симбиотический консорциум ЛМ-1 является более эффективным стимулятором продукции молекулярных факторов врожденного иммунитета в тканевых макрофагах ММ6 по сравнению с отдельными штаммами лактобацилл, входящими в его состав. Одновременное присутствие в молочной железе лактоферрина и лизоцима имеет важное значение для элиминации мастит-индуцирующих патогенов и профилактики лактационного мастита [Ellison R., Giehl Т. Killing of gram-negative bacteria by lactoferrin and lysozyme. J. Clin. Invest. 1991. 88 (4): 1080-1091].
Вывод. Симбиотический консорциум штаммов лактобацилл ЛМ-1 эффективно стимулирует продукцию лактоферрина и лизоцима в тканевых макрофагах, являющихся одним из основных клеточных компонентов врожденного иммунитета, обеспечивающих защиту молочной железы от мастит-индуцирующих патогенов.
Пример 8.
Синергизм ингибирующего действия ЛМ-1 и лактоферрина на LPS-индуцированную продукцию провоспалительных цитокинов в клетках тканевых макрофагов ММ6 человека.
Известно, что воспаление является быстрым развитием защитной функции врожденного иммунитета [Medzhitov R., 2001]. Избыточное проявление воспалительной реакции врожденного иммунитета лежит в основе патогенетических механизмов многих заболеваний человека. При дисбиозе молочной железы тканевые макрофаги выполняют ключевую роль в избыточном проявлении воспаления в молочной железе и патогенезе лактационного мастита [Elazar S., Gonen Е., Livnen-Kol A., Rosenshine I., Shpigel N. Neutrophil recruitment in endotoxin-induced murine mastitis is strictly dependent on mammary alveolar macrophages. Vet. Res. 2010. 41:10. DOI: 10.1051/vetres/2009058]. Лактоферрин принимает участие в регуляции воспаления и обеспечении иммунного гомеостаза [Rosa L., Cutone A., Lepanto М. et al. Lactoferrin: a natural glycoprotein involved in iron and inflammatory homeostasis. Int. J. Mol. Sci. 2017. Doi: 10.3390/ijms18091985].
Метод оценки синергизма ингибирующего действия ЛМ-1 и лактоферрина (ЛФ) на LPS-индуцированную продукцию провоспалительных цитокинов в клетках тканевых макрофагов ММ6 человека. В опытах использовали лактоферрин человека (Sigma, USA). Степень насыщения железом составляла 15%. Тканевые макрофаги ММ6 человека выращивали в среде RPMI-1640, содержащей 1% пенициллина и стрептомицина, в матрасах 25-cm2 (Falcon) в СО2 инкубаторе при 37°С, 5% СО2 в течение 24 ч. Далее культуру макрофагов ММ6 в концентрации 3×105 клеток/мл пересевали в RPMI-1640 в лунки 24-луночных планшетов (Falcon). Лунки под номером 1 содержали только культуру макрофагов ММ6 (контроль). В лунки под номером 2 дополнительно вносили 10 нг/мл LPS; в лунки под номером 3 дополнительно вносили 10 нг/мл LPS+200 мкг/мл ЛФ; в лунки под номером 4 дополнительно вносили 10 нг/мл LPS+200 мкг/мл ЛФ+ЛМ-1 (1.5×109 КОЕ /мл L. fermentum BKM В-2793D + 1.5×109 КОЕ /мл L. reuteri BKM B-3144D). Планшеты помещали в СО2 инкубатор на 16 ч при 37°С в атмосфере, содержащей 5% СО2. После окончания культивирования тканевых макрофагов ММ6 в супернатантах определяли концентрацию IL-8, IL-1β и TNF-α методом sandwich ELISA. Применяли коммерческие наборы для определения IL-8 (ELISA kit Biosource International), IL-1β и TNF-α (ФГУП «Гос. НИИ ОЧБ» ФМБА России, Санкт-Петербург). Определение цитокинов проводили согласно инструкциям, предложенным производителями. Результаты исследований приведены на Фиг. 8. ЛМ-1 и лактоферрин проявляют синергизм в ингибировании LPS-индуцированной продукции IL-8, IL-1β и TNF-α перевиваемой линией тканевых макрофагов ММ6 человека.
Вывод. Симбиотический консорциум лактобацилл ЛМ-1 (L. reuteri BKM B-3144D и L. fermentum BKM B-2793D) проявляет синергизм с лактоферрином в ингибировании LPS-индуцированной продукции провоспалительных цитокинов IL-8, IL-1β и TNF-α в клетках тканевых макрофагов ММ 6 человека.
Пример 9.
Влияние симбиотического консорциума штаммов лактобацилл ЛМ-1 (L. reuteri BKM B-3144D и L. fermentum BKM B-2793D) на продукцию IL-10 IL-12 незрелыми дендритными клетками человека. Метод получения незрелых дендритных клеток человека.
Незрелые дендритные клетки получали по методу, предложенному в работе [Ardavin С., Martinez del Hoyo G., Martin P. et al. Origin and differentiation of dendritic cells. Trends. Immunol. 2001. 22: 691-700] в модификации. Моноциты периферической крови были выделены из свежей гепаринизированной крови здоровых доноров на Ficoll-Hypaque (Sigma, USA) центрифугированием в градиенте плотности, трехкратно промыты и ресуспендированы в среде RPMI 1640 (Sigma, St. Louis, МО, USA). Моноциты дополнительно очищали с использованием магнитных бус (MACS, Miltenyi Biotec, Auburn, CA). Магнитные бусы содержали иммобилизованные антитела к: CD3 (Т лимфоциты), CD7 (T/NK клетки), CD16 (NK клетки), CD19 (В лимфоциты), CD56 (NK клетки), CD123 (дендритные клетки и базофилы), антитела к гликофорину А (эритроциты и ретикулоциты). Для получения незрелых дендритных клеток моноциты 1,5×106 клеток/мл культивировали в пластиковых матрасах (75 см2) в среде RPMI 1640 (20 мл), содержащей IL-4 (500 МЕ/мл), GM-CSF (800 МЕ/мл) и 10% сыворотки крови человека в течение 6-ти дней.
Незрелые дендритные клетки (НДК) пересевали в 24-луночные планшеты. Посевная доза на лунку составляла 105 клеток/мл. Первая контрольная группа лунок содержала интактные НДК; вторая опытная группа лунок содержала НДК+LPS 10 нг/мл; третья опытная группа лунок содержала НДК+106 КОЕ/мл L. reuteri BKM В-3144D; четвертая опытная группа лунок содержала НДК+106 КОЕ/мл L. fermentum BKM B-2793D; пятая опытная группа лунок содержала НДК+ЛМ-1 (5×105 КОЕ /мл L. fermentum BKM B-2793D + 5×105 КОЕ /мл L. reuteri BKM B-3144D). Планшеты помещали в CO2 инкубатор на 24 ч при 37°С в атмосфере, содержащей 5% СО2. После окончания культивирования НДК в супернатантах определяли концентрацию IL-10 и IL-12 методом sandwich ELISA. Применяли коммерческие наборы (ELISA kits Biosource International: human 11-10, sensitivity 5 pg/ml; human IL-12, sensitivity 5 pg/ml). Определение цитокинов проводили согласно инструкциям, предложенным производителем. Результаты исследований приведены на Фиг. 9. Штаммы L. fermentum BKM B-2793D, L. reuteri BKM B-3144D и их консорциум ЛМ-1 стимулируют продукцию IL-10 и ингибируют продукцию IL-12 в незрелых дендритных клетках человека, что препятствует спонтанному созреванию этих клеток и развитию воспаления в молочной железе при мастите. Дендритные клетки слизистых оболочек организма формируют иммунный ответ и регулируют развитие воспаления. Незрелые дендритные клетки выполняют функции биосенсоров врожденного иммунитета и обеспечивают иммунный гомеостаз [Kelsall B.L., Rescigno М. Mucosal dendritic cells in immunity and inflammation.Nat. Immunol. 2004. 5. 1091-1095]. Биомишень 3: адаптивный гуморальный и клеточный иммунитет
Воздействие на Биомишень 3.
Пример 10.
Стимуляция образования IgA-секретирующих клеток в молочных железах мышей при пероральном введении штаммов L. fermentum BKM B-2793D, L. reuteri BKM B-3144D и их симбиотического консорциума ЛМ-1.
Метод оценки влияния штаммов L. fermentum BKM B-2793D, L. reuteri BKM B-3144D и их консорциума ЛМ-1 на образование IgA-секретирующих клеток в молочных железах самок мышей.
Оценку влияния штаммов L. fermentum BKM B-2793D, L. reuteri BKM В-3144D и их консорциума ЛМ-1 на образование IgA-секретирующих клеток в молочных железах самок мышей проводили по методу, предложенному в работе [de Moreno de LeBlanc A., Maldonado Galdeano C., Chaves S., Perdigon G. Oral administration of L. casei CRL431 increases immunity in bronchus and mammary glands. Europ. J. Inflam. 2005. V. 3. №1. 25-30]. В опытах использовали мышей самок BALB/c в возрасте 6-8 недель весом 25-30 г. (Воду и корм животным предоставляли ad libitum. Исследования проводились в соответствии с регуляциями Комитета по работе с животными ОАО «ИИИ». В первой серии экспериментов исследовали динамику роста количества IgA+ клеток в ткани молочной железы, индуцируемого пероральным введением в течение 7 дней консорциума штаммов ЛМ-1. Было сформировано 4 группы. Каждая группа содержала по 6 животных. Группа 1 (опыт) получала в питьевой воде ЛМ-1 (1.5×109 клеток/мл L. fermentum BKM B-2793D + 1.5×109 клеток/мл L. reuteri BKM B-3144D) в течение 2 последовательных дней. Группа 2 (опыт) получала в питьевой воде ЛМ-1 (1.5×109 клеток/мл L. fermentum BKM B-2793D + 1.5×109 клеток/мл L. reuteri BKM B-3144D) в течение 5 последовательных дней. Группа 3 (опыт) получала в питьевой воде ЛМ-1 (1.5×109 клеток/мл L. fermentum BKM B-2793D + 1.5×109 клеток/мл L. reuteri BKM B-3144D) в течение 7 последовательных дней. Группа 4 (контроль) получала чистую питьевую воду в течение 7 последовательных дней. По завершении времени получения ЛМ-1 животных из опытных групп усыпляли с помощью СО2, извлекали молочные железы и готовили препараты для иммуногистохимических исследований. Количество IgA+ клеток в препаратах ткани молочной железы мышей определяли методом прямой иммунофлюоресценции с использованием моноспецифических антител, меченых FITC (FITC, Sigma, USA). Светящиеся клетки подсчитывали при 1000-кратном увеличении с помощью флуоресцентного микроскопа. Результаты выражали как среднее (М) из трех независимых экспериментов ± стандартное отклонение (SD). Полученные результаты исследований приведены на Фиг. 10. ЛМ-1 эффективно стимулирует образование IgA-секретирующих клеток в молочных железах мышей. При пероральном введении мышам ЛМ-1 в течение 5 последовательных дней в ткани молочных желез мышей отмечалось максимальное количество IgA+ клеток, которое не увеличивалось при продлении срока введения ЛМ-1 до 7 дней. В связи с этим во второй серии экспериментов животным вводили ЛМ-1 и входящие в его состав штаммы L. fermentum BKM B-2793D и L. reuteri BKM B-3144D в течение 5 дней. Во второй серии экспериментов было сформировано 4 группы. Каждая группа содержала по 6 животных. Группа 1 (контроль) получала чистую питьевую воду в течение 5 последовательных дней. Группа 2 (опыт) получала в питьевой воде клетки штамма L. fermentum BKM B-2793D (3×109 клеток/мл) в течение 5 последовательных дней. Группа 3 (опыт) получала в питьевой воде клетки штамма L. reuteri BKM В-3144D (3×109 клеток/мл) в течение 5 последовательных дней. Группа 4 (опыт) получала в питьевой воде лекарственный кандидат ЛМ-1 (1.5×109 клеток/мл L. fermentum BKM B-2793D + 1.5×109 клеток/мл L. reuteri BKM B-3144D) в течение 5 последовательных дней. Через 5 дней животных контрольной и опытных групп усыпляли с помощью СО2, извлекали молочные железы и готовили препараты для иммуногистохимических исследований. Результаты исследований приведены на Фиг. 11. Штаммы L. fermentum BKM B-2793D и L. reuteri BKM B-3144D, входящие в состав консорциума штаммов лактобацилл ЛМ-1, проявляют синергизм при стимуляции образования IgA-секретирующих клеток в молочных железах мышей (Фиг. 11).
Вывод. При пероральном введении симбиотический консорциум штаммов ЛМ-1 (L. reuteri BKM В-3144D и L. fermentum BKM B-2793D) эффективно стимулирует образование IgA-секретирующих клеток в молочных железах мышей.
Пример 11.
Стимуляция продукции TGF-β и IgA антител иммунокомпетентными клетками Пейеровых бляшек мышей под влиянием симбиотического консорциума штаммов ЛМ-1.
Для оценки влияния ЛМ-1 на продукцию TGF-β и IgA антител иммунокомпетентными клетками Пейеровых бляшек, а также продукцию INF-γ и IL-4 спленоцитами мышей было сформировано 2 группы по 10 животных в каждой. В опытах использовали мышей самок BALB/c в возрасте 6-8 недель весом 25-30 г. Исследования проводились в соответствии с регуляциями Комитета по работе с животными ОАО «НИИ». Опытная группа получала в питьевой воде симбиотический консорциум штаммов ЛМ-1 (1.5×109 клеток/мл L. fermentum BKM B-2793D + 1.5×109 клеток/мл L. reuteri BKM В-3144D) в течение 5 последовательных дней. Контрольная группа получала чистую питьевую воду в течение 5 последовательных дней. Через 5 дней животных контрольной и опытных групп усыпляли с помощью СО2, извлекали Пейеровы бляшки тонкого кишечника и выделяли из них иммунокомпетентные клетки. Селезенки животных извлекали для получения спленоцитов.
Метод выделения иммунокомпетентных клеток из Пейеровых бляшек мышей. Пейеровы бляшки выделяли из тонкой кишки мышей. Иссекали тонкую кишку промывали раствором Кребса-Рингера, разрезали по линии брыжейки, вырезали ПБ (овальные узелковые скопления лимфоидной ткани) из подвздошной кишки и помещали в среду RPMI-1640, содержащую 10% эмбриональной сыворотки теленка, 0.2 М HEPES, и 25 Ед/мл коллагеназы. Клетки инкубировали при 37°С на магнитной мешалке 10 мин. Клеточную суспензию фильтровали через нейлоновое ситечко, центрифугировали при 500g 10 мин, супернатант удаляли, к осадку добавляли среду RPMI-1640 и повторяли центрифугирование для отмывки клеток. Осадок клеток ресуспендировали в среде RPMI-1640, содержащей 10% эмбриональной сыворотки теленка. Полученные клетки лимфоидных узелков Пейеровых бляшек 5×105 клеток/мл культивировали в 96-луночных планшетах (Costar-Corning). Продукцию TGF-β и IgA исследовали методом sandwich ELISA. Применяли коммерческие наборы для определения TGF-β (Bio Sourse international, Camarillo, USA, sensitivity, 5 pg/ml), IgA (Bethyl Laboratories, Inc., Montgomery, USA, sensitivity, 50 pg/ml). Определение TGF-β и IgA проводили согласно инструкциям, предложенным производителями. Результаты исследований приведены на Фиг. 12. ЛМ-1 при пероральном введении мышам стимулирует продукцию TGF-β и IgA антител иммунокомпетентными клетками Пейеровых бляшек мышей.
Пейеровы бляшки тонкого кишечника являются основным компонентом лимфоидной ткани, ассоциированной с желудочно-кишечным трактом (gut-associated lymphoid tissue: GALT) и выполняют функции иммунных биосенсоров пищеварительной системы организма [Jung С., Hugot J., Barreau F. Peyers patches: the immune sensors of the intestine. Int. J. Inflam.2010. doi: 10.4061/2010/823710]. B-лимфоциты лимфоидной ткани, ассоциированной с желудочно-кишечным трактом (gut-associated lymphoid tissue: GALT) с помощью СД4+ Т-лимфоцитов в присутствии IL-6 и TGF-β превращаются в плазматические клетки, продуцирующие секреторный IgA изотип антител нейтрализующих патогенные бактерии, токсины и вирусы. Эти плазматические клетки диссеминируют в лимфоидную ткань молочных желез и другие органы, внося таким образом существенный вклад в защиту организма от инфекционных агентов и токсических субстанций. При лактационном мастите ведущая роль в развитии воспаления и нейтрофильной инфильтрации пораженного органа принадлежит активированным макрофагам альвеол молочной железы [Elazar et al., 2010]. Для устранения нейтрофильной инфильтрации молочной железы и снижения воспалительного процесса необходима деактивация макрофагов без уменьшения их бактерицидной активности. Этими свойствами обладает TGF-β [Ashcroft G.S. Bidurectional regulation of macrophage function by TGF-beta. Microbes Infect. 1999. 1 (15): 1275-1282].
Вывод. Пероральное введение симбиотического консорциума штаммов ЛМ-1 (L. reuteri BKM В-3144D и L. fermentum BKM B-2793D) мышам стимулирует продукцию TGF-β и IgA антител иммунокомпетентными клетками Пейеровых бляшек.
Пример 12.
Стимуляция продукции IL-6 в эпителиоцитах MCF-7 молочной железы человека штаммами L. fermentum BKM B-2793D, L. reuteri BKM B-3144D и их консорциумом ЛМ-1.
Культуру MCF-7 эпителиоцитов выращивали на среде DMEM, содержащей 10% фетальной сыворотки теленка, 1% пенициллина и стрептомицина, 0,2 mM Hepes, 2 mM L-глутамина при 37°С в СО2 инкубаторе в атмосфере, содержащей 5% СО2. Далее эпителиоциты MCF-7 в концентрации 3,0×105 клеток/мл пересевали на среду DMEM, содержащую 10% фетальной сыворотки теленка, 0,2 mM Hepes, 2 mM L-глутамина в 24-луночные культуральные планшеты. Лунки под номером 1 (контроль 1) содержали только интактые эпителиоциты MCF-7. В лунки под номером 2 (контроль 2) дополнительно вносили инактивированные нагреванием клетки S. aureus 8325-4 в концентрации 1,0×106 клеток/мл. В лунки под номером 3 дополнительно вносили L. fermentum BKM B-2793D в концентрации 3.0×109 клеток/мл. В лунки под номером 4 дополнительно вносили L. reuteri BKM B-3144D в концентрации 3.0×109 клеток/мл. В лунки под номером 5 дополнительно вносили ЛМ-1 (1.5×109 клеток/мл L. fermentum BKM B-2793D + 1.5×109 клеток/мл L. reuteri BKM B-3144D). В лунки под номером 6 дополнительно вносили (1,0×106 клеток/мл S. aureus 8325-4+3.0×109 клеток/мл L. fermentum BKM В-2793D). В лунки под номером 7 дополнительно вносили (1,0×106 клеток/мл S. aureus 8325-4 + 3.0×109 клеток/мл L. reuteri BKM В-3144D). В лунки под номером 8 дополнительно вносили 1,0×106 клеток/мл S. aureus 8325-4 + ЛМ-1 (1.5×109 клеток/мл L. fermentum BKM B-2793D + 1.5×109 клеток/мл L. reuteri BKM В-3144D). Планшеты помещали в СО2 инкубатор на 16 часов при 37°С в атмосфере, содержащей 5% СО2. Продукцию IL-6 определяли в супернатантах MCF-7 методом ELISA после культивирования клеток в течении 16 часов. Применяли тест-систему (ELISA kit Biosource International, sensitivity, 2 pg/ml). Определение IL-6 проводили согласно инструкции, предложенной производителем. Результаты исследований приведены на Фиг. 13. Штаммы L. fermentum BKM B-2793D, L. reuteri BKM B-3144D и их консорциум ЛМ-1 стимулируют продукцию IL-6 в эпителиоцитах MCF-7 молочной железы человека при внесении в культуральную среду мастит-индуцирующего патогена S. aureus 8325-4.
Вывод. Штаммы L. fermentum BKM B-2793D, L. reuteri BKM B-3144D и их консорциум ЛМ-1 стимулируют продукцию IL-6 в эпителиоцитах MCF-7 молочной железы человека при внесении в культуральную среду мастит-индуцирующего патогена S. aureus 8325-4.
Пример 13.
IFN-γ ингибирует внутриклеточный рост S. aureus 8325-4 в эпителиоцитах MCF-7 молочной железы человека.
Культуру эпителиоцитов MCF-7 выращивали на среде DMEM, содержащей 10% фетальной сыворотки теленка, 1% пенициллина и стрептомицина, 0,2 mM Hepes, 2 mM L-глутамина при 37°С в СО2 инкубаторе в атмосфере, содержащей 5% СО2. Далее эпителиоциты MCF-7 пересевали на среду DMEM, содержащую 10% фетальной сыворотки теленка, 0,2 mM Hepes, 2 mM L-глутамина в 24-луночные культуральные планшеты. В лунки под номером 1 (контроль 1) вносили (MCF-7 106 клеток/ S. aureus 108 КОЕ на лунку). В лунки под номером 2 (контроль 2) вносили (MCF-7 106 клеток/ S. aureus 108 КОЕ на лунку). В опытные лунки вносили рекомбинантные цитокины человека: rhTNF-α (ФГБУН Институт биоорганической химии им. академиков М.М. Шемякина и Ю.А. Овчинникова, РАН); rhIL-8 (PeproTech, UK); rhIL-1β (ФГУП «Гос. НИИ ОЧБ» ФМБА России, Санкт-Петербург); rhINF-γ (ФБУН «ГНЦ прикладной микробиологии и биотехнологии» Роспотребнадзора, Оболенск). В лунки под номером 3 вносили (MCF-7 106 клеток/ S. aureus 108 КОЕ на лунку + 50 мкг rhTNF-α). В лунки под номером 4 вносили (MCF-7 106 клеток/ S. aureus 108 КОЕ на лунку + 50 мкг rhIL-8). В лунки под номером 5 вносили (MCF-7 106 клеток/ S. aureus 108 КОЕ на лунку + 50 мкг rhIL-1β). В лунки под номером 6 вносили (MCF-7 106 клеток/ S. aureus 108 КОЕ на лунку + 50 мкг rhINF-γ). Совместное культивирование MCF-7 клеток/ S. aureus проводили при 37°С в СО2 инкубаторе в атмосфере, содержащей 5% СО2 в течение 2 ч. Клетки MCF-7 трехкратно отмывали ЗФР, обрабатывали лизостафином (5 мкг/мл) в течение 2-х часов, затем трехкратно промывали ЗФР. Для одного эксперимента готовили серию лунок с монослоем клеток MCF-7, содержащих внутриклеточно бактерии S. aureus 8325-4. В случае К1 монослой MCF-7 снимали, используя трипсин-ЭДТА, клетки лизировали тритоном Х-100. Серию разведений лизата высевали на селективный агар. Количество внутриклеточных бактерий подсчитывали на агаре, результаты выражали как КОЕ/мл лизата. Совместное культивирование смесей MCF-7 клеток/ S. aureus, содержащих различные цитокины (TNF-α, IL-8, IL-1β, INF-γ) и Контроль 2 (К2) продолжали культивировать дополнительно в течение 18 ч. Затем монослой MCF-7 снимали, лизировали, делали серии разведений лизатов и оценивали влияние различных цитокинов на внутриклеточное выживание бактерий. Результаты исследований приведены на Фиг. 14. Провоспалительные цитокины TNF-α, IL-8, IL-1β не ингибируют рост S. aureus 8325-4 внутри эптелиоцитов MCF-7 молочной железы человека. INF-γ ингибирует рост S. aureus 8325-4 внутри эпителиоцитов MCF-7 молочной железы человека. INF-γ является центральным цитокином, необходимым для активации клеточного иммунного ответа и элиминации мастит-индуцирующего бактериального патогена S. aureus 8325-4, проникшего внутрь MCF-7 эпителиоцитов молочной железы человека.
Вывод. INF-γ ингибирует рост мастит-индуцирующего бактериального патогена S. aureus 8325-4, проникшего внутрь MCF-7 эпителиоцитов молочной железы человека.
Пример 14.
Симбиотический консорциум штаммов ЛМ-1 стимулирует продукцию IFN-γ in vitro в культуре спленоцитов мышей и повышает уровень IFN-γ in vivo в крови при пероральном введении экспериментальным животным.
Выделение спленоцитов.
В опытах использовали мышей самок BALB/c в возрасте 6-8 недель весом 25-30 г. Селезенку мышей пропускали через нейлоновое клеточное ситечко 70 мкм (BD Bioscience) добавляли среду RPMI-1640 и центрифугировали при 500g в течение 10 мин. Супернатант удаляли, клетки ресуспендировали в RPMI-1640, вносили 1 мл (на одну селезенку) литического буфера, содержащего 0,15 М NH4Cl, 1 mM KHCO3, 0.1 mM EDTA и инкубировали 2 мин. Клетки промывали дважды средой RPMI-1640 центрифугированием, ресуспендировали в RPMI-1640, содержащей 2% мышиной сыворотки и высевали на 24-луночные планшеты (Greiner) в концентрации 5×105 клеток/мл. В опытные лунки вносили ЛМ-1 (1.5×109 клеток/мл L. fermentum BKM B-2793D + 1.5×109 клеток/мл L. reuteri BKM В-3144D), в контрольные лунки вносили ЗФР. Спленоциты культивировали в СО2 инкубаторе при 37°С в атмосфере, содержащей 5% СО2 в течение 24 ч. В супернатантах определяли уровень секреции INF-γ и IL-4 методом sandwich ELISA. Применяли наборы для определения цитокинов (ELISA kit PharMingen). Чувствительность тест-системы для определения INF-γ составляла 5 pg/ml. Чувствительность тест-системы для определения IL-4 составляла 60 pg/ml. Определение цитокинов проводили согласно инструкции, предложенной производителем. Результаты исследований приведены на Фиг. 15. и Фиг. 16. Симбиотический консорциум штаммов ЛМ-1, добавленный в среду культивирования спленоцитов мышей в системе in vitro, стимулирует в этих клетках продукцию INF-γ и ингибирует продукцию IL-4 (Фиг. 15). Уровень INF-γ повышается также в системе in vivo в крови мышей, получавших перорально ЛМ-1 (Фиг. 16). S. aureus обладает способностью к интернализации и внутриклеточной персистенции в различных эпителиоцитах, в том числе и эпителиоцитах молочной железы [Dzievanowska K., Patti J., Deobald С., et al. Fibronectin binding protein and host cell tyrosine kinase are required for internalization of Staphylococcus aureus by epithelial cells. Infect. Immunol. 1999. 67. 4673-4678; Brouillette E., Grondin G., Shkreta L. et al. In vivo and in vitro demonstration that Staphylococcus aureus is an intracellular pathogen in the presence or absence of fibronectin-binding proteins. Microb. Pathol. 2003a. 35. 159-168; Brouillette E., Grondin G., Lefebvre C., et al. Mouse mastitis model of infection for antimicrobial compound efficacy studies against intracellular and extracellular forms of Staphylococcus aureus. Vet. Microbiol. 2004. 101. 253-262]. INF-γ необходим для обеспечения резистентности эпителиоцитов молочной железы к внутриклеточным патогенам. Кроме этого, INF-γ может проявлять антивоспалительное действие, что имеет важное значение для профилактики и комплексного лечения лактационного мастита [Flaishon L., Topilski I., Shoseyov D., et al. Cutting edge: anti-inflammatory properties of low levels of IFN-gamma. J. Immunol. 2002. 168: 3707-3711].
Вывод. Симбиотический консорциум штаммов ЛМ-1 (L. reuteri BKM В-3144D и L. fermentum BKM В-2793D) стимулирует продукцию INF-γ в спленоцитах мышей в системе in vitro. При пероральном введении ЛМ-1 повышает уровень INF-γ в системе in vivo в крови у экспериментальных животных. Обнаруженная способность ЛМ-1 повышать продукцию INF-γ в системах in vitro и in vivo направлена на обеспечение иммунного гомеостаза в молочной железе в период лактации и защиту эпителиоцитов молочной железы от внутриклеточных мастит-индуцирующих патогенов.
Пример 15.
Исследование эффективности перорального применения консорциума штаммов лактобацилл ЛМ-1 (L. reuteri BKM B-3144D и L. fermentum BKM B-2793D) для профилактики экспериментального лактационного мастита у лактирующих самок мышей, а также для профилактики диссеминации мастит-индуцирующего патогена S. aureus 8325-4 в висцеральные органы.
Биомодель лактационного мастита.
Экспериментальный острый лактационный мастит был индуцирован по методу [Anderson J.C., Chandler R.L. Experimental staphylococcal mastitis in the mouse. Histological, ultrastructural and bacteriological changes caused by a virulent strain of Staphylococcus aureus. J. Comp. Pathol. 1975. 85. 490-510] путем интрамаммарной инокуляции л актирующим самкам мышей мастит-индуцирующего патогена S. aureus в дозе 1×104 КОЕ, в объеме 50 мкл в каждую молочную железу (R4 и L4) через сосок. Мышей предварительно анестезировали эфиром. Динамику роста патогена в молочных железах после инокуляциии исследовали через 10, 20, 30, 40 и 50 часов. В экспериментах in vivo использовали 100 самок белых аутбредных (беспородных) мышей в возрасте 6-8 недель в период беременности. Животных содержали в стандартных условиях, в соответствии с требованиями руководства по содержанию и использованию лабораторных животных [Guide for the Care and Use of Laboratory Animals, 8th editon. National Research Council (US) Committee for the Update of the Guide for the Care and Use of Laboratory Animals. Washington (DC): National Academies Press (US); 2011. ISBN-13; 978-0-309-15400-OISBN-10: 0-309-15400-6; Санитарно-эпидемиологические правила СП 2.2.1.3218-14. Санитарно-эпидемиологические требования к устройству, оборудованию и содержанию вивариев. Введ. 29.08.2014] при свободном доступе к воде и корму (Лабораторкорм, Москва, Россия). Исследования проводились в соответствии с регуляциями Комитета по работе с животными ОАО «ИИИ». Животные были распределены по 50 особей в двух группах. Животным группы 1 (опыт) ежедневно в течение семи дней до родов и пяти дней после родоразрешения вводили интрагастрально через катетер по 0,5 мл консорциум штаммов лактобацилл ЛМ-1 в дозе 1×109 КОЕ (5×108 КОЕ L. reuteri BKM B-3144D + 5×108 КОЕ L. fermentum BKM B-2793D). Животным группы 2 (контроль) вводили интрагастрально 0.5 мл стерильного ЗФР. На шестой день после родов у самок мышей опытной и контрольной групп индуцировали экспериментальный лактационный мастит путем интрамаммарного введения S. aureus 8325-4 в дозе 1×104 КОЕ, в объеме 50 мкл в каждую молочную железу (R4 и L4). Данный штамм S. aureus используется для индукции экспериментального лактационного мастита у лактирующих самок мышей [Bramley A.J., Patel A., et al. Roles of alfa-toxin and beta-toxin in virulence of Staphylococcus aureus for the mouse mammary gland. Infection and Immunity. 1989. V. 57. No. 8. P. 2489-2494; Brouillette E., Malouin F. The pathogenesis and control of Staphylococcus aureus - induced mastitis: study models in mouse. Microbes and Infection. 2005. 7. 560-568. Doi: 10.1016/j.micinf.2004.11.008]. S. aureus 8325-4 выращивали на триптическом соевом агаре (Дифко, США) в течение 18 часов при 37°С. Бактерии суспендировали в ЗФР и центрифугировали при 5000 g, 10 минут, при 4°С. Осадок бактерий ресуспендировали в ЗФР и готовили необходимую концентрацию клеток для интрамаммарного введения. Динамику роста патогена в молочных железах у мышей опытной и контрольной групп исследовали через 10, 20, 30, 40 и 50 часов после инокуляции S. aureus 8325-4. Мышей опытной и контрольной групп (по 10 особей в каждой) усыпляли с помощью СО2 через 10, 20, 30, 40, и 50 часов, молочные железы выделяли, гомогенизировали в 2 мл ЗФР. Для исследования влияния профилактического перорального введения консорциума штаммов ЛМ-1 на процесс диссеминации S. aureus 8325-4 в висцеральные органы при экспериментальном лактационном мастите у мышей опытной и контрольной групп, которых усыпляли через 50 часов, выделяли молочные железы, печень, почки, селезенку, сердце и гомогенизировали каждый орган в 2 мл ЗФР. Гомогенаты (10-кратные разведения) высевали на селективную питательную среду для стафилококков (агар Байрд - Паркера, фирмы Мерк, Германия) содержащую гентамицин (15 мкг/мл) и культивировали при 37°С в течение 24 ч. Определяли титры штамма S. aureus 8325-4.
Результаты.
У лактирующих мышей опытной группы, получавших ежедневно в течение 12 дней интрагастрально консорциум штаммов лактобацилл ЛМ-1 с профилактической целью (7 дней до родов и 5 дней после родоразрешения в дозе 109 КОЕ), происходило интенсивное ингибирование роста S. aureus 8325-4 в молочных железах после интрамаммарного введения патогена для индукции лактационного мастита. Через 20 часов после индукции лактационного мастита S. aureus 8325-4 не выявлялся в молочных железах опытной группы самок мышей (Фиг. 17). S. aureus обладает способностью к адгезии и инвазии эпителиоцитов молочной железы человека и животных, а также эпителиоцитов других органов [Brouillette Е., et al., 2003а; 2004]. Согласно данным [Martin R., Langa S., Reviriego С., Jimenez E., et al. The commensal microflora of human milk: new perspectives for food bacteriotherapy and probiotics. Trends in Food Science and Technol. 2004. 15: 121-127] лактобациллы, попадая в молочную железу по энтеро-маммарному пути, образуют биопленку внутри системы молочных протоков и обеспечивают колонизационную резистентность молочной железы. Таким образом, профилактическое применение консорциума штаммов лактобацилл ЛМ-1 per os в течение 12-ти последовательных дней (7 дней до родов и 5 дней после родоразрешения в дозе 109 КОЕ) эффективно повышает колонизационную резистентность молочных желез у опытной группы лактирующих мышей и предотвращает развитие экспериментального лактационного мастита, индуцированного S. aureus 8325-4. В то же время у лактирующих мышей контрольной группы, не получавших per os ЛМ-1 в течение 12-ти последовательных дней (7 дней до родов и 5 дней после родоразрешения в дозе 109 КОЕ) с профилактической целью, наблюдалось развитие экспериментального лактационного мастита, который характеризовался интенсивным ростом S. aureus 8325-4 в инфицированных молочных железах. Через 20 часов после индукции лактационного мастита концентрация патогена в инфицированной молочной железе у животных контрольной группы составляла (2,1±0.03)×108 КОЕ. Через 50 часов после индукции лактационного мастита концентрация патогена в инфицированной молочной железе у животных контрольной группы достигала уровня (3,2×0.16)×109 КОЕ (Фиг. 17). Через 50 часов после интрамаммарного инфицирования мастит-индуцирующим патогеном у 50% животных контрольной группы отмечался летальный исход (погибли 5 животных из 10-ти в данной группе).
У мышей, получавших перорально ЛМ-1 в течение 12 дней с профилактической целью, диссеминация S. aureus 8325-4 в висцеральные органы не происходила. Результаты исследований приведены в Таблице 4. В контрольной группе мышей, не получавших ЛМ-1, висцеральные органы (печень, почки, селезенка, сердце), а также молочные железы были обсеменены S. aureus 8325-4 через 50 часов после индукции острого лактационного мастита (Таблица 5). Ранее в работе [Anderson J.С. Dissemination of staphylococci in mice with experimental mastitis. J. Dairy Res. 1987. 54. 339-345] было установлено, что у мышей с острым экспериментальным лактационным маститом диссеминация S. aureus из молочных желез в висцеральные органы происходит очень быстро по венозной системе крови.


Выводы:
1. Профилактическое введение консорциума штаммов лактобацилл ЛМ-1 (L. reuteri BKM В-3144D и L. fermentum BKM B-2793D) per os самкам мышей в течение 12-ти последовательных дней (7дней до родов и 5 дней после родоразрешения в дозе 109 КОЕ) эффективно повышает колонизационную резистентность молочных желез лактирующих самок мышей и предотвращает развитие экспериментального лактационного мастита, индуцированного интрамаммарным инфицированием животных клетками S. aureus 8325-4.
2. Профилактическое введение консорциума штаммов лактобацилл ЛМ-1 (L. reuteri BKM В-3144D и L. fermentum BKM B-2793D) per os самкам мышей до индукции экспериментального лактационного мастита предотвращает диссеминацию мастит-индуцрующего патогена S. aureus 8325-4 из инфицированных молочных желез лактирующих самок мышей в висцеральные органы.
3. Симбиотический консорциум пробиотических штаммов лактобацилл ЛМ-1 (L. reuteri BKM В-3144D и L. fermentum BKM B-2793D) является перспективным для профилактики лактационного мастита и может быть использован для реализации стратегии превентивной борьбы с этим распространенным в мире заболеванием.
Названия фигур
Фиг. 1А, Б, В, Г. Антагонистическая активность штаммов L. reuteri BKM В-3144 D, L. fermentum BKM В-2793 D и их симбиотического консорциума к мастит-индуцирующему патогену S. aureus 8325-4.
Фиг. 1А. Интактные клетки мастит-индуцирующего патогена S. aureus 8325-4 (контроль).
Фиг. 1Б. Бактериолитическое действие клеток штамма L. reuteri BKM В-3144 D на клетки S. aureus 8325-4.
Фиг. 1В. Бактериолитическое действие клеток штамма L. fermentum BKM В-2793 D на клетки S. aureus 8325-4.
Фиг. 1Г. Бактериолитическое действие штаммов консорциума ЛМ-1 (L. reuteri BKM В-3144 D и L. fermentum BKM В-2793 D) на клетки S. aureus 8325-4.
Фиг. 2. Симбиотический консорциум лактобацилл ЛМ-1 (L. reuteri BKM B-3144D и L. fermentum BKM B-2793D) ингибирует продукцию IL-8 в эпителиоцитах MCF-7 молочной железы человека, индуцированную MALP2 (агонист TLR2/6) и LPS (агонист TLR4).
Примечания: 1 - интактные эпителиоциты MCF-7 (контроль); 2 - MALP2; 3 - MALP2+ЛМ-; 4 - LPS; 5 - LPS+ЛМ-1; 6 - ЛМ-1. ** р<0,01 - достоверность различий между LPS (4) и LPS+ЛМ-1 (5); *** р<0,001 - достоверность различий между MALP2 (2) и MALP2+ЛМ-1 (3).
Фиг. 3. Симбиотический консорциум лактобацилл ЛМ-1 (L. reuteri BKM В-3144D и L. fermentum BKM B-2793D) ингибирует продукцию IL-8, индуцированную агонистом MALP2 в первичных эпителиоцитах вымени коров.
Примечания: 1 - интактные эпителиоциты (контроль); 2 - MALP2; 3 - MALP2+ЛМ-1; 4 - MALP2+L. reuteri BKM B-3144D; 5 - MALP2+L. fermentum BKM B-2793D. * р<0,05 - достоверность различий между 1 и 4; 1 и 5; 3 и 4; 3 и 5. *** р<0,001 - достоверность различий между 2 и 3.
Фиг. 4. Синергизм штаммов L. reuteri BKM B-3144D и L. fermentum BKM B-2793D, входящих в состав симбиотического консорциума ЛМ-1, при стимуляции продукции лактоферрина культурой первичных эпителиоцитов вымени коров.
Примечания: 1 - интактные эпителиоциты (контроль); 2 - L. reuteri ВКМ B-3144D; 3 - L. fermentum BKM B-2793D; 4 - ЛМ-1.* р<0,05 - достоверность различий между 1 и 2; 1 и 3. ** р<0,01 - достоверность различий между 1 и 4.
Фиг. 5. Синергизм штаммов L. reuteri BKM B-3144D и L. fermentum BKM B-2793D, входящих в состав симбиотического консорциума ЛМ-1, при стимуляции продукции лизоцима в клетках первичных эпителиоцитов вымени коров.
Примечания: 1 - интактные эпителиоциты; 2 - L. fermentum BKM B-2793D; 3 - L. reuteri BKM B-3144D; 4 - ЛМ-1.* р<0,05 - достоверность различий между 1 и 2; 1 и 3. ** р<0,01 - достоверность различий между 1 и 4.
Фиг. 6. Синергизм штаммов L. fermentum BKM B-2793D и L. reuteri BKM В-3144D, входящих в состав симбиотического консорциума ЛМ-1, при стимуляции продукции лактоферрина в клетках тканевых ММ6 макрофагов человека.
Примечания: 1 - интактные макрофаги ММ6; 2 - ММ6+L. fermentum BKM B-2793D; 3 - ММ6+L. reuteri BKM B-3144D; 4 - ММ6+ЛМ-1. ** р<0,01- достоверность различий между 1 и 2; 1 и 3. ***р<0,001 - достоверность различий между 1 и 4.
Фиг. 7. Синергизм консорциума штаммов L. fermentum BKM B-2793D и L. reuteri BKM B-3144D, входящих в состав симбиотического консорциума ЛМ-1, при стимуляции продукции лизоцима в клетках тканевых ММ6 макрофагов человека.
Примечания: 1 - интактные макрофаги (контроль); 2 - L. reuteri BKM B-3144D; 3 - L. fermentum BKM B-2793D; 4 - ЛМ-1. ** р<0,01 - достоверность различий между 1 и 2; 1 и 3. *** р<0,001- достоверность различий между 1 и 4.
Фиг. 8. Синергизм ингибирующего действия консорциума штаммов лактобацилл ЛМ-1 и лактоферрина на LPS-индуцированную продукцию IL-8, IL-1β и TNF-α клетками тканевых ММ6 макрофагов человека.
Примечания: 1 - интактные макрофаги (контроль); 2 - LPS 10 нг/мл; 3 - LPS 10 нг/мл + ЛФ 200 мкг/мл; 4 - LPS 10 нг/мл + ЛФ 200 мкг/мл + ЛМ-1 ((1.5×109 КОЕ /мл L. fermentum BKM B-2793D + 1.5×109 КОЕ /мл L. reuteri BKM B-3144D). Время культивирования 16 часов ** р<0,01- достоверность различий между 2 и 3; *** р<0,001 - достоверность различий между 2 и 4.
Фиг. 9. Симбиотический консорциум штаммов лактобацилл ЛМ-1 регулирует продукцию IL-10 и IL-12 в незрелых дендритных клетках человека.
Примечания: Количество НДК 105 клеток/мл. Соотношение НДК/лактобациллы 1:10. Время культивирования 24 часа. * р<0,05. ** р<0,01.
Фиг. 10. Динамика роста количества IgA-секретирующих клеток в молочных железах мышей, получавших перорально симбиотический консорциум штаммов лактобацилл ЛМ-1. Примечание: * р<0,001 - достоверность различий между уровнем IgA+ клеток после пятидневного, семидневного приемов ЛМ-1 и контролем.
Фиг. 11. Увеличение количества IgA-секретирующих клеток в молочных железах мышей после перорального приема в течение пяти дней симбиотического консорциума лактобацилл ЛМ-1 и отдельных штаммов, входящих в его состав.
Примечание: * р<0,02 - достоверность различий между уровнем IgA+ клеток после приема ЛМ-1 и отдельных штаммов лактобацилл, входящих в его состав. *** р<0,001 - между ЛМ-1 и контролем. Фиг. 12. Влияние перорального введения симбиотического консорциума штаммов лактобацилл ЛМ-1 на продукцию TGF-β и IgA антител иммунокомпетентными клетками Пейеровых бляшек мышей в системе in vitro.
Примечание: * р<0,05 - достоверность различий по сравнению с контролем.
Фиг. 13. Стимуляция продукции IL-6 симбиотическим консорциумом штаммов лактобацилл ЛМ-1 в эпителиоцитах MCF-7 молочной железы человека, активированных мастит-индуцирующим патогеном S. aureus 8325-4.
Примечания: в опытах использован инактивированный температурой штамм S. aureus 8325-4; MOI 10:1, время культивирования 6 ч. * р<0,05 - достоверность различий между интактными клетками MCF-7 и активированными S. aureus. ** р<0,01 и *** р<0,001 достоверность различий между клетками MCF-7, активированными S. aureus и активированными S. aureus + лактобациллы.
Фиг. 14. Ингибирование роста S. aureus 8325-4 внутри эпителиоцитов MCF-7 молочной железы человека при внесении в культуральную среду INF-γ.
Примечание: * р<0,01 - достоверность различий между INF-γ и К1, К2, IL-8, TNF-α, IL-1β.
Фиг. 15. Влияние симбиотического консорциума штаммов лактобацилл ЛМ-1, добавленного в среду культивирования, на продукцию INF-γ и IL-4 спленоцитами мышей в системе in vitro.
Примечание: * р<0,01 - достоверность различий по сравнению с контролем.
Фиг. 16. Симбиотический консорциум штаммов лактобацилл ЛМ-1 повышает уровень INF-γ в крови мышей при пероральном введении.
Примечание: * р<0,05 - достоверность различий между контрольной и опытной группами мышей.
17. Ингибирование роста S. aureus 8325-4 в молочных железах лактирующих самок мышей, получавших per os консорциум штаммов ЛМ-1 (L. reuteri BKM В-3144D и L. fermentum BKM B-2793D) в течение 12 дней (7 дней до родов и 5 дней после родоразрешения) для профилактики лактационного мастита.
Примечания:
Острый лактационный мастит в опытной и контрольной группах лактирующих самок мышей индуцирован интрамаммарной инокуляцией S. aureus 8325-4 в дозе 1×104 КОЕ в объеме 50 мкл в каждую молочную железу (R4 и L4);
 - мыши, получавшие per os консорциум штаммов ЛМ-1 в дозе 109 КОЕ (5×108 КОЕ L. reuteri BKM B-3144D + 5×108 КОЕ L. fermentum BKM В-2793D) с профилактической целью в течение 12 дней (7 дней до родов и 5 дней после родоразрешения) до индукции острого лактационного мастита (опыт);
- мыши, получавшие per os консорциум штаммов ЛМ-1 в дозе 109 КОЕ (5×108 КОЕ L. reuteri BKM B-3144D + 5×108 КОЕ L. fermentum BKM В-2793D) с профилактической целью в течение 12 дней (7 дней до родов и 5 дней после родоразрешения) до индукции острого лактационного мастита (опыт);
 - мыши, получавшие per os стерильный ЗФР в течение 12 дней (7 дней до родов и 5 дней после родоразрешения) до индукции острого лактационного мастита (контроль).
- мыши, получавшие per os стерильный ЗФР в течение 12 дней (7 дней до родов и 5 дней после родоразрешения) до индукции острого лактационного мастита (контроль).
Список литературы
1. WHO. 2011. Exclusive breastfeeding for six months best for babies everywhere. Available at: https://www.who.int/mediacentre/news/statements/2011/breastfeeding_20110115/en/
2. WHO. 2000. Mastitis: causes end management. WHO, Geneva, Switzerland; American Academy of Pediatr.
3. 2012. Breastfeeding and the use of human milk. Pediatrics. 129. e827-e841. Doi:10.1542/peds.2011-3552.
4. Delgado S., Arroyo R., Martin R., Rodrigues J. PCR-DGGE assessment of the bacterial diversity of breast milk in women with lactational infectious mastitis. BMC Infect. Dis. 2008. 8. 51-58.
5. Contreras G., Rodriguez J. Mastitis: Comparative etiology and epidemiology. J Mammary Gland Biol. Neoplasia 2011. 16: 339-356.
6. Arroyo R., Martin V., Maldonado A., et al. Treatment of infectious mastitis during lactation: antibiotics versus oral administration of lactobacilli isolated from breast milk. Clin. Infect. Dis. 2010. 50 (12): 1551-1558.
7. Patent PCT: WO 2007/142596,2007.
8. Патент № RU 2435844 C2, 2011.
9. US Patent No: 5439678, 1995.
10. US Patent No: 5458875, 1995.
11. US Patent No: 5534253, 1996.
12. US Patent No: 5849289, 1998.
13. US Patent No: 2013/0171253 A1, 2013.
14. Патент RU 2133272 C1, 1999.
15. Патент № RU 2412239 C2, 2011.
16. Patent WO 03002131, 2001.
17. Патент RU 2284354 C2, 2006.
18. Патент RU 2391395, 2010.
19. Patent No: US 2004/0057943 A1, 2004.
20. Maldonado-Lobon J., Diaz-Lopez M., Carputo R., et al. Lactobacillus fermentum Lc40 (CECT5716) reduces staphylococcus load in the breastmilk of lactating mothers suffering breast pain: a randomized controlled trial. Breastfeeding Med. 2015. 10: 425-432. https://doi.org/10.1089/bfm.2015.0070.
21. Haggar A. et al. Extracellular adherence protein from Staphylococcus aureus enhances internalization into eukaryotic cells. 2003. V. 71. No. 5. P. 2310-2317.
22. Brouillette E., Grondin G., Shkreta L. et al. In vivo and in vitro demonstration that Staphylococcus aureus is an intracellular pathogen in the presence or absence of fibronectin-binding proteins. Microb. Pathol. 2003. 35. 159-168.
23. Vollmer W., Blanot D., de Pedro M. Peptidoglycan structure and architecture. FEMS Microbiol. Rev. 2008. 32: 149-167.
24.  M., Vogel R. Studies on the mode of action of reutericyclin. Appl. Environ. Microbiol. 2003. 69: 1305-1309.
M., Vogel R. Studies on the mode of action of reutericyclin. Appl. Environ. Microbiol. 2003. 69: 1305-1309.
25.  M. Reutericuclin: biological activity, mode of action, and potential application. Appl. Microbiol. Bio-technol. 2004. Vol. 64. P. 326-332.
M. Reutericuclin: biological activity, mode of action, and potential application. Appl. Microbiol. Bio-technol. 2004. Vol. 64. P. 326-332.
26. Руководство по проведению доклинических исследований лекарственных средств (иммунобиологические лекарственные препараты). Часть вторая / под ред. А.Н. Миронова. - М.: Гриф и К, 2012. - 536 с.
27. Lacroix М., Leclerq G. Relevance of breast tumors: an update. Breast Cancer Res. and Treatment. 2004. 83. 3. 249-289.
28. Brouillette E., Talbot В., Malouin F. The fibronectin-binding proteins of Staphylococcus aureus may promote mammary gland colonization in a lactating mouse model of mastitis. Infect. Immun. 2003. V. 71. No. 4. P. 2292-2295.
29. Rhem M.N. et al. The collagen-binding adhesin is a virulence factor in Staphylococcus aureus keratitis. Infect. Immun. 2000. V. 68. No. 6. P. 3776-3779.
30. Haggar A. et al. Extracellular adherence protein from Staphylococcus aureus enhances internalization into eukaryotic cells. 2003. V. 71. No. 5. P. 2310-2317.
31. Medzhitov R. Toll-like receptors and innate immunity. Nature Rev. Immunol. 2001. 1: 135-145. wvvw.namre.com/reviews/Immunol.
32. Fernandez L., Langa S., Martin V., et al. The human milk microbiota: origin and potential roles in health and disease. Pharmacol. Res. 2013. 69. 1-10.
33. Jost Т., Lacroix C., Braegger C., et al. Assessment of bacterial diversity in breast milk using culture-dependent and culture-independent approaches. British Journal of Nutrition. 2013. 110. 1253-1262.
34. Jost Т., Lacroix C., Braegger C., et al. Vertical mother-neonate transfer of maternal gut bacteria via breast-feeding. Environ.Microbiol.2013. doi:10.1111/1462-2920.12238.
35. Ward Т., Hosid S., Ioshikhers I., et al. Human milk metagenome: a functional capacity analysis. BMC Microbiol. 2013. 13: 116. http://wvvw.biomedcentral.eom/1471-2180/13/116.
36. Cifrian E., Guidry C., O'Brien J., et al. Bovine mammary teat and ductal epithelial cell cultures. Am. J. Vet. Res. 1994 B. 55. 239-246.
37. Mathur N., Dwarcadas A., Sharma V. et al. Anti-infective factors in preterm human colostrum. Acta Paediatr. Scand. 1990. 79: 1039-1044.
38. Thompson A., Bohling Т., Payvandi F., Rennard S. Lower respiratory tract lactoferrin and lysozyme arise primarily in the airways and are elevated in association with chronic bronchitis. J. Lab. Clin. Med. 1990. 115: 148-158.
39. Kawasaki J., Tazume S., Shimizu K et al. Inhibitory effects of bovine lactoferrin on the adherence of enterotoxigenic Escherichia coli to host cells. Biosc. Biotechnol. Biochem. 2000. 64 348-354.
40. Nascimento de Araujo A., Giugliano L. Human milk fractions inhibit the adherence of diffusely adherent Escherichia coli (DAEC) and enteroaggregative E. coli (EAEC) to Hela cells. FEMS Microbiol. Lett. 2000. 184: 91-94.
41. Edde L., Hipolito R., Hwang F. et al. Lactoferrin protects neonatal rats from gut-related systemic infection. Am. J. Physiol. Gastrointest. Liver Physiol. 2001. 281: 1140-1150.
42. Ellison R., Giehl T. Killing of gram-negative bacteria by lactoferrin and lysozyme. J. Clin. Invest. 1991. 88 (4): 1080-1091.
43. Elazar S., Gonen E., Livnen-Kol A., Rosenshine I., Shpigel N. Neutrophil recruitment in endotoxin-induced murine mastitis is strictly dependent on mammary alveolar macrophages. Vet. Res. 2010. 41:10. DOI: 10.1051/vetres/2009058.
44. Rosa L., Cutone A., Lepanto M. et al. Lactoferrin: a natural glycoprotein involved in iron and inflammatory homeostasis. Int. J. Mol. Sci. 2017. Doi: 10.3390/ijmsl8091985.
45. Kelsall B.L., Rescigno M. Mucosal dendritic cells in immunity and inflammation. Nat. Immunol. 2004. 5. 1091-1095.
46. Jung C., Hugot J., Barreau F. Peyers patches: the immune sensors of the intestine. Int. J. Inflam.2010. doi: 10.4061/2010/823710.
47. Ashcroft G.S. Bidurectional regulation of macrophage function by TGF-beta. Microbes Infect. 1999. 1 (15): 1275-1282.
48. Dzievanowska K., Patti J., Deobald C., et al. Fibronectin binding protein and host cell tyrosine kinase are required for internalization of Staphylococcus aureus by epithelial cells. Infect. Immunol. 1999.67. 4673-4678.
49. Brouillette E., Grondin G., Shkreta L. et al. In vivo and in vitro demonstration that Staphylococcus aureus is an intracellular pathogen in the presence or absence of fibronectin-binding proteins. Microb. Pathol. 2003a. 35. 159-168.
50. Brouillette E., Grondin G., Lefebvre C., et al. Mouse mastitis model of infection for antimicrobial compound efficacy studies against intracellular and extracellular forms of Staphylococcus aureus. Vet. Microbiol. 2004. 101. 253-262.
51. Flaishon L., Topilski I., Shoseyov D., et al. Cutting edge: anti-inflammatory properties of low levels of IFN-gamma. J. Immunol. 2002. 168: 3707-371.
52. Anderson J.C., Chandler R.L. Experimental staphylococcal mastitis in the mouse. Histological, ultrastructural and bacteriological changes caused by a virulent strain of Staphylococcus aureus. J. Comp. Pathol. 1975. 85. 490-510.
53. Guide for the Care and Use of Laboratory Animals, 8th editon. National Research Council (US) Committee for the Update of the Guide for the Care and Use of Laboratory Animals. Washington (DC): National Academies Press (US); 2011. ISBN-13; 978-0-309-15400-OISBN-10: 0-309-15400-6.
54. Санитарно-эпидемиологические правила СП 2.2.1.3218-14. Санитарно-эпидемиологические требования к устройству, оборудованию и содержанию вивариев. Введ. 29.08.2014.
55. Bramley A.J., Patel A., et al. Roles of alfa-toxin and beta- toxin in virulence of Staphylococcus aureus for the mouse mammary gland. Infection and Immunity. 1989. V. 57. No. 8. P. 2489-2494.
56. Brouillette E., Malouin F. The pathogenesis and control of Staphylococcus aureus -induced mastitis: study models in mouse. Microbes and Infection. 2005.7. 560-568. Doi: 10.1016/j.micinf.2004.11.008.
57. Martin R., Langa S., Reviriego C., Jimenez E., et al. The commensal microflora of human milk: new perspectives for food bacteriotherapy and probiotics. Trends in Food Science and Technol. 2004. 15: 121-127.
| название | год | авторы | номер документа |
|---|---|---|---|
| ШТАММ Lactobacillus fermentum, ОБЛАДАЮЩИЙ ШИРОКИМ СПЕКТРОМ АНТАГОНИСТИЧЕСКОЙ АКТИВНОСТИ И ПРОБИОТИЧЕСКИЙ КОНСОРЦИУМ ЛАКТОБАКТЕРИЙ ДЛЯ ИЗГОТОВЛЕНИЯ БАКТЕРИАЛЬНЫХ ПРЕПАРАТОВ | 2013 |
|
RU2528862C1 |
| ПРОБИОТИЧЕСКИЕ ШТАММЫ Lactobacillus И ИХ КОНСОРЦИУМ ДЛЯ ПРОФИЛАКТИКИ И ЛЕЧЕНИЯ УРОГЕНИТАЛЬНЫХ ИНФЕКЦИОННЫХ ЗАБОЛЕВАНИЙ У ЖЕНЩИН | 2012 |
|
RU2504580C1 |
| МИКРООРГАНИЗМЫ МОЛОКА МЛЕКОПИТАЮЩЕГО, ИХ СОДЕРЖАЩИЕ КОМПОЗИЦИИ И ИХ ПРИМЕНЕНИЕ ДЛЯ ЛЕЧЕНИЯ МАСТИТА | 2008 |
|
RU2446814C2 |
| КОНСОРЦИУМ ПРОБИОТИЧЕСКИХ ШТАММОВ Lactobacillus rhamnosus И Lactobacillus plantarum ДЛЯ ИЗГОТОВЛЕНИЯ БАКТЕРИАЛЬНОГО ПРЕПАРАТА И ЗАКВАСКИ ПРЯМОГО ВНЕСЕНИЯ ДЛЯ ПРОИЗВОДСТВА ФЕРМЕНТИРОВАННОГО МОЛОКА И ФЕРМЕНТИРОВАННОГО СВЕКОЛЬНОГО СОКА | 2012 |
|
RU2506308C1 |
| LACTOBACILLUS SALIVARIUS ДЛЯ ЛЕЧЕНИЯ МАСТИТА | 2014 |
|
RU2684600C1 |
| Пробиотический штамм Lactobacillus gasseri и его композиция с лактоферрином для профилактики диареи, некротизирующего энтероколита и сепсиса, вызываемых штаммами Escherichia coli у преждевременно рожденных детей | 2016 |
|
RU2641258C1 |
| ШТАММ БАКТЕРИЙ Lactobacillus jensenii, ОБЛАДАЮЩИЙ ШИРОКИМ СПЕКТРОМ АНТАГОНИСТИЧЕСКОЙ АКТИВНОСТИ И ПРОБИОТИЧЕСКИЙ КОНСОРЦИУМ ЛАКТОБАКТЕРИЙ ДЛЯ ИЗГОТОВЛЕНИЯ БАКТЕРИАЛЬНЫХ ПРЕПАРАТОВ | 2015 |
|
RU2572351C1 |
| СПОСОБ ЛЕЧЕНИЯ И ПРОФИЛАКТИКИ ОСТРЫХ И ХРОНИЧЕСКИХ ФОРМ МАСТИТА У ЖИВОТНЫХ | 2019 |
|
RU2709970C1 |
| ИММУНОМОДУЛИРУЮЩИЕ ПРОБИОТИЧЕСКИЕ МОЛОЧНО-КИСЛЫЕ БАКТЕРИИ | 2007 |
|
RU2535974C2 |
| Жидкий симбиотик и способ его получения | 2022 |
|
RU2805957C1 |
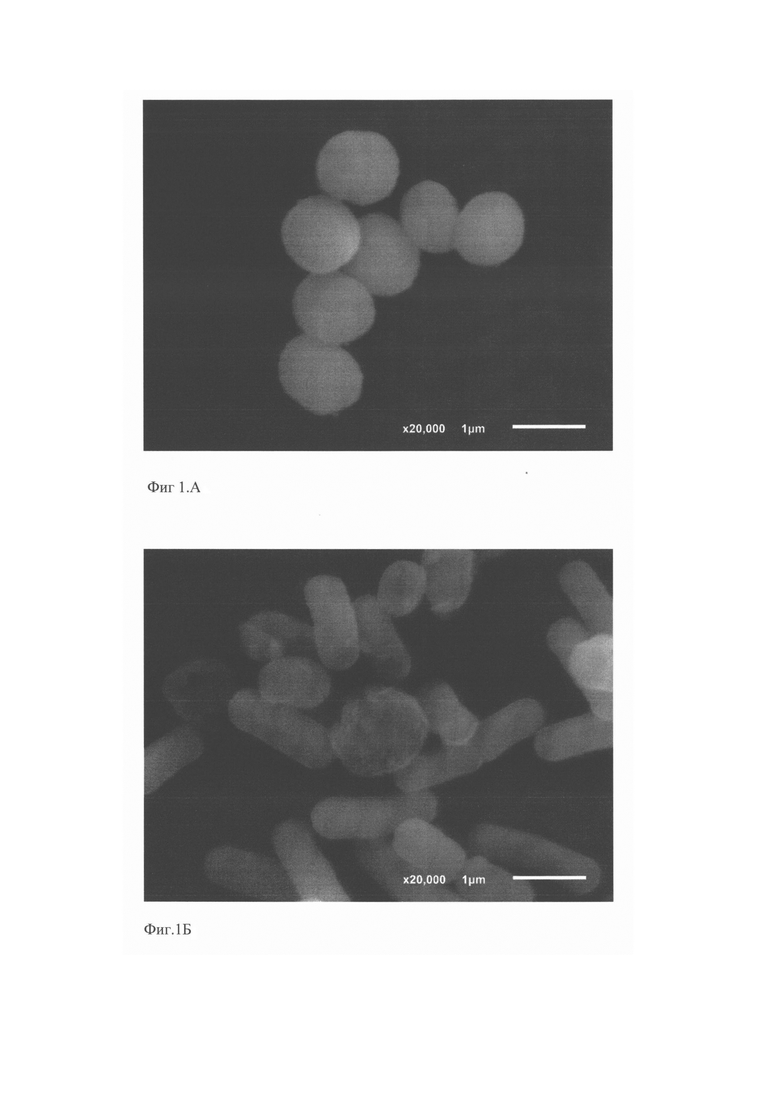



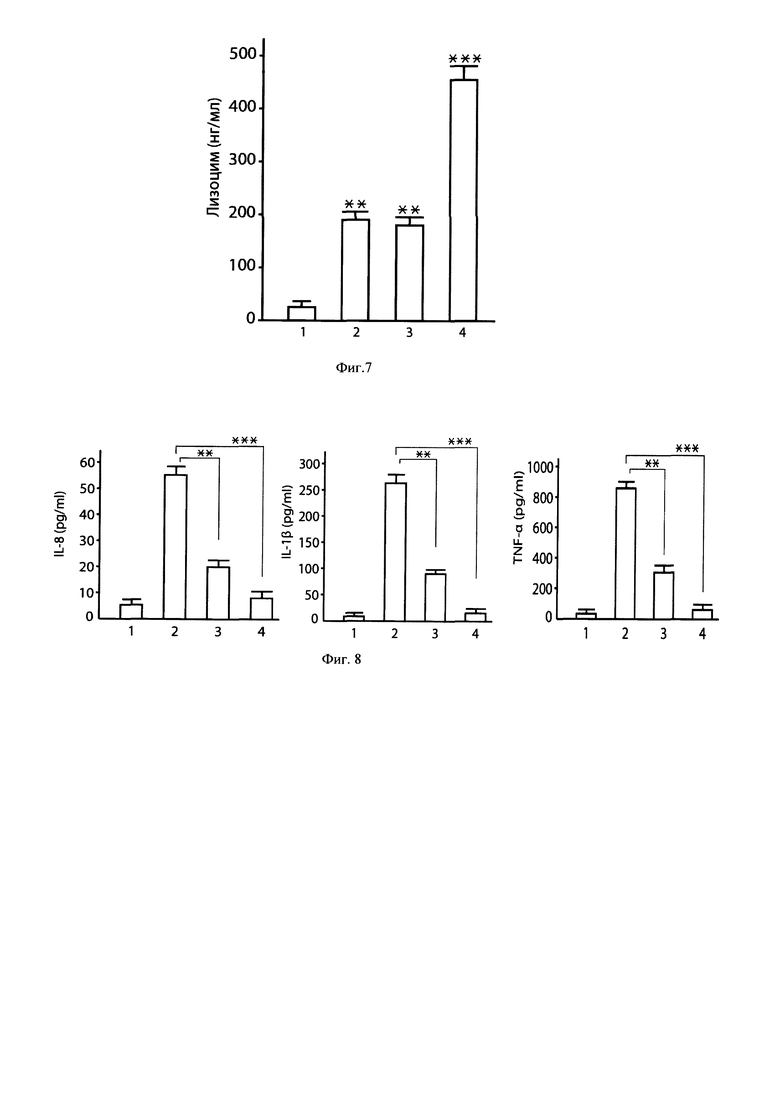
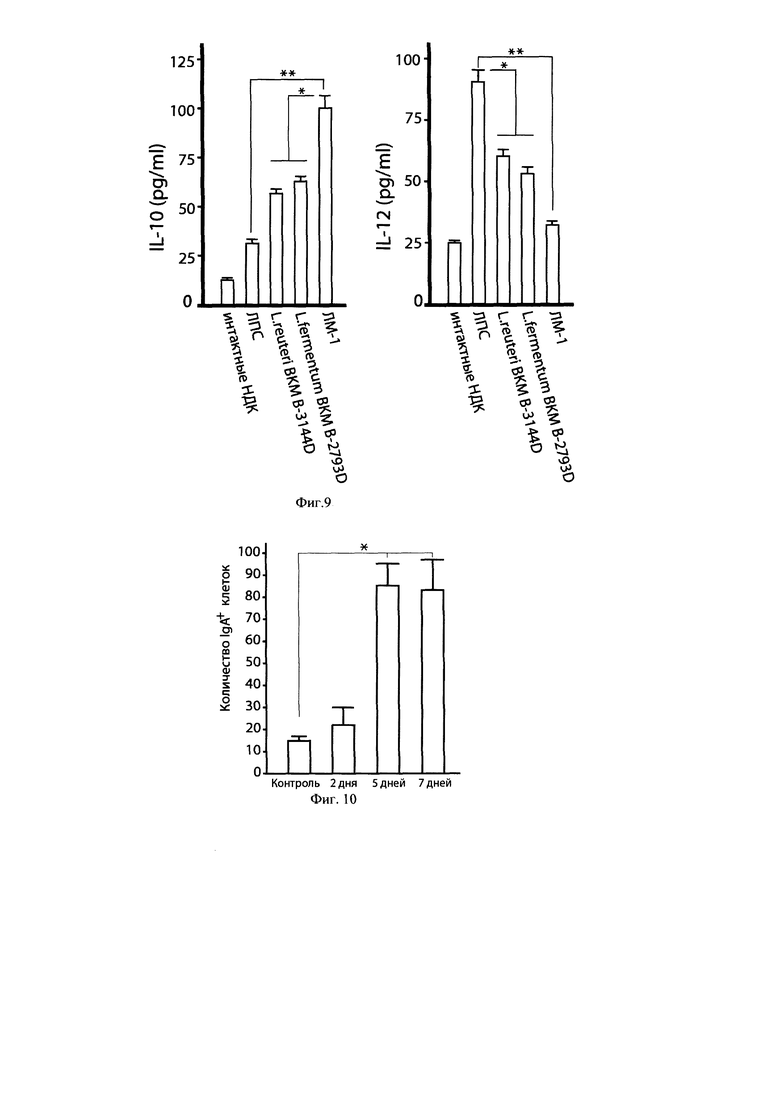
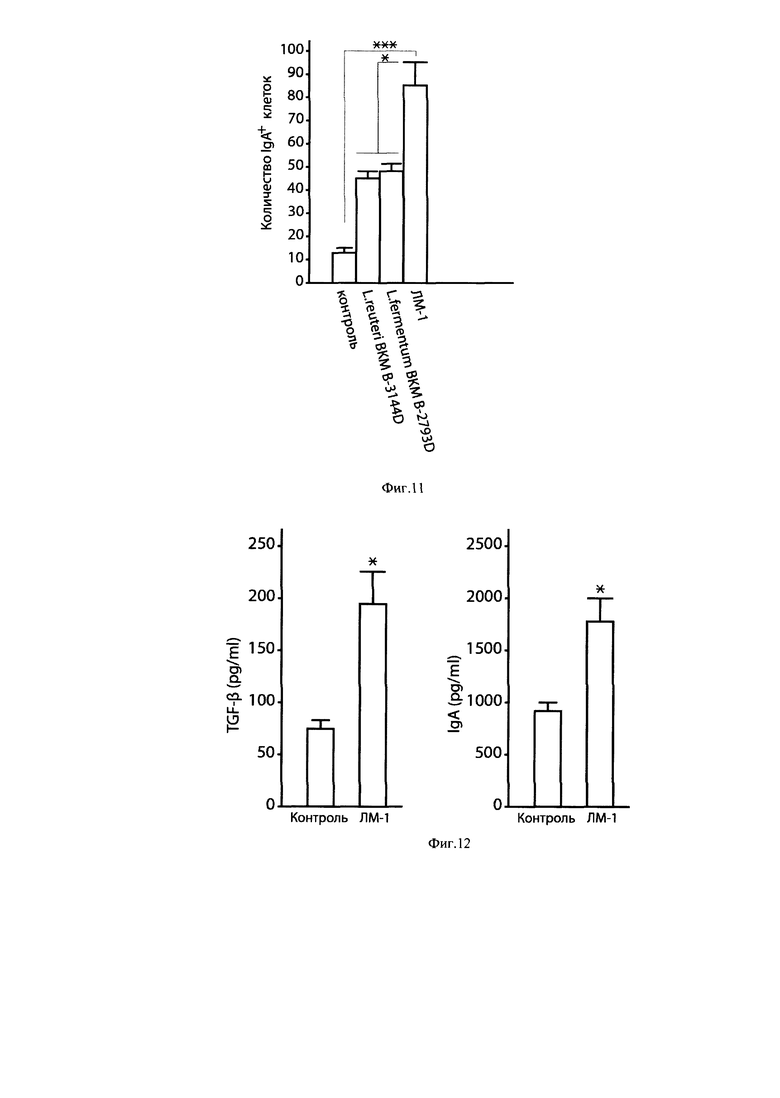
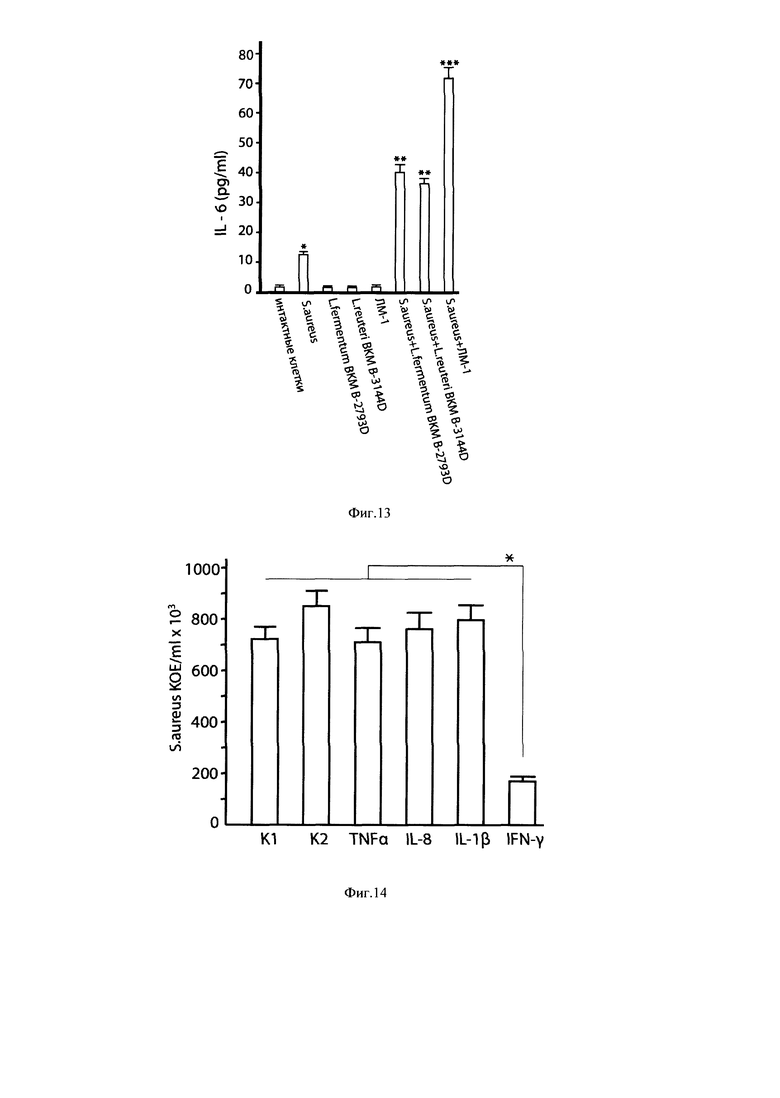

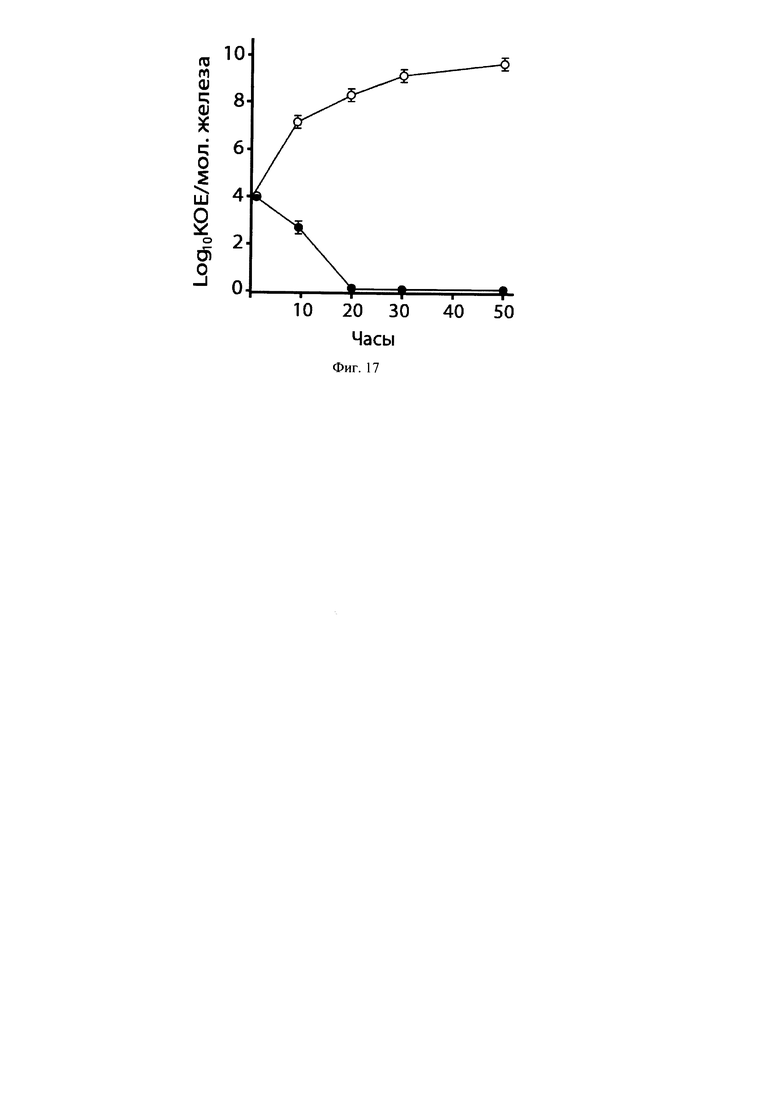
Изобретение относится к биотехнологии. Изобретение относится к применению симбиотического консорциума штаммов Lactobacillus reuteri ВКМ В-3144D и Lactobacillus fermentum ВКМ B-2793D в качестве средства, повышающего активность врожденного иммунитета (рецепторы TLR2/TLR6), адаптивного гуморального и клеточного иммунитета для обеспечения резистентности микроэкологической системы мать - дитя к инфекционным заболеваниям в период грудного вскармливания ребенка, для изготовления лекарственных средств на его основе, где штаммы симбиотического консорциума L. reuteri ВКМ В-3144D и L. fermentum ВКМ B-2793D в соотношении 1:1 обеспечивают резистентность микроэкологической системы мать - дитя к инфекционным заболеваниям, включая лактационный мастит матери, в период грудного вскармливания ребенка и воздействуют на 3 основные биомишени: Биомишень 1: врожденный иммунитет (рецепторы TLR2/TLR6). Биомишень 2: адаптивный гуморальный и клеточный иммунитет. Биомишень 3: патогены, вызывающие инфекционные заболевания в микроэкологической системе мать - дитя, включая лактационный мастит матери, в период грудного вскармливания ребенка, профилактики и лечения маститов у кормящих грудью женщин. Изобретение позволяет расширить ассортимент пробиотических лекарственных средств для комплексной профилактики инфекционных заболеваний в микроэкологической системе мать - дитя, включая лактационный мастит матери, в период грудного вскармливания ребенка и лечения маститов у кормящих грудью женщин. 17 ил., 4 табл., 15 пр.
Применение симбиотического консорциума L. reuteri ВКМ B-3144D и L. fermentum ВКМ В-2793D для изготовления лекарственного средства, повышающего врожденный иммунитет, адаптивный гуморальный и клеточный иммунитет, обеспечивающего резистентность микроэкологической системы мать - дитя к инфекционным заболеваниям в период грудного вскармливания ребенка.
| АБРАМОВ В.М | |||
| и др | |||
| Форма для перекрытий и т.п. | 1925 |
|
SU2793A1 |
| Способ изготовления звездочек для французской бороны-катка | 1922 |
|
SU46A1 |
| US 5439678 A1, 08.08.1995 | |||
| WHO | |||
| ЩИТОВОЙ ДЛЯ ВОДОЕМОВ ЗАТВОР | 1922 |
|
SU2000A1 |
| Mastitis: causes end management | |||
| WHO, Geneva, Switzerland; American | |||
Авторы
Даты
2023-08-02—Публикация
2022-06-24—Подача