Изобретение относится к биотехнологии и медицинской промышленности и может быть использовано в производстве бактериальных препаратов, предназначенных для профилактики и комплексного лечения урогенитальных инфекционных заболеваний и инфекций, передаваемых половым путем (ИППП). Согласно статистическим данным один миллиард женщин в мире ежегодно обращаются в клиники по поводу лечения различных урогенитальных инфекций. Урогенитальные инфекционные заболевания представляют собой одну из важных социальных проблем [1]. К числу таких заболеваний относится бактериальный вагиноз (БВ) - инфекционный невоспалительный синдром, характеризующийся резким снижением или отсутствием лактобацилл и их заменой на полимикробные ассоциации условно-патогенных бактерий G. vaginalis со строгими анаэробами Atopobium vaginae, Prevotella, Mobilincus и др., концентрация которых возрастает в несколько раз и достигает 109-1011 КОЕ/мл [2]. Вторым наиболее распространенным инфекционным заболеванием женской половой сферы является вульвовагинальный кандидоз (ВВК). Он относится к оппортунистическим инфекциям, развивающимся на фоне иммунологической недостаточности. В связи с этим ВВК весьма актуален во время беременности, отличается рецидивирующим и резистентным к терапии течением [2]. К факторам риска кандидозной инфекции относятся также гипофункция яичников, частое лечение антибиотиками, особенно пенициллинового ряда. В последние годы у человека все чаще ВВК вызывается не Candida albicans, а другими разновидностями грибков рода Candida (С. tropicalis, С. glabrata, С. krusei). Если раньше такие случаи были редки, то сейчас на долю этих грибков приходится 30-50% всех кандидозных инфекций. В настоящее время довольно часто встречаются БВ и КВВ одновременно в качестве смешанной инфекции, составляя от 10 до 39% всех случаев инфекционных заболеваний влагалища [4].
Второй важной социальной проблемой являются инфекции, передаваемые половым путем (ИППП), в связи с их широким распространением во многих странах мира, включая Российскую Федерацию [5-8]. Среди ИППП особое место занимает гонорея, что обусловлено высокой частотой осложнений, возникающих при этом заболевании. У женщин наиболее неблагоприятным отдаленным последствием острой гонококковой инфекции являются воспалительные заболевания органов малого таза, приводящие к бесплодию. Возбудителем гонококковой инфекции является гонококк, относящийся к семейству Neisseriaceae, роду Neisseria, виду Neisseria gonorrhoeae [9]. Уровень заболеваемости гонорей в Российской Федерации по данным официальной государственной статистики 2010 года составлял 42,7 случаев на 100000 населения [10], что существенно превышает показатели заболеваемости в странах Европы (10 случаев на 100000 населения) [7, 8]. В США гонококковая инфекция занимает второе место среди всех ИППП, уступая лишь урогенитальному хламидиозу [6, 11]. В 75-80% случаев у женщин гонорея протекает бессимптомно [12]. К настоящему времени гонококки приобрели устойчивость к многим классам антибиотиков. Антибиотикоустойчивые штаммы N. gonorrhoeae играют огромную роль в распространении гонококковой инфекции. Повышение устойчивости N. eisseria gonorrhoeae к антимикробным препаратам снижает эффективность стандартных схем лечения, что ведет к росту заболеваемости и увеличению экономических затрат на лечение [13]. N. gonorrhoeae - строго антропонозный патоген, единственным резервуаром этой инфекции является человек. Риск передачи гонококковой инфекции после однократного полового контакта составляет 70-80% от мужчины к женщине и 20-30% от женщины к мужчине [14]. Адгезия гонококков на эпителиоцитах влагалища и дистальных отделов уретры является первым и наиболее важным этапом в развитии гонореи и рассматривается в качестве мишени для создания эффективных профилактических и лекарственных средств, повышающих резистентность организма к данному заболеванию. Лактобациллы - один из наиболее перспективных источников конструирования антиадгезивных в отношении гонококков препаратов. Они выполняют ключевую роль в защите человека от патогенов, передаваемых половым путем. Бактериальный вагиноз, характеризующийся снижением уровня лактобацилл в репродуктивном тракте женщины вплоть до их полного исчезновения, создает предрасположенность к инфекциям, передаваемым половым путем [15]. В связи с вышеизложенным актуальной является разработка новых пробиотических препаратов для профилактики и комплексного лечения урогенитальных инфекционных заболеваний и ИППП, в частности гонореи.
Известна композиция, состоящая из Lactobacillus crispatus (DSM 22566), Lactobacillus rhamnosus (DSM 22560), Lactobacillus jensenii (DSM 22567), Lactobacillus gasseri (DSM 22583), предназначенная для лечения бактериального вагиноза и вульвовагинального кандидоза [16]. Однако спектр антагонистической активности этой композиции штаммов не включает N. honorrhoeae, что является актуальным в настоящее время.
Задачей настоящего изобретения является расширение ассортимента пробиотических штаммов, в частности, обладающих выраженными антагонистическими свойствами по отношению к N. honorrhoeae и пробиотических консорциумов, которые могут быть использованы при получении бактериальных препаратов, предназначенных для профилактики и лечения инфекций, передаваемых половым путем, в частности гонореи.
Поставленная задача решена тем, что получен пробиотический штамм Lactobacillus jensenii MD LIE-70(2) - BKM В-2834D, а также включающий его консорциум штаммов Lactobacillus jensenii BKM В-2834D, Lactobacillus crispatus BKM B-2727D, Lactobacillus gasseri BKM B-2728D, Lactobacillus plantarum BKM B-2731D, который обладает пробиотической активностью и может быть использован для изготовления бактериальных препаратов, направленных на профилактику и лечение инфекций, передаваемых половым путем, в частности гонореи.
Штамм Lactobacillus jensenii MD ПЕ-70(2) выделен из вагинального отделяемого здоровой женщины репродуктивного возраста.
Штамм Lactobacillus jensenii MD ПЕ-70(2) идентифицирован методом секвенирования гена 16S rRNA, депонирован во Всероссийской коллекции микроорганизмов Института биохимии и физиологии микроорганизмов им. Г.К. Скрябина РАН, (Московская обл., г. Пущино) и имеет регистрационный номер BKM B-2834D.
Штамм характеризуется следующими признаками.
Культурально-морфологические признаки.
При выращивании на поверхности агаризованной среды МРС рН-6,5 (Himedia, Индия) методом истощающего штриха в СО2 инкубаторе при 37°С в течение 24-48 часов образует средние, круглые, бледные колонии плоские с ровным краем.
При выращивании на жидкой среде МРС рН-6,5 (Himedia, Индия) при 37°С в течение 24-48 часов клетки штамма представляют средние палочки размером ~ 4 мкм, образуют короткие цепочки.
Физиолого-биологические признаки.
Штамм является факультативным анаэробом, температурный оптимум 37±2°С, растет при 42°С, слабый рост при 30°С. Оптимальное значение рН среды 5,0-6,0.
Биохимические свойства.
Способность штамма ферментировать углеводы оценивают в API-тесте в соответствии с инструкцией фирмы производителя (BioMerieux, Франция).
Штамм усваивает D-Рибозу, D-Галактозу, D-Глюкозу, D-Фруктозу, D-Мальтозу, D-Лактозу, D-Мелибиозу, D-Сахарозу.
Молекулярная идентификация.
Видовую принадлежность штамма Lactobacillus jensenii BKM B-2834D определяли с помощью анализа rRNA.
Для нахождения близкородственных организмов нуклеотидную последовательность гена16S rRNA сравнивают с последовательностями типовых штаммов по рибосомальной базе данных (RDBII - http://rdp.cme.msu.edu) и Генбанка национального центра биологической информации (NCBI - http://www.ncbi.nlm.nih.gov).
Чувствительность к антибиотикам.
Штамм Lactobacillus jensenii BKM B-2834D устойчив к антибиотикам пенициллинового и фторхинолонового ряда.
Способ, условия и состав сред для размножения штамма.
Штамм Lactobacillus jensenii BKM B-2834D выращивают при 37±2°С на жидкой среде МРС или в обезжиренном молоке (0,01-0,03% жира).
Коммерчески приобретенное обезжиренное молоко (0,01 - 0,03% жира) стерилизуют 20 минут автоклавированием при давлении 0,5 атм и температуре 110°С.
Для выращивания индивидуальных колоний штамма используют агаризованную среду МРС, содержащую 1,4% агара (Difco, США).
Способ, условия и состав сред для хранения штамма.
Штамм Lactobacillus jensenii BKM B-2834D может храниться:
- в стерильном обезжиренном молоке при 4°С с периодическим пересевом 1 раз в 15-20 дней;
- в лиофилизированном состоянии в запаянных ампулах (защитная среда при высушивании - сахароза 10%, рН 7,0 или стерильное обезжиренное молоко) в течение 2-х лет при температуре 4°С;
- в замороженном виде при -70°С. Длительность хранения 6 месяцев.
Консорциум штаммов Lactobacillus crispatus BKM В-2727D, Lactobacillus gasseri BKM B-2728D, Lactobacillus plantarum BKM B-2731D (далее консорциум 1), входящих в заявленный консорциум наряду со штаммом Lactobacillus jensenii BKM В-2834D, подробно описан в [17].
Заявленный консорциум штаммов Lactobacillus jensenii BKM В-2834D, Lactobacillus crispatus BKM B-2727D, Lactobacillus gasseri BKM В-2728D, Lactobacillus plantarum BKM B-2731D (далее консорциум 2) может храниться:
- в лиофилизированном состоянии в запаянных ампулах (защитная среда при высушивании - сахароза 10%, рН 7,0 или стерильное обезжиренное молоко) в течение 2-х лет при температуре 4°С;
- в замороженном виде при -70°С. Длительность хранения 6 месяцев.
Заявленное решение иллюстрируется чертежом, на котором показано влияние Lactobacillus jensenii BKM В-2834D, консорциума 1 и консорциума 2 на показатели инфицированности влагалища мышей патогеном N. gonorrhoeae.
Изобретение поясняется следующими примерами.
Пример 1. Культивирование штамма Lactobacillus jensenii BKM В-2834D в лабораторных условиях.
Для получения посевного материала в ампулу, содержащую 10 мг лиофилизированной культуры Lactobacillus jensenii BKM В-2834D, добавляют 0,5 мл стерильного раствора натрия хлорида 0,9% и выращивают культуру на поверхности агаризованной среды МРС методом истощающего штриха в термостате при 37°С в течение 18 часов. Затем изолированную колонию помещают в бактериологическую пробирку, содержащую 7 мл жидкой среды МРС и выращивают в термостате при 37°С в течение 15 часов.
Полученный посевной материал в количестве 1% вносят во флаконы, содержащие 500 мл жидкой среды МРС, и выращивают при 37°С в течение 18 часов. Титр полученной культуры 4,0×109 КОЕ/мл. Путем доведения концентрации клеток до 6,0×108 КОЕ/мл получают стандартизованную стартовую биомассу штамма Lactobacillus jensenii BKM В-2834D. Для длительного хранения клетки освобождают от компонентов среды выращивания путем центрифугирования, переводят в среду высушивания (защитная среда при высушивании - стерильное обезжиренное молоко), расфасовывают по 1 мл в пенициллиновые флаконы и лиофилизируют. В лиофильно высушенном состоянии стартовая биомасса может храниться в течение двух лет при температуре 4°С.
Пример 2. Получение бактериального препарата консорциума штаммов Lactobacillus jensenii BKM В-2834D, Lactobacillus crispatus BKM B-2727D, Lactobacillus sasseri BKM B-2728D. Lactobacillus plantarum BKM B-2731D.
Консорциум 1, содержащий штаммы Lactobacillus crispatus BKM B-2727D, Lactobacillus gasseri BKM B-2728D, Lactobacillus plantarum BKM B-2731D получают, как описано в работе [17]. Штаммы, составляющие консорциум 1, раздельно культивируют в жидкой среде МРС при 37°С в течение 18 часов, затем, доводя концентрацию клеток до 6,0×108 КОЕ/мл, получают стандартизованную стартовую биомассу каждого штамма. Культуры смешивают в равных объемах и получают стартовую биомассу консорциума 1. Стандартная концентрация клеток каждого штамма в полученной биомассе составляет 2×108 КОЕ/мл.
Стартовую биомассу штамма Lactobacillus jensenii BKM В-2834D, полученную по примеру 1, смешивают со стартовой биомассой консорциума 1 в соотношении 1:3 по объему, что позволяет получить консорциум 2, в котором штаммы Lactobacillus jensenii BKM В-2834D, Lactobacillus crispatus BKM B-2727D, Lactobacillus gasseri BKM B-2728D, Lactobacillus plantarum BKM B-2731D находятся в равных концентрациях, т.е. в соотношении 1:1:1:1.
Стандартная концентрация клеток каждого штамма в полученной биомассе (стандартизованная стартовая биомасса) составляет 1,5×108 КОЕ/мл. Общий титр - 6,0×108 КОЕ/мл.
Консорциум штаммов Lactobacillus jensenii BKM В-2834D, Lactobacillus crispatus BKM B-2727D, Lactobacillus gasseri BKM В-2728D, Lactobacillus plantarum BKM B-2731D может быть также получен непосредственным смешением стандартизованных биомасс всех штаммов. При этом для получения консорциума могут быть использованы и другие соотношения исходных штаммов (от 1:100 до 100:1), но соотношение 1:1:1:1 является предпочтительным.
Полученный консорциум лиофилизируют по примеру 1. В лиофильно высушенном состоянии бактериальный препарат может храниться в течение двух лет при температуре 4°С. Общий титр клеток в одном флаконе - 6,0×108 КОЕ.
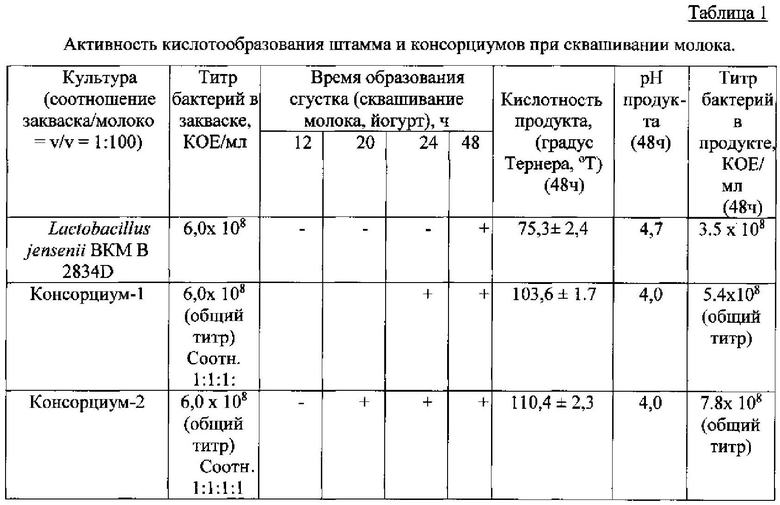
Пример 3. Оценка активности кислотообразования.
Активность кислотообразования определяют титриметрическим методом [18].
В качестве закваски используют стандартизованную стартовую биомассу штамма Lactobacillus jensenii BKM В-2834D, полученную по примеру 1, и стартовые биомассы консорциума 1 и консорциума 2, полученные по примеру 2.
Закваски (штамм и каждый консорциум в отдельности) в количестве 1% вносят во флаконы, содержащие молоко 1,5% жирности, и культивируют в течение 24-48 ч при 37°С. Измерения проводят в течение 48 часов. Результат представляют в градусах Тернера (Т° - величина, выражающая количество 0,1 N щелочи, пошедшей на титрование 100 мл исследуемого образца).
Результаты, приведенные в табл. 1, показывают, что штамм Lactobacillus jensenii BKM В-2834D сквашивает молоко за 48 часов, кислотность продукта составляет 75,3±2,4°T.
При инокуляции консорциума 2 образование сгустка происходит за 20 часов, и к 48 часам кислотность продукта достигает 110,4±2,3°Т, что соответствует нормативам кисломолочных напитков и йогуртов 70-140°Т. Полученный продукт обладает хорошими вкусовыми свойствами и имеет легкий кисломолочный запах. Проведенные исследования показали, что свойства заявляемого консорциума при использовании его в качестве закваски прямого внесения, соответствуют технологическим требованиям производства кисломолочных продуктов.
Пример 4. Исследование устойчивости штамма Lactobacillus jensenii BKM В-2834D к желудочному и кишечному стрессам (способность расти в среде с низким значением рН или в среде, содержащей желчь).
При пероральном применении пробиотических препаратов чрезвычайно важно, чтобы штаммы лактобацилл, входящие в консорциум, были устойчивы к желудочному и кишечному стрессам.
При исследовании используют следующие методики.
Имитация желудочного стресса in vitro
Композиция искусственного желудочного сока:
NaCl (SigmaS9625) 2,2 г/л
L-молочная кислота (SigmaL1750) 9,9 г/л (0,11 М)
Pepsin (SigmaP7125) 3,5 г/л
рН: 2,7±0,02 (доводят 35% NaOH)
рН после разведения 1/11: 3,10±0,10 (контролируют для каждой культуры).
1 мл искусственного желудочного сока добавляют к 100 мкл культуры в стационарной фазе (1/11 разведение). Культуры инкубируют в течение 10 минут, 30 минут и 60 минут при 37°С, 10% СО2. В качестве контроля вместо искусственного желудочного сока используют 1 мл МРС. Измерения выполняют в двух повторах для каждой культуры.
После инкубаций культуру (каждую повторность и контроли) разводят от 102 до 109 или 1010 в МРС, разведения высевают на чашках с МРС-агаром и инкубируют в течение 24-48 часов при 37°С, 10% СО2). Определяют титр культуры в условиях стресса и без стресса путем подсчета количества колоний для разведений.
Имитация кишечного стресса in vitro
Композиция искусственного кишечного сока:
Желчные соли (желчь свиньи SigmaB8631) 3,3 г/л (конечная концентрация: 0,3%)
Карбонатный буфер NaHCO3 (Sigma S8875) 16,5 г/л (конечная концентрация: 1,5%)
рН: 6,3
1 мл искусственного кишечного сока добавляют к 100 мкл культуры в стационарной фазе (1/11 разведение). Культуры инкубируют в течение 5 часов при 37°С, 10% СО2. В качестве контроля используют 1 мл МРС. Измерения выполняют в двух повторах для каждой культуры.
Культуры и контроли разводят от 102 до 109 или 1010 в МРС, разведения высевают на чашках с МРС-агаром и инкубируют в течение 24-48 часов при 37°С, 10% СО2. Определяют титр в условиях стресса и без стресса путем подсчета количества колоний для разведений.
Подсчет микроорганизмов в миллилитре культуры КОЕ осуществляют по формуле:
ΣC/(n1+0.1n2)d,
где: ΣC - сумма всех характерных колоний, подсчитанных на всех чашках, содержащих от 15 до 300 колоний;
n1 - количество чашек, в самом низком разведении (2 чашки на разведение);
n2 - количество чашек, в самом высоком разведении (2 чашки на разведение);
d - величина первого разведения (низкое разведение), взятого для подсчета.
Для определения устойчивости лактобацилл к желудочному и кишечному стрессам используют культуры в стационарной фазе роста, выращенные на жидкой среде МРС, рН-6,5 в течение 18 часов при 37°С, 10% CO2.
Результаты, приведенные в табл.2, показывают, что штамм Lactobacillus jensenii MD IIE-70(2) обладает высокой устойчивостью к желудочному и кишечному стрессам.
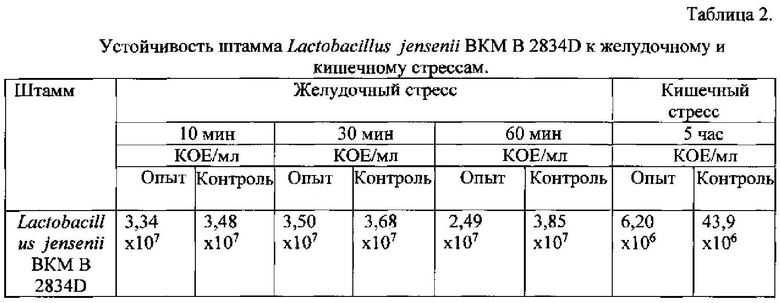
В работе [17] приведены данные, свидетельствующие об по устойчивости штаммов Lactobacillus crispatus BKM B-2727D, Lactobacillus gasseri BKM B-2728D, Lactobacillus plantarum BKM B-2731D к желудочному и кишечному стрессам. Таким образом, все штаммы, входящие в консорциум 2, являются устойчивыми к воздействию экстремальных факторов, таких как низкая кислотность и содержание желчи, и, следовательно, консорциум 2 является перспективным для использования в медицинской промышленности для получения лекарственных препаратов, применяемых не только интравагинально, но и per os.
Пример 5. Способность продуцировать Н2О2.
Эффективная продукция перекиси водорода (Н2О2) пробиотическими лактобациллами является одним из основных факторов, обеспечивающих колонизационную резистентность микробиоценозов организма [19]. Количественное определение перекиси водорода (Н2О2), продуцируемое культурами лактобацилл, осуществляют колориметрическим методом, используя хромофор 3,3′,5,5′-tetramethylbenzidine (ТМВ) (Sigma) в присутствии пероксидазы хрена (Sigma) [20].

Результаты, приведенные в табл.3, показывают, что наиболее эффективная продукция Н2О2 отмечалась при культивировании консорциума 2.
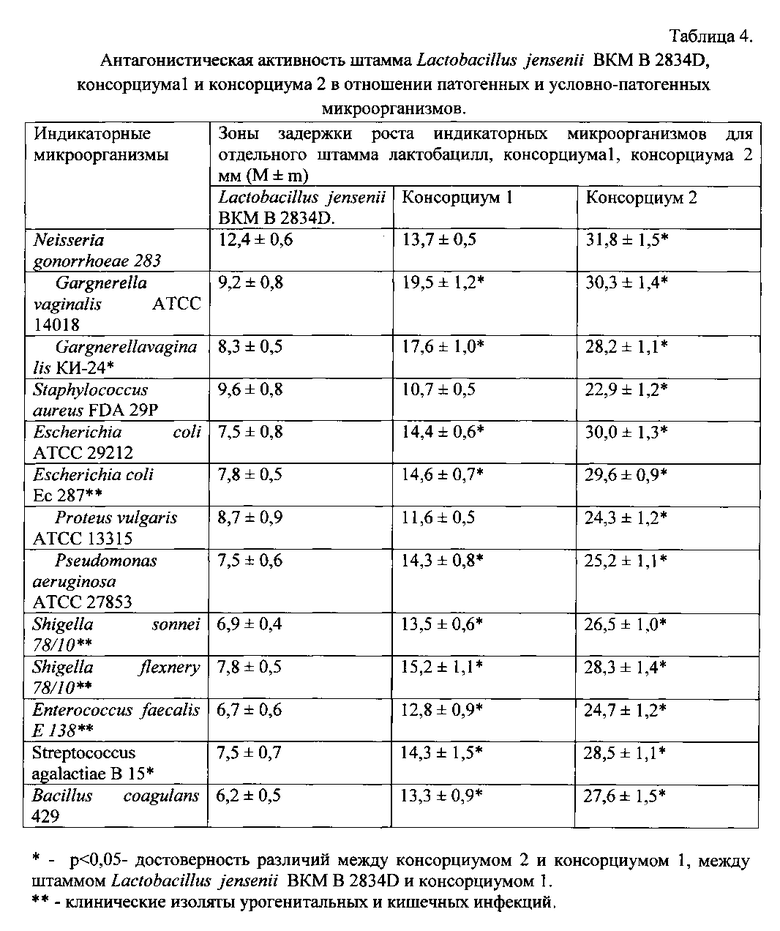
Пример 6. Исследование антагонистической активности штамма Lactobacillus jensenii BKM В-2834D, консорциума 1 и консорциума 2.
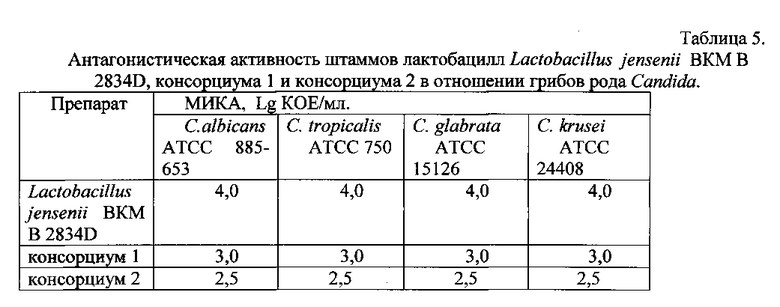
Исследование антагонистической активности культур лактобацилл проводят методом двухслойного агара [21]. Результаты исследований приведены в табл.4. Антагонистическую активность лактобацилл в отношении грибов рода Candida выражают минимальной ингибирующей концентрацией антагониста (МИКА, lg КОЕ/мл) - это минимальное количество антагониста, ингибирующего размножение индикаторной культуры.
Результаты исследований приведены в табл.5. Штамм Lactobacillus jensenii BKM В-2834D обладает широким спектром антагонистической активности. Различия в антагонистической активности штамма Lactobacillus jensenii BKM В-2834D и консорциума 1, содержащего штаммы Lactobacillus crispatus BKM B-2727D, Lactobacillus gasseri BKM B-2728D, Lactobacillus plantarum BKM B-2731D по отношению к Neisseria gonorrhoeae штамм 283 являются статистически недостоверными. Добавление штамма Lactobacillus jensenii BKM В-2834D к консорциуму 1 приводит к достоверному увеличению антагонистической активности нового пробиотического препарата - консорциума 2 - по сравнению с консорциумом 1 и отдельно используемым штаммом Lactobacillus jensenii BKM В-2834D (р<0,05). Антагонистическая активность консорциума 1 по отношению к G.vaginalis (этиологический агент бактериального вагиноза) достоверно выше по сравнению со шаммом Lactobacillus jensenii BKM В-2834D (р<0,05). При совместном применении шамма Lactobacillus jensenii BKM В-2834D со штаммами консорциума1 Lactobacillus crispatus BKM B-2727D, Lactobacillus gasseri BKM B-2728D, Lactobacillus plantarum BKM B-2731D (консорциум 2) отмечается синергизм их действия. Антагонистическая активность консорциума 2 достоверно выше по сравнению с консорциумом 1 (р<0,05).
Таким образом, результаты исследований свидетельствуют о том, что консорциум 2 проявляет более выраженную антагонистическую активность по сравнению с консорциумом 1 и штаммом Lactobacillus jensenii BKM В-2834D.
Штамм Lactobacillus jensenii BKM В-2834D проявляет в равной степени антагонистическую активность по отношению ко всем разновидностям грибков рода Candida (С. albicans, С. tropicalis, С. glabrata, С. krusei).
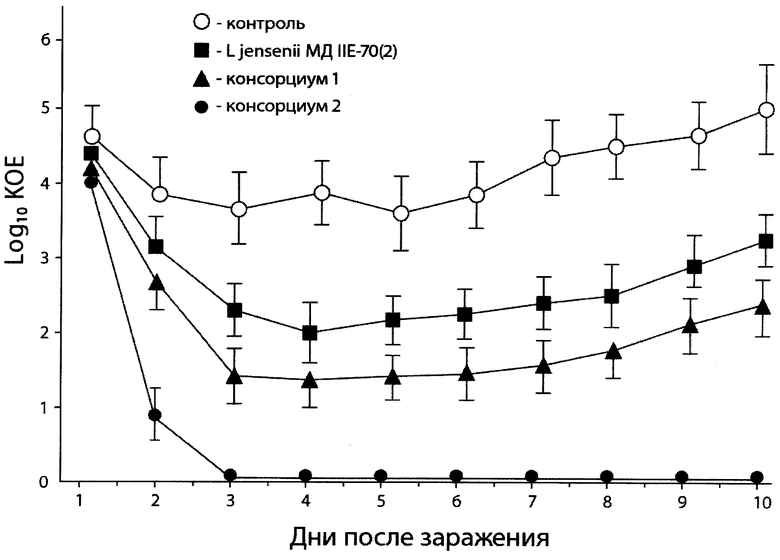
Пример 7. Снижение восприимчивости мышей Balb/c к экспериментальной гонококковой инфекции.
Эффективность применения Lactobacillus jensenii BKM В-2834D и консорциума 2 с целью снижения восприимчивости к гонококковой инфекции оценивают в опытах in vivo на мышах Balb/c по методу, предложенному в работе [22]. Мышей заражают интравагинально N. gonorrhoeae в дозе 106 КОЕ/мл. В данной работе использовали N. gonorrhoeae штамм 283.
Для интравагинального заражения животных культуру N. gonorrhoeae штамм 283 выращивают в течение 18 часов на GC - агаре (Becton Dickinson, США). Образцы вагинального отделяемого мышей получают с помощью ватных тампонов, которые после взятия исследуемого материала помещают в 1 мл физиологического раствора. Забор вагинального отделяемого проводят ежедневно в течение 10 дней и анализируют с помощью культуральных методов. Для выявления N. gonorrhoeae образцы вагинального отделяемого в физиологическом растворе высевают на GC-VCNTS агар (Becton Dickinson, США) и подсчитывают число выросших колоний. Восприимчивость мышей к экспериментальной гонококковой инфекции оценивают по изменению инфицированности влагалища животных под влиянием интравагинального введения лактобацилл. Инфицированность влагалища мышей определяют по количеству выросших колоний N. gonorrhoeae, выраженному в десятичном логарифме колониеобразующих единиц (КОЕ) на 1 мл. Для выявления лактобацилл образцы вагинального отделяемого в физиологическом растворе высевают на агаризованную среду МРС (Himedia, Индия).
Идентификацию штаммов Lactobacillus jensenii BKM В-2834D, Lactobacillus crispatus BKM B-2727D, Lactobacillus gasseri BKM B-2728D, Lactobacillus plantarum BKM B-2731D проводят методом геномного фингерпринтинга с применением ERIC-праймеров и ВОХА-1, BOXS1 - праймеров [23]. В опытах используют 24 мыши Balb/c (возраст 6 недель). Животных разделяют на 4 группы по 6 животных в каждой.
Животным группы 1 вводят интравагинально однократно 106 КОЕ/мл N. gonorrhoeae (контроль).
Животным группы 2 вводят интравагинально однократно 106 КОЕ/мл N. gonorrhoeae. Через 2 часа вводят дополнительно интравагинально 6×107 КОЕ/мл Lactobacillus jensenii BKM В-2834D.
Животным группы 3 вводят интравагинально однократно 106 КОЕ/мл N. gonorrhoeae. Через 2 часа вводят дополнительно интравагинально 6×107 КОЕ/мл консорциум 1, содержащий 2×107 КОЕ/мл Lactobacillus crispatus BKM B-2727D, Lactobacillus gasseri BKM B-2728D, Lactobacillus plantarum BKM B-2731D.
Животным группы 4 вводят интравагинально однократно 106 КОЕ/мл N. gonorrhoeae. Через 2 часа вводят дополнительно интравагинально 6×107 КОЕ/мл консорциум 2, содержащий 1,5×107 КОЕ/мл Lactobacillus jensenii BKM В-2834D), 1,5×107 КОЕ/мл Lactobacillus crispatus BKM B-2727D, 1,5×107 КОЕ/мл Lactobacillus gasseri BKM B-2728D, 1,5×107 КОЕ/мл Lactobacillus plantarum BKM B-2731D.
Результаты исследований, приведенные на чертеже, показывают, что консорциум 2, содержащий штаммы Lactobacillus jensenii BKM В-2834D, Lactobacillus crispatus BKM B-2727D, Lactobacillus gasseri BKM B-2728D, Lactobacillus plantarum BKM B-273 ID, наиболее эффективно снижает восприимчивость мышей Balb/c к гонококковой инфекции. У животных в группе 2 на протяжении всего периода наблюдения в вагинальном отделяемом обнаруживается штамм Lactobacillus jensenii BKM В-2834D. У животных в группе 3 обнаруживаются все штаммы лактобацилл, входящие в консорциум 1, а в группе 4 обнаруживаются все штаммы лактобацилл, входящие в состав консорциума 2.
Таким образом, проведенные исследования позволяют предложить штамм Lactobacillus jensenii BKM В-2834D и консорциум, содержащий штаммы Lactobacillus jensenii BKM В-2834D, Lactobacillus crispatus BKM B-2727D, Lactobacillus gasseri BKM B-2728D, Lactobacillus plantarum BKM B-2731D, для использования в производстве пробиотических бактериальных препаратов для профилактики и лечения урогенитальных инфекционных заболеваний и инфекций, передаваемых половым путем.
Литература
1. Кочеровец В.И., Бунятян Н.Д. Нормальная микрофлора женских мочеполовых путей и препараты для ее коррекции. Учебное пособие. - М.: Издательский дом «АКТЕОН», 2011, 72 с.
2. Анкирская А.С. Акушерство и гинекология, 2005, №3.
4. Redondo-Lopez V., Veriwether С, Schmitt С, et al., Vullvovaginal candidiasis complicating recruitment bacterial vaginosis. Sex. Transm. Dis. 1990.17, 51-53.
3. Sobel JD (2007) Vulvovaginal candidiasis. Lancet 369: 1961-1971. doi: 10.1016/S0140-314 6736(07)60917-9.
5. Кубанова А.А. Анализ эпидемиологической ситуации по заболеваемости инфекциями, передаваемыми половым путем, болезнями кожи и подкожной клетчатки населения Российской Федерации по данным официальной государственной статистики // Вестн. дерматол. и венерол. - 2008. - №5. - С. 8-18.
6. Centers for Disease Control and PreventionSexually Transmitted Diseases in the United States, 2008.
National Surveillance Data for Chlamydia, Gonorrhea, and Syphilis. Avaluated at: http://www.cdc.gov/std/stats08/trends.htm.
7. Bignell C. 2009 European (IUSTI/WHO) guideline on the diagnosis and treatment of gonorrhoea in adults // Int. J. STD & AIDS. - 2009. - V. 20, n. 7. - P. 453-457.
8. European health for all database (HFA-DB) World Health Organization Regional Office // Avaluated at: http://data.euro.who. int/hfadb/
9. Bergey′s Manual of Determinative Bacteriology", 241, - The Williams and Wilkins Company, Baltimore, 1980.
10. Резистентность возбудителей ИППП к антибактериальным препаратам. Информационный бюллетень, 2010 год. - М.: ООО «ДЭКС-ПРЕСС», 2010.
11. Workowski К.А. Centers for Disease Control and Prevention (CDC). Sexually transmitted diseases treatment guidelines, 2010 / K.A. Workowski, S. Berman // MMWR Recomm. Rep. - 2010. - V. 59 (RR-12). - P. 1-110.
12. Chandeying V. The prevalence of urethral infections amongst asymptomatic young men in Hat Yai, southern Thailand /V.Chandeying, S. Skov, P. Duramad et al // Int. J. STD AIDS. - 2000. - V. 11, n. 6. - P. 402-405.
13. Simonsen G.C. The antimicrobial resistance containment and surveillance approach - a public health tool / G.C. Simonsen, J.W. Tapsall, B. Allegranzi et al // Bull WHO - 2004. - V. 82. - P. 928-934.
14. Fischer S.H. Gonococci possessing only certain P.II outer membrane proteins interact with human neutrophils / S.H. Fischer, R.F. Rest // Infect. Immun. - 1988. - V. 56, n. 6. - P. 1574-1579.
15. Wiesenfeld, H.C., S.L. Hillier, M.A. Krohn, D.V. Landers, and R. Sweet. 2003. Bacterial vaginosis is a strong predictor of Neisseria gonorrhoeae and Chlamydia trachomatis infection. Clin. Infect. Dis. 36:663-668.
16. Патент EP 2509610 B1.
17. Патент РФ RU 2504580 C1.
18. ГОСТ 3624-92. Молоко и молочные продукты. Титриметрические методы определения кислотности.
19. ReidG. robiotic agents to protect the urogenital tract against infections. Am. J. Clin. Nutr., 2001, 73 (Suppl.): 437-443.
20. Martin R., Suárez J. Biosynthesis and Degradation of H2O2 by Vaginal http://Lactobacilli.2010.Appl. Environ. Microbiol. vol. 76 no. 2 p. 400-405.
21. Ермоленко Е.И., Исаков B.A., Ждан-Пушкина С.Х., Тец В.В. Количественная оценка антагонистической активности лактобацилл. // Журн. микробиол., эпидем., иммунобиол. - 2004. - 5. - С. 94-98.
22. Jerse А. Е. Experimental Gonococcal Genital Tract Infection and Opacity Protein Expression in Estradiol-Treated Mice. INFECTION AND IMMUNITY, 1999, 67, 5699-5708.
23. Цыганкова С, Булыгина E., Кузнецов Б. и др. Получение внутрипопуляционных диссоциантов некоторых бацилл и применение метода DIR-ПЦР для их идентификации. Микробиология. 2004. Т. 73. №3. 398-405.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПРОБИОТИЧЕСКИЕ ШТАММЫ Lactobacillus И ИХ КОНСОРЦИУМ ДЛЯ ПРОФИЛАКТИКИ И ЛЕЧЕНИЯ УРОГЕНИТАЛЬНЫХ ИНФЕКЦИОННЫХ ЗАБОЛЕВАНИЙ У ЖЕНЩИН | 2012 |
|
RU2504580C1 |
| ШТАММ Lactobacillus fermentum, ОБЛАДАЮЩИЙ ШИРОКИМ СПЕКТРОМ АНТАГОНИСТИЧЕСКОЙ АКТИВНОСТИ И ПРОБИОТИЧЕСКИЙ КОНСОРЦИУМ ЛАКТОБАКТЕРИЙ ДЛЯ ИЗГОТОВЛЕНИЯ БАКТЕРИАЛЬНЫХ ПРЕПАРАТОВ | 2013 |
|
RU2528862C1 |
| КОНСОРЦИУМ ПРОБИОТИЧЕСКИХ ШТАММОВ Lactobacillus rhamnosus И Lactobacillus plantarum ДЛЯ ИЗГОТОВЛЕНИЯ БАКТЕРИАЛЬНОГО ПРЕПАРАТА И ЗАКВАСКИ ПРЯМОГО ВНЕСЕНИЯ ДЛЯ ПРОИЗВОДСТВА ФЕРМЕНТИРОВАННОГО МОЛОКА И ФЕРМЕНТИРОВАННОГО СВЕКОЛЬНОГО СОКА | 2012 |
|
RU2506308C1 |
| Пробиотический штамм Lactobacillus gasseri и его композиция с лактоферрином для профилактики диареи, некротизирующего энтероколита и сепсиса, вызываемых штаммами Escherichia coli у преждевременно рожденных детей | 2016 |
|
RU2641258C1 |
| Применение симбиотического консорциума штаммов пробиотических лактобацилл, выделенных из женского молока, оказывающего бактерицидное действие на мастит-индуцирующие патогены, для изготовления лекарственных средств для комплексной профилактики и лечения лактационного мастита | 2022 |
|
RU2801119C1 |
| Штамм бактерий Lactobacillus plantarum ВКШМ-Г-06ПД | 2024 |
|
RU2827608C1 |
| Штамм Lactobacillus salivarius ВКШМ-Г-08ПД | 2024 |
|
RU2822455C1 |
| Способ криоконсервации аутологичных вагинальных лактобацилл | 2022 |
|
RU2802074C1 |
| Штамм бактерий Levilactobacillu brevis ВКШМ-Г-07ПД | 2024 |
|
RU2821556C1 |
| СПОСОБ ПРОИЗВОДСТВА КАПСУЛИРОВАННОЙ ФОРМЫ ПРОБИОТИЧЕСКОЙ ПИЩЕВОЙ ДОБАВКИ | 2021 |
|
RU2795965C1 |
Заявленная группа изобретений относится к биотехнологии. Штамм Lactobacillus jensenii депонирован во Всероссийской коллекции микроорганизмов ИБФМ им Г.К. Скрябина РАН под регистрационным номером BKM В-2834D. Данный штамм обладает широким спектром антагонистической активности по отношению к патогенным и условно-патогенным микроорганизмам. Биомассу штамма Lactobacillus jensenii BKM В-2834D смешивают с биомассами штаммов Lactobacillus crispatus BKM B-2727D, Lactobacillus gasseri BKM B-2728D, Lactobacillus plantarum BKM B-2731D с получением консорциума. Полученный консорциум обладает пробиотическим действием и может быть использован для изготовления бактериальных препаратов. Группа изобретений позволяет расширить ассортимент пробиотических штаммов для профилактики и лечения инфекций, передаваемых половым путем. 2 н.п. ф-лы, 1 ил., 5 табл., 6 пр.
1. Штамм бактерий Lactobacillus jensenii ВКМ В-2834D, обладающий широким спектром антагонистической активности по отношению к патогенным и условно-патогенным микроорганизмам.
2. Консорциум штаммов Lactobacillus jensenii ВКМ В-2834D, Lactobacillus crispatus ВКМ B-2727D, Lactobacillus gasseri ВКМ B-2728D, Lactobacillus plantarum ВКМ B-2731D, обладающий пробиотическими свойствами и используемый для изготовления бактериальных препаратов.
| СПОСОБ И УСТРОЙСТВО ДЛЯ ПОЛУЧЕНИЯ ЗАРЯЖЕННЫХ КАПЕЛЬ ЖИДКОСТИ | 2010 |
|
RU2509610C2 |
| ПРОБИОТИЧЕСКИЕ ШТАММЫ Lactobacillus И ИХ КОНСОРЦИУМ ДЛЯ ПРОФИЛАКТИКИ И ЛЕЧЕНИЯ УРОГЕНИТАЛЬНЫХ ИНФЕКЦИОННЫХ ЗАБОЛЕВАНИЙ У ЖЕНЩИН | 2012 |
|
RU2504580C1 |
| SOLEDAD B., HUAN E | |||
| SUAREZ et | |||
| al., Adherence of human vaginal Lactobacilli to vaginal epithelial cells and interaction with uropathogens, Infect immun, 1998, may, 66 (5) p | |||
| Приспособление для установки двигателя в топках с получающими возвратно-поступательное перемещение колосниками | 1917 |
|
SU1985A1 |
Авторы
Даты
2016-01-10—Публикация
2015-03-03—Подача