ОБЛАСТЬ ТЕХНИКИ
[001] Настоящее изобретение относится к комбинированной терапии для лечения раковых заболеваний, причем комбинация включает внутривенно вводимый рекомбинантный модифицированный вирус осповакцины Анкара (MVA), содержащий нуклеиновую кислоту, кодирующую гетерологичный опухолеассоциированный антиген (ОАА), и антитело.
УРОВЕНЬ ТЕХНИКИ ИЗОБРЕТЕНИЯ
[002] Рекомбинантные поксвирусы применяли в качестве иммунотерапевтических вакцин против инфекционных организмов и, позже, против опухолей. Mastrangelo et al. J Clin Invest. 2000;105(8):1031-1034.
[003] Одним из поксвирусных штаммов, применимость которых в качестве иммунотерапевтической вакцины против инфекционных заболеваний и рака была доказана, является модифицированный вирус осповакцины Анкара (MVA). MVA был создан путем 516 серийных пассажей в куриных эмбриональных фибробластах штамма Анкара вируса осповакцины (CVA) (обзор смотрите в Mayr, A., et al. Infection 3, 6-14 (1975)). Вследствие этих длительных пассажей в геноме полученного в результате вируса MVA было удалено около 31 тысяч оснований в его геномной последовательности и, следовательно, он очень ограничен по репликации в отношении клеток-хозяев клетками птиц (Meyer, H. et al., J. Gen. Virol. 72, 1031-1038 (1991)). В ряде животных моделей было показано, что полученный в результате MVA является по существу авирулентным (Mayr, A. & Danner, K., Dev. Biol. Stand. 41: 225-34 (1978)). Были описаны штаммы MVA, имеющие улучшенные профили безопасности, для разработки более безопасных продуктов, таких как вакцины или фармацевтические средства. Смотрите международную публикацию PCT WO2002042480 (также смотрите патенты США №№ 6761893 и 6913752), которые все включены в данный документ посредством ссылки. Такие варианты способны к репродуктивной репликации в нечеловеческих клетках и клеточных линиях, в особенности в куриных эмбриональных фибробластах (CEF), но не способны к репликации в человеческих клеточных линиях, в частности, включая линии клеток HeLa, HaCat и 143B. Такие штаммы также не способны к репродуктивной репликации in vivo, например, в определенных мышиных штаммах, таких как трансгенная мышиная модель AGR 129, которая имеет очень ослабленный иммунитет и высокую восприимчивость к реплицирующимся вирусам. Смотрите патент США № 6761893. Были описаны такие варианты MVA и его производные, включая рекомбинантные варианты, называемые «MVA-BN». Смотрите международную публикацию PCT WO2002042480 (также смотрите патенты США №№ 6761893 и 6913752).
[004] Было показано, что применение поксвирусных векторов, которые кодируют опухолеассоциированные антигены (ОАА), успешно снижает размер опухоли, а также повышает общий уровень выживаемости онкологических пациентов. Смотрите, например, WO 2014/062778. Было продемонстрировано, что когда онкологическому пациенту вводят поксвирусный вектор, кодирующий ОАА, такой как HER2, CEA, MUC1 и/или Brachyury, в организме пациента генерируется сильный и специфический Т-клеточный ответ для борьбы с раком. Id., также смотрите, Guardino et al. (2009), Heery et al., (2015)
[005] HER2 является одним таким ОАА, который, как было показано, является эффективным, когда он кодируется как часть поксвирусного вектора. Id. HER2 является опухолеассоциированным антигеном, который сверхэкспрессируется в определенных типах опухолевых клеток у некоторых пациентов, имеющих разные типы рака, такие как рак молочной железы, прямой и ободочной кишки, легкого, яичника, шейки матки, мочевого пузыря, желудка и уротелия. Иммунизацию различными полипептидами HER2 использовали для генерации иммунного ответа против опухолевых клеток, экспрессирующих этот антиген, как и вакцинацию векторами на основе рекомбинантного модифицированного вируса осповакцины Анкара («MVA»), экспрессирующими модифицированную форму белка HER2 (т. е. MVA-BN-HER2). Смотрите, например, Renard et al., J. Immunol. 171:1588-1595 (2003); Mittendorf et al., Cancer 106:2309-2317 (2006); Mandl et al., Cancer Immunol. Immunother. 61(1):19-29 (2012).
[006] В предыдущей работе по MVA-BN-HER2 было показано, что он индуцирует TH1-смещенный иммунный ответ, имеющий как связанную с антителом, так и клеточную компоненты. Смотрите, например, Mandl et al., 2012. Те же исследователи показали, что сбалансированный иммунный ответ, включающий как гуморальную, так и клеточноопосредованную компоненты, важен для защиты от различных патогенов и их выведения в контексте инфекционного заболевания. Смотрите, например, Hutchings et al., J. Immunol. 175:599-606 (2005).
[007] Помимо их эффективности в комбинации с ОАА, было показано, что поксвирусы, такие как MVA, имеют повышенную эффективность в комбинации с агонистом CD40, таким как лиганд CD40 (CD40L). Смотрите WO 2014/037124. CD40/CD40L является представителем суперсемейства рецепторов факторов некроза опухоли/факторов некроза опухоли («TNFR/TNF»). Хотя CD40 характеризуется конститутивной экспрессией на многих типах клеток, включая B-клетки, макрофаги, ДК (дендритные клетки), его лиганд CD40L экспрессируется преимущественно на активированных CD4+ T-клетках [Lee et al., "CD40, but not CD154, expression on B-cells is necessary for optimal primary B-cell responses," J. Immunol. 171(11):5707-5717 (2002); D. Y. Ma и E. A. Clark, "The role of CD40 and CD154/CD40L in dendritic cells," Semin. Immunol. 21(5):265-272 (2009)]. Когнатное взаимодействие между ДК и CD4+ T-клетками на ранних этапах после инфицирования или иммунизации «дает лицензию» ДК на примирование CD8+ T-клеточных ответов [J. P. Ridge et al., "A conditioned dendritic cell can be a temporal bridge between a CD4+ T-helper and a T-killer cell," Nature 393(6684):474-478 (1998)]. Лицензирование ДК приводит к повышению экспрессии костимулирующих молекул, повышению выживаемости и лучшей способности к перекрестной презентации ДК. Этот процесс опосредуется в основном через взаимодействие CD40/CD40L [S. R. Bennet et al., "Help for cytotoxic T-cell responses is mediated by CD40 signalling," Nature 393(6684):478-480 (1998); S. P. Schoenberger et al., "T-cell help for cytotoxic T-cell help is mediated by CD40-CD40L interactions," Nature 393(6684):480-483 (1998)], но также существуют CD40/CD40L-независимые механизмы (CD70, LT.beta.R). Интересно, что также было сделано предположение о прямом взаимодействии между CD40L, экспрессируемым на ДК, и CD40, экспрессируемым на CD8+ T-клетках, что обеспечивает возможное объяснение генерации хелпер-независимых ответов ЦТЛ [S. Johnson et al., "Selected Toll-like receptor ligands and viruses promote helper-independent cytotoxic T-cell priming by upregulating CD40L on dendritic cells," Immunity 30(2):218-227 (2009)].
[008] Несколько исследований показали, что агонистические анти-CD40 антитела можно применять в качестве адъюванта в вакцине. Кроме того, были созданы рекомбинантные AdV [K. Kato et al., "Gene transfer of CD40-ligand induces autologous immune recognition of chronic lymphocytic leukemia B-cells," J. Clin. Invest. 101(5):1133-1141 (1998)] и VV [Bereta et al., "Immune properties of recombinant vaccinia virus encoding CD154 (CD40L) are determined by expression of virally encoded CD40L and the presence of CD40L protein in viral particles," Cancer Gen. Ther. 11(12):808-818 (2004)], кодирующие CD40L, которые продемонстрировали превосходящую иммуногенность in vitro и in vivo по сравнению с неадъювантными вирусами.
[009] Было показано, что CD40L, кодируемый как часть MVA, способен индуцировать и усиливать общий Т-клеточный ответ в отношении связанного с заболеванием антигена. WO 2014/037124. В WO 2014/037124 было показано, что рекомбинантный MVA, кодирующий CD40L и гетерологичный антиген, был способен усиливать активацию ДК in vivo, повышать Т-клеточные ответы, специфические в отношении гетерологичного антигена, и повышать качество и количество CD8 T-клеток. Id.
[010] За последнее десятилетие применение антител для терапии онкологии также достигло значительного успеха. Смотрите, например, Scott et al., Nature Reviews Cancer 12, 278-287 (2012). Существует несколько терапевтических средств на основе антител, которые получили одобрение FDA и уничтожают опухолевые клетки несколькими путями. Например, терапевтические средства на основе антител могут уничтожать опухолевые клетки посредством прямого действия антитела, например, связывания антитела с опухолевым антигеном на клеточной поверхности. Id. Смотрите, например, Brodowicz et al., (2001). Это может приводить к апоптозу и гибели опухолевых клеток, а также ингибированию активности опухолевых рецепторов. Предотвращение активности рецепторов может включать: предотвращение димеризации опухолевого рецептора, предотвращение активации киназ, блокирование внеклеточного расщепления рецепторов, индукцию интернализации рецепторов и последующей сигнализации. Ингибирование активности опухолевых рецепторов терапевтическими средствами на основе антител может предотвратить пролиферацию опухоли. Id.
[011] Терапевтические средства на основе антител могут дополнительно уничтожать опухолевые клетки посредством усиления собственной иммунной системы онкологического пациента так, чтобы она атаковала опухолевые клетки, что называется иммуноопосредованным уничтожением опухолевых клеток. Id. Иммуноопосредованное уничтожение опухолевых клеток может включать фагоцитоз, активацию системы комплемента, антителозависимую клеточную цитотоксичность (АЗКЦ), нацеливание генетически модифицированных Т-клеток на опухоль антителом и ингибирование рецепторов ингибиторов Т-клеток, таких как CTLA-4. Id.
[012] АЗКЦ является одним из наиболее важных путей, посредством которого терапевтические средства на основе антител атакуют и разрушают опухолевые клетки. АЗКЦ запускается посредством активации взаимодействия между связанным с мишенью антителом на мембране опухолевой клетки и эффекторными клетками иммунной системы пациента. Wang et al., NK Cell mediated Antibody Dependent Cellular Cytotoxicity in Cancer Immunotherapy Front Immunol vol. 6 (2015). Было показано, что противоопухолевая эффективность многих терапевтических средств на основе антител зависит от естественных клеток-киллеров (NK). Id. Человеческие NK-клетки могут экспрессировать белки, которые связываются с Fc-фрагментом антител. После связывания и активации NK-клетки опосредуют уничтожение опухоли несколькими путями, включая экзоцитоз цитотоксических гранул, сигнализацию рецепторов семейства TNF и высвобождение провоспалительных цитокинов, таких как IFNγ. Id.
[013] Хотя существуют успешные варианты лечение рака на основе поксвирусов, химио- и лучевой терапии, а также терапевтических средств на основе антител для онкологических пациентов, существует много механизмов, которые используются опухолевыми клетками, чтобы уклониться от действия и/или снизить действие этих вариантов лечения. Например, чтобы уклониться от иммунной системы конкретного пациента, многие опухолевые клетки используют молекулы иммунных контрольных точек и/или снижают специфическую экспрессию молекул основного комплекса гистосовместимости (ГКГС) так, чтобы подавить и/или избежать обнаружения специфическими CD8 Т-клетками иммунной системы. Scott et al. (2012). Дополнительно было показано, что опухоли уклоняются от врожденного иммунного ответа пациента посредством модификации или снижения экспрессии опухолевых антигенов на поверхности опухолевых клеток, что может снижать как связывание антителом, так и уничтожение опухоли NK-клетками. Id.
[014] Не так давно было обнаружено, что опухолевые клетки могут уклоняться от иммунной системы и противораковой терапии за счет вхождения в равновесную фазу с иммунной системой онкологического пациента. Смотрите Bhatia et al., Cancer Microenvrionment vol. 4: 209-217 (2011). По меньшей мере в одном аспекте равновесной фазы опухолевые клетки могут оставаться в организме на уровне ниже предела традиционного морфологического распознавания или цитогенетического распознавания. Id. Например, экспрессия рецепторов опухолевых антигенов на опухолевых клетках будет колебаться и, во многих случаях, снижаться до точки ниже предела, на котором иммунная система может распознавать опухолевые клетки. Id.
[015] Учитывая способность рака и опухолевых клеток активно уклоняться от противораковой терапии и иммунной системы пациента, существует значительная потребность в разработке противоракового лечения, которое эффективно нацелено и уничтожает опухолевые клетки, которые активно уклоняются от иммунной системы. Кроме того, существует потребность в противораковом лечении, которое может атаковать и уничтожать опухоли и опухолевые клетки, которые используют равновесную фазу для уклонения от терапии и иммунной системы. По меньшей мере в одном аспекте различные варианты реализации настоящего изобретения успешно преодолевают трудности, связанные с лечением опухолевых клеток, которые активно уклоняются от иммунной системы.
КРАТКОЕ ОПИСАНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
[016] В различных вариантах реализации настоящего изобретения было определено, что рекомбинантный MVA, внутривенно вводимый пациенту в комбинации с антителом против опухолевого поверхностного антигена, усиливает лечение онкологического пациента, в частности, увеличивает снижение объема опухоли и/или повышает выживаемость онкологического пациента.
[017] Соответственно, в одном варианте реализации настоящее изобретение включает фармацевтическую комбинацию для применения в снижении размера опухоли и/или повышении выживаемости онкологического пациента, причем фармацевтическая комбинация содержит: a) рекомбинантный модифицированный вирус осповакцины Анкара (MVA), содержащий первую нуклеиновую кислоту, кодирующую первый гетерологичный опухолеассоциированный антиген (ОАА), который при внутривенном введении индуцирует у онкологического пациента как усиленный ответ естественных клеток-киллеров (NK), так и усиленный ответ Т-клеток по сравнению с ответом NK-клеток и Т-клеток, индуцированным невнутривенным введением рекомбинантного MVA, содержащего нуклеиновую кислоту, кодирующую гетерологичный опухолеассоциированный антиген; и b) антитело, содержащее Fc-домен и являющееся специфическим к антигену, который экспрессируется на клеточной мембране опухолевой клетки; причем введение a) и b) онкологическому пациенту снижает размер опухоли и/или повышает уровень выживаемости онкологического пациента по сравнению с невнутривенным введением любого из a) или b) отдельно. В дополнительных вариантах реализации рекомбинантный MVA дополнительно содержит вторую нуклеиновую кислоту, кодирующую второй гетерологичный ОАА.
[018] В одном или более предпочтительных вариантах реализации фармацевтическая комбинация дополнительно содержит CD40L. В наиболее предпочтительном варианте реализации CD40L кодируется рекомбинантным MVA.
[019] В различных вариантах реализации антитело одобрено для лечения онкологического пациента. В одном из более конкретных вариантов реализации антитело выбрано из группы, состоящей из: анти-CD20 (например, ритуксимаб; офатумумаб; тозитумомаб), анти-CD52 (например, алемтузумаб Кампат®), анти-EGFR (например, цетуксимаб Эрбитукс®, панитумумаб), анти-CD2 (например, сиплизумаб), анти-CD37 (например, BI836826), анти-CD123 (например, JNJ-56022473), анти-CD30 (например, XmAb2513), анти-CD38 (например, даратумумаб Дарзалекс®), анти-PDL1 (например, авелумаб, атезолизумаб, дурвалумаб), CTLA-4 (например, ипилимумаб), анти-GD2 (например, 3F8, ch14.18, KW-2871, динутуксимаб), анти-CEA, анти-MUC1, анти-FLT3, анти-CD19, анти-CD40, анти-SLAMF7, анти-CCR4, анти-B7-H3, анти-ICAM1, анти-CSF1R, анти-CA125 (например ореговомаб), анти-FRα (например MOv18-IgG1, мирветуксимаб соравтанзин (IMGN853), MORAb-202), анти-мезотелин (например MORAb-009) и анти-HER2. В одном более предпочтительном варианте реализации антитело представляет собой анти-HER2 антитело. В наиболее предпочтительном варианте реализации антитело представляет собой анти-HER2 антитело, выбранное из пертузумаба, трастузумаба, Герзумы, ABP 980 и адо-трастузумаба эмтанзина.
[020] В различных дополнительных вариантах реализации первый и/или второй ОАА содержит одну или более мутаций для предотвращения связывания и/или взаимодействия первого и/или второго ОАА с антителом комбинированной терапии. В одном или более предпочтительных вариантах реализации первый ОАА представляет собой антиген HER2. В более предпочтительном варианте реализации антиген HER2 содержит одну или более мутаций для предотвращения связывания первого ОАА с анти-HER2 антителом. В дополнительных предпочтительных вариантах реализации второй ОАА представляет собой антиген Brachyury (брахиурия). В более предпочтительном варианте реализации антиген Brachyury содержит одну или более мутаций в домене сигнализации ядерной локализации (СЯЛ).
[021] В одном или более предпочтительных вариантах реализации рекомбинантный MVA представляет собой MVA-BN или его производное.
[022] В различных вариантах реализации настоящее изобретение относится к одному или более способам снижения размера опухоли и/или повышения выживаемости онкологического пациента. В одном варианте реализации предложен способ, включающий: a) внутривенное введение онкологическому пациенту рекомбинантного MVA, содержащего первую нуклеиновую кислоту, кодирующую первый гетерологичный опухолеассоциированный антиген (ОАА), который при внутривенном введении индуцирует у онкологического пациента как усиленный ответ естественных клеток-киллеров (NK), так и усиленный ответ Т-клеток по сравнению с ответом NK-клеток и ответом Т-клеток, индуцированным невнутривенным введением рекомбинантного вируса MVA, содержащего нуклеиновую кислоту, кодирующую гетерологичный опухолеассоциированный антиген; и b) введение онкологическому пациенту антитела, содержащего Fc-домен и являющегося специфическим к антигену, который экспрессируется на клеточной мембране опухолевой клетки; причем введение a) и b) онкологическому пациенту снижает размер опухоли у онкологического пациента и/или повышает уровень выживаемости онкологического пациента по сравнению с невнутривенным введением любого из a) или b) отдельно.
[023] В одном или более предпочтительных вариантах реализации указанный способ включает внутривенное введение CD40L онкологическому пациенту. В более предпочтительном варианте реализации CD40L кодируется рекомбинантным MVA.
[024] В другом варианте реализации рекомбинантный MVA по настоящему изобретению вводят одновременно или после введения антитела. В более предпочтительном варианте реализации рекомбинантный MVA вводят после антитела.
[025] В другом варианте реализации настоящее изобретение включает способ усиления антителотерапии у онкологического пациента, включающий введение онкологическому пациенту фармацевтической комбинации по настоящему изобретению, причем введение фармацевтической комбинации усиливает антителозависимую клеточноопосредованную цитотоксичность (АЗКЦ), индуцированную терапией на основе антитела, по сравнению с применением только терапии на основе антитела.
[026] В другом варианте реализации предложен способ индукции как усиленного врожденного, так и усиленного адаптивного иммунного ответа у онкологического пациента, включающий введение фармацевтической комбинации по настоящему изобретению, причем введение фармацевтической комбинации усиливает как врожденный, так и приобретенный иммунные ответы онкологического пациента по сравнению с невнутривенным введением фармацевтической комбинации или элементов комбинации по отдельности.
[027] В различных дополнительных вариантах реализации настоящее изобретение относится к одному или более синтетическим пептидам и к нуклеиновым кислотам, кодирующим синтетические пептиды. В более конкретных вариантах реализации предложены синтетический пептид и нуклеиновая кислота HER2. В более предпочтительных вариантах реализации синтетический пептид HER2 содержит одну или более мутаций, которые предотвращают связывание пептида HER2 с антителом к HER2, причем антитело предпочтительно выбрано из пертузумаба, трастузумаба, Герзумы, ABP 980 и адо-трастузумаба эмтанзина. В дополнительных предпочтительных вариантах реализации синтетический пептид HER2 содержит одну или более мутаций, которые предотвращают внеклеточную димеризацию, тирозинкиназную активность и/или фосфорилирование антигена HER2.
[028] В другом более конкретном варианте реализации предложены один или более синтетических пептидов и одна или более нуклеиновых кислот Brachyury. В более предпочтительных вариантах реализации синтетические пептиды и нуклеиновые кислоты Brachyury содержат одну или более мутаций в домене сигнализации ядерной локализации (СЯЛ).
[029] Дополнительные цели и преимущества этого изобретения будут изложены частично в нижеприведенном описании, а частично станут очевидны из описания, или же они могут быть выявлены при практической реализации этого изобретения. Цели и преимущества этого изобретения будут реализованы и достигнуты посредством элементов и комбинаций, конкретно указанных в прилагаемой формуле изобретения.
[030] Сопроводительные графические материалы, которые включены и составляют часть этого описания, иллюстрируют один или более вариантов реализации этого изобретения и вместе с описанием служат для пояснения принципов этого изобретения.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
[031] На Фиг. 1A-1G показано, что внутривенное (в/в) введение MVA-OVA (rMVA) приводит к более сильной системной активации NK-клеток по сравнению с подкожным (п/к) введением. Активация NK-клеток дополнительно усиливается, когда MVA кодирует CD40L (rMVA-CD40L). Проиллюстрированы результаты примера 1, в котором окрашивание для оценки частоты NK-клеток и экспрессию (приведенную в виде геометрической средней интенсивности флуоресценции (ГСИФ)) указанных белковых маркеров в клетках NKp46+CD3- оценивали в селезенке. A) клетки NKp46+ CD3-; B) CD69; C) NKG2D; D) FasL; E); Bcl-XL; F), CD70; и G) IFN-γ.
[032] На Фиг. 2A-2G показано, что в/в введение MVA-OVA (rMVA) приводит к более сильной системной активации NK-клеток по сравнению с п/к введением. Активация NK-клеток дополнительно усиливается, когда MVA кодирует CD40L (rMVA-CD40L). Проиллюстрированы результаты примера 1, в котором окрашивание для оценки частоты NK-клеток и экспрессию (приведенную в виде геометрической средней интенсивности флуоресценции (ГСИФ)) указанных белковых маркеров в клетках NKp46+CD3- оценивали в печени. A) клетки NKp46+ CD3-; B) CD69; C) NKG2D; D) FasL; E); Bcl-XL; F), CD70; и G) IFN-γ.
[033] На Фиг. 3A-3G показано, что в/в введение MVA-OVA (rMVA) приводит к более сильной системной активации NK-клеток по сравнению с п/к введением. Активация NK-клеток дополнительно усиливается, когда MVA кодирует CD40L (rMVA-CD40L). Проиллюстрированы результаты примера 1, в котором окрашивание для оценки частоты NK-клеток и экспрессию (приведенную в виде геометрической средней интенсивности флуоресценции (ГСИФ)) указанных белковых маркеров в клетках NKp46+CD3- оценивали в легких. A) клетки NKp46+ CD3-; B) CD69; C) NKG2D; D) FasL; E); Bcl-XL; F), CD70; и G) IFN-γ.
[034] На Фиг. 4A-4F показано, что внутривенное (в/в) введение MVA-HER2-Twist-CD40L приводит к более сильной системной активации NK-клеток по сравнению с подкожным (п/к) введением. Проиллюстрированы результаты примера 1, в котором окрашивание для оценки частоты NK-клеток и экспрессию (приведенную в виде геометрической средней интенсивности флуоресценции (ГСИФ)) указанных белковых маркеров в клетках NKp46+CD3- оценивали в селезенке. A) клетки NKp46+ CD3-; B) CD69; C) FasL; D); Bcl-XL; E), CD70; и F) IFN-γ.
[035] На Фиг. 5A-5F показано, что в/в введение MVA-HER2-Twist-CD40L приводит к более сильной системной активации NK-клеток по сравнению с п/к введением. Проиллюстрированы результаты примера 1, в котором окрашивание для оценки частоты NK-клеток и экспрессию (приведенную в виде геометрической средней интенсивности флуоресценции (ГСИФ)) указанных белковых маркеров в клетках NKp46+CD3- оценивали в печени. A) клетки NKp46+ CD3-; B) CD69; C) FasL; D); Bcl-XL; E), CD70; и F) IFN-γ.
[036] На Фиг. 6A-6F показано, что в/в введение MVA-HER2-Twist-CD40L приводит к более сильной системной активации NK-клеток по сравнению с п/к введением. Проиллюстрированы результаты примера 1, в котором окрашивание для оценки частоты NK-клеток и экспрессию (приведенную в виде геометрической средней интенсивности флуоресценции (ГСИФ)) указанных белковых маркеров в клетках NKp46+CD3- оценивали в легких. A) клетки NKp46+ CD3-; B) CD69; C) FasL; D); Bcl-XL; E), CD70; и F) IFN-γ.
[037] На Фиг. 7A-7F показано, что в/в введение MVA-OVA-CD40L (rMVA-CD40L) приводит к повышению уровней IL-12p70 и IFN-γ. Проиллюстрированы результаты примера 2. A) Концентрация IFN-γ была выше после rMVA-CD40L по сравнению с иммунизацией MVA-OVA (rMVA). B) Активирующий NK-клетки цитокин IL-12p70 являлся обнаруживаемым только после иммунизации MVA-CD40L. Высокие сывороточные уровни IFN-γ согласуются с более высокой частотой IFN-γ+ NK-клеток (смотрите Фиг. 1G) и CD69+ гранзим B+ NK-клеток в селезенке C) после иммунизации rMVA-CD40L. Аналогичные ответы наблюдали у ОЧП (отличных от человека приматов) (Macaca fascicularis) после в/в инъекции MVA-MARV-GP-huCD40L (rMVA-CD40L), а именно, более высокие сывороточные концентрации IFN-γ (D) и IL-12p40/70 (E), а также больше пролиферирующих (Ki67+) NK-клеток (F) по сравнению с MVA-MARV-GP (rMVA).
[038] На Фиг. 8A-8C проиллюстрирована временная динамика активации и пролиферации NK-клеток. Проиллюстрированы результаты примера 3, в котором окрашивание для оценки частоты NK-клеток и экспрессию указанных белковых маркеров в клетках NKp46+CD3- оценивали в селезенке, печени, легких и крови. A) CD3- CD19-NKp46+) B) маркер пролиферации NK-клеток Ki67; и C) экспрессия CD69 (приведенная в виде геометрической средней интенсивности флуоресценции (ГСИФ)).
[039] На Фиг. 9 проиллюстрирована усиленная опосредованная NK-клетками токсичность ex vivo после системной иммунизации MVA-OVA (rMVA) и MVA-CD40L (rMVA-CD40L). NK-клетки селезенки очищали и использовали в качестве эффекторов в анализе уничтожения мишени, как описано в примере 4. NK-клетки культивировали с CFSE-меченными дефицитными по ГКГС класса I клетками YAC-1 в указанных соотношениях в течение ночи. Специфическое уничтожение оценивали путем количественного определения нежизнеспособных CFSE+ клеток YAC-1 методом проточной цитометрии.
[040] На Фиг. 10A-10E проиллюстрирована усиленная антителозависимая клеточная цитотоксичность (АЗКЦ) in vivo и ex vivo после системной иммунизации MVA-OVA (rMVA), MVA-CD40L (rMVA-CD40L) и MVA-HER2-Twist-CD40L, как описано в примере 5. A) мышей линии C57BL/6 обрабатывали в/в 25 мкг анти-CD4, rMVA+5 мкг крысиного IgG2b, 1 мкг анти-CD4 или MVA-OVA (rMVA) + 1 мкг анти-CD4. Анализировали истощение CD4 T-клеток (CD3+CD4+) в печени и привели его в виде процента специфического уничтожения. Чтобы оценить АЗКЦ-активность NK-клеток ex vivo, мышей линии B) C57BL/6 или C) Balb/c иммунизировали в/в ФСБ, MVA-OVA (rMVA) или MVA-OVA-CD40L (rMVA-CD40L). Мышей линии E) Balb/c иммунизировали в/в ФСБ или MVA-HER2-Twist-CD40L. NK-клетки селезенки очищали и использовали в качестве эффекторов в анализе антителозависимого уничтожения. B) клетки B16.F10 покрывали мышиным mAb против человеческого/мышиного Trp1 (клон TA99), а C) клетки CT26-HER2 покрывали мышиным mAb против человеческого HER2 (клон 7.16.4). Очищенные NK-клетки добавляли к покрытым антителом клеткам-мишеням в соотношении 5:1 и 4:1 соответственно. D) клетки CT26-HER2, которые инкубировали с разными концентрациями антитела против человеческого HER2, также более эффективно уничтожались активированными rMVA-CD40L NK-клетками по сравнению с активированными rMVA NK-клетками. E) клетки CT26-HER2 покрывали различными концентрациями мышиного mAb против человеческого HER2 (клон 7.16.4). Очищенные NK-клетки добавляли к покрытым антителом клеткам-мишеням в соотношении 5:1.
[041] На Фиг. 11 показано, что в/в иммунизация индуцирует более сильные ответы CD8 Т-клеток, чем п/к иммунизация. Как описано в примере 6, мышей линии C57BL/6 иммунизировали п/к или в/в MVA-OVA на 0 и 15 сутки. Ответы OVA-специфических CD8 T-клеток в крови оценивали после окрашивания декстрамерами H-2Kb/OVA257-264.
[042] На Фиг. 12 показано, что ответы CD8 T-клеток можно дополнительно усилить с помощью MVA-CD40L. Как описано в примере 7, мышей линии C57BL/6 иммунизировали в/в MVA-OVA (rMVA) или MVA-OVA-CD40L (rMVA-CD40L) на 0 и 35 сутки. Ответы OVA-специфических CD8 T-клеток в крови оценивали после окрашивания декстрамерами H-2Kb/OVA257-264.
[043] На Фиг. 13A-13B проиллюстрирована повторная активация и пролиферация NK-клеток после первичной/бустерной иммунизации. Как описано в примере 8, мышей линии C57BL/6 иммунизировали в/в ФСБ, MVA-OVA (rMVA) или MVA-OVA-CD40L (rMVA-CD40L), как показано в таблице 1. NK-клетки (NKp46+CD3-) анализировали в крови методом проточной цитометрии через одни и четверо суток после второй и третьей иммунизации. A) Иллюстрирует ГСИФ (геометрическая средняя интенсивность флуоресценции) CD69, а B) иллюстрирует частоту Ki67+ NK-клеток.
[044] На Фиг. 14A-14M проиллюстрированы системные ответы цитокинов после первичной/бустерной иммунизации. Как описано в примере 9, мышей линии C57BL/6 иммунизировали в/в ФСБ, MVA-OVA (rMVA) или MVA-OVA-CD40L (rMVA-CD40L), как показано в таблице 1. Сывороточные уровни цитокинов измеряли через 6 часов после иммунизации. Проиллюстрированы результаты для A) IL-6; B) CXCL10; C) IFN-α; D) IL-22; E) IFN-γ; F) CXCL1; G) CCL4; H) CCL7); I) CCL2; J) CCL5; K) TNF-α; L) IL-12p70; и M) IL-18.
[045] На Фиг. 15A-15D проиллюстрированы сильные антиген-специфические ответы CD8 T-клеток после первичной/бустерной иммунизации MVA и MVA-CD40L. Как описано в примере 10, мышей линии C57BL/6 иммунизировали в/в ФСБ, MVA-OVA (rMVA) или MVA-OVA-CD40L (rMVA-CD40L), как показано в таблице 1. Оценивали индукцию антиген-специфических ответов CD8 T-клеток после повторной иммунизации. A) оценивали частоту CD8 T-клеток; B) оценивали B8-специфические ответы CD8 T-клеток, C) оценивали трансген-специфические (OVA) ответы; и D) оценивали соотношения OVA/B8-специфических CD8 T-клеток.
[046] На Фиг. 16A-16B проиллюстрирована индукция CD8 и CD4 эффекторных T-клеток после первичной/бустерной иммунизации MVA и MVA-CD40L. Как описано в примере 11, мышей линии C57BL/6 иммунизировали в/в ФСБ, MVA-OVA (rMVA) или MVA-OVA-CD40L (rMVA-CD40L), как показано в таблице 1. Фенотипически, эффекторные Т-клетки идентифицировали по экспрессии CD44 и отсутствию поверхностного CD62L. Отслеживали A) CD44+ CD62L- CD8 Т-клетки и B) CD4 Т-клетки в крови.
[047] На Фиг. 17A-17B проиллюстрирован превосходящий противоопухолевый эффект в/в иммунизации rMVA-CD40L по гетерологичной прайм-буст схеме в модели меланомы. Мышей линии C57BL/6, несущих пальпируемые опухоли B16.OVA, примировали (пунктирная линия) ФСБ, MVA-OVA (rMVA) или MVA-OVA-CD40L (rMVA-CD40L) п/к или в/в, как описано в примере 12. Мыши получали последующие бустерные инъекции FPV-OVA через 7 и 14 суток после примирования (штрих-пунктирная линия). Рост опухоли измеряли через равные интервалы. Проиллюстрированы A) средний объем опухоли и B) выживаемость несущих опухоли мышей на 45 сутки после инокуляции опухоли.
[048] На Фиг. 18 проиллюстрирован эффективное подавление опухоли после одной в/в иммунизации MVA-OVA-CD40L (rMVA-CD40L). Мышей линии C57BL/6, несущих пальпируемые опухоли B16.OVA, примировали в/в, или же они получали в/в первичную и бустерную инъекции, как описано в примере 13. Рост опухоли измеряли через равные интервалы. Приведен средний объем опухоли.
[049] На Фиг. 19A-19C показано, что CD8 T-клетки играют существенную роль в опосредованном rMVA-CD40L подавлении опухоли. Мышей линии C57BL/6, несущих пальпируемые опухоли B16.OVA, иммунизировали в/в ФСБ, MVA-OVA (rMVA) или MVA-OVA-CD40L (rMVA-CD40L), как описано в примере 14. Где указано, мыши получали 200 мкг анти-CD8 антитела внутрибрюшинно (в/б). A) измеряли ответы CD8 T-клеток. B) измеряли ответы OVA-специфических CD8 T-клеток. C) представляет общую выживаемость.
[050] На Фиг. 20A-20C показано, что одновременное нацеливание на два ОАА является более эффективным, чем нацеливание только на один. Мышей линии C57BL/6, несущих пальпируемые опухоли B16.OVA, иммунизировали в/в ФСБ, MVA-OVA-CD40L, MVA-OVA-TRP2 или MVA-OVA-TRP2-CD40L, как описано в примере 15. Рост опухоли измеряли через равные интервалы и представляли в виде A) среднего диаметра для отдельной мыши; и B) среднего объема. C) проиллюстрирована общая выживаемость.
[051] На Фиг. 21A-21G проиллюстрирована повышенная инфильтрация Т-клеток в опухолевое микроокружение (ОМО) после иммунизации rMVA-CD40L. Мышей линии C57BL/6, несущих пальпируемые опухоли B16.OVA, иммунизировали в/в ФСБ, MVA-OVA (rMVA) или MVA-OVA-CD40L (rMVA-CD40L), как описано в примере 16. Через семь суток мышей умерщвляли. A) частота CD8+ T-клеток среди CD45+ лейкоцитов в селезенке, дренирующих опухоль лимфатических узлах (ДОЛУ) и опухолевых тканях; B) распределение OVA257-264-специфических CD8+ T-клеток в разных органах после иммунизации; C) ГСИФ для PD-1 и Lag3 на инфильтрирующих опухоль OVA257-264-специфических CD8+ T-клетках; D) репрезентативные точечные графики инфильтрирующих опухоль CD8+ T-клеток, демонстрирующие экспрессию Ki67 и PD-1; E) частота инфильтрирующих опухоль Ki67+ CD8+ T-клеток и ГСИФ для PD-1; F) частота инфильтрирующих опухоль регуляторных T-клеток (Treg) среди CD45+ лейкоцитов; и G) частота PD-1выс. - и PD-1отр.-опухоль-инфильтрирующих Treg.
[052] На Фиг. 22A-22F проиллюстрирована персистенция ОАА-специфических CD8 T-клеток с менее истощенным фенотипом в ОМО после иммунизации rMVA-CD40L. Очищенные OVA-специфические ТКР-трансгенные CD8 T-клетки (OT-I) переносили в/в несущим опухоль B16.OVA мышам, когда опухоли становились пальпируемыми, как описано в примере 17. Когда опухоли достигали по меньшей мере 60 мм3 в объеме, животных в/в иммунизировали MVA-BN®, MVA-OVA (rMVA) или MVA-OVA-CD40L (rMVA-CD40L). Через 17 суток мышей умерщвляли и проводили анализ в отношении: A) частоты CD8+ T-клеток среди лейкоцитов в опухолевых тканях; B) частоты Lag3+ PD1+ среди CD8+ T-клеток; C) частоты Eomes+ PD1+ T-клеток среди CD8+ T-клеток; D) присутствия OT-I-трансгенных CD8+ T-клеток в ОМО после иммунизации; E) частоты истощенных в отношении Lag3+ PD1+ T-клеток среди OT-I+ CD8+ T-клеток; и F) частоты истощенных в отношении Eomes+ PD1+ T-клеток среди OT-I+ CD8+ T-клеток.
[053] На Фиг. 23A-23B проиллюстрировано долгосрочное снижение количества регуляторных T-клеток (Treg) в ОМО после иммунизации rMVA-CD40L. Очищенные OVA-специфические ТКР-трансгенные CD8 T-клетки (OT-I) переносили в/в несущим опухоль B16.OVA мышам, когда опухоли становились пальпируемыми, как описано в примере 18. Когда опухоли достигали по меньшей мере 60 мм3 в объеме, животных в/в иммунизировали MVA-BN®, MVA-OVA (rMVA) или MVA-OVA-CD40L (rMVA-CD40L). Через 17 суток мышей умерщвляли для дополнительного анализа: A) частоты Foxp3+ CD4+ Treg среди CD4+ T-клеток в опухолевых тканях; B) соотношения CD8+ CD44+ эффекторных T-клеток (Teff) к Foxp3+ CD4+ Treg.
[054] На Фиг. 24 проиллюстрированы более низкие сывороточные уровни аланинаминотрансферазы (АЛТ) после иммунизации rMVA и rMVA-CD40L по сравнению с инъекцией анти-CD40 иммуноглобулина. Мышей линии C57BL/6 инъецировали в/в MVA-OVA (rMVA), MVA-OVA-CD40L (rMVA-CD40L) или анти-CD40 (FGK4.5), как в примере 19. Сывороточную концентрацию АЛТ анализировали через одни сутки после каждой иммунизации методом ELISA.
[055] На Фиг. 25A-25B проиллюстрирована продленная выживаемость в модели рака толстой кишки после в/в иммунизации rMVA-CD40L. Мышей линии Balb/c, несущих пальпируемые опухоли CT26.HER2, иммунизировали в/в MVA-AH1A5-p15-Trp2-CD40L (rMVA-CD40L), или же они получали ФСБ, как описано в примере 20. Рост опухоли измеряли через равные интервалы. Приведены A) средний объем опухоли и B) выживаемость.
[056] На Фиг. 26A-26B проиллюстрирован повышенный противоопухолевый эффект rMVA-CD40L в комбинации с анти-Trp1. Мышей линии C57BL/6, несущих пальпируемые опухоли B16.OVA, иммунизировали в/в MVA-OVA-CD40L (rMVA-CD40L) на 8 сутки, как описано в примере 21. Где указано, начиная с 5 суток дважды в неделю в/в инъецировали 200 мкг анти-Trp1 (клон TA99). Приведены A) средний объем опухоли и B) общая выживаемость.
[057] На Фиг. 27A-27D проиллюстрирована трансгенная экспрессия MVA-HER2-Brachyury-CD40L. Клетки HeLa оставляли необработанными (контроль; закрашенная серая линия) или инфицировали MVA-BN (закрашенная черная линия) или MVA-HER2-Brachyury-CD40L (незакрашенная черная линия), как описано в примере 23. Затем определяли белковую экспрессию A) MVA, B) HER2, C) Brachyury и D) CD40L методом проточной цитометрии (смотрите гистограммы).
[058] На Фиг. 28 показано, что анти-HER2 антитела Герцептин® (также известный как трастузумаб) и Перьета® (также известный как пертузумаб) не связываются с модифицированной последовательностью HER2, описанной в примере 24. Клетки CT26 инфицировали MVA-HER2-Brachyury-CD40L при множественности заражения (МЗ) 1. Через 24 часа клетки инкубировали с 5 мкг/мл антител к HER2 Герцептина®, Перьеты® или 24D2 и анализировали методом проточной цитометрии.
[059] На Фиг. 29A-29D проиллюстрирована дозозависимая и усиленная активация человеческих ДК с помощью MVA-HER2-brachyury-CD40L по сравнению MVA-HER2-brachyury. Моноцитарные ДК создавали после обогащения CD14+ моноцитов из человеческих МКПК и культивировали в течение 7 суток в присутствии ГМКСФ (GM-CSF) и IL-4, как описано в примере 25. ДК стимулировали MVA-HER2-brachyury или MVA-HER2-brachyury-CD40L. Экспрессию A) CD40L; B) CD86; и C) ГКГС класса II измеряли методом проточной цитометрии. D) Проводили количественное определение концентрации IL-12p70.
[060] На Фиг. 30A и 30B проиллюстрирован повышенный противоопухолевый эффект в/в иммунизации MVA-HER2-Twist-CD40L по сравнению с в/в иммунизацией MVA-CD40L в HER2-положительной модели карциномы толстой кишки. Мышей линии C57BL/6, несущих пальпируемые опухоли MC38.HER2, в/в иммунизировали (пунктирная линия) ФСБ, MVA-CD40L или MVA-HER2-Twist-CD40L, как описано в примере 26. Рост опухоли измеряли через равные интервалы. Приведены A) средний объем опухоли и B) общая выживаемость.
[061] На Фиг. 31A и 31B проиллюстрирован повышенный противоопухолевый эффект в/в иммунизации MVA-HER2-Twist-CD40L по сравнению с в/в иммунизацией MVA-CD40L в HER2-положительной модели карциномы толстой кишки. Мышей линии Balb/c, несущих пальпируемые опухоли CT26.HER2, в/в иммунизировали (пунктирная линия) ФСБ, MVA-CD40L или MVA-HER2-Twist-CD40L, как описано в примере 26. Рост опухоли измеряли через равные интервалы. Приведены A) средний объем опухоли и B) общая выживаемость.
[062] На Фиг. 32 проиллюстрирована повышенная инфильтрация HER2-специфических CD8+ T-клеток, вырабатывающих IFN-γ в опухолевом микроокружении после в/в иммунизации MVA-HER2-Twist-CD40L. Мышей линии Balb/c, несущих пальпируемые опухоли CT26.HER2, в/в иммунизировали ФСБ или MVA-HER2-Twist-CD40L, как описано в примере 27. Через семь суток методом магнитной сортировки клеток выделяли селезеночные и инфильтрирующие опухоль CD8+ T-клетки и культивировали в присутствии нагруженных пептидом HER2 дендритных клеток в течение 5 часов. На графиках показана процентная доля CD44+ IFN-γ+ клеток среди CD8+ T-клеток.
[063] На Фиг. 33A и 33B проиллюстрирован повышенный противоопухолевый эффект MVA-HER2-Twist-CD40L и трастузумаба (анти-HER2). Мышей линии Balb/c, несущих развившиеся 17-суточные опухоли CT26.HER2, в/в иммунизировали MVA-HER2-Twist-CD40L (пунктирная линия), как описано в примере 28. Где указано, в/б инъецировали (штрихпунктирная линия) 5 мкг анти-HER2 или huIgG1. Приведены A) средний объем опухоли и B) общая выживаемость.
ПОДРОБНОЕ ОПИСАНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
[064] Следует понимать, что как приведенное выше краткое описание сущности изобретения, так и приведенное ниже подробное описание являются просто иллюстративными и пояснительными и не ограничивают заявляемое изобретение.
[065] Антителозависимая клеточная цитотоксичность (АЗКЦ) является механизмом клеточноопосредованной иммунной защиты, который обеспечивает возможность иммунной системе активно лизировать и уничтожать клетки-мишени, которые экспрессируют антиген или рецептор, которые были связаны специфическими антителами. Смотрите, Hashimoto et al., Journal of Infectious Disease, 148: 785-794 (1983). АЗКЦ использует естественные клетки-киллеры (NK), которые взаимодействуют с антителами, чтобы лизировать и уничтожать клетки-мишени. Id. С учетом этого, за последнее десятилетие были разработаны терапевтические моноклональные антитела, которые нацелены на опухолеассоциированные антигены и усиливают АЗКЦ и, таким образом, способность уничтожать опухолевые клетки. Смотрите, например, Scott et al. (2012) и Kohrt et al. Хотя терапия на основе антител продемонстрировала эффективность в повышении уничтожения опухолевых клеток посредством АЗКЦ, было показано, что опухолевые клетки могут уклоняться от АЗКЦ и иммунной системы за счет ряда механизмов, таких как гетерогенность экспрессии опухолевых антигенов (например, снижение экспрессии опухолевых антигенов на поверхности опухолевых клеток), стабильность антител, низкая концентрация антител по сравнению с рецепторами, насыщение рецепторов, иммунная супрессия, например, посредством регуляторных Т-клеток, уклонение от иммунологического надзора и дисфункция NK-клеток. Scott et al. (2012). Некоторые аспекты уклонения опухолевых клеток были описаны как вхождение опухолевых клеток в «равновесную фазу» с иммунной системой пациента, за счет чего опухолевые клетки могут оставаться в организме в количестве ниже порога традиционного морфологического, цитологического или иммунного клеточного распознавания. Bhatia et al., 2011.
[066] Чтобы индуцировать синергетические противоопухолевые ответы, были разработаны различные фармацевтические комбинации по настоящему изобретению. В нескольких аспектах различные фармацевтические комбинации индуцируют как высокоэффективные опухолеспецифические Т-клетки-киллеры, так и естественные клетки-киллеры (NK), которые способны уничтожать опухолевые клетки, покрытые антителами против экспрессируемых опухолью рецепторов, посредством АЗКЦ. В предпочтительных аспектах, как описано в данном документе, внутривенная инъекция рекомбинантного MVA, кодирующего CD40L, индуцирует усиленную активацию NK-клеток и резко повышает уничтожение покрытых антителами опухолевых клеток. Продемонстрировано, что эта усиленная активация NK-клеток в комбинации с усиленным ответом Т-клеток-киллеров, также индуцированным MVA, действует синергетическим образом при терапевтической противоопухолевой вакцинации.
[067] В различных дополнительных аспектах варианты реализации настоящего изобретения индуцируют иммунный ответ, который характеризуется усиленной и/или повышенной способностью к нацеливанию и уничтожению тех опухолевых и раковых клеток, которые уклоняются от иммунной системы пациента. В дополнительных аспектах варианты реализации настоящего изобретения индуцируют иммунный ответ, который усиливает и/или повышает эффективность как врожденных, так и адаптивных иммунных ответов пациента. Способность усиливать и/или повышать как врожденный, так и адаптивный иммунные ответы обеспечивает исключительное преимущество, так как настоящее изобретение позволяет проводить нацеливание и уничтожение тех опухолевых клеток, которые уклоняются от адаптивного иммунного ответа пациента и/или подавляют его, а также тех опухолевых клеток, которые уклоняются от врожденного иммунного ответа пациента и/или подавляют его.
[068] В одном варианте реализации настоящее изобретение представляет собой комбинированную терапию, включающую: a) внутривенное (в/в) введение рекомбинантного MVA, который содержит нуклеиновую кислоту, кодирующую один или более гетерологичных опухолеассоциированных антигенов (ОАА), и b) антитело, которое содержит Fc-домен и является специфическим в отношении антигена, экспрессируемого на опухолевой клетке. В другом варианте реализации комбинированная терапия дополнительно включает в/в введение CD40L. В предпочтительном варианте реализации CD40L кодируется рекомбинантным MVA.
[069] Описанная и проиллюстрированная в настоящей заявке фармацевтическая комбинация и/или комбинированная терапия по настоящему изобретению усиливает ряд аспектов иммунного ответа онкологического пациента. По меньшей мере в одном аспекте фармацевтическая комбинация синергетическим образом усиливает как врожденный, так и адаптивный иммунные ответы со снижением объема опухоли и повышением выживаемости онкологического пациента. Один или более усиленных эффектов фармацевтической комбинации и/или терапии обобщены ниже.
[070] В/в введение рекомбинантного MVA усиливает ответ NK-клеток. В одном аспекте настоящее изобретение включает внутривенное введение рекомбинантного MVA субъекту, причем в/в введение индуцирует усиленный врожденный иммунный ответ, в частности, усиленный ответ NK-клеток у субъекта по сравнению с ответом NK-клеток, индуцированным невнутривенным введением рекомбинантного MVA субъекту. Как проиллюстрировано на Фиг. 1-9 и 13, в/в введение рекомбинантного MVA индуцировало сильный системный ответ NK-клеток в нескольких компартментах, как при одном в/в введении, так и при внутривенном введении в виде гомологичной прайм-буст инъекции, по сравнению с не-в/в введением.
[071] Как проиллюстрировано на Фиг. 1-6, качество ответа NK-клеток было повышено по сравнению с не-в/в введением. Маркер активации CD69 повышен во всех органах (селезенка, печень и легкие). Были повышены уровни представителя анти-апоптотического семейства Bcl, Bcl-XL, который повышает выживаемость NK-клеток, костимулирующего CD70 и эффекторного цитокина IFN-γ как в селезенке, так и в легких. Экспрессия активирующего естественные клетки-киллеры рецептора группы 2D (NKG2D) была в особенности повышена в печени и легких после в/в по сравнению с п/к инъекцией. NKG2D связывается с лигандами на опухолевых клетках, способствуя их элиминации (Garcia-Cuesta et al., 2015, обзор в Spear et al., 2013).
[072] В/в введение рекомбинантного MVA, кодирующего CD40L, дополнительно усиливает ответ NK-клеток. В другом аспекте настоящего изобретения было определено, что в/в введение антигена CD40L в дополнение к рекомбинантному MVA дополнительно усиливает ответ NK-клеток по сравнению с в/в введением одного рекомбинантного MVA. Как проиллюстрировано на Фиг. 1-9 и 13, рекомбинантный MVA, кодирующий антиген CD40L, индуцировал более сильный ответ NK-клеток по сравнению с рекомбинантным MVA без CD40L как при одном введении, так и при введении в виде гомологичной прайм-буст инъекции. Кроме того, качество ответа NK-клеток было повышено по сравнению с в/в введением одного рекомбинантного MVA. Повышенную экспрессию NK-клетками эффекторного цитокина IFN-γ наблюдали во всех анализируемых органах (Фиг. 1-6, селезенка, печень, легкие), как и экспрессию CD69 NK-клетками во всех анализируемых органах (Фиг. 5C). Кроме того, на Фиг. 7 проиллюстрированы повышенные сывороточные уровни IFN-γ через 6 часов после в/в иммунизации rMVA-CD40L по сравнению с рекомбинантным MVA и, что более важно, NK-активирующего цитокина IL-12p70, как у мышей, так и у ОЧП. Дополнительно, усиленную пролиферацию NK-клеток, демонстрируемую экспрессией Ki67, систематически наблюдали не только в периферической крови мышей (Фиг. 7B), но также и ОЧП (Фиг. 6F). Эти результаты показывают, что в/в иммунизация rMVA-CD40L по сравнению с rMVA улучшает качество NK-клеток в нескольких животных исследовательских моделях.
[073] Хотя рекомбинантные вирусы MVA раньше вводили внутривенно, смотрите, например, WO2002/42480, WO2014/037124, ранее считалось, что введение рекомбинантного MVA и лечение с его помощью было связано с усилением адаптивного иммунного ответа, такого как ответы CD8 T-клеток. Например, в WO2002/42480 измеряли ответы ЦТЛ после иммунизаций с помощью MVA, проводимых путем в/в введения 107 БОЕ MVA-BN на мышь или подкожного введения 107 БОЕ или 108 БОЕ MVA-BN на мышь. В WO2014/037124 мышей внутривенно инокулировали рекомбинантным MVA и рекомбинантным MVA, кодирующим CD40L. Смотрите WO2014/037124. Ответы ЦТЛ были усилены и было определено, что повышенная иммуногенность рекомбинантного MVA-CD40L не зависела от CD4+ T-клеток, но зависела от CD40 в организме-хозяине.
[074] По меньшей мере в одном аспекте усиленный ответ NK-клеток, наблюдаемый в настоящем изобретении, является неожиданным, так как в данной области техники было показано, что MVA-индуцированная активация NK-клеток зависит от присущих лимфатическим узлам CD169-положительных макрофагов субкапсулярного синуса (СКС) после подкожной иммунизации (Garcia et al. Blood 2012).
[075] В/в введение рекомбинантного MVA усиливает АЗКЦ опухолевых клеток. В дополнительном аспекте настоящее изобретение включает рекомбинантный MVA, содержащий нуклеиновую кислоту, кодирующую один или более гетерологичных антигенов, причем в/в введение субъекту усиливает ответ АЗКЦ у субъекта по сравнению с ответом АЗКЦ при не-в/в введении рекомбинантного MVA субъекту. В более конкретном аспекте усиление ответа АЗКЦ в результате в/в введения рекомбинантного MVA характеризуется повышением способности NK-клеток нацеливаться на покрытые антителами опухолевые клетки и уничтожать их. Как проиллюстрировано на Фиг. 10A-10D, клеточный лизис опухолевых клеток, представляющий мышиное mAb против человеческого HER2 или мышиное mAb против человеческого/мышиного Trp1, был повышен для NK-клеток, активированных в/в введением rMVA. Клеточный лизис опухолевых клеток был еще более повышен для NK-клеток, активированных рекомбинантным MVA вместе с CD40L по сравнению с rMVA без CD40L.
[076] Как проиллюстрировано на Фиг. 10D и 10E, усиление ответа АЗКЦ у субъекта дополнительно характеризуется как повышение эффективности ответа NK-клеток так, что NK-клетки способны нацеливаться и уничтожать опухолевые клетки, для которых концентрация антитела, связанного с опухолевым антигеном (антитело - опухолевый антиген), ниже. Способность нацеливаться на опухолевые клетки и уничтожать их при сниженных концентрациях покрытого антителом опухолевого антигена обеспечивает исключительное преимущество, так как один из механизмов, посредством которого, как было показано, опухолевые клетки уклоняются от иммунной системы, состоит в снижении экспрессии опухолевых антигенов (смотрите Scott et al. (2012)); что снижает концентрацию антител - опухолевых антигенов на опухолевых клеток.
[077] В/в введение рекомбинантного MVA усиливает уничтожение NK-клетками опухолевых клеток, имеющих низкие уровни ГКГС. В дополнительном аспекте, проиллюстрированном на Фиг. 9, усиленные активация NK-клеток и ответ NK-клеток приводят к усиленному уничтожению опухолевых клеток, имеющих низкие уровни ГКГС. Этот аспект обеспечивает исключительное преимущество, так как уничтожение NK-клетками опухолевых клеток с низкими уровнями ГКГС происходит независимо от АЗКЦ, тем самым обеспечивая дополнительный путь для атаки опухолевых клеток. Это обеспечивает дополнительное преимущество, так как многие опухоли и/или раки снижают уровни экспрессии ГКГС в попытке уклониться от иммунных ответов пациента.
[078] В/в введение рекомбинантного MVA повышает активацию и пролиферацию NK-клеток. В другом аспекте настоящего изобретения рекомбинантный MVA вводят посредством некоторого количества бустерных инъекций, что приводит к повышенной активации и пролиферации NK-клеток, как продемонстрировано на Фиг. 10A, посредством повышенной экспрессии CD69. На Фиг. 13B проиллюстрирована повышенная пролиферативная способность NK-клеток крови посредством экспрессии Ki67 через 24 часа после бустерных в/в иммунизаций по сравнению с не-в/в иммунизацией. Этот эффект наблюдали, когда за первичной иммунизацией рекомбинантным MVA следовала бустерная инъекция рекомбинантного MVA, когда за инъекцией рекомбинантного MVA-CD40L следовала бустерная инъекция rMVA-CD40L или когда за первичной иммунизацией rMVA следовала бустерная инъекция rMVA-CD40L.
[079] По меньшей мере в одном аспекте настоящего изобретения усиленные ответы NK-клеток в результате повторного в/в введения рекомбинантного MVA и рекомбинантного MVA-CD40L были неожиданными. Было неожиданно наблюдать повышенную активацию и пролиферацию NK-клеток через 24 часа после бустерных в/в иммунизаций в отсутствие повышения уровней IFN-α. Действительно, было известно, что активацией и примированием NK-клеток при вторичных инфекциях и раке в большой степени управляет IFN-α. Смотрите, например, Stackaruk et al., Expert Rev Vaccines. 2013 Aug;12(8):875-84; и Muller et al., Front Immunol (2017). Неожиданно через 6 часов после в/в бустерных иммунизаций rMVA hom, rMVA-CD40L hom или rMVA-CD40L het не наблюдали никакого повышения сывороточных уровней IFN-α (Фиг. 14C). Вместе повторные гомологичные или гетерологичные в/в иммунизации rMVA, содержащим нуклеиновую кислоту, кодирующую один или более гетерологичных антигенов, приводили к неожиданной активации и пролиферации NK-клеток, независимой от IFN-α.
[080] В/в введение рекомбинантного MVA, кодирующего гетерологичный антиген, усиливает адаптивные иммунные ответы онкологического пациента. В другом аспекте настоящего изобретения предложен рекомбинантный MVA, содержащий нуклеиновую кислоту, кодирующую один или более гетерологичных антигенов, причем в/в введение субъекту усиливает адаптивный иммунный ответ субъекта на один или более гетерологичных антигенов. В предпочтительном аспекте рекомбинантный MVA дополнительно кодирует CD40L. Как проиллюстрировано на Фиг. 11-12, в/в введение рекомбинантного MVA, экспрессирующего гетерологичный антиген, вызывало более сильный ответ ЦТЛ по сравнению с подкожным (п/к) введением. Также, как проиллюстрировано на фигурах, когда CD40L включен как часть рекомбинантного MVA, в/в введение рекомбинантного MVA и антигена вызывало более сильный ответ ЦТЛ по сравнению с в/в введением рекомбинантного MVA без CD40L.
[081] Дополнительно, как проиллюстрировано на Фиг. 14-16, когда рекомбинантный MVA, кодирующий гетерологичный антиген и CD40L, вводили внутривенно, качество ответа Т-клеток было повышено после бустерных в/в иммунизаций. На Фиг. 15 проиллюстрировано повышенное специфическое к MVA-антигену, B8 (Фиг. 15B) и гетерологичному антигену, OVA (Фиг. 15C), размножение CD8 T-клеток, усиленное бустерными в/в иммунизациями. Этот эффект связан с профилем экспрессии цитокинов и хемокинов, наблюдаемым на Фиг. 14, где проводили количественное определение активирующих Т-клетки цитокинов CXCL10, IFN-γ, CXCL1, CCL4, CCL7, CCL2, CCL5, TNF-α, IL-12p70 и IL-18 в сыворотке после бустерных в/в инъекций. В соответствии с этим, на Фиг. 16A и 16B проиллюстрировано размножение Т-клеток памяти, ключевая характеристика вакцин, после бустерных в/в иммунизаций. Соотношение CD8 Т-клеток, специфических для гетерологичного антигена, к специфическим к MVA-антигену CD8 Т-клеткам повышалось при каждой иммунизации (Фиг. 15D).
[082] До настоящего изобретения было известно, что CD40L, кодируемый рекомбинантным MVA, может замещать хелперные CD4 T-клетки (Lauterbach et al., 2013). Более никакого эффекта кодируемого рекомбинантным MVA CD40L на CD4 T-клетки не было известно. Неожиданно, мы наблюдали размножение CD4+ T-клеток памяти через 25 суток после первичной иммунизации (Фиг. 16B), что соответствует 4 суткам после бустерной в/в иммунизации rMVA-CD40L (rMVA-CD40L hom и rMVA-CD40L het) (сутки 21, смотрите таблицу 1). Этот факт подтверждается повышенной выработкой IL-22, важного цитокина, показательного для ответов хелперных Т-клеток, которую количественно определяли через 6 часов после бустерной в/в иммунизации в группах MVA-CD40L hom и MVA-CD40L het (Фиг. 14D). Это неожиданное наблюдение является релевантным для поддержания ответов памяти rMVA-CD40L. Кроме того, CD4 Т-клетки могут поддерживать опухолеспецифические CD8 Т-клетки в месте опухоли, избегать индуцированной активацией гибели клеток и также могут сами становиться цитотоксическими (обзор в Kennedy and Celis, 2008; Knutson and Disis, 2005). Эти результаты являются неожиданными, так как другие вирусные векторы, например, на основе аденовируса и вируса простого герпеса, индуцируют вектор-специфический иммунитет, который снижает индукцию иммунных ответов на кодируемые вакцинами антигены после бустерной иммунизации (Lauterbach et al., 2005; Pine et al., 2011).
[083] В/в введение рекомбинантного MVA одновременно или после введения антитела повышает эффективность уничтожения опухолевых клеток. В дополнительных аспектах в настоящем изобретении предложены одна или более схем введения субъекту фармацевтической комбинации по настоящему изобретению. По меньшей мере в одном аспекте схемы по настоящему изобретению повышают эффективность фармацевтической комбинации и/или терапии с усилением АЗКЦ-опосредованного уничтожения опухолевых клеток. В одном варианте реализации схема введения фармацевтической комбинации включает a) введение описанного в данном документе антитела и b) одновременно или после введения антитела, внутривенное введение субъекту рекомбинантного MVA по настоящему изобретению.
[084] В одном преимущественном аспекте настоящего изобретения введение рекомбинантного MVA одновременно или после антитела обеспечивает возможность для вводимого антитела связывать опухолевые клетки одновременно или до усиления ответа NK-клеток в результате введения рекомбинантного MVA. Соответственно, во время типового первого этапа вводят антитело, что приводит к связыванию антитела с опухолевыми или инфицированными клетками. Во время типового второго этапа внутривенно вводят рекомбинантный MVA, который, как описано в данном документе, усиливает и повышает ответ NK-клеток субъекта. Затем усиленный ответ NK-клеток приводит к агрессивному нацеливанию и уничтожению опухолевых клеток, имеющих связанное антитело.
[085] В других аспектах фармацевтическую комбинацию по настоящему изобретению вводят как часть гомологичной и/или гетерологичной прайм-буст схемы. Как проиллюстрировано на Фиг. 11-16, гомологичная и/или гетерологичная прайм-буст схема продлевает и повторно активирует усиленные ответы NK-клеток, а также повышает специфические ответы CD8 и CD4 T-клеток субъекта.
[086] В/в введение рекомбинантного MVA усиливает противоопухолевые эффекты. В другом аспекте настоящего изобретения предложен рекомбинантный MVA, содержащий нуклеиновую кислоту, кодирующую один или более гетерологичных антигенов, причем в/в введение субъекту приводит к повышению уровня выживаемости субъекта, также снижению общего объема опухоли по сравнению с не-в/в введением. В предпочтительном аспекте рекомбинантный MVA дополнительно кодирует CD40L. Как проиллюстрировано на Фиг. 17 и 18, в/в введение рекомбинантного MVA приводило к большему общему уровню выживаемости и большему снижению объема опухоли или более длительному подавлению роста опухоли по сравнению с п/к введением. Также проиллюстрировано, что CD40L, включенный как часть рекомбинантного MVA, приводил к улучшению общей выживаемости и снижению объема опухоли по сравнению с в/в введением рекомбинантного MVA без CD40L. Как проиллюстрировано на Фиг. 19, CD40L, включенный как часть рекомбинантного MVA, повышал общее накопление CD8- и антиген (OVA)-специфических Т-клеток в периферической крови несущих опухоль животных по сравнению с в/в введением рекомбинантного MVA без CD40L. Кроме того, CD8 T-клетки являются важными медиаторами противоопухолевого эффекта rMVA-CD40L, так как опосредованное антителами истощение клеток CD8 приводит к отсутствию продления общей выживаемости.
[087] В/в введение MVA, кодирующего два гетерологичных антигена, повышает противоопухолевую эффективность. В другом аспекте настоящего изобретения, проиллюстрированном на Фиг. 291, в/в иммунизация с применением MVA, кодирующего два гетерологичных антигена (OVA и TRP2), индуцирует продление подавления роста опухоли и повышает общую выживаемость. CD40L, включенный как часть рекомбинантного MVA, кодирующего два гетерологичных антигена, усиливает противоопухолевый ответ по сравнению с в/в введением рекомбинантного MVA с CD40L и только одним гетерологичным антигеном. Так как злокачественные новообразования используют разнообразные механизмы уклонения от иммунологического надзора, такие как снижение экспрессии опухолевых антигенов (Jensen et al., 2012), кодирование двух или более опухолевых антигенов в вакцине ограничивает развитие механизмов уклонения от противоопухолевого иммунного ответа.
[088] В/в введение MVA снижает иммуносупрессивные эффекты опухоли. Как проиллюстрировано на Фиг. 29 и 32, внутривенно вводимый рекомбинантный MVA, кодирующий гетерологичный антиген и, необязательно, CD40L, индуцировал инфильтрацию CD8+ T-клеток в опухоль и снижал некоторые иммуносупрессивные эффекты, как правило, используемые опухолями для уклонения от иммунной системы. Кроме повышения количества эндогенных клеток CD8+ в опухолях после стимуляции рекомбинантным MVA с или без CD40L, было повышено количество антиген (OVA)-специфических T-клеток в селезенке и опухолях после в/в введения рекомбинантного MVA с CD40L по сравнению с MVA без CD40L. Кроме того, инфильтрирующие опухоль Т-лимфоциты экспрессировали меньше иммуносупрессивных поверхностных молекул PD-1 и Lag3 при проверке в эндогенных Т-клетках (Фиг. 22C-E, 23B) или перенесенных антиген (OVA)-специфических Т-клетках (Фиг. 21 D) и пролиферировали в опухолевом микроокружении. Сниженная экспрессия PD-1 на инфильтрирующих опухоль Т-клетках после иммунизации rMVA и rMVA-CD40L была неожиданной, так как интерфероны I и II типов, которые индуцируются обоими векторами (Фиг. 14C и E), являются известными индукторами экспрессии PD-1 и PD-L1 (обзор в Dong et al., 2017). Неожиданно число иммуносупрессивных регуляторных Т-клеток (Treg) в опухолевом микроокружении было снижено (22F, 23A) при введении рекомбинантного MVA, кодирующего гетерологичный антиген и, необязательно, CD40L, что приводило к увеличению соотношения эффекторных Т-клеток к Treg в опухолевом микроокружении (Фиг. 23B). Сниженная экспрессия ослабляющих иммунитет молекул, таких как PD-1 и Lag3, а также сниженное число Treg в опухолевой ткани коррелирует с усиленными противоопухолевыми эффектами, наблюдаемыми после иммунизации rMVA и rMVA-CD40L.
[089] Фармацевтическая комбинация по настоящему изобретению снижает опухолевую нагрузку и повышает уровень выживаемости у онкологических пациентов. В различных вариантах реализации фармацевтическая комбинация включает a) в/в введение рекомбинантного MVA, кодирующего гетерологичный ОАА и, необязательно, CD40L, и b) введение антитела. Как проиллюстрировано на Фиг. 26 и 33, фармацевтическая комбинация приводит к снижению объема опухоли и повышению общего уровня выживаемости.
[090] По меньшей мере в одном аспекте усиленные противоопухолевые эффекты фармацевтической комбинации (например, сниженный объем опухоли и/или повышенный уровень выживаемости) обеспечиваются синергетической комбинацией отдельных эффектов усиления врожденного и адаптивного ответов Т-клеток, описанных в данном документе. В одном типовом варианте реализации эти отдельные эффекты усиления включают один или более из перечисленных выше, например, усиленный врожденный ответ (например, NK-клеток), усиленное опосредованное АЗКЦ уничтожение опухолевых клеток, усиленное уничтожение NK-клетками опухолевых клеток, имеющих меньшие уровни ГКГС класса I, и усиленный адаптивный ответ Т-клеток. Кроме того, одна или более схем дозирования по настоящему изобретению дополнительно улучшают и обеспечивают возможность уничтожения опухолевых клеток иммунной системой пациента в течение некоторого периода времени.
[091] В/в введение MVA-HER2-Brachyury плюс анти-HER2 антитела. В одном преимущественном варианте реализации изобретения фармацевтическая комбинация включает a) внутривенное введение рекомбинантного MVA, кодирующего антигены HER2 и Brachyury и, необязательно, CD40L, и b) введение анти-HER2 антитела. Этот вариант реализации индуцирует усиленный иммунный ответ, описанный в данном документе, и дополнительно сфокусирован на уничтожении опухолевых клеток, экспрессирующих HER2 и Brachyury. В дополнительных преимущественных аспектах антиген HER2 содержит одну или более модификаций, которые дополнительно повышают эффективность комбинированной терапии по настоящему изобретению. Как проиллюстрировано на Фиг. 29, rMVA-HER2-Brachyury и rMVA-HER2-Brachyury-CD40L продемонстрировали активацию дендритных клеток (ДК). Активация ДК была усилена за счет rMVA-HER2-Brachyury-CD40L по сравнению с rMVA-HER2-Brachyury. Как проиллюстрировано на Фиг. 33, введение фармацевтической комбинации, описанной в настоящем изобретении, приводило к существенному повышению снижения объема опухоли и общего уровня выживаемости субъектов.
[092] В одном конкретном варианте реализации настоящее изобретение относится и адаптировано к лечению онкологических пациентов с HER2-экспрессирующими злокачественными образованиями, такими как HER2-положительные раки молочной железы или желудка, которые лечат связывающими HER2 антителами. Рекомбинантный MVA, кодирующий HER2, индуцирует высокоэффективные Т-клетки-киллеры против HER2-экспрессирующих опухолевых клеток, тогда как трансген Brachyury, кодируемый рекомбинантным MVA, индуцирует высокоэффективные Т-клетки-киллеры против Brachyury-экспрессирующих опухолевых клеток, которые потенциально могут быть метастатическими.
[093] В контексте данного документа формы единственного числа включают ссылки на формы множественного числа, если из контекста явно следует иное. Так, например, ссылка на «нуклеиновую кислоту» включает одну или более нуклеиновых кислот, а ссылка на «способ» включает ссылку на эквивалентные этапы и способы, известные специалистам в данной области техники, которыми могут быть модифицированы или замещены способы, описанные в данном документе.
[094] Если не указано иное, термин «по меньшей мере», предшествующий ряду элементов, следует понимать как относящийся к каждому элементу ряда. Специалистам в данной области станет понятно или они смогут установить, используя не более чем рутинные эксперименты, существование многочисленных эквивалентов конкретных вариантов реализации изобретения, описанных в данном документе. Подразумевается, что такие эквиваленты охвачены объемом настоящего изобретения.
[095] В тексте этого описания и следующей за ним формулы изобретения, если из контекста не следует иное, слово «содержать» и его вариации, такие как «содержит» и «содержащий», следует понимать как включение указанного целого числа или этапа или группы целых чисел или этапов, но не исключение какого-либо другого целого числа или этапа или группы целых чисел или этапов. В контексте данного документа термин «содержащий» может быть заменен термином «включающий» или иногда, в контексте данного документа, термином «имеющий». Любой из вышеуказанных терминов (содержащий, включающий, имеющий), хотя это и менее предпочтительно, в каждом случае, когда он употреблен в данном документе в контексте аспекта варианта реализации настоящего изобретения, может быть заменен термином «состоящий из». В контексте данного документа термин «состоящий из» исключает любой элемент, этап или ингредиент, не указанные в элементе пункта формулы изобретения. В контексте данного документа термин «состоящий преимущественно из» не исключает материалы или этапы, которые не оказывают существенное влияние на основные и новые характеристики пункта формулы изобретения.
[096] В контексте данного документа соединительный термин «и/или» между множеством перечисляемых элементов следует понимать как включающий, как отдельные, так и комбинированные варианты. Например, если два элемента соединены «и/или», первый вариант относится к применению первого элемента без второго. Второй вариант относится к применению второго элемента без первого. Третий вариант относится к применению первого и второго элементов вместе. Подразумевается, что любой из этих вариантов соответствует значению и, соответственно, удовлетворяет требованию термина «и/или» в контексте данного документа. Также подразумевается, что одновременное применение более чем одного из этих вариантов соответствует значению и, соответственно, удовлетворяет требованию термина «и/или».
[097] Описанная в данном документе «мутация» представляет собой по определению данного документа любую модификацию в нуклеиновой кислоте или аминокислоте, такую как делеции, добавления, вставки и/или замены.
[098] В контексте данного документа «клетка-хозяин» представляет собой клетку, в которую были внесены чужеродная молекула, вирус или микроорганизм. В одном неограничивающем примере, описанном в данном документе, клетку из подходящей клеточной культуры, такой как, например, клетки CEF, можно инфицировать поксвирусом или, в других альтернативных вариантах реализации, плазмидным вектором, содержащим чужеродный или гетерологичный ген. Таким образом, подходящие клетки-хозяева и клеточные культуры служат хозяином для поксвируса и/или чужеродного или гетерологичного гена.
[099] «Процент (%) гомологии или идентичности последовательности» в отношении последовательностей нуклеиновых кислот, описанных в данном документе, определяется как процентное содержание нуклеотидов в кандидатной последовательности, которые являются идентичными с нуклеотидами в референсной последовательности (т. е. последовательности нуклеиновой кислоты, из которой она получена), после выравнивания последовательностей и введения в случае необходимости гэпов для достижения максимального процента идентичности последовательности и не считая любые консервативные замены частью идентичности последовательности. Выравнивание в целях определения процента идентичности или гомологии нуклеотидной последовательности можно осуществлять различными способами, находящимися в компетенции специалиста в данной области техники, например, с помощью общедоступного компьютерного программного обеспечения, такого как BLAST, ALIGN или Megalign (DNASTAR). Специалисты в данной области техники могут определить соответствующие параметры для определения выравнивания, включая любые алгоритмы, необходимые для достижения максимального выравнивания по всей длине сравниваемых последовательностей.
[0100] Например, соответствующее выравнивание для последовательностей нуклеиновых кислот обеспечивает алгоритм локальной гомологии Смита и Уотермана (Smith and Waterman, (1981), Advances in Applied Mathematics 2:482- 489). Этот алгоритм можно применять к аминокислотным последовательностям, используя весовую матрицу, разработанную Dayhoff, Atlas of Protein Sequences and Structure, M. O. Dayhoff ed., 5 suppl. 3:353-358, National Biomedical Research Foundation, Washington, D.C., USA, и нормализованную Gribskov (1986), Nucl. Acids Res. 14(6):6745-6763. Пример реализации этого алгоритма для определения процента идентичности последовательности приведен в Genetics Computer Group (Madison, Wis.) в приложении «BestFit». Параметры по умолчанию для этого метода описаны в Wisconsin Sequence Analysis Package Program Manual, Version 8 (1995) (доступной от Genetics Computer Group, Madison, Wis.). Предпочтительный способ определения процента идентичности в контексте настоящего изобретения заключается в использовании пакета программ MPSRCH, защищенного авторским правом Эдинбургского университета, разработанного John F. Collins и Shane S. Sturrok и распространяемого IntelliGenetics, Inc. (Mountain View, Calif). Из этого комплекса пакетов можно использовать алгоритм Смита-Уотермана, в котором используются параметры по умолчанию для таблицы весов (например, штраф за открытие гэпа, равный 12, штраф за продление гэпа, равный одному, и штраф за гэп, равный шести). Из сгенерированных данных значение «соответствие» (англ. - «Match») отражает «идентичность последовательности». Другие подходящие программы для вычисления процента идентичности или сходства между последовательностями в целом известны в данной области техники, например, другой программой выравнивания является BLAST, используемая с параметрами по умолчанию. Например, BLASTN и BLASTP можно использовать со следующими параметрами по умолчанию: генетический код=стандарт; фильтр=отсутствует; цепь=обе; отсечение=60; ожидание=10; матрица=BLOSUM62; описания=50 последовательностей; сортировать по=НАИБОЛЬШЕЙ ОЦЕНКЕ; базы данных=не дублирующиеся, GenBank+EMBL+DDBJ+PDB+переводы GenBank CDS+Swiss protein+Spupdate+PIR. Подробную информацию по этим программам можно найти по следующему интернет-адресу: blast.ncbi.nlm.nih.gov/.
[0101] Термин «прайм-буст вакцинация» или «прайм-буст схема» относится к стратегии вакцинации, в которой используют первичную (примирующую) инъекцию вакцины, нацеленной на конкретный антиген, за которой следуют через определенные интервалы одна или более бустерных инъекций той же вакцины. Прайм-буст вакцинация может быть гомологичной или гетерологичной. В гомологичной прайм-буст вакцинации используют вакцину, содержащую одинаковые антиген и вектор как для первичной инъекции, так и для одной или более бустерных инъекций. В гетерологичной прайм-буст вакцинации используют вакцину, содержащую одинаковый антиген как для первичной инъекции, так и для одной или более бустерных инъекций, но разные векторы для первичной инъекции и для одной или более бустерных инъекций. Например, в гомологичной прайм-буст вакцинации можно использовать рекомбинантный поксвирус, содержащий нуклеиновые кислоты, экспрессирующие один или более антигенов, для первичной инъекции, и такой же рекомбинантный поксвирус, экспрессирующий один или более антигенов, для одной или более бустерных инъекций. В противоположность этому, в гетерологичной прайм-буст вакцинации можно использовать рекомбинантный поксвирус, содержащий нуклеиновые кислоты, экспрессирующие один или более антигенов, для первичной инъекции, и другой рекомбинантный поксвирус, экспрессирующий один или более антигенов, для одной или более бустерных инъекций.
[0102] Термин «рекомбинантный» означает полинуклеотид, вирус или вектор полусинтетического или синтетического происхождения, который либо не существует в природе, либо связан с другим полинуклеотидом в порядке, не встречающемся в природе.
[0103] В контексте данного документа снижение или уменьшение объема опухоли можно охарактеризовать как снижение объема и/или размера опухоли, но также можно охарактеризовать в терминах конечных результатов клинического исследования, известных в данной области техники. Некоторые типовые конечные результаты клинического исследования, связанные со снижением объема и/или размера опухоли, могут включать, но не ограничиваются этим, частоту ответов (ЧО), частоту объективных ответов (ЧОО) и т.д.
[0104] В контексте данного документа повышение уровня выживаемости можно охарактеризовать как повышение выживаемости онкологического пациента, но также можно охарактеризовать в терминах конечных результатов клинического исследования, известных в данной области техники. Некоторые типовые конечные результаты клинического исследования, связанные с повышением уровня выживаемости, включают, но не ограничиваются этим, уровень общей выживаемости (УОВ), выживаемость без прогрессирования (ВБП) и т.д.
[0105] В контексте данного документа «трансген» или «гетерологичный» ген следует понимать как нуклеотидную или аминокислотную последовательность, которая не присутствует в геноме поксвируса дикого типа (например, вируса осповакцины, вируса оспы кур или MVA). Специалисту в данной области понятно, что «трансген» или «гетерологичный ген», если он присутствует в поксвирусе, таком как вирус осповакцины, должен быть включен в геном поксвируса так, чтобы после введения рекомбинантного поксвируса в клетку-хозяина он экспрессировался в виде соответствующего гетерологичного генного продукта, т.е. в виде «гетерологичного антигена» и/или «гетерологичного белка». Экспрессию обычно обеспечивают посредством функционального связывания гетерологичного гена с регуляторными элементами, которые делают возможной экспрессию в инфицированной поксвирусом клетке. Предпочтительно регуляторные элементы включают природный и синтетический поксвирусный промотор.
[0106] «Вектор» относится к рекомбинантным ДНК- или РНК-плазмиде или вирусу, которые могут содержать гетерологичный полинуклеотид. Гетерологичный полинуклеотид может содержать представляющую интерес последовательность в целях предотвращения или терапии и может, необязательно, иметь форму экспрессионной кассеты. В контексте данного документа вектор не обязательно должен быть способен к репликации в конечной целевой клетке или организме субъекта. Этот термин включает клонирующие векторы и вирусные векторы.
Фармацевтические комбинации и способы
[0107] В различных вариантах реализации настоящее изобретение включает фармацевтическую комбинацию для лечения онкологического пациента путем снижения объема опухоли и/или повышения выживаемости онкологического пациента. Фармацевтическая комбинация содержит рекомбинантный MVA, содержащий первую нуклеиновую кислоту, кодирующую первый гетерологичный опухолеассоциированный антиген (ОАА), и при внутривенном введении индуцирует как усиленный ответ естественных клеток-киллеров (NK), так и усиленный ответ Т-клеток по сравнению с ответом NK-клеток и ответом Т-клеток, индуцированным не внутривенным введением рекомбинантного вируса MVA, содержащего нуклеиновую кислоту, кодирующую гетерологичный опухолеассоциированный антиген.
Усиленный ответ NK-клеток
[0108] В одном аспекте усиленный ответ NK-клеток в соответствии с настоящим описанием характеризуется одним или более из следующего: 1) повышением частоты NK-клеток, 2) повышением активации NK-клеток и/или 3) повышением пролиферации NK-клеток. Таким образом, то, усилен ли ответ NK-клеток в соответствии с настоящим описанием, можно определить, измеряя экспрессию одного или более цитокинов, показательных для повышения частоты NK-клеток, повышения активации NK-клеток и/или повышения пролиферации NK-клеток. Типовые маркеры, применимые при определении частоты и/или активности NK-клеток, включают один или более из: NKp46, IFN-γ, CD69, CD70, NKG2D, FasL, гранзима B, CD56 и/или Bcl-XL. Типовые маркеры, применимые при определении активации NK-клеток, включают один или более из IFN-γ, CD69, CD70, NKG2D, FasL, гранзима B и/или Bcl-XL. Типовые маркеры, применимые при определении пролиферации NK-клеток, включают Ki67. Эти молекулы и их измерения относятся к валидированным методам анализа, известным в данной области техники, которые можно проводить в соответствии с известными методиками. Смотрите, например, Borrego et al., Immunology 1999; Fogeln et al., 2013. Помимо этого, методы анализа для измерения молекул можно найти в примерах 1-3 и 9 настоящего описания. По меньшей мере в одном аспекте 1) повышение частоты NK-клеток можно определить как по меньшей мере 2-кратное повышение количества CD3-NKp46+ клеток по сравнению с количеством до обработки/исходным уровнем; 2) повышение активации NK-клеток можно определить как по меньшей мере 2-кратное повышение экспрессии IFN-γ, CD69, CD70, NKG2D, FasL, гранзима B и/или Bcl-XL по сравнению с экспрессией до обработки/на исходном уровне; и/или 3) повышение пролиферации NK-клеток можно определить как по меньшей мере 1,5-кратное повышение экспрессии Ki67 по сравнению с экспрессией до обработки/на исходном уровне.
[0109] В более предпочтительном аспекте в контексте настоящего описания «усиленный ответ NK-клеток» характеризуется повышением опосредованного NK-клетками уничтожения опухолевых клеток. Опосредованное NK-клетками уничтожение опухолевых клеток можно анализировать, измеряя высвобождение лактатдегидрогеназы (ЛДГ) в клеточную культуральную среду, как показано в примере 5. Таким образом, в контексте настоящего изобретения то, усиливает ли фармацевтическая комбинация «ответ NK-клеток» или нет, можно определить по наличию повышения опосредованного NK-клетками уничтожения опухолевых клеток. Опосредованное NK-клетками уничтожение опухолевых клеток можно анализировать, измеряя высвобождение лактатдегидрогеназы, как показано в примере 5. Методы анализа, связанные с ЛДГ и ее измерениями, валидированы и известны в данной области техники. По меньшей мере в одном аспекте повышение опосредованного NK-клетками уничтожения опухолевых клеток можно определить как по меньшей мере 2-кратное повышение уничтожения опухолевых клеток.
Усиленный ответ АЗКЦ
[0110] По меньшей мере в одном аспекте усиленный ответ NK-клеток, индуцированный по настоящему изобретению, приводит к усиленному ответу АЗКЦ. «Усиленный ответ АЗКЦ» в соответствии с настоящим изобретением характеризуется повышением способности эффекторных клеток врожденного иммунитета нацеливаться и уничтожать опухолевые клетки, покрытые антителами. В контексте настоящего описания эффекторы врожденного иммунитета могут включать, но не ограничиваются этим, NK-клетки, макрофаги, нейтрофилы, базофилы, эозинофилы, тучные клетки, дендритные клетки и т. д. В более предпочтительном аспекте эффектор врожденного иммунитета представляет собой NK-клетку. Методы анализа, применимые для определения способности эффекторных клеток уничтожать опухолевые клетки, включают ex vivo анализ уничтожения эффектор:мишень, где «эффектор» представляет собой выделенные эффекторные клетки, а «мишень» представляет собой опухолевые клетки в присутствие антител. Смотрите Yamashita et al., (2016) and Broussas et al. (2013). Ex vivo анализ уничтожения эффектор:мишень валидирован и известен в данной области техники. Помимо этого, методы анализа для определения способности эффекторных клеток уничтожать опухолевые клетки можно найти в примере 5. Таким образом, в контексте настоящей заявки то, усиливает или нет усиленный врожденный иммунный ответ, включая усиленный ответ NK-клеток, АЗКЦ, можно определить, измеряя уровни уничтожения опухолевых клеток посредством одного или более из: 1) применения разных соотношений эффекторных клеток к покрытым клеткам-мишеням (опухолевым клеткам, покрытым антителами); и 2) применения постоянного соотношения эффекторных клеток и одной или более концентраций антител, например, меньшие концентрации антител, связанных с опухолевым антигеном, сравнивают с уровнями уничтожения опухолевых клеток при больших концентрациях.
[0111] В предпочтительном аспекте «усиленный ответ АЗКЦ» в соответствии с настоящим описание характеризуется повышением способности NK-клеток нацеливаться и уничтожать опухолевые клетки, покрытые антителами. Методы анализа, применимые для определения способности NK-клеток уничтожать опухолевые клетки, включают ex vivo анализ уничтожения эффектор:мишень, где «эффектор» представляет собой выделенные NK-клетки, а «мишень» представляет собой опухолевые клетки в присутствие антител. Помимо этого, методы анализа для определения способности NK-клеток уничтожать опухолевые клетки можно найти в примере 5. Таким образом, в одном аспекте в контексте настоящей заявки то, усиливает или нет ответ NK-клеток АЗКЦ, можно определить, измеряя уровни уничтожения опухолевых клеток: 1) применяя разные соотношения NK-клеток к покрытым клеткам-мишеням (опухолевым клеткам, покрытым антителами); и 2) применяя постоянное соотношение NK-клеток и одной или более концентраций антител, например, меньшие концентрации антител, связанных с опухолевым антигеном, сравнивают с уровнями уничтожения опухолевых клеток при больших концентрациях.
Более сильная опосредованная NK-клетками токсичность
[0112] В дополнительных аспектах усиленный ответ NK-клеток приводит к повышению способности эффекторов врожденного иммунитета, таких как NK-клетки, атаковать и уничтожать опухолевые клетки, имеющие низкие уровни экспрессии ГКГС. В одном аспекте уничтожение опухолевых клеток, имеющих низкие уровни ГКГС, может характеризоваться эффекторами врожденного иммунитета, например, NK-клеткам, характеризующимся более сильной опосредованной NK-клетками токсичностью, что означает, что NK-клетки более эффективно уничтожают опухолевые клетки. NK-клетки, характеризующиеся более сильной опосредованной NK-клетками токсичностью, можно определить по числу опухолевых клеток, уничтоженных NK-клетками. Это можно определить, используя анализ уничтожения эффектор:мишень. Такие методы анализа валидированы и известны в данной области техники, а также продемонстрированы в настоящей заявке по меньшей мере в примере 4 и на Фиг. 9.
Эффекторные клетки усиленного врожденного иммунитета
[0113] В дополнительных аспектах в/в введение рекомбинантных поксвирусов по настоящей заявке не только усиливает ответ NK-клеток, но также усиливает все аспекты врожденного иммунного ответа. Усиление врожденного иммунного ответа можно охарактеризовать как повышение 1) частоты, 2) активации и/или 3) пролиферации эффекторных клеток врожденного иммунитета. Эффекторные клетки врожденного иммунитета могут включать NK-клетки, лимфоидные клетки врожденного иммунитета (ЛКВИ), макрофаги, нейтрофилы, базофилы, эозинофилы, тучные клетки, моноциты и/или дендритные клетки. В различных аспектах то, усилен ли врожденный иммунный ответ в соответствии с настоящей заявкой, можно определить, измеряя одно или более из экспрессии цитокинов и/или маркеров активации, связанных с описанными эффекторными клетками врожденного ответа. Эти цитокины и маркеры активации и их измерения валидированы и известны в данной области техники, и их можно проводить в соответствии с известными методиками. Смотрите, например, Borrego et al., Immunology 1999; Fogeln et al., 2013.
Усиленный ответ Т-клеток
[0114] В соответствии с настоящей заявкой «усиленный ответ Т-клеток» характеризуется одним или более из следующего: 1) повышением частоты CD8 T-клеток; 2) повышением активации CD8 T-клеток; и/или 3) повышением пролиферации CD8 T-клеток. Таким образом, то, усилен ли ответ T-клеток в соответствии с настоящей заявкой, можно определить, измеряя экспрессию одного или более цитокинов, показательных для 1) повышения частоты CD8 T-клеток, 2) повышения активации CD8 T-клеток и/или 3) повышения пролиферации CD8 T-клеток. Типовые маркеры, применимые для определения частоты, активации и пролиферации CD8 T-клеток, включают CD3, CD8, IFN-γ, TNF-α, IL-2, CD69 и/или CD44 и Ki67, соответственно. Измерение частоты антиген-специфических Т-клеток также можно проводить с помощью ELIspot или мультимеров ГКГС, таких как пентамеры или декстрамеры, как проиллюстрировано на Фиг. 11, 12, 15, 19 и 21. Такие измерения и методы анализа валидированы и известны в данной области техники.
[0115] В одном аспекте повышение частоты CD8 T-клеток характеризуется по меньшей мере 2-кратным повышением количества IFN-γ и/или декстрамер+ CD8 T-клеток по сравнению с количеством до обработки/на исходном уровне. Повышение активации CD8 T-клеток характеризуется как по меньшей мере 2-кратное повышение экспрессии CD69 и/или CD44 по сравнению с экспрессией до обработки/на исходном уровне. Повышение пролиферации CD8 T-клеток характеризуется как по меньшей мере 2-кратное повышение экспрессии Ki67 по сравнению с экспрессией до обработки/на исходном уровне.
[0116] В альтернативном аспекте усиленный ответ Т-клеток характеризуется повышением экспрессии CD8 T-клетками эффекторных цитокинов и/или повышением цитотоксических эффекторных функций. Повышение экспрессии эффекторных цитокинов можно определить по экспрессии одного или более из IFN-γ, TNF-α и/или IL-2 по сравнению с экспрессией до обработки/на исходном уровне. Повышение цитотоксических эффекторных функций можно определить по экспрессии одного или более из CD107a, гранзима B и/или перфорина и/или антиген-специфическому уничтожению клеток-мишеней.
[0117] Описанные в данном документе методы анализа, цитокины, маркеры и молекулы, а также их измерения валидированы и известны в данной области техники, и их можно проводить в соответствии с известными методиками. Кроме того, методы анализа для определения ответов Т-клеток можно найти в примерах 6 и 7, к которых проводили анализ ответов Т-клеток.
[0118] Усиленный ответ Т-клеток, реализуемый посредством настоящего изобретения, обеспечивает исключительное преимущество в комбинации с усиленным ответом NK-клеток, так как усиленный ответ Т-клеток эффективно нацеливается и уничтожает те опухолевые клетки, которые уклонились и/или выжили после начальных ответов врожденного иммунитета у онкологического пациента. Кроме того, лечение антителами может усилить презентацию ГКГС класса I ОАА, что приводит к большей восприимчивости ОАА-экспрессирующих опухолей к лизису ОАА-специфическими Т-клетками (Kono et al., Clin Cancer Res, 2004).
[0119] В дополнительных вариантах реализации фармацевтическая комбинация дополнительно содержит антитело, специфическое к антигену, который экспрессируется или сверхэкспрессируется на клеточной мембране, предпочтительно внешней клеточной мембране опухолевой клетки. Подразумевается, что антитело может представлять собой любое антитело, описанное в настоящем изобретении. В предпочтительных вариантах реализации антитело содержит Fc-домен.
[0120] В дополнительных вариантах реализации предложен способ снижения объема опухоли и/или повышения выживаемости у онкологического пациента. Указанный способ включает a) внутривенное введение онкологическому пациенту рекомбинантного MVA, содержащего первую нуклеиновую кислоту, кодирующую первый гетерологичный опухолеассоциированный антиген (ОАА), который при внутривенном введении индуцирует как усиленный врожденный иммунный ответ, так и усиленный ответ Т-клеток по сравнению с врожденным иммунным ответом и ответом Т-клеток, индуцированным невнутривенным введением рекомбинантного вируса MVA, содержащего нуклеиновую кислоту, кодирующую гетерологичный опухолеассоциированный антиген; и b) введение онкологическому пациенту антитела, содержащего Fc-домен и являющегося специфическим к антигену, который экспрессируется на клеточной мембране опухолевой клетки, причем введение a) и b) онкологическому пациенту снижает размер опухоли у онкологического пациента и/или повышает уровень выживаемости онкологического пациента по сравнению с невнутривенным введением a) или введением b) отдельно. В более предпочтительном варианте реализации усиленный врожденный иммунный ответ включает усиленный ответ NK-клеток, описанный в данном документе.
[0121] В другом варианте реализации предложен способ усиления терапии на основе антител у пациента, включающий a) введение онкологическому пациенту антитела, содержащего Fc-домен и являющегося специфическим к антигену, который экспрессируется на клеточной мембране опухолевой клетки, и при этом введение антитела индуцирует АЗКЦ; и b) внутривенное введение онкологическому пациенту рекомбинантного MVA, содержащего первую нуклеиновую кислоту, кодирующую первый гетерологичный опухолеассоциированный антиген (ОАА), который индуцирует как усиленный врожденный иммунный ответ, так и усиленный ответ Т-клеток у пациента, причем усиленный врожденный иммунный ответ усиливает АЗКЦ у пациента по сравнению с невнутривенным введением комбинации a) и b) или же a) и b) отдельно. В более предпочтительном варианте реализации усиленный врожденный иммунный ответ включает усиленный ответ NK-клеток, описанный в данном документе.
[0122] В другом варианте реализации предложен способ повышения эффективности терапии на основе антител у онкологического пациента, включающий введение фармацевтической комбинации по настоящему изобретению, причем введение комбинации пациенту снижает концентрацию антител, необходимую для опосредованной NK-клетками токсичности в опухолевых клетках. По меньшей мере в одном преимущественном аспекте снижение концентрации антител, необходимой для опосредованной NK-клетками токсичности, обеспечивает возможность усиленного ответа NK-клеток для уничтожения опухолевых клеток, которые имеют сниженную внеклеточную экспрессию антигена с целью уклонения от уничтожения мишенями связанного антитела. Кроме того, снижение концентрации антител может обеспечить возможность лечения меньшими количествами антител.
[0123] В контексте настоящей заявки снижение концентрации антител, необходимой для опосредованной NK-клетками токсичности, можно охарактеризовать как снижение концентрации антител, необходимой для уничтожения опухолевых клеток. Снижение концентрации антител, необходимой для уничтожения опухолевых клеток, можно определить с помощью ex vivo анализа уничтожения эффектор:мишень, где «эффектор» представляет собой выделенные NK-клетки, а «мишень» представляет собой опухолевые клетки в присутствие антител. Кроме того, методы анализа для определения включают измерение уровней уничтожения опухолевых клеток, например, путем 1) применения разных соотношений NK-клеток к покрытым клеткам-мишеням (опухолевым клеткам, покрытым антителами); и 2) применения постоянного соотношения NK-клеток и одной или более концентраций антител, например, меньшие концентрации антител, связанных с опухолевым антигеном, сравнивают с уровнями уничтожения опухолевых клеток при больших концентрациях. Такие методы анализа известны в данной области техники и также описаны в примере 5 и 31 настоящей заявки.
[0124] В дополнительных вариантах реализации описанные в данном документе фармацевтическая комбинация и способы предназначены для лечения онкологического пациента-человека. В предпочтительных вариантах реализации онкологический пациент имеет и/или у него диагностирован рак, выбранный из группы, состоящей из: рака молочной железы, рака легкого, рака головы и шеи, рака щитовидной железы, меланомы, рака желудка, рака мочевого пузыря, рака почки, рака печени, меланомы, рака поджелудочной железы, рака предстательной железы, рака яичника, рака уротелия, рака шейки матки или колоректального рака.
[0125] В дополнительных предпочтительных вариантах реализации фармацевтические комбинации и способы по настоящему изобретению содержат CD40L. Предпочтительно CD40L кодируется рекомбинантным MVA.
Типовые опухолеассоциированные антигены
[0126] В определенных предпочтительных вариантах реализации первый и/или второй опухолеассоциированный антиген (ОАА) включает, но не ограничивается этим, HER2, PSA, PAP, CEA, MUC-1, сурвивин, TYRP1, TYRP2 или Brachyury (брахиурия) по отдельности или в комбинациях. Такие типовые комбинации могут содержать HER2 и Brachyury, CEA и MUC-1 или PAP и PSA.
[0127] В данной области техники известны многочисленные ОАА. Типовые ОАА включают, но не ограничиваются этим, 5-альфа-редуктазу, альфа-фетопротеин, AM-1, APC, April, BAGE, бета-катенин, Bcl12, bcr-abl, Brachyury (брахиурию), CA-125, CASP-8/FLICE, катепсины, CD19, CD20, CD21, CD23, CD22, CD33 CD35, CD44, CD45, CD46, CD5, CD52, CD55, CD59, CDC27, CDK4, CEA, c-myc, Cox-2, DCC, DcR3, E6/E7, CGFR, EMBP, Dna78, фарнезилтрансферазу, FGF8b, FGF8a, FLK-1/KDR, рецептор фолиевой кислоты, G250, GAGE-семейство, гастрин 17, гастрин-высвобождающий гормон, GD2/GD3/GM2, GnRH, GnTV, GP1, gp100/Pmel17, gp-100-in4, gp15, gp75/TRP-1, hCG, гепараназу, HER2/neu, HMTV, Hsp70, hTERT, IGFR1, IL-13R, iNOS, Ki67, KIAA0205, K-ras, H-ras, N-ras, KSA, LKLR-FUT, MAGE-семейство, маммаглобин, MAP17, мелан-A/MART-1, мезотелин, MIC A/B, MT-MMPs, муцин, NY-ESO-1, остеонектин, p15, P170/MDR1, p53, p97/меланотрансферрин, PAI-1, PDGF, uPA, PRAME, пробазин, прогенипоиентин, PSA, PSM, RAGE-1, Rb, RCAS1, SART-1, SSX-семейство, STAT3, STn, TAG-72, TGF-альфа, TGF-бета, тимозин-бета-15, TNF-альфа, TYRP-, TYRP-2, тирозиназу, VEGF, ZAG, p16INK4 и глутатион-S-трансферазу.
[0128] Предпочтительный антиген PSA содержит аминокислотную замену изолейцина на лейцин в позиции 155. U.S, как описано в патенте США 7247615, который включен в данный документ посредством ссылки.
[0129] В более предпочтительных вариантах реализации настоящего изобретения первый и/или второй гетерологичные ОАА выбраны из HER2 и Brachyury. В еще более предпочтительных вариантах реализации первый и/или второй гетерологичные ОАА выбраны из синтетических белков HER2 и Brachyury, описанных в данном документе.
[0130] В дополнительных предпочтительных вариантах реализации первый и/или второй гетерологичные ОАА содержат одну или более мутаций. По меньшей мере в одном варианте реализации одна или более мутаций включают мутации, которые предотвращают связывание антител по настоящему описанию с первым и/или вторым гетерологичными ОАА. В дополнительных вариантах реализации одна или более мутаций включают мутации, которые предотвращают осуществление первым и/или вторым гетерологичными ОАА одной или более нормальных клеточных функций ОАА. Типовые варианты реализации одной или более мутаций описаны синтетическими белками HER2 и синтетическими белками Brachyury по настоящему изобретению.
Синтетические белки HER2
[0131] В ходе работы над настоящим изобретением авторы изобретения определили, что одна или более модификаций антигенов HER2 и/или нуклеиновых кислот, кодирующих антигены HER2, описанных в данном документе, повышают эффективность комбинированной терапии.
[0132] Соответственно, в различных вариантах реализации настоящее изобретение включает нуклеиновую кислоту, кодирующую антиген HER2, выбранный из HER2v1 и HER2v2. HER2v1 и HER2v2 содержат SEQ ID NO: 1 и SEQ ID NO: 13, соответственно.
[0133] По меньшей мере в одном аспекте нуклеиновая кислота, кодируемая SEQ ID NO:1 и/или 13, обеспечивает исключительное преимущество, так как SEQ ID NO: 1 и/или 13 сконструированы так, чтобы синергетически функционировать с антителами к антигену HER2 при введение в качестве части комбинированной терапии.
[0134] В одном типовом варианте реализации настоящего изобретения антитела к HER2 включают те антитела, которые одобрены для лечения рака с экспрессией HER2, или, в более конкретном варианте реализации, рака молочной железы с экспрессией HER2. Были разработаны два гуманизированных моноклональных антитела, нацеленных на HER2, и одобрены для лечения рака молочной железы с экспрессией HER2. Оба антитела связываются с разными участками внеклеточного домена HER2. Связывание трастузумаба (продаваемого под торговой маркой Герцептин® и имеющего биоаналоги Герзума и ABP 980) приводит к блокировке передачи сигнала и предотвращению расщепления HER2. В противоположность этому, пертузумаб (Перьета®) стерично блокирует димеризацию HER2 с другими EGF-рецепторами и блокирует активируемую лигандами сигнализацию. Как трастузумаб, так и пертузумаб обеспечивают двойную блокировку HER2-управляемых сигнальных путей и дополнительно способны опосредовать АЗКЦ против рака молочной железы. Таким образом, в различных конкретных вариантах реализации настоящего изобретения антитела по настоящему изобретению включают трастузумаб, Герзуму, ABP 980 и/или пертузумаб.
Синтетический HER2 v1
[0135] В одном или более вариантах реализации синтетический белок HER2 представляет собой HER2v1 (SEQ ID NO: 1). Как было описано ранее, чтобы усилить эффективность комбинированной терапии, в трансгены, кодируемые рекомбинантным MVA, вводят мутации, чтобы минимизировать любое потенциальное взаимодействие и/или связывание между трансгеном и вводимыми антителами. Соответственно, чтобы повысить эффективность терапии, включающей совместное введение антитела к HER2, такого как трастузумаб и пертузумаб, создавали одну или более мутаций антигена HER2. В частности, мутации подвергали соответствующие сайты связывания антитела в HER2. Таким образом, в одном или более вариантах реализации синтетический белок HER2 содержит одну или более мутаций в следующих аминокислотных доменах: 579-625 (трастузумаб-связывающий домен), 267-337 (пертузумаб-связывающий домен), 274-288 (домен димеризации HER2), 721-987 (киназный домен) и 1139-1248 (домен фосфорилирования). В одном или более типовых вариантах реализации настоящего изобретения антиген HER2 содержит одну или более следующих мутаций: E580A, F595A, K615A, L317A, H318A, D277R, E280K, K753M, Y1023A. Мутации в антигене HER2v1 (на основе HER2 (NP_004439.2) проиллюстрированы ниже.

Аминокислотная последовательность HER2 v1. В основе приведенного выше синтетического HER лежит HER2 NP_004439.2. Мутированные аминокислоты выделены подчеркиванием и перечеркиванием. Аминокислоты 579-625 представляют сайт связывания Герцептина. Аминокислоты 267-337 представляют сайт связывания Перьеты. Аминокислоты 274-288 представляют остатки домена димеризации. Аминокислоты 721-987 представляют остатки киназного домена. Аминокислоты 1139-1248 представляют остатки в домене фосфорилирования. [SEQ ID NO: 1]
Синтетический HER2 v2
[0136] В одном или более вариантах реализации синтетический белок HER2 представляет собой HER2v2 (SEQ ID NO: 13). Как было описано ранее, чтобы усилить эффективность комбинированной терапии, в трансгены, кодируемые рекомбинантным MVA, вводят мутации, чтобы минимизировать любое потенциальное взаимодействие и/или связывание между трансгеном и вводимыми антителами. Соответственно, чтобы повысить эффективность терапии, включающей совместное введение антитела к HER2, такого как трастузумаб и пертузумаб, создавали одну или более мутаций антигена HER2. В частности, мутации подвергали соответствующие сайты связывания антитела в HER2. Таким образом, в одном или более вариантах реализации синтетический белок HER2 содержит одну или более мутаций в следующих аминокислотных доменах: 579-625 (трастузумаб-связывающий домен), 267-337 (пертузумаб-связывающий домен), 274-288 (домен димеризации HER2), 721-987 (киназный домен) и 1139-1248 (домен фосфорилирования). В одном или более типовых вариантах реализации настоящего изобретения антиген HER2 содержит одну или более следующих мутаций: E580A, F595A, K615A, L317A, H318A, D277R, E280K, K753M, Y1023A.
[0137] По меньшей мере в одном аспекте вышеуказанные мутации усиливают комбинированную терапию, так как их функция состоит в минимизации любого взаимодействия и/или нежелательного связывания антигена MVA-HER2 с антителами к HER2 трастузумабом и пертузумабом. Во взаимодействие трастузумаба с HER2 вовлечены 3 петли в околомембранной области HER2, образуемой аминокислотами 579-583 (петля 1), 592-595 (петля 2), а также 615-625 (петля 3) [6]. Смотрите, например, H. S. Cho, “Structure of the extracellular region of HER2 alone and in complex with the Herceptin Fab,” Nature, 2003. В этих петлях находится несколько ключевых остатков для связывания HER2-трастузумаб, в том числе E580, D582, P594, F595, K615, Q624S. Satyanarayanajois, “Design, Synthesis, and Docking Studies of Peptidomimetics based on HER2-Herceptin Binding Site with Potential Antiproliferative Activity Against Breast Cancer Cell lines,” Chem Biol Drug Des, 2009.
[0138] Соответственно, в одном варианте реализации антиген HER2 по настоящему изобретению содержит одну или более мутаций в остатках, которые влияют на связывание антигена HER2 с трастузумабом. Некоторые типовые остатки включают, но не ограничиваются этим, E580, D582, P594, F595, K615 и Q624. Таким образом, в более конкретном варианте реализации антиген HER2 по настоящему изобретению содержит одну или более мутаций в остатках, выбранных из группы, состоящей из E580, D582, P594, F595, K615, Q624 и их комбинации. В еще более конкретном варианте реализации антиген HER2 по настоящему изобретению содержит одну или более мутаций в остатках, выбранных из E580, F595 и K615. В другом конкретном варианте реализации одна или более мутаций в антигене HER2 включают замены Ala в E580, F595 и K615 (например, E580A, F595A и K615A).
[0139] В другом типовом варианте реализации антиген HER2 содержит одну или более мутаций в домене связывания пертузумаба. Пертузумаб связывается вблизи петли в домене димеризации (домене II) HER2, включая ключевые остатки H267, Y274, S310, L317, H318 и K333. Мутации на поверхности связывания сильно снижают связывание Перьеты с HER2. M. C. Franklin, “Insights into ErbB signaling from the structure of the ErbB2-pertuzumab complex,” Cancer Cell, 2004. Дополнительные аминокислотные остатки в этом связывающем домене потенциально участвуют во взаимодействии пертузумаб-HER2, включая F279, V308 и P337.
[0140] Соответственно, в одном варианте реализации антиген HER2 по настоящему изобретению содержит одну или более мутаций в остатках, которые влияют на связывание антигена HER2 с пертузумабом. В более конкретном варианте реализации антиген HER2 по настоящему изобретению содержит одну или более мутаций в остатках, выбранных из группы, состоящей из H267, F279, V308, S310, L317, H318, K333 и P337 и их комбинации. В другом конкретном варианте реализации одна или более мутаций в антигене HER2 включают замены Ala в H267, F279, V308, S310, L317, H318, K333 и P337 (например, H267A, F279A, V308A, S310A, L317A, H318A, K333A и P337A).
[0141] По меньшей мере в одном аспекте настоящего изобретения было сделано предположение, что если минимизировать димеризацию HER2, это минимизирует взаимодействие и связывание между кодируемым MVA HER2 и другими представителями семейства HER, такими как EGFR, HER3 или HER4, экспрессируемыми трансдуцированной MVA клеткой. Минимизация димеризации HER обеспечила бы исключительное преимущество, так как HER2 реализует свой онкогенный потенциал посредством внутриклеточной сигнализации, инициируемой димеризацией. Соответственно, в одном варианте реализации антиген HER2 по настоящему изобретению содержит одну или более мутаций в остатках, которые влияют на димеризацию HER2. Некоторые типовые остатки включают, но не ограничиваются этим, L317, H318, D277 и E280. Таким образом, в более конкретном варианте реализации антиген HER2 по настоящему изобретению содержит одну или более мутаций в остатках, выбранных из группы, состоящей из L317, H318, D277, E280 и их комбинаций. В более конкретном варианте реализации антиген HER2 по настоящему изобретению содержит одну или более мутаций в остатках, выбранных из D277, E280. В другом конкретном варианте реализации одна или более мутаций в антигене HER2 включают замену Arg в D277 (D277R) и замену Lys в E280 (E280K).
[0142] В дополнительных аспектах было сделано предположение, что если минимизировать активность тирозинкиназы, это минимизирует последующую активацию клеточных сигналов, которые могут индуцировать клеточную пролиферацию и ангиогенез. Соответственно, в одном варианте реализации антиген HER2 по настоящему изобретению содержит одну или более мутаций в остатках, которые влияют на активность тирозинкиназы HER2. Типовой остаток включает, но не ограничивается этим, K753. Таким образом, в более конкретном варианте реализации антиген HER2 по настоящему изобретению содержит мутацию в остатке K753. В более конкретном варианте реализации антиген HER2 по настоящему изобретению содержит замену Met в остатке K753 (K753M).
[0143] В дополнительных аспектах было сделано предположение, что если удалить потенциальные сайты фосфорилирования, это минимизирует последующую активацию клеточных сигналов, которые могут индуцировать клеточную пролиферацию и ангиогенез. Соответственно, в одном варианте реализации антиген HER2 по настоящему изобретению содержит одну или более мутаций в остатках, которые влияют на потенциальные сайты фосфорилирования в HER2. Некоторые типовые остатки включают, но не ограничиваются этим, аминокислоты от 1139 до 1248 и Y1023. Таким образом, в более конкретном варианте реализации антиген HER2 по настоящему изобретению содержит одну или более мутаций в остатках, выбранных из аминокислот от 1139 до 1248, Y1023 и их комбинации. В более конкретном варианте реализации антиген HER2 по настоящему изобретению содержит делецию аминокислот от 1139 до 1248 и/или замену Y1023 на Ala (Y1023A).
[0144] В одном предпочтительном варианте реализации антиген HER2 содержит одну или более мутаций в домене связывания пертузумаба, домене связывания трастузумаба, домене димеризации, киназном домене и/или домене фосфорилирования, находящихся в HER2. Типовые мутации антигена HER2 (на основе NP_004439.2) в ранее описанных доменах проиллюстрированы ниже как синтетический HER2v2.

Аминокислотная последовательность HER2_v2. (SEQ ID: NO 13) В основе приведенного выше синтетического HER_version2 лежит HER2 NP_004439.2. Мутированные аминокислоты выделены подчеркиванием и перечеркиванием. Аминокислоты 579-625 представляют сайт связывания трастузумаба. Аминокислоты 267-337 представляют сайт связывания пертузумаба. Аминокислоты 274-288 представляют остатки домена димеризации. Аминокислоты 721-987 представляют остатки киназного домена. Аминокислоты 1139-1248 представляют остатки в домене фосфорилирования.
[0145] В соответствии с определенными в данном документе преимуществами, в различных вариантах реализации настоящее изобретение включает синтетический антиген HER2, в котором мутированы одна или более аминокислот HER2 для предотвращения связывания антигена HER2 с антителом к HER2. В более предпочтительном варианте реализации синтетический антиген HER2 мутирован так, чтобы предотвратить связывание антитела, выбранного из пертузумаба, трастузумаба и адо-трастузумаб эмтанзина.
[0146] В других вариантах реализации синтетический антиген HER2 содержит одну или более мутаций для предотвращения внеклеточной димеризации, тирозинкиназной активности и/или фосфорилирования антигена HER2 (после экспрессии rMVA). В дополнительных конкретных вариантах реализации синтетический антиген HER2 содержит одну или более мутаций по меньшей мере в одной из 3 петель околомембранной области HER2.
[0147] В различных дополнительных вариантах реализации настоящее изобретение включает нуклеиновую кислоту, кодирующую антиген HER2, содержащий SEQ ID NO: 1. В дополнительных вариантах реализации настоящее изобретение включает нуклеиновую кислоту, кодирующую антиген HER2, имеющий по меньшей мере 90%, 95%, 97%, 98% или 99% идентичности с SEQ ID NO:1.
[0148] В одном варианте реализации настоящее изобретение включает нуклеиновую кислоту, содержащую SEQ ID NO:2, которая кодирует антиген HER2 с SEQ ID NO:1. В дополнительных вариантах реализации настоящее изобретение включает нуклеиновую кислоту, кодирующую антиген HER2, при этом нуклеиновая кислота имеет по меньшей мере 90%, 95%, 97%, 98% или 99% идентичности с SEQ ID NO:2.
[0149] В различных дополнительных вариантах реализации настоящее изобретение включает нуклеиновую кислоту, кодирующую антиген HER2, содержащий SEQ ID NO: 13. В дополнительных вариантах реализации настоящее изобретение включает нуклеиновую кислоту, кодирующую антиген HER2, имеющий по меньшей мере 90%, 95%, 97%, 98% или 99% идентичности с SEQ ID NO:13.
[0150] В одном варианте реализации настоящее изобретение включает нуклеиновую кислоту, содержащую SEQ ID NO:14, которая кодирует антиген HER2 с SEQ ID NO:13. В дополнительных вариантах реализации настоящее изобретение включает нуклеиновую кислоту, кодирующую антиген HER2, при этом нуклеиновая кислота имеет по меньшей мере 90%, 95%, 97%, 98% или 99% идентичности с SEQ ID NO:14.
Синтетические белки Brachyury
[0151] Как было проиллюстрировано ранее, добавление второго ассоциированного с заболеванием/опухолью антигена, кодируемого MVA, усиливало противоопухолевые ответ/активность комбинированной терапии. В соответствии с этим в различных вариантах реализации изобретения рекомбинантный MVA дополнительно кодирует антиген Brachyury (брахиурии).
[0152] Авторы изобретения определили, что одна или более модификаций антигенов Brachyury и/или нуклеиновых кислот, кодирующих антигены Brachyury, описанных в данном документе, повышают эффективность комбинированной терапии. В частности, одну или более мутаций вводили в домен сигнала ядерной локализации (СЯЛ), чтобы минимизировать и/или предупредить любую ядерную локализацию антигена Brachyury клеткой-хозяином.
[0153] Соответственно, в различных вариантах реализации синтетический полипептид Brachyury содержит одну или более мутаций для предотвращения ядерной локализации Brachyury. «Ядерную локализацию» можно определить как локализацию и/или перенос в ядро. Проведение анализа для определения, предотвращают ли одна или более мутаций ядерную локализацию антигена Brachyury, находится в компетенции специалиста в данной области техники. Такие методы анализа могут включать иммунофлуоресцентный анализ и иммунофлуоресцентную микроскопию.
[0154] В более конкретных вариантах реализации синтетический полипептид Brachyury содержит одну или более мутаций в домене СЯЛ. В более конкретном и предпочтительном варианте реализации в синтетическом полипептиде Brachyury удалены аминокислоты 286-293 антигена Brachyury (ссылка GenBank NP_003172.1), как показано ниже.

Аминокислотная последовательность типового модифицированного Brachyury. Были удалены остатки консервативного корового мотива RSSPYPSP в потенциальном СЯЛ Brachyury (показано перечеркиванием) [SEQ ID NO:3]
[0155] В более конкретных вариантах реализации настоящее изобретение включает нуклеиновую кислоту, кодирующую антиген Brachyury, выбранный из группы, состоящей из SEQ ID NO: 3, SEQ ID NO: 5 и SEQ ID NO:7. В предпочтительном аспекте различные варианты реализации настоящего изобретения включают нуклеиновую кислоту, кодирующую SEQ ID NO:3.
[0156] По меньшей мере в одном конкретном аспекте нуклеиновая кислота, кодируемая SEQ ID NO:3, обеспечивает исключительное преимущество, так как SEQ ID NO: 3 сконструирована так, чтобы предотвращать или минимизировать локализацию и/или перенос антигена Brachyury, кодируемого MVA, в ядро, в котором может существовать возможность нежелательной транскрипционной активности.
[0157] В соответствии с определенными преимуществами комбинированной терапии, в различных аспектах варианты реализации настоящего изобретения включают нуклеиновую кислоту, кодирующую антиген Brachyury, содержащий SEQ ID NO: 3. В дополнительных аспектах варианты реализации настоящего изобретения включают нуклеиновую кислоту, кодирующую антиген Brachyury, имеющий по меньшей мере 90%, 95%, 97%, 98% или 99% идентичности с SEQ ID NO:3.
[0158] В дополнительных аспектах варианты реализации настоящего изобретения включают нуклеиновую кислоту, содержащую SEQ ID NO:4, которая кодирует антиген Brachyury с SEQ ID NO:3. В дополнительных аспектах варианты реализации настоящего изобретения включают нуклеиновую кислоту, кодирующую антиген Brachyury, при этом нуклеиновая кислота имеет по меньшей мере 90%, 95%, 97%, 98% или 99% идентичности с SEQ ID NO:4.
CD40L
[0159] Как проиллюстрировано в настоящем описании, включение CD40L в качестве части фармацевтической комбинации и связанный с этим способ дополнительно усиливают снижение объема опухоли, продлевают выживаемость без прогрессирования и повышают уровень выживаемости, реализуемые посредством настоящего изобретения. Таким образом, в различных вариантах реализации фармацевтическая комбинация дополнительно включает введение CD40L онкологическому пациенту.
[0160] Хотя CD40 конститутивно экспрессируется во многих типах клеток, включая В-клетки, макрофаги и дендритные клетки, его лиганд CD40L экспрессируется преимущественно на активированных хелперных Т-клетках. Когнатное взаимодействие между дендритными клетками и хелперными Т-клетками в ранние моменты времени после инфицирования или иммунизации «дает лицензию» дендритным клеткам примировать ответы ЦТЛ. Лицензирование дендритных клеток приводит к повышению экспрессии костимулирующих молекул, повышению выживаемости и лучшей способности к перекрестной презентации. Этот процесс опосредован в основном за счет взаимодействия CD40/CD40L. При этом описаны различные конфигурации CD40L, от мембраносвязанной до растворимой (мономерной или тримерной), которые индуцируют разнообразные стимулы, индуцирующие или подавляющие активацию, пролиферацию и дифференцировку АПК.
[0161] Как проиллюстрировано результатами примера 19, кодируемый MVA CD40L представляет собой намного более безопасную альтернативу для онкологического пациента, так как CD40L, кодируемый MVA, характеризуется сниженной токсичностью по сравнению с растворимым агонистом CD40.
[0162] В одном или более предпочтительных вариантах реализации CD40L кодируется MVA по настоящему изобретению. В более предпочтительных вариантах реализации CD40L содержит нуклеиновую кислоту, кодирующую SEQ ID NO: 11. В более предпочтительных вариантах реализации CD40L содержит нуклеиновую кислоту, имеющую по меньшей мере 90%, 95%, 97%, 98% или 99% идентичности с SEQ ID NO:12. В наиболее предпочтительном варианте реализации CD40L содержит SEQ ID NO:12.
Типовые антитела
[0163] В различных вариантах реализации фармацевтическая комбинация и связанные с ней способы включают антитело, специфическое к антигену, который экспрессируется на клеточной мембране опухолевой клетки. В данной области техники известно, что при многих типах рака на мембране опухолевой клетки экспрессируются или сверхэкспрессируются один или более антигенов. Смотрите, например, Durig et al., 2002; Mocellin et al., 2013; Arteaga 2017; Fin 2017; Ginaldi et al., 1998. Методы анализа для определения того, экспрессируется или сверхэкспрессируется антиген на опухолевых клетках, хорошо известны в данной области техники (Id), как и способы получения антител к конкретному антигену.
[0164] В более конкретных вариантах реализации фармацевтическая комбинация и связанные с ней способы включают антитело, причем антитело является a) специфическим к антигену, который экспрессируется на клеточной мембране опухолевой клетки, и b) содержит Fc-домен. По меньшей мере в одном аспекте характеристики антитела (например, a) и b)) обеспечивают возможность связывания и взаимодействия антитела с эффекторной клеткой, такой как NK-клетка, макрофаг, базофил, нейтрофил, эозинофил, моноциты, тучные клетки и/или дендритные клетки, и обеспечивают возможность связывания антитела с опухолевым антигеном, который экспрессируется на опухолевой клетке. В предпочтительном варианте реализации антитело содержит Fc-домен. В дополнительном предпочтительном варианте реализации антитело способно связываться и взаимодействовать с NK-клеткой.
[0165] Некоторые типовые антитела к антигенам, экспрессируемым на опухолевых клетках, предусмотренные настоящим изобретением, включают, но не ограничиваются этим, анти-CD20 (например, ритуксимаб; офатумумаб; тозитумомаб), анти-CD52 (например, алемтузумаб Кампат®), анти-EGFR (например, цетуксимаб Эрбитукс®, панитумумаб), анти-CD2 (например, сиплизумаб), анти-CD37 (например, BI836826), анти-CD123 (например, JNJ-56022473), анти-CD30 (например, XmAb2513), анти-CD38 (например, даратумумаб Дарзалекс®), анти-PDL1 (например, авелумаб, атезолизумаб, дурвалумаб), анти-GD2 (например, 3F8, ch14.18, KW-2871, динутуксимаб), анти-CEA, анти-MUC1, анти-FLT3, анти-CD19, анти-CD40, анти-SLAMF7, анти-CCR4, анти-B7-H3, анти-ICAM1, анти-CSF1R, анти-CA125 (например ореговомаб), анти-FRα (например MOv18-IgG1, мирветуксимаб соравтанзин (IMGN853), MORAb-202), анти-мезотелин (например MORAb-009) и анти-HER2 (например, трастузумаб, Герзума, ABP 980 и/или пертузумаб).
[0166] В более предпочтительном варианте реализации антитело, включенное как часть настоящего изобретения, включает антитело, которое при введении пациенту связывается с соответствующим антигеном на опухолевой клетке и индуцирует антителозависимую клеточноопосредованную цитотоксичность (АЗКЦ). В еще более предпочтительном варианте реализации антитело включает антитело, которое одобрено или находится на стадии предварительного одобрения для лечения рака.
[0167] В еще более предпочтительных вариантах реализации антитело представляет собой анти-HER2 антитело. В наиболее предпочтительном варианте реализации антитело выбрано из пертузумаба, трастузумаба, Герзумы, ABP 980 и адо-трастузумаба эмтанзина.
[0168] В дополнительных вариантах реализации антитело содержит слияние одного или более антител и/или фрагментов антител. Типовые слитые антитела и/или фрагменты антител включают, но не ограничиваются этим, биспецифические, привлекающие клетки-киллеры антитела (BiKE) и триспецифические, привлекающие клетки-киллеры антитела (TriKE). Продемонстрированные Tay et al., (2016), BiKE и TriKE, как известно, эффективно управляют противоопухолевым действием NK-клеток и обеспечивают возможность опосредованной NK-клетками АЗКЦ. Смотрите Tay et al., (2016). Подразумевается, что 161533 TriKE и/или 1633 BiKE можно использовать в качестве антитела в настоящем изобретении. Дополнительно подразумевается, что антитела по настоящему изобретению можно реализовать как биспецифические, привлекающие клетки-киллеры антитела или BiTE. Смотрите, например, Huehls et al. Immunol Cell Biol. 2015 March, 93: 290-296.
Рекомбинантные поксвирусы
[0169] В одном или более аспектах настоящего изобретения нуклеотидные и белковые последовательности по настоящему изобретению могут быть включены в рекомбинантные поксвирусы.
[0170] В различных вариантах реализации настоящего изобретения рекомбинантный поксвирус предпочтительно представляет собой ортопоксвирус, такой как, без ограничения, вирус осповакцины, модифицированный вирус осповакцины Анкара (MVA), MVA-BN или производное MVA-BN.
[0171] Примеры штаммов вируса осповакцины включают штаммы Temple of Heaven, Copenhagen, Paris, Budapest, Dairen, Gam, MRIVP, Per, Tashkent, TBK, Tom, Bern, Patwadangar, BIEM, B-15, Lister, EM-63, New York City Board of Health, Elstree, Ikeda и WR. Предпочтительным штаммом вируса осповакцины (VV - от англ. «vaccinia virus») является штамм Wyeth (DRYVAX) (патент США 7410644).
Рекомбинантный MVA
[0172] В более предпочтительных вариантах реализации настоящего изобретения один или более описанных в данном документе белков или нуклеотидов включены в рекомбинантный MVA. Как описано и проиллюстрировано в настоящем описании, внутривенное введение рекомбинантных MVA по настоящему изобретению индуцирует в различных аспектах усиленный иммунный ответ у онкологических пациентов. Таким образом, в одном или более предпочтительных вариантах реализации изобретение включает рекомбинантный MVA, содержащий одну или более нуклеиновых кислот, кодирующих HER2, Brachyury и/или CD40L, описанные в данном документе. В более предпочтительных вариантах реализации рекомбинантный MVA содержит одну или более нуклеиновых кислот, кодирующих синтетический антиген HER2 и синтетический антиген Brachyury, описанные в данном документе. В другом более предпочтительном варианте реализации рекомбинантный MVA содержит одну или более нуклеиновых кислот, кодирующих синтетический антиген HER2 и синтетический антиген Brachyury, описанные в данном документе, а также CD40L. В другом более предпочтительном варианте реализации рекомбинантный MVA содержит одну или более нуклеиновых кислот, кодирующих SEQ ID NO:1 или SEQ ID NO: 13 (Her2) и SEQ ID NO: 3 (Brachyury). В другом предпочтительном варианте реализации рекомбинантный MVA содержит одну или более нуклеиновых кислот, кодирующих SEQ ID NO:1 или SEQ ID NO: 13, SEQ ID NO: 3 и CD40L. В более предпочтительном варианте реализации рекомбинантный MVA содержит одну или более нуклеиновых кислот, кодирующих SEQ ID NO:1, SEQ ID NO: 3, SEQ ID NO: 11 и/или SEQ ID NO: 13. В наиболее предпочтительном варианте реализации рекомбинантный MVA содержит одну или более нуклеиновых кислот, кодирующих SEQ ID NO:13, SEQ ID NO:3 и SEQ ID NO:11.
[0173] В дополнительных вариантах реализации рекомбинантный MVA содержит одну или более нуклеиновых кислот, выбранных из группы, состоящей из SEQ ID NO:2, SEQ ID NO: 4 и/или SEQ ID NO: 14. В другом более предпочтительном варианте рекомбинантный MVA содержит одну или более нуклеиновых кислот, выбранных из группы, состоящей из SEQ ID NO:2, SEQ ID NO:4, и CD40L. В другом предпочтительном варианте реализации рекомбинантный MVA содержит одну или более нуклеиновых кислот, выбранных из группы, состоящей из SEQ ID NO:2, SEQ ID NO: 4 и SEQ ID NO: 12. В более предпочтительном варианте реализации рекомбинантный MVA содержит SEQ ID NO: 2, SEQ ID NO: 4 и SEQ ID NO: 12. В наиболее предпочтительном варианте реализации рекомбинантный MVA содержит SEQ ID NO: 14, SEQ ID NO: 4 и SEQ ID NO:12.
[0174] Примерами штаммов вируса MVA, которые можно использовать при практической реализации настоящего изобретения и которые были депонированы в соответствии с требованиями Будапештского договора, являются штаммы MVA 572, депонированный в Европейской коллекции клеточных культур животных (ECACC), Vaccine Research and Production Laboratory, Public Health Laboratory Service, Centre for Applied Microbiology and Research, Porton Down, Salisbury, Wiltshire SP4 0JG, United Kingdom, под номером депонирования ECACC 94012707 27 января 1994 г., и MVA 575, депонированный в ECACC 00120707 7 декабря 2000 г., MVA-BN, депонированный 30 августа 2000 г. в Европейской коллекции клеточных культур (ECACC) под номером V00083008, и их производные, а также дополнительные типовые штаммы.
[0175] «Производные» MVA-BN относятся к вирусам, демонстрирующим практически такие же характеристики репликации, что и описанный в данном документе MVA-BN, но демонстрирующие различия в одной или более частях своих геномов. MVA-BN, а также его производные, являются некомпетентными по репликации, что означает неспособность к репродуктивной репликации in vivo и in vitro. В частности, in vitro, MVA-BN или его производные были описаны как способные к репродуктивной репликации в куриных эмбриональных фибробластах (CEF), но не способные к репродуктивной репликации в линии клеток человеческих кератиноцитов HaCat (Boukamp et al (1988), J. Cell Biol. 106:761-771), линии клеток остеосаркомы костей человека 143B (ECACC, депонирование № 91112502), линии клеток эмбриональной почки человека 293 (ECACC, депонирование № 85120602) и линии клеток аденокарциномы шейки матки человека HeLa (ATCC, депонирование № CCL-2). Кроме того, MVA-BN или его производные имеют показатель амплификации вируса, по меньшей мере в два раза меньший, более предпочтительно в три раза меньший, чем MVA-575 в клетках Hela и линиях клеток HaCaT. Исследования и анализ этих свойств MVA-BN и его производных описан в WO 02/42480 (патентная заявка США № 2003/0206926) и WO 03/048184 (патентная заявка США № 2006/0159699).
[0176] Термин «не способный к репродуктивной репликации» или «отсутствие способности к репродуктивной репликации» в человеческих линиях клеток in vitro, как описано в предыдущих параграфах, описан, например, в WO 02/42480, в которой также описано, как получать MVA, имеющий необходимые свойства, как указано выше. Этот термин относится к вирусу, который имеет показатель амплификации вируса in vitro через 4 суток после инфицирования менее 1 по определению в анализе, описанном в WO 02/42480 или в патенте США № 6761893.
[0177] Термин «неспособность к репродуктивной репликации» относится к вирусу, который имеет показатель амплификации вируса в человеческих линиях клеток in vitro, как описано в предыдущих параграфах, через 4 суток после инфицирования менее 1. Методы анализа, описанные в WO 02/42480 или в патенте США № 6761893, применимы для определения показателя амплификации вируса.
[0178] Амплификацию или репликацию вируса в человеческих линиях клеток in vitro, как описано в предыдущих параграфах, обычно выражают как соотношение вируса, полученного из инфицированной клетки (выход), к количеству, изначально использованному для инфицирования клетки на первом месте (ввод), и называют «показателем амплификации». Показатель амплификации «1» определяет статус амплификации, при котором количество вируса, полученного из инфицированных клеток, является таким же, как и количество, изначально использованное для инфицирования клеток, что означает, что инфицированные клетки восприимчивы к вирусной инфекции и репродукции. В противоположность этому, показатель менее 1, т. е. снижение выходного по сравнению с вводным уровнем, указывает на отсутствие репродуктивной репликации и, следовательно, ослабление вируса.
[0179] В другом варианте реализации рекомбинантный поксвирус, включая синтетические нуклеотиды и белки по настоящему изобретению, можно реализовать в авипоксвирусе, таком как, без ограничения, поксвирус кур.
[0180] Термин «авипоксвирус» относится к любому авипоксвирусу, такому как поксвирус кур, поксвирус канареек, поксвирус юнко, поксвирус майн, поксвирус голубей, поксвирус попугаев, поксвирус перепелов, поксвирус павлинов, поксвирус пингвинов, поксвирус воробьев, поксвирус скворцов и поксвирус индеек. Предпочтительные авипоксвирусы включают поксвирус канареек и поксвирус кур.
[0181] Примером поксвируса канареек является штамм Rentschler. Очищенный методом бляшек штамм поксвируса канареек, названный ALVAC (патент США № 5766598), был депонирован в соответствии с Будапештским договором в Американской коллекции типовых культур (ATCC) под номером доступа VR-2547. Другой штамм поксвируса канареек представляет собой коммерческий штамм для вакцины на основе поксвируса канареек, обозначенный LF2 CEP 524 24 10 75, доступный от Institute Merieux, Inc.
[0182] Примерами поксвируса кур являются штаммы FP-1, FP-5, TROVAC (патент США № 5766598), POXVAC-TC (патент США 7410644), TBC-FPV (Therion Biologics- FPV), FP-1 представляет собой штамм Duvette, модифицированный для применения в качестве вакцины для однодневных цыплят. Этот штамм представляет собой коммерческий штамм для вакцины на основе поксвируса кур, обозначенный O DCEP 25/CEP67/2309, октябрь 1980 г., и доступный от Institute Merieux, Inc. FP-5 представляет собой коммерческий штамм для вакцины на основе поксвируса кур куриного эмбрионального происхождения, доступный от American Scientific Laboratories (Division of Schering Corp.) Madison, Wis., United States Veterinary License No. 165, serial No. 30321.
Экспрессионные кассеты/регуляторные последовательности
[0183] В различных аспектах одну или более описанных в данном документе нуклеиновых кислот реализуют в одной или более экспрессионных кассетах, в которых одна или более нуклеиновых кислот функционально связаны с последовательностями регуляции экспрессии. «Функционально связанный» означает, что описанные компоненты находятся во взаимосвязи, позволяющей им функционировать предполагаемым образом, например, промотор для транскрипции подлежащей экспрессии нуклеиновой кислоты. Последовательность регуляции экспрессии, функционально связанная с кодирующей последовательностью, соединена так, чтобы обеспечить экспрессию кодирующей последовательности в условиях, совместимых с последовательностью регуляции экспрессии. Последовательности регуляции экспрессии включают, но не ограничиваются этим, соответствующие промоторы, энхансеры, терминаторы транскрипции, стартовый кодон в начале кодирующей белок открытой рамки считывания, сигналы сплайсинга для интронов и находящиеся в рамке считывания стоп-кодоны. Подходящие промоторы включают, но не ограничиваются этим, ранний промотор SV40, промотор RSV, ретровирусный ДКП, аденовирусный главный поздний промотор, немедленно-ранний промотор I CMV человека и различные поксвирусные промоторы, включая, но не ограничиваясь, следующие промоторы вируса осповакцины или полученные из MVA и полученные из FPV: промотор 30K, промотор I3, промотор PrS, промотор PrS5E, промотор Pr7.5K, промотор PrHyb, длинный промотор Pr13.5, промотор 40K, промотор MVA-40K, промотор FPV 40K, промотор 30k, промотор PrSynIIm, промотор PrLE1 и промотор PR1238. Дополнительные промоторы описаны в WO 2010/060632, WO 2010/102822, WO 2013/189611,WO 2014/063832 и WO 2017/021776, которые в полном объеме включены в данный документ посредством ссылки.
[0184] Дополнительные последовательности регуляции экспрессии включают, но не ограничиваются этим, лидерные последовательности, кодоны терминации, сигналы полиаденилирования и любые другие последовательности, необходимые для правильной транскрипции и последующей трансляции последовательности нуклеиновой кислоты, кодирующей необходимый рекомбинантный белок (например, HER2, Brachyury и/или CD40L) в необходимой хозяйской системе. Поксвирусный вектор также может содержать дополнительные элементы, необходимые для переноса и последующей репликации экспрессионного вектора, содержащего последовательность нуклеиновой кислоты, в необходимой хозяйской системе. Специалисту в данной области техники дополнительно понятно, что такие векторы нетрудно сконструировать, используя традиционные способы (Ausubel et al., (1987) в “Current Protocols in Molecular Biology,” John Wiley and Sons, New York, N.Y.), или же они являются коммерчески доступными.
[0185] В определенных вариантах реализации один или более рекомбинантных MVA по настоящему изобретению содержит один или более цитокинов, таких как IL-2, IL-6, IL-12, IL-15, IL-7, IL-21 RANTES, GM-CSF, TNF-α или IFN-γ, один или более факторов роста, таких как GM-CSF или G-CSF, одну или более костимулирующих молекул, таких как ICAM-1, LFA-3, CD72, B7-1, B7-2 или другие родственные B7 молекулы; одну или более молекул, таких как CD70, OX-40L или 4-1 BBL, или комбинации этих молекул, которые можно использовать в качестве биологических адъювантов (смотрите, например, Salgaller et al., 1998, J. Surg. Oncol. 68(2):122-38; Lotze et al., 2000, Cancer J. Sci. Am. 6(Suppl 1):S61-6; Cao et al., 1998, Stem Cells 16(Suppl 1):251-60; Kuiper et al., 2000, Adv. Exp. Med. Biol. 465:381-90). Эти молекулы можно вводить хозяину системно (или местно). В нескольких примерах вводят IL-2, RANTES, GM-CSF, TNF-α, IFN-γ, G-CSF, LFA-3, CD72, B7-1, B7-2, B7-1 B7-2, CD70, OX-40L, 4-1 BBL и ICAM-1.
Способы и схемы дозирования для введения фармацевтической комбинации
[0186] В дополнительных аспектах в настоящем изобретении предложены одна или более схем введения фармацевтической комбинации и/или применения способов по настоящему изобретению. По меньшей мере в одном аспекте схемы по настоящему изобретению повышают эффективность фармацевтической комбинации и/или терапии со снижением объема опухоли и повышением уровня выживаемости онкологического пациента.
[0187] Таким образом, в одном варианте реализации предложены фармацевтическая комбинация и/или способ для снижения размера опухоли и/или повышения выживаемости онкологического пациента, включающие введение онкологическому пациенту фармацевтической комбинации по настоящему изобретению, причем рекомбинантный MVA вводят одновременно или после введения антитела.
[0188] В одном конкретном типовом варианте реализации предложены фармацевтическая комбинация и/или способ для снижения размера опухоли и/или повышения выживаемости онкологического пациента, включающие a) введение онкологическому пациенту антитела, содержащего Fc-домен и специфического к антигену, который экспрессируется на клеточной мембране опухолевой клетки; и b) внутривенное введение онкологическому пациенту модифицированного вируса осповакцины Анкара (MVA), содержащего первую нуклеиновую кислоту, кодирующую первый гетерологичный опухолеассоциированный антиген (ОАА), который при внутривенном введении индуцирует у онкологического пациента как усиленный ответ естественных клеток-киллеров (NK), так и усиленный ответ цитотоксических Т-клеток; причем b) вводят одновременно или после a).
[0189] В нескольких конкретных вариантах реализации рекомбинантный MVA можно вводить одновременно с антителом. В других конкретных вариантах реализации рекомбинантный MVA вводят после или вслед за введением антитела. В различных вариантах реализации рекомбинантный MVA вводят в пределах от 1 до 6 суток после антитела. В более предпочтительных вариантах реализации рекомбинантный MVA вводят в пределах от 0 до 5 суток, от 0 до 4 суток, от 0 до 3 суток или 0-2 суток после введения антитела. В наиболее предпочтительном варианте реализации рекомбинантный MVA вводят через 0-3 суток после введения антитела.
[0190] В различных дополнительных вариантах реализации рекомбинантный MVA вводят в пределах от 1 до 6 суток после антитела. В более предпочтительных вариантах реализации рекомбинантный MVA вводят в пределах от 1 до 5 суток, от 1 до 4 суток, от 1 до 3 суток или 1-2 суток после введения антитела. В наиболее предпочтительном варианте реализации рекомбинантный MVA вводят через 1-3 суток после введения антитела.
[0191] В одном преимущественном аспекте настоящего изобретения введение рекомбинантного MVA одновременно или после антитела обеспечивает возможность для вводимого антитела связывать опухолевые клетки одновременно или до усиления ответа NK-клеток в результате введения рекомбинантного MVA. Соответственно, во время типового первого этапа вводят антитело, что приводит к связыванию антитела с антигеном на поверхности одной или более опухолевых клеток. Во время типового второго этапа внутривенно вводят рекомбинантный MVA, который, как описано в данном документе, усиливает и/или повышает как врожденный иммунный ответ субъекта (например, ответ NK-клеток), так и ответ Т-клеток. Усиленный врожденный иммунный ответ приводит к агрессивному нацеливанию и уничтожению опухолевых клеток, имеющих связанное антитело.
[0192] В другом преимущественном аспекте схемы по настоящему изобретению разработаны для эффективной атаки опухоли со стороны как врожденного, так и адаптивного иммунитета субъекта. В одном типовом аспекте фармацевтическая комбинация разработана для внутривенного введения рекомбинантного MVA одновременно или после введения антитела, при этом рекомбинантный MVA индуцирует усиленный ответ NK-клеток и врожденный иммунный ответ, которые атакуют и уничтожают опухолевые клетки, имеющие связанное антитело. Во время периода, когда врожденный иммунный ответ уничтожает покрытые антителами опухолевые клетки, рекомбинантный MVA также индуцирует специфический ответ T-клеток (включая как CD8, так и CD4 T-клетки) у пациента. Описанная схема разработана так, чтобы когда врожденный иммунный ответ, например, NK-клетки, природным образом снижается, усиленный ответ специфических CD8/CD4 T-клеток уничтожал опухолевые клетки. Разработанная схема обеспечивает исключительное преимущество, так как усиленный ответ специфических CD8/CD4 T-клеток может уничтожать те опухолевые клетки, которые могли потенциально уклониться от врожденного и/или неспецифического иммунного ответа пациента.
[0193] В других аспектах фармацевтическую комбинацию по настоящему изобретению вводят как часть гомологичной и/или гетерологичной прайм-буст схемы. Как проиллюстрировано на Фиг. 8-13, гомологичная и/или гетерологичная прайм-буст схема продлевает и повторно активирует усиленные ответы NK-клеток, а также повышает специфические ответы CD8 и CD4 T-клеток субъекта. Таким образом, в одном или более вариантах реализации предложены фармацевтическая комбинация и/или способ для снижения размера опухоли и/или повышения выживаемости онкологического пациента, включающие введение онкологическому пациенту фармацевтической комбинации по настоящему изобретению, причем фармацевтическую комбинацию вводят как часть гомологичной или гетерологичной прайм-буст схемы. В более предпочтительном аспекте прайм-буст схемы рекомбинантный MVA вводят внутривенно одновременно или после введения антитела.
Создание рекомбинантных вирусов MVA, содержащих трансгены
[0194] Предложенные в данном документе рекомбинантные вирусы MVA можно создавать обычными способами, известными в данной области техники. Способы получения рекомбинантных поксвирусов или вставки экзогенных кодирующих последовательностей в поксвирусный геном хорошо известны специалисту в данной области техники. Например, способы для осуществления стандартных методик молекулярной биологии, таких как клонирование ДНК, выделение ДНК и РНК, вестерн-блот-анализ, методик амплификации ОТ-ПЦР и ПЦР, описаны в Molecular Cloning, A laboratory Manual (2nd Ed.) [J. Samb rook et al., Cold Spring Harbor Laboratory Press (1989)], а способы для работы и манипуляций с вирусами описаны в Virology Methods Manual [B.W.J. Mahy et al. (eds.), Academic Press (1996)]. Аналогично, методики и практические наработки для работы, манипуляций и генетического конструирования MVA описаны в Molecular Virology: A Practical Approach [A.J. Davison & R.M. Elliott (Eds.), The Practical Approach Series, IRL Press at Oxford University Press, Oxford, UK (1993) (смотрите, например, Chapter 9: Expression of genes by Vaccinia virus vectors)] и Current Protocols in Molecular Biology [John Wiley & Son, Inc. (1998) (смотрите, например, Chapter 16, Section IV: Expression of proteins in mammalian cells using vaccinia viral vector)].
[0195] Для создания различных рекомбинантных вирусов MVA, описанных в данном документе, можно применять разные способы. Последовательность ДНК, подлежащую вставке в вирус, можно поместить в плазмидную конструкцию на основе E. coli, в которую была вставлена ДНК, гомологичная участку ДНК поксвируса. В ином случае последовательность ДНК, подлежащую вставке, можно лигировать к промотору. Связку промотор-ген можно размещать в плазмидной конструкции так, чтобы связка промотор-ген фланкировалась с обоих концов ДНК, гомологичной последовательности ДНК, фланкирующей область поксвирусной ДНК, содержащей несущественный локус. Полученную в результате плазмидную конструкцию можно амплифицировать путем размножения в бактериях E. coli и выделять. Выделенную плазмиду, содержащую генную последовательность ДНК, подлежащую вставке, можно переносить в клеточную культуру, например, куриных эмбриональных фибробластов (CEF), и в то же время инфицировать культуру вирусом MVA. Рекомбинация между гомологичной вирусной ДНК MVA в плазмиде и вирусном геноме, соответственно, может привести к созданию поксвируса, модифицированного присутствием чужеродных последовательностей ДНК.
[0196] В соответствии с предпочтительным вариантом реализации клетки из подходящей клеточной культуры, например, клетки CEF, можно инфицировать вирусом MVA. После этого инфицированные клетки можно трансфицировать первым плазмидным вектором, содержащим чужеродный или гетерологичный ген или гены, такие как одна или более нуклеиновых кислот, предложенных в настоящем изобретении; предпочтительно под транскрипционным управлением поксвирусного элемента регуляции экспрессии. Как объяснялось выше, плазмидный вектор также содержит последовательности, способные управлять вставкой экзогенной последовательности в выбранный участок вирусного генома MVA. Необязательно, плазмидный вектор также содержит кассету, содержащую маркерный и/или селективный ген, функционально связанный с поксвирусным промотором. Подходящими маркерными или селективными генами являются, например, гены, кодирующие зеленый флуоресцентный белок, β-галактозидазу, неомицин-фосфорибозилтрансферазу или другие маркеры. Использование кассет селективных маркеров упрощает идентификацию и выделение созданного рекомбинантного поксвируса. При этом рекомбинантный поксвирус также можно идентифицировать с помощью ПЦР-технологии. После этого дополнительные клетки можно инфицировать рекомбинантным поксвирусом, полученным как описано выше, и трансфицировать вторым вектором, содержащим второй чужеродный или гетерологичный ген или гены. В случае, если этот ген необходимо внести в другой сайт вставки поксвирусного генома, второй вектор также отличается в гомологичных с поксвирусом последовательностях, управляющих интеграцией второго чужеродного гена или генов в геном поксвируса. После того, как произошла гомологичная рекомбинация, рекомбинантный вирус, содержащий два или более чужеродных или гетерологичных генов, можно выделять. Для внесения дополнительных чужеродных генов в рекомбинантный вирус этапы инфицирования и трансфекции можно повторять, используя рекомбинантный вирус, выделенный на предыдущих этапах, для инфицирования и используя дополнительный вектор, содержащий дополнительный чужеродный ген или гены для трансфекции.
[0197] В альтернативном варианте этапы инфицирования и трансфекции, описанные выше, являются взаимозаменяемыми, т. е. подходящую клетку можно сначала трансфицировать плазмидным вектором, содержащим чужеродный ген, а затем инфицировать поксвирусом. В качестве дополнительного альтернативного варианта также возможно вносить каждый чужеродный ген в разные вирусы, совместно инфицировать клетку всеми полученными рекомбинантными вирусами и проводить скрининг в отношении рекомбинанта, содержащего все чужеродные гены. Третьим альтернативным вариантом является лигирование генома ДНК и чужеродных последовательностей in vitro и восстановление рекомбинированного генома ДНК вируса осповакцины с помощью хелперного вируса. Четвертым альтернативным вариантом является гомологичная рекомбинация в E.coli или другом виде бактерий между геномом вируса MVA, клонированным в виде бактериальной искусственной хромосомы (БИХ) и линейной чужеродной последовательности, фланкируемой последовательностями ДНК, гомологичными последовательностям, фланкирующим необходимый сайт интеграции в геном вируса MVA.
[0198] Одну или более нуклеиновых кислот по настоящему изобретению можно вставлять в подходящий участок вируса MVA или вирусного вектора MVA. Подходящими участками вируса MVA являются несущественные участки генома MVA. Несущественными участками геном MVA могут быть межгенные области или известные делеционные сайты 1-6 генома MVA. В альтернативном или дополнительном варианте несущественными участками рекомбинантного MVA может быть кодирующая область генома MVA, которая не является важной для вирусного роста. При этом сайты вставки не ограничены этими предпочтительными сайтами вставки в геноме MVA, так как в объем настоящего изобретения входит то, что нуклеиновые кислоты по настоящему изобретению (например, HER2, Brachyury и CD40L) и прилагаемые к ним промоторы, описанные в данном документе, можно вставлять в любое место вирусного генома при условии возможности получения рекомбинантов, которые можно амплифицировать и размножать по меньшей мере в одной клеточной культуральной системе, такой как куриные эмбриональные фибробласты (клетки CEF).
[0199] Предпочтительно нуклеиновые кислоты по настоящему изобретению можно вставлять в одну или более межгенных областей (МГО) вируса MVA. Термин «межгенная область» относиться преимущественно к участкам вирусного генома, расположенным между двумя соседними открытыми рамками считывания (ОРС) генома вируса MVA, предпочтительно между двумя существенными ОРС генома вируса MVA. В случае MVA в определенных вариантах реализации ОРС выбрана из ОРС 07/08, ОРС 44/45, ОРС 64/65, ОРС 88/89, ОРС 136/137 и ОРС 148/149.
[0200] В случае вируса MVA нуклеотидные последовательности можно, в дополнительном или альтернативном варианте, вставлять в один или более известных делеционных сайтов, т. е. делеционные сайты I, II, III, IV, V или VI генома MVA. Термин «известный делеционный сайт» относится к тем участками генома MVA, которые были удалены посредством непрерывного пассирования на клетках CEF, характеризуемых на 20 пассаже из 516, по отношению к геному родительского вируса, из которого получен MVA, в частности, родительского вируса осповакцины Анкара, культивируемого на хориоаллантоисе (CVA), например, как описано в Meisinger-Henschel et al. (2007), Journal of General Virology 88:3249-3259.
Вакцины
[0201] В определенных вариантах реализации рекомбинантный MVA по настоящему изобретению можно получить в виде части вакцины. Для приготовления вакцин вирус MVA можно конвертировать в физиологически приемлемую форму. В определенных вариантах реализации такое приготовление основано на опыте приготовления вакцин на основе поксвирусов, используемых для вакцинации против оспы, как описано, например, в Stickl, H. et al., Dtsch. med. Wschr. 99, 2386-2392 (1974).
[0202] Типовой способ приготовления приведен ниже. Очищенный вирус хранят при -80°C с титром 5×108 ТКИД50/мл в готовой смеси 10 мМ Трис, 140 мМ NaCl, pH 7,4. Для приготовления порций вакцины, например, 1×108-1×109 частиц вируса можно лиофилизировать в фосфатно-солевом буфере (ФСБ) в присутствии 2% пептона и 1% человеческого альбумина в ампуле, предпочтительно стеклянной ампуле. В альтернативном варианте порции вакцины можно готовить поэтапной лиофилизацией вируса в лекарственной форме. В определенных вариантах реализации лекарственная форма содержит дополнительные добавки, такие как маннит, декстран, сахар, глицин, лактоза, поливинилпирролидон, или другие добавки, такие как, включая, но не ограничиваясь этим, антиоксиданты или инертный газ, стабилизаторы или рекомбинантные белки (например, человеческий сывороточный альбумин), подходящие для in vivo введения. Затем ампулу запечатывают, и ее можно хранить при подходящей температуре, например, от 4°C до комнатной температуры, в течение нескольких месяцев. При этом, пока не существует потребности, ампулу хранят предпочтительно при температурах ниже -20°C, наиболее предпочтительно при около -80°C.
[0203] В различных вариантах реализации, включающих вакцинацию или терапию, лиофилизат растворяют в 0,1-0,5 мл водного раствора, преимущественно физиологического раствора или Трис-буфера, например, 10 мМ Трис, 140 мМ NaCl, pH 7,7. Подразумевается, что рекомбинантный MVA, вакцину или фармацевтическую композицию по настоящему описанию можно готовить в растворе в диапазоне концентраций от 104 до 1010 ТКИД50/мл, от 105 до 5×108 ТКИД50/мл, от 106 до 108 ТКИД50/мл или от 107 до 108 ТКИД50/мл. Предпочтительная доза для людей содержит от 106 до 1010 ТКИД50, включая дозу, составляющую 106 ТКИД50, 107 ТКИД50, 108 ТКИД50, 5×108 ТКИД50, 109 ТКИД50, 5×109 ТКИД50 или 1010 ТКИД50. Оптимизация дозы и количества введений входит в компетенцию и умения специалиста в данной области техники.
[0204] В одном или более предпочтительных вариантах реализации, приведенных в данном документе, рекомбинантный MVA внутривенно вводят онкологическому пациенту.
[0205] В дополнительных вариантах реализации антитело можно вводить системно или местно, т.е. посредством внутрибрюшинного, парентерального, подкожного, внутривенного, внутримышечного, интраназального, интрадермального или любого другого пути введения, известного специалисту в данной области техники.
Наборы, композиции и способы применения
[0206] В различных вариантах реализации это изобретение включает наборы, фармацевтические комбинации, фармацевтические композиции и/или иммуногенные комбинации, содержащие a) рекомбинантный MVA, который содержит нуклеиновые кислоты, описанные в данном документе, и b) одно или более антител, описанных в данном документе.
[0207] Подразумевается, что набор и/или композиция могут содержать один или несколько контейнеров или флаконов рекомбинантного поксвируса по настоящему изобретению, один или более контейнеров или флаконов антитела по настоящему изобретению вместе с инструкциями по введению рекомбинантного MVA и антитела. Подразумевается, что в более конкретном варианте реализации набор может содержать инструкции по введению рекомбинантного MVA и антитела в виде первого примирующего введения, а затем одного или более бустерных введений рекомбинантного MVA и антитела.
[0208] Предложенные в данном документе наборы и/или композиции могут в общем случае содержать один или более фармацевтически приемлемых и/или одобренных носителей, добавок, антибиотиков, консервантов, адъювантов, разбавителей и/или стабилизаторов. Такими вспомогательными веществами могут быть вода, солевой раствор, глицерин, этанол, смачивающие или эмульгирующие агенты, pH-буферные вещества и т.п. Подходящие носители, как правило, представляют собой большие, медленно метаболизируемые молекулы, такие как белки, полисахариды, полимолочные кислоты, полигликолевые кислоты, полимерные аминокислоты, аминокислотные сополимеры, липидные агрегаты и т. п.
ОПРЕДЕЛЕННЫЕ ТИПОВЫЕ ВАРИАНТЫ РЕАЛИЗАЦИИ
[0209] Вариант реализации 1 представляет собой способ снижения размера опухоли и/или повышения выживаемости у онкологического пациента, включающий a) внутривенное введение онкологическому пациенту рекомбинантного модифицированного вируса осповакцины Анкара (MVA), содержащего первую нуклеиновую кислоту, кодирующую первый гетерологичный опухолеассоциированный антиген (ОАА), который при внутривенном введении индуцирует как усиленный ответ естественных клеток-киллеров (NK), так и усиленный ответ цитотоксических Т-клеток по сравнению с ответом NK-клеток и ответом Т-клеток, индуцированным невнутривенным введением рекомбинантного MVA, содержащего первую нуклеиновую кислоту, кодирующую первый гетерологичный опухолеассоциированный антиген; и b) введение онкологическому пациенту антитела, содержащего Fc-домен и являющегося специфическим к антигену, который экспрессируется или сверхэкспрессируется на клеточной мембране опухолевой клетки; причем введение a) и b) онкологическому пациенту снижает размер опухоли у онкологического пациента и/или повышает уровень выживаемости онкологического пациента по сравнению с невнутривенным введением a) или введением b) отдельно.
[0210] Вариант реализации 2 представляет собой способ снижения размера опухоли и/или повышения выживаемости у онкологического пациента, включающий a) введение онкологическому пациенту антитела, содержащего Fc-домен и являющегося специфическим к антигену, который экспрессируется на клеточной мембране опухолевой клетки; и b) внутривенное введение онкологическому пациенту рекомбинантного модифицированного вируса осповакцины Анкара (MVA), содержащего первую нуклеиновую кислоту, кодирующую первый гетерологичный опухолеассоциированный антиген (ОАА), который при внутривенном введении индуцирует как усиленный ответ естественных клеток-киллеров (NK), так и усиленный ответ цитотоксических Т-клеток по сравнению с ответом NK-клеток и ответом Т-клеток, индуцированным невнутривенным введением рекомбинантного MVA, содержащего первую нуклеиновую кислоту, кодирующую первый гетерологичный опухолеассоциированный антиген; причем введение a) и b) онкологическому пациенту снижает размер опухоли у онкологического пациента и/или повышает уровень выживаемости онкологического пациента по сравнению с невнутривенным введением a) или введением b) отдельно.
[0211] Вариант реализации 3 представляет собой способ снижения размера опухоли и/или повышения выживаемости у онкологического пациента, включающий a) введение онкологическому пациенту антитела, содержащего Fc-домен и являющегося специфическим к антигену, который экспрессируется на внешней поверхности клеточной мембраны опухолевой клетки, которое при введении индуцирует АЗКЦ у онкологического пациента; и b) внутривенное введение онкологическому пациенту рекомбинантного модифицированного вируса осповакцины Анкара (MVA), содержащего первую нуклеиновую кислоту, кодирующую первый гетерологичный опухолеассоциированный антиген (ОАА), который при внутривенном введении индуцирует как усиленный ответ естественных клеток-киллеров (NK), так и усиленный ответ Т-клеток по сравнению с ответом NK-клеток и ответом Т-клеток, индуцированным невнутривенным введением рекомбинантного MVA, содержащего первую нуклеиновую кислоту, кодирующую первый гетерологичный опухолеассоциированный антиген; причем введение a) и b) онкологическому пациенту снижает размер опухоли у онкологического пациента и/или повышает уровень выживаемости онкологического пациента по сравнению с невнутривенным введением a) или введением b) отдельно.
[0212] Вариант реализации 4 представляет собой способ по любому из вариантов реализации 1-3, отличающийся тем, что антитело является специфическим к антигену, который сверхэкспрессируется на клеточной мембране опухолевой клетки.
[0213] Вариант реализации 5 представляет собой способ по любому из вариантов реализации 1-4, дополнительно включающий внутривенное введение CD40L онкологическому пациенту.
[0214] Вариант реализации 6 представляет собой способ по любому из вариантов реализации 1-5, отличающийся тем, что CD40L кодируется MVA.
[0215] Вариант реализации 7 представляет собой способ по любому из вариантов реализации 1-6, отличающийся тем, что индукция усиленного ответа NK-клеток включает по меньшей мере одно из a) индукции усиленного ответа АЗКЦ и b) индукции NK-клеток для нацеливания и уничтожения опухолевых клеток, имеющих низкую экспрессию ГКГС.
[0216] Вариант реализации 8 представляет собой способ по любому из вариантов реализации 1-6, отличающийся тем, что индукция и усиленный ответ NK-клеток включают индукцию усиленного ответа АЗКЦ.
[0217] Вариант реализации 9 представляет собой способ по любому из вариантов реализации 1-8, отличающийся тем, что рекомбинантный MVA вводят одновременно или после антитела.
[0218] Вариант реализации 10 представляет собой способ по любому из вариантов реализации 1-8, отличающийся тем, что рекомбинантный MVA вводят после антитела.
[0219] Вариант реализации 11 представляет собой способ по любому из вариантов реализации 1-10, отличающийся тем, что MVA дополнительно содержит вторую нуклеиновую кислоту, кодирующую второй гетерологичный ОАА.
[0220] Вариант реализации 12 представляет собой способ по любому из вариантов реализации 1-11, отличающийся тем, что первый и/или второй ОАА выбраны из группы, состоящей из: 5-α-редуктазы, α-фетопротеина («AFP»), AM-1, APC, April, гена антигена меланомы B («BAGE»), β-катенина, Bcl12, bcr-abl, Brachyury, CA-125, каспазы-8 («CASP-8», также известный как «FLICE»), катепсинов, CD19, CD20, CD21/рецептора комплемента 2 («CR2»), CD22/BL-CAM, CD23/FcεRII, CD33, CD35/рецептора комплемента 1 («CR1»), CD44/PGP-1, CD45/общего антигена лейкоцитов («LCA»), CD46/мембранного кофакторного белка («MCP»), CD52/CAMPATH-1, CD55/фактора ускорения распада («DAF»), CD59/протектина, CDC27, CDK4, карциноэмбрионального антигена («CEA»), c-myc, циклооксигеназы-2 («cox-2»), удаленного при колоректальном раке гена («DCC»), DcR3, E6/E7, CGFR, EMBP, Dna78, фарнезилтрансферазы, фактора роста фибробластов-8a («FGF8a»), фактора роста фибробластов-8b («FGF8b»), FLK-1/KDR, рецептора фолиевой кислоты, G250, семейства генов антигена меланомы G («GAGE-семейство»), гастрина 17, гастрин-высвобождающего гормона, ганглиозида 2 («GD2»)/ганглиозида 3 («GD3»)/ганглиозида-моносиаловой кислоты-2 («GM2»), гонадотропин-высвобождающего гормона («GnRH»), UDP-GlcNAc:R1Man(α1-6)R2 [GlcNAc до Man(α1-6)] β1,6-N-ацетилглюкозаминилтрансферазы V («GnT V»), GP1, gp100/Pme117, gp-100-in4, gp15, gp75/тирозин-родственного белка-1 («gp75/TRP-1»), человеческого хорионического гонадотропина («hCG»), гепараназы, HER2, вируса опухоли молочной железы человека («HMTV»), белка теплового шока 70 кДа («HSP70»), человеческой обратной транскриптазы теломеразы («hTERT»), рецептора инсулин-подобного фактора роста-1 («IGFR-1»), рецептора интерлейкина-13 («IL-13R»), индуцибельной синтазы оксида азота («iNOS»), Ki67, KIAA0205, K-ras, H-ras, N-ras, KSA, LKLR-FUT, гена, кодирующего антиген меланомы 1 («MAGE-1»), гена, кодирующего антиген меланомы 2 («MAGE-2»), гена, кодирующего антиген меланомы 3 («MAGE-3»), гена, кодирующего антиген меланомы 4 («MAGE-4»), маммаглобина, MAP17, мелан-A/антигена меланомы, распознаваемого Т-клетками 1 («MART-1»), мезотелина, MIC A/B, MT-MMP, муцина, специфического для семенников антигена NY-ESO-1, остеонектина, p15, P170/MDR1, p53, p97/меланотрансферрина, PAI-1, тромбоцитарного фактора роста («PDGF»), μPA, PRAME, пробазина, прогенипоиетина, простатического специфического антигена («PSA»), простат-специфического мембранного антигена («PSMA»), RAGE-1, Rb, RCAS1, SART-1, SSX-семейства, STAT3, STn, TAG-72, трансформирующего фактора роста альфа («TGF-α»), трансформирующего фактора роста бета («TGF-β»), тимозина-бета-15, фактора некроза опухоли альфа («TNF-α»), TP1, TRP-2, тирозиназы, фактора роста эндотелия сосудов («VEGF»), ZAG, p16INK4 и глутатион-S-трансферазы («GST»).
[0221] Вариант реализации 13 представляет собой способ по любому из вариантов реализации 1-12, отличающийся тем, что антитело представляет собой антитело, одобренное для лечения онкологического пациента.
[0222] Вариант реализации 14 представляет собой способ по любому из вариантов реализации 1-13, отличающийся тем, что антитело выбрано из группы, состоящей из: анти-CD20 (например, ритуксимаб; офатумумаб; тозитумомаб), анти-CD52 (например, алемтузумаб Кампат®), анти-EGFR (например, цетуксимаб Эрбитукс®, панитумумаб), анти-CD2 (например, сиплизумаб), анти-CD37 (например, BI836826), анти-CD123 (например, JNJ-56022473), анти-CD30 (например, XmAb2513), анти-CD38 (например, даратумумаб Дарзалекс®), анти-PDL1 (например, авелумаб, атезолизумаб, дурвалумаб), CTLA-4 (например, ипилимумаб), анти-GD2 (например, 3F8, ch14.18, KW-2871, динутуксимаб), анти-CEA, анти-MUC1, анти-FLT3, анти-CD19, анти-CD40, анти-SLAMF7, анти-CCR4, анти-B7-H3, анти-ICAM1, анти-CSF1R, анти-CA125 (например ореговомаб), анти-FRα (например MOv18-IgG1, мирветуксимаб соравтанзин (IMGN853), MORAb-202), анти-мезотелина (например MORAb-009) и анти-HER2.
[0223] Вариант реализации 15 представляет собой способ по любому из вариантов реализации 1-14, отличающийся тем, что антитело является специфическим к антигену HER2.
[0224] Вариант реализации 16 представляет собой способ по любому из вариантов реализации 1-15, отличающийся тем, что антитело выбрано из пертузумаба, трастузумаба, Герзумы, ABP 980 и адо-трастузумаба эмтанзина.
[0225] Вариант реализации 17 представляет собой способ по любому из вариантов реализации 1-16, отличающийся тем, что первый и/или второй ОАА были модифицированы для предотвращения связывания антитела с первым и/или вторым ОАА.
[0226] Вариант реализации 18 представляет собой способ по любому из вариантов реализации 1-17, отличающийся тем, что первый ОАА представляет собой HER2.
[0227] Вариант реализации 19 представляет собой способ по варианту реализации 18, отличающийся тем, что одна или более аминокислот HER2 мутированы для предотвращения связывания антитела к HER2 с антигеном HER2.
[0228] Вариант реализации 20 представляет собой способ по любому из вариантов реализации 18-19, отличающийся тем, что одна или более аминокислот HER2 мутированы для предотвращения внеклеточной димеризации, тирозинкиназной активности и/или фосфорилирования полипептида и/или антигена HER2.
[0229] Вариант реализации 21 представляет собой способ по любому из вариантов реализации 18-20, отличающийся тем, что одна или более мутаций введены по меньшей мере в одну из 3 петель околомембранной области HER2.
[0230] Вариант реализации 22 представляет собой способ по любому из вариантов реализации 18-21, отличающийся тем, что 3 петли околомембранной области HER2 выбраны из аминокислот 579-583 (петля 1), 592-595 (петля 2) и 615-625 (петля 3).
[0231] Вариант реализации 23 представляет собой способ по любому из вариантов реализации 18-22, отличающийся тем, что антиген HER2 содержит по меньшей мере одну мутацию по меньшей мере в одной из аминокислот H267, Y274, S310, L317, H318, K333, E580, D582, P594, F595, K615 и Q624.
[0232] Вариант реализации 24 представляет собой способ по любому из вариантов реализации 18-23, отличающийся тем, что антиген HER2 содержит по меньшей мере одну мутацию, выбранную из группы, состоящей из: E580A, F595A, K615A, S310A, H318A, L317A, D277R, E280K, K573M и Y1023A.
[0233] Вариант реализации 25 представляет собой способ по любому из вариантов реализации 18-24, отличающийся тем, что антиген HER2 содержит по меньшей мере одну мутацию в аминокислотах 1139-1248.
[0234] Вариант реализации 26 представляет собой способ по любому из вариантов реализации 18-25, отличающийся тем, что антиген HER2 содержит по меньшей мере одну делецию в аминокислотах 1139-1248.
[0235] Вариант реализации 27 представляет собой способ по любому из вариантов реализации 18-26, отличающийся тем, что антиген HER2 содержит делецию аминокислот 1139-1248.
[0236] Вариант реализации 28 представляет собой способ по любому из вариантов реализации 18-27, отличающийся тем, что первая нуклеиновая кислота кодирует антиген HER2, имеющий по меньшей мере 90%, 95%, 97%, 98% или 99% идентичности с SEQ ID NO:1.
[0237] Вариант реализации 29 представляет собой способ по любому из вариантов реализации 18-28, отличающийся тем, что первая нуклеиновая кислота кодирует антиген HER2, содержащий SEQ ID NO:1.
[0238] Вариант реализации 30 представляет собой способ по любому из вариантов реализации 18-29, отличающийся тем, что первая нуклеиновая кислота кодирует антиген HER2, при этом первая нуклеиновая кислота имеет по меньшей мере 90%, 95%, 97%, 98% или 99% идентичности с SEQ ID NO:2.
[0239] Вариант реализации 31 представляет собой способ по любому из вариантов реализации 18-30, отличающийся тем, что первая нуклеиновая кислота содержит SEQ ID NO:2.
[0240] Вариант реализации 32 представляет собой способ по любому из вариантов реализации 1-31, отличающийся тем, что MVA содержит вторую нуклеиновую кислоту, кодирующую второй гетерологичный ОАА, отличный от первого ОАА.
[0241] Вариант реализации 33 представляет собой способ по варианту реализации 32, отличающийся тем, что второй ОАА представляет собой Brachyury.
[0242] Вариант реализации 34 представляет собой способ по варианту реализации 33, отличающийся тем, что антиген Brachyury содержит одну или более мутаций для предотвращения ядерной локализации антигена Brachyury.
[0243] Вариант реализации 35 представляет собой способ по любому из вариантов реализации 33-34, отличающийся тем, что антиген Brachyury содержит одну или более мутаций в домене сигнала ядерной локализации (СЯЛ).
[0244] Вариант реализации 36 представляет собой способ по любому из вариантов реализации 33-35, отличающийся тем, что в антигене Brachyury удален домен СЯЛ.
[0245] Вариант реализации 37 представляет собой способ по любому из вариантов реализации 33-36, отличающийся тем, что вторая нуклеиновая кислота содержит антиген Brachyury, имеющий по меньшей мере 90%, 95%, 97%, 98% или 99% идентичности с SEQ ID NO:3.
[0246] Вариант реализации 38 представляет собой способ по любому из вариантов реализации 33-37, отличающийся тем, что вторая нуклеиновая кислота содержит SEQ ID NO:3.
[0247] Вариант реализации 39 представляет собой способ по любому из вариантов реализации 33-38, отличающийся тем, что вторая нуклеиновая кислота кодирует антиген Brachyury, при этом вторая нуклеиновая кислота имеет по меньшей мере 90%, 95%, 97%, 98% или 99% идентичности с SEQ ID NO:4.
[0248] Вариант реализации 40 представляет собой способ по любому из вариантов реализации 33-39, отличающийся тем, что вторая нуклеиновая кислота содержит SEQ ID NO:4.
[0249] Вариант реализации 41 представляет собой способ по любому из вариантов реализации 1-40, отличающийся тем, что антитело выбрано из группы, состоящей из: анти-CD20 (ритуксимаб; офатумумаб; тозитумомаб), анти-CD52 (алемтузумаб Кампат®), анти-EGFR (цетуксимаб Эрбитукс®, панитумумаб), анти-CD38 (даратумумаб Дарзалекс®), анти-PDL1 (авелумаб), анти-CTLA-4 (ипилимумаб), анти-GD2 (3F8, ch14.18, KW-2871, динутуксимаб), анти-CEA, анти-Muc1, анти-FLT3L, анти-CD19, анти-CD40, анти-SLAMF7, анти-CCR4, анти-B7-H3, анти-ICAM1, анти-CSF1R и анти-HER2.
[0250] Вариант реализации 42 представляет собой способ по любому из вариантов реализации 1-41, отличающийся тем, что антитело является специфическим к антигену HER2.
[0251] Вариант реализации 43 представляет собой способ по варианту реализации 42, отличающийся тем, что анти-HER2 антитело выбрано из пертузумаба, трастузумаба адо-трастузумаба эмтанзина.
[0252] Вариант реализации 44 представляет собой способ по любому из вариантов реализации 1-43, отличающийся тем, что антитело и MVA вводят по гомологичной прайм-буст схеме.
[0253] Вариант реализации 45 представляет собой способ по любому из вариантов реализации 1-44, отличающийся тем, что MVA представляет собой MVA-BN или производное MVA-BN.
[0254] Вариант реализации 46 представляет собой способ по любому из вариантов реализации 1-45, отличающийся тем, что онкологический пациент имеет и/или был диагностирован как имеющий рак, выбранный из группы, состоящей из рака молочной железы, рака легкого, рака головы и шеи, рака щитовидной железы, меланомы, рака желудка, рака мочевого пузыря, рака почки, рака печени, меланомы, рака поджелудочной железы, рака предстательной железы, рака яичника или колоректального рака.
[0255] Вариант реализации 47 представляет собой фармацевтическую комбинацию для применения для снижения размера опухоли и/или повышения выживаемости у онкологического пациента, содержащую a) рекомбинантный модифицированный вирус осповакцины Анкара (MVA), содержащий первую нуклеиновую кислоту, кодирующую первый гетерологичный опухолеассоциированный антиген (ОАА), который при внутривенном введении индуцирует как усиленный ответ естественных клеток-киллеров (NK), так и усиленный ответ Т-клеток по сравнению с ответом NK-клеток и ответом Т-клеток, индуцированным невнутривенным введением рекомбинантного вируса MVA, содержащего нуклеиновую кислоту, кодирующую гетерологичный ОАА; и b) антитело, содержащее Fc-домен и являющееся специфическим к антигену, который экспрессируется на клеточной мембране опухолевой клетки; причем введение a) и b) онкологическому пациенту снижает размер опухоли и/или повышает уровень выживаемости онкологического пациента по сравнению с не-в/в введением a) или введением b) отдельно.
[0256] Вариант реализации 48 представляет собой фармацевтическую комбинацию для применения для снижения размера опухоли и/или повышения выживаемости у онкологического пациента, содержащую a) рекомбинантный модифицированный вирус осповакцины Анкара (MVA), содержащий первую нуклеиновую кислоту, кодирующую первый гетерологичный опухолеассоциированный антиген (ОАА), который при внутривенном введении индуцирует как усиленный ответ естественных клеток-киллеров (NK), так и усиленный ответ Т-клеток по сравнению с ответом NK-клеток и ответом Т-клеток, индуцированным невнутривенным введением рекомбинантного MVA, содержащего нуклеиновую кислоту, кодирующую гетерологичный ОАА; и b) антитело, содержащее Fc-домен и являющееся специфическим к антигену, который экспрессируется на клеточной мембране опухолевой клетки, при этом при введении антитела оно связывается с антигеном на опухолевой клетке в организме онкологического пациента-человека и индуцирует антителозависимую клеточноопосредованную цитотоксичность (АЗКЦ); причем введение a) и b) онкологическому пациенту снижает размер опухоли и/или повышает уровень выживаемости онкологического пациента по сравнению с не-в/в введением a) или введением b) отдельно.
[0257] Вариант реализации 49 представляет собой фармацевтическую комбинацию по любому из вариантов реализации 47-48, отличающуюся тем, что CD40L кодируется рекомбинантным MVA.
[0258] Вариант реализации 50 представляет собой фармацевтическую комбинацию по любому из вариантов реализации 47-49, отличающуюся тем, что рекомбинантный MVA дополнительно содержит вторую нуклеиновую кислоту, кодирующую второй гетерологичный ОАА.
[0259] Вариант реализации 51 представляет собой фармацевтическую комбинацию по любому из вариантов реализации 47-50, отличающуюся тем, что первый и/или второй ОАА выбраны из группы, состоящей из: 5-α-редуктазы, α-фетопротеина («AFP»), AM-1, APC, April, гена антигена меланомы B («BAGE»), β-катенина, Bcl12, bcr-abl, Brachyury, CA-125, каспазы-8 («CASP-8», также известный как «FLICE»), катепсинов, CD19, CD20, CD21/рецептора комплемента 2 («CR2»), CD22/BL-CAM, CD23/FcεRII, CD33, CD35/рецептора комплемента 1 («CR1»), CD44/PGP-1, CD45/общего антигена лейкоцитов («LCA»), CD46/мембранного кофакторного белка («MCP»), CD52/CAMPATH-1, CD55/фактора ускорения распада («DAF»), CD59/протектина, CDC27, CDK4, карциноэмбрионального антигена («CEA»), c-myc, циклооксигеназы-2 («cox-2»), удаленного при колоректальном раке гена («DCC»), DcR3, E6/E7, CGFR, EMBP, Dna78, фарнезилтрансферазы, фактора роста фибробластов-8a («FGF8a»), фактора роста фибробластов-8b («FGF8b»), FLK-1/KDR, рецептора фолиевой кислоты, G250, семейства генов антигена меланомы G («GAGE-семейство»), гастрина 17, гастрин-высвобождающего гормона, ганглиозида 2 («GD2»)/ганглиозида 3 («GD3»)/ганглиозида-моносиаловой кислоты-2 («GM2»), гонадотропин-высвобождающего гормона («GnRH»), UDP-GlcNAc:R1Man(α1-6)R2 [GlcNAc до Man(α1-6)] β1,6-N-ацетилглюкозаминилтрансферазы V («GnT V»), GP1, gp100/Pme117, gp-100-in4, gp15, gp75/тирозин-родственного белка-1 («gp75/TRP-1»), человеческого хорионического гонадотропина («hCG»), гепараназы, HER2, вируса опухоли молочной железы человека («HMTV»), белка теплового шока 70 кДа («HSP70»), человеческой обратной транскриптазы теломеразы («hTERT»), рецептора инсулин-подобного фактора роста-1 («IGFR-1»), рецептора интерлейкина-13 («IL-13R»), индуцибельной синтазы оксида азота («iNOS»), Ki67, KIAA0205, K-ras, H-ras, N-ras, KSA, LKLR-FUT, гена, кодирующего антиген меланомы 1 («MAGE-1»), гена, кодирующего антиген меланомы 2 («MAGE-2»), гена, кодирующего антиген меланомы 3 («MAGE-3»), гена, кодирующего антиген меланомы 4 («MAGE-4»), маммаглобина, MAP17, мелан-A/антигена меланомы, распознаваемого Т-клетками 1 («MART-1»), мезотелина, MIC A/B, MT-MMP, муцина, специфического для семенников антигена NY-ESO-1, остеонектина, p15, P170/MDR1, p53, p97/меланотрансферрина, PAI-1, тромбоцитарного фактора роста («PDGF»), μPA, PRAME, пробазина, прогенипоиетина, простатического специфического антигена («PSA»), простат-специфического мембранного антигена («PSMA»), RAGE-1, Rb, RCAS1, SART-1, SSX-семейства, STAT3, STn, TAG-72, трансформирующего фактора роста альфа («TGF-α»), трансформирующего фактора роста бета («TGF-β»), тимозина-бета-15, фактора некроза опухоли альфа («TNF-α»), TP1, TRP-2, тирозиназы, фактора роста эндотелия сосудов («VEGF»), ZAG, p16INK4 и глутатион-S-трансферазы («GST»).
[0260] Вариант реализации 52 представляет собой фармацевтическую комбинацию по любому из вариантов реализации 47-51, отличающуюся тем, что первый ОАА представляет собой HER2.
[0261] Вариант реализации 53 представляет собой фармацевтическую комбинацию по варианту реализации 52, отличающуюся тем, что антиген HER2 содержит по меньшей мере одну мутацию, выбранную из группы, состоящей из: E580A, F595A, K615A, S310A, H318A, L317A, D277R, E280K, K573M и Y1023A.
[0262] Вариант реализации 54 представляет собой фармацевтическую комбинацию по любому из вариантов реализации 52-53, отличающуюся тем, что первая нуклеиновая кислота содержит антиген HER2, имеющий по меньшей мере 90%, 95%, 97%, 98% или 99% идентичности с SEQ ID NO:1.
[0263] Вариант реализации 55 представляет собой фармацевтическую комбинацию по любому из вариантов реализации 52-54, отличающуюся тем, что первая нуклеиновая кислота содержит SEQ ID NO:1.
[0264] Вариант реализации 56 представляет собой фармацевтическую комбинацию по любому из вариантов реализации 52-55, отличающуюся тем, что первая нуклеиновая кислота кодирует антиген HER2, при этом первая нуклеиновая кислота имеет по меньшей мере 90%, 95%, 97%, 98% или 99% идентичности с SEQ ID NO:2.
[0265] Вариант реализации 57 представляет собой фармацевтическую комбинацию по любому из вариантов реализации 52-56, отличающуюся тем, что первая нуклеиновая кислота содержит SEQ ID NO:2.
[0266] Вариант реализации 58 представляет собой фармацевтическую комбинацию по любому из вариантов реализации 47-57, отличающуюся тем, что MVA содержит вторую нуклеиновую кислоту, кодирующую второй гетерологичный ОАА, отличный от первого ОАА.
[0267] Вариант реализации 59 представляет собой фармацевтическую комбинацию по варианту реализации 58, отличающуюся тем, что второй ОАА представляет собой Brachyury.
[0268] Вариант реализации 60 представляет собой фармацевтическую комбинацию по варианту реализации 59, отличающуюся тем, что вторая нуклеиновая кислота содержит антиген Brachyury, имеющий по меньшей мере 90%, 95%, 97%, 98% или 99% идентичности с SEQ ID NO:3.
[0269] Вариант реализации 61 представляет собой фармацевтическую комбинацию по любому из вариантов реализации 59-60, отличающуюся тем, что вторая нуклеиновая кислота кодирует антиген, содержащий SEQ ID NO:3.
[0270] Вариант реализации 62 представляет собой фармацевтическую комбинацию по любому из вариантов реализации 59-61, отличающуюся тем, что вторая нуклеиновая кислота кодирует антиген Brachyury, при этом вторая нуклеиновая кислота имеет по меньшей мере 90%, 95%, 97%, 98% или 99% идентичности с SEQ ID NO:4.
[0271] Вариант реализации 63 представляет собой фармацевтическую комбинацию по любому из вариантов реализации 59-62, отличающуюся тем, что вторая нуклеиновая кислота содержит SEQ ID NO:4.
[0272] Вариант реализации 64 представляет собой фармацевтическую комбинацию по любому из вариантов реализации 47-63, отличающуюся тем, что антитело выбрано из группы, состоящей из: анти-CD20 (например, ритуксимаб; офатумумаб; тозитумомаб), анти-CD52 (например, алемтузумаб Кампат®), анти-EGFR (например, цетуксимаб Эрбитукс®, панитумумаб), анти-CD2 (например, сиплизумаб), анти-CD37 (например, BI836826), анти-CD123 (например, JNJ-56022473), анти-CD30 (например, XmAb2513), анти-CD38 (например, даратумумаб Дарзалекс®), анти-PDL1 (например, авелумаб, атезолизумаб, дурвалумаб), CTLA-4 (например, ипилимумаб), анти-GD2 (например, 3F8, ch14.18, KW-2871, динутуксимаб), анти-CEA, анти-MUC1, анти-FLT3, анти-CD19, анти-CD40, анти-SLAMF7, анти-CCR4, анти-B7-H3, анти-ICAM1, анти-CSF1R, анти-CA125 (например ореговомаб), анти-FRα (например MOv18-IgG1, мирветуксимаб соравтанзин (IMGN853), MORAb-202), анти-мезотелина (например MORAb-009) и анти-HER2.
[0273] Вариант реализации 65 представляет собой фармацевтическую комбинацию по любому из вариантов реализации 47-64, отличающуюся тем, что антитело является специфическим к антигену HER2.
[0274] Вариант реализации 66 представляет собой фармацевтическую комбинацию по варианту реализации 65, отличающуюся тем, что антитело выбрано из пертузумаба, трастузумаба, Герзумы, ABP 980 и адо-трастузумаба эмтанзина.
[0275] Вариант реализации 67 представляет собой фармацевтическую комбинацию по любому из вариантов реализации 47-66, отличающуюся тем, что MVA представляет собой MVA-BN или производное MVA-BN.
[0276] Вариант реализации 68 представляет собой способ индукции усиленного ответа естественных клеток-киллеров (NK) у онкологического пациента, включающий введение фармацевтической комбинации по любому из вариантов реализации 47-66, причем введение комбинации усиливает ответ NK-клеток у онкологического пациента по сравнению с невнутривенным введением комбинации a) или введением b) отдельно.
[0277] Вариант реализации 69 представляет собой способ индукции как усиленного врожденного, так и усиленного адаптивного иммунного ответа у онкологического пациента, включающий введение фармацевтической комбинации по любому из вариантов реализации 47-67, причем введение комбинации усиливает ответ NK-клеток у онкологического пациента по сравнению с невнутривенным введением комбинации a) или введением b) отдельно.
[0278] Вариант реализации 70 представляет собой способ по варианту реализации 69, отличающийся тем, что усиленный адаптивный иммунный ответ включает усиленный ответ Т-клеток.
[0279] Вариант реализации 71 представляет собой способ по варианту реализации 70, отличающийся тем, что усиленный ответ Т-клеток включает усиленный ответ CD8 Т-клеток и усиленный ответ CD4 Т-клеток.
[0280] Вариант реализации 72 представляет собой способ усиления терапии на основе антител у онкологического пациента, включающий введение фармацевтической комбинации по любому из вариантов реализации 47-67, причем введение фармацевтической комбинации усиливает антителозависимую клеточноопосредованную цитотоксичность (АЗКЦ), индуцированную терапией на основе антител, по сравнению с применением только терапии на основе антител.
[0281] Вариант реализации 73 представляет собой способ усиления уничтожения опухолевых клеток, имеющих сниженные уровни ГКГС, у онкологического пациента, включающий введение фармацевтической комбинации по любому из вариантов реализации 47-67, причем введение комбинации усиливает уничтожение опухолевых клеток, имеющих сниженные уровни ГКГС, по сравнению с введением только b).
[0282] Вариант реализации 74 представляет собой способ лечения онкологического пациента-человека, включающий введение онкологическому пациенту фармацевтической комбинации по любому из вариантов реализации 47-67.
[0283] Вариант реализации 75 представляет собой способ по любому из вариантов реализации 68-74, отличающийся тем, что рекомбинантный MVA вводят одновременно или после антитела.
[0284] Вариант реализации 76 представляет собой способ по любому из вариантов реализации 68-74, отличающийся тем, что рекомбинантный MVA вводят после антитела.
[0285] Вариант реализации 77 представляет собой способ по любому из вариантов реализации 68-75, отличающийся тем, что рекомбинантный MVA вводят через 0-8 суток, 0-7 суток, 0-6 суток, 0-5 суток, 0-4 суток, 0-3 суток, 0-2 суток или 0-1 суток после антитела.
[0286] Вариант реализации 78 представляет собой способ по любому из вариантов реализации 68-75, отличающийся тем, что рекомбинантный MVA вводят через 1-8 суток, 1-7 суток, 1-6 суток, 1-5 суток, 1-4 суток, 1-3 суток, 1-2 суток или 1 сутки после антитела.
[0287] Вариант реализации 79 представляет собой способ по любому из вариантов реализации 68-77, отличающийся тем, что рекомбинантный MVA вводят через 0-3 суток, 0-2 суток, 0-1 сутки после антитела.
[0288] Вариант реализации 80 представляет собой способ по варианту реализации 79, отличающийся тем, что рекомбинантный MVA вводят через 0-3 суток после антитела.
[0289] Вариант реализации 81 представляет собой способ по любому из вариантов реализации 68-80, отличающийся тем, что антитело и MVA вводят как часть гомологичной или гетерологичной прайм-буст схемы.
[0290] Вариант реализации 82 представляет собой способ по любому из вариантов реализации 68-80, отличающийся тем, что антитело и MVA вводят как часть гомологичной прайм-буст схемы.
[0291] Вариант реализации 83 представляет собой способ по любому из вариантов реализации 1-45 и 68-82, отличающийся тем, что онкологический пациент имеет и/или у него диагностирован рак, выбранный из группы, состоящей из: рака молочной железы, рака легкого, рака головы и шеи, рака щитовидной железы, меланомы, рака желудка, рака мочевого пузыря, рака почки, рака печени, меланомы, рака поджелудочной железы, рака предстательной железы, рака яичника или колоректального рака.
[0292] Вариант реализации 84 представляет собой фармацевтическую комбинацию для применения для снижения объема опухоли и/или повышения выживаемости онкологического пациента, содержащую фармацевтическую комбинацию по любому из вариантов реализации 47-67, причем введение комбинации снижает объем опухоли и/или повышает выживаемость пациента по сравнению с невнутривенным введением комбинации a) или введением b) отдельно.
[0293] Вариант реализации 85 представляет собой применение фармацевтической комбинации по любому из вариантов реализации 47-67 в способе снижения объема опухоли и/или повышения выживаемости онкологического пациента.
[0294] Вариант реализации 86 представляет собой применение фармацевтической комбинации по любому из вариантов реализации 47-67 при приготовлении фармацевтического или лекарственного средства для снижения объема опухоли и/или повышения выживаемости онкологического пациента.
[0295] Вариант реализации 87 представляет собой способ снижения размера опухоли и/или повышения выживаемости у онкологического пациента, включающий a) внутривенное введение онкологическому пациенту рекомбинантного модифицированного вируса осповакцины Анкара (MVA), содержащего первую нуклеиновую кислоту, кодирующую первый гетерологичный опухолеассоциированный антиген (ОАА), который при внутривенном введении индуцирует как усиленный врожденный иммунный ответ, так и усиленный ответ Т-клеток по сравнению с врожденным иммунным ответом и ответом Т-клеток, индуцированным невнутривенным введением рекомбинантного MVA, содержащего первую нуклеиновую кислоту, кодирующую первый гетерологичный опухолеассоциированный антиген; и b) введение онкологическому пациенту антитела, содержащего Fc-домен и являющегося специфическим к антигену, который экспрессируется на клеточной мембране опухолевой клетки; причем введение a) и b) онкологическому пациенту снижает размер опухоли у онкологического пациента и/или повышает уровень выживаемости онкологического пациента по сравнению с невнутривенным введением a) или введением b) отдельно.
[0296] Вариант реализации 88 представляет собой способ по варианту реализации 87, отличающийся тем, что усиленный врожденный иммунный ответ включает по меньшей мере одно из усиленного ответа NK-клеток, усиленного ответа макрофагов, усиленного ответа моноцитов, усиленного ответа нейтрофилов, усиленного ответа базофилов, усиленного ответа эозинофилов, усиленного ответа тучных клеток и усиленного ответа дендритных клеток.
[0297] Вариант реализации 89 представляет собой способ по любому из вариантов реализации 87-88, отличающийся тем, что рекомбинантный MVA дополнительно кодирует CD40L.
[0298] Вариант реализации 90 представляет собой способ по любому из вариантов реализации 88-89, отличающийся тем, что индукция усиленного ответа NK-клеток включает по меньшей мере одно из a) индукции усиленного ответа АЗКЦ и b) индукции NK-клеток для нацеливания и уничтожения опухолевых клеток, имеющих низкую экспрессию ГКГС.
[0299] Вариант реализации 91 представляет собой способ по любому из вариантов реализации 87-90, отличающийся тем, что рекомбинантный MVA вводят одновременно или после антитела.
[0300] Вариант реализации 92 представляет собой способ по любому из вариантов реализации 87-91, отличающийся тем, что рекомбинантный MVA вводят после антитела.
[0301] Вариант реализации 93 представляет собой способ по любому из вариантов реализации 87-92, отличающийся тем, что MVA содержит первую и/или вторую нуклеиновую кислоту, кодирующую первый и/или второй гетерологичный ОАА по любому из вариантов реализации 51-63.
[0302] Вариант реализации 94 представляет собой способ по любому из вариантов реализации 87-93, отличающийся тем, что антитело включает антитело по любому из вариантов реализации 64-66.
[0303] Вариант реализации 95 представляет собой фармацевтическую комбинацию для снижения размера опухоли и/или повышения выживаемости у онкологического пациента, содержащую a) рекомбинантный модифицированный вирус осповакцины Анкара (MVA), содержащий первую нуклеиновую кислоту, кодирующую первый гетерологичный опухолеассоциированный антиген (ОАА), который при внутривенном введении индуцирует как усиленный врожденный иммунный ответ, так и усиленный ответ Т-клеток по сравнению с врожденным иммунным ответом и ответом Т-клеток, индуцированным невнутривенным введением рекомбинантного вируса MVA, содержащего нуклеиновую кислоту, кодирующую гетерологичный ОАА; и b) антитело, содержащее Fc-домен и являющееся специфическим к антигену, который экспрессируется на клеточной мембране опухолевой клетки; причем введение a) и b) онкологическому пациенту снижает размер опухоли и/или повышает уровень выживаемости онкологического пациента по сравнению с не-в/в введением a) или введением b) отдельно.
[0304] Вариант реализации 96 представляет собой фармацевтическую комбинацию по варианту реализации 95, отличающуюся тем, что рекомбинантный MVA дополнительно кодирует CD40L.
[0305] Вариант реализации 97 представляет собой фармацевтическую комбинацию по любому из вариантов реализации 95-96, отличающуюся тем, что усиленный врожденный иммунный ответ включает по меньшей мере одно из усиленного ответа NK-клеток, усиленного ответа макрофагов, усиленного ответа нейтрофилов, усиленного ответа базофилов, усиленного ответа эозинофилов, усиленного ответа тучных клеток и усиленного ответа дендритных клеток.
[0306] Вариант реализации 98 представляет собой фармацевтическую комбинацию по любому из вариантов реализации 95-97, отличающуюся тем, что индукция усиленного ответа NK-клеток включает по меньшей мере одно из a) индукции усиленного ответа АЗКЦ и b) индукции NK-клеток для нацеливания и уничтожения опухолевых клеток, имеющих низкую экспрессию ГКГС.
[0307] Вариант реализации 99 представляет собой фармацевтическую комбинацию по любому из вариантов реализации 95-98, отличающуюся тем, что MVA содержит первую и/или вторую нуклеиновую кислоту, кодирующую первый и/или второй гетерологичный ОАА по любому из вариантов реализации 51-63.
[0308] Вариант реализации 100 представляет собой фармацевтическую комбинацию по любому из вариантов реализации 95-99, отличающуюся тем, что антитело включает антитело по любому из вариантов реализации 64-66.
[0309] Вариант реализации 101 представляет собой фармацевтическую комбинацию для снижения размера опухоли и/или повышения выживаемости у онкологического пациента, содержащую a) рекомбинантный поксвирус, содержащий первую нуклеиновую кислоту, кодирующую первый гетерологичный опухолеассоциированный антиген (ОАА), который при внутривенном введении индуцирует как усиленный ответ естественных клеток-киллеров (NK), так и усиленный ответ Т-клеток по сравнению с ответом NK-клеток и ответом Т-клеток, индуцированным невнутривенным введением рекомбинантного поксвируса, содержащего нуклеиновую кислоту, кодирующую гетерологичный ОАА; и b) антитело, содержащее Fc-домен и являющееся специфическим к антигену, который экспрессируется на клеточной мембране опухолевой клетки; причем введение a) и b) онкологическому пациенту снижает размер опухоли и/или повышает уровень выживаемости онкологического пациента по сравнению с не-в/в введением a) или введением b) отдельно.
[0310] Вариант реализации 102 представляет собой фармацевтическую комбинацию по варианту реализации 101, отличающуюся тем, что рекомбинантный поксвирус дополнительно кодирует CD40L.
[0311] Вариант реализации 103 представляет собой фармацевтическую комбинацию по любому из вариантов реализации 101-102, отличающуюся тем, что MVA содержит первую и/или вторую нуклеиновую кислоту, кодирующую первый и/или второй гетерологичный ОАА по любому из вариантов реализации 51-63.
[0312] Вариант реализации 104 представляет собой фармацевтическую комбинацию по любому из вариантов реализации 101-103, отличающуюся тем, что антитело включает антитело по любому из вариантов реализации 64-66.
[0313] Вариант реализации 105 представляет собой способ снижения размера опухоли и/или повышения выживаемости у онкологического пациента, включающий a) внутривенное введение онкологическому пациенту рекомбинантного модифицированного вируса осповакцины Анкара (MVA), содержащего первую нуклеиновую кислоту, кодирующую первый гетерологичный опухолеассоциированный антиген (ОАА), который при внутривенном введении индуцирует как усиленный ответ естественных клеток-киллеров (NK), так и усиленный ответ Т-клеток по сравнению с ответом NK-клеток и ответом Т-клеток, индуцированным невнутривенным введением рекомбинантного MVA, содержащего нуклеиновую кислоту, кодирующую гетерологичный опухолеассоциированный антиген; и b) введение онкологическому пациенту антитела, являющегося специфическим к антигену, который экспрессируется на клеточной мембране опухолевой клетки; причем введение a) и b) онкологическому пациенту снижает размер опухоли у онкологического пациента и/или повышает уровень выживаемости онкологического пациента по сравнению с невнутривенным введением a) или введением b) отдельно.
[0314] Вариант реализации 106 представляет собой фармацевтическую комбинацию для снижения размера опухоли и/или повышения выживаемости у онкологического пациента, содержащую a) антитело, содержащее Fc-домен и являющееся специфическим к антигену, который экспрессируется на клеточной мембране опухолевой клетки, которое при введении пациенту индуцирует АЗКЦ у пациента; и b) рекомбинантный модифицированный вирус осповакцины Анкара (MVA), содержащий первую нуклеиновую кислоту, кодирующую первый гетерологичный опухолеассоциированный антиген (ОАА), причем MVA при внутривенном введении пациенту индуцирует усиленный ответ естественных клеток-киллеров (NK), который усиливает АЗКЦ у пациента и усиливает опосредованную NK-клетками токсичность, и причем MVA индуцирует усиленный ответ Т-клеток, по сравнению с ответом NK-клеток и ответом Т-клеток, индуцированным невнутривенным введением рекомбинантного вируса MVA, содержащего нуклеиновую кислоту, кодирующую гетерологичный опухолеассоциированный антиген; и причем введение a) и b) онкологическому пациенту снижает размер опухоли и/или повышает уровень выживаемости онкологического пациента по сравнению с не-в/в введением a) или введением b) отдельно.
[0315] Вариант реализации 107 представляет собой фармацевтическую комбинацию по варианту реализации 106, отличающуюся тем, что рекомбинантный MVA дополнительно содержит нуклеиновую кислоту, кодирующую CD40L.
[0316] Вариант реализации 108 представляет собой фармацевтическую комбинацию по любому из вариантов реализации 106-107, отличающуюся тем, что MVA содержит первую и/или вторую нуклеиновую кислоту, кодирующую первый и/или второй гетерологичный ОАА по любому из вариантов реализации 51-63.
[0317] Вариант реализации 109 представляет собой способ снижения объема опухоли и/или повышения выживаемости у онкологического пациента, включающий введение фармацевтической комбинации по любому из вариантов реализации 106-108.
[0318] Вариант реализации 110 представляет собой фармацевтическую комбинацию для применения для снижения объема опухоли и/или повышения выживаемости онкологического пациента, содержащую фармацевтическую комбинацию по любому из вариантов реализации 106-108, причем введение комбинации снижает объем опухоли и/или повышает выживаемость пациента по сравнению с введением a) или невнутривенным введением b) отдельно.
[0319] Вариант реализации 111 представляет собой применение фармацевтической комбинации по любому из вариантов реализации 106-108 в способе снижения объема опухоли и/или повышения выживаемости онкологического пациента.
[0320] Вариант реализации 112 представляет собой применение фармацевтической комбинации по любому из вариантов реализации 106-108 при приготовлении фармацевтического или лекарственного средства для снижения объема опухоли и/или повышения выживаемости онкологического пациента.
[0321] Вариант реализации 113 представляет собой способ повышения эффективности терапии на основе антител у онкологического пациента, включающий введение фармацевтической комбинации по любому из вариантов реализации 47-67 и 106-108, причем введение комбинации пациенту снижает концентрацию антител, необходимую для опосредованной NK-клетками токсичности в опухолевых клетках.
[0322] Вариант реализации 114 представляет собой фармацевтическую комбинацию по любому из вариантов реализации 47-67 и 106-108, отличающуюся тем, что рекомбинантный MVA содержит нуклеиновую кислоту, кодирующую CD40L, а CD40L содержит SEQ ID NO:11.
[0323] Вариант реализации 115 представляет собой фармацевтическую комбинацию по варианту реализации 114, отличающуюся тем, что нуклеиновая кислота, кодирующая CD40L, представляет собой нуклеиновую кислоту, имеющую по меньшей мере 95%, 98%, 99% или 100% идентичности с SEQ ID NO:12.
[0324] Вариант реализации 116 представляет собой способ по любому из вариантов реализации 1-46, отличающийся тем, что рекомбинантный MVA содержит нуклеиновую кислоту, кодирующую CD40L, а CD40L содержит SEQ ID NO:11.
[0325] Вариант реализации 117 представляет собой способ по варианту реализации 116, отличающийся тем, что нуклеиновая кислота, кодирующая CD40L, представляет собой нуклеиновую кислоту, имеющую по меньшей мере 95%, 98%, 99% или 100% идентичности с SEQ ID NO:12.
[0326] Вариант реализации 118 представляет собой способ по варианту реализации 83, отличающийся тем, что рак молочной железы представляет собой рак молочной железы со сверхэкспрессией HER2.
[0327] Вариант реализации 119 представляет собой способ по любому из вариантов реализации 18-19, отличающийся тем, что одна или более аминокислот HER2 мутированы для предотвращения внеклеточной димеризации, тирозинкиназной активности и/или фосфорилирования полипептида и/или антигена HER2 после экспрессии рекомбинантным MVA.
[0328] Вариант реализации 120 представляет собой способ по любому из вариантов реализации 18-19, отличающийся тем, что антиген HER содержит одну или более мутаций для предотвращения связывания антитела к HER2 с антигеном HER2, экспрессируемым рекомбинантным MVA.
[0329] Вариант реализации 121 представляет собой фармацевтическую комбинацию по любому из вариантов реализации 50-63, отличающуюся тем, что первый и/или второй ОАА содержат одну или более мутаций для предотвращения связывания антитела с первым и/или вторым ОАА.
[0330] Вариант реализации 122 представляет собой способ по любому из вариантов реализации 18-20, отличающийся тем, что одна или более мутаций введены по меньшей мере в одну из 3 петель околомембранной области HER2.
[0331] Вариант реализации 123 представляет собой способ по любому из вариантов реализации 18-21, отличающийся тем, что 3 петли околомембранной области HER2 выбраны из аминокислот 579-583 (петля 1), 592-595 (петля 2) и 615-625 (петля 3).
[0332] Вариант реализации 124 представляет собой способ по любому из вариантов реализации 18-22, отличающийся тем, что антиген HER2 содержит по меньшей мере одну мутацию по меньшей мере в одной из аминокислот E580A, F595A, K615A, H267A, F279A, V308A, S310A, L317A, H318A, K333A, P337A.
[0333] Вариант реализации 125 представляет собой способ по любому из вариантов реализации 18-23, отличающийся тем, что антиген HER2 содержит по меньшей мере одну мутацию, выбранную из группы, состоящей из: E580A, F595A, K615A, H267A, F279A, V308A, S310A, L317A, H318A, K333A, P337A, D277R, E280K, K753M и Y1023A.
[0334] Вариант реализации 126 представляет собой фармацевтическую комбинацию для применения в терапии путем снижения объема опухоли и/или повышения выживаемости онкологического пациента (предпочтительно при этом онкологический пациент имеет и/иди диагностирован как имеющий рак, выбранный из группы, состоящей из: рака молочной железы, рака легкого, рака головы и шеи, рака щитовидной железы, меланомы, рака желудка, рака мочевого пузыря, рака почки, рака печени, меланомы, рака поджелудочной железы, рака предстательной железы, рака яичника или колоректального рака), содержащую фармацевтическую комбинацию по любому из вариантов реализации 47-67, причем введение комбинации снижает объем опухоли и/или повышает выживаемость пациента по сравнению с невнутривенным введением комбинации a) или введением b) отдельно.
[0335] Вариант реализации 127 представляет собой применение фармацевтической комбинации по любому из вариантов реализации 47-67 при приготовлении фармацевтического или лекарственного средства для снижения объема опухоли и/или повышения выживаемости онкологического пациента, предпочтительно при этом онкологический пациент имеет и/иди диагностирован как имеющий рак, выбранный из группы, состоящей из: рака молочной железы, рака легкого, рака головы и шеи, рака щитовидной железы, меланомы, рака желудка, рака мочевого пузыря, рака почки, рака печени, меланомы, рака поджелудочной железы, рака предстательной железы, рака яичника или колоректального рака.
[0336] Вариант реализации 128 представляет собой способ по любому из вариантов реализации 18-27, отличающийся тем, что первая нуклеиновая кислота кодирует антиген HER2, имеющий по меньшей мере 90%, 95%, 97%, 98% или 99% идентичности с SEQ ID NO: 13.
[0337] Вариант реализации 129 представляет собой способ по любому из вариантов реализации 18-28, отличающийся тем, что первая нуклеиновая кислота кодирует антиген HER2, содержащий SEQ ID NO: 13.
[0338] Вариант реализации 130 представляет собой способ по любому из вариантов реализации 18-29, отличающийся тем, что первая нуклеиновая кислота кодирует антиген HER2, при этом первая нуклеиновая кислота имеет по меньшей мере 90%, 95%, 97%, 98% или 99% идентичности с SEQ ID NO: 14.
[0339] Вариант реализации 131 представляет собой способ по любому из вариантов реализации 18-30, отличающийся тем, что первая нуклеиновая кислота содержит SEQ ID NO: 14.
[0340] Вариант реализации 132 представляет собой способ по любому из вариантов реализации 18-27, отличающийся тем, что первая нуклеиновая кислота кодирует антиген HER2, имеющий по меньшей мере 90%, 95%, 97%, 98% или 99% идентичности с полноразмерной SEQ ID NO: 13.
[0341] Вариант реализации 133 представляет собой способ по любому из вариантов реализации 18-29, отличающийся тем, что первая нуклеиновая кислота кодирует антиген HER2, при этом первая нуклеиновая кислота имеет по меньшей мере 90%, 95%, 97%, 98% или 99% идентичности с полноразмерной SEQ ID NO: 14.
[0342] Вариант реализации 134 представляет собой способ по любому из вариантов реализации 18-27, отличающийся тем, что первая нуклеиновая кислота кодирует антиген HER2, имеющий по меньшей мере 90%, 95%, 97%, 98% или 99% идентичности с полноразмерной SEQ ID NO: 1.
[0343] Вариант реализации 135 представляет собой способ по любому из вариантов реализации 18-29, отличающийся тем, что первая нуклеиновая кислота кодирует антиген HER2, при этом первая нуклеиновая кислота имеет по меньшей мере 90%, 95%, 97%, 98% или 99% идентичности с полноразмерной SEQ ID NO: 2.
[0344] Вариант реализации 136 представляет собой способ по любому из вариантов реализации 34-36, отличающийся тем, что первая нуклеиновая кислота кодирует антиген HER2, имеющий по меньшей мере 90%, 95%, 97%, 98% или 99% идентичности с полноразмерной SEQ ID NO: 3.
[0345] Вариант реализации 137 представляет собой способ по любому из вариантов реализации 18-29, отличающийся тем, что первая нуклеиновая кислота кодирует антиген HER2, при этом первая нуклеиновая кислота имеет по меньшей мере 90%, 95%, 97%, 98% или 99% идентичности с полноразмерной SEQ ID NO: 4.
[0346]
ПРИМЕРЫ
[0347] Следующие примеры иллюстрируют данное изобретение, но не должны восприниматься как ограничивающие каким-либо образом объем формулы изобретения.
Пример 1: Внутривенное введение рекомбинантного MVA приводит к более сильной активации NK-клеток
[0348] Мышей линии C57BL/6 подкожно (п/к) или внутривенно (в/в) иммунизировали 5×107 ТКИД50 MVA-OVA (показан как rMVA) или MVA-OVA-CD40L (показан как rMVA-CD40L). ФСБ вводили п/к. Через одни сутки, используя метод проточной цитометрии, оценивали частоту NK-клеток и белковую экспрессию (приведенную в виде геометрической средней интенсивности флуоресценции (ГСИФ)) в селезенке (проиллюстрировано на Фиг. 1A-1G), в печени (проиллюстрировано на Фиг. 2A-2G) и в легких (проиллюстрировано на Фиг. 3A-3G) путем окрашивания в отношении A) NKp46+ CD3- клеток; B) CD69; C) NKG2D; D) FasL; E); Bcl-XL; F), CD70; и G) IFN-γ.
[0349] Дополнительно, мышей линии C57BL/6 подкожно (п/к) или внутривенно (в/в) иммунизировали 5 × 107 ТКИД50 рекомбинантного MVA, кодирующего антигены HER2, TWIST и CD40L (показан как MVA-HER2-TWIST-CD40L). ФСБ вводили п/к. Через одни сутки, используя метод проточной цитометрии, оценивали частоту NK-клеток и белковую экспрессию (приведенную в виде геометрической средней интенсивности флуоресценции (ГСИФ)) в селезенке (проиллюстрировано на Фиг. 4A-4F), в печени (проиллюстрировано на Фиг. 5A-5F) и в легких (проиллюстрировано на Фиг. 6A-6F) путем окрашивания в отношении A) NKp46+ CD3- клеток; B) CD69; C) FasL; D); Bcl-XL; E), CD70; и F) IFN-γ.
[0350] Как проиллюстрировано на фигурах, частота NK-клеток падала или сохранялась после инъекции rMVA, rMVA-CD40L и MVA-HER2-TWIST-CD40L вне зависимости от пути введения. На A) в/в применение rMVA повышало частоту NK-клеток в печени и селезенке по сравнению с п/к применением. На B) CD69 представляет собой стимулирующий рецептор для NK-клеток (Borrego et al., Immunology 1999) и характеризуется сильно повышенной экспрессией после в/в, но не п/к инъекции rMVA, rMVA-CD40L и MVA-HER2-TWIST-CD40L. Наибольшую экспрессию CD69 индуцировало в/в применение rMVA-CD40L. На Фиг. 1-3C) наблюдается повышенная экспрессия активирующего лектин-подобного рецептора С-типа NKG2D на NK-клетках после иммунизации rMVA и rMVA-CD40L по сравнению с обработкой ФСБ. На Фиг. 1-3(D) и Фиг. 4-6(C) наблюдается повышенная экспрессия апоптоз-индуцирующего фактора FasL (CD95L) на NK-клетках после иммунизации rMVA и rMVA-CD40L по сравнению с обработкой ФСБ. На Фиг. 1-3(D) и Фиг. 4-6(C) экспрессия FasL в селезенке и легких была наибольшей после в/в инъекции rMVA-CD40L и MVA-HER2-TWIST-CD40L. На Фиг. 1-3(E) и 4-6(D) в/в иммунизация rMVA-CD40L и MVA-HER2-TWIST-CD40L также приводила к более высокой экспрессии представителя анти-апоптотического семейства Bcl, Bcl-xL, по сравнению с п/к иммунизацией. На Фиг. 1-3(F) и 4-6(E) повышение экспрессии костимулирующей молекулы CD70, представителя суперсемейства факторов некроза опухолей (TNF), индуцируется в/в инъекцией rMVA, rMVA-CD40L и MVA-HER2-TWIST-CD40L, в особенности на NK-клетках селезенки. На Фиг. 1-3(G) и 4-6(F), что важно, эффекторный цитокин IFN-γ наиболее сильно экспрессируется после в/в иммунизации rMVA-CD40L или в/в иммунизации MVA-HER2-TWIST-CD40L в селезенке, легких и печени. Эти данные показывают, что в/в иммунизация любым из rMVA-CD40L или MVA-HER2-TWIST-CD40L, но не п/к иммунизация, приводит к сильной, системной активации NK-клеток.
Пример 2: Внутривенное введение рекомбинантного MVA-CD40L приводит к более сильной системной активации NK-клеток
[0351] Мышей линии C57BL/6 в/в иммунизировали 5×107 ТКИД50 MVA-OVA (rMVA), MVA-OVA-CD40L (rMVA-CD40L) или ФСБ. Через шесть часов после инъекции проводили количественное определение сывороточных уровней цитокинов (A) IFN-γ, (B) IL-12p70 и (C) CD69+ гранзим B+ методом анализа с гранулами (Luminex) (A и B) и проточной цитометрии (C), как проиллюстрировано на Фиг. 7A-7F. Активирующий NK-клетки цитокин IL-12p70 подлежал обнаружению только после иммунизации rMVA-CD40L. Концентрация IFN-γ была выше после rMVA-CD40L по сравнению с иммунизацией rMVA. Повышенные сывороточные уровни IFN-γ согласуются с большей ГСИФ IFN-γ NK-клеток (по сравнению с Фиг. 1G) и более высокой частотой CD69+ гранзим B+ NK-клеток в селезенке через 48 часов после иммунизации rMVA-CD40L.
[0352] Аналогичные ответы наблюдали у ОЧП (Macaca fascicularis) после в/в инъекции MVA-MARV-GP-huCD40L, а именно, более высокие сывороточные концентрации IFN-γ (D) и IL-12p40/70 (E), а также больше пролиферирующих (Ki67+) NK-клеток (F) по сравнению с MVA-MARV-GP. Эти данные демонстрируют, что кодирующие CD40L вакцины на основе MVA имеют сравнимые иммунологические свойства у мышей и ОЧП.
Пример 3: Внутривенное введение приводит к более сильной активации и пролиферации NK-клеток в течение времени
[0353] Мышей линии C57BL/6 в/в иммунизировали 5 × 107 ТКИД50 MVA-OVA (rMVA), MVA-OVA-CD40L (rMVA-CD40L) или ФСБ. Активацию и пролиферацию NK-клеток определяли для (A) CD3- CD19-NKp46+, (B), Ki67 и (C) CD69 в селезенке, печени и легких через 1 сутки и 4 суток после иммунизации. Результаты проиллюстрированы на Фиг. 8.
[0354] Как проиллюстрировано на Фиг. 8A), частота NK-клеток в селезенке (определенных как CD3- CD19-NKp46+) временно падала на 1 сутки после иммунизации rMVA и rMVA-CD40L, как видно в примере 1, но повышалась на 4 сутки по сравнению с ФСБ. В печени и легких оба вектора индуцировали более высокую частоту NK-клеток уже на 1 сутки. Неожиданно на 4 сутки частота NK-клеток в печени была в 2,4 раза выше после иммунизации rMVA и в 4 раза выше после иммунизации rMVA-CD40L по сравнению с ФСБ. Аналогично, частота NK-клеток в легких и крови была резко повышена на 4 сутки после иммунизации, как проиллюстрировано на 8А. В соответствии с системным повышением количества NK-клеток более 80% всех NK-клеток на 4 сутки после иммунизации rMVA и rMVA-CD40L находились в процессе пролиферации, на что указывает экспрессия маркера пролиферации Ki67 на 8B. Пик экспрессии CD69 (приведенной в виде геометрической средней интенсивности флуоресценции (ГСИФ)) во всех анализируемых органах приходился на 1 сутки. На 4 сутки после иммунизации экспрессия CD69 возвращалась к исходному уровню (Фиг. 8C).
Пример 4: Внутривенное введение рекомбинантного MVA приводит к более сильной активации опосредованной NK-клетками токсичности
[0355] Мышей линии C57BL/6 в/в иммунизировали 5×107 ТКИД50 MVA-OVA (rMVA), MVA-OVA-CD40L (rMVA-CD40L) или ФСБ. 24 часа спустя мышей умерщвляли, а NK-клетки селезенки очищали методом магнитной сортировки клеток и использовали в качестве эффекторов в анализе уничтожения эффектор:мишень. Вкратце, NK-клетки культивировали с CFSE-меченными дефицитными по ГКГС класса I клетками YAC-1 в соотношениях, указанных на Фиг. 9. Специфическое уничтожение оценивали путем количественного определения нежизнеспособных CFSE+ клеток YAC-1 методом проточной цитометрии. В результате активированные rMVA и rMVA-CD40L NK-клетки после в/в иммунизации эффективно уничтожают дефицитные по ГКГС класса I клетки-мишени.
Пример 5: Внутривенное введение рекомбинантного MVA приводит к усиленной АЗКЦ
[0356] Как проиллюстрировано на Фиг. 10A, мышей линии C57BL/6 обрабатывали в/в 25 мкг анти-CD4 (клон GK1.5), MVA-OVA (rMVA) + 5 мкг крысиного IgG2b или 1 мкг анти-CD4 или MVA-OVA (rMVA) + 1 мкг анти-CD4. 24 часа спустя мышей умерщвляли и анализировали истощение CD4 T-клеток (CD3+CD4+) в печени методом проточной цитометрии. По определению 25 мкг анти-CD4 соответствовали 100% специфического уничтожения. В сравнении с rMVA+IgG2b (по определению 0% специфического уничтожения) 1 мкг анти-CD4 приводил к истощению 61% всех CD4 T-клеток печени. Комбинация rMVA+1 мкг анти-CD4 приводила к истощению 93% CD4 T-клеток, что почти так же эффективно, как и 25 мкг анти-CD4. Таким образом, комбинация rMVA и вызывающих истощение антител приводит к синергетическому уничтожению клеток-мишеней in vivo.
[0357] Как проиллюстрировано на Фиг. 10B и 10C, чтобы оценить АЗКЦ-активность NK-клеток ex vivo, мышей линии C57BL/6 (B) или Balb/c (C) иммунизировали в/в ФСБ, MVA-OVA (rMVA) или MVA-OVA-CD40L (rMVA-CD40L). 24 часа спустя мышей умерщвляли; NK-клетки селезенки очищали методом магнитной сортировки клеток и использовали в качестве эффекторов в анализе антителозависимого уничтожения эффектор:мишень. (B) Клетки-мишени B16.F10 покрывали мышиным mAb против человеческого/мышиного Trp1 (клон TA99), а (C) клетки-мишени CT26-HER2 покрывали мышиным mAb против человеческого HER2 (клон 7.16.4). Очищенные NK-клетки добавляли к покрытым антителом клеткам-мишеням в соотношении 5:1 и 4:1 соответственно. Гибель клеток определяли, измеряя высвобождение лактатдегидрогеназы (ЛДГ) в клеточную культуральную среду. В обоих анализах лизис клеток-мишеней был сильнее, когда NK-клетки были активированы in vivo rMVA или rMVA-CD40L по сравнению с ФСБ. Активация rMVA-CD40L приводила к наибольшей литической активности. Клетки CT26-HER2, которые инкубировали с разными концентрациями антитела против человеческого HER2 (от 0,1 до 10 мкг/мл анти-HER2), также более эффективно уничтожались активированными rMVA-CD40L NK-клетками по сравнению с активированными rMVA NK-клетками (проиллюстрировано на D).
[0358] Как проиллюстрировано на Фиг. 10E, ex vivo активность АЗКЦ NK-клеток анализировали, используя MVA-HER2-Twist-CD40L. Мышей линии Balb/c иммунизировали в/в ФСБ или MVA-HER2-Twist-CD40L. Клетки CT26-HER2 покрывали 5, 0,5 и 0,05 мкг/мл мышиного mAb против человеческого HER2 (клон 7.16.4). Очищенные NK-клетки добавляли к покрытым антителом клеткам-мишеням в соотношении 5:1. Гибель клеток определяли, измеряя высвобождение лактатдегидрогеназы (ЛДГ) в клеточную культуральную среду. Лизис клеток-мишеней был сильнее, когда NK-клетки были активированы in vivo MVA-HER2-Twist-CD40L по сравнению с ФСБ.
[0359] Таким образом, АЗКЦ-опосредованное уничтожение опухолевых клеток, экспрессирующих соответствующие опухолевые антигены, можно усилить за счет опосредованной rMVA и, в особенности rMVA-CD40L и MVA-HER2-Twist-CD40L, активации NK-клеток. Кроме того, усиленную rMVA и, в особенности rMVA-CD40L и MVA-HER2-Twist-CD40L, активность АЗКЦ наблюдали в широком диапазоне доз антитела.
Пример 6: Внутривенное введение рекомбинантного MVA индуцирует сильные ответы CD8 T-клеток
[0360] Мышей линии C57BL/6 иммунизировали в/в или п/к 5×107 ТКИД50 MVA-OVA на 0 и 16 сутки. На 7 и 22 сутки методом проточной цитометрии оценивали ответы OVA-специфических CD8 T-клеток в крови после окрашивания декстрамерами H-2Kb/OVA257-264. Как проиллюстрировано на Фиг. 11, на 7 сутки частота OVA-специфических CD8 T-клеток была в 9 раз выше по сравнению с п/к инъекциями. На 22 сутки количество OVA-специфических T-клеток было в 4 раза выше, чем после п/к инъекций.
Пример 7: Внутривенное введение рекомбинантного MVA-CD40L индуцирует сильные ответы CD8 T-клеток
[0361] Как проиллюстрировано на Фиг. 12, мышей линии C57BL/6 внутривенно иммунизировали 5×107 ТКИД50 MVA-OVA или MVA-OVA-CD40L на 0 и 35 сутки. Методом проточной цитометрии оценивали ответы OVA-специфических CD8 T-клеток в крови после окрашивания декстрамерами H-2Kb/OVA257-264. На пике первичного (7 сутки) и вторичного (39 сутки) ответа частота OVA-специфических CD8 T-клеток была повышена в 4 раза и 2 раза, соответственно, после иммунизации MVA-OVA-CD40L по сравнению с MVA-OVA (Lauterbach et al., 2013).
Пример 8: Прайм-буст иммунизация демонстрирует повторную активацию и пролиферацию NK-клеток
Таблица 1. Схема в/в иммунизации для примеров 8-10
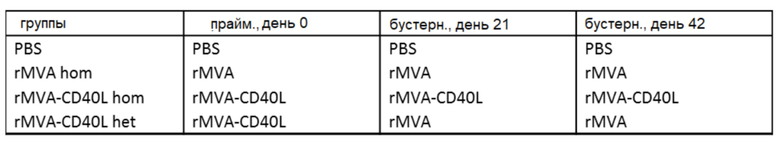
[0362] Мышей линии C57BL/6 в/в иммунизировали, как показано в таблице 1 (дозы рекомбинантного MVA составляли 5×107 ТКИД50). NK-клетки (CD3- NKp46+) анализировали в крови методом проточной цитометрии через одни и четверо суток после второй и третьей иммунизации. На Фиг. 13A и 13B проиллюстрированы ГСИФ CD69 (A) и частота Ki67+ NK-клеток (B). На Фиг. 13A и 13B проиллюстрировано, что активация NK-клеток происходит после каждой иммунизации, несмотря на наличие иммунитета против вектора. Это неожиданное открытие свидетельствует в пользу комбинированной терапии на основе антител с бустерными иммунизациями, которые активируют NK-клетки. Таким образом, когда онкологических пациентов лечат некоторое количество раз рекомбинантным MVA и у них вырабатываются ответы против вектора, активация NK-клеток остается не нарушенной. Наоборот, каждый этап лечения приводит к активации NK-клеток de novo.
Пример 9: Прайм-буст иммунизация демонстрирует более сильную индукцию хелперных CD4 T-клеток
[0363] Мышей линии C57BL/6 в/в иммунизировали, как показано в таблице 1 (дозы рекомбинантного MVA составляли 5×107 ТКИД50). Количественное определение сывороточных уровней цитокинов проводили через 6 часов после иммунизации методом многоканального анализа с гранулами (Luminex). Приведены результаты по экспрессии указанных цитокинов. 14A) IL-6; 14B) CXCL10; 14C) IFN-α; 14D) IL-22; 14E) IFN-γ; 14F) CXCL1; 14G) CCL4; 14H) CCL7; 14I) CCL2; 14J) CCL5; 14K) TNF-α; 14L) IL-12p70; и 14M) IL-18.
[0364] Как проиллюстрировано на Фиг. 14A-14M, мыши, обработанные rMVA-CD40L по гомологичной схеме, имели аналогичный профиль цитокинов с мышами, которым вводили примирующую инъекцию rMVA и бустерную инъекцию rMVA-CD40L (rMVA-CD40L het). Обработанные rMVA по гомологичной схеме мыши демонстрировали меньше уровни IL-6, IL12p70, IL-22, IFN-α, TNF-α, CCL2, CCL5 и CXCL1 после первой и второй иммунизации по сравнению с мышами, примированными rMVA-CD40L. Цитокином, который отсутствовал после первичной, но вырабатывался на высоком уровне после второй и третьей иммунизации, был IL-22. IL-22 в большом количестве вырабатывается эффекторными хелперными Т-клетками и субпопуляциями лимфоцитов врожденной иммунной системы. Более высокая экспрессия IL-22 у обработанных rMVA-CD40L het или rMVA-CD40L hom мышей, таким образом, указывает на более сильную индукцию ответов CD4 T-хелперов при иммунизации rMVA-CD40L. В целом, в/в иммунизация rMVA и rMVA-CD40L индуцировала высокие системные ответы цитокинов, которые были наивысшими у мышей, примированных rMVA-CD40L.
Пример 10: Прайм-буст иммунизация демонстрирует более сильные ответы антиген-специфических CD8 T-клеток
[0365] Мышей линии C57BL/6 в/в иммунизировали, как показано в таблице 1 (дозы рекомбинантного MVA составляли 5 × 107 ТКИД50). Аналогично NK-клеткам, оценивали индукцию антиген-специфических ответов CD8 T-клеток после повторной иммунизации. Как проиллюстрировано на Фиг. 15, частота CD8 T-клеток резко возрастала после второй и третьей иммунизации rMVA и rMVA-CD40L. Следует отметить, что после второй иммунизации около 80% всех ЛПК представляли собой CD8 T-клетки (A). Хотя вектор-специфический ответ (B8) CD8 T-клеток имел пик после второй иммунизации (B), трансген-специфические (OVA) ответы можно дополнительно усиливать с помощью третьей иммунизации (C). Это привело к повышению соотношения OVA/B8-специфических CD8 T-клеток (D), что указывает на иммунное фокусирование на трансгене. Что важно, эти результаты демонстрируют, что антиген-специфические ответы Т-клеток можно усиливать с помощью в/в иммунизации при наличии иммунитета к вектору. Таким образом, у онкологических пациентов некоторое количество этапов лечения может приводить к более сильным антиген-специфическим ответам CD8 Т-клеток.
Пример 11: Прайм-буст иммунизация демонстрирует более сильные ответы CD8 и CD4 T-клеток памяти
[0366] Мышей линии C57BL/6 в/в иммунизировали, как показано в таблице 1. Результаты проиллюстрированы на Фиг. 16. Фенотипически, эффекторные Т-клетки и эффекторные Т-клетки памяти можно идентифицировать по экспрессии CD44 и отсутствию поверхностного CD62L. Определение CD44+ CD62L- CD8 (A) и CD4 (B) Т-клеток в крови продемонстрировало, что повторная в/в иммунизация индуцирует размножение эффекторных Т-клеток и эффекторных Т-клеток памяти. Что интересно, мыши, получавшие rMVA-CD40L hom или rMVA-CD40L het, имели в около 2,5 раза больше эффекторных CD4 T-клеток в циркуляции, чем мыши, примированные rMVA (B, 25 сутки). Это указывает на то, что системное примирование rMVA-CD40L индуцирует более сильные ответы CD4 T-клеток, чем rMVA.
Пример 12: Внутривенное введение рекомбинантного MVA приводит к сильному противоопухолевому эффекту при лечении меланомы
[0367] Мышей линии C57BL/6, несущих пальпируемые опухоли B16.OVA, примировали (пунктирная линия) ФСБ, MVA-OVA (rMVA) или MVA-OVA-CD40L (rMVA-CD40L) п/к или в/в (дозы рекомбинантного MVA составляли 5×107 ТКИД50). На 7 и 14 сутки после первичной иммунизации мыши получали последующие бустерные инъекции FPV-OVA при 5×107 ТКИД50 (штрихпунктирные линии). Рост опухоли измеряли через равные интервалы. На Фиг. 17 проиллюстрированы средний объем опухоли (A) и выживаемость несущих опухоли мышей на 45 сутки после инокуляции опухоли (B). Таким образом, в/в примирование несущих опухоли B16.OVA мышей rMVA-CD40L обеспечивает более сильный противоопухолевый эффект по сравнению с п/к rMVA-CD40L или п/к или в/в rMVA.
Пример 13: Одно внутривенное введение рекомбинантного MVA приводит к сильному противоопухолевому эффекту
[0368] Мышей линии C57BL/6, несущих пальпируемые опухоли B16.OVA, в/в вакцинировали, как показано в таблице 2. Рост опухоли измеряли через равные интервалы. На Фиг. 18 проиллюстрирован средний объем опухоли. Полученные результаты указывают на то, что одна терапевтическая иммунизация rMVA-CD40L по эффективности равна гомологичной или гетерологичной прайм/буст иммунизациям. Что важно, эти данные подчеркивают сильную противоопухолевую активность rMVA-CD40L.
Таблица 2. Схема вакцинации соответствует примеру 13
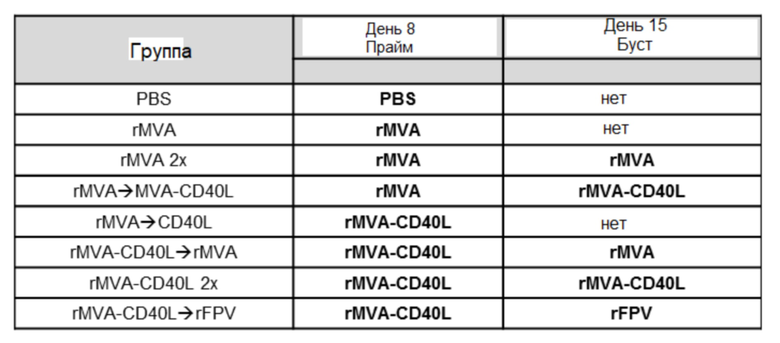
Пример 14: CD8 T-клетки важны для опосредованного rMVA-CD40L подавления опухоли
[0369] Мышей линии C57BL/6, несущих пальпируемые опухоли B16.OVA, иммунизировали путем внутривенного введения ФСБ, MVA-OVA (rMVA) или MVA-OVA-CD40L (rMVA-CD40L) (дозы рекомбинантного MVA составляли 5107 ТКИД50). Мыши получали внутрибрюшинные инъекции 200 мкг анти-CD8 антитела, если это указано. Как проиллюстрировано на Фиг. 19, иммунизация rMVA-CD40L индуцировала более сильный общий ответ CD8 T-клеток (A), а также более сильные специфические к неоантигену (OVA) ответы CD8 T-клеток (B) по сравнению с rMVA. C) представляет общую выживаемость. Эти данные указывают на то, что rMVA-CD40L индуцирует превосходящие ответы CD8 T-клеток в условиях опухоли и что индуцированные ответы CD8 T-клеток важны для противоопухолевого эффекта, наблюдаемого после терапевтической иммунизации.
Пример 15: В/в введение рекомбинантного MVA, кодирующего по меньшей мере два ОАА, является более эффективным
[0370] Мышей линии C57BL/6, несущих пальпируемые опухоли B16.OVA, иммунизировали в/в ФСБ, MVA-OVA-TRP2, MVA-OVA-TRP2-CD40L или MVA-OVA-CD40L. Как проиллюстрировано на Фиг. 20, рост опухоли измеряли через равные интервалы и представляли в виде среднего диаметра для отдельной мыши (A) и среднего объема (B). Выживаемость проиллюстрирована на (C). Эти данные указывают на то, что одна терапевтическая иммунизация rMVA-CD40L, кодирующим два ОАА, является более эффективной, чем иммунизация rMVA-CD40L, кодирующим только один ОАА.
Пример 16: Внутривенное введение рекомбинантного MVA-CD40L повышало инфильтрацию T-клеток в опухолевое микроокружение
[0371] Мышей линии C57BL/6, несущих пальпируемые опухоли B16.OVA, внутривенно иммунизировали ФСБ, rMVA (MVA-OVA) или rMVA-CD40L (MVA-OVA-CD40L) (дозы рекомбинантного MVA составляли 5×107 ТКИД50). Через 7 суток мышей умерщвляли. Как проиллюстрировано на Фиг. 21A и 21 B, частоту и распределение CD8+ T-клеток и OVA257-264-специфических CD8+ T-клеток анализировали среди лейкоцитов в селезенке, дренирующих опухоль лимфатических узлах (ДОЛУ) и опухолевых тканях. Как проиллюстрировано на Фиг. 21C, анализировали геометрическую среднюю интенсивность флуоресценции (ГСИФ) PD-1 и Lag3 на инфильтрирующих опухоль OVA257-264-специфических CD8+ T-клетках; на Фиг. 21D приведены репрезентативные пунктирные графики экспрессии Ki67 и PD-1 инфильтрирующих опухоль CD8+ T-клеток. На Фиг. 21E проиллюстрированы частоты инфильтрирующих опухоль Ki67+ CD8+ T-клеток и ГСИФ PD-1; на Фиг. 21F проиллюстрирована частота инфильтрирующих опухоль T-клеток (Treg) среди лейкоцитов. На Фиг. 21G проиллюстрирована частота инфильтрирующих опухоль PD-1выс. и PD-1отр. Treg. Вместе эти данные показывают, что иммунизация rMVA-CD40L приводит к более выраженной инфильтрации ОАА-специфических CD8 T-клеток в опухолевое микроокружение (ОМО) и что эти CD8 T-клетки экспрессируют меньшие количества маркеров, связанных с «иммунным истощением», по сравнению с иммунизацией ФСБ и rMVA. Кроме того, иммунизация rMVA-CD40L приводит к снижению количества высокосупрессивных Treg в ОМО по сравнению с ФСБ.
Пример 17: Внутривенное введение рекомбинантного MVA-CD40L повышало продолжительность инфильтрации T-клеток в опухолевое микроокружение
[0372] ТКР-трансгенные OVA-специфические CD8 T-клетки (OT-I) внутривенно переносили несущим опухоль B16.OVA мышам, когда опухоли становились пальпируемыми. Когда опухоли достигали по меньшей мере 60 мм3 в объеме, животных иммунизировали MVA-BN, MVA-OVA (rMVA) или MVA-OVA-CD40L (rMVA-CD40L) (дозы рекомбинантного MVA составляли 5107 ТКИД50). Через 17 суток мышей умерщвляли и анализировали в отношении A) частоты CD8+ T-клеток среди лейкоцитов в опухолевых тканях; B) частоты Lag3+ PD1+ среди CD8+ T-клеток; C) частоты Eomes+ PD1+ T-клеток среди CD8+ T-клеток; D) присутствия OT-I-трансгенных CD8+ T-клеток в ОМО после иммунизации; и E) частоты истощенных в отношении Lag3+ PD1+ T-клеток среди OT-I+ CD8+ T-клеток; и F) частоты истощенных в отношении Eomes+ PD1+ T-клеток среди OT-I+ CD8+ T-клеток. Результаты проиллюстрированы на Фиг. 22. Эти данные показывают, что ОАА-специфические CD8 T-клетки, рекрутированные в ОМО после иммунизации rMVA-CD40L, демонстрируют меньше признаков иммунного истощения, чем после контрольной обработки (MVA-BN без кодируемого ОАА) или иммунизации rMVA даже после длительного воздействия ОМО.
Пример 18: Внутривенное введение рекомбинантного MVA-CD40L снижало уровни Treg в опухолевом микроокружении
[0373] Очищенные OVA-специфические ТКР-трансгенные CD8 T-клетки (OT-I) внутривенно переносили несущим опухоль B16.OVA мышам, когда опухоли становились пальпируемыми. Когда опухоли достигали по меньшей мере 60 мм3 в объеме, животных иммунизировали MVA-BN, MVA-OVA (rMVA) или MVA-OVA-CD40L (rMVA-CD40L) (дозы рекомбинантного MVA составляли 5×107 ТКИД50). Через 17 суток мышей умерщвляли и проводили анализ в отношении: A) частоты Foxp3+ CD4+ Treg среди CD4+ T-клеток в опухолевых тканях; и B) соотношения CD8+ CD44+ эффекторных T-клеток к Foxp3+ CD4+ Treg. Результаты проиллюстрированы на Фиг. 23. Вместе эти данные показывают, что даже после длительного воздействия ОМО одна иммунизация rMVA-CD40L приводит к повышению соотношения Teff/Treg по сравнению с контрольной обработкой (MVA-BN без кодируемого ОАА) или иммунизацией rMVA.
Пример 19: MVA-OVA-CD40L более безопасен для людей по сравнению с агонистическим CD40 mAb
Таблица 3. Схема иммунизации для примера 19
[0374] Мышей линии C57BL/6 в/в инъецировали ФСБ, MVA-OVA (rMVA), MVA-OVA-CD40L (rMVA-CD40L) или анти-CD40 (FGK4.5), как показано в таблице 3 (дозы рекомбинантного MVA составляли 5×107 ТКИД50, доза анти-CD40 составляла 100 мкг). Сывороточную концентрацию аланинаминотрансферазы (АЛТ) определяли через одни сутки после каждой иммунизации методом ELISA. Как проиллюстрировано на Фиг. 24, уровни АЛТ были наибольшими после первой инъекции анти-CD40. Концентрация АЛТ после первой иммунизации rMVA-CD40L была в 2 раза ниже, чем после обработки анти-CD40. Что важно, сывороточные уровни АЛТ после повторной иммунизации rMVA и rMVA-CD40L не были повышены. Хотя повторная инъекция анти-CD40 также не приводила к повышению уровней АЛТ, 3 из 4 мышей в этой группе погибли (НМ=найдены мертвыми). Также, как проиллюстрировано на Фиг. 21, наблюдали более низкие сывороточные уровни аланинаминотрансферазы (АЛТ) после иммунизации rMVA и rMVA-CD40L по сравнению с инъекцией анти-CD40 иммуноглобулина. Таким образом, в отличие от описанной печеночной токсичности агонистического анти-CD40 (Medina-Echeverz et al., 2015), такой токсичности не наблюдали после повторной в/в инъекции rMVA и rMVA-CD40L.
Пример 20: Повышение общей выживаемости и уменьшение опухоли после в/в введения rMVA-CD40L
[0375] Мышей линии Balb/c, несущих пальпируемые опухоли CT26.HER2, иммунизировали в/в MVA-AH1A5-p15-TRP2-CD40L (rMVA-CD40L), или же они получали ФСБ. Рост опухоли измеряли через равные интервалы. На Фиг. 25 проиллюстрированы средний объем опухоли (A) и выживаемость (B). Эти данные указывают на то, что одна терапевтическая иммунизация rMVA-CD40L эффективно продлевает выживаемость в модели рака толстой кишки.
Пример 21: Повышение общей выживаемости и уменьшение опухоли при в/в введении rMVA-CD40L+анти-Trp1
[0376] Мышей линии C57BL/6, несущих пальпируемые опухоли B16.OVA (объемом по меньшей мере 60 мм3), внутривенно иммунизировали MVA-OVA-CD40L (mBNbc115) при 5×107 ТКИД50 на 8 сутки. Мышам внутрибрюшинно инъецировали 200 мкг анти-Trp1 (клон TA99) дважды в неделю, начиная с 5 суток. На Фиг. 26A и 26B проиллюстрированы результаты по среднему объему опухоли и общему уровню выживаемости соответственно. Как проиллюстрировано на фигурах, комбинация rMVA-CD40L и анти-Trp1 mAb демонстрировала общее снижение объема опухоли и повышение общего уровня выживаемости по сравнению с анти-Trp1 mAb и rMVA-CD40L по отдельности. Таким образом, внутривенно вводимая комбинация опухолеспецифического антитела и rMVA-CD40L имела существенно большую противоопухолевую активность по сравнению с не-в/в введением rMVA-CD40L или введением одного антитела.
Пример 22: Конструирование рекомбинантных MVA-вирусов MVA-mBN445, MVA-mBN451, MVA-mBNbc197, MVA-mBNbc195, MVA-mBNbc388, MVA-mBN bc389 и MVA-mBN484
[0377] Создание рекомбинантных вирусов MVA, которые являются частью комбинированной терапии (например, MVA-mBN445, MVA-mBN451 и MVA-mBN484), осуществляли путем вставки указанных трансгенов с их промоторами в вектор MVA-BN. Трансгены вставляли, используя рекомбинационные плазмиды, содержащие трансгены и селекционную кассету, а также последовательности, гомологичные целевым локусам в MVA-BN. Гомологичную рекомбинацию между вирусным геномом и рекомбинационной плазмидой обеспечивали путем трансфекции рекомбинационной плазмиды в инфицированные MVA-BN клетки CEF. Затем на втором этапе селекционную кассету удаляли с помощью плазмиды, экспрессирующей CRE-рекомбиназу, которая специфически нацелена на сайты loxP, фланкирующие селекционную кассету, вырезая, таким образом, промежуточную последовательность.
[0378] Для конструирования MVA-BN mBNbc197 и MVA-BN mBNbc195 использовали рекомбинационные плазмиды для двух или трех трансгенов для mBNbc197 (MVA-OVA-TRP2) и mBNbc195 (MVA-OVA-TRP2-CD40L) соответственно. Включенные плазмиды вставляют последовательности, которые также присутствуют в MVA. Нуклеотидные последовательности, кодирующие антигены OVA и TRP2 и/или CD40L, находились между вставленными последовательностями MVA, чтобы сделать возможной рекомбинацию в вирусный геном MVA. Таким образом, для каждой конструкции конструировали плазмиду, которая содержала кодирующие последовательности OVA и TRP2 и/или CD40L, каждая ниже промотора.
[0379] Для конструирования mBN451 рекомбинационная плазмида содержала два трансгена HER2v1 и Brachyury (SEQ ID NO: 1 и SEQ ID NO: 3 соответственно), каждому из которых предшествовала промоторная последовательность, а также последовательности, идентичные целевому сайту вставки в MVA-BN, чтобы сделать возможной гомологичную рекомбинацию в вирусный геном. Кодирующие последовательности HER2 и Brachyury (или нуклеотидные последовательности) представляют собой SEQ ID NO: 2 и SEQ ID NO: 4 соответственно.
[0380] Для конструирования mBN445 рекомбинационная плазмида содержала три трансгена HER2v1, Brachyury и CD40L (SEQ ID NO: 1, SEQ ID NO: 3 и SEQ ID NO: 11 соответственно), каждому из которых предшествовала промоторная последовательность, а также последовательности, идентичные целевому сайту вставки в MVA-BN, чтобы сделать возможной гомологичную рекомбинацию в вирусный геном. Кодирующие последовательности HER2, Brachyury и CD40L (или нуклеотидные последовательности) представляют собой SEQ ID NO: 2, SEQ ID NO: 4 и SEQ ID NO: 12 соответственно.
[0381] Для конструирования mBNbc388 рекомбинационная плазмида содержала три трансгена HER2v1, Twist и CD40L (SEQ ID NO: 1, SEQ ID NO: 15 и SEQ ID NO: 17 соответственно), каждому из которых предшествовала промоторная последовательность, а также последовательности, идентичные целевому сайту вставки в MVA-BN, чтобы сделать возможной гомологичную рекомбинацию в вирусный геном. Кодирующие последовательности HER2v1, Twist и CD40L (или нуклеотидные последовательности) представляют собой SEQ ID NO: 2, SEQ ID NO: 16 и SEQ ID NO: 18 соответственно.
[0382] Для конструирования mBNbc389 рекомбинационная плазмида содержала два трансгена HER2v1 и Twist (SEQ ID NO: 1, SEQ ID NO: 15 соответственно), каждому из которых предшествовала промоторная последовательность, а также последовательности, идентичные целевому сайту вставки в MVA-BN, чтобы сделать возможной гомологичную рекомбинацию в вирусный геном. Кодирующие последовательности HER2, Twist и CD40L (или нуклеотидные последовательности) представляют собой SEQ ID NO: 2 и SEQ ID NO: 16 соответственно.
[0383] Для конструирования mBN484 рекомбинационная плазмида содержала три трансгена HER2 v.2, Brachyury и CD40L (SEQ ID NO: 13, SEQ ID NO: 3 и SEQ ID NO: 11 соответственно), каждому из которых предшествовала промоторная последовательность, а также последовательности, идентичные целевому сайту вставки в MVA-BN, чтобы сделать возможной гомологичную рекомбинацию в вирусный геном. Кодирующие последовательности HER2 v.2, Brachyury и CD40L (или нуклеотидные последовательности) представляют собой SEQ ID NO: 14, SEQ ID NO: 4 и SEQ ID NO: 12 соответственно.
[0384] Для создания всех вышеописанных mBN MVA (например, mBN445, mBN451 и mBN484) культуры клеток CEF, каждую, инокулировали MVA-BN и трансфицировали соответствующей рекомбинационной плазмидой. В свою очередь, образцы из этих клеточных культур инокулировали в культуры CEF в среду, содержащую лекарственные препараты, индуцирующие селективное давление, а флуоресцентные вирусные клоны выделяли путем очищения на основе бляшкообразования. Исчезновение содержащей флуоресцентный белок селекционной кассеты из этих вирусных клонов было опосредовано на втором этапе CRE-опосредованной рекомбинацией, в которой участвовали два сайта loxP, фланкирующие селекционную кассету в каждой конструкции. После второго этапа рекомбинации оставались только трансгенные последовательности (например, HER2, Brachyury и/или CD40L) с промоторами, вставленными в целевые локусы MVA-BN. Готовили запас очищенного методом бляшкообразования вируса без селекционной кассеты.
[0385] После этого экспрессию идентифицированных трансгенов демонстрировали в клетках, инокулированных описанной конструкцией (смотрите, например, Фиг. 27).
[0386] Создание MVA-mBNbc197, mBNbc195, mBNbc388 и mBNbc389 проводили, используя клонированную версию MVA-BN в бактериальной искусственной хромосоме (БИХ). Использовали рекомбинационные плазмиды, содержащие разные трансгены для mBNbc197 (MVA-Ova-Trp2), mBNbc195 (MVA-Ova-Trp2-CD40L), mBNbc388 и mBNbc389. Эти плазмиды содержали последовательности, которые также присутствуют в MVA и, следовательно, позволяют проводить специфическое нацеливание на сайт интеграции. Нуклеотидные последовательности, кодирующие антигены OVA, Her2 v1, Twist, Trp2 и/или CD40L находились между последовательностями MVA, чтобы сделать возможной рекомбинацию в вирусный геном MVA. Таким образом, для каждой конструкции конструировали плазмиду, которая содержала кодирующие последовательности OVA, Her2 v1, Twist, Trp2 и/или CD40L, каждая ниже промотора. Вкратце, инфекционные вирусы восстанавливали из БИХ путем трансфекции ДНК БИХ в клетки BHK-21 и суперинфекции их вирусом фибромы Шоупа в качестве хелперного вируса. После трех дополнительных пассажей на культурах клеток CEF получали не содержащие хелперный вирус MVA-mBNbc197, MVA-mBNbc195, MVA-mBNbc388 и MVA-mBNbc389. Типовой способ создания MVA также можно найти в Baur et al., "Immediate-early expression of a recombinant antigen by modified vaccinia virus Ankara breaks the immunodominance of strong vector-specific B8R antigen in acute and memory CD8 T-cell responses,". Virol. 84(17):8743-52 (2010).
Пример 23: Гетерологичная экспрессия MVA-HER2-Brachyury-CD40L
[0387] Клетки HeLa оставляли без обработки (контроль) или инфицировали MVA-BN или MVA-HER2-Brachyury-CD40L (MVA-mBN445). После культивирования в течение ночи клетки окрашивали анти-HER2-APC (клон 24D2), анти-Brachyury (кроличье поликлональное) + анти-кроличьим IgG-PE и анти-CD40L-APC (клон TRAP1). Как проиллюстрировано на Фиг. 27A-27D, анализ методом проточной цитометрии выявил экспрессию всех трех трансгенов.
Пример 24: Синтетические белки HER2 предотвращают связывание трастузумаба и пертузумаба
[0388] Клетки карциномы толстой кишки мышей CT26 инфицировали MVA-HER2-Brachyury-CD40L (MVA-mBN484) при МЗ 1. Через 24 часа клетки инкубировали с 5 мкг/мл антител к HER2 трастузумаба, пертузумаба или 24D2. На фигурах проиллюстрированы уровни экспрессии HER2, нормализованные относительно окрашивания HER2 клона 24D2. Данные приведены как среднее ± СПС и представляют два независимых эксперимента. Результаты проиллюстрированы на Фиг. 28.
Пример 25: Усиленная активация человеческих ДК MVA-HER2-Brachyury-CD40L
[0389] Моноцитарные дендритные клетки (ДК) создавали после обогащения CD14+ моноцитов из человеческих МКПК и культивировали в течение 7 суток в присутствии GM-CSF и IL-4 в соответствии с протоколом (Miltenyi, набор для создания MO-DC). ДК стимулировали MVA-HER2-Brachyury или MVA-HER2-Brachyury-CD40L. Как проиллюстрировано на Фиг. 29, экспрессию A) CD40L; B) CD86 и C) ГКГС класса II анализировали методом проточной цитометрии. Как проиллюстрировано на D), концентрацию IL-12p70 в супернатанте определяли с помощью luminex после культивирования в течение ночи.
[0390] Этот эксперимент демонстрирует, что rMVA-HER2-Brachyury-CD40L стимулирует человеческие ДК, индуцируя их активацию и, таким образом, повышая их способность презентировать антигены. Выработка поляризующего Th1 и активирующего NK-клетки цитокина IL-12p70 стимулированными человеческими ДК указывает на то, что MVA-HER2-Brachyury-CD40L активирует человеческие ДК в направлении провоспалительного фенотипа.
Пример 26: Повышение общей выживаемости и уменьшение опухоли при внутривенном введении mBNbc388 и mBNbc389
[0391] Клетки карциномы толстой кишки мышей MC38, экспрессирующие HER2 (MC38.HER2), п/к инъецировали мышам линии C57BL/6. Клетки карциномы толстой кишки мышей CT26, экспрессирующие HER2 (CT26.HER2), п/к инъецировали мышам линии Balb/c. В обеих группах мышей, когда опухоли имели объем более 50 мм3, мышей, несущих опухоли MC38.HER2 (Фиг. 30A и 30B) и опухоли CT26.HER2 (Фиг. 31A и Фиг. 31B), иммунизировали (пунктирная линия) ФСБ, MVA-CD40L или MVA-HER2-Twist-CD40L IV. Рост опухоли измеряли через равные интервалы. На A) измеряли средний объем опухоли, а на B) проиллюстрирована общая выживаемость несущих опухоли мышей на 60 сутки после инокуляции опухоли.
[0392] Так как мышиный гомолог Brachyury не экспрессируется на высоком уровне в нормальных тканях мышей и не экспрессируется преимущественно в опухолевых тканях мышей, эффективность Brachyury в качестве мишени для активной иммунотерапии невозможно эффективно изучать в мышиной модельной системе. Смотрите WO 2014/043535, которая включена в данный документ посредством ссылки. Twist, мышиный гомолог человеческого Brachyury, используют в мышиных моделях, и он является прогнозной моделью функции Brachyury у людей. Это было продемонстрировано в WO 2014/043535. Как и Brachyury, мышиный гомолог регулятора EMT Twist стимулирует EMT во время развития путем снижения опосредованной E-кадгерином межклеточной адгезии и повышения экспрессии мезенхимальных маркеров и экспрессируется преимущественно в опухолевой ткани мышей. Смотрите, например, Фиг. 5 и пример 8 в WO 2014/043535. Следовательно, исследование Twist-специфической противораковой вакцины у мышей с большой вероятностью будет иметь существенное прогнозное значение в отношении эффективности Brachyury-специфической противораковой вакцины у людей. Id.
Пример 27: Внутривенное введение MVA-HER2-Twist-CD40L (mBNbc388) усиливает инфильтрацию HER2-специфических CD8+ T-клеток в опухоли.
[0393] Мыши линии Balb/c, несущие опухоли CT26.HER2, внутривенно получали ФСБ или 5×107 ТКИД50 MVA-HER2-Twist-CD40L. Через семь суток мышей умерщвляли, методом магнитной сортировки клеток выделяли селезеночные и инфильтрирующие опухоль CD8+ T-клетки и культивировали в присутствии нагруженных пептидом HER2 дендритных клеток в течение 5 часов. На графиках показана процентная доля CD44+ IFN-γ+ клеток среди CD8+ T-клеток. Результаты приведены как среднее ± СПС. Результаты, проиллюстрированные на Фиг. 32, демонстрируют, что различные варианты реализации настоящего изобретения являются опухолеспецифическими.
Пример 28: Повышение общей выживаемости и уменьшение опухоли при внутривенном введении mBNbc388 и mBNbc389 в комбинации с трастузумабом
[0394] Мыши линии Balb/c, несущие опухоли CT26.HER2 со средним объемом более 100 мм3, внутрибрюшинно получали 5 мкг человеческого IgG1 или трастузумаба на 15 сутки после инокуляции опухоли. Через 2 суток после первой инъекции человеческого IgG1 или трастузумаба мыши внутривенно получали ФСБ или 5×107 ТКИД50 MVA-HER2-Twist-CD40L, как проиллюстрировано на Фиг. 31. В этом примере человеческий IgG1 используют в качестве экспериментального контроля для трастузумаба, поскольку IgG1 не связывает HER2 как трастузумаб. Рост опухоли и общее время выживаемости измеряли через равные интервалы. (A) Средний объем опухоли и (B) выживаемость мышей со временем.
[0395] Как проиллюстрировано на Фиг. 33 (A) и (B), комбинация MVA-HER2-Twist-CD40L с трастузумабом была исключительно эффективной для уменьшения более крупных опухолей и увеличения общего уровня выживаемости мышей с такими крупными опухолями даже при сниженной дозировке антитела по сравнению с примером 21.
Пример 29: Общая выживаемость и уменьшение опухоли при в/в введении MVA-HER2-Twist-CD40L в модели ортотопического рака молочной железы
[0396] Мышей линии Balb/c, несущих ортотопические опухоли 4T1.HER2, примируют в/в 5×107 ТКИД50 MVA-HER2-Twist (mBNbc389) и/или MVA-HER2-Twist-CD40L (mBNbc388). Рост опухоли необходимо измерять через равные интервалы и записывать общую выживаемость.
Пример 30: Сильная опосредованная NK-клетками токсичность при в/в введении MVA-HER2-Twist-CD40L+анти-HER2
[0397] Мышей линии C57BL/6 в/в иммунизируют 5×107 ТКИД50 MVA-HER2-Twist, MVA-HER2-Twist плюс анти-Her2 или ФСБ. 24 часа спустя мышей умерщвляют, а NK-клетки селезенки очищают методом магнитной сортировки клеток и используют в качестве эффекторов в анализе уничтожения эффектор:мишень. Вкратце, NK-клетки культивируют с CFSE-меченными дефицитными по ГКГС класса I клетками YAC-1 в соотношениях, указанных в примере 4. Специфическое уничтожение оценивают путем количественного определения нежизнеспособных CFSE+ клеток YAC-1 методом проточной цитометрии.
Пример 31: В/в введение MVA-HER2-Twist-CD40L+анти-HER2 усиливает АЗКЦ
[0398] Мышей линии C57BL/6 обрабатывают в/в 25 мкг анти-CD4, MVA-HER2-TWIST-CD40L+5 мкг крысиного IgG2b или 1 мкг анти-CD4 или MVA-HER2-TWIST-CD40L+1 мкг анти-CD4. 24 часа спустя мышей умерщвляют, а истощение CD4 T-клеток (CD3+CD4+) в печени анализируют методом проточной цитометрии. По определению 25 мкг анти-CD4 соответствовали 100% специфического уничтожения.
[0399] Чтобы оценить АЗКЦ-активность NK-клеток ex vivo, мышей линии C57BL/6 (B) или Balb/c (C) иммунизируют в/в ФСБ, MVA-HER2-TWIST или MVA-HER2-TWIST-CD40L. 24 часа спустя мышей умерщвляют; NK-клетки селезенки очищают методом магнитной сортировки клеток и используют в качестве эффекторов в анализе антителозависимого уничтожения эффектор:мишень. (B) Клетки-мишени MC38-HER2 покрывают мышиным mAb против человеческого/мышиного HER2 . Клетки-мишени CT26-HER2 покрывают мышиным mAb против человеческого HER2. Очищенные NK-клетки добавляют к покрытым антителом клеткам-мишеням в соотношении 5:1 и 4:1 соответственно. Гибель клеток определяют, измеряя высвобождение лактатдегидрогеназы (ЛДГ) в клеточную культуральную среду.
Пример 32: Повышение общей выживаемости и уменьшение опухоли при в/в введении rMVA-CD40+анти-HER2 при снижающихся концентрациях антитела к HER2
[0400] Мышей линии Balb/c, несущих пальпируемые опухоли CT26-HER2, иммунизируют в/в MVA-HER2-Twist -CD40L при 5×107 ТКИД50 на 8 сутки. Мышам внутрибрюшинно инъецируют снижающиеся дозы анти-HER2 (200 мкг, 100 мкг, 25 мкг) дважды в неделю, начиная с 5 суток. Средний объем опухоли и общий уровень выживаемости анализируют в сравнении с мышами, которым инъецируют только 200 мкг анти-HER2 антитела, и мышами, которым инъецируют только MVA-HER2-TWIST-CD40L.
Пример 33: Повышение общей выживаемости и уменьшение опухоли при в/в введении rMVA-CD40L+анти-CD52 антитела.
[0401] Мыши линии Balb/c, несущие опухоли CT26.CD52, внутрибрюшинно получают 5 мкг человеческого IgG1 или анти-CD52 (алемтузумаб) после инокуляции опухоли. После первой инъекции человеческого IgG1 или алемтузумаба мыши внутривенно получают ФСБ или 5×107 ТКИД50 MVA-CD52-CD40L. Рост опухоли и общее время выживаемости измеряют через равные интервалы. (A) Средний объем опухоли и (B) выживаемость мышей со временем.
Пример 34: Повышение общей выживаемости и уменьшение опухоли при в/в введении rMVA-CD40L+анти-EGFR антитела.
[0402] Мыши линии Balb/c, несущие опухоли CT26.EGFR, внутрибрюшинно получают 5 мкг человеческого IgG1 или анти-EGFR (цетуксимаб) после инокуляции опухоли. После первой инъекции человеческого IgG1 или цетуксимаба мыши внутривенно получают ФСБ или 5×107 ТКИД50 MVA-EGFR-CD40L. Рост опухоли и общее время выживаемости измеряют через равные интервалы. (A) Средний объем опухоли и (B) выживаемость мышей со временем.
[0403] Следует понимать, что определенные детали описанных в данном документе способов и композиций можно варьировать или модифицировать, не отступая от сущности описанного изобретения. Мы заявляем, что все такие модификации и вариации соответствуют сущности и объему приведенной ниже формулы изобретения.
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
Нуклеотидные и аминокислотные последовательности, перечисленные в приложенном перечне последовательностей, приведены с помощью стандартных буквенных обозначений для нуклеотидных оснований и однобуквенного или трехбуквенного кода для аминокислот по определению 37 C.F.R. 1.822. Приведена только одна цепь каждой последовательности нуклеиновой кислоты, но подразумевается, что комплементарная цепь включена в приведенную цепь любой ссылкой.
SEQ ID NO:1
Аминокислотная последовательность синтетического Her2 v1 (1145 аминокислот):
MELAALCRWGLLLALLPPGAASTQVCTGTDMKLRLPASPETHLDMLRHLYQGCQVVQGNLELTYLPTNASLSFLQDIQEVQGYVLIAHNQVRQVPLQRLRIVRGTQLFEDNYALAVLDNGDPLNNTTPVTGASPGGLRELQLRSLTEILKGGVLIQRNPQLCYQDTILWKDIFHKNNQLALTLIDTNRSRACHPCSPMCKGSRCWGESSEDCQSLTRTVCAGGCARCKGPLPTDCCHEQCAAGCTGPKHSDCLACLHFNHSGICELHCPALVTYNTRTFKSMPNPEGRYTFGASCVTACPYNYLSTDVGSCTLVCPAANQEVTAEDGTQRCEKCSKPCARVCYGLGMEHLREVRAVTSANIQEFAGCKKIFGSLAFLPESFDGDPASNTAPLQPEQLQVFETLEEITGYLYISAWPDSLPDLSVFQNLQVIRGRILHNGAYSLTLQGLGISWLGLRSLRELGSGLALIHHNTHLCFVHTVPWDQLFRNPHQALLHTANRPEDECVGEGLACHQLCARGHCWGPGPTQCVNCSQFLRGQECVEECRVLQGLPREYVNARHCLPCHPECQPQNGSVTCFGPAADQCVACAHYKDPPACVARCPSGVKPDLSYMPIWAFPDEEGACQPCPINCTHSCVDLDDKGCPAEQRASPLTSIISAVVGILLVVVLGVVFGILIKRRQQKIRKYTMRRLLQETELVEPLTPSGAMPNQAQMRILKETELRKVKVLGSGAFGTVYKGIWIPDGENVKIPVAIMVLRENTSPKANKEILDEAYVMAGVGSPYVSRLLGICLTSTVQLVTQLMPYGCLLDHVRENRGRLGSQDLLNWCMQIAKGMSYLEDVRLVHRDLAARNVLVKSPNHVKITDFGLARLLDIDETEYHADGGKVPIKWMALESILRRRFTHQSDVWSYGVTVWELMTFGAKPYDGIPAREIPDLLEKGERLPQPPICTIDVYMIMVKCWMIDSECRPRFRELVSEFSRMARDPQRFVVIQNEDLGPASPLDSTFYRSLLEDDDMGDLVDAEEALVPQQGFFCPDPAPGAGGMVHHRHRSSSTRSGGGDLTLGLEPSEEEAPRSPLAPSEGAGSDVFDGDLGMGAAKGLQSLPTHDPSPLQRYSEDPTVPLPSETDGYVAPLTCSPQPELGLDVPV
SEQ ID NO:2
Нуклеотидная последовательность синтетического Her2 v1 (3441 нуклеотидов):
atggaactggctgctctgtgtagatggggactgctgcttgctctgttgcctcctggagctgcttctacccaagtgtgcacaggcaccgacatgaagctgagactgcctgcttctcctgagacacacctggacatgctgagacacctgtaccagggatgtcaggtggtgcagggaaatctggaactgacctacctgcctaccaacgccagcctgagctttctgcaggacatccaagaggtgcagggatacgtgctgatcgctcacaatcaagtgagacaggtgccactgcagaggctgagaatcgttagaggcacccagctgttcgaggacaactatgctctggctgtgctggacaatggcgaccctctgaacaacaccacacctgtgacaggagcttctcctggtggactgagagaactgcagctgagaagcctgaccgagatcctgaaaggaggagtgctgatccagcggaaccctcagctgtgctaccaggacaccatcctgtggaaggacatcttccacaagaacaaccagctggctctgacactgatcgacaccaacagaagcagagcctgccatccttgctctcccatgtgcaagggctctagatgttggggagagagcagcgaggattgccagagcctgaccagaacagtgtgtgctggaggatgtgccagatgcaaaggacctctgcctaccgactgctgccacgagcaatgtgcagctggatgtacaggaccaaagcactctgattgcctggcctgcctgcacttcaaccactctggaatctgcgagctgcactgtcctgctctggtcacctacaacacacggaccttcaagagcatgcctaatcctgaaggcagatacacctttggagccagctgtgtgacagcctgtccttacaactacctgagcaccgacgtgggcagctgcacactcgtttgtcctgctgccaatcaagaagtgacagccgaggacggcacccagagatgcgagaagtgtagcaagccttgcgctagagtgtgttacggactcggcatggaacacctgagagaagtgagagccgtgaccagtgccaacatccaagagtttgctggctgcaagaagatctttggcagcctcgccttcctgcctgagagcttcgatggcgatcctgccagcaatactgctcctctgcagcctgaacagctccaggtgttcgagacactggaagagatcacaggctacctgtacatcagcgcatggccagacagcctgcctgacctgtccgtgttccagaacctgcaagtgatcagaggcagaatcctgcacaacggagcctattctctgaccctgcaaggcctgggaatcagctggctgggactgagatccctgagagagcttggatctggcctggctctgatccaccacaatacccacctgtgcttcgtgcacaccgtgccttgggaccagctgtttcggaatcctcatcaggctctgctgcacacagccaacagacctgaggatgagtgtgttggcgaaggcctggcttgtcaccagctctgtgctagaggacactgttggggacctggacctacacagtgtgtgaactgtagccagttcctgagaggccaagaatgcgtggaagagtgtagagttctgcagggactgcctcgcgagtacgtgaacgctagacactgtctgccttgtcatcccgagtgccagcctcagaatggcagcgtgacatgttttggaccagctgccgatcagtgcgtggcctgtgctcactataaggaccctccagcctgcgtggccagatgtcctagcggagtgaagcctgacctgagctacatgcccatctgggcatttccagatgaggaaggagcttgccagccttgtcctatcaactgcacccacagctgcgtggacctggacgataagggatgtccagccgagcagagagcctctccactgacctctatcatctctgccgtcgtgggcatcctgctggtggtggttctgggagttgtgttcggcatcctgatcaagagacggcagcagaagatccggaagtacaccatgcggagactgctgcaagagactgagctggtggaacctctgacacccagcggagctatgcctaaccaggctcagatgcggattctgaaagaaaccgagctgcggaaagtgaaggtgctcggctctggagcctttggcacagtgtacaaaggcatctggatccctgacggagagaacgtgaagattcctgtggccatcatggtgctgagagagaacacaagtcccaaggccaacaaagagatcctggacgaggcctacgtgatggctggtgttggcagcccttatgtgtctagactgctgggcatctgtctgaccagcaccgtgcagctggtcactcagctgatgccttacggctgcctgctggatcacgtgagagagaatagaggcagactgggctctcaggacctgctgaactggtgcatgcagatcgccaagggcatgagctacctcgaggatgtgagactggtccacagagatctggctgccagaaacgtgctcgtgaagtctcctaaccacgtgaagatcaccgacttcggactggctaggctgctggatatcgacgagacagagtaccacgctgatggaggcaaggtgcccatcaagtggatggctctggaatccatcctgagacggagattcacccaccagtccgatgtgtggtcttacggagtgacagtgtgggagctgatgaccttcggagccaagccttacgacggcatccctgccagagagatcccagatctgctggaaaagggagagagactgcctcagcctcctatctgcaccatcgacgtgtacatgattatggtcaagtgttggatgatcgacagcgagtgcagacccagattcagagaactggtgtccgagttctctcggatggccagagatcctcagagattcgtggtcatccagaacgaggatctgggacctgccagccctctggacagcaccttctacagatccctgctggaagatgacgacatgggtgacctggtggacgctgaagaagctctggttcctcagcagggcttcttctgccctgatcctgctccaggagcaggtggaatggtgcatcacagacacagaagctccagcaccagaagcggaggcggagatctgacactgggactcgagccatctgaggaagaggctcctagatctcctctggctccttctgaaggagctggaagcgacgttttcgacggagatcttggaatgggagctgccaaaggactccagtctctgcccacacacgacccatctccactgcagagatacagcgaggaccctaccgtgcctctgccaagcgagacagatggatatgtggcacctctgacctgctctcctcagccagaactgggacttgatgtgcctgtttgatga
SEQ ID NO:3
Аминокислотная последовательность синтетического Brachyury (427 аминокислот):
MSSPGTESAGKSLQYRVDHLLSAVENELQAGSEKGDPTERELRVGLEESELWLRFKELTNEMIVTKNGRRMFPVLKVNVSGLDPNAMYSFLLDFVAADNHRWKYVNGEWVPGGKPEPQAPSCVYIHPDSPNFGAHWMKAPVSFSKVKLTNKLNGGGQIMLNSLHKYEPRIHIVRVGGPQRMITSHCFPETQFIAVTAYQNEEITALKIKYNPFAKAFLDAKERSDHKEMMEEPGDSQQPGYSQWGWLLPGTSTLCPPANPHPQFGGALSLPSTHSCDRYPTLRSHYAHRNNSPTYSDNSPACLSMLQSHDNWSSLGMPAHPSMLPVSHNASPPTSSSQYPSLWSVSNGAVTPGSQAAAVSNGLGAQFFRGSPAHYTPLTHPVSAPSSSGSPLYEGAAAATDIVDSQYDAAAQGRLIASWTPVSPPSM
SEQ ID NO:4
Нуклеотидная последовательность синтетического Brachyury (1287 нуклеотидов):
atgtctagccctggcacagagtctgctggcaagagcctccagtacagagtggaccatctgctgagcgctgtggagaatgaactgcaggctggaagcgagaagggagatcctacagaaagagagctgagagtcggactggaagagtccgagctgtggctgcggttcaaagaactgaccaacgagatgatcgtgaccaagaacggcagacggatgttccctgtgctgaaagtgaacgtgtccggactggaccctaacgccatgtacagctttctgctggatttcgtggcagctgacaaccacagatggaagtacgtgaacggagagtgggtgccaggaggaaaacctgaacctcaggctcctagctgcgtgtacattcaccctgacagccctaacttcggagcccactggatgaaggctcctgtgtccttcagcaaagtgaagctgaccaacaagctgaacggaggaggccagatcatgctgaacagcctgcacaagtatgagcctaggatccacatcgtcagagttggaggccctcagcggatgatcaccagccactgtttccctgagacacagttcatcgcagtgaccgcttaccagaacgaggaaatcacagccctgaagatcaagtacaatcccttcgccaaggccttcctggacgccaaagagcggagcgaccacaaagaaatgatggaagaacctggcgacagccagcagcctggctattctcaatggggatggctgctgccaggcacctccacattgtgccctccagccaatcctcatcctcagtttggcggagccctgagcctgcctagcacacacagctgcgacagataccctacactgagaagccactacgctcacagaaacaacagccctacctacagcgacaatagccctgcctgtctgagcatgctgcagtcccacgacaattggtccagcctgggaatgcctgctcacccttctatgctgcctgtctctcacaacgcctctccacctacaagcagctctcagtaccctagcctttggagcgtgtccaatggagctgtgacacctggatctcaggctgccgctgtgtctaatggactgggagcccagttcttcagaggcagccctgctcactacacacctctgacacatccagtgtctgctcctagcagcagcggaagccctctctatgaaggagccgctgcagccaccgacatcgtggattctcagtatgatgctgccgcacagggcagactgatcgcctcttggacacctgtgagcccaccttccatgtgatga
SEQ ID NO:5 (435 ак)
Изоформа 1 белка Brachyury, номер доступа GenBank № O15178.1
MSSPGTESAGKSLQYRVDHLLSAVENELQAGSEKGDPTERELRVGLEESELWLRFKELTNEMIVTKNGRRMFPVLKVNVSGLDPNAMYSFLLDFVAADNHRWKYVNGEWVPGGKPEPQAPSCVYIHPDSPNFGAHWMKAPVSFSKVKLTNKLNGGGQIMLNSLHKYEPRIHIVRVGGPQRMITSHCFPETQFIAVTAYQNEEITALKIKYNPFAKAFLDAKERSDHKEMMEEPGDSQQPGYSQWGWLLPGTSTLCPPANPHPQFGGALSLPSTHSCDRYPTLRSHRSSPYPSPYAHRNNSPTYSDNSPACLSMLQSHDNWSSLGMPAHPSMLPVSHNASPPTSSSQYPSLWSVSNGAVTPGSQAAAVSNGLGAQFFRGSPAHYTPLTHPVSAPSSSGSPLYEGAAAATDIVDSQYDAAAQGRLIASWTPVSPPSM
SEQ ID NO:6 (1308 нт)
Кодирующая последовательность для изоформы 1 белка Brachyury, номер доступа GenBank № O15178.1
atgagcagccctggcacagagagcgccggcaagagcctgcagtaccgggtggaccatctgctgagcgccgtggagaatgagctgcaggccggctccgagaagggcgaccccaccgagagggaactgagagtgggcctggaagagtccgagctgtggctgcggttcaaagaactgaccaacgagatgatcgtgaccaagaacggcagacggatgttccccgtgctgaaagtgaacgtgtccggcctggaccccaacgccatgtacagctttctgctggacttcgtggccgccgacaaccacaggtggaaatacgtgaacggcgagtgggtgccaggcggcaaacctgagcctcaggcccccagctgcgtgtacatccaccccgacagccccaatttcggcgcccactggatgaaggcccccgtgtccttcagcaaagtgaagctgaccaacaagctgaacggcggaggccagatcatgctgaacagcctgcacaagtacgagccccggatccacattgtgcgcgtgggcggaccccagagaatgatcaccagccactgcttccccgagacacagtttatcgccgtgaccgcctaccagaacgaggaaatcaccgccctgaagatcaagtacaaccccttcgccaaggccttcctggacgccaaagagcggagcgaccacaaagaaatgatggaagaacccggcgacagccagcagcctggctacagccagtggggctggctgctgccaggcacctccactctgtgcccccctgccaaccctcaccctcagttcggcggagccctgagcctgcctagcacacacagctgcgacagataccccaccctgcggagccacagaagcagcccctaccccagcccatacgcccaccggaacaacagccccacctacagcgacaactcccccgcctgcctgagcatgctgcagagccacgacaactggtccagcctgggcatgcctgcccaccctagcatgctgcccgtgtcccacaatgccagcccccctaccagcagctcccagtaccctagcctgtggagcgtgtccaatggcgccgtgacacctggatctcaggccgctgccgtgagcaatggcctgggagcccagttctttagaggcagccctgcccactacacccctctgacccaccctgtgtccgcccctagctccagcggcagccctctgtatgaaggcgccgctgcagccaccgatatcgtggacagccagtacgatgccgccgctcagggcagactgatcgccagctggacccccgtgtctccccccagcatgtga
SEQ ID NO:7 (435 ак)
Изоформа 1 белка Brachyury (L254V).
MSSPGTESAGKSLQYRVDHLLSAVENELQAGSEKGDPTERELRVGLEESELWLRFKELTNEMIVTKNGRRMFPVLKVNVSGLDPNAMYSFLLDFVAADNHRWKYVNGEWVPGGKPEPQAPSCVYIHPDSPNFGAHWMKAPVSFSKVKLTNKLNGGGQIMLNSLHKYEPRIHIVRVGGPQRMITSHCFPETQFIAVTAYQNEEITALKIKYNPFAKAFLDAKERSDHKEMMEEPGDSQQPGYSQWGWLLPGTSTVCPPANPHPQFGGALSLPSTHSCDRYPTLRSHRSSPYPSPYAHRNNSPTYSDNSPACLSMLQSHDNWSSLGMPAHPSMLPVSHNASPPTSSSQYPSLWSVSNGAVTPGSQAAAVSNGLGAQFFRGSPAHYTPLTHPVSAPSSSGSPLYEGAAAATDIVDSQYDAAAQGRLIASWTPVSPPSM
SEQ ID NO:8 (1308 нт)
Кодирующая последовательность, кодирующая изоформу 1 белка Brachyury с L254V
atgagctcccctggcaccgagagcgcgggaaagagcctgcagtaccgagtggaccacctgctgagcgccgtggagaatgagctgcaggcgggcagcgagaagggcgaccccacagagcgcgaactgcgcgtgggcctggaggagagcgagctgtggctgcgcttcaaggagctcaccaatgagatgatcgtgaccaagaacggcaggaggatgtttccggtgctgaaggtgaacgtgtctggcctggaccccaacgccatgtactccttcctgctggacttcgtggcggcggacaaccaccgctggaagtacgtgaacggggaatgggtgccggggggcaagccggagccgcaggcgcccagctgcgtctacatccaccccgactcgcccaacttcggggcccactggatgaaggctcccgtctccttcagcaaagtcaagctcaccaacaagctcaacggagggggccagatcatgctgaactccttgcataagtatgagcctcgaatccacatagtgagagttgggggtccacagcgcatgatcaccagccactgcttccctgagacccagttcatagcggtgactgcttatcagaacgaggagatcacagctcttaaaattaagtacaatccatttgcaaaggctttccttgatgcaaaggaaagaagtgatcacaaagagatgatggaggaacccggagacagccagcaacctgggtactcccaatgggggtggcttcttcctggaaccagcaccgtttgtccacctgcaaatcctcatcctcagtttggaggtgccctctccctcccctccacgcacagctgtgacaggtacccaaccctgaggagccaccggtcctcaccctaccccagcccctatgctcatcggaacaattctccaacctattctgacaactcacctgcatgtttatccatgctgcaatcccatgacaattggtccagccttggaatgcctgcccatcccagcatgctccccgtgagccacaatgccagcccacctaccagctccagtcagtaccccagcctgtggtctgtgagcaacggcgccgtcaccccgggctcccaggcagcagccgtgtccaacgggctgggggcccagttcttccggggctcccccgcgcactacacacccctcacccatccggtctcggcgccctcttcctcgggatccccactgtacgaaggggcggccgcggccacagacatcgtggacagccagtacgacgccgcagcccaaggccgcctcatagcctcatggacacctgtgtcgccaccttccatgtga
SEQ ID NO:9 (449 ак)
Слитый белок Brachyury-I3
MKNNLYEEKMNMSKKSSPGTESAGKSLQYRVDHLLSAVENELQAGSEKGDPTERELRVGLEESELWLRFKELTNEMIVTKNGRRMFPVLKVNVSGLDPNAMYSFLLDFVAADNHRWKYVNGEWVPGGKPEPQAPSCVYIHPDSPNFGAHWMKAPVSFSKVKLTNKLNGGGQIMLNSLHKYEPRIHIVRVGGPQRMITSHCFPETQFIAVTAYQNEEITALKIKYNPFAKAFLDAKERSDHKEMMEEPGDSQQPGYSQWGWLLPGTSTVCPPANPHPQFGGALSLPSTHSCDRYPTLRSHRSSPYPSPYAHRNNSPTYSDNSPACLSMLQSHDNWSSLGMPAHPSMLPVSHNASPPTSSSQYPSLWSVSNGAVTPGSQAAAVSNGLGAQFFRGSPAHYTPLTHPVSAPSSSGSPLYEGAAAATDIVDSQYDAAAQGRLIASWTPVSPPSM
SEQ ID NO:10 (1350 нт)
Кодирующая последовательность, кодирующая слитый белок I3-Brachyury с SEQ ID NO 9.
atgaaaaataacttgtatgaagaaaaaatgaacatgagtaagaaaagctcccctggcaccgagagcgcgggaaagagcctgcagtaccgagtggaccacctgctgagcgccgtggagaatgagctgcaggcgggcagcgagaagggcgaccccacagagcgcgaactgcgcgtgggcctggaggagagcgagctgtggctgcgcttcaaggagctcaccaatgagatgatcgtgaccaagaacggcaggaggatgtttccggtgctgaaggtgaacgtgtctggcctggaccccaacgccatgtactccttcctgctggacttcgtggcggcggacaaccaccgctggaagtacgtgaacggggaatgggtgccggggggcaagccggagccgcaggcgcccagctgcgtctacatccaccccgactcgcccaacttcggggcccactggatgaaggctcccgtctccttcagcaaagtcaagctcaccaacaagctcaacggagggggccagatcatgctgaactccttgcataagtatgagcctcgaatccacatagtgagagttgggggtccacagcgcatgatcaccagccactgcttccctgagacccagttcatagcggtgactgcttatcagaacgaggagatcacagctcttaaaattaagtacaatccatttgcaaaggctttccttgatgcaaaggaaagaagtgatcacaaagagatgatggaggaacccggagacagccagcaacctgggtactcccaatgggggtggcttcttcctggaaccagcaccgtttgtccacctgcaaatcctcatcctcagtttggaggtgccctctccctcccctccacgcacagctgtgacaggtacccaaccctgaggagccaccggtcctcaccctaccccagcccctatgctcatcggaacaattctccaacctattctgacaactcacctgcatgtttatccatgctgcaatcccatgacaattggtccagccttggaatgcctgcccatcccagcatgctccccgtgagccacaatgccagcccacctaccagctccagtcagtaccccagcctgtggtctgtgagcaacggcgccgtcaccccgggctcccaggcagcagccgtgtccaacgggctgggggcccagttcttccggggctcccccgcgcactacacacccctcacccatccggtctcggcgccctcttcctcgggatccccactgtacgaaggggcggccgcggccacagacatcgtggacagccagtacgacgccgcagcccaaggccgcctcatagcctcatggacacctgtgtcgccaccttccatgtga
SEQ ID NO:11
hCD40L , NCBI RefSeq NP_000065.1. (261 аминокислота)
MIETYNQTSPRSAATGLPISMKIFMYLLTVFLITQMIGSALFAVYLHRRLDKIEDERNLHEDFVFMKTIQRCNTGERSLSLLNCEEIKSQFEGFVKDIMLNKEETKKENSFEMQKGDQNPQIAAHVISEASSKTTSVLQWAEKGYYTMSNNLVTLENGKQLTVKRQGLYYIYAQVTFCSNREASSQAPFIASLCLKSPGRFERILLRAANTHSSAKPCGQQSIHLGGVFELQPGASVFVNVTDPSQVSHGTGFTSFGLLKL
SEQ ID NO:12
hCD40L , NCBI RefSeq NP_000065.1. (789 нуклеотидов)
нт-последовательность:
atgatcgagacatacaaccagacaagccctagaagcgccgccacaggactgcctatcagcatgaagatcttcatgtacctgctgaccgtgttcctgatcacccagatgatcggcagcgccctgtttgccgtgtacctgcacagacggctggacaagatcgaggacgagagaaacctgcacgaggacttcgtgttcatgaagaccatccagcggtgcaacaccggcgagagaagtctgagcctgctgaactgcgaggaaatcaagagccagttcgagggcttcgtgaaggacatcatgctgaacaaagaggaaacgaagaaagagaactccttcgagatgcagaagggcgaccagaatcctcagatcgccgctcacgtgatcagcgaggccagcagcaagacaacaagcgtgctgcagtgggccgagaagggctactacaccatgagcaacaacctggtcaccctggagaacggcaagcagctgacagtgaagcggcagggcctgtactacatctacgcccaagtgaccttctgcagcaacagagaggccagctctcaggctcctttcatcgccagcctgtgcctgaagtctcctggcagattcgagcggattctgctgagagccgccaacacacacagcagcgccaaaccttgtggccagcagtctattcacctcggcggagtgtttgagctgcagcctggcgcaagcgtgttcgtgaatgtgacagaccctagccaggtgtcccacggcaccggctttacatctttcggactgctgaagctgtgatga
SEQ ID NO:13
Аминокислотная последовательность синтетического Her2 v2 (1145 аминокислот):
MELAALCRWGLLLALLPPGAASTQVCTGTDMKLRLPASPETHLDMLRHLYQGCQVVQGNLELTYLPTNASLSFLQDIQEVQGYVLIAHNQVRQVPLQRLRIVRGTQLFEDNYALAVLDNGDPLNNTTPVTGASPGGLRELQLRSLTEILKGGVLIQRNPQLCYQDTILWKDIFHKNNQLALTLIDTNRSRACHPCSPMCKGSRCWGESSEDCQSLTRTVCAGGCARCKGPLPTDCCHEQCAAGCTGPKHSDCLACLHFNHSGICELACPALVTYNTRTAKSMPNPEGRYTFGASCVTACPYNYLSTDAGACTLVCPAANQEVTAEDGTQRCEACSKACARVCYGLGMEHLREVRAVTSANIQEFAGCKKIFGSLAFLPESFDGDPASNTAPLQPEQLQVFETLEEITGYLYISAWPDSLPDLSVFQNLQVIRGRILHNGAYSLTLQGLGISWLGLRSLRELGSGLALIHHNTHLCFVHTVPWDQLFRNPHQALLHTANRPEDECVGEGLACHQLCARGHCWGPGPTQCVNCSQFLRGQECVEECRVLQGLPREYVNARHCLPCHPECQPQNGSVTCFGPAADQCVACAHYKDPPACVARCPSGVKPDLSYMPIWAFPDEEGACQPCPINCTHSCVDLDDKGCPAEQRASPLTSIISAVVGILLVVVLGVVFGILIKRRQQKIRKYTMRRLLQETELVEPLTPSGAMPNQAQMRILKETELRKVKVLGSGAFGTVYKGIWIPDGENVKIPVAIMVLRENTSPKANKEILDEAYVMAGVGSPYVSRLLGICLTSTVQLVTQLMPYGCLLDHVRENRGRLGSQDLLNWCMQIAKGMSYLEDVRLVHRDLAARNVLVKSPNHVKITDFGLARLLDIDETEYHADGGKVPIKWMALESILRRRFTHQSDVWSYGVTVWELMTFGAKPYDGIPAREIPDLLEKGERLPQPPICTIDVYMIMVKCWMIDSECRPRFRELVSEFSRMARDPQRFVVIQNEDLGPASPLDSTFYRSLLEDDDMGDLVDAEEALVPQQGFFCPDPAPGAGGMVHHRHRSSSTRSGGGDLTLGLEPSEEEAPRSPLAPSEGAGSDVFDGDLGMGAAKGLQSLPTHDPSPLQRYSEDPTVPLPSETDGYVAPLTCSPQPELGLDVPV
SEQ ID NO:14
Нуклеотидная последовательность синтетического Her2 v2 (3441 нуклеотидов):
atggaactggctgctctgtgtagatggggactgctgcttgctctgttgcctcctggagctgcttctacccaagtgtgcacaggcaccgacatgaagctgagactgcctgcttctcctgagacacacctggacatgctgagacacctgtaccagggatgtcaggtggtgcagggaaatctggaactgacctacctgcctaccaacgccagcctgagctttctgcaggacatccaagaggtgcagggatacgtgctgatcgctcacaatcaagtgagacaggtgccactgcagaggctgagaatcgttagaggcacccagctgttcgaggacaactatgctctggctgtgctggacaatggcgaccctctgaacaacaccacacctgtgacaggagcttctcctggtggactgagagaactgcagctgagaagcctgaccgagatcctgaaaggaggagtgctgatccagcggaaccctcagctgtgctaccaggacaccatcctgtggaaggacatcttccacaagaacaaccagctggctctgacactgatcgacaccaacagaagcagagcctgccatccttgctctcccatgtgcaagggctctagatgttggggagagagcagcgaggattgccagagcctgaccagaacagtgtgtgctggaggatgtgccagatgcaaaggacctctgcctaccgactgctgccacgagcaatgtgcagctggatgtacaggaccaaagcactctgattgcctggcctgcctgcacttcaaccactctggaatctgcgagctcgcctgtcctgctctggtcacctacaacacacggaccgccaagagcatgcctaatcctgaaggcagatacacctttggagccagctgtgtgacagcctgtccttacaactacctgagcaccgacgctggagcctgcacactcgtttgtcctgctgccaatcaagaagtgacggccgaggacggcacccagagatgcgaggcctgtagcaaggcttgcgctagagtgtgttacggactcggcatggaacacctgagagaagtgagagccgtgaccagtgccaacatccaagagtttgctggctgcaagaagatctttggcagcctcgccttcctgcctgagagcttcgatggcgatcctgccagcaatactgctcctctgcagcctgaacagctccaggtgttcgagacactggaagagatcacaggctacctgtacatcagcgcatggccagacagcctgcctgacctgtccgtgttccagaacctgcaagtgatcagaggcagaatcctgcacaacggagcctattctctgaccctgcaaggcctgggaatcagctggctgggactgagatccctgagagagcttggatctggcctggctctgatccaccacaatacccacctgtgcttcgtgcacaccgtgccttgggaccagctgtttcggaatcctcatcaggctctgctgcacacagccaacagacctgaggatgagtgtgttggcgaaggcctggcttgtcaccagctctgtgctagaggacactgttggggacctggacctacacagtgtgtgaactgtagccagttcctgagaggccaagaatgcgtggaagagtgtagagttctgcagggactgcctcgcgagtacgtgaacgctagacactgtctgccttgtcatcccgagtgccagcctcagaatggcagcgtgacatgttttggaccagctgccgatcagtgcgtggcctgtgctcactataaggaccctccagcctgcgtggccagatgtcctagcggagtgaagcctgacctgagctacatgcccatctgggcatttccagatgaggaaggagcttgccagccttgtcctatcaactgcacccacagctgcgtggacctggacgataagggatgtccagccgagcagagagcctctccactgacctctatcatctctgccgtcgtgggcatcctgctggtggtggttctgggagttgtgttcggcatcctgatcaagagacggcagcagaagatccggaagtacaccatgcggagactgctgcaagagactgagctggtggaacctctgacacccagcggagctatgcctaaccaggctcagatgcggattctgaaagaaaccgagctgcggaaagtgaaggtgctcggctctggagcctttggcacagtgtacaaaggcatctggatccctgacggagagaacgtgaagattcctgtggccatcatggtgctgagagagaacacaagtcccaaggccaacaaagagatcctggacgaggcctacgtgatggctggtgttggcagcccttatgtgtctagactgctgggcatctgtctgaccagcaccgtgcagctggtcactcagctgatgccttacggctgcctgctggatcacgtgagagagaatagaggcagactgggctctcaggacctgctgaactggtgcatgcagatcgccaagggcatgagctacctcgaggatgtgagactggtccacagagatctggctgccagaaacgtgctcgtgaagtctcctaaccacgtgaagatcaccgacttcggactggctaggctgctggatatcgacgagacagagtaccacgctgatggaggcaaggtgcccatcaagtggatggctctggaatccatcctgagacggagattcacccaccagtccgatgtgtggtcttacggagtgacagtgtgggagctgatgaccttcggagccaagccttacgacggcatccctgccagagagatcccagatctgctggaaaagggagagagactgcctcagcctcctatctgcaccatcgacgtgtacatgattatggtcaagtgttggatgatcgacagcgagtgcagacccagattcagagaactggtgtccgagttctctcggatggccagagatcctcagagattcgtggtcatccagaacgaggatctgggacctgccagccctctggacagcaccttctacagatccctgctggaagatgacgacatgggtgacctggtggacgctgaagaagctctggttcctcagcagggcttcttctgccctgatcctgctccaggagcaggtggaatggtgcatcacagacacagaagctccagcaccagaagcggaggcggagatctgacactgggactcgagccatctgaggaagaggctcctagatctcctctggctccttctgaaggagctggaagcgacgttttcgacggagatcttggaatgggagctgccaaaggactccagtctctgcccacacacgacccatctccactgcagagatacagcgaggaccctaccgtgcctctgccaagcgagacagatggatatgtggcacctctgacctgctctcctcagccagaactgggacttgatgtgcctgtttgatga
SEQ ID NO:15
Аминокислотная последовательность синтетического Twist (205 аминокислот):
MQDVSSSPVSPADDSLSNSEEEPDRQQPASGKRGARKRRSSRRSAGGSAGPGGATGGGIGGGDEPGSPAQGKRGKKSAGGGGGGGAGGGGGGGGGSSSGGGSPQSYEELQTQRVMANVRERQRTQSLNEAFAALRKIIPTLPSDKLSKIQTLKLAARYIDFLYQVLQSDELDSKMASCSYVAHERLSYAFSVWRMEGAWSMSASH
SEQ ID NO:16
Нуклеотидная последовательность синтетического Twist (618 нуклеотидов):
Atgcaggacgtgtccagcagccctgtgtctcctgccgacgacagcctgagcaacagcgaggaagaacccgacagacagcagcccgcctctggcaagagaggcgccagaaagagaagaagctccagaagaagcgctggcggctctgctggacctggcggagctacaggcggaggaattggaggcggagatgagcctggctctccagcccagggcaagaggggcaagaaatctgctggcggaggcggcggaggaggagctggaggcggaggaggaggcggcggaggatcaagttctggcggaggaagccctcagagctacgaggaactgcagacccagcgcgtgatggccaacgtgcgcgagagacagagaacccagagcctgaacgaggccttcgccgccctgagaaagatcatccccaccctgcccagcgacaagctgagcaagatccagaccctgaagctggccgccagatatatcgacttcctgtatcaagtgctgcagagcgacgagctggacagcaagatggccagctgctcctacgtggcccacgagagactgagctacgccttcagcgtgtggcggatggaaggcgcctggtctatgagcgccagccactga
SEQ ID NO:17
Аминокислотная последовательность синтетического мышиного CD40L (260 аминокислот):
MIETYSQPSPRSVATGLPASMKIFMYLLTVFLITQMIGSVLFAVYLHRRLDKVEEEVNLHEDFVFIKKLKRCNKGEGSLSLLNCEEMRRQFEDLVKDITLNKEEKKENSFEMQRGDEDPQIAAHVVSEANSNAASVLQWAKKGYYTMKSNLVMLENGKQLTVKREGLYYVYTQVTFCSNREPSSQRPFIVGLWLKPSSGSERILLKAANTHSSSQLCEQQSVHLGGVFELQAGASVFVNVTEASQVIHRVGFSSFGLLKL
SEQ ID NO:18
Нуклеотидная последовательность синтетического мышиного CD40L (786 нуклеотидов):
atgatcgagacatacagccagcccagccccagaagcgtggccacaggactgcctgccagcatgaagatctttatgtacctgctgaccgtgttcctgatcacccagatgatcggcagcgtgctgttcgccgtgtacctgcacagacggctggacaaggtggaagaggaagtgaacctgcacgaggacttcgtgttcatcaagaaactgaagcggtgcaacaagggcgagggcagcctgagcctgctgaactgcgaggaaatgagaaggcagttcgaggacctcgtgaaggacatcaccctgaacaaagaggaaaagaaagaaaactccttcgagatgcagaggggcgacgaggaccctcagatcgctgctcacgtggtgtccgaggccaacagcaacgccgcttctgtgctgcagtgggccaagaaaggctactacaccatgaagtccaacctcgtgatgctggaaaacggcaagcagctgacagtgaagcgcgagggcctgtactatgtgtacacccaagtgacattctgcagcaacagagagcccagcagccagaggcccttcatcgtgggactgtggctgaagcctagcagcggcagcgagagaatcctgctgaaggccgccaacacccacagcagctctcagctgtgcgagcagcagagcgtgcacctgggcggagtgttcgagctgcaagctggcgcctccgtgttcgtgaacgtgacagaggccagccaagtgatccacagagtgggcttcagcagctttggactgctgaaactgtaatga
ЛИТЕРАТУРА
Ссылки на литературу, включенные как часть настоящего описания, помимо перечисленных ниже, в полном объеме включены в данный документ посредством ссылки.
[1] World Health Organisation, World Health report, 2013.
[2] L. A. Torre, „Global Cancer Statistics,“ CA: A Cancer Journal for Clinicians, 2012.
[3] J. S. Ross, „The Her-2/neu gene and protein in breast cancer 2003: biomarker and target of therapy“, Oncologist, 2003.
[4] C. Palena, „The human T-box mesodermal transcription factor Brachyury is a candidate target for T-cell-mediated cancer immunotherapy“, Clin Cancer Res, 2007.
[5] N. E. Hynes und H. A. Lane, „ERBB receptors and cancer: the complexity of targeted inhibitors“, Nat Rev Cancer, 2005.
[6] H. S. Cho, „Structure of the extracellular region of HER2 alone and in complex with the Herceptin Fab“, Nature, 2003.
[7] S. Satyanarayanajois, „Design, Synthesis, and Docking Studies of Peptidomimetics based on HER2-Herceptin Binding Site with Potential Antiproliferative Activity Against Breast Cancer Cell lines,“ Chem Biol Drug Des, 2009.
[8] M. C. Franklin, „Insights into ErbB signaling from the structure of the ErbB2-pertuzumab complex“, Cancer Cell, 2004.
[9] R. Yang, Targeting The Dimerization Of ERBB Receptor, All Theses and Dissertations (ETDs). Paper 391, 2009.
[10] M. Tan, „ErbB2 promotes Src synthesis and stability: novel mechanisms of Src activation that confer breast cancer metastasis“, Cancer Res, 2005.
[11] R. J. Roskoski, „ErbB/HER protein-tyrosine kinases: Structures and small molecule inhibitors“, Pharmacol Res, 2014.
[12] M. Roselli, „Brachyury, a driver of the epithelial-mesenchymal transition, is overexpressed in human lung tumors: an opportunity for novel interventions against lung cancer“, Clin Cancer Res, 2012.
[13] J. Z. Stoller und J. A. Epstein, „Identification of a novel nuclear localization signal in Tbx1 that is deleted in DiGeorge syndrome patients harboring the 1223delC mutation“, Hum Mol Genet, 2005.
[14] H. Lauterbach, „Genetic Adjuvantation of Recombinant MVA with CD40L Potentiates CD8 T Cell Mediated Immunity“, Front Immunol, 2013.
[15] A. Guardino et al., Results of Two Phase I Clinical Trials of MVA-BN®-HER2 in HER-2 Overexpressing Metastatic Breast Cancer Patients, Cancer Res, 69 (24 Supp Abstract nr 5089 (2009).
[16] C. Heery et al., Phase I, dose-escalation, clinical trial of MVA-Brachyury-TRICOM vaccine demonstrating safety and brachyury-specific T cell responses, J Immunother Cancer, 3: (Suppl 2) P132 (2015).
[17] Brodowicz et al., Anti-Her-2/neu antibody induces apoptosis in Her-2/neu overexpressing breast cancer cells independently from p53 status, Br J Cancer (2001).
[18] Stackaruk et al., Type I interferon regulation of natural killer cell function in primary and secondary infections, Expert Rev Vaccines. 12(8):875-84 (2013 Aug).
[19] Muller et al., Type I Interferons and Natural Killer Cell Regulation in Cancer, Front Immunol. 8: 304 (2017).
[20] Yamashita et al. A novel method for evalulating antibody dependent cell-mediated cytotoxicity by flow cytometry using human peripheral blood mononuclear cells, Scientific reports 6 (Article number 19772); (January 2016).
[21] Broussas et al., Evaluation of antibody-dependent cell cytotoxicity using lactate dehydrogenase (LDH) measurement. Methods Mol Biol, 988: 305-317 (2013).
[22] Tay et al., TriKEs and BiKEs join CARs on the cancer immunotherapy highway, Human Vaccines and Immunotherapeutics, vol 12: 2790-2796 (2016).
[23] Kono et al., Trastuzumab (Herceptin) Enhances Class I-Restricted Antigen Presentation Recognized by Her2/neu Specific T Cytotoxic Lymphocytes, Clinical Cancer Research 10: 2538-2544 (April 2004).
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> Bavarian Nordic A/S
<120> КОМБИНИРОВАННАЯ ТЕРАПИЯ ДЛЯ ЛЕЧЕНИЯ РАКА ПУТЕМ ВНУТРИВЕННОГО
ВВЕДЕНИЯ РЕКОМБИНАНТНОГО MVA И АНТИТЕЛА
<130> BNIT0012PCT
<160> 18
<170> PatentIn версия 3.5
<210> 1
<211> 1145
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Искусственная последовательность
<220>
<221> синтетический
<222> (1)..(1145)
<223> Синтетическая аминокислотная последовательность v1 Her2
<400> 1
Met Glu Leu Ala Ala Leu Cys Arg Trp Gly Leu Leu Leu Ala Leu Leu
1 5 10 15
Pro Pro Gly Ala Ala Ser Thr Gln Val Cys Thr Gly Thr Asp Met Lys
20 25 30
Leu Arg Leu Pro Ala Ser Pro Glu Thr His Leu Asp Met Leu Arg His
35 40 45
Leu Tyr Gln Gly Cys Gln Val Val Gln Gly Asn Leu Glu Leu Thr Tyr
50 55 60
Leu Pro Thr Asn Ala Ser Leu Ser Phe Leu Gln Asp Ile Gln Glu Val
65 70 75 80
Gln Gly Tyr Val Leu Ile Ala His Asn Gln Val Arg Gln Val Pro Leu
85 90 95
Gln Arg Leu Arg Ile Val Arg Gly Thr Gln Leu Phe Glu Asp Asn Tyr
100 105 110
Ala Leu Ala Val Leu Asp Asn Gly Asp Pro Leu Asn Asn Thr Thr Pro
115 120 125
Val Thr Gly Ala Ser Pro Gly Gly Leu Arg Glu Leu Gln Leu Arg Ser
130 135 140
Leu Thr Glu Ile Leu Lys Gly Gly Val Leu Ile Gln Arg Asn Pro Gln
145 150 155 160
Leu Cys Tyr Gln Asp Thr Ile Leu Trp Lys Asp Ile Phe His Lys Asn
165 170 175
Asn Gln Leu Ala Leu Thr Leu Ile Asp Thr Asn Arg Ser Arg Ala Cys
180 185 190
His Pro Cys Ser Pro Met Cys Lys Gly Ser Arg Cys Trp Gly Glu Ser
195 200 205
Ser Glu Asp Cys Gln Ser Leu Thr Arg Thr Val Cys Ala Gly Gly Cys
210 215 220
Ala Arg Cys Lys Gly Pro Leu Pro Thr Asp Cys Cys His Glu Gln Cys
225 230 235 240
Ala Ala Gly Cys Thr Gly Pro Lys His Ser Asp Cys Leu Ala Cys Leu
245 250 255
His Phe Asn His Ser Gly Ile Cys Glu Leu His Cys Pro Ala Leu Val
260 265 270
Thr Tyr Asn Thr Arg Thr Phe Lys Ser Met Pro Asn Pro Glu Gly Arg
275 280 285
Tyr Thr Phe Gly Ala Ser Cys Val Thr Ala Cys Pro Tyr Asn Tyr Leu
290 295 300
Ser Thr Asp Val Gly Ser Cys Thr Leu Val Cys Pro Ala Ala Asn Gln
305 310 315 320
Glu Val Thr Ala Glu Asp Gly Thr Gln Arg Cys Glu Lys Cys Ser Lys
325 330 335
Pro Cys Ala Arg Val Cys Tyr Gly Leu Gly Met Glu His Leu Arg Glu
340 345 350
Val Arg Ala Val Thr Ser Ala Asn Ile Gln Glu Phe Ala Gly Cys Lys
355 360 365
Lys Ile Phe Gly Ser Leu Ala Phe Leu Pro Glu Ser Phe Asp Gly Asp
370 375 380
Pro Ala Ser Asn Thr Ala Pro Leu Gln Pro Glu Gln Leu Gln Val Phe
385 390 395 400
Glu Thr Leu Glu Glu Ile Thr Gly Tyr Leu Tyr Ile Ser Ala Trp Pro
405 410 415
Asp Ser Leu Pro Asp Leu Ser Val Phe Gln Asn Leu Gln Val Ile Arg
420 425 430
Gly Arg Ile Leu His Asn Gly Ala Tyr Ser Leu Thr Leu Gln Gly Leu
435 440 445
Gly Ile Ser Trp Leu Gly Leu Arg Ser Leu Arg Glu Leu Gly Ser Gly
450 455 460
Leu Ala Leu Ile His His Asn Thr His Leu Cys Phe Val His Thr Val
465 470 475 480
Pro Trp Asp Gln Leu Phe Arg Asn Pro His Gln Ala Leu Leu His Thr
485 490 495
Ala Asn Arg Pro Glu Asp Glu Cys Val Gly Glu Gly Leu Ala Cys His
500 505 510
Gln Leu Cys Ala Arg Gly His Cys Trp Gly Pro Gly Pro Thr Gln Cys
515 520 525
Val Asn Cys Ser Gln Phe Leu Arg Gly Gln Glu Cys Val Glu Glu Cys
530 535 540
Arg Val Leu Gln Gly Leu Pro Arg Glu Tyr Val Asn Ala Arg His Cys
545 550 555 560
Leu Pro Cys His Pro Glu Cys Gln Pro Gln Asn Gly Ser Val Thr Cys
565 570 575
Phe Gly Pro Ala Ala Asp Gln Cys Val Ala Cys Ala His Tyr Lys Asp
580 585 590
Pro Pro Ala Cys Val Ala Arg Cys Pro Ser Gly Val Lys Pro Asp Leu
595 600 605
Ser Tyr Met Pro Ile Trp Ala Phe Pro Asp Glu Glu Gly Ala Cys Gln
610 615 620
Pro Cys Pro Ile Asn Cys Thr His Ser Cys Val Asp Leu Asp Asp Lys
625 630 635 640
Gly Cys Pro Ala Glu Gln Arg Ala Ser Pro Leu Thr Ser Ile Ile Ser
645 650 655
Ala Val Val Gly Ile Leu Leu Val Val Val Leu Gly Val Val Phe Gly
660 665 670
Ile Leu Ile Lys Arg Arg Gln Gln Lys Ile Arg Lys Tyr Thr Met Arg
675 680 685
Arg Leu Leu Gln Glu Thr Glu Leu Val Glu Pro Leu Thr Pro Ser Gly
690 695 700
Ala Met Pro Asn Gln Ala Gln Met Arg Ile Leu Lys Glu Thr Glu Leu
705 710 715 720
Arg Lys Val Lys Val Leu Gly Ser Gly Ala Phe Gly Thr Val Tyr Lys
725 730 735
Gly Ile Trp Ile Pro Asp Gly Glu Asn Val Lys Ile Pro Val Ala Ile
740 745 750
Met Val Leu Arg Glu Asn Thr Ser Pro Lys Ala Asn Lys Glu Ile Leu
755 760 765
Asp Glu Ala Tyr Val Met Ala Gly Val Gly Ser Pro Tyr Val Ser Arg
770 775 780
Leu Leu Gly Ile Cys Leu Thr Ser Thr Val Gln Leu Val Thr Gln Leu
785 790 795 800
Met Pro Tyr Gly Cys Leu Leu Asp His Val Arg Glu Asn Arg Gly Arg
805 810 815
Leu Gly Ser Gln Asp Leu Leu Asn Trp Cys Met Gln Ile Ala Lys Gly
820 825 830
Met Ser Tyr Leu Glu Asp Val Arg Leu Val His Arg Asp Leu Ala Ala
835 840 845
Arg Asn Val Leu Val Lys Ser Pro Asn His Val Lys Ile Thr Asp Phe
850 855 860
Gly Leu Ala Arg Leu Leu Asp Ile Asp Glu Thr Glu Tyr His Ala Asp
865 870 875 880
Gly Gly Lys Val Pro Ile Lys Trp Met Ala Leu Glu Ser Ile Leu Arg
885 890 895
Arg Arg Phe Thr His Gln Ser Asp Val Trp Ser Tyr Gly Val Thr Val
900 905 910
Trp Glu Leu Met Thr Phe Gly Ala Lys Pro Tyr Asp Gly Ile Pro Ala
915 920 925
Arg Glu Ile Pro Asp Leu Leu Glu Lys Gly Glu Arg Leu Pro Gln Pro
930 935 940
Pro Ile Cys Thr Ile Asp Val Tyr Met Ile Met Val Lys Cys Trp Met
945 950 955 960
Ile Asp Ser Glu Cys Arg Pro Arg Phe Arg Glu Leu Val Ser Glu Phe
965 970 975
Ser Arg Met Ala Arg Asp Pro Gln Arg Phe Val Val Ile Gln Asn Glu
980 985 990
Asp Leu Gly Pro Ala Ser Pro Leu Asp Ser Thr Phe Tyr Arg Ser Leu
995 1000 1005
Leu Glu Asp Asp Asp Met Gly Asp Leu Val Asp Ala Glu Glu Ala
1010 1015 1020
Leu Val Pro Gln Gln Gly Phe Phe Cys Pro Asp Pro Ala Pro Gly
1025 1030 1035
Ala Gly Gly Met Val His His Arg His Arg Ser Ser Ser Thr Arg
1040 1045 1050
Ser Gly Gly Gly Asp Leu Thr Leu Gly Leu Glu Pro Ser Glu Glu
1055 1060 1065
Glu Ala Pro Arg Ser Pro Leu Ala Pro Ser Glu Gly Ala Gly Ser
1070 1075 1080
Asp Val Phe Asp Gly Asp Leu Gly Met Gly Ala Ala Lys Gly Leu
1085 1090 1095
Gln Ser Leu Pro Thr His Asp Pro Ser Pro Leu Gln Arg Tyr Ser
1100 1105 1110
Glu Asp Pro Thr Val Pro Leu Pro Ser Glu Thr Asp Gly Tyr Val
1115 1120 1125
Ala Pro Leu Thr Cys Ser Pro Gln Pro Glu Leu Gly Leu Asp Val
1130 1135 1140
Pro Val
1145
<210> 2
<211> 3441
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Искусственная последовательность
<220>
<221> cинтетический
<222> (1)..(3441)
<223> Синтетическая нуклеотидная последовательность v1 Her2
<400> 2
atggaactgg ctgctctgtg tagatgggga ctgctgcttg ctctgttgcc tcctggagct 60
gcttctaccc aagtgtgcac aggcaccgac atgaagctga gactgcctgc ttctcctgag 120
acacacctgg acatgctgag acacctgtac cagggatgtc aggtggtgca gggaaatctg 180
gaactgacct acctgcctac caacgccagc ctgagctttc tgcaggacat ccaagaggtg 240
cagggatacg tgctgatcgc tcacaatcaa gtgagacagg tgccactgca gaggctgaga 300
atcgttagag gcacccagct gttcgaggac aactatgctc tggctgtgct ggacaatggc 360
gaccctctga acaacaccac acctgtgaca ggagcttctc ctggtggact gagagaactg 420
cagctgagaa gcctgaccga gatcctgaaa ggaggagtgc tgatccagcg gaaccctcag 480
ctgtgctacc aggacaccat cctgtggaag gacatcttcc acaagaacaa ccagctggct 540
ctgacactga tcgacaccaa cagaagcaga gcctgccatc cttgctctcc catgtgcaag 600
ggctctagat gttggggaga gagcagcgag gattgccaga gcctgaccag aacagtgtgt 660
gctggaggat gtgccagatg caaaggacct ctgcctaccg actgctgcca cgagcaatgt 720
gcagctggat gtacaggacc aaagcactct gattgcctgg cctgcctgca cttcaaccac 780
tctggaatct gcgagctgca ctgtcctgct ctggtcacct acaacacacg gaccttcaag 840
agcatgccta atcctgaagg cagatacacc tttggagcca gctgtgtgac agcctgtcct 900
tacaactacc tgagcaccga cgtgggcagc tgcacactcg tttgtcctgc tgccaatcaa 960
gaagtgacag ccgaggacgg cacccagaga tgcgagaagt gtagcaagcc ttgcgctaga 1020
gtgtgttacg gactcggcat ggaacacctg agagaagtga gagccgtgac cagtgccaac 1080
atccaagagt ttgctggctg caagaagatc tttggcagcc tcgccttcct gcctgagagc 1140
ttcgatggcg atcctgccag caatactgct cctctgcagc ctgaacagct ccaggtgttc 1200
gagacactgg aagagatcac aggctacctg tacatcagcg catggccaga cagcctgcct 1260
gacctgtccg tgttccagaa cctgcaagtg atcagaggca gaatcctgca caacggagcc 1320
tattctctga ccctgcaagg cctgggaatc agctggctgg gactgagatc cctgagagag 1380
cttggatctg gcctggctct gatccaccac aatacccacc tgtgcttcgt gcacaccgtg 1440
ccttgggacc agctgtttcg gaatcctcat caggctctgc tgcacacagc caacagacct 1500
gaggatgagt gtgttggcga aggcctggct tgtcaccagc tctgtgctag aggacactgt 1560
tggggacctg gacctacaca gtgtgtgaac tgtagccagt tcctgagagg ccaagaatgc 1620
gtggaagagt gtagagttct gcagggactg cctcgcgagt acgtgaacgc tagacactgt 1680
ctgccttgtc atcccgagtg ccagcctcag aatggcagcg tgacatgttt tggaccagct 1740
gccgatcagt gcgtggcctg tgctcactat aaggaccctc cagcctgcgt ggccagatgt 1800
cctagcggag tgaagcctga cctgagctac atgcccatct gggcatttcc agatgaggaa 1860
ggagcttgcc agccttgtcc tatcaactgc acccacagct gcgtggacct ggacgataag 1920
ggatgtccag ccgagcagag agcctctcca ctgacctcta tcatctctgc cgtcgtgggc 1980
atcctgctgg tggtggttct gggagttgtg ttcggcatcc tgatcaagag acggcagcag 2040
aagatccgga agtacaccat gcggagactg ctgcaagaga ctgagctggt ggaacctctg 2100
acacccagcg gagctatgcc taaccaggct cagatgcgga ttctgaaaga aaccgagctg 2160
cggaaagtga aggtgctcgg ctctggagcc tttggcacag tgtacaaagg catctggatc 2220
cctgacggag agaacgtgaa gattcctgtg gccatcatgg tgctgagaga gaacacaagt 2280
cccaaggcca acaaagagat cctggacgag gcctacgtga tggctggtgt tggcagccct 2340
tatgtgtcta gactgctggg catctgtctg accagcaccg tgcagctggt cactcagctg 2400
atgccttacg gctgcctgct ggatcacgtg agagagaata gaggcagact gggctctcag 2460
gacctgctga actggtgcat gcagatcgcc aagggcatga gctacctcga ggatgtgaga 2520
ctggtccaca gagatctggc tgccagaaac gtgctcgtga agtctcctaa ccacgtgaag 2580
atcaccgact tcggactggc taggctgctg gatatcgacg agacagagta ccacgctgat 2640
ggaggcaagg tgcccatcaa gtggatggct ctggaatcca tcctgagacg gagattcacc 2700
caccagtccg atgtgtggtc ttacggagtg acagtgtggg agctgatgac cttcggagcc 2760
aagccttacg acggcatccc tgccagagag atcccagatc tgctggaaaa gggagagaga 2820
ctgcctcagc ctcctatctg caccatcgac gtgtacatga ttatggtcaa gtgttggatg 2880
atcgacagcg agtgcagacc cagattcaga gaactggtgt ccgagttctc tcggatggcc 2940
agagatcctc agagattcgt ggtcatccag aacgaggatc tgggacctgc cagccctctg 3000
gacagcacct tctacagatc cctgctggaa gatgacgaca tgggtgacct ggtggacgct 3060
gaagaagctc tggttcctca gcagggcttc ttctgccctg atcctgctcc aggagcaggt 3120
ggaatggtgc atcacagaca cagaagctcc agcaccagaa gcggaggcgg agatctgaca 3180
ctgggactcg agccatctga ggaagaggct cctagatctc ctctggctcc ttctgaagga 3240
gctggaagcg acgttttcga cggagatctt ggaatgggag ctgccaaagg actccagtct 3300
ctgcccacac acgacccatc tccactgcag agatacagcg aggaccctac cgtgcctctg 3360
ccaagcgaga cagatggata tgtggcacct ctgacctgct ctcctcagcc agaactggga 3420
cttgatgtgc ctgtttgatg a 3441
<210> 3
<211> 427
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Искусственная последовательность
<220>
<221> cинтетический
<222> (1)..(427)
<223> Синтетическая аминокислотная последовательность Brachyury
<400> 3
Met Ser Ser Pro Gly Thr Glu Ser Ala Gly Lys Ser Leu Gln Tyr Arg
1 5 10 15
Val Asp His Leu Leu Ser Ala Val Glu Asn Glu Leu Gln Ala Gly Ser
20 25 30
Glu Lys Gly Asp Pro Thr Glu Arg Glu Leu Arg Val Gly Leu Glu Glu
35 40 45
Ser Glu Leu Trp Leu Arg Phe Lys Glu Leu Thr Asn Glu Met Ile Val
50 55 60
Thr Lys Asn Gly Arg Arg Met Phe Pro Val Leu Lys Val Asn Val Ser
65 70 75 80
Gly Leu Asp Pro Asn Ala Met Tyr Ser Phe Leu Leu Asp Phe Val Ala
85 90 95
Ala Asp Asn His Arg Trp Lys Tyr Val Asn Gly Glu Trp Val Pro Gly
100 105 110
Gly Lys Pro Glu Pro Gln Ala Pro Ser Cys Val Tyr Ile His Pro Asp
115 120 125
Ser Pro Asn Phe Gly Ala His Trp Met Lys Ala Pro Val Ser Phe Ser
130 135 140
Lys Val Lys Leu Thr Asn Lys Leu Asn Gly Gly Gly Gln Ile Met Leu
145 150 155 160
Asn Ser Leu His Lys Tyr Glu Pro Arg Ile His Ile Val Arg Val Gly
165 170 175
Gly Pro Gln Arg Met Ile Thr Ser His Cys Phe Pro Glu Thr Gln Phe
180 185 190
Ile Ala Val Thr Ala Tyr Gln Asn Glu Glu Ile Thr Ala Leu Lys Ile
195 200 205
Lys Tyr Asn Pro Phe Ala Lys Ala Phe Leu Asp Ala Lys Glu Arg Ser
210 215 220
Asp His Lys Glu Met Met Glu Glu Pro Gly Asp Ser Gln Gln Pro Gly
225 230 235 240
Tyr Ser Gln Trp Gly Trp Leu Leu Pro Gly Thr Ser Thr Leu Cys Pro
245 250 255
Pro Ala Asn Pro His Pro Gln Phe Gly Gly Ala Leu Ser Leu Pro Ser
260 265 270
Thr His Ser Cys Asp Arg Tyr Pro Thr Leu Arg Ser His Tyr Ala His
275 280 285
Arg Asn Asn Ser Pro Thr Tyr Ser Asp Asn Ser Pro Ala Cys Leu Ser
290 295 300
Met Leu Gln Ser His Asp Asn Trp Ser Ser Leu Gly Met Pro Ala His
305 310 315 320
Pro Ser Met Leu Pro Val Ser His Asn Ala Ser Pro Pro Thr Ser Ser
325 330 335
Ser Gln Tyr Pro Ser Leu Trp Ser Val Ser Asn Gly Ala Val Thr Pro
340 345 350
Gly Ser Gln Ala Ala Ala Val Ser Asn Gly Leu Gly Ala Gln Phe Phe
355 360 365
Arg Gly Ser Pro Ala His Tyr Thr Pro Leu Thr His Pro Val Ser Ala
370 375 380
Pro Ser Ser Ser Gly Ser Pro Leu Tyr Glu Gly Ala Ala Ala Ala Thr
385 390 395 400
Asp Ile Val Asp Ser Gln Tyr Asp Ala Ala Ala Gln Gly Arg Leu Ile
405 410 415
Ala Ser Trp Thr Pro Val Ser Pro Pro Ser Met
420 425
<210> 4
<211> 1287
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Искусственная последовательность
<220>
<221> cинтетический
<222> (1)..(1287)
<223> Синтетическая нуклеотидная последовательность Brachyury
<400> 4
atgtctagcc ctggcacaga gtctgctggc aagagcctcc agtacagagt ggaccatctg 60
ctgagcgctg tggagaatga actgcaggct ggaagcgaga agggagatcc tacagaaaga 120
gagctgagag tcggactgga agagtccgag ctgtggctgc ggttcaaaga actgaccaac 180
gagatgatcg tgaccaagaa cggcagacgg atgttccctg tgctgaaagt gaacgtgtcc 240
ggactggacc ctaacgccat gtacagcttt ctgctggatt tcgtggcagc tgacaaccac 300
agatggaagt acgtgaacgg agagtgggtg ccaggaggaa aacctgaacc tcaggctcct 360
agctgcgtgt acattcaccc tgacagccct aacttcggag cccactggat gaaggctcct 420
gtgtccttca gcaaagtgaa gctgaccaac aagctgaacg gaggaggcca gatcatgctg 480
aacagcctgc acaagtatga gcctaggatc cacatcgtca gagttggagg ccctcagcgg 540
atgatcacca gccactgttt ccctgagaca cagttcatcg cagtgaccgc ttaccagaac 600
gaggaaatca cagccctgaa gatcaagtac aatcccttcg ccaaggcctt cctggacgcc 660
aaagagcgga gcgaccacaa agaaatgatg gaagaacctg gcgacagcca gcagcctggc 720
tattctcaat ggggatggct gctgccaggc acctccacat tgtgccctcc agccaatcct 780
catcctcagt ttggcggagc cctgagcctg cctagcacac acagctgcga cagataccct 840
acactgagaa gccactacgc tcacagaaac aacagcccta cctacagcga caatagccct 900
gcctgtctga gcatgctgca gtcccacgac aattggtcca gcctgggaat gcctgctcac 960
ccttctatgc tgcctgtctc tcacaacgcc tctccaccta caagcagctc tcagtaccct 1020
agcctttgga gcgtgtccaa tggagctgtg acacctggat ctcaggctgc cgctgtgtct 1080
aatggactgg gagcccagtt cttcagaggc agccctgctc actacacacc tctgacacat 1140
ccagtgtctg ctcctagcag cagcggaagc cctctctatg aaggagccgc tgcagccacc 1200
gacatcgtgg attctcagta tgatgctgcc gcacagggca gactgatcgc ctcttggaca 1260
cctgtgagcc caccttccat gtgatga 1287
<210> 5
<211> 435
<212> БЕЛОК
<213> Homo sapiens
<220>
<221> Изоформа
<222> (1)..(435)
<223> Изоформа 1 белка Brachyury из номера доступа GenBank O15178.1
<400> 5
Met Ser Ser Pro Gly Thr Glu Ser Ala Gly Lys Ser Leu Gln Tyr Arg
1 5 10 15
Val Asp His Leu Leu Ser Ala Val Glu Asn Glu Leu Gln Ala Gly Ser
20 25 30
Glu Lys Gly Asp Pro Thr Glu Arg Glu Leu Arg Val Gly Leu Glu Glu
35 40 45
Ser Glu Leu Trp Leu Arg Phe Lys Glu Leu Thr Asn Glu Met Ile Val
50 55 60
Thr Lys Asn Gly Arg Arg Met Phe Pro Val Leu Lys Val Asn Val Ser
65 70 75 80
Gly Leu Asp Pro Asn Ala Met Tyr Ser Phe Leu Leu Asp Phe Val Ala
85 90 95
Ala Asp Asn His Arg Trp Lys Tyr Val Asn Gly Glu Trp Val Pro Gly
100 105 110
Gly Lys Pro Glu Pro Gln Ala Pro Ser Cys Val Tyr Ile His Pro Asp
115 120 125
Ser Pro Asn Phe Gly Ala His Trp Met Lys Ala Pro Val Ser Phe Ser
130 135 140
Lys Val Lys Leu Thr Asn Lys Leu Asn Gly Gly Gly Gln Ile Met Leu
145 150 155 160
Asn Ser Leu His Lys Tyr Glu Pro Arg Ile His Ile Val Arg Val Gly
165 170 175
Gly Pro Gln Arg Met Ile Thr Ser His Cys Phe Pro Glu Thr Gln Phe
180 185 190
Ile Ala Val Thr Ala Tyr Gln Asn Glu Glu Ile Thr Ala Leu Lys Ile
195 200 205
Lys Tyr Asn Pro Phe Ala Lys Ala Phe Leu Asp Ala Lys Glu Arg Ser
210 215 220
Asp His Lys Glu Met Met Glu Glu Pro Gly Asp Ser Gln Gln Pro Gly
225 230 235 240
Tyr Ser Gln Trp Gly Trp Leu Leu Pro Gly Thr Ser Thr Leu Cys Pro
245 250 255
Pro Ala Asn Pro His Pro Gln Phe Gly Gly Ala Leu Ser Leu Pro Ser
260 265 270
Thr His Ser Cys Asp Arg Tyr Pro Thr Leu Arg Ser His Arg Ser Ser
275 280 285
Pro Tyr Pro Ser Pro Tyr Ala His Arg Asn Asn Ser Pro Thr Tyr Ser
290 295 300
Asp Asn Ser Pro Ala Cys Leu Ser Met Leu Gln Ser His Asp Asn Trp
305 310 315 320
Ser Ser Leu Gly Met Pro Ala His Pro Ser Met Leu Pro Val Ser His
325 330 335
Asn Ala Ser Pro Pro Thr Ser Ser Ser Gln Tyr Pro Ser Leu Trp Ser
340 345 350
Val Ser Asn Gly Ala Val Thr Pro Gly Ser Gln Ala Ala Ala Val Ser
355 360 365
Asn Gly Leu Gly Ala Gln Phe Phe Arg Gly Ser Pro Ala His Tyr Thr
370 375 380
Pro Leu Thr His Pro Val Ser Ala Pro Ser Ser Ser Gly Ser Pro Leu
385 390 395 400
Tyr Glu Gly Ala Ala Ala Ala Thr Asp Ile Val Asp Ser Gln Tyr Asp
405 410 415
Ala Ala Ala Gln Gly Arg Leu Ile Ala Ser Trp Thr Pro Val Ser Pro
420 425 430
Pro Ser Met
435
<210> 6
<211> 1308
<212> ДНК
<213> Homo sapiens
<220>
<221> Изоформа
<222> (1)..(1308)
<223> Кодирующая последовательность изоформы 1 белка Brachyury, номер доступа GenBank
O15178.1
<400> 6
atgagcagcc ctggcacaga gagcgccggc aagagcctgc agtaccgggt ggaccatctg 60
ctgagcgccg tggagaatga gctgcaggcc ggctccgaga agggcgaccc caccgagagg 120
gaactgagag tgggcctgga agagtccgag ctgtggctgc ggttcaaaga actgaccaac 180
gagatgatcg tgaccaagaa cggcagacgg atgttccccg tgctgaaagt gaacgtgtcc 240
ggcctggacc ccaacgccat gtacagcttt ctgctggact tcgtggccgc cgacaaccac 300
aggtggaaat acgtgaacgg cgagtgggtg ccaggcggca aacctgagcc tcaggccccc 360
agctgcgtgt acatccaccc cgacagcccc aatttcggcg cccactggat gaaggccccc 420
gtgtccttca gcaaagtgaa gctgaccaac aagctgaacg gcggaggcca gatcatgctg 480
aacagcctgc acaagtacga gccccggatc cacattgtgc gcgtgggcgg accccagaga 540
atgatcacca gccactgctt ccccgagaca cagtttatcg ccgtgaccgc ctaccagaac 600
gaggaaatca ccgccctgaa gatcaagtac aaccccttcg ccaaggcctt cctggacgcc 660
aaagagcgga gcgaccacaa agaaatgatg gaagaacccg gcgacagcca gcagcctggc 720
tacagccagt ggggctggct gctgccaggc acctccactc tgtgcccccc tgccaaccct 780
caccctcagt tcggcggagc cctgagcctg cctagcacac acagctgcga cagatacccc 840
accctgcgga gccacagaag cagcccctac cccagcccat acgcccaccg gaacaacagc 900
cccacctaca gcgacaactc ccccgcctgc ctgagcatgc tgcagagcca cgacaactgg 960
tccagcctgg gcatgcctgc ccaccctagc atgctgcccg tgtcccacaa tgccagcccc 1020
cctaccagca gctcccagta ccctagcctg tggagcgtgt ccaatggcgc cgtgacacct 1080
ggatctcagg ccgctgccgt gagcaatggc ctgggagccc agttctttag aggcagccct 1140
gcccactaca cccctctgac ccaccctgtg tccgccccta gctccagcgg cagccctctg 1200
tatgaaggcg ccgctgcagc caccgatatc gtggacagcc agtacgatgc cgccgctcag 1260
ggcagactga tcgccagctg gacccccgtg tctcccccca gcatgtga 1308
<210> 7
<211> 435
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Искусственная последовательность
<220>
<221> Изоформа
<222> (1)..(435)
<223> Изоформа 1 белка Brachyury (L254V)
<400> 7
Met Ser Ser Pro Gly Thr Glu Ser Ala Gly Lys Ser Leu Gln Tyr Arg
1 5 10 15
Val Asp His Leu Leu Ser Ala Val Glu Asn Glu Leu Gln Ala Gly Ser
20 25 30
Glu Lys Gly Asp Pro Thr Glu Arg Glu Leu Arg Val Gly Leu Glu Glu
35 40 45
Ser Glu Leu Trp Leu Arg Phe Lys Glu Leu Thr Asn Glu Met Ile Val
50 55 60
Thr Lys Asn Gly Arg Arg Met Phe Pro Val Leu Lys Val Asn Val Ser
65 70 75 80
Gly Leu Asp Pro Asn Ala Met Tyr Ser Phe Leu Leu Asp Phe Val Ala
85 90 95
Ala Asp Asn His Arg Trp Lys Tyr Val Asn Gly Glu Trp Val Pro Gly
100 105 110
Gly Lys Pro Glu Pro Gln Ala Pro Ser Cys Val Tyr Ile His Pro Asp
115 120 125
Ser Pro Asn Phe Gly Ala His Trp Met Lys Ala Pro Val Ser Phe Ser
130 135 140
Lys Val Lys Leu Thr Asn Lys Leu Asn Gly Gly Gly Gln Ile Met Leu
145 150 155 160
Asn Ser Leu His Lys Tyr Glu Pro Arg Ile His Ile Val Arg Val Gly
165 170 175
Gly Pro Gln Arg Met Ile Thr Ser His Cys Phe Pro Glu Thr Gln Phe
180 185 190
Ile Ala Val Thr Ala Tyr Gln Asn Glu Glu Ile Thr Ala Leu Lys Ile
195 200 205
Lys Tyr Asn Pro Phe Ala Lys Ala Phe Leu Asp Ala Lys Glu Arg Ser
210 215 220
Asp His Lys Glu Met Met Glu Glu Pro Gly Asp Ser Gln Gln Pro Gly
225 230 235 240
Tyr Ser Gln Trp Gly Trp Leu Leu Pro Gly Thr Ser Thr Val Cys Pro
245 250 255
Pro Ala Asn Pro His Pro Gln Phe Gly Gly Ala Leu Ser Leu Pro Ser
260 265 270
Thr His Ser Cys Asp Arg Tyr Pro Thr Leu Arg Ser His Arg Ser Ser
275 280 285
Pro Tyr Pro Ser Pro Tyr Ala His Arg Asn Asn Ser Pro Thr Tyr Ser
290 295 300
Asp Asn Ser Pro Ala Cys Leu Ser Met Leu Gln Ser His Asp Asn Trp
305 310 315 320
Ser Ser Leu Gly Met Pro Ala His Pro Ser Met Leu Pro Val Ser His
325 330 335
Asn Ala Ser Pro Pro Thr Ser Ser Ser Gln Tyr Pro Ser Leu Trp Ser
340 345 350
Val Ser Asn Gly Ala Val Thr Pro Gly Ser Gln Ala Ala Ala Val Ser
355 360 365
Asn Gly Leu Gly Ala Gln Phe Phe Arg Gly Ser Pro Ala His Tyr Thr
370 375 380
Pro Leu Thr His Pro Val Ser Ala Pro Ser Ser Ser Gly Ser Pro Leu
385 390 395 400
Tyr Glu Gly Ala Ala Ala Ala Thr Asp Ile Val Asp Ser Gln Tyr Asp
405 410 415
Ala Ala Ala Gln Gly Arg Leu Ile Ala Ser Trp Thr Pro Val Ser Pro
420 425 430
Pro Ser Met
435
<210> 8
<211> 1308
<212> ДНК
<213> Искусственный организм
<220>
<223> Искусственная последовательность
<220>
<221> изоформа
<222> (1)..(1308)
<223> Кодирующая последовательность изоформы 1 белка Brachyury с L254V
<400> 8
atgagctccc ctggcaccga gagcgcggga aagagcctgc agtaccgagt ggaccacctg 60
ctgagcgccg tggagaatga gctgcaggcg ggcagcgaga agggcgaccc cacagagcgc 120
gaactgcgcg tgggcctgga ggagagcgag ctgtggctgc gcttcaagga gctcaccaat 180
gagatgatcg tgaccaagaa cggcaggagg atgtttccgg tgctgaaggt gaacgtgtct 240
ggcctggacc ccaacgccat gtactccttc ctgctggact tcgtggcggc ggacaaccac 300
cgctggaagt acgtgaacgg ggaatgggtg ccggggggca agccggagcc gcaggcgccc 360
agctgcgtct acatccaccc cgactcgccc aacttcgggg cccactggat gaaggctccc 420
gtctccttca gcaaagtcaa gctcaccaac aagctcaacg gagggggcca gatcatgctg 480
aactccttgc ataagtatga gcctcgaatc cacatagtga gagttggggg tccacagcgc 540
atgatcacca gccactgctt ccctgagacc cagttcatag cggtgactgc ttatcagaac 600
gaggagatca cagctcttaa aattaagtac aatccatttg caaaggcttt ccttgatgca 660
aaggaaagaa gtgatcacaa agagatgatg gaggaacccg gagacagcca gcaacctggg 720
tactcccaat gggggtggct tcttcctgga accagcaccg tttgtccacc tgcaaatcct 780
catcctcagt ttggaggtgc cctctccctc ccctccacgc acagctgtga caggtaccca 840
accctgagga gccaccggtc ctcaccctac cccagcccct atgctcatcg gaacaattct 900
ccaacctatt ctgacaactc acctgcatgt ttatccatgc tgcaatccca tgacaattgg 960
tccagccttg gaatgcctgc ccatcccagc atgctccccg tgagccacaa tgccagccca 1020
cctaccagct ccagtcagta ccccagcctg tggtctgtga gcaacggcgc cgtcaccccg 1080
ggctcccagg cagcagccgt gtccaacggg ctgggggccc agttcttccg gggctccccc 1140
gcgcactaca cacccctcac ccatccggtc tcggcgccct cttcctcggg atccccactg 1200
tacgaagggg cggccgcggc cacagacatc gtggacagcc agtacgacgc cgcagcccaa 1260
ggccgcctca tagcctcatg gacacctgtg tcgccacctt ccatgtga 1308
<210> 9
<211> 449
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Искусственная последовательность
<220>
<221> cинтетический
<222> (1)..(449)
<223> Слитый белок Brachyury-I3
<400> 9
Met Lys Asn Asn Leu Tyr Glu Glu Lys Met Asn Met Ser Lys Lys Ser
1 5 10 15
Ser Pro Gly Thr Glu Ser Ala Gly Lys Ser Leu Gln Tyr Arg Val Asp
20 25 30
His Leu Leu Ser Ala Val Glu Asn Glu Leu Gln Ala Gly Ser Glu Lys
35 40 45
Gly Asp Pro Thr Glu Arg Glu Leu Arg Val Gly Leu Glu Glu Ser Glu
50 55 60
Leu Trp Leu Arg Phe Lys Glu Leu Thr Asn Glu Met Ile Val Thr Lys
65 70 75 80
Asn Gly Arg Arg Met Phe Pro Val Leu Lys Val Asn Val Ser Gly Leu
85 90 95
Asp Pro Asn Ala Met Tyr Ser Phe Leu Leu Asp Phe Val Ala Ala Asp
100 105 110
Asn His Arg Trp Lys Tyr Val Asn Gly Glu Trp Val Pro Gly Gly Lys
115 120 125
Pro Glu Pro Gln Ala Pro Ser Cys Val Tyr Ile His Pro Asp Ser Pro
130 135 140
Asn Phe Gly Ala His Trp Met Lys Ala Pro Val Ser Phe Ser Lys Val
145 150 155 160
Lys Leu Thr Asn Lys Leu Asn Gly Gly Gly Gln Ile Met Leu Asn Ser
165 170 175
Leu His Lys Tyr Glu Pro Arg Ile His Ile Val Arg Val Gly Gly Pro
180 185 190
Gln Arg Met Ile Thr Ser His Cys Phe Pro Glu Thr Gln Phe Ile Ala
195 200 205
Val Thr Ala Tyr Gln Asn Glu Glu Ile Thr Ala Leu Lys Ile Lys Tyr
210 215 220
Asn Pro Phe Ala Lys Ala Phe Leu Asp Ala Lys Glu Arg Ser Asp His
225 230 235 240
Lys Glu Met Met Glu Glu Pro Gly Asp Ser Gln Gln Pro Gly Tyr Ser
245 250 255
Gln Trp Gly Trp Leu Leu Pro Gly Thr Ser Thr Val Cys Pro Pro Ala
260 265 270
Asn Pro His Pro Gln Phe Gly Gly Ala Leu Ser Leu Pro Ser Thr His
275 280 285
Ser Cys Asp Arg Tyr Pro Thr Leu Arg Ser His Arg Ser Ser Pro Tyr
290 295 300
Pro Ser Pro Tyr Ala His Arg Asn Asn Ser Pro Thr Tyr Ser Asp Asn
305 310 315 320
Ser Pro Ala Cys Leu Ser Met Leu Gln Ser His Asp Asn Trp Ser Ser
325 330 335
Leu Gly Met Pro Ala His Pro Ser Met Leu Pro Val Ser His Asn Ala
340 345 350
Ser Pro Pro Thr Ser Ser Ser Gln Tyr Pro Ser Leu Trp Ser Val Ser
355 360 365
Asn Gly Ala Val Thr Pro Gly Ser Gln Ala Ala Ala Val Ser Asn Gly
370 375 380
Leu Gly Ala Gln Phe Phe Arg Gly Ser Pro Ala His Tyr Thr Pro Leu
385 390 395 400
Thr His Pro Val Ser Ala Pro Ser Ser Ser Gly Ser Pro Leu Tyr Glu
405 410 415
Gly Ala Ala Ala Ala Thr Asp Ile Val Asp Ser Gln Tyr Asp Ala Ala
420 425 430
Ala Gln Gly Arg Leu Ile Ala Ser Trp Thr Pro Val Ser Pro Pro Ser
435 440 445
Met
<210> 10
<211> 1350
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Искусственная последовательность
<220>
<221> слитый белок
<222> (1)..(1350)
<223> Кодирующая последовательность, кодирующая слитый белок I3-Brachyury
с SEQ ID NO 9
<400> 10
atgaaaaata acttgtatga agaaaaaatg aacatgagta agaaaagctc ccctggcacc 60
gagagcgcgg gaaagagcct gcagtaccga gtggaccacc tgctgagcgc cgtggagaat 120
gagctgcagg cgggcagcga gaagggcgac cccacagagc gcgaactgcg cgtgggcctg 180
gaggagagcg agctgtggct gcgcttcaag gagctcacca atgagatgat cgtgaccaag 240
aacggcagga ggatgtttcc ggtgctgaag gtgaacgtgt ctggcctgga ccccaacgcc 300
atgtactcct tcctgctgga cttcgtggcg gcggacaacc accgctggaa gtacgtgaac 360
ggggaatggg tgccgggggg caagccggag ccgcaggcgc ccagctgcgt ctacatccac 420
cccgactcgc ccaacttcgg ggcccactgg atgaaggctc ccgtctcctt cagcaaagtc 480
aagctcacca acaagctcaa cggagggggc cagatcatgc tgaactcctt gcataagtat 540
gagcctcgaa tccacatagt gagagttggg ggtccacagc gcatgatcac cagccactgc 600
ttccctgaga cccagttcat agcggtgact gcttatcaga acgaggagat cacagctctt 660
aaaattaagt acaatccatt tgcaaaggct ttccttgatg caaaggaaag aagtgatcac 720
aaagagatga tggaggaacc cggagacagc cagcaacctg ggtactccca atgggggtgg 780
cttcttcctg gaaccagcac cgtttgtcca cctgcaaatc ctcatcctca gtttggaggt 840
gccctctccc tcccctccac gcacagctgt gacaggtacc caaccctgag gagccaccgg 900
tcctcaccct accccagccc ctatgctcat cggaacaatt ctccaaccta ttctgacaac 960
tcacctgcat gtttatccat gctgcaatcc catgacaatt ggtccagcct tggaatgcct 1020
gcccatccca gcatgctccc cgtgagccac aatgccagcc cacctaccag ctccagtcag 1080
taccccagcc tgtggtctgt gagcaacggc gccgtcaccc cgggctccca ggcagcagcc 1140
gtgtccaacg ggctgggggc ccagttcttc cggggctccc ccgcgcacta cacacccctc 1200
acccatccgg tctcggcgcc ctcttcctcg ggatccccac tgtacgaagg ggcggccgcg 1260
gccacagaca tcgtggacag ccagtacgac gccgcagccc aaggccgcct catagcctca 1320
tggacacctg tgtcgccacc ttccatgtga 1350
<210> 11
<211> 261
<212> БЕЛОК
<213> Homo sapiens
<220>
<221> hCD40L
<222> (1)..(261)
<223> hCD40L из NCBI RefSeq NP_000065.1.
<400> 11
Met Ile Glu Thr Tyr Asn Gln Thr Ser Pro Arg Ser Ala Ala Thr Gly
1 5 10 15
Leu Pro Ile Ser Met Lys Ile Phe Met Tyr Leu Leu Thr Val Phe Leu
20 25 30
Ile Thr Gln Met Ile Gly Ser Ala Leu Phe Ala Val Tyr Leu His Arg
35 40 45
Arg Leu Asp Lys Ile Glu Asp Glu Arg Asn Leu His Glu Asp Phe Val
50 55 60
Phe Met Lys Thr Ile Gln Arg Cys Asn Thr Gly Glu Arg Ser Leu Ser
65 70 75 80
Leu Leu Asn Cys Glu Glu Ile Lys Ser Gln Phe Glu Gly Phe Val Lys
85 90 95
Asp Ile Met Leu Asn Lys Glu Glu Thr Lys Lys Glu Asn Ser Phe Glu
100 105 110
Met Gln Lys Gly Asp Gln Asn Pro Gln Ile Ala Ala His Val Ile Ser
115 120 125
Glu Ala Ser Ser Lys Thr Thr Ser Val Leu Gln Trp Ala Glu Lys Gly
130 135 140
Tyr Tyr Thr Met Ser Asn Asn Leu Val Thr Leu Glu Asn Gly Lys Gln
145 150 155 160
Leu Thr Val Lys Arg Gln Gly Leu Tyr Tyr Ile Tyr Ala Gln Val Thr
165 170 175
Phe Cys Ser Asn Arg Glu Ala Ser Ser Gln Ala Pro Phe Ile Ala Ser
180 185 190
Leu Cys Leu Lys Ser Pro Gly Arg Phe Glu Arg Ile Leu Leu Arg Ala
195 200 205
Ala Asn Thr His Ser Ser Ala Lys Pro Cys Gly Gln Gln Ser Ile His
210 215 220
Leu Gly Gly Val Phe Glu Leu Gln Pro Gly Ala Ser Val Phe Val Asn
225 230 235 240
Val Thr Asp Pro Ser Gln Val Ser His Gly Thr Gly Phe Thr Ser Phe
245 250 255
Gly Leu Leu Lys Leu
260
<210> 12
<211> 789
<212> ДНК
<213> Homo sapiens
<220>
<221> hCD40L
<222> (1)..(789)
<223> hCD40L из NCBI RefSeq NP_000065.1.
<400> 12
atgatcgaga catacaacca gacaagccct agaagcgccg ccacaggact gcctatcagc 60
atgaagatct tcatgtacct gctgaccgtg ttcctgatca cccagatgat cggcagcgcc 120
ctgtttgccg tgtacctgca cagacggctg gacaagatcg aggacgagag aaacctgcac 180
gaggacttcg tgttcatgaa gaccatccag cggtgcaaca ccggcgagag aagtctgagc 240
ctgctgaact gcgaggaaat caagagccag ttcgagggct tcgtgaagga catcatgctg 300
aacaaagagg aaacgaagaa agagaactcc ttcgagatgc agaagggcga ccagaatcct 360
cagatcgccg ctcacgtgat cagcgaggcc agcagcaaga caacaagcgt gctgcagtgg 420
gccgagaagg gctactacac catgagcaac aacctggtca ccctggagaa cggcaagcag 480
ctgacagtga agcggcaggg cctgtactac atctacgccc aagtgacctt ctgcagcaac 540
agagaggcca gctctcaggc tcctttcatc gccagcctgt gcctgaagtc tcctggcaga 600
ttcgagcgga ttctgctgag agccgccaac acacacagca gcgccaaacc ttgtggccag 660
cagtctattc acctcggcgg agtgtttgag ctgcagcctg gcgcaagcgt gttcgtgaat 720
gtgacagacc ctagccaggt gtcccacggc accggcttta catctttcgg actgctgaag 780
ctgtgatga 789
<210> 13
<211> 1145
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Искусственная последовательность
<220>
<221> cинтетический
<222> (1)..(1145)
<223> Синтетическая аминокислотная последовательность v2 Her2
<400> 13
Met Glu Leu Ala Ala Leu Cys Arg Trp Gly Leu Leu Leu Ala Leu Leu
1 5 10 15
Pro Pro Gly Ala Ala Ser Thr Gln Val Cys Thr Gly Thr Asp Met Lys
20 25 30
Leu Arg Leu Pro Ala Ser Pro Glu Thr His Leu Asp Met Leu Arg His
35 40 45
Leu Tyr Gln Gly Cys Gln Val Val Gln Gly Asn Leu Glu Leu Thr Tyr
50 55 60
Leu Pro Thr Asn Ala Ser Leu Ser Phe Leu Gln Asp Ile Gln Glu Val
65 70 75 80
Gln Gly Tyr Val Leu Ile Ala His Asn Gln Val Arg Gln Val Pro Leu
85 90 95
Gln Arg Leu Arg Ile Val Arg Gly Thr Gln Leu Phe Glu Asp Asn Tyr
100 105 110
Ala Leu Ala Val Leu Asp Asn Gly Asp Pro Leu Asn Asn Thr Thr Pro
115 120 125
Val Thr Gly Ala Ser Pro Gly Gly Leu Arg Glu Leu Gln Leu Arg Ser
130 135 140
Leu Thr Glu Ile Leu Lys Gly Gly Val Leu Ile Gln Arg Asn Pro Gln
145 150 155 160
Leu Cys Tyr Gln Asp Thr Ile Leu Trp Lys Asp Ile Phe His Lys Asn
165 170 175
Asn Gln Leu Ala Leu Thr Leu Ile Asp Thr Asn Arg Ser Arg Ala Cys
180 185 190
His Pro Cys Ser Pro Met Cys Lys Gly Ser Arg Cys Trp Gly Glu Ser
195 200 205
Ser Glu Asp Cys Gln Ser Leu Thr Arg Thr Val Cys Ala Gly Gly Cys
210 215 220
Ala Arg Cys Lys Gly Pro Leu Pro Thr Asp Cys Cys His Glu Gln Cys
225 230 235 240
Ala Ala Gly Cys Thr Gly Pro Lys His Ser Asp Cys Leu Ala Cys Leu
245 250 255
His Phe Asn His Ser Gly Ile Cys Glu Leu Ala Cys Pro Ala Leu Val
260 265 270
Thr Tyr Asn Thr Arg Thr Ala Lys Ser Met Pro Asn Pro Glu Gly Arg
275 280 285
Tyr Thr Phe Gly Ala Ser Cys Val Thr Ala Cys Pro Tyr Asn Tyr Leu
290 295 300
Ser Thr Asp Ala Gly Ala Cys Thr Leu Val Cys Pro Ala Ala Asn Gln
305 310 315 320
Glu Val Thr Ala Glu Asp Gly Thr Gln Arg Cys Glu Ala Cys Ser Lys
325 330 335
Ala Cys Ala Arg Val Cys Tyr Gly Leu Gly Met Glu His Leu Arg Glu
340 345 350
Val Arg Ala Val Thr Ser Ala Asn Ile Gln Glu Phe Ala Gly Cys Lys
355 360 365
Lys Ile Phe Gly Ser Leu Ala Phe Leu Pro Glu Ser Phe Asp Gly Asp
370 375 380
Pro Ala Ser Asn Thr Ala Pro Leu Gln Pro Glu Gln Leu Gln Val Phe
385 390 395 400
Glu Thr Leu Glu Glu Ile Thr Gly Tyr Leu Tyr Ile Ser Ala Trp Pro
405 410 415
Asp Ser Leu Pro Asp Leu Ser Val Phe Gln Asn Leu Gln Val Ile Arg
420 425 430
Gly Arg Ile Leu His Asn Gly Ala Tyr Ser Leu Thr Leu Gln Gly Leu
435 440 445
Gly Ile Ser Trp Leu Gly Leu Arg Ser Leu Arg Glu Leu Gly Ser Gly
450 455 460
Leu Ala Leu Ile His His Asn Thr His Leu Cys Phe Val His Thr Val
465 470 475 480
Pro Trp Asp Gln Leu Phe Arg Asn Pro His Gln Ala Leu Leu His Thr
485 490 495
Ala Asn Arg Pro Glu Asp Glu Cys Val Gly Glu Gly Leu Ala Cys His
500 505 510
Gln Leu Cys Ala Arg Gly His Cys Trp Gly Pro Gly Pro Thr Gln Cys
515 520 525
Val Asn Cys Ser Gln Phe Leu Arg Gly Gln Glu Cys Val Glu Glu Cys
530 535 540
Arg Val Leu Gln Gly Leu Pro Arg Glu Tyr Val Asn Ala Arg His Cys
545 550 555 560
Leu Pro Cys His Pro Glu Cys Gln Pro Gln Asn Gly Ser Val Thr Cys
565 570 575
Phe Gly Pro Ala Ala Asp Gln Cys Val Ala Cys Ala His Tyr Lys Asp
580 585 590
Pro Pro Ala Cys Val Ala Arg Cys Pro Ser Gly Val Lys Pro Asp Leu
595 600 605
Ser Tyr Met Pro Ile Trp Ala Phe Pro Asp Glu Glu Gly Ala Cys Gln
610 615 620
Pro Cys Pro Ile Asn Cys Thr His Ser Cys Val Asp Leu Asp Asp Lys
625 630 635 640
Gly Cys Pro Ala Glu Gln Arg Ala Ser Pro Leu Thr Ser Ile Ile Ser
645 650 655
Ala Val Val Gly Ile Leu Leu Val Val Val Leu Gly Val Val Phe Gly
660 665 670
Ile Leu Ile Lys Arg Arg Gln Gln Lys Ile Arg Lys Tyr Thr Met Arg
675 680 685
Arg Leu Leu Gln Glu Thr Glu Leu Val Glu Pro Leu Thr Pro Ser Gly
690 695 700
Ala Met Pro Asn Gln Ala Gln Met Arg Ile Leu Lys Glu Thr Glu Leu
705 710 715 720
Arg Lys Val Lys Val Leu Gly Ser Gly Ala Phe Gly Thr Val Tyr Lys
725 730 735
Gly Ile Trp Ile Pro Asp Gly Glu Asn Val Lys Ile Pro Val Ala Ile
740 745 750
Met Val Leu Arg Glu Asn Thr Ser Pro Lys Ala Asn Lys Glu Ile Leu
755 760 765
Asp Glu Ala Tyr Val Met Ala Gly Val Gly Ser Pro Tyr Val Ser Arg
770 775 780
Leu Leu Gly Ile Cys Leu Thr Ser Thr Val Gln Leu Val Thr Gln Leu
785 790 795 800
Met Pro Tyr Gly Cys Leu Leu Asp His Val Arg Glu Asn Arg Gly Arg
805 810 815
Leu Gly Ser Gln Asp Leu Leu Asn Trp Cys Met Gln Ile Ala Lys Gly
820 825 830
Met Ser Tyr Leu Glu Asp Val Arg Leu Val His Arg Asp Leu Ala Ala
835 840 845
Arg Asn Val Leu Val Lys Ser Pro Asn His Val Lys Ile Thr Asp Phe
850 855 860
Gly Leu Ala Arg Leu Leu Asp Ile Asp Glu Thr Glu Tyr His Ala Asp
865 870 875 880
Gly Gly Lys Val Pro Ile Lys Trp Met Ala Leu Glu Ser Ile Leu Arg
885 890 895
Arg Arg Phe Thr His Gln Ser Asp Val Trp Ser Tyr Gly Val Thr Val
900 905 910
Trp Glu Leu Met Thr Phe Gly Ala Lys Pro Tyr Asp Gly Ile Pro Ala
915 920 925
Arg Glu Ile Pro Asp Leu Leu Glu Lys Gly Glu Arg Leu Pro Gln Pro
930 935 940
Pro Ile Cys Thr Ile Asp Val Tyr Met Ile Met Val Lys Cys Trp Met
945 950 955 960
Ile Asp Ser Glu Cys Arg Pro Arg Phe Arg Glu Leu Val Ser Glu Phe
965 970 975
Ser Arg Met Ala Arg Asp Pro Gln Arg Phe Val Val Ile Gln Asn Glu
980 985 990
Asp Leu Gly Pro Ala Ser Pro Leu Asp Ser Thr Phe Tyr Arg Ser Leu
995 1000 1005
Leu Glu Asp Asp Asp Met Gly Asp Leu Val Asp Ala Glu Glu Ala
1010 1015 1020
Leu Val Pro Gln Gln Gly Phe Phe Cys Pro Asp Pro Ala Pro Gly
1025 1030 1035
Ala Gly Gly Met Val His His Arg His Arg Ser Ser Ser Thr Arg
1040 1045 1050
Ser Gly Gly Gly Asp Leu Thr Leu Gly Leu Glu Pro Ser Glu Glu
1055 1060 1065
Glu Ala Pro Arg Ser Pro Leu Ala Pro Ser Glu Gly Ala Gly Ser
1070 1075 1080
Asp Val Phe Asp Gly Asp Leu Gly Met Gly Ala Ala Lys Gly Leu
1085 1090 1095
Gln Ser Leu Pro Thr His Asp Pro Ser Pro Leu Gln Arg Tyr Ser
1100 1105 1110
Glu Asp Pro Thr Val Pro Leu Pro Ser Glu Thr Asp Gly Tyr Val
1115 1120 1125
Ala Pro Leu Thr Cys Ser Pro Gln Pro Glu Leu Gly Leu Asp Val
1130 1135 1140
Pro Val
1145
<210> 14
<211> 3441
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Искусственная последовательность
<220>
<221> cинтетический
<222> (1)..(3441)
<223> Синтетическая нуклеотидная последовательность v2 Her2
<400> 14
atggaactgg ctgctctgtg tagatgggga ctgctgcttg ctctgttgcc tcctggagct 60
gcttctaccc aagtgtgcac aggcaccgac atgaagctga gactgcctgc ttctcctgag 120
acacacctgg acatgctgag acacctgtac cagggatgtc aggtggtgca gggaaatctg 180
gaactgacct acctgcctac caacgccagc ctgagctttc tgcaggacat ccaagaggtg 240
cagggatacg tgctgatcgc tcacaatcaa gtgagacagg tgccactgca gaggctgaga 300
atcgttagag gcacccagct gttcgaggac aactatgctc tggctgtgct ggacaatggc 360
gaccctctga acaacaccac acctgtgaca ggagcttctc ctggtggact gagagaactg 420
cagctgagaa gcctgaccga gatcctgaaa ggaggagtgc tgatccagcg gaaccctcag 480
ctgtgctacc aggacaccat cctgtggaag gacatcttcc acaagaacaa ccagctggct 540
ctgacactga tcgacaccaa cagaagcaga gcctgccatc cttgctctcc catgtgcaag 600
ggctctagat gttggggaga gagcagcgag gattgccaga gcctgaccag aacagtgtgt 660
gctggaggat gtgccagatg caaaggacct ctgcctaccg actgctgcca cgagcaatgt 720
gcagctggat gtacaggacc aaagcactct gattgcctgg cctgcctgca cttcaaccac 780
tctggaatct gcgagctcgc ctgtcctgct ctggtcacct acaacacacg gaccgccaag 840
agcatgccta atcctgaagg cagatacacc tttggagcca gctgtgtgac agcctgtcct 900
tacaactacc tgagcaccga cgctggagcc tgcacactcg tttgtcctgc tgccaatcaa 960
gaagtgacgg ccgaggacgg cacccagaga tgcgaggcct gtagcaaggc ttgcgctaga 1020
gtgtgttacg gactcggcat ggaacacctg agagaagtga gagccgtgac cagtgccaac 1080
atccaagagt ttgctggctg caagaagatc tttggcagcc tcgccttcct gcctgagagc 1140
ttcgatggcg atcctgccag caatactgct cctctgcagc ctgaacagct ccaggtgttc 1200
gagacactgg aagagatcac aggctacctg tacatcagcg catggccaga cagcctgcct 1260
gacctgtccg tgttccagaa cctgcaagtg atcagaggca gaatcctgca caacggagcc 1320
tattctctga ccctgcaagg cctgggaatc agctggctgg gactgagatc cctgagagag 1380
cttggatctg gcctggctct gatccaccac aatacccacc tgtgcttcgt gcacaccgtg 1440
ccttgggacc agctgtttcg gaatcctcat caggctctgc tgcacacagc caacagacct 1500
gaggatgagt gtgttggcga aggcctggct tgtcaccagc tctgtgctag aggacactgt 1560
tggggacctg gacctacaca gtgtgtgaac tgtagccagt tcctgagagg ccaagaatgc 1620
gtggaagagt gtagagttct gcagggactg cctcgcgagt acgtgaacgc tagacactgt 1680
ctgccttgtc atcccgagtg ccagcctcag aatggcagcg tgacatgttt tggaccagct 1740
gccgatcagt gcgtggcctg tgctcactat aaggaccctc cagcctgcgt ggccagatgt 1800
cctagcggag tgaagcctga cctgagctac atgcccatct gggcatttcc agatgaggaa 1860
ggagcttgcc agccttgtcc tatcaactgc acccacagct gcgtggacct ggacgataag 1920
ggatgtccag ccgagcagag agcctctcca ctgacctcta tcatctctgc cgtcgtgggc 1980
atcctgctgg tggtggttct gggagttgtg ttcggcatcc tgatcaagag acggcagcag 2040
aagatccgga agtacaccat gcggagactg ctgcaagaga ctgagctggt ggaacctctg 2100
acacccagcg gagctatgcc taaccaggct cagatgcgga ttctgaaaga aaccgagctg 2160
cggaaagtga aggtgctcgg ctctggagcc tttggcacag tgtacaaagg catctggatc 2220
cctgacggag agaacgtgaa gattcctgtg gccatcatgg tgctgagaga gaacacaagt 2280
cccaaggcca acaaagagat cctggacgag gcctacgtga tggctggtgt tggcagccct 2340
tatgtgtcta gactgctggg catctgtctg accagcaccg tgcagctggt cactcagctg 2400
atgccttacg gctgcctgct ggatcacgtg agagagaata gaggcagact gggctctcag 2460
gacctgctga actggtgcat gcagatcgcc aagggcatga gctacctcga ggatgtgaga 2520
ctggtccaca gagatctggc tgccagaaac gtgctcgtga agtctcctaa ccacgtgaag 2580
atcaccgact tcggactggc taggctgctg gatatcgacg agacagagta ccacgctgat 2640
ggaggcaagg tgcccatcaa gtggatggct ctggaatcca tcctgagacg gagattcacc 2700
caccagtccg atgtgtggtc ttacggagtg acagtgtggg agctgatgac cttcggagcc 2760
aagccttacg acggcatccc tgccagagag atcccagatc tgctggaaaa gggagagaga 2820
ctgcctcagc ctcctatctg caccatcgac gtgtacatga ttatggtcaa gtgttggatg 2880
atcgacagcg agtgcagacc cagattcaga gaactggtgt ccgagttctc tcggatggcc 2940
agagatcctc agagattcgt ggtcatccag aacgaggatc tgggacctgc cagccctctg 3000
gacagcacct tctacagatc cctgctggaa gatgacgaca tgggtgacct ggtggacgct 3060
gaagaagctc tggttcctca gcagggcttc ttctgccctg atcctgctcc aggagcaggt 3120
ggaatggtgc atcacagaca cagaagctcc agcaccagaa gcggaggcgg agatctgaca 3180
ctgggactcg agccatctga ggaagaggct cctagatctc ctctggctcc ttctgaagga 3240
gctggaagcg acgttttcga cggagatctt ggaatgggag ctgccaaagg actccagtct 3300
ctgcccacac acgacccatc tccactgcag agatacagcg aggaccctac cgtgcctctg 3360
ccaagcgaga cagatggata tgtggcacct ctgacctgct ctcctcagcc agaactggga 3420
cttgatgtgc ctgtttgatg a 3441
<210> 15
<211> 205
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Искусственная последовательность
<220>
<221> cинтетический
<222> (1)..(205)
<223> Синтетическая аминокислотная последовательность Twist
<400> 15
Met Gln Asp Val Ser Ser Ser Pro Val Ser Pro Ala Asp Asp Ser Leu
1 5 10 15
Ser Asn Ser Glu Glu Glu Pro Asp Arg Gln Gln Pro Ala Ser Gly Lys
20 25 30
Arg Gly Ala Arg Lys Arg Arg Ser Ser Arg Arg Ser Ala Gly Gly Ser
35 40 45
Ala Gly Pro Gly Gly Ala Thr Gly Gly Gly Ile Gly Gly Gly Asp Glu
50 55 60
Pro Gly Ser Pro Ala Gln Gly Lys Arg Gly Lys Lys Ser Ala Gly Gly
65 70 75 80
Gly Gly Gly Gly Gly Ala Gly Gly Gly Gly Gly Gly Gly Gly Gly Ser
85 90 95
Ser Ser Gly Gly Gly Ser Pro Gln Ser Tyr Glu Glu Leu Gln Thr Gln
100 105 110
Arg Val Met Ala Asn Val Arg Glu Arg Gln Arg Thr Gln Ser Leu Asn
115 120 125
Glu Ala Phe Ala Ala Leu Arg Lys Ile Ile Pro Thr Leu Pro Ser Asp
130 135 140
Lys Leu Ser Lys Ile Gln Thr Leu Lys Leu Ala Ala Arg Tyr Ile Asp
145 150 155 160
Phe Leu Tyr Gln Val Leu Gln Ser Asp Glu Leu Asp Ser Lys Met Ala
165 170 175
Ser Cys Ser Tyr Val Ala His Glu Arg Leu Ser Tyr Ala Phe Ser Val
180 185 190
Trp Arg Met Glu Gly Ala Trp Ser Met Ser Ala Ser His
195 200 205
<210> 16
<211> 618
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Искусственная последовательность
<220>
<221> синтетический
<222> (1)..(618)
<223> Синтетическая нуклеотидная последовательность Twist
<400> 16
atgcaggacg tgtccagcag ccctgtgtct cctgccgacg acagcctgag caacagcgag 60
gaagaacccg acagacagca gcccgcctct ggcaagagag gcgccagaaa gagaagaagc 120
tccagaagaa gcgctggcgg ctctgctgga cctggcggag ctacaggcgg aggaattgga 180
ggcggagatg agcctggctc tccagcccag ggcaagaggg gcaagaaatc tgctggcgga 240
ggcggcggag gaggagctgg aggcggagga ggaggcggcg gaggatcaag ttctggcgga 300
ggaagccctc agagctacga ggaactgcag acccagcgcg tgatggccaa cgtgcgcgag 360
agacagagaa cccagagcct gaacgaggcc ttcgccgccc tgagaaagat catccccacc 420
ctgcccagcg acaagctgag caagatccag accctgaagc tggccgccag atatatcgac 480
ttcctgtatc aagtgctgca gagcgacgag ctggacagca agatggccag ctgctcctac 540
gtggcccacg agagactgag ctacgccttc agcgtgtggc ggatggaagg cgcctggtct 600
atgagcgcca gccactga 618
<210> 17
<211> 260
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Искусственная последовательность
<220>
<221> синтетический
<222> (1)..(260)
<223> Синтетическая аминокислотная последовательность мышиного CD40L
<400> 17
Met Ile Glu Thr Tyr Ser Gln Pro Ser Pro Arg Ser Val Ala Thr Gly
1 5 10 15
Leu Pro Ala Ser Met Lys Ile Phe Met Tyr Leu Leu Thr Val Phe Leu
20 25 30
Ile Thr Gln Met Ile Gly Ser Val Leu Phe Ala Val Tyr Leu His Arg
35 40 45
Arg Leu Asp Lys Val Glu Glu Glu Val Asn Leu His Glu Asp Phe Val
50 55 60
Phe Ile Lys Lys Leu Lys Arg Cys Asn Lys Gly Glu Gly Ser Leu Ser
65 70 75 80
Leu Leu Asn Cys Glu Glu Met Arg Arg Gln Phe Glu Asp Leu Val Lys
85 90 95
Asp Ile Thr Leu Asn Lys Glu Glu Lys Lys Glu Asn Ser Phe Glu Met
100 105 110
Gln Arg Gly Asp Glu Asp Pro Gln Ile Ala Ala His Val Val Ser Glu
115 120 125
Ala Asn Ser Asn Ala Ala Ser Val Leu Gln Trp Ala Lys Lys Gly Tyr
130 135 140
Tyr Thr Met Lys Ser Asn Leu Val Met Leu Glu Asn Gly Lys Gln Leu
145 150 155 160
Thr Val Lys Arg Glu Gly Leu Tyr Tyr Val Tyr Thr Gln Val Thr Phe
165 170 175
Cys Ser Asn Arg Glu Pro Ser Ser Gln Arg Pro Phe Ile Val Gly Leu
180 185 190
Trp Leu Lys Pro Ser Ser Gly Ser Glu Arg Ile Leu Leu Lys Ala Ala
195 200 205
Asn Thr His Ser Ser Ser Gln Leu Cys Glu Gln Gln Ser Val His Leu
210 215 220
Gly Gly Val Phe Glu Leu Gln Ala Gly Ala Ser Val Phe Val Asn Val
225 230 235 240
Thr Glu Ala Ser Gln Val Ile His Arg Val Gly Phe Ser Ser Phe Gly
245 250 255
Leu Leu Lys Leu
260
<210> 18
<211> 786
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Искусственная последовательность
<220>
<221> cинтетический
<222> (1)..(786)
<223> Синтетическая нуклеотидная последовательность мышиного CD40L
<400> 18
atgatcgaga catacagcca gcccagcccc agaagcgtgg ccacaggact gcctgccagc 60
atgaagatct ttatgtacct gctgaccgtg ttcctgatca cccagatgat cggcagcgtg 120
ctgttcgccg tgtacctgca cagacggctg gacaaggtgg aagaggaagt gaacctgcac 180
gaggacttcg tgttcatcaa gaaactgaag cggtgcaaca agggcgaggg cagcctgagc 240
ctgctgaact gcgaggaaat gagaaggcag ttcgaggacc tcgtgaagga catcaccctg 300
aacaaagagg aaaagaaaga aaactccttc gagatgcaga ggggcgacga ggaccctcag 360
atcgctgctc acgtggtgtc cgaggccaac agcaacgccg cttctgtgct gcagtgggcc 420
aagaaaggct actacaccat gaagtccaac ctcgtgatgc tggaaaacgg caagcagctg 480
acagtgaagc gcgagggcct gtactatgtg tacacccaag tgacattctg cagcaacaga 540
gagcccagca gccagaggcc cttcatcgtg ggactgtggc tgaagcctag cagcggcagc 600
gagagaatcc tgctgaaggc cgccaacacc cacagcagct ctcagctgtg cgagcagcag 660
agcgtgcacc tgggcggagt gttcgagctg caagctggcg cctccgtgtt cgtgaacgtg 720
acagaggcca gccaagtgat ccacagagtg ggcttcagca gctttggact gctgaaactg 780
taatga 786
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| ТЕРАПИЯ ДЛЯ ЛЕЧЕНИЯ РАКА С ПОМОЩЬЮ ВНУТРИОПУХОЛЕВОГО И/ИЛИ ВНУТРИВЕННОГО ВВЕДЕНИЯ РЕКОМБИНАНТНОГО MVA, КОДИРУЮЩЕГО 4-1BBL (CD137L) И/ИЛИ CD40L | 2019 |
|
RU2830601C2 |
| ПРОМОТОРЫ ДЛЯ УСИЛЕНИЯ ЭКСПРЕССИИ В ПОКСВИРУСАХ | 2016 |
|
RU2753884C2 |
| ПОЛИСПЕЦИФИЧЕСКИЕ СВЯЗЫВАЮЩИЕ БЕЛКИ ДЛЯ АКТИВАЦИИ КЛЕТОК-НАТУРАЛЬНЫХ КИЛЛЕРОВ И ИХ ТЕРАПЕВТИЧЕСКОЕ ПРИМЕНЕНИЕ ДЛЯ ЛЕЧЕНИЯ ЗЛОКАЧЕСТВЕННОГО НОВООБРАЗОВАНИЯ | 2018 |
|
RU2809125C2 |
| АКТИВИРУЮЩИЙ NK-КЛЕТКИ СЛИТЫЙ БЕЛОК, NK-КЛЕТКИ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, ВКЛЮЧАЮЩАЯ ИХ | 2018 |
|
RU2740438C1 |
| МОДИФИЦИРОВАННАЯ J-ЦЕПЬ | 2015 |
|
RU2761118C2 |
| ДОСТАВКА ТЕРАПЕВТИЧЕСКИХ ПОЛИПЕПТИДОВ ПОСРЕДСТВОМ ПСЕВДОТИПИРОВАННЫХ ОНКОЛИТИЧЕСКИХ ВИРУСОВ | 2017 |
|
RU2758007C2 |
| ТРИФУНКЦИОНАЛЬНАЯ АНТИГЕНСВЯЗЫВАЮЩАЯ МОЛЕКУЛА | 2015 |
|
RU2753882C2 |
| КОМПОЗИЦИИ И СПОСОБЫ ИММУНОТЕРАПИИ | 2014 |
|
RU2798348C2 |
| КРИОКОНСЕРВИРОВАННЫЕ КЛЕТКИ-ЕСТЕСТВЕННЫЕ КИЛЛЕРЫ, ПРЕДВАРИТЕЛЬНО НАГРУЖЕННЫЕ КОНСТРУКЦИЕЙ АНТИТЕЛА | 2019 |
|
RU2819927C2 |
| Биспецифическое антитело анти-HER2/анти-4-1BB и его применение | 2020 |
|
RU2831838C2 |
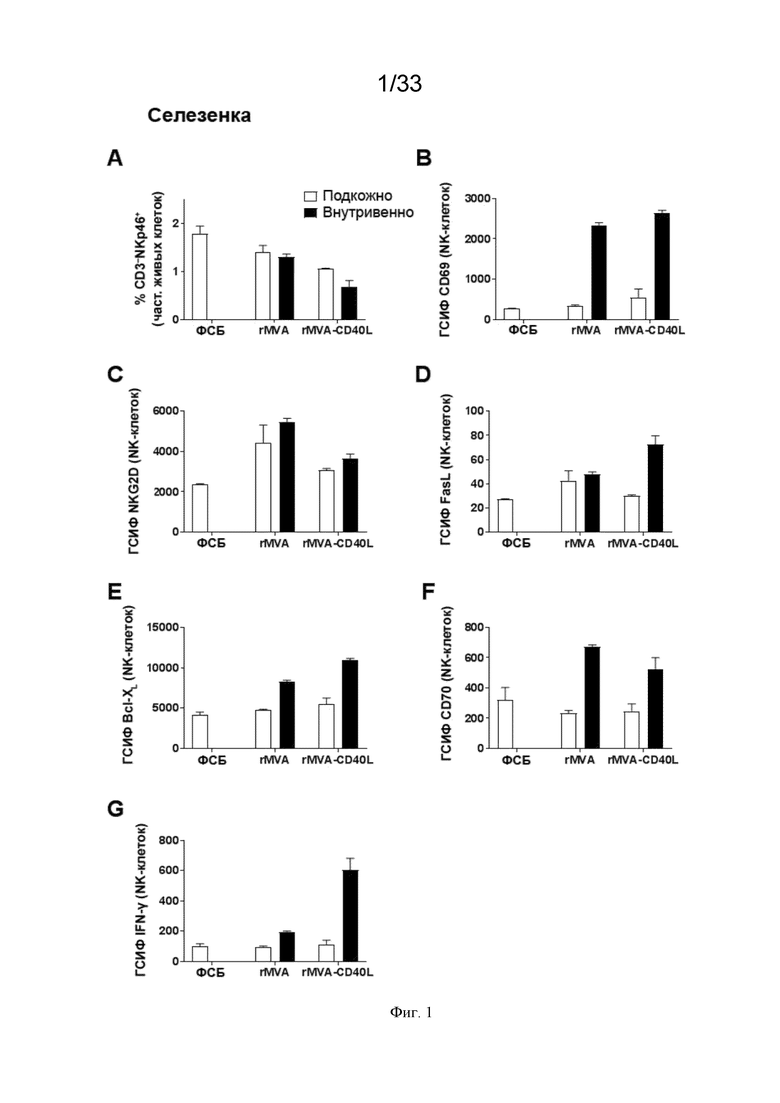
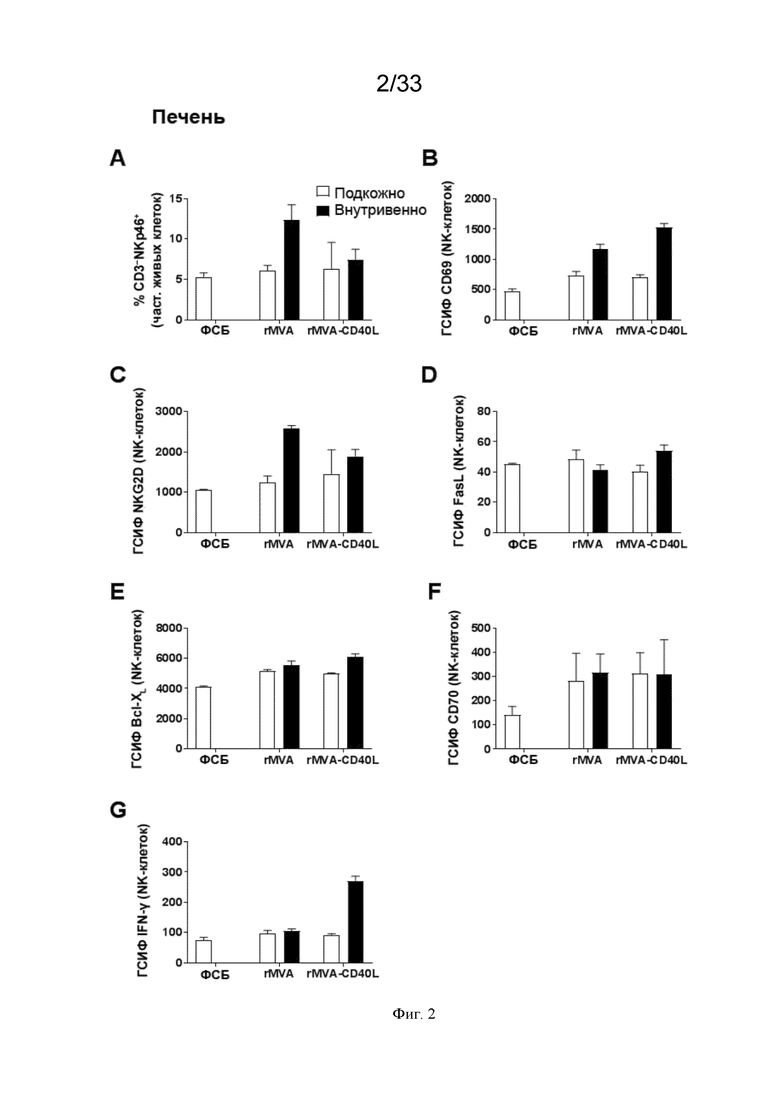
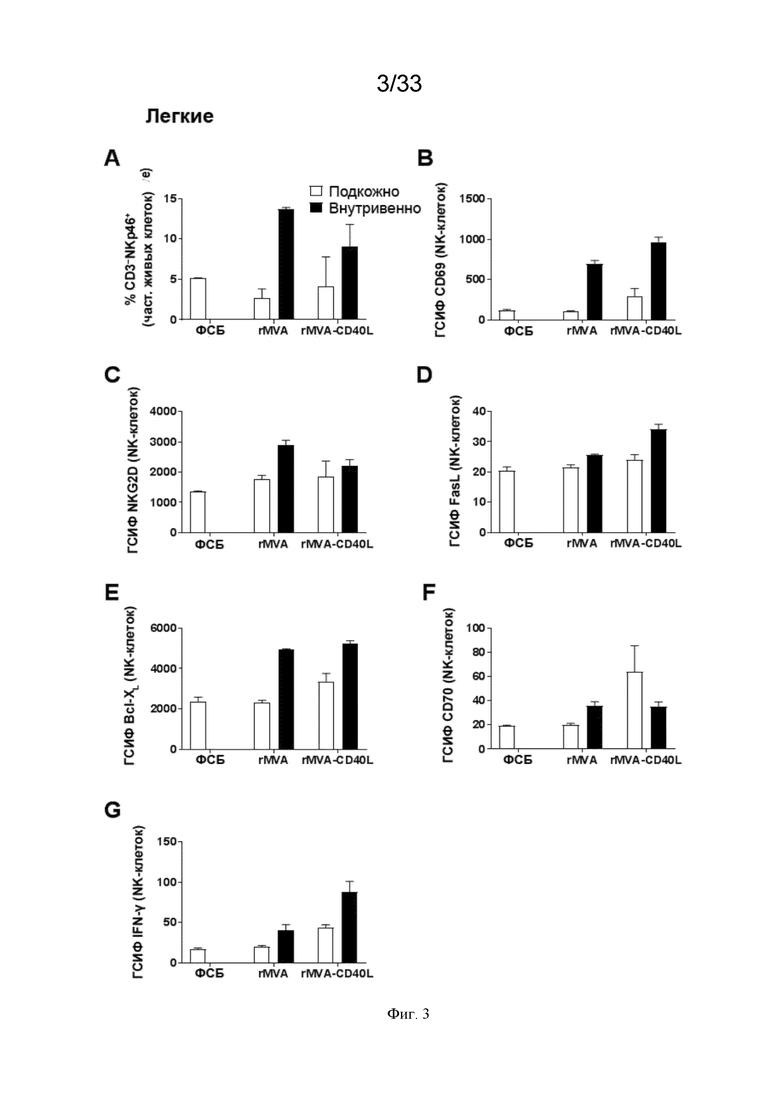
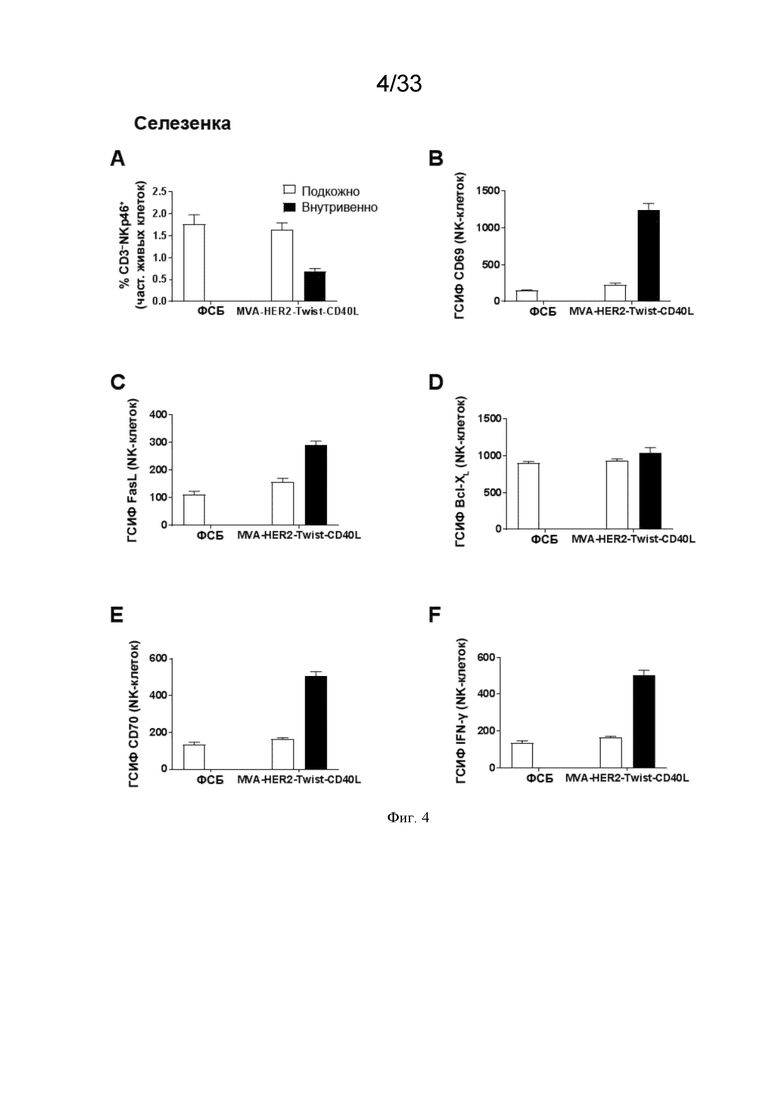
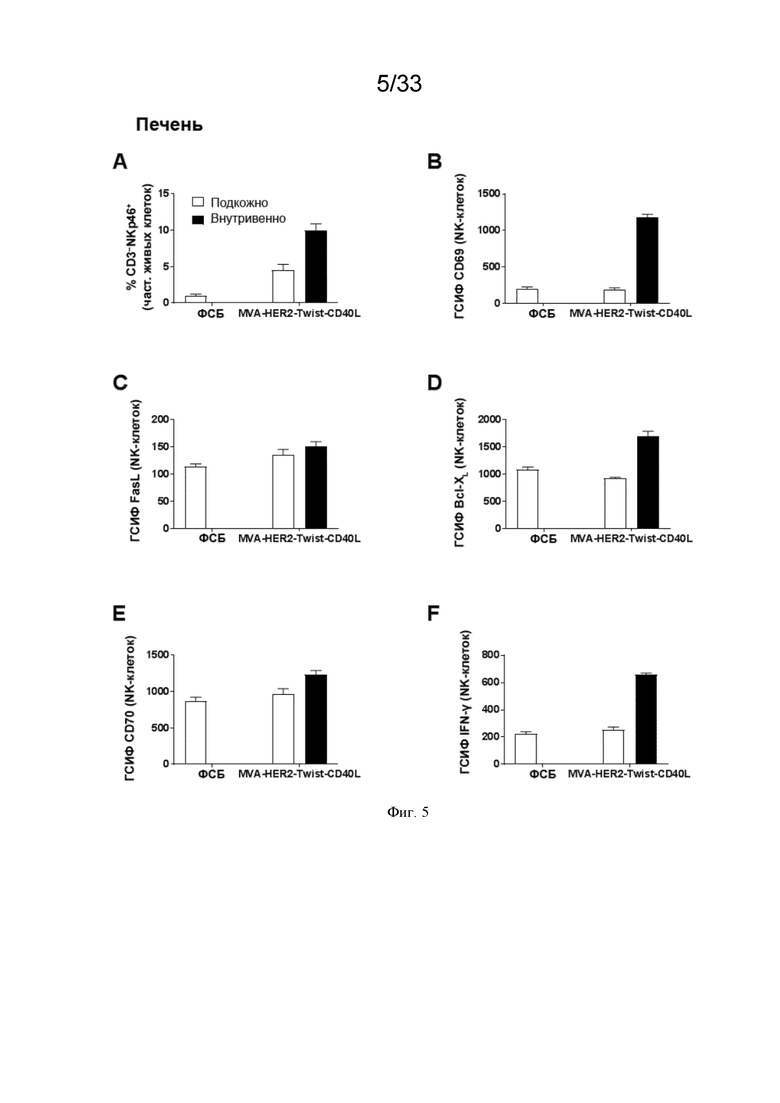
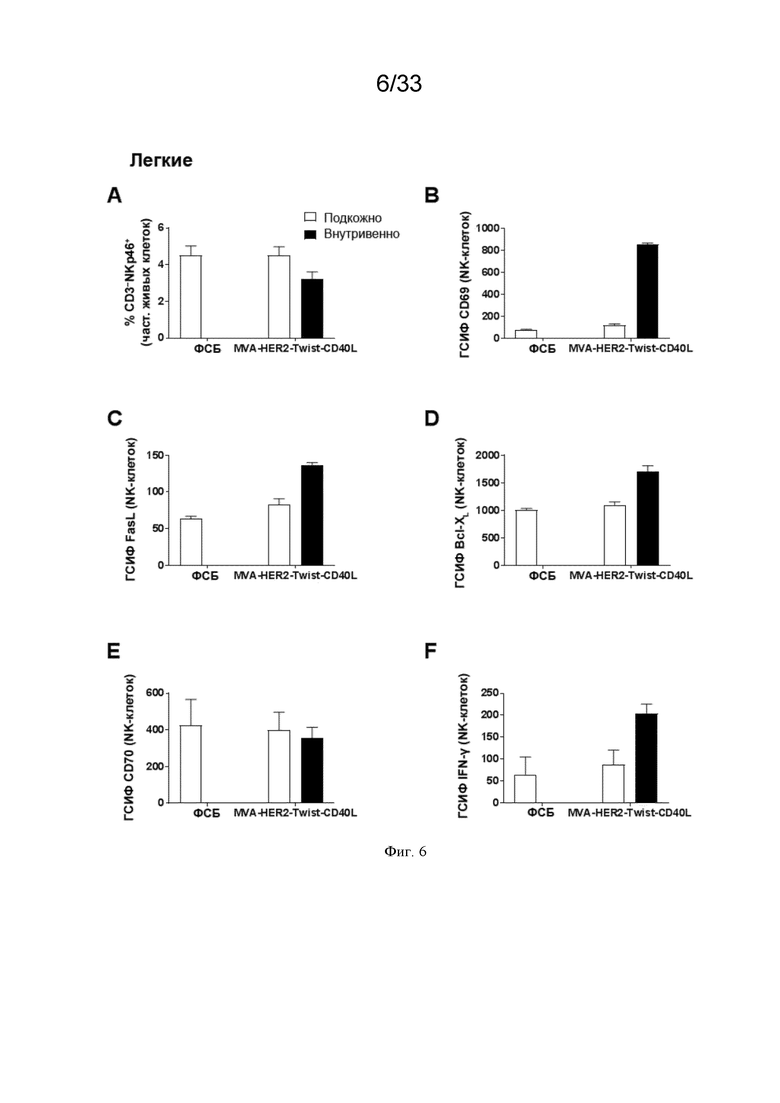
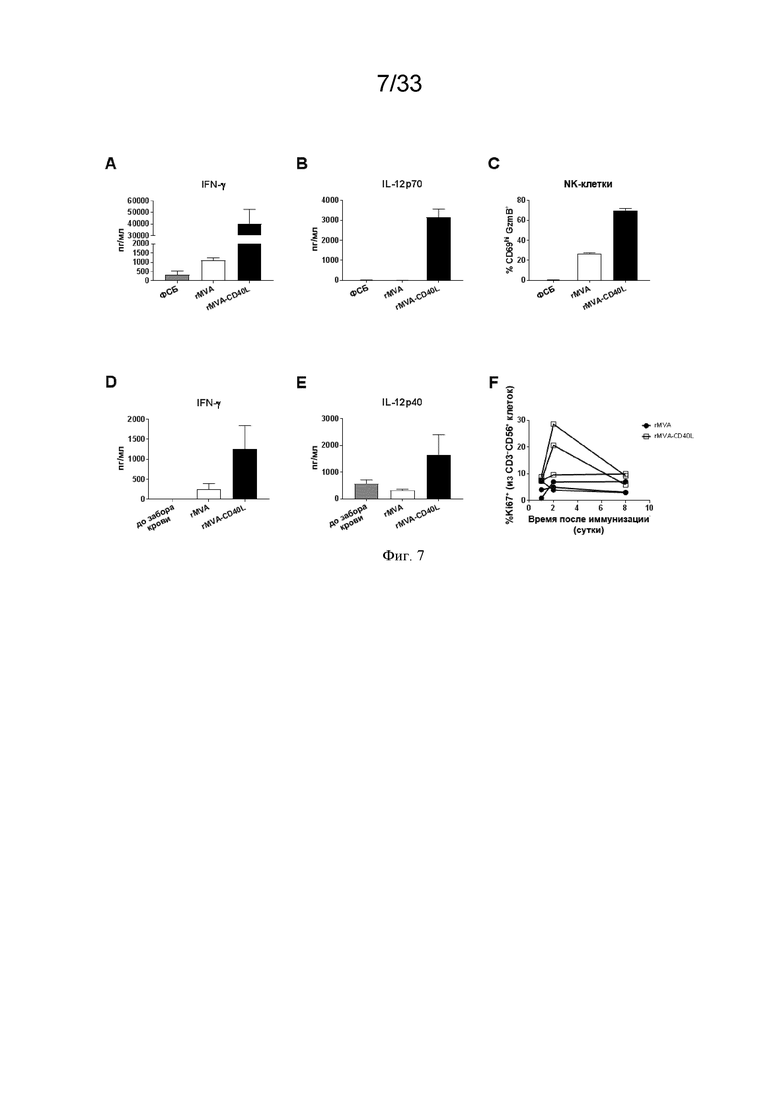
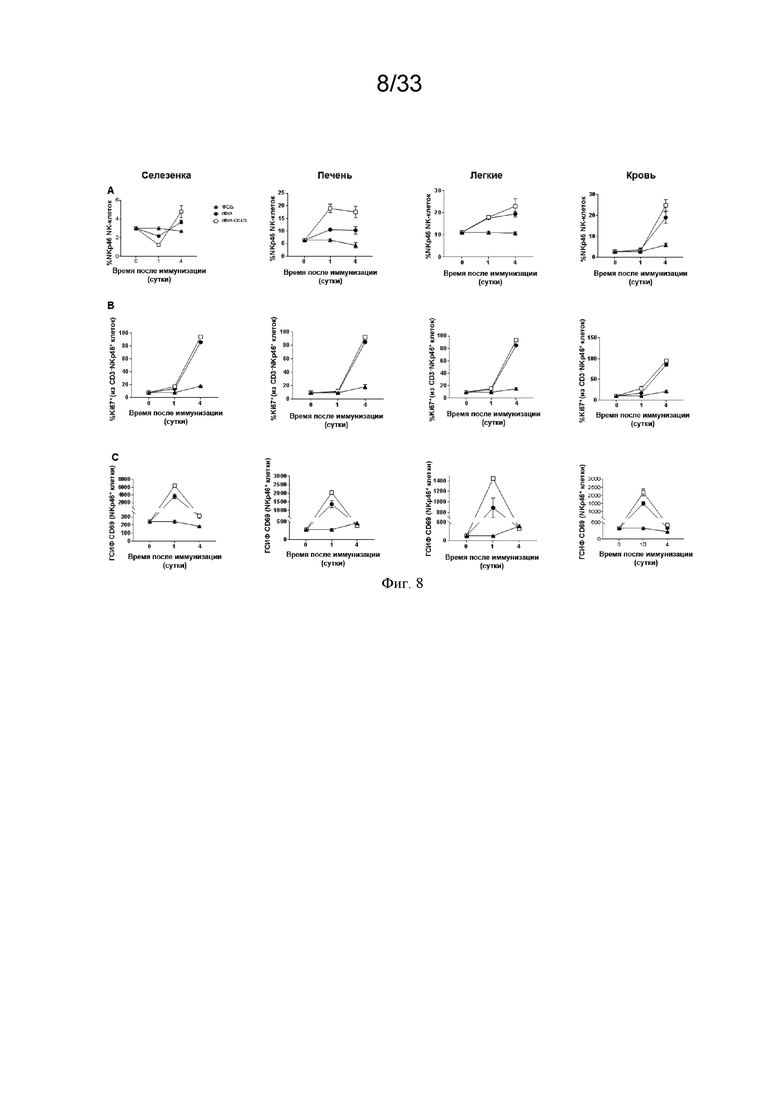
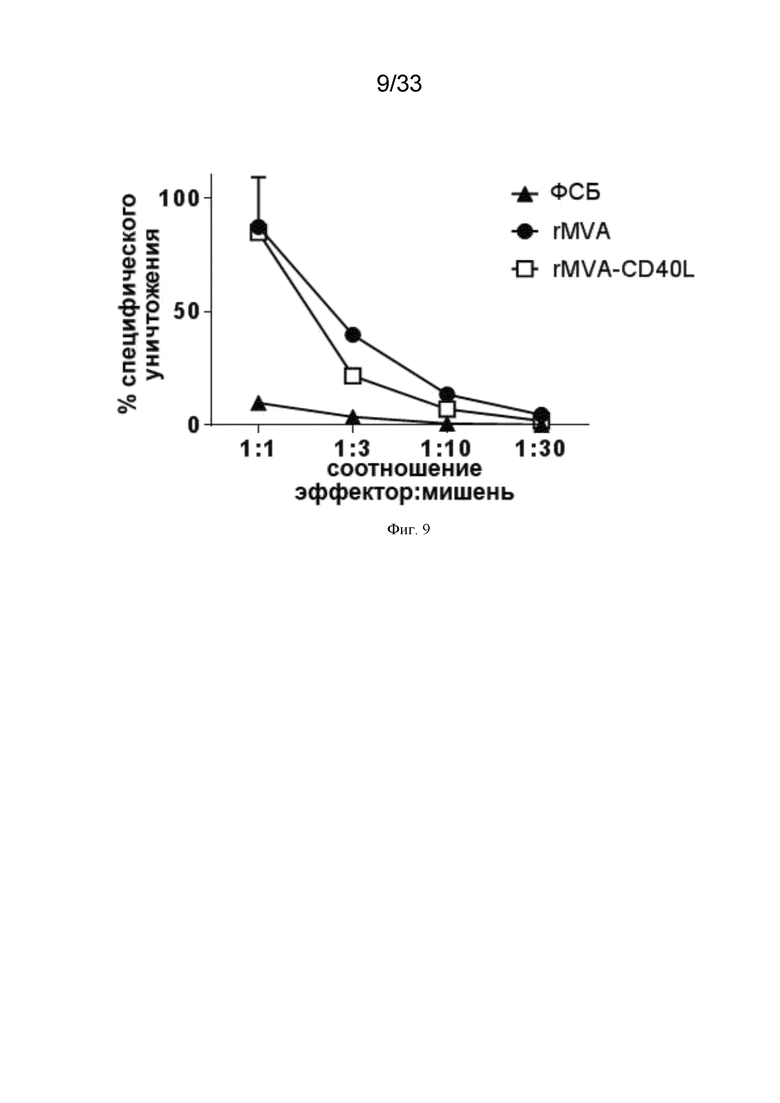
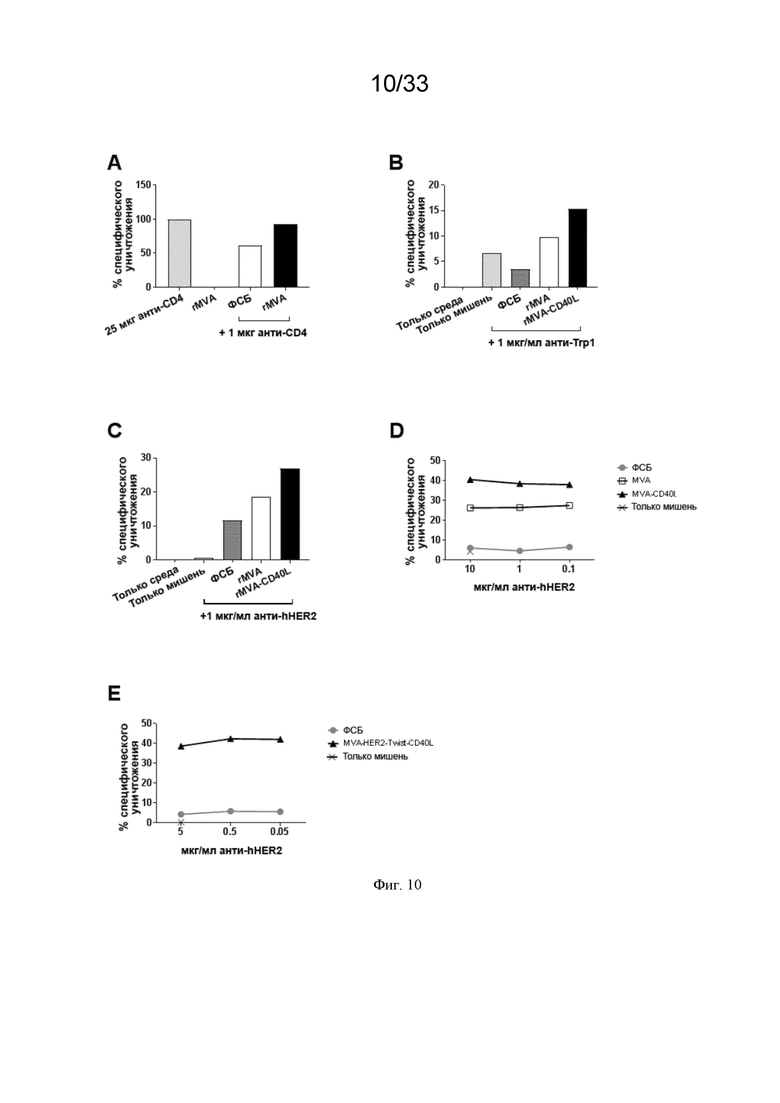
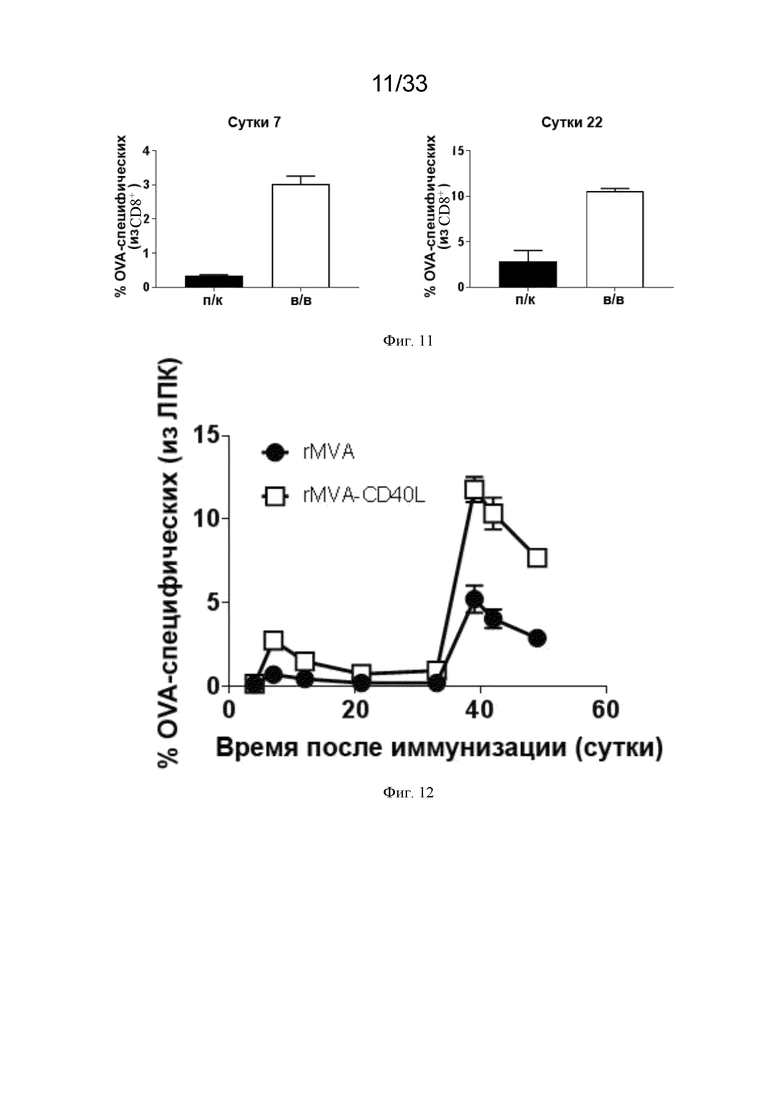
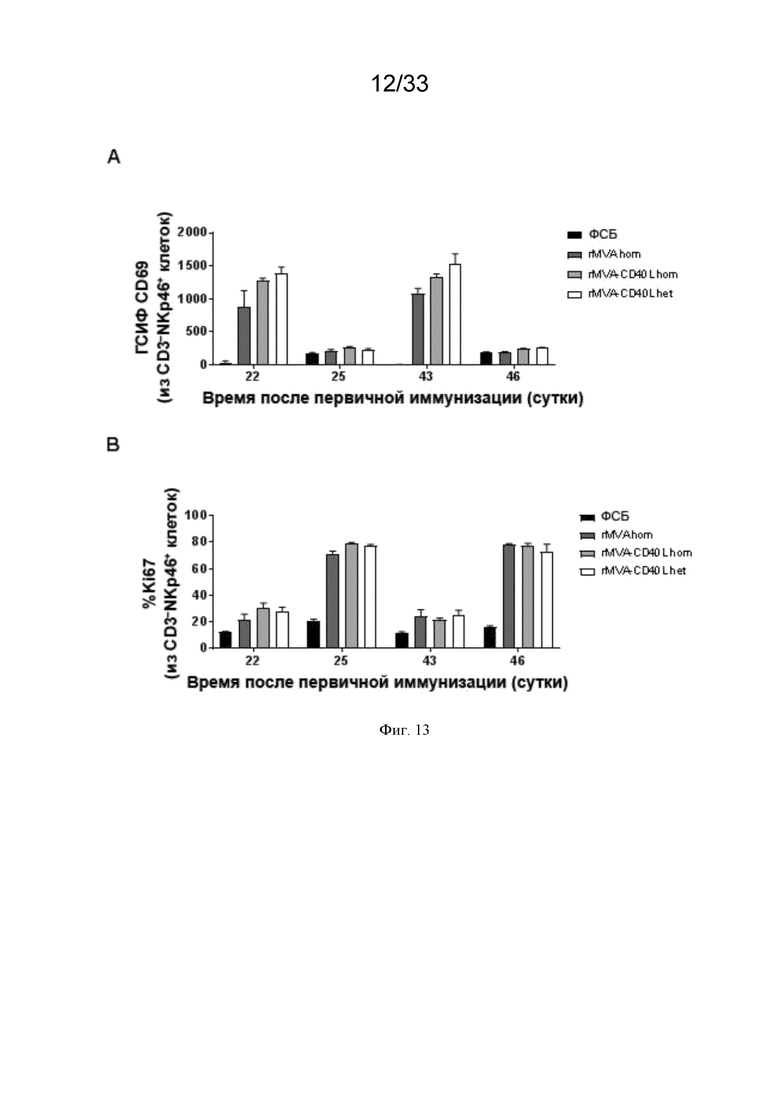
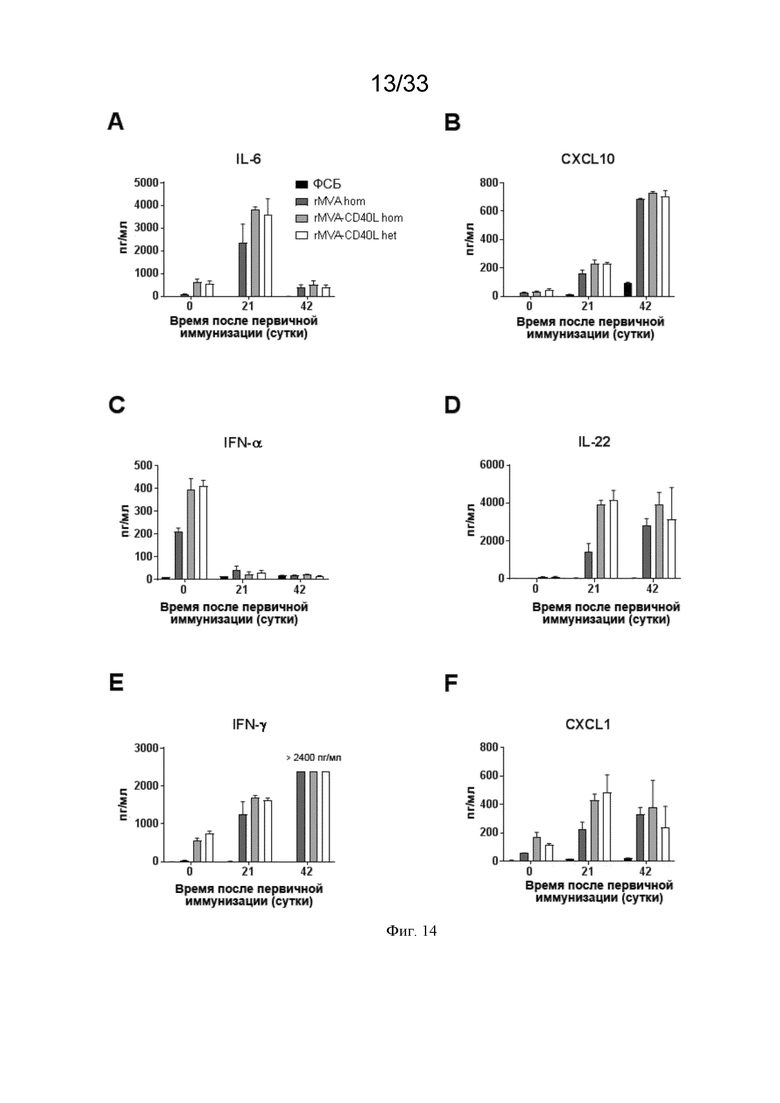
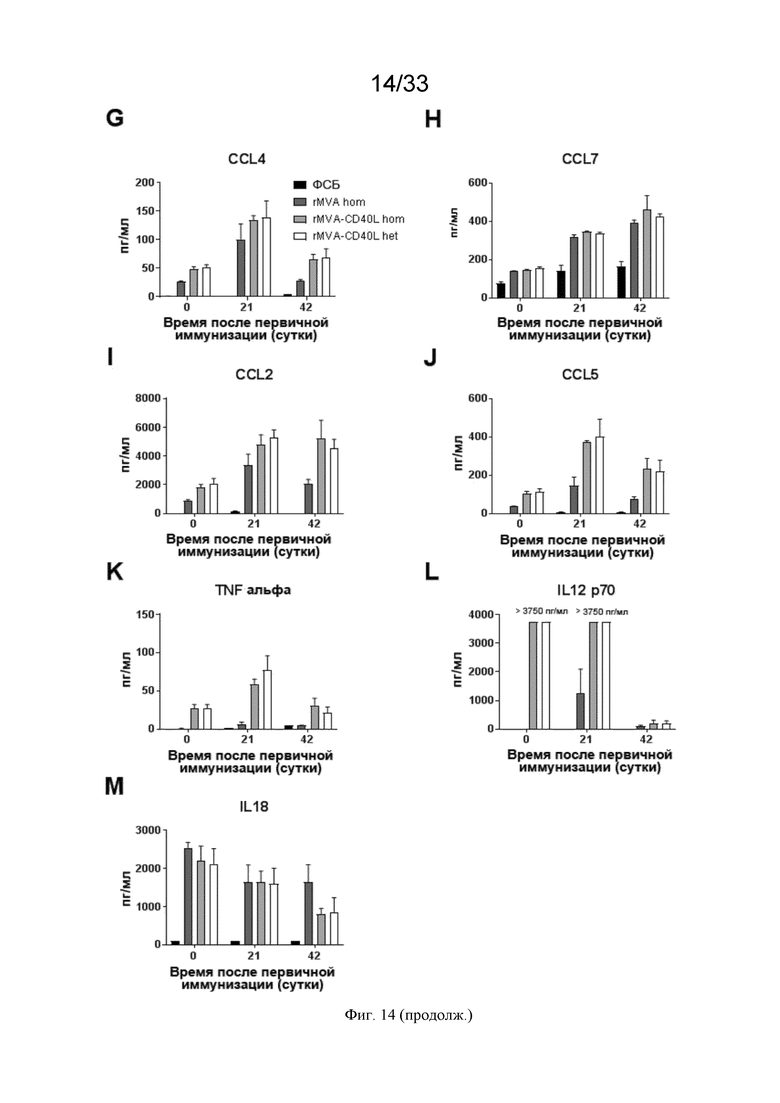
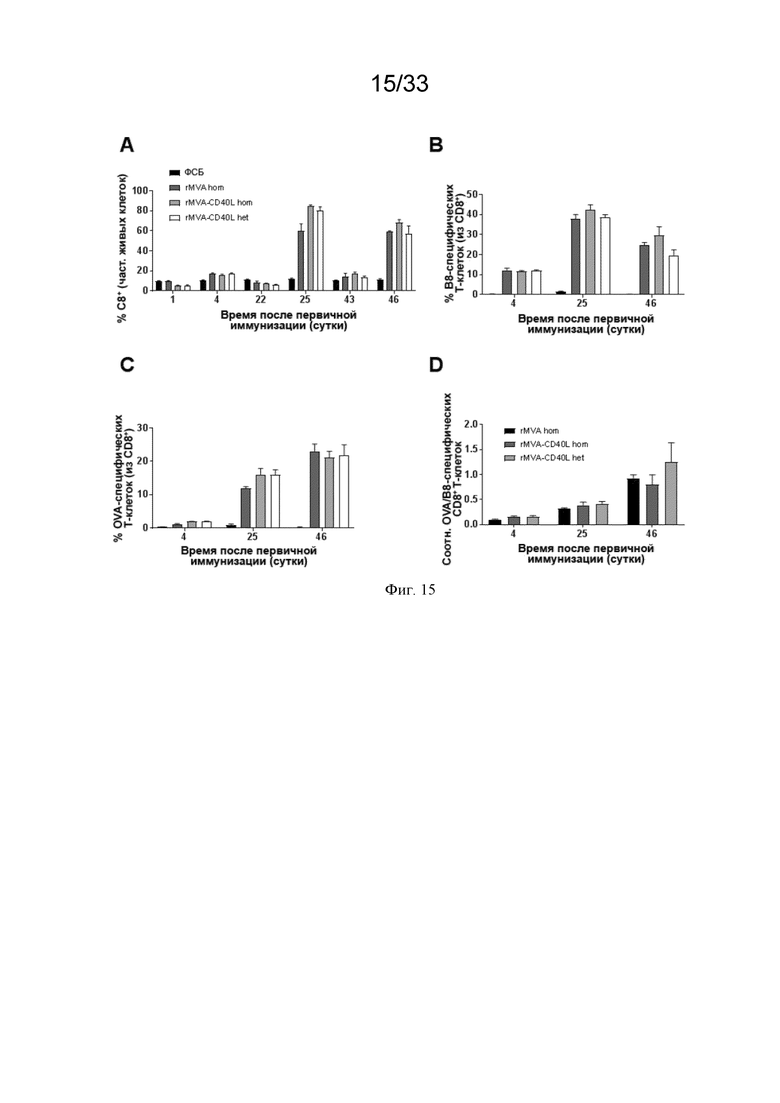
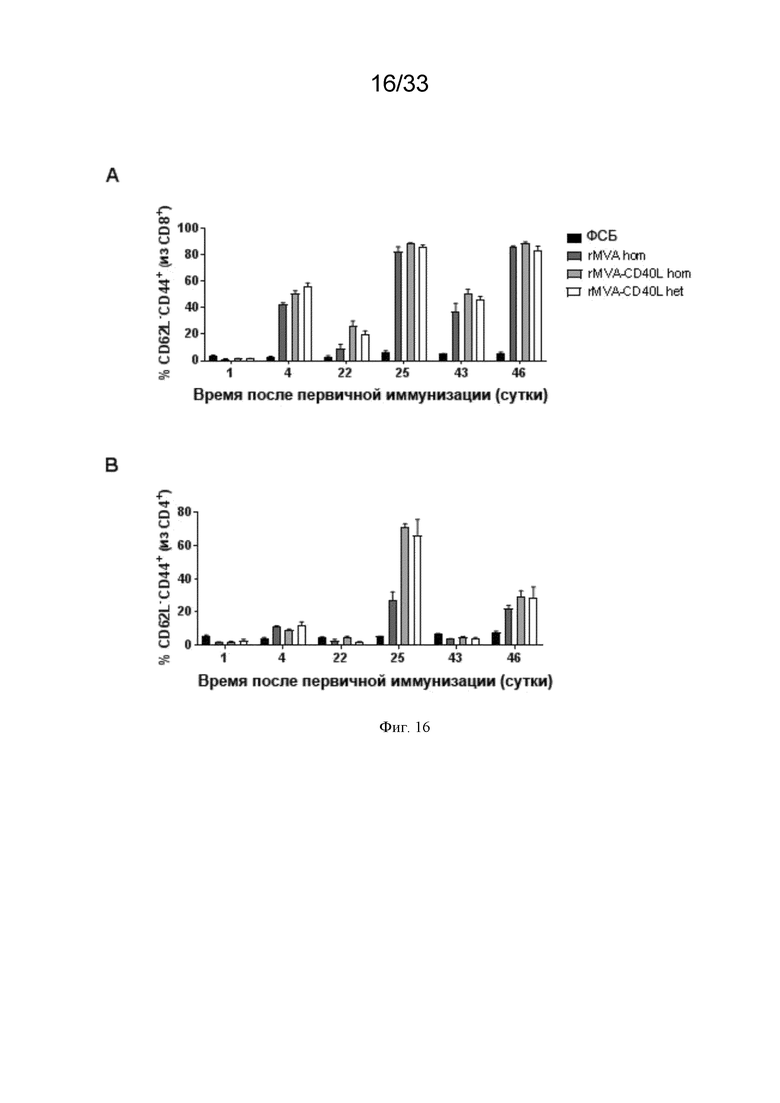
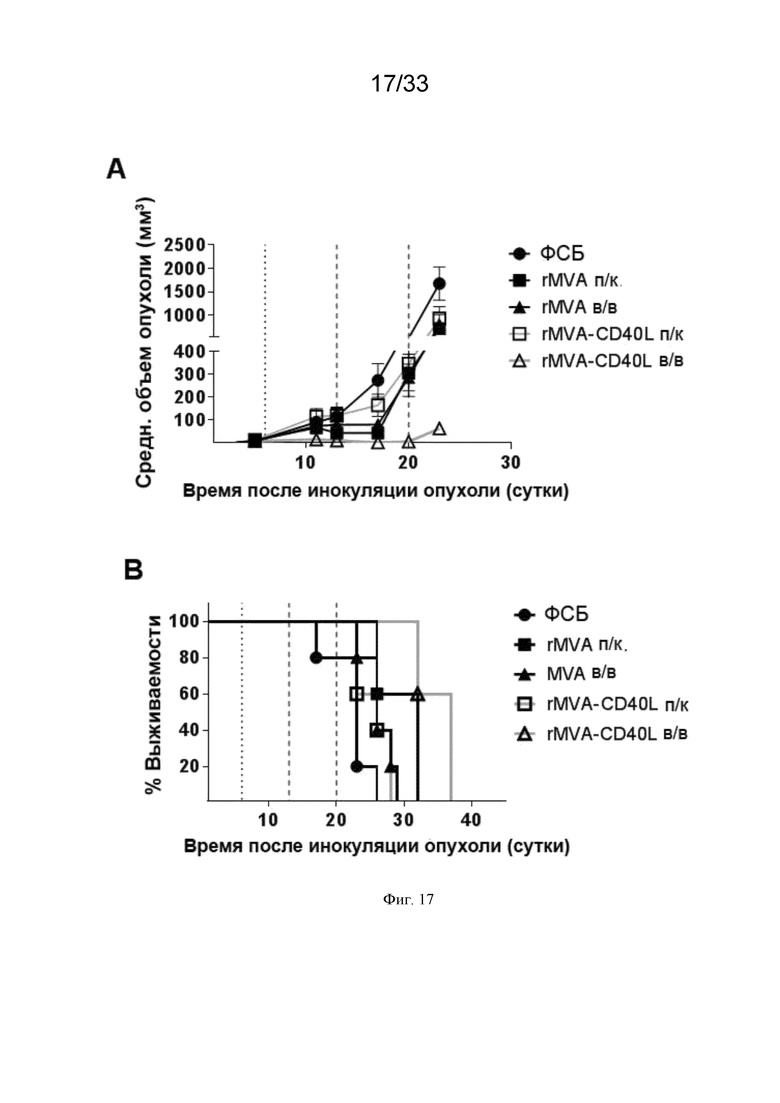
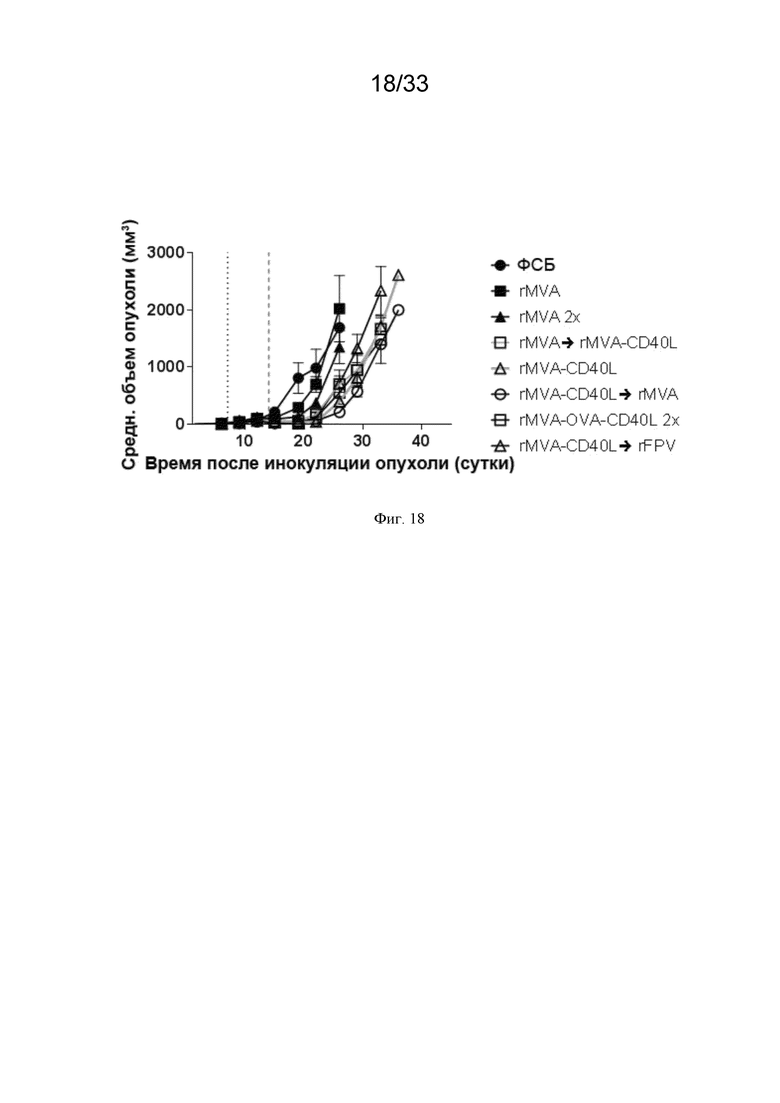
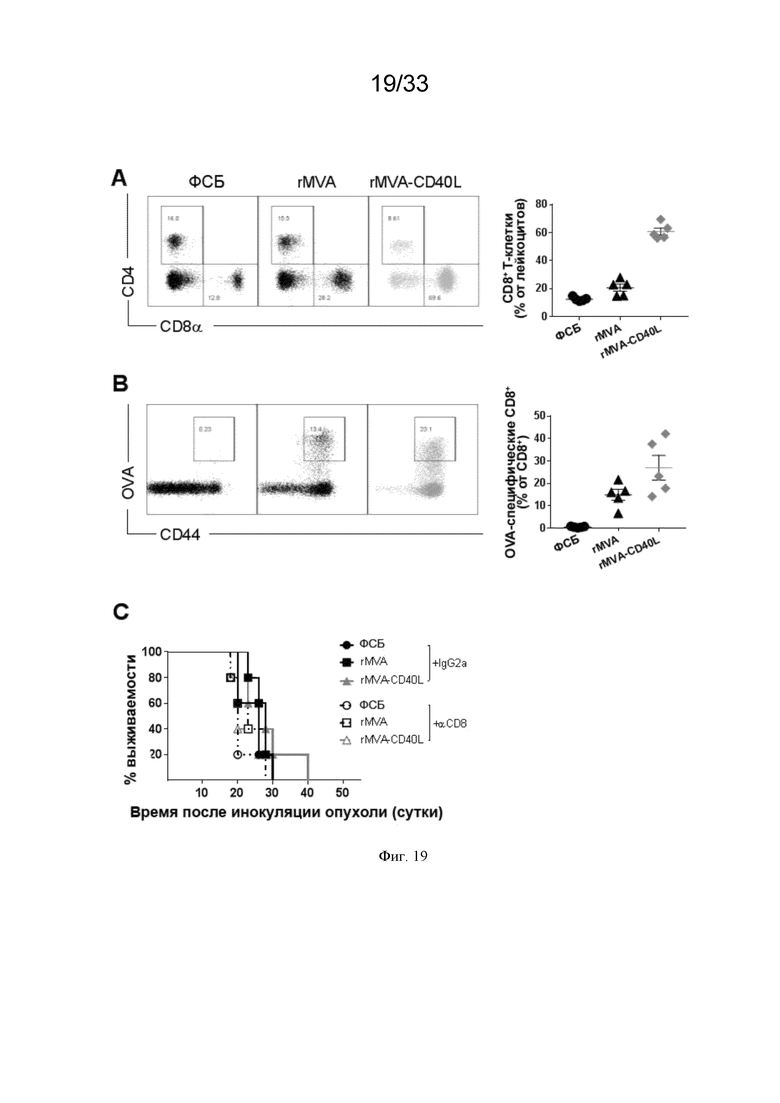
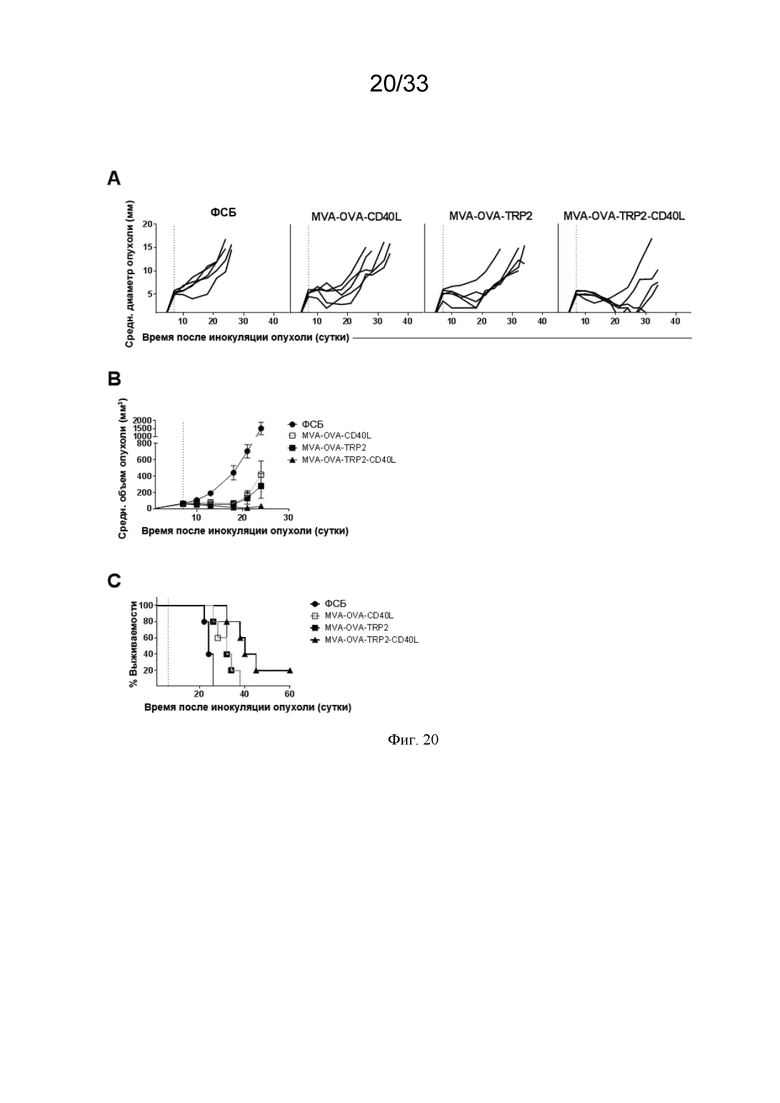
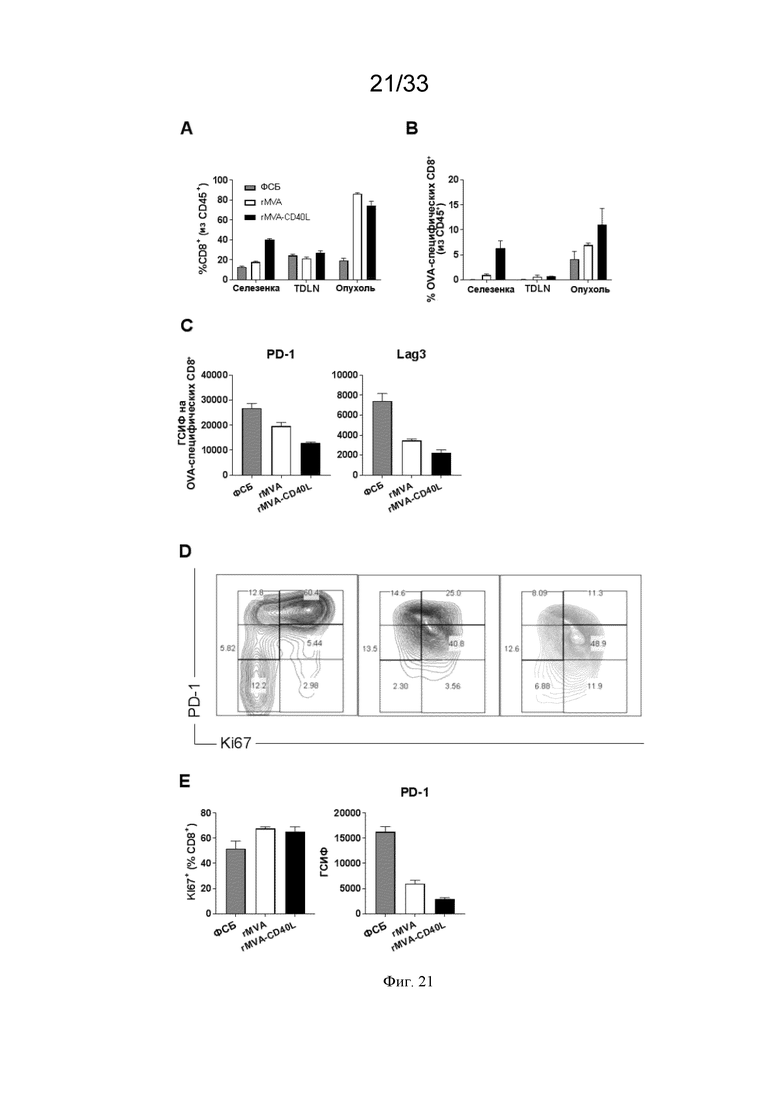
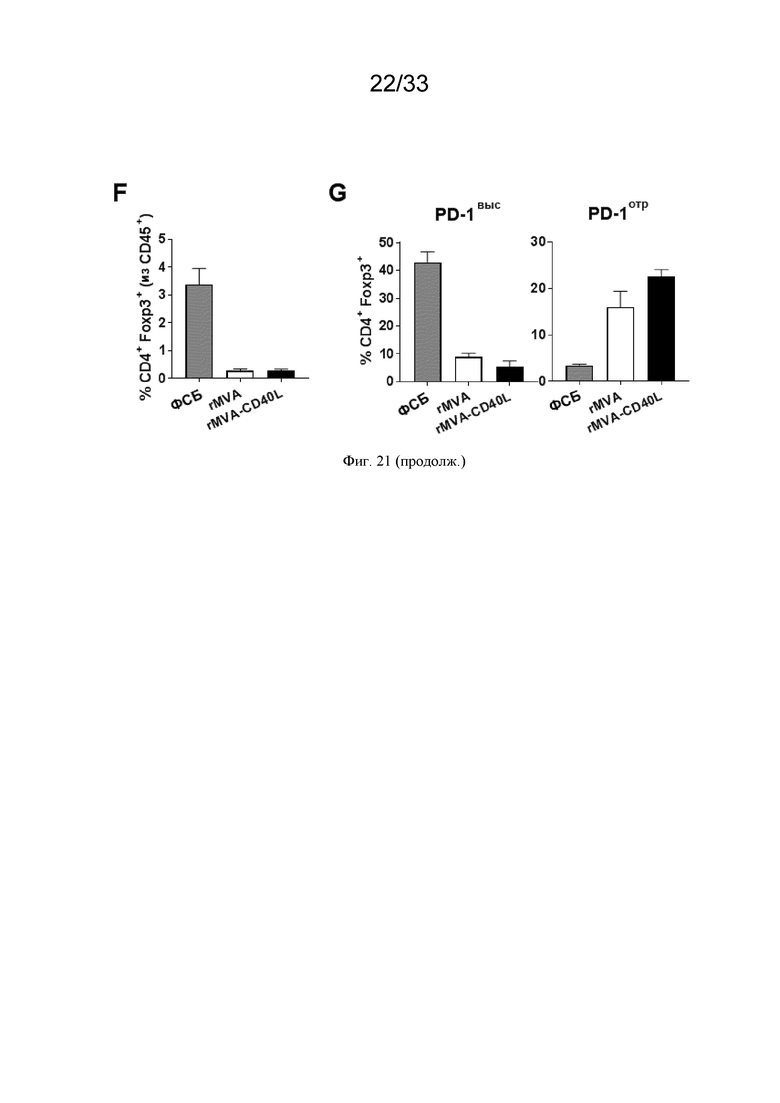
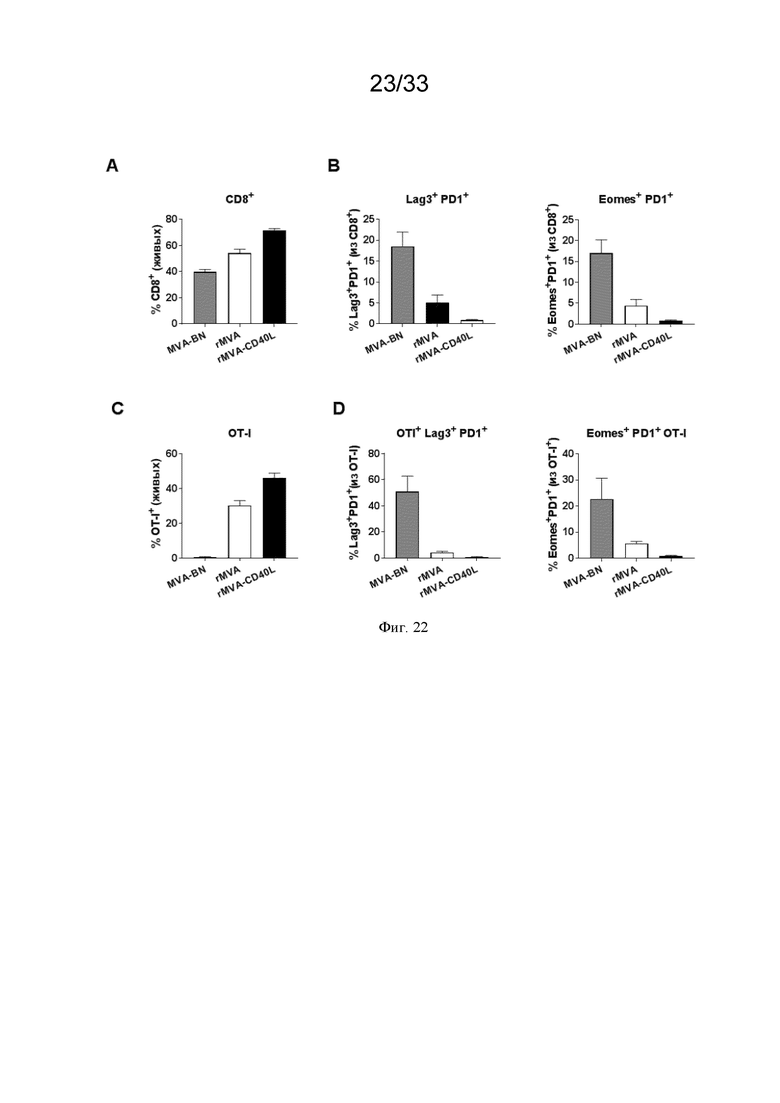
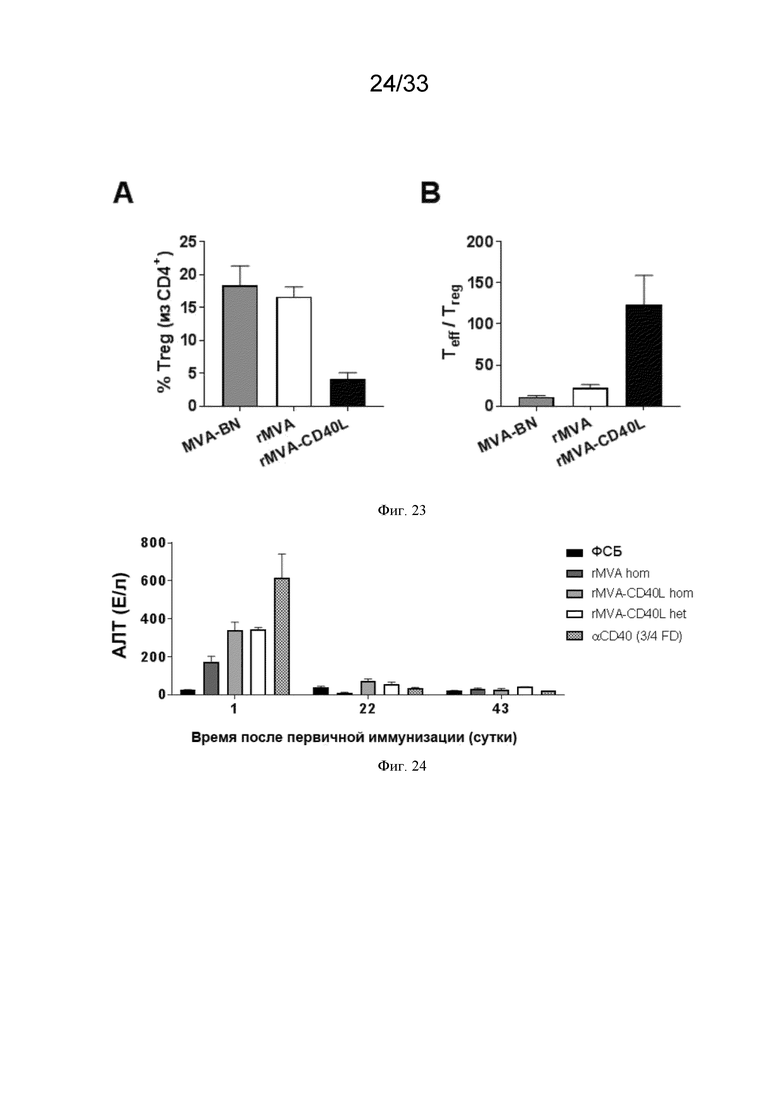
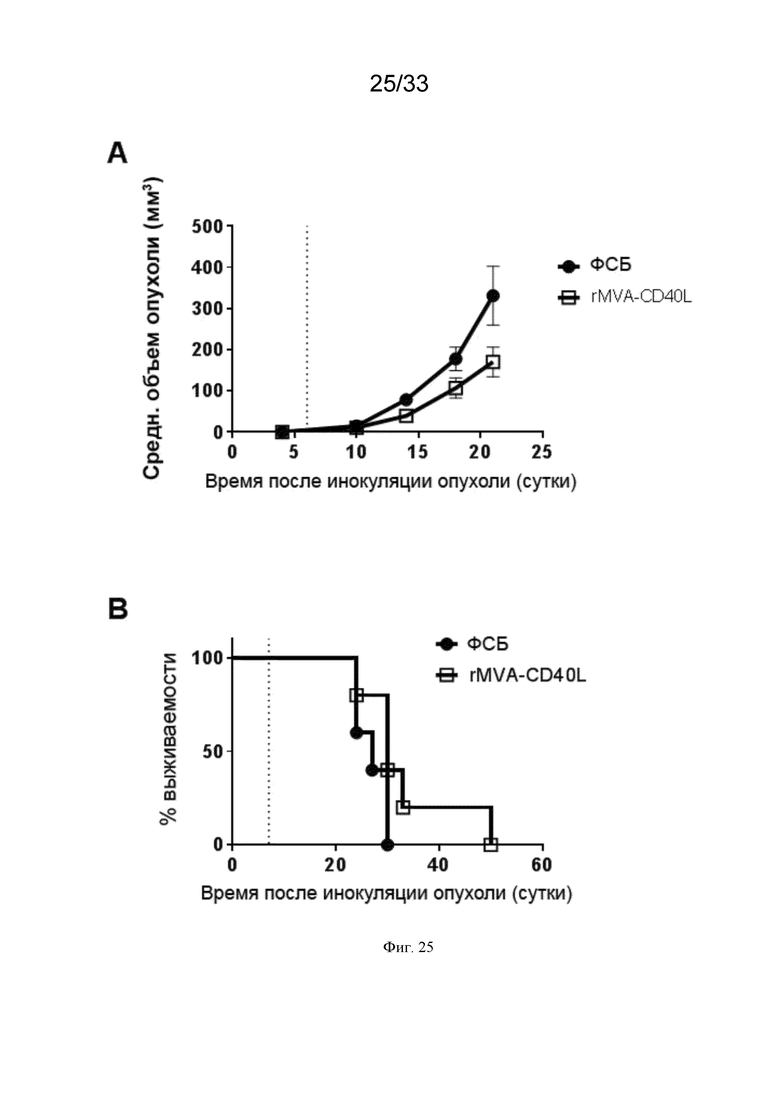
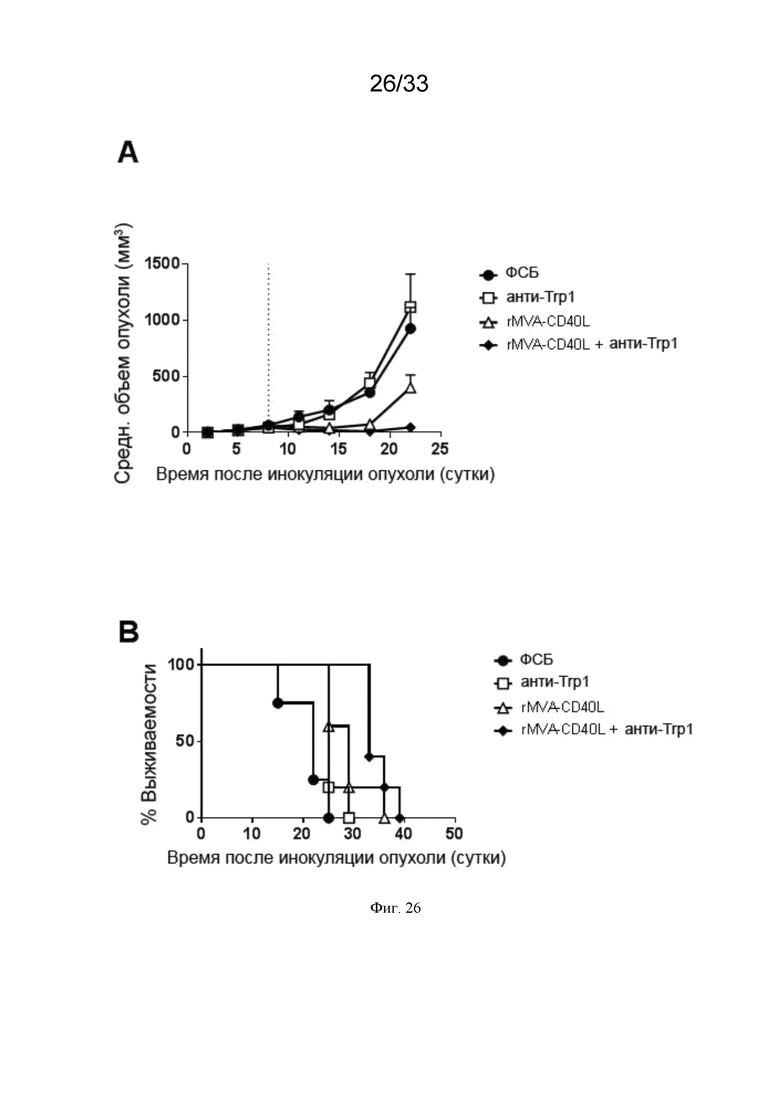
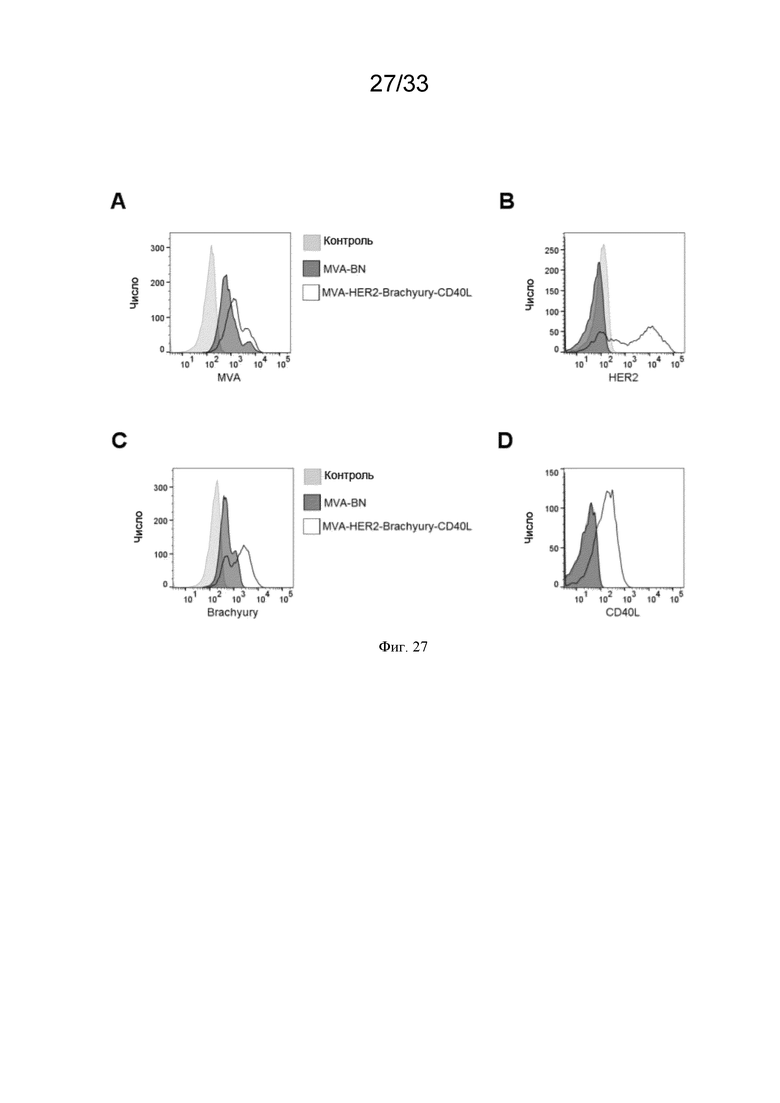
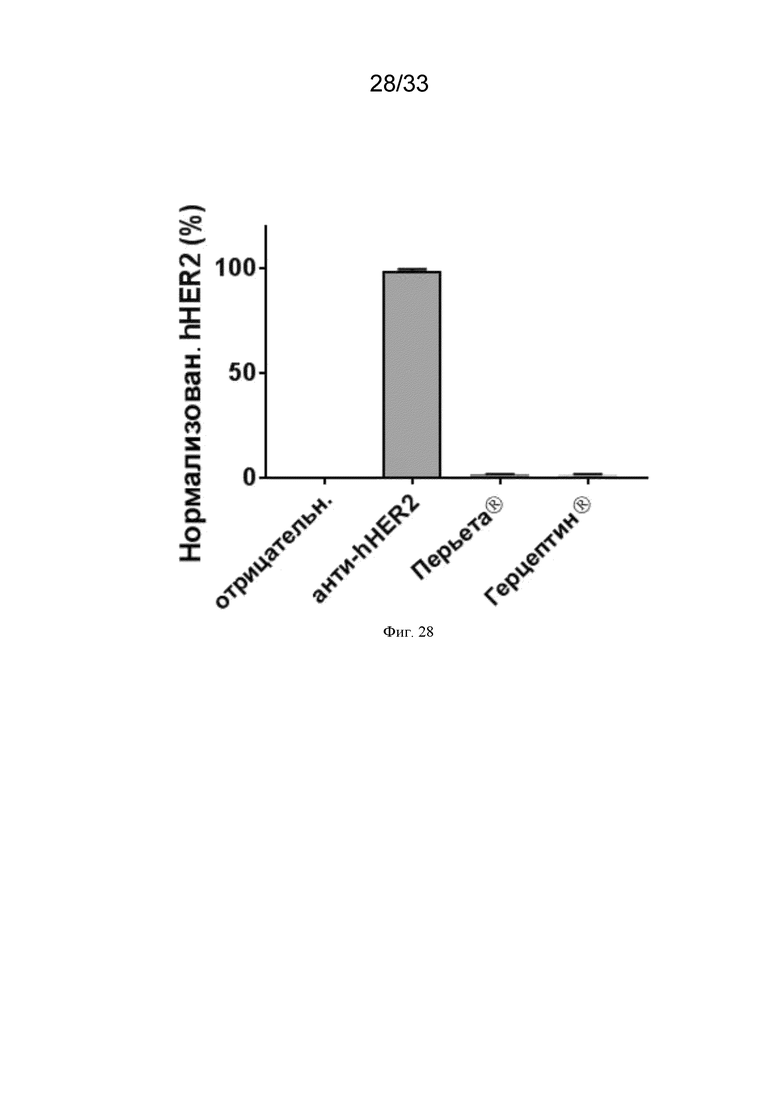
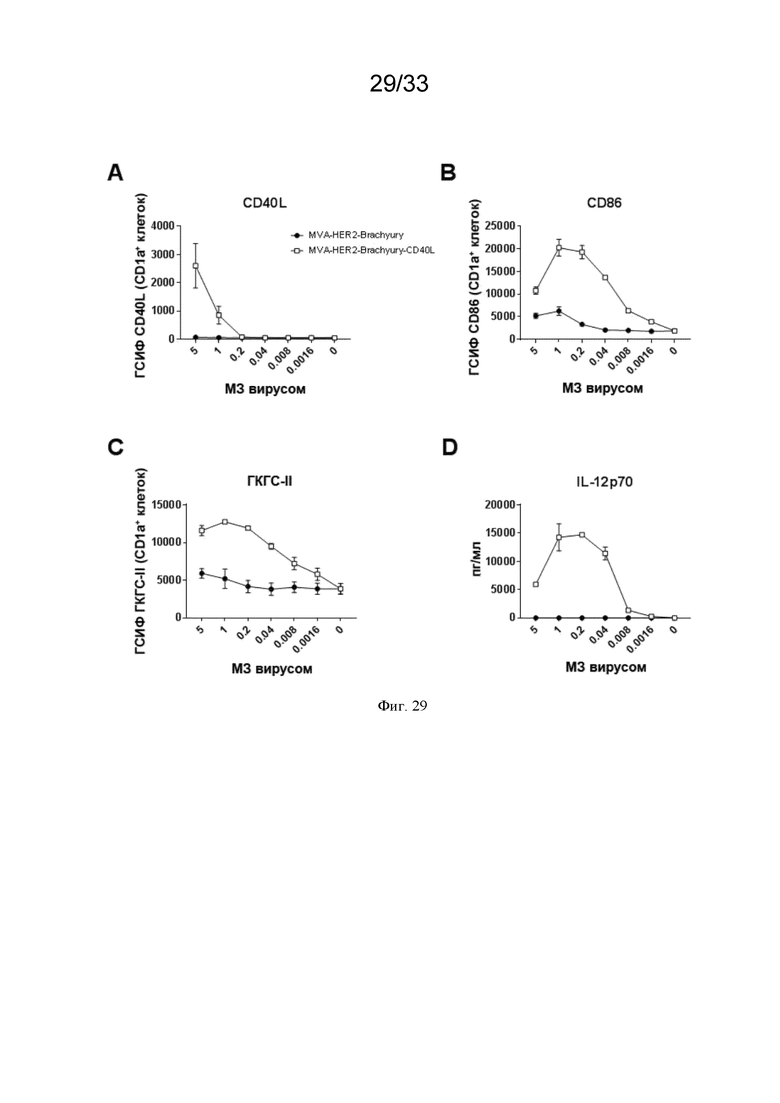
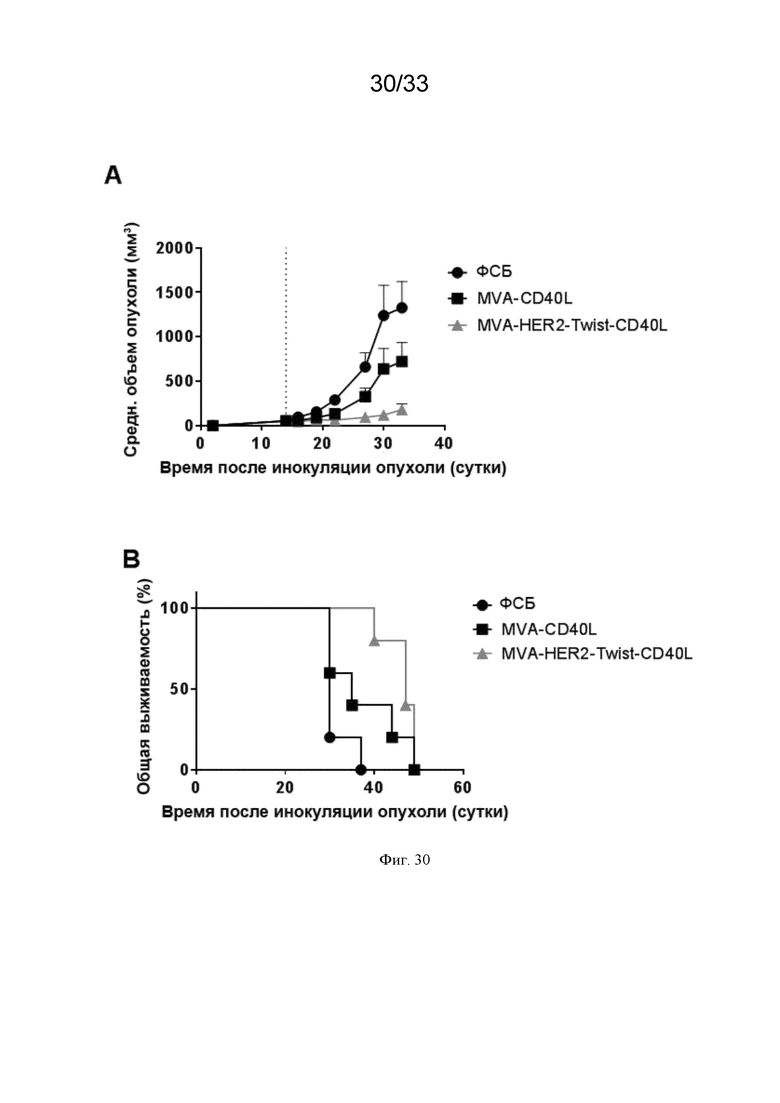
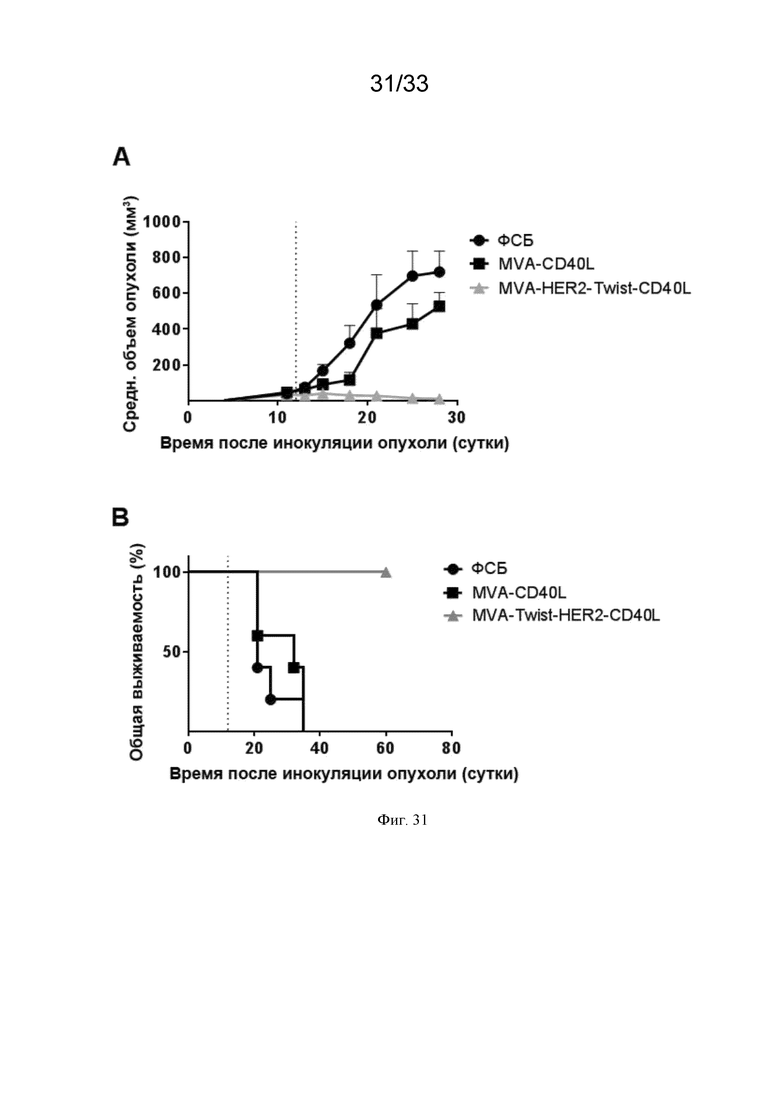
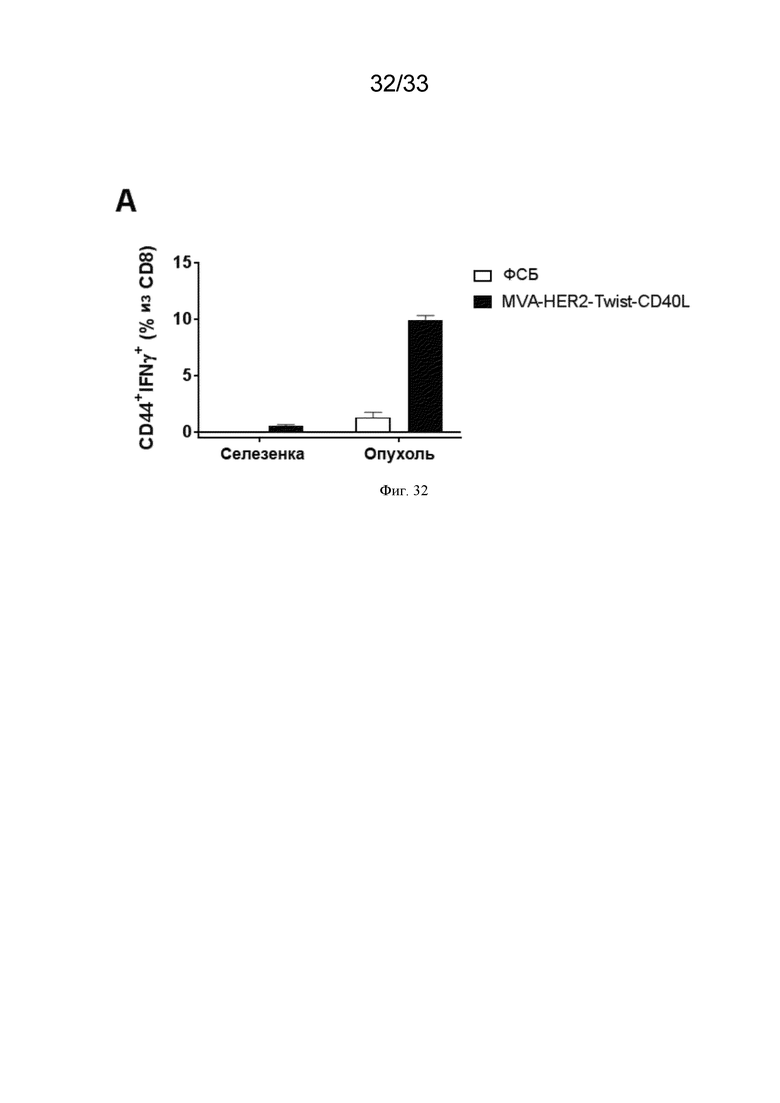
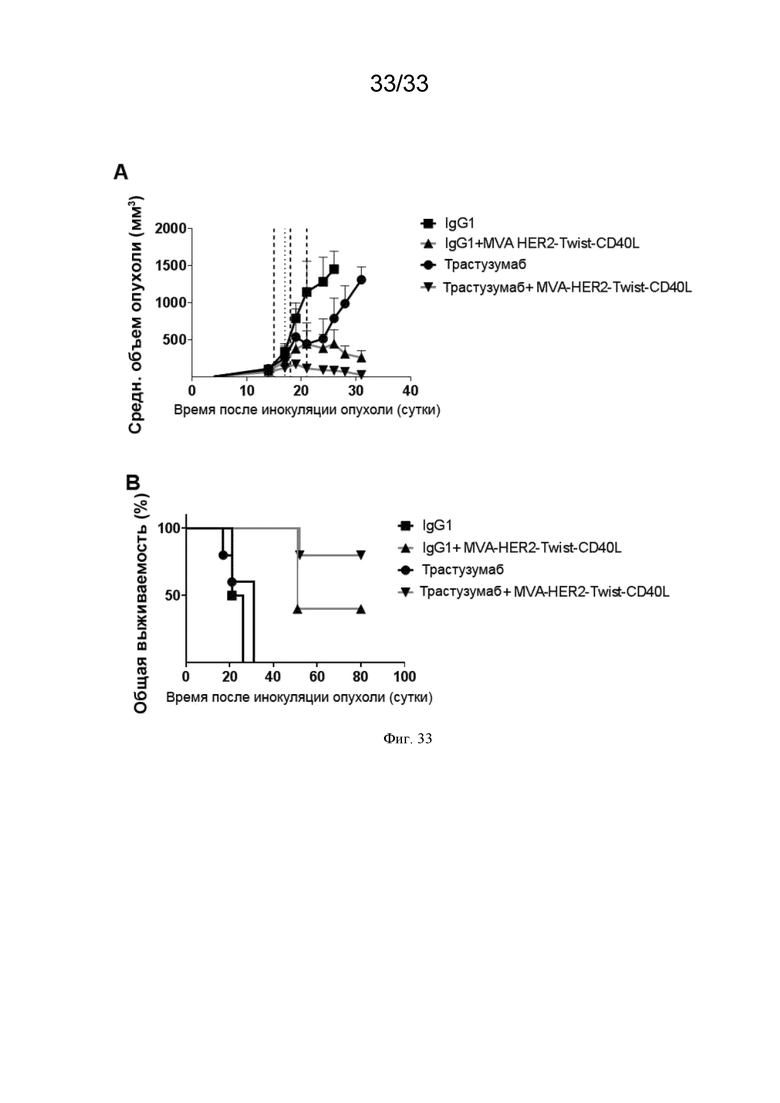
Группа изобретений относится к области медицины, а именно к онкологии, и предназначена для снижения размера опухоли и/или повышения выживаемости онкологического пациента. Фармацевтическая комбинация содержит рекомбинантный модифицированный вирус осповакцины Анкара (MVA)и антитело. В другом воплощении обеспечивается способ снижения размера опухоли и/или повышения выживаемости онкологического пациента, включающий введение пациенту указанной фармацевтической комбинации. Использование группы изобретений обеспечивает снижение объема опухоли и/или повышение выживаемости онкологического пациента благодаря эффективному нацеливанию и уничтожению опухолевых клеток. 2 н. и 30 з.п. ф-лы, 33 ил., 3 табл., 34 пр.
1. Фармацевтическая комбинация снижения размера опухоли и/или повышения выживаемости онкологического пациента, содержащая:
(a) рекомбинантный модифицированный вирус осповакцины Анкара (MVA), содержащий:
(i) первую нуклеиновую кислоту, кодирующую первый гетерологичный опухолеассоциированный антиген (ОАА), и
(ii) вторую нуклеиновую кислоту, кодирующую CD40L; и
(b) антитело, содержащее Fc-домен, и является специфическим к антигену, который экспрессируется на клеточной мембране опухолевой клетки.
2. Фармацевтическая комбинация по п. 1, отличающаяся тем, что рекомбинантный MVA дополнительно содержит вторую нуклеиновую кислоту, кодирующую второй гетерологичный ОАА.
3. Фармацевтическая комбинация по п. 1 или 2, отличающаяся тем, что первый и/или второй ОАА выбраны из группы, состоящей из: 5-α-редуктазы, α-фетопротеина («AFP»), AM-1, APC, April, гена антигена меланомы B («BAGE»), β-катенина, Bcl12, bcr-abl, Brachyury, CA-125, каспазы-8 («CASP-8», также известный как «FLICE»), катепсинов, CD19, CD20, CD21/рецептора комплемента 2 («CR2»), CD22/BL-CAM, CD23/FcεRII, CD33, CD35/рецептора комплемента 1 («CR1»), CD44/PGP-1, CD45/общего антигена лейкоцитов («LCA»), CD46/мембранного кофакторного белка («MCP»), CD52/CAMPATH-1, CD55/фактора ускорения распада («DAF»), CD59/протектина, CDC27, CDK4, карциноэмбрионального антигена («CEA»), c-myc, циклооксигеназы-2 («cox-2»), удаленного при колоректальном раке гена («DCC»), DcR3, E6/E7, CGFR, EMBP, Dna78, фарнезилтрансферазы, фактора роста фибробластов-8a («FGF8a»), фактора роста фибробластов-8b («FGF8b»), FLK-1/KDR, рецептора фолиевой кислоты, G250, семейства генов антигена меланомы G («GAGE-семейство»), гастрина 17, гастрин-высвобождающего гормона, ганглиозида 2 («GD2»)/ганглиозида 3 («GD3»)/ганглиозида-моносиаловой кислоты-2 («GM2»), гонадотропин-высвобождающего гормона («GnRH»), UDP-GlcNAc:R1Man(α1-6)R2 [GlcNAc до Man(α1-6)] β1,6-N-ацетилглюкозаминилтрансферазы V («GnT V»), GP1, gp100/Pme117, gp-100-in4, gp15, gp75/тирозин-родственного белка-1 («gp75/TRP-1»), человеческого хорионического гонадотропина («hCG»), гепараназы, HER2, вируса опухоли молочной железы человека («HMTV»), белка теплового шока 70 кДа («HSP70»), человеческой обратной транскриптазы теломеразы («hTERT»), рецептора инсулин-подобного фактора роста-1 («IGFR-1»), рецептора интерлейкина-13 («IL-13R»), индуцибельной синтазы оксида азота («iNOS»), Ki67, KIAA0205, K-ras, H-ras, N-ras, KSA, LKLR-FUT, гена, кодирующего антиген меланомы 1 («MAGE-1»), гена, кодирующего антиген меланомы 2 («MAGE-2»), гена, кодирующего антиген меланомы 3 («MAGE-3»), гена, кодирующего антиген меланомы 4 («MAGE-4»), маммаглобина, MAP17, мелан-A/антигена меланомы, распознаваемого Т-клетками 1 («MART-1»), мезотелина, MIC A/B, MT-MMP, муцина, специфического для семенников антигена NY-ESO-1, остеонектина, p15, P170/MDR1, p53, p97/меланотрансферрина, PAI-1, тромбоцитарного фактора роста («PDGF»), μPA, PRAME, пробазина, прогенипоиетина, простатического специфического антигена («PSA»), простат-специфического мембранного антигена («PSMA»), RAGE-1, Rb, RCAS1, SART-1, SSX-семейства, STAT3, STn, TAG-72, трансформирующего фактора роста альфа («TGF-α»), трансформирующего фактора роста бета («TGF-β»), тимозина-бета-15, фактора некроза опухоли альфа («TNF-α»), TP1, TRP-2, тирозиназы, фактора роста эндотелия сосудов («VEGF»), ZAG, p16INK4 и глутатион-S-трансферазы («GST»).
4. Фармацевтическая комбинация по любому из пп. 1-3, отличающаяся тем, что первый ОАА представляет собой антиген HER2 и антитело представляет собой антитело к HER2.
5. Фармацевтическая комбинация по любому из пп. 1-4, отличающаяся тем, что антиген HER2 содержит по меньшей мере одну мутацию: (a) для предотвращения связывания антитела к HER2 с антигеном HER2; (b) предотвращения внеклеточной димеризации антигена HER2; (c) предотвращения тирозинкиназной активности антигена HER2; и/или (d) предотвращения фосфорилирования антигена HER2.
6. Фармацевтическая комбинация по п. 4 или 5, отличающаяся тем, что антиген HER2 содержит по меньшей мере одну мутацию в связывающем домене трастузумаба, выбранную из группы, состоящей из: E580, D582, P594, F595, K615 и Q624.
7. Фармацевтическая комбинация по п. 4 или 5, отличающаяся тем, что антиген HER2 содержит по меньшей мере одну мутацию в связывающем домене пертузумаба, выбранную из группы, состоящей из: H267, Y274, F279, V308, S310, L317, H318, K333 и P337.
8. Фармацевтическая комбинация по любому из пп. 1-7, отличающаяся тем, что первая нуклеиновая кислота кодирует антиген HER2, имеющий по меньшей мере 90%, 95%, 97%, 98% или 99% идентичности с SEQ ID NO:1.
9. Фармацевтическая комбинация по любому из пп. 1-7, отличающаяся тем, что первая нуклеиновая кислота кодирует антиген HER2, имеющий по меньшей мере 90%, 95%, 97%, 98% или 99% идентичности с SEQ ID NO: 13.
10. Фармацевтическая комбинация по любому из пп. 1-7, отличающаяся тем, что первая нуклеиновая кислота кодирует SEQ ID NO: 1.
11. Фармацевтическая комбинация по любому из пп. 1-7, отличающаяся тем, что первая нуклеиновая кислота кодирует SEQ ID NO: 13.
12. Фармацевтическая комбинация по любому из пп. 1-7, отличающаяся тем, что первая нуклеиновая кислота содержит нуклеиновую кислоту, имеющую по меньшей мере 90%, 95%, 97%, 98% или 99% идентичности с SEQ ID NO: 2.
13. Фармацевтическая комбинация по любому из пп. 1-7, отличающаяся тем, что первая нуклеиновая кислота содержит нуклеиновую кислоту, имеющую по меньшей мере 90%, 95%, 97%, 98% или 99% идентичности с SEQ ID NO: 14.
14. Фармацевтическая комбинация по любому из пп. 1-7, отличающаяся тем, что первая нуклеиновая кислота содержит SEQ ID NO:2.
15. Фармацевтическая комбинация по любому из пп. 1-7, отличающаяся тем, что первая нуклеиновая кислота содержит SEQ ID NO: 14.
16. Фармацевтическая комбинация по любому из пп. 1-15, отличающаяся тем, что второй ОАА представляет собой антиген Brachyury.
17. Фармацевтическая комбинация по п. 16, отличающаяся тем, что антиген Brachyury содержит одну или более мутаций для предотвращения ядерной локализации.
18. Фармацевтическая комбинация по любому из пп. 1-17, отличающаяся тем, что вторая нуклеиновая кислота кодирует антиген Brachyury, имеющий по меньшей мере 90%, 95%, 97%, 98% или 99% идентичности с SEQ ID NO:3.
19. Фармацевтическая комбинация по любому из пп. 16-18, отличающаяся тем, что вторая нуклеиновая кислота кодирует антиген Brachyury, содержащий SEQ ID NO:3.
20. Фармацевтическая комбинация по любому из пп. 16-19, отличающаяся тем, что вторая нуклеиновая кислота содержит нуклеиновую кислоту, имеющую по меньшей мере 90%, 95%, 97%, 98% или 99% идентичности с SEQ ID NO:4.
21. Фармацевтическая комбинация по любому из пп. 16-20, отличающаяся тем, что вторая нуклеиновая кислота содержит SEQ ID NO:4.
22. Фармацевтическая комбинация по любому из пп. 1-3, отличающаяся тем, что антитело выбрано из группы, состоящей из: анти-CD20 (например, ритуксимаб; офатумумаб; тозитумомаб), анти-CD52 (например, алемтузумаб Кампат®), анти-EGFR (например, цетуксимаб Эрбитукс®¸ панитумумаб), анти-CD2 (например, сиплизумаб), анти-CD37 (например, BI836826), анти-CD123 (например, JNJ-56022473), анти-CD30 (например, XmAb2513), анти-CD38 (например, даратумумаб Дарзалекс®), анти-PDL1 (например, авелумаб, атезолизумаб, дурвалумаб), анти-GD2 (например, 3F8, ch14.18, KW-2871, динутуксимаб), анти-CEA, анти-MUC1, анти-FLT3, анти-CD19, анти-CD40, анти-SLAMF7, анти-CCR4, анти-B7-H3, анти-ICAM1, анти-CSF1R, анти-CA125 (например ореговомаб), анти-FRα (например MOv18-IgG1, мирветуксимаб соравтанзин (IMGN853), MORAb-202), анти-мезотелина (например MORAb-009) и анти-HER2.
23. Фармацевтическая комбинация по п. 4 или 5, отличающаяся тем, что антитело является специфическим к антигену HER2.
24. Фармацевтическая комбинация по п. 4 или 5, отличающаяся тем, что антитело выбрано из пертузумаба, трастузумаба, Герзумы, ABP 980 и адо-трастузумаба эмтанзина.
25. Фармацевтическая комбинация по любому из пп. 1-24, отличающаяся тем, что MVA представляет собой MVA-BN или производное MVA-BN.
26. Фармацевтическая комбинация по любому из пп. 1-25, отличающаяся тем, что (a) вводят одновременно или после (b).
27. Фармацевтическая комбинация по любому из пп. 1-26, отличающаяся тем, что (a) и (b) вводят онкологическому пациенту в виде примирующего введения с последующими одним или более бустерными введениями (a) и (b) онкологическому пациенту.
28. Фармацевтическая комбинация по любому из пп. 1-27, отличающаяся тем, что онкологический пациент имеет и/или у него диагностирован рак, выбранный из группы, состоящей из: рака молочной железы, рака легкого, рака головы и шеи, рака щитовидной железы, меланомы, рака желудка, рака мочевого пузыря, рака почки, рака печени, меланомы, рака поджелудочной железы, рака предстательной железы, рака яичника или колоректального рака.
29. Фармацевтическая комбинация по п. 28, отличающаяся тем, что рак молочной железы представляет собой рак молочной железы со сверхэкспрессией HER2.
30. Фармацевтическая комбинация по любому из пп. 1-29, отличающаяся тем, что (а) вводят внутривенно онкологическому пациенту.
31. Способ снижения размера опухоли и/или повышения выживаемости онкологического пациента, включающий введение пациенту фармацевтической комбинации по любому из пп. 1-29.
32. Способ по п.31, отличающаяся тем, что (а) фармацевтической комбинации вводят внутривенно онкологическому пациенту.
| WO 2015175334 A2, 19.11.2015 | |||
| WO 2014037124 A1, 13.03.2014 | |||
| FOY SP et al | |||
| Очаг для массовой варки пищи, выпечки хлеба и кипячения воды | 1921 |
|
SU4A1 |
| Cancer Immunol Immunother, 2016, 65(5):537-49 | |||
| WO 2014043518 A1, 20.03.2014 | |||
| WO 2005012527 A1, | |||
Авторы
Даты
2023-04-28—Публикация
2018-08-23—Подача