Область техники
Изобретение относится к новому вирусному вектору с модифицированным вирусным капсидом или вирусной оболочкой; фармацевтической композиции или иммуногенному средству или вакцине, содержащему(ей) вышеуказанное; клетке-мишени, трансформированной или трансфицированной вышеуказанным; терапевтической комбинации, содержащей вышеуказанное; использованию вышеуказанного при лечении рака и способу лечения рака с использованием вышеуказанного.
Уровень техники
Профилактические вакцинации - одна из наиболее эффективных форм медицинских вмешательств, имеющая прямые клинические преимущества и экономические преимущества в области здравоохранения, наиболее очевидным примером чего является искоренение распространенных смертельных инфекций. Большинство вакцин основываются на использовании аттенуированных патогенов или их частей и вызывают стойкий репертуар Т-клеток памяти, направленный против патогена, при чем в ответе Т-клеточной памяти доминируют Т-клетки CD4+. После иммунизации наивные Т-клетки дифференцируются в эффекторные Т-клетки памяти (TEM), которые быстро активируются в ответ на обнаружение стимулирующего антигена, и в Т-клетки центральной памяти (TCM), которые находятся преимущественно в лимфоидных органах и не сразу реагируют в ответ на патогены. В мировой популяции существует стойкий репертуар Т-клеток памяти против патогенов, которые включены в национальные программы вакцинации.
Напротив, эффективность иммунотерапии рака основывается на выработке специфических цитотоксических лимфоцитов CD8+, которые распознают белки главного комплекса гистосовместимости I (ГКГ I). Эффективная противоопухолевая активность требует быстрого клеточно-опосредованного иммунного ответа. Необходимо отметить, что была показана необходимость взаимодействия CD4+ и CD8+ Т-клеток для возникновения эффективного противоопухолевого иммунитета. Действительно, CD4+ T-клетки подают сигналы, которые улучшают функциональность CD8+ T-клеток в микроокружении опухоли. Было также установлено, что в мышиной модели их деплеция, проведенная до образования опухоли, приводит к полному прекращению отторжения опухоли.
Однако хотя ключевая роль CD4+ T-клеток в опосредованном Т-клетками иммунитете хорошо известна, пока не выяснено, как оптимально использовать взаимодействие между CD4+ и CD8+ Т-клетками в стратегиях лечения рака.
Также нерешенной остается задача использования патоген-специфических Т-клеток памяти (в основном - CD4+ T-клетки) для усиления противоопухолевого ответа CD8+ цитотоксических T-лимфоцитов (CTL).
Для оценки эффекта повторного использования патоген-специфических CD4+ Т-клеток памяти в противоопухолевых ответах CD8+ Т-клеток у мышей, предварительно иммунизированных вакцинами, специфическими для патогенов человека, мы использовали нашу платформу условно реплицирующегося аденовируса с пептидным покрытием (PeptiCRAd), основанную, например, на онколитическом аденовирусе, покрытом белками, специфичными в отношении ГКГ(11). Не связывая себя какой-либо конкретной теорией, авторы полагают, что антигенпрезентирующие клетки обрабатывают вирус и пептиды, специфические для опухоли и патогена, которые соединяются с поверхностью вируса, и презентируют опухоль-специфические эпитопы CD8+T-клеткам и патоген-специфические эпитопы CD4+ Т-клеткам памяти, которые, в свою очередь, в качестве побочного эффекта, поддерживают иммунный ответ, опосредованный CD8+ T-клетками.
В качестве доказательства концепции мы использовали не получавших никакого лечения или предварительно иммунизированных против столбняка иммунокомпетентых мышей с привитыми опухолями меланомы (B16.OVA). Мыши получали внутриопухолевые инъекции PeptiCRAd, покрытого антигеном SIINFEKL (т.е. CD8+ T-клеточным эпитопом овальбумина куриного яйца) и пептидами столбнячного токсина (CD4+ T-клеточным эпитопом). Как и предполагалось, наблюдался хороший противоопухолевый ответ у мышей, предварительно иммунизированных противостолбнячной вакциной и получавших лечение вирусами, покрытыми антигенами столбнячного токсина и меланомы (TT-OVA-PeptiCRAd). Важно отметить, что у мышей, не получавших предварительно никакого лечения, преимущество лечения TT-OVA-PeptiCRAd по сравнению с контрольным лечением утрачивалось, что подчеркивает необходимость наличия предварительного иммунитета против патогенных антигенов для использования CD4+ Т-клеток памяти. Мы проверили эту стратегию путем воздействия на различные патогены (например, дифтерию и коклюш), также в сочетании с лечением ингибитором иммунных контрольных точек (например, антителом к PD-1). Привлечение CD4 + Т-клеток специфическими для дифтерии-коклюша пептидами, ограниченными классом ГКГ-II, приводило к более медленному росту опухоли у предварительно иммунизированных мышей. Кроме того, у мышей, получавших лечение, наблюдалась более сильная, чем у животных контрольной группы, инфильтрация эффекторных CD4+ T-клеток памяти в микроокружение опухоли. Эти результаты показали, что предложенный механизм действия применим не только к столбняку, но может быть распространен на другие вакцинные композиции.
Таким образом, предлагаемый вирусный вектор может быть использован для вовлечения уже существующего репертуара CD4+ Т-клеток памяти для поддержки и усиления противоопухолевого ответа CD8+ цитотоксических T-лимфоцитов, что открывает путь к следующему важному улучшению в иммунотерапии рака.
Краткое описание изобретения
Согласно первому аспекту изобретения описан вирусный вектор с присоединенными к его капсиду или суперкапсиду полипептидами, которые не кодируются генетически указанным вирусным вектором, но были присоединены к капсиду или суперкапсиду ковалентными или нековалентными связями, где
i) по меньшей мере один из указанных полипептидов содержит антиген патогена, например вируса или бактерии, против которой субъект был предварительно иммунизирован, и
ii) по меньшей мере еще один из указанных полипептидов является специфическим противоопухолевым или противораковым полипептидом и, таким образом, стимулирует противоопухолевый или противораковый иммунный ответ субъекта, на который воздействует указанный вектор.
Термин "капсид" аденовируса или вектора относится к белковой оболочке вируса. Капсид состоит из нескольких олигомерных структурных субъединиц, состоящих из протеинов, называемых протомерами. Кроме того, как известно специалистам в данной области техники, у некоторых вирусов имеется суперкапсид, покрывающий их защитный капсид. Суперкапсид обычно состоит из фрагментов мембран клетки-хозяина (фосфолипидов и белков), а также некоторого количества вирусных гликопротеинов. Следовательно, в зависимости от природы вируса, указанные полипептиды могут быть присоединены к капсиду или суперкаписду.
Упоминающиеся в настоящем документе патогены чаще всего являются вирусами или бактериями, но могут быть также любыми другими патогенами. Наиболее подходящим при этом будет тот, против которого индивид был, или есть основания предполагать, что был, иммунизирован, поскольку обычно, но не исключительно, патоген является частью какой-либо программы вакцинации - национальной, международной или иной.
Предметом настоящего изобретения является повторная активация патоген-специфических Т-клеток памяти (в основном - CD4+ T-клетки) путем использования антигена патогена, такого как вирус или бактерия, против которого подлежащий лечению субъект был предварительно иммунизирован, при этом указанные CD4+ T-клетки взаимодействуют с онкоспецифическими цитотоксическими CD8+ T-клетками с целью повышения их эффективности.
Поэтому в предпочтительном варианте осуществления изобретения антиген согласно части i) может быть любым антигеном патогена, например вируса или бактерии, против которого субъект лечения был предварительно иммунизирован. В идеальном случае, но не исключительно, выбранный антиген патогена, например вируса или бактерии, является частью широко проводимой и/или плановой программы вакцинации, например, входит в нижеприведенный неисчерпывающий перечень: Measles morbillivirus, Mumps rupulavirus, Rubella virus, Rotavirus, Varicella zoster virus, Flavivirus (Yellow Fever), Hepatovirus, human papillomavirus, Streptococcus pneumoniae, Neisseria meningitidis, Corynebacterium diphtheriae, Clostridium tetani, Mycobacterium tuberculosis, Poliovirus, Bordetella pertussis, Vibrio cholerae, и т. п.
В предпочтительном варианте осуществления изобретения, указанные полипептиды согласно части i) выбираются из группы, включающей в себя:
QYIKANSKFIGITEL (Tetanus toxin) (SEQ ID NO:1);
ARYVSQQTRANPNPY (Pertussis) (SEQ ID NO:2);
IQSKRFAPLYAVEAK (Polio Mahoney) (SEQ ID NO:3);
SPVYVGNGVHANLHV (Diphtheria) (SEQ ID NO:4);
PVFAGANYAAWAVNVAQVI (Diphtheria) (SEQ ID NO:5);
ARYVSQQTRANPNPY (Pertussis) (SEQ ID NO:6);
IQSKRFAPLYAVEAK (Polio Mahoney) (SEQ ID NO:7); и
SPVYVGNGVHANLHV (Diphtheria) (SEQ ID NO:8).
Альтернативно или дополнительно к указанным полипептидам согласно части i) относится множество полипептидов по меньшей мере одного патогена, такого как вирус или бактерия, против которого индивид был предварительно иммунизирован. В предпочтительном варианте осуществления изобретения указанное множество полипептидов получают из некоторого количества различных патогенов.
В другом предпочтительном варианте осуществления изобретения антиген согласно части ii) может быть любым антигеном, который является противоопухолевым или противораковым антигеном, и, таким образом, стимулирует противоопухолевый или противораковый иммунный ответ субъекта, на который воздействует указанный антиген. Неисчерпывающий список противораковых антигенов включает в себя следующие антигены:
Фрагменты, полученные из пептидов gp100, NY-ESO-1 и Mage-A3, при этом в наилучшем случае антигены содержат следующие фрагменты:
KVPRNQDWL (gp100) (SEQ ID NO:9);
SLLMWITQC (NY-ESO-1) (SEQ ID NO:10);
RGPESRLLEFYLAMPFATPM (NY-ESO-1) (SEQ ID NO:11);
YLAMPFATPMEAELARRSLA (NY-ESO-1) (SEQ ID NO:12);
RGPESRLLEFYLAMPFATPMEAELARRSLA (NY-ESO-1 (SEQ ID NO:13);
PGVLLKEFTVSGNILTIRLTAADHR (NY-ESO-1) (SEQ ID NO:14);
YLAMPFATPMEAELARRSLA (NY-ESO-1) (SEQ ID NO:15);
YLAMPFATPMEAELARRSLAEE (NY-ESO-1) (SEQ ID NO:16);
VFGIELMEVDPIGHLYIFAT (MAGE-A3) (SEQ ID NO:17);
и
VFGIELMEVDPIGHLY (MAGE-A3) (SEQ ID NO:18).
Альтернативно или дополнительно указанные полипептиды согласно части ii) включают в себя множество полипептидов, которые по меньшей мере совместно, если не индивидуально, стимулируют противоопухолевый или противораковый иммунный ответ.
Указанные полипептиды обеспечивают преимущество, состоящее в стимулировании как патоген-специфического (часть i), так и пептид-специфического (часть ii) иммунного ответа в субъекте лечения, который уже был предварительно иммунизирован против указанного патогенного антигена. Таким образом указанные полипептиды вызывают как CD4+ T-клеточный, так и CD8+ T-клеточный ответ, при этом первый увеличивает эффективность второго. Кроме того, то, что указанные полипептиды не кодируются генетически указанным вирусным вектором, а были присоединены ковалентными или нековалентными связями к капсиду или суперкапсиду, обеспечивает преимущество, состоящее в том, что присоединение указанных полипептидов к указанному вирусу может быть проведено быстро и эффективно, т. е. без ожидания протекания вирусной репликации в клетке-хозяине.
В еще одном также предпочтительном варианте реализации изобретения указанные полипептиды выбираются из группы, включающей в себя: ГКГ I-специфические полипептиды, ГКГС II-специфические полипептиды и дендритно-клеточные специфические полипептиды. Следовательно, указанные полипептиды могут быть ГКГ I-специфическими полипептидами и/или ГКГ II-специфическими полипептидами и/или дендритно-клеточными специфическими полипептидами.
В оптимальном случае указанный вирусный вектор содержит множество ГКГ I-специфических полипептидов и/или еще одно множество ГКГ II-специфических полипептидов. Еще лучше, если полипептиды согласно части i) являются ГКГ II-специфическими и/ полипетиды согласно части ii) являются ГКГ I-специфическими, или наоборот.
В другом предпочтительном варианте реализации изобретения указанные полипептиды включают в себя слитые полипептиды, одна часть которых содержит антиген патогена, например, вируса или бактерии, против которого субъект лечения был предварительно иммунизирован, а другая часть которых является противоопухолевым или противораковым специфическим полипептидом и, таким образом, стимулирует противоопухолевый или противораковый иммунный ответ в субъекте, на который воздействует указанный вектор.
В еще одном предпочтительном варианте осуществления изобретения указанные полипептиды модифицированы полилизином или полиаргинином и, следовательно, обладают полилизиновым или полиаргининовым линкером для присоединения к указанному капсиду или суперкаписду. Обычно для упрощения присоединения указанных полипептидов к ним присоединяют полилизин или полиаргинин, используя по меньшей мере 4, в оптимальном случае - 5, 6, 7, 8 или 9 остатков лизина. Чаще всего используют 6 молекул лизина, которые присоединяются предпочтительнее всего, но не исключительно, к аминовому концу полипептида. В еще более оптимальном случае указанные полипептиды имеют лизиновый или аргининовый хвост, который содержит также одну иную аминокислоту, предпочтительно, например, 5 лизиновых или аргининовых остатков, далее один - пролиновый (или один остаток какой-либо иной кислоты), затем снова еще 4 лизиновых или аргининовых остатков.
Альтернативно, для присоединения указанных полипептидов к капсиду или суперкапсиду используют другие методы, известные в данной области техники, например, включая такие методы, но не ограничиваясь ими, как использование проникающего пептида в качества линкера между полипептидом и вирусом, что особенно результативно в случае вирусов с суперкапсидом, или использование фрагментов молекулы холестерина, или присоединение указанных полипептидов с помощью электростатической, дисульфидной или амидной связи к вирусному капсиду или суперкапсиду.
В другом предпочтительном варианте реализации изобретения указанный вирусный вектор является вирусом с суперкаписдом или без него.
Как понятно специалистам в данной области техники примерами вирусов с суперкапсидом являются вирусы из семейств, выбираемых из следующих групп: вирусы герпеса, вирусы оспы, гепаднавирусы, флавивирус, тогавирус, коронавирус, гепатит D, ортомиксовирус, парамиксовирус, рабдовирус, буньявирус, филовирус и ретровирусы.
Альтернативно, примерами вирусов без суперкапсида являются вирусы из семейств, выбираемых из следующих групп: аденовирусы, реовирусы, вирусы папилломы, пикорнавирусы, калицивирусы.
В предпочтительном варианте осуществления изобретения указанный вирус выбирается из группы, содержащей: вирус простого герпеса 1 (HSV-1), вирус простого герпеса 2 (HSV-2), вирус осповакцины, вирус везикулярного стоматита Индианы (VSV), вирус кори (MeV), вирус Мараба (MG1) и вирус Ньюкасла (NDV). В наиболее оптимальном случае указанный вирусный вектор является вирусом осповакцины, или HSV-1, или аденовирусом, или онколитическим аденовирусом.
Понятно, что предпочтительно указанный вирусный вектор является онколитическим, т. е. способным инфицировать и уничтожать раковые клетки путем селективной репликации в опухоли по сравнению с нормальными клетками.
Вирусный вектор, используемый в настоящем изобретении, может также содержать иные модификации в дополнение к описанным выше. При желании могут быть использованы любые дополнительные модификации, но они не являются обязательными для функционирования настоящего изобретения.
Из вышесказанного следует, что вирусный вектор согласно изобретению был разработан для стимулирования иммунного ответа против рака, в особенности путем использования взаимодействия между CD4+ Т-клетками памяти и CD8+ Т-клетками, и повторного задействования эффекторных CD4+ T-клеток памяти, выработанных против предварительно введенных патогенных антигенов с целью облегчения борьбы с раком, в расчете на обеспечение быстрого и надежного противоопухолевого ответа. Было обнаружено, что когда антигенпрезентирующие клетки/дендритные клетки обрабатывают вирус, соответствующий изобретению, и в особенности, пептиды, прикрепленные к его поверхности, то дендритные клетки презентируют не только опухоль-специфические пептиды D8+ T-клеткам для запуска противоопухолевого иммунного ответа, но, что важно, они также презентируют патоген-специфические пептиды D4+ T-клеткам-хелперам, которые усиливают и поддерживают цитотоксический иммунный ответ. Это делает очевидным важность взаимодействия между врожденной и приобретенной составляющими иммунной системы, а также ключевую роль эффекторных CD4+Т-клеток памяти в поддержании текущего противоопухолевого ответа.
Поэтому согласно второму аспекту изобретения, оно распространяется на фармацевтическую композицию, или иммуногенный агент, или вакцину, содержащую по меньшей мере один вирусный вектор согласно изобретению и фармацевтически приемлемый носитель, адъювант, разбавитель или вспомогательное вещество.
Подходящие фармацевтические вспомогательных вещества хорошо известны специалистам в данной области техники. Фармацевтические композиции могут иметь состав, позволяющий вводить их любым подходящим способом, например, путем внутриопухолевых, внутримышечных, внутриартериальных, внутривенных, внутриплевральных, внутрипузырных, внутриполостных или перитонеальных инъекций, а также буккально, назально или бронхиально (ингаляционно), трансдермально или парентерально, а также быть приготовленными любым методом, хорошо известным в фармацевтической промышленности.
Композиции могут быть приготовлены путем объединения вышеописанного вирусного вектора с носителем. В общем, композиции готовят путем равномерного и тщательного объединения вирусного вектора с жидкими носителями или тонко измельченными твердыми носителями, либо и теми и другими, с последующим, в случае необходимости, формованием продукта. Изобретение распространяется на методы приготовления фармацевтической композиции, включая слияние или объединение вирусного вектора, как определено в настоящем документе, с фармацевтически или ветеринарно приемлемым носителем или наполнителем.
Согласно третьему аспекту изобретения предложена трансформированная или трансфицированная клетка-мишень с указанным вирусным вектором, как определено в настоящем документе.
Согласно четвертому аспекту изобретения предложен комбинированный лекарственный препарат для лечения рака, содержащий:
вирусный вектор или фармацевтическую композицию, или иммуногенный агент, или вакцину, или клетку, в соответствии с определением в настоящем документе, в комбинации с по меньшей мере еще одним терапевтическим агентом.
К преимуществам данного изобретения относится то, что было обнаружено, что противоопухолевый эффект, вызываемый вирусным вектором согласно настоящему изобретению, становится еще более заметным, если указанный вирусный вектор комбинируется по меньшей мере с одним другим противораковым агентом, то подкрепляет обоснование комбинированной терапии с использованием вирусных векторов. Например, если опухоли выработали несколько иммуносупрессивных механизмов для противодействия иммунному ответу против них, то другим противораковым агентом может быть молекула ингибитора иммунных контрольных точек. Наиболее изученными путями иммунных контрольных точек являются путь протеина цитотоксических T-лимфоцитов 4 (CTLA-4) и путь протеина запрограммированной клеточной смерти 1 (PD-1/PD-L1). В связи с этим вирусный вектор согласно изобретению может использоваться в комбинации с по меньшей мере одним модулятором иммунных контрольных точек, таким как молекулы анти-CTLA-4, анти-PD1 или анти-PD-L1 для противодействия иммуносупрессивного микроокружения опухоли и формирования сильного противоопухолевого иммунного ответа.
Еще по меньшей один другой противораковый агент, наиболее подходящим образом включает в себя циклофосфатамид, так как он подавляет Т-регуляторные клетки.
Однако, как понятно специалистам в данной области, указанным дополнительным терапевтическим агентом может быть любой противораковый агент, известный из уровня техники.
Альтернативно или дополнительно изобретение относится к по меньшей мере одному вирусному вектору или фармацевтической композиции, или иммуногенному агенту, или вакцине, или клетке, или к комбинированному лекарственному препарату, соответствующего изобретению, для использования в лечении рака.
Альтернативно или дополнительно изобретение относится к использованию по меньшей мере одного вирусного вектора, или фармацевтической композиции, или иммуногенного агента, или клетке, или вакцине, или комбинированного препарата для лечения рака.
Альтернативно или дополнительно изобретение относится к использованию по меньшей мере одного вирусного вектора, или фармацевтической композиции, или иммуногенного агента, или клетке, или вакцине, или комбинированного препарата, соответствующего изобретению, для производства лекарственного препарата для лечения рака.
Согласно еще одному аспекту изобретения предлагается метод лечения рака, состоящий в ведении эффективной дозы по меньшей мере одного вирусного вектора или фармацевтической композиции, или иммуногенного агента, или вакцины, или клетки, или комбинированного лекарственного препарата, описанного в настоящем документе, субъекту, который в этом нуждается.
Содержащиеся в данном документе ссылки на "эффективную дозу" вирусного вектора или фармацевтической композиции, или иммуногенного агента, или вакцины, его содержащей, представляет собой дозу, достаточную для достижения желаемого биологического эффекта, а именно смерти раковой клетки. Очевидно, что эффективная доза будет зависеть от возраста, пола, состояния здоровья и массы пациента, получающего лечение, вида сопутствующей терапии, если имеется, а также частоты лечения и природы желаемого эффекта. Обычно эффективную дозу определяют лица, назначающие лечение.
Наиболее предпочтительно упомянутый здесь рак включает любой один или несколько из следующих видов рака: рак носоглотки, рак синовиальной оболочки, гепатоцеллюлярный рак, рак почек, рак соединительной ткани, меланома, рак легких, рак кишечника, рак толстой кишки, рак прямой кишки, колоректальный рак, рак мозга, рак горла, рак полости рта, рак печени, рак костей, рак поджелудочной железы, хориокарцинома, гастринома, феохромоцитома, пролактинома, Т-клеточный лейкоз/лимфома, неврома, болезнь фон Гиппеля-Линдау, синдром Золлингера-Эллисона, рак надпочечников, рак анального канала, рак желчного протока, рак мочевого пузыря, рак мочеточника, олигодендроглиома, нейробластома, менингиома, опухоль спинного мозга, остеохондрома, хондросаркома, саркома Юинга, рак неизвестной первичной локализации, карциноид, карциноид желудочно-кишечного тракта, фибросаркома, болезнь Педжета, рак шейки матки, рак пищевода, рак желчного пузыря, рак головы, рак глаза, рак шеи, рак почки, опухоль Вильмса, саркома Капоши, рак простаты, рак яичек, болезнь Ходжкина, неходжкинская лимфома, рак кожи, мезотелиома, множественная миелома, рак яичников, эндокринный рак поджелудочной железы, глюкагонома, рак паращитовидной железы, рак полового члена, рак гипофиза, саркома мягких тканей, ретинобластома, рак тонкой кишки, рак желудка, рак тимуса, рак щитовидной железы, трофобластический рак, хорионаденома, рак матки, рак эндометрия, рак влагалища, рак вульвы, акустическая неврома, грибовидный микоз, инсулинома, карциноидный синдром, соматостатинома, рак десен, рак сердца, рак губы, рак мозговых оболочек, рак ротовой полости, рак нервов, рак неба, рак околоушной железы, рак брюшины, рак глотки, рак плевры, рак слюнной железы, рак языка и рак миндалин.
В нижеследующей формуле изобретения и в предшествующем ему описании изобретения, за исключением случаев, в которых контекст требует иного в связи с особенностями языка или необходимо подразумеваемым положением, слово «содержать» или его варианты, такие как «включает» или «содержащий», используются в смысле охвата, то есть для указания на наличие заявленных признаков, но не исключения наличия или добавления признаков в различных вариантах осуществления изобретения.
Все использованные литературные источники, включая любые патенты или заявки на патенты, процитированные в настоящем документе, включены в него посредством ссылки. Настоящим не признается, что какие-либо ссылки составляют предшествующий уровень техники. Мы не признаем, что какой-либо из предшествующих уровней техники составляет часть общеизвестных знаний в данной области техники.
Предпочтительные признаки каждого аспекта изобретения могут быть такими, как описаны в связи с любыми другими аспектами изобретения.
Другие признаки настоящего изобретения станут более очевидными из нижеследующих примеров. В целом изобретение распространяется на любой новый признак или новую комбинацию признаков, раскрытых в описании данного изобретения (включая прилагаемые пункты формулы и чертежи). Таким образом, признаки, целые, свойства, соединения или химические фрагменты, описанные в связи с конкретным аспектом, вариантом осуществления изобретения или примером, следует понимать как применимые к любому другому аспекту, варианту осуществления изобретения или примеру, описанному в данном документе, если они не являются несовместимыми.
Более того, если не утверждается иное, то любой признак, описанный в данном документе, может быть заменен альтернативным признаком, служащим той же самой или сходной цели.
В данном описании и в формуле изобретения единственное число включает в себя множественное, если это не противоречит контексту. В частности, если используется неопределенный артикль, то описание изобретения следует понимать как предполагающее как множественное число, так и единственное, если контекст не требует иного.
Осуществление настоящего изобретения будет описано, только в качестве примера, со ссылкой на нижеследующее, где:
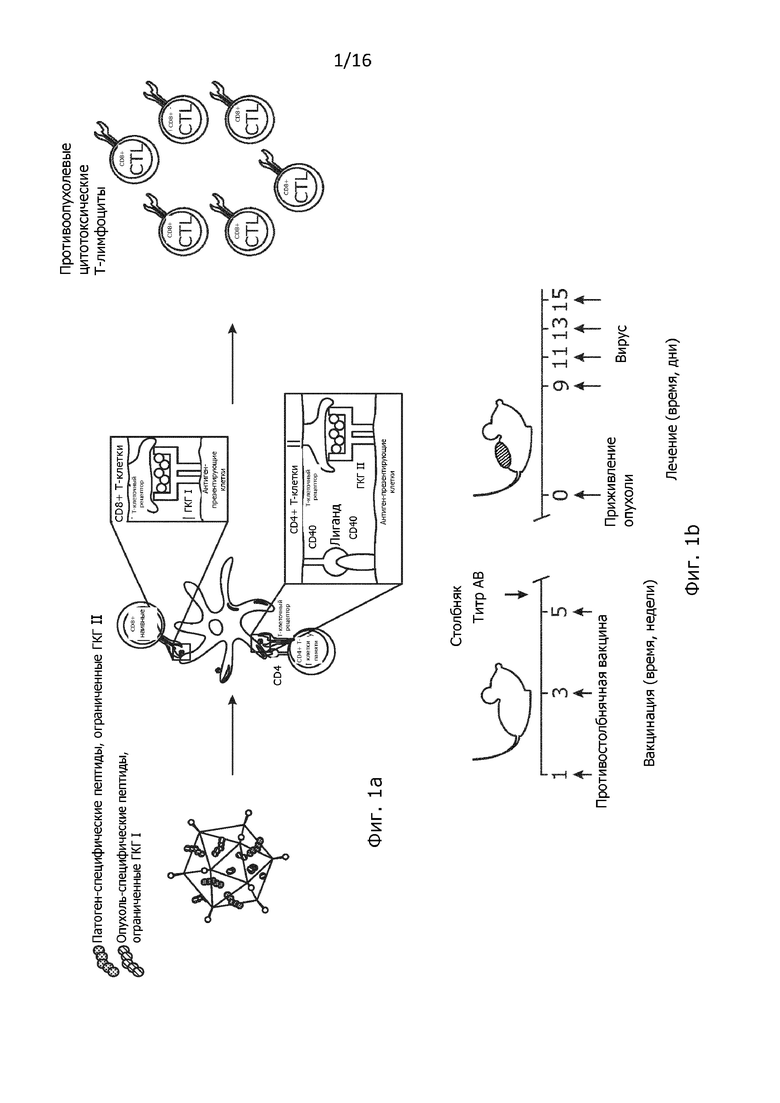
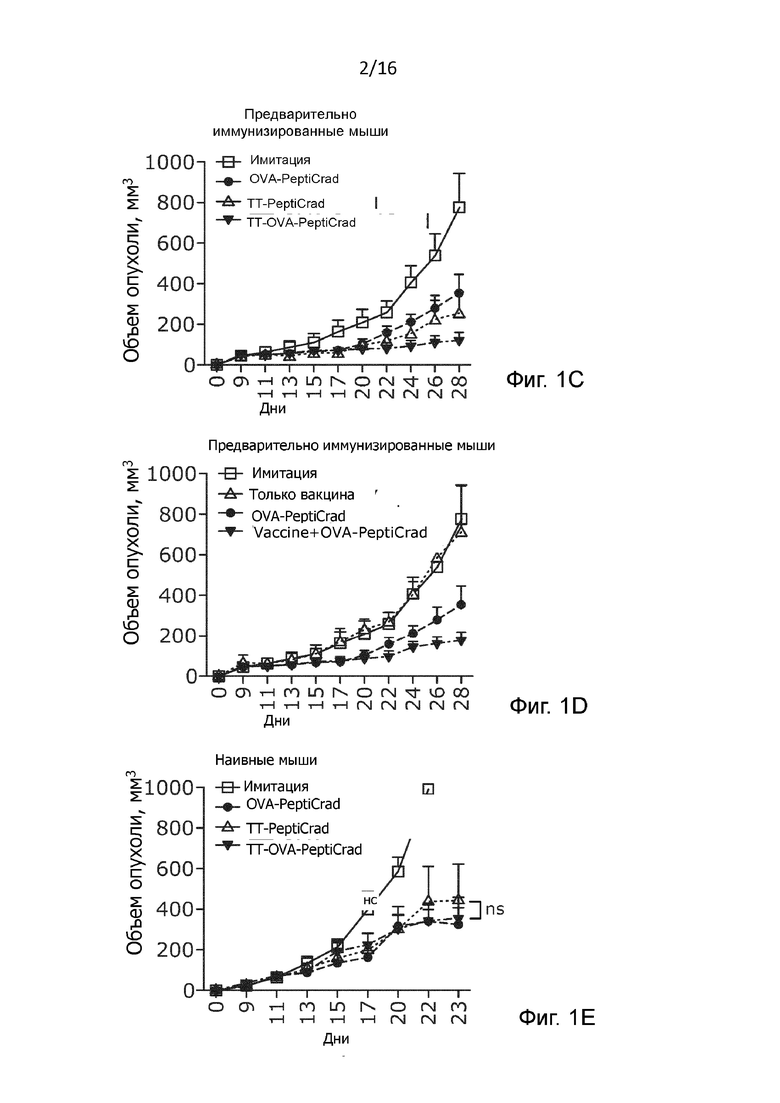
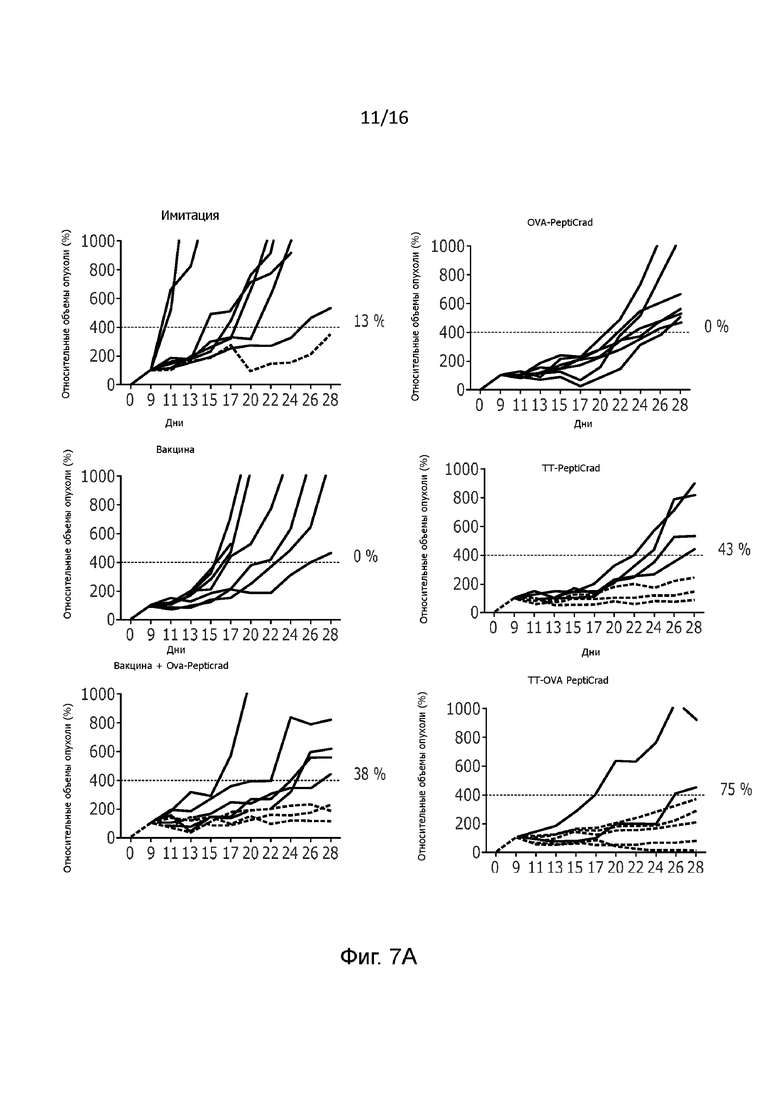
Рисунок 1. Влияние вовлечения репертуара клеток памяти в мышиной модели меланомы. (A) Схематическое представление новой гибридной системы PeptiCRAd. Один аденовирус, покрытый патоген-специфическими пептидами с целью вызвать предварительно имеющийся репертуар Т-клеток памяти и опухоль-специфическими пептидами с целью вызвать имеющийся репертуар противоопухолевых Т-клеток. (B) Схема лечения. 3×105 B16.OVA клетки были введены в правый бок наивных и предварительно иммунизированных против столбняка мышей линии C57BL/6 (n=7-8). Как показано на рисунке, внутриопухолевые инъекции делались 4 раза (на 9, 11, 13 и 15 день) (C-E) Рост опухоли B16.OVA у наивных и предварительно иммунизированный мышей отслеживали до окончания эксперимента. Размер опухоли представлен в виде среднего значения ± SEM (статистический анализ: двухфакторный дисперсионный анализ, * p<0,05, ** p<0,005, *** p<0,001, **** p<0,0001);
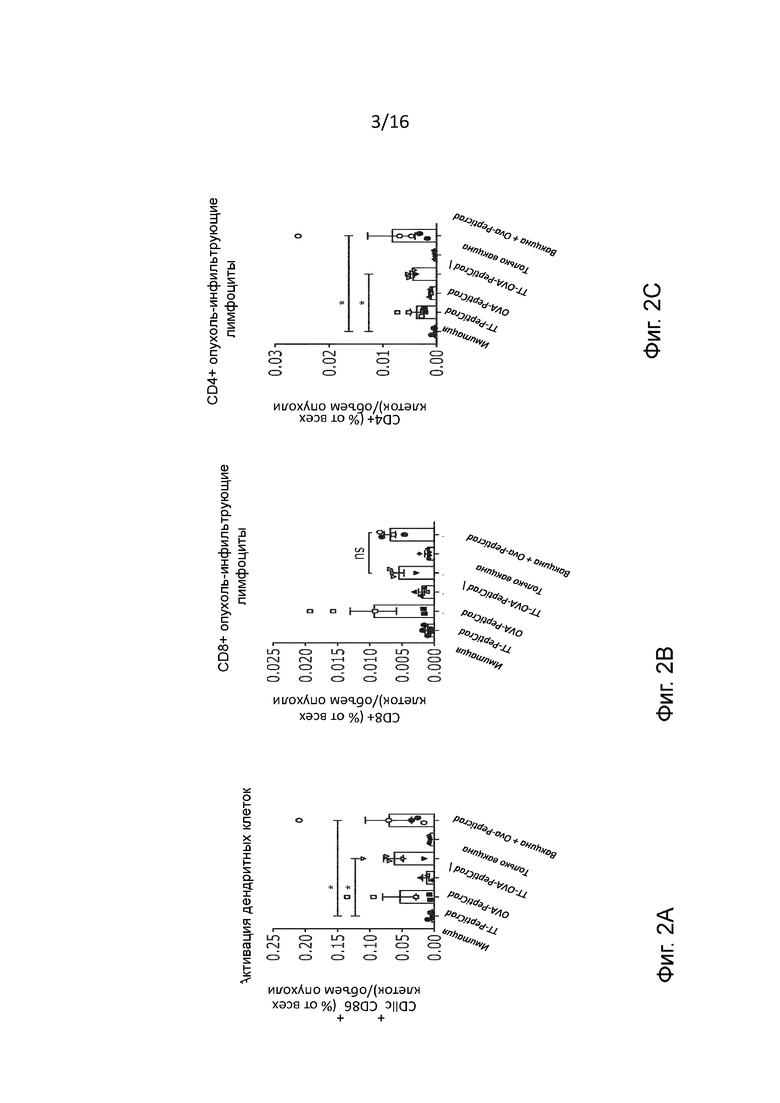
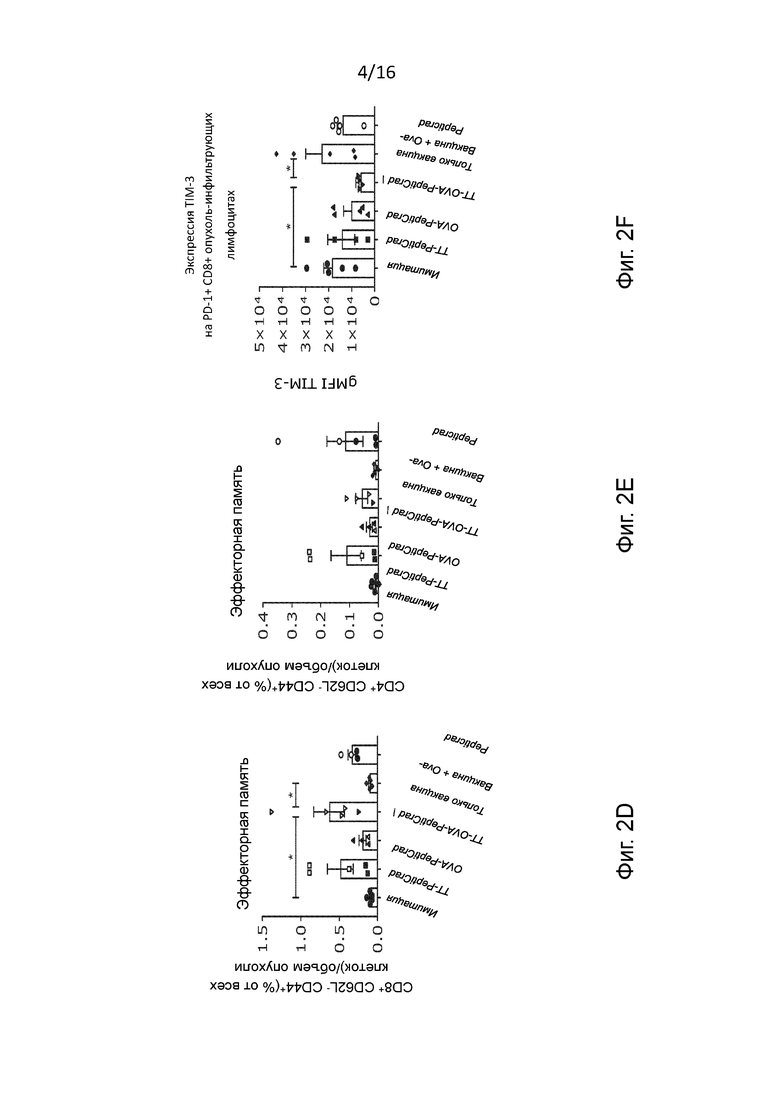
Рисунок 2. Компонент иммунной клетки в микроокружении опухоли предварительно иммунизированной мыши после инъекции. Анализ методом проточной цитометрии образцов опухоли, отобранных в конце эксперимента у мышей, предварительно иммунизированных столбняком. Приводится частота (A) активированных дендритных клеток, (B) CD8+ и (C) CD4+ T-клеток, (D-E) и CD8+ и CD4+ эффекторных Т-клеток памяти (CD44+CD62L-) в микроокружении опухоли. Данные представлены в виде гистограмм и отдельных значений (статистический анализ с помощью критерия Краскела-Уоллиса). (F) Анализ профиля активации/истощения CD8+ T-клеток в опухолях методом проточной цитометрии. Гистограмма показывает среднее геометрическое интенсивности флуоресценции CD8+T-клеток, которые являются обученными антигеном (PD1+) и истощенными (TIM3+). Статистическую значимость оценивали с помощью непарного двустороннего критерия Стьюдента *p<0,05, ** p<0,005, *** p<0,001, **** p<0,0001;
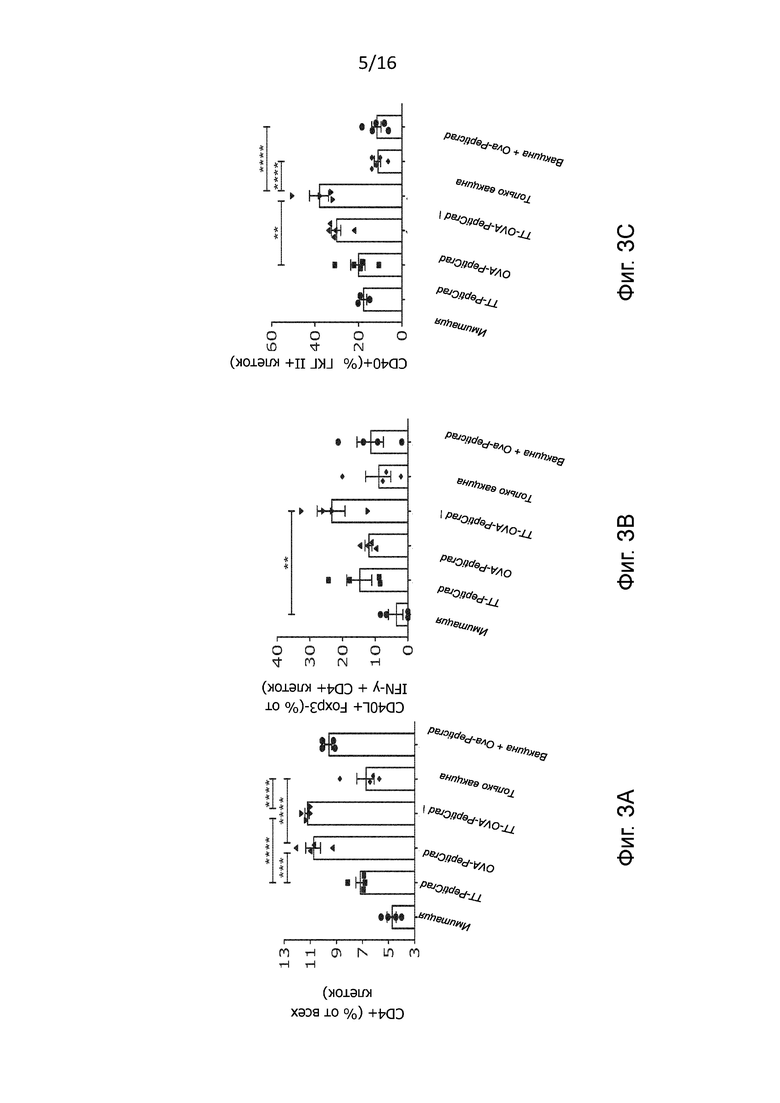
Рисунок 3. Фенотип иммунных клеток в лимфатических узлах. Анализ лимфатических узлов, отобранных у мышей, предварительно иммунизированных против столбнячного токсина (TT), на содержание (A) TT-специфических CD4+, (B) TT-специфических CD4+ экспрессирующих CD40L и (C) антигенпрезентирующих клеток, презентирующих рецептор CD40, проводили методом проточной цитометрии (статистический анализ с помощью простого однофакторного дисперсионного анализа *p<0,05, ** p<0,005, *** p<0,001, **** p<0,0001);
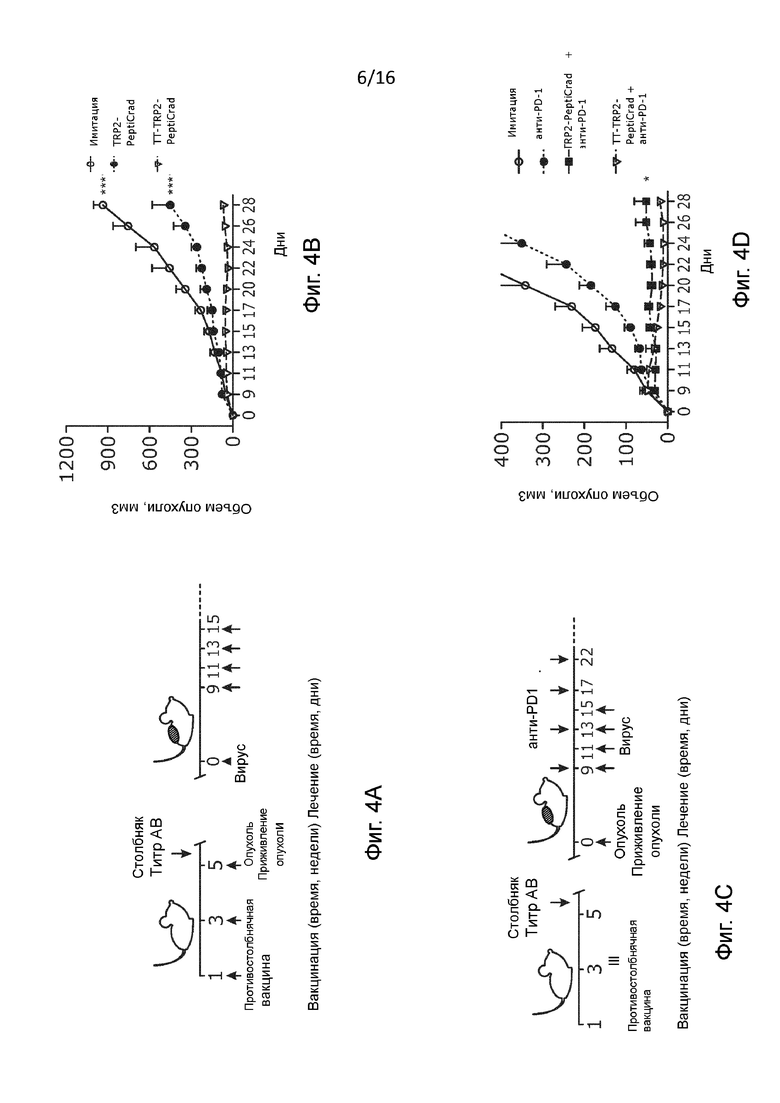
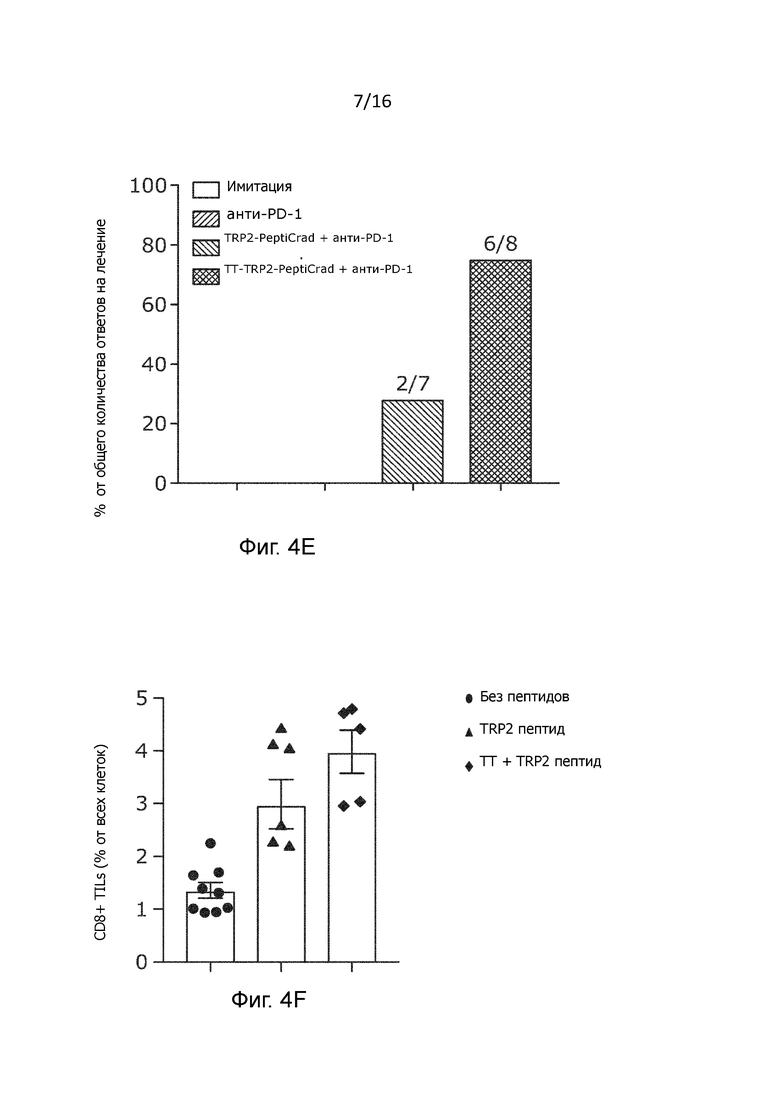
Рисунок 4 Синергетический эффект между гибридным PeptiCRAd и aPD1. (A) Схема лечения 3×105 клеток B16.OVA вводили в правый бок мышей линии C57BL/6, предварительно иммунизированных противостолбнячной вакциной (n=7-8). Лечение начинали на развившихся опухолях. Использовали либо только гибридный PeptiCRAd (A) или комбинацию с анти-PD-1 антителом (C). Кривая роста опухоли для мышей, получавших лечение без (B) или с (D) анти-PD-1 представлена в виде средних значений ± SEM. (E) Полные ответы (т.е. исчезновение всей массы опухоли в процессе лечения) для каждой группы показаны как процент экземпляров, отвечающих на лечение, от общего количества мышей, получавших лечение, в каждой группе, а также в виде отношения количества экземпляров, отвечающих на лечение, к количеству экземпляров, не отвечающих на лечение в каждой группе. (F) Анализ содержания CD8+T-клеток в опухолях, отобранных у мышей, получавших лечение связанным с тирозиназой белком 2 (TRP2) TRP2-PeptiCRAd и TT-TRP2-PeptiCRAd, проводили методом проточной цитометрии. Результат представлен как единичная точка для каждого экземпляра. Контрольные группы, которые не получали пептидную вакцину (только имитация и анти-PD-1) объединяют и обозначают как "без пептида". Статистический анализ проводили с использованием двухфакторного дисперсионного анализа с критерием Фишера (B) и критерия множественного сравнения Тьюки(D);
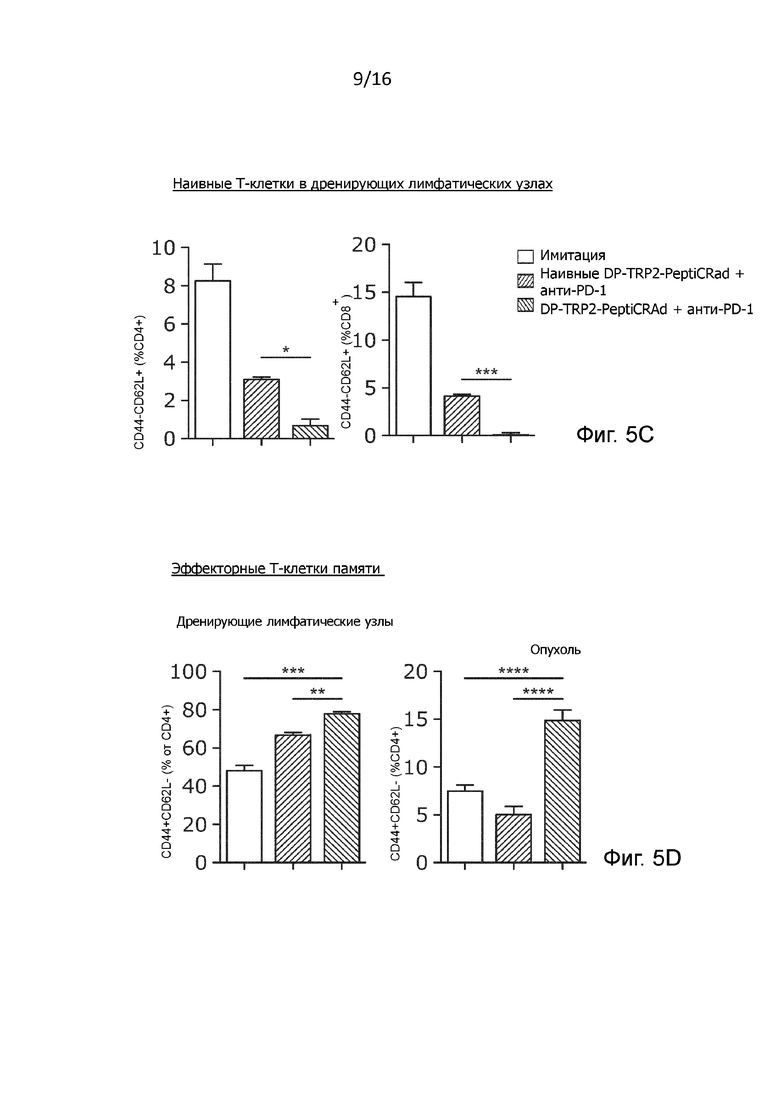
Рисунок 5. Действие гибридного PeptiCRAd и анти-PD1 в контексте четырехвалентной вакцины. (A) 3×105 клеток B16.OVA вводили в правый бок мышей линии C57BL/6, предварительно иммунизированных вакциной polioboostrix (n=8). Лечение начинали на развившихся опухолях (9 дней после имплантации опухоли). Мыши четыре раза получали DP-TRP2-PeptiCRAd (на 9, 11, 13 и 15 день) и три раза анти-PD-1 (на 9, 13 и 17 день). (B) Объем опухоли показан в виде среднего значения ± SEM (статистический анализ с помощью двухфакторного дисперсионного анализа с критерием множественного сравнения Тьюки). (C) Приводится концентрация наивных CD8+ и CD4+ (CD44-CD62L+) T-клеток в дренирующих лимфатических узлах опухоли наивных или предварительно иммунизированных мышей (статистический анализ с помощью непарного двустороннего критерия Стьюдента , * p<0,05, ** p<0,005, *** p<0,001, **** p<0,0001). (D) Показаны эффекторные (CD44+CD62L-) CD4+ Т-клетки памяти в дренирующих лимфатических узлах опухоли и в опухоли (статистический анализ с помощью однофакторного дисперсионного анализа с критерием множественного сравнения Тьюки. *P ≤0,05, **P ≤0,01, ***P ≤0,001);
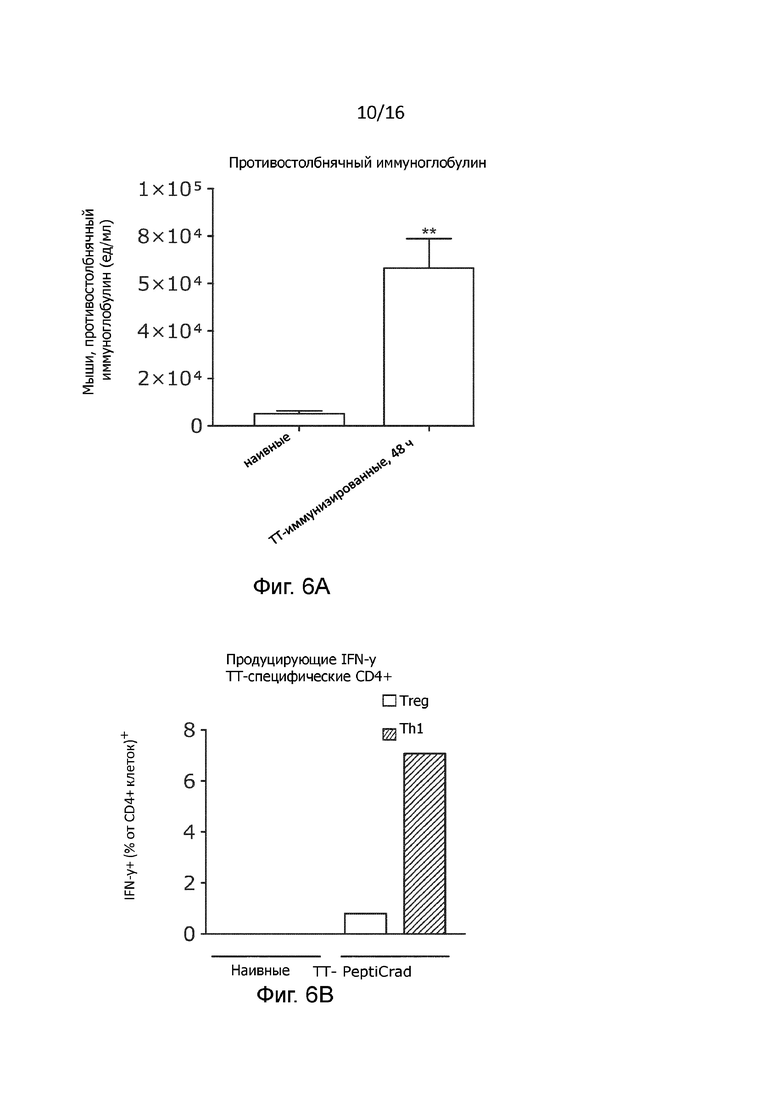
Рисунок 6. Определение гуморального и клеточного иммунитета в ответ на предварительную иммунизацию столбнячной вакциной. (A) Определение противостолбнячного IgG в образцах сыворотки крови мышей. Образцы сыворотки крови отбирали у наивных мышей линии C57BL/6 и и у мышей, предварительно иммунизированных противостолбнячной вакциной, через 48 часов после последнего бустинга и проводили измерение титра противостолбнячного IgG. Данные представлены в виде среднего значения противостолбнячного IgG в ед/мл (статистический анализ с помощью непарного двустороннего критерия Стьюдента, * p<0,05, ** p<0,005, *** p<0,001, **** p<0,0001). (B) Внутриклеточное окрашивание Th1. Для оценки концентрации IFN- γ (поляризация Th1 и Foxp3 (регуляторные Т-клетки) после TT-пептидной стимуляции методом проточной цитометрии проводили анализ спленоцитов не получавших лечения наивных мышей и предварительно иммунизированных мышей, получавших лечение TT-PeptiCRAd;
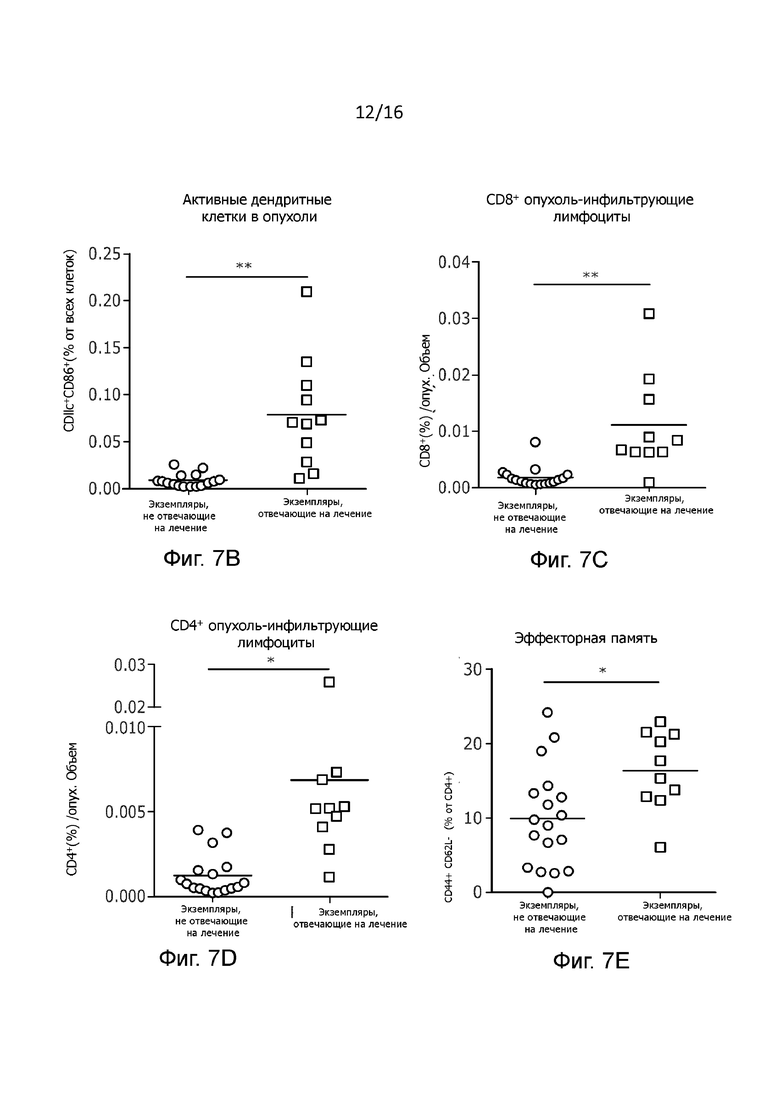
Рисунок 7. (A) Рост одиночной опухоли и компонент иммунной клетки в микроокружении опухоли. Представлены кривая роста опухоли для каждой мыши и один график для каждой группы с указанием конкретного лечения на каждом графике. Объемы опухолей нормализованы по значениям в день первого получения лечения и представлены в виде среднего значения в процентах ± SEM. Процент, показанный рядом с каждым графиком показывает долю отвечающих на терапию экземпляров (зеленый), определенной как количество мышей с объемом опухоли ниже 400 % (пунктирная линия). Результаты определения активации дендритных клеток (B) и общего содержания CD8+ T-клеток (C), а также CD4+ T-клеток (D) и эффекторных (CD44+CD62L-) CD4+T-клеток памяти (E) в микроокружении опухоли методом проточной цитометрии представлены для отдельной мыши зеленым (экземпляры, отвечающие на лечение) и черным (экземпляры, не отвечающие на лечение) цветом внутри каждой группы. Частота всех проанализированных типов клеток у экземпляров, отвечающих на терапию, была значительно выше, чем у экземпляров, не отвечающих на терапию. Статистическую значимость активации дендритных клеток и анализа инфильтрации CD8+ и CD4+T-клеток оценивали с помощью двухстороннего непарного t-критерия с поправкой Велша. Оценку статистической значимости инфильтрации эффекторных Т-клеток памяти проводили с помощью двухстороннего непарного t-теста;
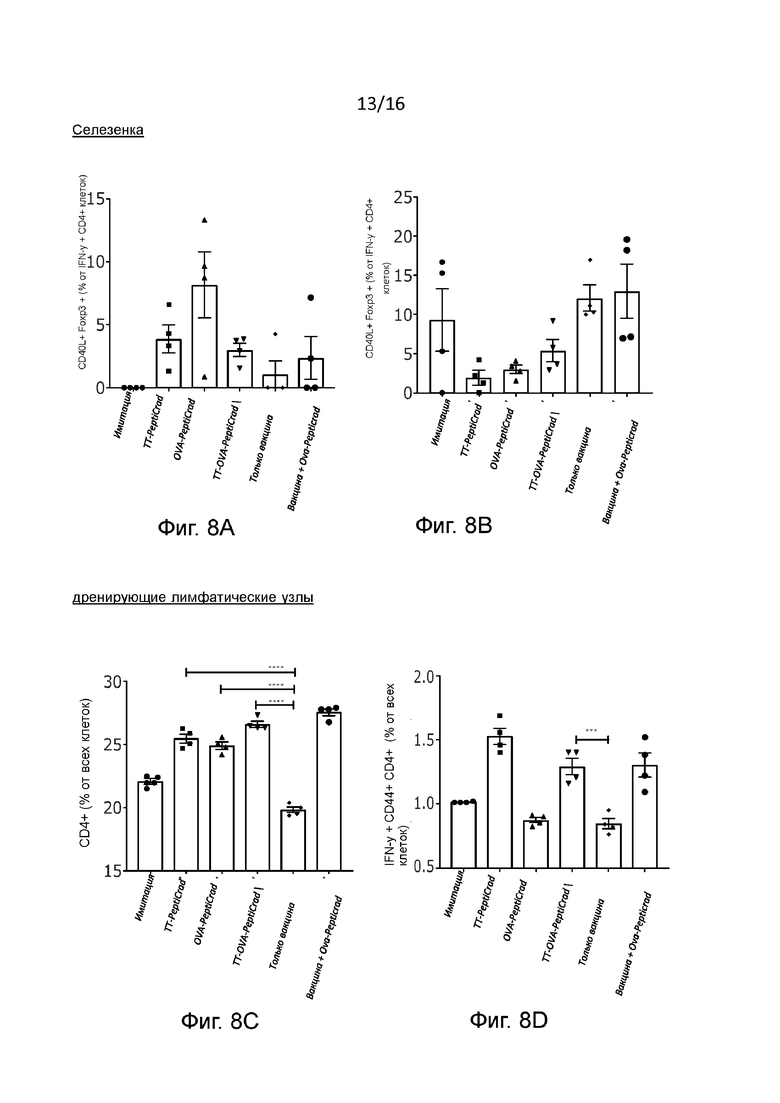
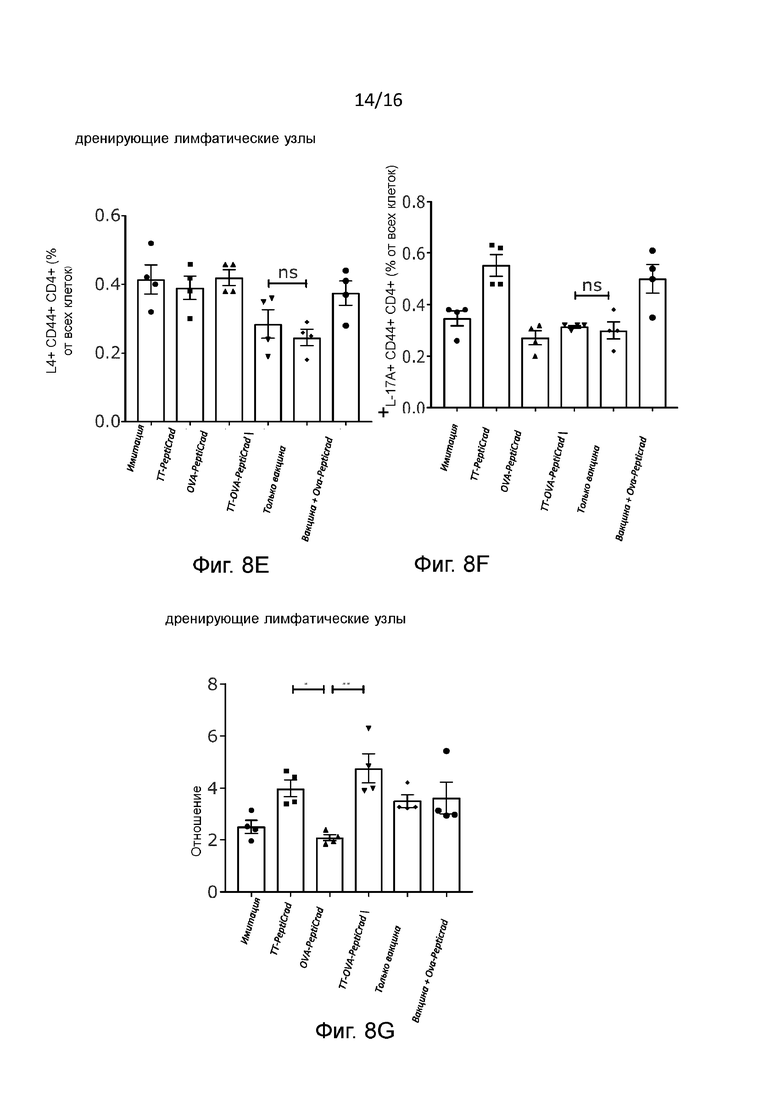
Рисунок 8. Эффекты взаимодействия CD40-CD40L в лимфоидных органах Спленоциты предварительно иммунизированных мышей были изучены методом проточной цитометрии с целью выявления CD4+ Т-клеток, экспрессирующих (A) или не экспрессирующие(B) Foxp3. Представлено общее количество CD4+ T-клеток в дренирующих лимфатических узлах (C). CD4+ T-клетки (CD44+) памяти были проанализированы методом внутриклеточного окрашивания для определения IFN-γ (фенотип Th1) (D), IL4 (фенотип Th2) (E) и IL-17 (фенотип Th17) (F). Отношение между Th1 и Th2 поляризованными CD4+ T-клетками показано в G. Статистический анализ проводили с помощью однофакторного дисперсионного анализа с критерием множественного сравнения Тьюки. *P ≤0,05, **P ≤0,01, ***P ≤0,001;
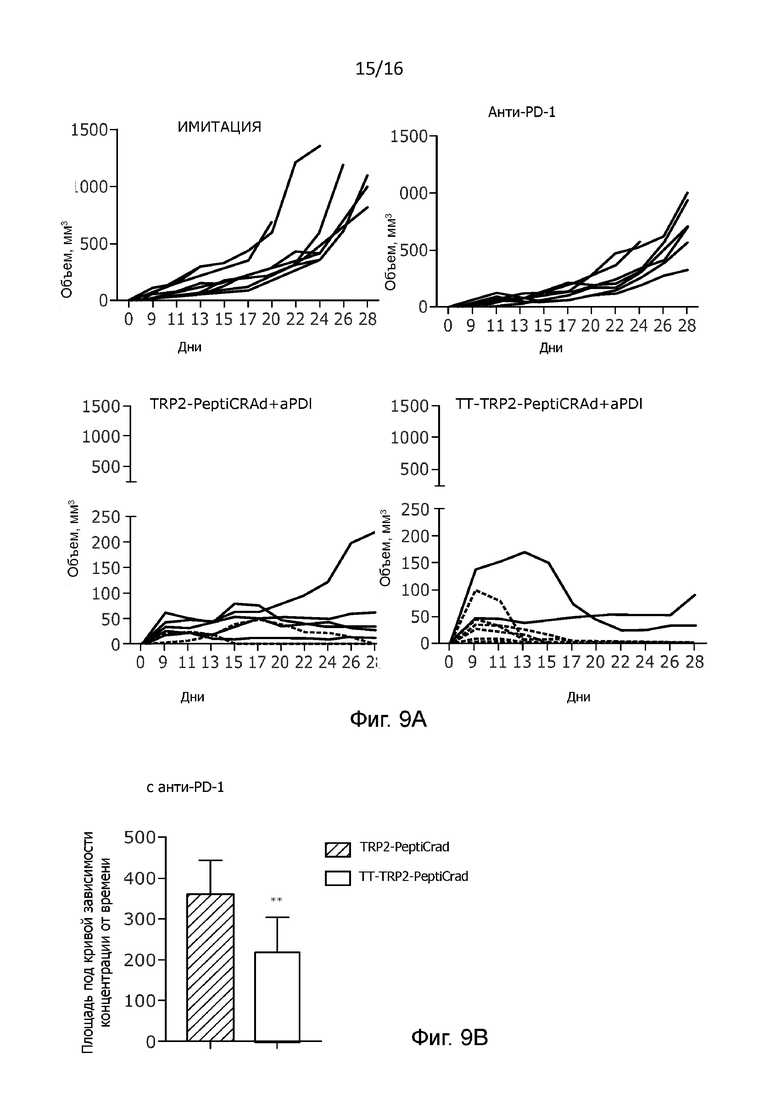
Рисунок 9. Рост одиночной опухоли и площадь под кривой. (A) Представлены кривая роста опухоли для каждой мыши и один график для каждой группы с указанием конкретного лечения на каждом графике. (B) Площадь под кривой роста опухоли представлена в виде элементов гистограммы ± SEM для групп, получавших лечение анти-PD-1 (статистический анализ с помощью непарного двустороннего критерия Стьюдента, * p<0,05, ** p<0,005, *** p<0,001, **** p<0,0001); и
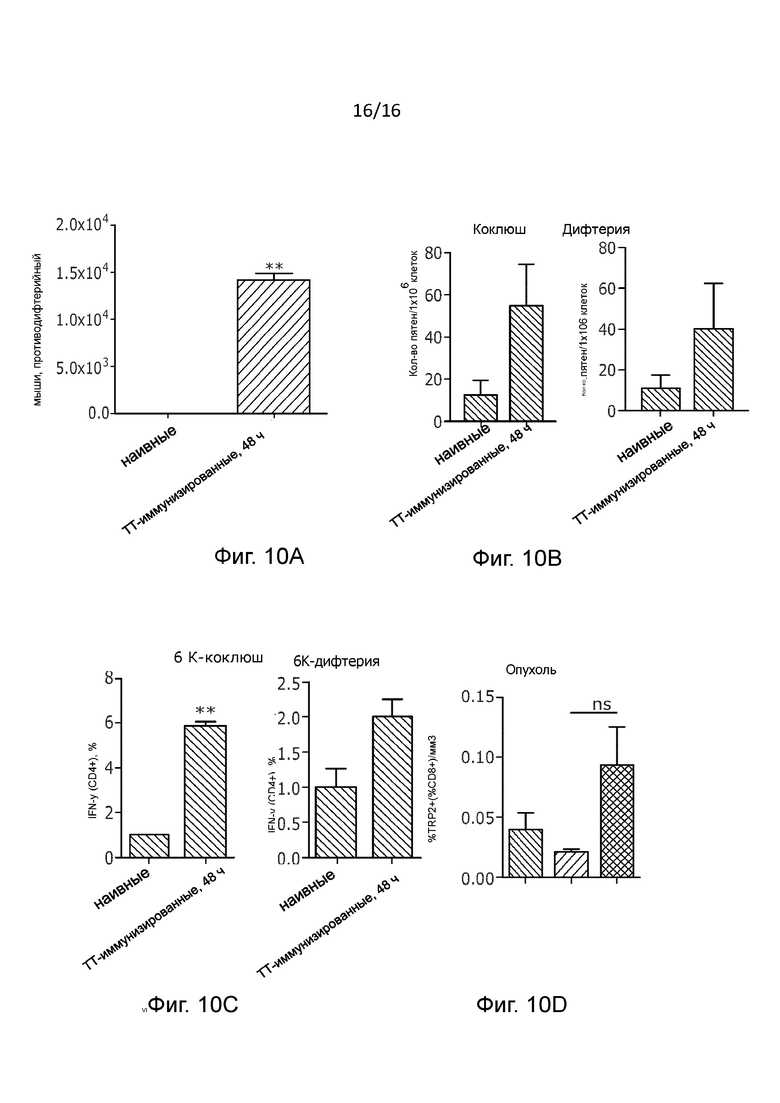
Рисунок 10. Иммунологические свойства мышей, предварительно иммунизированных вакциной PolioBoostrix. (A) Иммунный ответ, вызванный вакциной PolioBoostrix Мышей линии C57BL/6 иммунизировали, и отбирали образцы сыворотки через 5 дней после последней бустерной иммунизации. Антитела против дифтерийного анатоксина анализировали с помощью методом ИФА. Данные представлены в виде среднего значения IgG МЕ/мл ± SEM. (B) Количественное определение IFN-γ методом иммуноферментных пятен Спленоциты наивных мышей или мышей, предварительно иммунизированных вакциной PolioBoostrix, отбирали через месяц после итоговой бустерной иммунизации и культивировали в течение 72 часов с использованием стимулов, показанных на рисунке. Результаты представлены в виде средней частоты специфических IFN-γ пятнообразующих клеток на 1X106 клеток (статистический анализ с помощью непарного двустороннего критерия Стьюдента, * p<0,05, ** p<0,005, *** p<0,001, **** p<0,0001). (C) Определение IFN-γ методом внутриклеточного окрашивания Инкубировали спленоциты наивных и предварительно иммунизированных мышей в течение 6 часов с указанным стимулами. После внутриклеточного окрашивания проводили анализ методом проточной цитометрии. (D) Процент TRP2-специфических CD8+ T-клеток от общего количества CD8+ T-клеток в микроокружении опухоли. Данные были нормализованы по объему опухоли и представлены графически в виде среднего значения ± SEM (статистический анализ с помощью критерия Краскела - Уоллиса).
Методы и материалы
План исследования
Основной целью исследования был повторный вызов CD4+ T-клеток репертуара противопатогенной памяти для усиления противоопухолевого ответа. В качестве доказательства принципа наша гипотеза была проверена путем сравнения иммунизированных против столбняка мышей с B16.OVA с наивными мышами. Для того чтобы показать, что использование репертуара памяти дает преимущество перед наивными организмами, был исследован иммунологический фон мышей. После этого мы проверили нашу гипотезу, используя клинически значимый опухолевый пептид в комбинации с ингибитором иммунных контрольных точек. В завершение эксперимент был повторен с другим типом вакцины для подтверждения универсальной применимости принципа или концепции, лежащих в основе исследования. Контрольная и лечебная группы определены в подписи к рисункам. Количество животных в исследовании каждого типа определялось исследователями (каждая лечебная группа состояла не менее чем из n=8 мышей). Животные были рандомно распределены в контрольную и лечебную группы.
Клеточные линии и реактивы
Клеточную линию B16.OVA (линия клеток меланомы мыши, экспрессирующая куриный овальбумин (OVA)) культивировали в соответствии с рекомендациями Американской коллекции типовых культур (ATCC). Клетки культивировали в среде RPMI-1640 с низким содержанием глюкозы и с добавлением 10% фетальной бычьей сыворотки, 1% антибиотиков и 1% L-глутамина. Клетки культивировали при температуре 37°C, в увлажненной атмосфере с содержанием CO2 5%.
В исследовании использовались следующие пептиды, производства компании Ontores Biotechnologies Co. Ltd (Ханчжоу, Китай):
KKKKKQYIKANSKFIGITEL (Tetanus toxin) (SEQ ID NO:1);
KKKKARYVSQQTRANPNPY (Pertussis) (SEQ ID NO:2);
KKKKIQSKRFAPLYAVEAK (Polio Mahoney) (SEQ ID NO:3);
KKKKKKSPVYVGNGVHANLHV (Diphtheria) (SEQ ID NO:4);
KKKKKKPVFAGANYAAWAVNVAQVI (Diphtheria) (SEQ ID NO:5);
ARYVSQQTRANPNPY (Pertussis) (SEQ ID NO:6);
IQSKRFAPLYAVEAK (Polio Mahoney) (SEQ ID NO:7); и
SPVYVGNGVHANLHV (Diphtheria) (SEQ ID NO:8).
Следующие пептиды являются примерами противоопухолевых/противораковых пептидов
Предварительная иммунизация мышей
С целью вакцинации против столбняка и против дифтерии, столбняка, полиомиелита и коклюша 4-6-недельные самки мышей линии C57BL/6 получали первичную внутримышечную вакцинацию вакцинами Anatetall (GlaxoSmithKline, Италия: 8 МЕ/100 мкл) или PolioBoostrix (GlaxoSmithKline, Италия: дифтерийный токсин концентрацией 0,4 МЕ/100 мкл, столбнячный токсин 4 МЕ/100 мкл, антигены Bordetella pertussis: токсин коклюша 1,6 мг /100 мкл, гемагглютинин 1,6 мг/100 мкл и пертактин 0,5 мг/100 мкл соответственно, вводимые с двух сторон в четырехглавую мышцу (по 50 мкл в каждую ногу). Внутримышечная ревакцинация (50 мкл) проводилась дважды: первая через 2 недели после первоначальной вакцинации и вторая через 2 недели после первой ревакцинации. Образование у мышей IgG к столбнячному анатоксину и дифтерии измеряли методом ИФА (Xpress Bio Frederik, MD USA). Сыворотку крови отобрали у иммунизированных мышей на 5 день после иммунизации до начала эксперимента на животных.
Эксперименты на животных и этические соображения
Все эксперименты на животных были рассмотрены и одобрены Комитетом по экспериментам на животных Хельсинского Университета и правительством провинции Южная Финляндия (номер лицензии ESAVI/9817/04.10.07/2016).
4-6-недельные самки мышей линии C57BL/6JOlaHsd были получены от Envigo (Laboratory, Bar Harbor, Maine UK). 3x105 клеток B16.OVA вводили подкожно в правый бок. Подробную информацию о схеме лечения можно найти на легендах рисунков. Доза вируса составляла 1x109 вирусов/опухоль в комплексе с 20 мкг одного пептида или со смесью 10 мкг + 10 мкг из двух пептидов. Доза внутриопухольно вводимой вакцины Anatetall составляла 2 МЕ/мышь. Ингибиторы иммунных контрольных точек вводили внутрибрюшинно в дозе 100 мкг/мышь.
Проточная цитометрия
Использовались следующие антитела: TruStain Fcblock и анти-CD8-FITC (eBioscience, Affymetrix (Fisher), Foxp3-PE (eBioscience), CD4-PeCy7 (eBioscience), CD3-PerCPCy5.5 (eBioscience), IFNg-APC (eBioscience), CD40L-BV650 (BD Biosciences Bel Art Scienceware (Fisher), IFNg-FITC (BD), IL-17A-PE (BD), CD4-PerCPCy5.5 (BD), IL4-APC (BD), CD44-V450 (BD), CD44-PE (eBioscience), CD4-PeCy7 (eBioscience), CD3-PerCPCy5.5 (eBioscience), CD62L-APC (eBioscience), CCR7-V450 (BD), CD11c-FITC (BD), B220-PE (eBioscience), MHC-II(A-I/E-I)-PeCy7 (eBioscience), CD86-V450 (BD), CD40-APC (eBioscience), CD11b-PerCP-Cy5.5F4/80BV650 (BD), H-2Kb SVYDFFVWL-APC (ProImmune, Oxford Science Park UK), CD8a-FITC (ProImmune). Данные получены с использованием проточного цитометра BDLSRFORTESSA.
Анализ данных проведен с применением ПО FlowJo v9 (Ashland, Oregon, USA).
Определение IFN-γ методом иммуноферментных пятен
Количественные определения IFN-γ методом иммуноферментных пятен проводили с помощью доступного на рынке наборе реагентов mouse ELISPOT (ImmunoSpot, Bonn Germany) и 20 нг/мкл каждого пептида были исследованы in vitro на предмет стимуляции спленоцитов при температуре 37°C в течение 72 часов. Пятна подсчитывали, используя соответствующий (ImmunoSpot).
Образование комплекса PeptiCrad
Онколитический аденовирус и каждый эпитоп, модифицированный полилизином (полиК) (Ontores, Zhejiang, China) перемешивали для приготовления комплекса PeptiCRAd. Перед проведением лечения комплексами PeptiCRAd мы спешивали эпитопы, модифицированные полилизином (полиК) с Ad-5-D24-CpG в течение 15 минут при комнатной температуре. Более подробную информацию о стабильности и формировании комплекса можно найти в нашем предыдущем исследовании (11).
Статистический анализ данных
Статистический анализ был проведен с использованием ПО Graphpad Prism 6.0 (Graphpad Software Inc., La Jolla, CA USA). В экспериментах на животных использовали двухфакторный дисперсионный анализа с критерием множественного сравнения Тьюки, при этом значения P<0,05 рассматривались как статистически значимые. Все результаты представлены в виде среднего значений ± стандартная ошибка среднего (SEM).
Подробную информацию о статистических критериях, использованных в каждом эксперименте, можно найти на легенде соответствующего рисунка.
Результаты и обсуждение
Пример 1
Предварительная иммунизация противостолбнячной вакциной усиливает противоопухолевый ответ PeptiCRAd с двойным покрытием.
В настоящем примере мы оценили потенциал задействования CD4 + Т-клеток памяти с использованием вакцинной платформы PeptiCRAd, (11)а именно, мы покрыли онколитический аденовирус как опухоль-специфическими пептидами, ограниченными ГКГ-I, так и патоген-специфическими пептидами, ограниченными ГКГ-II, и изучили эффект на опухолях мышей у мышей, предварительно иммунизированных против патогена (Рисунок 1А). Наша гипотеза состояла в том, что добавлением патоген-специфических пептидов, ограниченных ГКГ-II, на платформу PeptiCRAd, мы обеспечиваем более быстрый и сильный ответ Т-хелперов, тем самым усиливая опухоль-специфический CTL-ответ.
Мы исследовали противоопухолевое действие модифицированного PeptiCRAd или PeptiCRAd с двойным покрытием у предварительно иммунизированных вводившейся внутримышечно противостолбнячной вакциной мышей с опухолями B16.OVA, которые являются моделью меланомы, экспрессирующей куриный OVA в качестве модельного антигена (15). Эпитоп OVA был выбран потому, что он обладает высокой иммуногенностью, а, значит, предоставляет подходящую модель для анализа генерации Т-клеточного ответа (16). Мышей линии C57BL/6 иммунизировали противостолбнячной вакциной три раза с интервалом 2 недели (Рисунок 1B). Образцы сыворотки мышей собирали через 5 недель после примирования, для подтверждения успешности вакцинации определяли титр противостолбнячных антител (Рисунок 1B и Рисунок 6A).
После приживления опухоли мыши были рандомизированы в группы и получали лечение PeptiCRAd, покрытым опухоль-специфическими пептидами (OVA-PeptiCRAd), специфическими пептидами столбняка (TT-PeptiCRAd) или пептидами как столбняка, так и OVA (TT-OVA-PeptiCRAd). В дополнение к этому, противостолбнячная вакцина отдельно или в комбинации с OVA-PeptiCRAd использовалась для оценки того, может ли введенная внутриопухолево доступная на рынке вакцина влиять на рост опухоли. Все инъекции были введены внутриопухольно согласно схеме лечения, показанной на рисунке 1В.
По результатам терапии TT-OVA-PeptiCRAd превосходил любой из вирусов с одинарным покрытием в отношении подавления роста опухоли у мышей, предварительно иммунизированных вакциной столбнячного анатоксина (Рисунок 1C). Это позволяет предположить, что ответ противостолбнячной памяти действительно усиливает первичный иммунный ответ, вызванный антигеном OVA. Способность покрытого столбнячным токсином PeptiCRAd вызывать в основном Th1-поляризованные CD4+ Т-клеточные ответы была также подтверждена по результатам анализа методом внутриклеточного окрашивания (Рисунок 6В). Менее удивительным является то, что данный подход работал также в тех случаях, когда противостолбнячная вакцина была повторно введена в виде комбинации с OVA-PeptiCRAd (вакцина + OVA-PeptiCRAd), при чем противостолбнячная вакцина сама по себе не обладала терапевтической эффективностью (Рисунок 1D). Примечательно, что при сравнении сочетания вакцина + OVA-PeptiCRAd с OVA-PeptiCRAd, последний показал значительно более высокую противоопухолевую эффективность (p=0,05). Это позволяет предположить, что эффект был вызван не самим адъювантом, содержащимся в вакцине, а, скорее, презентацией специфических для столбняка пептидов на ГКГ-II, вовлекающей CD4+ Т-клетки в поддержание цитотоксического CD8+ Т-клеточного ответа.
Интересно отметить, что когда тот же эксперимент был проведен на наивных мышах (мыши, которые не были предварительно иммунизированы противостолбнячной вакциной), то статистически значимых различий между OVA-PeptiCRAd и TT-OVA-PeptiCRAd не наблюдалось (Рисунок 1Е).
Эти результаты показывают, что противоопухолевая эффективность нашей противораковой вакцины PeptiCRAd на основе вирусов существенно увеличивается, если вирус одновременно покрыт также и пептидами, которые являются специфическими к патогенам, по отношению к которым у субъекта уже имеется иммунитет.
Пример 2
Ответ Т-клеточной памяти, специфичной к столбняку, благоприятным образом формирует иммунную среду в микроокружении опухоли.
С целью более глубокого понимания механизма действия PeptiCRAd с двойным покрытием, мы исследовали качество иммунного ответа, вызванного различными видами лечения. Для решения этой задачи мы проанализировали частоту различных популяций клеток в опухоли методом проточной цитометрии, что особенно важно - активированные дендритные клетки (DC), CD4+ и CD8+ Т-клетки с эффекторным фенотипом и фенотипом памяти, а также обученные и истощенные эффекторные CD8+ Т-клетки.
Примечательно, что мы обнаружили повышенную частоту активированных внутриопухолевых дендритных клеток во всех группах, которые получали лечение PeptiCRAd в контексте столбнячных антигенов (как покрытых пептидом столбнячного токсина, так и вводимых вместе с цельной вакциной) (Рисунок 2A). В противоположность этим видам комбинированного лечения использование только вакцины приводило к слабой индукции созревания дендритных клеток в микроокружении опухоли, что позволяет сделать вывод о том, что включение аденовирусного адъюванта может иметь решающее значение для достаточной активации дендритных клеток в данных условиях. Более того, мы наблюдали повышенные содержания CD4+ и CD8+ Т-клеток в опухолях во всех группах мышей, получавших лечение PeptiCRAd (Рисунок 2B-C). Это хорошо согласуется с тем, что ранее наблюдалось после лечения лекарственными препаратами на основе вирусов.(11) Наконец, мы хотели проанализировать фенотип этих Т-клеток. Большая часть опухоль-инфильтрующих лимфоцитов (TIL) имеет фенотип эффекторных Т-клеток памяти с увеличением частоты CD8+ и CD4+ в группах, получавших лечение TT-PeptiCRAd и OVA-TT-PeptiCRAd (Рисунок 2D-E). Более того, с целью исследования истощения Т-клеток были изучены уровень экспрессии Т-клеточного иммуноглобулина и домена муцина-3 (TIM-3) в PD1+ опухоль-инфильтрующих лимфоцитах. Интересно отметить, что мы наблюдали значительно более низкую частоту истощенных CD8+ Т-клеток в группе мышей, получавших TT-OVA-PeptiCRAd, по сравнению с другими группами, что указывает на то, что для оптимальной активности CD8+ Т-клеток требуется поддержка CD4+ Т-клеток (Рисунок 2F). Нами был сделан вывод, что предварительно существующий иммунитет против столбняка улучшал общую эффективность лечения путем существенного изменения иммунной среды в очаге опухоли, особенно в тех случаях, когда лечение основывалось на вирусах и включало в себя противостолбнячную вакцину или пептиды столбняка. Нужно отметить, что аденовирус человека 5-го серотипа, применявшийся в данных экспериментах, не является онколитическим в отношении мышиных опухолей, так что его влияние на подавление опухоли основано исключительно на противоопухолевом иммунном ответе. Для объяснения этого феномена мы еще раз проанализировали все наборы данных, разделив мышей на экземпляры, отвечающие на лечение, и экземпляры, не отвечающие на лечение, и провели повторную оценку их иммунологических ответов. Как и ожидалось, мы наблюдали существенное различие между двумя группами. Безотносительно к типу терапии, все экземпляры, отвечающие на лечение, имели непрерывный измеримый иммунный ответ, что подчеркивает важность иммунной системы в контроле роста опухоли, независимо от того, лечение какого типа они получали. Важно, что большинство экземпляров, отвечающих на лечение, были обнаружены в группе мышей, получавших лечение TT-OVA-PeptiCRAd (Рисунок 7A-E).
Пример 3
Во вторичных лимфоидных органах после лечения с использованием T-OVA-PeptiCRAd были обнаружены экспрессирующие CD40L TT-специфические CD4+ Т-клетки, поляризованные в направлении фенотипа Th1.
Чтобы проанализировать возможный механизм наблюдаемой терапевтической эффективности, мы провели оценку концентраций и фенотипа иммунных клеток во вторичных лимфоидных органах предварительно иммунизированных мышей. Как и ожидалось, у мышей, получавших PeptiCRAd, обнаружено увеличение количества CD4+ Т-клеток как в селезенке, так и в дренирующих лимфатических узлах (Рисунок 3A и Рисунок 8C). Еще более важно то, что у мышей, получавших TT-OVA, наблюдалось значительное увеличение ТТ-специфических CD4+ Т-клеток, экспрессирующих лиганд CD40 (CD40L) (Рисунок 3В). Большинство этих CD40L+ -клеток были поляризованы в направлении Th1-фенотипа, хотя было также обнаружено некоторое количество ТТ-специфических регуляторных Т-клеток (Tregs), экспрессирующих Foxp3+. Анализ дренирующих лимфатических узлов показал, что внутриопухолевая вакцинация с использованием TT-OVA-PeptiCRAd индуцировала в основном IFN- γ продуцирующие клетки памяти Th1 за счет клеток Th2, продуцирующих IL-4, тогда как в содержании клеток Th17, продуцирующих IL-17A, различий не наблюдалось (Рисунок 8D-G). Поскольку было показано, что CD40L, связанный с CD4+ Т-клетками, играет важную роль в стимуляции цитотоксических CD8+ Т-клеточных ответов, то мы хотели выяснить, можем ли мы обнаружить антиген-презентирующие клетки, презентирующие CD40+ -антигены. Действительно, у предварительно иммунизированных мышей, которые получали внутриопухолевые инъекции TT-OVA-PeptiCRAd, была обнаружена значительно более высокая частота антиген-презентирующих клеток, экспрессирующих CD40+ (Рисунок 3C). Это указывает на стимулирование PeptiCRAd с двойным покрытием ТТ-специфических CD4+ Т-клеток памяти, которые, в свою очередь, могут лицензировать профессиональные антиген-презентирующие клетки путем CD40-CD40L взаимодействия.
Пример 4
Комбинация с ингибиторами иммунных контрольных точек увеличивает количество экземпляров, отвечающих на лечение, и приводит к полному отторжению опухоли.
Ранее нами было показано, что комбинация нацеленного на опухоль PeptiCRAd с ингибиторами иммунных контрольных точек обладает синергетическим эффектов в смысле улучшения противоопухолевой эффективности (8). Поэтому мы хотели оценить, будет ли предварительно существующий иммунитет, вызванный вакциной, еще больше усиливать эту синергию, в частности, увеличивать частоту положительного ответа мышей на терапию.
Чтобы проверить эту гипотезу, мы покрыли вирус столбнячным токсином и пептидами (TRP2180-188 (23)) и связанного с тирозиназой белка 2 (TRP2), который является встречающимся в природе антигеном, связанным с меланомой, и, следовательно, более клинически значимым эпитопом, чем OVA. Предварительно иммунизированным против столбняка мышам подкожно имплантировали опухоли и затем внутриопухольно вводили PeptiCRAd, покрытый только пептидами TRP2 (TRP2-PeptiCRAd), или PeptiCRAd, покрытый пептидами TRP2 и TT (TT-TRP2-PeptiCRAd) (Рисунок 4A). Так же, как на Рисунке 1, мы наблюдали значительное, по сравнению с контрольной группой, ингибирование роста опухоли у мышей, получавших лечение вирусом с двойным покрытием (Рисунок 4B).
Интересно отметить, что когда мы комбинировали терапии PeptiCRAd с моноклональным антителом, блокирующим PD-1, то наблюдалось значительное повышение эффективности лечения как TRP2-PeptiCRAd, так и TT-TRP2-PeptiCRAd (Рисунок 4C-D). Однако PeptiCRAd с двойным покрытием в отношении контроля роста опухоли все еще оставался более эффективным, чем вирус с одним покрытием (Рисунок 9В).
Более важным является то, что включение ТТ-специфических пептидов в противораковую нановакцину привело к 75%-ой частоте положительного клинического ответа на анти-PD1, тогда как только у 28% мышей, получавших лечение с использованием TRP2-PeptiCRAd и блокады PD-1, произошло полное уничтожение опухоли (Рисунок 4E и Рисунок 9A). Одним из самых больших преимуществ комбинирования онколитических вирусов с ингибиторами иммунных контрольных точек является то, что вирусы в опухоли облегчают и увеличивают накопление Т-лимфоцитов, тем самым вызывая необычайную активность моноклональных антител. Вдоль этой линии мы наблюдали значительное увеличение количество CD8+ опухоль-инфильтрующих лимфоцитов у мышей, получавших лечение TT-TRP2-PeptiCRAd в сочетании с анти-PD-1 (Рисунок 4C), по сравнению с контрольными группами лечения (Рисунок 4F).
Пример 5
Предварительно существующий иммунитет является общим механизмом усиления противоопухолевого ответа. Он изменяет иммунологический баланс Т-клеточного репертуара.
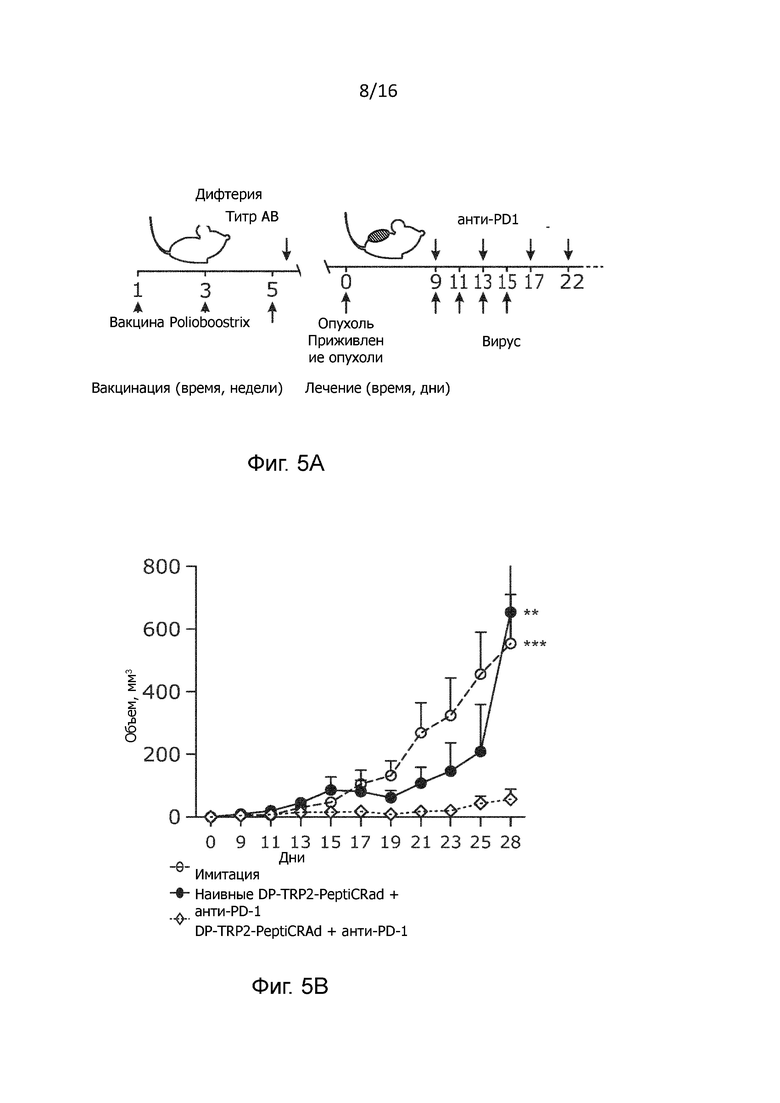
Так как мы наблюдали, что предварительно существовавший иммунитет к столбнячному анатоксину усиливает противоопухолевый ответ в случае использования PeptiCRAd с двойным покрытием самого по себе и в сочетании с блокадой PD-1, то мы старались в дополнение к этому изучить, применим ли наш подход также в контексте мультивалентной вакцины, например, четырехвалентной вакцины. Polioboostrix является четырехвалентной вакциной, которой охвачено 85% иммунизированных младенцев, что делает ее привлекательной моделью исследования.(25) Мыши линии C57BL/6 были предварительно иммунизированы вакциной Polioboostrix по той же схеме иммунизации, что и раньше (Рисунок 5A). С целью подтверждения эффективности были собраны и проанализированы образцы сыворотки и спленоциты для протокола иммунизации. Было обнаружено, что четырехвалентная вакцина эффективно генерирует антитела и CD4+ T-клетки, специфические к коклюшу и дифтерии (Рисунок 10А-С). С целью анализа роста опухолей наивные или предварительно иммунизированные мыши с опухолями B16.OVA получали лечение антителами анти-PD1 и PeptiCRAd, покрытым пептидами дифтерии-коклюша, ограниченными ГКГ II, и пептидами TRP2, ограниченными ГКГ I (DP-TRP2-PeptiCRAd). В соответствии с нашими предыдущими результатами, у предварительно иммунизированных, получавших DP-TRP2-peptiCRAd и анти-PD1, наблюдался мощный противоопухолевый ответ, в то время как эффективность лечения у наивных мышей была потеряна (Рисунок 5В).
Указанные результаты подтверждают, что предварительно существующий иммунитет к патогенам усиливает противоопухолевый ответ и что механизм действия зависит от Т-клеток памяти. Кроме того, данный эффект не ограничивается столбняком, но может быть адаптирован и к другим патогенам. С целью дополнительной проверки механизма действия, лежащего в основе повышенной эффективности лечения с использованием дифтерии и коклюша в качестве вакцины для предварительной иммунизации, мы проанализировали репертуар Т-клеток лимфатических узлов, дренирующих опухоль, микроокружения опухоли и селезенки. Частота наивных CD8+ и CD4+ T-клеток в дренирующих лимфатических узлах у предварительно иммунизированных мышей, получавших DP-TRP2 PeptiCRAd, была ниже, чем в контрольных группах (Рисунок 5С). Наряду с этим, в дренирующих лимфатических узлах и в микроокружении опухоли предварительно иммунизированных мышей наблюдались более высокие уровни CD4+ эффекторных Т-клеток памяти, чем у наивных и ложно обработанных мышей (Рисунок 5D). Кроме того, в опухолевой ткани иммунизированных мышей наблюдалась тенденция к более высокой, чем у наивных мышей, инфильтрации TRP2-специфических CD8+ Т-клеток (Рисунок 10D). Уровни эффекторных CD4+ Т-клеток памяти в опухоли и дренирующих лимфатических узлах сильно коррелировали с интенсивностью TRP2-специфического ответа опухоль-инфильтрующих лимфоцитов. В целом, вакцинная платформа PeptiCRAd с двойным покрытием может быть использована для стимуляции предварительного приобретенного патоген-специфического CD4+ Т-клеточного иммунитета для поддержки выработки эффективных противоопухолевых ответов CD8+ Т-клеток.
Сущность изобретения
Благодаря широкому охвату международными программами вакцинации большая часть населения мира вакцинирована против обычных патогенов. Это привело к приобретению патоген-специфического иммунитета со стойким репертуаром Т-клеток памяти. Указанные вакцины формируют иммунологическую память, которая способна развернуть гораздо более быстрый и эффективный иммунный ответ при повторной встрече с патогеном. В действительности первичный иммунный ответ является довольно слабым и медленным, а вторичный иммунный ответ - более быстрым и эффективным (26). Хотя CD8+ противоопухолевые цитотоксические Т-лимфоциты (CTL) являются предпочтительными эффекторами иммунотерапии рака, поддержка CD4+ Т-клеток также необходима для возникновения противоопухолевого иммунного ответа оптимальной силы.
Новый подход к иммунотерапии рака, который использует преимущества предварительно существующей патоген-специфической иммунологической памяти, присутствующей в мировой популяции вакцинированных людей, мы описываем путем исследования того, можно ли повторно задействовать популяции связанных с патогенами CD4+ T-клеток памяти для поддержки цитотоксических T-клеток и превращения слабого первичного противоопухолевого иммунного ответа в более сильный вторичный. Для этого мы использовали нашу технологию PeptiCRAd, которая основывается на вирусе, покрытом опухоль-специфическими пептидами, ограниченными ГКГ I, и развили ее путем добавления патоген-специфических пептидов, ограниченных ГКГ II.
Доказательство концепции было получено и проверено на меланоме с использованием противостолбнячной вакцины и вакцины polioboostrix, доступных для человека, что подчеркивает универсальный характер усиления онкоспецифических CTL-ответов CD4+ памятью. Важно отметить, что данный подход не ограничивается суррогатным OVA. Он может быть распространен на природные опухолевые пептиды, а также на другие патогены кроме столбняка, что подчеркивает пригодность нашего метода для полноценного использования репертуара CD4+ Т-клеток памяти при разработке схем иммунотерапевтического лечения.
В заключение следует отметить, что противоопухолевый эффект был еще более значительным в сочетании с ингибитором иммунных контрольных точек, например, анти-PD1, что подкрепляет обоснование комбинированной терапии онколитическими вирусами.
ССЫЛКИ
8. Ostroumov D, Fekete-Drimusz N, Saborowski M, Kuhnel F, Woller N. CD4 and CD8 T lymphocyte interplay in controlling tumor growth. Cell Mol Life Sci. 2018;75(4):689-713.
11. Capasso C, Hirvinen M, Garofalo M, Romaniuk D, Kuryk L, Sarvela T, et al. Онколитические аденовирусы, покрытые опухолевыми эпитопами ГКГ I, повышают противоопухолевый иммунитет и эффективность против меланомы. Oncoimmunology. 2016;5(4):e1105429.
15. Moore MW, Carbone FR, Bevan MJ. Introduction of soluble protein into the class I pathway of antigen processing and presentation. Cell. 1988;54(6):777-85.
16. Knocke S, Fleischmann-Mundt B, Saborowski M, Manns MP, Kuhnel F, Wirth TC, et al. Tailored Tumor Immunogenicity Reveals Regulation of CD4 and CD8 T Cell Responses against Cancer. Cell Rep. 2016;17(9):2234-46.
23. Bloom MB, Perry-Lalley D, Robbins PF, Li Y, el-Gamil M, Rosenberg SA, et al. Identification of tyrosinase-related protein 2 as a tumor rejection antigen for the B16 melanoma. J Exp Med. 1997;185(3):453-9.
25. Feldstein LR, Mariat S, Gacic-Dobo M, Diallo MS, Conklin LM, Wallace AS. Global Routine Vaccination Coverage, 2016. MMWR Morb Mortal Wkly Rep. 2017;66(45):1252-5.
26. Laidlaw BJ, Craft JE, Kaech SM. The multifaceted role of CD4(+) T cells in CD8(+) T cell memory. Nat Rev Immunol. 2016;16(2):102-11.
--->
Перечень последовательностей
<110> ВАЛО ТХЕРАПЕУТИЦС ОЫ
<120> Вирусный Вектор
<130> 4647P/GB
<150> GB1907413.7
<151> 2019-05-24
<160> 28
<170> PatentIn version 3.5
<210> 1
<211> 15
<212> PRT
<213> Artificial Sequence
<220>
<223> tetanus toxin
<400> 1
Gln Tyr Ile Lys Ala Asn Ser Lys Phe Ile Gly Ile Thr Glu Leu
1 5 10 15
<210> 2
<211> 15
<212> PRT
<213> Artificial Sequence
<220>
<223> pertussis
<400> 2
Ala Arg Tyr Val Ser Gln Gln Thr Arg Ala Asn Pro Asn Pro Tyr
1 5 10 15
<210> 3
<211> 15
<212> PRT
<213> Artificial Sequence
<220>
<223> polio mahoney
<400> 3
Ile Gln Ser Lys Arg Phe Ala Pro Leu Tyr Ala Val Glu Ala Lys
1 5 10 15
<210> 4
<211> 15
<212> PRT
<213> Artificial Sequence
<220>
<223> Diptheria
<400> 4
Ser Pro Val Tyr Val Gly Asn Gly Val His Ala Asn Leu His Val
1 5 10 15
<210> 5
<211> 19
<212> PRT
<213> Artificial Sequence
<220>
<223> Diptheria
<400> 5
Pro Val Phe Ala Gly Ala Asn Tyr Ala Ala Trp Ala Val Asn Val Ala
1 5 10 15
Gln Val Ile
<210> 6
<211> 15
<212> PRT
<213> Artificial Sequence
<220>
<223> Pertussis
<400> 6
Ala Arg Tyr Val Ser Gln Gln Thr Arg Ala Asn Pro Asn Pro Tyr
1 5 10 15
<210> 7
<211> 15
<212> PRT
<213> Artificial Sequence
<220>
<223> Polio Mahoney
<400> 7
Ile Gln Ser Lys Arg Phe Ala Pro Leu Tyr Ala Val Glu Ala Lys
1 5 10 15
<210> 8
<211> 15
<212> PRT
<213> Artificial Sequence
<220>
<223> Diptheria
<400> 8
Ser Pro Val Tyr Val Gly Asn Gly Val His Ala Asn Leu His Val
1 5 10 15
<210> 9
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> gp100 antigen
<400> 9
Lys Val Pro Arg Asn Gln Asp Trp Leu
1 5
<210> 10
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> NY-ESO-1 antigen
<400> 10
Ser Leu Leu Met Trp Ile Thr Gln Cys
1 5
<210> 11
<211> 20
<212> PRT
<213> Artificial Sequence
<220>
<223> NY-ESO-1 antigen
<400> 11
Arg Gly Pro Glu Ser Arg Leu Leu Glu Phe Tyr Leu Ala Met Pro Phe
1 5 10 15
Ala Thr Pro Met
20
<210> 12
<211> 20
<212> PRT
<213> Artificial Sequence
<220>
<223> NY-ESO-1 antigen
<400> 12
Tyr Leu Ala Met Pro Phe Ala Thr Pro Met Glu Ala Glu Leu Ala Arg
1 5 10 15
Arg Ser Leu Ala
20
<210> 13
<211> 30
<212> PRT
<213> Artificial Sequence
<220>
<223> NY-ESO-1 Antigen
<400> 13
Arg Gly Pro Glu Ser Arg Leu Leu Glu Phe Tyr Leu Ala Met Pro Phe
1 5 10 15
Ala Thr Pro Met Glu Ala Glu Leu Ala Arg Arg Ser Leu Ala
20 25 30
<210> 14
<211> 25
<212> PRT
<213> Artificial Sequence
<220>
<223> NY-ESO-1 Antigen
<400> 14
Pro Gly Val Leu Leu Lys Glu Phe Thr Val Ser Gly Asn Ile Leu Thr
1 5 10 15
Ile Arg Leu Thr Ala Ala Asp His Arg
20 25
<210> 15
<211> 20
<212> PRT
<213> Artificial Sequence
<220>
<223> NY-ESO-1 Antigen
<400> 15
Tyr Leu Ala Met Pro Phe Ala Thr Pro Met Glu Ala Glu Leu Ala Arg
1 5 10 15
Arg Ser Leu Ala
20
<210> 16
<211> 22
<212> PRT
<213> Artificial Sequence
<220>
<223> NY-ESO-1 Antigen
<400> 16
Tyr Leu Ala Met Pro Phe Ala Thr Pro Met Glu Ala Glu Leu Ala Arg
1 5 10 15
Arg Ser Leu Ala Glu Glu
20
<210> 17
<211> 20
<212> PRT
<213> Artificial Sequence
<220>
<223> MAGE-A3 antigen
<400> 17
Val Phe Gly Ile Glu Leu Met Glu Val Asp Pro Ile Gly His Leu Tyr
1 5 10 15
Ile Phe Ala Thr
20
<210> 18
<211> 20
<212> PRT
<213> Artificial Sequence
<220>
<223> MAGE-A3 antigen
<400> 18
Val Phe Gly Ile Glu Leu Met Glu Val Asp Pro Ile Gly His Leu Tyr
1 5 10 15
Ile Phe Ala Thr
20
<210> 19
<211> 15
<212> PRT
<213> Artificial Sequence
<220>
<223> poly lysine gp100 antigen position 25-35
<400> 19
Lys Lys Lys Lys Lys Lys Lys Val Pro Arg Asn Gln Asp Trp Leu
1 5 10 15
<210> 20
<211> 15
<212> PRT
<213> Artificial Sequence
<220>
<223> poly lysine NY-ESO-1 antigeb position 157-165
<400> 20
Lys Lys Lys Lys Lys Lys Ser Leu Leu Met Trp Ile Thr Gln Cys
1 5 10 15
<210> 21
<211> 26
<212> PRT
<213> Artificial Sequence
<220>
<223> poly lysine NY-ESO-1 antigen position 81-100
<400> 21
Lys Lys Lys Lys Lys Lys Arg Gly Pro Glu Ser Arg Leu Leu Glu Phe
1 5 10 15
Tyr Leu Ala Met Pro Phe Ala Thr Pro Met
20 25
<210> 22
<211> 26
<212> PRT
<213> Artificial Sequence
<220>
<223> poly lysine NY-ESO-1 antigen position 91-110
<400> 22
Lys Lys Lys Lys Lys Lys Tyr Leu Ala Met Pro Phe Ala Thr Pro Met
1 5 10 15
Glu Ala Glu Leu Ala Arg Arg Ser Leu Ala
20 25
<210> 23
<211> 36
<212> PRT
<213> Artificial Sequence
<220>
<223> poly lysine NY-ESO-1 antigen position 81-110
<400> 23
Lys Lys Lys Lys Lys Lys Arg Gly Pro Glu Ser Arg Leu Leu Glu Phe
1 5 10 15
Tyr Leu Ala Met Pro Phe Ala Thr Pro Met Glu Ala Glu Leu Ala Arg
20 25 30
Arg Ser Leu Ala
35
<210> 24
<211> 31
<212> PRT
<213> Artificial Sequence
<220>
<223> poly lysine NY-ESO-1 antigen position 119-143
<400> 24
Lys Lys Lys Lys Lys Lys Pro Gly Val Leu Leu Lys Glu Phe Thr Val
1 5 10 15
Ser Gly Asn Ile Leu Thr Ile Arg Leu Thr Ala Ala Asp His Arg
20 25 30
<210> 25
<211> 29
<212> PRT
<213> Artificial Sequence
<220>
<223> poly lysine NY-ESO-1 antigen position 91-110
<400> 25
Lys Lys Lys Lys Lys Lys Lys Lys Lys Tyr Leu Ala Met Pro Phe Ala
1 5 10 15
Thr Pro Met Glu Ala Glu Leu Ala Arg Arg Ser Leu Ala
20 25
<210> 26
<211> 28
<212> PRT
<213> Artificial Sequence
<220>
<223> poly lysine NY-ESO-1 antigen position 91-110
<400> 26
Lys Lys Lys Lys Lys Lys Tyr Leu Ala Met Pro Phe Ala Thr Pro Met
1 5 10 15
Glu Ala Glu Leu Ala Arg Arg Ser Leu Ala Glu Glu
20 25
<210> 27
<211> 26
<212> PRT
<213> Artificial Sequence
<220>
<223> poly lysine MAGE-A3 antigen position 161-180
<400> 27
Lys Lys Lys Lys Lys Lys Val Phe Gly Ile Glu Leu Met Glu Val Asp
1 5 10 15
Pro Ile Gly His Leu Tyr Ile Phe Ala Thr
20 25
<210> 28
<211> 22
<212> PRT
<213> Artificial Sequence
<220>
<223> poly lysine MAGE-A3 antigen position 161-176
<400> 28
Lys Lys Lys Lys Lys Lys Val Phe Gly Ile Glu Leu Met Glu Val Asp
1 5 10 15
Pro Ile Gly His Leu Tyr
20
<---
Изобретение относится к биотехнологии. Описан вирусный вектор с модифицированным вирусным капсидом или вирусной оболочкой. Описана фармацевтическая композиция или иммуногенное средство или вакцина, содержащее(ая) вышеуказанный вектор. Представлена клетка-мишень, трансформированная или трансфицированная вышеуказанным вектором. Также описана терапевтическая комбинация, содержащая вышеуказанное. Представлено использование вышеуказанного при лечении рака и способ лечения рака с использованием вышеуказанного. Изобретение расширяет арсенал вирусных векторов для терапевтического применения. 7 н. и 14 з.п. ф-лы, 10 ил., 5 пр.
1. Вирусный вектор для стимуляции противоракового иммунного ответа с присоединенными к его капсиду или суперкапсиду полипептидами, которые не кодируются генетически указанным вирусным вектором, но были присоединены к капсиду или суперкапсиду ковалентными или нековалентными связями, где:
i) по меньшей мере один из указанных полипептидов содержит антиген из патогена или антиген патогена, против которого субъект был предварительно иммунизирован, и
ii) по меньшей мере еще один из указанных полипептидов является специфическим противоопухолевым или противораковым полипептидом и, таким образом, стимулирует противоопухолевый или противораковый иммунный ответ у субъекта, на который воздействует указанный вектор.
2. Вирусный вектор согласно п. 1, в котором указанные полипептиды включают cлитые полипептиды, одна часть которых содержит антиген из патогена или антиген патогена, против которого субъект был предварительно иммунизирован, а другая часть которых является противоопухолевым или противораковым специфическим полипептидом и, таким образом, стимулирует противоопухолевый или противораковый иммунный ответ у субъекта, на который воздействует указанный вектор.
3. Вирусный вектор согласно п. 1 или 2, в котором указанные полипептиды являются модифицированными полилизином или полиаргинином с целью присоединения их к указанному капсиду.
4. Вирусный вектор согласно п. 1 или 2, в котором указанные полипептиды присоединены к капсиду или суперкапсиду проникающим пептидом, фрагментом молекулы холестерина или электростатической, дисульфидной или амидной связью.
5. Вирусный вектор согласно любому из пп. 1-4, в котором указанные полипептиды выбираются из группы, включающей в себя: ГКГ I-специфические полипептиды, ГКГ II-специфические полипептиды и дендритно-клеточные специфические полипептиды.
6. Вирусный вектор согласно любому из пп. 1-5, в котором по меньшей мере один или множество указанных полипептидов являются ГКГ I-специфическими полипептидами и по меньшей мере один или множество указанных полипептидов являются ГКГ II-специфическими полипептидами.
7. Вирусный вектор согласно любому из пп. 1-6, в котором указанный вирусный вектор входит в семейство, выбираемое из группы, включающей: аденовирусы, реовирусы, вирусы папилломы, пикорнавирусы, калицивирусы, вирусы герпеса, вирусы оспы, гепаднавирусы, флавивирус, тогавирус, коронавирус, гепатит D, ортомиксовирус, парамиксовирус, рабдовирус, буньявирус, филовирус и ретровирусы.
8. Вирусный вектор согласно п. 7, отличающийся тем, что указанный вирус выбирается из группы, содержащей: вирус простого герпеса 1 (HSV-1), вирус простого герпеса 2 (HSV-2), вирус осповакцины, вирус везикулярного стоматита Индианы (VSV), вирус кори (MeV), вирус Мараба (MG1) и вирус Ньюкасла (NDV).
9. Вирусный вектор согласно п. 7 или 8, в котором указанный вирус является или вирусом осповакцины, или HSV-1, или аденовирусом.
10. Вирусный вектор согласно любому из пп. 1-9, в котором указанный вектор является онколитическим.
11. Вирусный вектор согласно любому из пп. 1-10, в котором указанный полипептид части i) выбирается из группы, содержащей:
QYIKANSKFIGITEL (Tetanus toxin) (SEQ ID NO:1);
ARYVSQQTRANPNPY (Pertussis) (SEQ ID NO:2);
IQSKRFAPLYAVEAK (Polio Mahoney) (SEQ ID NO:3);
SPVYVGNGVHANLHV (Diphtheria) (SEQ ID NO:4);
PVFAGANYAAWAVNVAQVI (Diphtheria) (SEQ ID NO:5);
ARYVSQQTRANPNPY (Pertussis) (SEQ ID NO:6);
IQSKRFAPLYAVEAK (Polio Mahoney) (SEQ ID NO:7); и
SPVYVGNGVHANLHV (Diphtheria) (SEQ ID NO:8).
12. Вирусный вектор согласно любому из пп. 1-11, в котором указанный полипептид части ii) выбирается из группы, содержащей:
KVPRNQDWL (gp100) (SEQ ID NO:9);
SLLMWITQC (NY-ESO-1) (SEQ ID NO:10);
RGPESRLLEFYLAMPFATPM (NY-ESO-1) (SEQ ID NO:11);
YLAMPFATPMEAELARRSLA (NY-ESO-1) (SEQ ID NO:12);
RGPESRLLEFYLAMPFATPMEAELARRSLA (NY-ESO-1 (SEQ ID NO:13);
PGVLLKEFTVSGNILTIRLTAADHR (NY-ESO-1) (SEQ ID NO:14);
YLAMPFATPMEAELARRSLA (NY-ESO-1) (SEQ ID NO:15);
YLAMPFATPMEAELARRSLAEE (NY-ESO-1) (SEQ ID NO:16);
VFGIELMEVDPIGHLYIFAT (MAGE-A3) (SEQ ID NO:17); и
VFGIELMEVDPIGHLY (MAGE-A3) (SEQ ID NO:19).
13. Композиция для лечения рака, содержащая указанный вирусный вектор согласно любому из пп. 1-12 и подходящий носитель.
14. Вакцина для лечения рака, содержащая эффективное количество вирусного вектора согласно любому из пп. 1-12.
15. Клетка-мишень для стимуляции противоракового иммунного ответа, трансформированная или трансфицированная указанным вирусным вектором согласно любому из пп. 1-12.
16. Комбинация лекарственных препаратов для лечения рака, содержащая:
а) вирусный вектор согласно пп. 1-12 или фармацевтическую композицию по п. 13, вакцину согласно п. 14 или клетку согласно п. 15 в комбинации с b) еще одним противораковым агентом.
17. Вирусный вектор согласно любому из пп. 1-12, или фармацевтическая композиция согласно п. 13, или вакцина согласно п. 14, или клетка согласно п. 15, или комбинация лекарственных препаратов согласно п. 16 для использования в лечении рака.
18. Применение вирусного вектора согласно любому из пп. 1-12, или клетки согласно п. 15, или комбинации лекарственных препаратов согласно п. 16 для производства лекарственного препарата для лечения рака.
19. Способ лечения рака, включающий введение указанного вирусного вектора согласно любому из пп. 1-12, или указанной фармацевтической композиции согласно п. 13, или вакцины согласно п. 14, или клетки согласно п. 15, или комбинации лекарственных препаратов согласно п. 16 индивидууму, требующему лечения.
20. Способ согласно п. 19, отличающийся тем, что указанный вирусный вектор или указанная фармацевтическая композиция, вакцина или клетка используются в сочетании с противоопухолевым агентом или средством против сезонного расстройства.
21. Вирусный вектор согласно пп. 1-12, или фармацевтическая композиция согласно п. 13, или вакцина согласно п. 14, или клетка согласно п. 15, или комбинированный лекарственный препарат согласно п. 16, или применение согласно п. 17 или 18, или способ согласно п. 19 или 20, отличающийся тем, что указанный рак представляет собой рак, отвечающий на существующий репертуар CD4+ T-клеток памяти, и противоопухолевый ответ цитотоксических CD8+ T-лимфоцитов.
| WO 2015177098 A2, 26.11.2015 | |||
| DE 10010165 A1, 20.09.2001 | |||
| EVA SCHLINGLOFF AUS BRAUNSCHWEIG, Evaluierung der humoralen Immunantwort gegen Cancer-Testis-Antigene nach autologer und allogener Stammzelltransplantation bei Patienten mit Multiplem Myelom, Hamburg 2016, таблица 5, найдено в интернет 14.10.2022 https://d-nb.info/1150401583/34 | |||
| MANAMI |
Авторы
Даты
2023-07-05—Публикация
2020-05-21—Подача