Изобретение относится к области радиоэкологии, в частности к сорбентам для улавливания анионных форм радиоактивного иода, и может быть использовано в качестве компонента инженерных барьеров безопасности хранилищ радиоактивных отходов.
Радиоактивные изотопы иода являются одними из основных продуктов деления U-235, образующихся в ядерном реакторе, и представляют значительную опасность для человека и остальной биосферы ввиду их высокой подвижности в окружающей среде и органотропности. Радиоиод иммобилизуется в радиоактивные отходы (РАО) в формах иодид- и иодат-анионов, в этих же формах возможна его миграция в окружающую среду. Для захоронения РАО разрабатываются хранилища, важным компонентов которых являются инженерные барьеры безопасности (ИББ), предназначенные для предотвращения доступа подземных вод к упаковкам с отвержденными РАО и миграции радионуклидов за пределы хранилища в случае нарушения целостности матриц РАО и упаковок. В качестве основного материала ИББ планируются к использованию бентонитовые глины, обладающие высокими гидроизоляционными и катионообменными свойствами, но не способные сорбировать радионуклиды, представленные анионными формами.
В настоящий момент для сорбции анионов радиоактивного иода чаще всего используются синтетические ионообменные смолы. Известен композиционный сорбент для очистки воды хранилищ ОЯТ, состоящий из волокнистых полиамфолитов - крепана, радиационно-модифицированного для повышения его ионообменных свойств, и копана - и углеродного волокна - бусофита или актилена [Пат. RU 2086018 С1, МПК G21F 9/12 (1995.01). Сорбирующая композиция для очистки воды хранилищ отработанного ядерного топлива / Еперин А.П., Ковалев С.М., Ампелогова Н.И. и др. Заявитель и патентообладатель Ленинградская АЭС им. В.И. Ленина. - №95112128/25; заявл. 12.07.1995; опубл. 27.07.1997. - 10 с].
Однако, иониты химически неустойчивы и недолговечны, вследствие чего они не смогут обеспечить длительное удерживание радиоактивного иода в пределах хранилищ РАО. Кроме того, сорбция анионов иода ионообменными смолами протекает обратимо.
Альтернативой ионообменным смолам являются слоистые двойные гидроксиды (СДГ) - природные и синтетические неорганические аниониты. Известен сорбент на основе СДГ со смешанным слоем, образованным структурами двух видов. Первая структура [Me1-xMe'x(OH)2]x+ - это бруситоподобный гидроксид двухвалентного металла Me (Me = Mg, Са, Fe, Со, Ni, Cu, Zn) с некоторым количеством нестехиметрических изоморфных замещений Me на трехвалентный металл Me' (Me' = Al, Fe, Cr, Ga, In). Вторая структура [Al2Lix(OH)6]x+ представляет собой гиббсит Al(ОН)3, в кристаллическую решетку которого включены катионы Li+. Такой слой имеет отрицательный заряд, который компенсируется анионным обменным комплексом межслоевого пространства [(An-)x/n⋅mH2O]x- [Пат. US 2010191033 A1. Adsorbent for radioelement-containing waste and method for fixing radioelement / Yamada H., Tamura K., Tanaka J. et al. Заявитель National institute for materials science. - № US 20100708735 20100219; опубл. 29. 07.2010. - 11 с].
Известен сорбент на основе СДГ, состав которого выражается формулой [Ni0,8Al0,2(OH)2] [(An-)0,2/n⋅mH2O]. Слой представляет собой гидроксид никеля Ni(ОН)2 с некоторым количеством нестехиометрических замещений Ni2+ на Al3+, положительный заряд слоя компенсируется анионами An-, находящимися в межслоевом пространстве. Данный материал показал высокое сорбционное сродство к иодид-анионам, в противовес СДГ на основе Mg и Al, которые лучше сорбируют легкие галогенид-ионы [Пат. JP 2015020101 (A). Iodine collecting material having radiation shielding capability / Akira S. Заявитель: Shimane University. - № JP 20130149118 20130718; опубл. 2.02.2015-8 с].
Недостатками сорбентов для иода на основе СДГ является обратимый характер сорбции иодид-анионов и трудность получения СДГ. Необратимую фиксацию радиоиода могут обеспечить материалы, сорбирующие анионы иода за счет образования нерастворимых соединений.
Известны сорбенты на пористой основе (пористое силикатное стекло или силикагель), к поверхности которой привиты катионы тяжелых металлов. Сорбент получают в две стадии. Сначала на материал основы, который содержит большое количество поверхностных силаноловых групп ≡Si-OH, воздействуют раствором соли щелочного металла или металла Ib-подгруппы в степени окисления +1 (например, Cu+) в аммиачной среде с рН = 11-13, что приводит к обмену протонов силаноловых групп на катионы Ме+ и NH4+. Затем материал обрабатывают солью тяжелого металла при рН=5-7,5, в процессе чего катионы Ме+ и аммония замещаются катионами тяжелого металла. При этом наиболее эффективен сорбент, содержащий ртуть в форме Hg2+, так же достаточно эффективны сорбенты, содержащие ртуть в форме Hg22+ или таллий Tl3+. Эти катионы могут быть закомплексованы аммиаком. Сорбция радиоиода в форме I- происходит за счет связывания иодид-анионов с катионами тяжелого металла, например ≡Si-O-Hg++I- [Пат. US 4659477 (А). Fixation of anionic materials with a complexing agent / Macedo, P.B., Barkatt, A. Заявители: Macedo P.B., Litovitz T.A. - №US 19830517472 19830728; опубл. 28.07.1983 - 13 с].
Недостатком данных сорбентов является необходимость использования таких высокотоксичных металлов, как ртуть и таллий: авторами показано, что замена Hg на серебро Ag+ приводит к существенному снижению эффективности сорбции радиоиода. Кроме того, авторы отмечают, что при предложенном ими способе получения сорбента значительное количество тяжелого металла (в частности ртути или таллия) не фиксируется на поверхности материала основы, а остается в свободном виде в поровом пространстве, что повышает экологическую опасность данного сорбента.
Известно, что в качестве сорбента для радиоактивного иода в форме иодид-анионов может быть использован хлорид серебра AgCl. Сорбция иода протекает за счет взаимодействия иодид-ионов и хлорида серебра с образованием имеющего меньшую растворимость иодида серебра [Mostafa М., Ramadan Н. Е., El-Amir М. A. Sorption and desorption studies of radioiodine onto silver chloride via batch equilibration with its aqueous media //Journal of environmental radioactivity. - 2015. - T. 150. - C. 9 - 19.].
Недостатком хлорида серебра в чистом виде как сорбента является низкая площадь его удельной поверхности, из-за чего сорбция иодид-ионов протекает медленно, а хлорид серебра используется недостаточно эффективно.
Известен сорбент на основе высокопористых наночастиц трититаната натрия с нанесенным на поверхность оксидом серебра Ag2O. Для получения сорбента наночастицы трититаната натрия пропитывают раствором нитрата серебра, в процессе чего катионы Ag+ связываются с поверхностью, содержащей большое количество гидроксильных групп, с образованием «гидратов серебра» Ag(OH)n⋅(H2O)m. Затем материал высушивают при 353K, адсорбированное на поверхности серебро дегидратируется и образуется оксид серебра [Во A. Sarina S., Zheng Z. et al. Removal of radioactive iodine from water using Ag20 grafted titanate nanolamina as efficient adsorbent // Journal of hazardous materials. - 2013. - T. 246. - C. 199 - 205].
Однако, применение наночастиц в составе ИББ нецелесообразно ввиду возможности их уноса потоками подземных вод.
Наиболее близким по технической сущности аналогом является бентонит, содержащий в межслоевом пространстве катионы серебра Ag+, концентрация которых составляет 6⋅10-4 моль/г глины, что соответствует 6,5 масс.% серебра в бентоните и 75% емкости катионного обмена. Сорбент получают, выдерживая навеску природного бентонита, межслоевое пространство которого насыщено катионами Са2+, в 1,08М растворе нитрата серебра AgNO3 в течение 5 часов, после чего жидкую фазу отделяют фильтрованием, бентонит промывают дистиллированной водой и сушат в эксикаторе над силикагелем в течение 6 суток. Данный серебросодержащий бентонит обладает высокими сорбционными свойствами по отношению к анионам I- и Cl-, сорбция которых происходит за счет образования нерастворимых в воде Agl и AgCl соответственно: равновесная степень сорбции составляет 99% и более, сорбционное равновесие достигается в течение пяти минут [Buzetzky D., Nagy N. М., Konya J. Use of silver-bentonite in sorption of chloride and iodide ions // Journal of Radioanalytical and Nuclear Chemistry. - 2020. - Vol.326. - №. 3. - C. 1795 - 1804].
Недостатком такого сорбента является потенциальная подвижность межслоевых катионов серебра: при воздействии жидких сред с достаточно большой ионной силой может произойти вымывание катионов Ag+, что приведет к снижению сорбционных свойств модифицированного бентонита вплоть до полной потери способности улавливать анионы иода и хлора.
Задачей изобретения является повышение устойчивости серебросодержащего сорбента.
Поставленная задача решается серебросодержащим сорбентом для анионных форм радиоактивного иода на основе бентонитовой глины, при этом в качестве серебросодержащего сорбента используют хлорид серебра и бентонитовую глину при следующих соотношениях компонентов, масс.%:
Сорбент получают в две стадии. В ходе первой стадии на поверхность бентонита наносят металлическое серебро из маточного раствора, содержащего аммиачный комплекс [Ag(NH3)2]OH и гексаметилентетрамин (ГМТА, C6H12N4): при комнатной температуре ГМТА не взаимодействует с аммиачным комплексом серебра, что дает возможность серебру проникнуть внутрь частиц бентонита за счет его набухания в растворе. При повышении температуры происходит термический гидролиз ГМТА с выделением формальдегида СНОН, восстанавливающего серебро до металла. Применение данного способа позволяет добиться более полного, равномерного и глубокого распределения серебра в бентоните.
На второй стадии нанесенное на бентонит серебро переводят в форму хлорида AgCl воздействием раствора хлорида железа (III) FeCl3.
Преимуществами предлагаемого сорбента являются высокая сорбционная способность по отношению к анионам радиоиода и устойчивость в агрессивных средах, вследствие чего сохраняются эксплуатационные свойства сорбента в различных условиях.
Примеры осуществления изобретения
Пример 1
Готовят маточный раствор объемом 5,6 мл. 0,5511 г нитрата серебра AgNO3 растворяют в небольшом количестве воды, вносят 0,3633 г гидроксида калия KОН, выпавший осадок растворяют, добавляя по каплям 25% водный раствор аммиака NH3, затем добавляют 1,14 г гексаметилентетрамина C6H12N4. Полученным раствором пропитывают навеску 5 г бентонита месторождения Зырянское в закрытой посуде в течение 24 часов при комнатной температуре, после чего бентонит в открытой посуде помещают в сушильный шкаф, разогретый до 90°С, где протекает реакция восстановления серебра. В систему при необходимости добавляют дистиллированную воду для предотвращения ее пересыхания. О протекании реакции судят по качественной реакции пробы жидкой фазы на ионы серебра (выпадение белого осадка AgCl при добавлении к пробе капли разбавленной соляной кислоты). По завершении реакции бентонит отделяют от остатков жидкой фазы и выдерживают в 24 мл раствора хлорида железа (III) FeCl3 с концентрацией 45 мг/мл в течение суток. Затем взвесь бентонита центрифугируют, декантируют жидкую фазу, бентонит сушат при 105°С до постоянной массы и измельчают. В результате получают сорбент, содержащий 91,5 масс.% бентонитовой глины и 8,5 масс.% хлорида серебра.
Полученный материал был исследован методом рентгенофазового анализа (РФА) с помощью дифрактометра D2 Phaser (Bruker, Германия). Идентификацию серебросодержащих кристаллических фаз проводили с помощью базы данных эталонов PDF-2. Рентгеновская дифрактограмма приведена на фиг. 1. На оси абсцисс показан дифракционный угол рентгеновского луча при прохождении через образец исследуемого вещества. На оси ординат показана относительная интенсивность регистрируемого рентгеновского излучения при различных дифракционных углах.
На приведенной дифрактограмме видны отчетливые рефлексы при углах отклонения рентгеновского луча 27,90°; 32,33° и 46,30°, соответствующие межплоскостным расстояниям элементарной ячейки кристаллической решетки 3,195; 2,767 и 1,959 ангстрем и менее интенсивные рефлексы при 54,87°; 57,51° и 76,76°, соответствующие межплоскостным расстояниям элементарной ячейки кристаллической решетки 1,672; 1,601 и 1,241 ангстрем. Указанные межплоскостные расстояния характерны для элементарной ячейки кристаллической решетки хлорида серебра AgCl. Малоинтенсивные рефлексы при 38,22° и 60,03°, соответствующие межплоскостным расстояниям элементарной ячейки кристаллической решетки 2,353 и 1,540 ангстрем, могут соответственно указывать на присутствие незначительных количеств металлического серебра, наличие которого может быть объяснено труднодоступностью нанесенного серебра для окисления вследствие значительной глубины проникновения в породу при нанесении или же протеканием на свету реакции восстановления серебра. Рефлексы, соответствующие иным химическим формам серебра, не обнаружены. Таким образом, приведенная на фиг. 1 дифрактограмма подтверждает образование хлорида серебра на бентоните при получении сорбента.
Пример 2
Готовят маточный раствор объемом 5,6 мл. 0,3937 г нитрата серебра AgNO3 растворяют в небольшом количестве воды, вносят 0,2595 г гидроксида калия КОН, выпавший осадок растворяют, добавляя по каплям 25% водный раствор аммиака NH3, затем добавляют 0,81 г гексаметилентетрамина C6H12N4. Полученным раствором пропитывают навеску 5 г бентонита месторождения Зырянское в закрытой посуде в течение 24 часов при комнатной температуре, после чего бентонит в открытой посуде помещают в сушильный шкаф, разогретый до 90°С, где протекает реакция восстановления серебра. В систему при необходимости добавляют дистиллированную воду для предотвращения ее пересыхания. О протекании реакции судят по качественной реакции пробы жидкой фазы на ионы серебра (выпадение белого осадка AgCl при добавлении к пробе капли разбавленной соляной кислоты). По завершении реакции бентонит отделяют от остатков жидкой фазы и выдерживают в 42 мл раствора хлорида железа (III) FeCb с концентрацией 18 мг/мл в течение суток. Затем взвесь бентонита центрифугируют, декантируют жидкую фазу, бентонит сушат при 105°С до постоянной массы и измельчают. В результате получают сорбент, содержащий 93,8 масс.% бентонитовой глины и 6,2 масс.% хлорида серебра.
Пример 3
Готовят маточный раствор объемом 5,6 мл. 0,2362 г нитрата серебра AgNO3 растворяют в небольшом количестве воды, вносят 0,1557 г гидроксида калия KOH, выпавший осадок растворяют, добавляя по каплям 25% водный раствор аммиака NH3, затем добавляют 0,49 г гексаметилентетрамина C6H12N4. Полученным раствором пропитывают навеску 5 г бентонита месторождения Зырянское в закрытой посуде в течение 24 часов при комнатной температуре, после чего бентонит в открытой посуде помещают в сушильный шкаф, разогретый до 90°С, где протекает реакция восстановления серебра. В систему при необходимости добавляют дистиллированную воду для предотвращения ее пересыхания. О протекании реакции судят по качественной реакции пробы жидкой фазы на ионы серебра (выпадение белого осадка AgCl при добавлении к пробе капли разбавленной соляной кислоты). По завершении реакции бентонит отделяют от остатков жидкой фазы и выдерживают в 25 мл раствора хлорида железа (III) FeCb с концентрацией 18 мг/мл в течение суток. Затем взвесь бентонита центрифугируют, декантируют жидкую фазу, бентонит сушат при 105°С до постоянной массы и измельчают. В результате получают сорбент, содержащий 96,2 масс.% бентонитовой глины и 3,8 масс.% хлорида серебра.
Пример 4
Готовят маточный раствор объемом 5,6 мл. 0,0787 г нитрата серебра AgNO3 растворяют в небольшом количестве воды, вносят 0,0519 г гидроксида калия KОН, выпавший осадок растворяют, добавляя по каплям 25% водный раствор аммиака NH3, затем добавляют 0,16 г гексаметилентетрамина C6H12N4. Полученным раствором пропитывают навеску 5 г бентонита месторождения Зырянское в закрытой посуде в течение 24 часов при комнатной температуре, после чего бентонит в открытой посуде помещают в сушильный шкаф, разогретый до 90°С, где протекает реакция восстановления серебра. В систему при необходимости добавляют дистиллированную воду для предотвращения ее пересыхания. О протекании реакции судят по качественной реакции пробы жидкой фазы на ионы серебра (выпадение белого осадка AgCl при добавлении к пробе капли разбавленной соляной кислоты). По завершении реакции бентонит отделяют от остатков жидкой фазы и выдерживают в 9 мл раствора хлорида железа (III) FeCl3 с концентрацией 18 мг/мл в течение суток. Затем взвесь бентонита центрифугируют, декантируют жидкую фазу, бентонит сушат при 105°С до постоянной массы и измельчают. В результате получают сорбент, содержащий 98,7 масс.% бентонитовой глины и 1,3 масс.% хлорида серебра.
Пример 5
Готовят маточный раствор объемом 5,6 мл. 0,0394 г нитрата серебра AgNO3 растворяют в небольшом количестве воды, вносят 0,0259 г гидроксида калия KОН, выпавший осадок растворяют, добавляя по каплям 25% водный раствор аммиака NH3, затем добавляют 0,08 г гексаметилентетрамина C6H12N4. Полученным раствором пропитывают навеску 5 г бентонита месторождения Зырянское в закрытой посуде в течение 24 часов при комнатной температуре, после чего бентонит в открытой посуде помещают в сушильный шкаф, разогретый до 90°С, где протекает реакция восстановления серебра. В систему при необходимости добавляют дистиллированную воду для предотвращения ее пересыхания. О протекании реакции судят по качественной реакции пробы жидкой фазы на ионы серебра (выпадение белого осадка AgCl при добавлении к пробе капли разбавленной соляной кислоты). По завершении реакции бентонит отделяют от остатков жидкой фазы и выдерживают в 9 мл раствора хлорида железа (III) FeCb с концентрацией 18 мг/мл в течение суток. Затем взвесь бентонита центрифугируют, декантируют жидкую фазу, бентонит сушат при 105°С до постоянной массы и измельчают. В результате получают сорбент, содержащий 99,3 масс.% бентонитовой глины и 0,7 масс.% хлорида серебра.
Экспериментальную проверку сорбционной способности полученного материала проводили, исследуя сорбцию микроколичеств 131I в форме иодид-аниона из дистиллированной воды в статических условиях:
Готовили суспензию испытуемого сорбента в дистиллированной воде, содержащей радиоактивный иод, и оставляли на вибрационном стенде.
Через 1 час, 1 сутки и 30 суток взвесь центрифугировали в течение 10 минут при 8000 об/мин и отбирали пробу 2 мл жидкой фазы для измерения скорости счета 131I на гамма-спектрометре «Мультирад-Гамма». Определяли степень сорбции иода Е, % по формуле:

где:
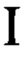 - скорость счета отобранной пробы 131I, имп/с;
- скорость счета отобранной пробы 131I, имп/с;
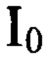 - скорость счета пробы, 131I, отобранной в начальный момент времени, имп/с.
- скорость счета пробы, 131I, отобранной в начальный момент времени, имп/с.
Для того чтобы исключить влияние радиоактивного распада 131I на результаты расчета, обе пробы измерялись в один и тот же день.
Результаты сорбционных экспериментов приведены в таблице 1.
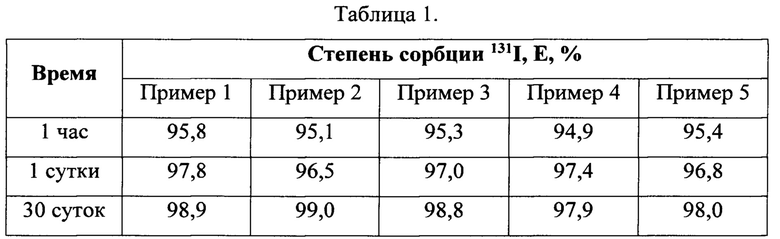
Полученные данные свидетельствуют о высокой сорбционной способности разработанного материала: 95 - 96% радиоиода сорбируется в течение часа, в течение 30 дней степень сорбции медленно увеличивается до 98 - 99%, что свидетельствует об отсутствии десорбции иода в дистиллированной воде.
Для экспериментальной проверки устойчивости разработанных сорбентов, исследовали воздействие на них различных сред, соответствующих возможным условиям эксплуатации:
- дистиллированная вода Н2О,
- раствор, состав которого соответствует составу подземных вод Нижнеканского кристаллического массива (далее - модельный раствор НКМ): 1,40⋅10-3 моль/л Na+, 1,15⋅10-4 моль/л K+, 1,62⋅10-4 моль/л Mg2+, 5,99⋅10-4 моль/л Са2+, 7,14⋅10-4 моль/л Cl-, 7,14⋅10-4 моль/л SO42-, 1,40⋅10-3 моль/л НСО3-,
- 1М раствор нитрата калия KNO3,
- 1М раствор сульфата калия K2SO4,
- 1М раствор хлорида натрия NaCl
- 1М азотная кислота HNO3
- 2М азотная кислота HNO3
- 3М азотная кислота HNO3
Навеску сорбента выдерживали в исследуемой среде при комнатной температуре, фазовом соотношении Т:Ж = 1:10 (0,5 г сорбента на 5 мл жидкой фазы) на вибрационном стенде в течение 1 суток, после чего взвесь центрифугировали и определяли массу катионов серебра в жидкой фазе титрованием по методу Фольгарда раствором тиоцианата аммония NH4SCN в присутствии ионов Fe3+ в качестве индикатора, после чего рассчитывали долю растворенного серебра от содержащегося на бентоните. Исходя из концентрации раствора титранта и объема одной порции титранта были рассчитаны пределы обнаружения доли растворенного серебра, составляющие 0,26% для Примера 1, 0,36% для Примера 2, 0,60% для Примера 3, 1,80% для Примера 4 и 3,60% для Примера 5.
Появление окрашивания индикатора уже после добавления первой порции титранта свидетельствовало об отсутствии ионов серебра в жидкой фазе в пределах обнаружения и устойчивости сорбентов к воздействию исследованных сред.
Результаты получены при использовании оборудования ЦКП им. Д.И. Менделеева.
| название | год | авторы | номер документа |
|---|---|---|---|
| КОМПОЗИЦИОННЫЙ МАТЕРИАЛ ДЛЯ СОРБЦИОННОЙ ОЧИСТКИ ВОЗДУХА ОТ ЛЕТУЧИХ ФОРМ РАДИОАКТИВНОГО ИОДА | 2019 |
|
RU2717818C1 |
| СПОСОБ ПОЛУЧЕНИЯ СОРБЕНТА НА ОСНОВЕ ПРИРОДНОГО БЕНТОНИТА | 2019 |
|
RU2714077C1 |
| СПОСОБ ПОВЫШЕНИЯ АДСОРБИРУЮЩИХ СВОЙСТВ БЕНТОНИТА | 2013 |
|
RU2540351C1 |
| НАНОСТРУКТУРНАЯ КОМПОЗИЦИЯ БИОЦИДА | 2009 |
|
RU2407289C1 |
| КОМПОЗИЦИЯ ДЛЯ ДОЛГОВРЕМЕННОГО ХРАНЕНИЯ ИОДА-129 | 2007 |
|
RU2341836C2 |
| АНТИСЕПТИЧЕСКАЯ МАЗЬ НАРУЖНОГО ПРИМЕНЕНИЯ (2 ВАРИАНТА) | 2009 |
|
RU2429820C2 |
| СОСТАВ ДЛЯ ПОЛУЧЕНИЯ КОМПЛЕКСНОГО ГРАНУЛИРОВАННОГО НАНОСОРБЕНТА | 2012 |
|
RU2501602C2 |
| НАПОЛНИТЕЛЬ УСТРОЙСТВА ОБЕЗЗАРАЖИВАНИЯ ВОДЫ ДЛЯ ПИТЬЯ | 1992 |
|
RU2043310C1 |
| СОРБИРУЮЩАЯ КОМПОЗИЦИЯ ДЛЯ ОЧИСТКИ ВОДЫ ХРАНИЛИЩ ОТРАБОТАННОГО ЯДЕРНОГО ТОПЛИВА | 1995 |
|
RU2086018C1 |
| БЕНТОНИТОВЫЙ СТРУКТУРООБРАЗОВАТЕЛЬ ДЛЯ СТРОИТЕЛЬСТВА, ЗАТРУБНОГО ИНЪЕКТИРОВАНИЯ И ЩИТОВОЙ ПРОХОДКИ ТУННЕЛЕЙ | 2023 |
|
RU2810661C1 |
Изобретение относится к области радиоэкологии, в частности к сорбентам для улавливания анионных форм радиоактивного иода, и может быть использовано в качестве компонента инженерных барьеров безопасности хранилищ радиоактивных отходов. Представлен серебросодержащий сорбент для анионных форм радиоактивного иода на основе бентонитовой глины, характеризующийся тем, что в качестве серебросодержащего сорбента используют хлорид серебра и бентонитовую глину при следующих соотношениях компонентов, масс.%: хлорид серебра 0,7-8,5; бентонитовая глина 91,5-99,3. Изобретение обеспечивает повышение устойчивости серебросодержащего сорбента. 1 ил., 1 табл., 5 пр.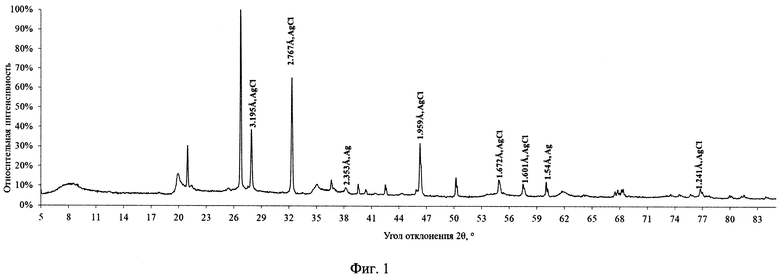
Серебросодержащий сорбент для анионных форм радиоактивного иода на основе бентонитовой глины, отличающийся тем, что в качестве серебросодержащего сорбента используют хлорид серебра и бентонитовую глину при следующих соотношениях компонентов, масс.%:
| BUZETZKY D | |||
| et al | |||
| Use of silver-bentonite in sorption of chloride and iodide ions | |||
| Journal of Radioanalytical and Nuclear Chemistry, 2020, Vol.326, P | |||
| Механизм для изменения угла атаки крыльев самолета | 1925 |
|
SU1795A1 |
| MOSTAFA M | |||
| et al | |||
| Sorption and desorption studies of radioiodine onto silver chloride via batch equilibration with its aqueous media | |||
| Journal of Environmental Radioactivity, 2015, | |||
Авторы
Даты
2023-08-21—Публикация
2022-07-15—Подача