Изобретение относится к медицине, клинической и лабораторной практике в области гематологии, а именно к способу оценки минимальной остаточной болезни (МОБ) методом многоцветной проточной цитофлуориметрии у больных острым миелоидным лейкозом (ОМЛ) в постиндукционной фазе лечения в клинически-значимых точках после первого (с 35 по 42 дни терапии) и после второго курса (с 70 по 84 дни индукционной химиотерапии) для определения возможности рецидива заболевания.
Острые лейкозы - это опухолевые заболевания кроветворной ткани, связанные с клональной пролиферацией клеток-предшественниц в костном мозге (КМ). В зависимости от того, в какой клетке произошли генетические нарушения, приводящие к неконтролируемой пролиферации опухолевого клона, острые лейкозы разделяют на лимфобластные (ОЛЛ), то есть представленные клетками предшественницами лимфоцитов, и миелоидными (ОМЛ), при которых опухолевая масса представлена клетками миелоидного ряда.
Внедрение в практику новых подходов к терапии острых лейкозов привело к тому, что полную ремиссию (ПР) на ранних этапах лечения могут достичь большинство больных. Но несмотря на достижение ПР, на разных сроках после окончания лечения у 30-40% больных развивается рецидив, который может быть связан с персистенцией МОБ [2]. МОБ называют популяцию опухолевых клеток, которая может быть обнаружена чувствительными методами, такими как полимеразная цепная реакция (ПЦР), многоцветная проточная цитометрия (МПЦ) и секвенирование нового поколения у пациентов в состоянии ПР. Величина МОБ может быть дана в относительном выражении или в процентном. Например, МОБ равная 10-3 (или 0,1%) означает, что на тысячу нормальных клеток приходится одна опухолевая клетка. Персистенция МОБ обусловливает развитие рецидивов при остром лейкозе. Изменение размера минимальной популяции лейкемических клеток после химиотерапевтического воздействия характеризует химиочувствительность опухоли: быстрый и глубокий клиренс опухолевой массы ассоциирован с более благоприятным прогнозом заболевания. Выявление МОБ (МОБ-положительный статус) в период ПР является независимым прогностическим фактором, который используют для окончательной стратификации больных на группы риска и принятия решения о модификации терапии [11].
Исследование МОБ интегрировано в различные протоколы терапии и проводится в контрольные точки, отличающиеся в разных протоколах. Протокол лечения больных ОМЛ «ОМЛ-17» предусматривал в качестве 1-го индукционного курса классическую программу «7+3» (даунорубицин 60 мг/м2 1 раз в день 1-3-й дни и цитарабин 200 мг/м2 в день в виде непрерывной инфузии 1-7-й дни). В качестве 2-го индукционного курса использовалась программа «FLARIDA», составленная на основе программы FLA-G-Ida (цитарабин в средних дозах (1,5 г/м2) через 2 ч после введения флударабина (25 мг/м2 в 1-5-й дни) и идарубицин (8 мг/м2, 1, 3-й дни). Этот курс повторяли и в качестве консолидации. В модифицированном протоколе «мОМЛ-17» в качестве 2-х индукционных курсов применяли 2 курса «7+3», а в качестве консолидации - 2 курса FLA-G. Различий в эффективности индукционной терапии по программе «ОМЛ-17» и «мОМЛ-17» нет. Больным в ПР из группы благоприятного и промежуточного прогнозов после завершения курсов индукции/консолидации проводили поддерживающую терапию: в зависимости от рандомизации 6 курсов «5+5» или постоянная 2-летняя поддерживающая терапия 6-меркаптопурином и метотрексатом. Всем больным из групп промежуточного и неблагоприятного прогнозов в период 1-ой ПР предусматривали выполнение аллогенной трансплантации гемопоэтических стволовых клеток (алло-ТГСК) как запланированного этапа программной терапии [2].
Перед исследователями стояла задача определить, дает ли исследование МОБ после 1-го индукционного курса и после 2-го индукционного курса химиотерапии прогностически значимую информацию, и определить какая из двух точек оптимальна и целесообразна для измерения МОБ у взрослых больных (до 60-ти лет) ОМЛ.
Каждый протокол терапии острых лейкозов предусматривает свое пороговое значение МОБ в зависимости от контрольной точки исследования и применяемого метода (МПЦ или ПЦР). Эти пороговые значения позволяют провести стратификацию больных на группы риска развития рецидива. Обнаружение МОБ интегрировано в различные протоколы терапии при этом исследователи предлагают использовать пороговые значения МОБ, установленные в различные контрольные точки. Однако недопустимо пороговые значения МОБ, полученные на одном протоколе, переносить на другой, так как при разных режимах химиотерапевтического воздействия будет наблюдаться разная скорость клиренса опухолевой массы. Следовательно, количество аберрантных клеток, принимаемых за порог для стратификации пациентов, может отличаться особенно на ранних этапах терапии. При разработке нового протокола или режима химиотерапии (ХТ) необходимо проводить проспективные исследования и определять пороговые значения и контрольные точки, а не заимствовать их из других протоколов.
Необходимо отметить, что лечение больных острыми миелоидными лейкозами в большинстве регионов Российской Федерации проводят в соответствии с российскими протоколами «ОМЛ-10» и «ОМЛ-17», в которых предусмотрено определение МОБ в контрольные точки: после первой/второй индукции для всех больных, после второй консолидации, перед поддерживающей терапией, после завершения программы лечения для больных из группы промежуточного риска, перед алло-ТГСК. Однако не все из этих временных точек дают прогностически значимую информацию, а оптимальные точки для целесообразного и информативного определения МОБ не были зафиксированы для отечественных протоколов, так же, как и значимый порог МОБ, то есть тот уровень МОБ, который бы позволял разбить пациентов на две значимо отличающиеся друг от друга группы.
Из уровня техники известны следующие аналоги:
В рекомендациях European LeukemiaNet (ELN) 2017 года рекомендуемыми методами для определения МОБ признаны ПЦР и МПЦ, а контрольными точками для мониторинга МОБ выбраны точки после индукции и после консолидации для установления ремиссии и кинетики ответа на лечение и после консолидации для выявления возможного морфологического рецидива. Однако конкретные сроки для мониторинга и их значение не уточняются и применить их на российские протоколы невозможно [6]. В рекомендациях ELN 2021 года указаны более точные сроки, подходящие для мониторинга МОБ методом МПЦ [9]. Если в дебюте заболевания обнаружен специфический лейкоз-ассоциированный иммунофенотип, то МОБ методом МПЦ исследуют после 2-х циклов терапии и перед окончанием терапии. Но план мониторинга МОБ, предложенный ELN в 2021 не может быть экстраполирован на все исследования и носит рекомендательный характер, поэтому необходимо выделить собственные точки для мониторинга МОБ при ОМЛ, в том числе и для использования в протоколе «ОМЛ-17».
В 2018 году ФГБУ «НМИЦ гематологии» Минздрава РФ были опубликованы данные о диагностической и клинической значимости выявления МОБ у больных ОМЛ при использовании российских протоколов «ОМЛ-10» и «ОМЛ-17». В данном исследовании определение МОБ-негативного статуса после 1-го курса индукции, но не после 2-го курса индукции достоверно ассоциировалось с лучшей общей выживаемостью (ОВ) и безрецидивной выживаемостью (БРВ). Поэтому точка после 1-го курса индукции была принята за ключевую точку мониторинга МОБ для определения долгосрочных результатов пациентов с ОМЛ [1, 3].
Существенным отличием заявляемого способа является то, что в отличие от прототипа в разработанном способе за ключевые точки для мониторинга МОБ, когда результаты будут иметь прогностическое значение, приняты точки после 1-ой индукции и после 2-ой индукции.
При проведении исследования в первую очередь ставилась задача разработка альтернативного доступного способа оценки МОБ при ОМЛ и выбор наиболее эффективных точек мониторинга МОБ для оценки рисков развития рецидива у больных ОМЛ, получающих лечение согласно протоколу «ОМЛ-17». Наше исследование показало, что значение имеет не только МОБ после 1 индукции, но и после второй и исследования МОБ только после первого курса химиотерапии недостаточно.
Предлагаемое изобретение направлено на достижение следующего технического результата: повышении эффективности оценки МОБ-статуса у больных ОМЛ, выбора порогового значения для установления МОБ-положительного статуса, выявления риска развития рецидива у пациентов с ОМЛ в зависимости от МОБ-статуса, что в дальнейшем приведет к назначению своевременного и адекватного лечения, снижению количества исследований при наблюдении пациентов и как следствие снижению финансовых затрат на такие исследования. Предлагаемый метод относительно, доступен и экономически выгоден, что может позволить применять его в рутинной практике.
Разработанный способ реализуется следующим образом:
Определение МОБ у больных ОМЛ выполняют методом МПЦ с использованием стандартизованных панелей моноклональных антител, подобранных с учетом рекомендаций международных и европейский групп исследователей [5, 11, 13].
Обнаружение опухолевых клеток проводят в 2-х (двух) контрольных точках: в период с 35 по 42 день после 1 курса индукционной химиотерапии и в период с 70 по 84 день после 2 курса индукционной химиотерапии при восстановлении показателей периферической крови и достижении ПР по данным миелограммы.
Материалом для исследования служит аспират костного мозга. В ходе исследования лейкоциты КМ инкубируют с моноклональными антителами, мечеными различными флуорохромными красителями. Моноклональные антитела специфичны к так называемым кластерам дифференцировки, или CD (CD - сокращение от «clusters of differentiation») - поверхностным или внутриклеточным молекулам - антигенам (рецепторам или лигандам), которые используются для иммунофенотипирования клеток [7].
Работу проводят на проточных цитометрах, снабженных как минимум двумя лазерами - приборах для полноценного многопараметрического анализа, позволяющего комбинировать от 6 до 13 флуоресцентных меток с минимальными ограничениями в выборе сочетаний флуорохромов.
Примеры панелей моноклональных антител, используемых для мониторинга МОБ, приведены в Таблицах 1 и 2. Таблица 1 иллюстрирует применение 6-цветной панели антител, Таблица 2 - применение 11-цветной панели моноклональных антител.
PerCP-Cy5.5
или CD4 (RPA-T4)
(clone 7)
(104D2)
Примечание: FITC - флуоресцеина изотиоцианат (fluorescein isothiocyanate), PE - фикоэритрин (phycoerythrin), PerCP - перидинин-хлорофилл протеин, PerCP-Cy5.5 - перидинин-хлорофилл протеин-цианин 5.5 (peridinin chlorophyll protein complex - cyanine 5.5), PE-Cy7 - фикоэритрин-цианин 7 (phycoerythrin- cyanine 7), APC - алофикоцианин (allophycocyanine), APC-Cy7 - алофикоцианин-цианин 7 (allophycocyanine-cyanine 7), нм - нанометры
Для выделения МОБ при ОМЛ используется гейтирование, то есть отделение популяций интереса от остальных клеток с помощью специального ПО для дальнейшего анализа, при котором последовательно изучаются и исключаются уже проанализированные клетки.
На первом этапе выделяют все CD34-положительные клетки и с помощью анализа иммунофенотипа сравнивают их с теми, что обнаруживается у здоровых доноров. При реализации предлагаемого изобретения обнаружение МОБ осуществляется с использованием анализа характера кластеризации клеток и поверхностной экспрессии ряда маркеров (CD45, CD33, CD34, HLA-DR, CD123, CD38), как экспрессия соотносится с нормальными аналогами CD34-положительных клеток. Затем те же действия проводят с CD117-, и CD33-положительными популяциями (пример гейтирования представлен на Фигуре 1) [4, 8,10, 12]. Мониторинг МОБ только при анализе CD34-положительных клеток не дает достоверных и полных результатов, поэтому обязательно нужно рассматривать все субпопуляции клеток.
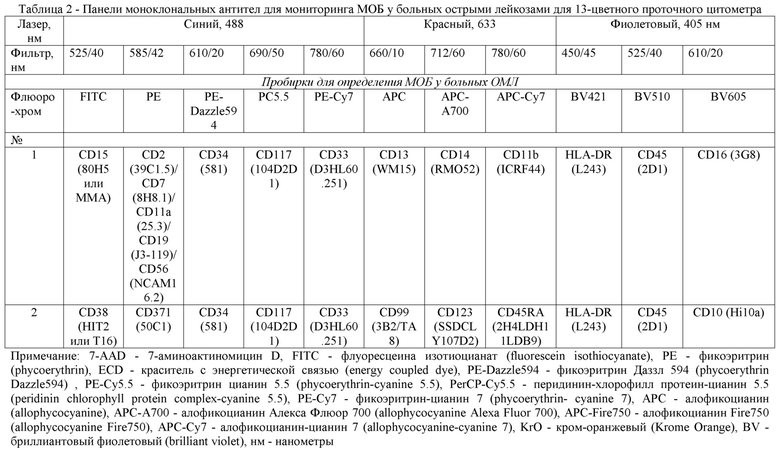
При последовательном раскладывании всех клеток образца на различные субпопуляции, присутствующие у здоровых доноров, становится возможным обнаружить популяцию клеток, имеющую отличный иммунофенотип, т.е. такой иммунофенотип и такую комбинацию антигенов на поверхности, которых у здоровых доноров не встречается. В случае выявления таких клеток производится их количественная оценка - подсчет доли (%) от всех клеток образца и делается заключение о наличии/отсутствии МОБ.
В случае если МОБ >0, то делается заключение о МОБ-положительном статусе пациента, если МОБ = 0, то делается заключение о МОБ-отрицательном статусе пациента с указанием чувствительности метода.
Существенными признаками разработанного способа определения МОБ при ОМЛ в постиндукционной фазе лечения являются:
- обнаружение МОБ осуществляется и после первого индукционного курса химиотерапии осуществляется в период с 35 по 42 день после 1-го курса индукционной химиотерапии (1-я контрольная точка) и в период с 70 по 84 день после 2-го курса индукционной химиотерапии (2-я контрольная точка);
- определение прогноза вероятности рецидива у больных ОМЛ производят на основе результатов оценки МОБ: после 1-й контрольной точки и 2-й контрольной точки;
- обнаружение опухолевых клеток после 1-го и после 2-го индукционных курсов химиотерапии методом МПЦ происходит с использованием единообразного структурированного логического гейтирования клеток;
- обнаружение опухолевых клеток осуществляется методом многоцветной проточной цитометрии.
Настоящее изобретение является альтернативным клинически и прогностически значимым способом измерения минимальной остаточной болезни у больных острым миелоидным лейкозом методом многоцветной проточной цитофлуориметрии.
Техническим результатом изобретения является его простота, точность, быстрота, а также универсальность, которые позволяют лаборатории, оснащенной проточным цитометром, определять минимальную остаточную болезнь.
Дополнительным техническим результатом является то, что данный способ доступен для проведения исследований в рутинной лабораторной практике, позволяет сравнивать результаты разных исследовательских групп и, в дальнейшем, применять его в клинических исследованиях.
Реализация заявленного изобретения направлена на дальнейшее назначение своевременного и адекватного лечения, снижения затрат и количества исследований при наблюдении пациентов.
Предлагаемое изобретение подтверждено проведенным исследованием, описание которого приводится ниже.
В исследование было включено 73 больных, проходивших лечение в ФГБУ «НМИЦ гематологии» с февраля 2017 года по январь 2021 года. Критериями включения в исследование были: впервые диагностированный ОМЛ, возраст до 60 лет, отсутствие острого промиелоцитарного лейкоза и изменений, свойственных миелодисплазии. С февраля 2017 г. по декабрь 2018 г. выполнялась терапия по протоколу «ОМЛ-17» (n=37), где 1-й индукционный курс проводился по программе «7+3», а во 2-ом курсе и в консолидации использовалась программа «FLARIDA» на основе FLA-G-Ida. С января 2019 г. применялся модифицированный протокол «mОМЛ-17» (n = 36), где 2 первых курса проводили по программе «7+3», а консолидации включала 2 курса FLA-G. Так как нет различий в эффективности индукционной терапии по программе «ОМЛ-17» и «mОМЛ-17», для анализа группы объединили в одну - «ОМЛ-17». На этапе диагностики выполняли стандартное цитогенетическое и FISH исследования, молекулярно-генетические тесты, (мутации генов FLT3, NPM-1 и CEBPα (ССААЕ/enhancer-binding protein α)) и формировали группы риска согласно классификации ELN-2017 (Таблице 3). Определение МОБ выполняли на 35-42 (после 1 фазы индукции) и 70-84 день (после 2 фазы индукции) от начала терапии при условии восстановления показателей периферической крови при достижении ПР по результатам миелограммы.
Благоприятная, n
Промежуточная, n
Неблагоприятная, n
53
5
t(8;21), n
inv(16) или t(16/16), n
мутации CEBPα, n
мутации NPM1, n
мутации NPM1 с низкой аллельной нагрузкой FLT3-ITD, n
8
7
3
18
5
Нормальный кариотип без мутаций, n
Низкая аллельная нагрузка FLT3-ITD, n
Мутации NPM1 с высокой аллельной нагрузкой FLT3-ITD, n
Трисомия 8 хромосомы, n
13
3
2
3
Транслокация с вовлечением локуса гена MLL (11q23), n
Высокая аллельная нагрузка FLT3-ITD, n
t(6;9), n
2
8
1
В группе благоприятного прогноза у 6 больных был МОБ-положительный статус после 1-го курса, 2 из этих больных после 2-го курса достигли МОБ-негативного статуса, у одного больного МОБ-негативный статус, который был установлен после 1-го курса изменился на МОБ-положительный после 2-го курса. В группе неблагоприятного прогноза у 2 больных МОБ-негативный статус после 1-го курса изменился на МОБ-положительный статус после 2-го курса терапии, а 3 больных с МОБ-положительным статусом после 1-го курса МОБ после 2-го курса не выявлялась. Оценка МОБ-статуса после 1-го курса индукции была проведена у 57 из 58 больных ОМЛ в ПР после 1-го курса, и у 38 больных (67%) подтвержден МОБ-негативный статус. После 2-го курса статус МОБ был оценен у 59 из 65 больных в ПР, при этом МОБ-негативный статус определен у 44 (75%) больных ОМЛ.
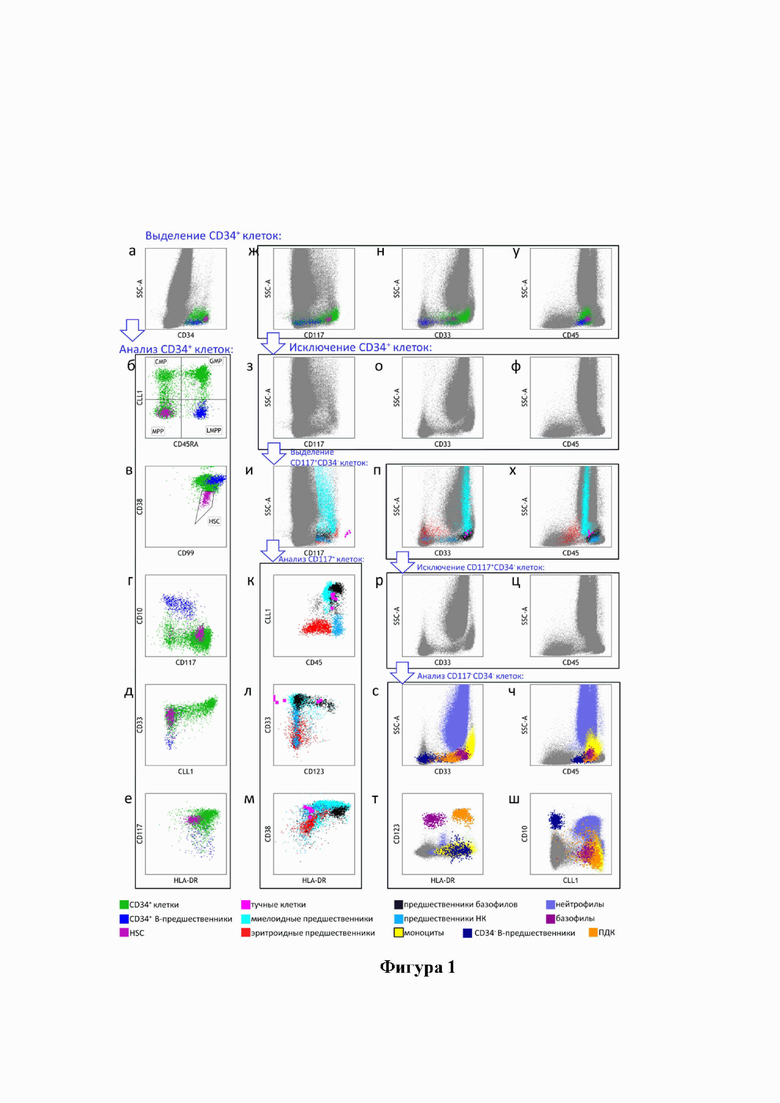
Изменение количества остаточных опухолевых клеток, определенных после 1-го и 2-го курсов индукции, показано на Фигуре 2. Значения МОБ после 1-го курса индукции было в пределах от 0,009% до 8% (медиана - 0,43%), а после 2-го курса - от 0,006% до 4% (медиана - 0,18%). Данные по эффективности терапии и полной ремиссии в зависимости от прогноза по классификации ELN-2017 описаны в таблице 4.
n (%)
Был проведен однофакторный анализ показателей ОВ, времени развития рецидива (ВРР) и БРВ больных ОМЛ в зависимости от следующих клинико-лабораторных параметров: пол, возраст, молекулярно-генетический риск по ELN-2017, активности лактатдегидрогеназы (ЛДГ), МОБ-статус после 1-го и 2-го индукционных курсов (Таблица 5). ОВ значимо зависит от пола и наличия МОБ после 1-го курса и в момент ПР. На ВРР и БРВ значимо оказывало влияние наличие МОБ или после 1-го, или 2-го курсов индукции, или в ПР). Для оценки результатов была взята точка 20 месяцев от начала терапии, так как в этой точке 50% больных, включенных в исследование, оставались под наблюдением и оценки выживаемости были достаточно надежны.
(p = 0,0007)
(p = 0,0008)
(p = 0,0001)
(p = 0,09)
(p = 0,002)
(p = 0,001)
(p < 0,0001)
(p = 0,0004)
(p < 0,0001)
В результате проведенного многофакторного анализа с пошаговым отбором единственным достоверным признаком, влияющим на ОВ и БРВ, оказался МОБ-статус в момент ПР. Анализ включал в качестве исходных следующие факторы: статус МОБ в момент ремиссии, пол, возраст старше 40 лет, наличие нейролейкемии, долю бластных клеток в дебюте заболевания (более 60%), ЛДГ больше 800 Ед/мл, лейкоцитоз более 100×109/л, риск по ELN-2017, цитогенетический риск, наличие мутации FLT3-ITD и аллельную нагрузку FLT3-ITD более 0,5. Достижение МОБ-негативности в ПР существенно (в 10-12 раз) снижает риск летального исхода и рецидивов (для ОВ - относительный риск 0,09; р = 0,001), для БРВ - 0,16; р = 0,0002).
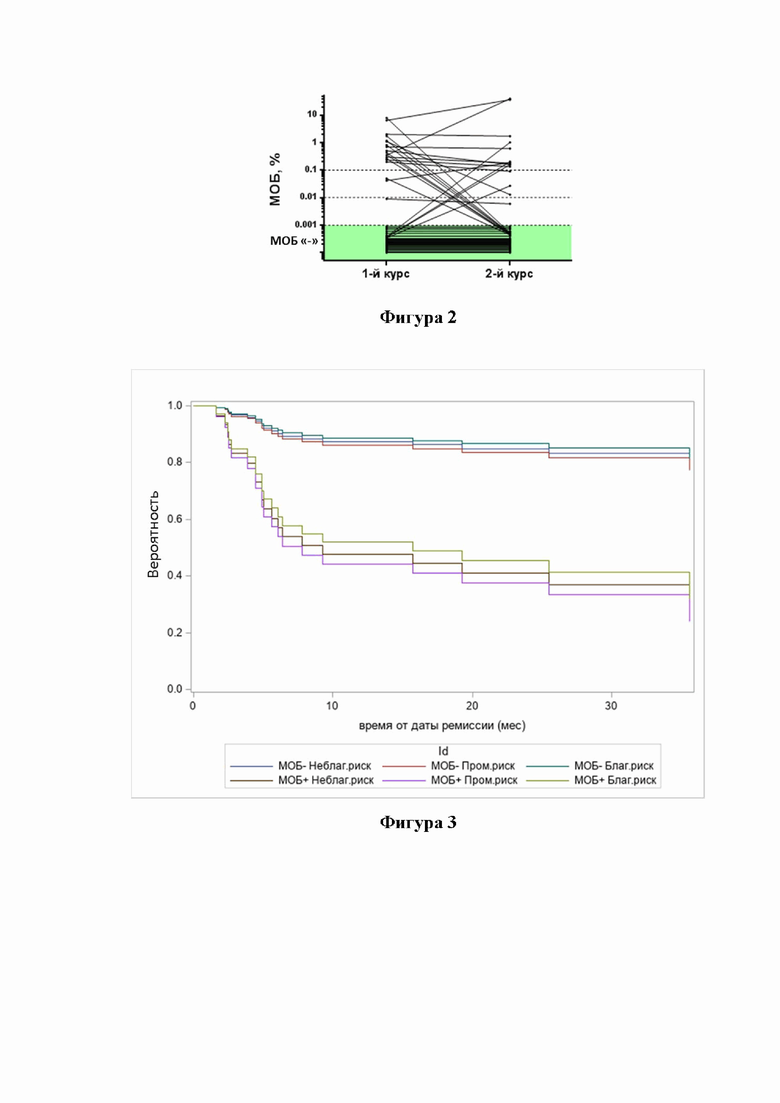
Далее было проведено исследование факторов, влияющих на отдаленный прогноз заболевания. По литературным данным известно, что наиболее информативным прогностическим фактором является группа риска ELN-2017, поэтому на основе регрессионной модели Кокса исследовано сочетанное влияние ключевых факторов на БРВ: группы риска ELN-2017, время достижения МОБ-негативности (после 1-го курса). На графике, отображающем гипотетические (модельные) оценки БРВ в зависимости от сочетаний значений этих факторов, видно, что достижение МОБ-негативности фактически нивелирует значение фактора по риску ELN-2017 на момент начала терапии (высокий риск МОБ-положительного статуса, ОР = 5,5 (ДИ 2-14,7), р=0,0007) (Фигура 3).
Таким образом, делается вывод, что обнаружение МОБ, т.е. положительный МОБ-статус, после индукционных курсов ассоциируется с худшей ОВ, БРВ, ВРР больных и увеличивает риск развития рецидивов, а МОБ-негативный статус после 1-го курса индукции нивелирует значение фактора по риску ELN-17 на момент начала терапии.
В качестве первого шага оценки прогностической значимости МОБ-статуса в 1-й и 2-й контрольной точке для предсказания рисков неблагоприятных событий после 2-й контрольной точки мы сравнили оценки ОВ и БРВ в 4 группах.
Сочетание МОБ-статусов в двух контрольных точках определяет следующие четыре группы больных ОМЛ:
1) больные, у которых подтверждался МОБ-негативный статус и после 1-го, и после 2-го курсов индукции (группа «МОБ1,2 = 0»), n = 30;
2) больные, с МОБ положительным статусом и после 1-го, и после 2-го курсов (группа «МОБ1,2 > 0»), n = 11;
3) больные, у которых МОБ выявлялась после 1-го курса, но не выявлялась после 2-го курса (группа «МОБ1 > 0»), n = 8;
4) больные, у которых МОБ выявлялась после 2-го курса, но не выявлялась после 1-го курса (группа «МОБ2 > 0»), n = 4.
В этом анализе проверялась основная базовая гипотеза: для событий после 2-й контрольной точки имеет ли остаточную информативность предыдущий МОБ-статус, т.е. статус в предыдущей точке, или важен только текущий статус, достигнутый ко 2-й точке.
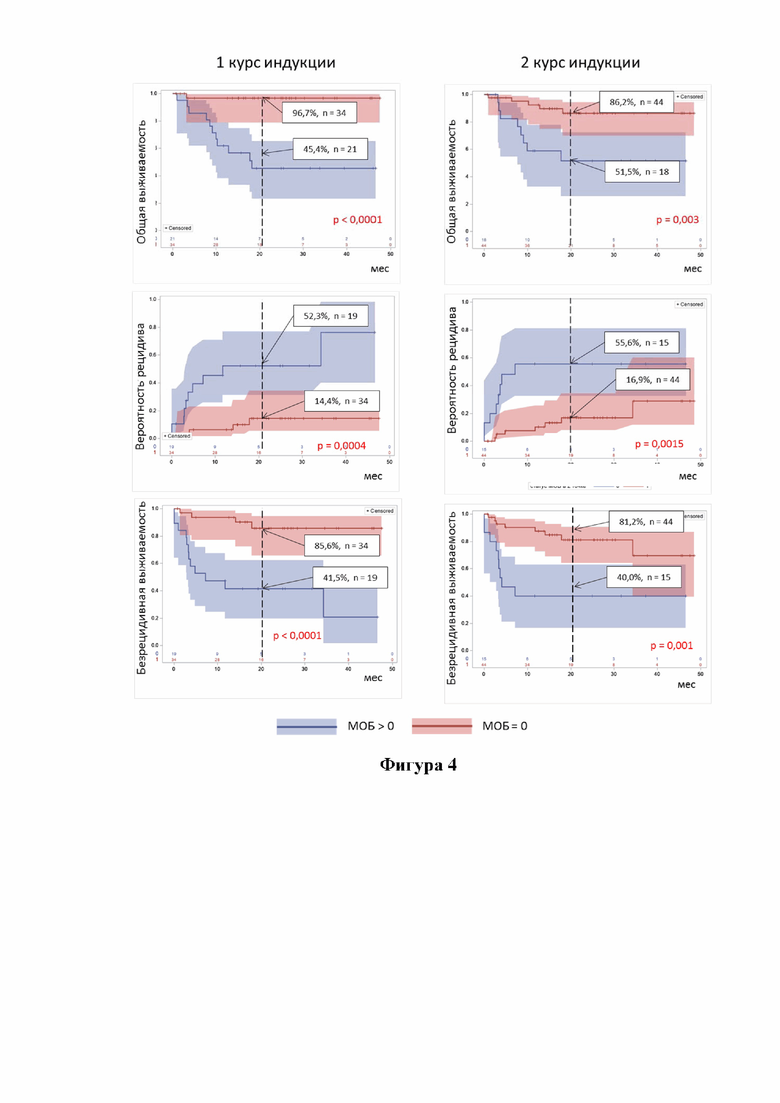
Оценки ОВ, БРВ и ВРР этих групп больных показаны на Фигуре 4, точка отсчета временных интервалов (ланд-марк) - на момент восстановления показателей периферической крови после 2-го курса. Для оценки выживаемости и рецидива взята точка 30 месяцев, так как 2/3 больных ОМЛ, включенных в исследование, оставались еще под наблюдением, а оценки выживаемости уже достоверно различались.
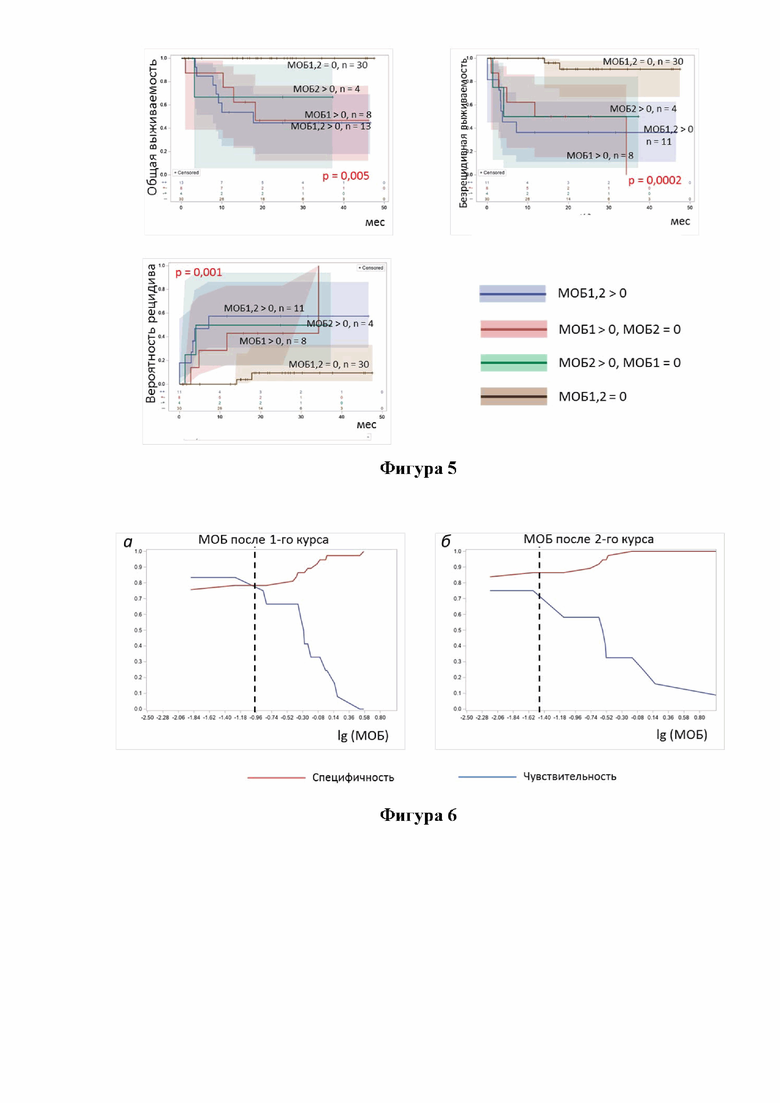
Наиболее благоприятный прогноз отмечался у больных ОМЛ, у которых МОБ не определялась ни после 1-го, ни после 2-го курсов индукции. ОВ к 30 мес. этой группы больных составила 100%, БРВ - 91%, а ВРР - 9%. При обнаружении МОБ характеристики клинического исхода были значимо хуже вне зависимости от того, когда МОБ была выявлена - после 1-го курса, после 2-го курса или после обоих курсов индукции (Фигура 5). Так, ВРР на 30 мес. после начала 2-го курса у больных из группы «МОБ1,2 > 0» составила 58%, в группе «МОБ1 > 0» ВРР составила 43%, в группе «МОБ2 > 0» - 50%. ОВ у больных группы «МОБ1,2 > 0» составила 45%, в «МОБ1 > 0» ОВ составила 47%, в «МОБ2 > 0» - 67%. Так, БРВ на 30 мес. после начала 2-го курса у больных из группы «МОБ1,2 > 0» составила 36%, из «МОБ1 > 0» БВР составила 50%, а «МОБ2 > 0» - 50%.
На основании анализа оценок, приведенных на Фигуре 5 можно прийти к выводу, что раннее достижение и сохранение МОБ-негативности значительно улучшает прогноз. Не достижение или позднее достижение МОБ-негативности не сильно отличается по прогнозу риска неблагоприятных событий.
Изучение сравнительной прогностической значимости 1-го и 2-го измерения МОБ было продолжено на двухфакторной модели Кокса. Дополнительно на ней также был изучен вопрос о возможности уточнения порога заключения о МОБ-положительности. В Таблице 6 приведены результаты двухфакторной регрессионной модели Кокса с включением измерений значений МОБ после 1-го и 2-го курсов у больных ОМЛ. Показано, что МОБ-положительный статус в первой контрольной точке увеличивает риск неблагоприятного события в 1,68 раза, а МОБ-положительный статус после 2-го курса индукции увеличивает риск неблагоприятного события в 1,63 раза.
Как видно из Таблицы 6, относительный риск, показывающий вес факторов, входящих в прогностическую модель для МОБ после 1-ой индукции и МОБ после 2-ой индукции примерно одинаков. Значит, несмотря на то, что прогнозируются вероятности неблагоприятных исходов после 2-й контрольной точки, информация о МОБ в первой точке столь же важна. Это подтверждает результаты анализа на основе Каплан-Мейера оценок выживаемости в 4 группах по статусу МОБ. С помощью оценок Каплан-Мейера и модели Кокса в нашем случае решали одну задачу двухфакторного анализа, в ходе которого проверяли и оценивали вклад в прогностическую модель измерения МОБ в 1-й и 2-й точках терапии на этапе индукции. И гипотеза, что измерение МОБ во 2-й точке нивелирует прогностическое значение измерения в 1-й точке, не подтвердилась.
Для определения пороговых значений МОБ при ОМЛ были также использованы специальные методы ROC-анализа - «ROC-survival», который является выходом из Кокс-анализа.
В нашем случае, для проведения «ROC-survival» в качестве стартовой точки для вычисления интервала времени до неблагоприятного события (рецидив или смерть) была взята дата восстановления показателей периферической крови после 2-го курса, а контрольная временная точка построения ROC-зависимостей через 18 мес. после 2-го курса. Факторы, включенные в ROC-логистическую модель - логарифмы от значений МОБ после 1-го и 2-го курсов. Результаты анализа представлены на Фигуре 6.
На Фигуре 6а до отметки 0,1% (lg(МОБ%) = -1,0), чувствительность и специфичность изменяются мало, но при увеличении порога выше 0,1% (lg(МОБ%) = -1,0) чувствительность достаточно резко начинает падать. На Фигуре 6б до отметки 0,03% (lg(МОБ%) = -1,5) чувствительность и специфичность изменяются мало, но при увеличении порога выше 0,03% чувствительность достаточно резко начинает падать. Это свидетельствует о том, что оптимальный порог МОБ находится в интервале от 0% до 0,1% или даже от 0 до 0,03% для второго измерения МОБ. После 1-го курса индукции МОБ менее 0,1% определялась лишь у трёх больных, а после 2-го курса - у 4-х. Поэтому точное определение оптимального порогового значения МОБ, которое будет клинически релевантным для уверенного заключения о МОБ-положительности, требует продолжения набора данных. Но можно достаточно уверенно утверждать, что оно не должно быть выше 0,1%.
Сущность изобретения также была проверена конкретными клиническими случаями.
Клинический случай №1. Пациент 1991 г.р. В апреле 2019 г. диагностирован острый миелоидный лейкоз. При стандартном цитогенетическом исследовании хромосомных аберраций не выявлено. При молекулярно-генетическом исследовании мутаций не обнаружено. Пациент отнесен в группу промежуточного генетического риска по ELN. При иммунофенотипическом исследовании после 1-ой индукции (на 35-й день) выявлялось 0,51% МОБ. После 2-го курса (на 70-й день) МОБ составила 0,1%. При этом по итогу окончания индукционной терапии констатирована костномозговая ремиссия. После проведения еще 4-х курсов химиотерапии пациенту было рекомендовано проведение курсов поддерживающей терапии. В дальнейшем в случае успешного подбора неродственного донора планировалось выполнить алло-ТГСК. Однако в сентябре 2019 в миелограмме был выявлен бластоз 40%, пациент вновь был госпитализирован, в отделении ФГБУ «НМИЦ гематологии» констатировали ранний рецидив ОМЛ с резистентным течением. Несмотря на проведенные мероприятия, 02.2020 была констатирована смерть пациента от рефрактерных к проводимой антибактериальной и противогрибковой терапии инфекционных осложнений на фоне прогрессии резистентного к терапии острого миелобластного лейкоза. Данный клинический случай подтверждает, что МОБ, обнаруженная после первого или второго курса индукции является фактором неблагоприятного прогноза и связана с развитием рецидива заболевания.
Клинический случай №2 Пациентка 1998 г.р. В октябре 2018 года был установлен острый миеломонобластный лейкоз. При молекулярно-генетическом исследовании обнаружена мутация FLT3/ITD. Хромосомных аномалий не выявлено. Установлен высокий риск по ELN. После первой и второй индукции по протоколу «ОМЛ-17» у пациентки сохранялась морфологическая ремиссия, однако персистировала МОБ (0,3% после 1 индукции на 38-й день и 0,18% после 2-й индукции на 78-й день). Учитывая неблагоприятный прогноз основного заболевания, молодой возраст и наличие родственного HLA-идентичного донора, в схему лечения было решено включить алло-ТГСК, которую провели в марте 2019 г. Через полгода после алло-ТГСК при обследовании по месту жительства в клиническом анализе крови обнаружены бластные клетки в количестве 46%. В миелограмме бластные клетки составляли 83,6 %, при молекулярно-генетическом исследовании примесь ДНК реципиента в пробе составляла 93% и выявлены клетки с мутацией FLT3/ITD (частота мутантного аллеля составила 33%), диагностирован ранний клинико-гематологический рецидив. Данный клинический случай подтверждает, что МОБ, обнаруженная после первого или второго курса индукции, является фактором неблагоприятного прогноза и связана с развитием рецидива заболевания.
Клинический случай №3
Пациент 1990 г.р. В июне 2018 г. установлен диагноз острый миеломонобластный лейкоз. При молекулярно-генетическом исследовании обнаружена мутация FLT3/ITD. Хромосомных аномалий не выявлено. Установлен промежуточный риск по ELN. Пациенту проведен 1-ый индукционный курс по протоколу «ОМЛ-17», после которого была констатирована клинико-гематологическая ремиссия, однако на 36-й день терапии сохранялась МОБ при исследовании методом МПЦ (0,365%). После 2-го индукционного курса (на 70-й день) протокола «ОМЛ-17» клинико-морфологическая ремиссия сохранялась, МОБ-статус был негативным. Учитывая неблагоприятный прогноз по основному заболеванию, молодой возраст и сохранный соматический статус, а также отсутствие HLA-идентичных родственных доноров было принято решение о проведении алло-ТГСК от неродственного HLA-идентичного донора. Через два месяца после трансплантации в миелограмме возросла доля бластных клеток (8,8%), при молекулярно-генетическом исследовании выявлялась мутация FLT3/ITD, а МОБ методом МПЦ составляла 11%. При молекулярно-генетическом исследовании химеризма кроветворения после неродственной трансплантации примесь собственного кроветворения составила 12%. Еще через неделю в миелограмме обнаружено 60% бластных клеток, а примесь собственного кроветворения в пробе КМ составила 54%. Таким образом, данный клинический пример подтверждает, что МОБ, обнаруженная после первого или второго курса индукции, является фактором неблагоприятного прогноза и связана с развитием раннего рецидив острого ОМЛ.
Клинический случай №4
Пациент 1984 г.р. Диагноз ОМЛ установлен в августе 2016 г. При цитогенетическом исследовании обнаружена t(8,21), а при молекулярно-генетическом исследовании - мутация FLT3/ITD и CEBPA. Таким образом, пациент отнесен в благоприятную группу риска по ELN. С августа по сентябрь проведено два курса индукции «7+3». После первого курса констатирована морфологическая и молекулярная ремиссия заболевания, МОБ-статус после первой и второй индукции - негативный. В ноябре 2016 проведен первый курс консолидации по программе «7+3» с идарубицином. В декабре 2016 проведен второй курс консолидации по программе «7+3» с митоксантроном. Учитывая неблагоприятный прогноз заболевания и отсутствие HLA-идентичного сиблинга, в схему терапии решено было включить трансплантацию гемопоэтических стволовых клеток от неродственного донора, которую провели в феврале 2017 г. На +16 день после алло-ТГСК в гемограмме отмечено восстановление показателей периферической крови.
На +25 день после алло-ТГСК по данным морфологического исследования сохраняется ремиссия заболевания. В июне 2017 года у пациента констатирована оРТПХ и начато специфическое лечение. Несмотря на развитие оРТПХ, до 2022 г. у пациента сохраняется полная клинико-морфологическая и молекулярная ремиссия ОМЛ. Таким образом, данный клинический пример подтверждает, что МОБ-негативный статус после первого или второго курсов индукции, является фактором благоприятного прогноза и указывает на низкую вероятность развития рецидива основного заболевания.
Клинический случай №5
Пациентка 1961 г.р. Дебют заболевания диагностирован в марте 2016 г. Цитогенетических аномалий у пациента не обнаружено. При молекулярно-генетическом исследовании мутаций также не было. Таким образом, пациент отнесен в промежуточную группу риска по ELN. С апреля по май 2016 г. проведен первый индукционный курс химиотерапии «7+3» с даунорубицином. После первого курса индукции (на 37-й день терапии) констатирована морфологическая и молекулярная ремиссия заболевания с МОБ-отрицательным статусом. Принимая во внимание длительную цитопению, инфекционные осложнения после курса ХТ, принято решение о проведении курса химиотерапии малыми дозами цитарабина (МДЦ). Суммарно пациентке было проведено 15 курсов поддерживающей химиотерапии в объеме "малые дозы цитарабина". Перед началом 16-го курса выполнено контрольное обследование, при котором установлено, что морфологическая ремиссия заболевания сохраняется, при этом МОБ составляла 0,44%. С февраля по июнь 2019 г. проведено еще три курса поддерживающей химиотерапии МДЦ. До августа 2022 г. сохраняется морфологическая и молекулярная ремиссия заболевания. Таким образом, данный клинический пример подтверждает, что МОБ-негативный статус после первого или второго курсов индукции, является фактором благоприятного прогноза, даже если небольшая МОБ выявлялась на поздних этапах лечения, и указывает на низкую вероятность развития рецидива основного заболевания.
Клинический случай №6
Пациент 1973 г.р. ОМЛ установлен в апреле 2017 года. Молекулярно-генетических аномалий у пациента не обнаружено. При цитогенетическом исследовании выявлена inv16. Таким образом, пациент отнесен в благоприятную группу риска по ELN 2017. В апреле-мае 2017 года проведены первый и второй индукционный курс «7+3». После первого курса индукции на 32-й день констатирована гематологическая и цитогенетическая ремиссии заболевания. МОБ-статус негативный и после первой, и после второй индукции. В июне и июле 2017 проведены первый и второй курс консолидации ремиссии «Flar-Ida». При контрольной пункции костного мозга в июле 2017 г. подтверждено, что ремиссия заболевания сохранялась. Учитывая сохраняющуюся костномозговую и цитогенетическую ремиссию заболевания, было принято решение начать поддерживающую химиотерапию (шесть курсов «5+5»). К январю 2021 года у пациента на основании проведенного обследования сохранялась полная ремиссия заболевания. Таким образом, данный клинический пример подтверждает, что МОБ-негативный статус после первого или второго курсов индукции, является фактором благоприятного прогноза и указывает на низкую вероятность развития рецидива основного заболевания.
Сущность предлагаемого изобретения пояснена на графических материалах:
Фигура 1 - Цитометрический анализ основных клеточных компонентов костного мозга донора стволовых клеток крови. Данные получены на проточном цитометре CytoFlex, 11-цветный анализ;
Фигура 2 - Индивидуальные динамики значений МОБ у 73 больных ОМЛ, включенных в протокол «ОМЛ-2017»;
Фигура 3 - Модельные оценки БРВ больных в ПР с МОБ-негативным и МОБ-положительным статусом после 1-го курса индукции из разных групп риска ELN-17;
Фигура 4 - ОВ, ВРР, БРВ у больных ОМЛ в ПР в зависимости от МОБ-статуса после 1-го и 2-го курсов индукции;
Фигура 5 - ОВ, БРВ, ВРР у больных ОМЛ в ПР в зависимости от сочетания МОБ-статусов после 1-го и 2-го курсов индукции, время - на момент восстановление показателей периферической крови после 2-го курса;
Фигура 6 - Результаты «ROC-survival» анализа. Чувствительность и специфичность 18-месячного прогноза БРВ в зависимости от порога определения МОБ-статуса, а) после 1-го курса индукции; б) после 2-го курса индукции;
Источники информации, принятые во внимание при составлении описания изобретения к заявке на выдачу патента РФ на изобретение:
1. Лобанова Т.И. Клиренс опухолевого клона у пациентов с разными молекулярно-генетическими вариантами острых миелоидных лейкозов: дисс. канд. мед. наук: 19.12.2018 / Лобанова Татьяна Игоревна. - М., 2018. - 166с.
2. Паровичникова Е.Н. Разработка программной терапии больных острыми миелоидными лейкозами в возрасте моложе 60 лет, основанной на принципах дифференцированного воздействия / Е. Н. Паровичникова, И. А. Лукьянова, В. В. Троицкая, М. Ю. Дроков, Л. А. Кузьмина, А. Н. Соколов, А. В. Кохно, З. Т. Фидарова, И. В. Гальцева, Ю. О. Давыдова, А. И. Кашлакова, Е. О. Грибанова, Е. Е. Звонков, Е. П. Сысоева, В. Н. Двирнык, Т. Н. Обухова, А. Б. Судариков, Ю. В. Сидорова, С. М. Куликов, Ю. А. Чабаева, В. Г. Савченко // Терапевтический архив - 2021. - Т. 93 - № 7- 753-762с.
3. Паровичникова Е.Н. Результаты программной терапии острых миелоидных лейкозов в ФГБУ «НМИЦ гематологии» Минздрава России / Е. Н. Паровичникова, И. А. Лукьянова, В. В. Троицкая, М. Ю. Дроков, Т. И. Лобанова, Л. А. Кузьмина, А. Н. Соколов, А. В. Кохно, З. Т. Фидарова, Г. А. Басхаева, О. А. Гаврилина, В. А. Васильева, Т. Н. Обухова, С. А. Кузнецова, А. Б. Судариков, В. Н. Двирнык, И. В. Гальцева, Ю. О. Давыдова, С. М. Куликов, В. Г. Савченко // Терапевтический архив - 2018. - Т. 90 - № 7- 14-22с.
4. Bill M. Mapping the CLEC 12A expression on myeloid progenitors in normal bone marrow; implications for understanding CLEC 12A-related cancer stem cell biology / M. Bill, P. B. van Kooten Niekerk, P. S. Woll, L. Laine Herborg, A. Stidsholt Roug, P. Hokland, L. Nederby // J. Cell. Mol. Med. - 2018. - Т. 22 - № 4- 2311-2318с.
5. Borowitz M.J. Minimal residual disease detection in childhood precursor-B-cell acute lymphoblastic leukemia: relation to other risk factors. A Children’s Oncology Group study. / M. J. Borowitz, D. J. Pullen, J. J. Shuster, D. Viswanatha, K. Montgomery, C. L. Willman, B. Camitta, Children’s Oncology Group study // Leukemia - 2003. - Т. 17 - № 8- 1566-72с.
6. Döhner H. Diagnosis and management of AML in adults: 2017 ELN recommendations from an international expert panel. / H. Döhner, E. Estey, D. Grimwade, S. Amadori, F. R. Appelbaum, T. Büchner, H. Dombret, B. L. Ebert, P. Fenaux, R. A. Larson, R. L. Levine, F. Lo-Coco, T. Naoe, D. Niederwieser, G. J. Ossenkoppele, M. Sanz, J. Sierra, M. S. Tallman, H.-F. Tien, A. H. Wei, B. Löwenberg, C. D. Bloomfield // Blood - 2017. - Т. 129 - № 4- 424-447с.
7. Engel P. CD Nomenclature 2015: Human Leukocyte Differentiation Antigen Workshops as a Driving Force in Immunology / P. Engel, L. Boumsell, R. Balderas, A. Bensussan, V. Gattei, V. Horejsi, B.-Q. Jin, F. Malavasi, F. Mortari, R. Schwartz-Albiez, H. Stockinger, M. C. van Zelm, H. Zola, G. Clark // J. Immunol. - 2015. - Т. 195 - № 10- 4555-4563с.
8. Goardon N. Coexistence of LMPP-like and GMP-like Leukemia Stem Cells in Acute Myeloid Leukemia / N. Goardon, E. Marchi, A. Atzberger, L. Quek, A. Schuh, S. Soneji, P. Woll, A. Mead, K. A. Alford, R. Rout, S. Chaudhury, A. Gilkes, S. Knapper, K. Beldjord, S. Begum, S. Rose, N. Geddes, M. Griffiths, G. Standen, A. Sternberg, J. Cavenagh, H. Hunter, D. Bowen, S. Killick, L. Robinson, A. Price, E. Macintyre, P. Virgo, A. Burnett, C. Craddock, T. Enver, S. E. W. Jacobsen, C. Porcher, P. Vyas // Cancer Cell - 2011. - Т. 19 - № 1- 138-152с.
9. Heuser M. 2021 Update on MRD in acute myeloid leukemia: a consensus document from the European LeukemiaNet MRD Working Party / M. Heuser, S. D. Freeman, G. J. Ossenkoppele, F. Buccisano, C. S. Hourigan, L. L. Ngai, J. M. Tettero, C. Bachas, C. Baer, M.-C. Béné, V. Bücklein, A. Czyz, B. Denys, R. Dillon, M. Feuring-Buske, M. L. Guzman, T. Haferlach, L. Han, J. K. Herzig, J. L. Jorgensen, W. Kern, M. Y. Konopleva, F. Lacombe, M. Libura, A. Majchrzak, L. Maurillo, Y. Ofran, J. Philippe, A. Plesa, C. Preudhomme, F. Ravandi, C. Roumier, M. Subklewe, F. Thol, A. A. van de Loosdrecht, B. A. van der Reijden, A. Venditti, A. Wierzbowska, P. J. M. Valk, B. L. Wood, R. B. Walter, C. Thiede, K. Döhner, G. J. Roboz, J. Cloos // Blood - 2021. - Т. 138 - № 26- 2753-2767с.
10. Ostendorf B.N. Phenotypic characterization of aberrant stem and progenitor cell populations in myelodysplastic syndromes / B. N. Ostendorf, E. Flenner, A. Flörcken, J. Westermann // PLoS One - 2018. - Т. 13 - № 5- e0197823c.
11. Schuurhuis G.J. Minimal/measurable residual disease in AML: a consensus document from the European LeukemiaNet MRD Working Party / G. J. Schuurhuis, M. Heuser, S. Freeman, M.-C. Béné, F. Buccisano, J. Cloos, D. Grimwade, T. Haferlach, R. K. Hills, C. S. Hourigan, J. L. Jorgensen, W. Kern, F. Lacombe, L. Maurillo, C. Preudhomme, B. A. van der Reijden, C. Thiede, A. Venditti, P. Vyas, B. L. Wood, R. B. Walter, K. Döhner, G. J. Roboz, G. J. Ossenkoppele // Blood - 2018. - Т. 131 - № 12- 1275-1291с.
12. Shameli A. Exploring blast composition in myelodysplastic syndromes and myelodysplastic/myeloproliferative neoplasms: CD45RA and CD371 improve diagnostic value of flow cytometry through assessment of myeloblast heterogeneity and stem cell aberr / A. Shameli, P. Dharmani-Khan, J. Luider, I. Auer, M. Shabani-Rad // Cytom. Part B Clin. Cytom. - 2021. - Т. 100 - № 5- 574-589с.
13. Wood B.L. Flow Cytometric Monitoring of Residual Disease in Acute Leukemia , 2013. - 123-136с.
Изобретение относится к медицине, а именно к гематологии, и может быть использовано для определения прогноза рецидива у больных острым миелоидным лейкозом (ОМЛ) на основе результатов оценки минимальной остаточной болезни (МОБ) в постиндукционной фазе лечения после 1-й контрольной точки - в период с 35-го по 42-й день после 1-го курса индукционной химиотерапии и 2-й контрольной точки - в период с 70-го по 84-й день после 2-го курса индукционной химиотерапии. Осуществляют обнаружение остаточных опухолевых клеток методом многоцветной проточной цитофлуориметрии у больных острым миелоидным лейкозом в двух контрольных точках. На первом этапе выделяют все CD34-положительные клетки и последовательно анализируют их по экспрессии всех антигенов, выделяя все в норме присутствующие у здоровых доноров CD34-положительные клетки. На втором этапе выделяют все CD117-положительные клетки и последовательно анализируют их по экспрессии всех антигенов, выделяя все в норме присутствующие у здоровых доноров CD117-положительные клетки. На третьем этапе выделяют все CD117-CD34- и последовательно анализируют их по экспрессии всех антигенов, выделяя все в норме присутствующие у здоровых доноров CD117-CD34-клетки. При диагностировании наличия МОБ после 1 курса и/или 2 курса прогнозируют рецидив у больных ОМЛ. Пробоподготовка образца костного мозга включает лизис эритроцитов и окрашивание лейкоцитов панелью моноклональных антител. Способ обеспечивает возможность повышения эффективности оценки МОБ-статуса у больных ОМЛ, выбора порогового значения для установления МОБ-положительного статуса, выявления риска развития рецидива у пациентов с ОМЛ за счет определения МОБ-статуса пациента методом многоцветной проточной цитофлуориметрии с помощью гейтирования и окрашивания лейкоцитов панелью моноклональных антител. 3 з.п. ф-лы, 6 ил., 6 табл., 6 пр.
1. Способ определения прогноза рецидива у больных острым миелоидным лейкозом (ОМЛ) на основе результатов оценки минимальной остаточной болезни (МОБ) в постиндукционной фазе лечения после 1-й контрольной точки - в период с 35-го по 42-й день после 1-го курса индукционной химиотерапии и 2-й контрольной точки - в период с 70-го по 84-й день после 2-го курса индукционной химиотерапии, включающий обнаружение остаточных опухолевых клеток методом многоцветной проточной цитофлуориметрии у больных острым миелоидным лейкозом в двух контрольных точках, отличающийся тем, что на первом этапе выделяют все CD34-положительные клетки и последовательно анализируют их по экспрессии всех антигенов, выделяя все в норме присутствующие у здоровых доноров CD34-положительные клетки; на втором этапе выделяют все CD117-положительные клетки и последовательно анализируют их по экспрессии всех антигенов, выделяя все в норме присутствующие у здоровых доноров CD117-положительные клетки; на третьем этапе выделяют все CD117-CD34- и последовательно анализируют их по экспрессии всех антигенов, выделяя все в норме присутствующие у здоровых доноров CD117-CD34-клетки, и при диагностировании наличия МОБ после 1 курса и/или 2 курса прогнозируют рецидив у больных ОМЛ.
2. Способ по п.1, отличающийся тем, что производят поиск и количественную оценку популяции клеток, отличающихся от клеток присутствующих в костном мозге здорового донора.
3. Способ по п.1, отличающийся тем, что забор образца костного мозга проводят согласно требованиям сбора материала для цитометрического исследования.
4. Способ по п.3, отличающийся тем, что пробоподготовка образца костного мозга включает лизис эритроцитов и окрашивание лейкоцитов панелью моноклональных антител из 6, 11 и 13 реактивов, в соответствии с таблицами 2 и 3 описания.
| ГАЛЬЦЕВА И.В | |||
| и др | |||
| Технические аспекты определения минимальной остаточной болезни методом многоцветной проточной цитометрии у пациентов с острыми миелоидными лейкозами | |||
| Клиническая онкогематология | |||
| Способ регенерирования сульфо-кислот, употребленных при гидролизе жиров | 1924 |
|
SU2021A1 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ БЕЗРЕЦИДИВНОЙ ВЫЖИВАЕМОСТИ У БОЛЬНЫХ МНОЖЕСТВЕННОЙ МИЕЛОМОЙ ПОСЛЕ ПРОВЕДЕНИЯ АУТОЛОГИЧНОЙ ТРАНСПЛАНТАЦИИ ГЕМОПОЭТИЧЕСКИХ СТВОЛОВЫХ КЛЕТОК | 2015 |
|
RU2580648C1 |
| SG 11202002753Q A, 28.05.2020 | |||
| US 20210223248 A1, 22.07.2021 | |||
| КАПРИН А.Д | |||
| Острые миелоидные | |||
Авторы
Даты
2023-08-22—Публикация
2022-10-31—Подача