Область техники
Изобретение относится к новым комплексам платины (IV) с по существу повышенной противоопухолевой эффективностью. Описан способ получения указанных новых комплексов платины (IV). Описаны фармацевтическая композиция и конечная дозированная форма для перорального введения новых комплексов платины (IV). Описано применение нового комплекса платины (IV) в способе лечения опухолевого заболевания, предпочтительно, тяжело поддающегося лечению рака, наиболее предпочтительно, рака поджелудочной железы, предпочтительно, путем перорального введения.
Уровень техники
Рак является серьезным заболеванием с непрерывным ростом заболеваемости и распространенности. Несмотря на значительные успехи в иммунотерапии, клеточной терапии и биологической терапии, все еще существует постоянная потребность в низкомолекулярных противоопухолевых препаратах с повышенной противоопухолевой эффективностью, сниженной токсичностью, хорошей доступностью и доступной ценой.
Комплексы платины (II) являются противоопухолевыми препаратами, используемыми в течение многих лет. Они обладают большой противоопухолевой эффективностью, синергическими эффектами при комбинированной терапии, хорошей доступностью и доступной ценой. Используемые в медицине комплексы платины (II) имеют плоскую структуру с центральным ионом Pt2+, окруженным двумя цис-нейтральными не уходящими амино лигандами и двумя цис-анионными уходящими лигандами X1, X2, как показано на фигуре (I):

(I)
где R1, R2 являются водородом или вместе 1R,2R-1,2-циклогексилом и X1, X2 являются хлоридом или вместе дикарбоксилатом. Высокая противоопухолевая эффективность комплексов платины (II) основана на уникальном механизме действия. Уходящие лиганды комплексов платины (II) замещаются водой во внутриклеточном пространстве (процесс «гидратации») с образованием очень реакционноспособных водных комплексов, которые затем реагируют с ДНК, вызывая ее деформацию. Обширное повреждение структуры ДНК индуцирует каскад внутриклеточных механизмов, приводящих к гибели клеток (апоптозу). Параллельно, раковая клетка борется с такими ксенобиотиками платины (II), превращая их в неактивные Pt-комплексы, например, с помощью металлотионеина, метионина, глутатиона и т. д. Затем инактивированные Pt-комплексы удаляются из клетки. Зависимость между строением комплексов платины (II) и их противоопухолевой активностью изучалась в статьях [1] - Cleare M.J., Hoeschele J.D.: Platinum Metals Rev., Vol.17, 2-13, 1973 и [2] - Ridgway H.J., Speer R.J. et al.: Journal of Clinical Hematology and Oncology, Vol.7, No.1, 220-230, 1976. Скорость «гидратации» и связанная с ней цитотоксичность и противоопухолевая эффективность зависят главным образом от силы связи между уходящим анионным лигандом и центральным ионом платины (II). Чем слабее эта связь, тем быстрее происходит образование реакционноспособных водных комплексов и тем выше связанные с ними токсичность и активность. Чем прочнее эта связь, тем медленнее происходит образование реакционноспособных водных комплексов и тем меньше связанная с ними токсичность и активность. Слабо связанные конъюгированные основания сильных кислот, например, нитраты или сульфаты, были очень реакционноспособными, но они также вызывали сильную токсичность (например, судороги), и их испытания пришлось прекратить. Напротив, сильно связанные конъюгированные основания слабых кислот, например, SCN-, NO2-, CNO-, были не реакционноспособными, проявляя только предельную токсичность и активность. Токсичность и противоопухолевая эффективность в комплексах Pt(II) взаимно неразделимы как из-за одинакового механизма действия, так и из-за низкой селективности действия на опухолевые клетки. Умеренно связанные анионные лиганды в виде хлоридов (цисплатин) или дикарбоксилатов (карбоплатин, оксалиплатин) были разработаны для терапевтического применения в качестве компромисса между токсичностью и противоопухолевой эффективностью комплексов платины (II). Затем их нежелательная токсичность была частично устранена путем премедикации пациентов; однако остается проблема их серьезной токсичности.
Комплексы платины (IV) являются пролекарствами комплексов платины (II). У них осевые положения в структуре заняты двумя другими анионными лигандами, обычно карбоксилатами. Осевые лиганды препятствуют доступу воды к центральному иону Pt, поэтому необходимый процесс «гидратации» может произойти только после их восстановительного удаления. Комплексы платины (IV) обладают всеми преимуществами комплексов платины (II) и одновременно улучшают их стабильность и токсичность для здоровых клеток. Обзор современного состояния лекарственных средств на основе платины (IV) дан в обзорах [3]- Johnston T.C., et al.: „The next Generation of Platinum Drugs: Targeted Pt (II) Agents, Nanoparticle Delivery and Pt (IV) Prodrugs“, Chem. Rev. 2016, 116, 3436-3486] и [3]- Kenny R.G., et al.: „Platinum (IV) Prodrugs-A Step Closer to Ehrlich´s Vision?“, Eur. J. Inorg. Chem. 2017, 1596-1612. Первый многообещающий липофильный комплекс платины (IV) для перорального введения был открыт Johnson Matthey, [4]-EP0328274, Johnson Matthey, приоритет 02 февраля 1988 г. Он имеет конфигурацию цис-(аммин, циклогексиламин)-транс-бис-ацетат-цис-дихлорида Pt (IV), и вскоре после этого он прошел клинические испытания под названием сатраплатин. Хотя за последние 30 лет были предприняты большие усилия по внедрению комплексов Pt (IV) в медицинскую практику, до сих пор это не достигнуто.
Комплекс платины (IV) TU31 с геометрической конфигурацией цис-(аммин,1-адамантиламин)-транс-бис(1-адамантилкарбоксилат)-цис-(дихлорид) Pt (IV) формулы (II) является очень перспективным комплексом платины (IV) для терапии рака в предшествующем уровне техники:

(II)
Этот комплекс платины (IV) TU31 был открыт VUAB Pharma, [5]-EP3189064, VUAB Pharma a.s., подана 03 сентября 2014 г. Этот комплекс платины (IV) представляет сочетание уникальных свойств 1-адамантильных лигандов с уникальными противоопухолевыми механизмами комплексов платины (II). Введение трех 1-адамантантильных лигандов, обладающих свойствами органических алмазов, придает комплексу TU31 превосходную стабильность, симметрию, компактность и способность к проникновению, что приводит к улучшению стабильности, поглощения клетками и противоопухолевой эффективности. Восстановительное расщепление осевых объемных и симметричных 1-адамантилкарбоксилатных лигандов требует повышенного уровня восстанавливающих агентов, защищающих клетки (например, металлотионеина, метионина или глутатиона), которые более специфичны для опухолевых клеток, в отличие от здоровых клеток. Это позволяет подавлять токсичность в здоровых клетках, в отличие от опухолевых. Это было проверено и подтверждено на доклинической стадии комплекса TU31, когда токсические симптомы не были достигнуты даже при однократном пероральном введении комплекса TU31 как у крыс, так и у собак.
Однако та же липофильность, компактность и инертность приводят к плохой растворимости комплекса TU31 в воде, что ограничивает его биодоступность по тем же причинам. Этот недостаток был устранен за счет уменьшения размера частиц и выбора подходящего носителя, однако сохраняется ограниченная биодоступность комплекса TU31. Это требует разработки новых производных TU31 с дальнейшим усилением противоопухолевой эффективности, сохраняя преимущества «материнского» комплекса платины (IV) TU31, в основном низкую токсичность и широкую противоопухолевую эффективность.
Сущность изобретения
Согласно первому аспекту изобретения, предложен комплекс платины (IV) с геометрической конфигурацией цис-(аммин,1-адамантиламин)-транс-бис(1-адамантилкарбоксилат)-цис-(хлорид,X) Pt (IV) общей формулы (III):
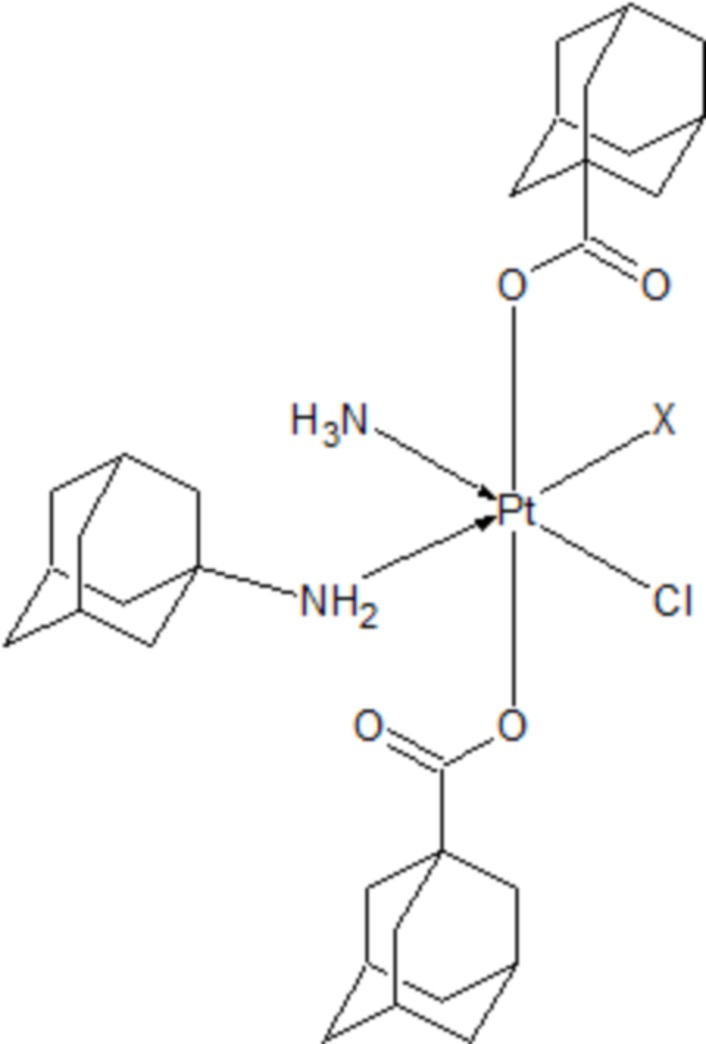
(III)
где X является сопряженным анионом сильной минеральной или органической кислоты.
В предпочтительном варианте осуществления, лиганд X выбран из группы, состоящей из нитрата, мезилата, монохлорацетата и трифторацетата.
В предпочтительном варианте осуществления, лиганд X является нитратом.
В предпочтительном варианте осуществления, лиганд X является мезилатом.
В предпочтительном варианте осуществления, лиганд X является монохлорацетатом.
В предпочтительном варианте осуществления, лиганд X является трифторацетатом.
Не будучи связанным теорией, введение слабо связанного конъюгированного аниона сильной кислоты X в комплексы платины (II) невозможно из-за большой реакционной способности связи Pt-X и большой соответствующей токсичности образовавшихся впоследствии частиц вода-платина (II). Однако такое же введение слабо связанного лиганда X в комплекс платины (IV) TU31 может иметь положительный эффект, поскольку реакционноспособная связь Pt-X пространственно экранирована объемными осевыми 1-адамантилкарбоксилатными лигандами, которые в здоровых клетках удалить труднее, чем в раковых клетках. Это приводит к подавлению токсичности такого комплекса платины (IV) в здоровых клетках, несмотря на то, что он содержит высоко реакционноспособную связь Pt-X. Наоборот, удаление экранирующих осевых лигандов в таком комплексе платины (IV) в раковых клетках возможно благодаря повышенной концентрации защитных восстанавливающих агентов (например, металлотионеина, глутатиона), специфичных для раковых клеток. Это приводит к быстрому образованию токсичных водных комплексов платины (II) в раковых клетках с соответствующим противоопухолевым действием, в отличие от здоровых клеток.
Во втором аспекте настоящего изобретения представлен способ получения комплекса платины (IV) формулы (III), где X является конъюгированным анионом сильной минеральной или органической кислоты, включающий следующие стадии получения:
а) Реакция исходного комплекса платины (IV) с геометрической конфигурацией цис-(аммин,1-адамантиламин)-транс-бис(1-адамантилкарбоксилат)-цис-(хлорид, иодид) Pt (IV) (TU31-моноиодидом) со стехиометрическим избытком серебряной соли сильной кислоты, в смеси хлорированного углеводородного растворителя, предпочтительно хлороформа, и соответствующей сильной кислоты при температуре кипения растворителя в течение времени реакции, необходимого для превращения с получением смеси.
b) Удаление твердой фазы из смеси фильтрацией с получением неочищенного фильтрата.
с) Промывка неочищенного фильтрата водой и сушка отделенной органической фазы.
d) Удаление растворителя из высушенной органической фазы выпариванием с получением комплекса платины (IV) формулы (III), где X является конъюгированным анионом сильной минеральной или органической кислоты.
В предпочтительном варианте осуществления изобретения, способ получения комплекса платины (IV) общей формулы (III), где X является конъюгированным анионом сильной минеральной или органической кислоты, дополнительно включает стадию
е) Растворение комплекса платины (IV) в ацетоне, добавление активированного угля, ультрафильтрация полученной суспензии и осаждение полученного ультрафильтрованного раствора чистого комплекса платины (IV) в большом количестве воды с получением чистого комплекса платины (IV) общей формулы (III), где X является конъюгированным анионом сильной минеральной или органической кислоты в виде наночастиц.
Предпочтительным способом получения по изобретению является введение слабо связанного аниона лиганда X непосредственно в комплекс TU31, полученный согласно фигуре 1.
Предпочтительно вводить один йодидный лиганд вместо одного хлоридного лиганда в исходный комплекс TU31 на стадии а), чтобы способствовать превращению исходного комплекса TU31 в новый комплекс платины (IV). Исходный комплекс TU31-монойодида с геометрической конфигурацией цис-(аммин,1-адамантиламин)-транс-бис(1-адамантилкарбоксилат)-цис-(хлорид, иодид) Pt(IV), которая соответствует комплексу платины(IV) формулы (III), где X замещен йодидом, может быть получен согласно трехстадийной реакционной процедуре, уже известной из предшествующего уровня техники. Например, хлоридный лиганд может быть заменен йодидным лигандом в промежуточном соединении TU9 комплекса платины (II) (TU9 - см. фигуру 1) путем взаимодействия комплекса платины (II) TU9 со стехиометрическим количеством KI в водной суспензии при температуре около 50°С в течение 24 ч с получением комплекса платины (II) TU9-монойодида. Затем комплекс платины (II) TU9-монойодид окисляют до соответствующего комплекса платины (IV) по известной методике, описанной, например, в EP0328274, Johnson Mathey. Коротко, комплекс Pt(II) TU9-монойодид окисляют 30-50 стехиометрическим избытком перекиси водорода при температуре примерно 60℃ в течение 6-8 часов с получением комплекса платины (IV) TU11-монойодида (TU11 - см. Схему 1). Наконец, комплекс платины (IV) TU11-монойодид эстерифицируют избытком 1-адамантилкарбонил хлорида с получением исходного комплекса TU31-монойодида по известной методике, описанной, например, в EP 3189064, VUAB Pharma. Коротко, один стехиометрический эквивалент комплекса TU11-монойодида подвергают реакции с 5 стехиометрическими эквивалентами 1-адамантилкарбонилхлорида с соответствующим количеством пиридина в 1,4-диоксане с получением неочищенного комплекса TU31-монойодида. Неочищенный комплекс TU31-монойодида очищают повторным выщелачиванием в 1,4-диоксане и водой. Затем полученный продукт растворяют в ацетоне, добавляют активированный уголь, ультрафильтруют суспензию и полученный ультрафильтрованный раствор осаждают в большом количестве воды, получая чистый исходный комплекс TU31-монойодида.
В предпочтительном варианте осуществления, выходы новых комплексов платины (IV), полученных в соответствии с изобретением на стадиях а) - е), составляют 62-78% по отношению к исходному комплексу TU31-монойодида. Чистота полученного комплекса платины (IV) обычно составляет 96-98,5% (ВЭЖХ-УФ).
В предпочтительном варианте осуществления, размер частиц полученных комплексов платины (IV) находится в диапазоне 100-300 нм, измеренный методом ДСР (динамического светорассеяния).
Молекулярная масса полученных комплексов платины (IV) может быть дополнительно подтверждена методом ВЭЖХ-МС. Получение комплексов платины (IV) общей формулы (III) более подробно поясняется в примерах 1, 2 и 3.
В соответствии с третьим аспектом изобретения, представлена фармацевтическая композиция, содержащая комплекс платины (IV) в соответствии с формулой (III) с фармацевтически приемлемым носителем.
В предпочтительном варианте осуществления, фармацевтическую композицию комплекса платины (IV) в соответствии с формулой (III) можно вводить перорально.
В предпочтительном варианте осуществления, фармацевтически приемлемым носителем является самоэмульгирующийся носитель, предпочтительно глицериды стеароил макрогола, наиболее предпочтительно, Gelucire 50/13.
В предпочтительном варианте осуществления, фармацевтическая композиция содержит комплекс платины (IV) в соответствии с формулой (III) в виде наночастиц.
В предпочтительном варианте осуществления, представлена конечная дозированная форма для применения в терапии опухолевых заболеваний, предпочтительно, для перорального введения, содержащая фармацевтическую композицию комплексов платины (IV) по изобретению, предпочтительно, в виде наночастиц, предпочтительно, с самоэмульгирующимся носителем, засыпанных в кислоторезистентные капсулы. Конечная дозированная форма по изобретению решает проблему как плохой растворимости с соответствующей плохой биодоступностью новых комплексов платины (IV), так и нестабильности этого комплекса в желудке и кишечнике, где концентрация восстанавливающих веществ и других биоразлагающих агентов также повышена, как и в опухолевых клетках. Превращение микрочастиц комплексов платины (IV) формулы (III) в наночастицы, предпочтительно, менее 250 нм, улучшает растворимость и биодоступность новых комплексов платины (IV), предпочтительно, после перорального введения.
Получение наночастиц новых комплексов платины (IV) описано в примерах получения таких комплексов платины (IV).
В предпочтительном варианте осуществления, использование в композиции самоэмульгирующегося носителя, предпочтительно, глицеридов стеароил макрогола, наиболее предпочтительно, Gelucire 50/13, поддерживает как защиту новых комплексов платины (IV) от преждевременной активации в кишечнике, так и биодоступность этого комплекса в теле путем его инкапсуляции в везикулы. Gelucire 50/13 имеет точку конденсации примерно 50℃ и низкую вязкость расплава, что позволяет легко приготовить термоплавкую композицию по настоящему изобретению при температуре выше 50℃. Этот носитель также является относительно простым, дешевым, не токсичным и сертифицирован для использования в фармацевтике.
В предпочтительном варианте осуществления, массовая доля Gelucire 50/13, составляющая не менее 80% масс. состава, рекомендуется для обеспечения максимального поддерживающего и защитного действия этого носителя.
Использование кислоторезистентных капсул в соответствии с предпочтительным вариантом осуществления защищает новые комплексы платины (IV) от преждевременной активации в желудке после перорального введения. Предпочтительными кислоторезистентными капсулами являются капсулы из фталата гидроксипропилметилцеллюлозы (HPMCP) или ацетата сукцината гидроксипропилметилцеллюлозы (HPMCAS), которые быстро растворяются в верхней части кишечника, в отличие от обычно используемых капсул с энтеросолюбильным покрытием. Комплекс платины (IV) по изобретению должен быть максимально защищен в желудочно-кишечном тракте, чтобы избежать риска нежелательной токсичности. Эта двойная защита нового комплекса платины (IV) с помощью как кислоторезистентной капсулы, так и самоэмульгирующегося носителя, сводит к минимуму риск его преждевременного восстановления/активации с сопутствующей токсичностью до тех пор, пока этот комплекс не достигнет раковых клеток-мишеней.
В соответствии с четвертым аспектом изобретения, представлено применение новых комплексов платины (IV) общей формулы (III) для применения в способе лечения опухолевых заболеваний, предпочтительно, тяжелых для лечения видов рака, наиболее предпочтительно, рака поджелудочной железы, пероральным введением.
Настоящее изобретение охватывает любой из следующих аспектов:
1) Комплекс платины (IV) с геометрической конфигурацией цис-(аммин,1-адамантиламин)-транс-бис(1-адамантилкарбоксилат)-цис-(хлорид,X) Pt (IV) общей формулы (III):

(III)
где X является конъюгированным анионом сильной минеральной или органической кислоты.
2) Комплекс платины (IV) по аспекту 1), где Х выбран из группы, состоящей из нитрата, мезилата, монохлорацетата и трифторацетата.
3) Способ получения комплекса платины (IV) по аспектам 1) или 2), включающий следующие стадии получения:
а) Взаимодействие исходного комплекса платины (IV) с геометрической конфигурацией цис-(аммин,1-адамантиламин)-транс-бис(1-адамантилкарбоксилат)-цис-(хлорид, иодид) Pt (IV) со стехиометрическим избытком серебряной соли сильной кислоты, в смеси хлорированного углеводородного растворителя, предпочтительно, хлороформа, и соответствующей сильной кислоты при температуре кипения растворителя в течение времени реакции, необходимого для превращения с получением смеси.
b) Удаление твердой фазы из смеси фильтрацией с получением неочищенного фильтрата.
с) Промывка неочищенного фильтрата водой и сушка отделенной органической фазы.
d) Удаление растворителя из высушенной органической фазы выпариванием с получением комплекса платины (IV) по аспекту 1) или 2).
4) Способ согласно аспекту 3), включающий дополнительную стадию:
е) Растворение комплекса платины (IV) в ацетоне, добавление активированного угля, ультрафильтрация полученной суспензии и осаждение полученного ультрафильтрованного раствора чистого комплекса платины (IV) в большом количестве воды с получением чистого комплекса платины (IV) по аспекту 1) или 2) в виде наночастиц.
5) Фармацевтическая композиция комплекса платины (IV) по аспекту 1) или 2), предпочтительно для перорального введения, содержащая комплекс Pt (IV) и фармацевтически приемлемый носитель.
6) Фармацевтическая композиция по аспекту 5), где фармацевтически приемлемым носителем является самоэмульгирующийся носитель, предпочтительно, глицериды стеароил макрогола, наиболее предпочтительно, Gelucire 50/13.
7) Фармацевтическая композиция по аспекту 5) или 6), где комплекс платины (IV) присутствует в виде наночастиц.
8) Фармацевтическая композиция по аспекту 6) или 7), где массовая доля самоэмульгирующегося носителя составляет более 80% масс.
9) Фармацевтическая композиция по любому из аспектов 5)-8), где фармацевтическая композиция помещена в кислоторезистентные капсулы, предпочтительно, капсулы из фталата гидроксипропилметилцеллюлозы или ацетата сукцината гидроксиперопилметилцеллюлозы.
10) Комплекс платины (IV) по аспекту 1) или 2) или фармацевтическая композиция по любому из аспектов 5) - 9) для применения в способе лечения опухолевого заболевания, предпочтительно, тяжело поддающегося лечению рака, наиболее предпочтительно, рака поджелудочной железы, предпочтительно, путем перорального введения.
11) Способ лечения опухолевых заболеваний, предпочтительно тяжело поддающегося лечению рака, наиболее предпочтительно, рака поджелудочной железы, у субъекта, нуждающегося в этом, включающий введение, предпочтительно, пероральное, комплекса платины (IV) по аспекту 1) или 2) или фармацевтической композиции по любому из аспектов 5) - 9).
Более подробное описание изобретения
Авторы неожиданно обнаружили, что комплексы платины (IV) общей формулы (III) обладают существенно улучшенной противоопухолевой эффективностью по сравнению с известным уровнем техники. Это продемонстрировано как в экспериментах in vitro и in vivo. Метод ХТТ использовали в экспериментах in vitro. Были испытаны исходный комплекс платины (IV) TU31 (где X=Cl-), три новых комплекса платины (IV) по изобретению, где X=ClCH2COO- (комплекс TU105), F3CCOO- (комплекс TU106) и NO3- (комплекс TU113), эталонный комплекс платины (II) оксалиплатин и эталонный комплекс платины (IV) сатраплатин. Две линии раковых клеток тяжело поддающихся лечению опухолей Capan-2 (аденокарциномы поджелудочной железы) и PC-3 (карциномы предстательной железы) использовали в тестах ХТТ. Полученные результаты суммированы в виде значений IC50 в следующей таблице 1:
Таблица 1: Значения IC50, измеренные для новых комплексов платины (IV) и эталонного комплекса платины (II) Оксалиплатина
Capan-2=аденокарцинома поджелудочной железы, ДСМЗ, АСС-245
PC-3=карцинома предстательной железы, ATCC® CRL-1435™
Мы неожиданно обнаружили, что комплексы платины (IV) формулы (III) обладают существенно повышенной противоопухолевой эффективностью in vitro по сравнению с известным уровнем техники. Исходный комплекс TU31 имеет примерно в 50-100 раз лучшую противоопухолевую эффективность in vitro, чем эталонный оксалиплатин, и в 11-55 раз лучшую противоопухолевую эффективность in vitro, чем эталонный сатраплатин. Отличные противоопухолевые эффекты комплекса TU31 по сравнению с эталонными оксалиплатином и сатраплатином в сочетании с его очень низкой токсичностью и возможностью перорального введения являются хорошими предпосылками успеха комплекса TU31 в клинических испытаниях. Однако, новые комплексы платины (IV) TU105, TU106 и TU113 общей формулы (III) по изобретению имеют значения IC50 даже более чем в 1000 раз лучше, чем у эталонного оксалиплатина, более чем в 100 раз лучше, чем у эталонного сатраплатина и более чем в 15 раз лучше, чем у исходного комплекса TU31, для обеих линий раковых клеток Capan-2 и PC-3. Такое дальнейшее улучшение представляется существенным по сравнению с известным уровнем техники и создает хорошие предпосылки для дальнейшей разработки новых комплексов платины (IV) по изобретению, в частности, для лечения опухолей, которые трудно поддаются лечению, например опухолей поджелудочной железы.
Более подробная информация о эффективности и результатах испытаний ХТТ приведена в Примере 4.
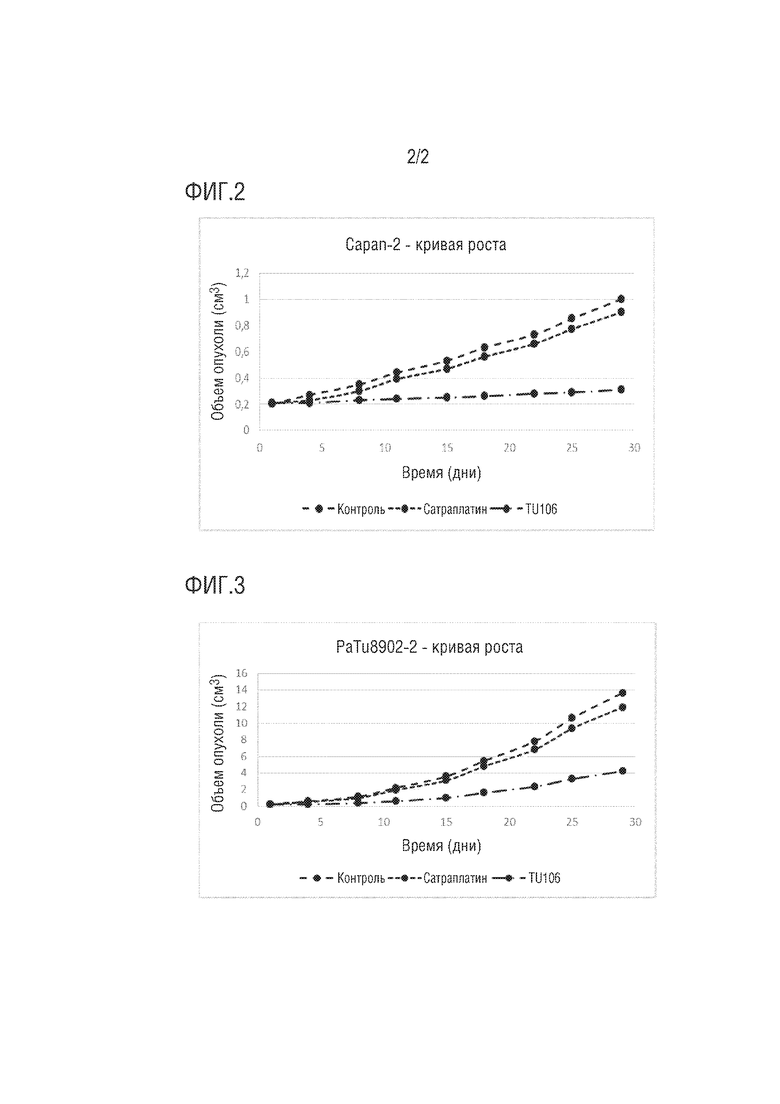
Два новых комплекса платины (IV) TU105 и TU106 из тестов XTT были дополнительно исследованы in vivo на модели бестимусных мышей с двумя опухолями поджелудочной железы. Комплекс платины (IV) сатраплатин и исходный комплекс TU31 снова использовали в качестве эталонных соединений. Две тяжелые для лечения опухоли поджелудочной железы Capan-2 и PaTu8902 культивировали и затем подкожно вводили мышам в дозе 1 х 107 клеток/мышь. После увеличения подкожных опухолей до объема примерно 0,2 см3 вводили перорально две дозы соответствующих комплексов 2×20 мг/кг каждые 1 неделю. Контрольная группа мышей препарат не получала. Объем опухолей непрерывно измеряли на протяжении всего эксперимента. Через три недели после введения второй дозы мышей умерщвляли, опухоли удаляли, взвешивали и полученные данные оценивали как ингибирование объема опухоли в % (TVI%) и ингибирование массы опухоли в % (TWI%), где:
TVI%= 100 - [(TVexp/TVcont) x 100]
TVexp=средний объем леченных опухолей в см3
TVcont=средний объем контрольных опухолей в см3
TWI%= 100 - [(TWexp/TWcont) x 100]
TWexp=средний вес леченных опухолей в г.
TWcont=средний вес контрольных опухолей в г.
Полученные результаты сведены в Таблицу 2 и Таблицу 3.
Таблица 2. Результаты противоопухолевой эффективности комплексов платины (IV) TU31, TU105, TU106 в %TWI, однократная пероральная доза 20 мг/кг, продолжительность эксперимента 28 дней (28 дней)
Мышь: бестимусная голая-FOXN-1n, 6 мышей в группе (3 самца+3 самки).
Опухоль: Capan-2, аденокарцинома поджелудочной железы (DSMZ, ACC-245)
28 д
Таблица 3. Результаты противоопухолевой эффективности комплексов платины (IV) TU31, TU105, TU106 в %TWI, однократная пероральная доза 20 мг/кг, продолжительность эксперимента 28 дней (28 дней)
Мышь: Бестимусная голая-FOXN-1nu, 6 мышей в группе (3 самца+3 самки)
Опухоль: PaTu8902, аденокарцинома поджелудочной железы, метастатическая, II степень (DSMZ, ACC-179)
28 д
Из полученных результатов следует, что исходный комплекс TU31 обладает очень хорошей противоопухолевой эффективностью при обеих опухолях поджелудочной железы, имея TWI примерно 50%, в отличие от эталонного комплекса сатраплатина. Однако новые комплексы платины (IV) TU105 и TU106 по изобретению продемонстрировали значительно улучшенную противоопухолевую эффективность, выраженную в TWI%, равную примерно 70-80%, что примерно в 7 раз выше, чем у эталонного комплекса платины (IV) сатраплатина и значительно больше, чем для исходного комплекса TU31, также для обеих исследованных опухолей поджелудочной железы. Более подробная информация об эффективности и результатах испытаний in vivo на модели бестимусных мышей приведена в примере 5.
Результаты, полученные как в тестах in vitro, так и в тестах in vivo, подтверждают значительно улучшенную противоопухолевую эффективность новых комплексов платины (IV) по сравнению с известным уровнем техники. Новые комплексы платины (IV) общей формулы (III) согласно изобретению предлагают очень многообещающие и доступные по цене средства для пероральной терапии рака, предпочтительно, тяжело поддающегося лечению рака, более предпочтительно, рака поджелудочной железы. Широкая противоопухолевая эффективность новых комплексов платины (IV) по изобретению основана на известном и уникальном механизме действия метаболитов платины (II), который мало зависит от изменчивости сигнальных путей и опухолевых маркеров в клетках. В этом случае, проблема лекарственного таргетирования токсических комплексов решается за счет селективной активации комплекса платины (IV) в опухолевых клетках по изобретению.
Изобретение дополнительно поясняется и иллюстрируется, но не ограничивается следующими примерами и чертежами.
На чертежах показано
На фигуре 1: схема получения комплекса платины (IV) TU31,
На фигуре 2: кривая роста опухоли Capan-2, и
На фигуре 3: кривая роста опухоли PaTu8902.
Примеры
ПРИМЕР 1.
Получение цис- (аммин,1-адамантиламин)- транс -бис(1-адамантилкарбоксилат)- цис -(хлорид, монохлорацетат) Pt (IV), нового комплекса Pt (IV) TU105, молекулярная масса 850,77 г/моль.
Получение проводят в вытяжном шкафу при отсутствии света. Исходный комплекс Pt(IV) TU31-монойодида получают в соответствии с известным уровнем техники.
70 мг оксида серебра (0,3 ммоль) и 7,9 г монохлоруксусной кислоты (83,6 ммоль) перемешивают в 20 мл хлороформа в течение 1 часа при комнатной температуре. Затем добавляют 360 мг исходного комплекса Pt(IV)-монойодида (0,4 ммоль) и смесь перемешивают 6 часов при 63℃ (слабое кипячение с обратным холодильником). Полученную суспензию охлаждают до комнатной температуры и удаляют твердую фазу фильтрацией. Полученный органический раствор трижды экстрагируют 20 мл воды для удаления из органического раствора водорастворимых соединений. Промытый органический раствор сушат с помощью молекулярных сит и затем удаляют хлороформ из прозрачного высушенного раствора вакуумной перегонкой с получением неочищенного комплекса TU105. Неочищенный комплекс TU105 растворяют в 33 мл ацетона и добавляют 20 мг активированного угля с получением суспензии, которую перемешивают 0,5 часа при комнатной температуре. Затем суспензию ультрафильтруют через фильтр с пористостью 0,22 мкм с получением ультрафильтрованного раствора продукта, который затем осаждают в 100 мл холодной воды с получением 270 мг чистого комплекса TU105, выход 78% теоретический, чистота 98,1% (способ ВЭЖХ) и размер частиц 200-400 нм (способ ДСР). МС-спектрометрия подтверждает молекулярную массу.
ПРИМЕР 2.
Получение цис- (аммин,1-адамантиламина)- транс -бис(1-адамантилкарбоксилат)- цис -(хлорид, трифторацетат) Pt (IV), нового комплекса Pt (IV) TU106, молекулярная масса 870,30 г/моль.
Получение проводят в вытяжном шкафу при отсутствии света. Исходный комплекс Pt(IV) TU31-монойодида получают в соответствии с известным уровнем техники.
Смесь 360 мг исходного комплекса Pt(IV)-монойодида (0,4 ммоль), 135 мг серебряной соли трифторуксусной кислоты (0,6 ммоль), 9,6 г трифторуксусной кислоты (84,2 ммоль) и 20 мл хлороформа перемешивают 6 ч при 63℃ (мягкое кипячение с обратным холодильником). Полученную суспензию охлаждают до комнатной температуры и удаляют твердую фазу фильтрацией. Полученный органический раствор трижды экстрагируют 20 мл воды для удаления из органического раствора водорастворимых соединений. Промытый органический раствор сушат с помощью молекулярных сит и затем удаляют хлороформ из прозрачного высушенного раствора вакуумной перегонкой с получением неочищенного комплекса TU106. Неочищенный комплекс TU106 растворяют в 33 мл ацетона и добавляют 20 мг активированного угля с получением суспензии, которую перемешивают 0,5 часа при комнатной температуре. Затем суспензию ультрафильтруют через фильтр с пористостью 0,22 мкм с получением ультрафильтрованного раствора продукта, который затем осаждают в 100 мл холодной воды с получением 287 мг чистого комплекса TU106, выход 81% теоретический, чистота 98,5% (метод ВЭЖХ) и размер частиц 200-400 нм (метод ДСР). МС-спектрометрия подтверждает молекулярную массу.
ПРИМЕР 3.
Получение цис- (аммин,1-адамантиламин)- транс -бис(1-адамантилкарбоксилат)- цис -(хлорид, нитрат) Pt (IV), нового комплекса Pt (IV) TU113, молекулярная масса 819,29 г/моль.
Получение проводят в вытяжном шкафу при отсутствии света. Исходный комплекс Pt(IV) TU31-монойодида получают в соответствии с известным уровнем техники.
Смесь 360 мг исходного комплекса Pt(IV)-монойодида (0,4 ммоль), 100 мг AgNO3 (0,6 ммоль), 6 мл (8,46 г) 65% азотной кислоты (87,3 ммоль) и 20 мл хлороформа перемешивают 10 ч при 63℃ (мягкое кипячение с обратным холодильником). Полученную суспензию охлаждают до комнатной температуры и удаляют твердую фазу фильтрацией. Из фильтрата, органическую фазу отделяют от водной фазы HNO3. Полученную органическую фазу трижды экстрагируют 20 мл воды для удаления из органического раствора водорастворимых соединений. Промытый органический раствор сушат с помощью молекулярных сит и затем удаляют хлороформ из прозрачного высушенного раствора вакуумной перегонкой с получением неочищенного комплекса TU113. Неочищенный комплекс TU113 растворяют в 33 мл ацетона и добавляют 20 мг активированного угля с получением суспензии, которую перемешивают 0,5 часа при комнатной температуре. Затем суспензию ультрафильтруют через фильтр с пористостью 0,22 мкм с получением ультрафильтрованного раствора продукта, который затем осаждают в 100 мл холодной воды с получением 227 мг чистого комплекса TU113, выход 69% теоретический, чистота 96,2% (метод ВЭЖХ) и размер частиц 200-350 нм (метод ДСР). МС-спектрометрия подтверждает молекулярную массу.
ПРИМЕР 4.
Изучение противоопухолевой эффективности in vitro новых комплексов Pt (IV) по настоящему изобретению, тяжелых для лечения опухолей поджелудочной железы и предстательной железы, ХТТ тест.
Противоопухолевую эффективность новых комплексов Pt (IV) по изобретению изучают на тяжелых для лечения раковых линиях поджелудочной железы и предстательной железы. Используют способ ХТТ. Результаты оценивают по значениям IC50 и сравнивают с эталонным комплексом Pt (II) оксалиплатином и эталонным комплексом Pt (IV) сатраплатином.
Тестируемые соединения:
1. Эталонный комплекс Pt (II) оксалиплатин, (1R,2R-1,2-циклогександиамин-N, N´) (этандиоато-O, O´) платина (II), CAS №: 61825-94-3, чистота: 99,7% (ВЭЖХ), источник VUAB Pharma a.s.
2. Эталонный комплекс Pt (IV) сатраплатин, цис-(аммин, циклогексиламин)-транс-бис-ацетат-цис-дихлорид Pt (IV), CAS №: 129580-63-8, >98,8% (ВЭЖХ), источник WATSON Inc., Ltd, CN.
3. Исходный комплекс Pt (IV) TU31, цис-(аммин,1-адамантиламин)-транс-бис(1-адамантилкарбоксилат)-цис-(дихлорид) Pt (IV), CAS №: NCE, чистота 99,5% (ВЭЖХ), источник VUAB Pharma a.s.
4. Новый комплекс Pt (IV) TU105, цис-(аммин,1-адамантиламин)-транс-бис(1-адамантилкарбоксилат)-цис-(хлорид, монохлорацетат) Pt (IV), CAS №: NCE, чистота 98,1% (ВЭЖХ), источник VUAB Pharma a.s.
5. Новый комплекс Pt(IV) TU106, цис-(аммин,1-адамантиламин)-транс-бис(1-адамантилкарбоксилат)-цис-(хлорид, трифторацетат) Pt (IV), CAS №: NCE, чистота 98,5% (ВЭЖХ), источник VUAB Pharma a.s.
6. Новый комплекс Pt(IV) TU113, цис-(аммин,1-адамантиламин)-транс-бис(1-адамантилкарбоксилат)-цис-(хлорид, нитрат) Pt (IV), CAS №: NCE, чистота 96,2% (ВЭЖХ), источник VUAB Pharma a.s.
Линии раковых клеток:
Свежие линии опухолевых клеток приобретают в Банке клеток для обеспечения их качества и активности.
а) Capan-2, аденокарцинома протока поджелудочной железы, DSMZ, ACC-245
b) PC-3, карцинома предстательной железы, ATCC® CRL-1435™
Условия культивирования линий опухолевых клеток:
Сокращение используемых соединений:
ДМСО: диметилсульфоксид
PBS: физиологический раствор с фосфатным буфером
XTT: соль 2,3-бис-(2-метокси-4-нитро-5-сульфофенил)-2H-тетразолий-5-карбоксанилида
PMS: N-метил-дибензопиразинметилсульфат
FBS: фетальная бычья сыворотка
NEAA: заменимые аминокислоты
L-glu: L-глутамин
DMEM: модифицированная по Дульбекко среда Игла (SigmaAldrich)
ФМС: феназин метосульфат
Условия культивирования: 37°C, 5% CO2
Среда для выращивания: DMEM, 10% FBS, 2 мМ L-glut., NEAA 100x
Методика XTT:
Тестируемые соединения растворяют в ДМСО и разводят PBS до тестируемого диапазона концентраций непосредственно перед добавлением к клеточным линиям в лунки. В качестве положительного контроля используют PBS, в качестве отрицательного контроля используют ДМСО в конечной концентрации 20%. Все концентрации соединений определяют в трех повторах. Каждое определение проводят дважды и заслепляется для экспериментатора.
Тестирование проводят на 96-луночном планшете. Дозировка опухолевых клеток составляет примерно 2,5 х 104 клеток на лунку, дозировка питательной среды составляет 100 мкл на лунку. Через 24 часа питательную среду отсасывают и в лунки добавляют по 80 мкл свежей питательной среды и по 20 мкл раствора с различной концентрацией тестируемого вещества. Через 72 часа среду отсасывают, и в лунки добавляют по 100 мкл раствора реагента Optimem, содержащего XTT и PMS. Еще через 4 часа измеряют оптическую плотность при 450 нм (эталон - при 630 нм).
Результаты в виде IC50 оценивают по графику нормализованной жизнеспособности клеток, построенному в зависимости от логарифма концентрации вещества.
Полученные результаты:
Результаты приведены в таблице 1:
Таблица 1: Измеренные значения IC50 для новых комплексов Pt(IV) и эталонного комплекса Pt(II) оксалиплатина
Заключение о противоопухолевой эффективности новых комплексов Pt (IV) in vitro:
Исходный комплекс TU31 имеет примерно в 50-100 раз лучшую противоопухолевую эффективность in vitro, по сравнению с эталонным оксалиплатином, и в 11-55 раз лучшую противоопухолевую эффективность in vitro, по сравнению с эталонным сатраплатином. Отличные противоопухолевые эффекты комплекса TU31 по сравнению с эталонными оксалиплатином и сатраплатином в сочетании с его очень низкой токсичностью и возможностью перорального введения являются хорошими предпосылками успеха комплекса TU31 в клинических испытаниях.
Однако, новые комплексы платины (IV) TU105, TU106 и TU113 по изобретению имеют значения IC50 даже более чем в 1000 раз лучше, чем у эталонного оксалиплатина, более чем в 100 раз лучше, чем у эталонного сатраплатина и более чем в 15 раз лучше, чем у исходного комплекса TU31, для обеих линий раковых клеток Capan-2 и PC-3. Такое улучшение новых комплексов Pt (IV) по изобретению представляется существенным по сравнению с предшествующим уровнем техники.
ПРИМЕР 5.
Изучение противоопухолевой эффективности in vivo новых комплексов Pt (IV) по настоящему изобретению на двух тяжелых для лечения опухолей поджелудочной железы, модель бестимусных мышей.
Модель in vivo: Бестимусные голые-FOXN-1nu, 6 мышей в группе (3 самца+3 самки).
Используемые линии раковых клеток:
а) Capan-2, аденокарцинома поджелудочной железы, протоковая (DSMZ, ACC-245)
б) PaTu9802, аденокарцинома поджелудочной железы, протоковая, высокая метастатическая, II степень (DSMZ, ACC-179)
Используемые комплексы Pt (IV):
а) эталонный комплекс Pt (IV) сатраплатин, подробную спецификацию см. в примере 4.
b) исходный комплекс Pt (IV) TU31, подробную спецификацию см. в примере 4.
c) новый комплекс Pt (IV) TU105, подробную спецификацию см. пример 4.
d) новый комплекс Pt (IV) TU106, подробную спецификацию см. пример 4.
Используемые дозы для перорального введения:
Гомогенную объемную композицию каждого испытанного комплекса Pt (IV) (20% масс.) с Gelucire 50/13 (80% масс.) превращают в водную эмульсию перед пероральным введением мышам.
Условия культивирования линий раковых клеток: 37°C, 5% CO2, DMEM (модифицированная по Дульбекко среда Игла, Sigma Aldrich), 10% FBS (фетальная бычья сыворотка), 2 мМ L-глутамин, заменимые аминокислоты.
Трансплантация раковых клеток. Каждой экспериментальной мыши подкожно трансплантируют дозу 1 х 107 клеток, затем мышей делят на отдельные экспериментальные группы. Каждая экспериментальная группа имеет контрольную группу, не получающую лекарственное средство.
Выполнение теста:
После увеличения подкожных опухолей до объема примерно 0,2 см3 вводят перорально две дозы соответствующих комплексов 2 × 20 мг/кг каждую 1 неделю. Контрольная группа мышей лекарственное средство не получает. Объем опухолей непрерывно измеряют на протяжении всего эксперимента. Через три недели после введения второй дозы мышей умерщвляют, опухоли удаляют, взвешивают, и полученные данные оценивают как ингибирование объема опухоли в % (TVI%) и ингибирование массы опухоли в % (TWI%), где:
TVI%= 100 - [(TVexp/TVcont) x 100]
TVexp=средний объем леченных опухолей в см3
TVcont=средний объем контрольных опухолей в см3
TWI%= 100 - [(TWexp/TWcont) x 100]
TWexp=средний вес леченных опухолей в г.
TWcont=средний вес контрольных опухолей в г.
Полученные результаты:
Полученные результаты сведены в Таблицу 2 и Таблицу 3.
Таблица 2. Результаты противоопухолевой эффективности комплексов платины (IV) TU31, TU105, TU106 в %TWI, однократная пероральная доза 20 мг/кг, продолжительность эксперимента 28 дней (28 дней)
Опухоль: Capan-2, аденокарцинома поджелудочной железы (DSMZ, ACC-245)
28 д
Таблица 3. Результаты противоопухолевой эффективности комплексов платины (IV) TU31, TU105, TU106 в %TWI, однократная пероральная доза 20 мг/кг, продолжительность эксперимента 28 дней (28 дней)
Опухоль: PaTu8902, аденокарцинома поджелудочной железы, метастатическая, II степень (DSMZ, ACC-179)
28 д
Достигнутые результаты в таблицах 2 и 3 дополнительно иллюстрируются кривыми роста опухоли для обеих опухолей поджелудочной железы на фигурах 2 и 3.
Заключение о противоопухолевой эффективности in vivo новых комплексов Pt (IV) по изобретению, модель бестимусных мышей:
Новые комплексы Pt (IV) TU105 и TU106 по изобретению продемонстрировали значительно улучшенную противоопухолевую эффективность, выраженную как в TVI%, так и в TWI%, равную примерно 70-80%, что примерно в 7 раз выше, чем у эталонного комплекса Pt (IV) сатраплатина и существенно больше, чем для исходного комплекса TU31, также, для обоих изученных тяжелых для лечения опухолей поджелудочной железы. Полученные результаты подтверждают значительно улучшенную противоопухолевую эффективность новых комплексов Pt (IV) по изобретению по сравнению с известным уровнем техники.
Новые комплексы Pt (IV) общей формулы (III) в соответствии с изобретением предлагают очень многообещающее и доступное по цене средство для пероральной терапии рака, предпочтительно, тяжело поддающегося лечению рака, более предпочтительно, рака поджелудочной железы.
| название | год | авторы | номер документа |
|---|---|---|---|
| КОМПЛЕКСЫ ПЛАТИНЫ (IV) С ПОВЫШЕННОЙ ПРОТИВОРАКОВОЙ ЭФФЕКТИВНОСТЬЮ | 2014 |
|
RU2666898C1 |
| КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ ПЛАТИНЫ, СПОСОБЫ ИХ ПОЛУЧЕНИЯ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 1999 |
|
RU2200164C2 |
| НОВЫЙ КОМПЛЕКС ПЛАТИНЫ (IV) | 2016 |
|
RU2695357C1 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ДЛЯ ИНЪЕКЦИОННОГО ОСОБЕННО ЦЕЛЕНАПРАВЛЕННОГО МЕСТНОГО ПРИМЕНЕНИЯ | 2007 |
|
RU2440113C2 |
| КОМБИНИРОВАННАЯ ХИМИОТЕРАПИЯ | 2001 |
|
RU2284818C2 |
| КОМБИНИРОВАННАЯ ХИМИОТЕРАПИЯ | 2006 |
|
RU2429838C2 |
| КОМБИНИРОВАННАЯ ХИМИОТЕРАПИЯ | 2010 |
|
RU2587013C2 |
| ТРЕХПЛАТИНОВЫЕ КОМПЛЕКСЫ PT(II), СПОСОБ ИХ ПОЛУЧЕНИЯ | 1994 |
|
RU2140422C1 |
| СПОСОБ ПОЛУЧЕНИЯ ЦИС-ДИАММОНИЙДИХЛОРДИГИДРОКСОПЛАТИНЫ (IV) И ЕЕ ПРИМЕНЕНИЕ | 2004 |
|
RU2345086C2 |
| ТРЕХЪЯДЕРНЫЕ КАТИОННЫЕ КОМПЛЕКСЫ ПЛАТИНЫ, ПРОЯВЛЯЮЩИЕ ПРОТИВООПУХОЛЕВУЮ АКТИВНОСТЬ, СПОСОБ ИХ ПОЛУЧЕНИЯ И ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ, СОДЕРЖАЩИЕ ЭТИ КОМПЛЕКСЫ | 1995 |
|
RU2130941C1 |

Изобретение относится к новым комплексам платины (IV), а именно к комплексу платины (IV) с геометрической конфигурацией цис-(аммин,1-адамантиламин)-транс-бис(1-адамантилкарбоксилат)-цис-(хлорид,X) Pt (IV) общей формулы (III), где X является конъюгированным анионом сильной минеральной или органической кислоты и где Х выбран из группы, состоящей из нитрата, монохлорацетата и трифторацетата. Также предложены способ получения указанных новых комплексов платины (IV), фармацевтическая композиция и способ лечения опухолевого заболевания. Предложенные комплексы платины (IV) обладают повышенной противоопухолевой эффективностью, и могут применяться для лечения, предпочтительно, тяжело поддающегося лечению рака, наиболее предпочтительно, рака поджелудочной железы. 4 н. и 11 з.п. ф-лы, 3 ил., 6 табл., 5 пр.

(III)
1. Комплекс платины (IV) с геометрической конфигурацией цис-(аммин,1-адамантиламин)-транс-бис(1-адамантилкарбоксилат)-цис-(хлорид,X) Pt (IV) общей формулы (III):

(III)
где X является конъюгированным анионом сильной минеральной или органической кислоты
и где Х выбран из группы, состоящей из нитрата, монохлорацетата и трифторацетата.
2. Способ получения комплекса платины (IV) по п. 1, включающий следующие стадии получения:
а) взаимодействие исходного комплекса платины (IV) с геометрической конфигурацией цис-(аммин,1-адамантиламин)-транс-бис(1-адамантилкарбоксилат)-цис-(хлорид, иодид) Pt (IV) со стехиометрическим избытком серебряной соли сильной кислоты, в смеси хлорированного углеводородного растворителя, и соответствующей сильной кислоты при температуре кипения растворителя в течение времени реакции, необходимого для превращения с получением смеси;
b) удаление твердой фазы из смеси фильтрацией с получением неочищенного фильтрата;
с) промывка неочищенного фильтрата водой и сушка отделенной органической фазы;
d) удаление растворителя из высушенной органической фазы выпариванием с получением комплекса платины (IV) по п. 1.
3. Способ по п. 2, где на стадии а) хлорированный углеводородный растворитель представляет собой хлороформ.
4. Способ по п. 2 или 3, включающий дополнительную стадию:
е) растворение комплекса платины (IV) в ацетоне, добавление активированного угля, ультрафильтрация полученной суспензии и осаждение полученного ультрафильтрованного раствора чистого комплекса платины (IV) в большом количестве воды с получением чистого комплекса платины (IV) по п. 1 в виде наночастиц.
5. Комплекс платины (IV) по п. 1 для применения в способе лечения опухолевого заболевания, предпочтительно, тяжело поддающегося лечению рака, наиболее предпочтительно, рака поджелудочной железы, предпочтительно, путем перорального введения.
6. Фармацевтическая композиция для лечения опухолевых заболеваний, содержащая комплекс Pt (IV) по п. 1 и фармацевтически приемлемый носитель.
7. Фармацевтическая композиция по п. 6, отличающаяся тем, что фармацевтически приемлемым носителем является самоэмульгирующийся носитель, предпочтительно, глицериды стеароил макрогола, наиболее предпочтительно, Gelucire 50/13.
8. Фармацевтическая композиция по п. 6 или 7, отличающаяся тем, что комплекс платины (IV) присутствует в виде наночастиц.
9. Фармацевтическая композиция по п. 7 или 8, отличающаяся тем, что массовая доля самоэмульгирующегося носителя составляет более 80% мас.
10. Фармацевтическая композиция по любому из пп. 6-9, отличающаяся тем, что фармацевтическая композиция помещена в кислоторезистентные капсулы, предпочтительно, капсулы из фталата гидроксипропилметилцеллюлозы или ацетата сукцината гидроксиперопилметилцеллюлозы.
11. Фармацевтическая композиция по любому из пп. 6-10 для применения в способе лечения опухолевого заболевания, предпочтительно, тяжело поддающегося лечению рака, наиболее предпочтительно, рака поджелудочной железы, предпочтительно, путем перорального введения.
12. Способ лечения опухолевых заболеваний у субъекта, нуждающегося в этом, включающий введение комплекса платины (IV) по п. 1 или фармацевтической композиции по любому из пп. 6-10.
13. Способ лечения по п. 12, включающий пероральное введение комплекса.
14. Способ лечения по п. 12 или 13, где заболевание представляет собой тяжело поддающийся лечению рак.
15. Способ лечения по любому из пп. 12-14, где заболевание представляет собой рак поджелудочной железы.
| WO 2016034214 A1, 10.03.2016 | |||
| WO 2014100417 A1, 26.06.2014 | |||
| KASPAROVA J | |||
| et al., Molecular Aspects of Antitumor Effects of a New Platinum(IV) Drug, Molecular Pharmacology, 2006, v | |||
| Деревянный торцевой шкив | 1922 |
|
SU70A1 |
| Кипятильник для воды | 1921 |
|
SU5A1 |
| Приспособление для укрепления цилиндров в станинах вертикальных машин внутреннего горения | 1925 |
|
SU1708A1 |
| КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ ПЛАТИНЫ, СПОСОБЫ ИХ ПОЛУЧЕНИЯ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 1999 |
|
RU2200164C2 |
| ПАТЕНТ.ЧС - <:ТЕлиичЕс;:.-"b>&ibA(?uid;A | 0 |
|
SU328274A1 |
Авторы
Даты
2023-08-30—Публикация
2019-09-05—Подача