Информация по родственным заявкам
[0001] Настоящая заявка заявляет приоритет предварительной заявки на патент США № 62/516432, поданной 7 июня 2017 г., и предварительной заявки на патент США № 62/531626, поданной 12 июля 2017 г. Содержание вышеуказанных заявок в полном объеме включено здесь посредством ссылки, включая весь текст, таблицы, список последовательностей и фигуры.
Область техники, к которой относится изобретение
[0002] Настоящее изобретение относится к области трансдукции (трансфекции) клеток нуклеиновой кислотой, например, плазмидами. Более конкретно, изобретение относится к композициям и способам получения трансдуцированных (трансфектированных) клеток, где указанные клетки необязательно продуцируют аденоассоциированный вирусный вектор (rAAV).
Введение
[0003] Несколько публикаций и патентных документов цитируются по всему тексту заявки для описания уровня области техники, к которой относится настоящее изобретение. Каждый из этих цитированных документов включен здесь посредством ссылки, как если бы он был изложен в полном объеме.
Сущность изобретения
[0004] Изобретение обеспечивает композиции и способы для трансфекции клеток, по меньшей мере, одной последовательностью нуклеиновой кислоты. В одном варианте осуществления композиция или способ трансфекции включают: (а) контактирование клеток, по меньшей мере, с одной нуклеиновой кислотой, составленной с раствором, содержащим полиэтиленимин (PEI); (b) инкубирование или культивирование клеток с нуклеиновой кислотой и раствором полиэтиленимина (PEI); (с) добавление усиливающего агента во время или сразу же после стадии (а) или до, но менее чем через 3 ч после стадии (а) с получением смеси; и (d) инкубирование указанной смеси со стадии (с), обеспечивая тем самым трансфекцию клеток последовательностью нуклеиновой кислоты.
[0005] Изобретение также обеспечивает композиции и способы получения клеток, которые продуцируют рекомбинантные вирусные векторы, такие как вектор rAAV. В одном варианте осуществления композиция или способ включает: (а) обеспечение смеси PEI/плазмида из компонентов (i), (ii) и (iii), в которой (i) представляет одну или более плазмид, содержащих нуклеиновые кислоты, кодирующие упаковочные белки AAV и/или нуклеиновые кислоты, кодирующие хелперные белки; (ii) представляет собой плазмиду, содержащую трансген, который кодирует белок или транскрибируется в представляющий интерес транскрипт; и (iii) представляет раствор полиэтиленимина (PEI), (b) контактирование клеток со смесью плазмида/PEI со стадии (а) с получением клеточной культуры со смесью плазмида/PEI; (с) добавление усиливающего агента к клеточной культуре со смесью плазмида/PEI с получением второй смеси; и (d) инкубирование указанной второй смеси со стадии (с) с получением трансфектированных клеток, которые продуцируют рекомбинантный вектор rAAV.
[0006] В различных дополнительных вариантах осуществления изобретения композиции и способы включают одну или более дополнительных необязательных стадий.
[0007] В конкретном аспекте дополнительная стадия включает (e) сбор указанных трансфектированных клеток, полученных на стадии (d), и/или культуральной среды из трансфектированных клеток, полученных на стадии (d), с получением сбора клеток и/или культуральной среды.
[0008] В конкретном аспекте дополнительная необязательная стадия включает (е) культивирование, экспансию, выделение или селекцию клеток, которые были трансфектированы нуклеиновой кислотой или плазмидами.
[0009] В конкретном аспекте дополнительная необязательная стадия включает (е) выделение и/или очистку рекомбинантного вектора AAV из трансфектированных клеток, полученных на стадии (d), и/или культуральной среды и/или из трансфектированных клеток, полученных на стадии (d).
[0010] В конкретном аспекте дополнительная необязательная стадия включает (f) выделение и/или очистку рекомбинантного вектора AAV из трансфектированных клеток и/или сбора культуральной среды, полученного на стадии (e).
[0011] В еще одном варианте осуществления последовательность(и) нуклеиновой кислоты содержит вектор и/или плазмиду.
[0012] В еще одном варианте осуществления последовательность(и) нуклеиновой кислоты содержит вирусный вектор и/или вирусную плазмиду. В конкретном аспекте вирусный вектор или вирусная плазмида включает лентивирусный вектор или плазмиду или аденоассоциированный вирусный вектор (AAV) или плазмиду.
[0013] В еще одном варианте осуществления вектор содержит трансген, который кодирует белок или транскрибируется в представляющий интерес транскрипт. В конкретном аспекте трансген кодирует фактор свертывания крови дикого типа или функциональный вариант, apoЕ2, ТРР1, аргининосукцинатсинтазу, медь-транспортирующую АТФазу 2, кислую альфа-глюкозидазу, β-глюкоцереброзидазу, α-галактозидазу или С1-ингибитор сериновой протеазы. В конкретном аспекте фактор свертывания крови дикого типа или функциональный вариант представляет собой фактор VII, фактор VIII или фактор IX.
[0014] В еще одном варианте осуществления усиливающий агент добавляют до стадии (а), во время стадии (а) или сразу же после стадии (а).
[0015] В еще одном варианте осуществления усиливающий агент добавляют до стадии (а), во время стадии (а) или не более чем через 16 ч после стадии (а).
[0016] В еще одном варианте осуществления усиливающий агент добавляют до стадии (а), во время стадии (а) или до, но не менее чем через 3 ч после стадии (а).
[0017] В еще одном варианте осуществления усиливающий агент добавляют до стадии (а), во время стадии (а), усиливающий агент добавляют два или более раз до или после стадий (а) или (b).
[0018] В еще одном варианте осуществления усиливающий агент сначала добавляют во время или сразу же после стадии (а) или не более чем через 16 ч после стадии (а) и снова добавляют через 16-72 ч после стадий (а) или (b), или снова добавляют через 16-48 ч после стадий (а) или (b), или снова добавляют через 16-24 ч после стадий (а) или (b).
[0019] В еще одном варианте осуществления усиливающий агент сначала добавляют во время или сразу же после стадии (а) или до, но не менее чем через 3 ч после стадии (а), и снова добавляют через 12-72 ч после стадий (а) или (b), или снова добавляют через 12-48 ч после стадий (a) или (b), или снова добавляют через 12-24 ч после стадий (a) или (b).
[0020] В еще одном варианте осуществления усиливающий агент сначала добавляют за 12-72 ч до стадии (а) и снова добавляют во время или сразу же после стадии (а) или не более чем через 16 ч после стадии (а).
[0021] В еще одном варианте осуществления усиливающий агент сначала добавляют за 12-72 ч до стадии (а) и снова добавляют во время или сразу же после стадии (а) или до, но не менее чем через 3 ч после стадии (а).
[0022] В еще одном варианте осуществления плазмиды (i) и (ii) находятся в диапазоне молярных соотношений примерно от 1:0,01 до примерно 1:100, или в диапазоне молярных соотношений примерно от 100:1 до примерно 1:0,01, и где смесь компонентов (i), (ii) и (iii) необязательно инкубируют в течение периода времени примерно от 10 с до примерно 4 ч перед стадией (b).
[0023] В еще одном варианте осуществления нуклеиновая кислота или плазмиды находятся в массовом соотношении PEI:нуклеиновая кислота или PEI:плазмида в диапазоне примерно от 0,1:1 до примерно 5:1 или массовом соотношении PEI:нуклеиновая кислота или PEI:плазмида в диапазоне примерно от 5:1 до примерно 0,1:1.
[0024] В еще одном варианте осуществления нуклеиновая кислота или плазмиды находятся в массовом соотношении PEI:нуклеиновая кислота или PEI:плазмида в диапазоне примерно от 1:1 до примерно 5:1 или в массовом соотношении PEI:нуклеиновая кислота или PEI:плазмида в диапазоне примерно от 5:1 до примерно 1:1.
[0025] В еще одном варианте осуществления нуклеиновая кислота или плазмиды находятся в массовом соотношении PEI:нуклеиновая кислота или PEI:плазмида в диапазоне примерно от 1:1 до примерно 3:1.
[0026] В еще одном варианте осуществления нуклеиновая кислота или плазмиды находятся в массовом соотношении PEI:нуклеиновая кислота или PEI:плазмида в диапазоне примерно 1:1, примерно 1,5:1, примерно 2:1, примерно 2,5:1 или примерно 3:1.
[0027] В еще одном варианте осуществления композиции или способы дополнительно включают добавление свободного PEI к клеткам.
[0028] В еще одном варианте осуществления свободный PEI добавляют к клеткам до, во время или после стадий (а) или (b), или до или во время или после стадии (с).
[0029] В еще одном варианте осуществления свободный PEI добавляют к клеткам во время или после стадий (а) или (b) или во время или после стадии (с).
[0030] В еще одном варианте осуществления свободный PEI добавляют так, чтобы массовое соотношение PEI:нуклеиновая кислота или PEI:плазмида находилось в диапазоне примерно от 0,1:1 до примерно 5:1 или в диапазоне примерно от 5:1 до примерно 0,1:1.
[0031] В еще одном варианте осуществления свободный PEI добавляют так, чтобы массовое соотношение PEI:нуклеиновая кислота или PEI:плазмида находилось в диапазоне примерно от 1:1 до примерно 5:1 или в диапазоне примерно от 5:1 до примерно 1:1.
[0032] В еще одном варианте осуществления PEI в смеси PEI:нуклеиновая кислота и/или PEI:плазмида и/или свободный PEI содержит линейный полиэтиленимин.
[0033] В еще одном варианте осуществления PEI в смеси PEI:нуклеиновая кислота и/или PEI:плазмида и/или свободный PEI содержит гидролизованный линейный полиэтиленимин.
[0034] В еще одном варианте осуществления PEI в смеси PEI:нуклеиновая кислота и/или PEI:плазмида и/или свободный PEI содержит гидролизованный линейный полиэтиленимин с молекулярной массой в диапазоне примерно от 4000 до примерно 160000 и/или с молекулярной массой в диапазоне примерно от 2500 до примерно 250000 в форме свободного основания.
[0035] В еще одном варианте осуществления PEI в смеси PEI:нуклеиновая кислота и/или PEI:плазмида и/или свободный PEI содержит гидролизованный линейный полиэтиленимин с молекулярной массой примерно 40000 и/или с молекулярной массой примерно 25000 в форме свободного основания.
[0036] В еще одном варианте осуществления молярное соотношение азота (N) в общем PEI к фосфату (P) в смеси нуклеиновая кислота:PEI и/или плазмида:PEI находится в диапазоне примерно от 1:1 до примерно 50:1 (N:P).
[0037] В еще одном варианте осуществления молярное соотношение азота (N) в общем PEI к фосфату (P) в смеси нуклеиновая кислота:PEI и/или плазмида:PEI составляет примерно от 5:1 до примерно 10:1.
[0038] В еще одном варианте осуществления молярное соотношение азота (N) в общем PEI к фосфату (P) в смеси нуклеиновая кислота:PEI и/или плазмида:PEI равно любому из примерно 5:1, 6:1, 7:1, 8:1, 9:1 или 10:1 (N:P).
[0039] В еще одном варианте осуществления количество свободного PEI составляет примерно от 10% до примерно 90% от общего PEI.
[0040] В еще одном варианте осуществления количество свободного PEI составляет примерно от 25% до примерно 75% от общего PEI.
[0041] В еще одном варианте осуществления количество свободного PEI составляет примерно 50% от общего PEI.
[0042] В еще одном варианте осуществления концентрация свободного PEI составляет примерно от 0,1 мкг/мл до примерно 10 мкг/мл.
[0043] В еще одном варианте осуществления концентрация свободного PEI составляет примерно от 1,0 мкг/мл до примерно 5 мкг/мл.
[0044] В еще одном варианте осуществления раствор PEI и/или свободный PEI содержит раствор, имеющий рН примерно от 7,0 до примерно 8,0.
[0045] В еще одном варианте осуществления последовательность нуклеиновой кислоты и PEI инкубируют вместе в течение примерно от 10 с до примерно 4 ч перед стадией (а).
[0046] В еще одном варианте осуществления последовательность нуклеиновой кислоты и PEI инкубируют вместе в течение примерно от 30 с до примерно 4 ч перед стадией (а).
[0047] В еще одном варианте осуществления последовательность нуклеиновой кислоты и PEI инкубируют вместе в течение примерно от 1 мин до примерно 30 мин перед стадией (а).
[0048] В еще одном варианте осуществления смесь компонентов (i), (ii) и (iii) инкубируют вместе в течение примерно от 10 с до примерно 4 ч перед стадией (b).
[0049] В еще одном варианте осуществления смесь компонентов (i), (ii) и (iii) инкубируют вместе в течение примерно от 30 с до примерно 4 ч перед стадией (b).
[0050] В еще одном варианте осуществления смесь компонентов (i), (ii) и (iii) инкубируют вместе в течение примерно от 1 мин до примерно 4 ч перед стадией (b).
[0051] В еще одном варианте осуществления инкубация на стадии (d) составляет, по меньшей мере, примерно 4 ч.
[0052] В еще одном варианте осуществления инкубация на стадии (d) составляет примерно от 4 ч до примерно 140 ч.
[0053] В еще одном варианте осуществления инкубация на стадии (d) составляет примерно от 4 ч до примерно 96 ч.
[0054] В еще одном варианте осуществления клетки включают клетки млекопитающих. В конкретных аспектах клетки представляют собой клетки эмбриональной почки человека (HEK) или клетки яичника китайского хомячка (CHO). В конкретных аспектах клетки включают клетки эмбриональной почки человека (HEK) 293. В конкретных аспектах клетки представляют клетки HEK 293E, HEK 293F или HEK 293T.
[0055] В еще одном варианте осуществления клетки стабильно или транзиентно трансфектированы.
[0056] В еще одном варианте осуществления клетки находятся в суспензионной культуре.
[0057] В еще одном варианте осуществления клетки являются прикрепленными к субстрату.
[0058] В еще одном варианте осуществления клетки культивируют или поддерживают в бессывороточной культуральной среде.
[0059] В еще одном варианте осуществления клетки имеют плотность в диапазоне примерно от 1×105 клеток/мл до примерно 1×108 клеток/мл при контактировании с указанной последовательностью нуклеиновой кислоты или указанной смесью плазмида/PEI и/или при контактировании с указанным свободным PEI.
[0060] В еще одном варианте осуществления клетки имеют плотность в диапазоне примерно от 5×105 клеток/мл до примерно 1×107 клеток/мл при контактировании с указанной последовательностью нуклеиновой кислоты или указанной смесью плазмида/PEI и/или при контактировании с указанным свободным PEI.
[0061] В еще одном варианте осуществления изобретения клетки имеют плотность в диапазоне примерно от 1×106 клеток/мл до примерно 5×106 клеток/мл при контактировании с указанной последовательностью нуклеиновой кислоты или указанной смесью плазмида/PEI и/или при контактировании с указанным свободным PEI.
[0062] В еще одном варианте осуществления жизнеспособность клеток при контактировании с указанной последовательностью нуклеиновой кислоты или смесью плазмида/PEI или с указанным свободным PEI составляет примерно 60% или более 60%, или где указанные клетки находятся в логарифмической фазе роста при контактировании с указанной последовательностью нуклеиновой кислоты или смесью плазмида/PEI.
[0063] В еще одном варианте осуществления жизнеспособность клеток при контактировании с указанной последовательностью нуклеиновой кислоты или смесью плазмида/PEI или с указанным свободным PEI составляет примерно 90% или более 90%, или где указанные клетки находятся в логарифмической фазе роста при контактировании с указанной последовательностью нуклеиновой кислоты или смесью плазмида/PEI или с указанным свободным PEI.
[0064] В еще одном варианте осуществления общее количество последовательности нуклеиновой кислоты или плазмиды находится в диапазоне примерно от 0,1 мкг до примерно 15 мкг на мл клеток.
[0065] В еще одном варианте осуществления молярное соотношение плазмиды, содержащей трансген, к одной или более плазмидам, содержащим нуклеиновые кислоты, кодирующие упаковочные белки AAV, и/или нуклеиновые кислоты, кодирующие хелперные белки, составляет примерно от 1:5 до примерно 1:1, или составляет примерно от 1:1 до примерно 5:1.
[0066] В еще одном варианте осуществления одна или более плазмид содержат первую плазмиду, содержащую нуклеиновые кислоты, кодирующие упаковочные белки AAV, и вторую плазмиду, содержащую нуклеиновые кислоты, кодирующие хелперные белки.
[0067] В еще одном варианте осуществления молярное соотношение плазмиды, содержащей трансген, к первой плазмиде, содержащей нуклеиновые кислоты, кодирующие упаковочные белки AAV, ко второй плазмиде, содержащей нуклеиновые кислоты, кодирующие хелперные белки, находится в диапазоне примерно 1-5: 1:1, или 1:1-5:1, или 1:1:1-5.
[0068] В еще одном варианте осуществления кодированные упаковочные белки AAV включают AAV rep и/или AAV cap.
[0069] В еще одном варианте осуществления кодированные упаковочные белки AAV включают белки AAV rep и/или AAV cap любого серотипа AAV.
[0070] В еще одном варианте осуществления кодированные хелперные белки включают аденовирусные E2 и/или E4, белки VARNA и/или хелперные белки, не относящиеся к AAV.
[0071] В еще одном варианте осуществления рекомбинантный вектор AAV содержит любой из серотипов AAV 1-12, капсидный белок AAV VP1, VP2 и/или VP3 или модифицированный или вариантный капсидный белок AAV VP1, VP2 и/или VP3, или капсидный белок AAV VP1, VP2 и/или VP3 дикого типа.
[0072] В еще одном варианте осуществления аденоассоциированный вирусный вектор (AAV) содержит последовательность капсидного белка VP1, VP2 и/или VP3 или последовательность инвертированного концевого повтора, имеющую 70% или более идентичность последовательности с последовательностью капсидного белка или последовательностью инвертированного концевого повтора (ITR) любой последовательности капсидного белка или ITR, выбранных из серотипов AAV1, AAV2, AAV3, AAV4, AAV5, AAV6, AAV7, AAV8, AAV9 и AAV10.
[0073] В еще одном варианте осуществления аденоассоциированный вирусный вектор (AAV) содержит последовательность капсидного белка VP1, VP2 и/или VP3, имеющую 70% или более идентичность последовательности с последовательностью капсидного белка, выбранной из SEQ ID NO: 1 и SEQ ID NO: 2.
[0074] В еще одном варианте осуществления вектор AAV включает серотип AAV или псевдотип AAV, где указанный псевдотип AAV содержит капсидный серотип AAV, отличный от серотипа ITR.
[0075] В еще одном варианте осуществления вектор AAV содержит капсидный белок VP1, VP2 и/или VP3 или инвертированный концевой повтор любого серотипа, выбранного из AAV1, AAV2, AAV3, AAV4, AAV5, AAV6, AAV7, AAV8, AAV9, AAV10, SEQ ID NO: 1 и SEQ ID NO: 2.
[0076] В еще одном варианте осуществления вектор AAV дополнительно содержит интрон, элемент контроля экспрессии, один или более инвертированных концевых повторов (ITR) аденоассоциированного вируса (AAV) и/или полинуклеотидную последовательность-наполнитель.
[0077] В еще одном варианте осуществления интрон находится внутри или фланкирует нуклеиновую кислоту, которая кодирует белок, или транскрибируется в представляющий интерес транскрипт.
[0078] В еще одном варианте осуществления элемент контроля экспрессии операбельно связан с нуклеиновой кислотой, которая кодирует белок или транскрибируется в представляющий интерес транскрипт.
[0079] В еще одном варианте осуществления AAV ITR(s) фланкируют 5'- или 3'-конец нуклеиновой кислоты, которая кодирует белок или транскрибируется в представляющий интерес транскрипт.
[0080] В еще одном варианте осуществления, полинуклеотидная последовательность-наполнитель фланкирует 5'- или 3'-конец нуклеиновой кислоты, которая кодирует белок или транскрибируется в представляющий интерес транскрипт.
[0081] В еще одном варианте осуществления элемент контроля экспрессии включает конститутивный или регулируемый контрольный элемент или тканеспецифический контрольный элемент экспрессии или промотор.
[0082] В еще одном варианте осуществления элемент контроля экспрессии включает элемент, который обеспечивает экспрессию в печени.
[0083] В еще одном варианте осуществления ITR включает один или более ITR любого из серотипов AAV2 или AAV6 или их комбинацию.
[0084] В еще одном варианте осуществления клетки субкультивируют до восстановленной плотности клеток перед контактированием с указанной последовательностью нуклеиновой кислоты или смесью плазмида/PEI.
[0085] В еще одном варианте осуществления клетки субкультивируют до плотности клеток в диапазоне примерно от 0,1×105 клеток/мл до примерно 5,0×106 клеток/мл до контактирования с указанной последовательностью нуклеиновой кислоты или смесью плазмида/PEI.
[0086] В еще одном варианте осуществления клетки контактируют с указанной последовательностью нуклеиновой кислоты или смесью плазмида/PEI в течение периода от 2 суток до 5 суток после субкультивирования.
[0087] В еще одном варианте осуществления клетки контактируют с указанной последовательностью нуклеиновой кислоты или смесью плазмида/PEI в течение периода от 3 суток до 4 суток после субкультивирования.
[0088] В еще одном варианте осуществления количество последовательности нуклеиновой кислоты или плазмид, вставленных в указанные трансфектированные клетки, по меньшей мере, на 50% больше на стадии добавления свободного PEI в клеточную культуру по сравнению с вариантом без добавления свободного PEI в клеточную культуру.
[0089] В еще одном варианте осуществления количество последовательности нуклеиновой кислоты или плазмид, вставленных в указанные трансфектированные клетки, по меньшей мере, на 50% больше со стадией добавления усиливающего агента по сравнению с вариантом без добавления усиливающего агента.
[0090] В еще одном варианте осуществления количество продуцированного рекомбинантного вектора AAV составляет, по меньшей мере, 50% или более со стадией добавления свободного PEI к культуре клеток со смесью плазмида/PEI по сравнению с вариантом без добавления свободного PEI к культуре клеток со смесью плазмида/PEI.
[0091] В еще одном варианте осуществления количество продуцированного рекомбинантного вектора AAV в 1-5, 5-8, 8-10 или 10-20 раз больше со стадией добавления свободного PEI к культуре клеток со смесью плазмида/PEI по сравнению с вариантом без добавления свободного PEI к культуре клеток со смесью плазмида/PEI.
[0092] В еще одном варианте осуществления количество продуцированного рекомбинантного вектора AAV в 1-5, 5-8, 8-10 или 10-15 раз больше со стадией добавления усиливающего агента по сравнению с вариантом без добавления усиливающего агента в клеточную культуру со смесью плазмида/PEI.
[0093] В еще одном варианте осуществления клетки находятся в объеме культуры примерно 10-500 мл, 500 мл-2 л, 2-20 л, 20-50 л, 50-100 л, 100-500 л, 500-1000 л или 1000-2000 л.
[0094] В еще одном варианте осуществления трансген имеет размер примерно от 4,0 т.п.н. до примерно 6,0 т.п.н.
[095] В еще одном варианте осуществления трансген имеет размер примерно от 4,5 т.п.н. до примерно 6,0 т.п.н.
[0096] В еще одном варианте осуществления трансген имеет размер примерно от 4,5 т.п.н. до примерно 5,5 т.п.н.
[0097] В еще одном варианте осуществления трансген имеет размер примерно от 4,5 т.п.н. до примерно 5,0 т.п.н.
[0098] В еще одном варианте осуществления усиливающий агент включает вальпроевую кислоту, ее соль или производное. В конкретном аспекте соль вальпроевой кислоты включает соль натрия или калия. В конкретном аспекте производное вальпроевой кислоты включает аминокислоту, связанную или конъюгированную с ней.
[0099] В еще одном варианте осуществления усиливающий агент включает изомасляную кислоту, ее соль или производное. В конкретном аспекте соль изомасляной кислоты включает соль натрия или калия. В конкретном аспекте производное изомасляной кислоты включает аминокислоту, связанную или конъюгированную с ней.
[0100] В еще одном варианте осуществления усиливающий агент включает изовалериановую кислоту, ее соль или производное. В конкретном аспекте соль изовалериановой кислоты включает соль натрия или калия. В конкретном аспекте производное изовалериановой кислоты включает аминокислоту, связанную или конъюгированную с ней.
[0101] В еще одном варианте осуществления после добавления усиливающий агент(ы) находится в концентрации примерно от 0,1 мМ до примерно 25 мМ.
[0102] В еще одном варианте осуществления после добавления усиливающий агент(ы) находится в концентрации примерно от 0,5 мМ до примерно 10 мМ.
[0103] В еще одном варианте осуществления после добавления усиливающий агент(ы) находится в концентрации примерно от 0,5 мМ до примерно 5 мМ.
[0104] В еще одних вариантах осуществления после добавления усиливающий агент(ы) находится в концентрации примерно от 1 мМ до примерно 10 мМ, примерно от 1 мМ до примерно 9 мМ, примерно от 1 мМ до примерно 8 мМ, примерно от 1 мМ до примерно 7 мМ, примерно от 1 мМ до примерно 6 мМ, примерно от 1 мМ до примерно 5 мМ, примерно от 1 мМ до примерно 4 мМ, примерно от 1 мМ до примерно 3 мМ или примерно от 1 мМ до примерно 2 мМ.
[0105] В еще одних вариантах осуществления любая из стадий (a)-(f) или условий, изложенных в любом из пунктов формулы изобретения 1-94, выполняется, как изложено в любом из примеров 1-7.
Краткое описание фигур
[0106] На фиг. 1 показано сравнение продукции вектора rAAV-FVIII. Клетки HEK 293F во вращающихся колбах трансфектировали тремя плазмидами: хелперной плазмидой pAd, содержащей гены хелперов из аденовируса для продукции rAAV; pAAV rep/cap экспрессирует гены Rep и Cap AAV; pAAVhFVIII, содержащей экспрессионную кассету человеческого фактора VIII, фланкированную ITR AAV. Общее количество использованной ДНК составляло 1,86 мкг/мл с молярным соотношением 1:1:1. Соотношение PEI/ДНК 1:1 (по массе) использовали для приготовления комплекса PEI/ДНК и трансфекции клеток. Дополнительный свободный PEI (такое же количество, которое использовали для приготовления комплекса PEI/ДНК) также добавляли к клеточной культуре по отдельности при трансфекции. Усилители 1 и 2 из набора для трансфекции ExpiFectamine™ 293 добавляли к клеткам либо одновременно с трансфекцией, либо через 16-18 ч после трансфекции (в соответствии с инструкциями изготовителя). Усилители 1 и 2 использовали в соотношении 1:200 и 1:20 к объему культуры соответственно. Клеточную культуру собирали через 72 ч после трансфекции и определяли вектор rAAV-FVIII с помощью анализа кПЦР. Титр вектора rAAV-FVIII был в 2-3 раза выше при добавлении усилителей во время трансфекции по сравнению с добавлением усилителей через 16 ч после трансфекции или без добавления усилителей.
[0107] На фиг. 2 показана оптимизация продукции вектора rAAV-FVIII с использованием различных количеств ДНК и соотношений PEI/ДНК. Клетки НЕК 293F во вращающихся колбах трансфектировали общим количеством ДНК 1,2, 1,86 или 2,8 мкг/мл ДНК, соответственно, с использованием трех плазмид. Соотношение плазмидной ДНК было таким же, как описано выше. Однако соотношения PEI/ДНК, используемые в данном исследовании, составляли 1:1, 1,5:1, 2:1, 2,5:1 и 3:1. Концентрация использованного свободного PEI составляла 1,5 мкг/мл. Усилители 1 и 2 из набора для трансфекции ExpiFectamine™ 293 использовали, как описано выше. Плотность клеток при трансфекции составляла 2-3×106 клеток/мл. Образцы отбирали через 48 ч (#) или 72 ч (*) после трансфекции и определяли титр вектора rAAV с помощью анализа кПЦР. Самые высокие выходы вектора rAAV наблюдали в условиях с 1,2 мкг/мл ДНК при соотношении PEI/ДНК 2-2,5:1 и с усилителями.
[0108] На фиг. 3 подтверждается наличие продукции вектора rAAV-FVIII в биореакторе. Клетки HEK 293F культивировали в биореакторах в объеме 400 мл и трансфектировали тремя плазмидами (общее количество плазмидной ДНК составляло 1,2 или 2,8 мкг/мл). Использовали молярное соотношение плазмидной ДНК 1:1:1, соотношение PEI/ДНК (по массе) 1,5:1, 2:1, 2,5:1 и 3:1. Свободный PEI в концентрации 1,5 мкг/мл и усилители 1 и 2 также использовали, как описано выше. Плотность клеток при трансфекции составляла 2-3×106 клеток/мл. Наиболее высокая продукция вектора (данные кПЦР) наблюдали в условиях с 1,2 мкг/мл общей ДНК с соотношениями PEI/ДНК 2,5-3:1.
[0109] На фиг. 4 показано, что высокая продукция вектора rAAV сохраняется при полном масштабировании биореактора DASGIP. Оптимизированные условия трансфекции дополнительно оценивали в отношении продукции rAAV в объеме 1,2 л, полном масштабировании биореактора DASGIP. Клетки HEK 293F культивировали в биореакторах DASGIP в объеме 1,2 л с 2 или 3 наклонными импеллерными мешалками при скорости перемешивания 130 об/мин, 150 об/мин и 170 об/мин. Клетки трансфектировали тремя плазмидами с общей плазмидной ДНК 1,2 мкг/мл, для получения комплекса PEI/ДНК использовали соотношение PEI/ДНК 2,5:1; молярное соотношение ДНК и количество свободного PEI и усилителей трансфекции были, как описано выше. Данные кПЦР показали, что продукция вектора в объеме 1,2 л оставалась сопоставимой с таковой, наблюдаемой в меньших объемах, указывая на то, что оптимизированная трансфекция может масштабироваться. Не желая связываться с какой-либо теорией, на основании данных кПЦР можно предположить, что высокая скорость перемешивания может дополнительно повысить продукцию вектора.
[0110] На фиг.5 показано, что один усилитель 1 повышал продукцию rAAV до того же уровня, который получали при использовании обоих усилителей 1 и 2. Для дальнейшей оптимизации способа получения rAAV проводили исследования с использованием только одного усилителя: только усилителя 1 или только усилителя 2 при трансфекции, для сравнения продукции вектора с таковой при использовании обоих усилителей. Данные кПЦР показали, что продукция rAAV при использовании усилителя 1 была сопоставима с таковой при использовании обоих усилителей 1 и 2. Однако усилитель 2 приводил к снижению продукции rAAV, свидетельствуя о том, что усилитель 2 не оказывает положительного влияния на продукцию rAAV. Кроме того, уменьшение количества усилителей 1 и 2 при трансфекции приводило к снижению титра rAAV.
[0111] На фиг. 6 показано, что повторное использование усилителей 1 и 2 как при трансфекции (TF), через 24 ч или через 48 ч после трансфекции, или использование усилителей 1 и 2 повторно три раза, при трансфекции и через 24 ч и 48 ч после трансфекции несколько повышало титры RAAV. Усилители 1 и 2 использовали в соотношении 1:200 и 1:20 к объему культуры, соответственно, сначала при трансфекции. Дополнительное количество усилителей 1 и 2 добавляли через 24 ч или через 48 ч, или через 24 ч и через 48 ч после трансфекции в клеточную культуру. Условия трансфекции, использованные в данном исследовании, приведены на фиг. 5. Данные кПЦР показали, что продукция вектора rAAV несколько увеличилась (менее чем в 1 раз) при повторном использовании усилителей.
[0112] На фиг.7 приведены данные, указывающие на усиление продукции rAAV вальпроевой кислотой. Клетки HEK 293F во вращающейся колбе трансфектировали тремя плазмидами, используя метод трансфекции с PEI, как описано выше. В данном исследовании не использовали усилители из набора для трансфекции ExpiFectamine™ 293. Вальпроевую кислоту в различных концентрациях добавляли к клеткам при трансфекции. Клетки трансфектировали 1,2 мкг/мл общей ДНК трех плазмид, молярное соотношение ДНК трех плазмид составляло 1:1:1, соотношение PEI/ДНК (по массе) составляло 2:1, и использовали 1,5 мкг/мл свободного PEI. Оценивали эффективность вальпроевой кислоты в количестве от 0,25 до 2 мМ. Данные кПЦР показали, что при использовании 2 мМ вальпроевой кислоты при трансфекции наблюдается увеличение продукции вектора rAAV в 10 раз по сравнению с количеством вектора, продуцированного в отсутствии вальпроевой кислоты.
[0113] На фиг. 8 показана продукция вектора rAAV-FVIII при использовании вальпроевой кислоты в различных концентрациях, что определяли с помощью кПЦР. Вальпроевую кислоту в количестве от 2 до 8 мМ (2 мМ, 3 мМ, 4 мМ, 5 мМ, 6 мМ, 7 мМ и 8 мМ) использовали при трансфекции клеток HEK 293F при культивировании в биореакторе емкостью 1 л. Вальпроевая кислота в концентрации ≥4 мМ приводила к повышению продукции вектора AAV в 1,2-1,8 раза по сравнению с 2 мМ вальпроевой кислоты. В данном исследовании использовали 1,2 мкг/мл ДНК, молярное соотношение ДНК 1:1:1, массовое соотношение PEI/ДНК 2,5 и 1,5 мкг/мл свободного PEI.
Подробное описание изобретения
[0114] В данном документе раскрываются композиции и способы трансдукции клеток молекулой, такой как нуклеиновая кислота (например, плазмида), с высокой эффективностью. Такие трансдуцированные с высокой эффективностью клетки могут, когда они трансдуцированы нуклеиновой кислотой (плазмидой), которая кодирует белок или содержит последовательность, которая транскрибируется в представляющий интерес транскрипт, могут продуцировать белок и/или транскрипт с высокой эффективностью. Кроме того, такие клетки, когда они трансдуцированы последовательностями, такими как плазмиды, которые кодируют вирусные упаковочные белки и/или хелперные белки, и трансген, который кодирует белок или транскрибируется в представляющий интерес транскрипт, могут продуцировать рекомбинантные векторы, которые включают трансген, который кодирует белок или содержит последовательность, которая транскрибируется в представляющий интерес транскрипт, который, в свою очередь, продуцирует рекомбинантные вирусные векторы с высоким выходом.
[0115] Изобретение обеспечивает платформу для трансфекции/трансдукции клеток и/или продукции вирусного вектора (например, AAV), которая включает признаки, которые отличают ее от существующих «стандартных для отрасли» способов получения векторного вируса (например, AAV). Композиции и способы по изобретению отличаются смешиванием PEI с нуклеиновыми кислотами в определенных условиях. Смешивание PEI с нуклеиновыми кислотами приводит к эффективному PEI-индуцированному сжатию нуклеиновых кислот с образованием стабильных комплексов, называемых полиплексами. Композиции и способы трансфекции клеток нуклеиновыми кислотами включают контактирование клеток с нуклеиновой кислотой, смешанной с PEI, в определенных условиях.
[0116] Композиции и способы по изобретению дополнительно включают добавление усиливающего агента к клеткам. В определенных вариантах осуществления усиливающий агент добавляют до, или примерно, или одновременно, когда клетки контактируют со смесью нуклеиновая кислота/PEI. В некоторых вариантах осуществления усиливающий агент добавляют после контактирования клеток со смесью нуклеиновая кислота/PEI. В определенных аспектах усиливающий агент добавляют через 5-30 или 30-60 с после контактирования клеток со смесью нуклеиновая кислота/PEI. В определенных аспектах усиливающий агент добавляют через 1-2, 2-5, 5-10, 10-20, 20-30, 30-60 мин после контактирования клеток со смесью нуклеиновая кислота/PEI. В определенных аспектах усиливающий агент добавляют через 1-2, 2-4, 4-6, 6-12, 12-24, 24-36, 36-48 или 48-72 ч после контактирования клеток со смесью нуклеиновая кислота/PEI.
[0117] Усиливающий агент можно поддерживать в контакте с клетками в течение определенного периода времени. В некоторых вариантах осуществления усиливающий агент находится в контакте с клетками в течение от 5 мин до 72 ч после того, как клетки контактировали со смесью нуклеиновая кислота/PEI. В некоторых вариантах осуществления усиливающий агент находится в контакте с клетками в течение 1-2, 2-5, 5-10, 10-20, 20-30, 30-60 мин после того, как клетки контактировали со смесью нуклеиновая кислота/PEI. В определенных аспектах усиливающий агент находится в контакте с клетками в течение 1-72 ч, 6-48 ч, 12-36 ч, 24-48 ч или 36-72 ч после того, как клетки контактировали со смесью нуклеиновая кислота/PEI. В определенных аспектах усиливающий агент находится в контакте с клетками в течение 1-2, 2-4, 4-6, 6-12, 12-24, 24-36, 36-48 или 48-72 ч после контактирования клеток со смесью нуклеиновая кислота/PEI.
[0118] В некоторых вариантах осуществления клетки контактируют со свободным PEI, или способы включают контактирование клеток со свободным PEI в определенной последовательности относительно стадии контактирования клеток со смесью PEI/нуклеиновая кислота. В некоторых вариантах осуществления изобретения клетки контактируют со свободным PEI примерно в одно и то же время, когда клетки контактируют со смесью нуклеиновая кислота/PEI. В конкретных вариантах осуществления клетки контактируют со свободным PEI после того, как клетки контактировали со смесью нуклеиновая кислота/PEI.
[0119] В некоторых вариантах осуществления изобретения клетки контактируют со свободным PEI, или способы включают контактирование клеток со свободным PEI в определенной последовательности относительно стадии добавления усиливающего агента к клеткам, контактирующим со смесью нуклеиновая кислота/PEI. В некоторых вариантах осуществления изобретения клетки контактируют со свободным PEI примерно в одно и то же время, когда клетки контактируют с усиливающим агентом. В конкретных вариантах осуществления клетки контактируют со свободным PEI после того, как клетки контактировали с усиливающим агентом.
[0120] Термины «нуклеиновая кислота» и «полинуклеотид» используются здесь взаимозаменяемо и относятся ко всем формам нуклеиновой кислоты, олигонуклеотидов, включающих дезоксирибонуклеиновую кислоту (ДНК) и рибонуклеиновую кислоту (РНК). Нуклеиновые кислоты и полинуклеотиды включают геномную ДНК, кДНК и антисмысловую ДНК, а также сплайсированную или не сплайсированную мРНК, рРНК тРНК и ингибиторную ДНК или РНК (РНК, например, малую или короткую шпилечную (sh)РНК, микроРНК (miРНК), малую или короткую интерферирующую (si)РНК, РНК, образовавшуюся в результате транс-сплайсинга, или антисмысловую РНК). Нуклеиновые кислоты и полинуклеотиды включают природные, синтетические, и намеренно модифицированные или измененные последовательности (например, вариантную нуклеиновую кислоту).
[0121] Нуклеиновая кислота или плазмида также могут относиться к последовательности, которая кодирует белок. Такие белки могут быть белками дикого типа или представлять вариантный, модифицированный или химерный белок. «Вариантный белок» может означать модифицированный белок, таким образом, что модифицированный белок имеет аминокислотное изменение по сравнению с белком дикого типа.
[0122] Белки, кодируемые нуклеиновой кислотой или плазмидой, включают терапевтические белки. Неограничивающие примеры включают фактор свертывания крови (например, фактор XIII, фактор IX, фактор X, фактор VIII, фактор VIIa или белок C), apoE2, TPP1, аргининсукцинатсинтазу, медь-транспортирующую АТФазу 2, кислую альфа-глюкозидазу, β-глюкоцереброзидазу, α-галактозидазу, С1-ингибитор сериновой протеазы, CFTR (трансмембранный белок-регулятор муковисцидоза), антитело, специфичный для пигментного эпителия белок с молекулярной массой 65 кДа (RPE65), эритропоэтин, рецептор LDL, липопротеинлипазу, орнитинтранскарбамилазу, β-глобин, α-глобин, спектрин, α-антитрипсин, аденозиндезаминазу (ADA), транспортер металлов (ATP7A или ATP7), сульфамидазу, фермент, участвующий в лизосомной болезни накопления (ARSA), гипоксантин-гуанин-фосфорибозилтрансферазу, β-25-глюкоцереброзидазу, сфингомиелиназу, лизосомальную гексозаминидазу, дегидрогеназу кетокислот с разветвленной цепью, гормон, фактор роста (например, инсулиноподобные факторы роста 1 и 2, фактор роста тромбоцитов, эпидермальный фактор роста, фактор роста нервов, нейротрофический фактор-3 и фактор-4, нейротрофический фактор головного мозга, глиальный фактор роста, трансформирующий фактор роста α и β и т. д.), цитокин (например, интерферон-α, интерферон-β, интерферон-γ, интерлейкин-2, интерлейкин-4, интерлейкин-12, гранулоцитарно-макрофагальный колониестимулирующий фактор, лимфотоксин и др.), продукт «суицидального» гена (например, тимидинкиназа вируса простого герпеса, цитозиндезаминаза, дифтерийный токсин, цитохром P450, дезоксицитидинкиназа, фактор некроза опухолей и т. д.), белок резистентности к лекарственным препаратам (например, который обеспечивает резистентность к препаратам, используемым в терапии рака), белок-супрессор опухолей (например, p53, Rb, Wt-1, NF1, белок фон Гиппеля-Линдау (VHL), белок, ассоциированный с аденоматозным полипозом толстого кишечника (APC)), пептид с иммуномодулирующими свойствами, толерогенный или иммуногенный пептид или белок Tregitopes или hCDR1, инсулин, глюкокиназу, гуанилатциклазу 2D (LCA-GUCY2D), Rab экскорта белок 1 (хороидеремия), LCA 5 (LCA-Lebercillin), аминотрансферазу орнитин-кетокислот (гиратная атрофия), ретиношизис 1 (Х-сцепленный врожденный ретиношизис), USH1C (синдром Ушера 1C), ГТФазу при Х-сцепленном пигментном ретините (XLRP), MERTK (AR-формы RP: пигментный ретинит), DFNB1 (тугоухость, связанная с коннексином 26), ACHM 2, 3 и 4 (ахроматопсия), PKD-1 или PKD-2 (поликистозная болезнь почек), TPP1, CLN2, белки, дефицит генов которых вызывает лизосомальную болезнь накопления (например, сульфатазы, N-ацетилглюкозамин-1-фосфаттрансфераза, катепсин A, GM2-AP, NPC1, VPC2, белки-активаторы сфинголипидов и т. д.), одну или более нуклеаз «цинкового пальца» для редактирования генома или донорные последовательности, используемые в качестве матриц репарации для редактирования генома.
[0123] Нуклеиновая кислота или плазмида также могут относиться к последовательности, которая продуцирует транскрипт при транскрибировании. Такими транскриптами может быть РНК, такая как ингибиторная РНК (RNAi, например, малая или короткая шпилечная РНК(sh), микроРНК (miРНК), малая или короткая интерферирующая (si)РНК, РНК, образовавшаяся в результате транс-сплайсинга или антисмысловая РНК).
[0124] Неограничивающие примеры включают ингибиторные нуклеиновые кислоты, которые ингибируют экспрессию: гена хантингтина (HTT), гена, связанного с дентаторубропаллидолюисовой аторофией (например, атрофин 1, ATN1); андрогенового рецептора на Х-хромосоме при спинобульбарной мышечной атрофии, Cav2.1 P/Q потенциал-зависимого кальциевого канала, кодированного (CACNA1A), TATA-связывающего белка, противоположной цепи атаксина 8, также известной как ATXN8OS, бета-изоформы регуляторной субъединицы B серин/треониновой протеинфосфатазы 2A 55 кДа при спиноцеребеллярной атаксии (тип 1, 2, 3, 6, 7, 8, 12 17), FMR1 (умственная отсталось 1, ассоциированная с хрупкой X-хромосомой) при синдроме хрупкой X-хромосомы, FMR1 (умственная отсталось 1, ассоциированная с хрупкой X-хромосомой) при синдроме тремора/атаксии, ассоциированного с хрупкой X-хромосомой, FMR1 (умственная отсталось 2, ассоциированная с хрупкой X-хромосомой) или члена 2 семейства AF4/FMR2 при умственной отсталости, ассоциированной с хрупкой XЕ-хромосомой, миотонинпротеинкиназы (MT-PK) при миотонической дистрофии; фратаксина при атаксии Фридрейха; мутантного гена супероксиддисмутазы 1 (SOD1) при боковом амиотрофическом склерозе; гена, участвующего в патогенезе болезни Паркинсона и/или болезни Альцгеймера; аполипопротеина B (APOB) и пропротеин-конвертазы субтилизин/кексин типа 9 (PCSK9), гиперхолестеринемия; ВИЧ Tat, гена трансактиватора транскрипции вируса иммунодефицита человека при ВИЧ-инфекции; HIV TAR, HIV TAR, гена элемента ответа трансактиватора вируса иммунодефицита человека при ВИЧ-инфекции; C-C-рецептора хемокина (CCR5) при ВИЧ-инфекции; нуклеокапсидного белка вируса саркомы Рауса (RSV) при RSV-инфекции, печень-специфической микроРНК (miR-122) при инфекции, вызванной вирусом гепатита C; р53 при острой травме почки или отсроченной функции почечного трансплантата; протеинкиназы N3 (PKN3) при прогрессирующих рецидивирующих или метастатических солидных злокачественных новообразованиях; LMP2, LMP2, также известной как субъединица протеасомы бета-типа 9 (PSMB 9) при метастатической меланоме; LMP7, также известной как субъединица протеосомы бета-типа 8 (PSMB 8) при метастатической меланоме; MECL1 также известной как субъединица протеасомы бета-типа 10 (PSMB 10) при метастатической меланоме; фактора роста эндотелия сосудов (VEGF) при солидных опухолях; кинезина, белка веретена при солидных опухолях, супрессора апоптоза B-клеточной CLL/лимфомы (BCL-2) при хроническом миелолейкозе; рибонуклеотидредуктазы М2 (RRM2) при солидных опухолях; фурина при солидных опухолях; polo-подобной киназы 1 (PLK1) при опухолях печени, диацилглицерол-ацилтрансферазы 1 (DGAT1) при инфекции, вызванной вирусом гепатита С, бета-катенина при семейном аденоматозном полипозе; адренергического рецептора бета2 при глаукоме; RTP801/Redd1, также известного как белок, индуцируемый повреждением DAN транскрипта 4, при диабетическом макулярной отеке (DME) или возрастной макулярной дегенерации; рецептора фактора роста эндотелия сосудов I (VEGFR1) при возрастной макулярной дегенерации или хориоидальной неоваскуляризации, каспазы 2 при неартериальной ишемической нейропатии зрительного нерва; мутантного белка N17K кератина 6А при врожденной пахионихии; геномных/генных последовательностей вируса гриппа А при инфекции, вызванной вирусом гриппа; геномных/генных последовательностей коронавируса, вызывающего тяжелый острый респираторный синдром (SARS) при SARS-инфекции; геномных/генных последовательностей респираторно-синцитиального вируса при респираторно-синцитиальной вирусной инфекции; геномных/генных последовательностей вируса лихорадки Эбола при заражении вирусом Эбола; геномных/генных последовательностей вируса гепатита В и С при гепатите В и С; геномных/генных последовательностей вируса простого герпеса (HSV) при HSV-инфекции, геномных/генных последовательностей вируса Коксаки B3 при инфекции, вызванной вирусом Коксаки B3; сайленсинг патогенного аллеля гена (аллель-специфический сайлесинг), такого как ген торсина А (TOR1A), при первичной дистонии, сайленсинг гена pan класса I и аллеля HLA, специфичного для трансплантата; мутантного гена родопсина (RHO) при аутосомно-доминантном врожденном пигментном ретините (adRP); или ингибиторная нуклеиновая кислота связывается с транскриптом любого из вышеуказанных генов или последовательностей.
[0125] Нуклеиновые кислоты (плазмиды) могут быть одноцепочечными, двухцепочечными или трехцепочечными, линейными или циклическими и могут иметь любую длину. При обсуждении нуклеиновых кислот (плазмид) последовательность или структура конкретного полинуклеотида может быть описана здесь в соответствии с соглашением о представлении последовательности в направлении от 5' к 3'.
[0126] «Плазмида» представляет собой форму нуклеиновой кислоты или полинуклеотида, которая обычно имеет дополнительные элементы для экспрессии (например, транскрипции, репликации и т. д.) или размножения (репликации) плазмиды. Термин «плазмида» может использоваться в отношении последовательности нуклеиновых кислот и полинуклеотидов. Следовательно, во всех аспектах композиции и способы по изобретению применимы к плазмидам, нуклеиновым кислотам и полинуклеотидам, например, для введения плазмид, нуклеиновой кислоты или полинуклеотида в клетки, для трансдукции (трансфекции) клеток плазмидой, нуклеиновой кислотой или полинуклеотидом, для получения трансдуцированных (трансфектированных) клеток, которые содержат плазмиду, нуклеиновую кислоту или полинуклеотид, с получением клеток, продуцирующих вирусные векторы (например, AAV), для продуцирования вирусных (например, AAV) векторов, для получения клеточной культуральной среды, которая содержит вирусные векторы (например, AAV) и т. д.
[0127] Композиции и способы по настоящему изобретению включают полиэтиленимин (PEI). PEI является катионным полимером и способен образовывать стабильный комплекс с нуклеиновой кислотой, называемой полиплексом. Однако, не желая связываться с какой-либо теорией, полагается, что полиплекс вводится в клетки посредством эндоцитоза.
[0128] PEI может представлять линейный PEI или разветвленный PEI. PEI может находиться в форме соли или свободного основания. В конкретных вариантах осуществления PEI представляет собой линейный PEI, такой как необязательно гидролизованный линейный PEI. Гидролизованный PEI может быть полностью или частично гидролизованным. Гидролизованный линейный PEI имеет большее относительное количество свободных (протонируемых) атомов азота по сравнению с негидролизованным линейным PEI, который обычно имеет, по меньшей мере, на 1-5% больше свободных (протонируемых) атомов азотов по сравнению с негидролизованным линейным PEI, более типично на 5-10% больше свободных (протонируемых) атомов азота по сравнению с негидролизованным линейным PEI или, как правило, имееет на 10-15% больше свободных (протонируемых) атомов азота по сравнению с негидролизованным линейным PEI.
[0129] В конкретных вариантах осуществления PEI может иметь молекулярную массу в диапазоне примерно от 4000 до примерно 160000 и/или молекулярную массу в диапазоне примерно от 2500 до примерно 250000 в форме свободного основания. В еще одних конкретных вариантах осуществления PEI может иметь молекулярную массу примерно 40000 и/или молекулярную массу примерно 25000 в форме свободного основания. В частности, линейный PEI имеет молекулярную массу примерно 40000 и/или молекулярную массу примерно 25000 в форме свободного основания. Кроме того, можно использовать химически модифицированный линейный PEI или разветвленный PEI. PEI является коммерчески доступным (например, производства Polysciences, Inc., Warrington, PA, USA).
[0130] В композициях и способах по изобретению нуклеиновую кислоту, такую как плазмида, смешивают с PEI с образованием смеси или раствора PEI. Такую смесь или раствор можно назвать «смесью плазмида/PEI» или «смесью нуклеиновая кислота/PEI». Следовательно, термины «смесь плазмида/PEI» и «смесь нуклеиновая кислота/PEI» означают, что PEI смешали с нуклеиновой кислотой/плазмидой. Следовательно, PEI, как здесь указано, можно смешать с нуклеиновой кислотой (плазмидой) до или практически одновременно с контактактированием клеток для трансдукции/трансфекции.
[0131] Как здесь используется, термин «свободный PEI» означает PEI, который практически или полностью не содержит нуклеиновой кислоты (плазмиды). Следовательно, PEI, как здесь указано, также может находиться в форме свободного PEI. Следовательно, «смесь плазмида/PEI» или «смесь нуклеиновая кислота/PEI» отличается от свободного PEI. Если свободный PEI является по существу свободным, то количество присутствующих последовательностей нуклеиновой кислоты (плазмиды) будет составлять примерно не более 5%, что определяется по молекулярной массе или массе. Конечно, количество может составлять ниже 5%, например, примерно 4,5% или ниже, примерно 4% или ниже, примерно 3,5% или ниже, примерно 3% или ниже, примерно 2,5% или ниже, примерно 2% или ниже, примерно 1,5% или ниже, примерно 1% или ниже или примерно 0,5% или ниже.
[0132] Как здесь используется, термин «общий PEI» означает суммарное количество PEI, присутствующее в смеси PEI/плазмида и в виде свободного PEI. Следовательно, общий PEI включает PEI, который смешан с плазмидой, и PEI, который по существу или полностью не содержит последовательностей нуклеиновой кислоты, такой как плазмида.
[0133] Раскрытие количеств PEI, соотношений, композиций, растворов, растворителей и буферов, pH, солей, а также времени и продолжительности контактирования с клеткой и инкубации относится к любому из, любым двум из, или ко всем трем из: 1) PEI в смеси плазмида/PEI или в смеси нуклеиновая кислота/PEI; 2) PEI в виде свободного PEI (т. е. PEI, который по существу или полностью не содержит нуклеиновокислотных или полинуклеотидных последовательностей, таких как плазмида, и 3) общий PEI (PEI в смеси плазмида/PEI или в смеси нуклеиновая кислота/PEI+свободный PEI).
[0134] В определенных вариантах осуществления PEI представляет собой раствор, такой как водный (например, в воде) раствор. В дополнительных конкретных вариантах PEI представляет собой подкисленный или нейтрализованный PEI. Термин «подкисленный PEI» означает раствор PEI, который получают растворением PEI в кислотном растворителе. Кислотность подкисленного раствора PEI обычно представляет рН примерно от 0 до примерно 3,0, более типично рН примерно от 0,5 до примерно 2,0. Термин «нейтрализованный PEI» означает раствор PEI, который получают растворением PEI в нейтральном растворителе или буфере. Нейтрализованные растворы PEI могут иметь pH в диапазоне примерно от 6,0 до примерно 8,0, обычно pH в диапазоне примерно от 6,5 до примерно 7,5, более типично pH в диапазоне примерно от 6,8 до примерно 7,2, и наиболее типично pH в диапазоне примерно от 7,0 до примерно 7,2, например, примерно 7,1.
[0135] Любой растворитель или буфер можно использовать для установления или поддержания pH раствора PEI в пределах вышеуказанного диапазона, не нарушая трансфекционную активность PEI. Примеры кислотных растворителей включают минеральные кислоты, такие как соляная кислота (HCl), и органические кислоты с pH в кислотном диапазоне, такие как раствор глицин-соляная кислота. Неограничивающие примеры нейтральных растворителей/буферов включают трис(тризма-основание) и HEPES. Буферы могут находиться в диапазоне концентраций примерно от 1 мМ до примерно 100 мМ, более типично примерно от 2 мМ до примерно 50 мМ и наиболее типично примерно от 5 мМ до примерно 20 мМ.
[0136] Растворы PEI могут необязательно включать соли. Неограничивающие примеры солей включают соли натрия (Na), калия (K) и магния (Mg). В конкретных аспектах концентрации соли в растворе PEI находятся в диапазоне примерно от 50 мМ до примерно 500 мМ, более типично примерно от 100 мМ до примерно 250 мМ и наиболее типично примерно от 125 мМ до примерно 175 мМ.
[0137] Смесь нуклеиновых кислот (плазмиды) и PEI готовят смешиванием нуклеиновых кислот (плазмиды) и PEI в растворе. Смешивание может иметь место в любом растворе, совместимом с трансдукцией клеток на основе PEI. Неограничивающими примерами являются такие, как здесь указаны. После смешивания смесь нуклеиновых кислот (плазмиды)/PEI можно инкубировать в течение периода времени примерно от 1 мин до примерно 8 ч; примерно от 10 с до примерно 4 ч; примерно от 1 мин до примерно 60 мин; примерно от 1 мин до примерно 30 мин; примерно от 10 мин до примерно 45 мин; примерно от 10 мин до примерно 30 мин; и/или примерно от 20 мин до примерно 30 мин. Обычно время включает примерно 1 мин, примерно 5 мин, примерно 10 мин, примерно 15 мин, примерно 20 мин и примерно 30 мин.
[0138] PEI и нуклеиновые кислоты (плазмиду) смешивают в соотношении, которое особым образом не ограничивается. Типичные соотношения включают смесь плазмид в диапазоне молярного (или массового) соотношения примерно от 1:0,01 до примерно 1:100 или в диапазоне молярного (или массового) соотношения примерно от 100:1 до примерно 1:0,01, чтобы получить смесь плазмида/PEI. Более типичные молярные (или массовые) соотношения включают смесь плазмид в диапазоне молярного (или массового) соотношения примерно от 1:1 до примерно 1:5 или в диапазоне молярного (или массового) соотношения примерно от 1:2 до примерно 1:4, чтобы получить смесь плазмида/PEI. В дополнительных вариантах осуществления массовое соотношение PEI:плазмида находится в диапазоне примерно от 0,1:1 до примерно 5:1 или в диапазоне примерно от 5:1 до примерно 0,1:1. В еще одних вариантах осуществления свободный PEI/плазмида/PEI в клеточной культуре имеет массовое соотношение PEI:плазмида в диапазоне примерно от 0,1:1 до примерно 5:1 или имеет массовое соотношение PEI:плазмида в диапазоне примерно от 5:1 до примерно 0,1:1. В конкретных вариантах осуществления смесь плазмида/PEI имеет массовое соотношение PEI:плазмида в диапазоне примерно от 1:1 до примерно 5:1 или в диапазоне примерно от 5:1 до примерно 1:1. В еще одних конкретных вариантах осуществления свободный PEI/плазмида/PEI в клеточной культуре имеет массовое соотношение PEI:плазмида в диапазоне примерно от 1:1 до примерно 5:1 или в диапазоне примерно от 5:1 до примерно 1:1.
[0139] Количество нуклеиновых кислот (плазмиды), используемых для получения композиций и способов трансдукции клеток, варьируется. В конкретных вариантах осуществления молярное соотношение азота (N) в общем PEI к фосфату (P) в плазмиде находится в диапазоне примерно от 1:1 до примерно 50:1 (N:P), в свободный PEI/плазмида/PEI в клеточной культуре, или молярное соотношение азота (N) в общем PEI к фосфату (P) в плазмиде составляет примерно от 1:1 до 10:1 (N:P) в свободный PEI/плазмида/PEI в клеточной культуре, или молярное отношение азота (N) в общем PEI к фосфату (P) в плазмиде составляет примерно 5:1, 6:1, 7:1, 8:1, 9:1 или 10:1 (N:P) в свободный PEI/плазмида/PEI в клеточной кульутре. В дополнительных конкретных вариантах осуществления общее количество плазмиды, содержащей нуклеиновую кислоту, которая кодирует белок или транскрибируется в представляющий интерес транскрипт, и одной или более плазмид, содержащих нуклеиновые кислоты, кодирующие упаковочные белки AAV, и/или нуклеиновые кислоты, кодирующие хелперные белки, находится в диапазоне примерно от 0,1 мкг до примерно 15 мкг на мл клеток.
[0140] Применение смеси нуклеиновых кислот (плазмиды)/PEI на клетках осуществляют добавлением смеси нуклеиновые кислоты (плазмида)/PEI к клеткам таким образом, чтобы смесь нуклеиновые кислоты (плазмиды)/PEI контактировала с клетками. Клетки, к которым добавляют смесь нуклеиновые кислоты (плазмида)/PEI (которые контактируют), могут представлять прикрепленные клетки или клетки в суспензии. Такие клетки могут включать совместные культуры с другими клетками.
[0141] Клетки контактируют со смесью нуклеиновые кислоты (плазмида)/PEI в течение периода времени, которое особым образом не ограничивается, для достижения трансдукции клеток. Контактирование клеток со свободным PEI обычно происходит одновременно с (или сразу же после) или после того, как клетки контактировали со смесью нуклеиновые кислоты (плазмида)/PEI. Если должен быть временной интервал между контактированием клеток со смесью нуклеиновые кислоты (плазмида)/PEI и контактактированием клеток со свободным PEI, то временной интервал может составлять примерно от 1 с до примерно 140 ч, обычно примерно от 1 с до примерно 96 ч, более типично примерно от 1 с до примерно 48 ч или примерно 72 ч, наиболее типично примерно от 1 с до примерно 24 ч или менее, например, примерно 16 ч, примерно 12 ч, примерно 8 ч или примерно 6 ч или менее.
[0142] При длительном контактировании на клетки может оказывать влияние цитотоксичность PEI, приводящая к увеличению количества мертвых (нежизнеспособных) клеток, что снижает эффективность трансфекции. Время инкубации после контактирования клеток с общим PEI может варьироваться от секунд до суток. В частности, клетки могут контактировать с нуклеиновыми кислотами (плазмидами)/PEI или общим PEI, например, в течение периода времени от примерно 1 мин до примерно 48 ч; примерно от 1 мин до примерно 24 ч; примерно от 1 мин до примерно 16 ч; примерно от 1 мин до примерно 8 ч; примерно от 1 мин до примерно 4 ч; примерно от 1 мин до примерно 120 мин; примерно от 5 мин до примерно 60 мин; примерно от 10 мин до примерно 45 мин; или примерно от 10 мин до примерно 30 мин.
[0143] Для снижения цитотоксичности PEI культуральную среду можно заменить свежей культуральной средой после контактирования клеток со смесью нуклеиновые кислоты (плазмида)/PEI. Замена культуральной среды после трансфекции может минимизировать цитотоксичность PEI без значительной потери эффективности трансфекции клеток.
[0144] Клетки, подлежащие трансфекции, до или во время контактирования со смесью плазмида/PEI, и/или контактирования с усиливающим агентом, и/или контактирования со свободным PEI, имеют плотность в диапазоне примерно от 1×105 клеток/мл до примерно 1×108 клеток/мл. Как правило, клетки имеют плотность в диапазоне примерно от 2×105 клеток/мл до примерно 5×106 клеток/мл. Более типично, клетки имеют плотность в диапазоне примерно от 3×105 клеток/мл до примерно 4×106 клеток/мл, например, примерно от 4×105 клеток/мл до примерно 3×106 клеток/мл, или примерно от 5×105 клеток/мл до примерно 2×106 клеток/мл. В еще одних вариантах осуществления клетки имеют плотность в диапазоне примерно от 5×105 клеток/мл до примерно 5×106 клеток/мл, например, примерно от 6×105 клеток/мл до примерно 4×106 клеток/мл или примерно от 7×105 клеток/мл до примерно 3×106 клеток/мл. В дополнительных вариантах осуществления клетки имеют плотность в диапазоне примерно от 1×106 клеток/мл до примерно 5×106 клеток/мл, например, примерно от 1×106 клеток/мл до примерно 4×106 клеток/мл или примерно от 2×106 клеток/мл до примерно 3×106 клеток/мл.
[0145] Клетки, подлежащие трансфекции, до или во время контактирования со смесью плазмида/PEI, и/или контактирования с усиливающим агентом, и/или контактирования со свободным PEI, могут необязательно, находиться в логарифмической (экспоненциальной) фазе роста. Клетки, подлежащие трансфекции, до или во время контактирования со смесью плазмида/PEI, и/или контактирования с усиливающим агентом, и/или контактирования со свободным PEI, могут иметь жизнеспособность 60% или выше 60%, например, жизнеспособности 70%, 80% или 90% или выше 90%.
[0146] Клетки, которые можно подвергнуть контактированию, как здесь указано, включают клетки млекопитающих, такие как клетки человека. Такие клетки могут представлять первичные клетки или клеточные линии, которые способны расти или поддерживать жизнеспособность in vitro, или были адаптированы для культивирования тканей in vitro. Примеры клеточных линий включают клетки HEK (эмбриональная почка человека), которые включают клетки HEK293, такие как клетки HEK293F (293F) и HEK293T (293T).
[0147] В более общем смысле такие клетки, которые контактируют, как здесь указано, могут относиться к «клеткам-хозяевам». «Клетка-хозяин» обозначает, например, микроорганизмы, дрожжевые клетки, клетки насекомых и клетки млекопитающих, которые могут или использовались в качестве реципиентов нуклеиновой кислоты (плазмиды), кодирующей упаковочные белки, такие как упаковочные белки AAV, нуклеиновой кислоты (плазмиды), кодирующей хелперные белки, нуклеиновую кислоту (плазмиду), которая кодирует белок или транскрибируется в представляющий интерес транскрипт или другой перенос нуклеиновой кислоты (плазмиды). Термин включает потомство исходной клетки, которая была трансдуцирована или трансфектирована. Таким образом, как здесь используется, «клетка-хозяин» обычно относится к клетке, которая была трансдуцирована или трансфектирована последовательностью экзогенной нуклеиновой кислоты. Понятно, что потомство одной родительской клетки необязательно может быть полностью идентичным по морфологии или по геномной или полной нуклеиновой кислоте исходного родителя за счет природной, случайной или намеренной мутации.
[0148] Многочисленные среды для культивирования клеток, подходящие для поддержания жизнеспособности клеток или обеспечения роста и/или пролиферации клеток, являются коммерчески доступными или могут быть легко получены. Примеры таких сред включают бессывороточные среды для культивирования эукариот, такие как среда для поддержания жизнеспособности или обеспечения роста клеток млекопитающих (например, клеток человека). Неограничивающие примеры включают среду Ham's F12 или F12K (Sigma-Aldrich), среду FreeStyle™M (FS) F17 (Thermo-Fisher Scientific), MEM, DMEM, RPMI-1640 (Thermo-Fisher Scientific) и их смеси. Такая среда может быть дополнена витаминами и/или микроэлементами, и/или солями, и/или аминокислотами, такими как незаменимые аминокислоты для клеток млекопитающих (например, клеток человека).
[0149] «Усиливающие агенты», иначе называемые здесь «усилителями трансфекции» или в том же контексте просто «усилители», представляют собой соединения, которые повышают трансдукцию/трансфекцию клеток нуклеиновой кислотой (плазмидой). В конкретных вариантах осуществления усиливающий агент включает или состоит из вальпроевой кислоты, ее соли или производного. В некоторых вариантах осуществления соль вальпроевой кислоты включает или состоит из соли натрия или калия. В некоторых вариантах осуществления производное вальпроевой кислоты включает или состоит из аминокислоты, связанной или конъюгированной с ней. Дополнительные примеры усиливающих агентов включают, например, и без ограничения, описанные в патентных публикациях США № 2013/0316400 и 2017/0016043, полностью включенных в настоящее описание в качестве ссылки, а также другие усилители трансфекции, известные в данной области.
[0150] Усиливающие агенты, включающие вальпроевую кислоту, можно использовать в концентрации, например, и без ограничения, в диапазоне примерно от 0,1 до примерно 25 мМ или в любых поддиапазонах или значениях концентрации, охватываемых ими. В определенных вариантах осуществления концентрация усиливающего агента составляет примерно от 0,5 мМ до примерно 10 мМ. В определенных вариантах осуществления концентрация усиливающего агента составляет примерно от 0,5 мМ до примерно 5 мМ. В определенных вариантах осуществления концентрация усиливающего агента составляет примерно от 1 мМ до примерно 4 мМ, примерно от 1 мМ до примерно 3 мМ или примерно от 1 мМ до примерно 2 мМ.
[0151] Термины «трансдукцировать» и «трансфектировать» относятся к введению молекулы, такой как нуклеиновая кислота (плазмида), в клетку-хозяин. Клетка была «трансдуцирована» или «трансфектирована», когда экзогенная нуклеиновая кислота была введена внутрь клеточной мембраны. Следовательно, «трансдуцированная клетка» представляет собой клетку, в которую была введена «нуклеиновая кислота» или «полинуклеотид», или ее потомство, в которое была введена экзогенная нуклеиновая кислота. В конкретных вариантах осуществления «трансдуцированная» клетка (например, у млекопитающего, такая как клетка, клетка ткани или органа) представляет собой генетическое изменение в клетке после включения экзогенной молекулы, например, нуклеиновой кислоты (например, трансген). «Трансдуцированные» или «трансфектированные» клетки могут размножаться, и введенная нуклеиновая кислота транскрибируется и/или экспрессируется белок.
[0152] В «трансдуцированной» или «трансфектированной» клетке нуклеиновая кислота (плазмида) может или может не интегрироваться в геномную нуклеиновую кислоту клетки-реципиента. Если введенная нуклеиновая кислота становится интегрированной в нуклеиновую кислоту (геномную ДНК) клетки или организма-реципиента, то она может стабильно поддерживаться в этой клетке или организме и далее передаваться или наследоваться потомками клеток или организма, или реципиентной клеткой или организмом. Наконец, введенная нуклеиновая кислота может существовать в клетке-реципиенте или организме-хозяине экстрахромосомально или только транзиентно. Известен ряд методов (см., например, Graham et al. (1973) Virology, 52: 456, Sambrook et al. (1989), Molecular Cloning, лабораторное руководство, Cold Spring Harbor Laboratories, New York, Davis et al. (1986) Basic Methods in Molecular Biology, Elsevier, and Chu et al. (1981) Gene 13: 197). Такие методы можно использовать для введения одного или более фрагментов экзогенной ДНК в подходящие клетки-хозяева.
[0153] Термин «вектор» относится к небольшой молекуле-носителю нуклеиновой кислоты, плазмиде, вирусу (например, вектору AAV) или другому носителю, с которым можно манипулировать посредством вставки или включения нуклеиновой кислоты. Такие векторы можно использовать для генетических манипуляций (т. е. «векторы клонирования»), для введения/переноса полинуклеотидов в клетки и для транскрипции или трансляции вставленного полинуклеотида в клетках. «Вектор экспрессии» представляет собой специализированный вектор, который содержит последовательность гена или нуклеиновой кислоты с необходимыми регуляторными областями, необходимыми для экспрессии в клетке-хозяине. Последовательность векторной нуклеиновой кислоты обычно содержит, по меньшей мере, ориджин репликации для размножения в клетке и необязательно дополнительные элементы, такие как гетерологичная полинуклеотидная последовательность, элемент контроля экспрессии (например, промотор, энхансер), интрон, ITR(s), селектируемый маркер (например, придающий резистентность к антибиотикам), сигнал полиаденилирования. Для целей изобретения «вектор», как здесь указано, входит в объем термина «плазмида», как этот термин используется в настоящем документе.
[0154] Вирусный вектор получают из или на основе одного или более элементов нуклеиновой кислоты, которые составляют вирусный геном. Конкретные вирусные векторы включают лентивирусные, псевдотипированные лентивирусные и парвовирусные векторы, такие как векторы на основе аденоассоциированных вирусов (AAV).
[0155] Термин «рекомбинантный» в качестве определителя вектора, такого как рекомбинантный вирусный, например, лентивирусный или парвовирусный (например, AAV) векторы, а также определителя последовательностей, таких как рекомбинантные полинуклеотиды и полипептиды, означает, что композиции подвергались манипуляцим (т.е. конструировали), которые обычно отсутствуют в природе. Конкретным примером рекомбинантного вектора, такого как вектор AAV, является вектор, когда полинуклеотид, который обычно отсутствует в вирусном геноме дикого типа (например, AAV), встроен в вирусный геном, т. е. является гетерологичным. Хотя термин «рекомбинантный» не всегда используется здесь применительно к векторам, таким как вирусные и AAV-векторы, а также к последовательностям, таким как полинуклеотиды, рекомбинантные формы, включая полинуклеотиды, охватываются настоящим изобретением, несмотря на любое такое упущение.
[0156] Рекомбинантный вирусный «вектор» или «вектор AAV» получают из генома вируса дикого типа, такого как AAV, с использованием молекулярных методов удаления генома дикого типа из вируса (например, AAV) и замены неприродной нуклеиновой кислотой, такой как нуклеиновая кислота, которая транскрибируется в транскрипт или кодирует белок. Как правило, для AAV одна или обе последовательности инвертированного концевого повтора (ITR) генома AAV сохраняются в векторе AAV. «Рекомбинантный» вирусный вектор (например, AAV) отличается от вирусного (например, AAV) генома, поскольку весь или часть вирусного генома заменена неприродной (т. е. гетерологичной) последовательностью относительно вирусной (например, AAV) геномной нуклеиновой кислоты. Следовательно, включение неприродной последовательности позволяет определить вирусный вектор (например, AAV) как «рекомбинантный» вектор, который в случае AAV может называться «вектором rAAV».
[0157] Последовательность рекомбинантного вектора (например, лентивирусного, парвовирусного, AAV) может быть упакована, относится здесь к «частице», для последующего инфицирования (трансдукции) клетки ex vivo, in vitro или in vivo. Когда рекомбинантная векторная последовательность капсидирована или упакована в частицу AAV, то частица также может обозначаться как «rAAV». Такие частицы включают белки, которые капсидируют или упаковывают векторный геном. Конкретные примеры включают белки вирусной оболочки, и в случае AAV - капсидные белки, такие как AAV VP1, VP2 и VP3.
[0158] Векторный «геном» относится к той части рекомбинантной плазмидной последовательности, которая в конечном итоге упакована или капсидирована с образованием вирусной (например, AAV) частицы. В случаях, когда рекомбинантные плазмиды используются для конструирования или получения рекомбинантных векторов, то векторный геном не включает часть «плазмиды», которая не соответствует последовательности векторного генома рекомбинантной плазмиды. Такая не являющаяся векторным геномом часть рекомбинантной плазмиды относится к «плазмидному остову», который важен для клонирования и амплификации плазмиды, процессе, который необходим для размножения и продукции рекомбинантного вируса, но сам он не упаковывается или не капсидируется в вирусные (например, AAV) частицы. Таким образом, векторный «геном» относится к нуклеиновой кислоте, которая упакована или капсидирована вирусом (например, AAV).
[0159] Термины «пустой капсид» и «пустая частица» относятся к вириону AAV, который включает белковую оболочку AAV, но в котором отсутствует полностью или частично нуклеиновая кислота, которая кодирует белок или транскрибируется в представляющий интерес транскрипт, фланкированный AAV ITR. Следовательно, пустой капсид не функционирует для переноса нуклеиновой кислоты, которая кодирует белок или транскрибируется в интересующий транскрипт в клетке-хозяине. Однако составы с пустым капсидом используются в других применениях, таких как ELISA.
[0160] Термин «упаковочные белки» относится к вирусным и/или клеточным функциям, не происходящим от AAV, от которых зависит репликации AAV. Таким образом, термин охватывает белки и РНК, которые необходимы для репликации AAV, включая такие фрагменты, которые вовлечены в активацию транскрипции гена AAV, стадию специфического сплайсинга мРНК AAV, репликацию ДНК AAV, синтез продуктов экспрессии Cap и сборку капсида AAV. Вирусные вспомогательные функции могут происходить от любого из известных вирусов-помощников, таких как аденовирус, вирус герпеса (отличного от вируса простого герпеса типа 1) и вирус коровьей оспы.
[0161] Как здесь используется, термин «упаковочные белки AAV» относится к производным последовательностей AAV, которые функционируют в транс-конфигурации для продуктивной репликации AAV. Таким образом, упаковочные белки AAV кодируются основными открытыми рамками считывания AAV (ORF), rep и cap. Было показано, что белки rep обладают многими функциями, включая, среди прочего: распознавание, связывание и никинг AAV ориджина репликации ДНК; ДНК-геликазную активность; и модуляцию транскрипции из AAV (или других гетерологичных) промоторов. Белки cap (капсидные) обеспечивают необходимые функции упаковки. Упаковочные белки AAV используются здесь для дополнения функций AAV в транс-конфигурации, которые отсутствуют в векторах AAV.
[0162] Термин «нуклеиновые кислоты, кодирующие упаковочные белки AAV», в общем, относится к молекуле нуклеиновой кислоты, которая включает нуклеотидные последовательности, обеспечивающие функции AAV, удаленные из вектора AAV, который должен использоваться для получения трансдуцирующего рекомбинантного вектора AAV. Нуклеиновые кислоты, кодирующие упаковочные белки AAV, обычно используются для обеспечения транзиентной экспрессии генов rep и/или cap AAV для дополнения отсутствующих функций AAV, которые необходимы для репликации AAV; однако нуклеиновокислотные конструкции не имеют ITR AAV и не могут ни реплицироваться, ни упаковываться сами. Нуклеиновые кислоты, кодирующие упаковочные белки AAV, могут находиться в форме плазмиды, фага, транспозона, космиды, вируса или вириона. Описан ряд конструкций нуклеиновых кислот, таких как часто используемые плазмиды pAAV/Ad и pIM29+45, которые кодируют как продукты экспрессии Rep, так и Cap. См., например, Samulski et al. (1989) J. Virol. 63: 3822-3828; и McCarty et al. (1991) J. Virol. 65: 2936-2945. Был описан ряд векторов, которые кодируют продукты экспрессии Rep и/или Cap (например, патенты США № 5139941 и 6376237).
[0163] Термин «нуклеиновые кислоты, кодирующие хелперные белки» относится, как правило, к молекуле(ам) нуклеиновой кислоты, которая включает нуклеотидные последовательности, кодирующие белки, которые обеспечивают хелперную функцию(и). Вектор с нуклеиновой кислотой(ами), кодирующей хелперный белок(и), может быть трансфектирован в подходящую клетку-хозяин, где затем вектор способен поддерживать продукцию вириона AAV в клетке-хозяине. Из термина явно исключаются инфекционные вирусные частицы, поскольку они существуют в природе, такие как частицы аденовируса, герпесвируса или вируса коровьей оспы.
[0164] Таким образом, векторы хелперного белка могут находиться в форме плазмиды, фага, транспозона или космиды. В частности, было показано, что полный набор генов аденовируса не требуется для хелперных функций. Например, было показано, что аденовирусные мутанты, неспособные к репликации ДНК и позднему синтезу генов, являются способными для репликации AAV. Ito et al., (1970) J. Gen. Virol. 9: 243; Ishibashi et al. (1971) Virology 45: 317.
[0165] Было показано, что мутанты по областям E2B и E3 поддерживают репликацию AAV, указывая на то, что области E2B и E3, вероятно, не участвуют в обеспечении хелперной функции. Carter et al., (1983), Virology 126: 505. Однако аденовирусы, дефектные по области El или с делецированной областью E4, не могут поддерживать репликацию AAV. Таким образом, для аденовирусных хелперных белков области EIA и E4, вероятно, необходимы для репликации AAV, прямо или опосредованно. Laughlin et al. (1982) J. Virol., 41: 868; Janik et al. (1981) Proc. Natl. Акад. Sci. USA, 78: 1925; Carter et al. (1983) Virology, 126: 505. Другие охарактеризованные мутанты Ad включают: EIB (Laughlin et al. (1982), выше; Janik et al. (1981), выше; Ostrove et al. (1980) Virology, 104: 502); E2A (Handa et al. (1975) J. Gen. Virol., 29: 239; Strauss et al. (1976) J. Virol., 17: 140; Myers et al. (1980) J. Virol., 35: 665; Jay et al. (1981) Proc. Natl. Acad. Sci. USA, 78: 2927; Myers et al. (1981) J. Biol. Chem., 256: 567); E2B (Carter, Adeno-Associated Virus Helper Functions, in I CRC Handbook of Parvoviruses (P. Tijssen ed., 1990)); E3 (Carter et al. (1983), выше); и Е4 (Carter et al. (1983), выше; Carter (1995)).
[0166] Исследования хелперных белков, обеспечиваемых аденовирусами, имеющих мутации в E1B, показали, что E1 B55k необходима для продукции вириона AAV, в то время как E1B 19k нет. Кроме того, в публикации международной заявки WO 97/17458 и в публикации Matshushita et al. (1998) Gene Therapy, 5: 938-945 описаны векторы с хелперными функциями, кодирующие различные гены Ad. Пример хелперного вектора содержит кодирующую область РНК VA аденовируса, кодирующую область E4 ORF6 аденовируса, кодирующую область E2A 72 кД аденовируса, кодирующую область E1A аденовируса и область E1B аденовируса, в которой отсутствует интактная кодирующая область EI BS5k (см. например, публикацию международной заявки WO 01/83797).
[0167] Термин «трансген» используется здесь для обозначения нуклеиновой кислоты, которая предназначена или была введена в клетку или организм. Трансгены включают любую нуклеиновую кислоту, такую как ген, которая транскрибируется в транскрипт или которая кодирует полипептид или белок.
[0168] «Элемент контроля экспрессии» относится к последовательности(ям) нуклеиновой кислоты, которые влияют на экспрессию операбельно связанной нуклеиновой кислоты. Элементы контроля, включая элементы контроля экспрессии, как здесь указано, такие как промоторы и энхансеры, векторные последовательности, включающие векторы AAV, могут включать один или более «элементов контроля экспрессии». Как правило, такие элементы включаются для облегчения правильной транскрипции гетерологичного полинуклеотида и, если необходимо, трансляции (например, промотор, энхансер, сигнал сплайсинга в интронах, поддержание правильной рамки считывания гена, для обеспечения трансляции мРНК в рамке и, стоп-кодоны и т. д.). Такие элементы обычно функционируют в цис-конфигурации, и именуются «цис-действующим» элементом, но могут также действовать в транс-конфигурации.
[0169] Контроль экспрессии может осуществляться на уровне транскрипции, трансляции, сплайсинга, стабильности транскрипта и т. д. Обычно элемент контроля экспрессии, который модулирует транскрипцию, располагается рядом с 5'-концом (т. е. «апстрим») транскрибируемой нуклеиновой кислоты. Элементы контроля экспрессии также могут располагаться на 3'-конце (т. е. «даунстрим») транскрибируемой последовательности или внутри транскрипта (например, в интроне). Элементы контроля экспрессии могут располагаться рядом или на расстоянии от транскрибируемой последовательности (например, 1-10, 10-25, 25-50, 50-100, 100-500 или более нуклеотидов от полинуклеотида), даже на более значительных расстояниях. Однако за счет ограничений, связанных с длиной некоторых векторов, таких как векторы AAV, элементы контроля экспрессии обычно находятся в пределах 1-1000 нуклеотидов от транскрибируемой нуклеиновой кислоты.
[0170] Функционально, экспрессия операбельно связанной нуклеиновой кислоты, по меньшей мере, частично регулируется элементом (например, промотором), так что элемент модулирует транскрипцию нуклеиновой кислоты и, при необходимости, трансляцию транскрипта. Конкретным примером элемента контроля экспрессии является промотор, который обычно располагается на 5'-конце транскрибируемой последовательности. Промотор обычно повышает количество, экспрессируемое из операбельно связанной нуклеиновой кислоты, по сравнению с экспрессируемым количеством, когда промотор отсутствует.
[0171] Как здесь используется, термин «энхансер» может относиться к последовательности, которая является смежной с гетерологичным полинуклеотидом. Энхансерные элементы обычно располагаются апстрим от промоторного элемента, но также функционируют и могут располагаться даунстрим или внутри последовательности нуклеиновой кислоты. Следовательно, энхансерный элемент может располагаться на расстоянии 100 пар оснований, 200 пар оснований или 300 или более пар оснований апстрим или даунстрим от нуклеиновой кислоты. Энхансерные элементы обычно повышают экспрессию операбельно связанной нуклеиновой кислоты по сравнению с экспрессией, обеспечиваемой промоторным элементом.
[0172] Экспрессионная конструкция может включать регуляторные элементы, которые служат для контроля экспрессии в конкретном типе клеток или тканей. Элементы контроля экспрессии (например, промоторы) включают такие, которые активны в конкретной ткани или типе клеток, называемые здесь «ткане-специфическими элементами контроля экспрессии/промоторами». Тканеспецифические элементы контроля экспрессии обычно активны в конкретной клетке или ткани (например, печени). Элементы контроля экспрессии обычно активны в определенных клетках, тканях или органах, потому что они распознаются белками-активаторами транскрипции или другими регуляторами транскрипции, которые являются уникальными для конкретного типа клетки, ткани или органа. Такие регуляторные элементы известны специалистам в данной области (см., например, Sambrook et al. (1989) и Ausubel et al. (1992)).
[0173] Включение тканеспецифических регуляторных элементов в плазмиды по изобретению обеспечивает, по меньшей мере, частичный тканевой тропизм для экспрессии нуклеиновой кислоты. Примерами промоторов, которые активны в печени, являются промотор TTR (например, мутантный промотор TTR), промотор человеческого альфа-1-антитрипсина (hAAT); промотор альбумина, Miyatake et al., J. Virol., 71: 5124-32 (1997); промотор корового антигена вируса гепатита В, Sandig et al., Gene Ther., 3: 1002-9 (1996); промотор альфа-фетопротеина (AFP), Arbuthnot et al., Hum. Gen. Ther., 7: 1503-14 (1996)], среди прочих. Примером энхансера, активного в печени, является энхансер аполипопротеина E (apoE) HCR-1 и HCR-2 (Allan et al., J. Biol. Chem., 272: 29113-19 (1997)).
[0174] Элементы контроля экспрессии также включают повсеместно распространенные или неизбирательные промоторы/энхансеры, которые способны направлять экспрессию полинуклеотида во многих различных типах клеток. Такие элементы включают, не ограничиваясь этим, последовательности раннего промотора/энхансера цитомегаловируса (CMV), последовательности промотора/энхансера вируса саркомы Рауса (RSV) и другие вирусные промоторы/энхансеры, активные в различных типах клеток млекопитающих, или синтетические элементы, которые отсутствуют в природе (см., например, Boshart et al., Cell, 41: 521-530 (1985)), промотор SV40, промотор дигидрофолатредуктазы, промотор цитоплазматического β-актина и промотор фосфоглицеролкиназы (PGK).
[0175] Элементы контроля экспрессии также могут обеспечивать экспрессию регулируемым образом, т. е. сигнал или стимулы повышают или снижают экспрессию операбельно связанного гетерологичного полинуклеотида. Регулируемый элемент, который повышает экспрессию операбельно связанного полинуклеотида в ответ на сигнал или стимулы, также называют «индуцибельным элементом» (т. е. индуцируется сигналом). Конкретные примеры включают, не ограничиваясь этим, гормон-индуцируемый (например, стероидами) промотор, Как правило, степень повышения или снижения, обеспечиваемая такими элементами, пропорциональна количеству присутствующего сигнала или стимулов; чем выше количество сигнала или стимулов, тем выше увеличение или уменьшение экспрессии. Конкретные неограничивающие примеры включают цинк-индуцируемый промотор овечьего металлотионина (MT); стероидный гормон-индуцируемый промотор вируса опухоли молочной железы мыши (MMTV); система промоторов полимеразы Т7 (WO 98/10088); тетрациклин-репрессируемую систему (Gossen et al., Proc. Natl. Acad. Sci. USA, 89: 5547-5551 (1992));, тетрациклин-индуцируемую систему (Gossen et al., Science, 268: 1766-1769 (1995); см. также Harvey et al., Curr. Opin. Chem. Biol. 2: 512-518 (1998)); RU486-индуцируемую систему (Wang et al., Nat. Biotech., 15: 239-243 (1997) и Wang et al., Gene Ther., 4: 432-441 (1997)]; и рапамицин-индуцируемую систему (Magari et al., J. Clin. Invest., 100: 2865-2872 (1997); Rivera et al., Nat. Medicine, 2: 1028-1032 (1996)). Другие регулируемые элементы контроля, которые могут быть пригодными в данном контексте, представляют таковые, которые регулируются определенным физиологическим состоянием, например, температурой, острой фазой, развитием.
[0176] Элементы контроля экспрессии также включают нативный элемент(ы) по отношению к нуклеиновой кислоте. Нативный контрольный элемент (например, промотор) можно использовать, когда желательно, чтобы экспрессия гетерологичного полинуклеотида имитировала нативную экспрессию. Нативный элемент можно использовать, когда экспрессия гетерологичного полинуклеотида подлежит временной или зависящей от стадии развития регуляции, или тканеспецифической регуляции, или в ответ на специфические стимулы транскрипции. Другие нативные элементы контроля экспрессии, такие как интроны, сайты полиаденилирования или консенсусные последовательности Козака, также могут быть использованы.
[0177] Термин «операбельно связанный» означает, что регуляторные последовательности, необходимые для экспрессии кодирующей последовательности, располагаются в соответствующих положениях относительно кодирующей последовательности, что позволяет им оказывать влияние на экспрессию кодирующей последовательности. Такое же определение иногда применяется к расположению кодирующих последовательностей и элементов контроля транскрипции (например, промоторов, энхансеров и элементов терминации) в экспрессионном векторе. Такое же определение также иногда применяется к расположению последовательностей нуклеиновых кислот первой и второй молекул нуклеиновых кислот, когда генерируется гибридная молекула нуклеиновых кислот.
[0178] В примере элемента контроля экспрессии, находящегося в операбельной связи с нуклеиновой кислотой, связь заключается в том, что контрольный элемент модулирует экспрессию нуклеиновой кислоты. Более конкретно, например, две ДНК являются операбельно связанными, означает, если две последовательности ДНК расположены (цис или транс) таким образом, что, по меньшей мере, одна из последовательностей ДНК способна оказывать физиологическое воздействие на другую последовательность.
[0179] Следовательно, дополнительные элементы для векторов включают, без ограничения, элемент контроля экспрессии (например, промотор/энхансер), сигнал терминации транскрипции или стоп-кодон, 5'- или 3'-нетранслируемые области (например, последовательности полиаденилирования (полиА)) которые фланкируют последовательность, такие как одна или более копий последовательности ITR AAV или интрон.
[0180] Другие элементы включают, например, полинуклеотидные последовательности-наполнители или спейсерные последовательности, например, для улучшения упаковки и уменьшения присутствия загрязняющей нуклеиновой кислоты. Векторы AAV обычно принимают вставки ДНК, имеющие различный диапазон размеров, который обычно составляет примерно от 4 т.п.н. до примерно 5,2 т.п.н. или немного больше. Таким образом, для более коротких последовательностей всключают спейсерную последовательность или наполнитель для доведения длины вставки до размера, близкого или равного обычному размеру геномной последовательности вируса, приемлемого для упаковки вектора AAV в вирусную частицу. В различных вариантах осуществления нуклеиновокислотная последовательность-наполнитель/спейсерная последовательность представляет собой нетранслируемый (не кодирующий белок) сегмент нуклеиновой кислоты. Для последовательности нуклеиновой кислоты менее 4,7 т.п.н., полинуклеотидная последовательность-наполнитель или спейсерная последовательность имеет длину, которая при объединении (например, вставке в вектор) с последовательностью имеет общую длину примерно 3,0-5,5 т.п.н. или примерно 4,0-5,0 т.п.н. или примерно 4,3-4,8 т.п.н.
[0181] Интрон также может функционировать в качестве полинуклеотидной последовательности-наполнителя или спейсерной последовательности, для достижения длины вектора AAV, подходящей для упаковки в вирусную частицу. Интроны и фрагменты интронов, которые функционируют в качестве полинуклеотидной последовательности-наполнителя или спейсерной последовательности, также могут усиливать экспрессию.
[0182] «Полипептиды», «белки» и «пептиды», кодируемые «нуклеиновой кислотой» или «плазмидами», включают полноразмерные нативные последовательности встречающихся в природе белков дикого типа, а также функциональные подпоследовательности, модифицированные формы или варианты последовательности при условии, что подпоследовательность, модифицированная форма или вариант сохраняют некоторую степень функциональных свойств нативного полноразмерного белка. Например, белок может иметь делецию, замену или добавление и сохранять, по меньшей мере, частичную функцию или активность.
[0183] Термины «модифицированная форма» или «вариантная форма» и их грамматические вариации означают, что нуклеиновая кислота или полипептид отличаются от референтной последовательности. Следовательно, модифицированные и вариантные последовательности могут иметь по существу одинаковую, большую или меньшую экспрессию, активность или функцию, чем референтная последовательность, но, по меньшей мере, сохранять частичную активность или функцию референтной последовательности.
[0184] Неограничивающие примеры модификаций включают одну или более нуклеотидных или аминокислотных замен (например, 1-3, 3-5, 5-10, 10-15, 15-20, 20-25, 25-30, 30 -40, 40-50, 50-100, 100-150, 150-200, 200-250, 250-500, 500-750, 750-850 или более нуклеотидов или остатков).
[0185] Пример аминокислотной модификации представляет консервативную аминокислотную замену или делецию (например, подпоследовательности или фрагментов) в референтной последовательности. В конкретных вариантах осуществления модифицированная или вариантная последовательность сохраняет, по меньшей мере, часть функции или активности немодифицированной последовательности.
[0186] Включаются все формы нуклеиновых кислот млекопитающих и не млекопитающих, которые транскрибируются, и нуклеиновые кислоты, которые кодируют белки. Таким образом, изобретение включает гены и белки не млекопитающих, млекопитающих, отличных от людей, и людей, чьи гены и белки функционируют по существу сходным образом с генами и белками человека.
[0187] После трансфекции клеток и/или продукции рекомбинантных вирусных векторов (например, AAV), как здесь описано, при желании вирусные (например, rAAV) вирионы можно получить/собрать из клеток/клеточной культуры и необязательно очистить и/или выделить из трансфектированных клеток с использованием различных обычных методов. Такие способы включают колоночную хроматографию, градиенты CsCl и тому подобное. Например, можно использовать множество стадий очистки на колонке, таких как очистка на анионообменной колонке, аффинной колонке и/или катионообменной колонке. (См., например, публикацию международной заявки WO 02/12455 и публикацию заявки США № 20030207439). В качестве альтернативы или в дополнение можно использовать стадии очистки в градиенте CsCl. (См., например, публикацию заявки США № 20120135515; и 20130072548). Также, если для экспрессии упаковочных и/или хелперных белков используется инфекционный вирус, то остаточный вирус можно инактивировать различными способами. Например, аденовирус можно инактивировать нагреванием до температуры примерно 60°С в течение, например, 20 мин или более. Такая обработка эффективно инактивирует вирус-помощник, поскольку AAV является термостабильным, а аденовирус-помощник - термолабильным.
[0188] Термин «выделенный», когда он используется в качестве определителя композиции, означает, что композиции получены искусственным путем или отделены, полностью или, по меньшей мере, частично, от их естественной среды in vivo. Как правило, выделенные композиции по существу не содержат одного или более веществ, с которыми они обычно связаны в природе, например, одного или более загрязняющих веществ, таких как белок, нуклеиновая кислота, липид, углевод, клеточная мембрана.
[0189] В отношении молекул РНК, то термин «выделенный» в основном относится к молекуле РНК, кодируемой выделенной молекулой ДНК, как определено выше. Альтернативно, термин может относиться к молекуле РНК, которая была достаточно отделена от молекул РНК, с которыми она связана в своем естественном состоянии (т. е. в клетках или тканях), так что она находится в «по существу в чистой» форме (термин «по существу чистый» определен ниже).
[0190] В отношении белка, то иногда здесь используется термин «выделенный белок» или «выделенный и очищенный белок». Этот термин относится в основном к белку, полученному экспрессией выделенной молекулы нуклеиновой кислоты. Альтернативно, этот термин может относиться к белку, который был в достаточной степени отделен от других белков, с которыми он связан в природе, чтобы находиться «по существу в чистой» форме.
[0191] Термин «выделенный» не исключает комбинаций, полученных искусственным путем, например, последовательность рекомбинантного вектора (например, rAAV) или вирусную частицу, которая упаковывает или капсидирует векторный геном и фармацевтическую композицию. Термин «выделенный» также не исключает альтернативные физические формы композиции, такие как гибриды/химеры, мультимеры/олигомеры, формы, полученные в результате модификации (например, такой как фосфорилирование, гликозилирование, липидирование) или дериватизированные формы или формы, экспрессированные в клетках-хозяевах, полученных искуственным путем.
[0192] Термин «по существу чистый» относится к препарату, содержащему, по меньшей мере, 50-60 мас.% представляющего интерес соединения (например, нуклеиновой кислоты, олигонуклеотида, белка и т. д.). Препарат может содержать, по меньшей мере, 75 мас.% или примерно 90-99 мас.% представляющего интерес соединения. Чистоту измеряют способами, подходящими для соединения, представляющего интерес (например, хроматографические методы, электрофорез в агарозном или полиакриламидном геле, анализ ВЭЖХ и тому подобное).
[0193] Молекулы нуклеиновой кислоты, векторы экспрессии (например, векторные геномы), плазмиды можно получить с использованием методов технологии рекомбинантных ДНК. Доступность информации о нуклеотидных последовательностях позволяет получать выделенные молекулы нуклеиновых кислот различными способами. Например, нуклеиновые кислоты (например, плазмиды) можно получить с использованием различных стандартных методов клонирования, технологии рекомбинантной ДНК, посредством клеточной экспрессии или трансляции in vitro и методов химического синтеза. Чистоту можно определить секвенированием, гель-электрофорезом и тому подобное. Например, нуклеиновые кислоты можно выделить с использованием гибридизации или компьютерных методов скрининга базы данных. Такие методы включают, не ограничиваясь этим: (1) гибридизацию геномной ДНК или библиотек кДНК с зондами для обнаружения гомологичных нуклеотидных последовательностей; (2) скрининг антител для детектирования полипептидов, имеющих общие структурные признаки, например, с использованием экспрессионной библиотеки; (3) полимеразную цепную реакцию (ПЦР) на геномной ДНК или кДНК с использованием праймеров, способных к отжигу с представляющей интерес последовательностью нуклеиновой кислоты; (4) компьютерный поиск родственных последовательностей в базах данных; и (5) дифференциальный скрининг библиотеки нуклеиновых кислот с вычитанием.
[0194] Нуклеиновые кислоты могут поддерживаться в виде ДНК в любом удобном клонирующем векторе. В одном варианте осуществления нуклеиновые кислоты содержатся в плазмиде. Альтернативно, нуклеиновые кислоты могут поддерживаться в векторе, подходящем для экспрессии в клетках млекопитающих.
[0195] Нуклеиновые кислоты, плазмиды, векторы, векторы экспрессии (например, rAAV) и частицы рекомбинантного вируса, способы и применения позволяют лечить генетические заболевания. При заболеваниях с дефицитным состоянием перенос генов можно использовать для введения нормального гена в пораженные ткани для заместительной терапии, а также для создания животных моделей заболевания с использованием антисмысловых мутаций. При несбалансированных болезненных состояниях перенос генов можно использовать для воспроизведения болезненного состояния в модельной системе, которая затем может быть использована для противодействия болезненному состоянию. Также можно использовать сайт-специфическую интеграцию последовательностей нуклеиновых кислот для коррекции дефектов.
[0196] Вирусные векторы, такие как лентивирусные и парвовирусные векторы, включая серотипы AAV и их варианты, обеспечивают средства для доставки нуклеиновой кислоты в клетки ex vivo, in vitro и in vivo, которые кодируют белки так, что клетки экспрессируют кодированные белка. AAV являются вирусами, пригодными в качестве векторов для генной терапии, поскольку они могут проникать в клетки и вводить нуклеиновую кислоту/генетический материал, обеспечивая стабильное поддержание нуклеиновой кислоты/генетического материала в клетках. Кроме того, эти вирусы могут, например, вводить нуклеиновую кислоту/генетический материал в конкретные сайты. Поскольку AAV не ассоциированы с патогенным заболеванием у людей, то векторы AAV способны доставлять гетерологичные полинуклеотидные последовательности (например, терапевтические белки и агенты) пациентам, не вызывая существенного патогенеза или заболевания, опосредованного AAV.
[0197] Вирусные векторы, которые можно использовать, включают, не ограничиваясь этим, векторы на основе аденоассоциированных вирусов (AAV) многочисленных серотипов (например, AAV-1 до AAV-12 и другие) и гибридные/химерные векторы AAV, лентивирусные векторы и псевдотипированные лентивирусные векторы (например, вирус Эбола, вирус везикулярного стоматита (VSV) и вирус иммунодефицита кошек (FIV)), векторы на основе вируса простого герпеса, аденовирусные векторы (с тканеспецифическими промоторами/энхансерами или без них), векторы на основе вируса коровьей оспы, ретровирусные векторы, лентивирусные векторы, невирусные векторы и другие.
[0198] AAV и лентивирусные частицы можно использовать в качестве носителей для эффективной доставки генов. Такие вирионы обладают рядом желательных свойств для таких применений, включая тропизм для делящихся и неделящихся клеток. Ранний клинический опыт с этими векторами также продемонстрировал отсутствие устойчивой токсичности, и иммунные ответы были минимальными или недетектируемыми. Известно, что AAV инфицирует широкий спектр типов клеток in vivo и in vitro посредством рецептор-опосредованного эндоцитоза или трансцитоза. Эти векторные системы тестировали у людей, нацеливая на эпителий сетчатки, печень, скелетные мышцы, дыхательные пути, головной мозг, суставы и гематопоэтические стволовые клетки. Невирусные векторы, например, на основе плазмидной ДНК или минициклах, также являются пригодными переносчиками генов.
[0199] Следовательно, в различных вариантах осуществления изобретения вектор включает лентивирусный или парвовирусный вектор, такой как аденовирусный вектор. В конкретных вариантах осуществления рекомбинантный вектор представляет собой парвовирусный вектор. Парвовирусы представляют небольшие вирусы, геном которых содержит одноцепочечную ДНК. «Аденоассоциированные вирусы» (AAV) относятся к семейству парвовирусов.
[0200] AAV-векторы и лентивирусные векторы обычно не включают вирусные гены, ассоциированные с патогенезом. Такие векторы обычно имеют один или более генов AAV дикого типа, полностью или частично делецированных, например, гены rep и/или cap, но сохраняют, по меньшей мере, одну функциональную фланкирующую последовательность ITR, необходимую для спасения, репликации и упаковки рекомбинантного вектора в векторную частицу AAV. Например, включаются только основные части вектора, например, элементы ITR и LTR соответственно. Следовательно, геном вектора AAV должен включать последовательности, необходимые в цис-конфигурации для репликации и упаковки (например, функциональные последовательности ITR).
[0201] Рекомбинантный вектор AAV, а также его способы и применения включают любой вирусный штамм или серотип. В качестве неограничивающего примера, рекомбинантный вектор AAV может быть основан на геноме любого AAV, например, таком как AAV-1, -2, -3, -4, -5, -6, -7, -8, -9, -10, -11, -12 или AAV-2i8. Такие векторы могут быть на основе одного и того же штамма или серотипа (или подгруппы или варианта) или могут отличаться друг от друга. В качестве неограничивающего примера, рекомбинантный вектор AAV на основе генома одного серотипа может быть идентичен одному или более капсидным белкам, которые упаковывают вектор. Кроме того, геном рекомбинантного вектора AAV может быть на основе генома серотипа AAV (например, AAV2), отличного от одного или более капсидных белков AAV, которые упаковывают вектор. Например, геном вектора AAV может быть на основе AAV2, тогда как, по меньшей мере, один из трех капсидных белков может представлять собой AAV1, AAV3, AAV4, AAV5, AAV6, AAV7, AAV8, AAV9, AAV10, AAV11, AAV12 или AAV- 2i8 или его вариант, например. Варианты AAV включают варианты и химеры AAV1, AAV2, AAV3, AAV4, AAV5, AAV6, AAV7, AAV8, AAV9, AAV10, AAV11, AAV12 AAV-2i8, капсиды SEQ ID NO1 и SEQ ID NO: 2.
[0202] В конкретных вариантах осуществления векторы на основе аденоассоциированного вируса (AAV) включают AAV1, AAV2, AAV3, AAV4, AAV5, AAV6, AAV7, AAV8, AAV9, AAV10, AAV11, AAV12, AAV-2i8, SEQ ID NO1 и SEQ ID NO: 2, а также их варианты (например, варианты капсидов, такие как аминокислотные вставки, добавления, замены и делеции), например, как описано в WO 2013/158879 (международная заявка PCT/US2013/037170), WO 2015/013313 (международная заявка PCT/US2014/047670) и заявке на патент США 2013/0059732 (заявка на патент США 13/594773, раскрывает LK01, LK02, LK03 и т. д.).
[0203] Серотипы вариантов AAV и AAV (например, капсидные варианты) (например, последовательности VP1, VP2 и/или VP3) могут отличаться или не отличаться от других серотипов AAV, включая, например, AAV1-AAV12 (например, разные из последовательностей VP1, VP2 и/или VP3 любого из серотипов AAV1-AAV12).
[0204] Как здесь используется, термин «серотип» представляет собой различие, используемое для обозначения AAV, содержащего капсид, который серологически отличается от других серотипов AAV. Серологическое отличие определяют на основе отсутствия перекрестной реактивности между антителами к одному AAV по сравнению с другим AAV. Такие различия в перекрестной реактивности обычно обусловлены различиями в последовательностях капсидных белков/антигенных детерминант (например, за счет различий последовательностей VP1, VP2 и/или VP3 серотипов AAV). Несмотря на возможность того, что варианты AAV, включающие капсидные варианты, могут не отличаться серологически от референтного AAV или другого серотипа AAV, они отличаются, по меньшей мере, на один нуклеотидный или аминокислотный остаток по сравнению с референтным AAV или AAV другого серотипа.
[0205] Согласно традиционному определению, серотип означает, что представляющий интерес вирус был тестирован на сыворотке, специфичной для всех существующих и охарактеризованных серотипов на нейтрализующую активность, и не было детектировано никаких антител, которые нейтрализуют представляющий интерес вирус. Поскольку обнаружено большое количество изолятов природного вируса и/или получены капсидные мутанты, то серологические различия с любым из существующих в настоящее время серотипов могут существовать или могут не существовать. Таким образом, в тех случаях, когда новый вирус (например, AAV) не имеет серологического различия, то этот новый вирус (например, AAV) будет представлять подгруппу или вариант соответствующего серотипа. Во многих случаях серологическое тестирование на нейтрализующую активность еще не было выполнено на мутантных вирусах с модификациями капсидной последовательности, чтобы определить, имеют ли они другой серотип в соответствии с традиционным определением серотипа. Следовательно, для удобства и во избежание повторения термин «серотип» в широком смысле относится как к серологически различным вирусам (например, AAV), так и к вирусам (например, AAV), которые серологически не различаются, и которые могут находиться в подгруппе или варианте данного серотипа.
[0206] В различных примерных вариантах осуществления вектор AAV, относящийся к референтному серотипу, имеет полинуклеотид, полипептид или его подпоследовательность, которая включает или состоит из последовательности, по меньшей мере, на 80% или более (например, 85%, 90%, 95%, 96%, 97%, 98%, 99%, 99,1%, 99,2%, 99,3%, 99,4%, 99,5% и т. д.) идентичной одному или более AAV1, AAV2, AAV3, AAV4, AAV5, AAV6, AAV7, AAV8, AAV9, AAV10, AAV11, AAV12, AAV-2i8, SEQ ID NO1 или SEQ ID NO: 2 (например, такие как ITR или последовательности VP1, VP2 и/или VP3).
[0207] Композиции, способы и применения по изобретению включают последовательности AAV (полипептиды и нуклеотиды) и их подпоследовательности, которые демонстрируют менее чем 100% идентичность последовательности с референтным серотипом AAV, таким как AAV1, AAV2, AAV3, AAV4, AAV5, AAV6, AAV7, AAV8, AAV9, AAV10, AAV11, AAV12 или AAV-2i8, но отличаются от и не идентичны известным генам или белкам AAV, таким как AAV1, AAV2, AAV3, AAV4, AAV5, AAV6, AAV7, AAV8, AAV9, AAV10, AAV11, AAV12 или AAV-2i8, гены или белки и т. д. В одном варианте осуществления полипептид AAV или его подпоследовательность включает или состоит из последовательности, по меньшей мере, на 75% или более идентичной, например, на 80%, 85%, 85%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 99,1%, 99,2%, 99,3%, 99,4%, 99,5% и т. д., до 100% идентичной любой референтной последовательности AAV или ее подпоследовательности, такой как AAV1, AAV2, AAV3, AAV4, AAV5, AAV6, AAV7, AAV8, AAV9, AAV10, AAV11, AAV12, AAV-2i8, SEQ ID NO1 или SEQ ID NO: 2 (например, капсид VP1, VP2 и/или VP3 или ITR). В конкретных аспектах вариант AAV имеет 1, 2, 3, 4, 5, 5-10, 10-15, 15-20 или более аминокислотных замен.
[0208] Рекомбинантные векторы AAV, включая AAV1, AAV2, AAV3, AAV4, AAV5, AAV6, AAV7, AAV8, AAV9, AAV10, AAV11, AAV12, AAV-2i8, SEQ ID NO1 или SEQ ID NO: 2 и вариант, связанный с ними, гибридные и химерные последовательности могут быть сконструированы с использованием рекомбинантных методов, которые известны специалистам в данной области, для включения одной или нескольких последовательностей нуклеиновых кислот (трансгенов), фланкированных одной или несколькими функциональными последовательностями ITR AAV.
[0209] Нуклеиновые кислоты (плазмиды), векторы, рекомбинантные векторы (например, rAAV) и частицы рекомбинантного вируса можно включить в фармацевтические композиции. Такие фармацевтические композиции пригодны, среди прочего, для введения и доставки субъекту in vivo или ex vivo. В конкретных вариантах осуществления фармацевтические композиции содержат фармацевтически приемлемый носитель или наполнитель. Такие эксципиенты включают любой фармацевтический агент, который сам по себе не вызывает иммунного ответа, вредного для субъекта, получающего композицию, и который можно вводить без проявления чрезмерной токсичности.
[0210] Как здесь используется, термин «фармацевтически приемлемый» и «физиологически приемлемый» означает биологически приемлемый состав, газообразный, жидкий или твердый, или их смесь, которая подходит для одного или более путей введения, доставки или контакта in vivo. «Фармацевтически приемлемая» или «физиологически приемлемая» композиция представляет собой вещество, которое не является биологически или иным образом нежелательным, например, вещество можно вводить субъекту без существенных нежелательных биологических эффектов. Таким образом, такую фармацевтическую композицию можно использовать, например, для введения субъекту нуклеиновой кислоты, вектора, вирусной частицы или белка.
[0211] Фармацевтически приемлемые наполнители включают, не ограничиваясь этим, жидкости, такие как вода, физиологический раствор, глицерин, сахара и этанол. Фармацевтически приемлемые соли также можно включить в нее, например, соли минеральных кислот, такие как гидрохлориды, гидробромиды, фосфаты, сульфаты и тому подобное; и соли органических кислот, таких как ацетаты, пропионаты, малонаты, бензоаты и тому подобное. Кроме того, в таких носителях могут присутствовать вспомогательные вещества, такие как смачивающие или эмульгирующие агенты, рН-буферные вещества и тому подобное.
[0212] Фармацевтическая композиция может быть обеспечена в виде соли, и соль может быть образована со многими кислотами, включая, не ограничиваясь этим, соляную, серную, уксусную, молочную, винную, яблочную, янтарную кислоту и т. д. Соли имеют тенденцию быть более растворимыми в воде или других протонных растворителях, чем соответствующие формы свободного основания. В других случаях препарат может представлять лиофилизированный порошок, который может содержать любое или все из следующего: 1-50 мМ гистидина, 0,1%-2% сахарозы и 2%-7% маннита при диапазоне рН от 4,5 до 5,5, и который объединяется с буфером перед использованием.
[0213] Фармацевтические композиции включают растворители (водные или неводные), растворы (водные или неводные), эмульсии (например, масло-в-воде или вода-в-масле), суспензии, сиропы, эликсиры, дисперсии и суспензии, носители, покрытия, изотонические и стимулирующие и снижающие абсорбцию агенты, совместимые с фармацевтическим введением или контактом или доставкой in vivo. Водные и неводные растворители, растворы и суспензии могут включать суспендирующие агенты и загустители. Такие фармацевтически приемлемые носители включают таблетки (с покрытием или без покрытия), капсулы (твердые или мягкие), микрогранулы, порошок, гранулы и кристаллы. Дополнительные активные соединения (например, консерванты, антибактериальные, противовирусные и противогрибковые агенты) также могут быть включены в композиции.
[0214] Фармацевтические композиции могут быть составлены таким образом, чтобы они были совместимыми с конкретным путем введения или доставки. Таким образом, фармацевтические композиции включают носители, разбавители или наполнители, подходящие для введения различными путями.
[0215] Композиции и способы могут быть стерильными. Композиции могут быть приготовлены, и способы могут быть выполнены в контейнерах, подходящих для таких процессов. Такие контейнеры включают кюветы, колбы, роликовые бутыли, пакеты, биореакторы, сосуды, пробирки, флаконы и т. д. Контейнеры могут быть изготовлены из материалов, которые включают, не ограничиваясь этим, стекло, пластик и полимеры, такие как полистирол, полибутилен, полипропилен и т. д.
[0216] Композиции и стадии способа могут выполняться в заранее определенном порядке или в переставленном порядке. Стадии способа могут выполняться поэтапно или через определенные промежутки времени. Другими словами, может быть выполнена стадия способа, и затем может иметь место временной интервал между следующей стадией, где такие интервалы варьируются, например, от примерно 1 с до примерно 60 с; примерно от 1 мин до примерно 60 мин; примерно от 1 ч до примерно 24 ч; примерно от 1 суток до примерно 7 суток; или примерно от 1 недели до примерно 48 недель.
[0217] Протоколы для получения аденовирусных векторов описаны в патентах США № 5998205; 6228646; 6093699 и 6100242; и международных патентных заявках WO 94/17810 и WO 94/23744, которые в полном объеме включены здесь посредством ссылки.
[0218] Изобретение пригодно для получения клеток и векторов для последующего применения в медицине и ветеринарии. Следовательно, подходящие субъекты включают млекопитающих, таких как люди, а также млекопитающих, отличных от людей. Термин «субъект» относится к животному, обычно млекопитающему, такому как человек, приматам, отличным от человека (обезьянам, гиббонам, гориллам, шимпанзе, орангутангам, макакам), домашнему животному (собакам и кошкам), сельскохозяйственному животному (птице, такой как куры и утки, лошадям, коровам, козам, овцам, свиньям) и экспериментальным животным (мыши, крысе, кролику, морской свинке). Человек-субъект включают эмбрионов, новорожденных, младенцев, подростков и взрослых. Субъекты включают животные модели заболеваний, например, мышиные и другие животные модели нарушений свертывания крови, таких как HemA и другие, известные специалистам в данной области.
[0219] Как здесь используется, термин «разовая лекарственная форма» относится к физически дискретным единицам, подходящим в качестве единичных доз для субъекта, подлежащего лечению; каждая единица содержит заранее определенное количество, необязательно в сочетании с фармацевтическим носителем (эксципиентом, разбавителем, носителем или наполнителем), которое при введении в одной или более дозах рассчитывается для получения желаемого эффекта (например, профилактического или терапевтического эффекта). Разовые лекарственные формы могут находиться, например, в ампулах и флаконах, которые могут включать жидкую композицию или композицию в сублимированном или лиофилизированном состоянии; например, стерильный жидкий носитель может быть добавлен до введения или доставки in vivo. Отдельные разовые лекарственные формы могут быть включены в мультидозовые наборы или контейнеры. Последовательности рекомбинантного вектора (например, rAAV), частицы рекомбинантного вируса и их фармацевтические композиции могут быть упакованы в одну или много разовых лекарственных форм для простоты введения и однородности дозирования.
[0220] Изобретение обеспечивает наборы с упаковочным материалом и одним или более компонентами в нем. Набор обычно включает этикетку или вкладыш в упаковку, включающий описание компонентов или инструкции по применению компонентов, находящихся в нем. Набор может содержать ряд таких компонентов, например, нуклеиновую кислоту (плазмиду), PEI, усиливающий агент, клетки.
[0221] Термин «набор» относится к физической структуре, в которой размещается один или более компонентов набора. Упаковочный материал может содержать компоненты в стерильном состоянии и может быть изготовлен из материала, обычно используемого для таких целей (например, бумаги, гофрированного волокна, стекла, пластика, фольги, ампул, флаконов, пробирок и т. д.).
[0222] Этикетки или вкладыши могут включать идентифицирующую информацию по одному или более компонентам. Этикетки или вкладыши могут содержать информацию, идентифицирующую изготовителя, номера партий, место и дату изготовления, дату срока годности. Этикетки или вкладыши могут включать идентифицирующую информацию об изготовителе, номерах партий, местонахождении изготовителя и дате. Этикетки или вкладыши могут включать инструкции по применению одного или более компонентов набора в способе, использовании или протоколе производства. Инструкции могут включать инструкции для получения композиций или применения любого из способов, описанных здесь.
[0223] Этикетки или вкладыши включают «печатные материалы», например, бумагу или картон, или отдельно или прикрепленные к компоненту, набору или упаковочному материалу (например, коробке), или наклеенные на ампулу, пробирку или флакон, содержащих компонент набора. Этикетки или вкладыши могут дополнительно включать машиночитаемый носитель, такой как печатная этикетка со штрих-кодом, диск, оптический диск, такой как CD- или DVD-ROM/RAM, DVD, MP3, магнитная лента или электрический носитель данных, такой как RAM и ROM, или их гибриды, такие как магнитные/оптические носители данных, флэш-носители или карты памяти.
[0224] Если не указано иное, то все технические и научные термины, используемые в данном документе, имеют то же значение, которое обычно понимают специалисты в области техники, к которой относится данное изобретение. Хотя способы и материалы, подобные или эквивалентные тем, которые описаны здесь, могут использоваться при практическом применении или испытании настоящего изобретения, подходящие способы и материалы описаны здесь.
[0225] Все патенты, заявки на патенты, публикации и другие ссылки, данные GenBank и данные ATCC, цитированные здесь, включены посредством ссылки во всей их полноте. В случае конфликта, описание, включая определения, будет иметь преимущество.
[0226] Различные термины, относящиеся к биологическим молекулам по изобретению, используются выше, а также в описании и формуле изобретения.
[0227] Все признаки, раскрытые в данном документе, могут быть объединены в любой комбинации. Каждый признак, раскрытый в описании, может быть заменен альтернативным признаком, служащим той же, эквивалентной или аналогичной цели. Таким образом, если прямо не указано иное, то раскрытые признаки (например, PEI, плазмида, вектор (например, rAAV или рекомбинантная вирусная частица) являются примером вида эквивалентных или сходных признаков.
[0228] Как здесь используется, формы единственного числа «а», «and» и «the» включают множественные ссылки, если контекст явно не указывает на иное. Таким образом, например, ссылка на «плазмиду» или «нуклеиновую кислоту» включает множество таких плазмид или нуклеиновых кислот, ссылка на «вектор» включает множество таких векторов, ссылка на «вирус» или «частицу» включает в себя множество таких вирусов/частиц, и ссылка на «усиливающий агент» включает множество таких агентов.
[0229] Как здесь используется, все числовые значения или числовые диапазоны включают целые числа в таких диапазонах и доли значений или целых чисел в пределах диапазонов, если контекст явно не указывает на иное. Таким образом, для иллюстрации, ссылка на 80% идентичность или более включает 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94% и т. д., а также 81,1%, 81,2%, 81,3%, 81,4%, 81,5% и т. Д., 82,1%, 82,2%, 82,3%, 82,4%, 82,5% и т. д., и т. д.
[0230] Ссылка на целое число с большим или меньшим, чем включает любое число, больше или меньше, чем ссылочный номер, соответственно. Таким образом, например, ссылка на менее 100 включает 99, 98, 97 и т. д. вплоть до числа один (1); и меньше 10, включая 9, 8, 7 и т. д. вплоть до числа один (1).
[0231] Как здесь используется, все числовые значения или диапазоны включают доли значений и целых чисел в таких диапазонах и доли целых чисел в таких диапазонах, если контекст явно не указывает на иное. Таким образом, для иллюстрации, ссылка на числовой диапазон, такой как 1-10, включает 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, а также 1,1, 1,2, 1,3, 1,4, 1,5, и т. д. и т. п. Ссылка на диапазон 1-50 включает 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, и т. д. до 50 включительно, а также 1,1, 1,2, 1,3, 1,4, 1,5 и т. д., 2,1, 2,2, 2,3, 2,4, 2,5 и т. д., и т. д.
[0232] Ссылка на серию диапазонов включает диапазоны, которые объединяют значения границ различных диапазонов в пределах серии. Таким образом, для иллюстрации ссылка на ряд диапазонов, например, 1-10, 10-20, 20-30, 30-40, 40-50, 50-60, 60-75, 75-100, 100-150 150-200, 200-250, 250-300, 300-400, 400-500, 500-750, 750-850, включает диапазоны 1-20, 1-30, 1-40, 1-50, 1- 60, 10-30, 10-40, 10-50, 10-60, 10-70, 10-80, 20-40, 20-50, 20-60, 20-70, 20-80, 20-90, 50-75, 50-100, 50-150, 50-200, 50-250, 100-200, 100-250, 100-300, 100-350, 100-400, 100-500, 150-250, 150-300, 150-350, 150-400, 150-450, 150-500 и т. д.
[0233] Изобретение, в общем, раскрыто в данном документе с использованием утвердительного выражения для описания многочисленных вариантов осуществления и аспектов. Изобретение также, в частности, включает варианты осуществления, в которых исключается конкретный предмет изобретения, полностью или частично, такой как вещества или материалы, стадии и условия способа, протоколы или процедуры. Например, в определенных вариантах осуществления или аспектах изобретения материалы и/или стадии способа исключаются. Таким образом, даже при том, что изобретение в целом не выражено здесь в терминах того, что изобретение не включает в себя аспекты, которые явно не исключены в изобретении, тем не менее, оно раскрыто в данном документе.
[0234] Был описан ряд вариантов осуществления изобретения. Тем не менее, специалист в данной области техники, не отступая от сущности и объема изобретения, может внести различные изменения и модификации изобретения, чтобы адаптировать его к различным применениям и условиям. Следовательно, следующие примеры предназначены для иллюстрации, но не для ограничения объема изобретения, заявленного любым образом.
Пример 1
Репрезентативные материалы и методы
[0235] Культивирование клеток. Клетки FreeStyle™ 293F (HEK 293F), полученные от Thermo Fisher Scientific (R79007), культивировали в экспрессионной среде FreeStyle™ F17 (F17) (Thermo Fisher Scientific, A1383501), с добавлением 1× GlutaMAX™ (Thermo Fisher Scientific, 35050-061) и 1× антибиотика-антимикотика (Thermo Fisher Scientific, 15240). Клетки культивировали во вращающихся колбах (Corning, 3152 или 3153), встряхиваемых колбах (Corning 431143 или 431145) или биореакторах. Для вращающейся колбы/встряхиваемой колбы клетки культивировали в термостате при 37°С с перемешиванием со скоростью 170 об/мин и в увлажненной атмосфере с 8% CO2; для биореакторов (Eppendorf, система DASGIP Parallel Bioreactor, стеклянные сосуды и одноразовые сосуды) культивирование клеток контролировали по запрограммированным параметрам (DO 40%, pH 7,2, перемешивание при 130 об/мин, 150 об/мин или 170 об/мин). Как правило, клетки высевали с титром 0,25-0,5×106/мл, субкультивировали каждые 2-3 дня добавлением свежей среды для культивирования клеток, когда плотность клеток достигала приблизительно 2-3×106/мл. Плотность и жизнеспособность клеток определяли с использованием анализатора жизнеспособности клеток Vi-cell™ XR (Beckman Coulter).
[0236] Плазмиды: три плазмиды использовали для получения рекомбинантных аденоассоциированных вирусных векторов (rAAV): 1) трансгенная плазмида, содержащая hFVIII, фланкированная ITR, 2) упаковочная плазмида, содержащая гены rep и cap, 3) аденовирусная хелперная плазмида, содержащая аденовирусные гены E2, E4 и VARNA. Все плазмиды были приобретены и изготовлены компанией Aldevron.
[0237] Приготовление растворов PEI. В качестве реагента для трансфекции использовали линейный полиэтиленимин (PEI) «Max» 40 кДа (Polysciences, 24765-2, гидрохлорид линейного PEI с молекулярной массой 25 кДа). Для исследований по оптимизации трансфекции PEI «Max» растворяли в 5 мМ Трис-буфере, с получением раствора 0,5 мг/мл, и рН раствора доводили до различных значений, включая pH 7,0, 7,1, 7,2, 7,3, 7,4, 7,6, 7,8 или 8,0. После нескольких эксперименов раствор PEI с pH 7,1 был выбран для всех исследований, если не указано иное, за счет лучшей трансфекции и продукции rAAV.
[0238] Использование усиливающих агентов при PEI-опосредованной трансфекции: потенциальные усиливающие агенты трансфекции, оцененные по их влиянию на трансфекцию и продукцию rAAV, представляли усилители 1 и 2 из набора для трансфекции ExpiFectamine™ 293 (Thermo Fisher Scientific, A14525), реагент P3000 из набора для трансфекции Lipofectamine® 3000 Transfection (Thermo Fisher Scientific, L3000015), усилитель из набора реагентов для трансфекции Effectene™ Transfection (Qiagen, 301427). Также были исследованы различные соединения, включая вальпроевую кислоту, этопозид, тенипозид, сиомицин А и вориностат, для тестирования их эффективности в отношении трансфекции клеток PEI и продукции rAAV.
[0239] Клетки HEK 293F выращивали в среде F17 плюс 1× добавка GlutaMAX™ и 1× антибиотик-антимикотик во вращающихся колбах или встряхиваемых колбах. За сутки до трансфекции клетки высевали из расчета 0,5-2×106 клеток/мл добавлением свежей среды. Через 24 ч клетки трансфицировали при плотности клеток 1-4×106 клеток/мл. Три плазмиды для трансфекции, hFVIII, Rep/cap, хелпер Ad2, использовали в молярном соотношении 1:1:1, 0,5:1:1 и 1:2:2 и в массовом соотношении 0,75:0,75:0,75, 1:1:1 и 1,5:1,5:1,5. Общее количество ДНК, использованное для трансфекции, составляло от 0,5 до 4,2 мкг на мл объема клеточной культуры. Комплекс PEI/ДНК готовили с различными массовыми соотношениями PEI и ДНК при 1:1, 1,5:1, 2:1, 2,5:1 и 3:1, инкубировали при комнатной температуре в течение 1, 5, 10, 15, 20, 25 и 30 мин, затем комплексы ДНК/PEI добавляли к клеточной культуре. Свободный PEI (без ДНК) в концентрации от 0,5 до 5,6 мкг/мл добавляли к клеточной культуре сразу после комплексов ДНК/PEI. Усиливающие агенты добавляли непосредственно к клеткам во время трансфекции или за 24 ч до трансфекции или через 16-18 ч после трансфекции. Оценивали различные количества усиливающих агентов. Образцы, включая клетки и среды для культивирования клеток, отбирали через 48 и 72 ч после трансфекции для подсчета клеток и оценки жизнеспособности клеток, и культуру клеток собирали через 72 ч после трансфекции.
[0240] Получение векторов rAAV в биореакторах: для масштабирования способа продукции векторов использовали систему параллельных биореакторов DASGIP 2L (Eppendorf), оснащенную двумя или тремя наклонными импеллерными мешалками. Конечный рабочий объем доводили до 400 мл или 1,2 л. Перемешивание устанавливали на 130 об/мин, 150 об/мин или 170 об/мин, температура поддерживалась на уровне 37°С. Значение pH тестировали на уровне 6,3, 6,8, 7,2, 7,4, 7,6 или 8. pH 7,2 был выбран за счет лучшего роста клеток и продукции rAAV. Растворенный кислород поддерживался на уровне 40% путем добавления газовой смеси кислорода, углекислого газа и воздуха. Проводился мониторинг всх этих параметров, и контроль осуществлялся системой управления DASGIP с программным обеспечением DASGIP Control 4.0. Клетки НЕК 293F, культивированные в среде F17, инокулировали при плотности клеток 0,4×106 клеток/мл с жизнеспособностью более 95%. Клетки субкультивировали на 3 сутки после посева добавлением свежей среды. Плотность клеток доводили примерно до 0,5-1,7×106 клеток/мл после субкультивирования. Через 24 ч после субкультивирования клетки трансфектировали комплексом PEI/ДНК, свободным PEI и усилителями трансфекции, как описано выше и в надписях к фигурам. При трансфекции плотность клеток составляла примерно 1-3×106 клеток/мл. 1,2-4,2 мкг/мл ДНК, смесь PEI/ДНК в массовом соотношении 1:1, 1,5:1, 2:1, 2,5:1 или 3:1 с 0,5-4,2 мкг/мл свободного PEI и усиливающие агенты анализировали в отношении влияния на трансфекцию плазмидой и продукцию RAAV. Культуру клеток собирали через 72 ч после трансфекции.
[0241] Количественное определение векторов rAAV: векторы rAAV выделяли из сбора трансфектированных клеток HEK 293F посредством микрофлюидизации (microfluidizer TM, Microfluidics) или трехкратной обработки ультразвуком. Клеточный дебрис осаждали центрифугированием, и супернатанты собирали и анализировали с использованием ПЦР в режиме реального времени.
[0242] Число копий генома вектора rAAV определяли с помощью полимеразной цепной реакции в режиме реального времени (кПЦР) (Thermo Fisher Scientific, QuanStudio 7), используя TaqMan Master Mix (Thermo Fisher Scientific, 4304437). 10 мкл клеточного лизата сначала обрабатывали 2 мкл универсальной РНК (Biochain, R423565), и затем 7,6 Е ДНКазы I (Qiagen, 79254) для расщепления контаминирующей неупакованной ДНК. Затем раствор обрабатывали 0,2% SDS/5 мМ ЭДТА/0,2 М NaCl и нагревали при 95°С в течение 10 мин для инактивации ДНКазы I и высвобождения векторной ДНК. Праймеры и зонд для детектирования последовательности трансгена hFVIII: прямой праймер: 5'- TGAGGAGGCTGAAGACTAT-3' (SEQ ID NO:3), обратный праймер 5'- CCACAGACCTGATCTGAATGAA ‐3' (SEQ ID NO:4) и зонд/5'-6FAM/TGGATGTGG /ZEN/TGAGGTTTGATGATGACA/3IABkFQ/-3' (SEQ ID NO:5). Стандарт получали линеаризацией плазмиды pAAV-hFVIII. Все образцы анализировали в трех повторах.
[0243] Вестерн-блот анализ: векторы rAAV выделяли из трансфектированных клеток HEK 293F с использованием микрофлюидизации (microfluidizer TM, Microfluidics) или трехкратной обработки ультразвуком. Клеточный дебрис осаждали центрифугированием и супернатанты собирали для вестерн-блоттинга. Клеточный лизат смешивали с 4× буфером для образцов NuPAGE LDS (Thermo Fisher Scientific, NP0007) и затем нагревали при 95°C в течение 5 мин. Образцы разделяли с помощью SDS-PAGE и переносили на мембрану PVDF (Thermo Fisher Scientific, LC2002). После блокирования с помощью блокирующего буфера Odyssey (Li-COR Biosciences, 927-50000) в течение 1 ч мембраны инкубировали при комнатной температуре в течение 2 ч с мышиным моноклональным анти-AAV VP1,2,3 антителом в разведении 1:500 (American Research Products, Inc., 03-65158). После трех промываний мембраны инкубировали при комнатной температуре в течение 1 ч с козьим антимышиным IgG вторичным антителом, конъюгированным с Alexa Fluo-680, в разведении 1:5000 (Invitrogen, A21057). Мембраны сканировали с использованием устройства для визуализации Odyssey® CLx (Li-COR Biosciences).
Пример 2
[0244] Усилители трансфекции повышали продукцию вектора rAAV-FVIII.
[0244] Высокоэффективный метод трансфекции на основе PEI с использованием PEI «Max» в качестве реагента для трансфекции был разработан для трансфекции трех плазмид в клетки HEK 293F в среде F17 для получения векторов rAAV. Описано лучшее окно клеточной культуры для трансфекции плазмиды с целью получения максимальной продукции rAAV. Однако при использовании для получения векторов rAAV-FVIII продукция вектора была относительно низкой (титр вектора на 2-3E+10 вг/мл). Причиной низкой продукции может быть то, что трансген FVIII является довольно большим по сравнению с другими трансгенами, такими как eGFP, FIX.
[0245] Был предпринят поиск агентов, которые могут улучшить эффективность трансфекции. Оценивали различные усилители трансфекции из нескольких наборов для трансфекции, включая набор для трансфекции ExpiFectamine™ 293, набор для трансфекции Lipofectamine® 3000 и набор реагентов для трансфекции Effectene™. Данные показывают, что усилители трансфекции из набора для трансфекции ExpiFectamine™ 293 могут значительно увеличить продукцию вектора rAAV. Усилители из других наборов для трансфекции существенно не улучшали продукцию rAAV. Усилители 1 и 2 из набора ExpiFectamine™ 293 использовали в соотношении 1:200 и 1:20 к объему культуры соответственно. Усилители 1 и 2 из набора для трансфекции ExpiFectamine™ 293 во время трансфекции увеличивали титр rAAV в 2-3 раза по сравнению с их добавлением через 16-18 ч после трансфекции или без усилителей (фиг. 1). Добавление усилителей 1 и 2 перед трансфекцией не приводило к повышению продукции rAAV. Усилитель 1 и усилитель 2 являются компонентами набора для трансфекции ExpiFectamine™ 293, который представляет собой набор катионных реагентов на основе липидов для трансфекции для экспрессии белка из клеток Expi293F™, культивируемых в среде для экспрессии Expi293™. Производители заявляют, что усилители представляют собой химически определенные, не содержащие белка, не содержащие сыворотки реагенты животного происхождения. Эти усилители использовали в новом применении, которое отличается от оригинального дизайна этого комплекта. Данные усилители использовали для генерации векторов rAAV вместо экспрессии белков. Набор предлагает использовать усилители 1 и 2 через 16-18 ч после трансфекции, для повышения трансфекции и экспрессии белка. Однако результаты исследований, раскрытых в данном документе, показывают, что усилитель 1 и усилитель 2, добавленные одновременно во время трансфекции, приводят к самой высокой продукции rAAV, в 2-3 раза выше, чем использование после трансфекции, что позволяет предположить, что усилители играют другую роль в продукции rAAV за счет экспрессии белка. Добавление этих усилителей к способу трансфекции, опосредованной PEI, описанному здесь и в PCT/US16/64414, усилило трансфекцию плазмиды с крупным трансгеном в клетки, что привело к значительному увеличению титра rAAV.
[0246] Параметры трансфекции, включая плотность клеток при трансфекции, количество ДНК, соотношение PEI/ДНК, количество свободного PEI в присутствии или в отсутствии этих усилителей, оптимизировали дополнительно. Полученные данные показывают, что увеличение плотности клеток при трансфекции и соотношение PEI/ДНК при использовании меньшего количества ДНК и свободного PEI приводило к наибольшей продукции rAAV в присутствии усилителей.
[0247] На фиг.2 показана продукция вектора rAAV-FVIII с использованием различного количества ДНК и соотношения PEI/ДНК во вращающейся колбе, которую определяли с помощью кПЦР. Клетки НЕК 293F во вращающихся колбах трансфектировали 1,2, 1,86, 2,8 мкг/мл ДНК, используемое соотношение PEI/ДНК (N/P) составляло 1:1, 1,5:1, 2:1, 2,5:1, 3:1 и 1,5 мкг/мл свободного PEI. Усилители 1 и 2 из набора для трансфекции ExpiFectamine™ 293 добавляли к клеткам при трансфекции. Усилитель 1 и усилитель 2 использовали в количестве 1:200 и 1:20 от объема культуры соответственно. Плотность клеток при трансфекции составляла 2,5-3×106 клеток/мл. Наилучшим условием для получения вектора было использование 1,2 мкг/мл ДНК с соотношением PEI/ДНК 2-2,5:1 и 1,5 мкг/мл свободного PEI и усилителя 1 (разведение 1:200) и услителя 2 (разведение 1:20) при трансфекции.
[0248] Оценивали и дополнительно оптимизировали в большем масштабе условия в биореакторах DASGIP емкостью 2 л. На фиг.3 показана продукция вектора rAAV-FVIII с использованием различного количества ДНК и соотношения PEI/ДНК в биореакторах, которую определяли с помощью кПЦР. Клетки НЕК 293F культивировали в 400 мл F17 при 37°С, рН 7,2, DO 40%, при перемешивании со скоростью 150 об/мин в биореакторах. Клетки трансфектировали с молярным соотношением ДНК 1:1:1 и 1,2 или 2,8 мкг/мл ДНК, соотношением PEI/ДНК (N/P) 1,5:1, 2:1, 2,5:1 или 3:1 и 1,5 мкг/мл свободного PEI. Усилители 1 и 2 из набора для трансфекции ExpiFectamine™ 293 добавляли в клетки при трансфекции. Усилитель 1 и усилитель 2 использовали в соотношении 1:200 и 1:20 к объему культуры соответственно. Плотность клеток составляла 2-3×106 клеток/мл при трансфекции. Условием, которое привело к наиболее высокой продукции вектора rAAV, было использование молярного соотношения ДНК 1:1:1 и 1,2 мкг/мл ДНК с соотношением PEI/ДНК 2,5-3:1 и 1,5 мкг/мл свободного PEI и усилителей.
[0249] Объем клеточной культуры увеличивали с 400 мл до 1,2 л в биореакторах для получения rAAV. Клетки НЕК 293F культивировали при 37°С, рН 7,2, DO 40%, перемешивание 130 об/мин, 150 об/мин или 170 об/мин с 2 или 3 импеллерными мешалками. Клетки трансфектировали с молярным соотношением ДНК 1:1:1, 1,2 мкг/мл ДНК, соотношением PEI/ДНК (N/P) 2,5:1 и 1,5 мкг/мл свободного PEI. Усилители 1 и 2 из набора для трансфекции ExpiFectamine™ 293 использовали, как описано выше. На фиг. 4 показаны титры rAAV, полученных в этих экспериментах. Данные показали, что оптимизированные условия от небольшого объема 50 мл во вращающейся колбе можно масштабировать до объема 400 мл, и затем до объема 1,2 л. Использование усиливающих агентов в оптимизированных PEI-опосредованных условиях трансфекции может повысить продукцию вектора rAAV в 8-10 раз в бессывороточной суспензионной культуре. Даный процесс очень эффективен, безопасен и является масштабируемым.
[0250] Для определения того, нужны ли оба усилителя 1 и 2 при трансфекции для повышения продукции rAAV и дальнейшего определения количества этих усилителей, их оценивали по отдельности. Данные показали, что один усилитель 1 может повысить продукцию rAAV до того же уровня, что и оба усилителя 1 и 2 вместе. Один только усилитель 2 не приводил к увеличению продукции rAAV (фиг. 5). Количество усилителей 1 и 2 также было уменьшено для дальнейшего определения оптимальных условий способа. Уменьшение количества усилителей 1 и 2 приводило к снижению титра rAAV (фиг. 5). Повышенное количество усилителя 1 (разведение 1:100 или 1:150) и усилителя 2 (разведение 1:10 или 1:15) при трансфекции заметно не улучшало продукцию rAAV. В дополнение к использованию усилителей 1 и 2 во время трансфекции их оценивали при добавлении через 24 ч или 48 ч или через 24 ч и 48 ч после трансфекции, для определения того, могут ли они в этом случае дополнительно увеличивать титр rAAV. На фиг. 6 показано, что повторное использование усилителей несколько увеличивало продукцию rAAV.
Пример 3
Вальпроевая кислота повышает продукцию вектора rAAV-FVIII.
[0251] Различные соединения, включая вальпроевую кислоту, этопозид, тенипозид, сиомицин А и вориностат, оценивали для определения их влияния на трансфекцию и продукцию rAAV. Среди этих соединений вальпроевая кислота достоверно увеличивала продукцию rAAV. Вальпроевая кислота является ингибитором гистондеацетилазы, а также одобренным FDA препаратом для лечения эпилептических состояний. Различные концентрации вальпроевой кислоты, 0,25 мМ, 0,5 мМ, 1 мМ, 1,5 мМ, 2 мМ, 5 мМ, 7,5 мМ и 10 мМ использовали при трансфекции при культивировании во вращающейся колбой/встряхиваемой колбе, а также при культивировании в биореакторе DASGIP. Использование вальпроевой кислоты в оптимизированной PEI-опосредованной трансфекции увеличивало титр вектора rAAV-FVIII примерно в 10 раз по сравнению с вариантом без усилителей и достигало того же уровня продукции rAAV или выше, что и с усилителями 1 и 2 в бессывороточной суспензионной системе культивирования (фиг. 7). 1,2 мкг/мл ДНК, молярное соотношение ДНК 1:1:1, массовое соотношение PEI/ДНК 2:1 или 2,5:1, и 1,5 мкг/мл свободного PEI использовали в этих экспериментах с вальпроевой кислотой. После добавления комплекса PEI/ДНК и свободного PEI в клетки при трансфекции добавляли вальпроевую кислоту в различных концентрациях. В данном исследовании не использовали усилители из набора для трансфекции ExpiFectamine™ 293. На фиг.8 показано повышенная продукция вектора AAV при повышенных концентрациях вальпроевой кислоты в биореакторе емкостью 1 л, например, в присутсвии вальпроевой кислоты в концентрации 4 мМ или выше, такой как 5-8 мМ.
Пример 4
[0252] Один усилитель 1 из набора для трансфекции ExpiFectamineTM 293 и вальпроевая кислота, используемые по отдельности в оптимизированном способе трансфекции на основе PEI, могут значительно повысить продукцию вектора rAAV, примерно в 10 раз, чем протокол получения, о котором сообщалось в настоящее время, с использованием аналогичных технологий. Использование только усилителя 1 или вальпроевой кислоты в системе продукции rAAV обеспечивает новую масштабируемую платформу продукции rAAV, которую можно использовать для эффективной продукции любого серотипа векторов rAAV в бессывороточной суспензионной культуре клеток. Этот процесс особенно применим для получения векторов rAAV с крупными трансгенами и для получения векторов rAAV, которые трудно генерировать. Данный способ является полностью масштабируемым, совместимым с требованиями cGMP и универсальной производственной системой rAAV, которая подходит для крупномасштабной продукции rAAV.
Пример 5
[0253] Данные на фиг.4 демонстрируют, что оптимизированные условия от небольшого объема 50 мл во вращающейся колбе можно масштабировать до объема 400 мл, и затем до объема 1,2 л. Может быть достигнута дальнейшая масштабируемость до больших объемов. Например, предполагается, что методы будут масштабируемыми до объемов 2 л, 2-20 л, 20-50 л или 50-100 л. Рассматриваются даже большие объемы, такие как 100-500 л, 500-1000 л или 1000 л или более. Такое масштабирование может включать клонирование клеток и селекцию клонов, которые продуцируют большие количества вектора rAAV. Создание мастер-банков клеток таких клонов, которые экспрессируют вектор rAAV в большом количестве, обеспечивает надежный и воспроизводимый источник клеток, применимый к композициям и способам по настоящему изобретению.
[0254] Дальнейшие усовершенствования условий культивирования клеток, условий трансфекции, лизиса клеток и/или сбора культурального супернатанта для выделения векторов rAAV, удаления примесей и условий последующей очистки могут также способствовать значительному увеличению масштабируемости.
Пример 6
1.0 Примерные, неограничивающие, критерии приемлемости разработки способа, общий вид, описание технологического процесса и параметры, изменяемые для увеличения масштаба производства вектора rAAV (например, LK03-FVIII) с использованием суспензионных клеточных культур.
1.1 Оттаивание и экспансия клеток
1.2 Продукция вектора rAAV в объеме 1,2 л в биореакторе
2.0 Общий вид процесса
2.1 Процесс размораживания клеток и экспансии клеток
2.1.1 Схема технологического процесса
Ниже представлена типичная схема технологического процесса для участка оттаивания клеток и экспансии клеток в восходящем потоке получения вектора rAAV:
2.1.2 Описание технологического процесса
Ниже приведено типичное описание технологического процесса для участка оттаивания и экспансии клеток в восходящем потоке получения вектора rAAV (например, LK03-FVIII):
Клетки помещают в 29 мл предварительно нагретой среды Freestyle™ F17 с 1X GlutaMAX™
30 мл клеток во встряхиваемой колбе емкостью 125 мл
Культивирование клеток при 37°C в течение 4 суток при 8% CO2, 125 об/мин
150 мл клеток во встряхиваемой колбе емкостью 500 мл
Культивирование клеток при 37°C в течение 3-4 суток при 8% CO2, 125 об/мин
400 клеток в каждой из 2× 1000 мл встряхиваемых колбах (в целом 800 мл)
Культивирование клеток при 37°C в течение 3-4 суток при 8% CO2, 125 об/мин
400 клеток в каждой из 3 × 1000 мл встряхиваемых колбах (в целом 1200 мл)
Культивирование клеток при 37°C в течение 3-4 суток при 8% CO2, 125 об/мин
2.1.3 Параметры, изменяемые во время исследования оттаивания клеток и экспансии клеток
Следующие параметры оценивали во время разработки процесса оттаивания клеток и экспансии клеток 293-F:
Пример 7
2.3. Примерное, неограничивающее получение вектора rAAV (например, LK03-FVIII) в масштабе биореактора емкостью 1,2 л, технологический процесс и параметры, изменяемые для масштабирования получения белка вектора rAAV
2.3.1. Блок-схема технологического процесса
Ниже представлена типичная блок-схема технологического процесса для продукции вектора rAAV (например, LK03-FVIII) в биореакторе емкостью 1,2 л:

2.3.2 Описание технологического процесса
Ниже приведено описание технологического процесса для продукции вектора rAAV (например, LK03-FVIII) в биореакторе емкостью 1,2 л:
(сутки 0)
Добавление Pluronic™ F-68 в среду, конечное содержание 0,1%
Рабочий объем составляет 400 мл
Культивирование клеток при 37°C, pH 7,2, DO 40%, 150 об/мин в течение 3 суток
(сутки 3)
Плотность клеток составляет 1-1,5 × 106 живых клеток/мл
Культивирование клеток пи 37°C, pH 7,2, DO 40%, 150 об/мин в течение 1 суток
(сутки 4)
Плотность клеток составляет 2-3 × 106 живых клеток/мл
Культивирование клеток пи 37°C, pH 7,2, DO 40%, 150 об/мин в течение 3 суток
(сутки 7)
2.3.3 Параметры, изменяемые во время разработки получения вектора rAAV (например, LK03-FVIII)
Оценивали следующие параметры во время разработки способа продукции вектора rAAV (например, LK03-FVIII)в биореакторе емкостью 1,2 л:
усилитель 1
усилитель 2
усилитель 1
Пример 8
[255] Репрезентативные ААА капсидные белки (VP1)
Капсид AAV-SPK VP1 (SEQ ID NO:1)
1 MAADGYLPDWLEDNLSEGIREWWDLKPGAPKPKANQQKQDNGRGLVLPGYKYLGPFNGLD
61 KGEPVNAADAAALEHDKAYDQQLQAGDNPYLRYNHADAEFQERLQEDTSFGGNLGRAVFQ
121 AKKRVLEPLGLVESPVKTAPGKKRPVEPSPQRSPDSSTGIGKKGQQPAKKRLNFGQTGDS
181 ESVPDPQPIGEPPAAPSGVGPNTMAAGGGAPMADNNEGADGVGSSSGNWHCDSTWLGDRV
241 ITTSTRTWALPTYNNHLYKQISNGTSGGSTNDNTYFGYSTPWGYFDFNRFHCHFSPRDWQ
301 RLINNNWGFRPKRLNFKLFNIQVKEVTQNEGTKTIANNLTSTIQVFTDSEYQLPYVLGSA
361 HQGCLPPFPADVFMIPQYGYLTLNNGSQAVGRSSFYCLEYFPSQMLRTGNNFEFSYNFED
421 VPFHSSYAHSQSLDRLMNPLIDQYLYYLSRTQSTGGTAGTQQLLFSQAGPNNMSAQAKNW
481 LPGPCYRQQRVSTTLSQNNNSNFAWTGATKYHLNGRDSLVNPGVAMATHKDDEERFFPSS
541 GVLMFGKQGAGKDNVDYSSVMLTSEEEIKTTNPVATEQYGVVADNLQQQNAAPIVGAVNS
601 QGALPGMVWQNRDVYLQGPIWAKIPHTDGNFHPSPLMGGFGLKHPPPQILIKNTPVPADP
661 PTTFNQAKLASFITQYSTGQVSVEIEWELQKENSKRWNPEIQYTSNYYKSTNVDFAVNTE
721 GTYSEPRPIGTRYLTRNL
Капсид AAV-LK03 VP1 (SEQ ID NO:2)
MAADGYLPDWLEDNLSEGIREWWALQPGAPKPKANQQHQDNARGLVLPGYKYLGPGNGLDKGEPVNAADAAALEHDKAYDQQLKAGDNPYLKYNHADAEFQERLKEDTSFGGNLGRAVFQAKKRLLEPLGLVEEAAKTAPGKKRPVDQSPQEPDSSSGVGKSGKQPARKRLNFGQTGDSESVPDPQPLGEPPAAPTSLGSNTMASGGGAPMADNNEGADGVGNSSGNWHCDSQWLGDRVITTSTRTWALPTYNNHLYKQISSQSGASNDNHYFGYSTPWGYFDFNRFHCHFSPRDWQRLINNNWGFRPKKLSFKLFNIQVKEVTQNDGTTTIANNLTSTVQVFTDSEYQLPYVLGSAHQGCLPPFPADVFMVPQYGYLTLNNGSQAVGRSSFYCLEYFPSQMLRTGNNFQFSYTFEDVPFHSSYAHSQSLDRLMNPLIDQYLYYLNRTQGTTSGTTNQSRLLFSQAGPQSMSLQARNWLPGPCYRQQRLSKTANDNNNSNFPWTAASKYHLNGRDSLVNPGPAMASHKDDEEKFFPMHGNLIFGKEGTTASNAELDNVMITDEEEIRTTNPVATEQYGTVANNLQSSNTAPTTRTVNDQGALPGMVWQDRDVYLQGPIWAKIPHTDGHFHPSPLMGGFGLKHPPPQIMIKNTPVPANPPTTFSPAKFASFITQYSTGQVSVEIEWELQKENSKRWNPEIQYTSNYNKSVNVDFTVDTNGVYSEPRPIGTRYLTRPL
--->
Список последовательностей
<110> SPARK THERAPEUTICS, INC.
Qu, Guang
Lu, Lin
Josue-Almqvist, Jesusa
Wright, John F.
<120> УСИЛИВАЮЩИЕ АГЕНТЫ ДЛЯ ПОВЫШЕННОЙ ТРАНСФЕКЦИИ КЛЕТОК И/ИЛИ
ПРОДУКЦИИ ВЕКТОРА rAAV
<130> 023637-0459431
<140> PCT/US2018/036344
<141> 2018-06-06
<150> 62/516,432
<151> 2017-06-07
<150> 62/531,626
<151> 2017-07-12
<160> 5
<170> PatentIn version 3.5
<210> 1
<211> 738
<212> Белок
<213> Аденоассоциированный вирус
<400> 1
Met Ala Ala Asp Gly Tyr Leu Pro Asp Trp Leu Glu Asp Asn Leu Ser
1 5 10 15
Glu Gly Ile Arg Glu Trp Trp Asp Leu Lys Pro Gly Ala Pro Lys Pro
20 25 30
Lys Ala Asn Gln Gln Lys Gln Asp Asn Gly Arg Gly Leu Val Leu Pro
35 40 45
Gly Tyr Lys Tyr Leu Gly Pro Phe Asn Gly Leu Asp Lys Gly Glu Pro
50 55 60
Val Asn Ala Ala Asp Ala Ala Ala Leu Glu His Asp Lys Ala Tyr Asp
65 70 75 80
Gln Gln Leu Gln Ala Gly Asp Asn Pro Tyr Leu Arg Tyr Asn His Ala
85 90 95
Asp Ala Glu Phe Gln Glu Arg Leu Gln Glu Asp Thr Ser Phe Gly Gly
100 105 110
Asn Leu Gly Arg Ala Val Phe Gln Ala Lys Lys Arg Val Leu Glu Pro
115 120 125
Leu Gly Leu Val Glu Ser Pro Val Lys Thr Ala Pro Gly Lys Lys Arg
130 135 140
Pro Val Glu Pro Ser Pro Gln Arg Ser Pro Asp Ser Ser Thr Gly Ile
145 150 155 160
Gly Lys Lys Gly Gln Gln Pro Ala Lys Lys Arg Leu Asn Phe Gly Gln
165 170 175
Thr Gly Asp Ser Glu Ser Val Pro Asp Pro Gln Pro Ile Gly Glu Pro
180 185 190
Pro Ala Ala Pro Ser Gly Val Gly Pro Asn Thr Met Ala Ala Gly Gly
195 200 205
Gly Ala Pro Met Ala Asp Asn Asn Glu Gly Ala Asp Gly Val Gly Ser
210 215 220
Ser Ser Gly Asn Trp His Cys Asp Ser Thr Trp Leu Gly Asp Arg Val
225 230 235 240
Ile Thr Thr Ser Thr Arg Thr Trp Ala Leu Pro Thr Tyr Asn Asn His
245 250 255
Leu Tyr Lys Gln Ile Ser Asn Gly Thr Ser Gly Gly Ser Thr Asn Asp
260 265 270
Asn Thr Tyr Phe Gly Tyr Ser Thr Pro Trp Gly Tyr Phe Asp Phe Asn
275 280 285
Arg Phe His Cys His Phe Ser Pro Arg Asp Trp Gln Arg Leu Ile Asn
290 295 300
Asn Asn Trp Gly Phe Arg Pro Lys Arg Leu Asn Phe Lys Leu Phe Asn
305 310 315 320
Ile Gln Val Lys Glu Val Thr Gln Asn Glu Gly Thr Lys Thr Ile Ala
325 330 335
Asn Asn Leu Thr Ser Thr Ile Gln Val Phe Thr Asp Ser Glu Tyr Gln
340 345 350
Leu Pro Tyr Val Leu Gly Ser Ala His Gln Gly Cys Leu Pro Pro Phe
355 360 365
Pro Ala Asp Val Phe Met Ile Pro Gln Tyr Gly Tyr Leu Thr Leu Asn
370 375 380
Asn Gly Ser Gln Ala Val Gly Arg Ser Ser Phe Tyr Cys Leu Glu Tyr
385 390 395 400
Phe Pro Ser Gln Met Leu Arg Thr Gly Asn Asn Phe Glu Phe Ser Tyr
405 410 415
Asn Phe Glu Asp Val Pro Phe His Ser Ser Tyr Ala His Ser Gln Ser
420 425 430
Leu Asp Arg Leu Met Asn Pro Leu Ile Asp Gln Tyr Leu Tyr Tyr Leu
435 440 445
Ser Arg Thr Gln Ser Thr Gly Gly Thr Ala Gly Thr Gln Gln Leu Leu
450 455 460
Phe Ser Gln Ala Gly Pro Asn Asn Met Ser Ala Gln Ala Lys Asn Trp
465 470 475 480
Leu Pro Gly Pro Cys Tyr Arg Gln Gln Arg Val Ser Thr Thr Leu Ser
485 490 495
Gln Asn Asn Asn Ser Asn Phe Ala Trp Thr Gly Ala Thr Lys Tyr His
500 505 510
Leu Asn Gly Arg Asp Ser Leu Val Asn Pro Gly Val Ala Met Ala Thr
515 520 525
His Lys Asp Asp Glu Glu Arg Phe Phe Pro Ser Ser Gly Val Leu Met
530 535 540
Phe Gly Lys Gln Gly Ala Gly Lys Asp Asn Val Asp Tyr Ser Ser Val
545 550 555 560
Met Leu Thr Ser Glu Glu Glu Ile Lys Thr Thr Asn Pro Val Ala Thr
565 570 575
Glu Gln Tyr Gly Val Val Ala Asp Asn Leu Gln Gln Gln Asn Ala Ala
580 585 590
Pro Ile Val Gly Ala Val Asn Ser Gln Gly Ala Leu Pro Gly Met Val
595 600 605
Trp Gln Asn Arg Asp Val Tyr Leu Gln Gly Pro Ile Trp Ala Lys Ile
610 615 620
Pro His Thr Asp Gly Asn Phe His Pro Ser Pro Leu Met Gly Gly Phe
625 630 635 640
Gly Leu Lys His Pro Pro Pro Gln Ile Leu Ile Lys Asn Thr Pro Val
645 650 655
Pro Ala Asp Pro Pro Thr Thr Phe Asn Gln Ala Lys Leu Ala Ser Phe
660 665 670
Ile Thr Gln Tyr Ser Thr Gly Gln Val Ser Val Glu Ile Glu Trp Glu
675 680 685
Leu Gln Lys Glu Asn Ser Lys Arg Trp Asn Pro Glu Ile Gln Tyr Thr
690 695 700
Ser Asn Tyr Tyr Lys Ser Thr Asn Val Asp Phe Ala Val Asn Thr Glu
705 710 715 720
Gly Thr Tyr Ser Glu Pro Arg Pro Ile Gly Thr Arg Tyr Leu Thr Arg
725 730 735
Asn Leu
<210> 2
<211> 736
<212> Белок
<213> Аденоассоциированный вирус
<400> 2
Met Ala Ala Asp Gly Tyr Leu Pro Asp Trp Leu Glu Asp Asn Leu Ser
1 5 10 15
Glu Gly Ile Arg Glu Trp Trp Ala Leu Gln Pro Gly Ala Pro Lys Pro
20 25 30
Lys Ala Asn Gln Gln His Gln Asp Asn Ala Arg Gly Leu Val Leu Pro
35 40 45
Gly Tyr Lys Tyr Leu Gly Pro Gly Asn Gly Leu Asp Lys Gly Glu Pro
50 55 60
Val Asn Ala Ala Asp Ala Ala Ala Leu Glu His Asp Lys Ala Tyr Asp
65 70 75 80
Gln Gln Leu Lys Ala Gly Asp Asn Pro Tyr Leu Lys Tyr Asn His Ala
85 90 95
Asp Ala Glu Phe Gln Glu Arg Leu Lys Glu Asp Thr Ser Phe Gly Gly
100 105 110
Asn Leu Gly Arg Ala Val Phe Gln Ala Lys Lys Arg Leu Leu Glu Pro
115 120 125
Leu Gly Leu Val Glu Glu Ala Ala Lys Thr Ala Pro Gly Lys Lys Arg
130 135 140
Pro Val Asp Gln Ser Pro Gln Glu Pro Asp Ser Ser Ser Gly Val Gly
145 150 155 160
Lys Ser Gly Lys Gln Pro Ala Arg Lys Arg Leu Asn Phe Gly Gln Thr
165 170 175
Gly Asp Ser Glu Ser Val Pro Asp Pro Gln Pro Leu Gly Glu Pro Pro
180 185 190
Ala Ala Pro Thr Ser Leu Gly Ser Asn Thr Met Ala Ser Gly Gly Gly
195 200 205
Ala Pro Met Ala Asp Asn Asn Glu Gly Ala Asp Gly Val Gly Asn Ser
210 215 220
Ser Gly Asn Trp His Cys Asp Ser Gln Trp Leu Gly Asp Arg Val Ile
225 230 235 240
Thr Thr Ser Thr Arg Thr Trp Ala Leu Pro Thr Tyr Asn Asn His Leu
245 250 255
Tyr Lys Gln Ile Ser Ser Gln Ser Gly Ala Ser Asn Asp Asn His Tyr
260 265 270
Phe Gly Tyr Ser Thr Pro Trp Gly Tyr Phe Asp Phe Asn Arg Phe His
275 280 285
Cys His Phe Ser Pro Arg Asp Trp Gln Arg Leu Ile Asn Asn Asn Trp
290 295 300
Gly Phe Arg Pro Lys Lys Leu Ser Phe Lys Leu Phe Asn Ile Gln Val
305 310 315 320
Lys Glu Val Thr Gln Asn Asp Gly Thr Thr Thr Ile Ala Asn Asn Leu
325 330 335
Thr Ser Thr Val Gln Val Phe Thr Asp Ser Glu Tyr Gln Leu Pro Tyr
340 345 350
Val Leu Gly Ser Ala His Gln Gly Cys Leu Pro Pro Phe Pro Ala Asp
355 360 365
Val Phe Met Val Pro Gln Tyr Gly Tyr Leu Thr Leu Asn Asn Gly Ser
370 375 380
Gln Ala Val Gly Arg Ser Ser Phe Tyr Cys Leu Glu Tyr Phe Pro Ser
385 390 395 400
Gln Met Leu Arg Thr Gly Asn Asn Phe Gln Phe Ser Tyr Thr Phe Glu
405 410 415
Asp Val Pro Phe His Ser Ser Tyr Ala His Ser Gln Ser Leu Asp Arg
420 425 430
Leu Met Asn Pro Leu Ile Asp Gln Tyr Leu Tyr Tyr Leu Asn Arg Thr
435 440 445
Gln Gly Thr Thr Ser Gly Thr Thr Asn Gln Ser Arg Leu Leu Phe Ser
450 455 460
Gln Ala Gly Pro Gln Ser Met Ser Leu Gln Ala Arg Asn Trp Leu Pro
465 470 475 480
Gly Pro Cys Tyr Arg Gln Gln Arg Leu Ser Lys Thr Ala Asn Asp Asn
485 490 495
Asn Asn Ser Asn Phe Pro Trp Thr Ala Ala Ser Lys Tyr His Leu Asn
500 505 510
Gly Arg Asp Ser Leu Val Asn Pro Gly Pro Ala Met Ala Ser His Lys
515 520 525
Asp Asp Glu Glu Lys Phe Phe Pro Met His Gly Asn Leu Ile Phe Gly
530 535 540
Lys Glu Gly Thr Thr Ala Ser Asn Ala Glu Leu Asp Asn Val Met Ile
545 550 555 560
Thr Asp Glu Glu Glu Ile Arg Thr Thr Asn Pro Val Ala Thr Glu Gln
565 570 575
Tyr Gly Thr Val Ala Asn Asn Leu Gln Ser Ser Asn Thr Ala Pro Thr
580 585 590
Thr Arg Thr Val Asn Asp Gln Gly Ala Leu Pro Gly Met Val Trp Gln
595 600 605
Asp Arg Asp Val Tyr Leu Gln Gly Pro Ile Trp Ala Lys Ile Pro His
610 615 620
Thr Asp Gly His Phe His Pro Ser Pro Leu Met Gly Gly Phe Gly Leu
625 630 635 640
Lys His Pro Pro Pro Gln Ile Met Ile Lys Asn Thr Pro Val Pro Ala
645 650 655
Asn Pro Pro Thr Thr Phe Ser Pro Ala Lys Phe Ala Ser Phe Ile Thr
660 665 670
Gln Tyr Ser Thr Gly Gln Val Ser Val Glu Ile Glu Trp Glu Leu Gln
675 680 685
Lys Glu Asn Ser Lys Arg Trp Asn Pro Glu Ile Gln Tyr Thr Ser Asn
690 695 700
Tyr Asn Lys Ser Val Asn Val Asp Phe Thr Val Asp Thr Asn Gly Val
705 710 715 720
Tyr Ser Glu Pro Arg Pro Ile Gly Thr Arg Tyr Leu Thr Arg Pro Leu
725 730 735
<210> 3
<211> 19
<212> ДНК
<213> Искусственная последовательность
<220>
<223> прямой праймер для трансгена hFVIII
<400> 3
tgaggaggct gaagactat
19
<210> 4
<211> 22
<212> ДНК
<213> Искусственная последовательность
<220>
<223> обратный праймер для трансгена hFVIII
<400> 4
ccacagacct gatctgaatg aa
22
<210> 5
<211> 27
<212> ДНК
<213> Искусственная последовательность
<220>
<223> зонд для трансгена hFVIII
<400> 5
tggatgtggt gaggtttgat gatgaca
27
<---
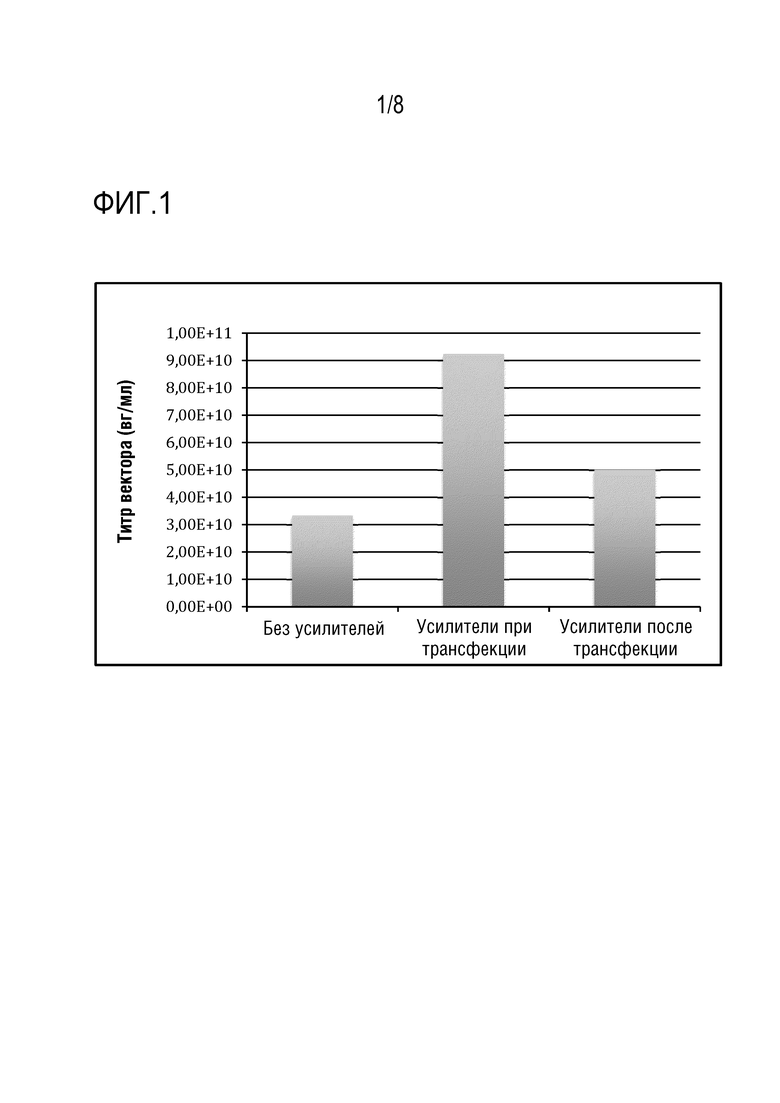

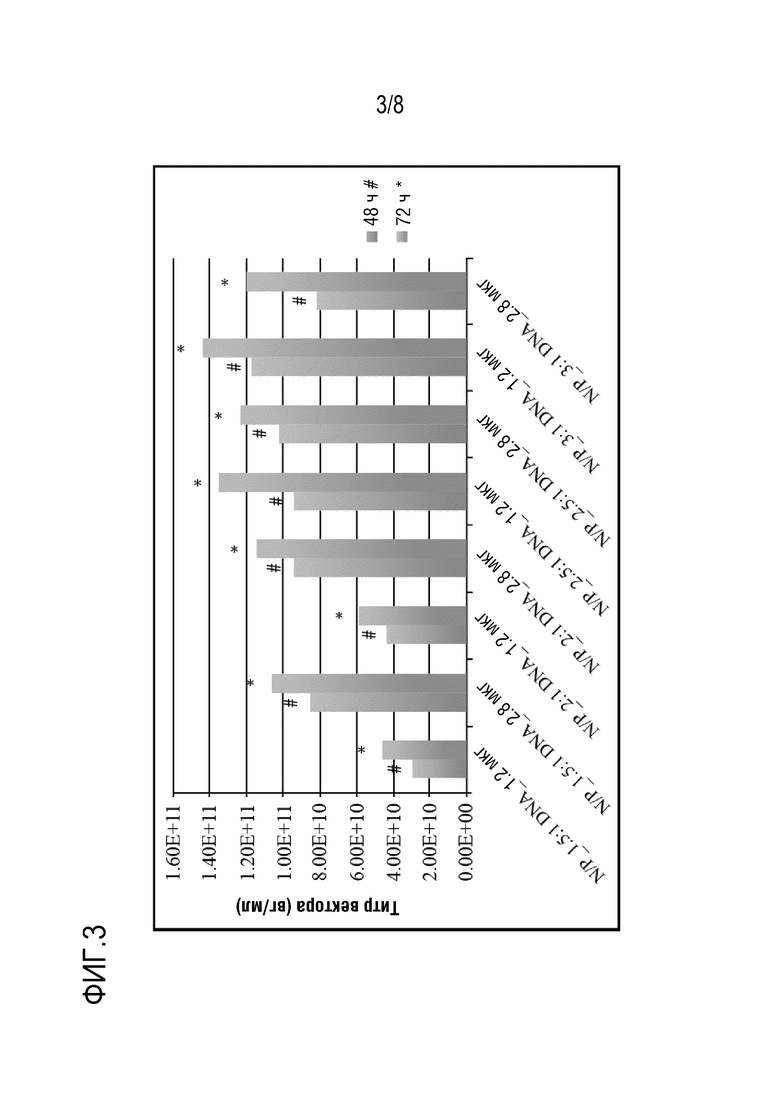


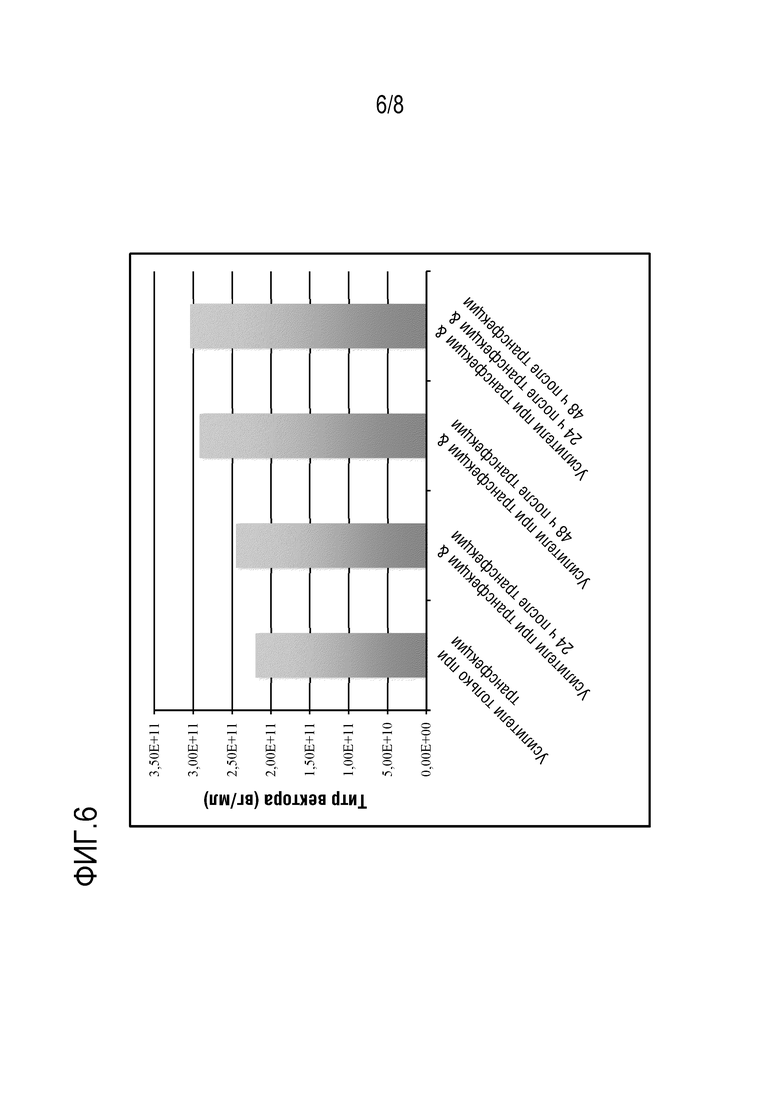
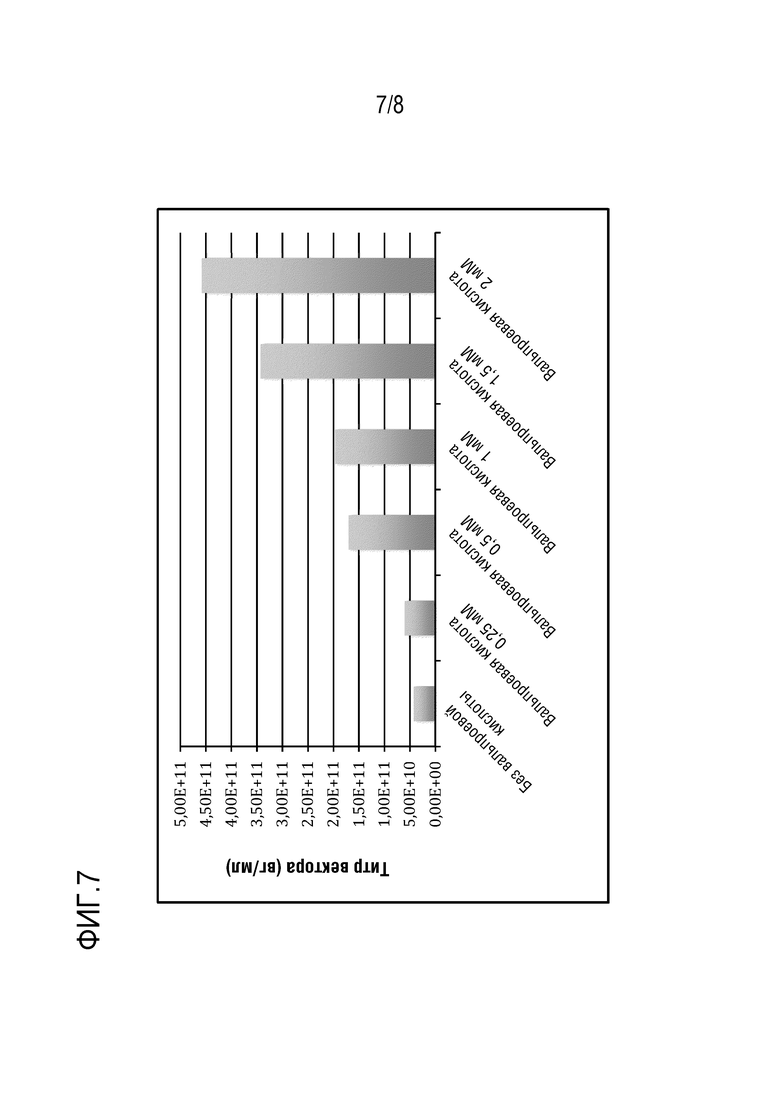
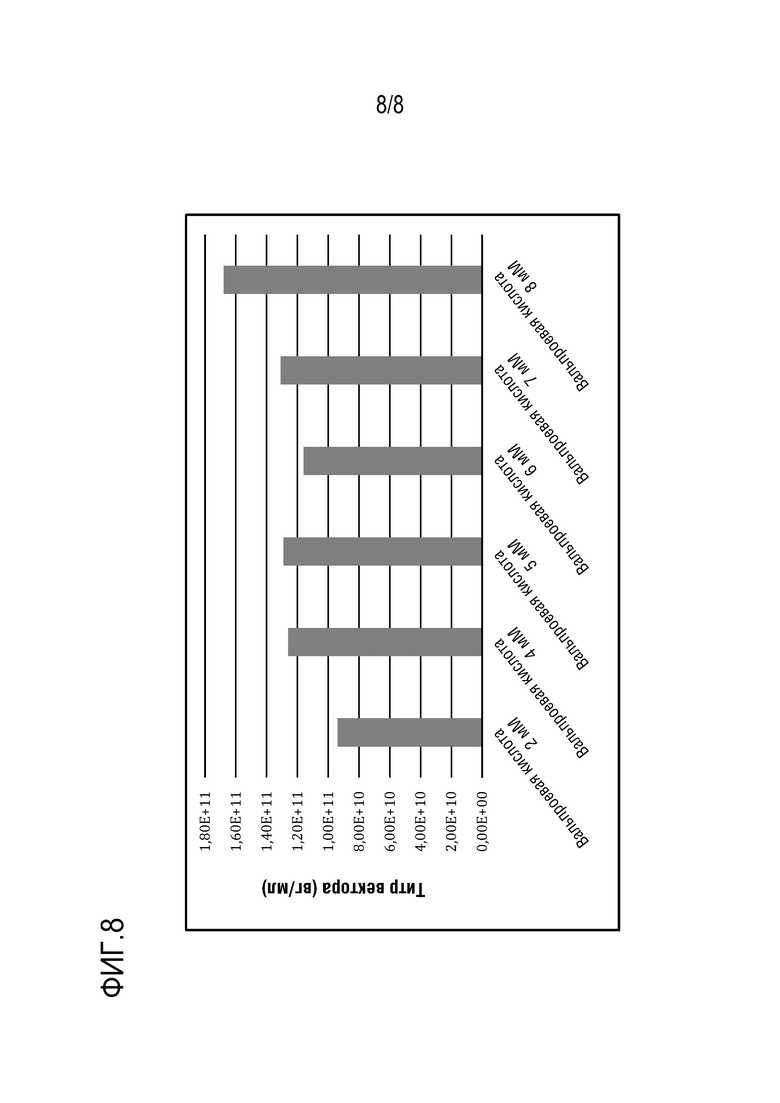
Изобретение относится к молекулярной биологии и биотехнологии, в частности к композициям и способам получения трансдуцированных (трансфектированных) клеток, где указанные клетки необязательно продуцируют аденоассоциированный вирусный вектор (rAAV). Клетки, трансдуцированные/трансфектированные с высокой эффективностью плазмидами, содержащими (i) нуклеиновые кислоты, кодирующие упаковочные белки AAV, и/или нуклеиновые кислоты, кодирующие хелперные белки; и (ii) трансген, который кодирует белок или транскрибируется в представляющий интерес транскрипт, могут продуцировать большое количество рекомбинантного вектора rAAV. 59 з.п. ф-лы, 8 ил., 8 пр.
1. Способ получения клеток, которые продуцируют рекомбинантный аденоассоциированный вирусный (rAAV) вектор, включающий стадии:
(а) обеспечение смеси PEI/плазмида из компонентов (i), (ii) и (iii):
(i) одна или более плазмид, содержащих нуклеиновые кислоты, кодирующие упаковочные белки AAV, и/или нуклеиновые кислоты, кодирующие хелперные функции;
(ii) плазмида, содержащая трансген, который кодирует белок или транскрибируется в представляющий интерес транскрипт; и
(iii) раствор полиэтиленимина (PEI),
(b) контактирование клеток со смесью плазмида/PEI со стадии (а) с получением клеточной культуры со смесью плазмида/PEI;
(с) добавление вальпроевой кислоты, ее соли или производного к клеточной культуре со смесью плазмида/PEI с получением второй смеси; и
(d) инкубирование указанной второй смеси со стадии (с) с получением трансфектированных клеток, которые продуцируют вектор rAAV.
2. Способ по п.1, дополнительно включающий стадию (e) сбор указанных трансфектированных клеток, полученных на стадии (d), и/или культуральной среды из трансфектированных клеток, полученных на стадии (d), с получением сбора клеток и/или культуральной среды.
3. Способ по п.1 или 2, дополнительно включающий стадию (е) культивирования, экспансии, выделения или селекции клеток, которые были трансфектированы плазмидами.
4. Способ по п.1 или 2, дополнительно включающий стадию (е) выделения и/или очистки рекомбинантного вектора AAV из трансфектированных клеток, полученных на стадии (d), и/или культуральной среды из трансфектированных клеток, полученных на стадии (d).
5. Способ по п.4, дополнительно включающий стадию (f) выделения и/или очистки рекомбинантного вектора AAV из трансфектированных клеток и/или сбора культуральной среды, полученного на стадии (е).
6. Способ по любому из пп.1-5, в котором трансген кодирует фактор свертывания крови дикого типа или функциональный вариант, apoЕ2, ТРР1, аргининосукцинатсинтазу, медь-транспортирующую АТФазу 2, кислую альфа-глюкозидазу, β-глюкоцереброзидазу, α-галактозидазу или С1-ингибитор сериновой протеазы.
7. Способ по п.6, где фактор свертывания крови дикого типа или функциональный вариант представляет фактор VII, фактор VIII или фактор IX.
8. Способ по любому из пп.1-7, где вальпроевая кислота представляет собой ее соль или производное.
9. Способ по любому из пп.1-8, где вальпроевую кислоту, ее соль или производное добавляют до стадии (а), во время стадии (а) или сразу же после стадии (а) или до, но не менее чем через 3 ч после стадии (а).
10. Способ по любому из пп.1-9, где вальпроевую кислоту, ее соль или производное добавляют два или более раз после стадий (а) или (b).
11. Способ по п.10, где вальпроевую кислоту, ее соль или производное сначала добавляют во время или сразу же после стадии (а) или до, но не менее чем через 3 ч после стадии (а) и снова добавляют через 12-72 ч после стадий (а) или (b), или снова добавляют через 12-48 ч после стадий (а) или (b), или снова добавляют через 12-24 ч после стадий (а) или (b).
12. Способ по любому из пп.1-11, где указанные плазмиды (i) и (ii) находятся в диапазоне молярных соотношений примерно от 1:0,01 до примерно 1:100 и где смесь компонентов (i), (ii) и (iii) необязательно инкубируют в течение периода времени примерно от 10 с до примерно 4 ч перед стадией (b).
13. Способ по любому из пп.1-12, где указанные плазмиды находятся в массовом соотношении PEI:плазмида в диапазоне примерно от 0,1:1 до примерно 5:1 или массовом соотношении PEI:плазмида в диапазоне примерно от 5:1 до примерно 0,1:1.
14. Способ по любому из пп.1-13, дополнительно включающий добавление свободного PEI к клеткам до, во время или после стадий (а) или (b), до или во время или после стадии (с).
15. Способ по любому из пп.1-13, дополнительно включающий добавление свободного PEI к клеткам во время или после стадий (а) или (b) или во время или после стадии (с).
16. Способ по любому из пп.1-15, где указанный свободный PEI добавляют так, чтобы массовое соотношение PEI:плазмида находилось в диапазоне примерно от 0,1:1 до примерно 5:1 или в диапазоне примерно от 5:1 до примерно 0,1:1.
17. Способ по любому из пп.1-16, где PEI в смеси PEI:плазмида и/или свободный PEI содержит линейный полиэтиленимин.
18. Способ по любому из пп.1-16, где PEI в смеси PEI:плазмида и/или свободный PEI содержит гидролизованный линейный полиэтиленимин.
19. Способ по любому из пп.1-18, где PEI в смеси PEI:плазмида и/или свободный PEI содержит гидролизованный линейный полиэтиленимин с молекулярной массой в диапазоне примерно от 4000 до примерно 160000 и/или с молекулярной массой в диапазоне примерно от 2500 до примерно 250000 в форме свободного основания.
20. Способ по любому из пп.1-19, где молярное соотношение азота (N) в общем PEI к фосфату (P) в смеси плазмида:PEI находится в диапазоне примерно от 1:1 до примерно 50:1 (N:P).
21. Способ по любому из пп.14-20, где количество свободного PEI составляет примерно от 10% до примерно 90% от общего PEI.
22. Способ по любому из пп.14-21, где концентрация свободного PEI составляет примерно от 0,1 мкг/мл до примерно 10 мкг/мл.
23. Способ по любому из пп.1-22, где раствор PEI и/или свободный PEI содержит раствор, имеющий рН примерно от 7,0 до примерно 8,00.
24. Способ по любому из пп.1-23, где указанные плазмиды и PEI инкубируют вместе в течение примерно от 10 с до примерно 4 ч перед стадией (а).
25. Способ по любому из пп.1-24, где указанные плазмиды и PEI инкубируют вместе в течение примерно от 1 мин до примерно 30 мин перед стадией (а).
26. Способ по любому из пп.1-25, где смесь компонентов (i), (ii) и (iii) инкубируют вместе в течение примерно от 10 с до примерно 4 ч перед стадией (b).
27. Способ по любому из пп.1-26, где инкубация на стадии (d) составляет, по меньшей мере, примерно 4 ч.
28. Способ по любому из пп.1-27, где клетки включают клетки млекопитающих.
29. Способ по любому из пп.1-28, где клетки представляют клетки эмбриональной почки человека (HEK) или клетки яичника китайского хомячка (CHO).
30. Способ по любому из пп.1-29, где клетки включают клетки эмбриональной почки человека (НЕК) 293.
31. Способ по любому из пп.1-30, где указанные клетки представляют клетки HEK 293E, HEK 293F или HEK 293T.
32. Способ по любому из пп.1-31, где клетки стабильно или транзиентно трансфектированы.
33. Способ по любому из пп.1-32, где клетки находятся в суспензионной культуре.
34. Способ по любому из пп.1-32, где клетки являются прикрепленными к субстрату.
35. Способ по любому из пп.1-34, где указанные клетки культивируют или поддерживают в бессывороточной культуральной среде.
36. Способ по любому из пп.1-35, где указанные клетки имеют плотность в диапазоне примерно от 1×105 клеток/мл до примерно 1×108 клеток/мл при контактировании с указанной смесью плазмида/PEI и/или при контактировании с указанным свободным PEI.
37. Способ по любому из пп.1-36, где жизнеспособность клеток при контактировании с указанной смесью плазмида/PEI или с указанным свободным PEI составляет примерно 60% или более 60%, или где указанные клетки находятся в логарифмической фазе роста при контактировании с указанной смесью плазмида/PEI.
38. Способ по любому из пп.1-37, где общее количество плазмиды находится в диапазоне примерно от 0,1 мкг до примерно 15 мкг на мл клеток.
39. Способ по любому из пп.1-37, где молярное соотношение плазмиды, содержащей трансген, к одной или более плазмидам, содержащим нуклеиновые кислоты, кодирующие упаковочные белки AAV, и/или нуклеиновые кислоты, кодирующие хелперные функции, составляет примерно от 1:5 до примерно 1:1 или составляет примерно от 1:1 до примерно 5:1.
40. Способ по любому из пп.1-39, где указанная одна или более плазмид содержат первую плазмиду, содержащую нуклеиновые кислоты, кодирующие упаковочные белки AAV, и вторую плазмиду, содержащую нуклеиновые кислоты, кодирующие хелперные функции.
41. Способ по п.40, где молярное соотношение плазмиды, содержащей трансген, к первой плазмиде, содержащей нуклеиновые кислоты, кодирующие упаковочные белки AAV, ко второй плазмиде, содержащей нуклеиновые кислоты, кодирующие хелперные функции, находится в диапазоне примерно 1-5:1:1, или 1:1-5:1, или 1:1:1-5.
42. Способ по любому из пп.1-41, где кодированные упаковочные белки AAV включают AAV rep и/или AAV cap.
43. Способ по любому из пп.1-42, где кодированные хелперные функции включают аденовирусные E2 и/или E4 белки, VA RNA и/или хелперные функции, не относящиеся к AAV.
44. Способ по любому из пп.1-43, где рекомбинантный вектор AAV содержит любой из серотипов AAV 1-12, капсидный белок AAV VP1, VP2 и/или VP3 или модифицированный или вариантный капсидный белок AAV VP1, VP2 и/или VP3, или капсидный белок AAV VP1, VP2 и/или VP3 дикого типа.
45. Способ по любому из пп.1-44, где аденоассоциированный вирусный вектор (AAV) содержит последовательность капсидного белка VP1, VP2 и/или VP3 или последовательность инвертированного концевого повтора, имеющую 70% или более идентичность последовательности с последовательностью капсидного белка или последовательностью инвертированного концевого повтора (ITR) любой последовательности капсидного белка или ITR, выбранных из серотипов AAV1, AAV2, AAV3, AAV4, AAV5, AAV6, AAV7, AAV8, AAV9 и AAV10.
46. Способ по любому из пп.1-45, где аденоассоциированный вирусный вектор (AAV) содержит последовательность капсидного белка VP1, VP2 и/или VP3, имеющую 70% или более идентичность последовательности с последовательностью капсидного белка, выбранной из SEQ ID NO: 1 и SEQ ID NO: 2.
47. Способ по п.1-46, где вектор AAV включает серотип AAV или псевдотип AAV, где указанный псевдотип AAV содержит капсидный серотип AAV, отличный от серотипа ITR.
48. Способ по любому из пп.1-47, где вектор AAV содержит капсидный белок VP1, VP2 и/или VP3 или инвертированный концевой повтор любого серотипа, выбранного из AAV1, AAV2, AAV3, AAV4, AAV5, AAV6, AAV7, AAV8, AAV9, AAV10, SEQ ID NO: 1 и SEQ ID NO: 2.
49. Способ по любому из пп.1-48, где вектор AAV дополнительно содержит интрон, элемент контроля экспрессии, один или более инвертированных концевых повторов (ITR) аденоассоциированного вируса (AAV) и/или полинуклеотидную последовательность-наполнитель.
50. Способ по п.49, где интрон находится внутри или фланкирует нуклеиновую кислоту, которая кодирует белок, или транскрибируется в представляющий интерес транскрипт, или где элемент контроля экспрессии операбельно связан с нуклеиновой кислотой, которая кодирует белок или транскрибируется в представляющий интерес транскрипт, или где AAV ITR(s) фланкируют 5'- или 3'-конец нуклеиновой кислоты, которая кодирует белок или транскрибируется в представляющий интерес транскрипт, или где полинуклеотидная последовательность-наполнитель фланкирует 5'- или 3'-конец нуклеиновой кислоты, которая кодирует белок или транскрибируется в представляющий интерес транскрипт.
51. Способ по любому из пп.1-50, где клетки субкультивируют до восстановленной плотности клеток перед контактированием с указанной смесью плазмида/PEI.
52. Способ по любому из пп.1-51, где клетки контактируют с указанной смесью плазмида/PEI в течение периода от 2 суток до 5 суток после субкультивирования.
53. Способ по любому из пп.1-52, где количество плазмид, вставленных в указанные трансфектированные клетки, по меньшей мере, на 50% больше на стадии добавления свободного PEI в клеточную культуру по сравнению с вариантом без добавления свободного PEI в клеточную культуру.
54. Способ по любому из пп.1-52, где количество плазмид, вставленных в указанные трансфектированные клетки, по меньшей мере, на 50% больше со стадией добавления вальпроевой кислоты, ее соли или производного, по сравнению с вариантом без добавления вальпроевой кислоты, ее соли или производного.
55. Способ по любому из пп.1-54, где количество продуцированного рекомбинантного вектора AAV составляет, по меньшей мере, 50% или более со стадией добавления свободного PEI к культуре клеток со смесью плазмида/PEI по сравнению с вариантом без добавления свободного PEI к культуре клеток со смесью плазмида/PEI.
56. Способ по любому из пп.1-54, где количество продуцированного рекомбинантного вектора AAV в 1-5, 5-8, 8-10 или 10-20 раз больше со стадией добавления свободного PEI к культуре клеток со смесью плазмида/PEI по сравнению с вариантом без добавления свободного PEI к культуре клеток со смесью плазмида/PEI.
57. Способ по любому из пп.1-55, где количество продуцированного рекомбинантного вектора AAV в 1-5, 5-8, 8-10 или 10-15 раз больше со стадией добавления вальпроевой кислоты, ее соли или производного по сравнению с вариантом без добавления вальпроевой кислоты, ее соли или производного в клеточную культуру со смесью плазмида/PEI.
58. Способ по любому из пп.1-57, где вальпроевая кислота представлена в виде ее производного.
59. Способ по любому из пп.1-58, где после стадии (с) вальпроевая кислота, ее соль или производное находятся в концентрации от примерно 0,1 до примерно 25 мМ.
60. Способ по любому из пп.1-58, где любая из стадий (a)-(f) или условий, описанных в любом из пп. 1-58, выполняется, как описано в любом из примеров 1-7.
| US 201100220927 A1, 27.01.2011 | |||
| BALAJI CHANDRA SEKHAR SINHADRI, Effect of valproic acid on transient protein expression in HEK 293E suspension adapted cells, Degree project in biology, Master of science (2 years), 2009, https://www.ibg.uu.se/digitalAssets/169/c_169881-l_3-k_sindhari-balaji-report.pdf | |||
| HSU P.Y., YANG Y.W., Gene delivery via the |
Авторы
Даты
2023-08-30—Публикация
2018-06-06—Подача