Перекрестная ссылка на родственные заявки
[0001] Данная заявка заявляет приоритет предварительной заявки на патент США №62/788324, поданной 4 января 2019 г., и предварительной заявки на патент США №62/834830, поданной 16 апреля, 2019 г., данные заявки в полном объеме включены здесь посредством ссылки.
Список последовательностей
[0002] Настоящая заявка содержит список последовательностей, который был представлен в электронном виде в формате ASCII и, тем самым в полном объеме включен в настоящее описание посредством ссылки. Указанная копия ASCII, созданная 31 декабря 2019 г., имеет название ULP-003WO_SL_ST25.txt и имеет размер 49846 байт.
Область техники
[0003] Данная заявка, в общем, относится к аденоассоциированным вирусным векторам и способам их применения в генной терапии для лечения болезни Вильсона (WD).
Уровень техники
[0004] Болезнь Вильсона (WD) представляет генетическое заболевание с аутосомно-рецессивным типом наследования, которое вызывает накопление меди в первую очередь в печени, и затем в нервной системе и других тканях. WD представляет собой редкое заболевание, которым страдает примерно 1 на 30000 субъектов, вызванное мутациями в гене медь-транспортирующей АТФазы 2 (ATP7B) на хромосоме 13. Существует более 600 уникальных мутаций ATP7B. ATP7B экспрессируется в основном в гепатоцитах и участвует в трансмембранном транспорте меди. Отсутствие белка ATP7B или снижение его функции приводит к снижению гепатоцеллюлярной экскреции меди с желчью, вызывая заболевание печени. Со временем без надлежащего лечения высокий уровень меди может вызвать опасное для жизни повреждение органов.
[0005] У пациентов с печеночной формой WD заболевание обычно проявляется в позднем детском или подростковом возрасте, и возникают признаки острого гепатита, фульминантной печеночной недостаточности или прогрессирующего хронического заболевания печени. Неврологические проявления WD обычно появляются позднее, чем симптомы поражения печени, чаще всего в возрасте двадцати или тридцати лет, и они включают экстрапирамидные, мозжечковые и церебральные симптомы.
Уровень техники
[0006] Целью медикаментозного лечения WD является удаление из организма токсических отложений меди и предупреждение их повторного накопления. Современные подходы к лечению WD представляют собой ежедневную пероральную терапию хелатирующими агентами (D-пеницилламином, триентином и солями цинка). Медикаментозная терапия эффективна у большинства, но не у всех пациентов с WD. Трансплантация печени представляет собой вариант лечения для пациентов с WD с фульминантной печеночной недостаточностью или прогрессирующей печеночной недостаточностью. Однако реципиенты трансплантата должны находиться на постоянном режиме поддерживающей иммуносупрессии для предотвращения отторжения органа.
[0007] Настоящее изобретение направлено на решение проблемы улучшенного и устойчивого лечения WD посредством доставки гена, экспрессирующего усеченную, но функциональную ATP7B, пациентам с использованием аденоассоциированного вирусного вектора. Усеченная ATP7B по настоящему изобретению обладает повышенной эффективностью в лечении WD и обладает преимуществом простоты получения и эффективности по сравнению с белком ATP7B дикого типа и другими усеченными формами белка.
Сущность изобретения
[0008] Настоящее изобретение относится к композициям и способам их применения в генной терапии. Настоящее изобретение относится к аденоассоциированным вирусным векторам (AAV), пригодным в лечении WD. В одном аспекте настоящее изобретение относится к рекомбинантной нуклеиновокислотной конструкции, содержащей: последовательность 5’-инвертированного концевого повтора (ITR); последовательность промотора; последовательность нуклеиновой кислоты, кодирующей усеченную человеческую медь-транспортирующую АТФазу 2 (ATP7B), в которой делецированы металл-связывающие домены (MBD) 1-3, но присутствует серин-богатая петля, включающая два остатка серина (S340 и S341) между MBD3 и MBD4; и последовательность 3’-ITR.
[0009] В другом аспекте настоящее изобретение относится к рекомбинантному аденоассоциированному вирусу (rAAV), пригодному для лечения болезни Вильсона, где rAAV содержит капсид AAV и упакованный в него векторный геном, где векторный геном содержит последовательность 5’-инвертированного концевого повтора (ITR); последовательность промотора; последовательность нуклеиновой кислоты, кодирующей усеченную человеческую медь-транспортирующую АТФазу 2 (ATP7B), в которой делецированы металл-связывающие домены (MBD) 1-3, но присутствует серин-богатая петля, включающая два остатка серина (S340 и S341) между MBD3 и MBD4; и последовательность 3’-ITR.
[0010] Данные и другие аспекты и признаки изобретения описаны в следующих разделах заявки.
Краткое описание фигур
[0011] Изобретение можно полнее понять при обращении на следующие фигуры.
[0012] На фиг. 1 представлена иллюстративная схема, показывающая примерную конструкцию векторного генома, содержащую нуклеотидную последовательность, которая кодирует усеченную человеческую медь-транспортирующую АТФазу 2 (ATP7B), в которой делецированы металл-связывающие домены (MBD) 1-3, но присутствует серин-богатая петля, включающая два остатка серина (S340 и S341) между MBD3 и MBD4 («ATP7B Δ1-3-SS» или «ATP7B del1-3 native»). Характеристики типичной конструкции векторного генома представлены ниже:
[0013] На фиг. 2 представлено схематическое изображение примерного AAV вектора (DTC319) с различными ключевыми компонентами, показанными в нем.
[0014] На фиг. 3 представлено схематическое изображение примерной плазмиды pAAV2/8.KanR (p2123FH) AAV Rep/Cap, которая обеспечивает функцию Rep и Cap в упаковке rAAV при котрансфекции клеток-хозяев AAV векторами.
[0015] На фиг. 4 представлено схематическое изображение примерной плазмиды, аденовирусной хелперной плазмиды pAdDeltaF6 (Kan), для продукции rAAV при котрансфекции клеток-хозяев AAV векторами и плазмидами Rep/Cap.
[0016] На фиг. 5 представлена точечная диаграмма концентрации меди в печени (мкг/г) у самок мышей C3He-Atp7btx-j (представлена кружками), которым вводили 109, 1010 или 1011 геномных копий (гк/кг) ATP7BcoFL (полноразмерного ATP7B человека, который был кодон-оптимизирован) и у самцов мышей C3He-Atp7btx-j (представлена квадратами), которым вводили 1010 или 1011 гк/кг того же вектора. На точечной диаграмме также представлены концентрации меди у совпадающих по возрасту самцов и самок гетерозиготных (Het) мышей и мышей C3He-Atp7btx-j, которым не проводили введение.
[0017] На фиг. 6 представлен столбчатый график, показывающий общий выход rAAV (титры в гк), полученного из клеток-хозяев после трансфекции AAV векторами, кодирующими полные или частичные кодирующие последовательности человеческой ATP7B (AAV вектор, несущий нуклеотидную последовательность, кодирующую полноразмерную (FL) человеческую ATP7B; AAV вектор, несущий нуклеотидную последовательность, кодирующую человеческую ATP7B, в которой были делецированы MBD 1-3, но присутствует серин-богатая петля, включающая два остатка серина (S340 и S341) между MBD3 и MBD4 (ATP7B Δ1-3-SS); или AAV вектор, несущий нуклеотидную последовательность, кодирующую человеческую ATP7B, в которой были делецированы MBD 1-4 (ATP7B Δ1-4).
[0018] На фиг. 7 представлена точечная диаграмма концентрации меди в моче и печени, квадраты и кружки соответственно (мкг/г), определенной после введения мышам C3He-Atp7btx-j AAV8, несущего полноразмерную человеческую ATP7B (ATP7B FL), ATP7B Δ1-3-SS или ATP7B Δ1-4. Забуференный фосфатом физиологический раствор (PBS), который вводили мышам C3He-Atp7btx-j, служил в качестве контроля (носитель).
[0019] На фиг. 8 представлен столбчатый график, показывающий общий выход rAAV (титры в гк), полученный из клеток-хозяев после трансфекции AAV вектором (DTC319), который кодирует усеченную человеческую ATP7B, в которой делецированы металл-связывающие домены (MBD) 1-3, но присутствует серин-богатая петля, включающая два остатка серина (S340 и S341) между MBD3 и MBD4, кодирующий капсид AAV8 или AAV9.
[0020] На фиг. 9 представлен столбчатый график концентрации накопления меди в печени (мкг/г сухой массы) у мышей C3He-Atp7btx-j, которым внутривенно вводили контрольный носитель (буфер для разведения; WD) или внутривенно вводили AAV8, несущий нативную ATP7B Δ1-3-СС (DelA). Уровни накопления меди в печени у мышей дикого типа (WT), которым не проводили введение, представленные на графике, служили отрицательным контролем. Значения выражены в виде среднего значения ± SEM (стандартная ошибка среднего).
[0021] На фиг. 10 представлен столбчатый график активности церулоплазмина у мышей C3He-Atp7btx-j, которым внутривенно вводили контрольный носитель (буфер для разведения; WD) или внутривенно вводили AAV8, несущий нативную ATP7B Δ1-3-SS (DelA), как измерено с использованием колориметрического анализа активности на основе ферментативной реакции. На графике также представлена активность церулоплазмина у мышей дикого типа (WT), которым не проводили введение, измеренная с помощью того же колориметрического анализа активности на основе ферментативной реакции.
[0022] На фиг. 11 представлен столбчатый график среднего балла оценки после стандартного анализа микроскопических препаратов, окрашенных гематоксилином и эозином (H&E), на предмет увеличения ядер и гепатоцеллюлярной гипертрофии, дезорганизации, воспалительного инфильтрата и гепатоцеллюлярного некроза.
[0023] На фиг. 12 представлена иллюстративная схема, показывающая примерную конструкцию векторного генома DTC327, содержащую капсид AAV9 с PPIA polyA, Rep/ITR AAV2 с полным промотором p5, содержащий ITR 145 п.н., и нуклеотидную последовательность, кодирующую усеченную человеческую медь-транспортирующую АТФазу 2 (ATP7B), в которой делецированы металл-связывающие домены (MBD) 1-3, но присутствует серин-богатая петля, включающая два остатка серина (S340 и S341) между MBD3 и MBD4.
Подробное описание изобретения
[0024] Данное изобретение относится к средствам и композициям для применения в лечении болезни Вильсона (WD). Последовательности нуклеиновых кислот, векторы, рекомбинантные вирусы и ассоциированные композиции по настоящему изобретению, как здесь описано, можно использовать для ослабления, профилактики или лечения WD.
[0025] Если не указано иное, то технические термины используются в соответствии с их общепринятым использованием. Определения общих терминов в молекулярной биологии можно найти в Benjamin Lewin, Genes V, published by Oxford University Press, 1994 (ISBN 0-19-854287-9); Kendrew et al. (eds.), The Encyclopedia of Molecular Biology, published by Blackwell Science Ltd., 1994 (ISBN 0-632-02182-9); and Robert A. Meyers (ed.), Molecular Biology and Biotechnology: a Comprehensive Desk Reference, published by VCH Publishers, Inc., 1995 (ISBN 1-56081-569-8).
[0026] Для облегчения обзора различных вариантов осуществления изобретения, представляются следующие пояснения конкретных терминов:
[0027] Аденоассоциированный вирус (AAV): малый репликационно-дефектный вирус без оболочки, который инфицирует людей и некоторых других видов приматов. Остается неизвестным, что AAV вызывает заболевание, и он вызывает очень слабый иммунный ответ. Векторы для генной терапии, в которых используются AAV, могут инфицировать как делящиеся, так и покоящиеся клетки и могут сохраняться во внехромосомном состоянии без интеграции в геном клетки-хозяина. Данные свойства делают AAV привлекательным вирусным вектором для генной терапии. В настоящее время существует 12 установленных серотипов AAV (AAV1-12).
[0028] Введение/вводить: предоставить или дать субъекту средство, такое как терапевтическое средство (например, рекомбинантный AAV), любым эффективным путем. Примеры способов введения включают, не ограничиваясь этим, инъекции (такие как подкожные, внутримышечные, внутрикожные, внутрибрюшинные и внутривенные), а также пероральный, внутрипротоковый, сублингвальный, ректальный, трансдермальный, интраназальный, интравагинальный и ингаляционный пути введения.
[0029] ATP7B Δ1-3-SS: в рамках настоящего изобретения, ATP7B Δ1-3-SS относится к усеченной человеческой медь-транспортирующей АТФазе 2 (ATP7B), в которой делецированы металл-связывающие домены (MBD) 1-3, но присутствует серин-богатая петля, включающая два остатка серина (S340 и S341) между MBD3 и MBD4.
[0030] Кодон-оптимизированная: «кодон-оптимизированная» нуклеиновая кислота относится к последовательности нуклеиновой кислоты, которая была изменена таким образом, что кодоны являются оптимальными для экспрессии в конкретной системе (такой как конкретный вид или группа видов). Например, последовательность нуклеиновой кислоты можно оптимизировать для экспрессии в клетках млекопитающих или в клетках определенных видов млекопитающих (таких как клетки человека). Кодон-оптимизация не изменяет аминокислотную последовательность кодированного белка.
[0031] Энхансер: последовательность нуклеиновой кислоты, которая повышает уровень транскрипции за счет увеличения активности промотора.
[0032] Интрон: участок ДНК в гене, не содержащий кодирующей информации для белка. Интроны удаляются перед трансляцией информационной РНК.
[0033] Инвертированный концевой повтор (ITR): симметричные последовательности нуклеиновых кислот в геноме аденоассоциированных вирусов, необходимые для эффективной репликации. Последовательности ITR расположены на каждом конце ДНК генома AAV. ITR служат в качестве ориджина репликации для синтеза вирусной ДНК и необходимы для инкапсидации вектора.
[0034] Выделенный: «выделенный» биологический компонент (такой как молекула нуклеиновой кислоты, белок, вирус или клетка) был существенно отделен или очищен от других биологических компонентов в клетке или ткани организма или самого организма, в которых компонент присутствует в природе, например, другие хромосомные и внехромосомные ДНК и РНК, белки и клетки. Молекулы нуклеиновых кислот и белки, которые были «выделены», включают те, которые очищены стандартными методами очистки. Термин также охватывает молекулы нуклеиновой кислоты и белки, полученные рекомбинантной экспрессией в клетке-хозяине, а также химически синтезированные молекулы и белки нуклеиновой кислоты.
[0035] Операбельно связанная: первая последовательность нуклеиновой кислоты операбельно связана со второй последовательностью нуклеиновой кислоты, когда первая последовательность нуклеиновой кислоты находится в функциональной взаимосвязи со второй последовательностью нуклеиновой кислоты. Например, промотор является операбельно связанным с кодирующей последовательностью, если промотор влияет на транскрипцию или экспрессию кодирующей последовательности. В общем, операбельно связанные последовательности ДНК являются смежными, и, при необходимости, могут соединять две белок-кодирующие области в одной считывания.
[0036] Фармацевтически приемлемый носитель: фармацевтически приемлемые носители (эксципиенты), используемые в данном описании, являются общепринятыми. В монографии Remington's Pharmaceutical Sciences, E.W. Martin, Mack Publishing Co., Easton, PA, 15-е издание (1975), описаны композиции и составы, подходящие для фармацевтической доставки одного или более терапевтических соединений, молекул или агентов.
[0037] В общем, природа носителя будет зависеть от конкретного применяемого способа введения. Например, составы для парентерального введения обычно содержат жидкости для инъекций, которые включают фармацевтически и физиологически приемлемые жидкости, такие как вода, физиологический раствор, сбалансированные солевые растворы, водный раствор декстрозы, глицерин или тому подобное в качестве носителя. Для твердых композиций (например, в форме порошка, пилюли, таблетки или капсулы) обычные нетоксичные твердые носители могут включать, например, фармацевтические марки маннита, лактозы, крахмала или стеарата магния. В дополнение к биологически нейтральным носителям фармацевтические композиции для введения могут содержать небольшие количества нетоксичных вспомогательных веществ, таких как смачивающие или эмульгирующие агенты, консерванты, забуферивающие агенты для поддержания pH и тому подобное, например ацетат натрия или сорбитана монолаурат.
[0038] Профилактика, лечение или ослабление заболевания: «профилактика» заболевания (такого как WD) относится к подавлению полного развития заболевания. «Лечение» относится к терапевтическому вмешательству, которое ослабляет признак или симптом заболевания или патологического состояния (например, WD) после того, как оно уже начало развиваться. «Ослабление» относится к уменьшению числа или тяжести признаков или симптомов заболевания (например, WD).
[0039] Промотор: область ДНК, которая направляет/инициирует транскрипцию нуклеиновой кислоты (например, гена). Промотор включает необходимые последовательности нуклеиновой кислоты рядом с сайтом начала транскрипции.
[0040] Очищенный: термин «очищенный» не требует абсолютной чистоты; в большей степени, это понятие относительное. Таким образом, например, очищенный пептид, белок, вирус или другое активное вещество представляет собой такое вещество, которое полностью или частично отделено от естественно связанных белков и других загрязняющих веществ. В некоторых вариантах осуществления термин «по существу очищенный» относится к пептиду, белку, вирусу или другому активному веществу, которое было выделено из клетки, среды для культивирования клеток или другого неочищенного препарата и подверглось фракционированию для удаления различных компонентов исходного препарата, таких как белки, клеточный дебрис и другие компоненты.
[0041] Рекомбинантная: рекомбинантная молекула нуклеиновой кислоты представляет собой молекулу, которая имеет последовательность, не встречающуюся в природе, или последовательность, полученную посредством искусственного комбинирования двух разделенных иным образом сегментов последовательности. Данное искусственное комбинирование может быть достигнуто посредством химического синтеза или искусственного манипулирования выделенными сегментами молекул нуклеиновых кислот, например, методами генной инженерии.
[0042] Аналогично, рекомбинантный вирус представляет собой вирус, содержащий последовательность (такую как геномная последовательность), которая не встречается в природе или получена искусственным комбинированием, по меньшей мере, двух последовательностей разного происхождения. Термин «рекомбинантный» также включает нуклеиновые кислоты, белки и вирусы, которые были изменены исключительно посредством добавления, замены или делеции части молекулы природной нуклеиновой кислоты, белка или вируса. В рамках настоящего изобретения, термин «рекомбинантный AAV» относится к частице AAV, в которой упакована молекула рекомбинантной нуклеиновой кислоты, такая как молекула рекомбинантной нуклеиновой кислоты, кодирующая усеченную человеческую ATP7B (например, SEQ ID NO: 1 или SEQ ID NO: 15).
[0043] Идентичность последовательностей: идентичность или сходство между двумя или более последовательностями нуклеиновых кислот или двумя или более аминокислотными последовательностями выражается по степени идентичности или сходства между последовательностями. Идентичность последовательностей можно измерить по степени процентной идентичности; чем выше процент, тем более идентичны последовательности. Сходство последовательностей можно измерить по степени процентного сходства (которое учитывает консервативные аминокислотные замены); чем выше процент, тем более сходными являются последовательности. Гомологи или ортологи нуклеиновых кислот или аминокислотных последовательностей обладают относительно высокой степенью идентичности/сходства последовательностей при выравнивании с использованием стандартных методов. Эта гомология более значима, когда ортологичные белки или кДНК происходят от видов, которые более тесно связаны (например, последовательности человека и мыши), по сравнению с видами, связанными более отдаленно (например, последовательности человека и C. elegans).
[0044] Способы выравнивания последовательностей для сравнения хорошо известны в данной области. Различные программы и алгоритмы выравнивания описаны в публикациях: Smith & Waterman, Adv. Appl. Math. 2:482, 1981; Needleman & Wunsch, J. Mol. Biol. 48:443, 1970: Pearson & Lipman, Proc. Natl. Acad. Sci. USA 85:2444, 1988; Higgins & Sharp, Gene, 73:237-44, 1988; Higgins & Sharp, CABIOS5:151-3, 1989; Corpet et al., Nuc. Acids Res. 16:10881-90, 1988; Huang et al. Computer Appls. in the Biosciences 8, 155-65, 1992: и Pearson et al., Meth. Mol. Rio. 24:307-31, 1994. Altschul et al., J. Mol. Biol. 215:403-10, 199. Подробное описание методов выравнивания последовательностей и расчетов гомологии можно найти, например, в статье Altschul et al. (1990), J. Mol. Biol. 215: 403-10.
[0045] Базовый инструмент поиска локального выравнивания (BLAST™; Altschul et al. (1990)) доступен из нескольких источников, включая Национальный центр биотехнологической информации (NCBI), а также в сети интернет, для использования в сочетании с несколькими программами анализа последовательностей blastp, blastn, blastx, tblastn и tblastx. Дополнительную информацию можно найти на веб-сайте NCBI.
[0046] Серотип: группа близкородственных микроорганизмов (таких как вирусы), отличающихся характерным набором антигенов.
[0047] Последовательность-вставка: относится к последовательности нуклеотидов, содержащейся в более крупной молекуле нуклеиновой кислоты (такой как вектор), которая обычно используется для создания желаемого промежутка между двумя элементами нуклеиновой кислоты (например, между промотором и кодирующей последовательностью), или для удлинения молекулы нуклеиновой кислоты так, чтобы она имела желаемую длину. Последовательности-вставки не содержат информации, кодирующей белок, и могут иметь неизвестное/синтетическое происхождение и/или могут быть не связаны с другими последовательностями нуклеиновых кислот в более крупной молекуле нуклеиновой кислоты.
[0048] Субъект: живые многоклеточные организмы, относящиеся к позвоночным, группа, которая включает человека и млекопитающих, отличных от человека.
[0049] Синтетическая: синтетическая нуклеиновая кислота, произведенная искусственным путем в лаборатории, например, может представлять собой химически синтезированную нуклеиновую кислоту в лаборатории.
[0050] Терапевтически эффективное количество: количество определенного фармацевтического или терапевтического средства (например, рекомбинантного AAV), достаточное для достижения желаемого эффекта у субъекта или в клетке, подлежащим лечению средством. Эффективное количество средства будет зависеть от нескольких факторов, включая, не ограничиваясь этим, субъекта или клетки, подлежащие лечению, и способ введения терапевтической композиции.
[0051] Вектор: вектор представляет собой молекулу нуклеиновой кислоты, позволяющую встраивать чужеродную нуклеиновую кислоту без нарушения способности вектора реплицироваться и/или интегрироваться в клетку-хозяин. Вектор может включать в себя последовательности нуклеиновых кислот, которые позволяют ему реплицироваться в клетке-хозяине, такие как ориджин репликации. Вектор также может включать один или более селективных маркерных генов и других генетических элементов. Экспрессионный вектор представляет собой вектор, который содержит необходимые регуляторные последовательности, обеспечивающие транскрипцию и трансляцию встроенного гена или генов. В некоторых вариантах осуществления настоящего изобретения вектор представляет собой AAV вектор.
[0052] Если не указано иное, то все технические и научные термины, используемые здесь, имеют то же значение, которое обычно понимается специалистами в данной области техники, к которой относится данное изобретение. Артикли «a», «an» и «the» в единственном числе включают ссылки во множественном числе, если контекст явно не указывает иное. «Содержит A или B» означает включает A или B, или A и B. Кроме того, следует понимать, что все размеры оснований или аминокислот, а также все значения молекулярного веса или молекулярной массы, приведенные для нуклеиновых кислот или полипептидов, являются примерными, и предназначены для описания. Несмотря на то, что способы и материалы, подобные или эквивалентные описанным здесь, можно использовать в практике или тестировании настоящего изобретения, подходящие способы и материалы описаны ниже. Все публикации, заявки на патенты, патенты и другие ссылки, упомянутые в данном документе, полностью включены посредством ссылки. В случае противоречия преимущественную силу имеет настоящее описание, включая пояснения терминов. Кроме того, материалы, методы и примеры являются только иллюстративными и не предназначены для ограничения.
Вирусные векторы
[0053] В некоторых аспектах настоящее изобретение относится к рекомбинантному аденоассоциированному вирусному вектору (AAV), содержащему геном, включающий последовательность AAV 5'-инвертированного концевого повтора (ITR), последовательность промотора, последовательность нуклеиновой кислоты, которая кодирует ATP7B Δ1-SS (например, SEQ ID NO: 1 или SEQ ID NO: 15) и последовательность AAV 3'-инвертированного концевого повтора (ITR).
[0054] В некоторых вариантах осуществления геном может дополнительно содержать энхансер, интрон, консенсусную последовательность Козака и/или сигнал полиаденилирования, как здесь описано. В некоторых вариантах осуществления рекомбинантный вектор может дополнительно включать одну или более последовательностей-вставок нуклеиновой кислоты. В одном варианте осуществления последовательность-вставка нуклеиновой кислоты расположена между интроном и частичной или полной последовательностью, кодирующей ATP7B.
[0055] В различных вариантах осуществления, описанных здесь, рекомбинантный вирусный вектор представляет собой аденоассоциированный вирусный вектор (AAV). Вектор AAV может представлять собой AAV вектор серотипа 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11 или 12 (т.е. AAV1, AAV2, AAV3, AAV4, AAV5, AAV6, AAV7, AAV8, AAV9, AAV10, AAV11 или AAV12), а также любой из более чем 100 вариантов, выделенных из тканей человека и приматов, отличных от человека. См., например, Choi et al., 2005, Curr. Gene Ther., 5: 299-310, 2005 и Gao et al., 2005, Curr. Gene Ther., 5: 285-297. В настоящем изобретении можно использовать AAV векторы любого серотипа, и выбор серотипа AAV будет частично зависеть от типа(ов) клеток, которые являются мишенями для генной терапии. Для лечения WD печень является одним из основных органов-мишеней. В некоторых вариантах осуществления AAV вектор выбран из серотипа 9 (AAV9), серотипа 8 (AAV8), серотипа 5 (AAV5) или их вариантов. В примерном варианте осуществления AAV вектор представляет собой серотип 9 (AAV9) или его вариант.
[0056] В некоторых вариантах осуществления рекомбинантный AAV вектор включает последовательность AAV ITR, которая функционирует в качестве ориджина репликации векторной ДНК и в качестве сигнала упаковки векторного генома, когда AAV и хелперные функции аденовируса находятся в транс-положении. Кроме того, ITR служат мишенью для обеспечения одноцепочечных разрывов эндонуклеазами крупными Rep-белками, отделяя отдельные геномы от промежуточных продуктов репликации.
[0057] В некоторых вариантах осуществления последовательность 5’-ITR происходит из AAV2. В некоторых вариантах осуществления последовательность 3’-ITR происходит из AAV2. В некоторых вариантах осуществления последовательность 5’-ITR и последовательность 3’-ITR происходят из AAV2. В некоторых вариантах осуществления последовательность 5’-ITR и/или последовательность 3’-ITR происходят из AAV2, и содержат или состоят из SEQ ID NO: 2. В других вариантах осуществления последовательность 5’-ITR и/или последовательность 3’-ITR происходят из источника, отличного от AAV2.
[0058] В некоторых примерных вариантах осуществления AAV вектор представляет собой AAV вектор серотипа 9 (AAV9), и вектор включает энхансер, промотор, интрон, последовательность нуклеиновой кислоты, которая кодирует ATP7B Δ1-3-SS (например, SEQ ID NO: 1 или SEQ ID NO: 15), и сигнал полиаденилирования, описанные здесь. В некоторых вариантах осуществления AAV9 вектор дополнительно включает две AAV2, AAV8 или AAV9 последовательности инвертированного концевого повтора (ITR): одну 5’ от энхансера и другую 3’ от сигнала полиаденилирования. В примерном варианте осуществления AAV9 вектор включает две последовательности инвертированного концевого повтора (ITR) AAV2: одну 5’ от энхансера и другую 3’ от сигнала полиаденилирования. В некоторых вариантах осуществления последовательности AAV2 ITR содержат или состоят из SEQ ID NO: 2. В другом примерном варианте осуществления AAV9 вектор включает две последовательности инвертированного концевого повтора (ITR) AAV9: одну 5’ от энхансера и другую 3’ от сигнала полиаденилирования.
[0059] В некоторых примерных вариантах осуществления настоящее изобретение относится к рекомбинантной нуклеиновой кислоте, содержащей векторный геном, включающий последовательность AAV 5'-инвертированного концевого повтора (ITR), последовательность промотора, последовательность нуклеиновой кислоты, показанную в SEQ ID NO: 1, которая кодирует нативную ATP7B Δ1-3-SS и последовательность AAV 3'-инвертированного концевого повтора (ITR). В некоторых примерных вариантах осуществления настоящее изобретение относится к рекомбинантной нуклеиновой кислоте, содержащей векторный геном, включающий последовательность AAV 5'-инвертированного концевого повтора (ITR), последовательность промотора, последовательность нуклеиновой кислоты, показанную в SEQ ID NO: 15, которая кодирует кодон-оптимизированный ATP7B Δ1-3-SS и последовательность AAV 3'-инвертированного концевого повтора (ITR). В некоторых примерных вариантах осуществления настоящее изобретение относится к векторному геному, содержащему SEQ ID NO: 14, который содержит последовательность AAV 5'-инвертированного концевого повтора (ITR), последовательность промотора, последовательность нуклеиновой кислоты, показанную в SEQ ID NO: 1, которая кодирует нативную ATP7B Δ1-3-SS, или аденоассоциированный вирусный вектор (AAV), содержащий его.
[0060] В дополнительных аспектах изобретение относится к последовательностям рекомбинантных нуклеиновых кислот, соответствующим векторным геномам, пригодным в лечении WD. В некоторых вариантах осуществления изобретение относится к рекомбинантной нуклеиновой кислоте, которая на 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или более идентична SEQ ID NO: 14. Таким образом, изобретение относится к рекомбинантным нуклеиновым кислотам, которые, по меньшей мере, на 80% (например, на 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 99,1%, 99,2%, 99,3%, 99,4%, 99,5%, 99,6%, 99,7%, 99,8%, 99,9% или 100%) идентичны SEQ ID NO: 14. В примерном варианте осуществления изобретение относится к последовательности рекомбинантной нуклеиновой кислоты, соответствующей векторному геному, содержащей последовательность AAV 5'-инвертированного концевого повтора (ITR), последовательность промотора, последовательность нуклеиновой кислоты, показанной в SEQ ID NO: 1, которая кодирует природную ATP7B Δ1-3-SS и последовательность AAV 3'-инвертированного концевого повтора (ITR), где векторный геном содержит или состоит из SEQ ID NO: 14. В примерном варианте осуществления изобретение относится к последовательности рекомбинантной нуклеиновой кислоты, соответствующей векторному геному, содержащей последовательность AAV 5'-инвертированного концевого повтора (ITR), последовательность промотора, последовательность нуклеиновой кислоты, показанную в SEQ ID NO: 15, которая кодирует кодон-оптимизированный ATP7B Δ1-3-SS и последовательность AAV 3'-инвертированного концевого повтора (ITR).
Промотор:
[0061] В различных аспектах, описанных здесь, изобретение относится к AAV векторам, которые содержат промоторную последовательность, которая обеспечивает направление и регуляцию экспрессии трансгена, например, экспрессии ATP7B Δ1-3-SS (например, аминокислотная последовательность ATP7B Δ1-3-SS, показанная в SEQ ID NO: 8). В примерных вариантах осуществления последовательность промотора расположена между выбранной последовательностью 5'-ITR и последовательностью, кодирующей ATP7B Δ1-3-SS (например, SEQ ID NO: 1 или SEQ ID NO: 15). В некоторых вариантах осуществления последовательность промотора расположена даунстрим от энхансерной последовательности. В некоторых вариантах осуществления промоторная последовательность расположена апстрим от последовательности интрона. В некоторых иллюстративных вариантах осуществления в векторе, описанном здесь, используется промотор транстиретина (TTR), который необязательно может располагаться даунстрим от энхансера транстиретина (enTTR).
[0062] В некоторых вариантах осуществления промотор выбран из промотора транстиретина (TTR), промотора куриного β-актина (CBA), немедленного раннего промотора гена цитомегаловируса (CMV), промотора тироксинсвязывающего глобулина (TBG), промотора альфа-1-антитрипсина (A1AT) и промотора CAG (сконструированного с использованием элемента раннего энхансера цитомегаловируса, первого экзона и первого интрона гена куриного бета-актина и акцептора сплайсинга гена кроличьего бета-глобина). В примерном варианте осуществления промотором является промотор TTR. В одном варианте промотор TTR содержит или состоит из SEQ ID NO: 12.
[0063] Помимо промотора, AAV вектор может содержать другие подходящие сигналы инициации, терминации транскрипции, энхансерные последовательности и эффективные сигналы процессинга РНК. Как более подробно описано ниже, такие последовательности включают сигналы сплайсинга и полиаденилирования (поли A), регуляторные элементы, которые усиливают экспрессию (т.е. WPRE), последовательности, стабилизирующие цитоплазматическую мРНК, последовательности, повышающие эффективность трансляции (т.е. консенсусную последовательность Козака), и последовательности, повышающие стабильность белка.
[0064] В некоторых вариантах осуществления AAV вектор содержит векторный геном, который дополнительно включает консенсусную последовательность Козака. В некоторых вариантах осуществления консенсусная последовательность Козака расположена даунстрим от последовательности интрона. В одном варианте осуществления консенсусная последовательность Козака представляет собой GCCGCC (SEQ ID NO: 11). Как будет понятно специалистам в данной области, консенсусная последовательность Козака обычно располагается непосредственно апстрим от кодирующей последовательности; в этом случае непосредственно апстрим от кодирующей последовательности усеченной ATP7B (ATP7B Δ1-3-SS) (например, SEQ ID NO: 1 или SEQ ID NO: 15). Как будет понятно специалистам в данной области, можно считать, что консенсусная последовательность Козака разделяет остаток ATG, соответствующий стартовому кодону терапевтического полипептида, например, усеченной ATP7B (ATP7B Δ1-3-SS) (например, SEQ ID NO: 1 или SEQ ID NO: 15). Для упрощения описания консенсусная последовательность Козака, как здесь описано, включает последовательность из шести нуклеотидов, соответствующую области, не являющейся общей с нуклеиновой кислотой, кодирующей терапевтический полипептид, например, усеченную ATP7B (ATP7B Δ1-3-SS, кодированную SEQ ID NO: 1 или SEQ ID NO: 15).
Полипептиды ATP7B:
[0065] В рамках настоящего изобретения, аспекты изобретения относятся к рекомбинантным векторам, которые содержат геном, который включает последовательность AAV 5'-инвертированного концевого повтора (ITR), последовательность промотора, последовательность, кодирующую усеченную человеческую ATP7B (ATP7B Δ1-3-SS), имеющую аминокислотную последовательность SEQ ID NO: 8 (например, SEQ ID NO: 1 или SEQ ID NO: 15) и последовательность AAV 3'-инвертированного концевого повтора (ITR). ATP7B имеет восемь трансмембранных доменов, которые образуют путь через клеточные мембраны для транслокации меди; и большой N-конец с шестью металл-связывающими доменами (MBD), каждый из которых содержит примерно 70 аминокислот и высококонсервативный металл-связывающий мотив GMxCxxC (где x представляет собой любую аминокислоту). В дополнение к канонической последовательности (также называемой изоформой a, которая является самой длинной изоформой; референсная последовательность NCBI: NP_000044.2), известны четыре дополнительные изоформы: референсные последовательности NCBI четыре дополнительные изоформы: референсные последовательности с идентификационными номерами NCBI NP_001005918.1, NP_001230111.1, NP_001317507.1, NP_001317508.1. Композиции и способы, описанные здесь, можно использовать для лечения субъектов, имеющих нефункциональный вариант белка ATP7B, который вызывает заболевание.
[0066] В одном варианте осуществления последовательность, кодирующая усеченную человеческую ATP7B (ATP7B Δ1-3-SS) (например, SEQ ID NO: 1 или SEQ ID NO: 15), кодирует белок с аминокислотами, показанными в SEQ ID NO: 8. SEQ ID NO: 1 обеспечивает кДНК нативной человеческой ATP7B, в которой делецированы MBD 1-3. SEQ ID NO: 8 представляет собой белок DEL1-3 нативный или ATP7B Δ1-3-SS, в котором присутствуют два сериновых остатка, соответствующие положениям 340 и 341 полноразмерной последовательности белка ATP7B дикого типа.
[0067] В различных вариантах осуществления, описанных здесь, обеспечиваются векторы, которые содержат геном, включающий последовательность, кодирующую усеченную ATP7B (ATP7B Δ1-3-SS) (например, SEQ ID NO: 1 или SEQ ID NO: 15).
[0068] В некоторых вариантах осуществления обеспечиваются векторы, которые содержат геном, содержащий сконструированную кДНК для человеческой ATP7B, которая была кодон-оптимизирована (например, SEQ ID NO: 15). Полипептиды, доставляемые векторами, описанными здесь, включают усеченную ATP7B, в которой были делецированы MBD 1-3 (ATP7B Δ1-3-SS), которые подходят для применения в лечении WD.
[0069] В некоторых вариантах осуществления полипептид, экспрессированный вектором, описанным здесь, представляет собой усеченную человеческую ATP7B (SEQ ID NO: 8).
Элементы вектора:
[0070] В некоторых вариантах осуществления AAV вектор содержит геном, который дополнительно включает одну или более энхансерных последовательностей. В одном варианте осуществления энхансер выбран из энхансера транстиретина (enTTR), немедленного раннего энхансера гена цитомегаловируса (CMV), энхансера куриного β-актина (CBA), энхансера En34 и энхансера аполипопротеина (ApoE). В примерном варианте осуществления энхансером является энхансер enTTR. В одном варианте энхансер enTTR содержит или состоит из SEQ ID NO: 3.
[0071] В некоторых вариантах осуществления AAV вектор содержит геном, который дополнительно включает одну или более интронных последовательностей. В одном варианте осуществления интрон выбран из малого Т-интрона SV40, интрона бета-субъединицы кроличьего гемоглобина (rHBB), интрона IVS2 человеческого бета-глобина, химерного интрона β-глобина/IgG (химерный интрон Promega) или интрона hFIX. В одном примерном варианте осуществления интрон представляет собой малый Т-интрон SV40. В одном варианте осуществления последовательность малого Т-интрона SV40 содержит или состоит из SEQ ID NO: 4. В еще одном примерном варианте осуществления интрон представляет собой интрон rHBB. В одном варианте осуществления последовательность интрона rHBB содержит или состоит из SEQ ID NO: 5.
[0072] В некоторых вариантах осуществления AAV вектор содержит геном, который дополнительно включает сигнальную последовательность полиаденилирования. В одном варианте осуществления сигнальная последовательность полиаденилирования выбрана из сигнальной последовательности полиаденилирования SV40, сигнальной последовательности полиаденилирования бычьего гормона роста (BGH) и сигнальной последовательности полиаденилирования кроличьего бета-глобина. В примерном варианте осуществления сигнальная последовательность полиаденилирования представляет собой сигнальную последовательность полиаденилирования бычьего гормона роста (BGH). В одном варианте осуществления сигнальная последовательность полиаденилирования BGH содержит или состоит из SEQ ID NO: 6. В еще одном примерном варианте осуществления сигнальная последовательность полиаденилирования представляет собой сигнальную последовательность полиаденилирования SV40. В одном варианте осуществления сигнальная последовательность полиаденилирования SV40 содержит или состоит из SEQ ID NO: 7.
Капсиды AAV:
[0073] В еще одном аспекте изобретение относится к рекомбинантному аденоассоциированному вирусу (rAAV), пригодному в качестве средств для генной терапии в лечении WD, где указанный rAAV включает капсид AAV и векторный геном, как здесь описано. В некоторых вариантах осуществления капсид AAV происходит из AAV серотипа 9, 8, 1, 2, 3, 4, 5, 6, 7, 10, 11, 12, rh10 или hu37 (т.е. AAV1, AAV2, AAV3, AAV4, AAV5, AAV6, AAV7, AAV8, AAV9, AAV10, AAV11, AAV12, AAVrh10 или AAVhu37). В примерном варианте осуществления AAV вектор представляет собой AAV вектор серотипа 9 (AAV9), вектор на основе варианта AAV9, вектор AAV серотипа 8 (AAV8), вектор AAV серотипа 5 (AAV5) или вектор AAV серотипа 2 (AAV2). В некоторых вариантах осуществления капсид и AAV вектор относятся к серотипу AAV9. В некоторых вариантах осуществления AAV капсид и вектор относятся к серотипу AAV8.
[0074] Капсид AAV9 представляет собой самособирающийся капсид AAV, состоящий из множества белков VP AAV9. Белки VP AAV9 обычно экспрессируются как альтернативные варианты сплайсинга, кодированные последовательностью нуклеиновой кислоты SEQ ID NO: 9 или последовательностью, которая, по меньшей мере, на 70%, по меньшей мере, на 75%, по меньшей мере, на 80%, по меньшей мере, на 85%, по меньшей мере, на 90%, по меньшей мере, на 95%, по меньшей мере, на 97%, по меньшей мере, на 99%, идентична ей, которая кодирует аминокислотную последовательность капсидного белка VP1 SEQ ID NO: 10 (идентификационный номер в GenBank: AAS99264). Данные варианты сплайсинга дают белки различной длины с SEQ ID NO: 10. В некоторых вариантах осуществления капсид AAV9 включает белок капсида AAV9, имеющий аминокислотную последовательность, которая на 99% идентична AAS99264 или на 99% идентична SEQ ID NO: 10. См. также патент США №7906111 и публикацию международной заявки № WO/2005/033321. В рамках настоящего изобретения, вариант AAV9 включает варианты, описанные, например, в публикации международной заявки № WO/2016/049230, патенте США №8927514, публикации патента США №2015/0344911 и патенте США №8734809.
[0075] В рамках настоящего изобретения, последовательности капсида AAV9 и белки капсида, кодированные последовательностями (например, последовательностью нуклеиновой кислоты SEQ ID NO: 9 или аминокислотная последовательность SEQ ID NO: 10, кодирующая капсидный белок VP1 AAV9), пригодны в получении rAAV. Однако в еще одних вариантах осуществления выбирается другой AAV капсид. Тканевая специфичность определяется типом капсида. Серотипы AAV, которые трансдуцируют подходящую мишень (например, печень, мышцы, легкое или ЦНС), могут быть выбраны в качестве источников капсидов вирусных векторов AAV, включая, например, AAV1, AAV2, AAV3, AAV4, AAV5, AAV6, AAV6.2, AAV7, AAV8, AAV9, AAVrh10, AAVrh64Rl, AAVrh64R2, AAVrh8. См., например, публикацию патента США №2007/0036760; публикацию патента США №2009/0197338; и EP1310571. См. также международную заявку № WO 2003/042397 (AAV7 и другой обезьяний AAV), патенты США №7282199 и 7790449 (AAV8). Кроме того, AAV, который еще предстоит открыть, или рекомбинантный AAV на его основе, можно использовать в качестве источника капсида AAV. В указанных документах также описаны другие AAV, которые могут быть выбраны для создания AAV, и они включены здесь посредством ссылки. В некоторых вариантах осуществления капсид AAV для использования в вирусном векторе может быть получен мутагенезом (т.е. посредством инсерций, делеций или замен) одного из вышеуказанных капсидов AAV или кодирующей его нуклеиновой кислоты.
Клетки-хозяева, содержащие молекулу рекомбинантной нуклеиновой кислоты:
[0076] В некоторых аспектах настоящее изобретение относится к клеткам-хозяевам, содержащим рекомбинантную молекулу нуклеиновой кислоты, вирусный вектор, например, AAV вектор или rAAV, раскрытые здесь. В конкретных вариантах осуществления клетки-хозяева могут быть пригодными для размножения AAV.
[0077] Можно использовать широкий ряд клеток-хозяев, таких как клетки бактерий, дрожжей, насекомых, млекопитающих и т.д. В некоторых вариантах осуществления клетка-хозяин может представлять собой клетку (или клеточную линию), подходящую для продукции рекомбинантного AAV (rAAV), например, клетки HeLa, Cos-7, HEK293, A549, BHK, Vero, RD, HT-1080, ARPE-19 или MRC-5. В некоторых вариантах осуществления линия клеток-хозяев по настоящему изобретению представляет собой линию клеток HeLa (например, HeLa S3). В еще одном варианте осуществления линия клеток-хозяев по настоящему изобретению представляет собой линию клеток HEK293.
[0078] Молекулы рекомбинантных нуклеиновых кислот или векторы могут быть доставлены в культуру клеток-хозяев с использованием любого подходящего метода, известного в данной области. В некоторых вариантах осуществления создается стабильная линия клеток-хозяев, в геном которой встраивается рекомбинантная молекула нуклеиновой кислоты или вектор. В некоторых вариантах осуществления создается стабильная линия клеток-хозяев, которая содержит AAV вектор, описанный здесь. После трансфекции культуры хозяина AAV вектором интеграцию rAAV в геном хозяина можно тестировать различными методами, такими как селекция с антибиотиками, сортировка клеток с активированной флуоресценцией, саузерн-блоттинг, детектирование на основе ПЦР, флуоресцентная гибридизация in situ, как описано Nakai et al., Nature Genetics (2003) 34: 297-302; Philpott et al., Journal of Virology (2002) 76 (11): 5411-5421, и Howden et al., J. Gene Med. (2008) 10: 42-50. Кроме того, стабильная клеточная линия может быть создана в соответствии с протоколами, хорошо известными в данной области, такими как описаны в публикациях Clark, Kidney International Vol. 61 (2002): S9-S15 и Yuan et al., Human Gene Therapy (2011) 22 (5): 613-24.
Рекомбинантный AAV для генной терапии:
[0079] Аденоассоциированный вирус (AAV) относится к семейству Parvoviridae и роду Dependovirus. AAV представляет собой малый вирус без оболочки, содержащий линейный одноцепочечный ДНК-геном. Как смысловые, так и антисмысловые цепи ДНК AAV упаковываются в капсиды AAV с одинаковой частотой.
[0080] Геном AAV характеризуется двумя инвертированными концевыми повторами (ITR), которые фланкируют две открытые рамки считывания (ORF). Геном AAV2, например, первые 125 нуклеотидов ITR представляют собой палиндром, который укладывается сам для максимального спаривания оснований и образует Т-образную структуру шпильки. Другие 20 оснований ITR, называемые последовательностью D, остаются неспаренными. ITR представляют собой цис-действующие последовательности, важные для репликации ДНК AAV; ITR является ориджином репликации и служит праймером для синтеза второй цепи с участием ДНК-полимеразы. Двухцепочечная ДНК, образованная во время этого синтеза, которая называется реплицирующимся мономером, используется для второго раунда репликации по механизму самопраймирования и образует реплицирующийся димер. Данные двухцепочечные промежуточные продукты процессируются посредством механизма замещения цепи, в результате чего одноцепочечная ДНК используется для упаковки, и двухцепочечная ДНК используется для транскрипции. Внутри ITR располагаются связывающие Rep-элементы и сайт концевого разрешения (TRS). Такие характерные особенности используются вирусным регуляторным белком Rep во время репликации AAV для процессинга двухцепочечных промежуточных продуктов. В дополнение к их роли в репликации AAV, ITR также важен для упаковки генома AAV, транскрипции, негативной регуляции в непермиссивных условиях и сайт-специфической интеграции (Days and Berns, Clin. Microbiol. Rev. (2008) 21 (4): 583-593).
[0081] Левая ORF AAV содержит ген Rep, который кодирует четыре белка - Rep78, Rep68, Rep52 и Rep40. Правая ORF содержит ген Cap, который продуцирует три вирусных капсидных белка (VP1, VP2 и VP3). Капсид AAV содержит 60 вирусных капсидных белков, расположенных в икосаэдрической симметрии. VP1, VP2 и VP3 находятся в молярном соотношении 1:1:10 (Daya and Berns, Clin. Microbiol. Rev. (2008) 21 (4): 583-593).
[0082] В настоящее время AAV является одним из наиболее часто используемых вирусов для генной терапии. Несмотря на то, что AAV инфицирует людей и некоторых других видов приматов, неизвестно, что он вызывает заболевание, и он индуцирует очень слабый иммунный ответ. Векторы для генной терапии, в которых используется AAV, могут инфицировать как делящиеся, так и покоящиеся клетки и сохраняться во внехромосомном состоянии без интеграции в геном клетки-хозяина. За счет преимущественных свойств AAV настоящее раскрытие обеспечивает применение AAV для рекомбинантных молекул нуклеиновых кислот и способов, раскрытых здесь.
[0083] AAV обладает несколькими необходимыми характеристиками для генотерапевтического вектора, включая способность связываться и проникать в клетки-мишени, проникать в ядро, способность экспрессироваться в ядре в течение длительного периода времени и низкую токсичность. Однако небольшой размер генома AAV ограничивает размер гетерологичной ДНК, которая может быть включена. Для минимизации данной проблемы, были построены векторы на основе AAV, которые не кодируют Rep и элемент эффективности интеграции (IEE). ITR сохраняются, поскольку они представляют собой сигналы в цис-конфигурации, необходимые для упаковки (Daya and Berns, Clin. Microbiol. Rev. (2008) 21 (4): 583-593).
[0084] Способы получения rAAV, подходящего для генной терапии, хорошо известны в данной области (см., например, заявки на патент США №2012/0100606; 2012/0135515; 2011/0229971; и 2013/0072548; и публикацию Ghosh et al., Gene Ther. (2006) 13 (4): 321-329), и его можно использовать с рекомбинантными молекулами нуклеиновой кислоты и способами, описанными здесь.
[0085] В некоторых аспектах изобретение относится к применению rAAV, раскрытого здесь, для лечения болезни Вильсона (WD), где rAAV включает капсид AAV и упакованный в него векторный геном. В некоторых вариантах осуществления вектор содержит геном, включающий в качестве функционально связанных компонентов в направлении от 5' к 3': последовательность 5'-инвертированного концевого повтора (ITR), последовательность промотора, последовательность, кодирующую усеченную человеческую ATP7B (ATP7B Δ1-3-SS) (например, SEQ ID NO: 1 или SEQ ID NO: 15) и последовательность 3'-инвертированного концевого повтора (ITR). В типичном варианте осуществления векторный геном также содержит последовательность энхансера апстрим от последовательности промотора, интрон даунстрим от промотора и последовательность полиаденилирования апстрим от 3’-ITR. Таким образом, в еще одном примерном варианте осуществления векторный геном включает в качестве функционально связанных компонентов в направлении от 5' к 3': последовательность 5'-инвертированного концевого повтора (ITR), последовательность энхансера, последовательность промотора, последовательность интрона, последовательность, кодирующую усеченную человеческую ATP7B (ATP7B Δ1-3-SS) (например, SEQ ID NO: 1 или SEQ ID NO: 15), сигнальную последовательность полиаденилирования и последовательность 3'-инвертированного концевого повтора (ITR). В еще одном иллюстративном варианте осуществления геном вектора содержит в качестве функционально связанных компонентов в направлении от 5' к 3': последовательность 5'-ITR AAV2, энхансер enTTR, промотор TTR, малый Т-интрон SV40, последовательность, кодирующую усеченную человеческую ATP7B (ATP7B Δ1-3-SS) (например, SEQ ID NO: 1 или SEQ ID NO: 15), сигнальную последовательность полиаденилирования SV40 и 3'-ITR AAV2. В некоторых вариантах осуществления изобретения векторный геном дополнительно содержит консенсусную последовательность Козака, расположенную даунстрим от последовательности интрона. В некоторых вариантах осуществления капсид представляет собой капсид AAV9.
[0086] В некоторых аспектах изобретение относится к применению rAAV, раскрытого здесь, для лечения болезни Вильсона (WD), где rAAV включает капсид AAV и упакованный в него векторный геном. В некоторых вариантах осуществления изобретения векторный геном содержит в качестве функционально связанных компонентов в направлении от 5' к 3': последовательность 5'-инвертированного концевого повтора (ITR), последовательность промотора, последовательность, кодирующую усеченную человеческую ATP7B (ATP7B Δ1-3-SS) (например, SEQ ID NO: 1) и последовательность 3'-инвертированного концевого повтора (ITR). В типичном варианте осуществления векторный геном также содержит последовательность энхансера апстрим от последовательности промотора, интрон даунстрим от промотора и последовательность полиаденилирования апстрим от 3’-ITR. Таким образом, в еще одном примерном варианте осуществления вектор содержит геном, включающий в качестве функционально связанных компонентов в направлении от 5' к 3': последовательность 5'-инвертированного концевого повтора (ITR), последовательность энхансера, последовательность промотора, последовательность интрона, последовательность, кодирующую усеченную человеческую ATP7B (ATP7B Δ1-3-SS) (например, SEQ ID NO: 1), сигнальную последовательность полиаденилирования и последовательность 3'-инвертированного концевого повтора (ITR). В еще одном примерном варианте осуществления вектор содержит геном, включающий в качестве функционально связанных компонентов в направлении от 5' к 3': последовательность 5'-ITR AAV2, энхансер enTTR, промотор TTR, малый Т-интрон SV40, последовательность, кодирующую усеченную человеческую ATP7B (ATP7B Δ1-3-SS) (например, SEQ ID NO: 1), сигнальную последовательность полиаденилирования SV40 и 3'-ITR AAV2. В некоторых вариантах осуществления упакованный геном дополнительно содержит консенсусную последовательность Козака, расположенную даунстрим от последовательности интрона. В некоторых вариантах осуществления капсид представляет собой капсид AAV9.
[0087] В некоторых аспектах изобретение относится к применению rAAV, раскрытого здесь, для лечения болезни Вильсона (WD), где rAAV включает капсид AAV и упакованный векторный геном. В некоторых вариантах осуществления вектор содержит упакованный геном, включающий в качестве функционально связанных компонентов в направлении от 5' к 3': последовательность 5'-инвертированного концевого повтора (ITR), последовательность промотора, последовательность, кодирующую усеченную человеческую (ATP7B Δ1-3-SS) (например, SEQ ID NO: 15) и последовательность 3'-инвертированного концевого повтора (ITR). В типичном варианте осуществления упакованный геном также содержит последовательность энхансера апстрим от последовательности промотора, интрон даунстрим от промотора и последовательность полиаденилирования апстрим от 3’-ITR. Таким образом, в еще одном примерном варианте осуществления вектор содержит упакованный геном, содержащий в качестве функционально связанных компонентов в направлении от 5' к 3': последовательность 5'-инвертированного концевого повтора (ITR), последовательность энхансера, последовательность промотора, последовательность интрона, последовательность, кодирующую усеченную человеческую ATP7B (ATP7B Δ1-3-SS) (например, SEQ ID NO: 15), сигнальную последовательность полиаденилирования и последовательность 3'-инвертированного концевого повтора (ITR). В еще одном примерном варианте осуществления вектор содержит упакованный геном, содержащий в качестве функционально связанных компонентов в направлении от 5' к 3': последовательность 5'-ITR AAV2, энхансер enTTR, промотор TTR, малый Т-интрон SV40, последовательность, кодирующую усеченную человеческую ATP7B (ATP7B Δ1-3-SS) (например, SEQ ID NO: 15), сигнальную последовательности полиаденилирования SV40 и 3'-ITR AAV2. В некоторых вариантах осуществления упакованный геном дополнительно содержит консенсусную последовательность Козака, расположенную даунстрим от последовательности интрона. В некоторых вариантах осуществления капсид представляет собой капсид AAV9.
[0088] Иллюстративная схема, показывающая типичную упакованную векторную геномную конструкцию для экспрессии усеченной ATP7B, сохраняющую MBD 4, 5 и 6, представлена на фиг. 1. 5’-ITR представлен нуклеотидами 1-145; энхансер enTTR представлен нуклеотидами 146-245; промотор TTR представлен нуклеотидами 246-435; малый Т-интрон SV40 представлен нуклеотидами 436-530; консенсусная последовательность Козака представлена нуклеотидами 531-536; кодирующая последовательность усеченной ATP7B представлена нуклеотидами 540-4142; сигнальная последовательность полиаденилирования SV40 представлена нуклеотидами 4143-4340; и 3’-ITR представлен нуклеотидами 4341-4485.
[0089] В некоторых вариантах осуществления последовательность нуклеиновой кислоты, кодирующая ATP7B Δ1-3-SS, является нативной последовательностью человека (представленной SEQ ID NO: 1). Альтернативно, в некоторых вариантах осуществления последовательность нуклеиновой кислоты, кодирующая ATP7B Δ1-3-SS, представляет собой кодон-оптимизированную последовательность человека (представленную SEQ ID NO: 15).
Повышенная эффективность в лечении WD:
[0090] В некоторых вариантах осуществления усеченная человеческая ATP7B (ATP7B Δ1-3-SS), кодированная SEQ ID NO: 1 или SEQ ID NO: 15, описанные здесь, более эффективна, чем полноразмерные или другие усеченные формы ATP7B (например, ATP7B Δ1-4, SEQ ID NO: 13). В некоторых аспектах ATP7B Δ1-3-SS по настоящему изобретению локализуется в транс-сети Гольджи (TGN). В некоторых вариантах осуществления rAAV, содержащий последовательность нуклеиновой кислоты SEQ ID NO: 1, которая кодирует ATP7B Δ1-3-SS, после инъекции млекопитающему, у которого диагностировано нарушение метаболизма меди (например, болезнь Вильсона), снижает уровни меди в печени и моче млекопитающего.
Повышенный выход векторов AAV, содержащих усеченную ATP7B:
[0091] В одном аспекте, rAAV, содержащий последовательность нуклеиновой кислоты, кодирующую ATP7B Δ1-3-SS, упакованный в AAV8 или AAV9, описанные здесь, имеет выход продукта примерно в 1,1-10 раз (например, примерно в 1,1 раза, примерно в 1,2 раза, примерно в 1,3 раза, примерно в 1,4 раза, примерно в 1,5 раза, примерно в 1,6 раза, примерно в 1,7 раза, примерно в 1,8 раза, примерно в 1,9 раза, примерно в 2 раза, примерно в 3 раза, примерно в 4 раза, примерно в 5 раз, примерно в 6 раз, примерно в 7 раз, примерно в 8 раз, примерно в 9 раз или примерно в 10 раз) выше, чем выход полноразмерной ATP7B или ATP7B Δ1-4.
Повышенный выход вектора AAV, содержащего капсид AAV9:
[0092] В одном аспекте, rAAV, содержащий капсид AAV9, имеет повышение выхода в титрах примерно в 1,1-10 раз (например, примерно в 1,1 раза, примерно в 1,2 раза, примерно в 1,3 раза, примерно 1,4 раза, примерно в 1,5 раза, примерно в 1,6 раза, примерно в 1,7 раза, примерно в 1,8 раза, примерно в 1,9 раза, примерно в 2 раза, примерно в 3 раза, примерно в 4 раза, примерно в 5 раз, примерно в 6 раз, примерно в 7 раз, примерно в 8 раз, примерно в 9 раз или примерно в 10 раз по сравнению с rAAV, содержащим капсид AAV8.
Фармацевтические композиции:
[0093] Настоящее изобретение относится к композиции, содержащей rAAV, раскрытый здесь, и фармацевтически приемлемый носитель. Подходящие фармацевтические композиции для введения rAAV можно найти, например, в публикации заявки на патент США №2012/0219528. Фармацевтически приемлемые носители (эксципиенты), используемые в настоящем изобретении, являются общепринятыми. В монографии Remington's Pharmaceutical Sciences, E.W. Martin, Mack Publishing Co., Easton, PA, 15-е издание (1975) описаны композиции и составы, подходящие для фармацевтической доставки одного или более терапевтических соединений, молекул или средств.
[0094] Как подчеркнуто в предыдущем абзаце, изобретение в некоторых аспектах относится к фармацевтическим композициям, содержащим rAAV по настоящему изобретению. В некоторых вариантах осуществления фармацевтическая композиция содержит фармацевтически приемлемый носитель или эксципиент. В некоторых вариантах осуществления фармацевтическая композиция формулирована для подкожного, внутримышечного, внутрикожного, внутрибрюшинного или внутривенного введения. В примерном варианте осуществления фармацевтическая композиция формулирована для внутривенного введения.
[0095] В некоторых вариантах осуществления изобретения rAAV фоормулирован в буфере/носителе, подходящем для инфузии людям. Буфер/носитель должен включать компонент, который предотвращает прилипание rAAV к инфузионной трубке, но не влияет на активность связывания rAAV in vivo. Различные подходящие растворы могут включать одно или более из следующего: забуференный солевой раствор, поверхностно-активное вещество и физиологически совместимую соль или смесь солей, с доведенной ионной силой, эквивалентной примерно от 100 мМ хлорида натрия (NaCl) до примерно 250 мМ NaCl, или физиологически совместимой соли с доведением до эквивалентной ионной концентрации. Значение pH может находиться в диапазоне от 6,5 до 8,5, или от 7 до 8,5, или от 7,5 до 8. Подходящее поверхностно-активное вещество или комбинация поверхностно-активных веществ могут быть выбраны из полоксамеров, т.е. неионогенных трехблочных сополимеров, состоящих из центральной гидрофобной цепи полиоксипропилена 10 (поли(пропиленоксида)), фланкированной двумя гидрофильными цепями полиоксиэтилена (поли(этиленоксида)), SOLUTOL HS 15 (макрогол-15 гидроксистеарат), LABRASOL (капроилполиоксилглицерида), полиоксиэтилен (10) олеилового эфира, Твина (сложные эфиры полиоксиэтиленсорбитана и жирных кислот), этанола и полиэтиленгликоля.
Способы лечения болезни Вильсона:
[0096] В еще одном аспекте изобретение относится к способам лечения WD у человека, включающим введение человеку терапевтически эффективного количества rAAV, включающего SEQ ID NO: 1 или SEQ ID NO: 15, для кодирования усеченной ATP7B (ATP7B Δ1-3-SS), раскрытой здесь.
[0097] В одном варианте осуществления изобретение относится к способу лечения WD, включающему введение rAAV, который включает капсид AAV и упакованный векторный геном, где векторный геном содержит последовательность, кодирующую усеченную человеческую ATP7B (ATP7B Δ1-3-SS) (например, SEQ ID NO: 1 или SEQ ID NO: 15).
[0098] В еще одном аспекте изобретение относится к способам лечения WD у человека, включающим введение человеку, у которого диагностирована, по меньшей мере, одна мутация в ATP7B, терапевтически эффективного количества, по меньшей мере, одного rAAV, содержащего векторный геном, включающий последовательность, кодирующую усеченную человеческую ATP7B (ATP7B Δ1-3-SS) (например, SEQ ID NO: 1 или SEQ ID NO: 15). В одном варианте осуществления изобретение относится к способу лечения WD у человека, у которого диагностирована, по меньшей мере, одна мутация в ATP7B, включающему введение rAAV, который включает капсид AAV и упакованный векторный геном, где векторный геном содержит последовательность, кодирующую усеченную человеческую ATP7B (ATP7B Δ1-3-SS) (например, SEQ ID NO: 1 или SEQ ID NO: 15). Кодирующая последовательность, показанная в SEQ ID NO: 1, кодирует усеченную ATP7B, показанную в SEQ ID NO: 8. В некоторых вариантах осуществления капсид представляет собой капсид AAV9.
[0099] В еще одном аспекте изобретение относится к способам лечения WD у человека, включающим введение человеку, у которого диагностирована, по меньшей мере, одна мутация в ATP7B, терапевтически эффективного количества, по меньшей мере, одного rAAV, содержащего векторный геном, включающий последовательность, кодирующую усеченную человеческую ATP7B (ATP7B Δ1-3-SS) (например, SEQ ID NO: 1). В одном варианте осуществления изобретение относится к способу лечения WD у человека, у которого диагностирована, по меньшей мере, одна мутация в ATP7B, включающему введение rAAV, который содержит капсид AAV и упакованный векторный геном, где векторный геном содержит последовательность, кодирующую усеченную человеческую ATP7B (ATP7B Δ1-3-SS) (например, SEQ ID NO: 1). Кодирующая последовательность, показанная в SEQ ID NO: 1, кодирует усеченную ATP7B, показанную в SEQ ID NO: 8. В некоторых вариантах осуществления капсид представляет собой капсид AAV9.
[00100] В еще одном аспекте изобретение относится к способам лечения WD у человека, включающим введение человеку, у которого диагностирована, по меньшей мере, одна мутация в ATP7B, терапевтически эффективного количества, по меньшей мере, одного rAAV, содержащего векторный геном, содержащий последовательность, кодирующую усеченную человеческую ATP7B (ATP7B Δ1-3-SS) (например, SEQ ID NO: 15). В одном варианте осуществления изобретение относится к способу лечения WD у человека, у которого диагностирована, по меньшей мере, одна мутация в ATP7B, включающему введение rAAV, который содержит капсид AAV и упакованный векторный геном, где векторный геном содержит последовательность, кодирующую усеченную человеческую ATP7B (ATP7B Δ1-3-SS) (например, SEQ ID NO: 15). В некоторых вариантах осуществления капсид представляет собой капсид AAV9.
[00101] Любой подходящий способ или путь можно использовать для введения rAAV или композиции, содержащей rAAV, описанной здесь. Пути введения включают, например, системный, пероральный, ингаляционный, интраназальный, интратрахеальный, внутриартериальный, внутриглазной, внутривенный, внутримышечный, подкожный, внутрикожный и другие парентеральные пути введения. В некоторых вариантах осуществления rAAV или композицию, содержащую rAAV, вводят внутривенно.
[00102] Конкретная вводимая доза может быть одинаковой дозой для каждого пациента, например, 1,0×1011-1,0×1014 вирусных геномов на килограмм массы тела пациента (вг/кг). В качестве альтернативы дозу пациента можно адаптировать к примерной массе тела или площади поверхности тела пациента. Другие факторы при определении подходящей дозировки могут включать заболевание или патологическое состояние, которое необходимо лечить или профилактировать, тяжесть заболевания, способ введения, а также возраст, пол и состояние здоровья пациента. Дальнейшее уточнение расчетов, необходимых для определения подходящей дозы для лечения, обычно выполняется специалистами в данной области техники, особенно в свете информации о дозировке и анализов, раскрытых здесь. Дозу также можно определить с использованием известных тестов для определения используемых доз в сочетании с соответствующими данными по зависимости доза-эффект. Дозу для индивидуального пациента также можно корректировать по мере наблюдения за прогрессированием болезни.
[00103] В некоторых вариантах осуществления изобретения rAAV вводят в дозе, например, примерно от 1×1014 вг/кг до примерно 5×1014 вг/кг, или примерно от 5×1011 вг/кг до примерно 5×1013 вг/кг, как определено с помощью количественной ПЦР или цифровой капельной ПЦР (ddPCR). В некоторых вариантах осуществления rAAV вводят в дозе примерно 2×1012 вг/кг. В некоторых вариантах осуществления rAAV вводят в дозе примерно 5×1012 вг/кг. В некоторых вариантах осуществления rAAV вводят в дозе примерно 6×1012 вг/кг. В некоторых вариантах осуществления rAAV вводят в дозе примерно 1×1013 вг/кг. В некоторых вариантах осуществления rAAV вводят в дозе примерно 7×1013 вг/кг. rAAV можно вводить в одной дозе или в многочисленных дозах (например, 2, 3, 4, 5, 6, 7, 8, 9, 10 или более дозах), если это необходимо для получения желаемых терапевтических результатов. В некоторых примерных вариантах осуществления вводится только разовая доза конкретного rAAV.
[00104] По тексту описания, где композиции описаны как имеющие, включающие или содержащие определенные компоненты, или где процессы и способы описаны как имеющие, включающие или содержащие конкретные стадии, полагается, что, кроме того, существуют композиции по настоящему изобретению, которые по существу состоят или состоят из указанных компонентов, и что существуют процессы и способы в соответствии с настоящим изобретением, которые по существу состоят или состоят из указанных стадий обработки.
[00105] В заявке, где говорится, что элемент или компонент включен и/или выбран из списка указанных элементов или компонентов, следует понимать, что элемент или компонент может быть любым из указанных элементов или компонентов, или элемент или компонент могут быть выбраны из группы, состоящей из двух или более указанных элементов или компонентов.
[00106] Кроме того, следует понимать, что элементы и/или признаки композиции или способа, описанные здесь, можно объединить с множеством способов, не отступая от сущности и объема настоящего изобретения, явного или подразумеваемого в данном документе. Например, когда делается ссылка на конкретное соединение, то это соединение можно использовать в различных вариантах осуществления композиций по настоящему изобретению и/или в способах по настоящему изобретению, если иное не следует из контекста. Другими словами, в рамках настоящей заявки варианты осуществления были описаны и показаны таким образом, чтобы можно было ясно и кратко описать и показать заявку, но полагается и будет принято во внимание, что варианты осуществления можно по-разному объединить или разделить, не отступая от предмета настоящего изобретения. Например, будет принято во внимание, что все признаки, описанные и показанные здесь, могут быть применимы ко всем аспектам изобретения, описанного и показанного в данном документе.
[00107] Следует понимать, что выражение «по меньшей мере, один из» включает в себя индивидуально каждый из перечисленных объектов после выражения и различные комбинации двух или более из перечисленных объектов, если иное не следует из контекста и применения. Следует понимать, что выражение «и/или» в связи с тремя или более перечисленными объектами имеет то же значение, если иное не следует из контекста.
[00108] Использование термина «включать», «включает», «включающий», «иметь», «имеет», «имеющий», «содержать», «содержит» или «содержащий», включая их грамматические эквиваленты, в целом следует понимать как открытый для включения и неограничивающий, например, не исключающий дополнительных неуказанных элементов или стадий, если иное специально не указано или не следует из контекста.
[00109] Если термин «примерно» используется перед количественным значением, то настоящее изобретение также включает само конкретное количественное значение, если специально не указано иное. В рамках настоящего изобретения, термин «примерно» относится к отклонению ± 10% от номинального значения, если иное не указано или не предполагается.
[00110] Следует понимать, что порядок стадий или порядок выполнения определенных действий не имеет значения, при условии, что настоящее изобретение остается операбельным. Более того, две или более стадии или действия могут выполняться одновременно.
[00111] Использование любых и всех примеров или примерных формулировок в данном документе, например, «такой как» или «включая», предназначено просто для лучшей иллюстрации настоящего изобретения и не накладывает ограничений на объем изобретения, если не заявлено. Никакие формулировки в описании не следует истолковывать как указывающие на какой-либо незаявленный элемент как существенный для практического применения настоящего изобретения.
Примеры
[00112] Изобретение, которое было описано в общем, будет легче понять, обратившись к нижеследующим примерам, которые включены только в целях иллюстрации определенных аспектов и вариантов осуществления настоящего изобретения и не предназначены для ограничения изобретения.
Пример 1 - векторы AAV и rAAV, полученный из векторов
Вектор AAV
[00113] В данном примере описано конструирование AAV вектора с последовательностью нуклеиновой кислоты, показанной в SEQ ID NO: 1, связанной двумя инвертированными концевыми повторами AAV2 (ITR, SEQ ID NO: 2). SEQ ID NO: 1 представляет собой кДНК нативной человеческой ATP7B, в которой делецированы MBD 1-3. Нуклеотиды 223-225 в SEQ ID NO: 1 кодируют остаток серина S340 и нуклеотиды 226-228 в SEQ ID NO: 1 кодируют остаток серина S341 (нумерация основана на последовательности полноразмерного белка ATP7B дикого типа).
[00114] Как показано на фиг. 1, в AAV векторе экспрессионная кассета ATP7B содержит энхансер (EnTTR), промотор (TTR), интрон (малый Т-интрон SV40), нуклеотидную последовательность SEQ ID NO: 1, которая кодирует усеченную человеческую ATP7B (ATP7B Δ1-3-SS) и сигнал поли(A) SV40. Круговая карта вектора, показывающая различные компоненты, приведена на фиг. 2.
[00115] Вектор AAV DTC319 содержит последовательность усеченной человеческой ATP7B, в которой сохранены металл-связывающие домены 4, 5 и 6. Усеченная последовательность человеческой ATP7B кодирует белок, который содержит два сериновых остатка S340 и S341 (нумерованных в соответствии с референсной последовательностью NCBI: NP_000044.2), показанной в SEQ ID NO: 8.
[00116] Сигнал позднего полиаденилирования обезьяньего вируса 40 (SV40) (идентификационный номер в Genbank J02400 (SEQ ID NO: 7)) обеспечивает последовательность в цис-конфигурации для эффективного полиаденилирования мРНК ATP7B. Данный элемент функционирует в качестве сигнала для определенного события расщепления в 3'-конце зарождающегося транскрипта и добавления длинного полиаденильного хвоста.
[00117] Каждую экспрессионную кассету усеченной ATP7B клонировали в AAV вектор. Все AAV векторы имели остов, кодирующий ген устойчивости к канамицину. Примерный вектор DTC319 AAV показан на фиг. 2. На фиг. 1 представлена экспрессионная кассета DTC319 для экспрессии ATP7B (ATP7B Δ1-3-SS).
rAAV вирионы
[00118] Геном вектора AAV представляет собой геном на основе одноцепочечной ДНК. Только последовательности между последовательностями ITR и включительно упакованы в вирион AAV. Вирионы получали трансфекцией трех плазмид в клетки эмбриональной почки человека 293 (HEK293), которые обеспечивали продукты генов E1a и E1b. Первая плазмида может представлять собой AAV вектор, описанный здесь. Вторая плазмида может быть упаковывающей плазмидой, содержащей гены rep AAV2 и гены cap AAV8 или AAV9 дикого типа. Третья плазмида представляет собой хелперную аденовирусную плазмиду.
[00119] Иллюстрация типичной упаковывающей плазмиды, плазмиды pAAV2/8.KanR (p2123FH), показана на фиг. 3. В данной плазмиде аденоассоциированная Rep/Cap плазмида pAAV2/8.KanR (p2123FH) (8354 п.н.) кодирует четыре репликационных белка вируса AAV2 (Rep) дикого типа и три капсидных белка (cap) VP AAV дикого типа серотипа 8. Внутри плазмиды промотор AAV p5, который обычно регулирует экспрессию гена Rep, был перемещен с 5'-конца области Rep в 3'-конец области cap AAV8. Такое расположение вводит спейсер между промотором и геном Rep (т.е. остов плазмиды), что приводит к отрицательной регуляции экспрессии Rep и повышению способности поддерживать продукцию rAAV с высоким титром. Ген устойчивости к канамицину и ориджин MB1 включены для продуцирования плазмиды в E. coli.
[00120] Иллюстрация примерной хелперной плазмиды pAdDeltaF6 (Kan) приведена на фиг. 4. В данной плазмиде обеспечены области аденовирусного генома, которые важны для репликации AAV, а именно E2A, E4 и VA РНК. Функции аденовирусной E1 также необходимы, но они обеспечиваются клетками-хозяевами HEK293. Плазмида, показанная на фиг. 4, не содержит других репликационных, структурных генов, аденовируса или цис-элементов, критических для репликации аденовируса, таких как ITR аденовируса, и, следовательно, не ожидается образования инфекционного аденовируса. Ген устойчивости к канамицину и ориджин MB1 включены для продуцирования плазмиды в E. coli.
Пример 2 - Делеция металл-связывающих доменов (MBD) 1-3 в человеческой ATP7B повышает выход продукта
[00121] В данном примере описаны эксперименты, результаты которых показали, что ATP7B Δ1-3-SS имела более высокий выход, чем полноразмерная ATP7B или усеченная форма ATP7B Δ1-4.
[00122] Недостаток функциональной ATP7B приводит к накоплению меди в печени и других тканях, что проявляется в виде поражения печени с неврологическими или психиатрическими симптомами. WD можно лечить, уменьшая всасывание меди или удаляя избыточное количество меди из организма. Мыши C3He-Atp7btx-j не экспрессируют функциональный Atp7b и, таким образом, служат мышиной моделью WD. Векторы AAV, содержащие кодон-оптимизированную полноразмерную последовательность ATP7B человека, использовали для трансфекции клеток HEK293 плазмидой Rep/Cap, которая кодирует четыре репликационных белка вируса AAV2 (Rep) дикого типа и три капсидных белка VP AAV дикого типа (cap) серотипа 8 и хелперной плазмидой с получением вирусных частиц ATP7BcoFL.
[00123] Самцам мышей C3He-Atp7btx-j внутривенно (в/в) вводили 1010 или 1011 гк/кг ATP7BcoFL (полноразмерная человеческая ATP7B, которая была кодон-оптимизирована). Самкам мышей C3He-Atp7btx-j вводили внутривенно 109, 1010 или 1011 гк/кг того же вектора. Концентрацию меди в печени самцов (обозначены квадратами) и самок (обозначены кружками) определяли с использованием масс-спектрометрии с индуктивно связанной плазмой (ICP-MS) и сравнивали с уровнями меди у гетерозиготных самцов и самок того же возраста (Het) и мышей C3He-Atp7btx-j, которым не проводили введение. Мышей вскрывали примерно в возрасте 9 месяцев и отбирали образцы печени. Данные представлены на фиг. 5.
[00124] Генную терапию с использованием векторов AAV можно использовать для лечения WD. Однако существует ограничение в отношении размера кДНК, которая может быть упакована внутри капсида вектора AAV. Геном AAV дикого типа составляет 4,7 т.п.н., и упаковка более крупных геномов может потенциально снизить выход и целостность последовательности ДНК, инкапсулированной в капсид AAV. Следовательно, нуклеотидная последовательность, кодирующая ATP7B Δ1-3-SS, была упакована в капсид AAV8, и тестировали выход продукции ATP7B Δ1-3-SS. Векторы AAV, кодирующие полноразмерную человеческую (FL) ATP7B или человеческую ATP7B, в которой были делецированы MBD 1-3, но присутствовала серин-богатая петля, включающая два остатка серина (S340 и S341) между MBD3 и MBD4 (ATP7B Δ1-3-SS), или человеческую ATP7B, в которой были делецированы MBD 1-4 (ATP7B Δ1-4), трансфектировали в клетки HEK293. Плазмиду Rep/Cap, которая кодирует четыре репликационных белка вируса AAV2 (Rep) дикого типа и три капсидных (cap) белка AAV VP дикого типа из серотипа 8, и хелперную плазмиду котрансфектировали с векторами AAV, экспрессирующими различные белки ATP7B. На фиг. 6 представлен столбчатый график, показывающий титры rAAV, продуцированного клетками-хозяевами после трансфекции различными векторами AAV. На оси Y представлен общий выход в титрах каждого rAAV в геномных копиях (гк). Данные показывают, что ATP7B Δ1-3-SS имел более высокий выход, чем полноразмерная или усеченная форма ATP7B Δ1-4.
Пример 3 - ATP7B Δ1-3-SS более эффективна в восстановлении метаболизма меди по сравнению с ATP7B FL
[00125] В данном примере описан эксперимент, результаты которого показали, что ATP7B Δ1-3-SS была более эффективной, чем полноразмерная ATP7B (ATP7B FL) или ATP7B Δ1-4, в восстановлении метаболизма меди у мышей C3He-Atp7btx-j.
[00126] Как описано выше в примере 2, упаковка объемной последовательности кДНК внутри капсида вектора AAV может снизить целостность последовательности ДНК и иметь потенциальные проблемы с качеством продукта. Таким образом, усеченные варианты человеческой ATP7B были упакованы в капсид AAV8, и была проверена их эффективность в восстановлении метаболизма меди. 1×1013 гк/кг вектора AAV8, включающего полноразмерную или усеченную человеческую ATP7B, вводили мышам C3He-Atp7btx-j. Концентрации меди в печени и моче определяли масс-спектрометрией с индуктивно связанной плазмой. На фиг. 7 представлена точечная диаграмма концентрации меди в моче и печени, квадраты и кружки, соответственно (мкг/г), определенные после введения мышам C3He-Atp7btx-j AAV8, несущего полноразмерную человеческую ATP7B (ATP7B FL), ATP7B Δ1-3-SS или ATP7B Δ1-4. На фиг. 7 показано, что ATP7B Δ1-3-SS более эффективна, чем полноразмерная ATP7B (ATP7B FL) или ATP7B Δ1-4, в восстановлении метаболизма меди у мышей C3He-Atp7btx-j. Фосфатно-солевой буфер (PBS), который вводили мышей C3He-Atp7btx-j, служил в качестве контроля (носитель).
Пример 4 - Вектор AAV, содержащий капсид AAV9, показал более высокую вирусную продукцию
[00127] В данном примере описывается эксперимент, результаты которого показали, что получение AAV вектора, содержащего капсид AAV9, дает более высокий выход по сравнению с продукцией вектора AAV, содержащего капсид AAV8. Различные AAV векторы титровали с использованием кПЦР, определяя количество устойчивых к ДНКазе частиц (DRP). На фиг. 8 показан общий выход rAAV (титры в геномных копиях (гк)), полученных из клеток-хозяев после трансфекции вектором AAV (DTC319), который кодирует усеченную человеческую ATP7B, в которой делецированы металл-связывающие домены (MBD) 1-3, но присутствует серин-богатая петля, включающая два остатка серина (S340 и S341) между MBD3 и MBD4, котрансфектированных плазмидой, кодирующей либо капсид AAV8, либо капсид AAV9.
Пример 5 - Терапевтические свойства ATP7B Δ1-3-SS
[00128] В данном примере описаны исследования на животных, результаты которых показали эффективность ATP7B Δ1-3-SS (например, DTC319, вектора rAAV, который кодирует усеченную человеческую ATP7B, в которой делецированы металл-связывающие домены (MBD) 1-3, но присутствует серин-богатая петля, включающая два остатка серина (S340 и S341) между MBD3 и MBD4, в ослаблении симптомов и лечении болезни Вильсона (WD) на мышиной модели (C3He-Atp7btx-j). В данном примере исследования проводили на трех группах мышей-самцов: мыши WD (мыши C3He-Atp7btx-j), которым внутривенно вводили AAV ATP7B Δ1-3-SS (например, DTC319), кодированную в векторе AAV8, или внутривенно вводили контрольный носитель (буфер для разведения) и мыши дикого типа (WT), которые служили отрицательным контролем. Для инфузии rAAV получали тройной транзиентной трансфекцией прикрепившихся клеток HEK и очищали ультрацентрифугированием в градиенте хлорида цезия, методом очистки, хорошо известным в данной области. В конечной точке исследования, через 4 недели после инфузии, у мышей из каждой группы определяли накопление меди в печени, активность церулоплазмина и оценивали патологию в печени.
[00129] Накопление меди в печени измеряли масс-спектрометрией с индуктивно связанной плазмой (ICP-MS) и было показано, что концентрация меди в печени была достоверно ниже у мышей WD, которым вводили ATP7B Δ1-3-SS (например, DTC319) (см. фиг. 9, столбец для DelA) по сравнению с носителем. На фиг. 9 показаны уровн накопления меди в печени (вг/г) у мышей C3He-Atp7btx-j после внутривенного введения контрольного носителя (буфера для разведения, столбец для WD) или введения AAV8, несущего нативную ATP7B Δ1-3-SS (столбец для DelA). Уровни накопления меди в печени у мышей дикого типа (WT) без введения, представленные на столбчатом графике, служили отрицательным контролем. Значения выражены в виде среднего значения ± SEM.
[00130] Активность церулоплазмина была достоверно выше у мышей WD после введения ATP7B Δ1-3-SS (например, DTC319) (см. фиг. 10, столбец для DelA). Активность церулоплазмина определяли с использованием колориметрического анализа активности на основе ферментативной реакции, хорошо известного в данной области (см. Schosinsky et. al., Clin Chem., 1974; 20 (12): 1556-63). На фиг. 10 показана активность церулоплазмина у мышей C3He-Atp7btx-j после внутривенного введения контрольного носителя (буфер для разведения, столбец для WD) или введения AAV ATP7B Δ1-3-SS, кодированной в векторе AAV8 (столбец для DelA), как измерено с помощью колориметрического анализа активности на основе ферментативной реакции. Активность церулоплазмина у мышей дикого типа (WT), которым не проводили введение, измеренная с помощью того же колориметрического анализа активности на основе ферментативной реакции, также представлена на столбчатом графике. График показывает активность церулоплазмина, измеренную по оптической плотности, OD, при 540 нм. Значения выражены в виде среднего значения ± SEM.
[00131] Печень отбирали у всех животных их каждой группы и окрашивали H&E (окраска гематоксилином и эозином). Микроскопические препараты, окрашенные H&E, были исследованы аттестованным патологоанатомом на предмет увеличения ядер и гепатоцеллюлярной гипертрофии, дезорганизации, воспалительного инфильтрата и гепатоцеллюлярного некроза по системе баллов от 0 до 4. Баллы для каждой мыши в группе усредняли. На фиг. 11 показан средний балл, полученный после стандартной оценки микроскопических препаратов, окрашенных H&E, для животных в каждой группе.
Пример 6 - Генная терапия AAV9 в качестве эффективной терапии болезни Вильсона (WD)
[00132] В данном примере описано использование частиц rAAV, содержащих ATP7B Δ1-3-SS, в лечении WD у субъекта. Вектор AAV, содержащий нуклеотидную последовательность, кодирующую усеченную человеческую ATP7B (ATP7B Δ1-3-SS), например, DTC319 (фиг. 2), плазмиду Rep/Cap, которая кодирует четыре репликационных белка вируса AAV2 дикого типа (Rep), и три капсидных (cap) белка VP AAV дикого типа из серотипа 9 (AAV9) и хелперную плазмиду, описанную в примере 1, котрансфектировали в клетку-хозяин. Собранные частицы rAAV затем вводят внутривенно субъекту, нуждающемуся в терапии WD. Альтернативно субъекту вводят частицы rAAV, которые собирают из клетки-хозяина, трансфектированной вектором, представленным на фиг. 12, для лечения WD.
Включение ссылок
[00133] Полное раскрытие каждого из патентных документов и научных статей, упомянутых в данном документе, включено здесь посредством ссылки для всех целей.
Эквивалентные варианты
[00134] Раскрытие может быть осуществлено в других конкретных формах без отступления от его сущности или основных характеристик. Следовательно, вышеизложенные варианты осуществления следует рассматривать во всех отношениях как иллюстративные, а не ограничивающие изобретение, описанное в данном документе. Различные структурные элементы различных вариантов осуществления и различные раскрытые стадии способа можно использовать в различных комбинациях и перестановках, и все такие варианты следует рассматривать как формы раскрытия. Объем изобретения, таким образом, указывается прилагаемой формулой изобретения, а не предшествующим описанием, и все изменения, которые подпадают под значение и диапазон эквивалентности формулы изобретения, предназначены для включения в нее.
--->
Список последовательностей
<110> ULTRAGENYX PHARMACEUTICAL INC.
<120> ГЕНОТЕРАПЕВТИЧЕСКИЕ КОНСТРУКЦИИ ДЛЯ ЛЕЧЕНИЯ БОЛЕЗНИ ВИЛЬСОНА
<130> ULP-003WO
<140> PCT/US20/12131
<141> 2020-01-03
<150> 62/788,324
<151> 2019-01-04
<150> 62/834,830
<151> 2019-04-16
<160> 15
<170> PatentIn version 3.5
<210> 1
<211> 3603
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Del 1-3 ATP7B,
нативная
<220>
<221> misc_feature
<222> (223)..(225)
<223> Нуклеотиды 223-225 кодируют остаток серина S340 (нумерация
основана на
последовательности белка дикого типа)
<220>
<221> misc_feature
<222> (226)..(228)
<223> Нуклеотиды 226-228 кодируют остаток серина S341 (нумерация
основана на
последовательности белка дикого типа)
<400> 1
atgcctgagc aggagagaca gatcacagcc agagaagggg ccagtcggaa aatcttatct
60
aagctttctt tgcctacccg tgcctgggaa ccagcaatga agaagagttt tgcttttgac
120
aatgttggct atgaaggtgg tctggatggc ctgggccctt cttctcaggt ggccaccagc
180
acagtcaggg atggagccga agggagtggg acagatcaca ggtcttccag ttctcattcc
240
cctggctccc caccgagaaa ccaggtccag ggcacatgca gtaccactct gattgccatt
300
gccggcatga cctgtgcatc ctgtgtccat tccattgaag gcatgatctc ccaactggaa
360
ggggtgcagc aaatatcggt gtctttggcc gaagggactg caacagttct ttataatccc
420
tctgtaatta gcccagaaga actcagagct gctatagaag acatgggatt tgaggcttca
480
gtcgtttctg aaagctgttc tactaaccct cttggaaacc acagtgctgg gaattccatg
540
gtgcaaacta cagatggtac acctacatct gtgcaggaag tggctcccca cactgggagg
600
ctccctgcaa accatgcccc ggacatcttg gcaaagtccc cacaatcaac cagagcagtg
660
gcaccgcaga agtgcttctt acagatcaaa ggcatgacct gtgcatcctg tgtgtctaac
720
atagaaagga atctgcagaa agaagctggt gttctctccg tgttggttgc cttgatggca
780
ggaaaggcag agatcaagta tgacccagag gtcatccagc ccctcgagat agctcagttc
840
atccaggacc tgggttttga ggcagcagtc atggaggact acgcaggctc cgatggcaac
900
attgagctga caatcacagg gatgacctgc gcgtcctgtg tccacaacat agagtccaaa
960
ctcacgagga caaatggcat cacttatgcc tccgttgccc ttgccaccag caaagccctt
1020
gttaagtttg acccggaaat tatcggtcca cgggatatta tcaaaattat tgaggaaatt
1080
ggctttcatg cttccctggc ccagagaaac cccaacgctc atcacttgga ccacaagatg
1140
gaaataaagc agtggaagaa gtctttcctg tgcagcctgg tgtttggcat ccctgtcatg
1200
gccttaatga tctatatgct gatacccagc aacgagcccc accagtccat ggtcctggac
1260
cacaacatca ttccaggact gtccattcta aatctcatct tctttatctt gtgtaccttt
1320
gtccagctcc tcggtgggtg gtacttctac gttcaggcct acaaatctct gagacacagg
1380
tcagccaaca tggacgtgct catcgtcctg gccacaagca ttgcttatgt ttattctctg
1440
gtcatcctgg tggttgctgt ggctgagaag gcggagagga gccctgtgac attcttcgac
1500
acgcccccca tgctctttgt gttcattgcc ctgggccggt ggctggaaca cttggcaaag
1560
agcaaaacct cagaagccct ggctaaactc atgtctctcc aagccacaga agccaccgtt
1620
gtgacccttg gtgaggacaa tttaatcatc agggaggagc aagtccccat ggagctggtg
1680
cagcggggcg atatcgtcaa ggtggtccct gggggaaagt ttccagtgga tgggaaagtc
1740
ctggaaggca ataccatggc tgatgagtcc ctcatcacag gagaagccat gccagtcact
1800
aagaaacccg gaagcactgt aattgcgggg tctataaatg cacatggctc tgtgctcatt
1860
aaagctaccc acgtgggcaa tgacaccact ttggctcaga ttgtgaaact ggtggaagag
1920
gctcagatgt caaaggcacc cattcagcag ctggctgacc ggtttagtgg atattttgtc
1980
ccatttatca tcatcatgtc aactttgacg ttggtggtat ggattgtaat cggttttatc
2040
gattttggtg ttgttcagag atactttcct aaccccaaca agcacatctc ccagacagag
2100
gtgatcatcc ggtttgcttt ccagacgtcc atcacggtgc tgtgcattgc ctgcccctgc
2160
tccctggggc tggccacgcc cacggctgtc atggtgggca ccggggtggc cgcgcagaac
2220
ggcatcctca tcaagggagg caagcccctg gagatggcgc acaagataaa gactgtgatg
2280
tttgacaaga ctggcaccat tacccatggc gtccccaggg tcatgcgggt gctcctgctg
2340
ggggatgtgg ccacactgcc cctcaggaag gttctggctg tggtggggac tgcggaggcc
2400
agcagtgaac accccttggg cgtggcagtc accaaatact gtaaagagga acttggaaca
2460
gagaccttgg gatactgcac ggacttccag gcagtgccag gctgtggaat tgggtgcaaa
2520
gtcagcaacg tggaaggcat cctggcccac agtgagcgcc ctttgagtgc accggccagt
2580
cacctgaatg aggctggcag ccttcccgca gaaaaagatg cagtccccca gaccttctct
2640
gtgctgattg gaaaccgtga gtggctgagg cgcaacggtt taaccatttc tagcgatgtc
2700
agtgacgcta tgacagacca cgagatgaaa ggacagacag ccatcctggt ggctattgac
2760
ggtgtgctct gtgggatgat cgcaatcgca gacgctgtca agcaggaggc tgccctggct
2820
gtgcacacgc tgcagagcat gggtgtggac gtggttctga tcacggggga caaccggaag
2880
acagccagag ctattgccac ccaggttggc atcaacaaag tctttgcaga ggtgctgcct
2940
tcgcacaagg tggccaaggt ccaggagctc cagaataaag ggaagaaagt cgccatggtg
3000
ggggatgggg tcaatgactc cccggccttg gcccaggcag acatgggtgt ggccattggc
3060
accggcacgg atgtggccat cgaggcagcc gacgtcgtcc ttatcagaaa tgatttgctg
3120
gatgtggtgg ctagcattca cctttccaag aggactgtcc gaaggatacg catcaacctg
3180
gtcctggcac tgatttataa cctggttggg atacccattg cagcaggtgt cttcatgccc
3240
atcggcattg tgctgcagcc ctggatgggc tcagcggcca tggcagcctc ctctgtgtct
3300
gtggtgctct catccctgca gctcaagtgc tataagaagc ctgacctgga gaggtatgag
3360
gcacaggcgc atggccacat gaagcccctg acggcatccc aggtcagtgt gcacataggc
3420
atggatgaca ggtggcggga ctcccccagg gccacaccat gggaccaggt cagctatgtc
3480
agccaggtgt cgctgtcctc cctgacgtcc gacaagccat ctcggcacag cgctgcagca
3540
gacgatgatg gggacaagtg gtctctgctc ctgaatggca gggatgagga gcagtacatc
3600
tga
3603
<210> 2
<211> 145
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: AAV2 ITR
<400> 2
ttggccactc cctctctgcg cgctcgctcg ctcactgagg ccgggcgacc aaaggtcgcc
60
cgacgcccgg gctttgcccg ggcggcctca gtgagcgagc gagcgcgcag agagggagtg
120
gccaactcca tcactagggg ttcct
145
<210> 3
<211> 100
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: последовательность
энхансера
enTTR
<400> 3
ctacctcgtg atcgcccggc ccctgttcaa acatgtccta atactctgtc tctgcaaggg
60
tcatcagtag ttttccatct tactcaacat cctcccagtg
100
<210> 4
<211> 95
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: малый Т-интрон SV40
<400> 4
gctctaaggt aaatataaaa tttttaagtg tataatgtgt taaactactg attctaattg
60
tttctctctt ttagattcca acctttggaa ctgat
95
<210> 5
<211> 315
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: интрон rHBB
<400> 5
gtgagcgggc gggacggccc ttctcctccg ggctgtaatt agcgcttggt ttaatgacgg
60
cttgtttctt ttctgtggct gcgtgaaagc cttgaggggc tccgggaggg ccctttgtgc
120
ggggggagcg gctcggggct gtccgcgggg ggacggctgc cttcgggggg gacggggcag
180
ggcggggttc ggcttctggc gtgtgaccgg cggctcaaga gcctctgcta accatgttca
240
tgccttcttc tttttcctac agctcctggg caacgtgctg gttattgtgc tgtctcatca
300
ttttggcaaa gaatt
315
<210> 6
<211> 215
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: сигнальная
последовательность
полиаденилирования BGH
<400> 6
gcctcgactg tgccttctag ttgccagcca tctgttgttt gcccctcccc cgtgccttcc
60
ttgaccctgg aaggtgccac tcccactgtc ctttcctaat aaaatgagga aattgcatcg
120
cattgtctga gtaggtgtca ttctattctg gggggtgggg tggggcagga cagcaagggg
180
gaggattggg aagacaatag caggcatgct gggga
215
<210> 7
<211> 198
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: сигнальная
последовательность
полиаденилирования SV40
<400> 7
gatccagaca tgataagata cattgatgag tttggacaaa ccacaactag aatgcagtga
60
aaaaaatgct ttatttgtga aatttgtgat gctattgctt tatttgtaac cattataagc
120
tgcaataaac aagttaacaa caacaattgc attcatttta tgtttcaggt tcagggggag
180
gtgtgggagg ttttttag
198
<210> 8
<211> 1200
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: DEL 1-3 ATP7B
нативная,
белок
<220>
<221> MISC_FEATURE
<222> (75)..(75)
<223> Аминокислотный остаток в положении 75 соответствует серину
S340
(нумерация основана на последовательности белка дикого типа)
<220>
<221> MISC_FEATURE
<222> (76)..(76)
<223> Аминокислотный остаток в положении 76 соответствует серину
S341
(нумерация основана на последовательности белка дикого типа)
<400> 8
Met Pro Glu Gln Glu Arg Gln Ile Thr Ala Arg Glu Gly Ala Ser Arg
1 5 10 15
Lys Ile Leu Ser Lys Leu Ser Leu Pro Thr Arg Ala Trp Glu Pro Ala
20 25 30
Met Lys Lys Ser Phe Ala Phe Asp Asn Val Gly Tyr Glu Gly Gly Leu
35 40 45
Asp Gly Leu Gly Pro Ser Ser Gln Val Ala Thr Ser Thr Val Arg Asp
50 55 60
Gly Ala Glu Gly Ser Gly Thr Asp His Arg Ser Ser Ser Ser His Ser
65 70 75 80
Pro Gly Ser Pro Pro Arg Asn Gln Val Gln Gly Thr Cys Ser Thr Thr
85 90 95
Leu Ile Ala Ile Ala Gly Met Thr Cys Ala Ser Cys Val His Ser Ile
100 105 110
Glu Gly Met Ile Ser Gln Leu Glu Gly Val Gln Gln Ile Ser Val Ser
115 120 125
Leu Ala Glu Gly Thr Ala Thr Val Leu Tyr Asn Pro Ser Val Ile Ser
130 135 140
Pro Glu Glu Leu Arg Ala Ala Ile Glu Asp Met Gly Phe Glu Ala Ser
145 150 155 160
Val Val Ser Glu Ser Cys Ser Thr Asn Pro Leu Gly Asn His Ser Ala
165 170 175
Gly Asn Ser Met Val Gln Thr Thr Asp Gly Thr Pro Thr Ser Val Gln
180 185 190
Glu Val Ala Pro His Thr Gly Arg Leu Pro Ala Asn His Ala Pro Asp
195 200 205
Ile Leu Ala Lys Ser Pro Gln Ser Thr Arg Ala Val Ala Pro Gln Lys
210 215 220
Cys Phe Leu Gln Ile Lys Gly Met Thr Cys Ala Ser Cys Val Ser Asn
225 230 235 240
Ile Glu Arg Asn Leu Gln Lys Glu Ala Gly Val Leu Ser Val Leu Val
245 250 255
Ala Leu Met Ala Gly Lys Ala Glu Ile Lys Tyr Asp Pro Glu Val Ile
260 265 270
Gln Pro Leu Glu Ile Ala Gln Phe Ile Gln Asp Leu Gly Phe Glu Ala
275 280 285
Ala Val Met Glu Asp Tyr Ala Gly Ser Asp Gly Asn Ile Glu Leu Thr
290 295 300
Ile Thr Gly Met Thr Cys Ala Ser Cys Val His Asn Ile Glu Ser Lys
305 310 315 320
Leu Thr Arg Thr Asn Gly Ile Thr Tyr Ala Ser Val Ala Leu Ala Thr
325 330 335
Ser Lys Ala Leu Val Lys Phe Asp Pro Glu Ile Ile Gly Pro Arg Asp
340 345 350
Ile Ile Lys Ile Ile Glu Glu Ile Gly Phe His Ala Ser Leu Ala Gln
355 360 365
Arg Asn Pro Asn Ala His His Leu Asp His Lys Met Glu Ile Lys Gln
370 375 380
Trp Lys Lys Ser Phe Leu Cys Ser Leu Val Phe Gly Ile Pro Val Met
385 390 395 400
Ala Leu Met Ile Tyr Met Leu Ile Pro Ser Asn Glu Pro His Gln Ser
405 410 415
Met Val Leu Asp His Asn Ile Ile Pro Gly Leu Ser Ile Leu Asn Leu
420 425 430
Ile Phe Phe Ile Leu Cys Thr Phe Val Gln Leu Leu Gly Gly Trp Tyr
435 440 445
Phe Tyr Val Gln Ala Tyr Lys Ser Leu Arg His Arg Ser Ala Asn Met
450 455 460
Asp Val Leu Ile Val Leu Ala Thr Ser Ile Ala Tyr Val Tyr Ser Leu
465 470 475 480
Val Ile Leu Val Val Ala Val Ala Glu Lys Ala Glu Arg Ser Pro Val
485 490 495
Thr Phe Phe Asp Thr Pro Pro Met Leu Phe Val Phe Ile Ala Leu Gly
500 505 510
Arg Trp Leu Glu His Leu Ala Lys Ser Lys Thr Ser Glu Ala Leu Ala
515 520 525
Lys Leu Met Ser Leu Gln Ala Thr Glu Ala Thr Val Val Thr Leu Gly
530 535 540
Glu Asp Asn Leu Ile Ile Arg Glu Glu Gln Val Pro Met Glu Leu Val
545 550 555 560
Gln Arg Gly Asp Ile Val Lys Val Val Pro Gly Gly Lys Phe Pro Val
565 570 575
Asp Gly Lys Val Leu Glu Gly Asn Thr Met Ala Asp Glu Ser Leu Ile
580 585 590
Thr Gly Glu Ala Met Pro Val Thr Lys Lys Pro Gly Ser Thr Val Ile
595 600 605
Ala Gly Ser Ile Asn Ala His Gly Ser Val Leu Ile Lys Ala Thr His
610 615 620
Val Gly Asn Asp Thr Thr Leu Ala Gln Ile Val Lys Leu Val Glu Glu
625 630 635 640
Ala Gln Met Ser Lys Ala Pro Ile Gln Gln Leu Ala Asp Arg Phe Ser
645 650 655
Gly Tyr Phe Val Pro Phe Ile Ile Ile Met Ser Thr Leu Thr Leu Val
660 665 670
Val Trp Ile Val Ile Gly Phe Ile Asp Phe Gly Val Val Gln Arg Tyr
675 680 685
Phe Pro Asn Pro Asn Lys His Ile Ser Gln Thr Glu Val Ile Ile Arg
690 695 700
Phe Ala Phe Gln Thr Ser Ile Thr Val Leu Cys Ile Ala Cys Pro Cys
705 710 715 720
Ser Leu Gly Leu Ala Thr Pro Thr Ala Val Met Val Gly Thr Gly Val
725 730 735
Ala Ala Gln Asn Gly Ile Leu Ile Lys Gly Gly Lys Pro Leu Glu Met
740 745 750
Ala His Lys Ile Lys Thr Val Met Phe Asp Lys Thr Gly Thr Ile Thr
755 760 765
His Gly Val Pro Arg Val Met Arg Val Leu Leu Leu Gly Asp Val Ala
770 775 780
Thr Leu Pro Leu Arg Lys Val Leu Ala Val Val Gly Thr Ala Glu Ala
785 790 795 800
Ser Ser Glu His Pro Leu Gly Val Ala Val Thr Lys Tyr Cys Lys Glu
805 810 815
Glu Leu Gly Thr Glu Thr Leu Gly Tyr Cys Thr Asp Phe Gln Ala Val
820 825 830
Pro Gly Cys Gly Ile Gly Cys Lys Val Ser Asn Val Glu Gly Ile Leu
835 840 845
Ala His Ser Glu Arg Pro Leu Ser Ala Pro Ala Ser His Leu Asn Glu
850 855 860
Ala Gly Ser Leu Pro Ala Glu Lys Asp Ala Val Pro Gln Thr Phe Ser
865 870 875 880
Val Leu Ile Gly Asn Arg Glu Trp Leu Arg Arg Asn Gly Leu Thr Ile
885 890 895
Ser Ser Asp Val Ser Asp Ala Met Thr Asp His Glu Met Lys Gly Gln
900 905 910
Thr Ala Ile Leu Val Ala Ile Asp Gly Val Leu Cys Gly Met Ile Ala
915 920 925
Ile Ala Asp Ala Val Lys Gln Glu Ala Ala Leu Ala Val His Thr Leu
930 935 940
Gln Ser Met Gly Val Asp Val Val Leu Ile Thr Gly Asp Asn Arg Lys
945 950 955 960
Thr Ala Arg Ala Ile Ala Thr Gln Val Gly Ile Asn Lys Val Phe Ala
965 970 975
Glu Val Leu Pro Ser His Lys Val Ala Lys Val Gln Glu Leu Gln Asn
980 985 990
Lys Gly Lys Lys Val Ala Met Val Gly Asp Gly Val Asn Asp Ser Pro
995 1000 1005
Ala Leu Ala Gln Ala Asp Met Gly Val Ala Ile Gly Thr Gly Thr
1010 1015 1020
Asp Val Ala Ile Glu Ala Ala Asp Val Val Leu Ile Arg Asn Asp
1025 1030 1035
Leu Leu Asp Val Val Ala Ser Ile His Leu Ser Lys Arg Thr Val
1040 1045 1050
Arg Arg Ile Arg Ile Asn Leu Val Leu Ala Leu Ile Tyr Asn Leu
1055 1060 1065
Val Gly Ile Pro Ile Ala Ala Gly Val Phe Met Pro Ile Gly Ile
1070 1075 1080
Val Leu Gln Pro Trp Met Gly Ser Ala Ala Met Ala Ala Ser Ser
1085 1090 1095
Val Ser Val Val Leu Ser Ser Leu Gln Leu Lys Cys Tyr Lys Lys
1100 1105 1110
Pro Asp Leu Glu Arg Tyr Glu Ala Gln Ala His Gly His Met Lys
1115 1120 1125
Pro Leu Thr Ala Ser Gln Val Ser Val His Ile Gly Met Asp Asp
1130 1135 1140
Arg Trp Arg Asp Ser Pro Arg Ala Thr Pro Trp Asp Gln Val Ser
1145 1150 1155
Tyr Val Ser Gln Val Ser Leu Ser Ser Leu Thr Ser Asp Lys Pro
1160 1165 1170
Ser Arg His Ser Ala Ala Ala Asp Asp Asp Gly Asp Lys Trp Ser
1175 1180 1185
Leu Leu Leu Asn Gly Arg Asp Glu Glu Gln Tyr Ile
1190 1195 1200
<210> 9
<211> 2211
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: последовательность
нуклеиновой
кислоты, кодирующей капсидный белок AAV9 VP1
<400> 9
atggctgccg atggttatct tccagattgg ctcgaggaca accttagtga aggaattcgc
60
gagtggtggg ctttgaaacc tggagcccct caacccaagg caaatcaaca acatcaagac
120
aacgctcgag gtcttgtgct tccgggttac aaataccttg gacccggcaa cggactcgac
180
aagggggagc cggtcaacgc agcagacgcg gcggccctcg agcacgacaa ggcctacgac
240
cagcagctca aggccggaga caacccgtac ctcaagtaca accacgccga cgccgagttc
300
caggagcggc tcaaagaaga tacgtctttt gggggcaacc tcgggcgagc agtcttccag
360
gccaaaaaga ggcttcttga acctcttggt ctggttgagg aagcggctaa gacggctcct
420
ggaaagaaga ggcctgtaga gcagtctcct caggaaccgg actcctccgc gggtattggc
480
aaatcgggtg cacagcccgc taaaaagaga ctcaatttcg gtcagactgg cgacacagag
540
tcagtcccag accctcaacc aatcggagaa cctcccgcag ccccctcagg tgtgggatct
600
cttacaatgg cttcaggtgg tggcgcacca gtggcagaca ataacgaagg tgccgatgga
660
gtgggtagtt cctcgggaaa ttggcattgc gattcccaat ggctggggga cagagtcatc
720
accaccagca cccgaacctg ggccctgccc acctacaaca atcacctcta caagcaaatc
780
tccaacagca catctggagg atcttcaaat gacaacgcct acttcggcta cagcaccccc
840
tgggggtatt ttgacttcaa cagattccac tgccacttct caccacgtga ctggcagcga
900
ctcatcaaca acaactgggg attccggcct aagcgactca acttcaagct cttcaacatt
960
caggtcaaag aggttacgga caacaatgga gtcaagacca tcgccaataa ccttaccagc
1020
acggtccagg tcttcacgga ctcagactat cagctcccgt acgtgctcgg gtcggctcac
1080
gagggctgcc tcccgccgtt cccagcggac gttttcatga ttcctcagta cgggtatctg
1140
acgcttaatg atggaagcca ggccgtgggt cgttcgtcct tttactgcct ggaatatttc
1200
ccgtcgcaaa tgctaagaac gggtaacaac ttccagttca gctacgagtt tgagaacgta
1260
cctttccata gcagctacgc tcacagccaa agcctggacc gactaatgaa tccactcatc
1320
gaccaatact tgtactatct ctcaaagact attaacggtt ctggacagaa tcaacaaacg
1380
ctaaaattca gtgtggccgg acccagcaac atggctgtcc agggaagaaa ctacatacct
1440
ggacccagct accgacaaca acgtgtctca accactgtga ctcaaaacaa caacagcgaa
1500
tttgcttggc ctggagcttc ttcttgggct ctcaatggac gtaatagctt gatgaatcct
1560
ggacctgcta tggccagcca caaagaagga gaggaccgtt tctttccttt gtctggatct
1620
ttaatttttg gcaaacaagg aactggaaga gacaacgtgg atgcggacaa agtcatgata
1680
accaacgaag aagaaattaa aactactaac ccggtagcaa cggagtccta tggacaagtg
1740
gccacaaacc accagagtgc ccaagcacag gcgcagaccg gctgggttca aaaccaagga
1800
atacttccgg gtatggtttg gcaggacaga gatgtgtacc tgcaaggacc catttgggcc
1860
aaaattcctc acacggacgg caactttcac ccttctccgc tgatgggagg gtttggaatg
1920
aagcacccgc ctcctcagat cctcatcaaa aacacacctg tacctgcgga tcctccaacg
1980
gccttcaaca aggacaagct gaactctttc atcacccagt attctactgg ccaagtcagc
2040
gtggagatcg agtgggagct gcagaaggaa aacagcaagc gctggaaccc ggagatccag
2100
tacacttcca actattacaa gtctaataat gttgaatttg ctgttaatac tgaaggtgta
2160
tatagtgaac cccgccccat tggcaccaga tacctgactc gtaatctgta a
2211
<210> 10
<211> 736
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: аминокислотная
последовательность капсидного белка AAV9 VP1
<400> 10
Met Ala Ala Asp Gly Tyr Leu Pro Asp Trp Leu Glu Asp Asn Leu Ser
1 5 10 15
Glu Gly Ile Arg Glu Trp Trp Ala Leu Lys Pro Gly Ala Pro Gln Pro
20 25 30
Lys Ala Asn Gln Gln His Gln Asp Asn Ala Arg Gly Leu Val Leu Pro
35 40 45
Gly Tyr Lys Tyr Leu Gly Pro Gly Asn Gly Leu Asp Lys Gly Glu Pro
50 55 60
Val Asn Ala Ala Asp Ala Ala Ala Leu Glu His Asp Lys Ala Tyr Asp
65 70 75 80
Gln Gln Leu Lys Ala Gly Asp Asn Pro Tyr Leu Lys Tyr Asn His Ala
85 90 95
Asp Ala Glu Phe Gln Glu Arg Leu Lys Glu Asp Thr Ser Phe Gly Gly
100 105 110
Asn Leu Gly Arg Ala Val Phe Gln Ala Lys Lys Arg Leu Leu Glu Pro
115 120 125
Leu Gly Leu Val Glu Glu Ala Ala Lys Thr Ala Pro Gly Lys Lys Arg
130 135 140
Pro Val Glu Gln Ser Pro Gln Glu Pro Asp Ser Ser Ala Gly Ile Gly
145 150 155 160
Lys Ser Gly Ala Gln Pro Ala Lys Lys Arg Leu Asn Phe Gly Gln Thr
165 170 175
Gly Asp Thr Glu Ser Val Pro Asp Pro Gln Pro Ile Gly Glu Pro Pro
180 185 190
Ala Ala Pro Ser Gly Val Gly Ser Leu Thr Met Ala Ser Gly Gly Gly
195 200 205
Ala Pro Val Ala Asp Asn Asn Glu Gly Ala Asp Gly Val Gly Ser Ser
210 215 220
Ser Gly Asn Trp His Cys Asp Ser Gln Trp Leu Gly Asp Arg Val Ile
225 230 235 240
Thr Thr Ser Thr Arg Thr Trp Ala Leu Pro Thr Tyr Asn Asn His Leu
245 250 255
Tyr Lys Gln Ile Ser Asn Ser Thr Ser Gly Gly Ser Ser Asn Asp Asn
260 265 270
Ala Tyr Phe Gly Tyr Ser Thr Pro Trp Gly Tyr Phe Asp Phe Asn Arg
275 280 285
Phe His Cys His Phe Ser Pro Arg Asp Trp Gln Arg Leu Ile Asn Asn
290 295 300
Asn Trp Gly Phe Arg Pro Lys Arg Leu Asn Phe Lys Leu Phe Asn Ile
305 310 315 320
Gln Val Lys Glu Val Thr Asp Asn Asn Gly Val Lys Thr Ile Ala Asn
325 330 335
Asn Leu Thr Ser Thr Val Gln Val Phe Thr Asp Ser Asp Tyr Gln Leu
340 345 350
Pro Tyr Val Leu Gly Ser Ala His Glu Gly Cys Leu Pro Pro Phe Pro
355 360 365
Ala Asp Val Phe Met Ile Pro Gln Tyr Gly Tyr Leu Thr Leu Asn Asp
370 375 380
Gly Ser Gln Ala Val Gly Arg Ser Ser Phe Tyr Cys Leu Glu Tyr Phe
385 390 395 400
Pro Ser Gln Met Leu Arg Thr Gly Asn Asn Phe Gln Phe Ser Tyr Glu
405 410 415
Phe Glu Asn Val Pro Phe His Ser Ser Tyr Ala His Ser Gln Ser Leu
420 425 430
Asp Arg Leu Met Asn Pro Leu Ile Asp Gln Tyr Leu Tyr Tyr Leu Ser
435 440 445
Lys Thr Ile Asn Gly Ser Gly Gln Asn Gln Gln Thr Leu Lys Phe Ser
450 455 460
Val Ala Gly Pro Ser Asn Met Ala Val Gln Gly Arg Asn Tyr Ile Pro
465 470 475 480
Gly Pro Ser Tyr Arg Gln Gln Arg Val Ser Thr Thr Val Thr Gln Asn
485 490 495
Asn Asn Ser Glu Phe Ala Trp Pro Gly Ala Ser Ser Trp Ala Leu Asn
500 505 510
Gly Arg Asn Ser Leu Met Asn Pro Gly Pro Ala Met Ala Ser His Lys
515 520 525
Glu Gly Glu Asp Arg Phe Phe Pro Leu Ser Gly Ser Leu Ile Phe Gly
530 535 540
Lys Gln Gly Thr Gly Arg Asp Asn Val Asp Ala Asp Lys Val Met Ile
545 550 555 560
Thr Asn Glu Glu Glu Ile Lys Thr Thr Asn Pro Val Ala Thr Glu Ser
565 570 575
Tyr Gly Gln Val Ala Thr Asn His Gln Ser Ala Gln Ala Gln Ala Gln
580 585 590
Thr Gly Trp Val Gln Asn Gln Gly Ile Leu Pro Gly Met Val Trp Gln
595 600 605
Asp Arg Asp Val Tyr Leu Gln Gly Pro Ile Trp Ala Lys Ile Pro His
610 615 620
Thr Asp Gly Asn Phe His Pro Ser Pro Leu Met Gly Gly Phe Gly Met
625 630 635 640
Lys His Pro Pro Pro Gln Ile Leu Ile Lys Asn Thr Pro Val Pro Ala
645 650 655
Asp Pro Pro Thr Ala Phe Asn Lys Asp Lys Leu Asn Ser Phe Ile Thr
660 665 670
Gln Tyr Ser Thr Gly Gln Val Ser Val Glu Ile Glu Trp Glu Leu Gln
675 680 685
Lys Glu Asn Ser Lys Arg Trp Asn Pro Glu Ile Gln Tyr Thr Ser Asn
690 695 700
Tyr Tyr Lys Ser Asn Asn Val Glu Phe Ala Val Asn Thr Glu Gly Val
705 710 715 720
Tyr Ser Glu Pro Arg Pro Ile Gly Thr Arg Tyr Leu Thr Arg Asn Leu
725 730 735
<210> 11
<211> 6
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: консенсусная
последоваельность
Козака
<400> 11
gccgcc
6
<210> 12
<211> 190
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: последовательность
промотора
TTR
<400> 12
atttcataga acgaatgttc cgatgctcta atctctctag acaaggttca tatttgtatg
60
ggttacttat tctctctttg ttgactaagt caataatcag aatcagcagg tttgcagtca
120
gattggcagg gataagcagc ctagctcagg agaagtgagt ataaaagccc caggctggga
180
gcagccatca
190
<210> 13
<211> 1120
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: DEL 1-4 ATP7B
нативная,
белок
<400> 13
Met Pro Glu Gln Glu Arg Gln Ile Thr Ala Arg Glu Gly Ala Ser Arg
1 5 10 15
Lys Ile Leu Ser Lys Leu Ser Leu Pro Thr Arg Ala Trp Glu Pro Ala
20 25 30
Met Lys Lys Ser Phe Ala Phe Asp Asn Val Gly Tyr Glu Gly Gly Leu
35 40 45
Asp Gly Leu Gly Pro Ser Ser Gln Val Ala Thr Ser Thr Val Arg Ser
50 55 60
Pro Glu Glu Leu Arg Ala Ala Ile Glu Asp Met Gly Phe Glu Ala Ser
65 70 75 80
Val Val Ser Glu Ser Cys Ser Thr Asn Pro Leu Gly Asn His Ser Ala
85 90 95
Gly Asn Ser Met Val Gln Thr Thr Asp Gly Thr Pro Thr Ser Val Gln
100 105 110
Glu Val Ala Pro His Thr Gly Arg Leu Pro Ala Asn His Ala Pro Asp
115 120 125
Ile Leu Ala Lys Ser Pro Gln Ser Thr Arg Ala Val Ala Pro Gln Lys
130 135 140
Cys Phe Leu Gln Ile Lys Gly Met Thr Cys Ala Ser Cys Val Ser Asn
145 150 155 160
Ile Glu Arg Asn Leu Gln Lys Glu Ala Gly Val Leu Ser Val Leu Val
165 170 175
Ala Leu Met Ala Gly Lys Ala Glu Ile Lys Tyr Asp Pro Glu Val Ile
180 185 190
Gln Pro Leu Glu Ile Ala Gln Phe Ile Gln Asp Leu Gly Phe Glu Ala
195 200 205
Ala Val Met Glu Asp Tyr Ala Gly Ser Asp Gly Asn Ile Glu Leu Thr
210 215 220
Ile Thr Gly Met Thr Cys Ala Ser Cys Val His Asn Ile Glu Ser Lys
225 230 235 240
Leu Thr Arg Thr Asn Gly Ile Thr Tyr Ala Ser Val Ala Leu Ala Thr
245 250 255
Ser Lys Ala Leu Val Lys Phe Asp Pro Glu Ile Ile Gly Pro Arg Asp
260 265 270
Ile Ile Lys Ile Ile Glu Glu Ile Gly Phe His Ala Ser Leu Ala Gln
275 280 285
Arg Asn Pro Asn Ala His His Leu Asp His Lys Met Glu Ile Lys Gln
290 295 300
Trp Lys Lys Ser Phe Leu Cys Ser Leu Val Phe Gly Ile Pro Val Met
305 310 315 320
Ala Leu Met Ile Tyr Met Leu Ile Pro Ser Asn Glu Pro His Gln Ser
325 330 335
Met Val Leu Asp His Asn Ile Ile Pro Gly Leu Ser Ile Leu Asn Leu
340 345 350
Ile Phe Phe Ile Leu Cys Thr Phe Val Gln Leu Leu Gly Gly Trp Tyr
355 360 365
Phe Tyr Val Gln Ala Tyr Lys Ser Leu Arg His Arg Ser Ala Asn Met
370 375 380
Asp Val Leu Ile Val Leu Ala Thr Ser Ile Ala Tyr Val Tyr Ser Leu
385 390 395 400
Val Ile Leu Val Val Ala Val Ala Glu Lys Ala Glu Arg Ser Pro Val
405 410 415
Thr Phe Phe Asp Thr Pro Pro Met Leu Phe Val Phe Ile Ala Leu Gly
420 425 430
Arg Trp Leu Glu His Leu Ala Lys Ser Lys Thr Ser Glu Ala Leu Ala
435 440 445
Lys Leu Met Ser Leu Gln Ala Thr Glu Ala Thr Val Val Thr Leu Gly
450 455 460
Glu Asp Asn Leu Ile Ile Arg Glu Glu Gln Val Pro Met Glu Leu Val
465 470 475 480
Gln Arg Gly Asp Ile Val Lys Val Val Pro Gly Gly Lys Phe Pro Val
485 490 495
Asp Gly Lys Val Leu Glu Gly Asn Thr Met Ala Asp Glu Ser Leu Ile
500 505 510
Thr Gly Glu Ala Met Pro Val Thr Lys Lys Pro Gly Ser Thr Val Ile
515 520 525
Ala Gly Ser Ile Asn Ala His Gly Ser Val Leu Ile Lys Ala Thr His
530 535 540
Val Gly Asn Asp Thr Thr Leu Ala Gln Ile Val Lys Leu Val Glu Glu
545 550 555 560
Ala Gln Met Ser Lys Ala Pro Ile Gln Gln Leu Ala Asp Arg Phe Ser
565 570 575
Gly Tyr Phe Val Pro Phe Ile Ile Ile Met Ser Thr Leu Thr Leu Val
580 585 590
Val Trp Ile Val Ile Gly Phe Ile Asp Phe Gly Val Val Gln Arg Tyr
595 600 605
Phe Pro Asn Pro Asn Lys His Ile Ser Gln Thr Glu Val Ile Ile Arg
610 615 620
Phe Ala Phe Gln Thr Ser Ile Thr Val Leu Cys Ile Ala Cys Pro Cys
625 630 635 640
Ser Leu Gly Leu Ala Thr Pro Thr Ala Val Met Val Gly Thr Gly Val
645 650 655
Ala Ala Gln Asn Gly Ile Leu Ile Lys Gly Gly Lys Pro Leu Glu Met
660 665 670
Ala His Lys Ile Lys Thr Val Met Phe Asp Lys Thr Gly Thr Ile Thr
675 680 685
His Gly Val Pro Arg Val Met Arg Val Leu Leu Leu Gly Asp Val Ala
690 695 700
Thr Leu Pro Leu Arg Lys Val Leu Ala Val Val Gly Thr Ala Glu Ala
705 710 715 720
Ser Ser Glu His Pro Leu Gly Val Ala Val Thr Lys Tyr Cys Lys Glu
725 730 735
Glu Leu Gly Thr Glu Thr Leu Gly Tyr Cys Thr Asp Phe Gln Ala Val
740 745 750
Pro Gly Cys Gly Ile Gly Cys Lys Val Ser Asn Val Glu Gly Ile Leu
755 760 765
Ala His Ser Glu Arg Pro Leu Ser Ala Pro Ala Ser His Leu Asn Glu
770 775 780
Ala Gly Ser Leu Pro Ala Glu Lys Asp Ala Val Pro Gln Thr Phe Ser
785 790 795 800
Val Leu Ile Gly Asn Arg Glu Trp Leu Arg Arg Asn Gly Leu Thr Ile
805 810 815
Ser Ser Asp Val Ser Asp Ala Met Thr Asp His Glu Met Lys Gly Gln
820 825 830
Thr Ala Ile Leu Val Ala Ile Asp Gly Val Leu Cys Gly Met Ile Ala
835 840 845
Ile Ala Asp Ala Val Lys Gln Glu Ala Ala Leu Ala Val His Thr Leu
850 855 860
Gln Ser Met Gly Val Asp Val Val Leu Ile Thr Gly Asp Asn Arg Lys
865 870 875 880
Thr Ala Arg Ala Ile Ala Thr Gln Val Gly Ile Asn Lys Val Phe Ala
885 890 895
Glu Val Leu Pro Ser His Lys Val Ala Lys Val Gln Glu Leu Gln Asn
900 905 910
Lys Gly Lys Lys Val Ala Met Val Gly Asp Gly Val Asn Asp Ser Pro
915 920 925
Ala Leu Ala Gln Ala Asp Met Gly Val Ala Ile Gly Thr Gly Thr Asp
930 935 940
Val Ala Ile Glu Ala Ala Asp Val Val Leu Ile Arg Asn Asp Leu Leu
945 950 955 960
Asp Val Val Ala Ser Ile His Leu Ser Lys Arg Thr Val Arg Arg Ile
965 970 975
Arg Ile Asn Leu Val Leu Ala Leu Ile Tyr Asn Leu Val Gly Ile Pro
980 985 990
Ile Ala Ala Gly Val Phe Met Pro Ile Gly Ile Val Leu Gln Pro Trp
995 1000 1005
Met Gly Ser Ala Ala Met Ala Ala Ser Ser Val Ser Val Val Leu
1010 1015 1020
Ser Ser Leu Gln Leu Lys Cys Tyr Lys Lys Pro Asp Leu Glu Arg
1025 1030 1035
Tyr Glu Ala Gln Ala His Gly His Met Lys Pro Leu Thr Ala Ser
1040 1045 1050
Gln Val Ser Val His Ile Gly Met Asp Asp Arg Trp Arg Asp Ser
1055 1060 1065
Pro Arg Ala Thr Pro Trp Asp Gln Val Ser Tyr Val Ser Gln Val
1070 1075 1080
Ser Leu Ser Ser Leu Thr Ser Asp Lys Pro Ser Arg His Ser Ala
1085 1090 1095
Ala Ala Asp Asp Asp Gly Asp Lys Trp Ser Leu Leu Leu Asn Gly
1100 1105 1110
Arg Asp Glu Glu Gln Tyr Ile
1115 1120
<210> 14
<211> 4485
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: экспрессионная
кассета
примерного вектора DTC319
<400> 14
ttggccactc cctctctgcg cgctcgctcg ctcactgagg ccgggcgacc aaaggtcgcc
60
cgacgcccgg gctttgcccg ggcggcctca gtgagcgagc gagcgcgcag agagggagtg
120
gccaactcca tcactagggg ttcctctacc tcgtgatcgc ccggcccctg ttcaaacatg
180
tcctaatact ctgtctctgc aagggtcatc agtagttttc catcttactc aacatcctcc
240
cagtgatttc atagaacgaa tgttccgatg ctctaatctc tctagacaag gttcatattt
300
gtatgggtta cttattctct ctttgttgac taagtcaata atcagaatca gcaggtttgc
360
agtcagattg gcagggataa gcagcctagc tcaggagaag tgagtataaa agccccaggc
420
tgggagcagc catcagctct aaggtaaata taaaattttt aagtgtataa tgtgttaaac
480
tactgattct aattgtttct ctcttttaga ttccaacctt tggaactgat gccgccacca
540
tgcctgagca ggagagacag atcacagcca gagaaggggc cagtcggaaa atcttatcta
600
agctttcttt gcctacccgt gcctgggaac cagcaatgaa gaagagtttt gcttttgaca
660
atgttggcta tgaaggtggt ctggatggcc tgggcccttc ttctcaggtg gccaccagca
720
cagtcaggga tggagccgaa gggagtggga cagatcacag gtcttccagt tctcattccc
780
ctggctcccc accgagaaac caggtccagg gcacatgcag taccactctg attgccattg
840
ccggcatgac ctgtgcatcc tgtgtccatt ccattgaagg catgatctcc caactggaag
900
gggtgcagca aatatcggtg tctttggccg aagggactgc aacagttctt tataatccct
960
ctgtaattag cccagaagaa ctcagagctg ctatagaaga catgggattt gaggcttcag
1020
tcgtttctga aagctgttct actaaccctc ttggaaacca cagtgctggg aattccatgg
1080
tgcaaactac agatggtaca cctacatctg tgcaggaagt ggctccccac actgggaggc
1140
tccctgcaaa ccatgccccg gacatcttgg caaagtcccc acaatcaacc agagcagtgg
1200
caccgcagaa gtgcttctta cagatcaaag gcatgacctg tgcatcctgt gtgtctaaca
1260
tagaaaggaa tctgcagaaa gaagctggtg ttctctccgt gttggttgcc ttgatggcag
1320
gaaaggcaga gatcaagtat gacccagagg tcatccagcc cctcgagata gctcagttca
1380
tccaggacct gggttttgag gcagcagtca tggaggacta cgcaggctcc gatggcaaca
1440
ttgagctgac aatcacaggg atgacctgcg cgtcctgtgt ccacaacata gagtccaaac
1500
tcacgaggac aaatggcatc acttatgcct ccgttgccct tgccaccagc aaagcccttg
1560
ttaagtttga cccggaaatt atcggtccac gggatattat caaaattatt gaggaaattg
1620
gctttcatgc ttccctggcc cagagaaacc ccaacgctca tcacttggac cacaagatgg
1680
aaataaagca gtggaagaag tctttcctgt gcagcctggt gtttggcatc cctgtcatgg
1740
ccttaatgat ctatatgctg atacccagca acgagcccca ccagtccatg gtcctggacc
1800
acaacatcat tccaggactg tccattctaa atctcatctt ctttatcttg tgtacctttg
1860
tccagctcct cggtgggtgg tacttctacg ttcaggccta caaatctctg agacacaggt
1920
cagccaacat ggacgtgctc atcgtcctgg ccacaagcat tgcttatgtt tattctctgg
1980
tcatcctggt ggttgctgtg gctgagaagg cggagaggag ccctgtgaca ttcttcgaca
2040
cgccccccat gctctttgtg ttcattgccc tgggccggtg gctggaacac ttggcaaaga
2100
gcaaaacctc agaagccctg gctaaactca tgtctctcca agccacagaa gccaccgttg
2160
tgacccttgg tgaggacaat ttaatcatca gggaggagca agtccccatg gagctggtgc
2220
agcggggcga tatcgtcaag gtggtccctg ggggaaagtt tccagtggat gggaaagtcc
2280
tggaaggcaa taccatggct gatgagtccc tcatcacagg agaagccatg ccagtcacta
2340
agaaacccgg aagcactgta attgcggggt ctataaatgc acatggctct gtgctcatta
2400
aagctaccca cgtgggcaat gacaccactt tggctcagat tgtgaaactg gtggaagagg
2460
ctcagatgtc aaaggcaccc attcagcagc tggctgaccg gtttagtgga tattttgtcc
2520
catttatcat catcatgtca actttgacgt tggtggtatg gattgtaatc ggttttatcg
2580
attttggtgt tgttcagaga tactttccta accccaacaa gcacatctcc cagacagagg
2640
tgatcatccg gtttgctttc cagacgtcca tcacggtgct gtgcattgcc tgcccctgct
2700
ccctggggct ggccacgccc acggctgtca tggtgggcac cggggtggcc gcgcagaacg
2760
gcatcctcat caagggaggc aagcccctgg agatggcgca caagataaag actgtgatgt
2820
ttgacaagac tggcaccatt acccatggcg tccccagggt catgcgggtg ctcctgctgg
2880
gggatgtggc cacactgccc ctcaggaagg ttctggctgt ggtggggact gcggaggcca
2940
gcagtgaaca ccccttgggc gtggcagtca ccaaatactg taaagaggaa cttggaacag
3000
agaccttggg atactgcacg gacttccagg cagtgccagg ctgtggaatt gggtgcaaag
3060
tcagcaacgt ggaaggcatc ctggcccaca gtgagcgccc tttgagtgca ccggccagtc
3120
acctgaatga ggctggcagc cttcccgcag aaaaagatgc agtcccccag accttctctg
3180
tgctgattgg aaaccgtgag tggctgaggc gcaacggttt aaccatttct agcgatgtca
3240
gtgacgctat gacagaccac gagatgaaag gacagacagc catcctggtg gctattgacg
3300
gtgtgctctg tgggatgatc gcaatcgcag acgctgtcaa gcaggaggct gccctggctg
3360
tgcacacgct gcagagcatg ggtgtggacg tggttctgat cacgggggac aaccggaaga
3420
cagccagagc tattgccacc caggttggca tcaacaaagt ctttgcagag gtgctgcctt
3480
cgcacaaggt ggccaaggtc caggagctcc agaataaagg gaagaaagtc gccatggtgg
3540
gggatggggt caatgactcc ccggccttgg cccaggcaga catgggtgtg gccattggca
3600
ccggcacgga tgtggccatc gaggcagccg acgtcgtcct tatcagaaat gatttgctgg
3660
atgtggtggc tagcattcac ctttccaaga ggactgtccg aaggatacgc atcaacctgg
3720
tcctggcact gatttataac ctggttggga tacccattgc agcaggtgtc ttcatgccca
3780
tcggcattgt gctgcagccc tggatgggct cagcggccat ggcagcctcc tctgtgtctg
3840
tggtgctctc atccctgcag ctcaagtgct ataagaagcc tgacctggag aggtatgagg
3900
cacaggcgca tggccacatg aagcccctga cggcatccca ggtcagtgtg cacataggca
3960
tggatgacag gtggcgggac tcccccaggg ccacaccatg ggaccaggtc agctatgtca
4020
gccaggtgtc gctgtcctcc ctgacgtccg acaagccatc tcggcacagc gctgcagcag
4080
acgatgatgg ggacaagtgg tctctgctcc tgaatggcag ggatgaggag cagtacatct
4140
gagatccaga catgataaga tacattgatg agtttggaca aaccacaact agaatgcagt
4200
gaaaaaaatg ctttatttgt gaaatttgtg atgctattgc tttatttgta accattataa
4260
gctgcaataa acaagttaac aacaacaatt gcattcattt tatgtttcag gttcaggggg
4320
aggtgtggga ggttttttag aggaacccct agtgatggag ttggccactc cctctctgcg
4380
cgctcgctcg ctcactgagg ccgcccgggc aaagcccggg cgtcgggcga cctttggtcg
4440
cccggcctca gtgagcgagc gagcgcgcag agagggagtg gccaa
4485
<210> 15
<211> 3603
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Del 1-3 ATP7B,
кодон-оптимизированная
<400> 15
atgcccgagc aggaaagaca gatcaccgcc agagagggcg ccagccggaa gatcctgagc
60
aagctgagcc tgcccaccag agcctgggag cccgccatga agaagtcctt cgccttcgac
120
aacgtgggct acgagggcgg cctggacgga ctgggaccat cttctcaggt ggccacaagc
180
accgtgcgcg acggagccga gggctccgga acagatcaca gaagcagcag cagccacagc
240
cctggcagcc cccctagaaa tcaggtgcag ggcacctgta gcaccaccct gatcgccatt
300
gccggcatga catgcgccag ctgcgtgcac tctattgagg gcatgatctc ccagctggaa
360
ggcgtgcagc agatcagtgt gtctctggcc gagggcaccg ccacagtgct gtacaaccct
420
agcgtgatca gccccgaaga actgagagcc gccattgagg acatgggatt cgaagccagc
480
gtggtgtccg agagctgctc caccaaccct ctgggcaatc acagcgccgg caacagcatg
540
gtgcagacca ccgacggcac ccccaccagc gtgcaggaag tggccccaca tacaggcaga
600
ctgcccgcca atcacgcccc cgatatcctg gccaagagcc cccagagtac aagagccgtg
660
gccccccaga agtgcttcct gcagatcaag ggcatgactt gtgcctcttg tgtgtccaat
720
atcgagcgga acctgcagaa agaggccggc gtgctgtctg tgctggtggc tctgatggcc
780
ggcaaggccg agatcaaata cgaccccgaa gtgattcagc ccctggaaat cgcccagttt
840
atccaggacc tgggctttga agccgccgtg atggaagatt acgccggctc cgacggcaac
900
atcgagctga ccatcaccgg aatgacctgc gcctcctgtg tgcacaacat tgagtccaag
960
ctgacccgga ccaacggcat cacctacgcc tctgtggctc tggccacctc caaggccctc
1020
gtgaagttcg atcccgagat catcggcccc agggacatca tcaagatcat cgaagagatc
1080
ggcttccacg ccagcctggc ccagaggaac cctaacgccc accacctgga ccacaagatg
1140
gaaatcaagc agtggaagaa aagcttcctg tgcagcctgg tgttcggcat ccccgtgatg
1200
gccctgatga tctacatgct gatccccagc aacgagcccc accagtccat ggtgctggat
1260
cacaacatca tccccggcct gtctatcctg aacctgatct tcttcatcct gtgcaccttc
1320
gtgcagctgc tgggcggctg gtacttctac gtgcaggcct acaagtccct gcggcacaga
1380
tccgccaaca tggacgtgct gatcgtgctg gccacatcta tcgcctacgt gtactccctc
1440
gtgatcctgg tggtggccgt ggccgagaaa gccgagagaa gccctgtgac cttcttcgac
1500
acccccccta tgctgttcgt gtttatcgcc ctgggccggt ggctggaaca cctggccaaa
1560
agcaagacca gcgaggccct ggctaagctg atgagtctgc aggccaccga ggccacagtc
1620
gtgaccctgg gcgaggacaa cctgatcatc cgcgaggaac aggtgccaat ggaactggtg
1680
cagcggggcg acatcgtgaa ggtggtgcct ggcggcaagt tccccgtgga cggaaaagtg
1740
ctggaaggga ataccatggc cgacgagagc ctgatcacag gcgaggccat gcccgtgacc
1800
aagaaacctg gcagcacagt gatcgccggc agcatcaatg cccacggcag cgtgctgatt
1860
aaggccacac acgtgggcaa cgataccacc ctggctcaga ttgtgaagct ggtggaagag
1920
gcccagatga gcaaggcccc cattcagcag ctggctgacc ggttcagcgg ctacttcgtg
1980
ccctttatca tcatcatgag caccctgaca ctggtcgtgt ggatcgtgat cggctttatc
2040
gacttcggag tggtgcagag atacttcccc aaccctaaca agcacatcag ccagacagaa
2100
gtgatcatca gattcgcctt tcagaccagc atcaccgtgc tgtgtatcgc ctgcccctgt
2160
agcctgggac tggccacacc taccgctgtg atggtgggaa caggcgtggc cgctcagaac
2220
ggcatcctga tcaagggggg caagcctctg gaaatggctc acaagatcaa gaccgtgatg
2280
ttcgacaaga ccggcaccat cacccacggc gtgcccagag tgatgagagt gctgctgctg
2340
ggggatgtgg ccaccctgcc tctgagaaag gtgctggctg tcgtgggcac agccgaggct
2400
agctctgaac acccactggg agtggccgtg acaaagtact gcaaagagga actgggcacc
2460
gaaaccctgg gctactgcac cgactttcag gccgtgcctg gctgtggcat cggctgcaag
2520
gtgtccaacg tggaaggcat cctggcccac agcgagaggc cactgtctgc ccctgccagc
2580
cacctgaacg aggccggatc tctgcccgcc gaaaaggacg ctgtgcccca gaccttctct
2640
gtgctgattg gcaacagaga gtggctgcgg cggaacggcc tgaccatctc ctccgatgtg
2700
tccgacgcca tgaccgacca cgagatgaag ggccagaccg ccattctggt ggccattgac
2760
ggggtgctgt gcggcatgat cgcaatcgcc gatgccgtga aacaggaagc agcactggcc
2820
gtgcacaccc tgcagtctat gggagtggat gtggtgctga tcaccggcga caacagaaag
2880
accgccaggg ccattgccac ccaggtgggc atcaacaagg tgttcgccga ggtgctgccc
2940
agccacaaag tggccaaggt gcaggaactg cagaacaaag gcaaaaaggt ggccatggtg
3000
ggagatggcg tgaacgactc tcctgctctg gcccaggcag atatgggcgt ggccatcggc
3060
acaggcaccg acgtggcaat tgaggctgct gacgtggtgc tgattcggaa cgacctgctg
3120
gacgtggtgg cctccatcca cctgtccaag agaaccgtgc ggcggatcag aatcaacctg
3180
gtgctggcac tgatctataa cctcgtgggc atccctatcg ccgctggcgt gttcatgcct
3240
atcggaatcg tgctgcagcc ctggatgggc tctgccgcca tggctgcaag ctccgtgtct
3300
gtggtgctgt ccagcctgca gctgaagtgc tacaagaagc ccgacctgga aagatacgag
3360
gcccaggccc acggacacat gaagcctctg acagcctccc aggtgtccgt gcacatcggc
3420
atggacgaca gatggcggga cagccctaga gccacccctt gggatcaggt gtcatacgtg
3480
tcacaggtgt ccctgagcag cctgaccagc gacaagccca gcagacatag cgccgctgcc
3540
gacgacgatg gggacaagtg gtccctgctg ctgaacggcc gggatgagga acagtacatc
3600
tga
3603
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| КОНСТРУКЦИИ НУКЛЕИНОВОЙ КИСЛОТЫ И ВЕКТОРЫ ДЛЯ ГЕНОТЕРАПИИ ДЛЯ ПРИМЕНЕНИЯ ДЛЯ ЛЕЧЕНИЯ БОЛЕЗНИ ВИЛЬСОНА И ДРУГИХ СОСТОЯНИЙ | 2015 |
|
RU2745567C2 |
| РЕКОМБИНАНТНЫЕ AAV ВЕКТОРЫ, ЭКСПРЕССИРУЮЩИЕ ОСТЕОПРОТЕКТИВНЫЕ ГЕНЫ, ВКЛЮЧАЯ HAS2 И ЛУБРИЦИН, ПРИГОДНЫЕ ПРИ ЛЕЧЕНИИ ОСТЕОАРТРИТА И СХОДНЫХ ЗАБОЛЕВАНИЙ СУСТАВОВ У МЛЕКОПИТАЮЩИХ | 2017 |
|
RU2771490C2 |
| ГЕННАЯ ТЕРАПИЯ ДЛЯ ЛЕЧЕНИЯ ГЕМОФИЛИИ A | 2017 |
|
RU2762257C2 |
| НОВЫЕ НАЦЕЛИВАЮЩИЕ НА ПЕЧЕНЬ АДЕНОАССОЦИИРОВАННЫЕ ВИРУСНЫЕ ВЕКТОРЫ | 2019 |
|
RU2793735C2 |
| ВЕКТОРЫ НА ОСНОВЕ АДЕНОАССОЦИИРОВАННОГО ВИРУСА ДЛЯ ЛЕЧЕНИЯ МУКОЛИПИДОЗА ТИПА II | 2016 |
|
RU2742612C2 |
| ЛЕЧЕНИЕ КОМПЛЕМЕНТ-ОПОСРЕДУЕМЫХ РАССТРОЙСТВ | 2017 |
|
RU2768982C2 |
| СПОСОБЫ ВЫЯВЛЕНИЯ AAV | 2017 |
|
RU2771622C2 |
| ВАРИАНТЫ, НА ОСНОВЕ АДЕНОАССОЦИИРОВАННОГО ВИРУСА, СОСТАВЫ И СПОСОБЫ ДЛЯ ПУЛЬМОНАЛЬНОЙ ДОСТАВКИ | 2021 |
|
RU2829874C1 |
| Выделенная нуклеиновая кислота, которая кодирует слитый белок на основе FVIII-BDD и гетерологичного сигнального пептида, и ее применение | 2022 |
|
RU2818229C2 |
| ОПТИМИЗИРОВАННЫЕ ГЕНЫ И ЭКСПРЕССИОННЫЕ КАССЕТЫ МИНИ-ДИСТРОФИНА И ИХ ПРИМЕНЕНИЕ | 2017 |
|
RU2753194C2 |
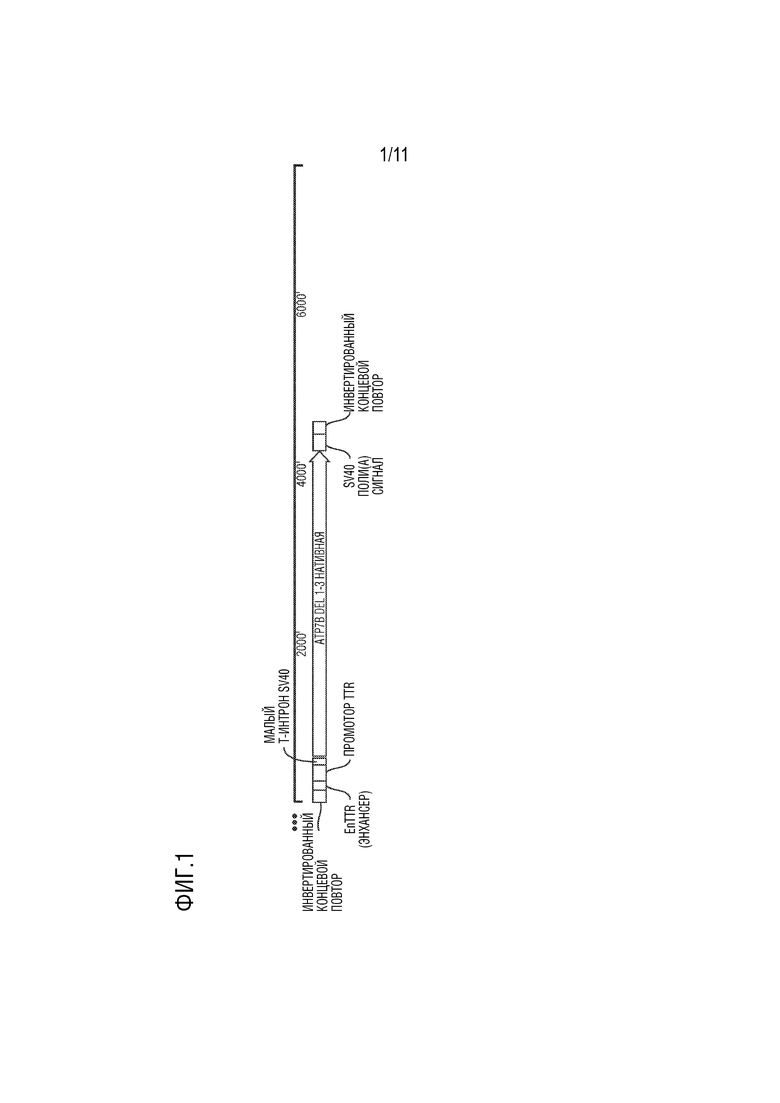
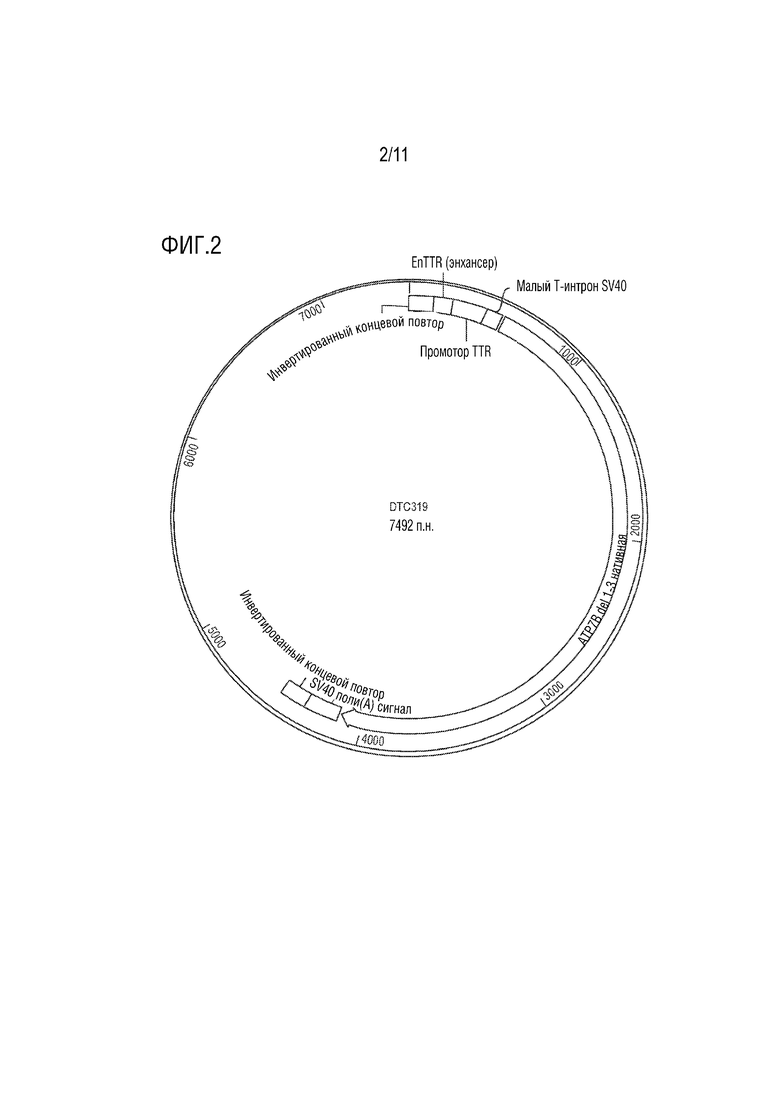
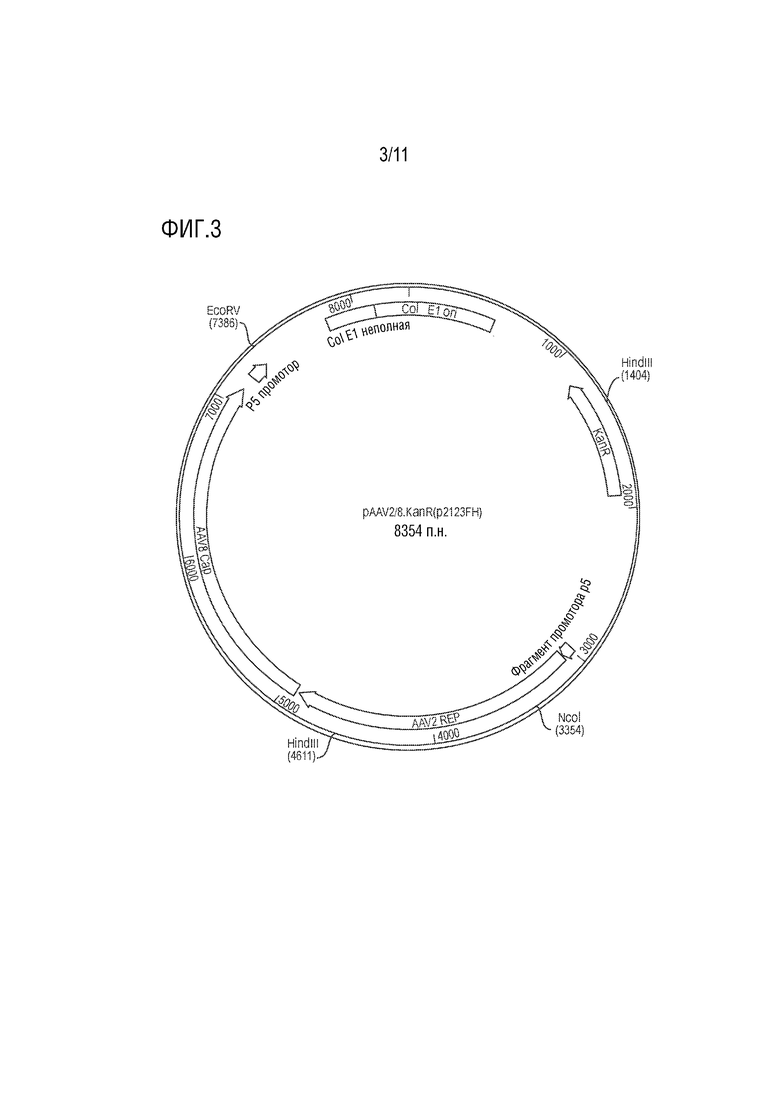
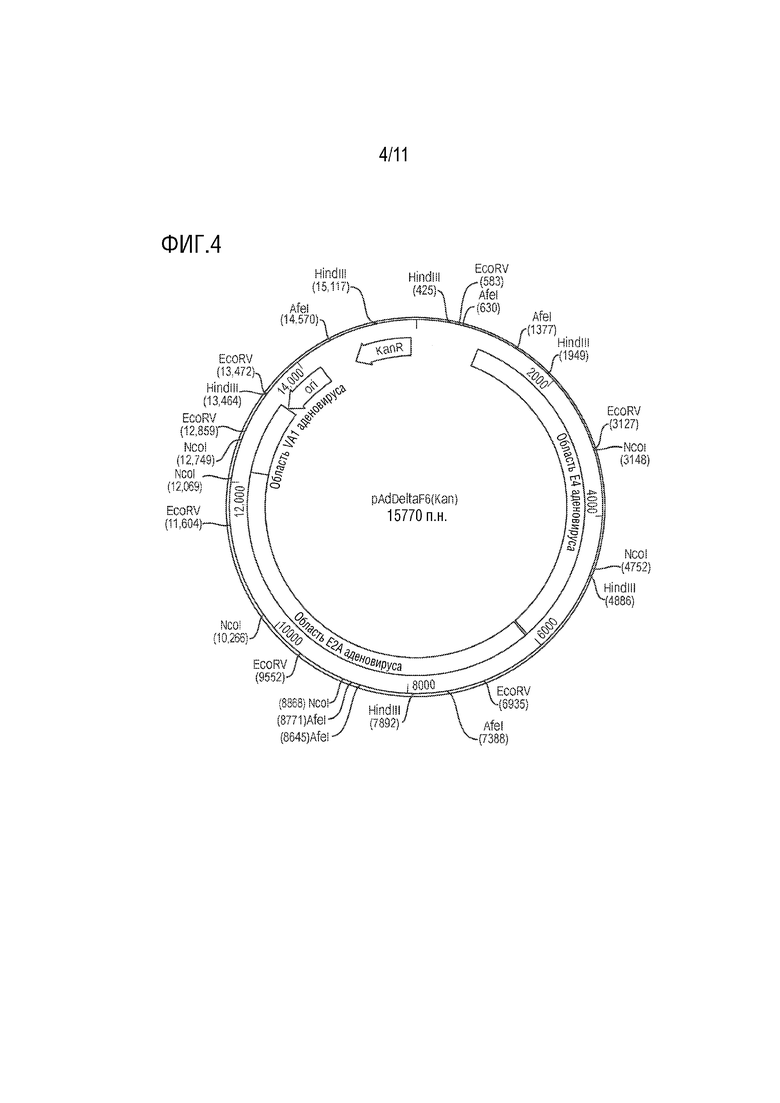
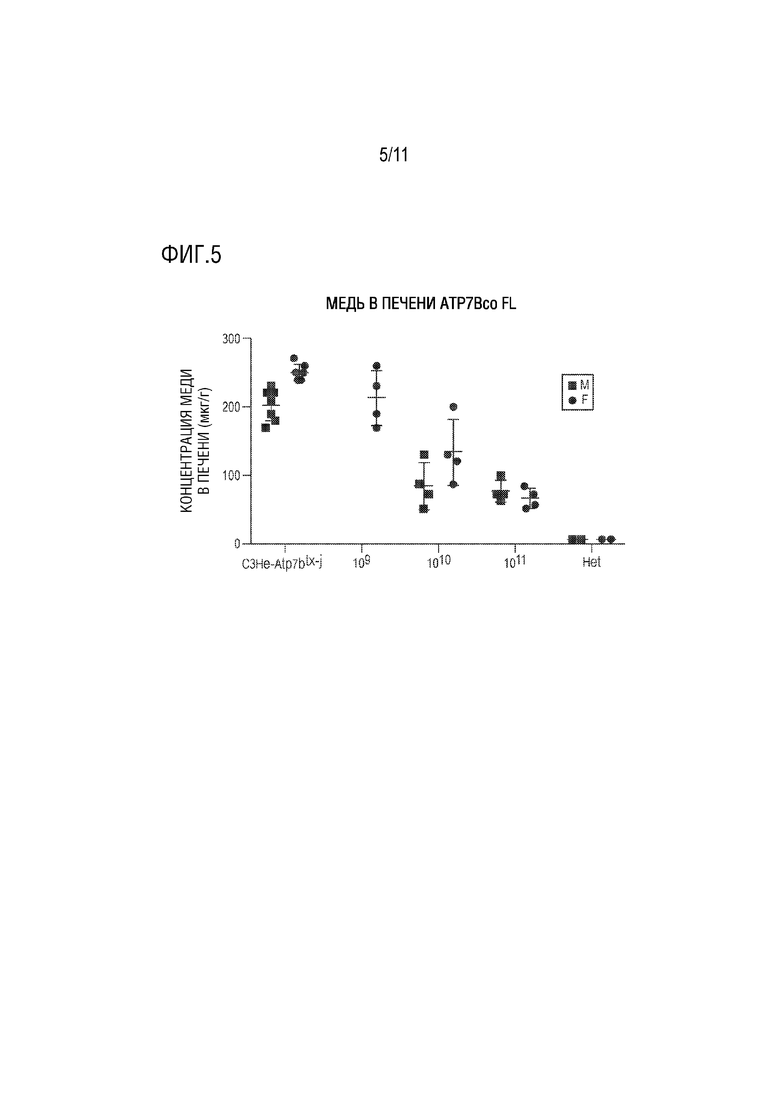
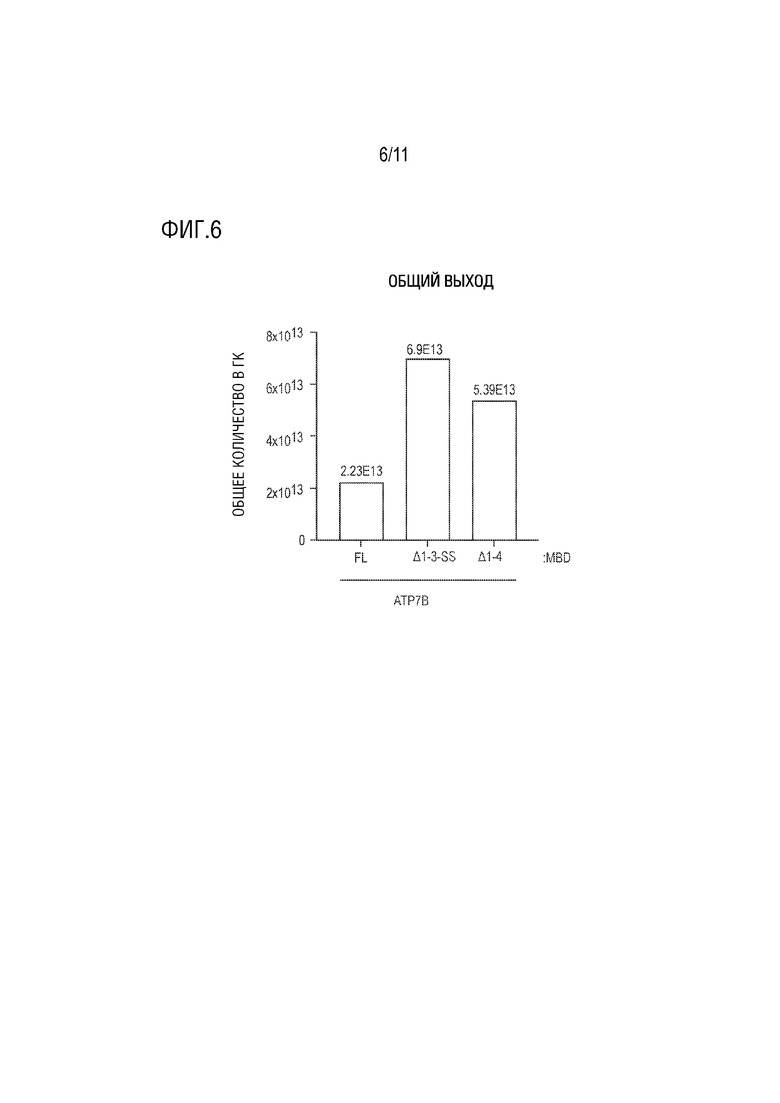
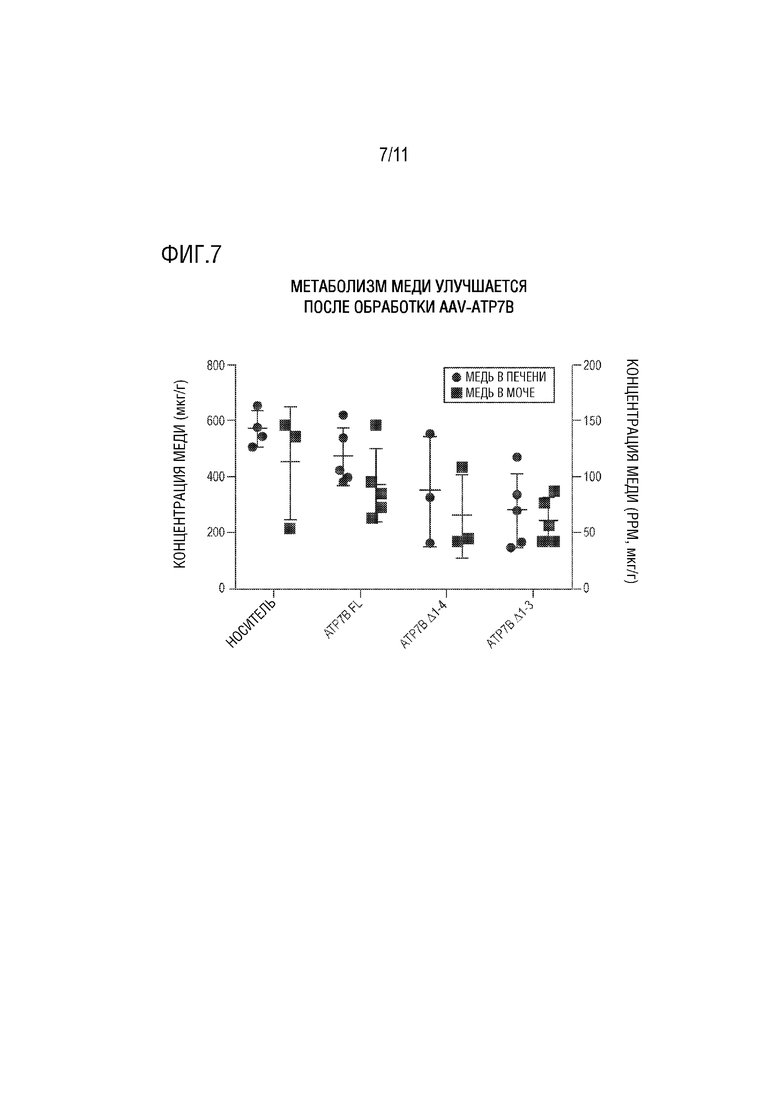
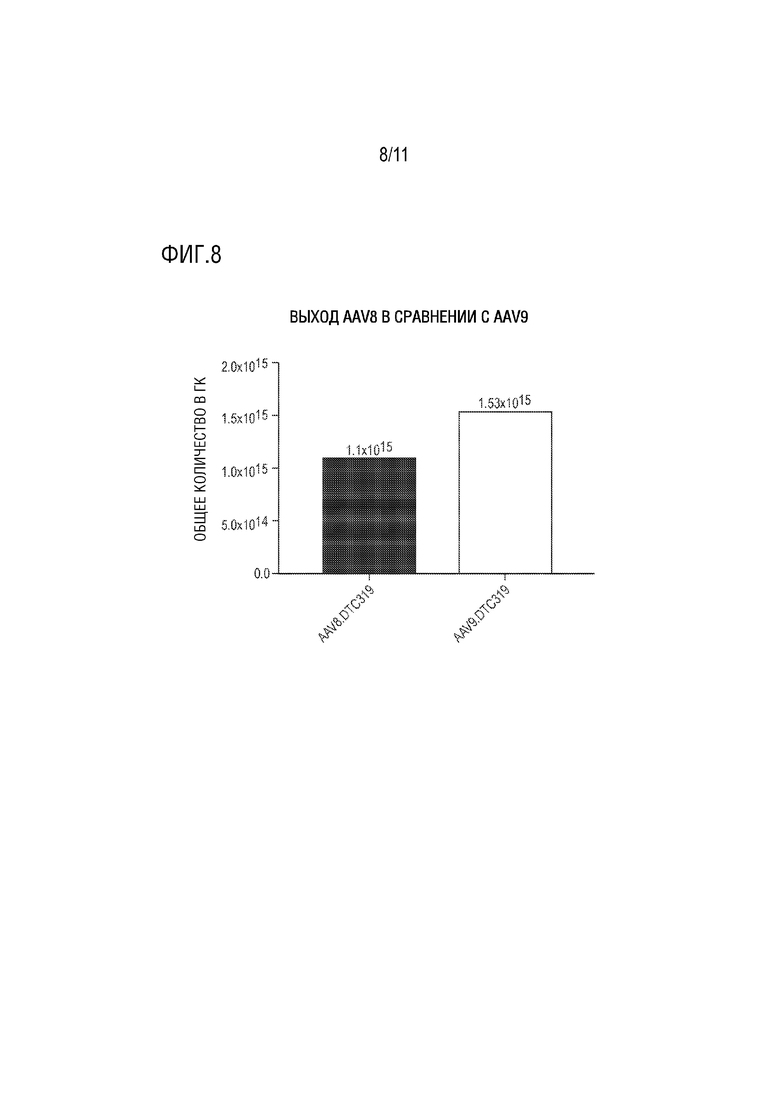
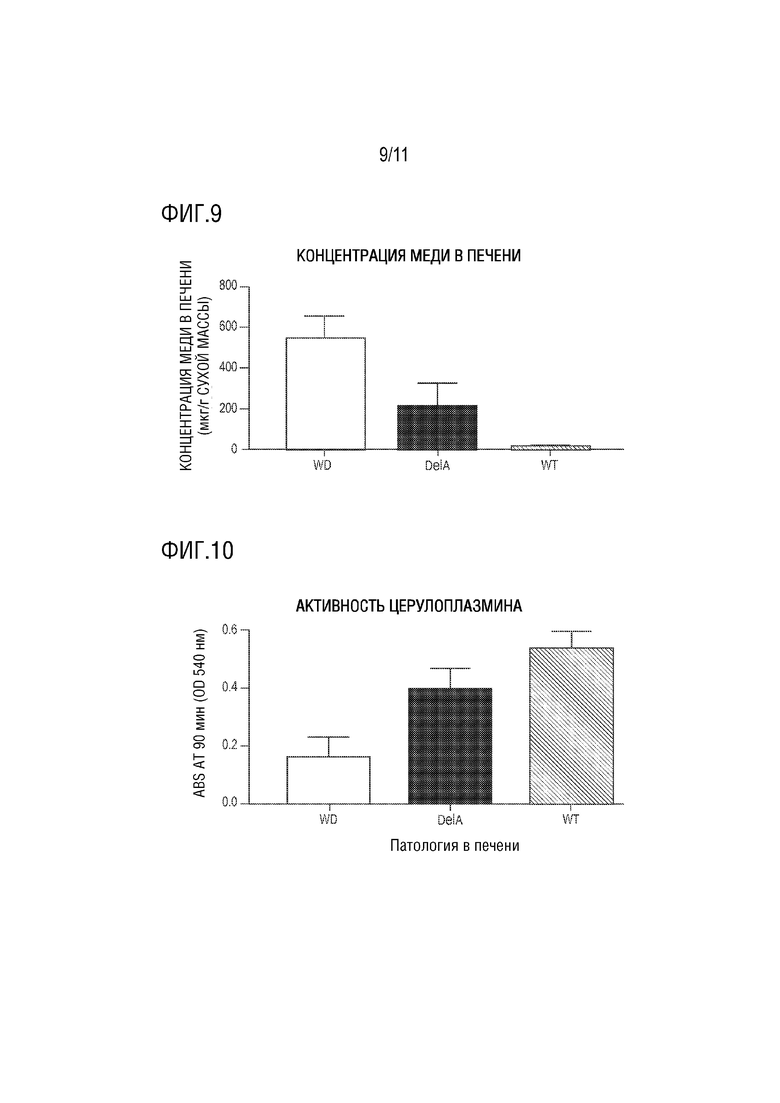
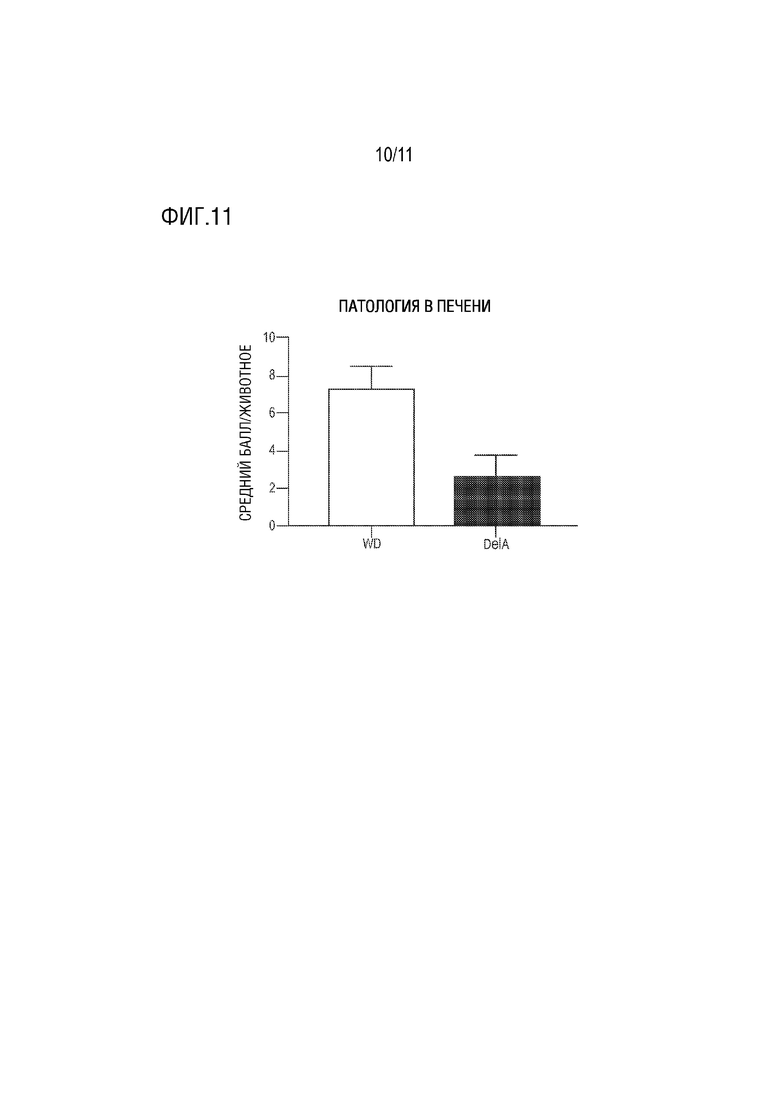
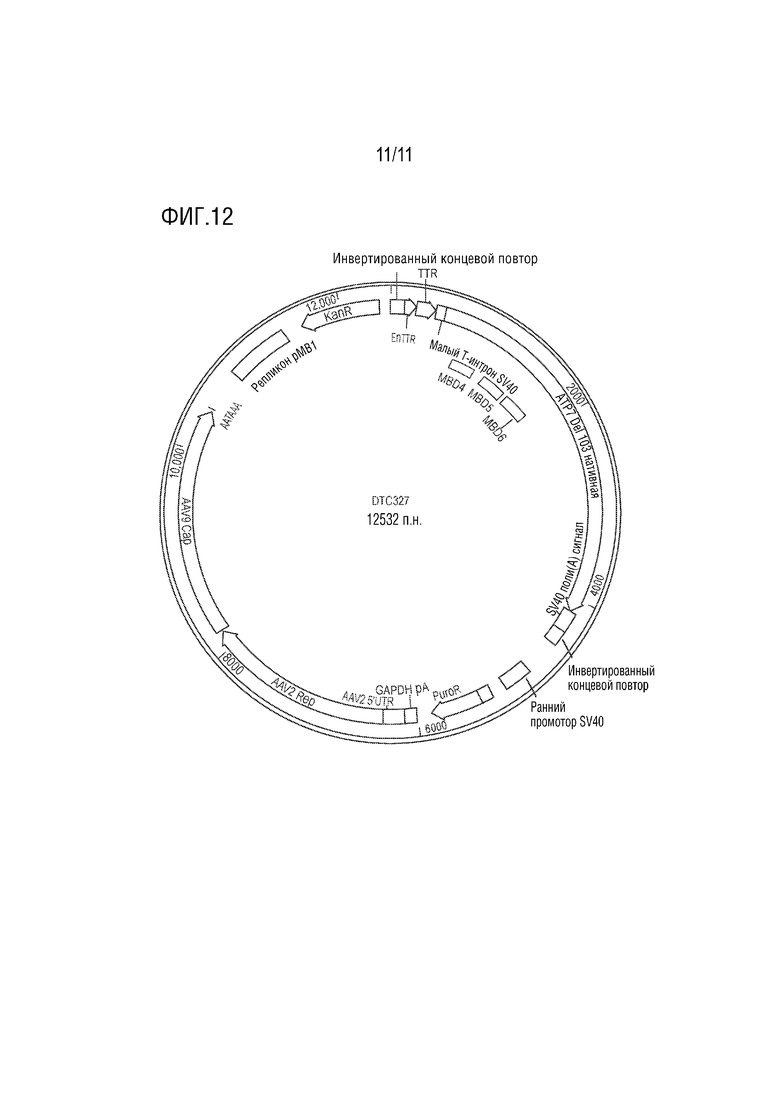
Изобретение относится к области биотехнологии, а именно к нуклеиновокислотной конструкции, содержащей последовательность 5’-инвертированного концевого повтора (ITR), последовательность промотора, последовательность нуклеиновой кислоты, кодирующей усеченную человеческую медь-транспортирующую АТФазу 2 (ATP7B), последовательность 3’-ITR, а также к композиции, ее содержащей. Изобретение эффективно для лечения болезни Вильсона. 5 н. и 15 з.п. ф-лы, 12 ил., 6 пр.
1. Рекомбинантная нуклеиновокислотная конструкция для лечения болезни Вильсона, содержащая:
(а) последовательность 5’-инвертированного концевого повтора (ITR);
(b) последовательность промотора;
(c) последовательность нуклеиновой кислоты, кодирующей усеченную человеческую медь-транспортирующую АТФазу 2 (ATP7B), в которой делецированы металл-связывающие домены (MBD) 1-3, но присутствует серин-богатая петля, включающая остатки серина S340 и S341 между MBD3 и MBD4; и
(d) последовательность 3’-ITR.
2. Рекомбинантный аденоассоциированный вирус (rAAV) для лечения болезни Вильсона, где указанный rAAV включает капсид AAV и упакованный в него векторный геном, где указанный векторный геном включает:
а) последовательность AAV 5’-инвертированного концевого повтора (ITR);
b) последовательность промотора;
c) последовательность нуклеиновой кислоты, кодирующей усеченную человеческую медь-транспортирующую АТФазу 2 (ATP7B), в которой делецированы металл-связывающие домены (MBD) 1-3, но присутствует серин-богатая петля, включающая остатки серина S340 и S341 между MBD3 и MBD4; и
d) последовательность AAV 3’-ITR.
3. rAAV по п.2, где капсид AAV происходит из AAV серотипа 9, 8, 1, 2, 3, 4, 5, 6, 7, 10, 11, 12, rh10 или hu37.
4. rAAV по любому из пп.2 или 3, где последовательность промотора выбрана из последовательности промотора транстиретина (TTR), последовательности промотора куриного β-актина (CBA), последовательности немедленного раннего промотора гена цитомегаловируса (CMV), последовательности промотора тироксинсвязывающего глобулина (TBG), последовательности промотора альфа-1-антитрипсина (A1AT) и последовательности промотора CAG.
5. rAAV по любому из пп.2-4, где последовательность 5’-ITR AAV и/или последовательность 3’-ITR AAV происходят из AAV2.
6. rAAV по любому из пп.2-4, где последовательность 5’-ITR AAV и/или последовательность 3’-ITR AAV происходят из источника, отличного от AAV2.
7. rAAV по любому из пп.2-6, где векторный геном дополнительно содержит одну или более энхансерных последовательностей, выбранных из последовательности энхансера транстиретина (enTTR), последовательности немедленного раннего энхансера гена цитомегаловируса (CMV), последовательности энхансера куриного β-актина (CBA), последовательности энхансера En34 и последовательности энхансера аполипопротеина (ApoE).
8. rAAV по п.7, где последовательность энхансера расположена апстрим от промоторной последовательности.
9. rAAV по любому из пп.2-8, где векторный геном дополнительно содержит одну или более интронных последовательностей.
10. rAAV по п.9, где последовательность интрона выбрана из последовательности малого Т-интрона SV40, последовательности интрона бета-субъединицы кроличьего гемоглобина (rHBB), последовательности интрона IVS2 человеческого бета-глобина, последовательности химерного интрона Promega или последовательности интрона hFIX.
11. rAAV по любому из пп.2-10, где векторный геном дополнительно содержит сигнальную последовательность полиаденилирования.
12. rAAV по п.11, где сигнальная последовательность полиаденилирования выбрана из сигнальной последовательности полиаденилирования SV40, сигнальной последовательности полиаденилирования бычьего гормона роста (BGH) и сигнальной последовательности полиаденилирования бета-глобина кролика.
13. rAAV для лечения болезни Вильсона, содержащий капсид AAV и упакованный в нем векторный геном, где указанный векторный геном содержит:
а) последовательность AAV 5’-инвертированного концевого повтора (ITR) с SEQ ID NO: 2;
b) последовательность энхансера SEQ ID NO: 3;
c) последовательность промотора SEQ ID NO: 12;
d) последовательность нуклеиновой кислоты, кодирующую усеченную человеческую медь-транспортирующую АТФазу 2 (ATP7B) SEQ ID NO: 1 или SEQ ID NO: 15; и
е) 3’-ITR AAV из SEQ ID NO: 2.
14. Композиция для лечения болезни Вильсона, содержащая rAAV по любому из пп.2-13 и фармацевтически приемлемый носитель.
15. Способ лечения болезни Вильсона у человека-субъекта, включающий введение человеку-субъекту терапевтически эффективного количества rAAV по любому из пп.2-13.
16. Способ по п.15, где rAAV вводят подкожно, внутримышечно, внутрикожно, внутрибрюшинно или внутривенно.
17. Способ по любому из пп.15 или 16, где rAAV вводят в дозе примерно от 1×1011 геномных копий (гк)/кг до примерно 1×1014 гк/кг.
18. Способ по п.17, где rAAV вводят в дозе примерно от 1×1012 гк/кг до примерно 1×1013 гк/кг.
19. Способ по любому из пп.15-18, где введение rAAV включает введение разовой дозы rAAV.
20. Способ по любому из пп.15-18, где введение rAAV включает введение нескольких доз rAAV.
| WO 2016097219 A1, 23.06.2016 | |||
| WO 2018126116 A1, 05.07.2018 | |||
| MEE Y | |||
| BARTEE et al., The Loop Connecting Metal-Binding Domains 3 and 4 of ATP7B Is a Target of a Kinase-Mediated Phosphorylation, Biochemistry, 2009 June 23; 48(24): 5573-5581 | |||
| Печь-кухня, могущая работать, как самостоятельно, так и в комбинации с разного рода нагревательными приборами | 1921 |
|
SU10A1 |
| NESRIN M | |||
| HASAN et al., Molecular Events Initiating Exit of a Copper-transporting | |||
Авторы
Даты
2023-11-10—Публикация
2020-01-03—Подача