ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение относится к кристаллической форме ((S)-2,2-дифторциклопропил)-((1R,5S)-3-(2-((1-метил-1H-пиразол-4-ил)амино)пиримидин-4-ил)-3,8-диазабицикло[3.2.1]-октан-8-ил)метанона. Настоящее изобретение также относится к фармацевтическим композициям, содержащим кристаллическую форму, и к способам получения таких форм. Настоящее изобретение также относится к применению кристаллической формы для лечения разных заболеваний и к способам ее получения.
УРОВЕНЬ ТЕХНИКИ
((S)-2,2-Дифторциклопропил)-((1R,5S)-3-(2-((1-метил-1H-пиразол-4-ил)амино)-пиримидин-4-ил)-3,8-диазабицикло[3.2.1]октан-8-ил)метанон обладает химической формулой C18H21F2N7O и следующей структурной формулой:
Синтез ((S)-2,2-дифторциклопропил)-((1R,5S)-3-(2-((1-метил-1H-пиразол-4-ил)амино)-пиримидин-4-ил)-3,8-диазабицикло[3.2.1]октан-8-ил)метанона описан в принадлежащей тому же правообладателю заявке US9663526, содержание которой во всей его полноте включено в настоящее изобретение в качестве ссылки. Кристаллическая форма свободного основания ((S)-2,2-дифторциклопропил)-((1R,5S)-3-(2-((1-метил-1H-пиразол-4-ил)амино)-пиримидин-4-ил)-3,8-диазабицикло[3.2.1]-октан-8-ил)метанона применима в качестве ингибитора протеинкиназ, таких как фермент киназа Janus (JAK), и сама по себе применима в терапии в качестве иммуносупрессорного средства при трансплантации органа, ксенотрансплантации, волчанке, рассеянном склерозе, ревматоидном артрите, псориатическом артрите, воспалительной болезни кишечника (IBD), псориазе, диабете типа I и осложнениях при диабете, раке, астме, атопическом дерматите, аутоиммунных нарушениях щитовидной железы, язвенном колите, болезни Крона, болезни Альцгеймера, лейкозе и других показаниях, когда желательна иммуносупрессия. Настоящее изобретение относится к новой твердой форме свободного основания, которая улучшенными характеристиками для применения при получении фармацевтической дозированной формы.
На основании химической структуры невозможно с какой-либо определенностью предсказать, будет ли соединение кристаллизоваться, при каких условиях оно будет кристаллизоваться, сколько кристаллических твердых форм соединения может существовать или предсказать твердофазную структуру какой-либо из этих форм. Ключевыми характеристиками любого кристаллического лекарственного средства является полиморфное поведение такого вещества. Обычно кристаллические формы лекарственных средств предпочтительнее, чем некристаллические формы лекарственных средств, в частности, вследствие их превосходной стабильности. Например, во многих случаях некристаллическое лекарственное средство при хранении превращается в кристаллическую форму лекарственного средства. Поскольку некристаллические и кристаллические формы лекарственного средства обычно обладают разными физическими характеристиками и химическими характеристиками, такое взаимопревращение может быть нежелательным по соображениям безопасности при фармацевтическом использовании. Разные физические характеристики разных твердых форм фармацевтического соединения могут повлиять на важные фармацевтические параметры, такие как хранение, прессуемость, плотность (важна при составлении и приготовлении продукта) и скорости растворения (важны для определения биодоступности). Различия в стабильности могут быть обусловлены изменениями химической реакционной способности (например, разными параметрами гидролиза или окисления, так что дозированная форма, содержащая некоторый полиморф, может обесцвечиваться быстрее, чем дозированная форма, содержащая другой полиморф), механическими изменениями (например, таблетки могут крошиться при хранении, поскольку кинетически более благоприятная кристаллическая форма превращается в термодинамически более стабильную кристаллическую форму) или и теми, и другими (например, таблетки одного полиморфа могут быть более склонны к разрушению при высокой влажности).
Различия в растворимости полиморфов в экстремальных ситуациях могут привести к переходам в кристаллические формы, которые не обладают активностью. Кроме того, физические характеристики кристаллической формы также могут быть важными для фармацевтической обработки. Например, конкретная кристаллическая форма может легче образовывать сольваты или ее может быть труднее отфильтровывать или отмывать от примесей, чем другие кристаллические формы (т. е. форма и распределение по размерам частиц могут быть разными для разных кристаллических форм).
Обычно не существует идеальной физической формы лекарственного средства, поскольку разные физические формы характеризуются разными преимуществами. Поиск наиболее стабильной формы затруднителен и результат непредсказуем. Таким образом, важен поиск множества форм конкретного лекарственного средства, например, солей, полиморфов, некристаллических форм, которые можно использовать в разных препаратах. Для выбора формы лекарственного средства для конкретного препарата или терапевтического применения необходимо рассмотрение разных характеристик и наилучшей формой для конкретного применения может быть такая, которая обладает одной конкретной хорошей характеристикой, а другие характеристики могут быть приемлемыми или минимально приемлемыми.
Для успешной разработки лекарственного средства необходимо, чтобы оно соответствовало некоторым общим требованиям для обеспечения терапевтически эффективного лечения пациентов. Эти требования разделяются на две категории: (1) требования для успешного изготовления дозированных форм и (2) требования для успешной доставки и распределения лекарственного средства после введения препарата лекарственного средства пациенту.
Разные кристаллические твердые формы одного и того же соединения часто обладают разными твердофазными характеристиками, такими как температура плавления, растворимость, скорость растворения, гигроскопичность, сыпучесть порошка, механические характеристики, химическая стабильность и физической стабильность. Эти твердофазные характеристики могут обеспечить преимущества при фильтровании, сушке и операциях установки для приготовления дозированной формы. Таким образом, после того, как идентифицированы разные кристаллические твердые формы одного и того же соединения, можно определить оптимальную для данного набора условий приготовления и обработки кристаллическую твердую форму, а также разные твердофазные характеристики каждой кристаллической твердой формы.
Полиморфы молекулы можно получить с помощью целого ряда методик, известных в данной области техники. Такие методики включают, но не ограничиваются только ими, перекристаллизацию из расплава, охлаждение расплава, перекристаллизацию из растворителя, десольватацию, быстрое выпаривание, быстрое охлаждение, медленное охлаждение, диффузию паров и возгонку. Полиморфы можно обнаружить, идентифицировать, классифицировать и охарактеризовать по хорошо известным методикам, таким как, но не ограничиваясь только ими, дифференциальная сканирующая калориметрия (DSC), термогравиметрия (TGA), порошковая рентгенография (XRPD), рентгенография монокристалла, твердофазный ядерный магнитный резонанс (NMR), инфракрасная (IR) спектроскопия, спектроскопия комбинационного рассеяния света и высокотемпературная оптическая микроскопия.
Настоящее изобретение относится к кристаллической форме свободного основания ((S)-2,2-дифторциклопропил)((1R,5S)-3-(2-((1-метил-1H-пиразол-4-ил)амино)пиримидин-4-ил)-3,8-диазабицикло[3.2.1]октан-8-ил)метанона. Настоящее изобретение также относится к композициям, включая фармацевтические композиции, содержащие кристаллическое свободное основание ((S)-2,2-дифторциклопропил)((1R,5S)-3-(2-((1-метил-1H-пиразол-4-ил)амино)пиримидин-4-ил)-3,8-диазабицикло[3.2.1]октан-8-ил)метанона. Настоящее изобретение также относится к способам получения кристаллического свободного основания ((S)-2,2-дифторциклопропил)((1R,5S)-3-(2-((1-метил-1H-пиразол-4-ил)амино)пиримидин-4-ил)-3,8-диазабицикло[3.2.1]октан-8-ил)метанона.
Поскольку постоянно ведут поиск препаратов лекарственного средства, характеризующихся, например, улучшенной биодоступностью или стабильностью, постоянно необходимы новые или более чистые полиморфные формы молекул лекарственного средства. Полиморф ((S)-2,2-дифторциклопропил)((1R,5S)-3-(2-((1-метил-1H-пиразол-4-ил)амино)-пиримидин-4-ил)-3,8-диазабицикло[3.2.1]октан-8-ил)метанона, описанный в настоящем изобретении, помогает решить эти и другие задачи.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к кристаллической форме ((S)-2,2-дифторциклопропил)-((1R,5S)-3-(2-((1-метил-1H-пиразол-4-ил)амино)-пиримидин-4-ил)-3,8-диазабицикло[3.2.1]-октан-8-ил)метанона.
Одним объектом настоящего изобретения является кристаллическая форма ((S)-2,2-дифторциклопропил)((1R,5S)-3-(2-((1-метил-1H-пиразол-4-ил)амино)пиримидин-4-ил)-3,8-диазабицикло[3.2.1]октан-8-ил)метанона, обладающая одной или большим количеством характеристик, выбранных из группы, состоящей из следующих:
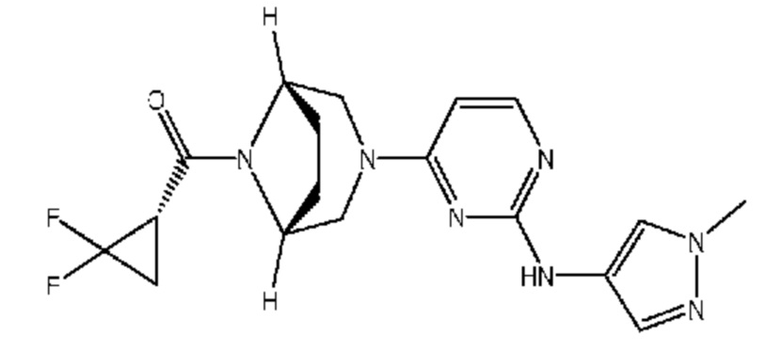
I) порошковая рентгенограмма, включающая: (a) один, два, три, четыре, пять или более пяти пиков, выбранных из группы, состоящей из пиков, приведенных в таблице 1, выраженных °2θ±0,2°2θ; (b) один, два, три, четыре, пять или более пяти характеристических пиков, выбранных из группы, состоящей из пиков, приведенных в таблице 1, выраженных в °2θ±0,2°2θ; или (c) пиков при значениях 2θ, в основном таких, как приведенные на фиг. 1;
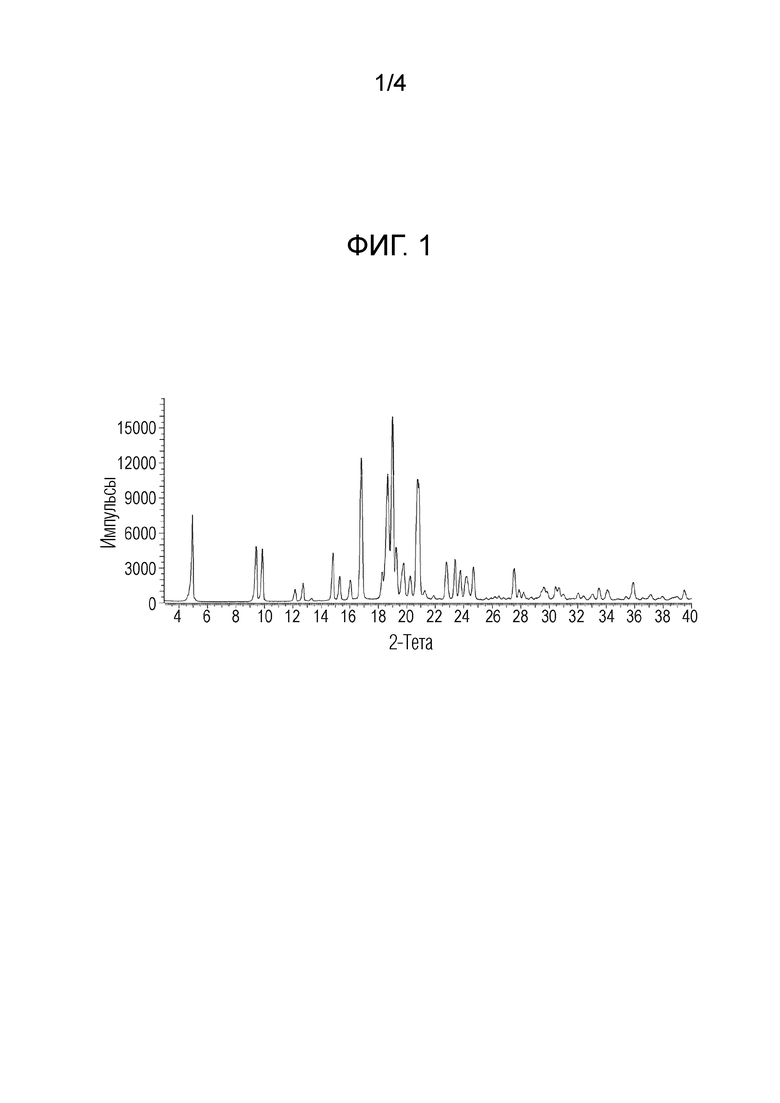
II) спектр комбинационного рассеяния, включающий: (a) одно, два, три, четыре, пять или более пяти значений волновых чисел (см-1), выбранных из группы, состоящей из значений, приведенных в таблице 2, выраженных в см-1±2 см-1; (b) одно, два, три, четыре, пять или более пяти значений волновых чисел (см-1), выбранных из группы, состоящей из характеристических значений, приведенных в таблице 2, выраженных в см-1±2 см-1; или (c) значений волновых чисел (см-1) , в основном таких, как приведенные на фиг. 2;
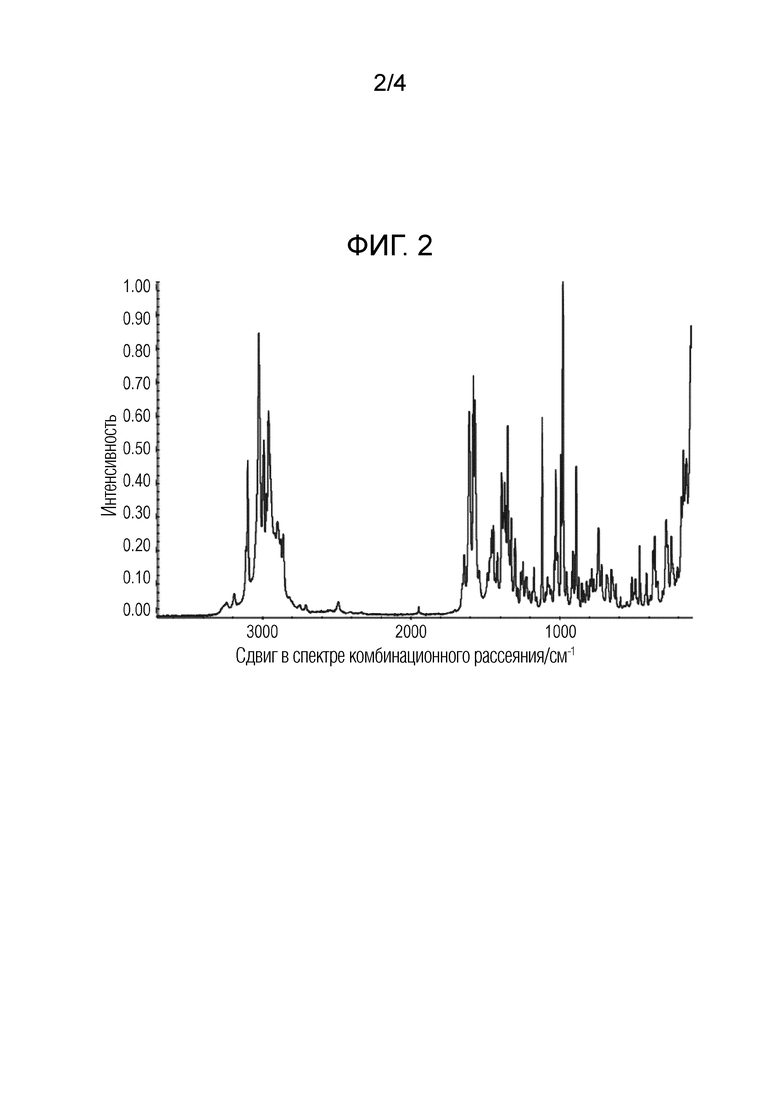
III) 13C твердофазный NMR спектр (част./млн.), включающий: (a) одно, два, три, четыре, пять или более пяти значений резонансов (част./млн.), выбранных из группы, состоящей из значений, приведенных в таблице 3, выраженных в част./млн.±0,2 част./млн.; (b) одно, два, три, четыре, пять или более пяти значений резонансов (част./млн.), выбранных из группы, состоящей из характеристических значений, приведенных в таблице 3, выраженных в част./млн.±0,2 част./млн.; или (c) значения резонансов (част./млн.), в основном таких, как приведенные на фиг. 3;
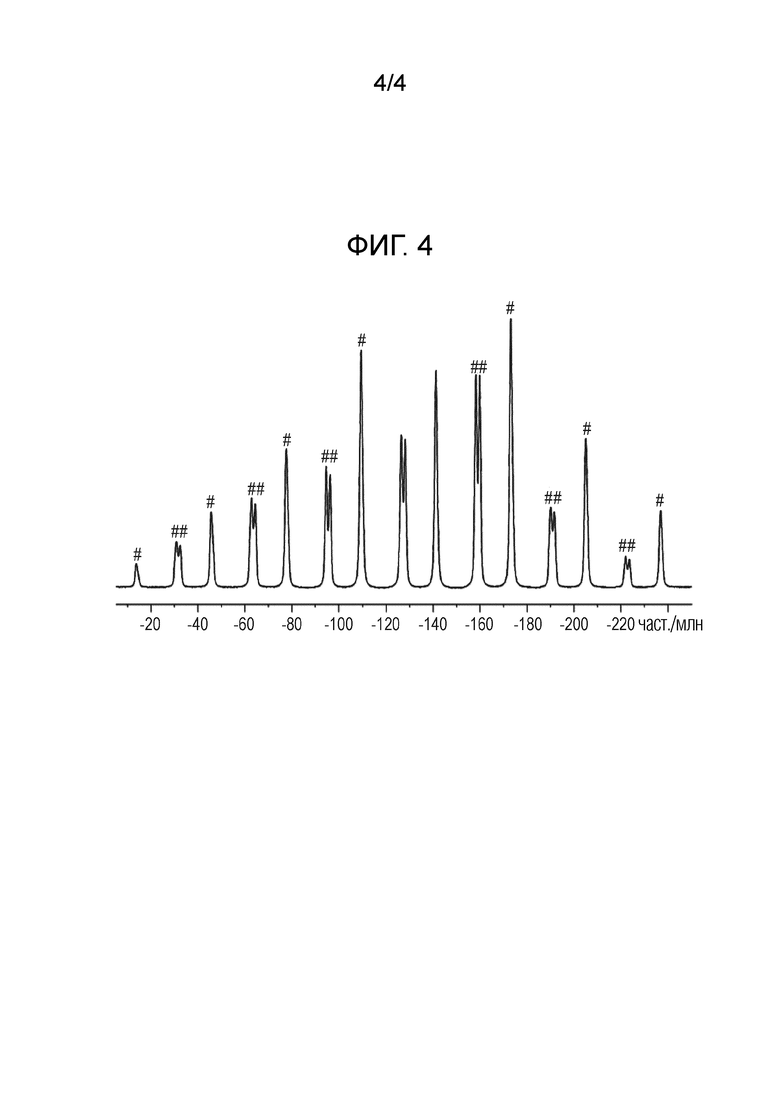
IV) твердофазный 19F спектр (част./млн), включающий: (a) одно, два или три значения резонансов (част./млн.), выбранных из группы, состоящей из значений, приведенных в таблице 4, выраженных в част./млн.±0,2 част./млн.; (b) характеристических значений, приведенных в таблице 3, выраженных в част./млн.±0,2 част./млн.; или (c) значения резонансов (част./млн.), в основном таких, как приведенные на фиг. 3; и
V) комбинация любых двух, трех или четырех из предшествующих вариантов осуществления (I)(a)-(c), (II)(a)-(c), (III)(a)-(c) или (IV)(a)-(c), при условии, что они не являются несогласующимися друг с другом.
Другим объектом настоящего изобретения является кристаллическая форма по любому из вариантов осуществления, описанных в настоящем изобретении, кристаллизованная из системы растворителей, которая могла включать ацетон, метилизобутилкетон, 2-пропанол, метанол, этанол, воду или тетрагидрофуран.
Другим объектом настоящего изобретения также является фармацевтическая композиция, содержащая кристаллический ((S)-2,2-дифторциклопропил)-((1R,5S)-3-(2-((1-метил-1H-пиразол-4-ил)амино)пиримидин-4-ил)-3,8-диазабицикло[3.2.1]октан-8-ил)метанон фармацевтически приемлемый носитель или инертный наполнитель.
Другим объектом настоящего изобретения также является способ лечения заболевания у млекопитающего, включающий введение нуждающемуся в нем млекопитающему терапевтически эффективного количества кристаллического ((S)-2,2-дифторциклопропил)((1R,5S)-3-(2-((1-метил-1H-пиразол-4-ил)амино)пиримидин-4-ил)-3,8-диазабицикло-[3.2.1]октан-8-ил)-метанон или его фармацевтически приемлемой соли или фармацевтической композиции по любому из вариантов осуществления, описанных в настоящем изобретении, указанное заболевание выбрано из группы, включающей ревматоидный артрит, волчанку, псориаз, псориатический артрит, атопический дерматити воспалительную болезнь кишечника.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
На фиг. 1 приведена порошковая рентгенограмма кристаллической формы ((S)-2,2-дифторциклопропил)((1R,5S)-3-(2-((1-метил-1H-пиразол-4-ил)амино)пиримидин-4-ил)-3,8-диазабицикло[3.2.1]октан-8-ил)метанона.
На фиг. 2 приведен спектр комбинационного рассеяния кристаллической формы ((S)-2,2-дифторциклопропил)((1R,5S)-3-(2-((1-метил-1H-пиразол-4-ил)амино)-пиримидин-4-ил)-3,8-диазабицикло[3.2.1]октан-8-ил)метанона.
На фиг. 3 приведен твердофазный спектр 13C ядерного магнитного резонанса кристаллической формы ((S)-2,2-дифторциклопропил)((1R,5S)-3-(2-((1-метил-1H-пиразол-4-ил)амино)пиримидин-4-ил)-3,8-диазабицикло[3.2.1]октан-8-ил)метанона. Боковые полосы вращения отмечены звездочкой.
На фиг. 4 приведен твердофазный спектр 19F ядерного магнитного резонанса кристаллической формы ((S)-2,2-дифторциклопропил)((1R,5S)-3-(2-((1-метил-1H-пиразол-4-ил)амино)пиримидин-4-ил)-3,8-диазабицикло[3.2.1]октан-8-ил)метанона. Боковые полосы вращения отмечены звездочкой.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к кристаллической форме ((S)-2,2-дифторциклопропил)((1R,5S)-3-(2-((1-метил-1H-пиразол-4-ил)амино)пиримидин-4-ил)-3,8-диазабицикло[3.2.1]октан-8-ил)метанона. Настоящее изобретение также относится к фармацевтическим композициям, содержащим кристаллическую форму, и к способам получения таких форм. Настоящее изобретение также относится к применению кристаллической формы для лечения разных заболеваний.
Существует целый ряд методик анализа, которые специалист с общей подготовкой в области химии твердого тела может использовать для анализа твердых форм. Термин "анализ" при использовании в настоящем изобретении означает получение информации о твердофазной структуре твердых форм. Например, порошковая рентгенография является подходящей методикой для установления отличий аморфных твердых форм от кристаллических твердых форм, проведения различий между кристаллическими формами и для характеризации и идентификации кристаллических твердых форм соединения. Порошковая рентгенография также является подходящей для количественного определения содержания кристаллической твердой формы (или форм) в смеси. В порошковой рентгенографии рентгеновское излучение направлено на порошок, содержащий кристаллы, и интенсивность дифрагированного рентгеновского излучения измеряют в зависимости от угла между источником рентгеновского излучения и пучком, дифрагированным образцом. Интенсивность этого дифрагированного рентгеновского излучения можно представить графически в виде пиков, где на оси x отложен удвоенный угол (также известный, как угол "2θ") между источником рентгеновского излучения и дифрагированным рентгеновским излучением и на оси y отложена интенсивность дифрагированного рентгеновского излучения. Этот график называют порошковой рентгенограммой. Разные кристаллические твердые формы обладают разными порошковыми рентгенограммами, поскольку положения пиков по оси x является характеристикой твердофазной структуры кристалла.
Такие порошковые рентгенограммы или их части можно использовать в качестве характерных признаков кристаллической твердой формы. Таким образом, можно взять порошковую рентгенограмму неизвестного образца и сопоставить эту порошковую рентгенограмму с эталонной порошковой рентгенограммой. Точное совпадение означает, что неизвестный образец является такой же кристаллической твердой формой, как эталон. Также можно проанализировать неизвестный образец, содержащий смесь твердых форм, путем добавления и вычитания порошковых рентгенограмм известных соединений.
При выборе пиков на порошковой рентгенограмме для характеризации кристаллической твердой формы или при использовании эталонной порошковой рентгенограммы для идентификации формы идентифицируют пик или набор пиков одной формы, которые не содержатся на порошковых рентгенограммах других твердых форм.
Термин "характеризовать" при использовании в настоящем изобретении означает проведение выбора подходящего набора данных, способных обеспечить отличие одной твердой формы от другой. Этот набор данных в порошковой рентгенографии состоит из положений одного или большего количества пиков. Выбор на порошковой рентгенограмме пиков, определяющих конкретную форму, является указанной характеризацией этой формы.
Термин "идентификация" при использовании в настоящем изобретении означает проведение выбора характеристических данных для твердой формы и использование этих данных для определения того, содержится ли эта форма в образце. В порошковой рентгенографии этими данными являются положение на оси x одного или большего количества пиков, характеризующих рассматриваемую форму, как рассмотрено выше. Например, после установления того, что некоторое количество пиков дифракции рентгеновских лучей характеризует конкретную твердую форму, можно использовать эти пики для определения того, содержится ли эта форма в образце.
При характеризации и/или идентификации кристаллических твердых форм одного и того же химического соединения с помощью порошковой рентгенографии, часто не требуется использовать всю порошковую рентгенограмму. Для проведения характеризации и/или идентификации часто можно использовать меньшую часть всей порошковой рентгенограммы. Путем выбора набора пиков, которые отличают кристаллическую твердую форму от других кристаллических твердых форм соединения, можно использовать эти пики для характеризации формы и для идентификации формы, например, в неизвестной смеси. Можно добавить дополнительные данные, такие как данные другой аналитической методики или дополнительные пики порошковой рентгенограммы для характеризации и/или идентификации формы, например, дополнительных полиморфов, идентифицируемых позднее.
Вследствие различий приборов и приготовления образцов значения для пиков иногда приведены с расположенным перед значениями для пиков словом "примерно". Это является обычной практикой в химии твердого тела, поскольку эти изменения присущи значениям для пиков. Типичная точность значения 2θ для пика по оси x на порошковой рентгенограмме составляет порядка±0,2° 2θ. Таким образом, пик на порошковой рентгенограмме, который находится при "примерно 9,2° 2θ", означает, что пик может находится в диапазоне от 9,0° 2θ до 9,4° 2θ при определении с помощью большинства рентгеновских дифрактометров при большинстве условий. Изменчивость интенсивностей пиков является следствием того, какова ориентация отдельных кристаллов в контейнере с образцом по отношению к наружному источнику рентгеновского излучения (известное, как "предпочтительная ориентация "). Этот эффект ориентации не дает информацию о структуре кристалла. Порошковая рентгенография является лишь одной из разных методик, которые можно использовать для характеризации и/или идентификации кристаллических твердых форм. Спектроскопические методики, такие как спектроскопию комбинационного рассеяния (включая микроскопическую спектроскопию комбинационного рассеяния), инфракрасную и твердофазную NMR спектроскопии можно использовать для характеризации и/или идентификации кристаллических твердых форм. Эти методики также можно использовать определения количества одной или большего количества кристаллических твердых форм в смеси и значения для пиков также могут быть приведены с расположенным перед значениями для пиков словом "примерно". Типичные колебания значений для пиков при исследовании с помощью FT-спектроскопия комбинационного рассеяния и FT-инфракрасная спектроскопия составляют порядка±2 см-1. Типичные колебания значений для пиков для 13C или 19F химического сдвига для кристаллического материала составляет порядка ±0,2 част./млн. Типичные колебания значения температуры начала в дифференциальной сканирующей калориметрии составляет порядка ±5°C.
Термин "комнатная температура" при использовании в настоящем изобретении означает температуру в диапазоне от 20°C до 23°C.
Первым объектом настоящего изобретения является кристаллическая форма ((S)-2,2-дифторциклопропил)((1R,5S)-3-(2-((1-метил-1H-пиразол-4-ил)амино)пиримидин-4-ил)-3,8-диазабицикло[3.2.1]октан-8-ил)метанона, обладающая одной или большим количеством характеристик, выбранных из группы, состоящей из следующих:
I) порошковая рентгенограмма, содержащая следующие значения 2θ, измеренные с использованием излучения Cu Kα1 (λ=1,54056 Å): 2θ , при 5,0, 9,9 и 15,3° 2θ±0,2° 2θ.
II) порошковая рентгенограмма, содержащая следующие значения 2θ, измеренные с использованием излучения Cu Kα1 (λ=1,54056 Å): 5,0, 9,9, 15,3 и 19,7° 2θ±0,2° 2θ.
III) порошковая рентгенограмма, содержащая следующие значения 2θ, измеренные с использованием излучения Cu Kα1 (λ=1,54056 Å): 5,0, 9,9, 15,3, 16,8 и 19,7° 2θ±0,2° 2θ.
Соответственно, настоящее изобретение относится к кристаллической форме ((S)-2,2-дифторциклопропил)-((1R,5S)-3-(2-((1-метил-1H-пиразол-4-ил)амино)-пиримидин-4-ил)-3,8-диазабицикло[3.2.1]октан-8-ил)метанона, обладающей порошковой рентгенограммой, включающей пики, выраженные в углах 2θ, при 5,0, 9,9 и 15,3° 2θ±0,2° 2θ. Настоящее изобретение также относится к кристаллической форме ((S)-2,2-дифторциклопропил)((1R,5S)-3-(2-((1-метил-1H-пиразол-4-ил)амино)-пиримидин-4-ил)-3,8-диазабицикло[3.2.1]октан-8-ил)метанона, обладающей порошковой рентгенограммой, включающей пики при 5,0, 9,9, 15,3 и 19,7° 2θ±0,2° 2θ. Настоящее изобретение также относится к кристаллической форме ((S)-2,2-дифторциклопропил)-((1R,5S)-3-(2-((1-метил-1H-пиразол-4-ил)амино)пиримидин-4-ил)-3,8-диазабицикло[3.2.1]-октан-8-ил)метанона, обладающей порошковой рентгенограммой, включающей пики при 5,0, 9,9, 15,3, 16,8 и 19,7° 2θ±0,2° 2θ. Кроме того, настоящее изобретение относится к фармацевтической композиции, содержащей кристаллическую форму ((S)-2,2-дифторциклопропил)((1R,5S)-3-(2-((1-метил-1H-пиразол-4-ил)амино)пиримидин-4-ил)-3,8-диазабицикло-[3.2.1]октан-8-ил)-метанона; и фармацевтически приемлемый носитель. В некоторых вариантах осуществления настоящее изобретение относится к указанной фармацевтической композиции, где указанная кристаллическая форма обладает порошковой рентгенограммой, включающей пики при 5,0, 9,9 и 15,3° 2θ±0,2° 2θ. В других вариантах осуществления настоящее изобретение относится к указанной фармацевтической композиции, где указанная кристаллическая форма обладает порошковой рентгенограммой, включающей пики при 5,0, 9,9, 15,3 и 19,7° 2θ±0,2° 2θ. В других вариантах осуществления настоящее изобретение относится к указанной фармацевтической композиции, где указанная кристаллическая форма обладает порошковой рентгенограммой, включающей пики при 5,0, 9,9, 15,3, 16,8 и 19,7° 2θ±0,2° 2θ.
Настоящее изобретение также относится к фармацевтической композиции указанной кристаллической формы по любому из вариантов осуществления, описанных в настоящем изобретении, включающей препарат для местного применения, выбранный из группы, включающей крем, чрескожный пластырь, мазь, глазные капли, примочку и гель. В некоторых вариантах осуществления настоящее изобретение относится к указанной фармацевтической композиции где препарат для местного применения содержит от примерно 0,1% до примерно 5,0% (мас./об.) кристаллического ((S)-2,2-дифторциклопропил)((1R,5S)-3-(2-((1-метил-1H-пиразол-4-ил)амино)пиримидин-4-ил)-3,8-диазабицикло[3.2.1]октан-8-ил)метанона.
Кроме того, настоящее изобретение относится к способу лечения заболевания у млекопитающего, включающему введение нуждающемуся в нем млекопитающему терапевтически эффективного количества кристаллической формы ((S)-2,2-дифторциклопропил)((1R,5S)-3-(2-((1-метил-1H-пиразол-4-ил)амино)пиримидин-4-ил)-3,8-диазабицикло[3.2.1]октан-8-ил)метанона или его фармацевтически приемлемой соли и фармацевтически приемлемый носитель, где заболевание выбрано из группы, включающей волчанку, ревматоидный артрит, IBD, язвенный колит, болезнь Крона, витилиго, алопецию, псориаз и атопический дерматит. В некоторых вариантах осуществления настоящее изобретение относится к указанному способу, где указанная кристаллическая форма обладает порошковой рентгенограммой, включающей пики при 5,0, 9,9 и 15,3° 2θ±0,2° 2θ. В некоторых других вариантах осуществления настоящее изобретение относится к указанной кристаллической форме, которая обладает порошковой рентгенограммой, включающей пики при 5,0, 9,9, 15,3 и 19,7° 2θ±0,2° 2θ. В других вариантах осуществления настоящее изобретение относится к указанной кристаллической форме, которая обладает порошковой рентгенограммой, включающей пики, выраженные в углах 2θ, при 5,0, 9,9, 15,3, 16,8 и 19,7° 2θ±0,2° 2θ.
Настоящее изобретение также относится к способу местного лечения заболевания у млекопитающего, включающему введение местным путем введения нуждающемуся в нем млекопитающему терапевтически эффективного количества кристаллической формы ((S)-2,2-дифторциклопропил)((1R,5S)-3-(2-((1-метил-1H-пиразол-4-ил)амино)пиримидин-4-ил)-3,8-диазабицикло[3.2.1]октан-8-ил)метанона или его фармацевтически приемлемой соли и фармацевтически приемлемый носитель, где заболевание выбрано из группы, включающей витилиго, алопецию, псориаз и атопический дерматит. В некоторых вариантах осуществления настоящее изобретение относится к указанному способу, где указанная кристаллическая форма обладает порошковой рентгенограммой, включающей пики при 5,0, 9,9 и 15,3° 2θ±0,2° 2θ. В некоторых других вариантах осуществления настоящее изобретение относится к указанному способу, где указанная кристаллическая форма обладает порошковой рентгенограммой, включающей пики при 5,0, 9,9, 15,3 и 19,7° 2θ±0,2° 2θ. В некоторых других вариантах осуществления настоящее изобретение относится к указанному способу, где указанная кристаллическая форма обладает порошковой рентгенограммой, включающей пики при 5,0, 9,9, 15,3, 16,8 и 19,7° 2θ±0,2° 2θ.
Прибор и методики анализа:
Рассчитанные порошковые рентгенограммы: Порошковые рентгенограммы рассчитывали по рентгенографическим данным для монокристалла с использованием программного обеспечения SHELXTL, включая XFOG (SHELXTL, Bruker AXS, XFOG, Version 5.100, 1997) и XPOW (SHELXTL, Bruker AXS, XPOW, Version 5.102, 1997-2000). Соответствующую длину волны, необходимую для наложения графики, добавляли с использованием программы обмена файлов XCH (SHELXTL, Bruker AXS, XCH, Version 5.0.4, 1995-2001).
Порошковая рентгенография:
Анализ с помощью порошковой рентгенографии проводили с помощью дифрактометра Bruker AXS D8 Advance, снабженного источником излучения Cu, снабженного зеркалом Гебеля. Дифрагированное излучение детектировали детектором LYNXEYE_EX со щелями с электроприводом. Для первичного и вторичного пучка использовали щели Соллера 2.5. Напряжение и силу тока на рентгеновской трубке устанавливали равными 40 кВ и 40 мА соответственно. Данные накапливали с помощью тета-тета гониометра при сканировании по схеме "тета-два тета" при длине волны Cu K-альфа от 3,0 до 40,0 градусов 2-тета с использованием 1204 шагов и скорости сканирования 0,50 с на шаг. Образцы готовили путем их помещения в кремниевый держатель с низким фоном и при сборе данных вращали. Данные собирали с использованием программного обеспечения Bruker DIFFRAC Plus. Анализ проводили с использованием программного обеспечения EVA diffract plus. Файл данных PXRD не обрабатывало до поиска пиков. С использованием алгоритма поиска пиков в программном обеспечении EVA для предварительного отнесения пиков использовали пики с пороговым значением, равным 1. Для обеспечения правильности отнесения проводили вручную; результаты автоматического отнесения проверяли визуально и положения пиков устанавливали по максимумам пиков. Обычно выбирали пики с относительной интенсивностью ≥ 2%. Неразрешенные пики и пики, согласующиеся с шумом, не выбирали. Типичная погрешность положения пика по данным PXRD в USP установлена равной +/- 0,2° 2-Тета (USP-941).
Отнесения отражений PXRD: Для визуализации и анализа спектров PXRD использовали программное обеспечение Eva Application 9.0. Положения пиков относили к максимуму интенсивности данного отражения. Все отражения, обладающие относительной интенсивностью, превышающей 10%, включены в последующие таблицы.
Твердофазный NMR: Твердофазный анализ NMR (ssNMR) проводили с помощью зонда CPMAS, расположенного в спектрометре Bruker-BioSpin Avance III™ 500 MHz (частота 1H) NMR. Материал помещали в 4 мм ротор, герметизированный с помощью стандартной головной насадки. Использование вращением под магическим углом с частотой 15,0 kHz. Во время накопления спектров прилагали поле 80-90 kHz развязки протонов с фазовой модуляцией. Спектр 13C ssNMR накапливали в экспериментах с вращением под магическим углом с перекрестной поляризацией с развязкой протонов (CPMAS). Время контакта при перекрестной поляризации установлено равным 3 мс и время ожидания при повторении установлено равным 60 с. Количество сканирований регулировали и адекватное значение отношения сигнал/шум получали при использовании 768 сканирований для API (активный фармацевтический ингредиент) и большего количества сканирований, обычно ≥4096, для лекарственных продуктов. Шкалу химических сдвигов 13C устанавливали с использованием эксперимента 13C CPMAS с кристаллическим адамантаном в качестве внутреннего стандарта, устанавливая его резонанс в сильных полях равным 29,5 част./млн.
Спектр 19F ssNMR накапливали в экспериментах с вращением под магическим углом (MAS) с развязкой протонов. Время ожидания при повторении установлено равным 60 с. Количество сканирований регулировали и адекватное значение отношения сигнал/шум получали при использовании 64 сканирований для API и большего количества сканирований, обычно ≥256, для лекарственного продукта. Шкалу химических сдвигов 19F устанавливали с использованием эксперимента 19F MAS с развязкой протонов с внешним стандартом 50/50 (об./об.) трифторуксусная кислота/вода, устанавливая его резонанс равным -76,54 част./млн.
Автоматическое выделение пиков проводили с помощью программного обеспечения Bruker-BioSpin TopSpin version 3.5. Обычно для предварительного отбора пиков использовали пороговое значение относительной интенсивности, составляющее 5%. Результаты автоматического выделения пиков визуально оценивали для обеспечения достоверности и при необходимости отнесения проводили вручную. Хотя в настоящем изобретении приведены конкретные значения для пиков в твердофазном NMR, все же значения для этих пиков находятся в диапазоне вследствие различий в приборах, образцах и приготовлении образцов. Высоты пиков в твердофазном NMR, приведенные в настоящем изобретении, являются относительными интенсивностями. В твердофазном NMR интенсивности могут меняться в зависимости от реальных установленных экспериментальных параметров CPMAS и термической предыстории образца.
Настоящее изобретение относится к кристаллической форме ((S)-2,2-дифторциклопропил)-((1R,5S)-3-(2-((1-метил-1H-пиразол-4-ил)амино)пиримидин-4-ил)-3,8-диазабицикло[3.2.1]-октан-8-ил)метанона, которую можно идентифицировать с помощью одной или большего количества твердофазных аналитических методик. Перечень пиков PXRD для кристаллической формы при 23°C приведен в таблице 1.
Таблица 1: Перечень пиков PXRD для формы 1 ((S)-2,2-дифторциклопропил)-((1R,5S)-3-(2-((1-метил-1H-пиразол-4-ил)амино)пиримидин-4-ил)-3,8-диазабицикло[3.2.1]октан-8-ил)метанона, полученных в примере 4. Отмеченные звездочками пики являются характеристическими для формы 1, безводного свободного основания.
Интенсивности могут меняться в зависимости от фактических установленных экспериментальных параметров CPMAS и термической предыстории образца. Интенсивности CPMAS необязательно являются количественными.
Пики комбинационного рассеяния для кристаллической формы приведены в таблице 2.
Таблица 2: Полный перечень пиков комбинационного рассеяния для формы 1 ((S)-2,2-дифторциклопропил)-((1R,5S)-3-(2-((1-метил-1H-пиразол-4-ил)амино)пиримидин-4-ил)-3,8-диазабицикло[3.2.1]октан-8-ил)метанона. Характеристические пики для формы 1 отмечены звездочкой (S=интенсивный, M=средний, W=слабый).
Перечни пиков в твердофазном 13C и твердофазном 19F спектре NMR для кристаллической формы приведены соответственно в таблицах 3 и 4.
Таблица 3: Перечень пиков в твердофазном спектре 13C для формы 1 ((S)-2,2-дифторциклопропил)-((1R,5S)-3-(2-((1-метил-1H-пиразол-4-ил)амино)пиримидин-4-ил)-3,8-диазабицикло[3.2.1]октан-8-ил)метанона. Отмеченные звездочками пики являются характеристическими для формы 1.
Таблица 4: Перечень пиков в твердофазном спектре 19F NMR для формы 1 ((S)-2,2-дифторциклопропил)-((1R,5S)-3-(2-((1-метил-1H-пиразол-4-ил)-амино)-пиримидин-4-ил)-3,8-диазабицикло[3.2.1]октан-8-ил)метанона. Отмеченные звездочками пики являются характеристическими для формы 11.
Соответственно, настоящее изобретение относится к фармацевтическим композициям, включающим кристаллическую форму, и к способам получения таких форм, а также фармацевтическим композициям для применения в медицине и для применения для лечения таких заболеваний, как волчанка, ревматоидный артрит, IBD, язвенный колит, болезнь Крона, витилиго, алопецию, псориаз, псориатический артрит и атопический дерматит. Настоящее изобретение также относится к применению таких фармацевтических композиций для получения лекарственного средства для лечения таких заболеваний, как волчанка, ревматоидный артрит, IBD, язвенный колит, болезнь Крона, витилиго, алопецию, псориаз и атопический дерматит.
Настоящее изобретение также относится к кристаллической форме ((S)-2,2-дифторциклопропил)((1R,5S)-3-(2-((1-метил-1H-пиразол-4-ил)амино)пиримидин-4-ил)-3,8-диазабицикло[3.2.1]октан-8-ил)-метанона, полученной перекристаллизацией ((2,2-дифторциклопропил)((1R,5S)-3-(2-((1-метил-1H-пиразол-4-ил)амино)пиримидин-4-ил)-3,8-диазабицикло[3.2.1]октан-8-ил)метанона) из подходящего растворителя.
Настоящее изобретение также относится к препарату для местного применения ((S)-2,2-дифторциклопропил)((1R,5S)-3-(2-((1-метил-1H-пиразол-4-ил)амино)пиримидин-4-ил)-3,8-диазабицикло[3.2.1]октан-8-ил)-метанона, полученному объединением его кристаллической формы с инертными наполнителями, подходящими для чрескожного введения.
Способы лечения заболеваний и синдромов, указанные в настоящем изобретении, следует понимать, как включающие введение индивидууму, нуждающемуся в таком лечении, терапевтически эффективного количества полиморфа, предлагаемого в настоящем изобретении, или содержащей его композиции. При использовании в настоящем изобретении термин "лечение" применительно к заболеванию означает предупреждение, подавление и/или улучшение протекания заболевания.
При использовании в настоящем изобретении термин "индивидуум" или "пациент", использующиеся взаимозаменяемым образом, означают любое животное, включая млекопитающих, предпочтительно мышей, крыс, других грызунов, кроликов, собак, кошек, свиней, крупный рогатый скот, овец, коз, лошадей или приматов и наиболее предпочтительно людей. При использовании в настоящем изобретении выражение "терапевтически эффективное количество" означает количество активного соединения или фармацевтического средства, которое приводит к биологическому или медицинскому ответу в ткани, системе, у животного, индивидуума или человека, который необходим исследователю, ветеринару, врачу или другому клиницисту или оказывающему помощь, или индивидууму, который включает одно или большее количество из следующих:
(1) предупреждение заболевания; например, предупреждение заболевания, патологического состояния или нарушения у индивидуума, который может быть предрасположен к заболеванию, патологическому состоянию или нарушению, но который не ощущает или у которого не наблюдаются патология или симптоматика заболевания;
(2) подавление заболевания; например, подавление заболевания, патологического состояния или нарушения у индивидуума, который ощущает или у которого наблюдаются патология или симптоматика заболевания, патологического состояния или нарушения (т. е. остановка или замедление дальнейшего развития патологии и/или симптоматики); и
(3) улучшение протекания заболевания; например, улучшение протекания заболевания, патологического состояния или нарушения у индивидуума, который ощущает или у которого наблюдаются патология или симптоматика заболевания, патологического состояния или нарушения (т. е. обращение патологии и/или симптоматики).
Дозы и препарат
Настоящее изобретение также включает фармацевтические композиции, в которых применяются одна или большее количество предлагаемых кристаллических форм вместе с одним или большим количеством следующих: фармацевтически приемлемые носители, инертные наполнители, разбавители и т. п..
Кристаллическую форму, предлагаемую в настоящем изобретении, вводят в количестве, эффективном для лечения патологического состояния, описанного в настоящем изобретении, и ее можно вводить в виде самого кристаллического соединения, или, альтернативно, в виде фармацевтически приемлемой соли. Для введения и дозирования само кристаллическое соединение или его фармацевтически приемлемую соль называют просто соединениями, предлагаемыми в настоящем изобретении.
Соединения, предлагаемые в настоящем изобретении, вводят любым подходящим путем в виде фармацевтической композиции, адаптированной для такого пути, в дозе эффективной для назначенного лечения. Соединения, предлагаемые в настоящем изобретении, можно вводить перорально, ректально, вагинально, парентерально или местно.
Соединения, предлагаемые в настоящем изобретении, можно вводить перорально. Пероральное введение может включать проглатывание, так что соединение попадает в желудочно-кишечный тракт, или можно использовать буккальное или сублингвальное введение, с помощью которого соединение попадает в кровоток непосредственно изо рта.
В другом варианте осуществления соединения, предлагаемые в настоящем изобретении, также можно вводить непосредственно в кровоток, в мышцу или во внутренний орган. Подходящие пути для парентерального введения включают внутривенный, внутриартериальный, внутрибрюшинный, интратекальный, внутрижелудочковый, внутриуретральный, надчревный, внутричерепной, внутримышечный и подкожный. Подходящие устройства для парентерального введения включают игольчатые (включая микроигольчатые) шприцы, безыгольные шприцы и устройства для вливания.
В другом варианте осуществления соединения, предлагаемые в настоящем изобретении, также можно вводить местно на кожу или слизистую оболочку, т. е. накожно или чрескожно. В другом варианте осуществления соединения, предлагаемые в настоящем изобретении, также можно вводить интраназально или путем ингаляции. В другом варианте осуществления соединения, предлагаемые в настоящем изобретении, можно вводить ректально или вагинально. В другом варианте осуществления соединения, предлагаемые в настоящем изобретении также можно вводить непосредственно в глаз или ухо.
Режим дозирования соединений, предлагаемых в настоящем изобретении, и/или композиций, содержащих указанные соединения, основан на множестве факторов, включая тип, возраст, массу, пол и состояние здоровья пациента; тяжесть патологического состояния; путь введения; и активность конкретного использующегося соединения. Таким образом, режим дозирования может значительно меняться. В одном варианте осуществления полная суточная доза соединения, предлагаемого в настоящем изобретении, обычно равна от примерно 0,01 до примерно 100 мг/кг (т. е. количество миллиграммов соединения, предлагаемого в настоящем изобретении, на 1 кг массы тела) для лечения указанных патологических состояний, рассмотренных в настоящем изобретении. В другом варианте осуществления полная суточная доза соединения, предлагаемого в настоящем изобретении, равна от примерно 0,1 до примерно 50 мг/кг и в другом варианте осуществления от примерно 0,5 до примерно 30 мг/кг.
Для перорального введения композиции можно использовать в форме таблеток, содержащих 0,01, 0,05, 0,1, 0,5, 1,0, 2,5, 5,0, 10,0, 15,0, 25,0, 50,0, 75,0, 100, 125, 150, 175, 200, 250 и 500 мг активного ингредиента для симптоматического подбора дозы для пациента. Лекарственное средство обычно содержит от примерно 0,01 мг до примерно 500 мг активного ингредиента или в другом варианте осуществления от примерно 1 мг до примерно 100 мг активного ингредиента. Внутривенные дозы могут находиться в диапазоне от примерно 0,01 до примерно 10 мг/кг/мин при постоянной скорости вливания.
Подходящие субъекты в контексте настоящего изобретения включают млекопитающих. Млекопитающие, подходящие для настоящего изобретения, включают собачьих, кошачьих, бычьих, козлиных, лошадиных, овечьих, свиных, грызунов, зайцеобразных, приматов и т. п., и включают млекопитающих в утробе. В одном варианте осуществления подходящими субъектами являются люди. Люди могут быть любого пола и на любой стадии развития.
При использовании в настоящем изобретении "фармацевтически приемлемый носитель" включает любые и все растворители, диспергирующие среды, покрытия, антибактериальные и фунгицидные агенты, изотонические агенты и агенты, задерживающие всасывание и т. п., которые являются физиологически совместимыми. Примеры фармацевтически приемлемых носителей включают одно или большее количество следующих: вода, физиологический раствор, забуференный фосфатом физиологический раствор, декстроза, глицерин, этанол и т. п., а также их комбинации, и могут содержать в композиции изотонические агенты, например, сахара, хлорид натрия или многоатомные спирты, такие как маннит, или сорбит. Фармацевтически приемлемые вещества, такие как смачивающие агенты или небольшие количества вспомогательных веществ, таких как смачивающие или эмульгирующие агенты, консерванты или буферы, которые увеличивают длительность действия или эффективность антител или фрагментов антител.
Композиции, предлагаемые в настоящем изобретении, могут находиться в разных формах. Они включают, например, жидкие, полужидкие и твердые дозированные формы, такие как жидкие растворы (например, растворы для инъекции и вливания), дисперсии или суспензии, таблетки, пилюли, порошки, липосомы и суппозитории. Форма зависит от назначенного пути введения и терапевтического применения.
Типичные композиции находятся в форме растворов для инъекции или вливания, такие как композиции, аналогичные используемым для пассивной общей иммунизации людей антителами. Одним путем введения является парентеральный (например, внутривенный, подкожный, внутрибрюшинный, внутримышечный). В другом варианте осуществления антитела вводят путем внутривенного вливания или инъекции. В еще одном варианте осуществления антитела вводят путем внутримышечной или подкожной инъекции.
Дозированная форма для перорального введения твердого вещества может, например, быть представлена в отдельных порциях, таких как твердые или мягкие капсулы, пилюли, облатки, пастилки или таблетки, каждая из которых содержат заданное количество по меньшей мере одного соединения, предлагаемого в настоящем изобретении. В другом варианте осуществления пероральное введение может проводиться в форме порошка или гранулы. В другом варианте осуществления пероральная дозированная форма является сублингвальной, такой как, например, пастилка. В таких твердых дозированных формах кристаллическое соединение обычно объединяют с одним или большим количеством вспомогательных веществ. Такие капсулы или таблетки могут представлять собой препарат регулируемого высвобождения. В случае капсул, таблеток и пилюль дозированные формы также могут содержать буферные реагенты или их можно приготовить с энтеросолюбильными покрытиями.
В другом варианте осуществления пероральное введение может проводиться с помощью жидкой дозированной формы. Жидкие дозированные формы для перорального введения включают, например, фармацевтически приемлемые эмульсии, растворы, суспензии, сиропы и эликсиры, содержащие инертные разбавители, обычно использующиеся в данной области техники (например, воду). Такие композиции также могут содержать вспомогательные вещества, такие как смачивающие, эмульгирующие, суспендирующие, придающие вкус (например, подсластители) и/или отдушки.
В другом варианте осуществления настоящее изобретение относится к парентеральной дозированной форме. "Парентеральное введение" включает, например, подкожные инъекции, внутривенные инъекции, внутрибрюшинные, внутримышечные инъекции, надчревные инъекции и вливание. Препараты для инъекции (т. е. стерильные водные или масляные суспензии для инъекции) можно приготовить в соответствии с известным уровнем техники с использованием подходящих диспергирующих, смачивающих агентов и/или суспендирующих агентов.
В другом варианте осуществления настоящее изобретение относится к дозированной форме для местного применения. "Местное введение" включает, например чрескожное введение, такое как с помощью чрескожных пластырей или устройств для ионтофореза, внутриглазное введение или интраназальное или ингаляционное введение. Композиции для местного введения также включают, например, гели, спреи, мази и кремы для местного применения. Препарат для местного применения может включать кристаллическое соединение, которое усиливает поглощение или проникновение активного ингредиента через кожу или другие пораженные участки. Если кристаллическое соединение, предлагаемое в настоящем изобретении, вводят с помощью чрескожного устройства, введение проводят с помощью пластыря резервуарного и пористого мембранного типа, или разных твердых матриц. Типичные препараты для этой цели включают гели, гидрогели, примочки, растворы, кремы, мази, присыпки, повязки, пенки, пленки, кожные пластыри, пластинки, имплантаты, губки, волокна, перевязочные материалы и микроэмульсии. Также можно использовать липосомы. Типичные носители включают спирт, воду, минеральное масло, жидкое вазелиновое масло, белое вазелиновое масло, глицерин, полиэтиленгликоль и пропиленгликоль. Можно включать средства, улучшающие проницаемость - см., например, B. C. Finnin and T. M. Morgan, J. Pharm. Sci., vol. 88, pp. 955-958, 1999.
Соответственно, препараты для местного применения, полученные из раскрытой в настоящем изобретении кристаллической формы ((S)-2,2-дифторциклопропил)((1R,5S)-3-(2-((1-метил-1H-пиразол-4-ил)амино)пиримидин-4-ил)-3,8-диазабицикло[3.2.1]октан-8-ил)метанона, можно вводить в виде таких препаратов, включая все обычные способы введения через поверхность тела и внутренние выстилки пассажей организма, включая эпителиальные ткани и слизистые оболочки, включая чрескожный, эпидермальный, буккальный, легочный, глазной, интраназальный, вагинальный и ректальный пути введения. Типичные носители включают спирт, воду, минеральное масло, жидкое вазелиновое масло, белое вазелиновое масло, глицерин, полиэтиленгликоль и пропиленгликоль. Такие препараты для местного применения можно получить в комбинации с дополнительными фармацевтически приемлемыми инертными наполнителями. Инертный наполнитель, который может быть важен для обеспечения клинической эффективности, представляет собой один или большее количество средств, улучшающих проницаемость, таких как один или большее количество насыщенных или цис-ненасыщенных C10-C18 жирных спиртов. Такие жирные спирты включают C16-C18 жирные спирты и наиболее предпочтительным является C18 жирный спирт. Примеры цис-ненасыщенных C16-C18 жирных спиртов включают олеиловый спирт, линолеиловый спирт, γ-линолениловый спирт и линолениловый спирт. Насыщенные C10-C18 жирные спирты, применимые, как средства, улучшающие проницаемость включают дециловый спирт, лауриловый спирт, миристиловый спирт, цетиловый спирт и стеариловый спирт. Альтернативно, другие средства, улучшающие проницаемость, которые можно использовать для получения препаратов для местного применения включают C10-C18 жирные кислоты, которые, если они являются насыщенными, могут включать каприновую кислоту, лауриновую кислоту, миристиновую кислоту, пальмитиновую кислоту, стеариновую кислоту и арахидиновую кислоту. Альтернативно, средство, улучшающее проницаемость предпочтительно может представлять собой цис-ненасыщенную жирную кислоту, такую как пальмитолеиновая кислота (цис-9-гексадеценовая кислота), олеиновая кислота (цис-9-октадеценовая кислота), цис-вакценовая кислота (цис-11-октадеценовая кислота), линолевая кислота (цис-9,12-октадекадиеновая кислота), γ-линоленовая кислота (цис-6,9,12-октадекатриеновая кислота), линоленовая кислота (цис-9,12,15- октадекатриеновая кислота) и арахидоновая кислота (цис-5,8,11,14-эйкозатетраеновая кислота). Средства, улучшающие проницаемость, например, выбранные из числа C10-C18 жирных спиртов, используют в количествах в диапазоне от примерно 0,1 до примерно 5% (мас./об.), более предпочтительно, от 1 примерно до 4%, еще более предпочтительно от 1 примерно до 3% (мас./об.).
Препараты для местного применения, содержащие ((S)-2,2-дифторциклопропил)-((1R,5S)-3-(2-((1-метил-1H-пиразол-4-ил)амино)пиримидин-4-ил)-3,8-диазабицикло[3.2.1]октан-8-ил)метан-он в терапевтически эффективных количествах, можно вводить нуждающимся в них пациентам один или два раза в сутки. Эти количества находятся в диапазоне от примерно 0,1% до примерно 5,0% (мас./об.), более предпочтительно, от примерно 0,1% до примерно 3,0% (мас./об.). В число других инертных наполнителей, которые увеличивают стабильность этих препаратов, входят поглотители альдегидов, такие как глицерин и пропиленгликоль, и антиоксиданты, такие как бутилгидроксианизол (BHA), бутилгидрокситолуол (BHT), пропилгаллат, аскорбиновая кислота (витамин C), полифенолы, токоферолы (витамин E) и их производные.
Препараты, подходящие для местного введения в глаза, включают, например, глазные капли, в которых соединение, предлагаемое в настоящем изобретении, растворено или суспендировано в подходящем носителе. Типичный препарат, подходящий для введения в глаза или уши, может находиться в форме капель микронизированной суспензии или раствора в изотоническом с установленным pH стерильном физиологическом растворе. Другие препараты, подходящие для введения в глаза или уши, включают мази, биологически разрушающиеся (т. е. впитывающие гель губки, коллаген) и биологически неразрушающиеся (т. е. силиконовые) имплантаты, пластинки, линзы и измельченные или везикулярные системы, такие как ниосомы или липосомы. Полимер, такой как сшитая полиакриловая кислота, поливиниловый спирт, гиалуроновую кислоту, полимер целлюлозы, например, гидроксипропилметилцеллюлозу, гидроксиэтилцеллюлозу или метилцеллюлозу, или полимерный гетерополисахарид, например, геллановую камедь, можно включить вместе с консервантом, таким как бензалконийхлорид. Такие препараты также можно доставить с помощью ионтофореза.
Для интраназального введения или введения путем ингаляции кристаллическое соединение, предлагаемое в настоящем изобретении, обычно доставляют в форме раствора или суспензии из контейнера с насосом для распыления, который сжимает или использует для накачивания пациент, или системы распыления аэрозоля из контейнера под давлением или распылителя с использованием подходящего пропеллента. Препараты, подходящие для интраназального введения обычно вводят в форме сухого порошка (чистого, в виде смеси, например, сухой смеси с лактозой, или смешанных частиц компонента, например, в смеси с фосфолипидами, такими как фосфатидилхолин) из ингалятора для сухого порошка или с распылением аэрозоля из контейнера под давлением, с помощью насоса, распылителя, атомизатора (предпочтительно атомизатора с использованием электродинамического устройства для получения тонкого тумана), или распылителя с использованием или без использования подходящего пропеллента, такого как 1,1,1,2-тетрафторэтан или 1,1,1,2,3,3,3-гептафторпропан. Для интраназального применения, порошок может содержать биоадгезивный агент, например, хитозан или циклодекстрин.
В другом варианте осуществления настоящее изобретение относится к ректальной дозированной форме. Такая ректальная дозированная форма может находиться в форме, например, суппозитория. Масло какао является традиционной основой для суппозитория, но можно использовать разные альтернативы, если они являются подходящими.
Также можно использовать другие материалы носителей и пути введения, известные в фармацевтике. Фармацевтические композиции, предлагаемые в настоящем изобретении, можно получить по любой из хорошо известных методик фармацевтики, таким как эффективные процедуры получения и введения. Приведенные выше соображения в отношении эффективных препаратов и методик введения хорошо известны в данной области техники и описаны в стандартных учебниках. Составление лекарственных средств рассмотрено, например, в Hoover, John E., Remington’s Pharmaceutical Sciences, Mack Publishing Co., Easton, Pennsylvania, 1975; Liberman et al., Eds., Pharmaceutical Dosage Forms, Marcel Decker, New York, N.Y., 1980; и Kibbe et al., Eds., Handbook of Pharmaceutical Excipients (3rd Ed.), American Pharmaceutical Association, Washington, 1999.
Кристаллическое соединение, предлагаемое в настоящем изобретении, можно использовать по отдельности или в комбинации с другими терапевтическими средствами. Настоящее изобретение относится к любым из применений, способов или композиций, определенных в настоящем изобретении, где кристаллическое соединение, предлагаемое в настоящем изобретении, или фармацевтически приемлемый сольват указанного соединения используют в комбинации с одним или большим количеством других терапевтических средств, рассмотренных в настоящем изобретении.
Введение двух или большего количества соединений "в комбинации" означает, что все соединения вводят в близкие моменты времени, так что наличие одного средства может изменить биологические воздействия другого соединения (соединений). Два или большее количество соединений можно вводить одновременно, совместно или последовательно. Кроме того, одновременное введение можно провести путем смешивания соединений до введения или путем введения соединений в один и тот же момент времени, но в виде отдельных дозированных форм на один или разные участки введения.
Выражения "одновременное введение", "совместное введение", "синхронное введение" и "введение одновременно" означает, что соединения вводят в комбинации.
В другом варианте осуществления настоящее изобретение относится к способам лечения, которые включают введение кристаллического соединения, предлагаемого в настоящем изобретении, в комбинации с одним или большим количеством других фармацевтических средств, где одно или большее количество других фармацевтических средств можно выбрать из числа средств, рассмотренных в настоящем изобретении.
Эти средства и кристаллическое соединение, предлагаемое в настоящем изобретении, можно объединить с фармацевтически приемлемыми разбавителями, такими как физиологический раствор, раствор Рингера, раствор декстрозы и т. п. Конкретный режим введения, т. е. доза, время и количество повторов, зависит от конкретного индивидуума и истории болезни индивидуума.
Приемлемые носители, инертные наполнители или стабилизаторы нетоксичны для реципиента в использующихся дозах и концентрациях и могут содержать буферы, такие как фосфатный, цитратный и включающий другие органические кислоты; соли, такие как хлорид натрия; антиоксиданты, включая аскорбиновую кислоту и метионин; консерванты (такие как октадецилдиметилбензилхлорид аммония; гексаметонийхлорид; бензалконийхлорид, бензэтонийхлорид; фенол, бутиловый или бензиловый спирт; алкилпарабены, такие как метил- или пропилпарабен; пирокатехин; резорцин; циклогексанол; 3-пентанол; и м-крезол); обладающие низкой молекулярной массой (менее примерно 10 остатков) полипептиды; белки, такие как сывороточный альбумин, желатин или Igs; гидрофильные полимеры, такие как поливинилпирролидон; аминокислоты, такие как глицин, глутамин, аспарагин, гистидин, аргинин или лизин; моносахариды, дисахариды и другие углеводы, включая глюкозу, маннозу или декстрины; хелатные агенты, такие как EDTA; сахара, такие как сахароза, маннит, трегалоза или сорбит; солеобразующие противоионы, такие как ионы натрия; комплексы металлов (например, комплексы Zn-белок); и/или неионогенные поверхностно-активные вещества, такие как TWEEN™, PLURONICS™ или полиэтиленгликоль (PEG).
Липосомы, содержащие эти средства и/или соединения, предлагаемые в настоящем изобретении, получают по методикам, известным в данной области техники, таким как описанные в патентах U.S. №№ 4485045 и 4544545. Липосомы с увеличенным временем обращения раскрыты в патенте U.S. № 5013556. Особенно полезные липосомы можно получить по методике обращенно-фазового выпаривания с использованием липидной композиции, содержащей фосфатидилхолин, холестерин и дериватизированный с помощью PEG фосфатидилэтаноламин (PEG-PE). Липосомы экструдируют через фильтры с определенным размером отверстий и получают липосомы желательного диаметра.
Эти средства и/или соединения, предлагаемые в настоящем изобретении, также можно поместить в микрокапсулы, получаемые, например, по методикам коацервации или с помощью межфазной полимеризации, например, гидроксиметилцеллюлозы, или желатиновые микрокапсулы и поли(метилметакрилатные) микрокапсулы соответственно для коллоидных систем доставки лекарственного средства (например, липосомы, микросферы альбумина, микроэмульсии, наночастицы и нанокапсулы) или включить в макроэмульсии. Такие методики раскрыты в Remington, The Science and Practice of Pharmacy, 20th Ed., Mack Publishing (2000).
Можно использовать препараты пролонгированного высвобождения. Подходящие примеры препаратов пролонгированного высвобождения включают полупроницаемые матрицы из твердых гидрофобных полимеров, содержащие антитела/соединение, предлагаемое в настоящем изобретении, и эти матрицы находятся в виде формованных изделий, например, пленок или микрокапсул. Примеры матриц пролонгированного высвобождения включают сложные полиэфиры, гидрогели (например, поли(2-гидроксиэтилметакрилат) или поли(виниловый спирт)), полилактиды (патент U.S. № 3773919), сополимеры L-глутаминовой кислоты и 7-этил-L-глутамата, неразлагающиеся сополимеры этилен-винилацетат, разлагающиеся сополимеры молочная кислота-гликолевая кислота, такие как использующиеся в LUPRON DEPOT™ (микросферы для инъекции, состоящие из сополимера молочная кислота-гликолевая кислота и лейпролидацетата), ацетат-изобутират сахарозы и поли-D-(-)-3-гидроксимасляную кислоту.
Препараты для использования для внутривенного введения должны быть стерильными. Это легко обеспечить, например, путем стерильного фильтрования через мембраны. Кристаллическую или некристаллическую форму н-((1S,3S)-3-(метил(7H-пирроло[2,3-d]пиримидин-4-ил)амино)циклобутил)пропан-1-сульфонамида, полученную способом, предлагаемым в настоящем изобретении, обычно помещают в контейнер, содержащий стерильное впускное отверстие, например, мешок с раствором для внутривенного введения или флакон с пробкой, прокалываемой иглой шприца для подкожной инъекции.
Подходящие эмульсии можно получить с использованием имеющихся в продаже эмульсии жиров, таких как Intralipid™, Liposyn™, Infonutrol™, Lipofundin™ и Lipiphysan™. Активный ингредиент можно растворить в предварительно смешанной композиции эмульсии или, альтернативно, его можно растворить в масле (таком как, соевое масло, сафлоровое масло, хлопковое масло, кунжутное масло, кукурузное масло или миндальное масло) и эмульсии, образовавшейся после перемешивания с фосфолипидом (таким как яичные фосфолипиды, соевые фосфолипиды или соевый лецитин) и водой. Следует понимать, что можно добавить другие ингредиенты, например, глицерин или глюкозу, для регулирования тоничности эмульсии. Подходящие эмульсии обычно содержат до 20% масла, например, от 5 до 20%. Эмульсия жира может содержать капельки жира размером от 0,1 до 1,0 мкм, предпочтительно от 0,1 до 0,5 мкм, и обладают pH в диапазоне от 5,5 до 8,0.
Соединения, предлагаемые в настоящем изобретении, можно получить по методикам, известным в данной области техники. Реагенты, использующиеся для получения соединений, предлагаемых в настоящем изобретении, можно приобрести или можно получить по стандартным методикам, описанным в литературе. Например, соединения, предлагаемые в настоящем изобретении, можно получить по методикам, приведенным в последующих примерах.
В описании настоящего изобретения используются разные аббревиатуры, хорошо известные специалистам в данной области техники, включая следующие:
CH3CN: Ацетонитрил
DCM: Дихлорметан
DMF: N, N-Диметилформамид
DMSO: Диметилсульфоксид
EtOAc: Этилацетат
EtOH: Этанол
FT-IR: Инфракрасная Фурье-спектроскопия
HOAc: Уксусная кислота
MeOH: Метанол
PXRD: порошковая рентгенография
ss 13C NMR: твердофазный 13C ядерный магнитный резонанс
THF: Тетрагидрофуран
TLC: Тонкослойная хроматография
ПРИМЕРЫ
Последующие неограничивающие примеры приведены только для иллюстрации настоящего изобретения. Специалист в данной области техники должен понимать, что имеются многочисленные эквиваленты и варианты, не приведенные в качестве примеров, которые все же являются частью настоящего изобретения.
Пример 1
Получение ((S)-2,2-дифторциклопропил)-((1R,5S)-3-(2-((1-метил-1H-пиразол-4-ил)амино)-пиримидин-4-ил)-3,8-диазабицикло[3.2.1]октан-8-ил)метанона
Искомое соединение получали в соответствии с примером 2 патента US № 9663526. Неочищенное вещество нагревали в 10 объемах (100 мг/мл) смеси 2:1 EtOH/вода при 80°C (до полного растворения) и затем фильтровали и медленно охлаждали до кристаллизации продукта. После фильтрования вещество сушили в вакууме при 45-55°C.
Пример 2
Получение формы I ((S)-2,2-дифторциклопропил)((1R,5S)-3-(2-((1-метил-1H-пиразол-4-ил)амино)пиримидин-4-ил)-3,8-диазабицикло[3.2.1]октан-8-ил)метанона
Одномолярный водный раствор гидроксида натрия (1,2 экв.) и п-толуолсульфонат ((S)-2,2-дифторциклопропил)((1R,5S)-3-(2-((1-метил-1H-пиразол-4-ил)амино)-пиримидин-4-ил)-3,8-диазабицикло[3.2.1]октан-8-ил)метанона (1,0 экв.) объединяли в метилизобутилкетоне (MIBK) (8 мл/г). После растворения твердых веществ и нейтрализации соли двум жидким слоят давали разделиться. Водный слой экстрагировали с помощью MIBK (5 мл/г) и объединенные органические слои промывали водой (3 мл/г). Промытый органический раствор фильтровали через фильтр тонкой очистки и концентрировали для удаления воды. Концентрат разбавляли с помощью MIBK (полный объем=6,8 мл/г в пересчете на свободное основание ((S)-2,2-дифторциклопропил)((1R,5S)-3-(2-((1-метил-1H-пиразол-4-ил)амино)-пиримидин-4-ил)-3,8-диазабицикло[3.2.1]октан-8-ил)метанон), нагревали при 75°C, затем дополнительно разбавляли н-гептаном (3,2 мл/г в пересчете на (S)-2,2-дифторциклопропил)-((1R,5S)-3-(2-((1-метил-1H-пиразол-4-ил)амино)-пиримидин-4-ил)-3,8-диазабицикло[3.2.1]-октан-8-ил)метанон и получали раствор свободного основания в отношении 2:1 об./об. MIBK:н-гептан. Раствор немного охлаждали до 65°C и в теплый раствор вносили затравку 0,02 мол.% свободного основания формы 1 ((S)-2,2-дифторциклопропил)((1R,5S)-3-(2-((1-метил-1H-пиразол-4-ил)амино)пиримидин-4-ил)-3,8-диазабицикло[3.2.1]октан-8-ил)метанона) (0,02 экв.). Свободному основанию API давали закристаллизоваться при 65°C в течение ~ 1 ч полученную суспензию охлаждали до температуры окружающей среды (~20°C при 0,1°C/мин) и выдерживали при этой температуре в течение 14 ч для завершения кристаллизации. Свободное основание ((S)-2,2-дифторциклопропил)-((1R,5S)-3-(2-((1-метил-1H-пиразол-4-ил)амино)пиримидин-4-ил)-3,8-диазабицикло[3.2.1]октан-8-ил)-метанона) собирали фильтрованием, промывали смесью 3:7 об./об. MIBK/н-гептан (0,7 мл/г) и сушили на фильтре или необязательно в вакуумном сушильном шкафу при 45°C.
Пример 3
Получение свободного основания (S)-2,2-дифторциклопропил)((1R,5S)-3-(2-((1-метил-1H-пиразол-4-ил)амино)пиримидин-4-ил)-3,8-диазабицикло[3.2.1]октан-8-ил)метанона:
Аморфное свободное основание ((S)-2,2-дифторциклопропил)((1R,5S)-3-(2-((1-метил-1H-пиразол-4-ил)амино)пиримидин-4-ил)-3,8-диазабицикло[3.2.1]октан-8-ил)метанона) (100 мг) и этилацетат (EtOAc) (1 мл) помещали в сосуд для образования раствора и нагревали при 60°C. Добавляли гептан до появления осадка, затем повторно добавляли EtOAc до повторного растворения осадка. Раствор охлаждали до комнатной температуры (RT) и перемешивали при КТ в течение ночи. На дне сосуда появлялись капли прозрачного масла, смесь нагревали при 60°C, затем ей давали охладиться до температуры окружающей среды. Добавляли кристаллы рацемата, полученные в соответствии с патентом US № 9663526, и смесь перемешивали при КТ в течение ночи. Смесь (затравка рацемата еще не растворена, но осаждение больше не происходит) нагревали при 35°C в течение ~64 ч. Полученный осадок отфильтровывали, как форму 1 кристаллического свободного основания ((S)-2,2-дифторциклопропил)((1R,5S)-3-(2-((1-метил-1H-пиразол-4-ил)амино)пиримидин-4-ил)-3,8-диазабицикло[3.2.1]октан-8-ил)-метанона) 1.
Пример 4
Получение рацемата: ((2,2-дифторциклопропил)((1R,5S)-3-(2-((1-метил-1H-пиразол-4-ил)амино)пиримидин-4-ил)-3,8-диазабицикло[3.2.1]октан-8-ил)метанон)
1 и 0,72 ммоля рацемата ((2,2-дифторциклопропил)((1R,5S)-3-(2-((1-метил-1H-пиразол-4-ил)амино)пиримидин-4-ил)-3,8-диазабицикло[3.2.1]октан-8-ил)метанона), 1 моль (S)-2,2-дифторциклопропан-1-карбоновой кислоты, 2,06 моля HATU (1-[бис(диметиламино)метилен]-1H-1,2,3-триазоло[4,5-b]пиридиний-3-оксидогексафторфосфат, N-[(диметиламино)-1H-1,2,3-триазоло-[4,5-b]пиридин-1-илметилен]-N-метилметанамминийгексафторфосфат-N-оксид) и 8 мл дихлорметана добавляли в колбу при КТ, затем добавляли 6,88 ммоля DIEA (N, N-диизопропилэтиламин). Реакционную смесь перемешивали при КТ в течение 6 ч. Растворитель удаляли, полученный неочищенный продукт реакции очищали с помощью хроматографии на силикагеле и элюировали смесью от 30% этилацетата и 70% гептана до 100% этилацетата. Его дополнительно очищали с помощью хроматографии на силикагеле с использованием 8% метанола (MeOH) и 92% дихлорметана (DCM). Образец растворяли в DCM и трижды промывали водой, насыщенной хлоридом аммония (NH4Cl). Органический слой концентрировали в смолу. Остаток помещали в колбу и добавляли 3 мл EtOAc и нагревали при 60°C, затем добавляли гептан до появления осадка, затем повторно добавляли EtOAc до повторного растворения осадка. Раствор охлаждали до RT и перемешивали в течение ночи при КТ. Полученный осадок обрабатывали с использованием температурного цикла со следующим параметрами: выдерживание при 60°C в течение 2 ч затем охлаждение до 20°C и выдерживание в течение еще 18 ч. Твердое вещество отфильтровывали и сушили в вакууме. PXRD показывала, что это твердое вещество было кристаллическим.
Для специалистов в данной области техники очевидны изменения, модификации и другие реализации того, что описано в настоящем изобретении, вводимые без отклонения от сущности и основных характеристик настоящего изобретения. Соответственно, объем настоящего изобретения следует определять не по предшествующему иллюстративному описанию, а по прилагаемой формуле изобретения, и предполагается, что все изменения в соответствии со смыслом и диапазоном эквивалентности формулы изобретения входят в объем настоящего изобретения.
Каждая из печатных публикаций, включая, но не ограничиваясь только ими, патенты, заявки на патенты, книги, технические документы, отраслевые издания и статьи в журналах, которые описаны или на которые даны ссылки в настоящем описании, во всей своей полноте включены в настоящее изобретение в качестве ссылки для всех объектов.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПРОИЗВОДНЫЕ АМИНОПИРИМИДИНИЛА | 2021 |
|
RU2817349C1 |
| ЛЕЧЕНИЕ ГИДРАДЕНИТА ИНГИБИТОРАМИ JAK | 2020 |
|
RU2805595C1 |
| КРИСТАЛЛИЧЕСКИЕ ФОРМЫ ПРОИЗВОДНОГО ДИАЗАБИЦИКЛООКТАНА И СПОСОБ ИХ ПОЛУЧЕНИЯ | 2014 |
|
RU2801220C2 |
| ИНГИБИТОРЫ БЕТА-ЛАКТАМАЗ | 2009 |
|
RU2445314C9 |
| КРИСТАЛЛИЧЕСКИЕ ФОРМЫ ПРОИЗВОДНОГО ДИАЗАБИЦИКЛООКТАНА И СПОСОБ ИХ ПОЛУЧЕНИЯ | 2023 |
|
RU2838718C2 |
| КРИСТАЛЛИЧЕСКИЕ ФОРМЫ ПРОИЗВОДНОГО ДИАЗАБИЦИКЛООКТАНА И СПОСОБ ИХ ПОЛУЧЕНИЯ | 2023 |
|
RU2840014C2 |
| ИНГИБИТОРЫ МУТАЦИИ HER2 | 2022 |
|
RU2834124C2 |
| КРИСТАЛЛИЧЕСКИЕ ФОРМЫ ПРОИЗВОДНОГО ДИАЗАБИЦИКЛООКТАНА И СПОСОБ ИХ ПОЛУЧЕНИЯ | 2014 |
|
RU2695219C2 |
| ОКСАДИАЗОЛЫ В КАЧЕСТВЕ АГОНИСТОВ МУСКАРИНОВОГО РЕЦЕПТОРА M1 И/ИЛИ M4 | 2019 |
|
RU2817018C2 |
| Полиморфные и псевдополиморфные формы фармацевтического соединения | 2010 |
|
RU2727509C2 |
Изобретение относится к способу получения кристаллической формы ((S)-2,2-дифторциклопропил)((1R,5S)-3-(2-((1-метил-1H-пиразол-4-ил)амино)пиримидин-4-ил)-3,8-диазабицикло[3.2.1]октан-8-ил)-метанона (формы 1), которая характеризуется порошковой рентгенограммой, включающей пики, выраженные в углах 2θ, при 5,0, 9,4, 9,9, 14,8, 16,8 и 18,7° 2θ±0,2° 2θ, где способ включает введение ((S)-2,2-дифторциклопропил)-((1R,5S)-3-(2-((1-метил-1H-пиразол-4-ил)амино)-пиримидин-4-ил)-3,8-диазабицикло[3.2.1]октан-8-ил)метанона в смесь этанол/вода и нагревание для образования раствора с последующим охлаждением для образования кристаллов. Также изобретение относится к способу получения кристаллической формы ((S)-2,2-дифторциклопропил)((1R,5S)-3-(2-((1-метил-1H-пиразол-4-ил)амино)пиримидин-4-ил)-3,8-диазабицикло[3.2.1]октан-8-ил)-метанона (формы 1), которая характеризуется порошковой рентгенограммой, включающей пики, выраженные в углах 2θ при 5,0, 9,4, 9,9, 14,8, 16,8 и 18,7° 2θ±0,2° 2θ, где способ включает введение свободного основания ((S)-2,2-дифторциклопропил)-((1R,5S)-3-(2-((1-метил-1H-пиразол-4-ил)амино)-пиримидин-4-ил)-3,8-диазабицикло[3.2.1]октан-8-ил)метанона в метилизобутилкетон и нагревание с последующим добавлением н-гептана с образованием раствора, затравку раствора введением свободного основания ((S)-2,2-дифторциклопропил)-((1R,5S)-3-(2-((1-метил-1H-пиразол-4-ил)амино)пиримидин-4-ил)-3,8-диазабицикло[3.2.1]октан-8-ил)метанона с последующим охлаждением до температуры окружающей среды для образования кристаллов. Технический результат - получение кристаллической формы ((S)-2,2-дифторциклопропил)((1R,5S)-3-(2-((1-метил-1H-пиразол-4-ил)амино)пиримидин-4-ил)-3,8-диазабицикло[3.2.1]октан-8-ил)-метанона. 2 н. и 6 з.п. ф-лы, 4 ил., 4 табл., 4 пр.
1. Способ получения кристаллической формы ((S)-2,2-дифторциклопропил)((1R,5S)-3-(2-((1-метил-1H-пиразол-4-ил)амино)пиримидин-4-ил)-3,8-диазабицикло[3.2.1]октан-8-ил)-метанона (формы 1), которая характеризуется порошковой рентгенограммой, включающей пики, выраженные в углах 2θ, при 5,0, 9,4, 9,9, 14,8, 16,8 и 18,7° 2θ±0,2° 2θ,
где способ включает введение ((S)-2,2-дифторциклопропил)-((1R,5S)-3-(2-((1-метил-1H-пиразол-4-ил)амино)-пиримидин-4-ил)-3,8-диазабицикло[3.2.1]октан-8-ил)метанона в смесь этанол/вода и нагревание для образования раствора с последующим охлаждением для образования кристаллов.
2. Способ по п.1, в котором раствор нагревают до температуры 80°С.
3. Способ по п.1, в котором раствор фильтруют после охлаждения.
4. Способ по п.1, в котором после образования кристаллов раствор сушат в вакууме.
5. Способ по п.4, в котором раствор сушат в вакууме при температуре от 45°С до 55°С.
6. Способ получения кристаллической формы ((S)-2,2-дифторциклопропил)((1R,5S)-3-(2-((1-метил-1H-пиразол-4-ил)амино)пиримидин-4-ил)-3,8-диазабицикло[3.2.1]октан-8-ил)-метанона (формы 1), которая характеризуется порошковой рентгенограммой, включающей пики, выраженные в углах 2θ при 5,0, 9,4, 9,9, 14,8, 16,8 и 18,7° 2θ±0,2° 2θ,
где способ включает введение свободного основания ((S)-2,2-дифторциклопропил)-((1R,5S)-3-(2-((1-метил-1H-пиразол-4-ил)амино)-пиримидин-4-ил)-3,8-диазабицикло[3.2.1]октан-8-ил)метанона в метилизобутилкетон и нагревание с последующим добавлением н-гептана с образованием раствора, затравку раствора введением свободного основания ((S)-2,2-дифторциклопропил)-((1R,5S)-3-(2-((1-метил-1H-пиразол-4-ил)амино)пиримидин-4-ил)-3,8-диазабицикло[3.2.1]октан-8-ил)метанона с последующим охлаждением до температуры окружающей среды для образования кристаллов.
7. Способ по п.6, в котором раствор нагревают до 75°C.
8. Способ по п.6, в котором раствор фильтруют после охлаждения.
| US 9663526 B2, 30.05.2017 | |||
| Fensome, Andrew; Ambler, Catherine M.; et al.: "Dual Inhibition of TYK2 and JAK1 for the Treatment of Autoimmune Diseases: Discovery of ((S)-2,2-Difluorocyclopropyl)((1R,5S)-3-(2-((1-methyl-1H-pyrazol-4-yl)amino)pyrimidin-4-yl)-3,8-diazabicyclo[3.2.1]octan-8-yl)methanone (PF-06700841)", Journal of Medicinal Chemistry, |
Авторы
Даты
2023-09-07—Публикация
2020-02-12—Подача