Область техники
Настоящее изобретение относится к химиотерапии рака с использованием пептида, имеющего 4 связанных эпитопа CTL, включающих 4 связанных пептида, способных индуцировать HLA-A-ограниченные ответы CTL, и модулятора иммунных контрольных точек (модулятора молекулы иммунных контрольных точек). Настоящее изобретение также относится к клетке, соэкспрессирующей эпитопный пептид опухолевого антигена человека, полученного из SART2 и человеческого HLA-A24, который может быть подходящим образом использован для оценки эффекта химиотерапии рака по настоящему изобретению.
Уровень техники
Противораковая пептидная вакцина долгое время считалась новой терапией рака. Однако эффективность лечения очень ограничена, хотя клинические исследования противораковых пептидных вакцин проводились во всем мире с 1990 года, когда были идентифицированы эпитопные пептиды опухоли человека (не патентная литература 1).
Механизм лечения противораковой пептидной вакциной заключается в том, что Т-клеточный рецептор (TCR) эпитоп-специфического цитотоксического Т-лимфоцита (CTL) распознает главный комплекс гистосовместимости (MHC), представляющий антигенный пептид на поверхности раковых клеток, и CTL убивает раковые клетки. Человеческий MHC также называют человеческим лейкоцитарным антигеном (HLA), а типы HLA, как известно, являются высоко полиморфными. Следовательно, была предпринята попытка разработки противораковых пептидных вакцин только для определенных аллелей HLA. Однако противораковые вакцины нацелены на ограниченные аллели HLA, и, к сожалению, пациенты с другими аллелями HLA не могут получить пользу от противораковых пептидных вакцин. Кроме того, требование HLA-типирования перед лечением увеличило бы некоторую нагрузку на пациентов из-за отсрочки начала лечения. Соответственно, были желательны исследование и разработка противораковых пептидных вакцин, которые применимы ко всем онкологическим пациентам без HLA-типирования.
Для решения этой проблемы был описан пептид, имеющий 4 связанных эпитопа CTL, полученный связыванием разных пептидов эпитопа CTL, способных вызывать любой или несколько из ограниченных HLA-A2, HLA-A24, HLA-A26 или HLA-A3 супертипом ответ CTL (патентный документ 1).
Молекулярные механизмы, участвующие в подавлении и активации иммунных клеток, были обнаружены в последние годы. Иммунные ответы Т-клеток регулируются сигналами и сопутствующими сигналами TCR. Сопутствующие сигналы включают сигнал костимуляции и сигнал коингибирования, которые соответственно положительно и отрицательно регулируют сигналы, медиированные TCR, и контролируют иммунные ответы Т-клеток. Раковые клетки используют этот механизм и вызывают истощение Т-клеток, подавляя антиген-специфическую активацию Т-клеток. В последние годы контроль ускользания опухоли от иммунного ответа путем усиления противоопухолевых иммунных ответов in vivo у онкологических больных через усиление сигналов костимуляции или блокирование сигналов коингибирования считается эффективным для лечения рака, и были предложены разные иммунотерапии рака, нацеленные на костимулирующие молекулы или коингибиторные молекулы (не патентный документ 2). Например, ниволумаб используется в качестве модулятора иммунных контрольных точек, который активирует Т-клетки через ингибирование связывания PD-1 с его лигандом (PD-L1 и PD-L2) при лечении злокачественной меланомы и т. д. (не патентные документы 2 и 3).
Однако улучшенное противоопухолевое действие при объединении пептида, имеющего 4 связанных CTL эпитопа, с модулятором иммунной контрольной точки не было показано.
Список цитирования
Патентные документы
Патентный документ 1: международная публикация № WO 2015/060235
Не патентные документы
Не патентный документ 1: Nature Med., 10 (9): 909-15 (2004)
Не патентный документ 2: Nat. Rev. Cancer., 12 (4): 252-64 (2012)
Не патентный документ 3: N. Engl. J. Med., 366 (26): 2443-54 (2012)
Сущность изобретения
Техническая проблема
Объектом настоящего изобретения является предоставление нового способа лечения рака, который демонстрирует заметно превосходный противоопухолевый эффект и вызывает меньше побочных реакций, путем введения пептида, имеющего 4 связанных эпитопа CTL, и модулятора иммунных контрольных точек в сочетании. Другим объектом настоящего изобретения является предоставление клетки, соэкспрессирующей эпитопный пептид человеческого опухолевого антигена, полученного из SART2 и человеческого HLA-A24, которая может быть подходящим образом использована для оценки действия противоопухолевого средства у людей.
Решение проблемы
Авторы данного изобретения изучили противоопухолевое действие путем введения пептида, имеющей 4 связанных CTL эпитопа и анти-PD-1 антитела или анти-PD-L1 антитела в качестве модулятора иммунной контрольной точки в сочетании, и затем обнаружили, что противоопухолевое действие значительно улучшается без развития серьезных побочных реакций, по сравнению с применением лекарственных средств по отдельности. Авторы данного изобретения дополнительно установили клетку, соэкспрессирующую эпитопный пептид человеческого опухолевого антигена, полученный из SART2 и человеческий HLA-A24, и установили способ, который может оценить противоопухолевое действие эпитопного пептида человеческого опухолевого антигена на клетку.
Более конкретно, в данном изобретении представлены следующие изобретения.
[1] Противоопухолевое средство для применения в сочетании с модулятором иммунной контрольной точки, содержащее активный ингредиент, пептид, имеющий 4 связанных эпитопа, содержащий 4 CTL эпитопных пептида, связанных через линкеры, где
в пептиде, имеющем 4 связанных эпитопа,
эпитопный пептид, такой как показан в SEQ ID NO: 5 (PEP5), и
3 эпитопных пептида, выбранных из группы, состоящей из эпитопного пептида, такого как показан в SEQ ID NO: 1 (PEP1), эпитопного пептида, такого как показан в SEQ ID NO: 2 (PEP2), эпитопного пептида, такого как показан в SEQ ID NO: 4 (PEP4), эпитопного пептида, такого как показан в SEQ ID NO: 6 (PEP6), эпитопного пептида, такого как показан в SEQ ID NO: 7 (PEP7), эпитопного пептида, такого как показан в SEQ ID NO: 8 (PEP8), эпитопного пептида, такого как показан в SEQ ID NO: 9 (PEP9), эпитопного пептида, такого как показан в SEQ ID NO: 10 (PEP10), эпитопного пептида, такого как показан в SEQ ID NO: 13 (PEP13), эпитопного пептида, такого как показан в SEQ ID NO: 15 (PEP15), эпитопного пептида, такого как показан в SEQ ID NO: 17 (PEP17) и эпитопного пептида, такого как показан в SEQ ID NO: 18 (PEP18),
связаны через линкеры, где пептид, имеющий 4 связанных эпитопа, необязательно дополнительно содержит пептидную последовательность, состоящую из гидрофильных аминокислот, и где пептид, имеющий 4 связанных эпитопа, имеет одну из характеристик, выбранных из следующих характеристик (1)-(3):
(1) пептид содержит PEP2 на С-конце (за исключением пептидов, содержащих PEP7 и PEP8 на N-конце, последовательно расположенных в таком порядке от N-конца через линкер);
(2) пептид содержит PEP4 на С-конце; и
(3) пептид содержит PEP10 на С-конце.
[2] Противоопухолевое средство по [1], где эпитопные пептиды, содержащиеся в пептиде, имеющем 4 связанных эпитопа, состоят из
PEP5,
PEP6,
PEP9, и
одного эпитопного пептида, выбранного из группы, состоящей из PEP2, PEP4 и PEP10, и
пептид, имеющий 4 связанных эпитопа, имеет PEP2, PEP4 или PEP10 на С-конце.
[3] Противоопухолевое средство по [1] или [2], где пептид, имеющий 4 связанных эпитопа, состоит из последовательности, выбранной из следующих последовательностей:
PEP5-(L)-PEP9-(L)-PEP6-(L)-PEP4;
PEP5-(L)-PEP9-(L)-PEP6-(L)-PEP2; и
PEP5-(L)-PEP9-(L)-PEP6-(L)-PEP10, где
"(L)" представляет линкер.
[4] Противоопухолевое средство по любому из [1]-[3], где линкером является аминокислотный линкер.
[5] Противоопухолевое средство по [4], где аминокислотным линкером является аргининовый димер, состоящий из двух аргининовых остатков, связанных друг с другом, или аргининовый тример, состоящий из трех аргининовых остатков, связанных друг с другом.
[6] Противоопухолевое средство по любому из [1]-[5], где пептидная последовательность, состоящая из гидрофильных аминокислот, связана с N-концом и состоит из аргининового тримера, состоящего из трех аргининовых остатков, связанных друг с другом, или аргининового тетрамера, состоящего из четырех аргининовых остатков, связанных друг с другом.
[7] Противоопухолевое средство по любому из [1]-[6], где пептид, имеющий 4 связанных эпитопа, такой как показан в SEQ ID NO: 24, SEQ ID NO: 25 или SEQ ID NO: 26.
[8] Противоопухолевое средство по любому из [1]-[7], где модулятором иммунной контрольной точки является, по меньшей мере, один, выбранный из группы, состоящей из антагониста пути PD-1, агониста пути ICOS, антагониста пути CTLA-4 и агониста пути CD28.
[9] Противоопухолевое средство по любому из [1]-[7], где модулятором иммунной контрольной точки является, по меньшей мере, один, выбранный из группы, состоящей из антагониста пути PD-1 и антагониста пути CTLA-4.
[10] Противоопухолевое средство по любому из [1]-[7], где модулятором иммунной контрольной точки является антагонист пути PD-1.
[11] Противоопухолевое средство по любому из [8]-[10], где антагонистом пути PD-1 является, по меньшей мере, один, выбранный из группы, состоящей из анти-PD-1 антитела, анти-PD-L1 антитела и анти-PD-L2 антитела.
[12] Противоопухолевое средство по любому из [8]-[10], где антагонистом пути PD-1 является, по меньшей мере, один, выбранный из группы, состоящей из анти-PD-1 антитела и анти-PD-L1 антитела.
[13] Противоопухолевое средство по [11] или [12], где анти-PD-1 антителом является ниволумаб или пембролизумаб, и анти-PD-L1 антителом является атезолизумаб, дурвалумаб или авелумаб.
[14] Противоопухолевое средство по [8] или [9], где антагонистом пути CTLA-4 является анти-CTLA-4 антитело.
[15] Противоопухолевое средство по [14], где анти-CTLA-4 антителом является ипилимумаб или тремелимумаб.
[16] Противоопухолевое средство для лечения онкологического пациента, получающего модулятор иммунной контрольной точки, содержащее пептид, имеющий 4 связанных эпитопа, в качестве активного ингредиента, где
в пептиде, имеющем 4 связанных эпитопа,
эпитопный пептид, такой как показан в SEQ ID NO: 5 (PEP5), и
3 эпитопных пептида, выбранных из группы, состоящей из эпитопного пептида, такого как показан в SEQ ID NO: 1 (PEP1), эпитопного пептида, такого как показан в SEQ ID NO: 2 (PEP2), эпитопного пептида, такого как показан в SEQ ID NO: 4 (PEP4), эпитопного пептида, такого как показан в SEQ ID NO: 6 (PEP6), эпитопного пептида, такого как показан в SEQ ID NO: 7 (PEP7), эпитопного пептида, такого как показан в SEQ ID NO: 8 (PEP8), эпитопного пептида, такого как показан в SEQ ID NO: 9 (PEP9), эпитопного пептида, такого как показан в SEQ ID NO: 10 (PEP10), эпитопного пептида, такого как показан в SEQ ID NO: 13 (PEP13), эпитопного пептида, такого как показан в SEQ ID NO: 15 (PEP15), эпитопного пептида, такого как показан в SEQ ID NO: 17 (PEP17) и эпитопного пептида, такого как показан в SEQ ID NO: 18 (PEP18),
связаны через линкеры, где пептид, имеющий 4 связанных эпитопа, необязательно дополнительно содержит пептидную последовательность, состоящую из гидрофильных аминокислот, и где пептид, имеющий 4 связанных эпитопа, имеет одну из характеристик, выбранных из следующих характеристик (1)-(3):
(1) пептид содержит PEP2 на С-конце (за исключением пептидов, содержащих PEP7 и PEP8 на N-конце, последовательно расположенных в таком порядке от N-конца через линкер);
(2) пептид содержит PEP4 на С-конце; и
(3) пептид содержит PEP10 на С-конце.
[17] Противоопухолевое средство для лечения онкологического пациента, получающего пептид, имеющий 4 связанных эпитопа, содержащее модулятор иммунной контрольной точки, где
в пептиде, имеющем 4 связанных эпитопа,
эпитопный пептид, такой как показан в SEQ ID NO: 5 (PEP5), и
3 эпитопных пептида, выбранных из группы, состоящей из эпитопного пептида, такого как показан в SEQ ID NO: 1 (PEP1), эпитопного пептида, такого как показан в SEQ ID NO: 2 (PEP2), эпитопного пептида, такого как показан в SEQ ID NO: 4 (PEP4), эпитопного пептида, такого как показан в SEQ ID NO: 6 (PEP6), эпитопного пептида, такого как показан в SEQ ID NO: 7 (PEP7), эпитопного пептида, такого как показан в SEQ ID NO: 8 (PEP8), эпитопного пептида, такого как показан в SEQ ID NO: 9 (PEP9), эпитопного пептида, такого как показан в SEQ ID NO: 10 (PEP10), эпитопного пептида, такого как показан в SEQ ID NO: 13 (PEP13), эпитопного пептида, такого как показан в SEQ ID NO: 15 (PEP15), эпитопного пептида, такого как показан в SEQ ID NO: 17 (PEP17) и эпитопного пептида, такого как показан в SEQ ID NO: 18 (PEP18),
связаны через линкеры, где пептид, имеющий 4 связанных эпитопа, необязательно дополнительно содержит пептидную последовательность, состоящую из гидрофильных аминокислот, и где пептид, имеющий 4 связанных эпитопа, имеет одну из характеристик, выбранных из следующих характеристик (1)-(3):
(1) пептид содержит PEP2 на С-конце (за исключением пептидов, содержащих PEP7 и PEP8 на N-конце, последовательно расположенных в таком порядке от N-конца через линкер);
(2) пептид содержит PEP4 на С-конце; и
(3) пептид содержит PEP10 на С-конце, и
где модулятором иммунной контрольной точки является, по меньшей мере, один, выбранный из группы, состоящей из антагониста пути PD-1, агониста пути ICOS, антагониста пути CTLA-4 и агонист пути CD28.
[18] Объединенный состав, содержащий пептид, имеющий 4 связанных эпитопа, и модулятор иммунной контрольной точки в сочетании, где
в пептиде, имеющем 4 связанных эпитопа,
эпитопный пептид, такой как показан в SEQ ID NO: 5 (PEP5), и
3 эпитопных пептида, выбранных из группы, состоящей из эпитопного пептида, такого как показан в SEQ ID NO: 1 (PEP1), эпитопного пептида, такого как показан в SEQ ID NO: 2 (PEP2), эпитопного пептида, такого как показан в SEQ ID NO: 4 (PEP4), эпитопного пептида, такого как показан в SEQ ID NO: 6 (PEP6), эпитопного пептида, такого как показан в SEQ ID NO: 7 (PEP7), эпитопного пептида, такого как показан в SEQ ID NO: 8 (PEP8), эпитопного пептида, такого как показан в SEQ ID NO: 9 (PEP9), эпитопного пептида, такого как показан в SEQ ID NO: 10 (PEP10), эпитопного пептида, такого как показан в SEQ ID NO: 13 (PEP13), эпитопного пептида, такого как показан в SEQ ID NO: 15 (PEP15), эпитопного пептида, такого как показан в SEQ ID NO: 17 (PEP17) и эпитопного пептида, такого как показан в SEQ ID NO: 18 (PEP18),
связаны через линкеры, где пептид, имеющий 4 связанных эпитопа, необязательно дополнительно содержит пептидную последовательность, состоящую из гидрофильных аминокислот, и где пептид, имеющий 4 связанных эпитопа, имеет одну из характеристик, выбранных из следующих характеристик (1)-(3):
(1) пептид содержит PEP2 на С-конце (за исключением пептидов, содержащих PEP7 и PEP8 на N-конце, последовательно расположенных в таком порядке от N-конца через линкер);
(2) пептид содержит PEP4 на С-конце; и
(3) пептид содержит PEP10 на С-конце.
[19] Усилитель противоопухолевого действия для усиления противоопухолевого действия модулятора иммунной контрольной точки, содержащий пептид, имеющий 4 связанных эпитопа, в качестве активного ингредиента, где
в пептиде, имеющем 4 связанных эпитопа,
эпитопный пептид, такой как показан в SEQ ID NO: 5 (PEP5), и
3 эпитопных пептида, выбранных из группы, состоящей из эпитопного пептида, такого как показан в SEQ ID NO: 1 (PEP1), эпитопного пептида, такого как показан в SEQ ID NO: 2 (PEP2), эпитопного пептида, такого как показан в SEQ ID NO: 4 (PEP4), эпитопного пептида, такого как показан в SEQ ID NO: 6 (PEP6), эпитопного пептида, такого как показан в SEQ ID NO: 7 (PEP7), эпитопного пептида, такого как показан в SEQ ID NO: 8 (PEP8), эпитопного пептида, такого как показан в SEQ ID NO: 9 (PEP9), эпитопного пептида, такого как показан в SEQ ID NO: 10 (PEP10), эпитопного пептида, такого как показан в SEQ ID NO: 13 (PEP13), эпитопного пептида, такого как показан в SEQ ID NO: 15 (PEP15), эпитопного пептида, такого как показан в SEQ ID NO: 17 (PEP17) и эпитопного пептида, такого как показан в SEQ ID NO: 18 (PEP18),
связаны через линкеры, где пептид, имеющий 4 связанных эпитопа, необязательно дополнительно содержит пептидную последовательность, состоящую из гидрофильных аминокислот, и где пептид, имеющий 4 связанных эпитопа, имеет одну из характеристик, выбранных из следующих характеристик (1)-(3):
(1) пептид содержит PEP2 на С-конце (за исключением пептидов, содержащих PEP7 и PEP8 на N-конце, последовательно расположенных в таком порядке от N-конца через линкер);
(2) пептид содержит PEP4 на С-конце; и
(3) пептид содержит PEP10 на С-конце.
[20] Противоопухолевое средство, содержащее пептид, имеющий 4 связанных эпитопа, содержащий 4 CTL эпитопных пептида, связанных через линкеры, и модулятор иммунной контрольной точки, в качестве активных ингредиентов, где
в пептиде, имеющем 4 связанных эпитопа,
эпитопный пептид, такой как показан в SEQ ID NO: 5 (PEP5), и
3 эпитопных пептида, выбранных из группы, состоящей из эпитопного пептида, такого как показан в SEQ ID NO: 1 (PEP1), эпитопного пептида, такого как показан в SEQ ID NO: 2 (PEP2), эпитопного пептида, такого как показан в SEQ ID NO: 4 (PEP4), эпитопного пептида, такого как показан в SEQ ID NO: 6 (PEP6), эпитопного пептида, такого как показан в SEQ ID NO: 7 (PEP7), эпитопного пептида, такого как показан в SEQ ID NO: 8 (PEP8), эпитопного пептида, такого как показан в SEQ ID NO: 9 (PEP9), эпитопного пептида, такого как показан в SEQ ID NO: 10 (PEP10), эпитопного пептида, такого как показан в SEQ ID NO: 13 (PEP13), эпитопного пептида, такого как показан в SEQ ID NO: 15 (PEP15), эпитопного пептида, такого как показан в SEQ ID NO: 17 (PEP17) и эпитопного пептида, такого как показан в SEQ ID NO: 18 (PEP18),
связаны через линкеры, где пептид, имеющий 4 связанных эпитопа, необязательно дополнительно содержит пептидную последовательность, состоящую из гидрофильных аминокислот, и где пептид, имеющий 4 связанных эпитопа, имеет одну из характеристик, выбранных из следующих характеристик (1)-(3):
(1) пептид содержит PEP2 на С-конце (за исключением пептидов, содержащих PEP7 и PEP8 на N-конце, последовательно расположенных в таком порядке от N-конца через линкер);
(2) пептид содержит PEP4 на С-конце; и
(3) пептид содержит PEP10 на С-конце.
[21] Набор состава, содержащий пептид, имеющий 4 связанных эпитопа, и инструкцию по применению, где в инструкции по применению сказано, что пептид, имеющий 4 связанных эпитопа, и модулятор иммунной контрольной точки вводят в сочетании онкологическому пациенту, где
в пептиде, имеющем 4 связанных эпитопа,
эпитопный пептид, такой как показан в SEQ ID NO: 5 (PEP5), и
3 эпитопных пептида, выбранных из группы, состоящей из эпитопного пептида, такого как показан в SEQ ID NO: 1 (PEP1), эпитопного пептида, такого как показан в SEQ ID NO: 2 (PEP2), эпитопного пептида, такого как показан в SEQ ID NO: 4 (PEP4), эпитопного пептида, такого как показан в SEQ ID NO: 6 (PEP6), эпитопного пептида, такого как показан в SEQ ID NO: 7 (PEP7), эпитопного пептида, такого как показан в SEQ ID NO: 8 (PEP8), эпитопного пептида, такого как показан в SEQ ID NO: 9 (PEP9), эпитопного пептида, такого как показан в SEQ ID NO: 10 (PEP10), эпитопного пептида, такого как показан в SEQ ID NO: 13 (PEP13), эпитопного пептида, такого как показан в SEQ ID NO: 15 (PEP15), эпитопного пептида, такого как показан в SEQ ID NO: 17 (PEP17) и эпитопного пептида, такого как показан в SEQ ID NO: 18 (PEP18),
связаны через линкеры, где пептид, имеющий 4 связанных эпитопа, необязательно дополнительно содержит пептидную последовательность, состоящую из гидрофильных аминокислот, и где пептид, имеющий 4 связанных эпитопа, имеет одну из характеристик, выбранных из следующих характеристик (1)-(3):
(1) пептид содержит PEP2 на С-конце (за исключением пептидов, содержащих PEP7 и PEP8 на N-конце, последовательно расположенных в таком порядке от N-конца через линкер);
(2) пептид содержит PEP4 на С-конце; и
(3) пептид содержит PEP10 на С-конце.
[22] Клетка, в которую введен полинуклеотид, кодирующий эпитопный пептид человеческого опухолевого антигена, полученный из SART2, и полинуклеотид, кодирующий α1 и α2 области человеческого HLA-A24.
[23] Клетка, в которую введен полинуклеотид, выбранный из следующих полинуклеотидов (a)-(e):
(a) полинуклеотид, кодирующий полипептид, имеющий аминокислотную последовательность, показанную в SEQ ID NO: 5;
(b) полинуклеотид, кодирующий полипептид, имеющий аминокислотную последовательность, имеющую замещение, делецию или добавление одной или нескольких аминокислот в аминокислотной последовательности, показанной в SEQ ID NO: 5;
(c) полинуклеотид, кодирующий полипептид, имеющий аминокислотную последовательность, имеющую 90% или более идентичность с аминокислотной последовательностью, показанной в SEQ ID NO: 5;
(d) полинуклеотид, содержащий нуклеотидную последовательность, показанную в SEQ ID NO: 29; и
(e) полинуклеотид, содержащий нуклеотидную последовательность, имеющую 90% или более идентичность к нуклеотидной последовательности, показанной в SEQ ID NO: 29; и
полинуклеотид, выбранный из следующих полинуклеотидов (f)-(j):
(f) полинуклеотид, кодирующий полипептид, имеющий аминокислотную последовательность, показанную в SEQ ID NO: 30;
(g) полинуклеотид, кодирующий полипептид, имеющий аминокислотную последовательность, имеющую замещение, делецию или добавление одной или нескольких аминокислот в аминокислотной последовательности, показанной в SEQ ID NO: 30;
(h) полинуклеотид, кодирующий полипептид, имеющий аминокислотную последовательность, имеющую 90% или более идентичность с аминокислотной последовательностью, показанной в SEQ ID NO: 30;
(i) полинуклеотид, содержащий нуклеотидную последовательность, показанную в SEQ ID NO: 31; и
(j) полинуклеотид, содержащий нуклеотидную последовательность, имеющую 90% или более идентичность к нуклеотидной последовательности, показанной в SEQ ID NO: 31
[24] Клетка, в которую введен полинуклеотид, выбранный из следующих полинуклеотидов (k)-(o):
(k) полинуклеотид, кодирующий полипептид, состоящий из аминокислотной последовательности, показанной в SEQ ID NO: 32;
(l) полинуклеотид, кодирующий полипептид, состоящий из аминокислотной последовательности, имеющей замещение, делецию или добавление одной или нескольких аминокислот в аминокислотной последовательности, показанной в SEQ ID NO: 32;
(m) полинуклеотид, кодирующий полипептид, состоящий из аминокислотной последовательности, имеющей 90% или более идентичность с аминокислотной последовательностью, показанной в SEQ ID NO: 32;
(n) полинуклеотид, состоящий из нуклеотидной последовательности, показанной в SEQ ID NO: 33; и
(o) полинуклеотид, состоящий из нуклеотидной последовательности, имеющей 90% или более идентичность к нуклеотидной последовательности, показанной в SEQ ID NO: 33; и
полинуклеотид, выбранный из следующих полинуклеотидов (p)-(t):
(p) полинуклеотид, кодирующий полипептид, состоящий из аминокислотной последовательности, показанной в SEQ ID NO: 34;
(q) полинуклеотид, кодирующий полипептид, состоящий из аминокислотной последовательности, имеющей замещение, делецию или добавление одной или нескольких аминокислот в аминокислотной последовательности, показанной в SEQ ID NO: 34;
(r) полинуклеотид, кодирующий полипептид, состоящий из аминокислотной последовательности, имеющей 90% или более идентичность с аминокислотной последовательностью, показанной в SEQ ID NO: 34;
(s) полинуклеотид, состоящий из нуклеотидной последовательности, показанной в SEQ ID NO: 35; и
(t) полинуклеотид, состоящий из нуклеотидной последовательности, имеющей 90% или более идентичность к нуклеотидной последовательности, показанной в SEQ ID NO: 35
[25] Клетка по любому из [22]-[24] для оценки противоопухолевого действия эпитопного пептида человеческого опухолевого антигена, полученного из SART2.
[26] Клетка по любому из [22]-[24] для оценки противоопухолевого действия пептида, имеющего 4 связанных эпитопа и/или модулятора иммунной контрольной точки, где
в пептиде, имеющем 4 связанных эпитопа,
эпитопный пептид, такой как показан в SEQ ID NO: 5 (PEP5), и
3 эпитопных пептида, выбранных из группы, состоящей из эпитопного пептида, такого как показан в SEQ ID NO: 1 (PEP1), эпитопного пептида, такого как показан в SEQ ID NO: 2 (PEP2), эпитопного пептида, такого как показан в SEQ ID NO: 4 (PEP4), эпитопного пептида, такого как показан в SEQ ID NO: 6 (PEP6), эпитопного пептида, такого как показан в SEQ ID NO: 7 (PEP7), эпитопного пептида, такого как показан в SEQ ID NO: 8 (PEP8), эпитопного пептида, такого как показан в SEQ ID NO: 9 (PEP9), эпитопного пептида, такого как показан в SEQ ID NO: 10 (PEP10), эпитопного пептида, такого как показан в SEQ ID NO: 13 (PEP13), эпитопного пептида, такого как показан в SEQ ID NO: 15 (PEP15), эпитопного пептида, такого как показан в SEQ ID NO: 17 (PEP17) и эпитопного пептида, такого как показан в SEQ ID NO: 18 (PEP18),
связаны через линкеры, где пептид, имеющий 4 связанных эпитопа, необязательно дополнительно содержит пептидную последовательность, состоящую из гидрофильных аминокислот, и где пептид, имеющий 4 связанных эпитопа, имеет одну из характеристик, выбранных из следующих характеристик (1)-(3):
(1) пептид содержит PEP2 на С-конце (за исключением пептидов, содержащих PEP7 и PEP8 на N-конце, последовательно расположенных в таком порядке от N-конца через линкер);
(2) пептид содержит PEP4 на С-конце; и
(3) пептид содержит PEP10 на С-конце.
[27] Способ оценки противоопухолевого действия эпитопного пептида человеческого опухолевого антигена, полученного из SART2, с применением клетки по любому из [22]-[24], включающий следующие стадии (I) и (II):
(I) введение эпитопного пептида человеческого опухолевого антигена, полученного из SART2, не иммунодефицитному отличному от человека животному с нокином человеческого HLA-A24 гена; и
(II) трансплантацию клетки по любому из [22]-[24] не иммунодефицитному отличному от человека животному с нокином человеческого HLA-A24 гена.
[28] Способ оценки противоопухолевого действия пептида, имеющего 4 связанных эпитопа, и/или модулятора иммунной контрольной точки с применением клетки по любому из [22]-[24], включающий следующие стадии (I) и (II):
(I) введение пептида, имеющего 4 связанных эпитопа и/или модулятора иммунной контрольной точки не иммунодефицитному отличному от человека животному с нокином человеческого HLA-A24 гена; и
(II) трансплантацию клетки по любому из [22]-[24] не иммунодефицитному отличному от человека животному с нокином человеческого HLA-A24 гена, где
в пептиде, имеющем 4 связанных эпитопа,
эпитопный пептид, такой как показан в SEQ ID NO: 5 (PEP5), и
3 эпитопных пептида, выбранных из группы, состоящей из эпитопного пептида, такого как показан в SEQ ID NO: 1 (PEP1), эпитопного пептида, такого как показан в SEQ ID NO: 2 (PEP2), эпитопного пептида, такого как показан в SEQ ID NO: 4 (PEP4), эпитопного пептида, такого как показан в SEQ ID NO: 6 (PEP6), эпитопного пептида, такого как показан в SEQ ID NO: 7 (PEP7), эпитопного пептида, такого как показан в SEQ ID NO: 8 (PEP8), эпитопного пептида, такого как показан в SEQ ID NO: 9 (PEP9), эпитопного пептида, такого как показан в SEQ ID NO: 10 (PEP10), эпитопного пептида, такого как показан в SEQ ID NO: 13 (PEP13), эпитопного пептида, такого как показан в SEQ ID NO: 15 (PEP15), эпитопного пептида, такого как показан в SEQ ID NO: 17 (PEP17) и эпитопного пептида, такого как показан в SEQ ID NO: 18 (PEP18),
связаны через линкеры, где пептид, имеющий 4 связанных эпитопа, необязательно дополнительно содержит пептидную последовательность, состоящую из гидрофильных аминокислот, и где пептид, имеющий 4 связанных эпитопа, имеет одну из характеристик, выбранных из следующих характеристик (1)-(3):
(1) пептид содержит PEP2 на С-конце (за исключением пептидов, содержащих PEP7 и PEP8 на N-конце, последовательно расположенных в таком порядке от N-конца через линкер);
(2) пептид содержит PEP4 на С-конце; и
(3) пептид содержит PEP10 на С-конце.
[29] Фармацевтическая композиция для профилактики и/или лечения опухоли, содержащей пептид, имеющий 4 связанных эпитопа, содержащий 4 CTL эпитопные пептиды, связанные через линкеры, модулятор иммунной контрольной точки и фармацевтически приемлемый носитель, где
в пептиде, имеющем 4 связанных эпитопа,
эпитопный пептид, такой как показан в SEQ ID NO: 5 (PEP5), и
3 эпитопных пептида, выбранных из группы, состоящей из эпитопного пептида, такого как показан в SEQ ID NO: 1 (PEP1), эпитопного пептида, такого как показан в SEQ ID NO: 2 (PEP2), эпитопного пептида, такого как показан в SEQ ID NO: 4 (PEP4), эпитопного пептида, такого как показан в SEQ ID NO: 6 (PEP6), эпитопного пептида, такого как показан в SEQ ID NO: 7 (PEP7), эпитопного пептида, такого как показан в SEQ ID NO: 8 (PEP8), эпитопного пептида, такого как показан в SEQ ID NO: 9 (PEP9), эпитопного пептида, такого как показан в SEQ ID NO: 10 (PEP10), эпитопного пептида, такого как показан в SEQ ID NO: 13 (PEP13), эпитопного пептида, такого как показан в SEQ ID NO: 15 (PEP15), эпитопного пептида, такого как показан в SEQ ID NO: 17 (PEP17) и эпитопного пептида, такого как показан в SEQ ID NO: 18 (PEP18),
связаны через линкеры, где пептид, имеющий 4 связанных эпитопа, необязательно дополнительно содержит пептидную последовательность, состоящую из гидрофильных аминокислот, и где пептид, имеющий 4 связанных эпитопа, имеет одну из характеристик, выбранных из следующих характеристик (1)-(3):
(1) пептид содержит PEP2 на С-конце (за исключением пептидов, содержащих PEP7 и PEP8 на N-конце, последовательно расположенных в таком порядке от N-конца через линкер);
(2) пептид содержит PEP4 на С-конце; и
(3) пептид содержит PEP10 на С-конце.
[30] Способ профилактики и/или лечения опухоли объединением пептида, имеющего 4 связанных эпитопа, содержащих 4 CTL эпитопных пептида, связанных через линкеры, с модулятором иммунной контрольной точки, включающий стадию введения профилактически и/или терапевтически эффективного количества пептида, имеющего 4 связанных эпитопа, пациенту, где
в пептиде, имеющем 4 связанных эпитопа,
эпитопный пептид, такой как показан в SEQ ID NO: 5 (PEP5), и
3 эпитопных пептида, выбранных из группы, состоящей из эпитопного пептида, такого как показан в SEQ ID NO: 1 (PEP1), эпитопного пептида, такого как показан в SEQ ID NO: 2 (PEP2), эпитопного пептида, такого как показан в SEQ ID NO: 4 (PEP4), эпитопного пептида, такого как показан в SEQ ID NO: 6 (PEP6), эпитопного пептида, такого как показан в SEQ ID NO: 7 (PEP7), эпитопного пептида, такого как показан в SEQ ID NO: 8 (PEP8), эпитопного пептида, такого как показан в SEQ ID NO: 9 (PEP9), эпитопного пептида, такого как показан в SEQ ID NO: 10 (PEP10), эпитопного пептида, такого как показан в SEQ ID NO: 13 (PEP13), эпитопного пептида, такого как показан в SEQ ID NO: 15 (PEP15), эпитопного пептида, такого как показан в SEQ ID NO: 17 (PEP17) и эпитопного пептида, такого как показан в SEQ ID NO: 18 (PEP18),
связаны через линкеры, где пептид, имеющий 4 связанных эпитопа, необязательно дополнительно содержит пептидную последовательность, состоящую из гидрофильных аминокислот, и где пептид, имеющий 4 связанных эпитопа, имеет одну из характеристик, выбранных из следующих характеристик (1)-(3):
(1) пептид содержит PEP2 на С-конце (за исключением пептидов, содержащих PEP7 и PEP8 на N-конце, последовательно расположенных в таком порядке от N-конца через линкер);
(2) пептид содержит PEP4 на С-конце; и
(3) пептид содержит PEP10 на С-конце.
[31] Способ по [30], где пептид, имеющий 4 связанных эпитопа, вводят пациенту до введения модулятора иммунной контрольной точки, одновременно с введением модулятора иммунной контрольной точки, или после введения модулятора иммунной контрольной точки.
[32] Способ по [30] для усиления противоопухолевого действия модулятора иммунной контрольной точки.
[33] Пептид, имеющий 4 связанных эпитопа, содержащих 4 CTL эпитопных пептида, связанных через линкеры, для применения в профилактике или лечении опухоли в сочетании с модулятором иммунной контрольной точки, где
в пептиде, имеющем 4 связанных эпитопа,
эпитопный пептид, такой как показан в SEQ ID NO: 5 (PEP5), и
3 эпитопных пептида, выбранных из группы, состоящей из эпитопного пептида, такого как показан в SEQ ID NO: 1 (PEP1), эпитопного пептида, такого как показан в SEQ ID NO: 2 (PEP2), эпитопного пептида, такого как показан в SEQ ID NO: 4 (PEP4), эпитопного пептида, такого как показан в SEQ ID NO: 6 (PEP6), эпитопного пептида, такого как показан в SEQ ID NO: 7 (PEP7), эпитопного пептида, такого как показан в SEQ ID NO: 8 (PEP8), эпитопного пептида, такого как показан в SEQ ID NO: 9 (PEP9), эпитопного пептида, такого как показан в SEQ ID NO: 10 (PEP10), эпитопного пептида, такого как показан в SEQ ID NO: 13 (PEP13), эпитопного пептида, такого как показан в SEQ ID NO: 15 (PEP15), эпитопного пептида, такого как показан в SEQ ID NO: 17 (PEP17) и эпитопного пептида, такого как показан в SEQ ID NO: 18 (PEP18),
связаны через линкеры, где пептид, имеющий 4 связанных эпитопа, необязательно дополнительно содержит пептидную последовательность, состоящую из гидрофильных аминокислот, и где пептид, имеющий 4 связанных эпитопа, имеет одну из характеристик, выбранных из следующих характеристик (1)-(3):
(1) пептид содержит PEP2 на С-конце (за исключением пептидов, содержащих PEP7 и PEP8 на N-конце, последовательно расположенных в таком порядке от N-конца через линкер);
(2) пептид содержит PEP4 на С-конце; и
(3) пептид содержит PEP10 на С-конце, и
где пептид, имеющий 4 связанных эпитопа, вводят до введения модулятора иммунной контрольной точки, одновременно с введением модулятора иммунной контрольной точки, или после введения модулятора иммунной контрольной точки.
[34] Пептид, имеющий 4 связанных эпитопа, по [33], где пептид, имеющий 4 связанных эпитопа, такой как показан в SEQ ID NO: 24, SEQ ID NO: 25 или SEQ ID NO: 26.
[35] Пептид, имеющий 4 связанных эпитопа, по [33] или [34], где модулятором иммунной контрольной точки является антагонист пути PD-1.
[36] Пептид, имеющий 4 связанных эпитопа, по любому из [33]-[35], где антагонистом пути PD-1 является, по меньшей мере, один, выбранный из группы, состоящей из анти-PD-1 антитела и анти-PD-L1 антитела.
[37] Пептид, имеющий 4 связанных эпитопа, по любому из [33]-[36], где анти-PD-1 антителом является ниволумаб или пембролизумаб, и анти-PD-L1 антителом является атезолизумаб, дурвалумаб или авелумаб.
[38] Пептид, имеющий 4 связанных эпитопа, для применения в усилении противоопухолевого действия модулятора иммунной контрольной точки.
[39] Пептид, имеющий 4 связанных эпитопа, и модулятор иммунной контрольной точки для применения в способе профилактики и/или лечения опухоли у пациента, где пептид, имеющий 4 связанных эпитопа, и модулятор иммунной контрольной точки вводят одновременно или отдельно пациенту, где пептид, имеющий 4 связанных эпитопа, содержит 4 CTL эпитопные пептиды, связанные через линкеры,
где эпитопный пептид, такой как показан в SEQ ID NO: 5 (PEP5), и
3 эпитопных пептида, выбранных из группы, состоящей из эпитопного пептида, такого как показан в SEQ ID NO: 1 (PEP1), эпитопного пептида, такого как показан в SEQ ID NO: 2 (PEP2), эпитопного пептида, такого как показан в SEQ ID NO: 4 (PEP4), эпитопного пептида, такого как показан в SEQ ID NO: 6 (PEP6), эпитопного пептида, такого как показан в SEQ ID NO: 7 (PEP7), эпитопного пептида, такого как показан в SEQ ID NO: 8 (PEP8), эпитопного пептида, такого как показан в SEQ ID NO: 9 (PEP9), эпитопного пептида, такого как показан в SEQ ID NO: 10 (PEP10), эпитопного пептида, такого как показан в SEQ ID NO: 13 (PEP13), эпитопного пептида, такого как показан в SEQ ID NO: 15 (PEP15), эпитопного пептида, такого как показан в SEQ ID NO: 17 (PEP17) и эпитопного пептида, такого как показан в SEQ ID NO: 18 (PEP18),
связаны через линкеры, где пептид, имеющий 4 связанных эпитопа, необязательно дополнительно содержит пептидную последовательность, состоящую из гидрофильных аминокислот, и где пептид, имеющий 4 связанных эпитопа, имеет одну из характеристик, выбранных из следующих характеристик (1)-(3):
(1) пептид содержит PEP2 на С-конце (за исключением пептидов, содержащих PEP7 и PEP8 на N-конце, последовательно расположенных в таком порядке от N-конца через линкер);
(2) пептид содержит PEP4 на С-конце; и
(3) пептид содержит PEP10 на С-конце.
Данное изобретение дополнительно относится к следующим аспектам.
Применение пептида, имеющего 4 связанных эпитопа, описанного выше, для усиления противоопухолевого действия модулятора иммунной контрольной точки.
Применение пептида, имеющего 4 связанных эпитопа, описанных выше, для производства усилителя противоопухолевого действия для модулятора иммунной контрольной точки.
Продукт, содержащий пептид, имеющий 4 связанных эпитопа, описанный выше, и модулятор иммунной контрольной точки в объединенном составе, где пептид, имеющий 4 связанных эпитопа, и модулятор иммунной контрольной точки применяют одновременно, последовательно или отдельно с интервалами для профилактики и/или лечения опухоли.
Это описание включает часть или все содержание, раскрытое в заявке на патент Японии № 2018-124894, на основе которого в данной заявке заявлен приоритет.
Преимущественные эффекты изобретения
Противоопухолевое средство по настоящему изобретению позволяет осуществить лечение рака с высоким противоопухолевым действием (в частности, эффектом уменьшения опухоли и/или эффектом задержки роста опухоли (эффектом продления жизни)) при подавлении развития побочных реакций. В результате, противоопухолевое средство по настоящему изобретению способствует долгосрочному выживанию больных раком.
Краткое описание чертежей
[Фигура 1] На фигуре 1 показана ВЭЖХ хроматограмма пептида TPV07, имеющего 4 связанных CTL эпитопа.
[Фигура 2] На фигуре 2 показана ВЭЖХ хроматограмма пептида TPV08, имеющего 4 связанных CTL эпитопа.
[Фигура 3] На фигуре 3 показан масс-спектр пептида TPV07, имеющего 4 связанных CTL эпитопа.
[Фигура 4] На фигуре 4 показан масс-спектр пептида TPV08, имеющего 4 связанных CTL эпитопа.
[Фигура 5] На фигуре 5a показано изменение объема опухоли при трансплантации колонии клеток EL4.A24/SART293-101 мышам. На фигуре 5b показано изменение объема опухоли при трансплантации колонии клеток B16F10.A24/SART293-101 мышам.
[Фигура 6] На фигуре 6 показано действие TPV06 и анти-мышиного PD-1 антитела, применяемых в сочетании, на рост опухоли в мышиных моделях, которым трансплантирована колония клеток B16F10.A24/SART293-101.
[Фигура 7] На фигуре 7 показано действие TPV06 и анти-мышиного PD-L1 антитела, применяемых в сочетании, на рост опухоли в мышиных моделях, которым трансплантирована колония клеток B16F10.A24/SART293-101.
[Фигура 8] На фигуре 8 показано действие TPV07 и анти-мышиного PD-1 антитела, применяемых в сочетании, на рост опухоли в мышиных моделях, которым трансплантирована колония клеток B16F10.A24/SART293-101.
[Фигура 9] На фигуре 9 показано действие TPV08 и анти-мышиного PD-1 антитела, применяемых в сочетании, на рост опухоли в мышиных моделях, которым трансплантирована колония клеток B16F10.A24/SART293-101.
Описание вариантов осуществления
Данное изобретение относится к противоопухолевому средству, усилителю противоопухолевого действия и сборному составу, и к применению этих средств, способу лечения и способу усиления противоопухолевого действия, где пептид, имеющий 4 связанных эпитопа, и модулятор иммунной контрольной точки (например, анти-PD-1 антитело и анти-PD-L1 антитело) вводят в сочетании.
В настоящем изобретении, пептид, имеющий 4 связанных CTL эпитопа (здесь далее обозначен как пептид, имеющий 4 связанных эпитопа) означает одну молекулу, в которой 4 пептида, выбранные из CTL эпитопных пептидов, полученных из одинаковых и/или разных молекул опухолевого антигена, линейно связаны через линкеры.
Известны следующие CTL эпитопные пептиды, полученные из молекул опухолевого антигена:
KLVERLGAA (SEQ ID NO: 1; здесь обозначен как "PEP1"; например, Международная публикация № WO 2001/011044);
ASLDSDPWV (SEQ ID NO: 2; здесь обозначен как "PEP2"; например, Международная публикация № WO 2002/010369);
ALVEFEDVL (SEQ ID NO: 3; здесь обозначен как "PEP3"; например, Международная публикация № WO 2002/010369);
LLQAEAPRL (SEQ ID NO: 4; здесь обозначен как "PEP4"; например, Международная публикация № WO 2000/12701);
DYSARWNEI (SEQ ID NO: 5; здесь обозначен как "PEP5"; например, Публикация патента JP (Kokai) № 11-318455 A (1999));
VYDYNCHVDL (SEQ ID NO: 6; здесь обозначен как "PEP6"; например, Международная публикация № WO 2000/12701);
LYAWEPSFL (SEQ ID NO: 7; здесь обозначен как "PEP7"; например, Публикация патента JP (Kokai) № 2003-000270 A);
DYLRSVLEDF (SEQ ID NO: 8; здесь обозначен как "PEP8"; например, Международная публикация № WO 2001/011044);
QIRPIFSNR (SEQ ID NO: 9; здесь обозначен как "PEP9"; например, Международная публикация № WO 2008/007711);
ILEQSGEWWK (SEQ ID NO: 10; здесь обозначен как "PEP10"; например, Международная публикация № WO 2009/022652);
VIQNLERGYR (SEQ ID NO: 11; здесь обозначен как "PEP11"; например, Международная публикация № WO 2009/022652);
KLKHYGPGWV (SEQ ID NO: 12; здесь обозначен как "PEP12"; например, Международная публикация № WO 1999/067288);
RLQEWCSVI (SEQ ID NO: 13; здесь обозначен как "PEP13"; например, Международная публикация № WO 2002/010369);
ILGELREKV (SEQ ID NO: 14; здесь обозначен как "PEP14"; например, Международная публикация № WO 2002/010369);
DYVREHKDNI (SEQ ID NO: 15; здесь обозначен как "PEP15"; например, Международная публикация № WO 2005/071075);
HYTNASDGL (SEQ ID NO: 16; здесь обозначен как "PEP16"; например, Международная публикация № WO 2001/011044);
NYSVRYRPGL (SEQ ID NO: 17; здесь обозначен как "PEP17"; например, Публикация патента JP (Kokai) № 2003-000270 A);
RYLTQETNKV (SEQ ID NO: 18; здесь обозначен как "PEP18"; например, Международная публикация № WO 2005/116056).
В таблице 1 ниже показана информация, относящаяся к белкам, из которых получены CTL эпитопные пептиды PEP1-PEP18. Было описано, что эти белки в высокой степени экспрессируются в опухолевых тканях.
[Таблица 1]
Пептидом, имеющим 4 связанных CTL эпитопа в соответствии с настоящим изобретением, является пептид, в котором 4 типа CTL эпитопных пептидов, выбранных из конкретных 13 типов CTL эпитопных пептидов (пептида, показанного в SEQ ID NO: 1 (PEP1), пептида, показанного в SEQ ID NO: 2 (PEP2), пептида, показанного в SEQ ID NO: 4 (PEP4), пептида, показанного в SEQ ID NO: 5 (PEP5), пептида, показанного в SEQ ID NO: 6 (PEP6), пептида, показанного в SEQ ID NO: 7 (PEP7), пептида, показанного в SEQ ID NO: 8 (PEP8), пептида, показанного в SEQ ID NO: 9 (PEP9), пептида, показанного в SEQ ID NO: 10 (PEP10), пептида, показанного в SEQ ID NO: 13 (PEP13), пептида, показанного в SEQ ID NO: 15 (PEP15), пептида, показанного в SEQ ID NO: 17 (PEP17) и пептида, показанного в SEQ ID NO: 18 (PEP18)) линейно связаны линкерами, и который может вызывать и/или активировать три или несколько CTL, специфических к каждому CTL эпитопному пептиду. Даже если специфическая к CTL эпитопному пептиду индукция не оценивается напрямую, существование специфической к CTL эпитопному пептиду индукции может быть определено в эксперименте расщепления с иммунопротеасомами (Международная публикация № WO 2015/060235, и т.д.).
Пептидом, имеющим 4 связанных эпитопа, в соответствии с настоящим изобретением является пептид, в котором
пептид, показанный в SEQ ID NO: 5 (PEP5), и
3 пептида, выбранных из группы, состоящей из пептида, показанного в SEQ ID NO: 1 (PEP1), пептида, показанного в SEQ ID NO: 2 (PEP2), пептида, показанного в SEQ ID NO: 4 (PEP4), пептида, показанного в SEQ ID NO: 6 (PEP6), пептида, показанного в SEQ ID NO: 7 (PEP7), пептида, показанного в SEQ ID NO: 8 (PEP8), пептида, показанного в SEQ ID NO: 9 (PEP9), пептида, показанного в SEQ ID NO: 10 (PEP10), пептида, показанного в SEQ ID NO: 13 (PEP13), пептида, показанного в SEQ ID NO: 15 (PEP15), пептида, показанного в SEQ ID NO: 17 (PEP17) и пептида, показанного в SEQ ID NO: 18 (PEP18),
связаны линкерами.
В настоящем изобретении, пептид, имеющий аминокислотную последовательность, имеющую замещение, вставку, делецию и/или добавление одной или нескольких аминокислот в каждой аминокислотной последовательности PEP1, PEP2, PEP4, PEP5, PEP6, PEP7, PEP8, PEP9, PEP10, PEP13, PEP15, PEP17 или PEP18, и имеющий способность вызывать CTL и/или способность вызывать продуцирование иммуноглобулина, эквивалентное или превышающее эту функцию у оригинального пептида, может применяться в качестве "CTL эпитопного пептида". Термин "несколько", применяемый здесь, относится к 2 или 3, и, предпочтительно, 2. Примером такого пептида является пептид, полученный замещением аминокислот аминокислотами, имеющими свойства, аналогичные свойствам оригинальных аминокислот (т.е. пептид, полученный консервативным замещение аминокислоты).
Имеет ли пептид "способность вызывать CTL и/или способность вызывать продуцирование иммуноглобулина, эквивалентное или превышающее эту функцию у оригинального пептида" или нет, может быть оценено в соответствии со способом, описанным в, например, Международной публикации № WO 2015/060235. В случае оценки способности вызывать CTL с применением этого способа, количество клеток, продуцирующих IFN-γ, в лунках с добавлением клеток, полученных у мышей, которые заранее дали тестируемый пептид, имеющий аминокислотную последовательность, имеющую замещение, вставку, делецию и/или добавление одной или нескольких аминокислот, антигенпрезентирующих клеток, полученных у сингенных мышей, и тестируемого пептида, используют как показатель, и может быть подтверждено, что пептид обладает способностью вызывать CTL, эквивалентный или превышающий эту функцию оригинального пептида, если результаты определения полученного значения Δ (положительное (10≤Δ < 100), умеренно положительное (100≤Δ < 200), сильно положительное (200≤Δ)) эквивалентны или выше. В этом случае, эквивалентную способность определяют, если оригинальный пептид является "положительным", и пептид, имеющий аминокислотную последовательность, имеющую замещение, вставку, делецию и/или добавлением одной или нескольких аминокислот, также является "положительным". Что касается способности вызывать продуцирование иммуноглобулина, титр специфического к CTL эпитопу IgG антитела в сыворотке мыши, получавшей тестируемый пептид, применяют в качестве показателя, и может быть подтверждено, что пептид обладает способностью вызывать продуцирование иммуноглобулина, эквивалентное или превышающее его у оригинального пептида, если результаты измеренного повышения (кратного) в полученном титре IgG антитела (2 < раз < 10, 10≤раз < 100, 100≤раз) эквивалентны или выше. В этом случае, эквивалентная способность определяется, если результаты измерения для оригинального пептида попадают в диапазон "2 < раз < 10", и результаты измерения для пептида, имеющего аминокислотную последовательность, имеющую замещение, вставку, делецию и/или добавление нескольких аминокислот, также попадают в диапазон "2 < раз < 10".
В настоящем изобретении может применяться любой линкер, при условии, что он отщепляется при введении пептида, имеющего 4 связанных CTL эпитопа, в организм, и связанные CTL эпитопные пептиды могут быть отделены друг от друга. Их примеры включают сложную эфирную связь, простую эфирную связь, линкер на основе сахарной цепи, полиэтиленгликолевый линкер и аминокислотный линкер. Примеры аминокислотных последовательностей, применяемых в качестве аминокислотных линкеров, включают аргининовый димер (RR), аргининовый тример (RRR), аргининовый тетрамер (RRRR), лизиновый димер (KK), лизиновый тример (KKK), лизиновый тетрамер (KKKK), глициновый димер (GG), глициновый тример (GGG), глициновый тетрамер (GGGG), глициновый пентамер (GGGGG), глициновый гексамер (GGGGGG), аланин-аланин-тирозин (AAY), изолейцин-лейцин-аланин (ILA) и аргинин-валин-лизин-аргинин (RVKR), где аргининовый димер (RR) или аргининовый тример (RRR) являются предпочтительными, и аргининовый димер (RR) является наиболее предпочтительным. Линкеры для применения в пептидах, имеющих связанные эпитопы, известны в данной области техники и могут быть подходящим образом выбраны для применения специалистами в данной области техники.
В пептиде, имеющем 4 связанных эпитопа в соответствии с настоящим изобретением, выбираемые CTL эпитопные пептиды и их расположения могут быть определены введением пептида, имеющего 4 связанных эпитопа, полученного синтезом его в данных сочетаниях и в данном порядке эпитопов, трансгенным мышам, экспрессирующим человеческий HLA-A, и оценкой наличия специфической к CTL индукции CTL эпитопного пептида in vivo. Наличие специфической к CTL индукции CTL эпитопного пептида in vivo может быть оценено в соответствии со способом, описанным в, например, международной публикации № WO 2015/060235. Выбираемые CTL эпитопные пептиды и их расположения могут быть определены с применением способа, такого как специфическая к CTL индукция CTL эпитопного пептида, найденного для, по меньшей мере, 3 или более предпочтительно, 4 CTL эпитопных пептидов.
Пептид, имеющий 4 связанных эпитопа, в соответствии с настоящим изобретением предпочтительно имеет одну из характеристик, выбранных из следующих характеристик (1)-(3):
(1) пептид содержит PEP2 на С-конце (за исключением пептидов, содержащих PEP7 и PEP8 на N-конце, последовательно расположенных в таком порядке от N-конца через линкер);
(2) пептид содержит PEP4 на С-конце; и
(3) пептид содержит PEP10 на С-конце.
Таким образом, предпочтительно, в пептиде, имеющем 4 связанных эпитопа в соответствии с настоящим изобретением,
пептид, показанный в SEQ ID NO: 5 (PEP5), и
3 пептида, выбранные из группы, состоящей из пептида, показанного в SEQ ID NO: 1 (PEP1), пептида, показанного в SEQ ID NO: 2 (PEP2), пептида, показанного в SEQ ID NO: 4 (PEP4), пептида, показанного в SEQ ID NO: 6 (PEP6), пептида, показанного в SEQ ID NO: 7 (PEP7), пептида, показанного в SEQ ID NO: 8 (PEP8), пептида, показанного в SEQ ID NO: 9 (PEP9), пептида, показанного в SEQ ID NO: 10 (PEP10), пептида, показанного в SEQ ID NO: 13 (PEP13), пептида, показанного в SEQ ID NO: 15 (PEP15), пептида, показанного в SEQ ID NO: 17 (PEP17) и пептида, показанного в SEQ ID NO: 18 (PEP18),
связаны линкерами, и пептид, имеющий 4 связанных эпитопа, имеет одну из характеристик, выбранных из следующих характеристик (1)-(3):
(1) пептид содержит PEP2 на С-конце (за исключением пептидов, содержащих PEP7 и PEP8 на N-конце, последовательно расположенных в таком порядке от N-конца через линкер);
(2) пептид содержит PEP4 на С-конце; и
(3) пептид содержит PEP10 на С-конце.
Более предпочтительно, пептид, имеющий 4 связанных эпитопа, в соответствии с настоящим изобретением содержит
пептид, показанный в SEQ ID NO: 5 (PEP5), пептид, показанный в SEQ ID NO: 6 (PEP6) и пептид, показанный в SEQ ID NO: 9 (PEP9), и
один пептид, выбранный из группы, состоящей из пептида, показанного в SEQ ID NO: 2 (PEP2), пептида, показанного в SEQ ID NO: 4 (PEP4) и пептида, показанного в SEQ ID NO: 10 (PEP10),
связанные линкерами, и содержит PEP2, PEP4 или PEP10 на С-конце.
Более предпочтительно, пептидом, имеющим 4 связанных эпитопа, в соответствии с настоящим изобретением, является пептид, состоящий из последовательности, выбранной из следующих последовательностей:
PEP5-(L)-PEP6-(L)-PEP9-(L)-PEP4;
PEP9-(L)-PEP5-(L)-PEP6-(L)-PEP4;
PEP6-(L)-PEP5-(L)-PEP9-(L)-PEP4;
PEP6-(L)-PEP9-(L)-PEP5-(L)-PEP4;
PEP9-(L)-PEP6-(L)-PEP5-(L)-PEP4;
PEP5-(L)-PEP9-(L)-PEP6-(L)-PEP4;
PEP5-(L)-PEP9-(L)-PEP6-(L)-PEP2; и
PEP5-(L)-PEP9-(L)-PEP6-(L)-PEP10,
где "(L)" представляет линкер.
Более предпочтительно, пептидом, имеющим 4 связанных эпитопа, в соответствии с настоящим изобретением, является пептид, состоящий из последовательности, выбранной из следующих последовательностей:
PEP5-(L)-PEP9-(L)-PEP6-(L)-PEP4;
PEP5-(L)-PEP9-(L)-PEP6-(L)-PEP2; и
PEP5-(L)-PEP9-(L)-PEP6-(L)-PEP10,
где "(L)" представляет линкер.
Более предпочтительно, пептидом, имеющим 4 связанных эпитопа, в соответствии с настоящим изобретением, является пептид, имеющий аргининовый димер в качестве линкера и последовательность, выбранную из следующих последовательностей:
PEP5-RR-PEP9-RR-PEP6-RR-PEP4 (SEQ ID NO: 24; здесь обозначена как TPV06);
PEP5-RR-PEP9-RR-PEP6-RR-PEP2 (SEQ ID NO: 25; здесь обозначена как TPV07); и
PEP5-RR-PEP9-RR-PEP6-RR-PEP10 (SEQ ID NO: 26; здесь обозначена как TPV08).
Более предпочтительно, пептидом, имеющим 4 связанных эпитопа, в соответствии с настоящим изобретением, является пептид TPV06, показанный в SEQ ID NO: 24.
В одном варианте осуществления по настоящему изобретению, пептидом, имеющим 4 связанных эпитопа, предпочтительно является пептид, имеющий последовательность, выбранную из SEQ ID №№: 19-28, показанных в таблице 2 ниже.
[Таблица 2]
Более предпочтительно, пептидом, имеющим 4 связанных эпитопа, является любой из следующих пептидов:
TPV01 (SEQ ID NO: 19);
TPV02 (SEQ ID NO: 20);
TPV03 (SEQ ID NO: 21);
TPV04 (SEQ ID NO: 22);
TPV05 (SEQ ID NO: 23); и
TPV06 (SEQ ID NO: 24),
выбранных из таблицы 2, описанной выше.
В настоящем изобретении, могут применяться 2 или несколько пептидов, имеющих 4 связанных эпитопа. Например, 2, 3, 4 или несколько пептидов, имеющих 4 связанных эпитопа, могут применяться отдельно или в смеси, и 3 или несколько пептида, имеющих 4 связанных эпитопа, предпочтительно применяют в смеси. В случае применения 2 или нескольких пептидов, имеющих 4 связанных эпитопа, одним или несколькими пептидами может быть пептид, имеющий 4 связанных эпитопа, в соответствии с настоящим изобретением, или может быть пептид, имеющий 4 связанных эпитопа, описанный в, например, международной публикации № WO 2015/060235, пока включен, по меньшей мере, один пептид, имеющий 4 связанных эпитопа, в соответствии с настоящим изобретением. Предпочтительно применять пептид, показанный в SEQ ID NO: 24 и один или более пептидов, имеющих 4 связанных CTL эпитопа, описанных в международной публикации № WO 2015/060235. Более предпочтительно применять пептид, показанный в SEQ ID NO: 24, и 2 пептида, имеющих 4 связанных эпитопа, описанных в международной публикации № WO 2015/060235. Еще более предпочтительно применять 3 пептида, т.е. пептид, показанный в SEQ ID NO: 24, пептид, показанный в SEQ ID NO: 44 (TPV011: PEP15-RR-PEP18-RR-PEP1-RR-PEP10) и пептид, показанный в SEQ ID NO: 45 (TPV012: RRRR-PEP7-RR-PEP13-RR-PEP8-RR-PEP2) в виде смеси.
Пептидом, имеющим 4 связанных CTL эпитопа, в соответствии с настоящим изобретением, дополнительно может быть пептидная последовательность, состоящая из гидрофильных аминокислот. Такая пептидная последовательность может быть добавлена на N-конце и/или C-конце пептида, имеющего 4 связанных CTL эпитопа, и ее предпочтительно добавляют на N-конце. Такая пептидная последовательность состоит из 1-15, предпочтительно, 2-10, и наиболее предпочтительно, 3-5 гидрофильных аминокислот, выбранных из группы, состоящей из аргинина, гистидина, лизина, треонина, тирозина, серина, аспарагина, глутамина, аспарагиновой кислоты и глутаминовой кислоты. Например, аргининовый тример (RRR) или аргининовый тетрамер (RRRR) могут применяться в качестве такой пептидной последовательности. Примеры пептидов, имеющих 4 связанные CTL эпитопы, содержащих такие пептидные последовательности, добавленные туда, включают RRR-TPV06, RRRR-TPV06, TPV06-RRR, TPV06-RRRR, RRR-TPV07, RRRR-TPV07, TPV07-RRR, TPV07-RRRR, RRR-TPV08, RRRR-TPV08, TPV08-RRR, TPV08-RRRR, KKK-TPV06, KKKK-TPV06, TPV06-KKK, TPV06-KKKK, KKK-TPV07, KKKK-TPV07, TPV07-KKK, TPV07-KKKK, KKK-TPV08, KKKK-TPV08, TPV08-KKK, TPV08-KKKK, HHH-TPV06, HHHH-TPV06, TPV06-HHH, TPV06-HHHH, HHH-TPV07, HHHH-TPV07, TPV07-HHH, TPV07-HHHH, HHH-TPV08, HHHH-TPV08, TPV08-HHH, TPV08-HHHH, RRKK-TPV06, RKRK-TPV06, RHRH-TPV06, RRHH-TPV06, KKHH-TPV06 и KHKH-TPV06, где RRR-TPV06, RRRR-TPV06, RRR-TPV07, RRRR-TPV07, RRR-TPV08, RRRR-TPV08, KKK-TPV06, KKKK-TPV06, KKK-TPV07, KKKK-TPV07, KKK-TPV08, KKKK-TPV08, HHH-TPV06, HHHH-TPV06, HHH-TPV07, HHHH-TPV07, HHH-TPV08, HHHH-TPV08, RRKK-TPV06, RKRK-TPV06, RHRH-TPV06, RRHH-TPV06, KKHH-TPV06, и, предпочтительно, KHKH-TPV06, RRR-TPV06 (TPV09), RRRR-TPV06 (TPV10), RRR-TPV07, RRRR-TPV07, RRR-TPV08, и, более предпочтительно, RRRR-TPV08, и, наиболее предпочтительно, RRR-TPV06 (TPV09) и RRRR-TPV06 (TPV10).
[0038]
Известно, что пептид, содержащий такую пептидную последовательность, состоящую из гидрофильных аминокислот, имеет улучшенную растворимость в водной растворителе (Peptides: 38, 302-311 (2012); публикация патента JP (Kokai) № 2006-188507 A). При добавлении такой пептидной последовательности к пептиду, имеющему 4 связанных CTL эпитопа, в соответствии с настоящим изобретением, растворимость пептида, имеющего 4 связанных CTL эпитопа, в водном растворителе может быть улучшена.
"Пептидом, имеющим 4 связанных эпитопа, необязательно дополнительно содержащим пептидную последовательность, состоящую из гидрофильных аминокислот" в соответствии с настоящим изобретением, предпочтительно является пептид, имеющий 4 связанных CTL эпитопа, необязательно содержащий пептидную последовательность, состоящую из гидрофильных аминокислот, на N-конце, более предпочтительно, пептид, имеющий 4 связанных CTL эпитопа, необязательно содержащий пептидную последовательность, состоящую из 3-5 гидрофильных аминокислот, выбранных из группы, состоящей из аргинина, гистидина и лизина, на N-конце, более предпочтительно, пептид, имеющий 4 связанных CTL эпитопа, необязательно содержащий аргининовый тример (RRR) или аргининовый тетрамер (RRRR) на N-конце, и еще более предпочтительно, пептид, имеющий 4 связанных CTL эпитопа, не содержащий пептидную последовательность, состоящую из гидрофильных аминокислот.
Пептид, имеющий 4 связанных CTL эпитопа, в соответствии с настоящим изобретением, может быть синтезирован в соответствии со способом, описанным в, например, международной публикации № WO 2015/060235.
Модулятор иммунной контрольной точки в соответствии с настоящим изобретением воздействует на молекулу иммунной контрольной точки и вызывает in vivo противоопухолевые иммунные ответы у онкологических пациентов и предотвращает ускользание от иммунного ответа опухоли.
Таким образом, вещество, нацеленное на молекулу иммунной контрольной точки, может применяться в качестве модулятора иммунной контрольной точки. Примеры молекулы иммунной контрольной точки включают молекулы семейства B7 (B7-1, B7-2, PD-L1, PD-L2 и т.д.), семейства CD28 (CTLA-4, PD-1 и т.д.), суперсемейства TNF (4-1BBL, OX40L и т.д.) и суперсемейства рецептора TNF (4-1BB, OX40 и т.д.), которые широко классифицированы на костимулирующие молекулы, обладающие стимулирующим действием, и коингибиторные молекулы, обладающие подавляющим действием.
Примеры модулятора иммунной контрольной точки, который может подходящим образом применяться в настоящем изобретении, включают вещества, стимулирующие функции костимулирующих молекул, и вещества, подавляющие функции коингибиторных молекул. Более конкретно, примеры модулятора иммунной контрольной точки включают антагонист пути PD-1, агонист пути ICOS, антагонист пути CTLA-4, агонист пути CD28, антагонист пути BTLA и агонист пути 4-1BB и т.д.
В настоящем изобретении, модулятором иммунной контрольной точки предпочтительно является, по меньшей мере, один, выбранный из группы, состоящей из антагониста пути PD-1, агониста пути ICOS, антагониста пути CTLA-4 и агониста пути CD28, более предпочтительно, по меньшей мере, один, выбранный из группы, состоящей из антагониста пути PD-1, антагониста пути CTLA-4 и агониста пути CD28, более предпочтительно, по меньшей мере, один, выбранный из группы, состоящей из антагониста пути PD-1 и антагониста пути CTLA-4, и еще более предпочтительно, антагониста пути PD-1 с точки зрения подавления побочных реакций.
Антагонист пути PD-1 ингибирует иммунодепрессивные сигналы, индуцируемые PD-1, экспрессированным на T клетках, или его лиганды PD-L1 или PD-L2. Его примеры включают анти-PD-1 антитело, анти-PD-L1 антитело, анти-PD-L2 антитело, PD-1 внеклеточный домен, PD-L1 внеклеточный домен, PD-L2 внеклеточный домен, PD-1-Ig (слитый белок PD-1 внеклеточного домена и FC области иммуноглобулина (Ig)), PD-L1-Ig, PD-L2-Ig, PD-1 миРНК, PD-L1 миРНК и PD-L2 миРНК. Антагонистом пути PD-1 предпочтительно является анти-PD-1 антитело, анти-PD-L1 антитело или анти-PD-L2 антитело, более предпочтительно, анти-PD-1 антитело или анти-PD-L1 антитело. Среди них, особенно предпочтительно анти-PD-1 антитело.
Антагонист пути CTLA-4 ингибирует иммунодепрессивные сигналы, индуцированные CTLA-4, экспрессированным на T клетках или его лигандами B7-1 (CD80) или B7-2 (CD86). Его примеры включают анти-CTLA-4 антитело, CTLA-4 внеклеточный домен, CTLA-4-Ig, анти-B7-1 (CD80) антитело, анти-B7-2 (CD86) антитело и CTLA-4 миРНК. Антагонистом пути CTLA-4 предпочтительно является анти-CTLA-4 антитело, CTLA-4 внеклеточный домен, CTLA-4-Ig, анти-B7-1 (CD80) антитело или анти-B7-2 (CD86) антитело, более предпочтительно, анти-CTLA-4 антитело или CTLA-4-Ig. Среди них, анти-CTLA-4 антитело является особенно предпочтительным.
Примеры этих антител включают иммуноглобулины (IgA, IgD, IgE, IgG, IgM, IgY и т.д.), Fab фрагменты, F(ab')2 фрагменты, одноцепочечные вариабельные фрагменты (scFv), однодоменные антитела и диатело (Nat. Rev. Immunol., 6: 343-357, 2006). Их примеры включают моноклональные или поликлональные антитела, включая человеческие антитела, гуманизированные антитела, химерные антитела, мышиные антитела, антитела ламы и куриные антитела.
Гуманизированное IgG моноклональное антитело или человеческое IgG моноклональное антитело являются предпочтительными.
Примеры анти-PD-1 антител в соответствии с настоящим изобретением включают ниволумаб, пембролизумаб, цемиплимаб и спартализумаб, где ниволумаб или пембролизумаб являются предпочтительными.
Примеры анти-PD-L1 антитела в соответствии с настоящим изобретением включают атезолизумаб, дурвалумаб, авелумаб и подобные, где атезолизумаб, дурвалумаб или авелумаб являются предпочтительными.
Примеры анти-CTLA-4 антитела в соответствии с настоящим изобретением включают ипилимумаб, тремелимумаб и подобные, где ипилимумаб является предпочтительным.
Примеры CTLA-4-Ig в соответствии с настоящим изобретением включают абатацепт и подобные, где абатацепт является предпочтительным.
Эти антитела могут быть получены широко известными способами получения антитела.
Анти-PD-1 антитело уже продается или будет продаваться как ниволумаб или пембролизумаб; анти-PD-L1 антитело уже продается или будет продаваться как атезолизумаб, дурвалумаб или авелумаб; анти-CTLA-4 антитело уже продается или будет продаваться как ипилимумаб или тремелимумаб; и CTLA-4-Ig уже продается или будет продаваться как абатацепт, любой из которых также может применяться.
В настоящем изобретении, в случае применения 2 или более модуляторов иммунной контрольной точки, например, анти-PD-1 антитело и/или анти-CTLA-4 антитело могут применяться в сочетании, или может применяться биспецифическое антитело, способное связываться с обоими PD-1 и CTLA-4. Примеры биспецифического антитела включают XmAb20717 (PD-1 × CTLA-4).
Рекомендованная доза пептида, имеющего 4 связанных эпитопа, применяемого в настоящем изобретении для человека, составляет в диапазоне от 3 до 9 мг/тело/день для каждого пептида, имеющего 4 связанных эпитопа, для монотерапии. В настоящем изобретении, количество пептида, имеющего 4 связанных эпитопа, вводимого в день, на день введения составляет, предпочтительно, 80-120%, предпочтительно, 100% от рекомендованной дозы пептида, имеющего 4 связанных эпитопа, для монотерапии, с точки зрения эффекта усиления противоопухолевого действия модулятора иммунной контрольной точки пептидом, имеющим 4 связанных эпитопа.
Таким образом, если рекомендованная доза для человека составляет 3 мг/тело/день, вводимое количество пептида, имеющего 4 связанных эпитопа, предпочтительно составляет от 1,5 до 6 мг/тело/день, более предпочтительно, от 2,4 до 3,6 мг/тело/день, и особенно предпочтительно, 3 мг/тело/день, на пептид, имеющий 4 связанных эпитопа. Если рекомендованной дозой для человека является 9 мг/тело/день, вводимое количество пептида, имеющего 4 связанных эпитопа, предпочтительно составляет от 4,5 до 18 мг/тело/день, более предпочтительно, от 7,2 до 10,8 мг/тело/день, и особенно предпочтительно, 9 мг/тело/день, на пептид, имеющий 4 связанных эпитопа.
В настоящем изобретении, количество модулятора иммунной контрольной точки, вводимого в день, на день введения, предпочтительно составляет 50-100%, и более предпочтительно, 100% от рекомендованной дозы модулятора иммунной контрольной точки, вводимого отдельно, с точки зрения эффекта усиления противоопухолевого действия модулятора иммунной контрольной точки пептидом, имеющим 4 связанных эпитопа.
Более конкретно, рекомендованная доза ниволумаба при отдельном введении составляет 2 мг/кг (массы тела) на дозу или 3 мг/кг (массы тела) на дозу, которая одобрена в Японии. Поэтому количество ниволумаба, вводимое в день, на день введения, в соответствии с настоящим изобретением, предпочтительно составляет от 1 до 3 мг/кг (массы тела) на дозу, и более предпочтительно, 2 мг/кг (массы тела) на дозу или 3 мг/кг (массы тела) на дозу.
Рекомендованная доза пембролизумаба при отдельном введении составляет 2 мг/кг (массы тела) на дозу или 200 мг на дозу, которая одобрена в Японии. Поэтому количество пембролизумаба, вводимое в день, на день введения, в соответствии с настоящим изобретением, предпочтительно составляет от 1 до 2 мг/кг (массы тела) на дозу или от 100 до 200 мг на дозу, и более предпочтительно, 2 мг/кг (массы тела) на дозу или 200 мг на дозу.
Рекомендованная доза атезолизумаба при отдельном введении составляет 1200 мг на дозу, которая одобрена в Японии. Поэтому количество атезолизумаба, вводимое в день, на день введения, в соответствии с настоящим изобретением, предпочтительно составляет от 600 до 1200 мг на дозу, и более предпочтительно, 1200 мг на дозу.
Рекомендованная доза авелумаба или дурвалумаба при отдельном введении составляет 10 мг/кг (массы тела) на дозу, которая одобрена в США. Поэтому количество авелумаба или дурвалумаба, вводимое в день, на день введения, в соответствии с настоящим изобретением, предпочтительно составляет от 5 до 10 мг/кг (массы тела) на дозу, и более предпочтительно, 10 мг/кг (массы тела) на дозу.
Рекомендованная доза ипилимумаба при отдельном введении составляет 3 мг/кг (массы тела) на дозу, которая одобрена в Японии. Поэтому количество ипилимумаба, вводимое в день, на день введения, в соответствии с настоящим изобретением, предпочтительно составляет от 1,5 до 3 мг/кг (массы тела) на дозу, и более предпочтительно, 3 мг/кг (массы тела) на дозу.
В настоящем изобретении, "рекомендованной дозой" является диапазон, который был определен в клинических исследованиях и т.д. и может безопасно применяться без тяжелых побочных эффектов, который может обеспечить максимальный терапевтический эффект. Более конкретно, ее примеры включают рекомендованную дозу, одобренную и/или рекомендованную общественной организацией или институтом, таким как Pharmaceuticals and Medical Devices Agency (PMDA), Food and Drug Administration (FDA) или European Medicines Agency (EMA), и описаны во вкладышах, даны на консультациях, в назначениях врача и подобных. Рекомендованная доза, одобренная любой из общественных организаций PMDA, FDA и EMA, является предпочтительной.
Противоопухолевое средство по настоящему изобретению может вводиться в соответствии со схемой, должным образом выбранной в зависимости от типа рака, стадии и т.д.
Пептид, имеющий 4 связанных эпитопа, предпочтительно вводят в соответствии со схемой, где один курс составляет всего 21 день, включая 3 повторяющихся стадии введения один раз в неделю (один раз в день в дни 1, 8 и 15). В 3 курсе или позже, его предпочтительно вводят в соответствии со схемой, где один курс составляет всего 21 день, включая введение в день 1 и отмену лекарственного средства в течение 20 дней (введение каждые 3 недели).
Ниволумаб предпочтительно вводят в соответствии со схемой введения с 2-недельными или 3-недельными интервалами.
Пембролизумаб, атезолизумаб или ипилимумаб предпочтительно вводят в соответствии со схемой введения с 3-недельными интервалами.
Авелумаб или дурвалумаб предпочтительно вводят в соответствии со схемой введения с 2-недельными интервалами.
Количество введений противоопухолевого средства по настоящему изобретению в день может быть должным образом выбрано в соответствии с типом рака, стадией и т.д.
Пептид, имеющий 4 связанных эпитопа, ниволумаб, пембролизумаб, атезолизумаб, авелумаб или ипилимумаб предпочтительно вводят один раз в день.
Пептид, имеющий 4 связанных эпитопа, в соответствии с настоящим изобретением и модулятор иммунной контрольной точки могут вводиться в порядке, должным образом выбранном в соответствии с типом рака, стадией и т.д., любой из них может вводиться первым или оба могут вводиться одновременно. В случае не одновременного введения этих агентов, агенты могут вводиться с должным образом выбранными интервалами, пока действует эффект усиления противоопухолевого действия. Интервал предпочтительно составляет от 1 до 21 дня, более предпочтительно, от 1 до 14 дней, и особенно предпочтительно, от 1 до 7 дней. Пептид, имеющий 4 связанных эпитопа, в соответствии с настоящим изобретением и модулятор иммунной контрольной точки предпочтительно вводят в порядке, в котором пептид, имеющий 4 связанных эпитопа, вводят первым.
Опухоль, поражаемая в настоящем изобретении, особо не ограничивается, пока проявляется эффект усиления противоопухолевого действия. Опухолью предпочтительно является опухоль, на которую пептид, имеющий 4 связанный эпитопа, оказывает противоопухолевое действие, более предпочтительно, злокачественная опухоль, положительная для Lck, WHSC2, SART2, SART3, MRP3, UBE2V, EGFR или PTHrP, и более предпочтительно, SART2-положительная злокачественная опухоль.
Конкретные примеры рака, поражаемого в настоящем изобретении, включают опухоль головного мозга, рак головы и шеи, рак желудочно-кишечного тракта (рак пищевода, рак желудка, рак двенадцатиперстной кишки, рак печени, рак желчных путей (рак желчного пузыря, рак желчных протоков) и т.д.), рак поджелудочной железы, рак тонкой кишки, рак толстой кишки (колоректальный рак, рак толстой кишки, рак прямой кишки и т.д.), стромальную опухоль желудочно-кишечного тракта и т.д.), рак легкого (немелкоклеточный рак легкого и мелкоклеточный рак легкого), рак груди, рак яичников, рак матки (рак шейки матки, рак эндометрия и т.д.), рак почек, рак уротелия (рак мочевого пузыря, рак почечной лоханки и рак мочеточника), рак простаты, рак кожи и рак неизвестного первичного происхождения. В этом контексте, рак включает не только первичную опухоль, но и рак, метастазирующий в другие органы (печень и т.д.). Среди них рак головы и шеи, рак желудочно-кишечного тракта, рак легких, рак почек, рак уротелия и рак кожи являются предпочтительными, рак пищеварительной системы, рак легких, рак уротелия и рак кожи являются более предпочтительными, а рак легких и рак уротелия являются особенно предпочтительными, с точки зрения противоопухолевого действия. Противоопухолевым средством по настоящему изобретению может быть средство для применения в послеоперационной адъювантной химиотерапии, которую проводят для предотвращения рецидива после хирургического удаления опухоли, или может быть средство для применения в предоперационной адъювантной химиотерапии, которую проводят перед хирургическим удалением опухоли.
В настоящем изобретении, пептид, имеющий 4 связанных эпитопа, и модулятор иммунной контрольной точки могут быть получены во множестве составов активных ингредиентов или в форме однокомпонентного состава (например, составов комбинированного лекарственного средства) на основе дозированной формы каждого активного ингредиента или схемы введения. Эти составы могут быть получены и распространяться в одной упаковке, подходящей для применения в сочетании, или могут быть получены и распространяться в отдельных упаковках.
Дозированная форма противоопухолевого средства по настоящему изобретению особо не ограничивается и может быть подходящим образом выбрана в соответствии с терапевтической целью. Ее конкретные примеры могут включать пероральные составы (таблетки, таблетки с покрытием, порошки, гранулы, капсулы, жидкие составы и т.д.), инъекции, суппозитории, пластыри и мази.
Примеры лекарственных форм пептида, имеющего 4 связанных эпитопа, анти-PD-1-антитела, анти-PD-L1-антитела и анти-CTLA-4 антитела включают лекарственные формы, описанные выше, причем предпочтительна инъекция.
Противоопухолевое средство по настоящему изобретению может быть получено общеизвестным способом с использованием фармацевтически приемлемого носителя в соответствии с дозированной формой как для пептида, имеющего 4 связанных эпитопа, так и для модулятора иммунной контрольной точки. Примеры таких носителей могут включать различные носители, обычно используемые в обычных лекарственных средствах, например, эксципиенты, связующие агенты, разрыхлители, смазывающие агенты, разбавители, солюбилизаторы, суспендирующие агенты, изотонизирующие агенты, регуляторы pH, буферы, стабилизаторы, красители, ароматизаторы и корректоры запаха.
Данное изобретение также относится к усилителю противоопухолевого действия для усиления противоопухолевого действия модулятора иммунной контрольной точки на онкологического пациента, включающему пептид, имеющий 4 связанных эпитопа, в качестве активного ингредиента. Усилитель противоопухолевого действия имеет дозированную форму противоопухолевого средства, описанного выше.
Данное изобретение также относится к противоопухолевому средству для лечения онкологического пациента, получающего модулятор иммунной контрольной точки, содержащему пептид, имеющий 4 связанных эпитопа. Противоопухолевое средство имеет дозированную форму, описанную выше.
Данное изобретение также относится к противоопухолевому средству для лечения онкологического пациента, получающего пептид, имеющий 4 связанных эпитопа, включающему модулятор иммунной контрольной точки. Противоопухолевое средство имеет дозированную форму, описанную выше.
«Лечение» включает послеоперационную адъювантную химиотерапию, которую проводят для предотвращения рецидива после хирургического удаления опухоли, и предоперационную адъювантную химиотерапию, которую проводят заранее для хирургического удаления опухоли.
Данное изобретение также относится к противоопухолевому средству, содержащему пептид, имеющий 4 связанных эпитопа, где пептид, имеющий 4 связанных эпитопа, применяют в сочетании с модулятором иммунной контрольной точки для онкологического пациента. Противоопухолевое средство имеет дозированную форму, описанную выше.
Данное изобретение также относится к противоопухолевому средству, содержащему модулятор иммунной контрольной точки, где модулятор иммунной контрольной точки применяют в сочетании с пептидом, имеющим 4 связанных эпитопа для онкологического пациента. Противоопухолевое средство имеет дозированную форму, описанную выше.
Настоящее изобретение также относится к составу набора, содержащему противоопухолевое средство, содержащее пептид, имеющий 4 связанных эпитопа, и инструкцию по применению, в которой указывается, что пептид, имеющий 4 связанного эпитопа и модулятор иммунной контрольной точки вводятся вместе больному раком.
В этом контексте «инструкция по применению» описывает количества вводимых средств и предпочтительные рекомендуемые дозы, как описано выше, с обязательной юридической привязкой или без нее. Их конкретные примеры включают вкладыши в упаковку и брошюры. В составе набора, содержащем инструкцию по применению, инструкция по применению может быть напечатана и/или прикреплена к упаковке состава набора, или инструкция по применению может быть приложена вместе с противоопухолевым средством в упаковке состава набора.
Тем временем группа авторов данного изобретения, et al. установили методику экспрессирования искусственного химерного гена полученного от человека или не человека β2 микроглобулина, α1 и α2 областей HLA класса I и полученной от человека или не человека α3 области MHC класса, связанных друг с другом у отличных от человека животных, и последующего получения отличного от человека животного, экспрессирующего HLA класса I (Международная публикация № WO 2015/056774).
Применение отличного от человека животного, описанного выше, позволяет восстанавливать человеческие иммунные ответы у отличных от человека животных. Более конкретно, антигенпрезентирующие клетки у отличного от человека животного экспрессируют α1 и α2 области HLA класса I и поэтому могут представлять эпитопный пептид человеческого опухолевого антигена, способного связываться с ним.
Авторы данного изобретения дополнительно обнаружили, что действие пептида, имеющего 4 связанных эпитопа, на индукции CTL может быть оценено через соэкспрессию человеческого HLA-A24 и эпитопного пептида человеческого опухолевого антигена, полученного из SART2. Например, опухоль, представляющая эпитопный пептид человеческого опухолевого антигена, полученный из SART2, выращивается соэкспрессией человеческого HLA-A24 и эпитопного пептида человеческого опухолевого антигена, полученного из SART2, на культивируемых клетках, полученных из мышиной опухоли, и трансплантацией культивированных клеток отличному от человека животному, описанному выше.
Более конкретно, в данном изобретении представлена клетка, в которую введен полинуклеотид, кодирующий эпитопный пептид человеческого опухолевого антигена, полученный из SART2, и полинуклеотид, кодирующий, в частности, α1 и α2 области человеческого HLA-A24. В этом контексте, эпитопный пептид человеческого опухолевого антигена, полученный из SART2, предпочтительно содержит PEP5. Таким образом, полинуклеотид, кодирующий PEP5, предпочтительно вводят в клетку.
Авторы данного изобретения успешно привили опухоли, соэкспрессирующие HLA-A24 и PEP5, отличному от человека животному, описанному выше, и продемонстрировали, что эта система позволяет оценивать противоопухолевое средство по настоящему изобретению и т.д.
Следовательно, настоящее изобретение относится к клетке, в которую введен полинуклеотид, кодирующий эпитопный пептид человеческого опухолевого антигена, полученный из SART2, и полинуклеотид, кодирующий α1 и α2 области человеческого HLA-A24 (далее названной "клетка по настоящему изобретению").
SART2 является одним из белков, описанных как в высокой степени экспрессируемые в опухолевых тканях, как описано выше. Примеры эпитопного пептида человеческого опухолевого антигена, полученного из SART2, который может быть представлен через связывание с молекулой HLA типа HLA-A24 в антигенпрезентирующих клетках, таких как дендритные клетки, включают PEP5, описанный выше. Аминокислотная последовательность пептида PEP5 показана в SEQ ID NO: 5, и полинуклеотидная последовательность, кодирующая пептид PEP5, показана в SEQ ID NO: 29.
"Полинуклеотидом, кодирующим эпитопный пептид человеческого опухолевого антигена, полученного из SART2" в данном описании предпочтительно является полинуклеотид, выбранный из следующих полинуклеотидов (a)-(e):
(a) полинуклеотид, кодирующий полипептид, имеющий аминокислотную последовательность, показанную в SEQ ID NO: 5;
(b) полинуклеотид, кодирующий полипептид, имеющий аминокислотную последовательность, имеющую замещение, делецию или добавление одной или нескольких аминокислот в аминокислотной последовательности, показанной в SEQ ID NO: 5;
(c) полинуклеотид, кодирующий полипептид, имеющий аминокислотную последовательность, имеющую 90% или более идентичность с аминокислотной последовательностью, показанной в SEQ ID NO: 5;
(d) полинуклеотид, содержащий нуклеотидную последовательность, показанную в SEQ ID NO: 29; и
(e) полинуклеотид, содержащий нуклеотидную последовательность, имеющую 90% или более идентичность к нуклеотидной последовательности, показанной в SEQ ID NO: 29;
более предпочтительно, полинуклеотид выбирают из следующих полинуклеотидов (a)-(e):
(a) полинуклеотид, кодирующий полипептид, имеющий аминокислотную последовательность, показанную в SEQ ID NO: 5;
(b) полинуклеотид, кодирующий полипептид, имеющий аминокислотную последовательность, имеющую замещение, делецию или добавление одной или нескольких аминокислот в аминокислотной последовательности, показанной в SEQ ID NO: 5 (где добавление аминокислот ограничено добавлением со стороны N-конца);
(c) полинуклеотид, кодирующий полипептид, имеющий аминокислотную последовательность, имеющую 90% или более идентичность с аминокислотной последовательностью, показанной в SEQ ID NO: 5;
(d) полинуклеотид, содержащий нуклеотидную последовательность, показанную в SEQ ID NO: 29; и
(e) полинуклеотид, содержащий нуклеотидную последовательность, имеющую 90% или более идентичность к нуклеотидной последовательности, показанной в SEQ ID NO: 29;
и более предпочтительно, полинуклеотид, выбранный из полинуклеотидов (a) и (d).
"Полипептид, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 5" здесь может дополнительно содержать добавленную сигнальную последовательность. Предпочтительно, "полипептидом, содержащим аминокислотную последовательность, показанную в SEQ ID NO: 5" является полипептид, имеющий сигнальную последовательность из 10-30 аминокислот, более предпочтительно, сигнальную последовательность из 15-25 аминокислот, добавляют со стороны N-конца аминокислотной последовательности, показанной в SEQ ID NO: 5, и более предпочтительно, полипептид, состоящий из аминокислотной последовательности, показанной в SEQ ID NO: 32.
Так же, "полипептид, имеющий аминокислотную последовательность, имеющую замещение, делецию или добавление одной или нескольких аминокислот в аминокислотной последовательности, показанной в SEQ ID NO: 5" здесь может дополнительно содержать добавленную сигнальную последовательность. Предпочтительно, этим полипептидом является полипептид, имеющий сигнальную последовательность из 10-30 аминокислот, более предпочтительно, сигнальную последовательность из 15-25 аминокислот, добавляют со стороны N-конца аминокислотной последовательности, имеющей замещение, делецию или добавление одной или нескольких аминокислот в аминокислотной последовательности, показанной в SEQ ID NO: 5, и более предпочтительно, полипептид, состоящий из аминокислотной последовательности, показанной в SEQ ID NO: 32.
Так же, "полипептид, имеющий аминокислотную последовательность, имеющую 90% или более идентичность с аминокислотной последовательностью, показанной в SEQ ID NO: 5" здесь может дополнительно содержать добавленную сигнальную последовательность. Предпочтительно, этим полипептидом является полипептид, имеющий сигнальную последовательность из 10-30 аминокислот, более предпочтительно, сигнальную последовательность из 15-25 аминокислот, добавляют со стороны N-конца аминокислотной последовательности, имеющей имеющую 90% или более идентичность с аминокислотной последовательностью, показанной в SEQ ID NO: 5, и более предпочтительно, полипептид, состоящий из аминокислотной последовательности, показанной в SEQ ID NO: 32.
Так же "полинуклеотид, содержащий нуклеотидную последовательность, показанную в SEQ ID NO: 29" здесь может дополнительно содержать добавленную нуклеотидную последовательность, кодирующую сигнальную последовательность. Предпочтительно, этим полинуклеотидом является полинуклеотид, имеющий 30-90 нуклеотидов, кодирующих сигнальную последовательность, более предпочтительно, 45-75 нуклеотидов, кодирующих сигнальную последовательность, добавленную со стороны 5' конца нуклеотидной последовательности, показанной в SEQ ID NO: 29, и более предпочтительно, полинуклеотид, состоящий из нуклеотидной последовательности, показанной в SEQ ID NO: 33.
Так же "полинуклеотид, содержащий нуклеотидную последовательность, имеющую 90% или более идентичность с нуклеотидной последовательностью, показанной в SEQ ID NO: 29" здесь может дополнительно содержать добавленную нуклеотидную последовательность, кодирующую сигнальную последовательность. Предпочтительно, этим полинуклеотидом является полинуклеотид, имеющий 30-90 нуклеотидов, кодирующих сигнальную последовательность, более предпочтительно, 45-75 нуклеотидов, кодирующих сигнальную последовательность, добавленную со стороны 5' конца нуклеотидной последовательности, имеющей 90% или более идентичность с нуклеотидной последовательностью, показанной в SEQ ID NO: 29, и более предпочтительно, полинуклеотид, состоящий из нуклеотидной последовательности, показанной в SEQ ID NO: 33.
В одном аспекте настоящего изобретения, "полинуклеотидом, кодирующим эпитопный пептид человеческого опухолевого антигена, полученного из SART2" предпочтительно может быть полинуклеотид, выбранный из следующих полинуклеотидов (k)-(o):
(k) полинуклеотид, кодирующий полипептид, состоящий из аминокислотной последовательности, показанной в SEQ ID NO: 32;
(l) полинуклеотид, кодирующий полипептид, состоящий из аминокислотной последовательности, имеющей замещение, делецию или добавление одной или нескольких аминокислот в аминокислотной последовательности, показанной в SEQ ID NO: 32;
(m) полинуклеотид, кодирующий полипептид, состоящий из аминокислотной последовательности, имеющей 90% или более идентичность с аминокислотной последовательностью, показанной в SEQ ID NO: 32;
(n) полинуклеотид, состоящий из нуклеотидной последовательности, показанной в SEQ ID NO: 33; и
(o) полинуклеотид, состоящий из нуклеотидной последовательности, имеющей 90% или более идентичность с нуклеотидной последовательностью, показанной в SEQ ID NO: 33
более предпочтительно, полинуклеотид выбирают из следующих полинуклеотидов (k)-(o):
(k) полинуклеотид, кодирующий полипептид, состоящий из аминокислотной последовательности, показанной в SEQ ID NO: 32;
(l) полинуклеотид, кодирующий полипептид, состоящий из аминокислотной последовательности, имеющей замещение, делецию или добавление одной или нескольких аминокислот в аминокислотной последовательности, показанной в SEQ ID NO: 32 (где добавление аминокислот ограничено добавлением со стороны N-конца);
(m) полинуклеотид, кодирующий полипептид, состоящий из аминокислотной последовательности, имеющей 90% или более идентичность с аминокислотной последовательностью, показанной в SEQ ID NO: 32;
(n) полинуклеотид, состоящий из нуклеотидной последовательности, показанной в SEQ ID NO: 33; и
(o) полинуклеотид, состоящий из нуклеотидной последовательности, имеющей 90% или более идентичность с нуклеотидной последовательностью, показанной в SEQ ID NO: 33
и более предпочтительно, полинуклеотид выбирают из полинуклеотидов (k) и (n).
Предпочтительно, "эпитопный пептид человеческого опухолевого антигена, полученного из SART2" может быть распознан CTL, специфическими к аминокислотной последовательности, показанной в SEQ ID NO: 5.
В этом контексте, может или нет эпитопный пептид "быть распознанным CTL, специфическим для аминокислотной последовательности, показанной в SEQ ID NO: 5", может быть подтверждено, например, анализом выделения 51Cr, ELISA (например, измерением IFN-γ) или ELISPOT анализом (например, измерением IFN-γ) с применением клетки по настоящему изобретению и CTL, специфических к аминокислотной последовательности, показанной в SEQ ID NO: 5.
"Полинуклеотидом, кодирующим α1 и α2 области человеческого HLA-A24" здесь, предпочтительно, может быть полинуклеотид, выбранный из следующих полинуклеотидов (f)-(j):
(f) полинуклеотид, кодирующий полипептид, имеющий аминокислотную последовательность, показанную в SEQ ID NO: 30;
(g) полинуклеотид, кодирующий полипептид, имеющий аминокислотную последовательность, имеющую замещение, делецию или добавление одной или нескольких аминокислот в аминокислотной последовательности, показанной в SEQ ID NO: 30;
(h) полинуклеотид, кодирующий полипептид, имеющий аминокислотную последовательность, имеющую 90% или более идентичность с аминокислотной последовательностью, показанной в SEQ ID NO: 30;
(i) полинуклеотид, содержащий нуклеотидную последовательность, показанную в SEQ ID NO: 31; и
(j) полинуклеотид, содержащий нуклеотидную последовательность, имеющую 90% или более идентичность с нуклеотидной последовательностью, показанной в SEQ ID NO: 31
и более предпочтительно, полинуклеотид, выбранный из полинуклеотидов (f) и (i).
"Полипептидом, содержащим аминокислотную последовательность, показанную в SEQ ID NO: 30" здесь, предпочтительно, может быть полипептид, содержащий β2 микроглобулин, добавленный со стороны N-конца, и α3 область MHC класса I, добавленная со стороны C-конца аминокислотной последовательности, показанной в SEQ ID NO: 30, и более предпочтительно, полипептид, состоящий из аминокислотной последовательности, показанной в SEQ ID NO: 34.
"Полипептидом, имеющим аминокислотную последовательность, имеющую замещение, делецию или добавление одной или нескольких аминокислот в аминокислотной последовательности, показанной в SEQ ID NO: 30" здесь, предпочтительно, может быть полипептид, содержащий β2 микроглобулин, добавленный со стороны N-конца, и α3 область MHC класса I, добавленная со стороны C-конца аминокислотной последовательности, имеющей замещение, делецию или добавление одной или нескольких аминокислот в аминокислотной последовательности, показанной в SEQ ID NO: 30, и более предпочтительно, полипептид, состоящий из аминокислотной последовательности, показанной в SEQ ID NO: 34.
"Полипептидом, содержащим аминокислотную последовательность, имеющую 90% или более идентичность с аминокислотной последовательностью, показанной в SEQ ID NO: 30" здесь, предпочтительно, может быть полипептид, содержащий β2 микроглобулин, добавленный со стороны N-конца, и α3 область MHC класса I, добавленная со стороны C-конца аминокислотной последовательности, имеющей 90% или более идентичность к аминокислотной последовательностью, показанной в SEQ ID NO: 30, и более предпочтительно, полипептид, состоящий из аминокислотной последовательности, показанной в SEQ ID NO: 34.
"Полинуклеотидом, содержащим нуклеотидную последовательность, показанную в SEQ ID NO: 31" здесь предпочтительно может быть полинуклеотид, содержащий кодирующую β2 микроглобулин нуклеотидную последовательность, добавленную со стороны 5'-конца, и кодирующую α3 область MHC класса I нуклеотидную последовательность, добавленную со стороны 3'-конца нуклеотидной последовательности, показанной в SEQ ID NO: 31, и более предпочтительно, полинуклеотид, состоящий из нуклеотидной последовательности, показанной в SEQ ID NO: 35.
"Полинуклеотидом, содержащим нуклеотидную последовательность, имеющую 90% или более идентичность с аминокислотной последовательностью, показанной в SEQ ID NO: 31" здесь предпочтительно может быть полинуклеотид, содержащий кодирующую β2 микроглобулин нуклеотидную последовательность, добавленную со стороны 5'-конца, и кодирующую α3 область MHC класса I нуклеотидную последовательность, добавленную со стороны 3'-конца нуклеотидной последовательности, имеющей 90% или более идентичность с аминокислотной последовательностью, показанной в SEQ ID NO: 31, и более предпочтительно, полинуклеотид, состоящий из нуклеотидной последовательности, показанной в SEQ ID NO: 35.
"β2 микроглобулин" здесь относится к белку, составляющему β цепь молекулы MHC класса I. "β2 микроглобулин" здесь может быть получен от человека или любого отличного от человека животного (мыши, крысы, хомяка, морской свинки, кролика, свиньи, коровы, овцы и т.д.) и, предпочтительно, является человеческим β2 микроглобулином (здесь также названным "hβ2M").
"Человеческий β2 микроглобулин" здесь может быть полинуклеотидом, выбранным из следующих полинуклеотидов (i)-(iii):
(i) полинуклеотид, кодирующий полипептид, состоящий из аминокислотной последовательности, показанной в SEQ ID NO: 36;
(ii) полинуклеотид, кодирующий полипептид, состоящий из аминокислотной последовательности, которая имеет замещение, делецию или добавление одной или нескольких аминокислот в аминокислотной последовательности, показанной в SEQ ID NO: 36, и имеет антигенпрезентирующую способность, специфическую для MHC класса I через образование комплекса с α цепью MHC класса I; и
(iii) полинуклеотид, кодирующий полипептид, состоящий из аминокислотной последовательности, которая имеет 90% или более идентичность с аминокислотной последовательностью, показанной в SEQ ID NO: 36 и имеет антигенпрезентирующую способность, специфическую для MHC класса I через образование комплекса с α цепью MHC класса I;
и, предпочтительно, является полинуклеотидом (i).
"α3 область MHC класса I" здесь относится к α3 области, вовлеченной в связывание с корецепторной CD8 молекулой, экспрессированной на поверхности CTL, и трансмембранной областью и внутриклеточной областью, расположенной на C-конце. "α3 область MHC класса I" здесь может быть получена от человека или любого отличного от человека животного (мыши, крысы, хомяка, морской свинки, кролика, свиньи, коровы, овцы и т.д.) и, предпочтительно, является мышиной α3 областью MHC класса I (здесь также названной "mα3").
"Мышиной α3 областью MHC класса I" здесь может быть полинуклеотид, выбранный из следующих полинуклеотидов (iv)-(vi):
(iv) полинуклеотид, кодирующий полипептид, состоящий из аминокислотной последовательности, показанной в SEQ ID NO: 37;
(v) полинуклеотид, кодирующий полипептид, состоящий из аминокислотной последовательности, которая имеет замещение, делецию или добавление одной или нескольких аминокислот в аминокислотной последовательности, показанной в SEQ ID NO: 37, и обладает способностью связываться с CD8 молекулой; и
(vi) полинуклеотид, кодирующий полипептид, состоящий из аминокислотной последовательности, которая имеет 90% или более идентичность с аминокислотной последовательностью, показанной в SEQ ID NO: 37 и обладает способностью связываться с CD8 молекулой;
и, предпочтительно, полинуклеотидом является (iv).
В одном аспекте по настоящему изобретению, "полинуклеотидом, кодирующим α1 и α2 области человеческого HLA-A24" здесь предпочтительно может быть полинуклеотид, выбранный из следующих полинуклеотидов (p)-(t):
(p) полинуклеотид, кодирующий полипептид, состоящий из аминокислотной последовательности, показанный в SEQ ID NO: 34;
(q) полинуклеотид, кодирующий полипептид, состоящий из аминокислотной последовательности, имеющей замещение, делецию или добавление одной или нескольких аминокислот в аминокислотной последовательности, показанной в SEQ ID NO: 34;
(r) полинуклеотид, кодирующий полипептид, состоящий из аминокислотной последовательности, имеющей 90% или более идентичность с аминокислотной последовательностью, показанной в SEQ ID NO: 34;
(s) полинуклеотид, состоящий из нуклеотидной последовательности, показанной в SEQ ID NO: 35; и
(t) полинуклеотид, состоящий из нуклеотидной последовательности, имеющей 90% или более идентичность с нуклеотидной последовательностью, показанной в SEQ ID NO: 35;
и более предпочтительно, полинуклеотид, выбранный из полинуклеотидов (p) и (s).
Предпочтительно, α1 и α2 области, кодированные "полинуклеотидом, кодирующим α1 и α2 области человеческого HLA-A24" могут представлять собой полипептид, состоящий из аминокислотной последовательности, показанной в SEQ ID NO: 5, в качестве антигена. Предпочтительно, эти области могут представлять собой полипептид, состоящий из аминокислотной последовательности, показанной в SEQ ID NO: 5, в качестве антигена, и обладать способностью связывать CD8 молекулу. Предпочтительно, эти области могут представлять собой полипептид, состоящий из аминокислотной последовательности, показанной в SEQ ID NO: 5 в качестве антигена и обладать способностью связывать CD8 молекулу, и β2 микроглобулин, предпочтительно, обладает антигенпрезентирующей способностью, специфической к MHC классу I через образование комплекса с α цепью MHC класса I.
Наличие у клетки этих функций может быть подтверждено, например, анализом выделения 51Cr, ELISA (например, измерением IFN-γ) или анализом ELISPOT (например, измерением IFN-γ) с применением клетки по настоящему изобретению и CTL, специфического для аминокислотной последовательности, показанной в SEQ ID NO: 5.
Клетками-хозяевами для применения в создании клетки по настоящему изобретению, предпочтительно являются колониями клеток, полученными от животного, и способны формировать опухоль при трансплантации животному. Более предпочтительно, клетками-хозяевами являются колонии клеток, полученные от мышей, и способные образовывать опухоль при трансплантации мыши. Опухоль, образованная клетками-хозяевами, не ограничена и, предпочтительно, например, является солидной опухолью, такой как меланома или лимфома, так как рост и регрессию и т.д. опухоли легко оценить. Клетками-хозяевами предпочтительно являются B16F10 клетки.
Вектор для введения полинуклеотида, кодирующего эпитопный пептид человеческого опухолевого антигена, полученного из SART2, и полинуклеотида, кодирующего α1 и α2 области человеческого HLA-A24, в клетку-хозяина для применения в создании клетки по настоящему изобретению, особенно не ограничен, пока вектор является реплицируемым в клетках-хозяевах. Вектор может быть должным образом выбран в соответствии типом клетки-хозяина для введения, способа введения и т.д. Его примеры включают плазмидные ДНК векторы и вирусные векторы. Примеры плазмидных ДНК векторов включают pCMV6 (OriGene Technologies, Inc.), piggyBac Transposon Vector (System Biosciences, LLC.), pCAG (FUJIFILM Wako Pure Chemical Corp.) и pcDNA3.1 (Thermo Fisher Scientific Inc.). Примеры вирусных векторов включают pMX (Cell Biolabs, Inc.), pLVSIN (Takara Bio Inc.), pAAV (Takara Bio Inc.) и pAdenoX (Clontech Laboratories, Inc.).
Клетка-хозяин может быть трансформирована вектором с применением липофекции, электропорации и т.п. Полученный трансформант может быть культивирован в соответствующих условиях с применением среды, содержащей источник ассимилируемого углерода, источник азота, соль металла, витамин и т.д.
Является ли клетка клеткой, в которую был введен полинуклеотид, кодирующий эпитопный пептид человеческого опухолевого антигена, полученный из SART2, и полинуклеотид, кодирующий α1 и α2 области человеческого HLA-A24, может быть подтверждено, например, с применением способов для определения экспрессии полинуклеотида, кодирующего эпитопный пептид человеческого опухолевого антигена, или кодированного полипептида, и полинуклеотида, кодирующего α1 и α2 области человеческого HLA-A24 или кодированного полипептида, и с применением экспрессии в качестве показателя.
В способе определения экспрессии полинуклеотида, кодирующего эпитопный пептид человеческого опухолевого антигена, полученный из SART2, может применяться, в качестве праймера, например, полипептид, специфически гибридизирующийся с полинуклеотидом, показанным в SEQ ID NO: 29 или SEQ ID NO: 33, включая полинуклеотид, кодирующий PEP5, или полинуклеотид, состоящий из нуклеотидной последовательности, комплементарной к полинуклеотиду, показанному в SEQ ID NO: 29 или SEQ ID NO: 33, и может применяться широко известный способ определения, такой как нозерн-блоттинг, саузерн-блоттинг, ОТ-ПЦР, ПЦР в режиме реального времени, цифровую ПЦР, методику ДНК-чипа, гибридизацию in situ или секвенирование.
В способе определения экспрессии полинуклеотида, кодирующего α1 и α2 области человеческого HLA-A24, может применяться, в качестве праймера, например, полипептид, специфически гибридизирующийся с полинуклеотидом, показанным в SEQ ID NO: 31 или SEQ ID NO: 35, включая полинуклеотид, кодирующий аминокислотные последовательности α1 и α2 областей человеческого HLA-A24, или полинуклеотид, состоящий из нуклеотидной последовательности, комплементарной полинуклеотиду, показанному в SEQ ID NO: 31 или SEQ ID NO: 35, и может применяться широко известный способ определения, такой как описан выше.
Такой праймер получают общеизвестным способом, в виде полинуклеотида, специфически гибридизирующегося с полинуклеотидом, показанным в SEQ ID NO: 29 или SEQ ID NO: 33, или полинуклеотидом, состоящим из нуклеотидной последовательности, комплементарной к полинуклеотиду, показанному в SEQ ID NO: 29 или SEQ ID NO: 33. Также такой праймер получают общеизвестным способом в виде полинуклеотида, более специфически гибридизирующегося с полинуклеотидом, показанным в SEQ ID NO: 31 или SEQ ID NO: 35, или полинуклеотида, состоящего из нуклеотидной последовательности, комплементарной к полинуклеотиду, показанному в SEQ ID NO: 31 или SEQ ID NO: 35. Количество нуклеотидов в таком праймере составляет 10-50 нуклеотидов, предпочтительно 10-40 нуклеотидов, и более предпочтительно, 10-30 нуклеотидов.
Праймер не обязательно должен быть полностью комплементарным, пока праймер специфически гибридизируется с полинуклеотидом, показанным в SEQ ID NO: 29 или SEQ ID NO: 33, или полинуклеотидом, состоящим из нуклеотидной последовательности, комплементарной к полинуклеотиду, показанному в SEQ ID NO: 29 или SEQ ID NO: 33, или полинуклеотидом, показанным в SEQ ID NO: 31 или SEQ ID NO: 35, или полинуклеотидом, состоящим из нуклеотидной последовательности, комплементарной к полинуклеотиду, показанному в SEQ ID NO: 31 или SEQ ID NO: 35. Таким праймером является полинуклеотид, имеющий 70% или более, предпочтительно, 80% или более, более предпочтительно, 90% или более, более предпочтительно, 95% или более, более предпочтительно, 98% или более идентичность с соответствующей нуклеотидной последовательностью, и наиболее предпочтителен полностью комплементарный полинуклеотид.
Праймером для применения в способе определения экспрессии полинуклеотида, кодирующего эпитопный пептид человеческого опухолевого антигена, полученный из SART2, предпочтительно, является праймер, показанный в SEQ ID NO: 42 и SEQ ID NO: 43.
Способ определения, широко применяемый, такой как ELISA, вестерн-блоттинг, проточная цитометрия или иммуногистохимическое окрашивание, например, с применением антитела, специфически связывающегося с полипептидом, показанным в SEQ ID NO: 5, может применяться в качестве способа определения экспрессии полипептида, кодирующего эпитопный пептид человеческого опухолевого антигена, полученный из SART2. Проточная цитометрия является предпочтительной. Антителом, специфически связывающимся с полипептидом, показанным в SEQ ID NO: 5, может быть коммерчески доступным или может быть получено общеизвестным способом.
Способ определения, широко применяемый, такой как ELISA, вестерн-блоттинг, проточная цитометрия или иммуногистохимическое окрашивание, например, с применением антитела, специфически связывающегося с полипептидом, показанным в SEQ ID NO: 30 или SEQ ID NO: 34, включая α1 и α2 области HLA-A24, может применяться в качестве способа определения экспрессии полипептида, кодирующего α1 и α2 области человеческого HLA-A24. Проточная цитометрия является предпочтительной. Антителом, специфически связывающимся с полипептидом, показанным в SEQ ID NO: 30 или SEQ ID NO: 34, может быть коммерчески доступным или может быть получено общеизвестным способом. Примеры коммерчески доступного антитела включают анти-человеческое HLA-A, B,C антитело (Клон: W6/32, BioLegend, Inc.), анти-HLA-A24 (человеческое) mAb (Клон: 22E1, MBL) и анти-HLA A антитело (Клон: EP1395Y, Abcam plc), где анти-человеческое HLA-A, B,C антитело (Клон: W6/32, BioLegend, Inc.) является предпочтительным. Если таким антителом является, например, анти-человеческое HLA-A, B,C антитело (Клон: W6/32, BioLegend, Inc.), его меченная форма, такая как PE-меченная форма, PE анти-человеческое HLA-A, B,C антитело (Клон: W6/32, BioLegend, Inc.) или FITC-меченная форма, FITC анти-человеческое HLA-A, B,C антитело (Клон: W6/32, BioLegend, Inc.) также включены в анти-человеческое HLA-A, B,C антитело (Клон: W6/32, BioLegend, Inc.).
Для проведения in vivo оценки, предпочтительно, чтобы клетка по настоящему изобретению могла образовывать опухоль у не иммунодефицитного отличного от человека животного при трансплантации не иммунодефицитному отличному от человека животному, и не должна спонтанно регрессировать. Можно подтвердить, что клетка не способна спонтанно регрессировать, посредством подкожной трансплантации клетки по настоящему изобретению, например, мыши с нокаутом человеческого HLA-A24 гена (Международная публикация № WO 2015/056774) и измерением размера опухоли. Предпочтительно, чтобы размер опухоли не снижался (размер опухоли увеличивался) в течение, по меньшей мере, 20 дней или дольше после трансплантации клетки по настоящему изобретению не иммунодефицитному, отличному от человека животному. Если отсутствие регрессии трансплантированных клеток (повышение размера опухоли) подтверждается в группе без введения лекарственного средства (контрольной группе) в течение периода тестирования in vivo, клетки могут быть включены в клетку по настоящему изобретению, даже если период без спонтанной регрессии короче 20 дней.
В настоящем изобретении, термин "не иммунодефицитное" в отношении не иммунодефицитного отличного от человека животного относится к животному, имеющему врожденную иммунную систему или модифицированную иммунную систему. Таким образом, такие не иммунодефицитные животные исключают иммунодефицитных животных, таких как голые мыши. "Отличное от человека животное" особенно не ограничено, пока животное имеет β2 микроглобулиновые локусы и туда может быть введен чужеродный ген. Предпочтительным является грызун, и более предпочтительной является мышь. Мышь является особенно предпочтительной с точки зрения выведения и экспериментального применения.
Настоящее изобретение также относится к клетке по настоящему изобретению для оценки противоопухолевого действия эпитопного пептида человеческого опухолевого антигена, полученного из SART2.
Настоящее изобретение также относится к клетке по настоящему изобретению для оценки противоопухолевого действия пептида, имеющего 4 связанных эпитопа и/или модулятора иммунной контрольной точки.
Настоящее изобретение также относится к способу оценки противоопухолевого действия эпитопного пептида человеческого опухолевого антигена, полученного из SART2, с применением клетки по настоящему изобретению. Способ предпочтительно проводят с применением не иммунодефицитного отличного от человека животного с нокином человеческого HLA-A24 гена, которому трансплантирована клетка по настоящему изобретению. В этом контексте, не иммунодефицитным отличным от человека животным с нокином человеческого HLA-A24 гена может быть не иммунодефицитное отличное от человека животное, имеющее α1 и α2 области человеческого HLA-A24 и, предпочтительно, мышь с нокином человеческого HLA-A24 гена (B2mtm2(HLA-A24/H-2Db/B2M)Tai мышь), описанная в Международной публикации № WO 2015/056774.
В этом способе может быть подходящим образом выбрано количество трансплантируемых клеток по настоящему изобретению, и предпочтительно оно составляет 1 × 105-1 × 107 клеток/тело, более предпочтительно, 1 × 105-5 × 105 клеток/тело, и более предпочтительно, 5 × 105 клеток/тело, на мышь с нокином человеческого HLA-A24 гена (B2mtm2(HLA-A24/H-2Db/B2M)Tai мышь). В способе может быть подходящим образом выбрано количество эпитопного пептида человеческого опухолевого антигена, полученного из SART2, вводимое на дозу, и оно предпочтительно составляет 10-1000 мкг/тело, более предпочтительно, 100-1000 мкг/тело, и более предпочтительно, 300 мкг/тело, на мышь с нокином человеческого HLA-A24 гена (B2mtm2(HLA-A24/H-2Db/B2M)Tai мышь).
Оценка противоопухолевого действия эпитопных пептидов человеческого опухолевого антигена, полученного из SART2, с применением клетки по настоящему изобретению, может проводиться способом, включающим следующие стадии.
Более конкретно, способ может осуществляться способом, содержащим стадии:
(I) введения эпитопного пептида человеческого опухолевого антигена, полученного из SART2, не иммунодефицитному отличному от человека животному с нокином человеческого HLA-A24 гена; и
(II) трансплантации клетки по настоящему изобретению не иммунодефицитному отличному от человека животному с нокином человеческого HLA-A24 гена.
Предпочтительно, способом является способ, содержащий следующие стадии (I) и (II):
(I) стадию введения эпитопного пептида человеческого опухолевого антигена, полученного из SART2, мыши с нокином человеческого HLA-A24 гена; и
(II) стадию трансплантации клетки по настоящему изобретению мыши с нокином человеческого HLA-A24 гена.
Более предпочтительно, способом является способ, содержащий следующие стадии (I) и (II):
(I) стадию введения, дважды или более, эпитопного пептида человеческого опухолевого антигена, полученного из SART2, мыши с нокином человеческого HLA-A24 гена; и
(II) стадию трансплантации клетки по настоящему изобретению мыши с нокином человеческого HLA-A24 гена после стадии (I).
Более предпочтительно, способом является способ, содержащий следующие стадии (I) и (II):
(I) стадию введения, трижды или более, эпитопного пептида человеческого опухолевого антигена, полученного из SART2, мыши с нокином человеческого HLA-A24 гена; и
(II) стадию трансплантации клетки по настоящему изобретению мыши с нокином человеческого HLA-A24 гена после стадии (I).
Настоящее изобретение также относится к способу оценки противоопухолевого действия пептида, имеющего 4 связанных эпитопа и/или модулятора иммунной контрольной точки с применением клетки по настоящему изобретению. Способ предпочтительно осуществляют с применением не иммунодефицитного отличного от человека животного с нокином человеческого HLA-A24 гена, которому трансплантируют клетку по настоящему изобретению. В этом контексте, не иммунодефицитным отличным от человека животным с нокином человеческого HLA-A24 гена может быть не иммунодефицитное отличное от человека животное, имеющее α1 и α2 области человеческого HLA-A24, и предпочтительно, является мышь с нокином человеческого HLA-A24 гена (B2mtm2(HLA-A24/H-2Db/B2M)Tai мышь), описанная в Международной публикации № WO 2015/056774.
В этом способе трансплантируемое количество клеток по настоящему изобретению может быть подходящим образом выбрано, и предпочтительно составляет 1 × 105-1 × 107 клеток/тело, более предпочтительно, 1 × 105-5 × 105 клеток/тело, и более предпочтительно, 5 × 105 клеток/тело, для мыши с нокином человеческого HLA-A24 гена (B2mtm2(HLA-A24/H-2Db/B2M)Tai мыши). В способе, количество пептида, имеющего 4 связанных эпитопа, вводимое на дозу, может быть подходящим образом выбрано, и предпочтительно составляет 10-1000 мкг/тело, более предпочтительно 100-1000 мкг/тело, и более предпочтительно, 300 мкг/тело, для мыши с нокином человеческого HLA-A24 гена (B2mtm2(HLA-A24/H-2Db/B2M)Tai мыши). В способе, количество модулятора иммунной контрольной точки, вводимого на дозу, может быть подходящим образом выбрано, и предпочтительно составляет 10-1000 мкг/тело, более предпочтительно 30-500 мкг/тело, и более предпочтительно, 50-200 мкг/тело, на мышь с нокином человеческого HLA-A24 гена (B2mtm2(HLA-A24/H-2Db/B2M)Tai мышь).
Способ оценки противоопухолевого действия пептида, имеющего 4 связанных эпитопа и/или модулятора иммунной контрольной точки с применением клетки по настоящему изобретению может содержать следующие стадии.
Более конкретно, способ может проводиться способом, включающим стадии:
(I) введения пептида, имеющего 4 связанных эпитопа и/или модулятора иммунной контрольной точки не иммунодефицитному отличному от человека животному с нокином человеческого HLA-A24 гена; и
(II) трансплантации клетки по настоящему изобретению не иммунодефицитному отличному от человека животному с нокином человеческого HLA-A24 гена.
Предпочтительно, способом является способ, содержащий следующие стадии (I) и (II):
(I) стадию введения пептида, имеющего 4 связанных эпитопа и/или модулятор иммунной контрольной точки мыши с нокином человеческого HLA-A24 гена; и
(II) стадию трансплантации клетки по настоящему изобретению мыши с нокином человеческого HLA-A24 гена.
Более предпочтительно, способом является способ, содержащий следующие стадии (I) и (II):
(I) стадию введения дважды или более раз пептида, имеющего 4 связанных эпитопа мыши с нокином человеческого HLA-A24 гена; и
(II) стадию трансплантации клетки по настоящему изобретению мыши с нокином человеческого HLA-A24 гена после стадии (I).
Более предпочтительно, способом является способ, содержащий следующие стадии (I) и (III):
(I) стадию введения трижды или более раз пептида, имеющего 4 связанных эпитопа мыши с нокином человеческого HLA-A24 гена;
(II) стадию трансплантации клетки по настоящему изобретению мыши с нокином человеческого HLA-A24 гена после стадии (I); и
(III) стадию введения модулятора иммунной контрольной точки мыши с нокином человеческого HLA-A24 гена после стадии (I).
В способе по настоящему изобретению, оценка противоопухолевого действия пептида, имеющего 4 связанных эпитопа, может проводиться способом, включающим следующие стадии.
Более конкретно, способ может осуществляться способом, включающим стадии:
(I) введения пептида, имеющего 4 связанных эпитопа, не иммунодефицитному отличному от человека животному с нокином человеческого HLA-A24 гена; и
(II) трансплантации клетки по настоящему изобретению не иммунодефицитному отличному от человека животному с нокином человеческого HLA-A24 гена.
Предпочтительно, способом является способ, содержащий следующие стадии (I) и (II):
(I) стадию введения пептида, имеющего 4 связанных эпитопа, мыши с нокином человеческого HLA-A24 гена; и
(II) стадию трансплантации клетки по настоящему изобретению мыши с нокином человеческого HLA-A24 гена.
Более предпочтительно, способом является способ, содержащий следующие стадии (I) и (II):
(I) стадию введения дважды или более раз пептида, имеющего 4 связанных эпитопа, мыши с нокином человеческого HLA-A24 гена; и
(II) стадию трансплантации клетки по настоящему изобретению мыши с нокином человеческого HLA-A24 гена после стадии (I).
Более предпочтительно, способом является способ, содержащий следующие стадии (I) и (II):
(I) стадию введения трижды или более раз пептида, имеющего 4 связанных эпитопа, мыши с нокином человеческого HLA-A24 гена; и
(II) стадию трансплантации клетки по настоящему изобретению мыши с нокином человеческого HLA-A24 гена после стадии (I).
В настоящем изобретении, оценка противоопухолевого действия модулятора иммунной контрольной точки может проводиться способом, содержащим следующие стадии.
Более конкретно, способ может проводиться способом, включающим стадии:
(I) введения модулятора иммунной контрольной точки не иммунодефицитному отличному от человека животному с нокином человеческого HLA-A24 гена; и
(II) трансплантации клетки по настоящему изобретению не иммунодефицитному отличному от человека животному с нокином человеческого HLA-A24 гена.
Предпочтительно, способом является способ, содержащий следующие стадии (I) и (II):
(I) стадию введения модулятора иммунной контрольной точки мыши с нокином человеческого HLA-A24 гена; и
(II) стадию трансплантации клетки по настоящему изобретению мыши с нокином человеческого HLA-A24 гена.
Более предпочтительно, способом является способ, содержащий следующие стадии (I) и (II):
(I) стадию введения модулятора иммунной контрольной точки мыши с нокином человеческого HLA-A24 гена; и
(II) стадию трансплантации клетки по настоящему изобретению мыши с нокином человеческого HLA-A24 гена в день проведения стадии (I).
В настоящем изобретении, оценка противоопухолевого действия пептида, имеющего 4 связанных эпитопа и модулятора иммунной контрольной точки может проводиться способом, содержащим следующие стадии.
Более конкретно, способ может проводиться способом, включающим стадии:
(I) введения пептида, имеющего 4 связанных эпитопа, и модулятора иммунной контрольной точки не иммунодефицитному отличному от человека животному с нокином человеческого HLA-A24 гена; и
(II) трансплантации клетки по настоящему изобретению не иммунодефицитному отличному от человека животному с нокином человеческого HLA-A24 гена.
Предпочтительно, способом является способ, содержащий следующие стадии (I) и (II):
(I) стадию введения пептида, имеющего 4 связанных эпитопа м модулятор иммунной контрольной точки мыши с нокином человеческого HLA-A24 гена; и
(II) стадию трансплантации клетки по настоящему изобретению мыши с нокином человеческого HLA-A24 гена.
Более предпочтительно, способом является способ, содержащий следующие стадии (I) и (II):
(I) стадию введения дважды или более раз пептида, имеющего 4 связанных эпитопа, мыши с нокином человеческого HLA-A24 гена; и
(II) стадию трансплантации клетки по настоящему изобретению мыши с нокином человеческого HLA-A24 гена после стадии (I).
Более предпочтительно, способом является способ, содержащий следующие стадии (I) и (III):
(I) стадию введения трижды или более раз пептида, имеющего 4 связанных эпитопа, мыши с нокином человеческого HLA-A24 гена;
(II) стадию трансплантации клетки по настоящему изобретению мыши с нокином человеческого HLA-A24 гена после стадии (I); and
(III) стадию введения модулятора иммунной контрольной точки мыши с нокином человеческого HLA-A24 гена после стадии (I).
Способ по настоящему изобретению, описанный выше, может содержать стадию оценки противоопухолевого действия пептида, имеющего 4 связанных эпитопа, и/или модулятора иммунной контрольной точки после стадий, описанных выше. Противоопухолевое действие может быть оценено с применением, например, подавления роста опухоли трансплантированных клеток у животного, регрессии и исчезновения опухоли, или повышения уровня выживаемости в качестве показателя.
"Противоопухолевое действие эпитопного пептида человеческого опухолевого антигена, полученного из SART2" и "противоопухолевое действие пептида, имеющего 4 связанных эпитопа" может быть оценено, например, с применением мыши с нокином человеческого HLA-A24 гена, подкожным введением три раза эпитопного пептида человеческого опухолевого антигена, полученного из SART2, или пептида, имеющего 4 связанных эпитопа, мыши, с последующей подкожной трансплантацией клетки по настоящему изобретению мыши, и измерением размера опухоли для подтверждения того, демонстрируется ли противоопухолевое действие или нет.
"Противоопухолевое действие модулятора иммунной контрольной точки" может быть оценено, например, с применением мыши с нокином человеческого HLA-A24 гена, внутривенным или внутрибрюшинным введением модулятора иммунной контрольной точки мыши в день трансплантации клетки по настоящему изобретению, и измерением размера опухоли для подтверждения того, демонстрируется ли противоопухолевое действие или нет.
Примеры
Далее настоящее изобретение будет описано более подробно со ссылкой на примеры. Однако настоящее изобретение никаким образом не ограничивается этими примерами. Специалисты в данной области техники могут вносить различные изменения или модификации без отклонения от технической идеи настоящего изобретения.
Для простоты понимания настоящего изобретения, SEQ ID №№: 29-43, описанные здесь, объясняются в таблице 3 ниже.
[Таблица 3]
[Пример 1. Пептидный синтез и очистка]
Пептиды TPV07 и TPV08, имеющие 4 связанных эпитопа, синтезируют с применением автоматизированного синтезатора пептидов Prelude (Protein Technologies, Inc.) способом твердофазного синтеза на основе способа 9-флуоренилметилоксикарбонила (Fmoc). Более конкретно, аминокислоту, у которой α-аминогруппа защищена Fmoc группой и функциональная группа боковой цепи защищена общей защитной группой, конденсируют в смоле Wang-ChemMatrix в условиях 1-(мезитилен-2-сульфонил)-3-нитро-1,2,4-триазола/N-метилмимдазола/ дихлорметана для завершения закрепления C-концевой аминокислоты на смоле. Туда впрыскивают деблокирующий раствор (20% пиперидин/N, N-диметилформамид (ДМФ)) для удаления Fmoc группы. Затем аминокислоту, у которой α-аминогруппа защищена Fmoc группой и функциональная группа боковой цепи защищена общей защитной группой, конденсируют туда в условиях гексафторфосфата 3-оксида 1-[бис(диметиламино)метилен]-5-хлор-1H-бензотриазолия (HCTU)/N-метилморфолина (NMM)/ДМФ для синтеза дипептида. Повторяя процедуру снятия защитной Fmoc группы деблокирующим раствором и конденсируя аминокислоту в условиях HCTU/NMM/ДМФ, синтезируют пептиды, содержащие представляющие интерес последовательности. После завершения синтеза защищенной пептидной смолы, удаление защитных групп на боковых цепях пептида и исключение свободных пептидов из смолы проводят реакцией в течение 4 часов в растворе для снятия защиты (2,5% триизопропилсилана, 2,5% воды, 2,5% 1,2-этандитиола, 92,5% трифторуксусной кислоты), добавленном к защищенной пептидной смоле. Смолу отфильтровывают, и добавлением полученного фильтрата в холодный простой эфир пептиды восстанавливают в форме осадков. Полученные разные синтетические пептиды очищают с применением колонки Proteonavi (Shiseido Japan Co., Ltd.) и системы растворителей с водным раствором 0,1% ТФК и ацетонитрила. После конечной стадии очистки, чистоту пептидов подтверждают на колонке CAPCELL PAK UG120 (Shiseido Japan Co., Ltd.) и системы ВЭЖХ (Hitachi, Ltd.). Молекулярную массу также подтверждают на системе ИЭР-МС (Synapt HDMS, Waters Corp.). Пептиды лиофилизируют, хранят при прохладной температуре в темноте и затем подвергают примерам, описанным ниже.
В таблице 4 показана молекулярная масса TPV07 и TPV08, измеренная масс-спектрометрией (МС). На фигурах 1-4 показаны хроматограммы ВЭЖХ и масс-спектры TPV07 и TPV08.
[Таблица 4]
TPV01 - TPV06, TPV09 и TPV10 могут быть синтезированы согласно способу, описанному в, например, международной публикации № WO 2015/060235, или могут быть синтезированы по методике, аналогичной способу TPV07 и TPV08, как описано выше. Все пептиды получают с чистотой 90% или более.
[Пример 2.Внедрение колонии клеток B16F10.A24/SART293-101 и колонии клеток EL4.A24/SART293-101]
B2mtm2(HLA-A24/H-2Db/B2M)Tai мышей получают способом, описанном в примере 8 международной публикации № WO 2015/056774. Эта мышь может экспрессировать искусственный химический белок, содержащий человеческий β2 микроглобулин, α1 и α2 области HLA-A24 и α3 область мышиного MHC класса I, связанные друг с другом.
Селезенку собирают у полученной мыши, плотно закрывают предметным стеклом и затем гемолизируют с применением BD Pharm Lyse (BD Bioscience) с получением суспензии отдельных клеток. РНК экстрагируют из полученной суспензии отдельных клеток с применением набора RNeasy (Qiagen N.V.). Более конкретно, после добавления 350 мкл буфера RLT к 1×106 клеткам, смесь добавляют в центрифужную колонку QIAshredder (Qiagen N.V.) и центрифугируют (15000 об/мин, 2 мин), и восстанавливают проточную фракцию. После добавления 350 мкл водного раствора 70% этанола в восстановленный раствор РНК, смесь добавляют в колонку RNeasy Mini и центрифугируют (10000 об/мин, 15 сек). Колонку затем промывают 350 мкл буфера RW1 и затем обрабатывают ДНазой с применением набора RNase-Free DNase (Qiagen N.V.). Колонку промывают 350 мкл буфера RW1, затем РНК очищают по протоколу набора RNeasy Mini Kit. К очищенной РНК добавляют 30 мкл не содержащей РНазу H2O для восстановления общей РНК.
кДНК синтезируют из полученной общей РНК с применением системы Superscript III First-Strand Synthesis System для ОТ-ПЦР (Thermo Fisher Scientific Inc.). Более конкретно, 2 мкг общей РНК суспендируют в 8 мкл очищенной воды. 1 мкл олиго (dT)20 и 1 мкл 10 мМ dNTP добавляют к суспензии, и смесь инкубируют при 65°C в течение 5 минут. После охлаждения в течение 2 минут на льду, туда добавляют 2 мкл 10 × RT буфера, 1 мкл 25 мМ MgCl2, 2 мкл 0,1 M DTT, 1 мкл RNaseOUT (40 Ед/мкл) и 1 мкл SuperScript III RT и смешивают. Смесь инкубируют при 50°C в течение 50 минут и затем обрабатывают при 85°C в течение 5 минут для окончания реакции.
Полинуклеотид, кодирующий искусственный химерный белок, описанный выше, имеющий последовательность, показанную в SEQ ID NO: 35, получают проведением ПЦР (94°C в течение 2 мин → 30 цикло, каждый включающий 94°C в течение 30 сек, 55°C в течение 30 сек и 68°C в течение 2 мин → 68°C в течение 2 мин → 4°C) с применением синтезированной кДНК в качестве шаблона, праймер 1 (TCAAGCTTAACTAGCATGGCCGTCATGGC: SEQ ID NO: 38) в качестве смыслового праймера, праймер 2 (TTAAACCTCGAGTGCTCACGCTTTACAATCTCGGAGAGA: SEQ ID NO: 39) в качестве антисмыслового праймера и KOD-Plus-ver. 2 (Toyobo Co., Ltd.). Амплифицированный полинуклеотид вставляют в вектор PiggyBac Transposon Vector (System Biosciences, LLC.) с применением набора InFusion HD Cloning Kit (Clontech Laboratories, Inc.) с получением плазмидного вектора A, имеющего последовательность SEQ ID NO: 35.
Затем, для получения полинуклеотида, кодирующего PEP5, проводят ПЦР (25 циклов, каждый включающий 98°C в течение 10 сек, 55°C в течение 15 сек и 68°C в течение 6 мин → 68°C в течение 3 мин → 4°C) с применением плазмидного вектора A, имеющего последовательность SEQ ID NO: 35, с получением шаблона, праймера 3 (CTCAAATTTCATTCCAGCGGGCACTGTAGTCTGCCCAGGTCTGGGT: SEQ ID NO: 40) в качестве антисмыслового праймера, праймера 4 (GCAGACTACAGTGCCCGCTGGAATGAAATTTGAGCACTCGAGGTTTAA: SEQ ID NO: 41) в качестве смыслового праймера и ДНК полимеразы PrimeSTAR GXL DNA Polymerase (Takara Bio Inc.). В результате получают плазмидный вектор B, имеющий нуклеотидную последовательность, показанную в SEQ ID NO: 33, включающий нуклеотидную последовательность, кодирующую сигнальную последовательность и PEP5 в векторе PiggyBac Transposon Vector.
Полученные таким образом плазмидные векторы A и B, вместе с вектором экспрессии PiggyBac Transposase Expression Vector (System Biosciences, LLC.) вводят в колонию клеток мышиной меланомы B16F10 (American Type Culture Collection, ATCC) с применением реагента Lipofectamine LTX Reagent с реагентом PLUS Reagent (Thermo Fisher Scientific Inc.). Клетки с одним клоном получают из трансфицированных таким образом клеток с применением методики предельного разведения.
Плазмидные векторы A и B, полученные как описано выше, и вектор экспрессии Super PiggyBac Transposase Expression Vector (System Biosciences, LLC.) также вводят в колонию клеток мышиной лимфомы EL4 (ATCC) с применением набора Cell line Nucleofector Kit L (Lonza Group AG) и устройства Nucleofector Device (Lonza Group AG). Клетки с одним клоном получают из клеток, трансфицированных таким образом, с применением методики предельного разведения.
Полученные клетки с одним клоном восстанавливают, и РНК экстрагируют из них с применением набора RNeasy kit (Qiagen N.V.). Более конкретно, после добавления 350 мкл буфера RLT к 5×105 клеткам, смеси добавляют в центрифужную колонку QIAshredder (Qiagen N.V.) и центрифугируют (15000 об/мин, 2 мин), и восстанавливают проточную фракцию. После добавления 350 мкл водного раствора 70% этанола в восстановленный раствор ОНК, смесь добавляют в колонку RNeasy Mini и центрифугируют (10000 об/мин, 15 сек). Колонку дополнительно промывают 350 мкл буфера RW1 и затем обрабатывают набором RNase-Free DNase (Qiagen N.V.). Колонку промывают 350 мкл буфера RW1, затем проводят очистку РНК по протоколу набора RNeasy Mini Kit. 30 мкл не содержащей РНазу H2O добавляют к очищенной таким образом РНК для восстановления общей РНК.
кДНК синтезируют из полученной РНК с применением набора SuperScript VILO cDNA Synthesis Kit (Thermo Fisher Scientific Inc.). Более конкретно, 2 мкг общей РНК суспендируют в 14 мкл воды, обработанной DPEC, и смешивают с 4 мкл 5× реакционной смеси VILO и 2 мкл 10× ферментной смеси SuperScript Enzyme Mix. Смесь инкубируют при 25°C в течение 10 минут и при 42°C в течение 60 минут и затем обрабатывают при 85°C в течение 5 минут для окончания реакции.
Для подтверждения экспрессии полинуклеотида, кодирующего PEP5 в полученных клетках с одним клоном, проводят ПЦР (94°C в течение 2 мин → 30 циклов, включающих 98°C в течение 10 сек, 55°C в течение 30 сек и 68°C в течение 30 сек → 68°C в течение 1 мин → 4°C) с применением синтезированной кДНК в качестве шаблона, праймера 5 (ATGGCCGTCATGGC: SEQ ID NO: 42) в качестве смыслового праймера, праймера 6 (TCAAATTTCATTCCAGCG: SEQ ID NO: 43) в качестве антисмыслового праймера и KOD-Plus-ver. 2 (Toyobo Co., Ltd.), и амплификацию полинуклеотидной последовательности, показанной в SEQ ID NO: 33, подтверждают электрофорезом в агарозном геле. Амплификация полинуклеотида, имеющего последовательность, показанную в SEQ ID NO: 33, не может быть подтверждена в клетках B16F10 и EL4 без вставки гена, а амплификация полинуклеотида, имеющего последовательность, показанную в SEQ ID NO: 33, не может быть подтверждена в полученных отдельных клонах. Таким образом, было подтверждено, что экспрессирующие PEP5 клетки были получены вставкой плазмидного вектора B.
Для анализа экспрессии молекулы HLA в полученных клетках с одним клоном, слетки окрашивают PE Анти-человеческим HLA-A, B,C Антителом (Клон: W6/32, BioLegend, Inc.). Окрашенные клетки анализируют с применением BD FACSVerse (BD Biosciences). В результате, повышение интенсивности флуоресценции, вызванной окрашиванием антителом, не может быть подтверждено в клетках B16F10 и EL4 без вставки гена, а повышение интенсивности флуоресценции, вызванной окрашиванием антителом, может быть подтверждено в полученных отдельных клонах. Таким образом было подтверждено, что экспрессирующие HLA-A24 клетки были получены вставкой плазмидного вектора A.
Более конкретно, было подтверждено, что полученные клетки являются клетками, экспрессирующими HLA-A24 и также экспрессирующими PEP5 (B16F10.A24/SART293-101 клетками и EL4.A24/SART293-101 клетками).
[Пример 3. Подтверждение энграфтмента колонии клеток B16F10.A24/SART293-101 и колонии клеток]
Колонию клеток B16F10.A24/SART293-101 и колонию клеток EL4.A24/SART293-101, полученные в примере 2, культивируют с применением среды Игла в модификации Дульбекко (Sigma-Aldrich Co. LLC.), содержащей 10% ФТС. Для пассажей, клетки субкультивируют в соотношении 1:25-1:40 два раза в неделю при 37°C в инкубаторе с 5% CO2.
Колонию клеток B16F10.A24/SART293-101 и колонию клеток EL4.A24/SART293-101 подкожно трансплантируют в количестве 1×105 клеток/0,1 мл в правую боковую область каждой из 9-11-недельных мышей B2mtm2(HLA-A24/H-2Db/B2M)Tai.
Длинные оси и короткие оси опухоли измеряют с применением штангенциркулей Digimatic, начиная с 7 дней после трансплантации, и объем опухоли (ОО) рассчитывают по следующей формуле.
ОО (мм3) = Длинные оси (мм) × Короткие оси (мм) × Короткие оси (мм) / 2
Результаты показаны на фигуре 5.
Как показано на фигуре 5a, при трансплантации колонии клеток EL4.A24/SART293-101, хотя временной энграфтмент (рост) был найден у некоторых мышей, спонтанная регрессия была подтверждена на 13 день у всех мышей (пяти). С другой стороны, как показано на фигуре 5b, при трансплантации колонии клеток B16F10.A24/SART293-101, энграфтмент в виде опухоли без спонтанной регрессии был подтвержден у всех мышей (десяти) даже через 20 дней после превращения. Более конкретно, только колония клеток B16F10.A24/SART293-101 была подтверждена как применимая в in vivo тестах.
[Пример 4. Действие TPV06 и анти-мышиного PD-1 антитела, применяемых в сочетании, в подкожно трансплантированной модели колонии клеток B16F10.A24/SART293-101]
8-недельных мышей B2mtm2(HLA-A24/H-2Db/B2M)Tai произвольно делят на группы, каждая из которых включает 15 животных. День деления на группы определен как день 0.
6 мг/мл пептидный раствор готовят растворением пептида, имеющего 4 связанных эпитопа, TPV06 в дистиллированной воде (Otsuka Pharmaceutical Factory Inc.) и заполняют в шприц B Braun Injekt (B. Braun Melsungen AG). После заполнения эквивалентного количества Montanide ISA 51 VG (SEPPIC) в другой шприц, эти шприцы соединяют друг с другом через соединитель, и пептидный раствор тщательно смешивают с Montanide ISA 51 VG с получением эмульсии. Также, эмульсию дистиллированной воды, смешанной с эквивалентным количеством Montanide ISA 51 VG, готовят в качестве контрольного носителя. Каждую из этих эмульсий подкожно вводят еженедельно в количествах 100 мкл каждой рядом с основанием хвоста каждой B2mtm2(HLA-A24/H-2Db/B2M)Tai мыши, и всего проводят три введения (дни 0, 7 и 14).
GoInVivo очищенное анти-мышиное CD279 (PD-1) (Клон: RMP-1-14, BioLegend, Inc.) готовят в качестве анти-мышиного PD-1 антитела (анти-mPD-1 Ab) в количестве 1 мг/мл с применением D-PBS (FUJIFILM Wako Pure Chemical Corp.) сразу же после введения. Через одну неделю после конечного введения эмульсий (день 21), анти-мышиное PD-1 антитело вводят внутрибрюшинно в дозе 100 мкг/тело.
Колонию клеток B16F10.A24/SART293-101 культивируют с применением среды Игла в модификации Дульбекко (Sigma-Aldrich Co. LLC.), содержащей 10% ФТС. B16F10.A24/SART293-101 субкультивируют в соотношении 1:25-1:40 два раза в неделю при 37°C в инкубаторе с 5% CO2.
В тот же день (день 21) после введения анти-мышиного PD-1 антитела, клеточную суспензию, приготовленную с применением D-PBS (FUJIFILM Wako Pure Chemical Corp.), подкожно трансплантируют в дозе 5×105 клеток/0,1 мл в правую боковую область мыши.
Длинные оси и короткие оси опухоли измеряют с применением штангенциркулей Digimatic, начиная с 7 дней после трансплантации, и объем опухоли (ОО) рассчитывают по следующей формуле.
ОО (мм3) = Длинные оси (мм) × Короткие оси (мм) × Короткие оси (мм) / 2
Как показано на фигуре 6 (изменение объема опухоли после трансплантации клеток), и TPV06 и анти-мышиное PD-1 антитело обладают действием, ингибирующим рост опухоли, при применении по отдельности, по сравнению с контрольной группой, а применение их в сочетании еще более значительно ингибирует рост опухоли.
В таблице 5 показаны краткие результаты, полученные через 18 дней после трансплантации клеток. В таблице, значение ОО представляет среднее значения для каждой группы. Скорость относительного изменения объема опухоли (T/C) рассчитывают из ОО согласно следующей формуле.
T/C (%) = (Средний ОО каждой группы введения) / (Средний ОО контрольной группы) × 100
Массу тела измеряют с применением электронных весов для животных, и скорость изменения массы тела (ИМТ) рассчитывают из массы тела в день 0 (день деления на группы, МТ0) и массы тела чрез 18 дней после трансплантации клеток (МТ) по следующей формуле.
Скорость изменения массы тела ИМТ (%) = (МТ - МТ0) / МТ0 × 100
Доля мышей без опухоли (Без опухоли) через 57 дней после трансплантации клеток рассчитывают по следующей формуле.
Без опухоли (%) = (Количество мышей без опухоли в каждой группе) / (Количество мышей в исследовании в каждой группе) × 100
[Таблица 5]
Через 18 дней после трансплантации клеток группы введения TPV06 или анти-мышиного PD-1 антитела по отдельности и группа объединенного введения TPV06+анти-мышиного PD-1 антитела имели меньшее значение ОО, чем контрольная группа, что показывает противоопухолевое действие. Кроме того, группа объединенного введения TPV06+анти-мышиного PD-1 антитела имела меньшее значение ОО, чем группы введения TPV06 или анти-мышиного PD-1 антитела по отдельности, что показывает более сильное противоопухолевое действие. Через 57 дней после трансплантации клеток, 53,3% мышей в группе объединенного введения TPV06+анти-мышиного PD-1 антитела не имели опухоли. Кроме того, в группе объединенного введения TPV06+анти-мышиного PD-1 антитела был подтвержден улучшенный уровень выживаемости через 57 после трансплантации клеток, по сравнению с группой введения одного лекарственного средства.
Скорость изменения средней массы тела в группе объединенного введения показала, что никакого усиления токсичности не наблюдали по сравнению с группами введения TPV06 или анти-мышиного PD-1 антитела по отдельности.
[Пример 5. Действие TPV06 и анти-мышиного PD-L1 антитела, применяемых в сочетании в модели подкожно трансплантированной колонии клеток B16F10.A24/SART293-101]
9-недельных мышей B2mtm2(HLA-A24/H-2Db/B2M)Tai произвольно делят на группы, каждая из которых включает 15 животных. День деления на группы определен как день 0.
Это исследование проводят по методике Примера 4 за исключением того, что анти-мышиное PD-L1 антитело применяют вместо анти-мышиного PD-1 антитела. GoInVivo очищенное анти-мышиное CD274 (B7-H1, PD-L1) (Клон: 10F.9G2, BioLegend, Inc.) получают в качестве анти-мышиного PD-L1 антитела (анти-mPD-L1 Ab) в 1 мг/мл с применением D-PBS (FUJIFILM Wako Pure Chemical Corp.) непосредственно перед введением. Через одну неделю после конечного введения эмульсий (день 21), анти-мышиное PD-L1 антитело внутрибрюшинно вводят в дозе 200 мкг/тело.
Как показано на фигуре 7 (изменение объема опухоли после трансплантации клеток), TPV06 обладает ингибирующим действием на рост опухоли при отдельном применении, по сравнению с контрольной группой, в то время как анти-мышиное PD-L1 антитело является не эффективным. Однако применение TPV06 и анти-мышиного PD-L1 антитела в сочетании более значительно ингибирует рост опухоли.
В таблице 6 ниже показан объем опухоли, скорость относительного изменения объема опухоли и изменения массы тела (ИМТ) через 18 дней после трансплантации клеток, и доля мышей без опухоли через 57 дней после трансплантации клеток.
[Таблица 6]
Анти-mPD-L1 Ab
987,4±168,9
157,4
21,2
0,0
Через 18 дней после трансплантации клеток, группа введения TPV06 по отдельности и группа объединенного введения TPV06+анти-мышиного PD-L1 антитела имели меньшее значение ОО, чем контрольная группа, что показывает противоопухолевое действие. Кроме того, группа объединенного введения TPV06+анти-мышиного PD-L1 антитела имела меньшее значение ОО, чем группы введения TPV06 или анти-мышиного PD-L1 антитела по отдельности, что показывает более сильное противоопухолевое действие. Через 57 дней после трансплантации клеток, 66,7% мышей в группе объединенного введения TPV06+анти-мышиного PD-L1 антитела не имели опухоли. Кроме того, в группе объединенного введения TPV06+анти-мышиного PD-L1 антитела был подтвержден улучшенный уровень выживаемости через 57 после трансплантации клеток, по сравнению с группой введения одного лекарственного средства.
Скорость изменения средней массы тела в группе объединенного введения показала, что никакого усиления токсичности не наблюдали по сравнению с группами введения TPV06 или анти-мышиного PD-L1 антитела по отдельности.
[Пример 6. Действие TPV07 или TPV08 и анти-мышиного PD-1 антитела, применяемых в сочетании в модели подкожно трансплантированной колонии клеток B16F10.A24/SART293-101]
9-недельных мышей B2mtm2(HLA-A24/H-2Db/B2M)Tai произвольно делят на группы, каждая из которых включает 15 животных. День деления на группы определен как день 0.
Это исследование проводят по методике Примера 4 за исключением того, что TPV07 или TPV08 применяют вместо TPV06 в качестве пептида, имеющего 4 связанных эпитопа. TPV07 и TPV08, как и TPV06, каждый получают в 6 мг/мл с применением дистиллированной воды (Otsuka Pharmaceutical Factory Inc.) и затем смешивают с эквивалентным количеством Montanide ISA 51 VG (SEPPIC) с получением эмульсии, которую вводят. Этот пример не включает группу введения только анти-мышиного PD-1 антитела.
На фигурах 8 и 9 показано изменение объема опухоли после трансплантации клеток. В таблице 7 показан объем опухоли, скорость относительного изменения объема опухоли и изменения массы тела (ИМТ) через 18 дней после трансплантации клеток, и доля мышей без опухоли через 56 дней после трансплантации клеток.
[Таблица 7]
На фигурах 8 и 9 показано, что оба TPV07 и TPV08 обладают высоким ингибирующим действием на рост опухоли при применении по отдельности, по сравнению с контрольной группой, в то время как применение их в сочетании с анти-мышиным PD-1 антителом более значительно ингибирует рост опухоли.
В таблице 7 показано, что через 18 дней после трансплантации клеток группы введения TPV07 или TPV08 по отдельности и группы объединенного введения TPV07+анти-мышиного PD-1 антитела или TPV08+анти-мышиного PD-1 антитела имеют более низкие значения ОО, чем в контрольной группе, что показывает противоопухолевое действие. Кроме того, группа объединенного введения TPV07+анти-мышиного PD-1 антитела показывает более низкое значение ОО, чем группа введения только TPV07, что показывает более сильное противоопухолевое действие. Также, группа объединенного введения TPV08+анти-мышиного PD-1 антитела показывает более низкое значение ОО, чем группа введения только TPV08, что показывает более сильное противоопухолевое действие. Через 56 дней после трансплантации клеток, 80,0% мышей в группе объединенного введения TPV07+анти-мышиного PD-1 антитела не имели опухоли, и 40,0% мышей в группе объединенного введения TPV08+анти-мышиного PD-1 антитела не имели опухоли. Кроме того, в группе объединенного введения TPV07+анти-мышиного PD-1 антитела или группе объединенного введения TPV08+анти-мышиного PD-1 антитела был подтвержден улучшенный уровень выживаемости через 56 после трансплантации клеток, по сравнению с группой введения одного лекарственного средства.
Скорость изменения средней массы тела в группе объединенного введения показала, что никакого усиления токсичности не наблюдали по сравнению с группами введения TPV076 или TPV08 по отдельности.
[Пример 7. Действие 3 смешанных пептидов, имеющих 4 связанных эпитопа (TPV06, TPV011 и TPV012) и анти-мышиного PD-1 антитела, применяемого в сочетании в модели подкожно трансплантированной колонии клеток B16F10.A24/SART293-101]
9-недельных мышей B2mtm2(HLA-A24/H-2Db/B2M)Tai произвольно делят на группы, каждая из которых включает 15 животных. День деления на группы определен как день 0.
Это исследование проводят по методике Примера 4 за исключением того, что всего 3 смешанных пептида, имеющих 4 связанных эпитопа, состоящие из TPV06 и других двух пептидов, имеющих 4 связанных эпитопа (TPV011 и TPV012) применяют вместо TPV06.
Более конкретно, исследование проводят с контрольной группой, группой 3 смешанных пептидов, имеющих 4 связанных эпитопа (TPV06, TPV011 и TPV012), группой анти-мышиного PD-1 антитела и группой объединенного введения 3 смешанных пептидов, имеющих 4 связанных эпитопа (TPV06, TPV011 и TPV012) + анти-мышиное PD-1 антитело.
3 смешанных пептида, имеющих 4 связанных эпитопа (TPV06, TPV011 и TPV012) получают в 6 мг/мл каждого из TPV06, TPV011 и TPV012 (т.е. общее количество пептидов: 18 мг/мл), с применением дистиллированной воды (Otsuka Pharmaceutical Factory Inc.) и затем смешивают с эквивалентным количеством Montanide ISA 51 VG (SEPPIC) с получением эмульсии, которую вводят.
В результате, было подтверждено, что группа объединенного введения 3 смешанных пептидов, имеющих 4 связанных эпитопа (TPV06, TPV011 и TPV012) + анти-мышиное PD-1 антитело имела улучшенную степень выживания через 56 дней после трансплантации клеток, по сравнению с группой введения 3 смешанных пептидов, имеющих 4 связанных эпитопа (TPV06, TPV011 и TPV012) или анти-мышиного PD-1 антитела по отдельности.
Скорость изменения средней массы тела в группе объединенного введения показала, что никакого усиления токсичности не наблюдали по сравнению с группами введения лекарственных средств по отдельности.
Все цитируемые здесь публикации, патенты и заявки на патенты полностью включены в настоящий документ посредством ссылки.
--->
СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> TAIHO PHARMACEUTICAL CO., LTD.
<120> Противоопухолевый агент и способ оценки агента
<130> PH-7968-PCT
<150> JP 2018-124894
<151> 2018-06-29
<160> 45
<170> PatentIn version 3.5
<210> 1
<211> 9
<212> PRT
<213> Homo sapiens
<400> 1
Lys Leu Val Glu Arg Leu Gly Ala Ala
1. 5
<210> 2
<211> 9
<212> PRT
<213> Homo sapiens
<400> 2
Ala Ser Leu Asp Ser Asp Pro Trp Val
1. 5
<210> 3
<211> 9
<212> PRT
<213> Homo sapiens
<400> 3
Ala Leu Val Glu Phe Glu Asp Val Leu
1. 5
<210> 4
<211> 9
<212> PRT
<213> Homo sapiens
<400> 4
Leu Leu Gln Ala Glu Ala Pro Arg Leu
1. 5
<210> 5
<211> 9
<212> PRT
<213> Homo sapiens
<400> 5
Asp Tyr Ser Ala Arg Trp Asn Glu Ile
1. 5
<210> 6
<211> 10
<212> PRT
<213> Homo sapiens
<400> 6
Val Tyr Asp Tyr Asn Cys His Val Asp Leu
1. 5 10
<210> 7
<211> 9
<212> PRT
<213> Homo sapiens
<400> 7
Leu Tyr Ala Trp Glu Pro Ser Phe Leu
1. 5
<210> 8
<211> 10
<212> PRT
<213> Homo sapiens
<400> 8
Asp Tyr Leu Arg Ser Val Leu Glu Asp Phe
1. 5 10
<210> 9
<211> 9
<212> PRT
<213> Homo sapiens
<400> 9
Gln Ile Arg Pro Ile Phe Ser Asn Arg
1. 5
<210> 10
<211> 10
<212> PRT
<213> Homo sapiens
<400> 10
Ile Leu Glu Gln Ser Gly Glu Trp Trp Lys
1. 5 10
<210> 11
<211> 10
<212> PRT
<213> Homo sapiens
<400> 11
Val Ile Gln Asn Leu Glu Arg Gly Tyr Arg
1. 5 10
<210> 12
<211> 10
<212> PRT
<213> Homo sapiens
<400> 12
Lys Leu Lys His Tyr Gly Pro Gly Trp Val
1. 5 10
<210> 13
<211> 9
<212> PRT
<213> Homo sapiens
<400> 13
Arg Leu Gln Glu Trp Cys Ser Val Ile
1. 5
<210> 14
<211> 9
<212> PRT
<213> Homo sapiens
<400> 14
Ile Leu Gly Glu Leu Arg Glu Lys Val
1. 5
<210> 15
<211> 10
<212> PRT
<213> Homo sapiens
<400> 15
Asp Tyr Val Arg Glu His Lys Asp Asn Ile
1. 5 10
<210> 16
<211> 9
<212> PRT
<213> Homo sapiens
<400> 16
His Tyr Thr Asn Ala Ser Asp Gly Leu
1. 5
<210> 17
<211> 10
<212> PRT
<213> Homo sapiens
<400> 17
Asn Tyr Ser Val Arg Tyr Arg Pro Gly Leu
1. 5 10
<210> 18
<211> 10
<212> PRT
<213> Homo sapiens
<400> 18
Arg Tyr Leu Thr Gln Glu Thr Asn Lys Val
1. 5 10
<210> 19
<211> 43
<212> PRT
<213> Искусственная
<220>
<223> синтетический пептид
<400> 19
Asp Tyr Ser Ala Arg Trp Asn Glu Ile Arg Arg Val Tyr Asp Tyr Asn
1. 5 10 15
Cys His Val Asp Leu Arg Arg Gln Ile Arg Pro Ile Phe Ser Asn Arg
20 25 30
Arg Arg Leu Leu Gln Ala Glu Ala Pro Arg Leu
35 40
<210> 20
<211> 43
<212> PRT
<213> искусственная
<220>
<223> синтетический пептид
<400> 20
Gln Ile Arg Pro Ile Phe Ser Asn Arg Arg Arg Asp Tyr Ser Ala Arg
1. 5 10 15
Trp Asn Glu Ile Arg Arg Val Tyr Asp Tyr Asn Cys His Val Asp Leu
20 25 30
Arg Arg Leu Leu Gln Ala Glu Ala Pro Arg Leu
35 40
<210> 21
<211> 43
<212> PRT
<213> искусственная
<220>
<223> синтетический пептид
<400> 21
Val Tyr Asp Tyr Asn Cys His Val Asp Leu Arg Arg Asp Tyr Ser Ala
1. 5 10 15
Arg Trp Asn Glu Ile Arg Arg Gln Ile Arg Pro Ile Phe Ser Asn Arg
20 25 30
Arg Arg Leu Leu Gln Ala Glu Ala Pro Arg Leu
35 40
<210> 22
<211> 43
<212> PRT
<213> искусственная
<220>
<223> синтетический пептид
<400> 22
Val Tyr Asp Tyr Asn Cys His Val Asp Leu Arg Arg Gln Ile Arg Pro
1. 5 10 15
Ile Phe Ser Asn Arg Arg Arg Asp Tyr Ser Ala Arg Trp Asn Glu Ile
20 25 30
Arg Arg Leu Leu Gln Ala Glu Ala Pro Arg Leu
35 40
<210> 23
<211> 43
<212> PRT
<213> искусственная
<220>
<223> синтетический пептид
<400> 23
Gln Ile Arg Pro Ile Phe Ser Asn Arg Arg Arg Val Tyr Asp Tyr Asn
1. 5 10 15
Cys His Val Asp Leu Arg Arg Asp Tyr Ser Ala Arg Trp Asn Glu Ile
20 25 30
Arg Arg Leu Leu Gln Ala Glu Ala Pro Arg Leu
35 40
<210> 24
<211> 43
<212> PRT
<213> искусственная
<220>
<223> синтетический пептид
<400> 24
Asp Tyr Ser Ala Arg Trp Asn Glu Ile Arg Arg Gln Ile Arg Pro Ile
1. 5 10 15
Phe Ser Asn Arg Arg Arg Val Tyr Asp Tyr Asn Cys His Val Asp Leu
20 25 30
Arg Arg Leu Leu Gln Ala Glu Ala Pro Arg Leu
35 40
<210> 25
<211> 43
<212> PRT
<213> искусственная
<220>
<223> синтетический пептид
<400> 25
Asp Tyr Ser Ala Arg Trp Asn Glu Ile Arg Arg Gln Ile Arg Pro Ile
1. 5 10 15
Phe Ser Asn Arg Arg Arg Val Tyr Asp Tyr Asn Cys His Val Asp Leu
20 25 30
Arg Arg Ala Ser Leu Asp Ser Asp Pro Trp Val
35 40
<210> 26
<211> 44
<212> PRT
<213> искусственная
<220>
<223> синтетический пептид
<400> 26
Asp Tyr Ser Ala Arg Trp Asn Glu Ile Arg Arg Gln Ile Arg Pro Ile
1. 5 10 15
Phe Ser Asn Arg Arg Arg Val Tyr Asp Tyr Asn Cys His Val Asp Leu
20 25 30
Arg Arg Ile Leu Glu Gln Ser Gly Glu Trp Trp Lys
35 40
<210> 27
<211> 46
<212> PRT
<213> искусственная
<220>
<223> синтетический пептид
<400> 27
Arg Arg Arg Asp Tyr Ser Ala Arg Trp Asn Glu Ile Arg Arg Gln Ile
1. 5 10 15
Arg Pro Ile Phe Ser Asn Arg Arg Arg Val Tyr Asp Tyr Asn Cys His
20 25 30
Val Asp Leu Arg Arg Leu Leu Gln Ala Glu Ala Pro Arg Leu
35 40 45
<210> 28
<211> 47
<212> PRT
<213> искусственная
<220>
<223> синтетический пептид
<400> 28
Arg Arg Arg Arg Asp Tyr Ser Ala Arg Trp Asn Glu Ile Arg Arg Gln
1. 5 10 15
Ile Arg Pro Ile Phe Ser Asn Arg Arg Arg Val Tyr Asp Tyr Asn Cys
20 25 30
His Val Asp Leu Arg Arg Leu Leu Gln Ala Glu Ala Pro Arg Leu
35 40 45
<210> 29
<211> 27
<212> ДНК
<213> Homo sapiens
<400> 29
gactacagtg cccgctggaa tgaaatt 27
<210> 30
<211> 182
<212> PRT
<213> Homo sapiens
<400> 30
Gly Ser His Ser Met Arg Tyr Phe Ser Thr Ser Val Ser Arg Pro Gly
1. 5 10 15
Arg Gly Glu Pro Arg Phe Ile Ala Val Gly Tyr Val Asp Asp Thr Gln
20 25 30
Phe Val Arg Phe Asp Ser Asp Ala Ala Ser Gln Arg Met Glu Pro Arg
35 40 45
Ala Pro Trp Ile Glu Gln Glu Gly Pro Glu Tyr Trp Asp Glu Glu Thr
50 55 60
Gly Lys Val Lys Ala His Ser Gln Thr Asp Arg Glu Asn Leu Arg Ile
65 70 75 80
Ala Leu Arg Tyr Tyr Asn Gln Ser Glu Ala Gly Ser His Thr Leu Gln
85 90 95
Met Met Phe Gly Cys Asp Val Gly Ser Asp Gly Arg Phe Leu Arg Gly
100 105 110
Tyr His Gln Tyr Ala Tyr Asp Gly Lys Asp Tyr Ile Ala Leu Lys Glu
115 120 125
Asp Leu Arg Ser Trp Thr Ala Ala Asp Met Ala Ala Gln Ile Thr Lys
130 135 140
Arg Lys Trp Glu Ala Ala His Val Ala Glu Gln Gln Arg Ala Tyr Leu
145 150 155 160
Glu Gly Thr Cys Val Asp Gly Leu Arg Arg Tyr Leu Glu Asn Gly Lys
165 170 175
Glu Thr Leu Gln Arg Thr
180
<210> 31
<211> 546
<212> ДНК
<213> Homo sapiens
<400> 31
ggatctcact ccatgaggta tttctccaca tccgtgtccc ggcccggccg cggggagccc 60
cgcttcatcg ccgtgggcta cgtggacgac acgcagttcg tgcggttcga cagcgacgcc 120
gcgagccaga ggatggagcc gcgggcgccg tggatagagc aggaggggcc ggagtattgg 180
gacgaggaga cagggaaagt gaaggcccac tcacagactg accgagagaa cctgcggatc 240
gcgctccgct actacaacca gagcgaggcc ggttctcaca ccctccagat gatgtttggc 300
tgcgacgtgg ggtcggacgg gcgcttcctc cgcgggtacc accagtacgc ctacgacggc 360
aaggattaca tcgccctgaa agaggacctg cgctcttgga ccgcggcgga catggcggct 420
cagatcacca agcgcaagtg ggaggcggcc catgtggcgg agcagcagag agcctacctg 480
gagggcacgt gcgtggacgg gctccgcaga tacctggaga acgggaagga gacgctgcag 540
cgcacg 546
<210> 32
<211> 33
<212> PRT
<213> искусственная
<220>
<223> синтетический пептид
<400> 32
Met Ala Val Met Ala Pro Arg Thr Leu Val Leu Leu Leu Ser Gly Ala
1. 5 10 15
Leu Ala Leu Thr Gln Thr Trp Ala Asp Tyr Ser Ala Arg Trp Asn Glu
20 25 30
Ile
<210> 33
<211> 102
<212> ДНК
<213> искусственная
<220>
<223> синтетический пептид
<400> 33
atggccgtca tggcgccccg aaccctcgtc ctgctactct cgggggccct ggccctgacc 60
cagacctggg cagactacag tgcccgctgg aatgaaattt ga 102
<210> 34
<211> 476
<212> PRT
<213> искусственная
<220>
<223> синтетический пептид
<400> 34
Met Ala Val Met Ala Pro Arg Thr Leu Val Leu Leu Leu Ser Gly Ala
1. 5 10 15
Leu Ala Leu Thr Gln Thr Trp Ala Ile Gln Arg Thr Pro Lys Ile Gln
20 25 30
Val Tyr Ser Arg His Pro Ala Glu Asn Gly Lys Ser Asn Phe Leu Asn
35 40 45
Cys Tyr Val Ser Gly Phe His Pro Ser Asp Ile Glu Val Asp Leu Leu
50 55 60
Lys Asn Gly Glu Arg Ile Glu Lys Val Glu His Ser Asp Leu Ser Phe
65 70 75 80
Ser Lys Asp Trp Ser Phe Tyr Leu Leu Tyr Tyr Thr Glu Phe Thr Pro
85 90 95
Thr Glu Lys Asp Glu Tyr Ala Cys Arg Val Asn His Val Thr Leu Ser
100 105 110
Gln Pro Lys Ile Val Lys Trp Asp Arg Asp Met Gly Gly Gly Gly Ser
115 120 125
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Ser His Ser Met Arg
130 135 140
Tyr Phe Ser Thr Ser Val Ser Arg Pro Gly Arg Gly Glu Pro Arg Phe
145 150 155 160
Ile Ala Val Gly Tyr Val Asp Asp Thr Gln Phe Val Arg Phe Asp Ser
165 170 175
Asp Ala Ala Ser Gln Arg Met Glu Pro Arg Ala Pro Trp Ile Glu Gln
180 185 190
Glu Gly Pro Glu Tyr Trp Asp Glu Glu Thr Gly Lys Val Lys Ala His
195 200 205
Ser Gln Thr Asp Arg Glu Asn Leu Arg Ile Ala Leu Arg Tyr Tyr Asn
210 215 220
Gln Ser Glu Ala Gly Ser His Thr Leu Gln Met Met Phe Gly Cys Asp
225 230 235 240
Val Gly Ser Asp Gly Arg Phe Leu Arg Gly Tyr His Gln Tyr Ala Tyr
245 250 255
Asp Gly Lys Asp Tyr Ile Ala Leu Lys Glu Asp Leu Arg Ser Trp Thr
260 265 270
Ala Ala Asp Met Ala Ala Gln Ile Thr Lys Arg Lys Trp Glu Ala Ala
275 280 285
His Val Ala Glu Gln Gln Arg Ala Tyr Leu Glu Gly Thr Cys Val Asp
290 295 300
Gly Leu Arg Arg Tyr Leu Glu Asn Gly Lys Glu Thr Leu Gln Arg Thr
305 310 315 320
Asp Ser Pro Lys Ala His Val Thr His His Pro Arg Ser Lys Gly Glu
325 330 335
Val Thr Leu Arg Cys Trp Ala Leu Gly Phe Tyr Pro Ala Asp Ile Thr
340 345 350
Leu Thr Trp Gln Leu Asn Gly Glu Glu Leu Thr Gln Asp Met Glu Leu
355 360 365
Val Glu Thr Arg Pro Ala Gly Asp Gly Thr Phe Gln Lys Trp Ala Ser
370 375 380
Val Val Val Pro Leu Gly Lys Glu Gln Asn Tyr Thr Cys Arg Val Tyr
385 390 395 400
His Glu Gly Leu Pro Glu Pro Leu Thr Leu Arg Trp Glu Pro Pro Pro
405 410 415
Ser Thr Asp Ser Tyr Met Val Ile Val Ala Val Leu Gly Val Leu Gly
420 425 430
Ala Met Ala Ile Ile Gly Ala Val Val Ala Phe Val Met Lys Arg Arg
435 440 445
Arg Asn Thr Gly Gly Lys Gly Gly Asp Tyr Ala Leu Ala Pro Gly Ser
450 455 460
Gln Ser Ser Glu Met Ser Leu Arg Asp Cys Lys Ala
465 470 475
<210> 35
<211> 1431
<212> ДНК
<213> искусственная
<220>
<223> синтетический пептид
<400> 35
atggccgtca tggcgccccg aaccctcgtc ctgctactct cgggggccct ggccctgacc 60
cagacctggg cgatccagcg tactccaaag attcaggttt actcacgtca tccagcagag 120
aatggaaagt caaatttcct gaattgctat gtgtctgggt ttcatccatc cgacattgaa 180
gttgacttac tgaagaatgg agagagaatt gaaaaagtgg agcattcaga cttgtctttc 240
agcaaggact ggtctttcta tctcttgtac tacactgaat tcacccccac tgaaaaagat 300
gagtatgcct gccgtgtgaa ccatgtgact ttgtcacagc ccaagatagt taagtgggat 360
cgagacatgg gaggtggcgg atccggcgga ggcggctcgg gtggcggcgg ctctggatct 420
cactccatga ggtatttctc cacatccgtg tcccggcccg gccgcgggga gccccgcttc 480
atcgccgtgg gctacgtgga cgacacgcag ttcgtgcggt tcgacagcga cgccgcgagc 540
cagaggatgg agccgcgggc gccgtggata gagcaggagg ggccggagta ttgggacgag 600
gagacaggga aagtgaaggc ccactcacag actgaccgag agaacctgcg gatcgcgctc 660
cgctactaca accagagcga ggccggttct cacaccctcc agatgatgtt tggctgcgac 720
gtggggtcgg acgggcgctt cctccgcggg taccaccagt acgcctacga cggcaaggat 780
tacatcgccc tgaaagagga cctgcgctct tggaccgcgg cggacatggc ggctcagatc 840
accaagcgca agtgggaggc ggcccatgtg gcggagcagc agagagccta cctggagggc 900
acgtgcgtgg acgggctccg cagatacctg gagaacggga aggagacgct gcagcgcacg 960
gattccccaa aggcacatgt gacccatcac cccagatcta aaggtgaagt caccctgagg 1020
tgctgggccc tgggcttcta ccctgctgac atcaccctga cctggcagtt gaatggggag 1080
gagctgaccc aggacatgga gcttgtggag accaggcctg caggggatgg aaccttccag 1140
aagtgggcat ctgtggtggt gcctcttggg aaggagcaga attacacatg ccgtgtgtac 1200
catgaggggc tgcctgagcc cctcaccctg agatgggagc ctcctccgtc cactgactct 1260
tacatggtga tcgttgctgt tctgggtgtc cttggagcta tggccatcat tggagctgtg 1320
gtggcttttg tgatgaagag aaggagaaac acaggtggaa aaggagggga ctatgctctg 1380
gctccaggct cccagagctc tgaaatgtct ctccgagatt gtaaagcgtg a 1431
<210> 36
<211> 99
<212> PRT
<213> Homo sapiens
<400> 36
Ile Gln Arg Thr Pro Lys Ile Gln Val Tyr Ser Arg His Pro Ala Glu
1. 5 10 15
Asn Gly Lys Ser Asn Phe Leu Asn Cys Tyr Val Ser Gly Phe His Pro
20 25 30
Ser Asp Ile Glu Val Asp Leu Leu Lys Asn Gly Glu Arg Ile Glu Lys
35 40 45
Val Glu His Ser Asp Leu Ser Phe Ser Lys Asp Trp Ser Phe Tyr Leu
50 55 60
Leu Tyr Tyr Thr Glu Phe Thr Pro Thr Glu Lys Asp Glu Tyr Ala Cys
65 70 75 80
Arg Val Asn His Val Thr Leu Ser Gln Pro Lys Ile Val Lys Trp Asp
85 90 95
Arg Asp Met
<210> 37
<211> 156
<212> PRT
<213> Mus musculus
<400> 37
Asp Ser Pro Lys Ala His Val Thr His His Pro Arg Ser Lys Gly Glu
1. 5 10 15
Val Thr Leu Arg Cys Trp Ala Leu Gly Phe Tyr Pro Ala Asp Ile Thr
20 25 30
Leu Thr Trp Gln Leu Asn Gly Glu Glu Leu Thr Gln Asp Met Glu Leu
35 40 45
Val Glu Thr Arg Pro Ala Gly Asp Gly Thr Phe Gln Lys Trp Ala Ser
50 55 60
Val Val Val Pro Leu Gly Lys Glu Gln Asn Tyr Thr Cys Arg Val Tyr
65 70 75 80
His Glu Gly Leu Pro Glu Pro Leu Thr Leu Arg Trp Glu Pro Pro Pro
85 90 95
Ser Thr Asp Ser Tyr Met Val Ile Val Ala Val Leu Gly Val Leu Gly
100 105 110
Ala Met Ala Ile Ile Gly Ala Val Val Ala Phe Val Met Lys Arg Arg
115 120 125
Arg Asn Thr Gly Gly Lys Gly Gly Asp Tyr Ala Leu Ala Pro Gly Ser
130 135 140
Gln Ser Ser Glu Met Ser Leu Arg Asp Cys Lys Ala
145 150 155
<210> 38
<211> 29
<212> ДНК
<213> искусственная
<220>
<223> праймер 1
<400> 38
tcaagcttaa ctagcatggc cgtcatggc 29
<210> 39
<211> 39
<212> ДНК
<213> искусственная
<220>
<223> праймер 2
<400> 39
ttaaacctcg agtgctcacg ctttacaatc tcggagaga 39
<210> 40
<211> 46
<212> ДНК
<213> искусственная
<220>
<223> праймер 3
<400> 40
ctcaaatttc attccagcgg gcactgtagt ctgcccaggt ctgggt 46
<210> 41
<211> 48
<212> ДНК
<213> искусственная
<220>
<223> праймер 4
<400> 41
gcagactaca gtgcccgctg gaatgaaatt tgagcactcg aggtttaa 48
<210> 42
<211> 14
<212> ДНК
<213> искусственная
<220>
<223> праймер 5
<400> 42
atggccgtca tggc 14
<210> 43
<211> 18
<212> ДНК
<213> искусственная
<220>
<223> праймер 6
<400> 43
tcaaatttca ttccagcg 18
<210> 44
<211> 45
<212> PRT
<213> искусственная
<220>
<223> синтетический пептид
<400> 44
Asp Tyr Val Arg Glu His Lys Asp Asn Ile Arg Arg Arg Tyr Leu Thr
1. 5 10 15
Gln Glu Thr Asn Lys Val Arg Arg Lys Leu Val Glu Arg Leu Gly Ala
20 25 30
Ala Arg Arg Ile Leu Glu Gln Ser Gly Glu Trp Trp Lys
35 40 45
<210> 45
<211> 47
<212> PRT
<213> искусственная
<220>
<223> синтетический пептид
<400> 45
Arg Arg Arg Arg Leu Tyr Ala Trp Glu Pro Ser Phe Leu Arg Arg Arg
1. 5 10 15
Leu Gln Glu Trp Cys Ser Val Ile Arg Arg Asp Tyr Leu Arg Ser Val
20 25 30
Leu Glu Asp Phe Arg Arg Ala Ser Leu Asp Ser Asp Pro Trp Val
35 40 45
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| АГЕНТ ДЛЯ АДЪЮВАНТНОЙ ТЕРАПИИ | 2020 |
|
RU2829433C1 |
| ЭМУЛЬСИОННЫЙ СОСТАВ И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2019 |
|
RU2793862C2 |
| НОВЫЙ ПЕПТИД, ИМЕЮЩИЙ 4 СВЯЗАННЫХ CTL-ЭПИТОПА | 2014 |
|
RU2636549C1 |
| НОВЫЙ ПЕПТИД, ИМЕЮЩИЙ 5 СОЕДИНЕННЫХ ЭПИТОПОВ CTL | 2014 |
|
RU2627175C2 |
| АНТИТЕЛА ПРОТИВ PD-1 И КОМПОЗИЦИИ | 2016 |
|
RU2750675C1 |
| ПЕПТИДЫ NEIL3 И ВКЛЮЧАЮЩИЕ ИХ ВАКЦИНЫ | 2010 |
|
RU2733985C2 |
| ИНДУКТОР ИММУНИТЕТА | 2017 |
|
RU2755542C2 |
| ИНДУКТОР ИММУНИТЕТА | 2016 |
|
RU2835947C2 |
| ИНДУКТОР ИММУНИТЕТА | 2016 |
|
RU2758112C2 |
| НОВЫЕ МОНОКЛОНАЛЬНЫЕ АНТИТЕЛА К БЕЛКУ ПРОГРАММИРУЕМОЙ СМЕРТИ 1(PD-1) | 2016 |
|
RU2757316C2 |
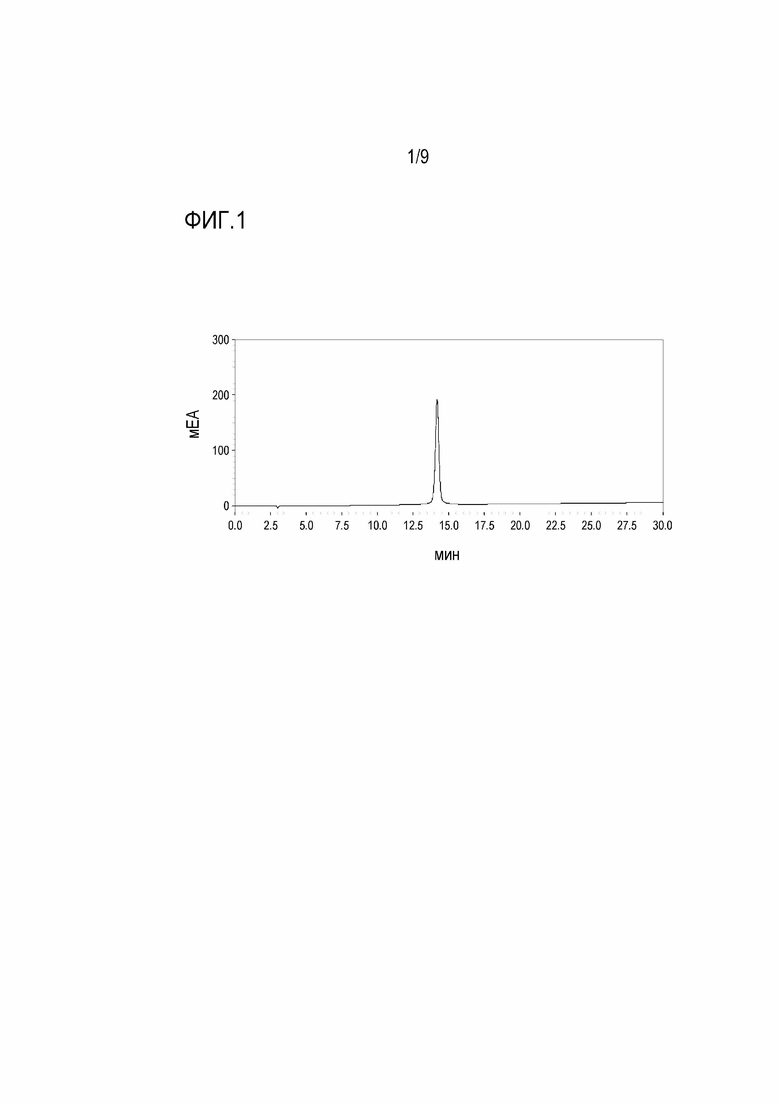
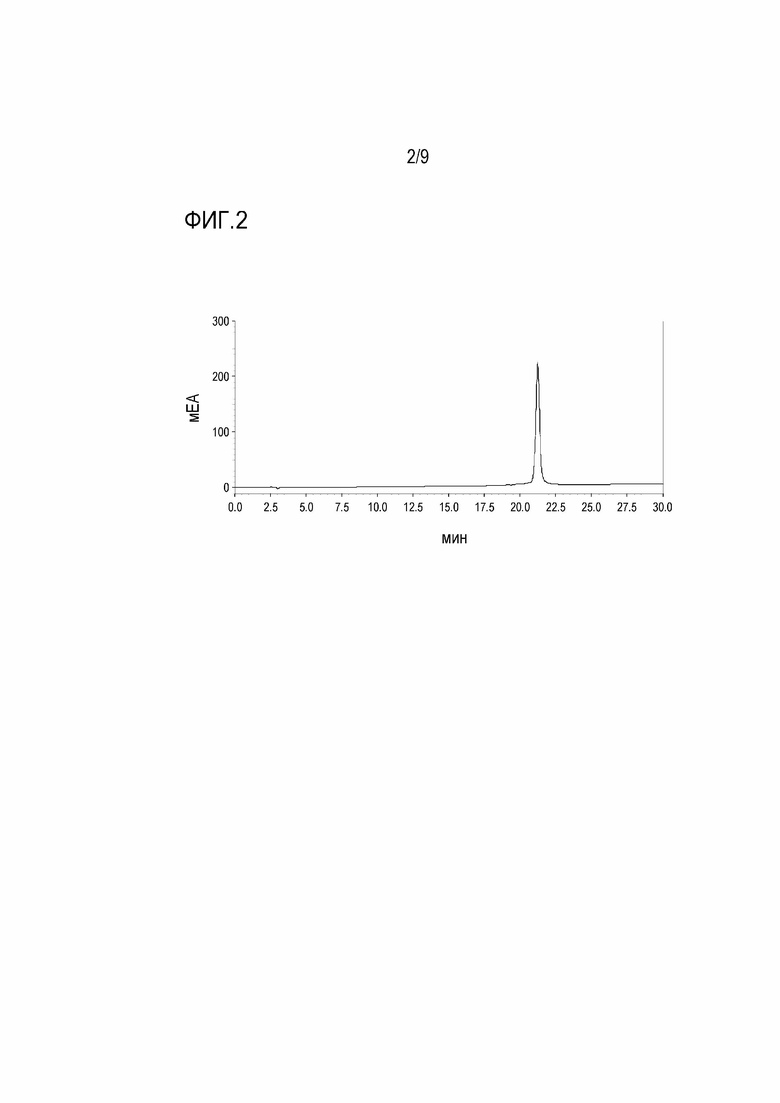
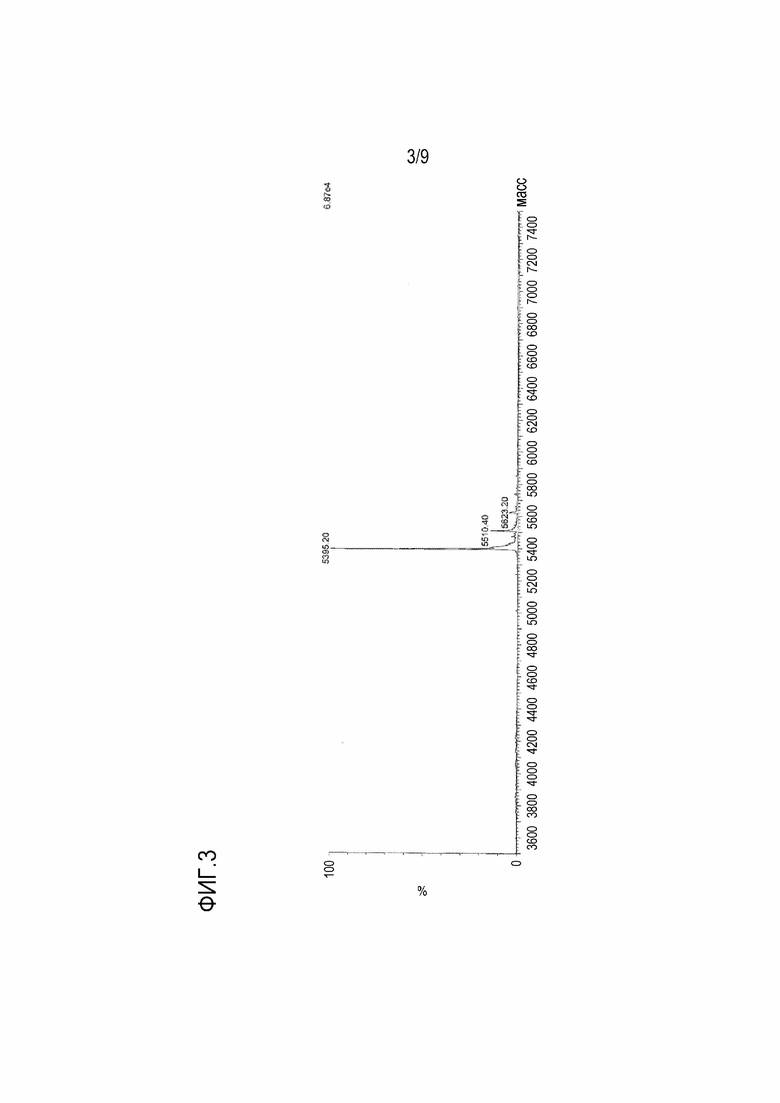
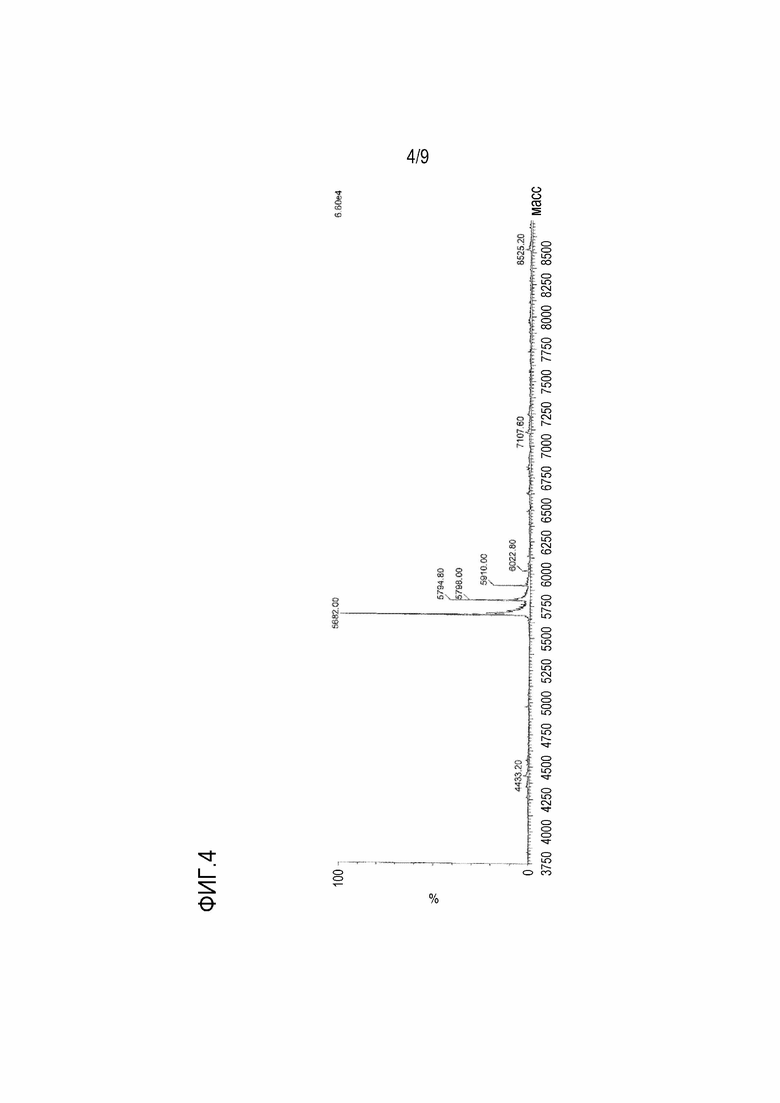
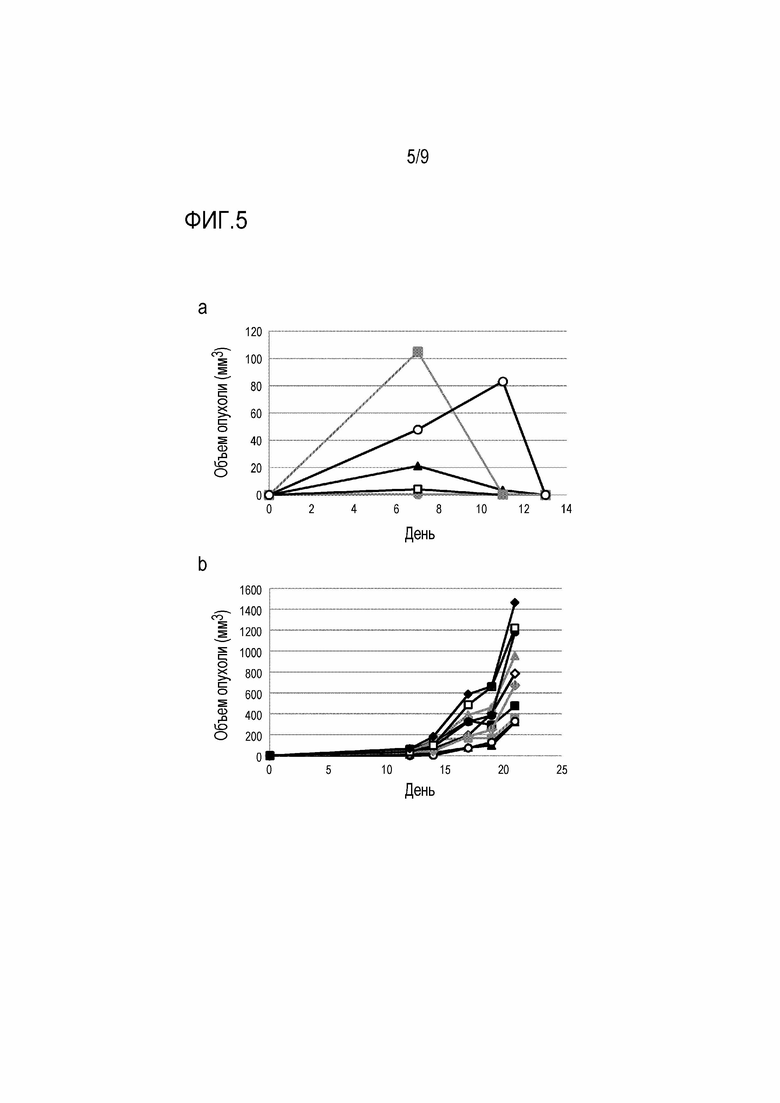
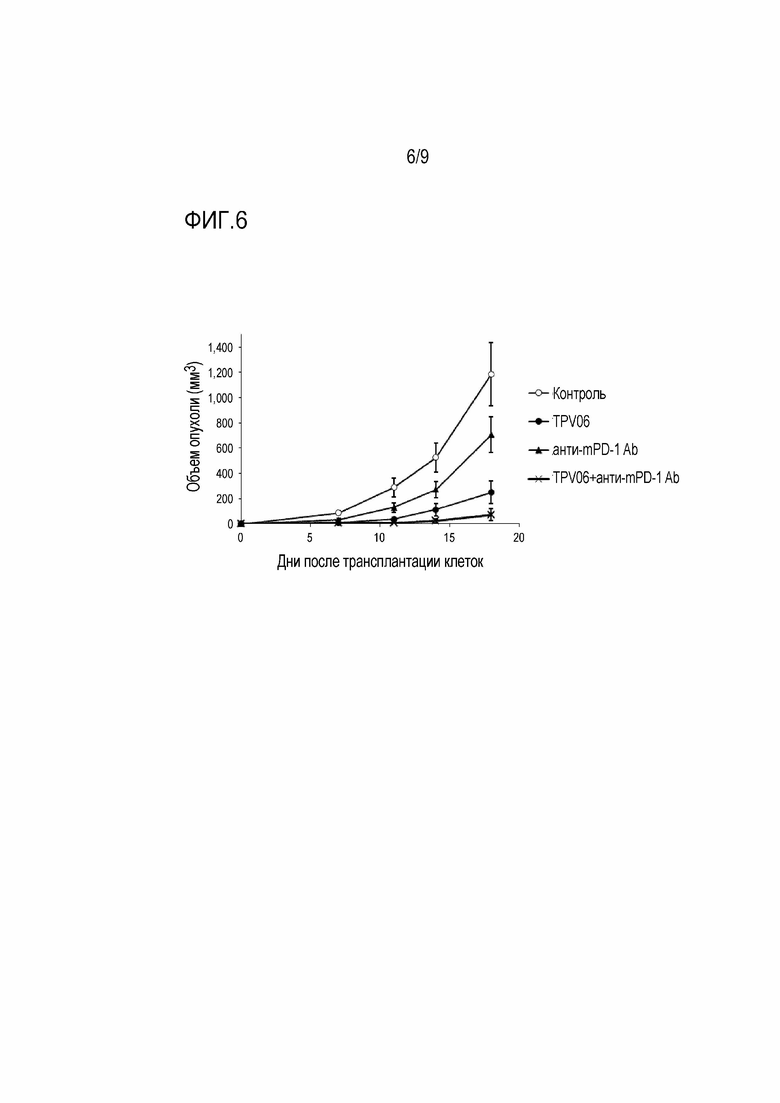
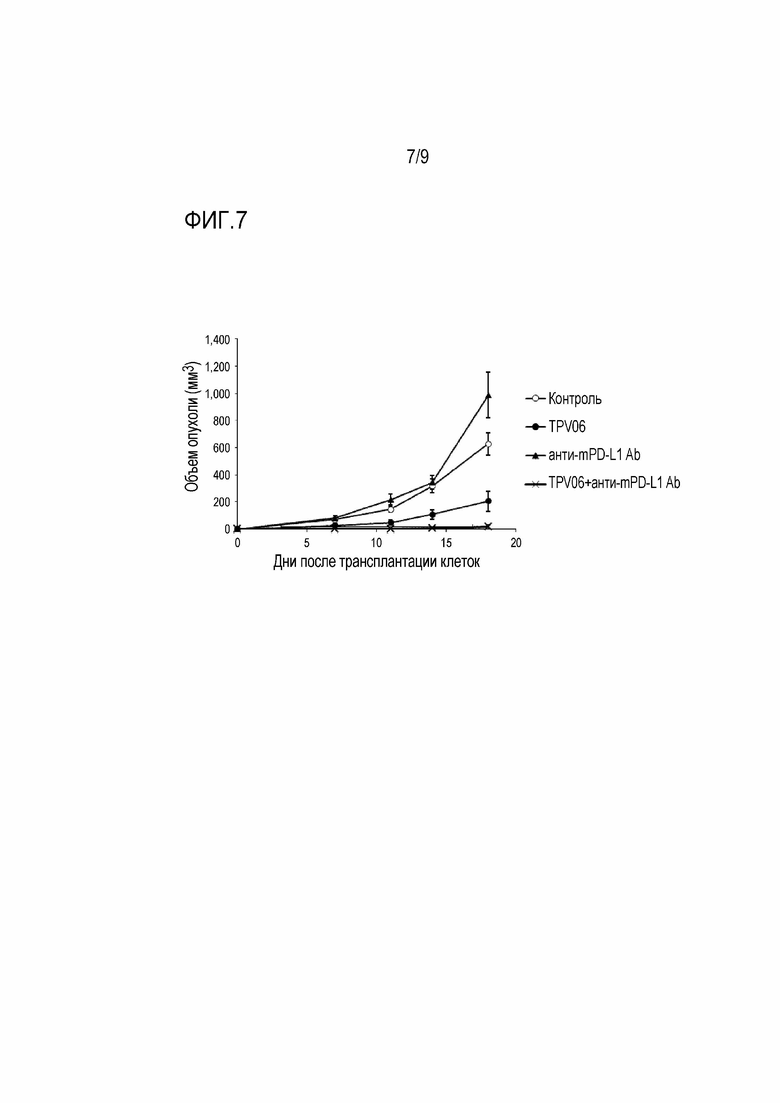
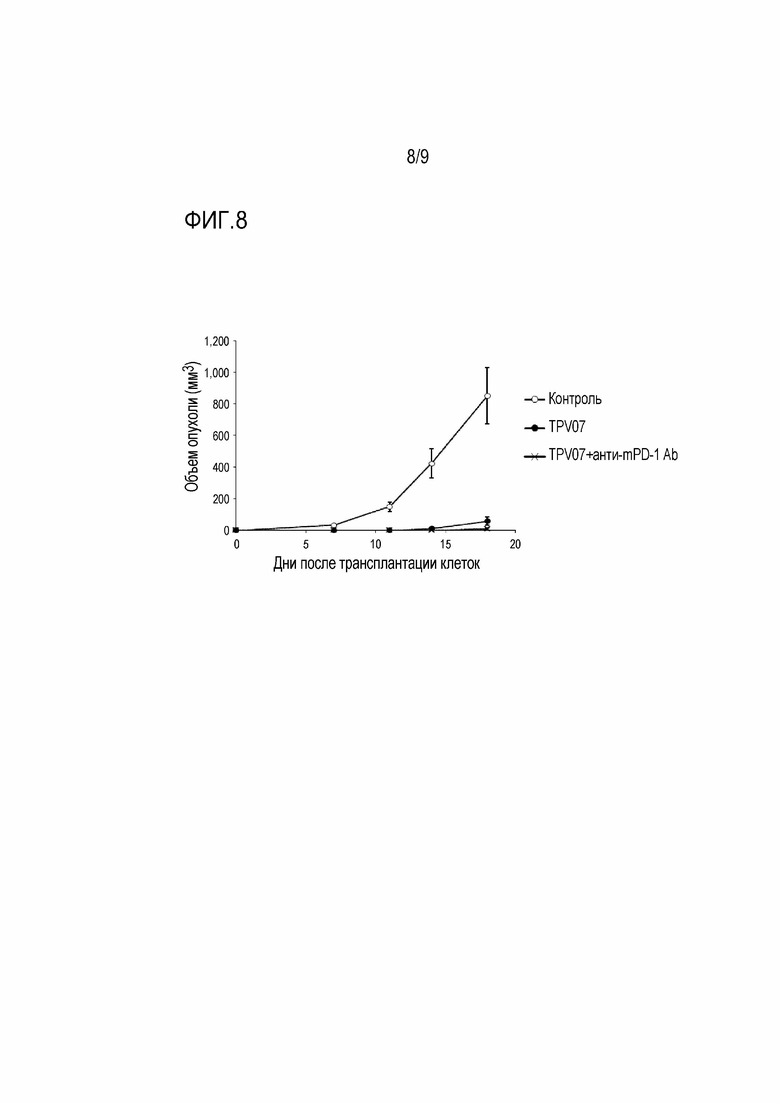
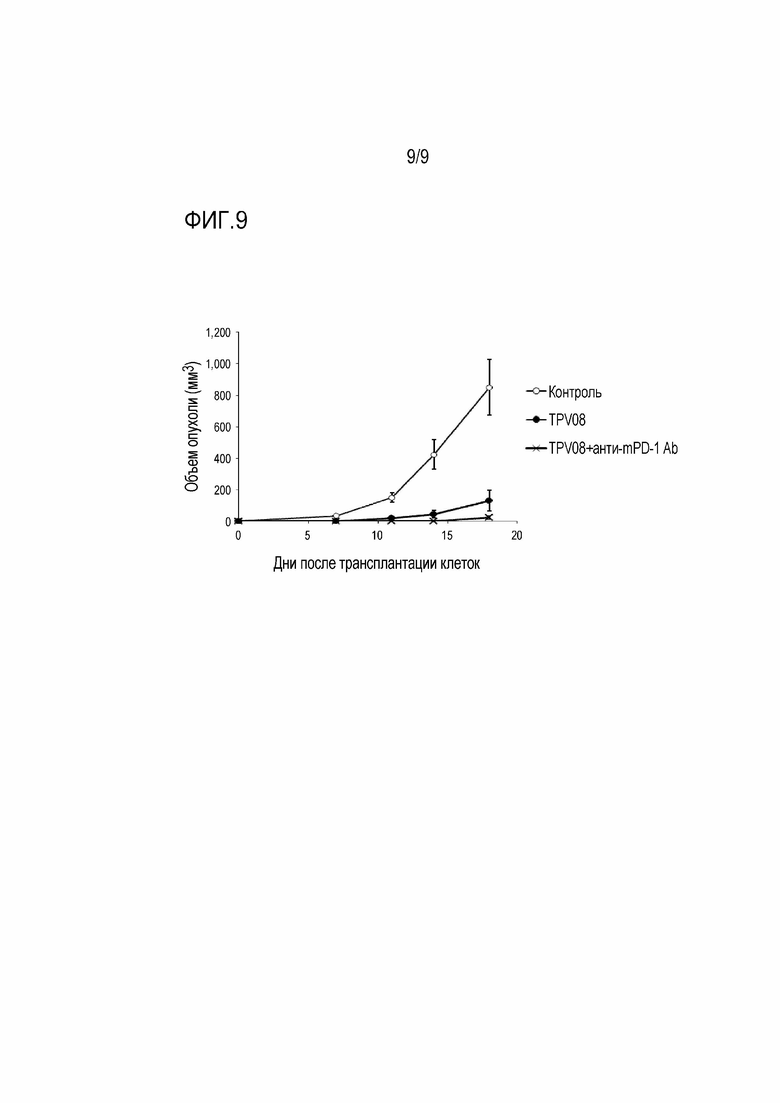
Изобретение относится к области биотехнологии. Представлено противоопухолевое средство, содержащее пептид, имеющий 4 связанных эпитопа, содержащий 4 CTL эпитопных пептида, связанных через линкеры, и антагонист пути PD-1, в качестве активных ингредиентов. Также предложены варианты применения указанного средства для лечения онкологического пациента. Раскрыт способ оценки противоопухолевого действия пептида, имеющего 4 связанных эпитопа, и антагониста пути PD-1 с применением клетки, в которую введен полинуклеотид, кодирующий эпитопный пептид человеческого опухолевого антигена, полученный из SART2, и полинуклеотид, кодирующий α1 и α2 области человеческого HLA-A24. Изобретение обеспечивает новый способ лечения рака, который демонстрирует превосходное противоопухолевое действие и вызывает меньше побочных реакций. 8 н. и 32 з.п. ф-лы, 9 ил., 7 табл., 7 пр.
1. Применение пептида, имеющего 4 связанных эпитопа, в качестве активного ингредиента для лечения онкологического пациента в комбинации с антагонистом пути PD-1,
где антагонист пути PD-1 представляет собой по меньшей мере один, выбранный из группы, состоящей из анти-PD-1 антитела, анти-PD-L1 антитела и анти-PD-L2 антитела,
где
пептид, имеющий 4 связанных эпитопа, содержит:
эпитопный пептид, такой как показан в SEQ ID NO: 5, эпитопный пептид, такой как показан в SEQ ID NO: 6, эпитопный пептид, такой как показан в SEQ ID NO: 9, и один эпитопный пептид, выбранный из группы, состоящей из эпитопного пептида, такого как показан в SEQ ID NO: 2, эпитопного пептида, такого как показан в SEQ ID NO: 4, и эпитопного пептида, такого как показан в SEQ ID NO: 10, на С-конце,
которые связаны через линкеры, где пептид, имеющий 4 связанных эпитопа, необязательно дополнительно содержит пептидную последовательность, состоящую из гидрофильных аминокислот, где линкером является аргининовый димер, состоящий из двух аргининовых остатков, связанных друг с другом,
где пептидная последовательность, состоящая из гидрофильных аминокислот, связана с N-концом и состоит из аргининового тримера, состоящего из трех аргининовых остатков, связанных друг с другом, или аргининового тетрамера, состоящего из четырех аргининовых остатков, связанных друг с другом.
2. Применение по п. 1, где пептид, имеющий 4 связанных эпитопа, необязательно дополнительно содержит пептидную последовательность, состоящую из гидрофильных аминокислот, и где пептид, имеющий 4 связанных эпитопа, состоит из последовательности, выбранной из следующих последовательностей:
SEQ ID NO: 5-(L)-SEQ ID NO: 9-(L)-SEQ ID NO: 6-(L)-SEQ ID NO: 4;
SEQ ID NO: 5-(L)-SEQ ID NO: 9-(L)-SEQ ID NO: 6-(L)-SEQ ID NO: 2; и
SEQ ID NO: 5-(L)-SEQ ID NO: 9-(L)-SEQ ID NO: 6-(L)-SEQ ID NO: 10, где
"(L)" представляет линкер.
3. Применение по п. 1, где пептид, имеющий 4 связанных эпитопа, является таким, как показан в SEQ ID NO: 24, SEQ ID NO: 25 или SEQ ID NO: 26.
4. Применение по п. 1, где антагонистом пути PD-1 является, по меньшей мере, один, выбранный из группы, состоящей из анти-PD-1 антитела и анти-PD-L1 антитела.
5. Применение по п. 1, где анти-PD-1 антителом является ниволумаб или пембролизумаб, и анти-PD-L1 антителом является атезолизумаб, дурвалумаб или авелумаб.
6. Применение антагониста пути PD-1 в качестве активного ингредиента для лечения онкологического пациента в комбинации с пептидом, имеющим 4 связанных эпитопа,
где антагонист пути PD-1 представляет собой по меньшей мере один, выбранный из группы, состоящей из анти-PD-1 антитела, анти-PD-L1 антитела и анти-PD-L2 антитела,
где пептид, имеющий 4 связанных эпитопа, содержит:
эпитопный пептид, такой как показан в SEQ ID NO: 5, и
эпитопный пептид, такой как показан в SEQ ID NO: 6, эпитопный пептид, такой как показан в SEQ ID NO: 9, и один эпитопный пептид, выбранный из группы, состоящей из эпитопного пептида, такого как показан в SEQ ID NO: 2, эпитопного пептида, такого как показан в SEQ ID NO: 4, иэпитопного пептида, такого как показан в SEQ ID NO: 10, на С-конце,
которые связаны через линкеры, где пептид, имеющий 4 связанных эпитопа, необязательно дополнительно содержит пептидную последовательность, состоящую из гидрофильных аминокислот,
где линкером является аргининовый димер, состоящий из двух аргининовых остатков, связанных друг с другом,
где пептидная последовательность, состоящая из гидрофильных аминокислот, связана с N-концом и состоит из аргининового тримера, состоящего из трех аргининовых остатков, связанных друг с другом, или аргининового тетрамера, состоящего из четырех аргининовых остатков, связанных друг с другом.
7. Применение по п. 6, где пептид, имеющий 4 связанных эпитопа, необязательно дополнительно содержит пептидную последовательность, состоящую из гидрофильных аминокислот, и где пептид, имеющий 4 связанных эпитопа, состоит из последовательности, выбранной из следующих последовательностей:
SEQ ID NO: 5-(L)-SEQ ID NO: 9-(L)-SEQ ID NO: 6-(L)-SEQ ID NO: 4;
SEQ ID NO: 5-(L)-SEQ ID NO: 9-(L)-SEQ ID NO: 6-(L)-SEQ ID NO: 2; и
SEQ ID NO: 5-(L)-SEQ ID NO: 9-(L)-SEQ ID NO: 6-(L)-SEQ ID NO: 10, где
"(L)" представляет линкер.
8. Применение по п. 6, где пептид, имеющий 4 связанных эпитопа, является таким, как показан в SEQ ID NO: 24, SEQ ID NO: 25 или SEQ ID NO: 26.
9. Применение по п. 6, где антагонистом пути PD-1 является, по меньшей мере, один, выбранный из группы, состоящей из анти-PD-1 антитела и анти-PD-L1 антитела.
10. Применение по п. 6, где анти-PD-1 антителом является ниволумаб или пембролизумаб, и анти-PD-L1 антителом является атезолизумаб, дурвалумаб или авелумаб.
11. Объединенный состав для лечения онкологического пациента, содержащий пептид, имеющий 4 связанных эпитопа, и антагонист пути PD-1, где антагонист пути PD-1 представляет собой по меньшей мере один, выбранный из группы, состоящей из анти-PD-1 антитела, анти-PD-L1 антитела и анти-PD-L2 антитела, где
пептид, имеющий 4 связанных эпитопа, содержит:
эпитопный пептид, такой как показан в SEQ ID NO: 5, эпитопный пептид, такой как показан в SEQ ID NO: 6, эпитопный пептид, такой как показан в SEQ ID NO: 9, и один эпитопный пептид, выбранный из группы, состоящей из эпитопного пептида, такого как показан в SEQ ID NO: 2, эпитопного пептида, такого как показан в SEQ ID NO: 4, и эпитопного пептида, такого как показан в SEQ ID NO: 10, на С-конце,
которые связаны через линкеры, где пептид, имеющий 4 связанных эпитопа, необязательно дополнительно содержит пептидную последовательность, состоящую из гидрофильных аминокислот,
где линкером является аргининовый димер, состоящий из двух аргининовых остатков, связанных друг с другом,
где пептидная последовательность, состоящая из гидрофильных аминокислот, связана с N-концом и состоит из аргининового тримера, состоящего из трех аргининовых остатков, связанных друг с другом, или аргининового тетрамера, состоящего из четырех аргининовых остатков, связанных друг с другом.
12. Объединенный состав по п. 11, где пептид, имеющий 4 связанных эпитопа, необязательно дополнительно содержит пептидную последовательность, состоящую из гидрофильных аминокислот, и где пептид, имеющий 4 связанных эпитопа, состоит из последовательности, выбранной из следующих последовательностей:
SEQ ID NO: 5-(L)-SEQ ID NO: 9-(L)-SEQ ID NO: 6-(L)-SEQ ID NO: 4;
SEQ ID NO: 5-(L)-SEQ ID NO: 9-(L)-SEQ ID NO: 6-(L)-SEQ ID NO: 2; и
SEQ ID NO: 5-(L)-SEQ ID NO: 9-(L)-SEQ ID NO: 6-(L)-SEQ ID NO: 10, где
"(L)" представляет линкер.
13. Объединенный состав по п. 11, где пептид, имеющий 4 связанных эпитопа, является таким, как показан в SEQ ID NO: 24, SEQ ID NO: 25 или SEQ ID NO: 26.
14. Объединенный состав по п. 11, где антагонистом пути PD-1 является, по меньшей мере, один, выбранный из группы, состоящей из анти-PD-1 антитела и анти-PD-L1 антитела.
15. Объединенный состав по п. 11, где анти-PD-1 антителом является ниволумаб или пембролизумаб, и анти-PD-L1 антителом является атезолизумаб, дурвалумаб или авелумаб.
16. Усилитель противоопухолевого действия для усиления противоопухолевого действия антагониста пути PD-1, содержащий пептид, имеющий 4 связанных эпитопа, в качестве активного ингредиента, где антагонист пути PD-1 представляет собой по меньшей мере один, выбранный из группы, состоящей из анти-PD-1 антитела, анти-PD-L1 антитела и анти-PD-L2 антитела,
где пептид, имеющий 4 связанных эпитопа, содержит:
эпитопный пептид, такой как показан в SEQ ID NO: 5, и
эпитопный пептид, такой как показан в SEQ ID NO: 6, эпитопный пептид, такой как показан в SEQ ID NO: 9, и один эпитопный пептид, выбранный из группы, состоящей из эпитопного пептида, такого как показан в SEQ ID NO: 2, эпитопного пептида, такого как показан в SEQ ID NO: 4, и эпитопного пептида, такого как показан в SEQ ID NO: 10, на С-конце,
которые связаны через линкеры, где пептид, имеющий 4 связанных эпитопа, необязательно дополнительно содержит пептидную последовательность, состоящую из гидрофильных аминокислот,
где линкером является аргининовый димер, состоящий из двух аргининовых остатков, связанных друг с другом,
где пептидная последовательность, состоящая из гидрофильных аминокислот, связана с N-концом и состоит из аргининового тримера, состоящего из трех аргининовых остатков, связанных друг с другом, или аргининового тетрамера, состоящего из четырех аргининовых остатков, связанных друг с другом.
17. Усилитель противоопухолевого действия по п. 16, где пептид, имеющий 4 связанных эпитопа, необязательно дополнительно содержит пептидную последовательность, состоящую из гидрофильных аминокислот, и где пептид, имеющий 4 связанных эпитопа, состоит из последовательности, выбранной из следующих последовательностей:
SEQ ID NO: 5-(L)-SEQ ID NO: 9-(L)-SEQ ID NO: 6-(L)-SEQ ID NO: 4;
SEQ ID NO: 5-(L)-SEQ ID NO: 9-(L)-SEQ ID NO: 6-(L)-SEQ ID NO: 2; и
SEQ ID NO: 5-(L)-SEQ ID NO: 9-(L)-SEQ ID NO: 6-(L)-SEQ ID NO: 10, где
"(L)" представляет линкер.
18. Усилитель противоопухолевого действия по п. 16, где пептид, имеющий 4 связанных эпитопа, является таким, как показан в SEQ ID NO: 24, SEQ ID NO: 25 или SEQ ID NO: 26.
19. Усилитель противоопухолевого действия по п. 16, где антагонистом пути PD-1 является, по меньшей мере, один, выбранный из группы, состоящей из анти-PD-1 антитела и анти-PD-L1 антитела.
20. Усилитель противоопухолевого действия по п. 16, где анти-PD-1 антителом является ниволумаб или пембролизумаб, и анти-PD-L1 антителом является атезолизумаб, дурвалумаб или авелумаб.
21. Противоопухолевое средство, содержащее пептид, имеющий 4 связанных эпитопа, содержащий 4 CTL эпитопных пептида, связанных через линкеры, и антагонист пути PD-1, в качестве активных ингредиентов,
где антагонист пути PD-1 представляет собой по меньшей мере один, выбранный из группы, состоящей из анти-PD-1 антитела, анти-PD-L1 антитела и анти-PD-L2 антитела,
где пептид, имеющий 4 связанных эпитопа, содержит:
эпитопный пептид, такой как показан в SEQ ID NO: 5, эпитопный пептид, такой как показан в SEQ ID NO: 6, эпитопный пептид, такой как показан в SEQ ID NO: 9, и один эпитопный пептид, выбранный из группы, состоящей из эпитопного пептида, такого как показан в SEQ ID NO: 2, эпитопного пептида, такого как показан в SEQ ID NO: 4, и эпитопного пептида, такого как показан в SEQ ID NO: 10, на С-конце,
которые связаны через линкеры, где пептид, имеющий 4 связанных эпитопа, необязательно дополнительно содержит пептидную последовательность, состоящую из гидрофильных аминокислот,
где линкером является аргининовый димер, состоящий из двух аргининовых остатков, связанных друг с другом,
где пептидная последовательность, состоящая из гидрофильных аминокислот, связана с N-концом и состоит из аргининового тримера, состоящего из трех аргининовых остатков, связанных друг с другом, или аргининового тетрамера, состоящего из четырех аргининовых остатков, связанных друг с другом.
22. Противоопухолевое средство по п. 21, где пептид, имеющий 4 связанных эпитопа, необязательно дополнительно содержит пептидную последовательность, состоящую из гидрофильных аминокислот, и где пептид, имеющий 4 связанных эпитопа, состоит из последовательности, выбранной из следующих последовательностей:
SEQ ID NO: 5-(L)-SEQ ID NO: 9-(L)-SEQ ID NO: 6-(L)-SEQ ID NO: 4;
SEQ ID NO: 5-(L)-SEQ ID NO: 9-(L)-SEQ ID NO: 6-(L)-SEQ ID NO: 2; и
SEQ ID NO: 5-(L)-SEQ ID NO: 9-(L)-SEQ ID NO: 6-(L)-SEQ ID NO: 10, где
"(L)" представляет линкер.
23. Противоопухолевое средство по п. 21, где пептид, имеющий 4 связанных эпитопа, является таким, как показан в SEQ ID NO: 24, SEQ ID NO: 25 или SEQ ID NO: 26.
24. Противоопухолевое средство по п. 21, где антагонистом пути PD-1 является, по меньшей мере, один, выбранный из группы, состоящей из анти-PD-1 антитела и анти-PD-L1 антитела.
25. Противоопухолевое средство по п. 21, где анти-PD-1 антителом является ниволумаб или пембролизумаб, и анти-PD-L1 антителом является атезолизумаб, дурвалумаб или авелумаб.
26. Набор состава для лечения онкологического пациента, содержащий пептид, имеющий 4 связанных эпитопа, в комбинации с антагонистом пути PD-1, и инструкцию по применению,
где антагонист пути PD-1 представляет собой по меньшей мере один, выбранный из группы, состоящей из анти-PD-1 антитела, анти-PD-L1 антитела и анти-PD-L2 антитела,
где пептид, имеющий 4 связанных эпитопа, содержит:
эпитопный пептид, такой как показан в SEQ ID NO: 5, эпитопный пептид, такой как показан в SEQ ID NO: 6, эпитопный пептид, такой как показан в SEQ ID NO: 9, и один эпитопный пептид, выбранный из группы, состоящей из эпитопного пептида, такого как показан в SEQ ID NO: 2, эпитопного пептида, такого как показан в SEQ ID NO: 4, и
эпитопного пептида, такого как показан в SEQ ID NO: 10 (PEP10), на С-конце,
которые связаны через линкеры, где пептид, имеющий 4 связанных эпитопа, необязательно дополнительно содержит пептидную последовательность, состоящую из гидрофильных аминокислот,
где линкером является аргининовый димер, состоящий из двух аргининовых остатков, связанных друг с другом,
где пептидная последовательность, состоящая из гидрофильных аминокислот, связана с N-концом и состоит из аргининового тримера, состоящего из трех аргининовых остатков, связанных друг с другом, или аргининового тетрамера, состоящего из четырех аргининовых остатков, связанных друг с другом.
27. Набор состава по п. 26, где пептид, имеющий 4 связанных эпитопа, необязательно дополнительно содержит пептидную последовательность, состоящую из гидрофильных аминокислот, и где пептид, имеющий 4 связанных эпитопа, состоит из последовательности, выбранной из следующих последовательностей:
SEQ ID NO: 5-(L)-SEQ ID NO: 9-(L)-SEQ ID NO: 6-(L)-SEQ ID NO: 4;
SEQ ID NO: 5-(L)-SEQ ID NO: 9-(L)-SEQ ID NO: 6-(L)-SEQ ID NO: 2; и
SEQ ID NO: 5-(L)-SEQ ID NO: 9-(L)-SEQ ID NO: 6-(L)-SEQ ID NO: 10, где
"(L)" представляет линкер.
28. Набор состава по п. 26, где пептид, имеющий 4 связанных эпитопа, является таким, как показан в SEQ ID NO: 24, SEQ ID NO: 25 или SEQ ID NO: 26.
29. Набор состава по п. 26, где антагонистом пути PD-1 является, по меньшей мере, один, выбранный из группы, состоящей из анти-PD-1 антитела и анти-PD-L1 антитела.
30. Набор состава по п. 26, где анти-PD-1 антителом является ниволумаб или пембролизумаб, и анти-PD-L1 антителом является атезолизумаб, дурвалумаб или авелумаб.
31. Способ оценки противоопухолевого действия пептида, имеющего 4 связанных эпитопа, и антагониста пути PD-1 с применением клетки, в которую введен полинуклеотид, кодирующий эпитопный пептид человеческого опухолевого антигена, полученный из SART2, и полинуклеотид, кодирующий α1 и α2 области человеческого HLA-A24, включающий следующие стадии (I) и (II):
(I) введение пептида, имеющего 4 связанных эпитопа и антагониста пути PD-1 не иммунодефицитному отличному от человека животному с нокином человеческого HLA-A24 гена; и
(II) трансплантацию клетки не иммунодефицитному отличному от человека животному с нокином человеческого HLA-A24 гена,
где антагонист пути PD-1 представляет собой по меньшей мере один, выбранный из группы, состоящей из анти-PD-1 антитела, анти-PD-L1 антитела и анти-PD-L2 антитела,
где пептид, имеющий 4 связанных эпитопа, содержит
эпитопный пептид, такой как показан в SEQ ID NO: 5, эпитопный пептид, такой как показан в SEQ ID NO: 6, эпитопный пептид, такой как показан в SEQ ID NO: 9,
и один эпитопный пептид, выбранный из группы, состоящей из эпитопного пептида, такого как показан в SEQ ID NO: 2, эпитопного пептида, такого как показан в SEQ ID NO: 4, и
эпитопного пептида, такого как показан в SEQ ID NO: 10, на С-конце,
которые связаны через линкеры, где пептид, имеющий 4 связанных эпитопа, необязательно дополнительно содержит пептидную последовательность, состоящую из гидрофильных аминокислот,
где линкером является аргининовый димер, состоящий из двух аргининовых остатков, связанных друг с другом,
где пептидная последовательность, состоящая из гидрофильных аминокислот, связана с N-концом и состоит из аргининового тримера, состоящего из трех аргининовых остатков, связанных друг с другом, или аргининового тетрамера, состоящего из четырех аргининовых остатков, связанных друг с другом.
32. Способ по п. 31, где пептид, имеющий 4 связанных эпитопа, необязательно дополнительно содержит пептидную последовательность, состоящую из гидрофильных аминокислот, и где пептид, имеющий 4 связанных эпитопа, состоит из последовательности, выбранной из следующих последовательностей:
SEQ ID NO: 5-(L)-SEQ ID NO: 9-(L)-SEQ ID NO: 6-(L)-SEQ ID NO: 4;
SEQ ID NO: 5-(L)-SEQ ID NO: 9-(L)-SEQ ID NO: 6-(L)-SEQ ID NO: 2; и
SEQ ID NO: 5-(L)-SEQ ID NO: 9-(L)-SEQ ID NO: 6-(L)-SEQ ID NO: 10, где
"(L)" представляет линкер.
33. Способ по п. 31, где пептид, имеющий 4 связанных эпитопа, является таким, как показан в SEQ ID NO: 24, SEQ ID NO: 25 или SEQ ID NO: 26.
34. Способ по п. 31, где антагонистом пути PD-1 является, по меньшей мере, один, выбранный из группы, состоящей из анти-PD-1 антитела и анти-PD-L1 антитела.
35. Способ по п. 31, где анти-PD-1 антителом является ниволумаб или пембролизумаб, и анти-PD-L1 антителом является атезолизумаб, дурвалумаб или авелумаб.
36. Способ лечения опухоли, включающий введение пептида, имеющего 4 связанных эпитопа, и антагониста пути PD-1 одновременно, последовательно или раздельно,
где антагонист пути PD-1 представляет собой по меньшей мере один, выбранный из группы, состоящей из анти-PD-1 антитела, анти-PD-L1 антитела и анти-PD-L2 антитела,
где пептид, имеющий 4 связанных эпитопа, содержит:
эпитопный пептид, такой как показан в SEQ ID NO: 5, эпитопный пептид, такой как показан в SEQ ID NO: 6, эпитопный пептид, такой как показан в SEQ ID NO: 9, и
один эпитопный пептид, выбранный из группы, состоящей из эпитопного пептида, такого как показан в SEQ ID NO: 2, эпитопного пептида, такого как показан в SEQ ID NO: 4, и эпитопного пептида, такого как показан в SEQ ID NO: 10, на С-конце,
которые связаны через линкеры, где пептид, имеющий 4 связанных эпитопа, необязательно дополнительно содержит пептидную последовательность, состоящую из гидрофильных аминокислот, где линкером является аргининовый димер, состоящий из двух аргининовых остатков, связанных друг с другом,
где пептидная последовательность, состоящая из гидрофильных аминокислот, связана с N-концом и состоит из аргининового тримера, состоящего из трех аргининовых остатков, связанных друг с другом, или аргининового тетрамера, состоящего из четырех аргининовых остатков, связанных друг с другом.
37. Способ по п. 36, где пептид, имеющий 4 связанных эпитопа, необязательно дополнительно содержит пептидную последовательность, состоящую из гидрофильных аминокислот, и где пептид, имеющий 4 связанных эпитопа, состоит из последовательности, выбранной из следующих последовательностей:
SEQ ID NO: 5-(L)-SEQ ID NO: 9-(L)-SEQ ID NO: 6-(L)-SEQ ID NO: 4;
SEQ ID NO: 5-(L)-SEQ ID NO: 9-(L)-SEQ ID NO: 6-(L)-SEQ ID NO: 2; и
SEQ ID NO: 5-(L)-SEQ ID NO: 9-(L)-SEQ ID NO: 6-(L)-SEQ ID NO: 10, где "(L)" представляет линкер.
38. Способ по п. 36, где пептид, имеющий 4 связанных эпитопа, является таким, как показан в SEQ ID NO: 24, SEQ ID NO: 25 или SEQ ID NO: 26.
39. Применение по п. 36, где антагонистом пути PD-1 является, по меньшей мере, один, выбранный из группы, состоящей из анти-PD-1 антитела и анти-PD-L1 антитела.
40. Применение по п. 36, где анти-PD-1 антителом является ниволумаб или пембролизумаб, и анти-PD-L1 антителом является атезолизумаб, дурвалумаб или авелумаб.
| WO 2015060235 A1, 30.04.2015 | |||
| WO 2017207814 A1, 07.12.2017 | |||
| SCHNEBLE E | |||
| et al., Peptide-Based Cancer Vaccine Strategies and Clinical Results, Methods in Molecular Biology, 2016, vol.1403, pp.797-817 | |||
| ПОЛИПЕПТИДЫ | 2011 |
|
RU2581800C2 |
Авторы
Даты
2023-09-07—Публикация
2019-06-28—Подача