Изобретение относится к медицине, и может найти применение в комбустиологии, травматологии, пластической хирургии, косметологии и других областях медицины в качестве средства для изоляции полости раны от внешней среды и стимуляции репаративной регенерации ткани.
Повреждение кожных покровов, в результате воздействия механических, физических или химических факторов, а также хронические раны могут вызвать тяжелые осложнения вплоть до летальных. Для повышения эффективности лечения ран ведется поиск новых технологий лечения, в том числе с использованием раневых покрытий с заданными функциональными качествами, такими как: гипоаллергенность, отсутствие токсического и местного раздражающего действия, атравматичность при использовании и замене, поддержание микросреды (рН, влажность, тепло и т.д.), защита от экзогенного инфицирования и др.
Известно раневое покрытие на основе коллаген-хитозанового комплекса для лечения ран [патент RU 2254145 C1, 20.06.2005], содержащее хитозан, хондроитинсерную кислоту, гиалуроновую кислоту, гепарин и сывороточный фактор роста крупного рогатого скота; изделие может использоваться в виде губки, геля, коллоидного раствора и пленки.
Известна композиция для лечения ран [RU 2467767 C1, 27.11.2012], изготовленная из природных биополимеров, представляющая собой полиэлектролитный белково-полисахаридный комплекс, ковалентно сшитый полифункциональными альдегидами или эпоксисоединениями, содержащий коллаген I типа и соли хитозония.
Известна композиция для местного лечения плоских ран [патент RU 2370270 C1, 20.10.2009], включающая сшитую глутаровым альдегидом смесь растворов ацетата коллагена и ацетата хитозана в соотношении 1:3, содержащую поверхностно-активное вещество Твин-80.
Известна медицинская повязка для защиты раневой поверхности [заявка на изобретение CN 1775301 А, 24.05.2006], представляющая собой композитное перевязочное средство, включающее пористую основу из полимерной пленки (поливинилхлоридной, полиэтиленовой, полипропиленовой, полиуретановой и др.). Повязка обладает барьерными свойствами в отношении экзогенной микрофлоры, обеспечивает транспорт водорастворимых веществ, в том числе лекарственных препаратов (трипсин, пепсин, антибиотики, анестетики).
Известен биопластический материал [RU 2722744 C1, 03.06.2020], содержащий биологически активные компоненты, который обеспечивает биологическую совместимость с тканями, повышает пролиферативный потенциал клеток, позволяет добиться органоспецифического восстановления ткани и может быть использован в качестве биологически активного материала для стимуляции регенерации и замещения дефектов покровных тканей.
Известно перевязочное средство [RU 2717312 С1, 20.03.2020], выполненное в виде полимерной пленки, которая плотно прикрепляется к раневой поверхности с возможностью равномерного проникновения через нее влаги, водорастворимых веществ и газов, но препятствует проникновению в рану микроорганизмов.
Среди преимуществ известных изделий из природных полимеров можно отметить их высокую биосовместимость, биорезорбируемость, пластичность, механическую совместимость с мягкими тканями, атравматичность. Однако такие изделия имеют и свои функциональные ограничения. Например, биологически активные материалы на основе природных полимеров при контакте с биологическими жидкостями раневой полости быстро теряют свою механическую прочность и разрушаются, тем самым нарушают изоляцию раны, способствуют ее высушиванию и воздействию патогенной микрофлоры на рану. При этом Wong, C. с соавторами считают, что для успешной регенерации биологически активный материал не должен подвергаться физическим и механическим воздействиям как минимум 4-6 недель [Wong, C.; Yoganarasimha, S.; Carrico, C.; Madurantakam, P. Incorporation of Fibrin Matrix into Electrospun Membranes for Periodontal Wound Healing. Bioengineering 2019, 6, 57].
Кроме того, для стабилизации биополимеров зачастую используются соединения (альдегиды, эпоксиды), ингибирующие жизнеспособность и пролиферативную активность клеток, участвующих в репаративном процессе.
Синтетические полимеры, используемые для регенерации тканей, с одной стороны, имеют предсказуемые и хорошо воспроизводимые механические и физические свойства (например, прочность на растяжение, модуль упругости, скорость деградации) и могут быть изготовлены с большой точностью. С другой стороны, они могут вызывать стойкие воспалительные реакции и обладают низкой биосовместимостью. Как правило, синтетические материалы менее дорогие, чем материалы природного происхождения, из них легко формировать трехмерные структуры, что делает их привлекательными для использования в качестве матрикса [Насонова М.В. и др. Перспективы переработки полимеров методом электроформования для биомедицины. Разработка и регистрация лекарственных средств, N2(11), 2015, с.112-120].
Для преодоления указанных недостатков широко используется комбинация синтетических полимеров с природными полимерами [Blessing Atim Aderibigbe, Hybrid-Based Wound Dressings: Combination of Synthetic and Biopolymers, Polymers (Basel). 2022 Sep 12;14(18):3806]. Комбинация обоих полимеров в конструкции раневых повязок приводит к получению раневых повязок с новыми свойствами. Такие раневые повязки обладают улучшенными характеристиками, такими как атравматичность, регулируемые механические свойства, биосовместимость, биоразлагаемость, высокая адсорбционная способность и т. д. Они также могут использоваться для лечения сильно экссудирующих, кровоточащих и инфицированных ран. Включение биологически активных веществ в биокомпозитные раневые покрытия позволяет создавать материалы, стимулирующие заживление ран и регенерацию кожи.
Так, существуют композитные раневые повязки в виде пены. Они обладают высокой биосовместимостью, кровоостанавливающими и антибактериальными свойствами. Недостатком таких изделий является их высокая элиминация из раневой полости и слабая абсорбирующая способность в отношении раневых экссудатов.
Кроме того, многие раневые повязки содержат антибиотики, что может вызвать различные осложнения. Постоянное использование противомикробных препаратов может индуцировать селекцию и распространение полирезистентных штаммов бактерий, что представляет серьезную угрозу для здоровья человека [Blessing Atim Aderibigbe, Hybrid-Based Wound Dressings: Combination of Synthetic and Biopolymers, Polymers (Basel). 2022 Sep 12;14(18):3806].
Известны композитные раневые повязки на основе желатина [Sindi P. Ndlovu et al.Gelatin-Based Hybrid Scaffolds: Promising Wound Dressings, Polymers (Basel). 2021 Sep; 13(17): 2959], которые способствуют ускоренному заживлению ран, а также обладают улучшенными эксплуатационными качествами, такими как умеренная скорость прохождения водяного пара, высокая пористость, высокое водопоглощение и способность к набуханию, хорошая биосовместимость. Однако применение только желатина для разработки раневых повязок сдерживается его плохой антибактериальной активностью, чрезмерной иммуногенностью и слабыми механическими свойствами.
Известен материал [заявка US20200405656A1], который представляет собой многослойный композитный материал, состоящий из: а) трехмерной матрицы, содержащей, как минимум два слоя: первый из полиэфирного волокна, второй слой из натуральных, синтетических или композитных полимеров. Технология изготовления изделия заключается в наложении двух материалов друг на друга и скрепления между собой в нескольких точках. Отмечается, что изделие может служить носителем для лекарственных препаратов и биологически активных соединений. Авторы определяют область применения изделия в качестве раневого покрытия для лечения ран, ссадин, порезов, язв, ожогов, повреждений или разрывов кожи у субъекта, при котором указанная обработка включает нанесение указанного многослойного композиционный материал на поверхности раны. Такой многослойный композитный материал обладает хорошей биосовместимостью и выгодными медико-биологическими качествами. К недостаткам можно отнести сложный метод крепления слоев, подразумевающий использование ультразвукового оборудования.
При этом по-прежнему существует потребность в удобных, доступных и эффективных биологически активных материалах для изоляции раневой поверхности.
В качестве ближайшего аналога (прототипа) предлагаемого изобретения может быть рассмотрен биопластический материал [RU 2722744 C1, 03.06.2020], состоящий из внеклеточного матрикса, обогащенного композицией, содержащей коллаген I типа, гиалуроновую кислоту, эластин и биологически активные соединения. Известный материал обеспечивает биологическую совместимость с тканями, повышает пролиферативный потенциал клеток, позволяет добиться органоспецифического восстановления ткани и может быть использован в качестве биологически активного материала для стимуляции регенерации и замещения дефектов покровных тканей.
Для увеличения периода биодеструкции заявленного материала было решено совместить биопластический пористый материал с основой из нетканного материала с применением гипоаллергенного синтетического акрилатного клея с атравматической сорбционной подушечкой из вискозы, покрытой полиэтиленовой сеткой, стерилизованной оксидом этилена.
Техническим результатом предложенного изобретения является улучшение эксплуатационных и функциональных свойств биологически активного материала, за счет увеличения периода биодеструкции биологически активного материала в солевых растворах, имитирующих кислотность раневого ложа при остром и хроническом воспалении, а также увеличения количества адгезированных фибробластов в кислой среде и снижения хрупкости материала.
Для достижения данного технического результата используют биологически активный материал для покрытия раневой поверхности, который включает биопластический пористый материал, состоящий из внеклеточного матрикса обогащенного композицией, содержащей коллаген I типа, гиалуроновую кислоту, эластин и культивированные неонатальные фибробласты человека в среде DMEM с добавлением FBS, L-глутамина, пенициллина, стрептомицина [RU 2722744 C1, 03.06.2020], в процентном соотношении компонентов исходной смеси, мас.%: коллаген I типа 70-85, гиалуроновая кислота 10-15, эластин 1-15, культивированные неонатальные фибробласты человека 3-5. Кроме того, биологически активный материал дополнительно включает основу, стерилизованную оксидом этилена, из нетканного материала с применением гипоаллергенного синтетического акрилатного клея с атравматической сорбционной подушечкой из вискозы, покрытой полиэтиленовой сеткой.
Осуществление изобретения.
Процесс изготовления биопластического пористого материала.
Получают гомогенную смесь исходных компонентов. Для этого предварительно готовится водный раствор гиалуроновой кислоты. Далее осуществляют смешивание коллагена, раствора гиалуроновой кислоты и эластина. Процентное содержание исходных веществ в смеси: коллаген 70-90%, гиалуроновая кислота 6-26%, эластин 1-30%. Перемешивание смеси осуществляется с использованием лопастной мешалки, параметры перемешивания 500-900 об/мин, время перемешивания 10-20 минут.
К гомогенной смеси добавляют биологически активный компонент (БАК), который получают при культивировании охарактеризованной культуры неонатальных фибробластов человека в среде DMEM с добавлением FBS, L-глутамина, пенициллина и стрептомицина [как описано в RU 2722744 C1, 03.06.2020]. При достижении культурой 80% монослоя проводят смену ростовой среды для получения кондиционированной среды, которую впоследствии очищают, фильтруют и концентрируют через мембраны размером 10 и 50 кДа.
Далее в полученную гомогенную смесь вводят раствор гелирующего агента из группы альдегидов с концентрацией 2-5 масс%. Раствор гелирующего агента готовят путем разбавления исходного раствора с содержанием действующего вещества не менее 25%. Полученную смесь перешивают в течение 20 минут, после чего разливают в чашки Петри и выдерживают 20 минут при комнатной температуре.
Затем проводят замораживание образца. Для того, чтобы защитить сформировавшуюся в ходе заморозки структуру, перед стадией замораживания возможно введение криопротекторов из группы полисахаридов. В конце стадии замораживания образцы приобретают структуру, от которой впоследствии будет зависеть качество конечного губчатого материала. Замораживание проводят в морозильном шкафу от 2 до 24 часов при температуре от -70°С до -20°С.
Заключительной стадией является процесс сублимационной сушки. Процесс проходит в вакуумно-сушильном аппарате, установка работает в автоматическом режиме. После загрузки заполненных поддонов запускается программа сушки с заданными параметрами. Температура полки в ходе процесса изменяется от 0°С до 20°С с шагом 5°С. Продолжительность каждого шага составляет от 5 до 15 часов. Давление в ходе процесса составляет 300 Па. Общее время сублимационной сушки составляет от 25 часов до 75 часов. По окончании процесса сушки вакуум гасится воздухом, поддоны вынимаются для извлечения конечного материала.
Проводят процесс интеграции биопластического пористого материала и основы из нетканного материала с применением гипоаллергенного синтетического акрилатного клея с атравматической сорбционной подушечкой из вискозы, покрытой полиэтиленовой сеткой, стерилизованного оксидом этилена. Для чего предварительно простерилизованные в 70% растворе этилового спирта равные по размеру фрагменты биопластического материала и основы из нетканного материала с сорбционной подушечкой совмещаются между собой и высушиваются при 37°С. Адгезированный таким образом биопластический материал обладает достаточной силой сцепления с основой, что позволяет проводить дальнейшие манипуляции с материалом без риска его расслоения.
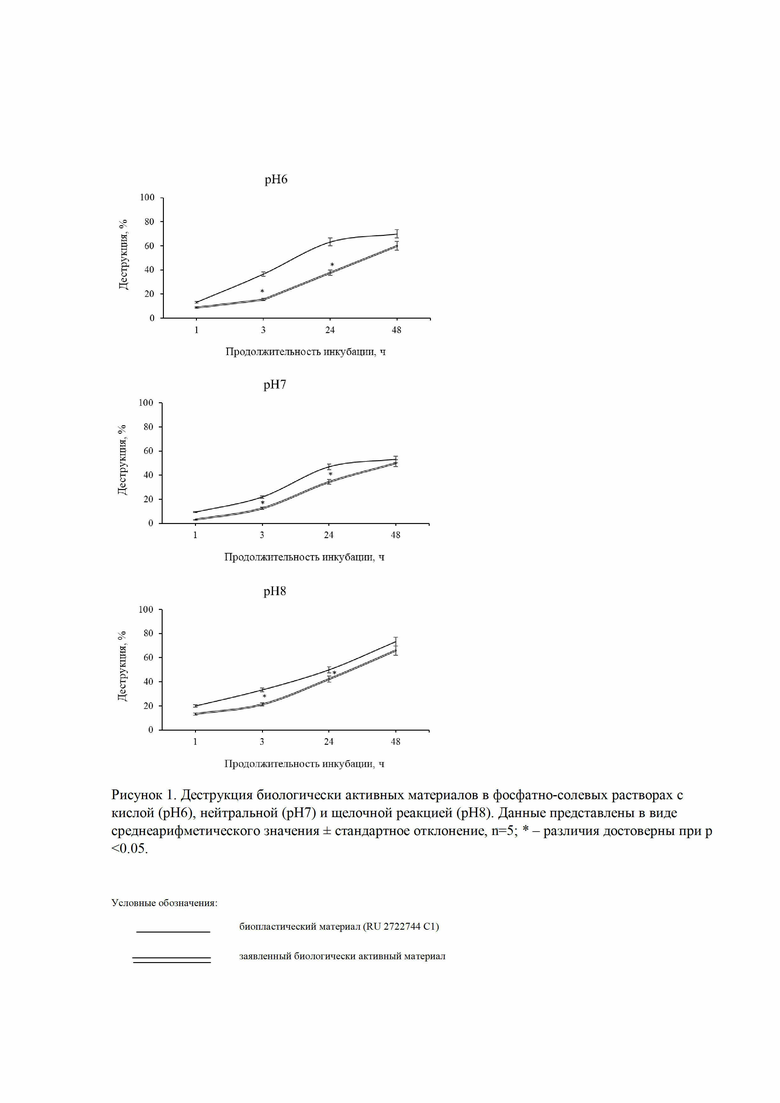
Для сравнительной характеристики функциональных свойств полученного биологически активного материала с прототипом, оценивали устойчивость материалов к биодеструкции в условиях in vitro. Согласно данным литературы, каждая стадия воспалительно-репаративного процесса характеризуется своим значением кислотности раневого ложа. Так, например, стадия острого воспаления сопровождается снижением кислотности раневого ложа до рН 5,5-6, на стадии репаративной регенерации кислотность составляет порядка рН7, хроническое воспаление характеризуется щелочной реакцией (рН8) [Schneider, L.A., Korber, A., Grabbe, S. et al. Influence of pH on wound-healing: a new perspective for wound-therapy. Arch Dermatol Res, 2007, 298, 413–420]. Хорошо известно, что кислотность среды оказывает влияние на функциональную активность клеток, а именно – на пролиферацию, клеточный цикл, генерацию белков межклеточного матрикса, внутриклеточные сигнальные каскады, генерацию цитокинов и т.д. [Shan T, Chen S, Chen X, Wu T, Yang Y, Li S, Ma J, Zhao J, Lin W, Li W, Cui X, Kang Y. M2-TAM subsets altered by lactic acid promote T-cell apoptosis through the PD-L1/PD-1 pathway. Oncol Rep. 2020 Nov;44(5):1885-1894. doi: 10.3892/or.2020.7767. Epub 2020 Sep 15. PMID: 33000216; PMCID: PMC7551099. Quinn WJ 3rd, Jiao J, TeSlaa T, Stadanlick J, Wang Z, Wang L, Akimova T, Angelin A, Schäfer PM, Cully MD, Perry C, Kopinski PK, Guo L, Blair IA, Ghanem LR, Leibowitz MS, Hancock WW, Moon EK, Levine MH, Eruslanov EB, Wallace DC, Baur JA, Beier UH. Lactate Limits T Cell Proliferation via the NAD(H) Redox State. Cell Rep. 2020 Dec 15;33(11):108500. doi: 10.1016/j.celrep.2020.108500. PMID: 33326785; PMCID: PMC7830708.]
Образцы инкубировали в растворе с нейтральной реакцией, используя для этого фосфатно-солевой буфер (ФСБ) с рН7, в растворе ФСБ с кислой реакцией с рН6 (который получали путем смешивания 1 мл ФСБ и 10 мкл 40% молочной кислоты) и в растворе с щелочной реакцией с рН8 (который получали путем смешивания 1 мл ФСБ и 15 мкл 10% NaOH). Интенсивность биодеструкции оценивали путем измерения массы сухих образцов до и через 1, 3, 24 и 48 часов их инкубации в солевых растворах.
Полученный биологически активный материал обладает пролонгированным периодом деструкции в кислой, нейтральной и щелочной среде по сравнению с биопластическим материалом известным из ближайшего аналога (патент RU 2722744 C1) (Рис. 1).
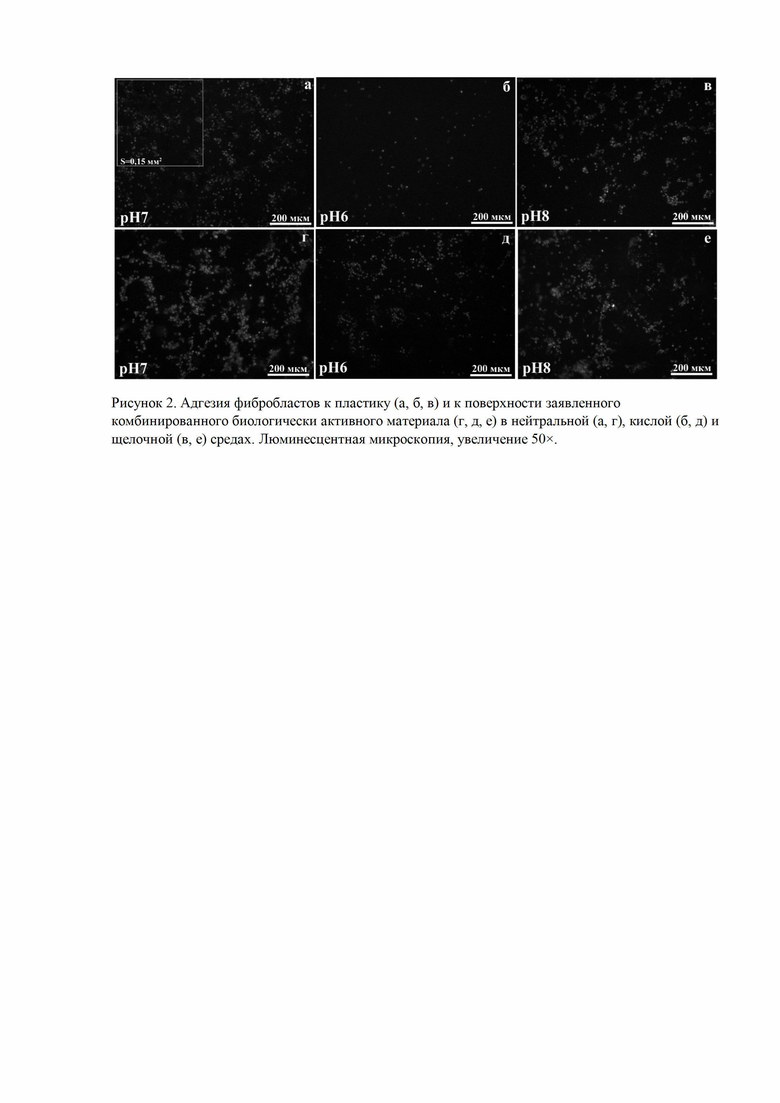
Для оценки адгезии фибробластов проводили подсчет количества адгезированных фибробластов на 1 мм2 поверхности исследуемых образцов в условиях кислой, нейтральной и щелочной сред, через 6 ч инкубации. При этом сравнивали количество адгезированных фибробластов в трех образцах: заявленный биологически активный материал, культуральный пластик и биопластический материал (по RU 2722744 C1) (Табл.1).
В образце из культурального пластика через 6 ч, при инкубации в нейтральной среде (рН 7), на поверхности пластика адгезируется 140±20 клеток на 0,15 мм2 (Табл. 1, Рис. 2а). В кислой среде, при рН6, количество адгезированных клеток снижается и составляет 25±5 клеток на 0,15 мм2 (Табл. 1, Рис. 2б). В щелочной среде, при рН8, количество адгезированных клеток составляет 114±10 клеток на 0,15 мм2 (Табл. 1, Рис. 2в). Во всех средах клетки имеют, преимущественно, сферическую форму, с площадью тела 97±27 мкм2 (Рис. 2а,б,в).
В образце из биопластического материала (по RU 2722744 C1) установлено, что в условиях нейтральной среды (рН 7) количество клеток на поверхности материала составляет 138±16 на 0,15 мм2 (Табл. 1). В кислой среде количество адгезированных клеток снижается. Несмотря на это количество адгезированных клеток на поверхности биоматериала в два раза выше, чем на поверхности культурального пластика (Табл. 1). Выявлено, что щелочная среда не влияет на адгезию клеток к биоматериалу, количество адгезированных клеток сопоставимо с другими образцами (Табл. 1). Размеры клеток, адгезированных на поверхности биоматериала, сопоставимы с размерами клеток адгезированных на культуральном пластике.
Образец заявленного биологически активного материала обладает способностью поддерживать адгезию и жизнеспособность фибробластов в условиях физиологического ацидоза (Табл. 1, Рис. 2д). Заявленный комбинированный биологически активный материал не оказывает влияние на адгезию клеток при инкубации в нейтральной (рН7) и щелочной (рН8) средах (Табл. 1, Рис 2г, е).
Таким образом, результаты проведенного исследования показывают, что в кислой среде адгезивные свойства фибробластов снижаются. Несмотря на дисфункцию фибробластов в условиях внеклеточного ацидоза, количество прикрепившихся клеток к поверхности заявленного комбинированного биологически активного материала выше, чем к культуральному пластику.
Примеры исполнения:
Пример 1. Берут фрагмент биопластического пористого материала. Для чего получают гомогенную смесь следующих компонентов: коллаген 75%, гиалуроновая кислота 15%, эластин 7%, БАК 3%. Далее в полученную гомогенную смесь вводят раствор гелирующего агента из группы альдегидов с концентрацией 4 масс%. Полученную смесь перешивают в течение 20 минут, после чего разливают в чашки Петри и выдерживают 20 минут при комнатной температуре. Затем проводят замораживание образца с последующей сублимационной сушкой в вакуумно-сушильном аппарате.
В качестве основы из нетканного материла берут фрагмент коммерческого изделия «Перевязка Докториус» (производитель ООО Новамед, Москва), представляющий собой нетканый материал из вискозы и полиэстера, содержащей гипоаллергенный синтетический акрилатный клей с атравматической сорбционной подушечкой, которая выполнена из вискозы и покрыта полиэтиленовой сеткой. Коммерческое изделие изготовлено в соответствии с ГОСТ Р 53498-2009.
Далее равные по размеру фрагменты полученного биопластического материала и основы из нетканного материала, предварительно простерилизованные в 70% растворе этилового спирта, совмещают между собой и высушивают при 37°С.
Пример 2. Берут фрагмент биопластического пористого материала. Для чего получают гомогенную смесь следующих компонентов: коллаген 70%, гиалуроновая кислота 10%, эластин 15%, БАК 5%. Далее в полученную гомогенную смесь вводят раствор гелирующего агента из группы альдегидов с концентрацией 2 масс%. Полученную смесь перешивают в течение 20 минут, после чего разливают в чашки Петри и выдерживают 20 минут при комнатной температуре. Затем проводят замораживание образца с последующей сублимационной сушкой в вакуумно-сушильном аппарате.
Далее равные по размеру фрагменты основы из нетканного материла и полученного биопластического материала, предварительно простерилизованные в 70% растворе этилового спирта, совмещают между собой и высушивают при 37°С.
Пример 3. Берут фрагмент биопластического пористого материала. Для чего получают гомогенную смесь следующих компонентов: коллаген 85%, гиалуроновая кислота 8%, эластин 4%, БАК 3%. Далее в полученную гомогенную смесь вводят раствор гелирующего агента из группы альдегидов с концентрацией 5 масс%. Полученную смесь перешивают в течение 20 минут, после чего разливают в чашки Петри и выдерживают 20 минут при комнатной температуре. Затем проводят замораживание образца с последующей сублимационной сушкой в вакуумно-сушильном аппарате.
Далее равные по размеру фрагменты основы из нетканного материла и полученного биопластического материала, предварительно простерилизованные в 70% растворе этилового спирта, совмещают между собой и высушивают при 37°С.
Таблица 1
Адгезия фибробластов к образцам в условиях кислой, нейтральной и щелочной сред
Данные представлены в виде среднеарифметического значения ± стандартное отклонение, n=5; * – различия достоверны по сравнению с контролем, при p <0.05.
| название | год | авторы | номер документа |
|---|---|---|---|
| ОРГАНОСПЕЦИФИЧЕСКИЙ БИОПЛАСТИЧЕСКИЙ МАТЕРИАЛ НА ОСНОВЕ РАСТВОРИМОЙ ФОРМЫ СТАБИЛИЗИРОВАННОГО ВНЕКЛЕТОЧНОГО МАТРИКСА | 2019 |
|
RU2722744C1 |
| МИКРОНАНОСТРУКТУРИРОВАННЫЙ БИОПЛАСТИЧЕСКИЙ МАТЕРИАЛ | 2012 |
|
RU2481127C1 |
| 3D БИОПЛАСТИЧЕСКИЙ МАТЕРИАЛ НА ОСНОВЕ ГИДРОКОЛЛОИДА ГИАЛУРОНОВОЙ КИСЛОТЫ | 2013 |
|
RU2565398C2 |
| ГИСТОЭКВИВАЛЕНТ-БИОПЛАСТИЧЕСКИЙ МАТЕРИАЛ | 2013 |
|
RU2513838C1 |
| КОЖА КОСМЕТИЧЕСКАЯ | 2013 |
|
RU2528899C1 |
| СПОСОБ ВОССТАНОВЛЕНИЯ ДЕФЕКТОВ ПОКРОВНЫХ ТКАНЕЙ | 2016 |
|
RU2644306C1 |
| МАТРИЦА ДЛЯ КУЛЬТИВИРОВАНИЯ КЛЕТОК | 2014 |
|
RU2571215C2 |
| СПОСОБ ТЕРАПИИ ПОВРЕЖДЕНИЙ КОЖИ И БИОТРАНСПЛАНТАТ ДЛЯ ЕГО ОСУЩЕСТВЛЕНИЯ | 2014 |
|
RU2588835C1 |
| ТЕХНОЛОГИЯ РЕГЕНЕРАТИВНОЙ БИОПЛАСТИКИ ДЕФЕКТОВ ПОКРОВНЫХ ТКАНЕЙ | 2013 |
|
RU2547386C1 |
| РЕГЕНЕРАЦИЯ ПОВРЕЖДЕННОЙ ТКАНИ | 2014 |
|
RU2677637C2 |
Настоящее изобретение относится к области медицины, а именно к биологически активному материалу для покрытия раневой поверхности, включающему биопластический пористый материал, состоящий из внеклеточного матрикса, обогащенного композицией, содержащей коллаген I типа, гиалуроновую кислоту, эластин и культивированные неонатальные фибробласты человека в среде DMEM с добавлением FBS, L-глутамина, пенициллина, стрептомицина, в процентном соотношении компонентов исходной смеси, мас.%: коллаген I типа 70-85, гиалуроновая кислота 10-15, эластин 1-15, культивированные неонатальные фибробласты человека 3-5; при этом биологически активный материал дополнительно включает основу, выполненную из нетканого материала с применением гипоаллергенного синтетического акрилатного клея с атравматической сорбционной подушечкой из вискозы, покрытой полиэтиленовой сеткой, стерилизованную оксидом этилена. Настоящее изобретение обеспечивает улучшение эксплуатационных и функциональных свойств биологически активного материала, за счет увеличения периода биодеструкции биологически активного материала в солевых растворах, имитирующих кислотность раневого ложа при остром и хроническом воспалении, а также увеличения количества адгезированных фибробластов в кислой среде и снижения хрупкости материала. 2 ил., 1 табл., 3 пр.
Биологически активный материал для покрытия раневой поверхности, включающий биопластический пористый материал, состоящий из внеклеточного матрикса, обогащенного композицией, содержащей коллаген I типа, гиалуроновую кислоту, эластин и культивированные неонатальные фибробласты человека в среде DMEM с добавлением FBS, L-глутамина, пенициллина, стрептомицина, в процентном соотношении компонентов исходной смеси, мас.%: коллаген I типа 70-85, гиалуроновая кислота 10-15, эластин 1-15, культивированные неонатальные фибробласты человека 3-5; при этом биологически активный материал дополнительно включает основу, выполненную из нетканого материала с применением гипоаллергенного синтетического акрилатного клея с атравматической сорбционной подушечкой из вискозы, покрытой полиэтиленовой сеткой, стерилизованную оксидом этилена.
| ОРГАНОСПЕЦИФИЧЕСКИЙ БИОПЛАСТИЧЕСКИЙ МАТЕРИАЛ НА ОСНОВЕ РАСТВОРИМОЙ ФОРМЫ СТАБИЛИЗИРОВАННОГО ВНЕКЛЕТОЧНОГО МАТРИКСА | 2019 |
|
RU2722744C1 |
| И | |||
| Р | |||
| Гильмутдинова и др., Разработка наноструктурированного биопластического материала для комбустиологии / Биотехнология | |||
| Способ восстановления спиралей из вольфрамовой проволоки для электрических ламп накаливания, наполненных газом | 1924 |
|
SU2020A1 |
| Ilmira R | |||
| Gilmutdinova et al., Development of nanostructured bioplastic material for wound healing / Eur J Transl Myol | |||
| Способ регенерирования сульфо-кислот, употребленных при гидролизе жиров | 1924 |
|
SU2021A1 |
| ФИЛЬТР ДЛЯ ОЧИСТКИ ВОЗДУХА В КОМПРЕССОРНЫХ ВЕНТИЛЯЦИОННЫХ И ТОМУ ПОДОБНЫХ УСТАНОВКАХ | 1936 |
|
SU53498A1 |
Авторы
Даты
2023-09-26—Публикация
2022-12-22—Подача