Изобретение относится к области органической и медицинской химии, онкологии, а именно к области радиофармпрепаратов, предназначенных для использования в качестве тераностических средств для диагностики и терапии рака предстательной железы.
Рак предстательной железы (РПЖ) является серьезной проблемой общественного здравоохранения, ежегодно у примерно 500 000 мужчин диагностируется это заболевание. Несмотря на высокий уровень (99 - 100%) 5-летней выживаемости при локальном и регионарном РПЖ, уровень 5-летней выживаемости для метастатического и метастазированного РПЖ не превышает 30%. В связи с низкой выживаемостью больных метастатическим РПЖ его эффективное выявление и лечение является одной из неудовлетворенных клинических потребностей современной онкологии.
Избирательное нацеливание радиофармацевтических препаратов на раковые клетки для визуализации или для терапевтических целей РПЖ является сложной задачей, попытки решить которую предпринимаются сегодня исследователями по всему миру.
Простатспецифический мембранный антиген (ПСМА) экспрессируется в большинстве карцином предстательной железы и обнаруживается как в низкодифференцированных опухолях, так и в метастатических поражениях. Доброкачественные клетки простаты, а также тонкий кишечник, почки и слюнные железы также производят эндогенную экспрессию ПСМА, однако значительно меньшую, примерно на 2-3 порядка меньше, чем в злокачественных клетках РПЖ. Этот факт превращает ПСМА в высокоспецифичный биомаркер РПЖ. ПСМА представляет собой трансмембранный белок из 750 аминокислот, состоящий из небольшого внутриклеточного компонента, трансмембранного домена и обширного внеклеточного сегмента. В одной раковой клетке определяется примерно 106 молекул ПСМА, что является дополнительным подтверждением того, что ПСМА идеальный объект для визуализации и терапии способами, основанными на использовании радионуклидов.
На сегодняшний день известны несколько нацеленных на ПСМА низкомолекулярных лигандов, способных связываться с внеклеточным доменом ПСМА и несущих терапевтические или диагностические компоненты для визуализации путем позитронно-эмиссионной томографии (ПЭТ) и однофотонной эмиссионной компьютерной томографии (ОФЭКТ), в том числе радиоактивно меченных. Большую группу среди них составляют лиганды на основе мочевины, которые интернализуются в клетку после связывания с активным центром ПСМА.
Чтобы обеспечить включение радионуклида, ПСМА-таргетные ингибиторы конъюгируют с хелатором. В качестве хелаторов для связывания и прочного удерживания радионуклида в составе коньюгата сегодня известно применение таких полидентантных лигандов, как 1,4,7,10-тетраазациклододекана-1,4,7,10-тетрауксусная кислота (DOTA), N,N-бис[2-гидрокси-5-(карбоксиэтил))- бензил]этилендиамин-N,N-диуксусная кислота (HBED-CC), 1,4,7-триазациклононан-1,4,7-триуксусная кислота (NOTA), 2-(4,7-бис(карбоксиметил)-1,4,7-триазонан-1ил)пентандиовая кислота (NODAGA), 2-(4,7,10-трис(карбоксиметил)-1,4,7,10 тетраазациклододекан-1-ил)-пентандиовая кислота (DOTAGA), 1,4,7-триазациклононанфосфиновая кислота (TRAP), 3,6,915-тетраазабицикло[9,3,1]пентадека-1 (15),11,13- триен-3,6,9-триуксусная кислота (PCTA), диэтилентриаминпентауксусная кислота (DTPA).
Известные хелаторы способны образовывать комплексы с большим числом известных радионуклидов: 99mTc, 90Y, 11lIn, 67Ga, 86Y, 90Y, 177Lu, 51Tb, 186Re, 188Re, 64Cu, 67Cu, 55Co, 57Co, 43Sc, 44Sc, 47Sc, 225Ac, 213Bi, 212Bi, 212Pb, 227Th, 153Sm, 166Ho, 152Gd, 153Gd, 157Gd. Выбор радионуклида определяется химической структурой и хелатообразующей способностью хелатора, а также, тем, каким будет практическое применение полученного конъюгата - диагностическим и/или терапевтическим.
Из уровня техники [Патент РФ №2730507, опубл.24.08.2020, МПК C07D 257/02] известно соединение для диагностики опухолей, экспрессирующих ПСМА, представляющее собой ПСМА-связывающий конъюгат на основе производного мочевины структуры DCL и модифицированного гидрофобного пептидного линкера, включающего фрагмент 6-аминогексановой кислоты, связанный с хелатором DOTA (1):

а также комплекс для диагностики опухолей, экспрессирующих ПСМА, включающий в
себя соединение формулы (I) по п.1 с радионуклидной меткой, в качестве которой используют трехзарядные катионы металлов, выбранные из 111In, 67Ga, 68Ga, 90Y, 109Pb, 203Pb, 105Rh, 177Lu, 213Bi, 44Sc, 47Sc, 153Sm, 161Tb и 225Ac.
Этот и другие доступные в настоящее время радиомеченные конъюгаты, нацеленные на ПСМА, обеспечивающие быстрый доступ, селективное нацеливание и проникновение в опухоль, однако, несут с собой риск неспецифических, нецелевых взаимодействий в здоровых тканях, экспрессирующих ПСМА, и накопления в них радиофармпрепаратов. Неопухолевые ткани в процессе применения радиомеченных коньюгатов подвергаются воздействию некоторых доз облучения, что в конечном итоге может привести к необратимому их повреждению.
Известен радиотерапевтический ПСМА-связывающий конъюгат PSMA-617, выбранный в качестве прототипа [Benesová M, Schäfer M, Bauder-Wüst U, Afshar-Oromieh A, Kratochwil C, Mier W, Haberkorn U, Kopka K, Eder M. Preclinical Evaluation of a Tailor-Made DOTA-Conjugated PSMA Inhibitor with Optimized Linker Moiety for Imaging and Endoradiotherapy of Prostate Cancer. J Nucl Med. 2015, 56, 914-920. DOI: 10.2967/ jnumed.114.147413]. PSMA-617 характеризуется наличием ПСМА- связывающего лиганда на основе мочевины (Glu-Urea-Lys), хелатирующей части в виде 1,4,7,10-тетраазациклододекана-1,4,7,10-тетрауксусной кислоты (DOTA), и линкерной части между ними из 2-нафтил-L-аланина и транексамовой кислоты (2).

В настоящее время [177Lu]Lu-PSMA-617 является золотым стандартом в разработке терапевтических радиофармпрепаратов, нацеленных на ПСМА. Однако в работе [Zechmann C. M, Afshar-Oromieh A., Armor T., Stubbs J. B. , Mier W., Hadaschik B., Joyal J., Kopka K., Debus J, Babich J. W., Haberkorn U. Radiation dosimetry and first therapy results with a 124 I/ 131 I-labeled small molecule (MIP-1095) targeting PSMA for prostate cancer therapy, European Journal of Nuclear Medicine and Molecular Imaging, 41, 1280-92, 2014.] было показано, что [177Lu]Lu-PSMA-617 накапливается также в слезных и слюнных железах пациентов, и может вызывать повреждение железистой ткани.
Целью настоящего изобретения является преодоление недостатков в предшествующем уровне техники и соответствие требованиям в данной области.
Техническим результатом заявляемого изобретения является расширение арсенала тераностических средств для селективного нацеливания и проникновения в патогенные опухолевые ткани, экспрессирующие ПСМА, при одновременном обеспечении превосходных характеристик клеточного поглощения и интернализации при относительно невысоких концентрациях конъюгата.
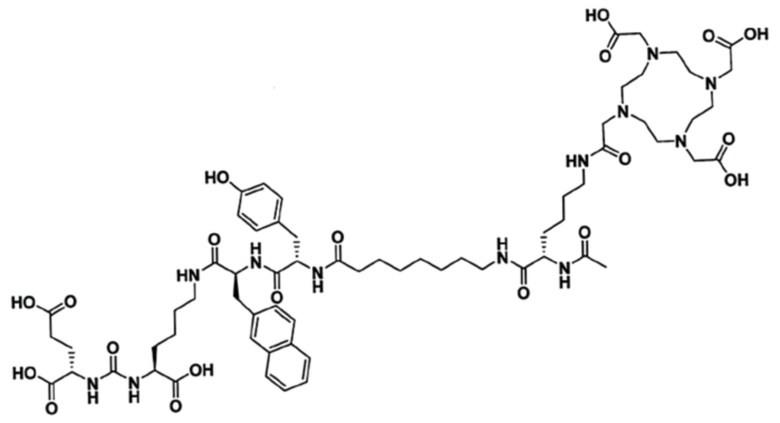
Технический результат достигается ПСМА-таргетным соединением для получения комплекса с радионуклидной меткой, предназначенного для тераностики опухолей, экспрессирующих ПСМА, общей формулы Glu-Urea-Lys-2-нафтил-L-аланин-L-тирозин-8Aoc-Lys-DOTA-ацетамид (3)
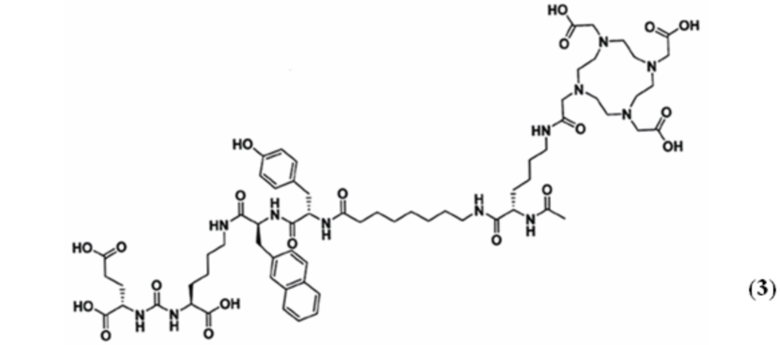
Технический результат также достигается комплексом для тераностики опухолей, экспрессирующих ПСМА, включающем в себя соединение (3) с радионуклидной меткой, в качестве которой используют радионуклид 177Lu, а также радионуклиды, способные обеспечивать прочное связывание с DOTA, а именно 90Y, 225Ac, 227Th, 68Ga, 111In, 55Co.
В тексте данной заявки новое соединение по настоящему изобретению (3) в дальнейшем обозначено как BQ7876, его комплекс с радиоактивным нуклидом 177Lu обозначен как [177Lu]Lu- BQ7876.
Изобретение поясняется следующими чертежами, где:
На Фиг.1 показана специфичность связывания радиомеченных коньюгатов с ПСМА-экспрессирующими клетками рака предстательной железы PC-3pip in vitro. Данные представлены в виде среднего значения и стандартного отклонения (n=3): a) [177Lu]Lu-BQ7876; б) [177Lu]Lu-PSMA-617.
На Фиг.2 представлено ингибирование связывания радиомеченных коньюгатов с клетками PC3-pip.Данные представлены в виде медианы и квартилей: a) [177Lu]Lu-BQ7876; б) [177Lu]Lu-PSMA-617.
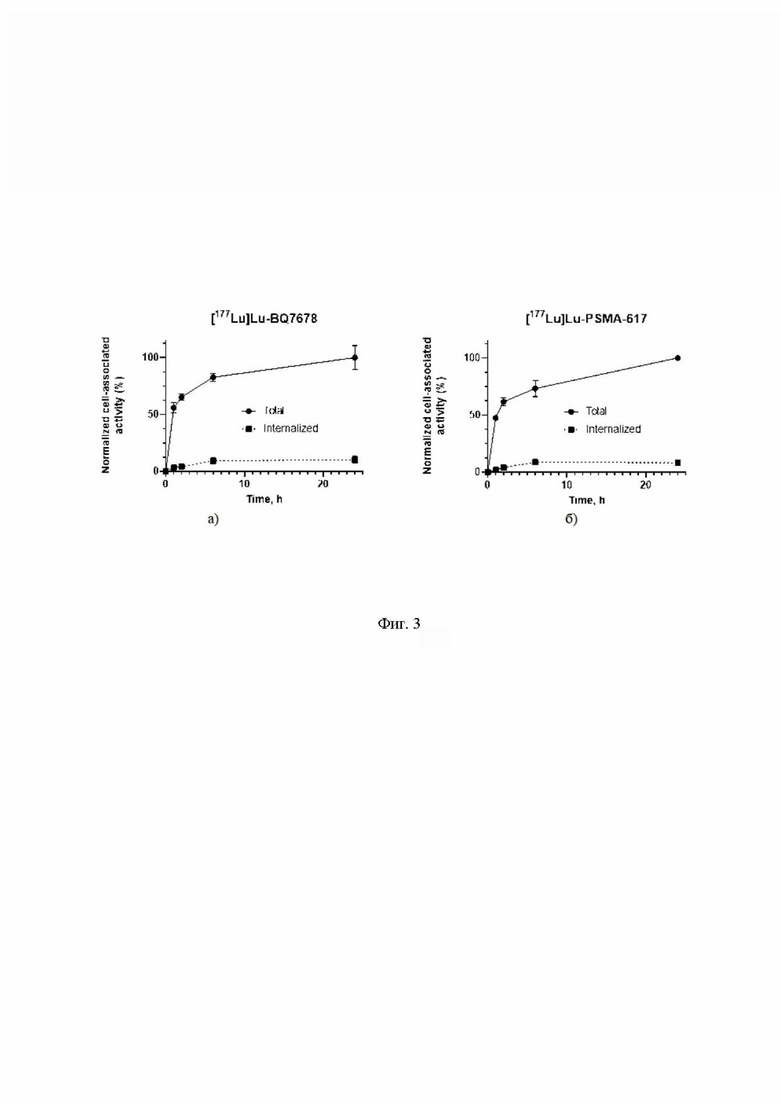
На Фиг.3 показаны клеточный процессинг и интернализация радиомеченных коньюгатов ПСМА-экспрессирующими клетками PC-3pip во время непрерывной инкубации в течение 24 часов. Данные представлены в виде среднего значения и стандартного отклонения (n=3): a) [177Lu]Lu-BQ7876; б) [177Lu]Lu-PSMA-617.
На Фиг.4 представлена специфичность нацеливания ПСМА in vivo: а) сравнение общего биораспределения [177Lu]Lu-BQ7876 у мышей, несущих ПСМА-положительные PC3-pip и ПСМА-отрицательные ксенотрансплантаты PC3; б) сравнение поглощения ксенотрансплантатами PC3-pip и PC3.
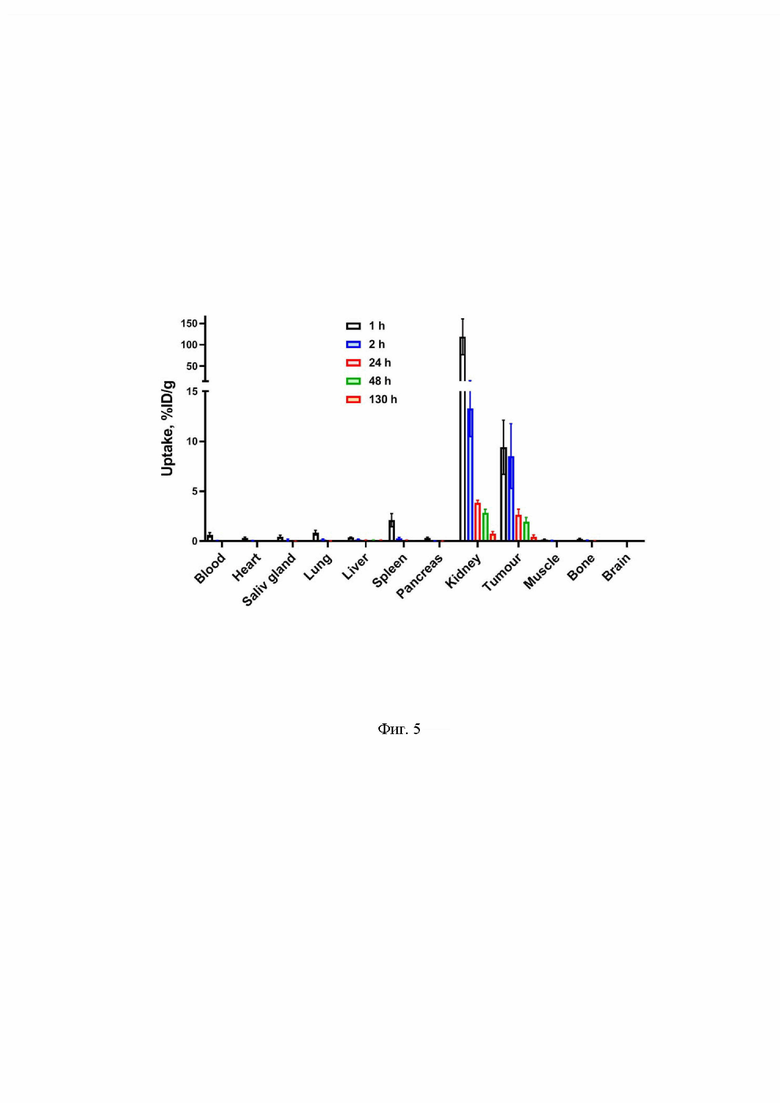
На Фиг.5 представлено биораспределение [177Lu]Lu-BQ7876 у самок мышей BALB/C nu/nu, несущих ксенотрансплантаты PC3-pip.. Данные представлены в виде среднего значения и стандартного отклонения (n=3).
На Фиг.6 показано: а) сравнение биораспределения [177Lu]Lu-BQ7876 и [177Lu]Lu-PSMA-617 у самок мышей BALB/C nu/nu, несущих ксенотрансплантаты PC3-pip через 3 ч после инъекции; б) поглощение печенью [177Lu]Lu-BQ7876 и [177Lu]Lu-PSMA-617. Данные представлены в виде среднего значения и стандартного отклонения (n=3).
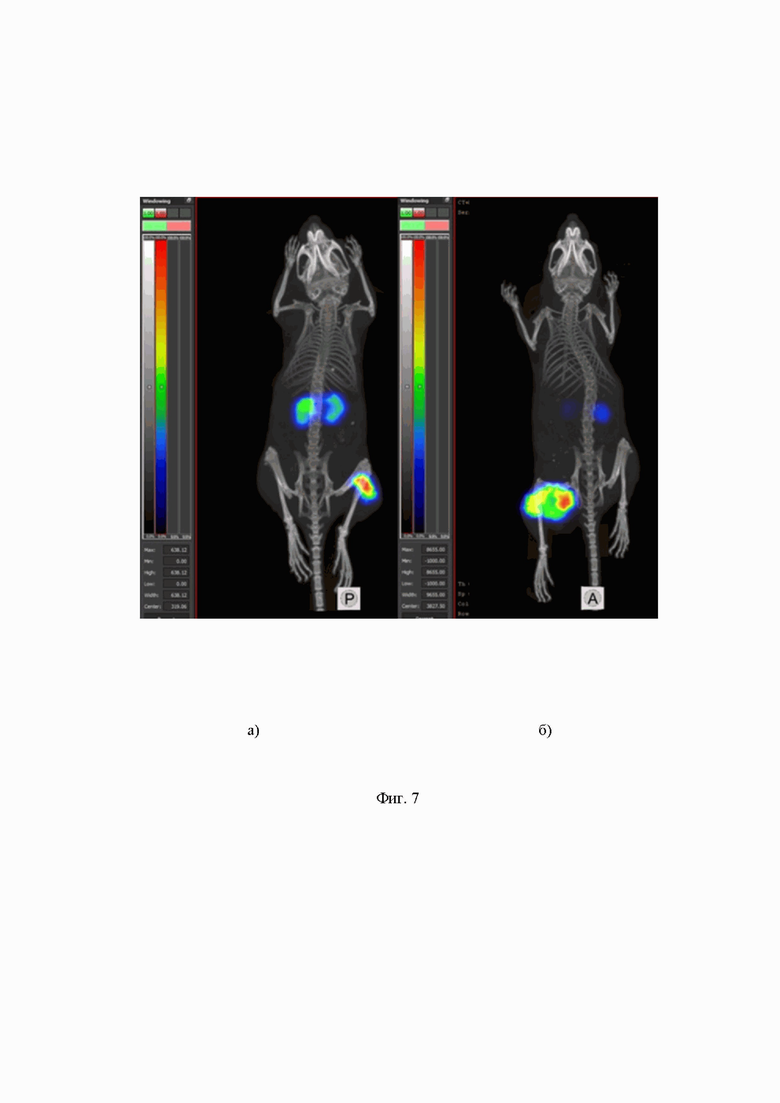
На Фиг.7 приведена визуализация микро ОФЭКТ/КТ мышей с ксенотрансплантатами PC3-pip: а) с использованием [177Lu]Lu-BQ7876; б) с использованием [177Lu]Lu-PSMA-617.
На Фиг.8 представлена схема синтеза ди-трет-бутил-2-изоцианатопентандиоата.
В заявляемом техническом решении новое соединение BQ7876, таргетно взаимодействующее с ПСМА и способное связывать определенные радионуклиды, пригодное для радионуклидной визуализации и терапии, может быть описано формулой: Glu-Urea-Lys-2-нафтил-L-аланин-L-тирозин-8Aoc-Lys-DOTA-ацетамид, и имеет структурную формулу (3). Новое соединение BQ7876 по настоящему изобретению содержит ту же нацеливающую молекулу на основе мочевины, что и PSMA-617. Техническим решением по настоящему изобретению является модификация линкерной части BQ7876, которая представлена 2-нафтил-L-аланином и L-тирозином и отделена от хелаторного фрагмента DOTA 8-аминооктановой кислотой. Новая структура линкерной части содержит более гидрофильные аминокислотные фрагменты с определенной оптической конфигурацией, одновременно с этим более гидрофобный и объемный нафтильный фрагмент.Введение в линкерную часть 8-аминооктановой кислоты пространственно удаляет ПСМА-таргетную часть от хелатирующего фрагмента, что позволяет избежать стерических затруднений при взаимодействии с ПСМА. Таким образом, заместители линкерной части отличаются по размеру, полярности (гидрофобности и гидрофильности), способности образовывать нековалентные взаимодействия (водородные, Ван-дер-Ваальсовые). Данный набор характеристик линкерной части позволяет BQ7876 принять оптимальное положение внутри полости для связывания, и сформировать дополнительные взаимодействия с различными субкарманами, удаленными от активного центра, без возникновения стерических помех. Заявляемое техническое решение обеспечивает увеличение аффинности связывания нового конъюгата с молекулярной мишенью и способствует уменьшению его нецелевого взаимодействия, т.е. уменьшает влияние на его свойства биораспределения и поглощение опухолью.
Хелаторным фрагментом нового соединения по настоящему изобретению, является 1,4,7,10-тетраазациклододекан-1,4,7,10-тетрауксусная кислота (DOTA). Использование DOTA в качестве хелатирующего агента в структуре нового соединения по настоящему изобретению было обосновано тем, что DOTA способен эффективно образовывать комплексы с диагностическими и терапевтическими радионуклидами, что позволяет использовать радиомеченный BQ7876, как для визуализации, так и для терапевтических целей, т.е. в качестве тераностического агента. DOTA обеспечивает прочное связывание с радионуклидом 177Lu, а также пригодна для мечения такими терапевтическими нуклидами, как 90Y, 225Ac и 227Th. Кроме того, DOTA обеспечивает достаточно стабильную связь с 68Ga, 111In и 55Co для разработки вспомогательного диагностического изображения.
Соединение BQ7876 получали следующим способом.
Синтез ди-трет-бутил-2-изоцианатопентандиоата (4) проводили по схеме Фиг.8.
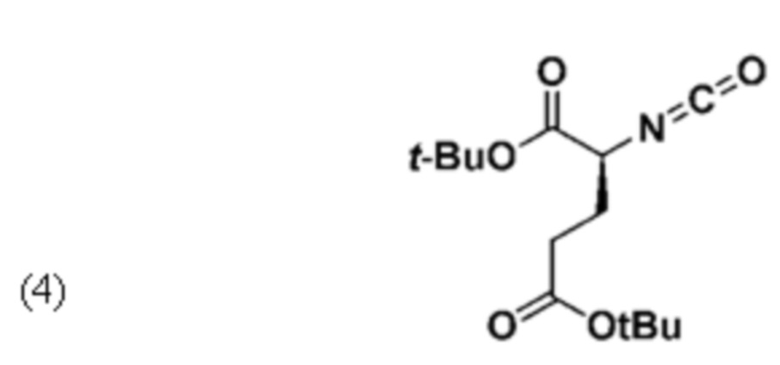
Трифосген (237 мг, 0,80 ммоль) растворяли в 10 мл дихлорметана (ДХМ), добавляли 10 мл насыщ. раствора NaHCO3 и энергично перемешивали. Добавляли L-Glu(tBu)-OtBu (591 мг, 2,0 ммоль). Через 20 мин реакцию проверяли с помощью ТСХ, которая указывала на образование продукта. Органическую фазу (ДХМ) отделяли от водной фазы, затем промывали 2М раствором KHSO4, сушили над MgSO4, фильтровали и упаривали. Продукт получали в виде желтого масла (420 мг, 1,47 ммоль).
Синтез ди-трет-бутил (((S)-6-амино-1-метокси-1-оксогексан-2-ил)карбамоил)-L-глутамата (5).

2-Хлортритиловую смолу (2-ХТЦ) (156 мг, 0,55 ммоль) добавляли в тионилхлорид (3 мл) и пиридин (2 мл) и оставляли суспензию на 16 часов. Смолу отфильтровывали и промывали ДХМ. Fmoc-Lys(alloc)-OH (498 мг, 1,1 ммоль) и диизопропилэтиламин (DIPEA) (383 мкл, 2,2 ммоль) растворяли в ДХМ, добавляли к смоле и оставляли на ночь. После этого смолу промывали ДХМ, Fmoc удаляли с помощью 20%-го пиперидина в диметилформамиде (ДМФА) (3×10 мин) и смолу снова промывали ДМФА, а затем ДХМ. ди-трет-бутил-2-изоцианатопентандиоата (4) (420 мг, 1,47 ммоль) и DIPEA (671 мкл, 3,85 ммоль) растворяли в DCM и добавляли к смоле для образования мочевины. Через 4 часа смолу промывали ДХМ. Аллокзащищенную боковую цепь лизина удаляли путем добавления PhSiH3 (20 экв.) и Pd(PPh3)4 (0,3 экв.) в ДХМ в течение 3 часов. Смолу промывали ДХМ и ДМФА, от смолы отделяли небольшую часть неочищенного вещества и анализировали с помощью аналитической жидкостной хроматографии и масс-спектрометрии (ЖХ-МС) для подтверждения правильной массы продукта.
Синтез ди-трет-бутил-(((S)-6-((S)-2-амино-3-(нафталин-2-ил)пропанамидо)-1-метокси-1-оксогексан-2-ил)карбамоил)-L -глутамата (6)
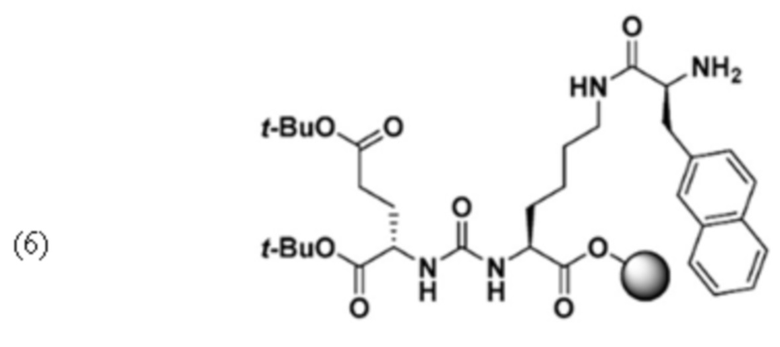
Соединение 5 (0,3 ммоль) набухали в ДМФ в течение 30 мин. В отдельном флаконе Fmoc-2-Nal-OH (525 мг, 1,2 ммоль), Oxyma Pure (171 мг, 1,2 ммоль), ДИК (188 мкл, 1,2 ммоль) и DIPEA (366 мкл, 2,1 ммоль) растворяли в ДМФА и затем добавляли к смоле и перемешивали в течение 3 часов. Далее промывали ДМФА, с Fmoc снимали защиту с помощью 20%-го пиперидина в ДМФ (3×10 мин) и смолу снова промывали ДМФА, а затем ДХМ.
Синтез BQ-7876.
Соединение 6 (50 мкмоль) набухали в ДМФ в течение 30 мин. В отдельном флаконе Fmoc-Tyr(tBu)-OH (92 мг, 0,2 ммоль), Oxyma Pure (28 мг, 0,2 ммоль), DIC (31 мкл, 0,2 ммоль) и DIPEA (61 мкл, 0,35 ммоль) растворяли в ДМФ и затем добавляли к соединению 6. Через 3 часа смолу промывали ДМФ и снимали защиту с Fmoc. Таким же образом Fmoc-8-Aoc-OH и Fmos-Lys(alloc)-OH присоединяли друг за другом к смоле. После снятия Fmoc-защиты с лизина проводили защиту свободных аминогрупп на N-конце путем добавления 2 мл уксусного ангидрида и пиридина (3:2). Через 30 мин раствор удаляли, а смолу промывали ДХМ. Защищенную боковую цепь лизина снимали с использованием PhSiH3 (20 экв.) и Pd(PPh3)4 (0,3 экв.) в ДХМ в течение 3 часов. В качестве окончательного сочетания DOTA-бис(tBu)эфир (0,1 ммоль), Oxyma Pure (14 мг, 0,1 ммоль), ДИК (15 мкл, 0,1 ммоль) и DIPEA (30 мкл, 0,175 ммоль) растворяли в ДМФ, добавляли к смоле и оставляли реагировать на ночь. Продукт отделяли от смолы, осаждали в холодном диэтиловом эфире и очищали с помощью ОФ-ВЭЖХ. Для подтверждения идентичности и чистоты продукта использовали аналитическую ЖХ-МС.
Для получения [177Lu]Lu-BQ7876 раствор [177Lu]LuCl3 (12 мкл в 0,1 М HCl, 83-108 МБк) смешивали с раствором соединения по п.1 в 80 мкл 1М аскорбата натрия при рН 6,0, и инкубировали при 85°С в течение 30 мин. Радиохимический выход и чистоту определяли с помощью ТСХ, элюировали 0,2 М раствором лимонной кислотой с pH 2,0. Радио-ВЭЖХ проводили с использованием системы ВЭЖХ Hitachi Chromaster, оснащенной колонкой Luna C18 (5 мкм, 100 Å, 150 x 4,6 мм; Phenomenex, Værløse, Дания). Градиенты растворителя: 5-10% CH3CN (0-15 мин), 70-95% CH3CN (15-17 мин) и 95 -100% CH3CN (19-20 мин).
При оценке аффинности связывания [177Lu]Lu-BQ7876 с ПСМА-экспрессирующими клетками PC3-pip, изучения его процессинга после связывания с этими клетками, биораспределения in vivo на мышах, специфичности накопления в ксенотрансплантатах опухоли, экспрессирующих ПСМА, одновременно был исследован [177Lu]Lu-ПСМА-617, результаты сравнения представлены ниже.
Связывание in vitro заявляемого [177Lu]Lu- BQ7876 с ПСМА -экспрессирующими клетками PC-3pip было насыщаемым, специфичным и на том же уровне, что и связывание [177Lu]Lu-PSMA-617. (Фиг.1.)
Значение концентрации полуингибирования IC50 для заявляемого [177Lu]Lu- BQ7876 оказалось также сопоставимым со значением для [177Lu]Lu-PSMA-617 (Рис.2).
Клеточный процессинг ПСМА-экспрессирующими клетками PC-3pip заявляемого [177Lu]Lu-BQ7876 и [177Lu]Lu-PSMA-617 были весьма сходными, что говорит об отсутствии различий между связыванием [177Lu]Lu-BQ7876 и [177Lu]Lu-PSMA-617 с раковыми клетками (Фиг.3).
Биораспределение [177Lu]Lu-BQ7876 у бестимусных мышей с ксенотрансплантатами PC3-pip продемонстрировало эффективное нацеливание на опухоли, экспрессирующие ПСМА, и через 1 ч после инъекции поглощение опухолью было выше, чем поглощение любой тканью, за исключением почки. Однако почечная активность быстро снижалась в течение первых часов после инъекции. Прямое сравнение показало, что поглощение в ПСМА-положительных опухолях PC3-pip было намного выше, чем в ПСМА-негативных опухолях PC3. Такая разница ясно демонстрирует, что поглощение [177Lu]Lu-BQ7876 в ксенотрансплантатах PC3-pip является ПСМА-опосредованным, что доказывает его таргетные свойства. (Фиг.4).
Экспериментально было установлено, что [177Lu]Lu-BQ7876 быстро выводится из крови и нормальных тканей. Через 1 ч после введения наибольшая активность была обнаружена в почках (118±42% ID/г), поглощение в селезенке составило (2,1±0,7%ID/г), в других нормальных тканях через 1 ч было уже ниже 1% ID/г. Однако, через 3 ч после инъекции поглощение почками (13±3% ID/г) уже существенно не отличалось от поглощения опухолью (9±3% ID/г), и через 24 часа после инъекции поглощение не поддавалось измерению в большинстве нормальных тканей. Поглощение опухолью стабильно от 1 до 3 часов, после чего следует его медленное снижение (Фиг.5).
Сравнение биораспределения [177Lu]Lu-BQ7876 и [177Lu]Lu-PSMA-617 у самок мышей, несущих ксенотрансплантаты PC3-pip через 3 часа после инъекций, показало, что поглощение опухолью обоих соединений существенно не отличаются. Не было существенной разницы между поглощением обоих соединений во всех нормальных тканях (Рис.6 а). При этом поглощение [177Lu]Lu-BQ7876 в печени было в 1,3 раза ниже, чем поглощение [177Lu]Lu-PSMA-617 (Фиг.6 б).
Результаты визуализации согласовываются с данными о биораспределении. Как [177Lu]Lu-BQ7876, так и [177Lu]Lu-PSMA-617 интенсивно накапливались в опухолях. Единственным другим местом накопления активности были почки. Заметного накопления активности в каком-либо другом органе или ткани не обнаружено. (Фиг.7).
Расчетная эффективная доза [177Lu]Lu-BQ7876 составила 0,00423 Зв/ГБк, что значительно ниже клинических значений, обычно приводимых для [177Lu]Lu-PSMA-617. В работе Скарпа [Scarpa, L., Buxbaum, S., Kendler, D., Fink, K., Bektic, J., Gruber, L., Decristoforo, C., Uprimny, C., Lukas, P., Horninger, W., & Virgolini, I. (2017). The 68Ga/177Lu theragnostic concept in PSMA targeting of castration-resistant prostate cancer: correlation of SUVmax values and absorbed dose estimates. European journal of nuclear medicine and molecular imaging, 44(5), 788-800.] сообщалось об эквивалентной дозе 0,08±0,07 Зв/ГБк (диапазон 0,02-0,26 Зв/ГБк). Наблюдаемые благоприятные характеристики поглощения заявляемого радиомеченного конъюгата опухолью, позволяют снизить вводимую дозы для достижения визуализизации. Так как для визуализации опухоли требуется меньшее количество радионуклидов, пациент подвергается меньшей общей поглощенной дозе облучения, также создается меньшая нагрузка на окружающую среду, снижаются производственные затраты.
Таким образом, заявляемый комплекс [177Lu]Lu-BQ7876 специфически связывается с ПСМА-экспрессирующими клетками рака предстательной железы in vitro и in vivo, имеет сродство к ПСМА, близкое сродству [177Lu]Lu-PSMA-617, таргетные свойства [177Lu]Lu-BQ7876 не уступают таковым для [177Lu]Lu-PSMA-617, и имеет определенное преимущество в виде меньшей величины эффективной дозы, меньшей токсичности, о чем свидетельствует в 1,3 раза меньшее поглощение печенью. Заявляемый новый 177Lu-меченый комплекс BQ7876 по настоящему изобретению является перспективным агентом с оптимальными характеристиками для ядерной тераностики.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ КОМПЛЕКСА ПСМА-ТАРГЕТНОГО СОЕДИНЕНИЯ НА ОСНОВЕ МОЧЕВИНЫ Lu-PS-161 И КОМПЛЕКС | 2023 |
|
RU2808636C1 |
| Лиофилизат на основе лигандов к простат-специфическому мембранному антигену (ПСМА) для приготовления радиофармацевтической композиции в форме раствора для инъекций для лечения рака предстательной железы, радиофармацевтическая композиция на ее основе для лечения рака предстательной железы и способ приготовления радиофармацевтической композиции | 2023 |
|
RU2817970C1 |
| КОМПЛЕКС ПРОИЗВОДНОГО МОЧЕВИНЫ С РАДИОНУКЛИДНОЙ МЕТКОЙ Tс ДЛЯ ДИАГНОСТИКИ ОПУХОЛЕЙ, ЭКСПРЕССИРУЮЩИХ ПРОСТАТСПЕЦИФИЧЕСКИЙ МЕМБРАННЫЙ АНТИГЕН, И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2023 |
|
RU2825402C1 |
| СОЕДИНЕНИЕ ДЛЯ ДИАГНОСТИКИ ОПУХОЛЕЙ, ЭКСПРЕССИРУЮЩИХ ПСМА, И КОМПОЗИЦИЯ НА ЕГО ОСНОВЕ | 2019 |
|
RU2730507C1 |
| НОВЫЕ СВЯЗЫВАЮЩИЕ ОПУХОЛЕВЫЙ АНТИГЕН АГЕНТЫ И ИХ ПРИМЕНЕНИЕ | 2019 |
|
RU2831681C2 |
| НОВЫЕ ПСА-СВЯЗЫВАЮЩИЕ АГЕНТЫ И ИХ ПРИМЕНЕНИЕ | 2018 |
|
RU2787105C2 |
| КОМПЛЕКС, СОДЕРЖАЩИЙ НАЦЕЛИВАЮЩЕЕСЯ НА PSMA СОЕДИНЕНИЕ, СВЯЗАННОЕ С РАДИОНУКЛИДОМ СВИНЦА ИЛИ ТОРИЯ | 2018 |
|
RU2795398C2 |
| Лиганды PSMA для визуализации и эндорадиотерапии | 2018 |
|
RU2807076C2 |
| СОЕДИНЕНИЕ И ЕГО КОМПЛЕКС С РАДИОНУКЛИДОМ Lu ДЛЯ ТЕРАНОСТИКИ ОПУХОЛЕЙ, ЭКСПРЕССИРУЮЩИХ НА HER2 РЕЦЕПТОРЫ | 2023 |
|
RU2826247C1 |
| Радиофармацевтический препарат для диагностики рака предстательной железы методом позитронной эмиссионной томографии и способ его получения | 2022 |
|
RU2796106C1 |





Изобретение относится к области органической и медицинской химии, онкологии, а именно к области радиофармпрепаратов, предназначенных для использования в качестве тераностических средств для диагностики и терапии рака предстательной железы. Техническим результатом заявляемого изобретения является расширение арсенала тераностических средств для селективного нацеливания и проникновения в патогенные опухолевые ткани, экспрессирующие ПСМА, при одновременном обеспечении превосходных характеристик клеточного поглощения и интернализации при относительно невысоких концентрациях конъюгата. Технический результат достигается ПСМА-таргетным соединением для получения комплекса с радионуклидной меткой, предназначенного для тераностики опухолей, экспрессирующих ПСМА, общей формулы Glu-Urea-Lys-2-нафтил-L-аланин-L-тирозин-8Aoc-Lys-DOTA-ацетамид. Комплекс для тераностики опухолей, экспрессирующих ПСМА, включает в себя ПСМА-таргетное соединение с радионуклидной меткой, в качестве которой используют радионуклид 177Lu. 2 н.п. ф-лы, 8 ил., 1 пр.
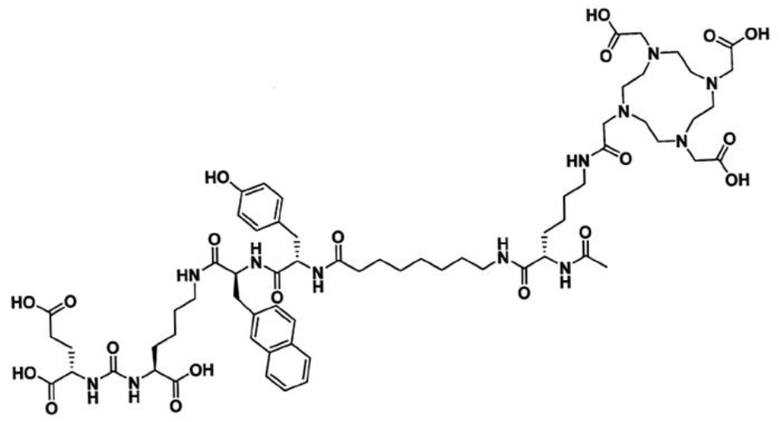
1. Соединение для получения комплекса с радионуклидной меткой, предназначенного для тераностики опухолей, экспрессирующих ПСМА, общей формулы Glu-Urea-Lys-2-нафтил-L-аланин-L-тирозин-8Aoc-Lys-DOTA-ацетамид
2. Комплекс для тераностики опухолей, экспрессирующих ПСМА, включающий в себя соединение по п. 1 с радионуклидной меткой, в качестве которой используют радионуклиды 177Lu.
| WO 2017165473 A1, 28.09.2017 | |||
| WO 2019115547 A1, 20.06.2019 | |||
| WO 2017116994 A1, 06.07.2017 | |||
| RU 2019141963 A, 24.06.2021 | |||
| Буровая коронка | 1934 |
|
SU40919A1 |
| СОЕДИНЕНИЕ ДЛЯ ДИАГНОСТИКИ ОПУХОЛЕЙ, ЭКСПРЕССИРУЮЩИХ ПСМА, И КОМПОЗИЦИЯ НА ЕГО ОСНОВЕ | 2019 |
|
RU2730507C1 |
| А.А | |||
| Ларенков, Г.Е | |||
| Способ получения смеси хлоргидратов опийных алкалоидов (пантопона) из опийных вытяжек с любым содержанием морфия | 1921 |
|
SU68A1 |
Авторы
Даты
2023-09-19—Публикация
2022-10-05—Подача