[001] Настоящее изобретение относится к биоразлагаемому сетчатому имплантату, содержащему полимерную несущую сетку, засеянную фибробластами, для применения при восстановлении мягких тканей в целом и, в частности, при хирургической герниопластике, как заявлено в пункте 1 формулы изобретения. Настоящее изобретение также относится к способу получения сетчатого имплантата и к набору, содержащему сетчатый имплантат согласно настоящему изобретению и дополнительную полимерную опорную сетку.
[002] Заживление ран представляет собой сложный процесс, который включает оркестровку ряда взаимосвязанных клеточных событий и каскадов цитокинов. Основные фазы заживления ран включают образование фибринового сгустка с последующими инфильтрацией воспалительных клеток и фибробластов, образованием грануляционной ткани и ангиогенезом, а также реэпителизацией. Важную роль играют факторы роста и цитокины, которые сначала снабжаются дегранулирующими тромбоцитами, а затем фибробластами и воспалительными клетками, в частности нейтрофилами и макрофагами. Вследствие своей сложной природы процесс заживления ран также является хрупким и восприимчив к прерыванию или патологии, что приводит к образованию хронических ран, заживление которых серьезно затрудняется. Следовательно, в зависимости от размера и типа дефекта мягких тканей может потребоваться хирургическое восстановление, с тем чтобы способствовать процессу заживления ран и снизить риск осложнений.
[003] В области хирургического восстановления мягких тканей часто применяется сетчатый имплантат, состоящий из рассасывающегося или нерассасывающегося материала, который вставляется так, чтобы покрыть область дефекта ткани. Сетчатый имплантат применяется в качестве механического закрытия дефекта и для обеспечения опорной структуры для регенерирующей ткани, т.е. для растущих клеток, которые образуют сильную рубцовую волокнистую ткань вокруг сетчатого имплантата.
[004] Помимо хронических ран, сетчатые имплантаты часто применяется при хирургическом вмешательстве для герниопластики грыжевых дефектов, в частности, в брюшной стенке, которые могут быть результатом травмы, резекции опухоли или пролапса. В общих чертах грыжа может быть описана как прохождение органов или частей органов из полости природного тела через предварительно сформированный или приобретенный зазор. Наиболее часто встречающимися типами грыжи являются паховая грыжа или грыжа бедренной кости, грыжа диафрагмы, пупочная грыжа и послеоперационная грыжа, последняя представляет собой грыжу, которая проталкивается через прошлый хирургический разрез или операцию. При хирургической герниопластике сетчатый имплантат вводят так, чтобы покрыть область дефекта в брюшной стенке для достижения безнатяжного закрытия - со сшиванием или без сшивания окружающих мышц и фасций. Это может быть сделано под местной или общей анестезией с применением техники открытого разреза или лапароскопа при малоинвазивной процедуре.
[005] Причины, по которым возникают грыжи, еще до конца не изучены. Одна из предлагаемых теорий в этой области состоит в том, что некоторые пациенты вследствие нарушений метаболизма коллагена имеют генетическую предрасположенность к развитию рецидивирующих грыж, особенно у пожилых пациентов. Считается, что измененное соотношение коллагена типов I и III у этих пациентов с увеличением коллагена типа III снижает механическую прочность соединительных тканей. Вполне вероятно, что снижение прочности на разрыв коллагена типа III играет ключевую роль в развитии послеоперационных грыж, см. KLINGE, U. et al. Abnormal collagen I to III distribution in the skin of patients with incisional hernia (Аномальноераспределение коллагена I-III в коже пациентов с послеоперационной грыжей). Eur Surg Res. 2000, vol. 32, no. l, стр. 43-48. Также считается, что нарушение выработки коллагена является фактором, способствующим развитию хронических ран, т.е. ран, которые не заживают должным образом и открываются снова и снова, особенно у пациентов с сахарным диабетом и пациентов с сосудистыми нарушениями.
[006] Коммерчески доступные сетки, применяемые сегодня при хирургическом восстановлении мягких тканей, являются либо неразлагающимися, либо полностью разлагаются и через конкретное время рассасываются в теле пациента.
[007] Нерассасывающиеся сетчатые имплантаты чаще всего изготавливаются из различных пластиков, которые, как известно, остаются биостабильными и безопасными в течение нескольких лет после имплантации. Однако введение инородного материала в организм человека или животного может сопровождаться побочными эффектами, такими как миграция сетки, хроническое воспаление, риск инфекции и т.д. Введение в организм относительно большого пластикового куска также может вызвать реакцию на инородное тело, вызванную системой иммунной защиты организма. В результате сетчатый имплантат может смяться и утратить функцию поддержки ткани. Еще одна проблема заключается в том, что пластиковые материалы, применяемые для сеток, например полипропилен, проявляют ограниченное стимулирующее действие на рост клеток. Поэтому врастание клеток в дефект часто ограничено, а заживление раны затягивается.
[008] С другой стороны, полностью рассасывающиеся (биоразлагаемые) сетки имеют то преимущество, что в теле не остается инородных тканей. Было показано, что некоторые полностью биоразлагаемые материалы, такие как полимолочная кислота (poly-lactic acid, PLA/ПМК) или коллаген, способствуют фиброгенезу, т.е. врастанию клеток в дефект мягких тканей, что важно для быстрого и устойчивого заживления ран. Тем не менее, если сетка разлагается и рассасывается слишком быстро, рубцовая бляшка, которая постепенно строится поверх дефекта ткани, еще не сможет выдерживать нагрузки, приложенные к репарированной мягкой ткани во время повседневной деятельности. Это особенно важно в случае герниопластики, так как рубцовая бляшка, покрывающая дефект, должна выдерживать внутрибрюшное давление, в противном случае рецидив грыжи практически гарантирован. Кроме того, сетки, изготовленные, например, из полимолочной кислоты, имеют недостаток, заключающийся в том, что они являются довольно хрупкими и имеют тенденцию к разрушению при складывании или свертывании для введения сетки с помощью лапароскопического инструмента.
[009] Таким образом, проблема, решаемая настоящим изобретением, состоит в обеспечении сетчатого имплантата, который позволяет быстро, безопасно и стабильно закрывать дефекты мягких тканей, в частности хронические раны, свищи или грыжевые дефекты. В то же время компоненты сетчатого имплантата должны быть простыми и недорогостоящими в производстве и выполненными с возможностью их применения с использованием традиционных способов открытого и лапароскопического хирургического вмешательства.
[0010] Указанную проблему решают с помощью сетчатого имплантата по пункту 1, способа получения по пункту 11 и набора для имплантата по пункту 15 формулы изобретения. Предпочтительные варианты осуществления являются объектом зависимых пунктов формулы изобретения.
[0011] В соответствии с настоящим изобретением обеспечен сетчатый имплантат для применения при восстановлении мягких тканей, в частности при хирургической герниопластике или хирургическом заживлении свищей, или при заживлении хронических ран, в теле пациента. Сетчатый имплантат содержит пористую гидрофильную биоразлагаемую полимерную несущую сетку, изготовленную по меньшей мере из первого полимера, содержащего полимолочную кислоту в качестве основного компонента. Термин "основной компонент", таким образом, означает, что содержание полимолочной кислоты в первом полимере выше, чем содержание любого дополнительного полимера, который включает первый полимер.
[0012] Полимерная несущая сетка (которая может в дальнейшем также называться "несущей сеткой") имеет губчатую структуру с соединенными между собой порами разного размера и краевой угол смачивания менее 75°, что означает, что она является гидрофильной. Сетчатый имплантат (который в дальнейшем также может называться "имплантатом") согласно настоящему изобретению дополнительно содержит фибробласты, которые присутствуют на несущей сетке или внутри нее.
[0013] Одним из ключевых элементов настоящего изобретения является то, что несущая сетка является гидрофильной, несмотря на то, что она содержит -предпочтительно в качестве основного компонента - поли(молочную кислоту) (обычно обозначаемую сокращенно "PLA" (polylactic acid) или, в случае поли-L-молочной кислоты, "PLLA" (poly-L-lactic acid)), т.е. биоразлагаемый синтетический полимер, который по своей природе в целом является гидрофобным. Благодаря конкретным этапам обработки при получении несущей сетки, которые будут подробно описаны ниже, несущей сетке могут быть приданы гидрофильные свойства, которые важны для содействия проникновению клеток и их адгезии.
[0014] Другим ключевым элементом настоящего изобретения является то, что несущая сетка несет фибробласты. Неожиданно было обнаружено, что образование новой ткани, особенно рубцовой ткани, для закрытия дефекта мягкой ткани может быть вызвано введением дополнительных фибробластов (любого происхождения, например аутологичных, гетерологичных, ксенофильных) в область дефекта. Таким образом, вместо того, чтобы фокусироваться на стимулировании прорастания тканей, например, гладкомышечных клеток и фибробластов из прилегающей ткани в дефект мягких тканей, например, в хроническую рану, свищ или грыжу, в имплантате согласно настоящему изобретению применяется разлагаемая несущая сетка, с тем чтобы принести увеличенное количество фибробластов в область дефекта. Фибробласты способствуют образованию ткани внеклеточного матрикса и коллагеновых волокон различных типов, тем самым формируя рубцовую бляшку, закрывающую дефект мягкой ткани. Таким образом, рубцовая бляшка будет образовывать прочное соединение между разлагаемой (и, следовательно, временной) полимерной несущей сеткой и краями дефекта, а также другими окружающими структурами (например, брюшной стенкой в случае брюшной грыжи) для обеспечения желаемой поддерживающей функции путем создания дополнительной рубцовости.
[0015] В настоящей заявке применяются следующие определения:
[0016] Термин "биоразлагаемый" означает, что сетка может рассасываться с течением времени, если ее поместить в живой организм, в котором она окружена текучими средами организма.
[0017] Термин "сетка", используемый в данной заявке, относится к трехмерной опоре, т.е. к матрице, что означает структуру, подобную каркасу или губке, которая подходит для колонизации клетками. В этом смысле сетка служит в качестве трехмерной основы, которая может быть заселена клетками или тканью. Эта колонизация может происходить in vitro или in vivo. Кроме того, применительно к трансплантациям указанная сетка служит для определения местоположения трансплантата, а также в качестве метки-заполнителя для ткани, которая постепенно формируется in vivo.
[0018] Термин "пористый", таким образом, относится к структуре, содержащей поры, т.е. полости или пустотные области. Эти поры могут иметь круглую форму и/или угловую форму в 2-мерном сечении и/или наклонную форму, если смотреть в 3-х измерениях. Форма пор также может характеризоваться расширениями так, что ее можно сравнить с формой нервных клеток. Хотя в целом термин "поры" также относится к полостям, образованным филаментами, окружающими пустотные области, поры в рамках значения согласно настоящему изобретению представляют собой полости, образованные в трехмерной губчатой структуре. Таким образом, полости закрываются стенками, как в естественных губках или кораллах. Эти поры или полости также могут быть соединены между собой, что означает, что стенки пор между двумя соседними порами могут содержать отверстия, образующие соединение между указанными соседними порами. В этом отношении следует отметить, что поры также могут быть образованы пустотными областями между гранулами гидрогеля.
[0019] Как упоминалось выше, полимерная несущая сетка согласно настоящему изобретению имеет трехмерную пористую губчатую структуру, содержащую поры разных размеров. В этом отличие от вязаной сетчатой конструкции. По меньшей мере некоторые из пор благодаря этому соединены между собой так, что они разделяют пространство с образованием соединенной по текучей среде межуточной сети. Таким образом, фибробласты могут распространяться по сетчатой структуре.
[0020] По смыслу настоящей заявки термин "гидрофильный" или "гидрофильность", применяемый в контексте настоящего изобретения, относится к краевому углу смачивания площади гидрофильной поверхности непосредственно на несущей сетке, составляющему менее 75°. Предпочтительно, он относится к краевому углу смачивания менее 60°.
[0021] Как уже упоминалось, биоразлагаемые синтетические полимеры, такие как полигликолиевая кислота или полимолочная кислота, обычно являются гидрофобными, и поверхности пористых каркасов или сеток, полученных из этих полимеров, поэтому обычно также являются гидрофобными. Было обнаружено, что гидрофильные свойства полимерной сетки, содержащей полимолочную кислоту в качестве основного компонента, могут быть улучшены с помощью способов последующей обработки, таких как плазменная обработка (т.е. обработка ионизированной газовой плазмой) и/или покрытие поверхности пористой структуры каркаса природным полимером, таким как коллаген или желатин.
[0022] Термин "биосовместимые полимеры" относится к полимерам, которые являются биологически переносимыми и не вызывают отторжения при попадании в живой организм. Для настоящего изобретения биосовместимые полимеры также охватывают полимеры, которые распознаются хозяином как чужеродные, но отторжение которых может быть подавлено соответствующей иммуносупрессией.
[0023] Выражение "биоразлагаемый" относится к материалу, который может превращаться в метаболизируемые продукты в живых организмах (или текучих средах организма или культурах клеток, полученных из живых организмов). Биологически разлагаемые полимеры включают, например, полимеры, которые являются саморассасывающимися и/или биоэродируемыми. "Биоэродируемый" означает способность растворяться или суспендироваться в биологических текучих средах. Саморассасывающийся означает способность поглощаться клетками, тканями или текучими средами живого организма.
[0024] В предпочтительном варианте осуществления полимерная несущая сетка имеет краевой угол смачивания менее 40°, предпочтительно менее 25°, более предпочтительно менее 15°, наиболее предпочтительно краевой угол смачивания гидрофильной поверхности несущей сетки находится в диапазоне от 0° до 10°, и, таким образом, несущая сетка является "супергидрофильной".
[0025] Термин "угол смачивания", применяемый в тексте настоящего изобретения, относится к углу смачивания воды на поверхности, т.е. к углу, образованному на границе раздела, где вода соприкасается с поверхностью. Таким образом, "вода", применяемая для измерения угла смачивания, относится к чистой воде, в особенности к сверхчистой воде. В частности, измерение угла смачивания осуществляют методом лежащей капли (например, с помощью устройства типа EasyDrop DSA20E от фирмы Kruss GmbH), используя размер капли 0,3 мкл. В общем случае, углы смачивания вычисляют путем подгонки функции кругового сегмента к контуру капли, помещенной на поверхность.
[0026] Было обнаружено, что несущая сетка, обладающая гидрофильными свойствами, способствует врастанию ткани, например, гладкомышечных клеток и фибробластов, из прилегающей ткани грыжевого дефекта и обеспечивает равномерное распределение клеток на сетке и по всей сетке. Кроме того, пористая природа несущей сетки обеспечивает среду, стимулирующую рост клеток, которые способствуют образованию ткани внеклеточного матрикса и коллагеновых волокон различных типов, тем самым формируя рубцовую бляшку, закрывающую грыжу. Образование рубцовой бляшки создаст прочное соединение между разлагаемой (и, следовательно, временной) полимерной несущей сеткой и краями грыжевого дефекта, а также брюшной стенкой или другими окружающими структурами. Пока продолжается разложение несущей сетки, вновь образованная рубцовая ткань будет обеспечивать необходимую опорную функцию путем создания дополнительного рубцевания, предотвращая, тем самым, образование рецидивной грыжи. В конце концов, после полного разложения несущей сетки, т.е. когда полимерные компоненты сетки рассосались, в теле пациента не останется постоянного инородного материала.
[0027] В предпочтительном варианте осуществления несущая сетка имеет плоскую листообразную форму и является упруго деформируемой, что позволяет ее складывать или сворачивать. В этом варианте осуществления предпочтительно, чтобы несущая сетка была упруго деформируемой, чтобы ее можно было складывать или сворачивать, и она могла возвращать свою первоначальную форму. Это позволяет вводить свернутую или сложенную сетку через троакар при лапароскопической процедуре.
[0028] Если несущая сетка обеспечена в форме листа, она предпочтительно имеет толщину по меньшей мере 0,1 мм, более предпочтительно по меньшей мере 0,3 мм, еще более предпочтительно примерно от 1 мм до примерно 4 мм, в некоторых случаях она может быть даже толще, например до 10 мм.
[0029] Если она обеспечена в форме листа, поперечное сечение несущей сетки может быть любого вида, например прямоугольным, квадратным, круглым, овальным и т.д., и затем она может быть разрезана в соответствии с формой грыжевого дефекта. Например, общая форма поперечного сечения может быть круглой или овальной.
[0030] Несущая сетка может быть в виде одной единой непрерывной структуры или может быть также обеспечена в виде множества более мелких частей сетки (т.е. "лоскутов"), которые отделены друг от друга. Эти небольшие сетчатые лоскуты могут содержаться в пастообразном, жидком или полужидком составе.
[0031] В альтернативном варианте осуществления несущая сетка может быть обеспечена в виде гидрогеля, т.е. без конкретной трехмерной наружной или поперечной формы - гидрогель, в силу своей в целом гидрофильной природы, способствует росту ткани в порах, благодаря чему достигается немедленное прикрепление несущей сетки к ткани. Гидрогель также может быть смешан с другими веществами, такими как факторы роста или фармацевтически активные вещества.
[0032] Что касается состава материала несущей сетки, предпочтительно, чтобы несущая сетка была выполнена только из первого полимера, который содержит полимолочную кислоту в качестве основного компонента, или из первого полимера и дополнительно природного полимера, выбранного из группы, состоящей из коллагена, желатина, ламинина, фибриногена, альбумина, хитина, хитозана, агарозы, альгината гиалуроновой кислоты и их смесей, причем коллаген является предпочтительным.
[0033] Предпочтительно губчатая структура полимерной несущей сетки состоит из первого полимера и покрыта указанным по меньшей мере одним природным полимером. Если пористая поверхность несущей сетки покрыта или накрыта природным полимером, предпочтительно, чтобы нижележащая пористая структура несущей сетки не изменялась покрытием. В частности, размер пор предпочтительно существенно не изменяется, например, путем образования дополнительных сетей в порах несущей сетки. Это гарантирует, что покрытие не оказывает отрицательного воздействия на способность фибробластов проникать в несущую сетку и распространяться внутри нее. Более подробная информация по этому поводу приведена ниже в экспериментальном разделе.
[0034] Кроме того, предпочтительно, чтобы природный полимер покрыл практически все доступные поверхности (за исключением поверхностей в закрытых порах) несущей сетки. Таким образом, клетки будут распространяться не только по верхней поверхности, но и внутри пористой структуры несущей сетки.
[0035] Предпочтительно первый полимер состоит по меньшей мере на 70% из поли(молочной кислоты), еще более предпочтительно по меньшей мере на 80% из поли(молочной кислоты). Было обнаружено, что полимолочная кислота обладает хорошей прочностью на разрыв и высоким модулем упругости. Кроме того, было обнаружено, что полимолочная кислота полезна в отношении достижения и поддержания гидрофильных свойств, полученных плазменной обработкой и/или путем покрытия структуры полимолочной кислоты природным полимером, таким как коллаген.
[0036] В рамках данной заявки термин "полимолочная кислота" (poly lactic acid, PLA) включает, например, поли-L-молочную кислоту (poly-L-lactic acid, PLLA) или поли-D,L-молочную кислоту (рацемическую смесь L- и D-лактидов; poly-D,L-lactic acid, PDLLA). Конкретным примером предпочтительного первого полимера является поли(L-лактид), который коммерчески доступен от компании Sigma Corporation (номер в каталоге PLLA Р1566) с молекулярной массой 85000-16000. Подходящей альтернативой является поли-L-молочная кислота от компании Durect Corporation (номер по каталогу Lactel® В6002-2).
[0037] В частности, было обнаружено, что для несущих сеток, изготовленных из материала с высоким содержанием полимолочной кислоты, в частности, если первый полимер состоит более чем на 50% из полимолочной кислоты, например по меньшей мере на 70% из полимолочной кислоты, гидрофильность поверхности может быть не только значительно улучшена - например, только плазменной обработкой или в сочетании с покрытием сетки природным полимером и при этом гидрофильность также может сохраняться в течение длительного времени. Фактически, гидрофильность также может поддерживаться после стерилизации несущей сетки перекисью водорода (как будет дополнительно описано ниже). Это увеличение гидрофильное™ не может быть достигнуто путем плазменной обработки сетки, содержащей, например, полигликолиевую кислоту (PGA) в качестве основного компонента.
[0038] Хотя первый полимер может по существу состоять из чистой полимолочной кислоты, он также может быть изготовлен из смеси полимолочной кислоты с другими биоразлагаемыми материалами, такими как полигликолиевая кислота. Например, первый полимер может состоять на 75% из полимолочной кислоты и на 25% полигликолиевой кислоты (по отношению к массе первого полимера). Одна из причин использования смеси полимолочной кислоты и других биоразлагаемых материалов заключается в том, что сетки из чистой полимолочной кислоты менее устойчивы к деформации по сравнению с сетками, изготовленными из полимолочной кислоты, смешанной с другими полимерами, такими как полигликолиевая кислота (PGA). Сокращенным наименованием полигликолевой кислоты является PGA (poly-glycolic acid). Сополимеры полимолочной кислоты и полигликолевой кислоты - так называемые сополимеры полилактида и гликолиевой кислоты (PLGA или PLG, poly-lactide-co-glycolic acid) - являются привлекательными кандидатами для изготовления биоразлагаемых сеток благодаря своим гибким и четко определенным физическим свойствам и относительной биосовместимости. Кроме того, продукты их разложения представляют собой низкомолекулярные соединения, которые попадают в нормальные метаболические пути. Кроме того, сополимеры полилактида и гликолиевой кислоты обладают преимуществом широкого спектра скоростей разложения от нескольких дней до лет за счет простого изменения соотношения сополимеров молочной кислоты и гликолевой кислоты.
[0039] В частности, если сетчатый имплантат предназначен для применения при лапароскопии при минимально инвазивной хирургии, он должен вводиться с помощью лапароскопического инструмента, такого как троакар. Для этих применений несущая сетка предпочтительно имеет форму пасты или гидрогеля или альтернативно имеет форму, которая может быть упруго сложена или свернута для введения через лапароскопический инструмент. Эластичные свойства могут быть обеспечены за счет использования сополимеров полилактида и гликолиевой кислоты, т.е. смеси полимолочной кислоты и полигликолевой кислоты, в качестве первого полимера.
[0040] Таким образом, для складной несущей сетки первый полимер предпочтительно изготовлен из сополимеров полилактида и гликолиевой кислоты (PLGA), в частности, поли(гликолевой кислоты-молочной кислоты), имеющей содержание молочной кислоты примерно 75 мол. % и содержание гликолевой кислоты примерно 25 мол. %). Такой материал поли(D,L-лактид-со-гликолид), с соотношением составляющих 75:25, может быть приобретен, например, как RESOMER® RG 752 от компании Evonik Industries AG (Эссен, Германия) или от компании Sigma Corporation PLGA, каталожный номер Р1941. Другими предпочтительными полимерными смесями являются поли(D,L-лактид-с-гликолидом) 65:35, например RESOMER® RG 653; поли(D,L-лактид-с-гликолидом) 75:25, например RESOMER® RG 502 от компания Durect (Купертино, Калифорния, США); поли(D,L-лактид-с-гликолидом) 85:15, например RESOMER® RG 858 или абсорбируемые полимеры LACTEL®.
[0041] Способы получения для получения пористых сеток из перечисленных синтетических полимеров хорошо известны в данной области техники. Один возможность заключается в применении технологии выщелачивания соли, описанной, например, в европейском патенте №2256155.
[0042] Как уже упоминалось, в предпочтительном варианте осуществления несущая сетка по существу состоит только из одного первого полимера или из первого полимера и дополнительного природного полимера, выбранного из группы, состоящей из коллагена, желатина, ламинина, фибриногена, альбумина, хитина, хитозана, агарозы, альгината гиалуроновой кислоты и их смесей. Природный полимер предпочтительно покрывает все поверхности несущей сетки. Таким образом, несущая сетка будет обеспечивать особенно гидрофильную, благоприятную для клеток среду, которая увеличивает выживаемость и скорость пролиферации клеток на сетке и внутри нее.
[0043] Из вышеупомянутых природных полимеров наиболее предпочтительным является коллаген. Коллаген представляет собой биомолекулу внеклеточного матрикса (ВКМ, extracellular matrix, ЕСМ) и является основным компонентом кожи и костей. Благодаря своей нановолоконной архитектуре коллаген особенно эффективен для стимулирования клеточной адгезии, роста и дифференцированной функции в тканевых культурах. Однако также было обнаружено, что, если природный полимер содержит коллаген, гидрофильные свойства несущей сетки согласно настоящему изобретению особенно улучшаются. В этом отношении термин "коллаген", как использовано в контексте настоящего изобретения, охватывает коллагены природного происхождения и синтетически полученные коллагены, а также вещества, полученные из коллагена, такие как желатин, который представляет собой гидролизованную форму коллагена.
[0044] В предпочтительном варианте осуществления природный полимер по существу состоит из коллагена. В этом отношении природный полимер может состоять только из одного типа коллагена, т.е. типа I, или может состоять из смеси типов коллагена, например смеси коллагена типа I и коллагена типа IV. В последнем случае предпочтение отдается смеси, содержащей примерно равные массовые проценты белков. Коллаген типа I является наиболее предпочтительным, поскольку он легкодоступен, имеет высокую степень биосовместимости и обеспечивает дополнительную прочность на разрыв. Кроме того, он является одним из основных компонентов естественных кровеносных сосудов и обеспечивает естественное место прикрепления клеток, участвующих в процессе заживления ран. Наконец, было показано, что продукт разложения коллагена I-III типов вызывает хемотаксическое притяжение человеческих фибробластов, что особенно полезно для предполагаемого применения несущей сетки в качестве имплантата, содержащего фибробласты.
[0045] Еще одним преимуществом имплантата по изобретению является возможность включения агентов в несущую сетку и последующей их доставки к участку раны, которые влияют на рост клеток, таких как коллаген типов IV и V, фибронектин, ламинин, гиалуроновая кислота и протеогликаны. Аналогичным образом, в несущую сетку также могут быть включены фармакологически активные вещества, такие как эпидермальный фактор роста, тробоцитарный фактор роста, трансформирующий фактор роста бета, фактор ангиогенеза, антибиотики, противогрибковые средства, спермицидные средства, гормоны, ферменты и/или ингибиторы ферментов.
[0046] Что касается разложения несущей сетки в организме - которое обычно происходит в результате биоабсорбции ее компонентов - предпочтительно, чтобы общее время разложения в живом организме составляло от 1 до 12 месяцев, предпочтительно от 1 до 8 месяцев, более предпочтительно примерно от 1 до 6 месяцев, наиболее предпочтительно примерно от 2 до 4 месяцев.
[0047] Поэтому для содействия образованию рубцовой ткани предпочтительно, чтобы несущая сетка дополнительно содержала факторы роста, предпочтительно выбранные из группы, состоящей из интерлейкинов, кислого фактора роста фибробластов, основного фактора роста фибробластов, эпидермального фактора роста, инсулиноподобного фактора роста, белка, связывающего инсулиноподобный фактор роста, тромбоцитарного фактора роста, трансформирующего фактора роста альфа, трансформирующего фактора роста бета, фактора роста эндотелия сосудов и фактора роста гепатоцитов. Эти факторы роста важны для регулирования пролиферации и дифференцировки клеток, синтеза белка и ремоделирования ВКМ (внеклеточного матрикса). В частности, было показано, что основной фактор роста фибробластов, тромбоцитарный фактор роста, фактор роста эндотелия сосудов и фактор роста гепатоцитов увеличивают грануляцию, эпителизацию и образование капилляров за счет секреции ангиогенных цитокинов. Также было доказано, что они ингибируют миграцию нейтрофилов и макрофагов к месту раны за счет секреции факторов, которые ингибируют миграцию и подавление как IL-1α, так и IL-1β, а также секретируют противовоспалительные факторы, которые предотвращают апоптоз и улучшают заживление раны.
[0048] Предпочтительно факторы роста добавляются к несущей сетке вместе с мезенхимальным секретомом плаценты. Одним предпочтительным коммерчески доступным секретомом является секретом, содержащий стволовые клетки из желе Уортона (CM-hWAO), которые культивировали в условиях гипоксии. Этот секретом стволовых клеток можно получить в Институте стволовых клеток и рака (РТ. Kalbe Farma Tbk.). Секретом применяется для стимуляции роста имплантированных клеток на несущей сетке. Учитывая его применение в качестве медицинского устройства, добавление секретома можно применять экстракорпорально в инкубаторе для стимуляции роста клеток перед имплантацией. Как только будет достигнут достаточный рост клеток, сетку можно промыть необходимой средой перед имплантацией.
[0049] Применение секретома, содержащего стволовые клетки из желе Уортона (CM-hW JSC), которые культивировали в условиях гипоксии для стимуляции роста клеток, оказалось высокоэффективным не только для стимуляции фибробластов, но и для других клеток, в частности клеток, которые более чувствительны к обработке и культивированию, таких как клетки печени (гепатоциты). Фактически, гепатоциты обычно культивируют совместно с клетками поджелудочной железы, в частности, клетками островков Лангерганса, поскольку это показало увеличение выживаемости и скорости пролиферации гепатоцитов. При добавлении упомянутого секретома к гепатоцитам в культуральных средах рост и пролиферация гепатоцитов оказались еще лучше, чем при совместном культивировании с клетками островков Лангерганса.
[0050] Фибробласты, обеспеченные на несущей сетке, предпочтительно являются аутологичными фибробластами пациента, которому имплантат предназначен для установки. Таким образом, значительно снижается риск нежелательного иммунного ответа пациента вследствие имплантации чужеродного клеточного материала.
[0051] Настоящее изобретение также относится к способу получения сетчатого имплантата, описанному выше, посредством следующих этапов:
a) обеспечения биоразлагаемой полимерной несущей сетки, как описано выше;
b) плазменной обработки полимерной несущей сетки плазмой окисленного газа при температуре ниже 50°С и
c) инокуляции полимерной несущей сетки фибробластами.
[0052] Было обнаружено, что плазменная обработка усиливает гидрофильные свойства поверхности, не оказывая отрицательного воздействия на стабильность или структурную целостность несущей сетки. Испытания показали, что плазменная обработка была особенно эффективной в отношении усиления, а также поддержания гидрофильных свойств, если полимерная несущая сетка имела высокое содержание полимолочной кислоты, т.е. содержала полимолочную кислоту в качестве основного компонента. С другой стороны, плазменная обработка сеток с полигликолевой кислотой не привела к значительному увеличению гидрофильности.
[0053] Плазму ионизированного газа, применяемую для плазменной обработки, предпочтительно выбирают из группы, состоящей из гелия, аргона, азота, неона, силана, водорода, кислорода и их смесей. Предпочтительным газом для обработки является кислород.
[0054] Плазменная обработка предпочтительно включает плазменную обработку при низком давлении, при которой несущая сетка подвергается воздействию плазмы ионизированного газа при температуре ниже 50°С, предпочтительно ниже 40°С. Давление предпочтительно находится в диапазоне от 10-2 до 10-6 бар, предпочтительно в диапазоне от 0,1 до 1,0 мбар.
[0055] Предпочтительное время обработки составляет по меньшей мере одну минуту, предпочтительно от 2 до 30 минут, более предпочтительно от 5 до 20 минут.
[0056] Таким образом, термин "плазма" в общем случае относится к возбужденному и содержащему радикалы газу, т.е. к электропроводящему технологическому газу, включающему электроны и ионы. Плазму обычно генерируют посредством электродов в вакуумной камере (так называемый "подход с высокочастотной плазмой"), однако ее также можно генерировать с применением емкостных или индуктивных способов или микроволнового излучения.
[0057] Более предпочтительно, способ получения имплантата, как описано выше, включает этапы
a) обеспечения биоразлагаемой полимерной несущей сетки, как описано выше;
b) покрытия по меньшей мере поверхности полимерной несущей сетки природным полимером, предпочтительно коллагеном;
c) плазменной обработки полимерной несущей сетки плазмой окисленного газа при температуре ниже 50°С и
d) инокуляции полимерной несущей сетки фибробластами.
[0058] Было обнаружено, что покрытие сетки полимерного носителя природным полимером, в частности коллагеном, также усиливает гидрофильные свойства поверхности сетки и является весьма полезным с точки зрения применения сетки носителя в качестве носителя для пролиферации клеток.
[0059] Особенно предпочтительно, чтобы перед инокуляцией фибробластами полимерную несущую сетку стерилизовали путем ее обработки Н2О2 при температуре ниже 50°С.
[0060] Этап стерилизации согласно способу получения, раскрытому в настоящем изобретении, является весьма предпочтительным для получения имплантата согласно настоящему изобретению. Неожиданно было обнаружено, что стерилизация с использованием перекиси водорода обеспечивает идеальную стерилизацию несущей сетки без использования каких-либо традиционных методов стерилизации, включающих горячий пар, гамма-лучи, облучение электронным пучком или жесткую химическую обработку, которые, как было показано, вызывают изменения или даже разрушение молекулярной структуры полимерной несущей сетки и, следовательно, не только снижает ее механическую и ферментативную стойкость, но и снижает ее гидрофильные свойства. Кроме того, способ стерилизации перекисью водорода по изобретению сохраняет любой слой коллагена, который может быть обеспечен на несущей сетке. В отличие от традиционных методов стерилизации, которые приводят к денатурализации слоев коллагена, в частности, в случае нанотолстых слоев коллагена, обработка с H2O2, как описано выше, действительно имеет этот ухудшающий эффект.
[0061] Время стерилизации сильно зависит от температуры и давления внутри камеры и концентрации раствора H2O2. Раствор H2O2 предпочтительно содержит H2O2 в количестве примерно 30% по объему или менее. Предпочтительное время обработки составляет по меньшей мере одну минуту, предпочтительно по меньшей мере 5 минут или по меньшей мере один час. При применении "более высокого" давления (например, примерно 10 мбар) и низких температур (например, ниже 40°С) или концентраций H2O2 менее 30 об.% может быть целесообразным время обработки до 10-12 часов.
[0062] Среду, содержащую перекись водорода, можно получить либо путем обработки плазмой H2O2, либо путем размещения стерилизуемого субстрата в вакуумную камеру вместе с источником (обычно жидкой) перекиси водорода. При приложении вакуума внутри вакуумной камеры перекись водорода сублимируется, и создается атмосфера, содержащая перекись водорода. Кроме того, отрицательное давление, приложенное в вакуумной камере, предпочтительно находится в диапазоне от 10-6 до 10-2 бар, более предпочтительно от 0,1 до 20,0 мбар, например около 9 мбар.
[0063] Для способствования процессу заживления ран описанный выше способ предпочтительно включает дополнительный этап, на котором секретом, содержащий факторы роста, в частности мезенхимальный секретом, вводят на несущую сетку или внутрь нее.
[0064] Настоящее изобретение также относится к применению сетчатого имплантата согласно настоящему изобретению при закрытии первичной раны, например, после первичного разреза брюшной полости, с тем чтобы способствовать заживлению ран, особенно в случае хронических ран и процессов рубцевания. Кроме того, он также хорошо подходит для применения при закрытии свищей или грыж.
[0065] В дополнительном аспекте настоящее изобретение также относится к способу закрытия грыжи с применением имплантата, описанного выше. В целом, во время указанного способа разлагаемая полимерная несущая сетка с посеянными фибробластами будет помещена над дефектом, например брюшной стенкой (пластика паховой грыжи по Лихтенштейну), под мышечным слоем брюшной стенки (методика sublay), в качестве пластики IPOM или в любой технике, которую хирург может счесть подходящей для пластики.
[0066] Помимо грыж, сетчатый имплантат согласно настоящему изобретению также особенно хорошо подходит для хирургического закрытия свищей. Свищ - это соединение, выстилаемое эпителиальной тканью, патологически соединяющее интраабдоминальное пространство с кожей, имеющее отверстие на уровне кожи - часто вызывающее текучую среду, протекающую через кожу - или патологическое соединение между толстым или тонким кишечником и анальной областью. Свищи трудно лечить хирургическим путем и они склонны к повторным рецидивам. До сегодняшнего дня полная резекция всей фистулы является предпочтительной терапией. Были разработаны различные материалы, которые можно вставить в резецированный канал для улучшения процесса заживления. Ни одно из них не доказало, что оно гарантирует долговременный успех. Однако было обнаружено, что введение или имплантация несущей сетки, несущей фибробласты, как описано выше, существенно увеличивает процесс заживления. Этот эффект также наблюдался при хронических ранах и свищах. В этом отношении, в соответствии с приведенным выше описанием, несущая сетка может иметь форму листа или не иметь определенной геометрической формы при выполнении в виде пасты или гидрогеля.
[0067] Настоящее изобретение также относится к набору для применения при хирургическом восстановлении мягких тканей, в частности при лечении свищей или герниопластике, в теле пациента, причем набор содержит а) полимерную несущую сетку, как определено выше, и b) дополнительную, предпочтительно биоразлагаемую, опорную сетку, имеющую более низкую скорость разложения, чем полимерная несущая сетка.
[0068] Если опорная сетка является биоразлагаемой, она предпочтительно имеет скорость разложения в диапазоне от 4 до 12 месяцев.
[0069] Неразлагаемая или разлагаемая опорная сетка предназначена для размещения под полимерной несущей сеткой для перекрытия грыжи после разложения полимерной несущей сетки. Это означает, что в целом опорная сетка будет обеспечивать дополнительную опорную функцию после первых трех месяцев.
[0070] В предпочтительном варианте осуществления опорная сетка является биоразлагаемой и разлагается самое большее через 12 месяцев. Подобно несущей сетке, опорная сетка предпочтительно является по меньшей мере частично гидрофильной и, таким образом, способствует образованию рубцовой бляшки, перекрывающей грыжу.
[0071] Наиболее предпочтительно, опорная сетка представляет собой обычную коммерчески доступную сетку.
[0072] В предпочтительном варианте осуществления полимерная опорная сетка содержит один или более полимеров, выбранных из группы, состоящей из поли(гликолевой кислоты), поли(молочной кислоты), поли(гликолевой кислоты-молочной кислоты) и их смесей. Кроме того, в этом варианте осуществления, если и полимерная несущая сетка, и опорная сетка являются биоразлагаемыми, то несущая сетка предпочтительно имеет более высокую скорость разложения, чем опорная сетка.
[0073] В другом предпочтительном варианте осуществления набор включает в качестве опорной сетки дополнительную двухслойную антиадгезионную сетку, которая содержит два отдельных или выполненных за одно целое слоя, состоящих из
i) гидрофильного слоя, обращенного к брюшине или обнаженной мышечной ткани или фасции живота и имеющего краевой угол смачивания меньше 75°, предпочтительно меньше 60°, и
ii) гидрофобного слоя, имеющего краевой угол смачивания больше 90°.
[0074] Этот вариант осуществления набора для имплантата обеспечивает два основных преимущества: с одной стороны, полимерная несущая сетка обеспечивает временное закрытие дефекта, в частности грыжи или свища, в то время как фибробласты образуют новую рубцовую ткань, которая возьмет на себя опорную функцию несущей сетки после ее разложения. С другой стороны, двухслойная антиадгезионная сетка, которая функционирует как опорная сетка, имеет верхний слой с гидрофильными свойствами, которые будут способствовать росту ткани на стороне, обращенной к дефекту мягких тканей, в частности пролиферацию имплантированных фибробластов, которые помогают формировать рубцовую бляшку, в конечном итоге закрывающую дефект, и нижний слой с гидрофобными свойствами, которые предотвращают прикрепление различных клеток, в частности воспалительных клеток, фибрина или дебриса, к антиадгезионной сетке с внутрибрюшинной стороны, т.е. со стороны опорной сетки, обращенной в сторону от дефекта, таким образом, что возникает воспаление и возникает рост спаечной ткани между антиадгезионной сеткой или вновь образованной рубцовой пластиной и нижележащими тканями брюшной полости.
[0075] Хотя, как говорят, опорная сетка в целом имеет более медленную скорость разложения, чем несущая сетка, также может быть так, что части опорной сетки имеют скорость разложения, аналогичную скорости разложения несущей сетки. Например, в варианте осуществления, в котором опорная сетка имеет верхний и нижний слой, как определено в предыдущих абзацах, верхний слой может иметь более высокую скорость разложения, чем нижний слой, так что, например, время разложения верхнего слоя в живом организме составляет от 1 до 3 месяцев, предпочтительно примерно 2 месяцев, а время разложения нижнего слоя в живом организме составляет от 4 до 8 месяцев, предпочтительно примерно 6 месяцев. Это означает, что в этом двухслойном варианте осуществления именно нижний слой опорной сетки обеспечивает дополнительную опорную функцию в течение первых четырех-восьми месяцев. После этого времени нижний слой также предпочтительно будет разлагаться.
[0076] Учитывая их применение при герниопластике или хирургическом заживлении свищей, предпочтительно, чтобы по меньшей мере одна, предпочтительно как полимерная несущая сетка, так и опорная сетка имела/имели гибкость, которая позволяет вводить ее/их в тело пациента через лапароскопический инструмент.
[0077] Каждая из полимерной несущей сетки и опорной сетки может быть предоставлена в любой форме, например, прямоугольной, квадратной, круглой, овальной и т.д., и затем она может быть разрезана в соответствии с формой грыжевого дефекта. Например, общая форма сетки может быть круглой или овальной. В качестве альтернативы, сетки могут иметь в целом квадратную или прямоугольную форму. В качестве еще одной альтернативы, опорная сетка может иметь плоскую листообразную форму, а несущая сетка выполнена в виде пасты или гидрогеля, содержащей или содержащего фибробласты. Таким образом, опорная сетка будет удерживать несущую сетку на месте, в то время как несущая сетка может быть использована для заполнения дефекта мягких тканей.
[0078] Набор для имплантата согласно настоящему изобретению при применении для закрытия грыжи может быть применен следующим образом:
[0079] Во-первых, обеспечивают набор для имплантата, как описано выше. Затем через кожу и ткань пациента делают разрез для получения доступа к дефекту в брюшине. Затем полимерную опорную сетку помещают либо над дефектом, например брюшной стенкой (пластика паховой грыжи по Лихтенштейну), либо в качестве альтернативы под мышечным слоем брюшной стенки (методика sublay), либо в качестве IPOM (intraperitoneal on lay mesh, внутрибрюшинной накладной сетки) ниже брюшины перед размещением полимерной несущей сетки поверх опорной сетки. Если несущая сетка обеспечена в форме листа, она может быть дополнительно прикреплена к мышцам живота. Затем разрез закрывают.
[0080] Грыжевой дефект обычно закрывается рубцовой бляшкой в течение 3-6 месяцев, и за это время биоразлагаемая несущая сетка постепенно теряет свою прочность и консистенцию. В конце концов, не останется постоянного инородного материала, когда компоненты сетки биопоглотятся в теле.
Экспериментальные данные
Получение несущей сетки
[0081] Твердые частицы хлорида натрия (NaCl) измельчили с использованием ступки и пестика перед просеиванием с получением частиц NaCl размером от 355 до 425 мкм. 9 г частиц NaCl поместили в центрифужную пробирку и высушили в эксикаторе. Затем частицы NaCl поместили в алюминиевый поддон.
[0082] Раствор поли-L-молочной кислоты, приготовленный из 1 г гранул поли-L-молочной кислоты, растворенных в 5 мл хлороформа, смешали с частицами NaCl, и затем смесь равномерно распределили в алюминиевом поддоне с образованием плоского слоя поли-L-молочной кислоты. Растворителю дали возможность испариться путем сушки на воздухе при комнатной температуре в течение от 20 до 48 часов, предпочтительно от 24 до 36 часов, наиболее предпочтительно от 28 до 32 часов. В качестве альтернативы, испарение растворителя проводили в печи с регулируемой температурой, помещенной в вытяжной шкаф для извлечения хлороформных токсичных газов.
[0083] Предварительно высушенный слой поли-L-молочной кислоты-NaCl отделили от алюминиевого поддона и высушили в вакуумной камере при отрицательном давлении 0,1 МПа в течение 3-4 дней.
[0084] Полученные высушенные слои поли-L-молочной кислоты-NaCl поместили в химический стакан, и частицы NaCl подвергли выщелачиванию, промывая матрицы деионизированной водой. Для этого матрицы погрузили в ddH2O (дважды денонсированную воду) и выдержали в ванне для линейного встряхивания при 25°С (комнатной температуре) при 60 об/мин в течение 48 часов. Воду в химическом стакане меняли каждые 1-2 часа. Полученные таким образом сетки из поли-L-молочной кислоты извлекли из химического стакана и высушили в вытяжном шкафу в течение ночи.
Последующая обработка коллагеном
[0085] Сетки из поли-L-молочной кислоты были нарезаны с получением круглой формы диаметром 1 см. Каждую сетку из поли-L-молочной кислоты затем погружали в кислый раствор коллагена типа I (1,0 (масс./об.)%, рН 3,0, приобретенный в компании Wako) под вакуумом, так что поры сетки были заполнены раствором коллагена. Для удаления любого избыточного раствора коллагена в сетках из поли-L-молочной кислоты их поместили в центрифужную пробирку и центрифугировали в течение 10 мин при центробежном ускорении 2000 g. Было обнаружено, что ускорение более 600 g обеспечивает образование сеток из поли-L-молочной кислоты, покрытых коллагеном, вместо образования коллагеновых микрогубок в порах.
[0086] Затем сетку из коллагена-поли-L-молочной кислоты замораживали при -80°С в течение 12 часов и лиофилизировали под вакуумом <5 Па в течение дополнительных 24 часов для удаления любого растворителя с сетки.
[0087] Если использовали сшивающий агент (который оказался несущественным для получения сетки), сетку из коллагена-поли-L-молочной кислоты дополнительно сшивали обработкой парами глутаральдегида, насыщенными 25% водным раствором глутаральдегида при 37°С в течение 4 часов. После сшивания сетку обработали 0,1 М водным раствором глицина для блокирования непрореагировавших альдегидных групп. Вместо глицина можно использовать другие блокирующие агенты, например казеин, альбумин, желатин или метанол-уксусный ангидрид. После промывки деионизированной водой и лиофилизации полимерная несущая сетка была получена в качестве конечного продукта. После лиофилизации (также известной как сублимационная сушка) сетки из коллагена-поли-L-молочной кислоты были сохранены в эксикаторе до использования.
[0088] Несущие сетки были получены с порами, имеющими диаметр в диапазоне от 50 до 900 микрометров, предпочтительно от 280 до 560 микрометров, наиболее предпочтительно от 355 до 425 микрометров.
[0089] Примечательно, что поры в сетках из поли-L-молочной кислоты имели по существу ту же форму, что и частицы NaCl. Коллагеновое покрытие сеток из поли-L-молочной кислоты, таким образом, изменило только смачиваемость поверхности (гидрофильность), но не изменило структуру пор.
[0090] По сравнению с сетками из поли-L-молочной кислоты без покрытия, сетка из поли-L-молочной кислоты с коллагеновым покрытием продемонстрировала как улучшенную смачиваемость, так и высокое водопоглощение.
Обработка плазмой О2
[0091] Несущие сетки - покрытые коллагеном или нет при необходимости подвергали плазменной обработке с использованием плазмы ионизированного газа, предпочтительно выбранной из группы, состоящей из гелия, аргона, азота, неона, силана, водорода, кислорода и их смесей. Предпочтительно, была использована плазменная обработка с применением ионизированного кислорода, водорода или газообразного азота.
[0092] Плазменную обработку проводили с применением устройства для плазменной обработки от компании Diener (Diener electronics; Plasma-Surface-Technology; Эбхаузен, Германия) в вакуумной камере в течение промежутка времени от 5 до 20 минут, предпочтительно от 8 до 15 минут. Были заданы следующие параметры обработки: давление в вакуумной камере: 0,40 мбар; мощность: 35 Вт; расход газообразного кислорода: 5 см3/мин (мин.) - 60 см3/мин (макс).
Стерилизация
[0093] Наконец, далее несущие сетки стерилизовали, помещая их в среду, содержащую H2O2, подвергая несущую сетку воздействию атмосферы, содержащей H2O2.
[0094] Среду или атмосферу, содержащую H2O2, создавали внутри вакуумной камеры, путем помещения несущей сетки в камеру вместе с открытой колбой, содержащей раствор H2O2, и последующего вакуумирования камеры для испарения H2O2. Раствор H2O2 содержал H2O2 в количестве 30% по объему. Время обработки сильно зависит от давления внутри камеры и концентрации раствора H2O2. Предпочтительно время стерилизации составляло от 10 до 12 часов при температуре 40°С и давлении примерно 9 мбар. Однако при более низком давлении или более высоких температурах время обработки, составляющее всего несколько минут, также оказалось эффективным.
Измерения статического краевого угла, метод лежащей капли
[0095] Измерения краевого угла проводили для определения степени гидрофильности или гидрофобности. Обычно краевые углы сеток определяли путем измерений статического краевого угла. Статические краевые углы определяли с использованием метода лежащей капли с ультрачистой водой (EasyDrop DSA20E, Krtiss GmbH). Капли воды размером 0,3 мкл дозировали с помощью автоматизированного блока. Значения краевых углов были вычислены путем подгонки функции кругового сегмента к контуру капли, помещенной на поверхность.
Сбор, культивирование и посев фибробластов
[0096] Сбор фибробластов выполняли путем дерматологического или хирургического иссечения образца кожи полной толщины в строгих стерильных условиях размером приблизительно 2 см × 1 см. Образец поместили в стерильный контейнер и покрыли предварительно нагретым фосфатно-солевым буферным раствором, содержащим 2% антибиотика/ антимикотика (АВ/АМ). Образец был доставлен в лабораторию, где его промывали предварительно нагретым промывочным раствором/ раствором этиленгликоль тетрауксусной кислоты, содержащим 2% АВ/АМ Промытый образец кожи покрывали свежеприготовленной 200 ед/мл коллагеназой в полной минимальной эссенциальной средой Игла, модифицированной по способу Дульбекко (DMEM, Dulbecco's minimal essential medium), содержащей 10-20% фетальной бычьей сыворотки, 2% АВ/АМ, 2 мМ L-глутамина и 1 мМ раствора Na-пирувата, а затем инкубировали со стороны дермы вниз - при 37°С, 5% CO2 в течение 3-5 часов. Боковую часть дермы осторожно соскребали с помощью клеточного скребка до тех пор, пока вся часть дермы не растворится в растворе коллагеназы. Часть эпидермиса отбрасывали, суспензию клеток просеивали через нейлоновое сито с размером ячеек 100 мкм, и клетки, собранные на сите, тщательно промывали фетальной бычьей сывороткой (2% АВ/АМ) перед сбором в центрифужной пробирке. Клетки центрифугировали в течение 10 минут, супернатант отбрасывали и клетки ресуспендировали в полной среде DMEM, содержащей 10-20% FBS, 2% АВ/АМ, 2 мМ L-глутамина, 1 мМ Na-пирувата и 10 мМ N-2-гидрокси-этилпиперазин-N-2-этансульфоновой кислоты (HEPES). Ресуспендированные клетки поместили в колбу, покрытую коллагеном, и инкубировали при 37°С, 5% СО2 в течение 30 минут. Фибробласты, прикрепленные к покрытой коллагеном поверхности колбы, отделили от нефибробластов, оставшихся в культуральной среде. Подсчет клеток проводили с окрашиванием триптановым синим.
[0097] При необходимости фибробласты инкубировали в среде DMEM. Несущую сетку высевали фибробластами (500000 клеток на 1 см2).
[0098] Было обнаружено, что коллагеновое покрытие увеличивает смачиваемость пористой поверхности несущей сетки и способствует проникновению раствора клеточной суспензии, что позволяет фибробластам легко проникать во внутренние поры несущей сетки.
[0099] Предпочтительные варианты осуществления в отношении структуры имплантата согласно изобретению и его размещения в теле пациента при восстановлении мягких тканей дополнительно описаны в связи с прилагаемой фигурой, на которой
[00100] на Фиг. 1 показано схематичное изображение разреза, проходящего через дефект мягкой ткани, репарированный с помощью набора в соответствии с настоящим изобретением.
[00101] На схематическом изображении на Фиг. 1 показан дефект (щель) в мышечной ткани 12, который был заполнен сетчатым имплантатом 10 согласно настоящему изобретению. В частности, коммерчески доступная опорная сетка 14 была помещена под дефектную мышечную ткань 12 перед вставкой в дефект полимерной биоразлагаемой несущей сетки 10, содержащей фибробласты 16. Затем наложенную кожу 17 репарировали, т.е. закрывали с помощью швов 18. Несущая сетка обеспечивает временную опорную структуру для пролиферации фибробластов и для роста клеток из соседних тканей. В общем случае, несущая сетка 10 с фибробластами 16 будет просто вставляться в дефект или помещаться над дефектом. Благодаря опорной сетке 14 предотвращается смещение несущей сетки 10 от места имплантации.
[00102] В течение нескольких дней и недель после введения сетчатого имплантата фибробласты, нанесенные с несущей сеткой в пределах дефекта мышечной ткани, продолжали пролиферировать и распространяться в соседние ткани. Это показано фибробластами, которые распространились в соседнюю мышечную ткань и опорную сетку под дефектом. Было показано, что чужеродные фибробласты вырабатывают коллаген, который помогает наращивать рубцовую ткань, которая плотно закрывает дефект в мышечной ткани в то время, когда несущая сетка полностью разлагается.
[00103] Сетчатый имплантат согласно настоящему изобретению также был протестирован in vivo на крысах, как будет описано в следующих разделах.
Гистология
[00104] Экспериментальная грыжа брюшной стенки у крысы была репарирована с помощью биоразлагаемого сетчатого имплантата в соответствии с настоящим изобретением, т.е. посредством несущей сетки, несущей фибробласты. В этом эксперименте грыжа в мышечной ткани брюшной стенки была заполнена опорной сеткой по изобретению, несущей многочисленные фибробласты, и секретомом, добавленным к несущей сетке. Для удержания имплантированной несущей сетки на месте были имплантированы две дополнительные опорные сетки, одна сверху и одна ниже грыжи в мышечной ткани и дополнительная опорная сетка как часть набора согласно изобретению, описанного выше. Гистологический анализ участка кожной раны показан на Фиг. 2-6А:
[00105] на Фиг. 2 показан вид сверху иссеченной части брюшной стенки, включающей бывшую ранее грыжевую область, которая была репарирована с помощью набора согласно настоящему изобретению, включающего несущую сетку, несущую фибробласты, и дополнительную опорную сетку;
[00106] на Фиг. 3А показан разрез через брюшную стенку по Фиг. 2 вдоль линии A, т.е. через бывшую ранее грыжевую область;
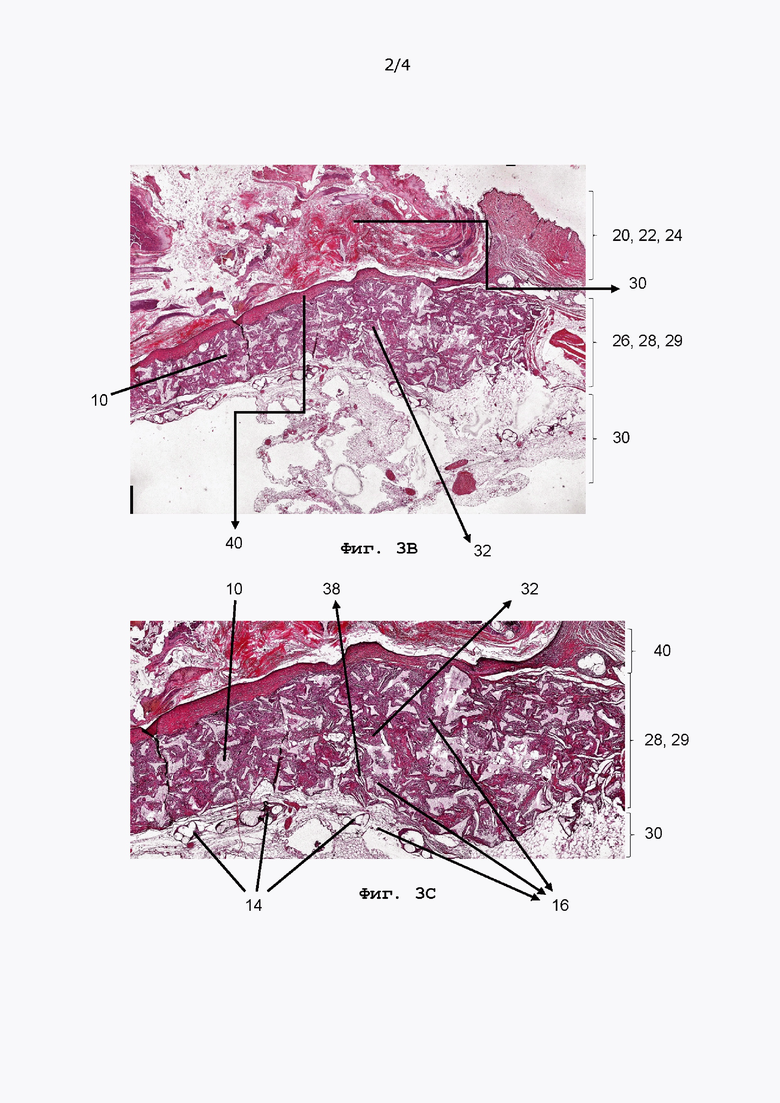
[00107] на Фиг. 3В, 3С показаны увеличенные детальные разрезы по Фиг. 3А с увеличением 40х и 200х, соответственно;
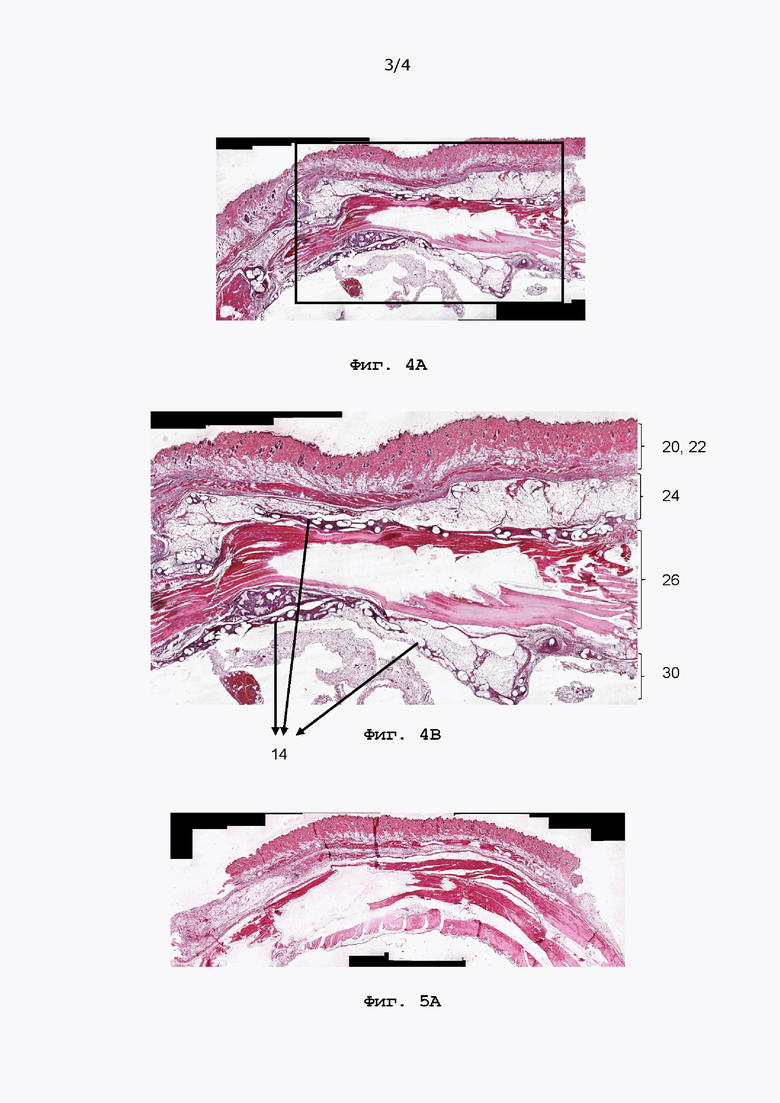
[00108] на Фиг. 4А показан разрез через брюшную стенку по Фиг. 2 вдоль линии B, т.е. возле бывшей ранее грыжевой области;
[00109] На Фиг. 4В показан увеличенный детальный разрез по Фиг. 4А с увеличением 40х;
[00110] На Фиг. 5А показан разрез через брюшную стенку по Фиг. 2 вдоль линии C, т.е. на расстоянии до бывшей ранее грыжевой области; и
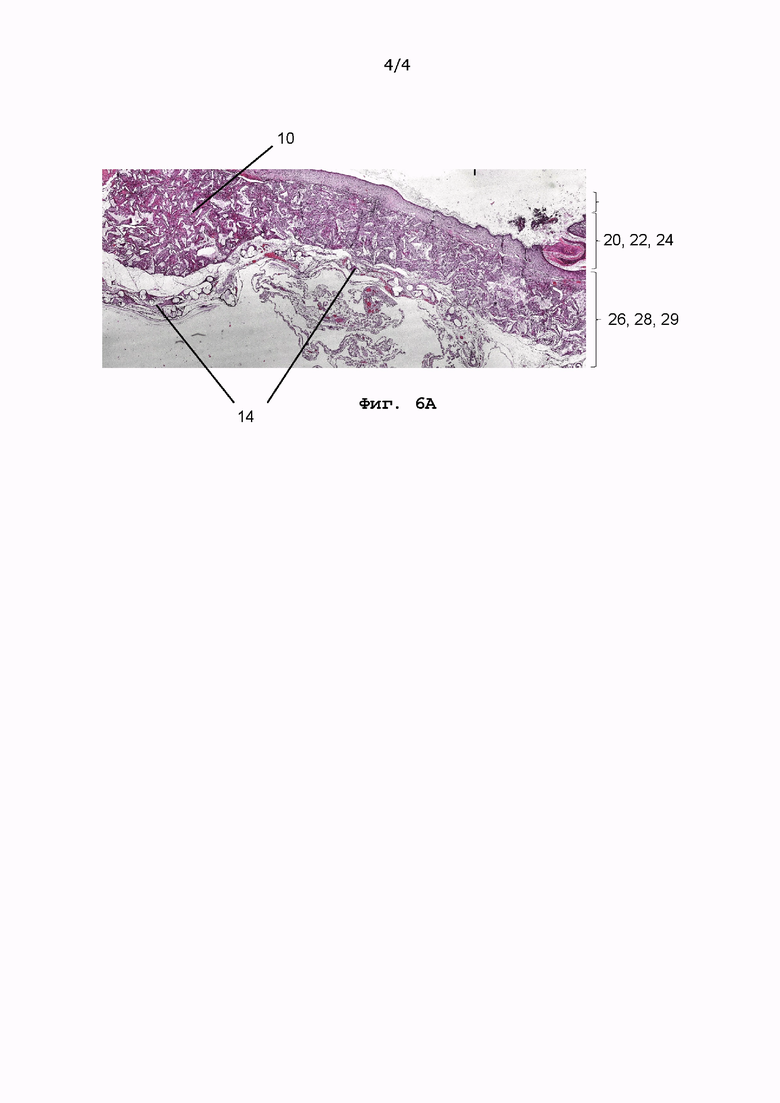
[00111] На Фиг. 6 показан увеличенный детальный разрез с увеличением 40х через брюшную стенку сравнительного примера, в котором грыжевая область была репарирована с помощью опорной сетки без фибробластов.
[00112] Как показано на Фиг. 2, брюшная стенка включает слои эпидермиса 20, дермы 22, подкожной ткани 24 с жировыми клетками, мышечной ткани 26 и, внутри мышечной области 26, бывшей ранее грыжевой области 28, в которую были имплантированы несущая сетка и опорная сетка. Таким образом, бывшая щель в мышечной ткани 26 была заполнена несущей сеткой (и фибробластами).
[00113] На Фиг. 3А-3С показан увеличенный участок бывшей ранее грыжевой области 28. В пределах этой области 28 видна тканевая масса 29, которая заполняет бывшую ранее грыжу и состоит по меньшей мере частично из частично разложившейся несущей сетки 10. В этой массе 29 можно увидеть популяцию мезенхимоподобных клеток (удлиненных и круглых клеток) 32, расположенных в переплетенных тканых связках, а также звездчатые веретенообразные фибробласты 16 с относительно четкой границей и овальными плоскими ядрами с мелкозернистым хроматином. Считается, что мезенхимальные клетки 32 происходят из секретома, который был нанесен на несущую сетку вместе с фибробластами 16. С мезенхимальными клетками 32 смешаны коллагеновые волокна 38. Жировая ткань 30 видна ниже массы 29 фибробластов/коллагена/мезенхимально-подобных клеток. Выше массы 29 видна область реэпителизации 40, которая отделяет массу 29 от нескольких слоев эпителиальных клеток с ортокератотическим гиперкератозом и внутрикорнеальной реэпителизацией пустулезных клеток. Остатки опорной сетки 14 можно наблюдать ниже массы 29 на границе мышечной области 26 с жировой тканью 30 (Фиг. 3С).
[00114] Обычно фибробласты обнаруживаются в гораздо меньшем количестве и в основном в подкожной области. Большое количество и расположение идентифицированных клеток в значительной степени подразумевает, что эти фибробластные клетки 16 в форме звездчатого веретена происходят из имплантированной несущей сетки 10.
[00115] Подтверждение вышеприведенных выводов приведено на Фиг. 4А-6А: На Фиг. 4А и 4В показан разрез через репарированную брюшную стенку, показанную на ФИГ. 3А-С, однако разрез выполнен не через бывшую грыжу 28, а рядом с ней. В этой расположенной рядом области присутствует только опорная сетка 14, поскольку она имеет размер, чтобы покрыть не только грыжевую область 28, но и области, расположенные рядом и вокруг нее. Опорная сетка 14 все еще хорошо видна над и под мышечной областью 26. В отличие от разрезов, показанных на Фиг. 3А-3С, несущая сетка отсутствует.
[00116] С другой стороны, на Фиг. 5А показан разрез через ткань на расстоянии от грыжевой области, т.е. через нормальную ткань брюшной стенки. Как и ожидалось, здесь нет ни опорной сетки, ни какой-либо несущей сетки.
[00117] На Фиг. 6А показаны результаты контрольного эксперимента, в котором была имплантирована несущая сетка 10 без фибробластов для закрытия дефекта мягких тканей в брюшной стенке крысы. Этот контрольный эксперимент подтвердил, что звездчатые веретенообразные клетки, идентифицированные в разрезах ткани, показанных на Фиг. 3А-3С (и отсутствующих на Фиг. 6А), являются фибробластами, из которых ткань не вырабатывается. Таким образом, гистологические результаты подтверждают, что присутствие фибробластов связано не с нормально протекающими процессами заживления ран и воспалением, а с тем, что фибробласты возникают в результате имплантации. Кроме того, было обнаружено, что фибробласты, введенные в дефект мягкой ткани с помощью сетчатого имплантата согласно изобретению, не только остаются на месте расположения несущей сетки, но и активно мигрируют в соседнюю питающую ткань, где они поддерживают образование коллагена, что, как полагают, в конечном итоге приводит к улучшению образования рубцов.
[00118] Таким образом, гистологический анализ не только подтвердил распределение имплантированных фибробластов в пределах дефекта мягких тканей и в пределах несущей сетки, но и показал врастание и миграцию фибробластов в соседние ткани.
| название | год | авторы | номер документа |
|---|---|---|---|
| БИОРАЗЛАГАЕМАЯ ДВУХСЛОЙНАЯ МАТРИЦА ДЛЯ ПРЕДОТВРАЩЕНИЯ ОБРАЗОВАНИЯ ПОСЛЕХИРУРГИЧЕСКИХ СПАЕК, В ЧАСТНОСТИ, ПРИ ГЕРНИОПЛАСТИКЕ | 2020 |
|
RU2826997C2 |
| БИОРАЗЛАГАЕМЫЙ КАРКАС ДЛЯ РЕГЕНЕРАЦИИ МЯГКИХ ТКАНЕЙ И ЕГО ПРИМЕНЕНИЕ | 2010 |
|
RU2538688C2 |
| ПРИМЕНЕНИЕ НИТРОКАРБОНОВЫХ КИСЛОТ ДЛЯ ЛЕЧЕНИЯ, ДИАГНОСТИКИ И ПРОФИЛАКТИКИ АГРЕССИВНЫХ ФОРМ ЗАЖИВЛЕНИЯ | 2011 |
|
RU2567049C2 |
| Способ пластики грыж передней брюшной стенки | 2017 |
|
RU2645951C1 |
| УСТРОЙСТВА ДЛЯ ВОССТАНОВЛЕНИЯ ТКАНИ С БЫСТРЫМ ВПИТЫВАНИЕМ ТЕРАПЕВТИЧЕСКИХ СРЕДСТВ | 2012 |
|
RU2608461C2 |
| Композитный сетчатый эндопротез для лечения парастомальной грыжи | 2021 |
|
RU2766669C1 |
| СПОСОБ ВОССТАНОВЛЕНИЯ СВЯЗКИ ИЛИ СУХОЖИЛИЯ | 2013 |
|
RU2629809C2 |
| ОДНОПЛОСКОСТНЫЙ ИМПЛАНТАТ ДЛЯ ВОССТАНОВЛЕНИЯ ТКАНИ | 2013 |
|
RU2628622C2 |
| СПОСОБ ПОВЫШЕНИЯ РЕГЕНЕРАЦИОННОГО ПОТЕНЦИАЛА ИМПЛАНТАТОВ ДЛЯ ВОССТАНОВИТЕЛЬНОЙ ХИРУРГИИ СОЕДИНИТЕЛЬНОЙ ТКАНИ | 2014 |
|
RU2561830C1 |
| ОДНОПЛОСКОСТНОЙ ИМПЛАНТАТ ДЛЯ ПЛАСТИКИ ТКАНИ, ОБЛАДАЮЩИЙ СТРУКТУРОЙ РАЗМЕЩЕНИЯ | 2014 |
|
RU2689030C2 |

Группа изобретений относится к хирургии и может быть использована для восстановления мягких тканей в хирургической герниопластике, для заживления хронических ран или для хирургического заживления свищей в теле пациента. Группа включает биоразлагаемый сетчатый имплантат, способ получения сетчатого имплантата и набор. Биоразлагаемый сетчатый имплантат содержит пористую гидрофильную биоразлагаемую полимерную несущую сетку и фибробласты на полимерной несущей сетке или внутри нее. Несущая сетка содержит губчатую структуру с соединенными между собой порами разного размера, имеет краевой угол смачивания менее 75° и изготовлена по меньшей мере из полимера, который включает полимолочную кислоту в качестве основного компонента. Набор содержит биоразлагаемый сетчатый имплантат и дополнительную полимерную опорную сетку. 3 н. и 15 з.п. ф-лы, 6 ил.
1. Биоразлагаемый сетчатый имплантат для применения при восстановлении мягких тканей, заживлении хронических ран или хирургическом заживлении свищей в теле пациента, при этом сетчатый имплантат содержит
пористую гидрофильную биоразлагаемую полимерную несущую сетку и
фибробласты на полимерной несущей сетке или внутри нее,
причем несущая сетка содержит губчатую структуру с соединенными между собой порами разного размера,
имеет краевой угол смачивания менее 75° и
изготовлена по меньшей мере из первого полимера, содержащего полимолочную кислоту в качестве основного компонента,
где полимерная несущая сетка подвергнута плазменной обработке и/или губчатая структура полимерной несущей сетки покрыта по меньшей мере одним природным полимером.
2. Имплантат по п. 1, в котором полимерная несущая сетка имеет краевой угол смачивания менее 40°, предпочтительно менее 25°, более предпочтительно менее 15°, наиболее предпочтительно в диапазоне от 0° до 10°.
3. Имплантат по п. 1 или 2, в котором несущая сетка имеет плоскую листообразную форму и является упруго деформируемой, что позволяет ее складывать или сворачивать.
4. Имплантат по одному из пп. 1-3, в котором первый полимер состоит по меньшей мере на 70% из поли(молочной кислоты), более предпочтительно по меньшей мере на 80% из поли(молочной кислоты) или по существу состоит из поли(молочной кислоты).
5. Имплантат по одному из пп. 1-4, в котором полимерная несущая сетка состоит только из первого полимера или из первого полимера и по меньшей мере одного природного полимера, выбранного из группы, состоящей из коллагена, желатина, ламинина, фибриногена, альбумина, хитина, хитозана, агарозы, альгината гиалуроновой кислоты и их смесей, причем коллаген является предпочтительным.
6. Имплантат по п. 5, в котором губчатая структура полимерной несущей сетки покрыта коллагеном.
7. Имплантат по одному из пп. 1-6, в котором несущая сетка имеет общее время разложения в живом организме от 1 до 12 месяцев, предпочтительно от 1 до 8 месяцев, более предпочтительно примерно от 1 до 6 месяцев, наиболее предпочтительно примерно от 2 до 4 месяцев.
8. Имплантат по одному из пп. 1-7, в котором фибробласты являются аутологичными фибробластами пациента, которому имплантат предназначен для установки.
9. Имплантат по одному из пп. 1-8, дополнительно содержащий факторы роста, предпочтительно выбранные из группы, состоящей из интерлейкинов, кислого фактора роста фибробластов, основного фактора роста фибробластов, эпидермального фактора роста, инсулиноподобного фактора роста, белка, связывающего инсулиноподобный фактор роста, тромбоцитарного фактора роста, трансформирующего фактора роста альфа, трансформирующего фактора роста бета, фактора роста эндотелия сосудов и фактора роста гепатоцитов.
10. Имплантат по п. 8, в котором факторы роста представляют собой факторы роста в мезенхимальном секретоме плаценты.
11. Способ получения сетчатого имплантата по пп. 1-10 посредством
a) обеспечения биоразлагаемой полимерной несущей сетки, содержащей губчатую структуру с соединенными между собой порами разного размера, имеющей краевой угол смачивания менее 75° и изготовленной по меньшей мере из первого полимера, содержащего полимолочную кислоту в качестве основного компонента;
b) плазменной обработки полимерной несущей сетки плазмой окисленного газа при температуре ниже 50°С и
c) инокуляции полимерной несущей сетки фибробластами.
12. Способ по п. 11, включающий этапы
a) обеспечения биоразлагаемой полимерной несущей сетки, изготовленной из первого полимера, содержащего губчатую структуру с соединенными между собой порами разного размера, имеющего краевой угол смачивания менее 75° и изготовленного по меньшей мере из первого полимера, содержащего полимолочную кислоту в качестве основного компонента;
b) покрытия по меньшей мере поверхности полимерной несущей сетки природным полимером, предпочтительно коллагеном;
c) плазменной обработки полимерной несущей сетки посредством обработки полимерной несущей сетки плазмой окисленного газа при температуре ниже 50°С и
d) инокуляции полимерной несущей сетки фибробластами.
13. Способ по одному из пп. 11 и 12, согласно которому перед инокуляцией фибробластами полимерную несущую сетку стерилизуют путем ее обработки H2O2 при температуре ниже 50°C.
14. Способ по п. 13, согласно которому этап стерилизации проводят путем обработки полимерной несущей сетки плазмой H2O2 или путем воздействия на несущую сетку атмосферой, содержащей H2O2, при давлении в диапазоне от 10-2 до 10-6 бар, предпочтительно в диапазоне от 0,1 до 20,0 мбар, в течение по меньшей мере 1 минуты, предпочтительно по меньшей мере 5 минут.
15. Способ по одному из пп. 11-14, дополнительно включающий этап добавления секретома, содержащего факторы роста, на несущую сетку.
16. Набор для имплантата для применения при хирургическом восстановлении ран в теле пациента, причем набор для имплантата включает
сетчатый имплантат, включающий биоразлагаемую полимерную несущую сетку, несущую фибробласты, по одному из пп. 1-10 и
полимерную опорную сетку, содержащую один или более полимеров, выбранных из группы, состоящей из поли(гликолевой кислоты), поли(молочной кислоты), поли(гликолевой кислоты-молочной кислоты) и их смесей;
причем
полимерная несущая сетка имеет более высокую скорость разложения, чем опорная сетка.
17. Набор для имплантата по п. 16, дополнительно включающий антиадгезионную сетку, содержащую два отдельных или выполненных за одно целое слоя, состоящих из гидрофильного слоя, обращенного к мышечной ткани живота и имеющего краевой угол смачивания меньше 75°, предпочтительно меньше 60°, и гидрофобного слоя, имеющего краевой угол смачивания больше 90°.
18. Набор для имплантата по п. 16 или 17, в котором опорная сетка имеет плоскую листообразную форму, а полимерная несущая сетка выполнена в виде пасты или гидрогеля, содержащей или содержащего фибробласты.
| БИОРАЗЛАГАЕМЫЙ КАРКАС ДЛЯ РЕГЕНЕРАЦИИ МЯГКИХ ТКАНЕЙ И ЕГО ПРИМЕНЕНИЕ | 2010 |
|
RU2538688C2 |
| БИОРЕЗОРБИРУЕМЫЙ ПЕРЕВЯЗОЧНЫЙ МАТЕРИАЛ ДЛЯ РАН | 2012 |
|
RU2577155C2 |
| CHEN GUOPING et al | |||
| "Culturing of skin fibroblasts in a thin PLGA-collagen hybrid mesh", BIOMATERIALS, ELSEVIER SCIENCE PUBLISHERS BV., BARKING, GB, (20040911), vol | |||
| Прибор для получения стереоскопических впечатлений от двух изображений различного масштаба | 1917 |
|
SU26A1 |
| Прибор для нагревания перетягиваемых бандажей подвижного состава | 1917 |
|
SU15A1 |
| HALBERSTADT C.R | |||
| et al | |||
| "The in Vitro Growth of a Three-Dimensional Human Dermal Replacement Using a Single-Pass | |||
Авторы
Даты
2023-10-16—Публикация
2020-03-03—Подача