ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Изобретение относится к области биотехнологии, а именно к новому штамму линии клеток яичника китайского хомяка (СНО), который является продуцентом рекомбинантного дарбэпоэтина альфа, представляющего аналог рекомбинантного человеческого эритропоэтина.
УРОВЕНЬ ТЕХНИКИ
Эритропоэтин является цитокином, который стимулирует эритропоэз. Его рекомбинантные варианты широко используются для коррекции анемии при различных заболеваниях, включая хроническую почечную недостаточность (диализные и предиализные пациенты), онкологические заболевания, хронические воспалительные заболевания кишечника (болезнь Крона, язвенный колит), а также при трансплантации органов и тканей, в пред- и послеоперационный период, у ослабленных пациентов и так далее (см. Эритропоэтин и его биологическая роль, О.Н. Варламова и др., Medicine: theory and practice том 4 №3 2019).
Эритропоэтин (ЭПО) является первым цитокином, который был клонирован и получен в виде рекомбинантного белка. Американская компания «Amgen» разработала (US 677813) биотехнологию получения эпоэтина альфа в системе клеток яичника китайского хомяка (СНО). Эпоэтин бета, синтезируемый клетками СНО, был разработан фирмами «F. Hoffmann-LaRoche» (NeoRecormon®) и «Chugai» (Эпогин®). Кроме того, был разработан препарат эпоэтин омега, фирмой «Еротах». Европейские фирмы «Transkaryotic» и «Aventis» разработали технологию получения препарата Dynepo (эпоэтин дельта), который синтезируется опухолевыми клетками фибросаркомы человека (НТ-1080). В Российской Федерации, разработаны и выпускаются препараты эпоэтина альфа (ГосНИИ ОЧБ) и эпоэтина бета («Фармапарк», «Микроген», «Биннофарм», «Лэнс-Фарм» и ЗАО МТХ) (Препараты рекомбинантных эритропоэтинов и их характеристика, Меркулов В.А. и др., Федеральное государственное бюджетное учреждение «Научный центр экспертизы средств медицинского применения» Министерства здравоохранения Российской Федерации, Москва, 22.08.2013 г.).
ЭПО человека представляет собой гликозилированный белок массой около 30,4 кДа, полипептидная цепь которого состоит из 165 аминокислотных остатков. В результате посттрансляционных модификаций к полипептидной цепи белка происходит присоединение N- и О-связанных углеводных цепей, на долю углеводного компонента приходится 40% молекулярной массы. Каждая из N-связанных цепей может содержать максимум 4 остатка сиаловых кислот, тогда как О-связанная цепь может содержать не более двух остатков. Таким образом, ЭПО может содержать от 4 до 14 остатков сиаловых кислот, что соответствует минимальному и максимальному уровню сиалирования (Egrie JC, Grant JR, Gillies DK, Aoki KH, Strickland TW. S7.7 The role of carbohydrate on the biological activity of erythropoietin. Glycoconjugate Journal 1993, 10:263-263).
Различные изоформы ЭПО, отличающиеся степенью сиалирования и, как следствие, зарядом, могут быть разделены методами изоэлектрического фокусирования в геле капиллярного электрофореза.
В рамках экспериментов по повышению стабильности ЭПО в крови больных было создано множество новых молекул ЭПО, одна из них, названная NM279, содержащая 4 N-присоединенные углеводные цепи, проявила увеличенную биологическую активность (исследования проводились на полицитемических мышах). Дальнейшие опыты привели к созданию молекулы NM321 (дарбэпоэтин альфа), которая содержала 5 N-связанных углеводных цепей, дополнительные углеводные цепочки присоединялись к остаткам Asn 30 и Asn 88 (Egrie JC, Browne JK. Development and characterization of novel erythropoiesis stimulating protein (NESP). Br J Cancer 2001, 84 Suppl 1:3-10). Для создания данной молекулы было проведено пять следующих аминокислотных замен в природной молекуле ЭПО: Ala30Asn, His32Thr, Pro87Val, Trp88Asn и Pro90Thr. Введение двух дополнительных N-связанных углеводных компонентов позволило увеличить максимальное количество остатков сиаловых кислот с 14 до 22. Дополнительный углеводный фрагмент дарбэпоэтина привел к увеличению молекулярной массы белка с 30,400 (для нативного ЭПО) до 38,000. Содержание углеводной части в дарбэпоэтине составляет около 52%, тогда как в ЭПО оно составляет 40%. Сродство молекулы дарбэпоэтина к рецептору эритропоэтина оказалось меньше, чем у природного лиганда, однако данный факт компенсируется его гораздо большей стабильностью.
Таким образом, дарбэпоэтин альфа представляет собой сверхсиалированный аналог человеческого эритропоэтина альфа (ЭПО-альфа), имеющий увеличенный период полувыведения из организма по сравнению с нативной и рекомбинантной формой этого гормона. Он имеет такой же механизм действия, как и ЭПО, связывается с тем же поверхностным мембранным рецептором и запускает ту же цепь молекулярных взаимодействий внутри клетки. Дополнительные N-связанные углеводные цепи дарбэпоэтина альфа приводят к большей метаболической устойчивости молекулы in vivo, таким образом время его полувыведения при внутривенном введении в три раза больше, по сравнению со временем полувыведения ЭПО-альфа. Данное свойство дарбэпоэтина позволяет вводить его пациентам менее часто. Исследования показали, что введение дарбэпоэтина раз в неделю позволяет поддерживать уровень гемоглобина у пациентов с почечной недостаточностью на постоянном уровне. Дарбэпоэтин с 2007 г. разрешен к применению в России, и так как по сравнению с природным прототипом генно- и гликомодифицированный дарбэпоэтин обладает втрое большим временем жизни в крови больных, он является более предпочтительным при лечении анемий различного происхождения (Cases A. Darbepoetin alfa: a novel erythropoiesis-stimulating protein. Drugs Today (Bare) 2003, 39:477-495, Smith R. Applications of darbepoietin-alpha, a novel erythropoiesis-stimulating protein, in oncology. Curr Opin Hematol 2002, 9:228-233, Macdougall 1С.Darbepoetin alfa: a new therapeutic agent for renal anemia. Kidney Int Suppi 2002:55-61).
В настоящее время для биосинтеза рекомбинантных белков человека, требующих корректного гликозилирования, обычно применяют клеточные линии СНО, несущие интегрированные в геном гены целевых белков под контролем сильных промоторов клеточного или вирусного происхождения. (Hansen LA. et al, Systematic Comparison of Constitutive Promoters and the Doxycycline-Inducible Promoter. PLoS One 2010, 5:e 10611, Magnusson T, et al. Sustained, high transgene expression in liver with plasmid vectors using optimized promoter-enhancer combinations. J Gene Med 2011, 13:382-391; Tokushige K, et al., Comparison between cytomegalovirus promoter and elongation factor-1 alpha promoter-driven constructs in the establishment of cell lines expressing hepatitis С virus core protein. J Virol Methods 1997, 64:73-80).
В число наиболее эффективных входят промоторы CMV (промоторно-энхансерный элемент предранних генов цитомегаловируса человека), EF1α (промотор альфа-субъединицы фактора 1 элонгации трансляции).
Авторы настоящего изобретения обнаружили, что объединение трех элементов, а именно, промотора фактора элонгации трансляции 1α (альфа EF1), связанного с 3'-концом энхансера цитомегаловируса, и промотора убиквитина С, связанного с 5'-концом энхансера цитомегаловируса, где указанные промоторы расположены относительно друг друга в транс-положении, позволяет значительно увеличить связывание РНК полимеразы 1 с промоторными областями и тем самым значительно повысить экспрессию целевого белка, в частности, дарбэпоэтина. При использовании указанных промоторов отдельно, такой уровень экспрессии был значительно ниже.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Авторами настоящего изобретения был создан вектор экспрессии, содержащий систему промоторы/энхансер, которая позволяет значительно повысить уровень экспрессии белка, находящегося под контролем такой системы, и две копии гена дарбэпоэтина альфа. В состав указанной системы входит промотор альфа EF1, связанный с 3'-концом энхансера цитомегаловируса, и промотор убиквитина С, связанный с 5'-концом энхансера цитомегаловируса. Указанные промоторы расположены относительно друг друга в транс-положении.
Авторами настоящего изобретения был получен штамм линии клеток яичника китайского хомячка (СНО), продуцента рекомбинантного дарбэпоэтина альфа, трансформированный указанным вектором экспрессии, позволяющий более эффективно и экономично получить необходимый вариант белка дарбэпоэтина альфа.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Фиг. 1. Сравнение кДНК гена эритропоэтина человека и гена дарбэпоэтина альфа.
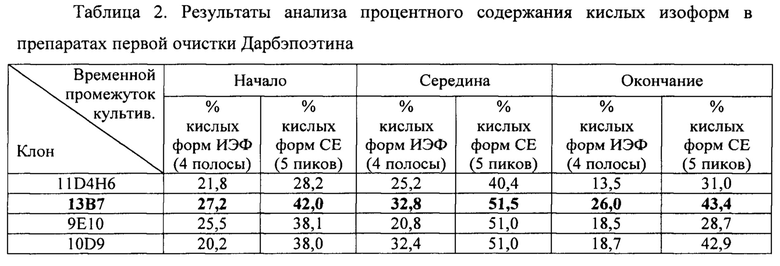
Фиг. 2. Кольцевая карта плазмидной ДНК pM2dEp.
На кольцевой карте плазмидной ДНК pM2dEp указано следующее: CMV enhancer - энхансер CMV промотора, UbiC -промотор убиквитина С, dEPO - ген дарбэпоэтина, chimeric intron - химерный вариант интронов аденовируса и генов тяжелой цепи иммуноглобулинов, IRES - участок внутренней посадки рибосомы вируса энцефаломиокардита, mGS - глутаминсинтетаза Mus musculus, bGH poly (A) - сигнал полиаденилирования бычьего гормона роста, ori - точка начала репликации pUC, AmpR-Р-лактамаза, промотор AmpR - промотор AmpR, сигнал HSV ТК poly (А) - сигнал полиаденилирования тимидинкиназы вируса простого герпеса, NeoR/KanR аминогликозидфосфотрансфераза Tn5, SV40 - энхансер и ранний промотор SV40, AmpR - промотор AmpR и ген устойчивости к ампициллину, dEPO - ген дарбэпоэтина, EF-la intron А - интрон, расположенный перед старт-кодоном EF-1α человека, EF-1α - промотор фактора элонгации EF-1α человека, MluI, NheI, BamHI, XbaI, PvuI - места разрезания соответствующими эндонуклеазами.
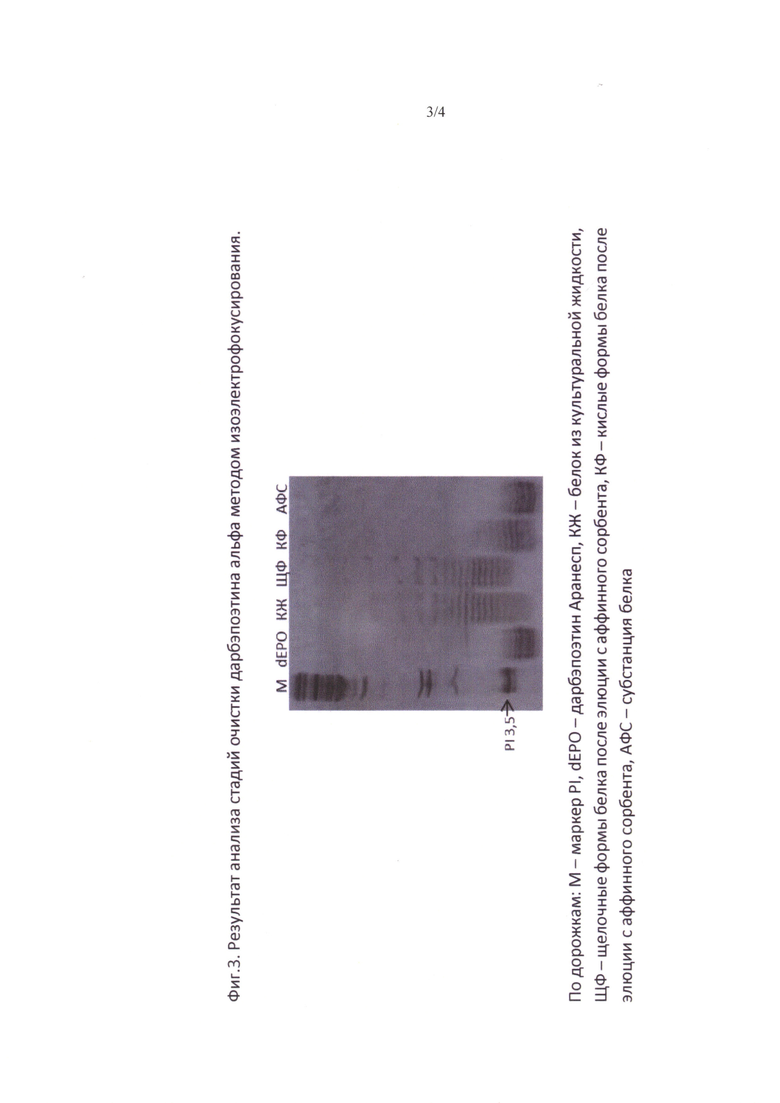
Фиг. 3. Результат анализа стадий очистки дарбэпоэтина альфа методом изоэлектрофокусирования.
Дорожки: М - маркер PI, dEPO - дарбэпоэтин «Аранесп», КЖ - белок из культуральной жидкости, ЩФ - щелочные формы белка после элюции с аффинного сорбента, КФ - кислые формы белка после элюции с аффинного сорбента, АФС - субстанция белка, полученная способом по изобретению.
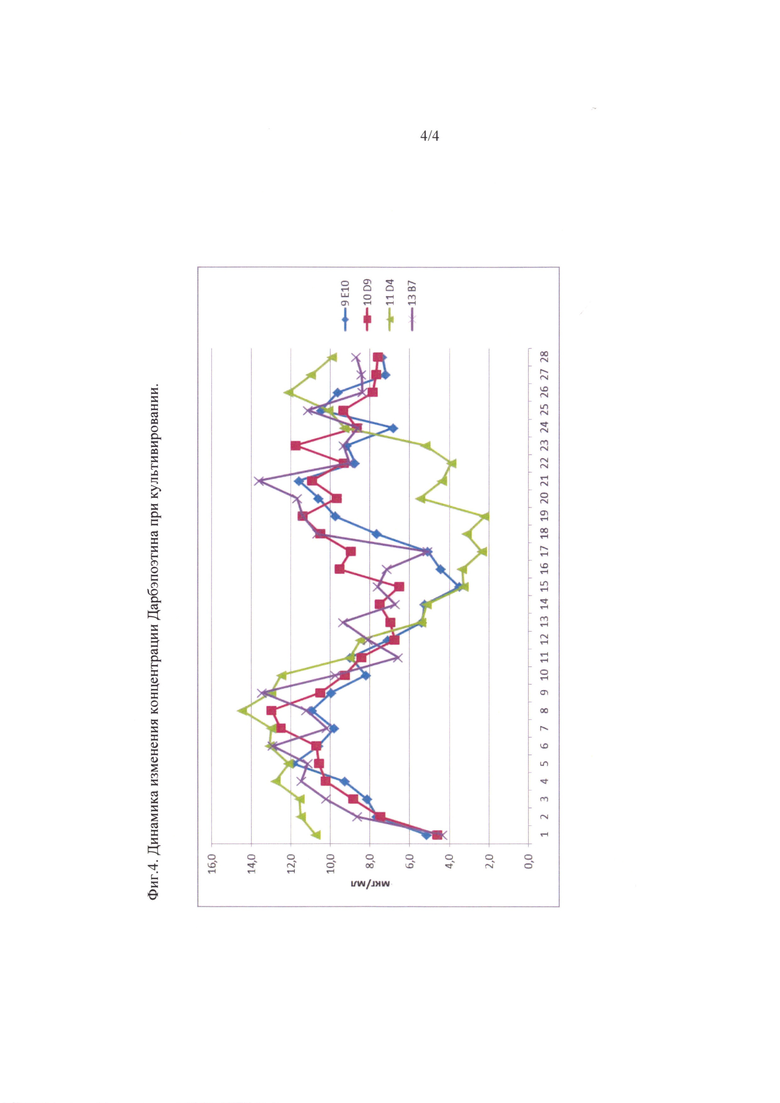
Фиг. 4. Динамика изменения концентрации Дарбэпоэтина при культивировании.
ПРИМЕРЫ
Пример 1. Конструирование экспресснойных плазмид для обеспечения продукции дарбэпоэтина в клетках СНО.
кДНК гена эритропоэтина человека (hEPO) была получена методом обратной транскрипции с последующей ПЦР на матрице тотальной РНК, выделенной из клеток линии СНО-ЭПО SPM (ООО «Протеиновый контур»), с использованием праймеров 5'TGCTAGCCGGAGATGGGGGTGCAC3' и 5'CGGATCCAGTCATCTGTCCCCTGTCCTGC3' (Seq1). Внесение замен в ген hEPO: G(169)A, С(170)А, C(175)G, А(176)С, C(340)G, С(341)Т, G(342)C, Т(343)А, G(344)A, G(345)C и С(349)А проводили методом праймер специфического мутагенеза с последующим синтезом гена дарбэпоэтина (dEP) перекрывающимся ПЦР. Для этих целей использовали праймеры:
5'TGCTAGCCGGAGATGGGGGTGCAC3' (SEQ ID NO:1)
5'CGGATCCAGTCATCTGTCCCCTGTCCTGC3' (SEQ ID NO:2)
5'GCTGCAGGTTTCATTACAGCCCGTCGTG3' (SEQ ID NO:3)
5'GGCTGTAATGAAACCTGCAGCTTGAATGAG3' (SEQ ID NO:4)
5'GCAGGGTCTCGTTGACCTGGGAAGAGTTGAC3' (SEQ ID NO:5)
5'CTCTTCCCAGGTCAACGAGACCCTGCAGCTG3' (SEQ ID NO:6)
В результате была получена кДНК гена дарбэпоэтина альфа (SEQ ID NO:9). Ген дарбэпоэтина был клонирован по сайтам рестрикции NheI - BamHI в вектора pSeq-EF1 и pZ-UbiC-GS (ООО «Протеиновый контур»). В результате были получены экспрессионные вектора pSeqdEp и pZdEp, каждый из которых нес вставку кДНК гена дарбэпоэтина. На матрице плазмиды pSeqdEp ставили ПЦР с использование праймеров 5'GTTCTTTCACGCGTTGACATTGATTATTG3' (SEQ ID NO:7) 5'CCGACGTTGGTCGCGAGCCCTGGGCCTTCAC3' (SEQ ID NO:8). Амплифицированный фрагмент ДНК, несущий элементы CMVenx/hEF1/dEp/pABGH/SV40/Neo/pATK клонировали в вектор pZdEp, по сайтам рестрикции MluI и NruI. В результате был получен экспрессионный вектор pM2dEp, содержащий две последовательности гена дарбэпоэтина в двух экспрессионных кассетах: hEF1/dEp/pA BGH и UbiC/dEp/IVS/IRES/mGS/pA BGH, объединенных энхансером CMVenx (Фиг. 1).
Пример 2. Получение стабильного клона-продуцента дЭПО-альфа
Трансфекцию клеток линий СНО K1 (ИНЦ РАН) линеаризованной плазмидной ДНК pM2dEp по сайту рестрикции PvuI проводили с использованием реагента TurboFect Transfection Reagent (Thermo Scientific) в соответствии со стандартным протоколом производителя. Для этого за сутки до проведения трансфекции в лунки 24-луночного планшета (Corning) высевали по 5×104 клеток. Для трансфекции использовали 1 мкг плазмидной ДНК pM2dEP, рестрицированной по сайту PvuI, и 3 мкл реагента TurboFect на одну лунку. В контрольные лунки ДНК не добавляли. Через 24 часа после трансфекции экспериментальные и контрольные лунки были переведены в селективные условия: полная ростовая среда без глютамина, содержащая 500 мкг/мл G418. Во всех лунках культуральную среду меняли каждые 3 дня. На 9 день после начала селекции клетки отрицательных контролей умерли. Заполнение лунок клетками основного эксперимента составляло около 70% поверхности. Клетки снимали раствором Версена и использовали для клонирования в 96-луночных планшетах, методом придельных разведений, в селективных условиях. В результате микроскопического исследования было выявлено 250 индивидуальных клонов. Через 15 дней заполнение лунок индивидуальных клонов составило 80%. Анализ экспрессии дарбэпоэтина в культуральной жидкости проводили методом ИФА. 83 лучших клона были перенесены в 24-луночные планшеты. Через 7 дней культивирования лунки имели заполнение более 80%. На основании критериев роста и продуктивности были отобраны перспективные клоны клеток 9Е10, 10D9, 13В7 и 11D4.
Пример 3. Культивирование клонов клеток 9Е10, 10D9, 13В7 и 11D4.
Клоны клеток 9Е10, 10D9, 13В7 и 11D4 были переведены во флаконы Т75, содержащие по 30 мл ростовой среды IMDM, L-Glu, 10% FCII, для культивирования. По достижении монослойного заполнения поверхности, культуру клеток снимали с подложки и переносили в роллерные бутыли (Corning, площадь поверхности 850 см2, выживаемость клеток при пересеве составляла более 95%), содержащие по 200 мл среды IMDM, L-Glu, 10% FCII. Культивирование вели при скорости вращения роллерной установки 2,5 об/мин. По достижении монослойного заполнения поверхности, культуру клеток переводили на культивирование в 400 мл накопительной среды, содержащей IMDM, l%FcII, 10 мМ Галактоза, 1 мМ Уридин, 1 мкМ MnCl2, 0,25 мМ N-ацетил-D-глюкозамин. Каждые 2 дня проводили слив культуральной жидкости с заменой на свежую среду, при этом для каждого из клонов клеток 9Е10, 10D9, 13В7 и 11D4 культуральную жидкость отрабатывали и накапливали индивидуально. Осветление культуральной жидкости проводили центрифугированием при 250g в течение 20 мин. К культуральной жидкости добавляли раствора натрия азида до концентрации 0,05%. Отбирали по 100 мкл для постановки ИФА на определение концентрации Дарбэпоэтина.
Культуральную жидкость (КЖ) различных сливов для каждого независимого клона клеток 9Е10, 10D9, 13В7 и 11D4 объединяли в единые стоки. Единый сток для каждого клона клеток 9Е10, 10D9, 13В7 и 11D4 был разделен на 3 порции. Первая содержала КЖ от 1 до 10 слива (начало культивирования), вторая - 11 до 20 слива (середина культивирования), и третья - 21 до 28 слива (окончание культивирования). КЖ хранили при минус 70°С. Контроль состояния клеток осуществляли микроскопическим анализом.
Результаты анализа состояния клеточного монослоя и концентраций Дарбэпоэтина, полученные в ИФА представлены в таблице 1. Также в конце таблицы 1 представлены средние арифметические значения концентрации Дарбэпоэтина выраженные в мкг/мл и расчетное количество Дарбэпоэтина, синтезированного за время культивирования в мг на роллерный флакон.
Динамическое изменение концентрации Дарбэпоэтина представлены на фигуре 4.
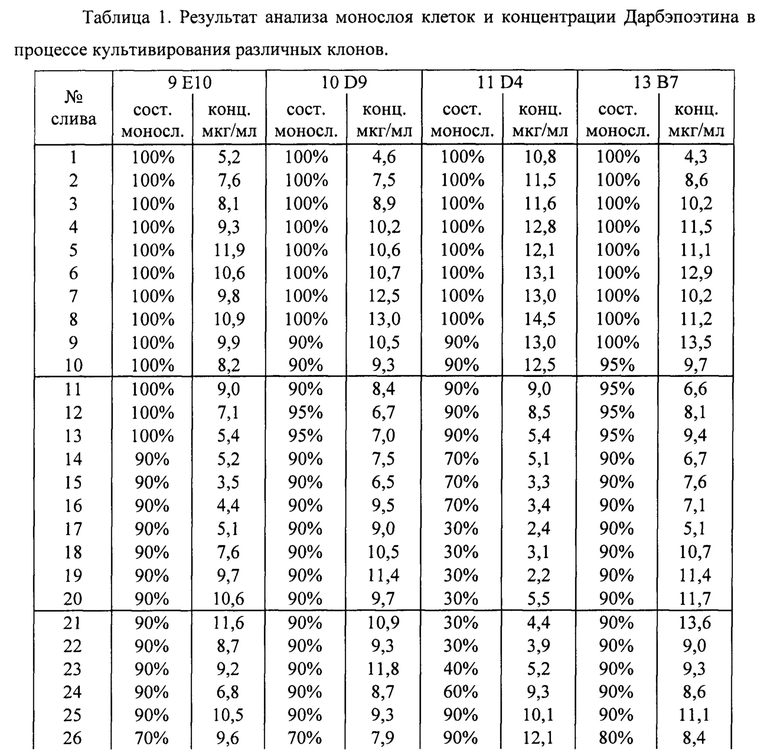
Как видно из результатов (табл.1 и фиг.4) клоны клеток 9Е10, 10D9, 13 В7 и 11D4 имеют различия в уровне синтеза Дарбэпоэтина. За время двух месячного культивирования происходит частичная потеря клеток с последующим замещением. Этапы переходов примерно соответствуют границам стоков КЖ начала, середины и конца культивирования. Клон клеток 11D4, демонстрирующий самые высокие результаты биосинтеза вначале культивирования, быстрее остальных теряет продуктивность, что коррелирует с состоянием клеточного монослоя. Клон клеток 9Е10 имеет минимальные показатели продуктивности. Клоны клеток 10D9 и 13В7 имеют схожую динамику синтеза и качества клеточного монослоя, но в среднем концентрация и количество Дарбэпоэтина на роллер для клона 13В7 выше, чем 10D9 (9,5 мкг/мл против 9,2 мкг/мл для концентрации, и 103 мг/роллер против 100 мг/роллер для количества).
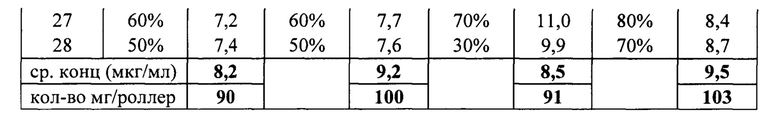
Пример 4. Сравнительный анализ выхода кислых форм Дарбэпоэтина из культуральной жидкости, наработанной при культивировании клонов 9Е10, 10D9, 13В7 и 11D4.
Для оценки качества биосинтеза Дарбэпоэтина проводили его очистку на хроматографической колонке, упакованной иммуносорбентом РС/ED7-Сефароза FF (ООО ПК). Элюцию белка проводили 0,1 м лимонной кислотой. По получению раствора белка его сразу нейтрализовали NaOH до рН 7,5. Очистку проводили из стоков КЖ начала, середины и окончания культивирования, полученных для каждого клона клеток индивидуально.
Был проведен анализ образцов методом зонального капиллярного электрофореза (СЕ) и изоэлектрофокусирования (ИЭФ). В качестве образца сравнения использовали коммерческий препарат Аранесп (Амджен Европа Б.В.). Перед анализом образцы белка концентрировали с помощью «Microcon-®-10 Centrifugal Filters Ultracel® PL-10». Для расчета оценивали процентное отношение содержания вещества в 5 пиках, соответствующих Аранесп, к общей площади под хроматографической кривой. Изоэлектрофокусирование проводили в полиакриламидном геле следующего состава: омфалиты - 70% Pharmalyte рН 3-10, 30% Servalyte рН 2-4, 7 М мочевина. Относительное содержание изоформ в образцах высчитывали с помощью программы CLIQS. В таблице 2 представлен результат анализа процентного содержания кислых изоформ, соответствующих Аранесп, в препаратах очистки Дарбэпоэтина.
Из таблицы 2 следует, что наиболее продуктивным по количеству изоформ, отвечающих Аранесп, является клон клеток 13В7, в среднем по протоколу культивирования их содержание составило около 45% (среднее по 42,0%, 51,5%, 43,4%). По уровню экспрессии клон клеток 13 В7 в среднем составлял 9,5 мкг/мл, 103 мг/роллер (табл.1), имел наименьшие повреждения клеточного монослоя и наиболее сглаженную динамическую кривую (фиг.4).
С учетом вышеизложенного клон клеток 13 В7 был использован для создания штамма линии клеток яичников китайского хомячка (СНО), продуцента рекомбинантного дарбэпоэтина альфа, а также для депонирования в специализированной коллекции культур клеток ЦКП «Коллекция культур клеток позвоночных» 26.06.2019 под номером РККК(П) 798Д, с авторским наименованием CHOdEpo13B7. Число пассажей к моменту паспортизации: 16 пассажей.
Пример 5. Полный цикл хроматографической очистки дарбэпоэтина альфа из культуральной жидкости.
Перед проведением хроматографических стадий в КЖ добавляли 10% раствор азида натрия до конечной концентрации 0,05% и фильтровали через каскад фильтров: глубинный фильтр с размером пор 10 мкм и стерилизующий фильтр с размером пор 0,22 мкм. Значение рН КЖ фиксировали в диапазоне 6,8-7,2.
Для осуществления стадии аффинной хроматографии использовали иммуносорбент PC/ED7 Sepharose FF (ООО «Протеиновый контур»), упакованный в хроматографическую колонну высотой слоя 10 см. На колонку, уравновешенную раствором PBS+0,05% NaN3 наносили культуральную жидкость. Промывали сорбент растворами: PBS+0,05% NaN3; PBS+0,05% Tween 20; PBS+0,05% Tween 20+1 M NaCl и 20 мМ ТРИС гидрохлорид рН 7,50. Элюировали щелочные формы белка раствором глицина гидрохлорида рН 3,20.
Элюировали кислые формы белка раствором глицина гидрохлорида рН 2,19. Полученный элюат нейтрализовали добавлением 1М раствора ТРИС до значения рН 7,50. Измеряют концентрацию дарбэпоэтина альфа в нейтрализованном элюате спектрофотометрическим методом. Выход на стадии составлял 37%.
Для осуществления стадии анионообменной хроматографии использовали сорбент YMC BioPro Q75, упакованный в хроматографическую колонну высотой слоя 13 см. Колонку уравновешивали раствором 50 мМ уксусной кислоты, 60 мМ ТРИС, 20 мМ хлорида натрия. Полупродукт после стадии аффинной хроматографии наносили на сорбент и промывали растворами, содержащими уксусную кислоту, ТРИС гидрохлорид, хлорид натрия и глицин гидрохлорид рН 2,87 Элюировали кислые формы целевого белка раствором 50 мМ уксусной кислоты, 60 мМ ТРИС гидрохлорид, 400 мМ хлорида натрия. Измеряли концентрацию дарбэпоэтина альфа в полученном элюате спектрофотометрическим методом. Выход на стадии составлял 25%.
Для осуществления стадии гель фильтрации использовали молекулярные сита Sephacryl S-200 HR, упакованные в хроматографическую колонну высотой слоя 60-90 см. Колонку уравновешивали раствором для субстанции. Полупродукт после стадии анионообменной хроматографии наносили в объеме, равном 2,5-3,5% от объема колонны. Элюировали 1,2 колоночными объемами раствора для субстанций. Измеряли концентрацию дарбэпоэтина альфа в полученном элюате спектрофотометрическим методом. Полупродукт после хроматографической очистки фильтруют через стерилизующий фильтр с размером пор 0,22 мкм и хранят при минус 70°С. Анализ по стадиям очистки методом изоэлектрофокусирования представлен на фиг.2.
| название | год | авторы | номер документа |
|---|---|---|---|
| ВЕКТОР ЭКСПРЕССИИ, ЭУКАРИОТИЧЕСКИЙ ШТАММ ПРОДУЦЕНТ И СПОСОБ ПОЛУЧЕНИЯ ДАРБЭПОЭТИНА АЛЬФА | 2022 |
|
RU2819866C2 |
| ЭУКАРИОТИЧЕСКАЯ КЛЕТКА-ХОЗЯИН ДЛЯ ЭКСПРЕССИИ ДАРБЭПОЭТИНА, ВЕКТОР ЭКСПРЕССИИ И СПОСОБ ПОЛУЧЕНИЯ ДАРБЭПОЭТИНА АЛЬФА | 2013 |
|
RU2523948C1 |
| Клеточная линия huFSHKKc6 - продуцент рекомбинантного человеческого фолликулостимулирующего гормона (ФСГ) и способ получения ФСГ с использованием данной линии | 2018 |
|
RU2694598C1 |
| ГИБРИДНЫЙ БЕЛОК НА ОСНОВЕ РЕКОМБИНАНТНОГО ЭРИТРОПОЭТИНА ЧЕЛОВЕКА, ОБЛАДАЮЩИЙ ПРОЛОНГИРОВАННЫМ ДЕЙСТВИЕМ (ВАРИАНТЫ), И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2013 |
|
RU2515914C1 |
| РЕКОМБИНАНТНАЯ ПЛАЗМИДНАЯ ДНК, КОДИРУЮЩАЯ ХИМЕРНОЕ АНТИТЕЛО ПРОТИВ ФАКТОРА НЕКРОЗА ОПУХОЛИ-АЛЬФА ЧЕЛОВЕКА, ЛИНИЯ ЭУКАРИОТИЧЕСКИХ КЛЕТОК-ПРОДУЦЕНТ ХИМЕРНОГО АНТИТЕЛА И СПОСОБ ПОЛУЧЕНИЯ ХИМЕРНОГО АНТИТЕЛА | 2013 |
|
RU2555533C9 |
| Синтетическая ДНК, кодирующая интерлейкин-7 человека, содержащий ее экспрессионный вектор (варианты), штамм-продуцент интерлейкина-7 человека и способ получения интерлейкина-7 человека | 2015 |
|
RU2615447C1 |
| СПОСОБ ПОЛУЧЕНИЯ ИММОРТАЛИЗОВАННОЙ КЛЕТКИ ЧЕЛОВЕКА, СТАБИЛЬНО ТРАНСФИЦИРОВАННАЯ ИММОРТАЛИЗОВАННАЯ КЛЕТКА ЧЕЛОВЕКА, СПОСОБ РЕКОМБИНАНТНОЙ ПРОДУКЦИИ ЦЕЛЕВОГО БЕЛКА ЧЕЛОВЕКА, ПРИМЕНЕНИЕ ВЕКТОРА ТРАНСФЕКЦИИ | 2006 |
|
RU2453597C2 |
| ШТАММ КЛЕТОК ЯИЧНИКОВ КИТАЙСКОГО ХОМЯЧКА - ПРОДУЦЕНТ РЕКОМБИНАНТНОГО АНТИТЕЛА ПРОТИВ ФАКТОРА НЕКРОЗА ОПУХОЛИ АЛЬФА ЧЕЛОВЕКА | 2014 |
|
RU2556816C1 |
| РЕКОМБИНАНТНАЯ ПЛАЗМИДНАЯ ДНК pOptiVEC-MBP-Fc, КОДИРУЮЩАЯ КОНСТАНТНЫЙ ФРАГМЕНТ ИММУНОГЛОБУЛИНА ЧЕЛОВЕКА, СЛИТНОГО С ФРАГМЕНТОМ ОСНОВНОГО БЕЛКА МИЕЛИНА, ЛИНИИ ЭУКАРИОТИЧЕСКИХ КЛЕТОК - ПРОДУЦЕНТОВ УКАЗАННОГО БЕЛКА И СПОСОБ ПОЛУЧЕНИЯ БЕЛКА MBP-Fc ДЛЯ ТЕРАПИИ РАССЕЯННОГО СКЛЕРОЗА | 2016 |
|
RU2679055C2 |
| КЛЕТКА, ПРОДУЦИРУЮЩАЯ С ВЫСОКОЙ ЭФФЕКТИВНОСТЬЮ АКТИВНЫЙ БЕЛОК АРИЛСУЛЬФАТАЗУ В, И СПОСОБ ПОЛУЧЕНИЯ ЭТОЙ КЛЕТКИ | 2020 |
|
RU2763990C2 |

Изобретение относится к области биотехнологии, а именно к штамму линии клеток яичника китайского хомячка (СНО), продуценту рекомбинантного дарбэпоэтина альфа, депонированному в специализированной коллекции культур клеток ЦКП «Коллекция культур клеток позвоночных» под номером РККК(П) 798Д. Изобретение позволяет получить необходимый вариант белка дарбэпоэтина альфа. 4 ил., 2 табл., 5 пр.
Штамм линии клеток яичника китайского хомячка (СНО), продуцент рекомбинантного дарбэпоэтина альфа, депонированный в специализированной коллекции культур клеток ЦКП «Коллекция культур клеток позвоночных» под номером РККК(П) 798Д.
| LEDERLE M | |||
| et al | |||
| Continuous optical in-line glucose monitoring and control in CHO cultures contributes to enhanced metabolic efficiency while maintaining darbepoetin alfa product quality,Biotechnol J, 2021, vol.16 | |||
| KIANMEHR A | |||
| et al | |||
| Purification and Characterization of Recombinant Darbepoetin Alfa from Leishmania tarentolae,Mol Biotechnol, |
Авторы
Даты
2023-10-24—Публикация
2023-04-20—Подача