Изобретение относится к биотехнологии и предназначено для получения дарбэпоэтина альфа - аналога рекомбинантного человеческого эритропоэтина. Способ осуществляют путем культивирования штамма клеток яичника китайского хомячка СНО, трансформированного экспрессионным вектором, содержащим ген дарбэпоэтина, в химически определенной, бессывороточной среде.
Штамм получен путем трансформации клеток яичника китайского хомяка CHO-S плазмидой pCI-dEPO2x, содержащей участки связывания с ядерным матриксом (S/MAR элементы) и две копии оптимизированной последовательности гена дарбэпоэтина, с последующей селекцией на среде, содержащей 500 мг на литр G418.
Настоящее изобретение также относится к способам трансформации, отбора и получения клеток млекопитающих, которые способны продуцировать белок дарбэпоэтина альфа - аналога рекомбинантного человеческого эритропоэтина, включая пострансляционные модификации, где указанные пострансляционные модификации исходно детерминированы и осуществляются в экспрессирующих клетках яичника китайского хомячка СНО, трансформированных экспрессионным вектором, содержащим ген дарбэпоэтина, в химически определенной, бессывороточной среде.
Детерминирование осуществляется заданной нуклеиновой кислотой, кодирующей белковую молекулу дарбэпоэтина в клетках СНО в экспрессируемой форме, культивированием трансформированных клеток в условиях, обеспечивающих продукцию целевого белка с необходимым профилем гликозилирования.
В настоящее время для лечения анемий применяются следующие группы препаратов, стимулирующих эритропоэз:
- Рекомбинантный эритропоэтин альфа (эпоэтин альфа, эпрекс, др.).
- Рекомбинантный эритропоэтин бета (эпоэтин бета, рекормон, рэпоэтин-СП, эпокрин, эпостим).
- Новый эритропоэз-стимулирующий белок (novel erythropoiesis stimulating protein; NESP) - аранесп или дарбэпоэтин альфа.
Все перечисленные препараты являются рекомбинантными производными эндогенного гормона эритропоэтина (ЭПО). ЭПО человека представляет собой гликозилированный белок массой около 30,4 кДа, полипептидная цепь которого состоит из 165 аминокислотных остатков. В результате посттрансляционных модификаций к полипептидной цепи белка происходит присоединение N- и O-связанных углеводных цепей, на долю углеводного компонента приходится 40-50% молекулярной массы [1]. Каждая из N-связанных цепей может содержать максимум 4 остатка сиаловых кислот, тогда как O-связанная цепь может содержать не более двух остатков. Таким образом, ЭПО может содержать от 4 до 14 остатков сиаловых кислот, что соответствует минимальному и максимальному уровню сиалирования [1]. Различные изоформы ЭПО, отличающиеся степенью сиалирования и, как следствие, зарядом, могут быть разделены методами изоэлектрического фокусирования в геле капиллярного электрофореза.
В рамках экспериментов по повышению стабильности ЭПО в крови больных было создано множество новых молекул ЭПО, одна из них, названная NM279, содержащая 4 N-присоединенные углеводные цепи, проявила увеличенную биологическую активность (исследования проводились на полицитемических мышах). Дальнейшие опыты привели к созданию молекулы NM321 (darbepoetin alfa), которая содержала 5 N-связанных углеводных цепей, дополнительные углеводные цепочки присоединялись к остаткам Asn 30 и Asn 88 [2]. Для создания данной молекулы было проведено пять следующих аминокислотных замен в природной молекуле ЭПО: Ala30Asn, His32Thr, Pro87Val, Trp88Asn и Pro90Thr. Введение двух дополнительных N-связанных углеводных компонентов позволило увеличить количество остатков сиаловых кислот с 14 до 22.
Дополнительный углеводный фрагмент дарбэпоэтина привел к увеличению молекулярной массы белка с 30,400 (для нативного ЭПО) до 38,000. Содержание углеводной части в дарбэпоэтине составляет около 52%, тогда как в ЭПО оно составляет 40%. Сродство молекулы дарбэпоэтина к рецептору эритропоэтина оказалось меньше, чем у природного лиганда, однако данный факт компенсируется его гораздо большей стабильностью [2].
Таким образом, дарбэпоэтин альфа представляет собой сверхсиалированный аналог человеческого эритропоэтина альфа (ЭПО-альфа), имеющий увеличенный период полувыведения из организма по сравнению с нативной и рекомбинантной формой этого гормона. Он имеет такой же механизм действия, как и ЭПО, связывается с тем же поверхностным мембранным рецептором и запускает ту же цепь молекулярных взаимодействий внутри клетки. Дополнительные N-связанные углеводные цепи дарбэпоэтина альфа приводят к большей метаболической устойчивости молекулы in vivo, таким образом время его полувыведения при внутривенном введении в три раза больше, по сравнению со временем полувыведения ЭПО-альфа. Данное свойство дарбэпоэтина позволяет вводить его пациентам менее часто. Исследования показали, что введение дарбэпоэтина раз в неделю позволяет поддерживать уровень гемоглобина у пациентов с почечной недостаточностью на постоянном уровне. Рекомендованная доза введения дарбэпоэтина составляет 0,45 мкг на кг массы тела раз в неделю подкожно, с последующей корректировкой в соответствии с изменением концентрации гемоглобина. Побочные эффекты от применения дарбэпоэтина очень сходны с таковыми от приема рекомбинантного ЭПО-альфа, причем у пациентов, принимающих данный препарат в течение пяти лет, не было детектировано наличие антител к ЭПО.
Дарбэпоэтин с 2007 г. разрешен к применению в России (фиг.1), и так как по сравнению с природным прототипом генно- и гликомодифицированный дарбэпоэтин обладает втрое большим временем жизни в крови больных [3], он является более предпочтительным при лечении анемий различного происхождения [4, 5].
В настоящее время для биосинтеза рекомбинантных белков человека, требующих корректного гликозилирования, обычно применяют клеточные линии СНО, несущие интегрированные в геном гены целевых белков под контролем сильных промоторов клеточного или вирусного происхождения. В число наиболее эффективных входят промоторы CMV (промоторно-энхансерный элемент предранних генов цитомегаловируса человека), EF1α (промотор альфа-субъединицы фактора 1 элонгации трансляции) [6-8] или сконструированный на их основе гибридный промотор CMV-EF1α, содержащий коровую область промотора EF1α и энхансер промоторно-энхансерной области гена CMV. Показано, что для некоторых трансгенов CMV-EF1α обеспечивает более высокий уровень экспрессии по сравнению с CMV [7, 9].
С целью оптимизации экспрессии помимо выбора эффективных промоторов разработаны многие другие приемы, ведущие к увеличению биосинтеза целевого белка.
Так, известно, что экспрессия трансгена в клетках млекопитающих подвержена «эффекту положения», то есть зависит от сайта интеграции трансгена в клеточный геном. В этой связи с целью снижения и преодоления «эффекта положения» в состав конструкций часто включают элементы, известные как SAR (Scaffold Attachment Region) и MAR (Matrix Attachment Region) элементы, которые пространственно разграничивают транскрипционные домены хромосом и защищают экспрессию интегрированных трансгенов от инактивирующего влияния фланкирующих областей хроматина [10-12]. Одним из наиболее популярных элементов подобного рода, традиционно используемым для оптимизации экспрессии трансгенов, является S/MAR элемент из 5'-области гена β-интерферона человека [11, 13].
Другим оптимизируемым параметром является частота использования синонимических кодонов в гене интереса [14]. Многочисленные программы и стратегии такой оптимизации опираются на известную положительную корреляцию между уровнем экспрессии генов интереса и соответствием частот использования кодонов в гене интереса и организме в целом [14, 15]. При этом с целью оптимизации кодонового состава изменяют первичную структуру гена интереса. Однако следствием такого изменения бывает не только улучшение кодонового состава гена, но и появление в составе транскриптов этого гена вторичных структур, способствующих улучшению его трансляции [16].
Уровень экспрессии трансгена также обычно зависит от его дозы, то есть от количества копий гена интереса в клетке (геноме) [17, 18]. Учет этого обстоятельства имеет особое значение при получении стабильно трансфецированных клеточных линий, когда важно чтобы клеточный геном содержал как можно больше копий гена интереса. В большинстве случаев решения проблемы получения многокопийных продуцентов достигают путем увеличения выборки трансфектантов, отобранных для анализа продуктивности, или путем генетической амплификации интегрированных трансгенов и селекции многокопийного клонального потомства в условиях увеличивающегося селективного давления [18, 19].
Альтернативой или дополнением к этим традиционным подходам может являться использование векторов, заранее содержащих несколько копий (доз) целевого гена. В этом случае можно ожидать, что уже на стадии трансфекции в клетку будет попадать увеличенное количество генов интереса, вследствие чего должна увеличиваться эффективность отбора высокопродуктивных трансфектантов. Подобный подход широко используется при создании стабильных продуцентов на основе клеток дрожжей [20].
Сущность изобретения
Изобретение относится к области биотехнологии, а именно к технологии получения рекомбинантного дарбэпоэтина альфа методами генной инженерии.
Цель настоящего изобретения заключается в создании штамма продуцента дарбэпоэтина альфа на основе оптимизированных генетических конструкций, отработанной технологии биосинтеза дарбэпоэтина в клетках СНО. Ранее было описано получение этого белка в результате экспрессии в клетках СНО мутантной кДНК природного гена эритропоэтина под контролем промотора CMV в присутствие S/MAR элемента [21]. В изобретении предложены дополнительные приемы, позволяющие получать эффективные продуценты этого белка, обеспечивающие детерминирование пострансляционной модификации целевого продукта.
Преимущества настоящего изобретения заключается в том, что описывает продукцию рекомбинантного дарбэпоэтина альфа с детерминированной пострансляционной модификацией.
Включает идентификацию систем экспрессии целевого белка, способ создания системы экспрессии на основе анализа пострансляционной модификации белка дарбэпоэтина альфа, продуцируемой клеточной линией CHO-S, способ отбора наиболее эффективной экспрессирующей клеточной линии. Пострансляционная модификация относится к модификации, которая присутствует в белковой молекуле дарбэпоэтина.
Подходящей клеточной линией для использования в рамках детерминированной пострансляционной модификации является суспензионная линия клеток CHO-CMV/rEF1-dEPO, депонированная в Всероссийской коллекции промышленных микроорганизмов (Номер №№133 от 02.11.2012).
Способ продуцирования белковых молекул в настоящем изобретении включает в себя дополнительную стадию очистки дарбэпоэтина альфа из культуральной жидкости.
Очистка может производится с использованием традиционных способов, а также с использованием хроматографической очистки с использованием сорбента 40Q.
Для лучшего понимания изобретение может быть проиллюстрировано, но не исчерпано следующими примерами его конкретного осуществления.
Краткое описание фигур
Фиг.1. Сравнение аминокислотных последовательностей эритропоэтина и дарбэпоэтина А) Аминокислотная последовательность дарбэпоэтина (курсивом обозначен сигнальный пептид, черным цветом выделены аминокислоты - введенные сайты дополнительного гликозилирования). Б) Выравнивание аминокислотных последовательностей дарбэпоэтина и эритропоэтина. ЕРО - эритропоэтин человеческий, DEPO - дарбэпоэтин.
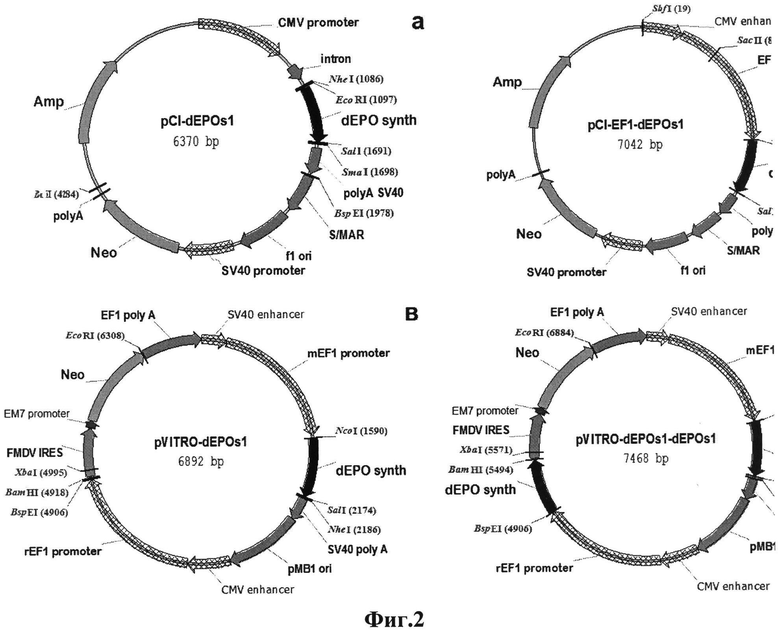
Фиг.2. Карты генетических конструкций для экспрессии дарбэпоэтина. dEPO synth - синтетический ген дарбэпоэтина, оптимизированный по поденному составу, S/MAR - S/MAR элемент 5'-области гена α-интерферона человека, CMV promoter - промотор предранних генов человеческого цитомегаловируса, CMV enhancer - энхансер предранних генов цитомегаловируса человека, Neo - ген неомицинфосфортрансферазы, Amp - β-лактамаза, ген устойчивости к ампициллину, pMB1 ori, f1 ori - сайты начала репликации плазмид, poly A SV40 - сигнал полиаденилирования, FMDV IRES - участок внутренней посадки рибосомы вируса FMDV.
Фиг.3. Схема расположения праймеров для мутагенеза природного гена эритропоэтина.
Последовательности праймеров и их расположение:
1. 5'-ctataggctagcctcgagaatt-3' FW. Расположение - 1079 - 1100 п.н. плазмиды pCI-EPOn.
2. 5'-caagctgcaggtttcattacagcc-3' RV. Расположение - 2118 - 2095 п.н. плазмиды pCI - EPOn.
3. 5' - ggctgtaatgaaacctgcagcttg-3' FW. Расположение - 2095 - 2118 п.н. плазмиды pCI - EPOn.
4. 5' - gctgcagggtctcgttcacctggga-3' RV. Расположение - 2905 - 2881 п.н. плазмиды pCI - EPOn.
5. 5' - tcccaggtgaacgagaccctgcagc-3' FW. Расположение - 2881 -2905 п.н. плазмиды pCI - EPOn.
6. 5' - cccgggtcgactctagaggt-3' RV. Расположение - 3375 - 3356 п.н. плазмиды pCI - EPOn.
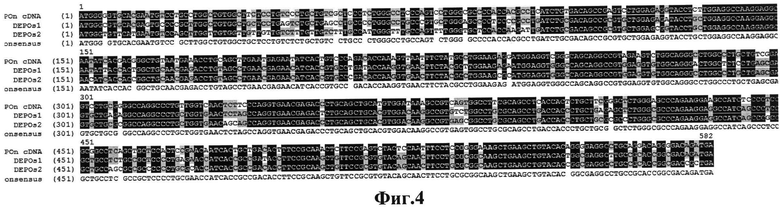
Фиг.4. Выравнивание трех вариантов кДНК генов дарбэпоэтина. DEPOn cDNA - кДНК мутированного гена человеческого эритропоэтина с заменой пяти кодонов, DEPOs1 и DEPOs2 синтетические гены дарбэпоэтина, оптимизированные по кодонному составу.
Фиг.5. Оценка эффективности конструкций в транзиентной трансфекции клеток CHO-S для экспрессии дарбэпоэтина. Количество дарбэпоэтина измерялось методом ИФА, через 72 часа после трансфекции. Эффективность транзиентной трансфекции 30% определенной по вектору, содержащий ген флуоресцентного белка (pEYFP).
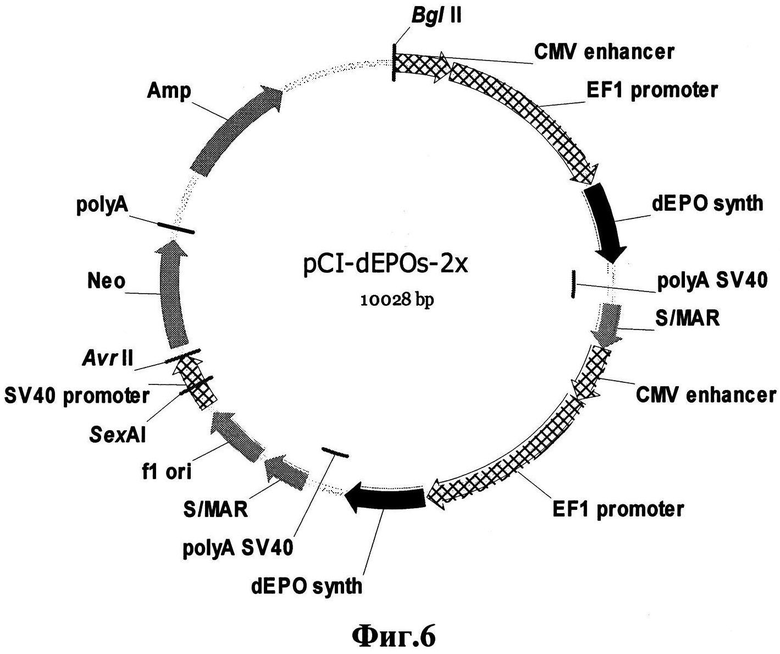
Фиг.6. Конструкция pCI-dEPOs-2X, содержащая двойной пул гена dEPOs. dEPO synth - синтетический ген дЭПО-альфа, оптимизированный по кодонному составу; S/MAR - S/MAR элемент 5'-области гена α-интерферона человека; CMV enhancer - энхансер предранних генов цитомегаловируса человека; EF1 promoter - промотор альфа-субъединицы фактора 1 элонгации трансляции крысы.
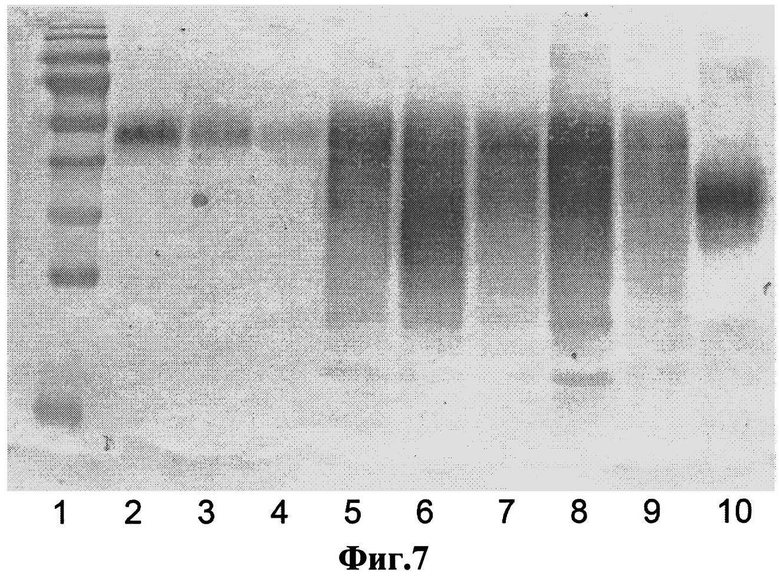
Фиг.7. Вестерн-блот образцов КЖ, содержащих дЭПО-альфа. 1 - маркер молекулярных масс (Fermentas, Литва); 2, 3, 4 - препарат Аранесп 100, 50, 10 нг, соответственно; 5, 6, 7, 8, 9 - КЖ клонов №13,17, 23, 28, 29, соответственно; 10 - EPO-BRP, 50 нг.
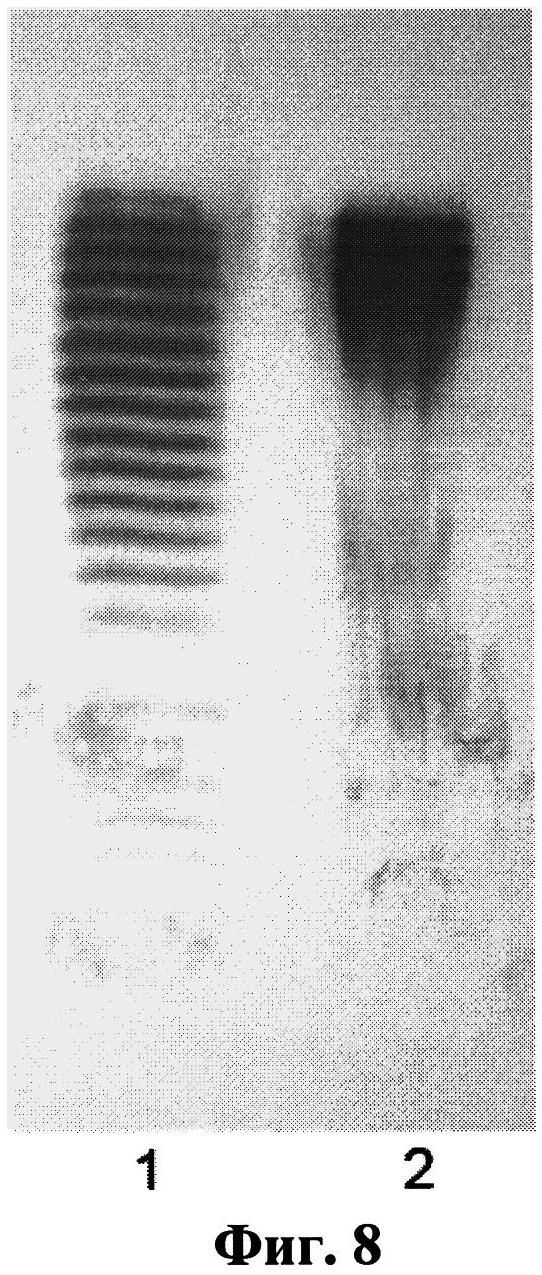
Фиг.8. Изоэлектрофоретическое разделение изоформ дЭПО-альфа (окраска антителами к ЭПО). 1 - КЖ клона №28, полученная на 7 сутки культивирования в колбе; 2 - препарат Аранесп, 100 нг.
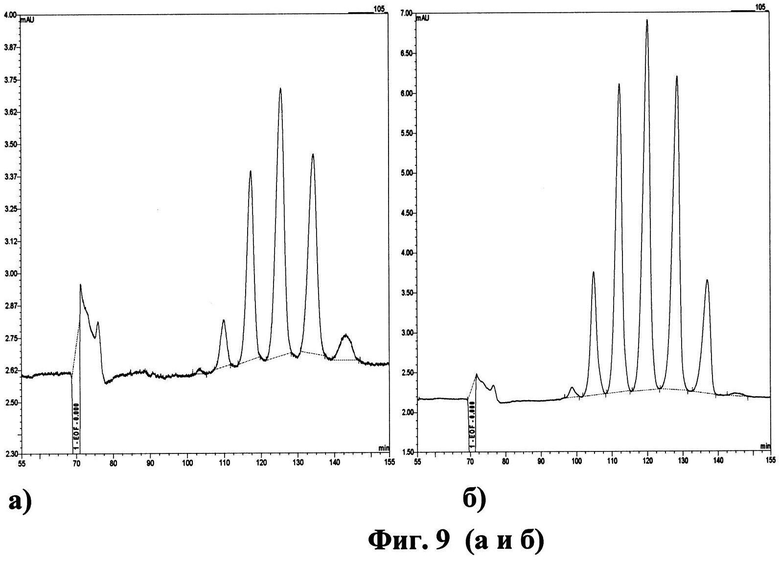
Фиг.9. Хроматограмма образцов, содержащих дЭПО-альфа, полученные методом капиллярного электрофореза, а - препарат Аранесп, б - конечный элюат dEPO после третьей стадии хроматографической очистки.
Примеры.
Пример 1. Конструирование экспрессионных плазмид для продукции дарбэпоэтина в клетках СНО
Для получения экспрессионных плазмид используют базовые экспрессионные векторы pCI-neo (Promega, США) и pVITROneo (InvivoGen, США). Плазмида pCI-neo содержит в своем составе сильный конститутивный промотор CMV цитомегаловируса человека и ген неомицинфосфотрансферазы, обеспечивающий устойчивость к антибиотикам группы неомицина. Плазмида pVITROneo в своем составе содержит два химерных промотора, один из которых представляет собой гибрид промоторной области гена EF1α крысы и энхансерной области CMV, а второй - гибрид промоторной области гена EF1α мыши и энхансерной области SV40 (фиг.2).
Были сконструированы три варианта структурного гена дарбэпоэтина - «природный», полученный путем направленного мутагенеза на основе природного (интронированного) гена эритропоэтина человека размером ~2,3 т.п.н., и два синтетических.
Конструирование плазмиды pCI-EPOn
На первом этапе вектор pCI-neo модифицируют: в его состав добавляют сайты рестриктаз BspEI, ApaI, Eco32I и NruI. С этой целью была проведена амплификация двух фрагментов ДНК вектора pCI-neo с использованием следующих пар праймеров:
Первая пара (продукт 429 п.н.):
5'-CATCCACTTTGCCTTTCTCTCC-3'
5'-GCTATTACGCCAGTCCGGATCGA-3'
Вторая пара (продукт 319 п.н.):
5'-GATCCGGACTGGCGATATCGCGAAGGGGCCCGCACC-3'
5'-GGCCCACTACGTGAACCATC-3'
Концы амплифицированных фрагментов ДНК были открыты путем обработки рестриктазами NotI и BspEI (фрагмент 429 п.н.) и BspEI и DraIII (фрагмент 319 п.н.) соответственно. Для клонирования полученных фрагментов ДНК плазмида pCI-neo была линеаризована путем обработки рестриктазами NotI и DraIII. Амплифицированные фрагменты ДНК и линеаризованная ДНК плазмиды pCI-neo были направленно лигированы друг с другом, в результате чего получена плазмида pCI-neo-2. Корректность сборки модифицированного участка плазмиды pCI-neo-2 была доказана секвенированием.
На втором этапе было проведено клонирование димеризованного фрагмента ДНК, кодирующего минимальную область S/MAR элемента гена интерферона-бета человека. С этой целью в реакции ПНР был амплифицирован фрагмент геномной ДНК человека размером 183 п.н. ПЦР проведена с использованием следующих праймерами:
5'-ATGGGAAAATGATGATCTTT-3'
5'-TCATGATCGCATGCTTCTAT-3'
Концы амплифицированного фрагмента ДНК были открыты путем обработки рестриктазой MboI, после чего полученные фрагменты лигированы с образованием линейных конкатамеров. Липкие концы конкатамеров были затуплены с использованием ДНК-полимеразы фага Т4 Е.coli, после чего результирующие фрагменты клонированы в векторе pCI-neo-2, линеаризованном по сайту рестрикции Eco32I. В результате клонирования был отобран рекомбинантный вектор pCI-neo-MAR, содержавший удвоенный S/MAR элемент, димеризованный по типу «голова к хвосту». Корректность ориентации и последовательности клонированного элемента были доказаны секвенированием.
Ген эритропоэтина (ЕРО) был амплифицирован в реакции ПЦР с использованием в качестве матрицы хромосомной ДНК (Promega, Кат. G1471, США). Праймерами для ПЦР служили
5'-CTCGAGAATTCGATGCGGAGATGGGGGTGC-3'
5'-CGTGAATTCACTAGTGATGGGGGAGGGTGTGGCACAAGC-3'
Концы амплифицированного фрагмента ДНК были открыты путем обработки рестриктазой EcoRI, после чего «природный» ген эритропоэтина был клонирован в сайт EcoRI плазмиды pCI-neo-MAR. Полученная плазмида названа pCI-EPOn. В составе этой плазмиды клонированный ген эритропоэтина был секвенирован.
Конструирование плазмиды pCI-dEPOn
Ген природного эритропоэтина человека, клонированный в составе плазмиды pCI-EPOn, использован в качестве матрицы для осуществления ПЦР-мутагенеза с целью конструирования гена дарбэпоэтина. Последовательности и схема отжига праймеров для осуществления этого мутагенеза, а также схема мутагенеза приведены на фиг.3.
Полученный в результате ПЦР-мутагенеза фрагмент ДНК размером ~2,3 т.п.н., кодирующий «природную» версию гена дарбэпоэтина человека, был клонирован в плазмиде pCI-EPOn по сайтам рестрикции NheI и SalI. В результате клонирования была получена конструкция, названная pCI-dEPOn. Корректность последовательности клонированного гена доказана секвенированием.
Конструирование плазмиды pVITRO-dEPOs1
Последовательность синтетического варианта гена дарбэпоэтина dEPOs1 была оптимизирована по кодонному составу, затем синтезирована в компании «Сервис-ген» (Санкт-Петербург). Структура гена dEPOs1 приведена на фиг.4. Фрагмент ДНК, кодирующий синтетический ген dEPOs1, был клонирован в плазмиде pVITROneo по сайту рестрикции EcoRV. Результирующая плазмида, содержащая ген дарбэпоэтина, названа pVITRO-dEPOs1.
Конструирование плазмиды pCI-dEPOs1
Синтетический ген дарбэпоэтина, клонированный в составе плазмиды pVITRO-dEPOs1, был амплифицирован в реакции ПЦР с использованием следующих праймеров:
5'-ATATGAATTCCGCCACCATGGGCGTGCACGAG-3';
5'-GAGAGTCGACTCATCTGTCGCCGGT-3'.
Амплифицированный фрагмент ДНК размером ~600 п.н., концы которого были открыты с помощью рестриктаз EcoRI и SalI, был клонирован в векторе pCI-EPOn, линеаризованном с использованием этих же рестриктаз. В результате клонирования была получена плазмида pCI-dEPOs1 (табл.1), корректность сборки которой доказана секвенированием.
Конструирование плазмиды pCI-dEPOs2
Синтетический вариант гена дарбэпоэтина dEPOs2 также был синтезирован в фирме «Сервис-ген». Последовательность гена dEPOs2 была разработана на основе оптимизированной последовательности гена эритропоэтина [16]. Фрагмент ДНК, кодирующий синтетический ген dEPOs2, был клонирован в плазмиде pCI-EPOn по сайтам рестрикции EcoRI и SalI. В результате была получена плазмида pCI-dEPOs2.
Конструирование плазмид pCI-ЕР1-dEPOs1 и pCI-EF1-dEPOs2
Фрагмент ДНК, кодирующий гибридный промотор CMV-EF1α, был амплифицирован в реакции ПЦР с использованием в качестве матрицы ДНК плазмиды pVITROneo. Праймерами для ПНР служили:
5'-ACATAGATCTAATTAACCTGCAGGCGTTACA-3';
5'-ATATCTCGAGCGTACGGGATCCGTATACTC-3'.
Амплифицированный фрагмент ДНК размером ~1700 п.н., концы которого были открыты с помощью рестриктаз BglII и XhoI, был клонирован в векторах pCI-dEPOs1 и pCI-dEPOs2, линеаризованных с использованием этих же рестриктаз.
В результате были получены плазмиды pCI-EF1-dEPOs1 и pCI-EF1-dEPOs2, в составе каждой из которых экспрессия синтетического гена дарбэпоэтина dEPOs1 или dEPOs2, соответственно, направлялась гибридным промотором CMV-EF1α.
Конструирование плазмиды р VITRO-dEPOs1-dEPOs1
Был получен вариант pVITRO-dEPOs1, содержащей две копии синтетического гена дарбэпоэтина. С этой целью ген dEPOs 1 был амплифицирован в реакции ПЦР с использованием следующих праймеров:
5'-TCGATCCGGAGCCACCATGGGCGTGCACGA-3';
5'-ATATGGATCCTCATCTGTCGCCGGTGCGGCAA-3'.
Амплифицированный фрагмент ДНК размером ~600 п.н., концы которого были открыты с помощью рестриктаз Kpn21 и BamHI, был клонирован в векторе pVITRO-dEPOs1, линеаризованном с использованием этих же рестриктаз. В результате клонирования была получена плазмида р VITRO-dEPOs1-dEPOs1 (табл.1), в составе которой одна копия синтетического гена дарбэпоэтина dEPOs1 находилась под контролем химерного промотора SV40-EF1α и энхансерной части, а вторая копия того же гена - под контролем химерного промотора CMV-EF1α.
Пример 2. Проведение транзиентной трансфекции и анализ уровня экспрессии дарбэпоэтина методом ИФА.
Для проведения транзиентной трансфекции экспрессионными конструкциями, содержащими ген дарбэпоэтина, клетки линии CHO-S (Invitrogen, США) культивируют в вентилируемых колбах объемом 125 мл при 37°С в 5% СО2 в бессывороточной среде PowerCHO (Lonza, Швейцария) с добавлением L-глутамина, гипоксантина натрия и тимидина до конечной концентрации 4 мМ, 100 мкМ и 16 мкМ, сооветственно. Культивирование проводят на орбитальном шейкере со скоростью 130 об/мин. После достижения суспензионной культурой плотности ~1*106 клеток/мл ростовую среда PowerCHO заменяют на равный объем среды CD CHO (Invitrogen, США) для проведения трансфекции.
Трансфекцию плазмидами производят с использованием реагента FreeStyle MAX (Invitrogen, США) в соответствии со стандартным протоколом для 6-луночных планшетов. Через 24 часа после проведения трансфекции среду CD CHO заменяют на равный объем ростовой среды PowerCHO.
Для выбора наиболее эффективной конструкции для экспрессии дарбэпоэтина в клетках CHO, для трансфекции использовали плазмиды, содержавшие ген дарбэпоэтина, и контрольные плазмиды pCI-EPOn, содержавшие ген эритропоэтина, а также pEYFP-N1 (Clontech, США), содержавшую ген зеленого флуоресцентного белка.
Анализ уровня экспрессии дарбэпоэтина методом ИФА
Для измерения концентрации дарбэпоэтина в среде культивирования трансфецированных линий клеток с помощью ИФА используют набор «Эритропоэтин-ИФА-БЕСТ» («Вектор-БЕСТ», п.Кольцове, Новосибирской обл.). Для калибровки ИФА используют препарат дарбэпоэтина Аранесп (Amgen, США). Пробы культуральной жидкости для измерения дарбэпоэтина отбирают на 3-е, 4-е и 5-е сутки для каждого из 8 пулов трансфецированных клеток.
Сравнение эффективности конструкций в транзиентной экспрессии показывает, что суммарный эффект 3-4-кратного увеличения экспрессии дарбепоэтина в клетках СНО достигается за счет: использования синтетических последовательностей структурного гена, имеющих оптимизированный кодоновый состав; использования промотора CMV-EF1α вместо промотора CMV; удвоения числа копий гена в составе трансфецирующей плазмиды; S/MAR элементы в условиях транзиентной экспрессии (эписомной локализации гена) не оказывают влияния на экспрессию дарбэпоэтина (фиг.5).
Пример 3. Получение стабильного клона-продуцента дЭПО-альфа
Получение экспрессионной плазмиды pCI-dEPOs-2x.
Экспрессионную плазмиду для получения стабильной клеточной получают на основе плазмиды pCI-neo (Promega, США). На первом этапе получают плазмиду pCI-EF1a-dEPOs1, содержащую синтетический ген дЭПО, как описано примером ранее. Далее плазмиду pCI-EF1a-dEPOs1 (реципиент) обрабатывают рестриктазой SdaI и проводят обработку Т4-полимеразой для затупления концов линеаризованного вектора. После инактивации Т4-полимеразы нагревом в течение 5 мин при 80° вектор обрабатывают рестриктазой BglII. Полученный реципиентный вектор pCI-EF1a-dEPOs1 содержит с одной стороны липкий конец BglII, другой конец остается тупым. Донорный вектор pCI-EF1a-dEPOs1 обрабатывают рестриктазами NruI и BglII, разгоняют продукты рестрикции в 1% агарозном геле (Helicon, Россия), далее вырезают участок размером 2500 п.о., содержащий промотор, ген dEPOs1, терминатор и S/MAR элемент. 5' - участок данного фрагмента содержит липкий конец BglII, а 3' - участок - тупой конец Nrul. Вектор pCI-EF1a-dEPOs1, содержащий BglII - затупленный конец, и фрагмент pCI-EF1a-dEPOs1 (NruI и BglII) лигируют для получения экспрессионной плазмиды pCI-dEPOs-2x (pCI-EF1a-dEPOs1-dEPOs1).
Правильность сборки экспрессионного вектора проверяют с помощью расширенного рестрикционного анализа. Нуклеотидные последовательности обоих генов и прилежащих к ним участков также проверяют секвенированием.
Отбор стабильного клона-продуцента дЭПО-альфа
После проведения трансфекции клеточной линии CHO-S вектором pCI-dEPOs-2x проводят отбор стабильного клона-продуцента дЭПО-альфа методом предельных разведении. Для этого суспензию клеток через 24 ч после трансфекции разводят средой Power CHO-2 CD (Lonza, Швейцария) до плотности 10000, 3000, 1000 клеток/мл и добавляют к каждому разведению стерильный раствор антибиотика G418 (Lonza, Швейцария) до конечной концентрации 500 мг/л. Суспензию разливают по 0,1 мл в лунки 96-луночных планшетов, используя по 30-40 планшетов на каждое разведение. Далее планшеты помещают в О2-инкубатор для культивирования в атмосфере 5%-ного углекислого газа при температуре 37°С и влажности 95% в течение 20-30 суток. Начиная с 12 суток, контролируют рост клеток в лунках под микроскопом, отмечая лунки, в которых наблюдается рост от одной клетки. Поскольку число клеток, попавших в лунку, подчиняется распределению Пуассона, то вероятность отсутствия клональности (попадания 2 и более клеток в одну лунку) можно рассчитать исходя из доли позитивных лунок по формуле:
Р(n>1)=1-Σ(е-λλn/n!),
где λ=-ln(P(0)) - доля лунок, в которых наблюдается клеточный рост,
n=0; 1 - число клеток в лунке.
По достижении 80-100% конфлюэнтности индивидуальные клоны переносят в новые 96-луночные планшеты. Через 5 суток анализируют пробы КЖ на наличие дЭПО-альфа. Клоны, показавшие наибольшую продуктивность при культивировании в 96-луночных планшетах, переносят в 24-луночные планшеты с 500 мкл селективной среды и культивировали в течение 5 суток. После определения жизнеспособности клеток клоны переносят в колбы объемом 125 мл для суспензионного культивирования. По результатам цикла продукции в колбах оценивают продуктивность клонов. На основании критериев роста, жизнеспособности и продуктивности выбирают лучшие клоны, для которых был создается клеточный банк.
Пример 4. Оценка качества и количества секретируемого дарбэпоэтина альфа
Определение концентрации дЭПО-альфа проводят методом твердофазного иммуноферментного анализа (ИФА) и аналитической аффинной хроматографии. Для проведения ИФА используют набор «Эритропоэтин-ИФА-БЕСТ» («Вектор-БЕСТ», Россия) с калибровкой по препарату Аранесп (Amgen, США).
Аналитическую аффинную хроматографию проводят с использованием системы ВЭЖХ UltiMate3000 (Dionex, США). Разделение осуществляют на колонке Tricorn 5/20 (GE Healthcare, США), заполненной агарозой Sepharose CL-2B (GE Healthcare, США), сшитой с моноклональными антителами к рекомбинантому ЭПО. Детекцию проводили с помощью флуоресцентного детектора при длине волны поглощения 270 нм и длине волны эмиссии 340 нм. Ступенчатую подачу элюентов осуществляли по следующей схеме: 0-7 мин элюент А (150 мМ NaCl, 10 мМ Na3PO4, рН 7,4), 7-12 мин элюент В (3 М NaCl, 10 мМ Na3PO4, рН 2,0), 12-17 мин элюент С (2 М глицин, рН 2,0) (все реагенты Sigma, США). Скорость потока составляла 0,5 мл/мин. В качестве образца сравнения используют препарат Аранесп (Amgen, США).
Иммуноблоттинг
SDS-ПААГ-электрофорез в восстанавливающих условиях проводят по стандартной методике Лэммли в 12% геле с последующим окрашиванием Кумасси-Р250 [22].
Белки КЖ, разделенные методом SDS-ПААГ-электрофореза, переносят на нитроцеллюлозную мембрану с диаметром пор 0,45 мкм (Bio-Rad, США) с помощью прибора для полусухого переноса Trans-Blot SD (Bio-Rad, США). Для окрашивания мембраны последовательно используют кроличьи поликлональные антитела к ЭПО человека (Е2531, Sigma-Aldrich, США), поликлональные козьи антитела против иммуноглобулинов кролика, коньюгированные с щелочной фосфатазой (А3937, Sigma-Aldrich, США), и жидкий хромогенный субстрат для щелочной фосфатазы (Sigma, США). В качестве стандартов используют европейский стандартный образец ЭПО - EPO-BRP (EDQM, Франция) и препарат Аранесп (Amgen, США). Обсчет интенсивности полос на гелях и мембранах проводится с помощью программы Quantity One (BioRad, США).
Изоэлектрическое фокусирование осуществляют в геле с градиентом рН от 2,0 до 10,0 с помощью системы GE Healthcare (Multiplier II, MultiTemp IV, EPS 3501 XL) с использованием следующих режимов: предфокусировка при напряжении 1000 В, силе тока 24 мА и мощности 20 Вт в течение 30 мин; вхождение белков в гель при напряжении 500 В, силе тока 24 мА и мощности 20 Вт в течение 30 мин; разделение белков при напряжении 1500 В, силе тока 24 мА и мощности 20 Вт в течение 60 мин. Для заливки геля используют амфолиты Pharmalyte 3-10 (GE Healthcare, Швеция) и Servalyt 2-4 (Serva, Германия). После проведения разделения белков гель переносят в раствор для фиксации, содержащий 0,7 М трихлоруксусной кислоты (Sigma, США) и 0,16 М сульфосалициловой кислоты (Merck, Германия), и инкубируют в течение 45 мин при комнатной температуре. Гель отмывают в растворе, содержащем 8% уксусной кислоты и 25% этанола, при температуре 90°, затем подвергают иммуноокрашиванию антителами к ЭПО человека, как описано выше.
Пример 5. Полный цикл хроматографической очистки дарбэпоэтина альфа из культуральной жидкости
Первая стадия концентрирование и диализ на лабораторной установке LabScale
После размораживания культуральной жидкости (КЖ) из морозильника на - 70°С ее отфильтровывают через фильтровальную капсулу Domnick Hunter с размером пор 0,22 µm. 3200 мл фильтрата культуральной жидкости концентрируют на установке для диализа и концентрирования LabScale до 500 мл на двух параллельно соединенных мембранах Pellicon Biomax 10 с пределом отсечения 10 кДа, производитель Millipore. Проводят диализ против 2 литров буфера 20 mM Tris-HCl, pH 6,65. Эта стадия подготовки сырья необходима, чтобы удалить большую часть компонентов питательной среды, которые необратимо забивают ионообменный сорбент, и снизить проводимость КЖ для обеспечения хорошей сорбции белка с ионообменным сорбентом. По данным ВЭЖХ в проскоке после концентрирования и диализа целевого белка не должно быть.
Первая стадия хроматографической очистки на сорбенте 40Q WorkBeads I (280 мл)
Первый технологический модуль на сорбенте 40Q WorkBeads предназначен для грубой очистки от компонентов питательной среды и отделения щелочных изоформ. Правильно выбранный рН кислой промывки позволяет отделять необходимые щелочные изоформы. Выход на этой стадии по целевому белку составляет 27%, наличие высокосиализированных изоформ подтверждается капиллярным изоэлектрофокусированием.
Объем сорбента: 280 мл
Уравновешивающий буфер: 30 mM Tris-HCl, рН 6,65 (4 литра)
Кислый буфер: 12 mM NaCl, 6 М мочевина, 1 mM глицин, 2 М уксусной кислоты, рН 3,1 (2,8 литра)
Элюирующий буфер: 150 mM Tris-HCl, рН 6,65 (1 литр)
Регенерирующий буфер: 30 mM Tris-HCl, 1 М NaCl, рН 6,65 (2 литра)
Санитизирующий буфер: 0,5 M NaOH
Буфер хранения: 0,01 M NaOH
Хроматографический процесс:
Вторая стадия хроматографической очистки на сорбенте СМ-Sepharose FF (20 мл)
Этот хроматографический шаг необходим для очистки целевого белка от примесных белков. Для этого подобраны такие условия процесса, которые позволяют целевой dEPO оставлять во фракции не связанной с колонкой, а большая часть примесных белков задерживается на носителе.
Объем сорбента: 20 мл
Уравновешивающий буфер: 20 mM NaAc, pH 5,0
Градиентный буфер: 20 mM NaAc, 1 M NaCl, pH 5,0
Регенерирующий буфер: 20 mM NaAc, 1 M NaCl, pH 5,0
Санитизирующий буфер: 0,1 M NaOH
Буфер хранения: 20% этанол
Хроматографический процесс:
Третья стадия хроматографической очистки на сорбенте 40Q WorkBeads II (20 мл)
После хроматографии на CM-Sepharose FF концентрация dEPO в растворе очень низкая, так как перед нанесением белок разводят для уменьшения ионной силы раствора. Поэтому следующая технологическая стадия направлена на очистку раствора белка от остаточных примесных белков и концентрированно белка. В данном технологическом модуле dEPO сорбируется на носителе и элюируется солевым градиентом, позволяющим отделиться от оставшихся примесных белков.
Объем сорбента: 20 мл
Уравновешивающий буфер: 20 mM Tris-HCl, pH 7,0
Градиентный буфер: 20 mM Tris-HCl, 1 M NaCl, pH 7,0
Регенерирующий буфер: 20 mM Tris-HCl, 1 M NaCl, pH 7,0
Санитизирующий буфер: 0,5 M NaOH
Буфер хранения: 0,01 M NaOH
На электрофореграмме представлен Аранесп (а) и конечный элюат dEPO 190113 после третьей стадии хроматографической очистки (б) (фиг.9).
Капиллярный электрофорез с УФ-детектированием при 214 нм проводили на приборе Капель 105М (Люмэкс, Россия). Использовали немодифицированные кварцевые капилляры с внешним полиамидным покрытием с внутренним диаметром 50 мкм и полной длиной 102 см (эффективная длина 93 см) (Agilent, США). Ввод пробы осуществляли гидродинамически под давлением 30 мбар в течение 20 с. Фоновым электролитом служили раствор, содержащий 10 мМ натрия хлорида, 10 мМ трицина, 10 мМ натрия ацетата, 7 М мочевины и 2,5 М путресцина дихлорида, рН 4,5 (все реагенты Sigma, США). Инструментальный контроль, сбор и регистрацию электрофоретических данных производили с помощью системы МультиХром 3.1.1594 (Амперсенд, Россия).
Четвертая стадия диализ целевого белка против буфера ГЛФ
Диализ белка проводят на установке для тангенциальной фильтрации Minim II на мембране Minimate TFF Capsule Omega 10K с пределом отсечения 10 кДа против 2,5 литров буфера ГЛФ. Затем белок стерильно отфильтровали с использованием фильтрующей насадки Millex, 0,22 µm.
Стабильная клеточная линия-продуцент рекомбинантного дЭПО-альфа на основе ранее созданной генетической конструкции с удвоенной дозой синтетического гена, имеющего оптимизированный кодонный состав, и клеток CHO-S. Методом предельных разведений отобран клон, обладающий оптимальными ростовыми характеристиками и продуктивностью не менее 100 мг целевого белка на литр среды. Проведена характеризация изоформного состава рекомбинантного дЭПО-альфа методами ИЭФ и капиллярного электрофореза, в результате которой было установлено соответствие профиля гликозилирования целевого белка с очищенным препаратом дЭПО-альфа (Аранесп).

Список литературы:
1. Egrie JC, Grant JR, Gillies DK, Aoki KH, Strickland TW. S7.7 The role of carbohydrate on the biological activity of erythropoietin. Glycoconjugate Journal 1993, 10:263-263.
2. Egrie JC, Browne JK. Development and characterization of novel erythropoiesis stimulating protein (NESP). Br J Cancer 2001, 84 Suppl 1:3-10.
3. Cases A. Darbepoetin alfa: a novel erythropoiesis-stimulating protein. Drugs Today (Bare) 2003, 39:477-495.
4. Smith R. Applications of darbepoietin-alpha, a novel erythropoiesis-stimulating protein, in oncology. Curr Opin Hematol 2002, 9:228-233.
5. Macdougall 1C. Darbepoetin alfa: a new therapeutic agent for renal anemia. Kidney Int Suppi 2002:55-61.
6. Hansen IA, Qin JY, Zhang L, Clift KL, Hulur I, Xiang AP, et al. Systematic Comparison of Constitutive Promoters and the Doxycycline-Inducible Promoter. PLoS One 2010, 5:e10611.
7. Magnusson Т, Haase R, Schleef M, Wagner E, Ogris M. Sustained, high transgene expression in liver with plasmid vectors using optimized promoter-enhancer combinations. J Gene Med 2011, 13:382-391.
8. Tokushige K, Moradpour D, Wakita Т, Geissler M, Hayashi N, Wands JR. Comparison between cytomegalovirus promoter and elongation factor-1 alpha promoter-driven constructs in the establishment of cell lines expressing hepatitis С virus core protein. J Virol Methods 1997, 64:73-80.
9. Teschendorf С, Warrington KH, Jr., Siemann DW, Muzyczka N. Comparison of the EF-1 alpha and the CMV promoter for engineering stable tumor cell lines using recombinant adeno-associated virus. Anticancer Res 2002, 22:3325-3330.
10. Bode J, Benham С, Knopp A, Mielke C. Transcriptional augmentation: modulation of gene expression by scaffold/matrix-attached regions (S/MAR elements). CritRev Eukaryot Gene Expr 2000, 10:73-90.
11. Bode J, Schlake T, Rios-Ramirez M, Mielke C, Stengert M, Kay V, et al. Scaffold/matrix-attached regions: structural properties creating transcriptionally active loci. Int Rev Cytol 1995, 162A:389-454.
12. Zahn-Zabal M, Kobr M, Girod PA, Imhof M, Chatellard P, de Jesus M, et al. Development of stable cell lines for production or regulated expression using matrix attachment regions. J Biotechnol 2001, 87:29-42.
13. Schubeler D, Mielke C, Maass K, Bode J. Scaffold/matrix-attached regions act upon transcription in a context-dependent manner. Biochemistry 1996, 35:11160-11169.
14. Grote A, Hiller K, Scheer M, Munch R, Nortemann B, Hempel DC, et al. JCat: a novel tool to adapt codon usage of a target gene to its potential expression host. Nucleic Acids Res 2005, 33:W526-531.
15. Comeron JM, Aguade M. An evaluation of measures of synonymous codon usage bias. J Mol Evol 1998, 47:268-274.
16. Kim CH, Oh Y, Lee TH. Codon optimization for high-level expression of human erythropoietin (EPO) in mammalian cells. Gene 1997, 199:293-301.
17. Kingston RE, Kaufman RJ, Bebbington CR, Rolfe MR. Amplification using CHO cell expression vectors. Curr Protoc Mol Biol 2002, Chapter 16: Unit 16 23.
18. Kellems RE. Gene amplification in mammalian cells: strategies for protein production. Curr Opin Biotechnol 1991, 2:723-729.
19. Wurm FM, Jordan M. Gene transfer and gene amplification in mammalian cells. 2003, 38:309-335.
20. Vassileva A, Chugh DA, Swaminathan S, Khanna N. Effect of copy number on the expression levels of hepatitis В surface antigen in the methylotrophic yeast Pichia pastoris. Protein Expr Purif 2001, 21:71-80.
21. PATELL V, Morawala (Avesthagen Limited, 9th Floor. AN EXPRESSION VECTOR CARRYING SCAFFOLD/MATRIX ATTACHMENT REGION(S). In: AVESTHAGEN LIMITED (IP Department, Discoverer Building 9th floor, International Tech park, Whitefield, Bangalore - 6, 56006, IN); PATELL, Villoo, Morawala (Avesthagen Limited, 9th Floor; 2011.
22. Laemmli UK. Cleavage of structural proteins during the assembly of the head of bacteriophage T4. Nature 1970, 227:680-685.



Изобретение относится к биотехнологии. Заявлены экспрессионные векторы, предназначенные для экспрессии человеческого дарбэпоэтина. Предложены клетки-хозяева, содержащие заявленные векторы. Заявлен способ получения человеческого дарбэпоэтина-α из культуральной жидкости предложенных клеток. Представлен оптимизированный ген дарбэпоэтина. Изобретение позволяет получать дарбэпоэтин альфа - аналог рекомбинантного человеческого эритропоэтина. 14 н.п. ф-лы, 9 ил., 3 табл., 5 пр.
1. Вектор pCI-dEPOn, предназначенный для экспрессии дарбэпоэтина, полученный на основе вектора pCI-neo, в который введены сайты рестриктаз BspEI, ApaI, Eco32I и NruI и удвоенный S/MAR элемент, а также ген эритропоэтина, с последующим проведением ПЦР-мутагенеза для получения вектора pCI-dEPOn по следующей схеме: 5'-ctataggctagcctcgagaatt-3' FW, Расположение - 1079 - 1100 п.н. плазмиды pCI-EPOn;
5'-caagctgcaggtttcattacagcc-3' RV, Расположение - 2118 - 2095 п.н. плазмиды pCI-EPOn; 5'-ggctgtaatgaaacctgcagcttg-3' FW, Расположение - 2095 - 2118 п.н. плазмиды pCI-EPOn;
5'-gctgcagggtctcgttcacctggga-3' RV, Расположение - 2905 - 2881 п.н. плазмиды pCI-EPOn; 5'-tcccaggtgaacgagaccctgcagc-3' FW, Расположение - 2881 - 2905 п.н. плазмиды pCI-EPOn; 5'-cccgggtcgactctagaggt-3' RV, Расположение - 3375 - 3356 п.н. плазмиды pCI-EPOn.
2. Вектор pVITRO-dEPOs1, предназначенный для экспрессии дарбэпоэтина, полученный на основе вектора pVITROneo, в который введен ген dEPOs1 (SEQ ID NO:1) по сайту рестрикции EcoRV.
3. Вектор pCI-dEPOs1, предназначенный для экспрессии дарбэпоэтина, полученный на основе вектора pCI-EPOn, полученного на основе вектора pCI-neo, в который введены сайты рестриктаз BspEI, ApaI, Eco32I и NruI и удвоенный S/MAR элемент, а также ген эритропоэтина с последующим встраиванием в вектор pCI-EPOn гена dEPOs1 (SEQ ID NO:1).
4. Вектор pCI-dEPOs2, предназначенный для экспрессии дарбэпоэтина, полученный на основе вектора pCI-EPOn, полученного на основе вектора pCI-neo, в который введены сайты рестриктаз BspEI, ApaI, Eco32I и NruI и удвоенный S/MAR элемент, а также ген эритропоэтина с последующим встраиванием в вектор pCI-EPOn гена dEPOs2 (SEQ ID NO:2).
5. Вектор pCI-EF1-dEPOsI, предназначенный для экспрессии дарбэпоэтина, полученный на основе вектора pCI-dEPOs1 по п.3 и гибридного промотора CMV-EF1α.
6. Вектор pCI-EF1-dEPOs2, предназначенный для экспрессии дарбэпоэтина, полученный на основе вектора pCI-dEPOs2 по п.4 и гибридного промотора CMV-EF1α.
7. Вектор pVITRO-dEPOs1-dEPOs1, предназначенный для экспрессии дарбэпоэтина, полученный на основе вектора pCI-dEPOs1 по п.3 и копии гена dEPOs1 (SEQ ID NO:1).
8. Вектор dEPOs-2x (pCI-EF1α-dEPOs1-dEPOs1), предназначенный для экспрессии дарбэпоэтина, полученный на основе вектора по п.5, параллельно обработанного рестриктазой Sdal и Т4-полимеразой, с последующей инактивацией Т4-полимеразы и обработкой рестриктазой BgIII, а также рестриктазами Nrul и BgIII с вырезанием участка 2500 п.о., содержащим промотор, ген dEPOs1, терминатор и S/MAR элемент с последующим лигированием параллельно полученных фрагментов векторов
9. Применение вектора по пп.1-8 для транзиторной трансфекции клеточной линии CHO-S.
10. Способ получения стабильного клона-продуцента дарбэпоэтина-α, включающий проведение трансфекции вектором по п.8 клеточной линии CHO-S, отбор стабильного клона-продуцента дарбэпоэтина-α методом предельных разведении.
11. Ген дарбэпоэтин-α, имеющий оптимизированную нуклеотидную последовательность гена dEPOs1 (SEQ ID NO:1).
12. Клетка-хозяин СНО, предназначенная для экспрессии дарбэпоэтина-α, содержащая вектор по пп.1-8.
13. Применение клетки-хозяина по п.12 для получения фармацевтической композиции.
14. Способ получения человеческого дарбэпоэтина-α с детерминированной посттрансляционной модификацией, способствующей большей метаболитической устойчивости in vivo, включающий культивирование клеток по п.12 в бессывороточной среде и очистку путем проведения стадии фильтрации культуральной жидкости через фильтровальную капсулу с размером пор 0,22 µm и концентрирования фильтрата культуральной жидкости в 6,4 раза, проведения диализа с последующим проведением трех стадий хроматографической очистки: на сорбенте 40Q WorkBeads при рН 6,65, на сорбенте CM-Sepharose FF при рН 5,0, на сорбенте 40Q WorkBeads II при рН 7,0; проведения стадии капиллярного электрофореза с УФ-детектированием при 214 нм и стадии диализа целевого белка против буфера ГЛФ.
| СПОСОБ ПОЛУЧЕНИЯ ЭРИТРОПОЭТИНА ЧЕЛОВЕКА | 1996 |
|
RU2129613C1 |
| НУРБАКОВ А.А, и др., Оптимизация технологии культивирования с подпиткой клеток CHO, экспрессирующих рекомбинантный дарбэпоэтин-альфа, в замкнутом объеме, Биотехнология, N5, 2012, с.55-65 | |||
| Приспособление для прорезки колей во льду при устройстве зимних дорог | 1930 |
|
SU20111A1 |
Авторы
Даты
2014-07-27—Публикация
2013-06-28—Подача