Область техники, к которой относится изобретение
Настоящее изобретение относится к способу лечения боли в суставах и минимизации побочных эффектов внутрисуставных стероидов путем введения фармацевтической композиции, включающей смесь липидов, включающую один или несколько липидов; и эффективное количество стероида или его фармацевтически приемлемой соли.
Уровень техники
Внутрисуставную (IA) стероидную терапию применяют более 50 лет с целью уменьшения воспаления суставов и боли за счет местной доставки противовоспалительного средства. Было показано, что она эффективна для временного облегчения боли в суставах, связанной с остеоартритом и другими воспалительными заболеваниями.
Через несколько лет после применения IA стероидной терапии врачи отметили развитие быстро прогрессирующего дегенеративного артрита у пациентов, получавших IA стероид. Последующие исследования in vivo и in vitro показали, что IA стероид вызывает прогрессирующие повреждения суставного хряща, включая разрушение и потерю протеогликанов, появление кисты в суставном хряще и апоптоз хондроцитов. Из трех исследованных стероидов (гидрокортизон, триамцинолон и дексаметазон) дексаметазон оказался наиболее эффективным в индукции апоптоза хондроцитов (F. Nakazawa et al, «Corticosteroid treatment induces chondrocyte apoptosis in an experimental arthritis model and in chondrocyte cultures», Clinical and Experimental Rheumatology, 2002; 20: 773-781)
Недавние исследования на людях дополнительно продемонстрировали пагубное действие IA стероида на суставной хрящ, поскольку стероиды вызывают значительно большую потерю объема хряща и хондротоксичность. По этой причине многие врачи ограничивают применение стероидов, в особенности, кортикостероидов, до 3-4 инъекций IA в год в любой конкретный сустав (P. Wehling et al, «Effectiveness of intra-articular therapies in osteoarthritis: a literature review» Ther Adv Musculoskelet Dis. 2017 Aug; 9(8): 183-196). Эффективность однократной инъекции стероидов IA сохраняется в течение только 1-2 недель. Более того, было собрано мало доказательств эффекта IA стероида через более чем 4 недели после инъекции. Соответственно, ограничение применения стероидов до 3-4 IA инъекций в год вызывает разрыв в терапевтическом эффекте между IA инъекциями и ухудшает симптомы артрита.
Ввиду описанных выше недостатков, существует потребность в терапии IA стероидами для лечения боли в суставах с удовлетворительной терапевтической эффективностью, но со сниженным профилем побочных эффектов, в особенности, с уменьшением повреждения хряща и/или хондроцитов. Настоящее раскрытие удовлетворяет эту потребность и другим потребности.
Раскрытие изобретения
Согласно одному из воплощений настоящего раскрытия обеспечивают фармацевтические композиции для поддержания терапевтического эффекта внутрисуставного стероида (IA стероид) при одновременном снижении побочных эффектов, связанных со IA стероидом. Фармацевтическая композиция включает:
(a) липидную смесь, включающую один или несколько липидов; и
(b) эффективное количество IA стероида или его фармацевтически приемлемой соли, в которой побочный эффект, связанный с IA стероидом, снижен по сравнению с побочным эффектом фармацевтической композиции без липидной смеси.
В другом воплощении настоящее раскрытие направлено на применение фармацевтической композиции, описанной в настоящем документе, для лечения боли в суставах с уменьшенным побочным эффектом, связанным с инъекцией IA стероида, путем введения фармацевтической композиции нуждающемуся в этом субъекту, в котором связанные с IA стероидом побочные эффекты уменьшаются по сравнению с побочными эффектами, индуцированными IA стероидом у субъекта после введения в суставы препарата немедленного высвобождения или стандартной стероидной композиции.
Также обеспечивают способ лечения боли в суставах со сниженным побочным эффектом, связанным с инъекцией суставных стероидов, включающий введение субъекту, нуждающемуся в лечении боли в суставах, эффективного количества фармацевтической композиции, описанной в настоящем документе, при этом побочные эффекты, индуцированные IA стероидом, уменьшены по сравнению с побочными эффектами, индуцированные IA стероидом у субъекта после введения в суставы препарата немедленного высвобождения или стандартной стероидной композиции.
Краткое описание чертежей
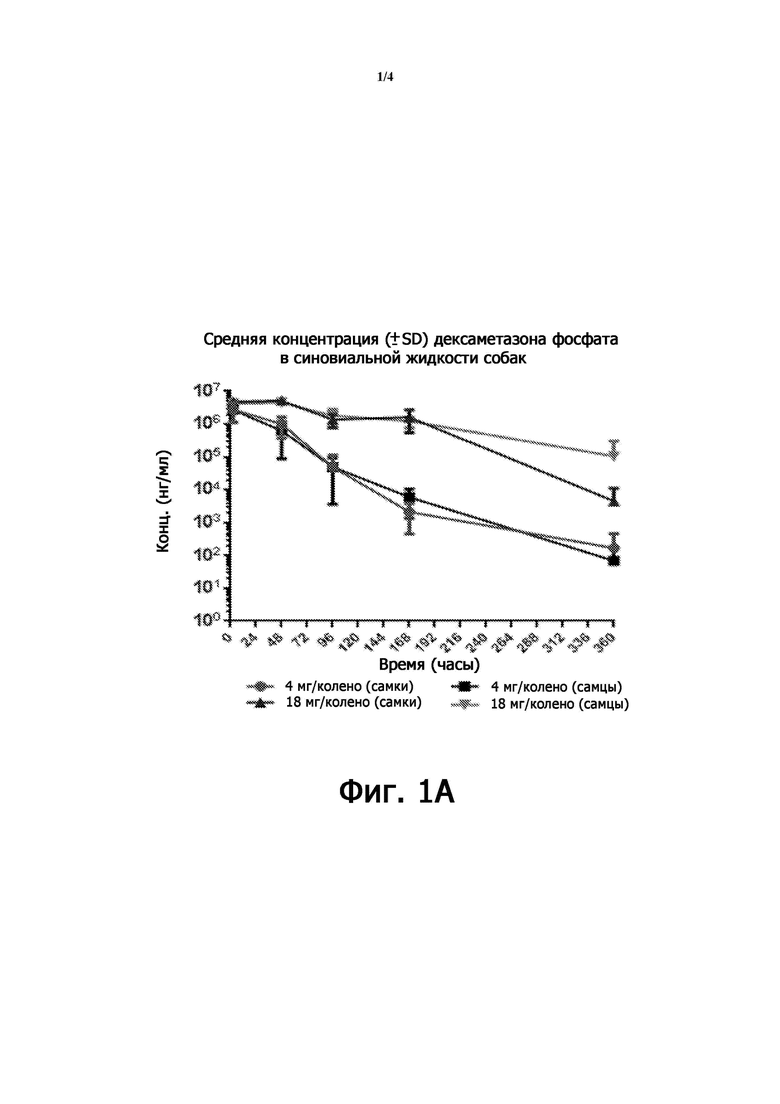
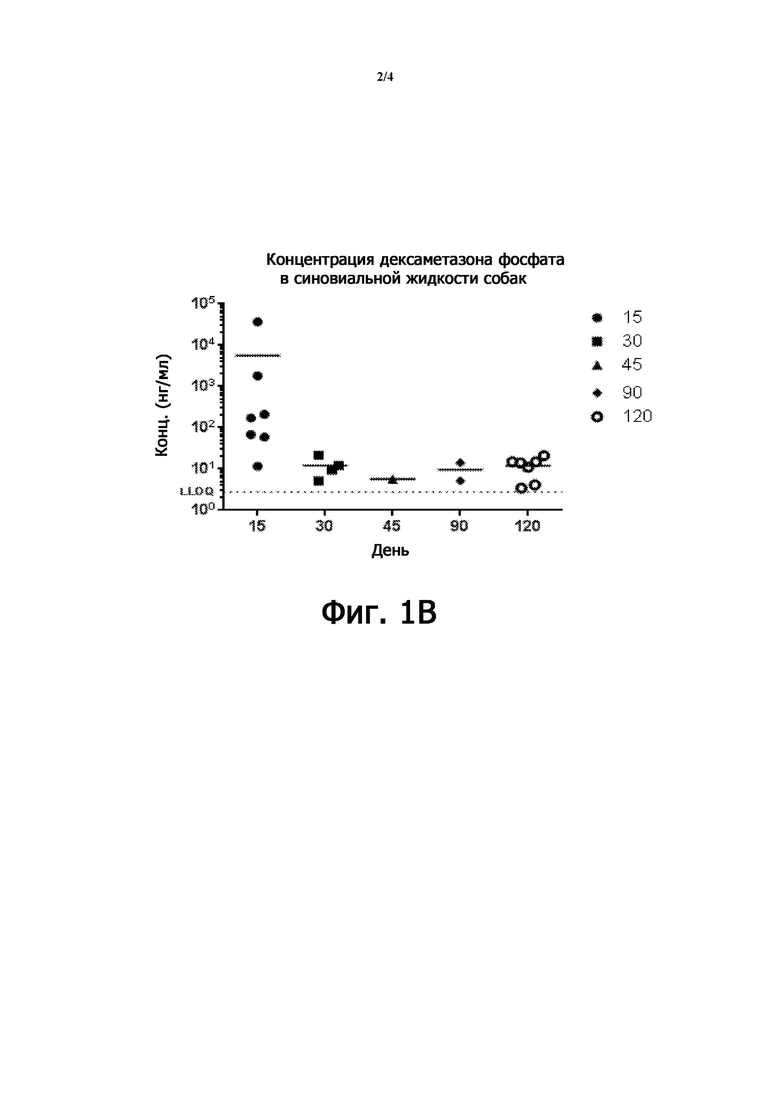
Фиг. 1A-1B представляют собой токсикокинетические профили липосомальной композиции DSP после однократной дозы IA инъекции собакам (исследование № 8351851 и № 8388198);
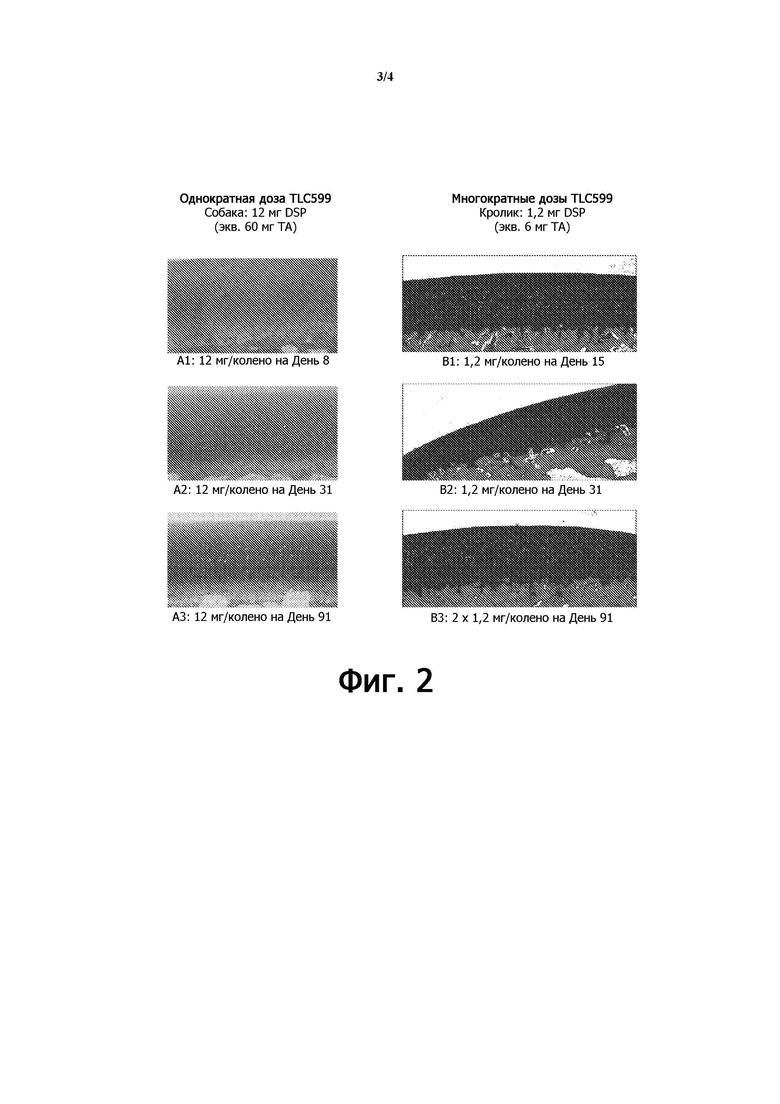
фиг. 2 показывает окрашивание толуидиновым синим хряща у собак (исследование № 8351850) и у кроликов (исследование № 8288836) после обработки одной или несколькими дозами липосомальной композиции DSP; и
фиг. 3 показывает окрашивание хряща собак толуидиновым синим (исследование № 79503-18-214) после обработки липосомальной композицией DSP (TLC599), триамцинолона ацетонидом (ТА), суспензией для инъекций с пролонгированным высвобождением триамцинолона ацетонида (ER-TA) или физиологическим раствором в качестве контроля.
Осуществление изобретения
Определения
При применении выше и во всем раскрытии следующие термины, если не указано иное, следует понимать как имеющие следующие значения.
Как применено в настоящем документе, формы единственного числа, «a», «an» и «the», включают множественное число, если контекст явно не указывает иное.
Все числа в настоящем документе могут пониматься как измененные словом «примерно», которое, когда речь идет об измеряемой величине, такой как количество, временная продолжительность и т.п., включает вариации в 10%, 5%, 1%, 0,1%, 0,01% от заданного значения, поскольку такие изменения подходят для получения желаемого количества вещества или периода времени, если не указано иное.
Термин «суставная инъекция», как применен в настоящем документе, охватывает местную инъекцию в месте наличия боли в суставе или рядом с ним, внутрисуставную инъекцию или околосуставную инъекцию.
Термин «эффективное количество», как применен в настоящем документе, относится к дозе фармацевтической композиции, которая достаточна для уменьшения симптомов и признаков заболевания, вызывающего боль в суставах, таких как боль, воспаление, жесткость и отек сустава, и для уменьшения побочного эффекта, связанного с инъекцией IA стероидов. Уменьшение симптомов и признаков заболевания, вызывающего боль в суставах, может составлять примерно 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90%, 100% или любое количество сокращения между ними, как измерено по соответствующей клинической шкале.
Термины «подвергать лечению», «лечить» или «лечение», как применено в настоящем документе, включают превентивные (например, профилактические) замедление, остановку или обращение прогрессирующего структурного повреждения ткани, вызывающего боль в суставах. В этой заявке под лечением подразумевается способ уменьшения, облегчения, подавления или замедления боли в суставах или полного облегчения боли в суставах, что определяется известными в данной области техники способами. К ним относятся, помимо прочего, клиническое обследование, визуализация или анализ сыворотки или аспирата суставов (например, ревматоидные факторы, скорость оседания эритроцитов), и это лишь некоторые из них. Например, раскрытый способ считается лечением, если имеет место около 1%, 5%, 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90% или 100% уменьшения боли в суставах у субъекта по сравнению с субъектом до лечения или контрольными субъектами.
Термин «субъект» может относиться к позвоночному, страдающему болью в суставах, или к позвоночному, которое, как считается, нуждается в лечении боли в суставах. Субъекты включают теплокровных животных, таких как млекопитающие, таких как приматы, и, более предпочтительно, человека. Приматы, не относящиеся к человеку, также представляют собой субъектов. Термин «субъект» включает домашних животных, таких как кошки, собаки и т.д., домашний скот (например, крупный рогатый скот, лошади, свиньи, овцы, козы и т.д.) и лабораторных животных (например, мышь, кролик, крыса, песчанка, морская свинка и др.). Таким образом, в настоящем документе рассматривают ветеринарные применения и медицинские композиции.
Термин «боль в суставах» относится к заболеванию или состоянию суставов, которое включает воспаление и/или боль в одном или нескольких суставах. Термин «боль в суставах», как его применяют в настоящем документе, охватывает множество типов и подтипов артрита различной этиологии и причин, известных или неизвестных, включая, помимо прочего, ревматоидный артрит, остеоартрит, инфекционный артрит, псориатический артрит, подагру, артрит и артрит, связанный с волчанкой, или болезненные местные ткани, пораженные бурситом, теносиновитом, эпикондилитом, синовитом и/или другими заболеваниями.
«Фармацевтически приемлемые соли» стероидов настоящего раскрытия включают соли кислого стероида, образованные с основаниями, а именно соли присоединения оснований, такие как соли щелочных и щелочноземельных металлов, таких как соли натрия, лития, калия, кальция, магния, а также 4 соли аммония, такие как соли аммония, триметиламмония, диэтиламмония и трис-(гидроксиметил)-метиламмония. Точно так же кислотно-аддитивные соли, такие как минеральные кислоты, органические карбоновые кислоты и органические сульфоновые кислоты, например, соляная кислота, метансульфоновая кислота, малеиновая кислота, также могут быть обеспечены основному стероиду.
Фармацевтическая композиция
В одном аспекте настоящее раскрытие обеспечивает фармацевтическую композицию, включающую смесь липидов, включающую один или несколько липидов и эффективное количество стероида или его фармацевтически приемлемой соли. Фармацевтическая композиция поддерживает терапевтическую эффективность IA стероида и снижает побочные эффекты, связанные с IA стероидом. Побочные эффекты IA стероида включают, но не ограничиваются ими, повреждение хондроцитов, апоптоз хондроцитов, потерю протеогликана, кисты в суставном хряще, деградацию суставного хряща или разрушение суставов. Оценка побочных эффектов IA стероида может быть проведена, например, но не ограничиваясь этим, неинвазивным обследованием, таким как МРТ. Снижение побочных эффектов у субъекта, которому вводят IA стероид, приготовленный с описанными в настоящем документе фармацевтическими композициями, может варьировать от 1%, 5%, 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90% или 100% по сравнению с субъектом, которому ввели с помощью инъекции IA стероид, приготовленный без фармацевтических композиций, описанных в настоящем документе, т.е. без смеси липидов.
В одном из воплощений, фармацевтическая композиция, дополнительно включающая, по меньшей мере, одно фармацевтически приемлемое вспомогательное вещество, разбавитель, основу, носитель, среду для активного ингредиента, консервант, криопротектор или их комбинацию.
В одном из воплощений, фармацевтическую композицию по настоящему изобретению получают путем смешивания одного или нескольких липидов с холестерином или без него и одного или нескольких буферов для образования липосом, лиофилизации липосом с одним или несколькими наполнителями с образованием липидной смеси в виде лепешки и восстановления лепешки из липидной смеси водным раствором, содержащим стероид, с образованием липосомальной стероидной композиции, в которой липосомальная стероидная композиция включает липидную смесь и стероид в неассоциированная форме или в форме, ассоциированная с липидами. Термин «неассоциированная форма» относится к молекулам стероидов, отделяемым посредством гель-фильтрации от фракции фосфолипидов/холестерина фармацевтической композиции, и обеспечивает компонент немедленного высвобождения.
В другом воплощении фармацевтическую композицию по настоящему раскрытию готовили путем смешивания одного или нескольких липидов, с холестерином или без него, в растворителе, затем удаления растворителя с образованием липидной смеси в форме порошка или пленки и восстановления порошка или пленки липидной смеси водным раствором, содержащим стероид, для получения фармацевтической композиции в форме водной суспензии.
В некоторых воплощениях, фармацевтическая композиция по настоящему раскрытию включает от около 10% до около 50% липид-ассоциированного стероида или от около 50% до около 90% неассоциированного стероида. В других вариантах реализации массовое отношение фосфолипида и холестерина в комбинации к стероиду составляет примерно 5-80: 1. В еще одном воплощении массовое соотношение фосфолипида и холестерина в комбинации к стероиду составляет примерно 5-40 к 1. Например, массовое соотношение фосфолипида и холестерина в комбинации к стероиду может составлять около 5, 10, 15, 20, 25, 30, 35, 40, 45, 50, 55, 60, 65, 70, 75 или 80 к 1.
Смесь липидов
Смесь липидов обеспеченной в настоящем документе фармацевтической композиции, относится к липиду или смеси липидов. Смесь липидов представлена, но не ограничивается этим, в форме пленки, лепешки, гранул или порошков.
В некоторых воплощениях смесь липидов включает один или несколько липидов. Необязательно, один или несколько липидов включают, по меньшей мере, один нейтральный липид и анионный липид с мольным процентом от 29,5% до 90%; от 3% до 37,5%; альтернативно, при мольном соотношении от 2:1 до 33:1.
В одном из воплощений, фосфолипид или смесь фосфолипидов, с холестерином или без него, предварительно превращают в липосомы перед дальнейшей обработкой для получения липидной смеси.
В другом воплощении, фосфолипид или смесь фосфолипидов, с холестерином или без него, не преобразуют в липосомы перед дальнейшей обработкой для получения липидной смеси.
Липосомы имеют размеры в наношкале и включают липидный монослой или липидный бислой, окружающий внутренний компонент, несущий лекарственное средство. Неограничивающие примеры липосом включают небольшие однослойные везикулы (SUV), большие однослойные везикулы (LUV), мультивезикулярные липосомы (MVL) и многослойные везикулы (MLV) или их комбинации.
Смесь липидов может быть приготовлена из разнообразных липидов, способных либо образовывать однослойную или двухслойную структуру, либо встраиваться в нее. Липиды, применяемые в настоящем раскрытии, представляют собой категорию амфифильных веществ, включая, но не ограничиваясь ими, жирные кислоты, глицеролипиды, фосфолипиды, сфинголипиды, стерины, пренольные липиды, сахаролипиды и поликетиды. Примеры одного или нескольких фосфолипидов включают, но не ограничиваются ими, фосфатидилхолин (PC), фосфатидилглицерин (PG), фосфатидилэтаноламин (PE), фосфатидилсерин (PS), фосфатидную кислоту (PA), фосфатидилинозитол (PI). В некоторых воплощениях один или несколько фосфолипидов включают яичный фосфатидилхолин (EPC), яичный фосфатидилглицерин (EPG), яичный фосфатидилэтаноламин (EPE), яичный фосфатидилсерин (EPS), яичную фосфатидную кислоту (EPA), яичный фосфатидилинозитол (EPI), соевый фосфатидилхолин (SPC), соевый фосфатидилглицерин (SPG), соевый фосфатидилэтаноламин (SPE), соевый фосфатидилсерин (SPS), соевую фосфатидную кислоту (SPA), соевый фосфатидилинозитол (SPI), дипальмитоилфосфатидилхолин (DPPC), 1,2-диолеоил-sn-глицеро-3-фосфатидилхолин (DOPC), димиристоилфосфатидилхолин (DMPC), дипальмитоилфосфатидилглицерин (DPPG), диолеоилфосфатидилглицерин (DOPG), димиристоилфосфатидилглицерин (DMPG), гексадецилфосфохолин (НЕРС), гидрогенизированный соевый фосфатидилхолин (HSPC), дистеароилфосфатидилхолин (DSPC), дистеароилфосфатидилглицерин (DSPG), диолеилфосфатидилэтаноламин (DOPE), пальмитоилстеароилфосфатидилхолин (PSPC), пальмитоилстеароилфосфатидилглицерин (PSPG), моноолеоилфосфатидилэтаноламин (MOPE), 1-пальмитоил-2-олеоил-Sn-глицеро-3-фосфатидилхолин (POPC), полиэтиленгликоль дистеароилфосфатидилэтаноламин (PEG-DSPE), дипальмитоилфосфатидилсерин (DPPS), 1,2-диолеоил-sn-глицеро-3-фосфатидилсерин (DOPS), димиристоилфосфатидилсерин (DMPS), дистеароилфосфатидилсерин (DSPS), дипальмитоилфосфатидную кислоту (DPPA), 1,2-диолеоил-1-sn-глицеро-3-фосфатидную кислоту (DOPA), димиристоилфосфатидную кислоту (DMPA), дистеароилфосфатидную кислоту (DSPA), дипальмитоилфосфатидилинозитол (DPPI), диолеоил-sn-глицеро-3-фосфатидилинозитол (DOPI), димиристоилфосфатидилинозитол (DMPI), дистеароилфосфатидилинозитол (DSPI) и их смесь.
В другом воплощении, смесь липидов включает гидрофильный полимер с длинной цепью высокогидратированного гибкого нейтрального полимера, присоединенного к молекуле фосфолипида. Примеры гидрофильного полимера включают, но не ограничиваются ими, полиэтиленгликоль (PEG) с молекулярной массой от примерно 2000 до примерно 5000 дальтон, метокси-PEG (mPEG), ганглиозид GMi, полисиаловую кислоту, полимолочную кислоту (также называемую полилактидом), полигликолевую кислоту (также называемую полигликолид), полимолочную-полигликолевую кислоту, поливиниловый спирт, поливинилпирролидон, полиэтилоксазолин, полиэтилоксазолин, полигидроксиэтилоксазолин, полигидроксипропилоксазолин, полиаспартамид, полигидроксипропилметакриламид, полиметакриламид, полидиметилакриламид, поливинилметиловый эфир, полигидроксиэтилакрилат, дериватизированные целлюлозы, такие как гидроксиэтилцеллюлоза или гидроксиметилцеллюлоза и синтетические полимеры.
В одном из воплощений, смесь липидов дополнительно содержит стерол. Стерол, применяемый в настоящем описании, особо не ограничивают, а его примеры включают холестерин, фитостерин (ситостерин, стигмастерин, фукостерин, спинастерин, брассикастерин и т.п.), эргостерин, холестанон, холестенон, копростенол, холестерил-2'-гидроксиэтиловый эфир и холестерил-4'-гидроксибутиловый эфир. Стероловый компонент липидной смеси, если он присутствует, может представлять собой любой из стеролов, обычно применяемых в области приготовления липосом, липидных везикул или липидных частиц. В другом воплощении смесь липидов содержит от около 10% до около 33% холестерина, от около 15 до менее около 30 мольных % холестерина, от около 18 до около 28 мольных % холестерина или от около 20 до около 25 мольных % холестерина.
В некоторых воплощениях смесь липидов содержит первый фосфолипид и второй фосфолипид. В других воплощениях первый фосфолипид выбирают из DOPC, POPC, SPC или EPC, а второй фосфолипид представляет собой PEG-DSPE или DOPG. В иллюстративном воплощении смесь липидов включает DOPC, DOPG и холестерин в мольных процентах 29,5%-90% : 3%-37,5% : 10%-33%.
В одном из воплощений смесь липидов свободна от жирной кислоты или катионного липида (т.е. липида, несущего полный положительный заряд при физиологическом pH).
В некоторых воплощениях, смесь липидов может дополнительно включать липидный конъюгат антитела или пептида, который действует как нацеливающий фрагмент, позволяя липосомам специфически связываться с клеткой-мишенью, несущей целевую молекулу. Неограничивающие примеры молекул-мишеней включают, но не ограничиваются ими, TNF-ct и поверхностный антиген В-клеток, такой как CD20. Другие антигены, такие как CD19, HER-3, GD2, Gp75, белок CS1, мезотелин, cMyc, CD22, CD4, CD44, CD45, CD28, CD3, CD123, CD138, CD52, CD56, CD74, CD30, Gp75, CD38, также можно применять CD33, GD2, VEGF или TGF.
Липосомы, полученные в соответствии с настоящим описанием, могут быть получены обычными способами, применяемыми для получения везикул. Эти способы включают способ инъекции эфира (Deamer et al., Acad. Sci. (1978) 308: 250), способ поверхностно-активного вещества (Brunner et al., Biochim. Biophys. Acta (1976) 455: 322), способ замораживания-оттаивания (Pick et al., Arch. Biochim. Biophys. (1981) 212: 186), способ испарения с обращенной фазой (Szoka et al., Biochim. Biophys. Acta. (1980) 601: 559 71), способ ультразвуковой обработки (Huang et al., Biochemistry (1969) 8: 344), способ инъекции этанола (Kremer et al., Biochemistry (1977) 16: 3932), способ экструзии (Hope et al., Biochim. Biophys. Acta (1985) 812: 55 65), способ Френч-пресса (Barenholz et al., FEBS Lett. (1979) 99: 210) и способы, подробно описанные в работе Szoka, F., Jr., et al., Ann. Rev. Biophys. Bioeng. 9: 467 (1980). Все вышеперечисленные процессы представляют собой базовые технологии образования везикул, и эти процессы включены в настоящий документ посредством отсылки. После стерилизации, предварительно сформированные липосомы в асептических условиях помещают в контейнер, а затем лиофилизируют с образованием порошка или лепешки. В воплощении, в котором смесь липидов включает предварительно сформированные липосомы, указанные липосомы получают способом инъекции растворителя с последующей лиофилизацией с образованием липидной смеси. Смесь липидов включает один или несколько наполнителей. В одном из воплощений смесь липидов дополнительно содержит один или несколько буферных агентов.
Наполнители включают, но не ограничиваются ими, полиолы или сахарные спирты, такие как маннит, глицерин, сорбит, декстроза, сахароза и/или трегалоза; аминокислоты, такие как гистидин, глицин. Маннит представляет собой один из предпочтительных наполнителей.
Буферные агенты включают, но не ограничиваются ими, одноосновный дигидрат фосфата натрия и безводный двухосновный фосфат натрия.
В воплощении, в котором смесь липидов включает липиды, которые не были предварительно преобразованы в липосомы, смесь липидов может быть приготовлена растворением в подходящем органическом растворителе, включая, но не ограничиваясь ими, этанол, метанол, трет-бутиловый спирт, эфир и хлороформ, и сушкой путем нагревания, выпаривания в вакууме, выпаривания азота, лиофилизации или других обычных средств удаления растворителя.
Конкретные примеры приготовления липидной смеси в поддержку настоящего раскрытия будут описаны ниже.
Стероид для инъекций в суставы
Стероид в фармацевтической композиции, описанной в настоящем документе, включает стероид, подходящий для инъекции в сустав, или его фармацевтически приемлемую соль. Примеры стероидов включают, но не ограничиваются ими, кортикостероиды, такие как глюкокортикоиды и минералокортикоиды. В одном из воплощений стероид в фармацевтической композиции, описанной в настоящем документе, представляет собой кортикостероид, подходящий для внутрисуставной (IA) инъекции.
IA cтероид, применяемый в настоящем описании, включает любые встречающиеся в природе стероидные гормоны, синтетические стероиды и их производные. Примеры IA стероида, его производных или его фармацевтически приемлемой соли включают, но не ограничиваются ими, кортизон, гидрокортизон, ацетат гидрокортизона, тиксокортола пивалат, флуоцинолон, преднизолон, метилпреднизолон, преднизон, триамцинолона ацетонид, триамцинолон, мометазон, амцинонид, будесонид, дезонид, флуоцинонид, флуоцинолона ацетонид, галцинонид, бетаметазон, бетаметазона фосфат натрия, дексаметазон, дексаметазона фосфат натрия (DSP), флуокортолон, гидрокортизон-17-бутират, гидрокортизон-17-валерат, алклометазона дипропионат, бетаметазона валерат, бетаметазона дипропионат, предикарбат, клобетазон-17-бутират, клобетазол-17-пропионат, флуокортолона капроат, флуокортолона пивалат, флупредниденацетат, дифлупреднат, лотепреднол, фторметолон, медризона римексолон, беклометазон, клопреднол, кортивазол, дезоксикортон, дифторокортолон, флухлоролон, фторокортизон, флуметазон, флунизолид, фторокортолон, флурандренолон, мепреднизон, метилпреднизолон, параметазон или их смесь. В иллюстративном варианте осуществления IA стероид представляет собой водорастворимый стероид. В другом иллюстративном воплощении IA стероид выбирают из стероидов группы B и группы C в соответствии с классификацией Купмана (S. Coopman et al., «Identification of cross-reaction patterns in allergic contact dermatitis from topical corticosteroids» Br J Dermatol. 1989 Jul; 121(1):27-34).
Фармацевтически приемлемые соли IA стероида включают нетоксичные соли, образованные из нетоксичных неорганических или органических оснований. Например, нетоксичные соли могут быть образованы с неорганическими основаниями, такими как гидроксид щелочного или щелочноземельного металла, например, калия, натрия, лития, кальция или магния; и с органическими основаниями, такими как амин и т.п.
Фармацевтически приемлемые соли IA стероида также включают нетоксичные соли, образованные из нетоксичных неорганических или органических кислот. Примеры органических и неорганических кислот представляют собой, например, соляную, серную, фосфорную, уксусную, янтарную, лимонную, молочную, малеиновую, фумаровую, пальмитиновую, холевую, памоевую, муциновую, D-глутаминовую, глутаровую, гликолевую, фталевую, винную, лауриновую, стеариновую, салициловую, сорбиновую, бензойные кислоты и им подобные.
IA стероид можно вводить в любом эффективном количестве путем инъекции в сустав для уменьшения симптомов или признаков артрита. Их можно вводить в дозе от около 0,1 мг до около 300 мг, от около 0,1 мг до около 100 мг, от около 0,1 мг до около 20 мг, от около 0,1 мг до около 18 мг, от около 1 мг до около 300 мг, от примерно 1 мг до примерно 100 мг, от примерно 1 мг до примерно 20 мг, от примерно 1 мг до примерно 18 мг, от примерно 4 мг до примерно 300 мг, от примерно 4 мг до примерно 100 мг, от примерно 4 мг до примерно 20 мг, от примерно 4 мг до примерно 18 мг. В некоторых воплощениях IA стероид фармацевтической композиции по настоящему раскрытию находится в концентрации в диапазоне от примерно 1 мг до примерно 20 мг, от примерно 1 мг до примерно 18 мг, от примерно 4 мг до примерно 300 мг, от примерно 4 мг до примерно 100 мг, от примерно 4 мг до примерно 20 мг или от примерно 4 мг до примерно 18 мг на миллилитр (мл).
В некоторых воплощениях, IA стероид фармацевтической композиции согласно настоящему раскрытию находится в концентрации, равной, по меньшей мере, 10 мМ, 11 мМ, 12 мМ, 13 мМ, 14 мМ, 15 мМ, 16 мМ, 17 мМ, 18 мМ, 19 мМ, 20 мМ. , 21 мМ, 22 мМ, 23 мМ, 24 мМ, 25 мМ, 26 мМ, 27 мМ, 28 мМ, 29 мМ, 30 мМ, 31 мМ, 32 мМ, 33 мМ, 34 мМ или 35 мМ; и, необязательно, в диапазоне от примерно 10 мМ до примерно 40 мМ, от примерно 15 мМ до примерно 40 мМ, от 20 мМ до примерно 40 мМ, от примерно 15 мМ до примерно 35 мМ, от примерно 15 мМ до примерно 30 мМ, от 15 мМ до примерно 25 мМ или от примерно 20 мМ до примерно 25 мМ.
Полезные дозы IA стероида для человека определяют путем сравнения их активности in vitro и активности in vivo на животных моделях. Способы экстраполяции эффективных доз для мышей и других животных на людей известны в данной области техники; например, смотри патент США No. № 4,938,949, который включен в настоящий документ в качестве отсылки.
Дозировка вводимого IA стероида будет зависеть от тяжести состояния, которое лечат, конкретного препарата и других клинических факторов, таких как вес, общее состояние реципиента и тяжесть побочного эффекта.
Фармацевтическую композицию можно вводить в виде лечения однократной дозой или лечения многократными дозами в течение периода времени, соответствующего состоянию, подлежащему лечению. Фармацевтическую композицию удобно вводить с подходящими интервалами, например, один раз в течение недели, двух недель, шести недель, месяца, двух месяцев, по меньшей мере, 3-х месяцев, по меньшей мере, 6-ти месяцев или до исчезновения симптомов и признаков состояния. В группах воплощений, при лечении множественными дозами, по меньшей мере, две инъекции в сустав вводят с интервалом дозирования, выбранным из группы, состоящей из двух недель, трех недель, четырех недель, пяти недель, шести недель, семи недель, восьми недель, девяти недель, десяти недель, одиннадцати недель, двенадцати недель, тринадцати недель, четырнадцати недель, пятнадцати недель, шестнадцати недель, семнадцати недель, восемнадцати недель, девятнадцати недель, двадцати недель, двадцати одной недели, двадцати двух недель и двадцати трех недель.
Например, по меньшей мере, две инъекции в суставы вводят с интервалом дозирования примерно от 10 до 14 недель, а IA стероид на каждую инъекцию в сустав вводят в дозе от 8 мг до 18 мг.
IA стероид по настоящему раскрытию может быть смешан либо с ddH2O, либо с подходящим буфером с образованием водного раствора, содержащего стероид, для применения при приготовлении липосомальной стероидной композиции. В некоторых воплощениях IA стероид представляет собой водорастворимый стрероид, и он не связан ковалентно с липидом, включая, но не ограничиваясь ими, стерол, фосфолипид или жирную кислоту, такую как пальмитат. Подходящая растворимость IA стероида в воде составляет, например, но не ограничиваясь этим, по меньшей мере, 4 мг/мл, 10 мг/мл, 20 мг/мл, 30 мг/мл, 40 мг/мл или 50 мг/мл; необязательно, от 4 мг/мл до 10 мг/мл; и от 5 мг/мл до 60 мг/мл.
Способы лечения боли или воспаления в суставах и уменьшения побочных эффектов, связанных с приемом IA стероидов
Как правило, суставной хрящ субъекта подвергается быстро прогрессирующей дегенерации или повреждению после введения IA стероида, такого как кортикостероид. Это связано с побочными эффектами IA стероида, включая повреждение хондроцитов, апоптоз хондроцитов, потерю протеогликана, деградацию суставного хряща или разрушение суставов.
Один из аспектов этого раскрытия направлен на способ лечения боли в суставах с минимальными побочными эффектами IA стероида у субъекта, включающий введение эффективного количества фармацевтической композиции, как описана в настоящем документе, нуждающемуся в этом субъекту, посредством чего побочные эффекты, индуцированные IA-стероидом, уменьшаются по сравнению с побочными эффектами у субъекта после введения препарата с немедленным высвобождением или стандартной стероидной композиции. В одном из воплощений субъект имеет артрит, такой как остеоартрит, ревматоидный артрит, острый подагрический артрит.
Также предложены способы минимизации артропатии, вызванной кортикостероидами, или побочных эффектов, связанных со IA стероидом, у субъекта, нуждающегося в лечении боли в суставах, путем введения фармацевтической композиции, раскрытой в настоящем документе.
В другом аспекте, длительное, устойчивое высвобождение IA стероида из фармацевтической композиции, описанной в настоящем документе, не вызывает повреждения или разрушения суставного хряща.
Обеспеченная в настоящем документе фармацевтическая композиция может быть применена в сочетании с любым из множества дополнительных терапевтических средств, включая, но не ограничиваясь ими, анальгетики (например, бупивакаин, ропивакаин или лидокаин), препараты гиалуроновой кислоты (например, Synvisc-OneТМ), нестероидное противовоспалительное средство (например, ибупрофен), модифицирующие заболевание средства (например, метотрексат) или биологические лекарственные препараты (например, этанерцепт, инфликсимаб, адалимумаб, цертолизумаб пегол, голимумаб или ритуксимаб). В некоторых воплощениях заявленная фармацевтическая композиция и дополнительное терапевтическое средство были составлены в единую терапевтическую композицию, и заявленную фармацевтическую композицию и дополнительное терапевтическое средство вводили одновременно. В качестве альтернативы, заявленная фармацевтическая композиция и дополнительное терапевтическое средство были отделены друг от друга, например, каждый из них был составлен в виде отдельной терапевтической композиции, и заявленную фармацевтическую композицию и дополнительное средство вводили одновременно или в разное время в течение курса лечения посредством одного и того же пути или разными путями, как разовую дозу или в виде нескольких доз.
Следующие ниже примеры дополнительно иллюстрируют фармацевтические композиции, способы или применения в соответствии с настоящим раскрытием. Эти примеры предназначены просто для иллюстрации фармацевтических композиций, способов или применений в соответствии с настоящим раскрытием и не должны рассматриваться как ограничивающие.
Пример 1. Получение смеси липидов
Раствор липидов готовили способом впрыска растворителя. Липиды, включая DOPC, DOPG и холестерин, объединяли в мольном процентном соотношении 67,5 : 7,5 : 25 и растворяли в 99,9% этаноле при температуре около 40°С в колбе с образованием раствора липидов. Для растворения липидов применяли настольную ультразвуковую ванну.
Раствор липидов добавляли к 1,0 мМ раствору фосфата натрия со скоростью 100 мл/мин с помощью перистальтического насоса с образованием суспензии про-липосом. Затем суспензию про-липосом пропускали 6-10 раз через поликарбонатную мембрану с размером пор, равным 0,2 мкм. Была получена смесь липосом, и липосомы имели средний диаметр везикул около 120-140 нм (измерен с помощью прибора Malvern ZetaSizer Nano ZS-90, Malvern Instruments Ltd, Вустершир, Великобритания).
Смесь липосом диализовали и концентрировали с помощью системы фильтрации с тангенциальным потоком с помощью Millipore Pellicon 2 Mini Ultrafiltration Module Biomax-100C (0,1 м2) (Millipore Corporation, Billerica, MA, США) и затем стерилизовали с применением стерильного фильтра 0,2 мкм.
Концентрацию липидов в отфильтрованной смеси липосом количественно определяли с помощью анализа фосфора, и отфильтрованную смесь липосом составляли с маннитом в концентрации 2% маннита, а затем снова стерилизовали с применением стерильного фильтра 0,2 мкм. Затем стерилизованную смесь липосом подвергали лиофилизации для получения смеси липидов в виде лепешки.
Пример 2. Приготовление фармацевтической композиции
Фармацевтическая композиция в соответствии с настоящим раскрытием была приготовлена путем смешивания смеси липидов, описанной в примере 1, с раствором DSP, который включает 13,2 мг/мл дексаметазона фосфата натрия (DSP) (C22H28FNa2O8P; молекулярная масса: 516,41 г/л) и 4 мг/мл цитрата натрия, в результате чего была получена липосомальная композиция DSP с конечной концентрацией DSP, составляющей 12,0 мг/мл (23,2 мМ).
Пример 3. Оценка in vivo фармацевтической композиции в снижении побочных эффектов различных доз суставных стероидов
Исследование in vivo было выполнено с применением собак породы бигль для оценки эффективности фармацевтической композиции в снижении побочных эффектов различных доз стероида IA. Контрольный носитель получали смешиванием липидной смеси, описанной в примере 1, с раствором, содержащим 0,9% хлорида натрия.
Собак породы бигль разделяли на пять групп, и они получили следующие инъекции IA в каждое колено:
Группа A (n = 8): однократная IA инъекция физиологического раствора (0,9% хлорида натрия по 1,5 мл на колено);
Группа B (n = 8): однократная IA инъекция контрольного носителя (суспензия липидной смеси без DSP по 1,5 мл на колено).
Группа C (n = 8): однократная IA инъекция липосомальной композиции DSP по примеру 2 (4 мг DSP в 0,34 мл фармацевтической композиции на колено).
Группа D (n = 8): однократная IA инъекция липосомальной композиции DSP по примеру 2 (12 мг DSP в 1,0 мл фармацевтической композиции на колено).
Группа E (n = 8): однократная IA инъекция липосомальной композиции DSP по примеру 2 (18 мг DSP в 1,5 мл фармацевтической композиции на колено).
Собак породы бигль умерщвляли через 3 месяца после IA инъекции тестируемой композиции в каждое колено. Окрашивание толуидиновым синим применяли для оценки потери протеогликана в коленном хряще. Тяжесть потери протеогликана оценивается по следующим критериям:
Балл 0: отсутствие протеогликана.
Балл 1: минимальная потеря протеогликана
Балл 2: небольшая потеря протеогликана
Балл 3: умеренная потеря протеогликана
Балл 4: выраженная потеря протеогликана
Балл 5: серьезная потеря протеогликана
Таблица 1 показывает, что степень потери протеогликана аналогична среди групп липосомальной композиции DSP при различных количествах доз (группы C, D и E), независимо от дозы DSP. После того, как собаки получили одну инъекцию IA липосомальной композиции DSP (дозу варьировали от 4 мг до 18 мг) в каждое колено, от 75% до 100% продемонстрировали от отсутствия до минимальной потери протеогликана хрящей коленного сустава, что аналогично потере протеогликана в контрольной группе, получавшей физиологический раствор, в которой 100% продемонстрировали от отсутствия до минимальной потери протеогликана коленного хряща (группа A).
Таблица 1. Потери протеогликана в баллах в группах A-E

Пример 4. Токсичность/токсикокинетический профиль и фармакокинетический профиль фармацевтической композиции
Цель настоящего примера заключается в оценке повреждения хряща липосомальной композицией DSP по примеру 2 по сравнению с современным способом лечения стероидами, такими как триамцинолона ацетонид (ТА) и инъекционной суспензией триамцинолона ацетонида с пролонгированным высвобождением (ER-TA), а также в оценке токсикокинетических (TK)/фармакокинетических (PK) профилей липосомальной композиции DSP по примеру 2 после IA инъекции в пяти доклинических исследованиях на здоровых собаках и кроликах.
В четырех исследованиях токсичности изучали гистологию хряща после IA инъекции липосомальной композиции DSP (обозначенной как TLC599) или других тестируемых препаратов. Потерю протеогликана оценивали с помощью катионных красителей, толуидинового синего, которые окрашивают протеогликаны. Снижение интенсивности окрашивания протеогликаном может указывать на повреждение хряща и лежащую в его основе хондротоксичность. В двух исследованиях TK/PK определяли концентрацию дексаметазона фосфата (DP) и оценивали профиль TK/PK (таблица 2). DSP представляет собой натриевую соль DP.
Таблица 2. Список доклинических исследований
На фиг. 1А показана средняя концентрация дексаметазона фосфата в синовиальной жидкости собаки, при этом образцы синовиальной жидкости отбирали через 2,5, 48, 96, 168 и 360 часов после однократной IA инъекции липосомальной композиции DSP на уровне доз 4 и 18 мг/колено в обоих коленях у самки и самца собаки.
На фиг. 1В показана концентрация дексаметазона фосфата в синовиальной жидкости собаки, при этом образцы синовиальной жидкости отбирали через 15, 30, 45, 90 и 120 дней после однократной IA инъекции TLC599 на уровне дозы 18 мг/колено (всего 36 мг/животное) в обоих коленях.
После IA инъекции липосомальной композиции DSP концентрация DP в синовиальной жидкости поддерживалась на высоком уровне в течение от 2,5 до 48,0 часов и сохранялась в течение 360 часов (фиг. 1A). DP сохранялся на аналогичных уровнях от 30 до 120 дней после введения дозы (фиг. 1B), демонстрируя длительное местное воздействие на сустав.
На фиг. 2 показано окрашивание хряща толуидиновым синим у собак (исследование № 8351850) и кроликов (исследование № 8288836) после обработки одной или несколькими дозами липосомальной композиции DSP. В исследовании № 8351850 собакам вводили 12 мг/колено липосомальной композиции DSP в коленные суставы и умерщвляли на день 8 (панель A1), день 31 (панель A2) и день 91 (панель A3) после обработки. В исследовании № 8288836 кроликам вводили 1,2 мг/колено липосомальной композиции DSP в коленные суставы по отдельности и умерщвляли на день 15 (панель B1) и день 31 (панель B2) после обработки; и кроликам дважды (вторая доза через один месяц) вводили 1,2 мг/колено липосомальной композиции DSP в коленные суставы и умерщвляли на день 91 (панель B3) после обработки.
Как показано на фиг. 2, в исследованиях, как на собаках, так и на кроликах, не наблюдали изменения интенсивности окрашивания толуидиновым синим и изменения морфологии окрашивания гематоксилином и эозином (H&E), что указывает на отсутствие потери протеогликана или повреждения хряща даже после повторного введения.
На фиг. 3 показано окрашивание хряща толуидиновым синим у собак (исследование № 75903-18-214) после однократной обработки ТА и ER-TA в высоких дозах. Высокие дозы TA и ER-TA показали значительную потерю протеогликана по сравнению с физиологическим раствором, а низкая доза ER-TA показала значительную потерю протеогликана по сравнению с его эквивалентной дозой TA, а также с физиологическим раствором (фиг. 3). Напротив, липосомальная композиция DSP (обозначена как TLC599) продемонстрировала уровень протеогликана, сравнимый с таковым для физиологического раствора, через 30 дней после обработки (фиг. 2).
Соответственно, было показано, что ER-TA приводил к большей потере протеогликана и лежащей в основе хондротоксичности, чем только TA, в особенности, при низком уровне дозы (2,1 мг/колено). Эти данные показали, что липосомальная композиция DSP значительно менее токсична, чем два обычных продукта.
В исследовании № 75903-18-214 собакам вводили физиологический раствор, 2,1 мг/колено и 18,75 мг/колено триамцинолона ацетонида (ТА) (обозначено как «ТА 2,1 мг» и «ТА 18,75 мг» соответственно), 2,1 мг/колено и 18,75 мг/колено инъекционной суспензии триамцинолона ацетонида с пролонгированным высвобождением (обозначено как «ER-TA 2,1 мг» и «ER-TA 18,75 мг», соответственно) или 12 мг/колено липосомальной композиции DSP в коленные суставы [обозначено как «TLC599 12 мг (эквивалент 60 мг ТА)»]
В исследовании № 8351851 не наблюдали значительного различия профилей токсичности и TK между первой дозой липосомальной композиции DSP и последней дозой липосомальной композиции у собак после 4-х повторных доз липосомальной композиции DSP, что свидетельствует о сходном профиле безопасности хряща при введении многократных и однократных доз. Липосомную композицию DSP можно вводить повторно без значительных побочных эффектов, и она представляет собой безопасное и эффективное средство для длительного лечения ОА.
Липосомальная композиция DSP в качестве фармацевтической композиции в соответствии с настоящим описанием, новая композиция DSP с пролонгированным высвобождением, показала высокий уровень воздействия DSP в суставе после однократной IA инъекции и сохранялась на аналогичных уровнях вплоть до четырех месяцев (фиг. 1B).
После однократной и многократной IA инъекции липосомальной композиции DSP никакой заметной токсичности для хряща в доклинических исследованиях на собаках и кроликах не наблюдали. Напротив, как для однократной дозы TA, так и для однократной дозы ER-TA наблюдали умеренную потерю протеогликана в хряще (фиг. 3).
| название | год | авторы | номер документа |
|---|---|---|---|
| ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ, ПОДХОДЯЩИЕ ДЛЯ СУСТАВНОЙ ДОСТАВКИ, И ИХ ПРИМЕНЕНИЕ ПРИ ЛЕЧЕНИИ СУСТАВНОЙ БОЛИ | 2019 |
|
RU2810788C2 |
| СПОСОБЫ ЛЕЧЕНИЯ АРТРИТА | 2013 |
|
RU2677658C2 |
| КОРТИКОСТЕРОИДЫ ДЛЯ ЛЕЧЕНИЯ СУСТАВНОЙ БОЛИ | 2011 |
|
RU2642279C2 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ДЛЯ УМЕНЬШЕНИЯ ОСЛОЖНЕНИЙ ПРИМЕНЕНИЯ СТЕРОИДНЫХ ПРЕПАРАТОВ ПРИ ЛЕЧЕНИИ ОФТАЛЬМОЛОГИЧЕСКИХ ЗАБОЛЕВАНИЙ | 2013 |
|
RU2660585C2 |
| КОМБИНИРОВАННЫЙ ПРЕПАРАТ, ВКЛЮЧАЮЩИЙ КОРТИКОСТЕРОИД И ЭКЗОСОМЫ | 2010 |
|
RU2557897C2 |
| ЛИПОСОМАЛЬНЫЕ ПРЕПАРАТЫ | 2013 |
|
RU2680096C2 |
| ПОЛИМЕРНЫЕ КОМПОЗИЦИИ МОДИФИЦИРОВАННОЙ ГИАЛУРОНОВОЙ КИСЛОТЫ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2010 |
|
RU2539395C2 |
| ВЫЗЫВАЕМАЯ МЕДИКАМЕНТОЗНЫМИ СРЕДСТВАМИ ЛИПОАТРОФИЯ ДЛЯ КОСМЕТИЧЕСКИХ ЦЕЛЕЙ | 2010 |
|
RU2530629C2 |
| КОМБИНИРОВАННЫЕ ПРЕПАРАТЫ С АНТАГОНИСТОМ ЦИТОКИНА И КОРТИКОСТЕРОИДОМ | 2010 |
|
RU2526161C2 |
| ПРИМЕНЕНИЕ ИНГИБИТОРА КАСПАЗЫ ДЛЯ ОБЛЕГЧЕНИЯ ИЛИ ЛЕЧЕНИЯ ОСТЕОАРТРИТА | 2021 |
|
RU2821263C1 |

Группа изобретений относится к области медицины и раскрывает фармацевтическую композицию для лечения боли в суставах и уменьшения побочных эффектов, вызванных внутрисуставным (IA) стероидом у субъекта, в котором фармацевтическая композиция включает: (а) липидную смесь, включающую 1,2-диолеоил-sn-глицеро-3-фосфатидилхолинел (DOPC), 1,2-диолеоил-sn-глицеро-3-фосфоглицерол (DOPG) и холестерин в молярном соотношении от 29,5% до 90%: от 3% до 37,5%: от 10% до 33%; и (b) эффективное количество IA стероида или его фармацевтически приемлемой соли, который выбран из группы, включающей дексаметазона фосфат натрия, дексаметазон, бетаметазон, бетаметазона фосфат натрия, бетаметазона ацетат, бетаметазона дипропиоинат, бетаметазона валерат, мометазона фуронат, триамцинолона ацетонид, триамцинолона гексацетонид, триамцинолона диацетат, метилпреднизолона сукцинат натрия, метилпреднизолона ацетат, преднизолона тебутат, гидрокортизона ацетат, алклометазона дипропионат, галцинонид, флуокортолон, флуоцинолона ацетонид или их комбинацию, и в которой IA стероид фармацевтической композиции находится в концентрации от 15 мМ до 40 мМ. Также группа изобретений раскрывает способ лечения боли в суставах и снижения побочных эффектов, вызванных внутрисуставным (IA) стероидом. Техническим результатом группы изобретений является снижение профиля побочных эффектов, таких как уменьшение повреждения хряща и/или хондроцитов. 2 н. и 22 з.п. ф-лы, 2 табл., 4 ил., 4 пр.
1. Фармацевтическая композиция для лечения боли в суставах и уменьшения побочных эффектов, вызванных внутрисуставным (IA) стероидом у субъекта, в котором фармацевтическая композиция включает:
(а) липидную смесь, включающую 1,2-диолеоил-sn-глицеро-3-фосфатидилхолинел (DOPC), 1,2-диолеоил-sn-глицеро-3-фосфоглицерол (DOPG) и холестерин в молярном соотношении от 29,5% до 90% : от 3% до 37,5% : от 10% до 33%; и
(b) эффективное количество IA стероида или его фармацевтически приемлемой соли, который выбран из группы, включающей дексаметазона фосфат натрия, дексаметазон, бетаметазон, бетаметазона фосфат натрия, бетаметазона ацетат, бетаметазона дипропиоинат, бетаметазона валерат, мометазона фуронат, триамцинолона ацетонид, триамцинолона гексацетонид, триамцинолона диацетат, метилпреднизолона сукцинат натрия, метилпреднизолона ацетат, преднизолона тебутат, гидрокортизона ацетат, алклометазона дипропионат, галцинонид, флуокортолон, флуоцинолона ацетонид или их комбинацию, и
в которой IA стероид фармацевтической композиции находится в концентрации от 15 мМ до 40 мМ.
2. Фармацевтическая композиция по п. 1, в которой IA стероид представляет собой водорастворимый стероид.
3. Фармацевтическая композиция по п. 1, в которой IA стероид фармацевтической композиции находится в диапазоне концентраций, выбранной из группы, состоящей из: от 15 мМ до 30 мМ и от 20 мМ до 25 мМ.
4. Фармацевтическая композиция по п. 1, в которой IA стероид представляет собой кортикостероид.
5. Фармацевтическая композиция по п. 1, в которой IA стероид находится в диапазоне доз от 0,1 до 300 мг.
6. Фармацевтическая композиция по п. 1, в которой IA стероид находится в диапазоне доз от 0,1 до 20 мг.
7. Фармацевтическая композиция по п. 1, в которой IA стероид находится в диапазоне доз от 4 мг до 18 мг.
8. Фармацевтическая композиция по п. 1, которая предназначена для введения путем суставной инъекции.
9. Фармацевтическая композиция по п. 8, которая предназначена для введения, по меньшей мере, путем двух суставных инъекций.
10. Фармацевтическая композиция по п. 9, по меньшей мере, две инъекции которой вводят в сустав с интервалом дозирования, выбираемым из группы, состоящей из двух недель, трех недель, четырех недель, пяти недель, шести недель, семи недель, восьми недель, девяти недель, десяти недель, одиннадцати недель, двенадцати недель, тринадцати недель, четырнадцати недель, пятнадцати недель, шестнадцати недель, семнадцати недель, восемнадцати недель, девятнадцати недель, двадцати недель, двадцати одной недели, двадцати двух недель и двадцати трех недель.
11. Фармацевтическая композиция по п. 9, в которой IA стероид находится в диапазоне доз от 8 мг до 18 мг.
12. Фармацевтическая композиция по п. 1, в которой IA стероид находится в диапазоне доз от 10 до 14 мг.
13. Способ лечения боли в суставах и снижения побочных эффектов, вызванных внутрисуставным (IA) стероидом, включающий введение субъекту, нуждающемуся в лечении боли в суставах, эффективного количества фармацевтической композиции, включающей
(a) липидную смесь, включающую DOPC, DOPG и холестерин в молярном соотношении от 29,5% до 90% : от 3% до 37,5% : от 10% до 33%; и
(b) эффективное количество IA стероида или его фармацевтически приемлемой соли, который выбран из группы, включающей дексаметазона фосфат натрия, дексаметазон, бетаметазон, бетаметазона фосфат натрия, бетаметазона ацетат, бетаметазона дипропиоинат, бетаметазона валерат, мометазона фуронат, триамцинолона ацетонид, триамцинолона гексацетонид, триамцинолона диацетат, метилпреднизолона сукцинат натрия, метилпреднизолона ацетат, преднизолона тебутат, гидрокортизона ацетат, алклометазона дипропионат, галцинонид, флуокортолон, флуоцинолона ацетонид или их комбинацию, и,
в котором IA стероид фармацевтической композиции находится в концентрации от 15 мМ до 40 мМ.
14. Способ по п. 13, в котором побочный эффект выбран из группы, состоящей из повреждения хондроцитов, апоптоза хондроцитов, потери протеогликана, кист в суставном хряще, деградации суставного хряща, разрушения сустава или их комбинаций.
15. Способ по п. 13, в котором IA стероид представляет собой водорастворимый стероид.
16. Способ по п. 13, в котором IA стероид фармацевтической композиции находится в диапазоне концентраций, выбранном из группы, состоящей из: от 15 мМ до 30 мМ и от 20 мМ до 25 мМ.
17. Способ по п. 13, в котором IA стероид представляет собой кортикостероид.
18. Способ по п. 13, в котором IA стероид вводят в дозе от 0,1 до 300 мг.
19. Способ по п. 13, в котором IA стероид вводят в дозе от 0,1 мг до 20 мг.
20. Способ по п. 13, в котором IA стероид вводят в дозе от 4 мг до 18 мг.
21. Способ по п. 13, в котором фармацевтическую композицию вводят, по меньшей мере, путем одной суставной инъекции.
22. Способ по п. 13, в котором фармацевтическую композицию вводят, по меньшей мере, путем двух суставных инъекций.
23. Способ по п. 22, в котором, по меньшей мере, две инъекции вводят в сустав с интервалом дозирования, выбираемым из группы, состоящей из двух недель, трех недель, четырех недель, пяти недель, шести недель, семи недель, восьми недель, девяти недель, десяти недель, одиннадцати недель, двенадцати недель, тринадцати недель, четырнадцати недель, пятнадцати недель, шестнадцати недель, семнадцати недель, восемнадцати недель, девятнадцати недель, двадцати недель, двадцати одной недели, двадцати двух недель и двадцати трех недель.
24. Способ по п. 22, в котором, по меньшей мере, две суставные инъекции вводят с интервалом дозирования от 10 до 14 недель, а IA стероид для каждой суставной инъекции находится в дозе от 8 мг до 18 мг.
| WO 2014008469 A2, 09.01.2014 | |||
| КОРТИКОСТЕРОИДЫ ДЛЯ ЛЕЧЕНИЯ СУСТАВНОЙ БОЛИ | 2011 |
|
RU2642279C2 |
| US 20060147511 A1, 06.07.2006 | |||
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ДЛЯ УМЕНЬШЕНИЯ ОСЛОЖНЕНИЙ ПРИМЕНЕНИЯ СТЕРОИДНЫХ ПРЕПАРАТОВ ПРИ ЛЕЧЕНИИ ОФТАЛЬМОЛОГИЧЕСКИХ ЗАБОЛЕВАНИЙ | 2013 |
|
RU2660585C2 |
| WERNECKE, C., et al: "The Effect of Intra-articular Corticosteroids on Articular Cartilage: A Systematic Review", Orthopaedic Journal of Sports Medicine, vol | |||
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
| Кипятильник для воды | 1921 |
|
SU5A1 |
Авторы
Даты
2023-10-25—Публикация
2019-07-08—Подача