Область техники
Изобретение относится к области высокотехнологичной и персонализированной медицины, а именно к способам запаковки лекарственных соединений, их адресной доставки и контролируемому высвобождению для локальной терапии различных заболеваний. Изобретение может быть использовано как для модификации поверхности медицинских изделий, так и в виде отдельностоящей пленки, элюирующей лекарственное соединение.
Уровень техники
Основным подходом к изготовлению пленок, содержащих различные лекарственные соединения, является создание композитных материалов (цельнолитых и нетканых пленок). В таких пленках лекарственное вещество в виде суспензии микрочастиц равномерно распределено в толще полимерной пленки или микроволокнах на основе различных биополимеров (полимолочная, полигликолевая кислоты, их сополимеры, поликапролактон и др.).
Покрытия такого рода чаще всего формируют на поверхностях медицинских изделий из металла (стенты и др.) путем их погружения в суспензию полимер-лекарство или распыления данной суспензии на поверхность медицинского изделия [Du, R., Wang, Y., Huang, Y. et al. Design and testing of hydrophobic core/hydrophilic shell nano/micro particles for drug-eluting stent coating // NPG Asia Mater 2018; 10: 642-658; Bedair, T.M., Park, W., Park, BJ. et al. Dual-Layer Coated Drug-Eluting Stents with Improved Degradation Morphology and Controlled Drug Release // Macromol. Res. 2018; 26: 641-649]. Также возможно использование отдельностоящих покрытий в качестве лечебных патчей и антибактериальных накладок [US9072681B2; US10159768B2]
Скорость высвобождения активного вещества в таких покрытиях определяется его молекулярной массой и характерным временем биодеградации полимерной основы. Средняя полезная загрузка на единицу площади для покрытий такого рода не превышает 150 мкг/см2 (для покрытий толщиной порядка 7 мкм.)
Существенными ограничениями известных композитных покрытий являются сложность настройки и управления кинетикой высвобождения лекарственного вещества, а также малое количество полезной загрузки.
Первое ограничение связано с тем, что лекарственное вещество распределено в толще пленки в виде локальных, независимых микрокристаллов, окруженных гидрофобным и водонерастворимым полимером. В системах такого рода период выхода вещества напрямую связан с характерным временем деградации полимерной основы и молекулярной массой лекарства. Из этого следует вывод, что время высвобождения лекарственного соединения фиксировано для каждой пары полимер-лекарство, а его настройка происходит за счет смены/модификации полимерной матрицы или лекарственного вещества, что нежелательно или в ряде случаев невозможно (особенности терапии, биосовместимость и т.д.).
Второе ограничение, связанное с загрузкой ограниченного количества активного вещества на единицу площади пленки, обусловлено необходимостью сохранения механических и адгезивных свойств лекарственного покрытия, определяемых полимерной матрицей. Для сохранения вышеуказанных механических свойств покрытия в композитных материалах массовая доля лекарственного вещества не превышает 20-30% от массы полимерной оболочки. В противном случае, покрытия становятся хрупкими и теряют свои эксплуатационные характеристики. Наряду с этим, еще одним фактором, ограничивающим количество активного вещества, является толщина покрытия, которая теоретически может лежать в широком интервале 5-500 мкм, однако на практике утолщение покрытия более 50 мкм является нежелательным, поскольку завышенная толщина может привести к нарушению механических свойств изделия, на котором формируется данное покрытие, существенно повысить массу полимерной матрицы, не несущей никакого терапевтического эффекта, и значительно удлинить время полного биоразложения лекарственного покрытия.
Раскрытие изобретения
Задача настоящего изобретения состоит в разработке многослойных пленок, элюирующих лекарственные средства, способных содержать в себе увеличенное количество лекарственных соединений (без привязки к конкретному биологически активному веществу) и обладающих возможностью настройки времени высвобождения активного вещества в широких пределах (дни-месяцы), а также чувствительных к различным внешним воздействиям для ускорения высвобождения активного вещества, в частности к терапевтическому медицинскому ультразвуку.
Поставленная задача решается путем разработки многослойных полимерных пленок, получаемых методом печатного многослойного регулируемого инкапсулирования груза (printed layered adjustable cargo encapsulation - PLACE).
Более конкретно, предложены многослойные пленки, выполненные с возможностью высвобождения биологически активных веществ (БАВ) в среды живого организма, включающие:
- оснóвный слой, состоящий из биосовместимого биоразлагаемого полимера, отличного от поливинилового спирта, и имеющий непрерывную поверхность одинаковой толщины по всей площади;
- на который нанесен по меньшей мере один лекарственный слой, состоящий из поливинилового спирта, в котором равномерно распределено по меньшей мере одно БАВ, причем в случае, если лекарственных слоев несколько, они расположены друг над другом и отделены друг от друга разделительным слоем, выполненным из биосовместимого биоразлагаемого полимера, отличного от поливинилового спирта;
- при этом основный слой вместе с нанесенным на него лекарственным слоем сверху покрыт защитным слоем, состоящим из биосовместимого биоразлагаемого полимера, отличного от поливинилового спирта, и имеющим непрерывную поверхность одинаковой толщины по всей площади, выполненным так, что лекарственный слой или совокупность всех лекарственных слоев, если их несколько, получается запаянным(-и) между основным и защитным слоями.
В некоторых вариантах изобретения в защитном слое многослойной пленки содержатся микро- и/или наноразмерные отверстия, выполненные с возможностью выхода через них БАВ из лекарственного(-ых) слоя(-ев).
В некоторых более предпочтительных вариантах изобретения размер (диаметр) отверстий составляет 5-20 мкм. В некоторых частных вариантах изобретения все отверстия имеют одинаковый размер. В некоторых других частных вариантах изобретения по меньшей мере два отверстия имеют разный размер.
В некоторых вариантах изобретения биосовместимый биоразлагаемый полимер выбран из группы, состоящей из полимолочной кислоты (ПМК), полигликолевой кислоты (ПГК), сополимеров ПМК и ПГК, поликапролактона (ПК), сополимеров ПК и ПМК, полигидроксибутирата (ПГБ), полилактид-капролактона (ПЛКЛ).
В некоторых вариантах изобретения БАВ представляет собой низкомолекулярное БАВ, олиго- или полимерное БАВ, в том числе полисахарид, вещество белковой природы.
В некоторых вариантах изобретения многослойная пленка имеет один лекарственный слой, включающий одно БАВ; в некоторых других вариантах изобретения многослойная пленка имеет по меньшей мере два лекарственных слоя, при этом все слои включают одно и то же БАВ. В других вариантах изобретения многослойная пленка имеет по меньшей мере два лекарственных слоя, при этом БАВ, включенные в каждый слой, различаются. В некоторых других вариантах изобретения многослойная пленка имеет по меньшей мере два лекарственных слоя, при этом БАВ по меньшей мере одного лекарственного слоя отличается от других. В частных вариантах изобретения многослойная пленка имеет один лекарственный слой, при этом лекарственный слой включает по меньшей мере два различных БАВ.
В некоторых вариантах изобретения лекарственный слой нанесен на поверхность оснóвного слоя в виде монослоя, равномерно покрывающего весь основный слой. В некоторых других вариантах изобретения лекарственный слой нанесен на поверхность оснóвного слоя в виде упорядоченных структур. В некоторых частных вариантах изобретения упорядоченная структура представляет собой сетку, змейку, точки, линии и/или плоскую спираль. При этом все точки могут быть выполнены одинакового размера или по меньшей мере двух различающихся размеров. Все линии (и другие структуры) также могут быть выполнены одинаковой длины и/или ширины или по меньшей мере двух различающихся размеров длины и/или ширины.
В некоторых вариантах изобретения многослойная пленка дополнительно включает адгезивный слой, выполненный из клеевой композиции, приемлемой для медицинского применения (т.е. одобренной для наружного применения и/или применения внутри живого организма), на котором расположен основный слой, при этом адгезивный слой позволяет фиксировать многослойную пленку на поверхности медицинских изделий или устройств. При этом адгезивный слой выбирают так, чтобы обеспечить необходимую фиксацию на поверхности конкретного медицинского изделия или устройства.
В некоторых вариантах изобретения основный слой многослойной пленки закреплен на армирующем слое, выполненным из поликапролактона и обеспечивающим механическую жесткость многослойной пленки.
Поставленная задача также решается путем применения многослойной пленки для доставки БАВ в организм пациента.
Поставленная задача также решается путем разработки способа получения многослойной пленки, элюирующей по меньшей мере одно БАВ.
Кроме того, поставленная задача решается путем разработки медицинских изделий и устройств, поверхность которых (по меньшей мере частично) модифицирована путем адгезии на нее многослойной пленки по изобретению, а также путем разработки отдельностоящих многослойных пленок для трансдермальной или эндоскопической доставки БАВ.
В результате осуществления изобретения достигаются следующие технические результаты:
- разработаны многослойные пленки (имеющие, как минимум, три слоя - основный, лекарственный и защитный) для доставки БАВ в организм пациента, способные содержать в себе как совсем небольшое, так и увеличенное количество БАВ (вплоть до 1000 мкг/см2 в каждом лекарственном слое), без привязки к конкретному БАВ, путем использования матрицы на основе поливинилового спирта;
- разработанные многослойные пленки обладают возможностью настройки времени высвобождения БАВ в широких пределах (от дней до месяцев и даже лет) путем изменения толщины защитного слоя, а также путем нанесения в нем отверстий различной плотности и размера; такая микроперфорация многослойных пленок по изобретению может быть использована в качестве инструмента для создания пленок, доставляющих БАВ с кинетикой элюирования нулевого порядка, позволяющей легко поддерживать уровень элюирования БАВ между минимально эффективной концентрацией и минимальной токсической концентрацией в течение заданного времени; это, в свою очередь, позволяет рассчитывать и настраивать характеристику времени высвобождения БАВ с высокой точностью;
- разработанные многослойные пленки чувствительны к различным внешним воздействиям для ускорения высвобождения БАВ, таким как терапевтический медицинский ультразвук;
- разработанные многослойные пленки могут быть использованы в качестве биополимерного покрытия медицинских изделий и устройств, таких как имплантируемые медицинские изделия (устройства), а также для трансдермальной и эндоскопической доставки БАВ в виде самостоятельных устройств (накладок, патчей и т.п.), размещаемых на коже и слизистых;
- разработанные многослойные пленки могут быть использованы для адресной доставки и контролируемого (пролонгированного) высвобождения БАВ для локальной терапии различных заболеваний;
- предложенный подход позволяет производить многослойные пленки большой площади с расширенными характеристиками - точной контролируемой загрузкой БАВ, значительной полезной нагрузкой, а также с возможностью изготовления пленок, содержащих несколько лекарственных слов, и чередования различных БАВ и биополимеров внутри слоев, что позволяет получать программируемые многофункциональные покрытия;
- для получения разработанных многослойных пленок не требуется сложных технологических процессов, и их получение возможно путем масштабного рулонного производства с автоматизированной системой размещения лекарственного слоя, благодаря чему способ получения пленок является простым, масштабируемым, воспроизводимым и экономически эффективным.
Термины и определения
Если иное не оговаривается, все технические и научные термины, используемые в данной заявке, имеют то же самое значение, которое понятно для специалистов в данной области. Ссылки на методики, используемые при описании данного изобретения, относятся к хорошо известным методам, включая изменения этих методов и замену их эквивалентными методами, известными специалистам.
В документах данного изобретения термины «включает», «включающий» и т.п., а также «содержит», «содержащий» и т.п. интерпретируются как означающие «включает, помимо всего прочего» (или «содержит, помимо всего прочего»). Указанные термины не предназначены для того, чтобы их истолковывали как «состоит только из».
Термин «и/или» означает один, несколько или все перечисленные элементы.
Использование терминов порядка или важности, включая «первый» и «второй», «верхний» или «нижний» («сверху»/ «снизу», «на»/ «под»), заключается в том, чтобы различать и идентифицировать отдельные элементы, а не обозначать или подразумевать конкретный порядок или важность, если это четко не указано в контексте.
Термин «биологически активное вещество (БАВ)», как используется в настоящем описании, относится к химическому веществу или соединению, пригодному для местного или трансдермального введения, и которое вызывает желаемый эффект. Термин охватывает вещества, которые являются терапевтически эффективными, профилактически эффективными и/или косметологически эффективными. Термины «биологически активное вещество», «лекарственное вещество» и «лекарство» используются в настоящем описании взаимозаменяемо. Природа БАВ может быть любой - это может быть как низкомолекулярное БАВ, так и олиго- и полимерные БАВ, в том числе полисахариды, вещества белковой природы, но не ограничиваясь ими. Примеры БАВ включают, но не ограничиваются ими, антибактериальные (например, ванкомицин, цефазолин), противовоспалительные (например, кеторолак, диклофенак) и антисептические вещества, другими примерами могут быть витамины, противоопухолевые, антиангиогенные агенты, антитромботические, антигипертензивные, антиаллергенные средства, терапевтические антитела (такие как ранибизумаб, бевацизумаб и др.), терапевтические белки (такие как инсулин, эритропоэтин) и др.
В некоторых случаях БАВ может быть объединен с фармацевтически приемлемой добавкой (вспомогательным веществом). Термин «фармацевтически приемлемая добавка» относится к консервантам, антиоксидантам, эмульгаторам, красителям, эксципиентам и т.п., известным или используемым в области приготовления лекарственных препаратов, которые не оказывают чрезмерного влияния на эффективность биологической активности БАВ и не токсичны для пациента. Обычно известно, что термин «вспомогательное вещество» означает носитель, разбавитель и/или наполнитель, используемый при составлении лекарственных композиций, эффективных для желаемого применения.
В рамках изобретения термин «терапевтически эффективное количество» относится к количеству лекарственного (биологически активного) вещества, которое является нетоксичным, но достаточным для обеспечения желаемого терапевтического (профилактического, косметологического) эффекта. Количество, которое является «эффективным», может варьировать в зависимости от конкретного лекарственного вещества или комбинации веществ, заболевания, тяжести состояния и тому подобного, как известно специалистам в данной области. Такое эффективное количество также может варьировать от субъекта к субъекту в зависимости от возраста, массы тела, общего состояния индивидуума и др.
Термин «биосовместимый биоразлагаемый полимер» («биополимер») предпочтительно означает биосовместимый биоразлагаемый нерастворимый в воде полимер медицинского назначения, такой как, например полимолочная кислота (ПМК), полигликолевая кислота (ПГК), сополимер ПМК и ПГК (например поли-D,L-лактид-ко-гликолид), поликапролактон (ПК), сополимер ПК и ПМК, полигидроксибутират (ПГБ), полилактид-капролактона (ПЛКЛ), но не ограничиваясь ими. Природные и модифицированные природные полимеры, в отличие от приведенных выше синтетических, менее предпочтительны, поскольку в большинстве случаев они не отвечают механическим требованиям к покрытиям и не обладают должно удерживающей способностью для пролонгированного высвобождения БАВ. В рамках изобретения могут быть использованы биополимеры любой молекулярной массы и могут выбираться, например, в зависимости от требуемого времени разложения пленки. Для поливинилового спирта (ПВС), чем выше его молекулярная масса, тем его требуется меньше для достижения желаемой динамической вязкости при приготовлении раствора, что в некоторых случаях может быть предпочтительнее, поскольку в таком случае возможно достижение большего соотношения массы БАВ к массе ПВС, и обеспечение повышенного количества БАВ, включенного в многослойную пленку.
Термин «сополимер» в рамках настоящего изобретения означает любые сополимеры (такие как, например, регулярные сополимеры, блоксополимеры, сополимеры с разветвленной цепью и др.), отвечающие необходимым требованиям к биополимерам.
Термины «субъект» и «пациент» охватывают любые виды животных, предпочтительно млекопитающих, более предпочтительно, подразумевают человека.
Если не определено отдельно, технические и научные термины в данной заявке имеют стандартные значения, общепринятые в научной и технической литературе.
Краткое описание рисунков
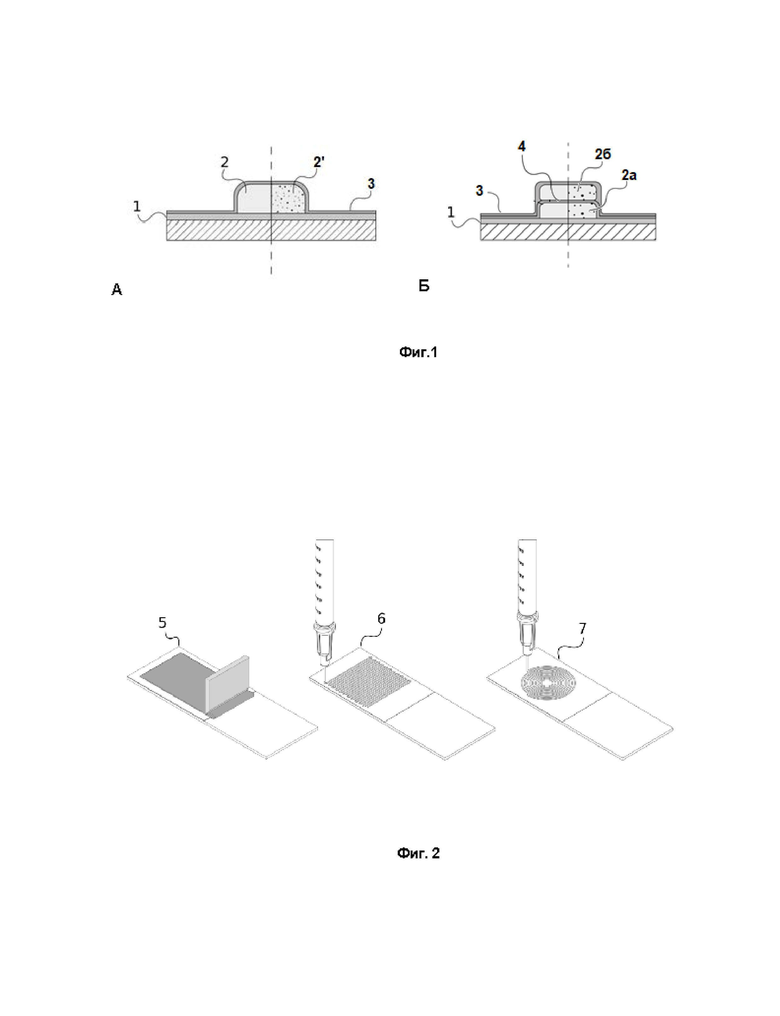
Фиг. 1 - фрагмент многослойной полимерной пленки в разрезе: А - с одним лекарственным слоем, Б - с двумя лекарственными слоями. Цифрами обозначены: (1) - основный слой, (2) - лекарственный слой, содержащий водорастворимые БАВ, (2’) - лекарственный слой, содержащий слабо- и водонерастворимые БАВ в виде равномерно распределённых микрокристаллов, (2а) - первый лекарственный слой, (2б) - второй лекарственный слой, (3) - защитный слой, (4) - разделительный слой. Штриховка на рисунке показывает поверхность, на которой расположена полимерная пленка по изобретению (например, подложка - в процессе формирования пленки, или поверхность медицинского изделия или инструмента - в варианте сформированного покрытия).
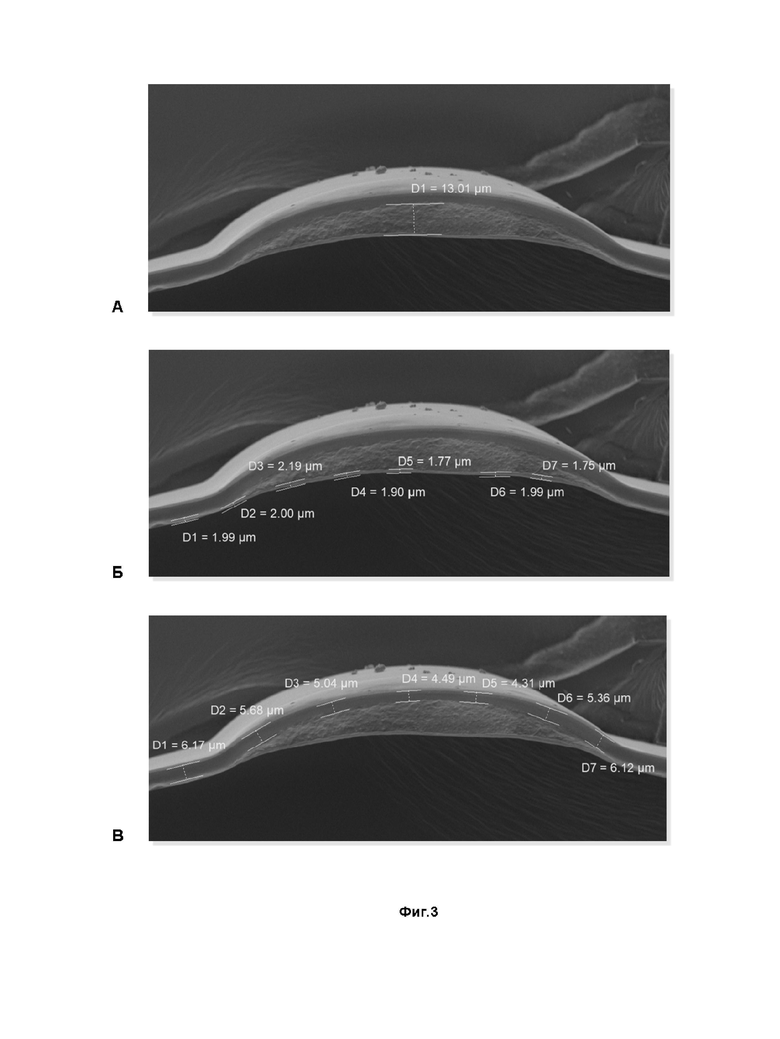
Фиг. 2 - различные варианты нанесения лекарственного слоя на основную пленку: (5) - нанесение сплошного лекарственного слоя заданной толщины ракельным методом, (6), (7) - нанесение лекарственного слоя путем его автоматической дозации на основную пленку в виде различных упорядоченных структур для достижения желаемой дозировки препарата или покрытия необходимой площади.
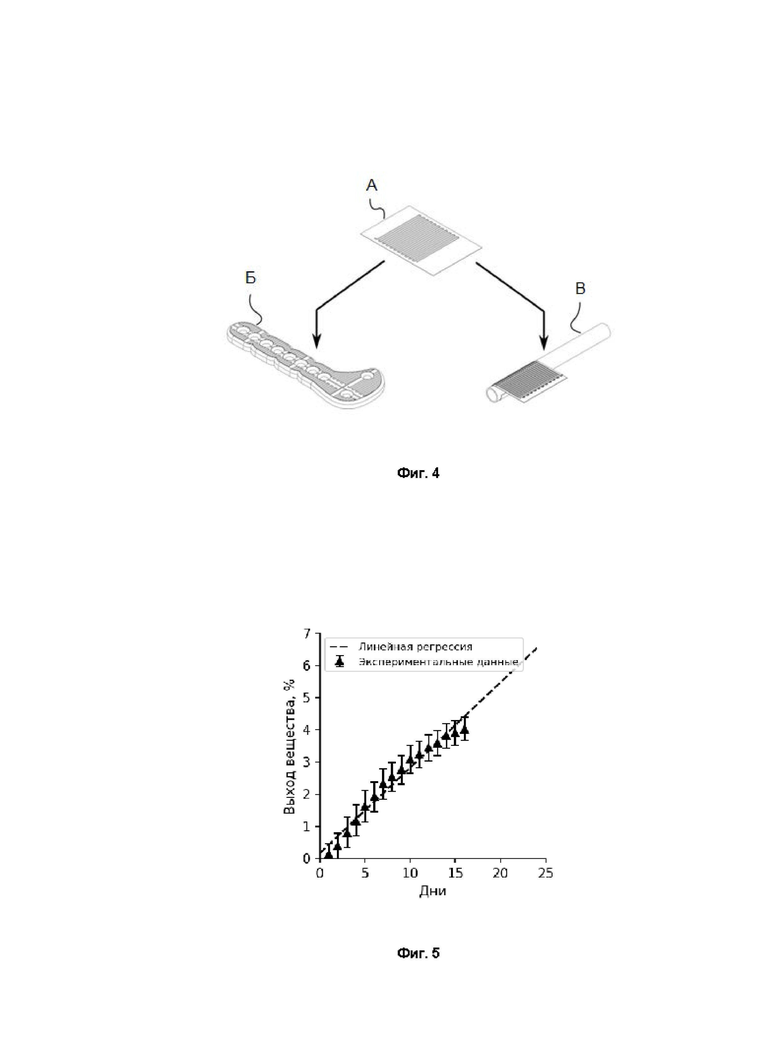
Фиг. 3 - изображение, полученное методами сканирующей электронной микроскопии, среза полимерного покрытия, демонстрирующее толщину А - лекарственного, Б - защитного и В - основного слоев.
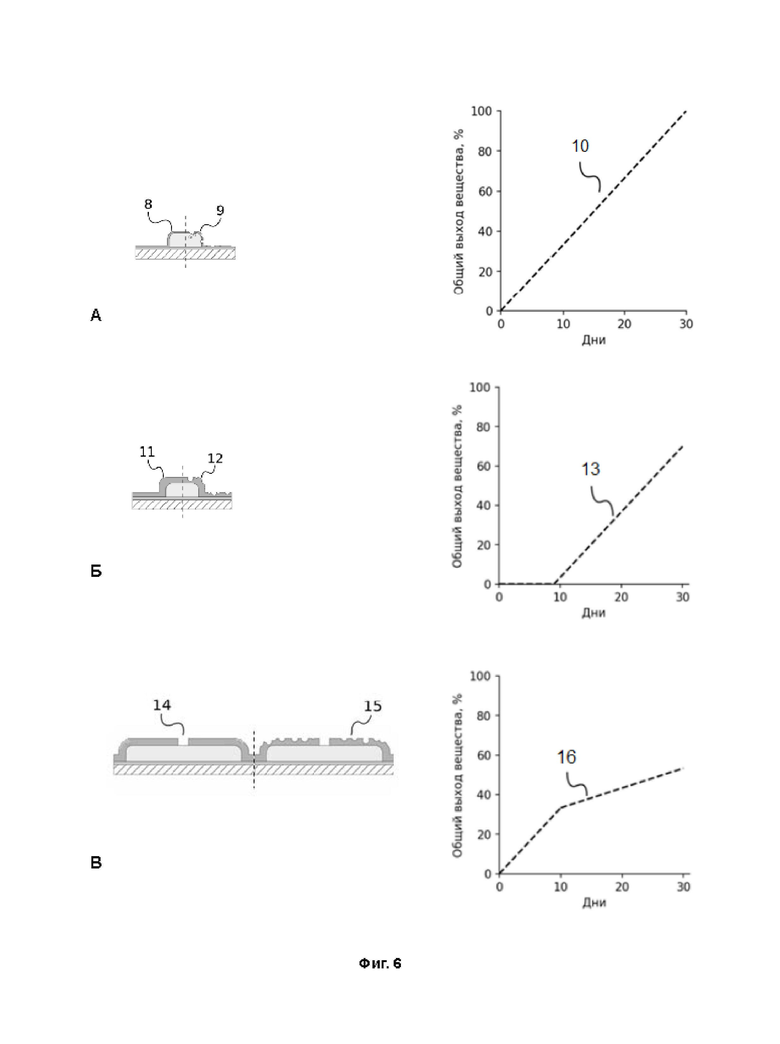
Фиг. 4 - примеры применения многослойных пленок по изобретению: А - отдельно стоящие патчи или накладки для закрытия постоперационных дефектов, ран и т.д, Б - покрытия в виде лоскутов, содержащие адгезивный слой, могут быть использованы для покрытия различных медицинских изделий сложной формы, В - многослойные пленки, содержащие адгезивный слой, могут быть обернуты вокруг циллиндрических изделий
Фиг. 5 - экспериментальные данные выхода модельного вещества метиленовый синий.
Фиг. 6 - зависимость временнóй кинетики высвобождения БАВ из лекарственного слоя от параметров защитного слоя:
А: тонкий защитный слой, (8) - интактный защитный слой, (9) - деградация тонкого защитного слоя, (10) - характерная зависимость общего выхода вещества от времени для тонкого защитного слоя,
Б: утолщенный защитный слой, (11) - интактный защитный слой, (12) - процесс биодеградации утолщенного защитного слоя, (13) - эффект сдвига старта высвобождения лекарственного вещества при наличии утолщенного защитного слоя,
В: утолщенный защитный слой со сквозной лазерной микроперфорацией, (14) - перфорированный интактный защитный слой, (15) - процесс биодеградации утолщенного защитного слоя, (16) - двухступенчатая кинетика высвобождения вещества из пленок с перфорированным защитным слоем. В первые несколько дней выход вещеста идет через микроотверстия, после этого выход вещества замедляется и далее в большей степени обусловлен характерным временем биодеградации защитного слоя.
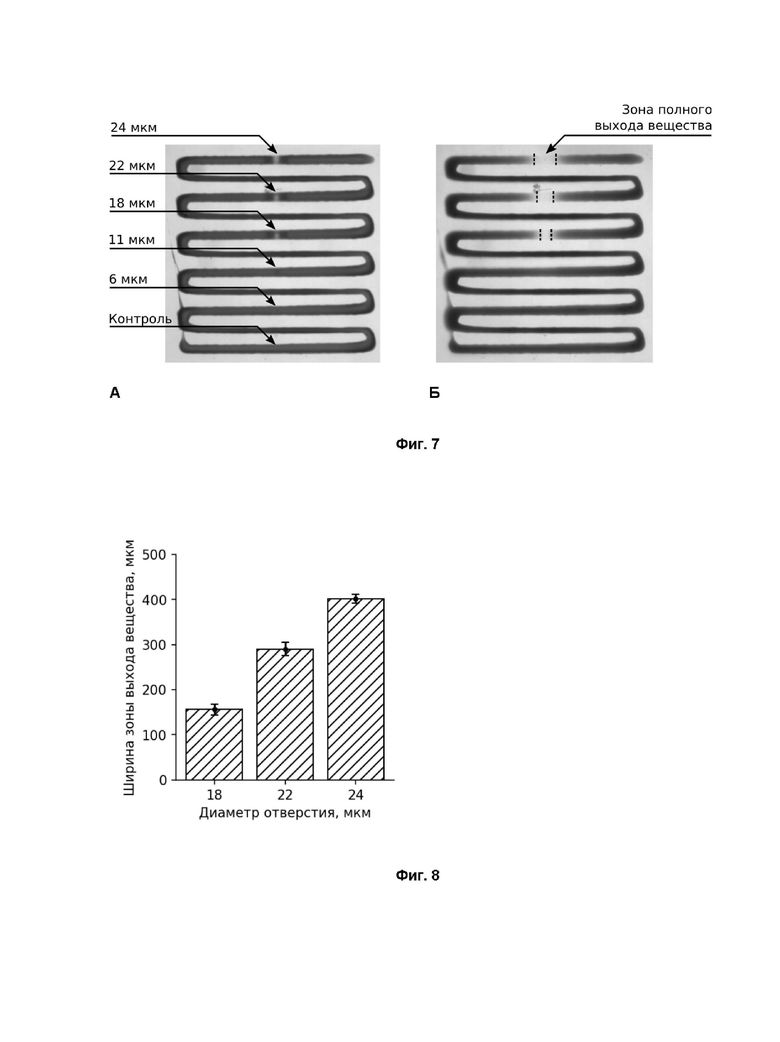
Фиг. 7 - экспериментальные данные, показывающие ширину зоны полного выхода модельного вещества при различных значениях диаметра перфорированного отверстия. Эксперимент проводился в условиях постоянного потока жидкости 1 мл/мин: А - изначальное состояние, Б - спустя 3 часа нахождения в условиях потока жидкости.
Фиг. 8 - количественные значения, отражающие величину зоны полного выхода лекарственного вещества, в зависимости от диаметра перфорированного отверстия. Наблюдается практически линейная зависимость между шириной зоны полного выхода вещества и диаметром отверстия
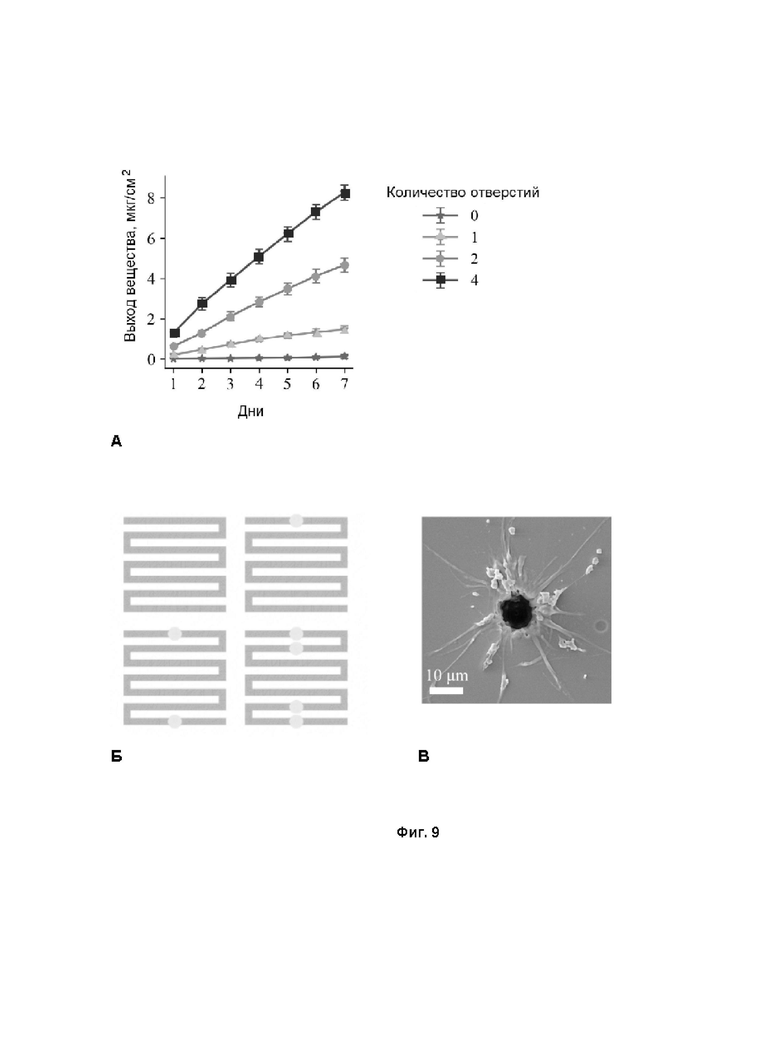
Фиг. 9 - экспериментальные данные, демонстрирующие выход модельного вещества в зависимости от количества отверстий: А - данные выхода модельного вещества за одну неделю в зависимости от количества отверстий, сделанных лазером; Б - локализация отверстий для разных групп образцов - 0, 1, 2, 4 отверстия соответственно; В - СЭМ-изображение перфорированного лазером отверстия. Средний диаметр отверстий составляет 10 мкм.
Подробное описание изобретения
Предлагаемые многослойные пленки, способные элюировать биологически активные вещества, представляют собой многослойную систему, состоящую из по меньшей мере трех слоев (оснóвный, лекарственный, защитный). При необходимости, система может быть дополнена адгезивным слоем - для фиксации пленки на поверхности какого-либо изделия, или армирующим слоем - для обеспечения механической жесткости многослойной пленки. В защитном слое может быть выполнена микроперфорация (например, путем лазерной абляции). Изменяя диаметр перфораций и их плотность на единицу площади пленки, возможно достижение желаемой временнóй кинетики высвобождения лекарственного вещества. Пленки могут выполнены любой необходимой площади. Благодаря тому, что получаемые пленки - очень тонкие и гибкие, они могут быть использованы для формирования покрытий на поверхностях любой сложности.
Многослойные пленки изготовлены на основе биосовместимых биоразлагаемых полимеров и могут содержать в себе как очень небольшое (например, 1-10 мкг/см2), так и сравнительно большое количество лекарственных и иных (вспомогательных) веществ (от более 400 и вплоть до 1000 мкг/см2 в одном лекарственном слое) и способны к их контролируемому и пролонгированному высвобождению. На Фиг. 1 А и Б изображен общий вид примеров многослойных пленок по изобретению (в разрезе). Многослойная пленка состоит из следующих основных слоев:
Оснóвный слой (Фиг. 1 (1)), состоящий из биосовместимого биоразлагаемого полимера, отличного от поливинилового спирта, и имеющий непрерывную поверхность одинаковой толщины по всей площади. Основный слой обеспечивает механическую стабильность и удобство манипуляций с готовой пленкой, а также, в комплексе с защитным слоем, обеспечивает инкапсуляцию лекарственного слоя.
Основный слой может быть получен путем его формирования на подложке методами ракельного нанесения раствора полимера в органическом растворителе или нанесения с использованием щелевой головки (slot-die-coating), который подходит для масштабного рулонного производства пленок. После нанесения, органический растворитель удаляют высушиванием, например, путем помещения подложки с нанесенным растворенным полимером в сухожаровой шкаф. Изготовление основного слоя возможно, но не ограничено, следующими парами полимер-органический растворитель в заданной концентрации: ПМК-Хлороформ (3.5%), ПМК-дихлорметан (4.5%), ПГК-хлороформ (5%), ПК-хлороформ (6.5%).
В качестве подложки может быть использован любой материал, инертный к органическому растворителю и не имеющий адгезивных свойств к биополимеру, чтобы после высушивания готовую пленку можно было снять с подложки. Могут быть использованы как гибкий (например, полипропилен), так и жесткий (например, стекло) материал. При этом использование подложки из гибкого материала позволяет использовать рулонные технологии при производстве многослойных пленок по изобретению, что, в свою очередь, позволяет легко масштабировать производство. Толщина слоя раствора, наносимого на подложку, может варьироваться в зависимости от конечной требуемой толщины основного слоя в многослойной пленке.
Лекарственный слой (Фиг.1 А (2) и (2’)) состоит из поливинилового спирта (ПВС), в который включено по меньшей мере одно БАВ, и расположен между основным и защитным слоями. Причем лекарственный слой может быть нанесен на поверхность оснóвного слоя как в виде монослоя, равномерно покрывающего весь основный слой, так и в виде различных упорядоченных структур. Например, упорядоченные структуры могут представлять собой сетку, змейку, точки, линии и/или плоскую спираль.
Лекарственный слой может быть получен, например, следующим образом. Для приготовления раствора ПВС (например, с концентрацией 12%) его необходимое количество добавляется в воду и при интенсивном перемешивании выдерживается на водяной бане при температуре 90°С до полного растворения. После этого раствор извлекается из водяной бани и остужается до комнатной температуры. Порошок БАВ измельчается до достижения фракции <50 мкм, что обеспечивает его быстрое растворение и/или легкое суспендирование в вязком растворе ПВС. Необходимое количество измельченного порошка БАВ постепенно добавляется к раствору ПВС комнатной температуры при интенсивном механическом перемешивании на протяжении 15 минут. Лекарства также могут добавляться к ПВС в виде водных растворов или суспензий. После перемешивания, из раствора ПВС с лекарством необходимо убрать пузырьки воздуха, путем выдержки его в вакуумной камере на протяжении 15 минут.
Лекарственный слой может быть один (Фиг. 1 А (2) и (2’)) или, с целью увеличения общей полезной нагрузки многослойной пленки, лекарственных слоев может быть несколько (Фиг. 1 Б (2а) и (2б)). При этом, в случае если лекарственных слоев несколько, они расположены друг над другом (так, что «рисунок» структуры каждого слоя одинаковый) и отделены друг от друга слоем биосовместимого, биозралагаемого полимера, отличного от поливинилового спирта (Фиг. 1 (4)), для создания ступенчатого профиля высвобождения.
Защитный слой (Фиг.1 (3)) представляет собой тонкую пленку, состоящую из биосовместимого биоразлагаемого полимера, отличного от поливинилового спирта, и имеющую непрерывную поверхность одинаковой толщины по всей площади, выполненную так, что лекарственный слой или совокупность всех лекарственных слоев, если их несколько, получается запаянным(-и) между основным и защитным слоями. В частных неограничивающих вариантах воплощения изобретения, защитный слой может быть изготовлен из тех же пар полимер-органический растворитель, что и основный слой.
Толщина защитного слоя может варьироваться в широких пределах - от долей микрона до нескольких микрон - для достижения желаемого профиля высвобождения лекарственного вещества и протекции лекарственного слоя в процессе трансдермальной доставки или эксплуатации медицинского изделия или устройства, на которое нанесена многослойная пленка. В то же время, защитный слой должен быть механически устойчивым к формированию микроповреждений, которые могут образоваться в результате процедуры нанесения покрытия и существенно изменить профиль высвобождения активного вещества.
На Фиг. 3 приведено изображение полученного методами сканирующей электронной микроскопии криосреза многослойной пленки по изобретению, основный и защитный слои которой выполнены из сополимера полимолочной и полигликоливый кислоты в соотношении 50/50, а лекарственный слой в качестве БАВ содержит цефозолин в концентрации 400 мг/мл. Фиг. 3 А, Б и В демонстрируют, соответственно, толщину лекарственного, защитного и основного слоев.
В общем случае способ получения многослойных пленок по изобретению может быть охарактеризован следующим образом.
Способ получения многослойной пленки, включающий следующие этапы:
(i) биосовместимый биоразлагаемый полимер (отличающийся от поливинилового спирта) растворяют в органическом растворителе, с получением раствора для формирования основного слоя;
(ii) основный слой формируют путем нанесения раствора полимера, полученного на этапе (i), на подложку, после чего проводят высушивание до удаления органического растворителя;
(iii) в водный раствор поливинилового спирта, при интенсивном перемешивании, добавляют по меньшей мере одно биологически активное вещество, с получением смеси для формирования лекарственного слоя;
(iv) для получения многослойной пленки, имеющей два и более лекарственных слоев, включающих разные биологически активные вещества, операцию, проведенную на этапе (iii), повторяют с другим(-и) выбранным(-и) биологически активным(-и) веществом(-ми), с получением смеси(-ей) для формирования второго (и следующих) лекарственных слоев;
(v) смесь, полученную на этапе (iii), наносят на основный слой в виде монослоя, равномерно покрывающего весь основный слой, или в виде упорядоченных структур, после чего производят высушивание полученной конструкции до удаления максимального количества воды и получения сформированного лекарственного слоя;
(vi) для получения многослойной пленки, имеющей более одного лекарственного слоя, на полученную конструкцию наносят раствор биосовместимого биоразлагаемого полимера (отличающегося от поливинилового спирта) в органическом растворителе, после чего проводят высушивание до удаления органического растворителя, с получением разделительного слоя; затем на сформированный разделительный слой наносят смесь, полученную на этапе (iii) или (iv), и производят высушивание полученной конструкции до удаления максимального количества воды, с получением следующего лекарственного слоя, форма (т.е. «рисунок» структуры) нанесения которого повторяет форму («рисунок») предыдущего лекарственного слоя;
(vii) операции этапа (vi) повторяют необходимое количество раз, до формирования необходимого количества лекарственных слоев;
(viii) для получения раствора для формирования защитного слоя, биосовместимый биоразлагаемый полимер, отличный от поливинилового спирта, растворяют в органическом растворителе;
(ix) конструкцию, полученную на этапе (v), или, в случае получения многослойной пленки, имеющей более одного лекарственного слоя, конструкцию, полученную на этапе (vii), покрывают раствором для формирования защитного слоя, полученным на этапе (viii), после чего проводят высушивание до удаления органического растворителя;
(x) полученную конструкцию высушивают для получения готовой многослойной пленки (например, путем ее помещения в вакуумную печь).
Готовую многослойную пленку отделяют от подложки и далее используют в зависимости от целевого назначения (применения).
Согласно изобретению,
- для формирования основного, защитного и разделительного слоев может быть использован любой биосовместимый биоразлагаемый полимер, одобренный для применения в медицине (или ветеринарии, в случае применения для животных), за исключением поливинилового спирта;
- при формировании соответствующего слоя выбранный биосовместимый биоразлагаемый полимер растворяют в органическом растворителе. Для этого может быть использован любой органический растворитель, в котором растворим выбранный полимер. Например, в качестве растворителя может быть использован ацетон, хлороформ, дихлорметан, этилацетат, бутилацетат, тетрагидрофуран (ТГФ), метил-ТГФ, диэтиловый эфир, ДМСО, гексафторизопропанол (HFIP) или их смеси, но не ограничиваясь ими. В процессе формирования соответствующего слоя органический растворитель удаляют путем проведения высушивания (например, путем помещения конструкции в сухожаровой шкаф) так, что готовая пленка, по существу, не содержит растворителей, или их остаточное содержание пренебрежимо мало. При этом важно, чтобы остаточное содержание растворителя в готовой многослойной пленке не превышало нормы, применяемой к конкретному растворителю, для медицинских (или, соответственно, ветеринарных) изделий. Например, как известно, содержание таких условно безопасных растворителей как ацетон, метил-ТГФ или этилацетат, строго не регламентируется (и поэтому они являются более предпочтительными), а, например, остаточное содержание хлороформа и дихлорметана не должно превышать 60 и 400 ppm (частей на миллион), соответственно;
- полимеры (и применяемые при изготовлении слоя органические растворители), применяемые при изготовлении основного, разделительного и защитного слоев, в одной и той же многослойной пленке, могут быть как одинаковые, так и различные, выбранные независимо друг от друга (но при этом выбор растворителя полимера связан с выбором этого полимера). Это возможно благодаря тому, что все слои наносятся в процессе изготовления многослойной пленки последовательно, после высушивания предыдущего слоя;
- толщина наносимого слоя раствора полимера в процессе изготовления многослойной пленки может варьироваться в зависимости от конечной требуемой толщины соответствующего слоя в многослойной пленке. Расчет наносимого слоя раствора полимера может быть произведен на основе требуемой конечной толщины слоя и массового содержания (концентрации) полимера в растворе. В частности, но не ограничиваясь этим, основный слой может быть сформирован путем нанесения на подложку раствора полимера слоем толщиной 100-300 мкм с получением на подложке полимерной пленки заданной толщины в интервале от 1 до 10 мкм; в некоторых предпочтительных вариантах изобретения конечная толщина основного слоя составляет 5 ± 1 мкм. Толщина каждого лекарственного слоя после сушки в некоторых неограничивающих вариантах осуществления изобретения составляет 8-15 мкм, в некоторых частных вариантах - 10 ± 1 мкм. При этом если в одной многослойной пленке присутствует несколько лекарственных слоев, их толщина может быть как одинаковой, так и различной. Толщина каждого из разделительных слоев также может быть одинаковой или разной, в некоторых неограничивающих вариантах изобретения толщина разделительного слоя может составлять 2-10 мкм. Толщина защитного слоя может варьироваться в широких пределах от долей микрона до нескольких микрон для достижения желаемого профиля высвобождения лекарственного вещества, например, от 0,1 до 10 мкм, в частности, от 0,1 до 1 мкм - для формирования ультратонкого защитного слоя; или более 1 мкм, в некоторых частных вариантах - 1-5 мкм, для формирования утолщенного слоя, а также для формирования утолщенного слоя с микроперфорациями. Толщина каждого из слоев выбирается независимо. При этом толщина каждого из слоев - основного, защитного и разделительных - на всем протяжении пленки является одинаковой (в пределах допустимой погрешности метода).
- количество биологически активного вещества, добавляемого в водный раствор поливинилового спирта на этапе (iii) и (iv), зависит от требуемой конечной концентрации БАВ в соответствующем лекарственном слое, которую выбирают так, чтобы результирующее количество БАВ было терапевтически эффективным, с учетом скорости и длительности его введения, площади сформированного покрытия и т.п. Благодаря многослойной конструкции, в которой лекарственный(-е) слой(-и), (где БАВ удерживается с помощью поливинилового спирта), расположен(-ы) между основным и защитным слоями полимеров, предлагаемые многослойные пленки по изобретению способны удерживать сравнительно большие дозы БАВ, обеспечивая их контролируемое и пролонгированное высвобождение. В зависимости от конечной цели, при изготовлении лекарственного слоя БАВ может добавляться как в очень небольшом количестве, так и в больших количествах. Так, например, для достижения больших количественных значений активного вещества на единицу площади пленки массовое соотношение ПВС : БАВ в растворе может быть от 1:2 до 1:5 и выше. Соответственно, если высокая концентрация БАВ не требуется, соотношение ПВС : БАВ в растворе может быть от 1:1 и ниже. Чем выше относительное содержание ПВС в лекарственном слое, тем более аморфной обычно является его структура. Хорошо растворимые в воде БАВ могут быть добавлены к водному раствору ПВС в виде водного раствора или в сухом виде, для лучшей растворимости БАВ может быть измельчено до достижения фракции <50 мкм, что обеспечивает его быстрое растворение и/или легкое суспендирование в вязком растворе ПВС. Плохорастворимые и нерастворимые в воде БАВ могут быть измельчены до микроразмерных частиц и предварительно диспергированы в гелеобразную суспензию ПВС с помощью коммерческих гомогенизаторов. Таким образом, БАВ могут добавляться к ПВС в сухом виде, в виде водных растворов или суспензий. В результате получают лекарственный слой в виде гелеобразной субстанции, содержащей водорастворимый БАВ, равномерно распределенный в лекарственном слое (Фиг.1 (2)) или содержащий слабо- или водонерастворимые формы БАВ в виде равномерно распределённых в лекарственном слое микрокристаллов (Фиг.1 (2’));
- в некоторых предпочтительных вариантах изобретения добавление БАВ к водному раствору ПВС производят при интенсивном перемешивании. В некоторых других предпочтительных вариантах полученную смесь выдерживают в вакуумной камере, для удаления пузырьков воздуха из раствора;
- лекарственный слой может быть нанесен на поверхность оснóвного слоя как в виде монослоя, равномерно покрывающего весь основный слой, так и в виде различных упорядоченных структур. Например, упорядоченные структуры могут быть представлены в виде связанных между собой линий, таких как сетка (например, в виде прямоугольной решётки, треугольной решётки, сотов и т.д.), змейка и/или плоская спираль (например, вариации архимедовой спирали, спираль Гильберта и др.), но не ограничиваясь ими. Кроме того, упорядоченные структуры также могут быть представлены в виде несвязанных между собой «контейнеров» в виде точек, линий различной длины, набора концентрических окружностей и многоугольников и др. При этом все эти «контейнеры» могут быть как одинакового размера, так и по меньшей мере двух различающихся размеров. Например, линии могут быть выполнены одинаковой длины и/или толщины или по меньшей мере двух различающихся размеров длины и/или толщины.
Фиг. 2 отражает различные варианты, но не ограничена ими, формирования лекарственного слоя на поверхности основного слоя. Фиг. 2 (5) относится к нанесению сплошного лекарственного слоя заданной толщины ракельным методом. Данный метод прост и быстр в реализации, однако существующие ограничения ракельного метода не позволяют точно дозировать БАВ, что приводит к необходимости контроля общего содержания биологически активных веществ различными методиками, например, фотометрическими.
Благодаря вязкости раствора ПВС, используемого для формирования лекарственного слоя, возможно его экструдирование на поверхность основного слоя с использованием системы автоматической дозировки пастообразных соединений, как это показано Фиг. 2 (6) и (7). В этом случае возможно точное дозирование лекарственного соединения и формирование необходимых паттернов, придающих необходимую жесткость итоговому покрытию в определённых направления сгиба, скручивания и т.д. Кроме того, при экструзионном нанесении раствора в виде несвязанных между собой «контейнеров» в дальнейшем возможно «выкраивание» фрагментов нужной формы из готовой пленки, без повреждения «контейнеров» с лекарственным слоем. Далее приведены основные (но не ограничивающие) технические параметры систем дозирования, которые могут быть использованы для экструдирования лекарственного слоя:
Объемный расход раствора для формирования лекарственного слоя - 0.1-0.3 мл/ч,
Скорость перемещения иглы дозатора относительно поверхности основного слоя - 300-600 мм/мин,
Расстояние от торца иглы до поверхности основного слоя - 150 мкм,
Количество лекарственных слоев ≥ 1,
Иглы - G28-G30.
- в различных вариантах реализации изобретения многослойная пленка может иметь один или более лекарственных слоев. Максимальное количество слоев выбирается исходя из целевого применения и может содержать до 5-10 слоев, если это целесообразно. В некоторых вариантах воплощения изобретения многослойная пленка имеет 2-3 лекарственных слоя. При этом, в различных вариантах воплощения изобретения, БАВ в каждом лекарственном слое могут быть одинаковыми, или БАВ по меньшей мере в одном слое отличается, или БАВ во всех слоях различаются. В некоторых других вариантах воплощения изобретения БАВ в каждом лекарственном слое одинаковы, но при этом количество БАВ по меньшей мере в одном слое отличается от других, или количество БАВ во всех слоях различается. В некоторых вариантах воплощения изобретения один лекарственный слой содержит один БАВ, в некоторых других вариантах один лекарственный слой содержит по меньшей мере два различающихся БАВ. При этом согласно изобретению возможны различные неограничивающие комбинации качественного и количественного содержания БАВ как в одном лекарственном слое, так и в различных лекарственных слоях.
- растворы и смеси для формирования соответствующих слоев многослойной пленки могут быть нанесены любыми подходящими методами. Так, например,
- раствор для формирования основного слоя может быть нанесен на подложку ракельным методом, методом экструзии (в том числе, например, методом экструзии с раздувом, плоскощелевой экструзией), но не ограничиваясь ими,
- смесь для формирования лекарственного слоя наносят на сформированный основный слой, например, путем экструзии и др.,
- при формировании разделительного слоя, отделяющего лекарственные слои друг от друга, раствор для его формирования может быть нанесен, например, путем ракельного нанесения, погружным методом, напылением раствора биополимера в органическом растворителе и др.,
- раствор для формирования защитного слоя может быть нанесен путем ракельного нанесения, погружным методом, методом электроформирования, путем напыления тонких пленок, но не ограничиваясь ими.
Согласно изобретению, в некоторых вариантах его осуществления возможны следующие неограничивающие модификации многослойных пленок по изобретению.
Несмотря на то, что существенным механизмом элюирования БАВ из многослойных пленок по изобретению является биодеградация полимерной матрицы, этот процесс очень зависит от окружающей среды, и может приводить к нелинейной кинетике высвобождения БАВ. В качестве инструмента для достижения линейной кинетики высвобождения БАВ (нулевого порядка) в некоторых вариантах воплощения изобретения в защитном слое многослойной пленки содержатся микро- и/или наноразмерные отверстия (микроперфорации), через которые возможен выход БАВ из лекарственного(-ых) слоя(-ев). Диаметр (размер) и количество отверстий выбирают в зависимости от требуемой скорости высвобождения БАВ. В некоторых частных вариантах воплощения изобретения отверстия имеют одинаковый размер. В некоторых других частных вариантах воплощения по меньшей мере два отверстия имеют разный размер, или по меньшей мере 20-50% отверстий имеют разный размер. В некоторых вариантах воплощения изобретения диаметр отверстий составляет 5-20 мкм, в некоторых частных вариантах - 10 мкм, а их плотность - 1-8 отверстий на квадратный сантиметр пленки. Регулируя диаметр отверстий и их плотность в различных вариантах воплощения изобретения, можно добиться широкого диапазона кинетики элюирования независимо от биодеградации полимера защитного слоя. Отверстия могут быть получены любыми доступными методами, например, с использованием порогенов, в более предпочтительных вариантах отверстия наносят («пробивают») в защитном слое путем лазерной микроперфорации. Такая микроперфорация многослойных пленок по изобретению может быть использована в качестве инструмента для достижения нулевого порядка кинетики высвобождения БАВ с различной скоростью элюирования.
Для фиксации готовой многослойной пленки, содержащей БАВ, на поверхность различных медицинских изделий или устройств могут быть применены различные адгезивы, подходящие и одобренные для применения в клинической практике. Для формирования адгезивного слоя могут быть использованы клеевые композиции, одобренные для наружного применения и/или применения внутри живого организма, не нарушающие целостность многослойной пленки, такие как фибриновые клеи, полиэлектролитные комплексы, полисахаридные и белковые комплексы, цианакрилатные композиции, акриловые и силиконовые адгезивы (например, цианоакрилаты, альбумин и глутаровый альдегид, полиэтиленгликоль (ПЭГ), полиуретан, фибрин, различные термопластичные адгезивы на основе легкоплавких биосовместимых полимеров (например, поликапролактона) и др.). Материал адгезивного слоя выбирают так, чтобы обеспечить необходимую фиксацию многослойной пленки на поверхности конкретного медицинского изделия или устройства. На выбор материала адгезивного слоя также влияют тип поверхности изделия/ устройства, условия и срок эксплуатации изделия/ устройства, срок биоразложения адгезива и др.
Адгезивное покрытие может быть зафиксировано на поверхности медицинского изделия/ устройства следующими способами:
1. Многослойная полимерная пленка отделяется от подложки, на которой она было изготовлена, и на основный слой пленки наносится адгезив, затем происходит фиксация полимерной пленки на поверхности медицинского изделия/ устройства. Данный способ подходит для адгезивов, не вступающих в химическую реакцию с полимерами, на основе которых изготовлена многослойная пленка (альбумин и глутаровый альдегид, полиэтиленгликоль (ПЭГ), полиуретан, фибрин, различные термопластичные адгезивы на основе поликапролактона и др.).
2. На поверхность медицинского изделия наносится тонкий слой адгезива, затем многослойная полимерная пленка отделяется от подложки, на которой она была изготовлена, и переносится на медицинское изделие/ устройство с преднанесенным адгезивным слоем. Такой метод подходит для адгезивов, способных к вступлению в химическую реакцию с биополимерами, из которых изготовлен многослойная пленка, например, адзегивы на основе производных цианоакрилата.
Для обеспечения механической жесткости многослойной пленки в виде самостоятельных устройств (накладок, патчей и т.п.), размещаемых на коже и слизистых, с целью трансдермальной и эндоскопической доставки БАВ, может быть использован дополнительный армирующий слой, выполненный из высококристалличного поликапролактона, толщина которого может варьировать в широких пределах и выбирается так, чтобы обеспечить требуемую жесткость. Армирующий слой, при необходимости, на «горячую» вклеивается в основный слой после его снятия с подложки. По сути, под воздействием температуры основный и армирующий слои подплавляются, спаиваясь между собой и образуя единый слой.
Согласно изобретению, в частных вариантах его выполнения, многослойная пленка может включать как одну, так и более одной из перечисленных выше модификаций, в любом их сочетании.
Как уже указывалось выше, многослойные пленки по изобретению могут быть использованы как в качестве отдельностоящих устройств (пленок) для введения лекарств (которые можно отнести к классу многослойных биоразлагаемых устройств с регулируемым профилем высвобождения БАВ), так и могут быть закреплены на медицинских устройствах для адресной доставки лекарств. Фиг. 4 отражает возможные (но не ограничивающие) сценарии их использования:
- как отдельно стоящие патчи (Фиг. 4 А) или накладки для закрытия постоперационных дефектов, ран и т.д.,
- в качестве покрытий различных медицинских изделий - протезов, пластин, катетеров и т.д., изготовленных из металлов и/или полимеров (Фиг. 4 Б и В). Поскольку многослойная пленка формируется на плоскости, для нанесения покрытий на изделия сложной 3Д формы многослойные пленки могут быть изготовлены в виде небольших фрагментов необходимой формы, либо возможно «выкраивание» фрагментов нужной формы из готовой пленки большого размера, как это указано выше. Далее фрагменты наносят на медицинское изделие в необходимом порядке (см. Фиг. 4 Б).
В современной высокотехнологичной медицине полимерные покрытия, содержащие лекарства, активно используются для решения широкого круга задач, в том числе для профилактики послеоперационных инфекционных, воспалительных, рестенозных, тромбозных и многих других имплант-ассоциированных осложнений. Использование антимикробных пленок, высвобождающих антибиотики, значительно снижает риск бактериального заражения стоматологических устройств и ортопедических имплантатов. Большинство современных антибиотиков предполагают продолжительность лечения в течение недели, в тяжелых случаях лечение может быть продлено до двух недель. Этот факт позволяет рассматривать предлагаемые многослойные пленки как перспективное средство для местного антибактериального лечения с контролируемой постоянной дозировкой. Применение комбинации лекарственных средств и коронарных стентов в виде стентов с лекарственным покрытием зарекомендовало себя как наиболее популярный вариант лечения восстановления кровоток в закупоренных сосудах. Предлагаемые пленки являются перспективными покрытиями для коронарных стентов.
Различные внешние стимулы, такие как терапевтический ультразвук или внешнее электрическое поле, могут быть использованы для увеличения по требованию количества лекарственного вещества, высвобождаемого из описанных многослойных пленок, для потенциального облегчения кризисных состояний.
Нижеследующие примеры приведены в целях раскрытия характеристик настоящего изобретения, и их не следует рассматривать как каким-либо образом ограничивающие объем изобретения.
Пример 1. Многослойная элюирующая пленка на основе полимолочной кислоты
С целью анализа времени высвобождения БАВ из многослойных пленок, по методике, описанной выше, была получена многослойная пленка на основе полимолочной кислоты (ПМК), в которой основный и защитный слои были изготовлены из ПМК (при их получении был использован 3,5% раствор ПМК в хлороформе), а лекарственный слой - на основе поливинилового спирта. В качестве модельного БАВ был использован краситель метиленовый синий (Sigma-Aldrich) (молярная масса ~320 г/моль) в концентрации 20 мг/мл. Метиленовый синий имеет умеренную растворимость в воде (43,6 г/л), сравнимую с растворимостью многих биологически активных молекул (например, антибиотиков), и его содержание в растворе можно количественно определить с помощью спектроскопического анализа.
Для изготовления лекарственного слоя 20 мг метиленового синего добавляли в 1 мл 9 мас.% раствора поливинилового спирта (ПВС) (Sigma Aldrich) и тщательно перемешивали. Пузырьки воздуха откачивали с помощью вакуумного насоса. Лекарственный слой наносили в виде «змейки».
Согласно анализу криосрезов пленки, проведенному с помощью сканирующей электронной микроскопии (СЭМ), толщина основного слоя полученной многослойной пленки составила 5±1 мкм, толщина лекарственного слоя - 10±1 мкм, толщина защитного слоя - 5±1 мкм. Изготовленную пленку на подложке помещали в физраствор. Для анализа выхода модельного вещества ежедневно отбиралась проба физраствора для контроля количественного содержания метиленового синего. Проведенные исследования показали, что скорость высвобождения метиленового синего из полученной пленки ~0.07 мкг/сутки (см. Фиг. 5), что, учитывая общую загрузку модельного вещества (25 мкг/см2), позволяет говорить о существенном времени удержания загрузки в многослойной пленке по изобретению - порядка 360 дней, не учитывая процессы биодеградации полимера. Большое количество различных лекарственных препаратов обладают схожей молярной массой (сотни-тысячи г/моль), что подтверждает способность покрытий на основе многослойной пленки по изобретению долговременно удерживать низкомолекулярные вещества для пролонгированного высвобождения.
Известно, что биосовместимые биоразлагаемые полимеры, используемые для производства многослойных пленок по изобретению, проницаемы для паров воды. Вследствие этого, загруженное в пленку водорастворимое биологически активное вещество будет находится внутри такой пленки в состоянии насыщенного раствора с неким количеством нерастворенных кристаллов. Сложные молекулы, такие как современные антибиотики, во многом нестабильны в высококонцентрированных растворах и со временем распадаются, существенно снижая свою антибактериальную активность, что может привести к их преждевременной деградации еще до высвобождения из пленки. Для каждого вещества его характерное время стабильности в растворе известно и обычно указывается в инструкции. В зависимости от конкретной терапии, требования к длительности и скорости введения лекарственных веществ, их профилю высвобождения также могут существенно различаться.
Особенностью предлагаемых многослойных пленок является наличие нескольких путей настройки и контролирования характерных времен и скоростей высвобождения биологически активных соединений. Во-первых, это изменение толщины защитного слоя и, во-вторых, это микроперфорация защитного слоя отверстиями заданного диаметра и плотности. Комбинирование данных методов настройки позволяет создавать многослойные пленки по изобретению с любыми заданными параметрами контролированного высвобождения БАВ.
Как уже указывалось выше, толщина защитного слоя многослойной пленки по изобретению может варьироваться в широких пределах от долей микрона до нескольких микрон для достижения желаемого профиля высвобождения лекарственного вещества: например, от 0,1 до 10 мкм, в частности, от 0,3 до 6 мкм.
Фиг. 6 отражает типичные профили высвобождения лекарственных веществ в зависимости от типа и толщины защитного слоя.
Ультратонкий (≤1 мкм) защитный слой, выполненный из биоразлагаемого полимера (Фиг. 6 А (8)), сравнительно быстро биорезорбируется, обеспечивая начало высвобождения лекарственного вещества в короткие сроки. В процессе постепенной деградации (9) ультратонкого защитного слоя будет обеспечиваться элюирование лекарственного вещества с неким профилем (10), зависящим как от типа вещества, так и от условий эксплуатации. Наряду с этим, ультратонкие защитные слои слабоустойчивы к различным механическим воздействиям и могут получить большое число микродефектов как в процессе нанесения, так и в процессе эксплуатации покрытия, сформированного из такой пленки, что может внести неконтролируемый вклад в изменение временнóй кинетики высвобождения лекарственного соединения.
Утолщенные защитные слои (Фиг. 6 Б (11)), толщиной более 1 мкм, играют роль барьера и «сдвигают» начало высвобождения лекарственного соединения во времени (13). Величина сдвига зависит от толщины слоя, типа полимера, а также условий эксплуатации покрытия. Известно, что, например, для полимолочной кислоты скорость деградации существенно зависит от pH среды. При нормальных значениях pH=7 полимолочная кислота деградирует с характерной скоростью ~15 Å/сутки, однако при повышенных значениях pH (≥8), скорость деградации возрастает до ~55 Å/сутки. В кислотных средах полимолочная кислота стабильна и практически не разлагается [Lebo Xu, Kaitlyn E. Crawford, C. Gorman Effects of Temperature and pH on the Degradation of Poly(lactic acid) Brushes // Macromolecules 2011; 44(12): 4777-4782]. Утолщенные защитные слои механически стойки и менее подвержены образованию микродефектов, связанных с процессами нанесения покрытия и его эксплуатации. Утолщенные защитные слои, в целом, обычно предпочтительнее, однако они не влияют на кинетику высвобождения, а лишь сдвигают ее во времени.
Согласно настоящему изобретению, для сочетания механической устойчивости утолщенных защитных слоев с незамедлительным началом высвобождения лекарства, а также контроля над скоростью высвобождения вещества, в некоторых вариантах воплощения изобретения предлагается лазерная микроперфорация утолщенного защитного слоя сквозными отверстиями различного диаметра и плотности покрытия на единицу площади (Фиг. 6 В (14)). Микроперфорация, по сути, является способом внесения контролируемых дефектов в утолщенные защитные слои, что позволяет обеспечить незамедлительное начало высвобождения лекарственного соединения из многослойной полимерной пленки, а также точно настраивать скорость его высвобождения. Для нанесения лазерной микроперфорации может быть использован, например, импульсный источник лазерного излучения с длиной импульса ≤1 нс и длиной волны, находящейся в полосе поглощения биосовместимого полимера, используемого в качестве защитного слоя. Большинство биосовместимых полимеров имеют полосу поглощения в ультрафиолетовой части спектра, однако полимер может быть допирован разрешенными в клинической практике пигментами/красителями (метиленовый синий, бриллиантовый зеленый и т.д.) для сдвига полосы поглощения в видимую и/или инфракрасную область, что существенно упростит процедуру нанесения микроотверстий. Сочетание утолщенного защитного слоя с контролируемо внесенными в его структуру дефектами (14), позволяет достичь желаемый профиль высвобождения (16), изменяя диаметр и плотность отверстий. В первые несколько дней выход вещества происходит через микроотверстия в защитном слое, после этого выход вещества замедлялется и далее в большей степени обуславлен характерным временем биодеградации защитного слоя.
Пример 2. Многослойные элюирующие пленки на основе поли-D,L-лактид-ко-гликолида с микроперфорациями разных размеров
В качестве полимера для формирования основного и защитного слоев был использован сополимер полимолочной (ПМК) и полигликолевой (ПГК) кислот (поли-D,L-лактид-ко-гликолид, PLGA) с соотношением молочной и гликолевой кислот 50:50 (PURASORB®PDLG 5010). PLGA растворяли в смеси 80:20 этилацетата (Acros Organics) и ацетона (Acros Organics) с образованием 10 мас.% раствора полимера. Процесс растворения проводили на нагретой водяной бане (40°С) при умеренном перемешивании в течение 2-х ч. После этого раствор охлаждали до комнатной температуры. Основный слой получали нанесением раствора полимера на полипропиленовую подложку с помощью пленочного аппликатора Baker (зазор между лезвиями 100 мкм, скорость нанесения 20 мм/с). Сушку основного слоя осуществляли в течение 15 минут при 50°С.
В качестве модельного БАВ использовался метиленовый синий (Sigma-Aldrich). Для получения лекарственного слоя 20 мг метиленового синего добавляли в 1 мл 9 мас.% раствора поливинилового спирта (Sigma Aldrich) и тщательно перемешивали. Пузырьки воздуха откачивали с помощью вакуумного насоса. Полученную основу для формирования лекарственного слоя загружали в шприц объемом 1 мл и вставляли в автоматический дозатор. Гель наносили на пленку-основу в виде квадратов 1×1 см, заполненных змеевидным узором, с помощью иглы G23 с объемной скоростью потока 0,85 мл/ч и оставляли для сушки (30 мин при 50°С).
Для герметизации сухого геля лекарственного слоя был сформирован защитный слой, для получения которого на конструкцию, полученную на предыдущем этапе, нанесли раствор PLGA с помощью пленочного аппликатора Baker (зазор между лезвиями 400 мкм, скорость нанесения 20 мм/с) и оставили его для высыхания на 15 минут при комнатной температуре. Готовую многослойную пленку на полипропиленовой подложке поместили в вакуумную печь (100 мбар, 40°С) на 2 часа для завершения процесса сушки.
Согласно СЭМ-анализу криосрезов пленки, средняя толщина основного слоя составляет 3±1 мкм, лекарственного слоя - 5±1 мкм, защитного слоя - 14±1 мкм. Общая загрузка модельного вещества составила 35±9 мкг/см2.
Для нанесения перфораций использовали импульсный лазер Cobolt Tor™ XS с длиной волны 532 нм (50 мкДж; 1,9 нс). Лазерное излучение фокусировалось на поверхность пленки объективом (8×0,2). Для выполнения одной микроперфорации использовали три последовательных лазерных импульса с частотой следования 1 кГц.
Чтобы оценить влияние диаметра отверстия на кинетику элюирования, на разных участках загруженной метиленовым синим полимерной пленки с помощью лазерной абляции были созданы наборы отверстий известного диаметра (24, 22 и 18 мкм).
Для количественной оценки выделения модельного вещества через микроперфорации образец помещали в проточную кювету. С помощью перистальтического насоса физраствор (0,9% NaCl в H2O, 37°С) прокачивали через образец в течение 24 ч со скоростью 10 мл/мин, чтобы имитировать динамику жидкости организма. Покадровую съемку элюирования модельного вещества регистрировали с помощью камеры DCC1545M CMOS (THORLABS, Inc.: Newton, NJ, USA) и объектива M112FM25 (TAMRON). Один кадр выборки снимался каждые 10 с.
На Фиг. 7 приведены результаты, полученные путем анализа последовательности изображений, полученных в эксперименте с проточной кюветой. Как видно из рисунка, существует четкая зависимость между шириной зон элюирования для отверстий разного диаметра, как показано на Фиг. 7 Б). В результате эксперимента были получены следующие результаты: для диаметра отверстия ~24 мкм характерная ширина зоны полного выхода вещества после трех часов нахождения в проточной ячейке со средним объемным расходом жидкости 1 мл/мин составляет ~400 мкм; для ~22 мкм ширина данной зоны ~300мкм; для ~18 мкм измеренное значение составило ~150 мкм. На Фиг. 8 приведены количественные значения, отражающие величину зоны полного выхода лекарственного вещества в зависимости от диаметра перфорированного отверстия. Как видно из Фиг. 8, наблюдается практически линейная зависимость между шириной зоны полного выхода вещества и диаметром отверстия.
Таким образом, было установлено, что имеет место практически линейная зависимость между диаметром отверстия и шириной зоны полного выхода вещества, что свидетельствует о возможности использования лазерной микроперфорации для точной настройки временной кинетики высвобождения лекарственного вещества из предлагаемых многослойных пленок.
Пример 3. Многослойные элюирующие пленки на основе поли-D,L-лактид-ко-гликолида с разным количеством микроперфораций
Многослойная пленка была получена так же, как описано в Примере 2. Постановка эксперимента также аналогична описанному в примере 2.
В отличие от примера 2, в защитном слое пленки были сформированы отверстия диаметром 10 мкм, которые хорошо подходят для среднесрочного или долгосрочного высвобождения модельного БАВ. Образцы были разделены на четыре группы:
1. нет отверстий (количество образцов (n) = 6);
2. одно отверстие (n = 6);
3. два отверстия (n = 6);
4. четыре отверстия (n = 6).
Количественные данные элюирования метиленового синего в зависимости от количества отверстий представлены на Фиг. 9 А. Расположение лазерных отверстий для разных групп образцов показано на Фиг. 9 Б. Все группы продемонстрировали линейную кинетику элюирования (кинетику нулевого порядка). Измеренные скорости элюирования составили 0,018±0,01 мкг/сутки, 0,211±0,08 мкг/сутки, 0,681±0,1 мкг/сутки и 1,19±0,12 мкг/сутки для групп с 0, 1, 2, 4 микроперфорациями соответственно.
Основной механизм линейного элюирования можно описать следующим образом: вблизи сформированного отверстия создается небольшой объем, из которого лекарство может диффундировать в окружающую среду. С другой стороны, в этот объем происходит постоянная подача вещества из остальной части лекарственного слоя. Такая подача возможна за счет набухания геля ПВС лекарственного слоя молекулами воды, проникающими через защитную пленку. Эти факторы сбалансированы таким образом, что достигается элюирование нулевого порядка. Наблюдается линейная зависимость между количеством отверстий и скоростью элюирования (см. Фиг. 9 А). Таким образом, учитывая среднюю суммарную загрузку БАВ в лекарственном слое, можно рассчитать теоретическую характеристику времени высвобождения БАВ (от месяцев до лет) в зависимости от количества перфораций.
Таким образом, экспериментальные данные на модельном веществе и фиксированном объемном расходе жидкости подтверждают возможность использования лазерной микроперфорации для точной настройки временнóй кинетики высвобождения лекарственного вещества из многослойных пленок по изобретению, а также позволяют производить оценку необходимого диаметра отверстий и их плотности для достижения желаемой кинетики высвобождения. Например, если отверстия диаметром 20 мкм, расположенные с шагом 300 мкм, обеспечивают полный выход вещества в условиях потока 1 мл/мин в первые 3 часа, то если шаг отверстий увеличить до 600 мкм, время выхода составит порядка 6 часов и т.д. Для достижения малых скоростей высвобождения, которые будут обеспечивать равномерный выход лекарственных веществ на протяжении недели или более, возможно нанесение перфорации малыми отверстиями (<10 мкм) с крупным шагом сетки перфорации >1000 мкм.
Микросистемы доставки лекарств с кинетикой элюирования нулевого порядка очень привлекательны и востребованы в современной фармации [Laracuente, M.L.; Marina, H.Y.; McHugh, K.J. Zero-order drug delivery: State of the art and future prospects. J. Controll. Release 2020, 327, 834-856] из-за их способности поддерживать уровень БАВ между минимально эффективной концентрацией и минимальной токсической концентрацией в течение заданного времени.
Производственный процесс известных в настоящее время систем доставки лекарств, способных обеспечивать элюирование нулевого порядка за счет введения лекарств через отверстие заданной площади, такие как элементарные осмотические насосы [19,20], перфорированные микротрубки [Wu, Z.J.; Luo, Z.; Rastogia, A.; Stavchansky, S.; Bowman, P.D.; Ho, P.S. Micro-fabricated perforated polymer devices for long-term drug delivery. Biomed. Microdevices 2011, 13, 485-491] или микрочипы [Sutradhar, K.B.; Sumi, C.D. Implantable microchip: the futuristic controlled drug delivery system. Drug Deliv. 2016, 23, 1-11; Meng, E. Hoang, T. Micro-and nano-fabricated implantable drug-delivery systems. Therapeutic Deliv. 2012, 3, 1457-1467], - сложный и многоступенчатый. А в случае, например, с элементарными осмотическими насосами, на их характеристики сильно влияют условия окружающей среды; кроме того, они не могут обеспечить длительное высвобождение нулевого порядка и перестают работать уже через несколько часов (<12 ч) [Tran, P.H.L.; Tran, T.T.D.; Park, J.B.; Lee, B.J. Controlled release systems containing solid dispersions: strategies and mechanisms Pharm. Res. 2011, 28, 2353-2378].
Отличительной чертой предлагаемого подхода является сочетание простой технологической схемы получения и возможности регулирования элюирования в широком диапазоне скоростей. Еще одним из основных преимуществ многослойных пленок по изобретению является возможность высокой загрузки БАВ в лекарственный слой. В частности, зависимости от растворимости БАВ, может быть загружено до 1000 мкг/см2 в один лекарственный слой с незначительным влиянием на кинетику элюирования.
Таким образом, предложены многослойные пленки с лекарственным слоем для контролируемого пролонгированного введения лекарств, способ получения которых является простым, масштабируемым, воспроизводимым и экономически эффективным. Предложенный подход позволяет производить многослойные пленки большой площади с расширенными характеристиками - точной контролируемой загрузкой лекарственного средства, значительной полезной нагрузкой, а также возможностью изготовления многослойных пленок и чередования различных лекарственных веществ и биополимеров внутри слоев, что позволяет получать программируемые многофункциональные покрытия.
Несмотря на то, что изобретение описано со ссылкой на раскрываемые варианты воплощения, для специалистов в данной области должно быть очевидно, что конкретные подробно описанные эксперименты приведены лишь в целях иллюстрирования настоящего изобретения, и их не следует рассматривать как каким-либо образом ограничивающие объем изобретения. Должно быть понятно, что возможно осуществление различных модификаций без отступления от сути настоящего изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| МНОГОСЛОЙНАЯ МЕДИЦИНСКАЯ ПЛЕНКА | 2001 |
|
RU2228768C2 |
| КОМПОЗИЦИОННЫЙ МАТЕРИАЛ ДЛЯ РЕНТГЕНКОНТРАСТНОЙ ВИЗУАЛИЗАЦИИ НЕРЕНТГЕНОКОНТРАСТНЫХ ИМПЛАНТАТОВ | 2015 |
|
RU2599510C1 |
| УСТРОЙСТВО ДЛЯ ДОСТАВКИ ФИЗИЧЕСКИ АКТИВНОГО ИЛИ ЛЕКАРСТВЕННОГО ПРЕПАРАТА НА ОСНОВЕ ЭЛЕКТРОУПРАВЛЯЕМОГО КОМПОЗИЦИОННОГО ПОЛИМЕРНОГО МАТЕРИАЛА | 2017 |
|
RU2670653C9 |
| РАСТВОР ДЛЯ ПОЛУЧЕНИЯ МАТЕРИАЛА НА ОСНОВЕ ХИТОЗАНА, СПОСОБ ПОЛУЧЕНИЯ ГЕМОСТАТИЧЕСКОГО МАТЕРИАЛА ИЗ ЭТОГО РАСТВОРА (ВАРИАНТЫ) И МЕДИЦИНСКОЕ ИЗДЕЛИЕ С ИСПОЛЬЗОВАНИЕМ ВОЛОКОН НА ОСНОВЕ ХИТОЗАНА | 2011 |
|
RU2487701C2 |
| СПОСОБ ПОЛУЧЕНИЯ НАНОКОМПОЗИЦИОННЫХ МАТЕРИАЛОВ ДЛЯ ПРИМЕНЕНИЯ ВО МНОГИХ ОБЛАСТЯХ ТЕХНИКИ | 2006 |
|
RU2412114C2 |
| УСТРОЙСТВА ДЛЯ ВОССТАНОВЛЕНИЯ ТКАНИ С БЫСТРЫМ ВПИТЫВАНИЕМ ТЕРАПЕВТИЧЕСКИХ СРЕДСТВ | 2012 |
|
RU2608461C2 |
| БИОРЕЗОРБИРУЕМАЯ ГИДРОГЕЛЕВАЯ ПОЛИМЕРНАЯ КОМПОЗИЦИЯ С БИОЛОГИЧЕСКИ АКТИВНЫМИ ВЕЩЕСТВАМИ (ВАРИАНТЫ) | 2012 |
|
RU2519103C2 |
| Глазная лекарственная пленка с метилурацилом, обладающая ранозаживляющим эффектом | 2020 |
|
RU2740924C1 |
| ЛЕКАРСТВЕННЫЕ СРЕДСТВА С КОНТРОЛИРУЕМЫМ ВЫСВОБОЖДЕНИЕМ, СОДЕРЖАЩИЕ ПЕПТИДЫ | 2009 |
|
RU2543327C2 |
| Медицинское изделие стент с полимерными покрытиями | 2019 |
|
RU2737505C1 |
Изобретение относится к области фармацевтики и может быть использовано для адресной доставки лекарственных соединений и их контролируемого высвобождения для локальной терапии различных заболеваний. Для этого предложена многослойная пленка для доставки биологически активных веществ в организм пациента, предназначенная для размещения на коже или слизистых или для фиксации на поверхности медицинского изделия или устройства, имплантируемого в организм пациента, элюирующая по меньшей мере одно биологически активное вещество, включающая: основный слой и защитный слои, состоящие из биосовместимого биоразлагаемого нерастворимого в воде синтетического полимера, отличного от поливинилового спирта, и имеющие непрерывную поверхность одинаковой толщины по всей площади; и нанесенный на основный слой по меньшей мере один лекарственный слой, состоящий из поливинилового спирта, в который включено по меньшей мере одно биологически активное вещество. При этом основный слой вместе с нанесенным на него лекарственным слоем сверху покрыт защитным слоем, выполненным так, что лекарственный слой или совокупность всех лекарственных слоев, если их несколько, получается запаянным(-и) между основным и защитным слоями. В случае, если лекарственных слоев несколько, они расположены друг над другом и отделены друг от друга разделительным слоем, выполненным из биосовместимого биоразлагаемого нерастворимого в воде синтетического полимера, отличного от поливинилового спирта. Предложено также применение указанной многослойной пленки для доставки биологически активных веществ в организм пациента. Изобретение позволяет получить пленки, способные содержать в себе увеличенное количество лекарственных соединений и обладающих возможностью настройки времени высвобождения активного вещества в широких пределах. 2 н. и 29 з.п. ф-лы, 9 ил., 3 пр.
1. Многослойная пленка для доставки биологически активных веществ в организм пациента, предназначенная для размещения на коже или слизистых или для фиксации на поверхности медицинского изделия или устройства, имплантируемого в организм пациента, элюирующая по меньшей мере одно биологически активное вещество, включающая:
- основный слой, состоящий из биосовместимого биоразлагаемого нерастворимого в воде синтетического полимера, отличного от поливинилового спирта, и имеющий непрерывную поверхность одинаковой толщины по всей площади;
- на который нанесен по меньшей мере один лекарственный слой, состоящий из поливинилового спирта, в который включено по меньшей мере одно биологически активное вещество, причем в случае, если лекарственных слоев несколько, они расположены друг над другом и отделены друг от друга разделительным слоем, выполненным из биосовместимого биоразлагаемого нерастворимого в воде синтетического полимера, отличного от поливинилового спирта;
- при этом основный слой вместе с нанесенным на него лекарственным слоем сверху покрыт защитным слоем, состоящим из биосовместимого биоразлагаемого нерастворимого в воде синтетического полимера, отличного от поливинилового спирта, и имеющим непрерывную поверхность одинаковой толщины по всей площади, выполненным так, что лекарственный слой или совокупность всех лекарственных слоев, если их несколько, получается запаянным(-и) между основным и защитным слоями.
2. Многослойная пленка по п. 1, в защитном слое которой содержатся микро- и/или наноразмерные отверстия через которые возможен выход биологически активного вещества из лекарственного(-ых) слоя(-ев).
3. Многослойная пленка по п. 2, в которой диаметр отверстий составляет 5-20 мкм.
4. Многослойная пленка по любому из пп. 2-3, в которой все отверстия имеют одинаковый диаметр.
5. Многослойная пленка по любому из пп. 2-3, в которой по меньшей мере два отверстия имеют разный диаметр.
6. Многослойная пленка по любому из пп. 2-5, в которой отверстия получены с использованием порогенов или путем лазерной микроперфорации.
7. Многослойная пленка по любому из пп. 1-6, в которой биосовместимый биоразлагаемый нерастворимый в воде синтетический полимер выбран из группы, состоящей из полимолочной кислоты (ПМК), полигликолевой кислоты (ПГК), сополимеров ПМК и ПГК, поликапролактона (ПК), сополимеров ПК и ПМК, полигидроксибутирата (ПГБ), полилактид-капролактона (ПЛКЛ).
8. Многослойная пленка по любому из пп. 1-6, в которой биологически активное вещество представляет собой низкомолекулярное биологически активное вещество, олиго- или полимерное биологически активное вещество.
9. Многослойная пленка по п. 8, в которой биологически активное вещество выбрано из полисахарида и вещества белковой природы.
10. Многослойная пленка по любому из пп. 1-9, имеющая один лекарственный слой, включающий одно биологически активное вещество.
11. Многослойная пленка по любому из пп. 1-9, имеющая по меньшей мере два лекарственных слоя, при этом все слои включают одно и то же биологически активное вещество.
12. Многослойная пленка по любому из пп. 1-9, имеющая по меньшей мере два лекарственных слоя, при этом биологически активные вещества, включенные в каждый слой, различаются.
13. Многослойная пленка по любому из пп. 1-9, имеющая по меньшей мере два лекарственных слоя, при этом биологически активное вещество по меньшей мере одного лекарственного слоя отличается от других.
14. Многослойная пленка по любому из пп. 1-9, имеющая один лекарственный слой, при этом лекарственный слой включает по меньшей мере два различных биологически активных вещества.
15. Многослойная пленка по любому из пп. 1-9, в которой лекарственный(-е) слой(-и) нанесен(-ы) на поверхность основного слоя в виде монослоя, равномерно покрывающего весь основный слой.
16. Многослойная пленка по п. 15, в которой лекарственный(-е) слой(-и) нанесен(-ы) ракельным методом.
17. Многослойная пленка по п. 1, в которой лекарственный(-е) слой(-и) нанесен(-ы) на поверхность основного слоя в виде упорядоченных структур.
18. Многослойная пленка по п. 17, в которой упорядоченная структура представляет собой сетку, змейку, точки, линии и/или плоскую спираль.
19. Многослойная пленка по любому из пп. 17-18, в которой упорядоченные структуры не связаны между собой.
20. Многослойная пленка по любому из пп. 17-18, в которой упорядоченные структуры связаны между собой.
21. Многослойная пленка по п. 18, в которой все точки выполнены одинакового размера или по меньшей мере двух различающихся размеров.
22. Многослойная пленка по п. 18, в которой все линии выполнены одинаковой длины и/или ширины или по меньшей мере двух различающихся размеров длины и/или ширины.
23. Многослойная пленка по любому из пп. 17-20, в которой лекарственный(-е) слой(-и) нанесен(-ы) методом экструзии.
24. Многослойная пленка по любому из пп. 1-23, включающая дополнительный адгезивный слой, выполненный из клеевой композиции, приемлемой для медицинского применения, на котором расположен основный слой, при этом адгезивный слой позволяет фиксировать многослойную пленку на поверхности медицинского изделия или устройства.
25. Многослойная пленка по п. 24, в которой адгезивный слой выбирают так, чтобы обеспечить необходимую фиксацию на поверхности конкретного медицинского изделия или устройства.
26. Многослойная пленка по любому из пп. 1-25, в которой основный слой закреплен на армирующем слое, выполненным из поликапролактона и обеспечивающим механическую жесткость многослойной пленки.
27. Применение многослойной пленки по любому из пп. 1-26 для доставки биологически активных веществ в организм пациента.
28. Применение по п. 27, в котором многослойную пленку фиксируют на поверхности медицинского изделия или устройства, имплантируемого в организм пациента.
29. Применение по п. 27, в котором многослойную пленку размещают на коже и/или слизистой.
30. Применение по любому из пп. 27-29, в котором пациент представляет собой человека.
31. Применение по любому из пп. 27-29, в котором пациент представляет собой животное.
| Многоступенчатая активно-реактивная турбина | 1924 |
|
SU2013A1 |
| Станок для изготовления деревянных ниточных катушек из цилиндрических, снабженных осевым отверстием, заготовок | 1923 |
|
SU2008A1 |
| US 5914118 A, 22.06.1999. | |||
Авторы
Даты
2023-11-09—Публикация
2022-11-09—Подача