Область техники
Изобретение относится к медицине, а именно к онкологии, и раскрывает новую композицию, которая может быть использована при лечении опухолей различного гистогенеза.
Изобретение создано при финансовой поддержке Министерства Науки и Высшего образования Российской Федерации в рамках Соглашения № 075-15-2019-1661 от 31.10.2019 на базе Центра высокоточного редактирования и генетических технологий для биомедицины (ЦВРГТБ) ИБГ РАН.
Уровень техники
Несмотря на значительные успехи в терапии опухолей, злокачественные новообразования остаются одной из ведущих причин смертности в развитых странах [1,2]. Основной прогресс в терапии в последние годы произошел за счет развития новых химиотерапевтических препаратов. Однако в процессе лечения у почти половины пациентов развивается устойчивость к применяемым препаратам, что приводит к летальным исходам [3]. Резистентность к химиотерапевтическим препаратам особенно часто возникает у онкологических пациентов с солидными (плотными) опухолями, способными метастазировать по всему организму, такими как рак молочной железы (РМЖ), рак легкого, предстательной железы, толстой кишки и другие [4].
Химиотерапевтические препараты могут не уничтожать опухолевые клетки, но индуцировать фенотип терминального клеточного блока (т.н. “клеточное старение”, или «senescence»). В клетках, претерпевших индуцированное химиотерапией клеточное старение, активируется ассоциированный с клеточным старением секреторный фенотип (senescence-associated secretory phenotype (SASP) [5], который с одной стороны рекрутирует клетки иммунной системы организма (Т-лимфоциты, макрофаги и другие) [6], с другой стороны запускает перепрограммирование транскрипции генов, направленное на выживание опухоли - активация транскрипционных факторов эпителиально-мезенхимального переход, генов-маркеров стволовых клеток и др. [7]. В конечном итоге, происходит «выход» некоторых «стареющих» клеток из этой стадии и последующее формирование новых клонов опухоли, потенциально более агрессивных и устойчивых к лечению [8,9].
Большинство агентов конвенциональной химиотерапии направлены на остановку деления пролиферирующих клеток. К таким препаратам относят антимитотические агенты, действие которых приводят к остановке клеточного цикла или блоку процесса митоза. Ингибитор кинезина (моторного белка, критически важного для сборки веретена митотического деления) - SB743921 - показал свою эффективность в доклинических испытаниях на разных типах опухолевых клеток [10-14] и клинических испытаниях при лечении лимфом [15]. Однако, терапевтическое применение ингибитора ограничено возможным развитием устойчивости [16]. Многочисленные исследования направлены на изучение механизма возникновения устойчивости к таким препаратам, как SB743921 и ему подобным [17-19], а также на поиск новых подходов, направленных на повышение эффективности комбинированной терапии опухолей, нацеленной на предотвращение образования «стареющими» клетками дочерних более агрессивных клонов.
Пластичность опухолевых клеток во многом определяется их способностью к перепрограммированию транскрипции [20]. При клеточном старении этот процесс приводит к развитию более агрессивных клонов, обладающих лекарственной устойчивостью [21,22]. Киназа CDK8 и ее паралог CDK19, компоненты Медиаторного комплекса, являются ключевыми участниками перепрограммирования транскрипции генов, индуцируемой в ответ на повреждение ДНК при химиотерапии [23]. Протеинкиназы CDK8/19 участвуют в транскрипции, запускаемой с помощью активированных транскрипционных факторов для специфичных групп генов [24]. В частности, CDK8 необходима для экспрессии белков, зависимых от таких транскрипционных факторов семейств SMAD и STAT, эстрогенового и андрогенового рецептора, β-катенина и других [25]. В клетках, претерпевших индуцированное химиотерапией клеточное старение, активируются гены, кодирующих секреторные, паракринные белки, обладающие антиапоптотической, митогенной и ангиогенной активностью [26], а также ингибирование генов, кодирующих белки пролиферации и прогрессии клеточного цикла [27]. Показано, что ингибирование CDK8/19 блокирует индуцируемую химиотерапией паракринную регуляцию, способствующую прогрессии опухолей [28]. Таким образом, закономерно предположить, что селективный ингибитор транскрипционных протеинкиназ CDK8/19 такой, как сенексин B, может быть использован для предотвращения возникновения фенотипа устойчивости (для предотвращения химиорезистентности) к антимитотическим препаратам таким, как SB743921, в опухолевых линиях.
Сущность изобретения
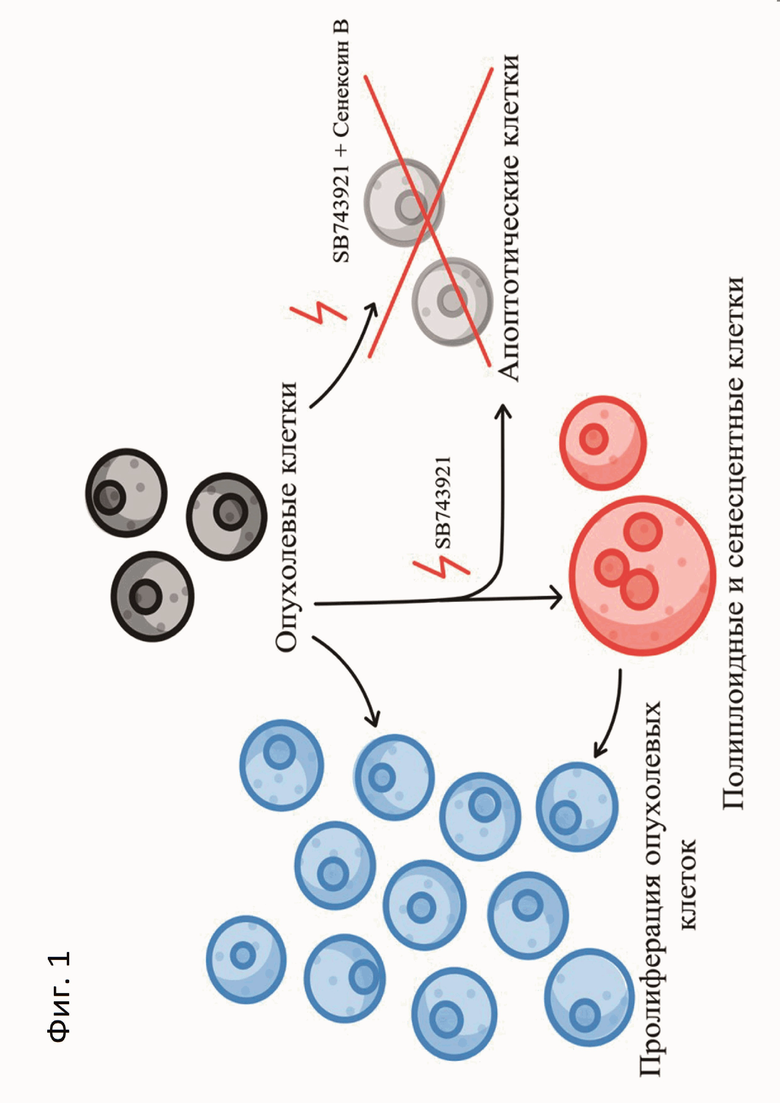
Нами было обнаружено, что комбинационное применение, по меньшей мере, одного антимитотического агента - SB743921 - и, по меньшей мере, одного ингибитора CDK8/19 - сенексина B - блокирует возникновение агрессивных клонов из «стареющих» клеток, и обеспечивает индукцию апоптоза в клетках злокачественных опухолей, например, аденокарциономы легкого A549 и РМЖ человека MCF-7. При этом предлагаемая композиция, включающая применение, по меньшей мере, одного антимитотического химиотерапевтического препарата и, по меньшей мере, одного ингибитора CDK8/19, действует эффективнее, чем использование только антимитотического соединения в качестве монопрепарата (фиг.1).
Таким образом, технический результат, проявляющийся при использовании настоящего изобретения, заключается в повышенной эффективности композиции, включающей, по меньшей мере, один антимитотический химиотерапевтический препарат и, по меньшей мере, один ингибитор CDK8/19, по сравнению с применением только антимитотического соединения, в элиминации более агрессивных клонов - «стареющих» опухолевых клеток, закономерном предотвращении химиорезистентности и понижении эффективных концентраций этих соединений.
Предлагаемое изобретение относится к композиции, включающей, по меньшей мере, один антимитотический агент и, по меньшей мере, один ингибитор CDK8/19.
В контексте настоящего изобретения композиция по изобретению предназначена для предотвращения химиорезистентности, т.е. для элиминации агрессивных клонов злокачественных клеток, возникших в результате возобновления пролиферации после воздействия антимитотического соединения и последующего «клеточного старения».
В контексте настоящего изобретения композиция по изобретению предназначена для снижения пролиферации клеток злокачественных опухолей различного гистогенеза.
В частном варианте осуществления изобретение относится к применению, по меньшей мере, одного антимитотического химиотерапевтического препарата и, по меньшей мере, одного ингибитора CDK8/19 для изготовления композиции для предотвращения химиорезистентности и элиминации агрессивных клонов злокачественных опухолей различного гистогенеза.
В частном варианте осуществления изобретение относится к применению, по меньшей мере, одного антимитотического химиотерапевтического препарата и, по меньшей мере, одного ингибитора CDK8/19, для изготовления композиции, нацеленной на снижение пролиферации клеток злокачественных опухолей различного гистогенеза.
В частном варианте осуществления изобретение относится к способу элиминации агрессивных клонов злокачественных клеток, возникших в результате возобновления пролиферации после воздействия антимитотического соединения и последующего «клеточного старения», в опухолях различного гистогенеза, путем введения, по меньшей мере, одного антимитотического препарата и, по меньшей мере, одного ингибитора CDK8/19.
В частном варианте осуществления изобретение относится к способу снижения пролиферации клеток злокачественных опухолей различного гистогенеза путем введения по меньшей мере, одного антимитотического химиотерапевтического препарата и, по меньшей мере, одного ингибитора CDK8/19.
В контексте настоящего изобретения антимитотический химиотерапевтический препарат представляет любой известный препарат, вызывающий нарушение прохождения процесса митоза через блокирование образования веретена деления и последующее проявление фенотипа «клеточного старения» (т.н. senescence).
В частном варианте осуществления антимитотический химиотерапевтический препарат представляет собой SB743921.
В контексте настоящего изобретения ингибитор CDK8/19 представляет любой известный ингибитор CDK8/19.
В частном варианте осуществления ингибитор CDK8/19 представляет собой сенексин B.
В контексте настоящего изобретения опухоль различного гистогенеза представляет собой любую опухоль, все клетки или часть клеток которой характеризуются злокачественным фенотипом.
В частном варианте осуществления опухоли различного гистогенеза представляют собой эстроген-позитивный рак молочной железы и аденокарцинома легкого.
В контексте настоящего изобретения ингибитор CDK8/19 может вводиться в концентрациях от приблизительно 0,5 мкМ до приблизительно 2 мкМ.
В частном варианте осуществления ингибитор CDK8/19 может вводиться в концентрациях от приблизительно 0,5 мкМ до приблизительно 2 мкМ.
В контексте настоящего изобретения антимитотический химиотерапевтический препарат может вводиться в концентрациях от приблизительно 1 нМ до приблизительно 100 нМ.
В частном варианте осуществления антимитотический химиотерапевтический препарат может вводиться в концентрациях от приблизительно 1 нМ до приблизительно 100 нМ.
В контексте настоящего изобретения антимитотический химиотерапевтический препарат и ингибитор CDK8/19 могут вводиться вместе или раздельно.
Антимитотический химиотерапевтический препарат и ингибитор CDK8/19 могут вводиться последовательно. Последовательность и интервал введения соединений определяется целью, условиями введения и/или наличием каких-либо мутаций.
В частном варианте осуществления такие интервалы составляют приблизительно от 1 до 24 часов.
В контексте настоящего изобретения антимитотический химиотерапевтический препарат и ингибитор CDK8/19 могут применяться в следующих массовых соотношениях: от приблизительно 1:2000 до приблизительно 1:5.
В частном варианте осуществления композиция может дополнительно содержать один или более фармацевтически приемлемых носителей.
В частном варианте осуществления антимитотический химиотерапевтический препарат и ингибитор CDK8/19 могут применяться в виде растворов.
В частном варианте осуществления может использоваться любой подходящий растворитель. Например, органический или неорганический растворитель водной или неводной природы.
Подходящими растворителями, без ограничения исключительно перечисленными, являются вода или различные водные растворы.
В предпочтительном варианте водные растворы имеют рН от приблизительно 7 до приблизительно 2.
Подходящими растворителями являются ДМСО (диметилсульфоксид), ДМФ (диметилформамид), этанол, натрий-фосфатный буфер.
Подробное описание терминов
Если не определено иначе, все употребляемые в настоящем описании термины используются в том значении, которое обычно подразумевает специалист в области, к которой относится изобретение.
Термин "приблизительно", когда он относится к величине, поддающейся измерению, охватывает отклонения ±20%, или в некоторых случаях ±10%, или в некоторых случаях ±5%, или в некоторых случаях ±1%, или в некоторых случаях ±0,1% от указанной величины, поскольку такие отклонения являются приемлемыми для осуществления описанных изобретений.
Использование антимитотического химиотерапевтического препарата и ингибитора CDK8/19 подразумевает использование препаратов и ингибиторов как таковых или их известных солей, полиморфов или изомеров.
Предотвращение химиорезистентности подразумевает под собой индукцию гибели “стареющих”, агрессивных опухолевых клеток млекопитающего как in vitro, так и в рамках целого организма.
Краткое описание чертежей
Фиг.1: Схема совместного действия SB743921 и сенексина B на опухолевые клетки.
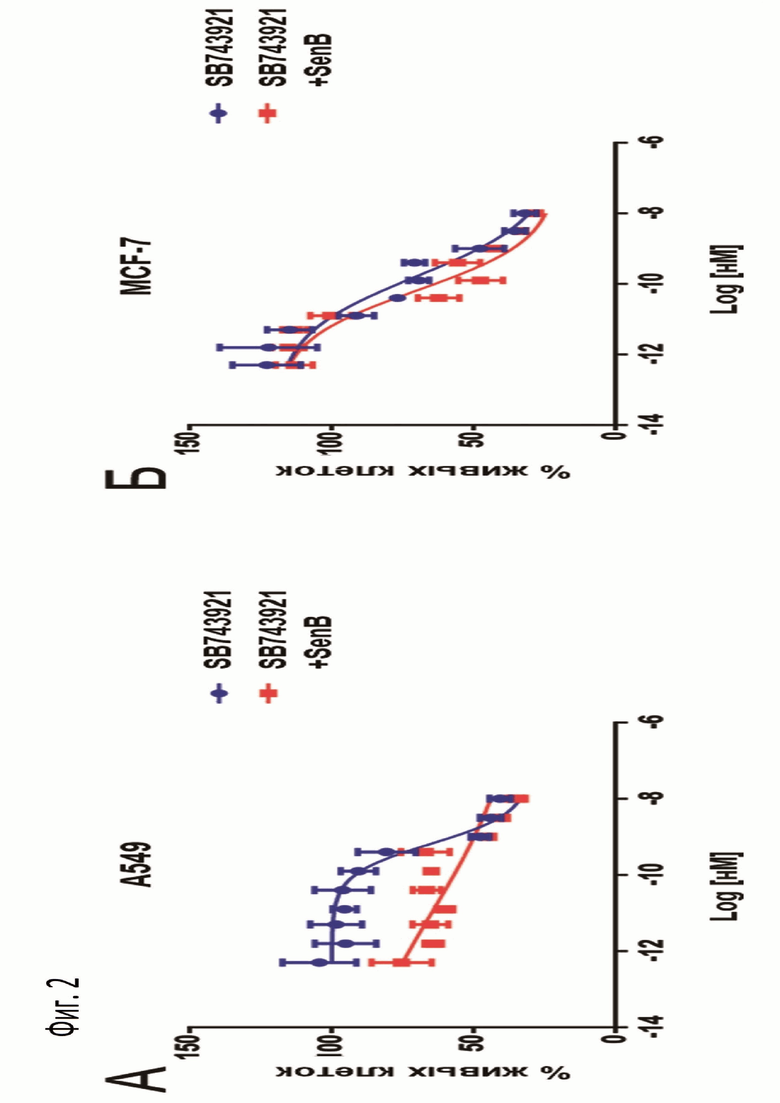
Фиг.2: График зависимости пролиферации клеток A549 (А) и MCF-7 (Б), обработанных SB743921 и SB743921 в комбинации с 1 мкМ сенексина B (SenB), от концентрации SB743921 на 7-ой день культивирования.
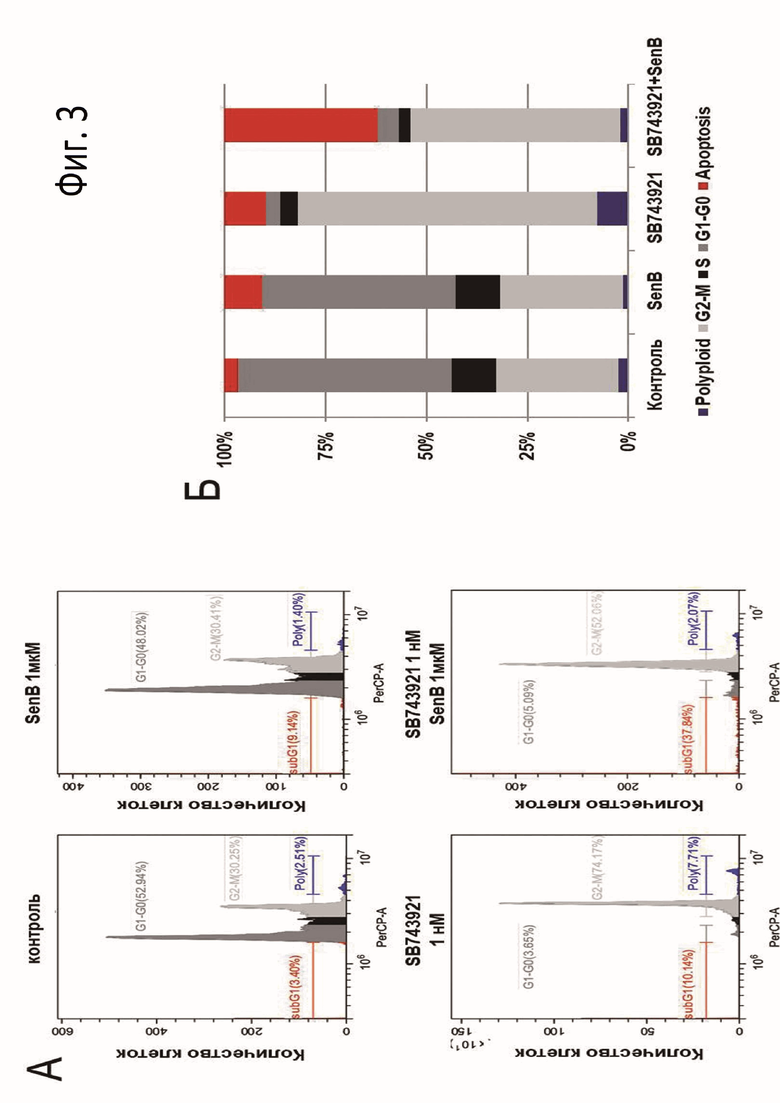
Фиг.3: Распределение опухолевых клеток линии А549, обработанных 1 нМ SB743921 и 1 нМ SB743921 в комбинации с 1 мкМ сенексина B (SenB) в течение 24 ч, по фазам цикла (А); столбиковая диаграмма, репрезентирующая процент клеток на стадиях клеточного цикла A549 (Б).
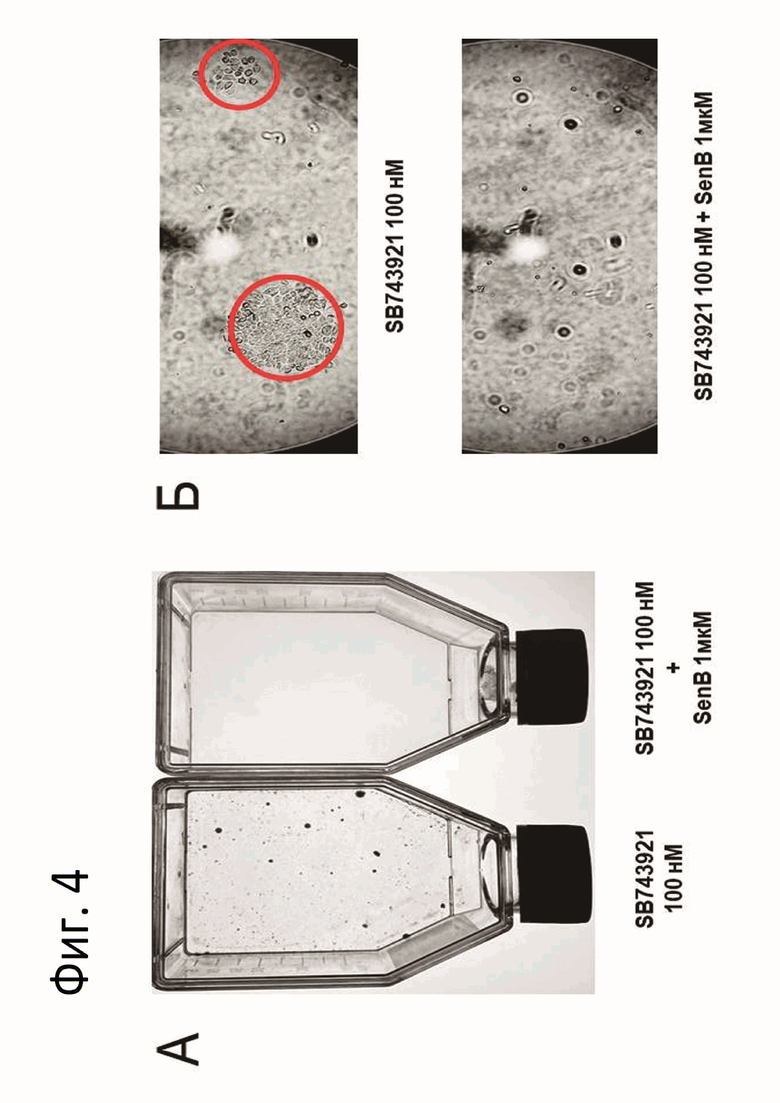
Фиг.4: Фотографии флаконов, в которых культивировались клетки линии MCF-7, обработанных 100 нМ SB743921 и 100 нМ SB743921 в комбинации с 1 мкМ сенексина B (SenB) в течение 7 суток: (А) общий вид и при увеличении х10 (Б).
Список литературы
1. Siegel RL, Miller KD, Fuchs HE, Jemal A. Cancer statistics, 2022. CA Cancer J Clin. 2022;72: 7-33.
2. Dalmartello M, La Vecchia C, Bertuccio P, Boffetta P, Levi F, Negri E, et al. European cancer mortality predictions for the year 2022 with focus on ovarian cancer. Ann Oncol. 2022;33: 330-339.
3. Bukowski K, Kciuk M, Kontek R. Mechanisms of Multidrug Resistance in Cancer Chemotherapy. Int J Mol Sci. 2020;21. doi:10.3390/ijms21093233
4. Dillekås H, Rogers MS, Straume O. Are 90% of deaths from cancer caused by metastases? Cancer Med. 2019;8: 5574-5576.
5. Coppé J-P, Patil CK, Rodier F, Sun Y, Muñoz DP, Goldstein J, et al. Senescence-associated secretory phenotypes reveal cell-nonautonomous functions of oncogenic RAS and the p53 tumor suppressor. PLoS Biol. 2008;6: 2853-2868.
6. Kale A, Sharma A, Stolzing A, Desprez P-Y, Campisi J. Role of immune cells in the removal of deleterious senescent cells. Immun Ageing. 2020;17: 16.
7. Wang B, Kohli J, Demaria M. Senescent Cells in Cancer Therapy: Friends or Foes? Trends Cancer Res. 2020;6: 838-857.
8. Yang L, Fang J, Chen J. Tumor cell senescence response produces aggressive variants. Cell Death Discov. 2017;3: 17049.
9. Wyld L, Bellantuono I, Tchkonia T, Morgan J, Turner O, Foss F, et al. Senescence and Cancer: A Review of Clinical Implications of Senescence and Senotherapies. Cancers . 2020;12. doi:10.3390/cancers12082134
10. Bongero D, Paoluzzi L, Marchi E, Zullo KM, Neisa R, Mao Y, et al. The novel kinesin spindle protein (KSP) inhibitor SB-743921 exhibits marked activity in in vivo and in vitro models of aggressive large B-cell lymphoma. Leuk Lymphoma. 2015;56: 2945-2952.
11. Song I-S, Jeong YJ, Nyamaa B, Jeong SH, Kim HK, Kim N, et al. KSP inhibitor SB743921 induces death of multiple myeloma cells via inhibition of the NF-κB signaling pathway. BMB Rep. 2015;48: 571-576.
12. Zhu L, Xiao F, Yu Y, Wang H, Fang M, Yang Y, et al. KSP inhibitor SB743921 inhibits growth and induces apoptosis of breast cancer cells by regulating p53, Bcl-2, and DTL. Anticancer Drugs. 2016;27: 863-872.
13. Hansson K, Radke K, Aaltonen K, Saarela J, Mañas A, Sjölund J, et al. Therapeutic targeting of KSP in preclinical models of high-risk neuroblastoma. Sci Transl Med. 2020;12. doi:10.1126/scitranslmed.aba4434.
14. Shi Y, Cui X, Jiang T, Pan Y, Lin Y, Feng X, et al. The therapeutic effect of KSP inhibitors in preclinical models of cholangiocarcinoma. Cell Death Dis. 2022;13: 799.
15. O'Connor OA, Gerecitano J, Van Deventer H, Hainsworth J, Zullo KM, Saikali K, et al. The addition of granulocyte-colony stimulating factor shifts the dose limiting toxicity and markedly increases the maximum tolerated dose and activity of the kinesin spindle protein inhibitor SB-743921 in patients with relapsed or refractory lymphoma: results of an international, multicenter phase I/II study. Leuk Lymphoma. 2015;56: 2585-2591.
16. Talapatra SK, Anthony NG, Mackay SP, Kozielski F. Mitotic kinesin Eg5 overcomes inhibition to the phase I/II clinical candidate SB743921 by an allosteric resistance mechanism. J Med Chem. 2013;56: 6317-6329.
17. Cabral F. Factors determining cellular mechanisms of resistance to antimitotic drugs. Drug Resist Updat. 2001;4: 3-8.
18. Tao W, South VJ, Zhang Y, Davide JP, Farrell L, Kohl NE, et al. Induction of apoptosis by an inhibitor of the mitotic kinesin KSP requires both activation of the spindle assembly checkpoint and mitotic slippage. Cancer Cell. 2005;8: 49-59.
19. van Vuuren RJ, Visagie MH, Theron AE, Joubert AM. Antimitotic drugs in the treatment of cancer. Cancer Chemother Pharmacol. 2015;76: 1101-1112.
20. Huang L, Yi X, Yu X, Wang Y, Zhang C, Qin L, et al. High-Throughput Strategies for the Discovery of Anticancer Drugs by Targeting Transcriptional Reprogramming. Front Oncol. 2021;11: 762023.
21. Faget DV, Ren Q, Stewart SA. Unmasking senescence: context-dependent effects of SASP in cancer. Nat Rev Cancer. 2019;19: 439-453.
22. Junaid M, Lee A, Kim J, Park TJ, Lim SB. Transcriptional Heterogeneity of Cellular Senescence in Cancer. Mol Cells. 2022;45: 610-619.
23. Rzymski T, Mikula M, Wiklik K, Brzózka K. CDK8 kinase--An emerging target in targeted cancer therapy. Biochim Biophys Acta. 2015;1854: 1617-1629.
24. Chen M, Liang J, Ji H, Yang Z, Altilia S, Hu B, et al. CDK8/19 Mediator kinases potentiate induction of transcription by NFκB. Proc Natl Acad Sci U S A. 2017;114: 10208-10213.
25. Roninson IB, Győrffy B, Mack ZT, Shtil AA, Shtutman MS, Chen M, et al. Identifying Cancers Impacted by CDK8/19. Cells. 2019;8. doi:10.3390/cells8080821
26. Chang B-D, Swift ME, Shen M, Fang J, Broude EV, Roninson IB. Molecular determinants of terminal growth arrest induced in tumor cells by a chemotherapeutic agent. Proc Natl Acad Sci U S A. 2002;99: 389-394.
27. Donner AJ, Szostek S, Hoover JM, Espinosa JM. CDK8 is a stimulus-specific positive coregulator of p53 target genes. Mol Cell. 2007;27: 121-133.
28. Porter DC, Farmaki E, Altilia S, Schools GP, West DK, Chen M, et al. Cyclin-dependent kinase 8 mediates chemotherapy-induced tumor-promoting paracrine activities. Proc Natl Acad Sci U S A. 2012;109: 13799-13804.
Осуществление изобретения
Настоящее изобретение подкреплено представленными ниже примерами. Эти примеры приведены только для иллюстрации, они никоим образом не являются ограничивающими. Представленные примеры следует истолковывать как охватывающие любые вариации изобретения.
Без дальнейшего полагается, что специалист в данной области может с использованием описания и представленных ниже иллюстративных примеров получать и использовать композиции по настоящему изобретению.
Пример 1. Определение цитотоксичности ингибитора SB743921 и SB743921 в комбинации с сенексином B для опухолевых клеточных линий человека - A549 (аденокарцинома легкого) и MCF-7 (рак молочной железы).
Клетки линий MCF-7 (рак молочной железы, Российская коллекция клеточных культур) и A549 (ATCC®CCL-185™, аднокарцинома легкого, ATCC). Клетки культивировали в среде DMEM с добавлением 10% телячьей эмбриональной сыворотки (Fetal Bovine Serum, FBS, PAA, Австрия), 2 мМ L-глутамина и 1% пенициллин-стрептомицина (Панэко, Россия). Все линии клеток культивировали при температуре 37°С в атмосфере 5% СO2. Для проведения экспериментов использовалась культуральные флаконы, чашки Петри и планшеты (Corning-Costar, США; SPL, Корея).
SB743921 (Selleckchem, USA) и сенексин B (Senex Biotechnology, США) растворялись в диметилсульфоксиде (ДМСО, ПанЭко, Россия) до конечной концентрации 10 мМ и хранились при температуре -20°С.
Анализ сульфородамина B (Sulforhodamine b, SRB) использовался для определения плотности клеток, основанного на измерении содержания клеточного белка. Описанный метод был оптимизирован для скрининга токсичности соединений по отношению к адгезионным клеткам в 96- луночном формате. Период инкубации составлял 7 суток. После периода инкубации, клеточные монослои фиксировали 10% трихлоруксусной кислотой и окрашивали в течение 30 мин, после чего избыток красителя удаляли повторной промывкой 1% уксусной кислотой. Связанный с белком краситель растворили в 10 мМ растворе Трис pH 10 для определения оптической плотности при 540 нм с использованием считывающего устройства для микропланшетов MultiScan FC (Thermo Scientific, США).
Комбинация SB743921 и сенексина B показала большую активность в культуре A549, больше, чем для MCF-7, но разница в кривых пролиферации была достоверно отличной для обеих культур (фиг.2).
Исходя из сделанных экспериментов, был сделан вывод, что комбинация митотического ингибитора SB743921 и ингибитора CDK8/19 сенексина B, работает эффективнее, чем SB743921 как монопрепарат.
Пример 2. Определение эффективности SB743921 и SB743921 в комбинации с сенексином B для индукции гибели опухолевой клеточной линии человека A549.
При исследовании действия 1 нМ SB743921 и комбинации с 1 мкМ сенексина B на опухолевые клеточные культуры в течение 24 ч использовался метод проточной цитометрии с последующим анализом данных о распределении клеток по фазам цикла. Пробы фиксировали с помощью лизирующего буфера для анализа клеточного цикла, предварительно отмыв в растворе PBS (ПанЭко, Россия) и открутив 5 минут при 1500 об./мин. в центрифуге. Состав лизирующего буфера: 0,1% цитрата натрия (Applichem, Германия), 0,3% нонилфеноксиполиэтоксиэтанол, NP-40 (SigmaAldrich, США), 50 мкг/мл РНКазы А (SigmaAldrich, США) и 50 мкг/мл пропидия иодида (SigmaAldrich, США). После добавления 200 мкл буфера к клеточным осадкам тщательно перемешивали и инкубировали при комнатной температуре в течение 30 минут в темноте. Распределение клеток по фазам клеточного цикла (по плоидности ДНК) анализировали на проточном цитофлуориметре Cytoflex S (Beckman Coulter, США) в каналах FSC, SSC и PerCP. Для исключения слипшихся клеток использовали двухмерную диаграмму PE-W против PE-A. Анализировали 10 000 «событий» для каждого образца, данные обрабатывали в программах программе CytExpert, Microsoft Excel и GraphPad Software.
При действии комбинации соединений SB743921 и сенексин B наблюдается быстрое увеличение количества апоптотических клеток (после 24-часового воздействия) по сравнению с клетками, обработанными только SB743921 (фиг.3). При этом SB743921 в комбинации с сенексином B препятствует задержке клеток в G2/M-фазе клеточного цикла.
Пример 3. Клоногенный анализ клеточной культуры MCF-7, обработанной SB743921 и SB743921 в комбинации с сенексином B в течение 14 суток.
С помощью клоногенного анализа было выявлено наличие устойчивых к SB743921 колоний, которые были задетектированы спустя 14 суток культивирования (фиг.4). Клоногенный анализ включал посадку клеток во флаконы с периодической сменой среды и соединений. Фиксация осуществлялась ледяным раствором 100% метанола при +4°С в течение 10 мин. Раствор кристаллического фиолетового добавлялся на 20 мин с последующими 3 отмывками в деионизированной воде и сушкой на воздухе. Высушенные флаконы были сфотографированы.
В то время как во флаконах, где клетки обрабатывались комбинацией веществ SB743921 и сенексина B, образования таких колоний не наблюдалось, т.е. преодолевалась устойчивость опухолевых клеток к действию антимитотического химиотерапевтического агента.
Таким образом, экспериментально подтверждено, что предлагаемая композиция, включающая антимитотический ингибитор SB743921 и ингибитор CDK8/19, обладает превосходным противоопухолевым действием и прекрасно проявляют себя в предотвращении химиорезистентности к антимитотическим препаратам в клетках злокачественных опухолей различного гистогенеза. Благодаря достижению противоопухолевого эффекта - элиминации особо агрессивных клонов “стареющих клеток”, способных вернуться к пролиферации - в перспективе возникает возможность уменьшения вероятности возникновения рецидивов и метастазов у онкологических пациентов.
Изобретение относится к композиции, предназначенной для предотвращения химиорезистентности к антимитотическим препаратам в клетках рака молочной железы и аденокарциномы лёгкого и включающей антимитотический ингибитор SB743921 и ингибитор CDK8/19 сенексин B. 3 з.п. ф-лы, 4 ил.
1. Композиция, предназначенная для предотвращения химиорезистентности к антимитотическим препаратам в клетках рака молочной железы и аденокарциномы лёгкого, включающая антимитотический ингибитор SB743921 и ингибитор CDK8/19 сенексин B.
2. Композиция по п.1, содержащая дополнительно по меньшей мере один фармацевтически приемлемый носитель.
3. Композиция по п.1, в которой ингибитор CDK8/19 сенексин B находится в концентрации от 0,5 мкМ до 2 мкМ.
4. Композиция по п.1, в которой антимитотический ингибитор SB743921 находится в концентрации от 1 нМ до 100 нМ.
| RONINSON I.B | |||
| et al | |||
| Топка с несколькими решетками для твердого топлива | 1918 |
|
SU8A1 |
| JACKSON J.R | |||
| et al | |||
| A second generation KSP inhibitor, SB-743921, is a highly potent and active therapeutic in preclinical models of cancer, Clinical Cancer Research, 2006, Vol.12, N19, pp.B11-B11 | |||
| GARCIA-SAEZ I | |||
| et al | |||
| Кипятильник для воды | 1921 |
|
SU5A1 |
Авторы
Даты
2023-11-21—Публикация
2022-12-15—Подача