Изобретение относится к медицине, а именно к абдоминальной хирургии и реаниматологии, и может быть использовано для установления вероятности развития гемостатических осложнений в раннем послеоперационном периоде (ПОП) у больных острыми заболеваниями живота.
Каждое хирургическое вмешательство сопровождается хирургическим стресс-ответом, имеющим сложный и мультифакторный характер, приводящим к нарушению системы гомеостаза, в том числе, развитию системного воспалительного ответа и дисбалансу гемостатической активности. Последние в определенной степени зависят от функциональной активности системы свертывания и равновесия ее компонентов. Регрессия воспалительной реакции, характеризующаяся восстановлением функционального состояния системы гемостаза, как правило, ведет к восстановлению общего состояния. Однако прогрессирование гомеостатических нарушений, в частности гемокоагуляционного компонента, может приводить к тромбоэмболическим осложнениям (ТЭО), полиорганной депрессии и даже смерти больного (RU 2642600, МПК G01N 33/48, опубл. 25.01.2018).
Актуальность вопроса тромбоэмболических осложнений в раннем послеоперационном периоде определяется частотой встречаемости, трудностью диагностики и лечения, значительной летальностью. Известно, что частота формирования венозных тромбоэмболических последствий хирургических вмешательств на органах брюшной полости составляет 3-5 %, а при бессимптомной форме достигает 70-75% (Тромбоз нижней полой вены, исходящий из гонадных вен, в послеродовом периоде: описание серии случаев и обзор литературы / И. С. Лебедев, Д. А. Сон, Д. А. Чуриков [и др.] // Флебология. – 2020. – Т. 14. – №3. – С. 244-252).
Прогнозирование ТЭО в раннем периоде хирургической терапии в условиях патологий острого живота позволило бы решить данный вопрос, так как при своевременной оценке возможности их развития можно провести оптимальное и высоко успешное профилактическое лечение. Безусловно, своевременное предупреждение тромбогеморрагических последствий эффективнее и дешевле, нежели проведение их терапии (Кузнецов, М. Р. Профилактика венозных тромбоэмболических осложнений в хирургии / М. Р. Кузнецов, И. П. Марченко, Е. Е. Федоров // Стационарозамещающие технологии: Амбулаторная хирургия. – 2018. – №1-2. – С. 20-25).
Согласно данным литературы, способы прогнозирования неблагоприятного исхода, в том числе ТЭО, у больных острым животом в раннем послеоперационном времени разнообразны, и основываются на значениях биохимических и инструментальных исследований (Прогнозирование течения и исходов тяжелого острого панкреатита / П. И. Миронов, О. И. Медведев, И. Х. Ишмухаметов, Р. Д. Булатов // Фундаментальные исследования. – 2011. – №10-2. – С. 319-323).
Известен способ прогнозирования исхода пациентов острым абдоминальным заболеванием в ПОП. Он заключается в определении скорости роста фибринового сгустка с помощью лабораторной системы «Регистратор Тромбодинамики Т-2» Hemacore. Отмечено, что ускорение образования фибринового сгустка больше 29 мкм/мин указывает на высокую вероятность развития ТЭО и необходимость проведения антикоагулянтной профилактики с ведением препаратов низкомолекулярных гепаринов (RU 2699050, МПК G01N 33/86, опубл. 03.09.2019).
Основным недостатком вышеуказанного способа является то, что полученный результат основывается лишь на одном параметре системы гемостаза. При этом не учитываются другие ее компоненты, такие как коагуляционная способность и тромбоцитарная активность, необходимые для оптимального определения активности свертывания, с одной стороны, и ТЭО – с другой (Понятие системного коагулопатического дистресс-синдрома в хирургии, его патогенез и принципы профилактики / А. П. Власов, В. В. Трофимов, Т. И. Власова, Н. А. Мышкина // Хирургия. Журнал им. Н.И. Пирогова. – 2019. – №9. – С. 66-72).
Способ раннего прогнозирования развития тромбоэмболических осложнений после операций на органах брюшной полости, включающий определение Международного нормализованного отношения, отличающийся тем, что дополнительно проводят инструментальное исследование кровотока на передней поверхности в средней трети голени с помощью лазерной допплеровской флоуметрии, регистрируют показатели максимальных амплитуд нейрогенного, миогенного и дыхательного компонентов, рассчитывают коэффициент Т по формуле:
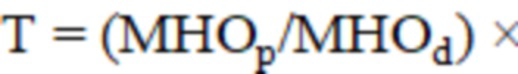
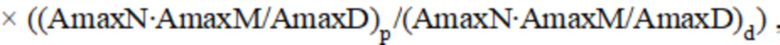
где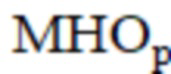 – Международное нормализованное отношение после операции;
– Международное нормализованное отношение после операции; 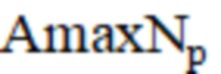 – максимальная амплитуда нейрогенного компонента после операции;
– максимальная амплитуда нейрогенного компонента после операции; 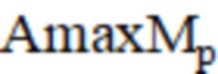 – максимальная амплитуда миогенного компонента после операции;
– максимальная амплитуда миогенного компонента после операции; 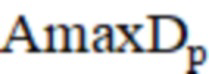 – максимальная амплитуда дыхательного компонента после операции;
– максимальная амплитуда дыхательного компонента после операции; 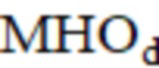 – Международное нормализованное отношение до операции;
– Международное нормализованное отношение до операции; 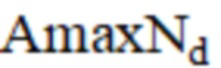 – максимальная амплитуда нейрогенного компонента до операции;
– максимальная амплитуда нейрогенного компонента до операции; 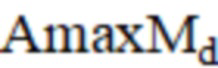 – максимальная амплитуда миогенного компонента до операции;
– максимальная амплитуда миогенного компонента до операции; 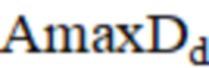 – максимальная амплитуда дыхательного компонента до операции.
– максимальная амплитуда дыхательного компонента до операции.
В данном способе при значении коэффициента Т<0,40 прогнозируют развитие тромбоэмболических осложнений (RU 2367350, МПК A61B 8/06, опубл. 20.09.2009).
Согласно мнениям исследователя, данный способ является недостаточно точным, поскольку в нем не учитывается фибринолитическая активность системы свертывания, а именно D-димер – продукт плазминового расщепления фибрина – показателя внутрисосудистого отложения фибрина (Периоперационное ведение пациентов с нарушениями системы гемостаза / И. Б. Заболотских, С. В. Синьков, К. М. Лебединский [и др.] // Анестезиология и реаниматология (Медиа Сфера). – 2018. – №1-2. – С. 58-81).
Прототипом для данного изобретения служит способ прогнозирования тромбоэмболических послеоперационных осложнений, при котором у больных в раннем послеоперационном периоде в динамике определяют значение Международного нормализованного отношения, содержание малонового диальдегида и лизоформ фосфолипидов, на основе полученных данных рассчитывают индекс прогнозирования тромбоэмболических послеоперационных осложнений (RU 2732246, МПК G01N 33/49, G01N 33/50. опубл. 14.09.2020).
Однако способ имеет недостатки. В его основе лежит исследование состояния свертывающей системы крови с оценкой состояние некоторых триггерных механизмов гемостатических расстройств. Однако не учитывается предрасположенность к гемокоагуляционным нарушениям, что возможно при оценке полиморфизма генов, ответственных за состояние гемостаза.
Исследованиями установлена взаимосвязь нарушений в системе гемостаза с процессами, которые во многом определяют их активность. Речь идет о мембранодестабилизирующих (мембранодеструктивных) процессах, которые являются источником тканевого тромбопластина – одного из компонентов, регулирующих агрегатное состояние свертывающей системы. Их состояние определяется по активности перекисного окисления мембранных липидов, фосфолипазной активности, а также состояния фосфолипидного состава биомембран (Понятие системного коагулопатического дистресс-синдрома в хирургии, его патогенез и принципы профилактики / А. П. Власов, В. В. Трофимов, Т. И. Власова, Н. А. Мышкина // Хирургия. Журнал им. Н.И. Пирогова. – 2019. – №9. – С. 66-72).
Особого внимания заслуживают данные о наличии сопряженности между выраженностью этих процессов в органах поражения и в крови (коэффициент корреляции r=0,815-0,957, р<0,05). Таким образом, уровень фракций липидов и активность перекисного окисления липидов в крови может быть достоверными маркерами, демонстрирующими степень мембранодеструктивных процессов в тканях различных органов у пациентов ургентными заболеваниями живота (Системный мембранодестабилизирующий дистресс-синдром в хирургии: понятие, патогенез, диагностика / А. П. Власов, В. А. Трофимов, Т. И. Власова [и др.] // Хирургия. Журнал им. Н.И. Пирогова. – 2019. – №5. – С. 25-30).
С другой стороны, развитие молекулярной генетики дает возможность изучать ургентные патологии на генном уровне путем исследования генов и их полиморфизмов, непосредственно связанных с их патологическими процессами. Анализ аллельных и генотипных вариантов этих генов позволяет прогнозировать течение заболевания, выявлять вероятность осложнений на ранних сроках, оценить эффективность терапии (Молекулярно-генетические подходы к диагностике наследственной патологии / А. Л. Архипенко, М. В. Беренштейн, А. В. Ухаботина [и др.] // Крымский журнал экспериментальной и клинической медицины. – 2021. – Т. 11. – №2. – С. 64-74).
Известно, что метаболические продукты патологических процессов системного мембранодестабилизирующего дистресс-синдрома, вызывающие гомеостатические, в том числе коагулопатические нарушения при ургентных заболеваниях, находятся под ДНК управлением. Развитие клеточного стресса определяет, как индивидуальные, так и универсальные проявления заболеваний. Поэтому для точного определения степени динамических реакций в тканях, органах и системах при воздействии повреждающего фактора, необходимо анализировать генотипы пациента, позволяя персонифицировать прогнозирование течения раннего ПОП (Gusev, E. Y. Cellular stress and general pathological processes / E. Y. Gusev, N. V. Zotova // Current Pharmaceutical Design. – 2019. – Vol. 25. – No 3. – P. 251-297).
Технический результат заключается в повышении точности прогнозирования формирования тромбоэмболических последствий в раннем послеоперационном периоде, а также анализе генотипа пациента, позволяющем персонифицировать диагностический алгоритм, за счет анализа биохимических параметров.
Сущность изобретения заключается в способе персонифицированного прогнозирования развития тромбоэмболических осложнений в ургентной хирургии живота, заключающийся в заборе венозной крови у больного острым животом в предоперационном и раннем послеоперационном периодах, ее анализе. В предоперационный период при поступлении пациента в клинику однократно выполняют анализ полиморфизма гена ингибитора активатора плазминогена - 675 4G/5G PAI-1, а измерение времени реакции свертывания крови (R) и определение содержания свободных жирных кислот и малонового диальдегида (MDA) производят после хирургического вмешательства в динамике, на основе полученных данных рассчитывают индекс прогнозирования тромбоэмболических осложнений (iTEC, index of thromboembolic complications) по формуле:
 ,
,
где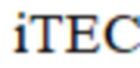 – индекс прогнозирования тромбоэмболических осложнений;
– индекс прогнозирования тромбоэмболических осложнений;
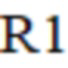 – время реакции в текущий момент;
– время реакции в текущий момент;
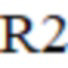 – время реакции в предыдущий момент;
– время реакции в предыдущий момент;
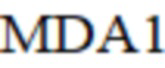 – малоновый диальдегид в текущий момент;
– малоновый диальдегид в текущий момент;
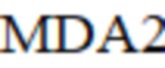 – малоновый диальдегид в предыдущий момент;
– малоновый диальдегид в предыдущий момент;
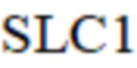 – свободные жирные кислоты в текущий момент;
– свободные жирные кислоты в текущий момент;
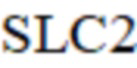 – свободные жирные кислоты в предыдущий момент;
– свободные жирные кислоты в предыдущий момент;
 – мутация гена ингибитора активатора плазминогена: 0 – отсутствие; 1 – имеется.
– мутация гена ингибитора активатора плазминогена: 0 – отсутствие; 1 – имеется.
И при значении индекса прогнозирования тромбоэмболических осложнений до 3,5 включительно прогнозируют отсутствие возможности формирования тромбоэмболических осложнений, от 3,6 до 4,9 – низкий риск развития тромбоэмболических осложнений, 5,0 и более – высокий риск тромбоэмболических осложнений.
В табл. 1 представлен iTEC, в табл. 2 показаны значения iTEC в динамике лечения больного А. острым панкреатитом, осложненным перитонитом в раннем ПОП, в табл. 3 показаны значения iTEC в динамике лечения больного Б. острой кишечной непроходимостью, осложненной перитонитом, в табл. 4 показаны значения iTEC в динамике лечения больного В. язвенной патологией желудка, осложненной перфорацией и перитонитом.
Новизна предлагаемого способа заключается в следующем:
1. По результатам времени реакции определяется активность коагуляционной способности крови, по значениям плазменного содержания MDA оценивается активность перекисного окисления липидов, по значению свободных жирных кислот определяется выраженность мембранодестабилизирующих явлений.
2. Оценивается динамика изменения (не статическим путем) изучаемых параметров на протяжение наблюдения за больным в раннем ПОП, что позволяет характеризовать в интегральном количестве гемостатические нарушения.
3. Основным преимуществом представляется то, что статистический расчет индекса прогнозирования формирования ТЭО в ПОП основывается на абсолютных данных, причем, в зависимости от ряда условий, связанных с техническими незначительными различиями каждой лаборатории, позволяя избегать возможность исключить возможность ошибочного прогноза.
Способ осуществляют следующим образом.
Анализ полиморфизма гена ингибитора активатора плазминогена (-675 4G/5G PAI-1) выполняют один раз при поступлении пациента в клинику.
Измерение времени реакции (R), и определение содержания свободных жирных кислот и MDA в плазме крови пациентов острым животом производят по ходу наблюдения раннего периода после хирургического вмешательства, поскольку клиническое течение ПОП при ургентных патологиях живота протекает различно и индивидуально. Итак, оценка указанного индекса становится объективной только при расчете в динамике.
Величину времени реакции (R) определяют стандартным методом при помощи тромбоэластографии (ТЭГ). Так, 1,0 мл венозной крови добавляют в каолиновую пробирку, затем кровь из каолиновой пробирки помещают в кювету ТЭГ, в которую добавляют 20 мкл хлорида кальция. Запускают ТЭГ и в течении 30 мин выполняют запись. Затем выполняют расчет параметра R.
Содержание MDA определяют по методике Егорова Д.Ю., Козлова А.В. (1988 г.). Так, 3 мл 1 %-ной фосфорной кислоты добавляют к 1 мл плазмы крови, содержащей этилендиаминтетрауксусную кислоту (ЭДТА) (0,5 ммоль) и 2-тиобарбитуровую кислоту (1 мл – 0,5%). После перемешивания образцы инкубируют при 100°С – 45 мин. Далее образцы охлаждают, приливают в них н-бутанол (4 мл), и центрифугируют при 1500 g на 15 мин. Спектр поглощения в области 515-550 нм регистрируют в верхней бутанольной фазе. Определяют оптическую плотность при 532 нм, используя в качестве базовых точек – точки спектра при 515 и 550 нм.
Уровень свободных жирных кислот определяют методом экстрактивного алкилирования (Крылов А.И., Хлебникова Н.С., Полуяктова С.К., 1991 г.).
Материалами генетического исследования гена ингибитора активатора плазминогена (-675 4G/5G PAI-1) являлись образцы ДНК цельной крови, которые были выделены набором реагентов ДНК-экстран 1 (ЗАО «Синтол», г. Москва). Молекулярные локусы гена PAI-1 анализировали с помощью амплификации (полимеразно-цепной реакции) аппаратом CFX96 Touch™ Real-Time PCR Detection System.
Таким образом, определение iTEC при ургентных заболеваниях живота позволяет достоверно судить как о возможности формирования ранних послеоперационных тромбоэмболических осложнений, так и о эффективности назначенной методики лечения.
Значения индекс прогнозирования ТЭО оценены опытным методом при проведении клинико-биохимического исследования 80 больных ургентной патологией живота.
Пример 1
Больной А., 21 год, поступил в больницу с диагнозом: острый деструктивный аппендицит, осложненный аппендикулярным абсцессом. Отметим, что у пациента отсутствовал генетический полиморфизм гена ингибитора активатора плазминогена (-675 4G/5G PAI-1). После госпитализации больному проведено хирургическое лечение: аппендэктомия. С первого дня пребывания в клинике, после операции и под наблюдением больному выполнено исследование параметра R, свободных жирных кислот и MDA. Выявлено, что значение iTEC составляло 3,4 через сутки после вмешательства, 3,2 – на третьи сутки, 2,1 – на пятые сутки. Это указывает на отсутствие возможности формирования ТЭО (табл. 2).
Установлена положительная динамика показателей в раннем послеоперационном периоде. Медикаментозное лечение назначалось по стандартным критериям. Послеоперационный период протекал без осложнений. Больной выписан в удовлетворительном состоянии.
Пример 2
Больной Б., 52 года, поступил с диагнозом прободная язва двенадцатиперстной кишки, осложненная перфорацией и острым перитонитом. Генетический тест показал наличие патологического полиморфизма гена ингибитора активатора плазминогена (-675 4G/5G PAI-1). После проведения предоперационной подготовки больной оперирован: лапаротомия, ушивание язвы, санация и дренирование брюшной полости. После хирургической терапии и в динамике больному произведено определение значения R, свободных жирных кислот и MDA. Значения индекса прогнозирования ТЭО, определены через 1, 3 и 5 суток после оперативного вмешательства и составляли 6,1, 5,8 и 5,4 соответственно (табл. 3). Согласно полученным данным прогнозирован повышенный риск формирования тромбоэмболических осложнений в раннем ПОП. С назначением стандартной терапии дополнительно включены профилактические меры ТЭО (применения антикоагулянтов). Несмотря на применение вышеуказанных мер регистрирован тромбоз глубоких вен правой нижней конечности на пятые сутки после хирургической терапии (табл. 3). Больному проведено хирургическое вмешательство, направленное на извлечение тромба из глубокой вены нижней конечности (тромбэктомия) с последующим восстановлением ее проходимости (пликация). На фоне антикоагулянтной терапии осложнений после повторной операции не было. Выписан в удовлетворительном состоянии.
Пример 3
Больной В., 72 года, госпитализирован в клинику с диагнозом острая кишечная непроходимость, осложненная острым перитонитом. В первые сутки проведено хирургическое вмешательство. Интраоперационно диагностирован рак сигмовидной кишки, осложненный перфорацией и каловым перитонитом. Выполнена резекция кишки с опухолью, санация и дренирование брюшной полости. Генетически больной не имел молекулярную мутацию гена ингибитора активатора плазминогена (-675 4G/5G PAI-). В послеоперационном времени и в динамике больному произведен анализ параметров R, свободных жирных кислот и MDA. Индекс прогнозирования ТЭО на 1-е сутки составил 4,5, через трое – 3,9, через пять – 2,9. Таким образом, на 1 и 3-е сутки после операции спрогнозирована низкая вероятность формирования тромбоэмболических осложнений, и отсутствие на 5-е сутки. Клинически тромбоэмболических осложнений не возникло (табл. 4).
По сравнению с известными решениями предлагаемое позволяет оптимально и точно отражать возможность формирования тромбоэмболических последствий в раннем послеоперационном периоде у больных ургентными патологиями живота.
Таблица 1
вероятности
степень
Таблица 2

(отсутствие)
(отсутствие)
(отсутствие)
Таблица 3

(высокая)
(высокая)
(высокая)
Таблица 4

(низкая)
(низкая)
(отсутствие)
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПРОГНОЗИРОВАНИЯ ТЯЖЕСТИ ОСТРОГО СИНДРОМА ВНУТРИСОСУДИСТОГО ДИССЕМИНИРОВАННОГО СВЕРТЫВАНИЯ КРОВИ С ИСПОЛЬЗОВАНИЕМ ГЕНЕТИЧЕСКОГО МОНИТОРИНГА | 2005 |
|
RU2303262C2 |
| Способ прогнозирования тромбоэмболических послеоперационных осложнений | 2020 |
|
RU2732246C1 |
| Способ оценки течения раннего послеоперационного периода у больных ургентными болезнями живота | 2020 |
|
RU2729730C1 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ ТРОМБОЭМБОЛИЧЕСКИХ ОСЛОЖНЕНИЙ | 2016 |
|
RU2621298C1 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ ФЛОТАЦИИ ТРОМБА В СИСТЕМЕ НИЖНЕЙ ПОЛОЙ ВЕНЫ С ДОПОЛНИТЕЛЬНЫМ ИСПОЛЬЗОВАНИЕМ МОЛЕКУЛЯРНО-ГЕНЕТИЧЕСКОГО МОНИТОРИНГА | 2012 |
|
RU2517215C2 |
| Способ прогнозирования развития осложнений при остром панкреатите в ранние сроки | 2024 |
|
RU2827086C1 |
| Способ оценки поражения кишечника при остром перитоните | 2022 |
|
RU2784413C1 |
| Способ персонифицированного прогнозирования развития осложнений у больных острыми заболеваниями живота | 2020 |
|
RU2750409C1 |
| Способ прогнозирования интенсивности системной воспалительной реакции при ургентных болезнях живота | 2020 |
|
RU2723736C1 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ ОТСЛОЙКИ ХОРИОНА И ПЛАЦЕНТЫ НА РАННИХ СРОКАХ БЕРЕМЕННОСТИ НА ОСНОВАНИИ ОПРЕДЕЛЕНИЯ ПОЛИМОРФИЗМА ГЕНА ИНГИБИТОРА АКТИВАТОРА ПЛАЗМИНОГЕНА I ТИПА (PAI-1) | 2012 |
|
RU2494400C1 |
Изобретение относится к медицине, а именно к абдоминальной хирургии и реаниматологии, и может быть использовано для персонифицированного прогнозирования развития тромбоэмболических осложнений в ургентной хирургии живота. Осуществляют забор венозной крови у больного острым животом в предоперационном и раннем послеоперационном периодах. В предоперационный период однократно выполняют анализ полиморфизма гена ингибитора активатора плазминогена - 675 4G/5G PAI-1. После хирургического вмешательства в динамике измеряют время реакции свертывания крови и содержание свободных жирных кислот и малонового диальдегида. На основе полученных данных рассчитывают индекс прогнозирования тромбоэмболических осложнений (iTEC). При значении iTEC до 3,5 включительно прогнозируют отсутствие формирования тромбоэмболических осложнений, от 3,6 до 4,9 – низкий риск развития тромбоэмболических осложнений, 5,0 и более – высокий риск тромбоэмболических осложнений. Способ обеспечивает повышение точности прогнозирования формирования тромбоэмболических последствий в раннем послеоперационном периоде за счет анализа биохимических и молекулярно-генетических параметров. 4 табл., 3 пр.
Способ персонифицированного прогнозирования развития тромбоэмболических осложнений в ургентной хирургии живота, заключающийся в заборе венозной крови у больного острым животом в предоперационном и раннем послеоперационном периодах, ее анализе, при этом в предоперационный период при поступлении пациента в клинику однократно выполняют анализ полиморфизма гена ингибитора активатора плазминогена - 675 4G/5G PAI-1, а измерение времени реакции свертывания крови (R) и определение содержания свободных жирных кислот и малонового диальдегида (MDA) производят после хирургического вмешательства в динамике, на основе полученных данных рассчитывают индекс прогнозирования тромбоэмболических осложнений (iTEC, index of thromboembolic complications) по формуле:
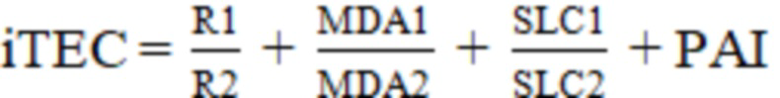 ,
,
где iTEC – индекс прогнозирования тромбоэмболических осложнений;
R1 – время реакции в текущий момент;
R2 – время реакции в предыдущий момент;
MDA1 – малоновый диальдегид в текущий момент;
MDA2 – малоновый диальдегид в предыдущий момент;
SLC1 – свободные жирные кислоты в текущий момент;
SLC2 – свободные жирные кислоты в предыдущий момент;
PAI – мутация гена ингибитора активатора плазминогена: 0 – отсутствие; 1 – имеется,
и при значении индекса прогнозирования тромбоэмболических осложнений до 3,5 включительно прогнозируют отсутствие возможности формирования тромбоэмболических осложнений, от 3,6 до 4,9 – низкий риск развития тромбоэмболических осложнений, 5,0 и более – высокий риск тромбоэмболических осложнений.
| Способ оценки течения раннего послеоперационного периода у больных ургентными болезнями живота | 2020 |
|
RU2729730C1 |
| Способ прогнозирования тромбоэмболических послеоперационных осложнений | 2020 |
|
RU2732246C1 |
| СПОСОБ РАННЕГО ПРОГНОЗИРОВАНИЯ РАЗВИТИЯ ТРОМБОЭМБОЛИЧЕСКИХ ОСЛОЖНЕНИЙ ПОСЛЕ ОПЕРАЦИЙ НА ОРГАНАХ БРЮШНОЙ ПОЛОСТИ | 2008 |
|
RU2367350C1 |
| FRANCIS C.W | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Arch Pathol Lab Med | |||
| Топчак-трактор для канатной вспашки | 1923 |
|
SU2002A1 |
Авторы
Даты
2023-11-21—Публикация
2023-01-30—Подача