Область техники
[0001] Настоящее изобретение относится к области химии и медицины. Более конкретно, оно относится к способу уменьшения или облегчения тромбоцитопении путем применения плинабулина.
Уровень техники
[0002] Тромбоциты, также называемые кровяными пластинками, представляют собой фрагменты безъядерных клеток, которые присутствуют в крови млекопитающих и опосредуют образование тромбов и гемостаз. Кроме того, тромбоциты выделяют факторы роста, которые играют важную роль в восстановлении и регенерации соединительных тканей и способствуют заживлению ран. Средняя продолжительность жизни тромбоцитов составляет примерно от 5 до 10 дней, а их физиологический уровень в крови у людей обычно составляет от 150000 до 450000 клеток на микролитр крови (клеток/мкл). Состояние, когда уровень циркулирующих тромбоцитов у пациента снижается до уровня ниже физиологического диапазона, известно как тромбоцитопения.
[0003] С тромбоцитопенией обычно связаны дефектное образование гемостатических пробок и кровотечения, при этом риск кровотечений обратно пропорционален количеству тромбоцитов. У онкологических больных тяжелая тромбоцитопения часто требует изменения режима химиотерапии, что ставит под угрозу достижение благоприятного результата противоопухолевого лечения. Следовательно, существует необходимость в разработке лекарственного средства, эффективного для лечения тромбоцитопении.
РАСКРЫТИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
[0004] Некоторые варианты реализации настоящего изобретения относятся к способу уменьшения тромбоцитопении, включающему введение плинабулина или его фармацевтически приемлемой соли субъекту, нуждающемуся в этом.
[0005] Некоторые варианты реализации настоящего изобретения относятся к способу увеличения выработки тромбоцитов у субъекта, включающему введение плинабулина или его фармацевтически приемлемой соли субъекту, нуждающемуся в этом.
[0006] Некоторые варианты реализации настоящего изобретения относятся к способу стимулирования выработки тромбоцитов у субъекта, включающему введение плинабулина или его фармацевтически приемлемой соли субъекту, нуждающемуся в этом.
[0007] Некоторые варианты реализации настоящего изобретения относятся к способу поддержания количества тромбоцитов на нормальном уровне у субъекта, подвергающегося химиотерапии или лучевой терапии, при этом указанный способ включает введение плинабулина или его фармацевтически приемлемой соли субъекту, нуждающемуся в этом.
[0008] Некоторые варианты реализации настоящего изобретения относятся к способу снижения частоты возникновения тромбоцитопении у субъекта, включающему введение плинабулина или его фармацевтически приемлемой соли субъекту, нуждающемуся в этом.
[0009] Некоторые варианты реализации настоящего изобретения относятся к способу увеличения количества тромбоцитов у пациента, получающего химиотерапевтическое лечение, включающему введение плинабулина или его фармацевтически приемлемой соли субъекту, нуждающемуся в этом.
[0010] Некоторые варианты реализации настоящего изобретения относятся к способу предотвращения тромбоцитопении у пациента, получающего химиотерапевтическое лечение, включающему введение плинабулина или его фармацевтически приемлемой соли субъекту, нуждающемуся в этом.
[0011] Некоторые варианты реализации настоящего изобретения относятся к способу увеличения количества тромбоцитов у субъекта, которому вводят гемцитабин, включающему введение плинабулина или его фармацевтически приемлемой соли субъекту, нуждающемуся в этом.
[0012] Некоторые варианты реализации настоящего изобретения относятся к способу лечения тромбоцитопении, вызванной гемцитабином, у субъекта, включающему: выявление пациента, страдающего раком молочной железы, раком яичника, немелкоклеточным раком легкого, раком поджелудочной железы или раком мочевого пузыря, и введение плинабулина в дозе в диапазоне от примерно 1 мг/м2 до примерно 50 мг/м2.
[0013] Некоторые варианты реализации настоящего изобретения относятся к способу стимуляции выживаемости тромбоцитов, включающему введение плинабулина в дозе в диапазоне от примерно 1 мг/м2 до примерно 50 мг/м2.
[0014] Некоторые варианты реализации настоящего изобретения относятся к фармацевтической композиции, содержащей от примерно 1 мг до примерно 100 мг плинабулина.
[0015] Некоторые варианты реализации настоящего изобретения относятся к стерильному контейнеру, содержащему гемцитабин и от примерно 1 мг до примерно 100 мг плинабулина, при этом гемцитабин и плинабулин находятся в двух отдельных стерильных контейнерах.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
[0016] На Фиг. 1 показано влияние плинабулина и пегфилграстима на гематологические эффекты, вызванные гемцитабином.
[0017] На Фиг. 2 показано изменение количества тромбоцитов с 1 дня по 15 день для группы, которой вводили 6 мг пегфилграстима, и группы, которой вводили 20 мг/м2 плинабулина.
[0018] На Фиг. 3 приведено количество пациентов в процентах со снижением количества тромбоцитов относительно базового уровня в циклах 1-4 более чем на 30%.
[0019] На Фиг. 4 приведено количество пациентов в процентах с тромбоцитопенией разных степеней в группах, получавших 5, 10 или 20 мг/м2 плинабулина, и в группе, получавшей пегфилграстим.
[0020] На Фиг. 5 приведено количество пациентов с тромбоцитопенией разных степеней в группах, получавших 20 мг/м2 плинабулина, и в группе, получавшей пегфилграстим.
ПОДРОБНОЕ ОПИСАНИЕ ПРЕДПОЧТИТЕЛЬНЫХ ВАРИАНТОВ РЕАЛИЗАЦИИ ИЗОБРЕТЕНИЯ
[0021] Некоторые варианты реализации настоящего изобретения относятся к способу уменьшения частоты возникновения тромбоцитопении, включающему введение плинабулина или его фармацевтически приемлемой соли субъекту, нуждающемуся в этом.
[0022] В некоторых вариантах реализации настоящего изобретения тромбоцитопения вызвана введением одного или более химиотерапевтических агентов или проведением лучевой терапии.
[0023] В некоторых вариантах реализации настоящего изобретения тромбоцитопения вызвана введением одного или более химиотерапевтических агентов.
[0024] В некоторых вариантах реализации настоящего изобретения тромбоцитопения вызвана введением гемцитабина или химиотерапевтической композиции, содержащей гемцитабин.
[0025] Некоторые варианты реализации настоящего изобретения относятся к способу увеличения количества тромбоцитов у пациента, получающего химиотерапевтическое лечение, включающему введение плинабулина или его фармацевтически приемлемой соли субъекту, нуждающемуся в этом.
[0026] Некоторые варианты реализации настоящего изобретения относятся к способу предотвращения тромбоцитопении у субъекта, получающего химиотерапевтическое лечение, включающему введение плинабулина или его фармацевтически приемлемой соли субъекту, нуждающемуся в этом.
[0027] Некоторые варианты реализации настоящего изобретения относятся к способу увеличения количества тромбоцитов у субъекта, которому вводят гемцитабин, включающему введение плинабулина или его фармацевтически приемлемой соли субъекту, нуждающемуся в этом.
[0028] Некоторые варианты реализации настоящего изобретения относятся к способу лечения тромбоцитопении, вызванной гемцитабином, у субъекта, включающему: выявление пациента, имеющего рак молочной железы, рак яичника, немелкоклеточный рак легкого, рак поджелудочной железы или рак мочевого пузыря, и введение плинабулина в дозе в диапазоне от примерно 1 мг/м2 до примерно 50 мг/м2.
[0029] Тромбоцитопению можно классифицировать в соответствии с общепринятыми терминологическими критериями Национального института рака (NCI-CTC). В норме количество тромбоцитов для пациента колеблется от 150×103 до 400×103/мл. В некоторых вариантах реализации настоящего изобретения тромбоцитопению диагностируют, когда количество тромбоцитов составляет <150×103/мл. В некоторых вариантах реализации настоящего изобретения выделяют тромбоцитопению 4 степеней, степень 1: от 75000 до 149000/мл, степень 2: от 50000 до 74000/мл, степень 3: от 25000 до 49000/мл и степень 4: <25000/мл.
[0030] В некоторых вариантах реализации настоящего изобретения тромбоцитопению классифицировали как легкую (количество тромбоцитов Z100 и <150×109/л), умеренную (количество тромбоцитов <50 и <100×109/л) и тяжелую (количество тромбоцитов <50×109/л).
[0031] В некоторых вариантах реализации настоящего изобретения у пациента метастатический рак молочной железы или рак молочной железы на поздней стадии, рак молочной железы на ранней стадии, немелкоклеточный рак легкого, рефрактерный метастатический рак предстательной железы. В некоторых вариантах реализации настоящего изобретения у пациента рак головы и шеи, рак легкого, рак желудка, рак толстой кишки, рак поджелудочной железы, рак предстательной железы, рак молочной железы, рак почки, рак мочевого пузыря, рак яичника, рак шейки матки, меланома, глиобластома, миелоидный лейкоз, миелома, лимфома или лейкоз. В некоторых вариантах реализации настоящего изобретения у пациента почечно-клеточная карцинома, злокачественная меланома, немелкоклеточный рак легкого (НМРЛ), рак яичника, лимфома Ходжкина или плоскоклеточная карцинома. В некоторых вариантах реализации настоящего изобретения у пациента рак молочной железы, рак толстой кишки, рак прямой кишки, рак легкого, рак предстательной железы, меланома, лейкоз, рак яичника, рак желудка, почечно-клеточная карцинома, рак печени, рак поджелудочной железы, лимфомы и миелома. В некоторых вариантах реализации настоящего изобретения у пациента солидная опухоль или опухоль системы крови (гематологический рак). В некоторых вариантах реализации настоящего изобретения у пациента острый лимфоцитарный лейкоз (ОЛЛ), острый миелоидный лейкоз (ОМЛ), рак надпочечников, базальный и плоскоклеточный рак кожи, рак желчных протоков, рак мочевого пузыря, рак костей, опухоли головного и спинного мозга, рак молочной железы, рак шейки матки, хронический лимфоцитарный лейкоз (ХЛЛ), хронический миелоидный лейкоз (ХМЛ), хронический миеломоноцитарный лейкоз (ХММЛ), колоректальный рак, рак эндометрия, рак пищевода, рак глаза (глазные меланома и лимфома), рак желчного пузыря, желудочно-кишечные карциноидные опухоли, стромальные опухоли желудочно-кишечного тракта (ГИСО), гестационная трофобластическая болезнь, лимфома Ходжкина, саркома Капоши, рак почки, рак гортани и гипофаренгиальный рак, лейкоз, рак печени, рак легкого, карциноидная опухоль легкого, лимфома, злокачественная мезотелиома, меланома кожи, рак кожи из клеток Меркеля, множественная миелома, миелодиспластические синдромы, рак носовой полости и носовых пазух, рак носоглотки, нейробластома, неходжкинская лимфома, немелкоклеточный рак легкого, рак полости рта и рак ротоглотки, остеосаркома, рак яичника, рак поджелудочной железы, рак предстательной железы, ретинобластома, рабдомиосаркома, рак слюнных желез, рак кожи, мелкоклеточный рак легкого, рак тонкой кишки, саркома мягких тканей, рак желудка, рак яичек, рак тимуса, рак щитовидной железы, саркома матки, рак влагалища, рак вульвы, макроглобулинемия Вальденстрема или опухоль Вильмса.
[0032] Некоторые варианты реализации настоящего изобретения относятся к способу лечения тромбоцитопении, вызванной химиотерапией (например, доцетакселом, гемцитабином), у субъекта с метастатическим раком молочной железы или раком молочной железы на поздней стадии, включающему выявление пациента с метастатическим раком молочной железы или раком молочной железы на поздней стадии с риском развития тромбоцитопении (например, тяжелой тромбоцитопении или тромбоцитопении степени 3 или 4); и введение фармацевтически эффективного количества плинабулина.
[0033] Некоторые варианты реализации настоящего изобретения относятся к способу лечения тромбоцитопении, вызванной химиотерапией (например, доцетакселом, гемцитабином, TAC или TC) у субъекта с немелкоклеточным раком легкого, включающему выявление пациента с немелкоклеточным раком легкого с риском развития тромбоцитопении (например, тяжелой тромбоцитопении или тромбоцитопении степени 3 или 4); и введение фармацевтически эффективного количества плинабулина.
[0034] Некоторые варианты реализации настоящего изобретения относятся к способу лечения тромбоцитопении, вызванной химиотерапией (например, доцетакселом, гемцитабином, TAC или TC) у субъекта с гормонорефрактерным метастатическим раком предстательной железы, включающему выявление пациента с гормонорефрактерным метастатическим раком предстательной железы с риском развития тромбоцитопении (например, тяжелой тромбоцитопении или тромбоцитопении степени 3 или 4); и введение фармацевтически эффективного количества плинабулина.
[0035] В некоторых вариантах реализации настоящего изобретения тромбоцитопения представляет собой тромбоцитопению 3 или 4 степени. В некоторых вариантах реализации настоящего изобретения тромбоцитопения представляет собой тромбоцитопению, вызванную лекарственными средствами. В некоторых вариантах реализации настоящего изобретения тромбоцитопения представляет собой тромбоцитопению, вызванную химиотерапией или лучевой терапией. В некоторых вариантах реализации настоящего изобретения тромбоцитопения представляет собой тромбоцитопению, вызванную таксанами. В некоторых вариантах реализации настоящего изобретения указанная тромбоцитопения не вызвана таксаном или химиотерапевтической композицией, содержащей таксан. В некоторых вариантах реализации настоящего изобретения указанная тромбоцитопения не вызвана доцетакселом.
[0036] Некоторые варианты реализации настоящего изобретения относятся к способу стимуляции выживаемости тромбоцитов, включающему введение плинабулина в дозе в диапазоне от примерно 1 мг/м2 до примерно 50 мг/м2. В некоторых вариантах реализации плинабулин вводят в дозе примерно 20 мг/м2.
[0037] В некоторых вариантах реализации настоящего изобретения у субъекта тромбоцитопения 1 степени. В некоторых вариантах реализации настоящего изобретения у субъекта тромбоцитопения 2 степени. В некоторых вариантах реализации настоящего изобретения у субъекта тромбоцитопения 3 степени. В некоторых вариантах реализации настоящего изобретения у субъекта тромбоцитопения 4 степени.
[0038] В некоторых вариантах реализации настоящего изобретения количество тромбоцитов у субъекта составляет менее 150000 /мм3. В некоторых вариантах реализации настоящего изобретения количество тромбоцитов у субъекта составляет менее 75000 /мм3. В некоторых вариантах реализации настоящего изобретения количество тромбоцитов у субъекта составляет менее 50000 /мм3. В некоторых вариантах реализации настоящего изобретения количество тромбоцитов у субъекта составляет менее 25000 /мм3. В некоторых вариантах реализации настоящего изобретения количество тромбоцитов у субъекта составляет менее 150000 /мм3 и более 75000 /мм3. В некоторых вариантах реализации настоящего изобретения количество тромбоцитов у субъекта составляет менее 75000 /мм3 и более 50000 /мм3. В некоторых вариантах реализации настоящего изобретения количество тромбоцитов у субъекта составляет менее 50000 /мм3 и более 25000 /мм3. В некоторых вариантах реализации настоящего изобретения количество тромбоцитов у субъекта составляет менее 25000 /мм3.
[0039] В некоторых вариантах реализации настоящего изобретения введение плинабулина помогает поддерживать количество тромбоцитов у пациента на уровне выше примерно 150000/мм3. В некоторых вариантах реализации настоящего изобретения введение плинабулина помогает поддерживать количество тромбоцитов у пациента на уровне выше примерно 75000/мм3. В некоторых вариантах реализации настоящего изобретения введение плинабулина помогает поддерживать количество тромбоцитов у пациента на уровне выше примерно 50000/мм3. В некоторых вариантах реализации настоящего изобретения введение плинабулина помогает поддерживать количество тромбоцитов у пациента на уровне выше примерно 25000/мм3. В некоторых вариантах реализации настоящего изобретения введение плинабулина помогает поддерживать количество тромбоцитов у пациента на уровне выше примерно 75000/мм3. В некоторых вариантах реализации настоящего изобретения введение плинабулина помогает поддерживать количество тромбоцитов у пациента в диапазоне от примерно 150000/мм3 до примерно 450000/мм3. В некоторых вариантах реализации настоящего изобретения введение плинабулина помогает поддерживать количество тромбоцитов у пациента в диапазоне от примерно 100000/мм3 до примерно 500000/мм3. В некоторых вариантах реализации настоящего изобретения введение плинабулина помогает поддерживать количество тромбоцитов у пациента в диапазоне от примерно 100000/мм3 до примерно 400000/мм3. В некоторых вариантах реализации настоящего изобретения введение плинабулина помогает поддерживать количество тромбоцитов у пациента в диапазоне от примерно 70000/мм3 до примерно 450000/мм3. В некоторых вариантах реализации настоящего изобретения введение плинабулина помогает поддерживать количество тромбоцитов у пациента в диапазоне от примерно 70000/мм3 до примерно 400000/мм3.
[0040] В некоторых вариантах реализации настоящего изобретения указанный способ включает введение гемцитабина. В некоторых вариантах реализации настоящего изобретения указанный способ включает введение одного или более дополнительных химиотерапевтических композиций указанному субъекту. В некоторых вариантах реализации настоящего изобретения указанный способ включает введение второй химиотерапевтической композиции. В некоторых вариантах реализации настоящего изобретения указанный способ включает введение третьей химиотерапевтической композиции. В некоторых вариантах реализации настоящего изобретения указанный способ включает введение четвертой химиотерапевтической композиции. В некоторых вариантах реализации настоящего изобретения указанный способ включает введение пятой химиотерапевтической композиции. В некоторых вариантах реализации настоящего изобретения указанный способ включает введение шестой химиотерапевтической композиции. В некоторых вариантах реализации настоящего изобретения указанный способ включает введение седьмой химиотерапевтической композиции. В некоторых вариантах реализации настоящего изобретения указанный способ включает введение восьмой химиотерапевтической композиции. В некоторых вариантах реализации настоящего изобретения указанная первая химиотерапевтическая композиция и каждая из дополнительных химиотерапевтических композиций являются разными. В некоторых вариантах реализации настоящего изобретения указанная первая химиотерапевтическая композиция и по меньшей мере одна из дополнительных химиотерапевтических композиций являются одинаковыми. В некоторых вариантах реализации настоящего изобретения указанная первая химиотерапевтическая композиция является такой же, как указанная вторая, указанная третья, указанная четвертая, указанная пятая, указанная шестая, указанная седьмая или указанная восьмая химиотерапевтическая композиция. В некоторых вариантах реализации настоящего изобретения указанная первая химиотерапевтическая композиция отличается от указанной второй, указанной третьей, указанной четвертой, указанной пятой, указанной шестой, указанной седьмой или указанной восьмой химиотерапевтической композиции.
[0041] В некоторых вариантах реализации настоящего изобретения способ, описанный в настоящем документе, может включать введение одной или более химиотерапевтических композиций. В некоторых вариантах реализации настоящего изобретения указанные одну или более химиотерапевтические композиции можно вводить после введения плинабулина. В некоторых вариантах реализации настоящего изобретения указанные одну или более химиотерапевтические композиции можно вводить до введения плинабулина. В некоторых вариантах реализации настоящего изобретения указанные одну или более химиотерапевтические композиции можно вводить одновременно с введением плинабулина.
[0042] В некоторых вариантах реализации настоящего изобретения указанная одна или более дополнительных химиотерапевтических композиций (например, вторая, третья, четвертая, пятая, шестая, седьмая или восьмая химиотерапевтическая композиция) может независимо содержать один или более агентов, выбранных из группы, состоящей из метотрексата, винбластина, доксорубицина, цисплатина, MVAC, доцетаксела, трастузумаба, циклофосфамида, паклитаксела, AC с сокращенными интервалами с последующим введением T (т.е. доксорубицин, циклофосфамид, паклитаксел), TAC (доцетаксел, доксорубицин, циклофосфамид), фторурацила, блеомицина, этопозида, винкристина, прокарбазина, преднизона, BEACOPP (блеомицин, этопозид, доксорубицин, циклофосфамид, винкристин, прокарбазин, преднизон), гемцитабина, ифосфамида, карбоплатина, ICE (ифосфамид, карбоплатин, этопозид), ритуксимаба, RICE (ритуксимаб, ифосфамид, карбоплатин, этопозид), CHOP-14 (циклофосфамид, доксорубицин, винкристин, преднизон), месны, новантрона, MINE (месна, ифосфамид, новантрон, этопозид), дексаметазона, цитарабина DHAP (дексаметазон, цисплатин, цитарабин), метилпреднизолона, ESHAP (этопозид, метилпреднизолон, цисплатин, цитарабин), HyperCVAD и ритуксимаба (циклофосфамид, винкристин, доксорубицин, дексаметазон, ритуксимаб), дакарбазина, винбластина, комбинации на основе дакарбазина (дакарбазин, цисплатин, винбластин), комбинации на основе дакарбазина с ИЛ-2 и интерфероном альфа (дакарбазин, цисплатин, винбластин, ИЛ-2, интерферон альфа), топотекана, MAID (месна, доксорубицин, ифосфамин, дакарбазин), VeIP (винбластин, ифосфамид, цисплатин), VIP (этопозид, ифосфамид, цисплатин), TIP (паклитаксел, ифосфамид, цисплатин),гемцитабина, CMF классического (циклофосфамид, метотрексат, фторурацил), АС (доксорубицин, циклофосфамид), FEC (фторурацил, эпирубицин, циклофосфамид), TC (доцетаксел, циклофосфамид), цисплатин/топотекан, паклитаксел/цисплатин, иринотекана, FOLFOX (фторурацил, лейковорин, оксалиплатин), иринотекан/цисплатин, эпирубицин/цисплатин/5-фторурацил, эпирубицин/цисплатин/капецитабин, DT-PACE (дексаметазон/талидомид/цисплатин/доксорубицин/циклофосфамид/этопозид), ET-PACE и бортезомиб, EPOCH (этопозид, преднизон, винкристин, циклофосфамид, доксорубицин), GDP (гемцитабин, дексаметазон, цисплатин), GDP и ритуксимаб, FMR (флударабин, митоксантрон, ритуксимаб, CHOP и ритуксимаб (циклофосфамид, доксорубицин, винкристин, преднизон, ритуксимаб), цисплатин/паклитаксел, цисплатин/винорелбин, цисплатин/доцетаксел, цисплатин/этопозид, карбоплатин/паклитаксел, карбоплатин/доцетаксел, FOLFIRINOX, кабазитаксела, этопозид/карбоплатин, этопозид/цисплатин. В некоторых вариантах реализации настоящего изобретения указанная одна или более дополнительных химиотерапевтических композиций (например, вторая, третья, четвертая, пятая, шестая, седьмая или восьмая химиотерапевтическая композиция) может независимо содержать один или более агентов, выбранных из группы, состоящей из метотрексата, винбластина, доксорубицина, цисплатина, доцетаксела, трастузумаба, циклофосфамида, паклитаксела, фторурацила, блеомицина, этопозида, винкристина, прокарбазина, преднизона, ифосфамида, карбоплатина, месны, новантрона, цитарабина метилпреднизолона, ритуксимаба дакарбазина, винбластина, топотекана, гемцитабина, иринотекана, эпирубицина, 5-фторурацила, капецитабина, бортезомиба и кабазитаксела.
[0043] Некоторые варианты реализации настоящего изобретения относятся к способу стимуляции выживаемости тромбоцитов, включающему введение плинабулина в дозе в диапазоне от примерно 1 мг/м2 до примерно 50 мг/м2. В некоторых вариантах реализации настоящего изобретения плинабулин вводят в дозе в диапазоне примерно 1-50 мг/м2 площади поверхности тела. В некоторых вариантах реализации настоящего изобретения плинабулин вводят в дозе в диапазоне примерно 1 - 2, 1 - 3, 1 - 4, 1 - 5, 1 - 6, 1 - 7, 1 - 8, 1 - 9, 1 - 10, 1 - 11, 1 - 12, 1 - 13, 1 - 13,75, 1 - 14, 1 - 15, 1 - 16, 1 - 17, 1 - 18, 1 - 19, 1 - 20, 1 - 22,5, 1 - 25, 1 - 27,5, 1 - 30, 1,5 - 2, 1,5 - 3, 1,5 - 4, 1,5 - 5, 1,5 - 6, 1,5 - 7, 1,5 - 8, 1,5 - 9, 1,5 - 10, 1,5 - 11, 1,5 - 12, 1,5 - 13, 1,5 - 13,75, 1,5 - 14, 1,5 - 15, 1,5 - 16, 1,5 - 17, 1,5 - 18, 1,5 - 19, 1,5 - 20, 1,5 - 22,5, 1,5 - 25, 1,5 - 27,5, 1,5 - 30, 2,5 - 2, 2,5 - 3, 2,5 - 4, 2,5 - 5, 2,5 - 6, 2,5 - 7, 2,5 - 8, 2,5 - 9, 2,5 - 10, 2,5 - 11, 2,5 - 12, 2,5 - 13, 2,5 - 13,75, 2,5 - 14, 2,5 - 15, 2,5 - 16, 2,5 - 17, 2,5 - 18, 2,5 - 19, 2,5 - 20, 2,5 - 22,5, 2,5 - 25, 2,5 - 27,5, 2,5 - 30, 2,5 - 7,5, 3 - 4, 3 - 5, 3 - 6, 3 - 7, 3 - 8, 3 - 9, 3 - 10, 3 - 11, 3 - 12, 3 - 13, 3 - 13,75, 3 - 14, 3 - 15, 3 - 16, 3 - 17, 3 - 18, 3 - 19, 3 - 20, 3 - 22,5, 3 - 25, 3 - 27,5, 3 - 30, 3,5 - 6,5, 3,5 - 13,75, 3,5 - 15, 2,5 - 17,5, 4 - 5, 4 - 6, 4 - 7, 4 - 8, 4 - 9, 4 - 10, 4 - 11, 4 - 12, 4 - 13, 4 - 13,75, 4 - 14, 4 - 15, 4 - 16, 4 - 17, 4 - 18, 4 - 19, 4 - 20, 4 - 22,5, 4 - 25, 4 - 27,5, 4 - 30, 5 - 6, 5 - 7, 5 - 8, 5 - 9, 5 - 10, 5 - 11, 5 - 12, 5 - 13, 5 - 13,75, 5 - 14, 5 - 15, 5 - 16, 5 - 17, 5 - 18, 5 - 19, 5 - 20, 5 - 22,5, 5 - 25, 5 - 27,5, 5 - 30, 6 - 7, 6 - 8, 6 - 9, 6 - 10, 6 - 11, 6 - 12, 6 - 13, 6 - 13,75, 6 - 14, 6 - 15, 6 - 16, 6 - 17, 6 - 18, 6 - 19, 6 - 20, 6 - 22,5, 6 - 25, 6 - 27,5, 6 - 30, 7 - 8, 7 - 9, 7 - 10, 7 - 11, 7 - 12, 7 - 13, 7 - 13,75, 7 - 14, 7 - 15, 7 - 16, 7 - 17, 7 - 18, 7 - 19, 7 - 20, 7 - 22,5, 7 - 25, 7 - 27,5, 7 - 30, 7,5 - 12,5, 7,5 - 13,5, 7,5 - 15, 8 - 9, 8 - 10, 8 - 11, 8 - 12, 8 - 13, 8 - 13,75, 8 - 14, 8 - 15, 8 - 16, 8 - 17, 8 - 18, 8 - 19, 8 - 20, 8 - 22,5, 8 - 25, 8 - 27,5, 8 - 30, 9 - 10, 9 - 11, 9 - 12, 9 - 13, 9 - 13,75, 9 - 14, 9 - 15, 9 - 16, 9 - 17, 9 - 18, 9 - 19, 9 - 20, 9 - 22,5, 9 - 25, 9 - 27,5, 9 - 30, 10 - 11, 10 - 12, 10 - 13, 10 - 13,75, 10 - 14, 10 - 15, 10 - 16, 10 - 17, 10 - 18, 10 - 19, 10 - 20, 10 - 22,5, 10 - 25, 10 - 27,5, 10 - 30, 11,5 - 15,5, 12,5 - 14,5, 7,5 - 22,5, 8,5 - 32,5, 9,5 - 15,5, 15,5 - 24,5, 5 - 35, 17,5 - 22,5, 22,5 - 32,5, 25 - 35, 25,5 - 24,5, 27,5 - 32,5, 2 - 20 до 2,5 - 22,5 или 9,5 - 21,5 мг/м2 площади поверхности тела. В некоторых вариантах реализации настоящего изобретения плинабулин вводят в дозе примерно 0,5, 1, 1,5, 2, 2,5, 3, 3,5, 4, 4,5, 5, 5,5, 6, 6,5, 7, 7,5, 8, 8,5, 9, 9,5, 10, 10,5, 11, 11,5, 12, 12,5, 13, 13,5, 14, 14,5, 15, 15,5, 16, 16,5, 17, 17,5, 18, 18,5, 19, 19,5, 20, 20,5, 21, 21,5, 22, 22,5, 23, 23,5, 24, 24,5, 25, 25,5, 26, 26,5, 27, 27,5, 28, 28,5, 29, 29,5, 30, 30,5, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40 мг/м2 площади поверхности тела. В некоторых вариантах реализации настоящего изобретения плинабулин вводят в дозе менее примерно 0,5, 1, 1,5, 2, 2,5, 3, 3,5, 4, 4,5, 5, 5,5, 6, 6,5, 7, 7,5, 8, 8,5, 9, 9,5, 10, 10,5, 11, 11,5, 12, 12,5, 13, 13,5, 14, 14,5, 15, 15,5, 16, 16,5, 17, 17,5, 18, 18,5, 19, 19,5, 20, 20,5, 21, 21,5, 22, 22,5, 23, 23,5, 24, 24,5, 25, 25,5, 26, 26,5, 27, 27,5, 28, 28,5, 29, 29,5, 30, 30,5, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40 мг/м2 площади поверхности тела. В некоторых вариантах реализации настоящего изобретения плинабулин вводят в дозе более примерно 0,5, 1, 1,5, 2, 2,5, 3, 3,5, 4, 4,5, 5, 5,5, 6, 6,5, 7, 7,5, 8, 8,5, 9, 9,5, 10, 10,5, 11, 11,5, 12, 12,5, 13, 13,5, 14, 14,5, 15, 15,5, 16, 16,5, 17, 17,5, 18, 18,5, 19, 19,5, 20, 20,5, 21, 21,5, 22, 22,5, 23, 23,5, 24, 24,5, 25, 25,5, 26, 26,5, 27, 27,5, 28, 28,5, 29, 29,5, 30, 30,5, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50 мг/м2 площади поверхности тела.
[0044] В некоторых вариантах реализации настоящего изобретения доза плинабулина составляет примерно 5 мг - 300 мг, 5 мг -200 мг, 7,5 мг - 200 мг, 10 мг - 100 мг, 15 мг - 100 мг, 20 мг - 100 мг, 30 мг - 100 мг, 40 мг - 100 мг, 10 мг - 80 мг, 15 мг - 80 мг, 20 мг - 80 мг, 30 мг - 80 мг, 40 мг - 80 мг, 10 мг - 60 мг, 15 мг - 60 мг, 20 мг - 60 мг, 30 мг - 60 мг или примерно 40 мг - 60 мг. В некоторых вариантах реализации настоящего изобретения вводят примерно 20 мг - 60 мг, 27 мг - 60 мг, 20 мг - 45 мг или 27 мг - 45 мг плинабулина. В некоторых вариантах реализации настоящего изобретения вводят примерно 5 мг - 7,5 мг, 5 мг - 9 мг, 5 мг - 10 мг, 5 мг - 12 мг, 5 мг - 14 мг, 5 мг - 15 мг, 5 мг - 16 мг, 5 мг - 18 мг, 5 мг - 20 мг, 5 мг - 22 мг, 5 мг - 24 мг, 5 мг - 26 мг, 5 мг - 28 мг, 5 мг - 30 мг, 5 мг - 32 мг, 5 мг - 34 мг, 5 мг - 36 мг, 5 мг - 38 мг, 5 мг - 40 мг, 5 мг - 42 мг, 5 мг - 44 мг, 5 мг - 46 мг, 5 мг - 48 мг, 5 мг - 50 мг, 5 мг - 52 мг, 5 мг - 54 мг, 5 мг - 56 мг, 5 мг - 58 мг, 5 мг - 60 мг, 7 мг - 7,7 мг, 7 мг - 9 мг, 7 мг - 10 мг, 7 мг - 12 мг, 7 мг - 14 мг, 7 мг - 15 мг, 7 мг - 16 мг, 7 мг - 18 мг, 7 мг - 20 мг, 7 мг - 22 мг, 7 мг - 24 мг, 7 мг - 26 мг, 7 мг - 28 мг, 7 мг - 30 мг, 7 мг - 32 мг, 7 мг - 34 мг, 7 мг - 36 мг, 7 мг - 38 мг, 7 мг - 40 мг, 7 мг - 42 мг, 7 мг - 44 мг, 7 мг - 46 мг, 7 мг - 48 мг, 7 мг - 50 мг, 7 мг - 52 мг, 7 мг - 54 мг, 7 мг - 56 мг, 7 мг - 58 мг, 7 мг - 60 мг, 9 мг - 10 мг, 9 мг - 12 мг, 9 мг - 14 мг, 9 мг - 15 мг, 9 мг - 16 мг, 9 мг - 18 мг, 9 мг - 20 мг, 9 мг - 22 мг, 9 мг - 24 мг, 9 мг - 26 мг, 9 мг - 28 мг, 9 мг - 30 мг, 9 мг - 32 мг, 9 мг - 34 мг, 9 мг - 36 мг, 9 мг - 38 мг, 9 мг - 40 мг, 9 мг - 42 мг, 9 мг - 44 мг, 9 мг - 46 мг, 9 мг - 48 мг, 9 мг - 50 мг, 9 мг - 52 мг, 9 мг - 54 мг, 9 мг - 56 мг, 9 мг - 58 мг, 9 мг - 60 мг, 10 мг - 12 мг, 10 мг - 14 мг, 10 мг - 15 мг, 10 мг - 16 мг, 10 мг - 18 мг, 10 мг - 20 мг, 10 мг - 22 мг, 10 мг - 24 мг, 10 мг - 26 мг, 10 мг - 28 мг, 10 мг - 30 мг, 10 мг - 32 мг, 10 мг - 34 мг, 10 мг - 36 мг, 10 мг - 38 мг, 10 мг - 40 мг, 10 мг - 42 мг, 10 мг - 44 мг, 10 мг - 46 мг, 10 мг - 48 мг, 10 мг - 50 мг, 10 мг - 52 мг, 10 мг - 54 мг, 10 мг - 56 мг, 10 мг - 58 мг, 10 мг - 60 мг, 12 мг - 14 мг, 12 мг - 15 мг, 12 мг - 16 мг, 12 мг - 18 мг, 12 мг - 20 мг, 12 мг - 22 мг, 12 мг - 24 мг, 12 мг - 26 мг, 12 мг - 28 мг, 12 мг - 30 мг, 12 мг - 32 мг, 12 мг - 34 мг, 12 мг - 36 мг, 12 мг - 38 мг, 12 мг - 40 мг, 12 мг - 42 мг, 12 мг - 44 мг, 12 мг - 46 мг, 12 мг - 48 мг, 12 мг - 50 мг, 12 мг - 52 мг, 12 мг - 54 мг, 12 мг - 56 мг, 12 мг - 58 мг, 12 мг - 60 мг, 15 мг - 16 мг, 15 мг - 18 мг, 15 мг - 20 мг, 15 мг - 22 мг, 15 мг - 24 мг, 15 мг - 26 мг, 15 мг - 28 мг, 15 мг - 30 мг, 15 мг - 32 мг, 15 мг - 34 мг, 15 мг - 36 мг, 15 мг - 38 мг, 15 мг - 40 мг, 15 мг - 42 мг, 15 мг - 44 мг, 15 мг - 46 мг, 15 мг - 48 мг, 15 мг - 50 мг, 15 мг - 52 мг, 15 мг - 54 мг, 15 мг - 56 мг, 15 мг - 58 мг, 15 мг - 60 мг, 17 мг - 18 мг, 17 мг - 20 мг, 17 мг - 22 мг, 17 мг - 24 мг, 17 мг - 26 мг, 17 мг - 28 мг, 17 мг - 30 мг, 17 мг - 32 мг, 17 мг - 34 мг, 17 мг - 36 мг, 17 мг - 38 мг, 17 мг - 40 мг, 17 мг - 42 мг, 17 мг - 44 мг, 17 мг - 46 мг, 17 мг - 48 мг, 17 мг - 50 мг, 17 мг - 52 мг, 17 мг - 54 мг, 17 мг - 56 мг, 17 мг - 58 мг, 17 мг - 60 мг, 20 мг - 22 мг, 20 мг - 24 мг, 20 мг - 26 мг, 20 мг - 28 мг, 20 мг - 30 мг, 20 мг - 32 мг, 20 мг - 34 мг, 20 мг - 36 мг, 20 мг - 38 мг, 20 мг - 40 мг, 20 мг - 42 мг, 20 мг - 44 мг, 20 мг - 46 мг, 20 мг - 48 мг, 20 мг - 50 мг, 20 мг - 52 мг, 20 мг - 54 мг, 20 мг - 56 мг, 20 мг - 58 мг, 20 мг - 60 мг, 22 мг - 24 мг, 22 мг - 26 мг, 22 мг - 28 мг, 22 мг - 30 мг, 22 мг - 32 мг, 22 мг - 34 мг, 22 мг - 36 мг, 22 мг - 38 мг, 22 мг - 40 мг, 22 мг - 42 мг, 22 мг - 44 мг, 22 мг - 46 мг, 22 мг - 48 мг, 22 мг - 50 мг, 22 мг - 52 мг, 22 мг - 54 мг, 22 мг - 56 мг, 22 мг - 58 мг, 22 мг - 60 мг, 25 мг - 26 мг, 25 мг - 28 мг, 25 мг - 30 мг, 25 мг - 32 мг, 25 мг - 34 мг, 25 мг - 36 мг, 25 мг - 38 мг, 25 мг - 40 мг, 25 мг - 42 мг, 25 мг - 44 мг, 25 мг - 46 мг, 25 мг - 48 мг, 25 мг - 50 мг, 25 мг - 52 мг, 25 мг - 54 мг, 25 мг - 56 мг, 25 мг - 58 мг, 25 мг - 60 мг, 27 мг - 28 мг, 27 мг - 30 мг, 27 мг - 32 мг, 27 мг - 34 мг, 27 мг - 36 мг, 27 мг - 38 мг, 27 мг - 40 мг, 27 мг - 42 мг, 27 мг - 44 мг, 27 мг - 46 мг, 27 мг - 48 мг, 27 мг - 50 мг, 27 мг - 52 мг, 27 мг - 54 мг, 27 мг - 56 мг, 27 мг - 58 мг, 27 мг - 60 мг, 30 мг - 32 мг, 30 мг - 34 мг, 30 мг - 36 мг, 30 мг - 38 мг, 30 мг - 40 мг, 30 мг - 42 мг, 30 мг - 44 мг, 30 мг - 46 мг, 30 мг - 48 мг, 30 мг - 50 мг, 30 мг - 52 мг, 30 мг - 54 мг, 30 мг - 56 мг, 30 мг - 58 мг, 30 мг - 60 мг, 33 мг - 34 мг, 33 мг - 36 мг, 33 мг - 38 мг, 33 мг - 40 мг, 33 мг - 42 мг, 33 мг - 44 мг, 33 мг - 46 мг, 33 мг - 48 мг, 33 мг - 50 мг, 33 мг - 52 мг, 33 мг - 54 мг, 33 мг - 56 мг, 33 мг - 58 мг, 33 мг - 60 мг, 36 мг - 38 мг, 36 мг - 40 мг, 36 мг - 42 мг, 36 мг - 44 мг, 36 мг - 46 мг, 36 мг - 48 мг, 36 мг - 50 мг, 36 мг - 52 мг, 36 мг - 54 мг, 36 мг - 56 мг, 36 мг - 58 мг, 36 мг - 60 мг, 40 мг - 42 мг, 40 мг - 44 мг, 40 мг - 46 мг, 40 мг - 48 мг, 40 мг - 50 мг, 40 мг - 52 мг, 40 мг - 54 мг, 40 мг - 56 мг, 40 мг - 58 мг, 40 мг - 60 мг, 43 мг - 46 мг, 43 мг - 48 мг, 43 мг - 50 мг, 43 мг - 52 мг, 43 мг - 54 мг, 43 мг - 56 мг, 43 мг - 58 мг, 42 мг - 60 мг, 45 мг - 48 мг, 45 мг - 50 мг, 45 мг - 52 мг, 45 мг - 54 мг, 45 мг - 56 мг, 45 мг - 58 мг, 45 мг - 60 мг, 48 мг - 50 мг, 48 мг - 52 мг, 48 мг - 54 мг, 48 мг - 56 мг, 48 мг - 58 мг, 48 мг - 60 мг, 50 мг - 52 мг, 50 мг - 54 мг, 50 мг - 56 мг, 50 мг - 58 мг, 50 мг - 60 мг, 52 мг - 54 мг, 52 мг - 56 мг, 52 мг - 58 мг или 52 мг - 60 мг плинабулина. В некоторых вариантах реализации настоящего изобретения доза плинабулина составляет более примерно 5 мг, примерно 10 мг, примерно 12,5 мг, примерно 13,5 мг, примерно 15 мг, примерно 17,5 мг, примерно 20 мг, примерно 22,5 мг, примерно 25 мг, примерно 27 мг, примерно 30 мг, примерно 40 мг, примерно 50 мг, примерно 60 мг, примерно 70 мг, примерно 80 мг, примерно 90 мг, примерно 100 мг, примерно 125 мг, примерно 150 мг или примерно 200 мг. В некоторых вариантах реализации настоящего изобретения доза плинабулина составляет менее примерно 5 мг, примерно 10 мг, примерно 12,5 мг, примерно 13,5 мг, примерно 15 мг, примерно 17,5 мг, примерно 20 мг, примерно 22,5 мг, примерно 25 мг, примерно 27 мг, примерно 30 мг, примерно 40 мг, примерно 50 мг, примерно 60 мг, примерно 70 мг, примерно 80 мг, примерно 90 мг, примерно 100 мг, примерно 125 мг, примерно 150 мг или примерно 200 мг.
[0045] Указанные химиотерапевтическую композицию или химиотерапевтический агент можно вводить в эффективном количестве, подходящем для лечения. В некоторых вариантах реализации настоящего изобретения способ, описанный в настоящем документе, включает введение одного или более химиотерапевтических агентов (например, гемцитабина) в дозе в диапазоне примерно 40-50 мг/кг в разделенных дозах в течение 2-5 дней. В некоторых вариантах реализации настоящего изобретения описанный в настоящем документе способ включает введение одного или более химиотерапевтических агентов в дозе в диапазоне примерно 10 - 30, 5 - 100, 10 - 200, 10 - 100, 10 - 90, 10 - 80, 10 - 70, 10 - 60, 10 - 50, 10 - 40, 10 - 30, 10 - 20, 20 - 200, 20 - 100, 20 - 90, 20 - 80, 20 - 70, 20 - 60, 20 - 50, 20 - 40, 20 - 30, 30 - 200, 30 - 100, 30 - 90, 30 - 80, 30 - 70, 30 - 60, 30 - 50, 30 - 40, 40 - 200, 40 - 100, 40 - 90, 40 - 80, 40 - 70, 40 - 60, 40 - 50, 50 - 300, 50 - 200, 50 - 100, 50 - 90, 50 - 80, 50 - 70, 50 - 60, 60 - 300, 60 - 200, 60 - 100, 60 - 90, 60 - 80, 60 - 70, 70 - 300, 70 - 200, 70 - 100, 70 - 90, 70 - 80, 80 - 300, 80 - 200, 80 - 100, 80 - 90 или 90 - 300, 90 - 200, 90 - 100, 100 - 500, 100 - 400, 100 - 300 или 100 - 200 мг/кг в течение 2 - 5 дней на цикл. В некоторых вариантах реализации настоящего изобретения способ, описанный в настоящем документе, включает введение одного или более химиотерапевтических агентов в дозе в диапазоне примерно 10-15 мг/кг в разделенных дозах в течение 7-10 дней или 3-5 мг/кг дважды в неделю. В некоторых вариантах реализации настоящего изобретения описанный в настоящем документе способ включает введение одного или более химиотерапевтических агентов в дозе в диапазоне примерно 10 - 30, 5 - 100, 10 - 200, 10 - 100, 10 - 90, 10 - 80, 10 - 70, 10 - 60, 10 - 50, 10 - 40, 10 - 30, 10 - 20, 20 - 200, 20 - 100, 20 - 90, 20 - 80, 20 - 70, 20 - 60, 20 - 50, 20 - 40, 20 - 30, 30 - 200, 30 - 100, 30 - 90, 30 - 80, 30 - 70, 30 - 60, 30 - 50, 30 - 40, 40 - 200, 40 - 100, 40 - 90, 40 - 80, 40 - 70, 40 - 60, 40 - 50, 50 - 300, 50 - 200, 50 - 100, 50 - 90, 50 - 80, 50 - 70, 50 - 60, 60 - 300, 60 - 200, 60 - 100, 60 - 90, 60 - 80, 60 - 70, 70 - 300, 70 - 200, 70 - 100, 70 - 90, 70 - 80, 80 - 300, 80 - 200, 80 - 100, 80 - 90 или 90 - 300, 90 - 200, 90 - 100, 100 - 500, 100 - 400, 100 - 300 или 100 - 200 мг/кг дважды в неделю. В некоторых вариантах реализации настоящего изобретения способ, описанный в настоящем документе, включает введение одного или более химиотерапевтических агентов в дозе в диапазоне примерно 1-5 мг/кг в день как в качестве для начальной дозы, так и в качестве поддерживающей дозы.
[0046] В некоторых вариантах реализации настоящего изобретения указанный способ дополнительно включает введение (например, гемцитабина) в дозе в диапазоне от примерно 500 до примерно 1500 мг/м2. В некоторых вариантах реализации настоящего изобретения указанный способ дополнительно включает введение (например, гемцитабина) в дозе в диапазоне от примерно 900 до примерно 1300 мг/м2. В некоторых вариантах реализации настоящего изобретения указанный способ дополнительно включает введение (например, гемцитабина) в дозе в диапазоне от примерно 500 до примерно 1500 мг/м2. В некоторых вариантах реализации настоящего изобретения указанный способ дополнительно включает введение (например, гемцитабина) в дозе примерно 1000 мг/м2. В некоторых вариантах реализации настоящего изобретения указанный способ дополнительно включает введение (например, гемцитабина) в дозе примерно 1250 мг/м2. В некоторых вариантах реализации настоящего изобретения гемцитабин вводят в 1-й и 8-й день каждого 21-дневного цикла. В некоторых вариантах реализации настоящего изобретения гемцитабин вводят в 1-й, 8-й и 15-й день каждого 21-дневного цикла. В некоторых вариантах реализации настоящего изобретения гемцитабин вводят ежедневно в течение недели. В некоторых вариантах реализации настоящего изобретения гемцитабин вводят один раз в неделю в течение семи недель, затем отдых в течение недели, затем один раз в неделю в течение трех недель.
[0047] В некоторых вариантах реализации настоящего изобретения указанный способ дополнительно включает введение одного или более химиотерапевтических агентов (например, гемцитабина) в дозе в диапазоне примерно 10 - 30, 5 - 100, 10 - 200, 10 - 100, 10 - 90, 10 - 80, 10 - 70, 10 - 60, 10 - 50, 10 - 40, 10 - 30, 10 - 20, 20 - 200, 20 - 100, 20 - 90, 20 - 80, 20 - 70, 20 - 60, 20 - 50, 20 - 40, 20 - 30, 30 - 200, 30 - 100, 30 - 90, 30 - 80, 30 - 70, 30 - 60, 30 - 50, 30 - 40, 40 - 200, 40 - 100, 40 - 90, 40 - 80, 40 - 70, 40 - 60, 40 - 50, 50 - 300, 50 - 200, 50 - 100, 50 - 90, 50 - 80, 50 - 70, 50 - 60, 60 - 300, 60 - 200, 60 - 100, 60 - 90, 60 - 80, 60 - 70, 70 - 300, 70 - 200, 70 - 100, 70 - 90, 70 - 80, 80 - 300, 80 - 200, 80 - 100, 80 - 90 или 90 - 300, 90 - 200, 90 - 100, 100 - 500, 100 - 400, 100 - 300 или 100 - 200 мг/м2 ежедневно в течение 5 дней на цикл. В некоторых вариантах реализации настоящего изобретения указанный способ дополнительно включает введение одного или более химиотерапевтических агентов в дозе 5, 10, 15, 20, 25, 30, 35, 40, 45, 50, 55, 60, 65, 70, 75, 80, 85, 90, 95, 100, 110, 120, 130, 140, 150, 160, 170, 180, 190, 200, 210, 220, 230, 240, 250, 260, 270, 280, 290, 300, 350, 400, 450, 500, 550, 600, 650, 700, 750, 800, 850, 900 или 1000 мг/м2 на цикл один раз в 4 недели. В некоторых вариантах реализации настоящего изобретения указанный способ дополнительно включает введение одного или более химиотерапевтических агентов в дозе 10 - 30, 5 - 100, 10 - 200, 10 - 100, 10 - 90, 10 - 80, 10 - 70, 10 - 60, 10 - 50, 10 - 40, 10 - 30, 10 - 20, 20 - 200, 20 - 100, 20 - 90, 20 - 80, 20 - 70, 20 - 60, 20 - 50, 20 - 40, 20 - 30, 30 - 200, 30 - 100, 30 - 90, 30 - 80, 30 - 70, 30 - 60, 30 - 50, 30 - 40, 40 - 200, 40 - 100, 40 - 90, 40 - 80, 40 - 70, 40 - 60, 40 - 50, 50 - 300, 50 - 200, 50 - 100, 50 - 90, 50 - 80, 50 - 70, 50 - 60, 60 - 300, 60 - 200, 60 - 100, 60 - 90, 60 - 80, 60 - 70, 70 - 300, 70 - 200, 70 - 100, 70 - 90, 70 - 80, 80 - 300, 80 - 200, 80 - 100, 80 - 90 или 90 - 300, 90 - 200, 90 - 100, 100 - 500, 100 - 400, 100 - 300 или 100 - 2000 мг/м2 на цикл один раз в 3 - 4 недели в зависимости от степени предшествующей лучевой терапии и/или предшествующей химиотерапии. В некоторых вариантах реализации настоящего изобретения указанный способ дополнительно включает введение одного или более химиотерапевтических агентов в дозе 50 мг/м2 на цикл, повторяемый каждые 4 недели. В некоторых вариантах реализации настоящего изобретения указанный способ дополнительно включает введение одного или более химиотерапевтических агентов (например, цисплатина) в дозе в диапазоне примерно 10 - 30, 5 - 100, 10 - 200, 10 - 100, 10 - 90, 10 - 80, 10 - 70, 10 - 60, 10 - 50, 10 - 40, 10 - 30, 10 - 20, 20 - 200, 20 - 100, 20 - 90, 20 - 80, 20 - 70, 20 - 60, 20 - 50, 20 - 40, 20 - 30, 30 - 200, 30 - 100, 30 - 90, 30 - 80, 30 - 70, 30 - 60, 30 - 50, 30 - 40, 40 - 200, 40 - 100, 40 - 90, 40 - 80, 40 - 70, 40 - 60, 40 - 50, 50 - 300, 50 - 200, 50 - 100, 50 - 90, 50 - 80, 50 - 70, 50 - 60, 60 - 300, 60 - 200, 60 - 100, 60 - 90, 60 - 80, 60 - 70, 70 - 300, 70 - 200, 70 - 100, 70 - 90, 70 - 80, 80 - 300, 80 - 200, 80 - 100, 80 - 90 или 90 - 300, 90 - 200, 90 - 100, 100 - 500, 100 - 400, 100 - 300 или 100 - 2000 мг/м2 на цикл каждые 3 недели или каждые 4 недели. В некоторых вариантах реализации настоящего изобретения указанный способ дополнительно включает введение одного или более химиотерапевтических агентов в дозе 30-70 или 40-60 мг/м2 на цикл один раз каждые 3 недели или каждые 4 недели. В некоторых вариантах реализации настоящего изобретения, когда пациенту вводят более одного химиотерапевтического агента, дозу каждого из вводимых химиотерапевтических агентов можно независимо выбрать из любого диапазона доз, описанных в настоящем документе.
[0048] В некоторых вариантах реализации настоящего изобретения один или более химиотерапевтических агентов вводят в количестве примерно 10 - 30, 5 - 100, 10 - 500, 10 - 400, 10 - 300, 10 - 200, 10 - 100, 10 - 90, 10 - 80, 10 - 70, 10 - 60, 10 - 50, 10 - 40, 10 - 30, 10 - 20, 20 - 500, 20 - 400, 20 - 300, 20 - 200, 20 - 100, 20 - 90, 20 - 80, 20 - 70, 20 - 60, 20 - 50, 20 - 40, 20 - 30, 30 - 500, 30 - 400, 30 - 300, 30 - 200, 30 - 100, 30 - 90, 30 - 80, 30 - 70, 30 - 60, 30 - 50, 30 - 40, 40 - 500, 40 - 400, 40 - 300, 40 - 200, 40 - 100, 40 - 90, 40 - 80, 40 - 70, 40 - 60, 40 - 50, 50 - 500, 50 - 400, 50 - 300, 50 - 200, 50 - 100, 50 - 90, 50 - 80, 50 - 70, 50 - 60, 60 - 500, 60 - 400, 60 - 300, 60 - 200, 60 - 100, 60 - 90, 60 - 80, 60 - 70, 70 - 500, 70 - 400, 70 - 300, 70 - 200, 70 - 100, 70 - 90, 70 - 80, 80 - 500, 80 - 400, 80 - 300, 80 - 200, 80 - 100, 80 - 90, 90 - 500, 90 - 400, 90 - 300, 90 - 200, 90 - 100, 100 - 500, 100 - 400, 100 - 300 или 100 - 200 мг на дозу.
[0049] В некоторых вариантах реализации настоящего изобретения плинабулин вводят до введения указанного химиотерапевтического агента или химиотерапевтической композиции. В некоторых вариантах реализации настоящего изобретения плинабулин вводят одновременно с указанным химиотерапевтическим агентом или химиотерапевтической композицией. В некоторых вариантах реализации настоящего изобретения плинабулин вводят после введения химиотерапевтического агента или химиотерапевтической композиции.
[0050] В некоторых вариантах реализации настоящего изобретения плинабулин вводят примерно через 1 минуту, 5 минут, 10 минут, 15 минут, 20 минут, 25 минут, 30 минут, 1 час, 1,5 часа, 2 часа, 2,5 часа, 3 часа, часа, 5 часов, 6 часов, 7 часов, 8 часов, 9 часов, 10 часов, 11 часов или 12 часов после введения химиотерапевтического агента или химиотерапевтической композиции. В некоторых вариантах реализации настоящего изобретения плинабулин вводят менее чем примерно через 1 минуту, 5 минут, 10 минут, 15 минут, 20 минут, 25 минут, 30 минут, 1 час, 1,5 часа, 2 часа, 2,5 часа, 3 часа, 4 часа, 5 часов, 6 часов, 7 часов, 8 часов, 9 часов, 10 часов, 11 часов, 12 часов, 13 часов, 14 часов, 15 часов, 16 часов, 17 часов, 18 часов, 19 часов, 20 часов, 21 час, 22 часа, 23 часа или 24 часа после введения химиотерапевтического агента или химиотерапевтической композиции. В некоторых вариантах реализации настоящего изобретения плинабулин вводят через более чем примерно 1 минуту, 5 минут, 10 минут, 15 минут, 20 минут, 25 минут, 30 минут, 1 час, 1,5 часа, 2 часа, 2,5 часа, 3 часа, 4 часа, 5 часов, 6 часов, 7 часов, 8 часов, 9 часов, 10 часов, 11 часов, 12 часов, 13 часов, 14 часов, 15 часов, 16 часов, 17 часов, 18 часов, 19 часов, 20 часов, 21 час, 22 часа, 23 часа или 24 часа после введения химиотерапевтического агента или химиотерапевтической композиции. В некоторых вариантах реализации настоящего изобретения плинабулин вводят примерно через 1 мин - 5 мин, 1 мин - 10 мин, 1 мин - 15 мин, 1 мин - 20 мин, 1 мин - 25 мин, 1 мин - 30 мин, 0,25 ч - 0,5 ч, 0,25 - 0,75 ч, 0,25 - 1 ч, 0,5 ч - 1 ч, 0,5 ч - 2 ч, 0,5 ч - 2,5 ч, 1 ч - 2 ч, 1 ч - 3 ч или 1 ч - 5 ч после введения химиотерапевтического агента или химиотерапевтической композиции.
[0051] В некоторых вариантах реализации настоящего изобретения, когда плинабулин вводят до введения химиотерапевтического агента или химиотерапевтической композиции, плинабулин вводят примерно за 1 мин - 5 мин, 1 мин - 10 мин, 1 мин - 15 мин, 1 мин - 20 мин, 1 мин - 25 мин, 1 мин - 30 мин, 0,25 ч - 0,5 ч, 0,25 - 0,75 ч, 0,25 - 1 ч, 0,5 ч - 1 ч, 0,5 ч - 2 ч, 0,5 ч - 2,5 ч, 1 ч - 2 ч, 1 ч - 3 ч или 1 ч - 5 ч до введения химиотерапевтического агента или химиотерапевтической композиции. В некоторых вариантах реализации настоящего изобретения плинабулин вводят примерно за 1 минуту, 5 минут, 10 минут, 15 минут, 20 минут, 25 минут, 30 минут, 1 час, 1,5 часа, 2 часа, 2,5 часа, 3 часа, часа, 5 часов, 6 часов, 7 часов, 8 часов, 9 часов, 10 часов, 11 часов или 12 часов до введения химиотерапевтического агента или химиотерапевтической композиции. В некоторых вариантах реализации настоящего изобретения плинабулин вводят за менее чем примерно 1 минуту, 5 минут, 10 минут, 15 минут, 20 минут, 25 минут, 30 минут, 1 час, 1,5 часа, 2 часа, 2,5 часа, 3 часа, 4 часа, 5 часов, 6 часов, 7 часов, 8 часов, 9 часов, 10 часов, 11 часов, 12 часов, 13 часов, 14 часов, 15 часов, 16 часов, 17 часов, 18 часов, 19 часов, 20 часов, 21 час, 22 часа, 23 часа или 24 часа до введения химиотерапевтического агента или химиотерапевтической композиции. В некоторых вариантах реализации настоящего изобретения плинабулин вводят за более чем примерно 1 минуту, 5 минут, 10 минут, 15 минут, 20 минут, 25 минут, 30 минут, 1 час, 1,5 часа, 2 часа, 2,5 часа, 3 часа, 4 часа, 5 часов, 6 часов, 7 часов, 8 часов, 9 часов, 10 часов, 11 часов, 12 часов, 13 часов, 14 часов, 15 часов, 16 часов, 17 часов, 18 часов, 19 часов, 20 часов, 21 час, 22 часа, 23 часа или 24 часа до введения химиотерапевтического агента или химиотерапевтической композиции. В некоторых вариантах реализации настоящего изобретения плинабулин вводят примерно за 30 минут до введения химиотерапевтического агента или химиотерапевтической композиции.
[0052] В некоторых вариантах реализации настоящего изобретения указанная схема лечения включает совместное введение химиотерапевтического агента или химиотерапевтической композиции и плинабулина в 1-й и 8-й день каждого 21-дневного цикла лечения. В некоторых вариантах реализации настоящего изобретения указанная схема лечения включает совместное введение химиотерапевтического агента или химиотерапевтической композиции и плинабулина в 1-й, 8-й и 15-й день каждого 21-дневного цикла лечения. В некоторых вариантах реализации настоящего изобретения указанная схема лечения включает совместное введение химиотерапевтического агента или химиотерапевтической композиции и плинабулина в 1-й день каждого 21-дневного цикла лечения. В некоторых вариантах реализации настоящего изобретения указанная схема лечения включает совместное введение химиотерапевтического агента или химиотерапевтической композиции и плинабулина в 1-й день каждого 21-дневного цикла лечения, и лечение повторяют в течение двух циклов. В некоторых вариантах реализации настоящего изобретения указанная схема лечения включает совместное введение химиотерапевтического агента или химиотерапевтической композиции и плинабулина в 1-й день каждого 21-дневного цикла лечения, и лечение повторяют в течение трех циклов. В некоторых вариантах реализации настоящего изобретения указанная схема лечения включает совместное введение химиотерапевтического агента или химиотерапевтической композиции и плинабулина в 1-й день каждого 21-дневного цикла лечения, и лечение повторяют в течение четырех циклов. В некоторых вариантах реализации настоящего изобретения указанная схема лечения включает совместное введение химиотерапевтического агента или химиотерапевтической композиции и плинабулина в 1-й день каждого 21-дневного цикла лечения, и лечение повторяют в течение пяти циклов. В некоторых вариантах реализации настоящего изобретения схема лечения включает совместное введение химиотерапевтического агента или химиотерапевтической композиции и плинабулина один раз в 3 недели. В некоторых вариантах реализации настоящего изобретения схема лечения включает совместное введение химиотерапевтического агента или химиотерапевтической композиции и плинабулина один раз в неделю, 2 недели, 3 недели, 4 недели, 5 недель, 6 недель, 7 недель или 8 недель. В некоторых вариантах реализации настоящего изобретения схема лечения включает совместное введение химиотерапевтического агента или химиотерапевтической композиции и плинабулина дважды в неделю, 2 недели, 3 недели, 4 недели, 5 недель, 6 недель, 7 недель или 8 недель. В некоторых вариантах реализации настоящего изобретения схема лечения включает совместное введение химиотерапевтического агента или химиотерапевтической композиции и плинабулина один раз каждую 1 неделю в цикле лечения продолжительностью 1 неделя, 2 недели, 3 недели, 4 недели, 5 недель, 6 недель, 7 недель или 8 недель. В некоторых вариантах реализации настоящего изобретения схема лечения включает совместное введение химиотерапевтического агента или химиотерапевтической композиции и плинабулина дважды каждую 1 неделю в цикле лечения продолжительностью 1 неделя, 2 недели, 3 недели, 4 недели, 5 недель, 6 недель, 7 недель или 8 недель. В некоторых вариантах реализации настоящего изобретения указанная схема лечения включает совместное введение химиотерапевтического агента или химиотерапевтической композиции и плинабулина в 1-й, 8-й и 15-й день 21-дневного цикла лечения. В некоторых вариантах реализации настоящего изобретения совместное введение химиотерапевтического агента или химиотерапевтической композиции и плинабулина включает введение химиотерапевтического агента перед введением плинабулина. В некоторых вариантах реализации настоящего изобретения совместное введение химиотерапевтического агента или химиотерапевтической композиции и плинабулина включает введение указанного химиотерапевтического агента или композиции примерно за 30 минут до введения плинабулина. В некоторых вариантах реализации настоящего изобретения совместное введение химиотерапевтического агента или химиотерапевтической композиции и плинабулина включает введение указанного химиотерапевтического агента или композиции примерно за 30 минут - 1 час до введения плинабулина. В некоторых вариантах реализации настоящего изобретения совместное введение химиотерапевтического агента или химиотерапевтической композиции и плинабулина включает введение указанного химиотерапевтического агента или композиции примерно за 30 минут - 2 часа до введения плинабулина. В некоторых вариантах реализации настоящего изобретения совместное введение химиотерапевтического агента или химиотерапевтической композиции и плинабулина включает введение химиотерапевтического агента после введения плинабулина. В некоторых вариантах реализации настоящего изобретения совместное введение химиотерапевтического агента или химиотерапевтической композиции и плинабулина включает введение химиотерапевтического агента одновременно с плинабулином. Химиотерапевтическая композиция, описанная в настоящем документе, может независимо представлять собой указанную первую, вторую, третью, четвертую, пятую, шестую, седьмую или восьмую химиотерапевтическую композицию. В некоторых вариантах реализации настоящего изобретения указанная схема лечения включает совместное введение химиотерапевтического агента или химиотерапевтической композиции и плинабулина каждый день в течение недели. В некоторых вариантах реализации настоящего изобретения указанная схема лечения включает совместное введение химиотерапевтического агента или химиотерапевтической композиции и плинабулина каждый день в течение 2 недель, 3 недель или 4 недель. В некоторых вариантах реализации настоящего изобретения указанная схема лечения включает совместное введение химиотерапевтического агента или химиотерапевтической композиции и плинабулина в 1-й день недельного лечения. В некоторых вариантах реализации настоящего изобретения указанная схема лечения включает совместное введение химиотерапевтического агента или химиотерапевтической композиции и плинабулина в 1-й день и 2-й день недельного лечения. В некоторых вариантах реализации настоящего изобретения указанная схема лечения включает совместное введение химиотерапевтического агента или химиотерапевтической композиции и плинабулина в 1-й день, 2-й день и 3-й день недельного лечения. В некоторых вариантах реализации настоящего изобретения указанная схема лечения включает совместное введение химиотерапевтического агента или химиотерапевтической композиции и плинабулина в 1-й день, 2-й день, 3-й день недельного лечения. В некоторых вариантах реализации настоящего изобретения указанная схема лечения включает совместное введение химиотерапевтического агента или химиотерапевтической композиции и плинабулина в 1-й день, 2-й день, 3-й день и 4-й день недельного лечения. В некоторых вариантах реализации настоящего изобретения указанная схема лечения включает совместное введение химиотерапевтического агента или химиотерапевтической композиции и плинабулина в 1-й день, 2-й день, 3-й день, 4-й день и 5-й день недельного лечения. В некоторых вариантах реализации настоящего изобретения указанная схема лечения включает совместное введение химиотерапевтического агента или химиотерапевтической композиции и плинабулина в 1-й день, 2-й день, 3-й день, 4-й день, 5-й день и 6-й день недельного лечения. В некоторых вариантах реализации настоящего изобретения указанная схема лечения включает совместное введение химиотерапевтического агента или химиотерапевтической композиции и плинабулина в 1-й день, 3-й день и 5-й день недельного лечения. В некоторых вариантах реализации настоящего изобретения в каждый день введения можно применять одну и ту же химиотерапевтическую композицию или разные. В некоторых вариантах реализации настоящего изобретения химиотерапевтическая композиция, применяемая в первый день введения, отличается от химиотерапевтической композиции, применяемой в остальные дни введения. В некоторых вариантах реализации настоящего изобретения химиотерапевтическая композиция, применяемая в первый день введения, является той же самой, что химиотерапевтическая композиция, применяемая во второй день введения, или отличается от нее. В некоторых вариантах реализации настоящего изобретения химиотерапевтическая композиция, применяемая в первый день введения, является той же самой, что химиотерапевтическая композиция, применяемая в третий день введения, или отличается от нее. В некоторых вариантах реализации настоящего изобретения химиотерапевтическая композиция, применяемая в первый день введения, является той же самой, что химиотерапевтическая композиция, применяемая в четвертый день введения, или отличается от нее. В некоторых вариантах реализации настоящего изобретения химиотерапевтическая композиция, применяемая в первый день введения, является той же самой, что химиотерапевтическая композиция, применяемая в пятый день введения, или отличается от нее. В некоторых вариантах реализации настоящего изобретения химиотерапевтическая композиция, применяемая в первый день введения, является той же самой, что химиотерапевтическая композиция, применяемая в шестой день введения, или отличается от нее. В некоторых вариантах реализации настоящего изобретения химиотерапевтическая композиция, применяемая в первый день введения, является той же самой, что химиотерапевтическая композиция, применяемая в седьмой день введения, или отличается от нее.
[0053] В некоторых вариантах реализации настоящего изобретения указанная схема лечения включает введение химиотерапевтического агента или химиотерапевтической композиции (например, первой, второй, третьей, четвертой, пятой, шестой, седьмой или восьмой) один раз каждые 3 недель. В некоторых вариантах реализации настоящего изобретения указанная схема лечения включает введение химиотерапевтического агента или химиотерапевтической композиции один раз в неделю, 2 недели, 3 недели, 4 недели, 5 недель, 6 недель, 7 недель или 8 недель. В некоторых вариантах реализации настоящего изобретения указанная схема лечения включает введение химиотерапевтического агента или химиотерапевтической композиции два раза в неделю, 2 недели, 3 недели, 4 недели, 5 недель, 6 недель, 7 недель или 8 недель. В некоторых вариантах реализации настоящего изобретения схема лечения включает введение химиотерапевтического агента или химиотерапевтической композиции один раз каждую 1 неделю в цикле лечения продолжительностью 1 неделя, 2 недели, 3 недели, 4 недели, 5 недель, 6 недель, 7 недель или 8 недель. В некоторых вариантах реализации настоящего изобретения схема лечения включает введение химиотерапевтического агента или химиотерапевтической композиции два раза каждую 1 неделю в цикле лечения продолжительностью 1 неделя, 2 недели, 3 недели, 4 недели, 5 недель, 6 недель, 7 недель или 8 недель. В некоторых вариантах реализации настоящего изобретения схема лечения включает введение химиотерапевтического агента или химиотерапевтической композиции три раза в неделю (например, день 1, 2, 3, или день 1, 3, 5) в цикле лечения продолжительностью 1 неделя, 2 недели, 3 недели, 4 недели, 5 недель, 6 недель, 7 недель или 8 недель. В некоторых вариантах реализации настоящего изобретения указанная схема лечения включает введение химиотерапевтического агента или химиотерапевтической композиции в 1-й, 8-й и 15-й день 21-дневного цикла лечения. Химиотерапевтическая композиция, описанная в настоящем документе, может независимо представлять собой указанную первую, вторую, третью, четвертую, пятую, шестую, седьмую или восьмую химиотерапевтическую композицию. В некоторых вариантах реализации настоящего изобретения указанная схема лечения включает введение химиотерапевтического агента или химиотерапевтической композиции каждый день в течение недели. В некоторых вариантах реализации настоящего изобретения указанная схема лечения включает введение химиотерапевтического агента или химиотерапевтической композиции каждый день недели в течение 2 недель, 3 недель или 4 недель. В некоторых вариантах реализации настоящего изобретения указанная схема лечения включает введение химиотерапевтического агента или химиотерапевтической композиции в 1-й день недельного лечения. В некоторых вариантах реализации настоящего изобретения указанная схема лечения включает введение химиотерапевтического агента или химиотерапевтической композиции в 1-й день и 2-й день недельного лечения. В некоторых вариантах реализации настоящего изобретения указанная схема лечения включает введение химиотерапевтического агента или химиотерапевтической композиции в 1-й день, 1-й день и 3-й день недельного лечения. В некоторых вариантах реализации настоящего изобретения указанная схема лечения включает введение химиотерапевтического агента или химиотерапевтической композиции в 1-й день, 3-й день и 5-й день недельного лечения. В некоторых вариантах реализации настоящего изобретения указанная схема лечения включает введение химиотерапевтического агента или химиотерапевтической композиции в 1-й день, 2-й день, 3-й день и 4-й день недельного лечения. В некоторых вариантах реализации настоящего изобретения указанная схема лечения включает введение химиотерапевтического агента или химиотерапевтической композиции в 1-й день, 2-й день, 3-й день, 4-й день и 5-й день недельного лечения. В некоторых вариантах реализации настоящего изобретения указанная схема лечения включает введение химиотерапевтического агента или химиотерапевтической композиции в 1-й день, 2-й день, 3-й день, 4-й день, 5-й день и 6-й день недельного лечения.
[0054] В некоторых вариантах реализации настоящего изобретения указанная схема лечения включает введение плинабулина один раз каждые 3 недели. В некоторых вариантах реализации настоящего изобретения указанная схема лечения включает введение плинабулина один раз в неделю, 2 недели, 3 недели, 4 недели, 5 недель, 6 недель, 7 недель или 8 недель. В некоторых вариантах реализации настоящего изобретения указанная схема лечения включает введение плинабулина два раза в неделю, 2 недели, 3 недели, 4 недели, 5 недель, 6 недель, 7 недель или 8 недель. В некоторых вариантах реализации настоящего изобретения указанная схема лечения включает введение плинабулина один раз каждую 1 неделю в цикле лечения продолжительностью 1 неделя, 2 недели, 3 недели, 4 недели, 5 недель, 6 недель, 7 недель или 8 недель. В некоторых вариантах реализации настоящего изобретения указанная схема лечения включает введение плинабулина два раза каждую 1 неделю в цикле лечения продолжительностью 1 неделя, 2 недели, 3 недели, 4 недели, 5 недель, 6 недель, 7 недель или 8 недель. В некоторых вариантах реализации настоящего изобретения указанная схема лечения включает введение плинабулина три раза каждую 1 неделю (например, день 1, 2, 3, или день 1, 3, 5) в цикле лечения продолжительностью 1 неделя, 2 недели, 3 недели, 4 недели, 5 недель, 6 недель, 7 недель или 8 недель. В некоторых вариантах реализации настоящего изобретения указанная схема лечения включает введение плинабулина в 1-й, 8-й и 15-й день 21-дневного цикла лечения. Химиотерапевтическая композиция, описанная в настоящем документе, может независимо представлять собой указанную первую, вторую, третью, четвертую, пятую, шестую, седьмую или восьмую химиотерапевтическую композицию. В некоторых вариантах реализации настоящего изобретения указанная схема лечения включает введение плинабулина каждый день в течение недели. В некоторых вариантах реализации настоящего изобретения указанная схема лечения включает введение плинабулина каждый день недели в течение 2 недель, 3 недель или 4 недель. В некоторых вариантах реализации настоящего изобретения указанная схема лечения включает введение плинабулина в 1-й день недельного лечения. В некоторых вариантах реализации настоящего изобретения указанная схема лечения включает введение плинабулина в 1-й день и 2-й день недельного лечения. В некоторых вариантах реализации настоящего изобретения указанная схема лечения включает введение плинабулина в 1-й день, 2-й день и 3-й день недельного лечения. В некоторых вариантах реализации настоящего изобретения указанная схема лечения включает введение плинабулина в 1-й день, 3-й день и 5-й день недельного лечения. В некоторых вариантах реализации настоящего изобретения указанная схема лечения включает введение плинабулина в 1-й день, 2-й день, 3-й день и 4-й день недельного лечения. В некоторых вариантах реализации настоящего изобретения указанная схема лечения включает введение плинабулина в 1-й день, 2-й день, 3-й день, 4-й день и 5-й день недельного лечения. В некоторых вариантах реализации настоящего изобретения указанная схема лечения включает введение плинабулина в 1-й день, 2-й день, 3-й день, 4-й день, 5-й день и 6-й день недельного лечения. В некоторых вариантах реализации настоящего изобретения указанная схема лечения включает введение плинабулина в 1-й день 21-дневного цикла лечения примерно через 30 минут после введения химиотерапевтического агента.
[0055] Указанный цикл лечения можно повторять до тех пор, пока субъект его переносит с клинической точки зрения. В некоторых вариантах реализации настоящего изобретения указанный цикл лечения химиотерапевтическим агентом и плинабулином повторяют n раз, где n представляет собой целое число в диапазоне от 2 до 30. В некоторых вариантах реализации настоящего изобретения n равно 2, 3, 4, 5, 6, 7, 8, 9 или 10. В некоторых вариантах реализации настоящего изобретения новый цикл лечения можно начинать сразу после завершения предыдущего цикла лечения. В некоторых вариантах реализации настоящего изобретения новый цикл лечения можно начинать по истечении периода времени после завершения предыдущего цикла лечения. В некоторых вариантах реализации настоящего изобретения новый цикл лечения можно начинать через 1 неделю, 2 недели, 3 недели, 4 недели, 5 недель, 6 недель или 7 недель после завершения предыдущего цикла лечения.
[0056] В некоторых вариантах реализации настоящего изобретения применение плинабулина может снизить частоту возникновения тромбоцитопении (т.е. тромбоцитопении 1, 2, 3 или 4 степени) на по меньшей мере примерно 5%, 10%, 12,5%, 15%, 17,5%, 20%, 22,5%, 25%, 27,5%, 30%, 32,5%, 35%, 37,5%, 40%, 42,5%, 45%, 47,5%, 50%, 52,5%, 55%, 57,5%, 60%, 62,5%, 65%, 67,5%, 70%, 72,5%, 75%, 77,5%, 80%, 82,5%, 85%, 87,5%, 90%, 95% или 100%. В некоторых вариантах реализации настоящего изобретения применение плинабулина может снизить частоту возникновения тромбоцитопении (т.е. тромбоцитопении 1, 2, 3 или 4 степени) на по меньшей мере примерно 5%, 10%, 12,5%, 15%, 17,5%, 20%, 22,5%, 25%, 27,5%, 30%, 32,5%, 35%, 37,5%, 40%, 42,5%, 45%, 47,5%, 50%, 52,5%, 55%, 57,5%, 60%, 62,5%, 65%, 67,5%, 70%, 72,5%, 75%, 77,5%, 80%, 82,5%, 85%, 87,5%, 90%, 95% или 100%. В некоторых вариантах реализации настоящего изобретения применение плинабулина может снизить частоту возникновения тромбоцитопении (т.е. тромбоцитопении 1, 2, 3 или 4 степени) на менее чем примерно 5%, 10%, 12,5%, 15%, 17,5%, 20%, 22,5%, 25%, 27,5%, 30%, 32,5%, 35%, 37,5%, 40%, 42,5%, 45%, 47,5%, 50%, 52,5%, 55%, 57,5%, 60%, 62,5%, 65%, 67,5%, 70%, 72,5%, 75%, 77,5%, 80%, 82,5%, 85%, 87,5%, 90%, 95% или 100%. В некоторых вариантах реализации настоящего изобретения применение плинабулина может снизить частоту возникновения тромбоцитопении (т.е. тромбоцитопении 1, 2, 3 или 4 степени) примерно на 5% - 40%, 10% - 40%, 12,5% - 40%, 5% - 50%, 10% - 50%, 12,5% - 50%, 15% - 50%, 17,5% - 50%, 20% - 50%, 25% - 50%, 27,5% - 50%, 30% - 50%, 5% - 60%, 10%-60%, 12,5% - 60%, 15% - 60%, 17,5% - 60%, 20% - 60%, 25% - 60%, 27,5% - 60%, 30% - 60%, 35% - 60%, 37,5% - 60%, 40% - 60%, 45% - 70% или 50% - 80%.
[0057] Как тромбоцитопения (ТП), так и снижение количества тромбоцитов на ≥30% связаны с повышенной смертностью, заболеваемостью и продолжительностью госпитализации (LOS) для пациентов, как описано в J Pediatr Hematol Oncol, V33:8 (декабрь 2011 года), содержание указанного документа полностью включено посредством ссылки. Плинабулин может снизить частоту возникновения тромбоцитопении как минимум на 30%. В некоторых вариантах реализации настоящего изобретения плинабулин может предотвратить снижение количества тромбоцитов более чем на 30%. В некоторых вариантах реализации настоящего изобретения плинабулин может предотвратить снижение количества тромбоцитов более чем на 30%. В некоторых вариантах реализации настоящего изобретения плинабулин может предотвратить снижение количества тромбоцитов более чем на 30%. В некоторых вариантах реализации настоящего изобретения плинабулин может предотвратить снижение количества тромбоцитов более чем на 20%. В некоторых вариантах реализации настоящего изобретения плинабулин может предотвратить снижение количества тромбоцитов более чем на 40%. В некоторых вариантах реализации настоящего изобретения плинабулин может предотвратить снижение количества тромбоцитов более чем на 50%.
[0058] В некоторых вариантах реализации настоящего изобретения применение плинабулина может быть примерно на 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90%, 100%, 110%, 120%, 130%, 140%, 150%, 160%, 170%, 180%, 190%, 200% более эффективным в снижении частоты возникновения тромбоцитопении (например, степени 1, 2, 3 или 4), чем применение пегфилграстима. В некоторых вариантах реализации настоящего изобретения применение плинабулина может быть более чем примерно на 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90%, 100%, 110%, 120%, 130%, 140%, 150%, 160%, 170%, 180%, 190%, 200%, 225%, 250%, 275% или 300% более эффективным в снижении частоты возникновения тромбоцитопении (например, степени 1, 2, 3 или 4), чем применение пегфилграстима. В некоторых вариантах реализации настоящего изобретения применение плинабулина может быть менее чем примерно на 10%, 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90%, 100%, 110%, 120%, 130%, 140%, 150%, 160%, 170%, 180%, 190%, 200%, 225%, 250%, 275%, 300%, 350% 400%, 450% или 500% более эффективным в снижении частоты возникновения тромбоцитопении (например, степени 1, 2, 3 или 4), чем применение пегфилграстима. В некоторых вариантах реализации настоящего изобретения применение плинабулина может быть более чем примерно на 10%, 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90%, 100%, 110%, 120%, 130%, 140%, 150%, 160%, 170%, 180%, 190%, 200%, 225%, 250%, 275%, 300%, 350% 400%, 450% или 500% более эффективным в снижении частоты возникновения тромбоцитопении (например, степени 1, 2, 3 или 4), чем применение пегфилграстима.
[0059] В некоторых вариантах реализации настоящего изобретения применение плинабулина может снижать длительность тромбоцитопении на примерно 5%, 10%, 12,5%, 15%, 17,5%, 20%, 22,5%, 25%, 27,5%, 30%, 32,5%, 35%, 37,5%, 40%, 42,5%, 45%, 47,5%, 50%, 52,5%, 55%, 57,5%, 60%, 62,5%, 65%, 67,5%, 70%, 72,5%, 75%, 77,5%, 80%, 82,5%, 85%, 87,5%, 90%, 95%, 100%, 110%, 120%, 130%, 140%, 150%, 160%, 170%, 180%, 190%, 200%, 225%, 250%, 275%, 300%, 350% 400%, 450%, 500%, 600%, 700%, 800%, 900%, в 10 раз, 11 раз, 12 раз, 13 раз, 14 раз, 15 раз или 16 раз. В некоторых вариантах реализации настоящего изобретения применение плинабулина может снижать длительность тромбоцитопении на более чем примерно 5%, 10%, 12,5%, 15%, 17,5%, 20%, 22,5%, 25%, 27,5%, 30%, 32,5%, 35%, 37,5%, 40%, 42,5%, 45%, 47,5%, 50%, 52,5%, 55%, 57,5%, 60%, 62,5%, 65%, 67,5%, 70%, 72,5%, 75%, 77,5%, 80%, 82,5%, 85%, 87,5%, 90%, 95%, 100%, 110%, 120%, 130%, 140%, 150%, 160%, 170%, 180%, 190%, 200%, 225%, 250%, 275%, 300%, 350% 400%, 450%, 500%, 600%, 700%, 800%, 900%, в 10 раз, 11 раз, 12 раз, 13 раз, 14 раз, 15 раз или 16 раз. В некоторых вариантах реализации настоящего изобретения применение плинабулина может снижать длительность тромбоцитопении на менее чем примерно 5%, 10%, 12,5%, 15%, 17,5%, 20%, 22,5%, 25%, 27,5%, 30%, 32,5%, 35%, 37,5%, 40%, 42,5%, 45%, 47,5%, 50%, 52,5%, 55%, 57,5%, 60%, 62,5%, 65%, 67,5%, 70%, 72,5%, 75%, 77,5%, 80%, 82,5%, 85%, 87,5%, 90%, 95%, 100%, 110%, 120%, 130%, 140%, 150%, 160%, 170%, 180%, 190%, 200%, 225%, 250%, 275%, 300%, 350% 400%, 450%, 500%, 600%, 700%, 800%, 900%, в 10 раз, 11 раз, 12 раз, 13 раз, 14 раз, 15 раз или 16 раз. В некоторых вариантах реализации настоящего изобретения применение плинабулина может снижать длительность тромбоцитопении в диапазоне примерно от 5% до 15 раз, от 20% до 10 раз или от 50% до 500%.
[0060] В некоторых вариантах реализации настоящего изобретения у пациентов, которые получают лечение гемцитабином, применение плинабулина может привести к повышению количества тромбоцитов на примерно 5%, 10%, 12,5%, 15%, 17,5%, 20%, 22,5%, 25%, 27,5%, 30%, 32,5%, 35%, 37,5%, 40%, 42,5%, 45%, 47,5%, 50%, 52,5%, 55%, 57,5%, 60%, 62,5%, 65%, 67,5%, 70%, 72,5%, 75%, 77,5%, 80%, 82,5%, 85%, 87,5%, 90%, 95%, 100%, 110%, 120%, 130%, 140%, 150%, 160%, 170%, 180%, 190%, 200%, 225%, 250%, 275%, 300%, 350% 400%, 450%, 500%, 600%, 700%, 800%, 900%, в 10 раз, 11 раз, 12 раз, 13 раз, 14 раз, 15 раз или 16 раз быстрее. В некоторых вариантах реализации настоящего изобретения у пациентов, которые получают лечение гемцитабином, применение плинабулина может привести к повышению количества тромбоцитов на по меньшей мере примерно 5%, 10%, 12,5%, 15%, 17,5%, 20%, 22,5%, 25%, 27,5%, 30%, 32,5%, 35%, 37,5%, 40%, 42,5%, 45%, 47,5%, 50%, 52,5%, 55%, 57,5%, 60%, 62,5%, 65%, 67,5%, 70%, 72,5%, 75%, 77,5%, 80%, 82,5%, 85%, 87,5%, 90%, 95%, 100%, 110%, 120%, 130%, 140%, 150%, 160%, 170%, 180%, 190%, 200%, 225%, 250%, 275%, 300%, 350% 400%, 450%, 500%, 600%, 700%, 800%, 900%, в 10 раз, 11 раз, 12 раз, 13 раз, 14 раз, 15 раз или 16 раз быстрее. В некоторых вариантах реализации настоящего изобретения у пациентов, которые получают лечение гемцитабином, применение плинабулина может привести к повышению количества тромбоцитов менее чем примерно на 5%, 10%, 12,5%, 15%, 17,5%, 20%, 22,5%, 25%, 27,5%, 30%, 32,5%, 35%, 37,5%, 40%, 42,5%, 45%, 47,5%, 50%, 52,5%, 55%, 57,5%, 60%, 62,5%, 65%, 67,5%, 70%, 72,5%, 75%, 77,5%, 80%, 82,5%, 85%, 87,5%, 90%, 95%, 100%, 110%, 120%, 130%, 140%, 150%, 160%, 170%, 180%, 190%, 200%, 225%, 250%, 275%, 300%, 350% 400%, 450%, 500%, 600%, 700%, 800%, 900%, в 10 раз, 11 раз, 12 раз, 13 раз, 14 раз, 15 раз или 16 раз. Для пациентов, получающих лечение гемцитабином, в некоторых вариантах реализации настоящего изобретения применение плинабулина может приводить к увеличению количества тромбоцитов в диапазоне примерно от 5% до 15 раз, от 20% до 10 раз или от 50% до 500%.
[0061] В некоторых вариантах реализации настоящего изобретения плинабулин может быть примерно на 5%, 10%, 12,5%, 15%, 17,5%, 20%, 22,5%, 25%, 27,5%, 30%, 32,5%, 35%, 37,5%, 40%, 42,5%, 45%, 47,5%, 50%, 52,5%, 55%, 57,5%, 60%, 62,5%, 65%, 67,5%, 70%, 72,5%, 75%, 77,5%, 80%, 82,5%, 85%, 87,5%, 90%, 95%, 100%, 110%, 120%, 130%, 140%, 150%, 160%, 170%, 180%, 190%, 200%, 225%, 250%, 275%, 300%, 350% 400%, 450%, 500%, 600%, 700%, 800%, 900%, в 10 раз, 11 раз, 12 раз, 13 раз, 14 раз, 15 раз или 16 раз более эффективен, чем Г-КСФ (например, пегфилграстим или филграстим), в отношении снижения продолжительности тромбоцитопении. В некоторых вариантах реализации настоящего изобретения плинабулин может быть более чем примерно на 5%, 10%, 12,5%, 15%, 17,5%, 20%, 22,5%, 25%, 27,5%, 30%, 32,5%, 35%, 37,5%, 40%, 42,5%, 45%, 47,5%, 50%, 52,5%, 55%, 57,5%, 60%, 62,5%, 65%, 67,5%, 70%, 72,5%, 75%, 77,5%, 80%, 82,5%, 85%, 87,5%, 90%, 95%, 100%, 110%, 120%, 130%, 140%, 150%, 160%, 170%, 180%, 190%, 200%, 225%, 250%, 275%, 300%, 350% 400%, 450%, 500%, 600%, 700%, 800%, 900%, в 10 раз, 11 раз, 12 раз, 13 раз, 14 раз, 15 раз или 16 раз более эффективен, чем Г-КСФ (например, пегфилграстим или филграстим), в отношении снижения продолжительности тромбоцитопении. В некоторых вариантах реализации настоящего изобретения плинабулин может быть менее чем примерно на 5%, 10%, 12,5%, 15%, 17,5%, 20%, 22,5%, 25%, 27,5%, 30%, 32,5%, 35%, 37,5%, 40%, 42,5%, 45%, 47,5%, 50%, 52,5%, 55%, 57,5%, 60%, 62,5%, 65%, 67,5%, 70%, 72,5%, 75%, 77,5%, 80%, 82,5%, 85%, 87,5%, 90%, 95%, 100%, 110%, 120%, 130%, 140%, 150%, 160%, 170%, 180%, 190%, 200%, 225%, 250%, 275%, 300%, 350% 400%, 450%, 500%, 600%, 700%, 800%, 900%, в 10 раз, 11 раз, 12 раз, 13 раз, 14 раз, 15 раз или 16 раз более эффективен, чем Г-КСФ (например, пегфилграстим или филграстим), в отношении снижения продолжительности тромбоцитопении. В некоторых вариантах реализации настоящего изобретения плинабулин может в диапазоне примерно от 5% до 15 раз, от 20% до 10 раз или на 50-500% эффективнее, чем Г-КСФ (например, пегфилграстим или филграстим), в отношении снижения продолжительности тромбоцитопении.
[0062] Период введения может представлять собой цикл лечения продолжительностью в несколько недель, при условии, что опухоль остается под контролем и субъект переносит данную схему лечения с клинической точки зрения. В некоторых вариантах реализации настоящего изобретения однократную дозу плинабулина или другого терапевтического агента можно вводить один раз в неделю и предпочтительно один раз в день в дни 1 и 8 трехнедельного (21 день) цикла лечения. В некоторых вариантах реализации настоящего изобретения однократную дозу плинабулина или другого терапевтического агента можно вводить один раз в неделю, два раза в неделю, три раза в неделю, четыре раза в неделю, пять раз в неделю, шесть раз в неделю или ежедневно в течение цикла лечения продолжительностью одну неделю, две недели, три недели, четыре недели или пять недель. Введение можно осуществлять в один и тот же или другой день каждой недели в цикле лечения.
[0063] Указанный цикл лечения можно повторять до тех пор, пока субъект его переносит с клинической точки зрения. В некоторых вариантах реализации настоящего изобретения указанный цикл лечения повторяют n раз, где n представляет собой целое число в диапазоне от 2 до 30. В некоторых вариантах реализации настоящего изобретения n равно 2, 3, 4, 5, 6, 7, 8, 9 или 10. В некоторых вариантах реализации настоящего изобретения новый цикл лечения можно начинать сразу после завершения предыдущего цикла лечения. В некоторых вариантах реализации настоящего изобретения новый цикл лечения можно начинать по истечении некоторого периода времени после завершения предыдущего цикла лечения.
[0064] Введение описанных в настоящем документе фармацевтических композиций можно осуществлять с использованием любого из приемлемых способов введения для агентов, имеющих аналогичное назначение, включая следующие, но не ограничиваясь ими: пероральное, сублингвальное, буккальное, подкожное, внутривенное, интраназальное, топическое, трансдермальное, интрадермальное, интраперитонеальное, внутримышечное, внутрилегочное, вагинальное, ректальное, или внутриглазное введение. Пероральное и парентеральное введение применяется в лечении по показаниям, составляющим предпочтительные варианты реализации настоящего изобретения.
[0065] Некоторые варианты реализации настоящего изобретения относятся к способу уменьшения тромбоцитопении у субъекта, включающему введение плинабулина или его фармацевтически приемлемой соли субъекту, нуждающемуся в этом. В некоторых вариантах реализации настоящего изобретения указанная тромбоцитопения представляет собой тромбоцитопению, вызванную химиотерапией. В некоторых вариантах реализации настоящего изобретения указанная тромбоцитопения вызвана введением химиотерапевтической композиции. Указанная химиотерапевтическая композиция может содержать один или более химиотерапевтических агентов. В некоторых вариантах реализации настоящего изобретения указанный химиотерапевтический агент представляет собой нуклеозидный аналог.В некоторых вариантах реализации настоящего изобретения указанный химиотерапевтический агент представляет собой гемцитабин.
[0066] В некоторых вариантах реализации настоящего изобретения указанная тромбоцитопения вызвана лучевой терапией. Некоторые варианты реализации настоящего изобретения относятся к уменьшению вероятности возникновения или уменьшению тяжести тромбоцитопении у субъекта и включают введение плинабулина субъекту, нуждающемуся в этом.
[0067] Некоторые варианты реализации описанных выше способов включают введение плинабулина или его фармацевтически приемлемой соли и одного или более дополнительных химиотерапевтических агентов. В различных вариантах реализации настоящего изобретения указанный дополнительный химиотерапевтический агент выбран из группы, состоящей из циклофосфамида, доксорубицина, паклитаксела, карбоплатина, цисплатина, иринотекана, топотекана и их фармацевтически приемлемых солей, или комбинаций двух или более из приведенных выше агентов, или комбинаций одного или более из приведенных выше агентов и доцетаксела. В одном варианте реализации настоящего изобретения плинабулин и один или более дополнительных химиотерапевтических агентов вводят одновременно. В одном таком варианте реализации настоящего изобретения введение в комбинации осуществляют путем объединения агентов в единичной лекарственной форме. В другом варианте реализации настоящего изобретения агенты вводят последовательно. Согласно одному из вариантов реализации настоящего изобретения агенты вводят одним и тем же путем, таким как перорально или внутривенно. В другом варианте реализации настоящего изобретения агенты вводят различными путями, например, один вводят перорально, а другой вводят внутривенно. В некоторых вариантах реализации настоящего изобретения период времени между введением одного или более агентов и введением совместно вводимых одного или более агентов может составлять примерно 1 час, 2 часа, 3 часа, 5 часов, 8 часов, 10 часов, 12 часов, 15 часов, 18 часов, 20 часов, 24 часа, 36 часов, 48 часов, 3 дня, 4 дня, 5 дней, 6 дней, 7 дней, 10 дней, 14 дней, 21 день, 28 дней или 30 дней. В некоторых вариантах реализации настоящего изобретения плинабулин вводят до введения указанных одного или более дополнительных химиотерапевтических агентов. В других вариантах реализации настоящего изобретения указанные дополнительные химиотерапевтические агенты вводят перед плинабулином.
[0068] В некоторых вариантах реализации настоящего изобретения описанный в настоящем документе способ включает совместное введение одного или более химиотерапевтических агентов и плинабулина. В некоторых вариантах реализации настоящего изобретения описанный в настоящем документе способ включает совместное введение двух химиотерапевтических агентов и плинабулина. В некоторых вариантах реализации настоящего изобретения описанный в настоящем документе способ включает совместное введение трех химиотерапевтических агентов и плинабулина. В некоторых вариантах реализации настоящего изобретения описанный в настоящем документе способ включает совместное введение четырех химиотерапевтических агентов и плинабулина. Для вариантов реализации настоящего изобретения, в которых плинабулин вводят с одним или более химиотерапевтическими агентами или химиотерапевтической композицией, также пациенту можно вводить Г-КСФ в комбинации с плинабулином.
[0069] В некоторых вариантах реализации настоящего изобретения, когда второй и/или третий химиотерапевтический агент вводят с первым химиотерапевтическим агентом и плинабулином, указанные второй или третий химиотерапевтический агент можно вводить до, после или одновременно с совместным введением указанного первого химиотерапевтического агента и плинабулина. В некоторых вариантах реализации настоящего изобретения схема введения указанного второго или третьего химиотерапевтического агента может отличаться от схемы введения первого химиотерапевтического агента. В некоторых вариантах реализации настоящего изобретения схема введения указанного второго или третьего химиотерапевтического агента может быть такой же, как и схема введения первого химиотерапевтического агента.
[0070] В некоторых вариантах реализации настоящего изобретения указанный дополнительный химиотерапевтический агент не содержит доцетаксел. В некоторых вариантах реализации настоящего изобретения указанный дополнительный химиотерапевтический агент не содержит таксан.
[0071] Некоторые варианты осуществления включают введение субъекту плинабулина или его фармацевтически приемлемой соли и лучевую терапию.
[0072] Некоторые варианты осуществления включают введение субъекту плинабулина или его фармацевтически приемлемой соли, Г-КСФ и лучевую терапию. В некоторых вариантах реализации настоящего изобретения пациенту также проводят переливание тромбоцитов. В некоторых вариантах реализации настоящего изобретения описанный в настоящем документе способ также включает введение Г-КСФ. В некоторых вариантах реализации настоящего изобретения описанный в настоящем документе способ не включает введение Г-КСФ.
[0073] Некоторые варианты реализации настоящего изобретения включают определение того, что субъект страдает тромбоцитопенией, и последующее введение указанному субъекту плинабулина или его фармацевтически приемлемой соли. Другие варианты реализации настоящего изобретения включают введение плинабулина или его фармацевтически приемлемой соли субъекту до обнаружения тромбоцитопении для уменьшения частоты ее возникновения или тяжести. Например, некоторые варианты реализации настоящего изобретения включают идентификацию субъекта, который подвержен риску развития тромбоцитопении (например, из-за миелосупрессивной химиотерапии или лучевой терапии), но у которого еще не проявляется тромбоцитопения, и затем введение плинабулина или его фармацевтически приемлемой соли субъекту.
[0074] В некоторых вариантах реализации настоящего изобретения плинабулин можно применять совместно с Г-КСФ для уменьшения, облегчения или предотвращения тромбоцитопении, вызванной химиотерапевтическим агентом или композицией или лучевой терапией.
[0075] В некоторых вариантах реализации описанных выше способов вводят дополнительный агент, действие которого направлено на уменьшение тромбоцитопении. Например, в некоторых вариантах реализации настоящего изобретения указанные способы осуществляют без введения Г-КСФ (например, пегфилграстима или филграстима). В некоторых вариантах реализации настоящего изобретения указанные способы осуществляют без введения какого-либо дополнительного активного агента, кроме агентов, указанных выше.
[0076] В некоторых вариантах реализации настоящего изобретения субъект представляет собой человека.
[0077] В некоторых вариантах реализации настоящего изобретения описанные выше способы можно осуществлять путем введения плинабулина и любого дополнительного химиотерапевтического агента, посредством любого из приемлемых способов введения для агентов, имеющих аналогичное назначение, включая следующие, но не ограничиваясь ими: пероральное, сублингвальное, буккальное, подкожное, внутривенное, интраназальное, топическое, трансдермальное, интрадермальное, интраперитонеальное, внутримышечное, внутрилегочное, вагинальное, ректальное или внутриглазное введение. Пероральное и парентеральное введение применяется в лечении по показаниям, составляющим предпочтительные варианты реализации настоящего изобретения.
[0078] Период введения может представлять собой цикл лечения продолжительностью в несколько недель. В некоторых вариантах реализации настоящего изобретения однократную дозу плинабулина или другого терапевтического агента можно вводить один раз в неделю и предпочтительно один раз в день в дни 1 и 8 трехнедельного (21 день) цикла лечения. В некоторых вариантах реализации настоящего изобретения однократную дозу плинабулина или другого терапевтического агента можно вводить один раз в неделю, два раза в неделю, три раза в неделю, четыре раза в неделю, пять раз в неделю, шесть раз в неделю или ежедневно в течение цикла лечения продолжительностью одну неделю, две недели, три недели, четыре недели или пять недель. Введение можно осуществлять в один и тот же или другой день каждой недели в цикле лечения.
[0079] Указанный цикл лечения можно повторять до тех пор, пока субъект его переносит с клинической точки зрения. В некоторых вариантах реализации настоящего изобретения указанный цикл лечения повторяют n раз, где n представляет собой целое число в диапазоне от 2 до 30. В некоторых вариантах реализации настоящего изобретения n равно 2, 3, 4, 5, 6, 7, 8, 9 или 10. В некоторых вариантах реализации настоящего изобретения новый цикл лечения можно начинать сразу после завершения предыдущего цикла лечения. В некоторых вариантах реализации настоящего изобретения новый цикл лечения можно начинать по истечении некоторого периода времени после завершения предыдущего цикла лечения.
Фармацевтические композиции
[0080] Некоторые варианты реализации настоящего изобретения относятся к фармацевтическим композициям, содержащим плинабулин или его фармацевтически эффективную соль и дополнительный химиотерапевтический агент. В некоторых вариантах реализации настоящего изобретения указанный химиотерапевтический агент выбран из группы, состоящей из метотрексата, винбластина, доксорубицина, цисплатина, MVAC (метотрексат, винбластин, доксорубицин и цисплатин), доцетаксела, трастузумаба, циклофосфамида, паклитаксела, AC с сокращенными интервалами с последующим введением T (т.е. доксорубицин, циклофосфамид, паклитаксел), TAC (доцетаксел, доксорубицин, циклофосфамид), фторурацила, блеомицина, этопозида, винкристина, прокарбазина, преднизона, BEACOPP (блеомицин, этопозид, доксорубицин, циклофосфамид, винкристин, прокарбазин, преднизон), гемцитабина, ифосфамида, карбоплатина, ICE (ифосфамид, карбоплатин, этопозид), ритуксимаба, RICE (ритуксимаб, ифосфамид, карбоплатин, этопозид), CHOP-14 (циклофосфамид, доксорубицин, винкристин, преднизон), месны, новантрона, MINE (месна, ифосфамид, новантрон, этопозид), дексаметазона, цитарабина DHAP (дексаметазон, цисплатин, цитарабин), метилпреднизолона, ESHAP (этопозид, метилпреднизолон, цисплатин, цитарабин), HyperCVAD и ритуксимаба (циклофосфамид, винкристин, доксорубицин, дексаметазон, ритуксимаб), дакарбазина, винбластина, комбинации на основе дакарбазина (дакарбазин, цисплатин, винбластин), комбинации на основе дакарбазина с ИЛ-2 и интерфероном альфа (дакарбазин, цисплатин, винбластин, ИЛ-2, интерферон альфа), топотекана, MAID (месна, доксорубицин, ифосфамин, дакарбазин), VeIP (винбластин, ифосфамид, цисплатин), VIP (этопозид, ифосфамид, цисплатин), TIP (паклитаксел, ифосфамид, цисплатин), гемцитабина, CMF классического (циклофосфамид, метотрексат, фторурацил), АС (доксорубицин, циклофосфамид), FEC (фторурацил, эпирубицин, циклофосфамид), TC (доцетаксел, циклофосфамид), цисплатин/топотекан, паклитаксел/цисплатин, иринотекана, FOLFOX (фторурацил, лейковорин, оксалиплатин), иринотекан/цисплатин, эпирубицин/цисплатин/5-фторурацил, эпирубицин/цисплатин/капецитабин, DT-PACE (дексаметазон/талидомид/цисплатин/доксорубицин/циклофосфамид/этопозид), ET-PACE и бортезомиб, EPOCH (этопозид, преднизон, винкристин, циклофосфамид, доксорубицин), GDP (гемцитабин, дексаметазон, цисплатин), GDP и ритуксимаб, FMR (флударабин, митоксантрон, ритуксимаб, CHOP и ритуксимаб (циклофосфамид, доксорубицин, винкристин, преднизон, ритуксимаб), цисплатин/паклитаксела, цисплатин/винорелбина, цисплатин/доцетаксела, цисплатин/этопозида, карбоплатин/паклитаксела, карбоплатин/доцетаксела, FOLFIRINOX (5-FU/лейковорин, иринотекан и оксалиплатин), кабазитаксела, этопозид/карбоплатина, этопозид/цисплатина. В некоторых вариантах реализации настоящего изобретения указанная одна или более дополнительных химиотерапевтических композиций (например, вторая, третья, четвертая, пятая, шестая, седьмая или восьмая химиотерапевтическая композиция) может независимо содержать один или более агентов, выбранных из группы, состоящей из метотрексата, винбластина, доксорубицина, цисплатина, доцетаксела, трастузумаба, циклофосфамида, паклитаксела, фторурацила, блеомицина, этопозида, винкристина, прокарбазина, преднизона, гемцитабина, ифосфамида, карбоплатина, месны, новантрона, цитарабина метилпреднизолона, ритуксимаба дакарбазина, винбластина, топотекана, гемцитабина, иринотекана, эпирубицина, 5-фторурацила, капецитабина, бортезомиба и кабазитаксела.
[0081] В некоторых вариантах реализации настоящего изобретения указанная первая химиотерапевтическое композиция может содержать один или более агентов, выбранных из группы, состоящей из метотрексата, винбластина, доксорубицина, цисплатина, MVAC (метотрексат, винбластин, доксорубицин и цисплатин), трастузумаба, циклофосфамида, AC с сокращенными интервалами с последующим введением T (т.е. доксорубицин, циклофосфамид, паклитаксел), фторурацила, блеомицина, этопозида, винкристина, прокарбазина, преднизона, BEACOPP (блеомицин, этопозид, доксорубицин, циклофосфамид, винкристин, прокарбазин, преднизон), гемцитабина, ифосфамида, карбоплатина, ICE (ифосфамид, карбоплатин, этопозид), ритуксимаба, RICE (ритуксимаб, ифосфамид, карбоплатин, этопозид), CHOP-14 (циклофосфамид, доксорубицин, винкристин, преднизон), месны, новантрона, MINE (месна, ифосфамид, новантрон, этопозид), дексаметазона, цитарабина DHAP (дексаметазон, цисплатин, цитарабин), метилпреднизолона, ESHAP (этопозид, метилпреднизолон, цисплатин, цитарабин), HyperCVAD и ритуксимаба (циклофосфамид, винкристин, доксорубицин, дексаметазон, ритуксимаб), дакарбазина, винбластина, комбинации на основе дакарбазина (дакарбазин, цисплатин, винбластин), комбинации на основе дакарбазина с ИЛ-2 и интерфероном альфа (дакарбазин, цисплатин, винбластин, ИЛ-2, интерферон альфа), топотекана, MAID (месна, доксорубицин, ифосфамин, дакарбазин), VeIP (винбластин, ифосфамид, цисплатин), VIP (этопозид, ифосфамид, цисплатин), TIP (паклитаксел, ифосфамид, цисплатин). В некоторых вариантах реализации настоящего изобретения гемцитабин, CMF классический (циклофосфамид, метотрексат, фторурацил), АС (доксорубицин, циклофосфамид), FEC (фторурацил, эпирубицин, циклофосфамид), цисплатин/топотекан, паклитаксел/цисплатин, иринотекан, FOLFOX (фторурацил, лейковорин, оксалиплатин), иринотекан/цисплатин, эпирубицин/цисплатин/5-фторурацил, эпирубицин/цисплатин/капецитабин, DT-PACE (дексаметазон/талидомид/цисплатин/доксорубицин/циклофосфамид/этопозид), ET-PACE и бортезомиб, EPOCH (этопозид, преднизон, винкристин, циклофосфамид, доксорубицин), GDP (гемцитабин, дексаметазон, цисплатин), GDP и ритуксимаб, FMR (флударабин, митоксантрон, ритуксимаб, CHOP и ритуксимаб (циклофосфамид, доксорубицин, винкристин, преднизон, ритуксимаб), цисплатин/паклитаксел, цисплатин/винорелбин, цисплатин/этопозид, карбоплатин/паклитаксел, FOLFIRINOX (5-FU/лейковорин, иринотекан и оксалиплатин), кабазитаксел, этопозид/карбоплатин, этопозид/цисплатин. В некоторых вариантах реализации настоящего изобретения указанные первые химиотерапевтические композиции могут содержать один или более агентов, выбранных из группы, состоящей из метотрексата, винбластина, доксорубицина, цисплатина, трастузумаба, циклофосфамида, фторурацила, блеомицина, этопозида, винкристина, прокарбазина, преднизона, гемцитабина, ифосфамида, карбоплатина, месны, новантрона, цитарабина, метилпреднизолона, ритуксимаба, дакарбазина, винбластина, топотекана, гемцитабина, иринотекана, эпирубицина, 5-фторурацила, капецитабина и бортезомиба.
[0082] В некоторых вариантах реализации настоящего изобретения, указанные фармацевтические композиции содержат дополнительный агент, который уменьшает тромбоцитопению. Например, в некоторых вариантах реализации настоящего изобретения указанные фармацевтические композиции содержат гранулоцитарно-колониестимулирующий фактор (например, пегфилграстим или филграстим). Примеры лекарственного средства, представляющего собой гранулоцитарно-колониестимулирующий фактор, включают, но не ограничиваются ими, следующие: нейпоген (Neupogen® (Amgen)), теваграстим (Tevagrastim® (Teva)), биограстим (Biograstim® (CT Arzneimittel)), ратиограстим (Ratiograstim® (Ratiopharm GmbH)), зарсио (Zarxio® (Sandoz GmbH)), филграстим гексал (Filgrastim Hexal® (Hexal AG)), неуласта (Neulasta® (Amgen)), граноцит и нейтроджин (Granocyte® и Neutrogin® (Chugai)) и нью-ап (Neu-up® (Kyowa Hakko)), ролонтис (Rolontis® (Spectrum, эфлапеграстим)), айдуо (Aiduo (мекапегфилграстим, Hengrui)).
[0083] В некоторых вариантах реализации настоящего изобретения, указанные фармацевтические композиции не содержат никаких дополнительных агентов, которые уменьшают тромбоцитопению. Например, в некоторых вариантах реализации настоящего изобретения указанные фармацевтические композиции не содержат гранулоцитарно-колониестимулирующий фактор (например, пегфилграстим или филграстим). В некоторых вариантах реализации настоящего изобретения указанные фармацевтические композиции не содержат какого-либо дополнительного активного агента, кроме агентов, указанных для композиций выше.
[0084] Другие варианты реализации настоящего изобретения относятся к двум или более отдельным фармацевтическим композициям, одна из которых содержит плинабулин или его фармацевтически приемлемую соль, и одна или более других фармацевтических композиций содержат дополнительные химиотерапевтические агенты. В различных вариантах реализации настоящего изобретения указанный дополнительный химиотерапевтический агент выбран из группы, состоящей из циклофосфамида, доксорубицина, паклитаксела, карбоплатина, цисплатина, иринотекана и их фармацевтически приемлемых солей.
[0085] В некоторых вариантах реализации настоящего изобретения композиции, описанные выше, могут дополнительно содержать один или более фармацевтически приемлемых разбавителей. В некоторых вариантах реализации настоящего изобретения указанный фармацевтически приемлемый разбавитель может содержать Kolliphor HS-15® (полиэтиленгликоль (15)-гидроксистеарат). В некоторых вариантах реализации настоящего изобретения указанный фармацевтически приемлемый разбавитель может содержать пропиленгликоль. В некоторых вариантах реализации настоящего изобретения указанные фармацевтически приемлемые разбавители могут содержать коллифор (kolliphor®) и пропиленгликоль. В некоторых вариантах реализации настоящего изобретения указанные фармацевтически приемлемые разбавители могут содержать коллифор и пропиленгликоль, при этом коллифор составляет примерно 40 мас. %, а пропиленгликоль составляет примерно 60 мас. % в расчете на общую массу разбавителей. В некоторых вариантах реализации настоящего изобретения указанные композиции могут дополнительно содержать один или более других фармацевтически приемлемых разбавителей.
[0086] В некоторых вариантах реализации настоящего изобретения композиции, описанные выше, могут дополнительно содержать один или более фармацевтически приемлемых носителей или вспомогательных веществ. Термины «фармацевтически приемлемый носитель» или «фармацевтически приемлемое вспомогательное вещество» включают любые и все растворители, дисперсионные среды, покрытия, антибактериальные и противогрибковые агенты, изотонические и замедляющие всасывание вещества и т.п. Применение таких сред и агентов с фармацевтически активными веществами хорошо известно в данной области техники. Любые обычные среды или агенты могут применяться в терапевтических композициях, за исключением тех случаев, когда они несовместимы с активным ингредиентом. Дополнительно согласно настоящему изобретению предусмотрено включение различных вспомогательных веществ, таких как вспомогательные вещества, обычно применяемые в данной области техники. Основания для включения в фармацевтические композиции различных компонентов описаны, например, в публикациях Gilman et al. (Eds.) (1990); Goodman and Gilman’s: The Pharmacological Basis of Therapeutics, 8th Ed., Pergamon Press, которые включены в настоящий документ полностью посредством ссылки.
[0087] Некоторые примеры веществ, которые могут служить в качестве фармацевтически приемлемых носителей или их компонентов, включают сахара, такие как лактоза, глюкоза и сахароза; крахмалы, такие как кукурузный крахмал и картофельный крахмал; целлюлозу и ее производные, такие как натрий карбоксиметилцеллюлоза, этилцеллюлоза и метилцеллюлоза; трагакантовая камедь в порошке; солод; желатин; тальк; твердые смазки, такие как стеариновая кислота и стеарат магния; сульфат кальция; растительные масла, такие как арахисовое масло, хлопковое масло, кунжутное масло, оливковое масло, кукурузное масло и масло какао; многоатомные спирты, такие как пропиленгликоль, глицерин, сорбит, маннит и полиэтиленгликоль; альгиновая кислота; эмульгаторы, такие как TWEENS; смачивающие агенты, такие как лаурилсульфат натрия; красители; вкусоароматические вещества; вещества для таблетирования, стабилизаторы; антиоксиданты; консерванты; апирогенную воду; изотонический солевой раствор, и фосфатные буферные растворы.
[0088] Описанные в настоящем документе композиции в предпочтительном варианте представлены в виде дозированной лекарственной формы. В настоящем документе «дозированная лекарственная форма» представляет собой композицию, содержащую некоторое количество соединения или композиции, которое подходит для введения субъекту, являющемуся животным, предпочтительно, млекопитающим, в одной дозе, в соответствии с надлежащей медицинской практикой. Тем не менее, то, что препарат представлен в виде единичной лекарственной формы или дозированной лекарственной формы не означает, что такую дозированную лекарственную форму вводят один раз в день или один раз за курс лечения. Предполагается, что такие лекарственные формы вводят один, два, три или более раз в день, а также возможно их введение путем инфузии в течение некоторого периода времени (например, от примерно 30 минут до примерно 2-6 часов), или возможно введение путем непрерывной инфузии, и возможно неоднократное введение за курс лечения, хотя однократное введение не исключается. Специалист в данной области техники поймет, что состав не определяет весь курс лечения, и такие решения будут приниматься лечащим врачом, а не специалистом в области изготовления препаратов.
[0089] Для получения фармацевтических композиций, описанных в настоящем документе, можно применять стандартные методики приготовления фармацевтических композиций, такие как методики, описанные в книге Remington, The Science and Practice of Pharmacy, 21st Ed., Lippincott Williams & Wilkins (2005), которая включена в настоящий документ полностью посредством ссылки.
[0090] Композиции, описанные выше, могут быть представлены в любой из множества форм, подходящих для различных путей введения, например, для перорального, сублингвального, буккального, назального, ректального, топического (включая трансдермальное), глазного, интрацеребрального, интракраниального, интратекального, внутриартериального, внутривенного, внутримышечного и других парентеральных путей введения. Для специалиста понятно, что композиции для перорального и назального введения включают композиции, которые вводят путем ингаляции, и изготавливают с использованием доступных методик. В зависимости от конкретного желательного пути введения могут применяться различные фармацевтически приемлемые носители, хорошо известные в данной области. Фармацевтически приемлемые носители включают, например, твердые или жидкие наполнители, разбавители, гидротропные вещества, поверхностно-активные вещества и инкапсулирующие вещества. Могут быть включены необязательные фармацевтически активные материалы, которые не оказывают существенного влияния на активность соединения или композиции. Количество носителя, применяемого в комбинации с соединением или композицией, является достаточным для обеспечения целесообразного количества материала для введения на одну дозу соединения. Методики и композиции для изготовления лекарственных форм, пригодных для применения в способах, описанных в настоящем документе, описаны в следующих источниках, которые включены в настоящий документ посредством ссылки: Modern Pharmaceutics, 4th Ed., Chapters 9, 10 (Banker & Rhodes, editors, 2002); Lieberman et al., Pharmaceutical Dosage Forms: Tablets (1989); и Ansel, Introduction to Pharmaceutical Dosage Forms 8th Edition (2004).
[0091] Можно применять различные лекарственные формы для перорального введения, включая такие твердые формы как таблетки, капсулы (например, мягкие желатиновые капсулы и твердые желатиновые капсулы), гранулы и нерасфасованные порошки. Таблетки могут представлять собой прессованные таблетки, растираемые в порошок таблетки, таблетки с растворяющимся в кишечнике покрытием, таблетки с сахарным покрытием, таблетки с пленочным покрытием или прессованные таблетки из нескольких структурных единиц, содержащие подходящие связующие, смазывающие вещества, разбавители, вещества, улучшающие распадаемость таблеток, красители, вкусоароматические вещества, вещества, улучшающие текучесть, и вещества, снижающие температуру плавления. Жидкие лекарственные формы включают водные растворы, эмульсии, суспензии, растворы и/или суспензии, восстановленные из нешипучих гранул, и шипучие препараты, восстановленные из шипучих гранул, содержащие подходящие растворители, консерванты, эмульгирующие агенты, суспендирующие агенты, разбавители, подсластители, вещества, снижающие температуру плавления, красители и вкусоароматические вещества.
[0092] Фармацевтически приемлемые носители, подходящие для получения дозированных лекарственных форм для перорального применения, хорошо известны в данной области. Таблетки обычно содержат фармацевтически совместимые вспомогательные вещества в качестве инертных разбавителей, такие как карбонат кальция, карбонат натрия, маннит, лактоза и целлюлоза; связующие, такие как крахмал, желатин и сахароза; разрыхлители, такие как крахмал, альгиновая кислота и кроскармеллоза; смазывающие вещества, такие как стеарат магния, стеариновая кислота и тальк. Улучшающие скольжение вещества, такие как диоксид кремния, могут использоваться для улучшения текучести порошковой смеси. Для улучшения внешнего вида можно добавлять красители, такие как красители для химической и пищевой промышленности. Подсластители и вкусоароматические вещества, такие как аспартам, сахарин, ментол, перечная мята и фруктовые вкусоароматические добавки, являются полезными вспомогательными веществами для жевательных таблеток. Капсулы обычно содержат один или более твердых разбавителей, описанных выше. Выбор компонентов носителя зависит от второстепенных факторов, таких как вкус, стоимость и стабильность при хранении, которые не являются критически важными, данный выбор легко может быть осуществлен специалистом.
[0093] Пероральные композиции также включают жидкие растворы, эмульсии, суспензии и тому подобное. Фармацевтически приемлемые носители, пригодные для получения таких композиций, хорошо известны в данной области техники. Типичные компоненты носителей для сиропов, эликсиров, эмульсий и суспензий включают этанол, глицерин, пропиленгликоль, полиэтиленгликоль, жидкую сахарозу, сорбит и воду. В случае суспензии типичные суспендирующие агенты включают метилцеллюлозу, натрий-карбоксиметилцеллюлозу, AVICEL RC-591, трагакант и альгинат натрия; типичные смачивающие агенты включают лецитин и полисорбат 80; и типичные консерванты включают метилпарабен и бензоат натрия. Жидкие композиции для перорального введения могут также содержать один или более таких компонентов, как подсластители, вкусоароматические вещества и красители, описанные выше.
[0094] Также на такие композиции может быть нанесено покрытие традиционными способами, обычно это покрытия, свойства которых зависят от рН или от времени, что обеспечивает высвобождение целевой композиции в желудочно-кишечном тракте вблизи требуемого места действия, или в разное время для улучшения требуемого действия. Такие лекарственные формы обычно включают, но не ограничиваются ими: одно или более из ацетатфталата целлюлозы, фталата поливинилацетата, фталата гидроксипропилметилцеллюлозы, этилцеллюлозы, покрытий Eudragit, восков и шеллака.
[0095] Другие композиции, которые можно применять для осуществления системной доставки соединений согласно настоящему изобретению, включают сублинвальные, буккальные и назальные лекарственные формы. Такие композиции обычно содержат одно или более растворимых соединений-наполнителей, таких как сахароза, сорбит и маннит; и связующих, таких как аравийская камедь, микрокристаллическая целлюлоза, карбоксиметилцеллюлоза и гидроксипропилметилцеллюлоза. Также могут быть включены скользящие вещества, смазывающие вещества, подсластители, красители, антиоксиданты и вкусоароматические вещества, описанные выше.
[0096] Жидкую композицию, которая приготовлена в виде состава для топического глазного применения, получают таким образом, чтобы ее можно было применять топически на глаза. При этом, насколько это возможно, должен обеспечиваться максимальный комфорт, хотя в некоторых случаях фармацевтические соображения (например, стабильность) могут требовать степени комфорта ниже оптимального. В случае невозможности обеспечить максимальный комфорт жидкость можно приготовить таким образом, чтобы ее глазное топическое введение было переносимым для пациента. Кроме того, подходящая для глазного использования жидкость может быть расфасована для однократного применения, либо содержать консервант для предотвращения загрязнения при многократном применении.
[0097] Для глазного применения растворы или лекарственные средства часто получают с применением физиологического раствора в качестве основного носителя. В растворах для глазного применения предпочтительно поддерживают комфортный рН при помощи соответствующих буферных систем. Составы могут также содержать традиционные фармацевтически приемлемые консерванты, стабилизаторы и поверхностно-активные вещества.
[0098] Консерванты, которые могут применяться в описанных в настоящем документе фармацевтических композициях, включают, но не ограничиваются ими: бензалкония хлорид, PHMB, хлорбутанол, тимеросал, фенилртути ацетат и фенилртути нитрат. Полезное поверхностно-активное вещество представляет собой, например, Tween 80. Аналогично, в препаратах для глазного введения, описанных в настоящем документе, можно использовать различные подходящие носители. Указанные носители включают, но не ограничиваются ими: поливиниловый спирт, повидон, гидроксипропилметилцеллюлоза, полоксамеры, карбоксиметилцеллюлоза, гидроксиэтилцеллюлоза и очищенная вода.
[0099] Также при необходимости или для удобства можно добавлять регуляторы тоничности. Они включают, но не ограничиваются ими: соли, в частности, хлорид натрия, хлорид калия, маннит и глицерин, или любой другой подходящий приемлемый для глазного применения регулятор тоничности.
[0100] Также можно применять различные буферы и средства для регулирования рН, при условии, что это не препятствует получению офтальмологически приемлемого препарата. Для многих композиций рН будет составлять от 4 до 9. Соответственно, буферы включают ацетатные буферы, цитратные буферы, фосфатные буферы и боратные буферы. Для регуляции рН указанных препаратов можно применять кислоты или основания.
[0101] Офтальмологически приемлемые антиоксиданты включают, но не ограничены ими, метабисульфит натрия, тиосульфат натрия, ацетилцистеин, бутилированный гидроксианизол и бутилированный гидрокситолуол.
[0102] Другими вспомогательными компонентами, которые могут быть включены в офтальмологические препараты для глазного применения, являются хелатирующие агенты. Подходящим хелатирующим агентом является эдетат динатрия (ЭДТА), хотя вместо него или вместе с ним можно также применять другие хелатирующие агенты.
[0103] Для топического применения используют кремы, мази, гели, растворы или суспензии и т.д., содержащие описанную в настоящем документе композицию. Составы для топического применения могут обычно состоять из фармацевтического носителя, сорастворителя, эмульгатора, усилителя проникновения, системы консервантов и смягчителя.
[0104] Для внутривенного введения композиции, описанные в настоящем документе, могут быть растворены или диспергированы в фармацевтически приемлемом растворителе, таком как физиологический раствор или раствор декстрозы. Подходящие вспомогательные вещества могут быть включены для достижения требуемого рН, включая, но не ограничиваясь ими: NaOH, карбонат натрия, ацетат натрия, HCl и лимонную кислоту. Согласно различным вариантам реализации настоящего изобретения рН конечной композиции может составлять от 2 до 8 или предпочтительно от 4 до 7. Вспомогательные вещества, представляющие собой антиоксиданты, могут включать бисульфит натрия, ацетон-бисульфит натрия, формальдегид натрия, сульфоксилат, тиомочевину и ЭДТА. Другие неограничивающие примеры подходящих вспомогательных веществ, присутствующих в конечной композиции для внутривенного введения, могут включать фосфаты натрия или калия, лимонную кислоту, винную кислоту, желатин и углеводы, такие как декстроза, маннит и декстран. Дополнительные приемлемые вспомогательные вещества описаны в Powell, et al., Compendium of Excipients for Parenteral Formulations, PDA J Pharm Sci and Tech 1998, 52 238-311 и Nema et al., Excipients and Their Role in Approved Injectable Products: Current Usage and Future Directions, PDA J Pharm Sci and Tech 2011, 65 287-332, каждый из этих документов включен в настоящий документ посредством ссылки. Также могут быть включены противомикробные агенты для получения бактериостатического или фунгистатического раствора, включая следующие, но не ограничиваясь ими: нитрат фенилртути, тимеросал, бензетония хлорид, бензалкония хлорид, фенол, крезол и хлорбутанол.
[0105] Композиции для внутривенного введения могут быть предоставлены лицам, осуществляющим уход за пациентом, в форме одного или более твердых веществ, которые восстанавливают в подходящем растворителе, таком как стерильная вода, солевой раствор или декстроза в воде, незадолго перед введением. Согласно другим вариантам реализации настоящего изобретения композиции представлены в форме раствора, готового для парентерального введения. Согласно дополнительным вариантам реализации настоящего изобретения композиции представлены в форме раствора, который дополнительно разбавляют перед введением. В тех вариантах реализации, которые включают введение комбинации соединения, описанного в настоящем документе, и другого агента, указанные комбинации могут предоставляться лицам, осуществляющим уход за пациентом, в виде смеси, или лица, осуществляющие уход за пациентом, могут смешивать два агента перед введением, или два агента можно вводить раздельно.
[0106] Фактическая доза активных соединений, описанных в настоящем документе, зависит от конкретного соединения и от состояния, которое лечат; выбор соответствующей дозы находится в компетенции опытного специалиста. В некоторых вариантах реализации настоящего изобретения разовая доза плинабулина или другого терапевтического агента может составлять от примерно 5 мг/м2 до примерно 150 мг/м2 площади поверхности тела, от примерно 5 мг/м2 до примерно 100 мг/м2 площади поверхности тела, от примерно 10 мг/м2 до примерно 100 мг/м2 площади поверхности тела, от примерно 10 мг/м2 до примерно 80 мг/м2 площади поверхности тела, от примерно 10 мг/м2 до примерно 50 мг/м2 площади поверхности тела, от примерно 10 мг/м2 до примерно 40 мг/м2 площади поверхности тела, от примерно 10 мг/м2 до примерно 30 мг/м2 площади поверхности тела, от примерно 13,5 мг/м2 до примерно 100 мг/м2 площади поверхности тела, от примерно 13,5 мг/м2 до примерно 80 мг/м2 площади поверхности тела, от примерно 13,5 мг/м2 до примерно 50 мг/м2 площади поверхности тела, от примерно 13,5 мг/м2 до примерно 40 мг/м2 площади поверхности тела, от примерно 13,5 мг/м2 до примерно 30 мг/м2 площади поверхности тела, от примерно 15 мг/м2 до примерно 80 мг/м2 площади поверхности тела, от примерно 15 мг/м2 до примерно 50 мг/м2 площади поверхности тела или от примерно 15 мг/м2 до примерно 30 мг/м2 площади поверхности тела. В некоторых вариантах реализации настоящего изобретения разовая доза плинабулина или другого терапевтического агента может составлять от примерно 13,5 мг/м2 до примерно 30 мг/м2 площади поверхности тела. В некоторых вариантах реализации настоящего изобретения разовая доза плинабулина или другого терапевтического агента может составлять примерно 5 мг/м2, примерно 10 мг/м2, примерно 12,5 мг/м2, примерно 13,5 мг/м2, примерно 15 мг/м2, примерно 17,5 мг/м2, примерно 20 мг/м2, примерно 22,5 мг/м2, примерно 25 мг/м2, примерно 27,5 мг/м2, примерно 30 мг/м2, примерно 40 мг/м2, примерно 50 мг/м2, примерно 60 мг/м2, примерно 70 мг/м2, примерно 80 мг/м2, примерно 90 мг/м2 или примерно 100 мг/м2 площади поверхности тела.
[0107] В некоторых вариантах реализации настоящего изобретения разовая доза плинабулина или другого терапевтического агента может составлять от примерно 5 мг до примерно 300 мг, от примерно 5 мг до примерно 200 мг, от примерно 7,5 мг до примерно 200 мг, от примерно 10 мг до примерно 100 мг, от примерно 15 мг до примерно 100 мг, от примерно 20 мг до примерно 100 мг, от примерно 30 мг до примерно 100 мг, от примерно 40 мг до примерно 100 мг, от примерно 10 мг до примерно 80 мг, от примерно 15 мг до примерно 80 мг, от примерно 20 мг до примерно 80 мг, от примерно 30 мг до примерно 80 мг, от примерно 40 мг до примерно 80 мг, от примерно 10 мг до примерно 60 мг, от примерно 15 мг до примерно 60 мг, от примерно 20 мг до примерно 60 мг, от примерно 30 мг до примерно 60 мг или от примерно 40 мг до примерно 60 мг. В некоторых вариантах реализации настоящего изобретения разовая доза плинабулина или другого терапевтического агента может составлять от примерно 20 мг до примерно 60 мг, от примерно 27 мг до примерно 60 мг, от примерно 20 мг до примерно 45 мг или от примерно 27 мг до примерно 45 мг. В некоторых вариантах реализации настоящего изобретения разовая доза плинабулина или другого терапевтического агента может составлять примерно 5 мг, примерно 10 мг, примерно 12,5 мг, примерно 13,5 мг, примерно 15 мг, примерно 17,5 мг, примерно 20 мг, примерно 22,5 мг, примерно 25 мг, примерно 27 мг, примерно 30 мг, примерно 40 мг, примерно 50 мг, примерно 60 мг, примерно 70 мг, примерно 80 мг, примерно 90 мг, примерно 100 мг, примерно 125 мг, примерно 150 мг или примерно 200 мг.
[0108] В некоторых вариантах реализации настоящего изобретения композиции, описанные в настоящем документе, можно вводить или применять в комбинации с другим лечением, таким как лучевая терапия или терапия биопрепаратами.
[0109] Чтобы дополнительно проиллюстрировать настоящее изобретение, приводятся следующие примеры. Указанные примеры в любом случае не должны истолковываться как ограничивающие настоящее изобретение. Варианты этих примеров в пределах объема формулы изобретения находятся в компетенции специалиста в данной области техники и считаются находящимися в пределах объема изобретения, как описано и заявлено в настоящем документе. Читатель поймет, что специалист в данной области, вооруженный настоящим документом и знаниями из данной области техники может подготовить и применять настоящее изобретение без всеохватывающих примеров.
ПРИМЕРЫ
Пример 1
[0110] Оценивали влияние плинабулина на изменение гематологических параметров, вызванных введением гемцитабина крысам. Четыре группы лечения и агенты, использованные в каждой группе, приведены в таблице 1. Носитель был приготовлен с применением 7,11% Твин 80 (об./об.): 25,5% пропиленгликоля (об./об.): 67,4% D5W (об./об.). D5W - 5% декстроза в воде для инъекций.

[0111] Плинабулин или пегфилграстим сначала растворяли в смеси Твин 80 - PG, а затем разбавляли раствором D5W. Тестовый образец растворяли в смеси Tween 80-PG накануне и хранили в RF. В день дозирования добавляли D5W для получения готового состава.
[0112] Животных рандомизировали по массе тела и/или абсолютному количеству нейтрофилов и распределяли по группам. Перед началом введения доз любые животные из групп, которые были посчитаны непригодными для использования в исследовании, были заменены альтернативными животными, полученными из той же партии и содержавшимися в тех же условиях. На каждое животное нанесли уникальную метку с помощью несмываемых чернил для однозначной идентификации. Между получением животного и началом лечения был предусмотрен минимальный период акклиматизации в 5 дней, чтобы животные привыкли к лабораторной среде.
[0113] Для лабораторной оценки отбирали образцы крови животных путем пункции яремной вены. Образцы (0,3 мл) собирали в пробирки с ЭДТА. Могли быть отобраны дополнительные образцы крови (например, из-за свертывания проб, не относящихся к сыворотке), если не превышались допустимая частота отбора образцов и объем крови. После отбора образцы передавали в клинические лаборатории для гематологического анализа с использованием Advia, а результаты вводили в систему Provantis®.
Введение индуцирующего агента
Гемцитабин; Группы 1, 3 и 4
Режим введения доз: Однократное введение дозы в день 1
Внутривенно (в/в болюс) в течение ~ 1 минуты при объеме дозы 5 мл/кг.
Группа 2 получала носитель.
Пегфилграстим; Группы 2 и 4
Режим введения доз: Однократное введение дозы во 2-й день, через 24 часа после гемцитабина
Путь введения: Подкожная инъекция.
Объем дозы: 10 мл/кг на основе последнего измерения массы тела
Плинабулин; Группа 3
Режим введения доз: Однократное введение дозы в 1-й день, через 1 час после гемцитабина
Путь введения: Внутрибрюшинная инъекция.
Объем дозы: 10 мл/кг на основе последнего измерения массы тела
Группа 1 получала носитель.
[0114] Время введения доз для групп с 1 по 4 включает дни - 3, 1, 2, 3, 4, 5, 6, 7, 8, 9 и 10. Могли быть собраны дополнительные пробы крови (например, из-за свертывания проб, не относящихся к сыворотке), если не превышались допустимая частота отбора проб и объем крови. После сбора образцы передадут в клинические лаборатории для гематологического анализа с использованием Advia, а результаты вводили в систему Provantis®.
[0115] Результаты исследования показаны на Фигуре 1. Плинабулин уменьшал тромбоцитопению, наблюдаемую при применении только гемцитабина, количество тромбоцитов всегда составляло более 500×103 клеток/мкл, что указывает на то, что плинабулин помогал избежать быстрого снижения количества тромбоцитов и предотвратить развитие тяжелой тромбоцитопении. На 8-й и 9-й дни количество тромбоцитов было статистически больше в группе гемцитабина и плинабулина, чем в группе, получавшей только гемцитабин. Выздоровление от вызванной гемцитабином тромбоцитопении было более быстрым в группе, получавшей гемцитабин и плинабулин, чем в группе, получавшей только гемцитабин.
Пример 2
[0116] Действие плинабулина на тромбоцитопению изучали в сравнении с пегфилграстимом. Проводили многоцентровое рандомизированное двойное слепое исследование фазы 2/3 по применению плинабулина по сравнению с пегфилграстимом у пациентов с солидными опухолями, получающих миелосупрессивную химиотерапию доцетакселом. Пациенты участвовали в исследовании примерно 5 месяцев, включая скрининг, лечение и последующее наблюдение.
[0117] Дизайн исследования: Данное исследование представляет собой многоцентровое рандомизированное исследование с частью фазы 2 (открытой) и частью фазы 3 (двойной слепой). В это исследование вовлечено примерно 190 пациентов. Все пациенты получают доцетаксел в дозе 75 мг/м2.
[0118] В исследование фазы 2 включали только пациентов с НМРЛ поздней стадии или метастатическим НМРЛ после неудачной терапии на основе платины. В исследование фазы 3 включали пациентов с одним из следующих диагнозов: рак молочной железы поздних стадий или метастатический рак молочной железы после неудачных <5 предыдущих курсов химиотерапии; НМРЛ поздних стадий или метастатический НМРЛ, при этом пациенты ранее получали терапию на основе платины и их заболевание прогрессирует, не переносят терапию на основе платины или, по мнению исследователя, могут получить пользу от химиотерапии доцетакселом; или гормонорефрактерный (андрогеннезависимый) метастатический рак предстательной железы.
[0119] В течение 28-дневного периода скрининга определяли пригодность всех пациентов к участию в исследовании.
[0120] Фаза 2 (открытая): В исследование включено примерно 40 пациентов с НМРЛ поздних стадий или метастатическим НМРЛ. Пациентов случайным образом распределяли примерно по 10 пациентов в каждую группу, с указанием группы и планируемого вмешательства следующим образом:
Группа 1: Доцетаксел (75 мг/м2)+пегфилграстим (6 мг)
Группа 2: Доцетаксел (75 мг/м2)+плинабулин (20 мг/м2)
Группа 3: Доцетаксел (75 мг/м2)+плинабулин (10 мг/м2)
Группа 4: Доцетаксел (75 мг/м2)+плинабулин (5 мг/м2)
[0121] Затем временно прекращали прием пациентов в фазу 2, выполняли анализ ФК/ФД для определения RP3D (рекомендуемая доза третьей фазы). Анализ ФК/ФД выполнялся независимой стороной, когда 40 пациентов фазы 2 завершили по меньшей мере цикл 1.
[0122] Фаза 3 (двойное слепое иссл.): Фазу 3 не начинали до тех пор, пока не определили RP3D на основе анализа ФК/ФД фазы 2, как указано выше.
[0123] Критерии включения в фазу 3 следующие: рак молочной железы поздних стадий или метастатический рак молочной железы после неудачных <5 предыдущих курсов химиотерапии (примечание: лечение в ходе исследования может быть первым химиотерапевтическим лечением для рака поздней стадии или метастатического рака); НМРЛ поздних стадий или метастатический НМРЛ, при этом пациенты ранее получали терапию на основе платины и их заболевание прогрессирует, не переносят терапию на основе платины или, по мнению исследователя, могут получить пользу от химиотерапии доцетакселом; гормонорефрактерный (андрогеннезависимый) метастатический рак предстательной железы (ГРРП).
[0124] После анализа ФК/ФД фазы 2 в качестве RP3D была выбрана фиксированная доза 40 мг. Планируется, что примерно 150 пациентов будут включены в Фазу 3 с одним из следующих диагнозов: рак молочной железы поздних стадий или метастатический рак молочной железы после неудачных <5 предыдущих курсов химиотерапии; НМРЛ поздних стадий или метастатический НМРЛ, при этом пациенты ранее получали терапию на основе платины и их заболевание прогрессирует, не переносят терапию на основе платины или, по мнению исследователя, могут получить пользу от химиотерапии доцетакселом; или гормонорефрактерный (андрогеннезависимый) метастатический рак предстательной железы. Каждого подходящего пациента распределяют в подгруппы в соответствии с его или ее типом опухоли (рак молочной железы, НМРЛ или ГРРП) и регионом (Азия, за пределами Азии). Пациенты распределяются случайным образом в каждой подгруппе (диагноз) с равной вероятностью (соотношение 1:1) или 75:75, с указанием группы и планируемого вмешательства следующим образом: Группа 1: Доцетаксел (75 мг/м2)+пегфилграстим (6 мг)+плацебо, соответствующее плинабулину; Группа 2: Доцетаксел (75 мг/м2)+плинабулин (40 мг)+плацебо, соответствующее пегфилграстиму.
[0125] Все пациенты должны получать предварительное лечение пероральными кортикостероидами, такими как дексаметазон 16 мг в сутки (например, 8 мг два раза в сутки) в течение 3 дней, начиная за 1 день до введения доцетаксела, чтобы снизить частоту возникновения и тяжесть задержки жидкости и степень тяжести реакций гиперчувствительности (см. Таксотер® (информация по назначению)). При гормонорезистентном метастатическом раке предстательной железы при одновременном приеме преднизона рекомендуемая схема предварительного лечения - пероральный прием дексаметазона в дозе 8 мг за 12 часов, 3 часа и 1 час до инфузии доцетаксела.
[0126] Данные всех пациентов, получавших дозу плинабулина RP3D в фазе 2 и фазе 3, не будут объединяться для оценки первичных и вторичных конечных точек исследования, а будут анализироваться отдельно.
[0127] Проведенное лечение: как фаза 2, так и фаза 3, циклы с 1 по 4, состоят из доцетаксела 75 мг/м2, вводимого внутривенной (в/в) инфузией в день 1 в течение 60 минут (±5 минут) каждые 21 день. В части фазы 2, в день 1 каждого цикла, через 1,5 часа (±10 минут) после времени начала инфузии доцетаксела (т.е. примерно через 30 минут после окончания инфузии доцетаксела), пациенты, распределенные в группу плинабулина (группы 2-4), получают однократную внутривенную инфузию плинабулина в назначенной дозе в течение 30 минут (±5 минут). Таким образом, время ожидания между окончанием инфузии доцетаксела и началом инфузии плинабулина составляет примерно 30 минут. На 2-й день каждого цикла, через ≥24 часа после завершения химиотерапии, пациенты, распределенные в группу пегфилграстима (группа 1), получают однократную дозу пегфилграстима (6 мг) (подкожная инъекция).
[0128] В части фазы 3, в день 1 каждого цикла, через 1,5 часа (±10 минут) после времени начала инфузии доцетаксела (т.е. примерно через 30 минут после окончания инфузии доцетаксела), пациенты получают однократную дозу плинабулина или плацебо внутривенно в течение 30 минут (±5 минут). На 2-й день каждого цикла, через ≥24 часа после завершения химиотерапии, пациенты получают однократную дозу пегфилграстима (6 мг) или плацебо (подкожная инъекция).
[0129] В течение 30 дней (±2 дня) после последней дозы исследуемого препарата каждому пациенту будет нанесен последующий контрольный визит для оценки безопасности. Если, по мнению исследователя, пациенту будет полезно получить более 4 циклов доцетаксела и пегфилграстима (в открытом исследовании), то пятый цикл не начнется до завершения контрольного визита для оценки безопасности (в данном случае контрольный визит будет проведен в день 21 цикла 4). Контрольные визиты требуются для отслеживания текущих НЯ, связанных с лечением. Всем пациентам, испытывающим токсические эффекты ≥2 степени в конце лечения, следует наносить не реже одного контрольного визита в месяц, пока НЯ не перейдет в степень ≤1 или явление будет считаться хроническим или пациент получит другую противоопухолевую терапию. Каким именно образом будет организован контрольный визит, остается на усмотрение исследователя (например, личное посещение или телефонный звонок). Обо всех случаях смерти, произошедших в течение 30 дней после приема исследуемого препарата, независимо от связи смерти с исследуемым препаратом, необходимо немедленно сообщить спонсору в течение 24 часов после того, как стало известно о событии.
[0130] Результаты лабораторных тестов (гематология и биохимический анализ сыворотки) собираются в центральной лаборатории. Лабораторные тесты на безопасность необходимы перед лечением в первый день каждого цикла и их можно проводить в местной лаборатории; однако все другие запланированные пробы крови в соответствии с графиком оценок и таблицей процедур также должны быть направлены для оценки в центральную лабораторию. Общий анализ мочи проводится только при скрининге. Подсчет CD34+ определяется методом сортировки клеток с активированной флуоресценцией (FACS).
[0131] Продолжительность лечения: пациенты получали лечение исследуемым препаратом в течение до 4 циклов в этом исследовании, цикл лечения составляет 21 день; после этого пациенты могут продолжать прием доцетаксела и пегфилграстима по усмотрению исследователя. После завершения 4 циклов пациентам наносили контрольный визит для оценки безопасности через 30 дней (±2 дня) после последней дозы исследуемого препарата. Если, по мнению исследователя, пациенту было бы полезно получить более 4 циклов доцетаксела и пегфилграстима (в открытом исследовании), то пятый цикл не будет начат до завершения контрольного визита для оценки безопасности (в данном случае контрольный визит для оценки безопасности будет проведен в день 21 цикла 4).
[0132] Фармакокинетика: некомпартментные фармакокинетические анализы используются для расчета концентраций плинабулина в плазме после доз 5 мг/м2, 10 мг/м2 и 20 мг/м2 и доцетаксела в цикле 1 части фазы 2 исследования. У пациентов в фазе 3 собирают пробы согласно графику отбора проб для ФК плинабулина и доцетаксела из фазы 2.
[0133] Предварительные результаты исследования приведены на Фиг. 2-4. На Фиг. 2 приведено изменение количества тромбоцитов с 1 по 15 день для группы, которой вводили 6 мг пегфилграстима, и группы, которой вводили 20 мг/м2 плинабулина; На Фиг. 3 показано количество пациентов со снижением тромбоцитов более чем на 30% от исходного уровня в циклах 1-4. На Фиг. 4 показано количество пациентов в процентах с тромбоцитопенией разных степеней в группе, получавшей 5, 10, 20 мг/м2 плинабулина по сравнению с группой, получавшей 6 мг пегфилграстима, а на Фиг. 5 показано количество пациентов в процентах с тромбоцитопенией разных степеней в группе, получавшей 20 мг/м2 плинабулина, и группе, получавшей пегфилграстим 6 мг.
[0134] На Фиг. 2 показано, что изменение процентного содержания тромбоцитов в группе, получавшей пегфилграстим, было больше, чем в группе, получавшей плинабулин, что указывает на то, что плинабулин более эффективен в поддержании количества тромбоцитов у пациентов, проходящих химиотерапию. Разница в изменении процентного количества тромбоцитов между двумя группами также показана на Фиг. 2. На Фиг. 3 показано, что почти у 85% пациентов в группе, получавшей пегфилграстим, наблюдалось снижение тромбоцитов более чем на 30% по сравнению с исходным уровнем, в то время как в группах, получавших плинабулин, количество пациентов, испытывавших такое снижение, было меньше. На Фиг. 4 показано, что при введении плинабулина в различных дозах (например, 5, 10 и 20 мг/м2) частота возникновения тромбоцитопении была ниже, чем в группе пегфилграстима. На Фиг. 5 показано, что у пациентов в группе плинабулина (20 мг/м2) не развивалась тромбоцитопения, тогда как у некоторых пациентов в группе пегфилграстима развивалась тромбоцитопения. Результаты исследования продемонстрировали эффективность плинабулина в отношении снижения частоты возникновения тромбоцитопении.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ УМЕНЬШЕНИЯ НЕЙТРОПЕНИИ | 2017 |
|
RU2760348C2 |
| СПОСОБ УМЕНЬШЕНИЯ НЕЙТРОПЕНИИ | 2018 |
|
RU2790989C2 |
| КОМПОЗИЦИЯ И СПОСОБ УМЕНЬШЕНИЯ ВЫЗВАННОЙ ХИМИОТЕРАПИЕЙ НЕЙТРОПЕНИИ С ПОМОЩЬЮ ВВЕДЕНИЯ ПЛИНАБУЛИНА И АГЕНТА Г-КСФ | 2019 |
|
RU2798103C2 |
| КОМБИНИРОВАННАЯ ХИМИОТЕРАПИЯ | 2006 |
|
RU2429838C2 |
| КОМБИНИРОВАННАЯ ХИМИОТЕРАПИЯ | 2010 |
|
RU2587013C2 |
| КОМБИНИРОВАННАЯ ХИМИОТЕРАПИЯ | 2001 |
|
RU2284818C2 |
| ЛЕЧЕНИЕ РАКА КОМБИНАЦИЕЙ ПЛИНАБУЛИНА И ТАКСАНА | 2013 |
|
RU2662298C2 |
| КОМБИНАЦИЯ И СПОСОБЫ ВВЕДЕНИЯ ТЕРАПЕВТИЧЕСКИХ СРЕДСТВ И КОМБИНИРОВАННОЙ ТЕРАПИИ | 2006 |
|
RU2452482C2 |
| СПОСОБ ЛЕЧЕНИЯ РАКА, АССОЦИИРОВАННОГО С МУТАЦИЕЙ RAS | 2016 |
|
RU2736045C2 |
| КОМБИНАЦИИ И СПОСОБЫ ВВЕДЕНИЯ ТЕРАПЕВТИЧЕСКИХ СРЕДСТВ И КОМБИНИРОВАННОЙ ТЕРАПИИ | 2012 |
|
RU2632103C2 |
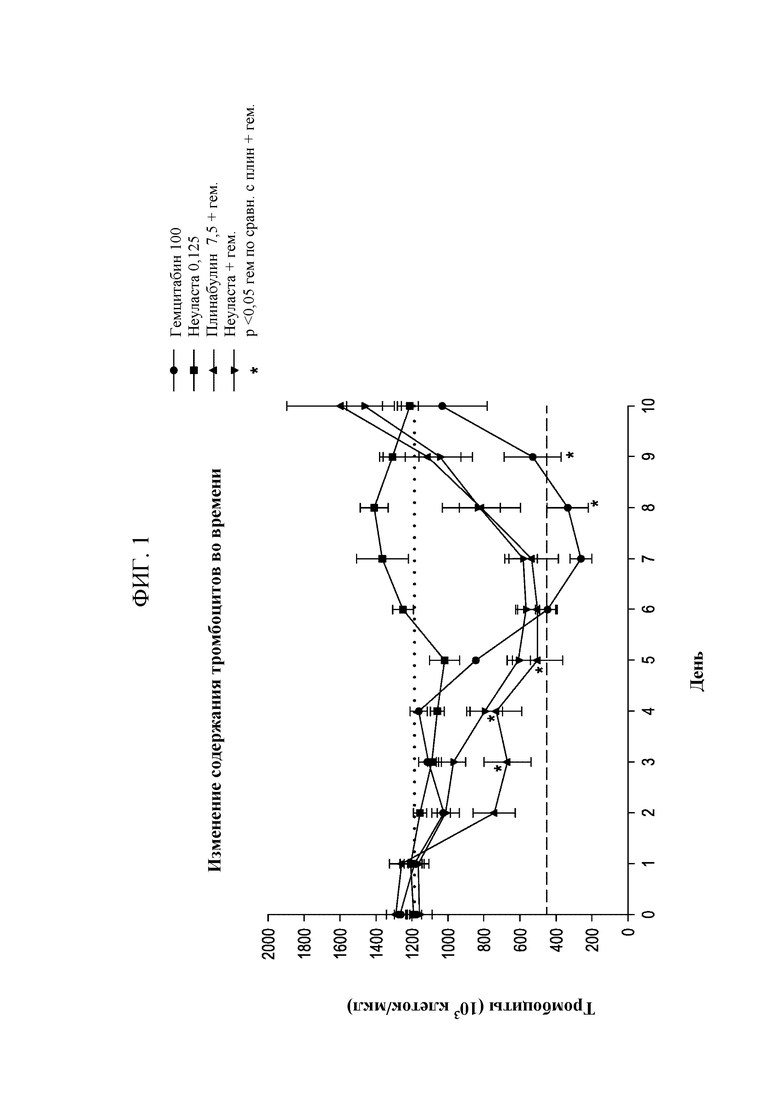


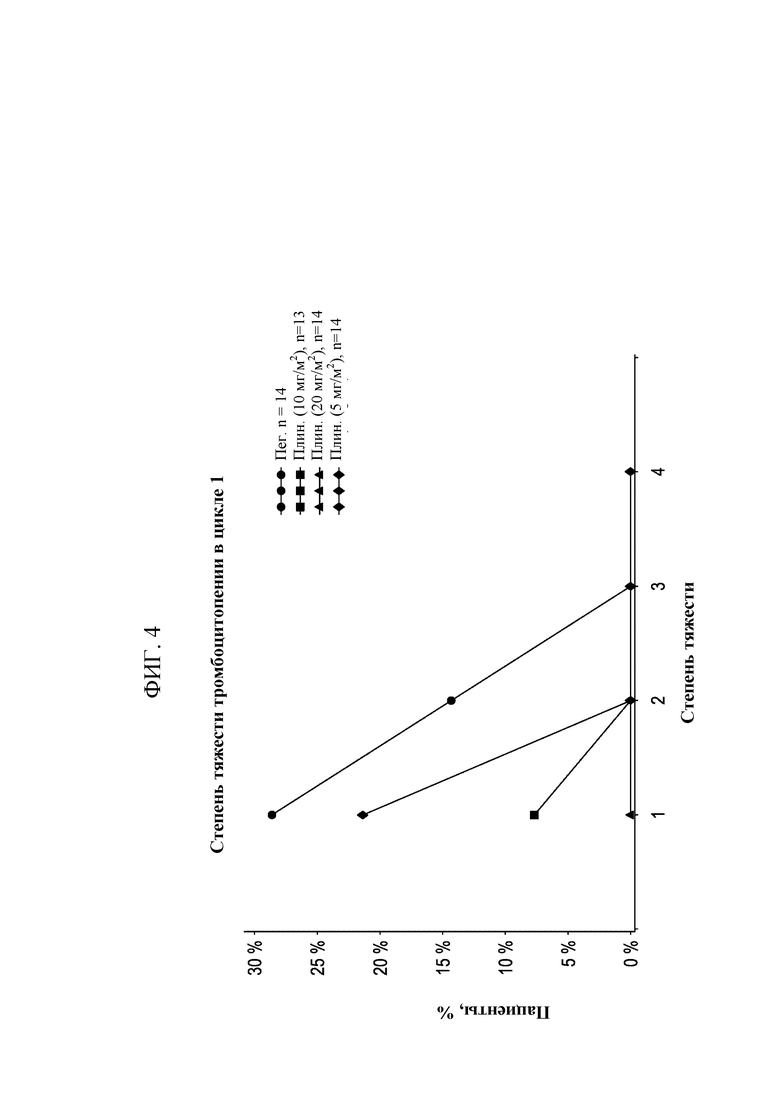
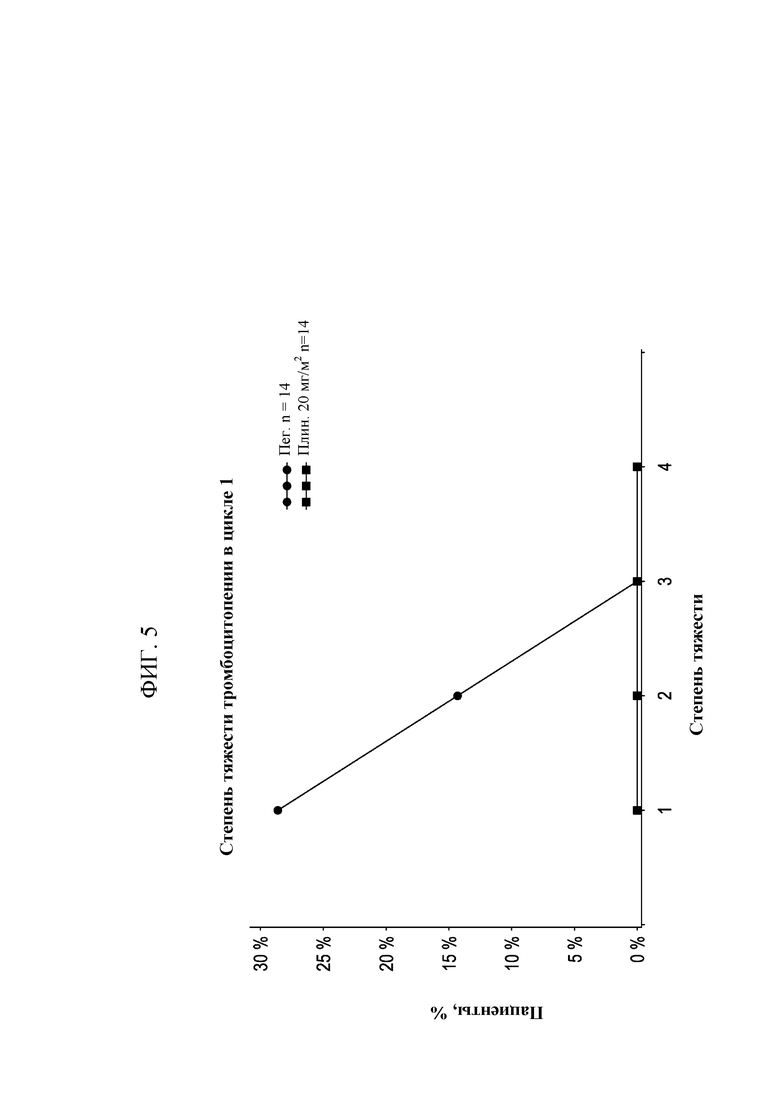
Изобретение относится к области медицины, а именно к фармакологии, и предназначено для уменьшения или облегчения тромбоцитопении. Способ уменьшения тромбоцитопении включает введение плинабулина или его фармацевтически приемлемой соли субъекту, нуждающемуся в этом. Указанная тромбоцитопения вызвана введением гемцитабина или химиотерапевтической композиции, содержащей гемцитабин. Гемцитабин вводят за 1 час до введения плинабулина, при этом плинабулин вводят в виде однократной дозы, составляющей 7,5 мг/кг или 10 мл/кг, с помощью внутрибрюшинной инъекции. Использование изобретения позволяет повысить эффективность лечения тромбоцитопении. 6 з.п. ф-лы, 5 ил., 1 табл., 2 пр.
1. Способ уменьшения тромбоцитопении, включающий введение плинабулина или его фармацевтически приемлемой соли субъекту, нуждающемуся в этом, где тромбоцитопения вызвана введением гемцитабина или химиотерапевтической композиции, содержащей гемцитабин, где гемцитабин вводят за 1 час до введения плинабулина, при этом плинабулин вводят в виде однократной дозы, составляющей 7,5 мг/кг или 10 мл/кг, с помощью внутрибрюшинной инъекции.
2. Способ по п. 1, отличающийся тем, что у субъекта тромбоцитопения 1 степени.
3. Способ по п. 1, отличающийся тем, что у субъекта тромбоцитопения 2 степени.
4. Способ по п. 1, отличающийся тем, что у субъекта тромбоцитопения 3 степени.
5. Способ по п. 1, отличающийся тем, что у субъекта тромбоцитопения 4 степени.
6. Способ по п. 1, в котором введение плинабулина или его фармацевтически приемлемой соли субъекту, нуждающемуся в этом, осуществляют в форме фармацевтической композиции, содержащей от 1 мг до 100 мг плинабулина и фармацевтически приемлемое вспомогательное вещество.
7. Способ по п. 6, где фармацевтическая композиция содержит гемцитабин и от 1 мг до 100 мг плинабулина, при этом гемцитабин и плинабулин находятся в двух отдельных стерильных контейнерах.
| WO 2015051543 A1, 16.04.2015 | |||
| WO 2015176012 A1, 19.11.2015 | |||
| WO 2015176012 A1, 19.11.2015 | |||
| СПОСОБ КОРРЕКЦИИ АМЕГАКАРИОЦИТАРНОЙ ТРОМБОЦИТОПЕНИИ | 2012 |
|
RU2519745C2 |
| WO 2016144635 A1, 15.09.2016 | |||
| WO 2016144635 A1, 15.09.2016 | |||
| МАСЧАН А | |||
| А | |||
| и др | |||
| Стимуляция продукции тромбоцитов: новый подход к лечению хронической иммунной тромбоцитопенической пурпуры | |||
| Онкогематология | |||
| Колосоуборка | 1923 |
|
SU2009A1 |
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
Авторы
Даты
2023-11-30—Публикация
2019-01-23—Подача