ВКЛЮЧЕНИЕ ПОСРЕДСТВОМ ССЫЛКИ ЛЮБОЙ ПРИОРИТЕТНОЙ ЗАЯВКИ
[0001] Данная заявка испрашивает приоритет на основании предварительной заявки на патент США №62/129654, поданной 6 марта 2015 года, и предварительной заявки на патент США №62/249788, поданной 2 ноября 2015 года, содержание которых полностью включено в настоящую заявку посредством ссылки.
УРОВЕНЬ ТЕХНИКИ
Область техники
[0002] Настоящее изобретение относится к области химии и медицины. Более конкретно, настоящее изобретение относится к способу лечения рака, ассоциированного с мутацией RAS, с применением плинабулина (Plinabulin).
Описание предшествующего уровня техники
[0003] Белки RAS функционируют как бинарные молекулярные переключатели, которые контролируют внутриклеточные сети передачи сигнала. RAS-регулируемые сигнальные пути контролируют такие процессы, как целостность актинового цитоскелета, пролиферация, дифференцировка, адгезия клеток, апоптоз и миграция клеток. Подсемейство RAS включает по меньшей мере 21 член, как, например, KRAS, NRAS и HRAS. Белки RAS или родственные RAS белки передают сигналы извне клетки в ядро клетки. Эти сигналы дают запускают рост клеток, их деление или созревание и выполнение специализированных функций (дифференцировку). Белки RAS относятся к классу белков, называемому ГТФазы, что означает, что они превращает молекулу, называемую ГТФ, в другую молекулу, называемую ГДФ. Белок RAS действует как переключатель, и он включается и выключается молекулами ГТФ и ГДФ. Для передачи сигналов белок RAS должен быть включен посредством присоединения (связывания) к молекуле ГТФ. Белок RAS выключается (инактивируется) при преобразовании им ГТФ в ГДФ. Когда этот белок связан с ГДФ, он не передает сигналы в ядро клетки. В случае мутации белка RAS по определенным кодонам, белок RAS постоянно находится в связанном с ГТФ состоянии, и поэтому продолжает посылать сигнал в ядро, и клетка не может прекратить деление, что является неконтролируемым клеточным ростом или раком.
[0004] Гены RAS относятся к классу генов, известных как онкогены. Мутантная форма гена RAS может привести к тому, что нормальные клетки становятся раковыми. Белки, кодируемые генами RAS, представляют собой ГТФазы. Данные белки играют важную роль в делении клеток, дифференцировке клеток и апоптозе клеток. Тем не менее, механизмы, посредством которых онкогенные RAS координируют сдвиг в метаболизме для поддержания роста опухоли, в частности, в микроокружении опухоли, и являются ли конкретные метаболические пути существенными для опосредуемого RAS поддержания опухолей, остаются областями активного исследования. Рак, характеризующийся мутацией RAS, трудно поддается лечению с применением известных препаратов, и не существует никаких одобренных лекарственных средств для лечения данных рака. Мутация RAS является негативным прогностическим фактором выживаемости пациентов с раком; у пациентов с раком окончательный прогноз намного хуже (или меньше общая выживаемость), если у них рак с мутацией RAS. Таким образом, существует острая неудовлетворенная потребность в более эффективном лечении рака, ассоциированного с мутацией онкогенных генов RAS.
КРАТКОЕ ОПИСАНИЕ
[0005] Некоторые варианты реализации относятся к способу лечения рака, характеризующегося экспрессией мутантной формы белка RAS, включающему введение плинабулина субъекту, нуждающемуся в этом.
[0006] Некоторые варианты реализации относятся к способу лечения рака, характеризующегося экспрессией мутантной формы белка KRAS, включающему введение плинабулина субъекту, нуждающемуся в этом.
[0007] Некоторые варианты реализации относятся к способу лечения рака, характеризующегося экспрессией мутантной формы белка NRAS, включающему введение плинабулина субъекту, нуждающемуся в этом.
[0008] Некоторые варианты реализации относятся к способу ингибирования (подавления) пролиферации клетки с мутацией RAS, включающему приведение указанной клетки в контакт с плинабулином.
[0009] Некоторые варианты реализации относятся к способу индуцирования апоптоза в клетке, содержащей мутацию RAS, включающему ведение указанной клетки в контакт с плинабулином.
[0010] Некоторые варианты реализации относятся к способу ингибирования прогрессирования рака, характеризующегося экспрессией мутантной формы белка RAS, у субъекта, включающему введение плинабулина субъекту, нуждающемуся в этом.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
[0011] На ФИГ. 1a-1d представлена генетически модифицированная мышиная модель (GEMM) глиобластомы (GBM) пронейрального типа, которая имитирует патологию человека. На ФИГ. 1а представлены изображения Т2 MPT GBM человека, на которых отображен перитуморальный отек; и на ФИГ. 1b представлены изображения Т2 MPT GBM мыши, на которых отображен перитуморальный отек; на ФИГ. 1 с представлены микрофотоснимки окрашивания помощи гематоксилином и эозином (Н&Е) GBM человека, показывающие характерный некроз с псевдопалисадными структурами и микрососудистую пролиферацию; на ФИГ. 1d представлены микрофотоснимки окрашивания гематоксилином и эозином (Н&Е) GBM мыши, отображающие характерный некроз с псевдопалисадными структурами и микрососудистую пролиферацию.
[0012] На ФИГ. 2 представлен размер опухоли у мышей с ТФР-индуцируемыми глиомами, получавших лечение средой-носителем, темозоломидом или фракционированным облучением.
[0013] На ФИГ. 3 представлена масса опухоли при вскрытии мышей, получавших лечение только средой-носителем, только Доцетакселом и комбинацией плинабулина и Доцетаксела.
[0014] На ФИГ. 4 представлен уровень выживаемости мышей с ТФР-индуцируемыми глиомами, характеризующимися экспрессией мутации KRAS, которые получали лечение контролем и плинабулином.
[0015] На ФИГ. 5 представлен уровень выживаемости мышей с ТФР-индуцируемыми глиомами, характеризующимися экспрессией мутации KRAS, которые получали лечение комбинацией плинабулина, Темозоломида и облучения, а также комбинацией Темозоломида и облучения.
[0016] На ФИГ. 6 представлено изменение объема опухоли у мышей с ксенотрансплантатной моделью опухоли толстой кишки человека НСТ-15 (мутация G13D KRAS) на протяжении всего исследования у мышей, получавших лечение средой-носителем, представляющей контроль, плинабулином, Иринотеканом или комбинацией плинабулина и Иринотекана.
[0017] На ФИГ. 7 представлено изменение объема опухоли у мышей с ксенотрансплантатной моделью опухоли толстой кишки человека LoVo (KRAS мутация, p. G13D) на протяжении всего исследования у мышей, получавших лечение средой-носителем, представляющей контроль, плинабулином, Иринотеканом или комбинацией плинабулина и Иринотекана.
ПОДРОБНОЕ ОПИСАНИЕ ПРЕДПОЧТИТЕЛЬНОГО ВАРИАНТА РЕАЛИЗАЦИИ
[0018] Плинабулин, (3Z,6Z)-3-бензилиден-6-{[5-(2-метил-2-пропанил)-1H-имидазол-4-ил]метилен}-2,5-пиперазиндион, представляет собой синтетический аналог природного соединения фенилагистина. Плинабулин можно легко получить в соответствии со способами и процедурами, подробно описанными в патентах США №№7064201 и 7919497, которые полностью включены в настоящую заявку посредством ссылки. Некоторые варианты реализации относятся к применению плинабулина для лечения рака, ассоциированного с онкогенной мутацией RAS. Некоторые варианты реализации относятся к применению плинабулина для лечения рака, характеризующегося экспрессией мутантной формы белка RAS, у субъекта. Некоторые варианты реализации относятся к применению плинабулина для ингибирования пролиферации клетки с мутацией RAS. Некоторые варианты реализации относятся к применению плинабулина для индукции апоптоза в клетке, содержащей мутацию RAS. Некоторые варианты реализации относятся к применению плинабулина для ингибирования прогрессирования рака, который характеризуется экспрессией мутантной формы белка RAS, у субъекта. В некоторых вариантах реализации указанный белок RAS представляет собой белок KRAS. В некоторых вариантах реализации указанный белок RAS представляет собой белок NRAS.
Определения
[0019] В отсутствие другого определения все технические и научные термины, используемые в настоящем документе, имеют то же значение, которое обычно понимается специалистом в области техники, к которой относится данное раскрытие. Все патенты, заявки, публикации заявок и другие публикации полностью включены посредством ссылки. В случае, когда существует множество определений для термина из настоящего документа, приоритет имеют определения, которые представлены в данном разделе, если не указано иное.
[0020] В контексте настоящего описания термин «субъект» означает человека или млекопитающее, не являющееся человеком, например, собаку, кошку, мышь, крысу, корову, овцу, свинью, козу, не являющегося человеком примата или птицу, например, курицу, а также любое другое позвоночное или беспозвоночное.
[0021] Термин «млекопитающее» используют в его обычном биологическом смысле. Таким образом, он включает, в частности, но не ограничивается ими, приматов, включая обезьян (шимпанзе, человекообразных обезьян, макак) и людей, крупный рогатый скот, лошадей, овец, коз, свиней, кроликов, собак, кошек, грызунов, крыс, мышей, морских свинок или им подобных.
[0022] В контексте настоящего описания «эффективное количество» или «терапевтически эффективное количество» относится к количеству терапевтического агента, которое эффективно для облегчения, в некоторой степени, или для снижения вероятности возникновения одного или более симптомов заболевания или состояния, и включает лечение болезни или состояния.
[0023] В контексте настоящего описания «лечить», «лечение» или «процесс лечения» относится к введению (применению) соединения или фармацевтической композиции субъекту в профилактических и/или терапевтических целях. Термин «профилактическое лечение» относится к лечению субъекта, у которого еще не проявились симптомы заболевания или состояния, но который чувствителен к или иным образом подвержен риску конкретного заболевания или состояния, при котором лечение снижает вероятность того, что у указанного пациента будет развиваться указанная болезнь или состояние. Термин «терапевтическое лечение» относится к применению лечения у субъекта, уже страдающего от заболеванием или состоянием.
[0024] Термин «фармацевтически приемлемая соль» относится к солям, которые сохраняют биологическую эффективность и свойства соединения, и которые не являются с биологической или другой точки зрения нежелательными для применения в фармацевтике. Во многих случаях раскрытые в настоящем документе соединения способны образовывать соли с кислотами и/или основаниями в силу присутствия аминогрупп и/или карбоксильных групп или групп, аналогичных им. Фармацевтически приемлемые соли присоединения кислот можно образовать с неорганическими кислотами и органическими кислотами. Неорганические кислоты, из которых можно получить соли, включают, например, хлористоводородную кислоту, бромистоводородную кислоту, серную кислоту, азотную кислоту, фосфорную кислоту и им подобные. Органические кислоты, из которых можно получить соли, включают, например, уксусную кислоту, пропионовую кислоту, гликолевую кислоту, пировиноградную кислоту, щавелевую кислоту, малеиновую кислоту, малоновую кислоту, янтарную кислоту, фумаровую кислоту, винную кислоту, лимонную кислоту, бензойную кислоту, коричную кислоту, миндальную кислоту, метансульфоновую кислоту, этансульфоновую кислоту, n-толуолсульфоновую кислоту, салициловую кислоту и им подобные. Фармацевтически приемлемые соли также можно получить с применением неорганических и органических оснований. Неорганические основания, из которых можно получить соли, включают, например, основания, которые содержат натрий, калий, литий, аммоний, кальций, магний, железо, цинк, медь, марганец, алюминий и им подобные; особенно предпочтительными являются соли аммония, калия, натрия, кальция и магния. В некоторых вариантах реализации лечение раскрытыми в настоящем документе соединениями с неорганическим основанием приводит к потере лабильного водорода из указанного соединения с получением соли, содержащей неорганический катион, такой как Li+, Na+, K+, Mg2+ и Са2+ и им подобные. Органические основания, из которых можно получить соли, включают, например, первичные, вторичные и третичные амины, замещенные амины, включая встречающиеся в природе замещенные амины, циклические амины, основные ионообменные смолы и им подобные, в частности такие, как изопропиламин, триметиламин, диэтиламин, триэтиламин, трипропиламин и этаноламин. Многие из таких солей известны в данной области техники, как описанные в публикации WO 87/05297, Johnston и др., опубликованной 11 сентября 1987 г. (полностью включенной в настоящее описание посредством ссылки).
[0025] В некоторых вариантах реализации указанная композиция может дополнительно содержать один или более фармацевтически приемлемых разбавителей. В некоторых вариантах реализации указанный фармацевтически приемлемый разбавитель может включать коллифор (kolliphor®) (полиэтиленгликоль(15)-гидроксистеарат). В некоторых вариантах реализации указанный фармацевтически приемлемый разбавитель может включать пропиленгликоль. В некоторых вариантах реализации указанные фармацевтически приемлемые разбавители могут включать коллифор и пропиленгликоль. В некоторых вариантах реализации указанные фармацевтически приемлемые разбавители могут включать коллифор и пропиленгликоль, при этом содержание коллифора составляет приблизительно 40% по массе, а содержание пропиленгликоля составляет приблизительно 60% по массе в расчете на общую массу разбавителей. В некоторых вариантах реализации указанная композиция может дополнительно содержать один или более других фармацевтически приемлемых вспомогательных веществ.
[0026] Стандартные методы получения фармацевтических составов можно применять для получения описанных в настоящем документе фармацевтических композиций, такие как, например, описанные в Remington's Science and Practice of Pharmacy, 21е изд., Lippincott Williams & Wilkins (2005), полностью включенном в настоящее описание посредством ссылки. Соответственно, некоторые варианты реализации включают фармацевтические композиции, содержащие: (а) безопасное и терапевтически эффективное количество плинабулина или его фармацевтически приемлемых солей; и (b) фармацевтически приемлемый носитель, разбавитель, вспомогательное вещество или их комбинацию.
[0027] Другие варианты реализации включают совместное введение плинабулина и дополнительного терапевтического агента в отдельных композициях или в одной композиции. Таким образом, некоторые варианты реализации включают первую фармацевтическую композицию, содержащую: (а) безопасное и терапевтически эффективное количество плинабулина или его фармацевтически приемлемых солей и (b) фармацевтически приемлемый носитель, разбавитель, вспомогательное вещество или их комбинацию; и вторую фармацевтическую композицию, содержащую: (а) безопасное и терапевтически эффективное количество дополнительного терапевтического агента и (b) фармацевтически приемлемый носитель, разбавитель, вспомогательное вещество или их комбинацию. Некоторые варианты реализации включают фармацевтическую композицию, содержащую: (а) безопасное и терапевтически эффективное количество плинабулина или его фармацевтически приемлемых солей; (b) безопасное и терапевтически эффективное количество дополнительного терапевтического агента; и (с) фармацевтически приемлемый носитель, разбавитель, вспомогательное вещество или их комбинацию.
[0028] Введение описанных в настоящем документе фармацевтических композиций можно осуществлять с использованием любого из принятых способов введения для агентов, которые применяют аналогичным образом, включая, но не ограничиваясь ими, перорально, сублингвально, буккально, подкожно, внутривенно, интраназально, местно, трансдермально, внутрикожно, интраперитонеально, внутримышечно, интрапульмонально, вагинально, ректально или внутриглазно. Пероральные и парентеральные пути введения являются обычными при лечении показаний, которые являются объектом предпочтительных вариантов реализации.
[0029] Термин «фармацевтически приемлемый носитель» или «фармацевтически приемлемое вспомогательное вещество» включает любые и все растворители, дисперсионные среды, покрытия, антибактериальные и противогрибковые агенты, изотонические и задерживающие абсорбцию агенты и им подобные. Применение таких сред и агентов для фармацевтически активных веществ хорошо известно в данной области техники. За исключением тех случаев, когда какая-либо обычная среда или агент несовместим с активным ингредиентом, предусмотрено их применение в терапевтических композициях. Кроме того, могут быть включены различные адъюванты, как, например, обычно применяемые в данной области техники. Критерии по включению различных компонентов в фармацевтические композиции описаны, например, в публикациях Gilman et al. (ред.) (1990); Goodman и Gilman's: The Pharmacological Basis of Therapeutics, 8th Ed., Pergamon Press, содержание которых полностью включено в настоящую заявку посредством ссылки.
[0030] Некоторыми примерами веществ, которые могут служить в качестве фармацевтически приемлемых носителей или их компонентов, являются сахара, такие как лактоза, глюкоза и сахароза; крахмалы, такие как кукурузный крахмал и картофельный крахмал; целлюлоза и ее производные, такие как натрий карбоксиметилцеллюлоза, этилцеллюлоза и метилцеллюлоза; порошкообразный трагакант; солод; желатин; тальк; твердые смазывающие вещества, такие как стеариновая кислота и стеарат магния; сульфат кальция; растительные масла, такие как арахисовое масло, хлопковое масло, кунжутное масло, оливковое масло, кукурузное масло и масло теобромы; полиолы, такие как пропиленгликоль, глицерин, сорбит, маннит и полиэтиленгликоль; альгиновая кислота; эмульгаторы, такие как TWEENS; смачивающие агенты, такие как лаурилсульфат натрия; красители; ароматизаторы; таблетирующие агенты, стабилизаторы; антиоксиданты; консерванты; вода, не содержащая пирогены; изотонический физиологический раствор и фосфатные буферные растворы.
[0031] Описанные в настоящем документы композиции предпочтительно представлены в дозированной лекарственной форме. В контексте настоящего описания термин «дозированная лекарственная форма» представляет собой композицию, содержащую количество соединения или композиции, которое является подходящим для введения животному, предпочтительно млекопитающему-субъекту, в однократной дозировке согласно надлежащей медицинской практике. Однако получение лекарственной формы с однократной дозировкой или дозированной лекарственной формы не означает, что лекарственную форму вводят один раз в день или один раз на курс терапии. Предполагается, что такие лекарственные формы вводят один, два, три или более раз в день, и их можно вводить в виде инфузии в течение периода времени (например, от приблизительно 30 минут до приблизительно 2-6 часов) или вводить в виде непрерывной инфузии, и их можно назначать более одного раза в течение курса терапии, хотя отдельное введение специальным образом не исключают. Специалисту в данной области техники будет понятно, что указанный препарат не подразумевает полный курс терапии, и такие решения принимаются специалистами в области лечения, а не получения препаратов.
[0032] Описанные выше подходящие композиции могут быть представлены в любой из множества подходящих форм для различных способов введения, например, для перорального, сублингвального, буккального, назального, ректального, местного (включая трансдермальный и внутрикожный), глазного, интрацеребрального, внутричерепного, интратекального, внутриартериального, внутривенного, внутримышечного или других парентальных способов введения. Специалисту в данной области техники будет понятно, что композиции для перорального и назального введения включают композиции, которые вводят путем ингаляции, и их получают с применением доступных методик. В зависимости от конкретного желаемого пути введения можно применять множество фармацевтически приемлемых носителей, хорошо известных в данной области техники. Фармацевтически приемлемые носители включают, например, твердые или жидкие наполнители, разбавители, гидротропные, поверхностно-активные вещества и инкапсулирующие вещества. Могут быть включены необязательные фармацевтически активные материалы, которые по существу не влияют на ингибирующую активность указанного соединения или композиции. Количество носителя, используемого в сочетании с указанным соединением или композицией, является достаточным на единицу дозы соединения. Методы и композиции для получения лекарственных форм, подходящих в описанных в настоящем документе способах, описаны в следующих источниках, каждый из которых включен в настоящую заявку посредством ссылки: Modern Pharmaceutical, 4th Ed., Chapters 9 и 10 (Banker & Rhodes, editors, 2002); Lieberman et al., Pharmaceutical Dosage Forms: Tablets (1989); и Ansel, Introduction to Pharmaceutical Dosage Forms, 8th Ed. (2004).
[0033] Можно применять различные лекарственные формы для перорального введения, включая такие твердые формы, как таблетки, капсулы (например, твердые желатиновые капсулы и жидкие желатиновые капсулы), гранулы и нерасфасованные порошки. Таблетки могут быть спрессованы, перетерты, покрыты энтеросолюбильной оболочкой, сахаром, пленкой или могут быть спрессованы множество раз и содержать подходящие связующие вещества, смазывающие вещества, разбавители, дезинтегрирующие агенты, красители, ароматизаторы, антислеживающие агенты и агенты, понижающие температуру замерзания. Жидкие лекарственные формы для перорального введения включают водные растворы, эмульсии, суспензии, растворы и/или суспензии, восстановленные из нешипучих гранул, и шипучие препараты, восстановленные из шипучих гранул, содержащие подходящие растворители, консерванты, эмульгаторы, суспендирующие агенты, разбавители, подсластители, агенты, понижающие температуру замерзания, красители и ароматизаторы.
[0034] Фармацевтически приемлемые носители, подходящие для получения препарата дозированной лекарственной формы для перорального введения, хорошо известны в данной области техники. Таблетки обычно содержат обычные фармацевтически совместимые адъюванты в качестве инертных разбавителей, такие как карбонат кальция, карбонат натрия, маннит, лактоза и целлюлоза, связующие вещества, такие как крахмал, желатин и сахароза, разрыхлители, такие как крахмал, альгиновая кислота и кроскармелоза, смазывающие вещества, такие как стеарат магния, стеариновая кислота и тальк. Для улучшения характеристик текучести порошковой смеси можно применять глиданты (скользящие вещества), такие как диоксид кремния. Для внешнего вида можно добавлять красители, такие как FD&С-красители. Подсластители и ароматизаторы, такие как аспартам, сахарин, ментол, перечная мята и фруктовые ароматизаторы, являются подходящими адъювантами для жевательных таблеток. Капсулы обычно содержат один или более твердых разбавителей, раскрытых выше. Отбор компонентов носителя зависит от вторичных критериев, таких как вкус, стоимость и стабильность при хранении, которые не являются критическими, и специалист в данной области техники может его легко осуществить.
[0035] Композиции для перорального введения также включают жидкие растворы, эмульсии, суспензии и им подобные. Фармацевтически приемлемые носители, подходящие для получения таких композиций, хорошо известны в данной области техники. Обычные компоненты носителей для сиропов, эликсиров, эмульсий и суспензий включают этанол, глицерин, пропиленгликоль, полиэтиленгликоль, жидкую сахарозу, сорбит и воду. Для суспензии обычные суспендирующие агенты включают метилцеллюлозу, натрий карбоксиметилцеллюлозу, AVICEL RC-591, трагакант и альгинат натрия; характерные смачивающие агенты включают лецитин и полисорбат 80; и характерные консерванты включают метилпарабен и бензоат натрия. Жидкие композиции для перорального введения могут также содержать один или более компонентов, таких как подсластители, ароматизаторы и красители, раскрытых выше.
[0036] Обычные методы также позволяют снабжать такие композиции покрытиями, обычно рН- или времязависимыми покарытиями, благодаря которым предлагаемая композиция высвобождается в желудочно-кишечном тракте вблизи желаемого места применения или в разное время для продления желаемого действия. Такие лекарственные формы обычно включают, но не ограничиваются ими, один или более из ацетатфталата целлюлозы, поливинилацетат фталата, фталата гидроксипропилметилцеллюлозы, этилцеллюлозы, покрытия Eudragit, восков и шеллака.
[0037] Описанные в настоящем документе композиции могут необязательно содержать другие лекарственные вещества.
[0038] Другие композиции, подходящие для обеспечения системной доставки указанных предлагаемых соединений, включают лекарственные формы для подъязычного, буккального и носового способов введений. Такие композиции обычно содержат один или более растворимых веществ-наполнителей, таких как сахароза, сорбит и маннитол, и связующих веществ, таких как гуммиарабик, микрокристаллическая целлюлоза, карбоксиметилцеллюлоза и гидроксипропилметилцеллюлоза. Также могут быть включены глиданты, смазывающие вещества, подсластители, красители, антиоксиданты и ароматизаторы, раскрытые выше.
[0039] Жидкую композицию, представленную в форме для местного офтальмологического применения, изготавливают таким образом, что ее можно вводить местно в глаз. Можно обеспечить максимальный комфорт, хотя иногда критерии для форм (например, стабильность лекарственного средства) могут обуславливать комфорт ниже оптимального. В случае, когда невозможно достичь максимального уровня комфорта, указанную жидкость можно изготавливать таким образом, что жидкость будет переноситься пациентом при местном офтальмологическом применении. Кроме того, офтальмологически приемлемая жидкость можно может быть либо упакована для однократного применения, либо она может содержать консервант для предотвращения заражения при многократных применениях.
[0040] Для офтальмологического применения растворы или лекарственные средства часто получают с применением физиологического солевого раствора в качестве основной среды-носителя. В предпочтительном варианте поддерживают комфортный рН офтальмоллогических растворов при помощи соответствующей буферной системы. Указанные составы могут также содержать обычные фармацевтически приемлемые консерванты, стабилизаторы и поверхностно-активные вещества.
[0041] Консерванты, которые можно применять в раскрытых в настоящем документе фармацевтических композициях, включают, но не ограничиваются ими, бензалкония хлорид, РНМВ, хлорбутанол, тимеросал, ацетат фенилртути и нитрат фенилртути. Подходящим поверхностно-активным веществом является, например, Tween 80. Аналогичным образом, в раскрытых в настоящем документе офтальмологических препаратах можно применять различные подходящие среды-носители. Такие среды-носители включают, но не ограничиваются ими, поливиниловый спирт, повидон, гидроксипропилметилцеллюлозу, полоксамеры, карбоксиметилцеллюлозу, гидроксиэтилцеллюлозу и очищенную воду.
[0042] Регуляторы тоничности можно добавлять по мере необходимости или удобства. Они включают, но не ограничиваются ими, соли, в частности хлорид натрия, хлорид калия, маннит и глицерин, или любой другой подходящий офтальмологически приемлемый регулятор тоничности.
[0043] Различные буферы и средства для регулирования рН можно применять при условии, что полученный препарат будет офтальмологически приемлемым. Для многих композиций значение рН будет составлять от 4 до 9. Соответственно, буферы включают ацетатные буферы, цитратные буферы, фосфатные буферы и боратные буферы. Кислоты или основания можно применять для регулирования рН данных составов по мере необходимости.
[0044] Офтальмологически приемлемые антиоксиданты включают, но не ограничиваются ими, метабисульфит натрия, тиосульфат натрия, ацетилцистеин, бутилированный гидроксианизол и бутилированный гидрокситолуол.
[0045] Другими вспомогательными компонентами, которые могут быть включены в офтальмологические препараты, являются хелатирующие агенты. Подходящим хелатирующим агентом является эдетат динатрия (ЭДТА), хотя другие хелатирующие агенты также можно применять вместо или в сочетании с ним.
[0046] Для местного применения используют кремы, мази, гели, растворы или суспензии и т.д., содержащие раскрытую в настоящем документе композицию. Составы для местного применения могут в целом состоять из фармацевтического носителя, сорастворителя, эмульгатора, усилителя проникновения, системы консервирования и смягчающего вещества.
[0047] Для внутривенного введения описанные в настоящем документе композиции можно растворить или диспергировать в фармацевтически приемлемом разбавителе, таком как физиологический раствор или раствор декстрозы. Подходящие вспомогательные вещества могут быть включены для достижения желаемого рН, включая, но не ограничиваясь ими, NaOH, карбонат натрия, ацетат натрия, HCl и лимонную кислоту. В различных вариантах реализации значение рН конечной композиции составляет от 2 до 8 или предпочтительно от 4 до 7. Обладающие антиоксидантными свойствами вспомогательные вещества могут включать бисульфит натрия, ацетон-бисульфит натрия, формальдегид натрия, сульфоксилат, тиомочевину и ЭДТА. Другие неограничивающие примеры подходящих вспомогательных веществ, обнаруживаемых в окончательной композиции для внутривенного введения, могут включать фосфаты натрия или калия, лимонную кислоту, винную кислоту, желатин и углеводы, такие как декстроза, маннит и декстран. Другие приемлемые вспомогательные вещества описаны в публикациях Powell et al., Compendium of Excipients for Parenteral Formulation, PDA J. Pharm. Sci. and Tech. 1998, 52 238-311 и Nema et al., Excipients and Their Role in Approved Injectable Products: Current Usage and Future Directions, PDA J. Pharm. Sci. and Tech. 2011, 65 287-332, обе из которых полностью включены в настоящую заявку посредством ссылки. Антимикробные агенты также могут быть включены для придания раствору бактериостатических или фунгистатических свойств, включая, но не ограничиваясь ими, нитрат фенилртути, тимеросал, бензетония хлорид, бензалкония хлорид, фенол, крезол и хлорбутанол.
[0048] Указанные композиции для внутривенного введения можно предоставлять осуществляющим уход лицам в форме одного или более твердых веществ, которые восстанавливают при помощи подходящего разбавителя, такого как стерильная вода, физиологический раствор или декстроза в воде, незадолго до введения. В других вариантах реализации композиции представлены в растворе, готовом для парентерального введения. В других вариантах реализации композиции предложены в растворе, который дополнительно разбавляют перед введением. В вариантах реализации, которые включают введение комбинации описанного в настоящем документе соединения и другого агента, указанную комбинацию можно предоставлять лицам, осуществляющим уход, в виде смеси, или осуществляющие уход лица могут смешать два агента до введения, или два агента можно вводить отдельно.
[0049] Фактическая доза активных соединений, описанных в настоящем документе, зависит от конкретного соединения и от состояния, которое лечат; выбор соответствующей дозы находится в пределах знаний квалифицированного специалиста. В некоторых вариантах реализации однократная доза плинабулина или другого терапевтического агента может составлять от 5 мг/м2 до приблизительно 150 мг/м2 площади поверхности тела, от приблизительно 5 мг/м2 до приблизительно 100 мг/м2 площади поверхности тела, от приблизительно 10 мг/м2 до приблизительно 100 мг/м2 площади поверхности тела, от приблизительно 10 мг/м2 до приблизительно 80 мг/м2 площади поверхности тела, от приблизительно 10 мг/м2 до приблизительно 50 мг/м2 площади поверхности тела, от приблизительно 10 мг/м2 до приблизительно 40 мг/м2 площади поверхности тела, от приблизительно 10 мг/м2 до приблизительно 30 мг/м2 площади поверхности тела, от приблизительно 13,5 мг/м2 до приблизительно 100 мг/м2 площади поверхности тела, от приблизительно 13,5 мг/м2 до приблизительно 80 мг/м2 площади поверхности тела, от приблизительно 13,5 мг/м2 до приблизительно 50 мг/м2 площади поверхности тела, от приблизительно 13,5 мг/м2 до приблизительно 40 мг/м2 площади поверхности тела, от приблизительно 13,5 мг/м2 до приблизительно 30 мг/м2 площади поверхности тела, от приблизительно 15 мг/м2 до приблизительно 80 мг/м2 площади поверхности тела, от приблизительно 15 мг/м2 до приблизительно 50 мг/м2 площади поверхности тела или от приблизительно 15 мг/м2 до приблизительно 30 мг/м2 площади поверхности тела. В некоторых вариантах реализации однократная доза плинабулина или другого терапевтического агента может составлять от приблизительно 13,5 мг/м2 до приблизительно 30 мг/м2 площади поверхности тела. В некоторых вариантах реализации однократная доза плинабулина или другого терапевтического агента может составлять приблизительно 5 мг/м2, приблизительно 10 мг/м2, приблизительно 12,5 мг/м2, приблизительно 13,5 мг/м2, приблизительно 15 мг/м2, приблизительно 17,5 мг/м2, приблизительно 20 мг/м2, приблизительно 22,5 мг/м2, приблизительно 25 мг/м2, приблизительно 27,5 мг/м2, приблизительно 30 мг/м2, приблизительно 40 мг/м2, приблизительно 50 мг/м2, приблизительно 60 мг/м2, приблизительно 70 мг/м2, приблизительно 80 мг/м2, приблизительно 90 мг/м2 или приблизительно 100 мг/м2 площади поверхности тела.
[0050] В некоторых вариантах реализации однократная доза плинабулина или другого терапевтического агента может составлять от приблизительно 5 мг до приблизительно 300 мг, от приблизительно 5 мг до приблизительно 200 мг, от приблизительно 7,5 мг до приблизительно 200 мг, от приблизительно 10 мг до приблизительно 100 мг, от приблизительно 15 мг до приблизительно 100 мг, от приблизительно 20 мг до приблизительно 100 мг, от приблизительно 30 мг до приблизительно 100 мг, от приблизительно 40 мг до приблизительно 100 мг, от приблизительно 10 мг до приблизительно 80 мг, от приблизительно 15 мг до приблизительно 80 мг, от приблизительно 20 мг до приблизительно 80 мг, от приблизительно 30 мг до приблизительно 80 мг, от приблизительно 40 мг до приблизительно 80 мг, от приблизительно 10 мг до приблизительно 60 мг, от приблизительно 15 мг до приблизительно 60 мг, от приблизительно 20 мг до приблизительно 60 мг, от приблизительно 30 мг до приблизительно 60 мг или от приблизительно 40 мг до приблизительно 60 мг. В некоторых вариантах реализации однократная доза плинабулина или другого терапевтического агента может составлять от приблизительно 20 мг до приблизительно 60 мг, от приблизительно 27 мг до приблизительно 60 мг, от приблизительно 20 мг до приблизительно 45 мг или от приблизительно 27 мг до приблизительно 45 мг. В некоторых вариантах реализации однократная доза плинабулина или другого терапевтического агента может составлять приблизительно 5 мг, приблизительно 10 мг, приблизительно 12,5 мг, приблизительно 13,5 мг, приблизительно 15 мг, приблизительно 17,5 мг, приблизительно 20 мг, приблизительно 22,5 мг, приблизительно 25 мг, приблизительно 27 мг, приблизительно 30 мг, приблизительно 40 мг, приблизительно 50 мг, приблизительно 60 мг, приблизительно 70 мг, приблизительно 80 мг, приблизительно 90 мг, приблизительно 100 мг, приблизительно 125 мг, приблизительно 150 мг или приблизительно 200 мг.
[0051] Период введения (применения) может представлять собой многонедельный цикл лечения до тех пор, пока опухоль остается под контролем и указанный режим клинически переносим. В некоторых вариантах реализации однократную дозировку плинабулина или другого терапевтического агента можно вводить один раз в неделю и предпочтительно один раз на каждый 1 и 8 день трехнедельного (21-дневного) цикла лечения. В некоторых вариантах реализации однократную дозировку плинабулина или другого терапевтического агента можно вводить один раз в неделю, два раза в неделю, три раза в неделю, четыре раза в неделю, пять раз в неделю, шесть раз в неделю или ежедневно в течение недельного, двухнедельного, трехнедельного, четырехнедельного или пятинедельного цикла лечения. Введение можно осуществлять в тот же или разные дни каждой недели в цикле лечения.
[0052] Указанный цикл лечения можно повторять до тех пор, пока режим клинически переносимтся. В некоторых вариантах реализации цикл лечения повторяют в течение n раз, где n представляет собой целое число в диапазоне от 2 до 30. В некоторых вариантах реализации n составляет 2, 3, 4, 5, 6, 7, 8, 9 или 10. В некоторых вариантах реализации новый цикл лечения можно начинать сразу же после завершения предыдущего цикла лечения. В некоторых вариантах реализации новый цикл лечения можно начинать через период времени после завершения предыдущего цикла лечения.
[0053] В некоторых вариантах реализации описанные в настоящем документе композиции можно применять в комбинации с другими терапевтическими агентами. В некоторых вариантах реализации описанные в настоящем документе композиции можно вводить или применять в комбинации со средствами для лечения, такими как химиотерапия, облучение и терапия биологическими методами.
Способы лечения
[0054] Некоторые варианты реализации относятся к способу лечения рака, характеризующегося экспрессией мутантной формы белка RAS, включающему введение плинабулина субъекту, нуждающемуся в этом. Некоторые варианты реализации относятся к способу лечения рака, ассоциированного с онкогенной мутацией RAS, включающему введение плинабулина субъекту, нуждающемуся в этом.
[0055] В некоторых вариантах реализации указанная мутантная форма белка RAS представляет собой мутантную форму белка KRAS, NRAS или HRAS. В некоторых вариантах реализации белок RAS представляет собой белок KRAS, NRAS или HRAS. В некоторых вариантах реализации указанная мутантная форма RAS представляет собой мутантную форму белка KRAS. В некоторых вариантах реализации указанная мутантная форма RAS представляет собой мутантную форму белка NRAS. В некоторых вариантах реализации мутация гена RAS представляет собой мутацию гена KRAS. В некоторых вариантах реализации мутация гена RAS представляет собой мутацию гена NRAS.
[0056] Некоторые варианты реализации относятся к способу лечения рака, характеризующегося экспрессией мутантной формы белка KRAS, включающему введение плинабулина субъекту, нуждающемуся в этом. Некоторые варианты реализации относятся к способу лечения рака, ассоциированного с онкогенной мутацией KRAS, включающему введение плинабулина субъекту, нуждающемуся в этом.
[0057] Некоторые варианты реализации относятся к способу лечения рака, характеризующегося экспрессией мутантной формы белка NRAS, включающему введение плинабулина субъекту, нуждающемуся в этом. Некоторые варианты реализации относятся к способу лечения рака, ассоциированного с онкогенной мутацией NRAS, включающему введение плинабулина субъекту, нуждающемуся в этом.
[0058] Некоторые варианты реализации настоящего изобретения включают способы лечения рака плинабулином и описанными в настоящем документе композициями, содержащими плинабулин. Некоторые способы включают введение соединения, композиции, фармацевтической композиции, описанной в настоящем документе, субъекту, нуждающемуся в этом. В некоторых вариантах реализации субъект может представлять собой животное, например, млекопитающее, человека.
[0059] В некоторых вариантах реализации рак выбран из колоректального рака, рака поджелудочной железы, рака почек, рака легких, рака печени, рака груди, рака предстательной железы, рака желудочно-кишечного тракта, перитонеального рака, меланомы, рака эндометрия, рака яичников, рака шейки матки, карциномы матки, рака мочевого пузыря, глиобластомы, метастазов в головной мозг, карциномы слюнных желез, рака щитовидной железы, рака мозга, лимфомы, миеломы и рака головы и шеи. В некоторых вариантах реализации рак выбран из плоскоклеточного рака, мелкоклеточного рака легких, немелкоклеточного рака легких, аденокарциномы легких, плоскоклеточного рака легких, гепатоцеллюлярной карциномы, рака толстой кишки, карциномы эндометрия и гепатоцеллюлярной карциномы. В некоторых вариантах реализации рак выбран из колоректального рака, рака предстательной железы, рака груди, рака легких, рака эндометрия, множественной миеломы, рака поджелудочной железы, рака почек и глиобластомы. В некоторых вариантах реализации рак выбран из немелкоклеточного рака легких, рака поджелудочной железы и глиобластомы. В некоторых вариантах реализации рак представляет собой немелкоклеточный рак легких.
[0060] В некоторых вариантах реализации KRAS содержит мутацию в одном или нескольких положениях, выбранных из кодонов 12, 13, 59 и 61. В некоторых вариантах реализации мутантная форма белка KRAS содержит мутацию в одном или более положениях аминокислот, выбранных из G12, G13, S17, Р34, А59 и Q61. В некоторых вариантах реализации мутантная форма белка KRAS содержит одну или более аминокислотных замен, выбранных из группы, состоящей из G12C, G12S, G12R, G12F, G12L, G12N, G12A, G12D, G12V, G13C, G13S, G13D, G13V, G13P, S17G, P34S, А59Е, A59G, А59Т, Q61K, Q61L, Q61R и Q61H. В некоторых вариантах реализации мутантная форма белка KRAS содержит мутацию в одном или более положениях аминокислот, выбранных из G12, G13, А59, Q61, K117 и А146. В некоторых вариантах реализации мутантная форма белка KRAS содержит одну или более аминокислотных замен, выбранных из группы, состоящей из G12C, G12R, G12S, G12A, G12D, G12V, G13C, G13R, G13S, G13A, G13D, G13V, А59Е, A59G, А59Т, Q61K, Q61L, Q61R, Q61H, K117N, K117R, K117E, А146Р, А146Т и A146V. В некоторых вариантах реализации мутантная форма белка KRAS содержит мутацию в одном или более положениях аминокислот, выбранных из G12, G13, А59 и Q61. В некоторых вариантах реализации мутантная форма белка KRAS содержит одну или более аминокислотных замен, выбранных из группы, состоящей из G12C, G12R, G12S, G12A, G12D, G12V, G13C, G13R, G13S, G13A, G13D, А59Е, A59G, А59Т, Q61K, Q61L, Q61R и Q61H. В некоторых вариантах реализации мутантная форма белка KRAS содержит мутацию в одном или более положениях аминокислот, выбранных из G12, G13 и D153. В некоторых вариантах реализации мутантная форма белка KRAS содержит одну или более аминокислотных замен, выбранных из группы, состоящей из G12A, G12C, G12D, G12V, G12S, G13D и D153V. В некоторых вариантах реализации мутантная форма белка KRAS содержит одну или более аминокислотных замен, выбранных из G12C, G12S и D153V.
[0061] В некоторых вариантах реализации NRAS содержит мутацию в одном или более положениях, выбранных из кодонов 12, 13, 59, 61 и 146. В некоторых вариантах реализации мутантная форма белка KRAS содержит мутацию в одном или более положениях аминокислот, выбранных из G12, G13, А59, Q61, K117 и А146. В некоторых вариантах реализации мутантная форма белка KRAS содержит одну или более аминокислотных замен, выбранных из группы, состоящей из G12C, G12R, G12S, G12A, G12D, G12V, G13C, G13R, G13S, G13A, G13D, G13V, A59D, А59Т, Q61K, Q61L, Q61R, Q61H, K117N, K117R, K117E, А146Р, А146Т и A146V. В некоторых вариантах реализации мутантная форма белка NRAS содержит мутацию в одном или более положениях аминокислот в Q61 или А146. В некоторых вариантах реализации мутантная форма белка NRAS содержит одну или более аминокислотных замен, выбранных из Q61K, Q61H, Q61R, Q61L, Q61N, Q61E, Q61P, А146Т, А146Р, A146V и любых их комбинаций. В некоторых вариантах реализации мутантная форма белка NRAS содержит одну или более аминокислотных замен, выбранных из Q61H, Q61R, Q61L и любых их комбинаций.
[0062] Некоторые варианты реализации относятся к способу ингибирования пролиферации клетки с мутацией RAS, включающему введение плинабулина субъекту, нуждающемуся в этом. Некоторые варианты реализации относятся к способу индуцирования апоптоза в клетке, содержащей мутацию RAS, включающему приведение указанной клетки в контакт с плинабулином. В некоторых вариантах реализации приведение в контакт включает введение плинабулина субъекту, нуждающемуся в этом. Некоторые варианты реализации относятся к способу ингибирования прогрессирования рака, характеризующегося экспрессией мутантной формы RAS, у субъекта, включающему введение клетки в контакт с плинабулином. В некоторых вариантах реализации приведение в контакт включает введение плинабулина субъекту, нуждающемуся в этом.
[0063] Некоторые варианты реализации относятся к способу ингибирования пролиферации клетки, содержащей мутацию KRAS, включающему введение плинабулина субъекту, нуждающемуся в этом. Некоторые варианты реализации относятся к способу индуцирования апоптоза в клетке, содержащей мутацию KRAS, включающему приведение указанной клетки в контакт с плинабулином. Некоторые варианты реализации относятся к способу ингибирования прогрессирования рака, характеризующегося экспрессией мутантной формы KRAS, у субъекта, включающему введение клетки в контакт с плинабулином.
[0064] Некоторые варианты реализации относятся к способу ингибирования пролиферации клетки, содержащей мутацию NRAS, включающему введение плинабулина субъекту, нуждающемуся в этом. Некоторые варианты реализации относятся к способу индуцирования апоптоза в клетке, содержащей мутацию NRAS, включающему приведение указанной клетки в контакт с Плинабулин. Некоторые варианты реализации относятся к способу ингибирования прогрессирования рака, характеризующегося экспрессией мутантной формы NRAS, у субъекта, включающему введение клетки в контакт с плинабулином.
[0065] В некоторых вариантах реализации субъект является человеком.
[0066] Другие варианты реализации включают введение комбинации соединений субъекту, нуждающемуся в этом. Комбинация может включать соединение, композицию, фармацевтическую композицию, описанную в настоящем документе, с дополнительным лекарственным средством.
[0067] Некоторые варианты реализации включают совместное введение соединения, композиции и/или фармацевтической композиции, описанной в настоящем документе, с дополнительным лекарственным средством. Под «совместным введением» подразумевают что два или более агента могут присутствовать одновременно в кровотоке пациента, независимо от того, когда и каким образом их фактически вводят. В одном варианте реализации указанных агентов вводят одновременно. В одном таком варианте реализации введение в комбинации осуществляют посредством объединения агентов в дозированной лекарственной форму. В другом варианте реализации указанных агентов вводят последовательно. В одном варианте реализации указанных агентов вводят с использованием одного и того же путей введения, как, например, перорального. В другом варианте реализации указанных агентов вводят с использованием различных путей введения, как, например, один вводят перорально, а другой вводят в.в.
[0068] Описанный в настоящем документе способ лечения может включать совместное введение плинабулина с дополнительным активным агентом. В некоторых вариантах реализации указанный способ дополнительно включает введение дополнительного терапевтического агента. В некоторых вариантах реализации указанный дополнительный терапевтический агент представляет собой доцетаксел, а рак представляет собой немелкоклеточный рак легких человека. В некоторых вариантах реализации дополнительным терапевтическим агентом является бевацизумаб, а рак представляет собой немелкоклеточный рак легких человека. В некоторых вариантах реализации дополнительным терапевтическим агентом является иринотекан, а рак представляет собой рак толстой кишки. В некоторых вариантах реализации дополнительным терапевтическим агентом является темолозомид, а рак представляет собой глиобластому. В некоторых вариантах реализации дополнительным терапевтическим агентом является иринотекан, а рак представляет собой рак толстой кишки.
[0069] В некоторых вариантах реализации дополнительным терапевтическим агентом может являться темозоломид, бевицизумаб, эверолимус, кармустин, ломустин, прокарбазин, винкристин, иринотекан, цисплатин, карбоплатин, метатрексат, этопозид, винблазатин, блеомицин, актиномицин, циклофосфамид или ифосфамид. В некоторых вариантах реализации дополнительный терапевтический агент выбран из бевацизумаба, доцетаксела, иринотекана и темозоломида. В некоторых вариантах реализации дополнительным терапевтическим агентом является доцетаксел. В некоторых вариантах реализации дополнительным терапевтическим агентом является иринотекан. В некоторых вариантах реализации дополнительным терапевтическим агентом является бевацизумаб. В некоторых вариантах реализации дополнительным терапевтическим агентом является темозоломид. В некоторых вариантах реализации дополнительным терапевтическим агентом является гемцитабин. В некоторых вариантах реализации дополнительным терапевтическим агентом является кармустин. В некоторых вариантах реализации дополнительным терапевтическим агентом является ломустин.
[0070] Описанный в настоящем документе способ лечения также можно применять в комбинации с лучевой терапией.
[0071] Описанный в настоящем документе способ может дополнительно включать идентификацию пациента, имеющего рак, характеризующийся экспрессией белка RAS мутантного типа. В некоторых вариантах реализации идентификация пациента может включать определение того, имеется ли у указанного пациента мутация RAS. Некоторые варианты реализации относятся к способу лечения рака у пациента, идентифицированного как имеющего мутацию RAS, причем способ включает введение указанному пациенту фармацевтически эффективного количества плинабулина, и при этом идентификацию указанного пациента осуществляют путем (i) взятия образца у пациента; (ii) выделения ДНК из указанного образца; (iii) амплификации гена RAS или его фрагмента в указанной выделенной ДНК и (iv) определения того, присутствует ли мутация в указанном амплифицированном гене RAS, что тем самым позволяет определить, имеется ли у указанного пациента рак, характеризующийся мутацией RAS. Примеры способов определения мутации RAS включают, но не ограничиваются ими, ПЦР с амплифицированной рефракторной системой для определения мутаций (ARMS), анализы с использованием технологии BEAM, цифровую ПЦР и другие подходящие праймеры, а также зонды для секвенирования или ПЦР.
[0072] Описанный в настоящем документе способ может дополнительно включать идентификацию пациента, имеющего рак, характеризующийся экспрессией мутантного типа белка KRAS. В некоторых вариантах реализации идентификация пациента может включать определение того, имеется ли у указанного пациента мутация KRAS. Некоторые варианты реализации относятся к способу лечения рака у пациента, идентифицированного как имеющего мутацию KRAS, причем способ включает введение указанному пациенту фармацевтически эффективного количества плинабулина, и при этом идентификацию указанного пациента осуществляют посредством (i) взятия образца у пациента; (ii) выделения ДНК из указанного образца; (iii) амплификации гена KRAS или его фрагмента в указанной выделенной ДНК и (iv) определения того, присутствует ли мутация в указанном амплифицированном гене KRAS, что тем самым позволяет определить, имеется ли у указанного пациента рак, характеризующийся мутацией KRAS.
[0073] Описанный в настоящем документе способ может дополнительно включать исследование на определение мутации KRAS. В некоторых вариантах реализации мутации KRAS, например, по кодонам 12, 13, 59, 61 и/или 146, могут быть определены в патологических образцах, взятых у пациента. В некоторых вариантах реализации такого исследования ДНК извлекают из указанного образца и тестируют против меченых олигонуклеотидных зондов с применением ПЦР для амплификации целевой мутантной ДНК, что позволяет определить (детектировать) мутацию. В некоторых вариантах реализации центры коммерческих исследований могут проводить такие исследования. В некоторых вариантах реализации можно применять набор для исследования, такой как TheraScreen: набор для определения мутации K-RAS Mutation kit (DxS Ltd, 48 Grafton Street, Manchester Ml 3 9XX, Великобритания). Например, набор TheraScreen позволяет обнаруживать мутации в кодонах 12 и 13 онкогена K-RAS:
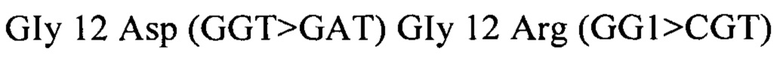

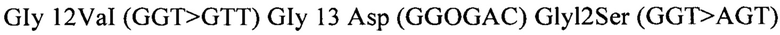
[0074] Описанный в настоящем документе способ может дополнительно включать идентификацию пациента, имеющего рак, характеризующийся экспрессией мутантного типа белка NRAS. В некоторых вариантах реализации идентификация пациента может включать определение того, имеется ли у указанного пациента мутация NRAS. Некоторые варианты реализации относятся к способу лечения рака у пациента, идентифицированного как имеющего мутацию NRAS, причем способ включает введение указанному пациенту фармацевтически эффективного количества плинабулина, и при этом идентификацию указанного пациента осуществляют путем (i) взятия образца у пациента; (ii) выделения ДНК из указанного образца; (iii) амплификации гена NRAS или его фрагмента в указанной выделенной ДНК и (iv) определения того, присутствует ли мутация в указанном амплифицированном гене NRAS, что позволяет определить, имеется ли у указанного пациента рак, характеризующийся мутацией NRAS.
[0075] Описанный в настоящем документе способ может дополнительно включать исследование на определение мутации NRAS. В некоторых вариантах реализации мутации NRAS, например, по кодонам 12, 13, 59, 61 и/или 146, можно определять в патологических образцах, взятых у пациента. В некоторых вариантах реализации такого исследования ДНК удаляют из указанного образца и исследуют против меченых олигонуклеотидных зондов с применением ПЦР для амплификации целевой мутантной ДНК для обеспечения определения (детектирования). Некоторые коммерчески доступные наборы (см. Dxs Diagnostic Innovations, Applied Biosystems и Quest diagnostics), праймеры и зонды для секвенирования или ПЦР можно разработать на основе мутаций кодонов NRAS.
[0076] Описанный в настоящем документе способ может дополнительно включать идентификацию пациента, имеющего рак, характеризующийся экспрессией мутантного типа белка HRAS. В некоторых вариантах реализации идентификация пациента может включать определение того, имеется ли у указанного пациента мутация HRAS. Некоторые варианты реализации относятся к способу лечения рака у пациента, идентифицированного как имеющего мутацию HRAS, причем способ включает введение указанному пациенту фармацевтически эффективного количества плинабулина, и при этом идентификацию указанного пациента осуществляют посредством (i) взятия образца у пациента; (ii) выделения ДНК из указанного образца; (iii) амплификации гена HRAS или его фрагмента в указанной выделенной ДНК и (iv) определения того, присутствует ли мутация в указанном амплифицированном гене HRAS, что тем самым позволяет определить, имеется ли у указанного пациента рак, характеризующийся мутацией HRAS.
[0077] Нижеследующие примеры приведены для дополнительной иллюстрации этого изобретения. Разумеется, что указанные примеры не должны толковаться как конкретные ограничения указанного изобретения. Варианты данных примеров в рамках объема формулы изобретения относятся к компетенции специалиста в данной области техники и рассматриваются как входящие в объем данного изобретения, описанного и заявленного в настоящем документе. Читателю будет понятно, что квалифицированный специалист после прочтения настоящего описания и специалист в данной области техники смогут получить и применить указанное изобретение без исчерпывающих примеров.
ПРИМЕРЫ
Пример 1
[0078] Все клеточные линии выращивали подходящих для них питательных средах, дополненных 2-10% ФБС, и держали в атмосфере с 5% СО2 при 37°С.
[0079] Клетки высевали в питательную среду в 96-луночные планшеты для микротитрования в объеме 100 мкл. Затем клетки инкубировали в течение 24 часов при 37°С в инкубаторе с увлажнением. Дозы исследуемого агента (Плинабулин) получали с применением цифрового дозатора HP D300. Вкратце, при помощи цифрового дозатора исследуемый агент (Плинабулин) в растворителе ДМСО в точных объемах добавляли к содержащим среду лункам. В контрольные лунки добавляли эквивалентные объемы ДМСО, которые добавляли в лунки с исследуемым агентом (Плинабулин). После добавления указанных исследуемых агентов, клетки обрабатывали концентрациями и разведениями, описанными в Таблице 1, в течение 72 часов при 37°С в инкубаторе с увлажнением. После 72-часового воздействия, Плинабулин и контрольную среду удаляли и к каждой лунке добавляли 200 мкл смеси с соотношением 1:1 среды и реагента CellTiter-Glo®. Указанные планшеты инкубировали в течение 60 минут при 37°С в инкубаторе с увлажнением. После инкубации регистрировали люминесценцию с применением люминометра.

1Концентрации и коэффициент разбавления можно изменять после проведения предварительного скрининга для оптимизации подбора эмпирической кривой.
2Высокую концентрации выбрали, исходя из ожидаемой активности соответствующего SOC.
[0080] Данные выражали как процент роста клеток от контроля без обработки (носитель), рассчитанный по сигналам люминесценции. Долю выживших клеток определяли путем деления средних значений люминесценции образцов, обработанных плинабулином, на средние значения люминесценции контроля без обработки. Значение ингибирующей концентрации (IC50) для обработанного плинабулином образца и контроля оценивали с применением программного обеспечения Prism 6 (GraphPad Software, Inc.) путем подбора эмпирической кривой для данных с применением нелинейного регрессионного анализа.
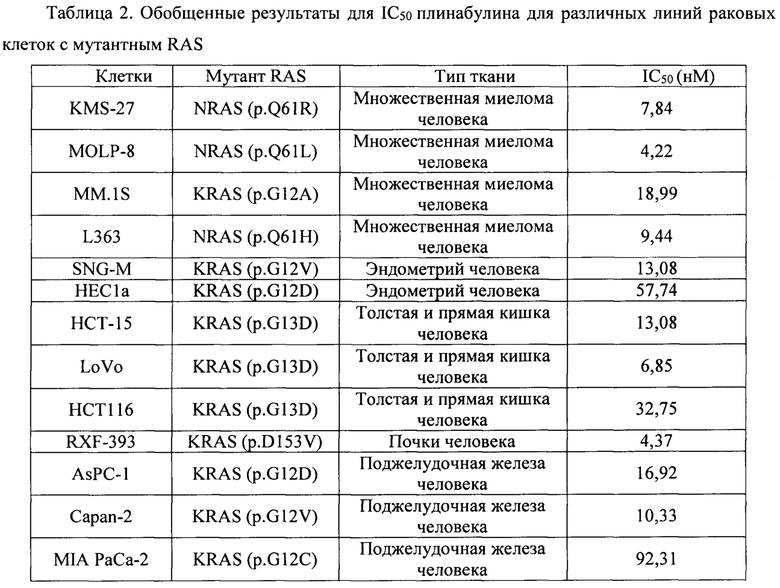
[0081] Как показано в Таблице 2, плинабулин в качестве единственного активного агента обладает цитотоксическими эффектами с низкими значениями концентрации IC50 в отношении различных линий опухолевых клеток с мутацией RAS, включая мутации KRAS и NRAS.
Пример 2
[0082] Исследовали комбинацию плинабулина и доцетаксела и ее активность сравнивали со стандартным химиотерапевтическим доцетакселом в ксенотрансплантатной модели опухоли легких человека А549 (KRAS G12S). Экспериментальные данные выявили потенциальные аддитивные или синергетические эффекты плинабулина в комбинации с доцетакселом в модели А549.
Ксенотрансплантатная модель опухоли легких человека А549
[0083] Самок «голых» мышей мышей («nude», nu/nu) в возрасте от 5 до 6 недель и массой приблизительно 20 г получили от Harlan, Inc. (Мадисон, штат Висконсис). Линию клеток опухоли легких человека А549 получили из Американской коллекции типовых культур (АТСС). Линия клеток опухоли легких человека А549 содержала мутацию в KRAS G12S. Опухоль происходит от культуры экспланта карциноматозной ткани легких 58-летнего мужчины европеоидной расы. Животным подкожно (s.c.) имплантировали троакар с фрагментами карциномы опухоли человека А549, собранными из подкожных растущих опухолей «голых» мышей-хозяев. Когда размер опухоли достигал приблизительно 46 мг (через 18 дней после инокуляции), животных попарно сопоставляли в группы лечения и контроля. Группа отрицательного контроля содержала 8 мышей с опухолью, а все остальные группы содержали 9 мышей с опухолью. К ушам каждой мыши прикрепляли бирки и за каждой индивидуально наблюдали на протяжении всего эксперимента. Исследование проводилось в условиях, не проверенных на соответствие требованиям надлежащей лабораторной практики (GLP). Начальные дозы вводили в первый день после парного сопоставления. Плинабулин в концентрации 7,5 мг/кг вводил и.п.по двум различным графикам - в дни 1, 4, 8, 11 и 15 и qdx5 (одно введение каждый день в течение пяти дней). 12,5% диметилсульфоксид (ДМСО), 5% кремофор и 82,5% арахисовое масло комбинировали и вводили и.п.; qdx5 служит в качестве отрицательного контроля. Доцетаксел (Aventis) в 1, 3 и 5 день в концентрации 12,5 мг/кг вводили в.в.; wklyx3 (3 раза в неделю) в концентрации 100 мг/кг служит в качестве положительного контроля. Плинабулин в концентрации 7,5 мг/кг по графику введения qdx5 также вводили в комбинации с доцетакселом при тех же дозе, способе введения и графике, что и при введении в качестве единственного агента. В группе с комбинацией плинабулина и доцетаксела доцетаксел вводили за 15-30 минут до плинабулина.
[0084] Плинабулин взвешивали и затем добавляли 12,5% ДМСО, 5% кремофор и 82,5% арахисовое масло соответственно. В конце указанные соединения перемешивали вихревым способом и вводили путем инъекции в течение одного часа.
[0085] Каждая группа включала восемь мышей. Мышей взвешивали два раза в неделю, а размеры опухолей определяли с применением штангенциркулей два раза в неделю, начиная с 1 дня. Размеры опухоли переводили в массу опухоли в мг по стандартной формуле (W2×L)/2. Эксперимент прекращали, когда размер опухоли в контрольной группе достигал в среднем 1 грамма. После прекращения мышей взвешивали, умерщвляли и вырезали из них опухоли. Опухоли взвешивали и рассчитывали среднюю массу опухоли на группу. В данной модели отношение средняя масса опухоли в группе лечения/средняя масса опухоли в контрольной группе × 100 вычитали из 100%, чтобы получить показатель ингибирования роста опухоли (TGI) для каждой группы. Для вычисления р-значений применяли односторонние t-критерии, используя программное обеспечение GraphPad Prism© (версия 3.0 для Macintosh).
[0086] Некоторые агенты могут вызвать уменьшение размера опухоли в данной ксенотрансплантатной модели опухоли. При применении данных агентов конечную массу данной опухоли вычитали из ее собственной массы в начале лечения в 1 день. Данную разницу делили на первоначальную массу опухоли с получением % регрессии. Средний % регрессии опухоли рассчитывали по данным, полученным от мышей в группе, в которой наблюдали регрессию опухолей.
Отрицательный и положительный контроли
[0087] Средняя масса конечной опухоли на 56 день в группе отрицательного контроля составляла 870,4 мг ± 305,1. Доцетаксел (12,5 мг/кг, в.в., дни 1,3,5) служил в качестве положительного контроля для исследования, и в нем средняя масса конечной опухоли составляла 655,1 мг ± 109,2 и 691,4 мг ± 175,8 соответственно. В результате показатель TGI для доцетаксела составил 26,1% по сравнению с контрольной группой, получавшей носитель, и находился в пределах ожидаемого диапазона активности, который наблюдали в прошлых проведенных исследованиях с применением А549. В группах с доцетакселом или иринотеканом токсических смертей не наблюдали.
[0088] У животных в группе с доцетакселом наблюдали некоторую потерю массы. На 11 день изначальную среднюю потерю массы зарегистрировали на уровне 2,7%. К 22 дню животные вернулись к своей массе и показали положительную прибавку в массе на 15,4%. В группе положительного контроля токсических смертей не наблюдали.
Комбинация плинабулина и доцетаксела
[0089] Интраперитонеальное введение плинабулин в концентрации 7,5 мг/кг в дни 1-5 давало среднюю массу опухоли в конце эксперимента 1525,7 мг ± 355,3. В группе с комбинацией плинабулина (7,5 мг/кг, дни 1-5) и доцетаксела (12,5 мг/кг, в.в., дни 1,3,5) средняя масса опухоли в конце эксперимента на 56 день составляла 265,8 мг ± 113,1. В результате показатель TGI составил 74,3%. Указанная комбинация превосходила группу лечения доцетакселом, в которой средняя масса опухоли в конце эксперимента составляла 655,1 мг ± 109, а различие между группой с комбинацией и группой с доцетакселом в качестве единственного агента было статистически значимым (р<0,05).
[0090] У животных в группе, получавшей плинабулин в качестве единственного агента, наблюдали прибавку в массе. На 11 и 22 день среднюю прибавку в массе зарегистрировали на уровне 10,6% и 21,8% соответственно. В этой группе лечения токсических смертей не наблюдали. У животных в группе, получавшей комбинацию. наблюдали потерю массы. На 11 день зарегистрировали начальную среднюю потерю массы, равную 2,7%. К 22 дню животные вернулись к своей массе и показали 16% прирост массы.
[0091] При исследуемых уровнях дозы и графике плинабулин в качестве единственного агента не проявлял токсичности для животных. Во всех пяти исследованиях наблюдали только один случай смерти в группе с плинабулином при его введении в качестве единственного агента. На ФИГ. 3 представлены массы опухоли при вскрытии у мышей, когда плинабулин (7,5 мг/кг) применяли в комбинации с доцетакселом (12,5 мг/кг) с использованием интраперитонеального пути введения. Плинабулин в комбинации с доцетакселом против модели опухоли легких А549 продемонстрировал статистически значимое (р<0,05) увеличение показателя TGI по сравнению с только доцетакселом (74,3% против 26,1%). Результаты свидетельствуют о сильном ингибировании роста опухоли для комбинации плинабулина и доцетаксела по сравнению с доцетакселом в качестве единственного агента, демонстрируя действенный аддитивный или синергетический эффекты плинабулина в комбинации с доцетакселом в ксенотрансплантатной модели опухоли легких человека А549 (KRAS G12S).
Пример 3
[0092] Применяемая мышиная модель глиомы представляла модель ТФР-опосредуемой глиомы на генетически-модифицированных мышах (GEMM), которая имитирует пронейральную молекулярную подгруппу глиобластомы (GBM). Данная модель основана на переносе генов, специфичном для соматических клеток; ретровирусная система сплайс-акцептора репликационно-компетентного ALV (RCAS) позволила внедрить конкретные генетические изменения в строго регулируемые окна дифференцировки клеточно-специфичным образом. В системе RCAS/tv-a использовали ретровирусный вектор RCAS для инфицирования мышей, экспрессирующих в результате генетической модификации рецептор RCAS (tv-a), в специфичных популяциях клеток. В данном случае глиомы получали RCAS-опосредованным переносом ТРФ в экспрессирующие нестин клетки в головном мозге. Нестин экспрессировался в популяции стволовых клеток/клеток-предшественников в головном мозге, и было показано, что он является маркером для раковых стволовых клеток, расположенных в периваскулярных областях (PVN) опухоли головного мозга как человека, так и мыши. ТФР-стимулируемые глиомы с полной пенетрантностью возникали при комбинации с делецией Ink4a-arf-/- на 4-5 неделю после инфицирования. Данные опухоли точно имитировали «пронейральный» подтип GBM, в котором делецию CDKN2A (кодирующую как p16INK4A, так и p14ARF) наблюдали в 56% случаев «пронейральных» глиом человека. В этой GEMM-модели воссозданы структуры опухолевых клеток, которые определяют глиомы человека, такие как структуры Шерера, микрососудистая пролиферация и некроз с псевдопалисадными структурами, что показано на ФИГ. 1a-1d. Кроме того, клетки глиомы мигрировали по следам белого вещества, окружали нейроны и кровеносные сосуды и накапливались на краю головного мозга в субпиальном пространстве. В связи с этим, ТФР-стимулируемые GEMM глиомы в большой степени повторяют PN-GBM и являются превосходной экспериментальной системой для определения взаимодействий между опухолевыми клетками и не являющимися неоплазматическими клетками в микроокружении опухоли.
[0093] ТФР-индуцированную модель глиомы использовали для определения ответа на облучение и темозоломид, как показано на ФИГ. 2. Мышей с глиомами идентифицировали по симптомам и верифицировали путем Т2-взвешенной МРТ. Эти мыши получали лечение либо средой-носителем, темозоломидом в концентрации 25 мг/кг ежедневно в течение 12 дней, либо фракционированным облучением при дозе 2 Гр в день 5 дней в неделю в течение 2 недель (всего 20 Гр). На двух верхних изображениях ФИГ. 2 показан рост опухолей без лечения (носитель); и, в отличие от этого, объем опухолей после лечения темозоломидом и опухолей, которые лечили облучением, сокращался за тот же период времени. Эти опухоли рецидивировали после лечения, и все животные умерли от рецидивирующей опухоли, как это можно видеть на кривых выживаемости для данных соответствующих когорт мышей. Данные по исследованию лечения облучением и темозоломидом показали следующее: 1) были проведены испытания на данной мышиной модели, 2) влияние данных средств лечения на выживаемость мышей отражало состояние человека, 3) все мыши умерли от заболевания и 4) относительно гомогенные результаты этих когорт мышей подкрепляли возможность применения данной экспериментальной парадигмы для обнаружения различий в выживаемости в исследовании.
[0094] Создали ТФР-индуцированную модель глиомы с использованием описанных выше процедур. Мышей, генетически модифицированных для экспрессии рецептора RCAS (tv-a) с промотора нестина и имеющих фон ink4a/arf-/- и lox-stop-lox люциферазы, инфицировали конструкциями RCAS-ТФР и RCAS-KRAS, которые экспрессировали мутантный по G12D KRAS. Опухоли возникали в течение первых 3-4 недель. Опухоли обладали гистологическими характеристиками GBM, и их можно идентифицировать по симптомам сонливости и слабой чистки (grooming), путем МРТ-сканирования с применением Т2-взвешенной последовательности или биолюминесцентной визуализаци при помощи системы IVIS. Мышам в группе лечения (опухоль KRAS) и.п. вводили плинабулин в концентрации 7,5 мг/кг два раза в неделю на протяжении 10 недель, а мышам в контрольной группе вводили только разбавитель для плинабулина (40% масс. коллифора и 60% масс. пропиленгликоля). Мыши, получавшие лечение, начали прибавлять в массе и демонстрировать улучшение симптомов в течение нескольких дней.
[0095] Плинабулин исследовали на мышах с ТФР-индуцированными глиомами, которые экспрессировали мутантный по G12D KRAS. 4-6-недельным nestin-tv-a/ink4a-arf-/-мышам при помощи Изофлурана проводили анестезию и осуществляли инъекцию Df-1 клеток, трансфицированных RCAS-ТФР-В-НА, RCAS-KRAS. Мышам осуществляли инъекцию одного микролитра смеси при соотношении 1:1 2×105 RCAS-ТФР-B-HA/RCAS-KRAS с применением стереотаксической рамы через иглу 26 калибра, прикрепленную к шприцу Гамильтона. Инъекцию клеток осуществляли в правую лобную кору с координатами брегмы 1,75 мм, Lat - 0,5 мм и глубиной 2 мм. Мышей тщательно отслеживали для выявления потери в массе и исследование проводили тогда, когда потеря составляла в общей сложности > 0,3 грамма в течение 2 последовательных дней, или у мышей наблюдали внешние признаки опухоли. Мышей включали в исследуемую группу, и они получали лечение либо плинабулином, либо разбавителем для плинабулина, как это описано выше, при этом их последовательно отслеживали для выявления сонливости, сгорбленной позы, потери аппетита, внешних признаков роста опухоли, возбуждения, потери в массе и общего отсутствия прибавки в массе. Мышей умерщвляли, когда они теряли более, чем 20% массы тела, подвижности, неспособности питаться или их масса составляла менее, чем 14 грамм для самца/12 грамм для самки. Мышей умерщвляли с применением CO2; головной мозг собирали и хранили в течение ночи в 10% нейтральном забуференном формалине, а затем заменяли на Flex 80 и хранили при 4 градусах.
[0096] На ФИГ. 4 представлен уровень выживаемости мышей с глиобластомой с мутацией G12D KRAS. Как представлено на ФИГ. 4, у мышей, имеющих ТФР-индуцируемую модель глиобластомы, в целом уровень выживаемости был значимо лучше в группе, получавшей лечение плинабулином, по сравнению с контрольной группой (р=0,001).
Пример 4
[0097] Мышей с ТФР-индуцированными глиомами, которые экспрессировали мутантный по G12D KRAS, получали с применением процедур согласно Примеру 3 и применяли в данном эксперименте. 4-6-недельным nestin-tv-a/ink4a-arf-/- мышам при помощи Изофлурана проводили анестезию и осуществляли инъекцию Df-1 клеток, трансфицированных RCAS-ТФР-В-НА, RCAS-KRAS. Мышам делали инъекцию одного микролитра смеси при соотношении 1:1 2×105 RCAS-ТФР-В-НА/RCAS-KRAS с применением стереотаксической рамы через иглу 26 калибра, прикрепленную к шприцу Гамильтона. Инъекцию клеток осуществляли в правую лобную кору с координатами брегмы 1,75 мм, Lat - 0,5 мм и глубиной 2 мм. За мышами тщательно слудили для выявления потери массы, и проводили исследование, когда потеря составляла в общей сложности > 0,3 грамма в течение 2 последовательных дней, или у мышей наблюдали внешние признаки опухоли.
[0098] Мышей делили на две группы исследования. Одна группа получала лечение комбинацией темозоломида (TMZ), облучения и плинабулина: облучение составляло 10 Гр x1, TMZ и Плинабулин в концентрации 7,5 мг/кг в разбавителе для плинабулина вводили интраперитонеально два раза в неделю в понедельник и четверг в течение 10 недель. Другая группа, контрольная группа, получала лечение комбинацией TMZ и облучения: облучение составляло при 10 Гр x1, TMZ вводили интраперитонеально два раза в неделю в понедельник и четверг в течение 10 недель. За мышами наблюдали для выявления сонливости, сгорбленной позы, потери аппетита, внешних признаков роста опухоли, возбуждения, потери в массе и общего отсутствия прибавки в массе. Мышей умерщвляли, когда они теряли более, чем 20% от своей массы тела, подвижности, при неспособности питаться или когда их масса составляла менее, чем 14 грамм для самца/12 грамм для самки. Мышей умерщвляли с применением СО2; головной мозг собирали и хранили в течение ночи в 10% нейтральном забуференном формалине, а затем заменяли на Flex 80 и хранили при 4 градусах. Как представлено на ФИГ. 5, у мышей, имеющих ТФР-индуцируемую модель глиобластомы, в целом уровень выживаемости был значимо лучше в группе, получавшей лечение плинабулином, TMZ и облучением, по сравнению с контрольной группой, которая получала TMZ и облучение (р=0,0149).
Пример 5
[0099] Исследовали комбинацию плинабулина и иринотекана, и ее активность сравнивали со стандартным химиотерапевтическим иринотеканом в ксенотрансплантатной модели опухоли толстой кишки человека НСТ-15 (мутация G13D KRAS, мутация S241F Р53). Экспериментальные данные определили синергетические эффекты плинабулина в комбинации с Иринотеканом в модели НСТ-15.
Ксенотрансплантатная модель опухоли толстой кишки человека НСТ-15
[0100] Самок бестимусных «голых» мышей (Hsd: Athymic Nude-Foxnlnu) получили от Harlan (Индианаполис, штат Индиана). Мышей получили в возрасте 4 недель. Всех мышей акклимировали до обработки. Линию клеток опухоли толстой кишки человека НСТ-15 получили от АТСС (Манассас, штат Виргиния). Культуры поддерживали в RPMI-1640 (Lonza, Уолкерсвилл, штат Мэриленд), дополненной 10% фетальной бычьей сыворотки (ФБС, Seradigm, Раднор, штат Пенсильвания) и размещали в атмосфере 5% СО2. Культуры размножали в колбах для культивирования тканей при соотношении 1:10 до тех пор, пока не собирали достаточное количество клеток. Линия клеток опухоли толстой кишки человека НСТ-15 содержала мутации в KRAS G13D и P53 S241F.
[0101] Самкам мышей подкожно инокулировали в правый бок 0,1 мл смеси 50% среды/50% матригеля, содержащей суспензию опухолевых клеток НСТ-15 (5×106 клеток/мышь).
[0102] Плинабулин (80 мг/20 мл в смеси 40% солютола : 60% пропиленгликоля) разбавляли в стерильном 5% растворе декстрозы до концентрации 0,75 мг/мкл. Плинабулин в концентрации 7,5 мг/кг вводили и.п.два раза в неделю до конца исследования. Носитель для плинабулина (40% солютола : 60% пропиленгликоля) разбавляли в стерильном 5% растворе декстрозы в том же соотношении, что и для плинабулина, и применяли в качестве отрицательного контроля. Иринотекан (Teva Pharmaceuticals (Ирвайн, штат Калифорния) разбавляли в 0,9% растворе хлорида натрия до концентрации 10 мг/мл для доставки дозы 100 мг/кг при объеме дозы 10 мл/кг. В качестве положительного контроля вводили иринотекан вводили интраперитонеально в дозе 100 мг/кг один раз в неделю в течение трех недель. Плинабулин также вводили в комбинации с иринотеканом при тех же дозе, способе введения и графике, что и при применении в качестве единственного агента. В группе с комбинацией плинабулина и иринотекана, Иринотекан вводили за 120 минут до плинабулина.
[0103] Через семь дней после инокуляции опухоли измеряли при помощи цифрового штангенциркуля. Штангенциркули применяли для измерения диаметров ширины и длины опухоли. Измеренные значения регистрировали в цифровой форме с применением программного обеспечения для управления исследованиями на животных, Study Director V.2.1.1 (Study Log). Объемы опухолей рассчитывали с использованием формулы: объем опухоли (мм3) = (а×b2/2), где «b» - наименьший диаметр, а «а» - наибольший диаметр1. Сорок мышей с размерами опухоли 104-125 мм3 случайным образом распределяли по четырем группам из десяти мышей, каждая со средним значением приблизительно 112 мм3, с применением случайного уравновешивания с применением Study Director (день 1). Данные по объемам опухолей и массам тела регистрировали при рандомизации мышей по группам, и после этого данные собирали два раза в неделю. Клинические наблюдения проводили ежедневно.
[0104] Эксперимент прекращали, когда размер опухоли в контрольной группе достигал в среднем 1 грамма. После прекращения эксперимента мышей взвешивали, умерщвляли и вырезали из них опухоли. Опухоли взвешивали и рассчитывали среднюю массу опухоли на группу, а также проводили визуальную оценку некроза опухолей.
[0105] Средний показатель ингибирования роста опухоли (TGI) рассчитывали на 27 день (последний день исследования). Все статистические анализы в исследовании с применением ксенотрансплантата осуществляли при помощи программного обеспечения Prism GraphPad® v6.00. Различия в объемах опухолей 27 дня подтверждали с применением дисперсионного анализа (ANOVA).
Отрицательный и положительный контроли
[0106] В группе отрицательного контроля средний объем опухоли в конце эксперимента на 27 день составлял 1701,4 мм3 ± 178,0. Иринотекан (100 мг/кг, день 1, 8, 15) выступал в качестве положительного контроля для исследования, и при нем средний объем конечной опухоли составлял 1196,2 мм3 ± 121,7. В результате показатель TGI для иринотекана составил 31,8% по сравнению с группой отрицательного контроля со средой-носителем. В группах отрицательного или положительного контроля токсических смертей не наблюдали.
[0107] Лечение носителем, представляющее отрицательный контроль, плинабулином и иринотеканом хорошо переносилось. Наблюдал умеренную потерю массы тела в контрольной группе с носителем и в группе с плинабулином в последние несколько дней исследования, однако потеря массы тела была незначительной. Клинические наблюдения состояли в основном из некроза опухолей, что характерно для данной модели опухоли. Комбинированное лечение плинабулином и иринотеканом было довольно хорошо переносимым с наблюдаемой умеренной потерей в массе тела.
[0108] В группе с комбинацией плинабулина (7,5 мг/кг, дни 1-5) и Иринотекана (100 мг/кг, дни 1, 8 и 15) средний объем конечной опухоли на 27 день составлял 766,8 мм3 ± 84,2. В результате показатель TGI составил 58,8%. Указанная комбинация превосходила группу лечения иринотеканом, в которой средний объем опухоли в конце эксперимента составлял 1196,2 мм3 ± 121,7, а различие между группой с комбинацией и группой, получавшей иринотекан, в качестве единственного агента было статистически значимым (р<0,05).
[0109] При исследуемых уровнях дозы и графиках Плинабулин в качестве единственного агента не проявлял токсичности по отношению к животным. На ФИГ. 6 представлен объем опухоли у мышей в ходе исследования при применении плинабулина (7,5 мг/кг) в комбинации с Иринотеканом (100 мг/кг) посредством интраперитонеального способа введения. Плинабулин в комбинации с Иринотеканом против модели опухоли толстой кишки человека НСТ-15 продемонстрировал статистически значимое (р<0,05) увеличение показателя TGI по сравнению с только Иринотеканом (58,8% против 31,8%). Результаты показали сильное ингибирование роста опухоли для комбинации плинабулина и иринотекана по сравнению с иринотеканом в качестве единственного агенто, демонстрирующие потенциальный аддитивный или синергетический эффект плинабулина в комбинации с иринотеканом в ксенотрансплантатной модели опухоли толстой кишки человека НСТ-15 (KRAS G13D).
Пример 6
[0110] Исследовали комбинацию плинабулина и иринотекана, и ее активность сравнивали с иринотеканом, применяемым отдельно, в ксенотрансплантатной модели опухоли толстой кишки человека LoVo (мутация p.G13D KRAS). Экспериментальные данные выявили потенциальные аддитивные или синергетические эффекты плинабулина в комбинации с Иринотеканом в модели LoVo.
[0111] Ксенотрансплантатная модель опухоли толстой кишки человека LoVo: Самок бестимусных «голых» мышей (Hsd: Athymic Nude-Foxnlnu) получили из Harlan (Индианаполис, штат Индиана). Мышей получили в возрасте 4 недель. Все мыши перед лечением прошли акклиматизацию. Линию клеток опухоли толстой кишки человека LoVo получили из АТСС (Манассас, штат Виргиния). Культуры поддерживали в F12-K (Corning/Cellgro, Манассас, штат Виргиния), дополненной 10% фетальной бычьей сыворотки (ФБС, Seradigm, Раднор, штат Пенсильвания), и держали в атмосфере 5% СО2. Культуры размножали в колбах для культивирования тканей при соотношении 1:10 до получения достаточного количества клеток. Линия клеток опухоли толстой кишки человека LoVo содержала мутацию в KRAS p.G13D.
[0112] Самкам мышей подкожно инокулировали в правый бок 0,1 мл смесь 50% среды/50% матригеля, содержащей суспензию опухолевых клеток LoVo (1×107 клеток/мышь).
[0113] Плинабулин (80 мг/20 мл в смеси 40% солютола:60% пропиленгликоля) разбавляли в стерильном 5% растворе декстрозы до концентрации 0,75 мг/мкл. Плинабулин в концентрации 7,5 мг/кг вводили и.п.два раза в неделю до конца исследования. Носитель для плинабулина (40% солютола : 60% пропиленгликоля) разбавляли в стерильном 5% растворе декстрозы в том же соотношении, что и для плинабулина, и применяли в качестве отрицательного контроля, иринотекан (Teva Pharmaceuticals (Ирвайн, штат Калифорния)) разбавляли в 0,9% растворе хлорида натрия до концентрации 10 мг/мл для доставки дозы 100 мг/кг в объеме дозы 10 мл/кг. Иринотекан вводили интраперитонеально в дозе 100 мг/кг один раз в неделю в течение трех недель для обеспечения положительного контроля. Плинабулин также вводили в комбинации с Иринотеканом при той же дозе, способе введения и графике, что и при монотерапии. В группе с комбинацией плинабулина и иринотекана, иринотекан вводили за 120 минут до плинабулина.
[0114] Через семь дней после инокуляции опухоли измеряли при помощи цифрового штангенциркуля. Штангенциркули применяли для измерения диаметров ширины и длины опухоли. Измеренные значения регистрировали в цифровой форме с применением программного обеспечения для управления исследованиями на животных, Study Director V.2.1.1 (Study Log). Объемы опухолей рассчитывали с использованием формулы: объем опухоли (мм3) = (а×b2/2), где «b» - наименьший диаметр, а «а» - наибольший диаметр. Сорок мышей с размерами опухоли 104-125 мм3 случайным образом распределяли по четырем группам из десяти мышей, каждая со средним значением приблизительно 112 мм3, путем случайного уравновешивания с применением Study Director (день 1). Данные по объемам опухолей и массам тела регистрировали при рандомизации мышей по группам, и после этого данные собирали два раза в неделю. Клинические наблюдения проводили ежедневно.
[0115] Контрольную группу, получавшую носитель, умерщвляли после достижения среднего объема опухоли, равного или превышающего 1500 мм3 на 15 день, как указано в протоколе. Лечение в группах прекратили, когда в группе, получавшей иринотекан, средний объем опухоли достиг 774 мм3, в результате смерти мышей или необходимости умертвить их для прекращения страданий. Во время вскрытия опухоли вырезали и регистрировали показатели сырой массы, а также проводили визуальную оценку некроза опухолей.
[0116] Средний показатель ингибирования роста опухоли (TGI) рассчитывали на 27 день. Все статистические анализы в исследовании с применением ксенотрансплантата осуществляли при помощи программного обеспечения Prism GraphPad® v6.00. Различия в объемах опухолей 27 дня подтверждали с применением дисперсионного анализа (ANOVA). Односторонний t-критерий Студента с коррекцией Уэлша также применяли для проверки любых различий между каждой группой и контрольной группой со средой-носителем, а двухсторонний t-критерий Стьюдента применяли для проверки различий между группами, получавшими комбинацию агентов, и группами, получавшими соответствующие агенты по отдельности.
[0117] В контрольной группе, получавшей носитель, средний объем опухоли достиг 2078,1 мм3 на 15 день. В данной группе не наблюдали заметной средней потери в массе тела на протяжении всего исследования. У девяти из десяти мышей наблюдали незначительный или умеренный некроз опухоли, впервые отмеченный на 12 день. Все животные выжили до конечного умерщвления.
[0118] Лечение плинабулином в концентрации 7,5 мг/кг приводило к среднему объему опухоли 1279,2 мм3 на 15 день. В данной группе показатель TGI составил 41,0% (n=7) на 15 день. Наблюдали значимое снижение среднего объема опухоли (р<0,05) по сравнению с контрольной группой со средой-носителем на 15 день (t-критерий Стьюдента). На протяжении всего исследования в данной группе не наблюдали средней потери в массе. У девяти из десяти мышей наблюдали незначительный некроз опухоли, впервые отмеченный на 12 день. Мышь 5 умерщвляли на 19 день вследствие клинических наблюдений, указывающих на заболеваемость от тяжелого некроза опухоли. Мыши 2, 3,4, 7 и 10 умерли во время исследования. Мышь 8 умерла из-за технической ошибки. Три из десяти мышей дожили до конечного умерщвления.
[0119] Лечение иринотеканом в концентрации 80 мг/кг давало средний объем опухоли 1156,7 мм3 на 15 день. В данной группе показатель TGI составил 47,2% (n=10) по сравнению с контрольной группой со средой-носителем на 15 день. Наблюдали значимое снижение среднего объема опухоли (р<0,05) по сравнению с контрольной группой, получавшей носитель, на 15 день (t-критерий Стьюдента). В данной группе наблюдали умеренную потерю массы тела с максимальным уровнем в 7,4% на 20 день, конечный день исследования. У восьми из десяти мышей наблюдали от незначительной до тяжелой степень некроза опухоли, впервые отмеченного на 12 день. Мышей 3, 4 и 5 умерщвляли на 19, 15 и 18 день соответственно на основании клинических наблюдений, указывающих на страдания от тяжелого некроза опухоли. Мыши 1 и 10 умерли на 17 и 20 день, соответственно. Пять из десяти мышей дожили до конечного умерщвления.
[0120] Лечение плинабулином в концентрации 7,5 мг/кг и иринотеканом в концентрации 80 мг/кг приводило к среднему объему опухоли 468,4 мм3 на 15 день. Показатель TGI в данной группе составлял 82,4% (n=10) по сравнению с контрольной группой со средой-носителем на 15 день. Наблюдали значимое снижение среднего объема опухоли (р<0,05) по сравнению с контрольной группой, получавшей носитель, на 15 день (t-критерий Стьюдента) и группой получавшей, плинабулин в качестве единственного агента (t-критерий Стьюдента). При сравнении с иринотеканом в качестве единственного агента на 15 день значимого различия в среднем объеме опухоли не наблюдали. В данной группе наблюдали умеренную потерю массы тела с максимальным уровнем в 5,8% на 20 день, конечный, день исследования. У пяти из десяти мышей наблюдали некроз опухоли от незначительного до умеренного, впервые отмеченный на 15 день. Все десять мышей дожили до конечного умерщвления. Как показано на ФИГ. 7, комбинация плинабулина и иринотекана превосходила иринотекан, применяемый в качестве единственного агента. Вследствие утраты мышей в группе, получавшей лечение только иринотеканом, средний объем опухолей уменьшился с 1157 мм3 на 15 день до 774 мм3 на 20 день, что вызвало заметный сдвиг в характеристиках.
| название | год | авторы | номер документа |
|---|---|---|---|
| КОМБИНИРОВАННАЯ ТЕРАПИЯ | 2018 |
|
RU2815400C2 |
| СПОСОБ ЛЕЧЕНИЯ ОПУХОЛИ ГОЛОВНОГО МОЗГА | 2016 |
|
RU2728796C2 |
| ТЕРАПЕВТИЧЕСКИЕ КОМБИНАЦИИ, СОДЕРЖАЩИЕ ИНГИБИТОР RAF И ИНГИБИТОР ERK | 2017 |
|
RU2774612C2 |
| НОВЫЕ МАЛЫЕ МОЛЕКУЛЫ ДЛЯ ЦЕЛЕНАПРАВЛЕННОГО РАСЩЕПЛЕНИЯ НЕ ПОДДАЮЩЕГОСЯ ЦЕЛЕНАПРАВЛЕННОМУ ВОЗДЕЙСТВИЮ KRAS В ТЕРАПИИ РАКА | 2021 |
|
RU2839932C1 |
| ПЕПТИДНАЯ ВАКЦИНА, ВКЛЮЧАЮЩАЯ ПЕПТИД RAS, СОДЕРЖАЩИЙ МУТАЦИИ, И ХИМИОТЕРАПЕВТИЧЕСКИЙ АГЕНТ | 2015 |
|
RU2700929C2 |
| НЕОАНТИГЕННЫЕ КОМПОЗИЦИИ И ИХ ИСПОЛЬЗОВАНИЕ | 2020 |
|
RU2832574C2 |
| ЛЕЧЕНИЕ ПАЦИЕНТОВ С ДИАГНОЗОМ АДЕНОКАРЦИНОМА ПРОТОКОВ ПОДЖЕЛУДОЧНОЙ ЖЕЛЕЗЫ С ИСПОЛЬЗОВАНИЕМ МОНОКЛОНАЛЬНЫХ АНТИТЕЛ К РЕЦЕПТОРУ ЭПИДЕРМАЛЬНОГО ФАКТОРА РОСТА (EGFR) | 2016 |
|
RU2728571C2 |
| СПОСОБЫ И КОМБИНИРОВАННОЕ ТЕРАПЕВТИЧЕСКОЕ СРЕДСТВО ДЛЯ ЛЕЧЕНИЯ РАКА ЖЕЛЧНЫХ ПРОТОКОВ | 2019 |
|
RU2793543C2 |
| Комбинация ингибитора EGFR и ингибитора MEK для применения в лечении рака, вызванного мутировавшим NRAS | 2015 |
|
RU2683276C2 |
| КОМПЛЕКСНАЯ ТЕРАПИЯ | 2013 |
|
RU2677245C2 |
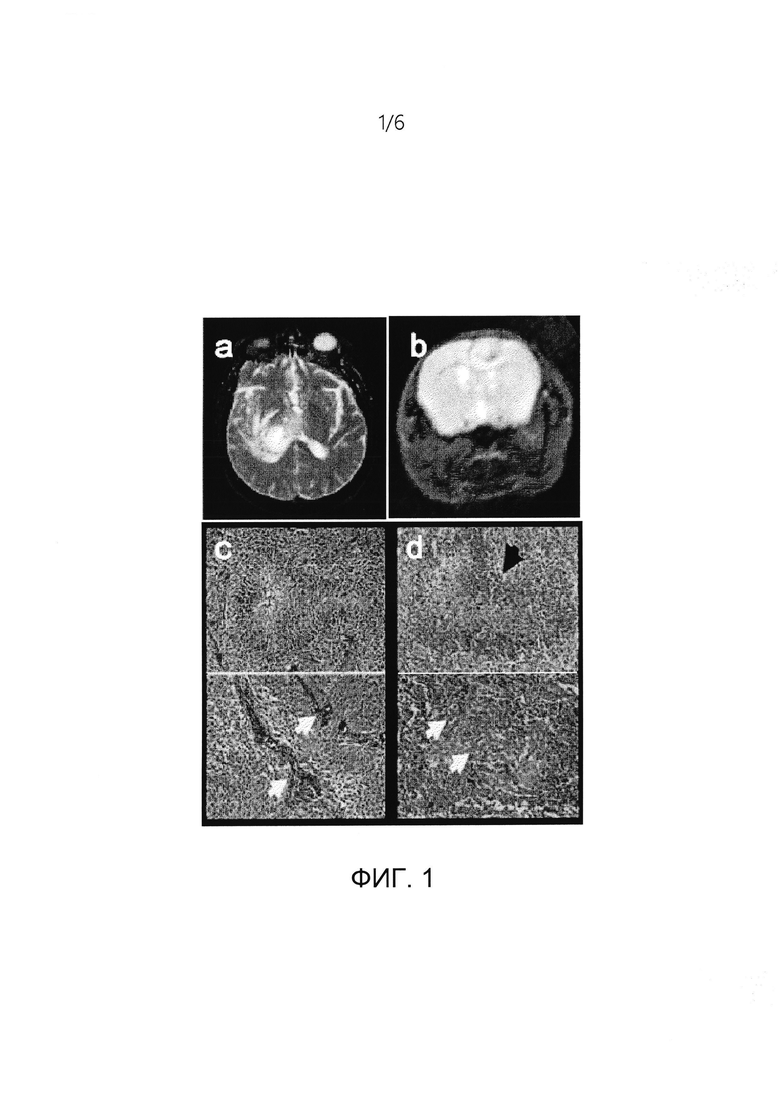
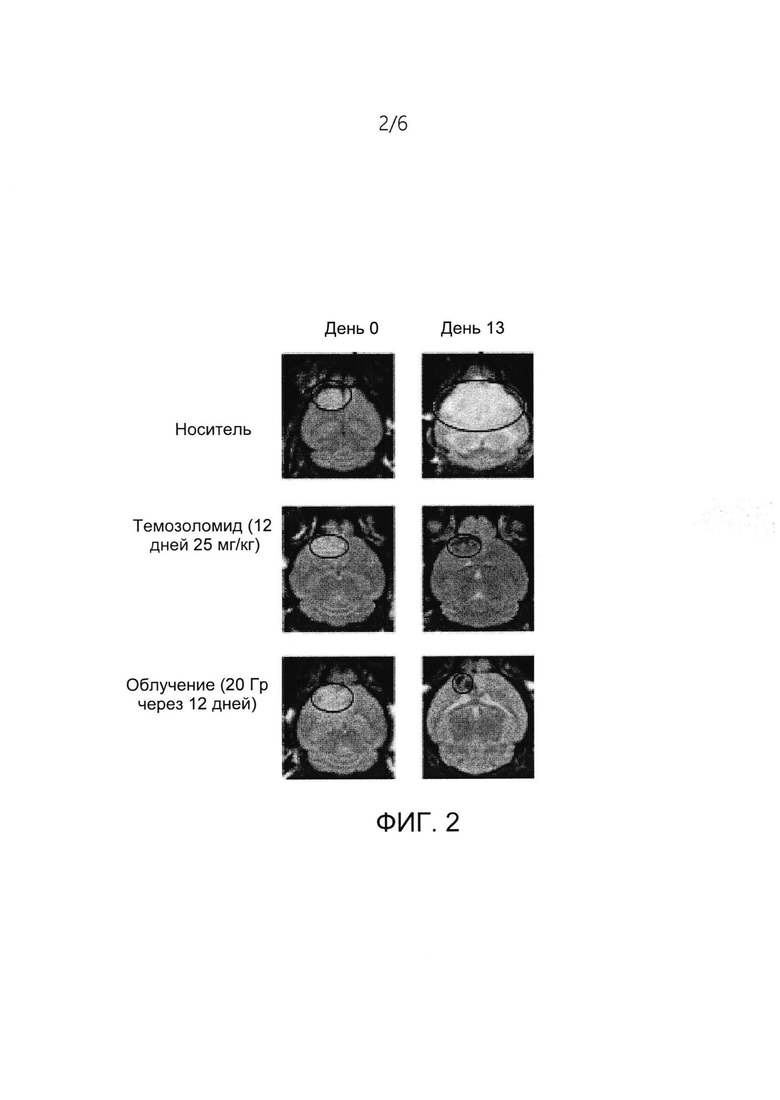
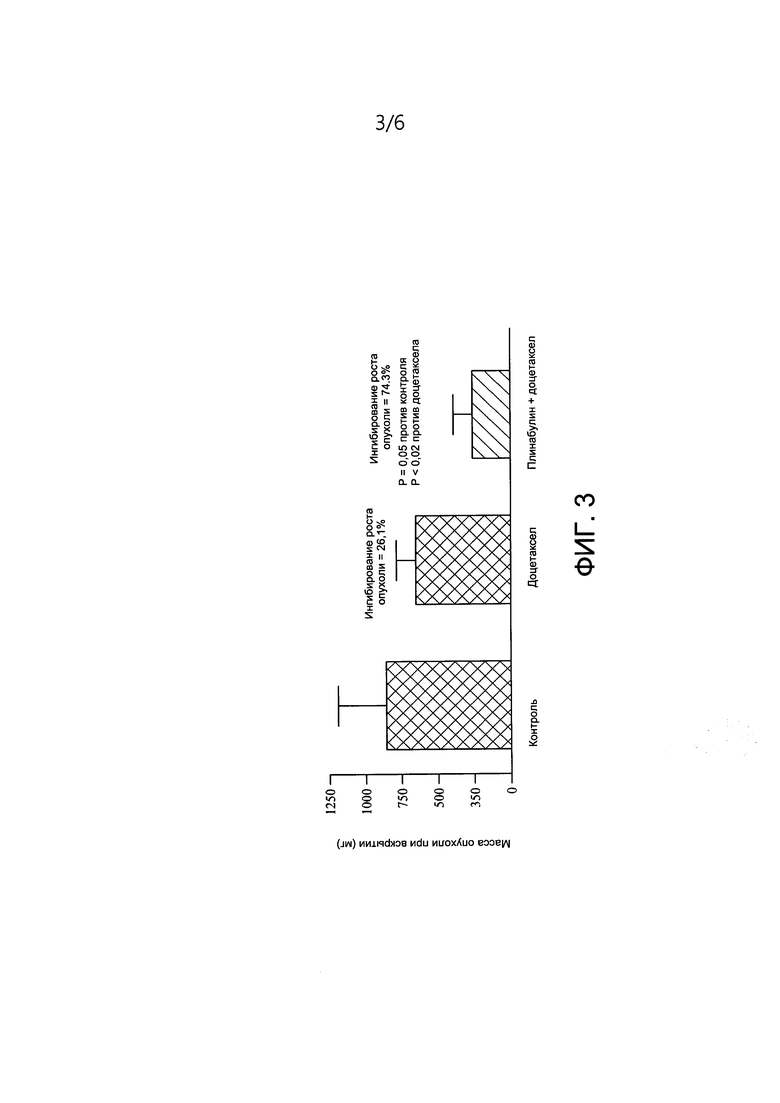
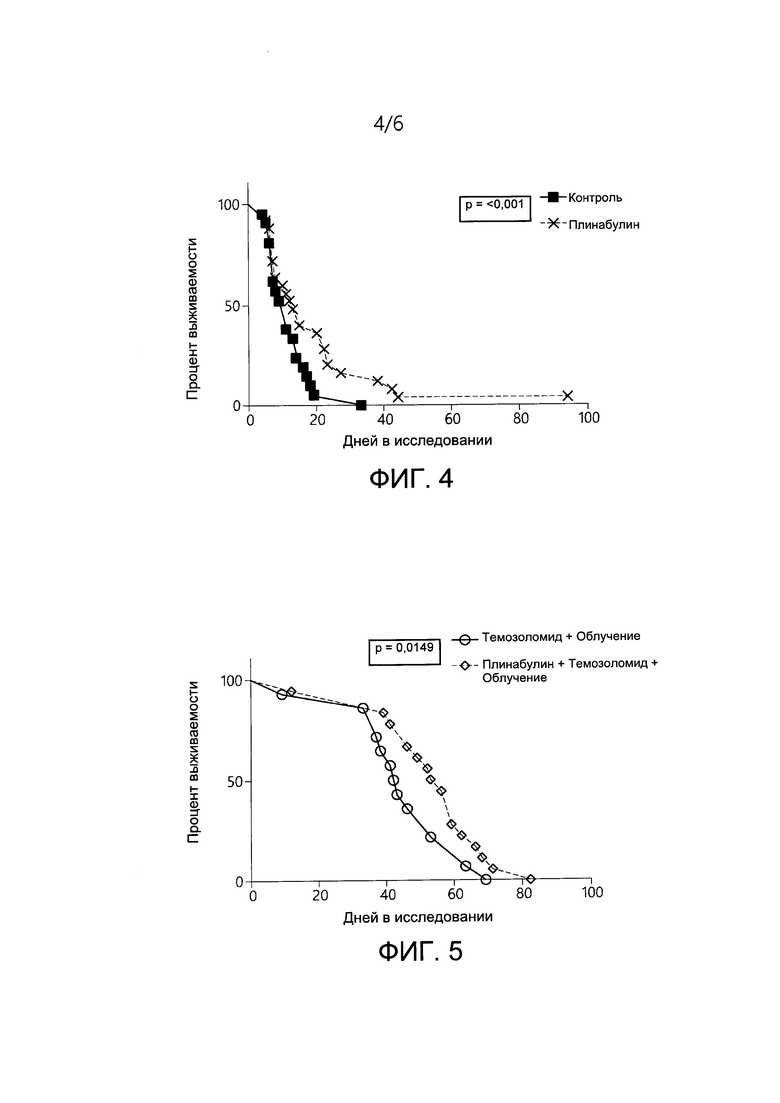
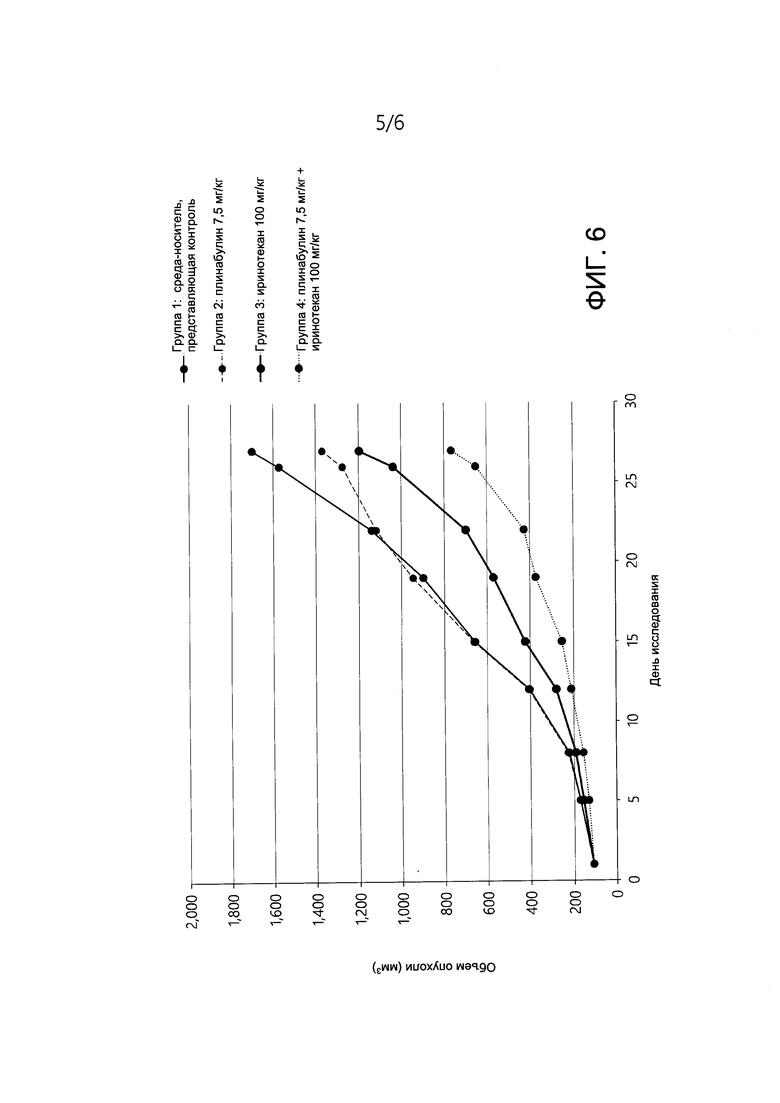
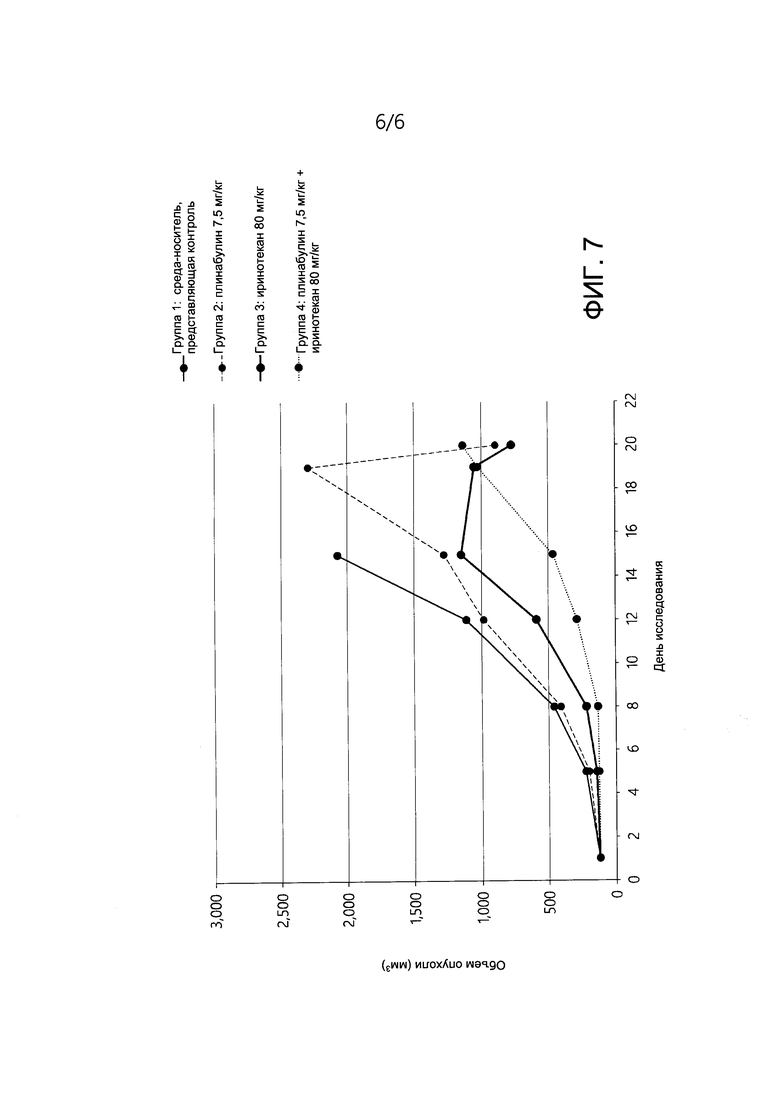
Настоящая группа изобретений относится к фармацевтической промышленности, а именно к способу лечения рака, характеризующегося экспрессией мутационной формы белка RAS. Способ лечения рака, характеризующегося экспрессией мутантной формы белка RAS, включающий введение плинабулина субъекту, причем мутантная форма белка RAS представляет собой мутантную форму белка NRAS, мутантную форму белка HRAS или мутантную форму белка KRAS, которая содержит одну или более аминокислотных замен G12C, G12R, G12D, G12V, G12F, G12L, G12N, G13C, G13R, G13S, G13A, G13V, G13P, S17G, P34S, A59E, A59G, A59T, Q61K, Q61L, Q61R, Q61H, K117N, A146P, A146T, A146V и D153V. Способ ингибирования пролиферации клетки с мутацией RAS, включающий приведение указанной клетки в контакт с плинабулином, причем мутантная форма белка RAS представляет собой мутантную форму белка NRAS, мутантную форму белка HRAS или мутантную форму белка KRAS, которая содержит одну или более аминокислотных замен, выбранных из группы G12C, G12R, G12D, G12V, G12F, G12L, G12N, G13C, G13R, G13S, G13A, G13V, G13P, S17G, P34S, A59E, A59G, A59T, Q61K, Q61L, Q61R, Q61H, K117N, A146P, A146T, A146V и D153V. Способ индуцирования апоптоза в клетке, содержащей мутацию RAS, включающий приведение указанной клетки в контакт с плинабулином, причем мутантная форма белка RAS представляет собой мутантную форму белка NRAS, мутантную форму белка HRAS или мутантную форму белка KRAS, которая содержит одну или более аминокислотных замен G12C, G12R, G12D, G12V, G12F, G12L, G12N, G13C, G13R, G13S, G13A, G13V, G13P, S17G, P34S, A59E, A59G, A59T, Q61K, Q61L, Q61R, Q61H, K117N, A146P, A146T, A146V и D153V. Способ ингибирования прогрессирования рака, характеризующегося экспрессией мутантной формы белка RAS, у субъекта, включающий введение плинабулина субъекту, причем мутантная форма белка RAS представляет собой мутантную форму белка NRAS, мутантную форму белка HRAS или мутантную форму белка KRAS, которая содержит одну или более аминокислотных замен, выбранных из группы G12C, G12R, G12D, G12V, G12F, G12L, G12N, G13C, G13R, G13S, G13A, G13V, G13P, S17G, P34S, A59E, A59G, A59T, Q61K, Q61L, Q61R, Q61H, K117N, A146P, A146T, A146V и D153V. Предложенные способы являются эффективными способами лечения рака, ассоциированного с мутацией онкогенных генов RAS. 4 н. и 22 з.п. ф-лы, 7 ил., 2 табл., 6 пр.
1. Способ лечения рака, характеризующегося экспрессией мутантной формы белка RAS, включающий введение плинабулина субъекту, нуждающемуся в этом, причем указанная мутантная форма белка RAS представляет собой мутантную форму белка NRAS, мутантную форму белка HRAS или мутантную форму белка KRAS, которая содержит одну или более аминокислотных замен, выбранных из группы, состоящей из G12C, G12R, G12D, G12V, G12F, G12L, G12N, G13C, G13R, G13S, G13A, G13V, G13P, S17G, P34S, A59E, A59G, A59T, Q61K, Q61L, Q61R, Q61H, K117N, A146P, A146T, A146V и D153V.
2. Способ по п. 1, в котором указанная мутантная форма белка RAS представляет собой мутантную форму белка KRAS.
3. Способ по п. 1, в котором указанный рак выбран из колоректального рака, рака поджелудочной железы, рака почек, рака легких, рака печени, рака груди, рака предстательной железы, рака желудочно-кишечного тракта, перитонеального рака, меланомы, рака эндометрия, рака яичников, рака шейки матки, карциномы матки, рака мочевого пузыря, глиобластомы, метастазов в головной мозг, карциномы слюнных желез, рака щитовидной железы, рака мозга, лимфомы, миеломы и рака головы и шеи.
4. Способ по любому из пп. 1-3, в котором указанный рак выбран из плоскоклеточного рака, мелкоклеточного рака легких, немелкоклеточного рака легких, аденокарциномы легких, плоскоклеточной карциномы легких, гепатоцеллюлярной карциномы, рака толстой кишки, карциномы эндометрия и гепатоцеллюлярной карциномы.
5. Способ по любому из пп. 1-4, в котором указанный рак выбран из колоректального рака, рака предстательной железы, рака груди, рака легких, рака эндометрия, множественной миеломы, рака поджелудочной железы, рака почек и глиобластомы.
6. Способ по п. 4, в котором указанный рак выбран из немелкоклеточного рака легких, рака поджелудочной железы и глиобластомы.
7. Способ по п. 6, в котором указанный рак представляет собой немелкоклеточный рак легких.
8. Способ по любому из пп. 1-7, в котором указанная мутантная форма белка RAS представляет собой белок KRAS, который содержит одну или более аминокислотных замен, выбранных из группы, состоящей из G12C, G12R, G12F, G12L, G12N, G12A, G12D, G12V, G13C, G13S, G13V, G13P, S17G, P34S, A59E, A59G, A59T, Q61K, Q61L, Q61R и Q61H.
9. Способ по любому из пп. 1-7, в котором указанная мутантная форма белка RAS представляет собой белок KRAS, который содержит одну или более аминокислотных замен, выбранных из группы, состоящей из G12C, G12R, G12A, G12D, G12V, G13C, G13R, G13S, G13A, G13V, A59E, A59G, A59T, Q61K, Q61L, Q61R, Q61H, K117N, A146P, A146T и A146V.
10. Способ по любому из пп. 1-7, в котором указанная мутантная форма белка RAS представляет собой мутантную форму белка KRAS, которая содержит одну или более аминокислотных замен, выбранных из группы, состоящей из G12C, G12R, G12A, G12D, G12V, G13C, G13R, G13S, G13A, A59E, A59G, A59T, Q61K, Q61L, Q61R и Q61H.
11. Способ по любому из пп. 1-7, в котором указанная мутантная форма белка KRAS содержит одну или более аминокислотных замен, выбранных из группы, состоящей из G12A, G12C, G12D, G12V и D153V.
12. Способ по п. 11, в котором указанная мутантная форма белка RAS представляет собой белок KRAS, который содержит одну или более аминокислотных замен, выбранных из G12C и D153V.
13. Способ по п. 1, в котором указанная мутантная форма белка RAS представляет собой мутантную форму белка NRAS.
14. Способ по п. 13, в котором указанная мутантная форма белка NRAS содержит мутацию в Q61 или A146.
15. Способ по п. 14, в котором указанная мутантная форма белка NRAS содержит одну или более аминокислотных замен, выбранных из Q61K, Q61H, Q61R, Q61L, Q61N, Q61E, Q61P, A146T, A146P и A146V.
16. Способ по п. 14 или 15, включающий определение того, имеет ли субъект мутацию NRAS.
17. Способ по п. 14 или 15, включающий определение того, имеет ли субъект мутацию HRAS.
18. Способ по любому из пп. 1-17, включающий совместное введение плинабулина с дополнительным терапевтическим агентом, выбранным из темозоломида, бевицизумаба, эверолимуса, кармустина, ломустина, прокарбазина, винкристина, иринотекана, цисплатина, карбоплатина, метатрексата, этопозида, винблазатина, блеомицина, актиномицина, циклофосфамида, ифосфамида, бевацизумаба, доцетаксела, иринотекана, темозоломида.
19. Способ по п. 18, в котором указанный дополнительный терапевтический агент представляет собой бевацизумаб, а рак представляет собой немелкоклеточный рак у человека.
20. Способ по п. 19, в котором указанным дополнительным терапевтическим агентом является доцетаксел и рак представляет собой немелкоклеточный рак легких человека.
21. Способ по п. 20, в котором указанным дополнительным терапевтическим агентом является иринотекан и рак представляет собой рак толстой кишки человека.
22. Способ ингибирования пролиферации клетки с мутацией RAS, включающий приведение указанной клетки в контакт с плинабулином, причем: указанная мутантная форма белка RAS представляет собой мутантную форму белка NRAS, мутантную форму белка HRAS или мутантную форму белка KRAS, которая содержит одну или более аминокислотных замен, выбранных из группы, состоящей из G12C, G12R, G12D, G12V, G12F, G12L, G12N, G13C, G13R, G13S, G13A, G13V, G13P, S17G, P34S, A59E, A59G, A59T, Q61K, Q61L, Q61R, Q61H, K117N, A146P, A146T, A146V и D153V.
23. Способ по п. 22, в котором приведение в контакт включает введение плинабулина субъекту, имеющему указанную клетку.
24. Способ индуцирования апоптоза в клетке, содержащей мутацию RAS, включающий приведение указанной клетки в контакт с плинабулином, причем: указанная мутантная форма белка RAS представляет собой мутантную форму белка NRAS, мутантную форму белка HRAS или мутантную форму белка KRAS, которая содержит одну или более аминокислотных замен, выбранных из группы, состоящей из G12C, G12R, G12D, G12V, G12F, G12L, G12N, G13C, G13R, G13S, G13A, G13V, G13P, S17G, P34S, A59E, A59G, A59T, Q61K, Q61L, Q61R, Q61H, K117N, A146P, A146T, A146V и D153V.
25. Способ по п. 24, в котором приведение в контакт включает введение плинабулина субъекту, нуждающемуся в этом.
26. Способ ингибирования прогрессирования рака, характеризующегося экспрессией мутантной формы белка RAS, у субъекта, включающий введение плинабулина субъекту, нуждающемуся в этом, причем: указанная мутантная форма белка RAS представляет собой мутантную форму белка NRAS, мутантную форму белка HRAS или мутантную форму белка KRAS, которая содержит одну или более аминокислотных замен, выбранных из группы, состоящей из G12C, G12R, G12D, G12V, G12F, G12L, G12N, G13C, G13R, G13S, G13A, G13V, G13P, S17G, P34S, A59E, A59G, A59T, Q61K, Q61L, Q61R, Q61H, K117N, A146P, A146T, A146V и D153V.
| US 20090170837 A1, 02.07.2009 | |||
| WO 2012035436 A1, 22.03.2012 | |||
| WO 2011109625 A1, 09.09.2011 | |||
| Пресс для выдавливания из деревянных дисков заготовок для ниточных катушек | 1923 |
|
SU2007A1 |
| IAN A | |||
| PRIOR et all., A comprehensive survey of RAS mutations in cancer// CANCER RES, 2012, May 15, p.p | |||
| Способ образования части, служащей для скрепления косы с косовищем у кос, изготовляемых штамповкой из листовой или тонкой полосовой стали | 1919 |
|
SU2457A1 |
| US 7919497 B2, 05.11.2011. | |||
Авторы
Даты
2020-11-11—Публикация
2016-03-02—Подача