Предлагаемое изобретение относится к области микробиологии, может быть использовано в медицине и ветеринарии для лечения и профилактики инфекционных заболеваний, вызываемых Pseudomonas aeruginosa (P. aeruginosa).
P. aeruginosa - грамотрицательные аэробные подвижные палочковидные бактерии, вызывают внутрибольничные инфекции, лечение затруднительно в виду высокой распространенности штаммов с множественной устойчивостью к противомикробным препаратам.
Штамм бактериофага Pseudomonas phage Ка2 не способен к лизогенному пути развития и является вирулентным, то есть обладает природной способностью лизировать (разрушать) клетки P. aeruginosa, вследствие чего выбран заявителем как перспективный бактериофаг для терапии инфекции, вызываемых бактериями P. aeruginosa, в том числе штаммами с множественной лекарственной устойчивостью.
Штамм бактериофага Pseudomonas phage Ка2 найден в естественных условиях, выделен из вод озера Байкал в зоне сброса сточных вод вблизи г. Слюдянка.
В результате анализа генома штамма бактериофага Pseudomonas phage Ка2 было идентифицировано 96 кодирующих последовательностей. Из них 68 генов кодируют гипотетические белки с неизвестной функцией, 28 генов кодируют белки с известными функциями, которые были распределены по функциональным группам.
Заявителем выявлено 6 генов, кодирующих структурные белки, из которых 2 гена отвечают за праймазную активность (праймаза синтезирует короткий фрагмент РНК, называемый праймером, комплементарный одноцепочечной матрице ДНК. Она играет ключевую роль в репликации ДНК) и 2 гена отвечают за хеликазную активность (хеликаза разделяет цепи двухцепочечной молекулы ДНК или внутримолекулярных связей в молекулах РНК, используя энергию гидролиза АТФ или ГТФ). В геноме штамма бактериофага Pseudomonas phage Ка2 отсутствуют потенциально связанные с лизогенией белки, такие как интеграза, транспозаза и рекомбиназа, что делает его перспективным для противомикробной терапии, в том числе в сочетании терапии с имеющимися противомикробными препаратами.
Фаговая терапия имеет ряд преимуществ перед терапией противомикробными препаратами, таких как разрушение биопленок, отсутствие зависимости от устойчивости возбудителя (бактерии) к противомикробным препаратам (в том числе множественной устойчивости), самоамплификация и отсутствие токсичности для человека. Информация, доступная по использованию фаготерапии против бактериальных инфекций, в особенности с инфекциями, вызываемыми бактериями с множественной лекарственной устойчивостью, все больше показывает многообещающие перспективы данной терапии в качестве альтернативы или дополнения к противомикробным препаратам.
Инфекционные заболевания, вызываемыми бактериями с множественной лекарственной устойчивостью, в настоящее время являются значительной причиной смертности во всем мире. Оценка этих заболеваний Всемирной организацией здравоохранения показала, что инфекции нижних дыхательных путей, вызываемые P. aeruginosa, диарейные заболевания входят в первую десятку факторов заболеваемости и смертности.
При этом появление устойчивости к противомикробным препаратам значительно увеличило распространенность инфекционных заболеваний и повысило смертность от них, а также увеличило расходы в сфере здравоохранения.
Несмотря на наличие разнообразных противомикробных агентов, используемых для лечения инфекций, у бактерий имеется резистентность ко многим из них. И эта резистентность возникает вскоре после того, как противомикробный препарат выходит в клиническую практику. Поэтому разработка противомикробных препаратов на основе бактериофагов, к которым бактерии не вырабатывают резистентности, является перспективной альтернативой классическим противомикробным препаратам для терапии инфекционных заболеваний, вызываемых бактериями с (множественной) лекарственной устойчивостью.
Использованные в описании сокращения термины и пояснения:
МПА - мясо-пептонный агар.
LA - твердая агаризованная среда Лурии-Бертани .
Лизис - в клинической медицине (греч, lysis) - растворение, разложение, ослабление, развязка клеток и их систем, в том числе микроорганизмов, под влиянием различных агентов, например ферментов, бактериолизинов, бактериофагов, противомикробных препаратов.
мкл - микролитр.
мкм - микрометр.
NaCl - хлорид натрия.
LA - твердая агаризованная среда Лурии-Бертани.
Клинические изоляты - потенциально болезнетворные микроорганизмы, в основном стафилококки и энтеробактерии, которые выделены не из природной среды, а из организма животных или людей, в том числе пациентов стационаров [https://www.google.com/search?q=%D0%BA%D0%B B%D0%B8%D0%BD%D0%B8% D1%87%D0%B5%D1%81%D0%BA%D0%B8%D0%B9+%D0%B8%D0%B7%D0%BE%D0%BB%D1%8F%D1%82+%D1%8D%D1%82%D0%BE&rlz=1C1GCEU_ruRU971RU971&oq=&aqs=chrome.0.69i59i450l8.1920183526j0j15&sourceid=chrome&ie=UTF-8].
КОЕ - колониеобразующая единица - единица измерения, оценивающая количество микробных клеток.
БОЕ - бляшкообразующая единица - наименьшее количество вируса или бактериофага, способное вызвать образование одной негативной (бляшки) соответственно на однослойной культуре клеток позвоночных или на агаровой культуре бактерий.
МПК - минимальная концентрация, подавляющая видимый рост исследуемого микроорганизма в бульонной культуре или на плотной среде.
Из исследованного уровня техники выявлено изобретение «Способ оценки эффективности фаготерапии при лечении инфекционных заболеваний» по патенту RU 2624511, сущностью является забор исследуемого биологического материала, введение раствора коммерческого бактериофага в исследуемый биологический материал и определение эффективности взаимодействия коммерческого бактериофага с патогенными микроорганизмами в исследуемом биологическом материале, отличается тем, что перед проведением хирургического вмешательства осуществляют идентификацию патогенных микроорганизмов в области планируемого хирургического вмешательства, определяют концентрацию (титр) бактериофага к патогенным микроорганизмам в исследуемом биологическом материале, вводят первую дозу раствора коммерческого бактериофага сразу после выполнения хирургического вмешательства, через 18 - 24 час после введения первой дозы раствора коммерческого бактериофага производят забор исследуемого биологического материала и определяют концентрацию (титр) бактериофага в исследуемом биологическом материале, при установлении титра не менее 106 БОЕ/мл делают вывод об эффективном воздействии раствора коммерческого бактериофага на целевой патогенный микроорганизм, через 18 - 24 час после введения первой дозы раствора коммерческого бактериофага вводят вторую дозу раствора коммерческого бактериофага, через 18 - 24 час после введения второй дозы раствора коммерческого бактериофага вводят третью дозу раствора коммерческого бактериофага, на 4 - 5 сутки после хирургического вмешательства выполняют забор исследуемого биологического материала и производят оценку эффективности путем сравнения бактериофага, содержащегося в исследуемом биологическом материале с раствором коммерческого бактериофага, при установлении тождественности литической активности не менее первых двух десятикратных разведений раствора коммерческого бактериофага, используемого для лечения пациента с бактериофагом, находящимся в исследуемом биологическом материале от пациента, делают вывод об эффективности фаготерапии и продолжают вводить раствор коммерческого бактериофага до полной элиминации патогенных микроорганизмов.
Недостатком известного способа является его ограниченная функциональность, а именно, он обеспечивает осуществление оценки эффективности фаготерапии при лечении инфекционных заболеваний, но не пригоден для лечения имеющегося заболевания.
Из исследованного уровня техники выявлено изобретение «Способ лечения или профилактики рецидивов нозокомиальной пневмонии» по заявке на изобретение RU 2021120556, сущностью является введение путем ингаляции фармацевтической композиции, содержащей один или более штаммов бактериофагов, отличающийся тем, что изготавливают базовый комплекс бактериофагов, содержащий фаги, активные в отношении бактерий основных возбудителей НП: Acinetobacter baumannti, Citrobacter freundii, Enterobacter cloacae, Enterobacter kobei, Enterococcus faecium, Klebsiella ozaenae, Klebsiella pneumoniae, Propionibacterium acnes, Pseudomonas aeruginosa, Staphylococcus aureus, Staphylococcus epidermidis, Staphylococcus haemolyticus, Stenotrophomonas maltophilia, Streptococcus pyogenes, адаптированный к конкретному отделению или лечебному учреждению на основании данных микробиологических исследований биоматериала пациентов с использованием чистых культур микроорганизмов, выделенных ранее из биоматериала пациентов данного учреждения и содержащий от 3 до 4 вирулентных бактериофагов к каждому из перечисленных возбудителей НП, проверяют активность фагов с использованием метода спот-тестирования, осуществляют адаптацию состава базового комплекса путем добавления штаммов бактериофагов из музея зарегистрированных в Международной коллекции микроорганизмов под инвентарным номером 986; готовую форму, содержащую базовый состав, адаптированный на основании проведенных исследований, передают в лечебное учреждение в виде раствора для ингаляций, каждый из флаконов которого содержит: действующее вещество в форме смеси стерильных очищенных фильтратов фаголизатов в концентрации по Грация 104 -9,9×107 БОЕ/см3 в 1 мл, вспомогательное вещество в форме физиологического раствора до 5 мл; препарат вводят ингаляционно пациентам по 1 дозе 5 мл 2-3 раза в день в течение не менее 7 дней. Способ, отличающийся тем, что пациентам, находящимся на самостоятельном дыхании, ингаляцию осуществляют с помощью небулайзера. Способ, отличающийся тем, что пациентам, находящимся на искусственной вентиляции легких (ИВЛ), небулайзер включают в контур аппарата ИВЛ.
Недостатком известного способа является отсутствие в описании технического решения информации о синергизме (взаимодействии различных биохимических и физиологических процессов, отдельных элементов целого организма) заявленной фармацевтической композиции в сочетании с противомикробными препаратами.
Из исследованного уровня техники выявлено изобретение «Способ лечения язвенных кератитов у лошадей препаратом с бактериофагами» по патенту RU 2770222, сущностью является способ лечения язвенных кератитов у лошадей препаратом с бактериофагами, включающий введение бактериофагового препарата «Фагодерм» в конъюнктивальную полость больного глаза в дозе 0,5 мл 4 раза в день в течение 25-30 дней до формирования лейкомы роговицы.
Недостатком известного способа является использование для его осуществления препарата «Фагодерм», куда входит малотоксичное вещество Carbopol ETD 2001. Но при этом данный препарат может вызывать аллергические реакции в виде кожного зуда, изжоги, тошноты, горечи во рту, болей в животе, так как содержит обладающий побочными действиями экстракт календулы [https://www.rlsnet.ru/drugs/kalenduly-nastoika-4328?ysclid.../ Календулы настойка - инструкция по применению, дозы, побочные действия, отзывы о препарате Календулы настойка: настойка - Энциклопедия лекарств РЛС (rlsnet.ru)] и эфирные масла. Кроме того, в описании отсутствует информация о положительной эффективности использовании способа в отношении антибиотико-резистентных штаммов бактерий при проведении профилактических и лечебных мероприятий в сочетании с противомикробными препаратами.
Известно изобретение «Бактериофаг, обладающий активностью против P. aeruginosa, белки бактериофага и способы их применения» по патенту RU 2580248, сущностью является выделенный бактериофаг с геномом, содержащим нуклеотидную последовательность SEQ ID NO: 3, обладающий активностью против P. aeruginosa. Фармацевтическая композиция, обладающая активностью против P. aeruginosa, включающая терапевтически эффективное количество бактериофага по п. 1 и фармацевтически приемлемый носитель. Фармацевтическая композиция по п. 2, дополнительно включающая один или более дополнительных бактериофагов, эффективных против P. aeruginosa. Фармацевтическая композиция по п. 2, дополнительно включающая один или более дополнительных бактериофагов, эффективных против бактерий, отличных от P. aeruginosa. Белок, имеющий аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 344-438, обладающий активностью против P. aeruginosa и кодируемый нуклеотидной последовательностью генома бактериофага по п. 1. Белок по п. 5, имеющий аминокислотную последовательность SEQ ID NO: 438 и представляющий собой концевой волоконный белок (tail fiber protein), обладающий активностью против P. aeruginosa, или белок, имеющий аминокислотную последовательность SEQ ID NO: 435 и представляющий собой белок хвостового отростка, обладающий активностью против P. aeruginosa. Белок, обладающий активностью против P. aeruginosa, имеющий аминокислотную последовательность, по меньшей мере на 90% идентичную аминокислотной последовательности SEQ ID NO: 438, соответствующей концевому волоконному белку, кодируемому нуклеотидной последовательностью генома бактериофага по п. 1. Белок, обладающий активностью против P. aeruginosa, имеющий аминокислотную последовательность, по меньшей мере на 90% идентичную аминокислотной последовательности SEQ ID NO: 435, соответствующей белку хвостового отростка, кодируемому нуклеотидной последовательностью генома бактериофага по п. 1. Фармацевтическая композиция, обладающая активностью против P. aeruginosa, содержащая терапевтически эффективное количество белка по п. 5, или по п. 7, или по п. 8 и фармацевтически приемлемый носитель. Фармацевтическая композиция по п. 9, включающая белок, имеющий аминокислотную последовательность SEQ ID NO: 435 или SEQ ID NO: 438. Фармацевтическая композиция по п. 10, дополнительно включающая один или более бактериофагов или дополнительных белков, кодируемых геномом бактериофага, где один или более бактериофагов или дополнительных белков эффективны против P. aeruginosa или эффективны против бактерий, отличных от P. aeruginosa. Выделенная нуклеиновая кислота, содержащая нуклеотидную последовательность, кодирующую белок по п. 5, или по п. 7, или по п. 8, обладающий активностью против P. aeruginosa. Применение терапевтически эффективного количества фармацевтической композиции по п. 2 или п. 9 в изготовлении лекарственного средства для лечения или уменьшения частоты возникновения инфекции, обусловленной P. aeruginosa, у пациента, который в этом нуждается. Применение по п. 13, в котором инфекция является нозокомиальной. Применение по п. 13, в котором композицию вводят местно. Применение по п. 13, в котором пациентом является млекопитающее. Применение по п. 16, в котором млекопитающее является человеком. Применение по п. 13, в котором инфекцией, подвергаемой лечению, является инфекция кожи, легких, мочевых путей или почек. Применение по п. 18, в котором указанная инфекция кожи связана с ожогом кожи или диабетической язвой стопы. Способ диагностики бактериальной инфекции, вызванной P. aeruginosa, включающий (i) культивирование образца ткани, взятой у пациента; (ii) контактирование культуры со стадии (i) с бактериофагом по п. 1 или белком по п. 5, или по п. 7, или по п. 8, обладающим активностью против P. aeruginosa; и (iii) мониторинг роста или лизиса культуры, причем наличие лизиса культуры указывает на то, что культура включает P. aeruginosa. Способ по п. 20, в котором образец ткани представляет собой образец крови, мочи, мокроты, поврежденной кожи, жидкости, биопсии ткани или мазок, взятый у указанного пациента. Применение бактериофага по п. 1, обладающего активностью против P. aeruginosa, в изготовлении лекарственного средства для уменьшения или ингибирования инфекции, обусловленной колонизацией или ростом P. aeruginosa на биологической поверхности. Применение по п. 22, в котором указанная поверхность является кожей или слизистой оболочкой млекопитающего. 24. Применение по п. 23, в котором указанное млекопитающее является человеком. Применение белка по п. 5, или по п. 7, или по п. 8, обладающего активностью против P. aeruginosa, в изготовлении лекарственного средства для уменьшения или ингибирования инфекции, обусловленной колонизацией или ростом P. aeruginosa на биологической поверхности. Применение по п. 25, в котором указанная поверхность является кожей или слизистой оболочкой млекопитающего. Применение по п. 26, в котором указанное млекопитающее является человеком. Способ уменьшения или ингибирования колонизации или роста P. aeruginosa на твердой поверхности, включающий приведение указанной твердой поверхности в контакт с бактериофагом по п. 1 или белком по п. 5, или по п. 7, или по п. 8, обладающим активностью против P. aeruginosa. Способ по п. 28, в котором указанная поверхность является поверхностью больничной аппаратуры или частью больничного оборудования. Способ по п. 29, в котором указанная аппаратура или оборудование является хирургической аппаратурой или частью оборудования для хирургии.
Недостатком известного способа является отсутствие описания того, на скольких клинических изолятах было подтверждено его действие, также не описан положительный эффект с противомикробными препаратами. Также не описан положительный эффект воздействия бактериофагов и их белков на смешанную биоплёнку P. aeruginosa и S. aureus.
Выявленные аналоги совпадают с заявленным техническим решением по отдельным совпадающим признакам, поэтому прототип не выявлен и формула изобретения составлена без ограничительной части.
Техническим результатом заявленного решения является штамм бактериофага Pseudomonas phage Ka2, обладающий литической активностью в отношении бактерий P. aeruginosa, для профилактики и лечения инфекционных заболеваний, в том числе в сочетании с имеющимися противомикробными препаратами. При этом достигается более высокий лечебный эффект по сравнению с использованием известных противомикробных препаратов.
Сущностью заявленного технического решения является штамм бактериофага Pseudomonas phage Ka2 для профилактики и лечения инфекционных заболеваний, вызываемых Pseudomonas aeruginosa.
Заявленное техническое решение иллюстрируется Фиг.1 - Фиг.4.
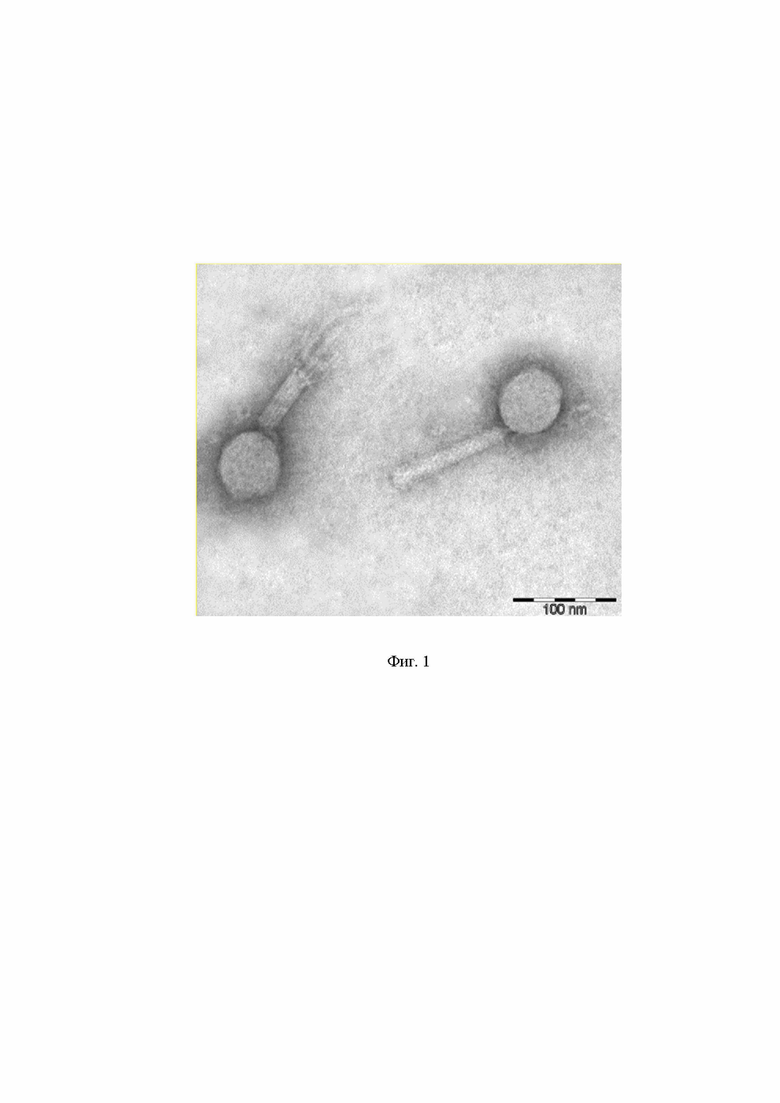
На Фиг. 1 представлена морфология изолированного штамма бактериофага Pseudomonas phage Ка2, полученная с помощью трансмиссионной электронной микроскопии.
На Фиг. 2 представлены зоны лизиса на газоне монокультуры P. aeruginosa. Фиг. 2 демонстрирует полный лизис бактериальной культуры в зоне соприкосновения.
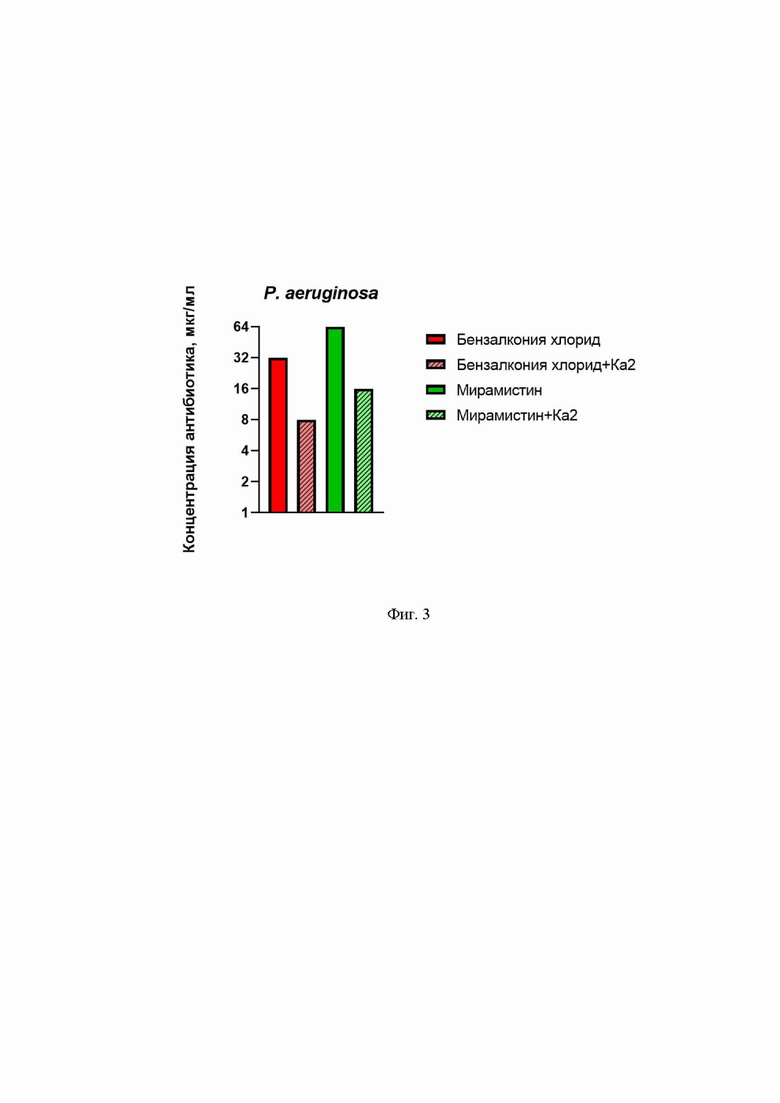
На Фиг. 3 представлена минимальная подавляющая концентрация противомикробных препаратов без и со штаммом бактериофага Pseudomonas phage Ка2 против монокультуры P. aeruginosa.
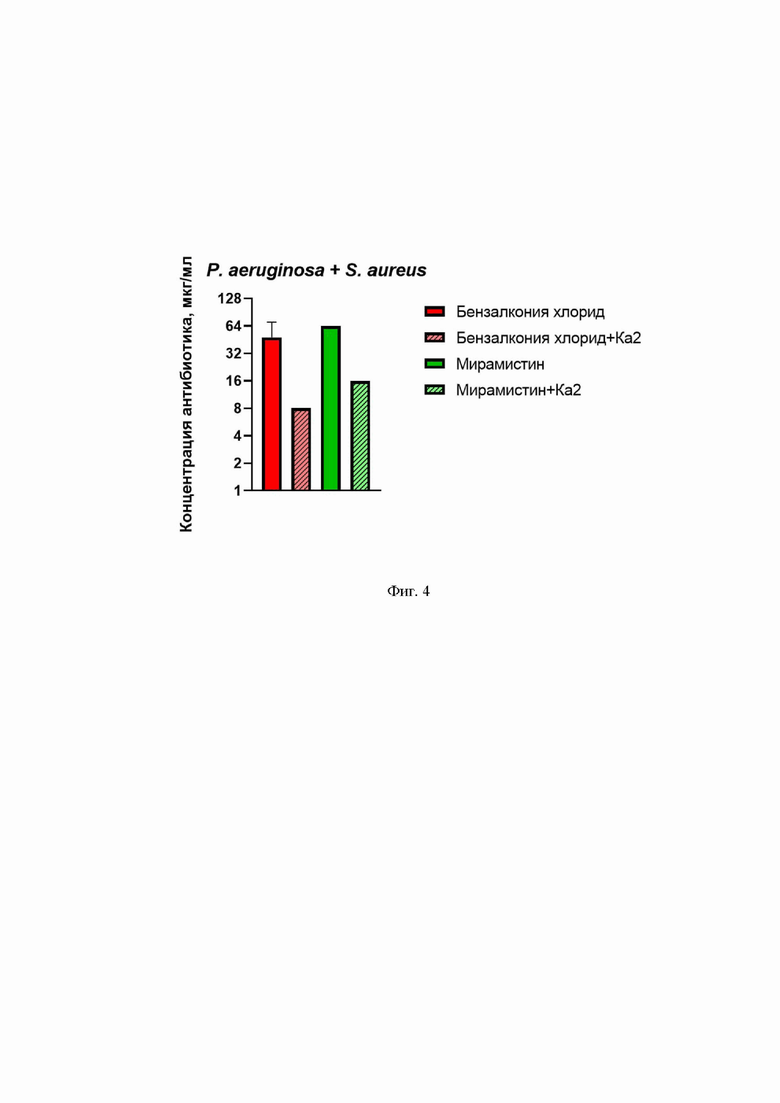
На Фиг. 4 представлена минимальная подавляющая концентрация противомикробных препаратов без и со штаммом бактериофага Pseudomonas phage Ка2 против смешанной культуры P. aeruginosa и S. aureus.
Далее заявителем приведено описание заявленного технического решения.
Характеристика заявленного штамма бактериофага Pseudomonas Phage Ка2.
Штамм бактериофага Pseudomonas Phage Ка2 найден в естественных условиях, выделен из вод озера Байкал в зоне сброса сточных вод вблизи г. Слюдянка. На Фиг. 1 представлена морфология изолированного штамма бактериофага Pseudomonas Phage Ка2, полученная с помощью трансмиссионной электронной микроскопии.
Культивирование штамма проводили по известной методике, например, https://pharmacopoeia.ru/ofs-1-7-1-0002-15-bakteriofagi-lechebno-profilakticheskie/#Испытания.
Средой для культивирования штамма бактериофага Pseudomonas Phage Ка2 является твердая агаризованная среда Лурии-Бертани (LA), состав среды LA (г/100 мл дистиллированной воды): триптон - 1,0; дрожжевой экстракт - 0,5; NaCl - 0,5; агар - 2,0.
Штамм бактериофага Pseudomonas Phage Ка2 выращивают на среде LA на бактериальном газоне методом двойного слоя агара в чашке Петри в условиях термостата при температуре плюс 37,0 ± 0,5°С в течение 24 час. Полужидкую LA с 0,6 % агара используют для верхнего слоя. Наличие бактериофага Pseudomonas Phage Ка2 и титр в супернатанте определяют по появлению бляшек на бактериальном газоне. Для получения бактериофага Pseudomonas Phage Ка2 из зоны лизиса носиком соскабливают слой бактериофагов Pseudomonas Phage Ка2 и опускают в 0,9% раствор NaCl 15 мл. Полученный раствор обрабатывают хлороформом 30 мкл/мл в течение 30 минут при +4°С, центрифугируют, чтобы осадить клеточный дебрис при 4500 об/мин в течение 10 мин и надосадочную жидкость фильтруют через мембранный фильтр с диаметром пор 0,22 мкм. Для длительного хранения бактериофага Pseudomonas Phage Ка2 500 мкл свежего фаголизата смешивают с 500 мкл стерильного глицерина и помещают в морозильную камеру при минус 86°С.
Для измерения концентрации фаголизата в стерильный 96-луночный планшет в лунки вносили по 90 мкл 0,9% NaCl. В первую лунку добавляли 10 мкл фаголизата, следующие лунки содержали двукратно уменьшающиеся концентрации фаголизата. Готовили серийные 10-кратные разведения жидкой фаговой культуры из каждой лунки в 0,9% NaCl и по 15 мкл суспензии переносили на чашки с LA, предварительно содержащие ночную культуру P. aeruginosa. БОЕ подсчитывали из капель, содержащих минимум 5 бляшек, умножая на число разведения.
Культурально-морфологические признаки бактериофага Pseudomonas Phage Ka2.
При высеве заявленного штамма на МПА образуются бляшкообразующие единицы с четким краем и прозрачным центром различного диаметра в диапазоне от 0,3±0,1 до 0,5±0,1 мм.
Штамм бактериофага Pseudomonas Phage Ка2 способен лизировать (разрушать) клетки P. aeruginosa PAO1. С помощью просвечивающего электронного микроскопа выявлено, что фаг имеет капсид размером 57±9 нм и сократимый негибкий хвост размером 115±10 нм в несокращенном состоянии (Фиг.1).
ДНК изолята выделена с помощью коммерческого набора Viral RNA/DNA Mini Kit (Invitrogen by Thermo Fisher Scientific) и проведено shotgun-секвенирование в режиме парноконцевых прочтений с длиной 300 п.о. на платформе Illumina MiSeq. Собран кольцевой геном размером 66310 п.о. с ГЦ-составом, равным 55%. Выравнивание с базой данных GenBank выявило максимальную идентичность с геномом бактериофага Pseudomonas phage S50 (97% идентичности при покрытии 99%). Геном депонирован в GenBank под номером ON529291.1 [https://www.ncbi.nlm.nih.gov/nuccore/ON529291.1]. Бактериофаг Pseudomonas Phage Ка2 задепонирован в Биоресурсном центре Всероссийской коллекции промышленных микроорганизмов (Регистрационный номер ВКПМ: Ph-1630). В результате аннотации генома штамма бактериофага Pseudomonas Phage Ка2 получены последовательности всех генов и выявлены их основные функции. В результате анализа идентифицировано 96 кодирующих последовательностей. Из них 68 генов кодируют гипотетические белки с неизвестной функцией. 28 генов кодируют белки с известными функциями, которые были распределены по функциональным группам с помощью SnapGene DNA. Выявлено 6 генов, кодирующих структурные белки. 2 гена отвечают за праймазную активность (праймаза синтезирует короткий фрагмент РНК, называемый праймером, комплементарный одноцепочечной матрице ДНК. Она играет ключевую роль в репликации ДНК) и 2 гена отвечают за хеликазную активность (хеликаза разделяет цепи двухцепочечной молекулы ДНК или внутримолекулярных связей в молекулах РНК, используя энергию гидролиза АТФ или ГТФ). В геноме бактериофага Ка2 отсутствуют потенциально связанные с лизогенией белки, такие как интеграза, транспозаза и рекомбиназа, что делает его перспективным для противомикробной терапии, в том числе в сочетании терапии с имеющимися противомикробными препаратами.
Далее заявителем представлены примеры конкретного выполнения заявленного технического решения.
Пример 1. Использование заявленного штамма бактериофага Pseudomonas Phage Ka2 для оценки лизиса культуры P. aeruginosa PAO1.
Для оценки лизиса культуры P. aeruginosa PAO1 с использованием заявленного штамма бактериофага Pseudomonas Phage Ka2 получают ночную культуру P. aeruginosa PAO1, наносят ее на поверхность LB - агара и подсушивают в ламинаре в течение 15 мин. Затем наносят на поверхность фаголизат в объеме 20 мкл и приподнимают чашку так, чтобы капли стекали вниз, формируя дорожки.
Полученную чашку после застывания переворачивают и инкубируют в термостате при +37°С 24 часа.
Получают зону лизиса на газоне монокультуры P. aeruginosa.
Полученный результат представлен на Фиг. 2 - представлены зоны лизиса на газоне монокультуры P. aeruginosa. Фиг. 2 демонстрирует полный лизис бактериальной культуры в зоне соприкосновения.
Пример 2. Использование заявленного штамма бактериофага Pseudomonas Phage Ka2 для оценки его совместного действия с противомикробными препаратами.
Оценку совместного действия штамма бактериофага Pseudomonas Phage Ка2 с известными противомикробными препаратами проводят с помощью метода серийных разведений противомикробного препарата в 96-луночных стерильных полистироловых планшетах и определяют минимальную подавляющую концентрацию противомикробного препарата без добавления штамма бактериофага Pseudomonas Phage Ка2 и с добавлением штамма бактериофага Pseudomonas Phage Ка2.
Сначала получают разведения противомикробного препарата (например, мирамистин, бензалкония хлорид) в питательной среде Мюллера-Хинтона (Sigmaaldrich). В первую лунку вносят противомикробный препарат в среде Мюллера-Хинтона в концентрации, в 2 раза превышающую максимальную, в объеме 200 мкл. В остальные лунки вносят чистую питательную среду Мюллера-Хинтона в объеме 100 мкл. Далее из первой лунки 100 мкл переносят во вторую лунку, тщательно перемешивают. Из второй лунки 100 мкл переносят в третью лунку и так далее. В результате, последовательным двукратным разведением доводят концентрацию противомикробного препарата до 0,0625 мкг/мл. Затем в каждую лунку вносят приготовленный инокулюм (100 мкл суспензии ночной культуры микроорганизмов P. aeruginosa с содержанием КОЕ 106 клеток в мл), разводя тем самым вдвое концентрацию противомикробного препарата. В результате максимальная финальная концентрация противомикробного препарата составляет 32 мкг/мл. В следующих лунках содержатся двукратно уменьшающиеся концентрации противомикробного препарата - 16-0,03125 мкг/мл.
В качестве контроля включают лунки, не содержащие противомикробного препарата (контроль роста культуры). Кроме того, ставят контроль чистоты питательных сред и растворителей.
Аналогично готовят серию разведений противомикробного препарата, в которую дополнительно вместе с инокулюмом вносят суспензию штамма бактериофага Pseudomonas Phage Ка2 до конечной концентрации 108 БОЕ/мл.
Планшеты инкубируют в термостате при +37 °С в течение 24 часов.
Оценку роста культур проводят с помощью окрашивания 0,1% водным раствором резазурина, внося по 5 мкл в каждую лунку. Сравнивают рост микроорганизмов P. aeruginosa в присутствии противомикробного препарата. Образование розовой окраски резазурина свидетельствовало о том, что данная концентрация исследуемого противомикробного препарата недостаточна, чтобы подавить жизнеспособность микроорганизмов P. aeruginosa. Первую, наименьшую, концентрацию исследуемого противомикробного препарата (из серии последовательных разведений), где не происходит образования розового продукта трансформации резазурина, считали МПК. В каждом опыте присутствовал положительный (бульон с растущей культурой P. aeruginosa) и отрицательный (бульон без растущей культуры P. aeruginosa) контроли. В качестве МПК соединения принимают его медианное значение, полученное в трех независимых экспериментах (биологические повторности).
Полученные результаты представлены на Фиг.3, где представлена минимальная подавляющая концентрация противомикробных препаратов без и с бактериофагом Pseudomonas Phage Ка2 против монокультуры P. aeruginosa. Показано, что в присутствии бактериофага Pseudomonas Phage Ка2 минимальная подавляющая концентрация и мирамистина, и бензалкония хлорида снижается в 4 раза, следовательно, повышается эффективность противомикробной терапии инфекций, вызываемых P. aeruginosa.
Аналогично описанному выше провели серию разведений со смешанной культурой P. aeruginosa и S. aureus.
Полученные результаты представлены на Фиг.4, где представлена минимальная подавляющая концентрация исследуемых противомикробных препаратов без и с бактериофагом Pseudomonas Phage Ка2 против смешанной культуры P. aeruginosa и S. aureus. Показано, что в присутствии бактериофага Pseudomonas Phage Ка2 минимальная подавляющая концентрация и мирамистина, и бензалкония хлорида снижается в 4 раза, следовательно, повышается эффективность противомикробной терапии смешанных инфекций, вызываемых P. aeruginosa и S. aureus.
Таким образом, из описанного выше можно сделать вывод, что заявителем достигнут заявленный технический результат, а именно: выделен штамм бактериофага Pseudomonas phage Ka2, обладающий литической активностью в отношении бактерий P. aeruginosa, для профилактики и лечения инфекционных заболеваний, в том числе в сочетании с имеющимися противомикробными препаратами.
При этом достигнут более высокий лечебный эффект при совместном использовании штамма бактериофага Pseudomonas Phage Ка2 с противомикробными препаратами по сравнению с использованием одних противомикробных препаратов против монокультуры P. aeruginosa и смешанной культуры P. aeruginosa с другим условно-патогенным микроорганизмом, например, S. aureus. В сочетании с бактериофагом минимальная подавляющая концентрация препаратов снижалась в несколько раз как в монокультуре, так и в смешанной культуре. Так, в присутствии штамма бактериофага Pseudomonas Phage Ка2 минимальная подавляющая концентрация и мирамистина, и бензалкония хлорида против монокультуры P. aeruginosa снижалась в 4 раза (Фиг. 3), против смешанной культуры P. aeruginosa и S. aureus также снижалась в 4 раза (Фиг. 4).

Изобретение относится к области биотехнологии. Изобретение представляет собой штамм бактериофага Pseudomonas phage Ka2 ВКПМ: Ph-1630. Изобретение используется для профилактики и лечения инфекционных заболеваний, вызываемых Pseudomonas aeruginosa. 4 ил.
Штамм бактериофага Pseudomonas phage Ka2 ВКПМ: Ph-1630 для профилактики и лечения инфекционных заболеваний, вызываемых Pseudomonas aeruginosa.
| Способ оценки эффективности фаготерапии при лечении инфекционных заболеваний | 2016 |
|
RU2624511C1 |
| СПОСОБ ЛЕЧЕНИЯ ЯЗВЕННЫХ КЕРАТИТОВ У ЛОШАДЕЙ ПРЕПАРАТОМ С БАКТЕРИОФАГАМИ | 2020 |
|
RU2770222C1 |
| SAUSSEREAU E et al | |||
| Effectiveness of bacteriophages in the sputum of cystic fibrosis patients | |||
| Clin Microbiol Infect., 2014 Dec; 20(12): O983-90, PMID: 24920209. | |||
Авторы
Даты
2023-12-05—Публикация
2023-05-29—Подача