Область техники, к которой относится изобретение
Изобретение относится к биохимии, молекулярной биологии, микробиологии и биотехнологии и может быть использовано в создании биологических препаратов для профилактики и лечения инфекций, а также дезинфекции.
Уровень техники
Устойчивость бактерий к существующим антимикробным средствам является одной из основных проблем современности в области здравоохранения. Горизонтальный перенос генов позволяет бактериям очень быстро распространять новые механизмы резистентности, что наряду с неправильным использованием и злоупотреблением антибиотиками среди населения, а также в сельском хозяйстве и промышленности, приводит к появлению штаммов, которые невосприимчивы к антибиотикам вообще. Всемирная организация здравоохранения обращает особое внимание на патогенов группы ESKAPE, к которым относятся Enterococcus faecium, Staphylococcus aureus, Acinetobacter baumannii, Pseudomonas aeruginosa, Klebsiella pneumoniae и другие представители Enterobacteriaceae. Данные бактерии способны приобретать устойчивость сразу к нескольким антибактериальным средствам и чаще других вызывают опасные для жизни пациентов инфекции, в том числе и внутрибольничные.
Альтернативой антибиотикам и синтетическим антибактериальным средствам являются бактериофаги, использование которых началось еще до открытия пенициллина. Применение бактериофагов имеет множество преимуществ: автоматическое дозирование в зависимости от степени заражения, минимальное нарушение естественной микрофлоры, низкая вероятность развития устойчивости, совместимость с антибиотиками, быстрая скорость разработки препаратов на основе фагов и их низкая стоимость, уничтожение биопленок, возможность единоразового введения и применения низких доз, а также низкая степень нагрузки на окружающую среду.
Помимо зарегистрированных на территории РФ бактериофаговых препаратов компании «Микроген», существует множество изолированных бактериофагов, которые можно применять для лечения инфекций, вызванных грамотрицательными бактериями. Например, вирулентный фаг Фи 03 (RU 2112800, опубликован 29.03.1996) обладает способностью действовать на клетки синегнойной палочки, имеющие пили. Однако его спектр действия довольно узкий. Фаг Фи 02 (RU 2113476, опубликован 29.03.1996) обладает широким спектром действия. Бактериофаг ph57 (RU 2455355, опубликован 29.04.2011) также обладает широким спектром и может применяться для лечения гнойно-септических инфекций. Бактериофаг Esc-СОР-1 способен специфически уничтожать штаммы Шига-токсин продуцирующей E. соli типа F18 и может быть использован в медицинской промышленности (RU 2662985, опубликован 28.12.2015). Высоковирулентный штамм бактериофага Pseudomonas aeruginosa ph57 обладает широким спектром литической активности в отношении бактерий Pseudomonas aeruginosa и может быть использован в качестве основы для приготовления антисептического средства против синегнойной палочки (RU 2455355, опубликован 19.04.2011). Штамм бактериофага Salmonella typhimurium S-394 обладает поливалентной литической активностью по отношению к бактериям родов Escherichia coli, штаммам Salmonella ТА 1537 и Salmonella ТА 100 и штаммам Shigella sonnei 32 и Shigella flexneri Аd (RU 2412243, опубликован 16.06.2009). Также можно отметить антибактериальные композиции широкого спектра действия, содержащие несколько бактериофагов, например те, которые описаны в патентах RU 2518303 (опубликован 29.06.2012) и RU 2628312 (опубликован 16.03.2015).
Штамм бактериофага Acinetobacter baumannii AP22, из генома которого был выделен эндолизин, являющийся предметом данного патента, был запатентован для идентификации Acinetobacter baumannii при бактериологическом анализе клинического материала и для получения препарата против внутрибольничных A.baumannii-инфекций (RU 2439151, опубликован 10.01.2012). Он обладает узким спектром действия и способен лизировать только представителей вида Acinetobacter baumannii.
Однако есть и минусы применения лекарственных препаратов на основе бактериофагов. Бактериофаги сложно и долго выделять из бактериальных культур, они могут переносить гены бактериальных токсинов, к ним зачастую может возникать устойчивость бактерий, они обладают сильной иммуногенностью. Также их выделение может быть затруднительным, а нормировать их фармакокинетические характеристики сложно, а порой и невозможно. Для раневых инфекций было показано, что присутствие бактериофагов вызывало непродуктивный иммунный ответ, способствующий развитию хронической раневой инфекции и определяющий более тяжелое течение.
Считается, что более перспективным классом антибактериальных агентов могут стать эндолизины бактериофагов - литические ферменты, способные расщеплять пептидогликан клеточной стенки бактерий, что влечет за собой гибель бактерии вследствие гипотонического лизиса.
Эндолизины обладают рядом преимуществ по сравнению с бактериофагами и антибактериальными молекулами. Чаще всего они действуют специфично на определенный вид бактерий, при этом литический эффект достигается очень быстро за счет прямого действия на пептидогликан. Однако для многих эндолизинов, чье действие показано против грамотрицательных бактерий, обнаруживается довольно широкий спектр активности на различные роды представителей грамотрицательных патогенов. Среди других преимуществ эндолизинов можно отметить низкую вероятность развития резистентности, действие на антибиотикоустойчивые штаммы, а также на бактерии, находящиеся в любых метаболических стадиях, включая дормантные.
Эндолизины все чаще отмечают как потенциальные и эффективные препараты в борьбе с различными возбудителями. Независимыми группами ученых проводятся исследования по созданию и применению их для борьбы с грамотрицательными бактериями особо важной группы ESKAPE. При этом очень часто (но не всегда) использованию эндолизинов в чистом виде мешает наличие наружной мембраны, экранирующей пептидогликан от действия фермента. В качестве веществ, увеличивающих проницаемость наружной мембраны, могут использоваться полимиксины, полигуанидины и их производные, аминогликозиды, этилендиаминтетрауксусная кислота (ЭДТА) и ее соли, лимонная кислота и др.
Среди примеров эндолизинов, чье бактерицидное действие проявляется или значительно увеличивается в присутствии пермеабилизующих агентов, в частности ЭДТА, можно отметить антисинегнойные эндолизины EL188 (WO2015071437 A1, опубликован 21.05.2015) и OBPgpLYS (US 8846865 B2, опубликован 30.09.2014).
Другим подходом, позволяющим не задействовать дополнительные реагенты, увеличивающие проницаемость наружных мембран, является создание химерных молекул. Эти соединения представляют собой ковалентно сшитые эндолизин и пептид, который позволяет перенести молекулу через наружную мембрану грамотрицательных бактерий. В частности, антимикробный пептид SMAP-29 использовался для создания Art-175, представляющего собой модифицированную молекулу KZ144. В отличие от KZ144 Art-175 может проходить через наружную мембрану синегнойной палочки и уничтожать бактерии, в том числе и с множественной резистентностью (US 20160281074 A1, опубликован 29.09.2016).
Известно, что OBPgpLYS также модифицировали с помощью SMAP-29. При этом он начинает проявлять значительно больший антимикробный эффект как на штаммы синегнойной палочки, так и на другие грамотрицательные бактерии (US 8846865 B2, опубликован 30.09.2014). Модифицированный и немодифицированный OBPgpLYS также способны элиминировать бактерии внутри биопленок (WO 2011134998 A1, опубликован 03.11.2011).
Однако встречается множество примеров рекомбинантных эндолизинов, которые способны действовать на представителей грамотрицательных бактерий и без пермеабилизаторов или видоизменения структуры.
Известно, что эндолизин PlyE146 за счет положительно заряженной области на С-конце белка также обладает способностью проникать через наружную мембрану грамотрицательных бактерий и лизировать клетки E. coli, P. aeruginosa и A. baumannii в концентрации 400 мкг/мл (Larpin et al., 2018). Эндолизин бактериофага Acinetobacter baumannii LysAB2 за счет амфифильных структур в молекуле обладает бактерицидным действием как против грамотрицательных, так и против грамположительных бактерий, эффект достигается при концентрации 500 мкг/мл. В его спектр входят штаммы A. baumannii, E. coli и S. aureus (Lai et al., 2011). Также без добавления пермеабилизаторов проявляет свой антимикробный эффект эндолизин Р28 в концентрации 500 мкг/мл, его спектр действия охватывает Bacillus subtilis, Bacillus cereus, Klebsiella mobilis, Shigella flexneri, Xanthomonas campestris и Staphylococcus aureus (Dong et al., 2015). Другие примеры включают в себя LysPA26, способный уничтожать клетки Pseudomonas aeruginosa, Klebsiella pneumonia, Acinetobacter baumannii и Escherichia coli в концентрации 500 мкг/мл (Guo et al., 2017), PlyAB1 с узким спектром действия против A. baumannii (Huang et al., 2014) и другие.
Таким образом, в настоящее время проводится множество исследований эндолизинов, чей эффект направлен против широких панелей штаммов грамотрицательных бактерий с лекарственной устойчивостью, в том числе и множественной. Это подтверждает актуальность данного направления исследований.
Техническая проблема
Техническая проблема состоит в необходимости расширения арсенала антибактериальных средств в отношении грамотрицательных бактерий, в том числе с множественной лекарственной устойчивостью.
Сущность изобретения
Данное изобретение представляет собой рекомбинантный белок LysAp22 (аминокислотная последовательность SEQ ID NO: 3 а также последовательности, которые по меньшей мере на 90% ей идентичны, и последовательность нуклеотидов SEQ ID NO: 4, а также последовательности, которые по меньшей мере на 80% ей идентичны), представляющий собой модифицированный 8-гистидиновой меткой рекомбинантный эндолизин бактериофага AP22 (аминокислотная последовательность SEQ ID NO: 1 и последовательность нуклеотидов SEQ ID NO: 2, а также последовательности, которые по меньшей мере на 90% им идентичны). Он обладает широким спектром действия, проявляя антибактериальную активность в отношении Pseudomonas aeruginosa, Acinetobacter baumannii, Klebsiella pneumoniae, Escherichia coli, Salmonella typhi и других видов бактерий.
Рекомбинантный эндолизин LysAp22 способен без добавления дополнительных увеличивающих проницаемость мембран компонентов проникать через наружную мембрану и эффективно и быстро уничтожать клетки грамотрицательных бактерий различных штаммов, видов и родов. Он позволит проводить антимикробную терапию различных видов инфекций, вызванных штаммами бактерий с множественной лекарственной устойчивостью, а также избавляться от бактерий, образовавших биопленки, внутрь которых доступ существующих антибактериальных средств затруднен.
Pseudomonas aeruginosa, Acinetobacter baumannii и Klebsiella pneumoniae являются одними из самых опасных возбудителей внутрибольничных инфекций, терапия которых зачастую затруднена в связи с высокой устойчивостью данных видов бактерий к существующим лекарственным средствам, а также их способностью образовывать биопленки. Инфекции, вызываемые этими патогенами, клинически очень разнообразны, а их течение очень тяжелое, особенно в случае нозокомиального происхождения, когда иммунитет пациента сильно снижен. По различным оценкам, внутрибольничные инфекции поражают 5-10% пациентов, находящихся в стационаре. Ежегодно в России число зафиксированных случаев внутрибольничных инфекций составляет порядка 2,5 млн.
Escherichia coli является представителем нормальной микрофлоры организма, но среди них есть и патогенные разновидности, которые морфологически не отличаются от непатогенных и вызывают эшерихиозы, чаще всего сопровождающиеся интоксикацией, лихорадкой и поражением желудочно-кишечного тракта. Заражение чаще всего происходит через загрязненную воду или пищу. E. coli также зачастую может развивать множественную устойчивость.
Различные представители рода Salmonella патогенны для человека и вызывают сальмонеллез, причем в последние годы заболеваемость сальмонеллезом сильно возросла, даже в развитых странах, так как данные бактерии активно развивают устойчивость к используемым антибиотикам. Также они могут вызывать внутрибольничные заболевания с тяжелым течением.
Сложность терапии и высокая летальность говорят о высокой актуальности внедрения в практику новых эффективных методов лечения инфекций, вызванных грамотрицательными патогенами.
Эндолизин LysAp22 в чистом виде, а также в комбинациях с различными средствами, увеличивающими проницаемость мембран, антимикробными пептидами и антимикробными средствами (в том числе антибиотиками) можно использовать в различных областях медицины, ветеринарии, сельском хозяйстве и пищевой промышленности.
Данные изобретения могут использоваться в виде подходящих лекарственных форм (раствор, аэрозоль, мазь и др.) для лечения и профилактики различных видов инфекций, вызванных чувствительными к действию эндолизина грамотрицательными бактериями. К таким инфекциям относятся эндокардит, респираторные инфекции (пневмонии), инфекции центральной нервной системы (менингит и абсцессы головного мозга), ушные и глазные инфекции (например, отит и кератит), бактериемия, инфекции кожных структур и мягких тканей (в том числе раневые и ожоговые), инфекции костей и суставов, инфекции мочевыводящих путей, инфекции желудочно-кишечного тракта и другие. Также возможно использование препаратов на основе LysAp22 для лечения пневмоний, сопутствующих муковисцидозу. При введении препарата, содержащего эффективную дозу активного вещества, местно, ингаляционно, внутримышечно, подкожно или внутривенно можно ожидать благоприятный исход течения инфекционного заболевания и быструю элиминацию патогенов.
Также LysAp22 можно использовать для быстрой и точной диагностики с целью определения возбудителя инфекции и своевременного начала терапии, а также для определения чувствительности различных штаммов бактерии к данным ферментам. Возможно создание различных систем детекции и биосенсоров на их основе.
Одной из наиболее важных проблем в медицине является образование грамотрицательными патогенами биопленок на различных поверхностях (в том числе медицинских инструментов). Бактерии внутри биопленок значительно меньше подвержены воздействию антимикробных средств и дезинфектантов. LysAp22 в виде раствора или любых других подходящих форм можно использовать для устранения биопленок, а также для дезинфекции инструментов (особенно используемых при различных хирургических манипуляциях), материалов, аппаратуры (в том числе аппаратов для искусственной вентиляции легких) и поверхностей.
В ветеринарии и сельском хозяйстве LysAp22 также можно использовать для лечения и профилактики инфекций животных, вызываемых чувствительными грамотрицательными бактериями.
В пищевой промышленности LysAp22 можно использовать для предотвращения контаминации воды и пищевых продуктов чувствительными грамотрицательными бактериями, а также для удаления биопленок и дезинфекции различных поверхностей.
В этом случае технический результат достигается использованием антибактериальной композиции, которая содержит эффективное количество (дозу) рекомбинантного белка LysAp22 и фармацевтически приемлемый носитель.
Технический результат достигается также использованием антибактериальной композиции, содержащей эффективное количество эндолизина LysAp22, пермеабилизатор и фармацевтически приемлемый носитель. В качестве пермеабилизаторов могут использоваться полимиксины и их производные, аминогликозиды, этилендиаминтетрауксусная кислота и ее соли (ЭДТА), лимонная кислота и др.
Термин «фармацевтически приемлемый носитель» включает любые и все растворители, добавки, эксципиенты вспомогательные вещества, дисперсионные среды, солюбилизирующие агенты, покрытия, консерванты, изотонические и абсорбционные агенты, поверхностно-активные вещества, пропелленты и тому подобное, которые являются фармацевтически совместимыми. Носитель (и) должен быть «приемлемым» в плане безвредности для субъекта, которому вводят препарат на основе объектов формулы изобретения в количествах, обычно используемых в лекарственных препаратах. Фармацевтически приемлемые носители совместимы с другими ингредиентами композиции без превращения композиции в непригодную для применения по назначению. Кроме того, фармацевтически приемлемые носители пригодны для использования без проявления серьезных нежелательных реакций (таких как токсичность, раздражение и аллергическая реакция). Побочные эффекты «неоправданы», когда их риск их появления превышает преимущество от применения композиции. Неограничивающие примеры фармацевтически приемлемых носителей или эксципиентов вспомогательных веществ включают в себя любой из стандартных фармацевтических носителей, таких как солевые растворы, вода и эмульсии, такие как эмульсии масло / вода и микроэмульсии.
Термин «эффективное количество» относится к количеству, которое при применении или назначении с соответствующей частотой приема или в определенном режиме дозирования является достаточным для предотвращения или ингибирования роста бактерий или предотвращения развития, улучшения течения, уменьшения тяжести, продолжительности или прогрессирования инфекционного заболевания, вызывает регрессию заболевания или усиливает или улучшает профилактический или терапевтический эффект другого метода лечения, такого как антимикробная терапия.
Термин «биопленка» относится к бактериям, которые прикрепляются к поверхностям и погружены в выделяемый ими внеклеточный матрикс. Биопленка представляет собой совокупность микроорганизмов, где клетки прилипают друг к другу на какой-либо поверхности. Эти адгезивные клетки часто погружены во внеклеточный матрикс из полимерного вещества. Биопленка представляет собой полимерную конгломерацию, обычно состоящую из внеклеточной ДНК, белков и полисахаридов.
Иллюстрации, поясняющие сущность изобретения
На иллюстрациях приведены поясняющие графические материалы, раскрывающие сущность изобретения. Указанные материалы не ограничивают объем притязаний заявителя и должны использоваться для пояснения существа заявленного технического решения.
На фиг. 1 приведен график, отображающий бактерицидную активность различных концентраций LysAp22 против штамма A. baumannii Ts 50-16. В качестве контроля использовали клетки бактерий, инкубированные с буфером вместо белка. Число выживших колоний после 18 часов инкубации чашек Петри выражено в виде снижения log10 КОЕ/мл по сравнению с контролем. Для всех экспериментов показаны средние значения по стандартным отклонением после трех независимых экспериментов. Звездочка (*) обозначает значимый бактерицидный эффект.
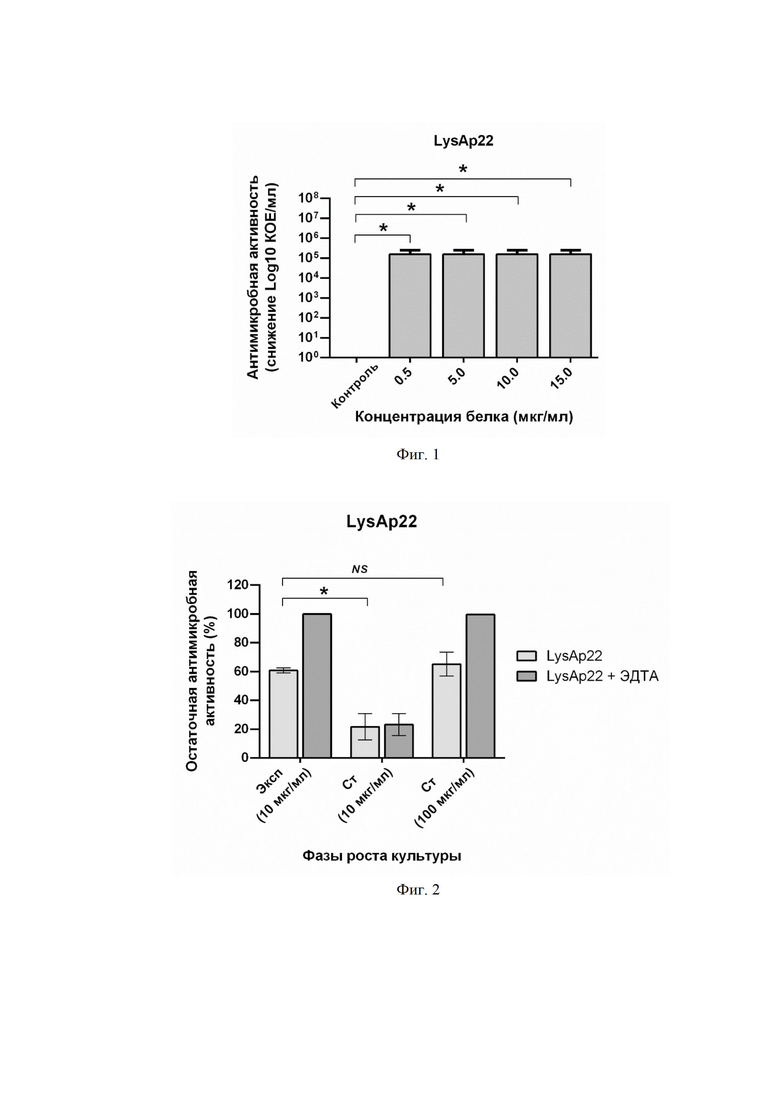
На фиг. 2 приведен график сравнения активности эндолизина LysAp22 в концентрациях 10 и 100 мкг/мл против штамма A. baumannii Ts 50-16 в экспоненциальной (Эксп) и стационарной (Ст) фазах роста без добавления и с добавлением 0,5 мМ ЭДТА. Приведена остаточная активность фермента (%) по сравнению с контролем. NS - нет статистически достоверного отличия от контрольной культуры без добавления эндолизина (p > 0,05, критерий Манна-Уитни). Для всех экспериментов показаны средние значения по стандартным отклонением после трех независимых экспериментов. Звездочка (*) обозначает значимый бактерицидный эффект.
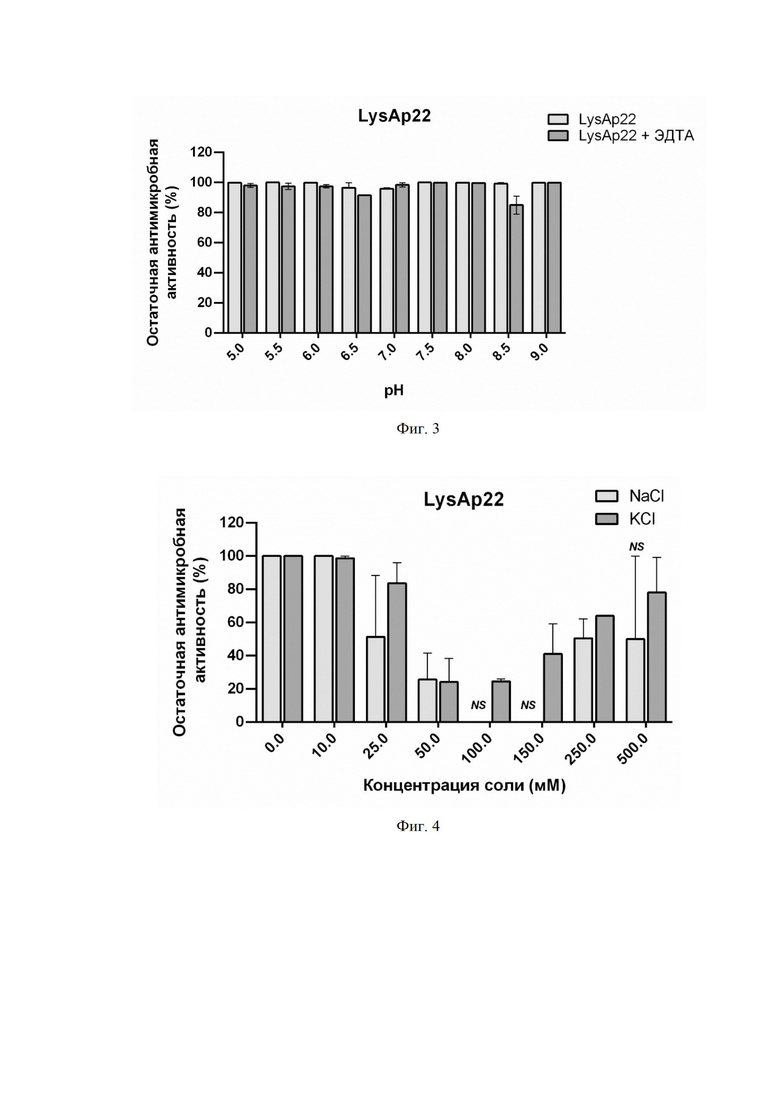
На фиг. 3 приведен график, отображающий влияние pH и 0,5 мМ ЭДТА на антимикробную активность LysAp22 в концентрации 1 мкг/мл против A. baumannii Ts 50-16. Приведена остаточная активность фермента (%) по сравнению с контролем. NS - нет статистически достоверного отличия от контрольной культуры без добавления эндолизина (p > 0,05, критерий Манна-Уитни). Для всех экспериментов показаны средние значения по стандартным отклонением после трех независимых экспериментов.
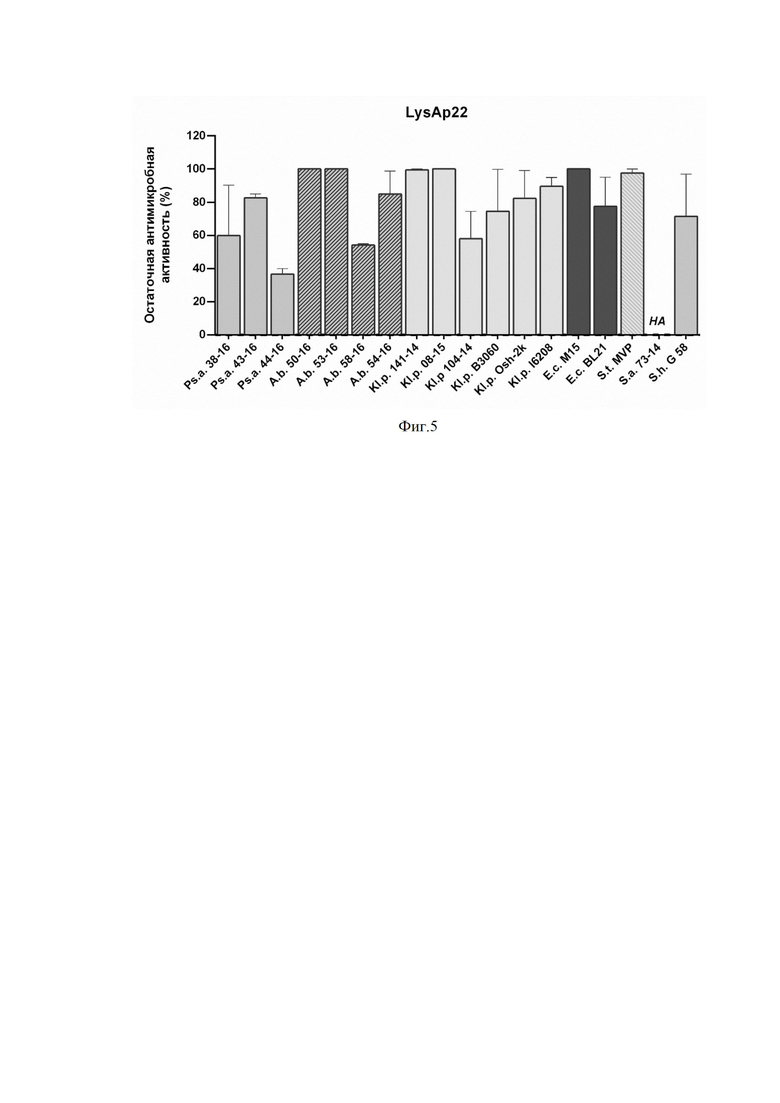
На фиг. 4 приведен график влияния солей на литическую активность LysAp22 в концентрации 10 мкг/мл против A. baumannii Ts 50-16. Приведена остаточная активность фермента (%) по сравнению с контролем. NS - нет статистически достоверного отличия от контрольной культуры без добавления эндолизина (p > 0,05, критерий Манна-Уитни). Все остальные значения статистически достоверно отличаются от контроля. Для всех экспериментов показаны средние значения по стандартным отклонением после трех независимых экспериментов.
На фиг. 5 приведен график, отображающий бактерицидную активность LysAp22 в концентрации 50 мкг/мл против различных штаммов грамотрицательных и грамположительных бактерий. Приведена остаточная активность фермента (%) по сравнению с контролем. НА - не было отмечено бактерицидной активности. Все значения статистически достоверно отличаются от контрольной культуры без добавления эндолизина (p < 0,05, критерий Манна-Уитни). Для всех экспериментов показаны средние значения по стандартным отклонением после трех независимых экспериментов.
Далее приведены аминокислотные и нуклеотидные последовательности: первая из которых аминокислотная последовательность эндолизина бактериофага AP22 (SEQ ID NO: 1); вторая - нуклеотидная последовательность эндолизина бактериофага AP22 (SEQ ID NO: 2); третья - аминокислотная последовательность эндолизина LysAp22, модифицированного 8-гистидиновой меткой (SEQ ID NO: 3); четвертая - нуклеотидная последовательность эндолизина LysAp22, модифицированного 8-гистидиновой меткой (SEQ ID NO: 4).
Сведения, подтверждающие возможность осуществления изобретения
Белок LysAp22 (аминокислотная последовательность SEQ ID NO: 3 и последовательность нуклеотидов SEQ ID NO: 4) был получен рекомбинантным путем и содержит в одной рамке трансляции гистидиновую метку (8 His). Данный фермент представляет собой модифицированный 8-гистидиновой меткой рекомбинантный эндолизин бактериофага AP22 (аминокислотная последовательность SEQ ID NO: 1 и последовательность нуклеотидов SEQ ID NO: 2) семейства Myoviridae, поражающего клетки Acinetobacter baumannii. Предсказано, что LysAp22 (белок размером 21,4 кДа) в своей структуре содержит лизоцим-подобный каталитический (мурамидазный), что и обеспечивает бактерицидную активность по отношению к клеточным стенкам бактерий.
Что касается антимикробных свойств, было показано, что LysAp22 оказывает бактерицидное действие на экспоненциально растущие клетки клинического штамма A. baumannii Ts 50-16 в концентрации от 0,5 мкг/мл в 20 мM Tрис HCl буфере (pH 7.5). График дозозависимого эффекта приведен на фиг. 1.
При действии LysAp22 на бактерии в стационарной фазе роста бактерицидный эффект в концентрации белка 10 мкг/мл и 100 мкг/мл сильно снижается, предположительно, из-за перестройки бактериальной клеточной стенки и отсутствия эффективной пермеабилизации мембраны. При этом добавление веществ, увеличивающих проницаемость мембран (0,5 мМ ЭДТА), способствует проявлению литического эффекта, однако, он восстанавливается лишь при высоких концентрациях фермента (100 мкг/мл) (фиг. 2).
Анализ in vitro антибактериальной активности при различных значениях рН (от 5,0 до 9,0) показал, что в буфере Tрис HCl наиболее оптимальными значениями являются слабокислые (5,0-6,0), а также нейтральные и слабощелочные (7,5-8,0). Однако, при рН 6,5-7,0 наблюдается некоторое снижение активности (примерно на 10%), что, предположительно, связано с изменением заряда С-конца белка, отвечающего за эффективную пермеабилизацию. Добавление 0,5 мМ ЭДТА устраняет различия в эффективности и элиминирует эффект рН, что подтверждает предположение о влиянии заряда белка на способность проникать через наружную мембрану (фиг. 3).
5 мМ калий фосфатный буфер (pH 7.5) является отличной заменой буферу, содержащему Трис, т.к. он более физиологичен по своему составу. Добавляя к LysAp22 в этом буфере различные концентрации солей щелочных металлов (NaCl и KCl), мы оценивали их влияние на бактерицидную активность. Было показано, что, начиная с концентрации 25 мМ для NaCl и 50 мМ для KCl, наблюдается ингибирование действия фермента. Хотя в концентрации 250-500 мМ для обеих солей литический эффект частично восстанавливается (фиг. 4).
Широта спектра действия оценивалась на 16 штаммах грамотрицательных бактерий различных родов и видов и 2 штаммах грамположительных бактерий различного происхождения: клинические изоляты и лабораторные штаммы (Таблица 1). Было показано, что LysAp22 оказывает различный по силе бактерицидный эффект по отношению ко всем изученным штаммам, кроме грамположительного Staphylococcus aureus Z 73-14 (фиг. 5).
Таблица 1. Спектр антимикробной активности LysAp22 против грамотрицательных бактерий. + наличие эффекта, - отсутствие эффекта.
Таким образом, эндолизин LysAp22 без добавления различных пермеабилизаторов или ковалентно связанных пенетрирующих пептидов способен проникать через наружную мембрану грамотрицательных бактерий и расщеплять пептидогликан, что в конечном итоге приводит к гибели бактерий. Значительное снижение количества колоний, выросших на чашках Петри, после инкубации бактерий и белка в течение небольшого количества времени, говорит о высокой активности LysAp22. Таким образом, данный эндолизин является перспективной молекулой для борьбы с патогенами группы ESKAPE.
Пример 1. Получение штамма бактериофага Acinetobacter baumannii АP22 и его лизата.
Для получения штамма бактериофага Acinetobacter baumannii АP22, активного в отношении Acinetobacter baumannii, бактериальную культуру штамма-хозяина в титре 108 КОЕ/мл засевали в сосуд для культивирования на скошенную плотную питательную среду с толщиной слоя от 10 мм до 25 мм.
Штамм-хозяин культивировали в течение 3 часов при оптимальной температуре для его роста (37 C), затем на полученный газон культуры Acinetobacter baumannii засевали маточный бактериофаг в титре 106 БОЕ/мл, герметично закрывали сосуд для культивирования (стеклянный микробиологический матрац) и культивировали бактериофаг в течение 13 часов при оптимальной температуре 37°C и толщине слоя воздуха над поверхностью плотной питательной среды от 25 мм до 40 мм.
Для получения фаголизата бактериофаг суспендировали с поверхности плотной питательной среды физиологическим раствором в количестве 0,04 мл на 1 см2 поверхности плотной питательной среды. Полученную жидкость отсасывали в стерильную емкость, добавляли хлороформ и выдерживали в течение 30 мин при непрерывной аэрации. Далее центрифугировали раствор в течение 30 мин при 6000 об/мин, стерилизовали надосадочную жидкость фильтрацией через фильтр с диаметром пор 0,2 мкм и пропускали полученный фильтрат через колонку, содержащую агент, аффинный к эндотоксину.
Полученный элюат представлял собой очищенный фаголизат и содержал бактериофаги в титре 1011 БОЕ/мл при отсутствии бактерий, ингредиентов использованной питательной среды и при концентрации эндотоксина менее 50 единиц эндотоксина на 1 мл очищенного фаголизата (ЕЭ/мл).
Пример 2. Получение экспрессионного вектора, несущего кодирующую последовательность LysAp22.
Кодирующую последовательность эндолизина LysAp22 получали методом ПЦР-амплификации с помощью ген-специфичных праймеров (Таблица 2) из лизата бактериофагов. Полученную нуклеотидную последовательность поместили в экспрессионную кассету pET42b (+). Корректность сборки векторной конструкций проверяли методом секвенирования по Сэнгеру. Для очистки рекомбинантного продукта с помощью аффинной хроматографии, кодирующая последовательность LysAp22 была слита с последовательностью, кодирующей 8-гистидиновую метку на С-конце.
Таблица 2. Последовательности праймеров, используемых для получения кодирующей последовательности LysAp22.
Таким образом, была получена генно-инженерная конструкция на основе вектора pET42b (+), кодирующая последовательность LysAp22, для дальнейшей экспрессии рекомбинантного фермента.
Пример 3. Получение рекомбинантного белка LysAp22 и его очистка.
Экспрессионный вектор помещали в компетентные клетки E. coli штамма BL21(DE3) pLysS с помощью протокола трансформации по методу «heat shock».
Клетки E. coli подращивали в среде LB (37°C, 240 rpm) до OD600 = 0,55-0,65 и проводили индукцию с помощью 1 мM ИПТГ при 37°C в течение 3 часов. Полученные клетки осаждали центрифугированием (6000 g, 10 мин, при 4°C), ресуспендировали в буфере, содержащем 20 мM Трис HCl pH 8,0, 250 мM NaCl, 0,1 мM ЭДТА), инкубировали с 100 мкл/мл лизоцима при комнатной температуре в течение 30 мин, а затем разрушали с помощью обработки ультразвуком. Полученный лизат центрифугировали при 10000 g в течение 30 мин при 4°C, а затем супернатант фильтровали через фильтр с размером пор 0.2 мкм. Очитка проводилась на хроматографе NGC Discovery™ 10 (Bio-Rad, США) с использованием колонки HisTrap FF на 5 мл (GE Healthcare, Германия), заряженной Ni2+ ионами. Лизат смешивали с 30 мM имидазола и 1 мM MgCl2 и наносили на колонку, предварительно уравновешенную с помощью буфера, содержащего 20 мM Трис HCl pH 8,0, 250 мM NaCl, 30 мM имидазола. Фракции белка элюировали с сорбента с помощью линейного градиента до 100% буфера, содержащего 20 мM Tрис HCl pH 8,0, 250 мM NaCl, 500 мM имидазола. Собранные фракции диализовали против буфера 20 мM Tрис HCl pH 7,5. Чистоту белка определяли с помощью электрофореза 16% SDS-PAGE.
Концентрацию белка определяли спектрофотометрически при длине волны 280 нм (Implen NanoPhotometer, IMPLEN, Германия). Концентрация рассчитывалась с учетом коэффициента поглощения E0,1%280нм.
Таким образом, рекомбинантный эндолизин LysAp22 был получен биотехнологическим путем и подготовлен для дальнейших экспериментов по оценке бактерицидной активности.
Пример 4. Изучение антибактериальных свойств LysAp22.
Ночную культуру бактериальных клеток (OD600 = 1,2-1,4) использовали в качестве культуры бактерий в стационарной фазе роста или разбавляли в 30 раз средой LB и подращивали до экспоненциальной фазы роста (OD600 = 0,6). Клетки осаждали центрифугированием (3000 g, 10 мин) и ресуспендировали в таком же объеме 20 мM Tрис HCl pH 7,5. Суспензию разводили в 100 раз в том же буфере до конечной плотности около 106 клеток/мл. После 100 мкл бактериальной суспензии смешивали со 100 мкл белка в требуемой концентрации в 96-луночном планшете. В качестве отрицательного контроля использовали буфер без добавления белка. Смесь инкубировали при 37°C в течение 30 мин (на качалке 200 rpm) и затем разбавляли в 10 раз фосфатно-солевым буфером (pH 7,4). 100 мкл каждого разведения наносили на чашки Петри с агаризованной средой LB. Колонии на чашках подсчитывали после ночной инкубации (18 часов) при 37°С. Все эксперименты проводились в трех независимых повторностях.
Антибактериальную активность выражали в виде log10 от числа колоний, либо в виде остаточной активности LysAp22 (%) по сравнению с контролем без добавления фермента.
В ходе экспериментов по изучению антимикробных свойств LysAp22 было выявлено, что фермент оказывает бактерицидное действие на экспоненциально растущие клетки клинического штамма A. baumannii Ts 50-16 в концентрации от 0,5 мкг/мл (фиг.1). Однако при действии на бактерии в стационарной фазе роста бактерицидный эффект значительно снижается, предположительно, из-за снижения способности белка проникать сквозь наружную мембрану. При этом при добавлении веществ, увеличивающих проницаемость мембран, (0,5 мМ ЭДТА) литический эффект частично восстанавливается (фиг.2).
Пример 5. Изучения влияния рН, солей и буферов на активность LysAp22.
Влияние рН, солей и буферов (Трис HCl pH 7,5 и натрий или калий фосфатный буфер pH 7,5) на специфическую активность эндолизина оценивали на экспоненциально растущем штамме A. baumannii Ts 50-16. Для изучения влияния рН бактерии инкубировали с белком по вышеуказанному протоколу (Пример 3) в 20 мM Tрис HCl буфере с различными значениями рН (от 5.0 до 9.0). Эффект ЭДТА на бактерицидную активность при различных значениях pH оценивали с добавлением 0,5 мM пермеабилизатора во время инкубации бактериальной суспензии с эндолизином. При подборе оптимального для действия физиологичного буфера изучали 5, 10, 50 мM натрий или калий фосфатный буферы (pH 7,5). А для оценки влияния солей щелочных металлов к белку в 5 мM калий фосфатном буфере (pH 7,5) добавляли различные концентрации солей NaCl или KCl (0, 10, 25, 50, 100, 150, 250 и 500 мM).
Антибактериальную активность выражали в виде остаточной активности LysAp22 (%) по сравнению с контролем без добавления фермента.
Было показано, что при различных значениях рН оптимальными для действия фермента являются слабокислые, а также нейтральные и слабощелочные условия. При рН 6,5-7,0 наблюдается некоторое снижение активности, однако добавление 0,5 мМ ЭДТА элиминирует эффект рН (фиг.3).
Более физиологичным является 5 мМ калий фосфатный буфер (pH 7.5). При добавлении к LysAp22 в этом буфере различных концентраций NaCl и KCl начиная с 25 мМ для NaCl и 50 мМ для KCl, наблюдалось ингибирование действия фермента. Хотя в концентрации 250-500 мМ для обеих солей литический эффект частично восстанавливается (фиг.4).
Пример 6. Изучения спектра активности LysAp22.
Спектр активности фермента изучали по вышеуказанному протоколу в буфере 20 мM Tрис HCl (Пример 3) с использованием 16 штаммов грамотрицательных бактерий различных родов и видов и 2 штаммов грамположительных бактерий. Все использованные штаммы депонированы в коллекциях ФГБУ «Национальный исследовательский центр эпидемиологии и микробиологии имени почетного академика Н. Ф. Гамалеи» и Государственной коллекции патогенных микроорганизмов и клеточных культур (ГКПМ-Оболенск).
Таблица 3. Использованные в исследовании бактериальные штаммы и клинические изоляты и их источник получения.
Антибактериальную активность выражали в виде остаточной активности LysAp22 (%) по сравнению с контролем без добавления фермента.
Было показано, что LysAp22 оказывает бактерицидный эффект по отношению ко всем изученным штаммам, кроме грамположительного Staphylococcus aureus Z 73-14 (фиг.5).
На фигуре 1 показана бактерицидная активность различных концентраций LysAp22 против штамма A. baumannii Ts 50-16. В качестве контроля использовали клетки бактерий, инкубированные с буфером вместо белка. Число выживших колоний после 18 часов инкубации чашек Петри выражено в виде снижения log10 КОЕ/мл по сравнению с контролем. Для всех экспериментов показаны средние значения по стандартным отклонениям после трех независимых экспериментов. Звездочка (*) обозначает значимый бактерицидный эффект.
На фигуре 2 показана бактерицидная активность эндолизина LysAp22 в концентрациях 10 и 100 мкг/мл против штамма A. baumannii Ts 50-16 в экспоненциальной (Эксп) и стационарной (Ст) фазах роста без добавления и с добавлением 0,5 мМ ЭДТА. Приведена остаточная активность фермента (%) по сравнению с контролем. NS - нет статистически достоверного отличия от контрольной культуры без добавления эндолизина (p > 0,05, критерий Манна-Уитни). Для всех экспериментов показаны средние значения по стандартным отклонениям после трех независимых экспериментов. Звездочка (*) обозначает значимый бактерицидный эффект.
На фигуре 3 показано влияние pH и 0,5 мМ ЭДТА на антимикробную активность LysAp22 в концентрации 1 мкг/мл против A. baumannii Ts 50-16. Приведена остаточная активность фермента (%) по сравнению с контролем. NS - нет статистически достоверного отличия от контрольной культуры без добавления эндолизина (p > 0,05, критерий Манна-Уитни). Для всех экспериментов показаны средние значения по стандартным отклонениям после трех независимых экспериментов.
На фигуре 4 показано влияние солей на литическую активность LysAp22 в концентрации 10 мкг/мл против A. baumannii Ts 50-16. Приведена остаточная активность фермента (%) по сравнению с контролем. NS - нет статистически достоверного отличия от контрольной культуры без добавления эндолизина (p > 0,05, критерий Манна-Уитни). Все остальные значения статистически достоверно отличаются от контроля. Для всех экспериментов показаны средние значения по стандартным отклонениям после трех независимых экспериментов.
На фигуре 2 показана бактерицидная активность LysAp22 в концентрации 50 мкг/мл против различных штаммов грамотрицательных и грамположительных бактерий. Приведена остаточная активность фермента (%) по сравнению с контролем. НА - не было отмечено бактерицидной активности. Все значения статистически достоверно отличаются от контрольной культуры без добавления эндолизина (p < 0,05, критерий Манна-Уитни). Для всех экспериментов показаны средние значения по стандартным отклонениям после трех независимых экспериментов.
Список литературы
Abdelkader K. et al. The Preclinical and Clinical Progress of Bacteriophages and Their Lytic Enzymes: The Parts are Easier than the Whole // Viruses. - 2019. - Vol.11. - P.96.
Briers Y, Walmagh M, Lavigne R. Use of bacteriophage endolysin EL188 and outer membrane permeabilizers against Pseudomonas aeruginosa // J. Appl. Microbiol. - 2011. - Vol.110, №3. - P.778-785.
Briers Y. et al. Art-175 is a highly efficient antibacterial against multidrug-resistant strains and persisters of Pseudomonas aeruginosa // Antimicrob. Agents Chemother. - 2014. - Vol.58, №7. - P.3774-3784.
Briers Y. et al. Engineered endolysin-based “Artilysins” to combat multidrug-resistant gram-negative pathogens // mBio. - 2014. - Vol.5, №4. - e01379-14.
Dong H. et al. Activity of Stenotrophomonas maltophilia Endolysin P28 against both Gram-Positive and Gram-Negative Bacteria // Front Microbiol. - 2015. - Vol.6. - P.1299.
Fischetti V.A. Bacteriophage endolysins: A novel anti-infective to control Gram-positive pathogens // Int. J. Med. Microbiol. - 2010. - Vol.300, №6. - P.357-362.
Guo M. et al. A Novel Antimicrobial Endolysin, LysPA26, against Pseudomonas aeruginosa // Front Microbiol. - 2017. - Vol.8. - P.293.
Huang G. et al. Antibacterial properties of Acinetobacter baumannii phage Abp1 endolysin (PlyAB1) // BMC Infectious Diseases. - 2014. - Vol.14. - P.681.
Lai M.-J. et al. Antibacterial activity of Acinetobacter baumannii phage 6AB2 endolysin (LysAB2) against both Gram-positive and Gram-negative bacteria // Appl Microbiol Biotechnol. - 2011. - Vol.90. - P.529-539.
Larpin Y. et al. In vitro characterization of PlyE146, a novel phage lysin that targets Gram-negative bacteria // PLoS ONE. - 2018. - Vol.13, №2. - e0192507.
Matsuzaki S. et al. Bacteriophage therapy: a revitalized therapy against bacterial infectious diseases // J Infect Chemother. - 2005. - Vol.11. - P.211-219.
Oliveira H. et al. Phage-Derived Peptidoglycan Degrading Enzymes: Challenges and Future Prospects for In Vivo Therapy // Viruses. - 2018. - Vol.10. - P.292.
Prestinaci F., Pezzotti P., Pantosti A. Antimicrobial resistance: a global multifaceted phenomenon // Pathog. Glob. Health. - 2015. - Vol.109, №7. - P.309-318.
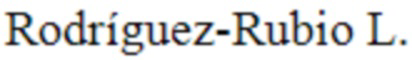 et al. Phage lytic proteins: biotechnological applications beyond clinical antimicrobials // Crit. Rev. Biotechnol. - 2016. - Vol.36, №10. - P.542-552.
et al. Phage lytic proteins: biotechnological applications beyond clinical antimicrobials // Crit. Rev. Biotechnol. - 2016. - Vol.36, №10. - P.542-552.
World Health Organization. Global priority list of antibiotic-resistant bacteria to guide research, discovery, and development of new antibiotics. - Geneva: WHO, 2017. - 7p.
Международный патент № 2011134998 A1, 03.11.2011.
Международный патент № 2015071437 A1, 21.05.2015.
Патент РФ № 2112800, 29.03.1996.
Патент РФ № 2113476, 29.03.1996.
Патент РФ № 2412243, 16.06.2009.
Патент РФ № 2439151, 24.06.2010.
Патент РФ № 2455355, 19.04.2011.
Патент РФ № 2455355, 29.04.2011.
Патент РФ № 2518303, 29.06.2012.
Патент РФ № 2628312, 16.03.2015.
Патент РФ № 2662985, 28.12.2015.
Патент США № 20160281074 A1, 29.09.2016.
Патент США № 8846865 B2, 30.09.2014.
Патент США № 8846865 B2, 30.09.2014.
--->
Перечень последовательностей
DGVGVWTIGI GTTIYPNGTK VKKGDTCTSE QAKTYFKHDL VKFENVVNES VKVPLSQNQF 120
DALVSLTYNI GSGAFKNSTL LKLLNNGDYQ GAADQFPAWK KAGGRVLEGL VKRRAAERSL 180
FLKK 184
GCACAAGTTG ACGATCTAAA CAAAGTGATT GATCGACTTT CACCTTCTGG AATGACCACA 120
AGTGATACTG GCATCAATCT AATTTCTACT TTTGAAGGAA CTAGATTAAC TGCATATGAT 180
GATGGTGTTG GCGTGTGGAC TATCGGCATA GGTACAACCA TCTACCCAAA TGGTACAAAA 240
GTTAAGAAAG GCGATACATG TACATCTGAA CAAGCAAAAA CCTACTTCAA ACATGATTTA 300
GTTAAGTTTG AAAATGTTGT AAATGAATCC GTTAAAGTTC CACTTAGTCA GAATCAATTT 360
GATGCTCTAG TGTCACTGAC CTACAACATC GGCTCAGGTG CTTTTAAAAA TTCAACTTTA 420
CTCAAGCTTC TTAACAATGG CGATTATCAA GGTGCTGCCG ATCAATTCCC AGCATGGAAA 480
AAAGCTGGTG GTCGAGTTCT TGAAGGTTTA GTTAAGCGCC GTGCTGCTGA AAGAAGTTTA 540
TTTCTAAAGA AGTAA 555
DGVGVWTIGI GTTIYPNGTK VKKGDTCTSE QAKTYFKHDL VKFENVVNES VKVPLSQNQF 120
DALVSLTYNI GSGAFKNSTL LKLLNNGDYQ GAADQFPAWK KAGGRVLEGL VKRRAAERSL 180
FLKKLEHHHH HHHH 194
GCACAAGTTG ACGATCTAAA CAAAGTGATT GATCGACTTT CACCTTCTGG AATGACCACA 120
AGTGATACTG GCATCAATCT AATTTCTACT TTTGAAGGAA CTAGATTAAC TGCATATGAT 180
GATGGTGTTG GCGTGTGGAC TATCGGCATA GGTACAACCA TCTACCCAAA TGGTACAAAA 240
GTTAAGAAAG GCGATACATG TACATCTGAA CAAGCAAAAA CCTACTTCAA ACATGATTTA 300
GTTAAGTTTG AAAATGTTGT AAATGAATCC GTTAAAGTTC CACTTAGTCA GAATCAATTT 360
GATGCTCTAG TGTCACTGAC CTACAACATC GGCTCAGGTG CTTTTAAAAA TTCAACTTTA 420
CTCAAGCTTC TTAACAATGG CGATTATCAA GGTGCTGCCG ATCAATTCCC AGCATGGAAA 480
AAAGCTGGTG GTCGAGTTCT TGAAGGTTTA GTTAAGCGCC GTGCTGCTGA AAGAAGTTTA 540
TTTCTAAAGA AGCTCGAGCA CCACCACCAC CACCACCACC ACTAA 585
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| Антибактериальная композиция (варианты) и применение белка в качестве антимикробного средства, направленного против грамотрицательных бактерий: Pseudomonas aeruginosa, Acinetobacter baumannii, Klebsiella pneumoniae и Salmonella typhi (варианты) | 2019 |
|
RU2730615C1 |
| Антибактериальная композиция (варианты) и применение белка в качестве антимикробного средства, направленного против бактерий Acinetobacter baumannii, (варианты) | 2019 |
|
RU2730616C1 |
| Антибактериальная композиция (варианты) и применение белка в качестве антимикробного средства, направленного против бактерий Pseudomonas aeruginosa, Klebsiella pneumoniae, Escherichia coli, Salmonella typhi и Staphylococcus haemolyticus (варианты) | 2019 |
|
RU2730613C1 |
| Модифицированный эндолизин и антибактериальные композиции на его основе для лечения инфекций, вызванных бактериями Acinetobacter baumannii, Pseudomonas aeruginosa, Klebsiella pneumoniae, Escherichia coli | 2023 |
|
RU2813626C1 |
| БАКТЕРИЦИДНАЯ ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ДЛЯ ПАРЕНТЕРАЛЬНОГО ПРИМЕНЕНИЯ В ФОРМЕ ЛИОФИЛИЗАТА С ЭНДОЛИЗИНОМ | 2021 |
|
RU2792679C1 |
| БАКТЕРИЦИДНАЯ ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ДЛЯ МЕСТНОГО ПРИМЕНЕНИЯ В ФОРМЕ ГЕЛЯ БАКТЕРИЦИДНОГО С ЭНДОЛИЗИНОМ | 2021 |
|
RU2781050C1 |
| ШТАММ БАКТЕРИОФАГА Acinetobacter baumannii АР22 ДЛЯ ИДЕНТИФИКАЦИИ БАКТЕРИЙ Acinetobacter baumannii ПРИ БАКТЕРИОЛОГИЧЕСКОМ АНАЛИЗЕ КЛИНИЧЕСКОГО МАТЕРИАЛА И ДЛЯ ПОЛУЧЕНИЯ ПРЕПАРАТА ПРОТИВ ВНУТРИБОЛЬНИЧНЫХ A.baumannii-ИНФЕКЦИЙ | 2010 |
|
RU2439151C1 |
| ЛИТИЧЕСКИЙ ФЕРМЕНТ БАКТЕРИОФАГА И АНТИБАКТЕРИАЛЬНАЯ КОМПОЗИЦИЯ НА ЕГО ОСНОВЕ | 2018 |
|
RU2703043C1 |
| Штамм бактериофага Pseudomonas phage Ka1 для лечения и/или профилактики инфекционных заболеваний, вызываемых Pseudomonas aeruginosa | 2024 |
|
RU2831173C1 |
| БАКТЕРИОФАГИ, ФАГОВЫЕ ПЕПТИДЫ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2011 |
|
RU2614114C2 |
Изобретение относится к области биотехнологии, конкретно к терапевтическим белкам и может быть использовано в медицине в качестве антибактериального средства. Предложено использование белка рекомбинантного эндолизина бактериофага, в том числе в комбинации с фармацевтически приемлемыми носителями и/или веществами, увеличивающими проницаемость мембран, в качестве антимикробного средства, направленного против бактерий Pseudomonas aeruginosa, Klebsiella pneumoniae, Escherichia coli, Salmonella typhi и Staphylococcus haemolyticus. На основе указанного белка, в том числе слитого с 8-гистидиновой меткой, получены антибактериальные композиции. Изобретение обеспечивает эффективное проникновение эндолизина без добавления различных пермеабилизаторов или ковалентно связанных пенетрирующих пептидов через наружную мембрану указанных бактерий и расщепление пептидогликана, что в конечном итоге приводит к гибели бактерий. 4 н.п. ф-лы, 3 табл., 6 пр., 5 ил.
1. Антибактериальная композиция, обладающая антибактериальным эффектом в отношении бактерий: Pseudomonas aeruginosa, Klebsiella pneumoniae, Escherichia coli, Salmonella typhi и Staphylococcus haemolyticus, включающая эффективное количество белка SEQ ID NO: 1 или SEQ ID NO: 3 и фармацевтически приемлемый носитель.
2. Антибактериальная композиция, обладающая антибактериальным эффектом в отношении бактерий: Pseudomonas aeruginosa, Klebsiella pneumoniae, Escherichia coli, Salmonella typhi и Staphylococcus haemolyticus, включающая эффективное количество белка SEQ ID NO: 1 или SEQ ID NO: 3, фармацевтически приемлемые носители и пермеабилизаторы, выбранные из этилендиаминтетрауксусной кислоты (ЭДТА) и/или ее солей.
3. Применение белка SEQ ID NO: 1 или SEQ ID NO: 3 в качестве антимикробного средства, направленного против бактерий Pseudomonas aeruginosa, Klebsiella pneumoniae, Escherichia coli, Salmonella typhi и Staphylococcus haemolyticus в чистом виде.
4. Применение белка SEQ ID NO: 1 или SEQ ID NO: 3 в комбинации с фармацевтически приемлемыми носителями и/или веществами, увеличивающими проницаемость мембран, в качестве антимикробного средства, направленного против бактерий: Pseudomonas aeruginosa, Klebsiella pneumoniae, Escherichia coli, Salmonella typhi и Staphylococcus haemolyticus.
| Станок для раскалывания чурок на газогенераторное топливо | 1938 |
|
SU57765A1 |
| Машина для изгибания железных полос и т.п. | 1928 |
|
SU17984A1 |
| ШТАММ БАКТЕРИОФАГА Acinetobacter baumannii АР22 ДЛЯ ИДЕНТИФИКАЦИИ БАКТЕРИЙ Acinetobacter baumannii ПРИ БАКТЕРИОЛОГИЧЕСКОМ АНАЛИЗЕ КЛИНИЧЕСКОГО МАТЕРИАЛА И ДЛЯ ПОЛУЧЕНИЯ ПРЕПАРАТА ПРОТИВ ВНУТРИБОЛЬНИЧНЫХ A.baumannii-ИНФЕКЦИЙ | 2010 |
|
RU2439151C1 |
| US 8846865 B2, 30.09.2014 | |||
| КОМПОЗИЦИЯ АНТИБАКТЕРИАЛЬНАЯ ДЛЯ ПРОФИЛАКТИКИ ИЛИ ЛЕЧЕНИЯ ГОСПИТАЛЬНЫХ ИНФЕКЦИЙ (ВАРИАНТЫ), ШТАММЫ БАКТЕРИОФАГОВ, ИСПОЛЬЗУЕМЫЕ ДЛЯ ПОЛУЧЕНИЯ ТАКОЙ КОМПОЗИЦИИ | 2015 |
|
RU2628312C2 |
Авторы
Даты
2020-08-24—Публикация
2019-05-08—Подача