УРОВЕНЬ ТЕХНИКИ
[001] Применение флуоресцентных красителей в качестве меток для обнаружения нашло широкое применение в молекулярной биологии, клеточной биологии и молекулярной генетике. Например, использование флуоресцентно меченых олигонуклеотидов в настоящее время широко распространено во множестве различных анализов, включая секвенирование полинуклеотидов, флуоресцентную гибридизацию in situ (FISH), анализы гибридизации на массивах нуклеиновых кислот, исследования с помощью флуоресцентной поляризации и анализы амплификации нуклеиновых кислот, включая анализы амплификации полимеразной цепи, проводимые с флуоресцентными зондами и/или праймерами.
[002] Были описаны различные системы мультиплексного анализа, в которых используются флуоресцентные красители. Например, красители родаминового ряда были описаны для применения в системах мультиплексного анализа, таких как описанные в WO 2012/067901 для применения в анализах идентификации человека (АИЧ). К сожалению, спектральные характеристики существующих наборов красителей, включая красители родаминового ряда, ограничивают возможность разработки надежных и чувствительных систем анализа, в которых используются более 6 красителей в комбинации. Для создания таких более мультиплексных систем существует потребность в разработке новых красителей родаминового ряда, обладающих спектральными свойствами, однозначно подходящими для создания таких альтернативных мультиплексных наборов красителей.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
[003] Описаны флуоресцентные соединения, которые могут быть применены для мечения синтетических олигонуклеотидов. В целом, описан класс соединений, имеющих следующую структуру:
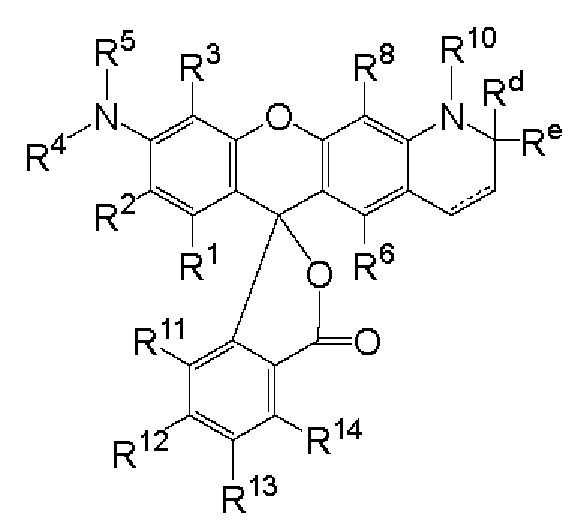
где
каждый R1, R2, R3, R6, R8, R11, R12, R13 и R14, взятый отдельно, независимо друг от друга выбран из водорода, низшего алкила, (С6-С14)-арила, (С7-С20)-арилалкила, 5-14-членного гетероарила, 6-20-членного гетероарилалкила, -Rb или -(CH2)n-Rb; или, в альтернативном варианте, R1 и R2 вместе с атомами углерода, с которыми они связаны, образуют необязательно замещенную бензогруппу;
R4 выбран из водорода, низшего алкила, (С6-С14)-арила, (С7-С20)-арилалкила, 5-14-членного гетероарила или 6-20-членного гетероарилалкила;
каждый из R5 и R10 независимо представляет собой Н или защитную группу;
причем n представляет собой целое число в диапазоне от 1 до 10;
причем каждый Ra, независимо от других, выбран из низшего алкила, (С6-С14)-арила, (С7-С20)-арилалкила, 5-14-членного гетероарила, -СХ3 и 6-20-членного гетероарилалкила;
причем Rb выбран из -X, -ОН, -ORa -SH, -SRa -NH2, -NHRa -NRcRc, -N+RcRcRcX-, низшего пергалогеналкила, тригалогенметила, трифторметила, -Р(O)(ОН)2, -P(O)(ORa)2, P(O)(OH)(ORa), -ОР(O)(ОН)2, -OP(O)(ORa)2, -OP(O)(ORa)(OH), -S(O)2OH, -S(O)2Ra, -C(O)H, -C(O)Ra, -C(S)X, -C(O)ORa, -C(O)OH, -C(O)NH2, -C(O)NHRa, -C(O)NRcRc, -C(S)NH2, -C(O)NHRa -C(O)NRcRc, -C(NH)NH2, -C(NH)NHRa и -C(NH)NRcRc;
каждый Rc, независимо от других, представляет собой Ra, или, в альтернативном варианте, два Rc, связанные с одним и тем же атомом азота, вместе с этим атомом азота могут образовывать 5-8-членное насыщенное или ненасыщенное кольцо, которое может необязательно содержать один или более одинаковых или разных циклообразующих гетероатомов, выбиранных из О, N и S;
каждый Rd и Re, взятый отдельно, независимо друг от друга, выбран из водорода, низшего алкила, (С6-С14)-арила, (С7-С20)-арилалкила, 5-14-членного гетероарила, 6-20-членного гетероарилалкила, -Rb или -(CH2)n-Rb;
X представляет собой галоген; и
n представляет собой целое число в диапазоне от 1 до 10. В приведенной выше структуре кольцо, содержащее Rd и Re, может содержать в структуре двойную связь, обозначенную пунктирной линией.
[004] В одном варианте реализации изобретения соединение имеет Формулу (I)
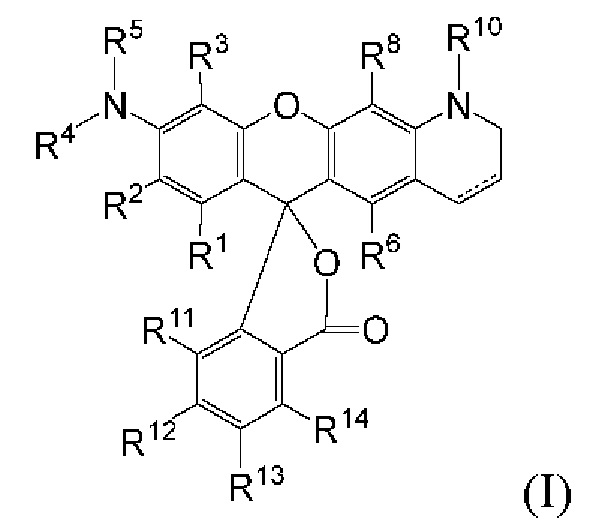
[005] где каждый R1, R2, R3, R6, R8, R11, R12, R13 и R14, взятый отдельно, независимо друг от друга выбран из водорода, низшего алкила, (С6-С14)-арила, (С7-С20)-арилалкила, 5-14-членного гетероарила, 6-20-членного гетероарилалкила, -Rb или -(CH2)n-Rb; или, в альтернативном варианте, R1 и R2 вместе с атомами углерода, с которыми они связаны, образуют необязательно замещенную бензогруппу;
[006] R4 выбран из водорода, низшего алкила, (С6-С14)-арила, (С7-С20)-арилалкила, 5-14-членного гетероарила или 6-20-членного гетероарилалкила;
[007] каждый из R5 и R10 независимо представляет собой Н или защитную группу;
[008] причем n представляет собой целое число в диапазоне от 1 до 10;
[009] причем каждый Ra, независимо от других, выбран из низшего алкила, (С6-С14)-арила, (С7-С20)-арилалкила, 5-14-членного гетероарила, -СХ3 и 6-20-членного гетероарилалкила;
[010] причем Rb выбран из -X, -ОН, -ORa -SH, -SRa -NH2, -NHRa -NRcRc, -N+RcRcRcX-, низшего пергалогеналкила, тригалогенметила, трифтормети, -Р(O)(ОН)2, -P(O)(ORa)2, P(O)(OH)(ORa), -OP(O)(OH)2, -OP(O)(ORa)2, -OP(O)(ORa)(OH), -S(O)2OH, -S(O)2Ra, -C(O)H, -C(O)Ra, -C(S)X, -C(O)ORa, -C(O)OH, -C(O)NH2, -C(O)NHRa, -C(O)NRcRc, -C(S)NH2, -C(O)NHRa -C(O)NRcRc, -C(NH)NH2, -C(NH)NHRa, and -C(NH)NRcRc;
[011] каждый Rc, независимо от других, представляет собой Ra, или, в альтернативном варианте, два Rc, связанные с одним и тем же атомом азота, вместе с этим атомом азота могут образовывать 5-8-членное насыщенное или ненасыщенное кольцо, которое может необязательно содержать один или более одинаковых или разных циклообразующих гетероатомов, выбиранных из О, N и S;
[012] каждый Rd и Re, взятый отдельно, независимо друг от друга, выбран из водорода, низшего алкила, (С6-С14)-арила, (С7-С20)-арилалкила, 5-14-членного гетероарила, 6-20-членного гетероарилалкила, -Rb или -(CH2)n-Rb;
[013] X представляет собой галоген; и
[014] n представляет собой целое число в диапазоне от 1 до 10.
[015] В другом аспекте данного раскрытия описан олигонуклеотид, содержащий фрагмент-метку, полученный взаимодействием олигонуклеотида, присоединенного к твердому носителю, с реагентом, и имеющий структуру Формулы:
LM-L-PEP
[016] где PEP представляет собой группу предшественника сложного фосфатного эфира, L представляет собой необязательный линкер, связывающий фрагмент-метку с группой PEP, и LM содержит N-защищенный NH-родаминовый фрагмент молекулы Формулы (I)
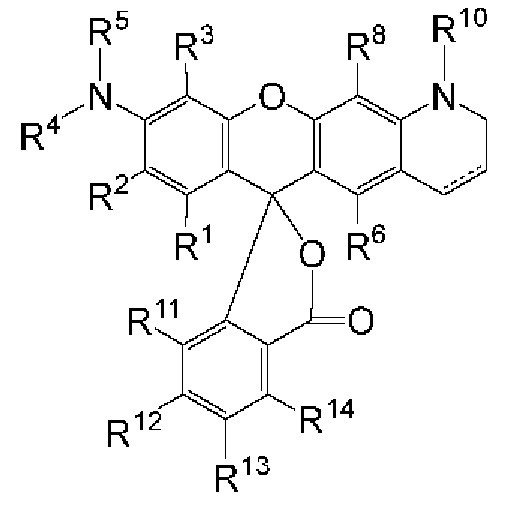
[017] где каждый R1, R2, R3, R6, R8, R11, R12, R13 и R14, взятый отдельно, независимо друг от друга, выбран из водорода, низшего алкила, (С6-С14)-арила, (С7-С20)-арилалкила, 5-14-членного гетероарила, 6-20-членного гетероарилалкила, -Rb или -(CH2)n-Rb; и один из R2, R3, R7, R8, R12 или R13 содержит группу формулы -Y-, где Y выбран из группы, состоящей из -С(О)-, S(O)2-, -S- и -NH-; или, в альтернативном варианте, R1 и R2 вместе с атомами углерода, с которыми они связаны, образуют необязательно замещенную бензогруппу;
[018] R4 выбран из водорода, низшего алкила, (С6-С14)-арила, (С7-С20)-арилалкила, 5-14-членного гетероарила или 6-20-членного гетероарилалкила;
[019] Каждый из R5 и R10 независимо представляет собой Н или защитную группу;
[020] причем n представляет собой целое число в диапазоне от 1 до 10;
[021] причем каждый Ra, независимо от других, выбран из низшего алкила, (С6-С14)-арила, (С7-С20)-арилалкила, 5-14-членного гетероарила, -СХ3 и 6-20-членного гетероарилалкила;
[022] где Rb выбран из -X, -ОН, -ORa -SH, -SRa -NH2, -NHRa -NRcRc, -N+RcRcRcX-, низшего пергалогеналкила, тригалогенметила, трифторметила, -Р(O)(ОН)2, -P(O)(ORa)2, P(O)(OH)(ORa), -OP(O)(OH)2, -OP(O)(ORa)2, -OP(O)(ORa)(OH), -S(O)2OH, -S(O)2Ra, -C(O)H, -C(O)Ra, -C(S)X, -C(O)OH, -C(O)NH2, -C(O)NHRa, -C(O)NRcRc, -C(S)NH2, -C(O)NHRa -C(O)NRcRc, -C(NH)NH2, -C(NH)NHRa, and -C(NH)NRcRc;
[023] каждый Rc, независимо от других, представляет собой Ra, или, в альтернативном варианте, два Rc, связанные с одним и тем же атомом азота, вместе с этим атомом азота могут образовывать 5-8-членное насыщенное или ненасыщенное кольцо, которое может необязательно содержать один или более одинаковых или разных циклообразующих гетероатомов, выбиранных из О, N и S;
[024] каждый Rd и Re, взятый отдельно, независимо друг от друга, выбран из водорода, низшего алкила, (С6-С14)-арила, (С7-С20)-арилалкила, 5-14-членного гетероарила, 6-20-членного гетероарилалкила, -Rb или -(CH2)n-Rb;
[025] X представляет собой галоген; и
[026] n представляет собой целое число в диапазоне от 1 до 10.
[027] В другом аспекте описан реагент, пригодный для мечения олигонуклеотида, который представляет собой соединение структурной Формулы:
LM-L-PEP
[028] где LM представляет собой фрагмент-метку, который содержит N-защищенный NH-родаминовый фрагмент молекулы, PEP представляет собой группу предшественника сложного фосфатного эфира, которая содержит фосфорамидитную группу или Н-фосфонатную группу, и L представляет собой необязательный линкер, связывающий фрагмент-метку с группой предшественника сложного фосфатного эфира, причем N-защищенный NH-родаминовый фрагмент молекулы имеет структуру (I)
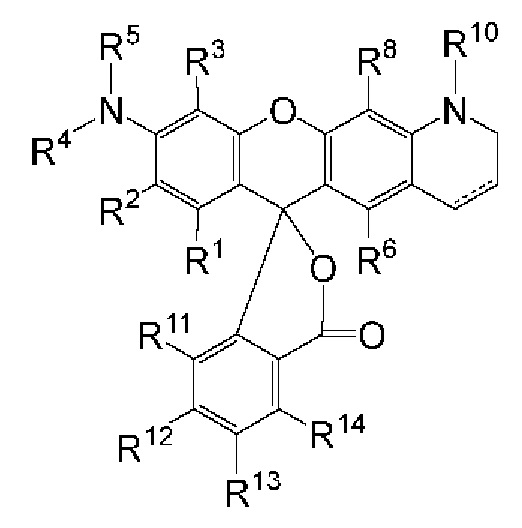
[029] где каждый R1, R2, R3, R6, R8, R11, R12, R13 и R14, взятый отдельно, независимо друг от друга, выбран из водорода, низшего алкила, (С6-С14)-арила, (С7-С20)-арилалкила, 5-14-членного гетероарила, 6-20-членного гетероарилалкила, -Rb или -(CH2)n-Rb; и один из R2, R3, R7, R8, R12 или R13 содержит группу формулы -Y-, где Y выбран из группы, состоящей из -С(О)-, S(O)2-, -S- и -NH-; или, в альтернативном варианте, R1 и R2 вместе с атомами углерода, с которыми они связаны, образуют необязательно замещенную бензогруппу;
[030] R4 выбран из водорода, низшего алкила, (С6-С14)-арила, (С7-С20)-арилалкила, 5-14-членного гетероарила или 6-20-членного гетероарилалкила;
[031] каждый из R5 и R10 независимо представляет собой Н или защитную группу;
[032] причем n представляет собой целое число в диапазоне от 1 до 10;
[033] причем каждый Ra, независимо от других, выбран из низшего алкила, (С6-С14)-арила, (С7-С20)-арилалкила, 5-14-членного гетероарила, -СХ3 и 6-20-членного гетероарилалкила;
[034] где Rb выбран из -X, -ОН, -ORa -SH, -SRa -NH2, -NHRa -NRcRc, -N+RcRcRcX-, низшего пергалогеналкила, тригалогенметила, трифторметила, -Р(O)(ОН)2, -P(O)(ORa)2, P(O)(OH)(ORa), -OP(O)(OH)2, -OP(O)(ORa)2, -OP(O)(ORa)(OH), -S(O)2OH, -S(O)2Ra, -C(O)H, -C(O)Ra, -C(S)X, -C(O)OH, -C(O)NH2, -C(O)NHRa, -C(O)NRcRc, -C(S)NH2, -C(O)NHRa -C(O)NRcRc, -C(NH)NH2, -C(NH)NHRa, and -C(NH)NRcRc;
[035] каждый Rc, независимо от других, представляет собой Ra, или, в альтернативном варианте, два Rc, связанные с одним и тем же атомом азота, вместе с этим атомом азота могут образовывать 5-8-членное насыщенное или ненасыщенное кольцо, которое может необязательно содержать один или более одинаковых или разных циклообразующих гетероатомов, выбиранных из О, N и S;
[036] каждый Rd и Re, взятый отдельно, независимо друг от друга, выбран из водорода, низшего алкила, (С6-С14)-арила, (С7-С20)-арилалкила, 5-14-членного гетероарила, 6-20-членного гетероарилалкила, -Rb или -(CH2)n-Rb;
[037] X представляет собой галоген; и
[038] n представляет собой целое число в диапазоне от 1 до 10.
[039] В другом аспекте способ включает:
[040] ко-амплификацию образца нуклеиновой кислоты со множеством пар праймеров для амплификации с образованием множества продуктов амплификации, причем по меньшей мере одна из каждой пары праймеров содержит меченый нуклеотид, имеющий структурную формулу LM-L-PEP, причем каждый из продуктов амплификации содержит разные генетические локусы.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
[041] На Фиг. 1 изображены типичные линкеры, которые могут быть использованы для связывания различных фрагментов молекул, содержащих описанные в данном документе реагенты, друг с другом;
[042] На Фиг. 2 изображены типичные варианты реализации ненуклеозидных реагентов для синтеза, которые не содержат маркеры синтеза;
[043] На Фиг. 3 изображены типичные варианты реализации нуклеозидных реагентов для синтеза, которые не содержат маркеры синтеза;
[044] На Фиг. 4 изображены типичные варианты реализации ненуклеозидных реагентов для синтеза, которые содержат маркер синтеза;
[045] На Фиг. 5 изображены типичные варианты реализации нуклеозидных реагентов для синтеза, которые содержат маркеры синтеза;
[046] На Фиг. 6 изображены типичные варианты реализации ненуклеозидных реагентов на твердом носителе;
[047] На Фиг. 7 изображены типичные варианты реализации нуклеозидных реагентов на твердой носителе;
[048] На Фиг. 8 изображено применение конкретного варианта реализации реагента для синтеза олигонуклеотида, меченного по 5'-гидроксилу, NH-родаминовым красителем;
[049] На Фиг. 9 изображено применение конкретного варианта реализации реагента для синтеза олигонуклеотида, меченного по 3-гидроксилу красителем переноса энергии;
[050] На Фиг. 10А изображено применение конкретного варианта реализации реагента для синтеза in situ олигонуклеотида, меченного по его 5'-гидроксилу, красителем переноса энергии; и
[051] На Фиг. 10В изображено применение линкерного фосфорамидита и конкретного варианта реализации реагента для синтеза in situ олигонуклеотида, меченного по его 5'-концу красителем переноса энергии;
[052] На Фиг. 11А изображены спектры трех коммерческих красителей, используемых в мультиплексных анализах;
[053] На Фиг. 11В изображены спектры трех коммерческих красителей, используемых в мультиплексных анализах, и Cmp А, асимметричного родамина, изображенного на структуре D.1.
[054] ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[055] Следует понимать, что предшествующее краткое описание и последующее подробное описание являются чисто иллюстративными и пояснительными, и не предполагаются быть ограничивающими для композиций и способов, описанных в данном документе. В этом раскрытии использование «или» означает «и/или», если не указано иное. Аналогично, выражения «содержать», «содержащий», «включать» и «включающий» не предназначены быть ограничивающими.
[056] Используемые в данном документе и в прилагаемой формуле изобретения формы единственного числа включают ссылки на множественное число, если контекст явно не диктует иное. Кроме того, следует отметить, что формула изобретения может быть составлена так, чтобы исключить любой необязательный элемент. Следовательно, это утверждение предназначено для использования в качестве предшествующего основания для использования такой исключающей терминологии, как «исключительно», «только» и т.п. в контексте перечисления элементов формулы изобретения или использования «отрицательного» ограничения.
[057] Используемые в данном документе термины «включающий», «вмещающий» и «содержащий» используются в их открытом, неограничивающем смысле.
[058] Чтобы обеспечить более краткое описание, некоторые из приведенных в данном документе количественных выражений не дополнены термином «около». Подразумевается, что независимо от того, используется ли термин «около» явно или нет, каждая количественная величина, указанная в данном документе, предназначена для обозначения фактического данного значения, а также подразумевается, что оно относится к приближению к такому данному значению, которое может быть разумно выведено на основании обычных навыков в данной области, включая эквиваленты и приближения, обусловленные экспериментальными условиями и/или условиями измерения для такого заданного значения. Всякий раз, когда выход указан в процентах, такой выход относится к массе объекта, для которого выход указан по отношению к максимальному количеству того же объекта, которое может быть получено при определенных стехиометрических условиях. Концентрации, указанные в процентах, относятся к массовым отношениям, если не указано иное.
Определения
[059] Если не указано иное, следующие термины и фразы, используемые в данном документе, имеют следующие значения:
[060] «Алкил» сам по себе или как часть другого заместителя относится к насыщенному или ненасыщенному разветвленному, линейному или циклическому одновалентному углеводородному радикалу, имеющему определенное количество атомов углерода (т.е. С1-С6 означает от одного до шести атомов углерода), который получают удалением одного атома водорода от одного атома углерода исходного алкана, алкена или алкина. Типичные алкильные группы включают, но не ограничиваются ими, метил; этиллы, такие как этанил, этенил, этинил; пропилы, такие как пропан-1-ил, пропан-2-ил, циклопропан-1-ил, проп-1-ен-1-ил, проп-1-ен-2-ил, проп-2-ен-1-ил, циклопроп-1-ен-1-ил, циклопроп-2-ен-1-ил, проп-1-ин-1-ил, проп-2-ин-1-ил и т.п.; бутилы, такие как бутан-1-ил, бутан-2-ил, 2-метилпропан-1-ил, 2-метилпропан-2-ил, циклобутан-1-ил, бут-1-ен-1-ил, бут-1-ен-2-ил, 2-метилпроп-1-ен-1-ил, бут-2-ен-1-ил, бут-2-ен-2-ил, бута-1,3-диен-1-ил, бута-1,3-диен-2-ил, циклобут-1-ен-1-ил, циклобут-1-ен-3-ил, циклобута-1,3-диен-1-ил, бут-1-ин-1-ил, бут-1-ин-3-ил, бут-3-ин-1-ил и т.п.; и т.п. Если предполагаются конкретные уровни насыщения, используется номенклатура «алканил», «алкенил» и/или «алкинил», как определено ниже. Используемый в данном документе термин «низший алкил» означает (С1-С8)-алкил.
[061] «Радикал алкана» сам по себе или как часть другого заместителя относится к насыщенному разветвленному, линейному или циклическому алкилу, полученному удалением одного атома водорода от одного атома углерода исходного алкана. Типичные радикалы алкана включают, но не ограничиваются ими, метанил; этанил; пропанилы, такие как пропан-1-ил, пропан-2-ил (изопропил), циклопропан-1-ил и т.п.; бутанилы, такие как бутан-1-ил, бутан-2-ил (втор-бутил), 2-метилпропан-1-ил (изобутил), 2-метилпропан-2-ил (трет-бутил), циклобутан-1-ил и т.п.; и т.п. Используемый в данном документе термин «низший радикал алкана» означает (С1-С8)-радикал алкана.
[062] «Алкенил» сам по себе или как часть другого заместителя относится к ненасыщенному разветвленному, линейному или циклическому алкилу, имеющему по меньшей мере одну двойную углерод-углеродную связь, полученную удалением одного атома водорода от одного атома углерода исходного алкена. Группа может находиться либо в цис-, либо в транс-конформации относительно двойной связи(ей). Типичные алкенильные группы включают, но не ограничиваются ими, этенил; пропенилы, такие как проп-1-ен-1-ил, проп-1-ен-2-ил, проп-2-ен-1-ил, проп-2-ен-2-ил, циклопроп-1-ен-1-ил; циклопроп-2-ен-1-ил; бутенилы, такие как бут-1-ен-1-ил, бут-1-ен-2-ил, 2-метилпроп-1-ен-1-ил, бут-2-ен-1-ил, бут-2-ен-2-ил, бута-1,3-диен-1-ил, бута-1,3-диен-2-ил, циклобут-1-ен-1-ил, циклобут-1-ен-3-ил, циклобута-1,3-диен-1-ил и т.п.; и т.п. Используемый в данном документе термин «низший алкенил» означает (С2-С8)-алкенил.
[063] «Алкинил» сам по себе или как часть другого заместителя относится к ненасыщенному разветвленному, линейному или циклическому алкилу, имеющему по меньшей мере одну тройную углерод-углеродную связь, полученную удалением одного атома водорода от одного атома углерода исходного алкина. Типичные алкинильные группы включают, но не ограничиваются ими, этинил; пропинилы, такие как проп-1-ин-1-ил, проп-2-ин-1-ил и т.п.; бутинилы, такие как бут-1-ин-1-ил, бут-1-ин-3-ил, бут-3-ин-1-ил и т.п.; и т.п. Используемый в данном документе термин «низший алкинил» означает (С2-С8)-алкинил.
[064] «Алкилдиил» сам по себе или как часть другого заместителя относится к насыщенной или ненасыщенной, разветвленной, линейной или циклической двухвалентной углеводородной группе, имеющей определенное количество атомов углерода (т.е. С1-С6 означает от одного до шести атомов углерода), полученной удалением одного атома водорода от каждого из двух различных атомов углерода исходного алкана, алкена или алкина, или удалением двух атомов водорода от одного атома углерода исходного алкана, алкена или алкина. Два центра одновалентного радикала или каждая валентность центра двухвалентного радикала могут образовывать связи с одинаковыми или разными атомами. Типичные алкилдиильные группы включают, но не ограничиваются ими, метилдиил; этилдиилы, такие как этан-1,1-диил, этан-1,2-диил, этен-1,1-диил, этен-1,2-диил; пропилдиилы, такие как пропан-1,1-диил, пропан-1,2-диил, пропан-2,2-диил, пропан-1,3-диил, циклопропан-1,1-диил, циклопропан-1,2-диил, проп-1-ен-1,1-диил, проп-1-ен-1,2-диил, проп-2-ен-1,2-диил, проп-1-ен-1,3-диил, циклопроп-1-ен-1,2-диил, циклопроп-2-ен-1,2-диил, циклопроп-2-ен-1,1-диил, проп-1-ин-1,3-диил и т.п.; бутилдиилы, такие как бутан-1-диил, бутан-1,2-диил, бутан-1,3-диил, бутан-1,4-диил, бутан-2,2-диил, 2-метилпропан-1,1-диил, 2-метилпропан-1,2-диил; циклобутан-1,1-диил, циклобутан-1,2-диил, циклобутан-1,3-диил, бут-1-ен-1,1-диил, бут-1-ен-1,2-диил, бут-1-ен-1,3-диил, бут-1-ен-1,4-диил, 2-метилпроп-1-ен-1,1-диил, 2-метанилиденпропан-1,1-диил, бута-1,3-диен-1,1-диил, бута-1,3-диен-1,2-диил, бута-1,3-диен-1,3-диил, бута-1,3-диен-1,4-диил, циклобут-1-ен-1,2-диил, циклобут-1-ен-1,3-диил, циклобут-2-ен-1,2-диил, циклобута-1,3-диен-1,2-диил, циклобута-1,3-диен-1,3-диил, бут-1-ин-1,3-диил, бут-1-ин-1,4-диил, бута-1,3-диин-1,4-диил и т.п.; и т.п. Если предполагаются конкретные уровни насыщения, используется номенклатура алканилдиил, алкенилдиил и/или алкинилдиил. Если специально предполагается, что две валентности находятся у одного и того же атома углерода, используется номенклатура «алкилиден». В некоторых вариантах реализации алкилдиильная группа представляет собой (С1-С8)-алкилдиил. Конкретные варианты реализации включают насыщенные ациклические алканилдиильные группы, в которых центры радикала находятся у концевых атомов углерода, например, метандиил (метано); этан-1,2-диил (этано); пропан-1,3-диил (пропано); бутан-1,4-диил (бутано); и т.п. (также именуемые алкиленами, определенными ниже). Используемый в данном документе термин «низший алкилдиил» означает (С1-С8)-алкилдиил.
[065] «Алкилен» сам по себе или как часть другого заместителя относится к линейной насыщенной или ненасыщенной алкилдиильной группе, имеющей два концевых одновалентных центра радикала, образованных удалением одного атома водорода от каждого из двух концевых атомов углерода линейной или разветвленный цепи исходного алкана, алкена или алкина, или удалением одного атома водорода от каждого из двух различных кольцевых атомов исходного циклоалкила. Локант для двойной или тройной связи, если она присутствует, в конкретном алкилене указывается в квадратных скобках. Типичные алкиленовые группы включают, но не ограничиваются ими, метилен (метано); этилены, такие как этано, этено, этино; пропилены, такие как пропано, проп[1]ено, пропа[1,2]диено, проп[1]ино и т.п.; бутилены, такие как бутано, бут[1]ено, бут[2]ено, бута[1,3]диено, бут[1]ино, бут[2]ино, бута[1,3]диино и т.п.; и т.п. Если предполагаются конкретные уровни насыщения, используется номенклатура алкано, алкено и/или алкино. В некоторых вариантах реализации алкиленовая группа представляет собой (С1-С8) или (С1-С3)-алкилен. Конкретные варианты реализации включают линейные насыщенные алкано-группы, например, метано, этано, пропано, бутано и т.п. Используемый в данном документе термин «низший алкилен» означает (С1-С8)-алкилен.
[066] «Гетероалкил», «радикал гетероалкана», «гетероалкенил», «гетероалкинил», «гетероалкилдиил» и «гетероалкилен» сами по себе или как часть другого заместителя относятся к алкильной, алкановой, алкенильной, алкинильной, алкилдиильной и алкиленовой группам, соответственно, в которых каждый один или более из атомов углерода независимо заменен одинаковыми или разными гетероатомами или гетероатомными группами. Типичные гетероатомы и/или гетероатомные группы, которые могут заменять атомы углерода, включают, но не ограничиваются ими, -О-, -S-, -S-О-, -NR'-, -РН-, -S(O)-, -SO2-, -S(O)NR'-, -SO2NR'- и т.п., включая их комбинации, где R' представляет собой водород или заместители, такие как, например, (С1-С8)-алкил, (С6-С14)-арил или (С7-С20)-арилалкил.
[067] «Циклоалкил» и «гетероциклоалкил» сами по себе или как часть другого заместителя относятся к циклическим вариантам «алкильной» и «гетероалкильной» группы, соответственно. Для гетероалкильных групп гетероатом может занимать положение, которое присоединено к остатку молекулы. Типичные циклоалкильные группы включают, но не ограничиваются ими, циклопропил; циклобутилы, такие как циклобутанил и циклобутенил; циклопентилы, такие как циклопентанил и циклопентенил; циклогексилы, такие как циклогексанил и циклогексенил; и т.п. Типичные гетероциклоалкильные группы включают, но не ограничиваются ими, тетрагидрофуранил (например, тетрагидрофуран-2-ил, тетрагидрофуран-3-ил и т.п.), пиперидинил (например, пиперидин-1-ил, пиперидин-2-ил и т.п.), морфолинил (например, морфолин-3-ил, морфолин-4-ил и т.п.), пиперазинил (например, пиперазин-1-ил, пиперазин-2-ил и т.п.) и т.п.
[068] «Исходная ароматическая кольцевая система» относится к ненасыщенной циклической или полициклической кольцевой системе, имеющей сопряженную π-электронную систему. В определение «исходная ароматическая кольцевая система» конкретно включены конденсированные кольцевые системы, в которых одно или более колец являются ароматическими, а одно или более колец являются насыщенными или ненасыщенными, такие как, например, флуорен, индан, инден, фенален, тетрагидронафталин и т.п. Типичные исходные ароматические кольцевые системы включают, но не ограничиваются ими, ацеантрилен, аценафтилен, ацефенантрилен, антрацен, азулен, бензол, хризен, коронен, флуорантен, флуорен, гексацен, гексафен, гексилен, индацен, симметричный-индацен, индан, инден, нафталин, октацен, октафен, октален, овален, пентацен, пентален, пентафен, перилен, фенален, фенантрен, пикен, плеяден, пирен, пирантрен, рубицен, тетрагидронафталин, трифенилен, тринафталин и т.п.
[069] «Арил» сам по себе или как часть другого заместителя относится к одновалентной ароматической углеводородной группе, имеющей определенное количество атомов углерода (т.е. С6-С14 означает от 6 до 14 атомов углерода), полученной удалением одного атома водорода от одного атома углерода исходной ароматической кольцевой системы. Типичные арильные группы включают, но не ограничиваются ими, группы, производные от ацеантрилена, аценафтилена, ацефенантрилена, антрацена, азулена, бензола, хризена, коронена, флуорантена, флуорена, гексацена, гексафена, гексилена, асимметричного индацена, симметричного индацена, индана, индена, нафталина, октацена, октафена, окталена, овалена, пентацена, пенталена, пентафена, перилена, феналена, фенантрена, пикена, плеядена, пирена, пирантрена, рубицена, трифенилена, тринафталина и т.п., а также их различные гидроизомеры. Конкретные типичные арилы включают фенил и нафтил.
[070] «Арилалкил» сам по себе или как часть другого заместителя относится к ациклической алкильной группе, в которой один из атомов водорода, связанный с атомом углерода, в некоторых вариантах реализации представляющий собой концевой или sp3-атом углерода, заменен арильной группой. Типичные арилалкильные группы включают, но не ограничиваются ими, бензил, 2-фенилэтан-1-ил, 2-фенилэтен-1-ил, нафтилметил, 2-нафтилэтан-1-ил, 2-нафтилэтен-1-ил, нафтобензил, 2-нафтофенилэтан-1-ил и т.п. Если подразумеваются алкильные фрагменты молекул, имеющие определенную степень насыщения, используется номенклатура радикал арилалкана, арилалкенил и/или арилалкинил. Когда указано определенное количество атомов углерода, например, (С7-С20)-арилалкил, это число относится к общему количеству атомов углерода, составляющих арилалкильную группу.
[071] «Исходная гетероароматическая кольцевая система» относится к исходной ароматической кольцевой системе, в которой каждый один или более атомов углерода независимо замещены одинаковыми или разными гетероатомами или гетероатомными группами. Типичные гетероатомы или гетероатомные группы для замены атомов углерода включают, но не ограничиваются ими, N, NH, Р, О, S, S(O), SO2, Si и т.п. В определение «исходной гетероароматической кольцевой системы» конкретно включены конденсированные кольцевые системы, в которых одно или более колец являются ароматическими, а одно или более колец являются насыщенными или ненасыщенными, такие как, например, бензодиоксан, бензофуран, хроман, хромен, индол, индолин, ксантен и т.п. В определение «исходной гетероароматической кольцевой системы» входят те известные кольца, которые включают широко известные заместители, такие как, например, бензопирон и 1-метил-1,2,3,4-тетразол. Типичные исходные гетероароматические кольцевые системы включают, но не ограничиваются ими, акридин, бензимидазол, бензизоксазол, бензодиоксан, бензодиоксол, бензофуран, бензопирон, бензотиадиазол, бензотиазол, бензотриазол, бензоксаксин, бензоксазол, бензоксазолин, карбазол, β-хромолин, хроман, хромен, циннолин, фуран, имидазол, индазол, индол, индолин, индолизин, изобензофуран, изохромен, изоиндол, изоиндолин, изохинолин, изотиазол, изоксазол, нафтиридин, оксадиазол, оксазол, перимидин, фенантридин, фенантролин, феназин, фталазин, птеридин, пурин, пиран, пиразин, пиразол, пиридазин, пиридин, пиримидин, пиррол, пирролизин, хиназолин, хинолин, хинолизин, хиноксалин, тетразол, тиадиазол, тиазол, тиофен, триазол, ксантен и т.п.
[072] «Гетероарил» сам по себе или как часть другого заместителя относится к одновалентной гетероароматической группе, имеющей определенное количество циклообразующих атомов (например, «5-14-членный» означает от 5 до 14 циклообразующих атомов), полученной удалением одного атома водорода от одного атома исходной гетероароматической кольцевой системы. Типичные гетероарильные группы включают, но не ограничиваются ими, группы, полученные из акридина, бензимидазола, бензизоксазола, бензодиоксана, бензодиаксола, бензофурана, бензопирона, бензотиадиазола, бензотиазола, бензотриазола, бензоксазина, бензоксазола, бензоксазолина, карбазола, β-карболина, хромана, хромена, циннолина, фурана, имидазола, индазола, индола, индолина, индолизина, изобензофурана, изохромена, изоиндола, изоиндолина, изохинолина, изотиазола, изоксазола, нафтиридина, оксадиазола, оксазола, перимидина, фенантридина, фенантролина, феназина, фталазина, птеридна, пурина, пирана, пиразина, пиразола, пиридазина, пиридина, пиримидина, пиррола, пирролизина, хиназолина, хинолина, хинолизина, хиноксалина, тетразола, тиадиазола, тиазола, тиофена, триазола, ксантена и т.п., а также их различные гидроизомеры.
[073] «Гетероарилалкил» сам по себе или как часть другого заместителя относится к ациклической алкильной группе, в которой один из атомов водорода, связанный с атомом углерода, в некоторых вариантах реализации представляющий собой концевой или sp3-атом углерода, заменен гетероарильной группой. Если подразумеваются алкильные фрагменты молекулы, имеющие конкретную степень насыщения, используется номенклатура радикал гетероарилалкана, гетероарилалкенил и/или гетероарилалкинил. Когда указано определенное количество атомов, например, 6-20-членный гетороарилалкил, это количество относится к общему количеству атомов, составляющих арилалкильную группу.
[074] «Галогеналкил» сам по себе или как часть другого заместителя относится к алкильной группе, в которой один или более атомов водорода замещены галогеном. Следовательно, подразумевается, что термин «галогеналкил» включает моногалогеналкилы, дигалогеналкилы, тригалогеналкилы и т.п. вплоть до пергалогеналкилов. Например, выражение «(С1-С2)-галогеналкил» включает фторметил, дифторметил, трифторметил, 1-фторэтил, 1,1-дифторэтил, 1,2-дифторэтил, 1,1,1-трифторэтил, перфторэтил и т.п.
[075] Определенные выше группы могут включать префиксы и/или суффиксы, которые широко используются в данной области техники для создания дополнительных хорошо известных групп заместителей. В качестве неограничивающих конкретных примеров «алкилокси» и/или «алкокси» относятся к группе Формулы -OR'', «алкиламин» относится к группе Формулы -NHR'', а «диалкиламин» относится к группе Формулы -NR''R'', где каждый R'' представляет собой алкил.
[076] Используемый в данном документе «ДНК» относится к дезоксирибонуклеиновой кислоте в ее различных формах, известных в данной области техники, таких как геномная ДНК, кДНК, выделенные молекулы нуклеиновой кислоты, векторная ДНК и хромосомная ДНК. «Нуклеиновая кислота» относится к ДНК или РНК (рибонуклеиновой кислоте) в любой форме. Используемый в данном документе термин «выделенная молекула нуклеиновой кислоты» относится к молекуле нуклеиновой кислоты (ДНК или РНК), которая была выделена из своего природного окружения. Некоторыми примерами выделенных молекул нуклеиновых кислот являются молекулы рекомбинантной ДНК, содержащиеся в векторе,
[077] молекулы рекомбинатной ДНК, содержащиеся в гетерологичной клетке-хозяине, частично или практически полностью очищенные молекулы нуклеиновой кислоты и молекулы синтетической ДНК. «Выделенная» нуклеиновая кислота может не содержать последовательностей, которые естественным образом фланкируют нуклеиновую кислоту (т.е. последовательности, расположенные на 5'- и 3'-концах нуклеиновой кислоты) в геномной ДНК организма, из которого получена нуклеиновая кислота. Более того, «выделенная» молекула нуклеиновой кислоты, такая как молекула кДНК, может по существу не содержать другого клеточного материала или культуральной среды при получении рекомбинантными методами или не содержать химических предшественников или других химикатов при химическом синтезе.
[078] Локусы «коротких тандемных дупликаций» или «КТД» относятся к участкам геномной ДНК, которые содержат короткие повторяющиеся элементы последовательности. Повторяющиеся элементы последовательности не ограничиваются, но, как правило, имеют длину от трех до семи пар оснований. Каждый элемент последовательности в КТД повторяется как минимум один раз и в данном документе именуется «повторяющейся единицей». Термин «КТД» также охватывает область геномной ДНК, в которой более чем одна повторяющаяся единица повторяется в тандеме или с промежуточными основаниями, при условии, что по меньшей мере одна из последовательностей повторяется в тандеме по меньшей мере два раза.
[079] «Полиморфные локусы коротких тандемных дупликаций» относятся к локусам КТД, в которых количество повторяющихся элементов последовательности (и чистая длина последовательности) в конкретной области геномной ДНК варьируется от аллеля к аллелю и от человека к человеку.
[080] Используемый в данном документе термин «аллельная лестница» относится к маркеру стандартного размера, состоящему из амплифицированных аллелей из локуса. «Аллель» относится к генетической вариации, связанной с сегментом ДНК, т.е. одной из двух или более альтернативных форм последовательности ДНК, занимающих один и тот же локус.
[081] «Биохимическая номенклатура» относится к стандартной биохимической номенклатуре, используемой в данном документе, в которой азотистые основания обозначены как аденин (А), тимин (Т), гуанин (Г) и цитозин (Ц). Соответствующие нуклеотиды представляют собой, например, дезоксигуанозин-5'⋅трифосфат (дГТФ).
[082] «Полиморфизм ДНК» относится к состоянию, при котором две или более различных нуклеотидных последовательностей в последовательности ДНК сосуществуют в одной и той же популяции скрещивания.
[083] «Локус» или «генетический локус» относится к определенному физическому положению на хромосоме. Аллели локуса расположены в идентичных сайтах на гомологичных хромосомах.
[084] «Локус-специфический праймер» относится к праймеру, который специфически гибридизуется с частью указанного локуса или его комплементарной цепи, по меньшей мере, для одного аллеля локуса, и не гибридизуется эффективно с другими последовательностями ДНК в условиях, используемых при амплификационном методе.
[085] «Полимеразная цепная реакция» или «ПЦР» относится к методике, в которой повторяющиеся циклы денатурации, отжига с праймером и удлинения с помощью фермента ДНК-полимеразы используются для увеличения количества копий целевой последовательности ДНК примерно в 106 раз или более. Процесс ПЦР для амплификации нуклеиновых кислот защищен патентами США №№4683195 и 4683202, которые целиком включены в данный документ посредством ссылки для описания способа. Условия реакции для любой ПЦР включают химические компоненты реакции и их концентрации, температуры, используемые в циклах реакции, количество циклов реакции и продолжительность этапов циклов реакции.
[086] Используемый в данном документе термин «амплифицировать» относится к способу ферментативного увеличения количества конкретной нуклеотидной последовательности. Эта амплификация не ограничивается ПЦР, но, как правило, выполняется с помощью ПЦР. Используемый в данном документе термин «денатурация» относится к отделению двух комплементарных нуклеотидных цепей от отожженного состояния. Денатурация может быть вызвана рядом факторов, таких как, например, ионная сила буфера, температура или химические вещества, которые нарушают взаимодействия спаривания оснований. Используемый в данном документе термин «отжиг» относится к специфическому взаимодействию между цепями нуклеотидов, при котором цепи связываются друг с другом, по существу, на основе комплементарности между цепями, как определено спариванием оснований Уотсона-Крика. Для отжига необязательно, чтобы комплементарность составляла 100%. Используемый в данном документе термин «удлинение» относится к циклу амплификации олигонуклеотидного праймера и целевой нуклеиновой кислоты после отжига, причем фермент полимераза влияет на удлинение праймера во фрагменты соответствующего размера с помощью целевой нуклеиновой кислоты в качестве репликативной матрицы.
[087] «Праймер» относится к одноцепочечному олигонуклеотид у или фрагменту ДНК, который гибридизуется с локусом цепи ДНК таким образом, что 3'-конец праймера может действовать как сайт полимеризации и удлинения с помощью фермента ДНК-полимеразы. «Пара праймеров» относится к двум праймерам, содержащим праймер 1, который гибридизуется с одной цепью на одном конце последовательности ДНК, подлежащей амплификации, и праймер 2, который гибридизуется с другим концом комплементарной цепи последовательности ДНК, подлежащей амплификации. «Сайт праймера» относится к области целевой ДНК, с которой гибридизуется праймер.
[088] «Генетические маркеры», как правило, представляют собой аллели геномной ДНК с характеристиками, представляющими интерес для анализа, такими как типирование ДНК, при котором индивиды дифференцируются на основании вариаций в их ДНК. Большинство методов типирования ДНК предназначены для обнаружения и анализа различий в длине и/или последовательности одного или более участков ДНК-маркеров, о которых известно, что они присутствуют по меньшей мере в двух различных формах или аллелях в популяции. Такая вариация именуется «полиморфизмом», а любая область ДНК, в которой происходит такая вариация, именуется «полиморфным локусом». Один из возможных методов типирования ДНК включает объединение технологии ПЦР-амплификации (K.В. Mullis, патент США №4683202) с анализом вариаций полиморфизма длины. Традиционно ПЦР можно было использовать только для надежной амплификации относительно небольших сегментов ДНК, т.е. только амплифицирующих сегментов ДНК длиной менее 3000 оснований (М. Ponce and L. Micol (1992), NAR 20(3):623; R. Decorte et al. (1990), DNA CELL BIOL 9(6):461 469). Короткие тандемные дупликации (КТД), минисателлиты и переменное количество тандемных дупликаций (ПКТД) являются некоторыми примерами вариаций полиморфизмов длины. Сегменты ДНК, содержащие минисателлиты или ПКТД, как правило, слишком длинные, чтобы их можно было надежно амплифицировать с помощью ПЦР. Напротив, КТД, содержащие повторяющиеся единицы из около трех-семи нуклеотидов, являются достаточно короткими, чтобы их можно было использовать в качестве генетических маркеров при применении ПЦР, поскольку протоколы амплификации могут быть разработаны для получения продуктов меньшего размера, чем это возможно из других участков ДНК переменной длины.
[089] Используемый в данном документе термин «набор» относится к любой системе доставки для доставки материалов. В контексте реакционных анализов такие системы доставки включают системы, которые позволяют хранить, транспортировать или доставлять из одного места в другое реакционные реагенты (например, олигонуклеотиды, ферменты, набор(ы) праймеров и т.п. в соответствующих контейнерах) и/или вспомогательные материалы (например, буферы, письменные инструкции по проведению анализа и т.п.). Например, наборы могут включать один или более корпусов (например, коробок), содержащих соответствующие реакционные реагенты и/или вспомогательные материалы. Используемый в данном документе термин «фрагментированный набор» относится к системе доставки, содержащей два или более отдельных контейнера, каждый из которых содержит часть всех компонентов набора. Контейнеры могут быть доставлены предполагаемому получателю вместе или по отдельности. Например, первый контейнер может содержать фермент для применения в анализе, а второй контейнер может содержать олигонуклеоиды. Действительно, любая система доставки, содержащая два или более отдельных контейнера, каждый из которых содержит часть всех компонентов набора, включен в термин «фрагментированный набор». Напротив, «комбинированный набор» относится к системе доставки, содержащей все компоненты реакционного анализа в одном контейнере (например, в одной коробке, содержащей каждый из необходимых компонентов). Термин «набор» включает как фрагментированные, так и комбинированные наборы.
[090] Типичные варианты реализации изобретения
[091] В данном описании предложены реагенты, которые можно использовать для химического синтеза олигонуклеотидов, содержащих фрагменты-метки, которые содержат красители родаминового ряда. Традиционно было трудно химически синтезировать олигонуклеотиды, меченные родамином, отчасти из-за отсутствия в наличии родаминсодержащих реагентов для синтеза, устойчивых в условиях синтеза и/или снятия защитных групп, обычно применяемых в поэтапном химическом синтезе олигонуклеотидов. В настоящее время обнаружено, что защита экзоциклических аминогрупп NH-родаминовых красителей с помощью неустойчивых к основанию защитных групп, таких как ацетильные группы, дает N-защищенные NH-родаминовые красители, устойчивые в условиях химического синтеза и снятия защиты, обычно используемых при твердофазном синтезе олигонуклеотидов. Как следствие, N-защищенные NH-родамины могут быть введены в реагенты, которые можно использовать для синтеза олигонуклеотидов, меченных фрагментами-метками, которые содержат красители родаминового ряда, тем самым устраняя необходимость прикрепления меток после синтеза. Поскольку метки прикрепляются во время синтеза, полученный меченый олигонуклеотид может быть очищен для применения без помощи ВЭЖХ.
[092] Реагенты используют преимущества различных свойств реагентов и химического состава, которые хорошо известны для поэтапного твердофазного синтеза олигонуклеотидов, и могут находиться в форме реагентов для синтеза, которые связаны с гидроксильной группой во время поэтапного твердофазного синтеза олигонуклеотид ной цепи, или в форме реагентов на твердом носителе, с которыми нуклеозидные мономерные реагенты, такие как нуклеозид-фосфорамидитные реагенты, и/или необязательно другие реагенты, связываются поэтапно с получением синтетического олигонуклеотида.
[093] Реагенты для синтеза и реагенты на твердом носителе могут иметь нуклеозидную природу в том смысле, что они могут включать нуклеозидный фрагмент молекулы, или они могут быть ненуклеозидными по природе.
[094] Все описанные в данном документе реагенты содержат фрагмент-метку, который содержит N-защищенный NH-родаминовый краситель или фрагмент молекулы. N-защищенный NH-родаминовый краситель может быть единственным красителем, содержащим фрагмент-метку, или, в альтернативном варианте, он может быть одним из двух или более красителей, составляющих более крупную сеть красителей. Реагенты на твердом носителе дополнительно содержат твердый носитель и один или более маркеров синтеза, к которым могут быть присоединены дополнительные группы. Реагенты для синтеза дополнительно содержат группу PEP, пригодную для связывания реагента с первичной гидроксильной группой, и могут необязательно содержать один или более маркеров синтеза. Различные фрагменты молекул и группы, составляющие реагенты, могут быть связаны вместе любым способом и/или в любой ориентации, которая позволяет им выполнять свои соответствующие функции. Они могут быть связаны друг с другом посредством линкерных групп, включенных во фрагменты молекул, или они могут быть связаны друг с другом с помощью линкеров.
[095] Различные фрагменты молекул, группы и линкеры, содержащие описанные в данном документе реагенты, описаны более подробно ниже.
[096] Линкеры и линкерные группы
[097] Различные группы и фрагменты молекул, содержащие описанные в данном документе реагенты, как правило, связаны друг с другом линкерами. Отличительные характеристики любого конкретного линкера будут частично зависеть от отличительных характеристик фрагментов молекул, связанных друг с другом. Как правило, линкеры содержат спейсерный фрагмент молекулы, который может содержать практически любую комбинацию атомов или функциональных групп, устойчивую в условиях синтеза, используемых для синтеза меченых олигонуклеотидов, таких как условия, обычно используемые для синтеза олигонуклеотидов фосфиттриэфирным методом, и могут иметь линейную, разветвленную или циклическую структуру или могут включать комбинации линейных, разветвленных и/или циклических структур. Спейсерный фрагмент молекулы может быть мономерным по природе, или он может представлять собой или содержать области, которые являются полимерными по природе. Спейсерный фрагмент молекулы может быть сконструирован так, чтобы он имел определенные свойства, такие как способность отщепляться в определенных условиях, или определенные степени жесткости, гибкости, гидрофобности и/или гидрофильности.
[098] Как будет описано более подробно ниже, многие варианты реализации описанных в данном документе реагентов синтезируют путем конденсации синтонов друг с другом определенным образом с получением целевых реагентов. Каждый синтон, как правило, содержит одну или более линкерных групп, подходящих для образования целевых связей. Как правило, линкерная группа содержит функциональную группу Fy, которая способна реагировать с другой функциональной группой Fz или может быть активирована, чтобы иметь возможность реагировать с другой функциональной группой Fz, с образованием ковалентной связи Y-Z, где Y представляет часть связи, вносимую Fy, a Z представляет собой часть, вносимую Fz. Такие группы Fy и Fz упоминаются в данном документе как «дополнительные функциональные группы».
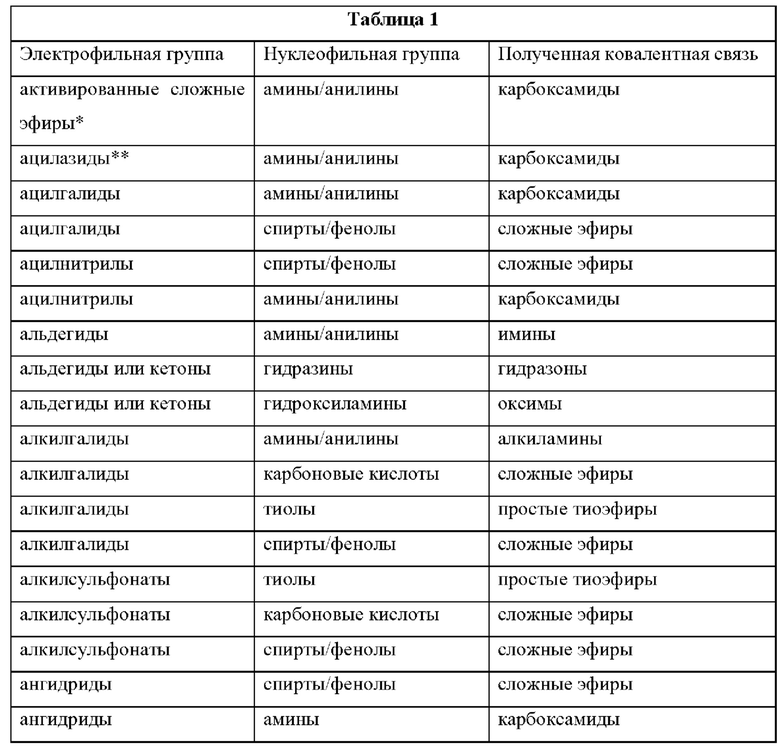
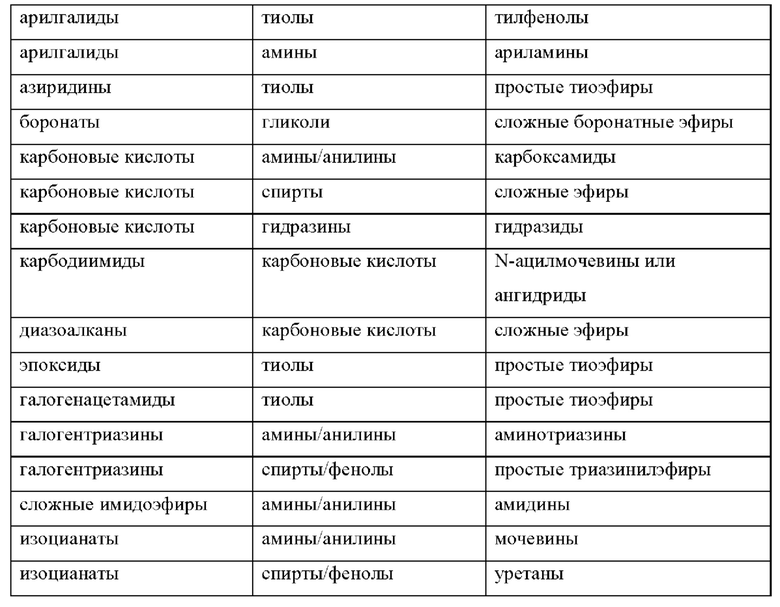
[099] Пары дополнительных функциональных групп, способных образовывать ковалентные связи друг с другом, хорошо известны в данной области техники. В некоторых вариантах реализации один из Fy или Fz содержит нуклеофильную группу, а другой из Fy или Fz содержит электрофильную группу. Дополнительные нуклеофильные и электрофильные группы, пригодные для образования связей (или их предшественников, которые являются или могут быть соответствующим образом активированы для образования связей), устойчивых к различным условиям синтеза и другим условиям, хорошо известны в данной области техники. Примеры подходящих дополнительных нуклеофильных и электрофильных групп, которые можно использовать для создания связей в различных реагентах, описанных в данном документе, а также образующиеся из них связи, представлены в Таблице 1 ниже:
[0100] Следовательно, линкерные синтоны в целом можно описать формулой LG-Sp-LG, где каждый LG независимо от другого представляет собой линкерную группу, a Sp представляет собой спейсерный фрагмент молекулы. В некоторых вариантах реализации изобретения линкерные синтоны могут быть описаны формулой Fz-Sp-Fz, где каждый Fz представляет собой, независимо от другого, один член пары дополнительных нуклеофильных или электрофильных функциональных групп, описанных выше. В конкретных вариантах реализации изобретения каждый Fz, независимо от другого, выбран из групп, перечисленных в Таблице 1 выше. Линкерные синтоны этого типа образуют линкерные фрагменты Формулы -Z-Sp-Z-, где каждый Z независимо от другого представляет собой часть связи, описанной выше. Конкретные линкеры, подходящие для связывания определенных групп и фрагментов молекул друг с другом в описанных в данном документе реагентах, будут обсуждаться более подробно в связи с типичными вариантами реализации реагентов. Неограничивающие типичные варианты реализации линкеров, которые могут быть использованы для связывания различных групп и фрагментов молекул, составляющих описанные в данном документе реагенты, друг с другом, изображены на Фиг. 2. На Фиг. 2, каждый Z1 и Z2 независимо друг от друга представляет собой часть связи, вносимую функциональной группой Fz, описанной ранее, и K выбран из -СН- и -N-. В некоторых конкретных вариантах реализации линкеров, изображенных на Фиг. 2, один из Z1 или Z2 представляет собой -NH-, а другой выбран из -О-, С(О)- и -S(O)2-.
[0101] Фрагмент-метка
[0102] Описанные в данном документе реагенты могут содержать фрагмент-метку, который содержит NH-родаминовый краситель, который защищен по одной из экзо циклических аминогрупп защитной группой, обладающей определенными свойствами. Как правило, красители родаминового ряда характеризуются четырьмя основными характеристиками: (1) исходное ксантеновое кольцо; (2) экзоциклический аминовый заместитель; (3) экзоциклический имминиевый заместитель; и (4) фенильная группа, замещенная в орто-положении карбоксильной группой. В некоторых вариантах реализации изобретения NH-родаминовый краситель по данному раскрытию может быть в целом описан Формулой (Ia). В некоторых вариантах реализации изобретения экзо циклические аминогруппы и/или имминиевые группы, как правило, расположены у атомов углерода С3' и С6' исходного ксантенового кольца, хотя также известны «удлиненные» родамины, в которых исходное ксантеновое кольцо содержит бензогруппу, конденсированную с атомами углерода С3' и С4' и/или атомами углерода С5' и С6'. В этих удлиненных родаминах характерные экзоциклические аминогруппы и имминиевые группы расположены в соответствующих положениях удлиненного ксантенового кольца.
[0103] Карбоксилзамещенная фенильная группа присоединена к атому углерода С1 исходного ксантенового кольца. Как следствие наличия орто-карбоксильного заместителя, красители родаминового ряда могут существовать в двух различных формах: (1) открытая кислотная форма и (2) закрытая лактонная форма. Не имея намерения ограничиваться какой-либо теорией действия, поскольку ЯМР-спектры типичных N-защищенных NH-родаминовых красителей, описанных в данном документе, согласуются с закрытой спиролактонной формой красителя, считается, что N-защищенные NH-родаминовые красители, содержащие фрагмент-метку описанных в данном документе реагентов, находятся в закрытой спиролактонной форме. Следовательно, различные родамины, а также их незащищенные аналоги изображены в данном документе в их закрытой спиролактоновой форме. Однако следует отметить, что это сделано только для удобства и не предназначено для ограничения различных реагентов, описанных в данном документе, лактонной формой красителей.
[0104] В закрытой спиролактонной форме кольца А и С исходного ксантенового кольца являются ароматическими, а оба заместителя С3' и С6' представляют собой амины. Экзоциклические аминогруппы красителей родаминового ряда, содержащиеся в описанных в данном документе фрагментах-метках, являются либо незамещенными, либо монозамещенными, так что эти аминогруппы являются первичными или вторичными аминами. Такие красители родаминового ряда упоминаются в данном документе как «NH-родамины». Следовательно, используемый в данном документе «NH-родамин» в целом содержит следующую кольцевую структуру исходного NH-родамина:
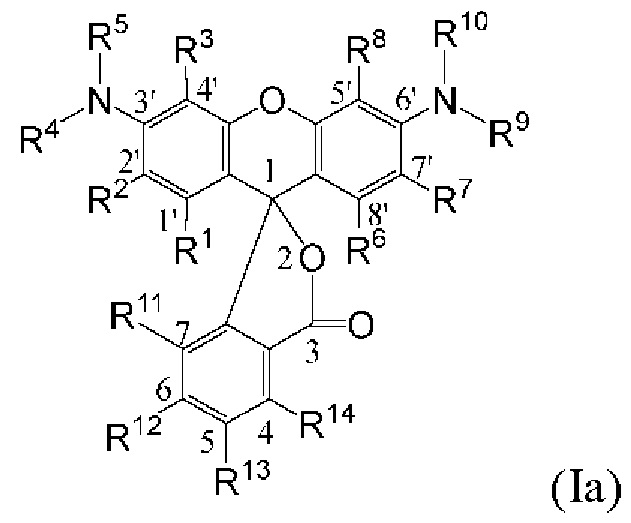
[0105] где каждый из R1, R2, R3, R4, R5, R6, R7, R8, R9, R10, R11, R12, R13 и R14 имеют значения, указанные в данном документе. В исходном NH-родаминовом кольце, изображенном выше, различные атомы углерода пронумерованы с использованием произвольного соглашения о нумерации, адаптированного из соглашения о нумерации, широко используемого для закрытой спиролактонной формы красителей родаминового ряда. Эта система нумерации используется только для удобства и никоим образом не предназначена для ограничения.
[0106] В любом из вариантов реализации изобретения, описанных в данном документе, типичные фрагменты-метки могут иметь Формулу
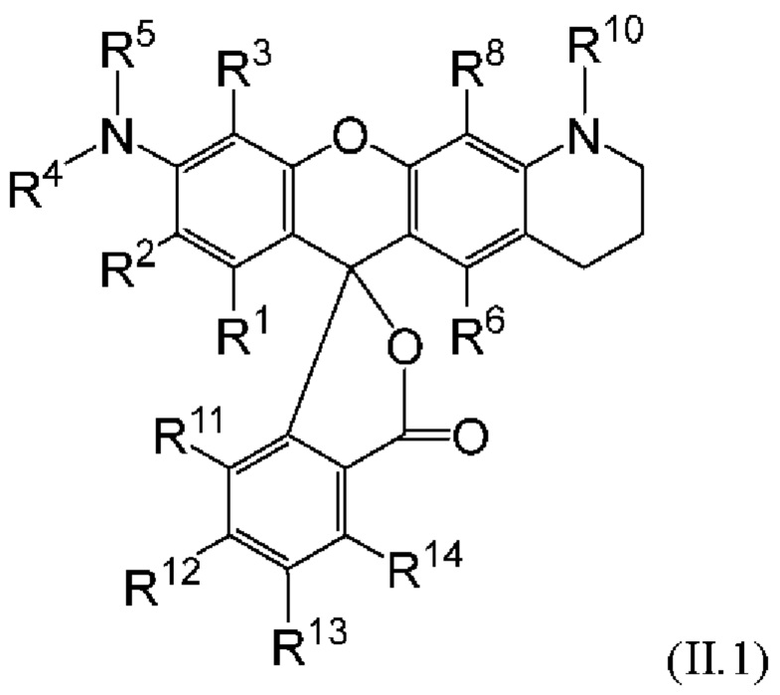
[0107] или, в частности, Формулу
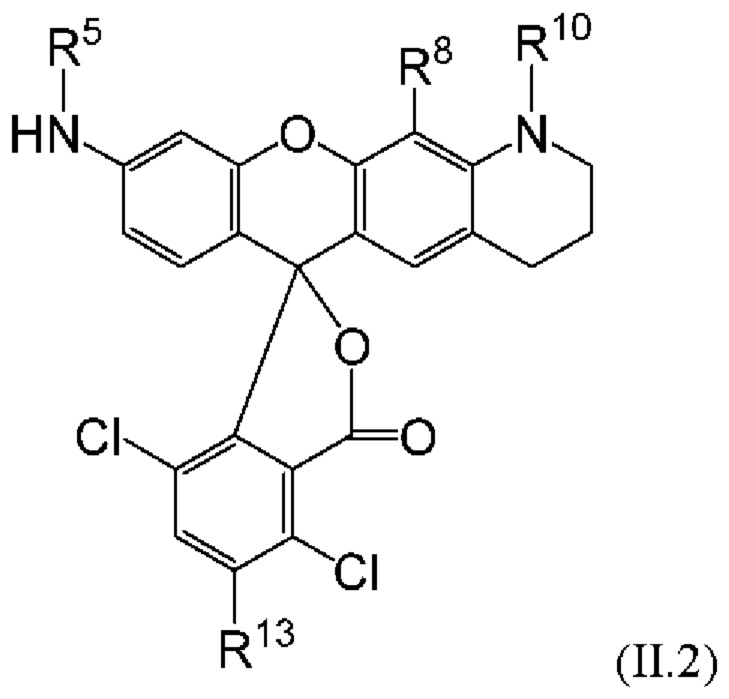
[0108] или, в частности, Формулу
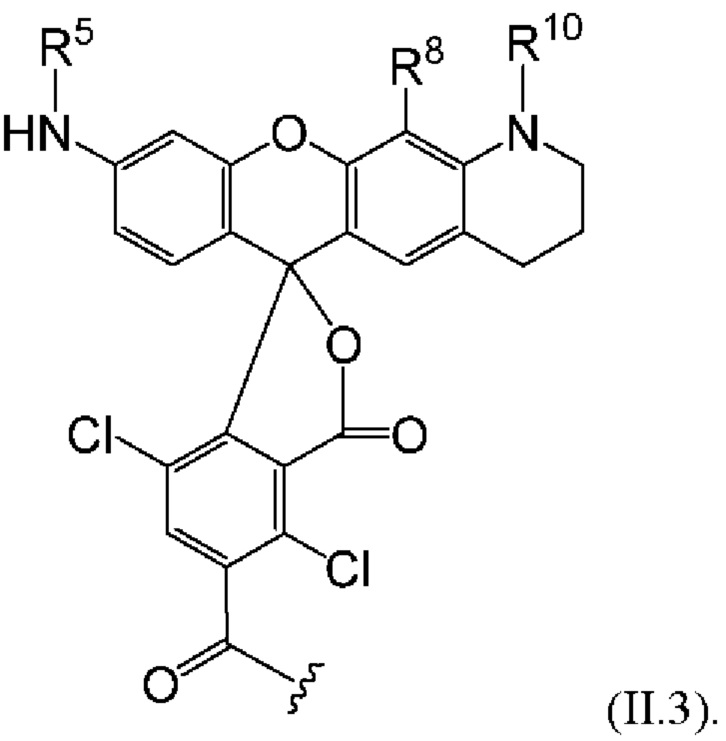
[0109] Неожиданно было обнаружено, что описанные в данном документе фрагменты-метки обладают свойствами, выгодными для их применения в биологических анализах. В частности, было обнаружено, что фрагменты-метки Формулы (II.1), (II.2) или, в частности (II.3), обладают спектральными свойствами, которые позволяют применять их в форматах мультиплексных анализов, которые обеспечивают лучшее разрешение и большую чувствительность.
[0110] В кольцах NH-родаминов структурной Формулы (Ia) и других описанных в данном документе Формулах R5 представляет собой водород или группы заместителей, замещающие экзоциклический амин, к которому R5 присоединен. В некоторых вариантах реализации изобретения R5 может быть замещенной или незамещенной алкиларильной или арилалкильной группой. В некоторых вариантах реализации изобретения R5 может представлять собой защитную группу.
[0111] В альтернативном варианте, заместители C1' и С2' вместе могут образовывать замещенные или незамещенные арильные мостики. В некоторых вариантах реализации изобретения группы, используемые для замещения атомов углерода С4, С5, С6, С7, С1', С2', С4', С5,' С7' и С8', не способствуют гашению красителя родаминового ряда, хотя в некоторых вариантах реализации изобретения гасящие заместители могут быть необходимы. Заместители, способные гасить красители родаминового ряда, включают карбонил, карбоксилат, тяжелые металлы, нитро, бром и йод. Атомы углерода в положениях С4, С5, С6 и С7 исходных NH-родаминовых колец структурной Формулы (Ia) также могут, независимо друг от друга, включать необязательные заместители. Эти заместители могут быть выбраны из различных заместителей, описанных выше. В некоторых вариантах реализации изобретения атомы углерода в положениях С4 и С7 замещены группами хлора, так что исходный NH-родаминовый краситель представляет собой NH-4,7-дихлородаминовый краситель. Огромное количество красителей родаминового ряда, которые содержат исходные NH-родаминовые кольца структурной Формулы (Ia), которые могут быть включены во фрагмент-метку описанных в данном документе реагентов, известны в данной области техники и описаны, например, в патенте США №6248884, патенте №6111116, патенте США №6080852, патенте США №6051719, патенте США. №6025505, патенте США №6017712, патенте США №5936087, патенте США №5847162, патенте США №5840999, патенте США №5750409, патенте США №5366860, патенте США №5231191, патенте США №5227487, WO 97/36960, WO 99/27020, Lee et al., 1992, Nucl. Acids Res. 20:2471-2483; Arden-Jacob, "Neue Lanwellige Xanthen Farbstoffe  FluoreszenZSonden und Farbstoff Lauer, Springer-Verlag, Germany, 1993; Sauer et al., 1995, Fluorescence 5:247-261; Lee et al., 1997, Nucl. Acids Res. 25:2816 2822; и Rosenblum et al., 1997, Nucl. Acids Res. 25:4500 4504, описания которых включены в данный документ посредством ссылки. Любой из красителей, описанных в этих ссылках, в которых экзоциклические амины представляют собой первичные или вторичные амины, описанные в данном документе, или 4,7-дихлор-аналоги таких NH-родаминовых красителей, может быть включен во фрагмент-метку описанных в данном документе реагентов.
FluoreszenZSonden und Farbstoff Lauer, Springer-Verlag, Germany, 1993; Sauer et al., 1995, Fluorescence 5:247-261; Lee et al., 1997, Nucl. Acids Res. 25:2816 2822; и Rosenblum et al., 1997, Nucl. Acids Res. 25:4500 4504, описания которых включены в данный документ посредством ссылки. Любой из красителей, описанных в этих ссылках, в которых экзоциклические амины представляют собой первичные или вторичные амины, описанные в данном документе, или 4,7-дихлор-аналоги таких NH-родаминовых красителей, может быть включен во фрагмент-метку описанных в данном документе реагентов.
[0112] Поскольку описанные в данном документе реагенты будут использоваться для химического синтеза меченых олигонуклеотидов, R5 может представлять собой защитную группу, устойчивую в условиях органического синтеза, используемых для синтеза олигонуклеотидов. Как упоминалось выше, R5 может представлять собой защитную группу, которая защищает амин в форме амида, например, карбоксамида, сульфонамида или фосфорамида, может быть выбрана для защиты экзоциклического амина указанным образом и, как полагают, может «блокировать» защищенный NH-родамин в закрытой лактонной форме, обеспечивая стабильность описанных в данном документе реагентов. Хотя это и не требуется, может быть удобно использовать защитную группу R5, которая является неустойчивой в условиях, используемых для удаления групп, защищающих экзоциклические амины азотистого основания синтетического олигонуклеотида, так что защитную группу можно удалить за один этап.
[0113] Условия, используемые для синтеза и снятия защиты с синтетических олигонуклеотидов, хорошо известны в данной области техники и описаны, например, в Current Protocols in Nucleic Acid Chemistry, Vol. I, Beancage et al., Eds. John Wiley & Sons, 2002, описание которого включено в данный документ посредством ссылки. Вкратце, способы синтеза, в которых используются фосфорамидитные реагенты, включают несколько циклов: (1) снятие защиты с ДМТ (DMT) для обнажения свободного гидроксила, что может быть осуществлено обработкой 2,5% или 3%-ной ди- или трихлоруксусной кислотой в дихлорметане; (2) сочетание нуклеозидных или других фосфорамидитных реагентов со свободным гидроксилом, которое может проводиться в ацетонитриле, содержащем 0,45 М или 0,5 М тетразола; (3) окисление, которое может осуществляться обработкой I2/2,6-лутидином/H2O, и кэпирование, которое может осуществляться обработкой 6,5%-ным уксусным ангидридом в тетрагидрофуране (ТГФ) с последующей обработкой 10%-ным 1-метилимидазолом (МИ) в ТГФ.
[0114] Другие условия проведения различных этапов синтеза также известны в данной области техники. Например, сочетание фосфорамидита может осуществляться в ацетонитриле, содержащем 0,25 М 5-этилтио-1H-тетразола, 0,25 М 4,5-дицианоимидазола (ДЦИ) или 0,25 М 5-бензилтио-1H-тетразола (БТТ). Окисление может осуществляться в 0,1 М, 0,05 М или 0,02 М I2 в ТГФ/H2O/пиридине (7:2:1). Кэпирование может осуществляться обработкой ТГФ/лутидином/уксусным ангидридом с последующей обработкой 16%-ным NMИ в ТГФ: обработкой 6,5%-ным ДМАП в ТГФ с последующей обработкой 10% Melm в ТГФ или обработкой 10% Melm в ТГФ с последующей обработкой 16% Melm в ТГФ.
[0115] Удаление любых защитных групп и отщепление от реагента для синтеза, как правило, может осуществляться обработкой концентрированным гидроксидом аммония при 60°С в течение 1-12 часов, хотя в данной области техники также известны нуклеозид-фосфорамидитные реагенты, защищенные группами, которые можно удалить при более мягких условиях, например, обработкой концентрированным гидроксидом аммония при комнатной температуре в течение 4-17 часов, или обработкой 0,05 М карбонатом калия в метаноле, или обработкой 25%-ным трет-бутиламином в НО/EtOH. Квалифицированные специалисты легко смогут выбрать защитные группы, обладающие свойствами, подходящими для использования в конкретных условиях синтеза и снятия защиты и/или отщепления. Широкое разнообразие защитных аминогрупп описано, например, в Greene & Wuts, "Protective Groups In Organic Chemistry". 3d Edition, John Wiley & Sons, 1999 (далее в данном документе "Green & Wuts"), например, на страницах 309-405. Квалифицированные специалисты могут легко выбрать защитные группы R5 или R10, обладающие подходящими свойствами, из числа тех, которые описаны в Green & Wuts. В некоторых вариантах реализации изобретения защитные группы R5 или R10 представляют собой ацильные группы Формулы -C(O)R15, где R15 выбран из водорода, низшего алкила, метила, -СХ3, -СНХ2, -CH2X, -СН, Od и фенила, необязательно монозамещенного низшим алкилом, метилом, X, ORd, циано или нитрогруппой, где R'' выбран из низшего алкила, фенила и пиридила, и каждый X представляет собой галогеновую группу, как правило, фтор или хлор. В некоторых вариантах реализации изобретения R15 представляет собой метил. В некоторых вариантах реализации изобретения R15 представляет собой трифторметил. Ацильные защитные группы, такие как группы, определенные как -C(O)R15, могут быть удалены при различных основных условиях, включая мягкие условия, используемые для удаления защитных групп из олигонуклеотидов, синтезированных с помощью «неустойчивых к основанию» фосфорамидитных реагентов, хорошо известных в данной области техники. В некоторых вариантах реализации изобретения R5 представляет собой -C(O)R15, где R15 выбран из группы, состоящей из водорода, низшего алкила, -СХ3, -СНХ2, -CH2X, -CH2-ORd, и фенила, необязательно монозамещенного низшим алкилом, -X, -ORd, циано или нитрогруппой, где Rd выбран из группы, состоящей из низшего алкила, фенила и пиридила, и каждый X представляет собой галогеновую группу. Типичные условия, которые можно использовать, указаны выше. Как будет описано более подробно в последующих разделах, N-защищенный NH-родаминовый фрагмент молекулы, содержащий фрагмент-метку, может быть связан с другими группами или фрагментами молекул. Например, N-защищенный NH-родамин может быть связан с другим красителем, содержащим фрагмент-метку, с группой PEP, с линкером, с маркером синтеза, с фрагментом молекулы для гашения, с фрагментом, который стабилизирует спаривания оснований (такие как, например, интеркалирующий краситель или молекула, связывающаяся с малой бороздой) или с другими фрагментами молекул. Такие связи, как правило, осуществляются через линкерные группы LG (описанные выше для линкеров), присоединенные к N-защищенным NH-родаминовым синтонам, используемым для синтеза реагентов.
[0116] Линкерная группа LG может быть присоединена к любому доступному атому углерода N-защищенного NH-родаминового синтона или к группе заместителя, присоединенной к одному из этих атомов углерода. Положения линкерных групп могут частично зависеть от группы или фрагмента молекулы, к которым будет присоединен N-защищенный NH-родаминовый синтон. В некоторых вариантах реализации изобретения линкерная группа присоединена в положении С1', С2', С4', С5', С7', С8', С5, С6 или С7 N-защищенного NH-родаминового синтона. В конкретном варианте реализации изобретения линкерная группа присоединена в положении С4', С5', С5 или С6.
[0117] N-защищенный NH-родаминовый синтон может содержать одну линкерную группу LG или может содержать более одной линкерной группы LG. В вариантах реализации изобретения, в которых используется более одной линкерной группы, линкерные группы могут быть одинаковыми или разными. N-защищенные NH-родаминовые синтоны, которые содержат множество линкерных групп LG, которые отличаются друг от друга, могут содержать разные группы или фрагменты молекул, присоединенные в разных положениях исходного NH-родаминового кольца с использованием ортогональной химии. Отличительные характеристики линкерной группы могут в некоторых случаях зависеть от ее местоположения в исходном NH-родаминовом кольце. В некоторых вариантах реализации изобретения, в которых линкерная группа LG присоединена в положении С4' или С5' исходного NH-родаминового кольца, линкерная группа LG представляет собой группу Формулы -(CH)n-Fy, где n представляет собой целое число в диапазоне от 0 до 10, и Fy описан в данном документе. В некоторых вариантах реализации изобретения n равно 1, a Fy представляет собой -NH.
[0118] В некоторых вариантах реализации изобретения, в которых линкерная группа LG присоединена в положении 5 или 6 исходного NH-родаминового кольца, линкерная группа LG представляет собой группу Формулы -(СН2)n, -C(O)ORf, где Rf выбран из водорода и подходящей замещаемой группы, а n определен ранее. В некоторых конкретных вариантах реализации изобретения линкерная группа LG включает эфир NHS. В некоторых конкретных вариантах реализации изобретения n равно 0, a Rf представляет собой NHS.
[0119] В некоторых вариантах реализации изобретения N-защищенный NH-родамин содержит фрагмент-метку различных реагентов, описанных в данном документе.
[0120] Как обсуждалось ранее, фрагмент-метка может содержать один или более дополнительных красителей, так что N-защищенный NH-родамин после снятия защиты становится членом более крупной сети красителей переноса энергии. Такие сети красителей переноса энергии хорошо известны в данной области техники и включают комбинации флуоресцентных красителей, спектральные свойства которых совпадают и/или чьи относительные расстояния друг до друга регулируются, так что один флуоресцентный краситель в сети при возбуждении случайным облучением соответствующей длины волны передает свою энергию возбуждения другому флуоресцентному красителю в сети, который затем передает свою энергию возбуждения еще одному флуоресцентному красителю в сети, и так далее, что приводит к флуоресценции конечного акцепторного красителя в сети. Сети красителей дают фрагменты-метки, имеющие длинные сдвиги Стокса. В таких сетях флуорофоры, которые передают или отдают свою энергию возбуждения другому флуорофору в сети, именуются «донорами». Флуорофоры, которые получают или принимают энергию возбуждения от другого флуорофора, именуются «акцепторами». В сетях красителей, содержащих только два флуоресцентных красителя, один действует как донор, а другой - как акцептор. В сетях красителей, содержащих три или более флуоресцентных красителей, по меньшей мере один краситель действует как донор, так и акцептор. Принципы работы сетей красителей, а также критерии выбора и связывания отдельных красителей, подходящих для создания таких сетей, хорошо известны и описаны, например, в Hung et al., 1997, Anal. Biochem. 252:78-88.
[0121] В описанных в данном документе фрагментах-метках, которые содержат сеть красителей, N-защищенный NH-родаминовый краситель после снятия защиты может действовать как донор или акцептор, или как донор, так и акцептор, в зависимости от отличительных характеристик других красителей, входящих в состав сети, и целевой длины падающих и флуоресцентных волн. Многочисленные красители, подходящие для использования в качестве доноров и/или акцепторов для NH-родаминовых красителей, известны в данной области техники и включают в качестве примера, но не ограничения, ксантеновые красители (такие как, например, флуоресцеиновые, родаминовые и родоловые красители), пиреновые красители, кумариновые красители (например, гидрокси- и аминокумарины), цианиновые красители, фталоцианиновые красители и лантенидные комплексы. Конкретные неограничивающие примеры этих красителей в контексте сетей красителей переноса энергии описаны в Hung et al., 1996, Anal. Biochem. 238:165-170; Medintz et al., 2004, Proc. Nat'l Acad. Sci. USA 101(26):9612-9617; патенте США №5800996; Sudhaker et al., 2003, Nucleosides, Nucleotides & Nucleic Acids 22:1443-1445; патенте США №6358684; Majumdar et al., 2005, J. Mol. Biol. 351:1123-1145; Dietrich et al., 2002, Reviews Mol. Biotechnology. 82(3):211-231; Tsuji et al., 2001, Biophysical J. 81(1):501-515; Dickson et al., 1995, J. Photochemistry & Photobiology 27(1):3-19; и Kumar et al., 2004, Developments in Nucl. Acid Res. 1:251-274, описания которых включены в данный документ посредством ссылок. Любой из этих красителей, который можно надлежащим образом защитить в соответствии с описанными в данном документе принципами, можно использовать в качестве донорных и акцепторных красителей во фрагментах-метках, которые содержат сети красителей. В некоторых вариантах реализации изобретения один или более донорных и/или акцепторных красителей, составляющих сеть, могут представлять собой N-защищенный NH-родаминовый краситель, описанный в данном документе. Конкретные положения для присоединения донорных и/или акцепторных красителей к родаминовым красителям с образованием сетей красителей, а также конкретные связи и линкеры, пригодные для присоединения таких красителей, хорошо известны в данной области техники. Конкретные примеры описаны, например, в патенте США №6811979, патенте США №6008379, патенте США №5945526, патенте США №5863727 и патенте США №5800996, описания которых включены в данный документ посредством ссылки.
[0122] В некоторых вариантах реализации изобретения линкер, связывающий донорный и акцепторный красители, представляет собой анионный линкер, описанный в патенте США №6811979, описание которого включено в данный документ посредством ссылки (см., например, раскрытие в столбце 17, строке 25 - столбце 18, строке 37 и Фиг. 1-17).
[0123] В некоторых вариантах реализации реагентов, описанных в данном документе, фрагмент-метка включает донорный краситель для NH-родаминового красителя. В некоторых вариантах реализации изобретения донорный краситель представляет собой флуоресцеиновый или родаминовый краситель, такой как, например, один из описанных в данном документе NH-родаминовых красителей. В конкретном варианте реализации изобретения донорный краситель представляет собой флуоресцеиновый краситель. Флуоресцеиновые красители сходны по структуре с красителями родаминового ряда, за исключением того, что 3- и 6-положения исходного ксантенового кольца (соответствующие 3'- и 6'-положениям NH-родаминовых колец структурной Формулы (Ia)), замещены гидроксильными группами. Подобно родаминам, флуоресцеины также могут иметь удлиненные кольцевые структуры, в которых атомы углерода в положениях С3' и С4' и/или С5' и С6' исходного ксантенового кольца включены в арильные мостики, такие как бензогруппы. Следовательно, флуоресцеины, как правило, включают соединения структурных Формул (IVa), (IVb) и (IVc), приведенных ниже:
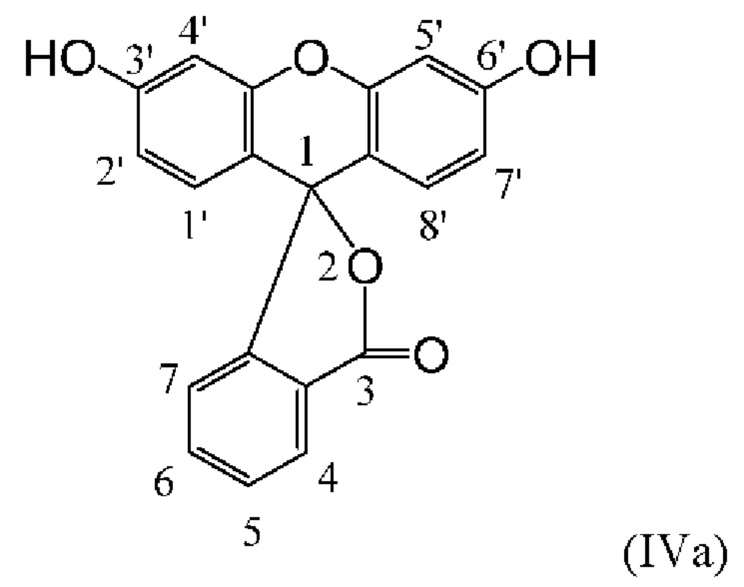
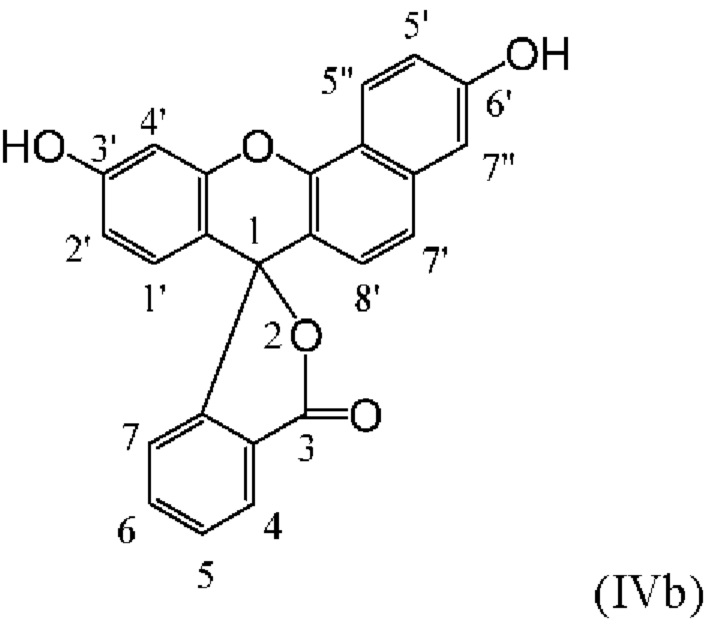
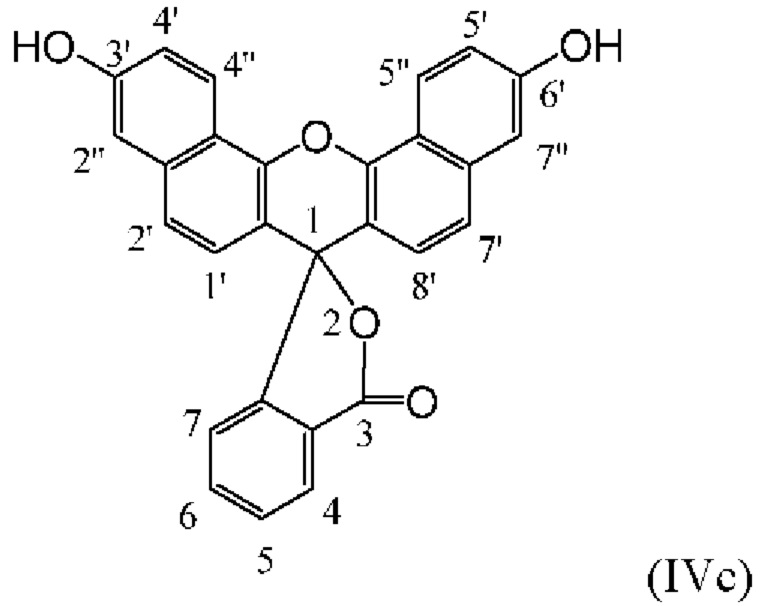
[0124] Как и NH-родамины, атомы углерода в положениях С1', С2', С2'', С4', С4'', С5', С5'', С7', С7'', С8', С4, С5, С6 и С7 флуоресцеинового кольца структурных Формул (IVa), (IVb) и (IVc) могут быть замещены множеством различных заместителей, таких как те, которые описаны ранее для NH-родаминов.
[0125] При введении в описанные в данном документе фрагменты-метки гидроксилы в положениях С3' и С6' должны быть защищены защитными группами, имеющими те же общие свойства, что и группы, защищающие экзоциклические амины NH-родаминов, обсуждаемые выше. Следовательно, в конкретных вариантах реализации изобретения защитные группы являются стабильными в условиях, используемых для синтеза олигонуклеотидов, таких как условия, используемые для синтеза и окисления олигонуклеотидов с помощью фосфиттриэфирного метода, и являются неустойчивыми в условиях, обычно используемых для снятия защиты и/или отщепления синтетических олигонуклеотидов от синтетической смолы, таких как, например, инкубация в концентрированном гидроксиде аммония при комнатной температуре или при 55°С.
[0126] Флуоресцеины, в которых экзоциклические гидроксилы С3' и С6' включают защитные группы, именуются в данном документе «О-защищенными флуоресцеинами». О-защищенные флуоресцеины, соответствующие флуоресцеинам структурных Формул (IVa), (IVb) и (IVc), соответственно, изображены как структурные Формулы (Va), (Vb) и (Vc) ниже:
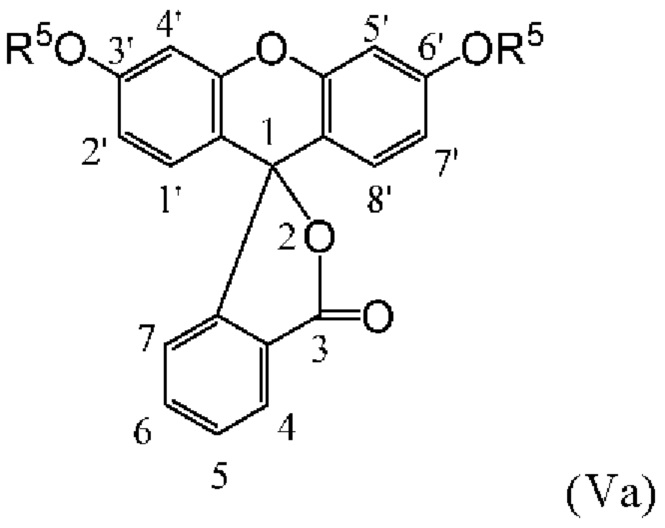
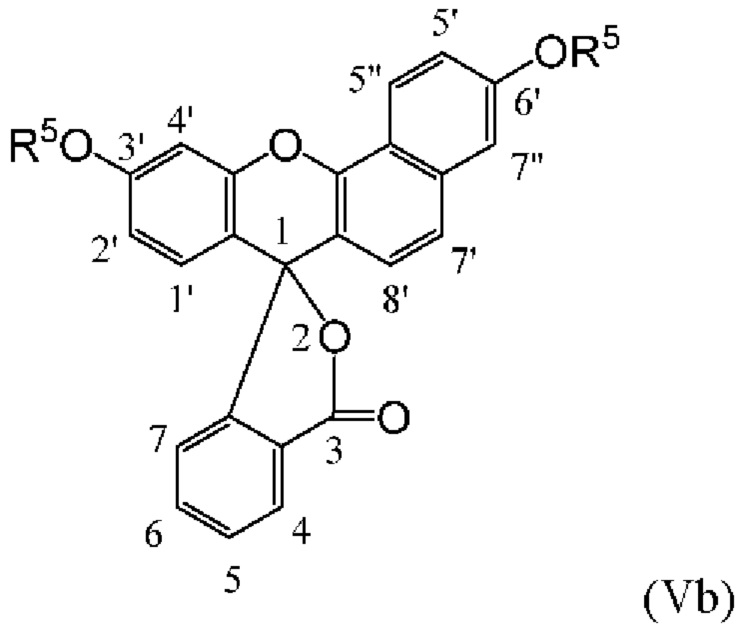
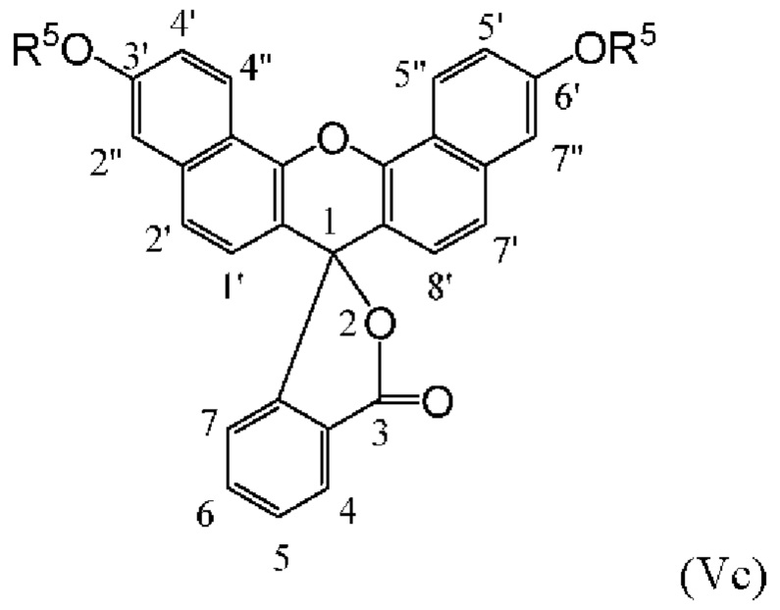
[0127] где R5 представляет собой защитную группу.
[0128] В данной области техники известно множество различных флуоресцеиновых красителей, которые могут быть подходящим образом защищены и введены во фрагменты-метки для использования в качестве доноров для NH-родамина. Конкретные типичные флуоресцеиновые красители описаны, например, в патенте США №6221604, патенте США №6008379, патенте США №5840999, патенте США №5750409, патенте США №5654441, патенте США №5188934, патенте США №5066580, патенте США №4481136, патенте США №4439356, WO 99/16832 и ЕР 0050684, описания которых включены в данный документ посредством ссылки. Квалифицированные специалисты смогут выбрать флуоресцеин, обладающий спектральными свойствами, подходящими для использования в качестве донора для конкретного NH-родамина. Конкретные варианты реализации исходных влуоресцеиновых красителей, которые могут быть включены во фрагменты-метки описанных в данном документе реагентов, изображены на Фиг. 1С.
[0129] Донор и N-защищенный NH-родаминовый акцептор могут быть связаны друг с другом в различных расположениях либо напрямую, либо с помощью линкера. В некоторых вариантах реализации изобретения, в которых донор представляет собой О-защищенный флуоресцеин или N-защищенный NH-родамин, донор связан с С2'-, С4'-, С5'-, С7'-, С5- или С6-положением N-защищенного NH-родаминового акцептора через его С2'-, С2''-, С4'-, С5'-, С7'-, С7''-, С5- или С6-положение.
[0130] Конкретные типичные расположения связей представлены в Таблице 2 ниже:

[0131] Фрагменты-метки, содержащие сети красителей, такие как донорно-акцепторные сети красителей из Таблицы 2, могут быть связаны с остатком реагента в любом доступном положении. В некоторых вариантах реализации изобретения фрагменты-метки, содержащие связанные голова к голове пары акцептор/донор, присоединены к остатку реагента через положение С5 или С6 донорного или акцепторного фрагмента. В некоторых вариантах реализации изобретения фрагменты-метки, содержащие связанные голова к хвосту пары акцептор/донор, присоединены к остатку реагента через доступное положение С4', С5', С5 или С6 донорного или акцепторного фрагмента. В некоторых вариантах реализации изобретения фрагменты-метки, содержащие связанные хвост к хвосту пары акцептор/донор, присоединены к остатку реагента через положение С4' или С5' донора или акцептора. В некоторых вариантах реализации изобретения фрагменты-метки, содержащие связанные сторона к стороне пары акцептор/донор, присоединены к остатку реагента через положение С4', С5', С5 или С6 донора или акцептора. В некоторых вариантах реализации изобретения фрагменты-метки, содержащие связанные сторона к голове пары акцептор/донор, присоединены к остатку реагента через доступное положение С4', С5', С5 или С6 донора или акцептора. В некоторых вариантах реализации изобретения фрагменты-метки, содержащие связанные сторона к хвосту пары акцептор/донор, присоединены к остатку реагента через доступное положение С4', С5', С5 или С6 донора или акцептора.
[0132] Независимо от их положения, О-защищенный флуоресцеиновый донор или N-защищенный NH-родаминовый донор и N-защищенный NH-родаминовый акцептор, как правило, связаны друг с другом через линкер. Ранее было обнаружено, что может быть выгодно связывать такие донорные и акцепторные красители через линкеры, которые являются жесткими по природе и/или относительно длинными, например, в диапазоне около 12-20 ангстрем в длину (используемая в данном документе «длина» линкера относится к расстоянию между связанными фрагментами, определенному путем вычисления суммы длин химических связей, определяющих самый короткий непрерывный путь между фрагментами). Не ограничиваясь какой-либо теорией действия, считается, что линкеры, которые имеют тенденцию удерживать донор и акцептор в непосредственной близости друг от друга, не позволяя их хромофорам соприкасаться друг с другом, обеспечивают достаточно эффективный перенос энергии. В этом отношении жесткость и длина линкера являются связанными параметрами. Как правило, более короткие линкеры (например, линкеры длиной от 5 до 12 Ангстрем) должны обладать большей степенью жесткости. Более длинные линкеры (например, линкеры длиной в диапазоне от около 15 до 30 Ангстрем) могут иметь меньшую степень жесткости или даже не иметь жесткости. Следует избегать коротких, нежестких (гибких) линкеров.
[0133] Жесткость может быть достигнута за счет использования групп, которые имеют ограниченные углы вращения вокруг своих связей, например, за счет использования ариленовых или гетероариленовых фрагментов и/или алкиленовых фрагментов, которые содержат двойные и/или тройные связи. В данной области техники известны различные линкеры, используемые для связывания родаминовых и флуоресцеиновых красителей друг с другом в контексте красителей переноса энергии, и они описаны, например, в патенте США №5800996, описание которого включено в данный документ посредством ссылки. Конкретные примеры линкеров, используемых для связывания О-защищенных флуоресцеиновых или N-защищенных NH-родаминовых доноров с N-защищенными NH-родаминовыми акцепторами в описанных в данном документе фрагментах-метках, включают, в качестве примера, но не ограничения, группы Формулы:
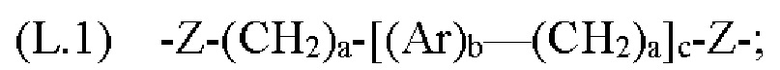
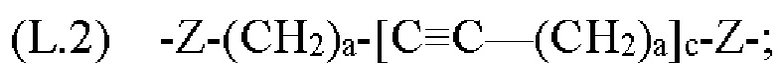
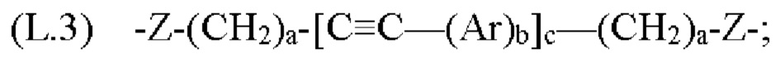
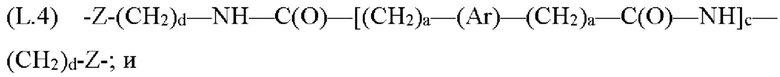
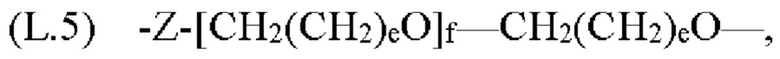
где каждый Z независимо от других представляет собой часть связи, вносимую линкерной группой Fz, описанной ранее; каждый а представляет собой, независимо от других, целое число в диапазоне от 0 до 4; каждый b представляет собой, независимо от других, целое число в диапазоне от 1 до 2; каждый с представляет собой, независимо от других, целое число в диапазоне от 1 до 5; каждый d представляет собой, независимо от других, целое число в диапазоне от 1 до 10; каждый е представляет собой, независимо от других, целое число в диапазоне от 1 до 4; каждый f представляет собой, независимо от других, целое число в диапазоне от 1 до 10; и каждый Ar представляет собой, независимо от других, необязательно замещенную моноциклическую или полициклическую циклоалкиленовую, циклогетероалкиленовую, ариленовую или гетероариленовую группу. Неограничивающие типичные варианты реализации Ar включают группы, полученные из низших циклоалканов, низших циклогетероалканов, исходных ароматических кольцевых систем и исходных гетероароматических кольцевых систем, описанных ранее. Конкретные неограничивающие типичные варианты реализации Ar включают циклогексан, пиперазин, бензол, нафталин, фенол, фуран, пиридин, пиперидин, имидазол, пирролидин и оксадизол. Конкретные неограничивающие типичные варианты реализации линкеров изображены на Фиг. 1. На Фиг. 1, каждый Z1 и Z2, независимо друг от друга, представляет собой часть связи, вносимую функциональной группой Fz, описанной ранее, и K выбран из -СН- и -N-. В некоторых конкретных вариантах реализации линкеров, изображенных на Фиг. 2, один из Z1 или Z2 представляет собой -NH-, а другой выбран из -О-, -С(О)- и S(O)2-.
[0134] В вариантах реализации изобретения линкер, связывающий донорный и акцепторный красители, представляет собой анионный линкер, описанный в патенте США №6811979, описание которого включено в данный документ посредством ссылки (см., например, описание в столбце 17, строке 25 - столбце 18, строке 37 и Фиг. 1-17). Конкретные, неограничивающие типичные варианты реализации подходящих анионных линкеров включают линкеры Формул (L.1)-(L.4), приведенных выше, в которых одна или более групп Ar замещены одной или более группами заместителей, имеющими отрицательный заряд в условиях использования, таких как, например, при рН в диапазоне от около рН 7 до около рН 9. Конкретные неограничивающие примеры подходящих групп заместителей включают сложные фосфатные эфиры, сложные сульфатные эфиры, сульфонатные и карбоксилатные группы.
[0135] В некоторых вариантах реализации изобретения линкер, связывающий донорный и акцепторный красители, представляет собой анионный линкер, описанный в патенте США №6811979, описание которого включено в данный документ посредством ссылки (см., например, описание в столбце 17, строке 25 - столбце 18, строке 37 и Фиг. 1-17). Конкретные, неограничивающие типичные варианты реализации подходящих анионных линкеров включают линкеры Формул (L.1)-(L.4), приведенных выше, в которых одна или более групп Ar замещены одной или более группами заместителей, имеющими отрицательный заряд в условиях использования, таких как, например, при рН в диапазоне от около рН 7 до около рН 9. Конкретные неограничивающие примеры подходящих групп заместителей включают сложные фосфатные эфиры, сложные сульфатные эфиры, сульфонатные и карбоксилатные группы.
[0136] Б некоторых вариантах реализации изобретения фрагмент-метка имеет Формулу (VI):
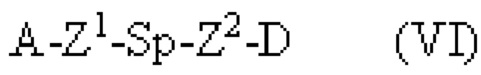
где А представляет собой N-защищенный NH-родаминовый акцептор; D представляет собой донор, например, N-защищенный NH-родаминовый или О-защищенный флуоресцеиновый донор; Z1 и Z2 представляют собой части связей, вносимые линкерными фрагментами, содержащими функциональную группу Fz, описанную ранее; и Sp представляет собой спейсерный фрагмент, описанный ранее. В некоторых конкретных вариантах реализации изобретения А представляет собой N-защищенный NH-родаминовый фрагмент, описанный в данном документе, и D выбран из группы, состоящей из фрагментов, имеющих структурные формулы D.1, D.2, D.3, D.4, D.5, D.6, D.7, D.8, D.9, D.10, D.11 и D.12:
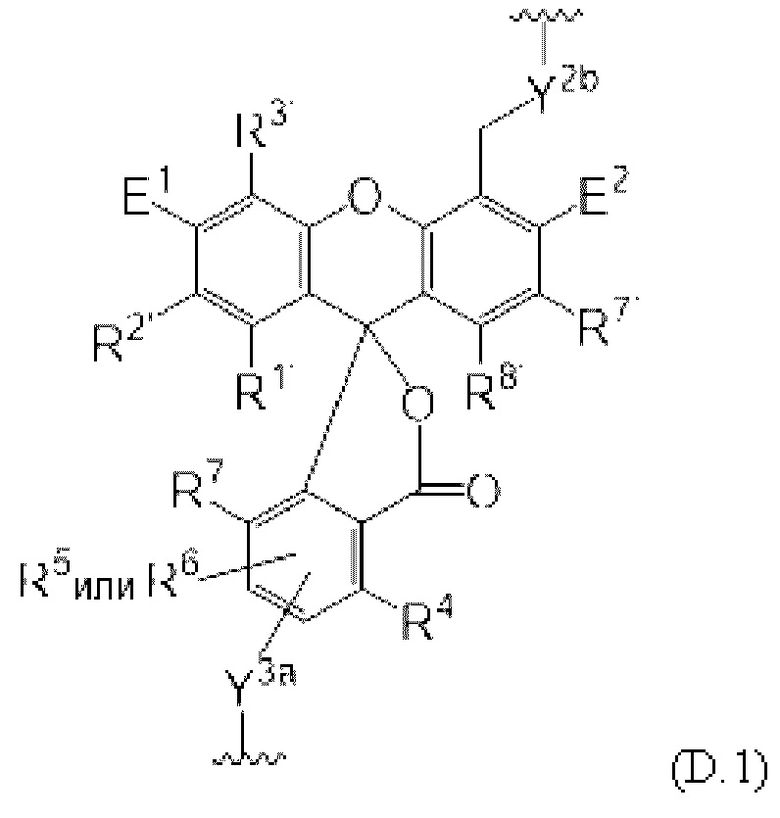
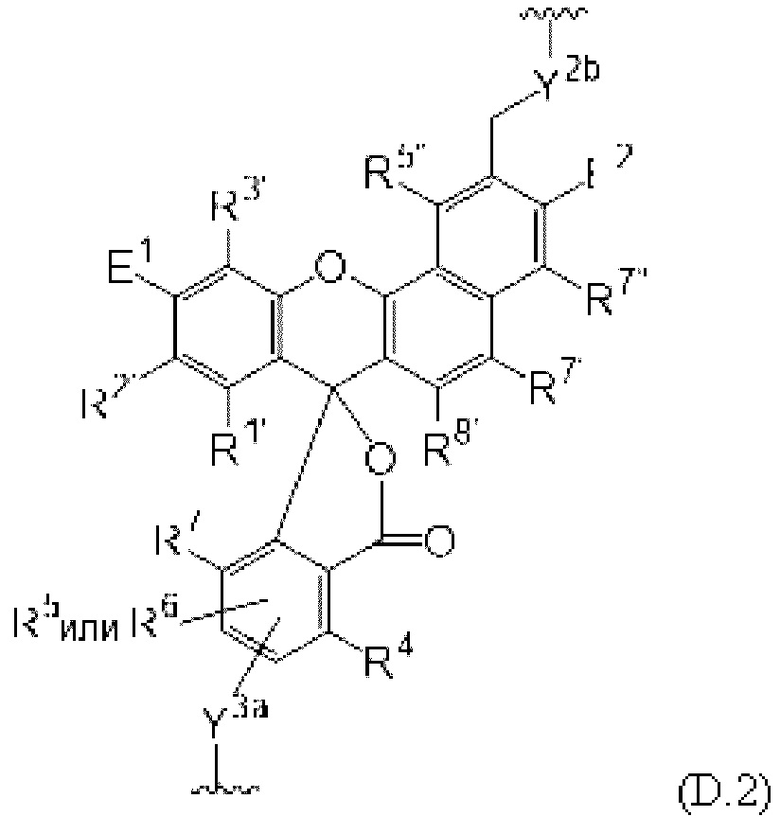
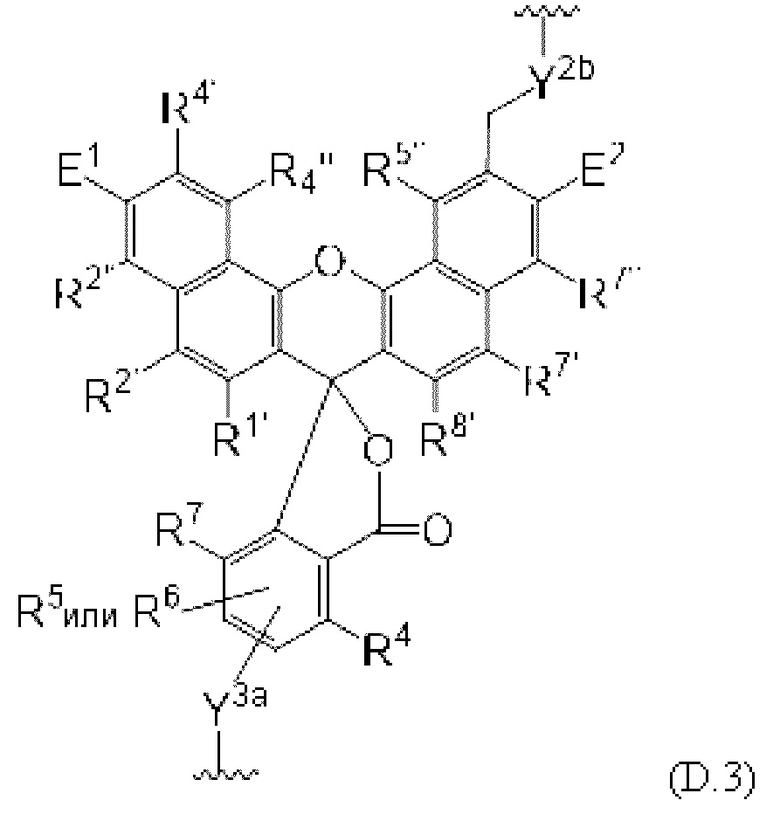
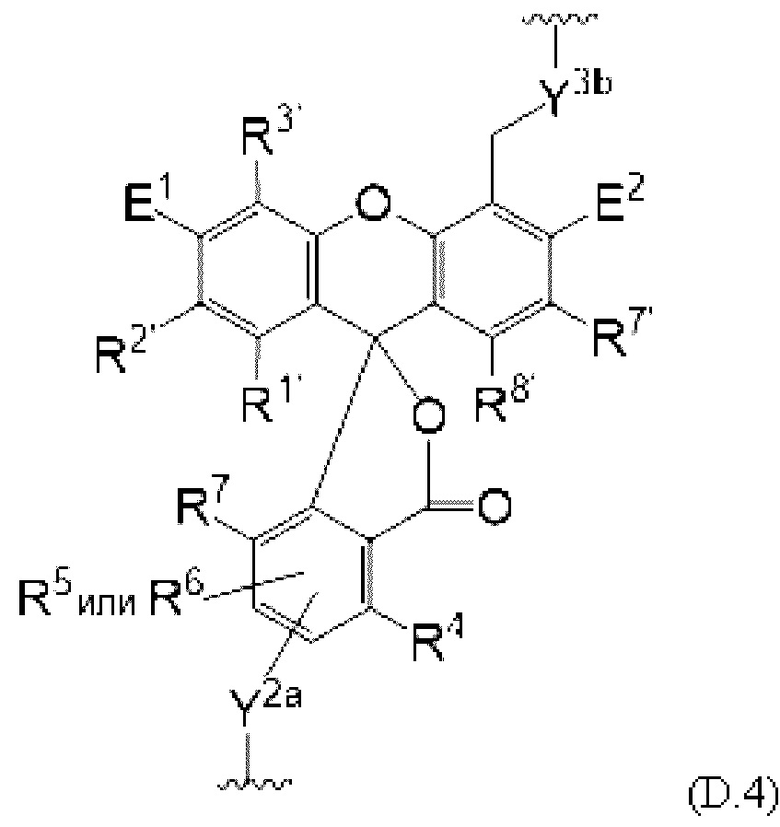
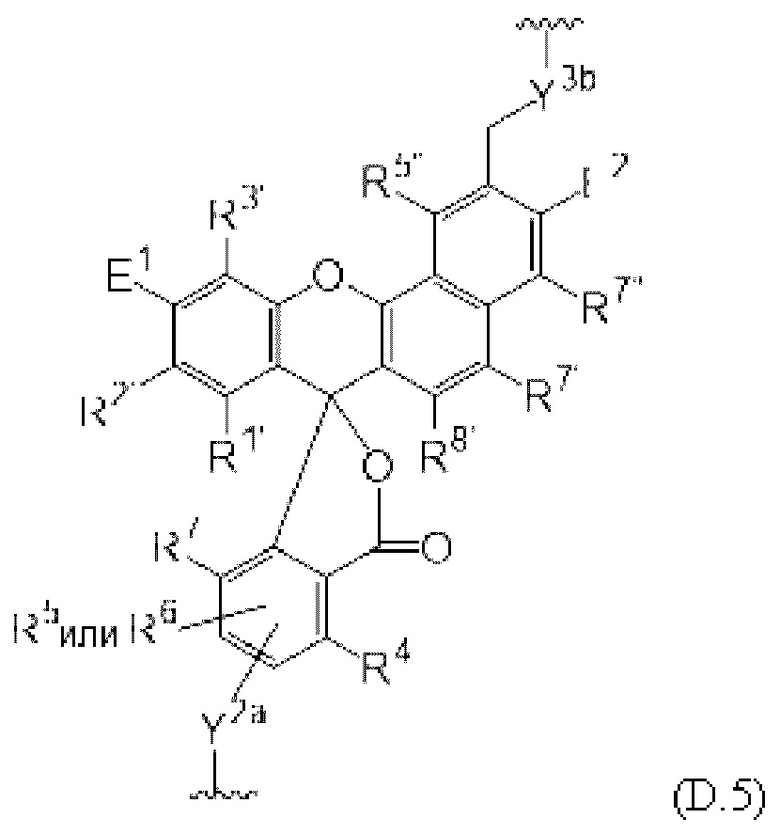
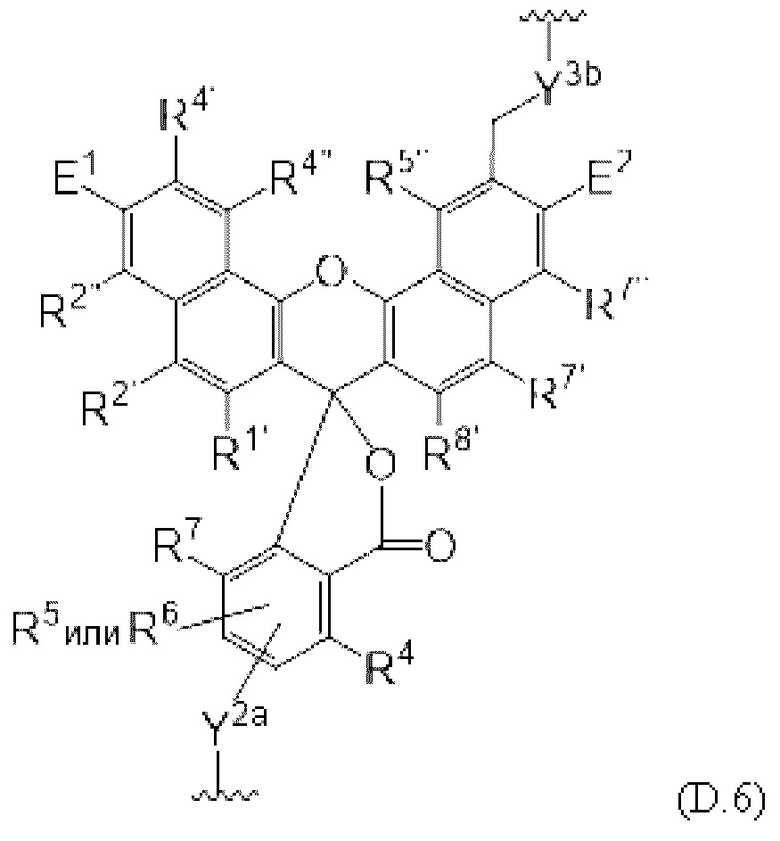
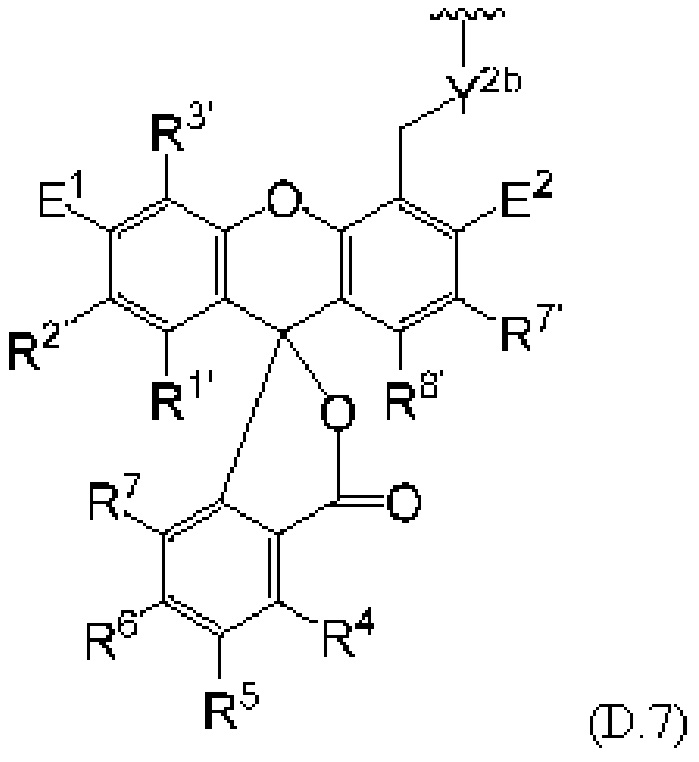
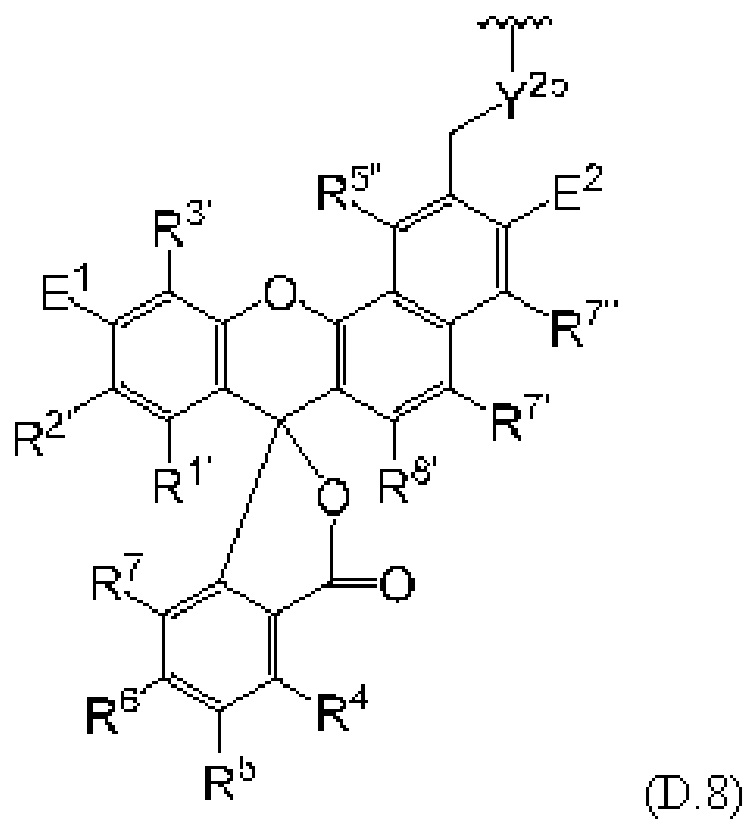
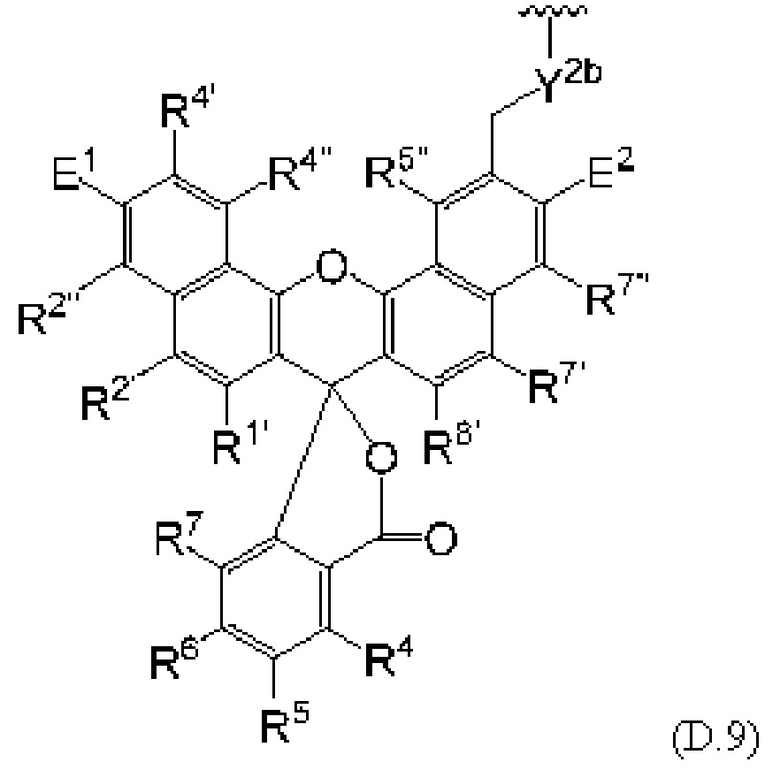
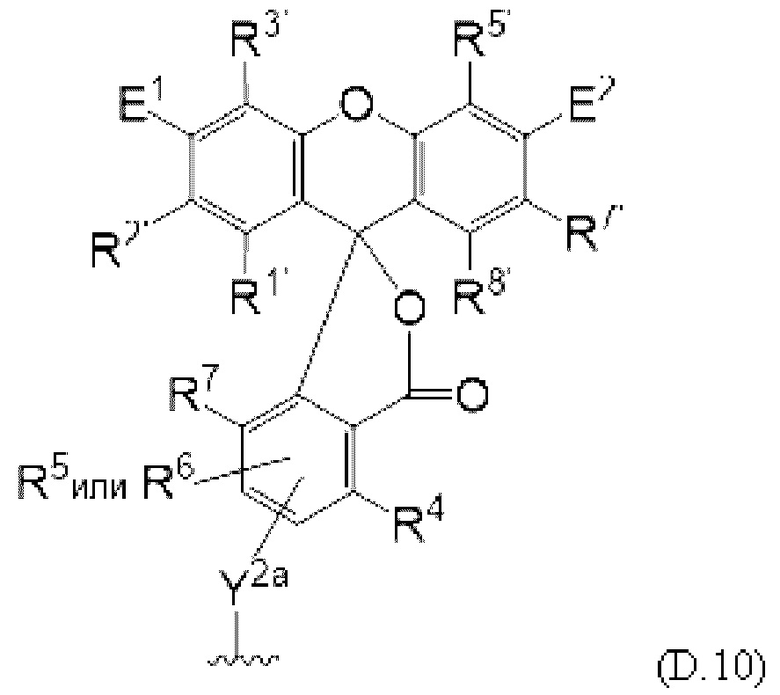
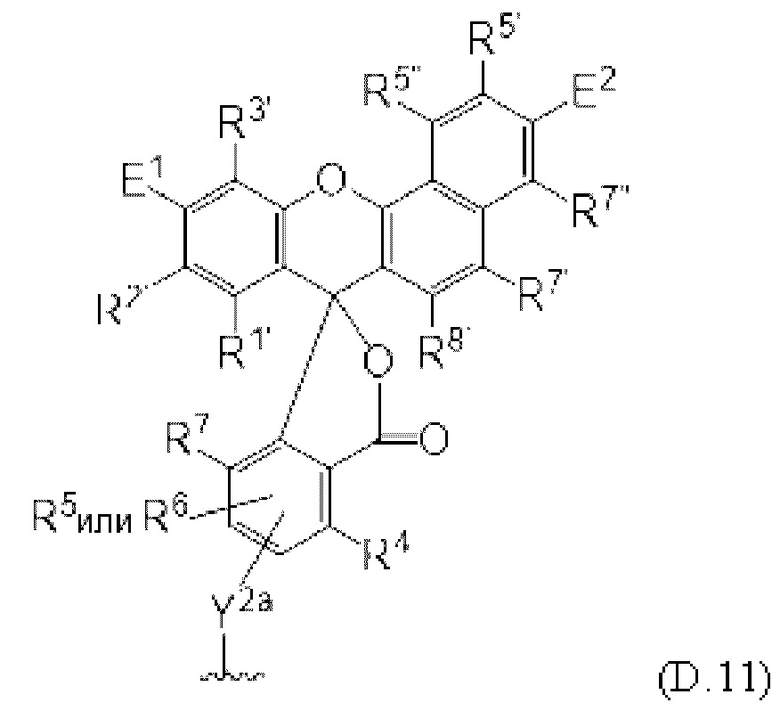
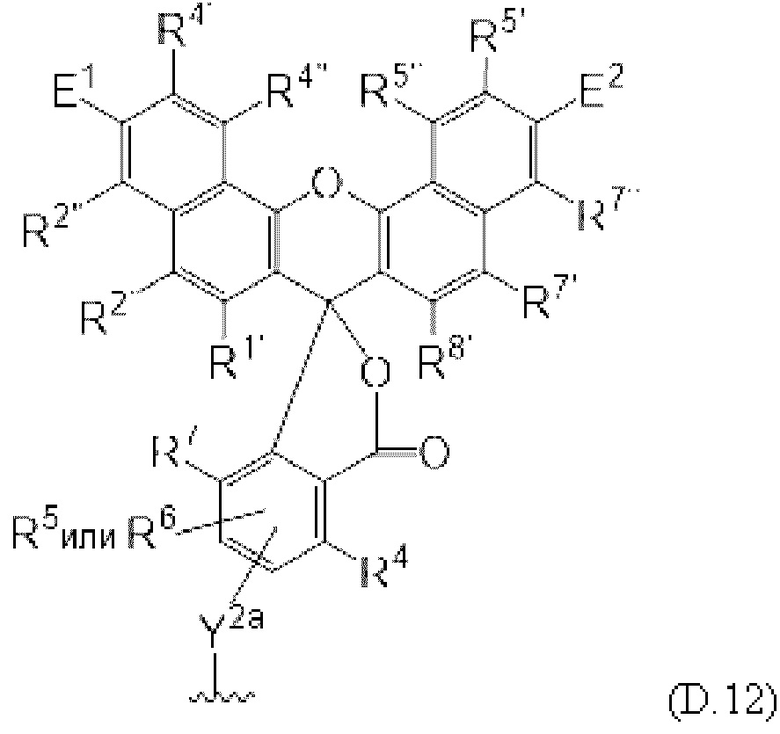
[0137] причем в каждой из D.1-D.12:
[0133] каждый из R1', R2', R2'', R4', R4'', R5', R5'', R7', R7'', и R8', взятый отдельно, независимо выбран из группы, состоящей из водорода, низшего алкила, (С6-С14)-арила, (С7-С20)-арилалкила, 5-14-членного гетероарила, 6-20-членного гетероарилалкила, Rb и -(СН2)x-Rb, где х представляет собой целое число, имеющее значение от 1 до 10, и Rb выбран из группы, состоящей из -X, -ОН, -ORa -SH, -SRa -NH2, -NHRa -NRcRc, -N+RcRcRc, низшего пергалогеналкила, тригалогенметила, трифторметила, -Р(O)(ОН)2, -P(O)(ORa)2, P(O)(OH)(ORa), -ОР(O)(ОН)2, -OP(O)(ORa)2, -OP(О)(ORa)(ОН), -S(O)2OH, -S(O)2Ra, -С(O)Н, -C(O)Ra, -C(S)X, -C(O)OH, -C(O)NH2, -C(O)NHRa, -C(O)NRcRc, -C(S)NH2, -C(O)NHRa, -C(O)NRcRc, -C(NH)NH2, -C(NH)NHRa и -C(NH)NRcRc, где X представляет собой галоген, каждый Ra независимо выбран из группы, состоящей из низшего алкила, (С6-С14)-арила, (С7-С20)-арилалкила, 5-14-членного гетероарил и 6-20-членного гетероарилалкила, и каждый Rc независимо представляет собой Ra, или, в альтернативном варианте, два Rc, связанные с одним и тем же атомом азота, вместе с этим атомом азота могут образовывать 5-8-членное насыщенное или ненасыщенное кольцо, которое необязательно может содержать один или более одинаковых или разных циклообразующих гетероатомов, выбранных из группы, состоящей из О, N и S;
[0139] или, в альтернативном варианте, R1' и R2' или R7' и R8' вместе с атомами углерода, с которыми они связаны, образуют необязательно замещенный (С6-С14)-арильный мостик и/или R4' и R4'' и/или R5' и R5'' вместе с атомами углерода, с которыми они связаны, образуют бензогруппу; и
[0140] каждый R4, R5, R6 и R7 независимо друг от друга выбран из водорода, низшего алкила, (С6-С14)-арила, (С7-С20)-арилалкила, 6-14-членного гетероарила, 7-20 членного гетероарилалкила, -Rb и -(СН2)х-Rb;
[0141] Е1 выбран из группы, состоящей из -NHR9, -NR9R10 и -OR9b;
[0142] Е2 выбран из группы, состоящей из -NHR9, -NR9R10 и -OR9b;
[0143] R9 и R10 описаны в данном документе;
[0144] R9b представляет собой R9;
[0145] каждый из Y1a, Y1b, Y2a, Y2b, Y3a и Y3b независимо выбран из группы, состоящей из -О-, -S-, -NH-, -С(O-) and -S(O)2,
[0146] при условии, что когда каждый из Е1 и Е2 представляет собой -OR9b, тогда R1' и R2' и/или R7' и R8' только вместе с атомами углерода, с которыми они связаны, могут образовывать необязательно замещенный (С6-С14)-арильный мостик. Используемый в данном документе термин «асимметричные родамины» означает соединения, в которых Е1 и Е2 независимо представляют собой -NHR9 или -NR9R10, а Е1 и Е2 не одинаковы.
[0147] В некоторых конкретных вариантах реализации фрагментов-меток структурной Формулы (VI) Y1a, Y2a и Y3a представляют собой -NH-; Y1b, Y2b и Y3b выбраны из -С(О)- и -S(O)2-; Z1 выбран из -С(О)- и -S(O)2-; Z2 представляет собой -NH-, а Sp представляет собой группу, выбранную из:
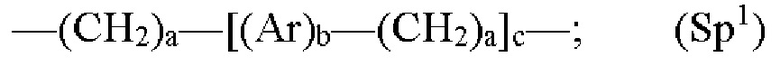
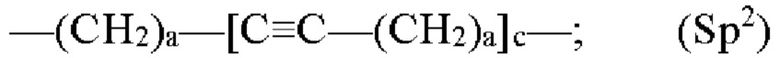
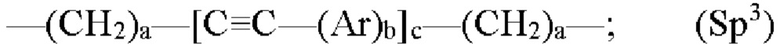
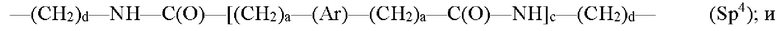
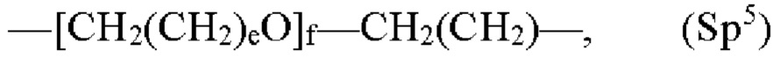
где а, b, с, d, е, f и Ar определены ранее.
[0148] В некоторых конкретных вариантах реализации фрагментов-меток структурной Формулы (VI), R9 выбран из -С(O)СН3 и С(O)CF3 и R9a представляет собой -С(O)С(СН3)3.
[0149] Группа PEP
[0150] Многие варианты реализации описанных в данном документе реагентов включают группу PEP («РЕР»). При использовании в поэтапном синтезе для синтеза меченого олигонуклеотида группа PEP сочетается с любой доступной гидроксильной группой, которая может быть 5'-гидроксильной группой возникающего синтетического олигонуклеотида, что в конечном итоге, после любого необходимого этапа окисления и/или снятия защиты, вносит вклад в связь, которая связывает фрагмент-метку с синтетическим олигонуклеотидом. Образованная связь может представлять собой связь сложного фосфатного эфира или модифицированную связь сложного фосфатного эфира, известную в данной области техники.
[0151] В данной области техники хорошо известно множество различных групп, подходящих для сочетания реагентов с первичными гидроксильными группами с получением связей сложного фосфатного эфира или модифицированных связей сложного фосфатного эфира. Конкретные примеры включают, в качестве примера, но не ограничения, фосфорамидитные группы (см., например, Letsinger et al., 1969, J. Am. Chem. Soc. 91:3350-3355; Letsinger et al., 1975 J. Am. Chem. Soc. 97:3278; Matteucci & Caruthers, 1981, J. Am. Chem. Soc. 103:3185, Beaucage & Caruthers, 1981, Tetrahedron Lett. 22:1859; раскрытия которых включены в данный документ посредством ссылки), 2-хлорфенил- или 2,5-дихлорфенилфосфатные группы (см., например, Sproat & Gait, "Solid Phase Synthesis of Oligonucleotides by the Phosphotriester Method," In: Oligonucleotide Synthesis, A Practical Approach, Gait, Ed., 1984, IRL Press, pages 83-115, раскрытия которых включены в данный документ посредством ссылки), и Н-фосфонатные группы (см., например, Garegg et al., 1985, Chem. Scr. 25:280-282; Garegg et al., 1986, Tet. Lett. 27:4051-4054; Garegg et al. 1986, Tet. Lett. 27:4055-4058; Garegg et al., 1986, Chem. Scr. 26:59-62; Froehler & Matteucci, 1986, Tet. Lett. 27:469472, Froehler et al., 1986, Nucl. Acid Res. 14:5399-5407, раскрытия которых включены в данный документ посредством ссылки) В конкретном варианте реализации изобретения группа PEP представляет собой фосфорамидитную группу Формулы (Р.1):
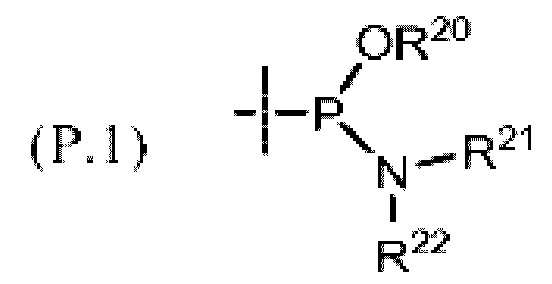
[0152] где R20 выбран из линейного, разветвленного или циклического насыщенного или ненасыщенного алкила, содержащего от 1 до 10 атомов углерода, 2-цианоэтила, арила, содержащего от 6 до 10 циклообразующих атомов углерода, и арилалкила, содержащего от 6 до 10 циклообразующих атомов углерода, и от 1 до 10 атомов углерода алкилена; и
[0153] каждый R21 и R22, независимо друг от друга выбран из линейного, разветвленного или циклического насыщенного или ненасыщенного алкила, содержащего от 1 до 10 атомов углерода, арила, содержащего от 6 до 10 циклообразующих атомов углерода, и арилалкила, содержащего от 6 до 10 циклообразующих атомов углерода и от 1 до 10 атомов углерода алкилена, или, в альтернативном варианте, R21 и R22 вместе с атомом азота, с которым они связаны, образуют насыщенное или ненасыщенное кольцо, содержащее от 5 до 6 циклообразующих атомов, один или два из которых, помимо проиллюстрированного атома азота, могут представлять собой гетероатом, выбранный из О, N и S.
[0154] В конкретном варианте реализации изобретения R20 представляет собой 2-цианоэтил, и каждый из R21 и R22 представляет собой изопропил.
[0155] Маркеры синтеза
[0156] Многие варианты реализации описанных в данном документе реагентов включают один или более маркеров синтеза, которые, после подходящего снятия защиты, при необходимости, обеспечивают сайты, которые могут быть использованы для присоединения дополнительных групп или фрагментов молекул к синтетическому меченному олигонуклеотиду. Группы могут быть присоединены к маркеру синтеза в ходе синтеза меченого олигонуклеотида, или, в альтернативном варианте, после синтеза с маркера синтеза может быть снята защита, чтобы обнажить функциональную группу, к которой могут быть присоединены дополнительные группы или фрагменты молекул. Например, маркер синтеза может содержать группу первичного амина, которая защищена защитной группой, стабильной в условиях, используемых для проведения синтеза меченого олигонуклеотида. Удаление защитной группы после синтеза либо одновременно с или отдельно от удаления различных других защитных групп на синтетическом олигонуклеотиде дает первичную аминогруппу, к которой могут быть присоединены дополнительные группы и/или фрагменты молекулы.
[0157] В данной области техники известны различные типы реакционноспособных групп, защищенных защитными группами, подходящими для использования при синтезе олигонуклеотидов, которые включают в качестве примера, но не ограничения, аминогруппы (защищенные, например, трифторацетильными или 4-монометокситритильными группами), гидроксильные группы (защищенные, например, 4,4'-диметокситритильными группами), тиоловые группы (защищенные, например, тритильными или алкилтиольными группами) и альдегидные группы (защищенные, например, ацетальной защитной группой). Все эти защищенные реакционноспособные группы могут включать маркеры синтеза описанных в данном документе реагентов.
[0158] В некоторых вариантах реализации изобретения маркер синтеза содержит защищенный первичный гидроксил формулы -ORk, где Rk представляет собой неустойчивую к кислотам защитную группу, которая может быть избирательно удалена в ходе синтеза олигонуклеотида. Неустойчивые к кислотам защитные группы, подходящие для защиты первичных гидроксильных групп в контексте синтеза олигонуклеотидов, известны в данной области техники и включают, в качестве примера, но не ограничения, трифенилметил (тритил), 4-монометокситритил, 4,4'-диметокситритил, 4,4',4''-триметокситритил, бис(п-анизил)фенилметил, нафтилдифенилметил, п-(п'-бромфенацилокси)фенилдифенилметил, 9-антрил, 9-(9-фенил)ксантенил и 9-(9-фенил-10-оксо)антрил. Все эти группы могут быть удалены обработкой слабой кислотой, например, обработкой 2,5% или 3% ди- или трихлорной кислотой и дихлорметаном. Способы защиты первичных гидроксильных групп с помощью перечисленных выше неустойчивых к кислотам защитных групп хорошо известны.
[0159] Твердые носители
[0160] Многие варианты реализации описанных в данном документе реагентов содержат твердые носители, к которым присоединены другие фрагменты молекул и/или группы. Твердые носители, как правило, активируются функциональными группами, такими как амино- или гидроксильными группами, к которым присоединены линкеры, несущие линкерные группы, подходящие для присоединения других фрагментов молекул.
[0161] Множество материалов, которые могут быть активированы функциональными группами, подходящими для присоединения к множеству фрагментов молекул и линкеров, а также способы активации материалов с включением функциональных групп известны в данной области техники и включают, например, стекло с контролируемым размером пор, полистирол и привитые сополимеры. Любой из этих материалов может быть использован в качестве твердых носителей в описанных в данном документе реагентах.
[0162] Регенты для синтеза, пригодные для мечения концевых гидроксильных групп
[0163] Некоторые варианты реализации описанных в данном документе реагентов для синтеза описаны структурной Формулой (VII):
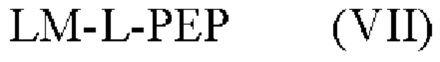
[0164] где LM представляет собой фрагмент-метку, описанный в данном документе, L представляет собой необязательный линкер, описанный в данном документе, и PEP представляет группу PEP, описанную в данном документе. Реагенты могут включать дополнительные группы или фрагменты молекул, такие как маркеры синтеза. В некоторых вариантах реализации изобретения реагенты для синтеза содержат фрагмент-метку и группу PEP и не содержат дополнительные фрагменты молекул или группы. Такие реагенты для синтеза могут сочетаться с гидроксильной группой во время поэтапного синтеза олигонуклеотида и могут использоваться, среди прочего, для присоединения фрагмента-метки к концевой гидроксильной группе синтетического олигонуклеотида, которая, как правило, представляет собой 5'-гидроксил.
[0165] В некоторых вариантах реализации фрагмент-метка может иметь Формулу
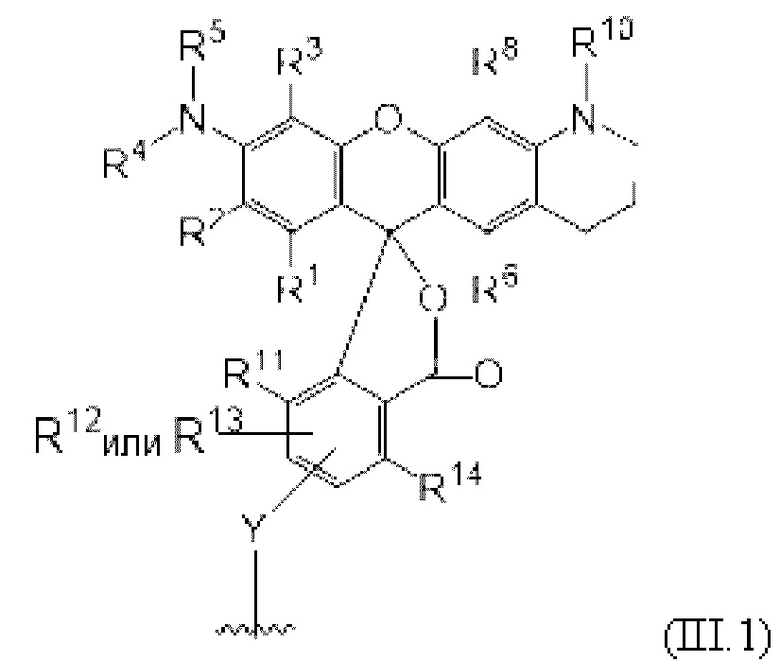
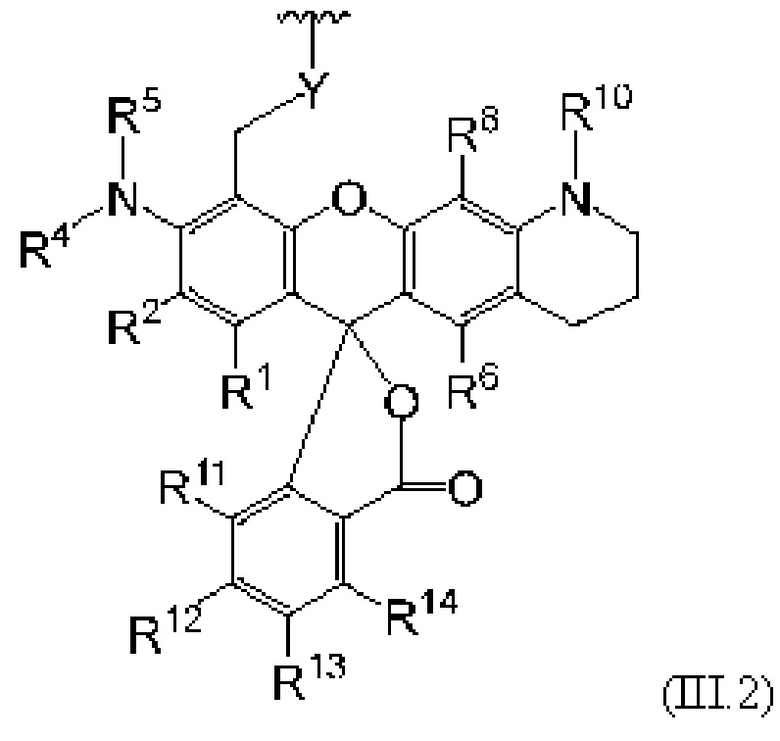
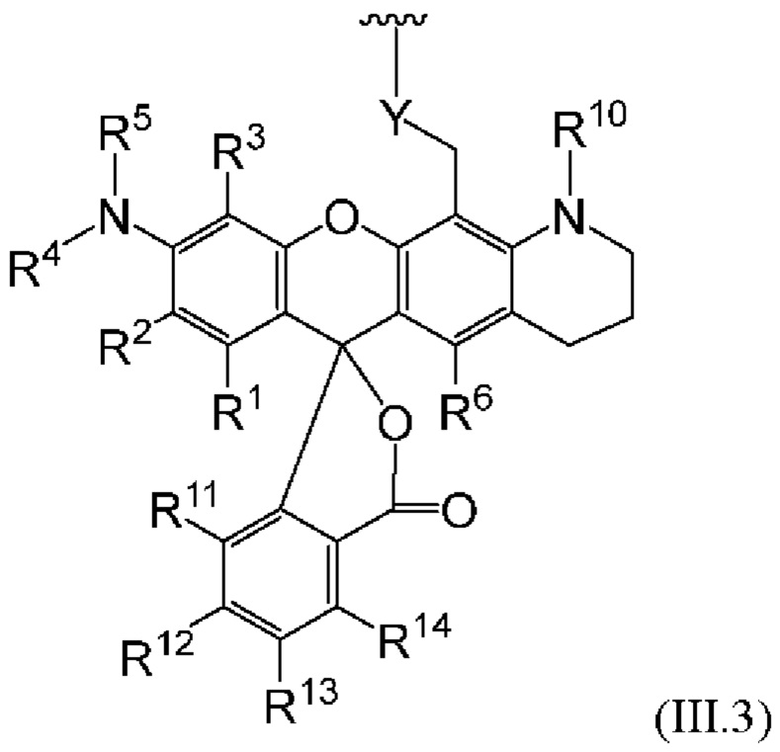
[0166] где R1-R14 и Y определены в данном документе.
[0167] Группа PEP может быть присоединена непосредственно к фрагменту-метке или может быть присоединена к фрагменту-метке с помощью линкера. Поскольку группы PEP, как правило, связаны с молекулами путем сочетания подходящих реагентов с первичными гидроксильными группами, в вариантах реализации изобретения, в которых группа PEP присоединена непосредственно к фрагменту-метке, фрагмент-метка должен включать группу заместителя, которая содержит первичную гидроксильную группу. В вариантах реализации изобретения, в которых группа PEP связана с фрагментом-меткой с помощью линкера, линкерный синтон должен включать линкерную группу, подходящую для образования связи с линкерной группой на синтоне фрагмента-метки, и первичную гидроксильную группу, подходящую для присоединения к группе PEP. Подходящие линкерные синтоны включают, но не ограничиваются ими, синтоны Формулы Fz-Sp-OH, где Fz представляет собой функциональную группу, комплементарную функциональной группе на синтоне фрагмента-метки, a Sp представляет собой спейсерный фрагмент молекулы. Спейсерный фрагмент молекулы может включать любую комбинацию атомов и/или функциональных групп, устойчивых в условиях, которые будут использоваться для синтеза и снятия защиты с меченого синтетического олигонуклеотида. Неограничивающие типичные линкеры изображены на Фиг. 1, где Z2 представляет собой О. В некоторых вариантах реализации изобретения Sp представляет собой необязательно замещенную алкиленовую цепь, которая содержит от 1 до 10 атомов в цепи. В конкретном варианте реализации изобретения Sp представляет собой незамещенную алкиленовую цепь, содержащую от 1 до 9 атомов углерода в цепи.
[0168] В некоторых вариантах реализации изобретения реагенты для синтеза представляют собой соединения структурной Формулы (VII), в которой:
LM представляет собой один из вариантов реализации фрагментов-меток, конкретно проиллюстрированных выше;
L выбран из -Z-(CH2)3-6-О-, -Z-(CH2)a-[(Ar)b-(СН2)а]с-О-, -Z-(СН2)а-[С≡С-(СН2)а]с-О-, -Z-(CH2)a-[С≡С-(Ar)b]c-(СН2)а-О-, -Z-(CH2)d-NH-С(О)-[(СН2)a-(Ar)-(СН2)a-С(О)-NH]c-(CH2)d-О-, -Z-[CH2(CH2)eO]f-СН2(СН2)еО- и один из линкеров, изображенных на Фиг. 1, в котором Z2 представляет собой О; и PEP представляет собой фосфорамидитную группу, такую как, например, фосфорамидитная группа структурной Формулы Р.1, описанной выше. В некоторых конкретных вариантах реализации изобретения Z в линкере L представляет собой -NH-.
[0169] В некоторых вариантах реализации изобретения линкер в реагентах для синтеза структурной Формулы (VII) содержит нуклеозид, так что реагент для синтеза представляет собой нуклеозид. В некоторых вариантах реализации изобретения нуклеозидные реагенты для синтеза представляют собой соединения структурной Формулы (VII.1):
где PEP представляет группу предшественника сложного фосфатного эфира, В представляет собой азотистое основание, LM представляет собой фрагмент-метку, a L2 представляет собой линкер, связывающий азотистое основание В с линкером LM. Характеристики и свойства азотистого основания В и линкера L описаны более подробно ниже. Неограничивающие типичные нуклеозидные реагенты структурной Формулы (VII.1) для синтеза изображены на Фиг. 3.
[0170] Типичная схема синтеза вариантов реализации реагентов для синтеза, в которых группа PEP связана с фрагментом-меткой через необязательный линкер, представлена на Схеме (I) ниже, где различные группы R, Fy, Fz, Y, Z и Sp определены ранее:
Схема I
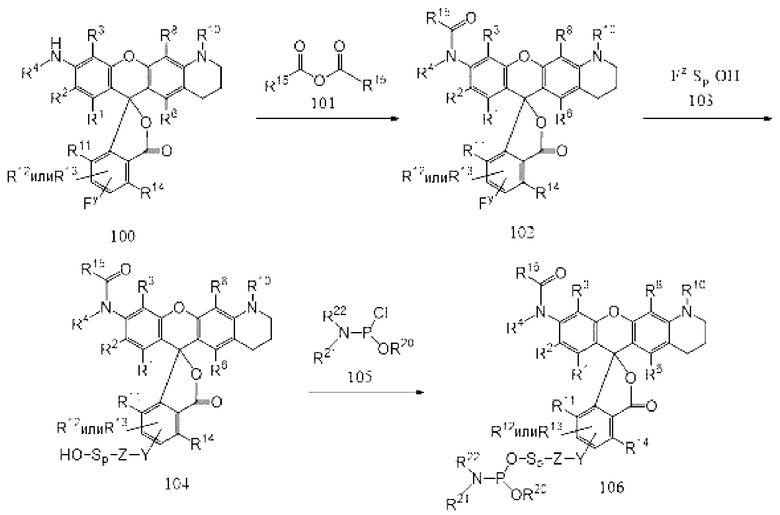
[0171] На Схеме (I) исходный NH-родаминовый синтон 100, который содержит линкерную группу, которая содержит функциональную группу Fy, ацетилируется ангидридом 101 с получением N-ацетил-защищенного NH-родаминового синтона 102. Затем синтон 102 сочетается с линкерным синтоном 103 с получением соединения 104. В зависимости от отличительных характеристик Fy синтон 102 может потребовать активации перед сочетанием. Например, если Fy представляет собой карбоксильную группу, ее можно активировать перед сочетанием как сложный эфир, такой как сложный эфир NHS. В соединении 104 -Y-Z- представляет собой связь, образованную дополнительными функциональными группами Fy и Fz, где Y представляет часть, вносимую Fy, a Z представляет часть, вносимую Fz, как это описано ранее. Затем соединение 104 реагирует с синтоном PEP 105, который, в конкретном проиллюстрированном варианте реализации изобретения, представляет собой фосфин, с получением фосфорамидитного реагента для синтеза 106.
[0172] Реагенты для синтеза, пригодные для внутреннего или 3'-концевого мечения
[0173] Реагенты для синтеза, описанные в данном документе, могут необязательно содержать один или более маркеров синтеза, пригодных для присоединения дополнительных групп и/или фрагментов молекул. Реагенты для синтеза, которые содержат маркер синтеза Формулы -ORk где Rk представляет неустойчивую к кислотам защитную группу, описанную ранее, обеспечивают первичную гидроксильную группу, к которой могут быть присоединены дополнительные нуклеотиды. Как следствие, реагенты для синтеза, которые содержат такой маркер синтеза, могут быть использованы для мечения синтетических олигонуклеотидов у 5'-гидроксила, 3'-гидроксила или в одном или более внутренних положениях. Они также могут сочетаться друг с другом или с другими фосфорамидитными реагентами для мечения, что обеспечивает синтез олигонуклеотидов, содержащих множество фрагментов-меток.
[0174] Фрагмент-метка, группа PEP и маркер синтеза -ORk, составляющие реагент для синтеза, могут быть связаны вместе любым способом и/или в любом положении, которое позволяет им выполнять свои соответствующие функции. В качестве конкретного примера, каждая группа PEP и маркер синтеза могут быть связаны с фрагментом-меткой необязательно через линкеры. В некоторых вариантах реализации изобретения такие реагенты для синтеза представляют собой соединения структурной Формулы (VIII):
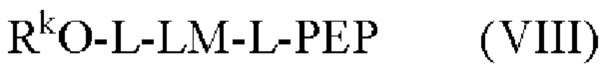
[0175] где каждый L представляет собой, независимо от другого, необязательный линкер, LM представляет собой фрагмент-метку, а PEP представляет собой группу PEP. Неограничивающие примеры подходящих защитных групп Rk, линкеров L, фрагментов-меток LM и групп PEP включают те, которые конкретно проиллюстрированы выше.
[0176] В качестве другого конкретного примера, группа PEP и маркер синтеза -ORk могут быть присоединены к разветвленному линкеру, который присоединен к фрагменту-метке. В некоторых вариантах реализации изобретения такие реагенты для синтеза представляют собой соединения структурной Формулы (IX):
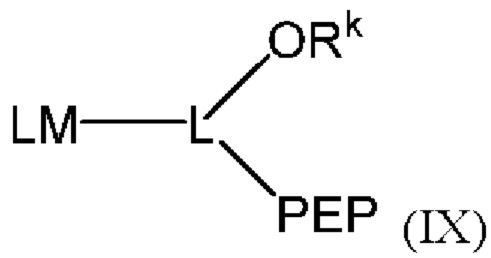
где L представляет собой линкер, LM представляет собой фрагмент-метку, а PEP представляет собой группу PEP.
[0177] В конкретном варианте реализации изобретения реагенты для синтеза структурной Формулы (IX) представляют собой соединения структурной Формулы (IX.1):
где LM представляет собой фрагмент-метку; -Z- представляет собой часть связи, вносимую функциональным Fz на линкере; каждый Sp1, Sp2 и Sp3, которые могут быть одинаковыми или разными, представляет собой спейсерные фрагменты молекул; G представляет СН, N или группу, содержащую арилен, фенилен, гетероарилен, низший циклоалкилен, циклогексилен и/или низший циклогетероалкилен; и PEP представляет собой группу PEP. В некоторых вариантах реализации изобретения LM представляет собой один из вариантов реализации фрагментов-меток, конкретно приведенных выше; каждый из Sp1, Sp2 и Sp3, независимо друг от друга, выбран из алкиленовой цепи, содержащей от 1 до 9 атомов углерода, Sp1, Sp2, Sp3, Sp4 и Sp5 (определенные выше) и/или PEP представляют собой фосфорамидитную группу структурной Формулы Р.1, выше. Неограничивающие конкретные варианты реализации типичных реагентов для синтеза структурной формулы (IX.1) изображены на Фиг. 2 и 3.
[0178] В некоторых вариантах реализации изобретения маркер синтеза -ORk обеспечивается нуклеозидом, так что реагент для синтеза представляет собой нуклеозид. В таких нуклеозидных реагентах для синтеза фрагмент-метка, как правило, связан с азотистым основанием нуклеозида посредством линкера, и любые экзоциклические функциональные группы азотистого основания, которые являются реакционноспособными в условиях, используемых для синтеза меченого олигонуклеотида, такие как, например, экзоциклические амины, являются защищенными. Примеры изображены на Фиг. 5.
[0179] Нуклеозид может представлять собой любой нуклеозид, который может быть подходящим образом защищен для использования в синтезе олигонуклеотидов, и может включать 2'-дезоксирибозный сахарный фрагмент, 3'-дезоксирибозный сахарный фрагмент (пригодный для синтеза меченых олигонуклеотидов, включая 2'-5' межнуклеотидную связь), соответствующим образом защищенный рибозный фрагмент, замещенный вариант любого из этих рибозных фрагментов или даже нерибозный сахарный фрагмент.
[0180] В некоторых вариантах реализации изобретения такие нуклеозидные реагенты для синтеза представляют собой соединения структурных Формул (IX.2), (IX.3), (IX.4) и (IX.5):
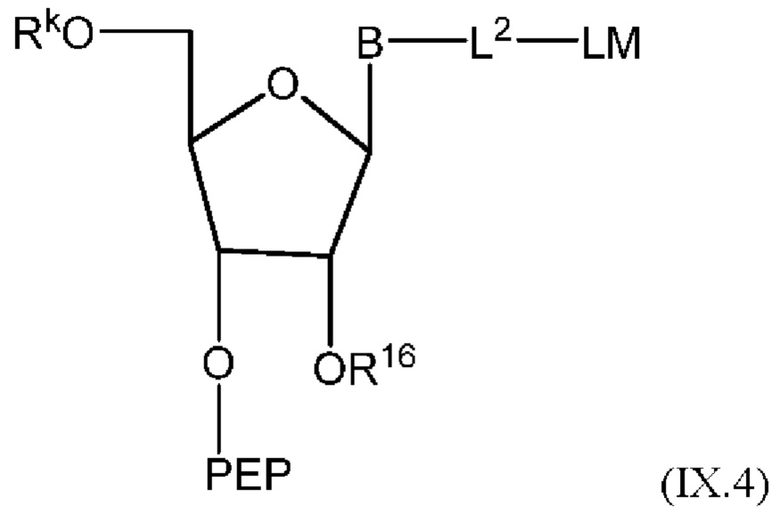
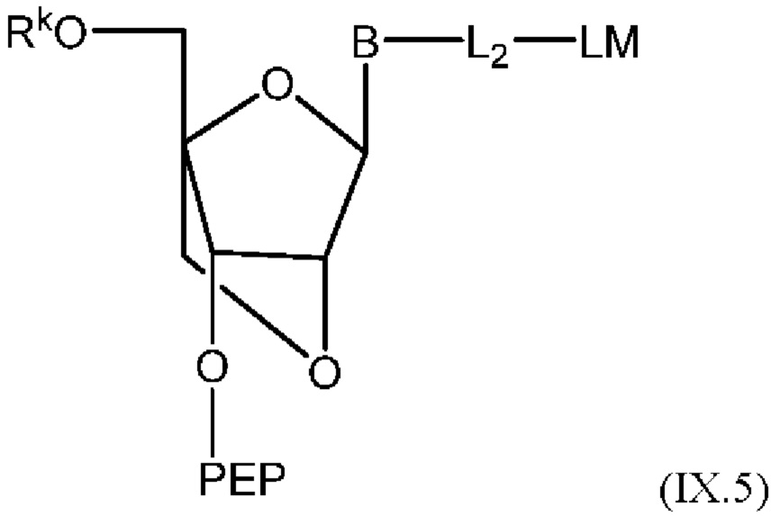
[0181] где LM представляет собой фрагмент-метку; В представляет собой защищенное подходящим образом азотистое основание; L2 представляет собой линкер, связывающий фрагмент-метку с азотистым основанием; Rk представляет собой неустойчивую к кислотам защитную группу; PEP представляет собой группу PEP; О представляет собой атом кислорода; и в структурной Формуле (IX.4) R16 представляет собой 2'-гидроксильную защитную группу.
[0182] В реагентах для синтеза структурных Формул (VII.1), (IX.2), (IX.3), (IX.4) и (IX.5) азотистым основанием В может быть практически любой гетероцикл, пригодный для введения в олигонуклеотиды. Например, азотистое основание может представлять собой один из генетически кодирующих пуринов (аденин или гуанин), одним из генетически кодирующих пиримидинов (цитозин, урацил или тимин), анологов и/или производных генетически кодирующих пуринов и/или пиримидинов (например, 7-деазаденин, 7-дезазагуанин, 5-метилцитозин), генетически не кодирующих пуринов и/или пиримидинов (например, инозин, ксантен и гипоксантен) или других типов гетероциклов. Широкий спектр гетероциклов, пригодных для введения в олигонуклеотиды, известен в данной области техники и описан, например, в Practical Handbook of Biochemistry and Molecular Biology, Fasman, Ed., 1989, CRC Press (см., например, страницы 385-393 и ссылки, цитируемые в нем), раскрытие которого включено в данный документ посредством ссылки. Все эти различные гетероциклы, а также те, которые были обнаружены позже, могут быть включены в описанные в данном документе нуклеозидные реагенты для синтеза.
[0183] Когда в реагентах для синтеза структурных Формул (VII.1), (IX.2), (IX.3), (IX.4) и (IX.5) В представляет собой пурин, проиллюстрированный сахарный фрагмент молекулы, как правило, присоединен в положении N9 пурина, а когда В представляет собой пиримидин, проиллюстрированный сахарный фрагмент молекулы, как правило, присоединен в положении N1 пиримидина. Места присоединения для других азотистых оснований будут очевидны специалистам в данной области техники.
[0184] Любой экзоциклический амин или другая реакционноспособная группа (группы) азотистого основания защищена защитными группами, стабильными в условиях синтеза, используемых для синтеза меченого олигонуклеотида. В данной области техники хорошо известны различные группы, которые подходят для защиты экзоциклических аминогрупп нуклеозидных азотистых оснований в контексте синтеза олигонуклеотидов, равно как и способы получения таких защищенных нуклеозидов.
[0185] Например, группы, которые использовались для защиты экзоциклического амина аденина, включают бензил (Bz), феноксиацетил (Рас) и изобутирил (iBu) Группы, которые использовали для защиты экзоциклического амина цистозина, включают ацетил (Ас) и Bz. Группы, которые использовались для защиты экзоциклического амина гуанина, включают iBu, диметилформамид (Dmf) и 4-изопропилфеноксиацетил (iPr-Pac). Все эти защитные группы могут быть удалены обработкой гидроксидом аммония при 55-65°С в течение 2-3 часов. Однако некоторые из этих защитных групп могут быть удалены при более мягких условиях. Например, отщепление защитных групп от AiBU, АРас, САс и GiPr-Pac может быть осуществлено в течение 4-17 часов при комнатной температуре с помощью гидроксида аммония или 0,05 М карбоната калия в метаноле, или обработкой 25% трет-бутиламином в H2O/EtOH. Поскольку некоторые из NH-родаминовых и/или других красителей, содержащих описанные в данном документе реагенты, могут быть нестабильными в более жестких условиях снятия защиты, которые требуются для других защитных групп, предпочтительными являются нуклеозидные реагенты, в которых используются защитные группы, которые могут быть удалены в этих более мягких условиях снятия защиты.
[0186] Линкер L2, связывающий фрагмент-метку LM с азотистым основанием В, может быть присоединен в любом положении азотистого основания. В некоторых вариантах реализации изобретения, если В представляет собой пурин, линкер присоединен в положении 8 пурина, если В представляет собой 7-дезазапурин, линкер присоединен в положении 7 7-дезазапурина, и если В представляет собой пиримидин, линкер присоединен в положении 5 пиримидина.
[0187] В некоторых вариантах реализации изобретения линкеры L2, используемые для присоединения LM к азотистому основанию, содержат ацетиленовую или алкеновую амино-связь, такую как, например, связь, выбранную из -С≡С-CH2-NH-, -С≡С-С(О)-, -СН=СН-NH-, -СН=СН-С(О)-, -С≡С-CH2-NH-С(О)-(CH2)1-6-NH- и -СН=СН-С(О)-NH-(CH2)1-6-NH-С(О)-, пропаргил-1-этоксиамино-связь, такую как, например, связь, имеющую Формулу -С-СН-CH2-О-CH2CH2-[О-CH2CH2]0-6-NH- или жесткую связь, такую как, например, связь, выбранную из -С≡С-С≡С-CH2-О-CH2CH2-[О-CH2CH2]0-6-NH-, -С≡С-(Ar)1-2-С≡С-СН2-О-CH2CH2-[О-CH2CH2]0-6-NH-, -С≡С-(Ar)1-2-О-СН2СН2-[О-СН2СН2]0-6-NH- и -С≡С-(Ar)1-2-О-CH2CH2-[О-CH2CH2]0-6-NH-, где Ar определен ранее.
[0188] В некоторых вариантах реализации изобретения линкеры L2, пригодные для присоединения LM к пуриновому азотистому основанию, содержат алкиламин, такой как, например, связь Формулы -NH-(CH2)1-6-NH-.
[0189] В некоторых вариантах реализации изобретения линкеры L2, пригодные для присоединения LM к пуриновому или пиримидиновому азотистому основанию, представляют собой анионные линкеры, описанные в патенте США №6811979, раскрытие которого включено в данный документ посредством ссылки (см., например, раскрытие в столбце 17, строке 25 - столбце 18, строке 37 и Фиг. 1-17).
[0190] Способы синтеза нуклеозидов, образующих производное с линкерами, такими как описанные выше, которые подходят для введения в описанные в данном документе реагенты, описаны, например, в Hobbs et al., 1989, J. Org. Chem. 54:3420; патенте США №5151507 авторства Hobbs et al., патенте США №5948648 авторства Khan et al. и патенте США №5821356 авторства Khan et al., раскрытия которых включены в данный документ посредством ссылки. Дериватизированные нуклеозиды могут быть использованы в качестве синтонов для синтеза нуклеозидных реагентов для синтеза, как будет более подробно описано ниже.
[0191] Конкретные типичные варианты реализации производных азотистых оснований с линкерами, которые могут содержать нуклеозидные реагенты для синтеза, описанные в данном документе и проиллюстрированы ниже:
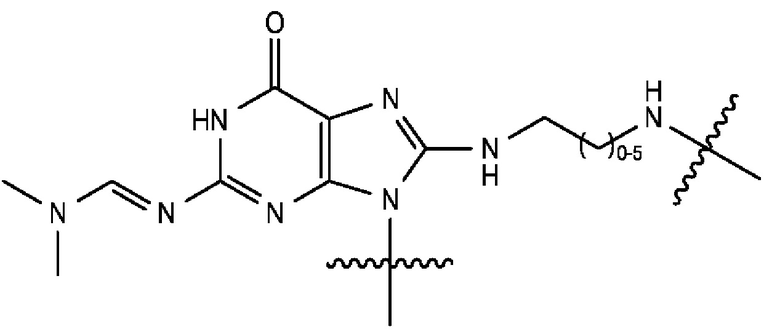
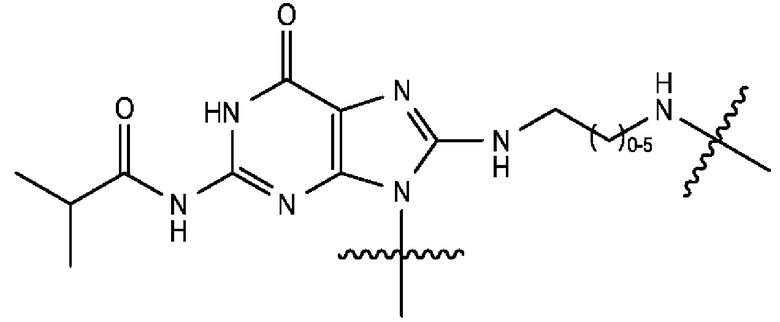
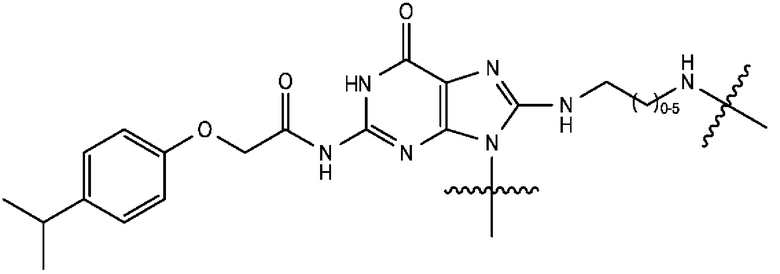
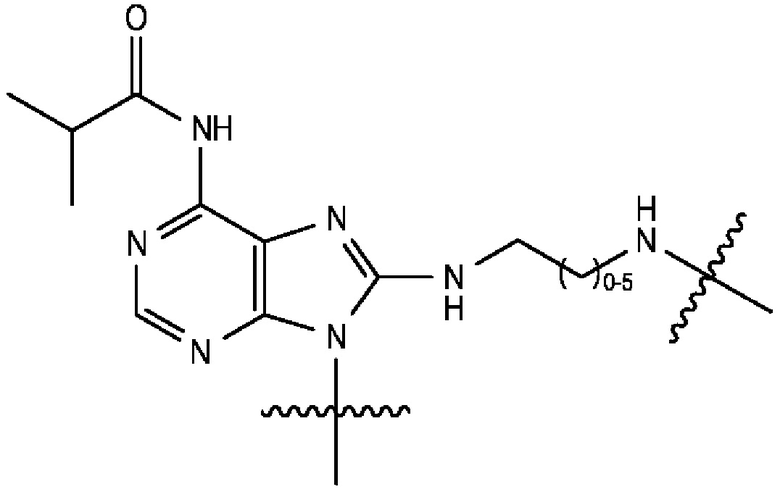
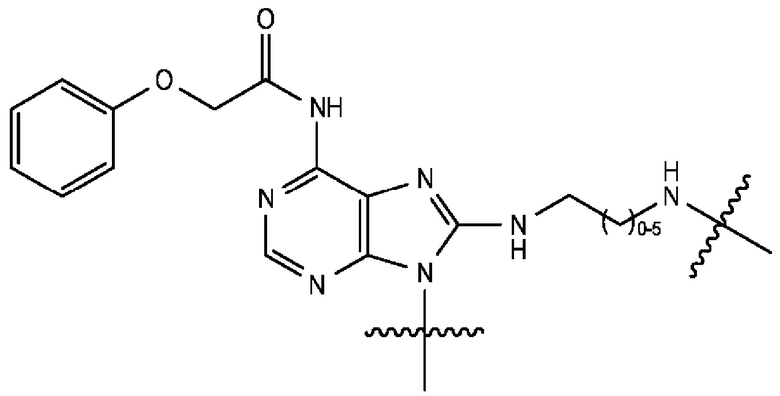
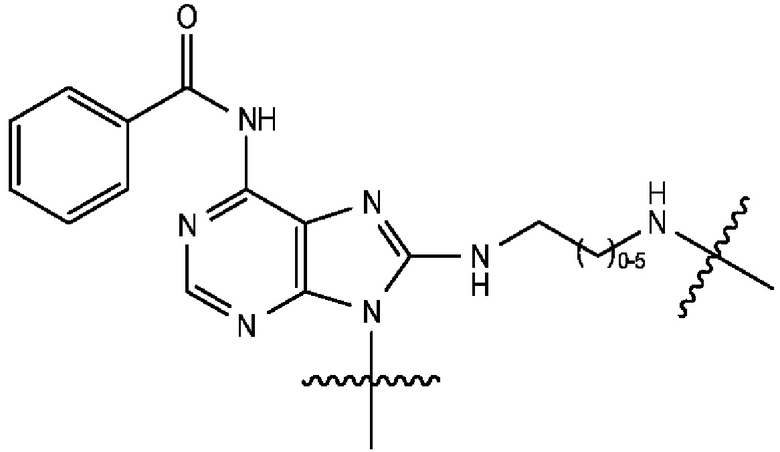
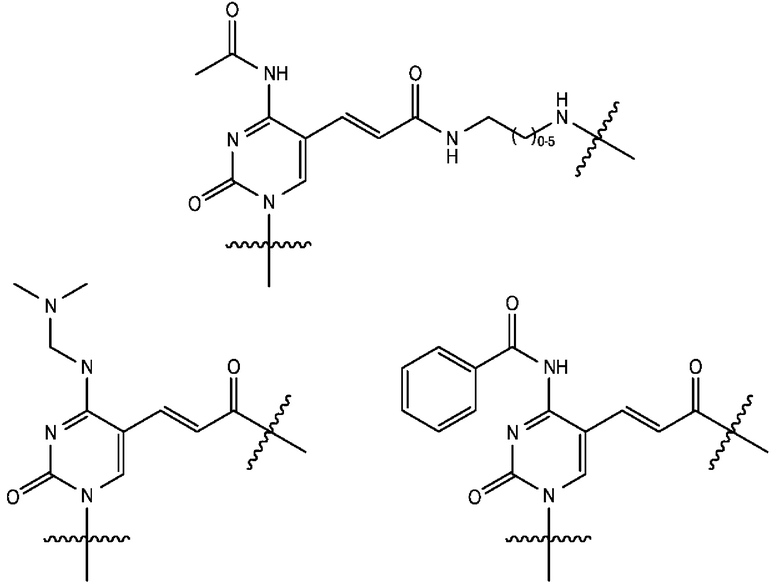
[0192] Нуклеозидные реагенты для синтеза могут быть получены из производных нуклеозидных синтонов с линкерами, как изображено на Схеме (II) ниже:
Схема II
[0193] На Схеме (II) производное 110 нуклеозидного синтона с линкером защищено по 5'-гидроксилу неустойчивой к кислотам защитной группой, что проиллюстрировано на Схеме с типичным хлоридным реагентом RkCl, где Rk определен ранее. Обработка основанием для удаления три фтор ацетильной защитной группы дает синтон 112. Взаимодействие синтона 112 с синтоном фрагмента-метки 102 (см. Схему (I) выше) с последующей обработкой синтоном PEP 105, который в этом конкретном примере проиллюстрирован фосфином (см. Схему (I) выше), дает нуклеозидный реагент для синтеза 114. Конкретные условия для проведения различных этапов синтеза, проиллюстрированных выше, хорошо известны. Ненуклеозидные реагенты для синтеза, которые содержат маркер синтеза, такой как изображенный на Фиг. 4, или маркер синтеза Формулы -ORk, может быть получен обычной адаптацией Схемы (II).
[0194] Реагенты на твердом носителе
[0195] Многие варианты реализации описанных в данном документе реагентов включают твердые носители. Такие реагенты, как правило, содержат твердый носитель, фрагмент-метку, описанный в данном документе, и маркер синтеза, и могут содержать дополнительные группы или фрагменты молекул, такие как дополнительные фрагменты-метки, группы гашения, маркеры синтеза и/или группы, пригодные, среди прочего, для стабилизации олигонуклеотидных дуплексов, такие как, например, агенты, которые размещаются между парами оснований (интеркалирующие агенты), и агент, связывающий малую бороздку дуплекса (агент, обеспечивающий связывание с малой бороздкой или MGB). Твердый носитель, фрагмент-метка, маркер синтеза и любые необязательные дополнительные фрагменты молекул могут быть связаны друг с другом любым способом или в любом взаимном положении, которое позволяет им выполнять свои соответствующие функции.
[0196] В некоторых вариантах реализации изобретения твердый носитель прикреплен к остатку реагента через линкер. Линкеры, прикрепляющие твердые носители к остатку реагента, как правило, включают связи, которые селективно отщепляются в определенных условиях, так что после синтеза синтезированный меченый олигонуклеотид может высвобождаться из твердого носителя. В некоторых вариантах реализации изобретения связи являются неустойчивыми по отношению к условиям, используемым для снятия защиты с синтетического меченого олигонуклеотида, так что с олигонуклеотида снимается защита и он отщепляется от твердого носителя за один этап. Такие линкеры, как правило, включают сложноэфирные связи, но могут включать и другие связи, такие как, например, карбонатные эфиры, диизопропилсилоксиэфиры, модифицированные сложные эфиры фосфатов и т.д.
[0197] В данной области техники известно огромное количество селективно отщепляемых линкеров, применимых в контексте синтеза олигонуклеотидов, равно как и способов дериватизации твердых носителей такими линкерами. Все эти различные линкеры могут быть адаптированы для использования в реагентах на твердых носителях, описанных в данном документе. Неограничивающие примеры реагентов на твердых носителях, содержащих типичные линкеры, которые отщепляются при основных условиях, используемых для снятия защиты с синтетических олигонуклеотидов, изображены на Фиг. 6.
[0198] Как и реагенты для синтеза, реагенты на твердых носителях могут быть ненуклеозидными или нуклеозидными по своей природе. Типичные варианты реализации ненуклеозидных реагентов на твердых носителях включают реагенты структурной Формулы (X):
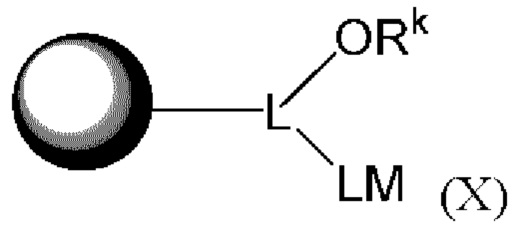
где LM представляет собой фрагмент-метку, L представляет собой необязательный селективно отщепляемый линкер и -ORk представляет собой маркер синтеза, где Rk представляет собой неустойчивую к кислотам защитную группу, описанную ранее.
[0199] В некоторых вариантах реализации изобретения реагенты для синтеза на твердых носителях структурной Формулы (X) представляют собой ненуклеозидные реагенты структурной Формулы (Х.1).
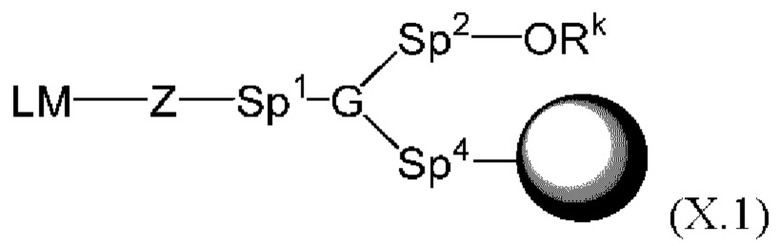
[0200] где Z, LM, G, Sp1, Sp2 и Rk определены ранее для структурной Формулы (IX.1), а Sp4 представляет собой селективно отщепляемый спейсерный фрагмент молекулы. В некоторых конкретных вариантах реализации изобретения селективно отщепляемый спейсерный фрагмент молекулы Sp4 содержит сложноэфирную связь.
[0201] В некоторых вариантах реализации изобретения реагенты для синтеза на твердых носителях структурной Формулы (X) представляют собой нуклеозидные реагенты структурных Формул (Х.2), (Х.3), (Х.4) или (Х.5):
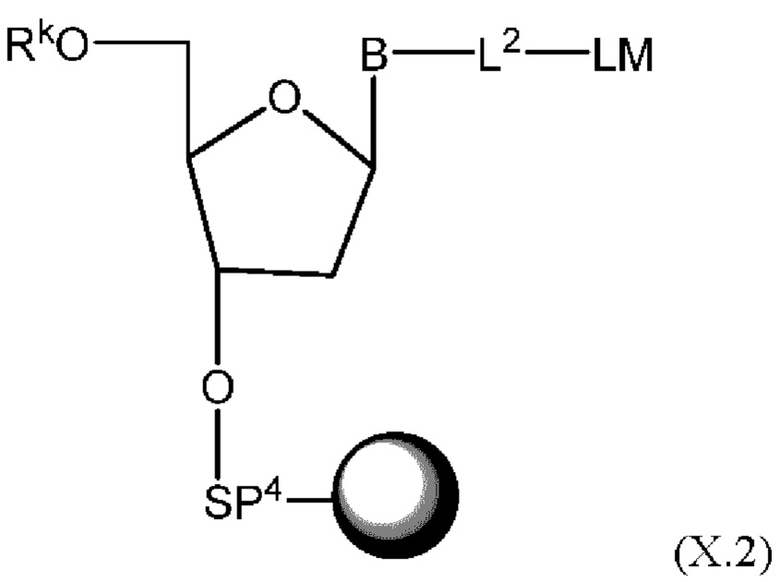
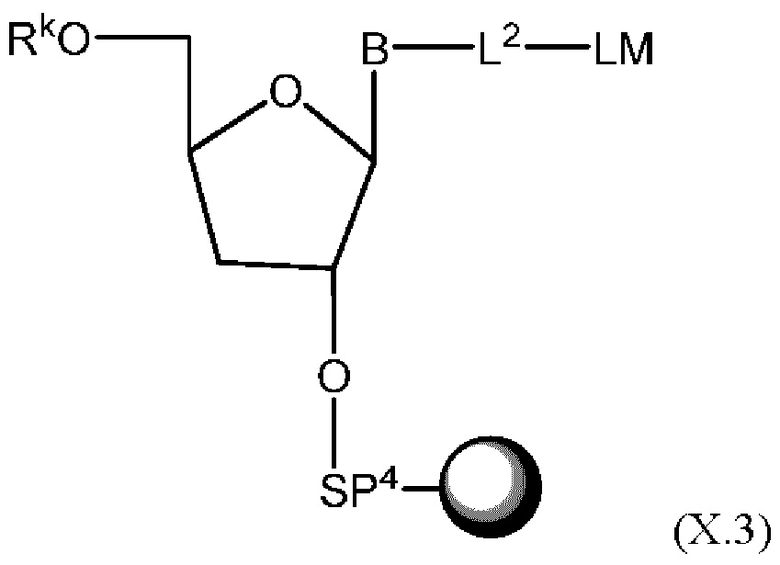
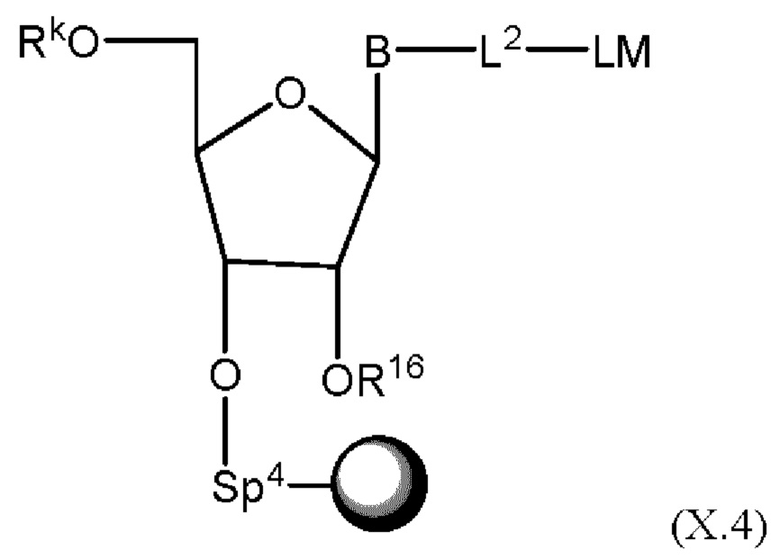
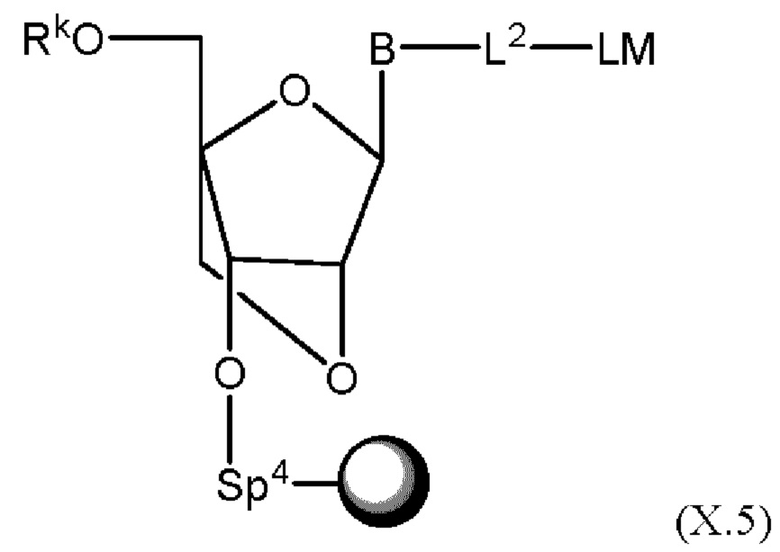
где LM, Rk, В и L2 определены ранее для структурных Формул (Х.2), (Х.3), (Х.4) и/или (Х.5), R16 определен ранее для структурной Формулы (IX.4) и Sp4 представляет собой селективно отщепляемый спейсерный фрагмент молекулы, описанный выше, который в некоторых вариантах реализации изобретения содержит сложноэфирную связь. Конкретные примеры (Х.2) изображены на Фиг. 7.
[0202] Дополнительные типичные варианты реализации изобретения
[0203] Следует понимать, что конкретные варианты реализации различных фрагментов молекул, групп и линкеров, описанных в раскрытии, могут быть введены во все описанные в данном документе реагенты. Более того, различные конкретные варианты реализации изобретения могут быть скомбинированны друг с другом в любой комбинации, как если бы конкретная комбинация была конкретно проиллюстрирована. В качестве конкретного примера, любой из конкретных вариантов реализации фрагмента-метки LM, описанных в данном документе, может быть включен в любой из конкретных примеров вариантов реализации ненуклеозидных и нуклеозидных твердых носителей и реагентов для синтеза, описанных в данном документе. В качестве другого конкретного примера, любой из конкретных вариантов реализации группы PEP, такой как фосфорамидитная группа структурной Формулы (Р.1) выше, может быть включен в любой из реагентов для синтеза, описанных в данном документе.
[0204] Применение реагентов
[0205] Различные описанные в данном документе реагенты могут быть использованы в поэтапном синтезе олигонуклеотидов для синтеза олигонуклеотидов, меченных красителями родаминового ряда, непосредственно на синтетической смоле. Следовательно, различные реагенты обеспечивают возможность синтетически метить олигонуклеотиды огромным множеством различных родаминов, устраняя необходимость в трудоемких модификациях после синтеза. Применение типичных реагентов для синтеза олигонуклеотида, меченного NH-родаминовым красителем, изображено на Фиг. 8А.
[0206] Как будет понятно специалистам в данной области техники, благодаря доступности фосфорамидитных реагентов, которые могут действовать как доноры, акцепторы или даже гасители для NH-родаминовых красителей, описанные в данном документе реагенты позволяют синтезировать олигонуклеотиды, меченные красителями переноса энергии, и/или пары NH-родаминового красителя-гасителя, которые синтезируются in situ. Типичные синтезы олигонуклеотидов, меченных красителями переноса энергии на основе пар NH-родамин-флуоресцеин, которые иллюстрируют универсальность, обеспечиваемую описанными в данном документе реагентами, изображены на Фиг. 9, 10А и 10В. Поскольку описанные в данном документе реагенты позволяют включать практически любой NH-родаминовый краситель в твердый носитель и/или реагент для синтеза, олигонуклеотиды, меченные парами красителей переноса энергии, обладающие спектральными свойствами, которые приспособлены для конкретных применений, могут быть легко синтезированы in situ, без необходимости модификации после синтеза. Более того, олигонуклеотиды, меченные огромным количеством различных комбинаций пар красителей переноса энергии, могут быть синтезированы из индивидуальных мономерных реагентов, что устраняет необходимость в создании реагентов для синтеза, содержащих указанные пары красителей. Каждый член пары красителей может быть присоединен к формирующемуся олигонуклеотиду поэтапно, с добавлением или без добавления промежуточных линкерных фрагментов молекул.
[0207] Рассматривая Фиг. 8, связанный с носителем синтетический олигонуклеотид обрабатывают кислотой для удаления группы ДМТ (DMT), защищающей его 5'-гидроксил, с получением связанного с носителем олигонуклеотида с удаленной 5'-защитой. Сочетание N-защищенного NH-родамин-фосфорамидитного реагента с последующим окислением дает связанный с носителем меченный NH-родамином олигонуклеотид. Окисление также служит для превращения NH-родамина в открытую лактонную форму со снятой защитой. Обработка концентрированным гидроксидом аммония для удаления любых защитных групп и отщепления синтезированного олигонуклеотида от твердого носителя (смолы) дает олигонуклеотид, меченный NH-родаминовым красителем.
[0208] Рассматривая Фиг. 9, реагент на твердом носителе, который включает пару красителей переноса энергии на основе защищенного NH-родамина-флуоресцеина в качестве фрагмента-метки, может быть подвергнут трем синтетическим циклам с получением меченого связанного с носителем олигонуклеотида. Отщепление от твердого носителя дает меченый олигонуклеотид со снятой защитой в открытой лактонной форме.
[0209] Рассматривая Фиг. 10А, возникающий связанный с носителем олигонуклеотид может быть мечен парой красителей NH-родамин-флуоресцеин, синтезированной in situ путем сочетания N-защищенного NH-родамин-фосфорамидитного реагента для синтеза с 5'-гидроксилом олигонуклеотида, который после окисления дает меченный NH-родамином олигонуклеотид. Удаление группы ДМТ (DMT) с последующим сочетанием с О-защищенным фосфорамидитом (который в конкретном проиллюстрированном примере является FAM-фосфорамидитом) дает меченый связанный с носителем олигонуклеотид. Отщепление и снятие защиты дает олигонуклеотид, который мечен парой красителей переноса энергии на основе NH-родамина-FAM, где NH-родамин находится в открытой лактонной форме со снятой защитой.
[0210] Длиной и характером связи, связывающей донорные и акцепторные красители, также можно управлять с помощью реагентов с фосфорамидитными линкерами. Этот аспект изображен на Фиг. 10В, на которой фосфорамидитный линкер связан с меченным родамином олигонуклеотидом с получением реагента. Сочетание с FAM-фосфорамидитом с последующим окислением, снятием защиты и отщеплением дает олигонуклеотид, меченный парой красителей переноса энергии на основе NH-родамина-FAM. В фосфорамидитном линкере «Sp» представляет собой спейсер, определенный ранее. Например, «Sp» может представлять (Sp1), (Sp2), (Sp3), (Sp4) или (Sp5), определенные ранее.
[0211] На Схеме, изображенной на Фиг. 10В, длину и свойства линкера, связывающего NH-родаминовый краситель и краситель FAM, можно регулировать путем сочетания дополнительных фосфорамидитных линкеров перед сочетанием с FAM-фосфорамидитом. Фосфорамидитные линкеры могут быть одинаковыми или разными. Следовательно, олигонуклеотиды, меченные парами красителей переноса энергии, в которых донорный и акцепторный красители, а также линкер, связывающий донор и акцепторы, адаптированы для конкретных целей, могут быть легко синтезированы in situ.
[0212] Хотя на Фиг. 10А и В изображено применение конкретного N-защищенного NH-родаминового реагента, квалифицированный специалист поймет, что можно использовать любой N-защищенный NH-родаминный реагент, который действует как акцептор для FAM. Кроме того, могут быть использованы другие О-защищенные флуоресцеины, а также другие типы фосфорамидитных красителей. Поскольку красители добавляются в виде мономеров, количество доступных меток на основе красителей переноса энергии превышает количество фосфорамидитных реагентов, необходимых для их синтеза. Например, олигонуклеотиды, меченные 9 различными парами красителей переноса энергии, могут быть синтезированы из 3 различных N-защищенных NH-родамин-фосфорамидитных реагентов (реагенты А, В и С) и 3 различных О-защищенных флуоресцеин-фосфорамидитных реагентов (реагенты 1, 2 и 3): олиго-А1, олиго-А2, олиго-А3, олиго-В1, олиго-В2, олиго-В3, олиго-С1, олиго-С2 и олиго-С3.
[0213] В настоящее время анализы функциональности клеток и тканей часто требуют извлечения как можно большего количества информации из материалов, количество которых часто ограничено. Например, такие образцы, как биопсия опухоли, трудно собрать, и они, как правило, дают лишь небольшое количество пригодной для применения нуклеиновой кислоты. Обнаружение и измерение посредством ПЦР одного целевого аналита, именуемое одноплексным анализом, было золотым стандартом для анализа клинических образцов для исследования на уровне нуклеиновых кислот и уже более четверти века имеет неоценимое значение для расширения границ знаний в области биологии.
[0214] Однако ограниченное количество нуклеиновой кислоты, полученной из образцов для клинических исследований, часто вынуждает делать выбор о том, как лучше всего использовать эти ценные образцы. Кроме того, если количество образца ограничено, количество локусов, которые могут быть проанализированы, также ограничено, что сокращает объем информации, которую можно извлечь из образца. Наконец, дополнительное время и материалы, необходимые для проведения нескольких анализов, включающих одну реакцию, могут значительно увеличить стоимость проекта в целом.
[0215] Мультиплексный ПЦР-анализ нуклеиновых кислот, стратегия, при которой более одной мишени амплифицируется и количественно определяется из одной аликвоты образца, является привлекательным решением этих проблем. В мультиплексном ПЦР аликвоту образца исследуют в одной реакции ПЦР с помощью нескольких зондов, содержащих флуоресцентные красители. Это увеличивает количество информации, которую можно извлечь из данного образца. С помощью мультиплексного ПЦР можно значительно сэкономить на образце и материалах. Чтобы повысить практическую ценность этого способа, был разработан мультиплексный ПЦР с применением нескольких пар геноспецифичных праймеров и зондов для одновременной амплификации и измерения нескольких целевых последовательностей. Мультиплексный ПЦР обеспечивает следующие преимущества: 1) Эффективность: мультиплексный ПЦР помогает сохранить материал образца и избежать вариаций от лунки к лунке за счет объединения нескольких анализов ПЦР в одну реакцию. Мультиплексирование позволяет более эффективно применять ограниченные по количеству образцы, например, содержащие редкую мишень, которую нельзя разделить на несколько аликвот без снижения чувствительности; 2) Экономичность: даже несмотря на то, что мишени амплифицируются синхронно, каждая из них выявляется независимо с помощью геноспецифичного зонда с уникальным репортерным красителем для различения амплификаций на основе их флуоресцентного сигнала. После оптимизации мультиплексный анализ оказывается более экономичным, чем те же самые анализы, которые амплифицируют независимо.
[0216] Однако в настоящее время существуют ограничения на количество мишеней, которые могут быть проанализированы в одном мультиплексном ПЦР анализе. Дизайн эксперимента для мультиплексного ПЦР является более сложным, чем для одиночных реакций. Зонды, применяемые для обнаружения отдельных мишеней, должны содержать уникальные репортерные красители с отличающимися спектрами. Настройки фильтров возбуждения и излучения систем обнаружения в реальном времени варьируются от производителя к производителю, поэтому приборы должны быть откалиброваны для каждого красителя как часть процесса оптимизации эксперимента. Следовательно, одним из ограничений при разработке мультиплексных ПЦР анализов является количество флуорофоров и, следовательно, зондов, которые можно эффективно измерить в одной реакции. Например, в мультиплексном ПЦР перекрестные помехи сигналов между различными флуоресцентными репортерами могут снизить корректность количественной оценки или дать ложноположительные результаты. Поэтому важно выбирать флуорофоры с минимальным наложением спектров. Кроме того, флуорофоры и, в частности, их спектры излучения и возбуждения, также должны быть совместимы с применяемым ПЦР прибором и, в частности, характеристиками полосы пропускания для каждого набора фильтров.
[0217] В дополнительном аспекте предложены способы и наборы для осуществления одноплексного или мультиплексного ПЦР, такого как кПЦР или ПЦР с детекцией по конечной точке, с применением описанного зонда. ПЦР с детекцией по конечной точке представляет собой анализ после завершения всех циклов ПЦР. В отличие от кПЦР, который обеспечивает количественный анализ при удвоении матрицы (экспоненциальной фазе), анализ с детекцией по конечной точке основан на фазе плато амплификации.
[0218] В частности, способ амплификации и обнаружения множества целевых последовательностей ДНК включает обеспечение композиции или реакционной смеси, содержащей описанный зонд, осуществление протокола термоциклирования реакционной смеси, в результате чего может происходить амплификация указаного множества целевых последовательностей, и мониторинг амплификации путем обнаружения флуоресценции описанного зонда по меньшей мере один раз в течение множества циклов амплификации.
[0219] Нуклеиновая кислота-мишень(и) описанного способа может представлять собой любую нуклеиновую кислоту-мишень, известную специалисту в данной области техники. Кроме того, мишенями могут быть области с низкой мутацией или области с высокой мутацией. Например, одно особенно ценное применение раскрытых в данном документе способов включает нацеливание на сильно мутировавшие нуклеиновые кислоты, такие как гены РНК-вирусов, или на участки с высокой генетической изменчивостью, такие как однонуклеотидные полиморфизмы (SNP). В некоторых вариантах реализации изобретения мишени могут быть фрагментированы или разрушены, например, как материал из судебно-медицинских образцов и/или фиксированных тканей. Мишени могут иметь любой размер, поддающийся амплификации. Одно особенно ценное применение способов и композиций, предложенных в данном документе, включает идентификацию коротких фрагментов, таких как миРНК и микроРНК. Другим особенно ценным применением является применение для образцов, которые могут содержать фрагментированную и/или разрушенную нуклеиновую кислоту, например, как фиксированные образцы или образцы, подвергшиеся воздействию окружающей среды. Следовательно, данные способы можно применять, например, для биопсии ткани и ДНК в судебной экспертизе. Мишени могут быть очищенными или неочищенными. Мишени могут быть получены in vitro (например, кДНК-мишень) или могут быть обнаружены в биологических образцах (например, РНК- или геномная ДНК (гДНК)-мишень). Биологический образец можно применять без обработки, или биологические образцы можно обрабатывать для удаления веществ, которые могут мешать раскрытым в данном документе способам.
[0220] Зонды, представленные в данном документе, можно применять в способах диагностики, например, при обнаружении SNP, идентификации конкретных биомаркеров и т.д., при условии, что зонды комплементарны последовательности (например, геномной) возбудителя инфекционного заболевания, например, заболевания человека, включая, но не ограничиваясь, вирусов, бактерий, паразитов и грибков, тем самым диагностируя присутствие инфекционного агента в образце от пациента, содержащем нуклеиновую кислоту. Нуклеиновая кислота-мишень может быть геномной, кДНК, или мРНК, или синтетической, человека или животного, или микроорганизмов и т.д. В других вариантах реализации изобретения зонды можно применять для диагностики или прогнозирования заболевания или расстройства, которое не вызвано инфекционным агентом. Например, зонды можно применять для диагностики или прогнозирования рака, аутоиммунных заболеваний, психических заболеваний, генетических нарушений и т.д. путем определения наличия мутации, полиморфизма или аллеля в образце от человека или животного. В некоторых вариантах реализации изобретения зонд содержит мутацию или полиморфизм. Кроме того, зонды можно применять для оценки или отслеживания прогрессирования лечения заболевания или расстройства.
[0221] Еще одна область, которая выигрывает от мультиплексного анализа, это использование генетических маркеров в области идентификации человека. Генетические маркеры, как правило, представляют собой набор полиморфных локусов, имеющих аллели в геномной ДНК с характеристиками, представляющими интерес для анализа, такими как типирование ДНК, по которому индивиды дифференцируются на основе вариаций в их ДНК. Большинство методов типирования ДНК предназначены для обнаружения и анализа различий в длине и/или последовательности одного или более участков ДНК-маркеров, о которых известно, что они присутствуют по меньшей мере в двух различных формах или аллелях в популяции. Такое изменение именуются «полиморфизмом», и любая область ДНК, в которой происходит такое изменение, именуется «полиморфным локусом». Один из возможных методов типирования ДНК включает объединение технологии ПЦР-амплификации (K.В. Mullis, патент США №4683202) с анализом вариаций полиморфизма длины. Короткие тандемные дупликации (КТД), минисателлиты и переменное количество тандемных дупликаций (ПКТД) являются некоторыми примерами вариаций полиморфизма длины. КТД, содержащие повторяющиеся единицы из около трех-семи нуклеотидов, являются достаточно короткими, чтобы их можно было использовать в качестве генетических маркеров в областях применения ПЦР, поскольку протоколы амплификации могут быть разработаны для получения продуктов меньшего размера, чем это возможно из других участков ДНК переменной длины.
[0222] Описано несколько таких систем, содержащих несколько КТД-локусов. См., например, AMPFLSTR® SGMPLUS™ PCRAMPLIFICATION KIT USER'S MANUAL, Applied Biosystems, стр. i-x и с 1-1 по 1-16 (2001); AMPFLSTR® IDENTIFILER® PCR AMPLIFICATION KIT USER'S MANUAL, Applied Biosystems, стр. i-x и с 1-1 no 1-10 (2001); J.W. Schumm et al., патент США №7008771.
[0223] Способы по данному изобретению предполагают выбор подходящего набора локусов, праймеров и протоколов амплификации для генерации амплифицированных аллелей (ампликонов) из нескольких коамплифицированных локусов, причем ампликоны могут быть сконструированы таким образом, что они не перекрываются по размеру, и/или могут быть мечены таким образом, чтобы можно было различать аллели из разных локусов, которые действительно перекрываются по размеру. Кроме того, эти методы предполагают выбор нескольких КТД-локусов, совместимых для использования в рамках единого протокола амплификации.
[0224] Успешные комбинации в дополнение к описанным в данном документе могут быть получены, например, методом проб и ошибок в комбинировании локусов, путем выбора последовательностей пар праймеров и путем корректировки концентраций праймеров для определения равновесия, при котором все локусы для анализа могут быть амплифицированы. После раскрытия методов и материалов по изобретению специалисту в данной области техники, вероятно, будут предложены различные способы выбора локусов, пар праймеров и методик амплификации для использования в способах и наборах по изобретению. Предполагается, что все такие способы входят в объем прилагаемой формулы изобретения.
[0225] Для выбора набора локусов для использования в соответствии с данным изобретением можно использовать любую из ряда различных методик. Независимо от того, какие способы могут быть использованы для выбора локусов, анализируемых способами по данному изобретению, локусы, выбранные для мультиплексного анализа в различных вариантах реализации изобретения, имеют одну или более из следующих характеристик: (1) они производят продукты амплификации, достаточные для оценки аллелей ДНК; (2) они генерируют мало артефактов, если они вообще есть, на этапе мультиплексной амплификации из-за включения дополнительных оснований во время удлинения действительного целевого локуса или продукции неспецифических ампликонов; и (3) они генерируют мало артефактов, если они вообще есть, из-за преждевременного прекращения реакций амплификации полимеразой. См., например, J.W. Schumm et al. (1993), FOURTH INTERNATIONAL SYMPOSIUM ON HUMAN IDENTIFICATION, pp. 177-187, Promega Corp.
[0226] Как правило, олигонуклеотидные праймеры можно синтезировать химическим путем. Дизайн и выбор праймеров является рутинной процедурой оптимизации ПЦР. Специалист в данной области техники может легко сконструировать специфические праймеры для амплификации интересующего целевого локуса или получить наборы праймеров из ссылок, перечисленных в данном документе. Все эти праймеры входят в объем данного изобретения.
[0227] Например, праймеры могут быть выбраны с использованием любой из различных доступных и известных в данной области техники программ пакета программного обеспечения для разработки систем амплификации и/или мультиплексирования. См., например, программное обеспечение Primer Express® (Applied Biosystems, Фостер-Сити, Калифорния). В примере использования программ пакета программного обеспечения информация о последовательности из области интересующего локуса может быть импортирована в программное обеспечение. Затем программное обеспечение использует различные алгоритмы для выбора праймеров, которые лучше всего соответствуют требованиям пользователя.
[0228] Образцы геномной ДНК могут быть получены для использования в способах по данному изобретению с помощью любых процедур подготовки образцов, которые совместимы с последующей амплификацией ДНК. Многие такие процедуры известны специалистам в данной области техники. Некоторыми примерами являются очистка ДНК путем экстракции фенолом (J. Sambrook et al. (1989), в MOLECULAR CLONING: A LABORATORY MANUAL, SECOND EDITION, Cold Spring Harbor Laboratory Press, Cold Spring Harbor, NY, pp. 9.14-9.19) и частичная очистка осаждением соли (S. Miller et al. (1988), NUCL. ACIDS REs. 16:1215) или реагентом Килекс (P.S. Walsh et al. (1991), BIOTECHNIQUES 10:506-513; CT Corney et al. (I 994), J. FORENSIC Ser. 39:1254), и высвобождение неочищенного материала с использованием необработанной крови (J. Burckhardt (1994), PCRMETHODS AND APPLICATIONS 3:239-243; RBE McCabe (1991), PCR METHODS AND APPLICATION 1:99-106; B.Y. Nordvag (1992), BIOTECHNIQUES 12:4 pp. 490-492).
[0229] Когда по меньшей мере один образец ДНК, который должен быть проанализирован с использованием способов, описанных в данном документе, представляет собой геномную ДНК человека, ДНК может быть получена из образцов ткани, таких как, например, один или более из образцов крови, спермы, вагинальных клеток, волос, слюны, мочи, кости, из образцов из буккальной полости, амниотической жидкости, содержащей плацентарные клетки или клетки плода, ворсинок хориона и/или смеси любых из этих или других тканей.
[0230] Образцы, содержащие кровь или образцы из буккальной полости, также можно обрабатывать непосредственно с бумаги FTA® (Whatman Inc., Пискатауэй, Нью-Джерси), буккального коллектора Боде или тампонов. Примеры тампонов включают, но не ограничиваются ими, Copan 4N6 Forensic Flocked Swab (Copan, P/N 3520CS01, Мурриета, Калифорния), Omi Swab (Whatman Inc., P/N 10005) и Puritan Cotton Swab (Puritan, P/N 25-806 1WC EC, различные поставщики медицинских услуг).
[0231] После получения образца геномной ДНК целевые локусы могут быть коамплифицированы на этапе мультиплексной амплификации по данному изобретению. Для амплификации локусов может быть использован любой из множества различных методов амплификации, таких как, например, ПЦР (R.K. Saiki et al. (1985), SCIENCE 230:1350-1354), амплификация на основе транскрипции (D.Y. Kwoh и T.J. Kwoh (1990), AMERICAN BIOTECHNOLOGY LABORATORY, October, 1990) и амплификация с замещением цепи (SDA) (G.T. Walker et al. (1992), PROC. NATL. ACAD. Ser., U.S.A 89:392-396). В некоторых вариантах реализации данного изобретения мультиплексная амплификация может осуществляться с помощью ПЦР, в которой образец ДНК подвергается амплификации с использованием пар праймеров, специфичных для каждого локуса в мультиплексе. Химические компоненты стандартного ПЦР, как правило, включают растворитель, ДНК-полимеразу, дезоксирибонуклеозидтрифосфаты («дНТФ»), олигонуклеотидные праймеры, ион двухвалентного металла и образец ДНК, который, как ожидается, будет содержать мишень(и) для амплификации ПЦР. В качестве растворителя для ПЦР, как правило, может использоваться вода, как правило, содержащая буферный агент и небуферирующие соли, такие как KCL. Буферным агентом может быть любой буфер, известный в данной области техники, такой как, но не ограничиваясь этим, трис-HCl, и может варьироваться с помощью рутинных экспериментов для оптимизации результатов ПЦР. Специалисты в данной области техники легко смогут определить оптимальные условия буферизации. Буферы ПЦР можно оптимизировать в зависимости от конкретного фермента, используемого для амплификации.
[0232] Фермент, который полимеризует нуклеотидтрифосфаты в продукты амплификации в ПЦР, может представлять собой любую ДНК-полимеразу. ДНК-полимераза может представлять собой, например, любую термостойкую полимеразу, известную в данной области техники. Примерами некоторых полимераз, которые могут быть использованы в данном изобретении, являются ДНК-полимеразы организмов, таких как Thermus aquaticus, Thermus thermophilus, Thermococcus litoralis, Bacillus stearothermophilus, Thermotoga maritima и Pyrococcus sp. Фермент можно получить любым из нескольких возможных способов, например, выделением из исходных бактерий, получением с помощью технологии рекомбинантной ДНК или приобретением из коммерческих источников. Некоторые примеры таких коммерчески доступных ДНК-полимераз включают ДНК-полимеразу AmpliTaq Gold®, ДНК-полимеразу AmpliTaq®, фрагмент Штоффеля ДНК-полимеразы AmpliTaq®, ДНК-полимеразу rTth и ДНК-полимеразу rTth, XL (все производятся Applied Biosystems, Фостер-Сити, Калифорния). Другие примеры подходящих полимераз включают большой фрагмент ДНК-полимеразы Tne, Bst из Bacillus stearothermophilus, Vent и Vent Exo из Thermococcus litoralis, Tma из Thermotoga maritima, Deep Vent и Deep Vent Exo и Pfu из Pyrococcus sp., и мутанты, варианты и производные вышеперечисленного.
[0233] Когда в мультиплексной реакции используется флуоресцентное мечение праймеров, для мечения различных праймеров можно, как правило, использовать по меньшей мере три разные метки. Когда для оценки продуктов мультиплексной реакции используется размерный маркер, праймеры, используемые для получения размерного маркера, могут быть помечены меткой, отличной от праймеров, которые амплифицируют интересующие локусы в реакции. С появлением автоматизированной флуоресцентной визуализации и анализа могут быть достигнуты более быстрое обнаружение и анализ продуктов мультиплексной амплификации.
[0234] В некоторых вариантах реализации данного изобретения для мечения по меньшей мере одного праймера мультиплексной амплификации может быть использован флуорофор, например, путем ковалентного связывания с праймером, создавая, таким образом, праймер с флуоресцентной меткой. В некоторых вариантах реализации изобретения праймеры для разных целевых локусов в мультиплексе могут быть помечены разными флуорофорами, причем каждый флуорофор дает продукт разного цвета в зависимости от длины волны излучения флуорофора. Эти по-разному меченые праймеры могут быть использованы в одной и той же мультиплексной реакции, а их соответствующие продукты амплификации впоследствии могут быть анализированы вместе. Можно пометить либо прямой, либо обратный праймер из пары, которая амплифицирует конкретный локус, хотя чаще может быть помечен прямой праймер.
[0235] Продукты ПЦР можно анализировать в просеивающей или не просеивающей среде. В некоторых вариантах реализации данного изобретения, например, продукты ПЦР могут быть анализированы с помощью электрофореза, например, капиллярного электрофореза, как это описано в Н. Wenz et al. (1998), GENOME REs. 8:69-80 (см. также E. Buel et al. (1998), J. FORENSIC SCI. 43: (1), pp. 164-170)), или электрофореза в пластине геля, как это описано в М. Christensen et al. (1999), SCAND. J. CLIN. LAB. INVEST. 59(3): 167-177, или электрофореза в полиакриламидном геле в денатурирующих условиях (см., например, J. Sambrook et al. (1989), в MOLECULAR CLONING: A LABORATORY MANUAL, SECOND EDITION, Cold Spring Harbor Laboratory Press, Cold Spring Harbor, NY, pp. 13.45-13.57). Разделение фрагментов ДНК при электрофорезе основывается, прежде всего, на разном размере фрагментов. Продукты амплификации также могут быть проанализированы с помощью хроматографии, например, с помощью эксклюзионной хроматографии (ЭХ).
[0236] После разделения амплифицированных аллелей эти аллели и любая другая ДНК, например, в геле или капилляре (например, размерные маркеры ДНК или аллельная лестница) могут быть визуализированы и проанализированы. Часто методом обнаружения множественных локусов может быть флуоресценция. См., например, J.W. Schumm et al. в PROCEEDINGS FROM THE EIGHTH INTERNATIONAL SYMPOSIUM ON HUMAN IDENTIFICATION, pub. 1998, Promega Corporation, pp. 78-84; E. Buel et al. (1998), выше. Когда флуоресцентно меченые праймеры используются для обнаружения каждого локуса в мультиплексной реакции, за амплификацией может следовать обнаружение меченых продуктов с использованием флуорометрического детектора.
[0237] Размер аллелей, присутствующих в каждом локусе в образце ДНК, может быть определен путем сравнения со стандартом размера в электрофорезе, таким как маркер ДНК известного размера. Маркеры для оценки мультиплексной амплификации, содержащей два или более полиморфных КТД-локуса, также могут содержать локус-специфичную аллельную лестницу или комбинацию аллельных лестниц для каждого из оцениваемых локусов. См., например, С. Puers et al. (1993), AM. J. HUM. GENET. 53:953-958; C. Puers et al. (1994), GENOMICS 23:260-264. См. также патенты США №№5599666, 5674686 и 5783406 для описания некоторых аллельных лестниц, подходящих для использования при обнаружении КТД-локусов, и некоторых способов построения лестниц, раскрытых в них. После построения аллельных лестниц для отдельных локусов эти лестницы могут быть подвергнуты электрофорезу одновременно с продуктами амплификации. Каждая аллельная лестница мигрирует вместе с аллелями соответствующего локуса.
[0238] Продукты мультиплексных реакций по данному изобретению также могут быть оценены с использованием внутреннего размерного стандарта, т.е. специального типа размерного маркера, сконфигурированного для электрофореза, например, в том же капилляре, что и продукты амплификации. Внутренний размерный стандарт может включать серию фрагментов известной длины. Внутренний размерный стандарт также может быть помечен флуоресцентным красителем, который отличается от других красителей в реакции амплификации. Внутренний размерный стандарт может быть смешан с амплифицированным образцом или размерными стандартами/аллельными лестницами и подвергнут электрофорезу с любым из них, чтобы сравнить миграцию в разных дорожках гель-электрофореза или разных капиллярах капиллярного электрофореза. Вариация миграции внутреннего размерного стандарта может указывать на изменение характеристик разделяющей среды. Количественное определение этой разницы и корреляции с аллельными лестницами может обеспечить калибровку продукта амплификации, подвергнутого электрофорезу в различных дорожках или капиллярах, и корректировку определения размера аллелей в неизвестных образцах.
[0239] Если для маркировки продуктов амплификации используются флуоресцентные красители, электрофорезированные и разделенные продукты могут быть проанализированы с использованием оборудования для обнаружения флуоресценции, такого как, например, генетический анализатор ABI PRISM® 310 или 3 130xl, или секвенсор ДНК ABI PRISM® 37 (Applied Biosystems, Фостер-Сити, Калифорния), или флуоресцентный сканер Hitachi FMBIO™ II (Hitachi Software Engineering America, Ltd., Южный Сан-Франциско, Калифорния). В различных вариантах реализации данного изобретения продукты ПЦР могут быть проанализированы с помощью протокола капиллярного гель-электрофореза в сочетании с такими приборами для электрофореза, как генетический анализатор ABI PRISM® 3130xl (Applied Biosystems), и может быть выполнен аллельный анализ продуктов амплификации, подвергнутых электрофорезу, например, с помощью программного обеспечения GeneMapper® ID v3.2 от Applied Biosystems. В других вариантах реализации изобретения продукты амплификации могут быть разделены электрофорезом, например, в около 4,5% 29:1 акриламиде : бисакриламиде, 8 М геле мочевины, приготовленном для автоматического флуоресцентного ДНК-секвенатора ABI PRISM® 377.
[0240] Данное изобретение также относится к наборам, в которых используются способы, описанные выше. В некоторых вариантах реализации изобретения базовый набор может содержать контейнер, содержащий один или более локус-специфичных праймеров. Набор также может необязательно содержать инструкции по применению. Набор также может содержать другие необязательные компоненты набора, такие как, например, одну или более аллельных лестниц, направленных на каждый из указанных локусов, достаточное количество фермента для амплификации, буфер для амплификации для облегчения амплификации, раствор двухвалентных катионов для облегчения ферментативной активности, дНТФ для удлинения цепи во время амплификации, загрузочный раствор для подготовки амплифицированного материала для электрофореза, геномная ДНК в качестве контроля матрицы, размерный маркер для гарантии того, что материалы мигрируют, как ожидается в разделяющей среде, а также протокол и руководство для обучения пользователя и ограничения количества ошибок при использовании. Количество различных реагентов в наборах также может варьироваться в зависимости от ряда факторов, таких как оптимальная чувствительность процесса. В объем данного изобретение входит предоставление тестовых наборов для использования вручную или тестовых наборов для использования с автоматическими детекторами или анализаторами.
[0241] В клинических условиях КТД-маркеры могут использоваться, например, для мониторинга степени приживления донорского трансплантата при трансплантации костного мозга. В больницах эти маркеры также могут быть полезны для сопоставления и отслеживания образцов. Эти маркеры также вошли в другие области науки, такие как исследования популяционной биологии расовых и этнических групп людей (D.B. Goldstein et al. (1995), PROC. NATL. ACAD. Ser. U.S.A. 92:6723-6727), эволюции и дивергенции видов, а также изменчивости таксонов животных и растений (M.W. Bruford et al. (1993), CURR. BIOL. 3:939-943).
[0242] Амплификация мини-КТД (локусов, содержащих менее 200 пар оснований) позволяет проводить анализ профилей сильно деградированной ДНК, как это показано в M.D. Coble (2005), J. FORENSIC SCI. 50(1):43-53, которая включена в данный документ посредством ссылки. В Таблице 1 (см. патентную заявку США №61/413946, поданную 15 ноября 2010 г. и патентную заявку №61/526195, поданную 22 августа 2011 г. для Таблицы 1) также представлены локусы, которые можно рассматривать как локусы мини-КТД в зависимости от расположения праймеров, используемых для амплификации маркера КТД в наборе для амплификации праймеров.
[0243] В способе по данному изобретению концентрации ДНК могут быть измерены перед использованием с помощью любого стандартного метода количественной оценки ДНК, известного специалистам в данной области техники. Такие методы количественной оценки включают, например, спектрофотометрическое измерение, описанное в Приложении Е.5 J. Sambrook et al. (1989), выше, или флуорометрическую методику с использованием такой методики измерения, как описанная C.F. Brunk et al. (1979), ANAL. BIOCHEM. 92: 497-500. Концентрацию ДНК можно измерить путем сравнения степени гибридизации стандартов ДНК с зондом, специфичным для человека, например, как это описано J.S. Waye et al. (1991), J. FORENSIC SCI. 36:1198-1203 (1991). Использование слишком большого количества матричной ДНК в реакциях амплификации может привести к образованию артефактов амплификации, которые не будут отражать истинные аллели.
[0244] Когда флуоресцентное мечение праймеров используется в мультиплексной реакции, как правило, используются по меньшей мере три разные метки, по меньшей мере четыре разные метки, по меньшей мере пять разных меток, по меньшей мере шесть разных меток. Например, в существующих коммерческих анализах используются 6 уникальных красителей (набор для амплификации VeriFiler™ Plus PCR, Thermo Fisher Scientific). Приборы, используемые для анализа мультиплексных реакций на основе флуоресцентных красителей, ограничены по длинам волн света, которые они могут излучать для возбуждения флуоресцентных красителей, и по длинам волн света, излучаемых красителями, которые они могут обнаруживать. Чтобы разработать мультиплексный анализ с использованием по меньшей мере 8 меток, по меньшей мере 10 меток или по меньшей мере 16 меток, необходим ряд красителей, которые обладают уникальными спектрами, отличными друг от друга, с небольшим наложением или без него. Кроме того, все метки флуоресцентных красителей должны поддаваться обнаружению на приборе, способном производить определенный набор длин волн при возбуждении и с определенным диапазоном обнаруживаемых излучаемых длин волн. Класс родаминовых производных, описанный в данном документе, обеспечивает метки с красителем с уникальными спектральными свойствами, которые недоступны для существующих соединений красителей, и, следовательно, открывает возможность увеличения количества меток с флуоресцентными красителями, используемых в мультиплексных реакциях, с вплоть до 8, 10, 12, 16 или более различных меток с использованием существующей лазерной технологии, обычно используемой для современных мультиплексных анализов. Предполагается, что с улучшением инструментальных возможностей, мультиплексные анализы, применяющие более 8 меток (например, по меньшей мере 10, по меньшей мере 12 или по меньшей мере 16 различных меток), могут быть использованы для мечения различных праймеров. Когда для оценки продуктов мультиплексной реакции используется размерный маркер, праймеры, используемые для получения размерного маркера, могут быть помечены меткой, отличной от праймеров, которые амплифицируют интересующие локусы в реакции. С появлением автоматизированной флуоресцентной визуализации и анализа могут быть достигнуты более быстрое обнаружение и анализ продуктов мультиплексной амплификации.
[0245] Ниже приведены некоторые примеры возможных флуорофоров, хорошо известных в данной области техники и подходящих для использования в комбинации с соединениями, описанными в данном изобретении, для проведения анализов с использованием нескольких флуоресцентных меток. Список предназначен для примера и ни в коем случае не является исчерпывающим. Некоторые возможные флуорофоры включают: флуоресцеин (ФЛ), который максимально поглощает при 492 нм и максимально излучает при 520 нм; N,N,N',N'-тетраметил-6-карбоксиродамин (TAMRA™), который максимально поглощает при 555 нм и максимально излучает при 580 нм; 5-карбоксифлуоресцеин (5-FAM™), который максимально поглощает при 495 нм и максимально излучает при 525 нм; 2',7'-диметокси-4',5'-дихлор-6-карбоксифлуоресцеин (JOE™), который максимально поглощает при 525 нм и максимально излучает при 555 нм; 6-карбокси-Х-родамин (ROX™), который максимально поглощает при 585 нм и максимально излучает при 605 нм; CY3™, который максимально поглощает при 552 нм и максимально излучает при 570 нм; CY5™, который максимально поглощает при 643 нм и максимально излучает при 667 нм; тетрахлорфлуоресцеин (ТЕТ™), который максимально поглощает при 521 нм и максимально излучает при 536 нм; и гексахлорфлуоресцеин (HEX™), который максимально поглощает при 535 нм и максимально излучает при 556 нм; NED™, который максимально поглощает при 546 нм и максимально излучает при 575 нм; 6-FAM™, который максимально излучает при около 520 нм; VIC®, который максимально излучает при около 550 нм; PET®, который максимально излучает при 590 нм; и LIZ™, который максимально излучает при около 650 нм. См. S.R. Coticone et al., патент США №6780588; AMPFLSTR® IDENTIFILER™ PCR AMPLIFICATION KIT USER'S MANUAL, pp. 1-3, Applied Biosystems (2001). Следует обратить внимание, что перечисленные выше длины волн излучения и/или поглощения являются типичными и могут использоваться только в общих целях; фактические пиковые длины волн могут различаться для разных областей применения и в разных условиях. Дополнительные флуорофоры могут быть выбраны для необходимых спектров поглощения и излучения, а также цвета, известны специалисту в данной области техники и представлены ниже:
[0246]
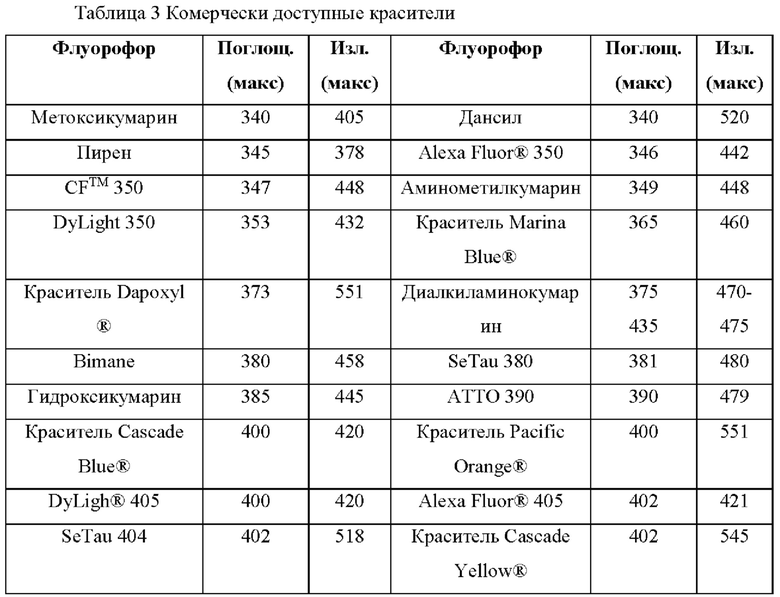
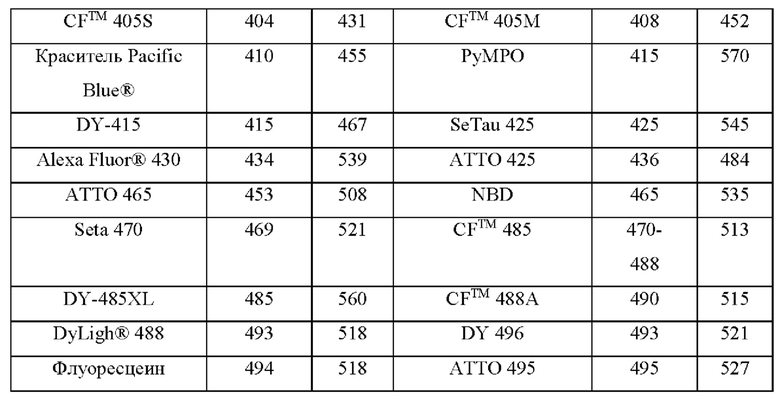
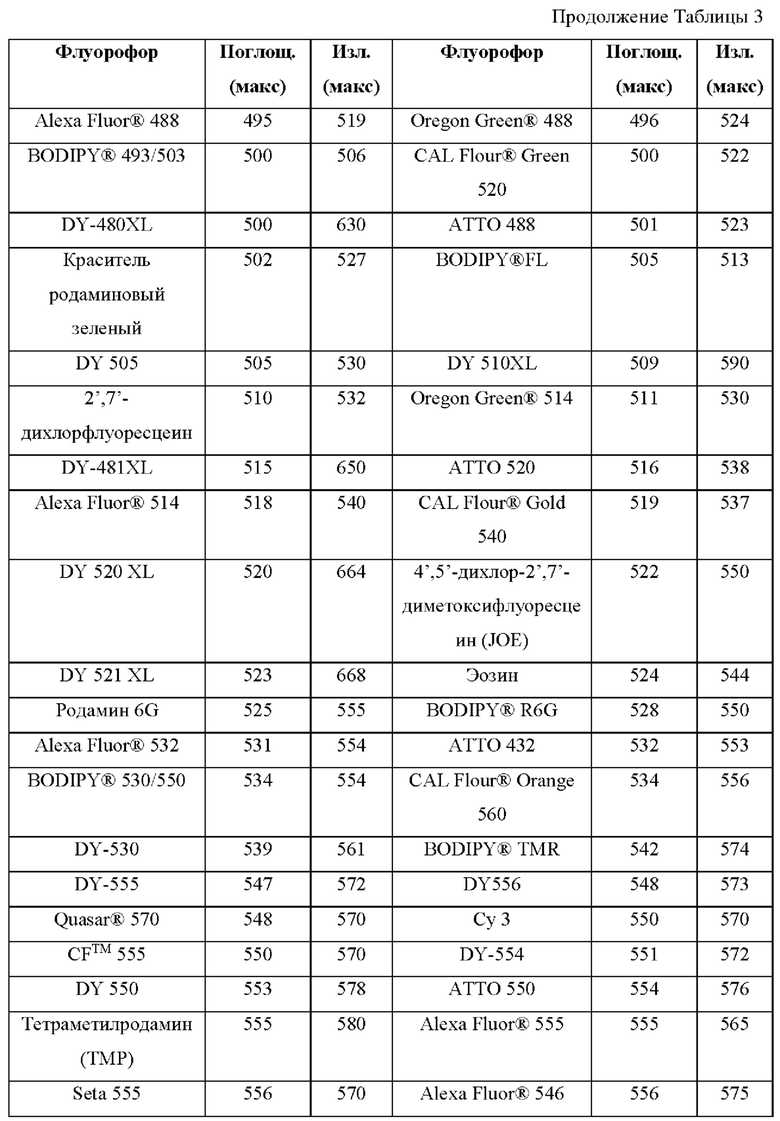
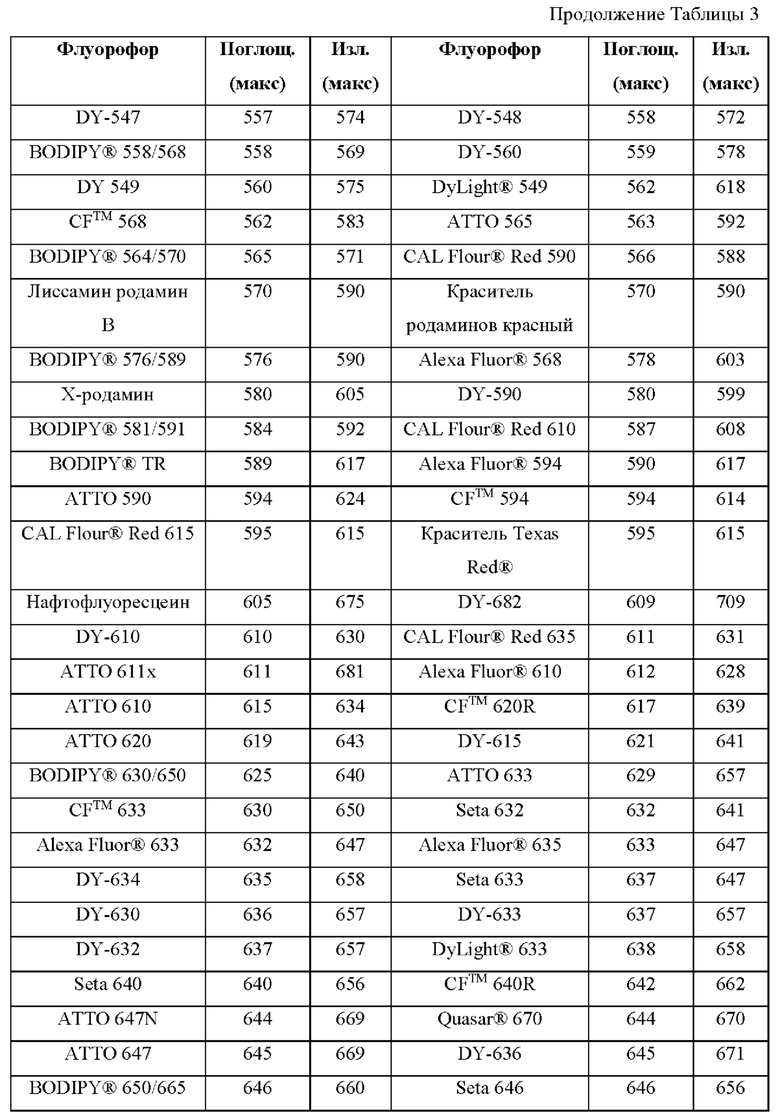
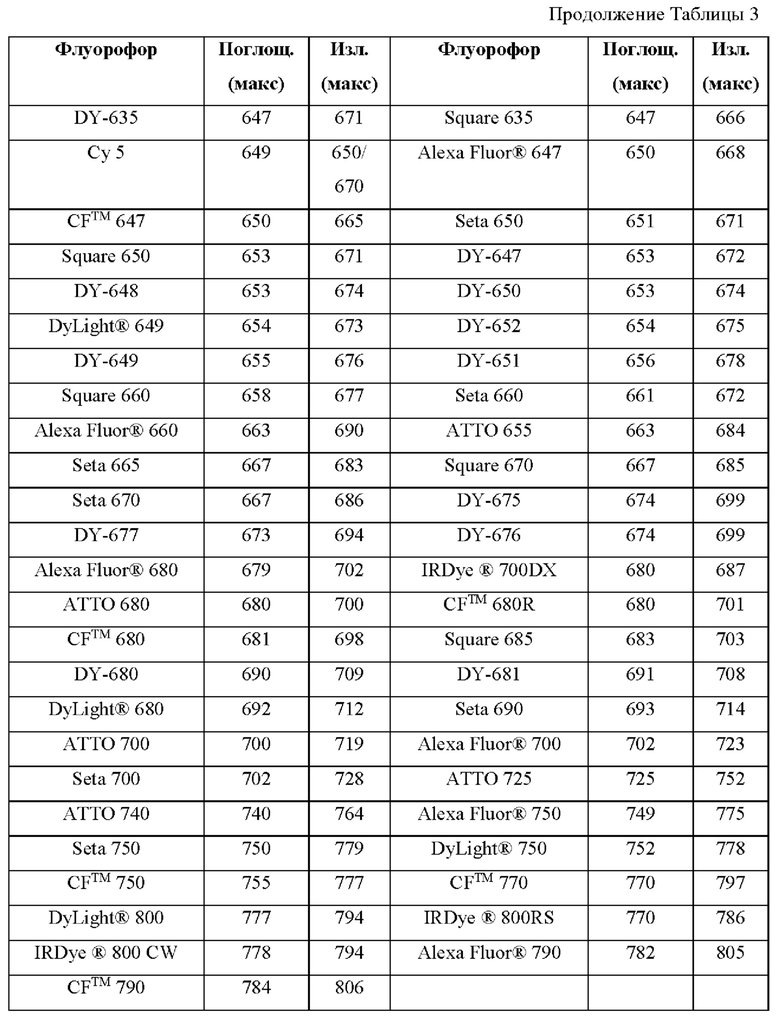
[0247] Описанные в данном документе соединения асимметричного родамина могут быть использованы в мультиплексном анализе в комбинации с одной или более дополнительными флуоресцентными метками. Различные варианты реализации данного изобретения могут включать одну мультиплексную реакцию, включающую по меньшей мере восемь различных красителей. По меньшей мере восемь красителей могут включать любые восемь из перечисленных выше красителей или любые другие восемь красителей, известные в данной области техники. В других вариантах реализации изобретения может использоваться единственная мультиплексная реакция, включающая по меньшей мере десять или по меньшей мере двенадцать или по меньшей мере шестнадцать различных красителей.
[0248] Также предложены композиции, такие как реакционная смесь или мастер-микс, содержащие описанный зонд. В одном варианте реализации изобретения композиция для ПЦР, а именно, для ПЦР в реальном времени или количественной ПЦР, ПЦР с детекцией по конечной точке, содержит по меньшей мере один из описанных зондов. В одном варианте реализации изобретения композиция или реакционная смесь, или мастер-микс для ПЦР (например, количественной ПЦР или ПЦР с детекцией по конечной точке) содержит зонды, позволяющие обнаруживать 4 целевые нуклеиновые кислоты, и описанный зонд(ы), позволяет обнаруживать по меньшей мере одну из 5-й и/или 6-й целевой нуклеиновой кислоты, при этом каждый из описанных зондов состоит из донорного фрагмента ФРПЭ, т.е. флуорофора, и акцепторного фрагмента ФРПЭ, то есть гасителя, причем флуорофор проявляет максимум излучения между около 650 и 720 нм. Максимальное поглощение гасителя, описанного в данном документе, находится в диапазоне от 660 до 668 нм. Диапазон поглощения гасителя, описанного в данном документе, составляет от 530 до 730 нм. В альтернативном варианте реализации изобретения предложены реагенты для мечения для конъюгирования описанного флуорофора и гасителя с выбранным олигонуклеотидом.
[0249] Кроме того, такая композиция или реакционная смесь, или мастер-микс может содержать одно или более соединений и реагентов, выбранных из следующего перечня: буфер, применимый для полимеразной цепной реакции, дезоксинуклеозидтрифосфаты (дНТФ), ДНК-полимераза с от 5' до 3' экзонуклеазной активностью, по меньшей мере одна пара или несколько пар праймеров для амплификации и/или дополнительные зонды.
[0250] В некоторых вариантах реализации изобретения предлагаемые способы дополнительно включают определение генотипа целевого полинуклеотида с использованием продукта амплификации. В некоторых вариантах реализации изобретения предлагаемые способы дополнительно включают определение количества копий целевого полинуклеотида с использованием продукта амплификации.
[0251] Справочные работы, патенты, патентные заявки, научная литература и другие печатные публикации, а также номера доступа к последовательностям базы данных Gen Bank, которые упоминаются в данном документе, полностью включены в данный документ посредством ссылки.
[0252] Специалистам в данной области техники будет понятно, что в различные варианты реализации данного изобретения могут быть внесены многочисленные изменения и модификации, не выходящие за рамки предмета данного изобретения. Предполагается, что все такие варианты входят в объем данного изобретения.
[0253] Если не указано иное, способы и методики по данным вариантам реализации изобретения, как правило, выполняются в соответствии с традиционными способами, хорошо известными в данной области техники и описанными в различных общих и более конкретных ссылках, которые цитируются и обсуждаются в данном описании. См., например, Loudon, Organic Chemistry, Fourth Edition, New York: Oxford University Press, 2002, pp. 360-361, 1084-1085; Smith and March, March's Advanced Organic Chemistry: Reactions, Mechanisms, and Structure, Fifth Edition, Wiley-Interscience, 2001.
[0254] Химическая номенклатура соединений, описанных в данном документе, в целом была получена с использованием коммерчески доступных ACD/Name 2014 (ACD/Labs) или ChemBioDraw Ultra 13.0 (Perkin Elmer).
[0255] Понятно, что определенные признаки раскрытия, которые для ясности описаны в контексте отдельных вариантов реализации изобретения, также могут быть предоставлены в комбинации в одном варианте реализации изобретения. И наоборот, различные признаки раскрытия, которые для краткости описаны в контексте одного варианта реализации изобретения, также могут быть предоставлены отдельно или в любой подходящей субкомбинации. Все комбинации вариантов реализации изобретения, относящиеся к химическим группам, представленным переменными, конкретно охватываются данным раскрытием и раскрываются в данном документе, как если бы каждая комбинация была отдельно и явно раскрыта, в той степени, в которой такие комбинации включают соединения, которые являются стабильными соединениями (т.е. соединениями, которые могут быть выделены, охарактеризованы и протестированы на биологическую активность). Кроме того, все субкомбинации химических групп, перечисленных в вариантах реализации изобретения, описывающих такие переменные, также конкретно охватываются данным раскрытием и раскрываются в данном документе, как если бы каждая такая субкомбинация химических групп была индивидуально и явно раскрыта в данном документе.
Химический синтез
[0256] Типичные химические соединения, используемые в способах по описанию, далее будут описаны со ссылкой на иллюстративные схемы синтеза для их общего получения, приведенные ниже, и конкретные примеры, которые следуют ниже. Рядовые специалисты в данной области техники признают, что, для получения различных соединений по данному документу исходные материалы могут быть подходящим образом выбраны так, чтобы в конечном итоге целевые заместители проходили через схему реакции с защитой или без нее, в зависимости от ситуации, с получением целевого продукта. В альтернативном варианте, может быть необходимо или желательно использовать вместо окончательного целевого заместителя подходящую группу, которая может быть введена в схему реакции и заменена, при необходимости, целевым заместителем. Кроме того, специалист в данной области техники поймет, что преобразования, изображенные на схемах ниже, могут выполняться в любом порядке, который совместим с функциональностью конкретных боковых групп.
[0257] Все химические вещества общего назначения были закуплены у коммерческих химических компаний, таких как Fisher Scientific, Acros или Alfa Aesar. Силикагель (220-400 меш) от Fisher Scientific использовался для флэш-хроматографии с нормальной фазой. Хроматографию с обратной фазой выполняли с использованием силикагеля, функционализированного октадецилом, от JT Baker. Все градиенты растворителя для хроматографии были ступенчатыми. Тонкослойную хроматографию (ТСХ) проводили на предметных стеклах из силикагеля с алюминиевой подложкой от ЕМ Science. ТСХ с обратной фазой выполняли на планшетах HPTLC RP18F Uniplate от Analtech. Проявляющиеся пятна визуализировались как при длинноволновом, так и при коротковолновом УФ-облучении.
[0258] Спектры ЯМР определяли на ЯМР Varian 400 МГц с привязкой к пику растворителя. ВЭЖХ выполняли на приборе Agilent 1200 HPLC с диодно-матричным детектором и множеством длин волн каналов. Типчное элюирование проводили со скоростью 1 мл/мин с градиентом ацетонитрила и 0,1 М ацетата триэтиламмония (ТЭАА) через колонку Agilent Pursuit С8 150×4,6 мм 5 мкм. Данные ЖХМС были получены с использованием системы ЖХ Agilent 1200, соединенной с масс-спектрометром РЕ Sciex API 150 EX. Данные МС получали путем прямой инфузии на масс-спектрометре API Sciex 4000.
[0259] Безводные растворители обрабатывали в атмосфере азота с помощью высушенных в печи шприцев. Используемый в данном документе термин «водная обработка» относится к способу очистки, включающему следующие этапы: растворение или разбавление реакционной смеси в указанном органическом растворителе, промывание указанным водным раствором или водой, однократное промывание объединенного органического слоя насыщенным NaCl, сушка раствора безводным Na2SO4, отфильтровывание осушающего агента и удаление растворителя в вакууме.
[0260] Пример 1. Получение асимметричного родаминового красителя.
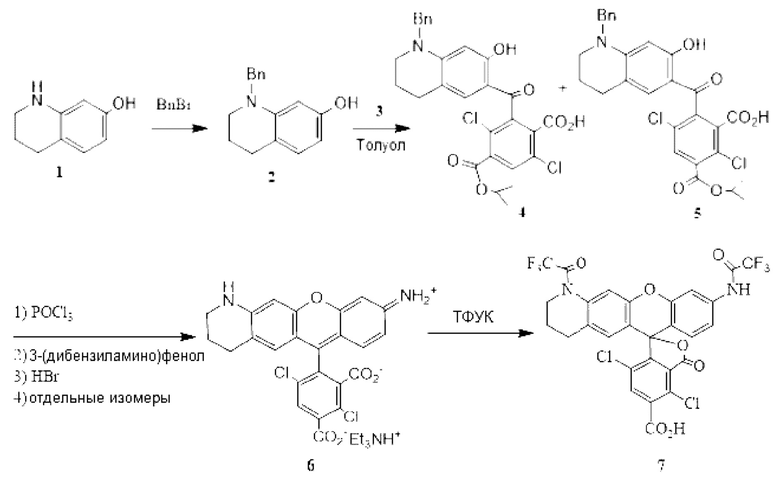
[0261] Этап 1: Получение 1-бензил-1,2,3,4-тетрагадрохинолин-7-ола, 2
[0262] 1,2,3,4-тетрагидрохинолин-7-ол 1 (10,00 г, 0,0670 моль; G. Field, P.R. Hammond, РТО 5283336) растворяли в безводном ДМФ (100 мл). Добавляли безводный K2CO3 (27,79 г, 0,138 моль) и бензилбромид (9,6 мл, 0,0804 моль), и смесь нагревали до 60°С в течение 2 часов, а затем перемешивали при комнатной температуре в течение ночи. Смесь фильтровали и промывали ДХМ. Фильтрат концентрировали, а затем растворяли в ДХМ, четыре раза промывали водой и обрабатывали с получением неочищенного твердого вещества коричневого цвета, которое очищали колоночной флэш-хроматографией на силикагеле, элюируя смесью 0-5% МеОН/ДХМ, с получением 1-бензил-1,2,3,4-тетрагидрохинолин-7-ола 2 (12,27 г, 76%) в виде твердого вещества бело-коричневого цвета (С. Zhang et al. WO 2003/072566); 1H-ЯМР (400 МГц, CD2Cl2) 7,37 (m, 2Н), 7,29 (m, 3Н), 6,82 (d, 1Н), 6,04 (dd, 1H), 5,96 (d, 1H), 4,53 (s, 1H), 4,49 (s, 2H), 3,41 (t, 2H), 2,76 (t, 2H), 2,02 (m, 2H); MC рассчитанный 240,33, наблюдаемый 240,2 (MH+).
[0263] Этап 2. Получение 2-(1-бензил-7-гидрокси-1,2,3,4-тетрагидрохинолин-6-карбонил)-3,6-дихлор-4-(изопропоксикарбонил)бензойной кислоты, 4/5
[0264] Соединение 2 (17,39 г, 72,65 ммоль), изопропиловый эфир 3,6-дихлортримеллитовой кислоты, 3 (22,02 г, 72,65 ммоль, получали в соответствии со способами, описанными в WO 2002/30944, включенной в данный документ посредством ссылки на получение 3) и толуол (100 мл) кипятили с обратным холодильником при интенсивном перемешивании в атмосфере азота в течение 6,5 часов. После охлаждения на ледяной бане смесь фильтровали и собирали пурпурно-желтое твердое вещество, которое промывали толуолом и сушили с получением изомеров кетона 4/5 в виде твердого вещества желтого цвета (30,81 г, 78%). 1Н-ЯМР (400 МГц, CD3C(O)CD3): δ 7,95 (s/s, 1H), 7,25-7,40 (m, 5Н), 6,79-6,80 (s/s, 1H), 5,99 (s, 1H), 5,25 (m, 1H), 4,68 (s, 1H), 3,54 (t, 2H), 2,60 (m, 2H), 1,95 (m, 2H), 1,39 (m, 6H); MC: рассчитанный 502,1, наблюдаемый 502,4 (MH+).
[0265] Этап 3: Получение асимметричного родаминового красителя 6
[0266] Оксихлорид фосфора (10,9 мл, 117,2 ммоль) добавляли к смеси изомеров кетона 4/5 (21,18 г, 30,43 ммоль) в хлороформе (400 мл) и перемешивали в течение 5 минут. 3-(дибензиламино)фенол (8,81 г, 39,05 ммоль; получен в соответствии со способами, описанными в A. Buta, et al., J Med Chem, 2015, 58, 4449, включенном в данный документ посредством ссылки на получение 3-(дибензиламино)фенола) растворяли в хлороформе (150 мл) и добавляли к смеси. Раствор сразу становился сине-зеленым. Раствор кипятили с обратным холодильником при перемешивании в течение 3 часов. Полученный темно-синий раствор концентрировали и сушили. Твердое вещество кипятили с бромистоводородной кислотой (400 мл) с обратным холодильником при интенсивном перемешивании в течение 45 минут и затем выливали на лед. Полученный мелкий синий осадок собирали центрифугированием и фильтрацией и промывали водой. Твердое вещество перемешивали с 2 М ТЭАА в течение ночи и фильтровали сквозь целит 545. Любое оставшееся твердое вещество собирали, отделяли от целита с использованием МеОН, затем концентрировали, смешивали с 10% МеОН/0,1 М ТЭАА и снова фильтровали сквозь целит 545. Фильтраты объединяли, и большой объем загружали в верхнюю часть большой хроматографической колонки с обратной фазой, уравновешенной 0,1 М ТЭАА. Изомеры разделяли, элюируя смесью 25%-35%-40% МеОН/0,1 М ТЭАА. Фракции анализировали с помощью ВЭЖХ, и краситель 6 (второй краситель, элюируемый ВЭЖХ и ОФ-ТСХ) разбавляли равным объемом воды и обессоливали на толстом слое из С18. Твердое вещество дополнительно очищали промыванием 1% ТФУК/ДХМ, фильтрованием и сушкой с получением красителя 6 (5,77 г, 25%) в виде соли ТЭА. 1Н-ЯМР (400 МГц, CD3OD): δ 9,57 (s, 1H), 9,15 (d. 1H), 8,96 (s, 1H), 8,73 (d/d, 1H), 8,64 (d, 1H), 8,53 (s, 1H), 5,36 (m, 1H), 5,26-5,13 (m/q 7H), 4,82 (m, 1H), 4,72 (m, 1H), 3,89 (m, 2H), 3,29 (t, 9H); MC: рассч. 483,05, наблюдаемый 483,05 (MH+); максимальная длина волны поглощения 537 нм.
[0267] Этап 4: Получение асимметричного родаминового красителя 7
[0263] Краситель 6 (4,21 г, 7,20 ммоль) растворяли в безводном ДХМ (500 мл) и смешивали с ТЭА (20,1 мл, 144 ммоль). По каплям добавляли ангидрид трифторуксусной кислоты (20,0 мл, 144 ммоль) и перемешивали в течение 0,5 часа. Полученный бесцветный раствор концентрировали, повторно растворяли в ДХМ, промывали 1 Н HCl и обрабатывали с получением соединения 7.
[0269] Пример 2
[0270] Получение фосфорамидита 10 N-защищенного асимметричного родамина 7
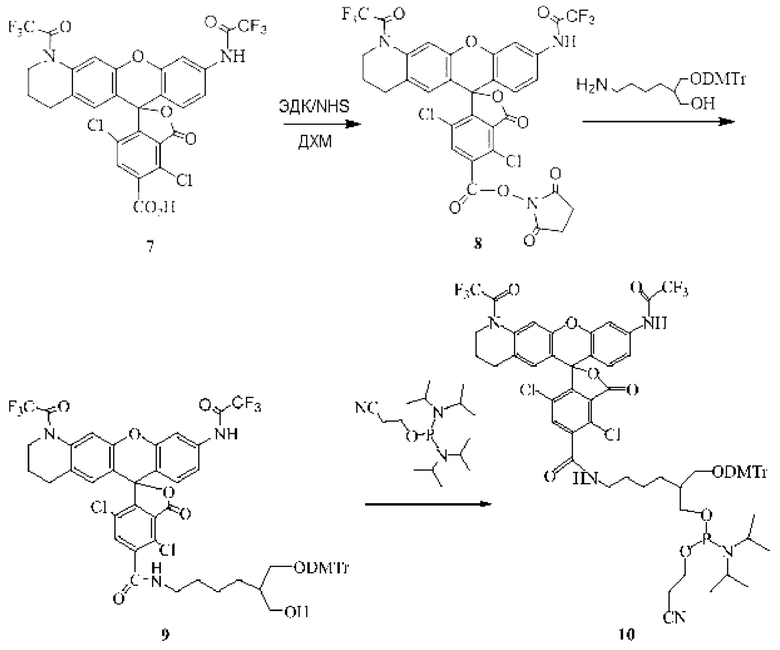
[0271] Этап 1: Получение активированного сложного эфира асимметричного родаминового красителя 8
[0272] Соединение 7 повторно растворяли в безводном ДХМ (300 мл), смешивали с N-гидроксисукцимидом (1,66 г, 14,4 ммоль) и 1-этил-3-(3-диметиламинопропил)карбодиимидом (ЭДК, 2,76 г, 14,4 ммоль) и перемешивали в течение 45 мин. Реакционный раствор дважды промывали водой и обрабатывали. Остаток очищали колоночной флэш-хроматографией на силикагеле, элюируя смесью 50% EtOAc/гексана, с получением соединения 8. МС: рассчит. 722,03, наблюдаемый 772,0.
[0273] Этап 2: 6-амино-2-ДМТ-гексан-1-оловый линкер N-защищенного асимметричного родаминового красителя 9
[0274] Соединение 8 суспендировали в безводном ДХМ (250 мл), по каплям добавляли раствор 6-амино-2-((бис(4-метоксифенил)(фенил)метокси)метил)гексан-1-ола (3,88 г, 8,64 ммоль) и триэтиламина (1,00 мл, 7,20 ммоль; ТЭА) и перемешивали в течение 45 мин. Полученный раствор концентрировали и затем очищали с использованием колоночной флэш-хроматографии на силикагеле, элюируя 2,5-5% МеОН/ДХМ, с получением 9 в виде твердого вещества бледно-желто-белого цвета (5,45 г, 68%). 1Н-ЯМР (400 МГц, CD2Cl2): δ 8,39 (s, 1H), 7,74 (s, 1Н), 7,73 (d, 1H), 7,42 (m, 2Н), 7,34-7,20 (m, 7Н), 6,90 (d/d, 1H), 6,83 (m, 4Н), 6,73 (s, 1H), 6,20 (t, 1H), 3,90 (m, 1H), 3,82-3,70 (m/s, 7Н), 3,63 (m, 2Н), 3,42 (m, 2Н), 3,25 (m, 1H), 3,09 (m, 1H), 2,16 (t, 1H), 2,04 (m, 2Н), 1,79 (m, 1H), 1,58 (m, 2Н/H2O), 1,35 (m, 4Н); ЖХМС: рассчит. 1104,3, наблюдаемый 1104,8 (МН-).
[0275] Этап 3: Получение фосфорамидита 10 N-защищенного асимметричного родамина 7
[0276] Соединение 9 (5,32 г, 4,81 ммоль) растворяли в безводном ДХМ (200 мл) и добавляли молекулярные сита 3А (15 г). Добавляли 2-цианоэтил-N,N,N',N'-тетраизопропилфосфородиамидит (2,17 г, 7,21 ммоль), затем тетразоламин (0,412 г, 2,40 ммоль), и смесь перемешивали в атмосфере азота при комнатной температуре в течение 1 часа. Реакционную смесь элюировали через хроматографическую колонку с обратной фазой, предварительно уравновешенную 20% ТЭА/ДХМ, а затем 2% ТЭА/ДХМ. Затем объединенный и концентрированный неочищенный продукт растворяли в минимальном количестве ДХМ и несколько раз осаждали гептаном при объемном соотношении 1:20. Полученное твердое вещество несколько раз концентрировали в ДХМ для удаления растворителя, а затем тщательно сушили. Если он все еще был загрязнен, продукт элюировали через слой из нейтрального оксида алюминия с ДХМ для дополнительной очистки продукта. Фосфорамидит красителя 10 получали в виде твердого вещества белого/бледно-янтарного цвета (4,95, 79%). 1Н-ЯМР (400 МГц, CD2Cl2): δ 7,75 (m, 3Н), 7,46 (d, 2Н), 7,20-7,35 (m, 8Н), 6,94 (d, 1H), 6,83 (d, 4Н), 6,77 (s, 1H), 3,91 (m, 1H), 3,65-3,83 (m/s, 11Н), 3,58 (m, 2Н), 3,44 (q, 2Н), 3,11 (m, 2Н), 2,75 (m, 2Н), 2,58 (q, 2Н), 2,05 (m, 2Н), 1,90 (m, 1H), 1,62 (m, 2Н/H2O), 1,46 (m, 2Н), 1,35 (m, 2Н), 1,15 (d/d, 12Н); 31Р-ЯМР (400 МГц, CD2Cl2): δ 147,3 (s, 1P); ЖХМС: рассчит. 1306,4, наблюдаемый 1306,8 (МН+).
[0277] Пример 3: Твердофазный синтез олигонуклеотида, меченного большим красителем из асимметричного родамина
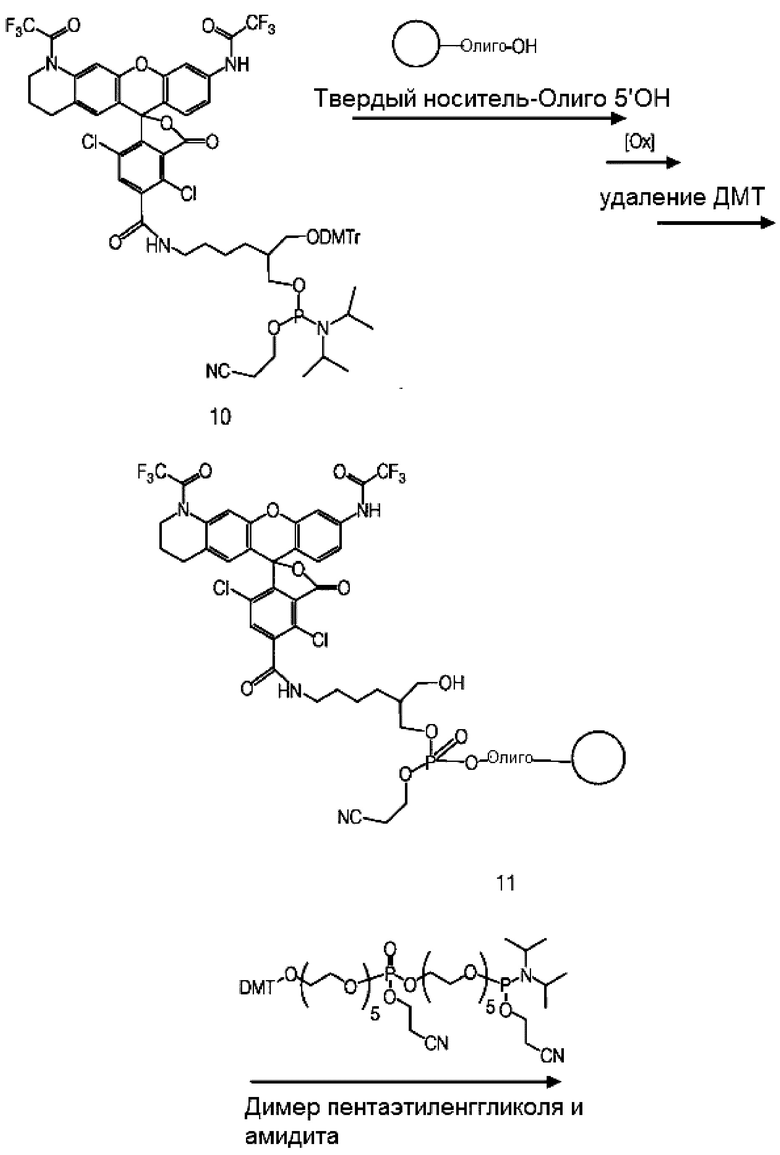
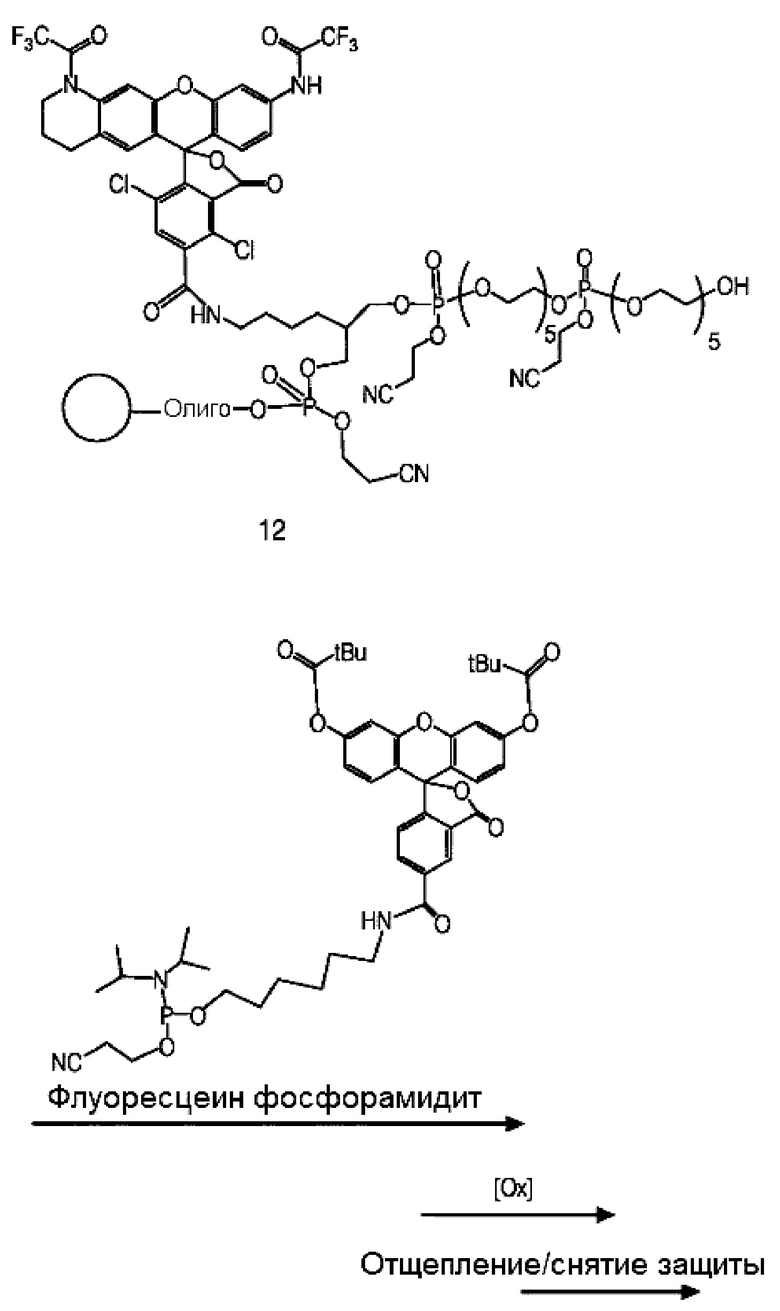
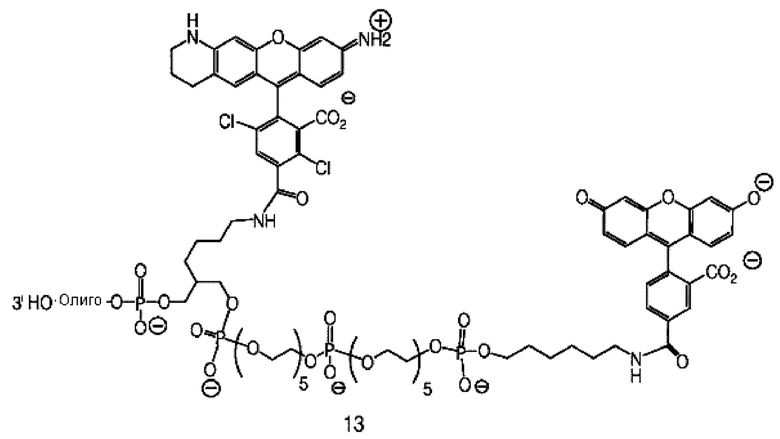
[0278] Олигонуклеотиды, меченные реагентами для синтеза из фосфорамидита N-защищенного асимметричного родамина, были синтезированы на твердых полистирольных носителях с использованием стандартных рабочих условий на автоматической установке для синтеза ДНК Biolytic 3900. Фосфорамидит N-защищенного асимметричного родамина 10 растворяли в ацетонитрильном растворителе для реакций сочетания, и аддукты N-защищенного асимметричного родаминового красителя были стабильны в повторяющихся синтетических циклах, в которых использовалось удаление ДМТ (DMT) трихлоруксусной кислотой, добавление других специальных нуклеозидных фосфорамидитных мономеров, блокирование с помощью уксусного ангидрида и окисление йодом с образованием межнуклеотидных фосфодиэфирных связей. Этот класс асимметричного родамина также оказался стабильным в условиях, используемых для снятия защиты и отщепления синтезированного меченого олигонуклеотида от твердого носителя (обработка раствором, содержащим трет-бутиламин/метанол/воду, при 65°С в течение пяти часов). Общая схема, используемая для синтеза меченого олигонуклеотида, проиллюстрирована на схеме выше. Посредством этого процесса бис-ТФУК-асимметричный родамин-ДМТ-фосфорамидит 10 был связан с 5'-гидроксилом связанного с носителем олигонуклеотида с образованием фосфодиэфирного промежуточного соединения 11 после окисления и удаления группы ДМТ (DMT). Димер ПЭГ и фосфорамидита был присоединен к свободному гидроксилу промежуточного соединения 11 с образованием промежуточного соединения 12 после окисления и удаления ДМТ (DMT). Флуоресцеин фосфорамидит (ThermoFisher) был присоединен к свободному гидроксилу промежуточного соединения 12. Полученный меченый олигонуклеотид окисляли, отщепляли и снимали защиту носителя с получением меченого олигонуклеотида 13. Олигонуклеотид 13 очищали с использованием стандартных хроматографических протоколов.
[0279] Раскрытие может быть дополнительно описано следующими пронумерованными пунктами.
[0280] 1. Соединение Формулы:
[0281]
[0282] 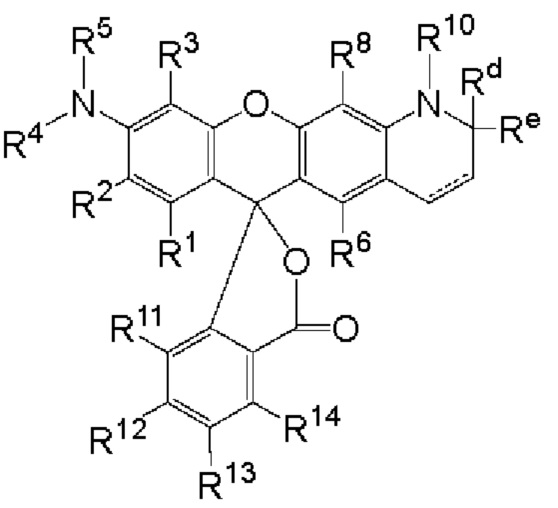
[0283] где
каждый R1, R2, R3, R6, R8, R11, R12, R13 и R14, взятый отдельно, независимо друг от друга выбран из водорода, низшего алкила, (С6-С14)-арила, (С7-С20)-арилалкила, 5-14-членного гетероарила, 6-20-членного гетероарилалкила, -Rb или -(CH2)n-Rb; или, в альтернативном варианте, R1 и R2 вместе с атомами углерода, с которыми они связаны, образуют необязательно замещенную бензогруппу;
[0284] R4 выбран из водорода, низшего алкила, (С6-С14)-арила, (С7-С20)-арилалкила, 5-14-членного гетероарила или 6-20-членного гетероарилалкила;
[0285] каждый из R5 и R10 независимо представляет собой Н или защитную группу;
[0286] причем n представляет собой целое число от в диапазоне 1 до 10;
[0287] причем каждый Ra, независимо от других, выбран из низшего алкила, (С6-С14)-арила, (С7-С20)-арилалкила, 5-14-членного гетероарила, -СХ3 и 6-20-членного гетероарилалкила;
[0288] где Rb выбран из -X, -ОН, -ORa -SH, -SRa -NH2, -NHRa -NRcRc, -N+RcRcRcX-, низшего пергалогеналкила, тригалогенметила, трифторметила, -Р(O)(ОН)2, -P(O)(ORa)2, P(O)(OH)(ORa), -ОР(O)(ОН)2, -OP(O)(ORa)2, -OP(O)(ORa)(OH), -S(O)2OH, -S(O)2Ra, -C(O)H, -C(O)Ra, -C(S)X, -C(O)ORa, -C(O)OH, -C(O)NH2, -C(O)NHRa, -C(O)NRcRc, -C(S)NH2, -C(O)NHRa, -C(O)NRcRc, -C(NH)NH2, -C(NH)NHRa и -C(NH)NRcRc;
[0289] каждый Rc, независимо от других, представляет собой Ra, или, в альтернативном варианте, два Rc, связанные с одним и тем же атомом азота, вместе с этим атомом азота могут образовывать 5-8-членное насыщенное или ненасыщенное кольцо, которое может необязательно содержать один или более одинаковых или разных циклообразующих гетероатомов, выбиранных из О, N и S;
[0290] каждый Rd и Re, взятый отдельно, независимо друг от друга, выбран из водорода, низшего алкила, (С6-С14)-арила, (С7-С20)-арилалкила, 5-14-членного гетероарила, 6-20-членного гетероарилалкила, -Rb или -(CH2)n-Rb;
[0291] X представляет собой галоген; и
[0292] n представляет собой целое число в диапазоне от 1 до 10.
[0293] 2. Соединение по п. 1, в котором спиролактонное кольцо находится в открытой кислотной форме и аминогруппы являются не защищенными. В определенных вариантах реализации изобретения открытая кислотная форма соединения является флуоресцентной (или демонстрирует усиление флуоресценции) по сравнению с закрытой спиролактонной формой соединения. Аминогруппы описанных в данном документе соединений являются защищаемыми в закрытой спиролактонной форме и могут быть превращены в фосфорамидиты и использоваться в качестве фосфорамидитов с целью обеспечения высокого выхода и высокой чистоты мечения нуклеиновых кислот. Следовательно, в данном документе также предложены флуоресцентно меченые зонды и праймеры нуклеиновых кислот, которые включают соединение по п. 1 в открытой лактонной форме со снятой защитой. Типичные примеры соединений по п. 1 в открытой лактонной форме после снятия защиты с аминогрупп и отщепления зонда нуклеиновой кислоты от твердого носителя изображены на Фиг. 8, 9, 10А и 10В.
[0294] Thermo Fisher Scientific предлагает набор для идентификации человека (HID), который включает реагенты для мечения нуклеиновых кислот с помощью 5 репортерных красителей (например, FAM, VIC, TED, TAZ и SID), и размерный стандарт LIZ (набор ПЦР для амплификации NGM Detect™). Определенные красители, представленные в данном документе, обладают уникальными спектральными свойствами, которые дополняют свойства в существующем наборе красителей, и могут использоваться для увеличения количества репортерных красителей, которые могут быть включены для применения HID. В частности, было обнаружено, что некоторые асимметричные родамины, описанные в п. 1, имеют максимальную длину волны излучения и узкую спектральную ширину, так что их можно отделить от других красителей в существующем коммерческом наборе красителей. Например, типичные соединения, которые демонстрируют максимальную длину волны излучения (например, ~559 нм), относятся к классу соединений асимметричного родамина, изображенных в структуре D.1. Такие соединения хорошо отделяются от соседних пиков излучения FAM (~517) и TED (~580 нм) в существующем наборе красителей (Фиг. 11А). Заявитель также обнаружил, что путем замены VIC двумя новыми красителями существующий набор красителей HID может быть расширен за счет включения 7 или более репортерных красителей (Фиг. 11В). В определенных вариантах реализации изобретения асимметричный родамин, имеющий структуру, изображенную на D.1, и ТЕТ (~537 нм), используют в качестве замены VIC в наборе, который дополнительно включает FAM, TED, TAZ и SID. Следовательно, определенные наборы, предложенные в данном документе, могут включать нуклеиновые кислоты, меченные (или реагенты для мечения нуклеиновых кислот) соединением, описанным в п. 1 (например, соединением, имеющим структуру D.1), с излучением при ~559 нм, FAM, TET, TED, TAZ и SID.
[0295] 3. Олигонуклеотид, содержащий фрагмент-метку, полученный взаимодействием олигонуклеотида, присоединенного к твердому носителю, с реагентом, имеет структуру Формулы:
[0296] LM-L-PEP
[0297] где PEP представляет собой группу предшественника сложного фосфатного эфира, L представляет собой необязательный линкер, связывающий фрагмент-метку с группой PEP, и LM содержит N-защищенный NH-родаминовый фрагмент молекулы Формулы (I),
[0298] 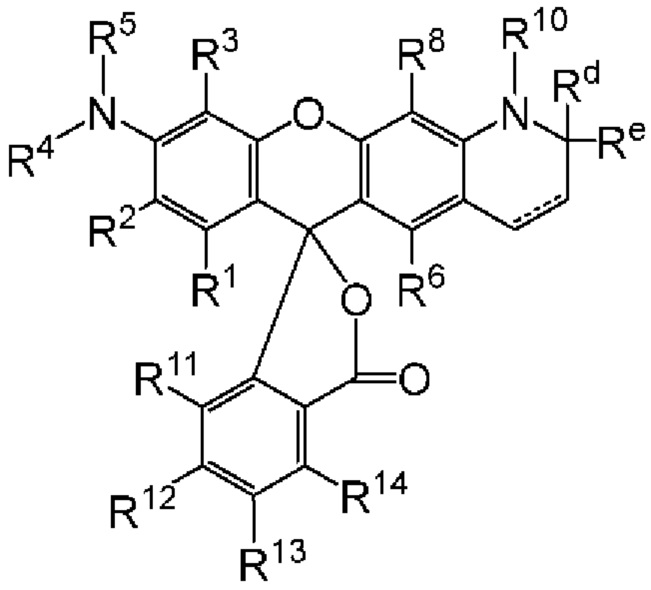
[0299] где
каждый R1, R2, R3, R6, R8, R11, R12, R13 и R14, взятый отдельно, независимо друг от друга выбран из водорода, низшего алкила, (С6-С14)-арила, (С7-С20)-арилалкила, 5-14-членного гетероарила, 6-20-членного гетероарилалкила, -Rb или -(CH2)n-Rb; и один из R2, R3, R7, R8, R12 или R13 включает группу формулы -Y-, где Y выбран из группы, состоящей из -С(О)-, -S(O)2-, -S- и -NH-; или, в альтернативном варианте, R1 и R2 вместе с атомами углерода, с которыми они связаны, образуют необязательно замещенную бензогруппу;
[0300] R4 выбран из водорода, низшего алкила, (С6-С14)-арила, (С7-С20)-арилалкила, 5-14-членного гетероарила или 6-20-членного гетероарилалкила;
[0301] каждый из R5 и R10 независимо представляет собой Н или защитную группу;
[0302] причем n представляет собой целое число от в диапазоне 1 до 10;
[0303] причем каждый Ra, независимо от других, выбран из низшего алкила, (С6-С14)-арила, (С7-С20)-арилалкила, 5-14-членного гетероарила, -СХ3 и 6-20-членного гетероарилалкила;
[0304] где Rb выбран из -X, -ОН, -ORa -SH, -SRa -NH2, -NHRa -NRcRc, -N+RcRcRcX-, низшего пергалогеналкила, тригалогенметила, трифторметила -Р(O)(ОН)2, -P(O)(ORa)2, P(O)(OH)(ORa), -ОР(O)(ОН)2, -OP(O)(ORa)2, -OP(O)(ORa)(OH), -S(O)2OH, -S(O)2Ra, -C(O)H, -C(O)Ra, -C(S)X, -C(O)OH, -C(O)NH2, -C(O)NHRa, -C(O)NRcRc, -C(S)NH2, -C(O)NHRa, -C(O)NRcRc, -C(NH)NH2, -C(NH)NHRa и -C(NH)NRcRc;
[0305] каждый Rc, независимо от других, представляет собой Ra, или, в альтернативном варианте, два Rc, связанные с одним и тем же атомом азота, вместе с этим атомом азота могут образовывать 5-8-членное насыщенное или ненасыщенное кольцо, которое может необязательно содержать один или более одинаковых или разных циклообразующих гетероатомов, выбиранных из О, N и S;
[0306] каждый Rd и Re, взятый отдельно, независимо друг от друга, выбран из водорода, низшего алкила, (С6-С14)-арила, (С7-С20)-арилалкила, 5-14-членного гетероарила, 6-20-членного гетероарилалкила, -Rb или -(CH2)n-Rb;
[0307] X представляет собой галоген; и
[0308] n представляет собой целое число в диапазоне от 1 до 10.
[0309] 4. Олигонуклеотид, содержащий фрагмент-метку, по п. 3, в котором спиролактонное кольцо находится в открытой форме и аминогруппы являются не защищенными.
[0310] 5. Реагент, используемый для мечения олигонуклеотида, который представляет собой соединение структурной Формулы:
[0311] 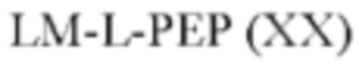
[0312] где LM представляет собой фрагмент-метку, который содержит N-защищенный NH-родаминовый фрагмент молекулы, PEP представляет собой группу предшественника сложного фосфатного эфира, которая включает фосфорамидитную группу или Н-фосфонатную группу, и L представляет собой необязательный линкер, связывающий фрагмент-метку с группой предшественника сложного фосфатного эфира, в которой N-защищенный NH-родаминовый фрагмент молекулы имеет Формулу,
[0313] 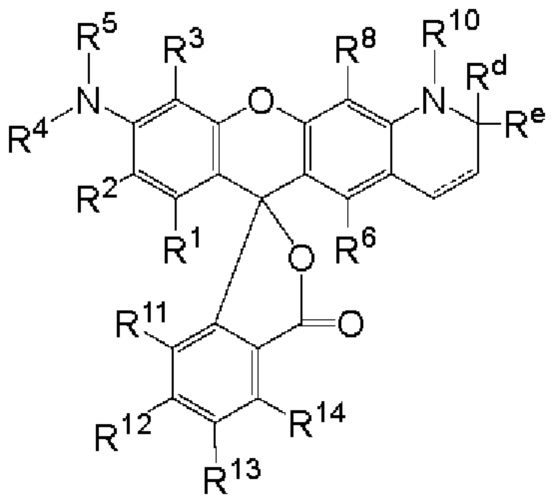
[0314] где
каждый R1, R2, R3, R6, R8, R11, R12, R13 и R14, взятый отдельно, независимо друг от друга выбран из водорода, низшего алкила, (С6-С14)-арила, (С7-С20)-арилалкила, 5-14-членного гетероарила, 6-20-членного гетероарилалкила, -Rb или -(CH2)n-Rb; и один из R2, R3, R7, R8, R12 или R13 включает группу формулы -Y-, где Y выбран из группы, состоящей из -С(О)-, -S(O)2-, -S- и -NH-; или, в альтернативном варианте, R1 и R2 вместе с атомами углерода, с которыми они связаны, образуют необязательно замещенную бензогруппу;
[0315] R4 выбран из водорода, низшего алкила, (С6-С14)-арила, (С7-С20)-арилалкила, 5-14-членного гетероарила или 6-20-членного гетероарилалкила;
[0316] каждый из R5 и R10 независимо представляет собой Н или защитную группу;
[0317] причем n представляет собой целое число от в диапазоне 1 до 10;
[0318] причем каждый Ra, независимо от других, выбран из низшего алкила, (С6-С14)-арила, (С7-С20)-арилалкила, 5-14-членного гетероарила, -СХ3 и 6-20-членного гетероарилалкила;
[0319] где Rb выбран из -X, -ОН, -ORa -SH, -SRa -NH2, -NHRa -NRcRc, -N+RcRcRcX-, низшего пергалогеналкила, тригалогенметила, трифторметила -Р(O)(ОН)2, -P(O)(ORa)2, P(O)(OH)(ORa), -ОР(O)(ОН)2, -OP(O)(ORa)2, -OP(O)(ORa)(OH), -S(O)2OH, -S(O)2Ra, -C(O)H, -C(O)Ra, -C(S)X, -C(O)OH, -C(O)NH2, -C(O)NHRa, -C(O)NRcRc, -C(S)NH2, -C(O)NHRa, -C(O)NRcRc, -C(NH)NH2, -C(NH)NHRa и -C(NH)NRcRc;
[0320] каждый Rc, независимо от других, представляет собой Ra, или, в альтернативном варианте, два Rc, связанные с одним и тем же атомом азота, вместе с этим атомом азота могут образовывать 5-8-членное насыщенное или ненасыщенное кольцо, которое может необязательно содержать один или более одинаковых или разных циклообразующих гетероатомов, выбиранных из О, N и S;
[0321] каждый Rd и Re, взятый отдельно, независимо друг от друга, выбран из водорода, низшего алкила, (С6-С14)-арила, (С7-С20)-арилалкила, 5-14-членного гетероарила, 6-20-членного гетероарилалкила, -Rb или -(CH2)n-Rb;
[0322] X представляет собой галоген; и
[0323] n представляет собой целое число в диапазоне от 1 до 10.
[0324] 6. Реагент по п. 5, в котором спиролактонное кольцо находится в открытой форме и аминогруппы являются не защищенными.
| название | год | авторы | номер документа |
|---|---|---|---|
| НОВЫЕ КОМБИНАЦИИ ГАСИТЕЛЯ И РЕПОРТЕРНОГО КРАСИТЕЛЯ | 2019 |
|
RU2795062C2 |
| НУКЛЕОЗИДЫ И НУКЛЕОТИДЫ С 3’-ГИДРОКСИ БЛОКИРУЮЩИМИ ГРУППАМИ И ИХ ПРИМЕНЕНИЕ В СПОСОБАХ СЕКВЕНИРОВАНИЯ ПОЛИНУКЛЕОТИДОВ | 2019 |
|
RU2818762C2 |
| НАБОР ЗОНДОВ ДЛЯ АНАЛИЗА ОБРАЗЦОВ ДНК И СПОСОБЫ ИХ ИСПОЛЬЗОВАНИЯ | 2016 |
|
RU2753883C2 |
| МОДИФИЦИРОВАННЫЕ НУКЛЕОТИДНЫЕ ЛИНКЕРЫ | 2015 |
|
RU2699993C2 |
| ТАГМЕНТАЦИЯ С ПРИМЕНЕНИЕМ ИММОБИЛИЗОВАННЫХ ТРАНСПОСОМ С ЛИНКЕРАМИ | 2018 |
|
RU2783536C2 |
| КУМАРИНЫ, ЗАМЕЩЕННЫЕ ВТОРИЧНЫМИ АМИНАМИ, И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ ФЛУОРЕСЦЕНТНЫХ МЕТОК | 2018 |
|
RU2756272C2 |
| МУЛЬТИПЛЕКСНОЕ ФЛУОРЕСЦЕНТНОЕ ОБНАРУЖЕНИЕ АНАЛИТОВ | 2020 |
|
RU2816515C2 |
| ПОЛИМЕТИНОВЫЕ СОЕДИНЕНИЯ И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ ФЛУОРЕСЦЕНТНЫХ МЕТОК | 2016 |
|
RU2696562C1 |
| БИОЛОГИЧЕСКИ АКТИВНОЕ СОЕДИНЕНИЕ, СОДЕРЖАЩЕЕ КОДИРУЮЩИЙ ОЛИГОНУКЛЕОТИД, И БИБЛИОТЕКА СОЕДИНЕНИЙ | 2011 |
|
RU2592673C2 |
| ИДЕНТИФИКАЦИЯ И АНАЛИЗ ОБРАЗЦОВ МИКРООРГАНИЗМОВ ПУТЕМ БЫСТРОГО ИНКУБИРОВАНИЯ И ОБОГАЩЕНИЯ НУКЛЕИНОВЫХ КИСЛОТ | 2020 |
|
RU2809853C2 |
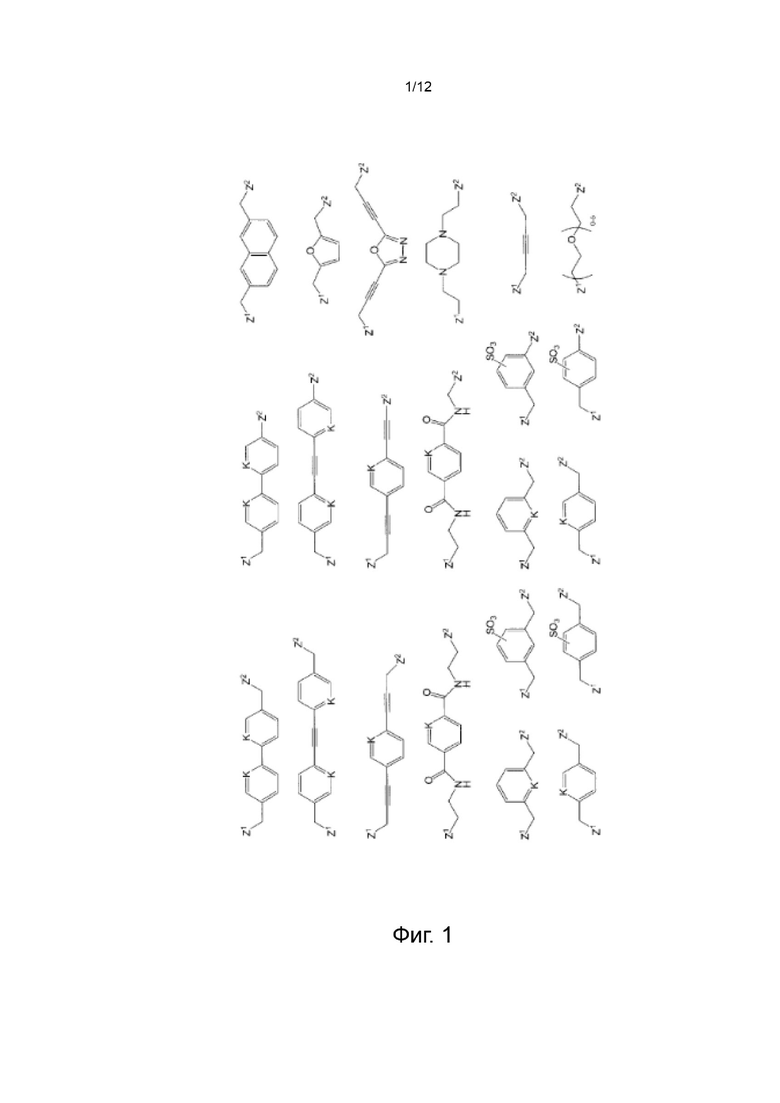
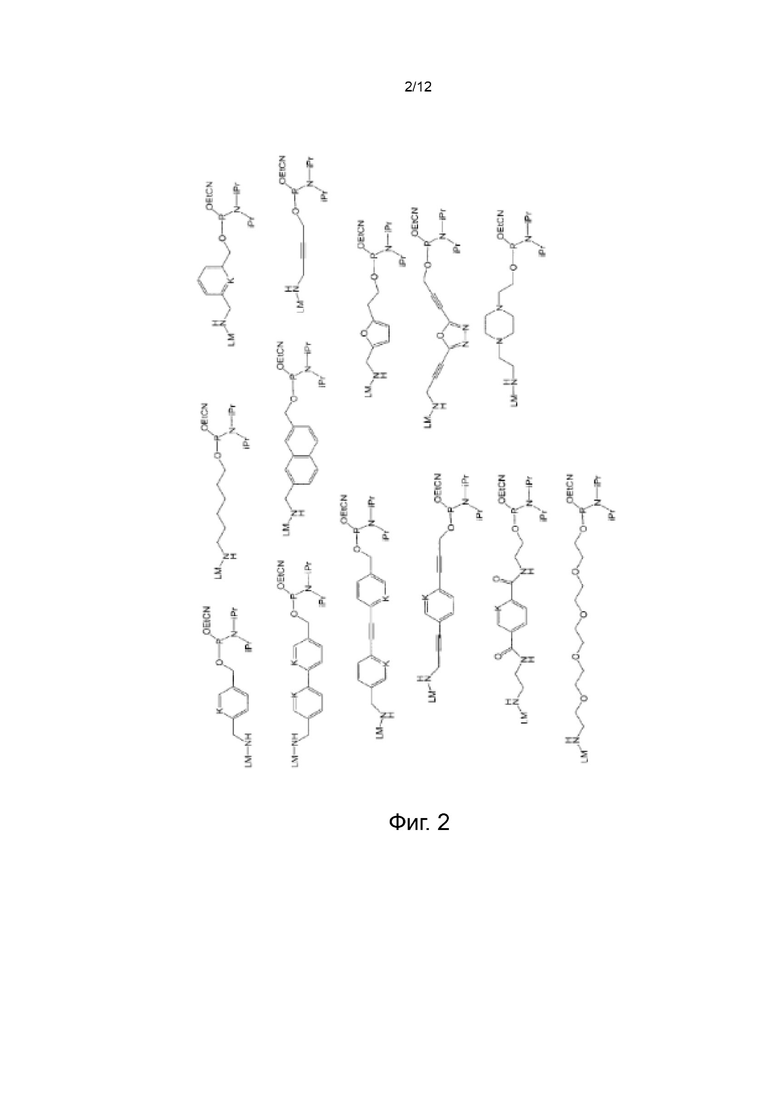
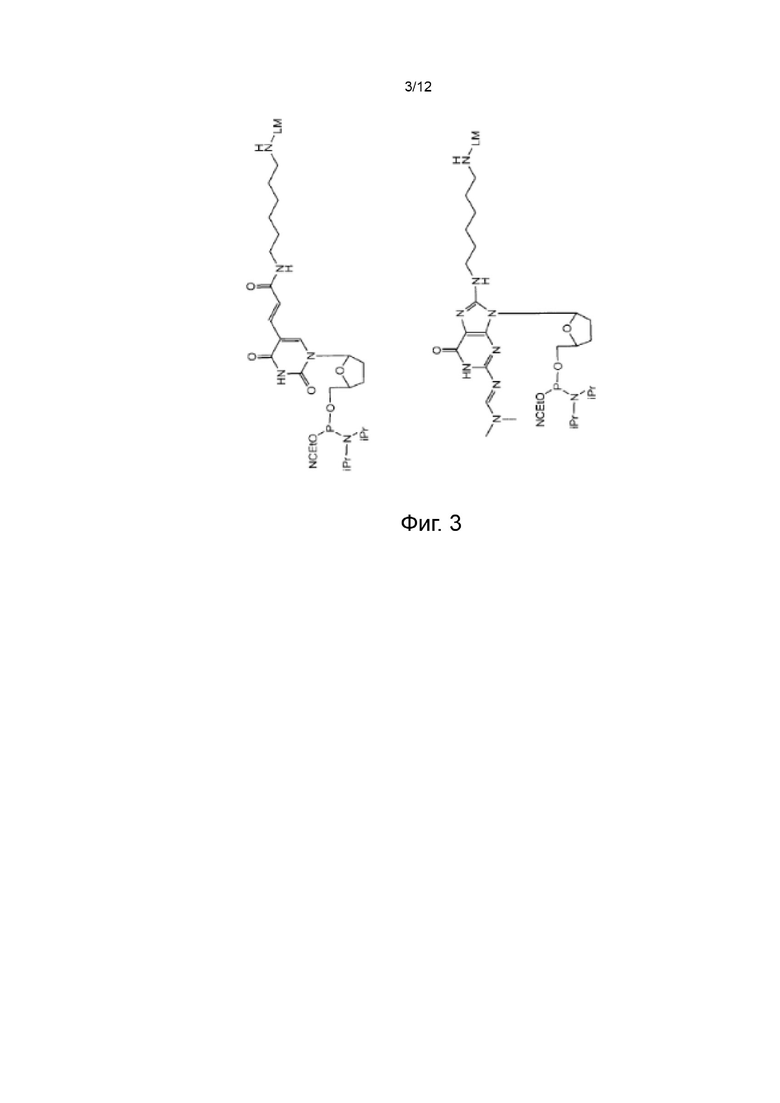
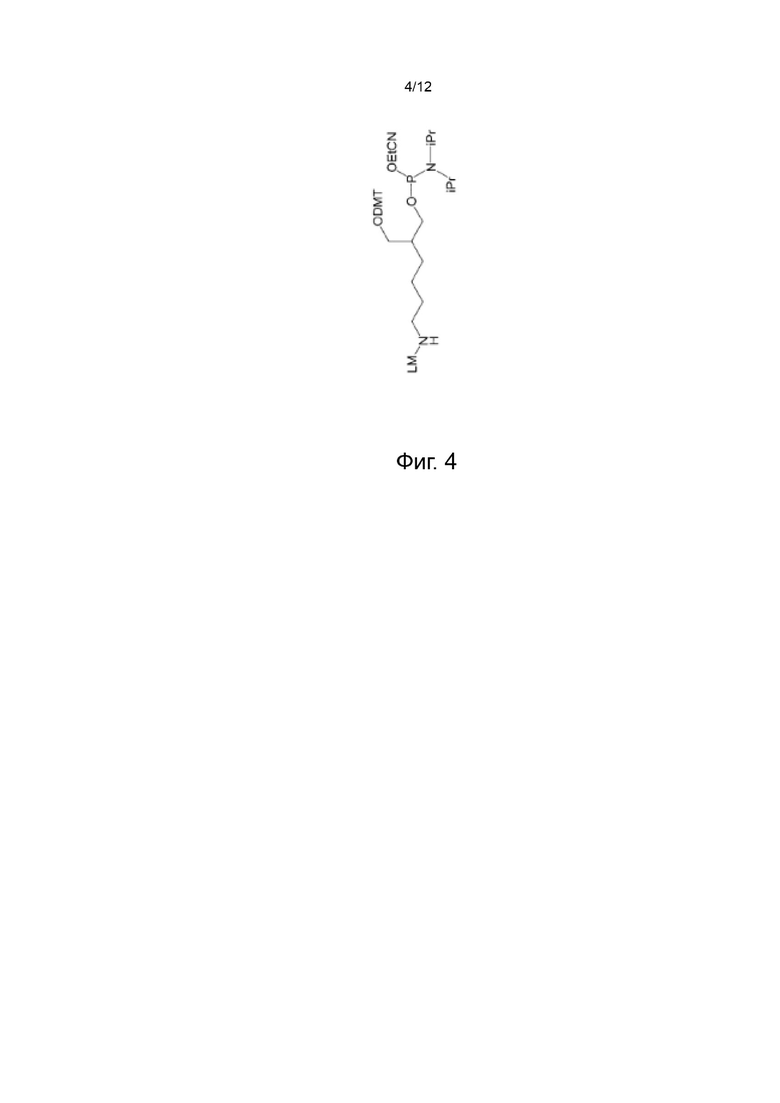
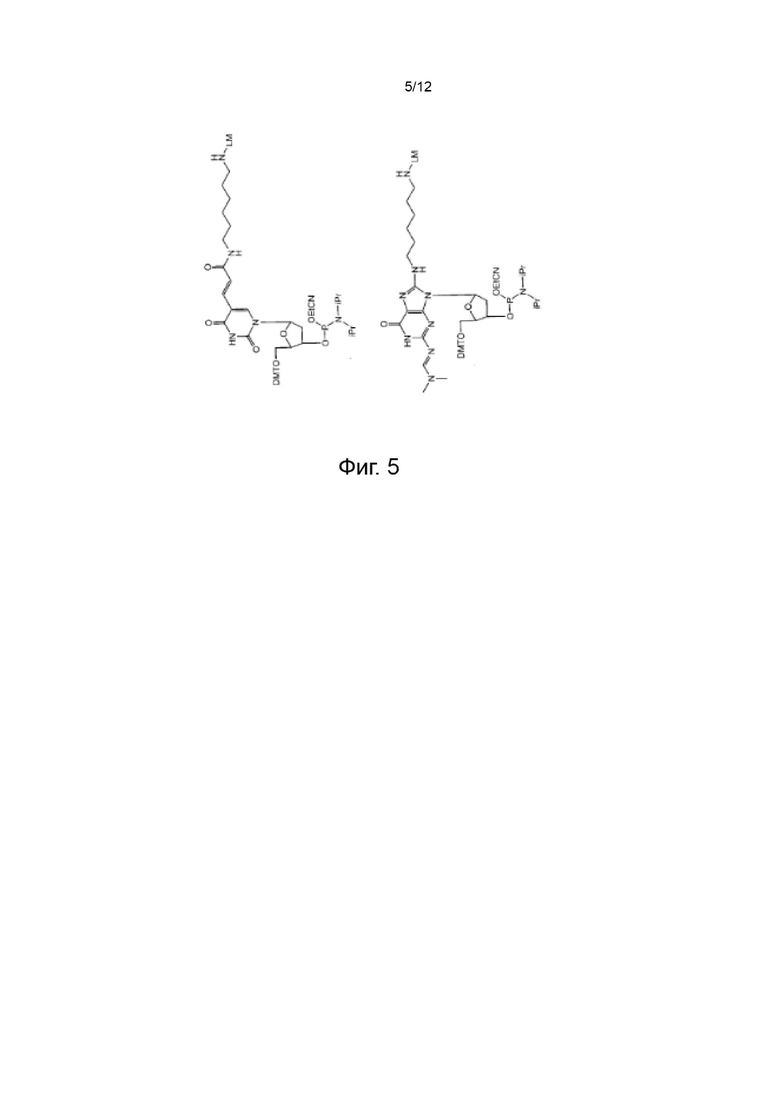
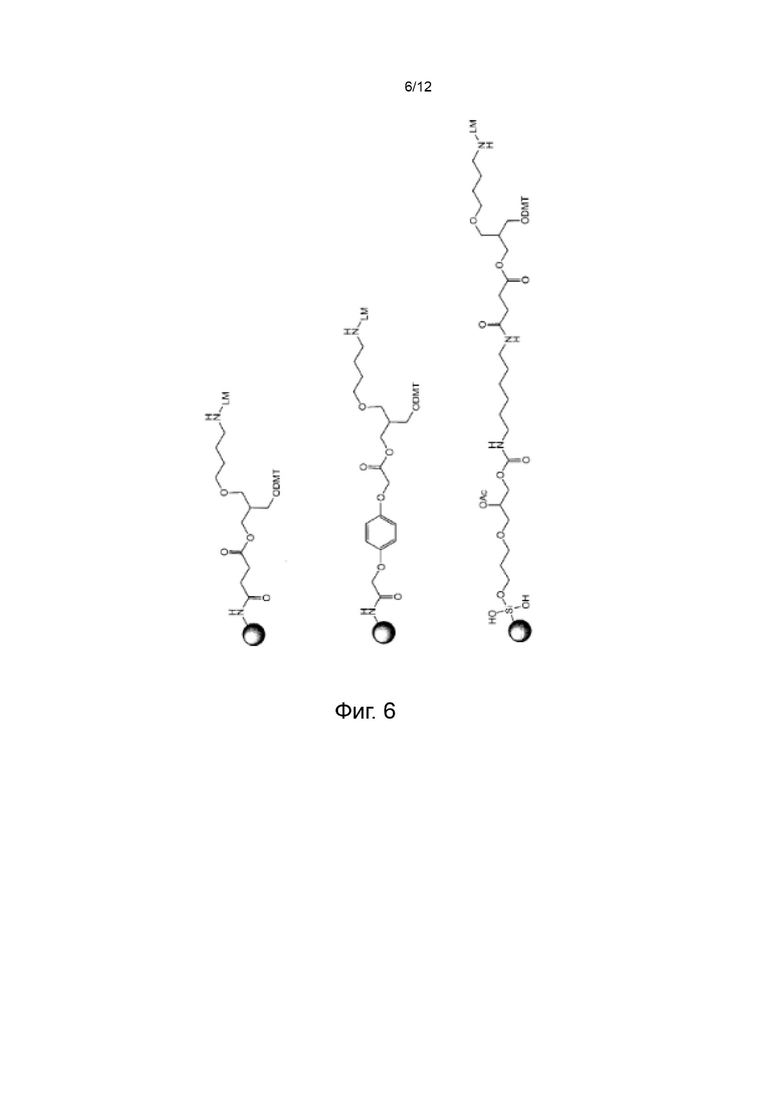
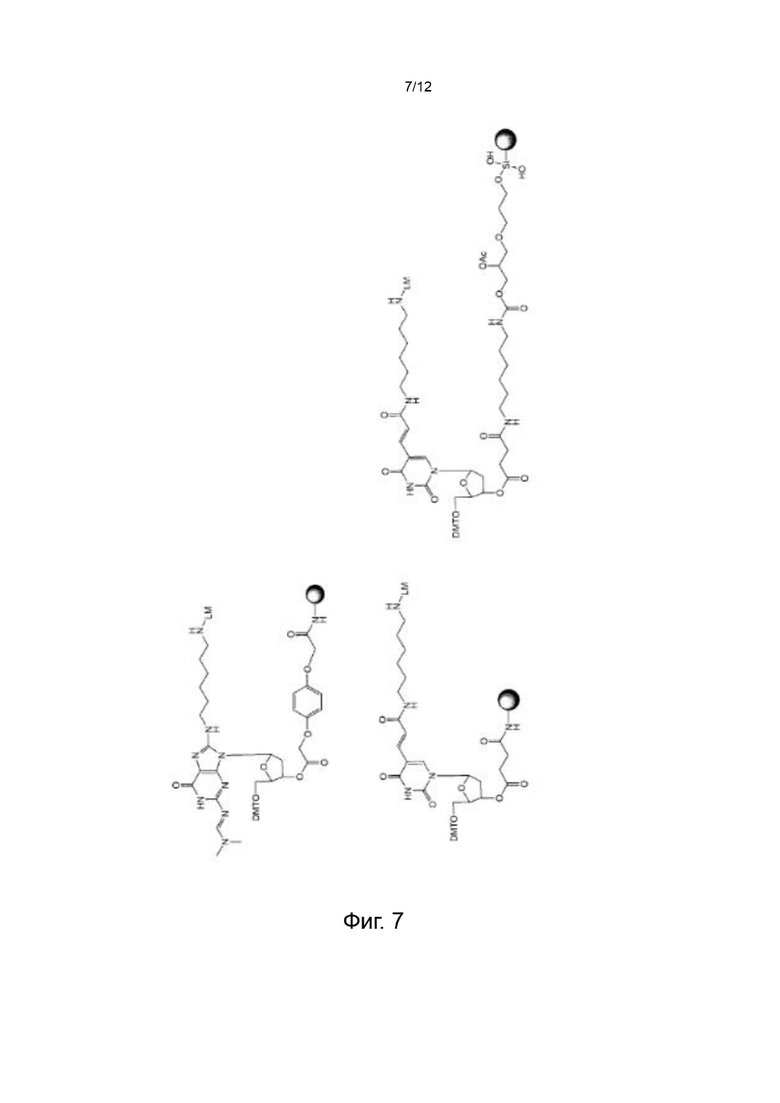
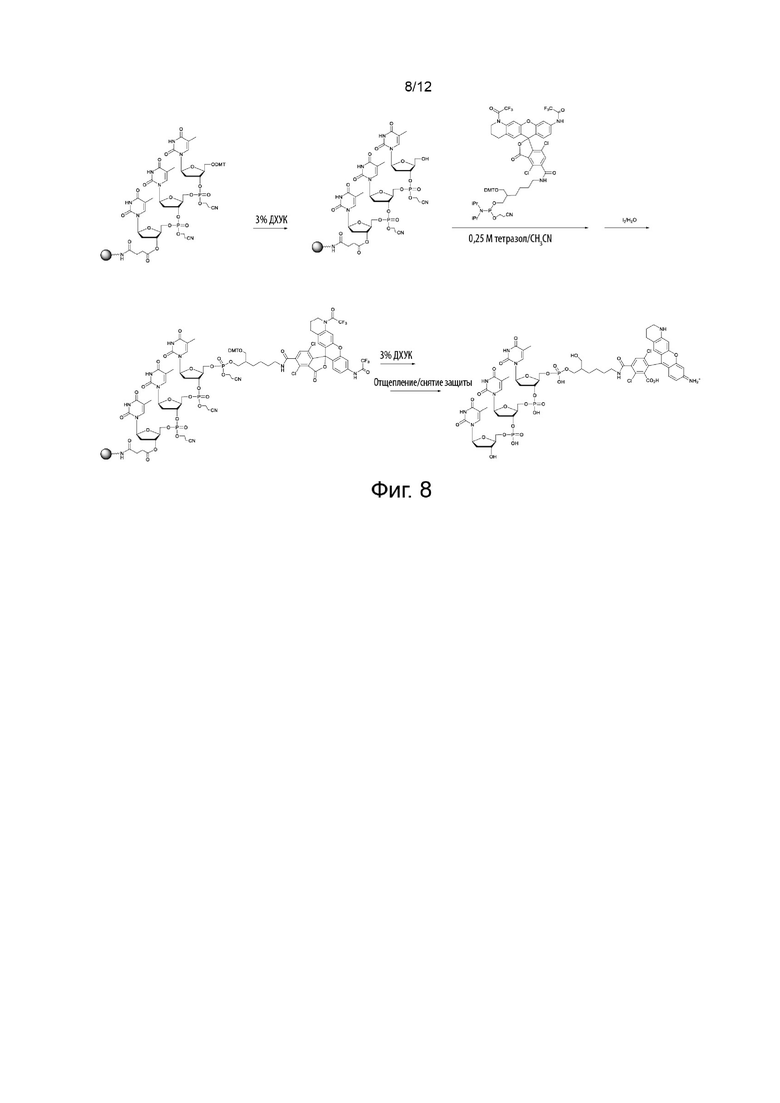
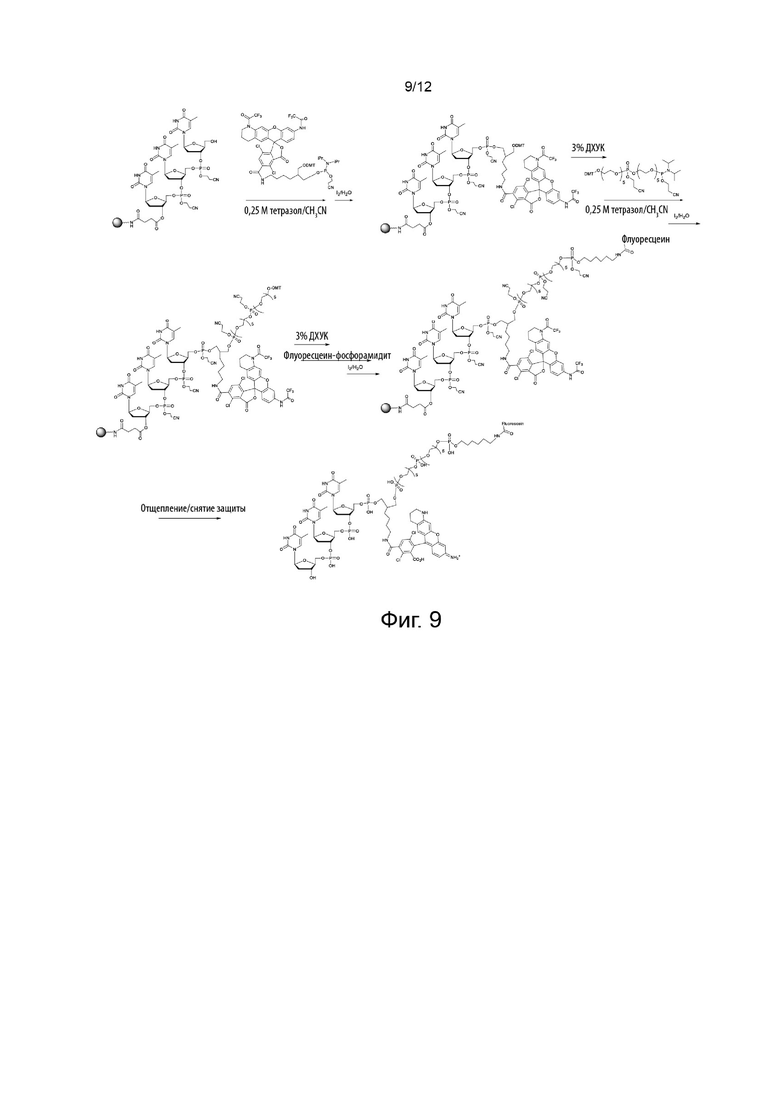
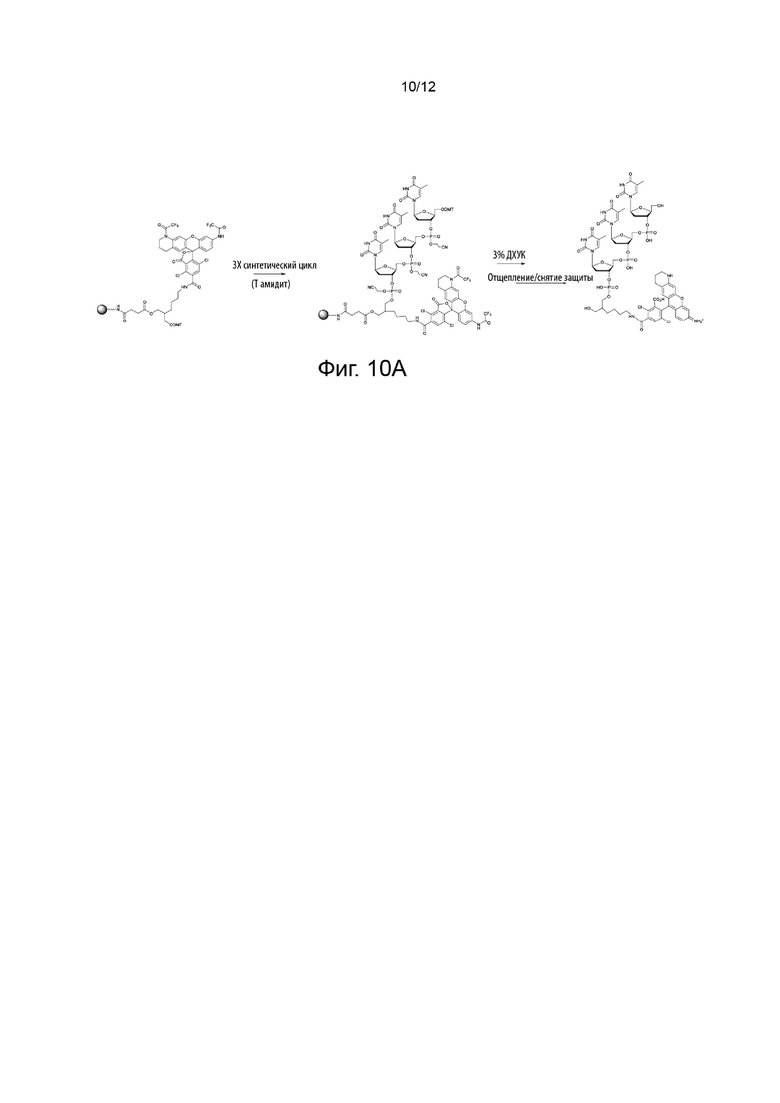
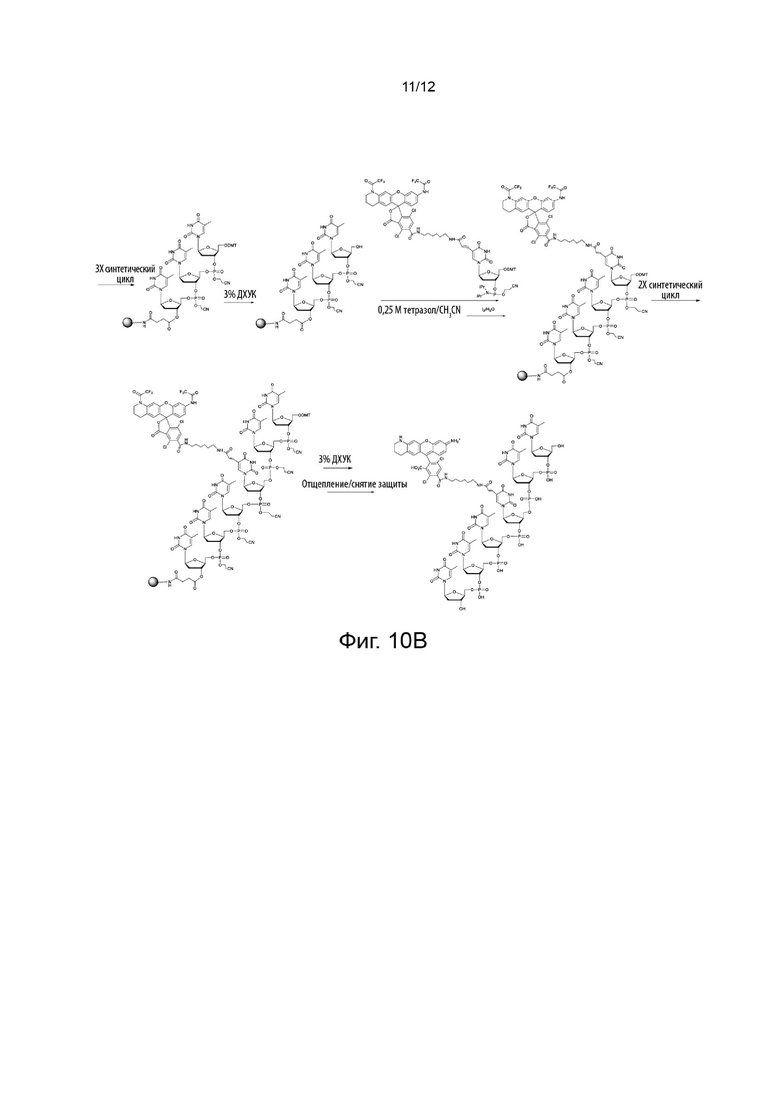
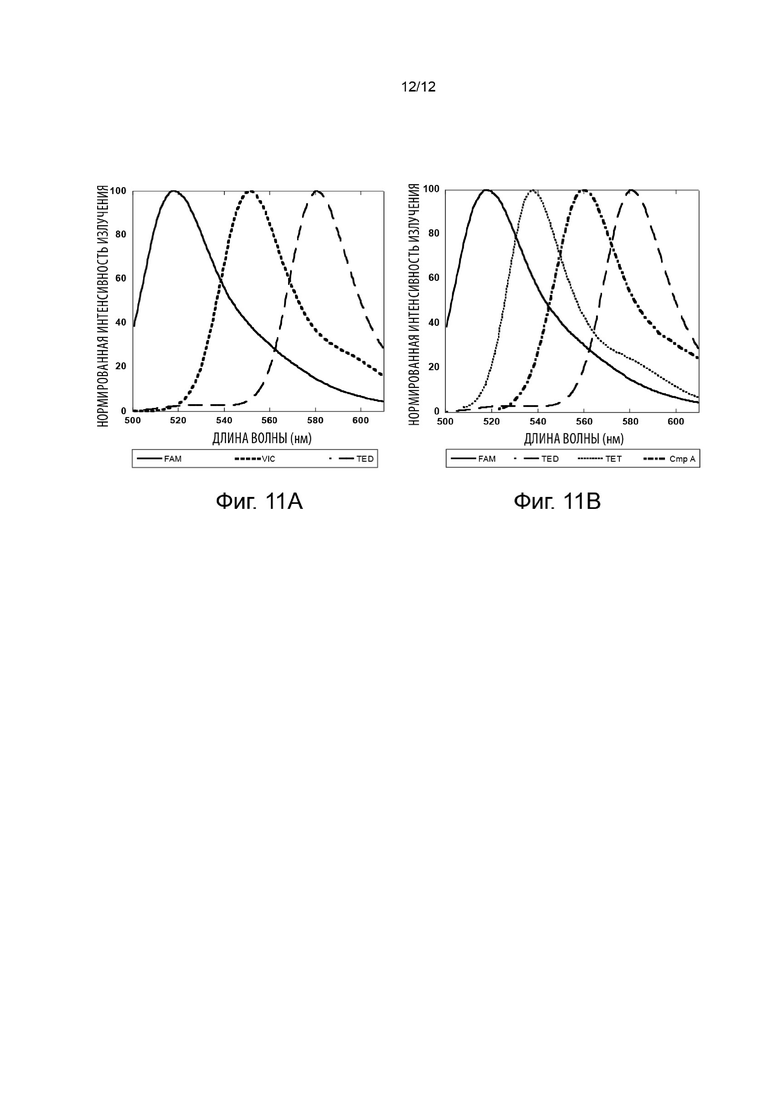
Группа изобретений относится к органической химии и включает соединение формулы (I), где R1, R2, R3, R4, R6, R8, R12, Rd и Re представляют собой водород; R11, R13 и R14 представляют собой -Rb; R5 и R10 представляют собой -C(O)R15, где R15 представляет собой -CX3; Rb выбран из -X и -C(O)OH; X представляет собой галоген; и пунктирная линия обозначает, что в указанном положении может быть двойная связь. Также группа изобретений включает реагент для мечения олигонуклеотида формулы LM-L-PEP (ХХ), олигонуклеотид, содержащий фрагмент-метку, полученный взаимодействием олигонуклеотида, присоединенного к твердому носителю, с реагентом, имеющим структуру формулы (ХХ), способ одновременной амплификации и анализа множества генетических локусов и набор, содержащий олигонуклеотидные праймеры для ко-амплификации набора генетических локусов. Где в формуле (ХХ) PEP представляет собой группу предшественника сложного фосфатного эфира формулы (P.1), LM представляет собой N-защищённый NH-родаминовый фрагмент молекулы формулы (I), L представляет собой линкер формулы –NH-(CH2)4-CH-(CH2-O-DMT)-CH2-O-. Технический результат - флуоресцентные красители родаминового ряда формулы (I), которые используются для мечения синтетических олигонуклеотидов. 5 н. и 20 з.п. ф-лы, 13 ил., 3 табл., 3 пр.
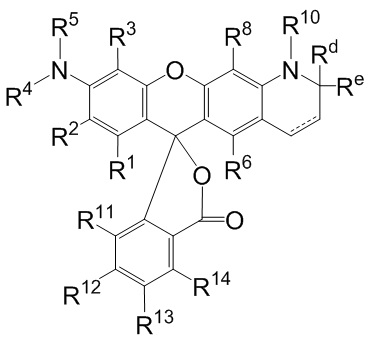 (I)
(I)  (Р.1)
(Р.1)
1. Соединение формулы (I):
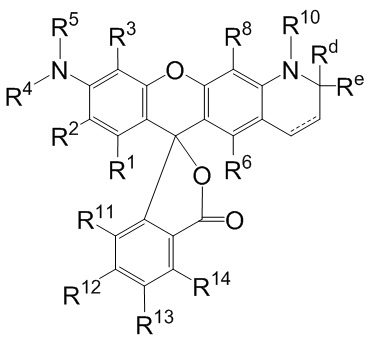 формула (I)
формула (I)
где
R1, R2, R3, R4, R6, R8, R12, Rd и Re представляют собой водород;
R11, R13 и R14 представляют собой -Rb;
R5 и R10 представляют собой защитную группу, где указанная защитная группа представляет собой -C(O)R15, где R15 представляет собой -CX3;
где Rb выбран из -X и -C(O)OH;
X представляет собой галоген; и
пунктирная линия обозначает, что в указанном положении может быть двойная связь.
2. Соединение по п. 1, в котором каждый из R11 и R14 представляет собой галоген.
3. Соединение по п. 2, в котором галоген представляет собой фтор или хлор.
4. Соединение по п. 2, в котором галоген представляет собой хлор.
5. Соединение по любому из пп. 1-4, в котором R13 представляет C(O)OH.
6. Соединение по п. 5, в котором R11 представляет собой -C(O)OH.
7. Соединение по любому из пп. 1-6, в котором X в защитной группе представляет собой фтор или хлор.
8. Соединение по п. 7, в котором X в защитной группе представляет собой фтор.
9. Олигонуклеотид, содержащий фрагмент-метку, полученный взаимодействием олигонуклеотида, присоединенного к твердому носителю, с реагентом, имеющим структуру формулы:
LM-L-PEP (XX)
где PEP представляет собой группу предшественника сложного фосфатного эфира, где указанная группа предшественника сложного фосфатного эфира включает фосфорамидит формулы (P.1):

где:
R20 представляет собой 2-цианоэтил; и
R21 и R22 представляют собой изопропил;
L представляет собой линкер, связывающий фрагмент-метку с группой PEP, где L представляет собой –NH-(CH2)4-CH-(CH2-O-DMT)-CH2-O-; и
LM представляет собой N-защищённый NH-родаминовый фрагмент молекулы формулы (I):
 формула (I)
формула (I)
где
R1, R2, R3, R4, R6, R8, R12, Rd и Re представляют собой водород;
R11, R13 и R14 представляют собой -Rb;
R5 и R10 представляют собой защитную группу, где указанная защитная группа представляет собой -C(O)R15, где R15 представляет собой -CX3;
где Rb выбран из -X и -C(O)OH; и
X представляет собой галоген; и
пунктирная линия обозначает двойную связь.
10. Олигонуклеотид по п. 9, в котором каждый из R11 и R14 представляет собой галоген.
11. Олигонуклеотид по п. 10, в котором галоген представляет собой фтор или хлор.
12. Олигонуклеотид по п. 10, в котором галоген представляет собой хлор.
13. Олигонуклеотид по п. 9, в котором R13 представляет собой -C(O)OH.
14. Олигонуклеотид по любому из пп. 9-13, в котором X в защитной группе, если он присутствует, представляет собой фтор или хлор.
15. Олигонуклеотид по любому из пп. 9-13, в котором X в защитной группе, если он присутствует, представляет собой фтор.
16. Олигонуклеотид по п. 9, в котором реагент дополнительно содержит подходящим образом защищенный маркер синтеза, содержащий реакционноспособную группу, выбранную из группы, состоящей из амино, гидроксила, тиола и альдегида, и защитную группу, способную
(а) быть удаленной для обеспечения реакционноспособной группы для присоединения дополнительных фрагментов молекул в ходе синтеза олигонуклеотида или
(b) быть стабильной в ходе синтеза олигонуклеотида и быть удаленной после синтеза олигонуклеотида для обеспечения реакционноспособной группы для присоединения дополнительных фрагментов молекул.
17. Реагент, используемый для мечения олигонуклеотида, представляющий собой соединение структурной формулы:
LM-L-PEP (XX)
где PEP представляет собой группу предшественника сложного фосфатного эфира, где указанная группа предшественника сложного фосфатного эфира включает фосфорамидит формулы (P.1):

где:
R20 представляет собой 2-цианоэтил; и
R21 и R22 представляют собой изопропил;
L представляет собой линкер, связывающий фрагмент-метку с группой предшественника сложного фосфатного эфира, где L представляет собой –NH-(CH2)4-CH-(CH2-O-DMT)-CH2-O-; и
LM представляет собой N-защищенный NH-родаминовый фрагмент молекулы формулы (I):
 формула (I),
формула (I),
где
R1, R2, R3, R4, R6, R8, R12, Rd и Re представляют собой водород;
R11, R13 и R14 представляют собой -Rb;
R5 и R10 представляют собой защитную группу; где указанная защитная группа представляет собой -C(O)R15, где R15 представляет собой -CX3;
где Rb выбран из –X и -C(O)OH; и
X представляет собой галоген; и
пунктирная линия обозначает двойную связь.
18. Способ одновременной амплификации и анализа множества генетических локусов, включающий:
амплификацию образца нуклеиновой кислоты множеством пар праймеров для амплификации с образованием множества продуктов амплификации, причем по меньшей мере одна из каждой пары праймеров содержит меченый нуклеотид по п. 9, причем каждый из продуктов амплификации содержит разные генетические локусы.
19. Способ по п. 18, в котором меченый нуклеотид по п. 10 применяют для мечения по меньшей мере трех пар праймеров.
20. Способ по п. 18, в котором меченый нуклеотид по п. 10 применяют для мечения от трех до восьми пар праймеров.
21. Способ по п. 18, в котором образец нуклеиновой кислоты выделяют из цельной крови; биопсии ткани; лимфы; кости; костного мозга; зуба; кожи, например, клеток кожи, содержащихся в отпечатках пальцев; кости; зуба; околоплодных вод, содержащих клетки плаценты, и околоплодных вод, содержащих клетки плода; волос; кожи; спермы; анальных выделений; кала; мочи; вагинальных выделений; пота; слюны; мазков из буккальной полости; различных образцов окружающей среды, исследовательских образцов и лизированных клеток.
22. Набор, содержащий олигонуклеотидные праймеры для ко-амплификации набора генетических локусов по меньшей мере одного анализируемого образца нуклеиновой кислоты, в котором набор локусов может быть ко-амплифицирован, причем по меньшей мере один из праймеров содержит меченый нуклеотид по п. 9, причем праймеры находятся в одном или более контейнерах.
23. Набор по п. 22, в котором все олигонуклеотидные праймеры в наборе находятся в одном контейнере.
24. Набор по п. 22, дополнительно содержащий по меньшей мере один из:
реагенты по меньшей мере для одной реакции мультиплексной амплификации; и
контейнер, имеющий хотя бы один размерный стандарт.
25. Набор по п. 24, в котором по меньшей мере один из олигонуклеотидных праймеров содержит меченый нуклеотид, причем меченый нуклеотид имеет спектральные свойства, отличные от меченого нуклеотида по п. 9.
| Liu Q.H | |||
| et al | |||
| Spectrofluorimetric determination of trace nitrite with a novel fluorescent probe | |||
| Spectrochimica acta part A: molecular and biomolecular spectroscopy, 2009, vol.73, no.5, p.789-793 | |||
| WO 2016061555 A2, 21.04.2016 | |||
| WO 2005051967 A2, 09.06.2005 | |||
| US 6605434 B2, 12.08.2003; | |||
| WO 2006132588 A1, 14.12.2006 | |||
| US 9228225 B2, 05.01.2016 | |||
| US |
Авторы
Даты
2023-12-15—Публикация
2019-12-20—Подача